УРОВЕНЬ ТЕХНИКИ
[01] Саркопения представляет собой связанную со старением потерю массы, свойств и прочности мышечной ткани. В какой-то момент времени после тридцати лет люди начинают терять мышечную массу и функциональную способность мускулатуры. Такая потеря мышечной массы обычно усиливается примерно в возрасте 75 лет. Саркопения развивается как у физически активных, так и физически неактивных людей. Поскольку средняя продолжительность жизни человека продолжает увеличиваться, саркопения становится серьезной проблемой для здоровья. Потеря мышечной массы в результате саркопении может привести к плохому равновесию, снижению скорости ходьбы и слабости. Индивидуумы, страдающие саркопенией, более подвержены травмам и инвалидизации и в результате могут быть неспособны жить самостоятельно. Распространение саркопении, вероятно, приведет к увеличению расходов на медицинское обслуживание и увеличению расходов на проживание с уходом.
[02] Саркопению рассматривают как неизбежный результат старения и естественного ухудшения состояния организма с течением времени. Первичное лечение саркопении представляет собой упражнения. Физические упражнения, в частности, тренировки с отягощением или силовые тренировки, могут уменьшить последствия саркопении. Тестостерон, анаболические стероиды, грелин, витамин D, ингибиторы ангиотензинпревращающего фермента (ингибиторы АПФ), эйкозапентаеновая кислота (ЕРА), миостатин, селективные модуляторы андрогенных рецепторов (SARM), урокортин II (Ucn2) и гормонозаместительная терапия были изучены или находятся на этапе исследований в качестве потенциальных вариантов терапии саркопении. Несмотря на эти исследования, в настоящее время отсутствуют агенты для лечения саркопении, одобренные Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA).
[03] В недавнем исследовании была выявлена причинная связь между клеточным старением и возрастными расстройствами, такими как саркопения. Исследовательская группа в клинике Майо в Рочестере, Миннесота, продемонстрировала, что эффекты, вызванные старением у мышей, могут быть отсрочены путем устранения стареющих клеток в жировой и мышечной тканях указанных мышей без явных побочных эффектов (Baker, D.J. et al., "Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders", Nature, Vol. 479, pp. 232-236, (2011)). Было показано, что устранение стареющих клеток у трансгенных мышей существенно задерживает начало развития саркопении и катаракты, а также снижает показатели старения в скелетных мышцах и глазу. В исследовании было установлено, что лечение трансгенных мышей для удаления стареющих клеток в течение всей жизни или начатое на поздних этапах жизни, не имеет отрицательных побочных эффектов и селективно задерживает развитие возрастных фенотипов, которые зависят от клеток (Id., page 234, col. 2, line 16 through page 235, col. 1, line 2). Авторы предположили, что удаление стареющих клеток может представлять собой один из вариантов лечения или задержки возрастных заболеваний у людей и улучшения продолжительности жизни без заболеваний у человека (Id., page 235, col. 2, lines 38-51).
[04] Стареющие клетки представляют собой клетки, которые являются частично функциональными или нефункциональными и находятся в состоянии необратимой остановки пролиферации. Старение является четко различимым состоянием клетки и связано с такими биомаркерами как активация биомаркера p16Ink4a и экспрессия бета-галактозидазы.
[05] Конечные продукты повышенного гликирования (AGE, также называемые AGE-модифицированными белками или конечными продуктами гликирования) вырабатываются в результате неферментативной реакции сахаров с боковыми цепями белков в стареющих клетках (Ando, K. et al., Membrane Proteins of Human Erythrocytes Are Modified by Advanced Glycation End Products during Aging in the Circulation, Biochem Biophys Res Commun., Vol. 258, 123, 125 (1999)). Этот процесс начинается с обратимой реакции между восстанавливающим сахаром и аминогруппой с образованием основания Шиффа, из которого впоследствии в результате перегруппировки Амадори образуется ковалентно связанный продукт. После образования продукт перегруппировки Амадори подвергается дальнейшей перегруппировке с получением AGE. Гипергликемия, вызванная сахарным диабетом (СД), и окислительный стресс стимулируют указанную посттрансляционную модификацию мембранных белков (Lindsey JB, et al, "Receptor For Advanced Glycation End-Products (RAGE) and soluble RAGE (sRAGE): Cardiovascular Implications," Diabetes Vascular Disease Research, Vol. 6(1), 7-14, (2009)). AGE связывют с несколькими патологическими состояниями, включая осложнения диабета, воспаление, ретинопатию, нефропатию, атеросклероз, инсульт, дисфункцию эндотелиальных клеток и нейродегенеративные расстройства (Bierhaus A, "AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. The AGE concept," Cardiovasc Res, Vol.37(3), 586-600 (1998)).
[06] AGE-модифицированные белки также являются маркером стареющих клеток. Такая связь между конечным продуктом гликирования и старением хорошо известна в данной области техники. См., например, Gruber, L. (WO 2009/143411, 26 Nov. 2009), Ando, K. et al. (Membrane Proteins of Human Erythrocytes Are Modified by Advanced Glycation End Products during Aging in the Circulation, Biochem Biophys Res Commun., Vol. 258, 123, 125 (1999)), Ahmed, E.K. et al. ("Protein Modification and Replicative Senescence of WI-38 Human Embryonic Fibroblasts" Aging Cells, vol. 9, 252, 260 (2010)), Vlassara, H. et al. (Advanced Glycosylation Endproducts on Erythrocyte Cell Surface Induce Receptor-Mediated Phagocytosis by Macrophages, J. Exp. Med., Vol. 166, 539, 545 (1987)) и Vlassara et al. ("High-affinity-receptor-mediated Uptake and Degradation of Glucose-modified Proteins: A Potential Mechanism for the Removal of Senescent Macromolecules" Proc. Natl. Acad. Sci. USAI, Vol. 82, 5588, 5591 (1985)). Помимо этого, в работе Ahmed, E.K. et al. указано, что конечные продукты гликирования являются «одной из основных причин спонтанного повреждения клеточных и внеклеточных белков» (Ahmed, E.K. et al., см. выше, стр. 353). Соответственно, накопление конечных продуктов гликирования связано со старением и потерей функции.
[07] Старение клеток и накопление AGE вовлечены в патофизиологию ряда заболеваний и расстройств, помимо саркопении и связанных с возрастом заболеваний. Старение клеток в центральной нервной системе, таких как глиальные клетки, астроциты и клетки микроглии, связано с нейродегенеративными расстройствами. Патологическое накопление стареющих астроцитов связано с болезнью Альцгеймера (БА) (Bhat, R. et al., "Astrocyte Senescence as a Component of Alzheimer's Disease", PLOS ONE, Vol.7(9), e45069, pp.1-10 (Sept. 2012)). Старение микроглиальных клеток, связанное с нормальным старением, усугубляется в результате присутствия амилоидных бляшек, указывающих на БА (Flanary, В.Е. et al, "Evidence That Aging And Amyloid Promote Microglial Cell Senescence", Rejuvenation Research, Vol. 10(1), pp. 61-74 (March 2007)). Присутствие AGE совместно с астроцитами и микроглиальными клетками при БА является еще одним свидетельством присутствия стареющих клеток (Takeda, A., et al. "Advanced glycation end products co-localize with astrocyes and microglial cells in Alzheimer's disease brain", Acta Neuropathologica, Vol. 95, pp. 555-558 (1998)). На основании недавно опубликованных результатов Chinta et al. было выдвинуто предположение, что стрессовые факторы окружающей среды, связанные с болезнью Паркинсона (БП), отчасти могут действовать, вызывая старение ненейрональных глиальных клеток, что способствует характерному снижению целостности нейронов, которое возникает при этом расстройстве (Chinta, S. J. et al. "Environmental stress, ageing and glial cell senescence: a novel mechanistic link to Parkinson's disease?", J Intern Med, Vol. 273, pp. 429-436 (2013)). Старение астроцитов также связано с БП (М. Mori, "The Parkinsonian Brain: Cellular Senescence and Neurodegeneration, SAGE (June 30, 2015) (sage.buckinstitute.org/the-parkinsonian-brain-cellular-senescence-and-neurodegeneration/). В модели семейного бокового амиотрофического склероза (БАС) у грызунов, при котором происходит гиперэкспрессия мутированной супероксиддисмутазы-1 (m-SOD1), повышается скорость, с которой астроциты приобретают фенотип старения (Das, М.М. and Svendsen, С.N., "Astrocytes show reduced support of motor neurons with aging that is accelerated in a rodent model of ALS", Neurobiology of Aging, Vol. 36, pp. 1130-1139 (2015)). Даже при рассеянном склерозе (PC) микроглия и макрофаги приобретают выраженный провоспалительный фенотип, напоминающий SASP, и могут усиливать повреждение нейронов, высвобождая провоспалительные цитокины и молекулы (Luessi, F., et al. "Neurodegeneration in multiple sclerosis: novel treatment strategies" Expert Rev. Neurother., Vol 9, pp. 1061-1077 (2012)).
[08] Некоторые нейродегенеративные расстройства связаны с патологическим клеточным старением вне центральной нервной системы. Большинство сателлитных клеток, также известных как миосателлитные клетки, присутствующих в мышечной ткани пациентов с БАС, проявляют патологическую морфологию, сходную с таковой стареющих клеток, хотя они могут быть способны к пролиферации в условиях in vitro (Pradat, P.-F. et al, "Abnormalities of satellite cells function in amyotrophic lateral sclerosis" Amyotrophic Lateral Sclerosis, Vol. 12, pp. 264-271 (2011)). Сателлитные клетки представляют собой небольшие мультипотентные клетки, обнаруженные в зрелой мышечной ткани, которые могут приводить к появлению дополнительных сателлитных клеток или дифференцироваться в миобласты, а также обеспечивают дополнительные мионуклеусы. В модели мышечной дистрофии Дюшенна (МД) у животных наблюдали снижение пролиферативной способности и преждевременное старение миобластов (Wright, W.Е., "Myoblast Senescence in Muscular Dystrophy" Exp Cell Res, Vol. 157, pp. 343-354 (1985)). Миобласты являются клетками-предшественниками, которые дифференцируются в миоциты (также называемые мышечными клетками).
[09] Нейродегенеративные расстройства также связаны с патологическим накоплением белка (King, O.D., et al, "The tip of the iceberg: RNA-binding proteins with prion-like domains in neurodegenerative disease" Brain Res. Vol. 1462, pp. 61-80 (2012)). Характерной особенностью БП и деменции с тельцами Леви является образование телец Леви, которые образуются внутри нервных клеток. Основным структурным компонентом телец Леви является белок альфа-синуклеин в виде фибрилл. Присутствие клубков и бляшек характерно для БА и используется для окончательной диагностики указанного состояния. Бляшки, состоящие из бета-амилоидного белка (также называемого бета-амилоид, Аβ или А-бета), накапливаются между нервными клетками. Клубки, состоящие из белка тау, образуют скрученные волокна внутри клеток. Прионные заболевания (также известные как трансмиссивные губчатые энцефалопатии (TSE)) включают различные расстройства у людей и животных, такие как болезнь Крейтцфельдта-Якоба, вариант болезни Крейтцфельдта-Якоба, губчатую энцефалопатию крупного рогатого скота (синдром коровьего бешенства), почесуху (скрейпи) (у овец и коз), хроническую изнуряющую болезнь (у оленя и лося), куру и смертельную семейную бессонницу. Прионный белок представляет собой неправильно фолдированную (уложенную) молекулу белка, при этом прионное заболевание может распространяться путем передачи белка с неправильным фолдингом, что приводит к накоплению белка с неправильным фолдингом и вызывает повреждение ткани и гибель клеток (Dobson, D.M., "The structural basis of protein folding and its links with human disease" Phil. Trans. R. Soc. Lond. B, Vol. 356, pp. 133-145 (2001)). Как полагают, при указанных заболеваниях белок представляет собой нормальный белок, который неправильно фолдирован или образует патологический агрегат. В случае некоторых пациентов с семейным БАС мутированная супероксиддисмутаза-1 (SOD1) образует включения и накапливается (Kato, S., et al. "Advanced glycation endproduct-modified superoxide dismutase-1 (SOD1)-positive inclusions are common to familial amyotrophic lateral sclerosis patients with SOD1 gene mutations and transgenic mice expressing human SOD1 with a G85R mutation" Acta Neuropathol, Vol. 100, pp. 490-505 (2000)).
[010] Известно, что стареющие клетки также способствуют размножению раковых клеток. Стареющие клетки связаны с секрецией многих факторов, вовлеченных в межклеточную передачу сигналов, включая провоспалительные факторы; секреция указанных факторов была названа секреторным фенотипом, связанным со старением, или SASP. Результаты одного исследования выявили, что стареющие мезенхимальные стволовые клетки стимулируют пролиферацию и миграцию клеток рака молочной железы путем секреции ИЛ-6 (Di, G-h. et al. IL-6 Secreted from Senescent Mesenchymal Stem Cells Promotes Proliferation and migration of Breast Cancer Cells, PLOS One, Vol. 9, 11, el 13572 (2014)). Результаты другого исследования выявили, что стареющие фибробласты человека увеличивают рост опухолей путем секреции матриксной металлопротеиназы (Liu, D. et al. Senescent Human Fibroblasts Increase the Early Growth of Xenograft Tumors via Matrix Metalloproteinase Secretion, Cancer Res, Vol. 67, 3117-3126 (2007)).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[011] Согласно первому аспекту настоящего изобретения предложено антитело к AGE, содержащее белок или пептид, содержащий по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 и SEQ ID NO: 39. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин.
[012] Согласно второму аспекту настоящего изобретения предложено антитело к AGE, содержащее белок или пептид, содержащий по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин.
[013] Согласно третьему аспекту настоящего изобретения предложено антитело к AGE, содержащее тяжелую цепь и легкую цепь. Тяжелая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 1, SEQ ID NO: 17, SEQ ID NO: 29, SEQ ID NO: 31 и SEQ ID NO: 33, или легкая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 3, SEQ ID NO: 19, SEQ ID NO: 35, SEQ ID NO: 37 и SEQ ID NO: 39. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин.
[014] Согласно четвертому аспекту настоящего изобретения предложено антитело к AGE, содержащее тяжелую цепь и легкую цепь. Тяжелая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 1, SEQ ID NO: 17, SEQ ID NO: 29, SEQ ID NO: 31 и SEQ ID NO: 33, и легкая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 3, SEQ ID NO: 19, SEQ ID NO: 35, SEQ ID NO: 37 и SEQ ID NO: 39. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин.
[015] Согласно пятому аспекту настоящего изобретения предложено антитело к AGE, содержащее участок, определяющий комплементарность (CDR), содержащий по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин. Антитело по существу является неиммуногенным у видов, выбранных из группы, состоящей из мышей, крыс, коз, овец, коров, лошадей, собак и кошек.
[016] Согласно шестому аспекту в настоящем изобретении предложен конъюгат антитела, содержащий фрагмент антитела к AGE, содержащий белок или пептид, содержащий по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична, предпочтительно по меньшей мере на 95% идентична, более предпочтительно по меньшей мере на 98% идентична аминокислотной последовательности, выбранной из группы, состоящей из последовательностей, представленных в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37 и SEQ ID NO: 39, и агент, который вызывает разрушение AGE-модифицированных клеток. Агент, который вызывает разрушение AGE-модифицированных клеток, конъюгирован с фрагментом антитела к AGE. Антитело связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин.
[017] ОПРЕДЕЛЕНИЯ
[018] Термин «пептид» означает молекулу, состоящую из 2-50 аминокислот.
[019] Термин «белок» означает молекулу, состоящую более чем из 50 аминокислот.
[020] Термин «саркопения» означает синдром, характеризующийся (1) низкой мышечной массой и (2) низкой мышечной функцией (низкая мышечная сила или сниженная физическая работоспособность). Мышечная масса может быть измерена с помощью методик визуализации тела, таких как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) или двухэнергетическая рентгеновская абсорбциометрия (DXA или DEXA); анализ электрического сопротивления (BIA); измерения концентрации калия в организме, например, общего калия (TBK) в организме или остаточного калия (PBK) в организме; или антропометрических измерений, таких как обхват середины плеча, толщина складки кожи или обхват голени. Предпочтительно мышечную массу измеряют посредством КТ, МРТ или DXA. Мышечная сила может быть измерена на основании толкающего усиления кисти, сгибания/разгибания колена или максимальной скорости выдоха. Предпочтительно мышечная сила измеряется на основании толкающего усиления кисти. Физическая работоспособность может быть измерена с помощью короткого теста по оценке физической работоспособности, измерения скорости походки, теста «встать и идти» (TGUG) или теста способности подниматься по лестнице. Предпочтительно физическую работоспособность измеряют путем измерения скорости походки. Субъект может быть выявлен как имеющий саркопению или нуждающийся в лечении, если (1) субъекту не менее 25 лет и (2) его или ее измеренная мышечная масса и измеренная мышечная функция находятся в пределах величины двух стандартных отклонений или более ниже среднего значения для здоровых 25-летних индивидуумов того же пола, и при этом не было выявлено какой-либо иной патологии, вызывающей уменьшение мышечной массы и снижение мышечной функции. Предпочтительно возраст субъекта, получающего лечение саркопении, не менее 40 лет. Более предпочтительно возраст субъекта, получающего лечение саркопении, не менее 50 лет. Наиболее предпочтительно возраст субъекта, получающего лечение саркопении, не менее 60 лет. В другом варианте субъект может быть идентифицирован как имеющий саркопению или нуждающийся в лечении, если (1) скорость его или ее походки составляет менее 1,0 м/с на дистанции 4 м, и (2) он или она имеет объективно измеренную низкую мышечную массу, например, аппендикулярную массу относительно квадрата роста, которая меньше или равна 7,23 кг/м2 для мужчин или меньше или равна 5,67 кг/м2 для женщин (Fielding, R.А., et ah, "Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences", Journal of the American Medical Directors Association, Vol. 12(4), pp. 249-256 (May 2011).
[021] Термин «нейродегенеративное расстройство» означает расстройство, которое приводит к потере функции нейронов и/или их гибели в центральной нервной системе, включая головной мозг. Такие расстройства включали нейродегенеративные расстройства центральной нервной системы, такие как БА, БП, деменцию с тельцами Леви, PC, прионные заболевания (также известные как трансмиссивные губчатые энцефалопатии (TSE), включая болезнь Крейтцфельдта-Якоба, вариант болезни Крейтцфельдта-Якоба, губчатую энцефалопатию крупного рогатого скота (болезнь коровьего бешенства), почесуху (у овец и коз), хроническую изнурительную болезнь (у оленя и лося), куру и смертельную семейную бессонницу) и БАС.
[022] «Нейродегенеративные белки» представляют собой белки, которые накапливаются у пациента, имеющего нейродегенеративное расстройство, и которые связаны с нейродегенеративным расстройством. Примеры включают бляшки белка бета-амилоида (связанные с БА), клубки белка тау (связанные с БА), мутированную супероксиддисмутазу-1 (связанную с БАС), агрегаты прионного белка (связанные с TSE) и фибриллы белка альфа-синуклеина (связанные с БП и деменцией с тельцами Леви). «Нейродегенеративный белок» представляет собой форму белка, которая накапливается во время нейродегенеративного расстройства, как правило, мутированную или форму с неправильным фолдингом.
[023] Термины «конечный продукт повышенного гликирования», «AGE», «AGE-модифицированный белок или пептид», «конечный продукт гликирования» и «антиген AGE» относятся к модифицированным белкам или пептидам, которые образуются в результате реакции сахаров с боковыми цепями белков, которые дополнительно перегруппировываются и образуют необратимые поперечные сшивки. Этот процесс начинается с обратимой реакции между восстанавливающим сахаром и аминогруппой с образованием основания Шиффа, которое затем в результате перегруппировки Амадори образует ковалентно связанный продукт. После образования продукт перегруппировки Амадори подвергается дальнейшей перегруппировке с получением AGE. AGE-модифицированные белки и антитела к AGE-модифицированным белкам описаны в патенте США №5702704 автором Bucala («Bucala») и US 6380165 коллективом авторов Al-Abed et al. («Al-Abed»). Гликированные белки или пептиды, которые не претерпели необходимой перегруппировки для образования AGE, такие как N-дезоксифруктозиллизин, обнаруженный на гликированном альбумине, не являются AGE. AGE могут быть выявлены на основании присутствия модификаций AGE (также называемых эпитопами AGE или фрагментами AGE), таких как 2-(2-фуроил)-4(5)-(2-фуранил)-1Н-имидазол («FFI»); 5-гидроксиметил-1-алкилпиррол-2-карбальдегид («пирралин»); 1-алкил-2-формил-3,4-дигликозилпиррол («AFGP»), не флуоресцентная модель AGE; карбоксиметиллизин; и пентозидин. ALI, еще один AGE, описан в работе Al-Abed.
[024] «Антитело, которое связывается с AGE-модифицированным белком на клетке», «анти-AGE антитело» или «антитело к AGE» означает антитело, фрагмент антитела или другой белок или пептид, который связывается с AGE-модифицированным белком или пептидом, который предпочтительно содержит константную область антитела, причем указанный протеин или пептид, который был модифицирован AGE, представляет собой белок или пептид, который обычно обнаруживается на поверхности клетки, предпочтительно клетки млекопитающего, более предпочтительно клетки человека, кошки, собаки, лошади, верблюда (например, верблюда или альпаки), крупного рогатого скота, овцы или козы. «Антитело, которое связывается с AGE-модифицированным белком на клетке», «анти-AGE антитело» или «антитело к AGE» не включает антитело или другой белок, который связывается с аналогичной специфичностью и селективностью с AGE-модифицированным белком или пептидом, и тем же самым белком или пептидом, не модифицированным AGE (то есть присутствие модификации AGE не увеличивает связывание). AGE-модифицированный альбумин не является AGE-модифицированным белком на клетке, поскольку альбумин не является белком, обычно встречающимся на поверхности клеток. «Антитело, которое связывается с AGE-модифицированным белком на клетке», «анти-AGE антитело», или «антитело к AGE» включает только те антитела, которые приводят к удалению, разрушению или гибели клетки. В область настоящего изобретения также включены антитела, которые конъюгированы, например, с токсином, лекарственным препаратом или другим химическим веществом или частицей. Предпочтительно антитела являются моноклональными антителами, но также возможны поликлональные антитела.
[025] Термин «стареющая клетка» означает клетку, которая находится в состоянии необратимой остановки пролиферации и экспрессирует один или более биомаркеров старения, таких как активация p16Ink4a или экспрессия связанной со старением β-галактозидазы. Термин также включает клетки, которые экспрессируют один или более биомаркеров старения, не пролиферируют в условиях in vivo, но могут пролиферировать в условиях in vitro при определенных условиях, например, некоторые сателлитные клетки, обнаруженные в мышцах пациентов с БАС.
[026] Термин «увеличение продолжительности жизни без заболеваний» означает уменьшение фенотипов, связанных с возрастом. Фенотипы, связанные с возрастом, включают, например, саркопению, катаракту, потерю жировой ткани и лордокифоз.
[027] Термин «вариант» означает нуклеотидную, белковую или аминокислотную последовательность, отличную от конкретно идентифицированных последовательностей, в которой один или более нуклеотидов, белков или аминокислотных остатков удалены, замещены или добавлены. Варианты могут представлять собой природные аллельные варианты или неприродные варианты. Варианты идентифицированных последовательностей могут сохранять некоторые или все функциональные характеристики идентифицированных последовательностей.
[028] Термин «процент (%) идентичности последовательностей» определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в эталонной полипептидной последовательности, после сопоставления последовательностей и введения пробелов, если это необходимо, для достижения максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен как части идентичности последовательностей. Сопоставление для определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, используя общедоступное компьютерное программное обеспечение, такое как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Предпочтительно значения процента идентичности последовательностей (%) рассчитывают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 общедоступна от Genentech, Inc. (Южный Сан-Франциско, Калифорния, США) или может быть скомпилирована из исходного кода, который был подан с документацией пользователя в Бюро по защите авторских прав США и зарегистрирован под номером регистрации прав на объект авторского права США TXU510087. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, включая цифровой UNIX V4.0D. Все параметры сравнения последовательностей задаются программой ALIGN-2 и не меняются.
[029] В тех случаях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, идентичность последовательностей (%) конкретной аминокислотной последовательности А в отношении или с конкретной аминокислотной последовательностью В (что можно перефразировать как конкретная аминокислотная последовательность А, которая имеет или обладает определенным процентом идентичности аминокислотной последовательности в отношении, с или в сравнении с конкретной аминокислотной последовательностью В), рассчитывается следующим образом: 100 умножить на долю X/Y, где X это количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 при сопоставлении этой программой А и В, и где Y это общее количество аминокислотных остатков в B. Если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то процент идентичности аминокислотной последовательности А с В не будет равен проценту идентичности аминокислотной последовательности В с А. Если не указано иное, в настоящей заявке все значения процента идентичности аминокислотных последовательностей получают с использованием компьютерной программы ALIGN-2.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[030] На Фиг. 1 представлен график зависимости ответа от времени в эксперименте со связыванием антитела.
ПОДРОБНОЕ ОПИСАНИЕ
[031] Выявление связи между клеточным старением и саркопенией позволяет использовать новые возможности лечения. Например, если антитела к AGE вводят субъекту, то антитела будут специфично и селективно нацелены на стареющие клетки и вызывают гибель или индуцируют апоптоз в таких клетках, экспрессирующих AGE-модифицированный белок или пептид.
[032] В настоящем изобретении используется открытие, согласно которому усиленный клиренс клеток, экспрессирующих AGE-модифицированные белки или пептиды (AGE-модифицированные клетки), обеспечивает пользу при лечении или облегчении саркопении. Это может быть достигнуто путем введения субъекту антител к AGE.
[033] Введение антител к AGE субъекту также может быть использовано для увеличения продолжительности жизни без заболеваний. Продолжительность жизни без заболеваний может быть увеличена за счет уменьшения фенотипов, связанных с возрастом. Введение антител к AGE можно использовать, например, для предотвращения или задержки начала развития катаракты, лордокифоза или потери жировой ткани.
[034] Другие заболевания или расстройства, связанные с клеточным старением, также можно лечить или улучшать их течение с использованием антител к AGE. Например, антитела к AGE можно использовать терапевтически для лечения нейродегенеративных расстройств или рака.
[035] Антитело, которое связывается с AGE-модифицированным белком на клетке («анти-AGE антитело» или «антитело к AGE»), известно в данной области техники. Примеры включают антитела, которые описаны в патентах США №5702704 (Bucala) и №6380165 (Al-Abed et al.). Примеры включают антитело, которое связывается с одним или более AGE-модифицированными белками, содержащими модификацию AGE, такими как FFI, пирралин, AFGP, ALI, карбоксиметиллизин, карбоксиэтиллизин и пентозидин, а также смеси указанных антител. Предпочтительно антитело связывается с белками, модифицированными карбоксиметиллизином. Предпочтительно антитело является неиммуногенным у животного, у которого оно будет использовано, например, неиммуногенным у человека; животных-компаньонов, включая кошек, собак и лошадей; и коммерчески важных животных, таких как верблюды (или альпака), домашний скот (крупный рогатый скот), овцы и козы. Более предпочтительно антитело содержит константную область антител из того же вида, как и антитела животного, для снижения иммунного ответа на антитело, т.е. антитело гуманизировано (для человека), содержит фрагменты антител кошачьих (для кошек), содержит фрагменты антител собачьих (для собак), содержит фрагменты антител лошадиных (для лошадей), содержит фрагменты антител верблюдовых (для верблюда или альпаки), содержит фрагменты антител крупного рогатого скота (для крупного рогатого скота), содержит фрагменты антител овец (для овец) или коз (для коз). Наиболее предпочтительно антитело идентично антителу животного, у которого оно будет использовано (за исключением вариабельной области), такому как антитело человека, кошачье антитело, собачье антитело, конское антитело, верблюжье антитело, бычье антитело, овечье антитело или козье антитело. Более подробная информация о константных областях и других частях антител для указанных животных представлена ниже. Предпочтительно антитело представляет собой моноклональное антитело (МАТ).
[036] Особенно предпочтительное антитело к AGE представляет собой антитело, которое связывается с белком или пептидом, который содержит модификацию, представляющую собой карбоксиметиллизин. Карбоксиметиллизин (также известный как CML, N(эпсилон)-(карбоксиметил)лизин, N(6)-карбоксиметиллизин или 2-амино-6-(карбоксиметиламино)гексановая кислота) обнаружен на белках или пептидах и липидах как результат окислительного стресса и химического гликирования, и его присутствие коррелировало со старением. CML-модифицированные белки или пептиды распознаются рецептором RAGE, который экспрессируется в различных клетках. CML хорошо изучен, и продукты, связанные с CML, являются коммерчески доступными. Например, Cell Biolabs, Inc. продает антигены CML-BSA, поликлональные антитела к CML, наборы для иммуноблотинга CML и наборы для конкурентного ИФА для CML (www.cellbiolabs.com/cml-assays). Особенно предпочтительное антитело содержит вариабельную область коммерчески доступного мышиного антитела к конечному продукту гликирования, которое вырабатывается к карбоксиметиллизину, конъюгированного с гемоцианином фиссуреллы, МАТ к карбоксиметиллизину (клон 318003), доступного от R&D Systems, Inc. (Миннеаполис, Миннесота, США; каталожный номер МАВ3247), которое модифицировано для включения константной области человека (или константной области животного, которому оно будет введено). Коммерчески доступные антитела, такие как антитело к карбоксиметиллизину, соответствующее каталожному номеру МАВ3247 от R&D Systems, Inc., могут быть предназначены для диагностических целей и могут содержать материал, который не подходит для использования у животных или человека. Предпочтительно коммерчески доступные антитела очищают и/или выделяют перед использованием у животных или человека для удаления токсинов или другого потенциально опасного материала.
[037] Антитело к AGE имеет низкую скорость диссоциации из комплекса антитело-антиген или kd (также называемую hack или скорость обратной реакции), предпочтительно не более 9×10-3, 8×10-3, 7×10-3 или 6×10-3 (с-1). Антитело к AGE обладает высокой аффинностью в отношении AGE-модифицированного белка клетки, которая может быть выражена как низкая константа диссоциации KD не более 9×10-6, 8×10-6, 7×10-6, 6×10-6, 5×10-6, 4×10-6 или 3×10-6 (М). Предпочтительно связывающие свойства антитела к AGE сходны, аналогичны или лучше таковых для МАТ к карбоксиметиллизину (клон 318003), доступного от R&D Systems, Inc. (Миннеаполис, Миннесота, США, каталожный номер МАВ3247), как показано на фиг. 1.
[038] Антитело к AGE может разрушать AGE-модифицированные клетки посредством антителозависимой клеточно-опосредованной цитотоксичности (ADCC). ADCC представляет собой механизм опосредованной клетками иммунной защиты, при котором эффекторная клетка иммунной системы активно лизирует клетку-мишень, поверхностные мембранные антигены которой были связаны со специфичными антителами. ADCC может быть опосредована природными клетками-киллерами (NK-клетками), макрофагами, нейтрофилами или эозинофилами. Эффекторные клетки связываются с частью Fc связанного антитела.
[039] Антитело к AGE может быть конъюгировано с агентом, который вызывает разрушение AGE-модифицированных клеток. Подходящие агенты могут представлять собой токсин, цитотоксический агент, магнитные наночастицы и магнитные спин-вихревые диски.
[040] Токсин, например, порообразующие токсины (PFT) (Aroian R. et al, "Pore-Forming Toxins and Cellular Non-Immune Defenses (CNIDs)," Current Opinion in Microbiology, 10:57-61 (2007)), конъюгированный с антителом к AGE, может быть введен пациенту путем инъекции, чтобы селективно нацелено воздействовать и удалить AGE-модифицированные клетки. Антитело к AGE распознает и связывается с AGE-модифицированными клетками. Затем токсин вызывает образование пор на поверхности клетки и последующее удаление клетки посредством осмотического лизиса.
[041] Магнитные наночастицы, конъюгированные с антителом к AGE, могут быть введены пациенту путем инъекции для нацеленного воздействия и удаления AGE-модифицированных клеток. Магнитные наночастицы могут быть нагреты путем применения магнитного поля для селективного удаления AGE-модифицированных клеток.
[042] В качестве альтернативы магнитные спин-вихревые диски, которые намагничиваются только при применении магнитного поля для того чтобы избежать самоагрегации, которая может блокировать кровеносные сосуды, начинают вращаться при применении магнитного поля, вызывая нарушение целостности мембраны клеток-мишеней. Магнитные спин-вихревые диски, конъюгированные с антителами к AGE, специфично нацелено воздействуют на AGE-модифицированные типы клеток, не удаляя другие клетки.
[043] Антитела, как правило, содержат две тяжелые цепи и две легкие цепи полипептидов, соединенные с образованием молекулы «Y»-формы. Константная область определяет механизм, используемый для нацеливания на антиген. Аминокислотная последовательность на конце «Y» (вариабельная область) варьируется среди различных антител. Такая изменчивость обеспечивает специфичность антитела в отношении связываемого антигена. Вариабельная область, которая включает концы легкой и тяжелой цепей, далее подразделяется на гипервариабельные области (HV - иногда также называемые участками, определяющими комплементарность, или CDR) и каркасные (FR) участки. Если антитела получают рекомбинантными способами, то можно получить одно антитело с вариабельными областями (или участками, определяющими комплементарность), которые связываются с двумя разными антигенами, причем каждый конец «Y» является специфичным в отношении каждого антигена; такие антитела называют биспецифичными антителами.
[044] Гуманизированное антитело к AGE в соответствии с настоящим изобретением может содержать аминокислотную последовательность константной области человека, представленную в SEQ ID NO: 22. Участки, определяющие комплементарность, тяжелой цепи гуманизированного антитела к AGE могут содержать одну или более из последовательностей белка, представленных в SEQ ID NO: 23 (CDR1H), SEQ ID NO: 24 (CDR2H) и SEQ ID NO: 25 (CDR3H). Участки, определяющие комплементарность, легкой цепи гуманизированного антитела к AGE могут содержать одну или более последовательностей белка, представленных в SEQ ID NO: 26 (CDR1L), SEQ ID NO: 27 (CDR2L) и SEQ ID NO: 28 (CDR3L),
[045] Тяжелая цепь иммуноглобулина G1 человека (Homo sapiens) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 1. Вариабельная область тяжелой цепи может содержать или может включать последовательность белка, представленную в SEQ ID NO: 2. Участки, определяющие комплементарность, вариабельной области тяжелой цепи (SEQ ID NO: 2), представлены в последовательностях SEQ ID NO: 41, SEQ ID NO: 42 и SEQ ID NO: 43. Легкая каппа-цепь человека (Homo sapiens) иммуноглобулина G1 может содержать или может включать последовательность белка, представленную в SEQ ID NO: 3. Вариабельная область легкой каппа-цепи может содержать или может включать последовательность белка, представленную в SEQ ID NO: 4. Необязательно остаток аргинина (Arg или R) в положении 128 последовательности, представленной в SEQ ID NO: 4, может отсутствовать. Участки, определяющие комплементарность, вариабельной области легкой цепи (SEQ ID NO: 4), представлены в последовательностях SEQ ID NO: 44, SEQ ID NO: 45 и SEQ ID NO: 46. Вариабельные области могут быть оптимизированы по кодонам, синтезированы и клонированы в векторы экспрессии, содержащие константные области иммуноглобулина G1 человека. Помимо этого вариабельные области могут быть использованы для гуманизации антител, отличных от антител человека.
[046] Тяжелая цепь антитела может кодироваться последовательностью ДНК, приведенной в SEQ ID NO: 12, которая представляет собой тяжелую цепь мышиного иммуноглобулина G2b к AGE. Белковая последовательность тяжелой цепи мышиного иммуноглобулина G2b к AGE, кодируемой последовательностью, представленной в SEQ ID NO: 12, приведена в последовательности SEQ ID NO: 16. Вариабельная область мышиного антитела представлена в SEQ ID NO: 20, что соответствует положениям 25-142 из последовательности, приведенной в SEQ ID NO: 16. Тяжелая цепь антитела альтернативно может кодироваться последовательностью ДНК, приведенной в SEQ ID NO: 13, которая представляет собой тяжелую цепь химерного иммуноглобулина G1 человека к AGE. Белковая последовательность тяжелой цепи химерного иммуноглобулина G1 человека к AGE, кодируемой последовательностью, представленной в SEQ ID NO: 13, приведена в SEQ ID NO: 17. Химерный иммуноглобулин человека к AGE содержит мышиную вариабельную область, представленную в последовательности SEQ ID NO: 20 в положениях 25-142. Легкая цепь антитела может кодироваться последовательностью ДНК, приведенной в SEQ ID NO: 14, которая представляет собой легкую каппа-цепь мышиного антитела к AGE. Белковая последовательность легкой каппа-цепи мышиного антитела к AGE, кодируемой последовательностью, представленной в SEQ ID NO: 14, приведена в SEQ ID NO: 18. Вариабельная область мышиного антитела представлена в SEQ ID NO: 21, что соответствует положениям 21-132 из последовательности SEQ ID NO: 18. Легкая цепь антитела может альтернативно кодироваться последовательностью ДНК, приведенной в SEQ ID NO: 15, которая представляет собой химерную легкую каппа-цепь антитела человека к AGE. Белковая последовательность химерной легкой каппа-цепи антитела человека к AGE, кодируемой последовательностью, представленной в SEQ ID NO: 15, приведена в SEQ ID NO: 19. Химерный иммуноглобулин человека к AGE содержит вариабельную область мыши, представленную в последовательности SEQ ID NO: 21 в положениях 21-132.
[047] Гуманизированное антитело к AGE в соответствии с настоящим изобретением может содержать или может включать одну или более гуманизированных тяжелых цепей или гуманизированных легких цепей. Гуманизированная тяжелая цепь может кодироваться последовательностью ДНК, представленной в SEQ ID NO: 30, 32 или 34. Белковые последовательности гуманизированных тяжелых цепей, кодируемых последовательностями, представленными в SEQ ID NO: 30, 32 и 34, приведены в SEQ ID NO: 29, 31 и 33, соответственно. Гуманизированная легкая цепь может кодироваться последовательностью ДНК, представленной в SEQ ID NO: 36, 38 или 40. Белковые последовательности гуманизированных легких цепей, кодируемые последовательностями, представленными в SEQ ID NO: 36, 38 и 40, приведены в SEQ ID NO: 35, 37 и 39, соответственно. Предпочтительно гуманизированное антитело к AGE содержит максимальное количество последовательности человека, сохраняя при этом первоначальную специфичность антитела. Может быть сконструировано полное гуманизированное антитело, которое содержит тяжелую цепь, содержащую последовательность белка, выбранную из последовательностей, приведенных в SEQ ID NO: 29, 31 и 33, и легкую цепь, содержащую последовательность белка, выбранную из последовательностей, приведенных в SEQ ID NO: 35, 37 и 39.
[048] Белковая последовательность антитела из вида, отличного от человека, может быть модифицирована с целью включения вариабельной области тяжелой цепи, содержащей последовательность, приведенную в SEQ ID NO: 2, или легкой каппа-цепи, содержащей последовательность, приведенную в SEQ ID NO: 4. Вид, отличный от человека, может быть животным-компаньоном, таким как домашняя кошка или домашняя собака, или домашний скот, такой как крупный рогатый скот, лошадь или верблюд. Предпочтительно вид, отличный от человека, не является мышью. Тяжелая цепь иммуноглобулина гамма-4 лошади (Equus caballus) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 5 (номер доступа в EMBL/GenBank AY445518). Тяжелая цепь иммуноглобулина-дельта лошади (Equus caballus) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 6 (номер доступа в EMBL/GenBank AY631942). Тяжелая цепь иммуноглобулина А собаки (Canis familiaris) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 7 (номер доступа в GenBank L36871). Тяжелая цепь иммуноглобулина Е собаки (Canis familiaris) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 8 (номер доступа в GenBank L36872). Тяжелая цепь иммуноглобулина G2 кошки (Felis catus) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 9 (номер доступа в DDBJ/EMBL/GenBank KF811175).
[049] Животные из семейства верблюдовых, такие как верблюды (Camelus dromedarius и Camelus bactrianus), ламы (Lama glama, Lama pacos и Lama vicugna), альпаки (Vicugna pacos) и гуанако (Lama guanicoe), имеют уникальное антитело, которое не встречается у других млекопитающих. В дополнение к обычным иммуноглобулинам G, состоящим из тетрамеров тяжелых и легких цепей, верблюдовые также имеют иммуноглобулины G, содержащие тяжелую цепь, но лишенные легких цепей, которые существуют как димеры тяжелой цепи. Эти антитела известны как антитела, состоящие только из тяжелой цепи, HCAbs, однодоменные антитела или sdAbs, и вариабельная область антитела верблюдовых, состоящего только из тяжелой цепи, известна как VHH. В антителах верблюдовых, состоящих только из тяжелой цепи, отсутствует домен СН1 тяжелой цепи и присутствует шарнирная область, которая не встречается у других видов. Вариабельная область однодоменного антитела арабского верблюда (Camelus dromedarius) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 10 (номер доступа в GenBank AJ245148). Вариабельная область тяжелой цепи тетрамерного иммуноглобулина арабского верблюда (Camelus dromedarius) может содержать или может включать последовательность белка, представленную в SEQ ID NO: 11 (номер доступа в GenBank AJ245184).
[050] Помимо верблюдовых антитела, состоящие только из тяжелой цепи, также встречаются у хрящевых рыб, таких как акулы, скаты и ромбовые скаты. Этот тип антитела известен как новый иммуноглобулинподобный антигенный рецептор или IgNAR, и вариабельный домен IgNAR известен как VNAR. IgNAR существует в виде димеров двух идентичных тяжелых цепей, каждая из которых состоит из одного вариабельного домена и пяти константных доменов. Как и у верблюдовых, данный тип антител лишен легкой цепи.
[051] Белковые последовательности дополнительных видов, отличных от человека, могут быть легко найдены в онлайн базах данных, таких как международная база данных по иммуногенетике (www.imgt.org), Европейский институт биоинформатики (www.ebi.ac.uk), Банк ДНК Японии (ddbj.nig.ac.jp/arsa) или Национальный информационный центр по биотехнологии (www.ncbi.nlm.nih.gov).
[052] Антитело к AGE или его вариант может содержать вариабельную область тяжелой цепи, которая имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2 или SEQ ID NO: 20, включая их посттрансляционные модификации. Вариабельная область, которая имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, может содержать замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, однако антитело к AGE, содержащее указанную последовательность, сохраняет способность связываться с AGE. Замены, вставки или делеции могут возникать в областях, расположенных за пределами вариабельной области.
[053] Антитело к AGE или его вариант могут содержать вариабельную область легкой цепи, которая имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 4 или SEQ ID NO: 21, включая их посттрансляционные модификации. Вариабельная область, которая имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, может содержать замены (например, консервативные замены), вставки или делеции относительно эталонной последовательности, однако антитело к AGE, содержащее указанную последовательность, сохраняет способность связываться с AGE. Замены, вставки или делеции могут возникать в областях, расположенных за пределами вариабельной области.
[054] В другом варианте антитело может содержать участки, определяющие комплементарность, из коммерчески доступного мышиного антитела к конечному продукту гликирования, которое вырабатывается к карбоксиметиллизину, конъюгированного с гемоцианином (CML-KLH), МАТ к карбоксиметиллизину (клон 318003), доступного от R&D Systems, Inc (Миннеаполис, Миннесота, США, каталожный номер МАВ3247).
[055] Антитело может содержать или может включать константные области, которые позволяют разрушать клетки-мишени с помощью иммунной системы субъекта.
[056] Также могут быть использованы смеси антител, которые связываются более чем с одним типом AGE из AGE-модифицированных белков.
[057] Также могут быть использованы биспецифичные антитела, которые представляют собой антитела к AGE, направленные к двум разным эпитопам. Подходящие антитела будут содержать вариабельную область (или участок, определяющий комплементарность) из одного антитела к AGE и вариабельную область (или участок, определяющий комплементарность) из другого антитела.
[058] Фрагменты антител можно использовать вместо целых антител. Например, иммуноглобулин G может быть разделен на более мелкие фрагменты с помощью ферментативного расщепления. Расщепление папаином отделяет N-концевую часть дисульфидных мостиков между тяжелыми цепями с получением фрагментов Fab. Фрагменты Fab содержат легкую цепь и один из двух N-концевых доменов тяжелой цепи (также известный как фрагмент Fd). Расщепление пепсином отделяет С-концевую часть дисульфидных мостиков между тяжелыми цепями с получением фрагментов F(ab')2. Фрагменты F(ab')2 содержат легкие цепи и два N-концевых домена, соединенных дисульфидными мостиками. Расщепление пепсином также приводит к образованию фрагмента Fv (вариабельный фрагмент) и фрагмента Fc (кристаллизующийся фрагмент). Фрагмент Fv содержит два N-концевых вариабельных домена. Фрагмент Fc содержит домены, которые взаимодействуют с рецепторами иммуноглобулинов на клетках и с начальными элементами каскада комплемента. Пепсин также может расщеплять иммуноглобулин G до третьей константной области тяжелой цепи (CH3) с образованием большого фрагмента F(abc) и небольшого фрагмента pFc'. В другом варианте фрагменты антител могут быть получены рекомбинантными способами.
[059] Если необходимы дополнительные антитела, они могут быть получены с использованием известных способов. Например, выработка поликлональных антител (ПАТ) может быть индуцирована у млекопитающего-хозяина путем введения одной или более инъекций иммуногена и, если необходимо, адъюванта. Как правило, иммуноген (и адъювант) вводят млекопитающему с помощью подкожной или внутрибрюшинной инъекции. Иммуноген может представлять собой AGE-модифицированный белок клетки, такой как AGE-антитромбин III, AGE-кальмодулин, AGE-инсулин, AGE-церулоплазмин, AGE-коллаген, AGE-катепсин В, AGE-альбумин, AGE-кристаллин, AGE-активатор плазминогена, AGE-белок плазматической мембраны клеток эндотелия, AGE-альдегидредуктаза, AGE-трансферрин, AGE-фибрин, AGE-медь/цинк-содержащая СОД, AGE-апоВ, AGE-фибронектин, AGE-панкреатическая рибоза, AGE-апоА-I и II, AGE-гемоглобин, AGE-Na+/K+-АТФаза, AGE-плазминоген, AGE-миелин, AGE-лизоцим, AGE-иммуноглобулин, AGE-транспортирующий глюкозу белок эритроцитов, AGE-β-N-ацетилгексокиназа, AGE-апоЕ, AGE-белок клеточной мембраны эритроцитов, AGE-альдозоредуктаза, AGE-ферритин, AGE-спектрин эритроцитов, AGE-алкогольдегидрогеназа, AGE-гаптоглобин, AGE-тубулин, AGE-гормон щитовидной железы, AGE-фибриноген, AGE-β2-микроглобулин, AGE-сорбитолдегидрогеназа, AGE-α1-антитрипсин, AGE-карбонатдегидратаза, AGE-РНКаза, AGE-липопротеин низкой плотности, AGE-гексокиназа, AGE-апоС-I, AGE-гемоглобин, такой как AGE-гемоглобин человека, AGE-альбумин, такой как AGE-бычий сывороточный альбумин (AGE-БСА) и AGE-сывороточный альбумин человека, AGE-липопротеин низкой плотности (AGE-LDL) и AGE-коллаген IV. В качестве AGE-антигенов также могут быть использованы AGE-модифицированные клетки, такие как AGE-модифицированные эритроциты, целые, лизированные или частично расщепленные. Примеры адъювантов включают полный адъювант Фрейнда, монофосфориллипид А, синтетический дикориномиколат трегалозы, гидроксид алюминия (квасцы), белки теплового шока HSP 70 или HSP96, эмульсию сквалена, содержащую монофосфориллипид А, α2-макроглобулин и поверхностно-активные вещества, включая масляные эмульсии, плюроновые полиолы, полианионы и динитрофенол. Для улучшения иммунного ответа иммуноген может быть конъюгирован с полипептидом, который является иммуногенным у хозяина, таким как гемоцианин фиссуреллы (KLH), сывороточный альбумин, бычий тиреоглобулин, холерный токсин, нестойкий энтеротоксин, частицы диоксида кремния или ингибитор трипсина сои. В другом варианте ПАТ могут быть получены у кур, вырабатывающих молекулы IgY.
[060] Моноклональные антитела (МАТ) также могут быть получены путем иммунизации хозяина или лимфоцитов хозяина, сбора секретирующих МАТ (или потенциально секретирующих) лимфоцитов, слияния полученных лимфоцитов с иммортализованными клетками (например, клетками миеломы) и отбора тех клеток, которые секретируют желаемое МАТ. Могут быть использованы другие методики, такие как методика EBV-гибридомы. Методики получения химерных антител с помощью сплайсинга генов, кодирующих вариабельные области антител, с генами константных областей иммуноглобулина человека (или другого животного), позволяют получать «химерные антитела», которые по существу являются антителами человека (гуманизированными) или по существу «превращенными» в антитела других животных (например, кошки, собаки, лошади, верблюда или альпаки, крупного рогатого скота, овцы или козы) на уровне аминокислот. Если необходимо, МАТ могут быть очищены от культуральной среды или асцитной жидкости с помощью стандартных методик, таких как хроматография на носителе белок А-сефароза или гидроксилапатит, гель-электрофорез, диализ, осаждение сульфатом аммония или аффинная хроматография. Помимо этого моноклональные антитела человека могут быть получены путем иммунизации трансгенных мышей, содержащих третью копию транс-локусов IgG человека и подавленные эндогенные локусы Ig мыши, или с использованием трансгенных мышей, несущих гены человека. Гуманизированные моноклональные антитела и их фрагменты также могут быть получены с помощью технологий фагового дисплея.
[061] «Фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие всасывание агенты и тому подобное, совместимые с фармацевтическим введением. Предпочтительные примеры подходящих носителей или разбавителей включают воду, физиологический раствор, растворы Рингера и раствор декстрозы. В композиции также могут быть включены дополнительные активные соединения. Растворы и суспензии, используемые для парентерального введения, могут включать стерильный разбавитель, такой как вода для инъекций, физиологический раствор, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; буферы, такие как буферы на основе ацетатов, цитратов или фосфатов, и агенты для корректировки тоничности, такие как хлорид натрия или декстроза. рН можно корректировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозные флаконы из стекла или пластика.
[062] Фармацевтические композиции, подходящие для инъекций, включают стерильные водные растворы или дисперсии для немедленного приготовления стерильных растворов или дисперсии для инъекций. Фармацевтические композиции антител, подходящие для инъекций, могут содержать различные вспомогательные вещества. Носители, подходящие для внутривенного введения, включают физиологический раствор, бактериостатическую воду, CREMOPHOR EL® (BASF, Парсиппани, Нью-Джерси, США) или забуференный фосфатом физиологический раствор (ФСБ). Во всех случаях композиция должна быть стерильной и должна быть жидкой так, чтобы ее можно было ввести с использованием шприца. Подходящие композиции должны быть стабильными во время производства и хранения и должны быть защищены от загрязнения микроорганизмами, такими как бактерии и грибы. Различные антибактериальные и противогрибковые агенты, например, парабены, хлорбутанол, фенол, аскорбиновая кислота и тимеросал, могут быть загрязнены микроорганизмами. Композиция может содержать изотонические агенты, такие как сахара, полиспирты, такие как манит, сорбит, и хлорид натрия. Композиции, которые могут замедлять всасывание, содержат такие агенты как моностеарат алюминия и желатин. Стерильные растворы для инъекций могут быть получены путем включения антител и, необязательно, других терапевтических компонентов, в необходимом количестве в подходящий растворитель с одним или комбинацией ингредиентов, если требуется, с последующей стерилизацией. Способы получения стерильных твердых веществ для приготовления стерильных растворов для инъекций включают вакуумную сушку и сушку вымораживанием с получением твердого вещества.
[063] Для введения путем ингаляции антитела могут быть доставлены в виде аэрозольного спрея из распылителя или контейнера под давлением, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода. Антитела также могут быть доставлены путем ингаляции в виде сухого порошка, например, с использованием платформы для доставки ингаляционных лекарственных препаратов iSPERSE™ (PULMATRJX, Лексингтон, Массачусетс, США). Использование антител к AGE, которые представляют собой куриные антитела (IgY), может быть неиммуногенным у различных животных, включая человека, при введении путем ингаляции.
[064] Соответствующий уровень дозировки каждого типа антитела обычно составит от приблизительно 0,01 до 500 мг на кг массы тела пациента. Предпочтительно уровень дозировки составит от приблизительно 0,1 до приблизительно 250 мг/кг; более предпочтительно от приблизительно 0,5 до приблизительно 100 мг/кг. Подходящий уровень дозировки может составлять от приблизительно 0,01 до 250 мг/кг, от приблизительно 0,05 до 100 мг/кг или от приблизительно 0,1 до 50 мг/кг. В пределах указанного диапазона дозировка может составлять от 0,05 до 0,5, от 0,5 до 5 или от 5 до 50 мг/кг. Несмотря на то, что каждый тип антитела можно вводить по схеме от 1 до 4 раз в сутки, например, один или два раза в сутки, антитела обычно имеют длительный период полувыведения в условиях in vivo. Соответственно, каждый тип антитела можно вводить один раз в сутки, один раз в неделю, один раз каждые две или три недели, один раз в месяц или один раз каждые 60-90 дней.
[065] Субъект, которому вводят антитело к AGE, может пройти обследование, чтобы определить, было ли лечение саркопении эффективным, путем измерения изменений мышечной массы с течением времени. Например, у субъекта может быть измерена исходная мышечная масса с последующим введением антитела к AGE. Эффективность лечения может быть определена путем периодического измерения мышечной массы у субъекта и сравнения последующих измерений с исходным измерением. Лечение саркопении у субъекта может считаться эффективным, если он или она не имеет потери мышечной массы между последовательными измерениями или с течением времени. В другом варианте также можно контролировать концентрацию и/или количество стареющих клеток в жировой или мышечной ткани. Введение антитела и последующее обследование можно повторять до достижения желаемого терапевтического результата.
[066] Стандартные лекарственные формы могут быть получены, чтобы облегчить введение и улучшить единообразие доз. Стандартная дозированная форма относится к физически дискретным единицам, подходящим для введения в виде однократных доз для субъекта, подлежащего лечению, содержащим терапевтически эффективное количество одного или более типов антител в комбинации с необходимым фармацевтическим носителем. Предпочтительно стандартная лекарственная форма находится в герметичном контейнере и является стерильной.
[067] Любое млекопитающее, у которого может развиться саркопения или другие заболевания или расстройства, связанные с клеточным старением, можно лечить с использованием, описанных в настоящем документе способов. Человек является предпочтительным млекопитающим для лечения. Другие млекопитающие, которые могут получить лечение, включают мышей, крыс, коз, овец, коров, лошадей и животных-компаньонов, таких как собаки или кошки. Субъект, нуждающийся в лечении, может быть выявлен с помощью диагностики заболевания или расстройства, которое, как известно, вызывает повышенные уровни AGE, такого как, например, диабет (типа 1 и 2), или присутствия патологического состояния, связанного с AGE, такого как, например, атеросклероз, воспаление, ретинопатия, нефропатия, инсульт, дисфункция эндотелиальных клеток, нейродегенеративные расстройства или рак. Помимо этого нуждающиеся в лечении субъекты могут быть выявлены на основании их возраста. Например, человек старше 75 лет может получить лечение саркопении, тогда как человек в возрасте до 30 лет не может быть выявлен как нуждающийся в лечении саркопении. В другом варианте любое из млекопитающих или субъектов, указанных выше, может быть исключено из популяции пациентов, нуждающихся в лечении саркопении.
[068] Субъект может быть выявлен как имеющий саркопению или нуждающийся в лечении, если (1) субъекту не менее 25 лет и (2) его или ее измеренная мышечная масса и измеренная мышечная функция находятся в пределах величины двух стандартных отклонений или более ниже среднего значения для здоровых 25-летних индивидуумов того же пола, и не было выявлено какой-либо иной патологии, вызывающей снижение мышечной массы и снижение мышечной функции. Предпочтительно возраст пациента, получающего лечение саркопении, составляет не менее 40 лет. Более предпочтительно возраст пациента, получающего лечение саркопении, составляет не менее 50 лет. Наиболее предпочтительно возраст пациента, получающего лечение саркопении, составляет не менее 60 лет. В другом варианте субъект может быть выявлен как имеющий саркопению или нуждающийся в лечении, если (1) скорость его походки составляет менее 1,0 м/с на дистанции 4 м, и (2) он или она имеет объективно измеренную низкую мышечную массу, такую как, например, аппендикулярная масса относительно квадрата роста, которая меньше или равна 7,23 кг/м2 для мужчин или меньше или равна 5,67 кг/м2 для женщин.
[069] В случае нейродегенеративных расстройств центральной нервной системы предпочтительным может быть введение композиции, содержащей антитело к AGE, непосредственно в центральную нервную систему. Примеры подходящих способов введения включают интратекальное введение; введение в желудочковую систему головного мозга (внутрижелудочковое введение), например, через катетер или постоянный шунт, или другое устройство для введения, которое может быть размещено во время вентрикулостомии (см, например, Takami, A. et al. "Treatment of primary central nervous system lymphoma with induction of complement-dependent cytotoxicity by intraventricular administration of autologous-serum-supplemented rituximab", Cancer Sci. Vol. 97, pp. 80-83 (January 2006)); и введение путем конвекционной доставки (CED) (см., например, Chen, K.S., et al. "MONOCLONAL ANTIBODY THERAPY FOR MALIGNANT GLIOMA" chapter 10 of Glioma: Immunotherapeutic Approaches, pp.132-141 (ed. R. Yamanaka; Landes Bioscience and Springer Science + Business Media, 2012)). Все подходящие способы введения в центральную нервную систему необязательно также могут включать введение сывороточной добавки (такой как аутологичная сыворотка) для усиления способности антитела к AGE вызывать гибель клеток; введение сывороточной добавки можно осуществлять до, одновременно или после введения антитела к AGE. Необязательно любая из композиций, содержащих антитела к AGE, описанных в настоящем документе, может дополнительно содержать сывороточную добавку (такую как аутологичная сывороточная добавка). Вместо сывороточной добавки или в дополнение к сывороточной добавке также могут быть использованы очищенные клетки иммунной системы, аутологичные клетки иммунной системы или клетки иммунной системы от донора; примеры подходящих клеток включают природные клетки-киллеры. В дополнение к природным клеткам-киллерам пациента или донора или вместо них могут быть использованы искусственные природные клетки-киллеры, такие как клетки NANTKWEST®, сконструированные для непосредственного связывания с антителами или сконструированные для непосредственного связывания с антигеном AGE (таким как карбоксиметиллизин) (см. www.nantkwest.com).
[070] В случае рака млекопитающее, у которого может развиваться метастатический рак, можно лечить с использованием способов, описанных в настоящем документе. Человек является предпочтительным млекопитающим для лечения. Другие млекопитающие, которые могут получить лечение, включают мышей, крыс, коз, овец, коров, лошадей и животных-компаньонов, таких как собаки или кошки. Субъект, нуждающийся в лечении, может быть выявлен на основании диагностирования рака. Виды рака, которые особенно подвержены метастазированию, включают рак легкого, меланому, рак толстой кишки, рак почек, рак предстательной железы, рак шейки матки, рак мочевого пузыря, ректальный рак, рак пищевода, рак печени, рак полости рта и горла, множественную миелому, рак яичников и рак желудка. Лечение могут получить пациенты с метастатическим раком. Лечение также может быть назначено пациентам, страдающим раком, но до момента выявления каких-либо метастазов, чтобы предотвратить образование метастазов. Субъект, которому вводят антитело к AGE, может пройти обследование, чтобы определить, было ли эффективным лечение рака, путем исследования распространения рака в различные части тела, особенно в лимфатические узлы пациента. Введение антитела и последующее обследование можно повторять до достижения желаемого терапевтического результата.
[071] Антитела к AGE могут быть использованы в процессах клеточной очистки, таких как иммунодиагностика и иммуноадсорбция. Процессы очистки можно применять для выделения желательных или нежелательных клеток из культур тканей, клеточных культур или крови. Клеточная очистка может быть использована при трансплантациях, таких как трансплантация костного мозга, или переливаниях, таких как переливание крови. Клеточная очистка особенно полезна при трансплантации аутологичных стволовых клеток во время химиотерапии для удаления злокачественных клеток и концентрирования полезных стволовых клеток, таких как гематопоэтические клетки, экспрессирующие белок CD34 (CD34+ клетки). Иммунопаннинг или иммуноадсорбция с использованием антитела к AGE позволят получить частично функциональные или нефункциональные клетки, такие как стареющие клетки, из культуры тканей, клеточной культуры или образца крови. Например, способ иммунопаннинга может включать иммобилизацию антитела к AGE на поверхности, такой как планшет для культивирования клеток. На поверхность затем может быть нанесена культура ткани или клеточная культура. Любые стареющие клетки, присутствующие в культуре ткани или клеточной культуре, будут связываться с антителом к AGE, оставляя очищенную культуру ткани или клеточную культуру, не содержащую стареющих клеток. Аналогичным образом, способ иммуноадсорбции может включать связывание антитела к AGE со стареющими клетками в культуре клеток. Клетки затем можно пропускать через колонку, заполненную гранулами, которые покрыты белком, который связывается со стареющими клетками, мечеными антителом к AGE. Клетки, которые проходят через колонку без связывания, будут представлять собой клетки, которые не экспрессируют AGE, такие как полностью функциональные клетки. Иммуноадсорбцию можно осуществлять с помощью системы концентрирования стволовых клеток CEPRATE SC (CellPro, Inc., Ботел, Вашингтон, США) или аналогичного устройства.
[072] Однобуквенная аминокислотная последовательность, которая соответствует последовательности SEQ ID NO: 1, представлена ниже:

[073] Положения 16-133 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 2. Положения 46-50 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 41. Положения 65-81 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO 42. Положения 114-122 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 43.
[074] Однобуквенная аминокислотная последовательность, которая соответствует последовательности SEQ ID NO: 3, представлена ниже:

[075] Положения 16-128 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 4. Необязательно остаток аргинина (Arg или R) в положении 128 из последовательности, представленной в SEQ ID NO: 4, может отсутствовать. Положения 39-54 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 44. Положения 70-76 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 45. Положения 109-117 вышеуказанной аминокислотной последовательности соответствуют последовательности, представленной в SEQ ID NO: 46.
[076] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 12, представлена ниже:

[077] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 13, представлена ниже:

[078] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 14, представлена ниже:

[079] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 15, представлена ниже:

[080] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 16, представлена ниже:

[081] Заштрихованная область вышеуказанной аминокислотной последовательности соответствует последовательности, приведенной в SEQ ID NO: 20.
[082] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 17, представлена ниже:

[083] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 18, представлена ниже:

[084] Заштрихованная область вышеуказанной аминокислотной последовательности соответствует последовательности, приведенной в SEQ ID NO: 21.
[085] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 19, представлена ниже:

[086] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 22, представлена ниже:

[087] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 23, представляет собой SYTMGVS.
[088] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 24, представляет собой TISSGGGSTYYPDSVKG.
[089] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 25, представляет собой QGGWLPPFAX, где X может представлять собой любую природную аминокислоту.
[090] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 26, представляет собой RASKSVSTSSRGYSYMH.
[091] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 27, представляет собой LVSNLES.
[092] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 28, представляет собой QHIRELTRS.
[093] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 29, представляет собой 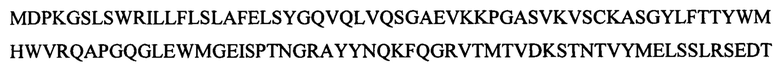

[094] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 30, представляет собой:

[095] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 31, представляет собой:

[096] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 32, представляет собой:

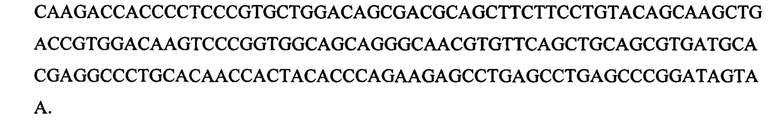
[097] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 33, представляет собой:

[098] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 34, представляет собой:

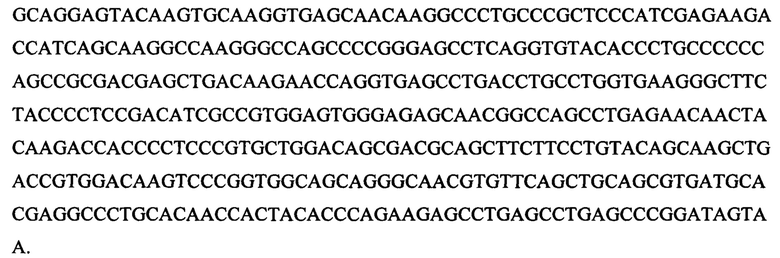
[099] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 35, представляет собой:

[0100] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 36, представляет собой:

[0101] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 37, представляет собой:

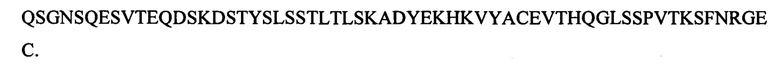
[0102] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 38, представляет собой: 
[0103] Однобуквенная аминокислотная последовательность, которая соответствует последовательности, приведенной в SEQ ID NO: 39, представляет собой:

[0104] Последовательность ДНК, которая соответствует последовательности, приведенной в SEQ ID NO: 40, представляет собой:

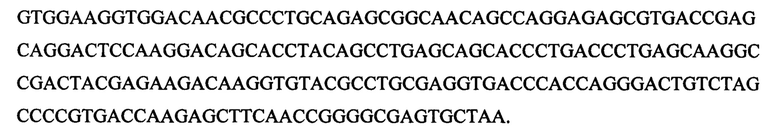
[0105] Примеры
[0106] Пример 1. Исследование введения антитела к конечному продукту гликирования в условиях in vivo
[0107] Для того чтобы исследовать влияние антитела к конечному продукту гликирования, антитело вводили старой мыши CD1 (ICR) (Charles River Laboratories) два раза в сутки путем внутривенной инъекции с частотой один раз в неделю в течение трех недель (1, 8 и 15 день), с последующим десятинедельным перерывом в применении препарата. Испытываемое антитело представляло собой коммерчески доступное мышиное антитело к конечному продукту гликирования, которое вырабатывалось к карбоксиметиллизину, конъюгированное с гемоцианином фиссуреллы, МАТ к карбоксиметиллизину (клон 318003), доступное от R&D Systems, Inc. (Миннеаполис, Миннесота, США, каталожный номер МАВ3247). У контрольных животных в качестве контроля использовали физиологический солевой раствор.
[0108] Возраст мышей, называемых «молодыми», составил 8 недель, в то время как возраст мышей, называемых «старыми», составил 88 недель (±2 дня). При введении антитела нежелательные явления не были обнаружены. Различные группы животных, использованные в исследовании, представлены в таблице 1.
[0109] Таблица 1: Различные группы животных, использованные в исследовании
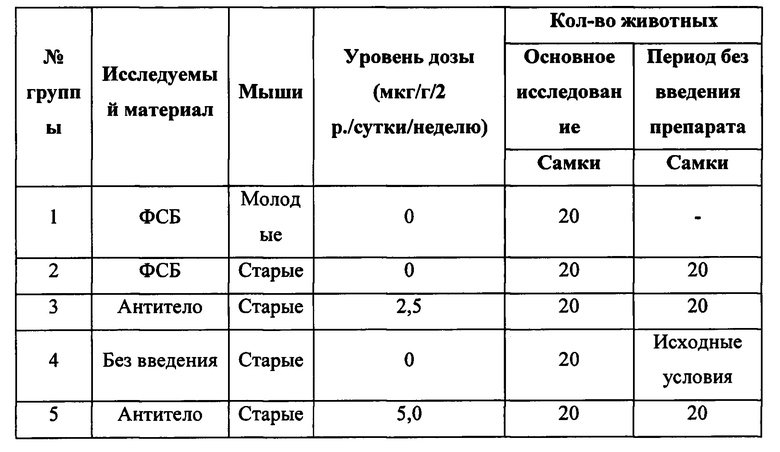
- = Неприменимо, Исходные условия = Подгруппа животных, умерщвленных до начала лечения для сбора жировой ткани.
[0110] мРНК P16INK4a, маркер стареющих клеток, количественно определяли в жировой ткани групп с помощью кПЦР в режиме реального времени. Результаты представлены в таблице 2. В таблице ΔΔCt = среднее значение ΔCt контрольной группы (2) - среднее значение ΔCt экспериментальной группы (1 или 3, или 5); Относительная экспрессия = 2-ΔΔCt.
[0111] Таблица 2: Количество мРНК P16Ing4a, определенное в жировой ткани
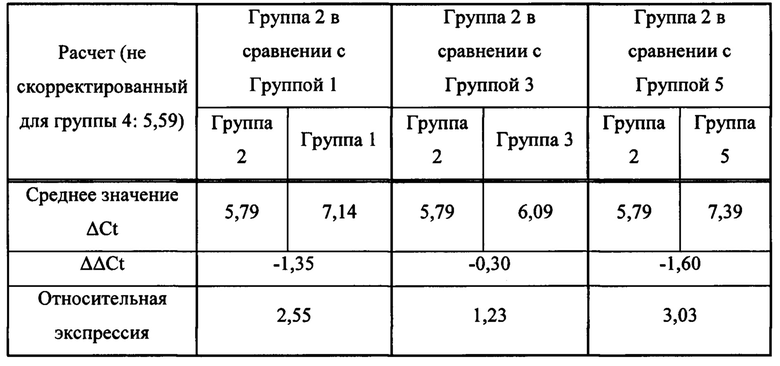
[0112] Результаты в приведенной выше таблице свидетельствуют о том, что, как и ожидалось, старые мыши, не получавшие лечения (контрольная группа 2), экспрессируют в 2,55 раза больше мРНК p16Ink4a, чем молодые мыши, не получавшие лечения (контрольная группа 1). Данный факт был обнаружен при сравнении результатов старых мышей в группе 2, не получавших лечения, которых умерщвляли в конце периода восстановления на 85 день, с результатами для молодых мышей в группе 1, не получавших лечения, которых умерщвляли по завершении лечения на 22 день. При сравнении результатов старых мышей в группе 2, не получавших лечения, с результатами старых мышей в группе 3, получавших лечение, которых умерщвляли на 85 день, было выявлено, что количество мРНК p16Ink4a было в 1,23 раза выше в группе 2, чем в группе 3. Таким образом, уровень экспрессии мРНК p16Ink4a был ниже, когда старых мышей лечили с использованием антитела в дозе 2,5 мкг/г/2 раза в сутки/неделю.
[0113] При сравнении результатов старых мышей в группе 2 (контроль), не получавших лечения, с результатами старых мышей в группе 5 (5 мкг/г), получавших лечение, которых умерщвляли на 22 день, было выявлено, что количество мРНК p16Ink4a было в 3,03 раза выше в группе 2 (контроль), чем в группе 5 (5 мкг/г). Это сравнение показало, что животные в группе 5 имели более низкие уровни экспрессии мРНК p16Ink4a после лечения антителом в дозе 5,0 мкг/г/2 раза в сутки/неделю, в результате чего уровни экспрессии мРНК p16Ink4a были сравнимы с уровнями у молодых мышей, не получавших лечения (т.е. в 1 группе). В отличие от мышей в группе 3 (2,5 мкг/г), которых умерщвляли в конце периода восстановления на 85 день, мышей в группе 5 умерщвляли по завершении лечения на 22 день.
[0114] Полученные результаты указывают на то, что введение антитела привело к гибели стареющих клеток.
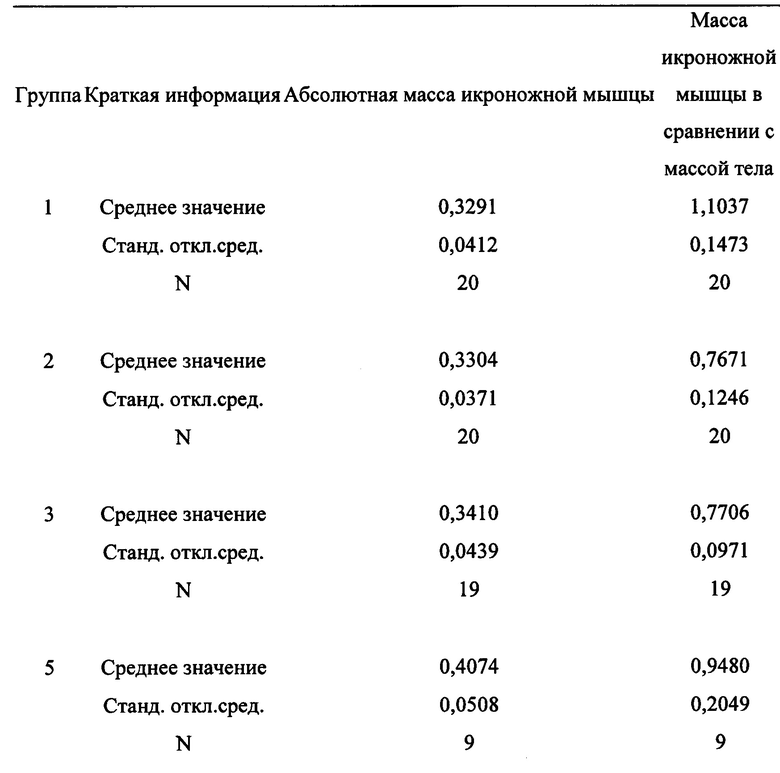
[0115] Также измеряли массу икроножной мышцы, чтобы определить влияние введения антитела при саркопении. Результаты представлены в таблице 3. Полученные результаты указывают на то, что введение антитела увеличивало мышечную массу по сравнению с контролем, но только при более высокой дозе 5,0 мкг/г/2 раза в сутки/неделю.
[0116] Таблица 3: Влияние введения антитела на массу икроножной мышцы
[0117] Пример 2. Аффинность и кинетика исследуемого антитела
[0118] Аффинность и кинетику исследуемого антитела, использованного в примере 1, исследовали с использованием Nα,Nα-бис(карбоксиметил)-L-лизинтрифторацетатной соли (Sigma-Aldrich, Сент-Луис, Миссури, США) в качестве модельного субстрата для AGE-модифицированного белка клетки. Исследование взаимодействия без использования метки проводили на устройстве BIACORE™ Т200 (GE Healthcare, Питтсбург, Пенсильвания, США), используя сенсорный чип серии S СМ5 (GE Healthcare, Питтсбург, Пенсильвания, США), при этом проточную ячейку FC1 установили как пустую, и проточную ячейку FC2 иммобилизовали с исследуемым антителом (молекулярная масса 150000 Да). Подвижный буфер представлял собой буфер HBS-EP (10 мМ HEPES, 150 мМ NaCl, 3 мМ ЭДТА и 0,05% Р-20, рН=7,4), при температуре 25°C. Программное обеспечение представляло собой программное обеспечение для анализа данных BIACORE™ Т200, версия 2.0. При анализе использовали двойной контроль (Fc2-1 и впрыскивание только буфера), и данные аппроксимировали с использованием модели связывания Ленгмюра 1:1.
[0119] Таблица 4: Экспериментальные параметры в исследовании аффинности и кинетики

[0120] График зависимости ответа от времени представлен на ФИГ. 1. В исследовании определяли следующие значения: ka (1/Мс)=1,857×103; kd (1/с)=6,781×10-3; KD (М)=3,651×10-6; Rmax (ед. ответа)=19,52; и χ2=0,114. Поскольку значение χ2 при аппроксимации составляет менее 10% от Rmax, подобранная модель является достоверной.
[0121] Пример 3. Конструирование и получение мышиного антитела IgG2b к AGE и химерного антитела IgG1 к AGE
[0122] Получали мышиные антитела к AGE и химерные антитела человека к AGE. Последовательность ДНК тяжелой цепи мышиного антитела IgG2b к AGE приведена в SEQ ID NO: 12. Последовательность ДНК химерного антитела человека IgG1 к AGE приведена в SEQ ID NO: 13. Последовательность ДНК легкой каппа-цепи мышиного антитела к AGE приведена в SEQ ID NO: 14. Последовательность ДНК легкой каппа-цепи химерного антитела человека к AGE приведена в SEQ ID NO: 15. Последовательности генов синтезировали и клонировали в векторы с высоким уровнем экспрессии у млекопитающих. Последовательности оптимизировали по кодонам. Готовые конструкции подтверждали с помощью секвенирования перед трансфекцией.
[0123] Клетки линии HEK293 высевали во встряхиваемую колбу за один день до трансфекции и выращивали с использованием бессывороточных сред с определенным химическим составом. Конструкции для экспрессии ДНК кратковременно трансфецировали в 0,03 литра суспензии клеток линии HEK293. Через 20 часов клетки отбирали, чтобы получить жизнеспособные клетки и жизнеспособное количество клеток и измеряли титры (Octet QKe, ForteBio). Дополнительные показатели регистрировали во время ряда этапов трансфекции. Культуры собирали на 5 день, и для каждой культуры измеряли дополнительный образец, чтобы определить плотность и жизнеспособность клеток, а также титр антител.
[0124] Кондиционированные среды для мышиных и химерных антител к AGE собирали и очищали после ряда этапов трансфекции путем центрифугирования и фильтрации. Супернатанты пропускали через колонку с белком А и элюировали буфером с низким pH. Фильтрацию с использованием мембранного фильтра с размером пор 0,2 мкм проводили перед разделением на аликвоты. После очистки и фильтрации концентрации белка рассчитывали на основании OD280 и коэффициента экстинкции. Обобщенные данные по величинам выхода и количеству аликвот приведены в таблице 5:
[0125] Таблица 5: Величины выхода и количество аликвот
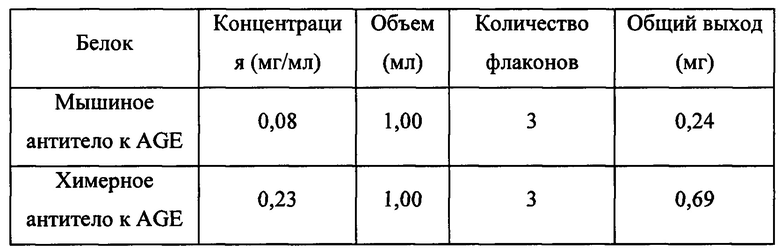
[0126] Чистоту антител оценивали с помощью капиллярного электрофореза в присутствии додецилсульфата натрия (CE-SDS) с использованием LabChip® GXII (PerkinElmer).
[0127] Пример 4. Связывание мышиных (исходных) и химерных антител к AGE
[0128] Связывание мышиных (исходных) и химерных антител к AGE, описанных в примере 3, исследовали с помощью ИФА с прямым связыванием. В качестве контроля использовали антитело к карбоксиметиллизину (CML) (R&D Systems, МАВ3247). CML конъюгировали с KLH (CML-KLH), и планшеты для ИФА покрывали CML и CML-KLH в течение ночи. Конъюгированное с пероксидазой хрена (ПХ) козье антитело к Fc мыши использовали для детектирования контрольных и мышиных (исходных) антител к AGE. Конъюгированное с пероксидазой хрена козье антитело к Fc человека использовали для детектирования химерного антитела к AGE.
[0129] Антигены разбавляли до концентрации 1 мкг/мл в 1× фосфатном буфере при рН=6,5. 96-луночный планшет для микротитрования для ИФА покрывали 100 мкл/лунку разведенного антигена и инкубировали для осаждения в течение ночи при 4°С. Планшет блокировали 1× ФСБ с добавлением 2,5% БСА и инкубировали для осаждения в течение 1-2 часов на следующее утро при комнатной температуре. Образцы антитела получали в виде последовательных разведений с использованием 1× ФСБ с добавлением 1% БСА с начальной концентрацией 50 мкг/мл. Вторичные антитела разбавляли в соотношении 1:5000. По 100 мкл разбавленных антител вносили в каждую лунку. Планшет инкубировали при комнатной температуре в течение 0,5-1 ч на шейкере для микропланшетов. Планшет промывали 3 раза с использованием 1× ФСБ. В лунки вносили по 100 мкл/лунку разбавленного конъюгированного с пероксидазой хрена вторичного козьего антитела к Fc человека. Планшет инкубировали в течение 1 часа на шейкере для микропланшетов. Затем планшет промывали 3 раза с использованием 1× ФСБ. По 100 мкл субстрата ПХ, ТМВ, добавляли в каждую лунку для развития окрашивания в планшетах. По истечении 3-5 минут реакцию останавливали добавлением 100 мкл 1 н HCl. Второй вариант ИФА с прямым связыванием выполняли только с покрытием CML. Абсорбцию при OD450 считывали с помощью считывателя для микропланшетов.
[0130] Исходные данные по абсорбции OD450 для ИФА с покрытием CML и CML-KLH приведены на карте планшета ниже. Использовали 48 из 96 лунок. Пустые лунки на карте планшета обозначают неиспользованные лунки.
[0131] Карта планшета для ИФА с покрытием CML и CML-KLH:
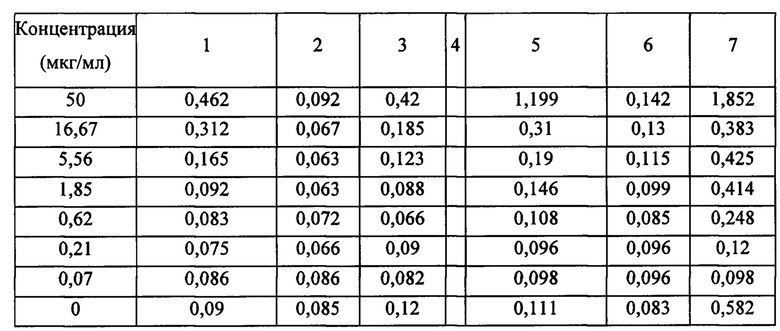

[0132] Исходные данные по абсорбции при OD450 для ИФА с покрытием только CML представлены в таблице ниже. Использовали 24 из 96 лунок в планшете. Пустые лунки на карте планшета обозначают неиспользованные лунки.
[0133] Карта планшета для ИФА с покрытием только CML:
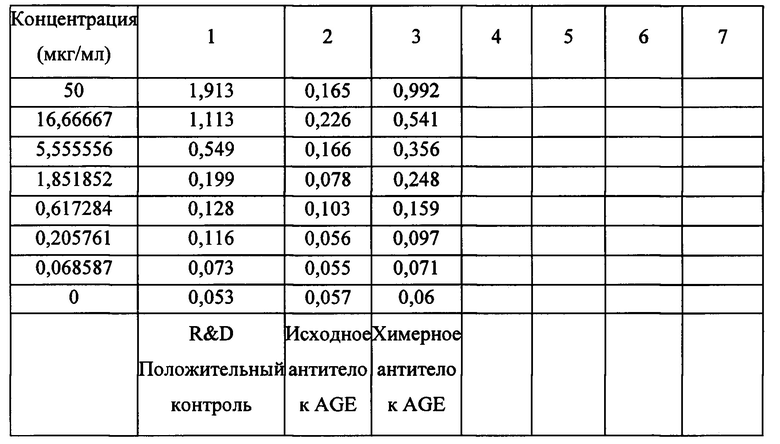
[0134] Контрольные и химерные антитела к AGE связывались как с CML, так и с CML-KLH. Мышиное (исходное) антитело к AGE не связывалось или связывалось в незначительной степени как с CML, так и с CML-KLH. Данные повторного ИФА подтверждают связывание контроля и химерного антитела к AGE с CML. Все контрольные пробы с использованием только буфера показали отрицательный сигнал.
[0135] Пример 5: Гуманизированные антитела
[0136] Гуманизированные антитела конструировали путем создания множества гибридных последовательностей, в которых отдельные части последовательности исходного (мышиного) антитела гибридизовали с каркасными последовательностями человека. Акцепторные каркасные участки выявляли на основании общей идентичности последовательностей по всей длине каркаса, совпадающих положений границ раздела, аналогично классифицированных канонических положений CDR и присутствия сайтов N-гликозилирования, которые необходимо было бы удалить. Три гуманизированные легкие цепи и три гуманизированные тяжелые цепи конструировали на основании двух различных акцепторных каркасов тяжелой и легкой цепи человека. Аминокислотные последовательности тяжелых цепей представлены в SEQ ID NO: 29, 31 и 33, которые кодируются последовательностями ДНК, представленными в SEQ ID NO: 30, 32 и 34, соответственно. Аминокислотные последовательности легких цепей представлены в SEQ ID NO: 35, 37 и 39, которые кодируются последовательностями ДНК, представленными в SEQ ID NO: 36, 38 и 40, соответственно. Указанные гуманизированные последовательности методично исследовали визуально и с помощью компьютерного моделирования, чтобы выделить последовательности, которые наиболее вероятно сохранят связывание с антигеном. Цель заключалась в том, чтобы максимально увеличить количество последовательности человека в готовых гуманизированных антителах, сохраняя при этом первоначальную специфичность антител. Легкие и тяжелые гуманизированные цепи могут быть объединены, чтобы создать девять вариантов полностью гуманизированных антител.
[0137] Три тяжелые цепи и три легкие цепи исследовали для определения их гуманизированности. Оценки гуманизированности антитела рассчитывали в соответствии со способом, описанным в Gao, S.Н., et al, "Monoclonal antibody humanness score and its applications", BMC Biotechnology, 13:55 (July 5, 2013). Оценка гуманизированности описывает степень сходства последовательности вариабельной области антитела с последовательностью антитела человека. Для тяжелых цепей оценка 79 баллов или выше свидетельствует о том, что они сходны с последовательностями человека; для легких цепей оценка 86 или выше свидетельствует о том, что они сходны с последовательностями человека. Оценки гуманизированности трех тяжелых цепей, трех легких цепей, исходной (мышиной) тяжелой цепи и исходной (мышиной) легкой цепи представлены ниже в таблице 6:
[0138] Таблица 6: Оценки гуманизированности антитела человека
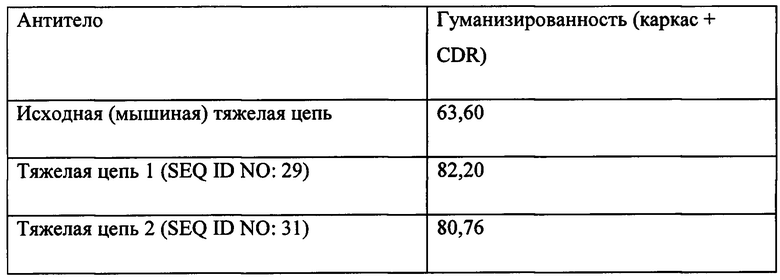

[0139] Гены полноразмерных антител конструировали путем в первую очередь синтеза последовательностей вариабельных областей. Последовательности оптимизировали для экспрессии в клетках млекопитающих. Полученные последовательности вариабельных областей затем клонировали в векторы экспрессии, которые уже содержали домены Fc человека; для тяжелой цепи использовали IgG1.
[0140] Маломасштабное получение гуманизированных антител осуществляли путем трансфекции плазмид для тяжелых и легких цепей в суспензию клеток линии HEK293 с использованием бессывороточных сред с определенным химическим составом. Целые антитела в кондиционированной среде очищали с использованием среды MabSelect SuRe Protein A (GE Healthcare).
[0141] Девять гуманизированных антител получали из каждой комбинации трех тяжелых цепей, имеющих аминокислотные последовательности, приведенные в SEQ ID NO: 29, 31 и 33, и трех легких цепей, имеющих аминокислотные последовательности, приведенные в SEQ ID NO: 35, 37 и 39. Также получали сравнительное химерное исходное антитело. Антитела и их соответствующие титры представлены в таблице 7 ниже:
[0142] Таблица 7: Титры антител

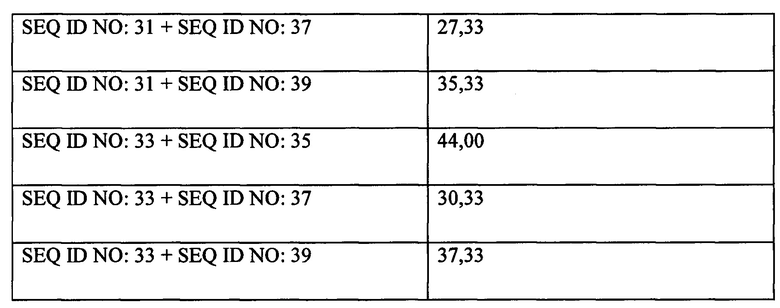
[0143] Связывание гуманизированных антител можно оценить, например, с помощью ИФА дозозависимого связывания или клеточного количественного исследования связывания.
[0144] Перечень литературы
[0145] 1. International Application Pub. No. WO 2009/143411 to Gruber (26 Nov. 2009).
[0146] 2. U.S. Patent No. 5,702,704 to Bucala (issued December 30,1997).
[0147] 3. U.S. Patent No. 6,380,165 to Al-Abed et al (issued April 30, 2002).
[0148] 4. U.S. Patent No. 6,387,373 to Wright et al. (issued May 14, 2002).
[0149] 5. U.S. Patent No. 4,217,344 to Vanlerberghe et al. (issued August 12, 1980).
[0150] 6. U.S. Patent No. 4,917,951 to Wallach (issued April 17, 1990).
[0151] 7. U.S. Patent No. 4,911,928 to Wallach (issued March 27,1990).
[0152] 8. U.S. Patent Application Publication Pub. No. US 2010/226932 to Smith et al. (September 9, 2010).
[0153] 9. Ando K, et al, "Membrane Proteins of Human Erythrocytes Are Modified by Advanced Glycation End Products During Aging in the Circulation," Biochemical and Biophysical Research Communications, Vol. 258, 123-27 (1999).
[0154] 10. Lindsey JB, et al, "Receptor For Advanced Glycation End-Products (RAGE) and soluble RAGE (sRAGE): Cardiovascular Implications," Diabetes Vascular Disease Research, Vol. 6(1), 7-14, (2009).
[0155] 11. Bierhaus A, "AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. The AGE concept," Cardiovasc Res, Vol. 37(3), 586-600 (1998).
[0156] 12. Meuter A., et al. "Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen" J Assist Reprod Genet. 2014 Aug 10. [Epub ahead of print].
[0157] 13. Baker, D.J. et al., "Clearance of pl6Ink4a-positive senescent cells delays ageing-associated disorders", Nature, vol. 479, pp.232-236, (2011).
[0158] 14. Jana  et al. "Chicken immunoglobulins for prophylaxis: Effect of inhaled antibodies on inflammatory parameters in rat airways" Journal of Applied Biomedicine (in press; Available online 5 May 2014).
et al. "Chicken immunoglobulins for prophylaxis: Effect of inhaled antibodies on inflammatory parameters in rat airways" Journal of Applied Biomedicine (in press; Available online 5 May 2014).
[0159] 15. Vlassara, H. et al, "High-affinity-receptor-mediated Uptake and Degradation of Glucose-modified Proteins: A Potential Mechanism for the Removal of Senescent Macromolecules", Proc. Natl. Acad. Sci. USA, Vol. 82, 5588, 5591 (1985).
[0160] 16. Roll, P. et al, "Anti-CD20 Therapy in Patients with Rheumatoid Arthritis", Arthritis & Rheumatism, Vol. 58, No. 6, 1566-1575 (2008).
[0161] 17. Kajstura, J. et al, "Myocite Turnover in the Aging Human Heart", Circ. Res., Vol.107(11), 1374-86, (2010).
[0162] 18. de Groot, K. et al, "Vascular Endothelial Damage and Repair in Antineutrophil Cytoplasmic Antibody-Associated Vasculitis", Arthritis and Rheumatism, Vol. 56(11), 3847, 3847 (2007).
[0163] 19. Manesso, E. et al, "Dynamics of β-Cell Turnover: Evidence for β-Cell Turnover and Regeneration from Sources of β-Cells other than β-cell Replication in the HIP Rat", Am. J Physiol. Endocrinol Metab., Vol. 297, E323, E324 (2009).
[0164] 20. Kirstein, M. et al, "Receptor-specific Induction of Insulin-like Growth Factor I in Human Monocytes by Advanced Glycosylation End Product-modified Proteins", J. Clin. Invest., Vol. 90, 439, 439-440 (1992).
[0165] 21. Murphy, J.F., "Trends in cancer immunotherapy", Clinical Medical Insights: Oncology, Vol. 14(4), 67-80 (2010).
[0166] 22. Virella, G. et al, "Autoimmune Response to Advanced Glycosylation End-Products of Human LDL", Journal of Lipid Research, Vol. 44, 487-493 (2003).
[0167] 23. Ameli, S. et al, "Effect of Immunization With Homologous LDL and Oxidized LDL on Early Atherosclerosis in Hypercholesterolemic Rabbits", Arteriosclerosis, Thrombosis, and Vascular Biology, Vol. 16, 1074 (1996).
[0168] 24. "Sarcopenia", available online at en.wikipedia.org/wiki/Sarcopenia (November 14,2014).
[0169] 25. "What is sarcopenia?", available online at www.iofbonehealth.org/what-sarcopenia (2014).
[0170] 26. Blahd, W., "Sarcopenia with aging", available online at www.webmd.com/healthy-aging/sarcopenia-with-aging (August 3, 2014).
[0171] 27. "Keyhole limpet hemocyanin", available online at en.wikipedia.org/wiki/Keyhole_limpet_hemocyanin (April 18,2014).
[0172] 28. "CML-BSA Product Data Sheet", available online at www.cellbiolabs.com/sites/default/files/STA-314-cml-bsa.pdf (2010).
[0173] 29. "CML (N-epsilon-(Carboxymethyl)Lysine) Assays and Reagents", available online at www.cellbiolabs.com/cml-assays (Accessed on December 15, 2014).
[0174] 30. Cruz-Jentoft, A.J. et ah, "Sarcopenia: European consensus on definition and diagnosis", Age and Ageing, Vol. 39, pp. 412-423 (April 13, 2010).
[0175] 31. Rolland, Y. et ah, "Sarcopenia: its assessment, etiology, pathogenesis, consequences and future perspectives", J. Nutr. Health Aging, Vol. 12(7), pp. 433-450 (2008).
[0176] 32. Mera, K. et al., "An autoantibody against Nε-(carboxyethyl)lysine (CEL): Possible involvement in the removal of CEL-modified proteins by macrophages", Biochemical and Biophysical Research Communications, Vol. 407, pp. 420-425 (March 12, 2011).
[0177] 33. Reddy, S. et al., "Nε-(carboxymethyl)lysine is a dominant advanced glycation end product (AGE) antigen in tissue proteins", Biochemistry, Vol. 34, pp. 10872-10878 (August 1, 1995).
[0178] 34. Naylor, R.M. et al., "Senescent cells: a novel therapeutic target for aging and age-related diseases", Clinical Pharmacology & Therapeutics, Vol. 93(1), pp. 105-116 (December 5, 2012).
[0179] 35. Katcher, H.L., "Studies that shed new light on aging", Biochemistry (Moscow), Vol. 78(9), pp. 1061-1070 (2013).
[0180] 36. Ahmed, E.K. et al., "Protein Modification and Replicative Senescence of WI-38 Human Embryonic Fibroblasts", Aging Cells, Vol. 9, 252, 260 (2010).
[0181] 37. Vlassara, H. et al., "Advanced Glycosylation Endproducts on Erythrocyte Cell Surface Induce Receptor-Mediated Phagocytosis by Macrophages", J. Exp. Med., Vol. 166, 539, 545 (1987).
[0182] 38. Fielding, R.A., et al., "Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences", Journal of the American Medical Directors Association, Vol. 12(4), pp. 249-256 (May 2011).
[0183] 39. Maass, D.R. et al., "Alpaca (Lamapacos) as a convenient source of recombinant camelid heavy chain antibodies (VHHs)", Journal of Immunological Methods, Vol. 324, No. 1-2, pp. 13-25 (July 31, 2007).
[0184] 40. Strietzel, C.J. et al., "in vitro functional characterization of feline IgGs", Veterinary Immunology and Immunopathology, Vol. 158, pp. 214-223 (2014).
[0185] 41. Patel, M. et al., "Sequence of the dog immunoglobulin alpha and epsilon constant region genes", Immunogenetics, Vol. 41, pp. 282-286 (1995).
[0186] 42. Wagner, B. et al., "The complete map of the Ig heavy chain constant gene region reveals evidence for seven IgG isotypes and for IgD in the horse", The Journal of Immunology, Vol. 173, pp.3230-3242 (2004).
[0187] 43. Hamers-Casterman, C. et al., "Naturally occurring antibodies devoid of light chains", Nature, Vol. 363, pp. 446-448 (June 3, 1993).
[0188] 44. De Genst, E. et ah, "Antibody repertoire development in camelids", Developmental & Comparative Immunology, Vol. 30, pp. 187-198 (available online July 11, 2005).
[0189] 45. Griffin, L.M. et al., "Analysis of heavy and light chain sequences of conventional camelid antibodies from Camelus dromedarius and Camelus bactrianus species", Journal of Immunological Methods, Vol. 405, pp. 35-46 (available online January 18, 2014).
[0190] 46. Nguyen, V.K. et ah, "Camel heavy-chain antibodies: diverse germline VHH and specific mechanisms enlarge the antigen-binding repertoire", The European Molecular Biology Organization Journal, Vol.19, No, 5, pp. 921-930 (2000).
[0191] 47. Muyldermans, S. et al., "Sequence and structure of VH domain from naturally occurring camel heavy chain immunoglobulins lacking light chains", Protein Engineering, Vol. 7, No. 9, pp. 1129-1135 (1994).
[0192] 48. Wesolowski, J. et al, "Single domain antibodies: promising experimental and therapeutic tools in infection and immunity", Medical Microbiology and Immunology, Vol. 198, pp. 157-174 (June 16, 2009).
[0193] 49. Yan, S.F. et al, "Soluble RAGE: therapy & biomarker in unraveling the RAGE axis in chronic disease and aging", Biochemical Pharmacology, Vol. 79, No. 10, pp. 1379-1386 (May 15, 2010).
[0194] 50. Chen, K.S. et al, "Monoclonal antibody therapy for malignant glioma", Glioma: Immunotherapeutic Approaches, pp. 121-141 (2012).
[0195] 51. Gao, S.H., et al, "Monoclonal antibody humanness score and its applications", BMC Biotechnology, 13:55 (July 5, 2013).
[0196] 52. Feige, M.J. et al, "The structural analysis of shark IgNAR antibodies reveals evolutionary principles of immunoglobulins", Proceedings of the National Academy of Sciences of the United States of America, Vol. 111, No. 22, pp. 8155-8160 (June 3, 2014).
--->
Перечень последовательностей
<110> Lewis S. Gruber
<120> Антитела к AGE и способы их применения
<130> SIW01-007-CIP-WO
<160> 46
<210> 1
<211> 463
<212> PRT
<213> Искусственная последовательность
<220>
<223> Модифицированная тяжелая цепь иммуноглобулина G1 Homo sapiens
<400> 1
Met Asn Leu Leu Leu Ile Leu Thr Phe Val Ala Ala Ala Val Ala Gln
1 5 10 15
Val Gln Leu Leu Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser
20 25 30
Val Lys Leu Ala Cys Lys Ala Ser Gly Tyr Leu Phe Thr Thr Tyr Trp
35 40 45
Met His Trp Leu Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly
50 55 60
Glu Ile Ser Pro Thr Asn Gly Arg Ala Tyr Tyr Asn Ala Arg Phe Lys
65 70 75 80
Ser Glu Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr Met
85 90 95
Gln Leu Ser Ser Leu Thr Ser Glu Ala Ser Ala Val Tyr Tyr Cys Ala
100 105 110
Arg Ala Tyr Gly Asn Tyr Glu Phe Ala Tyr Trp Gly Gln Gly Thr Leu
115 120 125
Val Thr Val Ser Val Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
130 135 140
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
145 150 155 160
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
165 170 175
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
180 185 190
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
195 200 205
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
210 215 220
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 2
<211> 118
<212> PRT
<213> Mus musculus
<400> 2
Gln Val Gln Leu Leu Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ala Cys Lys Ala Ser Gly Tyr Leu Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Leu Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Ser Pro Thr Asn Gly Arg Ala Tyr Tyr Asn Ala Arg Phe
50 55 60
Lys Ser Glu Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Ala Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Tyr Gly Asn Tyr Glu Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 3
<211> 234
<212> PRT
<213> Искусственная последовательность
<220>
<223> Модифицированная легкая каппа-цепь иммуноглобулина G1 Homo sapiens
<400> 3
Met Asn Leu Leu Leu Ile Leu Thr Phe Val Ala Ala Ala Val Ala Asp
1 5 10 15
Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly Asp
20 25 30
Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Leu Val Asn Ser Asn
35 40 45
Gly Asn Thr Phe Leu Gln Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro
50 55 60
Lys Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe Ser Gly Val Pro Asp
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
85 90 95
Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe Cys Ser Gln Ser Thr
100 105 110
His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 4
<211> 113
<212> PRT
<213> Mus musculus
<400> 4
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Leu Val Asn Ser
20 25 30
Asn Gly Asn Thr Phe Leu Gln Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 5
<211> 327
<212> PRT
<213> Equus caballus
<400> 5
Ala Ser Thr Thr Ala Pro Lys Val Phe Pro Leu Ala Ser His Ser Ala
1 5 10 15
Ala Thr Ser Gly Ser Thr Val Ala Leu Gly Cys Leu Val Ser Ser Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ser Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Met Val Thr Val Pro Ala Ser Ser Leu Lys Ser Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
85 90 95
Lys Ile Val Ile Lys Glu Cys Asn Gly Gly Cys Pro Ala Glu Cys Leu
100 105 110
Gln Val Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
115 120 125
Leu Met Ile Ser Arg Thr Pro Thr Val Thr Cys Val Val Val Asp Val
130 135 140
Gly His Asp Phe Pro Asp Val Gln Phe Asn Trp Tyr Val Asp Gly Val
145 150 155 160
Glu Thr His Thr Ala Thr Thr Glu Pro Lys Gln Glu Gln Phe Asn Ser
165 170 175
Thr Tyr Arg Val Val Ser Val Leu Pro Ile Gln His Lys Asp Trp Leu
180 185 190
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Ala Leu Pro Ala
195 200 205
Pro Val Glu Arg Thr Ile Ser Lys Pro Thr Gly Gln Pro Arg Glu Pro
210 215 220
Gln Val Tyr Val Leu Ala Pro His Arg Asp Glu Leu Ser Lys Asn Lys
225 230 235 240
Val Ser Val Thr Cys Leu Val Lys Asp Phe Tyr Pro Thr Asp Ile Asp
245 250 255
Ile Glu Trp Lys Ser Asn Gly Gln Pro Glu Pro Glu Thr Lys Tyr Ser
260 265 270
Thr Thr Pro Ala Gln Leu Asp Ser Asp Gly Ser Tyr Phe Leu Tyr Ser
275 280 285
Lys Leu Thr Val Glu Thr Asn Arg Trp Gln Gln Gly Thr Thr Phe Thr
290 295 300
Cys Ala Val Met His Glu Ala Leu His Asn His Tyr Thr Glu Lys Ser
305 310 315 320
Val Ser Lys Ser Pro Gly Lys
325
<210> 6
<211> 415
<212> PRT
<213> Equus caballus
<400> 6
Ser Leu Glu Asp Thr Ala Val Ile Pro Leu Phe Ser Glu Cys Lys Ala
1 5 10 15
Pro Lys Glu Asp Asp Val Val Ser Leu Ala Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Gln Val Thr Trp Glu Pro Glu Met Gln Asn Gln
35 40 45
Lys Pro Trp Thr Phe Pro Ala Met Lys Lys Gly Gln Glu Tyr Ile His
50 55 60
Val Phe Ser Leu Thr Thr Trp Trp Lys Pro Gly Ser His Ser Cys Thr
65 70 75 80
Val His His Lys Ala Ser Ser Phe Arg Lys Lys Met Thr Phe Gln Glu
85 90 95
Pro Ala Ser Trp Ala Pro Gln Arg Thr Ser Ala Leu Pro Val Thr Ser
100 105 110
Lys Glu Pro Thr Pro Ala Pro Thr Thr Leu Arg Lys Ser Glu Pro Ser
115 120 125
Thr Arg His Thr Gln Pro Glu Thr Gln Lys Pro Arg Ile Pro Val Asp
130 135 140
Thr Pro Leu Lys Glu Cys Gln Ser His Thr His Pro Pro Ser Ile Tyr
145 150 155 160
Leu Leu His Pro Pro Leu Gln Gly Leu Trp Leu Lys Gly Glu Ala Thr
165 170 175
Phe Thr Cys Leu Val Val Gly Asp Asp Leu Lys Asp Ala His Leu Ser
180 185 190
Trp Glu Leu Ser Glu Arg Ser Asn Gly Met Phe Val Glu Ser Gly Pro
195 200 205
Leu Glu Lys His Thr Asn Gly Ser Gln Ser Arg Ser Ser Arg Leu Ala
210 215 220
Leu Pro Arg Ser Ser Trp Ala Met Gly Thr Ser Val Thr Cys Lys Leu
225 230 235 240
Ser Tyr Pro Asn Leu Leu Ser Ser Met Glu Val Val Gly Leu Lys Glu
245 250 255
His Ala Ala Ser Ala Pro Arg Ser Leu Thr Val His Ala Leu Thr Thr
260 265 270
Pro Gly Leu Asn Ala Ser Pro Gly Ala Thr Ser Trp Leu Gln Cys Lys
275 280 285
Val Ser Gly Phe Ser Pro Pro Glu Ile Val Leu Thr Trp Leu Glu Gly
290 295 300
Gln Arg Glu Val Asp Pro Ser Trp Phe Ala Thr Ala Arg Pro Thr Ala
305 310 315 320
Gln Pro Gly Asn Thr Thr Phe Gln Thr Trp Ser Ile Leu Leu Val Pro
325 330 335
Thr Ile Pro Gly Pro Pro Thr Ala Thr Tyr Thr Cys Val Val Gly His
340 345 350
Glu Ala Ser Arg Gln Leu Leu Asn Thr Ser Trp Ser Leu Asp Thr Gly
355 360 365
Gly Leu Ala Met Thr Pro Glu Ser Lys Asp Glu Asn Ser Asp Asp Tyr
370 375 380
Ala Asp Leu Asp Asp Ala Gly Ser Leu Trp Leu Thr Phe Met Ala Leu
385 390 395 400
Phe Leu Ile Thr Leu Leu Tyr Ser Gly Phe Val Thr Phe Ile Lys
405 410 415
<210> 7
<211> 334
<212> PRT
<213> Canis familiaris
<400> 7
Ser Lys Thr Ser Pro Ser Val Phe Pro Leu Ser Leu Cys His Gln Glu
1 5 10 15
Ser Glu Gly Tyr Val Val Ile Gly Cys Leu Val Gln Gly Phe Phe Pro
20 25 30
Pro Glu Pro Val Asn Val Thr Trp Asn Ala Gly Lys Asp Ser Thr Ser
35 40 45
Val Lys Asn Phe Pro Pro Met Lys Ala Ala Thr Gly Ser Leu Tyr Thr
50 55 60
Met Ser Ser Gln Leu Thr Leu Pro Ala Ala Gln Cys Pro Asp Asp Ser
65 70 75 80
Ser Val Lys Cys Gln Val Gln His Ala Ser Ser Pro Ser Lys Ala Val
85 90 95
Ser Val Pro Cys Lys Asp Asn Ser His Pro Cys His Pro Cys Pro Ser
100 105 110
Cys Asn Glu Pro Arg Leu Ser Leu Gln Lys Pro Ala Leu Glu Asp Leu
115 120 125
Leu Leu Gly Ser Asn Ala Ser Leu Thr Cys Thr Leu Ser Gly Leu Lys
130 135 140
Asp Pro Lys Gly Ala Thr Phe Thr Trp Asn Pro Ser Lys Gly Lys Glu
145 150 155 160
Pro Ile Gln Lys Asn Pro Glu Arg Asp Ser Cys Gly Cys Tyr Ser Val
165 170 175
Ser Ser Val Leu Pro Gly Cys Ala Asp Pro Trp Asn His Gly Asp Thr
180 185 190
Phe Ser Cys Thr Ala Thr His Pro Glu Ser Lys Ser Pro Ile Thr Val
195 200 205
Ser Ile Thr Lys Thr Thr Glu His Ile Pro Pro Gln Val His Leu Leu
210 215 220
Pro Pro Pro Ser Glu Glu Leu Ala Leu Asn Glu Leu Val Thr Leu Thr
225 230 235 240
Cys Leu Val Arg Gly Phe Lys Pro Lys Asp Val Leu Val Arg Trp Leu
245 250 255
Gln Gly Thr Gln Glu Leu Pro Gln Glu Lys Tyr Leu Thr Trp Glu Pro
260 265 270
Leu Lys Glu Pro Asp Gln Thr Asn Met Phe Ala Val Thr Ser Met Leu
275 280 285
Arg Val Thr Ala Glu Asp Trp Lys Gln Gly Glu Lys Phe Ser Cys Met
290 295 300
Val Gly His Glu Ala Leu Pro Met Ser Phe Thr Gln Lys Thr Ile Asp
305 310 315 320
Arg Leu Ala Gly Lys Pro Thr His Val Asn Val Ser Val Val
325 330
<210> 8
<211> 426
<212> PRT
<213> Canis familiaris
<400> 8
Thr Ser Gln Asp Leu Ser Val Phe Pro Leu Ala Ser Cys Cys Lys Asp
1 5 10 15
Asn Ile Ala Ser Thr Ser Val Thr Leu Gly Cys Leu Val Thr Gly Tyr
20 25 30
Leu Pro Met Ser Thr Thr Val Thr Trp Asp Thr Gly Ser Leu Asn Lys
35 40 45
Asn Val Thr Thr Phe Pro Thr Thr Phe His Glu Thr Tyr Gly Leu His
50 55 60
Ser Ile Val Ser Gln Val Thr Ala Ser Gly Lys Trp Ala Lys Gln Arg
65 70 75 80
Phe Thr Cys Ser Val Ala His Ala Glu Ser Thr Ala Ile Asn Lys Thr
85 90 95
Phe Ser Ala Cys Ala Leu Asn Phe Ile Pro Pro Thr Val Lys Leu Phe
100 105 110
His Ser Ser Cys Asn Pro Val Gly Asp Thr His Thr Thr Ile Gln Leu
115 120 125
Leu Cys Leu Ile Ser Gly Tyr Val Pro Gly Asp Met Glu Val Ile Trp
130 135 140
Leu Val Asp Gly Gln Lys Ala Thr Asn Ile Phe Pro Tyr Thr Ala Pro
145 150 155 160
Gly Thr Lys Glu Gly Asn Val Thr Ser Thr His Ser Glu Leu Asn Ile
165 170 175
Thr Gln Gly Glu Trp Val Ser Gln Lys Thr Tyr Thr Cys Gln Val Thr
180 185 190
Tyr Gln Gly Phe Thr Phe Lys Asp Glu Ala Arg Lys Cys Ser Glu Ser
195 200 205
Asp Pro Arg Gly Val Thr Ser Tyr Leu Ser Pro Pro Ser Pro Leu Asp
210 215 220
Leu Tyr Val His Lys Ala Pro Lys Ile Thr Cys Leu Val Val Asp Leu
225 230 235 240
Ala Thr Met Glu Gly Met Asn Leu Thr Trp Tyr Arg Glu Ser Lys Glu
245 250 255
Pro Val Asn Pro Gly Pro Leu Asn Lys Lys Asp His Phe Asn Gly Thr
260 265 270
Ile Thr Val Thr Ser Thr Leu Pro Val Asn Thr Asn Asp Trp Ile Glu
275 280 285
Gly Glu Thr Tyr Tyr Cys Arg Val Thr His Pro His Leu Pro Lys Asp
290 295 300
Ile Val Arg Ser Ile Ala Lys Ala Pro Gly Lys Arg Ala Pro Pro Asp
305 310 315 320
Val Tyr Leu Phe Leu Pro Pro Glu Glu Glu Gln Gly Thr Lys Asp Arg
325 330 335
Val Thr Leu Thr Cys Leu Ile Gln Asn Phe Phe Pro Ala Asp Ile Ser
340 345 350
Val Gln Trp Leu Arg Asn Asp Ser Pro Ile Gln Thr Asp Gln Tyr Thr
355 360 365
Thr Thr Gly Pro His Lys Val Ser Gly Ser Arg Pro Ala Phe Phe Ile
370 375 380
Phe Ser Arg Leu Glu Val Ser Arg Val Asp Trp Glu Gln Lys Asn Lys
385 390 395 400
Phe Thr Cys Gln Val Val His Glu Ala Leu Ser Gly Ser Arg Ile Leu
405 410 415
Gln Lys Trp Val Ser Lys Thr Pro Gly Lys
420 425
<210> 9
<211> 335
<212> PRT
<213> Felis catus
<400> 9
Ala Ser Thr Thr Ala Ser Ser Val Phe Pro Leu Ala Pro Ser Cys Gly
1 5 10 15
Thr Thr Ser Gly Ala Thr Val Ala Leu Ala Cys Leu Val Leu Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ser Val Leu Gln Ala Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Met Val Thr Val Pro Ser Ser Arg Trp Leu Ser Asp Thr
65 70 75 80
Phe Thr Cys Asn Val Ala His Arg Pro Ser Ser Thr Lys Val Asp Lys
85 90 95
Thr Val Pro Lys Thr Ala Ser Thr Ile Glu Ser Lys Thr Gly Glu Gly
100 105 110
Pro Lys Cys Pro Val Pro Glu Ile Pro Gly Ala Pro Ser Val Phe Ile
115 120 125
Phe Pro Pro Lys Pro Lys Asp Thr Leu Ser Ile Ser Arg Thr Pro Glu
130 135 140
Val Thr Cys Leu Val Val Asp Leu Gly Pro Asp Asp Ser Asn Val Gln
145 150 155 160
Ile Thr Trp Phe Val Asp Asn Thr Glu Met His Thr Ala Lys Thr Arg
165 170 175
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
180 185 190
Pro Ile Leu His Gln Asp Trp Leu Lys Gly Lys Glu Phe Lys Cys Lys
195 200 205
Val Asn Ser Lys Ser Leu Pro Ser Ala Met Glu Arg Thr Ile Ser Lys
210 215 220
Ala Lys Gly Gln Pro His Glu Pro Gln Val Tyr Val Leu Pro Pro Thr
225 230 235 240
Gln Glu Glu Leu Ser Glu Asn Lys Val Ser Val Thr Cys Leu Ile Lys
245 250 255
Gly Phe His Pro Pro Asp Ile Ala Val Glu Trp Glu Ile Thr Gly Gln
260 265 270
Pro Glu Pro Glu Asn Asn Tyr Gln Thr Thr Pro Pro Gln Leu Asp Ser
275 280 285
Asp Gly Thr Tyr Phe Leu Tyr Ser Arg Leu Ser Val Asp Arg Ser His
290 295 300
Trp Gln Arg Gly Asn Thr Tyr Thr Cys Ser Val Ser His Glu Ala Leu
305 310 315 320
His Ser His His Thr Gln Lys Ser Leu Thr Gln Ser Pro Gly Lys
325 330 335
<210> 10
<211> 96
<212> PRT
<213> Camelus _romedaries
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Arg Glu Arg Glu Gly Val
35 40 45
Ala Ala Ile Asn Ser Gly Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Gln Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
<210> 11
<211> 96
<212> PRT
<213> Camelus dromedarius
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Asn Ser Gly Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Met Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
<210> 12
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь мышиного антитела IgG2b к AGE
<400> 12
atggacccca agggcagcct gagctggaga atcctgctgt tcctgagcct ggccttcgag 60
ctgagctacg gccaggtgca gctgctgcag ccaggtgccg agctcgtgaa acctggcgcc 120
tctgtgaagc tggcctgcaa ggcttccggc tacctgttca ccacctactg gatgcactgg 180
ctgaagcaga ggccaggcca gggcctggaa tggatcggcg agatctcccc caccaacggc 240
agagcctact acaacgcccg gttcaagtcc gaggccaccc tgaccgtgga caagtcctcc 300
aacaccgcct acatgcagct gtcctccctg acctctgagg cctccgccgt gtactactgc 360
gccagagctt acggcaacta cgagttcgcc tactggggcc agggcaccct cgtgacagtg 420
tctgtggcta agaccacccc tccctccgtg taccctctgg ctcctggctg tggcgacacc 480
accggatcct ctgtgaccct gggctgcctc gtgaagggct acttccctga gtccgtgacc 540
gtgacctgga actccggctc cctgtcctcc tccgtgcaca cctttccagc cctgctgcag 600
tccggcctgt acaccatgtc ctccagcgtg acagtgccct cctccacctg gccttcccag 660
accgtgacat gctctgtggc ccaccctgcc tcttccacca ccgtggacaa gaagctggaa 720
ccctccggcc ccatctccac catcaaccct tgccctccct gcaaagaatg ccacaagtgc 780
cctgccccca acctggaagg cggcccttcc gtgttcatct tcccacccaa catcaaggac 840
gtgctgatga tctccctgac ccccaaagtg acctgcgtgg tggtggacgt gtccgaggac 900
gaccctgacg tgcagatcag ttggttcgtg aacaacgtgg aagtgcacac cgcccagacc 960
cagacacaca gagaggacta caacagcacc atcagagtgg tgtctaccct gcccatccag 1020
caccaggact ggatgtccgg caaagaattc aagtgcaaag tgaacaacaa ggacctgccc 1080
agccccatcg agcggaccat ctccaagatc aagggcctcg tgcgggctcc ccaggtgtac 1140
attctgcctc caccagccga gcagctgtcc cggaaggatg tgtctctgac atgtctggtc 1200
gtgggcttca accccggcga catctccgtg gaatggacct ccaacggcca caccgaggaa 1260
aactacaagg acaccgcccc tgtgctggac tccgacggct cctacttcat ctactccaag 1320
ctgaacatga agacctccaa gtgggaaaag accgactcct tctcctgcaa cgtgcggcac 1380
gagggcctga agaactacta cctgaagaaa accatctccc ggtcccccgg ctag 1434
<210> 13
<211> 1416
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь химерного антитела IgG1 человека к AGE
<400> 13
atggacccca agggcagcct gagctggaga atcctgctgt tcctgagcct ggccttcgag 60
ctgagctacg gccaggtgca gctgctgcag ccaggtgccg agctcgtgaa acctggcgcc 120
tctgtgaagc tggcctgcaa ggcttccggc tacctgttca ccacctactg gatgcactgg 180
ctgaagcaga ggccaggcca gggcctggaa tggatcggcg agatctcccc caccaacggc 240
agagcctact acaacgcccg gttcaagtcc gaggccaccc tgaccgtgga caagtcctcc 300
aacaccgcct acatgcagct gtcctccctg acctctgagg cctccgccgt gtactactgc 360
gccagagctt acggcaacta cgagttcgcc tactggggcc agggcaccct cgtgacagtg 420
tctgtggcta gcaccaaggg ccccagcgtg ttccctctgg cccccagcag caagagcacc 480
agcggcggaa ccgccgccct gggctgcctg gtgaaggact acttccccga gcccgtgacc 540
gtgtcctgga acagcggcgc tctgaccagc ggagtgcaca ccttccctgc cgtgctgcag 600
agcagcggcc tgtactccct gagcagcgtg gtgaccgtgc ccagcagcag cctgggcacc 660
cagacctaca tctgcaacgt gaaccacaag ccctccaaca ccaaggtgga caagaaggtg 720
gagcctaaga gctgcgacaa gacccacacc tgccctccct gccccgcccc cgagctgctg 780
ggcggaccca gcgtgttcct gttccctccc aagcccaagg acaccctgat gatcagccgc 840
acccccgagg tgacctgcgt ggtggtggac gtgagccacg aggaccccga ggtgaagttc 900
aactggtacg tggacggcgt ggaggtgcac aacgccaaga ccaagcctcg ggaggagcag 960
tacaactcca cctaccgcgt ggtgagcgtg ctgaccgtgc tgcaccagga ctggctgaac 1020
ggcaaggagt acaagtgcaa ggtgagcaac aaggccctgc ccgctcccat cgagaagacc 1080
atcagcaagg ccaagggcca gccccgggag cctcaggtgt acaccctgcc ccccagccgc 1140
gacgagctga ccaagaacca ggtgagcctg acctgcctgg tgaagggctt ctacccctcc 1200
gacatcgccg tggagtggga gagcaacggc cagcctgaga acaactacaa gaccacccct 1260
cccgtgctgg acagcgacgg cagcttcttc ctgtacagca agctgaccgt ggacaagtcc 1320
cggtggcagc agggcaacgt gttcagctgc agcgtgatgc acgaggccct gcacaaccac 1380
tacacccaga agagcctgag cctgagcccc ggatag 1416
<210> 14
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая каппа-цепь мышиного антитела к AGE
<400> 14
atggagaccg acaccctgct gctctgggtg ctgctgctct gggtgcccgg ctccaccgga 60
gacgtcgtga tgacccagac ccctctgtcc ctgcctgtgt ctctgggcga ccaggcctcc 120
atctcctgcc ggtctagaca gtccctcgtg aactccaacg gcaacacctt cctgcagtgg 180
tatctgcaga agcccggcca gtcccccaag ctgctgatct acaaggtgtc cctgcggttc 240
tccggcgtgc ccgacagatt ttccggctct ggctctggca ccgacttcac cctgaagatc 300
tcccgggtgg aagccgagga cctgggcctg tacttctgca gccagtccac ccacgtgccc 360
cctacatttg gcggaggcac caagctggaa atcaaacggg cagatgctgc accaactgta 420
tccatcttcc caccatccag tgagcagtta acatctggag gtgcctcagt cgtgtgcttc 480
ttgaacaact tctaccccaa agacatcaat gtcaagtgga agattgatgg cagtgaacga 540
caaaatggcg tcctgaacag ttggactgat caggacagca aagacagcac ctacagcatg 600
agcagcaccc tcacgttgac caaggacgag tatgaacgac ataacagcta tacctgtgag 660
gccactcaca agacatcaac ttcacccatt gtcaagagct tcaacaggaa tgagtgttga 720
<210> 15
<211> 720
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая каппа-цепь химерного антитела человека к AGE
<400> 15
atggagaccg acaccctgct gctctgggtg ctgctgctct gggtgcccgg ctccaccgga 60
gacgtcgtga tgacccagac ccctctgtcc ctgcctgtgt ctctgggcga ccaggcctcc 120
atctcctgcc ggtctagaca gtccctcgtg aactccaacg gcaacacctt cctgcagtgg 180
tatctgcaga agcccggcca gtcccccaag ctgctgatct acaaggtgtc cctgcggttc 240
tccggcgtgc ccgacagatt ttccggctct ggctctggca ccgacttcac cctgaagatc 300
tcccgggtgg aagccgagga cctgggcctg tacttctgca gccagtccac ccacgtgccc 360
cctacatttg gcggaggcac caagctggaa atcaagcgga ccgtggccgc ccccagcgtg 420
ttcatcttcc ctcccagcga cgagcagctg aagtctggca ccgccagcgt ggtgtgcctg 480
ctgaacaact tctacccccg cgaggccaag gtgcagtgga aggtggacaa cgccctgcag 540
agcggcaaca gccaggagag cgtgaccgag caggactcca aggacagcac ctacagcctg 600
agcagcaccc tgaccctgag caaggccgac tacgagaagc acaaggtgta cgcctgcgag 660
gtgacccacc agggactgtc tagccccgtg accaagagct tcaaccgggg cgagtgctaa 720
<210> 16
<211> 477
<212> PRT
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь мышиного антитела IgG2b к AGE
<400> 16
Met Asp Pro Lys Gly Ser Leu Ser Trp Arg Ile Leu Leu Phe Leu Ser
1 5 10 15
Leu Ala Phe Glu Leu Ser Tyr Gly Gln Val Gln Leu Leu Gln Pro Gly
20 25 30
Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Leu Ala Cys Lys Ala
35 40 45
Ser Gly Tyr Leu Phe Thr Thr Tyr Trp Met His Trp Leu Lys Gln Arg
50 55 60
Pro Gly Gln Gly Leu Glu Trp Ile Gly Glu Ile Ser Pro Thr Asn Gly
65 70 75 80
Arg Ala Tyr Tyr Asn Ala Arg Phe Lys Ser Glu Ala Thr Leu Thr Val
85 90 95
Asp Lys Ser Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser
100 105 110
Glu Ala Ser Ala Val Tyr Tyr Cys Ala Arg Ala Tyr Gly Asn Tyr Glu
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Val Ala Lys
130 135 140
Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Cys Gly Asp Thr
145 150 155 160
Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro
165 170 175
Glu Ser Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Ser Val
180 185 190
His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr Thr Met Ser Ser
195 200 205
Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val Thr Cys
210 215 220
Ser Val Ala His Pro Ala Ser Ser Thr Thr Val Asp Lys Lys Leu Glu
225 230 235 240
Pro Ser Gly Pro Ile Ser Thr Ile Asn Pro Cys Pro Pro Cys Lys Glu
245 250 255
Cys His Lys Cys Pro Ala Pro Asn Leu Glu Gly Gly Pro Ser Val Phe
260 265 270
Ile Phe Pro Pro Asn Ile Lys Asp Val Leu Met Ile Ser Leu Thr Pro
275 280 285
Lys Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val
290 295 300
Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr
305 310 315 320
Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Ile Arg Val Val Ser Thr
325 330 335
Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys
340 345 350
Lys Val Asn Asn Lys Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
355 360 365
Lys Ile Lys Gly Leu Val Arg Ala Pro Gln Val Tyr Ile Leu Pro Pro
370 375 380
Pro Ala Glu Gln Leu Ser Arg Lys Asp Val Ser Leu Thr Cys Leu Val
385 390 395 400
Val Gly Phe Asn Pro Gly Asp Ile Ser Val Glu Trp Thr Ser Asn Gly
405 410 415
His Thr Glu Glu Asn Tyr Lys Asp Thr Ala Pro Val Leu Asp Ser Asp
420 425 430
Gly Ser Tyr Phe Ile Tyr Ser Lys Leu Asn Met Lys Thr Ser Lys Trp
435 440 445
Glu Lys Thr Asp Ser Phe Ser Cys Asn Val Arg His Glu Gly Leu Lys
450 455 460
Asn Tyr Tyr Leu Lys Lys Thr Ile Ser Arg Ser Pro Gly
465 470 475
<210> 17
<211> 471
<212> PRT
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь химерного антитела человека к AGE
<400> 17
Met Asp Pro Lys Gly Ser Leu Ser Trp Arg Ile Leu Leu Phe Leu Ser
1 5 10 15
Leu Ala Phe Glu Leu Ser Tyr Gly Gln Val Gln Leu Leu Gln Pro Gly
20 25 30
Ala Glu Leu Val Lys Pro Gly Ala Ser Val Lys Leu Ala Cys Lys Ala
35 40 45
Ser Gly Tyr Leu Phe Thr Thr Tyr Trp Met His Trp Leu Lys Gln Arg
50 55 60
Pro Gly Gln Gly Leu Glu Trp Ile Gly Glu Ile Ser Pro Thr Asn Gly
65 70 75 80
Arg Ala Tyr Tyr Asn Ala Arg Phe Lys Ser Glu Ala Thr Leu Thr Val
85 90 95
Asp Lys Ser Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser
100 105 110
Glu Ala Ser Ala Val Tyr Tyr Cys Ala Arg Ala Tyr Gly Asn Tyr Glu
115 120 125
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Val Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
245 250 255
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
260 265 270
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
275 280 285
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
290 295 300
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
305 310 315 320
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
325 330 335
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
340 345 350
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
355 360 365
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
370 375 380
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
385 390 395 400
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
405 410 415
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
420 425 430
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
435 440 445
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
450 455 460
Ser Leu Ser Leu Ser Pro Gly
465 470
<210> 18
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая каппа-цепь мышиного антитела к AGE
<400> 18
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro
20 25 30
Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser
35 40 45
Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln Trp Tyr Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe
100 105 110
Cys Ser Gln Ser Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys
115 120 125
Leu Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro
130 135 140
Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe
145 150 155 160
Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp
165 170 175
Gly Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys
195 200 205
Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys
210 215 220
Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 19
<211> 239
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая каппа-цепь химерного антитела человека к AGE
<400> 19
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro
20 25 30
Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser
35 40 45
Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln Trp Tyr Leu Gln Lys
50 55 60
Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe
100 105 110
Cys Ser Gln Ser Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys
115 120 125
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
130 135 140
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
145 150 155 160
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
165 170 175
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
195 200 205
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
210 215 220
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 20
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь (вариабельная область) мышиного антитела IgG2b к AGE
<400> 20
Gln Val Gln Leu Leu Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ala Cys Lys Ala Ser Gly Tyr Leu Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Leu Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Ser Pro Thr Asn Gly Arg Ala Tyr Tyr Asn Ala Arg Phe
50 55 60
Lys Ser Glu Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Ala Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Tyr Gly Asn Tyr Glu Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 21
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая каппа-цепь (вариабельная область) мышиного антитела к AGE
<400> 21
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Leu Val Asn Ser
20 25 30
Asn Gly Asn Thr Phe Leu Gln Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Leu Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 22
<211> 326
<212> PRT
<213> Искусственная последовательность
<220>
<223> Константная область человека
<400> 22
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 23
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR1H (тяжелая цепь)
<400> 23
Ser Tyr Thr Met Gly Val Ser
1 5
<210> 24
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR2H (тяжелая цепь)
<400> 24
Thr Ile Ser Ser Gly Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 25
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR3H (тяжелая цепь)
<220>
<221> misc_feature
<222> (10)..(10)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 25
Gln Gly Gly Trp Leu Pro Pro Phe Ala Xaa
1 5 10
<210> 26
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR1L (легкая цепь)
<400> 26
Arg Ala Ser Lys Ser Val Ser Thr Ser Ser Arg Gly Tyr Ser Tyr Met
1 5 10 15
His
<210> 27
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR2L (легкая цепь)
<400> 27
Leu Val Ser Asn Leu Glu Ser
1 5
<210> 28
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR3L (легкая цепь)
<400> 28
Gln His Ile Arg Glu Leu Thr Arg Ser
1 5
<210> 29
<211> 468
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 29
Met Asp Pro Lys Gly Ser Leu Ser Trp Arg Ile Leu Leu Phe Leu Ser
1 5 10 15
Leu Ala Phe Glu Leu Ser Tyr Gly Gln Val Gln Leu Val Gln Ser Gly
20 25 30
Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala
35 40 45
Ser Gly Tyr Leu Phe Thr Thr Tyr Trp Met His Trp Val Arg Gln Ala
50 55 60
Pro Gly Gln Gly Leu Glu Trp Met Gly Glu Ile Ser Pro Thr Asn Gly
65 70 75 80
Arg Ala Tyr Tyr Asn Gln Lys Phe Gln Gly Arg Val Thr Met Thr Val
85 90 95
Asp Lys Ser Thr Asn Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser
100 105 110
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Tyr Gly Asn Tyr Phe
115 120 125
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly
465
<210> 30
<211> 1408
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 30
atggacccca agggcagcct gagctggaga atcctgctgt tcctgagcct ggccttcgag 60
ctgagctacg gccaggtgca gctggtgcag tctggcgccg aagtgaagaa acctggcgcc 120
tccgtgaggt gtcctgcaag gcttccggct acctgttcac cacctactgg atgcactggg 180
tgcgacaggc ccctggacag ggcctggaat ggatgggcga gatctcccct accaacggca 240
gagcctacta caacagaaat tccagggcag agtgaccatg accgtggaca agtccaccaa 300
caccgtgtac atggaactgt cctccctgcg gagcgaggac accgccgtgt actactgcgc 360
tagagcctac ggcaactacg attcgcctac tggggccagg gcaccctcgt gacagtgtcc 420
tctgctagca ccaagggccc cagcgtgttc cctctggccc ccagcagcaa gagcaccagc 480
ggcggaaccg ccgccctggg ctgcctggga aggactactt ccccgagccc gtgaccgtgt 540
cctggaacag cggcgctctg accagcggag tgcacacctt ccctgccgtg ctgcagagca 600
gcggcctgta ctccctgagc agcgtggtga ccgtgccagc agcagcctgg gcacccagac 660
ctacatctgc aacgtgaacc acaagccctc caacaccaag gtggacaaga aggtggagcc 720
taagagctgc gacaagaccc acacctgccc tccctgcccc gccccgagct gctgggcgga 780
cccagcgtgt tcctgttccc tcccaagccc aaggacaccc tgatgatcag ccgcaccccc 840
gaggtgacct gcgtggtggt ggacgtgagc cacgaggacc ccgaggtgag ttcaactggt 900
acgtggacgg cgtggaggtg cacaacgcca agaccaagcc tcgggaggag cagtacaact 960
ccacctaccg cgtggtgagc gtgctgaccg tgctgcacca ggactggctg aacggcagga 1020
gtacaagtgc aaggtgagca acaaggccct gcccgctccc atcgagaaga ccatcagcaa 1080
ggccaagggc cagccccggg agcctcaggt gtacaccctg ccccccagcc gcgacgagct 1140
gacaagaacc aggtgagcct gacctgcctg gtgaagggct tctacccctc cgacatcgcc 1200
gtggagtggg agagcaacgg ccagcctgag aacaactaca agaccacccc tcccgtgctg 1260
gacagcgacg cagcttcttc ctgtacagca agctgaccgt ggacaagtcc cggtggcagc 1320
agggcaacgt gttcagctgc agcgtgatgc acgaggccct gcacaaccac tacacccaga 1380
agagcctgag cctgagcccg gatagtaa 1408
<210> 31
<211> 468
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 31
Met Asp Pro Lys Gly Ser Leu Ser Trp Arg Ile Leu Leu Phe Leu Ser
1 5 10 15
Leu Ala Phe Glu Leu Ser Tyr Gly Gln Val Gln Leu Val Gln Ser Gly
20 25 30
Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala
35 40 45
Ser Gly Tyr Leu Phe Thr Thr Tyr Trp Met His Trp Val Arg Gln Ala
50 55 60
Pro Gly Gln Gly Leu Glu Trp Met Gly Glu Ile Ser Pro Thr Asn Gly
65 70 75 80
Arg Ala Tyr Tyr Asn Ala Lys Phe Gln Gly Arg Val Thr Met Thr Val
85 90 95
Asp Lys Ser Thr Asn Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser
100 105 110
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Tyr Gly Asn Tyr Phe
115 120 125
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly
465
<210> 32
<211> 1408
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 32
atggacccca agggcagcct gagctggaga atcctgctgt tcctgagcct ggccttcgag 60
ctgagctacg gccaggtgca gctggtgcag tctggcgccg aagtgaagaa acctggcgcc 120
tccgtgaggt gtcctgcaag gcttccggct acctgttcac cacctactgg atgcactggg 180
tgcgacaggc ccctggacag ggcctggaat ggatgggcga gatctcccct accaacggca 240
gagcctacta caaccaaaat tccagggcag agtgaccatg accgtggaca agtccaccaa 300
caccgcttac atggaactgt cctccctgcg gagcgaggac accgccgtgt actactgcgc 360
tagagcctac ggcaactacg attcgcctac tggggccagg gcaccctcgt gacagtgtcc 420
tctgctagca ccaagggccc cagcgtgttc cctctggccc ccagcagcaa gagcaccagc 480
ggcggaaccg ccgccctggg ctgcctggga aggactactt ccccgagccc gtgaccgtgt 540
cctggaacag cggcgctctg accagcggag tgcacacctt ccctgccgtg ctgcagagca 600
gcggcctgta ctccctgagc agcgtggtga ccgtgccagc agcagcctgg gcacccagac 660
ctacatctgc aacgtgaacc acaagccctc caacaccaag gtggacaaga aggtggagcc 720
taagagctgc gacaagaccc acacctgccc tccctgcccc gccccgagct gctgggcgga 780
cccagcgtgt tcctgttccc tcccaagccc aaggacaccc tgatgatcag ccgcaccccc 840
gaggtgacct gcgtggtggt ggacgtgagc cacgaggacc ccgaggtgag ttcaactggt 900
acgtggacgg cgtggaggtg cacaacgcca agaccaagcc tcgggaggag cagtacaact 960
ccacctaccg cgtggtgagc gtgctgaccg tgctgcacca ggactggctg aacggcagga 1020
gtacaagtgc aaggtgagca acaaggccct gcccgctccc atcgagaaga ccatcagcaa 1080
ggccaagggc cagccccggg agcctcaggt gtacaccctg ccccccagcc gcgacgagct 1140
gacaagaacc aggtgagcct gacctgcctg gtgaagggct tctacccctc cgacatcgcc 1200
gtggagtggg agagcaacgg ccagcctgag aacaactaca agaccacccc tcccgtgctg 1260
gacagcgacg cagcttcttc ctgtacagca agctgaccgt ggacaagtcc cggtggcagc 1320
agggcaacgt gttcagctgc agcgtgatgc acgaggccct gcacaaccac tacacccaga 1380
agagcctgag cctgagcccg gatagtaa 1408
<210> 33
<211> 468
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 33
Met Asp Pro Lys Gly Ser Leu Ser Trp Arg Ile Leu Leu Phe Leu Ser
1 5 10 15
Leu Ala Phe Glu Leu Ser Tyr Gly Gln Val Gln Leu Val Gln Ser Gly
20 25 30
Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala
35 40 45
Ser Gly Tyr Leu Phe Thr Thr Tyr Trp Met His Trp Val Arg Gln Ala
50 55 60
Pro Gly Gln Gly Leu Glu Trp Met Gly Glu Ile Ser Pro Thr Asn Gly
65 70 75 80
Arg Ala Tyr Tyr Asn Ala Lys Phe Gln Gly Arg Val Thr Met Thr Val
85 90 95
Asp Lys Ser Ile Asn Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser
100 105 110
Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Tyr Gly Asn Tyr Phe
115 120 125
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly
465
<210> 34
<211> 1408
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная тяжелая цепь
<400> 34
atggacccca agggcagcct gagctggaga atcctgctgt tcctgagcct ggccttcgag 60
ctgagctacg gccaggtgca gctggtgcag tctggcgccg aagtgaagaa acctggcgcc 120
tccgtgaggt gtcctgcaag gcttccggct acctgttcac cacctactgg atgcactggg 180
tgcgacaggc ccctggacag ggcctggaat ggatgggcga gatctcccct accaacggca 240
gagcctacta caaccaaaat tccagggcag agtgaccatg accgtggaca agtccatcaa 300
caccgcttac atggaactgt ccagactgcg gagcgatgac accgccgtgt actactgcgc 360
tagagcctac ggcaactacg attcgcctac tggggccagg gcaccctcgt gacagtgtcc 420
tctgctagca ccaagggccc cagcgtgttc cctctggccc ccagcagcaa gagcaccagc 480
ggcggaaccg ccgccctggg ctgcctggga aggactactt ccccgagccc gtgaccgtgt 540
cctggaacag cggcgctctg accagcggag tgcacacctt ccctgccgtg ctgcagagca 600
gcggcctgta ctccctgagc agcgtggtga ccgtgccagc agcagcctgg gcacccagac 660
ctacatctgc aacgtgaacc acaagccctc caacaccaag gtggacaaga aggtggagcc 720
taagagctgc gacaagaccc acacctgccc tccctgcccc gccccgagct gctgggcgga 780
cccagcgtgt tcctgttccc tcccaagccc aaggacaccc tgatgatcag ccgcaccccc 840
gaggtgacct gcgtggtggt ggacgtgagc cacgaggacc ccgaggtgag ttcaactggt 900
acgtggacgg cgtggaggtg cacaacgcca agaccaagcc tcgggaggag cagtacaact 960
ccacctaccg cgtggtgagc gtgctgaccg tgctgcacca ggactggctg aacggcagga 1020
gtacaagtgc aaggtgagca acaaggccct gcccgctccc atcgagaaga ccatcagcaa 1080
ggccaagggc cagccccggg agcctcaggt gtacaccctg ccccccagcc gcgacgagct 1140
gacaagaacc aggtgagcct gacctgcctg gtgaagggct tctacccctc cgacatcgcc 1200
gtggagtggg agagcaacgg ccagcctgag aacaactaca agaccacccc tcccgtgctg 1260
gacagcgacg cagcttcttc ctgtacagca agctgaccgt ggacaagtcc cggtggcagc 1320
agggcaacgt gttcagctgc agcgtgatgc acgaggccct gcacaaccac tacacccaga 1380
agagcctgag cctgagcccg gatagtaa 1408
<210> 35
<211> 238
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 35
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro
20 25 30
Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
35 40 45
Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln Trp Tyr Gln Gln Arg
50 55 60
Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ser Gln Ser Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 36
<211> 715
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 36
atggagaccg acaccctgct gctctgggtg ctgctgctct gggtgcccgg ctccaccgga 60
gacgtcgtga tgacccagtc ccctctgtcc ctgcctgtga ccctgggaca gcctgcctcc 120
atctcctcag atcctcccag tccctcgtga actccaacgg caacaccttc ctgcagtggt 180
atcagcagcg gcctggccag agccccagac tgctgatcta caaggtgtcc ctgcggttct 240
ccggcgtgcc cgacgatttt ccggctctgg ctctggcacc gacttcaccc tgaagatctc 300
ccgggtggaa gccgaggacg tgggcgtgta ctactgctcc cagagcaccc acgtgccccc 360
tacatttggc ggaggcacca agtggaaatc aagcggaccg tggccgcccc cagcgtgttc 420
atcttccctc ccagcgacga gcagctgaag tctggcaccg ccagcgtggt gtgcctgctg 480
aacaacttct acccccgcga ggccaagggc agtggaaggt ggacaacgcc ctgcagagcg 540
gcaacagcca ggagagcgtg accgagcagg actccaagga cagcacctac agcctgagca 600
gcaccctgac cctgagcaag gccgactacg agaagacaag gtgtacgcct gcgaggtgac 660
ccaccaggga ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gctaa 715
<210> 37
<211> 238
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 37
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro
20 25 30
Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser
35 40 45
Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln Trp Tyr Gln Gln Arg
50 55 60
Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ser Gln Ser Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 38
<211> 715
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 38
atggagaccg acaccctgct gctctgggtg ctgctgctct gggtgcccgg ctccaccgga 60
gacgtcgtga tgacccagtc ccctctgtcc ctgcctgtga ccctgggaca gcctgcctcc 120
atctcctcag atccaggcag tccctcgtga actccaacgg caacaccttc ctgcagtggt 180
atcagcagcg gcctggccag agccccagac tgctgatcta caaggtgtcc ctgcggttct 240
ccggcgtgcc cgacgatttt ccggctctgg ctctggcacc gacttcaccc tgaagatctc 300
ccgggtggaa gccgaggacg tgggcgtgta ctactgctcc cagagcaccc acgtgccccc 360
tacatttggc ggaggcacca agtggaaatc aagcggaccg tggccgcccc cagcgtgttc 420
atcttccctc ccagcgacga gcagctgaag tctggcaccg ccagcgtggt gtgcctgctg 480
aacaacttct acccccgcga ggccaagggc agtggaaggt ggacaacgcc ctgcagagcg 540
gcaacagcca ggagagcgtg accgagcagg actccaagga cagcacctac agcctgagca 600
gcaccctgac cctgagcaag gccgactacg agaagacaag gtgtacgcct gcgaggtgac 660
ccaccaggga ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gctaa 715
<210> 39
<211> 238
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 39
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Val Val Met Thr Gln Ser Pro Leu Ser Ser Pro
20 25 30
Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser
35 40 45
Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln Trp Tyr His Gln Arg
50 55 60
Pro Gly Gln Pro Pro Arg Leu Leu Ile Tyr Lys Val Ser Leu Arg Phe
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly Lys Asp Phe
85 90 95
Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Ser Gln Ser Thr His Val Pro Pro Thr Phe Gly Gln Gly Thr Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 40
<211> 715
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гуманизированная легкая цепь
<400> 40
atggagaccg acaccctgct gctctgggtg ctgctgctct gggtgcccgg ctccaccgga 60
gacgtcgtga tgacccagtc ccctctgtcc agtcctgtga ccctgggaca gcctgcctcc 120
atctcctcag atcctcccag tccctcgtga actccaacgg caacaccttc ctgcagtggt 180
atcaccagcg gcctggccag cctcccagac tgctgatcta caaggtgtcc ctgcggttct 240
ccggcgtgcc cgacgatttt ccggctctgg cgctggcaag gacttcaccc tgaagatctc 300
ccgggtggaa gccgaggacg tgggcgtgta ctactgctcc cagagcaccc acgtgccccc 360
tacatttggc cagggcacca actggaaatc aagcggaccg tggccgcccc cagcgtgttc 420
atcttccctc ccagcgacga gcagctgaag tctggcaccg ccagcgtggt gtgcctgctg 480
aacaacttct acccccgcga ggccaagggc agtggaaggt ggacaacgcc ctgcagagcg 540
gcaacagcca ggagagcgtg accgagcagg actccaagga cagcacctac agcctgagca 600
gcaccctgac cctgagcaag gccgactacg agaagacaag gtgtacgcct gcgaggtgac 660
ccaccaggga ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gctaa 715
<210> 41
<211> 5
<212> PRT
<213> Mus musculus
<400> 41
Thr Tyr Trp Met His
1 5
<210> 42
<211> 17
<212> PRT
<213> Mus musculus
<400> 42
Glu Ile Ser Pro Thr Asn Gly Arg Ala Tyr Tyr Asn Ala Arg Phe Lys
1 5 10 15
Ser
<210> 43
<211> 9
<212> PRT
<213> Mus musculus
<400> 43
Ala Tyr Gly Asn Tyr Glu Phe Ala Tyr
1 5
<210> 44
<211> 16
<212> PRT
<213> Mus musculus
<400> 44
Arg Ser Arg Gln Ser Leu Val Asn Ser Asn Gly Asn Thr Phe Leu Gln
1 5 10 15
<210> 45
<211> 7
<212> PRT
<213> Mus musculus
<400> 45
Lys Val Ser Leu Arg Phe Ser
1 5
<210> 46
<211> 9
<212> PRT
<213> Mus musculus
<400> 46
Ser Gln Ser Thr His Val Pro Pro Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ и композиция для лечения рака, уничтожения метастатических раковых клеток и профилактики метастазов рака, используя антитела к конечным продуктам повышенного гликирования ( AGE) | 2017 |
|
RU2728964C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| АНТИТЕЛО ПРОТИВ ФАКТОРА РОСТА СОЕДИНИТЕЛЬНОЙ ТКАНИ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2819228C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
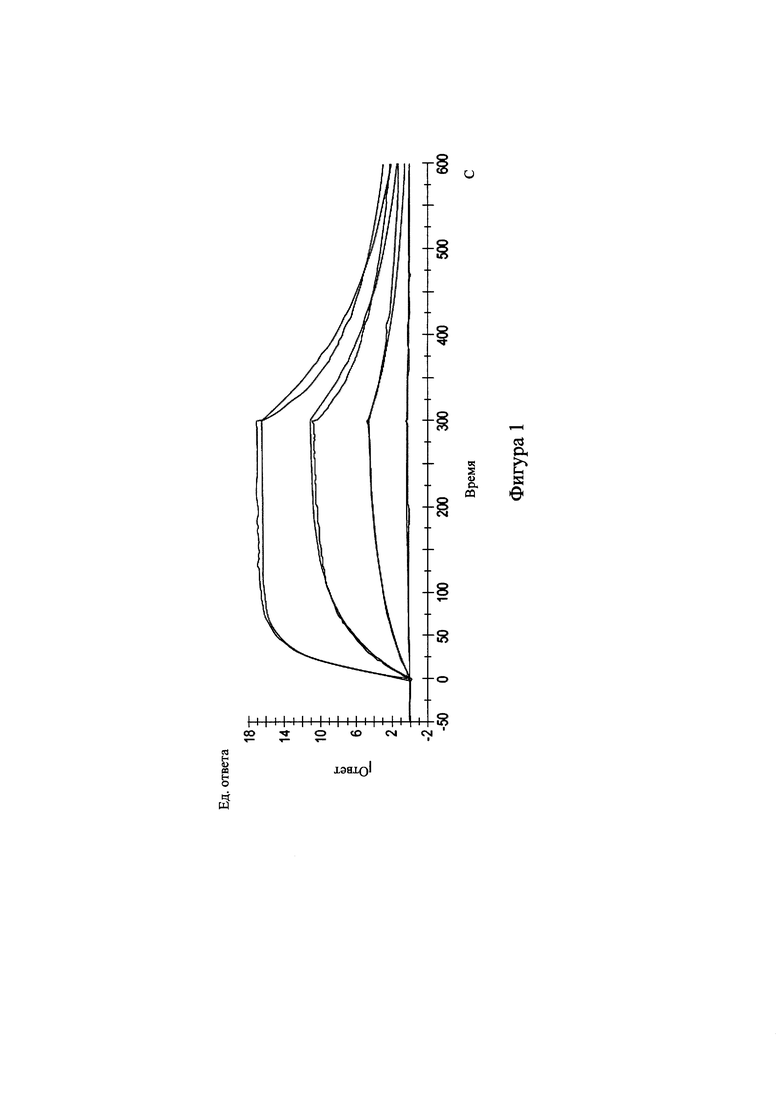
Изобретение относится к области биотехнологии, в частности к антителу, которое связывается с конечным продуктом повышенного гликирования, а также к содержащему его конъюгату. Изобретение эффективно для селективного нацеливания на белок или пептид с карбоксиметиллизиновой модификацией. 3 н. и 11 з.п. ф-лы, 1 ил., 7 табл., 5 пр.
1. Антитело, которое связывается с конечным продуктом повышенного гликирования, содержащее
тяжелую цепь и
легкую цепь,
где тяжелая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO:31, и
легкая цепь содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO:37; и
где антитело связывается с белком или пептидом с карбоксиметиллизиновой модификацией.
2. Антитело по п.1, где антитело представляет собой гуманизированное антитело.
3. Антитело по п.1 или 2, где антитело является моноклональным.
4. Антитело по любому из пп.1-3, где антитело по существу неиммуногенно для человека.
5. Антитело по любому из пп.1-4, где антитело имеет скорость диссоциации (kd) не более 9×10-3 с-1.
6. Антитело по любому из пп.1-5, где антитело содержит константные области, которые разрушают клетки-мишени под действием иммунной системы субъекта.
7. Конъюгат для селективного нацеливания, содержащий антитело по любому из пп.1-6 и средство, которое вызывает разрушение AGE-модифицированных клеток, выбранный из группы, состоящей из токсина, цитотоксического агента, магнитных наночастиц и магнитных спин-вихревых дисков.
8. Конъюгат антитела, который связывается с конечным продуктом повышенного гликирования, содержащий:
фрагмент антитела, которое связывается с конечным продуктом повышенного гликирования, содержащий белок или пептид, содержащий по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO:31, и
по меньшей мере одну аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO:37; и
агент, который вызывает разрушение AGE-модифицированных клеток, конъюгированный с фрагментом антитела, который связывается с конечным продуктом повышенного гликирования,
где фрагмент антитела, который связывается с конечным продуктом повышенного гликирования, связывается с белком или пептидом с карбоксиметиллизиновой модификацией.
9. Конъюгат антитела по п.8, где антитело представляет собой гуманизированное антитело.
10. Конъюгат антитела по п.8 или 9, где антитело является моноклональным.
11. Конъюгат антитела по любому из пп.8-10, где антитело по существу неиммуногенно у человека.
12. Конъюгат антитела по любому из пп.8-11, где антитело имеет скорость диссоциации (kd) не более 9×10-3 с-1.
13. Конъюгат антитела по любому из пп.8-12, где агент выбран из группы, состоящей из токсина, цитотоксического агента, магнитных наночастиц и магнитных спин-вихревых дисков.
14. Конъюгат антитела по любому из пп.8-13, где антитело содержит константные области, которые позволяют разрушать клетки-мишени с помощью иммунной системы субъекта.
| JP 2003160599 A, 03.06.2003 | |||
| CASPER GSCHALKWIJK et al | |||
| Increased accumulation of the glycoxidation productNq-(carboxymethyl)lysine in hearts of diabetic patients:generation and characterisation of a monoclonal anti-CML antibody, Biochimica et Biophysica Acta, 2004, Vol.1636, pp.82-89 | |||
| US 5702704 A, 30.12.1997 | |||
| DARREN J.BAKER et al | |||
| Clearance of |
Авторы
Даты
2022-02-09—Публикация
2016-05-27—Подача