ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к реакционной смеси и биотехнологическому способу получения спиртов, в том числе высших спиртов, из источника углерода в аэробных условиях. В частности, смесь и способ относятся к биотехнологическому получению по меньшей мере одного спирта в присутствии кислорода и молодых клеток.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Биотехнологические способы получения спиртов, в частности, этанола, хорошо известны из уровня техники. В частности, хорошо известно применение ацетогенных бактерий на различных источниках углерода с получением этанола и/или ацетата. Однако в большинстве случаев производство спиртов можно успешно осуществить только в отсутствие кислорода. Данное явление подтверждается по меньшей мере Brioukhanov, 2006 г., Imlay, 2006 г., Lan, 2013 г. и т. п., где показано, что ацетогенные бактерии не способны успешно продуцировать этанол в аэробных условиях. Таким образом, в современных способах, известных из уровня техники, углеродные субстраты, содержащие кислород, такие как отходящие газы сталелитейных заводов, сначала обрабатывают для удаления кислорода перед тем, как ввести в ацетогенные клетки для получения этанола и/или ацетата. Этап отделения кислорода делает процесс более дорогим и трудоемким. Кроме того, могут быть некоторые потери сырья на этом этапе отделения.
Таким образом, существует потребность в данной области техники в средствах получения этанола и/или ацетата в присутствии кислорода. Этанол затем можно использовать в качестве сырья для получения высших углеродных соединений, таких как спирты, кислоты и т. п.
Например, бутанол и высшие спирты характеризуются рядом применений, в том числе используются в качестве топлива. Например, бутанол в будущем может заменить бензин, поскольку энергосодержание в двух данных видах топлива практически одинаковое. Кроме того, бутанол имеет ряд других лучших характеристик в качестве альтернативного топлива по сравнению с этанолом. Они включают в себя то, что бутанол имеет более высокое энергосодержание, бутанол является менее “испаряющимся”, чем этанол или бензин, и бутанол легче транспортируется, по сравнению с этанолом. По этим и другим причинам уже существует потенциальный рынок для бутанола и/или близких высших спиртов. Бутанол и другие высшие спирты также используются в качестве промышленных растворителей.
В настоящее время бутанол и другие высшие спирты прежде всего изготавливают из нефтепродуктов. Эти соединения получают путем крекинга бензина или нефтепродуктов, что неблагоприятно для окружающей среды. Кроме того, поскольку расходы на эти исходные материалы будут связаны с ценой на нефть, с ожидаемым повышением цен на нефтепродукты в будущем цены на бутанол и другие высшие спирты также могут увеличиться относительно роста цен на нефтепродукты.
Исторически (1900-е - 1950-е годы) биобутанол изготавливали из кукурузы и мелассы в процессе брожения, при котором также получали ацетон и этанол, и который был известен как ферментация ABE (ацетон, бутанол, этанол), как правило, с использованием определенных бутанол-продуцирующих бактерий, таких как Clostridium acetobutylicum и Clostridium beijerinckii. Этот способ в последнее время снова приобрел популярность с возобновлением интереса к экологически чистой энергии. Однако способ “производства бутанола из кукурузного крахмала” требует ряда энергоемких этапов, включая сельскохозяйственное выращивание культур кукурузы, сбор урожая зерна кукурузы, обработка крахмала зерна кукурузы и ферментация крахмал-в-сахар-в-бутанол. Способ “производства бутанола из кукурузного крахмала” может, вероятно, требовать столько же много затрат энергии, сколько составляет энергетическая ценность его продукта бутанола.
Спиртовой процесс Alfol® представляет собой способ, применяемый для получения высших спиртов из этилена с помощью алюминийорганического катализатора. В реакции получают линейные первичные спирты (C2-C28) с длинной цепью. В способе используют алюминиевый катализатор для олигомеризации этилена и обеспечения окисления полученной алкильной группы. Однако данный способ дает широкий спектр спиртов и модель распределения сохраняется. Эта постоянная модель ограничивает способность производителя получать только определенный диапазон спиртов, который пользуется наибольшим спросом или имеет большее экономическое значение. Кроме того, газы, необходимые в реакции, должны быть очень чистыми, и для успешного осуществления реакции необходима особая композиция газов.
В WO 2009100434 также описывается непрямой способ получения бутанола и гексанола из углевода. Способ включает гомоацетатную ферментацию с получением промежуточного продукта уксусной кислоты, который затем химическим путем превращают в этанол. Затем этанол и оставшуюся часть промежуточного продукта уксусной кислоты используют в качестве субстрата при кислотообразующей ферментации с получением промежуточных продуктов масляной и капроновой кислоты, которые затем химически превращают в бутанол и гексанол. Однако в этом способе используют дорогое углеводное сырье и присутствует два дополнительных этапа способа, образование сложных эфиров и химическое гидрирование сложных эфиров, что делает способ не только более длительным, но и также попутно приводит к потере полезного материала.
Perez J.M. (2012) раскрывает способ превращения карбоновых кислот с короткой цепью в соответствующие им спирты в присутствии синтез-газа с применением Clostridium ljungdahlii. Однако карбоновые кислоты с короткой цепью необходимо добавлять в качестве субстрата для превращения в соответствующий высший спирт.
Доступные в настоящее время способы получения высших спиртов, таким образом, имеют ограничения переноса массы газообразных субстратов в ферментационный бульон, низкую производительность и более низкие концентрации конечных продуктов, что приводит к повышению энергозатрат для очистки продукта.
Соответственно, требуется найти более экологически рациональное сырье помимо чистых источников, основанных на нефтепродуктах или кукурузе, в качестве исходных материалов для получения бутанола и других высших спиртов с помощью биотехнологических средств, которые также наносят меньший вред окружающей среде. В частности, существует необходимость в простом и эффективном биотехнологическом производстве с одним реактором бутанола и других высших спиртов из экологически рационального сырья.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение решает указанные выше проблемы, предоставляя средства получения этанола и высших спиртов в аэробных условиях путем введения ацетогенных клеток в экспоненциальной/логарифмической фазе роста в водную среду, содержащую источник углерода и кислород. Концентрация этих ацетогенных клеток в экспоненциальной/логарифмической фазе роста может поддерживаться с помощью любых средств, известных из уровня техники, при условии, что кислород постоянно присутствует в водной среде. Кислород может присутствовать в водной среде в концентрации по меньшей мере 5 ppm.
В одном аспекте настоящего изобретения предоставлена реакционная смесь для получения этанола и/или ацетата из источника углерода в аэробных условиях, где смесь содержит
- первый ацетогенный микроорганизм в экспоненциальной фазе роста;
- свободный кислород и
- второй ацетогенный микроорганизм в пост-экспоненциальной фазе,
где первый и второй ацетогенные микроорганизмы способны превращать источник углерода в ацетат и/или этанол.
В частности, второй ацетогенный микроорганизм в пост-экспоненциальной фазе может находиться в стационарной фазе клетки. Ацетогенные клетки в логарифмической фазе позволяют любым другим ацетогенным клеткам в водной среде продуцировать ацетат и/или этанол в присутствии кислорода. Концентрация ацетогенных клеток в логарифмической фазе может поддерживаться в реакционной смеси. Таким образом, в любой момент времени в реакции реакционная смесь содержит ацетогенные клетки в логарифмической фазе и ацетогенные клетки в другой фазе роста, например, в стационарной фазе.
Специалист в данной области поймет различные фазы роста микроорганизмов и способы их измерения и идентификации. В частности, большинство микроорганизмов в периодической культуре могут находиться по меньшей мере в четырех различных фазах роста, а именно латентная фаза (A), логарифмическая фаза или экспоненциальная фаза (B), стационарная фаза (C) и фаза гибели (D). Логарифмическая фаза может дополнительно разделяться на раннюю логарифмическую фазу и среднюю - позднюю логарифмическую/экспоненциальную фазу. Стационарная фаза может также дополнительно разграничиваться на раннюю стационарную фазу и стационарную фазу. Например, Cotter J.L., 2009 г., Najafpour G., 2006 г., Younesi H., 2005 г. и Köpke M., 2009 г. раскрывают различные фазы роста ацетогенных бактерий. В частности, фазу роста клеток можно измерить с помощью способов, изложенных по меньшей мере в Shuler M.L., 1992 и Fuchs G., 2007.
Латентная фаза представляет собой фазу сразу после инокуляции клеток в свежую среду, при этом популяция остается временно без изменений. Хотя не происходит видимого деления клеток, клетки могут расти в объеме или массе, синтезировать ферменты, белки, РНК и т. д. и увеличивать метаболическую активность. Длительность латентной фазы может зависеть от множества различных факторов, включая размер инокулята; время, необходимое для восстановления от физического повреждения или шока при переносе; время, необходимое для синтеза важнейших коферментов или факторов деления; и время, необходимое для синтеза новых (индуцибельных) ферментов, которые необходимы для метаболизма субстратов, присутствующих в среде.
Экспоненциальная (логарифмическая) фаза роста представляет собой модель сбалансированного роста, где все клетки регулярно делятся путем бинарного деления и растут в геометрической прогрессии. Клетки делятся с постоянной скоростью в зависимости от состава питательной среды и условий инкубации. Скорость экспоненциального роста бактериальной культуры выражается как время генерации, а также как время удвоения популяции бактерий. Время генерации (G) определяется как время (t) на поколение (n = количество поколений). Следовательно, G = t/n представляет собой уравнение, с помощью которого получают расчеты времени генерации. Экспоненциальная фаза может разделяться на (i) раннюю логарифмическую фазу и (ii) среднюю - позднюю логарифмическую/экспоненциальную фазу. Специалист в данной области может легко определить, когда микроорганизм, в частности ацетогенная бактерия, входит в логарифмическую фазу. Например, способ расчета скорости роста ацетогенных бактерий с определением того, находятся ли они в логарифмической фазе, можно выполнить с применением способа, изложенного по меньшей мере в Henstra A.M., 2007. В частности, микроорганизм в экспоненциальной фазе роста согласно любому из аспектов настоящего изобретения может включать клетки в ранней логарифмической фазе и в средней - поздней логарифмической/экспоненциальной фазе.
Стационарная фаза представляет собой фазу, когда заканчивается экспоненциальный рост, поскольку экспоненциальный рост не может постоянно продолжаться в периодической культуре (например, в закрытой системе, такой как пробирка или колба). Рост популяции ограничен одним из трех факторов: 1. исчерпание доступных питательных веществ; 2. накопление ингибирующих метаболитов или конечных продуктов; 3. исчерпание пространства, в данном случае названное нехваткой "биологического пространства". Во время стационарной фазы, если подсчитываются жизнеспособные клетки, нельзя определить, погибает ли несколько клеток и равное количество клеток делится, или популяция клеток просто перестала расти и делиться. Стационарная фаза, подобно латентной фазе, не обязательно является периодом покоя. Бактерии, которые продуцируют вторичные метаболиты, такие как антибиотики, делают это во время стационарной фазы цикла роста (вторичные метаболиты определяются как метаболиты, продуцируемые после активной стадии роста).
Фаза гибели идет вслед за стационарной фазой. Во время фазы гибели количество жизнеспособных клеток снижается геометрически (экспоненциально), по существу, обратно росту во время логарифмической фазы.
В одном примере, когда O2 присутствует в реакционной смеси согласно любому из аспектов настоящего изобретения, первые ацетогенные бактерии могут находиться в экспоненциальной фазе роста, а другие ацетогенные бактерии могут находиться в любой другой фазе роста в жизненном цикле ацетогенного микроорганизма. В частности, согласно любому из аспектов настоящего изобретения, ацетогенные бактерии в реакционной смеси могут содержать одни ацетогенные бактерии в экспоненциальной фазе роста и другие - в стационарной фазе. В присутствии кислорода без наличия ацетогенных бактерий в экспоненциальном росте ацетогенные бактерии в стационарной фазе могут быть не способны продуцировать ацетат и/или этанол. Это явление подтверждено по меньшей мере Brioukhanov, 2006 г., Imlay, 2006 г., Lan, 2013 г. и т. п. Авторы настоящего изобретения, таким образом, обнаружили, что в присутствии ацетогенных бактерий в экспоненциальном росте ацетогенные бактерии в любой фазе роста могут аэробно дышать и продуцировать ацетат и/или этанол в большем или равном количестве относительно полученного, когда в реакционной смеси отсутствовал кислород. В одном примере ацетогенные бактерии в экспоненциальной фазе роста могут быть способны к удалению свободного кислорода из реакционной смеси, обеспечивая подходящие условия (отсутствие свободного кислорода) ацетогенным бактериям в любой фазе роста для метаболизма углеродного субстрата с получением ацетата и/или этанола.
В другом примере водная среда уже может содержать ацетогенные бактерии в любой фазе роста, в частности, в стационарной фазе, в присутствии источника углерода. В этом примере кислород может присутствовать в источнике углерода, подаваемом в водную среду, или в самой водной среде. В присутствии кислорода ацетогенные бактерии могут быть неактивными и не продуцировать ацетат и/или этанол до добавления ацетогенных бактерий в экспоненциальной фазе роста. В этом самом примере ацетогенные бактерии в экспоненциальной фазе роста могут быть добавлены в водную среду. Неактивные ацетогенные бактерии, уже находящиеся в водной среде, затем могут активироваться и начать продуцировать ацетат и/или этанол.
В дополнительном примере ацетогенные бактерии в любой фазе роста можно сначала смешать с ацетогенными бактериями в экспоненциальной фазе роста и затем добавить источник углерода и/или кислород.
Согласно любому из аспектов настоящего изобретения микроорганизм в экспоненциальной фазе роста, растущий в присутствии кислорода, может в результате привести к получению микроорганизма, адаптирующегося к росту и метаболизму в присутствии кислорода. В частности, микроорганизм может быть способен удалять кислород из среды, окружающей микроорганизм. Эта вновь приобретенная адаптация позволяет ацетогенным бактериям в экспоненциальной фазе роста освобождать среду от кислорода и таким образом производить ацетат и этанол из источника углерода. В частности, ацетогенные бактерии с вновь приобретенной адаптацией позволяют бактериям превращать источник углерода в ацетат и/или этанол.
В одном примере ацетогенные бактерии в реакционной смеси согласно любому из аспектов настоящего представления могут содержать комбинацию клеток: клетки в логарифмической фазе и клетки в стационарной фазе. В способе согласно любому из аспектов настоящего изобретения ацетогенные клетки в логарифмической фазе могут иметь скорость роста, выбранную из группы, состоящей из 0,01-2 ч-1, 0,01-1 ч-1, 0,05-1 ч-1, 0,05-2 ч-1, 0,05-0,5 ч-1 и т. п. В одном примере OD600 клеток у ацетогенных клеток в логарифмической фазе в реакционной смеси может быть выбрана из диапазона, состоящего из 0,001-2, 0,01-2, 0,1-1, 0,1-0,5 и т. п. Специалист в данной области сможет применить любой способ, известный из уровня техники для измерения OD600 и определения скорости роста клеток в реакционной смеси и/или подлежащих добавлению в реакционную смесь. Например, можно использовать Koch (1994). В частности, бактериальный рост можно определять и контролировать с применением различных способов. Одним из наиболее распространенных является измерение мутности, в котором опираются на оптическую плотность (OD) бактерий в суспензии и используют спектрофотометр. OD может быть измерено при 600 нм с использованием UV-спектрофотометра.
Для того, чтобы поддерживать концентрацию первой и второй ацетогенных бактерий в реакционной смеси, специалист в данной области способен извлечь образец в заданные моменты времени для измерения OD600, pH, концентрации кислорода и концентрации образованного этанола и/или высших спиртов. Специалист в данной области затем сможет добавить необходимый компонент(ы) для поддержания концентрации первой и второй ацетогенных бактерий в реакционной смеси и для обеспечения оптимальной среды, поддерживаемой для производства этанола и/или ацетата.
Выражение "ацетогенные бактерии", используемое в настоящем документе, относится к микроорганизму, который способен выполнять путь Вуда-Льюнгдаля и, таким образом, способен превращать CO, CO2 и/или водород в ацетат. Эти микроорганизмы включают микроорганизмы, которые в своей форме дикого типа не осуществляют путь Вуда-Льюнгдаля, но приобрели этот признак в результате генетической модификации. Такие микроорганизмы включают, без ограничения, клетки E. coli. Эти микроорганизмы могут также быть известны как карбоксидотрофные бактерии. В настоящее время из уровня техники известен 21 род различных ацетогенных бактерий (Drake и соавт., 2006 г.), и они также могут включать некоторые Clostridia (Drake и Kusel, 2005 г.). Эти бактерии способны использовать диоксид углерода или монооксид углерода в качестве источника углерода с водородом в качестве источника энергии (Wood, 1991). Кроме того, спирты, альдегиды, карбоновые кислоты, а также многочисленные гексозы также могут быть использованы в качестве источника углерода (Drake и соавт., 2004 г.). Восстановительный путь, который ведет к образованию ацетата, называется путь ацетил-CoA или Вуда-Льюнгдаля.
В частности, ацетогенные бактерии могут быть выбраны из группы, состоящей из Acetoanaerobium notera (ATCC 35199), Acetonema longum (DSM 6540), Acetobacterium carbinolicum (DSM 2925), Acetobacterium malicum (DSM 4132), вида Acetobacterium № 446 (Morinaga et al., 1990, J. Biotechnol., Vol. 14, p. 187-194), Acetobacterium wieringae (DSM 1911), Acetobacterium woodii (DSM 1030), Alkalibaculum bacchi (DSM 22112), Archaeoglobus fulgidus (DSM 4304), Blautia producta (DSM 2950, ранее Ruminococcus productus, ранее Peptostreptococcus productus), Butyribacterium methylotrophicum (DSM 3468), Clostridium aceticum (DSM 1496), Clostridium autoethanogenum (DSM 10061, DSM 19630 и DSM 23693), Clostridium carboxidivorans (DSM 15243), Clostridium coskatii (ATCC № PTA-10522), Clostridium drakei (ATCC BA-623), Clostridium formicoaceticum (DSM 92), Clostridium glycolicum (DSM 1288), Clostridium ljungdahlii (DSM 13528), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii ERI-2 (ATCC 55380), Clostridium ljungdahlii O-52 (ATCC 55989), Clostridium mayombei (DSM 6539), Clostridium methoxybenzovorans (DSM 12182), Clostridium ragsdalei (DSM 15248), Clostridium scatologenes (DSM 757), вида Clostridium ATCC 29797 (Schmidt et al., 1986, Chem. Eng. Commun., Vol. 45, p. 61-73), Desulfotomaculum kuznetsovii (DSM 6115), Desulfotomaculum thermobezoicum подвида thermosyntrophicum (DSM 14055), Eubacterium limosum (DSM 20543), Methanosarcina acetivorans C2A (DSM 2834), вида Moorella HUC22-1 (Sakai et al., 2004, Biotechnol. Let., Vol. 29, p. 1607-1612), Moorella thermoacetica (DSM 521, ранее Clostridium thermoaceticum), Moorella thermoautotrophica (DSM 1974), Oxobacter pfennigii (DSM 322), Sporomusa aerivorans (DSM 13326), Sporomusa ovata (DSM 2662), Sporomusa silvacetica (DSM 10669), Sporomusa sphaeroides (DSM 2875), Sporomusa termitida (DSM 4440) и Thermoanaerobacter kivui (DSM 2030, ранее Acetogenium kivui). Более конкретно, может быть использован штамм ATCC BAA-624 вида Clostridium carboxidivorans. Еще более конкретно, может быть использован бактериальный штамм Clostridium carboxidivorans, помеченный "P7" и "P11", как описано, например, в заявке на патент США № 2007/0275447 и в заявке на патент США № 2008/0057554.
Другой особенно пригодной бактерией может быть Clostridium ljungdahlii. В частности, штаммы, выбранные из группы, состоящей из Clostridium ljungdahlii PETC, Clostridium ljungdahlii ERI2, Clostridium ljungdahlii COL и Clostridium ljungdahlii O-52, могут быть использованы при превращении синтез-газа в гексановую кислоту. Эти штаммы, например, описаны в WO 98/00558, WO 00/68407, ATCC 49587, ATCC 55988 и ATCC 55989. Первая и вторая ацетогенные бактерии, используемые согласно любому из аспектов настоящего изобретения, могут представлять собой одинаковые или различные бактерии. Например, в одной реакционной смеси первой ацетогенной бактерией может быть Clostridium ljungdahlii в логарифмической фазе и второй ацетогенной бактерией может быть Clostridium ljungdahlii в стационарной фазе. В другом примере в реакционной смеси первой ацетогенной бактерией может быть Clostridium ljungdahlii в логарифмической фазе и второй ацетогенной бактерией может быть Clostridium carboxidivorans в стационарной фазе. В другом примере ацетогенной бактерией, выбранной для первого организма, может быть Clostridium autoethanogenum.
В реакционной смеси согласно любому из аспектов настоящего изобретения может присутствовать кислород. Целесообразно включить O2 в реакционную смесь и/или газовый поток, подаваемый в реакционную смесь, поскольку большинство отходящих газов, в том числе синтез-газ, содержат кислород в небольших или больших количествах. Сложно и дорого удалять этот кислород перед использованием синтез-газа в качестве источника углерода для производства высших спиртов. Способ согласно любому из аспектов настоящего изобретения позволяет получать по меньшей мере один высший спирт без необходимости предварительного удаления любого следового количества кислорода из источника углерода. Это позволяет сохранить время и деньги.
Более конкретно, концентрация O2 в газовом потоке может быть представлена менее чем 1% по объему от общего количества газа в газовом потоке. В частности, кислород может присутствовать в диапазоне концентраций от 0,000005 до 2% по объему, в диапазоне от 0,00005 до 2% по объему, от 0,0005 до 2% по объему, от 0,005 до 2% по объему, от 0,05 до 2% по объему, от 0,00005 до 1,5% по объему, от 0,0005 до 1,5% по объему, от 0,005 до 1,5% по объему, от 0,05 до 1,5% по объему, от 0,5 до 1,5% по объему, от 0,00005 до 1% по объему, от 0,0005 до 1% по объему, от 0,005 до 1% по объему, от 0,05 до 1% по объему, от 0,5 до 1% по объему, от 0,55 до 1% по объему, от 0,60 до 1% по объему, в частности, в диапазоне от 0,60 до 1,5%, от 0,65 до 1% и от 0,70 до 1% по объему. В частности, ацетогенный микроорганизм является особенно пригодным, когда доля О2 в газовой фазе/потоке составляет приблизительно 0,00005, 0,0005, 0,005, 0,05, 0,15, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2% по объему по отношению к объему газа в газовом потоке. Специалист в данной области сможет применить любой из способов, известных из уровня техники, для измерения объемной концентрации кислорода в газовом потоке. В частности, объем кислорода можно измерить с помощью любого способа, известного из уровня техники. В одном примере концентрацию кислорода в газовой фазе можно измерить с помощью погружного зонда для следовых количеств кислорода PreSens Precision Sensing GmbH. Концентрацию кислорода можно измерять с помощью тушения флуоресценции, где степень тушения коррелирует с парциальным давлением кислорода в газовой фазе. Еще более конкретно, первый и второй микроорганизмы согласно любому из аспектов настоящего изобретения способны оптимально работать в водной среде, когда кислород подают с газовым потоком с концентрацией кислорода менее 1% по объему от общего газа, приблизительно 0,015% по объему от общего объема газа в газовом потоке, подаваемом в реакционную смесь.
Согласно любому из аспектов настоящего изобретения аэробные условия, в которых источник углерода превращают в этанол и/или ацетат в реакционной смеси, относятся к газу, окружающему реакционную смесь. Исходя из общего объема газа, газ может содержать по меньшей мере 1% кислорода и других газов, в том числе источники углерода, такие как CO, CO2 и тому подобное.
Водная среда согласно любому из аспектов настоящего изобретения может содержать кислород. Кислород может быть растворен в среде любым способом, известным из уровня техники. В частности, кислород может присутствовать в концентрации 0,5 мг/л в отсутствие клеток. В частности, концентрация растворенного свободного кислорода в водной среде может составлять по меньшей мере 0,01 мг/л. В другом примере растворенный кислород может составлять приблизительно 0,01, 0,02, 0,03, 0,04, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5 мг/л. В частности, концентрация растворенного кислорода может составлять 0,01-0,5 мг/л, 0,01-0,4 мг/л, 0,01-0,3 мг/л, 0,01-0,1 мг/л. В частности, кислород может быть подан в водную среду в непрерывном газовом потоке. Более конкретно, водная среда может содержать кислород и источник углерода, содержащий CO и/или CO2. Более конкретно, кислород и источник углерода, содержащий CO и/или CO2, подают в водную среду в непрерывном газовом потоке. Еще более конкретно, непрерывный газовый поток содержит синтез-газ и кислород. В одном примере оба газа являются частью одного потока/струи. В другом примере каждый газ представляет собой отдельный поток/струю, подаваемые в водную среду. Эти газы могут быть разделены, например, с использованием отдельных сопел, которые открываются в водную среду, фритт, мембран внутри трубы подачи газа в водную среду и тому подобного. Кислород может быть свободным кислородом. Согласно любому из аспектов настоящего изобретения выражение "реакционная смесь, содержащая свободный кислород" относится к реакционной смеси, содержащей элементарный кислород в форме O2. O2 может быть растворенным кислородом в реакционной смеси. В частности, растворенный кислород может находиться в концентрации ≥5 ppm (0,000005 об. %; 5x10-6). Специалист в данной области способен применять любой метод, известный из уровня техники, для измерения концентрации растворенного кислорода. В одном примере растворенный кислород может быть измерен с помощью кислородных погружных зондов (типа PSt6 от PreSens Precision Sensing GmbH, Регенсбург, Германия).
Согласно любому из аспектов настоящего изобретения реакционная смесь дополнительно содержит
- третий микроорганизм, способный осуществлять этанол-карбоксилатный ферментационный путь и превращать ацетат и/или этанол с образованием кислоты, и
где первый и/или второй ацетогенные микроорганизмы способны превращать кислоту в соответствующий высший спирт.
В одном примере ацетогенные бактерии могут использоваться в сочетании со вторым микроорганизмом, который способен осуществлять этанол-карбоксилатный ферментационный путь. В одном примере одновременно первая и вторая ацетогенные бактерии и третий микроорганизм, который способен осуществлять этанол-карбоксилатный ферментационный путь, могут использоваться для получения высших спиртов из источника углерода. Кислоту затем можно превратить в соответствующий высший спирт, выбранный из группы, состоящей из бутанола, пентанола, гексанола, октанола, нонанола, деканола и тому подобного. В одном примере высший спирт можно выбрать из группы, состоящей из 1-бутанола, 2-метил-1-бутанола, изобутанола, 3-метил-1-бутанола, 1-гексанола, 1-октанола, 1-пентанола, 1-гептанола, 3-метил-1-пентанола, 4-метил-1-гексанола, 5-метил-1-гептанола, 4-метил-1-пентанола, 5-метил-1-гексанола, 6-метил-1-гептанола и их комбинаций.
В одном примере этанол и/или ацетат можно превратить в соответствующую высшую кислоту в присутствии третьего микроорганизма, способного осуществлять этанол-карбоксилатный ферментационный путь. Этанол-карбоксилатный ферментационный путь подробно описан по меньшей мере в Seedorf H. и соавт., 2008 г. В частности, третий организм можно выбрать из группы, состоящей из Clostridium kluyveri, C. carboxidivorans и тому подобного. Эти третьи микроорганизмы включают микроорганизмы, которые в своей форме дикого типа не осуществляют этанол-карбоксилатный ферментационный путь, но приобрели этот признак в результате генетической модификации. В частности, третьим микроорганизмом может быть Clostridium kluyveri.
В другом примере третий микроорганизм может быть организмом дикого типа, который экспрессирует по меньшей мере один фермент, выбранный из группы, состоящей из E1 - E11, где E1 представляет собой алкогольдегидрогеназу (adh), E2 представляет собой ацетальдегиддегидрогеназу (ald), E3 представляет собой ацетоацетил-CoA-тиолазу (thl), E4 представляет собой 3-гидроксибутирил-CoA-дегидрогеназу (hbd), E5 представляет собой 3-гидроксибутирил-CoA-дегидратазу (crt), E6 представляет собой бутирил-CoA-дегидрогеназу (bcd), E7 представляет собой субъединицу электронпереносящего флавопротеина (etf), E8 представляет собой кофермент A-трансферазу (cat), E9 представляет собой ацетаткиназу (ack), E10 представляет собой фосфотрансацетилазу (pta), и E11 представляет собой трансгидрогеназу. В частности, третий микроорганизм дикого типа согласно любому из аспектов настоящего изобретения может экспрессировать по меньшей мере E2, E3 и E4. Еще более конкретно, третий микроорганизм дикого типа согласно любому из аспектов настоящего изобретения может экспрессировать по меньшей мере E4.
В другом примере третий микроорганизм согласно любому из аспектов настоящего изобретения может быть генетически модифицированным организмом, который имеет повышенную экспрессию по сравнению с микроорганизмом дикого типа по меньшей мере одного фермента, выбранного из E1 - E11, где E1 представляет собой алкогольдегидрогеназу (adh), E2 представляет собой ацетальдегиддегидрогеназу (ald), E3 представляет собой ацетоацетил-CoA-тиолазу (thl), E4 представляет собой 3-гидроксибутирил-CoA-дегидрогеназу (hbd), E5 представляет собой 3-гидроксибутирил-CoA-дегидратазу (crt), E6 представляет собой бутирил-CoA-дегидрогеназу (bcd), E7 представляет собой субъединицу электронпереносящего флавопротеина (etf), E8 представляет собой кофермент A-трансферазу (cat), E9 представляет собой ацетаткиназу (ack), E10 представляет собой фосфотрансацетилазу (pta) и E11 представляет собой трансгидрогеназу. В частности, генетически модифицированный третий микроорганизм согласно любому из аспектов настоящего изобретения может экспрессировать по меньшей мере ферменты E2, E3 и E4. Еще более конкретно, генетически модифицированный третий микроорганизм согласно любому из аспектов настоящего изобретения может экспрессировать по меньшей мере E4. Ферменты E1 - E11 могут быть выделены из Clostridium kluyveri. Специалист в данной области способен измерять активность каждого из этих ферментов с помощью способов, известных из уровня техники. В частности, активность ферментов E1 и E2 можно измерять с помощью анализов, указанных по меньшей мере в Hillmer P., 1972, Lurz R., 1979; активность фермента E2 также можно измерить с помощью анализа, указанного в Smith L.T., 1980; активность ферментов E3 и E4 можно измерить с помощью анализов, указанных по меньшей мере в Sliwkowski M.X., 1984; активность E4 также можно измерить с помощью анализа, указанного в Madan V.K., 1972; активность E5 также можно измерить с помощью анализа, указанного в Bartsch R.G., 1961; активность ферментов E6 и E7 можно измерить с помощью анализа, указанного в Li F., 2008; активность E7 также можно измерить с помощью анализа, указанного в Chowdhury, 2013; активность E8 можно измерить с помощью анализа, указанного в Stadman, 1953; активность E9 можно измерить с помощью анализа, указанного в Winzer K., 1997; активность E10 можно измерить с помощью анализа, указанного в Smith L.T., 1976; и активность E11 можно измерить с помощью анализа, указанного в Wang S., 2010.
Согласно любому из аспектов настоящего изобретения первый, второй и/или третий микроорганизм может быть генетически модифицированным микроорганизмом. Генетически модифицированная клетка или микроорганизм может генетически отличаться от клетки или микроорганизма дикого типа. Генетическое различие между генетически модифицированным микроорганизмом согласно любому из аспектов настоящего изобретения и микроорганизмом дикого типа может состоять в присутствии полного гена, аминокислоты, нуклеотида и т. д. в генетически модифицированном микроорганизме, которые могут отсутствовать в микроорганизме дикого типа. В одном примере генетически модифицированный микроорганизм согласно любому из аспектов настоящего изобретения может содержать ферменты, которые позволяют микроорганизму продуцировать по меньшей мере одну карбоновую кислоту. Микроорганизм дикого типа по сравнению с генетически модифицированным микроорганизмом согласно любому из аспектов настоящего изобретения может не иметь совсем или иметь необнаруживаемую активность ферментов, которые позволяют генетически модифицированному микроорганизму продуцировать по меньшей мере одну карбоновую кислоту. Выражение ‘генетически модифицированный микроорганизм’, используемое в настоящем документе, можно использовать взаимозаменяемо с выражением ‘генетически модифицированная клетка’. Генетическая модификация согласно любому из аспектов настоящего изобретения может быть проведена в клетке микроорганизма.
Фраза “дикого типа”, используемая в настоящем документе в сочетании с клеткой или микроорганизмом, может обозначать клетку со структурой генома, которая находится в форме, встречающейся естественным образом в дикой природе. Выражение можно применять как к целой клетке, так и к индивидуальным генам. Выражение “дикий тип”, следовательно, не включает такие клетки или такие гены, где последовательности генов были изменены, по меньшей мере частично, человеком с использованием рекомбинантных способов.
Специалист в данной области сможет применить любой способ, известный из уровня техники, для генетической модификации клетки или микроорганизма. Согласно любому из аспектов настоящего изобретения генетически модифицированная клетка может быть генетически модифицирована таким образом, что в определенном интервале времени, в течение 2 часов, в частности, в течение 8 часов или 24 часов, она образует по меньшей мере в два раза, предпочтительно, по меньшей мере в 10 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз или по меньшей мере в 10000 раз больше карбоновой кислоты и/или соответствующего сложного эфира карбоновой кислоты, чем клетка дикого типа. Увеличение образования продукта можно определить, например, путем культивирования клетки согласно любому из аспектов настоящего изобретения и клетки дикого типа, каждой отдельно, в одинаковых условиях (одинаковая плотность клеток, одинаковая питательная среда, одинаковые условия культивирования) в течение определенного интервала времени в подходящей питательной среде, и затем определения количества целевого продукта (карбоновой кислоты) в питательной среде.
В другом примере кислоту можно получить из источника углерода любым способом, раскрытым в Steinbusch, 2011, Zhang, 2013, Van Eerten-Jansen M. C. A. A, 2013, Ding H. et al., 2010, Barker H.A., 1949, Stadtman E.R., 1950, Bornstein B. T. et al., 1948 и тому подобном. Еще более конкретно, кислоту можно получить из источника углерода в присутствии по меньшей мере Clostridium kluyveri.
Еще более конкретно, согласно любому из аспектов настоящего изобретения кислоту получают в присутствии по меньшей мере одного ацетогенного микроорганизма в двух различных фазах роста и Clostridium kluyveri. В одном примере ацетогенный микроорганизм может представлять собой Clostridium ljungdahlii или Clostridium ragsdahlei. Вновь образованную кислоту можно превратить в соответствующий высший спирт в присутствии спирта. Третий микроорганизм, выбранный из группы, состоящей из Clostridium kluyveri и C. carboxidivorans, может превращать ацетат и/или этанол с образованием вновь образованной кислоты. Как упомянуто ранее, предпочтительно, чтобы данный процесс выполнялся в присутствии O2 (т. e. с включением O2 в реакционную смесь), поскольку большинство отходящих газов, в том числе синтез-газ, содержат кислород в небольших или больших количествах. Эта реакционная смесь делает возможным способ получения высших спиртов из отходящих газов без необходимости проходить через дополнительный и дорогостоящий этап первоначального выделения кислорода.
Реакционная смесь может содержать два/три микроорганизма в гомогенной смеси. Выражение ‘гомогенная смесь’, используемое в настоящем документе, относится к смеси микроорганизмов, равномерно пространственно распределенных в среде. В частности, смесь может содержать по меньшей мере два микроорганизма, при этом два ацетогенных микроорганизма в различных фазах роста равномерно распределены в водной среде. В одном примере может быть примерно равное количество этих двух микроорганизмов в смеси. В другом примере в смеси может находится большее количество ацетогенного микроорганизма в стационарной фазе по сравнению с ацетогенным микроорганизмом в логарифмической фазе. В еще одном примере в смеси может находиться большее количество ацетогенного микроорганизма в логарифмической фазе по сравнению с ацетогенным микроорганизмом в стационарной фазе. Во всех возможных примерах микроорганизмы находятся в одной гомогенной смеси, где они равномерно распределены по всей смеси. Выражение ‘водная среда’, используемое в настоящем документе, можно использовать взаимозаменяемо с выражением ‘реакционная смесь’.
Выражение "ацетат", используемое в настоящем документе, относится как к уксусной кислоте, так и к ее солям, что возникает неизбежно, поскольку, как известно из уровня техники, микроорганизмы осуществляют жизнедеятельность в водной среде, и там всегда присутствует баланс между солью и кислотой.
Выражение "второй микроорганизм" или "третий микроорганизм" относится к микроорганизму, который отличается от "первого микроорганизма" согласно любому из аспектов настоящего изобретения.
В одном примере первый и второй микроорганизмы могут присутствовать в первом ферментере и третий микроорганизм - во втором ферментере. В ферментере 1 первый и второй микроорганизмы вступают в контакт с источником углерода с получением ацетата и/или этанола. Этанол и/или ацетат можно затем привести в контакт с третьим микроорганизмом в ферментере 2 с получением по меньшей мере одной кислоты. Затем кислоту можно подавать обратно в ферментер 1 с получением по меньшей мере одного спирта. Можно создать цикл, где ацетат и/или этанол, полученный в ферментере 1, можно постоянно подавать в ферментер 2, ацетат и/или этанол в ферментере 2 можно превращать по меньшей мере в одну кислоту, и кислоту из ферментера 2 подавать обратно в ферментер 1.
Аналогичным образом, в ферментере 1 первый и второй микроорганизмы могут вступать в контакт с источником углерода, содержащим CO, с получением ацетата и/или этанола. Этанол и/или ацетат можно затем привести в контакт с третьим микроорганизмом в ферментере 2 с получением по меньшей мере одной кислоты. Затем кислоту можно необязательно выделять и подавать обратно в ферментер 1 для превращения кислоты в требуемый высший спирт. Можно создать цикл, где ацетат и/или этанол, полученный в ферментере 1, можно постоянно подавать в ферментер 2, ацетат и/или этанол в ферментере 2 можно превращать по меньшей мере в одну кислоту, и кислоту из ферментера 2 подавать обратно в ферментер 1. CO, подаваемый в ферментер 1, можно перенести в ферментер 2 вместе с ацетатом и/или этанолом. Никакого специального способа выделения не нужно, поскольку третий микроорганизм, как было обнаружено, превращает ацетат и/или этанол по меньшей мере в одну кислоту в присутствии CO.
В другом примере среду подвергают рециркуляции между ферментерами 1 и 2. Таким образом, этанол и/или ацетат, полученный в ферментере 1, можно подавать обратно в ферментер 2, и кислоту, полученную в ферментере 2, можно подавать обратно в ферментер 1. В процессе рециркуляции среды CO из ферментера 1 можно ввести в ферментер 2. Кроме того, кислоты, полученные в ферментере 2, можно в результате повторно ввести в ферментер 1. Третий микроорганизм в ферментере 2 может быть способен продолжать продуцирование кислот из ацетата и этанола в присутствии CO, рециркулируемого из ферментера 1 в ферментер 2. Спирты, накопленные в ферментерах 1 и 2, можно затем выделять с помощью способов, известных из уровня техники.
В дополнительном примере могут присутствовать три контейнера для осуществления способа согласно любому из аспектов настоящего изобретения. Первый и второй микроорганизмы могут присутствовать в первом ферментере, третий микроорганизм - во втором ферментере и третьем ферментере с первым и вторым микроорганизмами. В ферментере 1 первый и второй микроорганизмы вступают в контакт с источником углерода с получением ацетата и/или этанола. Этанол и/или ацетат можно затем привести в контакт с третьим микроорганизмом в ферментере 2 с получением по меньшей мере одной кислоты. Затем кислоту можно подать в ферментер 3 с получением по меньшей мере одного спирта.
При производстве кислоты и/или высшего спирта из источника углерода можно использовать комбинацию бактерий. Более чем одна ацетогенная бактерия может присутствовать в комбинации с одним или более третьими микроорганизмами. В другом примере может присутствовать ацетогенная бактерия более чем одной разновидности и третий микроорганизм только одной разновидности. В еще одном примере может присутствовать более чем один третий микроорганизм в комбинации только с одной ацетогенной бактерией.
Выражение ‘приблизительно’, используемое в настоящем документе, относится к изменениям в пределах 20 процентов. В частности, выражение "приблизительно", используемое в настоящем документе, относится к +/- 20%, более конкретно к +/- 10%, еще более конкретно к +/- 5% от данного измерения или значения.
Все процентные содержания (%) представляют собой, если не указано иное, объемный процент.
Источник углерода, используемый согласно любому из аспектов настоящего изобретения, содержит диоксид углерода и/или монооксид углерода. Специалист в данной области поймет, что существует множество возможных источников для обеспечения СО и/или CO2 в качестве источника углерода. Можно видеть, что на практике в качестве источника углерода согласно любому из аспектов настоящего изобретения можно использовать любой газ или любую газовую смесь, которая способна предоставить микроорганизмам достаточное количество углерода, так чтобы мог быть образован ацетат и/или этанол из источника CO и/или СО2.
Как правило, для смешанной культуры согласно любому из аспектов настоящего изобретения источник углерода содержит по меньшей мере 50% по объему, по меньшей мере 70% по объему, предпочтительно по меньшей мере 90% по объему CO и/или CO2, где проценты по объему % относятся ко всем источникам углерода, которые доступны для первого микроорганизма в смешанной культуре.
В смешанной культуре согласно любому из аспектов настоящего изобретения может быть обеспечен источник углеродного материала. Примеры источников углерода в газообразной форме включают отработанные газы, такие как синтез-газ, топочный газ и газы от переработки нефтепродуктов, полученные при дрожжевой ферментации или ферментации с клостридиями. Эти отработанные газы образуются при газификации содержащих целлюлозу материалов или газификации угля. В одном примере эти отработанные газы не обязательно получают в виде побочных продуктов других процессов, но могут специально получить для применения со смешанной культурой согласно любому из аспектов настоящего изобретения.
Согласно любому из аспектов настоящего изобретения источник углерода может представлять собой синтез-газ. Синтез-газ можно, например, получать в виде побочного продукта газификации угля. Соответственно, микроорганизм смешанной культуры согласно любому из аспектов настоящего изобретения способен превращать вещество, которое представляет собой отходы производства, в ценный ресурс. В другом примере синтез-газ может быть побочным продуктом газификации широко доступного, недорогого сельскохозяйственного сырья для применения со смешанной культурой по настоящему изобретению с получением по меньшей мере этанола и/или одного высшего спирта.
Есть многочисленные примеры сырья, которое можно превратить в синтез-газ, поскольку почти все формы растительности могут быть использованы для этой цели. В частности, сырье выбирают из группы, состоящей из многолетних трав, таких как мискантус, остатков кукурузы, отходов переработки, таких как опилки, и тому подобного.
В целом, синтез-газ можно получить в устройстве для газификации сухой биомассы в основном за счет пиролиза, частичного окисления и парового риформинга, где первичными продуктами синтез-газа являются CO, H2 и CO2. Синтез-газ также может быть продуктом электролиза CO2. Специалисту в данной области будут понятны подходящие условия для проведения электролиза CO2, чтобы получить синтез-газ, содержащий СО в требуемом количестве.
Как правило, часть синтез-газа, полученного в процессе газификации, сначала обрабатывают, чтобы оптимизировать выход продукта и предотвратить образование смол. Крекинг нежелательной смолы и CO в синтез-газе можно выполнить с использованием извести и/или доломита. Эти процессы подробно описаны, например, в Reed, 1981.
Смеси источников можно использовать в качестве источника углерода.
Согласно любому из аспектов настоящего изобретения восстановитель, например, водород, может подаваться вместе с источником углерода. В частности, этот водород может подаваться, когда подают и/или используют С и/или CO2. В одном примере газообразный водород является частью синтез-газа, присутствующего согласно любому из аспектов настоящего изобретения. В другом примере, где газообразного водорода в синтез-газе недостаточно для способа по настоящему изобретению, может подаваться дополнительный газообразный водород.
Специалисту в данной области будут понятны другие условия, необходимые для осуществления способа согласно любому из аспектов настоящего изобретения. В частности, условия в контейнере (например, ферментере) могут изменяться в зависимости от используемых первого и второго микроорганизмов. Изменение условий, так чтобы они подходили для оптимального функционирования микроорганизмов, находится в пределах знаний специалиста в данной области.
В одном примере способ согласно любому из аспектов настоящего изобретения может осуществляться в водной среде с рН между 5 и 8, 5,5 и 7. Давление может находиться между 1 и 10 бар.
Преимуществом настоящего изобретения может быть то, что могут использоваться намного более благоприятные смеси CO2/CO сырья. Эти различные источники включают природный газ, биогаз, уголь, нефть, растительные остатки и тому подобное. Другим преимуществом способа может быть высокий выход углерода. Это стало возможным за счет возвращения образованного CO2. А именно, CO2 может прореагировать на первой стадии обратно до уксусной кислоты.
Еще одно преимущество может заключаться в большей гибкости в отношении используемых условий ферментации, поскольку любой ацетогенный микроорганизм и любой микроорганизм, способный осуществлять этанол-карбоксилатный ферментационный путь, можно использовать в комбинации для фактического производства высших спиртов. Другим преимуществом настоящего изобретения может быть то, что, поскольку третий микроорганизм может функционировать и/или производить кислоту из ацетата и/или этанола в присутствии СО, одновременно первый, второй и третий микроорганизмы могут присутствовать в однородной смеси для получения высших спиртов из источника углерода, содержащего СО. Эта особенность третьего микроорганизма позволяет, чтобы получение высших спиртов из источника углерода, такого как CO, было одноэтапным процессом, делая этот процесс более эффективным, а выход больше. Из-за этого преимущества третьего микроорганизма одноэтапную процедуру получения высших спиртов можно осуществить в одном ферментере без промежуточного этапа отделения. Также возможна повышенная концентрация конечного продукта с использованием этой одноэтапной процедуры. Неожиданно оказалось, что Baffert C., 2011 и Thauer R.K., 1973, оба сообщили, что гидрогеназы ингибировались в присутствии CO. По этой и другим причинам WO 2013/167663 включает этап отделения между (a) этапом образования ацетата и/или этанола из CO и/или CO2 в присутствии ацетогенного организма и (b) этапом образования углеводорода, содержащего по меньшей мере один атом кислорода (например, гексановая кислота), в присутствии второго микроорганизма. Возможность получения спирта, в частности такого, который содержит по меньшей мере 6 атомов углерода, в одном реакторе синтеза из СО согласно любому из аспектов настоящего изобретения, является, таким образом, неожиданным результатом. В любом случае, даже если этапы (a) и (b) выполняют в два отдельных этапа (т. e. в двух отдельных контейнерах), может отсутствовать необходимость в каком-либо специфическом способе выделения для удаления всех следовых количеств CO для функционирования как первого, так и третьего микроорганизмов.
Как можно видеть в Примерах, присутствие СО позволяет получить по меньшей мере бутанол и гексанол в способе согласно любому из аспектов настоящего изобретения, где источник углерода содержит по меньшей мере CO.
Согласно любому из аспектов настоящего изобретения источник углерода содержит CO. Источник углерода, содержащий CO, можно превратить по меньшей мере в одну кислоту в присутствии по меньшей мере первого и второго ацетогенных микроорганизмов и третьего микроорганизма, способного осуществлять этанол-карбоксилатный ферментационный путь в аэробных условиях. В частности, кислота может содержать 4 или более атома углерода. Более конкретно, образованную кислоту можно выбрать из группы, состоящей из бутановой кислоты, пентановой кислоты, гексановой кислоты, гептановой кислоты, октановой кислоты, нонановой кислоты декановой кислоты и тому подобного. В частности, источник углерода, содержащий СО, в присутствии первой и второй ацетогенных бактерий может привести к получению этанола и/или уксусной кислоты.
В частности, СО может быть подан в водную среду в непрерывном газовом потоке. Концентрация CO в газовом потоке может составлять по меньшей мере 2% по объему от объема общего количества газа в газовом потоке. В частности, CO может присутствовать в диапазоне концентраций от 2 до 99% по объему, в диапазоне от 2 до 95 % по объему, от 5 до 95% по объему, от 10 до 90% по объему, от 15 до 85% по объему, в частности, в диапазоне от 20 до 80% по объему. Более конкретно, концентрация CO может составлять приблизительно 24% по объему. Концентрацию газовой фазы монооксида углерода в источнике углерода можно измерять с помощью по меньшей мере газового хроматографа GC 6890N от Agilent Technologies Inc. с детектором по теплопроводности.
В частности, водная среда может содержать источник углерода, содержащий CO и/или CO2. Более конкретно, источник углерода, содержащий CO и/или CO2, подают в водную среду в непрерывном газовом потоке. Еще более конкретно, непрерывный газовый поток содержит синтез-газ. В одном примере газы являются частью одного потока/струи. В другом примере каждый газ представляет собой отдельный поток/струю, подаваемые в водную среду. Эти газы могут быть разделены, например, с использованием отдельных сопел, которые открываются в водную среду, фритт, мембран внутри трубы подачи газа в водную среду и тому подобного.
В одном примере согласно любому из аспектов настоящего изобретения источник углерода представляет собой синтез-газ, и источник углерода может быть смешан с газообразным кислородом перед подачей в водную среду. Этот этап смешивания может повысить эффективность и производство высших спиртов в реакции. Общая эффективность, производительность спирта и/или общий захват углерода в способе по настоящему изобретению может зависеть от стехиометрии CO2, CO, H2 и O2 в непрерывном газовом потоке. Подводимый непрерывный газовый поток может быть композицией O2, CO2 и H2. В частности, в непрерывном газовом потоке диапазон концентраций O2 может находится в пределах от 0,000005% до 1% по объему, CO/CO2 приблизительно 10-50%, в частности 33% по объему, и H2 будет в пределах от 44% до 84%, в частности от 64 до 66,04% по объему. Более конкретно, концентрация газов в непрерывном газовом потоке может составлять 0,15% по объему для O2, 32% по объему для СО/СО2 и 64% по объему для H2. В другом примере непрерывный газовый поток может также содержать инертные газы, подобные N2, вплоть до концентрации N2 50% по объему.
Специалист в данной области поймет, что может быть необходимо контролировать композицию и скорости потока струй через определенные промежутки времени. Контроль композиции потока может быть достигнут путем изменения пропорций составляющих его струй для достижения целевой или требуемой композиции. Композицию и скорость потока смешанного потока можно контролировать любыми средствами, известными из уровня техники. В одном примере систему адаптируют для непрерывного контроля скоростей потока и композиций по меньшей мере двух струй и комбинирования их для получения единой смешанной струи субстрата в непрерывном газовом потоке оптимальной композиции и средств для прохождения оптимизированного потока субстрата в смешанную культуру согласно любому из аспектов настоящего изобретения.
В частности, реакционную смесь согласно любому из аспектов настоящего изобретения (т. е. смесь первого микроорганизма - ацетогенного организма в логарифмической фазе, второго микроорганизма - ацетогенного организма в стационарной фазе, источника углерода в присутствии кислорода) можно использовать в любом известном биореакторе или ферментере для осуществления любого из аспектов настоящего изобретения. Реакционная смесь может дополнительно содержать третий микроорганизм, что приводит к получению высших спиртов в ферментере.
Выражение ‘высшие спирты’, используемое в настоящем документе, относится к спиртам, которые содержат от 4 до 10 атомов углерода и могут быть несколько вязкими или маслянистыми и характеризуются более тяжелыми фруктовыми ароматами. Высшие спирты могут включать, без ограничения, бутанол, пентанол, гексанол, гептанол, октанол, нонанол, деканол и тому подобное. Более конкретно, высший спирт может быть выбран из группы, состоящей из 1-бутанола, 2-метил-1-бутанола, изобутанола, 3-метил-1-бутанола, 1-гексанола, 1-октанола, 1-пентанола, 1-гептанола, 3-метил-1-пентанола, 4-метил-1-гексанола, 5-метил-1-гептанола, 4-метил-1-пентанола, 5-метил-1-гексанола, 6-метил-1-гептанола и их комбинаций.
Согласно любому из аспектов настоящего изобретения 'соответствующий высший спирт’ относится к спирту с тем же числом атомов углерода, что и кислота, из которой образуется соответствующий высший спирт. Например, бутановую кислоту можно превращать в соответствующий спирт - бутанол; гексановую кислоту можно превращать в соответствующий спирт - гексанол; гептановую кислоту можно превращать в соответствующий спирт - гептанол; октановую кислоту можно превращать в соответствующий спирт - октанол; нонановую кислоту можно превращать в соответствующий спирт - нонанол; декановую кислоту можно превращать в соответствующий спирт - деканол и тому подобное.
Способ согласно любому из аспектов настоящего изобретения может дополнительно включать этап экстрагирования полученного высшего спирта. Специалист в данной области будет знать средства для выполнения этого на основе способов, известных из уровня техники.
Согласно другому аспекту настоящего изобретения предлагается способ получения этанола и/или ацетата из источника углерода в аэробных условиях, при этом способ включает
(a) приведение в контакт реакционной смеси, содержащей
- первый ацетогенный микроорганизм в экспоненциальной фазе роста;
- свободный кислород и
- второй ацетогенный микроорганизм в стационарной фазе,
где первый и второй ацетогенные микроорганизмы способны превращать источник углерода в ацетат и/или этанол.
Согласно другому аспекту настоящего изобретения предлагается способ получения по меньшей мере одного высшего спирта из источника углерода в аэробных условиях, при этом способ включает
(a) приведение в контакт реакционной смеси согласно любому аспекту настоящего изобретения с источником углерода в аэробных условиях.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигуры отсутствуют.
ПРИМЕРЫ
Вышеизложенное описывает предпочтительные варианты осуществления, которые, как будет понятно специалистам в данной области, могут подвергаться изменениям или модификациям в проектировании, построении и эксплуатации без отхода от объема формулы изобретения. Эти изменения, например, предназначены для охвата объемом формулы изобретения.
Пример 1
Получение ацетата и этанола с помощью Clostridium ljungdahlii из синтез-газа без кислорода
В этом примере C. ljungdahlii анаэробно культивировали в комплексной среде с синтез-газом, состоящим из H2 и CO2, в отсутствие кислорода для того, чтобы получить ацетат и этанол. Для культуры клеток C. ljungdahlii 2 мл криокультуры культивировали анаэробно в 200 мл среды (среда ATCC1754: pH 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl, 1 г/л NH4Cl, 0,1 г/л KCl, 0,1 г/л KH2PO4, 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 × 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 г/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с приблизительно 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O. Культивирование проводили хемолитоавтотрофно в огнестойкой стеклянной бутыли объемом 1 л с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и фумигации 1-3 л/ч. в течение 161 ч. Введение газа в среду выполняли с помощью фильтра с размером пор 10 микрон, установленного в средней части реактора в газовыделительной трубе. Клетки центрифугировали, промывали с 10 мл среды ATCC и снова центрифугировали.
Для прекультуры множество промытых клеток из выращенной культуры C. ljungdahlii переносили в 200 мл среды ATCC с приблизительно 400 мг/л L-цистеингидрохлорида и выращивали до OD600 0,12. Культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 500 мл с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и аэрацией 3 л/ч. в течение 65 ч. Введение газа в среду выполняли с помощью фильтра с размером пор 10 микрон, который помещали в средней части реакторов. Клетки центрифугировали, промывали с 10 мл производственного буфера (pH 6,2; 0,5 г/л KOH, аэрированного в течение 1 ч. предварительно смешанной смесью газов из 67% H2, 33% CO2 при 1 л/ч.), снова промывали и центрифугировали.
Для производственной культуры множество промытых клеток из прекультуры C. ljungdahlii переносили в 200 мл среды ATCC с приблизительно 400 мг/л L-цистеингидрохлорида и выращивали до OD600 0,2. Культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 500 мл с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и аэрацией 3 л/ч. в течение 118 ч. Введение газа в среду выполняли с помощью фильтра с размером пор 10 микрон, который помещали в средней части реакторов. Когда значение pH опускалось ниже 5,0, добавляли 1 мл раствора 140 г/л KOH. При взятии образцов каждый образец объемом 5 мл удаляли для определения OD600, pH и диапазона продуктов. Определение концентрации продукта выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта служил триметилсилилпропионат натрия (T (M) SP).
За период культивирования 118 ч. плотность клеток в производственной культуре оставалась постоянной, узнаваемой по стандартной OD600 0,2, что соответствует скорости роста μ = 0 ч-1. Концентрация ацетата значительно повышалась за этот период времени с 4 мг/л до 3194 мг/л и концентрация этанола повышалась с 17 мг/л до 108 мг/л.
Пример 2
Отсутствие продуцирования ацетата и этанола с помощью Clostridium ljungdahlii из синтез-газа, содержащего CO2 и H2 с кислородом
C. ljungdahlii культивировали в комплексной среде с синтез-газом и кислородом. C. ljungdahlii первоначально культивировали в присутствии синтез-газа, состоящего из H2 и CO2, в отсутствие кислорода для того, чтобы получить ацетат и этанол. Для культивирования клетки выращивали в устойчивых к давлению стеклянных бутылях, которые можно герметично закрывать с помощью пробки из бутилкаучука. Все этапы, в которых использовали клетки C. ljungdahlii, проводили в анаэробных условиях.
Для культуры клеток C. ljungdahlii 2 мл криокультуры культивировали анаэробно в 200 мл среды (среда ATCC1754: pH 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl, 1 г/л NH4Cl, 0,1 г/л KCl, 0,1 г/л KH2PO4, 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 × 2H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 г/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с приблизительно 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O. Культивирование проводили хемолитоавтотрофно в огнестойкой стеклянной бутыли объемом 1 л с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и фумигации 1-3 л/ч. в течение 161 ч. Введение газа в среду выполняли с помощью фильтра с размером пор 10 микрон, установленного в средней части реактора в газовыделительной трубе. Клетки центрифугировали, промывали с 10 мл среды ATCC и снова центрифугировали.
Для прекультуры множество промытых клеток из выращенной культуры C. ljungdahlii переносили в 200 мл среды ATCC с приблизительно 400 мг/л L-цистеингидрохлорида и выращивали до OD600 0,12. Культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 500 мл с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и с аэрацией 3 л/ч. в течение 24 ч. Впоследствии смесь газов заменили на смесь с композицией из 66,85% H2, 33% CO2 и 0,15% O2 и клетки дополнительно газировали в течение 67 ч. при 3 л/ч. Ввод газа в среду осуществляли с помощью газирующей фритты с размером пор 10 микрон, которую помещали в средней части реакторов на барботер. Клетки центрифугировали, промывали с 10 мл среды ATCC и снова центрифугировали. Ввод газа в среду осуществляли с помощью фильтра с размером пор 10 микрон, который помещали в средней части реакторов. Клетки центрифугировали, промывали с 10 мл среды ATCC и снова центрифугировали.
Для производственной культуры множество промытых клеток из прекультуры C. ljungdahlii переносили в 200 мл среды ATCC с приблизительно 400 мг/л L-цистеингидрохлорида и выращивали до OD600 0,1. Культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 500 мл с предварительно смешанной смесью газов, состоящей из 66,85% H2, 33% CO2 и 0,15% O2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и с аэрацией 3 л/ч. в течение 113 ч. Ввод газа в среду осуществляли с помощью фильтра с размером пор 10 микрон, который помещали в средней части реакторов. При взятии образцов каждый образец объемом 5 мл удаляли для определения OD600, pH и диапазона продуктов. Определение концентрации продукта выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта служил триметилсилилпропионат натрия (T (M) SP).
За период с 89 ч. по 113 ч. не показано распознаваемого роста клеток. OD600 останавливалась на 0,29, что соответствует скорости роста μ = 0 ч-1. Концентрация ацетата слегка повысилась за это время с 89,4 мг/л до 86,9 мг/л и концентрация этанола снизилась с 16,2 мг/л до 11,9 мг/л.
Пример 3
Культивирование Clostridium ljungdahlii в логарифмической фазе в присутствии синтез-газа, содержащего CO2 и 0,15% кислорода
C. ljungdahlii питались H2 и CO2 из проникающей газовой фазы и образовывали ацетат и этанол. Для культивирования применяли устойчивые к давлению стеклянные бутыли, которые можно герметично закрывать с помощью пробки из бутилкаучука. Все этапы культивирования, в которых использовали клетки C. ljungdahlii, проводили в анаэробных условиях.
Для культуры клеток C. ljungdahlii 5 мл криокультуры культивировали анаэробно в 500 мл среды (среда ATCC1754: pH 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl, 1 г/л NH4Cl, 0,1 г/л KCl, 0,1 г/л KH2PO4, 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 × 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 г/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с приблизительно 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O. Культивирование проводили хемолитоавтотрофно в огнестойкой стеклянной бутыли объемом 1 л с предварительно смешанной смесью газов, состоящей из 67% H2, 33% CO2, во встряхивателе на открытой водяной бане при 37°C, 100 об./мин. и фумигации 3 л/ч. в течение 72 ч. Введение газа в среду выполняли с помощью фильтра с размером пор 10 микрон, установленного в средней части реактора в газовыделительной трубе. Клетки центрифугировали, промывали с 10 мл среды ATCC и снова центрифугировали.
Для основной культуры множество промытых клеток из выращенной культуры C. ljungdahlii переносили в 500 мл среды ATCC с приблизительно 400 мг/л L-цистеингидрохлорида и выращивали до OD600 0,1. Культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л с предварительно смешанной смесью газов, состоящей из 66,85% H2, 33% CO2, 0,15% O2, во встряхивателе на открытой водяной бане при 37°C, 150 об./мин. и с аэрацией 1 л/ч. в течение 45 ч. Ввод газа в среду осуществляли с помощью фильтра с размером пор 10 микрон, который помещали в средней части реакторов. При взятии образцов каждый образец объемом 5 мл удаляли для определения OD600 нм, pH и диапазона продуктов. Определение концентрации продукта выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта служил триметилсилилпропионат натрия (T (M) SP).
Показан значительный рост клеток в течение периода культивирования, о чем свидетельствует увеличение OD600 нм, составляющее от 0,10 до 0,54, что соответствует скорости роста μ = 0,037 ч -1. Концентрация ацетата повышалась за этот период времени с 9,6 мг/л до 3304 мг/л и концентрация этанола повышалась с 2,2 мг/л до 399 мг/л.
Пример 4
Культивирование Clostridium ljungdahlii в логарифмической фазе в присутствии синтез-газа, содержащего CO и 0,1% кислорода
C. ljungdahlii автотрофно культивировали в комплексной среде с синтез-газом, состоящим из СО, H2 и CO2, в присутствии кислорода, для того чтобы получить ацетат и этанол.
Использовали комплексную среду, состоящую из 1 г/л NH4Cl, 0,1 г/л KCl, 0,2 г/л MgSO4 x 7 H2O, 0,8 г/л NaCl, 0,1 г/л KH2PO4, 20 мг/л CaCl2 x 2 H2O, 20 г/л MES, 1 г/л дрожжевого экстракта, 0,4 г/л L-цистеин-HCl, 0,4 г/л Na2S x 9 H2O, 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O, 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O, 2 мг/л CoCl2 x 6 H2O, 2 мг/л ZnSO4 x 7 H2O, 0,2 мг/л CuCl2 x 2 H2O, 0,2 мг/л Na2MoO4 x 2 H2O, 0,2 мг/л NiCl2 x 6 H2O, 0,2 мг/л Na2SeO4, 0,2 мг/л Na2WO4 x 2 H2O, 20 мкг/л биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl, 50 мкг/л тиамин-HCl x H2O, 50 мкг/л рибофлавина, 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотеновой кислоты, 1 мкг/л витамина B12, 50 мкг/л п-аминобензойной кислоты, 50 мкг/л липоевой кислоты.
Автотрофное культивирование проводили в 500 мл среды в бутыли для сыворотки объемом 1 л, которую непрерывно газировали синтез-газом, состоящим из 67,7% CO, 3,5% H2 и 15,6% CO2 со скоростью 3,6 л/ч. Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 120 мин-1.
Значение pH не контролировали.
В начале эксперимента C. ljungdahlii инокулировали с OD600 0,1 автотрофно выращенными на H2/CO2 клетками. Таким образом, C. ljungdahlii выращивали в комплексной среде при непрерывном газировании синтез-газом, состоящим из 67% H2 и 33% CO2 со скоростью 3 л/ч. в бутылях для сыворотки объемом 1 л с 500 мл комплексной среды. Описанную выше среду также использовали для данного культивирования. Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 150 мин-1. Клетки собирали в логарифмической фазе с OD600 0,49 и pH 5,03 путем анаэробного центрифугирования (4500 мин-1, 4300 g, 20°C, 10 мин.). Удаляли надосадочную жидкость, а осадок снова суспендировали в 10 мл вышеописанной среды. Эту суспензию клеток затем использовали для инокуляции в эксперименте по культивированию. Концентрацию газовой фазы монооксида углерода измеряли путем сбора образцов газовой фазы и автономного анализа с помощью газового хроматографа GC 6890N от Agilent Technologies Inc. с детектором по теплопроводности. Концентрацию газовой фазы кислорода измеряли с помощью погружного зонда для следов кислорода от PreSens Precision Sensing GmbH. Концентрацию кислорода измеряли с помощью тушения флуоресценции, где степень тушения коррелирует с парциальным давлением кислорода в газовой фазе. Измерения кислорода указывали на концентрацию 0,1 об. % O2 в используемом синтез-газе.
Во время эксперимента отбирали образцы по 5 мл для определения OD600, pH и концентрации продуктов. Последнюю определяли с помощью количественного анализа с применением 1H-ЯМР-спектроскопии.
После инокуляции C. ljungdahlii клетки начали расти со скоростью роста µ = 0,062 ч-1 и непрерывно продуцировали ацетат до концентрации 6,2 г/л через 94,5 часа. Одновременно с получением ацетата получали этанол с более низкой скоростью по сравнению с получением ацетата до концентрации 1 г/л через 94,5 часа.

Пример 5
Рост и получение ацетата у Clostridium ljungdahlii на синтез-газе с 2% кислорода
Для биотрансформации водорода и диоксида углерода в уксусную кислоту культивировали гомоацетогенную бактерию Clostridium ljungdahlii на синтез-газе с кислородом. Все этапы культивирования проводили в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука.
Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулировали 5 мл замороженного исходного криоштамма C. ljungdahlii. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч. посредством предварительно смешанного газа с 67% H2, 33% CO2 во встряхивателе на открытой водяной бане в течение 72 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугировали (10 мин., 4200 об./мин.) и осадок промывали с помощью 10 мл среды и снова центрифугировали. Столько промытых клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,1, для основной культуры переносили в 200 мл среды с дополнительными 400 мг/л L-цистеингидрохлорида. Хемолитоавтотрофное культивирование проводили в устойчивых к давлению стеклянных бутылях объемом 250 мл при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. посредством предварительно смешанного газа с 65% H2, 33% CO2, 2%O2 во встряхивателе на открытой водяной бане в течение 47 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирали для определения OD600нм, рН и образования продукта. Определение концентрации продуктов выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта использовали триметилсилилпропионат натрия (T (M) SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдали по увеличению OD600 нм от 0,11 до 0,32, которое коррелировало со скоростью роста µ = 0,022 ч-1. Концентрация ацетата увеличивалась с 8 мг/л до 91 мг/л, увеличение концентрации этанола не наблюдалось. За период культивирования концентрация растворенного кислорода варьировала от 0,06 до 0,15 мг/л.
В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде была измерена концентрация растворенного кислорода 0,50 мг/л.
Пример 6
Рост и получение ацетата у Clostridium ljungdahlii на синтез-газе с 0,15% кислорода
Для биотрансформации водорода и диоксида углерода в уксусную кислоту культивировали гомоацетогенную бактерию Clostridium ljungdahlii на синтез-газе с кислородом. Все этапы культивирования проводили в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука.
Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулировали 5 мл замороженного исходного криоштамма C. ljungdahlii. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч. посредством предварительно смешанного газа с 67% H2, 33% CO2 во встряхивателе на открытой водяной бане в течение 72 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугировали (10 мин., 4200 об./мин.) и осадок промывали с помощью 10 мл среды и снова центрифугировали. Столько промытых клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,1, для основной культуры переносили в 200 мл среды с дополнительными 400 мг/л L-цистеингидрохлорида. Хемолитоавтотрофное культивирование проводили в устойчивых к давлению стеклянных бутылях объемом 250 мл при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. посредством предварительно смешанного газа с 66,85% H2, 33% CO2, 0,15% O2 во встряхивателе на открытой водяной бане в течение 47 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирали для определения OD600нм, рН и образования продукта. Определение концентрации продуктов выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта использовали триметилсилилпропионат натрия (T (M) SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдали по увеличению OD600 нм от 0,10 до 0,45, которое коррелировало со скоростью роста µ = 0,032 ч-1. Концентрация ацетата повышалась с 7 мг/л до 2347 мг/л и концентрация этанола повышалась с 2 мг/л до 319 мг/л. За весь период культивирования концентрация растворенного кислорода составляла 0,00 мг/л.
В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде была измерена концентрация растворенного кислорода 0,03 мг/л.
Пример 7
Совместное культивирование Clostridium ljungdahlii и Clostridium kluyveri в среде определенного состава на водороде и диоксиде углерода
C. ljungdahlii в качестве первого организма автотрофно культивировали в среде определенного состава для того, чтобы получать ацетат и этанол. Затем через заданное время C. kluyveri в качестве второго организма инокулировали в тот же реактор для превращения ацетата и этанола в бутират и гексаноат. Затем в дальнейшем C. ljungdahlii превращал бутират в бутанол.
Среду определенного состава использовали для совместного культивирования обоих микроорганизмов, которая состояла из 2 г/л (NH4)2HPO4, 0,2 г/л NaCl, 0,15 г/л KCl, 1 г/л KOH, 0,5 г/л MgCl2 x 6 H2O, 0,2 г/л CaCl2 x 2 H2O, 15 мг/л FeCl2 x 4 H2O, 0,4 г/л L-цистеин-HCl, 0,4 г/л Na2S x 9 H2O, 3 мг/л борной кислоты, 2 мг/л CoCl2 x 6 H2O, 1 мг/л ZnSO4 x 7 H2O, 0,3 мг/л Na2MoO4 x 2 H2O, 0,3 мг/л MnSO4 x H2O, 0,2 мг/л NiCl2 x 6 H2O, 0,1 мг/л CuCl2 x 2 H2O, 0,1 мг/л Na2SeO3, 106 мкг/л биотина, 5 мкг/л фолиевой кислоты, 2,5 мкг/л пиридоксин-HCl, 266 мкг/л тиамин-HCl x H2O, 12,5 мкг/л рибофлавина, 12,5 мкг/л никотиновой кислоты, 413 мкг/л Ca-пантотеновой кислоты, 12,5 мкг/л витамина B12, 12,5 мкг/л п-аминобензойной кислоты, 15 мкг/л липоевой кислоты.
Автотрофное культивирование проводили в 250 мл среды в бутылях для сыворотки объемом 500 мл, которые непрерывно газировали синтез-газом, состоящим из 67% H2 и 33% CO2 со скоростью 1 л/ч. Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 150 мин-1. Значение pH поддерживали в диапазоне pH 5,0-6,5 путем непрерывного добавления анаэробного исходного раствора KOH (40 г/л).
В начале эксперимента C. ljungdahlii инокулировали с OD600 0,1 автотрофно выращенными клетками. Таким образом, C. ljungdahlii выращивали в комплексной среде при непрерывном газировании синтез-газом, состоящим из 67% H2 и 33% CO2 со скоростью 3 л/ч. в бутылях для сыворотки объемом 1 л с 500 мл комплексной среды. Использовали комплексную среду, состоящую из 1 г/л NH4Cl, 0,1 г/л KCl, 0,2 г/л MgSO4 x 7 H2O, 0,8 г/л NaCl, 0,1 г/л KH2PO4, 20 мг/л CaCl2 x 2 H2O, 20 г/л MES, 1 г/л дрожжевого экстракта, 0,4 г/л L-цистеин-HCl, 0,4 г/л Na2S x 9 H2O, 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O, 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O, 2 мг/л CoCl2 x 6 H2O, 2 мг/л ZnSO4 x 7 H2O, 0,2 мг/л CuCl2 x 2 H2O, 0,2 мг/л Na2MoO4 x 2 H2O, 0,2 мг/л NiCl2 x 6 H2O, 0,2 мг/л Na2SeO4, 0,2 мг/л Na2WO4 x 2 H2O, 20 мкг/л биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl, 50 мкг/л тиамин-HCl x H2O, 50 мкг/л рибофлавина, 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотеновой кислоты, 1 мкг/л витамина B12, 50 мкг/л п-аминобензойной кислоты, 50 мкг/л липоевой кислоты. Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 150 мин-1. Клетки собирали в поздней логарифмической фазе с OD600 0,67 и pH 4,69 с помощью анаэробного центрифугирования (4500 мин-1, 4300 g, 20°C, 10 мин). Удаляли надосадочную жидкость, а осадок снова суспендировали в 10 мл вышеописанной среды определенного состава. Эту суспензию клеток затем использовали для инокуляции в эксперименте по совместному культивированию.
Параллельно с этим C. kluyveri выращивали гетеротрофно в 200 мл комплексной среды в бутылях для сыворотки объемом 500 мл на ацетате и этаноле. Использовали комплексную среду, состоящую из 0,25 г/л NH4Cl, 0,2 г/л MgSO4 x 7 H2O, 0,31 г/л K2HPO4, 0,23 г/л KH2PO4, 2,5 г/л NaHCO3, 1 г/л дрожжевого экстракта, 10 г/л K-ацетата, 20 г/л этанола, 0,25 г/л L-цистеин-HCl, 1,5 мг/л FeCl2 x 4 H2O, 70 мкг/л ZnCl2 x 7 H2O, 100 мкг/л MnCl2 x 4 H2O, 6 мкг/л борной кислоты, 190 мкг/л CoCl2 x 6 H2O, 2 мкг/л CuCl2 x 6 H2O, 24 мкг/л NiCl2 x 6 H2O, 36 мкг/л Na2MoO4 x 2 H2O, 3 мкг/л Na2SeOO3 x 5 H2O, 4 мкг/л Na2WO4 x 2 H2O, 100 мкг/л витамина B12, 80 мкг/л п-аминобензойной кислоты, 20 мкг/л биотина, 200 мкг/л никотиновой кислоты, 100 мкг/л Ca-пантотеновой кислоты, 300 мкг/л пиридоксин-HCl, 200 мкг/л тиамин-HCl x H2O. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 100 мин-1. Клетки собирали в поздней логарифмической фазе с OD600 0,81 и pH 5,96 с помощью анаэробного центрифугирования (4500 мин-1, 4300 g, 20°C, 10 мин.). Удаляли надосадочную жидкость, а осадок снова суспендировали в 10 мл вышеописанной среды определенного состава. Эту суспензию клеток затем использовали для инокуляции в эксперименте по совместному культивированию с OD600 0,2 через 96 часов прохождения эксперимента.
Во время эксперимента отбирали образцы по 5 мл для определения OD600, pH и концентрации продуктов. Последнюю определяли с помощью количественного анализа с применением 1H-ЯМР-спектроскопии.
После инокуляции C. ljungdahlii клетки начали расти и непрерывно продуцировали ацетат. Одновременно с получением ацетата получали этанол с более низкой скоростью по сравнению с получением ацетата. Затем через 96 часов C. kluyveri инокулировали в реактор и снижение концентрации этанола измеряли в следующем эксперименте. Затем производство бутирата (макс. 1163 мг/л) и гексаноата (макс. 136 мг/л) одновременно измеряли в следующие 113 часов эксперимента. Параллельно с производством с помощью C. kluyveri бутирата с помощью C. ljungdahlii бутират превращался в бутанол до максимальной концентрации 20 мг/л бутанола в конце эксперимента.
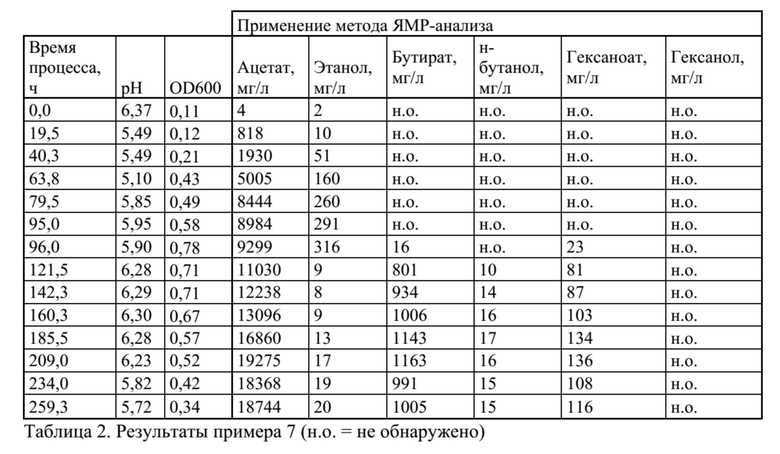
Пример 8
Совместное культивирование Clostridium ljungdahlii и Clostridium kluyveri в комплексной среде с CO-содержащим газом
C. ljungdahlii в качестве первого организма автотрофно культивировали в комплексной среде для того, чтобы получать ацетат и этанол. Затем через заданное время C. kluyveri в качестве второго организма инокулировали в тот же реактор для превращения ацетата и этанола в бутират и гексаноат. Затем в дальнейшем C. ljungdahlii превращал бутират в бутанол и гексаноат в гексанол.
Использовали комплексную среду для совместного культивирования обоих микроорганизмов, состоящую из 1 г/л NH4Cl, 0,1 г/л KCl, 0,2 г/л MgSO4 x 7 H2O, 0,8 г/л NaCl, 0,1 г/л KH2PO4, 20 мг/л CaCl2 x 2 H2O, 20 г/л MES, 1 г/л дрожжевого экстракта, 0,4 г/л L-цистеин-HCl, 0,4 г/л Na2S x 9 H2O, 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O, 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O, 2 мг/л CoCl2 x 6 H2O, 2 мг/л ZnSO4 x 7 H2O, 0,2 мг/л CuCl2 x 2 H2O, 0,2 мг/л Na2MoO4 x 2 H2O, 0,2 мг/л NiCl2 x 6 H2O, 0,2 мг/л Na2SeO4, 0,2 мг/л Na2WO4 x 2 H2O, 20 мкг/л биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl, 50 мкг/л тиамин-HCl x H2O, 50 мкг/л рибофлавина, 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотеновой кислоты, 1 мкг/л витамина B12, 50 мкг/л п-аминобензойной кислоты, 50 мкг/л липоевой кислоты.
Автотрофное культивирование проводили в 500 мл комплексной среды в бутыли для сыворотки объемом 1 л, которую непрерывно газировали синтез-газом, состоящим из 5% H2, 25% CO2, 25% CO и 45% N2 со скоростью ~12 л/ч. (≥ 0,5 ppm). Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 120 мин-1. Значение pH во время этого эксперимента не контролировали.
В начале эксперимента C. ljungdahlii инокулировали с OD600 0,1 автотрофно выращенными клетками. Таким образом, C. ljungdahlii выращивали в описанной выше комплексной среде при непрерывном газировании синтез-газом, состоящим из 67% H2 и 33% CO2 со скоростью 3 л/ч. в бутылях для сыворотки объемом 1 л с 500 мл комплексной среды. Газ вводили в жидкую фазу с помощью диспергатора микропузырьков с диаметром пор 10 мкм. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 150 мин-1. Клетки собирали в поздней логарифмической фазе с OD600 0,51 и pH 5,04 с помощью анаэробного центрифугирования (4500 мин-1, 4300 g, 20°C, 10 мин.). Удаляли надосадочную жидкость, а осадок снова суспендировали в 10 мл вышеописанной комплексной среды. Эту суспензию клеток затем использовали для инокуляции в эксперименте по совместному культивированию.
Параллельно с этим C. kluyveri выращивали гетеротрофно в 200 мл комплексной среды в бутылях для сыворотки объемом 500 мл на ацетате и этаноле. Использовали комплексную среду, состоящую из 0,25 г/л NH4Cl, 0,2 г/л MgSO4 x 7 H2O, 0,31 г/л K2HPO4, 0,23 г/л KH2PO4, 2,5 г/л NaHCO3, 1 г/л дрожжевого экстракта, 10 г/л K-ацетата, 20 г/л этанола, 0,25 г/л L-цистеин-HCl, 1,5 мг/л FeCl2 x 4 H2O, 70 мкг/л ZnCl2 x 7 H2O, 100 мкг/л MnCl2 x 4 H2O, 6 мкг/л борной кислоты, 190 мкг/л CoCl2 x 6 H2O, 2 мкг/л CuCl2 x 6 H2O, 24 мкг/л NiCl2 x 6 H2O, 36 мкг/л Na2MoO4 x 2 H2O, 3 мкг/л Na2SeOO3 x 5 H2O, 4 мкг/л Na2WO4 x 2 H2O, 100 мкг/л витамина B12, 80 мкг/л п-аминобензойной кислоты, 20 мкг/л биотина, 200 мкг/л никотиновой кислоты, 100 мкг/л Ca-пантотеновой кислоты, 300 мкг/л пиридоксин-HCl, 200 мкг/л тиамин-HCl x H2O. Бутыль для сыворотки непрерывно встряхивали на открытой водяной бане Innova 3100 от New Brunswick Scientific при 37°C и скорости встряхивания 100 мин-1. Клетки собирали в поздней логарифмической фазе с OD600 0,54 и pH 6,60 с помощью анаэробного центрифугирования (4500 мин-1, 4300 g, 20°C, 10 мин.). Удаляли надосадочную жидкость, а осадок снова суспендировали в 10 мл вышеописанной комплексной среды. Эту суспензию клеток затем использовали для инокуляции в эксперименте по совместному культивированию через 240 часов прохождения эксперимента.
Во время эксперимента отбирали образцы по 5 мл для определения OD600, pH и концентрации продуктов. Последнюю определяли с помощью количественного анализа с применением 1H-ЯМР-спектроскопии.
После инокуляции C. ljungdahlii клетки начинали расти и непрерывно продуцировали ацетат до концентрации ~ 3 г/л и этанол до концентрации ~0,5 г/л через 71 час. В дальнейшей динамике эксперимента ацетат полностью превращался в этанол до концентрации 4,8 г/л через 240 часов. Затем в момент процесса 240 часов C. kluyveri инокулировали в реактор. Поскольку этот организм помимо этанола нуждается в ацетате в качестве субстрата, одновременно с инокуляцией C. kluyveri примерно 3 г/л ацетата (в форме Na-ацетата) анаэробно вводили в реактор. В дальнейшей динамике эксперимента измеряли производство бутирата и гексаноата до концентрации каждого 1,6 г/л. Параллельно с получением с помощью C. kluyveri бутирата и гексаноата C. ljungdahlii превращал бутират в бутанол до максимальной концентрации 690 мг/л бутанола и превращал гексаноат в гексанол до максимальной концентрации 1478 мг/л гексанола.
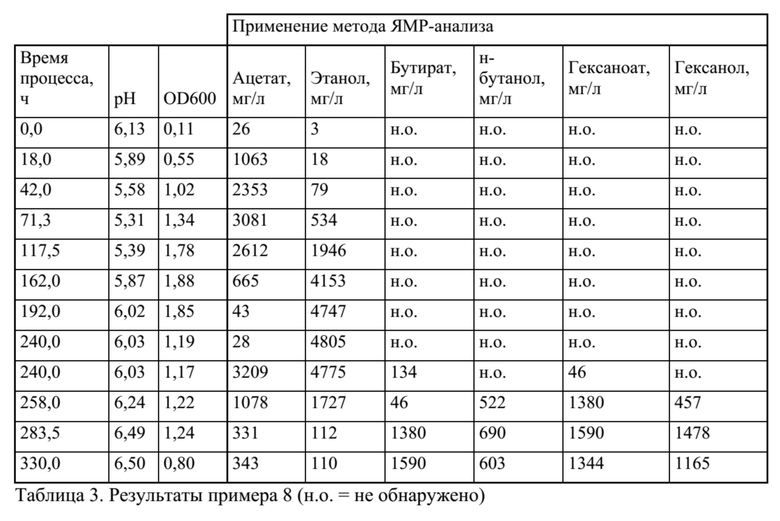
Пример 9
Рост и продуцирование ацетата и других соединений у Clostridium carboxidivorans на синтез-газе с 0,05% кислорода
Для биотрансформации водорода и диоксида углерода в уксусную кислоту и другие соединения культивировали гомоацетогенную бактерию Clostridium carboxidivorans на синтез-газе с кислородом. Все этапы культивирования проводили в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука.
Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, примерно 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулировали 5 мл замороженного исходного криоштамма C. carboxidivorans. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч посредством предварительно смешанного газа с 60% H2, 20% CO2 и 20% CO во встряхивателе на открытой водяной бане в течение 71 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугировали (10 мин., 4200 об./мин.) и осадок снова суспендировали в свежей среде. Столько много клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,2, для основной культуры переносили в 200 мл комплексной среды (ATCC1754) и параллельно в 200 мл минеральной среды (DM4-среда: pH = 6,00, 0,5 г/л MgCl2 x 6 H2O, 0,2 г/л CaCl2 x 2 H2O, 15 мг/л FeCl2 x 4 H2O, 2 г/л (NH4)H2PO4, 0,2 г/л NaCl, 0,15 г/л KCl, 3 мг/л H3BO3, 2 мг/л CoCl2 x 6 H2O, 1 мг/л ZnSO4 x 7 H2O, 300 мкг/л Na2MoO4 x 2 H2O, 300 мкг/л MnSO4 x H2O, 200 мкг/л NiCl2 x 6 H2O, 100 мкг/л CuCl2 x 2 H2O, 100 мкг/л Na2SeO3, 106 мкг/л d-биотина, 5 мкг/л фолиевой кислоты, 2,5 мкг/л пиридоксин-HCl, 266 мкг/л тиамин-HCl, 12,5 мкг/л рибофлавина, 12,5 мкг/л никотиновой кислоты, 413 мкг/л Ca-пантотената, 12,5 мкг/л витамина B12, 12,5 мкг/л п-аминобензоата, 15,0 мкг/л липоевой кислоты, прим. 1,3 г/л KOH) с дополнительными 400 мг/л L-цистеингидрохлорида в каждую. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. предварительно смешанным газом с 66,95% H2, 33% CO2 и 0,05% O2 во встряхивателе на открытой водяной бане в течение 40 ч. Газ высвобождали в свободное пространство через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирали для определения OD600нм, рН и образования продукта. Определение концентрации продуктов выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта использовали триметилсилилпропионат натрия (T (M) SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдали в комплексной среде по увеличению OD600нм от 0,20 до 0,36, которое коррелировало со скоростью роста µ = 0,015 ч-1. В минеральной среде OD600 нм снижалась от 0,20 до 0,19. В комплексной среде концентрация ацетата увеличилась от 29 мг/л до 280 мг/л, для этанола от 3 мг/л до 82 мг/л, для бутирата от 0 мг/л до 29 мг/л и для бутанола от 0 мг/л до 10 мг/л. В минеральной среде концентрация ацетата увеличилась от 25 мг/л до 110 мг/л, для этанола от 3 мг/л до 5 мг/л и для бутирата от 0 мг/л до 2 мг/л. За весь период культивирования концентрация растворенного кислорода в обеих культурах составляла 0,00 мг/л. В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде была измерена концентрация растворенного кислорода 0,01 мг/л в обеих средах.
Пример 10
Рост и продуцирование ацетата и этанола у Clostridium autoethanogenum на синтез-газе с 0,05% кислорода
Для биотрансформации водорода и диоксида углерода в уксусную кислоту и этанол культивировали гомоацетогенную бактерию Clostridium autoethanogenum на синтез-газе с кислородом. Все этапы культивирования проводили в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука.
Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, прим. 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулировали 5 мл замороженного исходного криоштамма C. autoethanogenum. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч. посредством предварительно смешанного газа с 67% H2, 33% CO2 во встряхивателе на открытой водяной бане в течение 72 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугировали (10 мин., 4200 об./мин.) и осадок снова суспендировали в свежей среде. Столько промытых клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,1, для основной культуры переносили в 500 мл среды с дополнительными 400 мг/л L-цистеингидрохлорида. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. посредством предварительно смешанного газа с 66,95% H2, 33% CO2 и 0,05% O2 во встряхивателе на открытой водяной бане в течение 41 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирали для определения OD600нм, рН и образования продукта. Определение концентрации продуктов выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта использовали триметилсилилпропионат натрия (T (M) SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдали по увеличению OD600 нм от 0,08 до 0,76 через 41 ч., которое коррелировало со скоростью роста µ = 0,054 ч-1. Концентрация ацетата повышалась от 37 мг/л до 6600 мг/л, и концентрация этанола повышалась от 4 мг/л до 120 мг/л. За весь период культивирования концентрация растворенного кислорода составляла 0,00 мг/л.
В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде была измерена концентрация растворенного кислорода 0,01 мг/л.
Пример 11
Рост и получение ацетата у Clostridium ljungdahlii на синтез-газе с 0,6% кислорода
Для биотрансформации водорода и диоксида углерода в уксусную кислоту культивировали гомоацетогенную бактерию Clostridium ljungdahlii на синтез-газе с кислородом. Все этапы культивирования проводили в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука.
Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, прим. 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулировали 5 мл замороженного исходного криоштамма C. ljungdahlii. Хемолитоавтотрофное культивирование проводили в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч. посредством предварительно смешанного газа с 67% H2, 33% CO2 во встряхивателе на открытой водяной бане в течение 72 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугировали (10 мин., 4200 об./мин.) и осадок промывали с 10 мл среды и снова центрифугировали. Столько промытых клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,1, для основной культуры переносили в 200 мл среды с дополнительными 400 мг/л L-цистеингидрохлорида. Хемолитоавтотрофное культивирование проводили в устойчивых к давлению стеклянных бутылях объемом 250 мл при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. посредством предварительно смешанного газа с 66,85% H2, 33% CO2, 0,6% O2 во встряхивателе на открытой водяной бане в течение 91 ч. Газ высвобождали в среду через барботер с размером пор 10 мкм, который был установлен в центральной части реакторов. Культивирование проводили без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирали для определения OD600нм, рН и образования продукта. Определение концентрации продуктов выполняли с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта использовали триметилсилилпропионат натрия (T (M) SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдали по увеличению OD600 нм от 0,10 до 0,16, которое коррелирует со скоростью роста µ = 5 x 10-3 ч-1. Концентрация ацетата повышалась от 9 мг/л до 476 мг/л, и концентрация этанола повышалась с 6 мг/л до 61 мг/л. За период культивирования концентрация растворенного кислорода составляла от 0,01 до 0,10 мг/л.
В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде была измерена концентрация растворенного кислорода 0,15 мг/л.
Пример 12
Рост и продуцирование ацетата у Acetobacterium woodii на синтез-газе с кислородом
Для биотрансформации водорода и диоксида углерода в уксусную кислоту культивируют гомоацетогенную бактерию Acetobacterium woodii на синтез-газе с кислородом. Все этапы культивирования проводят в анаэробных условиях в устойчивых к давлению стеклянных бутылях, которые можно герметично закрыть пробкой из бутилкаучука. Для прекультуры в 500 мл среды (ATCC1754-среда: pH = 6,0; 20 г/л MES; 1 г/л дрожжевого экстракта, 0,8 г/л NaCl; 1 г/л NH4Cl; 0,1 г/л KCl; 0,1 г/л KH2PO4; 0,2 г/л MgSO4 x 7 H2O; 0,02 г/л CaCl2 x 2 H2O; 20 мг/л нитрилотриуксусной кислоты, 10 мг/л MnSO4 x H2O; 8 мг/л (NH4)2Fe(SO4)2 x 6 H2O; 2 мг/л CoCl2 x 6 H2O; 2 мг/л ZnSO4 x 7 H2O; 0,2 мг/л CuCl2 x 2 H2O; 0,2 мг/л Na2MoO4 x 2 H2O; 0,2 мг/л NiCl2 x 6 H2O; 0,2 мг/л Na2SeO4; 0,2 мг/л Na2WO4 x 2 H2O; 20 мкг/л d-биотина, 20 мкг/л фолиевой кислоты, 100 мкг/л пиридоксин-HCl; 50 мкг/л тиамин-HCl x H2O; 50 мкг/л рибофлавина; 50 мкг/л никотиновой кислоты, 50 мкг/л Ca-пантотената; 1 мкг/л витамина B12; 50 мкг/л п-аминобензоата; 50 мкг/л липоевой кислоты, прим. 67,5 мг/л NaOH) с дополнительными 400 мг/л L-цистеингидрохлорида и 400 мг/л Na2S x 9 H2O инокулируют 5 мл замороженного исходного криоштамма A. woodii. Хемолитоавтотрофное культивирование проводят в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 100 об./мин. и скорости вентиляции 3 л/ч. посредством предварительно смешанного газа с 67% H2, 33% CO2 во встряхивателе на открытой водяной бане в течение 72 ч. Газ высвобождают в среду через барботер с размером пор 10 мкм, который устанавливают в центральной части реакторов. Культивирование проводят без контроля значения pH.
После предварительного культивирования суспензию клеток центрифугируют (10 мин., 4200 об./мин.) и осадок снова суспендируют в свежей среде. Столько промытых клеток из прекультуры, сколько необходимо для достижения OD600 нм, составляющей 0,1, для основной культуры переносили в 500 мл среды с дополнительными 400 мг/л L-цистеингидрохлорида. Хемолитоавтотрофное культивирование проводят в устойчивой к давлению стеклянной бутыли объемом 1 л при 37°C, 150 об./мин. и скорости вентиляции 1 л/ч. посредством предварительно смешанного газа с 66,95% H2, 33% CO2 и 0,05% O2 во встряхивателе на открытой водяной бане в течение 41 ч. Газ высвобождают в среду через барботер с размером пор 10 мкм, который устанавливают в центральной части реакторов. Культивирование проводят без контроля значения pH. Во время культивирования несколько образцов по 5 мл отбирают для определения OD600 нм, рН и образования продукта. Определение концентрации продуктов выполняют с помощью полуколичественного анализа с применением 1 H-ЯМР-спектроскопии. В качестве внутреннего количественного стандарта используют триметилсилилпропионат натрия (T(M)SP). Также растворенный кислород в культивационной среде измеряли в режиме реального времени с помощью кислородных погружных зондов (PSt6 с Oxy4Trace, Presens, Германия).
Во время периода культивирования клеточный рост наблюдают по увеличению OD600 нм. Также увеличивается концентрация ацетата.
В аналогичной технической обстановке с теми же параметрами (композиция среды, объем, бутыль, газ, скорость вентиляции, температура, частота встряхивания), но без клеток в среде измерили концентрацию растворенного кислорода 0,01 мг/л.
ССЫЛКИ
Baffert C. et al. J. Am. Chem. Soc. 2011, 133, 2096-2099
Barker H.A., 1949, J. Biol. Chem. 180. 1085-1093
Bartsch R.G., 1961, Archives of Biochemistry and biophysics, 92: 122-132
Bornstein B.T. et al., 1948 J Bact, 55:223
Bornstein B.T. et al., 1948 J Biol Chem, 172: 659
Brioukhanov, 2007, Applied Biochemistry and Microbiology, 43 (6): 567-582
Chowdhury N.P., 2014, J.Biol.Chem, 289(8):5145-57
Cotter J.L. (2009) Enzyme and Microbial Technology 44 281-288
Ding H. et al., 2010, Bioresour Technol, 101(24):9550-9
Drake et al., 2004. Strict and Facultative Anaerobes: Medical and Environmental Aspects. pp. 251-281, Horizon Scientific Press, United Kingdom
Drake & Kusel, 2005 Acetogenic clostridia. In: Dürre P. (ed.), Handbook on Clostridia, pp. 719-746. CRC Press, Boca Raton, Florida.
Drake et al., 2006, Acetogenic prokaryotes. In: Balows A., Trüper H.G., Dworkin M., Harder W. and
Gerhardt P. et al. (ed) American Society for Microbiology, Washington, DC. p. 248-277
Fuchs G., Schlegel H.-G. (2007) Allgemeine Mikrobiologie, Georg Thieme Verlag, Stuttgart
Henstra A.M., 2007 Current Opinion in Biotechnology, 18:200-206
Hillmer P., 1972; FEBS Letters; 21(3): 351-354
Imlay 2006, Molecular Microbiology, 59(4); 1073-1082
Koch A.L. 1994. “Growth Measurement” IN: Methods for General and Molecular Bacteriology
Köpke Michael 2009, Dissertation zur Erlangung des Doktorgrades Dr. rer. nat.
der Fakultät für Naturwissenschaften der Universität Ulm
Lan E.I., Energy Environ. Sci., 6: 2672
Li F., 2008, Journal of Bacteriology, 190 (3): 843-850
Lurz R., 1979; Arch Microbiol; 120: 255-262
Madan V.K., 1972, Eur. J. Biochem., 32; 51-56
Najafpour G., 2006 Enzyme and Microbial Technology 38 (2006) 223-228
Perez J.M. et al., Biotechnology and Bioengineering, 2012, Vol. xxx, No. xxx
Schleifer KH (eds). The Prokaryotes, 3rd edn. Springer: New York, pp 354-420
Shuler M.L., Kargi F. 1992. Bioprocess Engineering. Prentice Hall, Englewood Cliffs, NJ.
Sliwkowski M.X., 1984, Analytical Biochemistry, 141: 344-347
Smith L.T., 1976, Analytical biochemistry, 95: 2-7
Smith L.T., 1980, Archives of biochemistry and biophysics, 203 (2): 663-675
Stadtman E.R., 1950, Fed. Proc., 9, 233
Stadtman E.R., 1953, J. Biol. Chem.; 202(2): 873-90
Steinbusch, 2011, Energy Environ. Sci., 4, 216-224
Thauer R.K. et al., Eur.K.Biochem., 1974, 42, 447-452
Van Eerten-Jansen M. C. A. A., 2013, ACS Sustainable Chemistry & Engineering 1 (5), 513-518
Wang S., 2010, Journal of Bacteriology, 192 (19): 5115-5123
Winzer K. et al., 1997 Micrоbiology 143: 3279-3286
Wood, 1991 Life with CO or CO2 and H2 as a source of carbon and energy. FASEB J. 5: 156-163
Younesi H. et al. Biochemical Engineering Journal 27 (2005) 110-119
Zhang Y., 2013, Bioprocess. Biosyst. Eng.; 36(12): 1897-1904
Заявка на патент США № 2007/0275447, заявка на патент США № 2008/0057554, WO 98/00558, WO 00/68407.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЫСШИХ СПИРТОВ | 2016 |
|
RU2709952C2 |
| ЭКСТРАКЦИЯ АЛКАНОВЫХ КИСЛОТ | 2019 |
|
RU2785987C2 |
| СПОСОБ НАКОПЛЕНИЯ ИЗБЫТОЧНОЙ ЭНЕРГИИ | 2014 |
|
RU2663728C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-УНДЕКАНОНА И ЕГО ПРОИЗВОДНЫХ | 2019 |
|
RU2788086C2 |
| ЭКСТРАКЦИЯ АЛИФАТИЧЕСКИХ СПИРТОВ | 2020 |
|
RU2807367C2 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗА, СОДЕРЖАЩЕГО МОНООКСИД УГЛЕРОДА | 2011 |
|
RU2573918C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ АЦЕТОГЕННЫХ БАКТЕРИЙ НА СИНТЕЗ-ГАЗЕ | 2013 |
|
RU2629997C2 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗООБРАЗНОГО СУБСТРАТА, СОДЕРЖАЩЕГО ВОДОРОД | 2011 |
|
RU2573920C2 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗООБРАЗНОГО СУБСТРАТА, СОДЕРЖАЩЕГО МОНООКСИД УГЛЕРОДА И ВОДОРОД | 2011 |
|
RU2566565C2 |
| РЕГУЛИРОВАНИЕ ПРОВОДИМОСТИ В ПРОЦЕССЕ АНАЭРОБНОЙ ФЕРМЕНТАЦИИ | 2014 |
|
RU2639503C2 |
Группа изобретений относится к реакционной смеси для получения этанола и/или ацетата из источника углерода в аэробных условиях и ее применению. Предложена реакционная смесь для получения этанола и/или ацетата из источника углерода в аэробных условиях, содержащая первый ацетогенный микроорганизм в экспоненциальной фазе роста, свободный кислород в концентрации от 0,000005% до 1% по объему и второй ацетогенный микроорганизм в стационарной фазе. При этом первый и второй ацетогенные микроорганизмы способны превращать источник углерода в ацетат и/или этанол. Первый и второй микроорганизмы выбраны из группы, состоящей из Acetobacterium woodii (DSM 1030), Clostridium autoethanogenum (DSM 10061, DSM 19630 и DSM 23693), Clostridium carboxidivorans (DSM 15243), Clostridium ljungdahlii (DSM 13528), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii ERI-2 (ATCC 55380) и Clostridium ljungdahlii O-52 (ATCC 55989). Первый и второй ацетогенные микроорганизмы представляют собой одинаковые микроорганизмы. Предложено также применение смеси для получения этанола и/или ацетата. Группа изобретений обеспечивает эффективное получение этанола и/или ацетата из источника углерода в аэробных условиях. 2 н. и 3 з.п. ф-лы, 3 табл., 12 пр.
1. Реакционная смесь для получения этанола и/или ацетата из источника углерода в аэробных условиях, где смесь содержит:
- первый ацетогенный микроорганизм в экспоненциальной фазе роста;
- свободный кислород в концентрации от 0,000005% до 1% по объему и
- второй ацетогенный микроорганизм в стационарной фазе,
где первый и второй ацетогенные микроорганизмы способны превращать источник углерода в ацетат и/или этанол, где первый и второй микроорганизмы выбраны из группы, состоящей из Acetobacterium woodii (DSM 1030), Clostridium autoethanogenum (DSM 10061, DSM 19630 и DSM 23693), Clostridium carboxidivorans (DSM 15243), Clostridium ljungdahlii (DSM 13528), Clostridium ljungdahlii C-01 (ATCC 55988), Clostridium ljungdahlii ERI-2 (ATCC 55380) и Clostridium ljungdahlii O-52 (ATCC 55989),
где первый и второй ацетогенные микроорганизмы представляют собой одинаковые микроорганизмы.
2. Смесь по п. 1, где первый ацетогенный микроорганизм в экспоненциальной фазе роста характеризуется скоростью роста от 0,01 до 2 ч-1.
3. Смесь по п. 1, где первый ацетогенный микроорганизм в экспоненциальной фазе роста характеризуется OD600 от 0,01 до 2.
4. Смесь по п. 1, где источник углерода содержит CO.
5. Применение смеси по п. 1 для получения этанола и/или ацетата.
| US 20120009638 А1, 12.01.2012 | |||
| WO 2008028055 A2, 06.03.2008 | |||
| US 2007275447 A1, 29.11.2007 | |||
| ФЕРМЕНТАТИВНОЕ ПОЛУЧЕНИЕ ЧЕТЫРЕХУГЛЕРОДНЫХ СПИРТОВ | 2006 |
|
RU2394913C2 |
Авторы
Даты
2020-06-23—Публикация
2016-01-27—Подача