Настоящее изобретение относится к клеточной биотехнологии, а именно касается способа со культивирования клеток для создания моделей гематоэнцефалического барьера (ГЭБ) для изучения транспорта и токсичности лекарственных средств in vitro.
В частности, заявляемое изобретение может быть реализовано в высокопроизводительных скринингах способности проникновения ксенобиотиков и лекарственных средств через ГЭБ.
Заявляемое решение может быть использовано в более широкой области для изучения миграции клеток или для исследования влияния различных химических веществ на клетки в условиях in vitro.
Из уровня техники известен патент WO 9105038, в котором описана модель ГЭБ, состоящая из конфлюентного монослоя микроваскулярных эндотелиальных клеток из любого позвоночного, культивируемых на пористой мембране в среде обогащенной факторами, выделяемыми астроцитами, или сокультивируемых с астроцитами, находящимися в нижнем компартменте.
Из уровня техники известен патент WO 2007072953, в котором описывается модель, состоящая из эндотелиальных клеток, культивируемых в присутствии перицитов и астроцитов. В данной модели первичные микроваскулярные эндотелиальные клетки мозга крысы высаживаются на верхнюю поверхность мембраны, а перициты культивируются на обратной стороне мембраны; первичные астроциты высаживают на дно нижнего компартмента.
Из уровня техники известен патент US 2008044847, описывающий модель, в которой первичные микроваскулярные эндотелиальные клетки мозга или эндотелиальные клетки, полученные из эмбриональных стволовых клеток, культивируются совместно с нейрональными прогениторными клетками.
Недостатками вышеописанных способов является использование в них первичных культур видов отличных от человека, что может вызывать видоспецифические различия в проницаемости и других свойствах этих моделей. К тому же использование первичных культур является трудоемким процессом и требует высокой экспертизы, что делает эти способы малопригодными для высокопроизводительного скрининга.
Другими недостатками способов является культивирование в статических условиях, что не отражает физиологических условий, в которых эндотелий сосудов подвергаются воздействию касательного напряжения.
Наиболее близким решением является способ, описывающий трехмерную трубчатую структуру с постоянным потоком питательной среды, имитирующим физиологическое касательное напряжение в кровеносных сосудах (WO 03025206) (прототип). В этой динамической модели используются различные монокультуры и совместное культивирование клеток различного типа, а именно эндотелиальных клеток мозга крысы, астроцитов крысы и эндотелиальных клеток мозга человека. Недостатком модели является использование одновременно только двух типов клеток, эндотелиальных клеток и астроцитов.
Техническая задача, на решение которой направлено настоящее изобретение, заключается в преодолении перечисленных выше недостатков посредством разработки способа сокультивирования клеток до момента образования каждым типом клеток сплошного монослоя с последующим изучением сформированной клеточной модели in vitro, в т.ч. в динамическом режиме ростовой среды.
Поставленная задача реализуется следующим образом:
Готовят необходимое количество мембранных вставок Transwell для 96-луночного планшета:
- покрывают нижнюю сторону мембраны раствором ВКМ (35 мкл/вставку) следующего состава: коллаген IV (20 мкг/мл) + агрин (4 мкг/мл) + энтактин (4 мкг/мл) + ламинин 511 (5 мкг/мл) + ламинин 411 (5 мкг/мл) в DPBS (Са2+/Mg2+) (фиг. 1);
- покрывают верхнюю сторону мембраны раствором ВКМ (35 мкл/вставку) следующего состава: ламинин 211(10 мкг/мл) в DPBS (Ca2+/Mg2+).
Планшеты с покрытыми ВКМ мембранными вставками хранят в асептических условиях при +2°С - +8°С до 4 недель. К мембранам добавляют 1xDPBS (Ca++/Mg++), чтобы предотвратить пересыхание мембран с ВКМ.
Для покрытия нижней стороны мембраны ВКМ или для посева клеток на нижнюю сторону мембраны, мембранную вставку Transwell переворачивают в лунке планшета вверх дном, наносят каплю (~35 мкл) раствора ВКМ или суспензии клеток, закрывают крышкой или пленкой Parafilm для предотвращения испарения среды, ставят в CO2-инкубатор на достаточное время для формирования ВКМ или для прикрепления клеток.
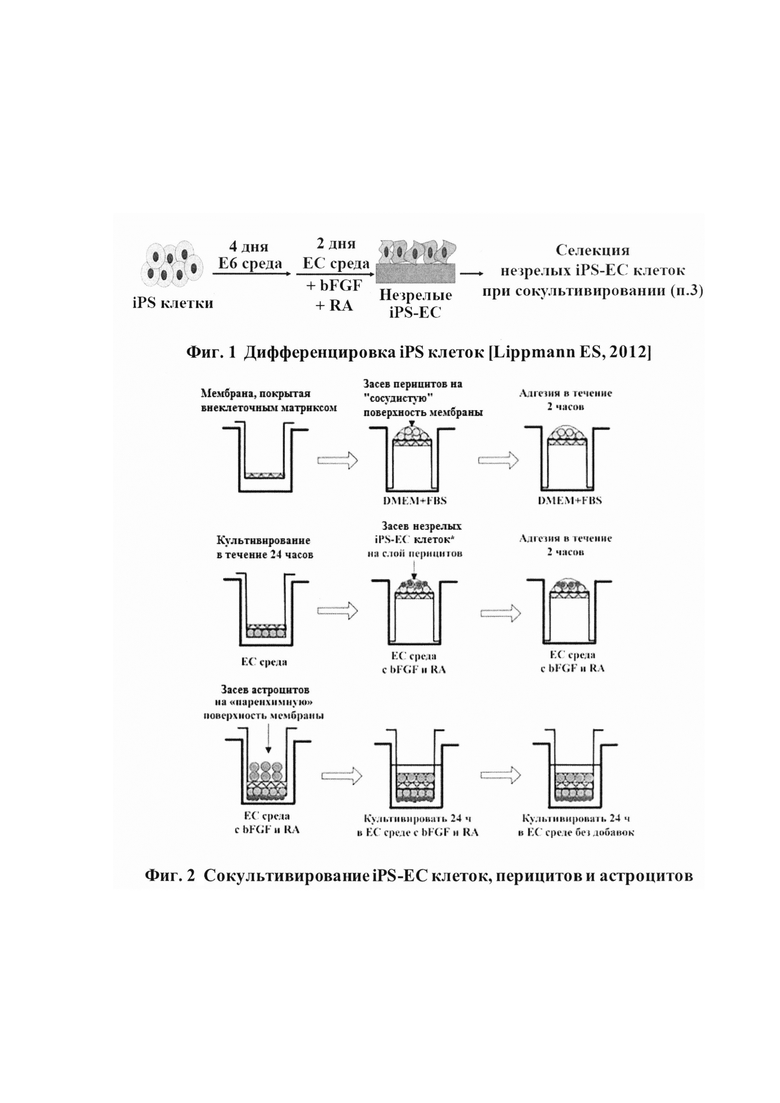
Дифференцировка iPS клеток
Дифференцировку клеток проводят в соответствии с детально описанным протоколом [Lippmann ES, 2012] (фиг. 1). Засевают iPS клетки линии IMR90 - 4 в 6-луночные планшеты в плотности 10000-15600 клеток/см2 в питательной среде Е8, содержащей 10 мкМ Y-27632 (День -1). Примерно через 24 часа после посева клеток меняют среду на Е6 питательную среду (День 0) для индукции дифференцировки. Меняют среду каждые 24 часа. Дифференцирут клетки в Е6 среде в течение 4 дней. Далее, меняют среду на ЕС питательную среду с добавлением 20 нг/мл bFGF и 10 мкМ ретиноевой кислоты (RA), инкубируют48 часов. После этого отбирают ЕС питательную среду, промывают клетки один раз DPBS и инкубируют с Аккутазой 20-25 минут. Осаждают клетки центрифугированием и далее пересаживают на слой Перицитов для селективной адгезии (3 пункт). Пересаживают клетки для селекции в отношении 1 лунка 6-луночного планшета с незрелыми дифференцированными клетками на 3 мембранных вставки (12-луночного планшета) или 24 мембранных вставки (96-луночного планшета).
Сокультивирование iPS-EC клеток, перицитов и астроцитов для формирования клеточной модели ГЭБ (фиг. 2).
Засевают перициты на нижнюю поверхность мембраны, покрытой ВКМ, в плотности 2,5*105 клеток/см2, в полной питательной среде (DMEM + 10% FBS). Ставят на 2 часа в СО2-инкубатор для прикрепления клеток. После этого, меняют среду на ЕС питательную среду, инкубируют еще 24 часа. Засевают незрелые (Immature) iPS-EC клетки (пункт 2) на слой из перицитов (в отношении 1 лунка 6-дуночного планшета с незрелыми iPS-EC клетками на 24 мембранные вставки 96-луночного планшета) в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты. Дают клеткам прикрепиться в течение 2 часов в СО2-инкубаторе. После этого, переверачивают мембранные вставки в лунках в их нормальное положение (дном вниз), и засевают астроциты на верхнюю (внутреннюю) сторону мембранной вставки в плотности 2,5*105 клеток/см2, в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты. Инкубируют 24 часа в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты. Через 24 часа меняют среду на ЕС питательную среду без добавок, инкубируют еще 24 часа.
В результате формируется плотный клеточный барьер с физиологически релевантными значениями TEER (>2000 Ω⋅см2), которые сохраняются длительное время (более 3 дней).
Для наилучшего понимания сущности заявляемого изобретения ниже представлен перечень материалов и оборудования, используемых в настоящем описании:
«Трансвелл» («Transwell») - емкость для выращивания клеток или клеточных моделей, которые используются в микрофлюидных устройствах при проведении исследований клеточных моделей. Трансвеллы имеют форму цилиндра или усеченного конуса, объем от 100±25 мкл до 1,5±0,15 мл, верхний диаметр от 4,26±0,50 ммдо 24±0,5 мм, нижний диаметр от 4,26±0,50 мм до 24±0,5 мм, высоту от 6±0,5 мм до 20±0,5 мм, дно выполнено в виде пористой мембраны с диаметром пор от 0,4 до 8,0 мкм и плотностью пор от 1×105 до 1×108 пор на 1 см2. Трансвеллы могут быть выполнены из полиэстера, поликарбоната или политетрафторэтилена. Из уровня техники известны Трансвеллы фирмы Corning Inc. В настоящем изобретении используются Трансвеллы с толщиной мембраны 10 μm, материал мембраны поликарбонат (PC), диаметр пор в мембране 3 μm.
Клетки для сокультивирования: iPS(IMR)-EC (клетки микроваскулярного эндотелия головного мозга человека, дифференцированные из iPS клеток линии IMR90-4) (WiCell); imHBVP (иммортализованные перициты головного мозга человека) (Celther); fHA-hTERT (иммортализованные астроциты человека) (abm).
Культуральный пластик (Corning): Т25 флаконы; 6-луночныепланшеты; 96-луночные планшеты с мембранными вставками Transwell; 96-луночные планшеты.
Компоненты клеточной модели ГЭБ: Мембранные вставки Transwell для 96-луночного планшета.
Поверхность PC мембраны, обращенная в сторону нижнего отсека лунки ("сосудистый отсек"), покрыта следующими компонентами ВКМ: коллаген IV + агрин + энтактин + ламинин (411+511), для адгезии к поверхности мембраны перицитов и iPS-EC эндотелиальных клеток.
Поверхность PC мембраны, обращенная в сторону верхнего отсека лунки ("мозговой отсек"), покрыта следующими компонентами ВКМ: ламинин 211 для адгезии к поверхности мембраны астроцитов.
Компоненты ВКМ для клеточной модели ГЭБ: Ламинин 511 (BioLamina), Ламинин 411 (BioLamina), Коллаген IV (MERCK), Агрин (R&D Systems), Энтактин (R&D Systems), Ламинин 211 (BioLamina).
Компоненты ВКМ для моно-культур клеток:
Культивирование, поддержание iPS клеток - Matrigel (Corning);
Дифференцировка iPS клеток (со стадии селекции) - Коллаген IV (MERCK); Фибронектин (Sigma-Aldrich); fHA-hTERT; Внеклеточный матрикс - Applied Cell Extracellular Matrix (G422) (ABM).
Культуральная среда (средаи компоненты от Thermo Fisher Scientific, Sigma Aldrich, R&D Systems или ABM):
Питательная среда для iPS и iPS-EC клеток: E8 питательная среда с добавлением или без 10 мкМ Y-27632; Е6 питательная среда; ЕС питательная среда с добавлением или без 20 нг/мл bFGF и 10 мкМ ретиноевой кислоты;
Питательная среда для imHBVP - DMEM с добавлением 10% FBS и антибиотиков (если необходимо);
Питательная среда для fHA-hTERT - Prigrow IV (abm) с добавлением 10% FBS.
Культуральная среда (для сокультивирования iPS-EC клеток, перицитов и астроцитов): ЕС питательная среда.
Диссоциирующие растворы: Stem Pro Аккутаза (для imHBVP клеток и iPS-ЕС клеток перед стадией селекции); Версен (для iPS клеток); Трипсин/ЭДТА (для fHA-hTERT клеток).
Изобретение относится к области медицины. Предложен способ сокультивирования iPS-EC клеток, перицитов и астроцитов для формирования клеточной модели гематоэнцефалического барьера (ГЭБ). Перициты засевают на нижнюю поверхность мембраны, покрытой внеклеточным матриксом, в плотности 2,5⋅105 клеток/см2. Незрелые iPS-EC клетки засевают на слой из перицитов в отношении 1 лунка 6-луночного планшета с незрелыми iPS-EC клетками на 24 мембранные вставки 96-луночного планшета в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты. Засевают астроциты на верхнюю (внутреннюю) сторону мембранной вставки в плотности 2,5⋅105 клеток/см2 в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты. Через 24 часа меняют среду на ЕС питательную среду без добавок, инкубируют еще 24 часа. Изобретение обеспечивает создание моделей ГЭБ in vitro. 2 ил.
Способ сокультивирования iPS-EC клеток, перицитов и астроцитов для формирования клеточной модели гематоэнцефалического барьера (ГЭБ), в котором перициты засевают на нижнюю поверхность мембраны, покрытой внеклеточным матриксом, в плотности 2,5*105 клеток/см2, в полной питательной среде DMEM+10% FBS, ставят на 2 часа в CO2-инкубатор для прикрепления клеток, меняют среду на ЕС питательную среду, инкубируют еще 24 часа, незрелые (Immature) iPS-EC клетки засевают на слой из перицитов в отношении 1 лунка 6-луночного планшета с незрелыми iPS-EC клетками на 24 мембранные вставки 96-луночного планшета в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты, дают клеткам прикрепиться в течение 2 часов в СО2-инкубаторе, после чего переворачивают мембранные вставки в лунках дном вниз и засевают астроциты на верхнюю (внутреннюю) сторону мембранной вставки в плотности 2,5*105 клеток/см2 в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты и инкубируют 24 часа в ЕС питательной среде с добавлением bFGF и ретиноевой кислоты, через 24 часа меняют среду на ЕС питательную среду без добавок, инкубируют еще 24 часа, при этом используют клетки микроваскулярного эндотелия головного мозга человека, дифференцированные из iPS клеток линии IMR90-4, иммортализованные перициты головного мозга человека и иммортализованные астроциты человека.
| СПОСОБ КОДИРОВАНИЯ ВИДЕО С ИСПОЛЬЗОВАНИЕМ РЕГУЛИРОВАНИЙ СМЕЩЕНИЯ СОГЛАСНО КЛАССИФИКАЦИИ ПИКСЕЛОВ И УСТРОЙСТВО ДЛЯ ЭТОГО, СПОСОБ И УСТРОЙСТВО ДЕКОДИРОВАНИЯ ВИДЕО ДЛЯ ЭТОГО | 2012 |
|
RU2632139C1 |
| RU 2017102573 A, 03.08.2018 | |||
| WO 2017143049 A1, 24.08.2017 | |||
| ICell GlutaNeurons User’s Guide | |||
| Приспособление для выключения счетчика выработки ткацкого станка при его останове | 1930 |
|
SU21840A1 |
| Cellular Dynamics International, Inc | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| AL AHMAD A | |||
| et al | |||
| Maintaining blood-brain barrier integrity: pericytes perform better than astrocytes during prolonged oxygen deprivation | |||
| J Cell Physiol | |||
Авторы
Даты
2020-06-29—Публикация
2019-10-29—Подача