Изобретение относится к области биофармакологии. В частности, к разработке нового лекарственного средства на основе иммунолипосомальной конструкции, к способу его получения и векторной доставки такого средства в мозговую ткань при опухолевой патологии центральной нервной системы (ЦНС).
Опухоли головного мозга - одни из самых злокачественных заболеваний. Малая эффективность лечения обуславливается бессимптомным началом заболевания, резистентностью этих опухолей к действию традиционных химио- и лучевой терапиям, высоким потенциалом к инфильтрированию здоровой ткани и, зачастую, невозможностью адекватного хирургического вмешательства из-за особенностей локализации очага опухоли.
Поэтому для лечения данной патологии необходимо разрабатывать принципиально новые средства и подходы по доставке терапевтического агента к клеткам опухоли, локализованной в ЦНС.
Одним из новых перспективных подходов в конструировании систем доставки различного назначения является использование липидных везикул нанодиапазона, получивших название липосомы, в качестве удобного транспортного средства, одновременно существенно понижающего токсичность препарата в сравнении с действием его свободной формы, кроме того, они могут служить как транспортная система для доставки цитотоксических агентов, более специфичных к опухолям или другим очагам патологии. Лекарственная субстанция, биологически активное вещество или генно-инженерный материал могут быть заключены во внутреннюю полость липидной микрокапсулы или непосредственно в образующий липосому липидный бислой (1).
С другой стороны, имеется проблема не просто транспортировки препарата к опухолевому очагу, но и адресной доставки его в определенный орган, пораженный опухолевым процессом, в нашем случае это - ткани ЦНС.
Проведенный нами патентный поиск подтвердил, что имеется ряд патентных публикаций, подтверждающих использование липосом и их различных усовершенствованных форм в качестве лекарственных средств для лечения опухолевых заболеваний.
В частности, еще в 1985 г. опубликован японский патент, где раскрывается антираковый или карциностатический агент, заключенный в липосомальную оболочку, а с поверхностью липосомы соединено антитело к эмбриональному белку альфа-фетапротеину, имеющему некоторое сродство с опухолевыми клетками (патент JP 60067434, 17.04.1985). Препарат предназначен для лечения гепатокарциномы.
Однако данное средство не может служить эффективным при лечении опухолей ЦНС и, кроме того, оно призвано использовать эмбриональный материал. Однако следует заметить, терапия препаратами, приготовленными из эмбриональной ткани, имеет очень серьезные проблемы тканевой совместимости, возникновения отсроченных иммунных конфликтов, а также морально-этические, юридические и религиозные ограничения.
Достаточно перспективными в качестве векторных носителей терапевтических агентов к опухолям можно рассматривать нейтральные стволовые клетки (далее НСК), обладающие нативным потенциалом направленной миграции к очагу и удаленным метастазам опухолевой ткани (2). При этом терапевтическим агентом может служить препарат генетически модифицированных НСК, экспрессирующий биологически активный фактор, к примеру фактор некроза опухоли (ФНО) (3) или цитозиндезаминазу, фермент, не содержащийся в организме человека и локально катализирующий нетоксическое вещество - пролекарство 5-фторцитозин или цитостатик 5-фторурацил (4).
Однако эти средства все же для опухолей мозга малоприемлемы из-за особенностей строения глиальных клеток и наличия гематоэнцефалического барьера (ГЭБ).
В последнее время сделаны попытки по созданию противоопухолевых препаратов, содержащих липосому с включением внутрь ее оболочки антираковых и канцеростатических средств, а липосомная частица дополнительно содержит векторный компонент пептидной природы, ковалентно присоединенный к липидам оболочки липосомы, причем векторный компонент выбран из группы семейств различных факторов роста (патент РФ 2292898, 10.02.2007 г.). Следует заметить, что представленное средство также не пригодно для лечения опухолей мозга, поскольку тропностью к опухолевым клеткам мозга не обладает.
Проводя тщательную проверку предшествующего уровня техники на предмет оценки нашей работы по критерию оценки «изобретательский уровень», мы изучили вопрос возможного использования протеинсвязывающих агентов, которые можно было бы использовать в качестве связующего агента (сшивки) между антителом и цитотоксическим агентом или оболочкой липосомы, наша работа состояла и в творческом выборе такой сшивки из множества известных (см., напр., пат. РФ 2270029, 2006 г.): бифункциональные производные имидоэфиров, активные сложные эфиры, например дисукцинимидилсуберат, иминотиолан, глутаровый альдегид, бисазидосоединения и многие другие.
Наиболее близким аналогом по решаемой задаче можно считать работу, описанную в пат. РФ 2229287, 2004 г. Здесь описана клеточная линия, способная экспрессировать молекулу, ингибирующую рост опухоли ЦНС, инкапсулированную в иммуноизолирующий альгинат, содержащий более 15% гулуроновой кислоты, причем молекула может оказывать воздействие на нейроваскуляризацию опухоли, может взаимодействовать с различными рецепторами и факторами роста в опухолевой клетке мозга. Однако, обладая достоинствами специфичности к опухоли мозга, скорее на физиологическом уровне, когда опухоль становится операбельной, данная методика не раскрывает воздействие на опухоль в неоперабельной, достаточно ранней, стадии развития, что является особенно важным в лечении онкологических патологий, особенно ЦНС.
Как многообещающий вектор доставки терапевтических агентов для лечения опухолей, в основном глиобластом, все чаще рассматриваются гемопоэтические стволовые клетки (далее ГСК). Человеческие и мышиные ГСК обладают повышенной тропностью (позитивным хоумингом) к очагу интракраниальных опухолей и являются инертными по отношению к нормальной ткани ЦНС. Исследования на органотипических культурах гиппокампа и in vivo, в том числе и наши, подтверждают факт направленной миграции ГСК к клеткам глиомы.
Преимущества применения ГСК в терапевтических целях для лечения интракраниальных глиом обуславливается еще и тем фактом, что традиционная терапия противоопухолевыми препаратами, а также лучевая терапия, не оказывает отрицательного влияния на процессы миграции ГСК в очаг патологии (5). Кроме этого, ГСК не являются эмбриональными клетками, их возможно выделить из крови взрослого организма, что выгодно отличает их от НСК.
Технической задачей, таким образом, явилось создание нового противоопухолевого средства, имеющего иммунотропность к опухолевой клетке глиального происхождения, выделенного без использования эмбриональных элементов, способного к высокоэффективнй векторной доставке к мозговой ткани, обладающего свойством, проникая через ГЭБ, воздействовать прицельно на глиальную клетку, сохраняя инертность в отношении здоровых клеток; способа получения такого средства и способа ингибирования опухолевого процесса в мозговой ткани.
Поставленная задача решается тем, что создано противоопухолевое средство, представляющее собой иммунолипосомальную конструкцию, включающее липосому, содержащую противоопухолевый терапевтический агент, сшитую с вектором пептидной природы, при этом для лечения опухолей в центральной нервной системе, липосома содержит терапевтический агент в водной фазе, в качестве вектора содержит моноклональные антитела к CD34+, а сшивка представляет собой 2-иминотиолан (ИТ) в 0,1%-ной концентрации. В качестве терапевтического агента иммунолипосома может содержать вещество, выбранное из группы: дауномицин, карминомицин, мелфталан, метотрексат, цитарабин, доксорубицин, рицин.
Поиск векторов для направленного воздействия на опухоли ЦНС привел нас, таким образом, к использованию гемопоэтических стволовых клеток, поскольку имеются генетические аспекты, поясняющие возможность наличия такого хоуминга у этих клеток, в частности, к клеткам глиомы. Хотя и существует мнение, что подавляющее большинство глиом не экспрессируют ген CXCL12 (6), но в другой работе с использованием более чувствительной методики ПЦР (полимеразной цепной реакции) исследователи показали наличие мРНК, кодирующей CXCL12, у 13 из 31 линии глиомы (7), но следует иметь в виду, что взаимодействие хемокина CXCL12 (или SDF-1 альфа) с рецептором CXCR4 приводит к активному фосфорилированию киназы митогенактивируемого белка, что в свою очередь инициирует синтез ДНК и обуславливает хемотаксис опухолевых клеток, то есть отвечает за рост опухоли и ее метастазирование.
Изобретение подтверждается рядом экспериментов, проведенных как in vitro, так и in vivo: далее приведено экспериментальное подтверждение способности терапевтического агента непосредственно проникать в опухолевые клетки мозга.
ПРИМЕР 1. Создание кокультуры С6 глиомы и гемопоэтических CD34 стволовых клеток (ГСК CD34), (ОПЫТ).
Для получения культуры глиобластомы использовали линию С6-глиомы
Берут 1·106 клеток С6 глиомы, быстро размораживают, отмывают центрифугированием от криоконсерванта (диметилсульфоксида), ресуспендируют в 12 мл среды (DMEM, 20% фетальной бычьей сыворотки, 2 мМ L-глутамина, 25 мМ ХЕПЕС, антибиотик-антимикотик 10000 ед./мл) и высаживают в культуральные матрасы (Costar). Культивирование глиомы продолжают до образования монослоя. Далее клетки глиомы собирают с помощью ферментативной диссоциации (0,05% трипсин-ЭДТА, 10 мин, 37°С) и используют во второй стадии эксперимента.
Для создания кокультур используют культуральные вставки фирмы Millipore (диаметр 12 мм, размер пор 0,4 мкм). Дно лунок 12-луночного культурального планшета покрывают полиэтиленимином (Gibco), затем ламинином (Gibco) в соответствии с рекомендациями производителя. Далее в каждую лунку планшета помещают культуральную вставку Millipore, где ее иммобилизуют каплей стерильного парафина. Внутрь культуральной вставки вносят по 0,5·106 клеток С6-глиомы, нормальных астроцитов крысы, нормальных фибробластов крысы, в 6, 3 и 2 лунки соответственно. Одну из вставок оставляют пустой. Планшет с культуральными вставками инкубируют в течение 24 часов. Затем на дно лунки планшета высаживают гемопоэтические CD34+ стволовые клетки по 0,25·106 клеток, окрашенных флуоресцентным маркером Vybrant™ CFDA SE Cell Tracer. Через 3 часа инкубации не прикрепившиеся ко дну лунки клетки отбирают.
Далее визуально анализируют распределение гемопоэтических CD34+ стволовых клеток по дну лунки. Подсчет клеток в области проекции мембраны культуральной вставки осуществляют с помощью программы денситометрического анализа изображения на 1-й, 2-й, 3-й, 5-й и 10-й день культивирования. В результате анализа полученных данных количество гемопоэтических CD34+ стволовых клеток в области проекции мембраны, содержащей клетки С6-глиомы, увеличилось на 6% - 22% за 2 первых дня кокультивирования. За последующие дни культивирования количество ГСК в области проекции мембраны достоверно не изменилось.
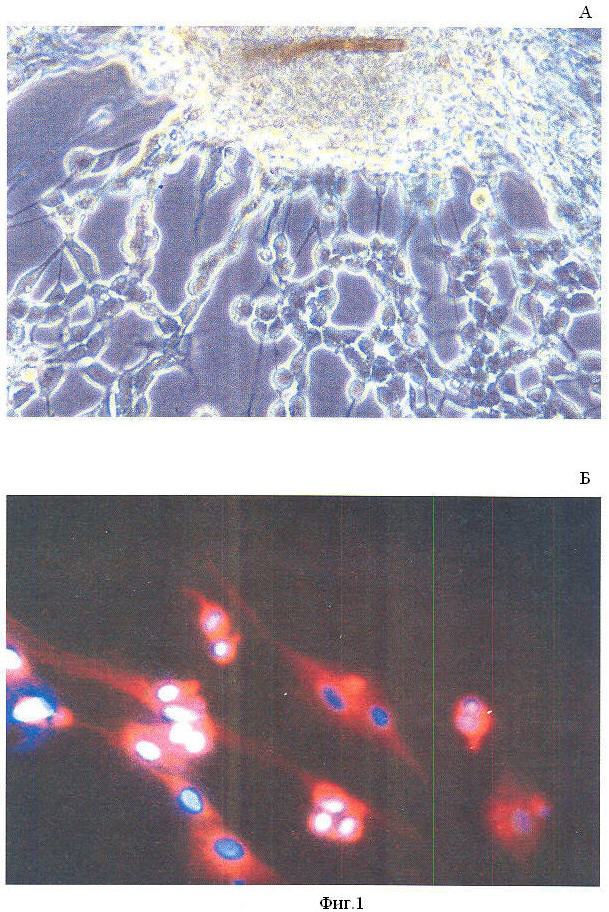
На фиг.1 представлены микрофотографии культуры С6-глиомы крысы.
А - прижизненная микрофотография, фазовый контраст,
В - иммуноцитохимическое окрашивание анти-GFAP (глиофибриллярный кислый протеин) mab, родамином, ядра окрашены DAPI.
ПРИМЕР 2. Создание кокультуры нормальных астроцитов и (ГСК CD34+), (КОНТРОЛЬ).
Для получения первичной культуры астроцитов крысы использовались новорожденные крысы породы Wistar. Животных умерщвляют эфиром для наркоза, поверхность тела обрабатывают спиртом. В стерильных условиях от крыс отделяют головы, вскрывают череп, вынимают мозг и помещают в чашку Петри с раствором Хенкса. Далее выделяют кору больших полушарий, очищают ее от сосудистых оболочек, измельчают, отмывают 2 раза раствором Хенкса и подвергают ферментной диссоциации 0,05% раствором трипсина-ЭДТА в течение 10 минут при 37°С. Ферментативную диссоциацию останавливают добавлением 5% FBS (фетальной бычьей сыворотки) в растворе Хенкса, дважды отмывают и подвергают механической диссоциации. Клеточную суспензию осаждают центрифугированием, ресуспендируют в полной среде (DMEM/F12 90%, FBS 10%, L-глутамин 2 мМ, глюкоза 0,8%, инсулин 0,2 ед./мл, HEPES 25 мМ, антибиотик-антимикотик 10000 ед./мл) и высаживают на культуральные матрасы (Costar). Культивирование астроцитов продолжают до образования монослоя. Далее астроциты собирают с помощью ферментативной диссоциации (0.05%трипсин-ЭДТА, 10 мин, 37°С) и используют во второй стадии эксперимента.
Для создания кокультур используют культуральные вставки фирмы Millipore, как в примере 1 (диаметр 12 мм, размер пор 0,4 мкм). Дно лунок 12 луночного культурального планшета покрывают полиэтиленимином (Gibco), затем ламинином (Gibco) в соответствии с рекомендациями производителя. Далее в каждую лунку планшета помещают культуральную вставку Millipore, где ее иммобилизуют каплей стерильного парафина. Внутрь культуральной вставки вносят по 0,5·106 клеток С6-глиомы, нормальных астроцитов крысы, в лунки соответственно. Одну из вставок оставляют пустой. Планшет с культуральными вставками инкубируют в течение 24 часов. Затем на дно лунки планшета высаживают гемопоэтические CD34+ стволовые клетки по 0,25·106 клеток, окрашенных флуоресцентным маркером Vybrant™ CFDA SE Cell Tracer. Через 3 часа инкубации не прикрепившиеся ко дну лунки клетки отбирают.
Далее визуально анализируют распределение гемопоэтических CD34+ стволовых клеток по дну лунки. Подсчет клеток в области проекции мембраны культуральной вставки осуществляют с помощью программы денситометрического анализа изображения Photo-Capt v. 12.4 на 1-й, 2-й, 3-й, 5-й и 10-й день культивирования. В результате анализа полученных данных количество гемопоэтических CD34+ стволовых клеток в области проекции, содержащей астроциты, достоверного изменения количества гемопоэтических CD34+ стволовых клеток в этом контроле не наблюдалось.
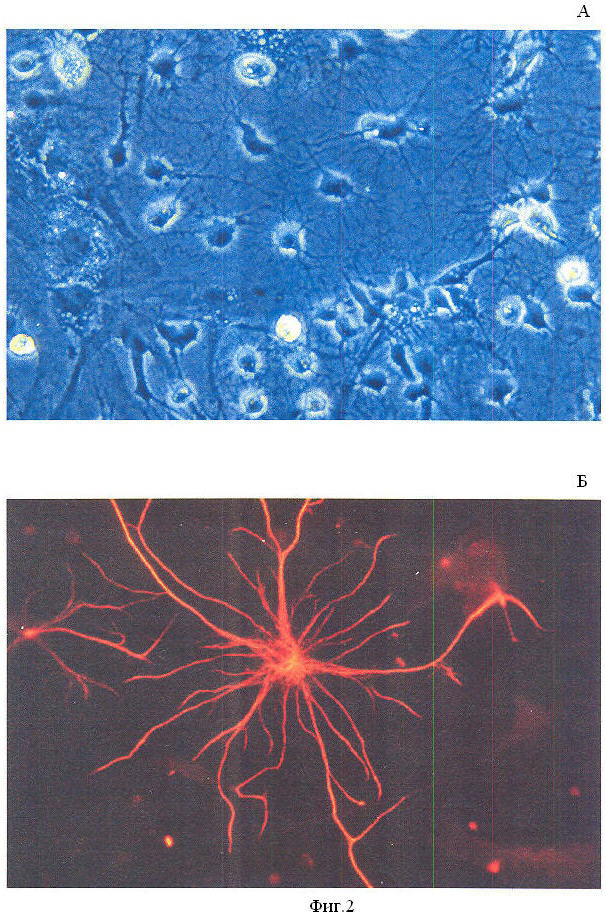
На фиг.2 представлены микрофотографии культуры нормальных астроцитов крысы.
А - прижизненная микрофотография, фазовый контраст,
В - иммуноцитохимическое окрашивание культуры астроцитов анти-GFAP mab.
ПРИМЕР 3. Создание кокультуры фибробластов и (ГСК CD34+), (КОНТРОЛЬ).
Для получения первичной культуры фибробластов крысы используют крысиные 12-дневные эмбрионы. Самку крысы умерщвляют эфиром для наркоза, тело протирают спиртом. Далее стерильно вскрывают брюшную полость, из рогов матки вынимают эмбрионы. Эмбрионы помещают в раствор Хенкса с добавлением антибиотика. У эмбриона удаляют конечности, голову и внутренние органы. Оставшуюся массу измельчают и подвергают ферментной диссоциации (0,25% трипсин, 40 минут, 37°С). Клетки осаждают центрифугированием (1000 g, 5 мин). Осадок ресуспендируют в полной среде (DMEM/F12, 10% FBS, 2 мМ L-глутамина, 0,8% глюкозы, инсулин 0,2 ед./мл, 25 мМ HEPES, антибиотик-антимикотик 10000 ед./мл) и высаживают на культуральные матрасы (Costar). Далее фибробласты собирают с помощью ферментативной диссоциации (0.05% трипсин-ЭДТА, 10 мин, 37°С) и используют во второй стадии эксперимента.
Для создания кокультур используют культуральные вставки фирмы Millipore, как в примере 1 (диаметр 12 мм, размер пор 0,4 мкм). Дно лунок 12 луночного культурального планшета покрывают полиэтиленимином (Gibco), затем ламинином (Gibco) в соответствии с рекомендациями производителя. Далее в каждую лунку планшета помещают культуральную вставку Millipore, где ее иммобилизуют каплей стерильного парафина. Внутрь культуральной вставки вносят по 0,5·106 клеток С6-глиомы, нормальных астроцитов крысы, нормальных фибробластов крысы, в 6, 3 и 2 лунки соответственно. Одну из вставок оставляют пустой. Планшет с культуральными вставками инкубируют в течение 24 часов. Затем на дно лунки планшета высаживают гемопоэтические CD34+ стволовые клетки по 0,25·106 клеток, окрашенных флуоресцентным маркером Vybrant™ CFDA SE Cell Tracer. Через 3 часа инкубации не прикрепившиеся ко дну лунки клетки отбирают.
Далее визуально анализируют распределение гемопоэтических CD34+ стволовых клеток по дну лунки. Подсчет клеток в области проекции мембраны культуральной вставки осуществляют с помощью программы денситометрического анализа изображения Photo-Capt v. 12.4 на 1-й, 2-й, 3-й, 5-й и 10-й день культивирования. В результате анализа полученных данных в области проекции мембраны, содержащей фибробласты, достоверного изменения количества гемопоэтических CD34+ стволовых клеток в этом контроле не наблюдалось.
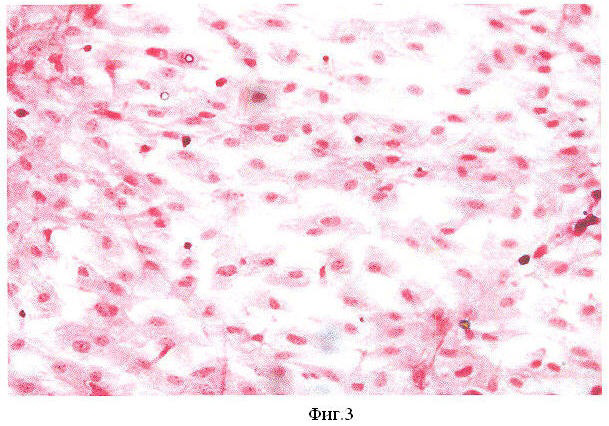
Результаты данного испытания визуализированы на фиг.3 (микрофотография культуры нормальных фибробластов крысы).
Приведенные примеры подтверждают высокую тропность ГСК CD34+ к глиомным клеткам. Мы делаем вывод, что антитела к CD34+ могут быть испытаны в качестве вектора для адресной доставки адекватного противоопухолевого средства в мозг при наличии в последнем соответствующего патологического процесса. В качестве исходной формы терапевтического средства мы взяли липосомальную конструкцию.
Еще одним объектом изобретения является способ получения вышеописанного противоопухолевого средства для борьбы с опухолями ЦНС. Способ заключается в следующем:
Способ получения противоопухолевого средства, включающий смешивание 5 частей холестерина, 15 частей лецитина, 5,0 частей дистеароилфосфатидилэтаноламина, конъюгированного с полиэтиленгликолем, далее все компоненты растворяют в хлороформно-метанольной (1:9) смеси и высушивают в виде пленки, к полученной липидной пленке добавляют циклогексан, замораживают и лиофилизуют, лиофилизированные липиды растворяют в водной фазе 0,1 М натрий-фосфатном буфере (рН=7,4), добавляя 0,5-2,5 вес. части терапевтического агента, получая липосомы, содержащие противоопухолевый агент, затем 10 объемных частей МА CD34+ смешивают с 1 объемной частью раствора 2-иминотиолана, взятого в 0,1%-ной концентрации, инкубируют около одного часа при комнатной температуре в темноте, затем отделяют от несвязавшегося 2-иминотиолана на хроматографической колонке (размером 1×15 см), с сефадексом G-25, уравновешенной натрий-фосфатным буфером, затем смешивают элюированный тиолированный белок с 10 объемными частями липосом и инкубируют 12 часов при температуре +4°С с получением в результате иммунолипосомальной конструкции, содержащей в водной части терапевтический агент, а в качестве вектора - моноклональные антитела к CD34+.
В последующих примерах подробно поясняется получение противоопухолевого средства в виде иммунолипосомальной конструкции.
ПРИМЕР 4. Синтез липосом.
Липосомы готовят по методике, описанной в статье (8) с нашими модификациями.
Все манипуляции за исключением краткосрочных (взвешивание, центрифугирование) проводились в атмосфере аргона. В состав липосом входят 5 мг холестерина, 15 мг лецитина, 5,0 мг дистеароилфосфатидилэтаноламина, конъюгированного с полиэтиленгликолем (DSPE-PEG), 3,0 мг DSPE-PEG, конъюгированного с малеимидом, 0,33 мг флуоресцентной метки (в данном случае Dil) для визуализации полученного эффекта. Все компоненты растворяют в хлороформно-метанольной (соотношение 1:9) смеси и высушивают на роторном испарителе (около 1,5 часов). К липидной пленке добавляют циклогексан, замораживают в жидком азоте и лиофилизуют. Лиофилизированные липиды растворяют в 1,25 мл 0,1 М натрий-фосфатного буфера (рН=7,4), содержащего 40 мкг флуоресцентной метки - Sytox Green (Molecular Probes), который является в данном случае имитатором терапевтического агента - гидрофильный флуоресцентный краситель нуклеиновых кислот, который самостоятельно не может проникнуть в неповрежденную клетку. Поэтому окрашивание ядра может произойти только в случае слияния липосомы с клеткой-мишенью и переноса внутрь содержимого водной фазы. Эмульсию инкубируют, обычно, на роторном испарителе при комнатной температуре около 12 часов.
Липидную эмульсию далее экструдируют последовательно через мембраны с диаметром пор 400, 200, 100 и 50 нм для получения липосомальных частиц, с включенными в их состав визуализирующей метки или терапевтического агента для последующих испытаний in vivo.
Имитатор терапевтического агента в этой методике может быть заменен на терапевтический агент, в нашем случае выбранный из группы: дауномицин, карминомицин, мелфалан, метотрексат, цитарабин, доксорубицин, а также рицин. В качестве терапевтических агентов могут быть использованы и другие подходящие вещества.
ПРИМЕР 5. Получение иммунолипосомальной биологической конструкции CD34+.
Для получения имунолипосомальной конструкции используют липосомы, приготовленные, как описано в примере 4.
Антитела к СD34-антигену были получены методом гибридомной технологии. При этом в качестве антигена используют рекомбинантный пептид, идентичный к экстрацеллярному домену CD34-белка.
200 мкг моноклональных антител к CD34 смешивают с 20 мкл раствора 2-иминотиолана (1 мг/мл), инкубируют 1 час при комнатной температуре в темноте, затем отделяют от несвязавшегося 2-иминотиолана на хроматографической колонке с сефадексом G-25 (1×15 см), уравновешенную натрий-фосфатным буфером. Контроль осуществляют спектрофотометрически при λ=280 нм. Затем смешивают элюированный тиолированный белок с 200 мкл липосом и инкубируют 12 часов при температуре +4°С.
Для остановки реакции конъюгации с антителами к липосомам добавляют 100-кратный мольный избыток раствора N-этил-малеимида (1 мг/мл), концентрируют на конусе до 0,5 мл и наносят на гель-фильтрационную колонку (1×47 см) с сефарозой CL4B. Элюцию проводят натрий-фосфатным буфером. На колонке иммунолипосомы отделяют от несвязавшегося N-этил-малеимида и не включенного внутрь красителя. Контроль осуществляют визуально по окраске Dil и при λ=280 нм. Собирают ПЭГилированные липосомы в 3 мл буферного раствора и концентрируют до необходимого объема. Полученную суспензию инкубируют с ГСК в течение 30 минут на орбитальном шейкере при 200 об/мин. При этом происходит связывание вектора (анти CD34 Mab), конъюгированного липосомой с поверхностью ГСК.
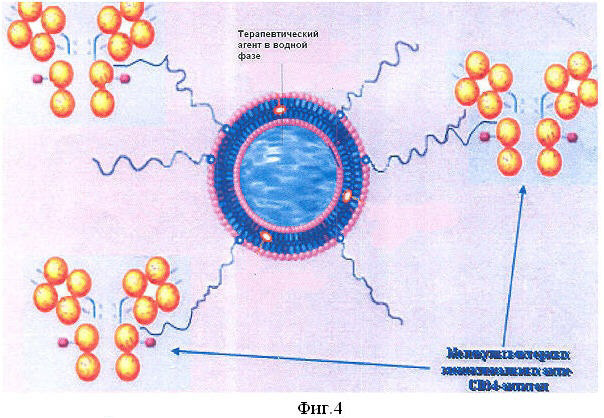
Схема иммунолипосомы представлена на фиг.4.
Полученное клеточно-липосомальное средство, обладающее тропностью к опухолевым клеткам мозга и содержащее внутри липосомы противоопухолевое средство в виде доксорубицина (в водной фазе) и некоторых других токсинов в нашем испытании, имеющее высокоэффективный вектор в виде пришитого к липосоме антитела к CD34, может быть использовано для адресной доставки в мозговую ткань. Это подтверждается нашими опытами.
В качестве цитотоксического агента в составе иммунолипосомы могут быть использованы препараты, обладающие противоопухолевой активностью и несущие свободные аминогруппы, например дауномицин, карминомицин, мелфталан, метотрексат, цитарабин, доксорубицин, а также цитотоксические препараты белковой природы, такие как токсины (дифтерийный или рицин) и другие, пригодные для борьбы с опухолями мозга. Далее приводим пример эксперимента, проведенного на животных.
ПРИМЕР 6. Подтверждение возможности адресной доставки противоопухолевой иммунолипосомы в мозг.
Крысам Вистар (масса тела 80 г, по 8 животных в группе) интраперитонеально вводили (0,1 мл/10 г массы тела) иммунолипосомальной конструкции, изготовленной по примеру 5, с антителом, меченным 125I (1 мКи/мл), растворенную в смеси 1,5% (мас./об.) сополимера Плуроник Р85 и 2,5% (мас./об.) сополимера Плуроник L64, растворенной в среде RPMI 1640. 125I-меченый полипептид, растворенный в среде RPMI 1640, вводили в той же концентрации (в качестве контрольной серии).
Через три дня животных умерщвляли наркозом и получали образцы ткани для радиоактивного анализа распределения метки в тканях. Распределение радиоактивности определяли количественно с помощью жидкостного сцинтилляционного счета.
Эксперименты повторяли по меньшей мере дважды и воспроизводимость результатов составляла более 90%. Эти результаты, выраженные как отношение радиоактивности в ткани головного мозга к радиоактивности в других тканях, представлены в нижеследующей таблице 1.
Из таблицы видно, что использование препарата in vivo у крыс для мозговой ткани практически на порядок превышает возможность его применения в других тканях, а испытания с кокультурами доказывает возможность адресной доставки противоопухолевого препарата в опухолевую клетку.
Еще одним объектом настоящего изобретения является способ ингибирования опухолевого процесса в мозге у экспериментальных животных. Способ ингибирования опухолевого процесса заключается в следующем.
Способ ингибирования опухолевого роста за счет векторной доставки иммунолипосомальной конструкции в опухоль ЦНС, характеризующаяся тем, что противоопухолевое средство, охарактеризованное ранее, и полученное по способу, охарактеризованному в примерах 4 и 5, вводят парентерально в фармацевтически пригодном носителе в эффективном количестве, при этом предварительно вводят препарат гематологических стволовых клеток CD34+.
ПРИМЕР 7. Ингибирование опухолевого роста на модели опухолевого процесса в мозге.
В эксперименте использовали крыс линии Wistar. Модель опухоли мозга получают путем введения клеточной культуры С6-глиомы. Через несколько дней у крыс развивается глиобластома. В группах использовали крыс, как в примере 6 (вес 80 г, по 8 животных в группе). Использовали иммунолипосомальную конструкцию с включенным в водную фазу липосомы доксорубицином. Препараты вводили в дозах 0,2 мкг/кг по доксорубицину по схеме: один раз в 2 дня, всего пять инъекций, начиная с 3-го дня после прививки опухоли. Предварительно вводили внутривенно препарат ГCКCD34+ из расчета 1,3(0,005)×106 клеток/кг, обладающий нативным потенциалом к хоумингу в очаге опухолевого процесса.
Для контроля вводили подопытным животным с привитой опухолью доксорубицин подкожно. Подсчет выживших животных показал, что в опытных группах продолжительность жизни животных достоверно увеличивалась в пределах то 25 до 35%.
Аналогичные результаты получены при испытании дауномицина, карминомицина, мелфталана, метатрексата, рицина и других терапевтических агентов против опухолей.
Создание противоопухолевого средства в виде векторной липосомальной конструкции, содержащей терапевтический противооопухолевый агент, с помощью которого возможно осуществление способа направленного транспорта таких агентов в мозговую ткань, пораженную злокачественным процессом, с использованием в качестве вектора моноклональных антител к CD34+, получаемых из гемопоэтических стволовых клеток, обеспечивает широкую перспективу создания лекарственных средств векторного типа для лечения различных тяжелых патологий ЦНС.
ЛИТЕРАТУРА
1. Tetsuya Hamaguchi, Yasuhiro Matsumura, Yukihiro Nakanishi,K. ei Muro, Yasuhide Yamada, et al. Cancer Sci, July 2004 vol., 95 no. 7.
2. Karen S. Aboody, Alice Brown, Nikolai G. Rainov, Kate A. Bower, Shaoxiong Liu et al. PNAS, 2000.
3. Connors Т. A.J. Gene Ther. 1995; 2: 702-709.
4. Bentires A.M., Hellin А.С., Lechanteur С., et al. J. Cancer Gene Ther. 2000; 7, 20-26.
5. Tabatabai G., Frank В., Mohle R., Weller M., Wick W. Brain. 2006.
6. Zhou Y., Larsen P. H., Hao C., Yong V. W. J. Biol. Chem. 2002 Dec 20; 277(51): 49481-7, Epub 2002 Oct 17.
7. Bajetto A., Barbieri F., Dorcaratto A. et al. Newochem Int. 2006 Apr 16.
8. N. Shi, W. Pardridge (PNAS, 2000, 97(13), 7567-72).
Изобретение относится к области биофармакологии и медицины. Заявлено противоопухолевое средство, представляющее собой иммунолипосомальную биологическую конструкцию, включающее липосому, содержащую терапевтический агент, сшитую с вектором пептидной природы, при этом для лечения опухолей ЦНС, липосома содержит терапевтический агент в водной фазе, в качестве вектора содержит моноклональные антитела к CD34+, а сшивка представляет собой 2-иминотиолан (ИТ) в 0,1%-ной концентрации. В качестве терапевтического агента иммунолипосома содержит вещество, выбранное из группы: дауномицин, карминомицин, мелфталан, метотрексат, цитарабин, доксорубицин, рицин. Заявлен также способ получения противоопухолевого средства и способ ингибирования опухоли мозга, заключающийся в введении средства по п.1 в фармацевтически пригодном носителе в эффективном количестве, при этом предварительно вводят парентерально препарат гематологических стволовых клеток CD34+. Изобретение обеспечивает высокоэффективную доставку противоопухолевого средства к опухоли в ЦНС. 3 н. и 1 з.п. ф-лы, 4 ил., 1 табл.
| АЛЬГИНАТНЫЕ КАПСУЛЫ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ОПУХОЛИ МОЗГА | 1999 |
|
RU2229287C2 |
| ИНГИБИТОР АНГИОГЕНЕЗА, АНТИАНГИОГЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2287341C1 |
| CN 101011358, 08.08.2007 | |||
| Преобразователь угла поворота вала в код | 1986 |
|
SU1305847A1 |
Авторы
Даты
2008-10-27—Публикация
2007-08-10—Подача