Область техники
Изобретение относится к медицине, в частности урологии, и может быть использовано для создания средства для лечения эректильной дисфункции (ЭД), содержащего 9-фенил-симм-октагидроселеноксантен (селеноксантен).
Уровень техники
В последнее время эректильная дисфункция приобретает все большую актуальность. Около 150 млн. мужчин в мире страдают эректильной дисфункцией (ЭД), и в ближайшие 25 лет это число может удвоиться. Широкая распространенность ЭД связана не только с возрастом, но и увеличением заболеваемости, применением лекарственных препаратов, вызывающих нарушение сексуальной функции, стрессом и наличием вредных привычек (курение, употребление алкоголя). Поэтому распространенность ЭД в целом является отражением социальных показателей здравоохранения [1]. Эпидемиологические данные о распространенности ЭД в России ограничены результатами исследования, по данным которого заболеваемость в Центральном Федеральном Округе составляет 26,9% опрошенных мужчин в возрасте от 20 до 75 лет включительно [2]. Препаратами первой линии терапии являются ингибиторы фосфодиэстеразы 5 типа (ИФДЭ-5) [3]. Несмотря на высокую эффективность ингибиторов ФДЭ-5, остается большая доля больных, у которых терапия этими препаратами неэффективна или противопоказана из–за сопутствующего приема нитратов [4]. Кроме того, совместный прием с гипотензивными препаратами чреват эпизодами ортостатической гипотензии, а с α-блокаторами противопоказан. Ввиду того, что ЭД часто развивается на фоне сопутствующей патологии, данные обстоятельства обуславливают актуальность поиска и разработки новых средств для терапии ЭД.
Также известны иные подходы к лечению ЭД, в частности, применение селенсодержащих препаратов в комплексной терапии. Так, в заявке US2002182585 (08.01.2002) описано применение композиции, содержащей ЭДТА, цистин, селен , витамин С, витамин Е и цинк, при сосудистых нарушениях, которые в свою очередь обусловливают в некоторых случаях эректильную дисфункцию.
В патенте CN104799271 (26.01.2014) описано средство для улучшения эрекции, включающее 10-35 г растительного белка, 12-58,8 г растительного жира, 3,5-15 г пищевых волокон, 0,0018-0,0026 г цинка и 0,000003-0,0000015 г селена.
Однако, данные способы обеспечивают комплексное воздействие на организм, и улучшение эрекции при их применении является одним из ряда достигаемых эффектов. Кроме того, из применения указанных способов не следует влияние на эректильную дисфункцию, поскольку оказываемое воздействие складывается из множества факторов и множества соединений, которые действуют совместно, т.е. лечение указанного заболевания определяется малоспецифическими факторами.
В то же время из уровня техники известно селенсодержащее вещество селеноксантен, применяемое при лечении различных заболеваний.
Селеноксантен - содержащее селен биологически активное вещество 9-фенил-симм-октагидроселеноксантен (9-фенил-симметричный-октагидроселеноксантен, C19H22Se, молекулярная масса: 329,37 а.е.м.). Данное соединение имеет антиоксидантное, бактерицидное, радиопротекторное, противоопухолевое, седативное, спазмолитическое, анальгетическое, снотворное действие и применяется для профилактики селеновой недостаточности у человека и животных, нормализации функций щитовидной железы, повышения активности антиоксидантных ферментов, нормализации функций репродуктивной системы. В частности, в качестве примера нормализующего действия селеноксантена на функционирование репродуктивной системы можно привести способ коррекции сперматогенеза у животных в условиях хронической интоксикации природным газом (патент RU 2480221 C1, 28.02.2012), в котором раскрывается возможность селеноксантена улучшать репродуктивный потенциал самцов, за счет положительного влияния на показатели спермограммы. Однако в данной работе не освещается терапия ЭД у человека (коды по МКБ-10: N48.4 и F52) и не учитываются возможные сопутствующие данной патологии состояния или заболевания (например, астенозооспермии).
Таким образом, технической проблемой и задачей, решаемой с помощью заявленного изобретения, является создание средства для лечения эректильной дисфункции, которое содержит в своем составе. 9-фенил-симм-октагидроселеноксантен/
Раскрытие сущности изобретения.
Проведенные нами исследования на животных моделях показали влияние 9-фенил-симм-октагидроселеноксантен на эректильную функцию, что позволяет использовать его в составе средства для лечения ЭД, в том числе связанной с соматическими причинами.
Исходя из изложенного, мы предлагаем средство для лечения эректильной дисфункции, содержащее в своем составе в качестве активного вещества 9-фенил-симм-октагидроселеноксантен в количестве 5-20 мас.% и вспомогательные вещества.
В частном случае фармацевтическая композиция изготовлена в виде капсул или таблеток.
В частном случае в качестве вспомогательных веществ используются для таблеток: МКЦ 65-77 мас.%, кальция карбонат 4-5мас%, кальция стеарат 1,5-2,5мас.%, тальк 2,5-3,5мас%, кремния диоксид 4,5-5 мас.%;
для капсул: МКЦ 60-75 мас.%, кальция карбонат 3,5-4,5 мас.%, кальция стеарат 2-3 мас.%, тальк 3-3,5 мас.%, кремния диоксид 7,5-9 мас.%.
Техническим результатом заявляемого изобретения является получение средства, устраняющего эректильную дисфункцию у мужчин, и не проявляющего побочные эффекты у пациентов с сопутствующими соматическими патологиями. Предлагаемое средство может быть хорошей альтернативой ингибиторам ФДЭ-5, так как не обладает выраженными побочными эффектами, а его эффект носит «накопительный» характер.
Краткое описание чертежей.
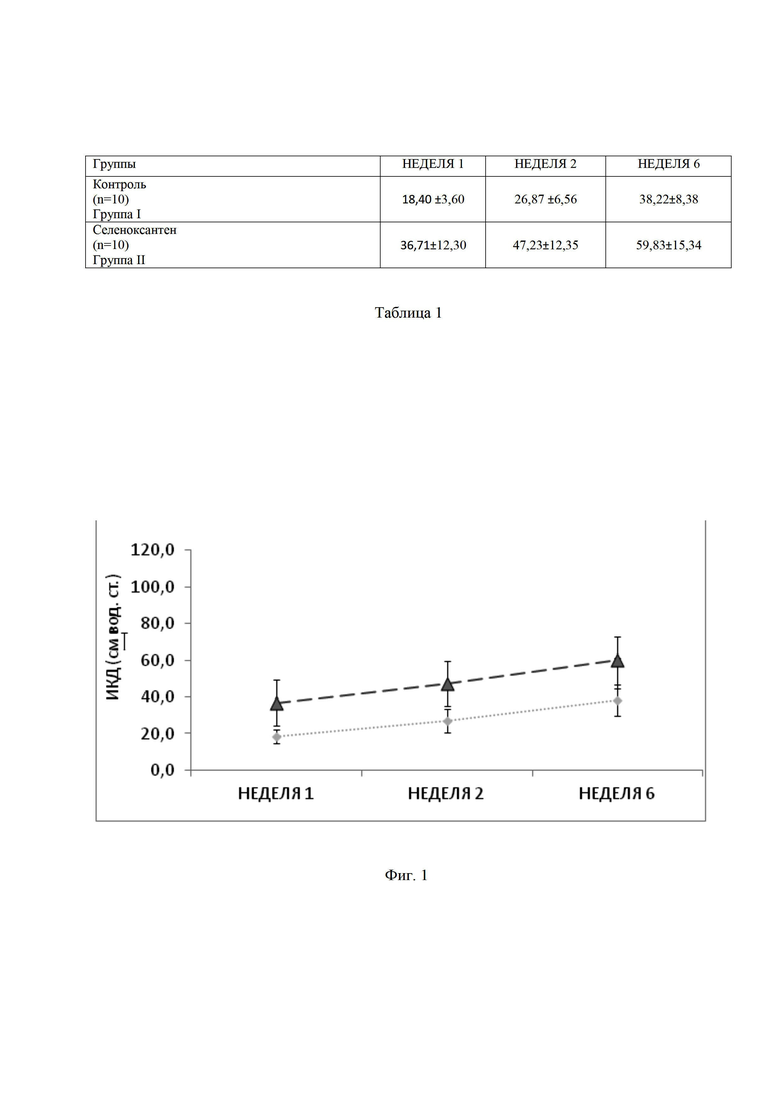
Таблица 1. Результаты измерения пикового давления в пещеристом синусе при электростимуляции кавернозного нерва в модели билатеральной перевязки внутренней подвздошной артерии у крыс, где * - уровень значимости р<0,05 (при сравнении с группой контроля).
Фигура 1. Пиковое интракавернозное давление (ИКД) при электростимуляции кавернозного нерва в модели билатеральной перевязки внутренней подвздошной артерии у крыс, где  - группа 1,
- группа 1,  - группа 2.
- группа 2.
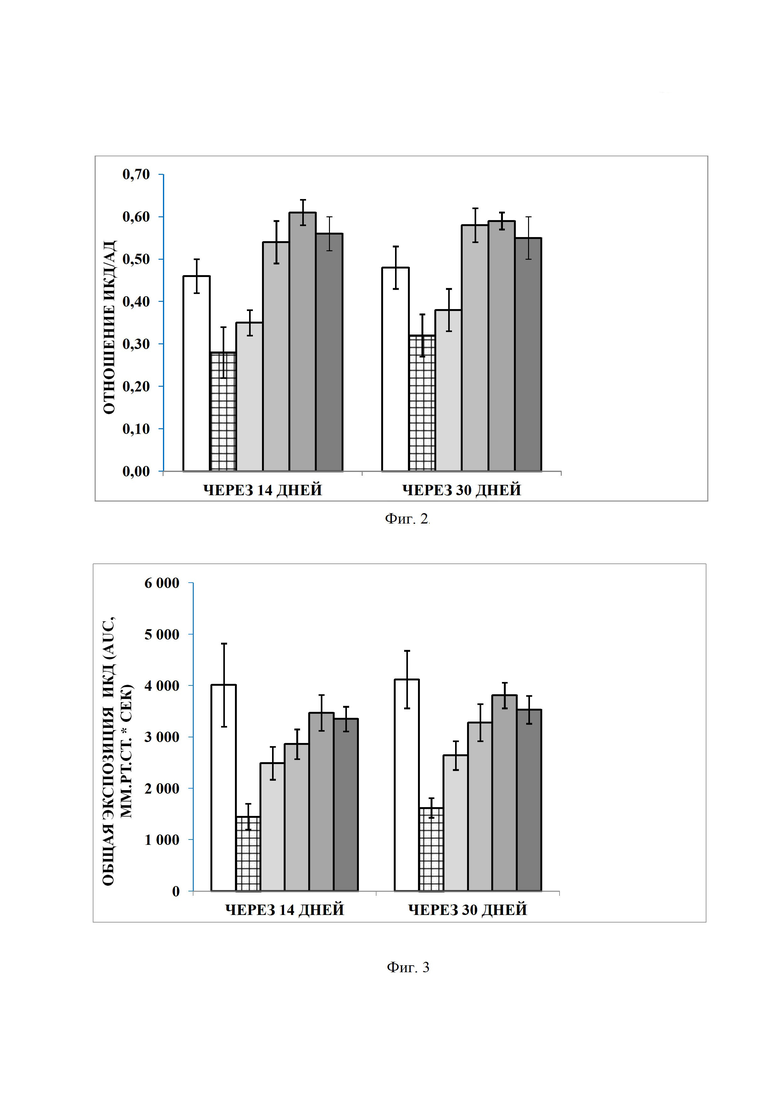
Фигура 2. Отношение ИКД/АД (отношение «интракавернозное давление / среднее артериальное давление) при разных дозировках 9-фенил-симм-октагидроселеноксантена в модели 2-недельного повреждения кавернозного нерва у крыс, где

Фигура 3. Общая экспозиция ИКД (AUC) при разных дозировках 9-фенил-симм-октагидроселеноксантена в модели 2-недельного повреждения кавернозного нерва у крыс, где

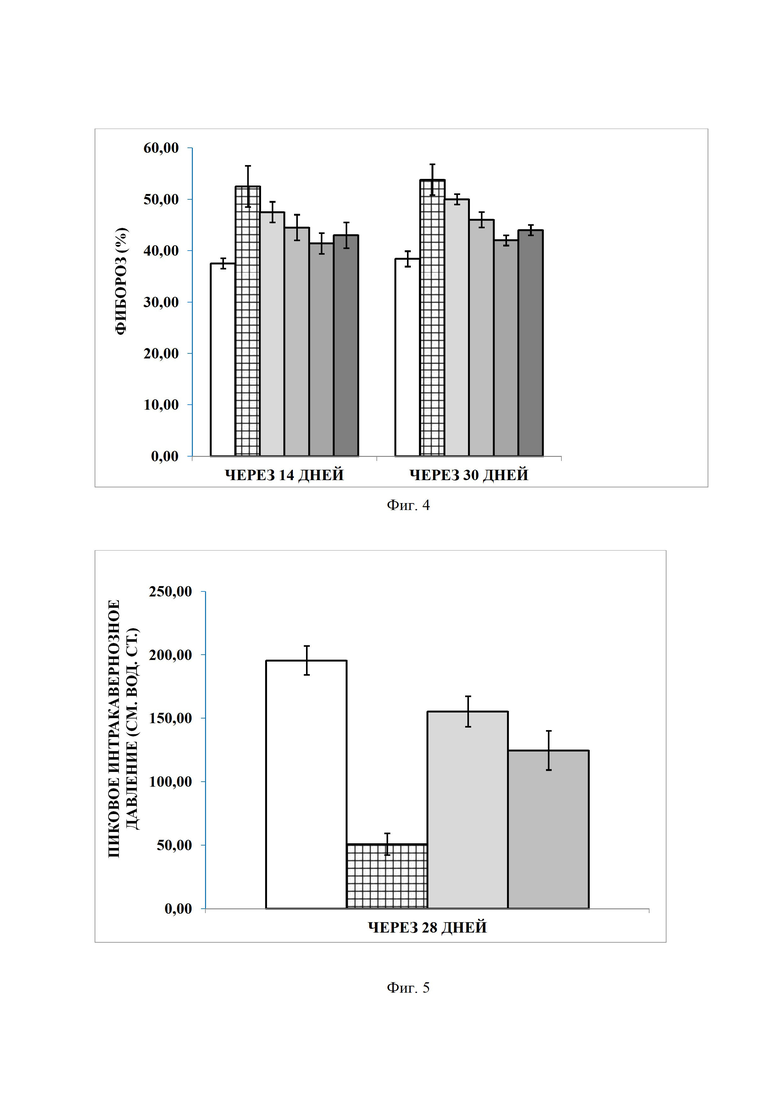
Фигура 4. Динамика фиброза (%) при различных дозировках 9-фенил-симм-октагидроселеноксантена в модели 2-недельного повреждения кавернозного нерва у крыс, где

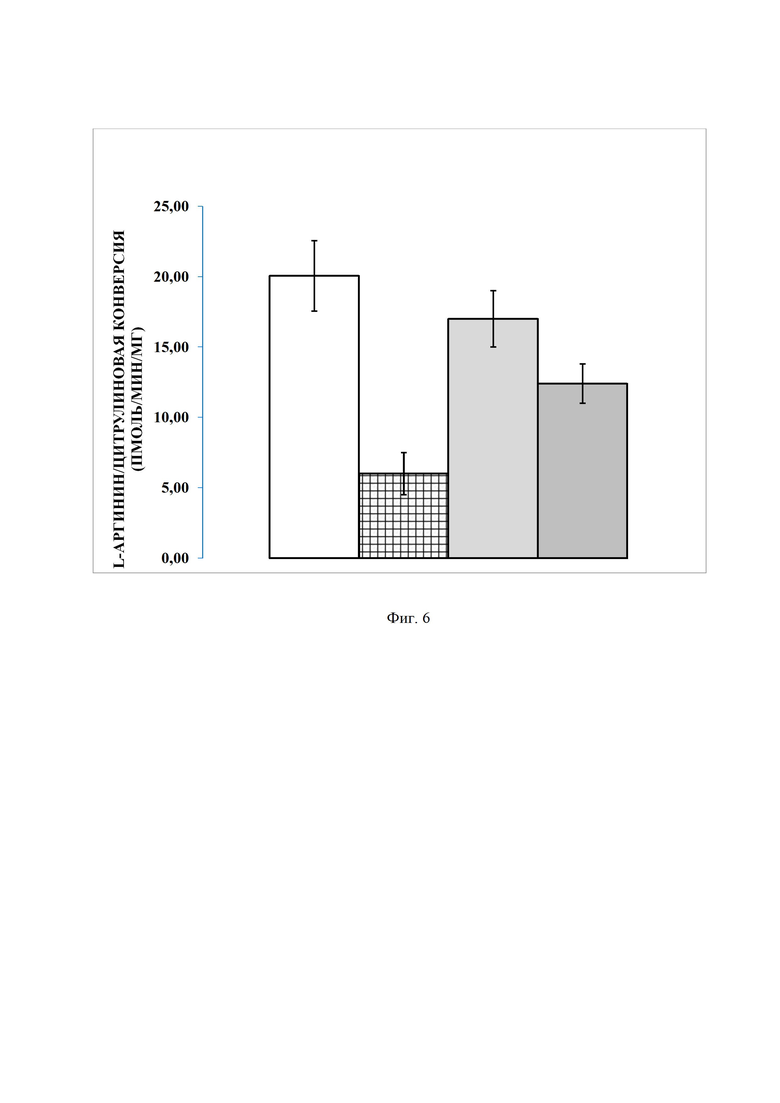
Фигура 5. Сравнение активности 9-фенил-симм-октагидроселеноксантена и препарата Импаза в отношении пикового ИКД в модели гиперлипидемии у крыс, где

Фигура 6. NO-синтазная активность гомогената пенильных тканей (L-аргинин/цитруллиновая конверсия в пмоль/мин/мг) в модели «пассивного курения» у крыс (сравнение 9-фенил-симм-октагидроселеноксантена и препарата Импаза), где

Осуществление изобретения.
Ниже приведены примеры осуществления изобретения в частных случаях выполнения.
Пример 1. Получение 9-фенил-симм-октагидроселеноксантена.
Для получения 9-фенил-симм-октагидроселеноксантена брали 12,5 г 9-(о-оксифенил)-октагидро-10-оксоксантена и помещали в трехгорлую колбу с магнитной мешалкой и с подводом газа. Затем добавляли 30 мл смеси уксусная кислота: уксусный ангидрид (4:1). При перемешивании реакционную смесь продували азотом в течение 30 минут, далее ток азота прекращали и пропускали в реакционную смесь селеноводород. Через 30 минут после начала пропускания селеноводорода в реакционную смесь с интервалом в 1 час дважды добавляли по 1,0 мл концентрированной соляной кислоты. Скорость пропускания селеноводорода составляла 2-3 пузырька в секунду. Общее время пропускания селеноводорода составляло 6 часов, по его окончанию реакционную смесь продували азотом в течение 40 минут. Далее реакционную смесь помещали в холодильник и через сутки выпавший осадок фильтровали, промывали уксусной кислотой и спиртом. Выход продукта составил 11,5 г.
Пример 2. Приготовление средства, содержащего 9-фенил-симм-октагидроселеноксантена.
Опытным путем было установлено, что наиболее предпочтительный (хотя и не ограничивающий объем притязаний в соответствии с настоящим изобретением) способ получения лекарственной формы (таблетки или капсулы) 9-фенил-симм-октагидроселеноксантена включает в себя:
Просеянный порошок целлюлозы микрокристаллической перемешивают в течение 2 мин, добавляют порошок 9-фенил-симм-октагидроселеноксантена и кальция карбоната, смесь тщательно перемешивают в течение 4 мин, затем добавляют порошок кальция стеарата и перемешивают в течение 3 мин, добавляют просеянные порошки талька и кремния диоксида и снова перемешивают в течение 2÷4 мин, таблетируют полученную смесь методом прямого прессования твердой лекарственной формы, или перемешанную смесь заключают в капсулы.
Состав лекарственной формы 9-фенил-симм-октагидроселеноксантен в виде таблеток
или
Состав лекарственной формы 9-фенил-симм-октагидроселеноксантена в виде капсул
или
Ниже приводим результаты экспериментов, подтверждающие эффективность 9-фенил-симм-октагидроселеноксантена в отношении эректильной функции. Исследования, приведенные в этих примерах, были спланированы и выполнены в соответствии с актуальными публикациями, затрагивающими разработку животных моделей изучения ЭД.
Важно отметить, что многие пациенты без верифицированного врачом диагноза и соответствующего обследования, самостоятельно принимают препараты безрецептурного отпуска, самым распространенным среди которых является препарат Импаза. Поэтому дополнительно были проведены исследования по сравнению эффективности 9-фенил-симм-октагидроселеноксантена и препарата Импаза, результаты которых освещаются в примерах 5 и 6.
Пример 3. Изучение фармакологической активности 9-фенил-симм-октагидроселеноксантена у крыс на модели перевязки внутренней подвздошной артерии.
Материалы и методы. Одной из наиболее распространенных причин эректильной дисфункции является артериальная недостаточность кавернозных тел. Атеросклероз или травматическая артериальная окклюзия за счет снижения притока крови и кровенаполнения пещеристых тел сказываются на выраженности эрекции. К таким сосудистым факторам риска причисляют гипертонию, гиперлипидемию, курение, сахарный диабет и облучение органов таза [5, 6, 7, 8]. Васкулогенная эректильная дисфункция – самый распространенный в клинической практике тип. За основу эксперимента была принята модель, описанная в работе [8].
В исследовании было задействовано 40 самцов крыс возраста 3 мес. весом 350-400 г. Животных вводили в наркоз внутрибрюшинной инъекцией 35 мг/кг пентобарбитала после предварительной ингаляции метоксифлураном. После срединной лапаротомии под микроскопом билатерально накладывали лигатуры на внутренние подвздошные артерии 40 крыс. Прочие (группа контроля, n=10) подверглись лишь ревизии. Дополнительный разрез в области голени обеспечивал установку катетера 23G для мониторинга интракавернозного давления (ИКД) во время электростимуляции кавернозного нерва. Дополнительные лигатуры накладывались для достижения отсутствия динамики (повышения) ИКД во время электростимуляции. Рану ушивали и состояние животных мониторировали через 1, 2 и 6 недель.
Для электростимуляции применяли биполярные платиновые электроды. Положительный электрод размещали на 2-3 мм проксимальнее отрицательного на нервном волокне, напряжение составляло 1,5 В, частота 20 Гц с длительностью импульса 0,2 мс и общей продолжительностью процедуры 50 с.
До начала эксперимента животных случайным образом распределяли на две группы: 1) контроль - только ревизия брюшной полости; 2) 9-фенил-симм-октагидроселеноксантен, 1 мг/кг*сут. Все препараты животные получали перорально (через внутрижелудочный зонд) в течение 6 недель, далее животных подвергали эвтаназии, а пенильные ткани изучали под микроскопом после иммуногистохимического окрашивания.
Из данных, представленных на таб. 1, видно, что 9-фенил-симм-октагидроселеноксантен показал преимущество перед плацебо в отношении восстановления ИКД.
Пример 4. Изучение влияния 9-фенил-симм-октагидроселеноксантена на ЭД в модели 2-недельного повреждения кавернозного нерва (КН). Поиск оптимальных дозировок.
Следующее исследование было выполнено с целью установить максимально эффективные дозировки. В качестве модели была выбрана модель повреждения кавернозного нерва у крыс, продемонстрировавшая свои преимущества в работе [9].
Исследуемые дозировки 9-фенил-симм-октагидроселеноксантена были следующими: 0,1; 0,5 и 1,0 и 10 мг/кг. Дополнительными когортами были группа контроля (без травматизации) и группа контроля с повреждением КН, получавшая плацебо.
Крысы 8-10 - недельного возраста общим количеством 120 особей были разделены на 6 когорт (n=20 в каждой), 10 особей в каждой когорте подвергали исследованию ИКД и последующей эвтаназии на 14-й день эксперимента, а другие 10 особей – на 30-й день эксперимента.
9-фенил-симм-октагидроселеноксантен вводили через внутрижелудочный зонд (пероральным путем) в виде предварительно измельченной фармацевтической композиции (Пример 2).
Фармакологическую активность соединений оценивали по следующим критериям: 1) отношение ИКД к среднему АД; 2) экспозиция ИКД и 3) доля фиброза.
Животных анестезировали кетамином/ксилазином (100+10 мг/кг), вводимых интраперитонеально. Доступ к простате осуществляли срединной лапаротомией. Кавернозный нерв и большой тазовый ганглий располагаются позади и латеральнее простаты. Билатеральная травматизация нерва выполнялась пинцетом Dumont №5, которым зажимали кавернозный нерв на 2-3 мм дистальнее большого тазового ганглия. Нерв зажимали пинцетом 3 раза длительностью 15 с каждый раз, в результате чего достигали стандартизации уровня травматизации. В группе контроля кавернозный нерв не подвергали травматизации, а рану просто ушивали. Через 14 и 30 дней после операции измеряли показатели эректильной функции и выполняли эвтаназию с последующим гистологическим исследованием. Артериальное давление измеряли с помощью катетера 25G, установленного в области голени и подключенного к гепаринизированной (250 Ед/мл) полиэтиленовой трубке, вводимой для измерения ИКД. Электростимулятор был установлен в области травмы на кавернозный нерв. Электроимпульсы производились с частотой 20 Гц длительностью 0,5 мс каждый общей длительностью 30 с. и напряжением 8 вольт.
Для нормирования на величину среднего артериального давления (АД) рассчитывали отношение между максимальным уровнем ИКД и средним АД, измеренными на пике эректильной реакции. Общая экспозиция ИКД вычислялась как площадь под эректильной кривой (AUC; мм рт. ст. × сек) от начала стимуляции кавернозного нерва до тех пор, пока ИКД не возвращалось к базовому уровню. Эректильную реакцию измеряли через 14 и 30 дней после травматизации кавернозного нерва. Также осуществляли мониторинг веса. Далее животных подвергали эвтаназии, а пенальные ткани извлекали для проведения гистологического исследования.
Интересно заметить, что увеличение дозировки 9-фенил-симм-октагидроселеноксантена до 10 мг/кг не улучшало показатели эффективности (отношение «ИКД/АД» и общая экспозиция ИКД), но даже, хоть и недостоверно статистически, уменьшало. При этом максимальная эффективность наблюдалась при дозировке 1 мг/кг (фиг. 2 и 3).
После билатеральной травмы кавернозного нерва наблюдалась индукция фиброза во всех группах. В то же время в группе, получавшей 9-фенил-симм-октагидроселеноксантен, была выявлена меньшая выраженность фибротического процесса. Область гладкомышечных волокон не изменялась после травмы. Соотношение коллагеновых и гладкомышечных элементов определяли визуально на поперечных срезах в окраске трихром по Массону. Отношение коллагеновых элементов к гладкомышечным оценивали как долю фиброза.
После травмы в течение 14 и 30 дней произошло значительное увеличение доли фиброза по сравнению с группой контроля. (р-величина <0,05). Однако фибротические изменения были обратимы, причем под действием 9-фенил-симм-октагидроселеноксантена значимо достоверно в дозировках 0,5 мг/кг и 1,0 мг/кг (фиг. 4).
Пример 5. Сравнение эффективности 9-фенил-симм-октагидроселеноксантена и препарата Импаза на модели ЭД, связанной с гиперлипидемией.
Гиперлипидемия ассоциируется с нарушением функции эндотелия и является довольно частой причиной ЭД. При этом риск развития ЭД прямо пропорционален уровню в крови холестерина и липопротеинов низкой плотности [10, 11]. Гиперлипидемия, проявляясь на клеточном уровне снижением продукции оксида азота (NO) и воздействуя как нейрогенный и васкулогенный фактор, может с успехом применяться для моделирования ЭД [12].
В исследовании задействовали 3-хмесячных белых крысах-самцов линии Wistar, всего 40 особей. Животных разделили на 4 группы: 1) контроль, получавший нормальную диету; 2) контроль, получавший диету с повышенным содержанием жиров, но не получавший терапии; 3) активный контроль, получавший препарат Импаза (в дозе 0,3 мг/кг*сут); 4) группа, получавшая 9-фенил-симм-октагидроселеноксантен в дозе 1мг/кг*сут. Сравниваемые препараты животные получали спустя 5 месяцев после откармливания в течение 28 дней (4-х недель).
9-фенил-симм-октагидроселеноксантен вводили один раз в сутки посредством внутрижелудочного зонда, препарат Импаза животные получали с водой: 1 таблетку 3 мг растворяли на 1000 мл воды, так что с учётом объема потребляемой жидкости 20±3 мл/животное*сут, каждое животное получало по 0,3 мг/кг действующего вещества препарата Импаза в сутки, что соответствует терапевтической дозе человека (≈3 мг).
Гиперлипидемия моделировалась с помощью диеты с высоким содержанием жиров, которую животные получали в течение 5 месяцев (диета включала 2% холестерина и 10% свиного жира). Далее одни животные получали 9-фенил-симм-октагидроселеноксантен (группа 4), другие препарата Импаза (группа 3), и наконец животные из группы № 2 не получали никакой терапии. Группа контроля № 1 получала нормальную диету в ходе всего эксперимента. Через 28 дней после получения исследуемых препаратов всех крыс вводили в наркоз интраперитонеальной инъекцией кетамина (100 мг/кг) и мидазолама (5 мг/кг). Выполняли нижнюю срединную лапаротомию и билатерально изолировали кавернозный нерв.
ИКД измеряли при электростимуляции длительностью 50 сек. Пенис освобождали от покрывающей кожи и кавернозный синус катетеризировали гипаринизированным катетером 25G для мониторинга ИКД. Кавернозные нервы стимулировали электроимпульсом длительностью 50 сек, частотой 20Гц и 1,5 мА. Отклик ИКД фиксировали с помощью программного обеспечения LabView 6.0.2 (США). Для анализа использовали максимальные (пиковые) величины. После выполнения функциональных тестов системное артериальное давление измеряли посредством катетеризации арты. Среднее артериальное давление рассчитывали по формуле среднее АД = (2/3 диастолическое АД + 1/3 систолическое АД). Далее получали образец крови для выполнения биохимического анализа крови на уровень тестостерона. Также выполняли определение содержания нейрональной NO-синтазы (nNOS) в дорсальном нерве иммуногистохимическим методом.
Было установлено, что гиперлипидемия в значительной степени снижает количество nNOS положительных волокон, причем прием как 9-фенил-симм-октагидроселеноксантена, так и препарата Импаза положительно сказывался, увеличивая их количество. Каких-либо отличий между препаратами при этом выявлено не было. Среднее артериальное давление между группами не различалось. Уровень тестостерона также оказался сопоставим в сравниваемых группах терапии и, кроме того, этот уровень значимо не отличался от групп контроля. Однако данные мониторинга ИКД продемонстрировали явное и статистически достоверное преимущество 9-фенил-симм-октагидроселеноксантена, по сравнению с препаратом Импаза (фиг. 5).
Пример 6. Сравнение эффективности 9-фенил-симм-октагидроселеноксантена и препарата Импаза на активность NO-синтазы в модели пассивной экспозиции сигаретного дыма (модель «пассивного курения»).
Для исследования за основу была использована модель, показавшая свою адекватность в работе [13]. Известно, что курение является фактором риска развития ЭД. Также установлено, что экспозиция сигаретного дыма повреждает NO-зависимый механизм эрекции, сокращая содержание синтазы оксида азота (NOS) в тканях пениса, причем эти изменения ассоциированы с изменениями системного артериального давления. Также в исследовании [13] было показано некоторое стимулирующее влияние экспозиции табачным дымом на ИКД, поэтому в нашем эксперименте было принято решение исследовать только активность NO-синтазы пенильных тканей, так как именно этот показатель будет отражать долгосрочное влияние курения на эректильную функцию. Активность NO-синтазы была определена оценкой аргинин-цитруллинового превращения и выражена в пмоль/мин на 1 мг протеинового цитозоля, для чего использовали [3Н]-меченый аргинин.
В исследование были включены 4 группы самцов крыс по 6 особей в каждой. Возраст всех животных составлял 5 мес. 1-я группа - нетронутый контроль (без воздействия табачного дыма), 2-я – контроль модели «пассивного курения» (животные подвергалиcь воздействию дыма), 3-я группа кроме того получала 9-фенил-симм-октагидроселеноксантен в дозе 1,0 мг/кг в течение 4 недель, а 4-я группа получала препарат Импаза в течение 4 недель в дозе 0,3 мг/кг.
Селеноксантен вводили один раз в сутки посредством внутрижелудочного зонда, препарат Импаза животные получали с водой: 1 таблетку 3 мг растворяли на 1000 мл воды, так что с учётом объема потребляемой жидкости 20±3 мл/животное*сут, каждое животное получало по 0,3 мг/кг действующего вещества препарата Импаза.
Для моделирования пассивного курения крысы содержались в пластиковых контейнерах размером 25 × 60 × 20 см, в которые постоянно поступал сигаретный дым. Экспозиция сигаретным дымом продолжалась в течение 1 часа ежедневно на протяжении 8 недель.
Ткани пениса гомогенизировали и препарировали в 0,32 M сахароза/20 мМ Hepes (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) pH 7,2/0,5 мМ ЭДТА/1 мМ DTT (дитиотреитол), а также ингибиторах протеаз (3 мкМ леупептин, 1 мМ PMSF (фенилметилсульфонилфторид), 1 мкМ пепстатин А). Микросомную фракцию выделяли центрифугированием при 12500 g в течение 60 мин. Далее фракцию фильтровали через среду Dowex AG5OWX-8 (Na+, Sigma Aldrich, США) для удаления эндогенного аргинина, и аликвоты (по 3 шт.) в дальнейшем инкубировали 45 мин при температуре 37°C в присутствии [3H]-меченого L-аргинина (2 мкКи/мл), 100 мкМ L-аргинина, 0,45 мМ Ca2+, 2 мМ НАДФН, в присутствии и отсутствии L-NAME (L-нитро-N- аргинин метиловый эфир) (2 мМ). После элиминации [3H]-меченого L-аргинина подсчитывали количество [3H]-меченого цитруллина, по которому определяли NO-синтазную активность. Все величины корректировались на уровень радиоактивности при инкубации холостых образцов.
Результаты показали, что экспозиция сигаретного дыма значимо снижает активность NO-синтазы пенильных тканей. Селеноксантен в большей степени, чем препарат Импаза, и статистически достоверно повышал ее активность (p-величина <0,05) (фиг. 6).
Заключение и выводы
В настоящем изобретении представлены результаты изучения эффективности 9-фенил-симм-октагидроселеноксантена для терапии ЭД, полученные на травматической (нейрогенной), сосудистой, метаболической моделях, а также в модели физического стресса – модели «пассивного курения». Таким образом, действие 9-фенил-симм-октагидроселеноксантена было изучено с учетом всех основных этиологических причина возникновения ЭД и учитывает все самые распространенные патофизиологические механизмы возникновения этого заболевания.
Возможно, что хорошая эффективность 9-фенил-симм-октагидроселеноксантена в терапии ЭД, показанная в вышеприведенных моделях связана с наличием у этого вещества антиоксидантных свойств. В то же время, с учетом многопланового действия производных селена в организме, нельзя исключить и наличие других, более специфичных для ЭД механизмов активности.
Известно, что ИФДЭ-5 показаны как препараты выбора при ЭД. Однако, эти рекомендации ограничены органической составляющей в этиологии заболевания. В прочих клинических случаях, при менее выраженной клинической симптоматике, в частности при психогенном компоненте ЭД (стресс, курение и т.д.) пациенты чаще всего принимают другие средства, например, препарат Импаза (гомеопатическое средство, афинно очищенные антитела к эндотелиальной NO-синтазе), лекарственные средства природного происхождения или симптоматические препараты. Для этой самой частой категории пациентов прием 9-фенил-симм-октагидроселеноксантена представляется более обоснованным, так как подразумевает отсутствие выраженных побочных эффектов.
Отличающийся от ИФД-5 механизм реализации активности 9-фенил-симм-октагидроселеноксантена, наличие у него антиоксидантных свойств могут объяснять более хорошие показатели ИКД.
Что касается эффективных в отношении ЭД дозировок 9-фенил-симм-октагидроселеноксантена, то хорошие результаты были получены для дозы 1,0 мг/кг у крыс, что соответствует суточной дозе человека около 10 мг/сут. Суточная доза может быть разделена на 2 приема. Поэтому для лечения ЭД целесообразно принять к рассмотрению лекарственные формы 9-фенил-симм-октагидроселеноксантена с дозировками 5 и 10 мг. В то же время известно, что терапевтически эффективные для человека дозы не всегда соответствуют эквивалентным дозам, полученным при перерасчете от животных моделей. Очевидно, что уточнение дозировок и режима дозирования при приеме пациентами с эректильной дисфункцией будет выполнено в ходе клинической разработки, по результатам которой содержание 9-фенил-симм-октагидроселеноксантена в составе средства может быть скорректировано.
Список литературы
[1] «Верткин А. Л. и др. Современные представления об эректильной дисфункции и новые методы ее лечения //Кардиоваскулярная терапия и профилактика. – 2018. – Т. 4. – №. 3, ч. II. – С. 101-112.».
[2] «Пушкарь Д. Ю. и др. Анализ результатов эпидемиологического исследования распространенности эректильной дисфункции в Российской Федерации //Урология. – 2012. – №. 6. – С. 5-9».
[3] «Wespes E. et al. Cексуальная дисфункция у мужчин: эректильная дисфункция и преждевременная эякуляция. Пер. Климова М.Н. / Европейская ассоциация урологов – 2011. – 51 с.».
[4] «Овчинников Р. И. Влияние фармакотерапии эректильной дисфункции на кавернозную электрическую активность и гемодинамику полового члена //Автореферат дисс. канд. мед. наук. - Москва. – 2008. – С. 26-27».
[5] «Goldstein, I., Feldman, M. I., Deckers, P. J. et al: Radiationassociated impotence. A clinical study of its mechanism.JAMA, 251: 903, 1984».
[6] «Rosen, M. P., Greenfield, A. J., Walker, T. G. et al: Arteriogenic impotence: findings in 195 impotent men examined with selective internal pudendal angiography. Radiology, 174: 1043, 1990».
[7] «Levine, F. J., Greenfield, A. J. and Goldstein, I.: Arteriographically determined occlusive disease within the hypogastriccavernous bed in impotent patients following blunt perineal and pelvic trauma. J Urol, 144: 1147, 1990».
[8] «Lee M. C. et al. The effect of vascular endothelial growth factor on a rat model of traumatic arteriogenic erectile dysfunction //The Journal of urology. – 2002. – Т. 167. – №. 2. – С. 761-767.».
[9] «Hannan J. L. et al. Valproic acid prevents penile fibrosis and erectile dysfunction in cavernous nerve-injured rats //The journal of sexual medicine. – 2014. – Т. 11. – №. 6. – С. 1442-1451.».
[10] «Huang Y. C. et al. The effect of intracavernous injection of adipose tissue-derived stem cells on hyperlipidemia-associated erectile dysfunction in a rat model //The journal of sexual medicine. – 2010. – Т. 7. – №. 4. – С. 1391-1400».
[11] «Virag R., Bouilly P., Frydman D. Is impotence an arterial disorder?: A study of arterial risk factors in 440 impotent men //The Lancet. – 1985. – Т. 325. – №. 8422. – С. 181-184.».
[12] «Gholami S. S. et al. The effect of vascular endothelial growth factor and adeno-associated virus mediated brain derived neurotrophic factor on neurogenic and vasculogenic erectile dysfunction induced by hyperlipidemia//The J.–2003.–Т.169.-№4.-С.1577-1581».
[13] «Xie Y. et al. Effect of long-term passive smoking on erectile function and penile nitric oxide synthase in the rat //The Journal of urology. – 1997. – Т. 157. – №. 3. – С. 1121-1126.».
[14] «Li H. et al. The effect of cavernous nerve traction on erectile function in rats //PloS one. – 2017. – Т. 12. – №. 10. – С. e0186077.».
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАЗВИТИЯ ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ У ПАЦИЕНТОВ ПОСЛЕ ТРАВМЫ УРЕТРЫ | 2006 |
|
RU2308271C1 |
| Применение фармацевтической композиции β-циклодекстрина с 9-фенил-2,3,4,5,6,7,8,9-октагидро-1Н-селеноксантеном для повышения/восстановления либидо | 2019 |
|
RU2782133C2 |
| АЛЬФА-КРИСТАЛЛИЧЕСКАЯ ФОРМА ЗАМЕЩЕННЫХ СЕЛЕНОКСАНТЕНОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2374238C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АНДРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2519226C1 |
| ПРИМЕНЕНИЕ НЕЙРЕГУЛИНА ДЛЯ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ | 2018 |
|
RU2715908C2 |
| ПРИМЕНЕНИЕ НЕЙРЕГУЛИНА ДЛЯ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ | 2010 |
|
RU2575570C2 |
| ПРИМЕНЕНИЕ НЕЙРЕГУЛИНА ДЛЯ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ | 2010 |
|
RU2657770C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ У ПАЦИЕНТОВ ПОСЛЕ РАДИКАЛЬНОЙ ПРОСТАТЭКТОМИИ | 2020 |
|
RU2744052C1 |
| Способ лечения эректильной дисфункции | 2016 |
|
RU2622757C1 |
| СПОСОБ ДИАГНОСТИКИ ВАСКУЛОГЕННОЙ ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ | 2006 |
|
RU2336820C2 |
Изобретение относится к области медицины и фармацевтики и представляет собой средство для лечения эректильной дисфункции, содержащее в качестве активного вещества 9-фенил-симм-октагидроселеноксантен в количестве 5-20 мас.% и вспомогательные вещества, причем средство может быть изготовлено в виде капсул или таблеток. Технический результат заключается в лечении эректильной дисфункции с помощью средства по изобретению, которое не проявляет побочные эффекты у пациентов с сопутствующими соматическими патологиями. 2 з.п. ф-лы, 6 ил., 1 табл., 6 пр.
1. Средство для лечения эректильной дисфункции, содержащее в своем составе в качестве активного вещества 9-фенил-симм-октагидроселеноксантен в количестве 5-20 мас.% и вспомогательные вещества.
2. Средство по п. 1, которое изготовлено в виде капсул или таблеток.
3. Средство по п. 2, отличающееся тем, что в качестве вспомогательных веществ используются для таблеток: МКЦ 65-77 мас.%, кальция карбонат 4-5 мас.%, кальция стеарат 1,5-2,5 мас.%, тальк 2,5-3,5 мас.%, кремния диоксид 4,5-5 мас.%;
для капсул: МКЦ 60-75 мас.%, кальция карбонат 3,5-4,5 мас.%, кальция стеарат 2-3 мас.%, тальк 3-3,5 мас.%, кремния диоксид 7,5-9 мас.%.
| КЛАТРАТНЫЙ КОМПЛЕКС ЦИКЛОДЕКСТРИНА ИЛИ АРАБИНОГАЛАКТАНА С 9-ФЕНИЛ-СИММ-ОКТАГИДРОСЕЛЕНОКСАНТЕНОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2451680C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ИНГИБИТОР ПРОТОННОЙ ПОМПЫ И АНТАЦИДЫ | 2002 |
|
RU2301662C2 |
| WO 2005097078 A1, 20.10.2005 | |||
| СРЕДСТВО ДЛЯ УЛУЧШЕНИЯ И/ИЛИ ВОССТАНОВЛЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ | 2009 |
|
RU2414215C1 |
| SIMON H | |||
| et al | |||
| Simultaneous electrochemical oxidation/ionization of a selenoxanthene revealed by on-line electrospray-high resolution mass spectrometry // Electrochimica Acta | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| - V | |||
| Говорящий кинематограф | 1920 |
|
SU111A1 |
| - P | |||
| Телефонный аппарат, отзывающийся только на входящие токи | 1921 |
|
SU324A1 |
| BADIELLO R | |||
| et al | |||
Авторы
Даты
2020-07-22—Публикация
2019-09-09—Подача