ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к производному пирроло-пиридинового соединения, способу его получения, а также в качестве активного ингредиента фармацевтической композиции для применения при профилактике или лечении заболеваний, связанных с протеинкиназой.
2. Описание предшествующего уровня техники
Протеинкиназа представляет собой фермент, который катализирует реакцию переноса концевой фосфатной группы аденозинтрифосфата (АТФ) в специфический остаток белка (тирозин, серин, треонин) и участвует в сигналах, которые регулируют активацию, рост и дифференцировку клеток в соответствии с внеклеточными медиаторами и изменениями окружающих условий.
Несоответственно высокая активность протеинкиназы прямо или косвенно связана с различными заболеваниями, возникающими в результате нарушения клеточных функций. Например, мутация, избыточная экспрессия или сбой соответствующего регуляторного механизма киназ, вовлеченных в несоответствующую активность фермента, или избыточный синтез или дефицит факторов, вовлеченных в трансдукцию восходящего или нисходящего сигнала цитокинов или киназ, могут вызывать заболевание. Следовательно, избирательное ингибирование киназной активности может быть полезной мишенью для разработки новых лекарственных средств для лечения заболевания.
Рак головного мозга является общим термином для первичного рака головного мозга, который возникает в ткани головного мозга и мозговых оболочек, окружающих мозг, и вторичного рака головного мозга, который метастазировал из черепа или других частей тела. Такой рак мозга во многих аспектах отличается от других видов рака, развившихся в других органах. Сначала раковые заболевания, развивающиеся в легких, желудке и молочной железе, ограничены одним или двумя типами рака для каждого органа, и их свойства одинаковы или сходны. Тем не менее, в мозге может развиться много различных видов рака. Например, в мозге могут развиваться полиморфная глиобластома, злокачественная глиома, лимфома, бластома и метастатическая опухоль.
Синдром Дауна представляет собой заболевание, вызванное хромосомной аберрацией, а именно трисомией человеческой хромосомы 21, для которой характерны такие симптомы, как умственная отсталость, нарушение способности к обучению и потеря памяти, раннее начало болезни Альцгеймера и черепно-лицевое расстройство. В частности, считается, что синдром Дауна вызывают изменения в уровнях экспрессии таких генов, которые существуют в определенной области хромосомы 21 человека, называемой «критическая область DSCR синдрома Дауна». DYRK1A (двойная специфичность тирозин-фосфорилирования-регулируемая киназа-1А) представляет собой ген, играющий важную роль в развитии и функционировании нервного центра, а также участвующий в фосфорилировании различных белков. Этот ген, в частности, связан с такими симптомами, как нарушение способности к обучению, потеря памяти, изменение синаптической пластичности, аномальный клеточный цикл и нейропатологические симптомы, сходные с деменцией Альцгеймера. Таким образом, для раскрытия патогенеза заболеваний, связанных с синдромом Дауна, и для разработки терапевтических средств для нейродефектов, связанных с синдромом Дауна, необходимо понимать биохимические, функциональные и молекулярно-биологические эффекты этого белка.
Синдром Дауна является наиболее частым синдромом хромосомной аномалии, который диагностируется у одного из 700 новорожденных. Синдром Дауна возникает независимо от расовых, экологических и социально-экономических различий. Заболеваемость является выше, когда возраст матери старше 35 лет. Если возраст матери старше 40 лет, частота составляет 1 случай на 100 новорожденных. В современной медицине нет способа предотвратить такую генетическую аномалию. Можно только до рождения с помощью генетического тестирования определить, есть ли у плода синдром Дауна.
Пациенты с синдромом Дауна проявляют следующие общие физические особенности. Симптомы появляются во всем организме, что приводит к задержке поведенческого развития из-за снижения функции мозга у детей с синдромом Дауна. 30-40% пациентов с синдромом Дауна рождаются с врожденными пороками сердца, такими как аномалии сердечного клапана, и имеют высокую частоту пневмонии, лейкемии, непроходимости кишечника и энтерита из-за снижения иммунитета. Большинство симптомов можно лечить или предотвращать благодаря развитию медицинской техники, так что средняя продолжительность жизни пациентов с синдромом Дауна увеличивается до 50 лет.
Однако до сих пор не было получено никаких многообещающих результатов в отношении разработки терапевтического средства для лечения депрессии черепно-мозговой нервной системы и нейродегенеративных симптомов, и известно, что пирацетам, который улучшает когнитивные способности, не эффективен у детей с синдромом Дауна (Lobaugh, N. J. et al. (2001). «Piracetam therapy does not enhance cognitive functioning in children with Down syndrome». Arch Pediatr Adolesc Med 155: 442-448). Поэтому настоятельно необходимо разработать новое терапевтическое средство на базе раскрытия механизма основных причин нарушений мозговой нервной системы у пациентов с синдромом Дауна.
В то же время болезнь Альцгеймера (AD) является прогрессирующим заболеванием, которое прогрессирует до старческого слабоумия. Это заболевание можно разделить на позднюю стадию развития у людей старшего возраста (старше 65 лет) и раннюю стадию развития у людей в возрасте от 35 до 60 лет. Патологический аспект между этими двумя типами заболеваний, описанных выше является одинаковым, но, когда заболевание начинается рано, симптомы становятся более серьезными и более превалирующими.
Все разработанные медицинские препараты, включая те, которые находятся в процессе изучения и разработки, могут задерживать развитие болезни Альцгеймера или ориентированы на облегчение симптомов болезни Альцгеймера. В последние два десятилетия были разработаны препараты, которые могут улучшить когнитивные способности, особенно у пациентов на ранних и промежуточных стадиях заболевания, и в настоящее время эти препараты используются в качестве основных лекарств для лечения пациентов с болезнью Альцгеймера.
В частности, ингибиторы ацетилхолинэстеразы (AchEI) и антагонист рецептора N-метил-D-аспартата (NMDA) являются примерами таких лекарств для лечения AD, которые все еще нацелены на ослабление симптомов заболевания, а не на путь распространения заболевания.
Такрин является ингибитором ацетилхолинэстеразы первого поколения (AchEl), который был впервые одобрен для его действия против слабоумия. Известно, что такрин может задерживать потерю когнитивной функции примерно у 30% пациентов с болезнью Альцгеймера на ранних и промежуточных стадиях путем ингибирования разложения ацетилхолина, образующегося в мозге. Несмотря на то, что, как известно, такрин задерживает потерю когнитивной функции за счет ингибирования разложения ацетилхолина, продолжительность его действия короткая, поэтому его необходимо вводить по меньшей мере 4 раза в день. Кроме того, он не может предотвратить дегенеративные изменения клеток головного мозга, что является основной проблемой болезни Альцгеймера, и, что еще хуже, он вызывает много побочных эффектов, связанных с печенью, так что в наши дни его практически не используют.
Донепезил, как ингибитор холинэстеразы второго поколения (ChEl), привлекающий внимание в настоящее время, был разработан Eisai Co., Япония, и одобрен FDA, США, в конце 1996 года, и, таким образом, с 1997 года продается более чем в 30 странах. Донепезил можно принимать один раз в день, и он способен ингибировать избирательно, чтобы уменьшить периферические побочные эффекты. Ривастигмин представляет собой препарат, разработанный Novartis Co., США, и одобренный в декабре 1997 года в Швейцарии и используемый в странах ЕС и Южной Америки. Этот препарат готовится к утверждению в США и Канаде, а в Корее был введен в сентябре 1997 года. Ривастигмин можно принимать два раза в день, и он значительно снижает периферические побочные эффекты из-за его высокой специфичности к центральной нервной системе. Сообщается, что ривастигмин обладает небольшой гепатотоксичностью, поскольку он метаболизируется в почках. Метрифонат проходит фазу 3 клинических испытаний у пациентов с деменцией и, как сообщается, имеет длительный период действия в качестве необратимого AChEI.
Патологические характеристики болезни Альцгеймера включают амилоидную бляшку, вызванную отложением амилоид-бета-пептида (Aβ), и нейрофибриллярный клубок, образованный гиперфосфорилированием белка Tau, который функционирует для стабилизации микротрубочек.
Бляшки образуются в результате чрезмерного накопления бета-амилоида из-за перепроизводства или метаболических нарушений у пациентов с болезнью Альцгеймера. Потеря нейронов может быть вызвана токсичностью бета-амилоида и бляшки, что приводит к когнитивным нарушениям и ухудшению памяти.
В ходе разработки ингибитора экспрессии DYRK1A, который является причиной различных заболеваний, включая злокачественное новообразование, синдром Дауна, диабет, болезнь Альцгеймера и деменцию, авторы настоящего изобретения подтвердили, что производное пирроло-пиридинового соединения по настоящему изобретению способно эффективно ингибировать экспрессию DYRK1A, что и привело к созданию настоящего изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является новое производное пирроло-пиридинового соединения.
Другой целью настоящего изобретения является способ получения производного пирроло-пиридинового соединения.
Другой целью настоящего изобретения является фармацевтическая композиция для профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Еще одной целью настоящего изобретения является пищевая функциональная оздоровительная композиция для профилактики или облегчения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
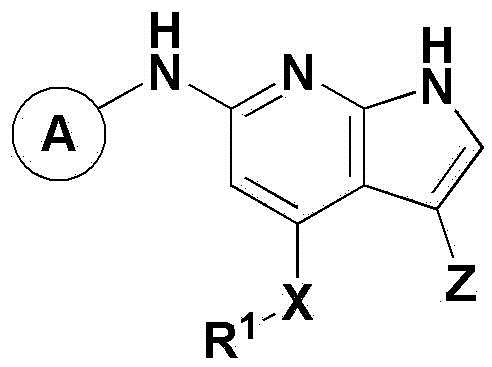
Для достижения вышеуказанных целей в настоящем изобретении предложено соединение, представленное химической формулой 1 ниже, его оптический изомер или его фармацевтически приемлемая соль:
[Химическая формула 1]

В химической формуле 1,  , R1, X и Z имеют значения, определенные в данном описании.
, R1, X и Z имеют значения, определенные в данном описании.
Настоящее изобретение относится также к способу получения соединения, представленного химической формулой 1, включающему следующие стадии, как показано на схеме реакции 1 ниже:
получение соединения, представленного химической формулой 4, путем взаимодействия соединения, представленного химической формулой 2, с соединением, представленным химической формулой 3 (стадия 1); и
получение соединения, представленного химической формулой 1, путем взаимодействия соединения, представленного химической формулой 4, полученного на стадии 1 выше, в присутствии кислоты (стадия 2):
[Схема реакции 1]
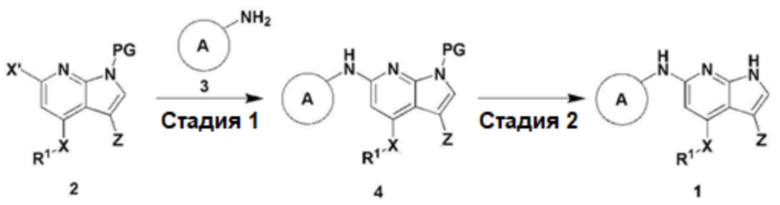
На схеме реакции 1  , R1, X, X', Z и PG имеют значения, определенные в данном описании.
, R1, X, X', Z и PG имеют значения, определенные в данном описании.
Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента для профилактики или лечения заболевания, связанного с протеинкиназой.
Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента для профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Настоящее изобретение относится также к пищевой функциональной оздоровительной композиции, содержащей соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента для профилактики или облегчения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Настоящее изобретение относится также к способу профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания, который включает стадию введения нуждающемуся в этом субъекту фармацевтической композиции или пищевой функциональной оздоровительной композиции, содержащей в качестве активного ингредиента соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение относится к применению фармацевтической композиции или пищевой функциональной оздоровительной композиции, содержащей в качестве активного ингредиента соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль, для профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
ПОЛОЖИТЕЛЬНЫЙ ЭФФЕКТ
Соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемая соль в соответствии с настоящим изобретением обладают превосходной активностью ингибирования различных протеинкиназ, включая DYRK1A, так что фармацевтическая композиция, содержащая его в качестве активного ингредиента, может быть эффективно использована для профилактики или лечения заболеваний, связанных с протеинкиназой. В частности, оно может быть эффективно использовано для профилактики, лечения или ослабления болезни Альцгеймера, деменции или деменции Альцгеймера.
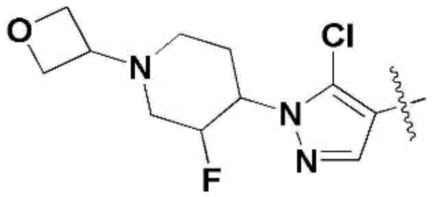
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1а представлен график, иллюстрирующий люциферазную активность DYRK1A, на которую влияют соединения по примерам 53, 54, 55, 56 и 57.
На фигуре 1b представлен график, иллюстрирующий люциферазную активность DYRK1A, на которую влияют соединения по примерам 58, 59, 60, 61, 62, 63, 64, 65, 66, 67 и 68.
На фигуре 2а представлена фотография, иллюстрирующая результаты экспериментов по ингибированию Tau, hnRNPA1 и GAPDH в клетках для каждой концентрации соединения по примеру 57.
На фигуре 2b представлен график, иллюстрирующий степень ингибирования Tau в клетках для каждой концентрации соединения по примеру 57.
На фигуре 3а представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы дикого типа.
На фигуре 3b представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы со сверхэкспрессирующей minibrain аномалией развития нервной системы.
На фигуре 3с представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы со сверхэкспрессирующей minibrain аномалией развития нервной системы, рожденного родителями, которых перед спариванием в течение 7 дней обрабатывали соединением по примеру 57.
На фигуре 4а представлена фотография крыльев контрольной группы и дрозофилы, сверхэкспрессирующей minibrain, в частности, в крыльях.
На фигуре 4b представлен график, иллюстрирующий ингибирующее действие соединений по примерам 58, 59, 60, 61, 62, 63, 64, 65, 66 и 67 по настоящему изобретению на венозную аномалию развития крыльев.
На фигуре 5а представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием контрольной группы.
На фигуре 5b представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием мыши, получавшей гармин.
На фигуре 5с представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием мыши, обработанной соединением по примеру 57.
На фигуре 5d представлен график, иллюстрирующий количество клеток каждой модели мыши.
На фигуре 6 представлены результаты оценки активности соединения по ингибированию Tau-фосфорилирования в экспериментальной модели болезни Альцгеймера. ФИГ. 6а: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), AT180: изображение, полученное с помощью иммуногистохимии с использованием антитела AT180, слияние: изображение, полученное путем наложения изображений DAPI и AT180; укрупнение: изображение, полученное путем увеличения изображения AT180), ФИГ. 6b: график, иллюстрирующий иммунореактивность AT180 в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 6с: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), AT180: изображение, полученное с помощью иммуногистохимии с использованием антитела AT180, укрупнение (CA1): увеличенное изображение CA1 (cornus aminus, область, где начинается гиппокамп и формируется долговременная память) гиппокампа изображения AT180, укрупнение (DG): увеличенное изображение DG (зубчатая извилина, область, где заканчивается гиппокамп и формируется новая память) изображения гиппокампа AT180, ФИГ. 6d: график, иллюстрирующий иммунореактивность AT180 в CA1 (cornus aminus), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 6e: график, иллюстрирующий иммунореактивность AT180 в DG (зубчатая извилина), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера.
На фигуре 7 представлены изменения белка DYRK1A с помощью соединения по настоящему изобретению в экспериментальной модели болезни Альцгеймера. ФИГ. 7а: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), DYRK1A: изображение, полученное с помощью иммуногистохимии с использованием белка DYRK1A, слияние: изображение, полученное путем наложения изображений DAPI и DYRK1A, укрупнение: изображение, полученное путем увеличения изображения DYRK1A), ФИГ. 7b: график, иллюстрирующий иммунореактивность DYRK1A в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 7с: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), DYRK1A: изображение, полученное методом иммуногистохимии с использованием белка DYRK1A, укрупнение (CA1): увеличенное изображение CA1 (cornus aminus, область, где начинается гиппокамп и формируется долговременная память) гиппокампа изображения DYRK1A, укрупнение (DG): увеличенное изображение DG (зубчатая извилина, область, в которой заканчивается гиппокамп и формируется новая память) изображения гиппокампа DYRK1A, ФИГ. 7d: график, иллюстрирующий иммунореактивность DYRK1A в СА1 (cornus aminus), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 7e: график, иллюстрирующий иммунореактивность DYRK1A в DG (зубчатая извилина), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера .
На фигуре 8 представлены изменения амилоидной бляшки с помощью соединения по примеру 57, в экспериментальной модели болезни Альцгеймера. ФИГ. 8а: иммунофлуоресцентное окрашивание, конфокальная флуоресцентная микрофотография коры головного мозга и гиппокампа, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашивание DAPI (4',6-диамидино-2)-фенилиндол), 4G8: изображение, полученное с помощью иммуногистохимии с использованием антитела 4G8, слияние: изображение, полученное путем наложения изображений DAPI и 4G8), ФИГ. 8b: график, иллюстрирующий изменения числа амилоидных бляшек 4G8 в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 8с: график, иллюстрирующий изменения в количестве амилоидной бляшки 4G8 в СА1 (cornus aminus), обработанной носителем (необработанная группа) или соединением по примера 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 8d: график, иллюстрирующий изменения количества амилоидной бляшки 4G8 в DG (зубчатая извилина), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера
На фигуре 9 представлены результаты оценки краткосрочного эффекта улучшения когнитивных функций с помощью поведенческих тестов. ФИГ. 9a: схематическая диаграмма Y-образного лабиринта для измерения кратковременной памяти мозга, ФИГ. 9b: график, иллюстрирующий поведенческие изменения мыши, протестированной с Y-образного лабиринта
На фигуре 10 представлены результаты оценки долгосрочного эффекта улучшения когнитивных функций с помощью поведенческих тестов. ФИГ. 10a: схематическая диаграмма теста распознавания нового объекта для измерения долговременной памяти мозга и уравнение для вычисления предпочтения нового объекта, ФИГ. 10b: график, иллюстрирующий предпочтение объекта у тестируемой мыши, оцененное с помощью теста распознавания нового объекта, ФИГ. 10c: график, иллюстрирующий предпочтение нового объекта у исследуемой мыши, оцененное с помощью теста распознавания нового объекта
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее настоящее изобретение описано подробно.
Настоящее изобретение относится к соединению, представленному химической формулой 1 ниже, его оптическому изомеру или его фармацевтически приемлемой соли:
[Химическая формула 1]
 .
.
В химической формуле 1,
Z представляет собой циано (-CN); или прямой или разветвленный C1-C3 алкил, замещенный одним или несколькими атомами галогена;
X представляет собой -NRa-, -O- или -S-, где Ra представляет собой водород или прямой или разветвленный C1-C10 алкил, где алкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей -OH и C1-C3 алкокси;
R1 представляет собой прямой или разветвленный C1-C10 алкил, C3-C8 циклоалкил или C6-14 арил, где алкил или циклоалкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей -OH и прямой или разветвленный C1-C3 алкил и C1-C3 алкокси, и арил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей прямой или разветвленный C1-C3 алкил и прямой или разветвленный C1-C3 алкокси, незамещенный или замещенный одним или несколькими атомами галогена;
или Ra, вместе с R1 и атомом азота, к которому они присоединены, может образовывать незамещенный или замещенный 5-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N, O и S, и замещенный гетероциклоалкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей прямой или разветвленный C1-C6 алкил и прямой или разветвленный C1-C6 алкокси; и
 представляет собой
представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,
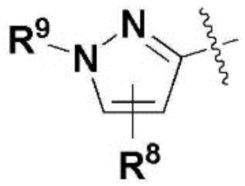
где каждый R2, R4, R6, R8, R11, R17, R23 и R24 представляют собой, независимо, один или несколько заместителей, выбранных из группы, включающей водород, галоген, прямой или разветвленный C1-C6 алкил и прямой или разветвленный C1-C6 алкокси;
R3, R5, R7 и R9 представляют собой, независимо, водород; прямой или разветвленный C1-C6 алкил или алкокси; 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O; или -(C=O)NR26R27, где R26 и R27 представляют собой, независимо, водород, прямой или разветвленный C1-C3 алкил или 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O, замещенный 3-5 членным гетероциклоалкилом, содержащим один или несколько атомов кислорода, или R26 и R27, вместе с атомом азота, к которому они присоединены, образуют 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O, где алкил или гетероциклоалкил замещен одним или несколькими заместителями, выбранными из группы, включающей -CN, галоген, прямой или разветвленный C1-C3 алкил, и 3-6 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O, незамещенный или замещенный одним или несколькими прямыми или разветвленными C1-C3 алкилами,
R10 представляет собой -CR28R29-CN, где R28 и R29 представляют собой, независимо, водород или прямой или разветвленный C1-C3 алкил,
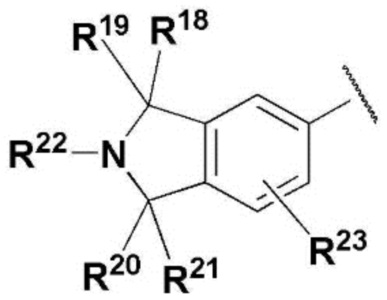
R12, R13, R14, R15, R18, R19, R20 и R21 представляют собой, независимо, водород или прямой или разветвленный C1-C3 алкил, или два из R12, R13, R14, R15, R18, R19, R20 и R21, присоединенные к одному и тому же атому углерода, могут образовывать карбонил вместе с атомом углерода, к которому они присоединены, и
R16, R22 и R25 представляют собой, независимо, водород или прямой или разветвленный C1-C3 алкил, где алкил может быть замещен одним или несколькими атомами галогена.
Кроме того, Z представляет собой -CN или метил, замещенный одним или несколькими атомами галогена;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или прямой или разветвленный C1-C6 алкил, где алкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей -OH и C1-C3 алкокси;
R1 представляет собой прямой или разветвленный C1-C6 алкил, C3-C8 циклоалкил или C6-10 арил, где алкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей –OH, метил и метокси, и арил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей метил и метокси, незамещенный или замещенный одним или несколькими атомами галогена;
или Ra, вместе с R1 и атомом азота, к которому они присоединены, может образовывать незамещенный или замещенный 5-6 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N, O и S, и замещенный гетероциклоалкил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей прямой или разветвленный C1-C3 алкил и прямой или разветвленный C1-C3 алкокси; и
 представляет собой
представляет собой  ,
,  ,
, ,
,  ,
,  ,
,  ,
,  или
или  ,
,
где, R2, R4, R6, R8, R11, R17, R23 и R24 представляют собой, независимо, один или несколько заместителей, выбранных из группы, включающей водород, галоген, прямой или разветвленный C1-C3 алкил и прямой или разветвленный C1-C3 алкокси;
R3, R5, R7 и R9 представляют собой, независимо, водород, прямой или разветвленный C1-C3 алкил или алкокси; морфолинил, пиперазинил, пиперидинил или -(C=O)NR26R27,
где R26 и R27 представляют собой, независимо, водород, метил, морфолинил, пиперазинил или пиперидинил, или R26 и R27, вместе с атомом азота, к которому они присоединены, образуют морфолинил, пиперазинил или пиперидинил, где C1-C3 алкил, морфолинил, пиперазинил или пиперидинил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей -CN, фтор, оксетанил, морфолинил, пиперазинил и незамещенный или замещенный метилом пиперидинил,
R10 представляет собой -CR28R29-CN, где R28 и R29 представляют собой, независимо, водород, метил или этил,
R12, R13, R14, R15, R18, R19, R20 и R21 представляют собой, независимо, водород, метил или этил, или два из R12, R13, R14, R15, R18, R19, R20 и R21, присоединенные к одному и тому же атому углерода, могут образовывать карбонил вместе с атомом углерода, к которому они присоединены, и
R16, R22 и R25 представляют собой, независимо, водород или метил, незамещенный или замещенный одним или несколькими атомами галогена, или этил, незамещенный или замещенный одним или несколькими атомами галогена.
При этом Z представляет собой -CN или -CF3;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или метил;
R1 представляет собой метил, этил, н-пропил, изопропил, циклопропил,  ,
,  , 1-метилциклопропил, тетрагидропиранил, тетрагидрофуранил или фенил, замещенный одним или несколькими CF3;
, 1-метилциклопропил, тетрагидропиранил, тетрагидрофуранил или фенил, замещенный одним или несколькими CF3;
или Ra, вместе с R1 и атомом азота, к которому они присоединены, может образовывать морфолинил; и
 представляет собой
представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,
где, R2, R4, R6, R8, R11, R17, R23 и R24 представляют собой, независимо, один или несколько заместителей, выбранных из группы, включающей водород, хлор, фтор, метил и метокси;
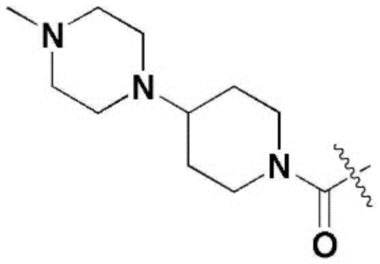
R3 и R7 независимо представляют собой метокси, 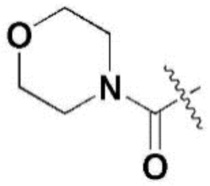 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или 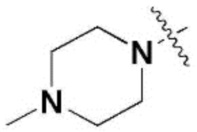 ,
,
R5 и R9 независимо представляют собой метил, изопропил, 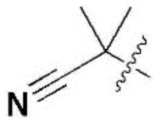 или
или  ,
,
R10 представляет собой -CR28R29-CN, где R28 и R29 представляют собой, независимо, водород или метил,
R12, R13, R14, R15, R18, R19, R20 и R21 представляют собой, независимо, водород или метил, или два из R12, R13, R14, R15, R18, R19, R20 и R21, присоединенные к одному и тому же атому углерода, могут образовывать карбонил вместе с атомом углерода, к которому они присоединены, и
R16, R22 и R25 представляют собой, независимо, водород, или метил, незамещенный или замещенный одним или несколькими атомами галогена.
При этом Z представляет собой -CN или -CF3;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или метил;
R1 представляет собой метил, этил, н-пропил, изопропил, циклопропил, 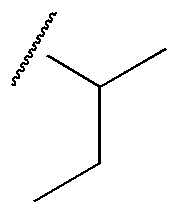 ,
, 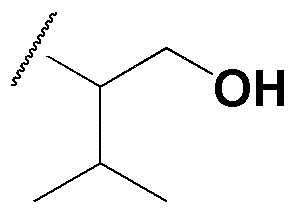 , 1-метилциклопропил, тетрагидропиран-4-ил или тетрагидрофуран-3-ил, или
, 1-метилциклопропил, тетрагидропиран-4-ил или тетрагидрофуран-3-ил, или  ;
;
или Ra, вместе с R1 и атомом азота, к которому они присоединены. может образовывать морфолинил; и
 представляет собой
представляет собой  ,
, 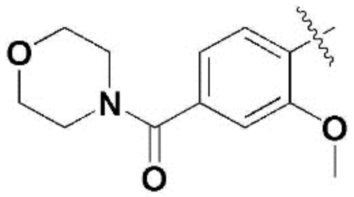 ,
, 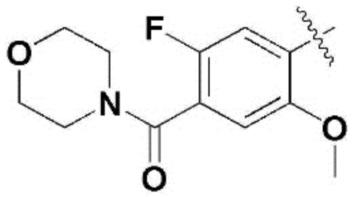 ,
, 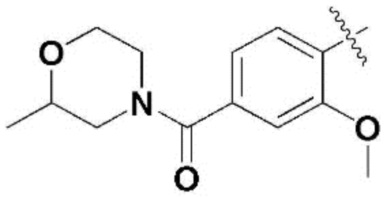 ,
,  ,
,  ,
, 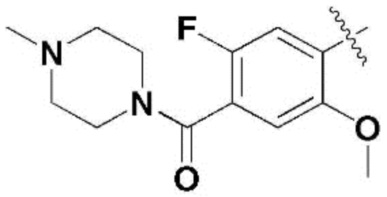 ,
, 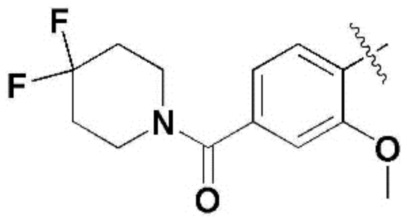 ,
, 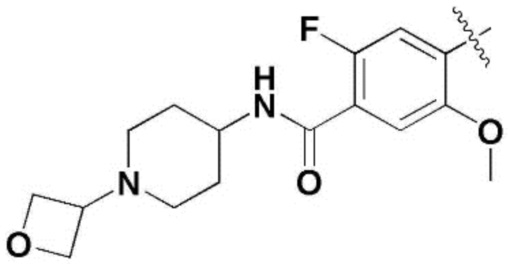 ,
,  ,
,  ,
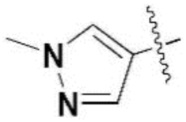
,  ,
,  ,
,  ,
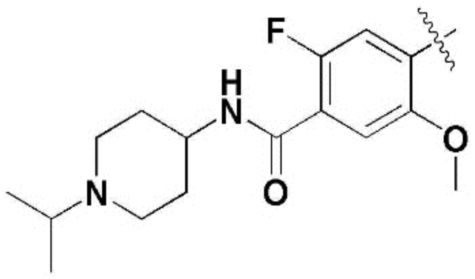
,  ,
, 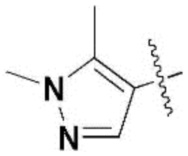 ,
,  ,
,  ,
, 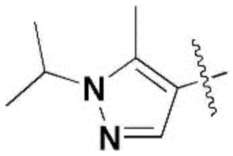 ,
,  ,
,  ,
,  ,
, 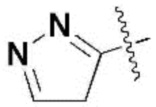 ,
,  ,
, 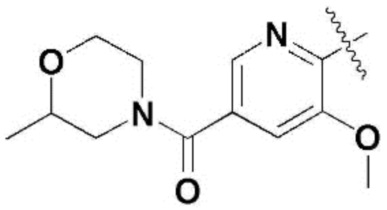 ,
,  ,
, 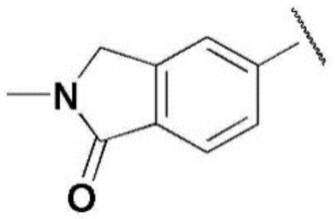 ,
,  ,
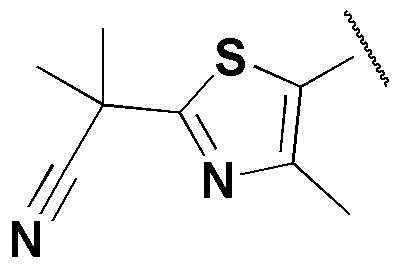
,  ,
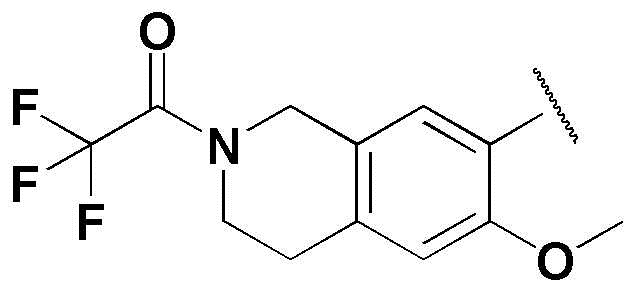
,  ,
,  ,
,  ,
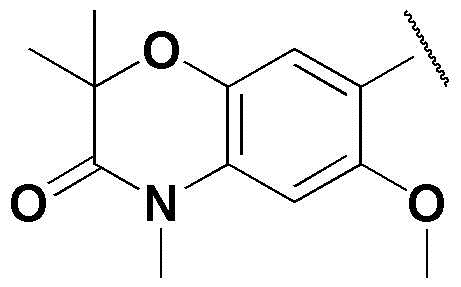
,  или
или  .
.
Далее, соединение, представленное химической формулой 1 выше, может быть любым, выбранным из группы, состоящей из следующих соединений.
(1) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (2) 4-(этиламино)-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (3) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-((2-метоксиэтил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (4) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (5) 4-((2-метоксиэтил)амино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (6) 4-((2-метоксиэтил)амино)-6-((1-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (7) 4-((2-метоксиэтил)амино)-6-((1-метил-1H-пиразол-3-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (8) 4-(этиламино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (9) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (10) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (11) 4-(пропиламино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (12) 6-((1-метил-1H-пиразол-4-ил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (13) 6-((1-метил-1H-пиразол-3-ил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (14) 4-(этиламино)-6-((1-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (15) 4-(этиламино)-6-((1-метил-1H-пиразол-3-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (16) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (17) 6-((5-фтор-2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (18) 4-(этиламино)-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (19) 6-((5-фтор-2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (20) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)(метил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (21) 6-((5-фтор-2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)(метил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (22) (R)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (23) (S)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (24) 6-((4-((2R,6S)-2,6-диметилморфолин-4-карбонил)-2-метоксифенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (25) 6-((4-(4,4-дифторпиперидин-1-карбонил)-2-метоксифенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (26) (R)-4-(этиламино)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (27) (S)-4-(этиламино)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (28) 6-((4-((2R,6S)-2,6-диметилморфолин-4-карбонил)-2-метоксифенил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (29) 6-((4-(4,4-дифторпиперидин-1-карбонил)-2-метоксифенил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (30) 6-((1,3-диметил-1H-пиразол-4-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (31) 6-((1,5-диметил-1H-пиразол-4-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (32) 4-(этиламино)-6-((1-изопропил-3-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (33) 4-(этиламино)-6-((1-изопропил-5-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (34) 6-((1,5-диметил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (35) 6-((1,3-диметил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (36) 6-((1-изопропил-3-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (37) 6-((1-изопропил-5-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (38) 6-((1-(2-цианопропан-2-ил)-3-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (39) 6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (40) 4-(этиламино)-6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (41) 6-((5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)амино)(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (42) 6-((5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)амино)(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (43) (R)-4-(этиламино)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (44) (R)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (45) 3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (46) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (47) 4-метокси-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (48) 4-метокси-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (49) 4-этокси-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (50) 4-этокси-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (51) (R)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-4-(1-метилциклопропокси)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (52) 6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-4-(1-метилциклопропокси)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (53) N4-этил-3-(трифторметил)-N6-(3,4,5-триметоксифенил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (54) N4-этил-N6-(1-метил-1H-пиразол-3-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (55) N4-этил-N6-(1-метил-1H-пиразол-4-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (56) (4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(морфолино)метанон; (57) (4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (58) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(морфолино)метанон; (59) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-морфолинопиперидин-1-ил)метанон; (60) (2-фтор-5-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (61) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (62) N6-(2-метокси-4-(4-метилпиперазин-1-ил)фенил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (63) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (64) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6yl)амино)фенил)(морфолино)метанон; (65) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-морфолинопиперидин-1-ил)метанон; (66) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)-метанон; (67) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (68) N6-(2-метокси-4-(4-метилпиперазин-1-ил)фенил)-N4-(2-метоксиэтил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (69) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-N4-этил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (70) (4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (71) 4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-5метокси-N-(1-(оксетанeпиперидин-4-ил)бензамид; (72) 4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-5-метокси-N-(1-метилпиперидин-4-ил)бензиламид; (73) 2-фтор-5-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)(1-метилпиперидин-4-ил)бензамид; (74) 4-((4-(этиламино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-N-(1-изопропилпиперидин-4-ил)-5-метоксибензамид; (75) (R)-(2,4-диметилпиперазин-1-ил) (2-фтор-5-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил) метанон; (76) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил) (морфолино) метанон; (77) N-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-амин; (78) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (79) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-3-метоксиэтил)-3-(трифторметил)-1H-пирроло [2,3-b]пиридин-4,6-диамин; (80) 1-(6-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-7-метокси-3,4-дигидроизохинолин-2(1H)-ил)-2,2,2-трифторэтан-1-он; (81) N4-этил-N6-(7-метокси-1,2,3,4-тетрагидроизохинолин-6-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (82) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (83) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (84) (3-метокси-4-(3-(трифторметил)-4-(3-(трифторметил)фениламино)-1H-пирроло[2,3-b]пиридин-6-иламино)фенил) (морфолино)метанон; (85) (3-метокси-4-(3-(трифторметил)-4-(3-(трифторметил)фениламино)-1H-пирроло[2,3-b]пиридин-6-иламино)фенил)(4-морфолинопиперидин-1-ил)метанон; (86) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-3-(трифторметил)-N4-(3-(трифторметил)фенил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (87) (3-метокси-4-((4-метоксиэтил) (метил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(морфолино)метанон; (88) (3-метокси-4-((4-метоксиэтил)(метил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)((4-морфолинопиперидин-1-ил) метанон; (89) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил) метоксиэтил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (90) (4-(4-(изопропиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-иламино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (91) (R)-(4-((4-((1-гидрокси-3-метилбутан-2-ил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (92) (R)-(4-((4-((1-hydroxy-3-метилбутан-2-ил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]амино)-3-метоксифенил)(морфолино)метанон; (93) (S)-(4-((4-(2-бутиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)-метанон; (94) (4-((4-(циклопропиламино)-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-6-ил)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (95) (4-((4-(циклопропиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(морфолино) метанон; (96) 5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-6-метокси-2-метилизоиндолин-1-он; (97) 7-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-6-метокси-2,2,4-триметил-2H-бензо[1,4]оксазин-3(4H)-1-он; (98) 6-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-5-метокси-2-метилизоиндолин-1-он; (99) 4-(этиламино)-6-((6-метокси-2-метил-3-оксоизоиндол-5-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (100) 6-((2(2-цианопропан-2-ил)-4-метилтиазол-5-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (101) (6-хлор-5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-метилизоиндолин-1-он; (102) 5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-метилизоиндолин-1-он; (103) 4-(этиламино)-6-((2-метил-1-оксоизоиндол-5-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (104) 6-((6-хлор-2-метил-1-оксоизоиндолин-5-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; и (105) 4-(этиламино)-6-((6-метокси-2,2,4-триметил-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-7-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил.
Соединение, представленное химической формулой 1 по настоящему изобретению, может быть использовано в виде фармацевтически приемлемой соли, в которой соль предпочтительно представляет собой соль добавления кислоты, образованную фармацевтически приемлемыми свободными кислотами. Соль добавления кислоты по настоящему документу может быть получена из неорганических кислот, таких как хлористоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, азотистая кислота и фосфористая кислота; нетоксичных органических кислот, таких как алифатические моно/дикарбоксилаты, фенилзамещенные алканоаты, гидроксиалканоаты, алкандиоаты, ароматические кислоты и алифатические/ароматические сульфоновые кислоты; или органических кислот, таких как уксусная кислота, бензойная кислота, лимонная кислота, молочная кислота, малеиновая кислота, глюконовая кислота, метансульфоновая кислота, 4-толуолсульфоновая кислота, винная кислота и фумаровая кислота. Примером фармацевтически нетоксичных солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, фторид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутилат, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, cabacate, фумарат, малат, бутин-1,4-диоат, гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутилат, цитрат, лактат, гидроксибутилат, гликолят, малат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат.
Соль добавления кислоты по данному изобретению может быть получена обычным способом, известным специалистам в данной области. Например, производное, представленное химической формулой 1, растворяют в органическом растворителе, таком как метанол, этанол, ацетон, дихлорметан и ацетонитрил, к которому добавляют органическую кислоту или неорганическую кислоту, чтобы вызвать образование осадка. Затем осадок отфильтровывают и сушат, получая соль. Либо растворитель и избыток кислоты перегоняют при пониженном давлении и сушат, получая соль. Либо, чтобы получить соль, осадок кристаллизуют в органическом растворителе.
Фармацевтически приемлемая соль металла может быть получена с использованием основания. Соль щелочного металла или щелочноземельного металла получают следующими способами: растворение соединения в избыточном растворе гидроксида щелочного металла или гидроксида щелочноземельного металла; фильтрование нерастворимой соли соединения; выпаривание оставшегося раствора и его сушка. На данном этапе соль металла предпочтительно получают в фармацевтически подходящей форме соли натрия, калия или кальция. И соответствующую соль серебра получают взаимодействием соли щелочного металла или щелочноземельного металла с подходящей солью серебра (например, нитратом серебра).
Соединение, представленное химической формулой 1 в соответствии с настоящим изобретением, его оптический изомер или его фармацевтически приемлемая соль превосходно ингибируют активность киназы DYRK1A, и было также подтверждено, что оно обладает превосходной ингибирующей активность киназы DYRK1A на клеточном уровне посредством эксперимента по активации сигнального пути кальциенурин/NFAT с высокой зависимостью от DYRK1A. Кроме того, соединение по настоящему изобретению превосходно ингибирует фосфорилирование Tau, известного как важный фактор синдрома Дауна, и ингибирует DYRK1A in vivo, что подтверждается экспериментами in vivo. Следовательно, соединение, представленное химической формулой 1 в соответствии с настоящим изобретением, его оптический изомер или его фармацевтически приемлемая соль могут быть эффективно использованы для лечения или профилактики заболевания, связанного с DYRK1A (см. экспериментальные примеры 1-5).
Соединение, представленное химической формулой 1 согласно настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладает активностью ингибирования не только киназу DYRK1A, но также других киназ, таких как ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), РСК3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK или YSK4, так что его так же можно эффективно использовать для лечения связанного с ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), РСК3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK или YSK4 заболевания (см. экспериментальный пример 6).
Соединение, представленное химической формулой 1 по настоящему изобретению, проявляет эффект ослабления болезни Альцгеймера, так что его можно эффективно использовать для лечения деменции при болезни Альцгеймера (см. экспериментальные примеры 7-9).
Соединение, представленное химической формулой 1 по настоящему изобретению, может положительно сказаться на кратковременном снижении когнитивных функций, вызванном болезнью Альцгеймера, так что его можно эффективно использовать для лечения деменции при болезни Альцгеймера (см. экспериментальный пример 10).
Соединение, представленное химической формулой 1 по настоящему изобретению, может также положительно сказаться на долговременном снижении когнитивных функций, вызванном болезнью Альцгеймера, так что его можно эффективно использовать для лечения деменции при болезни Альцгеймера (см. экспериментальный пример 11).
Кроме того, настоящее изобретение относится к способу получения соединения, представленного химической формулой 1, включающий следующие стадии, как показано на схеме реакции 1 ниже:
получение соединения, представленного химической формулой 4, путем взаимодействия соединения, представленного химической формулой 2, с соединением, представленным химической формулой 3 (стадия 1); и
получение соединения, представленного химической формулой 1, путем взаимодействия соединения, представленного химической формулой 4, полученного на стадии 1 выше, в присутствии кислоты (стадия 2):
[Схема реакции 1]

На схеме реакции 1, X, Z, R1 и  имеют значения, определенные для химической формулы 1 выше;
имеют значения, определенные для химической формулы 1 выше;
X' представляет собой галоген; и
PG представляет собой (2-(триметилсилил)метокси)метил (SEM), трет-бутилоксикарбонил (BOC), карбобензилокси (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), ацетил (Ac), бензоил (Bz), бензил (Bn), 3,4-диметоксибензил (DMPM), п-метоксифенил (PMP), тозил (Ts), 2,2,2-трихлорэтоксикарбонил (Troc), 2-триметилсилилэтоксикарбонил (Teoc), арилоксикарбонил (Alloc) или п-метоксибензил (PMB).
Далее способ получения согласно настоящему изобретению описан более подробно.
В способе получения по настоящему изобретению стадия 1 заключается в получении соединения, представленного химической формулой 4, путем взаимодействия соединения, представленного формулой 2, с соединением, представленным химической формулой 3.
В качестве предпочтительного примера стадии 1 соединение, представленное химической формулой 2, и соединение, представленное химической формулой 3, растворяют в растворителе в присутствии основания, а затем газ удаляют ультразвуковой обработкой. При 100яяяС к приготовленной реакционной смеси добавляют палладиевый катализатор и Xphos с последующим взаимодействием в течение 2 часов.
На данном этапе основание по настоящему документу может быть выбрано из группы, состоящей из таких неорганических оснований, как карбонат цезия, трет-бутоксид натрия, трет-бутоксид калия, гидроксид натрия, карбонат натрия, карбонат калия и гидрид натрия; и таких органических оснований, как N,N-диаизопропилэтиламин (DIPEA), 1,8-диазабицикло[5.4.0]-7-ундецен (DBU), пиридин и триэтиламин. Выбранное основание может быть использовано в эквивалентном количестве или избыточном количестве, отдельно или в комбинации. Согласно настоящему документу предпочтительно использовать карбонат калия.
Примером палладиевого катализатора могут служить трис(дибензилиденацетон)палладий (Pd2(dba)3), тетракис(трифенилфосфин)палладий (Pd(Ph3P)4), палладий на угле (Pd-C), бис(трифенилфосфин)палладий дихлорид (PdCl2(PPh3)2), [1,1-бис(дифенилфосфино)ферроцен]дихлорпалладий (PdCl2(dppf)), димер хлорида аллилпалладия ([PdCl(аллил)]2), ацетат палладия (Pd(OAc)2) и хлорид палладия (PdCl2), из которых предпочтительным является трис(дибензилиденацетон) палладий (PdCl2(PPh3)2).
Примерами используемых в настоящем документе реакционных растворителей являются толуол, диметилацетамид (ДМА), диметилформамид (ДМФА), диметилсульфоксид (ДМСО), метиленхлорид, дихлорэтан, вода, этилацетат, ацетонитрил; низшие спирты, включая изопропанол, метанол, этанол, пропанол и бутанол; и эфирные растворители, включая тетрагидрофуран (ТГФ), диоксан, этиловый эфир и 1,2-диметоксиэтан, которые можно использовать независимо или вместе, и в настоящем документе втор-бутанол является более предпочтительным.
После взаимодействия реакционную смесь можно отфильтровать через фильтрующую мембрану и промыть органическим растворителем. Твердое соединение 4, полученное после концентрирования фильтрата, можно использовать на следующей стадии без дополнительной очистки.
На данной стадии примером реакционного растворителя является толуол, диметилацетамид (ДМА), диметилформамид (ДМФА), диметилсульфоксид (ДМСО), метиленхлорид, дихлорэтан, вода, этилацетат, ацетонитрил; низшие спирты, включая изопропанол, метанол, этанол, пропанол и бутанол; и эфирные растворители, включая тетрагидрофуран (ТГФ), диоксан, этиловый эфир и 1,2-диметоксиэтан, которые можно использовать независимо или вместе, и в настоящем документе EtOAc (этилацетат) и MeOH (метанол) являются более предпочтительными.
Следующая стадия (стадия 2) заключается в получении соединения, представленного химической формулой 1, путем взаимодействия соединения, представленного химической формулой 4, полученного на стадии 1 выше, в присутствии кислоты.
В качестве предпочтительного примера стадии 2 соединение, представленное химической формулой 3, растворяли в дихлорметане, к которому при комнатной температуре добавляли ТФУ (трифторуксусную кислоту). Через 4 часа реакции растворитель удаляли. Затем концентрированную смесь снова растворяли в органическом растворителе. К ней добавляли основание при комнатной температуре с последующим взаимодействием в течение 14 часов.
На данной стадии в настоящем документе основание может быть выбрано из группы, состоящей из таких неорганических оснований, как карбонат цезия, трет-бутоксид натрия, трет-бутоксид калия, гидроксид натрия, карбонат натрия, карбонат калия и гидрид натрия; и таких органических оснований, как N,N-диаизопропилэтиламин (DIPEA), 1,8-диазабицикло[5.4.0]-7-ундецен (DBU), пиридин и триэтиламин. Выбранное основание может быть использовано в эквивалентном количестве или избыточном количестве, отдельно или в комбинации. Согласно настоящему документу предпочтительно использовать карбонат калия.
По завершении реакции продукт реакции разбавляли EtOAc (этилацетатом) с последующим поэтапным промыванием водой и солевым раствором. Органический слой сушили над MgSO4 (сульфат магния). Затем реакционную смесь очищали путем препаративной ВЭЖХ и в результате получали соединение 1 в виде твердого продукта.
Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента, для профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Соединение, представленное химической формулой 1 выше, может ингибировать активность протеинкиназы.
На данном этапе протеинкиназа может представлять собой ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), RSK3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK или YSK4.
Дегенеративное заболевание головного мозга в данном случае может представлять собой болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, болезнь Лу Герига, деменцию, болезнь Хантингтона, рассеянный склероз, проксимальный латеральный склероз, апоплексию, инсульт или умеренное когнитивное нарушение.
Упомянутая деменция может представлять собой деменцию Альцгеймера, цереброваскулярную деменцию, деменцию, вызванную травмой головы, мультиинфарктную деменцию, деменцию Альцгеймера/мультиинфарктную деменцию или алкогольную деменцию.
Метаболическое заболевание в настоящем документе может представлять собой диабет, гипогликемию, гиперхолестеринемию, гиперлипидемию, гемохроматоз, амилоидоз или порфирию.
Злокачественное новообразование может представлять собой рак головного мозга, опухоль головного мозга, доброкачественную астроцитому, злокачественную астроцитому, аденому гипофиза, менингиому, лимфому головного мозга, олигодендроглиому, внутричерепную карциному, эпендимому, опухоль ствола мозга, опухоль головы и шеи, рак гортани, рак ротоглотки, рак полости носа/околоносовых пазух, рак носоглотки, рак слюнной железы, гипофарингеальный рак, рак щитовидной железы, рак ротовой полости, опухоль грудной клетки, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак вилочковой железы, опухоль средостения, рак пищевода, рак молочной железы, рак молочной железы у мужчины, опухоль брюшной полости, рак желудка, рак печени, рак желчного пузыря, рак желчных путей, рак поджелудочной железы, рак тонкой кишки, рак толстой кишки, рак прямой кишки, рак анального канала, рак мочевого пузыря, рак почки, опухоль половых органов у мужчин, рак полового члена, рак предстательной железы, опухоль женских половых органов, рак шейки матки, рак эндометрия, рак яичников, саркому матки, рак влагалища, рак наружных половых клеток у женщин, рак уретры у женщин или рак кожи. Дегенеративное заболевание головного мозга может представлять собой болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, болезнь Лу Герига, деменцию, болезнь Хантингтона, рассеянный склероз, проксимальный латеральный склероз, апоплексию, инсульт или умеренное когнитивное нарушение. Кроме того, в настоящем документе метаболическое заболевание может представлять собой диабет, гипогликемию, гиперхолестеринемию, гиперлипидемию, гемохроматоз, амилоидоз или порфирию.
Соединение, представленное химической формулой 1, или его фармацевтически приемлемая соль, включенные в фармацевтическую композицию по настоящему изобретению, можно вводить перорально или парентерально и использовать в виде обычных форм фармацевтической композиции. То есть композиция по настоящему изобретению может быть получена для перорального или парентерального введения путем смешивания с обычно используемыми разбавителями или вспомогательными веществами, такими как наполнители, добавки, связующие вещества, смачивающие агенты, разрыхлители и поверхностно-активные вещества.
Примерами составов для перорального введения являются таблетки, пилюли, твердые/мягкие капсулы, растворы, суспензии, эмульсии, сиропы, гранулы, эликсиры и пастилки и т. д. Эти составы в дополнение к активному ингредиенту могут включать разбавители (например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин) и смазывающие вещества (например, кремнезем, тальк, стеарат и его соль магния или кальция и/или полиэтиленгликоль). Таблетки могут включать связующие агенты, такие как силикат магния и алюминия, крахмальная паста, желатин, метилцеллюлоза, натрий-карбоксиметилцеллюлоза и/или поливинилпирролидон, и, при необходимости, в них могут быть дополнительно включены разрыхляющие агенты, такие как крахмал, агароза, альгиновая кислота или ее натриевая соль или азеотропные смеси и/или абсорбенты, красители, ароматизаторы и подсластители.
Фармацевтическая композиция, содержащая соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента, может вводиться парентерально, и парентеральное введение включает подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию или внутригрудную инъекцию.
Для получения соединения, представленного химической формулой 1, или его фармацевтически приемлемой соли в качестве препарата для парентерального введения соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль смешивают со стабилизатором или буферным агентом в воде для получения раствора или суспензии, которые затем представляют в виде ампул или флаконов. В настоящем документе композиция может быть стерилизована и дополнительно содержать консерванты, стабилизаторы, смачивающиеся порошки или эмульгаторы, соли и/или буферы для регулирования осмотического давления и другие терапевтически полезные материалы, и композиция может быть составлена путем обычного смешивания, гранулирования или нанесения покрытия.
Эффективная дозировка фармацевтической композиции, содержащей соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента, может быть определена в соответствии с возрастом, весом, полом, способом введения, состоянием здоровья и тяжестью заболевания. Дозировка обычно составляет 0,1-1000 мг/день и, предпочтительно, 1-500 мг/день в расчете на взрослого пациента весом 70 кг, которую можно вводить один или несколько раз в день с интервалами в определенное время в зависимости от оценки врача или фармацевта.
Фармацевтическую композицию, содержащую соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента, можно вводить отдельно или одновременно с хирургической операцией, гормональной терапией, химиотерапией и биологическими регуляторами для предотвращения и лечения заболевания, связанного с DYRK1A.
В экспериментальных примерах 1 и 2 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходной активностью в отношении ингибирования киназы DYRK1A. Кроме того, в экспериментальном примере 3было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходной активностью в отношении ингибирования фосфорилирования DYRK1A на клеточном уровне. В экспериментальном примере 4 было также подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль, превосходно ингибируют фосфорилирование Tau, важного фактора синдрома Дауна. Кроме того, в экспериментальном примере 5 также было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают эффектом ингибирования активности киназы DYRK1A in vivo.
В экспериментальном примере 7 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходной активностью в отношении ингибирования фосфорилирования Tau в экспериментальной модели болезни Альцгеймера. В экспериментальном примере 8 также было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль превосходно ингибируют активность белка DYRK1A. В экспериментальном примере 9 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль уменьшают амилоидную бляшку, одну из причин болезни Альцгеймера. В экспериментальном примере 10 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль положительно сказываются на кратковременном снижении когнитивных функций, вызванном болезнью Альцгеймера, а в экспериментальном примере 11 также было подтверждено положительное влияние на длительное снижение когнитивных функций, вызванное болезнью Альцгеймера.
Следовательно, фармацевтическую композицию и пищевую функциональную оздоровительную композицию, содержащую соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемую соль, можно эффективно использовать для лечения или профилактики заболевания, связанного с DYRK1A. В частности, они могут эффективно использоваться для профилактики, лечения или ослабления болезни Альцгеймера, деменции или деменции Альцгеймера.
Настоящее изобретение относится также к пищевой функциональной оздоровительной композиции, содержащей соединение, представленное химической формулой 1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента, для профилактики или облегчения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Соединение, представленное химической формулой 1 выше, может ингибировать активность протеинкиназы.
На данном этапе протеинкиназа может представлять собой ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), RSK3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK или YSK4.
Дегенеративное заболевание головного мозга в настоящем документе может представлять собой болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, болезнь Лу Герига, деменцию, болезнь Хантингтона, рассеянный склероз, проксимальный латеральный склероз, апоплексию, инсульт или умеренное когнитивное нарушение.
Упомянутая деменция может представлять собой деменцию Альцгеймера, цереброваскулярную деменцию, деменцию, вызванную травмой головы, мультиинфарктную деменцию, деменцию Альцгеймера/мультиинфарктную или алкогольную деменцию.
Метаболическое заболевание в настоящем документе может представлять собой диабет, гипогликемию, гиперхолестеринемию, гиперлипидемию, гемохроматоз, амилоидоз или порфирию.
Злокачественное новообразование может представлять собой рак головного мозга, опухоль головного мозга, доброкачественную астроцитому, злокачественную астроцитому, аденому гипофиза, менингиому, лимфому головного мозга, олигодендроглиому, внутричерепную карциному, эпендимому, опухоль ствола мозга, опухоль головы и шеи, рак гортани, рак ротоглотки, рак полости носа/околоносовых пазух, рак носоглотки, рак слюнной железы, гипофарингеальный рак, рак щитовидной железы, рак ротовой полости, опухоль грудной клетки, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак вилочковой железы, опухоль средостения, рак пищевода, рак молочной железы, рак молочной железы у мужчины, опухоль брюшной полости, рак желудка, рак печени, рак желчного пузыря, рак желчных путей, рак поджелудочной железы, рак тонкой кишки, рак толстой кишки, рак прямой кишки, рак анального канала, рак мочевого пузыря, рак почки, опухоль половых органов у мужчин, рак полового члена, рак предстательной железы, опухоль женских половых органов, рак шейки матки, рак эндометрия, рак яичников, саркому матки, рак влагалища, рак наружных половых клеток у женщин, рак уретры у женщин или рак кожи. Дегенеративное заболевание головного мозга в данном случае может представлять собой болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, болезнь Лу Герига, деменцию, болезнь Хантингтона, рассеянный склероз, проксимальный латеральный склероз, апоплексию, инсульт или умеренное когнитивное нарушение. Кроме того, метаболическое заболевание в настоящем документе может представлять собой диабет, гипогликемию, гиперхолестеринемию, гиперлипидемию, гемохроматоз, амилоидоз или порфирию.
Соединение, представленное химической формулой 1 по настоящему изобретению, может быть использовано в качестве пищевой добавки. В этом случае соединение, представленное химической формулой 1 по настоящему изобретению, может быть добавлено в том виде, как оно есть, или в смеси с другими пищевыми компонентами в соответствии с общепринятым способом. Соотношение смешивания активных ингредиентов можно регулировать в зависимости от цели использования (профилактика или облегчение). Как правило, соединение по настоящему изобретению предпочтительно добавляют к пище или напиткам в количестве от 0,1 до 90 массовых частей от общей массы пищи или напитков. Однако, если для здоровья и гигиены или регулирования состояния здоровья требуется длительное введение, его содержание может быть ниже, чем указанное выше, но также может быть приемлемым и более высокое содержание, поскольку было доказано, что соединение по настоящему изобретению является весьма безопасным.
Композиция оздоровительного напитка по настоящему изобретению может дополнительно включать различные ароматизаторы или натуральные углеводы и т. д., а также и другие напитки. Указанные выше природные углеводы могут представлять собой один из моносахаридов, таких как глюкоза и фруктоза; дисахаридов, таких как мальтоза и сахароза; полисахаридов, таких как декстрин и циклодекстрин, и сахарных спиртов, таких как ксилитол, сорбит и эритрит. Кроме того, в качестве подсластителя могут быть включены натуральные подсластители (тауматин, экстракт стевии, например, ребаудиозид А, глицирризин и т. д.) и синтетические подсластители (сахарин, аспартам и т. д.). Содержание природного углевода предпочтительно составляет 1~20 г и, более предпочтительно, 5~12 г в 100 г композиции по изобретению.
Помимо ингредиентов, упомянутых выше, соединение, представленное химической формулой 1 по настоящему изобретению, может дополнено различными питательными веществами, витаминами, минералами (электролитами), ароматизаторами, включая натуральные ароматизаторы и синтетические ароматизаторы, красителями и наполнителями (сыр, шоколад и т. д.), пектиновой кислотой и ее солями, альгиновой кислотой и ее солями, органической кислотой, защитными коллоидными загустителями, регуляторами рН, стабилизаторами, антисептиками, глицерином, спиртами, карбонаторами, которые раньше добавляли в соду, и т. д. Соединение, представленное химической формулой 1 по настоящему изобретению, может также включать натуральные фруктовые соки, фруктовые напитки и фруктовую мякоть, добавляемые к овощным напиткам.
Настоящее изобретение относится также к способу профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания, который включает стадию введения нуждающемуся в этом субъекту фармацевтической композиции или пищевой функциональной оздоровительной композиции, содержащей соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к применению фармацевтической композиции или пищевой функциональной оздоровительной композиции, содержащей соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль в качестве активного ингредиента, для профилактики или лечения заболевания, выбранного из группы, включающей злокачественное новообразование, дегенеративные заболевания головного мозга и метаболические заболевания.
Практические и в настоящее время предпочтительные варианты настоящего изобретения являются иллюстративными, как показано в следующих примерах.
Однако следует понимать, что при рассмотрении этого изобретения специалисты в данной области могут вносить модификации и улучшения согласно духу и объему настоящего изобретения.
<Пример получения 1-1> Получение 6-хлор-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил получали способом, показанным на схеме реакции 2 ниже.
[Схема реакции 2]
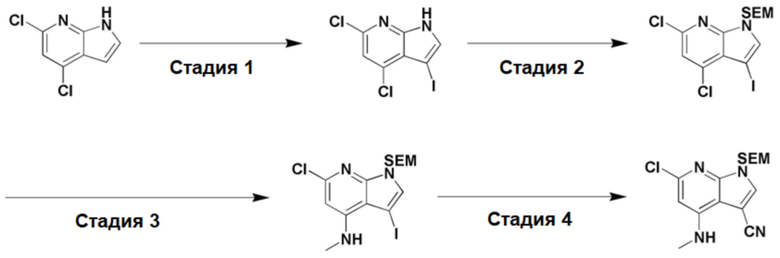
Стадия 1: 4,6-Дихлор-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ, затем понижали температуру до -10яяяC. В смесь добавляли N-йодсукцинимид (1,1 экв.), затем повышали температуру до комнатной. Смесь перемешивали в течение 1 часа. После завершения реакции добавляли ледяную воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали, и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 2: 4,6-Дихлор-3-йод-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ (0,5 M), затем понижали температуру до -78яяяC. В вышеуказанную смесь добавляли NaH (1,5 экв.), затем перемешивали в течение 5 минут. После завершения реакции при температуре -78яяяC добавляли SEM-Cl (1,2 экв.). Потом температуру реакционной смеси повышали до комнатной, затем перемешивали в течение 1 часа. В вышеуказанную реакционную смесь добавляли ледяную воду, после чего органические продукты экстрагировали с помощью EtOAc (×3). Собранный органический слой промывали насыщенным солевым раствором и от остатков воды сушили над MgSO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 3: 4,6-Дихлор-3-йод-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в EtOH, при комнатной температуре добавляли метиламин (5,0 экв., 35 масс% в этаноле), затем перемешивали при температуре 100яяяC в течение 14 часов. После завершения реакции добавляли воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали и в результате получали целевое соединение (выход: 86%).
Стадия 4: 6-Хлор-3-йод-N-метил-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амин (1,0 экв.) растворяли в ДМФ (0,2 M), в атмосфере азота постепенно добавляли Pd(PPh3)4 (0,15 экв.) и Zn(CN)2 (2,0 экв.), затем температуру повышали до 80яяяC. После взаимодействия в течение 14 часов реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc. Органический слой промывали постепенно насыщ. NaHCO3 и насыщенным солевым раствором, и от остатков воды сушили над MgSO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде вещества желтого цвета, (6-хлор-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил) (выход: 57%).
<Пример получения 1-2> Получение 6-хлор-4-(этиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-(этиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 1-1> (выход: 56%).

<Пример получения 1-3> Получение 6-хлор-4-(пропиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-(пропиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 1-1> (выход: 67%).

<Пример получения 1-4> Получение 6-хлор-4-(2-метоксиэтиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-(2-метоксиэтиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 1-1> (выход: 67%).

<Пример получения 1-5> Получение 6-хлор-4-((2-метоксиэтил)(метил)амино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-((2-метоксиэтил)(метил)амино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 1-1> (выход: 67%).
<Пример получения 2-1> Получение 6-хлор-4-метокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-метокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил получали способом, показанным на схеме реакции 3 ниже.
[Схема реакции 3]

Стадия 1: 4,6-Дихлор-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ, затем понижали температуру до -10яяяC. В смесь добавляли N-йодсукцинимид (1,1 экв.), затем повышали температуру до комнатной. Смесь перемешивали в течение 1 часа. После завершения реакции добавляли ледяную воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 2: 4,6-Дихлор-3-йод-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ (0,5 M), затем понижали температуру до -78яяяC. В вышеуказанную смесь добавляли NaH (1,5 экв.), затем перемешивали в течение 5 минут. После завершения реакции при температуре -78яяяC добавляли SEM-Cl (1,2 экв.). Потом температуру реакционной смеси повышали до комнатной, затем перемешивали в течение 1 часа. В вышеуказанную реакционную смесь добавляли ледяную воду, после чего органические продукты экстрагировали с помощью EtOAc (×3). Собранный органический слой промывали насыщенным солевым раствором и от остатков воды сушили над MgSO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 3: 4,6-Дихлор-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в метаноле (0,1 M), при комнатной температуре добавляли Na фрагменты. Температуру смеси повышали до 90яяяC, и затем кипятили с обратным холодильником в течение 14 часов. После завершения реакции температуру реакционной смеси понижали до комнатной и добавляли воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали, и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 80%).
Стадия 4: 6-Хлор-3-йод-4-метокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ (0,2 M) при комнатной температуре, в атмосфере азота постепенно добавляли Pd(PPh3)4 (0,15 экв.) и Zn(CN)2 (2,0 экв.), затем температуру повышали до 80яяяC. После взаимодействия в течение 14 часов реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc. Органический слой постепенно промывали насыщ. NaHCO3 и насыщенным солевым раствором, и от остатков воды сушили над MgSO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде вещества желтого цвета, (6-хлор-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил) (выход: 57%).
<Пример получения 2-2> Получение 6-хлор-4-этокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-этокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 2-1> (выход: 67%).

<Пример получения 2-3> Получение 6-хлор-4-(1-метилциклопропокси)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрила
6-Хлор-4-(1-метилциклопропокси)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил был получен способом, аналогичным способу, описанному в <примере получения 2-1> (выход: 67%).

<Пример получения 3-1> Получение 6-хлор-N-метил-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амина
6-Хлор-4-метокси-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил получали способом, показанным на схеме реакции 4 ниже.
[Схема реакции 4]
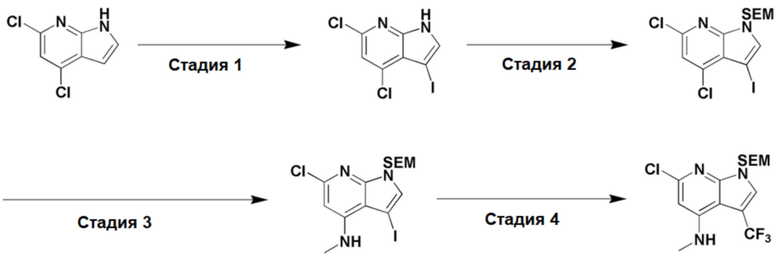
Стадия 1: 4,6-Дихлор-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ, затем понижали температуру до -10яяяC. В смесь добавляли N-йодсукцинимид (1,1 экв.), затем повышали температуру до комнатной. Смесь перемешивали в течение 1 часа. После завершения реакции добавляли ледяную воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 2: 4,6-Дихлор-3-йод-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в ДМФ (0,5 M), затем понижали температуру до -78яяяC. В вышеуказанную смесь добавляли NaH (1,5 экв.), затем перемешивали в течение 5 минут. После завершения реакции при температуре -78яяяC добавляли SEM-Cl (1,2 экв.). Потом температуру реакционной смеси повышали до комнатной, затем перемешивали в течение 1 часа. В вышеуказанную реакционную смесь добавляли ледяную воду, после чего органические продукты экстрагировали с помощью EtOAc (×3). Собранный органический слой промывали насыщенным солевым раствором и от остатков воды сушили над MgSO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 100%).
Стадия 3: 4,6-Дихлор-3-йод-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин (1,0 экв.) растворяли в EtOH, при комнатной температуре добавляли метиламин (5,0 экв., 35 масс% в этаноле). Смесь перемешивали при температуре 100яяяC в течение 14 часов. После завершения реакции добавляли воду, чтобы вызвать образование осадка. Образовавшийся осадок отфильтровывали и в результате получали целевое соединение (выход: 86%).
Стадия 4: Двухгорлую круглодонную колбу заполняли газообразным азотом, добавляли CuI (5,0 экв.) и KF (5,0 экв.). Температуру смеси повышали до 150яяяC, затем перемешивали при пониженном давлении в течение 2 часов. После завершения реакции температуру понижали до комнатной температуры. В присутствии азота добавляли с помощью шприца триметил(трифторметил)силан (5,0 экв.), растворенный в ДМФ/NMP (1:1). После взаимодействия в течение 30 минут добавляли с помощью шприца 6-хлор-3-йод-N-метил-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амин (1,0 экв.), растворенный в ДМФ/NMP (1:1), затем реакцию продолжали при температуре 45яяяC в течение 48 часов. После завершения реакции к реагентам добавляли воду, чтобы вызвать образование осадка, и образовавшийся осадок удаляли фильтрованием. Органические вещества извлекали из собранного фильтрата с помощью EtOAc (×3). Собранный органический слой промывали насыщенным солевым раствором и от остатков воды сушили над Na2SO4. Смесь очищали с помощью MPCL (EtOAc:Hex) и в результате получали целевое соединение в виде твердого вещества белого цвета (выход: 58%).
<Пример получения 3-2> Получение 6-хлор-N-этил-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амина
6-Хлор-N-этил-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амин был получен способом, аналогичным способу, описанному в <примере получения 3-1> (выход: 67%).
<Пример получения 3-3> Получение 6-хлор-N-(2-метоксиэтил)-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амина
6-Хлор-N-(2-метоксиэтил)-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-амин был получен способом, аналогичным способу, описанному в <примере получения 3-1>.

<Пример 1> Получение 1 соединения в соответствии с настоящим изобретением
Производное пирроло-пиридинового соединения в соответствии с настоящим изобретением получали способом, показанным на схеме реакции 5 ниже.
[Схема реакции 5]
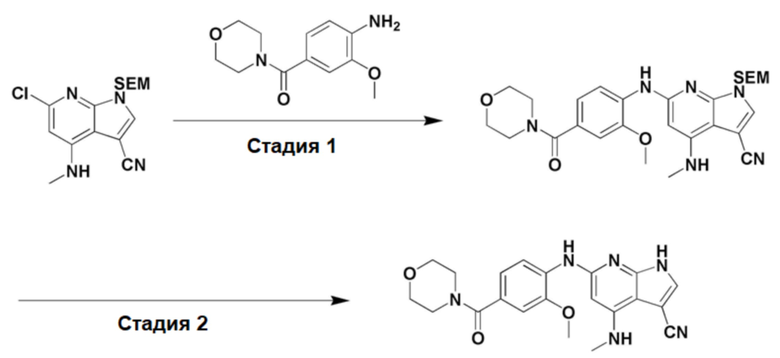
Стадия 1: 6-Хлор-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил (1,0 экв.), полученный в <примере получения 1-1>, (4-амино-3-метоксифенил)(морфолино)метанон (1,0 экв.) и K2CO3 (5,0 экв.) растворяли во втор-BuOH (0,1 M с последующей ультразвуковой обработкой в течение 1 минуты для удаления газа. В реакционную смесь при температуре 100яяяC добавляли Pd2(dba)3 (0,1 экв.) и Xphos (0,1 экв.), затем реакцию продолжали в течение 2 часов. После завершения реакции реакционную смесь отфильтровывали через целит и затем промывали EtOAc и MeOH. Полученный фильтрат концентрировали и органические материалы извлекали из собранного фильтрата, в результате получали целевое соединение в виде вещества желтого цвета, (6-(2-метокси-4-(морфолин-4-карбонил)фениламино)-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил).
Стадия 2: 6-(2-Метокси-4-(морфолин-4-карбонил)фениламино)-4-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбонитрил (1,0 экв.), полученный на стадии 1 выше, растворяли в CH2Cl2 (0,05 M), при комнатной температуре добавляли ТФУ (100 экв.). После взаимодействия в течение 4 часов растворитель удаляли. Концентрированную реакционную смесь вновь растворяли в ТГФ (0,03 M), добавляли при комнатной температуре насыщ. Na2CO3 (0,03 M), затем реакцию продолжали в течение 14 часов. После завершения реакции полученный продукт разбавляли EtOAc и затем постепенно промывали водой и насыщенным солевым раствором. Органический слой сушили над MgSO4. Смесь очищали с помощью преп-ВЭЖХ и в результате получали целевое соединение в виде твердого вещества желтого цвета, (6-(2-метокси-4-(морфолин-4-карбонил)фениламино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил) (выход: 67%).
<Пример 2>~<Пример 105> Получение 2 соединения в соответствии с настоящим изобретением
Производные пирроло-пиридина по настоящему изобретению были получены способом, аналогичным способу, описанному в примере 1, с использованием соединений <примера получения 1-1>~<примера получения 1-5>, <примера получения 2-1>~<примера получения 2-3> и <примера получения 3-1>~<примера получения 3-3>. Структурные химические формулы соединений примеров 1~105 приведены в таблицах 1~3 ниже. Названия соединений, 1H ЯМР данные, выходы и результаты ВЭЖХ приведены в таблице 4 ниже.
[Таблица 1]



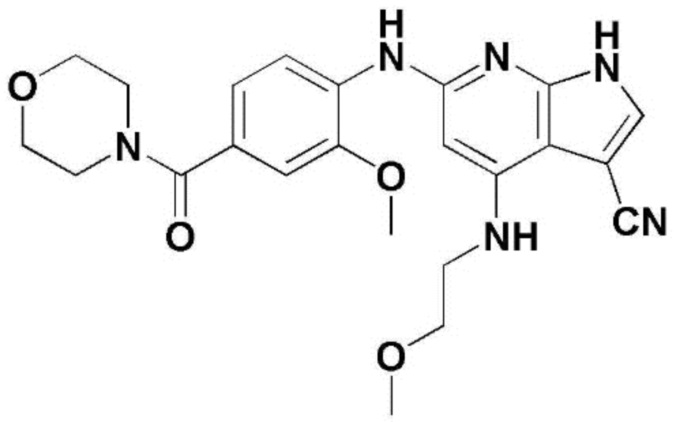

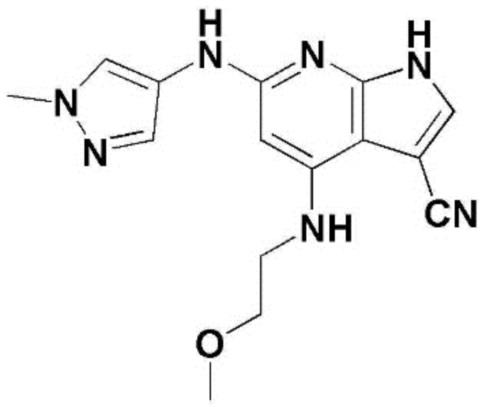

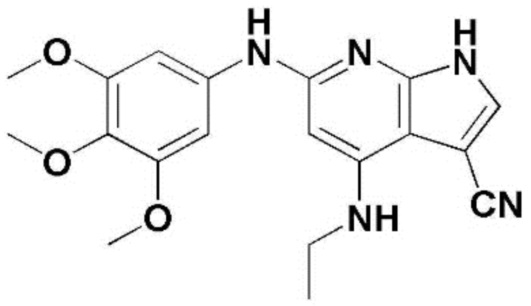


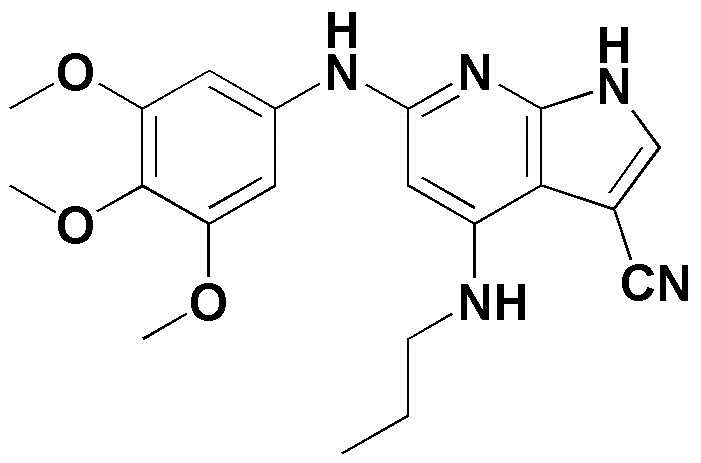
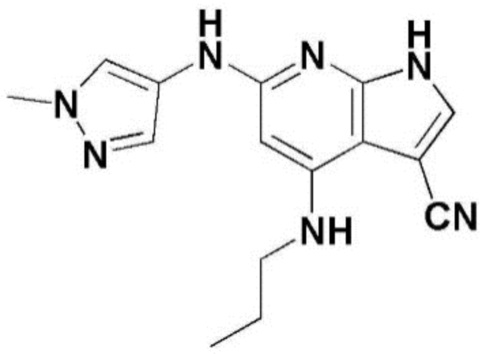



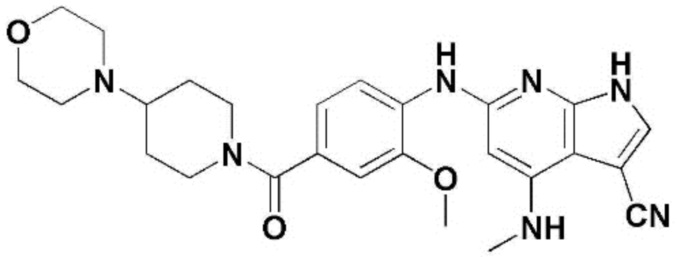


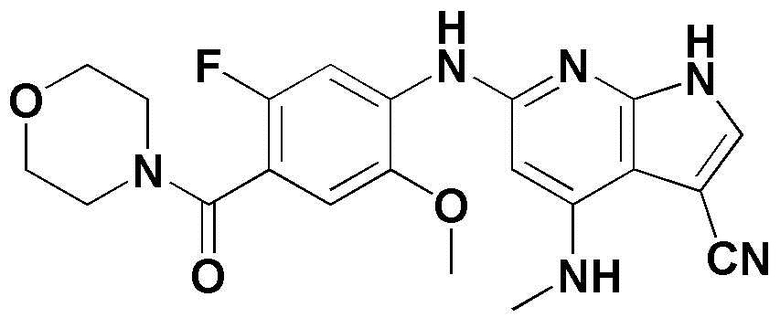

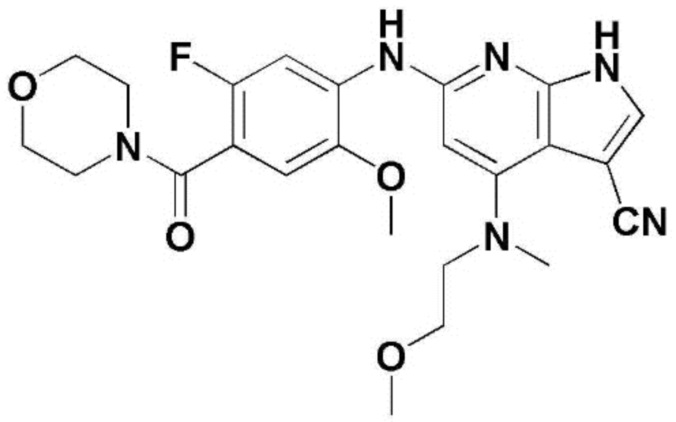
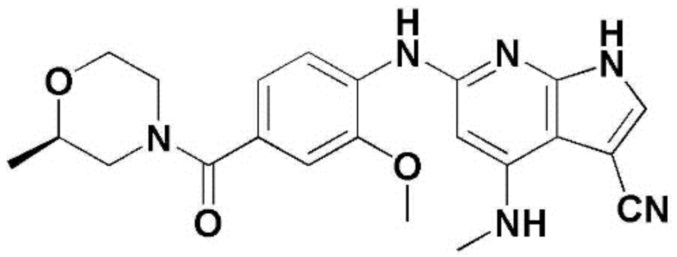

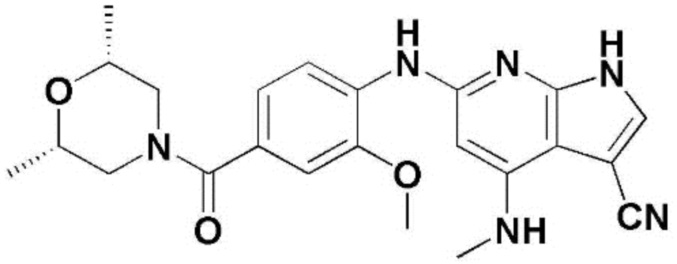
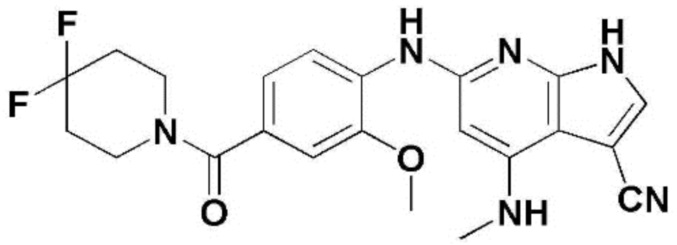

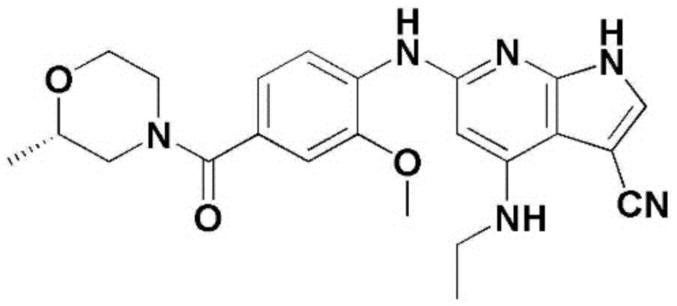



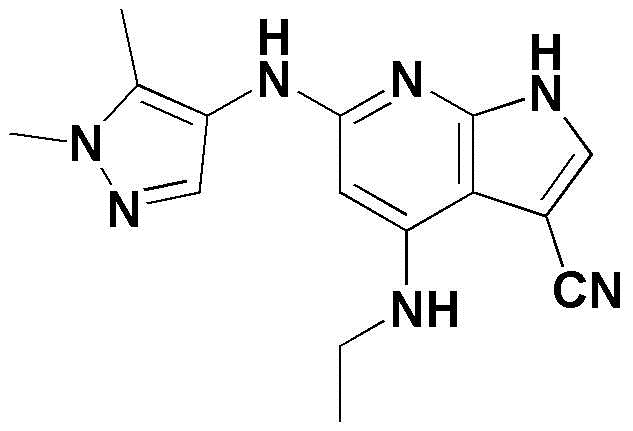



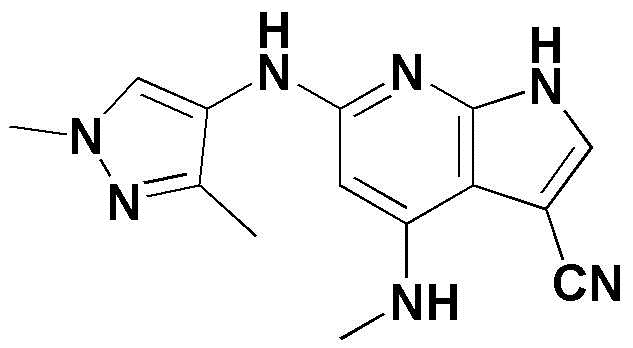

[Таблица 2}
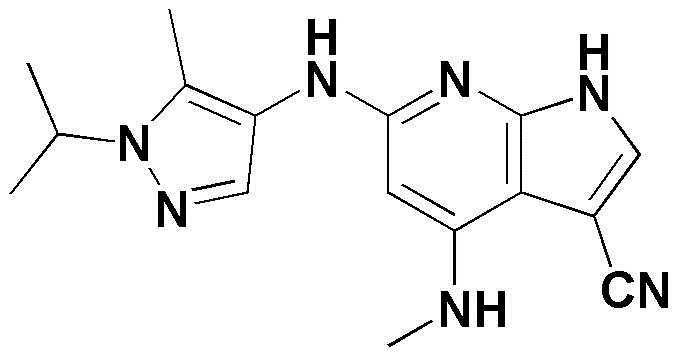



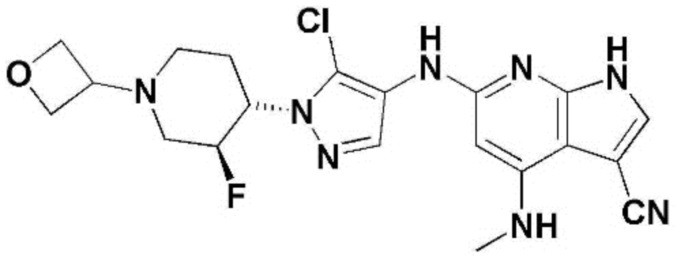


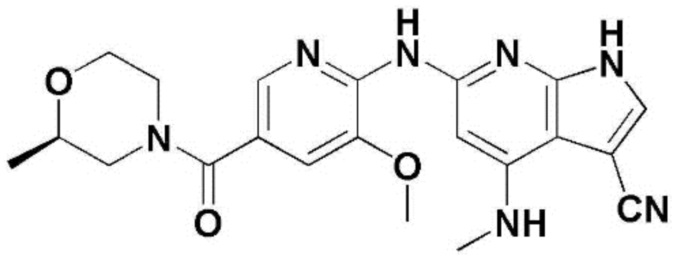
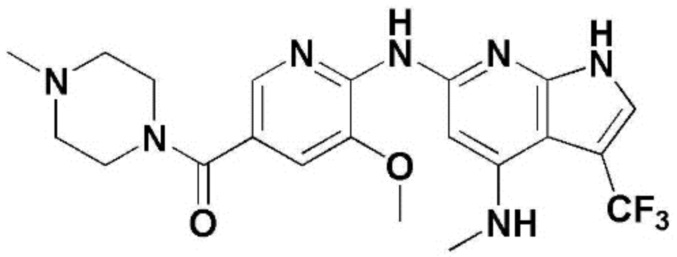
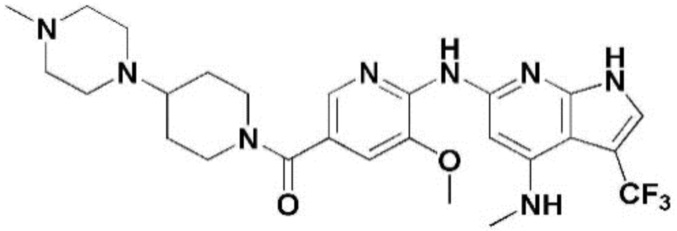



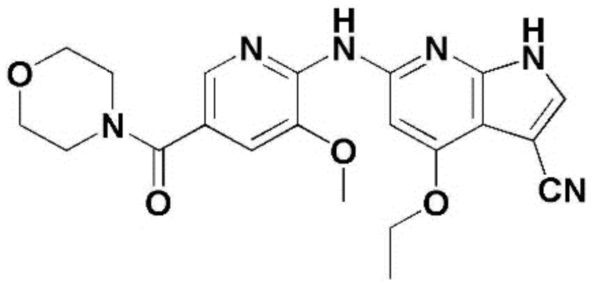

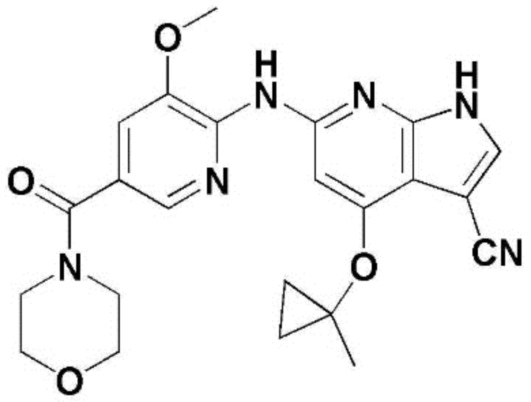
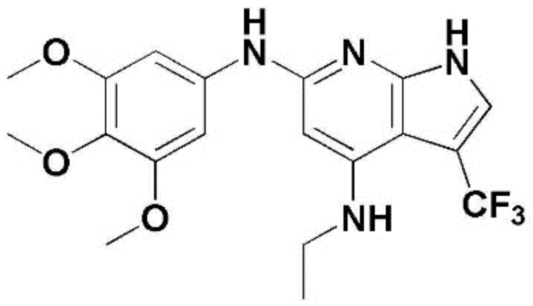

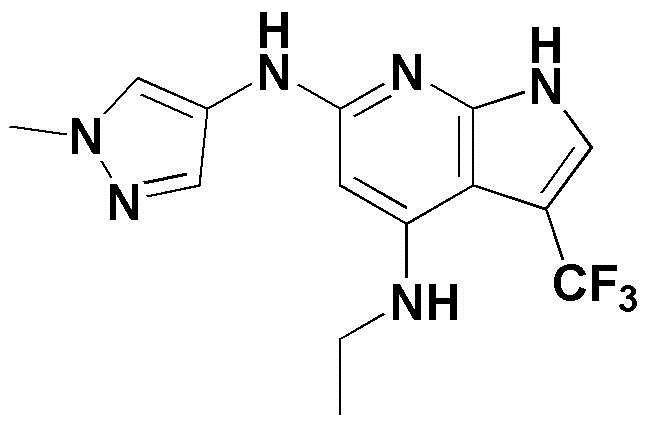

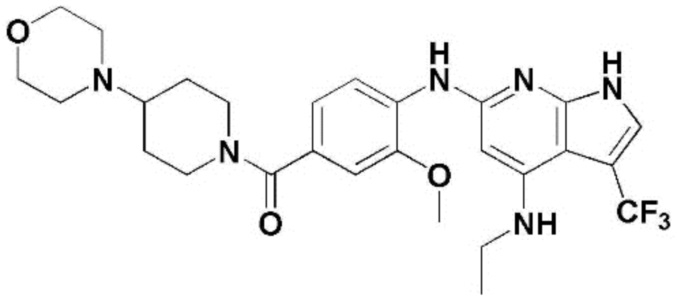


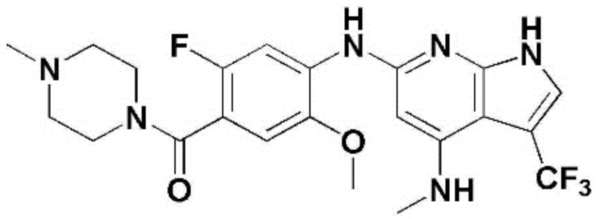

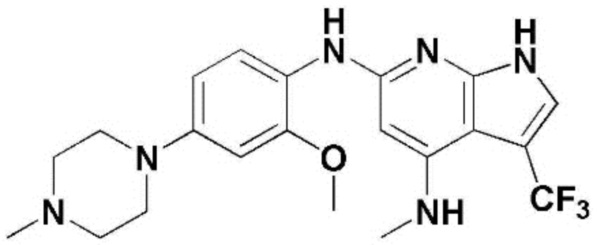
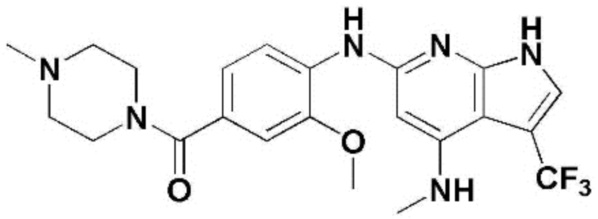
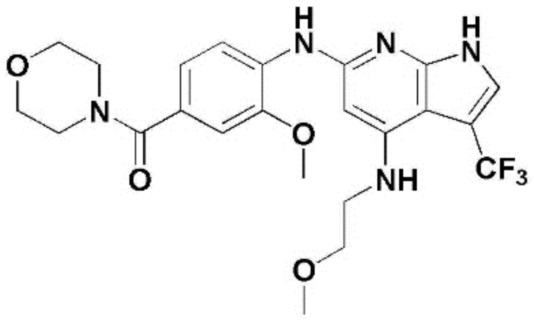
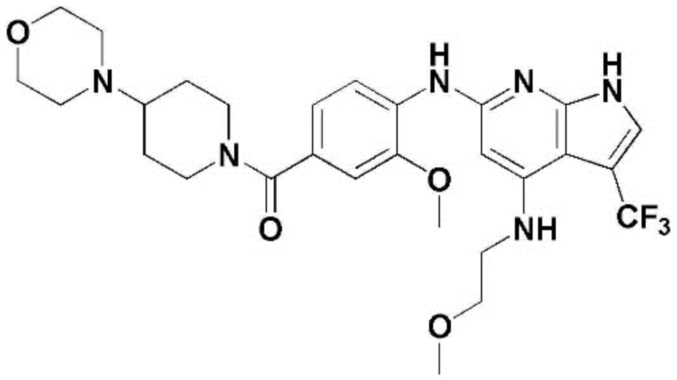

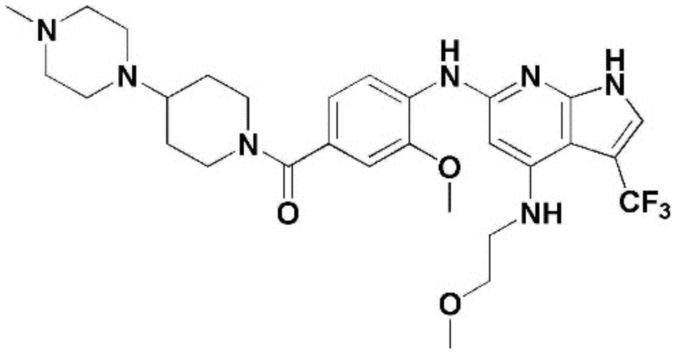
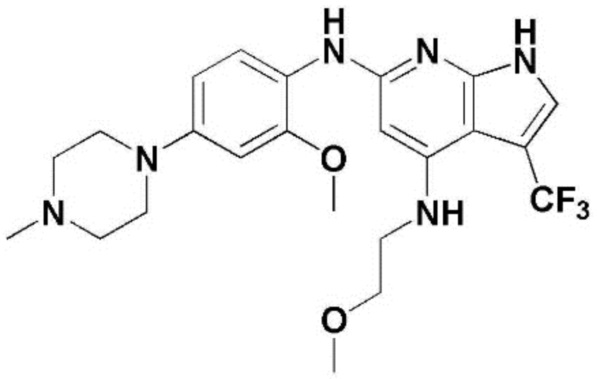
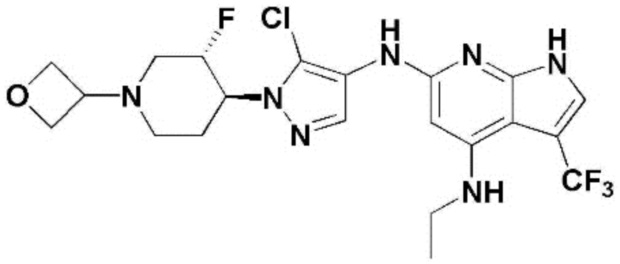
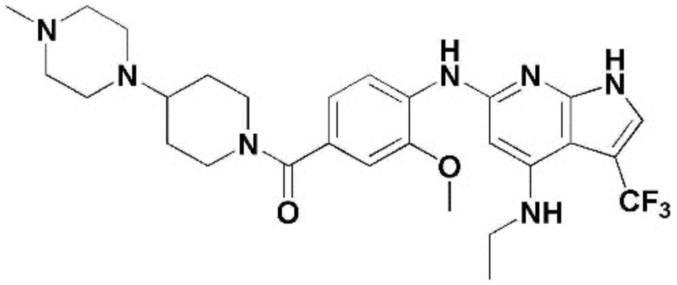


[Таблица 3]

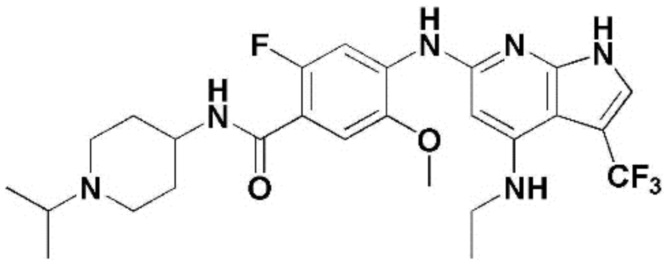
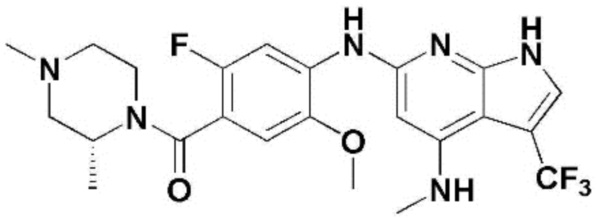

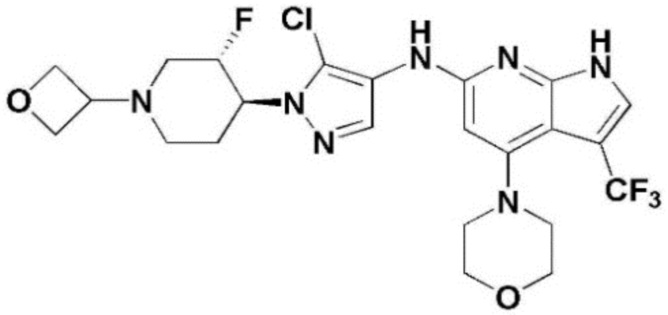


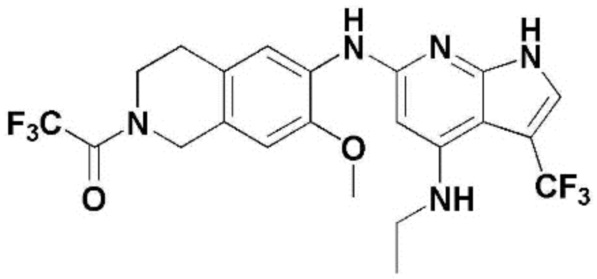
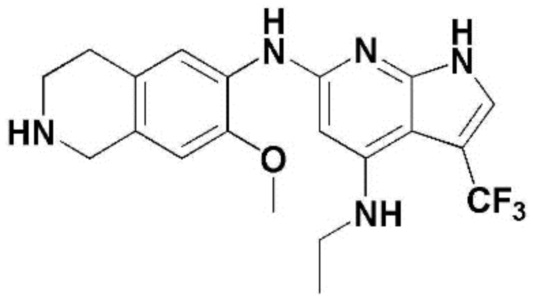
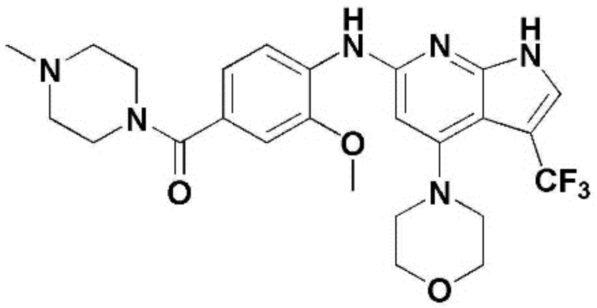
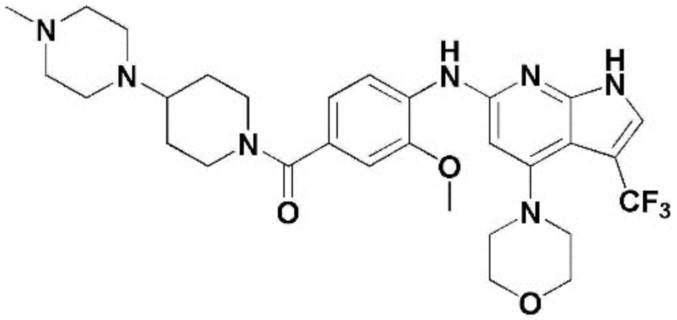





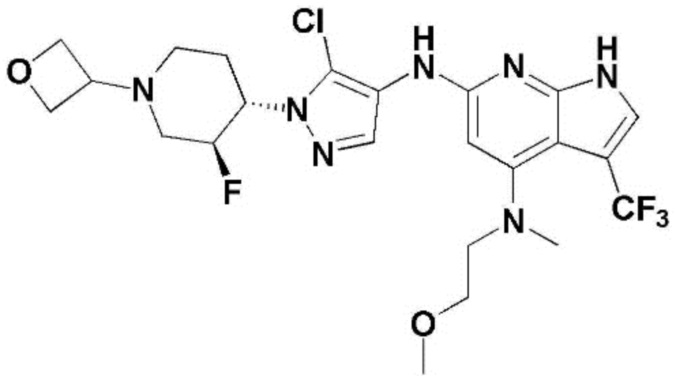
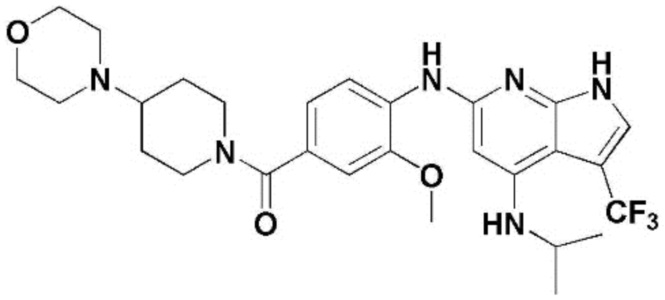
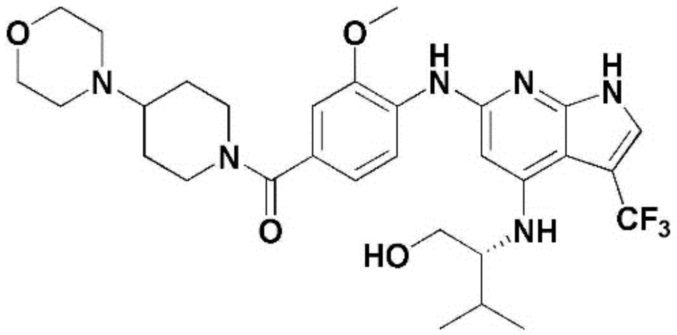

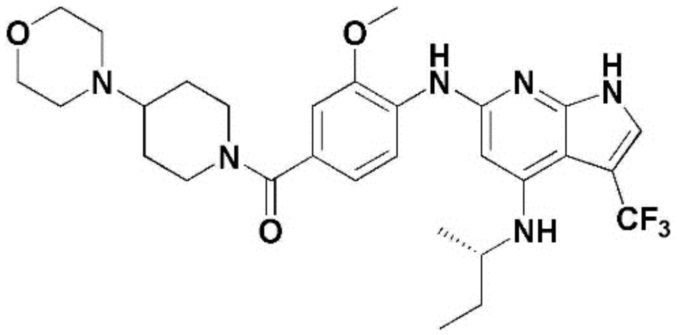
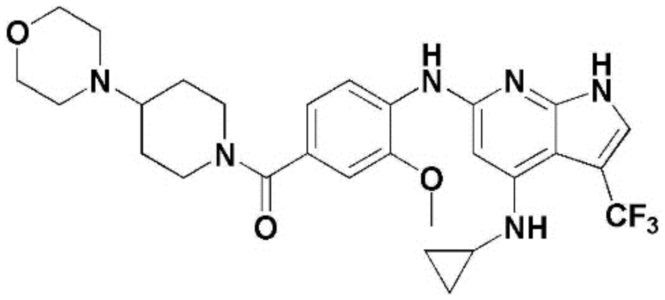
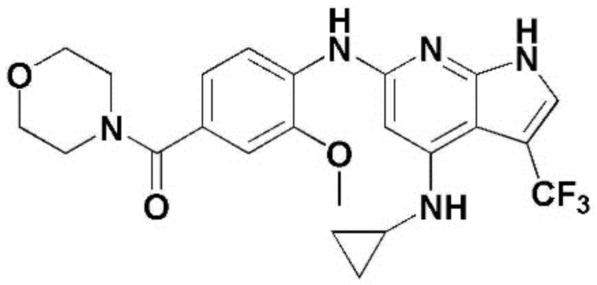



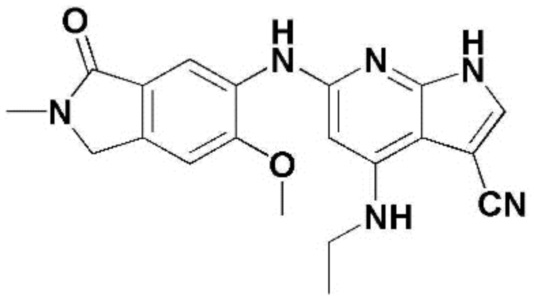

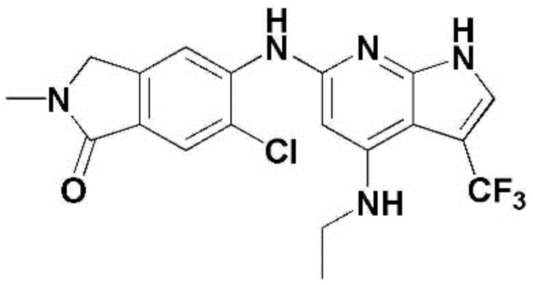
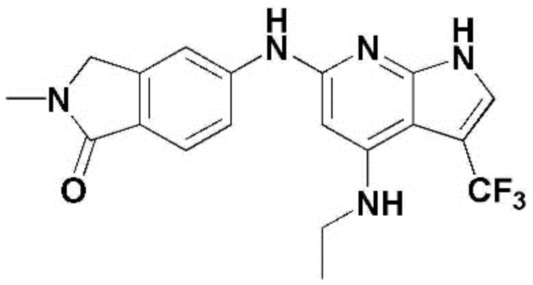

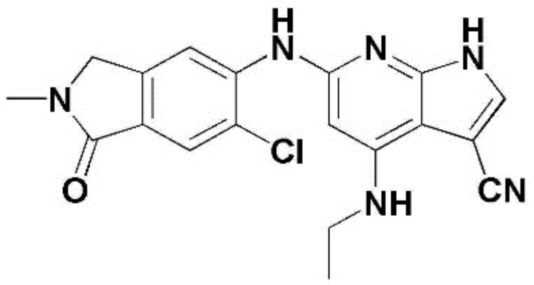

[Таблица 4]
(%)
к. т. (мин)
(способ)
CH2Cl2/Hex перекристаллизация
CH2Cl2/Hex перекристаллизация
CH2Cl2/Hex перекристаллизация
<Экспериментальный пример 1> Оценка 1 ингибирующего действия ферментативной активности соединения в соответствии с настоящим изобретением
Следующий эксперимент был проведен для оценки ингибирующей активности соединения по настоящему изобретению в отношении DYRK1A киназы.
В частности, в основной реакционный буфер (20 мМ Hepes (pH 7,5), 10 мМ MgCl2, 1 мМ EGTA, 0,02% Brij35, 0,02 мг/мл BSA, 0,1 мМ Na3VO4, 2 мМ DTT, 1% ДМСО), в который были добавлены кофакторы, необходимые для реакции, добавляли субстрат. Затем добавляли DYRK1A киназу и потом хорошо перемешивали. Добавляли каждое соединение по примерам с использованием акустической технологии (Echo550; диапазон нанолитров). Смесь оставляли при комнатной температуре на 20 минут и затем добавляли 33P-ATP (удельная активность 10 мКи/мл) чтобы инициировать реакцию. После протекания реакции при комнатной температуре в течение 2 часов было выполнено определение пятна на обменной бумаге P81. По завершении реакции активность киназы определяли с использованием метода связывания с фильтром.
Ингибирующая активность соединений по примерам 1, 2, 4, 5, 10, 23, 27, 53, 56, 57, 59, 60, 61, 63, 65 и 67 в отношении DYRK1A представлена в таблице 5 ниже.
Рассчитанные значения IC50 киназы были отсортированы следующим образом и представлены в таблице 5 ниже:
Степень A: менее чем 10 нМ,
Степень B: 10~100 нМ, и
Степень C: более чем 100 нМ.
[Таблица 5]
Как показано в таблице 5, при обработке соединениями по настоящему изобретению концентрация DYRK1A значительно снижалась до 0,01 мкМ или менее. Следовательно, поскольку соединения по настоящему изобретению превосходно ингибируют экспрессию DYRK1A, их можно эффективно использовать для лечения или профилактики заболевания, связанного с DYRK1A.
<Экспериментальный пример 2> Оценка 2 ингибирующего действия ферментативной активности соединения в соответствии с настоящим изобретением
Для оценки ингибирующей активности соединений по примерам 2, 54, 55, 69, 70, 71, 64, 66, 72, 73, 74, 75, 77, 78, 79, 87, 88, 89, 90, 91, 92, 93, 94 и 95 по настоящему изобретению в отношении DYRK1A киназы осуществляли анализ связывания DYRK1A киназы, используя LanthaSceenTM Eu следующим образом.
Сначала 10 концентраций (9 концентраций, последовательно разбавленных 3X и ДМСО) каждого соединения разбавляли в 1X киназном буфере A (Invitrogen, PV6135) три раза до конечной концентрации. Разбавленные соединения добавляли в 384-луночный белый аналитический планшет (Corning, 4513) (5 мкл/лунку).
Затем антитело LanthaScreenTM Eu-anti-GST (Invitrogen, PV5594) и DYRK1A (Invitrogen, PV3785) разбавляли до конечных концентраций 6 нМ и 15 нМ, соответственно, в 1X киназном буфере A, что приводило к получению раствора смеси антитело/киназа. Этот раствор смеси антитело/киназа добавляли в планшет для анализа, где разбавленное соединение помещали в концентрации 5 мкл/лунку. В это время конечные концентрации антитела и DYRK1A составляли 2 нМ и 5 нМ, соответственно.
Затем раствор трассера киназы 236 (Invitrogen, PV5592) разводили в 1X киназном буфере А до концентрации 45 нМ. Этот разбавленный раствор добавляли в планшет для анализа в концентрации 5 мкл/лунку. На данном этапе конечная концентрация трассера киназы 236 составляла 15 нМ, и значение Kd для трассера киназы 236 определялось с помощью индикаторного титриметрического анализа.
Наконец, после протекания реакции при комнатной температуре в течение 1 часа измеряли флуоресценцию (возбуждение 340 нм, эмиссия трассера киназы 665 нм, эмиссия антитела LanthaScreenTM Eu-anti-GST 620 нм) с использованием Synergy neo (BioTek). Коэффициент эмиссии (эмиссия трассера киназы÷эмиссия анти-эмиссия) был рассчитан на основе измеренных значений, которые были представлены в виде кривой доза-эффект. Затем был рассчитан IC50.
Значения IC50 для каждого соединения по примерам 52, 54, 55, 69, 70, 71, 64, 66, 72, 73, 74, 75, 77, 78, 79, 87, 88, 89, 90, 91, 92, 93, 94 и 95 были обобщены в таблице 6 ниже.
Рассчитанные значения IC50 киназы были отсортированы следующим образом и представлены в таблице 6 ниже:
Степень A: менее чем 10 нМ,
Степень B: 10~100 нМ, и
Степень C: более чем 100 нМ.
[Таблица 6]
Как показано в таблице 6, значения IC50 соединения по настоящему изобретению для DYRK1A составляли 0,1 мкМ или менее, указывая на то, что соединения по настоящему изобретению обладали превосходной активностью по ингибированию экспрессии DYRK1A.
Следовательно, поскольку соединения по настоящему изобретению превосходно ингибируют экспрессию DYRK1A, их можно эффективно использовать для лечения или профилактики заболевания, связанного с DYRK1A.
<Экспериментальный пример 3> Кальциенурин/NFAT сигнальная ингибирующая активность соединения по настоящему изобретению
Чтобы исследовать внутриклеточное ингибирующее действие DYRK1A соединений по настоящему изобретению, был проведен эксперимент по передаче сигналов DYRK1A с высокой зависимостью от кальцинейрина/NFAT.
Факторы транскрипции NFATc обычно существуют в виде фосфорилированных белков в цитоплазме. На данном этапе, поскольку концентрация Ca2+ увеличивается, NFATc дефосфорилируется с помощью Ca2+-зависимой протеинфосфатазы кальциенурин, и NFATc перемещается в ядро.
NFATc в ядре может образовывать транскрипционный комплекс с партнерским белком NFATn и может связываться с промотором гена-мишени для индукции экспрессии гена-мишени. На данном этапе DYRK1A обратно фосфорилирует NFATc для ингибирования миграции NFATc в ядро, что приводит к подавлению экспрессии гена-мишени.
Основываясь на вышеизложенных фактах, ингибирующий эффект соединений-кандидатов на DYRK1A измеряли количественно с использованием репортера люциферазы, содержащего чувствительный к NFAT элемент (NFAT-RE) в промоторе, который может быть использован для измерения транскрипционной активности NFATc.
В частности, репортер NFAT-RE-люциферазы и DYRK1A были сверхэкспрессированы в клетках 293T. Через 24 часа клетки обрабатывали IM и PMA (форбол-12-миристат-13-ацетат). Через 12 часов после обработки соединений-кандидатов активность люциферазы измеряли с использованием реагента One-Glo (Promega).
На фигуре 1а представлен график, иллюстрирующий люциферазную активность DYRK1A, на которую влияют соединения по примерам 53, 54, 55, 56 и 57.
На фигуре 1b представлен график, иллюстрирующий люциферазную активность DYRK1A, на которую влияют соединения по примерам 58, 59, 60, 61, 62, 63, 64, 65, 66, 67 и 68.
Как показано на фигуре 1а и фигуре 1b, при обработке соединениями по настоящему изобретению люциферазная активность DYRK1A была значительно увеличена по сравнению с обработкой одним ДМСО. Таким образом, было подтверждено, что соединения по настоящему изобретению способны эффективно ингибировать передачу сигналов кальциенурин/NFAT, что позволяет предположить, что они могут быть эффективно использованы для лечения или профилактики заболеваний, связанных с DYRK1A.
<Экспериментальный пример 4> Ингибирующее действие соединения по настоящему изобретению на фосфорилирование Tau
Чтобы исследовать ингибирующую активность DYRK1A у соединений согласно настоящему изобретению, фосфорилирование Tau, который является репрезентативным субстратным белком DYRK1A и в то же время ключевым фактором болезни Альцгеймера и синдрома Дауна, было подтверждено с помощью K1.
Тау представляет собой белок, связанный с микротрубочками. DYRK1A фосфорилирует главным образом Thr212 белка Tau, и это фосфорилирование четко наблюдалось в ткани гиппокампа на мышиной модели с синдромом Дауна, демонстрируя сверхэкспрессию DYRK1A.
В частности, клетки 293Т культивировали в 6-луночном планшете с плотностью 5×105 клеток в течение 12 часов с последующей котрансфекцией с 1 мкг каждой ДНК, экспрессирующей Tau и DYRK1A. После 24 часов инкубации соединение по примеру 53 обрабатывали до концентраций 0,001, 0,01, 0,1 и 1 мкМ, соответственно, с последующим культивированием в течение 6 часов. Затем клетки извлекали и разрушали для получения клеточного экстракта, содержащего общий белок клеток 293T.
Общий белок был разработан на SDS-PAGE и перенесен на блоттинг-мембрану 0,45 мкм из поливинилиденфторида; (GE Healthcare, США) с последующим блокированием 5% обезжиренным молоком. Первичные антитела, антитело против Tau (Thermo), антитело против pTau (T212) (Invitrogen) и антитело против DYRK1A (Santa Cruz) разводили в трис-буферизированном физрастворе Твин-20 (TBST), содержащем 5% обезжиренного молока, в соотношении 1:1000, и обрабатывали блоттинг-мембрану с последующим взаимодействием в течение ночи.
Затем мембрану промывали TBST 4 раза в течение 10 минут с последующей реакцией со вторичными антителами. По завершении реакции мембрану промывали TBST 4 раза в течение 10 минут. Уровень фосфорилирования белка на блоттинг-мембране определяли с использованием системы обнаружения вестерн-блоттинга WEST-ZOL плюс (iNtRON Biotechnology, США) и анализатора изображений LAS-4000 (Fuji Film, Japan).
Что касается контроля, тот же эксперимент был выполнен с использованием других ингибиторов DYRK1A - гармина и CX-4945. В качестве контроля для сравнения уровня экспрессии hnRNPA1 и GAPDH были подтверждены таким же образом, как описано выше, с использованием антитела против hnRNP A1 (Gideon Dreyfuss, University of Pennsylvania, США) и антитела против GAPDH в качестве первичных антител.
На фигуре 2а представлена фотография, иллюстрирующая результаты экспериментов по ингибированию Tau, hnRNPA1 и GAPDH для каждой концентрации соединения по примеру 57 в клетках.
На фигуре 2b представлен график, иллюстрирующий степень ингибирования Tau при каждой концентрации соединения по примеру 57 в клетках.
Как показано на фигуре 2а и фигуре 2b, когда соединение по настоящему изобретению обрабатывали клетками, фосфорилирование Tau эффективно ингибировалось. Таким образом, было подтверждено, что соединение по настоящему изобретению способно эффективно ингибировать фосфорилирование Tau, что позволяет предположить, что его можно эффективно использовать для лечения или профилактики заболевания, связанного с DYRK1A.
<Экспериментальный пример 5> Оценка ингибирующего DYRK1A действия соединения по настоящему изобретению in vivo
1. Наблюдение за эмбрионами на модели нарушения развития центральной нервной системы дрозофилы
Чтобы исследовать ингибирующее DYRK1A действие соединения по настоящему изобретению in vivo, проводили анализ структуры эмбриональной нервной системы с использованием модели сверхэкспрессирующего гена minibrain у Drosophila melanogaster. Minibrain представляет собой гомологичный ген DYRK1A. Известно, что мутанты Drosophilas, лишенные гена minibrain, имеют нарушение развития центральной нервной системы, приводящее к меньшему фенотипу мозга.
Для подтверждения ингибирующего DYRK1A действия соединения по настоящему изобретению с использованием модели Drosophila in vivo сначала был клонирован ген minibrain (mnb), гомологичный ген Drosophila DYRK1A, а затем была индуцирована специфическая сверхрэкспрессия ткани с использованием системы UAS/Gal4.
В частности, дрозофилы, трансформированные экспрессирующим вектором UAS-Minibrain, получали путем трансформации зародышевой линии, опосредованной P-элементом. Эти трансформированные дрозофилы были использованы для осуществления спаривания с различными тканеспецифичными промоторными линиями.
Сначала minibrain был сверхэкспрессирован в нервной системе с использованием специфической для нервной системы Drosophila промоторной линии elav-Gal4 с использованием системы UAS/Gal4. Эмбрионы поколения F1 за 24 часа до пробуждения в личинки 1-го возраста собирали и фиксировали 4% формалином. Затем синаптобревин-GFP, флуоресцентный белок, который может подтвердить структуру нервной системы, был совместно экспрессирован и наблюдался с помощью флуоресцентного конфокального микроскопа для анализа структуры и морфологии нервной системы.
На фигуре 3а представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы дикого типа,
На фигуре 3b представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы со сверхэкспрессирующей minibrain аномалией, связанной с нарушением развития центральной нервной системы, и
На фигуре 3с представлена флуоресцентная конфокальная микрофотография эмбриона дрозофилы с сверхэкспрессирующей minibrain аномалией развития нервной системы, рожденного родителями, которых перед спариванием в течение 7 дней обрабатывали соединением по примеру 57.
По сравнению с нормальным эмбрионом дрозофилы дикого типа, показанным на фигуре 3а, дисгенезия центральной и периферической нервной системы была вызвана сверхэкспрессией minibrain, что подтверждается на фигуре 3b.
С другой стороны, по сравнению с эмбрионом дрозофилы, показанным на фигуре 3b, при совместной обработке соединением по настоящему изобретению дисгенезия периферической нервной системы была значительно уменьшена, что подтверждается на фигуре 3с.
Следовательно, было подтверждено, что соединение по настоящему изобретению обладает превосходным ингибирующим DYRK1A действием in vivo. Таким образом, соединение по настоящему изобретению можно эффективно использовать для профилактики или лечения заболевания, связанного с DYRK1A.
2. Наблюдение за крыльями дрозофилы, обнаруживающими венозную аномалию развития
Чтобы подтвердить ингибирующее DYRK1A действие соединения по настоящему изобретению in vivo, наблюдали крылья модели Drosophila со сверхэкспрессией гена minibrain специфически в крыльях.
Сначала, чтобы получить сверхэкспрессирующий minibrain Drosophila специфически в крыльях, трансформированную UAS-Minibrain Drosophila соединяли со специфичным для крыльев промотором, MS1096-Gal4 трансформированной дрозофилой, что привело к получению поколения F1.
Затем был подтвержден эффект положительного влияния на дефекты крыла для проверки ингибирующего DYRK1A действия соединения согласно настоящему изобретению с использованием модели обнаружения Drosophila DYRK1A/ингибитор minibrain. Готовили среду, дополненную соединением в концентрации 10 мкМ, в которой выращивали эмбрионы сверхэкспрессирующего minibrain Drosophila, специфически в крыльях, с последующим исследованием фенотипа крыла.
На фигуре 4а представлена фотография крыльев контрольной группы и сверхэкспрессирующей minibrain Drosophila специфически в крыльях, и
На фигуре 4b представлен график, иллюстрирующий ингибирующее действие соединений по примерам 58, 59, 60, 61, 62, 63, 64, 65, 66 и 67 по настоящему изобретению на венозную аномалию развития крыльев.
Как показано на рисунке 4а, по крайней мере, 90% поколения F1 (MS1096>2xmnb) обнаруживали аномалии развития в вене L5 (фенотип короткой вены крыла).
Как показано на фигуре 4b, было подтверждено, что соединения по настоящему изобретению проявляют превосходное ингибирующее действие на аномалию развития вены крыла. В частности, было подтверждено, что соединения по примерам 58 (47,9%), 62 (47,7%) и 63 (43,8%) значительно ингибируют аномалии развития вены крыла.
3. Наблюдение пролиферации β-клеток поджелудочной железы мыши
Известно, что, когда человеческие β-клетки обрабатывают гармином, который ингибирует DYRK1A, пролиферация β-клеток стимулируется путем увеличения активности фактора транскрипции путем ингибирования фосфорилирования NFAT, известного как субстрат фосфорилирования DYRK1A. Чтобы подтвердить ингибирующее действие DYRK1A соединения по настоящему изобретению in vivo, был проведен эксперимент для изучения пролиферации β-клеток поджелудочной железы мыши.
В частности, островковые ткани Лангерганса поджелудочной железы извлекали из мыши в возрасте 8 недель с последующим культивированием в среде RPMI1640, дополненной 10% FCS (фетальная телячья сыворотка), 5,5 мМ глюкозы и 1% пенициллин-стрептомицина, в течение 24 часов.
Затем, чтобы отделить β-клетки в виде отдельных клеток от островка Лангерганса, клетки дважды промывали PBS с последующим центрифугированием. Собранные клетки оставляли в среде, дополненной 1 мг/мл трипсина, на 10 минут при 37яяяC. Клетки встряхивали с использованием пипетки каждые 10 секунд в течение 5 минут. Реакцию трипсина прекращали добавлением RPMI1640, содержащего 10% FCS (фетальная телячья сыворотка), 5,5 мМ глюкозы и 1% пенициллин-стрептомицина, с последующим центрифугированием для сбора отдельных клеток.
Затем отдельные клетки наносили на покрытое ламинином покровное стекло и стабилизировали в течение 24 часов. Клетки культивировали в среде, содержащей соединение по настоящему изобретению, в течение 72 часов. Иммунофлуоресцентное окрашивание проводили с использованием антитела Ki-67, которое может использовано для подтверждения деления клеток, и антитела к инсулину, которое может быть использовано для подтверждения β-клеток. Клетки, дважды окрашенные Ki-67/инсулином, подсчитывали под конфокальным флуоресцентным микроскопом Olympus F-1000 для исследования пролиферации клеток.
На фигуре 5а представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием контрольной группы,
на фигуре 5b представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием у мыши, получавшей гармин,
на фигуре 5с представлена конфокальная флуоресцентная микрофотография с иммунофлуоресцентным окрашиванием у мыши, обработанной соединением по примеру 57, и
на фигуре 5d представлен график, иллюстрирующий количество клеток каждой модели мыши.
Как показано на фигурах 5a и 5b, при обработке гармином пролиферация клеток была активной.
Как показано на фигуре 5с, при обработке соединением по примеру 57 пролиферация клеток также была активной.
Кроме того, как показано на фигуре 5d, количественным измерением клеток было подтверждено, что обработка соединением по примеру 57 увеличивала количество клеток в 5 раз.
В каждом вышеописанном эксперименте in vivo было подтверждено, что соединение по настоящему изобретению способно эффективно ингибировать экспрессию DYRK1A. Таким образом, поскольку соединение по настоящему изобретению эффективно ингибирует экспрессию DYRK1A, его можно эффективно использовать для лечения и профилактики заболевания, связанного с DYRK1A.
<Экспериментальный пример 6> Оценка ингибирующей киназу активности соединения по настоящему изобретению
Следующий эксперимент был выполнен для оценки активности соединений по настоящему изобретению в отношении ингибирования ряда ферментов.
В частности, соединения по примерам 18 и 57 были выбраны среди всех этих соединений по настоящему изобретению. DiscoverX Co. было предложено измерить селективность в отношении фермента (киназы), и эксперимент проводили с использованием панели анализа scanMAXTM Kinase.
На данном этапе концентрация лекарственного средства, обработанного каждым ферментом, составляла 1 мкМ в ДМСО, и контрольный процент (% контроля) определяли по следующему уравнению 1. Результаты приведены в таблице 7 ниже.
[Уравнение 1]
(Соединение по примеру-положительный контроль)/(отрицательный контроль-положительный контроль)×100
В настоящем документе положительный контроль указывает на соединение, показывающее % контроля как 0%, а отрицательный контроль указывает на ДМСО, показывающий % контроля как 100%. Селективность фермента в настоящем изобретении определяется следующим образом: когда % контроля для каждого фермента составляет менее 35% (<35%), оценивается, что соединение обладает активностью в отношении соответствующего фермента.
[Таблица 7 ]
Как показано в таблице 7, соединения по настоящему изобретению продемонстрировали меньший % контроля, чем 35%, для таких киназ, как ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), РСК3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK и YSK4. Приведенный выше результат указывает на то, что соединения по настоящему изобретению обладают активностью ингибирования перечисленных выше ферментов, что подтверждает применимость соединений по изобретению при заболевании, связанного с ферментами, перечисленными выше.
Следовательно, производные пирроло-пиридинового соединения по настоящему изобретению можно эффективно использовать в качестве фармацевтической композиции для лечения или профилактики ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), РСК3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK или YSK4 связанное заболевание.
<Экспериментальный пример 7> Оценка активности по ингибированию Tau-фосфорилирования соединения по изобретению в экспериментальной модели болезни Альцгеймера
Следующий эксперимент был проведен для изучения влияния соединения по примеру 57 по настоящему изобретению на фосфорилирование Tau в модели на животных с болезнью Альцгеймера.
В частности, 5x FAD мышам вводили соединение по примеру 57 по настоящему изобретению (20 мг/кг) или носитель (необрабатываемая группа) путем внутрибрюшинной инъекции каждый день в течение 2 недель. Спустя 2 недели иммуногистохимию проводили с использованием AT180, одного из антител к фосфорилированию Tau, и в результате получали изображения конфокального микроскопа. Количественный анализ изображений проводили с использованием программного обеспечения image j. Результаты показаны на фигуре 6.
На фигуре 6 представлены результаты оценки ингибирующей Tau-фосфорилирование активности соединения в экспериментальной модели болезни Альцгеймера. ФИГ. 6а: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга в экспериментальной модели болезни Альцгеймера, обработанной носителем (необработанная группа) или соединением по примеру 57 (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), AT180: изображение, полученное с помощью иммуногистохимии с использованием антитела AT180, слияние: изображение, полученное путем наложения изображений DAPI и AT180; укрупнение: изображение, полученное путем увеличения изображения AT180), ФИГ. 6b: график, иллюстрирующий иммунореактивность AT180 в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 6с: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), AT180: изображение, полученное с помощью иммуногистохимии с использованием антитела AT180, укрупнение (CA1): увеличенное изображение CA1 (cornus aminus, область, где начинается гиппокамп и формируется долговременная память) из гиппокампа изображения AT180, укрупнение (DG): увеличенное изображение DG (зубчатая извилина, область, где заканчивается гиппокамп и формируется новая память) изображения гиппокампа AT180, ФИГ. 6d: график, иллюстрирующий иммунореактивность AT180 в CA1 (cornus aminus) на модели животных, страдающих болезнью Альцгеймера обработанные носителем (необработанная группа) или соединением по примеру 57, ФИГ. 6e: график, иллюстрирующий иммунореактивность AT180 в DG (зубчатая извилина) в экспериментальной модели болезни Альцгеймера, обработанной носителем (необработанная группа) или соединением по примеру 57.
Как показано на фигуре 6, было подтверждено, что иммунореактивность AT180 значительно снижалась в гиппокампе мышей, которым внутрибрюшинно вводили 20 мг/кг соединения по примеру 57 по настоящему изобретению (носитель в сравнении с № 57 (20 мг/кг): *р<0,05, **р<0,001). Однако не было значительного изменения иммунореактивности AT180 в области коры головного мозга по сравнению с группой, получавшей носитель (необрабатываемая группа).
Исходя из вышеприведенных результатов, было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, способно облегчить симптомы болезни Альцгеймера.
<Экспериментальный пример 8> Оценка изменений белка DYRK1A соединением по изобретению в экспериментальной модели болезни Альцгеймера
Следующий эксперимент был проведен для изучения влияния соединения примера 57 по настоящему изобретению на целевой белок гена DYRK1A в экспериментальной модели болезни Альцгеймера.
В частности, 5x FAD мышам вводили соединение по примеру 57 по настоящему изобретению (20 мг/кг) или носитель (не обрабатываемая группа) путем внутрибрюшинной инъекции каждый день в течение 2 недель. Через 2 недели иммуногистохимию проводили с использованием DYRK1A, и в результате получали изображения с конфокальным микроскопом. Количественный анализ изображений проводили с использованием программного обеспечения image j. Результаты показаны на фигуре 7.
На фигуре 7 представлены изменения белка DYRK1A соединением по настоящему изобретению в экспериментальной модели болезни Альцгеймера. ФИГ. 7а: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), DYRK1A: изображение, полученное с помощью иммуногистохимии с использованием белка DYRK1A, слияние: изображение, полученное путем наложения изображений DAPI и DYRK1A, укрупнение: изображение, полученное путем увеличения изображения DYRK1A), ФИГ. 7b: график, иллюстрирующий иммунореактивность DYRK1A в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 7с: иммунофлуоресцентное окрашивание конфокальной флуоресцентной микрофотографии коры головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашенное DAPI (4',6-диамидино-2-фенилиндол), DYRK1A: изображение, полученное методом иммуногистохимии с использованием белка DYRK1A, укрупнение (CA1): увеличенное изображение CA1 (cornus aminus, область, где начинается гиппокамп и формируется долговременная память) гиппокампа изображения DYRK1A, укрупнение (DG): увеличенное изображение DG (зубчатая извилина, область, в которой заканчивается гиппокамп и формируется новая память) изображения гиппокампа DYRK1A, ФИГ. 7d: график, иллюстрирующий иммунореактивность DYRK1A в СА1 (cornus aminus), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 7e: график, иллюстрирующий иммунореактивность DYRK1A в DG (зубчатая извилина), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера.
Как показано на фигуре 7, было подтверждено, что иммунореактивность DYRK1A значительно снижалась не только в коре головного мозга, но также в областях CA1 и DG гиппокампа у мышей, которым внутрибрюшинно вводили 20 мг/кг соединения по примеру 57 по настоящему изобретению (носитель по сравнению с № 57 (20 мг/кг): ***р<0,0001).
Исходя из вышеприведенных результатов, было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, способно облегчить симптомы болезни Альцгеймера.
<Экспериментальный пример 9> Оценка изменений амилоидной бляшки соединением по изобретению в экспериментальной модели болезни Альцгеймера
Следующий эксперимент был проведен для изучения влияния соединения по примеру 57 по настоящему изобретению на амилоидную бляшку, один из ключевых факторов, вызывающих болезнь Альцгеймера, в экспериментальной модели болезни Альцгеймера.
В частности, 5x FAD мышам вводили соединение по примеру 57 по настоящему изобретению (20 мг/кг) или носитель (не обрабатываемая группа) путем внутрибрюшинной инъекции каждый день в течение 2 недель. Через 2 недели иммуногистохимию проводили с использованием антитела 4G8, способного обнаруживать амилоидную бляшку, и в результате получали изображения конфокального микроскопа. Количественный анализ изображений проводили с использованием программного обеспечения image j. Результаты показаны на фигуре 8.
На фигуре 8 представлены изменения амилоидной бляшки соединением по примеру 57, в экспериментальной модели болезни Альцгеймера. ФИГ. 8а: иммунофлуоресцентное окрашивание, конфокальная флуоресцентная микрофотография коры головного мозга и гиппокампа, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера (DAPI: иммунофлуоресцентное изображение, окрашивание DAPI (4',6-диамидино-2)-фенилиндол), 4G8: изображение, полученное с помощью иммуногистохимии с использованием антитела 4G8, слияние: изображение, полученное путем наложения изображений DAPI и 4G8), ФИГ. 8b: график, иллюстрирующий изменения числа амилоидных бляшек 4G8 в коре головного мозга, обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 8с: график, иллюстрирующий изменения в количестве амилоидной бляшки 4G8 в СА1 (cornus aminus), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера, ФИГ. 8d: график, иллюстрирующий изменения количества амилоидной бляшки 4G8 в DG (зубчатая извилина), обработанной носителем (необработанная группа) или соединением по примеру 57, в экспериментальной модели болезни Альцгеймера
Как показано на фигуре 8, было подтверждено, что количество амилоидных бляшек было значительно снижено не только в коре головного мозга, но также в области DG гиппокампа у мышей, которым внутрибрюшинно вводили 20 мг/кг соединения по примеру 57 по настоящему изобретению (носитель по сравнению с 20 мг/кг: ***р<0,0001). Однако в области CA гиппокампа количество амилоидных бляшек не было значительно снижено по сравнению с не обрабатываемой группой.
Исходя из вышеприведенных результатов, было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, способно облегчить симптомы болезни Альцгеймера.
<Экспериментальный пример 10> Оценка кратковременного эффекта улучшения познавательных способностей соединения по изобретению с помощью поведенческого теста (Y-образный лабиринт)
Следующий эксперимент был проведен для исследования того, способно ли соединение по примеру 57 по настоящему изобретению положительно сказаться на кратковременной когнитивной функции в экспериментальной модели болезни Альцгеймера.
В частности, 5x FAD мышам вводили соединение по примеру 57 по настоящему изобретению (20 мг/кг) или носитель (не обрабатываемая группа) путем внутрибрюшинной инъекции каждый день в течение 2 недель. Затем мышей помещали в Y-образный лабиринт, состоящий из трех плеч, примыкающих под углом 120яяя, и каждое плечо последовательно поднимали в течение пяти минут, чтобы вычислить количество чередующихся триплетов, чтобы увидеть, насколько хорошо мыши помнили, где они были.
Оборудование, используемое для испытания Y-образного лабиринта, состоит из трех плеч. Длина каждого плеча составляла 42 см, ширина 3 см, а высота 12 см. Угол контакта между тремя плечами составлял 120яяя. Все экспериментальные устройства были изготовлены из черного поливинилового пластика. Каждое плечо были обозначено как A, B и C. Исследуемая мышь была аккуратно помещена в одно плечо и ей давали свободно перемещаться в течение 8 минут. Затем плечо, в которое входила исследуемая мышь, регистрировалось. На данном этапе «вход» означает случай, когда полностью входил хвост мыши. Если мышь входила в то плечо, где она уже побывала, случай также регистрировался. Если мышь входила в три разных плеча одно за другим (фактическое чередование), то давалось одно очко. Поведение чередования было определено тем, что мышь поэтапно входила в три разных плеча, что рассчитывалось по следующему уравнению. На фигуре 9а показана принципиальная схема Y-образного лабиринта, а на фигуре 9b представлены результаты расчета.
[поведение чередования (%)=фактическое чередование/*максимальное чередование×100]
*максимальное чередование: всего записей - 2
На фигуре 9 представлены результаты оценки краткосрочного эффекта улучшения когнитивных функций с помощью поведенческих тестов. ФИГ. 9a: схематическая диаграмма Y-образного лабиринта для измерения кратковременной мозговой памяти, ФИГ. 9b: график, иллюстрирующий поведенческие изменения мыши, протестированной с Y-образного лабиринта.
Как показано на фигуре 9, кратковременная память была снижена в необрабатываемой группе (5x FAD мышам вводили носитель посредством внутрибрюшинной инъекции) по сравнению с группой дикого типа (мышам дикого типа вводили носитель посредством внутрибрюшинной инъекции), что подтверждено путем изменения поведения теста выше. С другой стороны, экспериментальная группа (5x FAD мышам, которым вводили соединение по примеру 57 по настоящему изобретению в концентрации 20 мг/кг посредством внутрибрюшинной инъекции), показала улучшенную кратковременную память по сравнению с необработанной группой (5x FAD: носитель в сравнении с 20 мг/кг: **р <0,01).
На основании приведенных выше результатов было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, способно положительно сказаться на кратковременном снижении когнитивных функций, вызванном болезнью Альцгеймера.
<Экспериментальный пример 11> Оценка долгосрочного эффекта улучшения познавательных способностей соединения по изобретению с помощью поведенческого теста - теста распознавания нового объекта
Следующий эксперимент был проведен для исследования того, способно ли соединение по примеру 57 по настоящему изобретению положительно сказаться на длительной когнитивной функции в экспериментальной модели болезни Альцгеймера. Тестом распознавания нового объекта являлся эксперимент по проверке памяти на восприятие объекта. Мышам давали возможность увидеть два одинаковых объекта. По истечении определенного периода времени (несколько часов в неделю) мышам давали увидеть новый объект вместе с ранее представленным объектом. Затем оценивали, насколько эти мыши были заинтересованы в новом объекте и изучали его, что приводило к оценке долговременной памяти предыдущего объекта.
В частности, 5x FAD мышам вводили соединение по примеру 57 по настоящему изобретению (20 мг/кг) или носитель (необрабатываемая группа) путем внутрибрюшинной инъекции каждый день в течение 2 недель. Два объекта, которые были одинаковы по форме и размеру (F, F), размещались в определенном углу камеры «открытого поля» (42×42×42 см), чтобы внешняя сторона не была невидимой изнутри, и исследуемая мышь выпускалась из центра камеры. Затем количество и время касания исследуемой мыши этих двух объектов регистрировали в течение 5 минут (определение местоположения). 24 часа спустя один из этих двух объектов заменяли на новый (F, N). Номер и время доступа к исходному объекту (F) и новому объекту (N) записывались и оцифровались (способность различать). Предпочтение для объекта (p) рассчитывалось по (время приближения к определенному объекту)/(общее время приближения к двум объектам). На фигуре 10 (а) представлена схематическая диаграмма теста распознавания нового объекта, а на фигуре 10 (B) представлены результаты обсчета.
На фигуре 10 представлены результаты оценки долгосрочного эффекта улучшения когнитивных функций с помощью поведенческих тестов. ФИГ. 10a: схематическая диаграмма теста распознавания нового объекта для измерения долговременной памяти мозга и уравнения для вычисления предпочтения нового объекта, ФИГ. 10b: график, иллюстрирующий предпочтение объекта у тестируемой мыши, оцененное с помощью теста распознавания нового объекта, ФИГ. 10c: график, иллюстрирующий предпочтение нового объекта для исследуемой мыши, оцененное с помощью теста распознавания нового объекта
Как показано на фигуре 10, на стадии способности различать долговременная память, измеренная по предпочтению к новому объекту, была снижена в необрабатываемой группе (5x FAD мышам вводили носитель посредством внутрибрюшинной инъекции) по сравнению с группой дикого типа (мышам дикого типа вводили носитель посредством внутрибрюшинной инъекции). С другой стороны, экспериментальная группа (5x FAD мышам, которым вводили соединение по примеру 57 по настоящему изобретению в концентрации 20 мг/кг посредством внутрибрюшинной инъекции), показала улучшенную долговременную память по сравнению с необработанной группой (5x FAD: носитель в сравнении с 20 мг/кг: **р <0,01).
На основании приведенных выше результатов было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, способно положительно сказаться на долговременном снижении когнитивных функций, вызванное болезнью Альцгеймера.
Было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходной активностью по ингибированию киназы DYRK1A в экспериментальных примерах 1 и 2. Кроме того, было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходно активностью по ингибированию фосфорилирования DYRK1A на клеточном уровне в экспериментальном примере 3. В экспериментальном примере 4 было также подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль превосходно ингибируют фосфорилирование Tau, важного фактора синдрома Дауна. Кроме того, в экспериментальном примере 5 также было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают эффектом ингибирования активности киназы DYRK1A in vivo.
Было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль обладают превосходной активностью в отношении ингибирования фосфорилирования Tau в экспериментальной модели болезни Альцгеймера в экспериментальном примере 7. В экспериментальном примере 8 также было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль превосходно ингибируют активность белка DYRK1A. В экспериментальном примере 9 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль уменьшают амилоидную бляшку, одну из причин болезни Альцгеймера. В экспериментальном примере 10 было подтверждено, что соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль положительно сказываются на кратковременном снижении когнитивных функций, вызванное болезнью Альцгеймера, а также в экспериментальном примере 11 подтверждают положительное влияние на длительное снижение когнитивных функций, вызванное болезнью Альцгеймера.
Следовательно, фармацевтическую композицию и пищевую функциональную оздоровительную композицию, содержащую соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемую соль можно эффективно использовать для лечения или профилактики заболевания, связанного с DYRK1A. В частности, они могут эффективно использоваться для профилактики, лечения или ослабления болезни Альцгеймера, деменции или деменции Альцгеймера.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Соединение, представленное химической формулой 1 по настоящему изобретению, его оптический изомер или его фармацевтически приемлемая соль могут быть эффективно использованы для лечения или профилактики заболеваний, связанных с протеинкиназой. В частности, они могут эффективно использоваться для профилактики, лечения или ослабления болезни Альцгеймера, деменции или деменции Альцгеймера.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОАРИЛЬНОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С PI3 КИНАЗАМИ, СОДЕРЖАЩАЯ ДАННОЕ ДЕЙСТВУЮЩЕЕ ВЕЩЕСТВО | 2016 |
|
RU2719367C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
| НОВОЕ СОЕДИНЕНИЕ, ПРОЯВЛЯЮЩЕЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ЭНТЕРОПЕПТИДАЗЫ | 2019 |
|
RU2768755C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[2,3-c] ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2385320C2 |
| ПИРИМИДО[5,4-b]ИНДОЛИЗИНОВОЕ ИЛИ ПИРИМИДО[5,4-b]ПИРРОЛИЗИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2721774C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННЫХ ГЕТЕРОЦИКЛИЛ-КАРБОНОГИДРАЗОНОИЛДИЦИАНИДОВ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2826002C1 |
| СОЕДИНЕНИЕ ДЛЯ РАЗРУШЕНИЯ АНДРОГЕНОВОГО РЕЦЕПТОРА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2817356C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,2-A]ПИРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2725147C1 |
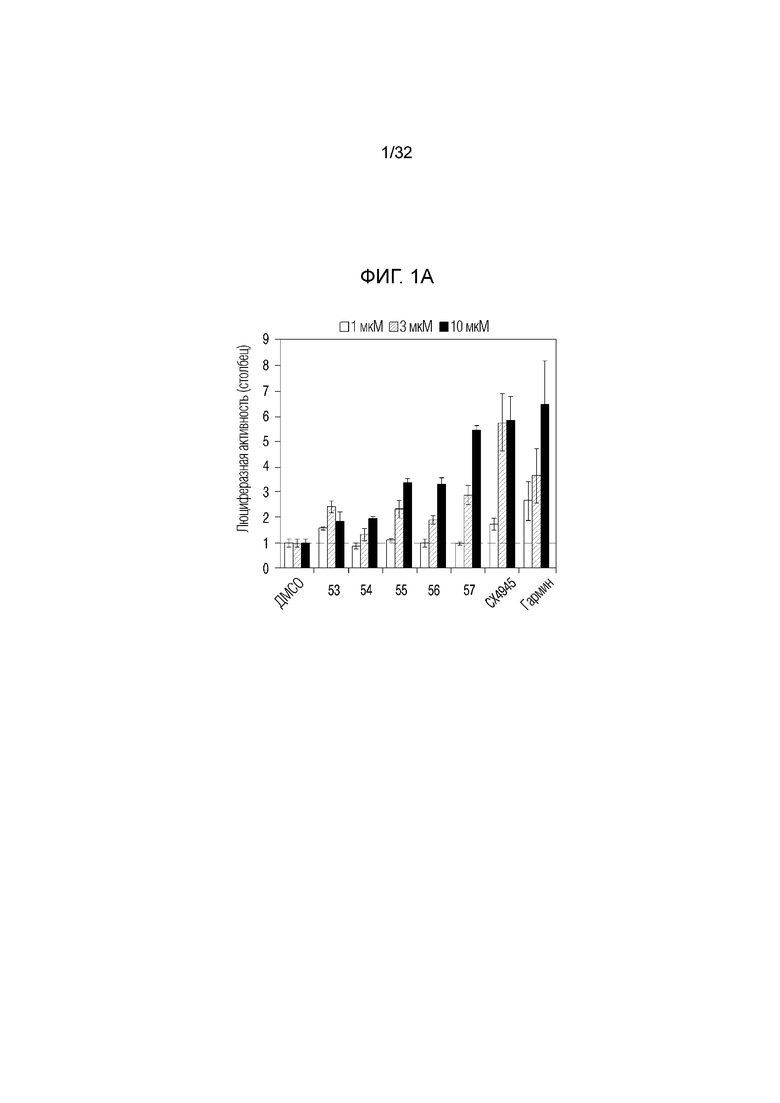
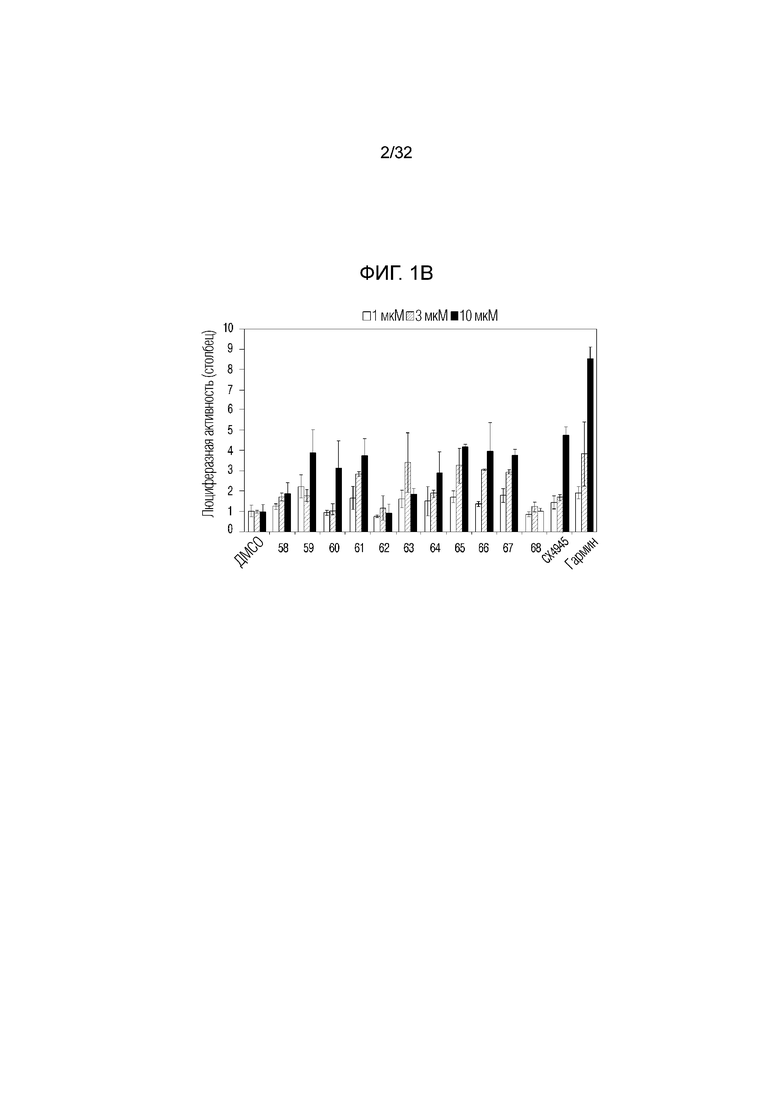










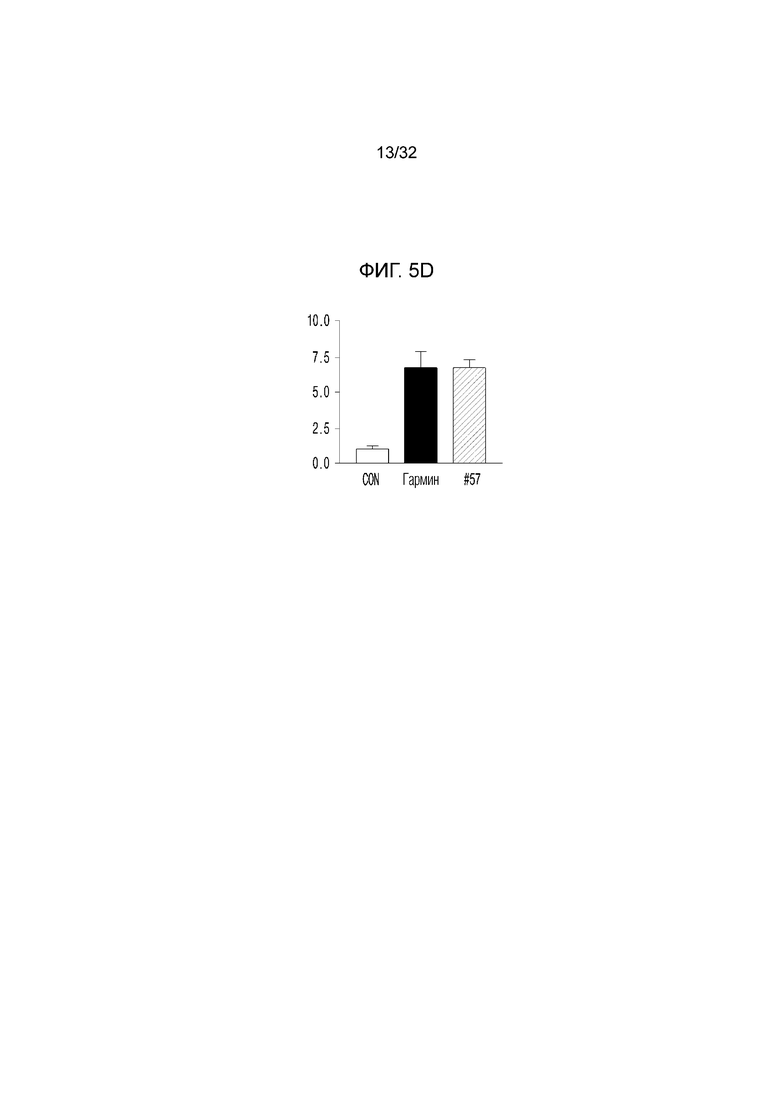

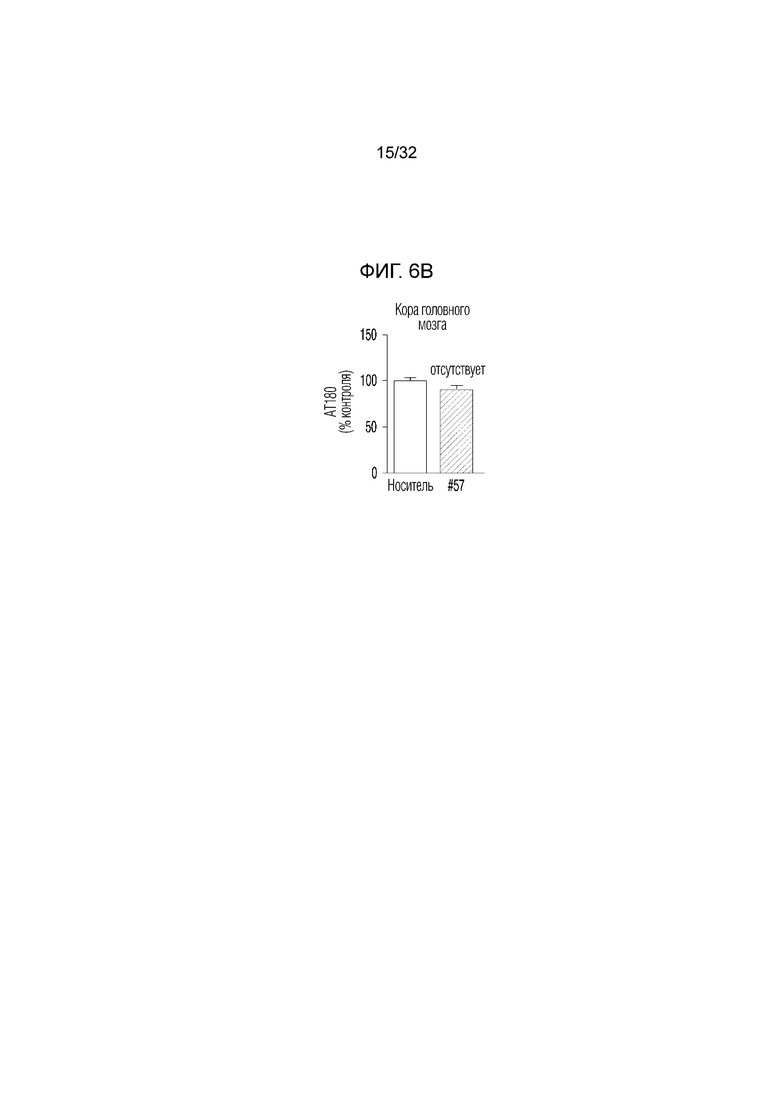

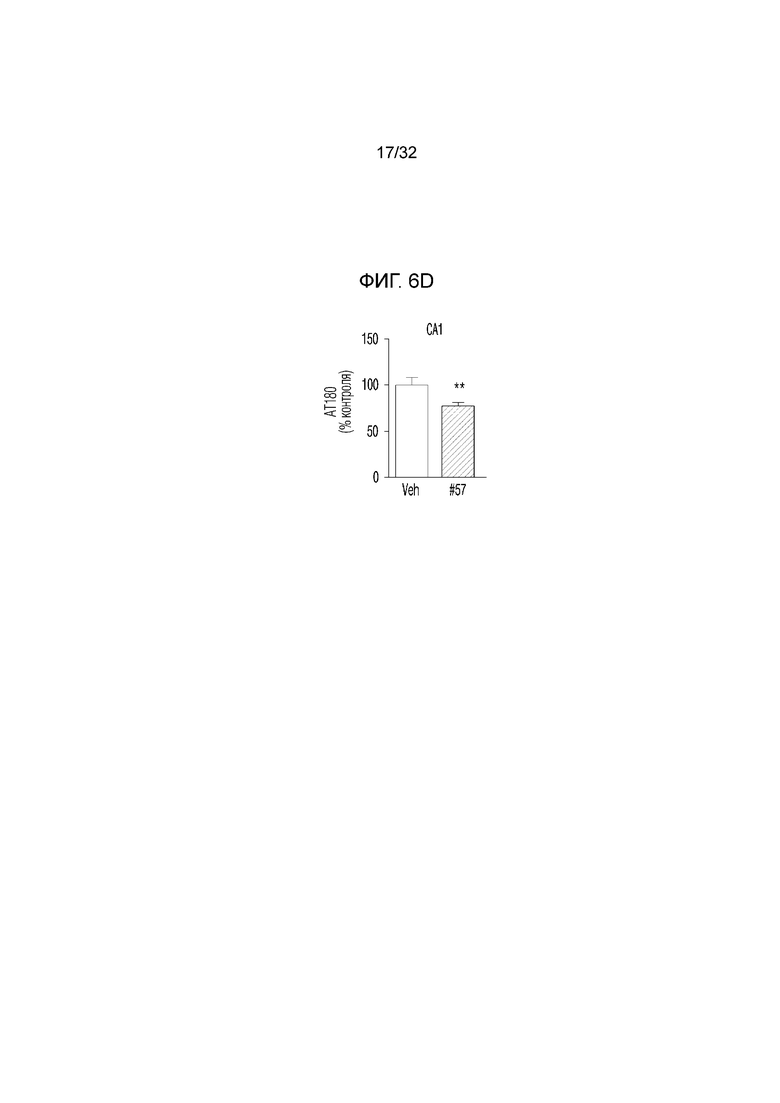

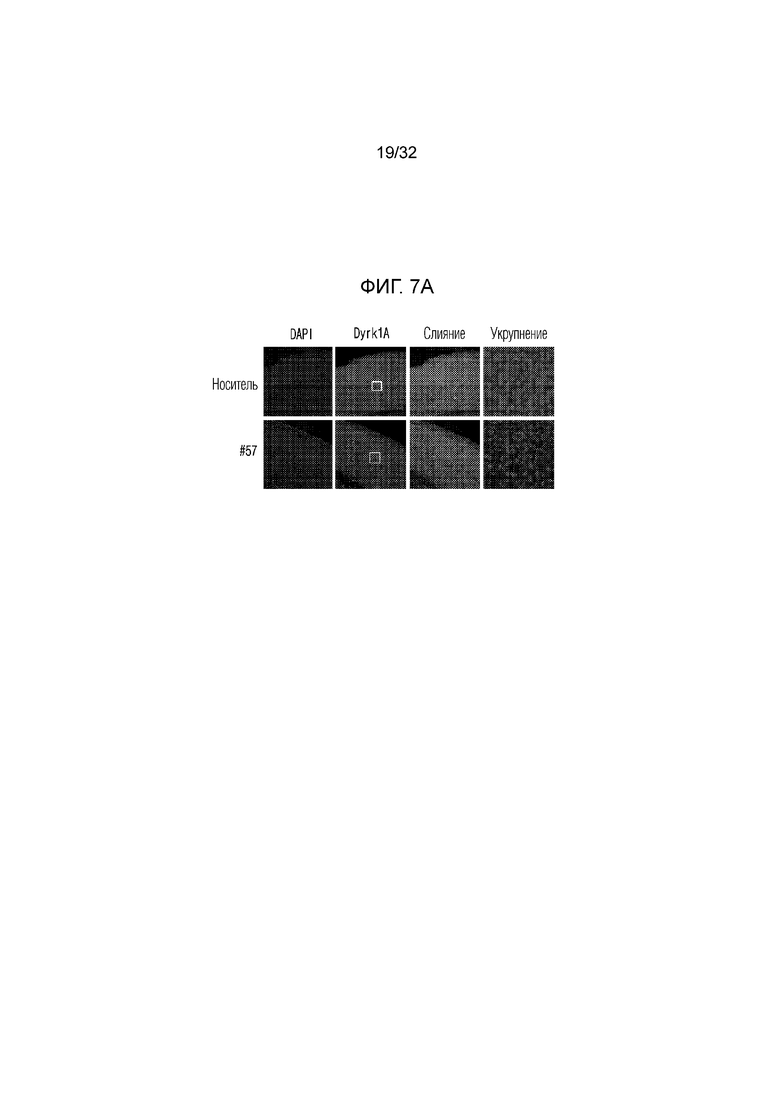
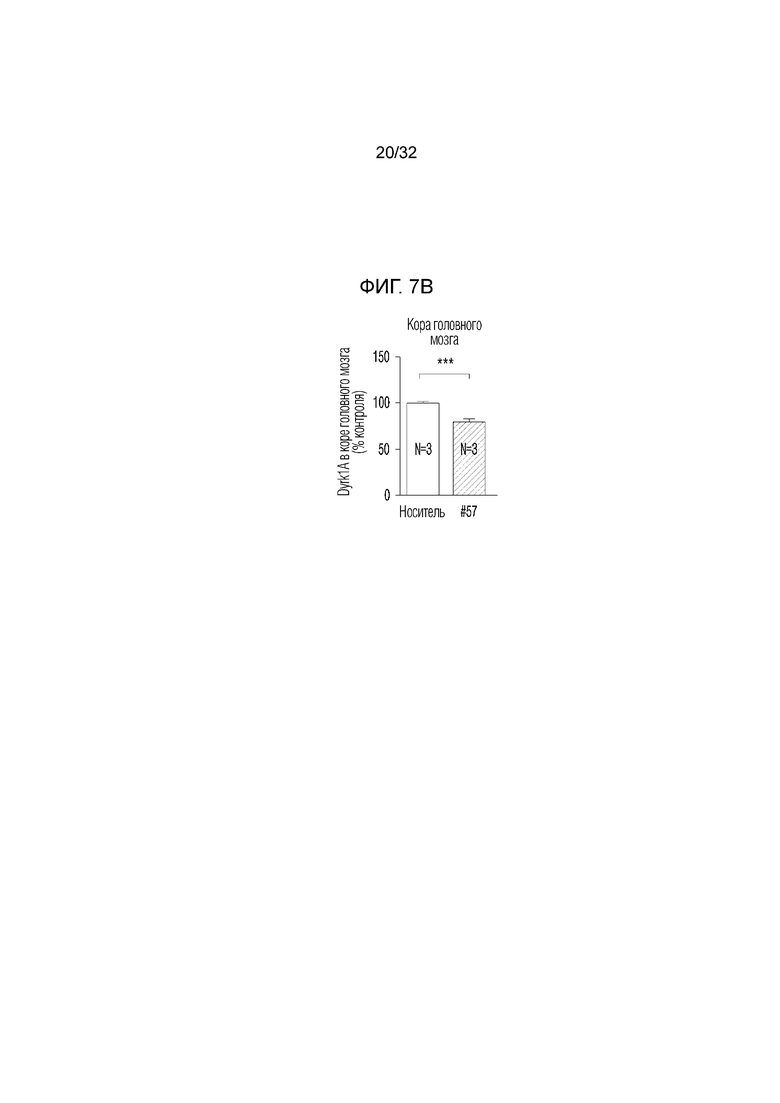
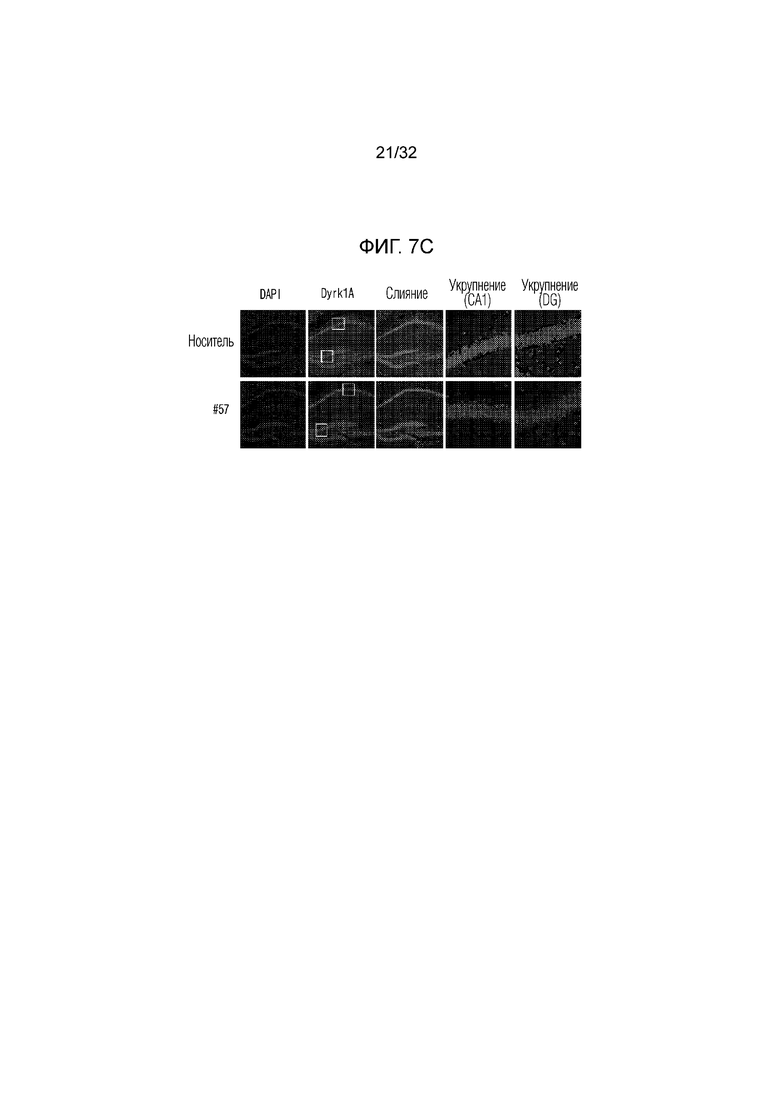
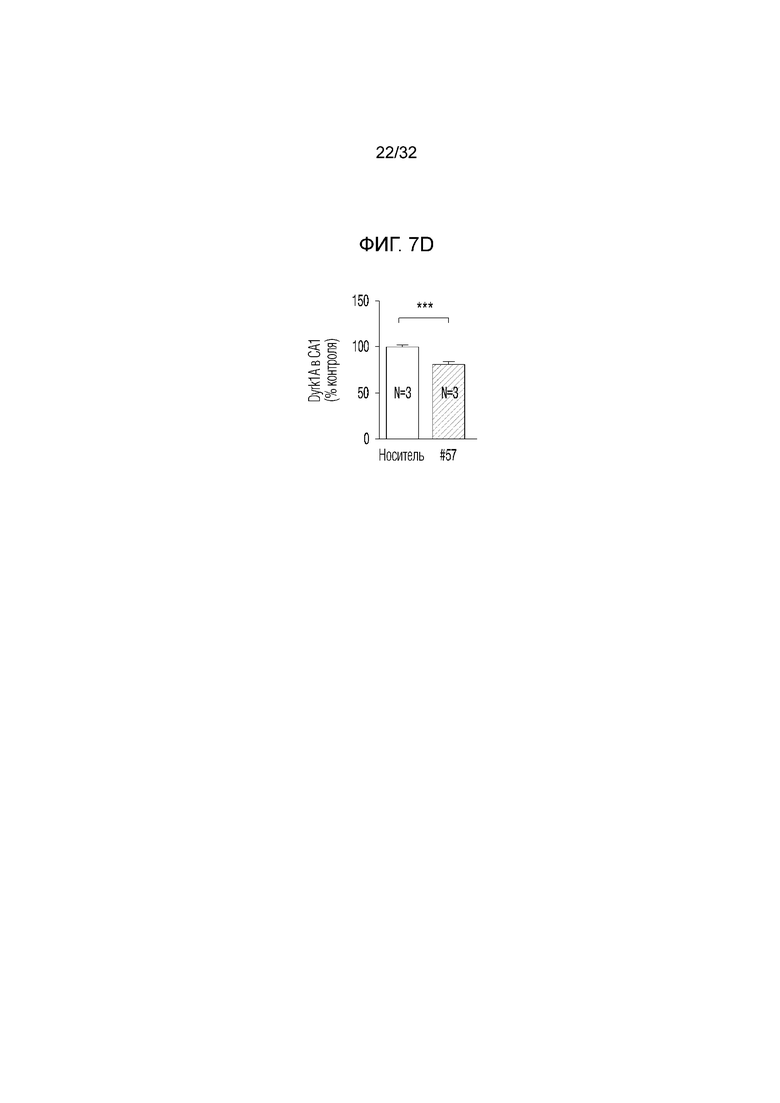

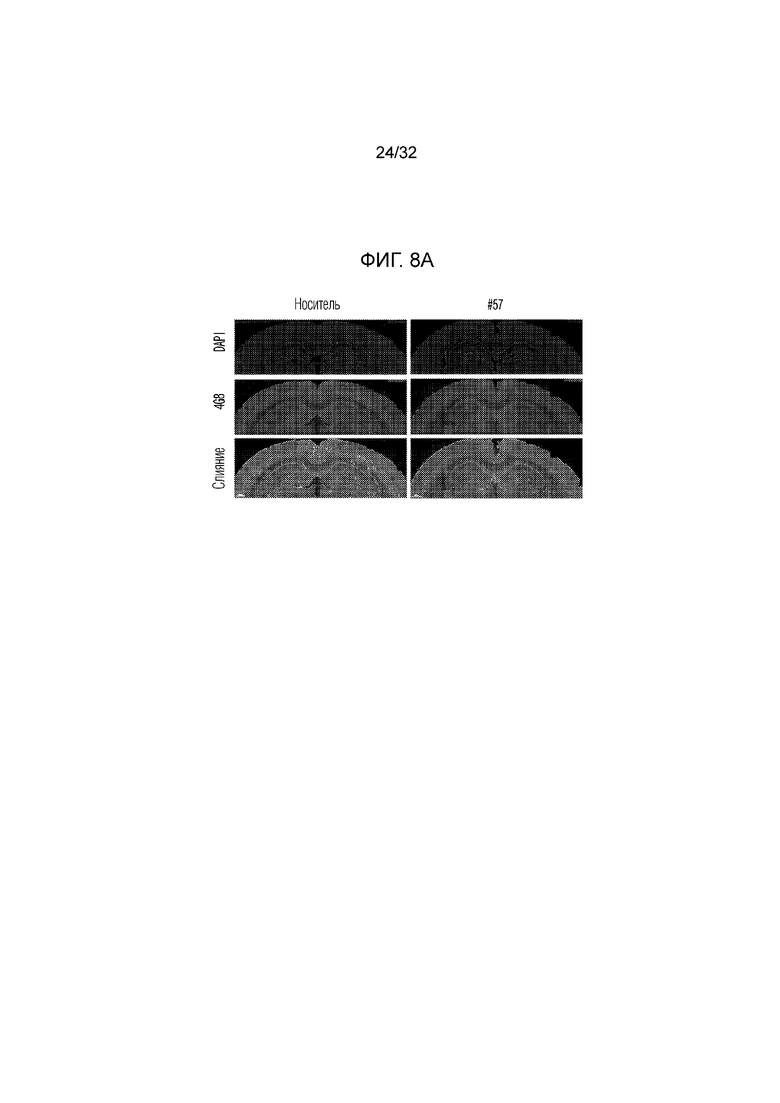


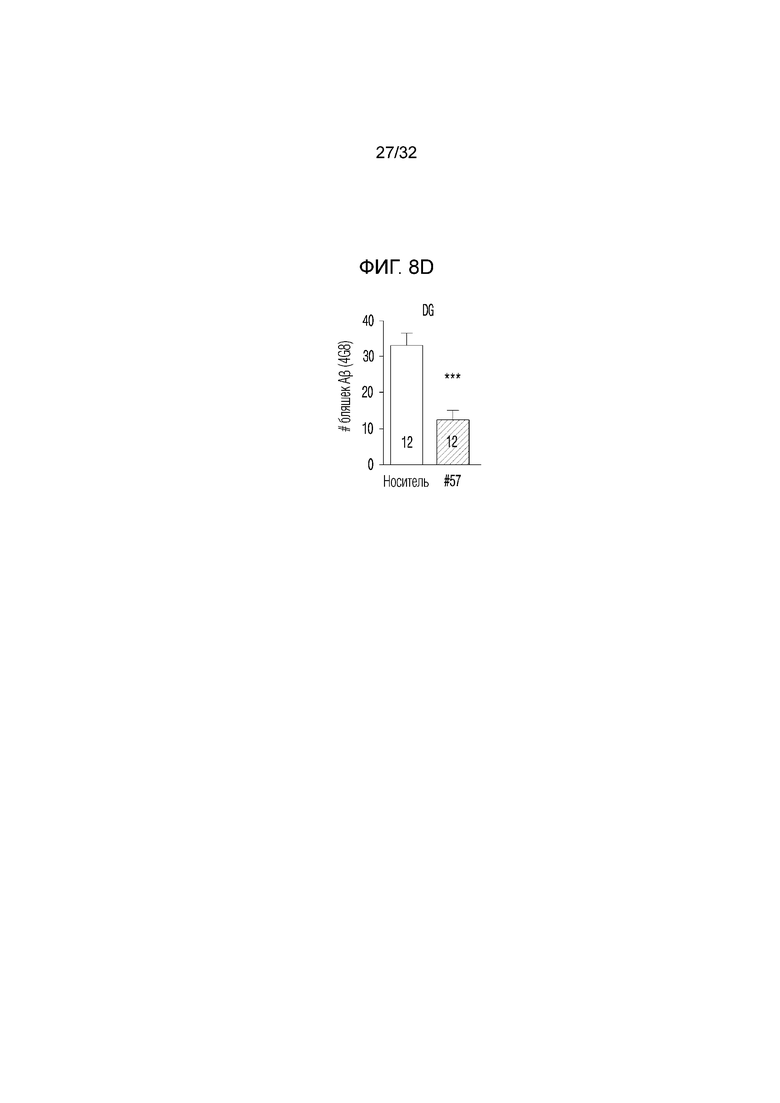




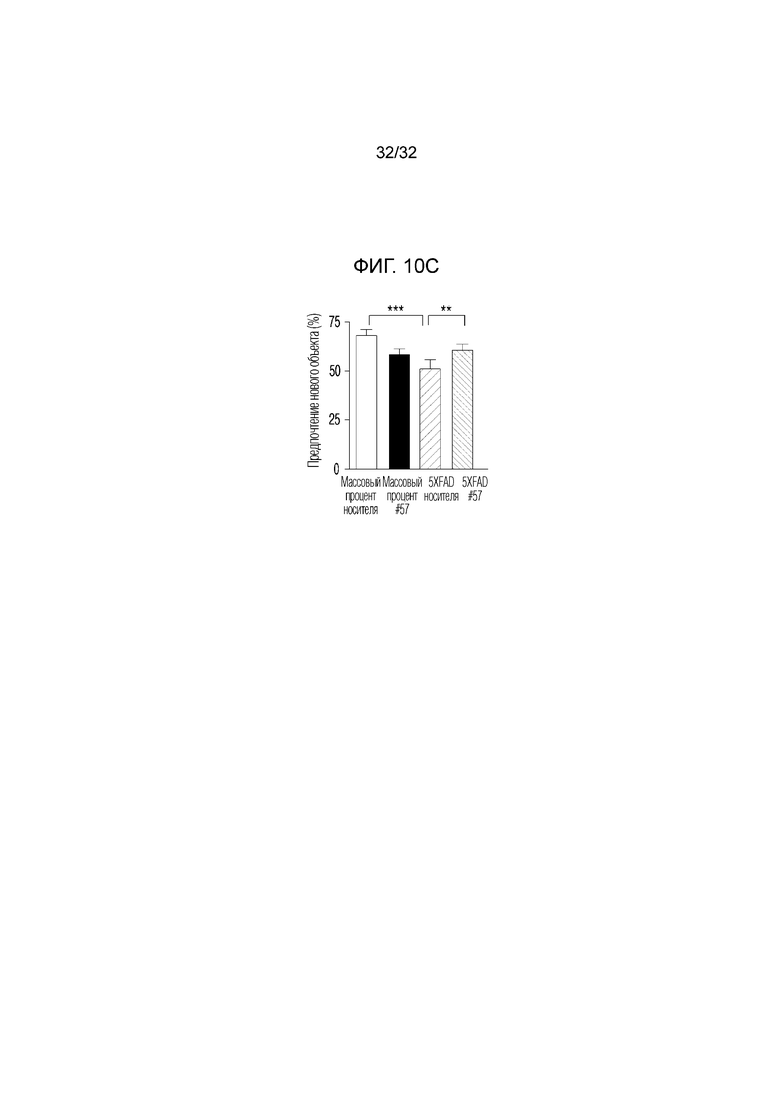
Изобретение относится к области органической химии, а именно к соединению, представленному химической формулой 1 ниже, его оптическому изомеру или его фармацевтически приемлемой соли:
[Химическая формула 1]
 .
.
В химической формуле 1 Z представляет собой циано (-CN) или -CF3; X представляет собой -NRa- или -O-, где Ra представляет собой водород или прямой или разветвленный C1-C10 алкил. Значения радикала R1 и кольца A такие, как приведены в формуле изобретения. Также предложен способ получения соединения формулы 1 и фармацевтические композиции. Технический результат: предложено новое органическое соединение, представленное химической формулой 1, обладающее ингибирующей активностью в отношении различных протеинкиназ, включая DYRK1A, и которое можно использовать для лечения или профилактики дегенеративного заболевания головного мозга. 4 н. и 7 з.п. ф-лы, 10 ил., 7 табл., 23 пр.
1. Соединение, представленное химической формулой 1 ниже, его оптический изомер или его фармацевтически приемлемая соль:
[Химическая формула 1]
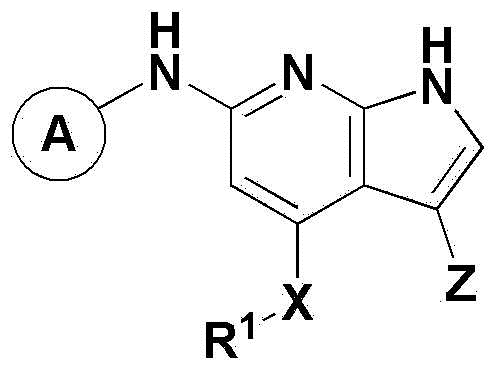
(в химической формуле 1
Z представляет собой циано (-CN) или -CF3;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или прямой или разветвленный C1-C10 алкил;
R1 представляет собой прямой или разветвленный C1-C10 алкил, C3-C8 циклоалкил или C6-14 арил, где алкил или циклоалкил может быть замещен одним заместителем, выбранным из группы, включающей -OH и прямой C1-C3 алкил и C1-C3 алкокси, и арил может быть замещен одним или несколькими заместителями, выбранными из группы, включающей прямой C1-C3 алкил, замещенный одним или несколькими атомами галогена;
или Ra вместе с R1 и атомом азота, к которому они присоединены, могут образовывать 5-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N, O; и
 представляет собой
представляет собой 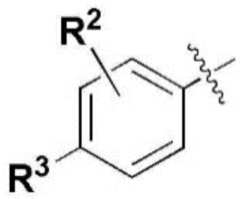 ,
,  ,
, 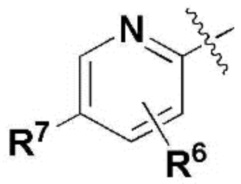 ,
, 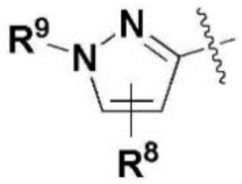 ,
, 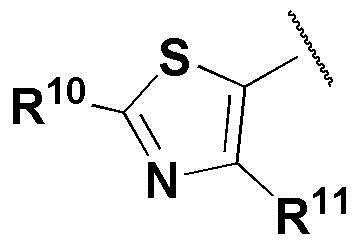 ,
,  ,
,  ,
,
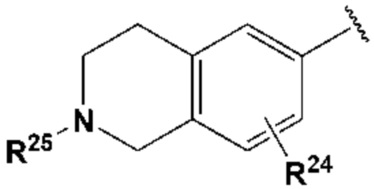 ,
, 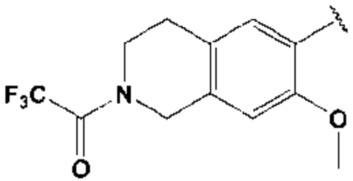 ,
, 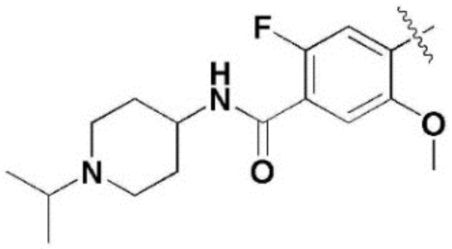 или
или 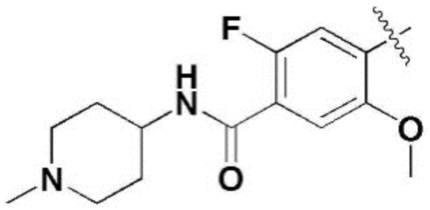 ,
,
где каждый R2, R4, R6, R8, R11, R17, R23 и R24 представляет собой, независимо, один или несколько заместителей, выбранных из группы, включающей водород, галоген, прямой или разветвленный C1-C6 алкил и прямой или разветвленный C1-C6 алкокси;
R3, R5, R7 и R9 представляют собой, независимо, водород; прямой или разветвленный C1-C6 алкил или C1-C6 алкокси; 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из N; или -(C=O)NR26R27, где R26 и R27 представляют собой, независимо, водород или 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из N, замещенный 3-5 членным гетероциклоалкилом, содержащим один атом кислорода, или R26 и R27 вместе с атомом азота, к которому они присоединены, образуют 3-8 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O, где алкил или гетероциклоалкил замещен одним или несколькими заместителями, выбранными из группы, включающей -CN, галоген, прямой или разветвленный C1-C3 алкил, и 3-6 членный гетероциклоалкил, содержащий один или несколько гетероатомов, выбранных из группы, включающей N и O, незамещенный или замещенный одним прямым или разветвленным C1-C3 алкилом,
R10 представляет собой -CR28R29-CN, где R28 и R29 представляют собой, независимо, прямой или разветвленный C1-C3 алкил,
R12, R13, R18, R19, R20 и R21 представляют собой, независимо, водород или прямой или разветвленный C1-C3 алкил, или два из R14, R15, R18, R19, R20 и R21, присоединенные к одному и тому же атому углерода, могут образовывать карбонил вместе с атомом углерода, к которому они присоединены, и
R16, R22 и R25 представляют собой, независимо, водород или прямой или разветвленный C1-C3 алкил).
2. Соединение, его оптический изомер или его фармацевтически приемлемая соль по п.1, где:
Z представляет собой -CN или -CF3;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или метил;
R1 представляет собой метил, этил, н-пропил, изопропил, циклопропил, 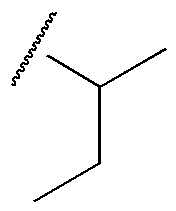 ,
,  , 1-метилциклопропил или фенил, замещенный одним или несколькими CF3;
, 1-метилциклопропил или фенил, замещенный одним или несколькими CF3;
или Ra вместе с R1 и атомом азота, к которому они присоединены, может образовывать морфолинил.
3. Соединение, его оптический изомер или его фармацевтически приемлемая соль по п.1, где:
Z представляет собой -CN или -CF3;
X представляет собой -NRa- или -O-, где Ra представляет собой водород или метил;
R1 представляет собой метил, этил, н-пропил, изопропил, циклопропил,  ,
,  , 1-метилциклопропил или
, 1-метилциклопропил или  ;
;
или Ra вместе с R1 и атомом азота, к которому они присоединены, может образовывать морфолинил.
4. Соединение, его оптический изомер или его фармацевтически приемлемая соль по п.1, где соединение, представленное химической формулой 1, выбрано из группы, включающей следующие соединения:
(1) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (2) 4-(этиламино)-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (3) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-((2-метоксиэтил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (4) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (5) 4-((2-метоксиэтил)амино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (6) 4-((2-метоксиэтил)амино)-6-((1-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (7) 4-((2-метоксиэтил)амино)-6-((1-метил-1H-пиразол-3-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (8) 4-(этиламино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (9) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (10) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (11) 4-(пропиламино)-6-((3,4,5-триметоксифенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (12) 6-((1-метил-1H-пиразол-4-ил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (13) 6-((1-метил-1H-пиразол-3-ил)амино)-4-(пропиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (14) 4-(этиламино)-6-((1-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (15) 4-(этиламино)-6-((1-метил-1H-пиразол-3-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (16) 6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (17) 6-((5-фтор-2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (18) 4-(этиламино)-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (19) 6-((5-фтор-2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (20) 6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)(метил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (21) 6-((5-фтор-2-метокси-4-(морфолин-4-карбонил)фенил)амино)-4-((2-метоксиэтил)(метил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (22) (R)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (23) (S)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (24) 6-((4-((2R,6S)-2,6-диметилморфолин-4-карбонил)-2-метоксифенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (25) 6-((4-(4,4-дифторпиперидин-1-карбонил)-2-метоксифенил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (26) (R)-4-(этиламино)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (27) (S)-4-(этиламино)-6-((2-метокси-4-(2-метилморфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (28) 6-((4-((2R,6S)-2,6-диметилморфолин-4-карбонил)-2-метоксифенил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (29) 6-((4-(4,4-дифторпиперидин-1-карбонил)-2-метоксифенил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (30) 6-((1,3-диметил-1H-пиразол-4-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (31) 6-((1,5-диметил-1H-пиразол-4-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (32) 4-(этиламино)-6-((1-изопропил-3-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (33) 4-(этиламино)-6-((1-изопропил-5-метил-1H-пиразол-4-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (34) 6-((1,5-диметил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (35) 6-((1,3-диметил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (36) 6-((1-изопропил-3-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (37) 6-((1-изопропил-5-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (38) 6-((1-(2-цианопропан-2-ил)-3-метил-1H-пиразол-4-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (39) 6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (40) 4-(этиламино)-6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (41) 6-((5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)амино)(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (42) 6-((5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)амино)(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (43) (R)-4-(этиламино)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (44) (R)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-4-(метиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (45) (5-метокси-6-(4-(метиламино)-3-(трифторметил)-1Н-пирроло[2,3-b]пиридин-6-иламино)пиридин-3-ил)(4-метилпиперазин-1-ил)метанон; (46) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (47) 4-метокси-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (48) 4-метокси-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (49) 4-этокси-6-((2-метокси-4-(4-морфолинопиперидин-1-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (50) 4-этокси-6-((2-метокси-4-(морфолин-4-карбонил)фенил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (51) (R)-6-((3-метокси-5-(2-метилморфолин-4-карбонил)пиридин-2-ил)амино)-4-(1-метилциклопропокси)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (52) 6-((3-метокси-5-(морфолин-4-карбонил)пиридин-2-ил)амино)-4-(1-метилциклопропокси)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (53) N4-этил-3-(трифторметил)-N6-(3,4,5-триметоксифенил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (54) N4-этил-N6-(1-метил-1H-пиразол-3-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (55) N4-этил-N6-(1-метил-1H-пиразол-4-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (56) (4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(морфолино)метанон; (57) (4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (58) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(морфолино)метанон; (59) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-морфолинопиперидин-1-ил)метанон; (60) (2-фтор-5-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (61) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (62) N6-(2-метокси-4-(4-метилпиперазин-1-ил)фенил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (63) (3-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (64) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6yl)амино)фенил)(морфолино)метанон; (65) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-морфолинопиперидин-1-ил)метанон; (66) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)-метанон; (67) (3-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (68) N6-(2-метокси-4-(4-метилпиперазин-1-ил)фенил)-N4-(2-метоксиэтил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (69) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-N4-этил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (70) (4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (71) 4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-5метокси-N-(1-(оксетанeпиперидин-4-ил)бензамид; (72) 4-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-5-метокси-N-(1-метилпиперидин-4-ил)бензиламид; (73) 2-фтор-5-метокси-4-((4-((2-метоксиэтил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)(1-метилпиперидин-4-ил)бензамид; (74) 4-((4-(этиламино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-фтор-N-(1-изопропилпиперидин-4-ил)-5-метоксибензамид; (75) (R)-(2,4-диметилпиперазин-1-ил)(2-фтор-5-метокси-4-((4-(метиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)метанон; (76) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(морфолино)метанон; (77) N-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-амин; (78) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (79) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-3-метоксиэтил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (80) 1-(6-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-7-метокси-3,4-дигидроизохинолин-2(1H)-ил)-2,2,2-трифторэтан-1-он; (81) N4-этил-N6-(7-метокси-1,2,3,4-тетрагидроизохинолин-6-ил)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (82) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-метилпиперазин-1-ил)метанон; (83) (3-метокси-4-((4-морфолино-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(4-(4-метилпиперазин-1-ил)пиперидин-1-ил)метанон; (84) (3-метокси-4-(3-(трифторметил)-4-(3-(трифторметил)фениламино)-1H-пирроло[2,3-b]пиридин-6-иламино)фенил)(морфолино)метанон; (85) (3-метокси-4-(3-(трифторметил)-4-(3-(трифторметил)фениламино)-1H-пирроло[2,3-b]пиридин-6-иламино)фенил)(4-морфолинопиперидин-1-ил)метанон; (86) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)-3-(трифторметил)-N4-(3-(трифторметил)фенил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (87) (3-метокси-4-((4-метоксиэтил)(метил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)(морфолино)метанон; (88) (3-метокси-4-((4-метоксиэтил)(метил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)фенил)((4-морфолинопиперидин-1-ил)метанон; (89) N6-(5-хлор-1-((3S,4S)-3-фтор-1-(оксетан-3-ил)пиперидин-4-ил)-1H-пиразол-4-ил)метоксиэтил)-N4-метил-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-4,6-диамин; (90) (4-(4-(изопропиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-иламино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (91) (R)-(4-((4-((1-гидрокси-3-метилбутан-2-ил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (92) (R)-(4-((4-((1-гидрокси-3-метилбутан-2-ил)амино)-3-(трифторметил)-1H-пирроло[2,3-b]амино)-3-метоксифенил)(морфолино)метанон; (93) (S)-(4-((4-(2-бутиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(4-морфолинопиперидин-1-ил)-метанон; (94) (4-((4-(циклопропиламино)-3-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-6-ил)-3-метоксифенил)(4-морфолинопиперидин-1-ил)метанон; (95) (4-((4-(циклопропиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-3-метоксифенил)(морфолино)метанон; (96) 5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-6-метокси-2-метилизоиндолин-1-он; (97) 7-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-6-метокси-2,2,4-триметил-2H-бензо[1,4]оксазин-3(4H)-1-он; (98) 6-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-5-метокси-2-метилизоиндолин-1-он; (99) 4-(этиламино)-6-((6-метокси-2-метил-3-оксоизоиндол-5-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (100) 6-((2(2-цианопропан-2-ил)-4-метилтиазол-5-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (101) (6-хлор-5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-метилизоиндолин-1-он; (102) 5-((4-(этиламино)-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-6-ил)амино)-2-метилизоиндолин-1-он; (103) 4-(этиламино)-6-((2-метил-1-оксоизоиндол-5-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; (104) 6-((6-хлор-2-метил-1-оксоизоиндолин-5-ил)амино)-4-(этиламино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил; и (105) 4-(этиламино)-6-((6-метокси-2,2,4-триметил-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-7-ил)амино)-1H-пирроло[2,3-b]пиридин-3-карбонитрил.
5. Способ получения соединения, представленного химической формулой 1, включающий следующие стадии, как показано на схеме реакции 1 ниже:
получение соединения, представленного химической формулой 4, путем взаимодействия соединения, представленного химической формулой 2, с соединением, представленным химической формулой 3 (стадия 1); и
получение соединения, представленного химической формулой 1, путем взаимодействия соединения, представленного химической формулой 4, полученного на стадии 1 выше, в присутствии кислоты (стадия 2):
[Схема реакции 1]
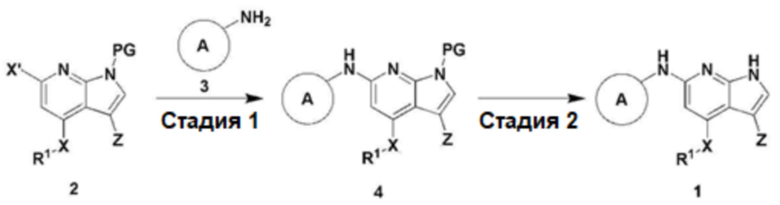
(на схеме реакции 1, X, Z, R1 и  имеют значения, определенные для химической формулы 1 по п.1;
имеют значения, определенные для химической формулы 1 по п.1;
X' представляет собой галоген; и
PG представляет собой (2-(триметилсилил)метокси)метил (SEM), трет-бутилоксикарбонил (BOC), карбобензилокси (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), ацетил (Ac), бензоил (Bz), бензил (Bn), 3,4-диметоксибензил (DMPM), п-метоксифенил (PMP), тозил (Ts), 2,2,2-трихлорэтоксикарбонил (Troc), 2-триметилсилилэтоксикарбонил (Teoc), арилоксикарбонил (Alloc) или п-метоксибензил (PMB)).
6. Фармацевтическая композиция для лечения или профилактики дегенеративного заболевания головного мозга, содержащая:
(i) эффективную дозу соединения, представленного химической формулой 1 по п.1, его оптический изомер или его фармацевтически приемлемую соль; и
(ii) фармацевтически приемлемый наполнитель.
7. Фармацевтическая композиция по п.6, где соединение ингибирует активность протеинкиназы.
8. Фармацевтическая композиция по п.7, где протеинкиназа представляет собой один или несколько ферментов, выбранных из группы, состоящей из ALK, ALK (C1156Y), ALK (L1196M), CAMK1B, CAMK1D, CHEK2, CLK1, CLK2, CLK3, CLK4, CSNK1A1, CSNK1A1L, CSNK1D, CSNK1E, CSNK1G2, CSNK1G3, DAPK1, DAPK2, DAPK3, DRAK2, DYRK1A, DYRK1B, DYRK2, ERK5, ERN1, GAK, HASPIN, INSRR, JNK1, JNK2, JNK3, KIT (V559D), LATS2, LRRK2, LRRK2 (G2019S), LTK, MAPKAPK2, MEK1, MEK2, MEK3, MEK4, MYLK, NIK, PHKG1, PHKG2, PIP5K2C, PRKD1, PRKD2, PRKD3, RIPK5, ROCK1, ROCK2, RPS6KA4 (Kin.Dom.2-C-terminal), RPS6KA5 (Kin.Dom.2-C-terminal), RSK3 (Kin.Dom.2-C-terminal), STK33, STK39, TSSK1B, TSSK3, TTK и YSK4.
9. Фармацевтическая композиция по п.6, где дегенеративное заболевание головного мозга представляет собой одно или несколько заболеваний, выбранных из группы, включающей болезнь Альцгеймера, синдром Дауна, болезнь Паркинсона, болезнь Лу Герига, деменцию, болезнь Хантингтона, рассеянный склероз, проксимальный латеральный склероз, апоплексию, инсульт или умеренные когнитивные нарушения.
10. Фармацевтическая композиция по п.9, где деменция представляет собой одно или несколько заболеваний, выбранных из группы, включающей деменцию Альцгеймера, цереброваскулярную деменцию, деменцию, вызванную травмой головы, мультиинфарктную деменцию, деменцию Альцгеймера/мультиинфарктную деменцию и алкогольную деменцию.
11. Фармацевтическая композиция, ингибирующая активность протеинкиназы DYRK1A, содержащая соединение, представленное химической формулой 1 по п.1, его оптический изомер или его фармацевтически приемлемую соль в качестве активного ингредиента.
| KR 20160106623 A, 12.09.2016 | |||
| WO 2014170248 A1, 23.10.2014 | |||
| WO 2006127587 A1, 30.11.2006 | |||
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ЯНУС-КИНАЗЫ 3 | 2006 |
|
RU2434013C2 |
Авторы
Даты
2020-08-26—Публикация
2018-03-23—Подача