ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка испрашивает приоритет заявки на патент Кореи No.10-2020-0089940, поданной 21 июля 2020 г., и все содержание, раскрытое в описании и чертежах этой заявки, включено в настоящую заявку.
Настоящее изобретение относится к группе соединений, которые обладают активностью разрушения андрогенового рецептора. Настоящее изобретение также относится к фармацевтическим композициям, содержащим такие соединения. Настоящее изобретение также относится к пригодным способам лечения заболеваний, связанных с андрогеновым рецептором, с применением таких соединений. То есть, настоящее изобретение относится к медицинскому применению соединений настоящего изобретения для лечения или предотвращения заболеваний, связанных с андрогеновым рецептором.
УРОВЕНЬ ТЕХНИКИ
Рецептор андрогенного гормона (AR) представляет собой фактор транскрипции, относящийся к ядерному гормональному рецептору (NR). В отсутствие андрогенов AR связывается с белком теплового шока 90 (Hsp90). Hsp90 и AR диссоциированы, и андроген связывается с AR. Когда AR связывается с гормоном дигидротестостероном (ДГТ), эти комплексы перемещаются в ядро и посредством ряда процессов активируют транскрипцию генов-мишеней.
AR способствует развитию маскулинности, но он также является хорошо известным онкогеном при некоторых формах рака, включающих рак предстательной железы (Endocr. Rev. 2004, 25(2), 276-308). Существующие схемы лечения рака предстательной железы, связанного с андрогенами, можно разделить на две основные категории. Первый подход заключается в контроле уровня андрогенов путем удаления андрогенов или предотвращения их транслокации в ядро путем вмешательства в связывание его лиганда, ДГТ. Вторая стратегия направлена на подавление функции AR путем воздействия на AR (Nature Reviews Drug Discovery, 2013, 12, 823-824). То есть, альтернативный подход к лечению рака предстательной железы предполагает удаление белка AR. AR является важным фактором онкогенеза при многих формах рака предстательной железы.
Этот AR также может быть основной мишенью для лечения акне, алопеции (особенно андрогенной алопеции), кожных ран, гирсутизма и т.д. (Arch Dermatol Res. 2012 September; 304(7): 499-510, Biomedicine & Pharmacotherapy 137 (2021) 111247), и было обнаружено, что экспрессия и активация AR также играют важную роль в развитии рака молочной железы (особенно трижды негативного рака молочной железы, положительного по андрогеновому рецептору (AR+ ТНРМЖ)) (npj Breast Cancer (2020) 6: 47).
Типичные лекарственные средства против андрогенового рецептора включают в себя энзалутамид и бикалутамид, а недавно был одобрен апалутамид. Тем не менее, около 15-25% больных раком предстательной железы не реагируют на антиандрогенные препараты, и одобренные препараты обладают отличным противораковым действием на начальном этапе введения, но при постоянном применении развивается лекарственная устойчивость, что затрудняет их более длительное применение. Поэтому существует острая необходимость в разработке новых терапевтических агентов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Соответственно, задачей, подлежащей решению настоящим изобретением, является обеспечение соединения, обладающего активностью, разрушающей андрогеновый рецептор (AR), фармацевтических композиций, содержащих его в качестве активного ингредиента, и медицинское применение для лечения или предупреждения заболеваний, связанных с AR.
Другой задачей, подлежащей решению настоящим изобретением, является обеспечение способа лечения или облегчения заболеваний, связанных с AR, отличающегося тем, что с его помощью разрушают AR и, следовательно, снижают активность AR, и данный способ содержит введение пациенту, нуждающемуся в лечении, облегчении или предупреждении заболеваний, связанных с AR, соединения согласно настоящему изобретению.
РЕШЕНИЕ ТЕХНИЧЕСКОЙ ЗАДАЧИ
Соединения настоящего изобретения
Для решения вышеуказанной проблемы, один вариант осуществления настоящего изобретения обеспечивает соединение, представленное следующей химической формулой 1 или его фармацевтически приемлемую соль.
Химическая формула 1

В химической формуле 1,
R1 представляет собой H, C1-6алкил, галоген, галогенС1-6алкил, C1-6алкокси или галоС1-6алкокси,
R2 представляет собой H, C1-4алкил, галоген или галоС1-4алкил,
X1, X3, X4 и X5, каждый независимо представляет собой CH или N,
X2 представляет собой CR3 или N, где R3 представляет собой H, C1-6алкил, галоген, галоС1-6алкил, C1-6алкокси или -OH,
n равно 0, 1 или 2,
m равно 0 или 1,
L представляет собой следующую химическую формулу 2,
химическая формула 2

в химической формуле 2,
A1, A2 и A3 каждый независимо представляет собой прямую связь, -O-, -N(R4)-, -C(O)-, -CC-, -C(O)NH-, -NHC(O)-, -C (O)CH2NH- или -C(O)CH2O-, где R4 представляет собой H, C1-6алкил или галоС1-6алкил,
B1, B2 и B3 каждый независимо представляет собой прямую связь, C3-12циклоалкил, гетероцикл, арил или гетероарил, где они необязательно имеют один или несколько атомов водорода, замещенных C1-6алкилом, галогеном, галоС1-6алкилом или -ОН,
q1-q6 каждый независимо представляет собой целое число от 0 до 6,
E представляет собой следующую химическую формулу 3 или 4.
Химическая формула 3

Химическая формула 4
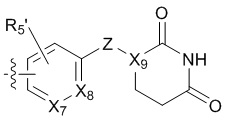
В химической формуле 3 и 4,
X6, X7, X8 и X9 каждый независимо представляет собой CH или N,
Y представляет собой -C(R6)2-, -C(O)-, -C(R6)2-C(R6')2-, -C(R6)=C(R6')-, -C(R6)=N-, -N=C(R6)- или -N=N-,
Z представляет собой прямую связь, -C(R6)2-, -N(R6)-, -O- или -C(O)NH-,
R5 и R5' каждый независимо представляет собой H, C1-4алкил, галоген, галоС1-4алкил, C1-4алкокси или галоС1-4алкокси,
R6 и R6' каждый независимо представляет собой H, C1-4алкил, галоген, галоС1-4алкил, C1-4алкокси или галоС1-4алкокси.
Авторы настоящего изобретения попытались получить новое соединение с превосходной активностью разрушения AR, стабильностью (при метаболизме) и т.д., а также превосходными физико-химическими свойствами (значение cLogP, растворимость в воде, проницаемость через клеточную мембрану) в качестве активного ингредиента путем объединения лиганда CRBN (E в химической формуле 1) со специфической структурой, которая связывается с убиквитинлигазой Е3, и фрагментом, который связывается с AR (левая часть соединения относительно линкера). С этой целью использовали различные известные AR-связывающие агенты, такие как энзалутамид, но, вопреки ожиданиям, желаемая степень активности или физические свойства не могли быть достигнуты. При использовании нового AR-связывающего фрагмента, используемого только в настоящем изобретении, могут быть получены соединения, обладающие лучшей активностью и физическими свойствами.
Кроме того, эти соединения более полно отвечали различным задачам настоящего изобретения в конкретных комбинациях. Например, в случае фрагмента(связывающего AR), который связывается с AR, когда пиридиновое кольцо превращается в пиримидиновое или бензольное кольцо, активность разрушения AR относительно снижается. Когда левое бензольное кольцо химической формулы 1 превращали в пиридиновое кольцо, а F вводили в пиперидиновое кольцо, активность разрушения AR имела тенденцию к снижению. Кроме того, в случае линкера (L в формуле 1) линейный линкер был менее предпочтительным с точки зрения активности разрушения AR и метаболической стабильности, а когда длина линкера была слишком короткой, активность деградации AR имела тенденцию к снижению. Некоторые молекулы линкера были менее желательны, чем другие, с точки зрения активности разрушения AR или метаболической стабильности. Кроме того, в случае фрагментов, связывающих CRBN (E в химической формуле 1), некоторые фрагменты, связывающие CRBN, были менее предпочтительны с точки зрения активности разрушения AR, фармакокинетики (скорость перорального всасывания и т.д.) или физико-химических свойств (растворимость и т.д.).
С другой стороны, соединения настоящего изобретения обладают превосходной активностью разрушения в отношении мутантов AR (T877A, M896V, F876L, H874Y, L702H, W741C и т.д.). Поскольку резистентность к существующим лекарственным средствам против андрогеновых рецепторов может быть вызвана мутацией AR, превосходная активность соединений настоящего изобретения в отношении разрушения мутантов AR может помочь преодолеть устойчивость к существующим лекарственным средствам. Например, соединения примеров 6 и 49 настоящего изобретения показали активность деградации 73% и 46% соответственно для мутанта T877A AR при концентрации 100 нМ.
Кроме того, другим механизмом возникновения устойчивости к существующим способам лечения является экспрессия вариантов сплайсинга AR (например, AR-V7). Соединения настоящего изобретения прекрасно снижают экспрессию этих вариантов (например, AR-V7) и, таким образом, обладают лучшим антипролиферативным эффектом в AR-V7-положительных клетках рака предстательной железы. Например, соединения примеров 6 и 169 настоящего изобретения ингибировали экспрессию AR-V7 на 87% и 48% соответственно при концентрации 100 нМ.
Используемые здесь термины «заместитель», «радикал», «группа», «агент» и «фрагмент» могут быть использованы взаимозаменяемо.
Если заместитель описан как «необязательно замещенный», то этот заместитель может быть (1) незамещенным или (2) замещенным одним или несколькими определенными заместителями. Если замещаемое положение незамещено, заместителем по умолчанию является гидридный радикал.
Используемый здесь термин «алкил» означает насыщенный нециклический углеводород с прямой или разветвленной цепью, если из контекста явно не следует иное, содержащий от 1 до 10 атомов углерода. Термин «низший алкил» означает алкил, содержащий от 1 до 4 атомов углерода. Типичные насыщенные алкилы с прямой цепью включают в себя -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -н-октил, -н-нонил и -н-децил, в то время как насыщенные разветвленные алкилы включают в себя -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и т.п.
Используемый здесь термин «алкокси» означает -O-(алкил), включая -OCH3, -OCH2CH3, -O(CH2)2CH3, -O(CH2)3CH3, -O(CH2)4CH3, -O(CH2)5CH3 и т.п., где алкил является таким, как описано выше.
Используемый здесь термин «C1-6», «C1-6» или «C1-C6» означает, что число атомов углерода составляет от 1 до 6. Например, термин «C1-6алкил» означает алкил, у которого число атомов углерода равно любому целому числу от 1 до 6.
Используемые здесь термины «галоген» и «гало» означают фтор, хлор, бром или йод. В предпочтительном варианте осуществления настоящего изобретения галоген представляет собой хлор или фтор.
Используемый здесь термин «галогеналкил», «галогеналкокси», «галогеналкенил» или «галогеналкинил» означает алкильную, алкоксильную, алкенильную или алкинильную группу соответственно, в которой один или несколько атомов водорода замещены атомами галогена. Например, галогеналкил включает в себя -CF3, -CHF2, -CH2F, -CBr3, -CHBr2, -CH2Br, -CCl3, -CHCl2, -CH2Cl, -CI3, -CHI2, -CH2I, -CH2-CF3, -CH2- CHF2, -CH2-CH2F, -CH2-CBr3, -CH2-CHBr2, -CH2-CH2Br, -CH2-CCl3, -CH2-CHCl2, -CH2-CH2Cl, -CH2-CI3, -CH2-CHI2, -CH2- CH2I и т.п., где алкил и галоген являются такими, как описано выше. В предпочтительном варианте осуществления настоящего изобретения галогеналкил представляет собой -CF3.
Используемый здесь термин «циклоалкил» означает моноциклическое или полициклическое насыщенное кольцо, содержащее атомы углерода и водорода и не имеющее множественных углерод-углеродных связей. Примеры моноциклических колец включают в себя без ограничений (C3-C7)циклоалкильные группы, включая циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Примеры полициклических колец включают в себя без ограничений конденсированные бициклические кольца, такие как октагидропентален и декагидронафталин; спирокольца, такие как спиро[3.3]гептан, спиро[3.4]октан, спиро[3.5]нонан, спиро[4.4]нонан, спиро[4.5]декан и спиро[5.5]ундекан; и мостиковые бициклические кольца, такие как бицикло[2.1.1]гексан, бицикло[2.2.1]гептан и бицикло[2.2.2]октан. Циклоалкильная группа может быть незамещенной или необязательно замещенной.
Термин «гетероцикл» или «гетероциклоалкил» означает 5-7-членное моноциклическое или 7-12-членное бициклическое насыщенное гетероциклическое кольцо, которое содержит от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода и серы, и где гетероатомы азота и серы могут быть необязательно окислены, и гетероатом азота может быть необязательно кватернизован. Гетероциклы включают в себя гетероарилы, как определено выше. Типичные гетероциклы включают в себя оксиран, оксетан, тетрагидрофуран, тетрагидропиран, 1,4-диоксан, азиридин, азетидин, пирролидин, пиперидин, пиперазин, пирролидинон, гидантоин, валролактам, тииран, тиетан, тетрагидротиофен, тетрагидротиопиран, морфолин, тетрагидропиридин и тетрагидропиримидин. Гетероциклы включают в себя бициклическое кольцо, в котором часть гетероцикла конденсирована с бензольным или циклопента-1,3-диеновым кольцом. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Кроме того, гетероциклы включают в себя конденсированные бициклические кольца, спирокольца и мостиковые бициклические кольца, в которых один или несколько атомов углерода вышеупомянутых полициклических колец заменены атомами азота, кислорода или серы. Например, когда гетероатом представляет собой азот, они включают в себя без ограничений конденсированные гетеробициклические кольца, такие как октагидроциклопента[c]пиррол, октагидропирроло[3,4-c]пиррол, декагидроизохинолин и декагидро-2,6-нафтиридин; спирокольца, такие как 2-азаспиро[3.3]гептан, 2,6-диазаспиро[3.3]гептан, 2-азаспиро[3.4]октан, 2,6-диазаспиро[3.4]октан, 2-азаспиро[3.5]нонан, 2,7-диазаспиро[3.5]нонан, 2-азаспиро[4.4]нонан, 2,7-диазаспиро[4.4]нонан, 8-азаспиро[4.5]декан, 2,8-диазаспиро[4.5]декан, 3-азаспиро[5.5]ундекан и 3,9-диазаспиро[5.5]ундекан; и мостиковые гетеробициклические кольца, такие как 2-азабицикло[2.1.1]гексан, 2-азабицикло[2.2.1]гептан, 2,5-диазабицикло[2.2.1]гептан, 2-азабицикло[2.2.2]октан и 2,5-диазабицикло[2.2.2]октан.
Используемый здесь термин «арил» означает карбоциклическую ароматическую группу, содержащую от 5 до 10 атомов в кольце. Типичные примеры включают в себя без ограничений фенил, толил, ксилил, нафтил, тетрагидронафтил, антраценил, флуоренил, инденил и азуленил. Карбоциклическая ароматическая группа может быть незамещенной или необязательно замещенной.
Используемый здесь термин «гетероарил» означает ароматическое гетероциклическое кольцо, содержащее от 5 до 10 членов и имеющее, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы, и содержащее по меньшей мере 1 атом углерода, включая как моно-, так и бициклические кольцевые системы. Типичными гетероарилами являются фуран, 4H-пиран, пиррол, имидазол, пиразол, триазол, тетразол, пиридин, пиримидин, пиридазин, пиразин, триазин, тиофен, оксазол, изоксазол, тиазол, изотиазол, оксадиазол, бензофуран, бензотиофен, хинолин, индол, бензоксазол, бензимидазол, бензотиазол, циннолин, фталазин, хиназолин, 1Н-азепин и т.п.
В различных аспектах, таких как активность разрушения AR, стабильность (при метаболизме), физико-химические свойства и т.д., предпочтительный вариант осуществления настоящего изобретения обеспечивает соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль, где
R1 представляет собой H, C1-6алкил, галоген или галогенС1-6алкил,
R2 представляет собой H или C1-2алкил,
X1, X3, X4 и X5 каждый независимо представляет собой CH или N,
X2 представляет собой CR3 или N, где R3 представляет собой H, C1-6алкил, галоген или -OH,
n равно 0, 1 или 2,
m равно 0 или 1,
L представляет собой следующую химическую формулу 2,
химическая формула 2

в химической формуле 2,
A1, A2 и A3 каждый независимо представляет собой прямую связь, -O-, -N(R4)-, -C(O)-, -CC-, -C(O)NH-, -NHC(O)-, -C (O)CH2NH- или -C(O)CH2O- (предпочтительно прямая связь, -O-, -N(R4)-, -C(O)-, -CC-, -C(O)NH-, или -C(O)CH2NH-), где R4 представляет собой H или C1-6алкил,
B1, B2 и B3 каждый независимо представляет собой прямую связь или любой из следующих заместителей,

где каждый из R4' независимо представляет собой H, C1-4алкил, галогенС1-4алкил, галоген или -OH,
q1-q6 каждый независимо представляет собой целое число от 0 до 4,
E представляет собой следующую химическую формулу 3 или 4.
химическая формула 3

химическая формула 4

В химической формуле 3 и 4,
X6, X7, X8 и X9 каждый независимо представляет собой CH или N,
Y представляет собой -C(R6)2-, -C(O)- или -N=N-,
Z представляет собой прямую связь, -N(R6)- или -C(O)NH-,
R5 и R5' каждый независимо представляет собой H, C1-4алкил, галоген, галогенС1-4алкил или C1-4алкокси,
R6 каждый независимо представляет собой H, C1-4алкил или галогенС1-4алкил.
В предпочтительном варианте осуществления настоящее изобретение обеспечивает соединение, представленное химической формулой 1, или его фармацевтически приемлемую соль, где
R1 представляет собой галоген или галогенС1-6алкил (предпочтительно R1 представляет собой Cl или CF3),
R2 представляет собой Н,
X1 представляет собой N или CH (предпочтительно CH),
Х3, Х4 и Х5 каждый независимо представляет собой комбинацию N, СН и СН; N, N и СН; или CH, N и N (предпочтительно, N, CH и CH; или CH, N и N),
X2 представляет собой CR2, где R2 представляет собой H, F или CH3 (предпочтительно, H),
n равно 1,
m равно 0,
L представляет собой следующую химическую формулу 2,
химическая формула 2

в химической формуле 2,
A2 представляет собой прямую связь, A1 и A3 каждый независимо представляет собой прямую связь или -O- (предпочтительно, когда A3 представляет собой -O-, B3 представляет собой прямую связь и q6 равно 0, и когда A1 представляет собой -O-, q1 равно 0),
B1, B2 и B3, каждый независимо, представляют собой прямую связь или любой из следующих заместителей,

где R4' каждый независимо представляет собой H или C1-4алкил (предпочтительно, H или CH3),
q1-q6 каждый независимо представляет собой целое число от 0 до 2, (предпочтительно  и
и  не связаны напрямую с кольцом, содержащим X3, X4 и X5),
не связаны напрямую с кольцом, содержащим X3, X4 и X5),
E представляет собой следующую химическую формулу 3.
Химическая формула 3

В химической формуле 3,
X6 представляет собой CH или N (предпочтительно CH),
Y представляет собой -C(O)- или -CH2- (предпочтительно -C(O)-),
R5 представляет собой Н или галоген (предпочтительно Н или F).
В одном варианте осуществления настоящего изобретения химическая формула 1, за исключением -L-E (связанная с *-L-E), может представлять собой любую из следующих структур:

В предпочтительном варианте осуществления настоящего изобретения химическая формула 1, за исключением -L-E (связанная с *-L-E), может быть любой из следующих структур:

В одном варианте осуществления настоящего изобретения E в химической формуле 1 может представлять собой любую из следующих структур:
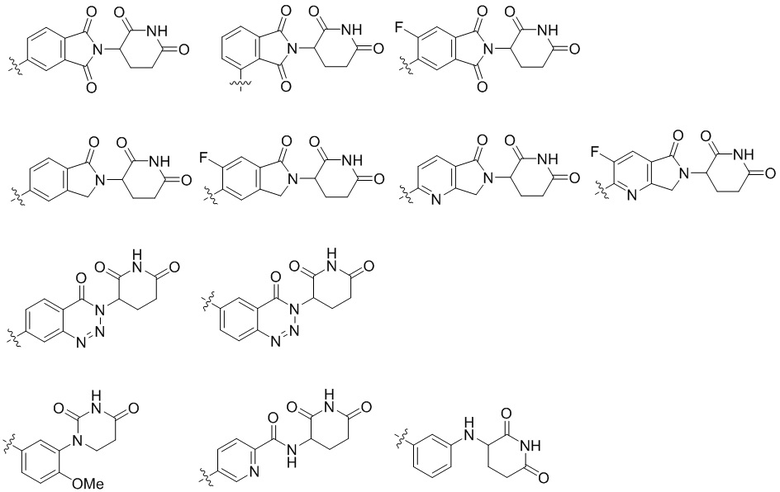
В предпочтительном варианте осуществления настоящего изобретения E в химической формуле 1 может представлять собой любую из следующих структур:

В одном варианте осуществления настоящего изобретения L в химической формуле 1 может представлять собой любую из следующих структур:
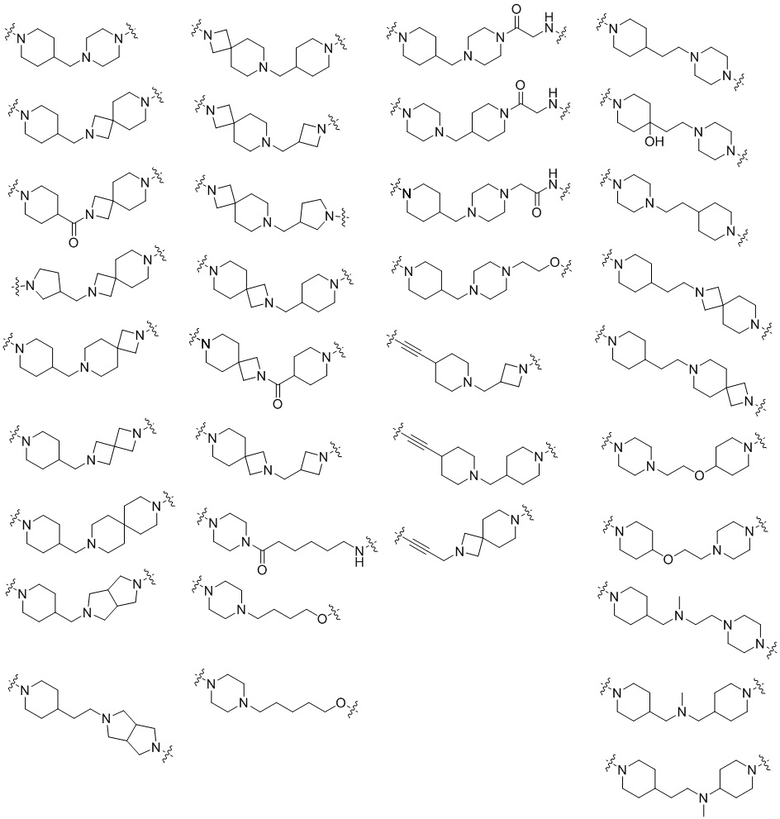
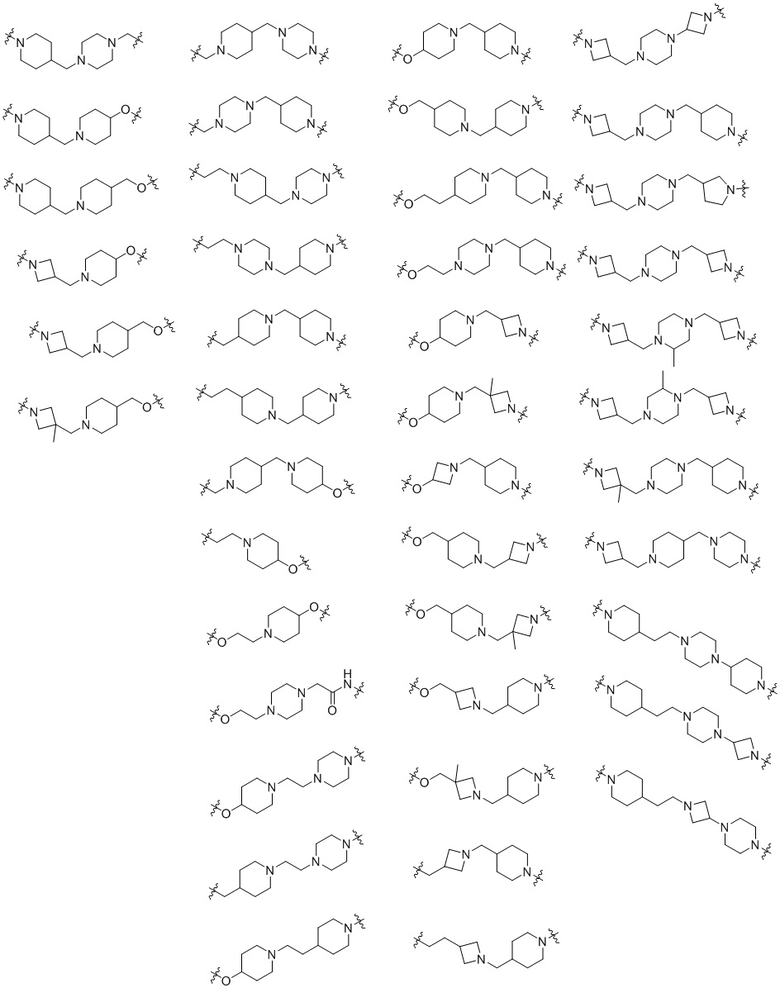

В данном описании * или  означает соединенный с другим агентом.
означает соединенный с другим агентом.
Неограничивающими примерами соединения химической формулы 1 в соответствии с настоящим изобретением являются соединения, полученные в примерах, описанных ниже. Каждый номер примера соответствует каждому номеру соединения. Например, номер конечного соединения, полученного в примере 150, представляет собой соединение 150.
Среди соединений соединения из приведенной ниже Таблицы 1 оказались особенно предпочтительными с точки зрения различных аспектов, таких как активность разрушения AR, цитотоксичность для линии раковых клеток, (метаболическая) стабильность, физико-химические свойства и т.д.
В частности, авторы настоящего изобретения посредством различных экспериментов подтвердили следующее.
- Имеющее определенную структуру соединение, связывающее AR, было более желательным для целей настоящего изобретения. Например, в химической формуле 1, когда кольцо, содержащее X3, представляет собой пиридиновое кольцо, оно было предпочтительным во многих комбинациях, а когда оно представляло собой пиримидиновое или бензольное кольцо, оно было менее предпочтительным. Кроме того, когда использовалось пиридиновое кольцо, активность разрушения AR снижалась, когда N пиридин перемещали в положение 3 вместо положения 2 на основе амида.
- Хотя линкеры со специфическими структурами, включая 4-этинилпиперидин, пиперазинилэтанол и 1-метилпиперидин, проявляют некоторую эффективность, они менее желательны для целей настоящего изобретения, таких как метаболическая стабильность и активность разрушения AR. 2,7-диазаспиро[3.5]нонановый линкер, в котором 6-членное кольцо сначала соединено со связывающим AR соединением, также менее предпочтителен с точки зрения активности разрушения AR. Кроме того, в том случае, когда длина линкера была короткой, когда положение связывания агента E было перемещено с положения 5 на положение 4, активность разрушения AR была относительно снижена.
- Для структуры E химической формулы 1, структура химической формулы 3 больше подходит для структуры связующего AR соединения настоящего изобретения, чем структура химической формулы 4. Кроме того, даже в структуре E химической формулы 3, конкретная структура была более предпочтительной с точки зрения скорости перорального всасывания, растворимости, активности разрушения AR и тому подобного.
Используемый здесь термин «фармацевтически приемлемая(ые) соль(и)» относится к соли, полученной из активных соединений в соответствии с настоящим изобретением с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей этих соединений. Когда соединения имеют относительно кислую группу, соли присоединения основания могут быть получены путем контактирования нейтральных соединений с достаточным количеством желаемого основания и чистого или инертного растворителя. Подходящие фармацевтически приемлемые соли присоединения основания включают в себя без ограничений натриевые, калиевые, кальциевые, алюминиевые, органические амино-, магниевые соли и тому подобное. Когда соединения имеют относительно основную группу, соли присоединения кислоты могут быть получены путем контактирования нейтральных соединений с достаточным количеством желаемой кислоты и чистого или инертного растворителя. Подходящие фармацевтически приемлемые соли присоединения кислоты включают в себя соли, полученные из нетоксичных органических кислот, включая без ограничений уксусную кислоту, пропионовую кислоту, изобутиловую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, бензойную кислоту, янтарную кислоту, субериновую кислоту, фумаровую кислоту, миндальную кислоту, фталевую кислоту, бензолсульфоновую кислоту, п-толилсульфоновую кислоту, лимонную кислоту, винную кислоту, метансульфоновую кислоту и тому подобное, а также нетоксичные неорганические кислоты, включая, без ограничений соляную кислоту, бромистоводородную кислоту, азотную кислоту, угольную кислоту, моногидрокарбоновую кислоту, фосфорную кислоту, моногидрофосфорную кислоту, дигидрогенфосфорную кислоту, серную кислоту, моногидрогенсерную кислоту, йодистый водород, фосфористую кислоту и тому подобное. Также они включают в себя соль аминокислоты, такую как аргинат или ее аналоги, и они также включают в себя аналоги органической кислоты, такой как глюкуроновая или галактуроновая кислота. Некоторые конкретные соединения настоящего изобретения обладают как основной, так и кислотной функциональностью для превращения в соли соединений с основной или кислотной частью (аддитивные соли). Другие примеры солей хорошо известны из литературы, известной в области техники, к которой относится настоящее изобретение.
Используемый здесь термин «соединение(я) настоящего/этого изобретения» включает в себя любое соединение(я) химической формулы 1, а также их клатраты, гидраты, сольваты или полиморфы. И даже если в термине «соединение(я) настоящего изобретения» не упоминается его фармацевтически приемлемая соль, этот термин включает в себя его соли. В одном варианте осуществления изобретения соединения настоящего изобретения включают в себя стереохимически чистые соединения, например соединения, практически не содержащие (например, более 85% э.и., более 90% э.и., более 95% э.и., более 97% э.и. или более чем 99% э.и.) других стереоизомеров. То есть, если соединения химической формулы 1 настоящего изобретения или их соли представляют собой таутомерные изомеры и/или стереоизомеры (например, геометрические изомеры и конформационные изомеры), то такие изолированные изомеры и их смеси также включены в объем настоящего изобретения. Если соединения настоящего изобретения или их соли имеют в своей структуре асимметричный углерод, то их активные оптические изомеры и их рацемические смеси также входят в объем настоящего описания.
Используемый здесь термин «полиморф» относится к твердым кристаллическим формам соединения настоящего изобретения или его комплекса. Различные полиморфы одного и того же соединения могут проявлять различные физические, химические и/или спектроскопические свойства. Различные физические свойства включают в себя, помимо прочего, стабильность (например, при нагревании или на свету), сжимаемость и плотность (важные для композиции и производства продукта) и скорость растворения (которая может влиять на биодоступность). Различия в стабильности могут быть результатом изменений химической активности (например, дифференциального окисления, когда лекарственная форма обесцвечивается быстрее, когда она состоит из одного полиморфа, чем когда она состоит из другого полиморфа) или механических характеристик (например, таблетки крошатся при хранении, когда кинетически благоприятный полиморф превращается в термодинамически более стабильный полиморф) или и то, и другое (например, таблетки одного полиморфа более подвержены разрушению при высокой влажности). Различные физические свойства полиморфов могут влиять на их обработку. Например, один полиморф может с большей вероятностью образовывать сольваты или его труднее фильтровать или отмывать от примесей, чем другой полиморф, например, из-за формы или распределения размеров его частиц.
Используемый здесь термин «сольват» означает соединение настоящего изобретения или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Предпочтительные растворители являются летучими, нетоксичными и приемлемыми для введения человеку в следовых количествах.
Используемый здесь термин «гидрат» означает соединение настоящего изобретения или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными силами.
Используемый здесь термин «клатрат» означает соединение или его соль в форме кристаллической решетки, которая содержит пространства (например, каналы), внутри которых находится гостевая молекула (например, растворитель или вода).
Используемый здесь термин «очищенный» означает, что при выделении изолят имеет чистоту более 90%, в одном варианте осуществления изобретения чистоту более 95%, в другом варианте осуществления изобретения чистоту более 99% и в другом варианте осуществления изобретения чистоту более 99,9%.
Медицинское применение соединений настоящего изобретению и способы лечения с их использованием
Настоящее изобретение дополнительно относится к способам лечения заболевания или состояния у субъекта, имеющего такое заболевание или состояние или предрасположенного к нему, путем введения субъекту терапевтически эффективного количества одного или нескольких соединений, как описано выше. В одном варианте осуществления изобретения лечение представляет собой профилактическое лечение. В другом варианте осуществления изобретения лечение представляет собой паллиативное лечение. В другом варианте осуществления изобретения лечение представляет собой восстановительное лечение.
1. Заболевания или состояния
Соединения настоящего изобретения для разрушения AR применимы для различных терапевтических или профилактических применений (например, при раке, раке предстательной железы, болезни Кеннеди). Эти соединения могут быть использованы для разрушения AR с целью снижения активности AR, а также для лечения заболеваний, связанных с AR, или для предотвращения обострения этих заболеваний. Соответственно, настоящее изобретение относится к способу разрушения AR в клетке. В этом способе клетки контактируют с эффективным количеством соединения настоящего изобретения. В одном варианте осуществления изобретения клетка присутствует у субъекта. Способ настоящего изобретения включает в себя введение субъекту, нуждающемуся в лечении или предотвращении, фармацевтической композиции, содержащей терапевтически или профилактически эффективное количество соединения настоящего изобретения.
В одном варианте осуществления настоящее изобретение относится к способу разрушения AR в клетке связанного с AR заболевания. Например, настоящее изобретение может быть использовано для разрушения AR в клетках субъекта, имеющего связанное с AR заболевание, которое будет описано позже, и, следовательно, снижения активности AR. В другом варианте осуществления настоящего изобретения настоящее изобретение может быть использовано для разрушения AR в клетках рака, в частности рака предстательной железы.
В другом варианте осуществления настоящее изобретение относится к способу лечения связанного с AR заболевания, включающему в себя введение субъекту терапевтически эффективного количества соединения химической формулы 1 или его фармацевтически приемлемой соли. Такой способ включает в себя введение нуждающемуся в лечении субъекту количества соединения настоящего изобретения, достаточного для разрушения AR, т.е. терапевтически эффективного количества. В таком способе соединение настоящего изобретения может быть введено субъекту в форме описанной здесь фармацевтической композиции.
В настоящем изобретении связанные с AR заболевания включают в себя без ограничений астму (рассеянный склероз), рак (в частности, рак предстательной железы, рак молочной железы (в частности, трижды негативный рак молочной железы, положительный по андрогеновому рецептору (AR+ ТНРМЖ))), болезнь Кеннеди, акне, алопецию (особенно андрогенную алопецию), кожные раны, гирсутизм, цилиопатию, расщелину неба, диабет, болезни сердца, гипертонию, воспалительные заболевания кишечника, задержку умственного развития, расстройство настроения, ожирение, аномалию рефракции, бесплодие, синдром Ангельмана, болезнь Канавана, целиакию, амиотрофию Шарко-Мари-Тута, муковисцидоз, мышечную дистрофию Дюшенна, гемохроматоз, гемофилию, синдром Клайнфельтера, нейрофиброматоз, фенилкетонурию, поликистоз почек, синдром Прадера-Вилли, серповидно-клеточную анемию, болезнь Тея-Сакса, синдром Тернера. В предпочтительном варианте осуществления настоящего изобретения связанным с AR заболеванием является рак, более предпочтительно рак предстательной железы.
То есть, настоящее изобретение относится к медицинскому применению соединения химической формулы 1 или его фармацевтически приемлемой соли для лечения или предотвращения вышеуказанных заболеваний.
2. Субъекты
Подходящие субъекты, подлежащие лечению в соответствии с настоящим изобретением включают в себя млекопитающих. Млекопитающие в соответствии с настоящим изобретением включают в себя без ограничений человека, собак, кошек, крупный рогатый скот, коз, лошадей, овец, свиней, грызунов, зайцеобразных, приматов и тому подобное, и включают в себя млекопитающих в утробе матери.
В одном варианте осуществления изобретения подходящим субъектом, подлежащим лечению в соответствии с настоящим изобретением, является человек.
3. Введение и дозировка
Соединения настоящего изобретения обычно вводят в терапевтически эффективном количестве.
Используемый здесь термин «эффективное количество» относится к количеству соединения настоящего изобретения, достаточному для замедления или сведения к минимуму прогрессирования связанного с AR заболевания или для обеспечения терапевтического эффекта при лечении или сдерживании связанного с AR заболевания. Термин «эффективное количество» также относится к количеству, достаточному для ингибирования или снижения активности AR как in vitro, так и in vivo.
Соединения настоящего изобретения могут быть введены любым подходящим способом в форме фармацевтической композиции, адаптированной к такому способу, и в дозе, эффективной для предполагаемого лечения. Эффективная доза обычно находится в диапазоне от около 0,001 до около 100 мг/кг массы тела в день, предпочтительно от около 0,01 до около 50 мг/кг/день, в виде однократной или разделенной дозы. В зависимости от возраста, вида и заболевания или состояния, подлежащего лечению, могут быть подходящими уровни доз ниже нижнего предела этого диапазона. В других случаях могут быть использованы еще большие дозы без вредных побочных эффектов. Большие дозы также могут быть разделены на несколько меньших доз для приема в течение дня.
Фармацевтические композиции соединений настоящего изобретения
В другом варианте осуществления настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение химической формулы 1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или вспомогательное вещество. В одном варианте осуществления настоящего изобретения фармацевтическую композицию применяют для лечения или предупреждения связанных с AR заболеваний, предпочтительно рака предстательной железы, который описан выше.
Термин «фармацевтически приемлемый» означает подходящий для применения в качестве фармацевтического препарата и обычно считающийся безопасным для такого применения. Этот термин также означает, что вещество было официально одобрено руководящим органом страны для такого использования или включено в Корейскую фармакопею или Фармакопею США.
Фармацевтические композиции, лекарственные формы и способы введения
Для лечения заболеваний или состояний, упомянутых выше, описанные здесь соединения или их фармацевтически приемлемые соли могут быть введены следующим образом:
Пероральное введение
Соединения настоящего изобретения могут быть введены перорально, в том числе путем проглатывания, так что соединение попадает в желудочно-кишечный тракт или всасывается в кровоток непосредственно изо рта (например, буккальное или сублингвальное введение).
Подходящие композиции для перорального введения включают в себя твердые, жидкие, гелеобразные или порошкообразные препараты и имеют такую лекарственную форму, как таблетка, пастилка, капсула, гранула или порошок.
Композиции для перорального введения могут если требуется иметь энтеросолюбильное покрытие и могут демонстрировать отсроченное или пролонгированное высвобождение через энтеросолюбильное покрытие. То есть композиция для перорального введения настоящего изобретения может быть препаратом, имеющим паттерн немедленного или модифицированного высвобождения.
Жидкие препараты могут включать в себя растворы, сиропы и суспензии, которые могут быть использованы в мягких или твердых капсулах. Такие препараты могут содержать фармацевтически приемлемый носитель, например воду, этанол, полиэтиленгликоль, целлюлозу или масло. Композиция также может содержать один или несколько эмульгирующих агентов и/или суспендирующих агентов.
В таблетированной лекарственной форме количество присутствующего лекарственного средства, активного ингредиента может составлять от примерно 0,05% до примерно 95% по массе, более типично от примерно 2% до примерно 50% по массе лекарственной формы. Кроме того, таблетки могут содержать разрыхлитель, составляющий от примерно 0,5% до примерно 35% по массе, более типично от примерно 2% до примерно 25% лекарственной формы. Примеры разрыхлителей включают в себя без ограничений лактозу, крахмал, крахмалгликолят натрия, кросповидон, кроскармеллозу натрия, мальтодекстрин или их смеси.
Подходящие смазывающие вещества для использования в таблетке могут присутствовать в количествах от примерно 0,1% до примерно 5% по массе и включают в себя без ограничений тальк, диоксид кремния, стеариновую кислоту, стеарат кальция, цинка или магния, стеарилфумарат натрия и тому подобное.
Подходящие связующие вещества для использования в таблетках включают в себя без ограничений желатин, полиэтиленгликоль, сахара, камеди, крахмал, поливинилпирролидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и тому подобное. Подходящие разбавители для использования в таблетках включают в себя без ограничений маннит, ксилит, лактозу, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу и крахмал.
Подходящие солюбилизаторы для использования в таблетках могут присутствовать в количествах от примерно 0,1% до примерно 3% по массе и включают в себя без ограничений полисорбаты, лаурилсульфат натрия, додецилсульфат натрия, пропиленкарбонат, моноэтиловый эфир диэтиленгликоля, диметилизосорбид, полиэтиленгликоль (натуральный или гидрогенизированный) касторовое масло, HCOR™ (Nikkol), олеиловый эфир, Gelucire™, моно/диглицерид каприловой/каприловой кислоты, сложные эфиры сорбита и жирных кислот и Solutol HS™.
Парентеральное введение
Соединения настоящего изобретения может быть введено непосредственно в кровоток, мышцы или внутренние органы. Подходящие способы для парентерального введения включают в себя внутривенное, внутримышечное, подкожное, внутриартериальное, внутрибрюшинное, подоболочечное, внутричерепное введение и т.п. Подходящие устройства для парентерального введения включают в себя инъекторы (включая игольчатые и безыгольные инъекторы) и способы инфузии.
Композиции для парентерального введения могут быть приготовлены с немедленным или модифицированным высвобождением, включая отсроченное или пролонгированное высвобождение.
Большинство парентеральных препаратов представляют собой жидкие композиции, а жидкая композиция представляет собой водный раствор, содержащий активный ингредиент в соответствии с настоящим изобретением, соль, буферный агент, изотонический агент и тому подобное.
Парентеральные препараты также могут быть приготовлены в обезвоженной форме (например, путем лиофилизации) или в виде стерильных неводных растворов. Эти препараты можно использовать с подходящим носителем, таким как стерильная вода. Агенты, повышающие растворимость, также могут быть использованы при приготовлении растворов для парентерального введения.
Местное применение
Соединения настоящего изобретения могут быть введены местно на кожу или чрескожно. Препараты для этого местного применения могут включать в себя лосьоны, растворы, кремы, гели, гидрогели, мази, пены, имплантаты, пластыри и тому подобное. Фармацевтически приемлемые носители для препаратов для местного введения могут включать в себя воду, спирт, минеральное масло, глицерин, полиэтиленгликоль и тому подобное. Местное введение можно также осуществлять электропорацией, ионтофорезом, фонофорезом и тому подобными способами.
Композиции для местного применения могут быть приготовлены с немедленным или модифицированным высвобождением, включая отсроченное или пролонгированное высвобождение.
Полезные эффекты изобретения
Настоящее изобретение относится к соединениям, способным проявлять различную фармакологическую активность путем разрушения AR, фармацевтическим композициям, содержащим это соединение в качестве активного ингредиента, их медицинскому применению (в частности, при лечении рака предстательной железы) и способам лечения или предотвращения, включающим в себя введение этого соединения субъекту, нуждающемуся в таком лечении или предотвращении. Соединение в соответствии с настоящим изобретением или его фармацевтически приемлемая соль превосходят известные решения в различных аспектах, таких как эффективность, метаболическая стабильность, физико-химические свойства и т.д.
Принцип изобретения
Далее настоящее изобретение описано достаточно подробно с приведением примеров, чтобы помочь специалистам в данной области техники понять настоящее изобретение. Однако следующие примеры предлагаются в качестве иллюстрации и не предназначены для ограничения объема изобретения. Очевидно, что могут быть внесены различные изменения, не отступая от сущности и объема изобретения и не жертвуя всеми его материальными преимуществами.
Получение соединений настоящего изобретения
Далее будет описан процесс синтеза некоторых соединений настоящего изобретения, а другие соединения, не упомянутые ниже, могут быть получены путем замены исходных материалов, промежуточных соединений и/или реагентов аналогичным образом.
Промежуточное соединение 1-1: 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновая кислота
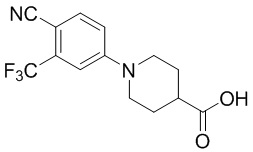
4-фтор-2-(трифторметил)бензонитрил (5,00 г, 26,4 ммоль), пиперидин-4-карбоновую кислоту (3,41 г, 15,9 ммоль) и DIPEA (11,0 мл, 79,2 ммоль) суспендировали в ДМСО (20,0 мл) и затем перемешивали при температуре 90°C в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (30 мл) раствор экстрагировали EtOAc (25 мл × 3). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (EtOAc) с получением 5,98 г (76%) не совсем белого твердого вещества. m/z 299,06 [М+Н]+.
Промежуточное соединение 1-2: 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновая кислота

Промежуточное соединение 1-2 синтезировали способом, аналогичным способу синтеза промежуточного соединения 1-1.
Промежуточное соединение 1-3: 1-(4-циано-3-(трифторметил)фенил)-4-метилпиперидин-4-карбоновая кислота

Промежуточное соединение 1-3 синтезировали способом, аналогичным способу синтеза промежуточного соединения 1-1.
Промежуточное соединение 1-4: 1-(4-циано-3-(трифторметил)фенил)-4-гидроксипиперидин-4-карбоновая кислота

Этап 1: Синтез гидрохлорида 1-бензил-4-гидроксипиперидин-4-карбоновой кислоты
Гидрохлорид 1-бензил-4-гидроксипиперидин-4-карбонитрила (500 мг, 1,97 ммоль) суспендировали в 6 н. водном растворе HCl (2,0 мл) и перемешивали в микроволновой печи при температуре 120°С в течение 1 часа. Реакционный раствор фильтровали и концентрировали при пониженном давлении с получением 542 мг белого твердого вещества.
Этап 2: Синтез гидрохлорида 4-гидроксипиперидин-4-карбоновой кислоты
После растворения гидрохлорида 1-бензил-4-гидроксипиперидин-4-карбоновой кислоты (542 мг, 1,66 ммоль) в EtOH (20 мл) добавляли Pd/C (10 мас. % Pd, 180 мг) и перемешивали в течение 3 часов при комнатной температуре под потоком водорода. Реакционный раствор фильтровали и концентрировали, с получением 237 мг белого твердого вещества.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-4-гидроксипиперидин-4-карбоновой кислоты
Гидрохлорид 4-гидроксипиперидин-4-карбоновой кислоты (77 мг, 0,43 ммоль), 4-фтор-2-(трифторметил)бензонитрил (100 мг, 0,529 ммоль) и DIPEA (0,18 мл, 1,06 ммоль) суспендировали в ДМСО (3,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (3,0 мл) экстрагировали EtOAc (2,5 мл × 3) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (EtOAc) с получением 35 мг (26%) белого твердого вещества. m/z 496,10 [М+Н]+.
Промежуточное соединение 1-5: 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновая кислота

Этап 1: Синтез этил 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоксилата
4-фтор-2-(трифторметил)бензонитрил (100 мг, 0,529 ммоль), гидрохлорид этил-4-фторпиперидин-4-карбоксилата (123 мг, 0,582 ммоль) и K2CO3 (146 мг, 1,06 ммоль) суспендировали в ДМСО (5,0 мл) и перемешивали при температуре 100°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (3,0 мл) экстрагировали EtOAc (2,5 мл × 3) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 191 мг белого твердого вещества. m/z 345,40 [М+Н]+.
Этап 2: Синтез 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты
После суспендирования этилового эфира 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоксилата (255 мг) в ТГФ (3,0 мл) и дистиллированной воде (1,0 мл) добавляли LiOH⋅H2O (89 мг, 2,12 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Растворитель выпаривали и экстрагировали дистиллированной водой. К водному слою снова добавляли 1 н. HCl и экстрагировали EtOAc (20 мл × 2). Органический слой высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 112 мг (2 стадия, 67%) белого твердого вещества. m/z 317,03 [М+Н]+.
Промежуточное соединение 1-6: 2-(1-(4-циано-3-(трифторметил)фенил)пирролидин-3-ил)уксусная кислота

Промежуточное соединение 1-6 синтезировали способом, аналогичным способу синтеза промежуточного соединения 1-5.
Промежуточное соединение 1-7: 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновая кислота

Этап 1: Синтез этил 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоксилата
5-бром-3-(трифторметил)-2-пиридинкарбонитрил (500 мг, 1,99 ммоль), этилпиперидин-4-карбоксилат (344 мг, 2,19 ммоль), CuI (38 мг, 0,199 ммоль) и K2CO3 (550 мг, 3,98 ммоль) суспендировали в ДМФА (3,0 мл) и перемешивали в микроволновой печи при температуре 150°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (10 мл) смесь экстрагировали EtOAc (10 мл × 2), высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 449 мг (69%) белого твердого вещества. m/z 328,09 [М+Н]+.
Этап 2: Синтез 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновой кислоты
После суспендирования этилового эфира 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоксилата (449 мг, 1,37 ммоль) в ТГФ (10,0 мл) и дистиллированной воде (5,0 мл) добавляли LiOH⋅H2O. (230 мг, 5,49 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и экстрагировали EtOAc (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 327 мг (81%) белой жидкости. m/z 300,05 [М+Н]+.
Промежуточное соединение 1-8: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-4-фторпиперидин-4-карбоновая кислота

Промежуточные соединения 1-8 синтезировали способом, аналогичным способу синтеза промежуточных соединений 1-7.
Промежуточное соединение 2-1: 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион

5-фторизобензофуран-1,3-дион (5,00 г, 30,1 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (4,95 г, 30,1 ммоль) и ацетат натрия (4,94 мг, 60,2 ммоль) суспендировали в AcOH (50 мл) и перемешивали при температуре 120°С в течение 24 часов. После концентрирования растворителя при пониженном давлении к реакционному раствору добавляли дистиллированную воду (30 мл) и полученное твердое вещество фильтровали, получая 7,55 г (90%) фиолетового твердого вещества.
Промежуточное соединение 2-2: 2-(2,6-диоксопиперидин-3-ил)-4-фторизоиндолин-1,3-дион

Промежуточное соединение 2-2 синтезировали способом, аналогичным способу синтеза промежуточного соединения 2-1.
Промежуточное соединение 2-3: 2-(2,6-диоксопиперидин-3-ил)-5,6-дифторизоиндолин-1,3-дион

Промежуточное соединение 2-3 синтезировали способом, аналогичным способу синтеза промежуточного соединения 2-1.
Промежуточное соединение 2-4: 3-(6-фтор-4-оксобензо[d][1,2,3]триазин-3(4H)-ил)пиперидин-2,6-дион

Этап 1: Синтез N-(2,6-диоксопиперидин-3-ил)-5-фтор-2-нитробензамида
5-фтор-2-нитробензойную кислоту (2,00 г, 10,8 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (2,14 г, 13,0 ммоль), EDCI (2,48 г, 13,0 ммоль), HOBt (1,75 г, 13,0 ммоль) и DIPEA (3,76 мл, 21,6 ммоль) суспендировали в ДМФА (10,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (EtOAc) с получением 2,28 г (72%) не совсем белого твердого вещества.
Этап 2: Синтез 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-фторбензамида
После растворения N-(2,6-диоксопиперидин-3-ил)-5-фтор-2-нитробензамида (2,28 мг, 7,72 ммоль) в смеси ДМФА (10 мл) и МеОН (10 мл) добавляли Pd/C (10 мас. % Pd, 228 мг) и перемешивали в течение 3 часов при комнатной температуре в токе водорода. Реакционный раствор фильтровали и концентрировали с получением коричневого твердого вещества (1,62 г, 79%).
Этап 3: Синтез 3-(6-фтор-4-оксобензо[d][1,2,3]триазин-3(4H)-ил)пиперидин-2,6-диона
После суспендирования 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-фторбензамида (1,60 г, 6,04 ммоль) в AcOH (10,0 мл) добавляли нитрит натрия (631 мг, 9,16 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (30 мл) экстрагировали EtOAc (25 мл × 3), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (EtOAc) с получением 756 мг (45%) не совсем белого твердого вещества.
Промежуточное соединение 2-5: 3-(7-фтор-4-оксобензо[d][1,2,3]триазин-3(4H)-ил)пиперидин-2,6-дион

Промежуточное соединение 2-5 синтезировали способом, аналогичным способу синтеза промежуточного соединения 2-4.
Промежуточное соединение 2-6: 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-дион

Этап 1: Синтез метил-2-(бромметил)-6-хлорникотината
Метил-6-хлор-2-метилникотинат (1,00 г, 5,38 ммоль), N-бромсукцинимид (1,44 г, 8,08 ммоль) и AHCN (130 мг, 0,0538 ммоль) суспендировали в ацетонитриле (10,0 мл) и перемешивали в микроволновой печи при температуре 110°С в течение 4 часов. После добавления к реакционной смеси дистиллированной воды (10 мл) проводили экстракцию EtOAC (10 мл × 2). Органический слой промывали соляным раствором (10 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% EtOAc/гексан), получая 980 мг белого твердого вещества. m/z 263,99 [М+Н]+.
Этап 2: Синтез 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона
Метил 2-(бромметил)-6-хлорникотинат (980 мг), гидрохлорид 3-аминопиперидин-2,6-диона (686 мг, 4,17 ммоль) и DIPEA (1,05 мл, 10,4 ммоль) суспендировали в ацетонитриле (10,0 мл) и перемешивали при температуре 110°С в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (30 мл) экстрагировали EtOAc (25 мл × 3), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (MeOH) с получением 244 мг (2 стадия, 16%) не совсем белого твердого вещества. m/z 280,09 [М+Н]+.
Промежуточное соединение 2-7: 3-((3-аминофенил)амино)пиперидин-2,6-дион

Этап 1: Синтез трет-бутил-(3-((2,6-диоксопиперидин-3-ил)амино)фенил)карбамата
После суспендирования трет-бутил-(3-аминофенил)карбамата (300 мг, 1,44 ммоль) и 3-бромпиперидин-2,6-диона (331 мг, 1,73 ммоль) в ДМФА (5,0 мл) добавляли NaHCO3 (241 мг, 2,88 ммоль) и перемешивали при температуре 50°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (30 мл) полученное твердое вещество отфильтровывали, получая 323 мг (70%) твердого вещества зеленого цвета. m/z 342,20 [M+Na]+.
Этап 2: Синтез 3-((3-аминофенил)амино)пиперидин-2,6-диона
После суспендирования трет-бутил-(3-((2,6-диоксопиперидин-3-ил)амино)фенил)карбамата (100 мг, 0,313 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,39 мл, 1,57 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали, добавляли водный раствор NaHCO3 (15 мл), экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 34 мг (51%) коричневого твердого вещества. m/z 220,20 [М+Н]+.
Промежуточное соединение 2-8: 5-(бромметил)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион
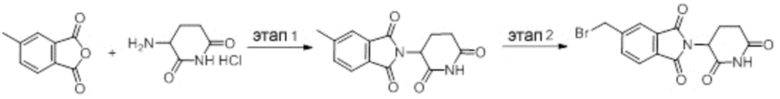
Этап 1: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-метилизоиндолин-1,3-диона
5-метилизобензофуран-1,3-дион (2,18 г, 13,44 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (2,21 г, 13,44 ммоль) и NaOAc (2,20 г, 26,89 ммоль) суспендировали в AcOH (22 мл) и затем перемешивали с обратным холодильником при температуре 120°С в течение 16 часов. После концентрирования реакционного раствора при пониженном давлении добавляли дистиллированную воду (100 мл) и выпавшее в осадок твердое вещество фильтровали с получением 3,2 г (87%) фиолетового твердого вещества.
Этап 2: Синтез 5-(бромметил)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
2-(2,6-диоксопиперидин-3-ил)-5-метилизоиндолин-1,3-дион (541,8 мг, 1,99 ммоль), N-бромсукцинимид (390,0 мг, 2,19 ммоль) и ACHN (97,7 мг, 0,4 ммоль) суспендировали в ацетонитриле (10 мл) и затем перемешивали с обратным холодильником при температуре 80°С в течение 11 часов. После концентрирования реакционного раствора при пониженном давлении полученный остаток подвергали ЖХСД (40% EtOAc/гексан), получая 420 мг (60%) белого твердого вещества.
Промежуточное соединение 3-1: 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегид
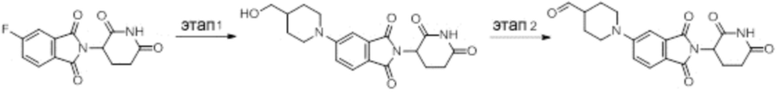
Этап 1: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-(4-(гидроксиметил)пиперидин-1-ил)изоиндолин-1,3-диона
2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 300 мг, 1,09 ммоль), пиперидин-4-илметанол (149 мг, 1,30 ммоль) и DIPEA (0,29 мл, 1,64 ммоль) суспендировали в ДМСО (5,0 мл) и перемешивали при температуре 100°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (30 мл) экстрагировали EtOAc (25 мл × 3), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 332 мг (82%) твердого вещества желтого цвета.
Этап 2: Синтез 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида
2-(2,6-диоксопиперидин-3-ил)-5-(4-(гидроксиметил)пиперидин-1-ил)изоиндолин-1,3-дион (332 мг, 0,894 ммоль) суспендировали в ДХМ (5,0 мл. После этого добавляли ДМП (569 мг, 1,34 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору водного раствора Na2S2O3 (10 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/ДХМ), получая 303 мг (92%) желтого твердого вещества.
Промежуточное соединение 3-2 - Промежуточное соединение 3-13
Промежуточные соединения с 3-2 по 3-13 синтезировали способом, аналогичным способу синтеза промежуточного соединения 3-1.
1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперидин-4-карбальдегид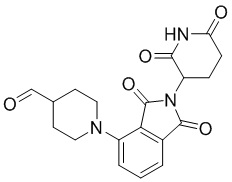
1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегид
(3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегид
(3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегид
(3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-карбальдегид
(3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-карбальдегид
1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегид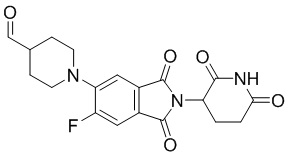
1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегид
(3S)-1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегид
(3R)-1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегид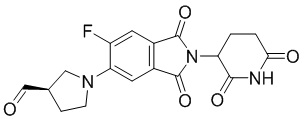
1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-3-метилазетидин-3-карбальдегид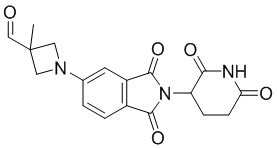
2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегид
Промежуточное соединение 3-14: 2-(2,6-диоксопиперидин-3-ил)-5-(2,7-диазаспиро[3.5]нонан-7-ил)изоиндолин-1,3-дион
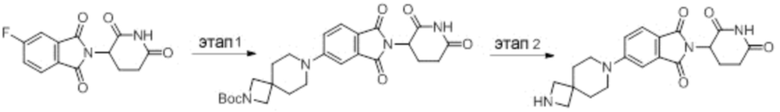
Этап 1: Синтез трет-бутил-7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 500 мг, 1,81 ммоль), трет-бутил 2,7-диазаспиро[3.5]нонан-2-карбоксилат (473 мг, 2,09 ммоль) и DIPEA (0,63 мл, 3,62 ммоль) суспендировали в ДМСО (4,0 мл) и перемешивали при температуре 100°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (25 мл × 3), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 748 мг (86%) твердого вещества желтого цвета.
Этап 2: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-(2,7-диазаспиро[3.5]нонан-7-ил)изоиндолин-1,3-диона
Трет-бутил 7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилат (100 мг, 0,21 ммоль) суспендировали в ДХМ (1,0 мл). Затем добавляли 4М HCl в диоксане (0,5 мл, 2,1 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали при пониженном давлении с получением 84 мг (96%) не совсем белого твердого вещества.
Промежуточное соединение 3-15: 2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)глицин

Промежуточное соединение 3-15 синтезировали способом, аналогичным способу синтеза промежуточного соединения 3-14.
Промежуточное соединение 4-1: трет-бутил (S)-4-(пирролидин-3-илметил)пиперазин-1-карбоксилат

Этап 1: Синтез бензил-(S)-3-(гидроксиметил)пирролидин-1-карбоксилата
После суспендирования (S)-пирролидин-3-илметанола (1,00 г, 9,87 ммоль) в ацетонитриле (10,0 мл) добавляли бензилхлорформиат (1,55 мл, 10,9 ммоль) и ТЭА (1,52 мл, 10,9 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/ДХМ), получая 2,07 г (89%) бесцветной жидкости.
Этап 2: Синтез бензил-(S)-3-формилпирролидин-1-карбоксилата
После суспендирования бензил-(S)-3-(гидроксиметил)пирролидин-1-карбоксилата (2,07 г, 8,79 ммоль) в ДХМ (20,0 мл) добавляли DMP (4,48 мг, 10,6 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной смеси водного раствора Na2S2O3 (20 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/DCM), получая 1,62 г (79%) бесцветной жидкости.
Этап 3: Синтез трет-бутил-(R)-4-((1-((бензилокси)карбонил)пирролидин-3-ил)метил)пиперазин-1-карбоксилата
После суспендирования бензил-(S)-3-формилпирролидин-1-карбоксилата (1,12 г, 4,80 ммоль) и трет-бутилпиперазин-1-карбоксилата (1,07 г, 5,76 ммоль) в ацетонитриле (20,0 мл) добавляли триацетоксиборогидрид натрия (3,05 г, 14,4 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (20 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 1,32 г (68%) бесцветной жидкости.
Этап 4: Синтез трет-бутил-(S)-4-(пирролидин-3-илметил)пиперазин-1-карбоксилата
После растворения трет-бутил-(R)-4-((1-((бензилокси)карбонил)пирролидин-3-ил)метил)пиперазин-1-карбоксилата (1,39 г, 3,27 ммоль) в MeOH (10 мл) добавляли Pd/С (10 мас. % Pd, 132 мг) и перемешивали в течение 3 часов при комнатной температуре в токе водорода. Реакционный раствор фильтровали и концентрировали с получением твердого вещества белого цвета (874 мг, 99%).
Промежуточное соединение 4-2 - Промежуточное соединение 4-8
Промежуточные соединения с 4-2 по 4-8 синтезировали способом, аналогичным способу синтеза промежуточного соединения 4-1.

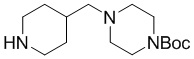
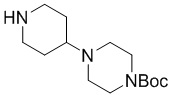


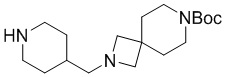
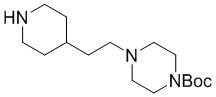
Промежуточное соединение 4-9: трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилат

Этап 1: Синтез бензил-4-(1-(трет-бутоксикарбонил)пиперидин-4-ил)пиперазин-1-карбоксилата
После суспендирования бензилпиперазин-1-карбоксилата (1,03 г, 4,54 ммоль) и трет-бутил-4-оксопиперидин-1-карбоксилата (905 мг, 4,45 ммоль) в МеОН (20,0 мл) добавляли триацетоксиборогидрид натрия (1,92 г, 9,08 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (20 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 880 мг (48%) бесцветной жидкости.
Этап 2: Синтез трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата
После растворения бензил-4-(1-(трет-бутоксикарбонил)пиперидин-4-ил)пиперазин-1-карбоксилата (880 мг, 2,39 ммоль) в MeOH (20 мл) добавляли Pd/C (10 мас. % Pd, 88 мг) и перемешивали в течение 6 часов при комнатной температуре в токе водорода. Реакционный раствор фильтровали и концентрировали. Получали белое твердое вещество (600 мг, 93%).
Промежуточное соединение 4-10: трет-бутил-4-(пиперазин-1-илметил)пиперидин-1-карбоксилат
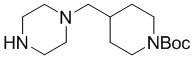
Промежуточное соединение 4-10 синтезировали способом, аналогичным способу синтеза промежуточного соединения 4-9.
Промежуточное соединение 4-11: трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилат

После суспендирования 2-(пиперазин-1-ил)этан-1-ола (300 мг, 2,30 ммоль) в ТГФ (15,0 мл), ди-трет-бутилдикарбонате (0,90 мл, 3,92 ммоль) и ТЭА (0,96 мл, 6,90 ммоль) добавляли при температуре 0°С и перемешивали при комнатной температуре в течение 3 часов. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 205 мг (39%) бесцветной жидкости.
Пример 1: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез (1-(6-нитропиридин-3-ил)пиперидин-4-ил)метанола
5-хлор-2-нитропиридин (5,00 г, 31,5 ммоль), пиперидин-4-илметанол (5,45 г, 47,3 ммоль) и DIPEA (11,1 мл, 63,0 ммоль) суспендировали в ДМСО (20,0 мл) и затем перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 5,66 г (76%) желтого твердого вещества.
Этап 2: Синтез 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида
После суспендирования (1-(6-нитропиридин-3-ил)пиперидин-4-ил)метанола (2,00 г, 8,43 ммоль) в ДХМ (3,0 мл) добавляли DMP (5,36 г, 12,6 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После добавления к реакционной смеси водного раствора Na2S2O3 (15 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 1,90 г (96%) желтого твердого вещества.
Этап 3: Синтез трет-бутил-4-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
После суспендирования 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида (300 мг, 1,28 ммоль) и трет-бутилпиперазин-1-карбоксилата (285 мг, 1,53 ммоль) в MeOH (20,0 мл) Добавляли триацетоксиборгидрид натрия (814 мг, 3,84 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 419 мг (81%) желтого твердого вещества. m/z 406,38 [М+Н]+.
Этап 4: Синтез трет-бутил-4-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
После растворения трет-бутил-4-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (419 мг, 1,03 ммоль) в смешанном растворе ДХМ (20 мл) и MeOH (10 мл), добавляли Pd/C (10 мас. % Pd, 84 мг) и перемешивали при комнатной температуре в течение 6 часов в токе водорода. Реакционный раствор фильтровали и концентрировали с получением коричневого твердого вещества (374 мг, 97%). m/z 376,42 [М+Н]+.
Этап 5: Синтез трет-бутил-4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
Трет-бутил 4-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилат (374 мг, 0,996 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 356 мг, 1,20 ммоль), HATU (456 мг, 1,20 ммоль) и DIPEA (0,35 мл, 1,99 ммоль) суспендировали в ДМФА (3,0 мл) и затем перемешивали в течение 16 часов при комнатной температуре. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 453 мг (69%) коричневого твердого вещества.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил 4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (453 мг, 0,680 ммоль) в ДХМ (3,00 мл) добавляли 4М HCl в диоксане (1,31 мл, 3,40 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали, затем добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 305 мг (76%) белого твердого вещества.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (50 мг, 0,094 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 39 мг, 0,14 ммоль) и DIPEA (0,033 мл, 0,19 ммоль) суспендировали в ДМСО (3,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 24 мг (31%) твердого вещества желтого цвета.
Пример 2: 1-(3-хлор-4-цианофенил)-N-(5-(4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 2 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 3: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(2-((2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)окси)этил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (11 мг, 0,020 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-(2-иодэтокси)изоиндолин-1,3-дион (WO 2018/119448 A1, 8,6 мг, 0,020 ммоль) и K2CO3 (5,52 мг, 0,04 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 2,3 мг (13%) твердого вещества желтого цвета.
Пример 4: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 4 синтезировали способом, аналогичным способу синтеза соединения Примера 3, с использованием 5-(бромметил)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (промежуточное соединение 2-8) вместо 2-(2,6-диоксопиперидин-3-ил)-5-(2-иодэтокси)изоиндолин-1,3-диона (WO 2018/119448 A1).
Пример 5: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)глицил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (35 мг, 0,059 ммоль), (2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)глицин (промежуточное соединение 3-15, 30 мг, 0,071 ммоль), HATU (27 мг, 0,071 ммоль) и DIPEA (0,04 мл, 0,24 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 6 мг (12%) твердого вещества желтого цвета.
Пример 6: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (35 мг, 0,063 ммоль) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегид (промежуточное соединение 3-1, 28 мг, 0,076 ммоль) суспендировали в ацетонитриле (20,0 мл), к которому добавляли триацетоксиборгидрид натрия (40 мг, 0,19 ммоль) и затем перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 7 мг (12%) твердого вещества желтого цвета.
Пример 7: 1-(3-хлор-4-цианофенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 7 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) вместо 1-(4-циано -3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 8: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид
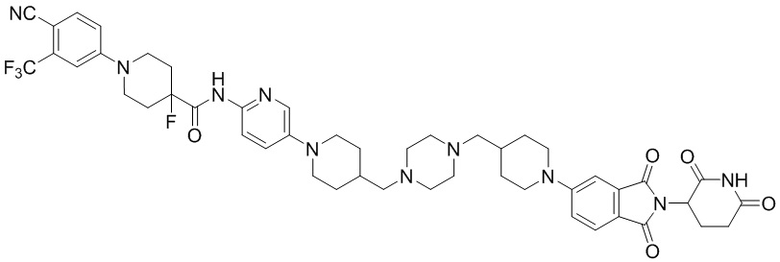
Соединение Примера 8 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 9: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 9 синтезировали аналогично способам синтеза соединений Примеров 1 и 6, используя 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-7) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 10: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 10 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 1-(6-циано-5-(трифторметил)пиридин-3-ил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-8) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 11: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 11 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 12: 1-(3-хлор-4-цианофенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
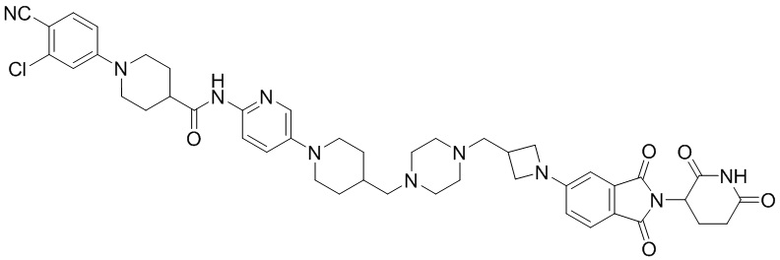
Соединение Примера 12 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3), соответственно, вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 13: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 13 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-2) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 14: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 14 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием (3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-4) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 15: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3S)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 15 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием (3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-5) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 16: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 16 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием (3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-карбальдегида (промежуточное соединение 3-6) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 17: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3S)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 17 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием (3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-3-карбальдегида (промежуточное соединение 3-7) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 18: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-6)-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
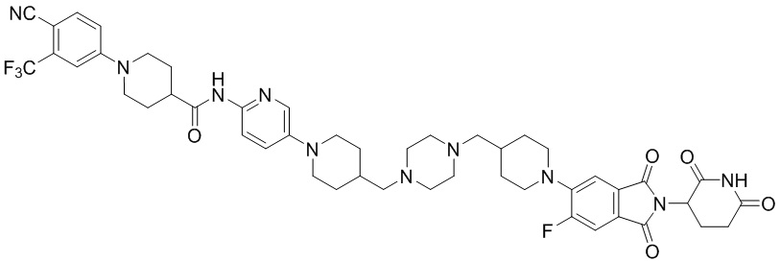
Соединение Примера 18 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием 1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-8) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 19: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 19 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием (3S)-1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-10) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 20: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-6)-фтор-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 20 синтезировали способом, аналогичным способу синтеза соединения Примера 6, с использованием 1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-9) вместо 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 21: 1-(4-циано-3-(трифторметил)фенил)-N-(4-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)фенил)пиперидин-4-карбоксамид

Соединение Примера 21 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 4-фторнитробензола вместо 5-хлор-2-нитропиридина.
Пример 22: 1-(4-циано-3-(трифторметил)фенил)-N-(4-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)фенил)пиперидин-4-карбоксамид
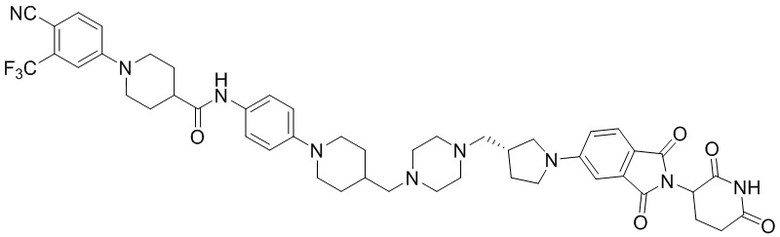
Соединение Примера 22 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием 4-фторнитробензола и (3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-4) соответственно вместо 5-хлор-2-нитропиридина и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 23: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 23 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 24: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 24 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил) )-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 25: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 25 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием трет-бутил-(R)-2-метилпиперазин-1-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 26: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 26 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием трет-бутил-(R)-2-метилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 27: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
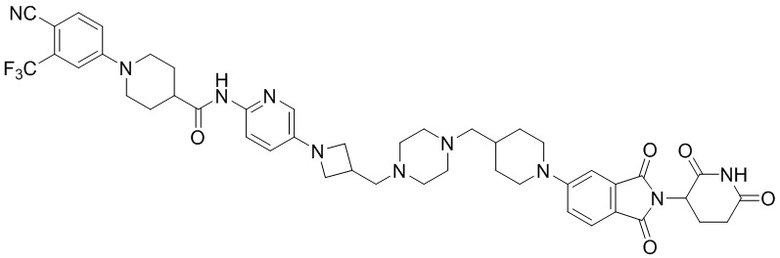
Соединение Примера 27 синтезировали способом аналогичным способам синтеза соединений Примеров 1 и 6, используя азетидин-3-илметанол вместо пиперидин-4-илметанола.
Пример 28: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 28 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием азетидин-3-илметанола и (3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-4) соответственно вместо пиперидин-4-илметанола и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 29: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-(((3S)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
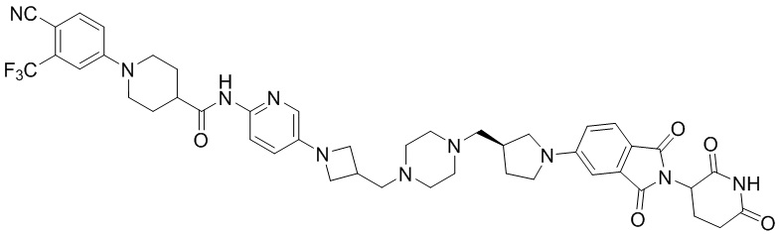
Соединение Примера 29 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием азетидин-3-илметанола и (3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-5) соответственно вместо пиперидин-4-илметанола и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 30: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 30 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, используя азетидин-3-илметанол и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегид (промежуточное соединение 3-3) соответственно вместо пиперидин-4-илметанола и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил) пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 31: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-(((2R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)-2-метилпиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 31 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием азетидин-3-илметанола, трет-бутил-(R)-3-метилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3), соответственно, вместо пиперидин-4-илметанола трет-бутилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 32: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-(((3R)-4-((1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)-3-метилпиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 32 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 6, с использованием азетидин-3-илметанола, трет-бутил-(R)-2-метилпиперазин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3), соответственно, вместо пиперидин-4-илметанола трет-бутилпиперазин-1-карбоксилата и 1 -(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 33: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(6-(2,6-диоксопиперидин-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)азетидин-3-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
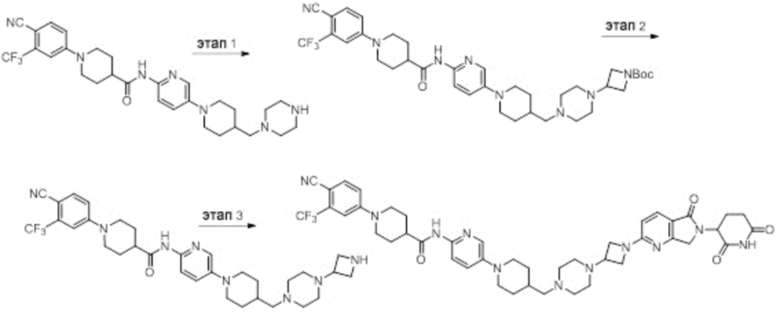
Этап 1: Синтез трет-бутил-3-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)азетидин-1-карбоксилата
1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (200 мг , 0,360 ммоль) и трет-бутил-3-оксоазетидин-1-карбоксилат (74 мг, 0,432 ммоль) суспендировали в ацетонитриле (20,0 мл), к которому добавляли триацетоксиборогидрид натрия (229 мг, 1,08 ммоль), и перемешивали смесь при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 129 мг (50%) белого твердого вещества. m/z 711,35 [М+Н]+.
Этап 2: Синтез N-(5-(4-((4-(азетидин-3-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
После суспендирования трет-бутил 3-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)азетидин-1-карбоксилата (129 мг, 0,181 ммоль) в ДХМ (1,00 мл) получая, 4М HCl в диоксане (0,23 мл, 0,905 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали, добавляли водный раствор NaHCO3 (15 мл), экстрагировали ДХМ (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 109 мг (99%) белого твердого вещества. m/z 611,44 [М+Н]+.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)азетидин-3-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
N-(5-(4-((4-(азетидин-3-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамид (30 мг, 0,046 ммоль), 3-(2-хлор-5-оксо-5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-дион (промежуточное соединение 2-6, 16 мг, 0,056 ммоль), DIPEA (0,02 мл, 0,092 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ) с получением 18 мг (45%) не совсем белого твердого вещества.
Пример 34: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(6-(2,6-диоксопиперидин-3-ил)-5)-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2 -ил)пиперидин-4-карбоксамид

Соединение Примера 34 синтезировали способом, аналогичным способу синтеза соединения Примера 33, с использованием трет-бутил-4-формилпиперидин-1-карбоксилата вместо трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 35: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 35 синтезировали способом, аналогичным способу синтеза соединения Примера 33, используя 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1) вместо 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 36: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)пиперазин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 36 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием азетидин-3-илметанола и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное 2-1) соответственно вместо пиперидин-4-илметанола и 3-(2-хлор-5-оксо-5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 37: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3S)-1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил )пиридин-2-ил)пиперидин-4-карбоксамид
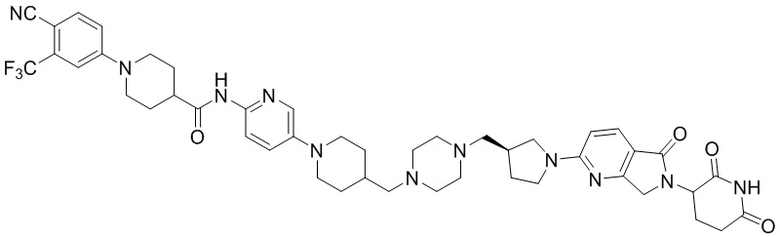
Соединение Примера 37 синтезировали способом, аналогичным способу синтеза соединения Примера 33, с использованием трет-бутил-(R)-3-формилпирролидин-1-карбоксилата вместо трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 38: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3S)-1-(2-(2,6-диоксопиперидин)-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 38 синтезировали способом, аналогичным способу синтеза соединения Примера 33, с использованием трет-бутил-(R)-3-формилпирролидин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5,6-дифторизоиндолин-1,3-диона (промежуточное соединение 2-3) соответственно вместо трет-бутил 3-оксоазетидин-1-карбоксилата и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 39: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил )пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 39 синтезировали способом, аналогичным способу синтеза соединения Примера 33, с использованием трет-бутил-(S)-3-формилпирролидин-1-карбоксилата вместо трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 40: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3R)-4-(1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 40 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-2-метилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 41: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-(1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 41 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 42: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-(1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 42 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата, трет-бутил-4-оксопиперидин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1), соответственно, вместо трет-бутилпиперазин-1-карбоксилата, трет-бутил-3-оксоазетидин-1-карбоксилата, и 3-(2-хлор-5-оксо-5,7-дигидро-6Н-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6).
Пример 43: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-(1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил )пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 43 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата и трет-бутил-4-оксопиперидин-1-карбоксилата соответственно вместо трет-бутилпиперазин-1-карбоксилата и трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 44: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2R)-4-((1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)метил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 44 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-3-метилпиперазин-1-карбоксилата и трет-бутил-4-формилпиперидин-1-карбоксилата соответственно вместо трет-бутилпиперидин-1-карбоксилата и трет-бутил-4-оксопиперидин-1-карбоксилата.
Пример 45: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2S)-4-(1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 45 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(S)-3-метилпиперазин-1-карбоксилата и трет-бутил-4-оксопиперидин-1-карбоксилата соответственно вместо трет-бутилпиперазин-1-карбоксилата и трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 46: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2S)-4-((1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)метил)-2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 46 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(S)-3-метилпиперазин-1-карбоксилата и трет-бутил-4-формилпиперидин-1-карбоксилата соответственно вместо трет-бутилпиперазин-1-карбоксилата и трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 47: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3R)-4-((1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 47 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(R)-2-метилпиперазин-1-карбоксилата и трет-бутил-4-формилпиперидин-1-карбоксилата соответственно вместо трет-бутилпиперазин-1-карбоксилата и трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 48: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3S)-4-((1-(6-(2,6-диоксопиперидин)-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 48 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием трет-бутил-(S)-2-метилпиперазин-1-карбоксилата и трет-бутил-4-формилпиперидин-1-карбоксилата соответственно вместо трет- бутилпиперазин-1-карбоксилата и трет-бутил-3-оксоазетидин-1-карбоксилата.
Пример 49: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 49 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 50: 1-(3-хлор-4-цианофенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
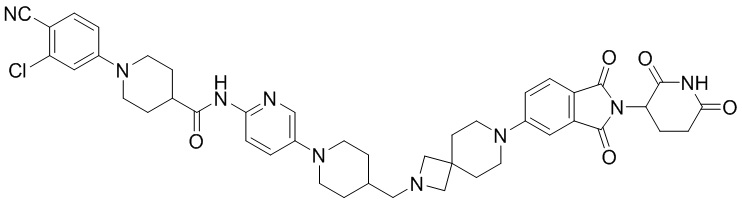
Соединение Примера 50 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) и трет-бутил-2,7-диазаспиро[3,5]нонан-7-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 51: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-метилпиперидин-4-карбоксамид

Соединение Примера 51 синтезировали способом, аналогичным способу синтеза Примера 1, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-метилпиперидин-4-карбоновой кислоты (промежуточное соединение 1-3) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 52: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(3-(2,6-диоксопиперидин-3-ил)-4-оксо-3),4-дигидробензо[d][1,2,3]триазин-7-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 52 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и 3-(7-фтор-4-оксобензо[d][1,2,3]триазин-3(4H)-ил)пиперидин-2,6-диона (промежуточное соединение 2-5) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 53: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(3-(2,6-диоксопиперидин-3-ил)-4-оксо-3),4-дигидробензо[d][1,2,3]триазин-6-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин -4-карбоксамид

Соединение Примера 53 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и 3-(6-фтор-4-оксобензо[d][1,2,3]триазин-3(4H)-ил)пиперидин-2,6-диона (промежуточное соединение 2-4) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 54: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 54 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 55: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-гидроксипиперидин-4-карбоксамид
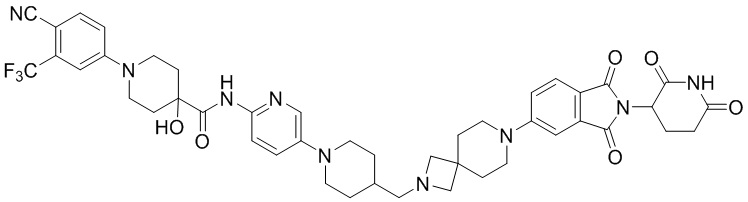
Соединение Примера 55 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-гидроксипиперидин-4-карбоновой кислоты (промежуточное соединение 1-4) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилат соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 56: 2-(1-(4-циано-3-(трифторметил)фенил)пирролидин-3-ил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3)-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)ацетамид
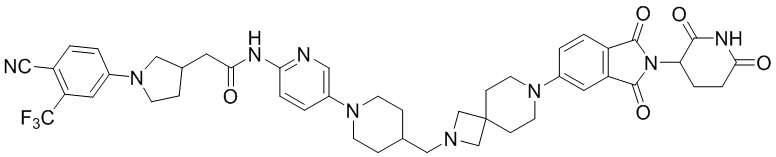
Соединение Примера 56 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(1-(4-циано-3-(трифторметил)фенил)пирролидин-3-ил)уксусной кислоты (промежуточное соединение 1-6) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутил пиперазин-1-карбоксилата.
Пример 57: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил))-1),3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 57 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-7) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилат соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилат.
Пример 58: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил))-1),3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 58 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(6-циано-5-(трифторметил)пиридин-3-ил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-8) и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 59: 1-(4-циано-3-(трифторметил)фенил)-N-(6-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)пиперидин-4-карбоксамид
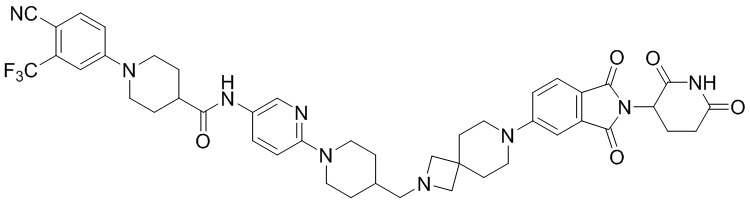
Соединение Примера 59 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-хлор-5-нитропиридина и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо 5-хлор-2-нитропиридина и трет-бутилпиперазин-1-карбоксилата.
Пример 60: 1-(3-хлор-4-цианофенил)-N-(6-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)пиперидин-4-карбоксамид

Соединение Примера 60 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2), 2-хлор-5-нитропиридина и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата, соответственно, вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1), 5-хлор-2-нитропиридина и трет-бутилпиперазин-1-карбоксилата.
Пример 61: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((3S)-3-((7-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пирролидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 61 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием (R)-пирролидин-3-илметанола и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 62: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((3R)-3-((7-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пирролидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 62 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием (S)-пирролидин-3-илметанола и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 63: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-7-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
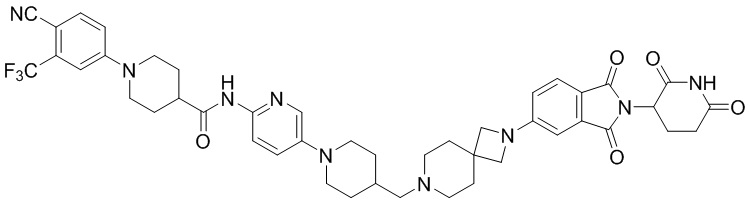
Соединение Примера 63 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 64: 1-(3-хлор-4-цианофенил)-N-(5-(4-((2-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-7-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
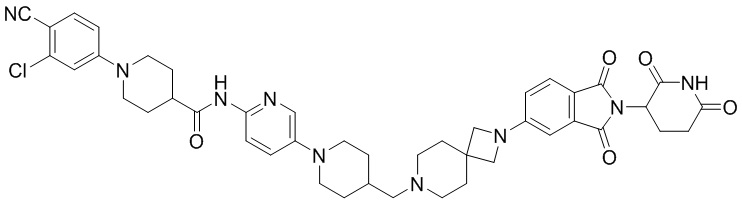
Соединение Примера 64 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) и трет-бутил-2,7-диазаспиро[3,5]нонан-2-карбоксилата соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 65: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((2-(3-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-4-метоксибензоил)-2,7-диазаспиро[3.5]нонан-7-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Гидрохлорид N-(5-(4-((2,7-диазаспиро[3.5]нонан-7-ил)метил)пиперидин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (50 мг, 0,079 ммоль), 3-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-4-метоксибензойную кислоту (WO 2019/186343, 25 мг, 0,095 ммоль), HATU (36 мг, 0,095 ммоль) и DIPEA (0,03 мл, 0,16 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 18 мг (27%) белого твердого вещества.
Пример 66: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((6-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,6-диазаспиро[3.3]гептан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 66 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-2,6-диазаспиро[3.3]гептан-2-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 67: 1-(3-хлор-4-цианофенил)-N-(5-(4-((6-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,6-диазаспиро[3.3]гептан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 67 синтезировали аналогично способу синтеза соединения Примера 1, используя 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2) и трет-бутил 2,6-диазаспиро[3,3]гептан-2-карбоксилат соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 68: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((9-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-3,9-диазаспиро[5.5]ундекан-3-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 68 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-3,9-диазаспиро[5.5]ундекан-3-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 69: 1-(3-хлор-4-цианофенил)-N-(5-(4-((9-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)-3,9-диазаспиро[5.5]ундекан-3-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
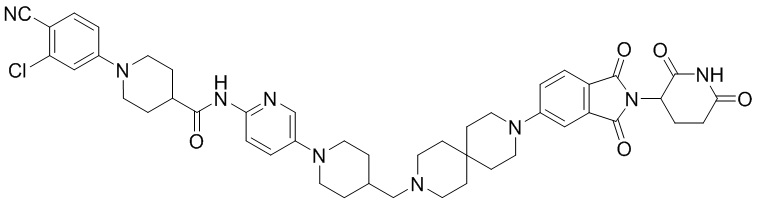
Соединение Примера 69 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2) и трет-бутил-3,9-диазаспиро[5,5]ундекан-3-карбоксилат соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 70: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 70 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата (промежуточное соединение 4-9) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 71: 1-(3-хлор-4-цианофенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин)-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 71 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2) и трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилат (промежуточное соединение 4-9) соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 72: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 72 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) и трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилат (промежуточное соединение 4-9) соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 73: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 73 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-7) и трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилат (промежуточное соединение 4-9) соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 74: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 74 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(6-циано-5-(трифторметил)пиридин-3-ил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-8) и трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата (промежуточное соединение 4-9) соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и трет-бутилпиперазин-1-карбоксилата.
Пример 75: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(6-(2,6-диоксопиперидин-3-ил))-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
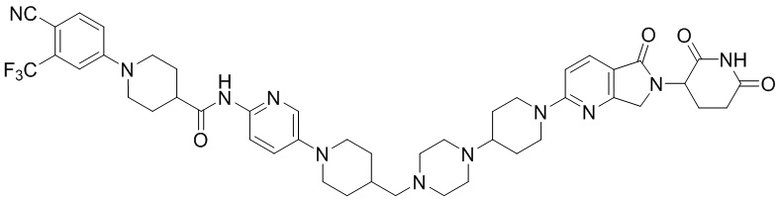
Соединение Примера 75 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата (промежуточное соединение 4-9) и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6), соответственно, вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 76: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
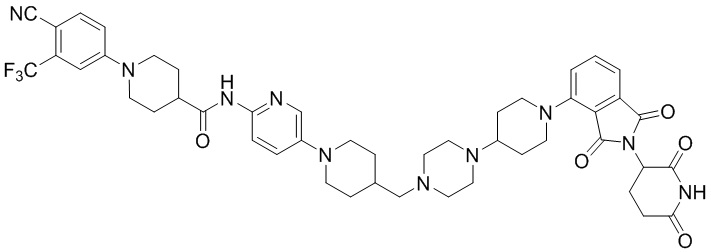
Соединение Примера 76 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата (промежуточное соединение 4-9) и 2-(2,6-диоксопиперидин-3-ил)-4-фторизоиндолин-1,3-диона (промежуточное соединение 2-2) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 77: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((3-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)азетидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 77 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(азетидин-3-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-6) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 78: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((3-(4-(6-(2,6-диоксопиперидин-3-ил))-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперазин-1-ил)азетидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
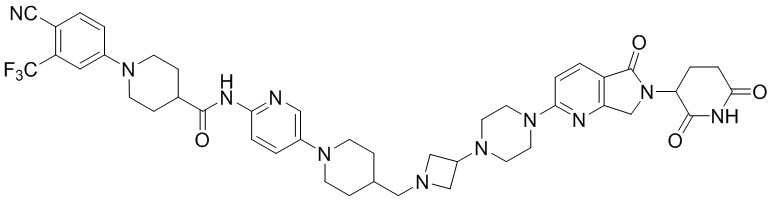
Соединение Примера 78 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(азетидин-3-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-6) и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6), соответственно, вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 79: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((3-((4-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)азетидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
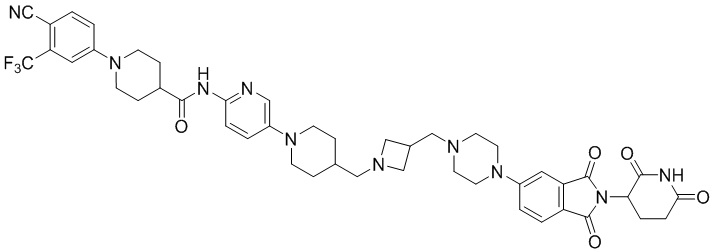
Соединение Примера 79 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(азетидин-3-илметил)пиперазин-1-карбоксилата (Пример 4-5) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 80: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((3-((4-(6-(2,6-диоксопиперидин-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперазин-1-ил)метил)азетидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 80 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(азетидин-3-ил метил)пиперазин-1-карбоксилата (Пример 4-5) и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6), соответственно, вместо трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 81: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 81 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-(пиперидин-4-ил метил)пиперазин-1-карбоксилата (промежуточное соединение 4-3) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 82: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3S)-3-((4-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пирролидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
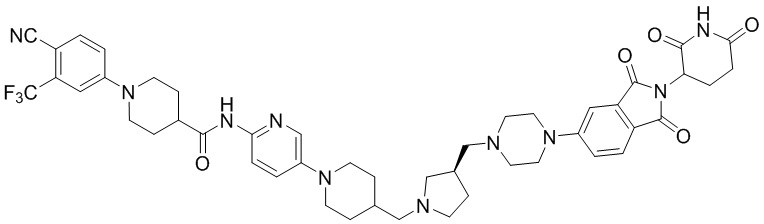
Соединение Примера 82 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-(S)-4-(пирролидин-3-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-1) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 83: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((3R)-3-((4-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пирролидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
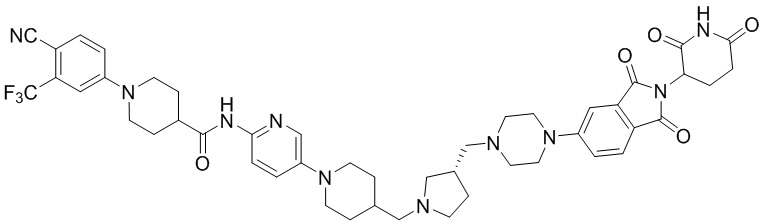
Соединение Примера 83 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-(R)-4-(пирролидин-3-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-2) вместо трет-бутилпиперазин-1-карбоксилата.
Пример 84: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)(метил)амино)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 84 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутил-4-((метиламино)метил)пиперидин-1-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 85: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((5-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)гексагидропирроло[3,4-c]пиррол-2(1H)-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 85 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием трет-бутилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата вместо трет-бутилпиперазин-1-карбоксилата.
Пример 86: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
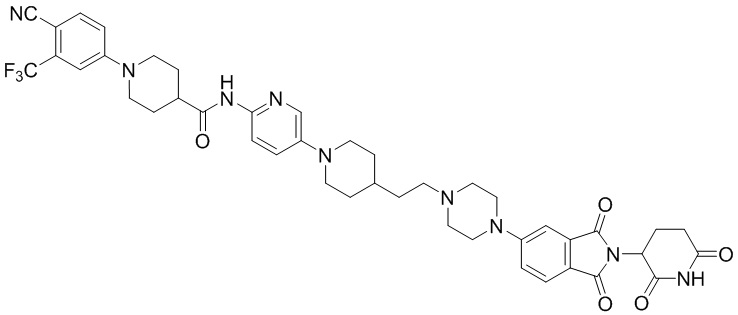
Соединение Примера 86 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 2-(пиперидин-4-ил)этан-1-ол вместо пиперидин-4-илметанола.
Пример 87: 1-(3-хлор-4-цианофенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 87 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) и 2-(пиперидин-4-ил)этан-1-ола соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и пиперидин-4-илметанола.
Пример 88: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид
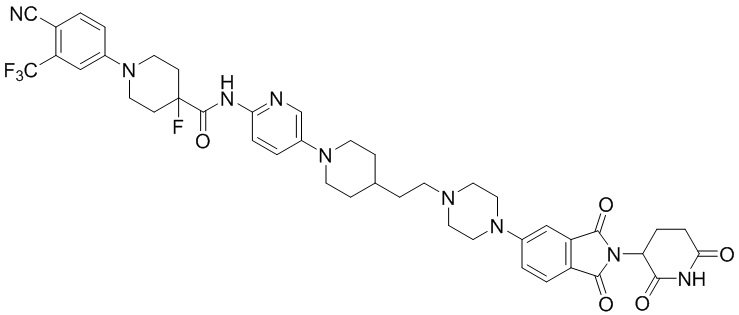
Соединение Примера 88 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) и 2-(пиперидин-4-ил)этан-1-ола соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и пиперидин-4-илметанола.
Пример 89: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 89 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-7) и 2-(пиперидин-4-ил)этан-1-ола соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и пиперидин-4-илметанола.
Пример 90: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 90 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 1-(6-циано-5-(трифторметил)пиридин-3-ил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-8) и 2-(пиперидин-4-ил)этан-1-ола соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и пиперидина-4-илметанола.
Пример 91: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 91 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутил-4-(пиперазин-1-ил)пиперидин-1-карбоксилата (промежуточное соединение 4-9) соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 92: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(6-(2,6-диоксопиперидин-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
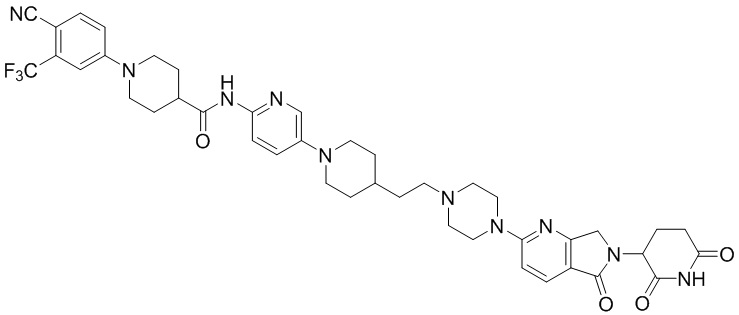
Соединение Примера 92 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6) соответственно вместо пиперидин-4-илметанола и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 93: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
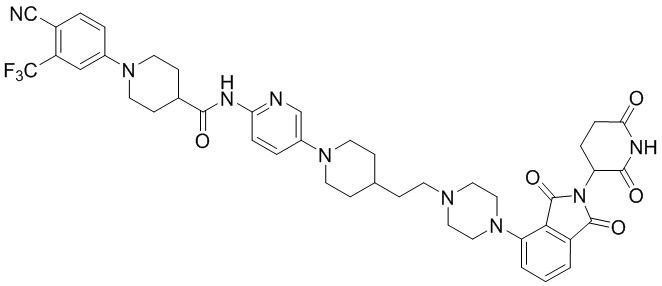
Соединение Примера 93 синтезировали способом, аналогичным способу синтеза соединения Примера 1, используя 2-(пиперидин-4-ил)этан-1-ол и 2-(2,6-диоксопиперидин-3-ил)-4-фторизоиндолин-1,3-дион (промежуточное соединение 2-2), соответственно, вместо пиперидин-4-илметанола и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1.
Пример 94: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(7-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 94 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата соответственно, вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 95: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-7-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 95 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата соответственно, вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 96: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(2-(6-(2,6-диоксопиперидин-3-ил))-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)-2,7-диазаспиро[3.5]нонан-7-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
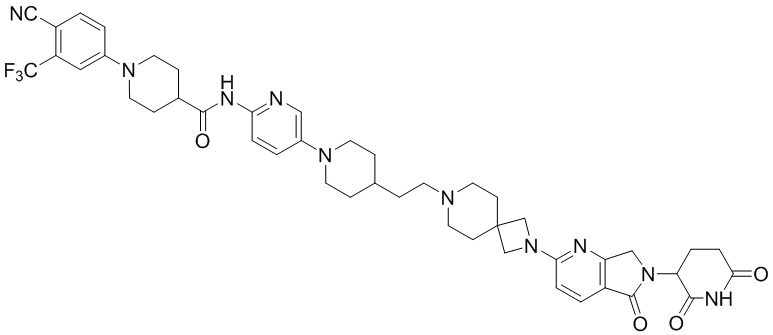
Соединение Примера 96 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола, трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (промежуточное соединение 2-6), соответственно, вместо пиперидин-4-илметанола, трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 97: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(3-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)азетидин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 97 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутил-4-(азетидин-3-ил)пиперазин-1-карбоксилата (Промежуточное соединение 4-6) соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 98: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(3-(4-(6-(2,6-диоксопиперидин-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)пиперазин-1-ил)азетидин-1-ил)этил)пиперидин-1-ил)пиридин-2- ил)пиперидин-4-карбоксамид

Соединение Примера 98 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола, трет-бутил-4-(азетидин-3-ил)пиперазин-1-карбоксилата (Промежуточное соединение 4-6) и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-диона (Промежуточное соединение 2-6) соответственно вместо пиперидин-4-илметанола трет-бутилпиперазин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 99: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 99 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием 2-(пиперидин-4-ил)этан-1-ола и 2-(2,6-диоксопиперидин-3-ил)-5- фторизоиндолин-1,3-диона (промежуточное соединение 2-1) соответственно вместо пиперидин-4-илметанола и 3-(2-хлор-5-оксо-5,7-дигидро-6H-пирроло[3,4-b]пиридин-6-ил)пиперидин-2,6-дион (промежуточное соединение 2-6).
Пример 100: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(1-(6-(2,6-диоксопиперидин-3-ил)-5-оксо-6,7-дигидро-5H-пирроло[3,4-b]пиридин-2-ил)азетидин-3-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2- ил)пиперидин-4-карбоксамид

Соединение Примера 100 синтезировали способом, аналогичным способам синтеза соединений Примеров 1 и 33, с использованием 2-(пиперидин-4-ил)этан-1-ола вместо пиперидин-4-илметанола.
Пример 101: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(5-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)гексагидропирроло[3,4-c]пиррол-2(1H)-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
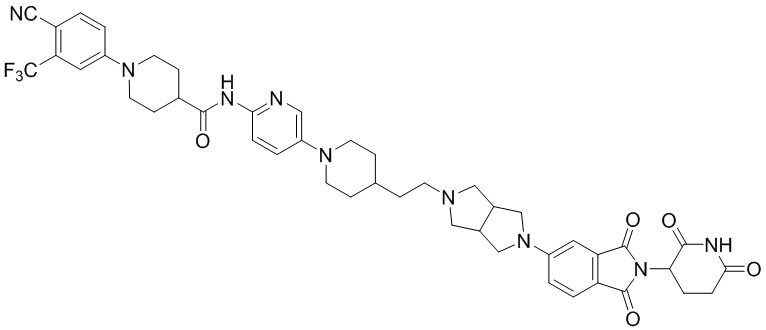
Соединение Примера 101 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутилгексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 102: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)(метил)амино)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 102 синтезировали способом, аналогичным способу синтеза соединения Примера 1, с использованием 2-(пиперидин-4-ил)этан-1-ола и трет-бутил-4-(метиламино)пиперидин-1-карбоксилата соответственно вместо пиперидин-4-илметанола и трет-бутилпиперазин-1-карбоксилата.
Пример 103: 4-(4-циано-3-(трифторметил)фенил)-N-(6-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)пиперазин-1-карбоксамид

Этап 1: Синтез 4-(пиперазин-1-ил)-2-(трифторметил)бензонитрила
4-фтор-2-(трифторметил)бензонитрил (1,00 г, 5,29 ммоль) и пиперазин (683 мг, 7,93 ммоль) суспендировали в ДМФА (5,0 мл) и перемешивали при температуре 85°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% ДХМ/МеОН), получая 968 мг (72%) белого твердого вещества. m/z 256,13 [М+Н]+.
Этап 2: Синтез трет-бутил-2-((1-(5-(4-(4-циано-3-(трифторметил)фенил)пиперазин-1-карбоксамидо)пиридин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
После суспендирования трет-бутил-2-((1-(5-аминопиридин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата (100 мг, 0,24 ммоль) в ацетонитриле (5,0 мл) добавляли фенилхлорформиат (0,04 мл, 0,26 ммоль), триэтиламин (0,04 мл, 0,26 ммоль) и ДМАП (30 мг, 0,24 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 3 часов. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. После суспендирования полученного остатка в ацетонитриле (5,0 мл) добавляли 4-(пиперазин-1-ил)-2-(трифторметил)бензонитрил (91 мг, 0,36 ммоль) и пиридин (0,02 мл, 0,26 ммоль) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% MeOH/ДХМ), получая 33 мг (19%) фиолетового твердого вещества. m/z 697,47 [М+Н]+.
Этап 3: Синтез гидрохлорида N-(6-(4-((2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)-4-(4-циано-3-(трифторметил)фенил)пиперазин-1-карбоксамида
После суспендирования трет-бутил-2-((1-(5-(4-(4-циано-3-(трифторметил)фенил)пиперазин-1-карбоксамидо)пиридин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата (33 мг, 0,47 ммоль) в ДХМ (0,5 мл), добавляли 4М HCl в диоксане (0,2 мл, 0,47 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали при пониженном давлении. Получали 29 мг (99%) фиолетового твердого вещества.
Этап 4: Синтез 4-(4-циано-3-(трифторметил)фенил)-N-(6-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)пиперазин-1-карбоксамида
Гидрохлорид N-(6-(4-((2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)-4-(4-циано-3-(трифторметил)фенил)пиперазин-1-карбоксамида (29 мг, 0,050 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 21 мг, 0,075 ммоль) и DIPEA (0,013 мл, 0,075 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 3 мг (7%) твердого вещества желтого цвета.
Пример 104: 4-(3-хлор-4-цианофенил)-N-(6-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-3-ил)пиперазин-1-карбоксамид

Соединение Примера 104 синтезировали способом, аналогичным способу синтеза соединения Примера 103, с использованием 2-хлор-4-фторбензонитрила вместо 4-фтор-2-(трифторметил)бензонитрила.
Пример 105: 5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамид

Этап 1: Синтез трет-бутил-4-(1-(6-(метоксикарбонил)пиридин-3-ил)пиперидин-4-ил)пиперазин-1-карбоксилата
Метил-5-бромпиколинат (100 мг, 0,463 ммоль), трет-бутил-4-(пиперидин-4-ил)пиперазин-1-карбоксилат (промежуточное соединение 4-4, 125 мг, 0,463 ммоль), Pd2(dba)3 (12 мг, 0,0139 ммоль), Ruphos (21 мг, 0,0463 ммоль) и Cs2CO3 (452 мг, 1,39 ммоль) суспендировали в толуоле (10,0 мл) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 66 мг (35%) белого твердого вещества. m/z 405,41 [M+Na]+.
Этап 2: Синтез гидрохлорида метил 5-(4-(пиперазин-1-ил)пиперидин-1-ил)пиколината
После суспендирования трет-бутил-4-(1-(6-(метоксикарбонил)пиридин-3-ил)пиперидин-4-ил)пиперазин-1-карбоксилата (66 мг, 0,16 ммоль) в ДХМ (1,0 мл), добавляли 4M HCl в диоксане (0,20 мл, 0,82 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Получали 54 мг (100%) белого твердого вещества.
Этап 3: Синтез метил-5-(4-(4-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколината
После суспендирования гидрохлорида метил 5-(4-(пиперазин-1-ил)пиперидин-1-ил)пиколината (54 мг, 0,16 ммоль) и 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида (37 мг, 0,16 ммоль) в ацетонитриле (5,0 мл), добавляли триацетоксиборгидрид натрия (101 мг, 0,48 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 34 мг (41%) твердого вещества желтого цвета. m/z 524,28 [М+Н]+.
Этап 4: Синтез метил-5-(4-(4-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколината
После растворения метил 5-(4-(4-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколината (34 мг, 0,065 ммоль) в смеси ДХМ (3 мл) и MeOH (1 мл), добавляли Pd/C (10 мас. % Pd, 3 мг) и перемешивали в течение 6 часов при комнатной температуре в токе водорода. Реакционный раствор фильтровали и концентрировали. Получали 31 мг (97%) фиолетового твердого вещества. m/z 494,38 [М+Н]+.
Этап 5: Синтез метил-5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколината
Метил 5-(4-(4-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколинат (31 мг, 0,063 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 22 мг, 0,076 ммоль), HATU (28 мг, 0,076 ммоль) и DIPEA (0,02 мл, 0,13 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 20 мг (41%) серого твердого вещества. m/z 796,49 [M+Na]+.
Этап 6: Синтез 5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколиновой кислоты
После суспендирования метил 5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколината (20 мг, 0,026 ммоль) в ТГФ (3,0 мл) и дистиллированной воде (1,0 мл) добавляли LiOH⋅H2O (4 мг, 0,11 ммоль) и перемешивали при комнатной температуре в течение 3 часов. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и проводили экстракцию EtOAc (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 18 мг (91%) белого твердого вещества. m/z 760,51 [М+Н]+.
Этап 7: Синтез 5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамида
5-(4-(4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)пиперидин-1-ил)пиколиновую кислоту (18 мг, 0,024 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (5 мг, 0,028 ммоль), HATU (11 мг, 0,028 ммоль) и DIPEA (0,01 мл, 0,048 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 10 мг (48%) твердого вещества желтого цвета.
Пример 106: 5-(4-((4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамид
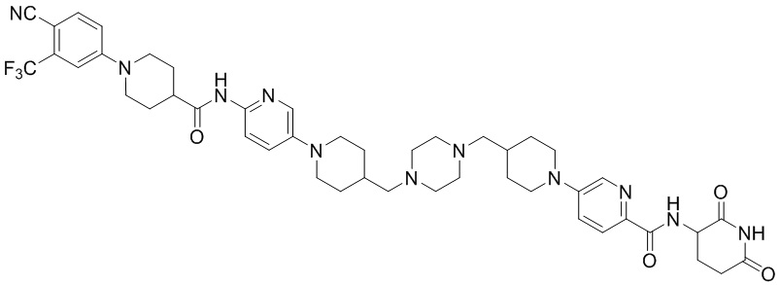
Соединение Примера 106 синтезировали способом, аналогичным способу синтеза соединения Примера 105, с использованием трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3) вместо трет-бутил-4-(пиперидин- 4-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-4).
Пример 107: 5-(4-(2-(1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)этил)пиперазин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамид

Соединение Примера 107 синтезировали способом, аналогичным способу синтеза соединения Примера 105, с использованием 2-(1-(6-нитропиридин-3-ил)пиперидин-4-ил)ацетальдегида и трет-бутилпиперазин-1-карбоксилата соответственно вместо 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида и трет-бутил-4-(пиперидин-4-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-4).
Пример 108: 5-(4-(((R)-4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил) пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамид

Этап 1: Синтез метил-(R)-5-(4-((4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3)-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиколината
Гидрохлорид (R)-1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((2-метил-4-(пиперидин-4-илметил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (70 мг, 0,010 ммоль), метил-5-фторпиколинат (23 мг, 0,15 ммоль) и DIPEA (0,03 мл, 0,20 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 26 мг (33%) не совсем белого твердого вещества.
Этап 2: Синтез (R)-5-(4-((4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3- ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиколиновой кислоты
После суспендирования метил-(R)-5-(4-((4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиколината (26 мг, 0,040 ммоль) в ТГФ (3,0 мл) и дистиллированной воде (1,0 мл) добавляли LiOH⋅H2O (7 мг, 0,16 ммоль) и перемешивали при комнатной температуре в течение 3 часов. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и проводили экстракцию EtOAc (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 25 мг (98%) белого твердого вещества. m/z 788,51 [М+Н]+.
Этап 3: Синтез 5-(4-(((R)-4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3- ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамида
(R)-5-(4-((4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиколиновую кислоту (27 мг, 0,034 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (6,8 мг, 0,0,041 ммоль), HATU (16 мг, 0,041 ммоль) и DIPEA (0,01 мл, 0,068 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 10 мг (32%) белого твердого вещества.
Пример 109: 5-(4-(((S)-4-((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)-3-метилпиперазин-1-ил)метил)пиперидин-1-ил)-N-(2,6-диоксопиперидин-3-ил)пиколинамид

Соединение Примера 109 синтезировали способом, аналогичным способу синтеза соединения Примера 108, с использованием гидрохлорида (S)-1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида вместо гидрохлорида (R)-1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((2-метилпиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида.
Пример 110: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2-(4-(2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)(метил)амино)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
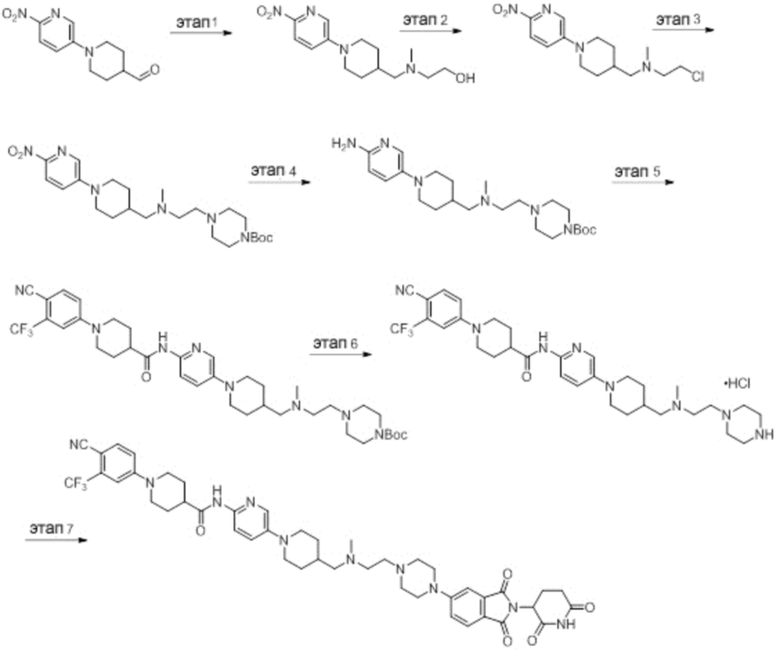
Этап 1: Синтез 2-(метил((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)амино)этан-1-ола
После суспендирования 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида (200 мг, 0,850 ммоль) и 2-(метиламино)этан-1-ола (77 мг, 1,02 ммоль) в МеОН (10,0 мл) добавляли триацетоксиборгидрид натрия (540 мг, 2,55 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (20 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 149 мг (60%) твердого вещества желтого цвета. m/z 295,06 [М+Н]+.
Этап 2: Синтез 2-хлор-N-метил-N-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)этан-1-амина
После суспендирования 2-(метил((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)амино)этан-1-ола (49 мг, 0,17 ммоль), тозилхлорида (63 мг, 0,33 ммоль) и ДМАП (11 мг, 0,09 ммоль) в ДХМ (10,0 мл), добавляли ТЭА (0,05 мл, 0,33 ммоль) и перемешивали при комнатной температуре в течение 12 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 39 мг (73%) желтого твердого вещества. m/z 313,18 [М+Н]+.
Этап 3: Синтез трет-бутил-4-(2-(метил((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)амино)этил)пиперазин-1-карбоксилата
2-хлор-N-метил-N-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)этан-1-амин (39 мг, 0,12 ммоль), трет-бутилпиперазин-1 -карбоксилат (835 мг, 0,19 ммоль), K2CO3 (33 мг, 0,24 ммоль) и KI (10 мг, 0,088 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 53 мг (95%) твердого вещества желтого цвета. m/z 463,37 [М+Н]+.
Этап 4: Синтез трет-бутил-4-(2-(((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)(метил)амино)этил)пиперазин-1-карбоксилата
После суспендирования трет-бутил-4-(2-(метил((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)амино)этил)пиперазин-1-карбоксилата (53 мг, 0,11 ммоль) в смеси ДХМ (3 мл) и MeOH (9 мл) добавляли Pd/C (10 мас. % Pd, 11 мг) и перемешивали в течение 6 часов при комнатной температуре в токе водорода. Реакционный раствор фильтровали и концентрировали. Получали серое твердое вещество (43 мг, 91%). m/z 433,38 [М+Н]+.
Этап 5: Синтез трет-бутил-4-(2-(((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)(метил)амино)этил)пиперазин-1-карбоксилата
Трет-бутил-4-(2-(((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)(метил)амино)этил)пиперазин-1-карбоксилат (43 мг, 0,10 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 36 мг, 0,12 ммоль), HATU (46 мг, 0,12 ммоль) и DIPEA (0,03 мл, 0,03 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 57 мг (80%) не совсем белого твердого вещества. m/z 713,48 [М+Н]+.
Этап 6: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((метил(2-(пиперазин-1-ил)этил)амино)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(2-(((1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-ил)метил)(метил)амино)этил)пиперазин-1-карбоксилата (57 мг, 0,080 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,1 мл, 0,40 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении. Получали 51 мг (98%) белого твердого вещества.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(((2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)(метил)амино)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((метил(2-(пиперазин-1-ил)этил)амино)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (51 мг, 0,079 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 32 мг, 0,12 ммоль) и DIPEA (0,02 мл, 0,12 ммоль) суспендировали в ДМСО (3,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 34 мг (50%) твердого вещества желтого цвета.
Пример 111: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(6-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)амино)гексаноил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез трет-бутил-4-(6-нитропиридин-3-ил)пиперазин-1-карбоксилата
5-хлор-2-нитропиридин (1 г, 6,31 ммоль), N-Boc-пиперазин (1,41 г, 7,57 ммоль) и DIPEA (3,3 мл, 3,3 ммоль) суспендировали в ДМСО (10,0 мл) и перемешивали при температуре 110°С в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (5 мл) и 1 н. водного раствора HCl (5 мл) экстрагировали EtOAc (5 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% ЭА/гексан), получая 1,88 г (97%) желтого твердого вещества.
Этап 2: Синтез трет-бутил-4-(6-аминопиридин-3-ил)пиперазин-1-карбоксилата
Трет-бутил-4-(6-нитропиридин-3-ил)пиперазин-1-карбоксилат (830 мг, 2,69 ммоль) и 10% Pd/C (287 мг, 0,27 ммоль) суспендировали в EtOH (8,0 мл) и перемешивали при комнатной температуре в течение 6 часов в токе водорода. После фильтрации реакционного раствора его концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 686 мг (92%) коричневого твердого вещества.
Этап 3: Синтез трет-бутил-4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1-карбоксилата
1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 167 мг, 1,68 ммоль), трет-бутил-4-(6-аминопиридин-3-ил)пиперазин-1-карбоксилат (500 мг, 1,68 ммоль), HATU (957 мг, 2,52 ммоль) и DIPEA (0,58 мл, 3,36 ммоль) суспендировали в ДМФА (5 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (2 мл) и 1 н. водного раствора HCl (2 мл) экстрагировали EtOAc (5 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 810 мг (87%) твердого вещества желтого цвета.
Этап 4: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1-карбоксилата (810 мг, 1,45 ммоль) в ДХМ (5 мл) добавляли 4 н. HCl в диоксане (0,7 мл, 2,90 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. Получали 717 мг (99%) желтого твердого вещества.
Этап 5: Синтез трет-бутил-(6-(4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1-ил)-6-оксогексил)карбамата
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (100 мг, 0,22 ммоль), 6-((трет-бутоксикарбонил)амино)гексановую кислоту (50 мг, 0,22 ммоль), HATU (124 мг, 0,33 ммоль) и DIPEA (0,12 мл, 0,73 ммоль) суспендировали в ДМФА (1 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (1 мл) и 1 н. водного раствора HCl (1 мл) экстрагировали EtOAc (1 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 105 мг (71%) твердого вещества желтого цвета.
Этап 6: Синтез гидрохлорида N-(5-(4-(6-аминогексаноил)пиперазин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-(6-(4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1-ил)-6-оксогексил)карбамата (85 мг, 0,14 ммоль) в ДХМ (1 мл), добавляли 4 н. HCl в диоксане (0,07 мл, 0,28 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. Получали 82 мг (99%) желтого твердого вещества.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(6-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)амино)гексаноил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид N-(5-(4-(6-аминогексаноил)пиперазин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (82 мг, 0,14 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 38 мг, 0,14 ммоль) и DIPEA (0,07 мл, 0,41 ммоль) суспендировали в ДМСО (1 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (1 мл) экстрагировали EtOAc (1 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 10 мг (9%) твердого вещества желтого цвета.
Пример 112: 1-(3-хлор-4-цианофенил)-N-(5-(4-(6-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5- ил)амино)гексаноил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 112 синтезировали способом, аналогичным способу синтеза соединения Примера 111, используя 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2) вместо 1-(4-циано-3)-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 113: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(5-((2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин)-5-ил)окси)пентил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
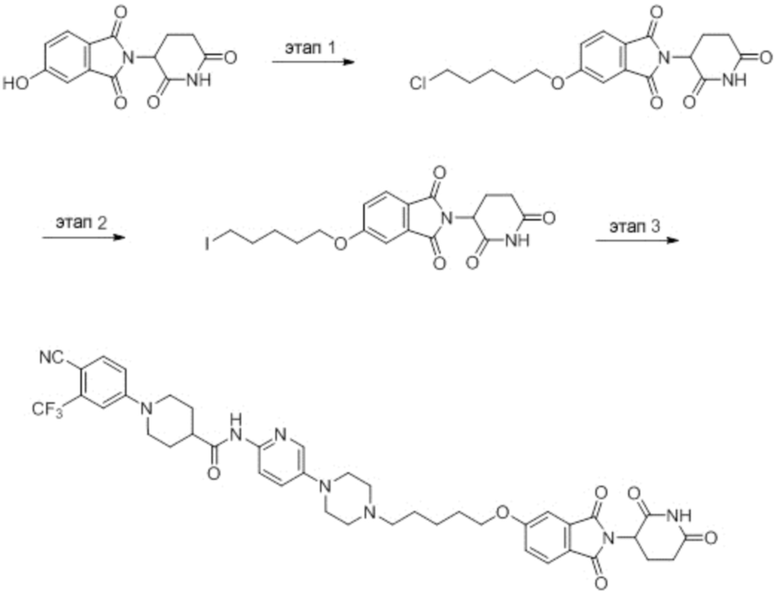
Этап 1: Синтез 5-((5-хлорпентил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
2-(2,6-диоксопиперидин-3-ил)-5-гидроксиизоиндолин-1,3-дион (1,0 г, 3,65 ммоль), 1-бром-5-хлорпентан (0,48 мл, 3,64 ммоль) и K2CO3 (756 мг, 5,47 ммоль) суспендировали в ДМФА (10 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (50 мл) смесь экстрагировали EtOAc (25 мл × 2). Органический слой промывали соляным раствором (30 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (60% ЭА/Гексан), получая 100 мг (8%) белого твердого вещества.
Этап 2: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-((5-йодпентил)окси)изоиндолин-1,3-диона
После суспендирования 5-((5-хлорпентил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (96,5 мг, 0,26 ммоль) в ацетоне (5 мл) добавляли NaI (153,8 мг, 1,0 ммоль) и перемешивали с обратным холодильником при температуре 80°С в течение 16 часов. После добавления к реакционному раствору раствора тиосульфата натрия (15 мл) экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 90 мг (75%) белого твердого вещества.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(5-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пентил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (23,3 мг, 0,05 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-((5-йодпентил)окси)изоиндолин-1,3-дион (23,8 мг, 0,05 ммоль) и DIPEA (0,02 мл, 0,1 ммоль) суспендировали в ДМСО (1 мл) и перемешивали при температуре 70°С в течение 6 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) смесь экстрагировали EtOAc (10 мл × 2). Органический слой промывали соляным раствором (10 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (3% МеОН/ДХМ), получая 12,1 мг (30%) белого твердого вещества.
Пример 114: 1-(3-хлор-4-цианофенил)-N-(5-(4-(5-((2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)окси)пентил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 114 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 113, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 115: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(4-((2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин)-5-ил)окси)бутил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 115 синтезировали способом, аналогичным способу синтеза соединения Примера 113, с использованием 1-бром-4-хлорбутана вместо 1-бром-5-хлорпентана.
Пример 116: 1-(3-хлор-4-цианофенил)-N-(5-(4-(4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5- ил)окси)бутил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 116 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 113, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) и 1-бром-4-хлорбутана соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) и 1-бром-5-хлорпентана.
Пример 117: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
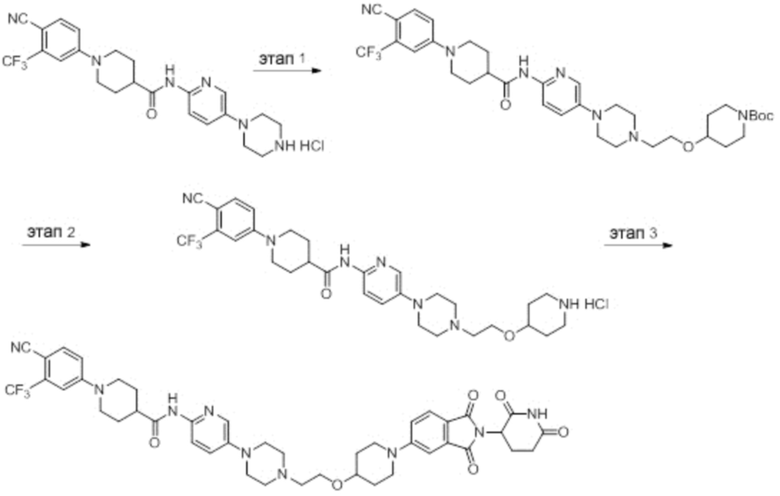
Этап 1: Синтез трет-бутил-4-(2-(4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1- ил)этокси)пиперидин-1-карбоксилата
После суспендирования гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (31,6 мг, 0,063 ммоль) и трет-бутил 4-(2-(тозилокси)этокси)пиперидин-1-карбоксилат (25,2 мг, 0,063 ммоль) в ДМФА (1 мл) добавляли DIPEA (0,03 мл, 0,19 ммоль) и перемешивали при температуре 70°С в течение 4 часов. После добавления к реакционному раствору дистиллированной воды (5 мл) экстрагировали EtOAc (5 мл × 2). Органический слой промывали соляным раствором (3 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 22,4 мг (52%) белого твердого вещества.
Этап 2: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(пиперидин-4-илокси)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(2-(4-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперазин-1-ил)этокси)пиперидин-1-карбоксилата (13 мг, 0,019 ммоль) в ДХМ (0,5 мл) добавляли 4 н. HCl в диоксане (0,005 мл, 0,16 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали. Получали 10 мг (90%) белого твердого вещества.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(пиперидин-4-илокси)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (18 мг, 0,03 ммоль) и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1, 8 мг, 0,03 ммоль) в ДМСО (1 мл) добавляли DIPEA (0,02 мл, 0,09 ммоль) и перемешивали в микроволновой печи при температуре 120°С в течение 1 часа. После добавления к реакционной смеси дистиллированной воды (10 мл) экстрагировали EtOAc (10 мл × 2). Органический слой промывали соляным раствором (10 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ПТСХ (5% МеОН/ДХМ), получая 3,2 мг (13%) твердого вещества желтого цвета.
Пример 118: 1-(3-хлор-4-цианофенил)-N-(5-(4-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 118 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 117 с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 119: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3)-диоксоизоиндолин-5-ил)пиперидин-4-ил)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

После суспендирования гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (60 мг, 0,12 ммоль) и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13, 55 мг, 0,14 ммоль) в ацетонитриле (20,0 мл) добавляли триацетоксиборгидрид натрия (76 мг, 0,36 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% MeOH/ДХМ), получая 11 мг (11%) белого твердого вещества.
Пример 120: 1-(3-хлор-4-цианофенил)-N-(5-(4-(2-(1-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)этил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 120 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 119, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-2) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 121: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(7-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 121 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 119, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 122: 1-(3-хлор-4-цианофенил)-N-(5-(7-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 122 синтезировали способам, аналогичным способу синтеза соединений Примеров 111 и 119, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2), трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилат и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегид (промежуточное соединение 3-1) соответственно вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 123: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(7-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)азетидин-3-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 123 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 119, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 124: 1-(3-хлор-4-цианофенил)-N-(5-(7-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 124 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 119, с использованием 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2), трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилат и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегид (промежуточное соединение 3-3), соответственно, вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1) трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 125: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(7-(((3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 125 синтезировали способом, аналогичным способам синтеза Примеров 111 и 119, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и (3S)-1-(2-(2,6- диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-4) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 126: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(7-(((3S)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)-2,7-диазаспиро[3.5]нонан-2-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 126 синтезировали способом, аналогичным способам синтеза соединений Примеров 111 и 119, с использованием трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата и (3R)-1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-карбальдегида (промежуточное соединение 3-5) соответственно вместо трет-бутилпиперазин-1-карбоксилата и 2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)ацетальдегида (промежуточное соединение 3-13).
Пример 127: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез трет-бутил-7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
5-хлор-2-нитропиридин (1,0 г, 6,31 ммоль), трет-бутил-2,7-диазаспиро[3,5]нонан-2-карбоксилат (1,43 г, 6,31 ммоль) и ТЭА (2,6 мл, 18,93 ммоль) суспендировали в ДМСО (10,0 мл) и перемешивали в микроволновом реакторе при температуре 90°С в течение 1 часа. После добавления к реакционной смеси дистиллированной воды (10 мл) экстрагировали EtOAc (10 мл × 2). Органический слой промывали соляным раствором (10 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (MeOH/гексан), получая 2,12 г (97%) твердого вещества желтого цвета.
Этап 2: Синтез гидрохлорида 7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонана
После суспендирования трет-бутил-7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата (750 мг, 2,15 ммоль) в MeOH (5 мл) добавляли 4 н. HCl в диоксане (1 мл, 4,3 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и перекристаллизовывали (MeOH/гексан), получая 391 мг (73%) твердого вещества желтого цвета.
Этап 3: Синтез трет-бутил-4-((7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилата
После суспендирования гидрохлорида 7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонана (152 мг, 0,612 ммоль) и 1-Boc-4-пиперидинкарбоксальдегида (157 мг, 0,735 ммоль) в MeOH (10,0 мл) добавляли триацетоксиборогидрид натрия (259 мг, 1,22 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 196 мг (72%) твердого вещества желтого цвета. m/z 446,31 [М+Н]+.
Этап 4: Синтез трет-бутил-4-((7-(6-аминопиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилата
После растворения трет-бутил-4-((7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилата (196 мг, 0,440 ммоль) в смеси ДХМ (10 мл) и MeOH (5 мл) добавляли Pd/C (10 мас. % Pd, 39 мг) и перемешивали в токе водорода при комнатной температуре в течение 3 часов. Реакционный раствор фильтровали и концентрировали. Получали 156 мг (85%) коричневого твердого вещества. m/z 416,26 [М+Н]+.
Этап 5: Синтез трет-бутил-4-((7-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилата
Трет-бутил-4-((7-(6-аминопиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилат (80 мг, 0,19 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 69 мг, 0,23 ммоль), HATU (87 мг, 0,23 ммоль) и DIPEA (0,066 мл, 0,38 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 100 мг (76%) коричневого твердого вещества. m/z 696,45 [М+Н]+.
Этап 6: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-илметил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((7-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-карбоксилата (100 мг, 0,144 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,36 мл, 1,44 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали. Получали 89 мг (98%) белого твердого вещества. m/z 596,36 [М+Н]+.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-илметил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамида (30 мг, 0,047 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 20 мг, 0,071 ммоль) и DIPEA (0,02 мл, 0,094 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 12 мг (30%) твердого вещества желтого цвета.
Пример 128: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)азетидин-3-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 128 синтезировали способом, аналогичным способу синтеза соединения Примера 127, с использованием трет-бутил-3-формилазетидин-1-карбоксилата вместо 1-Boc-4-пиперидинкарбоксальдегида.
Пример 129: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин- 5-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез трет-бутил-4-(7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-карбоксилата
Гидрохлорид 7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонана (90 мг, 0,36 ммоль), N-Boc-пиперидин-4-карбоновую кислоту (100 мг, 0,43 ммоль), HATU (163 мг, 0,43 ммоль) и DIPEA (0,13 мл, 0,72 ммоль) суспендировали в ДМФА (3,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 116 мг (70%) твердого вещества желтого цвета. m/z 482,20 [M+Na]+.
Этап 2: Синтез трет-бутил-4-(7-(6-аминопиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-карбоксилата
После суспендирования трет-бутил-4-(7-(6-нитропиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-карбоксилата (116 мг, 0,252 ммоль) в смеси ДХМ (10 мл) и MeOH (5 мл) добавляли Pd/C (10 мас. % Pd, 23 мг) и перемешивали в токе водорода при комнатной температуре в течение 3 часов. Реакционный раствор фильтровали и концентрировали. Получали коричневое твердое вещество (105 мг, 96%). m/z 430,22 [М+Н]+.
Этап 3: Синтез трет-бутил-4-(7-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-2,7-диазаспиро[ 3,5]нонан-2-карбонил)пиперидин-1-карбоксилата
Трет-бутил-4-(7-(6-аминопиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-карбоксилат (105 мг, 0,244 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 57 мг, 0,293 ммоль), HATU (111 мг, 0,293 ммоль) и DIPEA (0,085 мл, 0,488 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 116 мг (67%) фиолетового твердого вещества. m/z 710,35 [М+Н]+.
Этап 4: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(7-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-карбоксилата (116 мг, 0,163 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,41 мл, 1,63 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали. Получали 102 мг (97%) твердого вещества розового цвета. m/z 610,28 [М+Н]+.
Этап 5: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-ил)пиридин-2-ил )пиперидин-4-карбоксамида (40 мг, 0,065 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 27 мг, 0,097 ммоль) и DIPEA (0,02 мл, 0,13 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 15 мг (27%) твердого вещества желтого цвета.
Пример 130: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((1-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)глицил)пиперидин-4-ил)метил)пиперазин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
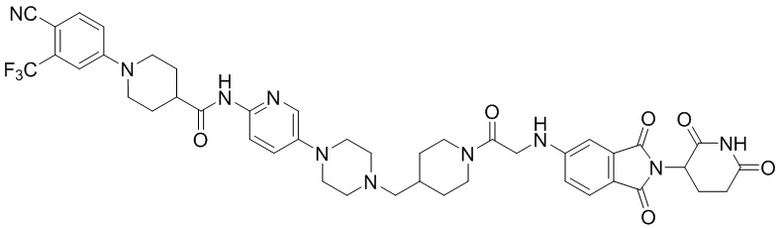
Соединение Примера 130 синтезировали способом, аналогичным способам синтеза соединений Примеров 127 и 5, используя трет-бутилпиперазин-1-карбоксилат вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата.
Пример 131: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)этинил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-йодпиридин-2-ил)пиперидин-4-карбоксамида
5-йодпиридин-2-амин (300 мг, 1,36 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 406 мг, 1,36 ммоль), HATU (620 мг, 1,63 ммоль) и DIPEA (0,47 мл, 2,72 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% EtOAc/гексан), получая 207 мг (30%) белого твердого вещества. m/z 501,03 [М+Н]+.
Этап 2: Синтез трет-бутил-4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этинил)пиперидин-1-карбоксилата
1-(4-циано-3-(трифторметил)фенил)-N-(5-иодпиридин-2-ил)пиперидин-4-карбоксамид (300 мг, 0,60 ммоль), трет-бутил-4-этинилпиперидин-1-карбоксилат (190 мг, 0,90 ммоль), Pd(PPh3)2Cl2 (20 мг, 0,03 ммоль), CuI (6 мг, 0,03 ммоль) и ТЭА (0,17 мл, 1,2 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (25% EtOAc/гексан), получая 302 мг (87%) коричневого твердого вещества. m/z 604,29 [M+Na]+.
Этап 3: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперидин-4-илэтинил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этинил)пиперидин-1-карбоксилата (302 мг, 0,437 ммоль) в ДХМ (2,00 мл), добавляли 4М HCl в диоксане (1,0 мл, 4,37 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали. Получали 221 мг (89%) твердого вещества светло-коричневого цвета. m/z 482,24 [М+Н]+.
Этап 4: Синтез трет-бутил-4-((4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этинил)пиперидин-1-ил)метил)пиперидин-1-карбоксилата
После суспендирования гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперидин-4-илэтинил)пиридин-2-ил)пиперидин-4-карбоксамида (100 мг, 0,21 ммоль) и 1-Boc-4-пиперидинкарбоксальдегида (81 мг, 0,386 ммоль) в MeOH (10,0 мл) добавляли триацетоксиборгидрид натрия (123 мг, 0,579 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 30 мг (21%) бледно-желтовато-коричневого твердого вещества. m/z 679,35 [М+Н]+.
Этап 5: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-(пиперидин-4-илметил)пиперидин-4-ил)этинил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этинил)пиперидин-1-ил)метил)пиперидин-1-карбоксилата (30 мг, 0,044 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,1 мл, 0,44 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали. Получали 27 мг (98%) коричневого твердого вещества. m/z 579,26 [М+Н]+.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)этинил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-(пиперидин-4-илметил)пиперидин-4-ил)этинил)пиридин-2-ил)пиперидин-4-карбоксамида (27 мг, 0,043 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 18 мг, 0,065 ммоль) и DIPEA (0,01 мл, 0,065 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 7 мг (19%) твердого вещества желтого цвета.
Пример 132: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперидин-4-ил)этинил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 132 синтезировали способом, аналогичным способу синтеза соединения Примера 131, с использованием трет-бутил-3-формилазетидин-1-карбоксилата вместо трет-бутил-4-формилпиперидин-1-карбоксилата.
Пример 133: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамида
После растворения 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперидин-4-илэтинил)пиридин-2-ил)пиперидин-4-карбоксамида (58 мг, 0,12 ммоль) в МеОН ( 10 мл), добавляли Pd/C (10 мас. % Pd, 12 мг) и перемешивали в токе водорода при комнатной температуре в течение 6 часов. Реакционный раствор фильтровали и концентрировали. Получали 56 мг (96%) белого твердого вещества. m/z 486,26 [М+Н]+.
Этап 2: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперидин-4-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамида (56 мг, 0,12 ммоль) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1, 53 мг, 0,14 ммоль) в ацетонитриле (5,0 мл), добавляли триацетоксиборгидрид натрия (76 мг, 0,36 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 26 мг (25%) бледно-желтого твердого вещества.
Пример 134: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-(7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)проп-1-ин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-гидроксипроп-1-ин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-йодпиридин-2-ил)пиперидин-4-карбоксамид (1,00 г, 1,99 ммоль), проп-2-ин-1-ол (0,17 мл, 2,99 ммоль), Pd(PPh3)2Cl2 (28 мг, 0,04 ммоль), CuI (7,6 мг, 0,04 ммоль) и ТЭА (0,55 мл, 4,0 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали в микроволновой печи при температуре 120°С в течение 30 минут. После добавления к реакционному раствору дистиллированной воды (2 мл) экстрагировали EtOAc (2 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (25% EtOAc/гексан), получая 434 мг (51%) желтого твердого вещества.
Этап 2: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-(7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)проп-1-ин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-гидроксипроп-1-ин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид (9,2 мг, 0,02 ммоль), ТЭА (0,04 мл, 0,04 ммоль) и мезилхлорид (0,02 мл, 0,03 ммоль) суспендировали в ДХМ (0,3 мл) и перемешивали при комнатной температуре в течение 5 минут. Реакционный раствор концентрировали. Полученный остаток суспендировали в ДМФА (0,3 мл) и добавляли к нему Cs2CO3 (7 мг, 0,02 ммоль) и 2-(2,6-диоксопиперидин-3-ил)-5-(2,7-диазаспиро[3.5]нонан-2-ил)изоиндолин-1,3-дион (промежуточное соединение 3-14, 13,5 мг, 0,03 ммоль). Затем смесь перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (0,5 мл) экстрагировали EtOAc (1 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 3,2 мг (19%) твердого вещества желтого цвета.
Пример 135: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5)-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
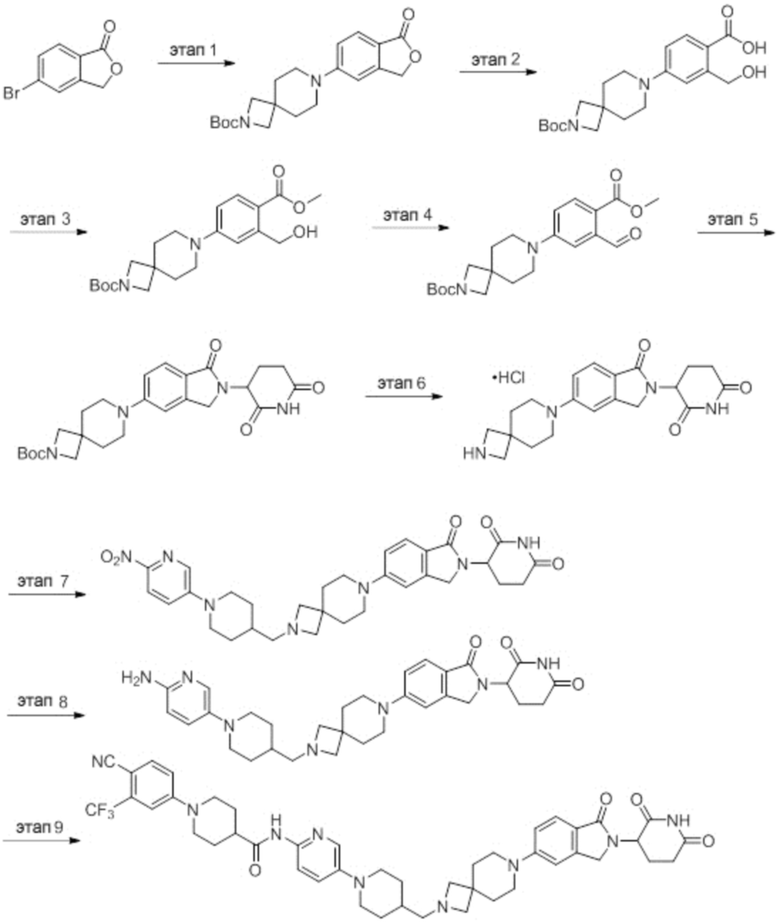
Этап 1: Синтез трет-бутил-7-(1-оксо-1,3-дигидроизобензофуран-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
После суспендирования 5-бромфталида (3,00 г, 14,1 ммоль), 2-Boc-2,7-диазаспиро[3,5]нонана (3,19 г, 14,1 ммоль) и K3PO4 (5,99 г, 28,2 ммоль) в ДМФА (20,0 мл ) добавляли Pd2(dba)3 (1,29 г, 1,41 ммоль) и Xantphos (815 мг, 1,41 ммоль) и перемешивали при температуре 100°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 2,53 г (50%) коричневого твердого вещества. m/z 359,23 [М+Н]+.
Этап 2: Синтез 4-(2-(трет-бутоксикарбонил)-2,7-диазаспиро[3.5]нонан-7-ил)-2-(гидроксиметил)бензойной кислоты
После суспендирования трет-бутил-7-(1-оксо-1,3-дигидроизобензофуран-5-ил)-2,7-диазаспиро[3,5]нонан-2-карбоксилата (2,53 г, 7,06 ммоль) в смеси ТГФ (5,0 мл), MeOH (5,0 мл) и дистиллированной воды (5,0 мл), добавляли NaOH (1,13 г, 28,2 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и экстрагировали EtOAc (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали (EtOAc/гексан), получая 1,75 г (66%) твердого вещества желтого цвета. m/z 377,22 [М+Н]+.
Этап 3: Синтез трет-бутил-7-(3-(гидроксиметил)-4-(метоксикарбонил)фенил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
После суспендирования 4-(2-(трет-бутоксикарбонил)-2,7-диазаспиро[3.5]нонан-7-ил)-2-(гидроксиметил)бензойной кислоты (1,75 г, 4,65 ммоль) в MeOH (10,0 мл) и EtOAc (10,0 мл), добавляли триметилсилилдиазометан (6,98 ммоль, 14,0 мл) при температуре -10°С и перемешивали при температуре -10°С в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 1,24 г (68%) желтого твердого вещества. m/z 391,28 [М+Н]+.
Этап 4: Синтез трет-бутил-7-(3-формил-4-(метоксикарбонил)фенил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
После суспендирования трет-бутил-7-(3-(гидроксиметил)-4-(метоксикарбонил)фенил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата (620 мг, 1,59 ммоль) в ДХМ (20,0 мл) добавляли ДМФА (1,10 г, 2,59 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору водного раствора Na2S2O3 (15 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 523 мг (85%) желтого твердого вещества. m/z 389,22 [М+Н]+.
Этап 5: Синтез трет-бутил-7-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата
После суспендирования трет-бутил-7-(3-формил-4-(метоксикарбонил)фенил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата (523 мг, 1,35 ммоль) и гидрохлорида 3-аминопиперидин-2,6-диона (333 мг, 2,03 ммоль) в МеОН (10,0 мл) добавляли триацетоксиборогидрид натрия (858 мг, 4,05 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 227 мг (36%) серого твердого вещества. m/z 469,29 [М+Н]+.
Этап 6: Синтез гидрохлорида 3-(1-оксо-5-(2,7-диазаспиро[3.5]нонан-7-ил)изоиндолин-2-ил)пиперидин-2,6-диона
После суспендирования трет-бутил-7-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбоксилата (227 мг, 0,484 ммоль) в ДХМ (2,0 мл) добавляли 4M HCl в диоксане (0,61 мл, 2,42 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали. Получали 194 мг (99%) коричневого твердого вещества.
Этап 7: Синтез 3-(5-(2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона
После суспендирования гидрохлорида 3-(1-оксо-5-(2,7-диазаспиро[3.5]нонан-7-ил)изоиндолин-2-ил)пиперидин-2,6-диона (200 мг, 0,494 ммоль) и 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида (128 мг, 0,543 ммоль) в MeOH (5,0 мл) добавляли триацетоксиборгидрид натрия (419 мг, 1,98 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (25 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 95 мг (33%) белого твердого вещества. m/z 588,36 [М+Н]+.
Этап 8: Синтез 3-(5-(2-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона
После растворения 3-(5-(2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона (95 мг, 0,17 ммоль) в смеси ДХМ (10 мл) и MeOH (5 мл) добавляли Pd/C (10 мас. % Pd, 19 мг) и перемешивали в токе водорода при комнатной температуре в течение 6 часов. Реакционный раствор фильтровали и концентрировали. Получали 56 мг (59%) коричневого твердого вещества. m/z 558,33 [М+Н]+.
Этап 9: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
3-(5-(2-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-ил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-дион (20 мг, 0,033 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 12 мг, 0,039 ммоль), HATU (15 мг, 0,039 ммоль) и DIPEA (0,01 мл, 0,066 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 5 мг (16%) твердого вещества желтого цвета.
Пример 136: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5)-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 136 синтезировали способом, аналогичным способу синтеза соединения Примера 135, используя 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновую кислоту (промежуточное соединение 1-5) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 137: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1)-оксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 137 синтезировали способом, аналогичным способу синтеза соединения Примера 135, используя 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-7) вместо 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 138: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(7-(2-(2,6-диоксопиперидин-3-ил))-1-оксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 138 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием 2-(1-(6-нитропиридин-3-ил)пиперидин-4-ил)ацетальдегида вместо 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида.
Пример 139: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил))-1-оксоизоиндолин)-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
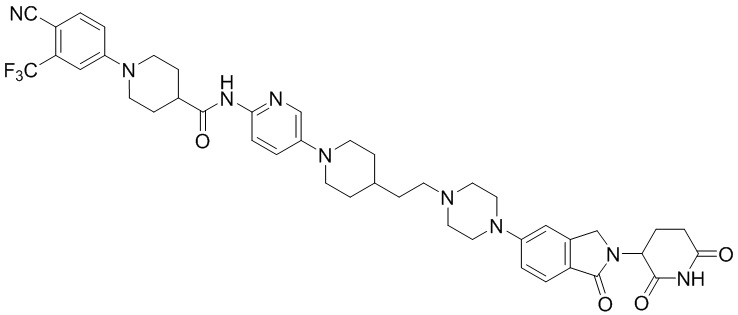
Соединение Примера 139 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутилпиперазин-1-карбоксилата и 2-(1-(6-нитропиридин-3-ил)пиперидин-4-ил)ацетальдегида соответственно вместо трет-бутил 2,7-диазаспиро[3.5]нонан-2-карбоксилата и 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида.
Пример 140: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил))-1-оксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 140 синтезировали способом, аналогичным способу синтеза соединения Примера 135, используя трет-бутил 4-(пиперидин-4-ил)пиперазин-1-карбоксилат (промежуточное соединение 4-4) вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата.
Пример 141: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил))-1-оксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 141 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутил-4-(пиперидин-4-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-4) и 1-(4-циано-3-(трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) соответственно вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата и 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 142: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-(1-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)пиперидин-4-ил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 142 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутил-4-(пиперидин-4-ил)пиперазин-1-карбоксилата (промежуточное соединение 4-4) и 1-(6-циано-5-(трифторметил)пиридин-3-ил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-7) соответственно вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата и 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 143: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
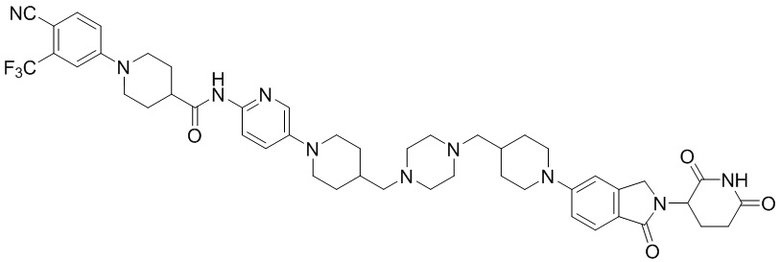
Соединение Примера 143 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3) вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата.
Пример 144: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)-4-фторпиперидин-4-карбоксамид

Соединение Примера 144 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3) и 1-(4-циано-3- (трифторметил)фенил)-4-фторпиперидин-4-карбоновой кислоты (промежуточное соединение 1-5) соответственно вместо трет-бутил-2,7-диазаспиро[3.5]нонан-2-карбоксилата и 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 145: 1-(6-циано-5-(трифторметил)пиридин-3-ил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 145 синтезировали способом, аналогичным способу синтеза соединения Примера 135, с использованием трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3) и 1-(6-циано-5- (трифторметил)пиридин-3-ил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-7) соответственно вместо трет-бутил 2,7-диазаспиро[3.5]нонан-2-карбоксилата и 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 146: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
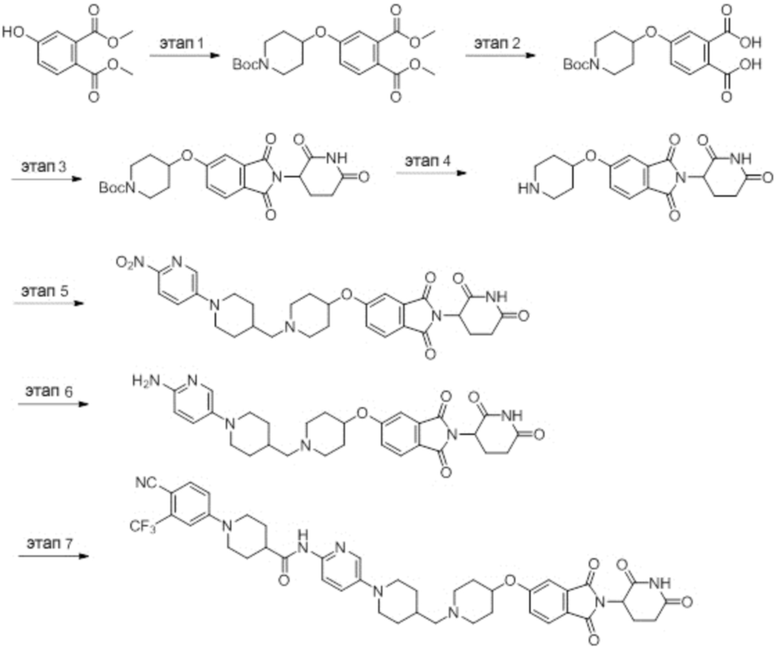
Этап 1: Синтез диметил-4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)окси)фталата
После суспендирования диметил-4-гидроксифталата (300 мг, 1,43 ммоль), 1-(трет-бутоксикарбонил)-4-гидроксипиперидина (315 мг, 1,57 ммоль) и трифенилфосфина (1,13 г, 4,29 ммоль) в ТГФ (15,0 мл) добавляли DEAD (0,67 мл, 4,29 ммоль) и перемешивали при температуре 40°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 512 мг (91%) бесцветной жидкости.
Этап 2: Синтез 4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)окси)фталевой кислоты
После суспендирования диметил-4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)окси)фталата (512 мг, 1,30 ммоль) в смеси ТГФ (10,0 мл), МеОН (10,0 мл) и дистиллированной воды (10,0 мл), добавляли NaOH (311 г, 7,80 ммоль) и перемешивали при комнатной температуре в течение 4 часов. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и проводили экстракцию EtOAc (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 416 мг (88%) белого твердого вещества.
Этап 3: Синтез трет-бутил-4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-карбоксилата
4-((1-(трет-бутоксикарбонил)пиперидин-4-ил)окси)фталевую кислоту (416 мг, 1,14 ммоль) и гидрохлорид 3-аминопиперидин-2,6-диона (206 мг, 1,25 ммоль) суспендировали в пиридине (4,0 мл) и перемешивали при температуре 110°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 396 мг (76%) твердого вещества синего цвета.
Этап 4: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-(пиперидин-4-илокси)изоиндолин-1,3-диона
После суспендирования трет-бутил-4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-карбоксилата (396 мг, 0,87 ммоль) в ДХМ (3,00 мл), добавляли 4M HCl в диоксане (1,01 мл, 4,03 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 255 мг (88%) белого твердого вещества.
Этап 5: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-((1-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперидин-4- ил)окси)изоиндолин-1,3-диона
После суспендирования 2-(2,6-диоксопиперидин-3-ил)-5-(пиперидин-4-илокси)изоиндолин-1,3-диона (100 мг, 0,279 ммоль) и 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида (66 мг, 0,279 ммоль) в МеОН (20,0 мл) добавляли триацетоксиборгидрид натрия (177 мг, 0,837 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (20 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 123 мг (77%) твердого вещества желтого цвета. m/z 577,15 [М+Н]+.
Этап 6: Синтез 5-((1-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперидин-4-ил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
После растворения 2-(2,6-диоксопиперидин-3-ил)-5-((1-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)метил)пиперидин-4-ил)окси)изоиндолин-1,3-диона (123 мг, 0,213 ммоль) в смеси ДХМ (5 мл) и МеОН (10 мл), добавляли Pd/C (10 мас. % Pd, 25 мг) и перемешивали в токе водорода при комнатной температуре в течение 4 часов. Реакционный раствор фильтровали и концентрировали. Получали желтое твердое вещество (100 мг, 86%). m/z 547,42 [М+Н]+.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
5-((1-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)метил)пиперидин-4-ил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион (50 мг, 0,091 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 32 мг, 0,11 ммоль), HATU (42 мг, 0,11 ммоль) и DIPEA (0,02 мл, 0,18 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 29 мг (38%) не совсем белого твердого вещества.
Пример 147: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((2-(2,6-диоксопиперидин-3-ил)-1,3)-диоксоизоиндолин-5-ил)окси)метил)пиперидин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
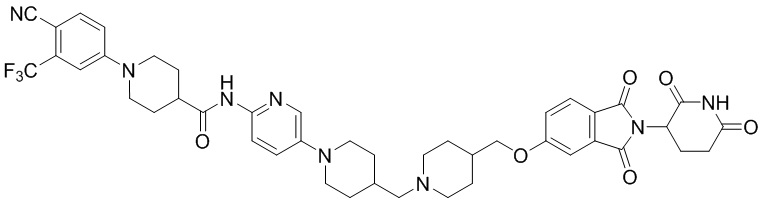
Соединение Примера 147 синтезировали способом, аналогичным способу синтеза соединения Примера 146, с использованием трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилата вместо трет-бутил-4-гидроксипиперидин-1-карбоксилата.
Пример 148: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 148 синтезировали способом, аналогичным способу синтеза соединения Примера 146, с использованием 1-(6-нитропиридин-3-ил)азетидин-3-карбальдегида вместо 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида.
Пример 149: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(3-((4-(((2-(2,6-диоксопиперидин-3-ил)-1,3)-диоксоизоиндолин-5-ил)окси)метил)пиперидин-1-ил)метил)азетидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 149 синтезировали способом, аналогичным способу синтеза соединения Примера 146, с использованием трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилата и 1-(6-нитропиридин-3-ил)азетидин-3-карбальдегида соответственно вместо трет-бутил-4-гидроксипиперидин-1-карбоксилата и 1-(6-нитропиридин-3-ил)пиперидин-4-карбальдегида.
Пример 150: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этокси)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез метил-2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)ацетата
После суспендирования 5-хлор-2-нитропиридина (801,3 мг, 5,05 ммоль) и гидрохлорида метил-2-(пиперидин-4-илокси)ацетата (1,06 г, 5,05 ммоль) в ДМСО (8,5 мл) добавляли ТЭА (2,8 мл, 20,2 ммоль) и перемешивали в микроволновой печи при температуре 120°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (15 мл × 2). Органический слой промывали соляным раствором (15 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 1,0 г (67%) твердого вещества желтого цвета.
Этап 2: Синтез 2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)этан-1-ола
После суспендирования метил 2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)ацетата (430 мг, 1,46 ммоль) в безводном ТГФ (10 мл), 2 М алюмогидрида лития в ТГФ (0,23 мл, 5,1 ммоль) медленно добавляли и перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли дистиллированную воду (10 мл) и 1 н. водный раствор HCl (0,5 мл) с последующей экстракцией EtOAc (15 мл × 2). Органический слой промывали соляным раствором (5 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ПТСХ (0,5% МеОН/ДХМ), получая 82 мг (21%) твердого вещества желтого цвета.
Этап 3: Синтез 2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)ацетальдегида
После суспендирования 2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)этан-1-ола (70,6 мг, 0,28 ммоль) в ДХМ (13 мл) добавляли ДМФА (134,4 мг, 0,31 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной смеси водного раствора Na2S2O3 (10 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 41,3 мг (55%) твердого вещества желтого цвета.
Этап 4: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-(4-(2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)изоиндолин-1,3-диона
После суспендирования 2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)ацетальдегида (41,3 мг, 0,155 ммоль) и 2-(2,6-диоксопиперидин-3-ил)-5-(пиперазин-1-ил)изоиндолин-1,3-диона (68,4 мг, 0,155 ммоль) в МеОН (1,0 мл) и ДХМ (0,5 мл) добавляли триацетоксиборгидрид натрия (66 мг, 0,311 ммоль) и перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли водный раствор NaHCO3 (3 мл), затем экстрагировали EtOAc (3 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 35 мг (38%) твердого вещества желтого цвета.
Этап 5: Синтез 5-(4-(2-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
После растворения 2-(2,6-диоксопиперидин-3-ил)-5-(4-(2-((1-(6-нитропиридин-3-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)изоиндолин-1,3-диона (38 мг, 0,064 ммоль) в MeOH (1,0 мл) добавляли Pd/C (10 мас. % Pd, 3,8 мг) и перемешивали в токе водорода при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали. Получали желтое твердое вещество (24 мг, 72%).
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этокси)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
5-(4-(2-((1-(6-аминопиридин-3-ил)пиперидин-4-ил)окси)этил)пиперазин-1-ил)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион (12,5 мг, 0,02 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 6,56 мг, 0,02 ммоль), HATU (12,5 мг, 0,03 ммоль) и DIPEA (0,01 мл, 0,03 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (1 мл) экстрагировали EtOAc (1 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 6 мг (32%) коричневого твердого вещества.
Пример 151: 1-(3-хлор-4-цианофенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил))-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этокси)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 150 синтезировали способом, аналогичным способу синтеза соединения Примера 151, используя 1-(3-хлор-4-цианофенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-2) вместо 1-(4-циано-3)-(трифторметил)фенил)пиперидин-4-карбоновой кислоты (промежуточное соединение 1-1).
Пример 152: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)пиперазин-1-ил)этокси)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 152 синтезировали способом, аналогичным способу синтеза соединения Примера 150, с использованием 2-(2,6-диоксопиперидин-3-ил)-4-(пиперазин-1-ил)изоиндолин-1,3-диона вместо 2-(2,6-диоксопиперидин-3-ил)-5-(пиперазин-1-ил)изоиндолин-1,3-диона.
Пример 153: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)-4-гидроксипиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
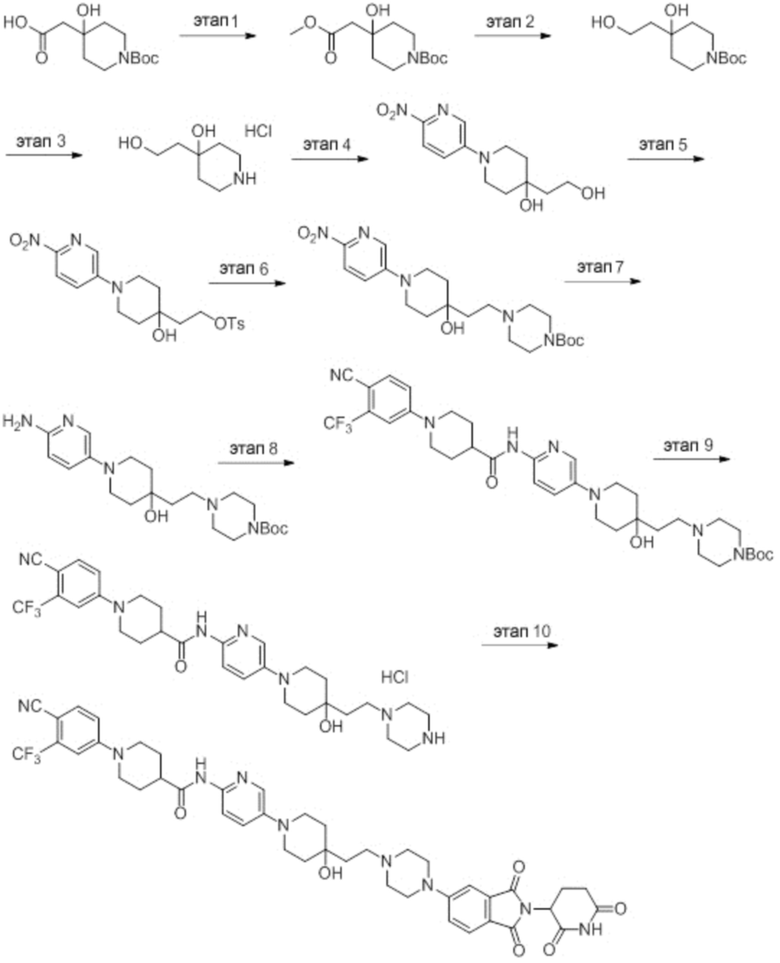
Этап 1: Синтез трет-бутил-4-гидрокси-4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилата
2-(1-(трет-бутоксикарбонил)-4-гидроксипиперидин-4-ил)уксусную кислоту (100 мг, 0,38 ммоль) и 2М триметилсилилдиазометана в гексане (0,82 мл, 1,17 ммоль) суспендировали в смеси МеОН : EtOAc = 1:1 (4 мл) и перемешивали при температуре -10°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 96 мг (93%) прозрачного масла.
Этап 2: Синтез трет-бутил-4-гидрокси-4-(2-гидроксиэтил)пиперидин-1-карбоксилата
После суспендирования трет-бутил-4-гидрокси-4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилата (89 мг, 0,33 ммоль) в ТГФ (3,3 мл), 2М алюмогидрида лития в ТГФ (0,4 мл, 0,81 ммоль) медленно добавляли и перемешивали при комнатной температуре в течение 1 часа. После медленного добавления 1 н. HCl к реакционной смеси добавляли дистиллированную воду (20 мл) и проводили экстракцию с помощью EtOAc (20 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ) с получением 44 мг (55%) прозрачного масла.
Этап 3: Синтез гидрохлорида 4-(2-гидроксиэтил)пиперидин-4-ола
После суспендирования трет-бутил-4-гидрокси-4-(2-гидроксиэтил)пиперидин-1-карбоксилата (42 мг, 0,17 ммоль) в ДХМ (1,7 мл) добавляли 4М HCl в диоксане (0,26 мл, 1,03 ммоль) и перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали. Получали 30 мг (97%) белого твердого вещества.
Этап 4: Синтез 4-(2-гидроксиэтил)-1-(6-нитропиридин-3-ил)пиперидин-4-ола
Гидрохлорид 4-(2-гидроксиэтил)пиперидин-4-ола (30 мг, 0,17 ммоль), 5-хлор-2-нитропиридин (26 мг, 0,17 ммоль) и DIPEA (0,09 мл, 0,5 ммоль) суспендировали в ДМСО ( 1,65 мл) и перемешивали в микроволновой печи при температуре 120°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 19 мг (34%) твердого вещества желтого цвета.
Этап 5: Синтез 2-(4-гидрокси-1-(6-нитропиридин-3-ил)пиперидин-4-ил)этил 4-метилбензолсульфоната
4-(2-гидроксиэтил)-1-(6-нитропиридин-3-ил)пиперидин-4-ол (17 мг, 0,06 ммоль), 4-толуолсульфонилхлорид (12,2 мг, 0,06 ммоль), ДМАП (1,56 мг, 0,013 ммоль) и ТЭА (0,02 мл, 0,13 ммоль) суспендировали при температуре 0°С в ДХМ (0,64 мл) и перемешивали при комнатной температуре в течение 5 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали ДХМ (20 мл), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 22 мг (82%) твердого вещества желтого цвета.
Этап 6: Синтез трет-бутил-4-(2-(4-гидрокси-1-(6-нитропиридин-3-ил)пиперидин-4-ил)этил)пиперазин-1-карбоксилата
2-(4-гидрокси-1-(6-нитропиридин-3-ил)пиперидин-4-ил)этил 4-метилбензолсульфонат (40 мг, 0,09 ммоль), трет-бутилпиперазин-1-карбоксилат (34 мг, 0,14 ммоль) и K2CO3 (26 мг, 0,19 ммоль) суспендировали в ДМФА (1 мл) и перемешивали при температуре 70°С в течение 8 часов. После добавления к реакционному раствору дистиллированной воды (20 мл) экстрагировали EtOAc (20 мл), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (3% МеОН/ДХМ), получая 26 мг (63%) твердого вещества желтого цвета.
Этап 7: Синтез трет-бутил-4-(2-(1-(6-аминопиридин-3-ил)-4-гидроксипиперидин-4-ил)этил)пиперазин-1-карбоксилата
После растворения трет-бутил-4-(2-(4-гидрокси-1-(6-нитропиридин-3-ил)пиперидин-4-ил)этил)пиперазин-1-карбоксилата (30 мг, 0,07 ммоль) в МеОН (0,7 мл) добавляли палладий (10 мас. % на активированном угле, 15 мг) и перемешивали в токе водорода при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали при пониженном давлении. Получали 28 мг (99%) коричневого твердого вещества.
Этап 8: Синтез трет-бутил-4-(2-(1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-4-гидроксипиперидина-4-ил)этил)пиперазин-1-карбоксилата
1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновая кислота (промежуточное соединение 1-1, 21 мг, 0,07 ммоль), трет-бутил-4-(2-(1-(6-аминопиридин-3)-ил)-4-гидроксипиперидин-4-ил)этил)пиперазин-1-карбоксилат (28 мг, 0,07 ммоль), HATU (32 мг, 0,08 ммоль) и DIPEA (0,03 мл, 0,14 ммоль) суспендировали в ДМФА (0,7 мл) и перемешивали при комнатной температуре в течение 18 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (5% МеОН/ДХМ), получая 20 мг (43%) коричневого твердого вещества.
Этап 9: Синтез гидрохлорида 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-гидрокси-4-(2-(пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(2-(1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)-4-гидроксипиперидин-4-ил)этил)пиперазин-1-карбоксилата (19 мг, 0,03 ммоль) в ДХМ (0,3 мл) добавляли 4М HCl в диоксане (0,04 мл, 0,16 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали. Получали 18 мг (97%) белого твердого вещества.
Этап 10: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)-4-гидроксипиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-гидрокси-4-(2-(пиперазин-1-ил)этил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида (18 мг, 0,03 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 8 мг, 0,03 ммоль) и DIPEA (0,015 мл, 0,08 ммоль) суспендировали в ДМСО (0,3 мл) и перемешивали при температуре 90°С в течение 18 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 5 мг (22%) твердого вещества желтого цвета.
Пример 154: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
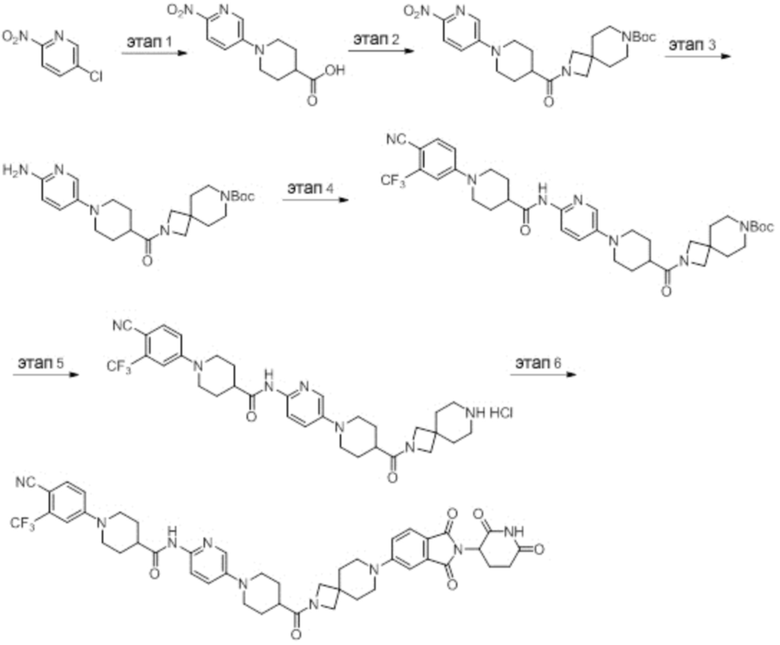
Этап 1: Синтез 1-(6-нитропиридин-3-ил)пиперидин-4-карбоновой кислоты
5-хлор-2-нитропиридин (1 г, 6,31 ммоль), пиперидин-4-карбоновую кислоту (896 мг, 6,91 ммоль) и ТЭА (2,6 мл, 18,93 ммоль) суспендировали в ДМСО (10 мл) и перемешивали в микроволновом реакторе при температуре 120°С в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (10 мл) побочные продукты удаляли экстракцией EtOAc (10 мл) и водный слой концентрировали при пониженном давлении. Получали 650 мг (41%) твердого вещества желтого цвета.
Этап 2: Синтез трет-бутил-2-(1-(6-нитропиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
1-(6-нитропиридин-3-ил)пиперидин-4-карбоновую кислоту (232 мг, 0,93 ммоль), гидрохлорид трет-бутил-2,7-диазаспиро[3.5]нонан-7-карбоксилата (242 мг, 0,93 ммоль), HATU (527 мг, 0,39 ммоль) и DIPEA (0,47 мл, 2,77 ммоль) суспендировали в ДМФА (3 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (2 мл) смесь экстрагировали EtOAc (3 мл × 2). Органический слой промывали соляным раствором (2 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 199 мг (47%) твердого вещества желтого цвета.
Этап 3: Синтез трет-бутил-2-(1-(6-аминопиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
Трет-бутил-2-(1-(6-нитропиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-карбоксилат (199 мг, 0,43 ммоль), 10% Pd/C (194 мг, 0,086 ммоль) суспендировали в МеОН (1 мл) и ДХМ (1 мл) и перемешивали в токе водорода при комнатной температуре в течение 16 часов. Реакционный раствор фильтровали и концентрировали при пониженном давлении. Получали 207 мг (100%) коричневого твердого вещества.
Этап 4: Синтез трет-бутил-2-(1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
Трет-бутил-2-(1-(6-аминопиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3.5]нонан-7-карбоксилат (207 мг, 0,48 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 144 мг, 0,48 ммоль), HATU (275 мг, 0,72 ммоль) и DIPEA (0,25 мл, 1,45 ммоль) суспендировали в ДМФА (2 мл) и перемешивали в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (2 мл) смесь экстрагировали EtOAc (3 мл × 2). Органический слой промывали соляным раствором (2 мл) и дистиллированной водой (2 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 135 мг (39%) темно-серого твердого вещества.
Этап 5: Синтез гидрохлорида N-(5-(4-(2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-2-(1-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)пиперидин-4-карбонил)-2,7-диазаспиро[3,5]нонан-7-карбоксилата (135 мг, 0,19 ммоль) в ДХМ (1 мл) добавляли 4 н. HCl в диоксане (0,2 мл) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. Получали 123 мг (100%) темно-серого твердого вещества.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид N-(5-(4-(2,7-диазаспиро[3.5]нонан-2-карбонил)пиперидин-1-ил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (38 мг, 0,06 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 19 мг, 0,07 ммоль) и DIPEA (0,03 мл, 0,17 ммоль) суспендировали в ДМСО (1 мл) и перемешивали в микроволновом реакторе при температуре 100°С в течение 1 часа. После добавления к реакционной смеси дистиллированной воды (1 мл) смесь экстрагировали EtOAc (1 мл × 2). Органический слой промывали соляным раствором (1 мл × 2), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ПТСХ с получением 5,1 мг (10%) твердого вещества желтого цвета.
Пример 155: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиразин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез трет-бутил-2-((1-(5-аминопиразин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
5-бромпиразин-2-амин (50 мг, 0,29 ммоль), трет-бутил-2-(пиперидин-4-илметил)-2,7-диазаспиро[3.5]нонан-7-карбоксилат (промежуточное соединение 4-7, 140 мг, 0,44 ммоль), CuI (11 мг, 0,058 ммоль), 2-ацетилциклогексанон (0,008 мл, 0,058 ммоль) и Cs2CO3 (189 мг, 0,58 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали в микроволновом реакторе при температуре 130°С в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (10 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 17 мг (14%) коричневого твердого вещества. m/z 417,33 [М+Н]+.
Этап 2: Синтез трет-бутил-2-((1-(5-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиразин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата
Трет-бутил-2-((1-(5-аминопиразин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3.5]нонан-7-карбоксилат (45 мг, 0,11 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 39 мг, 0,13 ммоль), HATU (49 мг, 0,13 ммоль) и DIPEA (0,04 мл, 0,22 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 35 мг (45%) коричневого твердого вещества. m/z 697,40 [М+Н]+.
Этап 3: Синтез гидрохлорида N-(5-(4-((2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиразин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
Трет-бутил-2-((1-(5-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиразин-2-ил)пиперидин-4-ил)метил)-2,7-диазаспиро[3,5]нонан-7-карбоксилат (35 мг, 0,050 ммоль) и 4М HCl в диоксане (0,06 мл, 0,25 ммоль) суспендировали в ДХМ (0,5 мл) и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Получали 31 мг (98%) оранжевого твердого вещества. m/z 597,33 [М+Н]+.
Этап 4: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((7-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиразин-2-ил)пиперидин-4-карбоксамида
Гидрохлорид N-(5-(4-((2,7-диазаспиро[3.5]нонан-2-ил)метил)пиперидин-1-ил)пиразин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (30 мг, 0,047 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 19 мг, 0,071 ммоль) и DIPEA (0,02 мл, 0,094 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 6 мг (15%) твердого вещества желтого цвета.
Пример 156: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(2-(4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)этил)пиперидин-1-ил)пиразин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 156 синтезировали способом, аналогичным способу синтеза соединения Примера 155, используя трет-бутил-4-(2-(пиперидин-4-ил)этил)пиперазин-1-карбоксилат (промежуточное соединение 4-8) вместо трет-бутил-2-(пиперидин-4-илметил)-2,7-диазаспиро[3.5]нонан-7-карбоксилата (промежуточное соединение 4-7).
Пример 157: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 5-бром-N-(4-метоксибензил)пиримидин-2-амина
5-бром-2-хлорпиримидин (1,00 г, 5,17 ммоль) и 4-метоксибензиламин (0,64 мл, 10,3 ммоль) суспендировали в этаноле (10,0 мл) и перемешивали при температуре 80°С в течение 16 часов. После концентрирования реакционного раствора при пониженном давлении добавляли дистиллированную воду (20 мл), полученное твердое вещество фильтровали и сушили, получая 772 мг (51%) белого твердого вещества. m/z 294,97 [М+Н]+.
Этап 2: Синтез трет-бутил-4-((1-(2-((4-метоксибензил)амино)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
5-бром-N-(4-метоксибензил)пиримидин-2-амин (403 мг, 1,37 ммоль), трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилат (промежуточное соединение 4-3, 428 мг, 1,51 ммоль), Pd(OAc)2 (62 мг, 0,274 ммоль), Xphos (158 мг, 0,274 ммоль) и трет-бутоксид натрия (197 мг, 2,06 ммоль) суспендировали в толуоле (15,0 мл) и перемешивали при температуре 110°С в течение 48 часов. После добавления к реакционному раствору дистиллированной воды (10 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 156 мг (23%) твердого вещества желтого цвета. m/z 497,28 [М+Н]+.
Этап 3: Синтез 5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиримидин-2-амина
После суспендирования трет-бутил-4-((1-(2-((4-метоксибензил)амино)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (156 мг, 0,314 ммоль) в ДХМ (1,50 мл), добавляли ТФУ (1,50 мл) и перемешивали при температуре 40°С в течение 16 часов. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 475 мг коричневой жидкости.
Этап 4: Синтез трет-бутил-4-((1-(2-аминопиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
После суспендирования 5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиримидин-2-амина (475 мг) в ДХМ (10,0 мл) добавляли ди-трет-бутилдикарбоната (102 мг, 0,471 ммоль) и ТЭА (0,13 мл, 0,942 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 1 часа. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% MeOH/ДХМ), получая 99 мг (в 2 этапа, 84%) твердого вещества желтого цвета. m/z 377,24 [М+Н]+.
Этап 5: Синтез трет-бутил-4-((1-(2-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
После суспендирования оксалилхлорида (0,07 мл, 0,792 ммоль) и ДМФА (0,01 мл) в ДХМ добавляли 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 138 мг, 0,396 ммоль) и перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли трет-бутил-4-((1-(2-аминопиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилат (99 мг, 0,264 ммоль) и ТЭА (0,09 мл, 0,528 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ) с получением 135 мг (78%) не совсем белого твердого вещества. m/z 657,23 [М+Н]+.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((1-(2-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (135 мг, 0,206 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,26 мл, 1,03 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 115 мг (98%) белого твердого вещества. m/z 557,29 [М+Н]+.
Этап 7: Синтез трет-бутил-4-((4-((1-(2-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-карбоксилата
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамида (65 мг, 0,12 ммоль) и трет-бутил-4-формилпиперидин-1-карбоксилата (30 мг, 0,14 ммоль) в ацетонитриле (2,0 мл) добавляли триацетоксиборгидрид натрия (74 мг, 0,35 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли водный раствор NaHCO3 (15 мл), затем экстрагировали EtOAc (20 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ) с получением 48 мг (54%) не совсем белого твердого вещества. m/z 754,34 [М+Н]+.
Этап 8: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(пиперидин-4-илметил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((4-((1-(2-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиримидин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-карбоксилата (89 мг, 0,12 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,15 мл, 0,59 ммоль) и перемешивали при комнатной температуре в течение 1 час. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 76 мг (97%) белого твердого вещества. m/z 654,44 [М+Н]+.
Этап 9: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(пиперидин-4-илметил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамид (35 мг, 0,054 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 22 мг, 0,081 ммоль) и DIPEA (0,02 мл, 0,11 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 40 мг (80%) твердого вещества желтого цвета.
Пример 158: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 158 синтезировали способом, аналогичным способу синтеза соединения Примера 157, с использованием трет-бутил-(S)-3-формилпирролидин-1-карбоксилата вместо трет-бутил-4-формилпиперидин-1-карбоксилата.
Пример 159: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-6)-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 159 синтезировали способом, аналогичным способу синтеза соединения Примера 157, используя 2-(2,6-диоксопиперидин-3-ил)-5,6-дифторизоиндолин-1,3-дион (промежуточное соединение 2-3) вместо 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 160: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(((3R)-1-(2-(2,6-диоксопиперидин)-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пирролидин-3-ил)метил)пиперазин-1-ил)метил)пиперидин-1-ил)пиримидин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 160 синтезировали способом, аналогичным способу синтеза соединения Примера 157, с использованием трет-бутил-(S)-3-формилпирролидин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5,6-дифторизоиндолин-1,3-диона (промежуточное соединение 2-3) соответственно вместо трет-бутил-4-формилпиперидин-1-карбоксилата и 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-диона (промежуточное соединение 2-1).
Пример 161: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 5-(((трет-бутилдиметилсилил)окси)метил)пиридин-2-амина
После суспендирования (6-аминопиридин-3-ил)метанола (500 мг, 4,02 ммоль) в ДХМ (20,0 мл) и ДМФ (5,0 мл) добавляли TBDMSCl (850 мг, 5,64 ммоль), DIPEA (1,05 мл, 6,03 ммоль) и ДМАП (9,82 мг, 0,0804 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали ДХМ (20 мл × 2), и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 816 мг (85%) твердого вещества желтого цвета.
Этап 2: Синтез N-(5-(((трет-бутилдиметилсилил)окси)метил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
5-(((трет-бутилдиметилсилил)окси)метил)пиридин-2-амин (300 мг, 1,26 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 450 мг, 1,51 ммоль), HATU (574 мг, 1,51 ммоль) и DIPEA (0,43 мл, 2,52 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 457 мг (70%) белого твердого вещества.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(гидроксиметил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования N-(5-(((трет-бутилдиметилсилил)окси)метил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (457 мг, 0,881 ммоль) в ДХМ (3,00 мл), добавляли 4M HCl в диоксане (1,10 мл, 4,41 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 260 мг (73%) белого твердого вещества. m/z 405,23 [М+Н]+.
Этап 4: Синтез N-(5-(хлорметил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(гидроксиметил)пиридин-2-ил)пиперидин-4-карбоксамида (260 мг, 0,643 ммоль) в ДХМ (10,0 мл) добавляли мезилхлорид (0,10 мл, 1,29 ммоль) и DIPEA (0,45 мл, 2,57 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 266 мг (98%) белого твердого вещества. m/z 423,23 [М+Н]+.
Этап 5: Синтез трет-бутил-4-((1-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)метил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
N-(5-(хлорметил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамид (100 мг, 0,236 ммоль), трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилат (промежуточное соединение 4-3, 80 мг, 0,249 ммоль) и NaHCO3 (40 мг, 0,472 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при температуре 50°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/ДХМ), получая 100 мг (63%) белого твердого вещества. m/z 670,30 [М+Н]+.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-(пиперазин-1-илметил)пиперидин-1-ил)метил)пиридин-2-ил) пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((1-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)метил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (100 мг, 0,149 ммоль) в ДХМ (1,00 мл), добавляли 4М HCl в диоксане (0,19 мл, 0,747 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 84 мг (99%) белого твердого вещества. m/z 570,30 [М+Н]+.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-(пиперазин-1-илметил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамид (40 мг, 0,070 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 31 мг, 0,011 ммоль) и DIPEA (0,03 мл, 0,15 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 20 мг (34%) твердого вещества желтого цвета.
Пример 162: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамид
Соединение Примера 162 синтезировали способом, аналогичным способу синтеза соединения Примера 161, с использованием трет-бутил-4-(пиперазин-1-илметил)пиперидин-1-карбоксилата (промежуточное соединение 4-10) вместо трет-бутил-4-(пиперидин- 4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3).
Пример 163: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-((4-((2-(2,6-диоксопиперидин-3-ил)-1,3)-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)метил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамид
Этап 1: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-(гидроксиметил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4- карбоксамида
N-(5-(хлорметил)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамид (50 мг, 0,12 ммоль), пиперидин-4-илметанол (16 мг , 0,14 ммоль) и NaHCO3 (20 мг, 0,24 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при температуре 50°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (1,0 мл) экстрагировали EtOAc (1 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/ДХМ), получая 37 мг (62%) белого твердого вещества. m/z 502,26 [М+Н]+.
Этап 2: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-формилпиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-(гидроксиметил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида (37 мг, 0,074 ммоль) в ДХМ (5,0 мл) добавляли ДМФА (38 мг, 0,089 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной смеси водного раствора Na2S2O3 (10 мл) экстрагировали ДХМ (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 30 мг (81%) белого твердого вещества. m/z 500,26 [М+Н]+.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-((4-((2-(2,6-диоксопиперидин-3-ил)-1),3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)метил)пиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-((4-формилпиперидин-1-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида (30 мг, 0,060 ммоль) и 2-(2,6-диоксопиперидин-3-ил)-5-(пиперидин-4-илокси)изоиндолин-1,3-диона (24 мг, 0,066 ммоль) в ацетонитриле (5,0 мл) добавляли триацетоксиборгидрид натрия (38 мг, 0,18 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (10 мл), затем экстрагировали EtOAc (20 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 28 мг (55%) белого твердого вещества.
Пример 164: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез трет-бутил-4-((6-аминопиридин-3-ил)метил)пиперидин-1-карбоксилата
5-бромпиридин-2-амин (190 мг, 1,10 ммоль), трет-бутил-4-метиленпиперидин-1-карбоксилат (255 мг, 1,20 ммоль), Pd(dppf)Cl2 ⋅ ДХМ (27 мг, 0,033 ммоль), 0,5 М 9-BBN в ТГФ (3,87 мл, 1,98 ммоль) и K2CO3 (194 мг, 1,43 ммоль) суспендировали в ДМФА (2,4 мл) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 179 мг (56%) твердого вещества желтого цвета. m/z 292,25 [М+Н]+.
Этап 2: Синтез трет-бутил-4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)метил)пиперидин-1-карбоксилата
Трет-бутил-4-((6-аминопиридин-3-ил)метил)пиперидин-1-карбоксилат (179 мг, 0,614 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 220 мг, 0,737 ммоль), HATU (280 мг, 0,737 ммоль) и DIPEA (0,21 мл, 1,23 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% MeOH/ДХМ), получая 271 мг (77%) белого твердого вещества. m/z 572,18 [М+Н]+.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперидин-4-илметил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)метил)пиперидин-1-карбоксилата (271 мг, 0,398 ммоль) в ДХМ (3,00 мл), добавляли 4М HCl в диоксане (0,50 мл, 1,99 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (25 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 138 мг (62%) белого твердого вещества. m/z 472,25 [М+Н]+.
Этап 4: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)метил)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(пиперидин-4-илметил)пиридин-2-ил)пиперидин-4-карбоксамида (40 мг, 0,096 ммоль), 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1, 39 мг, 0,11 ммоль) в ацетонитриле (1,0 мл) добавляли триацетоксиборгидрид натрия (61 мг, 0,29 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (1,5 мл) с последующей экстракцией EtOAc (2,0 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 45 мг (64%) твердого вещества желтого цвета.
Пример 165: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез 2-(6-нитропиридин-3-ил)этан-1-ола
После суспендирования этил-2-(6-нитропиридин-3-ил)ацетата (500 мг, 2,38 ммоль) в безводном ТГФ (10 мл) медленно добавляли 1М BH3⋅ТГФ (7,14 мл, 7,14 ммоль) и перемешивали при температуре 60°С в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (10 мл) экстрагировали EtOAc (15 мл × 2), органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 300 мг (74%) белого твердого вещества.
Этап 2: Синтез 5-(2-бромэтил)-2-нитропиридина
После суспендирования 2-(6-нитропиридин-3-ил)этан-1-ола (358 мг, 2,13 ммоль) в ДХМ (20,0 мл), добавляли трифенилфосфин (614 мг, 2,34 ммоль) и тетрабромид углерода (918 мг, 2,77 ммоль) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 490 мг (99%) белого твердого вещества.
Этап 3: Синтез трет-бутил-4-((1-(2-(6-нитропиридин-3-ил)этил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
5-(2-бромэтил)-2-нитропиридин (100 мг, 0,430 ммоль), трет-бутил-4-(пиперидин-4-илметил)пиперазин-1-карбоксилат (промежуточное соединение 4-3, 147 мг, 0,520 ммоль) и K2CO3 (119 мг, 0,600 ммоль) суспендировали в ацетонитриле (1,0 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 161 мг (86%) белого твердого вещества. m/z 434,11 [М+Н]+.
Этап 4: Синтез трет-бутил-4-((1-(2-(6-аминопиридин-3-ил)этил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата
После суспендирования трет-бутил-4-((1-(2-(6-нитропиридин-3-ил)этил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (161 мг, 0,065 ммоль) в смеси ДХМ (15 мл) и MeOH (5 мл), добавляли Pd/C (10 мас. % Pd, 32 мг) и перемешивали в токе водорода при комнатной температуре в течение 4 часов. Реакционный раствор фильтровали и концентрировали. Получали черное твердое вещество (133 мг, 89%). m/z 404,27 [М+Н]+.
Этап 5: Синтез трет-бутил-4-((1-(2-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этил)пиперидина-4-ил)метил)пиперазин-1-карбоксилата
Трет-бутил-4-((1-(2-(6-аминопиридин-3-ил)этил)пиперидин-4-ил)метил)пиперазин-1-карбоксилат (133 мг, 0,330 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 118 мг, 0,396 ммоль), HATU (140 мг, 0,396 ммоль) и DIPEA (0,11 мл, 0,660 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ) с получением 65 мг (29%) белого твердого вещества. m/z 684,53 [М+Н]+.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-(пиперазин-1-илметил)пиперидин-1-ил)этил)пиридин-2- ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-((1-(2-(6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)этил)пиперидин-4-ил)метил)пиперазин-1-карбоксилата (65 мг, 0,095 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,12 мл, 0,48 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (1,5 мл) с последующей экстракцией ДХМ (2,0 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 33 мг (60%) белого твердого вещества. m/z 584,38 [М+Н]+.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((4-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамида
1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-(пиперазин-1-илметил)пиперидин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамид (33 мг, 0,057 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-фторизоиндолин-1,3-дион (промежуточное соединение 2-1, 23 мг, 0,085 ммоль) и DIPEA (0,02 мл, 0,11 ммоль) суспендировали в ДМСО (1,0 мл) и перемешивали при температуре 90°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (10 мл) экстрагировали EtOAc (2,0 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 17 мг (36%) твердого вещества желтого цвета.
Пример 166: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамид
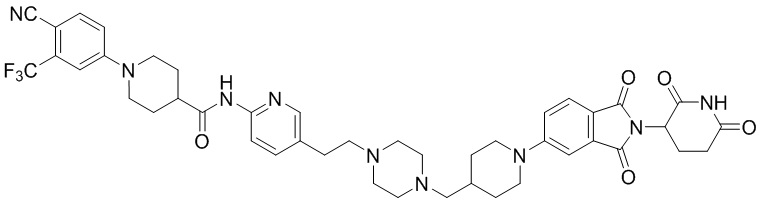
Соединение Примера 166 синтезировали способом, аналогичным способу синтеза соединения Примера 165, с использованием трет-бутил-4-(пиперазин-1-илметил)пиперидин-1-карбоксилата (промежуточное соединение 4-10) вместо трет-бутил-4-(пиперидин- 4-илметил)пиперазин-1-карбоксилата (промежуточное соединение 4-3).
Пример 167: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамид
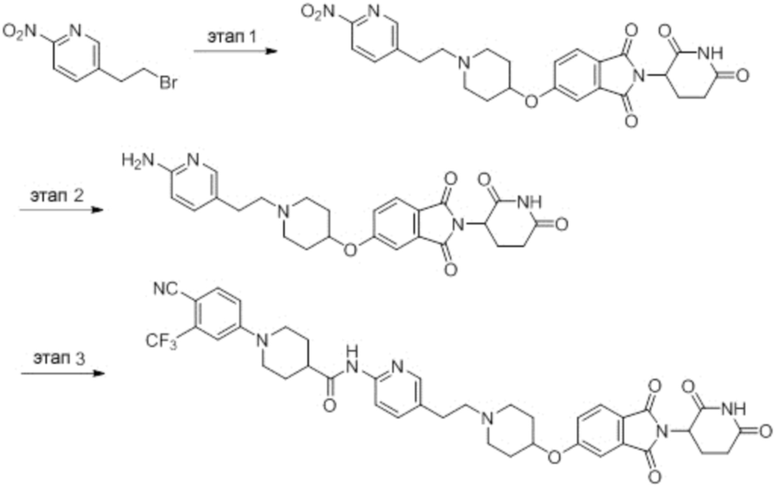
Этап 1: Синтез 2-(2,6-диоксопиперидин-3-ил)-5-((1-(2-(6-нитропиридин-3-ил)этил)пиперидин-4-ил)окси)изоиндолина-1,3-диона
5-(2-бромэтил)-2-нитропиридин (50 мг, 0,22 ммоль), 2-(2,6-диоксопиперидин-3-ил)-5-(пиперидин-4-илокси)изоиндолин-1,3-дион (116 мг, 0,32 ммоль) и K2CO3 (61 мг, 0,44 ммоль) суспендировали в ацетонитриле (1,0 мл) и перемешивали при температуре 70°С в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 49 мг (44%) белого твердого вещества. m/z 508,10 [М+Н]+.
Этап 2: Синтез 5-((1-(2-(6-аминопиридин-3-ил)этил)пиперидин-4-ил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолина-1,3-диона
После растворения 2-(2,6-диоксопиперидин-3-ил)-5-((1-(2-(6-нитропиридин-3-ил)этил)пиперидин-4-ил)окси)изоиндолин-1,3-диона (49 мг, 0,097 ммоль) в смеси ДХМ (10 мл) и MeOH (5 мл), добавляли Pd/C (10 мас. % Pd, 10 мг) и перемешивали в токе водорода при комнатной температуре в течение 4 часов. Реакционный раствор фильтровали и концентрировали. Получали 41 мг (89%) фиолетового твердого вещества. m/z 478,29 [М+Н]+.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)этил)пиридин-2-ил)пиперидин-4-карбоксамида
5-((1-(2-(6-аминопиридин-3-ил)этил)пиперидин-4-ил)окси)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион (41 мг, 0,086 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 30 мг, 0,10 ммоль), HATU (38 мг, 0,10 ммоль) и DIPEA (0,03 мл, 0,17 ммоль) суспендировали в ДМФ (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 10 мг (15%) белого твердого вещества.
Пример 168: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамид
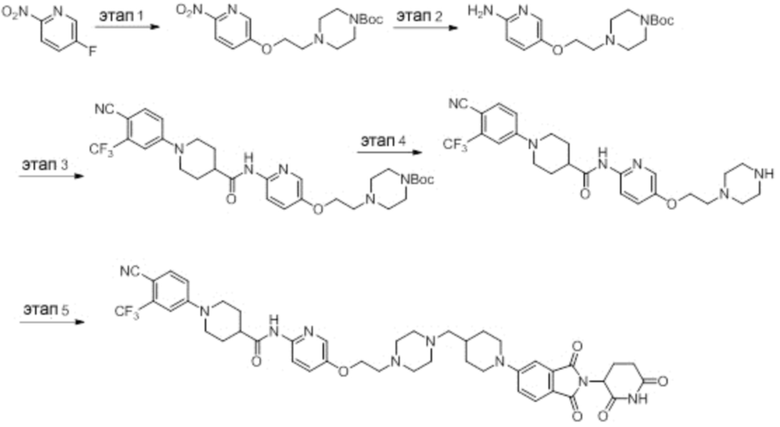
Этап 1: Синтез трет-бутил-4-(2-((6-нитропиридин-3-ил)окси)этил)пиперазин-1-карбоксилата
После суспендирования трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11, 195 мг, 0,845 ммоль) в ТГФ добавляли 60% NaH (33 мг, 0,845 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 1 часа. После добавления к реакционному раствору 5-фтор-2-нитропиридина (100 мг, 0,704 ммоль) смесь перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 125 мг (52%) белого твердого вещества.
Этап 2: Синтез трет-бутил-4-(2-((6-аминопиридин-3-ил)окси)этил)пиперазин-1-карбоксилата
После растворения трет-бутил-4-(2-((6-нитропиридин-3-ил)окси)этил)пиперазин-1-карбоксилата (125 мг, 0,355 ммоль) в смеси ДХМ (10 мл) и МеОН (5 мл) добавляли Pd/C (10 мас. % Pd, 25 мг) и перемешивали в токе водорода при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали. Получали 111 мг (97%) фиолетового твердого вещества. m/z 323,42 [М+Н]+.
Этап 3: Синтез трет-бутил-4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазин-1-карбоксилата
Трет-бутил-4-(2-((6-аминопиридин-3-ил)окси)этил)пиперазин-1-карбоксилат (111 мг, 0,334 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 112 мг, 0,378 ммоль), HATU (143 мг, 0,378 ммоль) и DIPEA (0,11 мл, 0,688 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 179 мг (86%) белого твердого вещества. m/z 603,31 [М+Н]+.
Этап 4: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования трет-бутил-4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазин-1-карбоксилата (179 мг, 0,297 ммоль) в ДХМ (1,00 мл) добавляли 4М HCl в диоксане (0,37 мл, 1,49 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционной смеси добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 135 мг (91%) белого твердого вещества. m/z 503,27 [М+Н]+.
Этап 5: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида (50 мг, 0,099 ммоль) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1, 44 мг, 0,12 ммоль) в ацетонитриле (10,0 мл) добавляли триацетоксиборогидрид натрия (62 мг, 0,30 ммоль) и перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли водный раствор NaHCO3 (10 мл), затем экстрагировали EtOAc (20 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 38 мг (45%) твердого вещества желтого цвета.
Пример 169: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)окси)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 169 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-4-гидроксипиперидин-1-карбоксилата вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11).
Пример 170: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)окси)пиридин-2-ил)пиперидин-4-карбоксамид
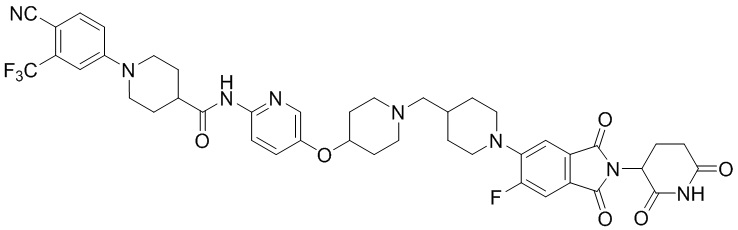
Соединение Примера 170 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-4-гидроксипиперидин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-6-фтор-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-8) соответственно вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 171: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-ил)метил)пиперидин-4-ил)окси)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 171 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-4-гидроксипиперидин-1-карбоксилата и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)азетидин-3-карбальдегида (промежуточное соединение 3-3) соответственно вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 172: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-3-метилазетидин-3-ил)метил)пиперидин-4-ил)окси)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 172 синтезировали способом, аналогичным способу синтеза соединения Примера 168, используя трет-бутил-4-гидроксипиперидин-1-карбоксилат и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)-3-метилазетидин-3-карбальдегид (промежуточное соединение 3-12) соответственно вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11) и 1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-карбальдегида (промежуточное соединение 3-1).
Пример 173: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)азетидин-3-ил)окси)пиридин-2-ил)пиперидин-4-карбоксамид
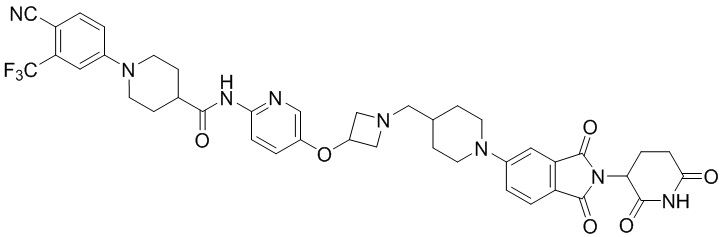
Соединение Примера 173 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-3-гидроксиазетидин-1-карбоксилата вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11).
Пример 174: 1-(4-циано-3-(трифторметил)фенил)-N-(5-((1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)метокси)пиридин-2-ил)пиперидин-4-карбоксамид
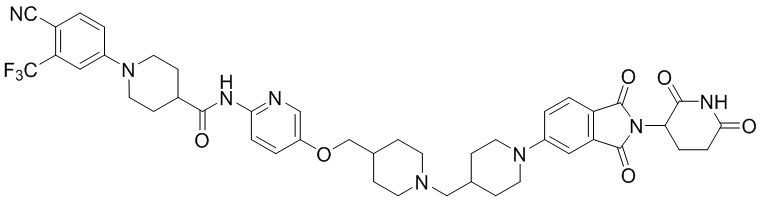
Соединение Примера 174 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилата вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11).
Пример 175: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(1-((1-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)пиперидин-4-ил)метил)пиперидин-4-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамид

Соединение Примера 175 синтезировали способом, аналогичным способу синтеза соединения Примера 168, с использованием трет-бутил-4-(2-гидроксиэтил)пиперидин-1-карбоксилата вместо трет-бутил-4-(2-гидроксиэтил)пиперазин-1-карбоксилата (промежуточное соединение 4-11).
Пример 176: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-(2-((3-((2,6-диоксопиперидин-3-ил))амино)фенил)амино)-2-оксоэтил)пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамид

Этап 1: Синтез метил-2-(4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазина-1-ил)ацетата
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида (70 мг, 0,14 ммоль) в ТГФ (1,0 мл) добавляли метилбромацетат (0,013 мл, 0,14 ммоль) и ТЭА (0,06 мл, 0,42 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционному раствору дистиллированной воды (1,0 мл) экстрагировали EtOAc (2,0 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/гексан), получая 50 мг (62%) белого твердого вещества. m/z 575,26 [М+Н]+.
Этап 2: Синтез 2-(4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазин-1-ил)уксусной кислоты
После суспендирования метил-2-(4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазин-1-ил)ацетата (50 мг, 0,087 ммоль) в ТГФ (2,0 мл) и дистиллированной воде (2,0 мл), добавляли LiOH⋅H2O (14 мг, 0,35 ммоль) и перемешивали при комнатной температуре в течение 3 часов. После выпаривания растворителя и экстракции дистиллированной водой к водному слою добавляли 1 н. HCl и проводили экстракцию EtOAc (2,0 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 20 мг (41%) белого твердого вещества. m/z 561,28 [М+Н]+.
Этап 3: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-(2-((3-((2,6-диоксопиперидин-3-ил)амино)фенил)амино)-2-оксоэтил)пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида
2-(4-(2-((6-(1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамидо)пиридин-3-ил)окси)этил)пиперазин-1-ил)уксусную кислоту (20 мг, 0,036 ммоль), 3-((3-аминофенил)амино)пиперидин-2,6-дион (промежуточное соединение 2-7, 9,5 мг, 0,043 ммоль), HATU (16 мг, 0,043 ммоль) и DIPEA. (0,01 мл, 0,072 ммоль) суспендировали в ДМФА (1,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (10 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ), получая 12 мг (44%) белого твердого вещества.
Пример 177: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-((4-(2-((3-((2,6-диоксопиперидин-3-ил)амино))фенил)амино)-2-оксоэтил)пиперазин-1-ил)метил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид
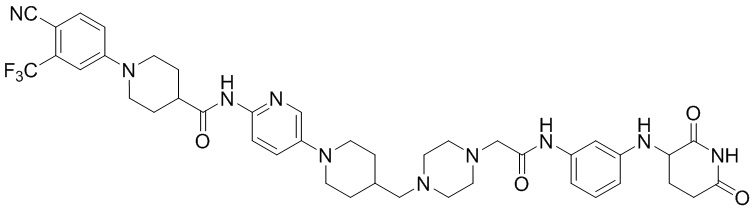
Соединение Примера 177 синтезировали способом, аналогичным способу синтеза соединения Примера 176, используя 1-(4-циано-3-(трифторметил)фенил)-N-(5-(4-(пиперазин-1-илметил)пиперидин-1-ил)пиридин-2-ил)пиперидин-4-карбоксамид вместо 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(пиперазин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида.
Пример 178: 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин)-5-ил)окси)пиперидин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамид
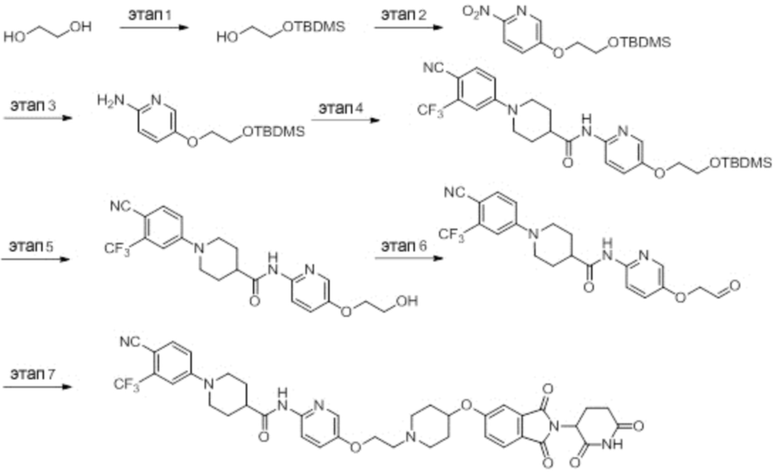
Этап 1: Синтез 2-((трет-бутилдиметилсилил)окси)этан-1-ола
После суспендирования этан-1,2-диола (500 мг, 8,06 ммоль) в ТГФ добавляли 60% NaH (388 мг, 9,67 ммоль) при температуре 0°С и перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли TBDMSCl (1,46 г, 9,67 ммоль) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционной смеси дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 665 мг (46%) белого твердого вещества.
Этап 2: Синтез 5-(2-((трет-бутилдиметилсилил)окси)этокси)-2-нитропиридина
После суспендирования 2-((трет-бутилдиметилсилил)окси)этан-1-ола (629 мг, 3,57 ммоль), 5-гидрокси-2-нитропиридина (500 мг, 3,57 ммоль) и трифенилфосфина (1,13 г, 4,28 ммоль) в ТГФ (15,0 мл), добавляли DEAD (0,67 мл, 4,28 ммоль) и перемешивали при температуре 40°С в течение 4 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (30% EtOAc/гексан), получая 650 мг (61%) бесцветной жидкости. m/z 299,14 [М+Н]+.
Этап 3: Синтез 5-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-2-амина
После растворения 5-(2-((трет-бутилдиметилсилил)окси)этокси)-2-нитропиридина (320 мг, 1,07 ммоль) в МеОН (10 мл) добавляли Pd/C (10 мас. % Pd, 64 мг) и перемешивали в токе водорода при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали. Получали фиолетовое твердое вещество (288 мг, 100%). m/z 269,27 [М+Н]+.
Этап 4: Синтез N-(5-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида
5-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-2-амин (288 мг, 1,07 ммоль), 1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоновую кислоту (промежуточное соединение 1-1, 384 мг, 1,29 ммоль), HATU (490 мг, 1,29 ммоль) и DIPEA (0,37 мл, 2,14 ммоль) суспендировали в ДМФА (2,0 мл) и перемешивали при комнатной температуре в течение 16 часов. После добавления к реакционному раствору дистиллированной воды (15 мл) экстрагировали EtOAc (20 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% МеОН/ДХМ) с получением 356 мг (61%) белого твердого вещества. m/z 549,23 [М+Н]+.
Этап 5: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-гидроксиэтокси)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования N-(5-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-2-ил)-1-(4-циано-3-(трифторметил)фенил)пиперидин-4-карбоксамида (156 мг, 0,284 ммоль) в ДХМ (1,00 мл), добавляли 4М HCl в диоксане (0,36 мл, 1,42 ммоль) и перемешивали при комнатной температуре в течение 1 часа. После концентрирования реакционного раствора добавляли водный раствор NaHCO3 (15 мл) с последующей экстракцией ДХМ (20 мл × 2). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 111 мг (90%) белого твердого вещества. m/z 435,27 [М+Н]+.
Этап 6: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-оксоэтокси)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-гидроксиэтокси)пиридин-2-ил)пиперидин-4-карбоксамида (61 мг, 0,14 ммоль) в ДХМ (5,0 мл) добавляли ДМП (72 мг, 0,17 ммоль) и перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной смеси водного раствора Na2S2O3 (10 мл) экстрагировали ДХМ (25 мл × 2), органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (50% EtOAc/ДХМ) с получением 40 мг (66%) белого твердого вещества. m/z 433,21 [М+Н]+.
Этап 7: Синтез 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-(4-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-5-ил)окси)пиперидин-1-ил)этокси)пиридин-2-ил)пиперидин-4-карбоксамида
После суспендирования 1-(4-циано-3-(трифторметил)фенил)-N-(5-(2-оксоэтокси)пиридин-2-ил)пиперидин-4-карбоксамида (40 мг, 0,093 ммоль) и 2-(2,6-диоксопиперидин-3-ил)-5-(пиперидин-4-илокси)изоиндолин-1,3-диона (33 мг, 0,093 ммоль) в ацетонитриле (5,0 мл) добавляли триацетоксиборгидрид натрия (59 мг, 0,28 ммоль) и перемешивали при комнатной температуре в течение 30 минут. К реакционному раствору добавляли водный раствор NaHCO3 (10 мл), затем экстрагировали EtOAc (10 мл × 2) и органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток подвергали ЖХСД (10% MeOH/DCM), получая 10 мг (14%) белого твердого вещества.
Соединения следующих Примеров были синтезированы способами, аналогичными предыдущим способам.
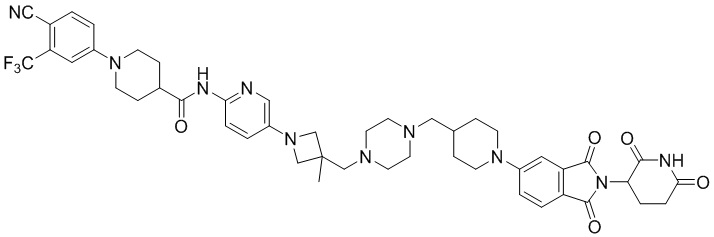



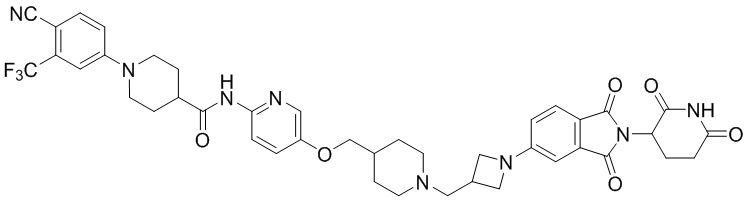
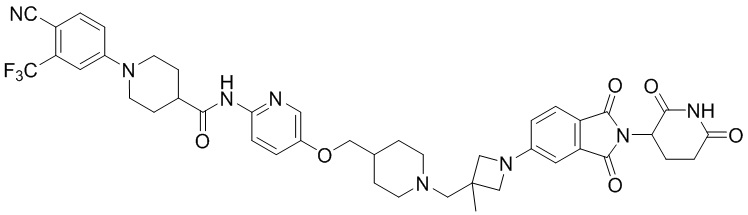
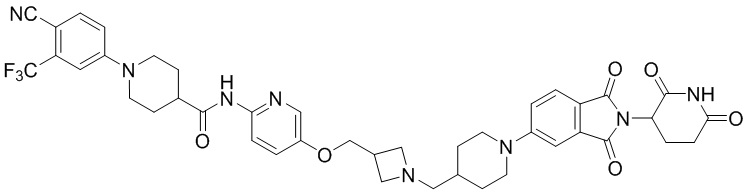
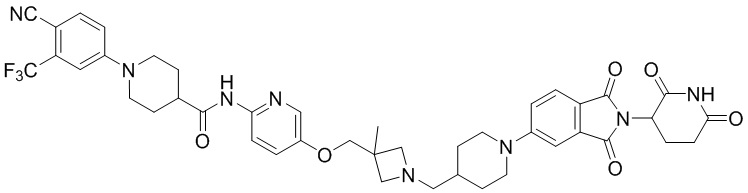





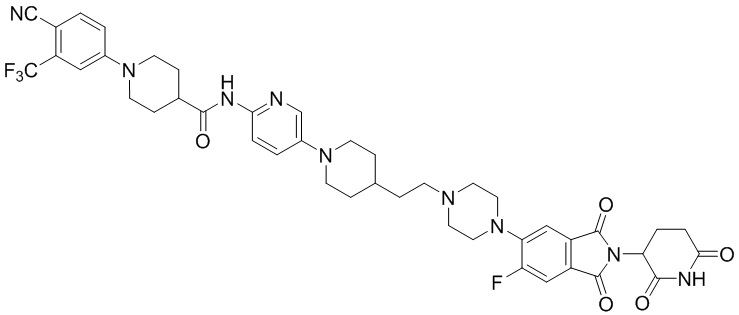


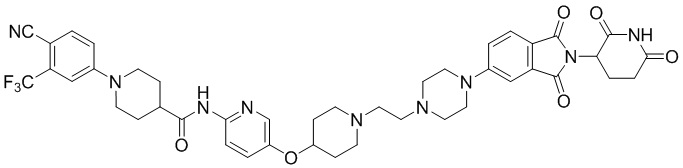





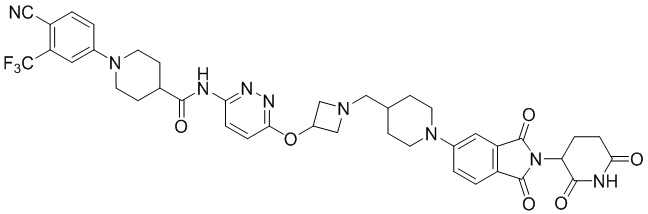


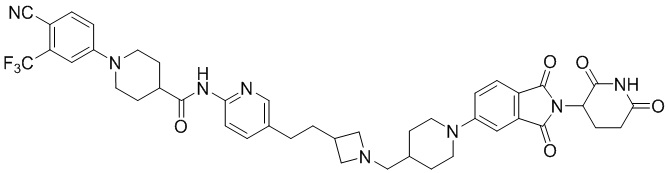


Результаты ЯМР и/или ЖХ/МС анализа вышеуказанных синтезированных соединений приведены ниже в Таблице 5.
Экспериментальный пример 1: Анализ разрушения белка андрогенового рецептора (AR)
После обработки клеток LNCaP синтезированным соединением Примера измеряли количество белка AR, присутствующего в клетках. Количество белка AR измеряли с использованием метода обнаружения на основе вестерн-блоттинга. Протокол эксперимента с использованием клеток LNCaP был следующим:
Культура. Клетки LNCaP ресуспендировали в среде RPMI1640 MEDIUM (Hyclone, SH30027.01) с 10% ФБС (Hyclone, SV30207.02) и 1% пенициллин-стрептомицина (Welgene, LS 202-02) с получением концентрации 3×105 клеток/мл. Затем по 1 мл высевали в 12-луночный планшет. После этого их культивировали в течение 3 дней.
Обработка соединением. 10 мкл 0,1, 1, 10 и 100 мкМ соединения, что представляет собой конечную концентрацию для обработки соединением, и их 100-кратные разведения 0,001, 0,01, 0,1 и 1 мкМ добавляли в 1 мл среды каждой лунки, и через 20 часов клетки собирали.
Лизис клеток. Осадок клеток суспендировали с использованием 1% SDS-буфера для лизиса (50 мМ Трис, 1 мМ ЭДТА, 1% SDS, pH 8,0, 0,5 мМ PMSF, 1x коктейль ингибиторов протеазы/фосфатазы (Cell Signaling Technology, 5872s)) и обрабатывали ультразвуком (70% АМП, 5 циклов (30 секунд ВКЛ/59 секунд ВЫКЛ). Лизат клеток получали после центрифугирования при температуре 4°С, при 15000 g, в течение 20 минут.
Количественная оценка белка. Анализ белка с бицинхониновой кислотой (BCA) (набор для анализа белка SMARTTM BCA Protein Assay Kit, iNtRON Biotechnology, 21071) проводили с использованием 96-луночного микропланшета. После добавления 5 мкл клеточного лизата и 5 мкл 1% SDS-буфера для лизиса в каждую лунку 96-луночного планшета дополнительно добавляли 200 мкл реагента ВСА (реагент А : реагент В = 50 : 1). После инкубации при температуре 37°С в течение 30 минут планшет охлаждали при комнатной температуре в течение 10 минут. Затем измеряли оптическую плотность при длине волны 562 нм. Концентрацию неизвестного белка измеряли с помощью стандартной кривой BSA (0, 0,125, 0,25, 0,5, 1, 2 мг/мл). Образцы для вестерн-блоттинга готовили путем смешивания клеточного лизата, 1% SDS-буфера для лизиса, 4X буфера для образцов Bolt™ LDS Sample (Invitrogen, B0008) и 10X реагента BoltTM Sample Reduction Agent (Invitrogen, B0009) и кипячения смеси при температуре 70°С в течение 10 минут.
Электрофорез. После загрузки 8 мкг образца белка в каждую лунку 17-луночного 1,0 мм мини-протеинового геля Bolt™ с градиентом концентрации от 4 до 12%, Bis-Tris, (Invitrogen, NW04127BOX), электрофорезный буфер Bolt™ MES SDS (Invitrogen, B0002) использовали для электрофореза при напряжении 200 В (постоянное напряжение) в течение 50 минут.
Перенос. Используя гель для электрофореза и стартовую систему переноса Trans-Blot® Turbo™ (Bio-RAD, #17001918, нитроцеллюлозная мини-мембрана), осуществляли перенос в течение 15 минут в условиях 1,3 А (постоянная сила тока) и 25 В (предел напряжения). Для подтверждения переноса белка использовали 15 мл раствора Понсо S (Sigma, P7170-1L) для окрашивания в течение 1 минуты с последующей промывкой для подтверждения степени переноса.
Блокирование. Мембраны для обнаружения AR блокировали в течение 45 минут с помощью 5% раствора обезжиренного молока/0,2% буфера TBST (обезжиренное молоко: BD, 232100/20X TBS: Biosesang, TR2008-100-00/10% раствор Tween 20: Bio-RAD, #161-0781). Мембраны для обнаружения GAPDH и β-актина блокировали в течение 45 минут блокирующим буфером Odyssey: 0,1% TBST = 1:1 (блокирующий буфер Odyssey: Li-COR Biosciences, 927-50000).
Антитело и обнаружение. Первичное антитело к AR (андрогеновому рецептору: CST, 5153s) смешивали с 5% раствором обезжиренного молока/0,2% TBST в соотношении 1:1000 и прикрепляли в течение 3 часов при комнатной температуре. Первичное антитело к β-актину (GeneTex, 629630) смешивали с 5% БСА/0,2% TBST в соотношении 1:2000 и прикрепляли в течение 3 часов при комнатной температуре. Первичное антитело к GAPDH (GeneTex, 100118) смешивали с 5% БСА/0,2% TBST в соотношении 1:2000 и прикрепляли в течение 3 часов при комнатной температуре. Через 3 часа планшет промывали 3 раза каждые 5 минут с помощью TBST (0,2% Tween 20). Антикроличий IgG, HRP-связанное антитело (CST, 7074s), вторичное антитело для AR-антитела смешивали с 5% раствором обезжиренного молока/0,2% TBST в соотношении 1:5000 и прикрепляли в течение 45 минут при комнатной температуре. Козье анти-кроличье IgG вторичное антитело IRDye® 800CW и козье анти-мышиное IgG вторичное антитело IRDye® 680RD (LI-COR, 926-32211, 926-68070), вторичные антитела против антитела к β-актину и антитела к GAPDH смешивали с 5% БСА/0,2% TBST в соотношении 1:10000 и присоединяли при комнатной температуре в течение 45 минут. Через 45 минут планшет промывали 5 раз каждые 5 минут, используя TBST (0,2% Tween 20). После взаимодействия с мембраной с использованием хемилюминесцентного субстрата SuperSignalTM West Pico Plus (Thermo Scientific, 34580) проводили обнаружение с использованием системы Odyssey® Fc Imaging (LI-COR, 2800).
Результаты этой оценки обобщены и показаны в Таблице 6 ниже.
Как показано в Таблице 5, соединения настоящего изобретения показали хорошую активность в отношении разрушения андрогенового рецептора.
В частности, в различных аспектах, таких как активность разрушения андрогенового рецептора, предпочтительными оказались соединения Примеров 6, 11, 14, 15, 18, 19, 20, 34, 35, 38, 43, 44, 49, 66, 70, 75, 86 , 121, 133, 140, 143, 146, 147, 164, 169, 170, 173, 174, 175, 181, 182, 185, 187 и 197.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| Гетероциклическое соединение в качестве ингибитора протеинкиназы | 2018 |
|
RU2783723C2 |
| PROTAC, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩИЕ НА ТАУ-БЕЛОК, И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2805523C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2826628C1 |
| Новое соединение 2,3,5-замещенного тиофена в качестве ингибитора протеинкиназы | 2017 |
|
RU2724957C2 |
| Соединение на основе оксазолидина и содержащий его селективный агонист андрогенового рецептора | 2015 |
|
RU2702001C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| СОЕДИНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТА АДЕНОЗИНОВОГО РЕЦЕПТОРА A2a И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2840068C2 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗ | 2012 |
|
RU2705577C2 |
Изобретение относится к соединению Химической формулы 1 или его фармацевтически приемлемой соли, которые обладают свойством разрушения или ингибирования андрогенового рецептора (AR). В указанных ниже формулах R1 представляет Н, галоген, галогенС1-6алкил или С1-6алкокси, R2 представляет Н или С1-4алкил, X1, Х3, Х4 и Х5 каждый независимо представляет СН или N, Х2 представляет CR3 или N, R3 представляет Н, С1-6алкил, галоген или -ОН, n равно 0, 1 или 2, m равно 0 или 1, L представляет Химическую формулу 2, А1, А2 и А3 каждый независимо представляет прямую связь, -О-, -N(R4)-, -С(О)-, -СС-, -C(O)NH-, -NHC(O)-, -С(O)CH2NH- или -С(O)СН2O-, R4 представляет Н или С1-6алкил, B1, В2 и В3 каждый независимо представляет прямую связь или любой из указанных ниже заместителей, каждый из R4' независимо представляет Н, С1-4алкил, галогенС1-4алкил, галоген или -ОН, q1-q6 каждый независимо представляет целое число от 0 до 4, Е представляет Химическую формулу 3 или 4, Х6, Х7, Х8 и Х9 каждый независимо представляет СН или N, Y представляет -C(R6)2-, -С(О)- или -N=N-, Z представляет прямую связь, -N(R6)- или -C(O)NH-, R5 и R5' каждый независимо представляет Н, С1-4алкил, галоген, галогенС1-4алкил или С1-4алкокси, R6 каждый независимо представляет Н, С1-4алкил или галогенС1-4алкил. Изобретение относится также к фармацевтической композиции, содержащей указанное соединение или его фармацевтически приемлемую соль, и к способу лечения или предотвращения связанного с андрогеновым рецептором заболевания с его использованием. 3 н. и 6 з.п. ф-лы, 6 табл., 206 пр.





1. Соединение Химической формулы 1:

или его фармацевтически приемлемая соль,
в Химической формуле 1
R1 представляет собой Н, галоген, галогенС1-6алкил или С1-6алкокси,
R2 представляет собой Н или С1-4алкил,
X1, Х3, Х4 и Х5 каждый независимо представляет собой СН или N,
Х2 представляет собой CR3 или N, где R3 представляет собой Н, С1-6алкил, галоген, или -ОН,
n равно 0, 1 или 2,
m равно 0 или 1,
L представляет собой следующую Химическую формулу 2:
 ,
,
в Химической формуле 2
А1, А2 и А3 каждый независимо представляет собой прямую связь, -О-, -N(R4)-, -С(О)-, -СС-, -C(O)NH-, -NHC(O)-, -С(O)CH2NH- или -С(O)СН2O-, где R4 представляет собой Н или С1-6алкил,
B1, В2 и В3 каждый независимо представляет собой прямую связь или любой из следующих заместителей:
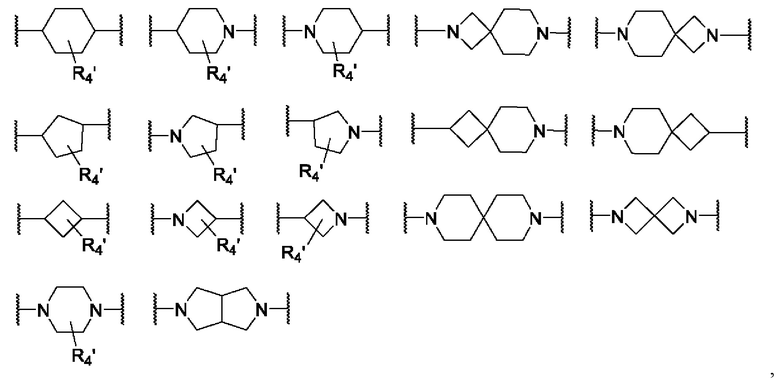
где каждый из R4' независимо представляет собой Н, С1-4алкил, галогенС1-4алкил, галоген или -ОН,
q1-q6 каждый независимо представляет собой целое число от 0 до 4,
Е представляет собой следующую Химическую формулу 3 или 4:
 ,
,
 ,
,
в Химической формуле 3 и 4
Х6, Х7, Х8 и Х9 каждый независимо представляет собой СН или N,
Y представляет собой -C(R6)2-, -С(О)- или -N=N-,
Z представляет собой прямую связь, -N(R6)- или -C(O)NH-,
R5 и R5' каждый независимо представляет собой Н, С1-4алкил, галоген, галогенС1-4алкил или С1-4алкокси,
каждый R6 независимо представляет собой Н, С1-4алкил или галогенС1-4алкил.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где в Химической формуле 1
R1 представляет собой галоген или галогенС1-6алкил,
R2 представляет собой Н,
Х1 представляет собой N или СН,
Х3, Х4 и Х5 каждый независимо представляет собой комбинацию N, СН и СН; N, N и СН; или СН, N и N,
Х2 представляет собой CR3, где R3 представляет собой Н, F или СН3,
n равно 1,
m равно 0,
L представляет собой следующую Химическую формулу 2:
 ,
,
в Химической формуле 2
А2 представляет собой прямую связь и A1 и А3 каждый независимо представляет собой прямую связь или -О-,
В1, В2 и В3 каждый независимо представляет собой прямую связь или любой из следующих заместителей:
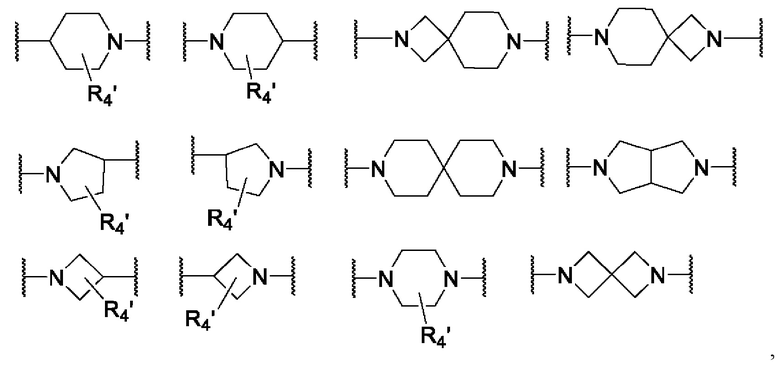
где каждый из R4' независимо представляет собой Н или С1-4алкил,
q1-q6 каждый независимо представляет собой целое число от 0 до 2,
Е представляет собой следующую Химическую формулу 3:
 ,
,
в Химической формуле 3
Х6 представляет собой СН или N,
Y представляет собой -С(О)- или -СН2-,
R5 представляет собой Н или галоген.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, где соединение представляет собой любое из следующих соединений:












4. Соединение по п. 3 или его фармацевтически приемлемая соль, где соединение представляет собой любое из следующих соединений:

5. Фармацевтическая композиция для разрушения или ингибирования андрогенового рецептора (AR), содержащая в качестве эффективного агента соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль.
6. Фармацевтическая композиция по п. 5, где фармацевтическая композиция предназначена для лечения или предотвращения рака, болезни Кеннеди, акне, алопеции, кожных ран или гирсутизма.
7. Фармацевтическая композиция по п. 6, где фармацевтическая композиция предназначена для лечения или предотвращения рака предстательной железы.
8. Способ лечения или предотвращения связанного с андрогеновым рецептором заболевания, которое представляет собой рак, болезнь Кеннеди, акне, алопецию, кожные раны или гирсутизм, включающий в себя введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения по любому из пп. 1-4 или его фармацевтически приемлемой соли.
9. Способ по п. 8, отличающийся тем, что связанное с андрогеновым рецептором заболевание представляет собой рак предстательной железы.
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| CN 111285851 A, 16.06.2020 | |||
| CN 109928956 A, 25.06.2019 | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| ПРОИЗВОДНЫЕ ТИОГИДАНТОИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА АНДРОГЕНА | 2012 |
|
RU2598854C2 |
Авторы
Даты
2024-04-15—Публикация
2021-07-19—Подача