Изобретение относится к биотехнологии, в частности к культивированию тканей и органов растений, и может быть использовано в садоводстве для повышения коэффициента размножения сельскохозяйственно-ценных генотипов, а также в селекционной практике для создания новых и улучшения уже известных сортов растений.
Термин "витрификация" обычно используется для характеристики гипергидрогенных нарушений развития, часто развивающихся во время вегетативного размножения in vitro травянистых и древесных растений. Также при описании этого физиологического расстройства используют такие понятия как стекловидность, прозрачность и витрификация - гипергидричность. Витрификация выражается в утолщении листьев и побегов, увеличении содержания воды в тканях и усилении ломкости стебля микрорастения. На микроморфологическом уровне ее проявления характеризуется увеличением размеров клеток их излишнем растяжении вследствие недостаточного уровня лигнификации клеточной стенки. Проблема витрификации связана, прежде всего, с низким выходом укорененных и адаптированных растений на последующих этапах процесса микроклонирования [Gaspar Т. Vitrification in micropropagation // High-Tech and Micropropagation I. - Springer, Berlin, Heidelberg, 1991. - C. 116-126].
Известен способ размножения in vitro ореха грецкого с использованием этиолированных эксплантов на этапе введения растения в чистую культуру. Экспланты получали из однолетних этиолированных сеянцев, выращенных в теплице в темноте, стерилизовали известным способом и помещали в пробирки на агаризованную питательную среду Мурасиге и Скуга (МС), в которой концентрация макросолей уменьшена в 4 раза, и выдерживали в темноте. Через неделю экспланты переносили на питательную среду МС, содержащую половинную концентрацию макросолей и фитогармоны: 0,01-0,02 мг/л ИМК (индолил-3-масляная кислота) и 1 мг/л БАП (6-бензиламинопурин). Экспланты помещали в условиях низкой освещенности (150-200 лк). Через три недели культивирования использовали среду с полной концентрацией макросолей, а освещение эксплантов увеличивали до 500 лк [Способ микроклонального размножения ореха грецкого: пат. 1706478 СССР: МПК7 А01Н 4/00 / Пивень Н.М., Мельничук Г.Г., Фелалиев А.С.; заявитель и патентообладатель: Отделение клеточной биологии и инженерии Института ботаники им. Н.Г. Холодного. - №4707550/13; заявл. 19.06.89; опубл. 23.01.92, Бюл. №3].
Недостатком данного приема является сложная процедура этапа введения эксплантов в культуру, состоящая как минимум из трех ступеней, каждая из которых характеризуется своими требованиями к питательной среде и освещенности. Кроме этого высокое содержание цитокининов (БАП) приводит к развитию верифицированных микрорастений.
Известен подход микроклонирования Juglans regia L. из апикальных почек, при котором использовалась специальная вентилируемая посуда. В качестве основной среды была использована высокосолевая среда DKW, в которую были внесены 30 г/л сахарозы, 0,01 мг/л ИМК, 1,0 мг/л БАП. В качестве желирующего компонента был использован Фитогель в количестве 2,2 мг/л. В каждом сосуде, объемом 600 или 650 мл и содержащем 50 мл среды, культивировали по 4 микропобега. Вентиляция в сосудах осуществлялась двумя способами: 1) через два фильтра для холодной стерилизации растворов через шприц (0,45 мкм: диаметр 25 мм: СНМ® SCA); 2) через встроенную в крышке полипропиленовую мембрану (микропористая полипропиленовая мембрана 50 мкм; Unipak Co.). Объемы сосудов составляли 650, 650 и 600 мл соответственно. Культуры инкубировали в течение 24 дней при 25±2°С цикл чередования свет / темнота составлял 16/8 ч (100 мкмоль м-2 с-1) [Hassankhah, A., Vahdati, K., Lotfi, М., Mirmasoumi, М., Preece, J., & Assareh, М. Н. (2014). Effects of ventilation and sucrose concentrations on the growth and plantlet anatomy of micropropagated persian walnut plants. International Journal of Horticultural Science and Technology, 1(2), 111-120].
К недостаткам описанного метода можно отнести использование специализированной дорогостоящей посуды для in vitro, производящейся только за рубежом и не имеющей аналогов на территории РФ.
Наиболее близким к заявляемому способу техническим решением является следующий способ микроклонального размножения ореха грецкого. Способ включал получение молодых растений в фитотроне и дальнейшую их обработку каждые 15 дней растворами 0,04 г/л касугамицина, 0,97 г/л зинеба и 0,38 г/л оксихлорида меди. Также перед взятием эксплантов молодые побеги опрыскивали 2 или 3 раза каждые 5 дней раствором 100 мг/л БАП (6-бензиламинопурин) и 50 мг/л GA 3 (гиббереллин) для стимулирования быстрого роста. Экспланты помещали на 1-кратную агаризованную среду Мурасига и Скуга с добавлением 30% сахарозы и ростовых веществ: 1-5 мг/л БАП, 0,1 мг/л ИМК и 0,1-1 мг/л ГКЗ (гиббереловая кислота), а также антибиотиков цефотаксима (25 мг/л), тетрациклина (25 мг/л), рифампицина (6 мг/л) и стрептомицина (2 мг/л) [Revilla М.A., Majada J., Rodriguez R. Walnut (Juglans regia L.) micropropagation //Annales des Sciences  . - EDP Sciences, 1989. - V. 46. - №. Supplement. - S. 149-151].
. - EDP Sciences, 1989. - V. 46. - №. Supplement. - S. 149-151].
Наиболее принятой в практике микроразмножения ореха грецкого является подход, при котором после дезинфекции экспланты помещают на агаризованную питательную среду DKW (Driver and Kuniyuki, 1984) с добавлением ростовых веществ ИМК - 0,1 мг/л, БАП - 1 мг/л ВАР и 3% сахарозы. РН культуральной среды доводят до 5,5 или 5,9 перед добавлением гелеобразующего агента и автоклавированием. Гелеобразующими агентами часто служат агар-агар или Герлит. Дальнейшее субкультивирование инициированных микропобегов проводят при тех же условиях и составе среды [Gotea R., Gotea I., Sestras R.E., Vahdati K. In vitro Propagation of Several Walnut Cultivars // Bulletin of the University of Agricultural Sciences & Veterinary Medicine Cluj-Napoca. Horticulture. - 2012. - V. 69. - №. 1. - P. 167-171].
Основным недостатком указанных способов является высокое количество верифицированных микрорастений связанное с высокими концентрациями ростового вещества - БАП.
Техническим результатом предлагаемого изобретения является повышение коэффициента размножения генетически стабильных растений в условиях in vitro, за счет нивелирования последствий нежелательных морфогенетических процессов, возникающих при микроклонировании.
Эффект достигается исключением ростовых веществ из питательной среды на этапе введения в культуру in vitro эксплантов ореха грецкого.
Суть способа включает посадку эксплантов на агаризованную питательную среду, содержащую однократную концентрацию макро- и микросолей, а также витаминов по Driver and Kuniyuki (DKW), 3.0% сахарозы, антибиотики 25 мг/л тетрациклин гидрохлорид и 2 мг/л стрептомицина. При этом в среду, на этапе введения эксплантов в культуру in vitro, не добавляют никаких ростовых веществ. Перед посадкой на агаризованную питательную среду экспланты промывали в растворе, содержащем ПАВ, и водопроводной водой, и в дальнейшем подвергали дезинфекции 70% р-ром спирта, в течение 1 минуты, и 1/5 раствором гипохлорита натрия с отмывкой стерильной дистиллированной водой. Дальнейшие пересевы микрорастений на этапе мультипликации, производили на агаризованную питательную среду DKW, включающую 30 мг/л сахарозы и ростовые компоненты ИМК (0,015 мг/л) и БАП (1 мг/л). Способ позволяет снизить уровень верифицированных микрорастений растений на 25-30% при 4-ом мультипликационном пересеве (табл.).
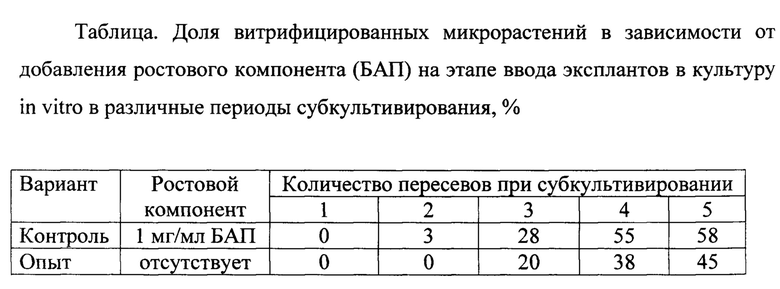
Отсутствие фитогормонов в питательной среде не сказывалось на инициации и развитии микропобега из почки экспланта. По-видимому, эксплант содержит достаточный запас ростовых веществ, полученных от материнского растения, необходимый для нормального органогенеза микропобега. Между тем, исключение фитогормонов из состава питательной среды на этапе введения ореха грецкого в культуру, где их влияние не значительно, дает эффект снижения количества витрифицированных микрорастений при дальнейшем субкультивировании.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ СИРЕНИ IN VITRO | 2010 |
|
RU2457669C2 |
| Способ клонального микроразмножения кардамона черного (Amomum tsao-ko) | 2023 |
|
RU2814183C1 |
| Способ микроклонального размножения кирказона маньчжурского (Aristolochia manshuriensis Kom.) | 2023 |
|
RU2807740C1 |
| Способ повышения эффективности культивирования in vitro Березы повислой, Лимонника китайского, Рододендрона и Сирени | 2015 |
|
RU2619177C1 |
| Способ размножения катальпы бигнониевидной (Catalpa bignonioides) | 2024 |
|
RU2834051C1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ В КУЛЬТУРЕ IN VITRO СОРТА МИСКАНТУСА "СОРАНОВСКИЙ" | 2024 |
|
RU2829652C1 |
| СПОСОБ СОХРАНЕНИЯ КАЧЕСТВЕННЫХ ХАРАКТЕРИСТИК КУЛЬТУРЫ in vitro НЕКОТОРЫХ ДРЕВЕСНЫХ ВИДОВ РАСТЕНИЙ (ЛИМОННИК КИТАЙСКИЙ, РОДОДЕНДРОН, СИРЕНЬ, БЕРЕЗА ПОВИСЛАЯ) | 2015 |
|
RU2590703C1 |
| Способ выращивания брусники обыкновенной (Vaccinium vitis-idaea L.) | 2024 |
|
RU2827225C1 |
| Способ выращивания морошки приземистой (Rubus chamaemorus L.) | 2024 |
|
RU2824883C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ И ПОЛУЧЕНИЯ ПОСАДОЧНОГО МАТЕРИАЛА ВЕЙГЕЛЫ ПРИЯТНОЙ (WEIGELA SUAVIS (КОМ.) L.H.BAILEY) И ВЕЙГЕЛЫ ЦВЕТУЩЕЙ "ВАРИЕГАТА" (WEIGELA FLORIDA "VARIEGATA" BUNGE A. DC.) | 2016 |
|
RU2634431C1 |
Изобретение относится к области биотехнологии. Предложен способ снижения витрификации микрорастений ореха грецкого в культуре in vitro. Способ включает посадку дезинфицированных эксплантов ореха грецкого (Juglands regia L.) на агаризованную питательную среду, содержащую однократную концентрацию макро- и микросолей, а также витаминов по Driver and Kuniyuki (DKW). При этом в питательную среду на этапе введения эксплантов в культуру in vitro не добавляют никаких ростовых веществ. Дальнейшие пересевы микрорастений на этапе мультипликации производят на агаризованную питательную среду DKW с добавлением ростовых веществ, а именно ИМК и БАП. Способ позволяет снизить уровень витрифицированных микрорастений ореха грецкого. 1 табл.
Способ снижения витрификации микрорастений ореха грецкого в культуре in vitro, включающий культивирование стерильных эксплантов с использованием базовой питательной среды Driver and Kuniyuki, отличающийся тем, что в питательную среду на этапе введения эксплантов в культуру не добавляются ростовые компоненты, которые вводятся только со следующего этапа культивирования в концентрациях 0,015 мг/л ИМК и 1 мг/л БАП.
| Способ микроклонального размножения грецкого ореха | 1989 |
|
SU1706478A1 |
| REVILLA M.A | |||
| et al | |||
| Walnut (Juglansregia L.) micropropagation, Annales des Sciences Forestieres, 1989, vol.46 suppl., pp.149s-151s | |||
| LESLIE C., MCGRANAHAN G | |||
| Micropropagation of Persian Walnut (Juglansregia L.) | |||
| Biotechnology in agriculture and forestry, vol.18 | |||
| High-Tech and Micropropagation II, 1992, pp.136-150 | |||
Авторы
Даты
2020-11-05—Публикация
2019-02-18—Подача