Изобретение относится к фармацевтической промышленности и касается способа получения субстанции и таблеток азотсодержащих бетаинов гидрохлоридов на основе жидкой фазы послеспиртовой кукурузной барды, предназначенных для использования в качестве пищеварительных, ферментных лекарственных средств (ЛС).
Известен способ получения из жидкой фазы послеспиртовой зерновой (в том числе кукурузной) барды фармацевтической субстанции «Биобардин», содержащей, наряду с другими биологически активными соединениями, 54,0% белков и аминокислот. Способ заключается в отделении и концентрировании до плотности 1,480 г/мл жидкой фазы барды, обработке ее этиловым спиртом 95% (по объему 1:3), фильтрации и высушивании (60°С) осажденной субстанции «Биобардин» (выход 3,3% к жидкой фазе) (Кайшева Н.Ш., Кайшев А.Ш. Антиоксидантное лекарственное средство на основе зерновой послеспиртовой барды. Пат. РФ 2404766, МПК A61K 31/375, опубл. 10.09.10). Данный способ получения ЛС близок к заявляемому способу по используемому сырью (послеспиртовой зерновой барды), выделяемому целевому продукту (аминокислотам), специфической фармакологической активности (ЛС пищеварительного действия) и выбран в качестве прототипа. Недостатками указанного способа являются:
- потеря белков и аминокислот за счет осаждения спиртом 95%;
- потеря бетаинов, растворимых в спирте, при обработке концентрата спиртом 95% (Полюдек-Фабини Р., Бейрих Т. Органический анализ. Руководство по анализу органических соединений, в том числе лекарственных веществ. Пер. с нем., Ленинград, Химия, 1981, 624 с.);
- отсутствие стадии очистки целевых продуктов от сопутствующих веществ (олигогалактуронидов, биогенных элементов);
- низкий технологический выход целевых продуктов.
Для получения таблеток «Биобардин» из лактозы (наполнителя) и полипласдона (связывающего вещества) (1:1) готовят гранулят, в который вводят 50% раствор субстанции, смесь гранулируют, «опудривают» кальция стеаратом (смазывающее вещество) и прессованием получают плоскоцилиндрические таблетки. Состав 1 таблетки: 0,250 г субстанции «Биобардин» (содержит 0,135 г белков и аминокислот), 0,300 г лактозы, 0,300 г полипласдона «Polyplasdone XL-10», 0,001 г кальция стеарата. Таблетки практически нетоксичны, предназначены для применения в гастроэнтерологии (Кайшева Н.Ш., Кайшев А.Ш., Шевченко A.M., Микелов В.А. Фармацевтические таблетки «Биобардин», полученные на основе жидкой фазы послеспиртовой зерновой барды и предназначенные для гастроэнтерологии. Пат. РФ 2662064, МПК A61K 31/70). Целевой продукт проявляет специфическую фармакологическую активность не за счет всех компонентов, а только благодаря частичному наличию бетаинов аминокислот. По-видимому, целенаправленное получение из барды азотсодержащих бетаинов гидрохлоридов и введение пищеварительного фермента могут способствовать усилению специфического фармакологического эффекта.
Близкими к заявляемым таблеткам являются таблетки «Ацидин-пепсин» (Регистрационное удостоверение (РУ) ЛС001355241011: приказ МЗ Республики Беларусь №843 от 24.08.2015). Одна таблетка средней массой 252 мг содержит в качестве активных веществ: 200 мг бетаина гидрохлорида (бетаин глицина гидрохлорид) и 0,5 мг протеолитического фермента пепсина свиного (в пересчете на 10% пепсин); в качестве вспомогательных веществ: 12 мг повидона-К25 (поливинилпирролидона) (связывающее вещество), 5,2 мг аэросила (кремния диоксида коллоидного безводного) (вещество, улучшающее смачиваемость; скользящее вещество), 2,5 мг кальция стеарата (антифрикционное вещество), 31,8 мг сорбитола (наполнитель, разбавитель, скользящее вещество). Таблетки круглой формы, плоские, с риской и фаской, белого или белого со слегка желтоватым оттенком цвета, со специфическим запахом, кислого вкуса. По фармакологическим свойствам таблетки относятся к пищеварительным, ферментным ЛС (НД 42-9712-05 «Ацидин-пепсин», Республика Беларусь), при этом ацидин должен соответствовать требованиям государственной фармакопеи США (United States Pharmacopoeia, 2019, USP 42-NF 37), пепсин свиной - стандарта предприятия (СТП 55-98). В литературе отсутствует описание технологии таблеток «Ацидин-пепсин». Недостатками указанного состава таблеток является:
- заниженное содержание пепсина (0,5 мг); для оказания пищеварительного, ферментного действия в таблетках «Ацидин-пепсина» должно быть 200 мг ацидина и 50 мг пепсина (4:1) (Машковский М.Д. Лекарственные средства. - 16-е изд., перераб. и доп. - М.: Новая Волна, 2016. - 1216 с.);
- качество пепсина должно регламентироваться фармакопейными статьями, а не стандартами, предназначенными для контроля качества пищевых продуктов;
- относительно высокая доля вспомогательных веществ (20,4% от массы таблетки);
- использование повидона-К25 - низкомолекулярного вспомогательного вещества не обеспечивает удовлетворительной распадаемости таблеток, соответствующей фармакопейным требованиям (Государственная фармакопея Российской Федерации (ГФ РФ): в 4 т. XIV изд., М, 2018);
- таблетки, из-за высокой водопоглощаемости, даже до истечения срока годности «расплываются», прилипая друг к другу;
- небольшой срок годности (1 год 6 месяцев) (Инструкция (информация для специалистов) по медицинскому применению ЛС Ацидин-Пепсин: приказ МЗ Республики Беларусь №843 от 24.08.2015).
Цель изобретения - разработка способа получения суммы азотсодержащих бетаинов гидрохлоридов (субстанции) на основе жидкой фазы послеспиртовой кукурузной барды, а также состава и технологии таблеток с оптимальными фармацевтико-технологическими показателями, продолжительным сроком хранения, пригодными для использования в качестве пищеварительных, ферментных ЛС.
Поставленная цель достигается тем, что после разделения послеспиртовой кукурузной барды на жидкую и твердую фазы процеживанием, сначала из жидкой фазы удаляют восстанавливающие сахара (мальтозу, глюкозу) путем гидролиза мальтозы безводной уксусной кислотой (массовое соотношение мальтозы и кислоты 1:1, 100±2°С, 0,5 час; Морриссон Р., Бойд Р. Органическая химия. Пер. с англ. В.М. Демьянович и В.А. Смита, под ред. И.К. Коробицыной, М., Мир, 1974, 1133 с.) до образования глюкозы, обработки гидролизата безводной уксусной кислотой (общее массо-объемное соотношение глюкозы и кислоты 1:2), кристаллизации (0-5°С, 1 сутки), фильтрации и высушивания (70±2°С) кристаллов глюкозы, концентрирования фильтрата (55±2°С, до 1/25 объема) и его охлаждения (до 20±2°С). Содержащиеся в концентрированном фильтрате белки и пептиды гидролизуют до образования аминокислот путем обработки фильтрата концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19,98% масс.) (по объему 1:1, 110±2°С, 72 час), медленного охлаждения смеси (до 20±2°С), удаления фильтрацией осадка балластных веществ, обработки фильтрата активированным углем (0,3% к объему смеси, 55±2°С, 0,5 час), фильтрации и промывки осадка водой (осадок отбрасывают), объединения фильтрата с промывными водами. Продукты гидролиза - аминокислоты (в фильтрате) подвергают исчерпывающему метилированию по атому азота до образования бетаинов (триметиламинокислот) способом Гофмана (Гауптман З., Грефе Ю., Ремане X. Органическая химия. Пер. с нем., М.. Химия, 1979, с. 502) с помощью йодистого метила (молярное соотношение азота в составе аминокислот и реагента 1:4) в присутствии натрия карбоната (молярное соотношение азота в составе аминокислот и реагента 2:1) (42±2°С, 30 час). Для получения глицина бетаина гидрохлорида к смеси добавляют концентрированную хлористоводородную кислоту (по объему 1:1), концентрируют (55±2°С, до 1/3 объема), охлаждают (до 20±2°С), фильтруют и промывают образующийся осадок (осадок А) концентрированной хлористоводородной кислотой (по объему 1:10). Объединенный с промывными водами фильтрат концентрируют (55±2°С, до 1/3 объема), кристаллизуют (0-5°С, 8 час), отделяют осадок (осадок Б) глицина бетаина гидрохлорида декантацией; осадки А и Б объединяют (осадок В). Осадок В очищают путем растворения в воде (55±2°С, 1:2), обработки раствора активированным углем (0,3% к массе раствора, 40±2°С, 0,5 час), фильтрации, концентрирования фильтрата (55±2°С, до 1/3 объема), кристаллизации (0-5°С, 8 час), фильтрации и высушивания (20±2°С). Далее из маточных растворов, образовавшихся после отделения и очистки осадка глицина бетаина гидрохлорида, выделяют глутаминовой кислоты бетаина гидрохлорид путем разбавления раствора водой (1:1), осветления его активированным углем (0,3% к массе раствора, 55±2°С, 0,5 час), охлаждения (до 40±2°С), фильтрации, концентрирования фильтрата (55±2°С, до 1/3 объема), охлаждения (до 20±2°С), обработки концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19,98%) масс.) (1:1), кристаллизации (0-5°С, 5 суток), фильтрации кристаллов. Полученные кристаллы очищают переосаждением из водного раствора (1:10) концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19.98% масс.) (1:1) с последующей фильтрацией, высушиванием (20±2°С) осадка глутаминовой кислоты бетаина гидрохлорида (осадок Г). Из маточных растворов, образовавшихся после выделения и очистки осадка Г, путем выпаривания под вакуумом (55±2°С) и досушивания в вакуум-эксикаторе получают остаток бетаинов других аминокислот гидрохлоридов (осадок Д). Полученные целевые продукты (осадки В, Г, Д массой соответственно 93,6229 г, 82,8289 г, 28,8863 г) смешивают до образования однородного белого порошка (масса 205,3381 г), который, после предварительного сухого гранулирования, подвергают таблетированию. В расчете на 1 таблетку смесь из 200,0 мг (66,7%) субстанции и 50,0 мг (16,7%) государственного стандартного образца (ГСО) пепсина (соответствующего требованиям фармакопейной статьи ФС 42-0077-01) (фармацевтическая субстанция) подсушивают (40±2°С) до остаточной влажности не более 3%. Затем добавляют 29,9 мг (10%) аэросила (антифрикционное вещество), 15,0 мг (5,0%) коллидона CL (разрыхлитель), увлажняют 1,0-1,5 мл спирта этилового 96%, растирают в ступке. Полученный сухой гранулят протирают через сито №15 (диаметр отверстий 1,5 мм), «опудривают» 3.0 мг (1,0%) кальция стеарата (смазывающее вещество) и прессованием получают таблетки круглой формы, с двояковыпуклыми поверхностями, цельными краями, без риски и фаски, белого цвета, со специфическим запахом. Состав одной таблетки диаметром 9 мм, высотой 3 мм, средней массой 300,0 мг: субстанции бетаинов гидрохлоридов 200,0 мг, пепсина 50,0 мг, аэросила 29,9 мг, коллидона CL 15,0 мг, кальция стеарата 3,0 мг.
Послеспиртовая кукурузная барда предпочтительна для получения аминокислот (предшественников азотсодержащих бетаинов), содержание которых в барде весомо: 28,8-28,9% в пересчете на сухой остаток (Кайшев А.Ш., Кайшева Н.Ш. Научные основы фармацевтического использования сырьевых ресурсов спиртового производства. Волгоград, ВолгГМУ, 2013, 156 с.). Объектом выделения целевых продуктов явилась жидкая фаза послеспиртовой кукурузной барды, содержащая (28,8-36,0%) в 13 раз больше аминокислот и пептидов, чем твердая фаза (2,5%) (Кайшев А.Ш., 2013).
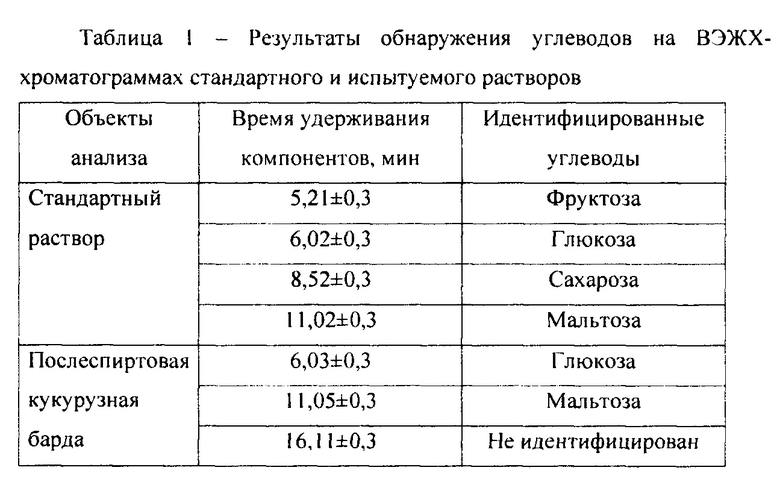
При переработке кукурузы извлекают крахмал, подвергаемый ферментативному гидролизу до образования глюкозы, которую подвергают спиртовому брожению (Производственный технологический регламент (ПТР) на получение спирта из крахмалистого сырья для предприятия ООО «Суворовский»: в 2 ч. Утв. Минсельхоз РФ, М., 2004). В этой связи, вторичные сырьевые ресурсы могут содержать остаточные количества углеводов : в кукурузной барде не более 0,5% (ПТР, 2004). Для контроля остаточного содержания углеводов использован метод высокоэффективной жидкостной хроматографии (ВЭЖХ), основанный на разделении углеводов, их регистрации с помощью рефрактометрического детектора и количественном определении по методу внешних стандартов (ГОСТ 32167-2013 Метод определения сахаров). Определение проведено на жидкостном хроматографе UltiMate 3000 («Dionex», США) с колонками длиной 250 мм, внутренним диаметром 4,6 мм, заполненными аминмодифицированным диоксидом кремния (Eclipse XDB-C18, 5 мкм). Сбор и обработка данных проведена с использованием системы «Chromeleon, версия 7» («Dionex», США). Для приготовления стандартного раствора точные навески фруктозы около 2.0 г, глюкозы около 1,5 г, сахарозы около 0,25 г, мальтозы около 0,15 г растворяют в 30 мл воды в одной мерной колбе вместимостью 100 мл, добавляют 25 мл метанола, объем раствора доводят водой до метки, фильтруют через нейлоновый фильтр. Для приготовления испытуемых растворов в мерную колбу вместимостью 100 мл вносят точную навеску мелассы около 5,0 г, добавляют 20 мл воды; в другую, такую же, колбу вносят 5 мл жидкой фазы кукурузной барды; в обе колбы приливают по 30 мл воды. 25 мл метанола, доводят объем растворов водой до метки, фильтруют через нейлоновый фильтр. Стандартный и испытуемые растворы последовательно хроматографируют в следующих условиях: температура колонки 30,0±0,1°С, скорость потока 1,3 мл/мин, подвижная фаза (элюент): ацетонитрил и вода (80:20), объем вводимого раствора 0,020 мл, рефрактометрический детектор. Значения времен удерживания углеводов на ВЭЖХ-хроматограммах приведены в таблице 1. Путем сравнения значений времен удерживания на ВЭЖХ-хроматограммах стандартного и испытуемого растворов в мелассе идентифицированы фруктоза, глюкоза, сахароза, в послеспиртовой кукурузной барде - глюкоза, мальтоза.
Количественное содержание углеводов (ВЭЖХ, метод внешних стандартов, ГОСТ 32167-2013) определено по площадям пиков определяемых углеводов на хроматограммах испытуемых растворов по отношению к таковым стандартного раствора. Экспериментальные значения для расчета количественного содержания приведены в таблице 2. Количественное содержание углеводов (X, %) вычислено по формуле (1) (ГОСТ 32167-2013):

где: S1 и S2 - площадь пика углевода на хроматограмме испытуемого и стандартного растворов соответственно, мм2;
a1 и а2 - масса навески барды (мелассы) и стандартного образца углевода соответственно, г;
V1 и V2 - общий объем испытуемого и стандартного растворов соответственно, мл.
Полученные данные свидетельствуют о содержании в жидкой фазе послеспиртовой кукурузной барды 17,5% восстанавливающих сахаров (3,5% мальтозы, 14,0% глюкозы).
В отличие от прототипа, заявляемый способ предусматривает удаление восстанавливающих сахаров из сырья после предварительного кислотного гидролиза мальтозы с образованием глюкозы (Морриссон Р., 1974) и последующей кристаллизации глюкозы из безводной уксусной кислоты (Губен И. Методы органической химии. Т. 3, вып. 1, М.-Л., 1934, с. 274). Большинство аминокислот, пептидов растворимы в безводной уксусной кислоте (Боровлев И.В. Органическая химия: термины и основные реакции. - М.: БИНОМ. ЛЗ. 2018. - 359 с.), поэтому они остаются в фильтрате после кристаллизации глюкозы.
В заявляемом способе обеспечено практически полное протекание гидролиза белков и пептидов до образования аминокислот: в течение 72 час концентрированной хлористоводородной кислотой (плотность 1,097 г/мл. концентрация 6,0 моль/л, 19,98% масс.), что рекомендовано ГФ РФ (ГФ РФ, XIV, 2018). Небольшой избыток концентрированной хлористоводородной кислоты по отношению к фильтрату (1:1) обусловлен частичной потерей кислоты вследствие ее летучести и легкостью ее удаления после выделения целевых продуктов.
Соотношение гидролизата белков, пептидов и активированного угля, а также продолжительность обработки гидролизата углем подобрано экспериментально путем визуального определения окраски растворов (таблицы 3, 4). Как видно из приведенных данных, оптимальной концентрацией активированного угля по отношению к объему гидролизата является 0,3%, оптимальной продолжительностью обработки гидролизата активированным углем является 0,5 час.
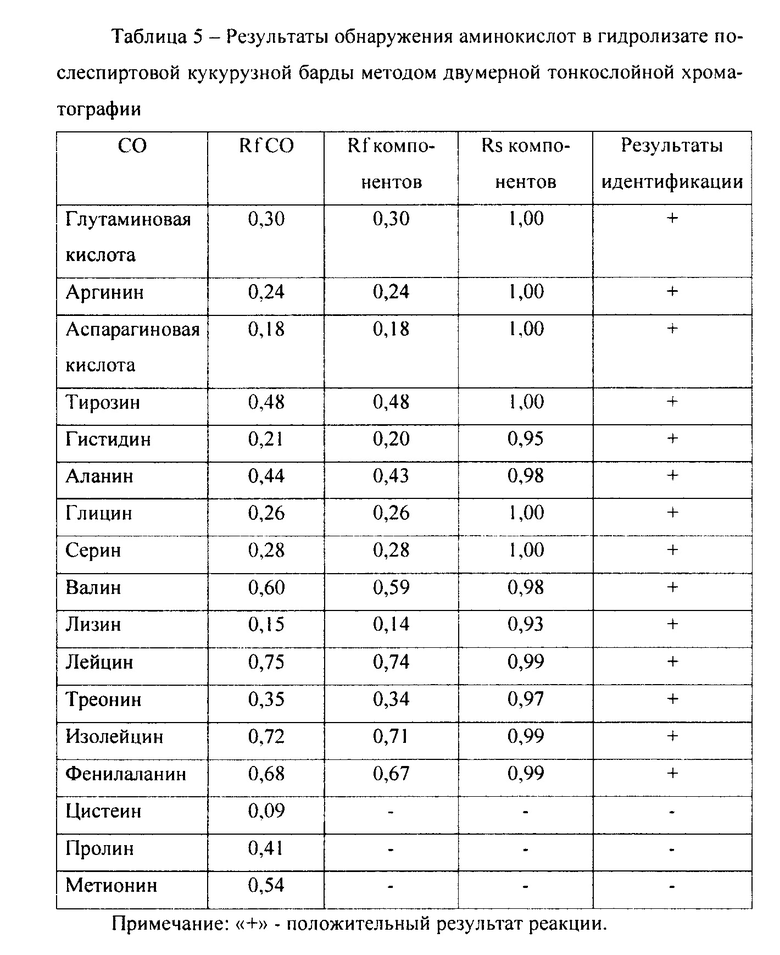
Полученный гидролизат испытан на наличие аминокислот в сравнении со стандартными образцами (СО) α-аминокислот (в концентрации 2,5 моль/л) методом двумерной хроматографии в тонком слое сорбента на пластинках «Sorbfil ПТСХ-П-А». Для хроматографирования в первом направлении использована система растворителей: н-бутанол - уксусная кислота - вода (4:1:5). во втором направлении - система: этанол 95% - вода (95:5). Детектирование зон адсорбции проведено 1% спиртовым раствором нингидрина (Якубке Х.-Д.. Ешкайт X. Аминокислоты. Пептиды. Белки. Пер. с нем., под ред. Ю.В. Митина, М., Мир, 1985, 82 с.). Идентификация пятен осуществлена по коэффициентам подвижности (Rf) и относительным коэффициентам подвижности (Rs) (относительно СО соответствующих аминокислот) (таблица 5). Полученные данные свидетельствуют о наличии в гидролизате кукурузной барды 14-ти α-аминокислот.
Количественное определение аминокислот (в пересчете на глутаминовую кислоту) в гидролизате кукурузной барды проведено методом спектрофотометрии по реакции взаимодействия с нингидрином при длине волны 566 нм и толщине слоя 10 мм (Гаккель В.А. Исследования по стандартизации сырья и настоек гомеопатических матричных кактуса крупноцветкового: автореф. дис. канд. фармац. наук. М., 2008, 21 с.). Расчет количественного содержания аминокислот проведен по удельному показателю поглощения (А1%1см=0,673) продукта взаимодействия СО глутаминовой кислоты с нингидрином при 566 им (Кайшев А.Ш., 2013). Оптическая плотность (А) продукта взаимодействия гидролизата (50 мл) с нингидрином составила 0,639. Количественное содержание аминокислот (в пересчете на глутаминовую кислоту) (X, %) в гидролизате барды вычислено по формуле (2) (Харитонов Ю.Я. Аналитическая химия (аналитика): в 2 кн. М., ВШ, 2005):

где: V - объем испытуемого гидролизата барды, мл.

Таким образом, содержание аминокислот составило 1,90% к жидкой фазе барды.
Осадки балластных веществ, образовавшихся в результате кислотного гидролиза белков и пептидов, не дали положительных результатов реакций с нингидрином, биуретовым реактивом (отсутствовали сине-фиолетовые окраски растворов), что свидетельствует об отсутствии в осадках белков или аминокислот (Харитонов Ю.Я., 2005).
Исчерпывающее метилирование α-аминокислот по атому азота до образования бетаинов (триметиламинокислот) проведено способом Гофмана с помощью йодистого метила в присутствии натрия карбоната (Гауптман З., 1979). В основе способа лежат следующие уравнения реакций:

По результатам количественного определения аминокислот их содержание в 3600 мл жидкой фазы барды составляет 68,4 г (1,90%). Известно, что в большинстве аминокислот содержание азота примерно одинаково и может быть принято равным 16% (ГФ РФ. XIV, 2018), следовательно, 68,4 г аминокислот содержат 10,944 г или 0,782 моль атома азота. В соответствии с приведенными уравнениями, молярное соотношение азота в составе аминокислот и йодистого метила составляет 1:3. Однако всегда требуется избыток метилирующего реагента (обычно 1:4), поэтому на 0,782 моль атома азота нами израсходовано 3,128 моль йодистого метила (или 443,86 г с учетом его молярной массы 141,9 г/моль). В соответствии со стехиометрическими коэффициентами уравнений реакций, на нейтрализацию продуктов метилирования при участии избытка (0,782 моль) йодистого метила требуется 0,391 моль (2:1) натрия карбоната (или 41,446 г с учетом его молярной массы 106 г/моль).
В заявляемом способе азотсодержащие бетаины, после гидрохлорирования концентрированной хлористоводородной кислотой, выделяются путем кристаллизации из кислотного раствора, что обеспечивает их изолирование от сопутствующих веществ. Другой особенностью способа является температура кристаллизации: с понижением температуры кристаллизация протекает активнее ввиду меньшей растворимости целевого продукта, поэтому в заявляемом способе температура кристаллизации составляет 0-5°С. Практически установлено, что при температуре 0-5°С кристаллизация бетаинов завершается через 8 час (Лазурьевский Г.В., Терентьева И.В.. Шамшурин А.А. Практические работы по химии природных соединений. 2 изд., М., ВШ, 1966, 335 с.).
Идентификация целевых продуктов проведена по качественным цветным, осадительным и термическим реакциям (Лутцева Т.Ю., Садчикова Н.П., Арзамасцев А.П. Методы анализа и стандартизации лекарственных четвертичных аммониевых оснований. Вопросы биологической, медицинской и фармацевтической химии, 2002, №3. с. 17-20; ГФ РФ, XIV, 2018) (таблица 6). Представленные результаты свидетельствуют о том, что все три целевых продукта (осадки В, Г, Д) содержат четвертичный атом азота (бетаины), а также хлорид ион; нигде не обнаружены ни первичная, ни вторичная, ни третичная аминогруппы.
Кроме того, идентификация осадков В и Г проведена по температуре плавления открытым капиллярным методом (ГФ РФ. XIV, 2018). Температура плавления осадка В составила 227,5±0,2°С (с разложением), что соответствует бетаину глицину гидрохлориду (Лазурьевский Г.В., 1966). Температура плавления осадка Г составила 134±0,2°С, что соответствует бетаину глутаминовой кислоты гидрохлориду (Лазурьевский Г.В., 1966).
Анализ качественного состава компонентов осадков В, Г, Д проведен методом ВЭЖХ путем использования нетрадиционною режима хроматографии: с динамически индуцированным разделом фаз (ДИРФ) (Сапрыкин Л.В., Сердан А.А., Сапрыкина Л.В. Прямой анализ бетаинов в биологических жидкостях методом ВЭЖХ. Интернет-журнал «Химический анализ», 2005). Определение проведено на жидкостном хроматографе «UltiMate 3000» («Dionex», США), оснащенном УФ-детектором (модель 115), с колонками длиной 250 мм. внутренним диаметром 4,6 мм, заполненными немодифицированным силикагелем (Separon SGX, 5 мкм). В качестве элюента использован водно-ацетонитрильный раствор дигидрофосфата калия, содержащий 70% ацетонитрила в 0,1 моль/л растворе фосфатног о буфера с рН 6,2; элюирование проведено по 250 мкл с исследованием каждой фракции на хроматографе; в качестве рабочей длины волны УФ детектирования выбрано значение 198 нм. Анализу подвергнуты водные растворы осадков В, Г, Д (по 0,1 мг/мл) и модельная водная смесь рабочих стандартных образцов (РСО) бетаинов гидрохлоридов аминокислот (по 0,1 мг/мл каждого), полученных метилированием и гидрохлорированием СО аминокислот по описанным методикам. Сбор и обработка данных проведена с использованием системы «Chromeleon, версия 7» («Dionex», США). Путем сравнения значений времен удерживания на ВЭЖХ-хроматограммах испытуемых растворов и модельной смеси РСО (таблица 7) достаточно надежно детектором хроматографа осадок В идентифицирован, как глицина бетаина гидрохлорид, осадок Г - глутаминовой кислоты бетаина гидрохлорид, осадок Д - смесь бетаинов гидрохлоридов аргинина, аланина, аспарагиновой кислоты, тирозина, гистидина, серина, валина, лейцина, лизина, треонина.
Количественное определение целевых продуктов проведено по содержанию гидрохлоридов методом прямой алкалиметрии путем титрования растворов, полученных растворением около 0,20 г (точная навеска) порошков растертых осадков В, Г, Д в 30 мл воды, 0,1 моль/л раствором натрия гидроксида (НД 42-9712-05) с фиксацией значения водородного показателя (рН) на приборе «рН-150МИ» (индикаторный электрод - стеклянный, электрод сравнения - хлоридсеребряный) (температура растворов 23±2°С). Объем титранта в точке эквивалентности определен по кривой титрования, построенной в графической системе координат «(ΔpH/ΔV)=f(V+1/2ΔV)» (Харитонов Ю.Я., 2005). Кривые потенциометрического алкалиметрического титрования трех целевых продуктов имеют однотипный характер. Количественное содержание целевых продуктов (X, %) вычислено по формуле (3) (Харитонов Ю.Я., 2005):

где а - навеска субстанции для анализа, г;
V - объем титранта в точке эквивалентности, мл;
K - поправочный коэффициент к концентрации раствора титранта;
Т - титр титранта по определяемому веществу, мг/мл;
Р - общая масса анализируемой субстанции.
Величина Т для осадка В составляет 15,36 мг/мл (по глицину бетаину гидрохлориду), для осадка Г - 22,56 мг/мл (по глутаминовой кислоте бетаину гидрохлориду), для осадка Д - 25,27 мг/мл (по сумме азотсодержащих бетаинов гидрохлоридов в пересчете на аргинина бетаина гидрохлорид).
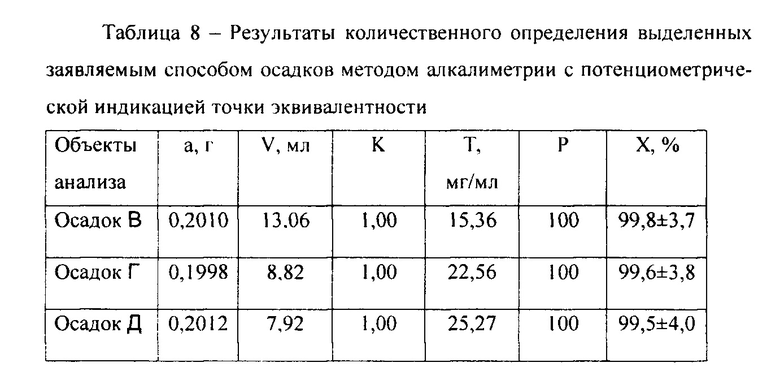
Экспериментальные данные количественного определения целевых продуктов методом алкалиметрии с потенциометрической фиксацией точки эквивалентности приведены в таблице 8. Полученные результаты свидетельствуют об удовлетворительном качестве целевых продуктов, как фармацевтических субстанций, по показателю «Количественное определение»: одинаково высокие значения средних результатов и отклонения от средних результатов не более ±5% (ГФ РФ, XIV, 2018).
Для оказания пищеварительного, ферментного действия оптимальным содержанием пепсина в одной таблетке является доза 50 мг, т.е. массовое соотношение бетаинов и пепсина должно быть 4:1 (200 мг : 50 мг) (Машковский М.Д., 2016. - 1216 с.; Крыжановский С.А., Вититнова М.Б. Современные лекарственные средства: Более 10000 наименований. - М: Рипол-Кл., 2016. - 640 с.). Поэтому в предлагаемом способе в указанном соотношении смешаны полученные осадки бетаинов (осадки В, Г, Д) и пепсин (далее «фармацевтическая субстанция»).
Оценка фармацевтико-технологических свойств полученной фармацевтической субстанции для определения возможности получения таблеток (известной лекарственной формы бетаинов (ацидина)) проведена по следующим показателям и методикам (ГФ РФ, XIV, 2018; Промышленная технология лекарств. Под ред. В.И. Чуешова, Харьков: НФАУ, 2002, т. 2, 716 с.):
- органолептические свойства.
- сыпучесть порошка (способность высыпаться под силой собственной тяжести и равномерно заполнять матричный канал таблеточной машины) - время (сек) прохождения 100 г порошка через выходное отверстие диаметром 15 мм вибрационного устройства «ВП-12А» (среднее значение из 3 определений):
- угол естественного откоса порошка (в угловых градусах) - трехмерный угол относительно горизонтальной поверхности, сформированный конусообразной пирамидкой сыпучего материала, оценен на вибрационном устройстве «ВП-12А» при помощи угломера (среднее значение из 3 определений);
- прессуемость порошка - способность частиц к когезии под давлением, определена путем оценки 10 таблеток, полученных на ротационной таблеточной машине «РТМ-12» в матрице с диаметром пуансонов 13 мм при давлении 120 МПа, по среднему коэффициенту прессуемости (отношению массы таблетки к ее высоте, г/мм) и средней прочности таблеток на раздавливание (Ньютоны. Н) в приборе «Эрвека»;
- насыпная (объемная) плотность (г/см3) - масса единицы объема порошка, определена на приборе «545Р-АК-3» (среднее значение из 3 определений);
- давление (сила) выталкивания (МПа) получаемых таблеток из матрицы определена по показаниям манометра пресса на ротационной таблеточной машине «РТМ-12» в матрице с диаметром пуансонов 9 мм при давлении 120 МПа (среднее значение из 3 определений).
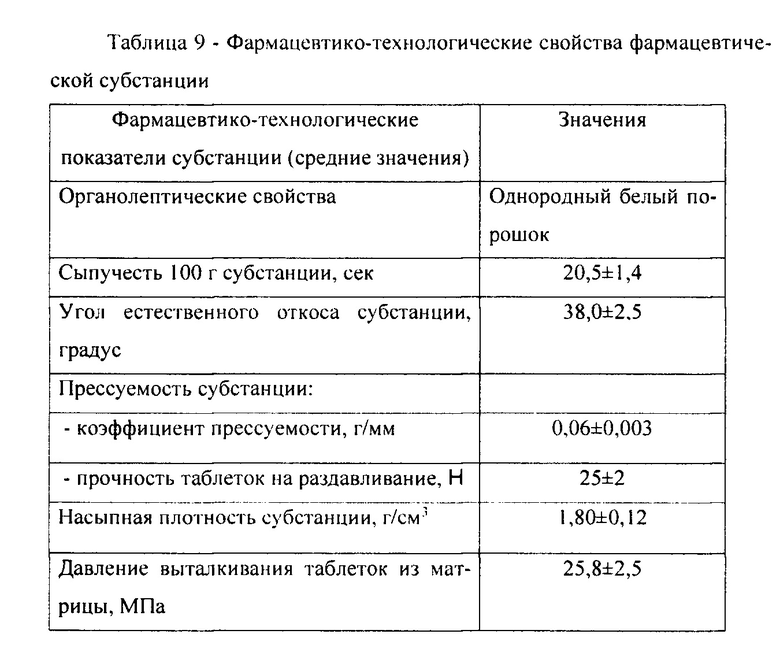
Полученные средние результаты (таблица 9) свидетельствуют о неудовлетворительных фармацевтико-технологических показателях фармацевтической субстанции, что дополняется гигроскопичностью и слеживаемостью субстанции, малой прочностью таблеток на раздавливание. Представленные данные обусловили необходимость подбора вспомогательных веществ, способных оптимизировать фармацевтико-технологические показатели субстанции.
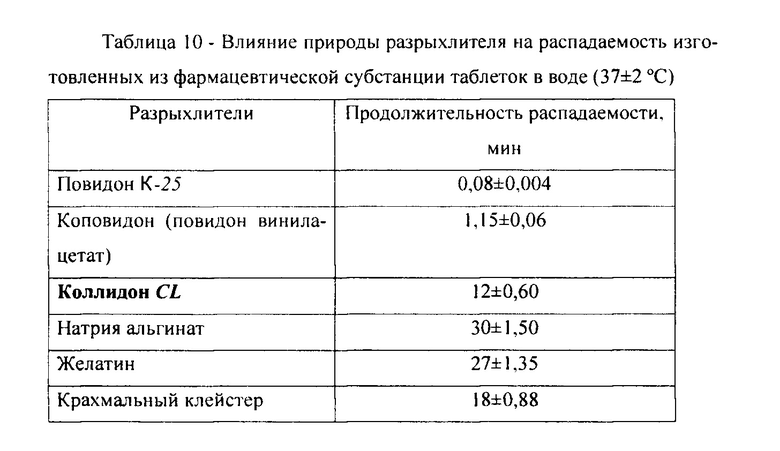
С целью коррекции технологических показателей фармацевтической субстанции, лабильных к воздействию внешних факторов (влаги, повышенной температуры, света (НД 42-9712-05)). для изготовления таблеток предпочтительно сухое, а не влажное гранулирование. В этой связи, использование в известном способе (регистрационное удостоверение ЛС001355241011) низкомолекулярного вспомогательного вещества повидона-К25 не приемлемо, поскольку оно используется для влажной грануляции, не обеспечивая при сухой грануляции должной прочности таблеток (Егошина Ю.А., Поцелуева Л.А. Современные вспомогательные вещества в таблеточном производстве. Успехи современного естествознания, 2009, №10, С. 30-33). Для улучшения распадаемости таблеток в среде желудочно-кишечного тракта и высвобождения лекарственных веществ с оказанием необходимого терапевтического эффекта используют разрыхлители (дезинтегранты). Таким разрыхлителем в известных таблетках «Ацидин-пепсин» является низкомолекулярный полимер - повидон K-25, который не обеспечивает удовлетворительной распадаемости таблеток: таблетки уже на воздухе расплываются, при контакте с водой распадаются в течение 5 сек. Поэтому нами осуществлен подбор оптимального разрыхлителя, обеспечивающего удовлетворительную распадаемость таблеток в воде при температуре 37±2°С (по ГФ РФ, XIV, 2018: в течение 15 мин) (таблица 10, средние значения из 3 определений). Полученные данные свидетельствуют об обеспечении удовлетворительной распадаемости таблеток (в течение 15 мин) при введении в них в качестве разрыхлителей повидона K-25, коповидона, коллидона CL. Однако применение первых двух разрыхлителей, в отличие от коллидона CL, обусловливает очень быструю распадаемость таблеток (в течение времени, недостаточного для их поступления в желудочно-кишечный тракт) и расплываемость таблеток на воздухе, поэтому в качестве оптимального разрыхлителя выбран коллидон CL.
Для обеспечения хороших разрыхляющих свойств рекомендуемое количество коллидона CL составляет 2-5% от массы таблетки (Егошина Ю.А., 2009), экспериментально подобранная доза коллидона CL составила 5% от средней массы таблетки (таблица 11, средние значения из 3 определений). Полученные данные показывают, что в изученном интервале массовой доли коллидона CL от массы таблетки наблюдается оптимальная продолжительность распадаемости таблеток в воде, однако, только при концентрации разрыхлителя 5% обеспечивается удовлетворительная (71-72 Н) прочность таблеток на раздавливание.
Другим вспомогательным веществом в составе известных таблеток «Ацидин-пепсин» является сорбитол - разбавитель, скользящее вещество (Егошина Ю.А., 2009). Известно, что разбавители используются в случае малых количеств действующих веществ для обеспечения необходимой массы таблетки (Гроссман В.А. Фармацевтическая технология. М.: ГЭОТАР-Медиа, 2014, 320 с.), что не относится к известным таблеткам, где содержание действующих веществ (бетаина и пепсина) высокое: 200,5 мг, в предлагаемых таблетках еще больше - 250,0 мг. С другой стороны, в составе известных таблеток «Ацидин-пепсин» имеется аэросил, выполняющий роль скользящего вещества, поэтому необходимости введения еще одного скользящего вещества - сорбитола, к тому же, в высокой концентрации (31,8 мг или 12,62% к массе таблетки) при относительно высокой доле вспомогательных веществ (20,4% от массы таблетки), нецелесообразно. В этой связи, в предлагаемом способе из состава таблеток исключен сорбитол и увеличено содержание аэросила до достижения оптимального давления выталкивания таблеток из матрицы таблеточной машины (таблица 12, средние значения из трех определений). Приведенные данные свидетельствуют о том, что при предельно допустимой концентрации аэросила в составе таблеток 10% (не более 10% по ГФ РФ. XIV. 2018) скольжение таблетируемой массы становится оптимальным: достигается минимальное давление выталкивания таблеток из матрицы. При этом доля скользящих веществ снижается с 14,68% к массе таблетки (2,06% аэросила и 12,62% сорбитола) в известных таблетках до 10% в предлагаемых таблетках.
Содержание кальция стеарата в предлагаемых таблетках (1% к массе таблетки) аналогично известным таблеткам.
Для увлажнения гранулята, приготовленного из фармацевтической субстанции, способной с водой образовывать клейкую, оплывающую, плохо гранулируемую массу, обычно используют спирт этиловый 96% (Егошина Ю.А., 2009). в связи с чем в предлагаемом способе использован именно этот увлажнитель.
Таким образом, сравнительный состав таблеток в известном и предлагаемом способах отличается по содержанию как действующих, так и вспомогательных веществ (таблица 13). Содержание действующих веществ в предлагаемых таблетках составило 83,4%, в известных таблетках 79,6%, содержание вспомогательных веществ в предлагаемых таблетках 16,6%, в известных таблетках 20,4%.
Фарманевтико-технологические характеристики предлагаемых таблеток приведены в таблице 14. Полученные данные полностью удовлетворяют требованиям, предъявляемым ГФ РФ (ГФ РФ XIV, 2018) к таблеткам без оболочек.
Контроль качества заявляемых таблеток без оболочки диаметром 9 мм, высотой 3 мм, средней массой одной таблетки 300 г, проведен по показателям:
- описание (ГФ РФ, XIV, 2018),
- подлинность:
- азотсодержащие бетаины гидрохлориды (Лутцева Т.Ю., 2002; ГФ РФ. XIV, 2018).
- пепсин (НД 42-9712-05),
- однородность массы дозированных лекарственных форм (ГФ РФ, XIV, 2018),
- прочность таблеток на истирание (ГФ РФ, XIV, 2018),
- распадаемость таблеток в воде при температуре 37±1°С (ГФ РФ, XIV, 2018),
- растворение таблетки в 0,01 моль/л растворе хлористоводородной кислоты при температуре 37±1°С (ГФ РФ, XIV, 2018),
- вспомогательные вещества (аэросил, кальция стеарат) (ГФ РФ. XIV, 2018),
- количественное определение (азотсодержащие бетаины гидрохлориды, пепсин) (НД 42-9712-05).
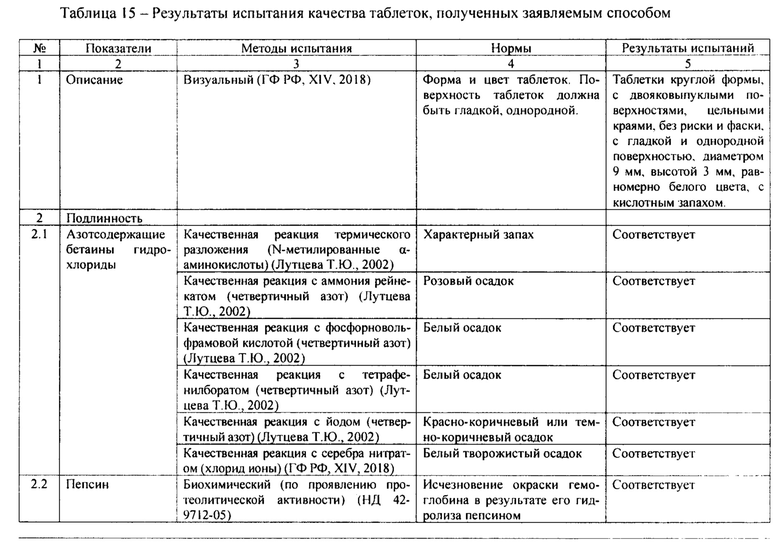
Результаты испытания качества заявляемых таблеток в сравнении с нормами приведены в таблице 15. По показателям подлинности, физико-химическим характеристикам и количественного содержания заявляемые таблетки соответствуют фармакопейным нормам.
Стабильность заявляемых таблеток в процессе хранения изучена с помощью метода ускоренного хранения (ускоренного старения) (ГФ РФ, XIV, 2018). Для этого 3 серии таблеток (по 6 штук) хранили в термостатах при температурах 40, 50 и 60°С соответственно в течение 114, 57 и 29 суток. Показатели качества таблеток, приведенные в таблице 15, контролировали через 11 (при 40°С), 6 (при 50°С) и 2,9 (при 60°С) суток. В течение экспериментальных сроков хранения ни одна серия таблеток не отклонилась от показателей, приведенных в таблице 10. На основании экспериментальных сроков хранения, используя математическое выражение правила Вант-Гоффа, рассчитан срок годности заявляемых таблеток при температуре 10±2°С, составивший 2 года.
Способ получения заявляемых ЛС на основе азотсодержащих бетаинов гидрохлоридов: фармацевтической субстанции и таблеток, изготовленных из жидкой фазы послеспиртовой кукурузной барды и пригодных для использования в качестве пищеварительных, ферментных ЛС, поясняется следующим конкретным примером.
Пример 1.
Для разделения на жидкую и твердую фазы послеспиртовую кукурузную барду (объем 5000 мл) процеживают через полотняный фильтр и вату, твердую фазу отбрасывают. Жидкую фазу барды (жидкость желтого цвета со специфическим дрожжевым запахом, объем 3600 мл), содержащую 3,5% мальтозы и 14.0% глюкозы (таблица 2), освобождают от восстанавливающих сахаров. Для этого сначала гидролизуют мальтозу: к жидкой фазе объемом 3600 мл, содержащей 126 г (3,5%) мальтозы, добавляют 120 мл (126 г) безводной уксусной кислоты (плотность 1,052 г/мл, концентрация 99,8%) (мае. соотношение мальтозы и кислоты 1:1) и нагревают в течение 0,5 час на кипящей водяной бане в колбе, снабженной обратным водяным шариковым холодильником.
Суммарное содержание восстанавливающих Сахаров в жидкой фазе барды составляет 17.5%, значит, в 3600 мл барды содержится 630 г глюкозы (свободной и образовавшейся после гидролиза мальтозы). Поскольку для кристаллизации глюкозы требуется двойной объем (1260 мл) безводной уксусной кислоты (Губен И., 1934), то с учетом уже добавленного объема кислоты (120 мл), необходимо еще добавить 1140 мл (1260-120 мл) кислоты. Поэтому к охлажденному гидролизату приливают 1140 мл холодной (5°С) безводной уксусной кислоты, кристаллизуют при перемешивании (0-5°С, 1 сутки). Кристаллы глюкозы фильтруют на воронке Бюхнера со стеклянным фильтром, высушивают (70±2°С); выход глюкозы составляет 470 г или 74,6% к содержанию восстанавливающих сахаров, 13,1%) к жидкой фазе барды. Полученный фильтрат концентрируют на водяной бане под вакуумом водоструйного насоса (55±2°С) до 1/25 первоначального объема, охлаждают (до 20±2°С).
Далее проводят кислотный гидролиз белков и пептидов. содержащихся в концентрированном фильтрате, для чего фильтрат (объем 180 мл), находящийся в колбе, снабженной обратным водяным шариковым холодильником, обрабатывают 180 мл концентрированной хлористоводородной кислоты (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19,98% масс.) на водяной бане при температуре 110±2°С (72 час). В ходе гидролиза выпадает осадок балластных веществ. По окончании гидролиза реакционную смесь медленно охлаждают (до 20±2°С), дополнительно выделяя осадок балластных веществ, который отфильтровывают на воронке Бюхнера со стеклянным фильтром. Фильтрат обрабатывают 1 г активированного угля (55±2°С, 0,5 час), фильтруют на воронке Бюхнера со стеклянным фильтром, промывая осадок 10 мл горячей воды; фильтрат объединяют с промывными водами, осадок отбрасывают.
Содержащиеся в фильтрате α-аминокислоты подвергают исчерпывающему метилированию по атому азот а йодистым метилом в присутствии натрия карбоната до образования бетаинов известным способом Гофмана (Гауптман З., 1979). Для этого к полученному фильтрату, помещенному в колбу, снабженную обратным водяным шариковым холодильником, добавляют 443,860 г йодистого метила и 41,446 г натрия карбоната. Смесь нагревают на водяной бане до температуры кипения (42±2°С) и кипятят до прекращения выделения углекислого газа (30 час).
Для получения глицина бетаина гидрохлорида к смеси добавляют концентрированную хлористоводородную кислоту (по объему 1:1), концентрируют на водяной бане под вакуумом водоструйного насоса (55±2°С, до 1/3 объема). Смесь охлаждают до температуры 20±2°C, при этом выделяется обильный осадок «сырой соли ацидина», который фильтруют на воронке Бюхнера со стеклянным фильтром; осадок (осадок А) на фильтре промывают 100 мл концентрированной хлористоводородной кислоты. Фильтрат с промывными водами концентрируют на водяной бане под вакуумом водоструйного насоса (55±2°С, до 1/3 объема), охлаждают, переносят в кристаллизатор (0-5°С, 8 час). При этом выпадает стекловидный осадок глицина бетаина гидрохлорида (осадок Б), который декантируют, отжимают между листами фильтровальной бумаги. Оба осадка А и Б объединяют (глицина бетаина гидрохлорид, осадок В).
Далее осадок В очищают путем растворения в теплой воде (55±2°С, 1:2), обработки раствора 0,35 г активированного угля, нагревания в колбе, снабженной обратным водяным шариковым холодильником, на водяной бане (40±2°С, 0,5 час), фильтрации на воронке Бюхнера со стеклянным фильтром (осадок отбрасывают). Фильтрат (прозрачная бесцветная жидкость) концентрируют на водяной бане под вакуумом водоструйного насоса (55±2°С, до 1/3 объема), кристаллизуют (0-5°С, 8 час); выпавший осадок, отделенный воронке Бюхнера, отжимают между листами фильтровальной бумаги, высушивают на воздухе (20±2°С) и досушивают в вакуум-эксикаторе. Осадок очищенного глицина бетаина гидрохлорида представляет собой белый порошок; его выход составляет 93,6229 г или 2,60% к жидкой фазе барды.
Маточные растворы, образовавшиеся после отделения и очистки осадка глицина бетаина гидрохлорида, объединяют и используют для выделения глутаминовой кислоты бетаина гидрохлорида Для этого раствор разбавляют водой (1:1), осветляют активированным углем (0,3% к массе раствора, 55±2°С, 0,5 час), охлаждают (до 40±2°С), фильтруют на воронке Бюхнера со стеклянным фильтром, осадок отбрасывают, фильтрат концентрируют на водяной бане под вакуумом водоструйного насоса (55±2°С, до 1/3 объема), охлаждают на ледяной бане (до 20±2°С), обрабатывают концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19,98% масс.) (по объему 1:1), кристаллизуют (0-5°С, 5 суток), образовавшиеся кристаллы глутаминовой кислоты бетаина гидрохлорида отделяют на воронке Бюхнера со стеклянным фильтром. Очистку кристаллов проводят растворением осадка в воде (1:10), обработкой раствора концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, концентрация 6,0 моль/л, 19,98% масс.) (по объему 1:1), фильтрацией на воронке Бюхнера со стеклянным фильтром. Осадок отжимают между листами фильтровальной бумаги, высушивают на воздухе (20±2°С) и досушивают в вакуум-эксикаторе; масса осадка очищенной глутаминовой кислоты бетаина гидрохлорида (осадок Г) 82,8289 г или 2,30% к жидкой азе барды. Образовавшиеся после выделения и очистки осадка Г маточные растворы объединяют, выпаривают на водяной бане под вакуумом водоструйного насоса (55±2°С) почти досуха, досушивают в вакуум-эксикаторе; образующийся остаток содержит бетаины других аминокислот гидрохлоридов (осадок Д); выход осадка Д составляет 28,8863 г или 0,80% к жидкой фазе барды.
Количественное содержание бетаинов гидрохлоридов в фармацевтической субстанции: 99,8% (осадок В), 99,6% (осадок Г), 99,5% (осадок Д).
Полученные очищенные целевые продукты (осадки В, Г, Д общей массой 205,3381 г) помещают в ступку, где смешивают и растирают до образования однородного порошка белого цвета (фармацевтическая субстанция). Далее изготавливают таблетки (все числовые данные приведены в расчете на 1 таблетку), для чего в ступку помещают 200,0 мг полученной субстанции, добавляют 50,0 мг ГСО пепсина («Meito Sangyo Co., LTD», Япония, количественное содержание 100±7,5%), смешивают, высушивают в вакуум-сушильном шкафу (40±2°С) до остаточной влажности не более 3%. К полученной смеси, для приготовления сухого гранулята, добавляют 29,9 мг аэросила (антифрикционное, скользящее, вещество, улучшающее смачиваемость), 15,0 мг коллидона CL (разрыхлитель, набухающее вещество), увлажняют 1,0-1,5 мл спирта этилового 96%, перемешивают. Гранулят протирают через сито №15 (диаметр отверстий 1,5 мм), гранулы «опудривают» 3,0 мг кальция стеарата (смазывающее вещество), прессуют на ротационной таблеточной машине «РТМ-12» в матрице с диаметром пуансонов 9 мм при давлении 120 МПа. Таблетки упаковывают в пеналы, закрывающиеся крышками с гранулированным силикагелем (влагопоглотителем). Целевой продукт - таблетки круглой формы, с двояковыпуклыми поверхностями, цельными краями, без риски и фаски, с гладкой и однородной поверхностью, диаметром 9 мм, высотой 3 мм, равномерно белого цвета, со специфическим (кислотным) запахом. Состав одной таблетки со средней массой 300,0 мг: бетаинов гидрохлоридов 200,0 мг, пепсина 50,0 мг, аэросила 29,9 мг, коллидона CL 15,0 мг, кальция стеарата 3,0 мг.
Фармацевтико технологические характеристики таблеток
Показатели гранулята: сыпучесть порошка 11,5 г/сек, угол естественного откоса 28°, насыпная плотность 0,95 г/см3. Показатели таблеток: коэффициент прессуемости 0,1 г/мм, прочность таблеток на раздавливание 71 Н, давление выталкивания таблеток из матрицы 11,1 МПа.
Средняя масса одной таблетки из 20 испытанных таблеток находилась в пределах 296,4 мг-303,6 мг; отклонение массы каждой таблетки от средней массы из 20 таблеток не превысило ±1,2%. Потеря в массе 10 таблеток при истирании составила ±0,7% от исходной массы таблеток (не более 3%). В течение 12 мин в воде при температуре 37°С все 6 испытуемых таблеток распались. При испытании по тесту «растворение» одной таблетки в приборе «Вращающаяся корзинка» со скоростью вращения корзинки 100 об./мин в 0,01 моль/л растворе хлористоводородной кислоты (рН 2,0±,01) с температурой 37±1°С и объемом 0,9 л в течение 45 мин методом алкалиметрии с потенциометрической индикацией точки эквивалентности обнаружено 199,6 мг (99,8%) бетаинов гидрохлоридов. Количественное содержание вспомогательных веществ аэросила и кальция стеарата, определенное методом гравиметрии по массе золы (ГФ РФ, XIV, 2018), составило 9,9% и 1,0%) соответственно. Количественное содержание бетаинов гидрохлоридов, определенное методом алкалиметрии, составило 199,6 мг в одной таблетке. Количественное содержание пепсина, определенное биохимическим и спектрофотометрическим методами, составило 47,5 мг в одной таблетке.
Срок годности заявляемых таблеток, оцененный с помощью метода ускоренного хранения (ускоренного старения) по показателям подлинности, физико-химическим характеристикам и количественного содержания бетаинов гидрохлоридов, пепсина, аэросила, при температуре 10±2°С составил 2 года.
Биологические испытания заявляемых таблеток проведены по тестам: острая токсичность, гиперацидное и протеолитическое действие в опытах на животных, каждая группа которых включала 6 особей. Результаты испытаний обработаны методом множественной статистики (ГФ РФ, XIV, 2018) с использованием параметрического критерия Стьюдента, определением средней арифметической величины и отклонения от нее, вероятности различий результатов сравниваемых групп животных.
Острая токсичность заявляемых таблеток определена методом Кербера (Сидоров К.К. Методы определения острой токсичности и опасности химических веществ (токсикометрия). М., Медицина, 1970, 117 с.) путем перорального однократного введения мышам массой 20 г таблеток в дозах (мг субстанции / кг веса мыши): 100, 250, 500, 1000, 5000 в 5 мл раствора. За время наблюдения (14 дней) за состоянием животных их гибели не отмечено. При вскрытии животных, через 14 дней после введения таблеток, изменений со стороны печени, почек, селезенки не обнаружено. Результаты изучения острой токсичности заявляемых таблеток (таблица 16) свидетельствуют о том, что даже максимально введенная доза (5000 мг/кг) не вызвала токсичности, поэтому рассчитать LD50 не представилось возможным, очевидно, LD50>5000 мг/кг. В этой связи, согласно классификации токсических веществ (Сидоров К.К., 1970), заявляемые таблетки отнесены к группе практически нетоксичных веществ.
Гиперацидное действие заявляемых таблеток оценивали по содержанию кислотных компонентов желудочного сока у крыс типа Вистар массой 180-220 г. Использованы 3 группы животных по 6 особей в каждой группе, находящихся на стационарном режиме питания: группа №1 - интактные животные, получавшие изотонический раствор (контроль); группа №2 -животные, получавшие известные таблетки «Ацидин-пепсин» (препарат сравнения); группа №3 - животные, получавшие заявляемые таблетки. Дозу введения заявляемых таблеток животным рассчитывали с учетом дозы применения известных таблеток «Ацидин-пепсин»: по 4 таблетки или 1600 мг ацидина в сутки (Инструкция, приказ №843), что составляет 23 мг/кг веса взрослого человека. В пересчете веса взрослого человека на вес животного (коэффициент 5.9). суточные дозы бетаинов и пепсина составляют 23⋅5,9=136 мг и 5,75⋅5,9=34 мг на 1 кг веса животного соответственно, или 170 мг субстанции на 1 кг веса животного. Рассчитанная доза субстанции соответствует 0,68 доли заявляемой таблетки. Таким образом, в течение 7 дней животным ежедневно перорально (после еды) вводили заявляемые таблетки в суточной дозе 0,68 таблетки или 170 мг субстанции на 1 кг веса животного (в четыре приема). На следующие сутки после окончания эксперимента животных умерщвляли, извлекали желудок, вскрывали его по малой кривизне, отбирали содержимое желудка, в котором определяли концентрацию соляной кислоты (свободной, общей, связанной с белками) и общую кислотность методом алкалиметрии (Строев Е.А., Макарова В.Г. Практикум по биологической химии. М., ВШ. 1986, 231 с.). Определение кислотных компонентов желудочного сока основано на их титровании раствором натрия гидроксида с использованием двух индикаторов: п-диметиламиноазобензола (рН 2,3-4,2) и фенолфталеина (рН 8,2-10,0). По изменению окраски п-диметиламиноазобензола (от красной к оранжевой) определялась свободная соляная кислота; по переходу окраски фенолфталеина (от бесцветной к розовой) - общая кислотность желудочного сока.
Оценку протеолитической функции желудка по содержанию белков проводили методом фотометрии по реакции с биуретовым реактивом (Строев Е.А., 1986).
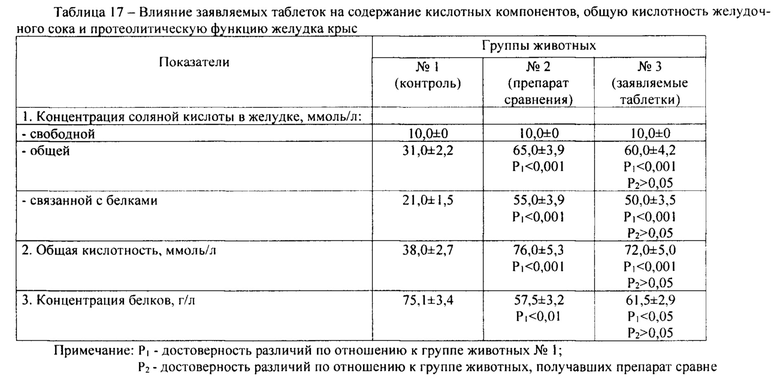
Результаты изучения влияния заявляемых таблеток на содержание кислотных компонентов, общую кислотность желудочного сока и протеолитическую функцию желудка крыс приведены в таблице 17. Согласно полученным данным, заявляемые таблетки, как и известные таблетки «Ацидин-пепсин», по сравнению с контролем, не вызывают изменения концентрации свободной соляной кислоты в желудке крыс, но достоверно повышают содержание общей соляной кислоты (в 1,94 раз), соляной кислоты, связанной с белками (в 2,4 раз), общую кислотность (в 1,90 раз). Препарат сравнения действует аналогичным образом: увеличение показателей в 2,10 раз, 2,62 раз, 2,00 раз соответственно по отношению к контролю. Установлено достоверное снижение концентрации белков в желудке, как заявляемых, так и известных таблеток по сравнению с контролем: в 1,22 и 1,31 раз соответственно. Достоверных различий между заявляемыми и известными таблетками, как по гиперацидной, так и по протеолитической активности не установлено (Р2>0,05). Таким образом, заявляемые таблетки не уступают препарату сравнения по гиперацидному и протеолитическому действию, повышая содержание всех кислотных компонентов, кроме свободной соляной кислоты, и снижая концентрацию белков в желудке.
Таким образом, предлагаемый способ получения лекарственных средств - субстанции азотсодержащих бетаинов гидрохлоридов и таблеток, содержащих в качестве активных компонентов бетаины гидрохлориды и пепсин, обеспечивает следующий положительный эффект:
1. Получение 12-ти азотсодержащих бетаинов гидрохлоридов (глицина, глутаминовой кислоты, аргинина, аланина, аспарагиновой кислоты, тирозина, гистидина, серина, валина, лейцина, лизина, треонина) благодаря высокой концентрации содержащихся в послеспиртовой кукурузной барде аминокислот (28,8-28,9%).
2. Увеличение технологического выхода целевого продукта: 5,70% к жидкой фракции (в заявляемом способе) против 3,3% к жидкой фракции (в способе, принятом за прототип). Это обусловлено оптимизацией технологического процесса: практически полным кислотным гидролизом белков и пептидов (72 час в заявляемом способе), полусинтезом целевых продуктов путем метилирования и гидрохлорирования аминокислот, «щадящими» температурными режимами, предотвращающими улетучивание гидрохлоридов, исключением стадии обработки этиловым спиртом, приводящим к потере белков, пептидов, аминокислот.
3. Высокая степень чистоты полученного целевого продукта, подтверждаемая количественным содержанием (99,5-99,8%), что обусловлено стадией удаления углеводов и оптимизацией технологических условий.
4. Оптимальное для оказания гиперацидного и ферментативного (пищеварительного) действия массовое соотношение бетаинов и пепсина (200 мг : 50 мг, 4:1), рекомендованное фармакологами, в отличие от известной субстанции (200 мг : 0,5 мг, 400:1).
5. Введение пепсина с фармакопейными нормами качества (фармакопейная статья ФС 42-0077-01), в частности, количественным содержанием 100±7,5% в состав фармацевтической субстанции.
6. Оптимизация фармацевтико-технологических свойств гранулята и таблеток:
- для гранулята: снижение сыпучести (11,5 сек), угла естественного откоса (28,0°), насыпной (объемной) плотности (0,95 г/см3);
- для таблеток: увеличение коэффициента прессуемости (0,10 г/мм), прочности таблеток на раздавливание (71 Н), снижение давления (силы) выталкивания таблеток (11,1 МПа).
Указанные оптимальные свойства достигаются путем коррекции технологии таблеток и состава вспомогательных веществ: применения сухого гранулирования; замены низкомолекулярного разрыхлителя повидона K-25 (известное ЛС) на высокомолекулярный разрыхлитель коллидон CL (заявляемое ЛС); снижения доли скользящих веществ (12,62% сорбитола и 2,06% аэросила в известных таблетках) до 10,0% аэросила (в заявляемых таблетках); снижения доли вспомогательных веществ с 16,6% (заявляемое ЛС) до 20,4% (известное ЛС).
7. Использование доступного для любого фармацевтического производства технологического оборудования (сушилок, ротационной таблеточной машины и др.), вспомогательных веществ.
8. Соответствие заявляемых таблеток фармакопейным нормам по всем показателям: описание, подлинность, физико-химические характеристики (однородность массы, прочность на истирание, распадаемость в воде, растворение), количественное содержание действующих и вспомогательных веществ.
9. Обеспечение точной дозы ЛС при использовании таблеток, в отличие от порошка, употребление которого сопряжено со значительными колебаниями концентраций действующих веществ.
10. Оптимальные потребительские свойства заявляемых таблеток: отсутствие запаха, готовность к употреблению.
11. Увеличение срока годности таблеток при температуре хранения 10°С: с 1,5 лет до 2 лет.
12. Заявляемые таблетки практически нетоксичны: оказывают выраженное гиперацидное действие (повышают содержание общей соляной кислоты в 1,94 раз, соляной кислоты, связанной с белками в 2,4 раз, общую кислотность в 1,90 раз), выраженное протеолитическое действие (снижают концентрацию белков в желудке в 1,22 раз). По специфической активности заявляемые таблетки находятся на уровне известных таблеток «Ацидин-пепсин».












| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ ТАБЛЕТКИ "БИОБАРДИНА" АНТИОКСИДАНТНОГО ДЕЙСТВИЯ, ПОЛУЧЕННЫЕ НА ОСНОВЕ ПОСЛЕСПИРТОВОЙ ЗЕРНОВОЙ БАРДЫ | 2016 |
|
RU2630466C1 |
| ФАРМАЦЕВТИЧЕСКИЕ ТАБЛЕТКИ "БИОБАРДИН", ПОЛУЧЕННЫЕ НА ОСНОВЕ ЖИДКОЙ ФАЗЫ ПОСЛЕСПИРТОВОЙ ЗЕРНОВОЙ БАРДЫ И ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ГАСТРОЭНТЕРОЛОГИИ | 2016 |
|
RU2662064C2 |
| Таблетированный препарат для улучшения процессов пищеварения | 1990 |
|
SU1745252A1 |
| Фармацевтическая композиция, обладающая антиаритмической активностью различной этиологии | 2021 |
|
RU2783944C1 |
| ТВЕРДАЯ ЛЕКАРСТВЕННАЯ ФОРМА ТЕРБИНАФИНА ГИДРОХЛОРИДА | 2001 |
|
RU2200003C1 |
| Производные 2-аминохроменов проявляющие противоопухолевую активность. Фармацевтические композиции | 2018 |
|
RU2704262C1 |
| Способ получения солей разветвлённого олигогексаметиленгуанидина, имеющих степень чистоты, достаточную для их применения в качестве фармацевтической субстанции | 2019 |
|
RU2729421C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ АНЕМИИ, СВЯЗАННОЙ С ХРОНИЧЕСКИМ ЗАБОЛЕВАНИЕМ ПОЧЕК, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2756312C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, СОДЕРЖАЩЕЙ ГЛЮКОЗАМИНА ГИДРОХЛОРИД | 2003 |
|
RU2247563C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ АНЕМИИ, СВЯЗАННОЙ С ХРОНИЧЕСКИМ ЗАБОЛЕВАНИЕМ ПОЧЕК, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2749719C1 |
Изобретение относится к субстанции и лекарственной форме, содержащим азотсодержащие бетаинов гидрохлориды на основе жидкой фазы послеспиртовой кукурузной барды, предназначенные для использования в качестве пищеварительных, ферментных лекарственных средств (ЛС), а также к способам их получения. Способ получения лекарственной субстанции заключается в том, что из жидкой фазы, отделенной от твердой фазы послеспиртовой кукурузной барды процеживанием, удаляют восстанавливающие сахара после предварительного гидролиза мальтозы путем кристаллизации, фильтрации и высушивания глюкозы, концентрирования и охлаждения фильтрата, содержащиеся в фильтрате белки и пептиды гидролизуют концентрированной HCl, охлаждают, отфильтровывают, содержащиеся в фильтрате аминокислоты метилируют, обрабатывают концентрированной HCl, концентрируют, охлаждают, отфильтровывают осадок А, фильтрат концентрируют, кристаллизуют, отделяют осадок Б, объединенный (А и Б) осадок В растворяют в воде, очищают активированным углем, фильтруют, фильтрат концентрируют, выделяют из него очищенный осадок В, фильтраты, образовавшиеся после выделения и очистки осадка В, разбавляют водой, обрабатывают активированным углем, охлаждают, фильтруют, концентрируют, охлаждают, обрабатывают концентрированной HCl, кристаллизуют, кристаллы (осадок Г) фильтруют, переосаждают из водного раствора концентрированной HCl, фильтруют и высушивают очищенный осадок Г, фильтраты, образовавшиеся после выделения и очистки осадка Г, выпаривают и досушивают до сухого остатка (осадок Д), осадки В, Г, Д объединяют и смешивают с фармакопейным пепсином (массовое соотношение 4:1). Фармацевтическая субстанция представляет собой однородный кристаллический порошок белого цвета с кислотным запахом, с составом азотсодержащих бетаинов гидрохлоридов: глицина (осадок В, 36,5 мас.% к субстанции), глутаминовой кислоты (осадок Г, 32,3 мас.% к субстанции), аргинина, аланина, аспарагиновой кислоты, тирозина, гистидина, серина, валина, лейцина, лизина, треонина (осадок Д, 11,2 мас.% к субстанции) и фармакопейного пепсина (20,0 мас.% к субстанции), с количественным содержанием бетаинов гидрохлоридов: 99,8% (осадок В), 99,6% (осадок Г), 99,5% (осадок Д), пепсина 100±7,5%. Способ получения лекарственной формы (таблетки) заключается в том, что фармацевтическую субстанцию массой 250,0 мг высушивают до остаточной влажности не более 3%, смешивают с 29,9 мг скользящего вещества аэросила, 15,0 мг разрыхлителя коллидона CL, увлажняют 1,0-1,5 мл спирта этилового 96%, растирают, протирают через сито, «опудривают» 3,0 мг смазывающего вещества кальция стеарата, полученный сухой гранулят прессуют для получения таблеток. Лекарственная форма представляет собой таблетку для перорального применения массой 296,4-303,6 мг, диаметром 9 мм, высотой 3 мм, круглой формы, с двояковыпуклыми поверхностями, цельными краями, без риски и фаски, с гладкой и однородной поверхностью, белого цвета, с кислотным запахом, с составом биологически активных соединений в 1 таблетке: 200,0 мг азотсодержащих бетаинов гидрохлоридов, 50,0 мг пепсина, с содержанием вспомогательных веществ в 1 таблетке: 29,9 мг аэросила, 15,0 мг коллидона CL, 3,0 мг кальция стеарата, со сроком годности таблеток при температуре хранения 10°С 2 года. 4 н.п. ф-лы, 17 табл.
1. Способ получения фармацевтической субстанции, содержащей азотсодержащие бетаины гидрохлориды, заключающийся в том, что из жидкой фазы, отделенной от твердой фазы послеспиртовой кукурузной барды процеживанием, удаляют восстанавливающие сахара после предварительного гидролиза мальтозы (безводная уксусная кислота, мас. соотношение мальтозы и кислоты 1:1, 100°С, 0,5 ч) путем кристаллизации (0-5°С, 1 сутки), фильтрации и высушивания (70°С) глюкозы, концентрирования (55°С, до 1/25 объема) и охлаждения (до 20°С) фильтрата, содержащиеся в фильтрате белки и пептиды гидролизуют концентрированной хлористоводородной кислотой (плотность 1,097 г/мл, объемное соотношение фильтрата и кислоты 1:1, 110°С, 72 ч), охлаждают (до 20°С), отфильтровывают балластные вещества, обрабатывают фильтрат активированным углем (0,3% к объему смеси, 55°С, 0,5 ч), отфильтровывают после промывки осадок, содержащиеся в фильтрате аминокислоты исчерпывающе метилируют йодистым метилом (молярное соотношение азота в составе аминокислот и йодистого метила 1:4) в присутствии натрия карбоната (молярное соотношение азота в составе аминокислот и натрия карбоната 2:1) (42°С, 30 ч), полученную смесь обрабатывают концентрированной хлористоводородной кислотой (объемное соотношение смеси и кислоты 1:1), концентрируют (55°С, до 1/3 объема), охлаждают (до 20°С), отфильтровывают после промывки той же кислотой (объемное соотношение осадка А и кислоты 1:10) осадок А, фильтрат концентрируют (55°С, до 1/3 объема), кристаллизуют (0-5°С, 8 ч), отделяют осадок Б, объединенный (А и Б) осадок В растворяют в воде (55°С, 1:2), очищают активированным углем (0,3% к массе раствора, 40°С, 0,5 ч), фильтруют, фильтрат концентрируют (55°С, до 1/3 объема), выделяют из него кристаллизацией (0-5°С, 8 ч), фильтрацией и высушиванием (20°С) очищенный осадок В, фильтраты, образовавшиеся после выделения и очистки осадка В, разбавляют водой (1:1), обрабатывают активированным углем (0,3% к массе раствора, 55°С, 0,5 ч), охлаждают (до 40°С), фильтруют, концентрируют (55°С, до 1/3 объема), охлаждают (до 20°С), обрабатывают концентрированной хлористоводородной кислотой (объемное соотношение фильтрата и кислоты 1:1), кристаллизуют (0-5°С, 5 суток), кристаллы (осадок Г) фильтруют, переосаждают из водного раствора (1:10) концентрированной хлористоводородной кислотой (объемное соотношение раствора и кислоты 1:1), фильтруют и высушивают (20°С) очищенный осадок Г, фильтраты, образовавшиеся после выделения и очистки осадка Г, выпаривают (55°С) и досушивают в вакуум-эксикаторе до сухого остатка (осадок Д), осадки В, Г, Д объединяют и смешивают с фармакопейным пепсином (массовое соотношение 4:1).
2. Фармацевтическая субстанция пищеварительного (ферментного, гиперацидного) действия, полученная способом по п. 1, представляет собой однородный кристаллический порошок белого цвета с кислотным запахом, с составом азотсодержащих бетаинов гидрохлоридов: глицина (осадок В, 36,5 мас.% к субстанции), глутаминовой кислоты (осадок Г, 32,3 мас.% к субстанции), аргинина, аланина, аспарагиновой кислоты, тирозина, гистидина, серина, валина, лейцина, лизина, треонина (осадок Д, 11,2 мас.% к субстанции) и фармакопейного пепсина (20,0 мас.% к субстанции), с количественным содержанием бетаинов гидрохлоридов: 99,8% (осадок В), 99,6% (осадок Г), 99,5% (осадок Д), пепсина 100±7,5%.
3. Способ получения лекарственной формы (таблетки), заключающийся в том, что фармацевтическую субстанцию, полученную способом по п. 1, массой 250,0 мг (все данные на 1 таблетку) высушивают в вакуум-сушильном шкафу (40°С) до остаточной влажности не более 3%, смешивают в ступке с 29,9 мг скользящего вещества аэросила, 15,0 мг разрыхлителя коллидона CL, увлажняют 1,0-1,5 мл спирта этилового 96%, растирают, протирают через сито №15 с диаметром отверстий 1,5 мм, «опудривают» 3,0 мг смазывающего вещества кальция стеарата, полученный сухой гранулят с сыпучестью 11,5 г/с, углом естественного откоса 28°, насыпной плотностью 0,95 г/см3 прессуют для получения таблеток с коэффициентом прессуемости 0,1 г/мм, прочностью на раздавливание 71 Н, давлением выталкивания из матрицы 11,1 МПа.
4. Лекарственная форма пищеварительного (ферментного, гиперацидного) действия, полученная способом по п. 3, представляющая собой таблетку для перорального применения массой 296,4-303,6 мг, диаметром 9 мм, высотой 3 мм, круглой формы, с двояковыпуклыми поверхностями, цельными краями, без риски и фаски, с гладкой и однородной поверхностью, белого цвета, с кислотным запахом, с потерей в массе при истирании 10 таблеток ±0,7%, с распадаемостью 6 таблеток в воде при температуре 37°С в течение 12 мин, с высвобождением 199,6 мг или 99,8% азотсодержащих бетаинов гидрохлоридов при растворении 1 таблетки в 0,01 моль/л растворе хлористоводородной кислоты (рН 2,0±0,1) с температурой 37°С и объемом 0,9 л в течение 45 мин при скорости вращения корзинки 100 об/мин, с составом биологически активных соединений в 1 таблетке: 200,0 мг азотсодержащих бетаинов гидрохлоридов, 50,0 мг пепсина, с содержанием вспомогательных веществ в 1 таблетке: 29,9 мг аэросила, 15,0 мг коллидона CL, 3,0 мг кальция стеарата, со сроком годности таблеток при температуре хранения 10°С 2 года.
| Способ получения солянокислого бетаина | 1971 |
|
SU445270A1 |
| АНТИОКСИДАНТНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ЗЕРНОВОЙ ПОСЛЕСПИРТОВОЙ БАРДЫ | 2009 |
|
RU2404766C1 |
| ФАРМАЦЕВТИЧЕСКИЕ ТАБЛЕТКИ "БИОБАРДИН", ПОЛУЧЕННЫЕ НА ОСНОВЕ ЖИДКОЙ ФАЗЫ ПОСЛЕСПИРТОВОЙ ЗЕРНОВОЙ БАРДЫ И ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ГАСТРОЭНТЕРОЛОГИИ | 2016 |
|
RU2662064C2 |
| КОМБИНИРОВАННЫЙ С ВОЗДУШНЫМ КЛАПАНОМ НАСОС ДЛЯ ГОРЮЧЕЙ ЖИДКОСТИ | 1923 |
|
SU1355A1 |
Авторы
Даты
2020-11-12—Публикация
2019-07-29—Подача