Область техники
Настоящее изобретение относится к способу получения ребаудиозида J и, в частности, относится к биологическому способу получения ребаудиозида J.
Предпосылки создания изобретения
Подсластители представляют собой класс пищевых добавок, которые широко применяют в производстве продуктов питания, таких как напитков и конфет. Их можно добавлять в процессе производства продуктов питания или, в альтернативном варианте осуществления, можно использовать при соответствующем разбавлении в качестве заменителя сахарозы в домашней выпечке. Подсластители включают натуральные подсластители, например сахарозу, кукурузный сироп с высоким содержанием фруктозы, мед и т.п., и искусственные подсластители, например аспартам, сахарин и т.п. Стевиозиды представляют собой класс натуральных подсластителей, экстрагируемых из растения Stevia rebaudiana, и в настоящее время их широко используют в продуктах питания и напитках. Экстракт Stevia rebaudiana содержит разнообразные стевиозиды, включая ребаудиозид. Экстрагируемые естественным путем стевиозиды значительно различаются по ингредиентам между разными партиями и требуют последующей очистки.
Содержание ребаудиозида J, обнаруживаемого в стевиозидах листьев стевии, не превышает 0,5%; поэтому получить экстракт ребаудиозида J высокой чистоты стандартным способом чрезвычайно сложно. Таким образом, углубленные исследования ребаудиозида J ограничены, а коммерческое применение ребаудиозида J затруднительно.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая задача, которую предстоит решить с помощью настоящего изобретения, состоит в устранении недостатков предшествующего уровня техники. В настоящем изобретении это достигается путем разработки способа получения ребаудиозида J с применением ферментативного способа. При таком способе продукт ребаудиозид J высокой чистоты может быть получен с меньшими затратами и более коротким циклом производства.
Для решения описанной выше технической задачи в настоящем изобретении использовано следующее техническое решение.
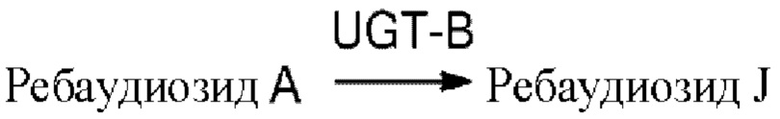
Предложен способ получения ребаудиозида J с применением ферментативного способа, в котором в качестве субстрата используют ребаудиозид А; и в присутствии донора гликозила получают ребаудиозид J посредством реакции в условиях катализа содержащими UDP-гликозилтрансферазу рекомбинантными клетками и/или полученной из них UDP-гликозилтрансферазой. UDP-гликозилтрансфераза (т.е. уридиндифосфогликозилтрансфераза), также называемая UGT, уже хорошо известна.
Предпочтительно донор гликозила представляет собой донор рамнозила.
Более предпочтительно донор рамнозила представляет собой UDP-рамнозу.
Предпочтительно UDP-гликозилтрансфераза представляет собой UGT-B из Oryza sativa (риса).
Аминокислотная последовательность UGT-B из Oryza sativa предпочтительно по меньшей мере на 60% соответствует последовательности 2, как показано в перечне последовательностей.
Более предпочтительно аминокислотная последовательность UGT-B из Oryza sativa по меньшей мере на 70% соответствует последовательности 2, как показано в перечне последовательностей.
Более предпочтительно аминокислотная последовательность UGT-B из Oryza sativa по меньшей мере на 80% соответствует последовательности 2, как показано в перечне последовательностей.
Еще более предпочтительно аминокислотная последовательность UGT-B из Oryza sativa по меньшей мере на 90% соответствует последовательности 2, как показано в перечне последовательностей.
В соответствии с одним из примеров аминокислотная последовательность UGT-B из Oryza sativa полностью идентична последовательности 2, как показано в перечне последовательностей.
В соответствии с настоящим изобретением реакцию проводят в водной системе при температуре 4-50°С и рН от 5,0 до 9,0. Предпочтительно реакцию проводят в водной системе при температуре 35-45°С и рН от 7,5 до 8,5. Более предпочтительно реакцию проводят при температуре ниже 40°С и рН ниже 8,0.
Более предпочтительно реакцию проводят в фосфатном буферном растворе.
Более предпочтительно реакционная система содержит рекомбинантные клетки, содержащие UDP-гликозилтрансферазу, и пермеабилизирующий клетку агент, и реакцию проводят в присутствии пермеабилизирующего клетку агента. Кроме того, пермеабилизирующий клетку агент представляет собой толуол, и объемная концентрация толуола в реакционной системе составляет 1-3%. Более того, объемная концентрация толуола составляет 2%.
Более предпочтительно все исходные материалы, используемые в реакции, добавляют в реактор для однородного смешивания и затем оставляют при заданной температуре для реакции при перемешивании. После завершения реакции продукт ребаудиозид J, который может удовлетворять требованиям к применению, может быть получен посредством процесса очистки. Конкретный способ очистки представляет собой последующую обработку, включая выделение на смоле; и продукт ребаудиозид J может быть получен с чистотой до 95%.
Рекомбинантная клетка предпочтительно представляет собой клетку микроорганизма.
Более предпочтительно микроорганизм представляет собой Escherichia coli, Saccharomyces cerevisiae или Pichia pastoris.
За счет вышеупомянутых технических решений настоящее изобретение имеет следующие преимущества по сравнению с предшествующим уровнем техники:
Предложенный в настоящем изобретении способ получения ребаудиозида J с применением ферментативного способа имеет важное прикладное значение. Поскольку с применением ферментативного способа субстрат ребаудиозид А можно получить в больших количествах, производство ребаудиозида J уже не ограничено количеством сырьевых материалов. Таким образом, затраты на производство значительно сокращаются. Кроме того, ввиду низкого количества стевиозидов с различными структурами довольно сложно экстрагировать продукт высокой чистоты. По сравнению с предшествующим уровнем техники, в котором экстрагируют ребаудиозид J из листьев стевии, в настоящем изобретении предложен продукт более высокой чистоты, полученный путем применения способа ферментативного синтеза, который будет способствовать исследованию и применению нового стевиозида ребаудиозида J.
Подробное описание изобретения
Структурные формулы ребаудиозида А и ребаудиозида J представлены в виде формул I и II соответственно.
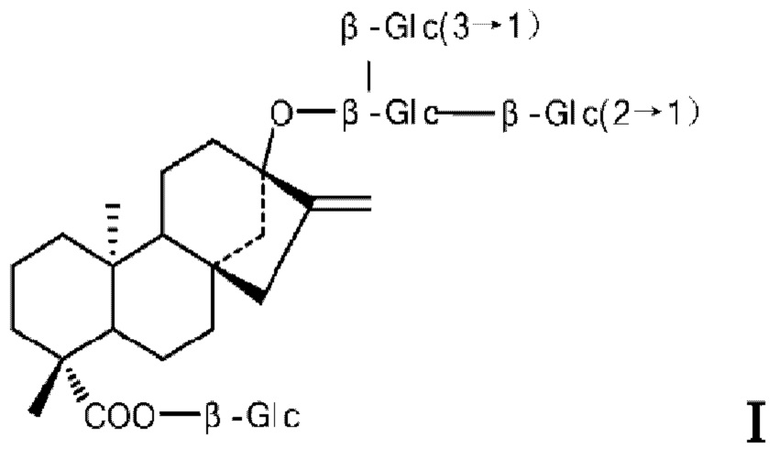
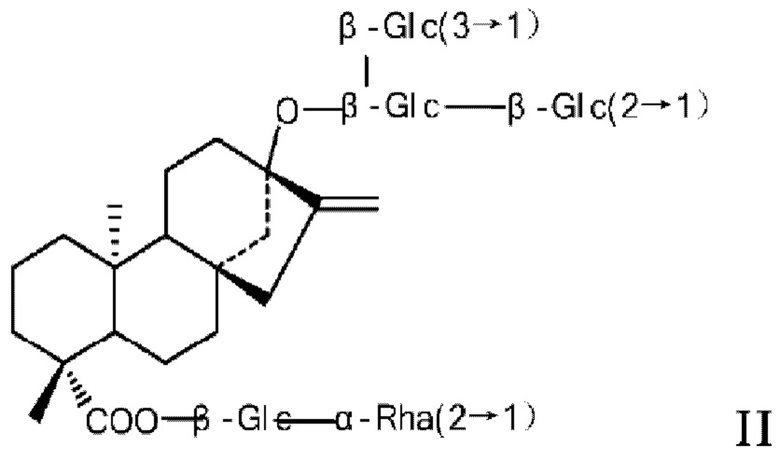
Основной путь синтеза ребаудиозида J, предложенный в соответствии с настоящим изобретением, описан ниже:
UGT-B, применяемый в настоящем изобретении, может существовать в форме порошка лиофилизированного фермента или в рекомбинантных клетках.
Способ получения UGT-B описан ниже:
рекомбинантный штамм Escherichia coli (или других микроорганизмов), экспрессирующий UGT-B, получают с использованием методов молекулярного клонирования и генной инженерии; впоследствии рекомбинантный штамм Escherichia coli ферментируют для получения содержащих UGT-B рекомбинантных клеток или для приготовления и получения лиофилизированного порошка UGT-B из вышеупомянутых рекомбинантных клеток.
Оба метода молекулярного клонирования и генной инженерии, описанные в настоящем изобретении, уже хорошо известны. Метод молекулярного клонирования описан в руководстве Molecular Cloning: A Laboratory Manual (3rd Edition) (J. Sambrook, 2005).
Стадии экспрессии описанного в настоящем документе рекомбинантного штамма, сконструированного методом генной инженерии, описаны ниже:
(1) (в соответствии с последовательностью1 и последовательностью 2, как показано в перечне последовательностей) необходимый фрагмент гена синтезируют генетическим путем, лигируют в векторе pUC57, соответственно присоединяя сайты ферментов рестрикции NdeI и BamHI на обоих концах;
(2) каждый фрагмент гена встраивают в сайт соответствующего фермента рестрикции экспрессионного вектора рЕТ30а посредством двойного расщепления и лигирования так, чтобы каждый ген был помещен под контроль промотора Т7;
(3) рекомбинантную плазмиду трансформируют в штамм Escherichia coli BL21 (DE3); экспрессию целевого белка индуцируют с использованием изопропилтиогалактозида (ИПТГ); и впоследствии получают рекомбинантные штаммы Escherichia coli, экспрессирующие UGT-B.
Стадии получения содержащих UGT-B рекомбинантных клеток и лиофилизированного порошка UGT-B с использованием рекомбинантных экспрессионных штаммов Escherichia coli, содержащих UGT-B, описаны ниже:
рекомбинантные экспрессионные штаммы Escherichia coli, содержащие UGT-B, инокулируют в 4 мл жидкой среды Лурия-Бертани (LB) в соответствии с долей 1%; проводят культивирование при встряхивании при 37°С (при 200 об/мин) в течение ночи; отбирают вещество из ночной культуры и инокулируют в 50 мл LB жидкой среды в соответствии с долей 1%; проводят культивирование при встряхивании при 37°С (при 200 об/мин) в течение ночи, пока значение OD600 не достигнет 0,6-0,8; затем добавляют ИПТГ до конечной концентрацией 0,4 ммоль/л при 20°С для культивирования в течение ночи при встряхивании. После завершения индукции клетки собирают центрифугированием (8000 об/мин в течение 10 мин); затем клетки ресуспендируют в 5 мл фосфатного буферного раствора 2 ммоль/л (рН 7,0) для получения рекомбинантных клеток; затем клетки разрушают ультразвуком на ледяной бане; гомогенат центрифугируют (8000 об/мин, 10 мин); и супернатант собирают и лиофилизируют в течение 24 ч для получения лиофилизированного порошка.
Настоящее изобретение дополнительно подробно описано в сочетании со следующими конкретными примерами.
Пример 1. Получение рекомбинантных клеток Escherichia coli, содержащих UGT-B
В соответствии с последовательностью 3 и последовательностью 4 фрагмент гена UGT-B был генетически синтезирован с присоединением соответствующих сайтов ферментов рестрикции NdeI и BamHI на обоих концах и лигирован в векторе pUC57 (производства компании Suzhou Genewiz Biotech. Co., Ltd.). Сегмент гена UGT подвергали ферментативному расщеплению эндонуклеазами рестрикции NdeI и BamHI; а затем сегменты выделяли и очищали; добавляли лигазу Т4 для лигирования сегментов в сайтах соответствующих ферментов рестрикции рЕТ30а с целью трансформации в штамм BL21 (DE3).
Штаммы UGT инокулировали в 4 мл жидкой среды LB в соответствии с долей 1%; проводили культивирование при встряхивании при 37°С (при 200 об/мин) в течение ночи; отбирали вещество из ночной культуры и инокулировали в 50 мл жидкой среды LB в соответствии с долей 1%; проводили культивирование при встряхивании при 37°С (при 200 об/мин) в течение ночи, пока значение OD600 не достигало 0,6-0,8; затем добавляли ИПТГ до конечной концентрацией 0,4 ммоль/л при 20°С для культивирования в течение ночи при встряхивании. После завершения индукции клетки собирали центрифугированием (8000 об/мин, 10 мин); и собранные клетки ресуспендировали в 5 мл фосфатного буфера 2 моль/л (рН 7,0) для получения содержащих UGT-B рекомбинантных клеток для катализа.
Пример 2. Получение лиофилизированного порошка из UGT-B
Рекомбинантные клетки, содержащие UGT-B, полученные в примере 1, разрушали ультразвуком на ледяной бане; гомогенат центрифугировали (8000 об/мин, 10 мин); и супернатант собирали и лиофилизировали в течение 24 ч для получения лиофилизированного порошка UGT-B.
Пример 3. Синтез ребаудиозида J в условиях катализа UDP-гликозилтрансферазой с ребаудиозидом А в качестве субстрата
В данном примере для катализа и синтеза ребаудиозида J использовали лиофилизированный порошок UGT-B, полученный в соответствии со способом примера 2.
1 л фосфатного буферного раствора 0,05 моль/л (рН 8,0), 2 г UDP-рамнозы, 1 г ребаудиозида А, 10 г лиофилизированного порошка UGT-B последовательно добавляли в реакционную систему и после равномерного смешивания помещали на водяную баню при 40°С.Реакцию проводили при перемешивании при 300 об/мин в течение 24 часов. После завершения реакции 500 мкл реакционной смеси добавляли в безводный метанол равного объема для однородного смешивания; затем его центрифугировали при 8000 об/мин в течение 10 мин; и использовали высокоэффективную жидкостную хроматографию для обнаружения супернатанта после его фильтрации через мембрану для фильтрования (хроматографические условия: колонка: Agilent eclipse sb C18 4,6×150 мм; длина волны детектирования: 210 нм; подвижная фаза : ацетонитрил : деионизированная вода = 24% : 76%; объемный расход: 1,0 мл/мин; температура колонки: 30°С). Скорость преобразования ребаудиозида А составляла более 90%. После очистки супернатанта последующей обработкой, такой как выделение на силикагелевой смоле и кристаллизация, получили 0,52 г ребаудиозида J с чистотой свыше 95%.
Пример 4. Синтез ребаудиозида J в условиях катализа рекомбинантными клетками с UDP-гликозилтрансферазой с ребаудиозидом А в качестве субстрата
В данном примере для катализа и синтеза ребаудиозида J использовали содержащие UGT-B рекомбинантные клетки, полученные в соответствии со способом примера 1.
1 л фосфатного буферного раствора 0,05 моль/л (рН 8,0), 2 г UDP-рамнозы, 1 г ребаудиозида А, 20 мл толуола, 40 г целых клеток UGT-B последовательно добавляли в реакционную систему и после однородного смешивания помещали на водяную баню при 40°С.Реакцию проводили при перемешивании при 300 об/мин в течение 24 часов. После завершения реакции отбирали и центрифугировали 500 мкл реакционной смеси. К супернатанту добавляли безводный метанол равного объема для однородного смешивания; затем его центрифугировали при 8000 об/мин в течение 10 мин; и использовали высокоэффективную жидкостную хроматографию для обнаружения супернатанта после его фильтрации через мембрану для фильтрования (хроматографические условия: колонка: Agilent eclipse sb C18 4,6×150 мм; длина волны детектирования: 210 нм; подвижная фаза : ацетонитрил : деионизированная вода = 24% : 76%; объемный расход: 1,0 мл/мин; температура колонки: 30°С). Скорость преобразования ребаудиозида А составляла более 90%. После очистки супернатанта последующей обработкой, такой как выделение на силикагелевой смоле и кристаллизация, получили 0,49 г ребаудиозида J с чистотой свыше 95%.
Описанные выше примеры приведены только для иллюстрации технической концепции и признаков настоящего изобретения. Цель приведения примеров заключается только в том, чтобы дать возможность специалистам в данной области понять настоящее изобретение и реализовать его соответствующим образом; объем настоящего изобретения не ограничен ими. Любые эквивалентные вариации или модификации, производные от сущности настоящего изобретения, входят в объем защиты настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА C С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2736155C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА N С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2737118C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА M С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2013 |
|
RU2658436C2 |
| Способ получения ребаудиозида D и ребаудиозида M | 2022 |
|
RU2839979C2 |
| СПОСОБЫ И ВЕЩЕСТВА ДЛЯ ОСНОВАННОГО НА РЕКОМБИНАЦИИ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ШАФРАНА | 2012 |
|
RU2676730C2 |
| БИОСИНТЕТИЧЕСКОЕ ПОЛУЧЕНИЕ СТЕВИОЛОВОГО ГЛИКОЗИДА РЕБАУДИОЗИДА D4 ИЗ РЕБАУДИОЗИДА E | 2017 |
|
RU2764803C2 |
| UDP-ЗАВИСИМАЯ ГЛИКОЗИЛТРАНСФЕРАЗА ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОДУЦИРОВАНИЯ РЕБАУДИОЗИДОВ | 2017 |
|
RU2777901C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2706789C2 |
| ПРИМЕНЕНИЕ КАУРЕНОКСИДАЗЫ PISUM SATIVUM ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2018 |
|
RU2795550C2 |
| ГИДРОЛИЗ СТЕВИОЛОВЫХ ГЛИКОЗИДОВ С ПОМОЩЬЮ БЕТА-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2775697C2 |


Изобретение относится к области биотехнологии. Предложен способ получения ребаудиозида J с применением ферментативного способа, включающий использование ребаудиозида А в качестве субстрата и применение субстрата в присутствии донора рамнозила в реакции в условиях катализа содержащими UDP-гликозилтрансферазу рекомбинантными клетками и/или полученной из них UDP-гликозилтрансферазой. Изобретение позволяет получить ребаудиозид J высокой чистоты с меньшими затратами и более коротким циклом производства. 10 з.п. ф-лы, 4 пр.
1. Способ получения Ребаудиозида J с применением ферментативного способа, включающий реакцию ребаудиозида А в реакционной системе с донором гликозила в присутствии i) UDP-гликозилтрансферазы или ii) рекомбинантной клетки, содержащей UDP-гликозилтрансферазу, с образованием Ребаудиозида J, при этом UDP-гликозилтрансфераза в i) и ii) имеет аминокислотную последовательность SEQ ID NO: 2 и при этом донор гликозила представляет собой донор рамнозила.
2. Способ по п. 1, в котором донор рамнозила представляет собой UDP-рамнозу.
3. Способ по п. 1, в котором UDP-гликозилтрансфераза представляет собой UGT-B из Oryza sativa.
4. Способ по п. 1, в котором реакционная система содержит систему водной фазы с температурой 35-45°С и рН от 7,5 до 8,5.
5. Способ по п. 4, в котором система водной фазы представляет собой фосфатный буферный раствор.
6. Способ по п. 4, в котором реакционная система дополнительно содержит пермеабилизирующий клетку агент.
7. Способ по п. 6, в котором пермеабилизирующий клетку агент представляет собой толуол, и при этом толуол имеет объемную концентрацию 1-3%.
8. Способ по п. 1, в котором рекомбинантная клетка представляет собой клетку микроорганизма.
9. Способ по п. 8, в котором микроорганизм представляет собой Escherichia coli, Saccharomyces cerevisiae или Pichia pastoris.
10. Способ по п. 1, дополнительно содержащий очистку ребаудиозида J посредством выделения на смоле.
11. Способ по п. 10, в котором ребаудиозид J, очищенный посредством выделения на смоле, имеет чистоту более 95%.
| US 9243273 B2, 26.01.2016 | |||
| US 20160186225 A1, 30.06.2016 | |||
| CN 103397064 A, 20.11.2013 | |||
| WO 2015113231 А1, 06.08.2015 | |||
| РЕБАУДИОЗИД D ВЫСОКОЙ СТЕПЕНИ ЧИСТОТЫ И ЕГО ПРИМЕНЕНИЕ | 2010 |
|
RU2596190C9 |
Авторы
Даты
2020-11-16—Публикация
2016-10-21—Подача