Область техники
Настоящая заявка относится к способам получения ребаудиозида D и ребаудиозида М посредством реакции с использованием уридиндифосфат(UDP)-гликозилтрансфераз; и композициям для получения ребаудиозида D и ребаудиозида М, содержащим уридиндифосфат(UDP)-гликозилтрансферазы.
Предшествующий уровень техники
Поскольку Всемирная организация здравоохранения (ВОЗ) рекомендует понизить количество ежедневного потребления сахара из-за опасений по поводу заболевания (ожирения), вызванного потреблением сахара, правительства развитых стран активно обсуждают различные меры политики, направленные на снижение потребления сахара. Таким образом, поскольку на рынке растет потребность в разработке различных альтернативных подсластителей вместо сахара и продуктов с высоким содержанием фруктозы, постоянно разрабатывают и коммерциализируют альтернативные подсластители.
Альтернативные подсластители являются предметом постоянных изменений в форме синтетических высокоинтенсивных подсластителей (например сахарина, аспартама, сукралозы и т.д.), синтетических сахарных спиртов (например мальтита и ксилита) и высокоинтенсивных подсластителей (например ребаудиозида А и лакрицы). Тем не менее, из-за опасений по поводу безопасности синтетических подсластителей потребность потребителей в натуральных подсластителях неуклонно растет; однако из-за ограничений, связанных со специфическими вкусовыми свойствами натуральных подсластителей (т.е. неприятного запаха и привкуса), натуральные подсластители не могут полностью заменить существующие низкокалорийные продукты и продукты с нулевой калорийностью на основе синтетических подсластителей.
Натуральный высокоинтенсивный подсластитель, которому в последние годы уделяется значительное внимание, представляет собой стевию, экстрагированную из листьев стевии. Стевия потенциально может использоваться в качестве альтернативного подсластителя, поскольку сообщалось, что она не генерирует калории, положительно влияет на уровень глюкозы и инсулина в крови и не оказывает побочных эффектов на организм человека; однако стевия имеет ограничения в применении для уменьшения количества сахара, поскольку она имеет горький вкус.
Стевия представляет собой многолетнее растение семейства Asteraceae, произрастающее в Парагвае, Южной Америке, и его научное название - Stevia rebaudiana Bertoni. Листья стевии содержат подслащивающие компоненты, сладость которых в 200-300 раз выше сахара, и эти подслащивающие компоненты экстрагируют и используют в качестве натурального подсластителя. Подслащивающие компоненты экстрактов стевии содержат различные стевиоловые гликозиды, такие как стевиозид, ребаудиозид А, ребаудиозид С, ребаудиозид D, ребаудиозид М, ребаудиозид I и ребаудиозид Е и т.д.
Листья стевии содержат относительно высокие содержания стевиозида (STV), ребаудиозида A (Reb А) и ребаудиозида С (Reb С) среди подслащивающих компонентов экстракта стевии, и, таким образом, был начат выпуск экстрагированных и очищенных промышленных продуктов высокой чистоты, но они имеют ограничение в использовании для снижения количества сахара из-за горького вкуса.
Между тем, ребаудиозид D (Reb D) и ребаудиозид М (Reb М) имеют менее горький вкус, чем STV, ребаудиозид А и ребаудиозид С, и обладают превосходными подслащивающими свойствами и, таким образом, являются очень ценными в качестве альтернативных подсластителей. Однако ребаудиозид D и ребаудиозид М присутствуют в листьях стевии лишь в очень небольших количествах, что является недостатком, заключающимся в том, что способ экстракции и очистки ребаудиозида D и ребаудиозида М из листьев и их производство требует больших затрат.
Литература из предшествующего уровня техники
Патентная литература
(Патентная литература 0001) корейский патент №1404728.
Описание изобретения
Техническая проблема
В результате интенсивных усилий по разработке фермента, который обладает активностью превращения ребаудиозида А в ребаудиозид D, заявитель настоящего изобретения обнаружил, что полипептидная последовательность, гликозилтрансферазная активность которой ранее была неизвестна, обладает гликозилтрансферазной активностью, и завершил эту заявку, подтвердив, что данный полипептид обладает гликозилтрансферазной активностью, обеспечивающей превращение ребаудиозида А в ребаудиозид D.
Техническое решение
Одной из задач настоящей заявки является предложение способа получения ребаудиозида D, включающего: взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) с получением ребаудиозида D, где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Другой задачей настоящей заявки является предложение способа получения ребаудиозида М, включающего: взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) с получением ребаудиозида D; и взаимодействие ребаудиозида D с нуклеотиддифосфатом, с которым связана глюкоза, в присутствии уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) с получением ребаудиозида М, где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Еще одной задачей настоящей заявки является предложение способа получения ребаудиозида D из ребаудиозида А, включающего: взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, сахарозосинтазы и уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) in situ с получением ребаудиозида D.
Еще одной задачей настоящей заявки является предложение способа получения ребаудиозида М из ребаудиозида А, включающего: взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, ребаудиозида D, сахаросинтазы, уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A). и уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) in situ для получения ребаудиозида М.
Еще одной задачей настоящей заявки является предложение композиции для получения ребаудиозида D, включающей уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B).
Кроме того, еще одной задачей настоящей заявки является предложение композиции для получения ребаудиозида М, включающей уридиндифосфат(UDP)-гликозилтрансферазу A (UGT-A).
Кроме того, еще одной задачей настоящей заявки является предложение применения уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) для превращения ребаудиозида А в ребаудиозид D, где уридиндидифосфат (UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Положительные эффекты
Способ получения ребаудиозида D и ребаудиозида М с использованием уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) согласно настоящей заявке может обеспечить получение ребаудиозида D и ребаудиозида М высокой чистоты и с высоким выходом, практически без побочных продуктов и, таким образом, может эффективно использоваться для массового производства ребаудиозида D и ребаудиозида М, поскольку он является экономичным за счет использования недорогого сырья, и процедура является простой и занимает меньше времени. Краткое описание графических материалов
На Фиг. 1 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид А превращается в ребаудиозид D при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_6).
На Фиг. 2 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид А превращается в ребаудиозид D, изомер ребаудиозида D и изомер ребаудиозида М при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_7).
На Фиг. 3 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид А превращается в ребаудиозид D при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_8).
На Фиг. 4 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид D, ребаудиозид М, ребаудиозид I и ребаудиозид А образуются из стевиозида при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_6), уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) и сахарозосинтазы.
На Фиг. 5 представлен результат анализа ВЭЖХ, показывающий, что изомер ребаудиозида М, ребаудиозид D, ребаудиозид М, ребаудиозид I и ребаудиозид А получают из стевиозида при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_7), уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) и сахарозосинтазы.
На Фиг. 6 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид D, ребаудиозид М, ребаудиозид I и ребаудиозид А получают из стевиозида при помощи уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_8), уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) и сахарозосинтазы.
На Фиг. 7 представлен результат анализа ВЭЖХ, показывающий, что ребаудиозид D превращается в ребаудиозид М при помощи уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A).
На Фиг. 8 представлен результат анализа LC-MS/MS (жидкостная хроматография и масс-спектрометрии) изомера ребаудиозида D.
На Фиг. 9 представлен результат анализа LC-MS/MS ребаудиозида D.
На Фиг. 10 представлен результат анализа LC-MS/MS изомера ребаудиозида М.
На Фиг. 11 представлен результат анализа LC-MS/MS ребаудиозида М.
Подробное описание предпочтительных воплощений
Настоящая заявка будет описана подробно следующим образом. При этом, каждое описание и воплощение, раскрытое в настоящем документе, могут быть применены к другим описаниям и воплощениям, соответственно. То есть все комбинации различных элементов, раскрытые здесь, входят в объем настоящей заявки. Кроме того, объем настоящей заявки не ограничен конкретным описанием, приведенным ниже. Кроме того, в настоящем описании указан ряд статей и патентных документов. Содержание указанных статей и патентных документов включено в данное описание посредством ссылки во всей своей полноте, и уровень технической области, к которой относится настоящая заявка, и содержание настоящей заявки будут описаны более подробно.
Один аспект настоящей заявки представляет способ получения ребаудиозида D, включающий: взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) с получением ребаудиозида D, где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-В) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, имеющих аминокислотные последовательности SEQ ID NO: 1-3.
В настоящем документе термин "уридиндифосфат(UDP)-гликозилтрансфераза (UGT)" представляет собой фермент, который катализирует перенос моносахаридной группы от гликозильного донора к гликозильной акцепторной молекуле, и, в частности, он относится к ферменту, который использует UDP-caxap в качестве гликозильного донора. В настоящей заявке UDP-гликозилтрансфераза может использоваться взаимозаменяемо с UGT.
UDP-гликозилтрансфераза может быть получена из рекомбинантных Е. coli, Bacillus, дрожжей, Corynebacterium или Agrobacterium, трансформированных вектором, содержащим ген гликозилтрансферазы, и UDP-гликозилтрансфераза может быть дополнительно очищена после получения из Е. coli или тому подобного, или может быть приобретен и использован коммерчески производимый продукт, но UDP-гликозилтрансфераза этим не ограничивается. Кроме того, UDP-гликозилтрансфераза известна в данной области техники, и белок и последовательность гена UDP-гликозилтрансферазы можно получить из известной базы данных, например GenBank NCBI и т.д., но без ограничения этим.
В настоящей заявке было впервые обнаружено, что новая уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), которая представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3, обладает ферментативной активностью по превращению ребаудиозида А в ребаудиозид D, тем самым обеспечивая новое применение UGT-B.
В частности, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) по настоящей заявке может иметь и/или включать аминокислотную последовательность SEQ ID NO: 1, аминокислотную последовательность SEQ ID NO: 2 или аминокислотную последовательность SEQ ID NO: 3, или по существу состоять или состоять из этих аминокислотных последовательностей.
Кроме того, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может включать аминокислотную последовательность, имеющую гомологию или идентичность, составляющую по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,7% или 99,9% или более с аминокислотной последовательностью SEQ ID NO: 1, с аминокислотной последовательностью SEQ ID NO: 2, или с аминокислотной последовательностью SEQ ID NO: 3. Кроме того, очевидно, что любая уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), имеющая аминокислотную последовательность, в которой часть последовательности удалена, модифицирована, заменена, консервативно заменена или добавлена, также может входить в объем настоящей заявки при условии, что аминокислотная последовательность имеет такую гомологию или идентичность и проявляет эффект, соответствующий эффекту уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B).
В контексте настоящего документа, хотя он описан как "полипептид или белок, включающий аминокислотную последовательность, описанную конкретным номером последовательности", "полипептид или белок, состоящий из аминокислотной последовательности, описанной конкретным номером последовательности" или "полипептид или белок, имеющий аминокислотную последовательность, описанную конкретным номером последовательности", очевидно, что любой белок, имеющий аминокислотную последовательность, в которой часть последовательности удалена, модифицирована, заменена, консервативно заменена или добавлена, может быть использован в настоящей заявке, при условии, даже если он имеет ту же или соответствующую активность, что и полипептид, состоящий из аминокислотной последовательности с соответствующим номером последовательности. Например, это может быть случай, когда к N-концу и/или С-концу аминокислотной последовательности добавлена последовательность, которая не изменяет функцию белка, естественная мутация, его потенциальная мутация (молчащая мутация) или консервативная замена.
Например, это может быть случай, когда к N-концу, С-концу и/или во внутреннюю часть аминокислотной последовательности добавляют или их них удаляют последовательности, которые не изменяют функцию уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) согласно настоящей заявки, возникающую в природе мутацию, его потенциальную мутацию (молчащую мутацию) или консервативную замену.
Используемый здесь термин "консервативная замена" относится к замене аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства. Такая аминокислотная замена обычно может происходить на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатка. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; ароматические аминокислоты включают фенилаланин, триптофан и тирозин; и гидрофобные аминокислоты включают аланин, валин, изолейцин, лейцин, метионин, фенилаланин, тирозин и триптофан. Кроме того, аминокислоты можно разделить на аминокислоты с электрически заряженными боковыми цепями и аминокислоты с незаряженными боковыми цепями, и примеры аминокислот с электрически заряженными боковыми цепями включают аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин и гистидин. Аминокислоты с незаряженными боковыми цепями можно дополнительно разделить на неполярные аминокислоты или полярные аминокислоты. Примерами неполярных аминокислот являются глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, и примеры полярных аминокислот включают серии, треонин, цистеин, тирозин, аспарагин и глутамин. Обычно консервативные замены незначительно влияют или не влияют на активность полученного полипептида. Как правило, консервативные замены могут оказывать незначительное влияние или не влиять на активность белка или полипептида.
Кроме того, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) также может включать удаление или добавление аминокислот, которые оказывают минимальное влияние на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце, участвующей в котрансляционном или посттрансляционном переносе белков. Кроме того, полипептид также может быть конъюгирован с другой последовательностью или линкером для идентификации, очистки или синтеза полипептида.
Используемый здесь термин "гомология" или "идентичность" относится к степени родства двух заданных аминокислотных последовательностей или нуклеотидных последовательностей и она может быть выражена в процентах. Термины "гомология" и "идентичность" часто могут использоваться взаимозаменяемо.
Гомология или идентичность последовательностей консервативных полинуклеотидных или полипептидных последовательностей может быть определена с помощью стандартных алгоритмов выравнивания и может использоваться со штрафом за пропуск по умолчанию, установленным используемой программой. По существу, обычно ожидается, что гомологичные или идентичные последовательности будут гибридизоваться со всеми последовательностями или с их частью в условиях умеренной или высокой жесткости. Очевидно, что гибридизация с полинуклеотидами, содержащими общий кодон или вырожденные кодоны в гибридизующихся полинуклеотидах, также включена.
Обладают ли какие-либо две полинуклеотидные или полипептидные последовательности гомологией, сходством или идентичностью, можно, например, определить с помощью известного компьютерного алгоритма, такого как программа «FASTA» (Pearson et al., (1988) Proc. Natl. Acad. Sci. USA 85:2444) с использованием параметров по умолчанию. Альтернативно это можно определить с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), который выполняют с использованием программы Нидлмана пакета EMBOSS (EMBOSS: The European Molecular Biology). Open Software Suite, Rice et al., 2000, Trends Genet 16:276-277) (предпочтительно версия 5.0.0 или выше) (пакет программ GCG). (Devereux, J. et al., Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S. F. et al., J MOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994, and CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, гомология, сходство или идентичность могут быть определены с использованием BLAST или ClustalW Национального центра биотехнологической информации (NCBI).
Гомология, сходство или идентичность полинуклеотидов или полипептидов может быть определена, например, путем сравнения информации о последовательностях с использованием, например, компьютерной программы GAP, такой как Needleman et al. (1970), J Mol Biol. 48:443, как раскрыто в Smith and Waterman, Adv. Appl. Math (1981) 2:482. Кратко, программа GAP определяет гомологию, сходство или идентичность, как значение, полученное путем деления количества одинаково выровненных символов (т.е. нуклеотидов или аминокислот) на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать 1) унарную матрицу сравнения (содержащую значение 1 для идентичностей и 0 для неидентичностей) и взвешенную матрицу сравнения Gribskov et al. (1986), Nucl. Acids Res. 14:6745, как раскрыто в Schwartz and Dayhoff, eds., Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (или EDNAFULL матрица замены (EMBOSS версия NCBI NUC4.4)); (2) штраф 3,0 за каждый пробел и дополнительный штраф 0,10 за каждый символ в каждом пробеле (или штраф за открытие пробела 10 и штраф за продление пробела 0,5); и (3) отсутствие штрафов за пробелы на концах.
В одном примере настоящей заявки уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может обладать активностью превращения ребаудиозида А в ребаудиозид D.
В настоящем документе термин "соответствующий" относится к аминокислотному остатку в положении, указанном в пептиде, или к аминокислотному остатку, который подобен, идентичен или гомологичен остатку, указанному в пептиде. Идентификация аминокислоты в соответствующем положении может означать определение конкретной аминокислоты в последовательности, которая относится к конкретной последовательности. Используемый здесь термин "соответствующая область" обычно относится к аналогичному или соответствующему положению в родственном белке или эталонном белке.
Например, какая-то аминокислотная последовательность выровнена с SEQ ID NO: 1, и на основании этого выравнивания каждый аминокислотный остаток аминокислотной последовательности может быть пронумерован со ссылкой на числовое положение аминокислотного остатка, соответствующего аминокислотному остатку в SEQ ID NO: 1. Например, алгоритм выравнивания последовательностей, такой, как описано в настоящем документе, может идентифицировать положение аминокислоты или положение, в котором происходят модификации, такие как замены, вставки или делеции, по сравнению с запрашиваемой последовательностью (также называемой "эталонной последовательностью").
Пример выравнивания может быть определен с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), который выполняют с помощью программы Needleman из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277), и т.д., но не ограничивается этим, и можно соответствующим образом использовать программы выравнивания последовательностей, такие как алгоритмы парного сравнения последовательностей и т.д., известные в данной области техники.
Кроме того, полинуклеотид, кодирующий уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B) по настоящему изобретению, представляет собой не только нуклеотидную последовательность, кодирующую аминокислоты, представленные каждой SEQ ID NO, указанной выше, но также включена без ограничения нуклеотидная последовательность, имеющая гомологию 80% или более, предпочтительно 90% или более, более предпочтительно 95% или более, еще более предпочтительно 98% или более, и наиболее предпочтительно 99% или более с указанной выше последовательностью и с любой последовательностью гена, кодирующего белок, проявляющий ту же или соответствующую эффективность, что и каждый из вышеуказанных белков. Кроме того, очевидно, что любая нуклеотидная последовательность, в которой часть последовательности удалена, модифицирована, заменена или добавлена, также может входить объем настоящей заявки, при условии, что эта нуклеотидная последовательность имеет такую гомологию.
В настоящем документе термин "полинуклеотид", который представляет собой полимер из нуклеотидов, состоящий из нуклеотидных мономеров, соединенных в длинную цепь ковалентной связью, представляет собой цепь ДНК или РНК, имеющую по меньшей мере определенную длину. Более конкретно, он может относиться к фрагменту полинуклеотида, кодирующему уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B).
Полинуклеотид, кодирующий уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B) по настоящему изобретению, может включать нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3. В качестве примера настоящего изобретения, полинуклеотид может иметь или включать последовательность SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8. Кроме того, полинуклеотид может состоять или по существу состоять из последовательности SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8.
Полинуклеотид по настоящему изобретению может подвергаться различным модификациям в кодирующей области в объеме, который не меняют аминокислотную последовательность уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) по настоящему изобретению, вследствие вырожденности кодонов или с учетом кодонов, предпочтительных в организме, в котором должна экспрессироваться уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) по настоящему изобретению. В частности, полинуклеотид по настоящему изобретению может иметь или включать нуклеотидную последовательность, имеющую гомологию или идентичность, составляющую 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 96% или более, 97% или более, 98% или более и 100% или менее с последовательностью SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8, или может состоять или состоять по существу из нуклеотидной последовательности, имеющей гомологию или идентичность, составляющую 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 96% или более, 97% или более, 98% или более и 100% или менее с последовательностью SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8, но не ограничивается этим.
Кроме того, полинуклеотид по настоящему изобретению может включать зонд, который может быть получен из известной последовательности гена, например любой последовательности, которая может гибридизоваться с последовательностью, комплементарной всей или части полинуклеотидной последовательности по настоящему изобретению, в жестких условиях без ограничения. "Жесткие условия" относятся к условиям, в которых допускается специфическая гибридизация между полинуклеотидами. Такие условия конкретно описаны в литературе (J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F. M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York, 9.50-9.51, 11.7-11.8). Например, жесткие условия могут включать условия, в которых гены, имеющие высокую гомологию и идентичность, составляющую 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 95% или более, 96% или более, 97% или более, 98% или более или 99% или более гибридизуются друг с другом, и гены, имеющие гомологию или идентичность, которая ниже, чем вышеуказанные гомологии или идентичности, не гибридизуются друг с другом, или в условиях промывки Саузерн-гибридизации, то есть промывки один раз, особенно два или три раза с концентрацией соли и температурой, соответствующими 60°С, 1×SSC (цитратно-солевой буфер), 0,1% SDS (додецилсульфат натрия), конкретно 60°С, 0,1×SSC, 0,1% SDS и более конкретно 68°С, 0,1×SSC, 0,1% SDS.
Для гибридизации требуется, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя возможны несоответствия между основаниями в зависимости от жесткости гибридизации. Термин "комплементарный" используется для описания взаимоотношения между нуклеотидными основаниями, которые могут гибридизоваться друг с другом. Например, по отношению к ДНК, аденин комплементарен тимину и цитозин комплементарен гуанину. Следовательно, полинуклеотид по настоящей заявке может включать выделенные нуклеотидные фрагменты, комплементарные всей последовательности, а также последовательности нуклеиновой кислоты, по существу подобные им.
В частности, полинуклеотиды, имеющие гомологию или идентичность с полинуклеотидом по настоящей заявке, могут быть обнаружены при использовании условий гибридизации, включающих стадию гибридизации при значении Tm 55°С в описанных выше условиях. Кроме того, значение Tm может составлять 60°С, 63°С или 65°С, но не ограничивается этим, и может быть соответствующим образом подобрано специалистами в данной области техники в зависимости от цели.
Подходящая жесткость для гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементации, и эти переменные хорошо известны в данной области техники (например, Sambrook et al).
В одном воплощении настоящей заявки нуклеотиддифосфат, с которым связана глюкоза, может быть получен путем взаимодействия сахарозы и нуклеотиддифосфата в присутствии сахарозосинтазы, но не ограничивается этим.
В настоящем документе термин "сахарозосинтаза" играет роль в получении сахарозы путем обратимого переноса глюкозы, которая связана с нуклеотиддифосфатом, к фруктозе при метаболизме растений. В настоящем изобретении сахарозосинтаза демонстрирует активность разделения нуклеотиддифосфата, с которым связана глюкоза, и фруктозы путем взаимодействия сахарозы и нуклеотиддифосфата в диапазоне рН 5-10.
Сахарозосинтаза может быть получена из риса, кукурузы, пшеницы, бамбука, Arabidopsis thaliana, травы, ячменя, сорго или картофеля. Предпочтительно сахарозосинтазу получают из риса, кукурузы, пшеницы или ячменя, и более предпочтительно из риса, в частности Oryza sativa. Сахарозосинтаза может быть получена из рекомбинантных Escherichia coli, Bacillus, дрожжей, Corynebacterium или Agrobacterium, трансформированных вектором, содержащим ген сахарозосинтазы, и может быть дополнительно очищена после ее получения из Escherichia coli и т.п. Сахарозосинтаза может быть известна в данной области техники или может быть коммерчески приобретена, но не ограничивается этим.
В частности, сахарозосинтаза по настоящей заявке может иметь и/или включать аминокислотную последовательность SEQ ID NO: 5 или может состоять или по существу состоять из этой аминокислотной последовательности.
Сахароза конкретно не ограничена при условии, что она может служить субстратом для сахарозосинтазы, чтобы обеспечить глюкозу для нуклеотиддифосфата. Примеры сахарозы могут включать сахар-сырец или сахар, без ограничений.
В настоящей заявке в качестве нуклеотиддифосфата можно использовать пуриновый нуклеотид или пиримидиновый нуклеотид. Предпочтительно, в качестве нуклеотиддифосфата используют уридиндифосфат, но нуклеотиддифосфат не ограничен этим.
Нуклеотиддифосфат, с которым связана глюкоза, может быть подвергнут взаимодействию с ребаудиозидом А с получением ребаудиозида D с помощью уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) по настоящей заявке.
В одном воплощении настоящей заявки ребаудиозид А можно получить путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, со стевиозидом в присутствии уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A), без ограничения этим.
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может производить ребаудиозид А путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, со стевиозидом.
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может быть получена из Oryza sativa, Stevia rebaudiana Bertoni, Bambusa oldhamii, Brachypodium distachyon, Hordeum vulgare, Sorghum bicolor, Zea mays или Arabidopsis thaliana. Предпочтительно, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может быть получена из Oryza sativa, Stevia rebaudiana Bertoni или Bambusa oldhamii. Более предпочтительно, когда она может быть получена из Stevia rebaudiana Bertoni. Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может быть получена из рекомбинантных Escherichia coli, Bacillus, дрожжей, Corynebacterium или Agrobacterium, трансформированных вектором, содержащим ген гликозилтрансферазы, или может быть дополнительно очищена после получения из Escherichia coli и тому подобного. Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может быть известна в данной области техники или может быть приобретена коммерчески, но не ограничивается этим.
В частности, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) по настоящей заявке может иметь и/или включать аминокислотную последовательность SEQ ID NO: 4 или может состоять или по существу состоять из этой аминокислотной последовательности.
Стевиозид представляет собой экстракт Stevia rebaudiana, полученный с помощью горячей воды или водного раствора этанола, или очищенное из него вещество, или побочный продукт после получения ребаудиозида А из экстракта. Стевиозидами могут быть те, которые имеют содержание стевиозида 10% масс. или более, предпочтительно 50% масс. или более, особенно предпочтительно 70% масс. или более, и еще более предпочтительно 80% масс. или более, в расчете на общую массу стевиолгликозида, но не ограничиваются этим.
В одном воплощении настоящего изобретения ребаудиозид D может быть получен, как показано ниже в химической реакции 1, но не ограничивается этим.
Химическая реакция 1

В частности, способ получения может быть последовательно осуществлен in situ.
Используемый здесь термин "in situ" означает, что реакцию последовательно осуществляют в одной реакционной системе.
Способ получения по настоящему изобретению представляет собой последовательную реакционную систему, в которой одна глюкоза специфически связывается с положением С-3' стевиозида-13-О-глюкозы с синтезом ребаудиозида А с высоким выходом, а ребаудиозид D синтезируется из ребаудиозида А в соответствии с химической реакцией 1 выше.
В одном воплощении настоящего изобретения, без ограничения этим, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 2, и может быть дополнительно получен изомер ребаудиозида D.
Например, ребаудиозид D может иметь следующую структуру, но не ограничивается ею:
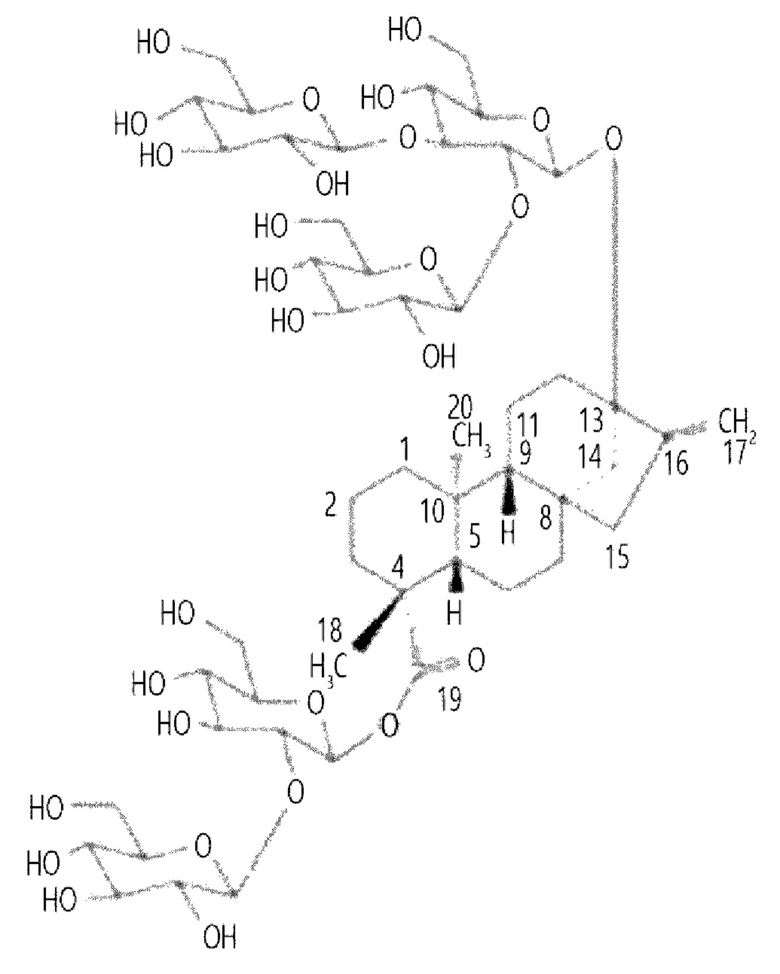
В другом аспекте настоящего изобретения предложен способ получения ребаудиозида М, включающий: взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) с получением ребаудиозида D; и
взаимодействие ребаудиозида D с нуклеотиддифосфатом, с которым связана глюкоза, в присутствии уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) с получением ребаудиозида М,
где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Нуклеотиддифосфат, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), ребаудиозид А и ребаудиозид D являются такими, как описано выше.
В одном воплощении настоящего изобретения, нуклеотиддифосфат, с которым связана глюкоза, может быть получен путем взаимодействия сахарозы с нуклеотиддифосфатом в присутствии сахарозосинтазы, как показано в Химической реакции 1 выше, но не ограничивается этим.
В частности, сахарозосинтаза по настоящему изобретению может иметь и/или включать аминокислотную последовательность SEQ ID NO: 5 или может состоять или по существу состоять из этой аминокислотной последовательности.
В одном воплощении настоящего изобретения ребаудиозид А может быть получен путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, со стевиозидом в присутствии уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A), как показано в Химической реакции 1 выше, но не ограничивается этим.
В частности, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) по настоящему изобретению может иметь и/или включать аминокислотную последовательность SEQ ID NO: 4 или может состоять или по существу состоять из этой аминокислотной последовательности.
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) по настоящему изобретению может продуцировать ребаудиозид М путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом D.
В частности, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) по настоящему изобретению может иметь и/или включать аминокислотную последовательность SEQ ID NO: 4 или может состоять или по существу состоять из аминокислотной последовательности.
В одном воплощении настоящего изобретения, ребаудиозид М может быть получен, как показано ниже в Химической реакции 2, но не ограничивается этим.
Химическая реакция 2
В частности, способ получения может быть осуществлен последовательно in situ.
Способ получения по настоящему изобретению предлагает последовательную реакционную систему, в которой ребаудиозид А синтезируется из стевиозида с высоким выходом, ребаудиозид D синтезируется из ребаудиозида А, и ребаудиозид М синтезируется из ребаудиозида D в соответствии с химической реакцией 2, приведенной выше.
Соответственно, в способе получения по настоящему изобретению используют такие сырьевые материалы, как стевиозид и ребаудиозид А, которые являются недорогими и их можно легко получить, а также можно превратить стевиозид и ребаудиозид А, которые представляют собой горькие компоненты, содержащиеся в экстракте стевии, в ребаудиозид D и ребаудиозид М, которые представляют собой компоненты с превосходным вкусом и, таким образом, могут быть эффективно использованы в производстве подсластителя стевии с отличными подслащивающими свойствами.
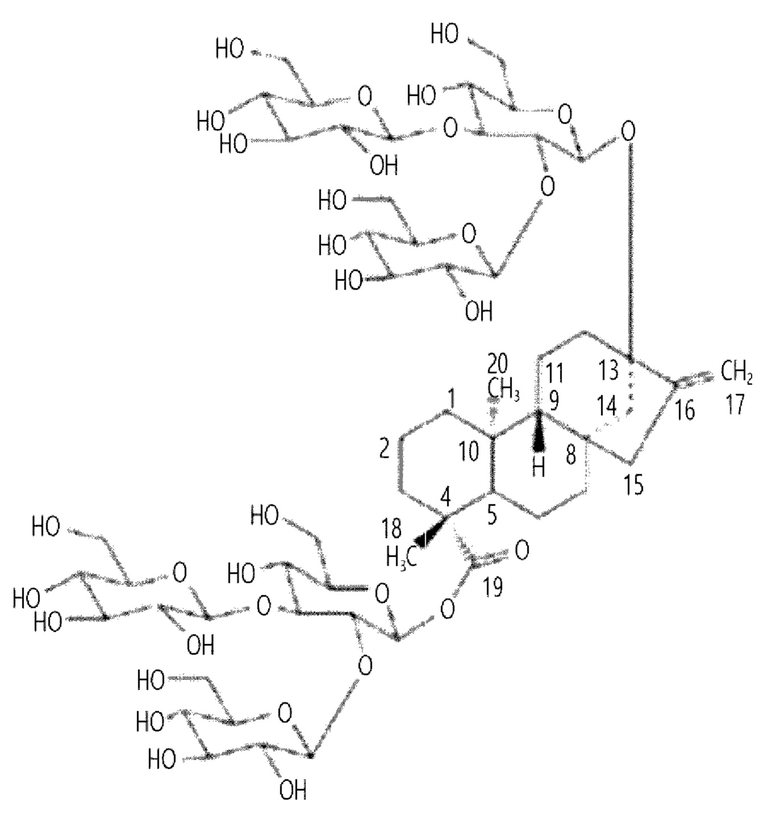
В одном воплощении настоящего изобретения уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 2, и дополнительно может быть получен изомер ребаудиозида М, без ограничения этим.
Например, ребаудиозид М может иметь следующую структуру, без ограничения ею:
В еще одном аспекте по настоящему изобретению предложен способ получения ребаудиозида D из ребаудиозида А, включающий: взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, сахарозосинтазы и уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) in situ с получением ребаудиозида D,
где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Сахароза, нуклеотиддифосфат, ребаудиозид А, сахарозосинтаза, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), ребаудиозид D и in situ являются такими, как описано выше.
В одном воплощении настоящего изобретения, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 2, и может быть дополнительно получен изомер ребаудиозида D, без ограничения этим.
В еще одном аспекте настоящего изобретения предложен способ получения ребаудиозида М из ребаудиозида А, включающий: взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, ребаудиозида D, сахарозосинтазы, уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) и уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) in situ с получением ребаудиозида М,
где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Сахароза, нуклеотиддифосфат, ребаудиозид А, ребаудиозид D, сахарозосинтаза, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A), уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), in situ и ребаудиозид М являются такими, как описано выше.
В частности, уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4, но не ограничивается им.
В одном воплощении настоящего изобретения, уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 2, и может быть дополнительно получен изомер ребаудиозида М, но без ограничения этим.
В еще одном аспекте настоящего изобретения предлагается композиция для получения ребаудиозида D, включающая уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B), где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, имеющих аминокислотные последовательности SEQ ID NO: 1-3.
Уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) и ребаудиозид D являются такими, как описано выше.
В одном воплощении настоящего изобретения уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3, и ребаудиозид D может быть по меньшей мере одним, выбранным из группы, состоящей из ребаудиозида D и изомера ребаудиозида D, но они не ограничивается этим.
В еще одном аспекте по настоящему изобретению предлагается композиция для получения ребаудиозида М, включающая уридиндифосфат(UDP)-гликозилтрансферазу А (UGT-A) и уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B), где уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4, и уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотной последовательности SEQ ID NO: 1-3.
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A), уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) и ребаудиозид М являются такими, как описаны выше.
В одном воплощении настоящего изобретения уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3, и ребаудиозид M может быть по меньшей мере одним, выбранным из группы, состоящей из ребаудиозида М и изомера ребаудиозида М, но они не ограничиваются этим.
Композиция по настоящему изобретению может дополнительно включать любой подходящий эксципиент, обычно используемый в композиции для получения аминокислот, и такой эксципиент может представлять собой, например, консервант, увлажняющий агент, диспергирующий агент, суспендирующий агент, буферный агент, стабилизатор или изотонический агент, но не ограничивается ими.
В еще одном аспекте настоящего изобретения предлагается применение уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) для превращения ребаудиозида А в ребаудиозид D, где уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B) представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белков, состоящих из аминокислотных последовательностей SEQ ID NO: 1-3.
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A), уридиндифосфат(UDP)-гликозилтрансфераза В (UGT-B), ребаудиозид А, ребаудиозид М и т.д., являются такими, как описано выше.
Способ осуществления изобретения
Ниже настоящая заявка будет подробно описана посредством примеров. Однако эти примеры являются всего лишь предпочтительными примерами, приведенными в иллюстративных целях, и, таким образом, объем настоящего изобретения не предполагается ограничивать этими примерами. При этом, технические признаки, которые не описаны здесь, могут быть в достаточной степени поняты и легко реализованы специалистами в области техники в технической области настоящего изобретения или в аналогичной технической области.
Пример 1. Условия культивирования
Рекомбинантный микроорганизм был получен путем введения полинуклеотида, кодирующего уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B) по настоящему изобретению, и затем использован во взаимодействии после экспрессии уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B). Условия культивирования рекомбинантного микроорганизма являются следующими.
Пример 1-1. Условия культивирования Е. coli
Рекомбинантную E.coli культивировали следующим образом: в пробирку, содержащую 5 мл среды LB, содержащей канамицин в концентрации 50 мкг/мл, инокулировали рекомбинантную E.coli с последующим культивированием в инкубаторе при 37°С, пока поглощение при 600 нм не стало 2,0. Посевной культуральный раствор добавляли в колбу, содержащую 500 мл среды LB, содержащей канамицин в концентрации 50 мкг/мл, и затем культивировали. Затем добавляли 0,1 мМ IPTG (изопропил-β-D-1-тиогалактиопиранозид) и культивировали до тех пор, пока поглощение при 600 нм не становилось равным 0,4, тем самым индуцируя массовую экспрессию ферментов. Условия культивирования регулировали так, что скорость перемешивания составляла 180 об/мин и температура культуры составляла 37°С во время процедуры, и скорость перемешивания была равна 120 об/мин после добавления IPTG.
Пример 1-2. Условия культивирования Corynebacteria
Рекомбинантные Corynebacteria инокулировали в среду (Бакто-Триптон 10 г/л, Бакто-дрожжевой экстракт 5 г/л, NaCl 5 г/л, Soytone 5 г/л), содержащую канамицин в концентрации 10 мкг/мл, с исходной концентрацией O.D.600=0,1, и культивировали при 30°С в течение 24 часов для индукции экспрессии фермента. Полученный таким образом культуральный раствор инокулировали в ферментер, содержащий среду (глюкоза 80 г/л, soytone 20 г/л, (NH4)2SO4 10 г/л, KH2PO4 1,2 г/л, MgSO4 1,4 г/л), содержащую канамицин в концентрации 10 мкг/мл с O.D.600=0,6 и культивировали при 30°С в течение 24 часов.
Пример 2. Измерение ферментативной активности уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) для ребаудиозида А в качестве сырья
Пример 2-1. Очистка уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-В)
Для уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) (UGT-B; SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 3) по настоящему изобретению, которая превращает ребаудиозид А в ребаудиозид D, каждую рекомбинантную плазмиду (вектор-рЕТ28а), содержащую ген (SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8), кодирующий уридиндифосфат(UDP)-гликозилтрансферазу В (UGT-B), получали и клонировали в E.coli BL21 (DE3) для индукции массовой экспрессии каждого фермента, а затем ферменты очищали и использовали.
В частности, в пробирку, содержащую 5 мл среды LB, инокулировали рекомбинантный штамм BL21(DE3) с последующим культивированием посевного материала в инкубаторе при 37°С до тех пор, пока поглощение при 600 нм не стало 2,0. Раствор с посевной культурой добавляли в колбу, содержащую 500 мл среды LB, и затем культивировали. Затем добавляли 0,1 мМ IPTG (изопропил-β-D-1-тиогалактиопиранозид) до тех пор, пока поглощение при 600 нм не становилось равным 0,4, тем самым индуцируя тем самым массовую экспрессию ферментов. Условия культивирования регулировали так, чтобы скорость перемешивания составляла 180 об/мин и температура культуры составляла 37°С во время процедуры, и скорость перемешивания составляла 120 об/мин и температура культуры составляла 16°С после добавления IPTG. Раствор культуры трансформированного штамма центрифугировали при 6000g при 4°C в течение 20 минут для отделения клеточного супернатанта в виде раствора фермента. Чтобы точно определить свойства ферментов, раствор фермента очищали с использованием колонки Ni-NTA Superflow.
Каждый фермент, массово экспрессируемый с использованием рекомбинантной плазмиды, содержащей SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8, был назван UGT-B_6, UGT-B_7 и UGT-B_8 соответственно.
Между тем, рекомбинантную культуру Corynebacteria инокулировали в среду (Бакто-Триптон 10 г/л, Бакто-дрожжевой экстракт5 г/л, NaCl 5 г/л, Soytone 5 г/л), содержащую канамицин в концентрации 10 мкг/мл с начальной концентрацией OD600=0,1 и культивировали при 30°С в течение 24 часов для индукции экспрессии фермента. Полученный таким образом раствор культуры инокулировали в ферментер, содержащий среду (глюкоза 80 г/л, soytone 20 г/л, (NH4)2SO4 10 г/л, KH2PO4 1,2 г/л, MgSO4 1,4 г/л), содержащую канамицин в концентрации 10 мкг/мл, с OD600=0,6 и культивировали при 30°С в течение 24 часов.
Пример 2-2. Измерение ферментативной активности уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) для ребаудиозида А в качестве сырья
Ферментативную активность уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) для ребаудиозида А в качестве исходного материала измеряли с использованием каждого из ферментов, полученных в Примере 2-1.
В частности, сырьем, используемым в ферментативной реакции, был RebA (Daepyeong), который растворяли в воде до концентрации 2 мМ. Реакцию проводили при 37°С в течение 16 часов с использованием каждого из ферментов, экспрессированных в микроорганизмах и приготовленных в Примере 2-1, и затем анализировали с помощью ВЭЖХ. Водный раствор сырья может содержать UDP-глюкозу или UDP (уридиндифосфат) в количестве 2 мМ.
Условия для анализа ВЭЖХ следующие:
- Длина волны детектора: 210 нм,
- Скорость потока: 1 мл/мин,
- Объем введенной пробы: 10 мкл,
- Колонка: Capcell pak С18 MG II (Shiseido, 250 мм × 4,6 мм, размер частиц: 5 мкм),
- Растворитель: Ацетонитрил 30%.
Результаты измерений показаны в таблице 1 ниже и на Фиг. 1-3.
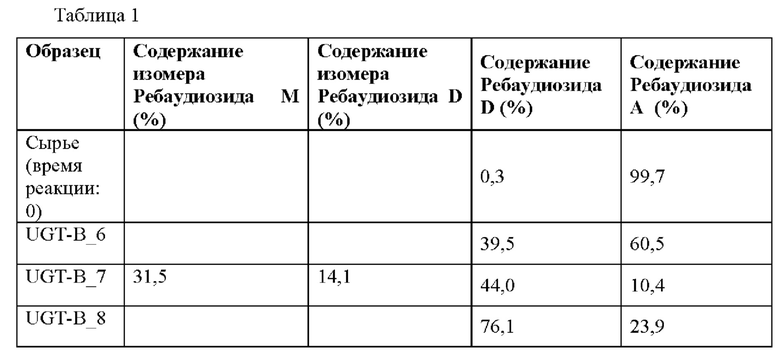
Как показано в таблице 1 выше и на Фиг. 1-3, было подтверждено, что ребаудиозид А превращался в ребаудиозид D под действием уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_6 и UGT-B_8) по настоящему изобретению, и что ребаудиозид А превращался в изомер ребаудиозида М, изомер ребаудиозида D и ребаудиозид D под действием уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B_7).
Пример 3. Измерение ферментативной активности уридиндифосфата (UDP)-гликозилтрансферазы A (UGT-A) и уридиндифосфата (UDP)-гликозилтрансферазы В (UGT-B) при применении ребаудиозида А в качестве сырья
Уридиндифосфат(UDP)-гликозилтрансфераза A (UGT-A) и сахарозосинтаза были очищены с использованием метода, раскрытого в предшествующей патентной литературе (WO 2014/133248), и их последовательности были показаны в SEQ ID NO: 4 и SEQ ID NO: 5 соответственно.
Ферментативную активность уридиндифосфат(UDP)-гликозилтрансферазы А (UGT-A) и уридиндифосфат(UDP)-гликозилтрансферазы В (UGT-B) при применении ребаудиозида А в качестве сырья измеряли с использованием уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A), сахарозосинтазы и каждой из уридиндифосфат(UDP)-гликозилтрансфераз В (UGT-B), полученных в Примере 2-1.
В частности, сырьем, используемым для ферментативной реакции, были 2 мМ стевиозида (Haigen) и 50 мМ водный раствор сахара (CJ Cheiljedang). Реакцию проводили при 37°С в течение 24 часов с использованием уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A), сахарозосинтазы и каждой из приготовленных уридиндифосфат(UDP)-гликозилтрансфераз В (UGT-B) в Примере 2-1, которые экспрессировали в микроорганизмах, а затем анализировали с помощью ВЭЖХ. Водный раствор сырья может содержать UDP-глюкозу или UDP (уридиндифосфат) в концентрации 2 мМ.
Условия для анализа ВЭЖХ следующие:
- Длина волны детектора: 210 нм,
- Скорость потока: 1 мл/мин,
- Объем ввода пробы: 10 мкл,
- Колонка: Capcell pak С18 MG II (Shiseido, 250 мм × 4,6 мм, размер частиц: 5 мкм),
- Растворитель: Ацетонитрил 30%.
Результаты измерений показаны в таблице 2 ниже и на Фиг. 4-6.
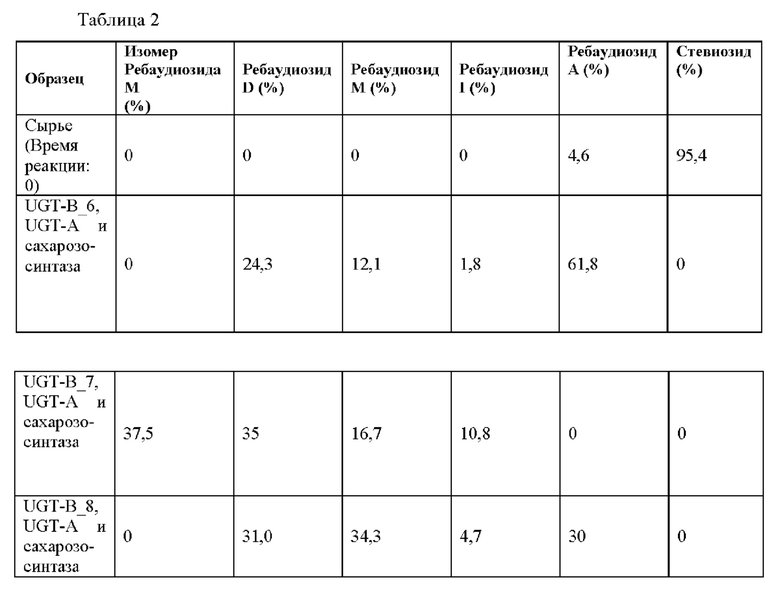
Как показано в таблице 2 выше и на фиг. 4-6, было подтверждено, что 100% стевиозида превратилось в изомер ребаудиозида М, ребаудиозид D, ребаудиозид М и ребаудиозид I, и ребаудиозид А относительно молярной концентрации.
Пример 4. Измерение ферментативной активности уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) для ребаудиозида D в качестве сырья
Скорость превращения ребаудиозида М из ребаудиозида D измеряли с помощью уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) согласно Примеру 3.
В частности, сырьем, использованным для ферментативной реакции, был ребаудиозид D (Haigen), который растворяли в воде до концентрации 1 мМ. Реакцию проводили при 37°С в течение 16 часов с использованием уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A), экспрессируемой в микроорганизмах, и затем анализировали с помощью ВЭЖХ. Водный раствор сырья может содержать UDP-глюкозу или UDP(уридиндифосфат) в концентрации 2 мМ.
Условия для анализа ВЭЖХ следующие:
- Длина волны детектора: 210 нм,
- Скорость потока: 1 мл/мин,
- Объем ввода пробы: 10 мкл,
- Колонка: Capcell pak С18 MG II (Shiseido, 250 мм × 4,6 мм, размер частиц: 5 мкм),
- Растворитель: Ацетонитрил 30%.
Результаты измерений показаны на Фиг. 7.
Как показано на Фиг. 7, было подтверждено, что большая часть ребаудиозида D превращалась в ребаудиозид М под действием уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A) по настоящему изобретению.
Пример 5. Анализ посредством жидкостной хроматографии с масс-спектрометрией (LC-MS/MS) изомера Ребаудиозида D и изомера Ребаудиозид М
Чтобы подтвердить, является ли соединение, превращенное в примерах 2 и 3, изомером ребаудиозида D или изомером ребаудиозида М, изомер ребаудиозида D и изомер ребаудиозида М, превращенные в примерах 2 и 3, сравнивали с ребаудиозидом D и ребаудиозидом М соответственно, используя анализ посредством жидкостной хроматографии и масс-спектрометрии (LC-MS/MS).
В частности, использовали Acquity UPLC (Waters) и масс-спектрометр Xe-vo G2-XS Q-Tof. Условия анализа LC-MS/MS показаны в Таблице 3 ниже, условия элюирования показаны в Таблице 4 ниже, и условия MS показаны в Таблице 5 ниже.
В результате, как показано на Фиг. 8 и 9, сравнение стандарта RebD и неизвестного пика 1 показало, что и стандарт RebD, и неизвестный пик 1 имеют одинаковую молекулярную массу, и их MSMS-фрагменты совпадают друг с другом, но различаются только временем удерживания пика, тем самым подтверждая, что Неизвестный Пик 1 представляет собой изомер RebD.
Кроме того, как показано на фиг. 10 и 11, сравнение стандарта RebM и неизвестного пика 2 показало, что и стандарт RebM, и неизвестный пик 2 имеют одинаковую молекулярную массу, и их MSMS-фрагменты совпадают друг с другом, но различаются только временем удерживания пика, подтверждая тем самым, что Неизвестный Пик 2 представляет собой изомер RebM.
Из вышесказанного специалист в области техники, к которой относится настоящая заявка, сможет понять, что настоящая заявка может быть воплощена в других конкретных формах без изменения технических концепций или существенных характеристик настоящего изобретения. В этом отношении типичные воплощения, раскрытые в настоящем документе, предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие объем настоящего изобретения. Таким образом, объем настоящего изобретения определяется прилагаемой формулой изобретения, а не приведенным выше описанием. Все изменения, которые попадают в смысл и диапазон эквивалентности формулы изобретения, должны быть включены в объем настоящего изобретения.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="en"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3"
fileName="P24304RU-st26-RU.xml" softwareName="WIPO Sequence"
softwareVersion="2.2.0" productionDate="2024-06-11">
<ApplicationIdentification>
<IPOfficeCode>KR</IPOfficeCode>
<ApplicationNumberText>PCT/KR2022/015809</ApplicationNumberText>
<FilingDate>2022-10-18</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>P24304RU</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>KR</IPOfficeCode>
<ApplicationNumberText>10-2021-0139473</ApplicationNumberText>
<FilingDate>2021-10-19</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">СИДЖЕЙ ЧЕИЛДЖЕДАНГ КОРПОРЕЙШН
</ApplicantName>
<ApplicantNameLatin>CJ CHEILJEDANG CORPORATION</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ получения ребаудиозида D и
ребаудиозида M</InventionTitle>
<SequenceTotalQuantity>10</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>441</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>REGION</INSDFeature_key>
<INSDFeature_location>1..441</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q1">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..441</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MATLRVLMFPWLAYGHISPFLNIAKQLADRGFLIYLCSTLINLESIIKK
IPEKYSESIRFVELHLPELPELPPHYHTTNGLPPHLNHTLHKALKMSKPNFSKILQNLKPDLVIYDILQP
WAEHVVNEQNIPAVKILTSGAALFSYFFNFLKNPGVEFPFPAIYLPKVEQVKMREMFEKEPNEEDRLAEG
NMQIMLMCTSRTIEAKYLDYCTELSNWKVVPVGPPFQDPITNDVDDMELIDWLGTKDENSTVFVCFGSEY
FLSREDMEEVAFGLELSNVNFIWVARFPKGEEQNLEDVLPKGFLERIGERGRVLDKFAPQPRILNHPSTG
GFISHCGWNSVMESLDFGVPIIAMPMHNDQPINAKLIVELGVAMEIVRDDDGNIHRGEITETLKDVITGE
TGEILRGKVRDISKNLKSIREEEMNAAAEELIQLCRNSNKYK</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>441</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>REGION</INSDFeature_key>
<INSDFeature_location>1..441</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q3">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..441</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MATLKVLMFPFLAYGHISPYLNVAKKLADRGFLIYFCSTPINLKSIIKK
IPEKYANSIHLIELHLPELPELPPHYHTTNGLPPNLNHILQKALKMSKPNFSKILQNLKPDLVIYDVLQR
WAKHVANEQNIPAVKLLTSGAAVFSYFFNVLKKPGVEFPFPGIYLRKIEQVRLSEMMKELEDDDDDDDLL
VDGNMQIMLMSTSRTIEAKYIDFCTALTNWKVVPVGPPVQDLITNDADDMELIDWLGTKDENSTVFVSFG
SEYFLSKEDMEEVAFALELSNVNFIWVARFPKGEERNLEDALPKGFLERIGERGRVLDKFAPQPRILNHP
STGGFISHCGWNSAMESIDFGVPIIAMPMHLDQPMNARLIVELGVAVEIVRDDDGKIHRGEIAETLKGVI
TGKTGGKLRAKVRDISKNLKTIRDEEMDAAAEELIQLCRNSN</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>461</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>REGION</INSDFeature_key>
<INSDFeature_location>1..461</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q5">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..461</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MDASESESSPLHVVIFPWLAMGHLLPCLELAERLAARGHRVSFVSTPRN
LARLPPVRPALASLVHLVALPLPRVAGLPDGAESTSDVPPDKFHLHRVAFDGLAAPFTAFLDAACAGGRR
PDWVVADFVHHWVAAVAQARKVPCAMLLPCAAGVAALSGPPPESRAEEHQAVSRSMDAAPRFEAELTTEE
FAAEDASGLSIMGRFFMTLKRSKLVALRSSPELEPDAFPLLTRLYGKPAVPLGLLPPPPNGDRSASENSE
DVAIIQWLDARPAKSVVYVALGSEAPLRAELLRELAHGLELSGTRFLWVLRNPVNGDADTILPDGFMERT
AERGLVAVRWVPQVSILAHGAVGAFLTHCGWGSVVEGLQFGHPLIMLPLAGDQGPNARLMEERKVGVLVP
RDEKDGSFTRDGVAGAVRAVVVEEGGRVFADNAKRLQGIVASVECNERCIDLFVQHLRSCRN</INSDSe
q_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>458</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>REGION</INSDFeature_key>
<INSDFeature_location>1..458</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q7">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-A</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..458</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MENKTETTVRRRRRIILFPVPFQGHINPILQLANVLYSKGFSITIFHTN
FNKPKTSNYPHFTFRFILDNDPQDERISNLPTHGPLAGMRIPIINEHGADELRRELELLMLASEEDEEVS
CLITDALWYFAQSVADSLNLRRLVLMTSSLFNFHAHVSLPQFDELGYLDPDDKTRLEEQASGFPMLKVKD
IKSAYSNWQILKEILGKMIKQTKASSGVIWNSFKELEESELETVIREIPAPSFLIPLPKHLTASSSSLLD
HDRTVFQWLDQQPPSSVLYVSFGSTSEVDEKDFLEIARGLVDSKQSFLWVVRPGFVKGSTWVEPLPDGFL
GERGRIVKWVPQQEVLAHGAIGAFWTHSGWNSTLESVCEGVPMIFSDFGLDQPLNARYMSDVLKVGVYLE
NGWERGEIANAIRRVMVDEEGEYIRQNARVLKQKADVSLMKGGSSYESLESLVSYISSL</INSDSeq_s
equence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>808</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>REGION</INSDFeature_key>
<INSDFeature_location>1..808</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q9">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Sucrose synthase</INSDQualifier_value>
<NonEnglishQualifier_value>сахарозосинтаза</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..808</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MAAKLARLHSLRERLGATFSSHPNELIALFSRYVNQGKGMLQRHQLLAE
FDALIEADKEKYAPFEDILRAAQEAIVLPPWVALAIRPRPGVWDYIRVNVSELAVEELSVSEYLAFKEQL
VDGHTNSNFVLELDFEPFNASFPRPSMSKSIGNGVQFLNRHLSSKLFQDKESLYPLLNFLKAHNHKGTTM
MLNDRIQSLRGLQSSLRKAEEYLMGIPQDTPYSEFNHRFQELGLEKGWGDCAKRVLDTIHLLLDLLEAPD
PANLEKFLGTIPMMFNVVILSPHGYFAQSNVLGYPDTGGQVVYILDQVRALENEMLLRIKQQGLDITPKI
LIVTRLLPDAVGTTCGQRVEKVIGTEHTDILRVPFRSENGILRKWISRFDVWPFLETYTEDVANEIMREM
QAKPDLIIGNYSDGNLVATLLAHKLGVTQCTIAHALEKTKYPNSDIYLDKFDSQYHFSCQFTADLIAMNH
TDFIITSTFQEIAGSKDTVGQYESHIAFTLPGLYRVVHGIDVFDPKFNIVSPGADMSVYFPYTEADKRLT
AFHPEIEELLYSEVENDEHKFVLKDKNKPIIFSMARLDRVKNMTGLVEMYGKNAHLRDLANLVIVCGDHG
NQSKDREEQAEFKKMYGLIDQYKLKGHIRWISAQMNRVRNGELYRYICDTKGVFVQPAFYEAFGLTVIEA
MTCGLPTIATCHGGPAEIIVDGVSGLHIDPYHSDKAADILVNFFEKCKQDSTYWDNISQGGLQRIYEKYT
WKLYSERLMTLTGVYGFWKYVSNLERRETRRYIEMFYALKYRSLASAVPLAVDGESTSK</INSDSeq_s
equence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>1326</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>misc_feature</INSDFeature_key>
<INSDFeature_location>1..1326</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q11">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1326</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q21">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggcgaccttgcgcgtactgatgtttccctggttggcgtatggtcaca
tttctccttttctcaacatagccaagcagctcgcggatagaggattcctgatctacctttgtagcacgct
gatcaacctcgaaagcatcatcaagaaaatccccgaaaaatactctgagtcaattcgttttgtggagctt
cacctgcccgaattgcctgaacttcctcctcattaccacacaaccaatggtctgccgccccatctgaacc
acacacttcataaagccctgaaaatgtccaaaccaaacttttccaaaatcctgcagaatctgaaacccga
tttggtgatttatgacatattgcagccgtgggccgagcatgtcgtaaatgagcagaatattccggcagtc
aagatattaacgtcgggtgcagctctgttttcgtatttcttcaactttctaaaaaatccaggggttgaat
ttccgtttccggcaatttatctcccgaaagtggagcaagtcaagatgcgagaaatgttcgagaaggaacc
taatgaagaggatcgtctcgccgagggcaacatgcagattatgttaatgtgcacctctaggaccattgag
gccaagtatctagattattgtactgaactgagcaattggaaagttgttccagttggtccaccgttccaag
acccgatcaccaacgacgtggacgacatggagctcattgattggctaggcacaaaggatgagaattcaac
tgttttcgtctgctttggaagtgagtatttcttgtcacgggaagatatggaagaagtagcgtttggtttg
gagctgagtaatgtgaatttcatctgggtagcccgctttccgaaaggtgaggagcagaaccttgaggatg
tattgccgaaaggttttcttgaaagaattggagagcggggccgtgtgttagacaaatttgcaccacagcc
acgcattttaaatcatccgtccaccggcggattcataagtcattgtggctggaattcagtgatggagagt
ttagattttggcgttcctatcatcgccatgcctatgcataacgatcaaccaatcaacgcgaagttgatag
tggaattgggggtggcaatggaaattgttcgcgatgatgatgggaatattcaccggggtgaaattacgga
aactcttaaagatgtcataacgggggaaacaggggagattttgcgtggcaaagtgcgtgacatcagcaaa
aatttgaagtctatccgcgaggaagagatgaacgctgcagctgaagagctgattcagctgtgccggaata
gcaataagtacaaatag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>1326</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>misc_feature</INSDFeature_key>
<INSDFeature_location>1..1326</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q22">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1326</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q23">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggctactctgaaagtactgatgtttccgtttttggcttatggccaca
tttctccctatctgaatgtagccaagaagctcgccgatcggggcttcctgatttacttctgctcaacacc
gataaatctgaagagcattatcaaaaaaatccctgaaaaatacgcgaatagcattcatcttatcgagctt
cacttaccggagttaccggagttaccccctcattaccatacgacgaatggtctcccgccaaacctcaatc
acatccttcagaaagcactgaaaatgtcaaagccaaacttctcgaagatcttacagaacctgaaacctga
tctggtgatttatgacgtattgcagcggtgggcgaaacatgtcgccaatgaacagaatatcccagcagtt
aagctcctgacgagtggtgcagccgtgtttagctattttttcaatgtcttgaaaaagccaggggtcgaat
ttccattcccgggaatttatctgcgcaaaatcgaacaagtaagactgagtgaaatgatgaaagaactgga
ggacgacgatgacgatgatgatcttctggtggatggcaatatgcaaataatgttgatgagtacctctcgc
accatcgaagccaaatatatcgatttttgcactgcgttgacgaactggaaagttgttccggttggtcctc
cggttcaggatctgataaccaacgacgcggacgatatggaacttatcgattggctaggcacaaaagatga
gaactcaactgtgtttgtctcctttggtagtgagtatttcctgtccaaggaagatatggaagaagtggct
tttgcgttggaattatcgaacgtgaactttatctgggttgccagatttccgaaaggggaagagcgaaatc
tggaagacgcactgccgaagggatttcttgagcggattggagaaaggggacgtgttttggataaatttgc
cccccagccacgtattctgaaccatccgtctaccggcggttttatatcccattgtggttggaattcagca
atggaatctatagacttcggggttcctatcatcgcgatgcctatgcacctagatcagcccatgaacgctc
gtctcatcgtagaattaggcgttgcggtcgagattgttcgtgatgatgatggtaagatccacagaggaga
aatcgcggaaaccttgaaaggtgtgataacagggaaaacaggtggaaagctccgtgctaaagtgcgcgac
attagtaaaaacttaaaaaccatacgcgacgaagagatggatgcagctgctgaggagctaatccagcttt
gtcgcaatagcaattag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>1386</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>misc_feature</INSDFeature_key>
<INSDFeature_location>1..1386</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q24">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-B</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1386</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q25">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggatgcgtcggaaagcgagtcatctccgctccacgttgttatatttc
cttggttagcaatgggtcatctgctcccgtgtctggaactggcagaacgattggcagcacgtggtcatcg
ggtttcgttcgttagcactcccagaaatttagcacgtttaccaccagttcgtcctgcattggcatcactc
gttcatctggttgcactgccgttgcctcgtgttgcaggtctgcccgatggagcagaaagtacatctgatg
ttccgccggataaatttcaccttcatcgtgttgctttcgatggtttggctgcaccatttaccgcatttct
ggatgcagcttgcgcaggaggtaggcgtcctgattgggttgtggcagattttgtacatcattgggttgct
gcagttgcacaagcacgtaaggtaccgtgtgcaatgttactgccttgcgcagcaggtgttgcagcactaa
gcggtccaccaccggaaagtcgtgcagaggaacatcaggctgttagtcgaagcatggatgcggcaccacg
ttttgaagcagaactgactaccgaggaatttgctgcggaagatgcgagtggtctgagtattatgggacgt
tttttcatgacgctgaaaagatctaaattagttgctctacgttcatcaccggaattagaaccggatgcat
ttccgctgctgacccgtctttatggtaaaccggcagttccgcttggactgttaccgccccctcctaacgg
agatagaagcgcaagcgaaaatagcgaggatgttgcaattatccagtggttggatgcacgtccagccaaa
tctgttgtttacgttgcactgggtagcgaagcacccctccgtgcagaactgttacgtgaattagcacatg
gacttgaactgtctggtacgcgatttttatgggttctgcgtaatccagttaacggtgatgcagatacgat
tttacctgatggttttatggaacgtacagcagaacgtggtcttgttgcagttcgttgggtacctcaagta
agcatcctggcacacggtgcagttggtgcattcttaacccactgtgggtggggttcagttgttgaaggtc
ttcaatttggtcatccattgattatgcttccgcttgcaggcgatcaggggcccaacgctcgcttaatgga
agaacgtaaagttggtgttttggtaccccgtgacgaaaaggatggttcgtttacacgtgatggtgttgca
ggtgcagttagagcagttgttgttgaagaaggtggtcgtgtatttgcagataatgcaaaacgtctgcagg
gtatagttgcgagtgttgaatgcaatgagagatgcattgatctgtttgtacagcatctacgtagctgtcg
taattag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="9">
<INSDSeq>
<INSDSeq_length>1377</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>misc_feature</INSDFeature_key>
<INSDFeature_location>1..1377</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q26">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>UGT-A</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1377</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q27">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggaaaataaaacggagaccaccgttcgccggcgccggagaataatat
tattcccggtaccatttcaaggccacattaacccaattcttcagctagccaatgtgttgtactctaaagg
attcagtatcaccatctttcacaccaacttcaacaaacccaaaacatctaattaccctcacttcactttc
agattcatcctcgacaacgacccacaagacgaacgcatttccaatctaccgactcatggtccgctcgctg
gtatgcggattccgattatcaacgaacacggagctgacgaattacgacgcgaactggaactgttgatgtt
agcttctgaagaagatgaagaggtatcgtgtttaatcacggatgctctttggtacttcgcgcaatctgtt
gctgacagtcttaacctccgacggcttgttttgatgacaagcagcttgtttaattttcatgcacatgttt
cacttcctcagtttgatgagcttggttacctcgatcctgatgacaaaacccgtttggaagaacaagcgag
tgggtttcctatgctaaaagtgaaagacatcaagtctgcgtattcgaactggcaaatactcaaagagata
ttagggaagatgataaaacaaacaaaagcatcttcaggagtcatctggaactcatttaaggaactcgaag
agtctgagctcgaaactgttatccgtgagatcccggctccaagtttcttgataccactccccaagcattt
gacagcctcttccagcagcttactagaccacgatcgaaccgtttttcaatggttagaccaacaaccgcca
agttcggtactgtatgttagttttggtagtactagtgaagtggatgagaaagatttcttggaaatagctc
gtgggttggttgatagcaagcagtcgtttttatgggtggttcgacctgggtttgtcaagggttcgacgtg
ggtcgaaccgttgccagatgggttcttgggtgaaagaggacgtattgtgaaatgggttccacagcaagaa
gtgctagctcatggagcaataggcgcattctggactcatagcggatggaactctacgttggaaagcgttt
gtgaaggtgttcctatgattttctcggattttgggctcgatcaaccgttgaatgctagatacatgagtga
tgttttgaaggtaggggtgtatttggaaaatgggtgggaaagaggagagatagcaaatgcaataagaaga
gttatggtggatgaagaaggagaatacattagacagaatgcaagagttttgaaacaaaaggcagatgttt
ctttgatgaagggtggttcgtcttacgaatcattagagtctctagtttcttacatttcatcgttgtaa</
INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="10">
<INSDSeq>
<INSDSeq_length>2427</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>misc_feature</INSDFeature_key>
<INSDFeature_location>1..2427</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier id="q28">
<INSDQualifier_name>note</INSDQualifier_name>
<INSDQualifier_value>Sucrose synthase</INSDQualifier_value>
<NonEnglishQualifier_value>сахарозосинтаза</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..2427</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q29">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>unidentified</INSDQualifier_value>
<NonEnglishQualifier_value>неустановленный</NonEnglishQualifier
_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggctgccaagctagctcgcctccacagtctccgcgaacgcctcggtg
ccaccttctcgtctcatcccaatgagttgattgcactcttctctaggtatgttaaccagggaaagggaat
gctccagcgtcaccagctgcttgcggagttcgatgccttgatcgaagctgacaaagagaaatatgctccc
tttgaagacattctccgggctgctcaggaagccattgtgctgccgccctgggttgcactggccatcaggc
caaggcctggtgtctgggactacattcgggtgaatgtaagtgagttggcagtggaagagctgagtgtttc
tgagtacttggcattcaaggaacagcttgttgatggacacaccaacagcaactttgttcttgagcttgat
tttgagcccttcaatgcctccttcccgcgcccgtccatgtccaagtccatcggaaatggggtgcagttcc
ttaaccgtcacctgtcgtccaagttgttccaggacaaggagagcctctaccccttgctgaacttcctgaa
agcccataaccacaagggcacgacaatgatgctgaatgacagaattcagagccttcgtgggctccaatca
tcccttagaaaggcagaagaatatctgatgggcattcctcaagacacgccctactcggagttcaaccaca
ggttccaagagctcggtttggagaagggttggggtgactgtgcaaagcgtgtgcttgacaccatccactt
gcttcttgaccttcttgaggcccctgatccggccaacttggagaagttccttggaactattccaatgatg
ttcaatgttgttatcctgtctccgcatggatactttgcccaatccaatgtgttgggataccctgatactg
gtggtcaggttgtgtacattttggaccaagtccgcgctttggagaatgagatgcttttgaggatcaagca
gcaaggccttgatatcacacctaagatcctcattgtaaccaggctgttgcctgatgctgttggtactaca
tgcggccagcgtgtggagaaggttattggaactgagcacactgacattcttcgtgttccattcaggagtg
agaatggtatcctccgcaagtggatctcccgttttgatgtctggccattcctggaaacatacactgagga
tgttgcaaacgaaattatgagggaaatgcaagccaaacctgatctcatcattggcaattacagtgatgga
aaccttgttgccactctgctggctcacaaattaggagttacccagtgtaccattgctcatgccttggaga
aaaccaaataccccaactcagacatatacttggacaagtttgacagccagtaccacttctcatgccaatt
cactgctgatcttatcgccatgaatcacactgatttcatcatcaccagtacattccaagaaattgctgga
agcaaggacactgtggggcagtatgaatcacacattgcattcacccttcctgggctttaccgagttgtgc
atggcatagatgtttttgatcccaagttcaacattgtctctcctggagctgacatgagtgtctacttccc
gtacaccgaggctgacaagaggctcactgctttccaccctgaaattgaggagcttctctacagtgaagtc
gagaacgatgaacacaagtttgtattgaaggacaagaacaagccaatcatcttctccatggctcgtcttg
accgagtgaagaacatgacaggtctggttgagatgtatggtaagaatgcacatctcagggatttggcaaa
ccttgtgattgtttgtggtgaccacggcaatcagtccaaggacagggaggagcaggctgagttcaagaag
atgtacggtctcattgaccagtacaagttgaaggggcatatccgctggatctcagctcagatgaaccgtg
ttcgtaacggggagttgtaccgatacatttgtgacaccaagggagtctttgtccagcctgcattctatga
agcgtttggtctgactgtcatcgaagccatgacatgtggtttgccaacaatcgcaacatgccatggtggc
cctgctgagattattgttgatggggtgtctggtctgcacattgatccttaccacagtgacaaggctgctg
atatcttggtcaacttctttgagaagtgcaagcaggattcaacctactgggacaatatttcacagggagg
tctgcagaggatttacgagaagtacacctggaagctgtactctgagaggctgatgaccttgactggtgta
tacggattctggaagtacgtaagcaaccttgagaggcgcgagactcgccgttacattgagatgttctatg
ctctgaaataccgcagcctggccagcgccgtcccattggctgtcgatggagagagcacatccaagtaa</
INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОСИНТЕТИЧЕСКОЕ ПОЛУЧЕНИЕ СТЕВИОЛОВОГО ГЛИКОЗИДА РЕБАУДИОЗИДА D4 ИЗ РЕБАУДИОЗИДА E | 2017 |
|
RU2764803C2 |
| UDP-ЗАВИСИМАЯ ГЛИКОЗИЛТРАНСФЕРАЗА ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОДУЦИРОВАНИЯ РЕБАУДИОЗИДОВ | 2017 |
|
RU2777901C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2706789C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА C С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2736155C1 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2741103C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА N С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2737118C2 |
| ПРИМЕНЕНИЕ КАУРЕНОКСИДАЗЫ PISUM SATIVUM ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2018 |
|
RU2795550C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА M С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2013 |
|
RU2658436C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА J С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2736352C1 |
| СПОСОБЫ И ВЕЩЕСТВА ДЛЯ ОСНОВАННОГО НА РЕКОМБИНАЦИИ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ШАФРАНА | 2012 |
|
RU2676730C2 |
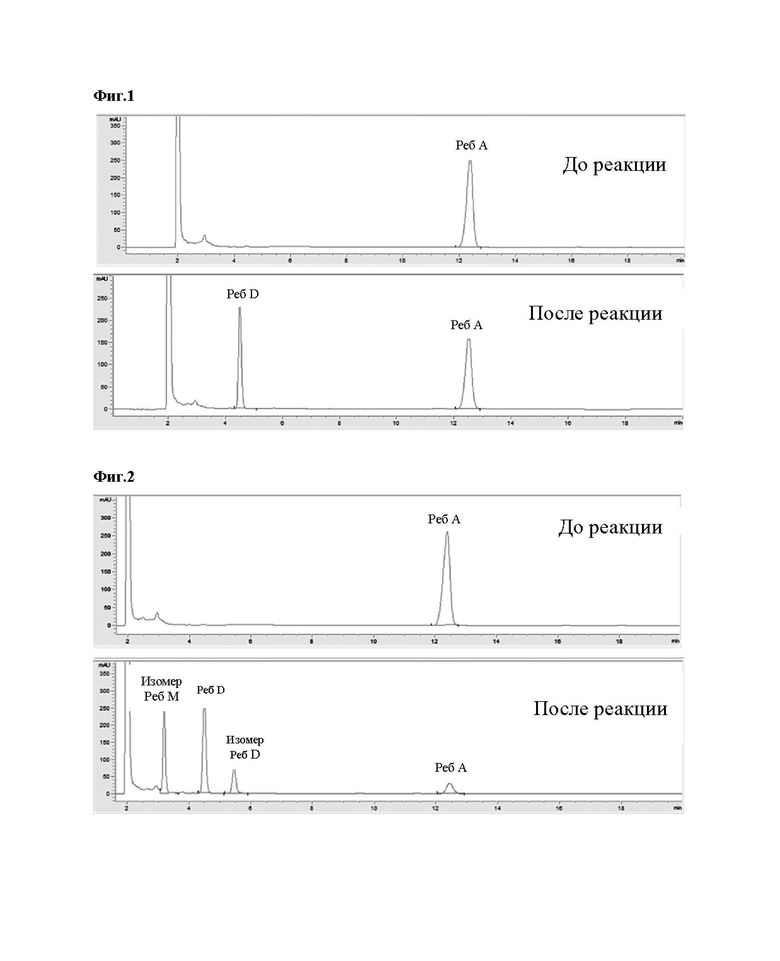
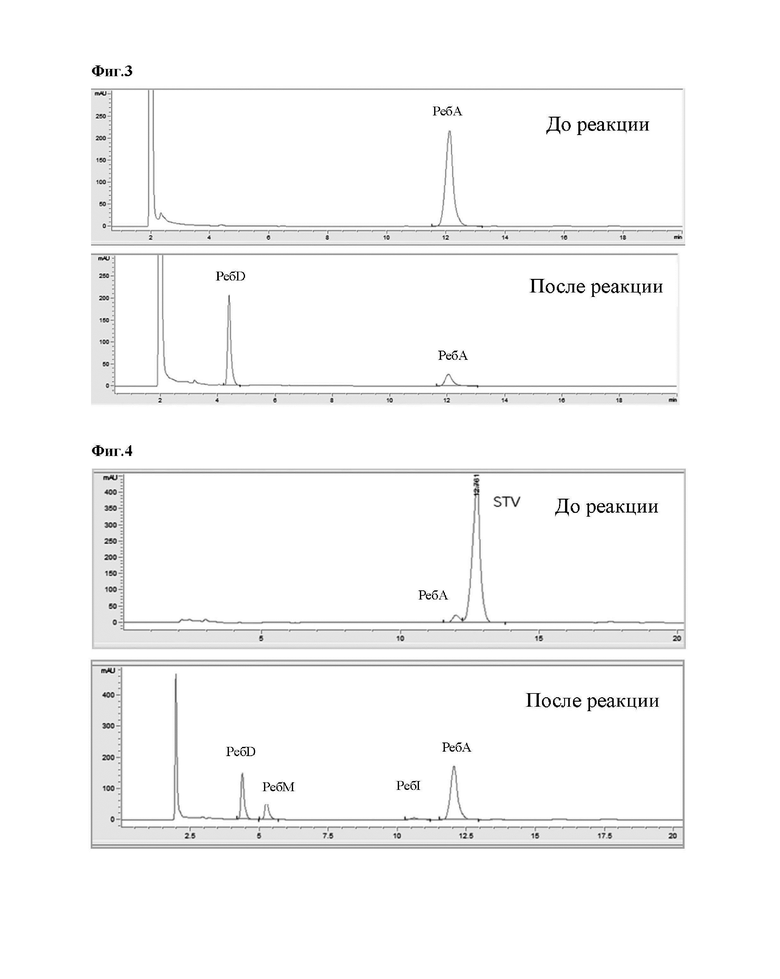
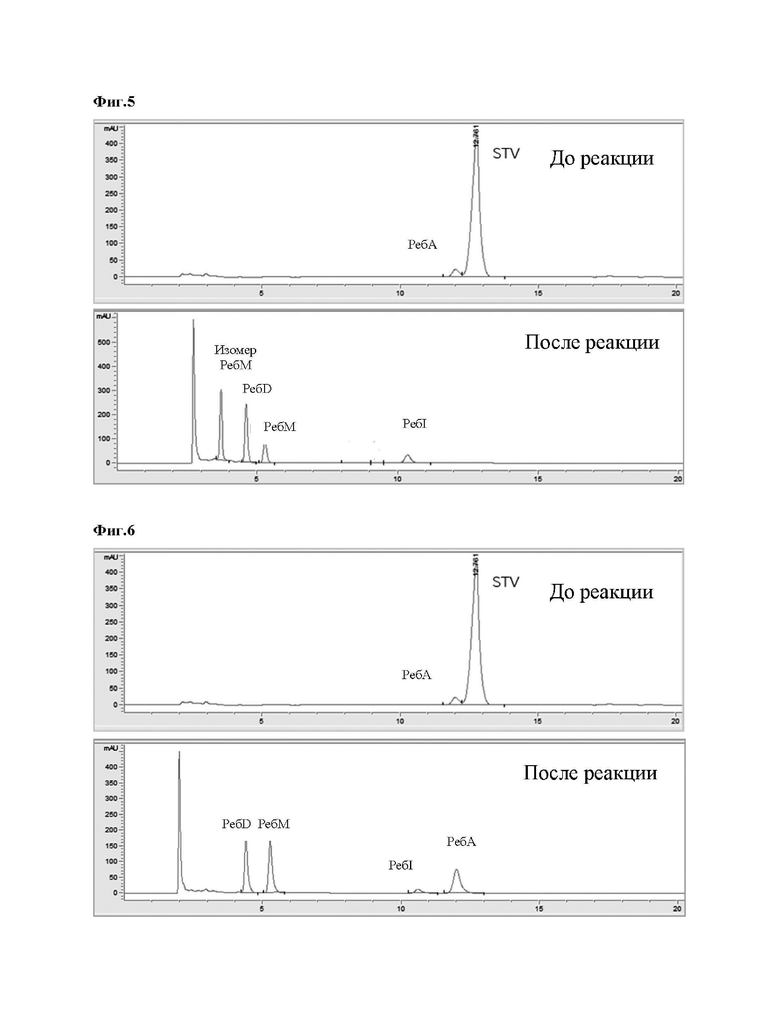
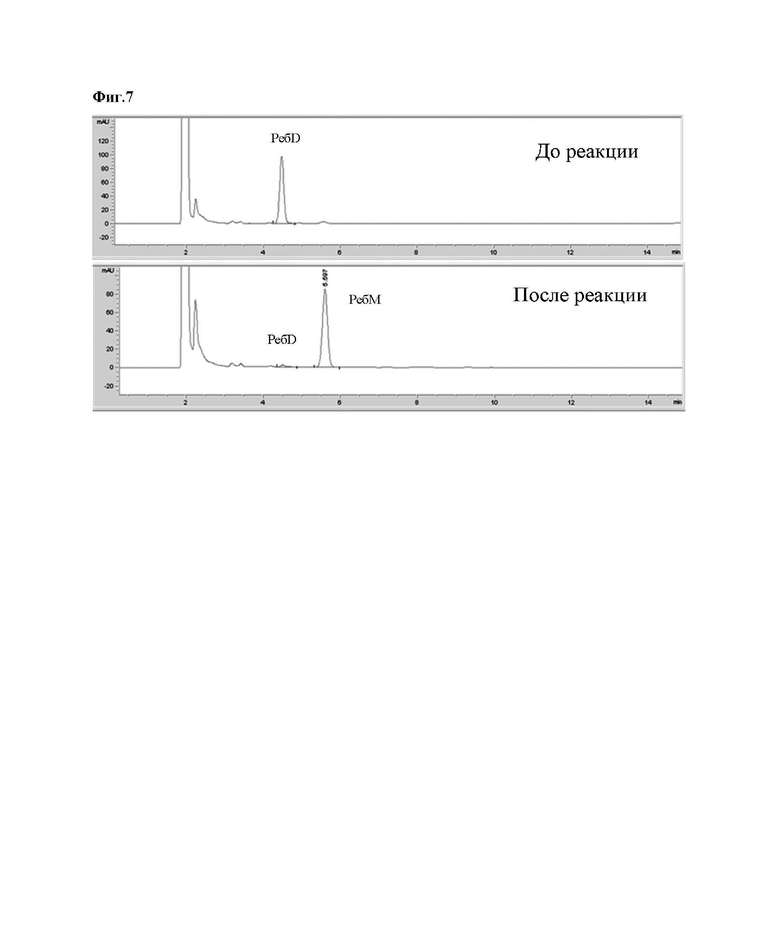




Настоящая группа изобретений относится к области биотехнологии и может быть применима в пищевой промышленности. Изобретение раскрывает способы получения гликозидов-подсластителей, в частности ребаудиозида D (Reb D) и ребаудиозида М (Reb M) посредством активной биоконверсии более доступного ребаудиозида A (Reb A) в присутствии ферментов группы уридиндифосфат(UDP)-гликозилтрансфераз, характеризующихся новыми аминокислотными последовательностями SEQ ID NO: 3 и 4 соответственно. Изобретение может быть применимо для получения альтернативных подсластителей, обладающих более привлекательными вкусовыми характеристиками в сравнении с известными как синтетическими, так и выделяемыми из природного сырья аналогами. 6 н. и 12 з.п. ф-лы, 11 ил., 5 табл., 5 пр.
1. Способ получения ребаудиозида D из ребаудиозида А, включающий:
взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии уридиндифосфат(UDP)-гликозилтрансферазы B (UGT-B) с получением ребаудиозида D,
где UGT-B представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
2. Способ по п. 1, где нуклеотиддифосфат, с которым связана глюкоза, получают путем взаимодействия сахарозы и нуклеотиддифосфата в присутствии сахарозосинтазы.
3. Способ по п. 1, где ребаудиозид А получают путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, со стевиозидом в присутствии уридиндифосфат(UDP)-гликозилтрансферазы A (UGT-A).
4. Способ по п. 2, где сахарозосинтаза представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 5.
5. Способ по п. 3, где UGT-A представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4.
6. Способ по любому из пп. 1-5, который осуществляют последовательно in situ.
7. Способ получения ребаудиозида M из ребаудиозида А, включающий:
взаимодействие нуклеотиддифосфата, с которым связана глюкоза, с ребаудиозидом А в присутствии UGT-B с получением ребаудиозида D; и
взаимодействие ребаудиозида D с нуклеотиддифосфатом, с которым связана глюкоза, в присутствии UGT-A с получением ребаудиозида M,
где UGT-B представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
8. Способ по п. 7, где UGT-A представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4.
9. Способ по п. 7, где нуклеотиддифосфат, с которым связана глюкоза, получают путем взаимодействия сахарозы и нуклеотиддифосфата в присутствии сахарозосинтазы.
10. Способ по п. 7, где ребаудиозид A получают путем взаимодействия нуклеотиддифосфата, с которым связана глюкоза, со стевиозидом в присутствии UGT-A.
11. Способ по п. 9, где сахарозосинтаза представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 5.
12. Способ по п. 10, где UGT-A представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4.
13. Способ по любому из пп. 7-12, который осуществляют последовательно in situ.
14. Способ получения ребаудиозида D из ребаудиозида A, включающий:
взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, сахарозосинтазы и UGT-B in situ с получением ребаудиозида D,
где UGT-B представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
15. Способ получения ребаудиозида M из ребаудиозида A, включающий:
взаимодействие сахарозы, нуклеотиддифосфата, ребаудиозида А, ребаудиозида D, сахарозосинтазы, UGT-A и UGT-B in situ с получением ребаудиозида M,
где UGT-B представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
16. Способ по п. 15, где UGT-A представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4.
17. Композиция для получения ребаудиозида D из ребаудиозида А, содержащая UGT-B, которая представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
18. Композиция для получения ребаудиозида M из ребаудиозида А, содержащая:
UGT-B, которая представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 3, и
UGT-A, которая представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 4.
| US 20140357588 A1, 04.12.2014 | |||
| US 2020032227 A1, 30.01.2020 | |||
| WO 2018144679 A2, 09.08.2018 | |||
| WO 2014133248 A1, 04.09.2014 | |||
| WO 2017031424 A1, 23.02.2017 | |||
| CHEN L | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Biotechnol., 2020, v | |||
| Насос | 1917 |
|
SU13A1 |
| WO 2016073740 A1, 12.05.2016 | |||
| RU | |||
Авторы
Даты
2025-05-15—Публикация
2022-10-18—Подача