ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения ребаудиозида N с применением ферментативного способа и, в частности, относится к биологическому способу получения ребаудиозида N.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Подсластители представляют собой вид пищевых добавок, широко применяемых в производстве пищевых продуктов, таких как напитки и кондитерские изделия. Подсластители можно добавлять либо в процессе производства пищевых продуктов, либо использовать после соответствующего разбавления в качестве заменителей сахарозы в домашней выпечке. Подсластители включают натуральные подсластители и искусственные подсластители, в состав которых входит сахароза, кукурузный сироп с высоким содержанием фруктозы, мед и т.п.; последние включают аспартам, сахарин и т.п. Стевиозид представляет собой натуральный подсластитель, экстрагированный из растения Stevia rebaudiana, и в настоящее время широко используется в пищевых продуктах и напитках. Экстракты Stevia rebaudiana содержат множество стевиозидов, включая ребаудиозид, и экстрагированные естественным путем стевиозиды имеют существенные различия по составу между разными партиями и требуют последующей очистки.
Доля ребаудиозида N в листьях Stevia rebaudiana составляет менее 1,5%. Получить ребаудиозид N высокой чистоты с помощью традиционных способов экстракции крайне сложно, что ограничивает углубленное исследование ребаудиозида N и затрудняет его коммерческое применение.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая задача, которую предстоит решить с помощью настоящего изобретения, состоит в устранении недостатков предшествующего уровня техники и в разработке способа получения ребаудиозида N с применением ферментативного способа. В соответствии с этим способом можно получить продукты ребаудиозида N высокой чистоты с низкой стоимостью в течение короткого производственного цикла.
Для решения описанной выше технической задачи в настоящем изобретении использовано следующее техническое решение.
Предложен способ получения ребаудиозида N с применением ферментативного способа. Этот способ включает: использование ребаудиозида А в качестве субстрата в присутствии донора гликозила, реакцию в условиях катализа содержащей UDP-гликозилтрансферазу рекомбинантной клеткой и/или полученной из них UDP-гликозилтрансферазой с образованием ребаудиозида N.
Дополнительно предложен способ получения ребаудиозида N с применением ферментативного способа. Этот способ включает: использование ребаудиозида J в качестве субстрата в присутствии донора гликозила, реакцию в условиях катализа содержащей UDP-гликозилтрансферазу рекомбинантной клеткой и/или полученной UDP-гликозилтрансферазой с образованием ребаудиозида N.
Донор гликозила предпочтительно включает один или два из донора на основе глюкозы и донора рамнозила; причем донор на основе глюкозы представляет собой UDP-глюкозу или систему регенерации UDP-глюкозы (2007, FEBS Letters, 581, 2562-2566), состоящую из сахарозы, синтазы сахарозы и UDP, а донор рамнозила представляет собой UDP-рамнозу. Донор на основе глюкозы предпочтительно представляет собой систему регенерации UDP-глюкозы, состоящую из сахарозы, синтазы сахарозы и UDP. UDP-глюкоза стоит дорого. Следовательно, использование системы регенерации UDP-глюкозы может значительно снизить затраты.
Предпочтительно UDP-гликозилтрансфераза (то есть уридиндифосфатглюкантрансфеаза, сокращенно именуемая UGT и известная специалистам в данной области) включает один или два из UGT-A из Stevia rebaudiana и UGT-B из Oryza sativa.
Предпочтительно UDP-гликозилтрансфераза включает UGT-А из Stevia rebaudiana и UGT-B из Oryza sativa; UDP-гликозилтрансферазу добавляют в реакционную систему в две стадии; при этом на первой стадии добавляют UGT-B, а на второй стадии добавляют UGT-A. Аминокислотная последовательность UGT-A характеризуется по меньшей мере 60% идентичностью с последовательностью 2, указанной в перечне последовательностей; и/или аминокислотная последовательность UGT-B характеризуется по меньшей мере 60% идентичностью с последовательностью 4, указанной в перечне последовательностей.
Более предпочтительно аминокислотная последовательность UGT-A характеризуется по меньшей мере 70% идентичностью с последовательностью 2, указанной в перечне последовательностей; и/или аминокислотная последовательность UGT-B характеризуется по меньшей мере 70% идентичностью с последовательностью 4, указанной в перечне последовательностей.
Кроме того, аминокислотная последовательность UGT-A характеризуется по меньшей мере 80% идентичностью с последовательностью 2, указанной в перечне последовательностей; и/или аминокислотная последовательность UGT-B характеризуется по меньшей мере 80% идентичностью с последовательностью 4, указанной в перечне последовательностей.
Кроме того, аминокислотная последовательность UGT-A характеризуется по меньшей мере 90% идентичностью с последовательностью 2, указанной в перечне последовательностей; и/или аминокислотная последовательность UGT-B характеризуется по меньшей мере 90% идентичностью с последовательностью 4, указанной в перечне последовательностей.
В некоторых конкретных вариантах осуществления аминокислотная последовательность UGT-А абсолютно идентична последовательности 2, указанной в перечне последовательностей; и/или аминокислотная последовательность UGT-B абсолютно идентична последовательности 4, указанной в перечне последовательностей.
Предпочтительно UDP-гликозилтрансфераза представляет собой UGT-A из Stevia rebaudiana; причем аминокислотная последовательность UGT-A характеризуется по меньшей мере 60% идентичностью с последовательностью 2, указанной в перечне последовательностей.
Более предпочтительно аминокислотная последовательность UGT-A характеризуется по меньшей мере 70% идентичностью с последовательностью 2, указанной в перечне последовательностей.
Кроме того, аминокислотная последовательность UGT-A обладает по меньшей мере 80% идентичностью с последовательностью 2, указанной в перечне последовательностей.
Кроме того, аминокислотная последовательность UGT-A обладает по меньшей мере 90% идентичностью с последовательностью 2, указанной в перечне последовательностей. В некоторых конкретных вариантах осуществления аминокислотная последовательность UGT-A абсолютно идентична последовательности 2, указанной в перечне последовательностей.
В соответствии с настоящим изобретением реакцию проводят в системе с водной фазой при температуре от 4-50°С и величине рН 5,0-9,0. Предпочтительно реакцию проводят в системе с водной фазой при температуре 35-45°С и величине рН 7,5-8,5.
Более предпочтительно реакцию проводят в фосфатном буферном растворе.
Более предпочтительно реакционная система включает содержащую UDP-гликозилтрансферазу рекомбинантную клетку и агент для пермеабилизации клетки. Кроме того, агент для пермеабилизации клетки представляет собой толуол; где объемная концентрация толуола в реакционной системе составляет 13%.
Более предпочтительно все сырьевые материалы, используемые для проведения реакции, добавляют в реакционный сосуд, перемешивают до однородного состояния и затем оставляют при заданной температуре при перемешивании для создания достаточных условий для протекания реакции. По завершении реакции продукт ребаудиозид N, удовлетворяющий требованиям к применению, можно получить путем очистки. Конкретный способ очистки представляет собой последующую обработку, включая разделение с помощью смолы. В соответствии с этим способом очистки можно получить продукт ребаудиозид N с чистотой, достигающей 95%.
Рекомбинантная клетка предпочтительно представляет собой клетку микроорганизма. Более предпочтительно микроорганизм представляет собой Escherichia coli, Saccharomyces cerevisiae или Pichia pastoris.
В соответствии с конкретным аспектом настоящего изобретения субстратом реакции на первой стадии является ребаудиозид А, а UDP-гликозилтрансфераза представляет собой UGT-B из Oryza sativa, причем аминокислотная последовательность UGT-B из Oryza sativa характеризуется по меньшей мере 80% идентичностью с последовательностью 4; а на второй стадии субстратом реакции является реакционный раствор, содержащий продукт реакции ребаудиозид J с первой стадии, а UDP-гликозилтрансфераза представляет собой UGT-A из Stevia rebaudiana, причем аминокислотная последовательность UGT-A из Stevia rebaudiana характеризуется по меньшей мере 80% идентичностью с последовательностью 2.
В соответствии с другим конкретным аспектом настоящего изобретения субстратом реакции является ребаудиозид J, UDP-гликозилтрансфераза представляет собой UGT-A из Stevia rebaudiana, причем аминокислотная последовательность UGT-A из Stevia rebaudiana характеризуется по меньшей мере 80%-й идентичностью с последовательностью 2.
В сравнении с предшествующим уровнем техники настоящее изобретение имеет следующие преимущества, обусловленные реализацией вышеупомянутого технического решения:
Способ получения ребаудиозида N с применением ферментативного способа в соответствии с настоящим изобретением имеет очень важное прикладное значение. Так как эти микроорганизмы растут намного быстрее, чем растения, с помощью этого способа можно
значительно снизить производственные затраты, сократить цикл производства и значительно улучшить конкурентоспособность продуктов. Кроме того, растения имеют низкое содержание стевиозида, но содержат большое количество стевиозидов с различными структурами. Поэтому экстрагировать чистые продукты достаточно сложно. По сравнению со стандартной методикой экстракции ребаудиозида N из листьев Stevia rebaudiana способом ферментативного синтеза в соответствии с настоящим изобретением можно получить продукты, обладающие более высокой чистотой, что в конечном счете стимулирует исследования и применение нового типа стевиозида - ребаудиозида N.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Формула I и формула II представляют собой структурные формулы ребаудиозида J и ребаудиозида N.
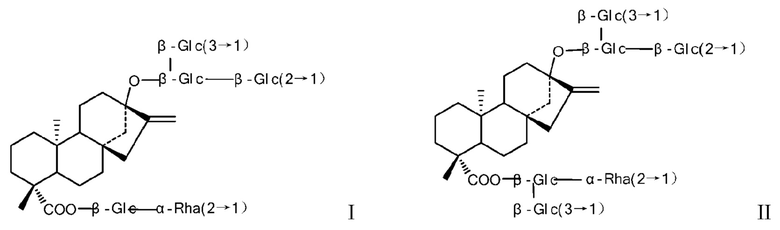
В настоящем изобретении в основном предложены два способа синтеза ребаудиозида N. Первый путь:
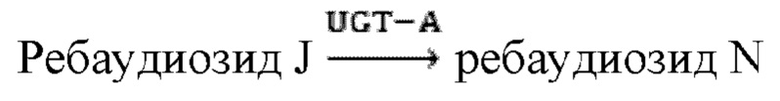
Второй путь:
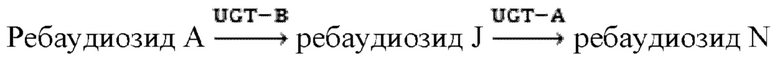
UGT-A или UGT-B, используемые в настоящем изобретении, могут находиться в форме лиофилизированного порошка фермента или находиться в рекомбинантной клетке.
Способ получения UGT-A или UGT-B описан ниже.
Экспрессионные штаммы рекомбинантных Escherichia coli (или других микроорганизмов) получают методом молекулярного клонирования и методом генной инженерии, а затем рекомбинантную Escherichia coli ферментируют для получения рекомбинантных клеток, содержащих UGT-A или UGT-B; или из рекомбинантных клеток получают лиофилизированный порошок UGT-A или UGT-B.
Оба метода: молекулярного клонирования и генной инженерии, описанные в настоящем изобретении, известны. Для получения дополнительных сведений о методе молекулярного клонирования можно обратиться к руководству Molecular Cloning: A laboratory Manual, third version (by Joseph Sambrook, 2005).
Стадии экспрессии описанного в настоящем документе рекомбинантного штамма, сконструированного методом генной инженерии, описаны ниже.
(1) Требуемые фрагменты генов генетически синтезируют (на основе последовательности 1 и последовательности 2 или последовательности 3 и последовательности 4, указанных в перечне последовательностей) и лигируют в вектор pUC57, нагруженный с двух концов сайтами расщепления ферментов NdeI и BamHI.
(2) Путем двойного ферментативного расщепления и соединения фрагменты гена встраивают в соответствующие сайты ферментативного расщепления экспрессионного вектора рТЕ30а таким образом, чтобы гены были помещены под контроль промотора Т7.
(3) Рекомбинантные плазмиды трансформируют и помещают в Escherichia coli BL21 (DE3) и индуцируют экспрессию целевого белка с помощью ИПТГ, так чтобы получить рекомбинантные экспрессионные штаммы Escherichia coli, содержащие UGT-A или UGT-B. Рекомбинантные клетки, содержащие UGT-A или UGT-B, и лиофилизированный порошок UGT-A или UGT-B получают с использованием содержащих UGT-A или UGT-B рекомбинантных экспрессионных штаммов Escherichia coli с помощью следующих стадий: Рекомбинантные экспрессионные штаммы Escherichia coli, содержащие UGT-A или UGT-B, инокулируют в 4 мл жидкой среды Лурия - Бертани (LB) в доле 1%, и среду встряхивают (с частотой 200 об/мин) при 37°С в течение ночи; выдержанную в течение ночи культуру в количестве инокулята 1% переносят в 50 мл жидкой среды LB и инокулируют путем встряхивания (с частотой 200 об/мин) при 37°С до тех пор, пока значение OD600 не достигнет диапазона от 0,6 до 0,8; а затем добавляют изопропилтиогалактозид (ИПТГ) в концентрации 0,4 ммоль/л и инокулируют в течение ночи путем встряхивания при 20°С. После завершения индукции клетки центрифугируют (8000 об/мин и 10 мин) и собирают, клетки ресуспендируют с использованием 5 мл фосфатного буфера 2 ммоль/л (имеющего величину рН 7,0) для получения рекомбинантных клеток. Полученные рекомбинантные клетки дополнительно обрабатывают на ледяной бане и подвергают разрушению ультразвуком. Жидкость после разрушения клеток центрифугируют (8000 об/мин и 10 мин). После этого супернатант собирают и лиофилизируют в течение 24 ч для получения лиофилизированного порошка.
Настоящее изобретение подробно описано ниже со ссылкой на конкретные примеры.
Пример 1. Получение рекомбинантных клеток Escherichia coli, содержащих UGT-A
В соответствии с последовательностью 1 и последовательностью 2, указанными в перечне последовательностей, фрагменты гена UGT-A генетически синтезировали, нагружали с двух концов сайтами расщепления ферментов NdeI и BamHI, соответственно, и соединяли фрагменты генов с вектором pUC57 (производства компании Suzhou GENEWIZ Biotechnology Co., Ltd). Фрагменты гена UGT расщепляли ферментами с использованием эндонуклеаз рестрикции NdeI и BamHI и выделяли очищенные фрагменты. Фрагменты соединяли с соответствующим сайтом ферментативного расщепления вектора рТЕ30а с помощью лигазы Т4, и, таким образом, фрагменты трансформировали в штаммы BL21 (DE3).
Штаммы UGT инокулировали в 4 мл жидкой среды LB в доле 1%, и среду встряхивали (с частотой 200 об/мин) при 37°С в течение ночи; выдержанную в течение ночи культуру в количестве инокулята 1% переносили в 50 мл жидкой среды LB и инкубировали путем встряхивания (с частотой 200 об/мин) при 37°С до тех пор, пока значение OD600 не достигало диапазона от 0,6 до 0,8; а затем добавляли ИПТГ в концентрации 0,4 ммоль/л и проводили инкубацию в течение ночи путем встряхивания при 20°С. После завершения индукции клетки центрифугировали (8000 об/мин и 10 мин) и собирали, клетки ресуспендировали с использованием 5 мл фосфатного буфера 2 ммоль/л (имеющего величину рН 7,0) для получения содержащих UGT-A рекомбинантных клеток.
Пример 2. Получение лиофилизированного порошка UGT-A
Полученные в примере 1 рекомбинантные клетки, содержащие UGT-A, дополнительно обрабатывали на ледяной бане и подвергали разрушению ультразвуком. Жидкость после разрушения клеток центрифугировали (8000 об/мин и 10 мин). После этого супернатант собирали и лиофилизировали в течение 24 ч для получения лиофилизированного порошка UGT-A.
Пример 3. Получение рекомбинантных клеток Escherichia coli, содержащих UGT-B
В соответствии с последовательностью 3 и последовательностью 4, указанными в перечне последовательностей, фрагменты гена UGT-B генетически синтезировали, нагружали с двух концов сайтами расщепления ферментов NdeI и BamHI, соответственно, и соединяли фрагменты генов с вектором pUC57 (производства компании Suzhou GENEWIZ Biotechnology Co., Ltd). Фрагменты гена UGT расщепляли ферментами с использованием эндонуклеаз рестрикции NdeI и BamHI и выделяли очищенные фрагменты. Фрагменты соединяли с соответствующим сайтом ферментативного расщепления вектора рТЕ30а с помощью лигазы Т4, и, таким образом, фрагменты трансформировали в штаммы BL21 (DE3).
Штаммы UGT инокулировали в 4 мл жидкой среды LB в доле 1%, и среду встряхивали (с частотой 200 об/мин) при 37°С в течение ночи; выдержанную в течение ночи культуру в количестве инокулята 1% переносили в 50 мл жидкой среды LB и инкубировали путем встряхивания (с частотой 200 об/мин) при 37°С до тех пор, пока значение OD600 не достигало диапазона от 0,6 до 0,8; а затем добавляли ИПТГ в концентрации 0,4 ммоль/л и проводили инкубацию в течение ночи путем встряхивания при 20°С. После завершения индукции клетки центрифугировали (8000 об/мин и 10 мин) и собирали, клетки ресуспендировали с использованием 5 мл фосфатного буфера 2 ммоль/л (имеющего величину рН 7,0) для получения содержащих UGT-B рекомбинантных клеток.
Пример 4. Получение лиофилизированного порошка UGT-B
Полученные в примере 3 рекомбинантные клетки, содержащие UGT-B, дополнительно обрабатывали на ледяной бане и подвергали разрушению ультразвуком. Жидкость после разрушения клеток центрифугировали (8000 об/мин и 10 мин). После этого супернатант собирали и лиофилизировали в течение 24 ч для получения лиофилизированного порошка UGT-B.
Пример 5. Синтез ребаудиозида N с использованием ребаудиозида J в качестве субстрата реакции в условиях катализа UDP-гликозилтрансферазой (первый путь)
В данном примере ребаудиозид N был каталитически синтезирован с использованием лиофилизированного порошка UGT-A, полученного способом, описанным в примере 2. В этом примере в качестве донора на основе глюкозы использовали систему регенерации UDP-глюкозы, состоящую из сахарозы, синтазы сахарозы из Arabidopsis thaliana (далее называемой AtSUS1) и UDP.
1 л фосфатного буфера 0,05 моль/л (имеющего величину рН 8,0), 0,5 г UDP, 1 г ребаудиозида J, 5 г сахарозы, 10 г лиофилизированного порошка UGT-A и 0,5 г лиофилизированного порошка AtSUS1 последовательно добавляли в реакционную систему и смешивали до однородного состояния, а затем полученный в результате раствор помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. После завершения реакции отбирали 500 мкл реакционного раствора и добавляли в эквивалентный объем безводного метанола до получения однородной смеси, и полученный в результате раствор центрифугировали с частотой 8000 об/мин в течение 10 мин. После этого супернатант фильтровали с помощью мембранного фильтра и исследовали методом высокоэффективной жидкостной хроматографии (условия хроматографирования: хроматографическая колонка: Agilent eclipse SB С18 4,6 × 150 мм; аналитическая длина волны: 210 нм; подвижная фаза: 0,1% раствор муравьиной кислоты : ацетонитрил = 65% : 35%; объемный расход: 1,0 мл/мин; и температура колонки: 30°С). Коэффициент конверсии ребаудиозида J составлял более 90%. В результате очистки путем разделения на силикагелевой смоле, кристаллизации и подобных последующих обработок получили 0,61 г ребаудиозида N, и чистота полученного ребаудиозида N составляла более 95%.
Пример 6. Синтез ребаудиозида N с использованием ребаудиозида А в качестве субстрата реакции в условиях катализа UDP-гликозилтрансферазой (второй путь)
В данном примере ребаудиозид N был каталитически синтезирован с использованием лиофилизированного порошка UGT-A, полученного способом, описанным в примере 2, и лиофилизированного порошка UGT-B, полученного способом, описанным в примере 4.
Реакция на первой стадии: 1 л фосфатного буфера 0,05 моль/л (имеющего величину рН 8,0), 2 г UDP-рамнозила, 1 г ребаудиозида А и 10 г лиофилизированного порошка UGT-B последовательно добавляли в реакционную систему и смешивали до однородного состояния, а затем полученный в результате раствор помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. Реакция на второй стадии: После завершения реакции на первой стадии реакционный раствор кипятили в течение 10 мин, величину рН реакционного раствора доводили до 8,0, добавляли 0,5 г yUDP, 5 г сахарозы, 10 г лиофилизированного порошка UGT-А и 3 г лиофилизированного порошка AtSUSI и смешивали до однородного состояния, а затем полученный в результате раствор помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. После завершения реакции отбирали 500 мкл реакционного раствора и добавляли в эквивалентный объем безводного метанола до получения однородной смеси, и полученный в результате раствор центрифугировали с частотой 8000 об/мин в течение 10 мин. После этого супернатант фильтровали с помощью мембранного фильтра и исследовали методом высокоэффективной жидкостной хроматографии (условия хроматографирования: хроматографическая колонка: Agilent eclipse SB C18 4,6 × 150 мм; аналитическая длина волны: 210 нм; подвижная фаза: 0,1% раствор муравьиной кислоты : ацетонитрил = 65% : 35%; объемный расход: 1,0 мл/мин; и температура колонки: 30°С). Коэффициент конверсии ребаудиозида А составлял более 90%. В результате очистки путем разделения на силикагелевой смоле, кристаллизации и подобных последующих обработок получили 0,58 г ребаудиозида N, и чистота полученного ребаудиозида N составляла более 95%.
Пример 7. Синтез ребаудиозида N с использованием ребаудиозида J в качестве субстрата реакции в условиях катализа содержащими UDP-гликозилтрансферазу рекомбинантными клетками
В данном примере ребаудиозид N был каталитически синтезирован с использованием содержащих UGT-А рекомбинантных клеток, полученных способом, описанным в примере 1.
1 л фосфатного буфера 0,05 моль/л (имеющего величину рН 8,0), 0,5 г UDP, 1 г ребаудиозида J, 5 г сахарозы, 40 г содержащих UGT-A цельных клеток и 10 г содержащих AtSUS1 цельных клеток последовательно добавляли в реакционную систему и смешивали до однородного состояния, а затем полученный в результате раствор помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. После завершения реакции отбирали 500 мкл реакционного раствора и добавляли в эквивалентный объем безводного метанола до получения однородной смеси, и полученный в результате раствор центрифугировали с частотой 8000 об/мин в течение 10 мин. После этого супернатант фильтровали с помощью мембранного фильтра мембраны и исследовали методом высокоэффективной жидкостной хроматографии (условия хроматографирования: хроматографическая колонка: Agilent eclipse SB C18 4,6 × 150 мм; аналитическая длина волны: 210 нм; подвижная фаза: 0,1% раствор муравьиной кислоты : ацетонитрил = 65% : 35%; объемный расход: 1,0 мл/мин; и температура колонки: 30°С). Коэффициент конверсии ребаудиозида J составлял более 90%. В результате очистки путем разделения на силикагелевой смоле, кристаллизации и подобных последующих обработок получили 0,54 г ребаудиозида N, и чистота полученного ребаудиозида N составляла более 95%.
Пример 8. Синтез ребаудиозида N с использованием ребаудиозида А в качестве субстрата реакции в условиях катализа содержащими UDP-гликозилтрансферазу рекомбинантными клетками
Реакция на первой стадии: 1 л фосфатного буфера 0,05 моль/л (имеющего величину рН 8,0), 2 г UDP-рамнозила, 1 г ребаудиозида А и 40 г содержащих UGT-B цельных клеток последовательно добавляли в реакционную систему и смешивали до однородного состояния, затем помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. Реакция на второй стадии: После завершения реакции на первой стадии реакционный раствор кипятили в течение 10 мин, величину рН реакционного раствора доводили до 8,0, добавляли 0,5 г UDP, 5 г сахарозы, 40 г содержащих UGT-A цельных клеток и 10 г содержащих AtSUSI цельных клеток и смешивали до однородного состояния, а затем полученный в результате раствор помещали на водяную баню при 40°С, перемешивали с частотой 300 об/мин и подвергали взаимодействию в течение 24 ч. После завершения реакции отбирали 500 мкл реакционного раствора и добавляли в эквивалентный объем безводного метанола до получения однородной смеси, и полученный в результате раствор центрифугировали с частотой 8000 об/мин в течение 10 мин. После этого супернатант фильтровали с помощью мембранного фильтра и исследовали методом высокоэффективной жидкостной хроматографии (условия хроматографирования: хроматографическая колонка: Agilent eclipse SB C18 4,6 × 150 мм; аналитическая длина волны: 210 нм; подвижная фаза: 0,1% раствор муравьиной кислоты : ацетонитрил = 65% : 35%; объемный расход: 1,0 мл/мин; и температура колонки: 30°С). Коэффициент конверсии ребаудиозида А составлял более 90%. В результате очистки путем разделения на силикагелевой смоле, кристаллизации и подобных последующих обработок получили 0,53 г ребаудиозида N, и чистота полученного ребаудиозида N составляла более 95%.
Приведенные выше примеры предназначены только для описания технических концепций и характеристик настоящего изобретения, чтобы специалист в данной области смог лучше понять описание настоящего изобретения и реализовать на практике настоящее изобретение. Однако эти примеры не следует рассматривать как ограничивающие объем защиты настоящего изобретения. Различные эквивалентные вариации или изменения, сделанные без отступления от сущности и духа настоящего изобретения, считаются входящими в объем защиты настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА C С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2736155C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА J С ПРИМЕНЕНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2016 |
|
RU2736352C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕБАУДИОЗИДА M С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТАТИВНОГО СПОСОБА | 2013 |
|
RU2658436C2 |
| Способ получения ребаудиозида D и ребаудиозида M | 2022 |
|
RU2839979C2 |
| БИОСИНТЕТИЧЕСКОЕ ПОЛУЧЕНИЕ СТЕВИОЛОВОГО ГЛИКОЗИДА РЕБАУДИОЗИДА D4 ИЗ РЕБАУДИОЗИДА E | 2017 |
|
RU2764803C2 |
| СПОСОБЫ И ВЕЩЕСТВА ДЛЯ ОСНОВАННОГО НА РЕКОМБИНАЦИИ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ШАФРАНА | 2012 |
|
RU2676730C2 |
| UDP-ЗАВИСИМАЯ ГЛИКОЗИЛТРАНСФЕРАЗА ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОДУЦИРОВАНИЯ РЕБАУДИОЗИДОВ | 2017 |
|
RU2777901C2 |
| ГИДРОЛИЗ СТЕВИОЛОВЫХ ГЛИКОЗИДОВ С ПОМОЩЬЮ БЕТА-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2775697C2 |
| ПРИМЕНЕНИЕ КАУРЕНОКСИДАЗЫ PISUM SATIVUM ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2018 |
|
RU2795550C2 |
| СПОСОБЫ ФЕРМЕНТАТИВНОГО СИНТЕЗА МОГРОЗИДНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2633644C2 |





Изобретение относится к биотехнологии. Предложен способ получения ребаудиозида N с применением ферментативного способа, включающий использование ребаудиозида А или ребаудиозида J в качестве субстрата и получение субстрата в присутствии донора гликозила в реакции в условиях катализа UDP-гликозилтрансферазой и/или содержащими UDP-гликозилтрансферазу рекомбинантными клетками. Способ позволяет получить ребаудиозид N высокой чистоты с низкой стоимостью в течение короткого производственного цикла. 11 з.п. ф-лы, 8 пр.
1. Способ получения ребаудиозида N с применением ферментативного способа, включающий:
a) реакцию ребаудиозида J в реакционной системе с донором гликозила в присутствии i) рекомбинантных клеток, содержащих UDP-гликозилтрансферазу; или ii) UDP-гликозилтрансферазы, полученной из рекомбинантных клеток, при этом UDP-гликозилтрансфераза в i) или ii) имеет аминокислотную последовательность SEQ ID NO: 2, или
b) реакцию ребаудиозида А в реакционной системе с донором гликозила и донором рамнозила в присутствии i) рекомбинантных клеток, содержащих UDP-гликозилтрансферазу; или ii) UDP-гликозилтрансферазы, полученной из рекомбинантных клеток, при этом UDP-гликозилтрансфераза в i) или ii) имеет аминокислотную последовательность SEQ ID NO: 2, и при этом реакционная система дополнительно содержит UDP-гликозилтрансферазу, которая имеет аминокислотную последовательность SEQ ID NO: 4, и
при этом донор гликозила в а) или b) представляет собой UDP-глюкозу или систему регенерации UDP-глюкозы.
2. Способ по п. 1, в котором система регенерации UDP-глюкозы содержит сахарозу, синтазу сахарозы и UDP, и при этом донор рамнозила представляет собой UDP-рамнозу.
3. Способ по п. 1, в котором UDP-гликозилтрансфераза включает одну из или обе UGT-А из Stevia rebaudiana и UGT-B из Oryza sativa.
4. Способ по п. 1, в котором UDP-гликозилтрансфераза содержит UGT-A из Stevia rebaudiana и UGT-B из Oryza sativa; при этом на первой стадии добавляют UGT-B, а на второй стадии добавляют UGT-A.
5. Способ по п. 1, в котором реакционная система содержит водную фазу системы при температуре 35-45°С и величине рН от 7,5 до 8,5.
6. Способ по п. 5, в котором водная фаза системы представляет собой фосфатный буферный раствор.
7. Способ по п. 5, в котором реакционная система дополнительно содержит агент для пермеабилизации клетки.
8. Способ по п. 7, в котором агент для пермеабилизации клетки представляет собой толуол; и где объемная концентрация толуола составляет 1-3%.
9. Способ по п. 1, в котором рекомбинантная клетка представляет собой клетку микроорганизма.
10. Способ по п. 9, в котором клетка микроорганизма представляет собой одно из Escherichia coli, Saccharomyces cerevisiae или Pichia pastoris.
11. Способ по п. 1, который дополнительно включает очищение ребаудиозида N путем разделения с помощью смолы.
12. Способ по п. 11, в котором ребаудиозид N, очищенный путем разделения с помощью смолы, характеризуется чистотой более чем 95%.
| US 20140357588 A1, 04.12.2014 | |||
| WO 2013176738 A1, 28.11.2013 | |||
| WO 2016028899 A1, 25.02.2016 | |||
| РЕБАУДИОЗИД D ВЫСОКОЙ СТЕПЕНИ ЧИСТОТЫ И ЕГО ПРИМЕНЕНИЕ | 2010 |
|
RU2596190C9 |
Авторы
Даты
2020-11-24—Публикация
2016-10-21—Подача