Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США № 61/521171, поданной 8 августа 2011, предварительной заявки на выдачу патента США № 61/576460, поданной 16 декабря 2011, и предварительной заявки на выдачу патента США № 61/595450, поданной 6 февраля 2012.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам и веществам для основанного на рекомбинации получения соединений из Crocus sativus, растения шафрана, и более конкретно к способам и веществам для основанного на рекомбинации получения корригентов, ароматизаторов и красящих соединений из растения шафрана в рекомбинантном хозяине.
УРОВЕНЬ ТЕХНИКИ
Шафран представляет собой высушенную специю, получаемую в результате экстракции рыльцев цветка Crocus sativus L. и применяемую, как считается, более 3500 лет. Такую специю исторически применяли для многочисленных медицинских целей, но в последнее время широко используют в связи с его красящими свойствами. Кроцетин, один из основных компонентов шафрана, обладает антиоксидантными свойствами, подобными свойствам родственных молекул каротиноидного типа, а также является красителем. Основным пигментом шафрана является кроцин, который представляет собой смесь гликозидов, которые придают желтовато-красную окраску. Основным составляющим компонентом кроцина является α-кроцин, который имеет желтую окраску. Сафраналь считается продуктом процесса сушки и также обладает ароматизирующими свойствами, которые могут быть применимы для приготовления пищи. Сафраналь представляет собой агликоновую форму горькой части экстрактов шафрана, пикрокроцина, который является бесцветным. Таким образом, экстракты шафрана применимы для многих целей, в качестве красителя или корригента, или в связи с их ароматизирующими свойствами.
Растения шафрана выращивают с коммерческими целями во многих странах, включая Италию, Францию, Индию, Испанию, Грецию, Марокко, Турцию, Швейцарию, Израиль, Пакистан, Азербайджан, Китай, Египет, Объединенные Арабские Эмираты, Японию, Австралию и Иран. Иран производит примерно 80% всей ежегодной мировой продукции шафрана (по оценкам более 200 тонн). Сообщалось, что требуется более 150000 цветков для получения 1 кг продукта. Попытки селекции растений для повышения урожайности осложняются триплоидностью генома растений, что приводит к получению стерильных растений. Кроме того, растение цветет в течение только примерно 15 дней, начиная с середины или конца октября. Обычно производство заключается в ручном извлечении рыльцев из цветков, что также является неэффективным способом. Цены, по которым продают шафран, обычно составляют более 1000 долларов/кг шафрана. Привлекательной альтернативой является биологическое превращение или биосинтез de novo компонентов шафрана.
СУЩНОСТЬ ИЗОБЕРТЕНИЯ
Настоящее изобретение основано на открытии способов и веществ для улучшения получения соединений из растения шафрана в рекомбинантных хозяевах, а также полинуклеотидов и полипептидов, применимых для разработки путей рекомбинации для получения таких соединений, как пикрокроцин, сафраналь, кроцин, кроцетин или сложные эфиры кроцетина. Настоящее изобретение также относится к композициям, содержащим кроцетин и сложные эфиры кроцетина. Продукты могут быть получены по отдельности и снова соединены для получения оптимальных характеристик в пищевой системе или для медицинских добавок. В других вариантах соединения могут быть получены в виде смеси. В некоторых вариантах штаммом-хозяином являются рекомбинантные дрожжи. В других вариантах полинуклеотиды, описанные в настоящей публикации, можно использовать в генетике растений и в качестве вспомогательных маркеров в методиках селекции растений.
В одном аспекте отличительным признаком настоящего изобретения является рекомбинантный продуцирующий каротиноиды хозяин (например, микроорганизм), который содержит экзогенную нуклеиновую кислоту, кодирующую диоксигеназу, расщепляющую зеаксантин (ZCD). Хозяин может продуцировать регистрируемые количества кроцетина и/или диальдегида кроцетина и/или гидроксил-β-циклоцитраля (HBC). ZCD может представлять собой ZCD Crocus sativus.
Хозяин может содержать эндогенные гены, кодирующие геранилгеранилдифосфатсинтазу (GGPPS), фитоинсинтазу, фитоиндегидрогеназу и β-каротинсинтазу.
Хозяин дополнительно может содержать по меньшей мере одну экзогенную нуклеиновую кислоту, кодирующую GGPPS, фитоинсинтазу, фитоиндегидрогеназу и β-каротинсинтазу.
Отличительным признаком настоящего изобретения также является рекомбинантный хозяин, содержащий по меньшей мере одну экзогенную нуклеиновую кислоту, кодирующую GGPPS, фитоинсинтазу, фитоиндегидрогеназу, β-каротинсинтазу, β-каротингидроксилазу и расщепляющую зеаксантин диоксигеназу (ZCD) (например ZCD Crocus sativus). Экспрессия по меньшей мере одной экзогенной нуклеиновой кислоты может давать регистрируемые количества кроцетина и/или диальдегида кроцетина в хозяине.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать эндогенный ген, кодирующий альдегиддегидрогеназу, или экзогенную нуклеиновую кислоту, кодирующую альдегиддегидрогеназу (ALD). Альдегиддегидрогеназа может представлять собой альдегиддегидрогеназу Saccharomyces cerevisiae (например, ALD2-ALD6 или HFD1).
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать эндогенный ген, кодирующий β-каротингидроксилазу, или экзогенную нуклеиновую кислоту, кодирующую β-каротингидроксилазу. β-Каротингидроксилаза может представлять собой β-каротингидроксилазу Xanthophyllomyces dendrorhous.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую агликон-O-гликозил-уридин-5'-дифосфо-(UDP)-гликозилтрансферазу (O-гликозил-UGT). Такой хозяин может продуцировать регистрируемые количества пикрокроцина или кроцина. Агликон-O-гликозил-UGT может представлять собой UGT85C2, UGT73-EV12 или гибридный фермент UGT71. Агликон-O-гликозил-UGT также может представлять собой Cs VrUGT2 из Crocus sativus.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую O-гликозил-UGT. Такой хозяин может продуцировать регистрируемые количества сложных моно- и диглюкозиловых эфиров кроцетина. Агликон-O-гликозил-UGT может представлять собой UGT76G1 или гибридный фермент UGT71 (например, 71C125571C2 и/или 71C125571E1).
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую UGT, которая катализирует образование β-глюкозидной связи между двумя остатками глюкозы (например, β-1,6-связи). Такой хозяин может продуцировать регистрируемое количество сложного гентиобиозилового эфира кроцетина. UGT, которая катализирует образование β-глюкозидной связи между двумя остатками глюкозы, может представлять собой гибридный фермент UGT71, такой как 71C125571C2 или 71C125571E1.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую уридин-5'-дифосфоглюкоза-(UDP-глюкоза)-кроцетин-8,8'-глюкозилтрансферазу. Такой хозяин может продуцировать регистрируемое количество моноглюкозида кроцетина. UDP-глюкоза-кроцетин-8,8'-глюкозилтрансфераза может представлять собой UDP-глюкоза-кроцетин-8,8'-глюкозилтрансферазу Crocus.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую UGT, которая катализирует образование β-глюкозидной связи между двумя остатками глюкозы (например, β-1,6-связи). Такой хозяин может продуцировать регистрируемое количество кроцина. UGT, которая катализирует образование β-глюкозидной связи между двумя остатками глюкозы, может представлять собой UGT76G1, UN4522 или UN1761.
Любой из хозяев, описанных в настоящей публикации, может представлять собой микроорганизм, растение или растительную клетку. Микроорганизм может представлять собой жировые дрожжи, Saccharomycete, такие как Saccharomyces cerevisiae, или Escherichia coli. Растением или растительной клеткой может быть растение или растительная клетка Crocus sativus.
Любой из хозяев, описанных в настоящей публикации, может дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую один или несколько ферментов: дезоксиксилулоза-5-фосфатсинтазу (DXS), D-1-дезоксиксилулоза-5-фосфатредуктоизомеразу (DXR), 4-дифосфоцитидил-2-С-метил-D-эритритсинтазу (CMS), 4-дифосфоцитидил-2-С-метил-D-эритриткиназу (СМК), 4-дифосфоцитидил-2-С-метил-D-эритрит-2,4-циклодифосфатсинтазу (MCS), 1-гидрокси-2-метил-2(Е)-бутенил-4-дифосфатсинтазу (HDS), и 1-гидрокси-2-метил-2(Е)-бутенил-4-дифосфатредуктазу (HDR).
Любой из хозяев, описанных в настоящей публикации, может
дополнительно содержать экзогенную нуклеиновую кислоту, кодирующую один или несколько ферментов: укороченную 3-гидрокси-3-метилглутарил(HMG)-CoA-редуктазу (tHMG), мевалонаткиназу (MK), фосфомевалонаткиназу (PMK) и мевалонатпирофосфатдекарбоксилазу (MPPD).
В другом аспекте отличительным признаком настоящего изобретения является способ получения пикрокроцина. Способ включает в себя осуществление контакта HBC с агликон-O-гликозил-UGT и UDP-глюкозой с получением пикрокроцина, при этом агликон-O-гликозил-UGT выбрана из группы, состоящей из UGT85C2, UGT73-EV12 или гибридного фермента UGT71. UGT также может представлять собой Cs VrUGT2.
В еще одном аспекте отличительным признаком настоящего изобретения является выделенная нуклеиновая кислота, кодирующая полипептид UGT73. Полипептид UGT73 может иметь по меньшей мере 80% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3. Отличительным признаком настоящего изобретения также является конструкция нуклеиновой кислоты, содержащая регуляторную область, функционально связанную с такой нуклеиновой кислотой, а также рекомбинантный хозяин, содержащий такую нуклеиновую кислоту или конструкцию нуклеиновой кислоты.
В другом аспекте отличительным признаком настоящего изобретения является выделенный полипептид, имеющий по меньшей мере 80% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3. Полипептид может иметь по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3. Полипептид может иметь по меньшей мере 95% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3. Полипептид может иметь аминокислотную последовательность UGT73, указанную на фиг. 3.
В другом аспекте отличительным признаком настоящего изобретения является выделенный полипептид, имеющий аминокислотную последовательность, указанную на фиг. 9, и нуклеиновая кислота, кодирующая такой полипептид.
Отличительным признаком настоящего изобретения также является способ получения кроцетина. Способ включает в себя осуществление контакта диальдегида кроцетина с альдегиддегидрогеназой с получением кроцетина.
Другой аспект изобретения относится к синтетической последовательности ДНК, которая указана в SEQ ID NO:58, кодирующей аминокислотную последовательность, которая указана в SEQ ID NO:57.
В еще одном аспекте отличительным признаком изобретения является синтетическая последовательность ДНК, которая указана в SEQ ID NO:65, кодирующая аминокислотную последовательность, которая указана в SEQ ID NO:66.
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такие же значения, которые обычно подразумевает специалист в области, к которой относится изобретение. Хотя при практическом осуществлении изобретения можно использовать способы и вещества, сходные или эквивалентные способам и веществам, описанным в настоящей публикации, ниже описаны подходящие способы и вещества. Все публикации, заявки на выдачу патентов, патенты и другие ссылки, упоминаемые в настоящем описании, включены путем ссылки в полном объеме. В случае конфликта, настоящее описание, включая определения, будет подвергнуто проверке. Кроме того, вещества, способы и примеры являются только иллюстративными и не предназначены для ограничения. Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания. Заявители сохраняют за собой право на альтернативное описание раскрытого изобретения с использованием переходной фразы «содержащий», «по существу состоящий из» или «состоящий из» согласно стандартной практике патентного права.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 является схемой пути биосинтеза от IPP до β-каротина.
Фиг. 2 является схемой путей биосинтеза у шафрана.
На фиг. 3 показаны нуклеотидные и аминокислотные последовательности UGT88B1 (SEQ ID NO: 1 и 2), UGT76G1 (SEQ ID NO: 3 и 4), UGT74G1 (SEQ ID NO: 5 и 6), UGT91D2e (SEQ ID NO: 7 и 8), UGT85C2 (SEQ ID NO: 9 и 10) и UGT73 (SEQ ID NO: 11 и 12) Stevia rebaudiana, UGT2 (SEQ ID NO: 13 и 14) Catharanthus roseus, UGT75B1 (SEQ ID NO: 15 и 16) Arabidopsis thaliana и двух гибридных UGT A. thaliana (гибридного фермента 1 UGT71: 71C125571C2, SEQ ID NO: 17 и 18) и гибридного фермента 2 UGT71: 71С125571Е1, SEQ ID NO: 19 и 20).
Фиг. 4 является схемой, на которой изображено, что аминокислотные последовательности UGT UN1761, UN3356, UN4522, UN4666, UN6460 и UN2281 образуют кластер с известнымипоследовательностями UGT91.
На фиг. 5 представлены последовательности UGT, идентифицированных в примере 4 (UN6338, SEQ ID NO: 21; UN4666, SEQ ID NO: 22 (ДНК) и 23 (аминокислотная); UN3356, SEQ ID NO: 24 (ДНК) и 25 (аминокислотная); UN6428, SEQ ID NO: 26; UN3131, SEQ ID NO: 27; UN1761, SEQ ID NO: 28 (ДНК) и 29 (аминокислотная); UN4522, SEQ ID NO: 30 (ДНК) и 31 (аминокислотная); UN6460, SEQ ID NO: 32 (ДНК) и 33 (аминокислотная); UN2281, SEQ ID NO: 34 (ДНК) и 35 (аминокислотная); и UN2644, SEQ ID NO: 36).
На фиг. 6 представлены последовательности оптимизированных по кодонам нуклеотидных последовательностей для экспрессии EUGT1-EUGT19 в Saccharomyces cerevisiae (источник: DNA 2.0>), SEQ ID NO: 37-55.
На фиг. 7 представлены нуклеотидная (SEQ ID NO: 56) и аминокислотная (SEQ ID NO: 57) последовательности глюкозилтрансферазы 2 (UGT2) Crocus sativus (номер доступа в GenBank AY262037.1), а также оптимизированная по кодонам последовательность нуклеиновой кислоты (SEQ ID NO: 58).
На фиг. 8 представлены оптимизированные по кодонам последовательности генов, используемые в примере 6 (SEQ ID NO: 59-64). Последовательность, указанная строчными буквами, является чужеродной по отношению к кодирующей области и использована в целях клонирования.
На фиг. 9 представлены оптимизированные по кодонам нуклеотидные последовательности (источник: GenScript) (SEQ ID NO: 65) и аминокислотная последовательность (SEQ ID NO: 66) варианта UGT Crocus (Cs VrUGT2), используемого в примере 8.
На фиг. 10 показаны выравнивание CsUGT2 (номер доступа в GenBank: AY262037.1) и варианта Cs VrUGT2 из Crocus sativus, а также аминокислотная последовательность каждого полипептида (SEQ ID NO:57 и 66).
На фиг. 11 представлены нуклеотидные последовательности, кодирующие альдегиддегидрогеназу (ALD) 2, ALD3, ALD4, ALD5, ALD6 и HFD1 (также предположительно являющуюся альдегиддегидрогеназой) (SEQ ID NO:67-72).
Сходные условные обозначения на разных чертежах указывают сходные элементы.
ПОДРОБНОЕ ОПИСАНИЕ
Различные сложные эфиры кроцетина ответственны за красящие свойства экстрактов шафрана. Кроцетин представляет собой дитерпен, образованный из C18-остова с 2 группами карбоновой кислоты на каждом конце. Кроцетин образуется в каротиноидном пути, включающем β-каротин и зеаксантин (см. фиг. 2). Основным пигментом шафрана является кроцин, сложный диэфир кроцетина с двумя остатками гентиобиозы (дигентиобиозид). Кроцин является преобладающей формой сложных эфиров кроцетина. Другие гликозидные формы кроцетина (также называемого α-кроцетин или кроцетин-1), включают гентиобиозид, глюкозид, гентиоглюкозид и диглюкозид. γ-Кроцетин в форме сложного моно- или диметилового эфира также присутствует в шафране наряду с 13-цис-изомером кроцетина и транс-изомером кроцетина.
Пикрокроцин, который является бесцветным, ответственен за горький вкус шафрана. Он представляет собой монотерпеновый альдегид, получаемый из зеаксантина через HBC. Деглюкозилирование пикрокроцина приводит к образованию сафраналя (4-гидрокси-2,4,4-триметил-1-циклогексен-1-карбоксальдегида или дегидро-β-циклоцитраля), основного ароматического компонента специи шафрана.
Экстракты шафрана также содержат воски и жиры, белок, эфирные масла, антоцианины, флавоноиды, витамины (рибофлавин и тиамин), аминокислоты, крахмал, минералы, камеди. Монотерпеновые альдегиды и родственные изофорону соединения являются летучими компонентами шафрана, наряду с сафраналем.
Настоящий документ основан на открытии того, что могут быть разработаны рекомбинантные хозяева, такие как растительные клетки, растения или микроорганизмы, которые экспрессируют полипептиды, применимые для биосинтеза соединений из шафрана, таких как кроцетин, диальдегид кроцетина, пикрокроцин, кроцин или сафраналь. Такие хозяева могут экспрессировать расщепляющую зеаксантин диоксигеназу (ZCD) (также называемую расщепляющей зеаксантин оксигеназой (ZCO) (например, из Crocus sativus), и в некоторых вариантах одну или несколько уридин-5'-дифосфо(UDP)-гликозилтрансфераз. Экспрессия таких биосинтетических полипептидов в разных микробиологических каркасах позволяет получать соединения из шафрана, такие как кроцетин, диальдегид кроцетина, пикрокроцин, кроцин или сафраналь, постоянным и воспроизводимым образом из таких источников энергии и углерода, как сахара, глицерин, CO2, H2 и солнечный свет. Долю каждого соединения, продуцируемого рекомбинантным хозяином, можно специально подбирать посредством включения предварительно отобранных ферментов биосинтеза в хозяев и экспрессии их на соответствующих уровнях.
По меньшей мере один из генов является рекомбинантным геном, при этом конкретный рекомбинантный ген(гены) зависит от вида или штамма, выбранного для применения. Могут быть включены дополнительные гены или модули для биосинтеза, чтобы увеличить выход соединений, повысить эффективность, с которой источники энергии и углерода превращаются в соединения шафрана, и/или чтобы повысить продуктивность культуры клеток или растения. Такие дополнительные модули для биосинтеза включают в себя гены, вовлеченные в синтез предшественников терпеноидов, изопентилдифосфата и диметилаллилдифосфата. Дополнительные модули для биосинтеза включают в себя гены терпенсинтазы и терпенциклазы, такие как гены, кодирующие геранилгеранилдифосфатсинтазу, и гены, кодирующую ферменты, вовлеченные в синтез каротиноидов; такие гены могут быть эндогенными генами или рекомбинантными генами (например, экзогенной нуклеиновой кислотой).
От глюкозы до IPP
В некоторых вариантах рекомбинантный хозяин, описанный в настоящей публикации, экспрессирует рекомбинантные гены, вовлеченные в биосинтез дитерпенов или продукцию предшественников терпеноидов, например, гены пути метилэритрит-4-фосфата (MEP) или мевалоната (MEV). Например, рекомбинантный хозяин может содержать один или несколько генов, кодирующих ферменты, вовлеченные в путь MEP для биосинтеза изопреноида. Ферменты пути MEP включают дезоксиксилулоза-5-фосфатсинтазу (DXS), D-1-дезоксиксилулоза-5-фосфатредуктоизомеразу (DXR), 4-дифосфоцитидил-2-C-метил-D-эритритсинтазу (CMS), 4-дифосфоцитидил-2-C-метил-D-эритриткиназу (CMK), 4-дифосфоцитидил-2-C-метил-D-эритрит-2,4-циклодифосфатсинтазу (MCS), 1-гидрокси-2-метил-2(E)-бутенил-4-дифосфатсинтазу (HDS) и 1-гидрокси-2-метил-2(E)-бутенил-4-дифосфатредуктазу (HDR). Один или несколько генов DXS, генов DXR, генов CMS, генов CMK, генов MCS, генов HDS и/или генов HDR могут быть включены в рекомбинантный микроорганизм. См. публикацию Rodriguez-Conception and Boronat, Plant Phys. 130: 1079-1089 (2002).
Подходящие гены, кодирующие полипептиды DXS, DXR, CMS, CMK, MCS, HDS и/или HDR, включают гены E. coli, Arabidopsis thaliana и Synechococcus leopoliensis. Нуклеотидные последовательности, кодирующие полипептиды DXR, описаны, например, в патенте США № 7335815.
В некоторых вариантах рекомбинантный хозяин содержит один или несколько генов, кодирующих ферменты, вовлеченные в путь мевалоната для биосинтеза изопреноида. Гены, подходящие для превращения в хозяина, кодируют ферменты пути мевалоната, такие как укороченная 3-гидрокси-3-метилглутарил(HMG)-CoA-редуктаза (tHMG), и/или ген, кодирующий мевалонаткиназу (MK), и/или ген, кодирующий фосфомевалонаткиназу (PMK), и/или ген, кодирующий мевалонатпирофосфатдекарбоксилазу (MPPD). Таким образом, один или несколько генов HMG-CoA-редуктазы, генов MK, генов PMK и/или генов MPPD могут быть включены в рекомбинантного хозяина, такого как микроорганизм.
Известны подходящие гены, кодирующие полипептиды пути мевалоната. Например, подходящие полипептиды включают полипептиды, продуцируемые в E. coli, Paracoccus denitrificans, Saccharomyces cerevisiae, Arabidopsis thaliana, Kitasatospora griseola, Homo sapiens, Drosophila melanogaster, Gallus gallus, Streptomyces sp. KO-3988, Nicotiana attenuata, Kitasatospora griseola, Hevea brasiliensis, Enterococcus faecium и Haematococcus pluvialis. См., например, патенты США №№ 7183089, 5460949 и 5306862.
От IPP до β-каротина
В некоторых вариантах рекомбинантный хозяин, описанный в настоящей публикации, экспрессирует гены, вовлеченные в путь биосинтеза от IPP до β-каротина (фиг. 1). Гены могут быть эндогенными для хозяина (т.е. хозяин в природе продуцирует каротиноиды) или могут быть экзогенными, например, рекомбинантный ген (т.е. хозяин в природе не продуцирует каротиноиды). Первая стадия в пути биосинтеза от IPP до β-каротина катализируется геранилгеранилдифосфатсинтазой (GGPPS или также известной как GGDPS, GGDP-синтаза, геранилгеранилпирофосфатсинтетаза или CrtE), имеющая классификационный номер EC 2.5.1.29. В реакции, катализируемой EC 2.5.1.29, транс,транс-фарнезилдифосфат и изопентенилдифосфат превращаются в дифосфат и геранилгеранилдифосфат. Таким образом, в некоторых вариантах рекомбинантный хозяин содержит нуклеиновую кислоту, кодирующую GGPPS. Известны подходящие полипептиды GGPPS. Например, не ограничивающие подходящие ферменты GGPPS включают ферменты, продуцируемые в Stevia rebaudiana, Gibberella fujikiiroi, Mus musculus, Thalassiosira pseudonana, Xanthophyllomyces dendrorhous, Streptomyces clavuligerus, Sulfulobus acidicaldarius, Synechococcus sp. и Arabidopsis thaliana. См. номера доступа в GenBank ABD92926, CAA75568, AAH69913, XP_002288339, ZP_05004570, BAA43200, ABC98596 и NP_195399.
Следующая стадия в пути, изображенном на фиг.1, катализируется фитоинсинтазой или CrtB, имеющей классификационный номер EC 2.5.1.32. В указанной реакции, катализируемой EC 2.5.1.32, взаимодействуют две молекулы геранилгеранилдифосфата с образованием у молекул 2 пирофосфата и фитоина. Указанную стадию также могут катализировать ферменты, известные как фитоин-β-каротинсинтаза или CrtYB. Таким образом, в некоторых вариантах рекомбинантный хозяин содержит нуклеиновую кислоту, кодирующую фитоинсинтазу. Не ограничивающие примеры подходящих фитоинсинтаз включают фитоин-β-каротинсинтазу X. dendrorhous.
Следующая стадия биосинтеза β-каротина катализируется фитоиндегидрогеназой, также известной как фитоиндесатураза или CrtI. Указанный фермент превращает фитоин в ликопин. Таким образом, в некоторых вариантах рекомбинантный хозяин содержит нуклеиновую кислоту, кодирующую фитоиндегидрогеназу. Не ограничивающие примеры подходящих фитоиндегидрогеназ включают фитоиндесатуразу Neurospora crassa (номер доступа в GenBank XP_964713). Такие ферменты также в большом количестве найдены в растениях и цианобактериях.
β-Каротин образуется из ликопина с участием фермента β-каротинсинтазы, также называемого CrtY или CrtL-b. Указанную стадию также может катализировать многофункциональный CrtYB. Таким образом, в некоторых вариантах рекомбинантный хозяин содержит нуклеиновую кислоту, кодирующую β-каротинсинтазу.
От β-каротина до соединений зеаксантина и шафрана
Фиг. 2 иллюстрирует пути от β-каротина до различных соединений шафрана.
На начальной стадии β-каротин превращается в зеаксантин. Такое превращение катализируется β-каротингидроксилазой (BCH), которая превращает β-каротин в β-криптоксантин, который затем дополнительно взаимодействует с образованием зеаксантина. Такой фермент также известен как CrtZ. Подходящие β-каротингидроксилазы доступны из Xanthophyllomyces dendrorhous, Arabidopsis thaliana, Adonis aestivalis, а также ряда других продуцирующих каротиноиды микроорганизмов.
Зеаксантин превращается в гидроксил-β-циклоцитраль (HBC) и диальдегид кроцетина посредством фермента расщепляющей зеаксантин диоксигеназы (ZCD) (также известной как расщепляющая зеаксантин оксигеназа (ZCO)). Подходящая ZCD доступна из растения Crocus sativa. См. пример 6. На фиг. 8 показана оптимизированная по кодонам генная последовательность, кодирующая подходящую ZCD.
HBC превращается в пикрокроцин ферментом агликон-O-гликозил-UGT, который использует UDP-глюкозу в качестве донора глюкозы. Подходящие UGT включают UGT85C2 из Stevia rebaudiana, гомолог 73 Stevia, и две гибридных UGT семейства UGT 71. См. фиг. 3, на которой показаны нуклеотидные и аминокислотные последовательности таких UGT (SEQ ID NO:1-20). Также можно использовать вариант Cs UGT2 (см. фиг. 9 и 10). Указанные ферменты обозначены UGTb на фиг. 2. Обратная реакция катализируется неизвестной глюкозидазой. Чтобы улучшить выходы и титры продуцирования пикрокроцина, может быть желательным нокаут функции β-глюкозидазы в выбранном организме-хозяине.
Сафраналь образуется спонтанно во время обработки шафрана, при этом неизвестно, является ли это следствием физических превращений или требуется катализ ферментом или ферментами. Неизвестно, может ли HBC непосредственно превращаться в сафраналь в результате дегидратации, или пикрокроцин является промежуточным соединением.
Диальдегид кроцетина вероятно превращается в кроцетин в растении шафрана с помощью альдегиддегидрогеназы (ADH), также известной как альдегидоксидоредуктаза. Как описано в примере 9, S. cerevisiae имеет множественные эндогенные гены альдегиддегидрогеназы, которую можно использовать для превращения диальдегида в форму карбоксилата без введения гетерологичных генов. См. пример 9.
Второй стадией образования кроцина является добавление остатков глюкозы к карбоновым кислотам на концах молекулы кроцетина. Было показано, что UGT2 Crocus sativus (CsUGT2) превращает кроцетин в моноглюкозиды кроцетина (многлюкозиловый сложный эфир кроцетина или дигликозиловый сложный эфир кроцетина). Такой фермент имеет классификационный номер EC 2.4.1, уридин-5'-дифосфоглюкоза(UDP-глюкоза)кроцетин-8,8'-глюкозилтрансфераза. Соответственно, рекомбинантный хозяин может содержать нуклеиновую кислоту, кодирующую UGT2. См. фиг. 7, на которой показаны последовательность нуклеиновой кислоты и аминокислотная последовательность UGT2 Crocus sativus и оптимизированная по кодонам последовательность нуклеиновой кислоты. Номер доступа для CsUGT2 в GenBank AY262037.1.
Рекомбинантный хозяин также может содержать UGT Crocus sativus (Cs VrUGT2), которая катализирует образование сложных эфиров глюкозы (моноглюкозиловый сложный эфир кроцетина или дигликозиловый сложный эфир кроцетина) из кроцетина. См. пример 8. Аминокислотная последовательность Cs VrUGT2 представлена на фиг. 9. Также см. фиг. 10, на которой показано выравнивание Cs VrUGT2 и Cs UGT2.
Рекомбинантный хозяин также может содержать UGT, которая катализирует образование β-глюкозидной связи (например, β-1,6-глюкозидной связи) между двумя остатками глюкозы, так что может быть образован кроцин из диальдегида кроцетина. Такая UGT обозначена как UGTa на фиг. 2. Соответственно, рекомбинантный хозяин может содержать нуклеиновую кислоту, кодирующую UGT2. Показано, что UGT Stevia rebaudiana, UGT76G1, способна образовывать сложный эфир кроцетина с четырьмя остатками глюкозы. См. пример 4. Может быть осуществлена характеристика изомеров, если продуктом является кроцин или аналог кроцина.
Было показано, что три UGT, UGT76G1 из Stevia rebaudiana и два фермента UN1761 и UN4522 из Crocus способны образовывать сложный эфир кроцетина с четырьмя остатками глюкозы. См. пример 4. В случае UGT76G1 Stevia может быть определена характеристика изомеров, если продуктом является кроцин или аналог кроцина. Аминокислотная последовательность каждого фермента UN1761 и UN4522 указана на фиг. 5.
Рекомбинантный хозяин также может содержать UGT, которая катализирует агликон кроцетин на любом одном конце или на обоих карбоксильных концах. Показано, что три UGT UGT76G1 или гибридные ферменты UGT71 (71C125571C2 и 71C125571E1) образуют сложные моно- и диглюкозиловые эфиры из кроцетина. См. пример 7.
Рекомбинантный хозяин также может содержать UGT, которая катализирует образование сложного гентиобиозилового эфира непосредственно из кроцетина. Показано, что два гибридных фермента UGT UGT71 (71C125571C2 и 71C125571E1) образуют сложный гентиобиозиловый эфир из кроцетина. См. пример 7.
Функциональные гомологи
Функциональные гомологи полипептидов, описанных выше, также подходят для применения с целью получения соединений шафрана в рекомбинантном хозяине. Функциональный гомолог представляет собой полипептид, который имеет сходство последовательностей с эталонным полипептидом и который осуществляет одну или несколько биохимических или физиологических функций эталонного полипептида. Функциональный гомолог и эталонный полипептид могут быть встречающимися в природе полипептидами, и сходство последовательностей может быть следствием конвергентных или дивергентных эволюционных событий. Соответственно, функциональные гомологи иногда называют в литературе гомологами или ортологами, или паралогами. Варианты встречающегося в природе функционального гомолога, такого как полипептиды, кодируемые мутантами кодирующей последовательности дикого типа, сами по себе могут быть функциональными гомологами. Функциональные гомологи также могут быть созданы в результате сайт-специфичного мутагенеза кодирующей последовательности полипептида или в результате объединения доменов из последовательностей, кодирующих разные встречающиеся в природе полипептиды («перестановка доменов»). Способы модификации генов, кодирующих функциональные полипептиды UGT, описанные в настоящей публикации, известны и включают, наряду с прочими, способы направленной эволюции, способы сайт-специфичного мутагенеза и способы случайного мутагенеза, и могут быть применимы для повышения удельной активности полипептида, изменения субстратной специфичности, изменения уровней экспрессии, изменения субклеточной локализации или модификации взаимодействий полипептид:полипептид требуемым образом. Такие модифицированные полипептиды считают функциональными гомологами. Термин «функциональный гомолог» иногда применяют по отношению к нуклеиновой кислоте, которая кодирует функционально гомологичный полипептид.
Функциональные гомологи можно идентифицировать путем анализа, основанного на выравнивании нуклеотидных и полипептидных последовательностей. Например, осуществляя запрос в базе данных нуклеотидных или полипептидных последовательностей, можно идентифицировать гомологи полипептидов, описанных в настоящей публикации. Анализ последовательностей может включать анализ BLAST, реципрокный анализ BLAST или анализ PSI-BLAST неизбыточных баз данных с использованием представляющей интерес аминокислотной последовательности в качестве эталонной последовательности. В некоторых случаях аминокислотную последовательность рассчитывают на основании нуклеотидной последовательности. Такие полипептиды в базе данных, которые имеют более чем 40% идентичность последовательности, являются кандидатами для дальнейшей оценки их пригодности в качестве полипептида, применимого в синтезе соединений шафрана. Сходство аминокислотных последовательностей обеспечивает возможность консервативных аминокислотных замен, таких как замена одного гидрофобного остатка другим или замена одного полярного остатка другим. При необходимости может быть осуществлен просмотр таких кандидатов вручную, чтобы сузить количество кандидатов для дальнейшей оценки. Просмотр в ручном режиме можно осуществлять, отбирая таких кандидатов, которые, по-видимому, имеют консервативные функциональные домены.
Консервативные области могут быть идентифицированы по положению области в первичной аминокислотной последовательности полипептида, описанного в настоящей публикации, которая представляет собой повторяющуюся последовательность, образует определенную вторичную структуру (например, спирали и бета-слои), образует положительно или отрицательно заряженные домены или представляет собой мотив или домен белка. См., например, веб-сайт Pfam, на котором описаны консенсусные последовательности множества белковых мотивов и доменов, во Всемирной сети на сайтах sanger.ac.uk/Software/Pfam/ и pfam.janelia.org/. Информация, включенная в базу данных Pfam, описана в публикациях Sonhhammer et al., Nucl. Acids Res., 26:320-322 (1998); Sonnhammer et al, Proteins, 28:405-420 (1997); and Bateman et al, Nucl. Acids Res., 27:260-262 (1999). Консервативные области также могут быть определены при выравнивании последовательностей одинаковых или родственных полипептидов из близкородственных видов. Близкородственные виды предпочтительно относятся к одному и тому же семейству. В некоторых вариантах выравнивание последовательностей из двух разных видов является достаточным.
Обычно полипептиды, которые имеют по меньшей мере примерно 40% идентичность аминокислотной последовательности, применимы для идентификации консервативных областей. Консервативные области родственных полипептидов имеют по меньшей мере 45% идентичность аминокислотной последовательности (например, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% идентичность аминокислотной последовательности). В некоторых вариантах консервативная область имеет по меньшей мере 92%, 94%, 96%, 98% или 99% идентичность аминокислотной последовательности.
Идентичность в процентах для любой нуклеиновой кислоты или полипептида, являющихся кандидатами, относительно эталонной нуклеиновой кислоты или полипептида может быть определена следующим образом. Эталонную последовательность (например, последовательность нуклеиновой кислоты или аминокислотную последовательность) выравнивают с одной или несколькими последовательностями-кандидатами, используя компьютерную программу ClustalW (версия 1.83, параметры по умолчанию), которая позволяет осуществлять выравнивание последовательностей нуклеиновой кислоты или полипептида по всей длине (глобальное выравнивание). Chenna et al., Nucleic Acids Res., 31(13):3497-500 (2003).
ClustalW вычисляет наилучшее совпадение между эталонной и одной или несколькими исследуемыми последовательностями и выравнивает их так, чтобы можно было определить идентичность, сходство и различия. Могут быть встроены пробелы вместо одного или нескольких остатков в эталонную последовательность, исследуемую последовательность или в обе последовательности, чтобы максимизировать выравнивание последовательностей. Для быстрого попарного выравнивания последовательностей нуклеиновых кислот используют следующие параметры по умолчанию: размер слова: 2; размер окна: 4; способ оценки: проценты; количество лучших диагоналей: 4; и штраф за пробел: 5. В случае множественного выравнивания последовательностей нуклеиновых кислот используют следующие параметры: штраф за открытие пробела: 10,0; штраф за удлинение пробела: 5,0; и взвешенные транзиции: да. В случае быстрого попарного выравнивания последовательностей белков используют следующие параметры: размер слов: 1; размер окна: 5; способ оценки: проценты; количество лучших диагоналей: 5; штраф за пробел: 3. В случае множественного выравнивания последовательностей белков используют следующие параметры: матрица весов: blosum; штраф за открытие пробела: 10,0; штраф за удлинение пробела: 0,05; гидрофильные пробелы: включено; гидрофильные остатки: Gly, Pro, Ser, Asn, Asp, Gln, Glu, Arg и Lys; штраф за пробелы, специфичные для остатков: включено. Результатом ClustalW является выравнивание последовательностей, которое отражает взаимосвязь между последовательностями. ClustalW может быть использована для работы, например, на сайте Search Launcher Бэйлорского медицинского колледжа во Всемирной сети (searchlauncher.bcm.tmc.edu/multi-align/multi-align.html) и на сайте Европейского институт биоинформатики во Всемирной сети (ebi.ac.uk/clustalw).
Чтобы определить идентичность в процентах выбранной в качестве кандидата последовательности нуклеиновой кислоты или аминокислотной последовательности с эталонной последовательностью, последовательности выравнивают, используя ClustalW, количество идентичных совпадений при выравнивании делят на длину эталонной последовательности и результат умножают на 100. Следует отметить, что значение идентичности в процентах можно округлять до ближайшей десятой доли. Например, 78,11, 78,12, 78,13 и 78,14 округляют до 78,1, тогда как 78,15, 78,16, 78,17, 78,18 и 78,19 округляют до 78,2.
Будет понятно, что полипептиды, описанные в настоящей публикации, могут содержать дополнительные аминокислоты, которые не вовлечены в гликозилирование или другие ферментативные активности, осуществляемые ферментом, и поэтому такой полипептид может быть более длинным, чем он мог бы быть в ином случае. Например, полипептид может содержать метку для очистки (например, HIS-метку или GST-метку), транзитный пептид хлоропластов, транзитный пептид митохондрий, амилопластный пептид, сигнальный пептид или метку секреции, добавляемую к аминоконцу или карбоксильному концу. В некоторых вариантах полипептид содержит аминокислотную последовательность, которая функционирует в качестве репортера, например, зеленый флуоресцирующий белок или желтый флуоресцирующий белок.
Нуклеиновые кислоты
Рекомбинантный ген, кодирующий полипептид, описанный в настоящей публикации, содержит кодирующую последовательность для такого полипептида, функционально связанную в смысловой ориентации с одной или несколькими регуляторными областями, подходящими для экспрессии полипептида. Поскольку многие микроорганизмы способны экспрессировать множественные генные продукты с полицистронной мРНК, в случае таких микроорганизмов множественные полипептиды могут экспрессироваться, при необходимости, под контролем одной регуляторной области. Считают, что кодирующая последовательность и регуляторная область функционально связаны, когда регуляторная область и кодирующая последовательность расположены так, что регуляторная область эффективно регулирует транскрипцию или трансляцию последовательности. Обычно сайт инициации трансляции трансляционной рамки считывания кодирующей последовательности расположен на расстоянии от одного до примерно пятидесяти нуклеотидов ниже регуляторной области моноцистронного гена.
Во многих случаях кодирующую последовательность для полипептида, описанного в настоящей публикации, идентифицируют у другого вида, отличного от рекомбинантного хозяина, т.е. гетерологичную нуклеиновую кислоту. Таким образом, если рекомбинантным хозяином является микроорганизм, то кодирующая последовательность может быть из других прокариотических или эукариотических микроорганизмов, из растений или из животных. Однако в некоторых случаях кодирующая последовательность представляет собой последовательность, которая является нативной для хозяина и реинтродуцирована в такой организм. Нативная последовательность часто может отличаться от встречающейся в природе последовательности наличием неприродных последовательностей, связанных с экзогенной нуклеиновой кислотой, например, ненативных регуляторных последовательностей, фланкирующих нативную последовательность в рекомбинантной конструкции нуклеиновой кислоты. Кроме того, стабильно трансформированные экзогенные нуклеиновые кислоты обычно интегрируют в других положениях, отличных от положения, в котором встречается нативная последовательность.
«Регуляторная область» относится к нуклеиновой кислоте, имеющей нуклеотидные последовательности, которые влияют на инициацию и скорость транскрипции или трансляции и стабильность и/или подвижность продукта транскрипции или трансляции. Регуляторные области включают, без ограничения, промоторные последовательности, энхансерные последовательности, отвечающие элементы, сайты узнавания белка, индуцируемые элементы, последовательности связывания белка, 5'- и 3'-нетранслируемые области (UTR), сайты старта транскрипции, последовательности терминации, последовательности полиаденилирования, интроны и их сочетания. Регуляторная область обычно содержит, по меньшей мере, коровый (базовый) промотор. Регуляторная область также может содержать по меньшей мере один регуляторный элемент, такой как энхансерная последовательность, выше расположенный элемент или ниже расположенную область активации (UAR). Регуляторная область функционально связана с кодирующей последовательностью в результате расположения регуляторной области и кодирующей последовательности так, чтобы регуляторная область была эффективной в регуляции транскрипции или трансляции последовательности. Например, чтобы функционально связать кодирующую последовательность и промоторную последовательность, сайт инициации трансляции трансляционной рамки считывания кодирующей последовательности обычно располагают на расстоянии от одного до примерно пятидесяти нуклеотидов ниже промотора. Однако регуляторная область может быть расположена на расстоянии примерно до 5000 нуклеотидов выше сайта инициации трансляции или примерно на 2000 нуклеотидов выше сайта старта транскрипции.
Выбор включаемых регуляторных областей зависит от нескольких факторов, включая, без ограничения, эффективность, избирательность, индуцируемость, требуемый уровень экспрессии и предпочтительную экспрессию во время определенных стадий культивирования. Для специалиста в данной области обычной практикой является модулирование экспрессии кодирующей последовательности в результате соответствующего отбора и расположения регуляторных областей по отношению к кодирующей последовательности. Будет понятно, что могут присутствовать более одной регуляторной области, например, интроны, энхансеры, вышерасположенные области активации, терминаторы транскрипции и индуцируемые элементы.
Один или несколько генов можно сочетать в рекомбинантной конструкции нуклеиновой кислоты в «модулях», применимых для отдельного аспекта продуцирования соединения шафрана. Объединение множества генов в модуль, в частности, в полицистронный модуль, облегчает применение модулей в разных видах. Например, расщепляющую зеаксантин диоксигеназу или кластер генов UGT можно объединять в полицистронном модуле так, чтобы после вставки подходящей регуляторной области модуль можно было вводить в широкое множество видов. В качестве другого примера, кластер генов UGT можно объединять так, чтобы каждая кодирующая последовательность UGT была функционально связана с отдельной регуляторной областью для образования модуля UGT. Такой модуль можно использовать для таких видов, в случае которых необходима или желательна моноцистронная экспрессия. Кроме генов, применимых для получения соединений шафрана, рекомбинантная конструкция обычно также содержит начало репликации и один или несколько селектируемых маркеров для поддержания конструкции в соответствующем виде.
Один вариант осуществления настоящего изобретения относится к синтетической последовательности ДНК, которая указана в SEQ ID NO:58, кодирующей аминокислотную последовательность, которая указана в SEQ ID NO:57.
Другой вариант осуществления настоящего изобретения относится к синтетической последовательности ДНК, которая указана в SEQ ID NO:65, кодирующей аминокислотную последовательность, которая указана в SEQ ID NO:66.
Другой вариант осуществления настоящего изобретения относится к кассете экспрессии ДНК, содержащей выделенную нуклеиновую кислоту, кодирующую полипептид UGT73, имеющий по меньшей мере 80% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3, или конструкции нуклеиновой кислоты, содержащей регуляторную область, функционально связанную с указанной нуклеиновой кислотой.
Другой вариант осуществления настоящего изобретения относится к кассете экспрессии ДНК, содержащей синтетическую последовательность ДНК, которая указана в SEQ ID NO:58, кодирующую аминокислотную последовательность, которая указана в SEQ ID NO:57, при этом такая выделенная нуклеиновая кислота или синтетическая последовательность ДНК функционально связана с промотором.
Другой вариант осуществления настоящего изобретения относится к кассете экспрессии ДНК, содержащей синтетическую последовательность ДНК, которая указана в SEQ ID NO:65, кодирующую аминокислотную последовательность, которая указана в SEQ ID NO:66, при этом такая выделенная нуклеиновая кислота или синтетическая последовательность ДНК функционально связана с промотором.
Другой вариант осуществления настоящего изобретения относится к рекомбинантному вектору, включающему кассету экспрессии ДНК, содержащую выделенную нуклеиновую кислоту, кодирующую полипептид UGT73, имеющий по меньшей мере 80% идентичность последовательности с аминокислотной последовательностью UGT73, указанной на фиг. 3, или конструкцию нуклеиновой кислоты, содержащую регуляторную область, функционально связанную с указанной нуклеиновой кислотой.
Другой вариант осуществления настоящего изобретения относится к рекомбинантному вектору, включающему кассету экспрессии ДНК, при этом кассета экспрессии ДНК содержит синтетическую последовательность ДНК, которая указана в SEQ ID NO:58, кодирующую аминокислотную последовательность, которая указана в SEQ ID NO:57, при этом выделенная нуклеиновая кислота или синтетическая последовательность ДНК функционально связана с промотором.
Другой вариант осуществления настоящего изобретения относится к рекомбинантному вектору, включающему кассету экспрессии ДНК, при этом кассета экспрессии ДНК содержит синтетическую последовательность ДНК, которая указана в SEQ ID NO:65, кодирующую аминокислотную последовательность, которая указана в SEQ ID NO:66, при этом выделенная нуклеиновая кислота или синтетическая последовательность ДНК функционально связана с промотором.
Еще один вариант осуществления настоящего изобретения относится к рекомбинантной клетке, содержащей кассету экспрессии ДНК или рекомбинантный вектор, которые раскрыты в настоящем изобретении.
Еще один вариант осуществления настоящего изобретения относится к рекомбинантной клетке, выбранной из группы, состоящей из дрожжевой клетки, E. coli, растительной клетки, клетки млекопитающего и клетки насекомого.
Еще один вариант осуществления настоящего изобретения относится к рекомбинантной клетке, при этом рекомбинантной клеткой является клетка Saccharomyces cerevisiae.
Будет понятно, что вследствие вырожденности генетического кода ряд нуклеиновых кислот могут кодировать конкретный полипептид; т.е. для многих аминокислот существует более одного нуклеотидного триплета, которые служат в качестве кодонов для аминокислоты. Таким образом, кодоны в кодирующей последовательности для данного полипептида могут быть модифицированы с тем, чтобы получить оптимальную экспрессию в конкретном хозяине, используя соответствующие таблицы смещения частоты использования кодонов для такого хозяина (например, микроорганизма). В качестве выделенных нуклеиновых кислот такие модифицированные последовательности могут существовать в виде очищенных молекул и могут быть включены в вектор или вирус для использования в конструировании модулей для рекомбинантных конструкций нуклеиновых кислот.
Рекомбинантные хозяева
Ряд прокариот и эукариот подходят для применения в конструировании рекомбинантных микроорганизмов, описанных в настоящей публикации, например, грамотрицательные бактерии, дрожжи и грибы. Вид и штамм, выбранный для применения в качестве штамма для получения соединений шафрана, сначала анализируют, чтобы определить, какие гены, необходимые для продуцирования, являются эндогенными для штамма, и какие гены отсутствуют (например, гены каротиноидов). Гены, эндогенный аналог которых не присутствует в штамме, собирают в одной или нескольких рекомбинантных конструкциях, которыми затем трансформируют штамм, чтобы обеспечить отсутствующую функцию(и).
Примеры прокариотических и эукариотических видов более подробно описаны ниже. Однако будет понятно, что подходящими могут быть другие виды. Например, подходящие виды могут относиться к роду, выбранному из группы, состоящей из Agaricus, Aspergillus, Bacillus, Candida, Corynebacterium, Escherichia, Fusarium/Gibberella, Kluyveromyces, Laetiporus, Lentinus, Phaffia, Phanerochaete, Pichia, Physcomitrella, Rhodoturula, Saccharomyces, Schizosaccharomyces, Sphaceloma, Xanthophyllomyces и Yarrowia. Примеры видов из таких родов включают Lentinus tigrinus, Laetiporus sulphureus, Phanerochaete chrysosporium, Pichia pastoris, Physcomitrella patens, Rhodoturula glutinis 32, Rhodoturula mucilaginosa, Phaffia rhodozyma UBV-AX, Xanthophyllomyces dendrorhous, Fusarium fujikuroi/Gibberella fujikuroi, Candida utilis и Yarrowia lipolytica. В некоторых вариантах микроорганизмом может быть Ascomycete, такой как Gibberella fujikuroi, Kluyveromyces lactis, Schizosaccharomyces pombe, Aspergillus niger или Saccharomyces cerevisiae. В некоторых вариантах микроорганизмом может быть прокариот, такой как Escherichia coli, Rhodobacter sphaeroides или Rhodobacter capsulatus. Будет понятно, что некоторые микроорганизмы могут быть использованы для скрининга и тестирования представляющих интерес генов в способе с высокой пропускной способностью, тогда как другие микроорганизмы с требуемыми характеристиками продуктивности или роста могут быть использованы для крупномасштабного получения соединений шафрана.
Saccharomyces cerevisiae
Saccharomyces cerevisiae является широко используемым базовым организмом в синтетической биологии и может быть использован в качестве платформы, основанной на рекомбинантном микроорганизме. Существуют библиотеки мутантов, плазмиды, подробные компьютерные модели метаболизма и другая информация о S. cerevisiae, позволяющая осуществлять рациональное конструирование различных модулей для повышения выхода продукта. Известны способы получения рекомбинантных микроорганизмов.
Гены, описанные в настоящей публикации, могут быть экспрессированы в дрожжах с использованием любого из ряда известных промоторов. Штаммы, которые сверхпродуцируют терпены, известны и могут быть использованы для увеличения количества геранилгеранилдифосфата, доступного для получения соединений шафрана.
Подходящие штаммы S. cerevisiae также могут быть модифицированы, чтобы обеспечить возможность повышенного накопления запасных липидов и/или повышенных количеств доступных молекул-предшественников, таких как ацетил-CoA. Например, накопление триацилглицеринов (TAG) вплоть до 30% в S. cerevisiae было показано Kamisaka et al. (Biochem. J. (2007) 408, 61-68) путем разрушения фактора транскрипции SNF2, сверхэкспрессии полученной из растений диацилглицеринацилтрансферазы 1 (DGA1) и сверхэкспрессия дрожжевой LEU2. Кроме того, Froissard et al. (FEMS Yeast Res. 9 (2009) 428-438) показали, что экспрессия в дрожжах AtClo1, белка, образующего масляные тельца растений, может стимулировать образование масляных телец и приводить к сверхнакоплению запасных липидов. Такие накопленные TAG или жирных кислот может направлять по пути биосинтеза ацетил-CoA, например, дополнительно экспрессируя фермент, который, как известно, способен образовывать ацетил-CoA из TAG (гены POX) (например, ген POX Yarrowia lipolytica).
Виды Aspergillus
Виды Aspergillus, такие как A. oryzae, A. niger и A. sojae, являются микроорганизмами, широко применяемыми для получения продуктов питания, и также могут быть использованы в качестве основанной на рекомбинантном микроорганизме платформы. Нуклеотидные последовательности доступны для геномов A. nidulans, A. fumigatus, A. oryzae, A. clavatus, A. flavus, A. niger и A. terreus, что дает возможность рационально конструировать и модифицировать эндогенные пути для усиления flux и увеличения выхода продукта. Были разработаны метаболические модели для Aspergillus, а также транскриптомные исследования и протеомные исследования. A. niger культивируют для промышленного получения ряда пищевых ингредиентов, таких как лимонная кислота и глюконовая кислота, и следовательно, такие виды, как A. Niger, как правило, подходят для получения соединений из шафрана.
Escherichia coli
Escherichia coli, другой широко применяемый в качестве платформы организм в синтетической биологии, также можно использовать в качестве основанной на рекомбинантном микроорганизме платформы. Так же, как в случае Saccharomyces, существуют библиотеки мутантов, плазмиды, подробные компьютерные модели метаболизма и другая информация о E. coli, позволяющая рационально конструировать различные модули для повышения выхода продукта. Можно использовать способы, сходные со способами, описанными выше для Saccharomyces, чтобы получить рекомбинантные микроорганизмы E. coli.
Виды Agaricus, Gibberella и Phanerochaete
Могут быть применимы виды Agaricus, Gibberella и Phanerochaete, так как они, как известно, продуцируют большие количества гиббереллина в культуре. Таким образом, терпеновые предшественники для получения больших количеств соединений шафрана уже продуцируются эндогенными генами. Следовательно, модули, содержащие рекомбинантные гены для биосинтеза соединений шафрана, могут быть введены в виды из такого рода без необходимости во введении генов пути мевалоната или MEP.
Виды Rhodobacter
Rhodobacter можно использовать в качестве основанной на рекомбинантном микроорганизме платформы. Так же, как в случае E. coli, существуют доступные библиотеки мутантов, а также подходящие плазмидные векторы, позволяющие рационально конструировать различные модули для повышения выхода продукта. Были сконструированы пути изопреноидов в мембранных бактериальных видах Rhodobacter для увеличения продукции каротиноида и CoQ10. См. публикации патентов США №№ 20050003474 и 20040078846. Можно использовать способы, подобные способам, описанным выше для E. Coli, чтобы получить рекомбинантные микроорганизмы Rhodobacter.
Виды Physcomitrella
Мхи Physcomitrella при выращивании в суспензионной культуре имеют характеристики, сходные с дрожжами или другими культурами грибов. Такой род становится важным типом клеток для получения вторичных метаболитов растений, получение которых может быть затруднено в других типах клеток.
Растения и растительные клетки
В некоторых вариантах нуклеиновые кислоты и полипептиды, описанные в настоящей публикации, вводят в растения или растительные клетки для получения соединений шафрана. Таким образом, хозяином может быть растение или растительная клетка, которая содержит по меньшей мере один рекомбинантный ген, описанный в настоящей публикации. Растение или растительная клетка могут быть трансформированными в случае присутствия рекомбинантного гена, интегрированного в геном, т.е. могут быть стабильно трансформированы. Стабильно трансформированные клетки обычно сохраняют введенную нуклеиновую кислоту при каждом клеточном делении. Растение или растительная клетка также могут быть временно трансформированы так, что рекомбинантный ген не интегрируется в их геном. Временно трансформированные клетки обычно теряют всю или некоторую часть введенной нуклеиновой кислоты с каждым клеточным делением, так что введенная нуклеиновая кислота не может быть выявлена в дочерних клетках после достаточного количества клеточных делений. Как временно трансформированные, так и стабильно трансформированные трансгенные растения и растительные клетки могут быть применимы в способах, описанных в настоящей публикации.
Трансгенные растительные клетки, используемые в способах, описанных в настоящей публикации, могут составлять часть или все целое растение. Такие растения могут быть выращены способом, подходящим для исследуемого вида, либо в ростовой камере, в теплице, либо на поле. Трансгенные растения можно скрещивать так, как требуется для конкретной цели, например, чтобы ввести рекомбинантную нуклеиновую кислоту в другие линии, перенести рекомбинантную нуклеиновую кислоту в другие виды или для дальнейшей селекции других требуемых признаков. Альтернативно, трансгенные растения можно размножать вегетативно в случае таких видов, которые могут быть подвергнуты обработке такими способами. В используемом в настоящем описании смысле трансгенное растение также относится к потомству исходного трансгенного растения, при условии, что потомство наследует трансген. Семена, образуемые на трансгенных растениях, можно выращивать и затем подвергать самоопылению (или ауткроссингу и самоопылению), чтобы получить семена, гомозиготные по конструкции нуклеиновой кислоты.
Трансгенные растения можно выращивать в суспензионной культуре или культуре тканей или органов. Для целей настоящего изобретения можно использовать способы твердой и/или жидкой культуры тканей. При использовании твердой среды трансгенные растительные клетки можно помещать непосредственно на среду или можно помещать на фильтр, который затем помещают так, чтобы он был в контакте со средой. При использовании жидкой среды трансгенные растительные клетки могут быть помещены на плавающее устройство, например, пористую мембрану, которая контактирует с жидкой средой.
При использовании временно трансформированных растительных клеток в способ трансформации может быть включена репортерная последовательность, кодирующая репортерный полипептид, обладающий репортерной активностью, и анализ репортерной активности или экспрессии может быть осуществлен в подходящий момент времени после трансформации. Подходящий момент времени для проведения анализа обычно наступает через 1-21 день после трансформации, например, примерно 1-14 дней, примерно 1-7 дней или примерно 1-3 дня. Использование временных анализов особенно подходит для быстрого анализа в разных видах или для подтверждения экспрессии гетерологичного полипептида, экспрессия которого не была ранее подтверждена в конкретных реципиентных клетках.
Способы введения нуклеиновых кислот в однодольные и двудольные растения известны в данной области и включают, без ограничения, опосредованную Agrobacterium трансформацию, опосредованную вирусными векторами трансформацию, электропорацию и трансформацию с использованием пушки для частиц, патенты США №№ 5538880, 5204253, 6329571 и 6013863. Если в качестве реципиентной ткани для трансформации используют клетку или культивируемую ткань, растения при необходимости могут быть регенерированы из трансформированных культур способами, известными специалистам в данной области.
Популяция трансгенных растений может быть подвергнута скринингу и/или отобрана в отношении таких представителей популяции, которые имеют признак или фенотип, обусловленный экспрессией трансгена. Например, популяция потомства, полученного после одного события трансформации, может быть подвергнута скринингу в отношении растений, имеющих требуемый уровень экспрессии полипептида или нуклеиновой кислоты ZCD или UGT. Можно использовать физические и биохимические способы для идентификации уровней экспрессии. Такие способы включают Саузерн-анализ или ПЦР-амплификацию для выявления полинуклеотида; Нозерн-блоты, защиту от РНК-азы S1, удлинение праймера или ОТ-ПЦР-амплификацию для выявления РНК-транскриптов; ферментативные анализы для выявления ферментативной или рибозимной активности полипептидов и полинуклеотидов; и гель-электрофорез белков, Вестерн-блоты, иммунопреципитацию и иммуноанализы с использованием ферментов для выявления полипептидов. Можно также использовать другие способы, такие как гибридизация in situ, ферментативное окрашивание и иммуноокрашивание, для выявления присутствия или экспрессии полипептидов и/или нуклеиновых кислот. Способы осуществления всех указанных способов известны. В качестве альтернативы популяцию растений, содержащих независимые события трансформации, можно подвергать скринингу в отношении растений, имеющих требуемый признак, такой как продукция соединения шафрана. Селекцию и/или скрининг можно осуществлять на протяжении одного или нескольких поколений и/или более чем в одном географическом местоположении. В некоторых случаях трансгенные растения можно выращивать и подвергать селекции в условиях, которые индуцируют требуемый фенотип или каким-либо иным образом необходимы для получения требуемого фенотипа у трансгенного растения. Кроме того, селекцию и/или скрининг можно применять во время конкретной стадии развития, на которой, как ожидается, данный фенотип проявляется у растения. Селекцию и/или скрининг можно осуществлять для того, чтобы выбрать трансгенные растения, имеющие статистически значимое отличие в уровне соединения шафрана от контрольного растения, в котором отсутствует трансген.
Нуклеиновые кислоты, рекомбинантные гены и конструкции, описанные в настоящей публикации, можно использовать для трансформации ряда однодольных и двудольных растений и систем растительных клеток. Не ограничивающие примеры подходящих однодольных включают, например, зерновые культуры, такие как рис, рожь, сорго, просо, пшеница, кукуруза и ячмень. Растение также может быть двудольным, таким как соя, хлопчатник, подсолнечник, горох, герань, шпинат или табак. В некоторых случаях растение может иметь пути предшественников для продуцирования фенилфосфата, такие как путь мевалоната, обычно находящийся в цитоплазме и митохондриях. Немевалонатный путь чаще встречается в пластидах растений [Dubey, et al., 2003 J. Biosci. 28 637-646]. Специалист в данной области может направить экспрессию полипептидов, биосинтез которых необходим, в соответствующий органоид, используя лидерные последовательности, так что биосинтез будет происходить в требуемом положении в растительной клетке. Специалист в данной области может использовать соответствующие промоторы, чтобы при необходимости направить синтез, например, в лист растения. Экспрессия также может происходить в культурах тканей, таких как каллусная культура или культура «бородатых» корней, если такие требуются.
Далее изобретение будет описано на следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
ПРИМЕРЫ
Пример 1: Получение β-каротина в дрожжах
Репортерный штамм дрожжей, продуцирующих β-каротин, конструировали для eYAC-экспериментов, предназначенных для поиска оптимальных сочетаний генов биосинтеза шафрана. Гены фитоиндесатуразы (также известной как фитоиндегидрогеназа) Neurospora crassa (№ доступа XP_964713) и GGDP-синтазы Xanthophyllomyces dendrorhous, также известной как геранилгеранилпирофосфатсинтетаза или CrtE (№ доступа DQ012943), и фитоин-β-каротинсинтазы CrtYB X. dendrorhous (№ доступа AY177204) встраивали в кассеты экспрессии, и такие кассеты интегрировали в геном лабораторного штамма дрожжей Saccharomyces cerevisiae CEN.PK 113-11. Фитоиндесатураза и CrtYB сверхэкспрессировались под контролем сильного конститутивного промотора GPD1, тогда как сверхэкспрессия CrtE была возможна при использовании сильного конститутивного промотора TPI1. Интеграция в хромосому кассет экспрессии CrtE X. dendrorhous и фитоиндесатуразы Neurospora crassa была осуществлена в межгенную область ECM3-YOR093C S. cerevisiae, тогда как интеграция кассеты экспрессии CrtYB была осуществлена в межгенную область KIN1-INO2 S. cerevisiae.
В колониях, выращенных на чашках с SC-средой с исключенными компонентами, наблюдали образование оранжевой окраски в случае продуцирования β-каротина. Присутствие β-каротина количественно оценивали посредством экстракции метанолом и ЖХ/МС-анализа.
Пример 2: Оптимизированная продукция HBC и диальдегида кроцетина дрожжами
Известно, что кроцетин образуется из диальдегида кроцетина, и диальдегид кроцетина и гидроксил-бета-циклоцитраль (HBC) образуются при расщеплении зеаксантина ферментом диоксигеназой, расщепляющей зеаксантин (ZCD). Набор генов собирали в eYAC, чтобы получить оптимальный путь биосинтеза диальдегида кроцетина и HBC, используя eYAC и штамм продуцирующих β-каротин дрожжей, описанный в примере 1.
Набор аналогов генов для ферментов, которые превращают β-каротин в диальдегид кроцетина, получали в результате синтеза, оптимизированного по дрожжевым кодонам (DNA 2.0), и встраивали в исходные векторы eYAC под контроль множества репрессируемых метионином генных промоторов. Использование методики eYAC описано Naesby et al., Microb. Cell Fact. 8:45 (2009). Кассеты экспрессии для 37 генов биосинтеза шафрана, показанные в таблице 1, соединяли в цепи (с генами UGT или без генов UGT) и лигировали в eYAC. eYAC обоих типов использовали для трансформации продуцирующего β-каротиноид штамма дрожжей EFSC301. Указанный штамм является стабильным продуцентом каротиноида, полученным в результате интеграции основанных на промоторах GPD/TPI кассет экспрессии генов CrtYB/CrtE/Nc-AI-1 в 3'-UTR-области ECM3 и KIN1 дрожжей.
Эффективность трансформации дрожжей примерно 800 колоний/чашку получали, используя чашки для селекции ауксотрофов по одному компоненту. Затем трансформанты повторно высевали штрихом на чашки для селекции двойных ауксотрофов (лейцин-, триптофан-). Позитивные трансформанты выращивали на SC-среде с исключенными компонентами (-лейцин, -триптофан и -метионин). Клетки выращивали в течение 24-72 часов при 30°C во встряхиваемых колбах и не содержащий клеток бульон, а также клеточные экстракты экстрагировали органическим растворителем и анализировали в отношении присутствия HBC, диальдегида кроцетина и кроцетина.
На основании содержания диальдегида кроцетина, кроцетина и HBC, образованных в результате биосинтеза в трансформированных дрожжах, идентифицируют высокие, средние и низкие продуценты. Такие трансформанты подвергают скринингу с использованием ПЦР, чтобы определить состав генов у высоких, средних и низких продуцентов. На основании результатов ПЦР идентифицируют гены, которые важны и которые не являются важными для продуцирования диальдегида кроцетина, кроцетина и HBC, и конструкции могут быть дополнительно улучшены добавлением или удалением генов в новых сочетаниях и в новых конструкциях eYAC.
Пример 3: Обнаружение пикрокроцин-образующей UGT
Фермент глюкозилтрансфераза необходим для образования пикрокроцина из гидроксил-бета-циклоцитраля (HBC). Такая реакция представляет собой гликозилирование агликона, которое противоположно реакции образования связи глюкоза-глюкоза, и существует множество семейств, использующих UDP-глюкозу гликозилтрансфераз для скрининга активности такого типа.
Источник субстрата HBC
Синтезировали HBC и требуемое соединение очищали хроматографией на хиральных колонках (GVK, Hyderabad).
Скрининг ферментов UGT
Следующие UGT анализировали в отношении образования пикрокроцина: 88B1, 76G1, 74G1, 91D2e, 85C2, 73EV12 Stevia rebaudiana; UGT2 Catharanthus roseus; и UGT 75B1 Arabidopsis thaliana и гибридные ферменты Arabidopsis UGT 353 и UGT354 (последовательности приведены на фиг. 3).
Гены, кодирующие такие UGT, клонировали в плазмидах, используя промотор T7, и трансформировали в клетки E. coli BL21 для исследований экспрессии. Штаммы, несущие такие UGT, вводили с 0,1 мМ IPTG и индуцированные культуры выращивали при 20°C в течение ночи. Затем индуцированные клетки лизировали реагентом BugBuster (Novagen) и осветленные лизаты использовали для анализа UGT.
Анализ UGT осуществляли в реакционных смесях объемом 100 мкл, при этом 98 мкл индуцированных осветленных лизатов добавляли к HBC в качестве субстрата-акцептора глюкозы (конечная концентрация 10 мкМ) и UDP-глюкозе (конечная концентрация 1 мМ) в качестве донора. Реакции осуществляли при 30°C в течение 3 часов и останавливали добавлением 300 мкл насыщенного водой 1-бутанола. Образцы три раза экстрагировали с использованием 300 мкл насыщенного водой 1-бутанола. Объединенные бутанольные фракции полностью высушивали в вакуумном устройстве Speed-vac и анализировали с помощью ЖХ/МС, используя следующий способ. Колонку Luna-SL C18 (5 мкм, 100 ангстрем), модели G1316B (4,6 мм ID) использовали для ЖХ-разделения с контролем при 440 нм. Осуществляли разделение в течение 20 минут с расходом 0,8 мл/минуту, используя градиент 20-80% ацетонитрила с другим растворителем, 0,25% муравьиной кислотой (FA). ЖХ сопряжена с Q-TOF для МС-анализа.
Среди указанных UGT, UGT85C2 и UGT73EV12 Stevia и два гибридных фермента Arabidopsis демонстрировали образование пикрокроцина из HBC в анализируемых условиях. Предварительный анализ показал, что реакции с участием UGT85C2 Stevia частично превращали HBC в соединение со временем удерживания и массой, сходными со стандартом пикрокроцина. Площадь пика HBC контролировали в точке, соответствующей времени удерживания стандарта.
UGT85C2 Stevia коэкспрессируют в дрожжевом штамме, который, как было показано, продуцирует HBC (см. примеры 2 и 6). Предполагается, что такой фермент будет катализировать такую же реакцию in vivo, которая показана in vitro, так что дрожжевой штамм будет способен продуцировать пикрокроцин из глюкозы.
Скрининг набора UGT
Набор более чем 170 ферментов UGT с широким диапазоном специфичности экспрессировали в E. coli и анализировали подобно тому, как описано выше. Идентифицировали три дополнительных UGT, которые могут осуществлять реакцию гликозилирования с HBC с образованием пикрокроцина: UGT73 Stevia и два гибридных фермента UGT71 Arabidopsis (см. публикацию Hansen, et al., Phytochemistry 70 (2009) 473-482, относящуюся к гибридным ферментам). На фиг. 3 представлены нуклеотидные и аминокислотные последовательности гибридных ферментов UGT73 и UGT71.
Пример 4: Обнаружение ферментов гликозилтрансфераз, образующих кроцин
Кроцин является производным кроцетина, которое имеет четыре остатка глюкозы, добавляемых к нему в последовательных реакциях. Последние два остатка глюкозы присоединены к двум первым остаткам глюкозы β-1,6-связями, весьма вероятно в результате действия одной гликозилтрансферазы. Ферменты UGT, которые катализируют добавление второй глюкозы, менее распространены, чем гликозилтрансферазы агликона, и вероятно относятся к подсемейству UGT 91 или 79. Два указанных подсемейства представляют собой только два известных в настоящее время подсемейства ферментов, которые катализируют образование 1,2- или 1,6-связи глюкоза-глюкоза.
При попытке идентификации генов Crocus были идентифицированы и выделены UGT подсемейств 79 и 91 из рыльцев Crocus, а также другие UGT подсемейства 91.
Пиросеквенирование Crocus
Данные пиросеквенирования кДНК из рыльцев Crocus получали из MOgene LC (St. Louis, MO, USA). Общее секвенирование транскриптома осуществляли, используя два планшета FLX Titanium, и получали необработанные данные секвенирования всего примерно 1100 Мб и осуществляли сборку de novo.
После анализа 66000 уникальных контигов из данных пиросеквенирования в Blast-анализе против известных UGT было идентифицировано примерно 10 UGT-подобных последовательностей (подсемейство 91). На основе полученных результатов конструировали специфичные для гена/аллеля обратные ПЦР-праймеры, чтобы выделить полноразмерные гены из библиотеки кДНК Crocus.
Специфичные для генов и векторов праймеры конструировали на основе данных пиросеквенирования и использовали для получения 5'- и 3'-концов генов UGT. После успешной амплификации 5'- и 3'-концов последовательности UGT с применением сочетания специфичных для генов и векторов праймеров и с использованием корректирующих полимераз (например, полимераз Advantage 2 и KOD) амплифицированные ПЦР-фрагменты экстрагировали из геля для дальнейшей обработки. Амплифицированные в ПЦР фрагменты очищали, используя набор для очистки продуктов ПЦР, и затем клонировали в клонирующем векторе TA (набор для клонирования InstaTA, Fermentas) и трансформировали в штамм E. coli (компетентные клетки NEB 10-β, New England Biolabs, UK). После качественного анализа ПЦР-фрагментов с использованием специфичной для гена ПЦР с образованием молекулярных колоний образцы плазмидной ДНК секвенировали.
Таким образом, идентифицировали шесть полноразмерных последовательностей кДНК UGT Crocus из подсемейства 91. Аминокислотные последовательности всех шести UGT (UN1761, UN3356, UN4522, UN4666, UN6460 и UN2281) образуют кластер с известными последовательностями UGT91 (см. фиг. 4; на фиг. 5 представлены последовательности UN1761, 3356, 4522, 4666, 6460 и 2281). Из указанных шести последовательностей транскрипт UN1761 и транскрипт UN4 522 экспрессировались на наиболее высоком уровне из 91 найденного гомолога на основании их относительного содержания в транскриптоме.
Затем шесть полноразмерных последовательностей UN1761, UN4522, UN4666, UN6460 UN3356 и UN2281 амплифицировали, используя специфичные для гена праймеры, и встраивали в плазмидные векторы для экспрессии в Е. coli и экспрессии in vitro.
Способ синтеза кДНК на основе ПЦР SMART использовали для амплификации полной последовательности дополнительных семи UGT. Таким способом можно получать кДНК высокого качества из нанограммовых количеств суммарной РНК. кДНК RACE получали из мРНК Crocus, которая была очищена на основе способов аффинной очистки, в которых улавливают полиаденилированную область мРНК. Специфичные для генов и аллелей праймеры использовали для получения полноразмерных кодирующих областей UGT. Кодирующими областями трансформировали штамм компетентных клеток Е. coli Т7 Express lysY/IQ (New England Biolabs, UK), несущий соответствующие UGT, выращенных в среде на основе бульона Луриа,содержащей антибиотик, и инкубировали при 37°C в течение 16 часов (встряхивание при 250 об/мин). Клетки инокулировали до OD600 0,01 в свежую среду LB и выращивали при 30°C до достижения OD600 0,4-0,5. Температуру снижали до 20°C и клетки индуцировали, используя 0,1 мМ IPTG, и инкубировали в течение 24 часов. Клетки осаждали при 12000 об/мин в течение 1 минуты при комнатной температуре и лизировали в реагенте Bug buster (Novagen) согласно протоколам производителя. Осветленный супернатант использовали для анализов UGT, используя 10 мМ UDP-глюкозу (конечная концентрация) и 1 мМ сложного диглюкозилового эфира (конечная концентрация) в реакционных смесях, инкубируемых при 30°C в течение 3 часов.
Скрининг ферментов, транслированных in vitro
Всего отобрали 19 генов UGT (см. таблицу 2) в качестве кандидатов для превращения частично моногликозилированных сложных эфиров кроцетина в кроцин вследствие их гомологии с другими последовательностями UGT подсемейств 79 или 91. Все гены синтезировали с оптимизацией в отношении использования кодонов у дрожжей (нуклеотидные последовательности показаны на фиг.6).
Трансляция in vitro была успешной в случае 16 UGT; три других UGT клонировали в основанной на E. coli системе экспрессии. 16 транслированных in vitro UGT подвергали скринингу в отношении образования кроцина, используя сложный гентиобиозилглюкозиловый эфир кроцетина (кроцетин-3G, GVK, India) в качестве субстрата-акцептора глюкозы и UDP-глюкозы в качестве донора глюкозы. Сорок микролитров транслированного in vitro белка использовали в реакционной смеси объемом 100 мкл, содержащей MgCl2 в конечной концентрации 3 мМ, 10 мкг/мл БСА, 50 мкМ субстрата и 1 мМ UDP-глюкозы. Реакции осуществляли при 30°C в течение 3 часов в 50 мМ калий-фосфатном буфере, pH 7,2, и останавливали добавлением 300 мкл насыщенного водой 1-бутанола. Объединенные бутанольные фракции полностью высушивали в вакуумном устройстве Speed-Vac, ресуспендировали в метаноле и анализировали с использованием ВЭЖХ на Agilent 1200 и Q-TOF-ЖХ/МС 6520. По-видимому, ни один из тестированных образцов не продуцировал кроцин в анализируемых условиях реакции.
Скрининг растительных ферментов UGT
Пять UGT из Stevia (88 В1, 76G1, 74G1, 912D2e и 85С2), а также UGT2 Catharanthus roseus и UGT 7 5 В1 Arabidopsis thaliana (см. пример 3) также анализировали в отношении получения кроцина.
Среди указанных UGT ферменты UGT UN17 61 и UN4 522 Crocus и UGT76G1 Stevia демонстрировали способность гликозилировать кроцетин-3G. Предварительный анализ с использованием ЖХ-МС показал появление молекулы продукта с молекулярной массой, сходной с молекулярной массой кроцина. Так как UGT подсемейства 76 обычно образует 1,3-связь между двумя остатками глюкозы, тип связи глюкоза-глюкоза подтверждают с использованием ЯМР, чтобы определить, был ли получен кроцин или аналог кроцина.
Пример 5: Клонирование UGT2 Crocus для образования сложного глюкозилового эфира кроцетина
Полагают, что UGT2 Crocus (CsUGT2, номер доступа в GenBank: AY262037.1) катализирует два первичных глюкозилирования кроцетина в положениях карбоксилатов, приводя к образованию сложных моно- и диглюкозиловых эфиров кроцетина. CsUGT2 клонировали, со слиянием с полигистидиновой меткой или без нее, в бактериальном экспрессирующем векторе, используя промотор Т7.Ген также клонировали в дрожжевой экспрессирующей конструкции, используя сильный конститутивный промотор GPD1. Для клонирования использовали ген для оптимизированной экспрессии в дрожжах. На фиг. 7 представлены нуклеотидная и аминокислотная последовательности CsUGT2, а также оптимизированная по кодонам нуклеотидная последовательность.
Трансформированные аутолизируемые штаммы дрожжей K XJa (DE3) индуцировали, используя IPTG, согласно протоколам производителя (Zymo research, CA 92614, USA). Трансформированные клетки Saccharomyces cerevisiae (штамм DSY5, Dualsystems Biotech, Switzerland) выращивали в SC-среде с исключенными компонентами, содержащей 2% глюкозы, pH 5,8. Отдельные колонии штамма DSY5, несущие ген CsUGT2, инокулировали в SC-среду с глюкозой и инкубировали при 30°C и 250 об/мин в течение ночи. Дрожжевые клетки повторно инокулировали в свежую среду до плотности, эквивалентной 1,0 OD600, в свежий SC-бульон и инкубировали дополнительно еще в течение 72 часов. Затем клетки осаждали и лизировали, используя реагент для экстракции белков YeastBuster™ (Merck, India). Бесклеточные экстракты анализировали в отношении активности в гликозилировании кроцетина, используя 10 мМ UDP-глюкозы (конечная концентрация), 1 мМ кроцетина (конечная концентрация), приобретенных у Chromadex (US), и инкубировали при 30°C в течение 3 часов. Анализ осуществляли на неочищенных реакционных смесях и присутствие сложных моно- и диглюкозиловых эфиров обнаруживали на основе их масс, используя масс-спектрометрию в соответствии с публикацией J. Mass. Spectrom. 2009, 44, 1661-1667.
Пример 6: Получение кроцетина в дрожжах
Функциональный путь биосинтеза для получения кроцетина разрабатывали следующим образом. Сконструированный дрожжевой штамм (EYS886), описанный в примере 1, продуцирующий β-каротин, использовали для конструирования пути биосинтеза шафрана. Коэкспрессия генов расщепляющей зеаксантин оксигеназы C. sativus (ZCO, также известной как расщепляющая зеаксантин диоксигеназа или ZCD) и каротингидроксилазы Xanthophyllomyces dendrorhous (CH) CH-2 приводила к продукции кроцетина, которую выявляли с использованием ЖХ и МС-анализа. Гетерологичный ген не использовали для превращения диальдегида кроцетина в кроцетин; такая активность должна осуществляться в клетках S. cerevisiae в естественных условиях.
Большое количество челночных векторов pRS416 E.coli/дрожжи использовали для экспрессии нескольких сочетаний аналогов генов каротингидроксилазы («CH») и расщепляющей зеаксантин оксигеназы («ZCO»), полученных из источников, которые описаны в таблице 3 (на фиг.8 представлены оптимизированные последовательности ДНК). Гены ZCO экспрессировали под контролем промотора TEF; гены CH экспрессировали, используя промотор GPD. Тестировали следующие сочетания: CH2/ZCO1, CH3/ZCO2 и CH6/ZCO4.
Плазмидами, содержащими сочетания ZCO/CH6, трансформировали продуцирующий β-каротин штамм согласно протоколам производителя (набор для трансформации дрожжей, Frozen-EZ Yeast Transformation II Kit,™ Zymo research, Switzerland). Трансформанты высевали на чашки SC Ura (pH 5,8), содержащие 2% глюкозы, и инкубировали при 30°C в течение 3 дней.
Позитивные дрожжевые колонии выращивали в жидкой SC Ura-среде, содержащей глюкозу, при 30°C, с аэрацией при 200 об/мин во встряхиваемом инкубаторе в течение ночи.
Культуры концентрировали центрифугированием и ресуспендировали в свежей SC Ura-среде до эквивалента OD 1,2. Затем клетки инкубировали при 30°C при 200 об/мин еще в течение 72 часов. Затем клетки осаждали и готовили экстракты для анализа. Осадки дважды промывали холодным буфером PBS (10 мМ; pH 7,2), суспендировали в 2 мл смеси метанол:PBS-буфер (3:1) и хранили при -18°C в течение ночи. Такую смесь размораживали и центрифугировали при 10000 об/мин в течение 3 минут и осадки повторно экстрагировали, используя вихревой смеситель и 3 мл смеси хлороформ:метанол (1:2). Полученную смесь центрифугировали при 10000 об/мин в течение 2 минут и супернатант инъецировали для анализа ВЭЖХ. Сходным образом супернатант экстрагировали хлороформом, метанолом и водой в указанном порядке и анализировали методом ВЭЖХ.
Анализ
Экстракты клеток анализировали, используя колонку для ВЭЖХ C18 Discovery HS и линейный градиент метанола от 60% до 100% в 1% уксусной кислоте и воде в течение 40-минутного периода с расходом 1 мл/мин. Препаративную систему Shimadzu LC 8A использовали в сочетании с детектором на фотодиодной матрице Shimadzu SPD M20A, осуществляя первичный анализ оптической плотности при 440 нм.
Анализ одного из рекомбинантных штаммов, содержащих ZCO1 C. sativus (номер доступа в GenBank AJ489276, идентификационный номер белка в GenBank CAD33262.1) и CH-2 X. dendrorhous, показал продукцию новых соединений, время элюирование которых было сравнимо со стандартами кроцетина и диальдегида кроцетина. Внутриклеточные метаболиты, продуцируемые таким дрожжевым штаммом, дополнительно подвергали ЖХ-МС-анализу и подтверждали массы кроцетина и диальдегида кроцетина.
Предполагается, что другие сочетания ZCO и CH также могут быть функциональными в условиях, подходящих для экспрессии растворимого белка.
Полученные данные показывают, что дрожжи способны создавать диальдегид кроцетина из глюкозы, и что дрожжи обладают ферментативной активностью, которая может окислять по меньшей мере некоторое количество диальдегида кроцетина в кроцетин. Кроме того, поскольку HBC является побочным продуктом реакции ZCO, дрожжи также способны продуцировать HBC. С добавлением UGT и CsUGT2, описанных выше, предполагается, что дрожжи также будут продуцировать пикрокроцин и кроцин.
Пример 7: Обнаружение ферментов гликозилтрансфераз, образующих сложные эфиры кроцетина
Было высказано предположение, что кроцетин подвергается ферментативному глюкозилированию в многостадийном пути, в который вовлечены две отдельные UGT. Одна UGT может катализировать добавление остатков глюкозы к карбоксильным концам кроцетина с образованием сложных моноглюкозиловых и диглюкозиловых эфиров. Другая UGT может переносить остатки глюкозы на группы глюкозила, образуя сложные моногентиобиозиловые и дигентиобиозиловые эфиры.
Следующие UGT подвергали скринингу в отношении образования сложных эфиров кроцетина, подобных моно-, ди- или гентиобиозиловым молекулам, из кроцетина: ферменты Stevia rebaudiana (88B1, 76G1, 74G1, 912D2e и 85C2, UGT73) и два гибридных фермента Arabidopsis UGT71 (71C125571C2 и 71C125571E1).
Гены, кодирующие такие UGT, клонировали в плазмидах под контролем промотора T7 и трансформировали в клетки E. coli BL21 (Autolysis: XJb(DE3), Zymoresearch) для исследований экспрессии. Штаммы, несущие такие UGT, индуцировали, используя 0,1 мМ IPTG, и индуцированные культуры выращивали при 20°C в течение ночи. Затем индуцированные клетки лизировали способом замораживания и размораживания.
Анализ UGT осуществляли в реакционных смесях объемом 100 мкл, при этом 98 мкл индуцированных осветленных лизатов инкубировали с кроцетином в качестве субстрата-акцептора глюкозы (конечная концентрация 10 мкМ) и UDP-глюкозой (конечная концентрация 1 мМ) в качестве донора. Реакции осуществляли при 30°C в течение 3 часов и останавливали добавлением 300 мкл насыщенного водой 1-бутанола. Образцы три раза экстрагировали с использованием 300 мкл насыщенного водой 1-бутанола. Объединенные бутанольные фракции полностью высушивали в вакуумном устройстве Speed-vac и анализировали с помощью ЖХ/МС, используя следующий способ. Устройство: Agilent 1200 HPLC & Q-TOF LC/MS 6520, колонка: c18 с обращенной фазой Luna, 4 мкм, 4,6×150 мм, инъецируемый объем: 20 мкл, подвижная фаза: ацетонитрил (B): вода (A) (0,1% HCOOH), расход: 0,8 мл/мин, время анализа: 20 минут, детекция: 440 нм, градиент: 20% B в течение 5 минут, 80% B в течение 15 минут, 80% B в течение 20 минут, ионизация - двойная ESI, режим сбора данных - МС, диапазон масс - 100-1500, режим - отрицательный режим.
Из указанных ферментов три UGT (76G1 из Stevia и два гибридных фермента UGT71 Arabidopsis) катализировали глюкозилирование кроцетина с образованием сложных моно- и диглюкозиловых эфиров. Два гибридных фермента UGT71 Arabidopsis (71C125571C2 и 71C125571E1) также проявляли способность образовывать сложный гентиобиозиловый эфир кроцетина. Предварительный анализ с использованием ЖХ-МС показал появление молекул продукта с такой же массой, как масса сложных моно-, ди- и гентиобиозиловых эфиров.
Пример 8: Обнаружение гликозилтрансферазы Crocus sativus, образующих сложные моно- и диглюкозиловые эфиры кроцетина
Данные пиросеквенирования, описанные в примере 4, также показали наличие варианта UGT Crocus, Cs VrUGT2. На фиг. 9 показана аминокислотная последовательность Cs VrUGT2. Последовательность варианта UGT сравнивали с UGT2 Crocus (CsUGT2, GenBank № доступа: AY262037.1), используя BLAST. На фиг. 10 показано выравнивание CsUGT2 и варианта Cs VrUGT2 из Crocus sativus, а также аминокислотная последовательность каждого полипептида. На основании BLAST-анализа были сконструированы специфичные для гена/аллеля обратные ПЦР-праймеры, чтобы выделить полноразмерные гены из библиотеки кДНК Crocus.
Оптимизированную по кодонам нуклеотидную последовательность, кодирующую Cs VrUGT2, клонировали в плазмидах под контролем промотора T7 и трансформировали в клетки E. coli BL21 (Autolysis: XJb(DE3), Zymoresearch) для исследований экспрессии. Штамм, несущий Cs VrUGT2, индуцировали, используя 0,1 мМ IPTG, и индуцированные культуры выращивали при 20°C в течение ночи. Затем индуцированные клетки лизировали способом замораживания и размораживания.
Анализ UGT осуществляли в реакционных смесях объемом 100 мкл, используя 98 мкл осветленных лизатов индуцированных культур, инкубируемых с кроцетином в качестве субстрата-акцептора глюкозы (конечная концентрация 10 мкМ) и UDP-глюкозой (конечная концентрация 1 мМ) в качестве донора. Реакции осуществляли при 30°C в течение 3 часов и останавливали добавлением 300 мкл насыщенного водой 1-бутанола. Образцы три раза экстрагировали с использованием 300 мкл насыщенного водой 1-бутанола и фракции объединяли. Объединенные бутанольные фракции полностью высушивали в вакуумном устройстве Speed-vac и анализировали с помощью ЖХ/МС, используя следующий способ. Устройство: Agilent 1200 HPLC & Q-TOF LC/MS 6520, колонка: c18 с обращенной фазой Luna, 4 мкм, 4,6×150 мм, инъецируемый объем: 20 мкл, подвижная фаза: ацетонитрил (B): вода (A) (0,1% HCOOH), расход: 0,8 мл/мин, время анализа: 20 минут, детекция: 440 нм, градиент: 20% B в течение 5 минут, 80% B в течение 15 минут, 80% B в течение 20 минут, ионизация - двойная ESI, режим сбора данных - МС, диапазон масс - 100-1500, режим - отрицательный режим.
Предварительный анализ с использованием ЖХ-МС показал появление молекул продуктов с такой же молекулярной массой, как масса сложных моно- и диглюкозиловых эфиров.
Пример 9: Обнаружение эндогенных альдегиддегидрогеназ дрожжей, которые превращают диальдегид кроцетина в кроцетин
Окраска шафрана, главным образом, обусловлена гликозидами каротиноидов, образуемыми в результате последовательного гликозилирования кроцетина. Одной из ключевых стадий в пути биосинтеза шафрана является окисление диальдегида кроцетина в кроцетин. Тестировали способность эндогенных альдегиддегидрогеназ Saccharomyces cerevisiae осуществлять такое превращение. Геном дрожжей содержит пять известных генов, кодирующих альдегиддегидрогеназы (ALD2-ALD6), а также дополнительный ген, HFD1, который предположительно является геном альдегиддегидрогеназы. См. фиг. 11, на которой показаны нуклеотидные последовательности, кодирующие ALD2, ALD3, ALD4, ALD5, ALD6 и HFD1, эталонного штамма S288C (SEQ ID NO:67-72). Последовательности указаны для эталонного штамма S288C. Могут иметь место небольшие изменения в генных последовательностях штамма, который был использован. Бесклеточные экстракты готовили из дрожжевых культур, выращенных в течение ночи, а затем разрушенных посредством механического лизиса. Лизаты осветляли и тестировали в отношении их способности превращать диальдегид кроцетина в кроцетин в реакциях in vitro, проводимых, как указано в таблице 4. Также включали негативный контроль без экстрактов целых клеток. Реакции осуществляли при 25°C в течение 60 минут, затем останавливали добавлением трех объемов (1500 мл) насыщенного водой бутанола.
Органическую фазу отделяли центрифугированием и подвергали вакуумной сушке, после которой анализировали, используя высокоэффективную жидкостную хроматографию в сочетании с масс-спектроскопией (ЖХ-МС). Использовали Agilent 1200 HPLC & Q-TOF LC/MS 6520 с колонкой Luna C18, 5 мкм (4,6×150 мм), снабженную 5-микронной предколонкой. Подвижная фаза представляла собой смесь ацетонитрил (B) (0,1% муравьиная кислота (HCOOH)):H2O (A) (0,1% HCOOH), расход 0,8 мл/мин. Время анализа обычно составляло 15 минут с 1-минутным периодом после анализа.
Параметры МС включали следующие параметры: ESI в качестве источника ионов, режим получения данных с использованием двойного режима ESI; диапазон масс 100-450 Д; режим +/- (быстрое переключение полярности).
Дрожжевая эндогенная альдегиддегидрогеназа(ы) способна превращать диальдегид кроцетина в кроцетин, как показано на основании результатов ЖХ-МС.
ДРУГИЕ ВАРИАНТЫ
Следует понимать, что хотя изобретение описано посредством его подробного представления, приведенное выше описание предназначено для иллюстрации, а не для ограничения объема изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем следующей далее формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| UDP-ЗАВИСИМАЯ ГЛИКОЗИЛТРАНСФЕРАЗА ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОДУЦИРОВАНИЯ РЕБАУДИОЗИДОВ | 2017 |
|
RU2777901C2 |
| ПРИМЕНЕНИЕ КАУРЕНОКСИДАЗЫ PISUM SATIVUM ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2018 |
|
RU2795550C2 |
| БИОСИНТЕТИЧЕСКОЕ ПОЛУЧЕНИЕ СТЕВИОЛОВОГО ГЛИКОЗИДА РЕБАУДИОЗИДА D4 ИЗ РЕБАУДИОЗИДА E | 2017 |
|
RU2764803C2 |
| СПОСОБЫ ФЕРМЕНТАТИВНОГО СИНТЕЗА МОГРОЗИДНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2633644C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ, ВЕКТОРЫ, КЛЕТКИ ХОЗЯИНА И СПОСОБЫ ПОЛУЧЕНИЯ БЕТА-ФРУКТОФУРАНОЗИДАЗЫ ИЗ ASPERGILLUS NIGER | 2020 |
|
RU2840101C1 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2706789C2 |
| КОРМОВЫЕ КОМПОЗИЦИИ ДЛЯ ЖИВОТНЫХ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2762075C2 |
| ПОЛИПЕПТИДЫ С ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2005 |
|
RU2393224C2 |
| МУТАНТНЫЕ РЕЦЕПТОРЫ И ИХ ИСПОЛЬЗОВАНИЕ В СИСТЕМЕ ЭКСПРЕССИИ ИНДУЦИБЕЛЬНОГО ГЕНА НА ОСНОВЕ ЯДЕРНОГО РЕЦЕПТОРА | 2005 |
|
RU2539036C2 |
| ПРОТИВОМИКРОБНЫЕ ПОЛИПЕПТИДЫ ИЗ PSEUDOPLECTANIA NIGRELLA | 2002 |
|
RU2336278C2 |

















































































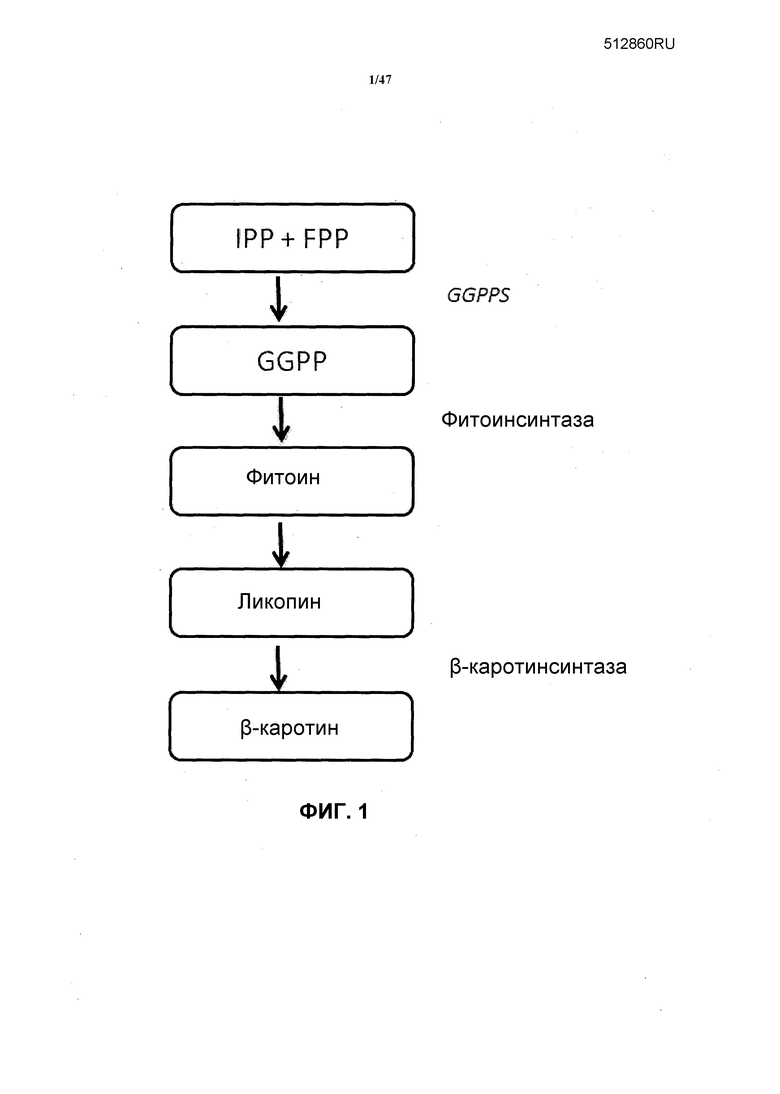
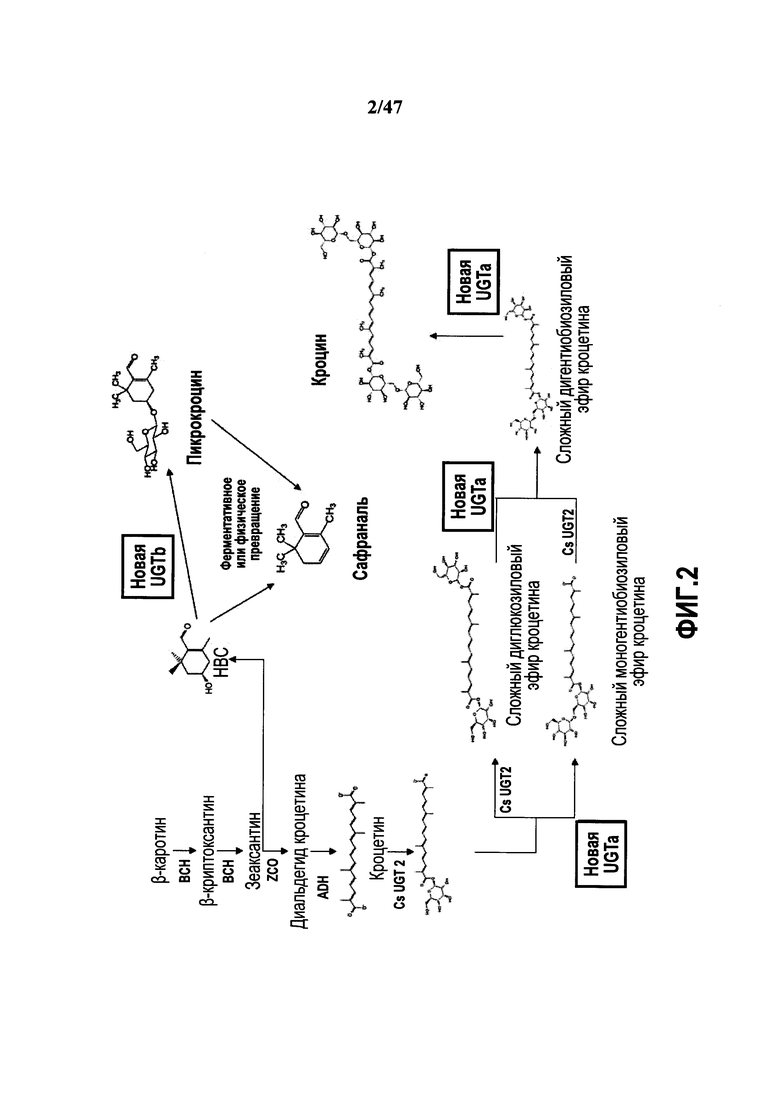
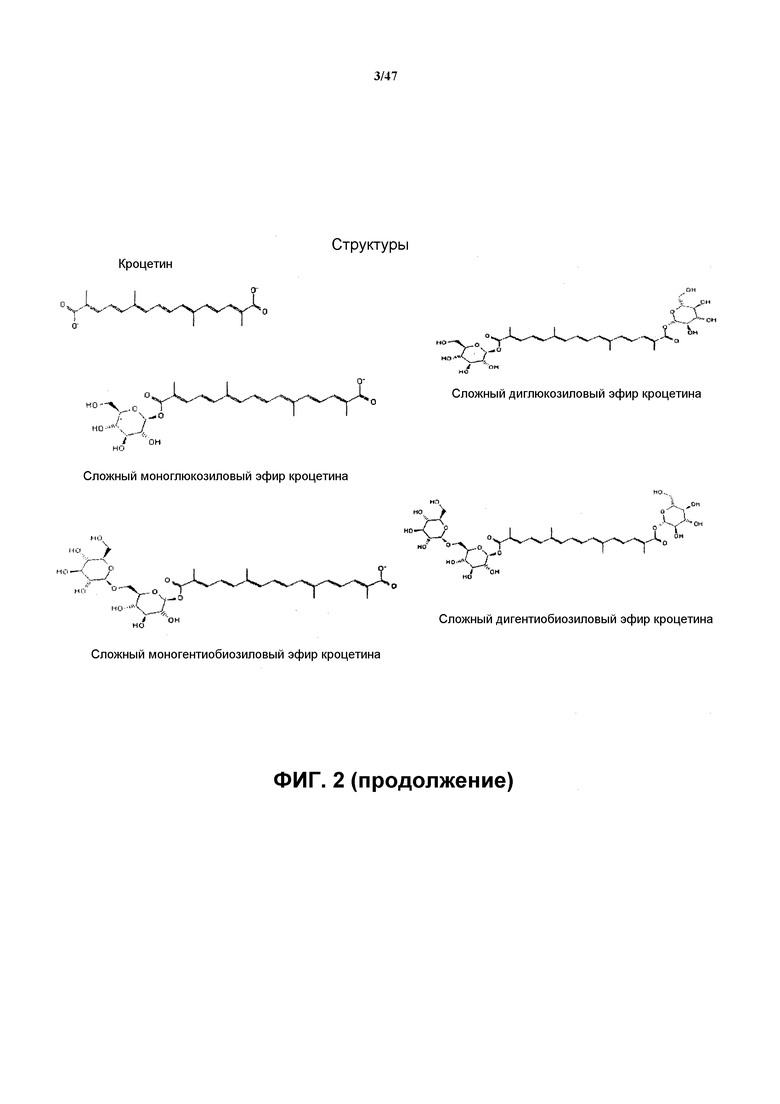
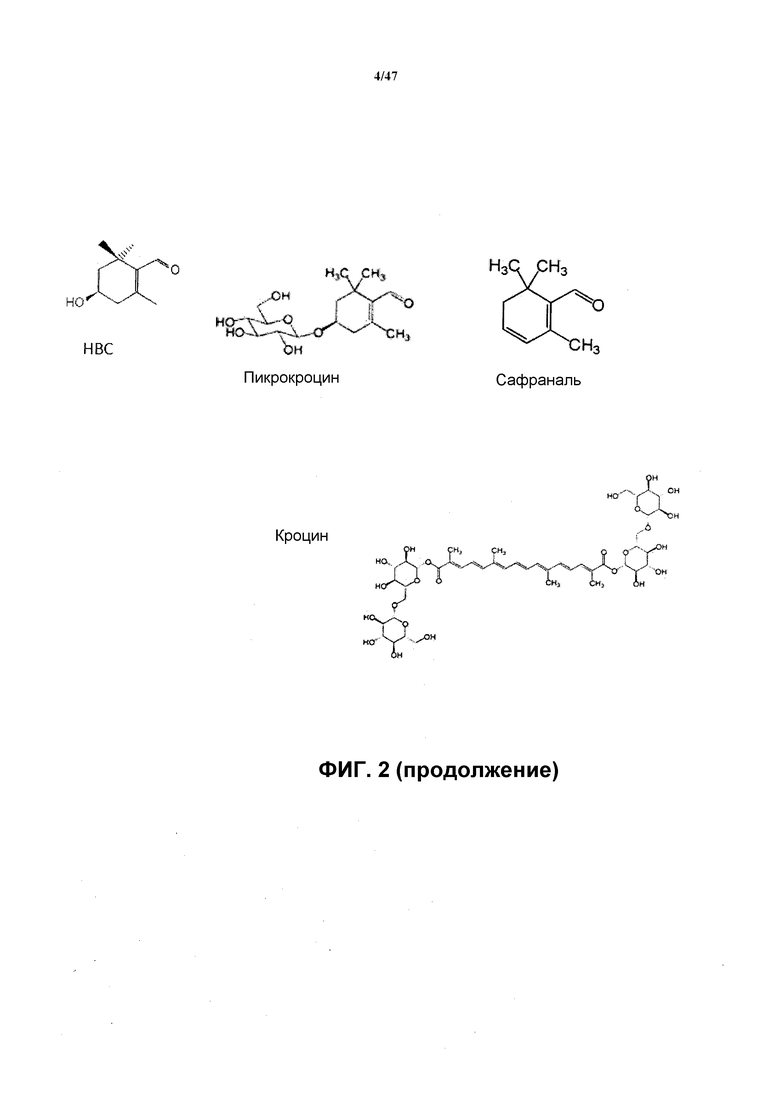









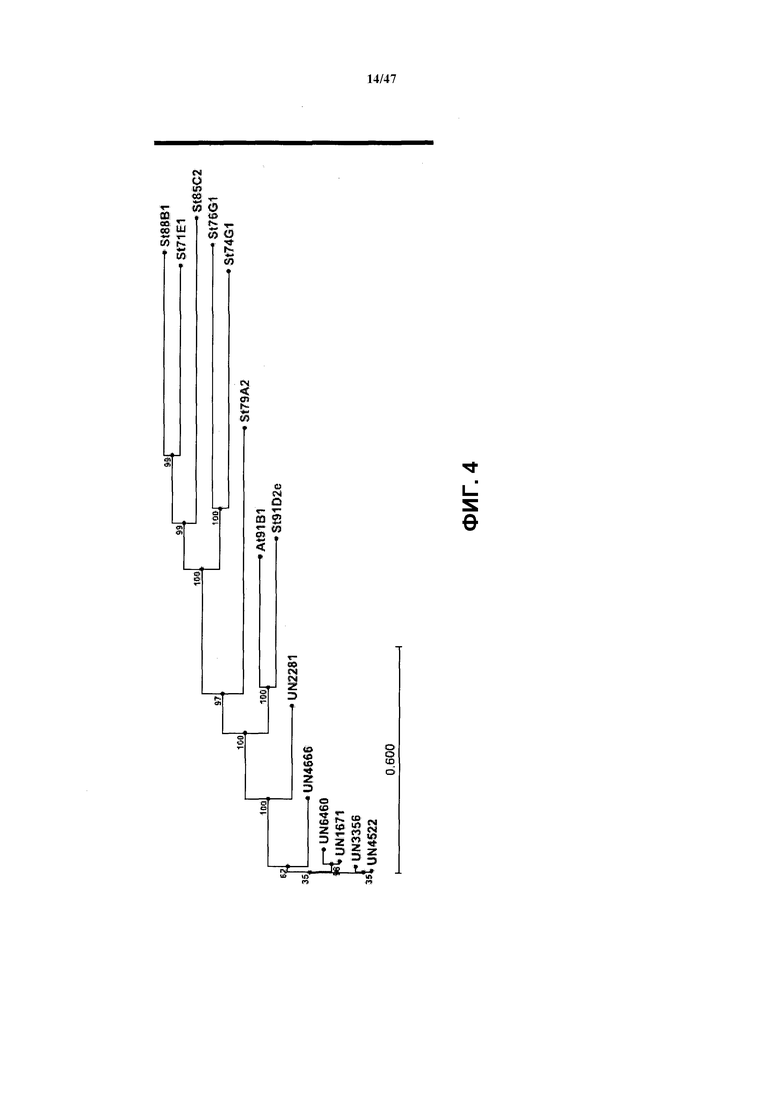

































Изобретение относится к области биотехнологии и биохимии, в частности к рекомбинантной клетке-хозяину для получения диальдегида кроцетина, кроцетина и гидроксил-β-циклоцитраля. Указанная клетка-хозяин согласно изобретению содержит экзогенные нуклеиновые кислоты, кодирующие расщепляющую зеаксантин диоксигеназу, β-каротингидроксилазу, геранилгеранилдифосфатсинтазу, фитоинсинтазу, фитоиндегидрогеназу и β-каротинсинтазу. Настоящее изобретение позволяет получать диальдегид кроцетина, кроцетин и гидроксил-β-циклоцитраль с помощью рекомбинантной клетки-хозяина. 15 з.п. ф-лы, 11 ил., 4 табл., 9 пр.
1. Рекомбинантная клетка-хозяин для получения диальдегида кроцетина, кроцетина и гидроксил-β-циклоцитраля, содержащая:
(а) экзогенную нуклеиновую кислоту, кодирующую расщепляющую зеаксантин диоксигеназу, при этом указанная расщепляющая зеаксантин диоксигеназа необязательно представляет собой расщепляющую зеаксантин диоксигеназу Crocus sativus,
(b) экзогенную нуклеиновую кислоту, кодирующую β-каротингидроксилазу,
(c) экзогенную нуклеиновую кислоту, кодирующую геранилгеранилдифосфатсинтазу,
(d) экзогенную нуклеиновую кислоту, кодирующую фитоинсинтазу,
(e) экзогенную нуклеиновую кислоту, кодирующую фитоиндегидрогеназу, и
(f) экзогенную нуклеиновую кислоту, кодирующую β-каротинсинтазу.
2. Клетка-хозяин по п.1, где указанная клетка-хозяин дополнительно содержит эндогенный ген, кодирующий β-каротингидроксилазу или альдегиддегидрогеназу, или экзогенную нуклеиновую кислоту, кодирующую альдегиддегидрогеназу.
3. Клетка-хозяин по любому из пп.1 или 2, где указанная клетка-хозяин дополнительно содержит экзогенную нуклеиновую кислоту, кодирующую агликон-O-гликозил-уридин-5’-дифосфо(UDP)гликозилтрансферазу (O-гликозил-UGT).
4. Клетка-хозяин по п.3, где указанная агликон-O-гликозил UGT представляет собой UGT85C2, имеющую аминокислотную последовательность, представленную SEQ ID NO:10, или агликон-O-гликозил UGT, имеющую 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO:12, или гибридный фермент UGT71, содержащий 71C125571C2, имеющий 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO:18, и 71C125571E1, имеющий 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO:20.
5. Клетка-хозяин по п.3, где указанная клетка-хозяин продуцирует регистрируемые количества пикрокроцина или кроцина.
6. Клетка-хозяин по п.5, где некоторое количество или весь полученный пикрокроцин деглюкозилирован для получения сафраналя.
7. Клетка-хозяин по любому из пп.1-6, где указанная клетка-хозяин дополнительно содержит экзогенную нуклеиновую кислоту, кодирующую уридин-5’-дифосфоглюкоза(UDP-глюкоза)кроцетин-8,8’-глюкозилтрансферазу, где указанная UDP-глюкоза-кроцетин-8,8’-глюкозилтрансфераза содержит UDP-глюкоза-кроцетин-8,8’-глюкозилтрансферазу Crocus sativus, и где UDP-глюкоза-кроцетин-8,8’-глюкозилтрансфераза Crocus sativus содержит полипептид, имеющий 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO:66.
8. Клетка-хозяин по п.7, где указанная клетка-хозяин продуцирует регистрируемое количество моноглюкозида кроцетина, диглюкозида кроцетина, кроцина или сложного эфира кроцетина.
9. Клетка-хозяин по любому из пп. 1-8, где клетка-хозяин дополнительно содержит:
(a) экзогенную нуклеиновую кислоту, кодирующую UGT76G1, который может необязательно иметь 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO: 4;
(b) экзогенную нуклеиновую кислоту, кодирующую 71C125571C2, который может необязательно иметь 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO: 18; или
(c) экзогенную нуклеиновую кислоту, кодирующую 71C125571E1, который может необязательно иметь 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO: 20.
10. Клетка-хозяин по п. 8, где клетка-хозяин продуцирует регистрируемое количество сложного гентиобиозилового эфира из кроцетина, кроцина или сложных моно- и диглюкозиловых эфиров из кроцетина.
11. Клетка-хозяин по любому из пп. 1-10, где клетка-хозяин дополнительно содержит ген, имеющий 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO: 29, или ген, имеющий 80% или более идентичность аминокислотной последовательности, представленной SEQ ID NO: 31.
12. Клетка-хозяин по любому из пп. 1-11, где клетка-хозяин представляет собой микроорганизм или растительную клетку.
13. Клетка-хозяин по п. 12, где микроорганизмом являются дрожжи Saccharomycete или Escherichia coli.
14. Клетка-хозяин по п. 13, где дрожжами являются жировые дрожжи.
15. Клетка-хозяин по п. 13, где Saccharomycete является Saccharomyces cerevisiae.
16. Клетка-хозяин по п. 12, где растительной клеткой является клетка Crocus sativus.
| QIU D | |||
| et al | |||
| Improved protocol for Agrobacterium mediated transformation of tomato and production of transgenic plants containing carotenoid biosynthetic gene CsZCD | |||
| SCIENTIA HORTICULTURAE, 2007 | |||
| CASTILLO R | |||
| et al | |||
| Implications of carotenoid biosynthetic genes in apocarotenoid formation during the stigma development of Crocus sativus and its closer relatives | |||
| PLANT PHYSIOLOGY, 2005 | |||
| RU 2003108882 A, 10.12.2004. |
Авторы
Даты
2019-01-10—Публикация
2012-08-07—Подача