ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки U.S. № 62/038682, поданной 18 августа 2014 г., полное содержание которой включено в настоящее изобретение в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу лечения патологического состояния сустава. Способ включает введение эффективного количества фармацевтической композиции, содержащей дикетопиперазин с множеством аминокислотных цепей, состоящих из аспарагиновой кислоты и аланина (DA-DKP). Настоящее изобретение также относится к применению фармацевтического продукта, содержащего DA-DKP.
УРОВЕНЬ ТЕХНИКИ
Остеоартрит является самой распространенной формой артрита, поражающей от 25 до 35 миллионов человек в США. Хроническая боль и инвалидность при остеоартрите первоначально вызвана воспалительными ответами в суставном хряще и костях и со временем она постепенно ухудшается. Симптоматический остеоартрит коленного сустава возникает у от 10 до 13% людей в возрасте 60 лет и старше. Сам остеоартрит коленного сустава увеличивает риск потери подвижности, такой как необходимость помощи при ходьбе и подъеме по лестнице, который выше, чем для любого другого патологического состояния у людей в возрасте 65 лет и старше.
Современное лекарственное лечение остеоартрита коленного сустава ограничено анальгетиками, нестероидными противовоспалительными лекарственными средствами (NSAIDs) и внутрисуставными стероид инъекциями, которые все характеризуются значительными ограничениями вследствие побочных эффектов. Несмотря на эти средства лечения, хронический остеоартрит коленного сустава часто приводит к прогрессирующей инвалидности, вследствие которой необходима полная замена сустава. Увеличивающаяся распространенность остеоартрита коленного сустава вследствие старения и ожирения населения свидетельствует о возрастании необходимости в безопасном и эффективном местном средстве лечения коленного сустава, которое отложит и, возможно, исключит необходимость в более далеко идущем хирургическом лечении.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одним вариантом осуществления настоящего изобретения является способ лечения патологического состояния сустава путем введения животному, нуждающемуся в таком лечении, эффективного количества фармацевтической композиции, которая содержит DA-DKP, в многодозовом режиме. Патологическим состоянием сустава может быть заболевание сустава, такое как дегенеративное заболевание сустава, например, остеоартрит. Альтернативно, патологическим состоянием сустава может быть поражение сустава, такое как травматическое поражение, послеоперационное поражение или хроническое растяжение травматического характера. Кроме того, патологическим состоянием сустава может быть воспаление.
В этом способе композицию можно вводить путем локального введения, местного введения или инъекции, такой как внутрисуставная инъекция. В случае введения с помощью внутрисуставной инъекции композиция может обладать концентрацией DA-DKP, равной от примерно 50 мкМ до примерно 350 мкМ.
В этом способе композиция может дополнительно содержать N-ацетилтриптофан (NAT), каприловую кислоту, каприлат или их комбинации. В этом варианте осуществления композиция может обладать концентрацией NAT, каприловой кислоты, каприлата или их комбинации, равной от примерно 4 мМ до примерно 20 мМ. В другом варианте осуществления DA-DKP может содержаться в композиции, полученной путем удаления альбумина из раствора композиции сывороточного альбумина человека, такого как обработка композиции сывороточного альбумина человека по методике разделения, выбранной из группы, включающей ультрафильтрование, центрифугирование в градиенте плотности сахарозы, хроматографию, осаждение соли и обработку ультразвуком. В предпочтительном варианте осуществления стадия удаления может включать пропускание композиции сывороточного альбумина человека через ультрафильтрующую мембрану, обладающую номинальной задерживаемой молекулярной массой, которая обеспечивает удерживание альбумина и при использовании которой полученный фильтрат содержит DA-DKP, например, путем использования ультрафильтрующей мембраны, которая обладает номинальной задерживаемой молекулярной массой, равной менее 50 кДа, менее 40 кДа, менее 30 кДа, менее 20 кДа, менее 10 кДа, менее 5 кДа или менее 3 кДа.
В другом варианте осуществления фармацевтическая композиция может дополнительно включать второе лекарственное средство, выбранное из группы, включающей анальгетическое, противовоспалительное лекарственное средство и их комбинации.
В этом способе количество доз в многодозовом режиме может равняться от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 4 или равняться 3. Кроме того, промежуток времени между дозами может составлять от 2 дней до 6 недель от 2 дней до 5 недель, от 2 дней до 4 недель, от 2 дней до 3 недель, от 1 недели до 3 недель или 2 недели.
Предпочтительным вариантом осуществления настоящего изобретения является способ лечения остеоартрита путем введения с помощью внутрисуставной инъекции в пораженный сустав первой дозы, второй дозы и третьей дозы. В этом варианте осуществления каждая первая доза, вторая доза и третья доза содержит 4 мл обладающей равной <5000 молекулярной массой (ММ) фракции сывороточного альбумина человека и, кроме того, вторую дозу вводят через две недели после первой дозы и третью дозу вводят через две недели после второй дозы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
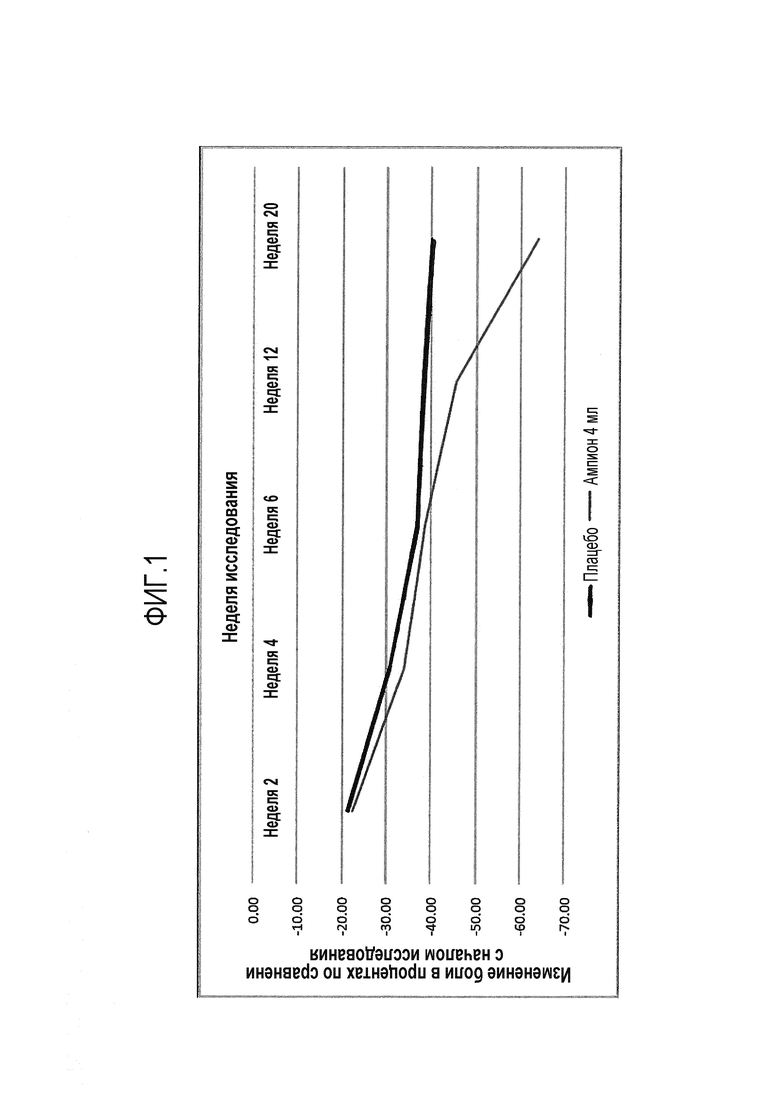
На фиг. 1 представлено среднее изменение в процентах показателя боли WOMAC A для лечения, описанного в примере 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения патологического состояния сустава путем введения композиции, содержащей DA-DKP, в многодозовом режиме. Лечение включает введение нуждающемуся в нем индивидууму эффективного количества фармацевтической композиции, содержащей аспартилаланилдикетопиперазин (DA-DKP). DA-DKP характеризуется многими противовоспалительными и иммуномодулирующими воздействиями, включая ингибирование множества провоспалительных цитокинов, хемокинов и сигнальных молекул на уровне транскрипции, ингибирование миграции и адгезии T-клеток и моноцитов, активности на уровне связанного с G-белком рецептора, активности актинзависимых цитоскелетных проявлений, снижение проницаемости сосудов и подавление воспаления, вызванного фактором активации тромбоцитов. Как подробнее описано ниже, установлено, что влияние DA-DKP на патологические состояния суставов является неожиданно длительным и в некоторых исследованиях установлено, что оно усиливается со временем по сравнению со случаем использования стероидов.
Настоящее изобретение также относится к фармацевтическому продукту, содержащему композицию DA-DKP. DA-DKP продукта можно получить путем удаления альбумина из раствора сывороточного альбумина человека.
При использовании в настоящем изобретении термин "патологическое состояние сустава" означает любое заболевание, расстройство или поражение сустава. Примеры патологических состояний суставов включают, но не ограничиваются только ими, острые заболевания, хронические заболевания, рефракторные заболевания, прогрессирующие заболевания (включая дегенеративные заболевания), травматические поражения, хронические растяжения травматического характера, токсические поражения, послеоперационные патологические состояния и воспаление со структурным поражением или без него.
Дегенеративное заболевание сустава представляет собой постепенное разрушение суставного хряща, который покрывает суставы. Дегенеративное заболевание сустава (остеоартрит) является неинфекционным прогрессирующим нарушением несущих нагрузку суставов. Нормальный суставной хрящ является гладким, белым и полупрозрачным. Он состоит из хрящевых клеток (хондроцитов), включенных в губчатый матрикс, состоящий из коллагена, белка, полисахаридов и воды. В случае раннего первичного артрита хрящ становится желтым и непрозрачным с локализованными участками размягчения и огрубления поверхностей. По мере прогрессирования дегенерации мягкие участки растрескиваются и истираются, открывая кость, находящуюся под хрящом. Затем кость начинает ремоделироваться и ее плотность увеличивается, а весь оставшийся хрящ начинает изнашиваться. В конечном счете на краю сустава образуются остеофиты (выросты новой кости), покрытые хрящом. При увеличении механического износа хрящ необходимо восстановить. Хрящевые клетки неспособны выработать достаточное количество губчатого матрикса и поэтому поврежденный хрящ не способен восстановиться самостоятельно. В хрящ не поступает кровоток для стимулирования излечивания. Большинство дегенеративных заболеваний суставов является следствием механических нестабильностей или старческих изменений в суставе. Они включают старческий дегенеративный артрит и у более молодых индивидуумов может быть следствием, например, поражений, ушибов, анормальной конфигурации сустава (т. е. дисплазии тазобедренного сустава) или механического износа вследствие разрыва передней крестообразной связки, надколенного вывиха или рассекающего теохондрита. Дегенеративное заболевание сустава может наблюдаться в любом суставе организма, включая, без наложения ограничений, колено, бедро, плечо, руку и спинной хребет.
Обычные фармацевтические средства лечения патологических состояний суставов включают ацетаминофен, нестероидные противовоспалительные лекарственные средства (NSAIDS), наркотики и кортикостероиды.
"Лечение" при использовании в настоящем изобретении означает ослабление (полное или частичное) симптомов, уменьшение длительности или тяжести патологического состояния.
Фармацевтическую композицию, содержащую DA-DKP, предлагаемую в настоящем изобретении, вводят животному, нуждающемуся в таком лечении. Предпочтительно, если животным является млекопитающее, такое как кролик, коза, собака, кошка, лошадь или человек. Эффективные дозы могут меняться в зависимости от тяжести заболевания или патологического состояния, пути (путей) введения, длительности лечения, любых конкретных других лекарственных средств, вводимых животному, возраста, размера и вида животного и аналогичных факторов, известных в медицине и ветеринарии.
Композицию, предлагаемую в настоящем изобретении, содержащую DA-DKP, можно вводить пациенту-животному любым подходящим путем введения, включая местный, парентеральный (например, инъекцию, внутрисуставную, внутривенную, внутрипозвоночную, внутрибрюшинную, подкожную или внутримышечную инъекцию), чрескожный и местный. Предпочтительным путем введения является внутрисуставная инъекция.
Композиция, предлагаемая в настоящем изобретении, может представлять собой фармацевтический раствор, обладающий концентрацией DA-DKP, находящейся в диапазоне с нижним конечным значением, равным примерно 10 мкМ, примерно 20 мкМ, примерно 30 мкМ, примерно 40 мкМ, примерно 50 мкМ, примерно 60 мкМ, примерно 70 мкМ, примерно 80 мкМ, примерно 90 мкМ, примерно 100 мкМ, примерно 110 мкМ, примерно 120 мкМ, примерно 130 мкМ, примерно 140 мкМ, примерно 150 мкМ, примерно 160 мкМ, примерно 170 мкМ, примерно 180 мкМ, примерно 190 мкМ, примерно 200 мкМ, примерно 210 мкМ, примерно 220 мкМ, примерно 230 мкМ, примерно 240 мкМ, примерно 240, примерно 250 мкМ, примерно 260 мкМ, примерно 270 мкМ, примерно 280 мкМ, примерно 290 мкМ, примерно 300 мкМ, примерно 310, примерно 320 мкМ, примерно 330 мкМ, примерно 340 мкМ, примерно 350 мкМ, примерно 360 мкМ, примерно 370 мкМ, примерно 380 мкМ, примерно 390 мкМ или примерно 400 мкМ. Композиция, предлагаемая в настоящем изобретении, может представлять собой фармацевтический раствор, обладающий концентрацией DA-DKP, находящейся в диапазоне с верхним конечным значением, равным примерно 600 мкМ, примерно 580 мкМ, примерно 570 мкМ, примерно 560 мкМ, примерно 550 мкМ, примерно 540 мкМ, примерно 530 мкМ, примерно 520 мкМ, примерно 510 мкМ, примерно 500 мкМ, примерно 490 мкМ, примерно 480 мкМ, примерно 470 мкМ, примерно 460 мкМ, примерно 450 мкМ, примерно 440 мкМ, примерно 430 мкМ, примерно 420 мкМ, примерно 410 мкМ, примерно 400 мкМ, примерно 390 мкМ, примерно 380 мкМ, примерно 370 мкМ, примерно 360 мкМ, примерно 350, примерно 340 мкМ, примерно 330 мкМ, примерно 320 мкМ, примерно 310 мкМ, примерно 300 мкМ, примерно 290 мкМ, примерно 280, примерно 270 мкМ, примерно 260 мкМ, примерно 250 мкМ, примерно 240 мкМ, примерно 230 мкМ, примерно 220 мкМ, примерно 210 мкМ или примерно 200 мкМ.
Эффективное количество DA-DKP в композиции, предлагаемой в настоящем изобретении, для лечения патологического состояния сустава, предлагаемого в настоящем изобретении, может находиться в диапазоне с нижним конечным значением, равным примерно 10 мкг, примерно 15 мкг, примерно 20 мкг, примерно 25 мкг, примерно 30 мкг, примерно 35 мкг, примерно 40 мкг, примерно 45 мкг, примерно 50 мкг, примерно 55 мкг, примерно 60 мкг, примерно 65 мкг, примерно 70 мкг, примерно 75 мкг, примерно 80 мкг, примерно 85 мкг, примерно 90 мкг, примерно 95 мкг, примерно 100 мкг, примерно 110 мкг, примерно 120 мкг, примерно 130 мкг, примерно 140 мкг, примерно 150 мкг, примерно 160 мкг, примерно 170 мкг, примерно 180 мкг, примерно 190 мкг, примерно 200 мкг, примерно 210 мкг, примерно 220 мкг, примерно 230 мкг, примерно 240 мкг, примерно 250 мкг, примерно 260 мкг, примерно 270 мкг, примерно 280 мкг, примерно 290 мкг, примерно 300 мкг, примерно 310 мкг, примерно 320 мкг, примерно 330 мкг, примерно 340 мкг, примерно 350 мкг, примерно 360 мкг, примерно 370 мкг, примерно 380 мкг, примерно 390 мкг, примерно 400 мкг, примерно 425 мкг, примерно 450 мкг, примерно 475 мкг или примерно 500 мкг. Кроме того, эффективное количество DA-DKP в композиции, предлагаемой в настоящем изобретении, для лечения патологического состояния сустава, может находиться в диапазоне с верхним конечным значением, равным примерно 500 мкг, примерно 490 мкг, примерно 480 мкг, примерно 470 мкг, примерно 460 мкг, примерно 450 мкг, примерно 440 мкг, примерно 430 мкг, примерно 420 мкг, примерно 410 мкг, примерно 400 мкг, примерно 390 мкг, примерно 380 мкг, примерно 370 мкг, примерно 360 мкг, примерно 350 мкг, примерно 340 мкг, примерно 330 мкг, примерно 320 мкг, примерно 310 мкг, примерно 300 мкг, примерно 290 мкг, примерно 280 мкг, примерно 270 мкг, примерно 260 мкг, примерно 250 мкг, примерно 240 мкг, примерно 230 мкг, примерно 220 мкг, примерно 210 мкг, примерно 200 мкг, примерно 190 мкг, примерно 180 мкг, примерно 170 мкг, примерно 160 мкг, примерно 150 мкг, примерно 140 мкг, примерно 130 мкг, примерно 120 мкг, примерно 110 мкг, примерно 100 мкг, примерно 90 мкг, примерно 80 мкг, примерно 70 мкг, примерно 60 мкг, примерно 50 мкг, примерно 40 мкг, примерно 30 мкг или примерно 20 мкг.
В вариантах осуществления, в которых вводят DA-DKP и низкомолекулярную фракцию сывороточного альбумина человека, такую как обладающая ММ, равной <5000, описанная ниже и примером которой является ампион™, доза, вводимая пациенту, может составлять от примерно 1 мл до примерно 20 мл, от примерно 1 мл до примерно 15 мл, от примерно 1 мл до примерно 10 мл, от примерно 1 мл до примерно 8 мл, от примерно 2 мл до примерно 6 мл, от примерно 3 мл до примерно 5 мл или примерно 4 мл.
Дозированные формы для местного или чрескожного введения соединений, предлагаемых в настоящем изобретении, включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и капли. Активный ингредиент в стерильных условиях можно смешать с фармацевтически приемлемым носителем и с любыми буферами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели в дополнение к активному ингредиенту могут содержать инертные наполнители, такие как животные и растительные жиры, масла, воска, парафины, крахмал, трагакантовая камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка или их смеси. Порошки и спреи в дополнение к активному ингредиенту могут содержать инертные наполнители, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и порошкообразный полиамид или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
Чрескожные пластыри обладают тем дополнительным преимуществом, что обеспечивают регулируемую доставку в организм соединений, предлагаемых в настоящем изобретении. Такие дозированные формы можно получить применения растворения, диспергирования или другой процедуры с включением одного или большего количества соединений, предлагаемых в настоящем изобретении, в надлежащей среде, такой как эластомерный матричный материал. Для усиления потока соединения через кожу также можно использовать усилители абсорбции. Скорость такого потока можно изменять путем использования регулирующей скорость мембраны или диспергирования соединения в полимерной матрице или геле.
Фармацевтические композиции, предлагаемые в настоящем изобретении, пригодные для парентеральный путей введения, содержат одно или большее количество соединений, предлагаемых в настоящем изобретении, в комбинации с одним или большим количеством фармацевтически приемлемых стерильных изотонических водных или неводных растворов, дисперсий, суспензий или эмульсий, или стерильных порошков, которые непосредственно перед использованием можно восстановить с получением стерильных растворов или дисперсий для инъекции, которые могут содержать антиоксиданты, буферы, растворенные или суспендирующие или загущающие агенты.
Примеры подходящих водных или неводных носителей, которые можно использовать в фармацевтических композициях, предлагаемых в настоящем изобретении, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т. п.) и подходящие их смеси, растительные масла, такие как оливковое масло, и применимые для инъекции органические сложные эфиры, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования материалов покрытий, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ.
Эти композиции также могут содержать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Также может быть желательным включение в композиции изотонических агентов, таких как сахара, хлорид натрия и т. п. Кроме того, пролонгированное всасывание фармацевтической формы для инъекции можно обеспечить путем включения агентов, которые задерживают всасывание, таких как моностеарат алюминия и желатин.
В некоторых случаях для пролонгирования действия лекарственного средства желательно замедлить всасывание лекарственного средства при подкожных или внутримышечных инъекциях. Это можно осуществить путем использования жидкой суспензии кристаллического или аморфного вещества, обладающего плохой растворимостью в воде. Тогда скорость всасывания лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание вводимого парентерально лекарственного средства обеспечивают путем растворения или суспендирования лекарственного средства в маслообразном носителе.
Формы депо для инъекции готовят путем формирования микрокапсульных матриц лекарственного средства в биологически разлагающихся полимерах, таких как полилактид-полигликолид. В зависимости от отношения количества лекарственного средства к количеству полимера и природы конкретного использующегося полимера можно регулировать скорость высвобождения лекарственного средства. Примеры других биологически разлагающихся полимеров включают поли(ортоэфиры) и поли(ангидриды). Формы депо для инъекции также готовят путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканью организма. Материалы для инъекции можно стерилизовать, например, фильтрованием через удерживающий бактерии фильтр.
Составы можно предоставлять в однодозовых или многодозовых герметичных емкостях, например, в ампулах и флаконах, и их можно хранить в лиофилизированном виде и для их использования необходимо непосредственно перед применением только добавление стерильного жидкого носителя, например, воды для инъекции. Растворы и суспензии для немедленного применения в виде инъекции можно приготовить из стерильных порошков, гранул и таблеток описанного выше типа.
В объем настоящего изобретения также входят наборы, содержащие фармацевтические продукты, предлагаемые в настоящем изобретении. Наборы могут содержать композицию DA-DKP, приготовленную для введения путем инъекции. DA-DKP можно получить, как описано в настоящем изобретении, например, путем удаления альбумина из композиции раствора альбумина человека. Наборы могут содержать однодозовые или многодозовые герметичные емкости, например, ампулы и флаконы, и их можно хранить в лиофилизированном виде и для их использования необходимо непосредственно перед применением только добавление стерильного жидкого носителя, например, воды для инъекции. Наборы также можно хранить при условиях, при которых содержимое готово к непосредственному применению или для инъекции.
Хотя соединение, предлагаемое в настоящем изобретении, можно вводить отдельно, предпочтительно вводить соединение в виде фармацевтического состава (композиции). Фармацевтические композиции, предлагаемые в настоящем изобретении, содержат соединение или соединения, предлагаемые в настоящем изобретении, в качестве активного ингредиента в смеси с одним или большим количеством фармацевтически приемлемых носителей и необязательно с одним или большим количеством других соединений, лекарственных средств или других веществ. Каждый носитель должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами состава и не быть вредными для животного. Фармацевтически приемлемые носители хорошо известны в данной области техники. Независимо от выбранного пути введения, соединения, предлагаемые в настоящем изобретении, готовят в виде фармацевтически приемлемых дозированных форм по обычным методикам, известным специалистам в данной области техники. См., например, Remingtonʹs Pharmaceutical Sciences.
Композиция, предлагаемая в настоящем изобретении, может дополнительно содержать N-ацетилтриптофан (NAT), каприловую кислоту, каприлат или их комбинации. Предпочтительно, если композиция может содержать NAT. Композиции, предлагаемые в настоящем изобретении, содержащие NAT, каприловую кислоту, каприлат или их комбинации, могут представлять собой фармацевтическую композицию, содержащую NAT, каприловую кислоту, каприлат или их комбинации, при концентрации, находящейся в диапазоне с нижним конечным значением, равным примерно 1 мМ, примерно 2 мМ, примерно 3 мМ, примерно 4 мМ, примерно 5 мМ, примерно 6 мМ, примерно 7 мМ, примерно 8 мМ, примерно 9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ или примерно 20 мМ. Кроме того, композиции, предлагаемые в настоящем изобретении, содержащие NAT, каприловую кислоту, каприлат или их комбинации, могут представлять собой фармацевтическую композицию, содержащую NAT, каприловую кислоту, каприлат или их комбинации, при концентрации, находящейся в диапазоне с верхним конечным значением, равным примерно 40 мМ, примерно 39 мМ, примерно 38 мМ, примерно 37 мМ, примерно 36 мМ, примерно 35 мМ, примерно 34 мМ, примерно 33 мМ, примерно 32 мМ, примерно 31 мМ, примерно 30 мМ, примерно 29 мМ, примерно 28 мМ, примерно 27 мМ, примерно 26 мМ, примерно 25 мМ, примерно 24 мМ, примерно 23 мМ, примерно 22 или примерно 21 мМ. Предпочтительно, если диапазон концентрации составляет от примерно 4 мМ до примерно 20 мМ.
Кроме того, композиция, предлагаемая в настоящем изобретении, также может содержать второе лекарственное средство, такое как анальгетическое (такое как лидокаин или парацетамол), противовоспалительное (такое как бетаметазон, нестероидные противовоспалительные лекарственные средства (NSAIDs), ацетаминофен, ибупрофен, напроксен) и/или другие подходящие лекарственные средства.
Способы получения дикетопиперазинов, таких как DA-DKP, хорошо известны в данной области техники и эти способы можно использовать для синтеза дикетопиперазинов, предлагаемых в настоящем изобретении. См., например, патенты U.S. №№ 4694081, 5817751, 5990112, 5932579 и 6555543, публикацию заявки на патент U.S. № 2004/0024180, заявки PCT WO 96/00391 и WO 97/48685, и Smith et al., Bioorg. Med. Chem. Letters, 8, 2369-2374 (1998), полные раскрытия которых включены в настоящее изобретение в качестве ссылки.
Например, дикетопиперазины, такие как DA-DKP, можно получить путем проводимого сначала синтеза дипептидов. Дипептиды можно синтезировать по методикам, хорошо известным в данной области техники, с использованием L-аминокислот, D-аминокислот или комбинации D- и L-аминокислот. Предпочтительными являются твердофазные методики синтеза пептидов. Разумеется, дипептиды также можно приобрести из разных источников, включая фирмы DMI Synthesis Ltd., Cardiff, UK (заказной синтез), Sigma-Aldrich, St. Louis, MO (первичный заказной синтез), Phoenix Pharmaceuticals, Inc., Belmont, CA (заказной синтез), Fisher Scientific (заказной синтез) и Advanced ChemTech, Louisville, KY.
После синтеза или приобретения дипептида его циклизуют с образованием дикетопиперазина. Это можно провести по различным методикам. Например, в публикации заявки на патент U.S. № 2004/0024180 описан способ циклизации дипептидов. Вкратце, методика заключается в следующем: дипептид нагревают в органическом растворителе с удалением воды путем отгонки. Предпочтительным является органический растворитель, который образует азеотропную смесь с водой, такой как ацетонитрил, аллиловый спирт, бензол, бензиловый спирт, н-бутанол, 2-бутанол, трет-бутанол, бутиловый эфир уксусной кислоты, тетрахлорид углерода, хлорбензол хлороформ, циклогексан, 1,2-дихлорэтан, диэтилацеталь, диметилацеталь, этиловый эфир уксусной кислоты, гептан, метилизобутилкетон, 3-пентанол, толуол и ксилол. Температура зависит от скорости реакции циклизации и от типа использующегося азеотропного реагента. Реакцию предпочтительно проводят при температуре, равной 50-200°C, более предпочтительно равной 80-150°C. Специалист в данной области техники может без труда определить диапазон значений pH, при котором происходит циклизация. Предпочтительно, если он составляет 2-9, более предпочтительно 3-7.
Если одна или обе из аминокислот дипептида содержит в боковой цепи карбоксигруппу (например, остаток аспарагиновой кислоты или глутаминовой кислоты) или она включена путем получения производного, то дипептид предпочтительно циклизуют так, как это описано в патенте U.S. № 6555543. Вкратце, методика заключаемся в следующем: дипептид, содержащий в боковой цепи защищенную карбоксигруппу, нагревают в нейтральной среде. Обычно дипептид нагревают при температуре, равной от примерно 80°C до примерно 180°C, предпочтительно примерно при 120°C. Растворителем должен быть нейтральный растворитель. Например, растворитель может включать спирт (такой как бутанол, метанол, этанол и высшие спирты, но не фенол) и образующий азеотропную смесь сорастворитель (такой как толуол, бензол или ксилол). Предпочтительно, если спиртом является бутан-2-ол, и образующий азеотропную смесь сорастворителем является толуол. Нагревание продолжают до завершения реакции и его продолжительность можно определить эмпирически. Обычно дипептид циклизуют путем кипячения с обратным холодильником в течение примерно 8-24 ч, предпочтительно в течение примерно 18 ч. В заключение из дикетопиперазина удаляют защитную группу. При проведении удаления для сохранения хиральности конечного соединения следует избегать использование сильных кислот (неорганических кислот, таких как серная или хлористоводородная кислоты), сильных оснований (щелочей, таких как гидроксид калия или гидроксид натрия) и сильных восстановительных реагентов (например, алюмогидрид лития).
Дипептиды, приготовленные на твердофазных смолах, можно циклизовать и отделять от смолы за одну стадию. См., например, патент U.S. № 5817751. Например, молу, содержащую присоединенный N-алкилированный дипептид, суспендируют в толуоле или смеси толуол/этанол в присутствии уксусной кислоты (например, 1%) или триэтиламина (например, 4%). Обычно для более быстрого приведения циклизации предпочтительной является щелочная среда.
Другие методики циклизации дипептидов и получения дикетопиперазинов известны в данной области техники и их можно использовать для получения дикетопиперазинов, применимых при практическом осуществлении настоящего изобретения. См., например, приведенные выше ссылки. Кроме того, многие дикетопиперазины, пригодные для использования в настоящем изобретении, можно получить из белков и пептидов, как описано ниже. Кроме того, дикетопиперазины для применения при практическом осуществлении настоящего изобретения, можно приобрести, например, у фирмы DMI Synthesis Ltd., Cardiff, UK (заказной синтез).
Композицию DA-DKP и/или продукты, предлагаемые в настоящем изобретении, можно приготовить из растворов, содержащих DA-DKP, включая имеющиеся в продаже фармацевтические композиции, содержащие альбумин, такой как сывороточный альбумин человека, по хорошо известным методикам, таким как ультрафильтрование, эксклюзионная хроматография, афинная хроматография (например, с использованием колонки с гранулами, к которым присоединено антитело или антитела против желательного дикетопиперазина (дикетопиперазинов), или антитело или антитела против процессированного белка или пептида), анионообменная или катионообменная), центрифугирование в градиенте плотности сахарозы, хроматография, осаждение соли или обработка ультразвуком, которые удаляют часть или весь альбумин, находящийся в растворе. Полученную композицию и/или продукт, содержащий DA-DKP, можно использовать и включить в фармацевтические композиции, как описано выше.
С использованием методики разделения ультрафильтрованием композицию сывороточного альбумина человека можно пропустить через ультрафильтрующую мембрану, обладающую номинальной задерживаемой молекулярной массой, которая обеспечивает удерживание альбумина, тогда как DA-DKP проходит в полученный фильтрат или фракцию. Этот фильтрат может содержать компоненты, обладающие молекулярными массами, равными менее примерно 50 кДа, менее примерно 40 кДа, менее 30 кДа, менее примерно 20 кДа, менее примерно 10 кДа, менее примерно 5 кДа, или менее примерно 3 кДа. Предпочтительно, если фильтрат содержит компоненты, обладающие молекулярными массами, равными менее примерно 5 Да (также обозначаемые, как "ММ <5000"). Эта обладающая ММ, равной <5000, фракция или фильтрат содержит DA-DKP, который образуется после отщепления дипептида аспартат-аланин от альбумина и затем его циклизуют с получением дикетопиперазина.
При практическом осуществлении настоящего изобретения также можно использовать физиологически приемлемые соли DA-DKP, предлагаемого в настоящем изобретении,. Физиологически приемлемые соли включают обычные нетоксичные соли, такие как соли, образованные из неорганических кислот (таких как хлористоводородная, бромистоводородная, серная, фосфорная, азотная и т. п.), органических кислот (таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, глутаминовая, аспарагиновая, бензойная, салициловая, щавелевая, аскорбиновая кислота и т. п.) или оснований (таких как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла или органических катионов, образованных из N,N-дибензилэтилендиамина, D-глюкозамина или этилендиамина). Соли получают обычным образом, например, путем нейтрализации кислотой соединения, находящегося в форме основания.
Настоящее изобретение относится к способу лечения патологического состояния сустава, который включает введение нуждающемуся в нем животному эффективного количества фармацевтической композиции, содержащей DA-DKP, в многодозовом режиме. Согласно изобретению неожиданно было установлено, что значительное ослабление доли и улучшение воздействия по сравнению с однодозовым режимом можно обеспечить путем использования многодозового режима введения фармацевтических композиций, предлагаемых в настоящем изобретении. В патенте U.S. № 8980834, выданном Bar-Or et al. ("Bar-Or"), переуступленном Ampio Pharmaceuticals, Inc., раскрыто лечение остеоартрита с помощью инъекции обладающей ММ, равной <5000, фракции сывороточного альбумина человека (под названием ампион™). В патенте Bar-Or не раскрыт многодозовый режим и, в действительности, предположено, что, вследствие длительного эффекта лечения, введение одной дозы достаточно для периодов времени, достигающих 6 месяцев. Если не ограничиваться теорией, то можно предположить, что улучшенный результат многодозового режима обусловлен не только увеличением количества вводимой активной композиции. Как показано ниже в примере 1, не обнаруживается благоприятный эффект при увеличении вводимой одной дозы от 4 мл ампиона™ до 10 мл. Однако, когда три дозы ампиона™ по 4 мл (всего 12 мл) вводят с промежутками в две недели, как показано в примере 2, наблюдается значительное улучшение. Таким образом, предполагается, что при пролонгированном воздействии на сустав средства лечения в расширенном многодозовом режиме проявляется по меньшей мере небольшой эффект, который не зависит от полного количества вводимой активной композиции.
Многодозовый режим означает введение пациенту фармацевтических композиций, предлагаемых в настоящем изобретении, в виде множества доз, которые вводят через некоторые промежутки времени. В многодозовом режиме двумя важными параметрами являются количество доз и промежуток времени между дозами. В настоящем изобретении количество доз равно более двух и может равняться от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 4 или 3. В настоящем изобретении промежуток времени между любыми двумя дозами может составлять от 2 дней до 6 недель, от 2 дней до 5 недель, от 2 дней до 4 недель, от 2 дней до 3 недель, от 1 недели до 2 недель или быть равен примерно 2 неделям.
Настоящее изобретение может обеспечит значительное ослабление боли, вызванной патологическими состояниями суставов, такими как остеоартрит, и, в особенности в коленном суставе, по сравнению со случаем однократного введения средства лечения. Боль можно оценивать по множеству шкал и одной подходящей шкалой боли является WOMAC A (Western Ontario and McMaster Universities Osteoarthritis). Настоящее изобретение может привести к улучшению показателей WOMAC A или других шкал боли на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с базовыми показателями.
Этот вариант осуществления настоящего изобретения может обеспечить значительное улучшение функции сустава и, в особенности, функции коленного сустава. Функцию суставов можно оценивать по множеству шкал и одной подходящей шкалой является WOMAC C. Настоящее изобретение может привести к улучшению показателей WOMAC C или других шкал функции сустава на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% по сравнению с базовыми показателями.
При использовании в настоящем изобретении "один" означает" один или большее количество.
При использовании в настоящем изобретении "содержит" и "содержащий" включают в свой объем все более узкие термины, такие как "состоящий в основном из" и "состоящий из" в качестве альтернативных вариантов осуществления настоящего изобретения, охарактеризованных в настоящем изобретении терминами "содержит" и "содержащий". При использовании выражения "состоящий в основном из" это выражение ограничивает объем пункта формулы изобретения заданными стадиями и материалами и это не оказывает существенного влияния на основные и новые характеристики раскрытого изобретения.
Дополнительные объекты, преимущества и новые особенности настоящего изобретения должны быть понятны специалистам в данной области техники из рассмотрения приведенных ниже неограничивающих примеров. Приведенные ниже экспериментальные результаты представлены только для иллюстрации и не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Пример 1
Для оценки эффективности и безопасности внутрисуставной (IA) инъекции двух доз ампионаTM взрослым, страдающим болью вследствие остеоартрита коленного сустава (OAK), проведено рандомизированное двойное слепое исследование с контролем с помощью плацебо.
Главная цель исследования
Исследовали, является ли при введении пациентам, страдающих от OAK, эффективность ослабления боли при IA инъекции 10 мл ампионаTM по сравнению с 10 мл плацебо большей, чем эффективность 4 мл ампионаTM по сравнению с 4 мл плацебо.
Субъекты исследования
Субъектами исследования являлись взрослые мужчины и женщины в возрасте от 40 лет до 85 лет (включительно). Подходящие пациенты наблюдались амбулаторно, но в контрольном коленном суставе страдали от умеренной до умеренно сильной вызванной OAK боли, которая при скрининге характеризовалась равным не менее 1,5 показателем WOMAC Index 3.1 по пятиточечной субшкале боли Ликерта. Контрольный коленный сустав пациентов должен был быть симптоматическим в течение более 6 месяцев с клиническим диагнозом OAK, который должен был быть подтвержден данными радиологического исследования (классификация Kellgren-Lawrence (KL) стадии от 2-й до 4-й). У пациентов также должна быть от умеренной до умеренно сильной вызванная OAK боль в контрольном коленном суставе даже при постоянном приеме NSAID в течение 4 недель до скрининга. Пациенты не должны были принимать анальгетики (включая ацетаминофен) в течение 12 ч до исследования эффективности.
Способы лечения
Исследуемым препаратом являлся ампионTM, 4 мл или 10 мл, вводимый в коленный сустав в виде одной IA инъекции. Контрольным препаратом являлся физиологический раствор - плацебо, 4 мл или 10 мл, вводимый в коленный сустав в виде одной IA инъекции. Пациентов, которые соответствовали критериям включения в исследование, случайным образом в соотношении 1:1:1:1 разделяли на следующие 4 группы, которые получали: 4 мл ампионаTM, 4 мл плацебо, 10 мл ампионаTM и 10 мл плацебо.
Клинические результаты лечения боли при OAK определяли с использованием WOMAC и общей оценки пациентом активности заболевания (PGA) при посещениях исследовательского центра через 6 и 12 недель и необязательно через 20 недель и при беседах по телефону через 2, 5, 8 и 10 недель. Полная продолжительность исследования составляла 12 недель, необязательно до 20 недель, исключая период скрининга, составлявший до 4 недель перед днем 0.
Первичная конечная точка эффективности
Первичной конечной точкой эффективности этого исследования являлось изменение субпоказателя боли WOMAC A по пятиточечной шкале боли Ликерта за период от начала исследования (день 0) до недели 12.
Вторичные конечные точки эффективности
Вторичными конечными точками эффективности этого исследования являлись:
изменение субпоказателя боли WOMAC A за период от начала исследования до недель 2, 4, 6, 8 и 10, и необязательно недели 20;
изменение субпоказателя скованности WOMAC B за период от начала исследования до недель 2, 4, 6, 8, 10 и 12;
изменение субпоказателя физического функционирования WOMAC C за период от начала исследования до недель 2, 4, 6, 8, 10 и 12, и необязательно недели 20;
изменение показателя PGA за период от начала исследования до недель 6, 8, 10 и 12, и необязательно недели 20;
изменение состояния ответа, основанного на критериях OMERACT-OARSI на неделях 2, 4, 6, 8, 10 и 12;
изменение среднего субпоказателя боли WOMAC A при опросах 1 и 2 (боль при движении) за период от начала исследования до недель 2, 4, 6, 8, 10 и 12;
изменение среднего субпоказателя боли WOMAC A при опросах от 3 до 5 (боль в состоянии покоя) за период от начала исследования до недель 2, 4, 6, 8, 10 и 12;
применение неотложной анальгезии (использовавшееся количество ацетаминофена); и
частота и тяжесть TEAEs (побочные эффекты после начала лечения).
Оценки безопасности
Оценки безопасности включали сбор данных о сопутствующих лекарственных средствах, физикальных обследованиях, основных показателях состояния организма, клинических лабораторных исследованиях и мониторинг TEAEs.
Демографические и исходные характеристики
Популяция, вошедшая в исследование, являлась репрезентативной популяцией, которой предполагалось назначить лечение ампиономTM. Исходные характеристики были сходными для групп, получавших лечение: в каждой группе большинство пациентов были белыми женщинами и обладали медианным возрастом, равным примерно 62 года.
Результаты для эффективности
У субъектов, принимавших ампионTM, обеспечивалось значительно большее ослабление боли по субпоказателям WOMAC A (улучшение) за период от начала исследования до недели 12, чем у принимавших плацебо (P=0,0038), что соответствовало ослаблению боли примерно на 42% по сравнению с началом исследования. Кроме того, это ослабление боли было более выраженным у пациентов с более тяжелым заболеванием OAK; например, у пациентов с заболеванием, соответствующим стадиям 3 и 4 KL, происходило большее ослабление боли, чем у пациентов, принимавших плацебо, к неделе 12. У пациентов, принимавших ампионTM, также обеспечивалось значительно большее улучшение функции (WOMAC C) за период от начала исследования до недели 12, чем у пациентов, принимавших плацебо (P=0,04). Кроме того, у пациентов, принимавших ампионTM, также наблюдалось значительно большее улучшение характеристик общего качества жизни, оцененного с помощью PGA, за период от начала исследования до недели 12, чем у пациентов, принимавших плацебо (P=0,01). Эти клинически и статистически значимые ослабление боли, улучшение функции и характеристик общего качества жизни наблюдались после лишь одной IA инъекции ампионаTM в коленный сустав.
Таблица 1. Субпоказатель боли WOMAC A - средние значения и изменения за период от начала исследования до недели 12
В объединенной группе субъектов, которые посещали исследовательский центр через 20 недель, не наблюдалось статистически значимое изменение субпоказателей боли WOMAC A по сравнению с началом исследования; однако наблюдалось статистически значимое улучшение для подгруппы KL стадии 4 (P=0,036)
Таблица 2. Субпоказатель боли WOMAC A для субъектов на стадии 4 по классификации Kellgren-Lawrence (KL) -средние значения и изменения за период от начала исследования до недели 20
Выводы
Результаты этого исследования подтвердили безопасность и эффективность ампионаTM для ослабления боли через 12 недель после одной IA инъекции в коленный сустав пациентов, страдающих от OAK. Обе дозы ампиона™, по 4 мл и 10 мл, являлись безопасными, эффективными и хорошо переносимыми. Вследствие отсутствии различия в эффективности доз ампионаTM, равных 4 мл и 10 мл, в последующих исследованиях оценивали меньшую дозу, равную 4 мл. Уменьшение среднего субпоказателя WOMAC A для пациентов KL стадии 4 в объединенных группах, получавших 4 мл и 10 мл, за 20 недель составило примерно 34%. В объединенной группе пациентов, исследованных на неделе 20, включая пациентов в дополнение к KL стадии 4, не наблюдалось статистически значимое изменение.
Пример 2
Для оценки эффективности и безопасности трех внутрисуставных инъекций ампионаTM (4 мл), вводимого с промежутками в две недели взрослым, страдающим болью вследствие остеоартрита коленного сустава, проводили фазы I/II проспективного исследования.
Главные цели исследования
Главной целью фазы I являлось исследование безопасности ампионаTM 4 мл, вводимого в виде трех IA инъекций с промежутками в две недели пациентам, страдающим от OAK коленного сустава, за период от начала исследования до недели 20.
Главной целью фазы II являлось исследование безопасности и эффективности инъекции 4 мл ампионаTM по сравнению с плацебо за период от начала исследования до недели 20, при введении в виде 3 IA инъекций для ослабления боли в коленном суставе у пациентов, страдающих OAK коленного сустава.
Субъекты исследования
При исследованиях и в фазе I, и в фазе II, субъектами являлись взрослые мужчины и женщины в возрасте от 40 лет до 85 лет (включительно), страдающие вызванной OAK болью в коленном суставе. Для подходящих пациентов требовалось, чтобы они наблюдались амбулаторно, и контрольный коленный сустав пациентов должен был быть симптоматическим в течение более 6 месяцев с клиническим диагнозом OAK, при скрининге подтвержденным данными радиологического исследования (стадии KL от 2-й до 4-й). У пациентов также должна быть от умеренной до умеренно сильной вызванная OAK боль в контрольном коленном суставе (равный не менее 1,5 показатель WOMAC Index 3.1 по пятиточечной субшкале боли Ликерта), оцененная при скрининге и подтвержденная при рандомизации. У пациентов также должна быть от умеренной до умеренно сильной вызванная OAK боль в контрольном коленном суставе даже если проводили или проводят длительный прием NSAID, которая не менялась в течение 4 недель до скрининга. Пациенты не должны были принимать анальгетики в течение 12 ч до исследования эффективности. Рекомендовали, чтобы у пациентов показатель WOMAC Index 3.1 по пятиточечной субшкале боли Ликерта в противоположном коленном суставе, который оценивали при скрининге был равен менее 1,5.
В фазе I включали всего 7 пациентов и количество включенных пациентов KL стадии 2 ограничено не более, чем двумя. Медицинский монитор проводил оценку безопасности после того, как для всех 7 пациентов проведена оценка с помощью наблюдения после 4 недель. Если не наблюдались тяжелые связанные с лекарственным средством AEs (побочные эффекты) или неожиданные связанные с лекарственным средством AEs, то включение в исследование следовало проводить в фазе II. В зависимости от анализа безопасности 7 пациентов продолжали участвовать в фазе I исследования до недели 52.
В фазе II включали примерно 40 пациентов и рандомизировали в соотношении 1:1 на две исследуемые группы (по 20 пациентов в исследуемой группе). Пациентов KL стадии 2 включали в исследования в количестве, составляющем не более 25% от всех пациентов, включенных в фазе II, т. е. всего 8 пациентов, рандомизированных в соотношении 1:1 на две исследуемые группы.
Способы лечения
Исследуемым препаратом для фазы I и фазы II являлся ампионTM и Контрольным препаратом для фазы II являлся физиологический раствор - плацебо.
В фазе I пациенты, которые соответствовали критериям включения в исследование, делали три IA инъекции по 4 мл ампионаTM в коленный сустав в начале исследования (день 0) и в недели 2 и 4. В фазе II пациентов, которые соответствовали критериям включения в исследование, случайным образом в соотношении 1:1 разделяли на группу, которая получала 4 мл ампионаTM, и группу, которая получала 4 мл плацебо. Субъектам делали в коленный сустав три IA инъекции исследуемого препарата (ампионTM или плацебо) в начале исследования (день 0) и в недели 2 и 4.
Субъекты посещали исследовательский центр в неделю 6, неделю 12, неделю 20, неделю 24 и неделю 52. Для каждого пациента максимальная продолжительность исследования составляла 52 недели, исключая период скрининга, составлявший до 4 недель.
Конечные точки
В фазе I определяли частоту и тяжесть TEAEs и SAEs (тяжелые побочные эффекты).
Первичной конечной точкой эффективности фазы II являлось изменение субпоказателя боли WOMAC A по пятиточечной шкале боли Ликерта за период от начала исследования (день 0) до недели 20. Вторичными конечными точками фазы II были:
изменение субпоказателя боли WOMAC A за период от начала исследования (день 0) до недель 2, 4, 6, 12, 24 и 52;
изменение субпоказателя физического функционирования WOMAC C за период от начала исследования (день 0) до недель 2, 4, 6, 12, 20, 24 и 52;
изменение показателя PGA за период от начала исследования (день 0) до недель 2, 4, 6, 12, 20, 24 и 52;
применение неотложной анальгезии (использовавшееся количество ацетаминофена) до недели 20; и
частота и тяжесть TEAEs.
Оценки безопасности
Оценки безопасности включали регистрацию всех TEAEs при всех посещениях клиники и через 24 ч после инъекции по телефону; регистрацию данных физикального обследования и основных показателей состояния организма при посещениях клиники в начале исследования (день 0) и в недели 2, 4, 6, 12, 20, 24 и 52); и стандартных лабораторных исследований.
Воздействие
В фазе I включали 7 субъектов и всем назначали 3 инъекции ампионаTM. В фазе II включали 40 субъектов (20 получали ампионTM, 20 получали плацебо) и всем назначали 3 инъекции исследуемого лекарственного средства.
Демографические и исходные характеристики
Исходные характеристики были сходными для групп, получавших лечение: в каждой группе большинство пациентов были белыми женщинами и обладали медианным возрастом, равным 62,5 лет, и характеризовались KL стадией 3 (58%) или стадией 4 (38%).
Результаты для эффективности
У субъектов, принимавших ампионTM, обеспечивалось значительно большее ослабление боли по субпоказателям WOMAC A (улучшение) за период от начала исследования до недели 20, чем у принимавших плацебо (P=0,0231). Это соответствует среднему ослаблению боли примерно на 64% по сравнению с началом исследования для группы, получавшей ампионTM, тогда как для группы, получавшей плацебо, ослабление составляло примерно 40% (P=0,0313), что проиллюстрировано на фиг. 1.
Таблица 3. Субпоказатель боли WOMAC A - средние значения и изменения за период от начала исследования до недели 20
Для пациентов, получавших ампионTM, не обнаружены значительные различия субпоказателей боли WOMAC A за период от начала исследования до недель 2, 4, 6, 12 или 24 по сравнению с данными для пациентов, получавших плацебо.
Выводы
Результаты этого исследования подтвердили безопасность и эффективность ампионаTM для ослабления боли через 20 недель после трех IA инъекций с промежутками в две недели в коленный сустав пациентов, страдающих от OAK. Равная 4 мл доза ампионаTM являлась безопасной, эффективной и хорошо переносимой.
Хотя варианты осуществления настоящего изобретения подробно описаны, очевидно, что для специалистов в данной области техники понятны модификации и изменения этих вариантов осуществления. Однако следует четко понимать, что такие модификации и изменения входят в объем настоящего изобретения, определяемый приведенной ниже типичной формулой изобретения.
Настоящее изобретение относится к медицине, а именно к способу лечения патологического состояния сустава. Способ лечения патологического состояния сустава, включающий введение нуждающемуся в этом животному эффективного количества фармацевтической композиции, содержащей DA-DKP, в многодозовом режиме, в котором промежуток времени между дозами в многодозовом режиме составляет от 2 дней до 6 недель. Способ лечения остеоартрита, включающий введение с помощью внутрисуставной инъекции в пораженный сустав первой дозы, второй дозы и третьей дозы, в котором каждая первая доза, вторая доза и третья доза содержит 4 мл фракции сывороточного альбумина человека, имеющей ММ, равную <5000, и в котором вторую дозу вводят через две недели после первой дозы и третью дозу вводят через две недели после второй дозы. Вышеописанные способы способствуют улучшенному эффекту в лечении патологического состояния сустава, остеоартрита. 2 н. и 29 з.п. ф-лы, 1 ил., 3 табл., 2 пр.
1. Способ лечения патологического состояния сустава, включающий введение нуждающемуся в этом животному эффективного количества фармацевтической композиции, содержащей DA-DKP, в многодозовом режиме, в котором промежуток времени между дозами в многодозовом режиме составляет от 2 дней до 6 недель.
2. Способ по п. 1, в котором патологическим состоянием сустава является заболевание сустава.
3. Способ по п. 2, в котором заболеванием сустава является дегенеративное заболевание сустава.
4. Способ по п. 3, в котором дегенеративным заболеванием сустава является остеоартрит.
5. Способ по п. 1, в котором патологическим состоянием сустава является поражение сустава.
6. Способ по п. 5, в котором поражением сустава является по меньшей мере одно из следующих: травматическое поражение и послеоперационное поражение.
7. Способ по п. 5, в котором поражением сустава является хроническое повреждение травматического характера.
8. Способ по п. 1, в котором патологическим состоянием сустава является воспаление.
9. Способ по п. 1, в котором композицию вводят с помощью пути введения, выбранного из группы, включающей локальное введение, местное введение и инъекцию.
10. Способ по п. 9, в котором введение с помощью инъекции проводят с помощью внутрисуставной инъекции.
11. Способ по п. 10, в котором композиция, вводимая с помощью внутрисуставной инъекции, представляет собой композицию, имеющую концентрацию DA-DKP, равную от 50 мкМ до 350 мкМ.
12. Способ по п. 1, в котором композиция дополнительно содержит N-ацетилтриптофан (NAT), каприловую кислоту, каприлат или их комбинации.
13. Способ по п. 10, в котором композиция представляет собой композицию, имеющую концентрацию NAT, каприловой кислоты, каприлата или их комбинации, равную от 4 мМ до 20 мМ.
14. Способ по п. 1, в котором DA-DKP содержится в композиции, полученной путем удаления альбумина из раствора композиции сывороточного альбумина человека.
15. Способ по п. 14, в котором стадия удаления альбумина включает обработку композиции сывороточного альбумина человека по методике разделения, выбранной из группы, включающей ультрафильтрование, центрифугирование в градиенте плотности сахарозы, хроматографию, осаждение соли и обработку ультразвуком.
16. Способ по п. 15, в котором стадия удаления включает пропускание композиции сывороточного альбумина человека через ультрафильтрующую мембрану, обладающую номинальной задерживаемой молекулярной массой, которая обеспечивает удерживание альбумина и при использовании которой полученный фильтрат содержит DA-DKP.
17. Способ по п. 16, в котором ультрафильтрующая мембрана обладает номинальной задерживаемой молекулярной массой, равной менее 50 кДа, менее 40 кДа, менее 30 кДа, менее 20 кДа, менее 10 кДа, менее 5 кДа или менее 3 кДа.
18. Способ по п. 14, в котором композиция дополнительно содержит NAT, каприловую кислоту, каприлат или их комбинации.
19. Способ по п. 18, в котором композиция представляет собой композицию, имеющую концентрацию NAT, каприловой кислоты, каприлата или их комбинации, равную от 4 мМ до 20 мМ.
20. Способ по п. 1, в котором фармацевтическая композиция дополнительно содержит второе лекарственное средство, выбранное из группы, включающей анальгетическое, противовоспалительное лекарственное средство и их комбинации.
21. Способ по п. 1, в котором количество доз в многодозовом режиме равно от 2 до 10.
22. Способ по п. 1, в котором количество доз в многодозовом режиме равно от 2 до 8.
23. Способ по п. 1, в котором количество доз в многодозовом режиме равно от 2 до 6.
24. Способ по п. 1, в котором количество доз в многодозовом режиме равно от 2 до 4.
25. Способ по п. 1, в котором количество доз в многодозовом режиме равно 3.
26. Способ по п. 1, в котором промежуток времени между дозами в многодозовом режиме составляет от 2 дней до 5 недель.
27. Способ по п. 1, в котором промежуток времени между дозами в многодозовом режиме составляет от 2 дней до 4 недель.
28. Способ по п. 1, в котором промежуток времени между дозами в многодозовом режиме составляет от 2 дней до 3 недель.
29. Способ по п. 1, в котором промежуток времени между дозами в многодозовом режиме составляет от 1 недели до 3 недель.
30. Способ по п. 1, в котором промежуток времени между дозами в многодозовом режиме составляет примерно 2 недели.
31. Способ лечения остеоартрита, включающий введение с помощью внутрисуставной инъекции в пораженный сустав первой дозы, второй дозы и третьей дозы, в котором каждая первая доза, вторая доза и третья доза содержит 4 мл фракции сывороточного альбумина человека, имеющей ММ, равную <5000, и в котором вторую дозу вводят через две недели после первой дозы и третью дозу вводят через две недели после второй дозы.
| WO 2013055734 A1, 18.04.2013 | |||
| US 20120022004 A1, 26.01.2012 | |||
| DAVID BAR-OR et all | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2020-11-17—Публикация
2015-08-18—Подача