Изобретение относится к области разработки новых ростовых веществ, активных в отношении роста и развития растений с целью применения их в сельском хозяйстве. Результаты изобретения будут использоваться для тестирования (скрининга) широкого спектра низкомолекулярных соединений с целью установления их биологической активности как регуляторов роста растений.
Получение новых биологически активных веществ с целью их применения в биотехнологии и медицине, а также при создании новых регуляторов роста, развития, стрессовых и защитных реакций сельскохозяйственных растений сопровождается тестированием новых соединений на биологических модельных системах. В качестве стандартного способа тестирования ростовых веществ для анализа биологической активности низкомолекулярных соединений в настоящее время широко используют семена высших растений. В данных экспериментах семена тестируют на всхожесть семян, а также анализируют развитие проростков (ГОСТ 33061-2014). В последнее время, начиная с 2000-х годов, для биологического тестирования ростовых веществ широко используются растения Arabidopsis thaliana L. (арабидопсис). Для культивирования растений арабидопсис в тестовых экспериментах были разработаны методы компактного выращивания целых растений в стандартных чашках Петри (Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.1128436. Kondo, T. (2006). A plant peptide encoded by CLV3 identified by in situ MALDI-TOF MS analysis. Science 313, 845-8. doi:10.1126/science.1128439.) и луночных планшетах (патент KR20080095041). В процессе анализа биологической активности низкомолекулярных соединений широко применяются тест-системы, основанные на регистрации ростовых параметров корней проростков Arabidopsis thaliana L. (Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.1128436. Kondo, T. (2006). A plant peptide encoded by CLV3 identified by in situ MALDI-TOF MS analysis. Science 313, 845-8. doi:10.1126/science.1128439; патент WO 2012/107451 A2). В связи с тем, что в данных тестах основное внимание уделяется именно росту и развитию корней, а не побегов проростков арабидопсис, мы будем называть эти системы корневыми тест-системами, как это принято в литературе (Root Growth Assays) (Whitford, R., Fernandez, A., De Groodt, R., Ortega, E., and Hilson, P. (2008). Plant CLE peptides from two distinct functional classes synergistically induce division of vascular cells. Proc. Natl. Acad. Sci. 105, 18625-18630. doi:10.1073/pnas.0809395105). Поиск новых регуляторов роста и развития растений с использованием корневых модельных систем арабидопсис в начале 2000-х годов привел к раскрытию пептидной структуры ростового фактора апикальной меристемы Arabidopsis thaliana, взаимодействующего с мембранным рецептором CLV1. Результаты этих исследований привели к идентификации важнейшего для биологии растений и сельского хозяйства додекапептида CLV3 (Kondo, T., Sawa, S., Kinoshita, A., Mizuno, S., Kakimoto, T., Fukuda, H., et al. (2006). A plant peptide encoded by CLV3 identified by in situ MALDI-TOF MS analysis. Science 313, 845-8. doi:10.1126/science.1128439). Функциональная роль додекапептида CLV3 была установлена путем тестирования синтетических коротких пептидов с использованием моделей с проростками арабидопсис и анализом роста корней на средах с добавлением синтетических пептидов. В результате было установлено, что регуляторный фактор белковой природы CLV3 является физиологически активным регуляторным додекапептидом у растений арабидопсис. Скрининг 26 додекапептидов, синтезированных на основе данных по структуре консервативного домена, объединяющего семейство генов CLE, на корневых моделях арабидопсис дал возможность функционально охарактеризовать регуляторные пептиды CLE (Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.1128436). Так с помощью корневых тестов биологической активности пептидов были выделены пептиды А-типа, которые проявляют себя как стимулятораы роста корней, но неактивны как факторы дифференцировки сосудов, и пептиды B-типа, которые проявляют активность как факторы дифференцировки проводящей системы, но не влияют на скорость роста корней (Whitford, R., Fernandez, A., De Groodt, R., Ortega, E., and Hilson, P. (2008). Plant CLE peptides from two distinct functional classes synergistically induce division of vascular cells. Proc. Natl. Acad. Sci. 105, 18625-18630. doi:10.1073/pnas.0809395105; Yamaguchi, Y. L., Ishida, T., and Sawa, S. (2016). CLE peptides and their signaling pathways in plant development. J. Exp. Bot. 67, 4813-4826. doi:10.1093/jxb/erw208). Важно отметить, что большинство CLE-пептидов арабидопсис синтезируются не только в корнях, но практически во всех органах растения. При этом, большая часть из CLE-пептидов проявляют активность в отношении роста и развития корней, как показывают корневые тесты на проростках арабидопсис в чашках Петри (Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.1128436; Whitford, R., Fernandez, A., De Groodt, R., Ortega, E., and Hilson, P. (2008). Plant CLE peptides from two distinct functional classes synergistically induce division of vascular cells. Proc. Natl. Acad. Sci. 105, 18625-18630. doi:10.1073/pnas.0809395105; Kondo, Y., Hirakawa, Y., Kieber, J. J., and Fukuda, H. (2011). CLE Peptides can Negatively Regulate Protoxylem Vessel Formation via Cytokinin Signaling. Plant Cell Physiol. 52, 37-48. doi:10.1093/pcp/pcq129). Таким образом, использование корневых тестов было широко апробировано как универсальный способ скрининга ростовых веществ - регуляторов роста растений. Начиная с середины 2000-х годов, корневые тест-системы на основе проростков арабидопсис и других семенных растений начали активно применять не только для анализа корневых пептидов, но и в целях скрининга биологической активности широкого спектра пептидов и других низкомолекулярных соединений. Корневые тест-систмы на основе проростков арабидопсис в чашках Петри сыграли важную роль при открытии таких семейств регуляторных пептидов растений, как PSY (Amano, Y., Tsubouchi, H., Shinohara, H., Ogawa, M., and Matsubayashi, Y. (2007). Tyrosine-sulfated glycopeptide involved in cellular proliferation and expansion in Arabidopsis. Proc. Natl. Acad. Sci. U. S. A. 104, 18333-8. doi:10.1073/pnas.0706403104) и CEP (Ohyama, K., Ogawa, M., and Matsubayashi, Y. (2008). Identification of a biologically active, small, secreted peptide in Arabidopsis by in silico gene screening, followed by LC-MS-based structure analysis. Plant J. doi:10.1111/j.1365-313X.2008.03464.x.). В настоящее время способы скрининга, основанные на корневых тестах, продолжают использоваться для исследования биологической активности новых фитогормонов пептидной природы с целью разработки методов повышения урожайности сельскохозяйственных растений. Универсальность тест-систем, основанных на анализе роста корней, проявляется в том, что в качестве тестовых растений используются не только растения арабидопсис, но и другие семенные растения, например рис, корни которого по ростовой активности специфически реагируют на микромолярные дозы пептидов семейства CLE из арабидопсис (Kinoshita, A., Nakamura, Y., Sasaki, E., Kyozuka, J., Fukuda, H., and Sawa, S. (2007). Gain-of-function phenotypes of chemically synthetic CLAVATA3/ESR-Related (CLE) peptides in Arabidopsis thaliana and Oryza sativa. Plant Cell Physiol. 48, 1821-1825. doi:10.1093/pcp/pcm154.). Работы трех независимых групп исследователей в США (Meng, L., Buchanan, B. B., Feldman, L. J., and Luan, S. (2012). A Putative Nuclear CLE-Like (CLEL) Peptide Precursor Regulates Root Growth in Arabidopsis. Mol. Plant 5, 955-957. doi:10.1093/mp/sss060.), Японии (Matsuzaki, Y., Ogawa-Ohnishi, M., Mori, A., and Matsubayashi, Y. (2010). Secreted Peptide Signals Required for Maintenance of Root Stem Cell Niche in Arabidopsis. Science 329, 1065-1067. doi:10.1126/science.1191132.) и Европы (Whitford, R., Fernandez, A., Tejos, R., Pérez, A. C., Kleine-Vehn, J., Vanneste, S., et al. (2012). GOLVEN Secretory Peptides Regulate Auxin Carrier Turnover during Plant Gravitropic Responses. Dev. Cell 22, 678-685. doi:10.1016/j.devcel.2012.02.002.), проведенные в ходе анализа ростовой активности коротких пептидов с использованием корневых проростковых культур арабидопсис в чашках Петри, привели к открытию семейства фитогормонов пептидной природы CLEL/RGF/Golven. Таким образом, культуры проростков, в которых растения арабидопсис выращиваются в чашках Петри на агаризованных средах, дали возможность получить весомые результаты по открытию новых фитогормонов, которые являются низкомолекулярными пептиднымих биорегуляторами с большим потенциалом для использования в сельском хозяйстве и биотехнологии. Данные способы скрининга ростовых веществ оказались высокоэффективными в значительной степени из-за того, что проростки арабидопсис достаточно компактны по размерам и их можно выращивать в стандартных чашках Петри.
Для скрининга и анализа биологической активности широкого спектра низкомолекулярных соединений в качестве потенциальных регуляторов роста растений и гербицидов используются не только тест-культуры, созданные на основе проростков (патент KR20080095041; Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.1128436; Meng, L., Buchanan, B. B., Feldman, L. J., and Luan, S. (2012). A Putative Nuclear CLE-Like (CLEL) Peptide Precursor Regulates Root Growth in Arabidopsis. Mol. Plant 5, 955-957. doi:10.1093/mp/sss060.) и культивируемых клеток семенных растений (например, клетки табака и риса, патент US20050178564A1), но и культуры in vitro, в которых используются культивируемые клетки организмов, систематически далеких от покрытосеменных растений, таких как фотомиксотрофные клетки моховидного растения Marchantia polymorpha L. (патент US20050178564A1). Эффективность применения клеток моховидных для скрининга и тестирования соединений, в целях разработки новых фитогормональных регуляторов роста высших растений и гербицидов для сельского хозяйства и сельскохозяйственной биотехнологи связана с тем, что базовые метаболические и регуляторные пути моховидных во многом сходны с таковыми у семенных растений, а культуры мхов in vitro имеют технические и биологические преимущества по сравнению с культурами in vitro семенных растений (Cove, D., Bezanilla, M., Harries, P., and Quatrano, R. (2006). Mosses as model systems for the study of metabolism and development. Annu. Rev. Plant Biol. 57, 497-520. doi:10.1146/annurev.arplant.57.032905.105338; Cove, D. J., Perroud, P. F., Charron, A. J., McDaniel, S. F., Khandelwal, A., and Quatrano, R. S. (2009). Culturing the moss Physcomitrella patens. Cold Spring Harb. Protoc. doi:10.1101/pdb.prot5136).
Культуры зеленых мхов in vitro используются как тест-объекты для анализа регуляции роста и дифференцировки при воздействии биофизических и биохимических факторов среды (Imaizumi, T. (2002). Cryptochrome Light Signals Control Development to Suppress Auxin Sensitivity in the Moss Physcomitrella patens. PLANT CELL ONLINE 14, 373-386. doi:10.1105/tpc.010388; Harrison, C. J., Roeder, A. H. K., Meyerowitz, E. M., and Langdale, J. A. (2009). Local Cues and Asymmetric Cell Divisions Underpin Body Plan Transitions in the Moss Physcomitrella patens. Curr. Biol. doi:10.1016/j.cub.2009.02.050; Coudert, Y., Palubicki, W., Ljung, K., Novak, O., Leyser, O., and Harrison, C. J. (2015). Three ancient hormonal cues co-ordinate shoot branching in a moss. Elife. doi:10.7554/eLife.06808; Coudert, Y., Bell, N. E., Edelin, C., and Harrison, C. J. (2017). Multiple innovations underpinned branching form diversification in mosses. New Phytol. 215, 840-850. doi:10.1111/nph.14553; Whitewoods, C. D., Cammarata, J., Nemec Venza, Z., Sang, S., Crook, A. D., Aoyama, T., et al. (2018). CLAVATA Was a Genetic Novelty for the Morphological Innovation of 3D Growth in Land Plants. Curr. Biol. 28, 2365-2376.e5. doi:10.1016/j.cub.2018.05.068). Путем эксплантации протонематических клубков мха Physcomitrella patens размером 1-2 мм на агаризованные среды получают «точечные культуры» (spot cultures) с целью индукции дифференциации почек на нитях протонемы и развития из почек побегов в течение 2-3 недель (Imaizumi, T. (2002). Cryptochrome Light Signals Control Development to Suppress Auxin Sensitivity in the Moss Physcomitrella patens. PLANT CELL ONLINE 14, 373-386. doi:10.1105/tpc.010388; Harrison, C. J., Roeder, A. H. K., Meyerowitz, E. M., and Langdale, J. A. (2009). Local Cues and Asymmetric Cell Divisions Underpin Body Plan Transitions in the Moss Physcomitrella patens. Curr. Biol. doi:10.1016/j.cub.2009.02.050; Cove, D. J., Perroud, P. F., Charron, A. J., McDaniel, S. F., Khandelwal, A., and Quatrano, R. S. (2009). Culturing the moss Physcomitrella patens. Cold Spring Harb. Protoc. doi:10.1101/pdb.prot5136). В полученных «колониях» (colony) подсчитывают число побегов, которое служит критерием для оценки активности процессов клеточной дифференцировки (Imaizumi, T. (2002). Cryptochrome Light Signals Control Development to Suppress Auxin Sensitivity in the Moss Physcomitrella patens. PLANT CELL ONLINE 14, 373-386. doi:10.1105/tpc.010388) . Недавно в ходе гистологического анализа побегов зеленых мхов, полученных путем эксплантации точечных культур гаметофитов Physcomitrella patens, установлено, что развитие дополнительных побегов происходит в результате клеточной дифференцировки в эпидермисе побегов и находится под фитогормональным контролем (Coudert, Y., Palubicki, W., Ljung, K., Novak, O., Leyser, O., and Harrison, C. J. (2015). Three ancient hormonal cues co-ordinate shoot branching in a moss. Elife. doi:10.7554/eLife.06808). В опытах с добавлением в культуральные среды ауксинов в микромолярных концентрациях показали эффективное ингибирование развитие побегов в субапикальной зоне при воздействии экзогенных ауксинов, что подтверждает их роль в процессе ветвления побегов (Coudert, Y., Palubicki, W., Ljung, K., Novak, O., Leyser, O., and Harrison, C. J. (2015). Three ancient hormonal cues co-ordinate shoot branching in a moss. Elife. doi:10.7554/eLife.06808). Таким образом, точечные культуры протонематических гаметофитов Physcomitrella patens используются как тест-системы для изучения процессов дифференцировки и развития побегов с использованием математической статистики для интерпретации результатов экспериментов.
Таким образом, патентный поиск и анализ научной литературы по способам скрининга ростовой активности низкомолекулярных веществ показывает, что для анализа биологической активности в настоящее время широко используются тест-системы, которые можно рассматривать как аналоги и прототипы для разработки новых способов скрининга ростовых веществ, в частности, для того способа, который предлагается в настоящей патентной заявке. Вместе с тем следует отметить, что существующие в настоящее время способы тестирования ростовых веществ имеют существенные недостатки и ограничения.
Недостатком и ограничением тестирования семян высших растений на всхожесть и анализ проростков при воздействии химических агентов (ГОСТ 33061-2014) является то, что они семена сложными многоклеточными системами; фактически это целые организмы, при развитии которых происходят различные процессы в клетках и тканях, по которым трудно и, как правило, невозможно однозначно судить о механизмах действия исследуемого вещества. К недостаткам тестирования на всхожесть и прорастание семян относится их неспецифичность по механизмам биологического действия химических агентов.
Корневые тесты, проводимые при культивировании проростков Arabidopsis thaliana в чашках Петри, апробированы в ряде экспериментов и дали весомый вклад в разработку новых фитогормональных регуляторов (Ito, Y., Nakanomyo, I., Motose, H., Iwamoto, K., Sawa, S., Dohmae, N., et al. (2006). Dodeca-CLE peptides as suppressors of plant stem cell differentiation. Science 313, 842-5. doi:10.1126/science.11284364; Meng, L., Buchanan, B. B., Feldman, L. J., and Luan, S. (2012). A Putative Nuclear CLE-Like (CLEL) Peptide Precursor Regulates Root Growth in Arabidopsis. Mol. Plant 5, 955-957. doi:10.1093/mp/sss060). К ограничениям и недостаткам данного способа тестирования ростовых веществ можно отнести: 1) узкая корневая специфичность тестов, сфокусированность тестовых экспериментов на корневых процессах роста и дифференцировки т.е. ограниченность тестирования на росте корней; 2) технические и экспериментальные ограничения по анализу роста и развития побегов, структурная недоступность апикальных побеговых меристем для анализа активности их функционирования.
Способ тестирования ростовых веществ, основанный на точечной культуре протонемных гаметофитов Physcomitrella patens, в которой производится анализ развития побегов при воздействии биохимических и биофизических факторов (Imaizumi, T. (2002). Cryptochrome Light Signals Control Development to Suppress Auxin Sensitivity in the Moss Physcomitrella patens. PLANT CELL ONLINE 14, 373-386. doi:10.1105/tpc.010388; Cove, D., Bezanilla, M., Harries, P., and Quatrano, R. (2006). Mosses as model systems for the study of metabolism and development. Annu. Rev. Plant Biol. 57, 497-520. doi:10.1146/annurev.arplant.57.032905.105338; Harrison, C. J., Roeder, A. H. K., Meyerowitz, E. M., and Langdale, J. A. (2009). Local Cues and Asymmetric Cell Divisions Underpin Body Plan Transitions in the Moss Physcomitrella patens. Curr. Biol. doi:10.1016/j.cub.2009.02.050; Coudert, Y., Palubicki, W., Ljung, K., Novak, O., Leyser, O., and Harrison, C. J. (2015). Three ancient hormonal cues co-ordinate shoot branching in a moss. Elife. doi:10.7554/eLife.06808; Coudert, Y., Bell, N. E., Edelin, C., and Harrison, C. J. (2017). Multiple innovations underpinned branching form diversification in mosses. New Phytol. 215, 840-850. doi:10.1111/nph.14553; Whitewoods, C. D., Cammarata, J., Nemec Venza, Z., Sang, S., Crook, A. D., Aoyama, T., et al. (2018). CLAVATA Was a Genetic Novelty for the Morphological Innovation of 3D Growth in Land Plants. Curr. Biol. 28, 2365-2376.e5. doi:10.1016/j.cub.2018.05.068), является прототипом способа тестирования ростовых веществ, предлагаемого в настоящей патентной заявке. Недостатком данного способа тестирования ростовых веществ, который проводится на основе точечной культуры протонемных гаметофитов мхов заключается в том, что в качестве экспланта используется клубок нитей протонемы размером 1-2 мм (clump, Harrison, C. J., Roeder, A. H. K., Meyerowitz, E. M., and Langdale, J. A. (2009). Local Cues and Asymmetric Cell Divisions Underpin Body Plan Transitions in the Moss Physcomitrella patens. Curr. Biol. doi:10.1016/j.cub.2009.02.050; Cove, D. J., Perroud, P. F., Charron, A. J., McDaniel, S. F., Khandelwal, A., and Quatrano, R. S. (2009). Culturing the moss Physcomitrella patens. Cold Spring Harb. Protoc. doi:10.1101/pdb.prot5136), который является гетерогенным эксплантом, в котором нет выраженной структуры нитей протонемы, их естественная структура нарушена технически при сборе нитей при помощи пинцета. В данной операции приготовления инокулюма (экспланта) невозможно избежать механического повреждения большого числа интактных клеток протонемы. Фактически на этой стадии подготовки тест-системы происходит эксплантация заведомо поврежденного материала с помощью приемов, которые невозможно оптимизировать и стандартизировать. В целом можно отметить, что несмотря на значительный научный интерес и экспериментальный потенциал, побеги зеленых мхов остаются невостребованными как модельная система, пригодная для анализа новых низкомолекулярных веществ с регуляторным и фитогормональным потенциалом применительно к высшим растениям.
Таким образом, техническая проблема при проведении биологического тестирования низкомолекулярных химических агентов с использованием известных в настоящее время способов заключается в низкой специфичности, невысокой чувствительности и ограниченности спектра механизмов биологического действия тестируемых соединений, которые поддаются адекватной интерпретации.
С развитием работ по получению новых регуляторов роста и развития растений в последнее время возникла потребность в создании новых универсальных способов тестирования ростовых веществ, адекватных для анализа биологической активности новых перспективных низкомолекулярых соединений, в том числе коротких пептидов, в качестве потенциальных регуляторов клеточной активности, роста и развития растений.
Технический результат, который позволяет получать настоящее изобретение, заключается в достижении высокой чувствительности и специфичности способа скрининга ростовых веществ при низких концентрациях тестируемых веществ, высокой стандартизируемости процесса тестирования и высокой воспроизводимости результатов тестирования.
Для решения заявленной технической проблемы и достижения технического результата предлагается способ скрининга регуляторов роста растений, в котором в качестве тест-системы используют культуры верхушек побегов зеленых мхов Physcomitrtella patens, Ceratodon purpureus, Atrichum tenellum, включающий стадию подготовки тест-системы, которая заключается в выделении верхушек побегов из гаметофоров, выращенных в стандартных условиях in vitro, стадию культивирования тест-системы, на которой верхушки побегов зеленых мхов культивируют в чашках Петри на агаризованной среде с последующим растворением исследуемого вещества в воде и добавлением в виде аликвоты в агаризованную среду, и стадию анализа роста тест-системы, при этом в качестве показателя ростовой активности учитывается число побегов, образовавшихся на одном экспланте.
На стадии подготовки тест-системы верхушки побегов для эксплантации выделяют из гаметофоров, выращенных в стандартных условиях in vitro, микрохирургическим путем.
На стадии культивирования верхушки побегов зеленых мхов культивируют в чашках Петри на агаризованной среде. Исследуемое вещество растворяют в воде и добавляют в виде водной аликвоты в агаризованную среду, охлажденную до 45°C. Культивирование верхушек побегов мхов осуществляют при температуре от 16°C до 28°C в условиях фотопериода от 8 до 20 ч.
Анализ роста тест-системы осуществляют после завершения культивирования верхушек побегов зеленых мхов в течение периода от 12 до 42 суток.
Для анализа роста тест-системы используют бинокулярный стереомикроскоп.
Предлагается система скрининга регуляторов роста растений для осуществления способа, включающая тест-систему в виде культуры верхушек побегов зеленых мхов, культуральный планшет и микроскоп.
Микроскоп может быть бинокулярным стереомикроскопом.
Предлагается применение верхушек побегов зеленых мхов для скрининга регуляторов роста растений заявленным способом.
В соответствии с изобретением, верхушки побегов зеленых мхов выделяют путем микрохирургической процедуры. По существу изобретенный способ, основанный на анализе индукции дифференциации побегов мхов, принципиально отличается от метода точечной культуры гаметофитов мхов по природе экспланта. В отличие от точечной культуры гаметофитов в способе тестирования ростовых веществ, разработанном в настоящем изобретении, применяют эксплантацию верхушек побегов зеленых мхов, а не протонематических клубков.
Новизна заявленного способа и его отличие от любых других аналогичных способов заключается в том, что верхушки побегов зеленых мхов впервые используют как эксплантируемые растительные тест-системы, высокочувствительные к регуляторам дифференциации и веществам с регуляторным ростовым потенциалом. Данный способ позволяет анализировать различные соединения в широких диапазонах их концентраций (от 10 мкМ до 0,1 пМ). Скрининг в данном изобретении основан на анализе биорегуляторных эффектов веществ при стартовых процессах дифференциации клеток в стандартизированных тест-системах, основанных на культуре верхушек побегов зеленых мхов.
В литературе описано гормональное действие хорошо изученных ростовых веществ, таких как индолилуксусная кислота, на дифференциацию побегов мхов в отдельных экспериментах протонемами мхов (Cove, D., Bezanilla, M., Harries, P., and Quatrano, R. (2006). Mosses as model systems for the study of metabolism and development. Annu. Rev. Plant Biol. 57, 497-520. doi:10.1146/annurev.arplant.57.032905.105338). Патентный поиск и анализ научных публикаций показывает отсутствие примеров использования верхушек побегов мхов в способах скрининга ростовых и биоактивных веществ.
Заявленное изобретение иллюстрируются следующими рисунками.
На Фиг. 1 приведено изображение чашки Петри с апикальными верхушками побегов мха Physcomitrella patens, которые эксплантированы на агаризованную среду.
На Фиг. 2 приведена культура верхушек побегов мха Physcomitrella patens в чашке Петри, время культивирования 21 суток.
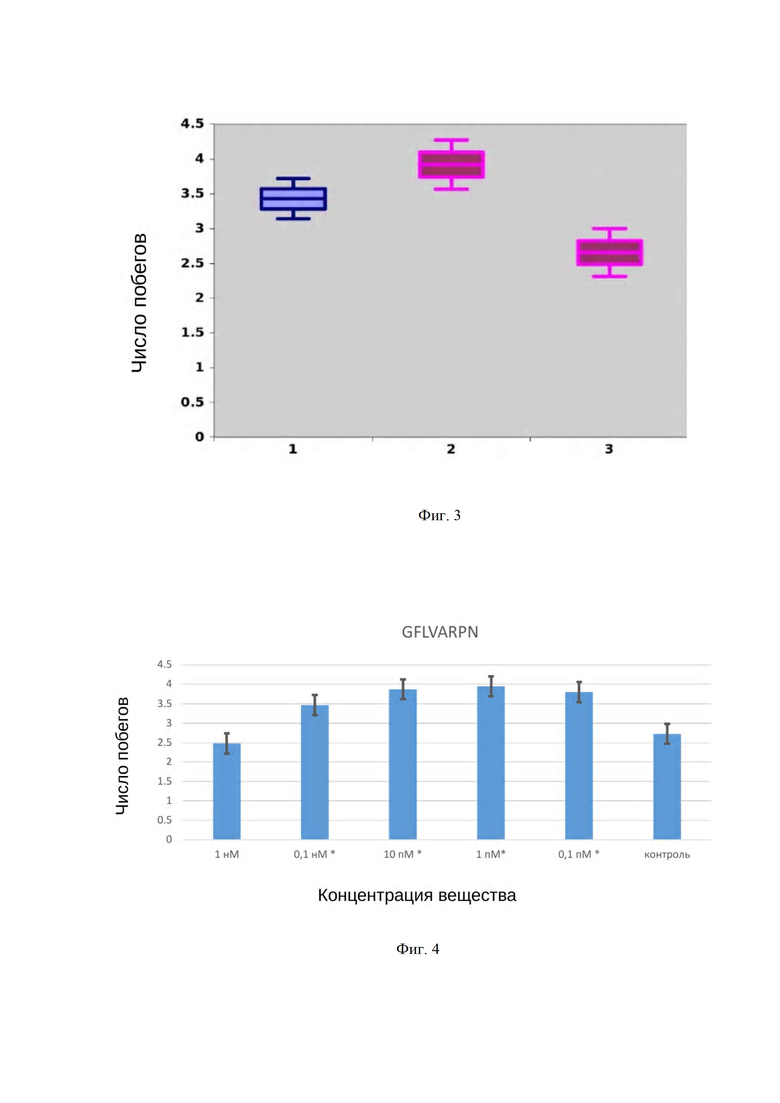
На Фиг. 3 демонстрируется действие пептида LNVIKGHGLL SEQ ID №1 и абсцизовой кислоты на дифференциацию побегов мха Physcomitrella patens.
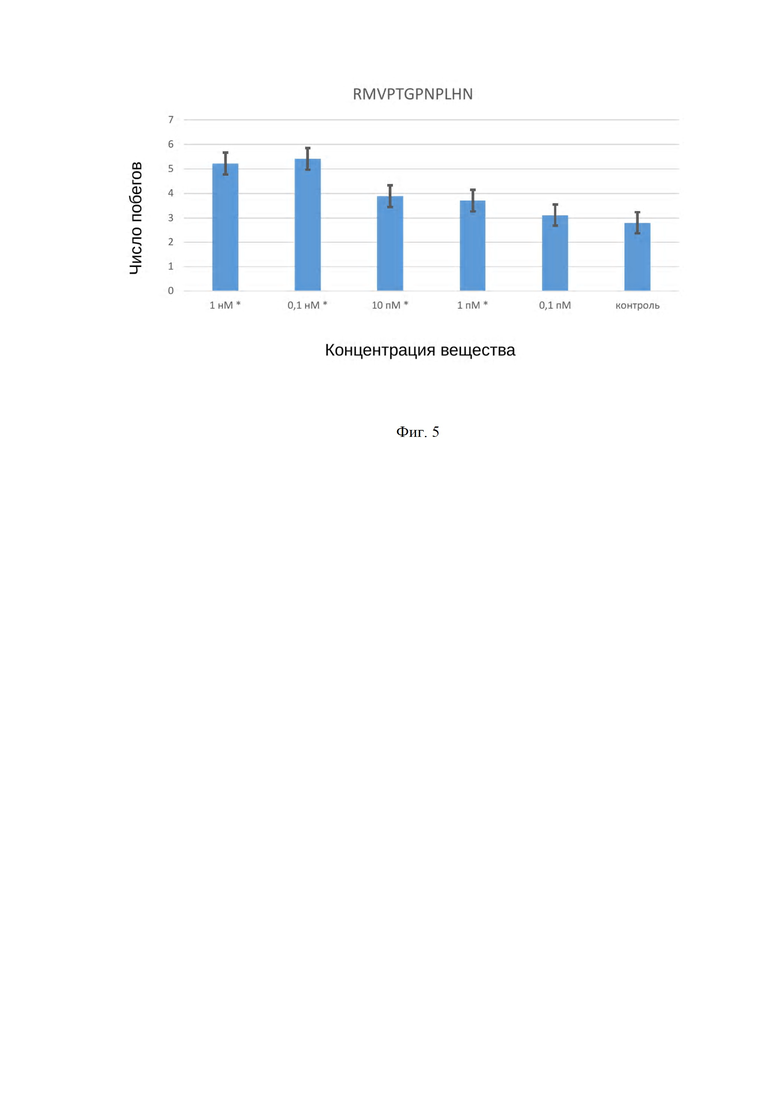
На Фиг. 4 приведены данные по тестированию активности пептида GFLVARPN SEQ ID №2 в отношении процессов дифференциации побегов мха Ceratodon purpureus. На Фиг. 5 приведены результаты тестирования действия пептида RTVPSGPDPLHH SEQ ID №3 на дифференциацию побегов мха Atrichum tenellum.
Техническое описание способа скрининга потенциальных регуляторов роста растений на основе культур верхушек побегов мхов. Способ скрининга потенциальных регуляторов роста растений на основе культур верхушек побегов мхов представляет собой тест-систему, основанную на культуре верхушек побегов зеленых мхов, выращиваемых в чашках Петри. Исходный материал представляет собой культуры гаметофоров зеленых мхов Physcomitrtella patens, Ceratodon purpureus, Atrichum tenellum, Barbula unguiculata, Bryum argenteum, Ceratodon purpureus, Ditrichum pusillum, Ephemerum serratum, Fissidens bryoides, Fissidens exilis, Funaria hygrometrica, Physcomitrium pyriforme, Physcomitrium sphaericum, Pottia truncata, Pottia intermedia, Weissia brachycarpa, выращиваемых в стандартных условиях (Cove, D., Bezanilla, M., Harries, P., and Quatrano, R. (2006). Mosses as model systems for the study of metabolism and development. Annu. Rev. Plant Biol. 57, 497-520. doi:10.1146/annurev.arplant.57.032905.105338; Cove, D. J., Perroud, P. F., Charron, A. J., McDaniel, S. F., Khandelwal, A., and Quatrano, R. S. (2009). Culturing the moss Physcomitrella patens. Cold Spring Harb. Protoc. doi:10.1101/pdb.prot5136). Из гаметофоров микрохирургическим путем выделяют верхушки побегов длиной 3-4 мм и эксплантируют в чашки Петри с агаризованной средой (Фиг. 1). В опытном варианте в культуральную среду добавляют исследуемое вещество в составе водной аликвоты в момент заливки остывшей до 45°C агаризованной культуральной среды в чашки Петри, в контрольном варианте в среду добавляется водная аликвота без добавления исследуемого вещества. Верхушки побегов мхов культивируют в условиях фотопериода от 8 до 20 ч при температуре от 16 до 28°C. В результате культивирования верхушек побегов в течение периода от 12 до 42 суток в основании каждого экспланта образуется от 2-х до 10 боковых побегов (Фиг. 2). Число побегов, образовавшихся на каждом экспланте, учитывается при помощи бинокулярного стереомикроскопа. Среднее число побегов, образовавшихся на месте одного экспланта, является показателем ростовой регуляторной активности, связанной с клеточной цитодифференцировкой. Сравнение результатов подсчетов активности образования боковых побегов в опытном и контрольном вариантах ведется при помощи стандартных статистических методов на основе критерия Стьюдента с использованием стандартного отклонения с возможностью применения дисперсионного анализа. В случае достоверной разности между контролем и опытом по числу побегов, образовавшихся на каждом экспланте, можно говорить о наличии ростовой активности исследуемого вещества. На Фиг. 1. приведено изображение чашки Петри с верхушками побегов мха Physcomitrella patens сразу после эксплантации. На Фиг. 2. приведена культура верхушек побегов мха Physcomitrella patens в чашке Петри. Время культивирования 21 суток. На Фиг. 2 показано, что в основании побеговых эксплантов образовались новые побеги мха.
Техническая сущность изобретений поясняется следующими примерами осуществления заявленного способа.
Пример 1. В примере в качестве регулятора роста растений (исследуемого вещества) использовали абсцизовую кислоту. Абсцизовая кислота известна в физиологии растений как фитогормон, подавляющий ряд процессов развития, например, прорастание семян.
Способ скрининга осуществляли, как указано ранее в описании.
На Фиг. 3. представлены данные по действию абсцизовой кислоты на дифференциацию побегов мха Physcomitrella patens. 1 - контрольный вариант без добавления исследуемого вещества, 3 - абсцизовая кислота в концентрации 1 нМ.
По оси ординат отображено среднее число побегов, дифференцированных на одном экспланте. Верхушки побегов мха были получены микрохирургическим путем из культуры гаметофоров Physcomitrella patens, выращенных в лабораторных условиях на стандартной питательной среде. Верхушки побегов Physcomitrella patens культивировали при температуре 16°C в условиях 20 ч фотопериода в течение 28 суток на чашках Петри. В данном эксперименте продемонстрирована адекватность предложенного в изобретении способа скрининга ростовых веществ, который подтверждает ингибирующий эффект, характерный для действия абсцизовой кислоты процессы роста и развития растений.
Пример 2. В примере в качестве регулятора роста растений использовали новый пептид LNVIKGHGLL, SEQ ID №1 с неизвестной активностью, обнаруженный в составе пептидных пулов мха Physcomitrella patens. Способ скрининга осуществляли, как указано ранее в описании. На фиг. 3 представлены данные по тестированию действия пептида LNVIKGHGLL, SEQ ID №1 на процессы дифференциации в культуре верхушек побегов мха Physcomitrella patens. Верхушки побегов мха были получены микрохирургическим путем из культуры гаметофоров Physcomitrella patens, выращенных в лабораторных условиях на стандартной питательной среде. На графике обозначено: 1 - контрольный вариант без добавления исследуемого вещества, 2- пептид LNVIKGHGLL, SEQ ID №1 в концентрации 1 нМ. По оси ординат отображено среднее число побегов, дифференцированных на одном экспланте. Верхушки побегов Physcomitrella patens культивировали при температуре 16°C в условиях 20 ч фотопериода в течение 28 суток на чашках Петри. Пептид мха LNVIKGHGLL, SEQ ID №1 в концентрации 1 нМ, как видно из графика фиг. 3, оказывает стимулирующее воздействие на рост побегов.
Пример 3. В примере в качестве регулятора роста растений использовали пептид GFLVARPN, SEQ ID №2. Пептид GFLVARPN, SEQ ID №2 является новым растительным пептидом с неизвестной функцией, который обнаружен как фрагмент малой субъединицы фотосинтетического белка Рубиско. В данном тесте использованы верхушки побегов мха Ceratodon purpureus. Тестирование данного пептида на биологическую активность в широком диапазоне концентраций на культуре верхушек побегов мха позволяет детектировать стимулирующий эффект пептида GFLVARPN, SEQ ID №2 как регулятора роста растений. Так, на Фиг. 4 приведена диаграмма концентрационной зависимости действия пептида GFLVARPN, SEQ ID №2 на процесс дифференциации побегов мха Ceratodon purpureus в диапазоне концентраций от 0.1 пМ до 1 нМ. Доверительные интервалы построены при 95% уровне вероятности. Символом «*» указана разность между средними выборочных долей в опытных образцах и контрольном существенна на 5% уровне значимости. Верхушки побегов мха были получены микрохирургическим путем из культуры гаметофоров Ceratodon purpureus, выращенных в лабораторных условиях на стандартной питательной среде. Верхушки побегов Ceratodon prupureus культивировали при температуре 24°C в условиях 8 ч фотопериода в течение 42 суток на чашках Петри. Как показали исследования, пептид GFLVARPN, SEQ ID №2 оказывает положительный эффект на дифференциацию побегов мха Ceratodon purpureus в диапазоне низких концентраций от 0.1 пМ до 0.1 нМ, что говорит о его свойствах как потенциального регулятора роста и развития растений.
Пример 4. В примере в качестве регулятора роста растений использовали пептид RMVPTGPNPLHN, SEQ ID №3. Установлено, что пептид RMVPTGPNPLHN, SEQ ID №3 является одним из членов крупного семейства регуляторных растительных пептидов CLE, хотя его функция неизвестна. В данном тесте использованы верхушки побегов мха Atrichum tenellum. Тестирование пептида RMVPTGPNPLHN, SEQ ID №3 на биологическую активность в широком диапазоне концентраций на культуре верхушек побегов мха позволяет детектировать стимулирующий эффект данного пептида как регулятора роста растений. Так, на Фиг. 5 приведена диаграмма концентрационной зависимости действия пептида RMVPTGPNPLHN, SEQ ID №3 на процесс дифференциации побегов мха Atrichum tenellum в диапазоне концентраций от 0.1 пМ до 1 нМ. Доверительные интервалы построены при 95% уровне вероятности. Символом «*» указана разность между средними выборочных долей в опытных образцах и контрольном существенна на 5% уровне значимости. Верхушки побегов мха были получены микрохирургическим путем из культуры гаметофоров Atrichum tenellum, выращенных в лабораторных условиях на стандартной питательной среде. Верхушки побегов Atrichum tenellum культивировали при температуре 28°C в условиях 14 ч фотопериода в течение 12 суток на чашках Петри. Как показали исследования, пептид RMVPTGPNPLHN, SEQ ID №3 оказывает положительный эффект на дифференциацию побегов мха Atrichum tenellum в диапазоне низких концентраций от 0.1 пМ до 0.1 нМ, что говорит о его свойствах как потенциального регулятора роста и развития растений.
Таким образом, в настоящем изобретении предложен новый способ для скрининга ростовых веществ путем регистрации процессов дифференциации в культурах верхушек побегов зеленых мхов при воздействии низкомолекулярных регуляторных факторов в широких диапазонах концентраций. В качестве эксплантов в приведенных примерах использованы верхушки побегов мхов Physcomitrella patens, Ceratodon purpureus, Atrichum tenellum, получаемые микрохирургическим путем из культур гаметофоров. Аналогичные результаты были получены при использовании в качестве тест-систем верхушек побегов мхов следующих видов: Barbula unguiculata, Bryum argenteum, Ceratodon purpureus, Ditrichum pusillum, Ephemerum serratum, Fissidens bryoides, Fissidens exilis, Funaria hygrometrica, Physcomitrium pyriforme, Physcomitrium sphaericum, Pottia truncata, Pottia intermedia, Weissia brachycarpa.
Преимуществами способа скрининга ростовых и биоактивных веществ, предложенного в настоящем изобретении, является: 1) невысокая стоимость комплекса работ и расходных материалов, 2) высокая чувствительность (низкие концентрации действующих веществ от 10 мкм до 0,1 пм), 3) короткие сроки получения ответной реакции (от 12 до 42 суток), 4) компактность тест-системы, которая позволяет выращивать верхушки побегов в чашках Петри.
Последовательности аминокислотных остатков пептидов
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ скрининга регуляторов роста растений и комплект скрининга, основанный на заявленном способе | 2019 |
|
RU2740004C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВЫХ ВЕЩЕСТВ | 2000 |
|
RU2250264C2 |
| Носитель для культивирования клеток человека и животных | 2017 |
|
RU2663131C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАТЕРИАЛА С КЛЕТОЧНОЙ ПОВЕРХНОСТИ РАСТЕНИЙ | 2020 |
|
RU2839090C1 |
| СПОСОБ СКРИНИНГА БАКТЕРИЙ, СТИМУЛИРУЮЩИХ РОСТ РАСТЕНИЙ | 2023 |
|
RU2833807C1 |
| ДЕЛЬТА 6-АЦЕТИЛЕНАЗА/ДЕЛЬТА-6-ДЕСАТУРАЗА И ДЕЛЬТА-6-ДЕСАТУРАЗА ИЗ Ceratodon purpureus | 2000 |
|
RU2268939C2 |
| Способ микроклонального размножения винограда | 2023 |
|
RU2835624C1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ СМОРОДИНЫ И АНТИОКСИДАНТ ДЛЯ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ СМОРОДИНЫ | 1994 |
|
RU2080060C1 |
| Штамм Streptomyces sp. YVZ020 ВКМ Ас-3001D - продуцент метаболитов, обладающих фитостимулирующим и фитозащитным действием против возбудителя бактериоза Clavibacter michiganensis | 2024 |
|
RU2840021C1 |
| Способ оздоровления картофеля при клональном микроразмножении | 2022 |
|
RU2805327C1 |

Изобретение относится к способу скрининга регуляторов роста растений, в котором в качестве тест-системы используют культуры верхушек побегов зеленых мхов Physcomitrtella patens, Ceratodon purpureus, Atrichum tenellum. Способ включает стадию подготовки тест-системы, которая заключается в выделении верхушек побегов из гаметофоров, выращенных в стандартных условиях in vitro, стадию культивирования тест-системы, на которой верхушки побегов зеленых мхов культивируют в чашках Петри на агаризованной среде с последующим растворением исследуемого вещества в воде и добавлением в виде аликвоты в агаризованную среду, и стадию анализа роста тест-системы, при этом в качестве показателя ростовой активности учитывается число побегов, образовавшихся на одном экспланте. Также изобретение относится к системе скрининга регуляторов роста растений, включающей тест-систему в виде культуры верхушек побегов зеленых мхов, чашек Петри и микроскоп, и к применению верхушек побегов зеленых мхов для скрининга регулятора роста растений. Технический результат - достижение высокой чувствительности и специфичности способа скрининга ростовых веществ при низких концентрациях тестируемых веществ, высокой стандартизируемости процесса тестирования и высокой воспроизводимости результатов тестирования. 3 н. и 6 з.п. ф-лы, 4 пр., 5 ил.
1. Способ скрининга регуляторов роста растений, в котором в качестве тест-системы используют культуры верхушек побегов зеленых мхов Physcomitrtella patens, Ceratodon purpureus, Atrichum tenellum, включающий стадию подготовки тест-системы, которая заключается в выделении верхушек побегов из гаметофоров, выращенных в стандартных условиях in vitro, стадию культивирования тест-системы, на которой верхушки побегов зеленых мхов культивируют в чашках Петри на агаризованной среде с последующим растворением исследуемого вещества в воде и добавлением в виде аликвоты в агаризованную среду, и стадию анализа роста тест-системы, при этом в качестве показателя ростовой активности учитывается число побегов, образовавшихся на одном экспланте.
2. Способ по п. 1, отличающийся тем, что верхушки побегов зеленых мхов выделяют микрохирургическим путем.
3. Способ по п. 1, отличающийся тем, что аликвоту добавляют в агаризованную среду, охлажденную до 45°С.
4. Способ по п. 3, отличающийся тем, что культивирование верхушек побегов мхов осуществляют при температуре от 16 до 28°С в условиях фотопериода длиной от 8 до 20 ч.
5. Способ по п. 1, отличающийся тем, что культивирование верхушек побегов зеленых мхов проводят в течение периода от 12 до 42 суток.
6. Способ по п. 1, отличающийся тем, что анализ роста тест-системы осуществляют на бинокулярном стереомикроскопе.
7. Система скрининга регуляторов роста растений для осуществления способа по п. 1, включающая тест-систему в виде культуры верхушек побегов зеленых мхов, чашек Петри и микроскоп.
8. Система по п. 1, отличающаяся тем, что микроскоп представляет собой бинокулярный стереомикроскоп.
9. Применение верхушек побегов зеленых мхов для скрининга регуляторов роста растений способом по п. 1.
| KR 20080095041 A, 28.10.2008 | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| СКРИПНИКОВ А.Ю | |||
| и др | |||
| "Протеомный анализ мха Physcomitrellapatens (Hedw.) B.S.G." Биохимия, 2009, т | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Прибор для изменения шага резьбы при токарных винторезных | 1921 |
|
SU593A1 |
| ВОЕЙКОВ В.Л | |||
| и др | |||
| "Влияние растительных пептидов на биологические и физико-химические тест-системы в широком диапазоне концентраций" | |||
| VIII МЕЖДУНАРОДНЫЙ КОНГРЕСС | |||
Авторы
Даты
2020-12-02—Публикация
2019-09-05—Подача