Изобретение относится к новым 5-замещенным-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-онам общей формулы I, которые могут найти применение в медицине, например, в качестве антифунгальных средств. Изобретение также относится к их способу получения.
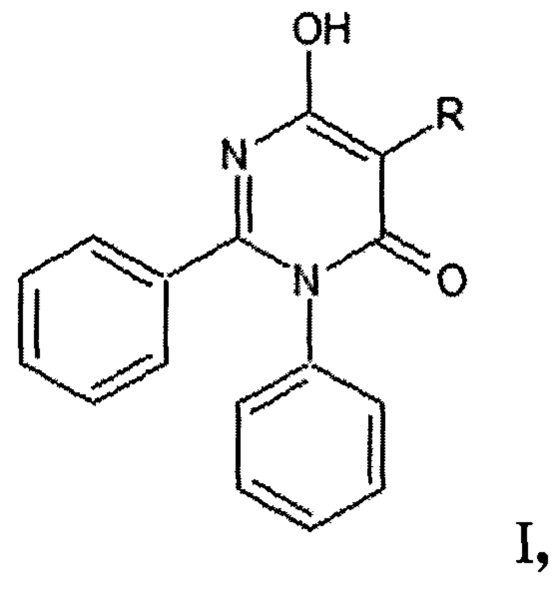 где:
где:
R=СН3 (I а - 6-гидрокси-5-метил-2,3-дифенилпиримидин-4(3Н)-он);
R=C4H9(I б - 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-он);
R=С6Н5 (I в - 6-гидрокси-2,3,5-трифенилпиримидин-4(3Н)-он).
Описан 6-гидрокси-2,3-дифенил-пиримидин-4(3Н)-он (IV), который был получен взаимодействием N-фенилбензолкарбоксимидамида (II) с малоновым эфиром (III) в среде метанола в присутствии метанолята натрия с добавлением 2-метоксиэтанола. Синтез осуществляется в атмосфере азота при нагревании в течение 18 часов. Затем выделяют продукт путем добавления реакционной массы в воду, с последующим подкислением, экстракцией этилацетатом и отгонкой последнего [WO 089051 US, A01N 43/54 (2006.01) A61K 31/505 (2006.01. N-Substituted Glycine Derivatives: Prolyl Hydroxylase Inhibitors: №050831: priority data. 12.01.2007: filing date. 11.01.2008 / Shaw, Antony, N., Duffy, Kevin, J., Tedesco, Rosanna, Wiggall, Kenneth; applicant Smithkline beecham corporation. - 137 P.].
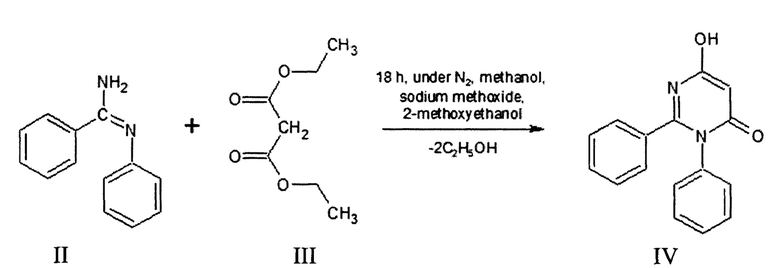
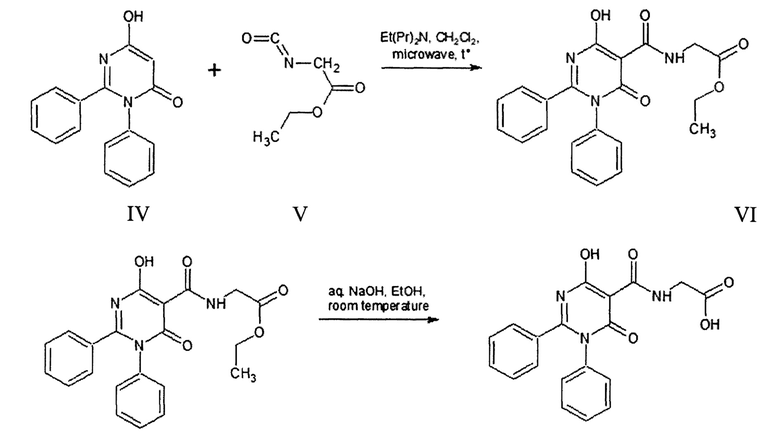
Из литературы известен [N-(4-гидрокси-6-оксо-1,2-дифенил-1,6-дигидропиримидин-5-ил)карбонил]глицин (VI), полученный в результате взаимодействия 6-гидрокси-2,3-дифенил-пиримидин-4(3Н)-она (IV), этилизоцианатоацетата (V) и диизопропилэтиламина в среде дихлорметана при перемешивании в микроволновом реакторе при температуре 140°С в течение 1 часа [WO 089051 US, A01N 43/54 (2006.01) А61К 31/505 (2006.01). N-Substituted Glycine Derivatives: Prolyl Hydroxylase Inhibitors: №050831: priority data. 12.01.2007 / Shaw, Antony, N., Duffy, Kevin, J., Tedesco, Rosanna, Wiggall, Kenneth; applicant Smithkline beecham corporation. - 137 P.].
Известны 2,5-дизамещенные-6-гидроксипиримидин-4(3H)-оны общей формулы VII.
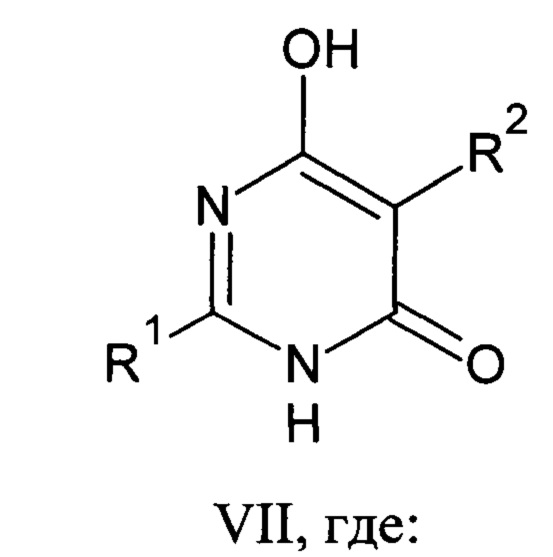
R1=СН3, R2=Н (2-метил-6-гидроксипиримидин-4(3Н)-он);
R1=СН3, R2=С2Н5 (6-гидрокси-2-метил-5-этилпиримидин-4(3Н)-он);
R1=СН3, R2=С4Н9 (5-бутил-6-гидрокси-2-метилпиримидин-4(3Н)-он);
R1=СН3, R2=С6Н5СН2 (5-бензил-6-гидрокси-2-метилпиримидин-4(3Н)-он);
R1=СН3, R2=С6Н5 (6-гидрокси-2-метил-5-фенилпиримидин-4(3Н)-он);
R1=С6Н5, R2=Н (6-гидрокси-2-фенилпиримидин-4(3Н)-он);
R1=СН3, R2=СН2=СН (5-винил-6-гидрокси-2-метилпиримидин-4(3Н)-он);
R1=4-Cl С6Н4, R2=Н (6-гидрокси-2-(4-хлорфенил)пиримидин-4(3Н)-он);
R1=4-NO2 С6Н4, R2=Н (6-гидрокси-2-(4-нитрофенил)пиримидин-4(3Н)-он);
R1=4-СН3 С6Н4, R2=Н (6-гидрокси-2-(4-толил)пиримидин-4(3Н)-он).
Данные соединения получены путем взаимодействия малонилхлоридов (IX) с незамещенными по атомам азота амидинами (VIII). Реакцию проводят, прикапывая малонилхлорид к суспензии амидина в бензоле при перемешивании с последующим нагреванием, при температуре 50°С в течение 1 часа. Целевые продукты выделяют путем переосаждения [Патент №2604060 РФ, МПК C07D 239/54 (2006.01). Способ получения 2,5-дизамещенных 6-гидроксипиримидин-4(3Н)-онов: №2015142491: заявл. 06.10.2015: опубл. 10.12.2016 / Потапова А.Э., Куваева Е.В., Яковлев И.П., Федорова Е.В., Семакова Т.Л., Сопова М.В.; заявитель ФГБОУ ВО СПХФА Минздрава России. - 14 с.: ил. - Текст: непосредственный].
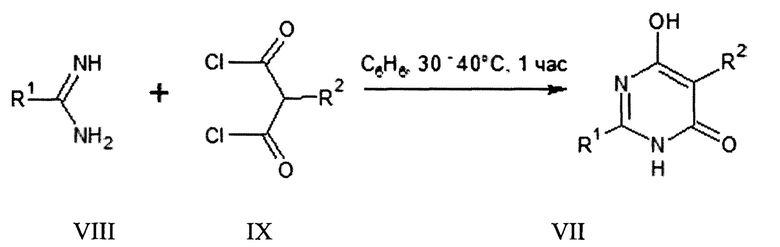
В литературе описан 6-гидрокси-3-фенил-2-(фениламино)пиримидин-4(3Н)-он (X) и способ его получения [Skinner, G.S. Condensation of monophenyl- and diphenylguanidine with malonates and α-alkyl-α-carbethoxy-γ-butyrolactones / G.S. Skinner, J.M. Reneberger, H.C. Vogt // Journal of American Chemical Society. - 1957. - Vol. 79. - P. 6207-6209].
Из патентной и научно-технической литературы не выявлены ни способы получения новых, заявляемых авторами соединений, ни сами структуры.
Задачей предполагаемой группы изобретений является создание новых неописанных в литературе соединений - 5-замещенных-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-онов, которые позволят расширить ассортимент потенциальных антифунгальных средств.
Техническими результатами, на решение которых направлено изобретение, являются получение новых соединений формулы I; разработка простого способа их синтеза с высоким выходом продуктов.
Поставленная задача осуществляется путем взаимодействия N-фенилбензолкарбоксимидамида (XI) с замещенными пропандиоилдихлоридами (XII) в мольном соотношении 1:1,3 в среде абсолютного о-ксилола. К суспензии N-фенилбензолкарбоксимидамида медленно прикапывают раствор одного из свежеперегнанных замещенных пропандиоилдихлоридов в абсолютном о-ксилоле при комнатной температуре при перемешивании. После прикапывания всего раствора реакционную массу нагревают и выдерживают при температуре 144°С до прекращения выделения соляной кислоты. Далее, отгоняют о-ксилол. Целевой продукт выделяют из твердого остатка методом кислотно-основного переосаждения.
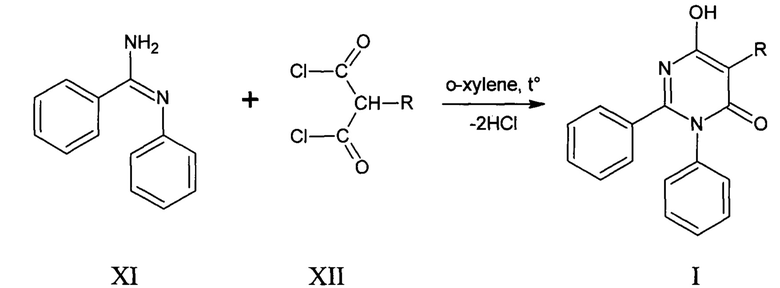
где: R=СН3(I а - 6-гидрокси-5-метил-2,3-дифенилпиримидин-4(3Н)-он);
R=C4H9(I б - 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-он);
R=С6Н5(1 в - 6-гидрокси-2,3,5-трифенилпиримидин-4(3Н)-он).
Способ получения 5-замещенных-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-онов изучен и проведен в лабораторных условиях на стандартном товарном сырье.
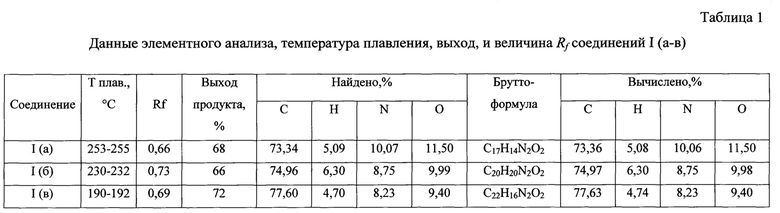
Данные элементного анализа, выход продуктов реакции, температуры плавления и величины Rf приведены в табл. 1, спектральные характеристики полученных соединений приведены в табл. 2.
Пример 1. Получение 6-гидрокси-5-метил-2,3-дифенилпиримидин-4(3Н)-она (I а)
В грушевидную колбу емкостью 100 мл загружают 5,88 г (0,03 моль) N-фенилбензолкарбоксимидамида и 20 мл абсолютного о-ксилола, смесь перемешивают с помощью магнитной мешалки. Затем с помощью капельной воронки прикапывают раствор, состоящий из 6,05 г 2-метилпропандиоилдихлорида (0,039 моль) и 15 мл абсолютного о-ксилола. По завершении прикапывания раствора отсоединяют капельную воронку, извлекают якорь для магнитной мешалки из реакционной массы с помощью специального извлекателя и присоединяют к колбе обратный холодильник. Далее, реакционную смесь кипятят при температуре 144°С в течение 4 часов до прекращения выделения соляной кислоты. Затем реакционную массу охлаждают, отгоняют из нее о-ксилол, который идет на регенерацию. К сухому остатку прибавляют 20 мл 10% раствора натрия гидроксида. Смесь перемешивают в течение 30 минут, затем фильтруют. Фильтрат подкисляют разбавленной соляной кислотой (7%) до рН=4. Формируется осадок целевого продукта. Спустя 20 минут суспензию отфильтровывают. Твердое вещество сушат в сушильном шкафу при температуре 70°С в течение 20 минут. Полученный продукт кремово-белого цвета составляет 5,76 г, 68% от теоретического из расчета на N-фенилбензолкарбоксимидамид. Температура плавления 253-255°С. Хроматографическая однородность полученного продукта подтверждалась хроматографированием его в 96% этаноле в системе - метанол: дихлорметан (1:9). Rf=0,66. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C17H14N2O2. Найдено %: С - 73,34, Н - 5,09, N - 10,07, О - 11,50. Вычислено %: С -73,36, Н - 5,08, N - 10,06,0 - 11,50.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н, ЯМР С13 и масс-спектрометрией.
Спектр ЯМР Н1 полученного соединения в ДМСО-d6 характеризуется наличием резонансных сигналов протонов бензольных колец (7.20-7.31 м.д.), сигнала протонов группы СН3 при 1.88 м.д. и сигнала в области 11.49 м.д., соответствующего протонам ОН группы.
В спектре ЯМР С13 полученного соединения помимо сигналов атомов углерода бензольных колец в области 128.01-138.34 м.д. и сигнала метальной группы 8.96 м.д. в слабом поле при 164.46 м.д. и 164.01 м.д. наблюдаются сигналы атомов углерода -С=O и -С-ОН соответственно, а также сигналы атомов углерода С2 - 156.80 м.д. и С5 - 96.41 м.д.
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=278).
Пример 2. Получение 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-она(1б)
В грушевидную колбу емкостью 100 мл загружают 5,88 г (0,03 моль) N-фенилбензолкарбоксимидамида и 20 мл абсолютного о-ксилола, смесь перемешивают с помощью магнитной мешалки. Затем с помощью капельной воронки прикапывают раствор, состоящий из 7,68 г 2-бутилпропандиоилдихлорида (0,039 моль) и 15 мл абсолютного о-ксилола. По завершении прикапывания раствора отсоединяют капельную воронку, извлекают якорь для магнитной мешалки из реакционной массы с помощью специального извлекателя и присоединяют к колбе обратный холодильник. Далее, реакционную смесь кипятят при температуре 144°С в течение 4 часов до прекращения выделения соляной кислоты. Затем реакционную массу охлаждают, отгоняют из нее о-ксилол, который идет на регенерацию. К сухому остатку прибавляют 20 мл 10% раствора натрия гидроксида. Смесь перемешивают в течение 30 минут, затем фильтруют. Фильтрат подкисляют разбавленной соляной кислотой (7%) до рН=4. Формируется осадок целевого продукта. Спустя 20 минут суспензию отфильтровывают. Твердое вещество сушат в сушильном шкафу при температуре 70°С в течение 20 минут. Выделенный продукт кремового цвета составляет 6,34 г, 66% от теоретического из расчета на N-фенилбензолкарбоксимидамид. Температура плавления 230-232°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием его в 96% этаноле в системе метанол: дихлорметан (1:9). Rf=0,73. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C20H20N2O2. Найдено %: С - 74,96, Н - 6,30, N - 8,75, О - 9,99. Вычислено %: С - 74,97, Н - 6,30, N - 8,75, О -9,98.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н, ЯМР С13 и масс-спектрометрией.
Спектр ЯМР Н1 полученного соединения в ДМСО-d6 характеризуется наличием резонансных сигналов протонов бензольных колец (7.06-7.61 м.д.), сигнала протонов группы СН3 при 0.91 м.д., сигналы протонов трех метиленовых групп СН2 в области 1.33-2.38 м.д. и сигнала в области 11.40 м.д., соответствующего протонам ОН группы.
В спектре ЯМР С13 полученного соединения помимо сигналов атомов углерода бензольных колец в области 128.01-138.33 м.д., сигнала метальной группы 14.40 м.д. и сигналов метиленовых групп 22.77-30.27 м.д. в слабом поле при 164.43 м.д. и 163.74 м.д. наблюдаются сигналы атомов углерода -С=O и -С-ОН соответственно, а также сигналы атомов углерода С2 - 156.97 м.д. и С5 - 101.13 м.д.
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=320).
Пример 3. Получение 6-гидрокси-2,3,5-трифенилпиримидин-4(3H)-она (I в)
В грушевидную колбу емкостью 100 мл загружают 5,88 г (0,03 моль) N-фенилбензолкарбоксимидамида и 20 мл абсолютного о-ксилола, смесь перемешивают с помощью магнитной мешалки. Затем с помощью капельной воронки прикапывают раствор, состоящий из 8,46 г 2-фенилпропандиоилдихлорида (0,039 моль) и 15 мл абсолютного о-ксилола. По завершении прикапывания раствора отсоединяют капельную воронку, извлекают якорь для магнитной мешалки из реакционной массы с помощью специального извлекателя и присоединяют к колбе обратный холодильник. Далее, реакционную смесь кипятят при температуре 144°С в течение 4 часов до прекращения выделения соляной кислоты. Затем реакционную массу охлаждают, отгоняют из нее о-ксилол, который идет на регенерацию. К сухому остатку прибавляют 20 мл 10% раствора натрия гидроксида. Смесь перемешивают в течение 30 минут, затем фильтруют. Фильтрат подкисляют разбавленной соляной кислотой (7%) до рН=4. Формируется осадок целевого продукта. Спустя 20 минут суспензию отфильтровывают. Твердое вещество сушат в сушильном шкафу при температуре 70°С в течение 20 минут. Выделенный продукт кремово-желтого цвета составляет 7,35 г, 72% от теоретического из расчета на N-фенилбензолкарбоксимидамид. Температура плавления 190-192°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием его в 96% этаноле в системе - метанол: дихлорметан (1:9). Rf=0,69. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C22H16N2O2. Найдено %: С - 77,60, Н - 4,70, N - 8,23, О - 9,40. Вычислено %: С - 77,63, Н - 4,74, N - 8,23,0 - 9,40.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР Н1, ЯМР С13 и масс-спектрометрией.
Спектр ЯМР Н1 полученного соединения в ДМСО-d6 характеризуется наличием резонансных сигналов протонов бензольных колец (6.94-7.96 м.д.) и сигнала в области 11.86 м.д., соответствующего протонам ОН группы.
В спектре ЯМР С13 полученного соединения помимо сигналов атомов углерода бензольных колец в области 127.30-130.58 м.д. в слабом поле при 161.23 м.д. и 160.40 м.д. наблюдаются сигналы атомов углерода -С=O и -С-ОН соответственно, а также сигналы атомов углерода С2 - 140.40 м.д. и С5 - 98.43 м.д.
Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=340).
Пример 4. Соединения формулы I (I а, I б, I в) обладают антифунгальной активностью в отношении Candida tropicalis
Определение минимально ингибирующих концентраций (МИК) проводили методом серийных разведений. Тест-культуру Candida tropicalis выращивали на среде Сабуро. Предварительно соединения были растворены в растворителе ДМСО, который разрешен к применению в медицинской практике. Затем полученные растворы переносили в первые пробирки в объеме 1,0 мл, перемешивали и проводили дальнейшие двукратные разведения во всех пробирках ряда. Из последних пробирок удаляли 1,0 мл полученной смеси. Взвесь готовили путем разведения до 1×106 клеток в 1,0 мл. Микробная нагрузка при этом составляла 1×105 кл/мл. Посевы термостатировали в условиях, соответствующих выбранной культуре. По окончании времени выдержки учитывали результаты. Все операции проводились в стерильных условиях с использованием предварительно простерилизованных инструментов. Проводилась трехразовая повторность экспериментов. В качестве препарата сравнения был выбран флуконазол, который широко используется в медицинской практике.
Полученные данные свидетельствуют о том, что соединения I (а, б) находятся на уровне с препаратом сравнения (МИК 2 мкг/мл), а соединение I (в) несколько превосходит его по активности (МИК 2,3 мкг/мл).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 5-замещённых-6-гидрокси-2,3-дифенилпиримидин-4(3Н)-онов | 2020 |
|
RU2738107C1 |
| 1,2-Дифенил-5-бутил-6-оксо-1,6-дигидропиримидин-4-олят натрия и способ его получения | 2021 |
|
RU2757391C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 4-ГАЛОГЕН-3-ГИДРОКСИФУРО[3,4-c]ПИРИДИН-1(3Н)-ОНОВ | 2015 |
|
RU2574412C1 |
| НОВЫЕ ОПТИЧЕСКИ АКТИВНЫЕ 4-ГИДРОКСИ-2-АЗА-9,10-АНТРАХИНОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2436775C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ БЕНЗОФУРАН-5,6-ДИКАРБОНИТРИЛОВ | 2009 |
|
RU2429235C2 |
| ФТОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ТЕВИНОЛА И ОРВИНОЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2012 |
|
RU2506265C1 |
| ЭНАНТИОМЕРНО ЧИСТЫЕ ОСНОВНЫЕ ЭФИРЫ АРИЛ-ЦИКЛОАЛКИЛГИДРОКСИКАРБОНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 1997 |
|
RU2238936C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ N-3-ОКСОАЛКИЛТИОАМИДОВ | 1994 |
|
RU2068411C1 |
| ЗАМЕЩЕННЫЕ 2-ФЕНИЛИНДОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНЫЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2010 |
|
RU2440339C1 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРЕНКАРБОКСАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ | 2003 |
|
RU2320656C2 |
Изобретение относится к 5-замещенным-6-гидрокси-2,3-дифенилпиримидин-4(3H)-онам общей формулы I, где: R=CH3; R=C4H9; R=C6H5. Также изобретение относится способу получения 5-замещенных-6-гидрокси-2,3-дифенилпиримидин-4(3H)-онов общей формулы I, путем взаимодействия N-фенилбензолкарбоксимидамида с соответствующим замещенным пропандиоилдихлоридом, выбранным из группы: 2-метилпропандиоилдихлорида, 2- бутилпропандиоилдихлорида, 2-фенилпропандиоилдихлорида, в мольном соотношении 1:1,3 в среде абсолютного о-ксилола, затем реакционную массу нагревают и выдерживают при температуре 144°С до прекращения выделения соляной кислоты, о-ксилол отгоняют, а целевой продукт выделяют из твердого остатка методом кислотно-основного переосаждения. Соединения по изобретению предназначены для применения в медицине в качестве антифунгальных средств. 2 н.п. ф-лы, 2 табл, 4 пр.
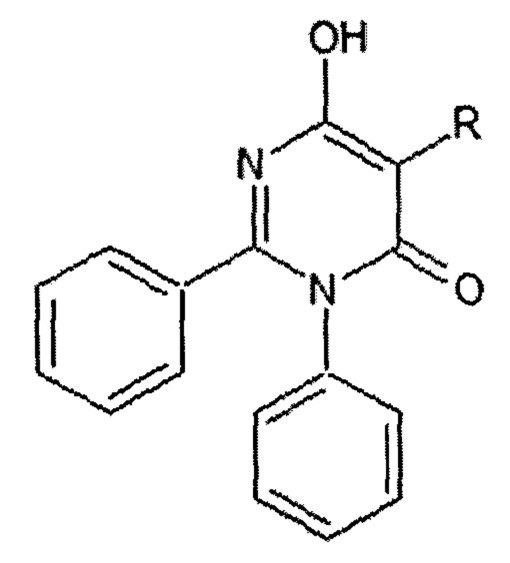
1. 5-Замещенные-6-гидрокси-2,3-дифенилпиримидин-4(3H)-оны общей формулы I,
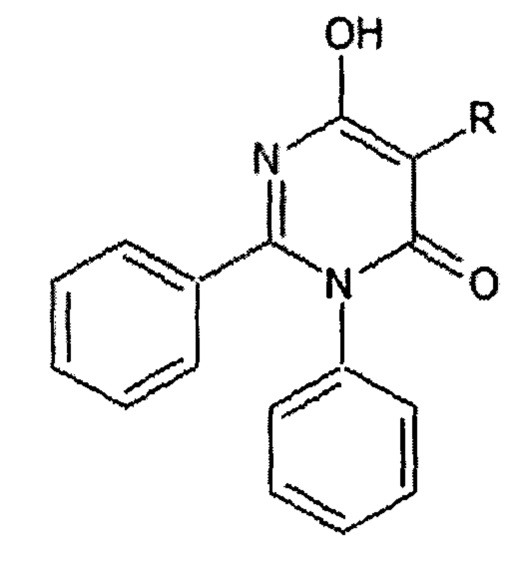
где:
R=CH3 (I а - 6-гидрокси-5-метил-2,3-дифенилпиримидин-4(3H)-он);
R=C4H9 (I б - 5-бутил-6-гидрокси-2,3-Дифенилпиримидин-4(3H)-он);
R=C6H5 (I в - 6-гидрокси-2,3,5-трифенилпиримидин-4(3H)-он).
2. Способ получения 5-замещенных-6-гидрокси-2,3-дифенилпиримидин-4(3H)-онов общей формулы I,
где: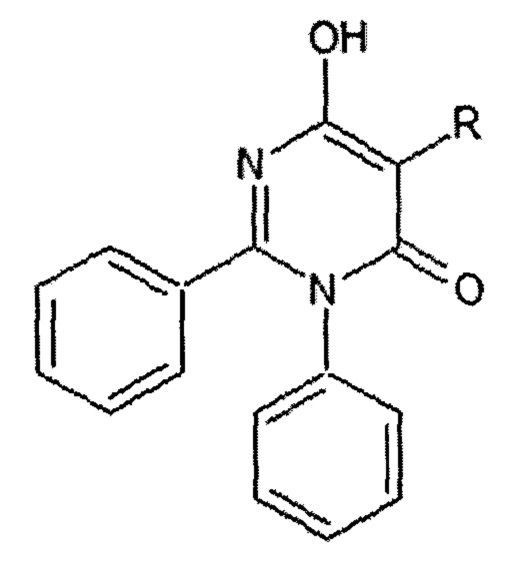
R=CH3 (I а - 6-гидрокси-5-метил-2,3-дифенилпиримидин-4(3H)-он);
R=C4H9 (I б - 5-бутил-6-гидрокси-2,3-дифенилпиримидин-4(3H)-он);
R=C6H5 (I в - 6-гидрокси-2,3,5-трифенилпиримидин-4(3H)-он), - путем взаимодействия N-фенилбензолкарбоксимидамида с соответствующим замещенным пропандиоилдихлоридом, выбранным из группы: 2-метилпропандиоилдихлорида, 2-бутилпропандиоилдихлорида, 2-фенилпропандиоилдихлорида, - в мольном соотношении 1:1,3 в среде абсолютного о-ксилола, затем реакционную массу нагревают и выдерживают при температуре 144°С до прекращения выделения соляной кислоты, о-ксилол отгоняют, а целевой продукт выделяют из твердого остатка методом кислотно-основного переосаждения.
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИЗАМЕЩЕННЫХ 6-ГИДРОКСИПИРИМИДИН-4(3Н)-ОНОВ | 2015 |
|
RU2604060C1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Habib N | |||
| S., Kappe T | |||
| : "Ylides of heterocycles | |||
| VII | |||
| I-, N-, P- and S-ylides of pyrimidones" | |||
| Journal of Heterocyclic Chemistry, 1984, 21(2), 385-388 | |||
| 6-Оксо-1-фенил-2-(фениламино)-1,6-дигидропиримидин-4-олят натрия и способ его получения | 2018 |
|
RU2669555C1 |
Авторы
Даты
2020-12-14—Публикация
2020-03-06—Подача