1. Область техники, к которой относится изобретение
Изобретение относится к химико-фармацевтической промышленности, медицине, фармакологии и касается производства средств антигликирующего действия.
2. Уровень техники
Сахарный диабет (СД) - хроническое неинфекционное заболевание, темпы роста распространенности которого приобрели масштаб мировой эпидемии [DiabetesAtlas 7thEdition // InternationalDiabetesFederation. 2015. 144 p.; Dedov I.I., Shestakova M.V., Vikulova O.K. Epidemiology of diabetes mellitus in Russian Federation: clinical and statistical report according to the federal diabetes registry // Diabetes Mellit. 2017. Vol. 20, №1. P. 13-41]. Заболевание характеризуется прогрессирующим течением и развитием ряда острых и поздних осложнений, зачастую приводящих к временной потере трудоспособности, инвалидизации и ранней смерти [Дедов, Шестакова. Сахарный диабет: диагностика, лечение, профилактика. Москва: ООО «Издательство «Медицинское информационное агентство», 2011. 808 р.]. Поэтому вопрос профилактики и лечения осложнений СД - один из важнейших в современной медицине.
Одним из патогенетических факторов развития поздних осложнений сахарного диабета считают неферментативное взаимодействие между свободными аминогруппами белков и карбонильными группами восстановленных Сахаров и других карбонильных соединений, приводящее к формированию протеазоустойчивых аддуктов, известных как конечные продукты гликирования (КПГ) (AGE) [Ramasamy R. Advanced glycation end products and RAGE: a common thread in aging, diabetes, neurodegeneration, and inflammation // Glycobiology. 2005. Vol. 15, №7. P. 16R-28R.]. КПГ препятствуют действию оксида азота [Bierhaus A. etal. AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. The AGE concept. // Cardiovasc. Res. 1998. Vol. 37, №3. P. 586-600] и способны индуцировать перекисное окисление липидов [Gasic-Milenkovic J., Loske С.,  G. Advanced glycation end products cause lipid peroxidation in the human neuronal cell line // J. Alzheimer's Dis. 2003. Vol. 5, №1. P. 25-30.]. Наконец, существует рецептор-опосредованный путь, связанный с индукцией и активацией рецепторов к КПГ (RAGE), запускающих провоспалительные и прокоагулянтные сигнальные пути [Schmidt A.M. et al. The multiligand receptor RAGE as a progression factor amplifying immune and inflammatory responses // J. Clin. Invest. 2001. Vol. 108, №7. P. 949-955]. Активация RAGE участвует не только в патогенезе сахарного диабета, но и в почечной недостаточности [Deane R.J.R. et al. A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease // J. Clin. Invest. 2012. Vol. 122, №4. P. 1377-1392]. Формирование КПГ в процессе старения и при сахарном диабете обладает выраженным провоспалительным эффектом и приводит к повышению сердечно-сосудистого риска [Hanssen N.M.J, et al. Plasma Advanced Glycation End Products Are Associated With Incident Cardiovascular Events in Individuals With Type 2 Diabetes: A Case-Cohort Study With a Median Follow-up of 10 Years (EPIC-NL) // Diabetes. 2015. Vol. 64, №1. P. 257-265]. Накопление КПГ характерно для всех осложнений диабета, включая нефропатию, ретинопатию, атеросклероз и нейропатию [Vlassara Н., Uribarri J. Advanced Glycation End Products (AGE) and Diabetes: Cause, Effect, or Both? // Curr. Diab. Rep. 2014. Vol. 14, №1 P. 453; Singh V.P. et al. Advanced glycation end products and diabetic complications // Korean J. Physiol. Pharmacol. 2014. Vol. 18, №1. P. 1-14]. Ha основании этого можно утверждать, что, используя ингибиторы образования КПГ, можно существенно уменьшить риск развития осложнений СД.
G. Advanced glycation end products cause lipid peroxidation in the human neuronal cell line // J. Alzheimer's Dis. 2003. Vol. 5, №1. P. 25-30.]. Наконец, существует рецептор-опосредованный путь, связанный с индукцией и активацией рецепторов к КПГ (RAGE), запускающих провоспалительные и прокоагулянтные сигнальные пути [Schmidt A.M. et al. The multiligand receptor RAGE as a progression factor amplifying immune and inflammatory responses // J. Clin. Invest. 2001. Vol. 108, №7. P. 949-955]. Активация RAGE участвует не только в патогенезе сахарного диабета, но и в почечной недостаточности [Deane R.J.R. et al. A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease // J. Clin. Invest. 2012. Vol. 122, №4. P. 1377-1392]. Формирование КПГ в процессе старения и при сахарном диабете обладает выраженным провоспалительным эффектом и приводит к повышению сердечно-сосудистого риска [Hanssen N.M.J, et al. Plasma Advanced Glycation End Products Are Associated With Incident Cardiovascular Events in Individuals With Type 2 Diabetes: A Case-Cohort Study With a Median Follow-up of 10 Years (EPIC-NL) // Diabetes. 2015. Vol. 64, №1. P. 257-265]. Накопление КПГ характерно для всех осложнений диабета, включая нефропатию, ретинопатию, атеросклероз и нейропатию [Vlassara Н., Uribarri J. Advanced Glycation End Products (AGE) and Diabetes: Cause, Effect, or Both? // Curr. Diab. Rep. 2014. Vol. 14, №1 P. 453; Singh V.P. et al. Advanced glycation end products and diabetic complications // Korean J. Physiol. Pharmacol. 2014. Vol. 18, №1. P. 1-14]. Ha основании этого можно утверждать, что, используя ингибиторы образования КПГ, можно существенно уменьшить риск развития осложнений СД.
В последнее десятилетие опубликованы многочисленные работы, посвященные синтетическим низкомолекулярным ингибиторам КПГ и их терапевтическому потенциалу [Sourris K.С., Harcourt В.Е., Forbes J.M. A New Perspective on Therapeutic Inhibition of Advanced Glycation in Diabetic Microvascular Complications: Common Downstream Endpoints Achieved Through Disparate Therapeutic Approaches? // Am. J. Nephrol. 2009. Vol. 30, №4. P. 323-335; Schalkwijk C.G., Miyata T. Early- and advanced non-enzymatic glycation in diabetic vascular complications: the search for therapeutics // Amino Acids. 2012. Vol. 42, №4. P. 1193-1204].
Аминогуанидин (Pimagedine) был первым выявленным ингибитором образования КПГ и изучен наиболее подробно [Brownlee М. et al. Aminoguanidine prevents diabetes-induced arterial wall protein cross-linking. // Science. 1986. Vol. 232, №4758. P. 1629-1632.]. Рандомизированные плацебо-контролируемые исследования оценивали эффективность аминогуанидина у пациентов с диабетом 1 и 2 типа. В клиническом исследовании III фазы у пациентов с СД1 аминогуанидин уменьшал протеинурию и прогрессирование ретинопатии [Bolton W.K. et al. Randomized Trial of an Inhibitor of Formation of Advanced Glycation End Products in Diabetic Nephropathy // Am. J. Nephrol. 2004. Vol. 24, №1. P. 32-40]. Это было первым клиническим доказательством эффективности ингибирования образования КПГ для борьбы с серьезными осложнениями СД1. Однако в силу неудовлетворительного профиля безопасности, выявленных прооксидантных свойств [Suji G., Sivakami S. DNA damage by free radical production by aminoguanidine. // Ann. N.Y. Acad. Sci. 2006. Vol. 1067. P. 191-199] он не может использоваться для терапевтических целей. Тем не менее, аминогуанидин продолжает служить веществом сравнения при разработке новых ингибиторов образования КПГ.
Пиридоксамин, производное витамина В6, предотвращает образование КПГ из промежуточных продуктов Амадори [Ahmad S. et al. Inhibitory Effect of Metformin and Pyridoxamine in the Formation of Early, Intermediate and Advanced Glycation End-Products // PLoS One / ed. Agarwal P.K. 2013. Vol. 8, №9. P. е72128]. Он замедляет прогрессирование заболевания почек, снижает гиперлипидемию и окислительно-восстановительный дисбаланс у крыс с экспериментальным СД1 [Degenhardt Т.Р. et al. Pyridoxamine inhibits early renal disease and dyslipidemia in the streptozotocin-diabetic rat. // Kidney Int. 2002. Vol. 61, №3. P. 939-950]. В исследованиях II фазы у пациентов с диабетической нефропатией пиридоксамин значительно нормализовал содержание креатинина в сыворотке, тогда как различий в экскреции альбумина в моче не наблюдалось [Williams М.Е. et al. Effects of pyridoxamine in combined phase 2 studies of patients with type 1 and type 2 diabetes and overt nephropathy. // Am. J. Nephrol. 2007. Vol. 27, №6. P. 605-614]. Однако маловероятно, что этот эффект обусловлен витамином В6 и, тем самым, компрометирует использование пиридоксамина [Thornalley P.J., Rabbani N. Therapy: Vitamin B6, B9 and В12 in diabetic nephropathy-beware. // Nat. Rev. Endocrinol. 2010. Vol. 6, №9. P. 477-478].
3. Сущность изобретения
Задачей изобретения является создание фармацевтической композиции для перорального введения лекарственного средства, действующего на конечные продукты гликирования коллагена (AGE), в форме желатиновых капсул, содержащих фармакологически приемлемую дозу натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата).
Сущность изобретения поясняется следующими материалами: При выборе лекарственной формы необходимо было учитывать, что добавление вспомогательных веществ должно быть минимальным, чтобы не увеличивать ее размер, ухудшающий проглатывание. Также нежелательно использовать в качестве наполнителей производные углеводов, т.к. они нивелируют антигликирующий эффект. Наиболее удобными в этом плане являются капсулы, которые в отличие от таблеток, содержат минимальный набор вспомогательных веществ.
Изучение технологических свойств субстанции натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) показало, что она обладает мелкокристаллической структурой, неудовлетворительной сыпучестью, неоднородным размером частиц, в связи с чем получение содержимого капсул необходимо проводить с использованием предварительного влажного гранулирования с последующим добавлением антифрикционных веществ.
Установленная в ходе фармакологических исследований средне-терапевтическая доза субстанции составила 300 мг на прием.
На Фиг. 1 представлена таблица №1, в которой приведены установленные в ходе экспериментов основные технологические свойства субстанции натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата).
Планируемый размер капсул должен быть в пределах №1 (вместимость 0,5 см3). Из таблицы №1 следует, что при насыпном объеме даже с уплотнением в капсулу №1 может поместиться 0,644×0,5=0,322 г субстанции, т.е. на долю вспомогательных веществ остается не более 22 мг. При этом основной задачей было обеспечение равномерности фракционного состава, увеличение насыпного объема, прочности гранул и их сыпучести.
На Фиг. 2 представлена таблица №2, в которой приведены 5 модельных прописей гранулятов для выбора количественного и качественного состава вспомогательных веществ. Выбор вспомогательных веществ проводили направленно: брали наиболее часто употребляемые наполнители, связывающие и скользящие вещества, получали грануляты изучали их свойства, при получении неудовлетворительных результатов переходили к следующему составу и т.д. В таблице №2 содержание связывающих веществ дано в пересчете на сухое вещество (для подсчета средней массы капсулы), но показаны концентрации использованных растворов, таким образом можно рассчитать количество увлажнителя.
Грануляты получали следующим образом: субстанцию и вспомогательные вещества, просеянные сквозь сито 0,5 мм, смешивали, увлажняли раствором ВМВ. Необходимое количество увлажнителя устанавливалось опытным путем. Затем влажную массу гранулировали сквозь сито 3 мм, сушили при температуре 35-40°С, вновь протирали сквозь сито 1 мм, опудривали стеаратом кальция или магния. Указанные в таблице №2 грануляты подвергались оценке по наиболее важным физико-химическим и технологическим показателям по методикам ГФ XIV издания [Государственная фармакопея Российской Федерации / МЗ РФ. - XIV изд. - Т. 2. - Москва, 2018].
На Фиг. 3 в таблице №3 приведены результаты оценки технологических показателей модельных прописей гранулята для капсул натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) 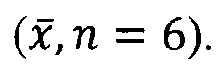 Как следует из таблицы №3, по совокупности показателей, находящихся в интервале оптимальных значений, наиболее приемлемыми характеристиками обладал гранулят состава №5, содержащий на одну дозу 300 мг (97%) натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата, 6,8 мг (2,2%) пласдона марки К 29/32 и 2,5 мг (0,8%) магния стеарата.
Как следует из таблицы №3, по совокупности показателей, находящихся в интервале оптимальных значений, наиболее приемлемыми характеристиками обладал гранулят состава №5, содержащий на одну дозу 300 мг (97%) натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата, 6,8 мг (2,2%) пласдона марки К 29/32 и 2,5 мг (0,8%) магния стеарата.
Технологическая схема получения капсулированного препарата натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) включала подготовку ингредиентов (измельчение, просеивание), увлажнение субстанции раствором ВМВ из ряда производных поливинилпирролидона, гранулирование влажной массы, сушку, дробление и ситовою калибровку высушенных гранул, опудривание антифрикционными агентами, выбранными из ряда стеаратов, фасовку полученной сухой массы в количестве 309,3 мг в желатиновые капсулы размера №1.
Техническим результатом настоящего изобретения является фармацевтическая композиция в твердой лекарственной форме (капсулы), действующая на конечные продукты гликирования коллагена (AGE), предназначенная для профилактики и лечения осложнений сахарного диабета.
Фармакокинетические свойства соединения в твердой лекарственной форме
Методы исследования фармакокинетических свойств соединения
Эксперименты выполнены на кроликах-самцах породы «Шиншилла», массой 3-4 кг. Субстанцию натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) и композицию твердой лекарственной формы вводили перорально с помощью интрагастрального зонда в дозе 20,0 мг/кг из расчета на действующую субстанцию (экспериментально, доказанная терапевтическая доза). За 12 часов до проведения исследования животные лишались доступа к пище без ограничения потребления воды.
Использована методика ВЭЖХ с ультрафиолетовым детектированием, позволяющая определять изучаемую субстанцию в биологическом материале и проводить фармакокинетические исследования. В работе использован жидкостный хроматограф Shimadzu LC-20 с ультрафиолетовым детектором Shimadzu SPD10-Avp (Shimadzu, Япония). Определение действующего вещества натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата (Натрия 3,8-диэтокси-карбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) осуществлялось при помощи ультрафиолетового детектора на колонке SupelcoSil LC-18 15 cm × 4,6 mm, 5 μm. Оптимальные условия количественного определения субстанции: длина волны - 205 нм, температура - 30°С, скорость элюента - 1 мл/мин. Элюент - смесь 0.05М калий-фосфатного буфера (рН=3.0) и ацетонитрила в соотношении 72:28. Нижний предел количественного определения - 0.5 мкг/мл.
Для оценки фармакокинетических свойств изучаемых лекарственных веществ рассчитывали ряд параметров.
1) Площадь под фармакокинетической кривой "концентрация - время" (AUC) является основным фармакокинетическим параметром и характеризует биологическую доступность лекарственного средства. Данный параметр рассчитывали модельно - независимым методом статистических моментов в программе MicrosoftExcel:
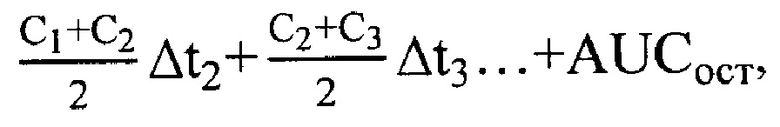
где
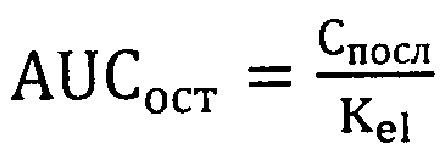
где
Константа элиминации (Kel), характеризующая снижение концентрации препарата на конечном (моноэкспоненциальном) участке фармакокинетической кривой:
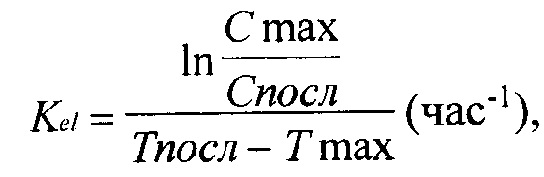
где Cmax и Tmax - максимальная концентрация и время ее достижения, Спосл и Тпосл - последнее значение концентрации и время ее определения.
2) Период полувыведения (Т1/2), отражающий время, в течение которого концентрация ЛВ в крови снижается вдвое:
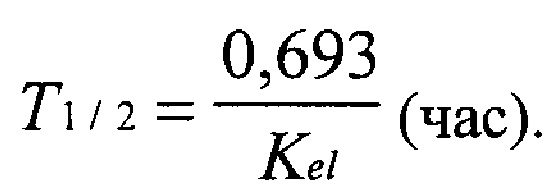
3) Среднее время удерживания, характеризующее среднее время пребывания в организме молекулы препарата (MRT):
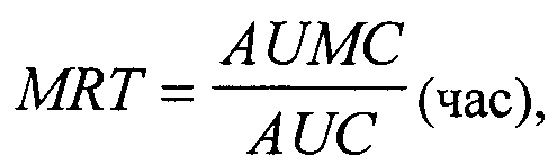
где AUMC - площадь под кривой "произведение времени на концентрацию лекарственного вещества - время".
4) Общий (кажущийся) клиренс (cl), отражающий скорость освобождения от препарата единицы объема биожидкости, как отношение дозы (D) к AUC:
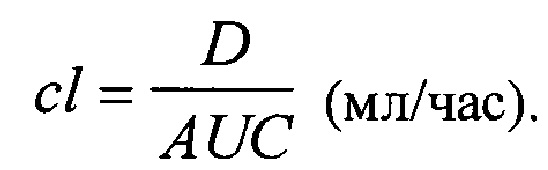
5) Общий (кажущийся) объем распределения (Vd), под которым понимают такой объем, при распределении в котором препарат имел бы ту же концентрацию, что и в плазме крови, как отношение клиренса (cl) к константе элиминации (Kel):
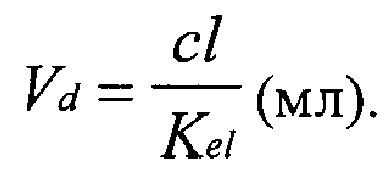
6) Относительная биодоступность рассчитывалась как отношение AUC при пероральном введении ГЛФ к AUC при пероральном введении субстанции изучаемого соединения кроликам.
Для всех данных применялась описательная статистика с использованием подходящих критериев парного или множественного сравнения данных соответствующая Гауссовскому распределению данных, которые представлены в итоговых таблицах.
Тестируемые образцы:
1) Субстанция натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрат) (введение животным перорально в дозе 20,0 мг/кг и взятие проб плазмы крови в течение 5 периодов полувыведения).
2) Композиция в твердой лекарственной форме (введение животным в дозе 20,0 мг/кг в пересчете на действующую субстанцию) и взятие проб плазмы крови в течение 5 периодов полувыведения.
Результаты исследования:
На Фиг. 4 представлен рисунок №1, на котором приведена фармакокинетическая кривая содержания диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрат) в крови кроликов после внутрижелудочного введения композиции готовой лекарственной формы (ГЛФ) в дозе 20,0 мг/кг (в расчете на действующую субстанцию) в сравнении с фармакокинетической кривой, полученной при введении фармацевтической субстанции (ФС), введенной в дозе 20,0 мг/кг в зависимости от времени.
На Фиг. 5 представлена таблица №4, в которой приведены фармакокинетические параметры (М±m) действующего вещества у кроликов при пероральном введении субстанции и композиции твердой лекарственной формы в дозе 20,0 мг/кг.
Таким образом, на основании приведенных данных установлено, что субстанция и композиция готовой лекарственной формы близки по фармакокинетическим профилям. При детальном анализе фармакокинетических параметров композиции ГЛФ в сравнении с субстанцией статистически значимых отличий выявлено не было.
Установлено, что для композиции ГЛФ характерна высокая относительная биодоступность (Фиг. 5, таблица №4).
Фармакодинамические свойства соединения в твердой лекарственной форме
Моделирование экспериментального стрептозотоцинового сахарного диабета
Эксперименты проводили на 75-ти половозрелых крысах-самцах Sprague-Dawley массой 250-320 г, которых содержали в условиях вивария Волгоградского государственного медицинского университета с естественным световым режимом на полнорационной сбалансированной по содержанию питательных веществ диете для лабораторных животных, согласно ГОСТ Р50258-92. Экспериментальный сахарный диабет (ЭСД) моделировали путем однократного внутривенного введения стрептозотоцина («Sigma», США), растворенного в 0,1 М цитратном буфере с рН 4,5 в дозе 45 мг/кг [Kaur, R. Etal. Renoprotective effect of lansoprazole in streptozotocin-induced diabetic nephropathy in wistar rats / R. Kaur, R. Kaur Sodhi, N. Aggarwal, J. Kaur, U.K. Jain // Naunyn-Schmiedeberg's Arch. Pharmacol. 2016. - Vol. 389(1). - PP. 73-85]. Количественное определение глюкозы в крови проводили через сутки после введения цитотоксина и далее еженедельно, в утреннее время, натощак, в течение всего срока эксперимента длительностью 12 недель, с использованием глюкометра «Глюкокард Сигма-Мини» (Россия). В эксперимент брали животных с уровнем глюкозы натощак более 17 ммоль/л. Через неделю после введения стрептозотоцина животных распределяли на группы по 15 крыс. Контрольным группам: интактным животных и крысам с ЭСД вводили воду дистиллированную (1 мл/100 г); опытным группам - изучаемую субстанцию и композицию твердой лекарственной формы натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрат) вводили перорально в дозе 20,0 мг/кг из расчета на действующую субстанцию и вещество сравнения аминогуанидин (50,0 мг/кг). Введение воды дистиллированной и растворов изучаемых веществ осуществляли через интрагастральный зонд ежедневно 1 раз в сутки. Уровень гликозилированного гемоглобина определяли с использованием набора «ДИАБЕТ-ТЕСТ» («Фосфосорб», Россия). Содержание конечных продуктов гликирования (AGEs) в сыворотке крови определяли иммунохимическим методом с помощью наборов реактивов для иммуноферментного анализа RatAGEs ELISA Kit (кат. номер CSB-E09413r) («Cusabio», КНР) на многофункциональном микропланшетном ридере Infinite 200 PRO («Tecan», Австрия) и выражали в мкг/мл сыворотки. Определение растворимости коллагена сухожилий хвоста крыс определяли на многофункциональном микропланшетном ридере Infinite 200 PRO («Tecan», Австрия) по методу [KochakianM., etal. Chronic Dosing With Aminoguanidine and Novel Advanced Glycosylation End Product-Formation Inhibitors Ameliorates Cross-Linking of Tail Tendon Collagen in STZ-Induced Diabetic Rats // M. Kochakian, B.N. Manjula, J.J. Egan / Diabetes. - 1996. - Vol. 45. - PP. 1694-1700.].
Статистическая обработка экспериментальных данных проводилась с расчетом базовых статистических показателей (среднего арифметического М, стандартной ошибки среднего арифметического m, парного t-критерия Стьюдента и непараметрического критерия Манна-Уитни (Mann-Whitney, U-test) с поправкой Бонферрони [Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. - М.: МедиаСфера, 2006. - 312 с.] с использованием пакетов программ Statistica 6,0 («StatSoft», USA), GraphPadPrism 5.0 и MicrosoftExcel (Microsoft, США).
Тестируемые образцы:
1. Субстанция диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрат)) (введение животным перорально в дозе 20,0 мг/кг в течение 3х месяцев).
2. Композиция в твердой лекарственной форме (введение животным перорально в дозах 20,0 мг/кг (из расчета на действующую субстанцию) в течение 3х месяцев).
3. Аминогуанидин (введение животным перорально в дозе 50,0 мг/кг в течение 3х месяцев).
Результаты исследования:
В результате было показано, что после введения стрептозотоцина наблюдали достоверное увеличение уровня глюкозы в крови выше 15 ммоль/л у крыс с ЭСД по отношению к показателям интактных животных. Развитие диабета сопровождалось полидипсией, полиурией, животные были вялы и апатичны. Уровень глюкозы в крови у крыс всех экспериментальных групп с сахарным диабетом оставался достоверно высоким на протяжении всего эксперимента, превышая значения интактной группы животных в среднем в 4,9 раза - 1-й месяц, в 5,8 раза - 2-й месяц, в 5,26 раза - 3-й месяц (р<0,05). Полученные результаты подтверждались статистически значимым увеличением уровня гликированного гемоглобина во всех экспериментальных группах крыс со стрептозотоциновым диабетом длительностью 3 месяца относительно интактных животных в среднем в 2,8 раза (р<0,05).
На Фиг. 6 представлена таблица №5, в которой приведено влияние субстанции диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата), композиции в твердой лекарственной форме и препарата сравнения - аминогуанидина, при внутрижелудочном введении на содержание гликозилированного гемоглобина (HbA1c) у крыс через 3 месяца после развития экспериментального сахарного диабета (М±m), мкг/мл.
Примечание: * - различия статистически значимы относительно показателей Интактного контроля, t-критерий Стьюдента и непараметрический критерий Манна-Уитни (Mann-Whitney, U-test) с поправкой Бонферрони (р<0,05); # - различия статистически значимы относительно показателей ЭСД, t-критерий Стьюдента и непараметрический критерий Манна-Уитни (Mann-Whitney, U-test) с поправкой Бонферрони (р<0,05); ЭСД - экспериментальный сахарный диабет.
Кроме того, формирование конечных продуктов гликирования (КПГ) подтверждалось статистически значимым увеличением их концентрации в сыворотке крови крыс с ЭСД по отношению к интактной группе на 45,9%, а растворимость коллагена хвоста при этом в группе ЭСД снижалась на 38,9% (р<0,05) относительно интактного контроля.
На Фиг. 7 представлена таблица №6, в которой приведено влияние субстанции диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата (Натрия 3,8-диэтоксикарбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата), композиции в твердой лекарственной форме и препарата сравнения - аминогуанидина, при внутрижелудочном введении на содержание КПГ в крови крыс через 3 месяца после развития экспериментального сахарного диабета (М±m), мкг/мл.
Примечание: * - различия статистически значимы относительно показателей Интактного контроля, t-критерий Стьюдента и непараметрический критерий Манна-Уитни (Mann-Whitney, U-test) с поправкой Бонферрони (p<0,05); # - различия статистически значимы относительно показателей ЭСД, t-критерий Стьюдента и непараметрический критерий Манна-Уитни (Mann-Whitney, U-test) с поправкой Бонферрони (р<0,05); ЭСД - экспериментальный сахарный диабет.
Введение фармацевтической субстанции диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата (Натрия 3,8-диэтокси-карбонил-4-оксо-4Н-1,2,4-триазоло[5,1-с][1,2,4]триазинид моногидрата) и композиции готовой лекарственной формы внутрижелудочноприводилок значимому уменьшению содержания гликозилированного гемоглобина на 51,5% и 49,8% (р<0,05), препарат сравнения аминогуанидин снижал HbA1c на 37,9% (р<0,05) по отношению к группе ЭСД (Фиг. 6). Изучаемые субстанция и композиция готовой лекарственной формы снижали концентрацию КПГ по отношению к показателю животных с ЭСД на 21,9% и 34,6% (р<0,05) соответственно, а препарат сравнения аминогуанидин снижал КПГ на 24,3% относительно крыс с ЭСД (Фиг. 7). Под влиянием субстанции и композиции готовой лекарственной формы у крыс с ЭСД несколько повышалась растворимость коллагена хвоста на 9,1% и 8,07% соответственно, препарат сравнения аминогуанидин повышал растворимость коллагена хвоста на 29,8% (р<0,05) относительно группы ЭСД.
Таким образом, на основании приведенных данных установлено, что субстанция и композиция готовой лекарственной формы близки по фармакодинамическим свойствам.
Следовательно, предлагаемая композиция в твердой лекарственной форме (капсулы), действующая на конечные продукты гликирования коллагена (AGE), может быть использована как средство для профилактики и лечения осложнений сахарного диабета.
Изобретение иллюстрируется следующими примерами.
Пример 1. Субстанция натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат - 970,0 г увлажняется 10% водным раствором поливинилпирролидона К30, добавляемым в количестве 220,0 г. Затем влажная масса гранулируется через сетку с размером отверстий 3,0 мм, влажный гранулят сушат при температуре не выше 40°С до остаточной влажности не выше 2%. Высушенный гранулят протирают сквозь сетку с диаметром отверстий 1 мм и опудривают 8,0 г магния стеарата, получается около 1 кг готовой капсулируемой массы.
Массу капсулируют на ручной капсулонаполняющей машинке «Optima 300» с использованием капсул размера №1 вместимостью 0,5 см3. Средняя масса содержимого капсулы 0,309±7,5% г, содержание активной субстанции 300 мг. Из 1 кг массы для капсулирования получают 3200 капсул.
Пример 2. Субстанция натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрат - 970,0 г увлажняется 10% водным раствором пласдона К 29/32, добавляемым в количестве 220,0 г. Затем влажная масса гранулируется через сетку с размером отверстий 3,0 мм, влажный гранулят сушат при температуре не выше 40°С до остаточной влажности не выше 2%. Высушенный гранулят протирают сквозь сетку с диаметром отверстий 1 мм и опудривают 8,0 г магния стеарата, получается около 1 кг готовой капсулируемой массы.
Массу капсулируют на ручной капсулонаполняющей машинке «Optima 300» с использованием капсул размера №3 вместимостью 0,30 см3. Средняя масса содержимого капсулы 0,206±10% г, содержание активной субстанции 200 мг. Из 1 кг массы для капсулирования получают 4850 капсул.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАТРИЕВАЯ СОЛЬ ДИЭТИЛОВОГО ЭФИРА 4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-C]-1,2,4-ТРИАЗИН-3,8-ДИКАРБОНОВОЙ КИСЛОТЫ, МОНОГИДРАТ | 2015 |
|
RU2612300C1 |
| НАТРИЕВАЯ СОЛЬ 3-НИТРО-4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-8-КАРБОНОВОЙ КИСЛОТЫ, ДИГИДРАТ | 2016 |
|
RU2641107C1 |
| ПРИМЕНЕНИЕ НАТРИЕВОЙ СОЛИ ДИЭТИЛОВОГО ЭФИРА 4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-С]-1,2,4-ТРИАЗИН-3,8-ДИКАРБОНОВОЙ КИСЛОТЫ, МОНОГИДРАТА В КАЧЕСТВЕ СРЕДСТВА ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА | 2019 |
|
RU2765117C2 |
| 2-(5-НИТРОНИЛФУРАН-2-ИЛ)-5-МЕТИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-А]ПИРИМИДИН-7(4Н)-ОН И ЕГО СОЛИ | 2018 |
|
RU2716715C2 |
| Способ получения высококонцентрированного раствора риамиловира | 2024 |
|
RU2830367C1 |
| 3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2668971C1 |
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛТИО-6-ЦИАНО-1,2,4-ТРИАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-7(4Н)-ОНА, ТРИГИДРАТ | 2015 |
|
RU2607628C1 |
| БИС[1,2,4]ТРИАЗОЛО[4,3-b:3',4'-f][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ, АНТИГЛИКОКСИДАЦИОННОЙ И АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2755897C1 |
| Этиловый эфир 2-(адамантан-1-ил)-3-бром-7-оксо-4,7-дигидропиразоло[1,5-a]пиримидин-6-карбоновой кислоты, обладающий противовирусным действием в отношении коронавируса SARS-CoV-2 | 2024 |
|
RU2839407C1 |
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛТИО-6-НИТРО-1,2-4-ТРИАЗОЛО[5,1-C]-1,2,4-ТРИАЗИН-7(4H)-ОНА, ДИГИДРАТ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2294936C1 |
Изобретение относится к медицине, а именно к фармакологии и фармации и касается производства лекарственного средства антигликирующего действия. Таким средством является фармацевтическая композиция в твердой лекарственной форме для перорального введения, содержащая в качестве активного компонента натриевую соль диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты, моногидрата при следующем соотношении компонентов, масс. %: натриевая соль диэтилового эфира 4-оксо-1,4 дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата 95-97,0%; пласдонК 29/32 1-5%; магния стеарат не более 1%. Композиция обеспечивает антигликирующее действие за счет ингибирующего влияния на конечные продукты гликирования коллагена. 2 н. и 1 з.п .ф-лы, 7 ил., 2 пр.
1. Фармацевтическая композиция антигликирующего действия в виде твердой дозированной лекарственной формы , характеризующаяся тем, что в качестве активного компонента содержит субстанцию натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата, при следующем соотношении компонентов, масс. %:
2. Способ получения фармацевтической композиции антигликирующего действия, включающий' измельчение и просеивание субстанции и вспомогательных веществ, увлажнение субстанции натриевой соли диэтилового эфира 4-оксо-1,4-дигидропиразоло[5,1-с]-1,2,4-триазин-3,8-дикарбоновой кислоты моногидрата раствором ВМВ из ряда производных поливинилпирролидона, гранулирование влажной массы, сушку, дробление и ситовую калибровку высушенных гранул, опудривание антифрикционными агентами, выбранными из ряда стеаратов, и фасовку полученной сухой массы в желатиновые капсулы.
3. Способ по п. 2, характеризующийся тем, что фармацевтическая композиция, обладающая антигликирующей активностью, выполнена в форме желатиновой капсулы для перорального приема.
| ПРИМЕНЕНИЕ ГЕТЕРОЦИКЛИЧЕСКИХ ГИДРАЗОНОВ В КАЧЕСТВЕ СРЕДСТВ, ОБЛАДАЮЩИХ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2658819C2 |
| Одновальный, снабженный дробителем, торфяной пресс | 1919 |
|
SU261A1 |
| Применение азопроизводных фенилсульфокислот в качестве ингибиторов образования конечных продуктов гликирования | 2016 |
|
RU2628605C1 |
| JP 2008056576,13.09.2008 | |||
| КУЗНЕЦОВА В.А | |||
| и др | |||
| Метод оценки антигликирующей активности in vitro новых веществ | |||
| Волгоградский научно-медицинский журнал, 2014, 3, с.50-51. | |||
Авторы
Даты
2020-12-17—Публикация
2019-07-15—Подача