Область, к которой относится изобретение
Настоящее изобретение относится к способам идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, а также к способам лечения таких индивидуумов. Кроме того, настоящее изобретение относится к способу предсказания или определения прогноза у индивидуума с раком.
Предшествующий уровнь техники
Среди наиболее перспективных способов активизации терапевтического противоопухолевого иммунитета является блокада иммунных сверочных точек. Иммунные сверочные точки представляют собой пути ингибирования иммунной системы, которые играют важную роль в сохранении аутотолерантности и модуляции длительности и амплитуды физиологических иммунных ответов в периферических тканях для минимизации коллатерального повреждения ткани. Уже очевидно, что опухоли используют определенные пути иммунных сверочных точек в качестве основного механизма иммуннорезистентности, особенно в отношении Т-клеток, которые являются специфичными к опухолевым антигенам. Поскольку многие из иммунных сверочных точек инициируется посредством лиганд-рецепторных взаимодействий, то они могут легко блокироваться антителами или модулироваться рекомбинантными формами лигандов или рецепторов.
Современные подходы к регуляции иммунных сверочных точек при раковых заболеваниях, до некоторой степени, основаны лишь на догадках и интуиции, исходя, главным образом, из той последовательности, в которой эти соединения были применены. CTLA4, PD-1 и PDL1 были открыты и получены в указанном порядке, и в таком же порядке они и использовались до сих пор. Первые испытания были проведены с использованием CTLA-4, так как они были первыми, которые были одобрены FDA. Впоследствии, было одобрено и проведено лечение с использованием PD-1/PDL1.
В WO 2015/103037 описан способ идентификации индивидуума, который может реагировать на лечение с использованием модулятора иммунных сверочных точек, и этот способ основан на обнаружении того факта, что раковые клетки могут иметь соматические мутации, которые приводят к образованию неоэпитопов, распознаваемых иммунной системой пациента как «не свое». Идентификация одного или более неоэпитопов в образце раковой опухоли может быть использована для определения раковых пациентов, благоприятно реагирующих на лечение модулятором иммунных сверочных точек.
Сущность изобретения
Авторами настоящего изобретения было сделалано важное и неожиданное обнаружение того, что раковые пациенты с более высоким числом клональных неоантигенов и/или с более высоким отношением клональных:субклональных неоантигенов или с низкой фракцией субклональных неоантигенов с большей вероятностью будут реагировать на лечение с использованием иммунных сверочных точек.
Как показано в примерах настоящего изобретения, пациенты с опухолями, имеющими высокую клональную неоантигенную нагрузку или низкую субклональную неоантигенную нагрузку, лучше реагируют на иммунотерапию посредством блокады сверочных точек (например, анти-PD1 терапию). Это является важным вкладом в науку, который открывает новые возможности для разработки улучшенных и более целенаправленных методов лечения и профилактики рака. В соответствии с этим, терапевтические и профилактические меры могут быть направлены на конкретного индивидуума и на конкретный тип рака.
Кроме того, авторами настоящего изобретения было неожиданно обнаружено, что опухолевые клетки с высоким числом клональных неоантигенов обладают аналогичными профилями экспрессии молекул иммунных сверочных точек, то есть они демонстрируют общий профиль экспрессии молекул иммунных сверочных точек. Это является важным вкладом в науку, так как ранее не сообщалось, что раковые заболевания конкретных типов имеют конкретные профили экспрессии молекул иммунных сверочных точек. Такой вывод был сделан авторами настоящего изобретения впервые, и этот вывод облегчает разработку более целенаправленных подходов к лечению или профилактике конкретных видов рака.
Авторами настоящего изобретения также было неожиданно обнаружено, что у пациентов с более высоким числом клональных мутаций и более высоким отношением клональных:субклональных мутаций, улучшается прогноз.
Следовательно, целью настоящего изобретения является разработка новых, альтернативных и/или более эффективных способов лечения и профилактики рака.
В соответствии с этим, настоящее изобретение относится к способу идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, где указанный способ включает:
(i) определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума; и/или
(ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более чем одной раковой клетке у указанного индивидуума; и/или
(iii) определение профиля экспрессии молекул иммунных сверочных точек в раковых клеток и/или в опухоль-инфильтрирующих иммунных клетках указанного индивидуума или типа опухоли,
где более высокое число клональных неоантигенов, и/или более высокое отношение клональных:субклональных неоантигенов, или более низкая (или низкая) фракция субклональных неоантигенов и/или дифференциальная экспрессия молекул иммунных сверочных точек по сравнению с контрольным образцом являются показателем ответа на лечение с использованием иммунных сверочных точек.
В другом своем аспекте, настоящее изобретение относится к способу предсказания или определения прогноза у индивидуума с раком, где указанный способ включает:
(i) определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума; и/или
(ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более чем одной раковой клетке у указанного индивидуума,
где более высокое число клональных неоантигенов и/или более высокое отношение клональных:субклональных неоантигенов, или более низкая (или низкая) фракция субклональных неоантигенов являются показателем улучшения прогноза.
В другом своем аспекте, настоящее изобретение относится к способу лечения или профилактики рака у индивидуума, где указанный способ включает следующие стадии:
i) идентификацию индивидуума с раком, который является подходящим для лечения с использованием иммунных сверочных точек в соответствии со способом согласно изобретению; и
ii) лечение указанного индивидуума с использованием иммунных сверочных точек.
В еще одном своем аспекте, настоящее изобретение относится к способу лечения или профилактики рака у индивидуума, который включает лечение индивидуума, страдающего раком, с использованием иммунных сверочных точек, где индивидуум был идентифицирован как индивидуум, имеющий:
(i) более высокое число клональных неоантигенов; и/или
(ii) более высокое отношение клональных:субклональных неоантигенов или более низкую (или низкую) фракцию субклональных неоантигенов; и/или
(iii) дифференциальную экспрессию молекулы иммунных сверочных точек по сравнению с контрольным образцом.
Настоящее изобретение также относится к применению иммунных сверочных точек в способе лечения или профилактики рака у индивидуума, где указанный способ включает:
i) идентификацию индивидуума с раком, который является подходящим для лечения с использованием иммунных сверочных точек в соответствии со способом согласно изобретению; и
ii) лечение указанного индивидуума с использованием иммунных сверочных точек.
Настоящее изобретение также относится к применению иммунных сверочных точек для лечения или профилактики рака у индивидуума, где индивидуум имеет:
(i) более высокое число клональных неоантигенов; и/или
(ii) более высокое отношение клональных:субклональных неоантигенов или более низкую (или низкую) фракцию субклональных неоантигенов; и/или
(iii) дифференциальную экспрессию молекулы иммунных сверочных точек по сравнению с контрольным образцом.
Описание чертежей
Фигура 1: (A) Вся предполагаемая неоантигенная нагрузка в группе с опухолями АКЛ (аденокарциномы легких) по TCGA. Показана часть неоантигенов, происходящих от клональных (синий) или субклональных (красный) мутаций или неоантигенов неопределенной клональности (серый). (В) Общие кривые продолжительности жизни для пациентов с опухолями, имеющими высокую неоантигенную нагрузку, определенную как верхний квартиль для группы (n=30), по сравнению с остальной частью группы (n=86) (логранговая величина P=0,011), (С) высокая клональная неоантигенная нагрузка, определенная как верхний квартиль для группы (n=29) по сравнению с остальной частью группы (n=87) (логранговая величина P=0,0077) и (D) высокая субклональная неоантигенная нагрузка, определенная как верхний квартиль для группы (n=30) по сравнению с остальной частью группы (n=86) (логранговая величина Р=0,12). (Е) Дифференциально экспрессированные гены опухолей с высокой клональной неоантигенной нагрузкой и низкой клональной неоантигенной нагрузкой, определяемые как нижняя квартиль для группы, кластеризованной по коэкспрессии. Кластеры иммунных генов выделены в тексте рамкой.
Фигура 2: А) Филогенетические деревья для L011 и L012 с длиной стволов и ветвей, пропорциональной числу не-молчащих мутаций. В) Предполагаемые неоантигены, предсказанные для всех миссенс-мутаций у L011. Неоантиген MTFR2D326Y (FAFQEYDSF) выделен. С) Предполагаемые неоантигены, предсказанные для всех миссенс-мутаций у L012. Показаны неоантиген CHTF18 L769V (LLLDIVAPK) и неоантиген MYADMR30W (SPMIVGSPW). D, Е) MHC-мультимерный анализ in vitro размноженных CD8+-T-лимфоцитов, происходящих от трех опухолевых областей и нормальных тканей для L011 (D) и L012 (E). В обоих случаях указана частота СD3+CD8+-T-лимфоцитов, реагирующих с мутантными пептидами.
Фигура 3: А) МНС-мультимерный анализ неразмноженных CD8+-T-клеток от опухолевых областей 1-3, смежной нормальной легочной ткани и МКПК от пациента L011 (верхняя панель) и L012 (нижняя панель). Показана частота МНС-мультимер-позитивных клеток за пределами СD3+CD8+-компартмента. В) Иммунофенотип опухоль-инфильтрующих CD8+-T-клеток от пациента L011, где MTFR2-реактивные CD8+-T-клетки (MTFR2+) сравниваются с МНС-мультимер- негативными CD8+-T-клетками (MTFR2-) в той же области опухоли, в нормальной ткани и в МКПК. Данные показаны для опухолевой области 3 и эти данные являются репрезентативными для всех областей. Показан процент клеток, экспрессирующих CTLA-4, PD-1, LAG-3, Ki-67 и GzmB. С) Соэкспрессия PD-1, Ki67 и GzmB на MTFR2- реактивных (MTFR2 +) и нереактивных CD8+-T-клетках (MTFR2-). D) Верхняя панель: Многоцветная ИГХ первичной опухоли от L011 и L012. Показаны CD8 (красный), гранзим В (синий) и LAG-3 (коричневый). Нижняя панель: PD-L1-окрашивание в области 3 у L011 по сравнению с нормальной тканью.
Фигура 4: Для идентифицированной (A-C) и оцениваемой группы (D-F), количество клональных неоантигенов и фракция субклональных неоантигенов показаны для пациентов с длительным клиническим эффектом (DCB) или с коротким эффектом (NDB). Продолжительность жизни индивидуумов без прогрессирования опухолей с более высоким числом неоантигенов и меньшей субклональной фракцией по сравнению с индивидуумами, у которых имеется меньшее число неоантигенов или большая субклональная фракция, показаны для идентифицированной (C) и оцениваемой группы (F). G) Клональная архитектура каждой секвенированной опухоли. PFS указаны под гистограммой, и указано число выживших индивидуумов без прогрессирования опухоли, помеченное +. PD-L1 указан под гистограммой: Сильное (+) 50% мембранное окрашивание; Слабое (+/-), 1-49% мембранное окрашивание; отсутствие (-), <1% мембранное окрашивание; не определено (?). (Н) выживаемость без прогрессирования заболевания в комбинированной группе с опухолью сравнивают для групп с опухолями, имеющими более высокое число неоантигенов и меньшую субклональную фракцию, и с опухолями, имеющими меньшее число неоантигенов или большую субклональную фракцию. I) Клональная архитектура образца опухоли CA9903 с HERC1-мутациями выделена и указана вместе с субклонами. J) Предполагаемые неоантигены, предсказанные для всех миссенс-мутаций в CA9903. Неоантиген HERC1P3278S (ASNASSAAK) выделен.
Фигура 5: Уменьшение квартиля продолжительности жизни у пациентов с АКЛ. В целом, показаны кривые продолжительности жизни, иллюстрирующие все четыре квартиля, сравниваемые у пациентов с общей неоантигенной нагрузкой (A), клональной неоантигенной нагрузкой (В) и субклональной неоантигенной нагрузкой (С). Ассоциированные логранговые р-величины между каждым квартилем указаны справа от графиков.
Фигура 6: Продолжительность жизни по числу SNV при АКЛ. (B) Кривые общей продолжительности жизни пациентов, несущих опухоли с высокой SNV-нагрузкой (n=30) по сравнению с остальными группами (n=86) (логранговая величина P=0,01), (С) с высокой клональной SNV-нагрузкой (n=30) по сравнению с остальными группами (n=86) (логранговая величина P=0,014) и (D) с высокой субклональной SNV-нагрузкой (n=30) по сравнению с остальными группами (n=86) (логранговая величина Р=0,14).
Фигура 7: Систематизированные данные для группы с ПККЛ (плоскоклеточной карциномой легких). (A) Вся предполагаемая неоантигенная нагрузка в группе с опухолями у пациентов с ПККЛ по TCGA. В цветных столбцах показана часть неоантигенов, происходящих от клональных (синий) или субклональных (красный) мутаций, или неоантигенов неопределенной клональности (серый). (В) Общие кривые продолжительности жизни для пациентов с высокой неоантигенной нагрузкой (n=30) по сравнению с группой, имеющей низкую неоантигенную нагрузку (n=91) (логранговая величина P=0,84), (С) высокую клональную неоантигенную нагрузку (n=29) по сравнению с группой, имеющей низкую клональную неоантигенную нагрузку (n=92) (логранговая величина P=0,99), и (D) высокую субклональную неоантигенную нагрузку (n=30) по сравнению с группой, имеющей низкую субклональную неоантигенную нагрузку (n=91) (логранговая величина P=0,32). (Е) Кривые общей продолжительности жизни пациентов, несущих опухоли с высокой SNV-нагрузкой (n=30) по сравнению с остальными группами (n=90) (логранговая величина P=0,52), (F) с высокой клональной SNV-нагрузкой (n=30) по сравнению с остальными группами (n=91) (логранговая величина P=0,89) и (G) с высокой субклональной SNV-нагрузкой SNV (n=30) по сравнению с остальными группами (n=92) (логранговая величина Р=0,28).
Фигура 8: Анализ на дифференциальную экспрессию генов. Дифференциально экспрессированные гены у пациентов с высокой клональной неоантигенной нагрузкой и у остальных пациентов в группе, кластеризованной по коэкспрессии.
Фигура 9: Иммунофенотип опухоль-инфильтрирующих CD8+-T-клеток от пациента L012. (А) Активация и функциональный фенотип опухоль-инфильтрирующих CD8+CHTF18-реактивных (CHTF18+) и MYADM-реактивных (MYADM+) Т-клеток по сравнению с МНС-мультимер-негативными CD8+-T-клетками в опухоли (мультимер-), в нормальной ткани и в МКПК. Показан процент клеток, экспрессирующих CTLA-4, Pd-1, LAG-3, Ki-67 и GzmB. Гистограммы были построены по данным для L012, области 2, и эти данные были репрезентативными для всех опухолевых областей. (В) Коэкспрессия PD-1, Ki67 и гранзима В на опухоль-инфильтрирующих CD8+CHTF18-реактивных (CHTF18+) и MYADM-реактивных (MYADM+) Т-клетках по сравнению с опухоль-инфильтрирующими МНС-мультимер-негативными CD8+-T-клетками (мультимер-). (С) Размноженные in vitro опухоль-инфильтрирующие CD8+-T-клетки окрашивали MHC-мультимерами, нагруженными либо мутантными пептидами, либо пептидами дикого типа, и анализировали с помощью проточной цитометрии. Показан процент MHC-мультимер-позитивных клеток в CD3+CD8+-окне возбуждения. L011 (верхняя панель): Размноженные CD8+-T-клетки из опухолей области 1 распознают мутантный MTFR2, но не MTFR2 дикого типа. L012 (средняя панель): Размноженные CD8+-T-клетки из опухолей области 2 распознают мутантный CHTF18, но не CHTF18 дикого типа. L012 (нижняя панель): Размноженные CD8+-T-клетки из опухолей области 2 распознают мутантный MYADM и MYADM дикого типа. Мутация в MYADM находится на якорном остатке, который влияет, главным образом, на HLA-связывание, но не на распознавание Т-клеток. Хотя полученные данные позволяют предположить, что Т-клетки у этого пациента могут распознавать мутантные пептиды и пептиды дикого типа (после стабилизации в MHC-мультимерной системе согласно изобретению), однако, очень низкая аффинность пептида дикого типа препятствует адекватной презентации in vivo. (D) Подтверждение связывания МНС-мультимера BV650 и PE-Cy7 с размноженными опухоль-инфильтрирующими лимфоцитами от L011 и L012. Для подтверждения качества реагентов, используемых для характеризации MTFR2-, MYADM- и CHTF18-реактивных Т-клеток в неразмноженных образцах опухоли, авторами были использованы те же самые реагенты для окрашивания большего количества размноженных TIL. Данные для L011 (левая панель) и L012 (правая панель) указывают на точные и определенные популяции MTFR2-, MYADM- и CHTF18-реактивных Т-клеток в размноженных TIL.
Фигура 10: Мутационная нагрузка и клональная архитектура опухолей для (А) идентифицированной группы и (В) оцениваемой группы.
Фигура 11: Экспрессия PD-L1 в опухолях двух групп. PD-L1 значительно сильнее экспрессируется в опухолях, несущих высокую клональную неоантигенную нагрузку и низкую субклональную нео- антигенную фракцию по сравнению с опухолями, несущими низкую клональную неоантигенную нагрузку или высокую субклональную неоантигенную фракцию.
Фигура 12: А) Число предсказанных клональных мутаций в опухолях идентифицированной группы пациентов с длительным клиническим эффектом (DCB) или с коротким клиническим эффектом (NDB). В) Субклональная фракция в опухолях у пациентов с DCB или NDB. С) Продолжительность жизни без прогрессирования идентифицированных опухолей с более высоким числом клональных мутаций и низкой субклональной фракцией по сравнению с опухолями, имеющими меньшее число клональных мутаций или высокую субклональную фракцию. D) Число предсказанных клональных мутаций в оцениваемых опухолях у группы пациентов с DCB или с NDB. Е) субклональная фракция в опухолях обследуемых пациентов с DCB или NDB. F) Продолжительность жизни без прогрессирования оцениваемых опухолей с более высоким числом клональных мутаций и низкой субклональной фракцией по сравнению с опухолями, имеющими меньшее число клональных мутаций или высокую субклональную фракцию. G) Число клональных и субклональных мутаций для каждой секвенированной опухоли с клонами (темная штриховка) и субклонами (светлая штриховка), представленными на гистограмме. Заштрихованные гистограммы соответствуют клиническому эффекту: DCB, зеленый; NDB, красный. PFS указаны под гистограммой и относятся к продолжительности жизни без прогрессирования заболевания, где эти PFS помечены +. PD-L1 указан под гистограммой: Сильное (+) 50% мембранное окрашивание; слабое (+/-) 1-49% мембранное окрашивание; отсутствие (-), 1% мембранное окрашивание; не определено (?), не оценивали. (Н) Продолжительность жизни без прогрессирования заболевания в комбинированной группе с опухолью сравнивают для групп с опухолями, имеющими большее число клональных мутаций и небольшую субклональную фракцию, и с опухолями, имеющими меньшее число клональных мутаций или высокую субклональную фракцию.
Подробное описание изобретения
«Неоантиген» представляет собой опухоль-специфический антиген, который продуцируется в результате мутации в раковых клетках. Таким образом, неоантиген не экспрессируется здоровыми клетками у индивидуума.
Описанный здесь неоантиген может продуцироваться посредством любой не-молчащей мутации, которая модифицирует белок, экспрессируемый раковыми клетками, по сравнению с немутированным белком, который экспрессируется здоровыми клетками дикого типа. Так, например, мутированный белок может быть транслоцированным или гибридным.
«Мутация» означает изменение в нуклеотидной последовательности (например, ДНК или РНК) в опухолевой клетке по сравнению со здоровой клеткой от того же самого индивидуума. Различие в нуклеотидных последовательностях может приводить к экспрессии белка, который не экспрессируется здоровми клетками того же самого индивидуума.
Так, например, мутация может представлять собой один нуклеотидный вариант (SNV), множество нуклеотидных вариантов, делеционную мутацию, инсерционную мутацию, транслокацию, миссенс-мутацию или мутацию в сайте сплайсинга, приводящую к модификации аминокислотной последовательности (кодирующую мутацию).
Эти мутации могут быть идентифицированы путем секвенирования экзома, секвенирования РНК, секвенирования всего генома и/или секвенирования всей панели генов и/или рутинного секвенирования одиночных генов по Сэнгеру. Подходящие способы известны специалистам.
Описание секвенирования экзома и секвенирования РНК приводится в публикациях Boa et al. (Cancer Informatics. 2014; 13(Suppl 2):67-82.) и Ares et al. (Cold Spring Harb Protoc. 2014 Nov 3;2014(11):1139-48); соответственно. Описание секвенирования панели генов-мишеней можно найти, например, в публикациях Kammermeier et al. (J. Med. Genet. 2014 Nov; 51 (11):748-55) и Yap KL et al. (Clin Cancer Res. 2014. 20:6605). См., также Meyerson et al., Nat. Rev. Genetics, 2010 и Mardis, Annu Rev Anal Chem, 2013. Панели для секвенирования генов-мишеней также является коммерчески доступными (например, они кратко описаны на сайте Biocompare((http://www.biocompare.com/Editorial-Articles/161194-Build-Your-Own-Gene-Panels-with-These-Custom-NGS-Targeting-Tools/)).
Выравнивание последовательностей для идентификации нуклеотидных различий (например, SNV) в ДНК и/или РНК в образце опухоли по сравнению с ДНК и/или РНК в неопухолевом образце может быть осуществлено с применением способов, известных специалистам. Так, например, нуклеотидные модификации по сравнению с контрольным образцом, могут быть введены методом, описанным Koboldt и др. (Genome Res. 2012; 22: 568-576). Контрольный образец может представлять собой последовательность ДНК и/или РНК зародышевой линии.
Клональные неоантигены
Авторами настоящего изобретения было определено, что внутриопухолевая гетерогенность (ITH) может приводить к различию между неоантигенами, экспрессируемыми в различных областях опухоли и между различными клетками в опухоли. В частности, авторами настоящего изобретения было установлено, что в опухоли, некоторые неоантигены экспрессируются во всех областях, а по существу, во всех клетках опухоли, тогда как другие неоантигены, экспрессируются только в субсерии опухолевых областей и клеток.
По существу, «клональный» или «стволовой» неоантиген представляет собой неоантиген, который эффективно экспрессируется во всей опухоли и кодируется почти в каждой опухолевой клетке. «Субклональный» или «разветвленный» неоантиген представляет собой неоантиген, который экспрессируется в субсерии или в части клеток или областей в опухоли.
Используемое здесь словосочетание «по существу все» относится к большинству опухолевых клеток у индивидуума. Так, например, у индивидуума может присутствовать 60-100% клеток, например, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% опухолевых клеток.
Термины «присутствует во всей опухоли», «эффективно экспрессируется во всей опухоли» и «кодируется почти в каждой клетке опухоли» могут означать, что клональный неоантиген экспрессируется во всех областях опухоли, образцы которых были проанализированы.
Следует иметь в виду, что для того, чтобы определить, что мутация «кодируется почти в каждой опухолевой клетке», проводят статистический расчет и, следовательно, статистический анализ и оценку пороговых величин.
Аналогичным образом, чтобы определить, что клональный неоантиген «эффективно экспрессируется во всей опухоли», проводят статистический расчет, и следовательно, статистический анализ и оценку пороговых величин.
Выражение «эффективно экспрессируется почти в каждой опухолевой клетке или почти во всех опухолевых клетках» может означать, что мутация присутствует во всех опухолевых клетках, проанализированных в образце, как было определено с применением соответствующих статистических методов.
Так, например, для того, чтобы определить, являются ли мутации клональными или разветвленными, может быть использована фракция раковых клеток (CCF), содержащая часть раковых клеток, имеющих мутацию. Так, например, фракция раковых клеток может быть определена путем объединения частот аллельных вариантов с числом копий, и оценки чистоты, как описано Ландау и др. (Cell, 2013, Feb. 14; 152 (4):714-26).
Короче говоря, значения CCF вычисляют для всех мутаций, определенных для всех и каждой области опухоли, которые были проанализированы. Если используется только одна область (т.е. только один образец), то будет получена только одна серия величин CCF. Это дает информацию о том, какие мутации присутствуют во всех опухолевых клетках в этой области, и таким образом позволяет определить, является ли мутация клональной или разветвленной. Все субклональные мутации (т.е. CCF <1) в области опухоли определены как разветвленные, а клональные мутации с CCF=1 определены как клональные.
Как указывалось выше, для определения клональной мутации проводят статистический анализ и оценку пороговой величины. Таким образом, мутация может быть идентифицирована как клональная, если было определено, что она имееет CCF с 95% доверительным интервалом ³0,60, например, 0,65, 0,70, 0,75, 0,80, 0,85, 0,90, 0,95, 1,00 или >1,00. И наоборот, мутация может быть идентифицирована как разветвленная, если было определено, что она имееет CCF с 95% доверительным интервалом ≤0,60, например, 0,55, 0,50, 0,45, 0,40, 0,35, 0,30, 0,25, 0,20, 0,15, 0,10, 0,05 или 0,01 в любом анализируемом образце.
Следует отметить, что точность метода идентификации клональных мутаций повышается путем идентификации клональных мутаций для более чем одного образца, выделенного из опухоли.
Образцы опухоли
Взятие биоптатов и образцов опухоли осуществляется в соответствии со стандартной практикой и может быть проведено любым подходящим методом, известным специалистам.
Способ согласно этому аспекту может включать, например, определение мутаций, присутствующих в раковых клетках одной или более областей опухоли, выделенных из этой опухоли. Так, например, могут быть определены мутации, присутствующие в одном биоптате или, альтернативно, по меньшей мере в двух, по меньшей мере в трех, по меньшей мере в четырех, по меньшей мере в пяти, по меньшей мере в шести, по меньшей мере в семи, по меньшей мере в восьми, по меньшей мере в девяти или по меньшей мере в десяти или более биоптатах, выделенных из опухоли.
Отдельные образцы опухоли могут быть выделены из различных областей, расположенных по всей опухоли в первичном участке или между первичным участком и метастазами или в метастазах или между метастазами. Так, например, определение мутаций, присутствующих в опухолях, которые, как известно, обнаруживают морфологически отличающуюся гистологию в различных областях, может включать определение мутаций, присутствующих в ряде отдельных образцов, выделенных из морфологически отличающихся областей.
Образец может представлять собой пробу крови. Так, например, проба крови может включать циркулирующую ДНК опухоли, циркулирующие опухолевые клетки или экзосомы, содержащие опухолевую ДНК.
Индивидуум, подходящий для лечения
Настоящее изобретение относится к способу идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, где указанный способ включает определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума, где высокое число клональных неоантигенов является показателем ответа на лечение с использованием иммунных сверочных точек.
Используемый здесь термин «подходящий для лечения» может относиться к индивидууму, который более вероятно окажется восприимчивым к лечению с использованием иммунных сверочных точек, или который является кандидатом на лечение с использованием иммунных сверочных точек. Индивидуум, подходящий для лечения, скорее всего будет более восприимчивым к указанному лечению, чем индивидуум, который, как было определено, является не подходящим для лечения согласно изобретению. Индивидуум, который, как было определено, является подходящим для лечения согласно изобретению, может продемонстрировать длительный клинический эффект (DCB), который может быть определен как частичный ответ или стабилизация заболевания, продолжающиеся в течение по меньшей мере 6 месяцев, после начала лечения с использованием иммунных сверочных точек.
Число клональных неоантигенов, идентифицированных или предсказанных в раковых клетках, полученных от индивидуума, можно сравнить с одной или более заранее определенными пороговыми величинами. С использованием таких пороговых величин, индивидуумы могут быть стратифицированы по категориям, которые являются показателем степени восприимчивости к лечению.
Пороговая величина может быть определена по отношению к контрольной группе раковых пациентов. Группа может включать 10, 25, 50, 75, 100, 150, 200, 250, 500 или более раковых пациентов. Такой группой может быть любая группа раковых пациентов. Альтернативно, все пациенты могут иметь раковое заболевание соответствующего или специфического типа, рассматриваемого в настоящей заявке.
В одном из вариантов осуществления изобретения, «высокое» число клональных неоантигенов означает число, превышающее медианное значение клональных неоантигенов, предсказанное в контрольной группе раковых пациентов, такое как минимальное число клональных неоантигенов, которое, как было предсказано, входит в верхний квартиль контрольной группы.
В другом варианте осуществления изобретения, «высокое» число клональных неоантигенов может быть определено как 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 или более клональных неоантигенов.
Специалисту в данной области будет очевидно, что «высокое» или «более высокое» число клональных неоантигенов может зависеть от конкретных условий и может быть определено с помощью соответствующего анализа.
Настоящее изобретение также относится к способу идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, где указанный способ включает определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более, чем одной раковой клетке у индивидуума, где высокое отношение клональных:субклональных неоантигенов или более низкая/низкая фракция субклональных неоантигенов является показателем восприимчивости к лечению с использованием иммунных сверочных точек.
Как указывалось выше, отношение клональных:субклональных неоантигенов может зависеть от группы индивидуумов, то есть, индивидуумов, страдающих каким-нибудь любым раковым заболеванием или релевантным/конкретным раковым заболеванием. Соответственно, отношение клональных:субклональных неоантигенов может быть определено обсуждаемыми выше методами, относящимися к контрольной группе. «Высокое» или «более высокое» отношение клональных:субклональных неоантигенов может соответствовать числу, превышающему медианное отношение клональных:субклональных неоантигенов, предсказанное у контрольной группы раковых пациентов, такое как минимальное отношение клональных:субклональных неоантигенов, которое, как было предсказано, входит в верхний квартиль контрольной группы.
В другом варианте осуществления изобретения, «высокое» или «более высокое» отношение клональных:субклональных неоантигенов означает отношение в пределах от 3:1 до 100:1, например, отношение, составляющее по меньшей мере 3:1, 5:1, 10:1, 15:1, 20:1, 25:1, 50:1, 75:1 или 100:1. Для специалиста в данной области очевидно, что эти величины могут зависеть от рассматриваемой группы.
Фракция субклональных неоантигенов может быть также определена по отношению к фракции контрольной группы, как обсуждалось выше. Так, например, «более низкая» или «низкая» фракция субклональных неоантигенов может соответствовать фракции, которая меньше медианной фракции субклональных неоантигенов, предсказанной для контрольной группы раковых пациентов, например, соответствовать максимальному числу, которое, как было предсказано, входит в нижний квартиль группы.
Альтернативно, специалисту в данной области очевидно, что фракция субклональных неоантигенов может быть определена (например, для каждого пациента) путем деления числа субклональных неоантигенов (например, предсказанных в одной или более раковых клетках у указанного индивидуума) на общее число неоантигенов (например, предсказанных в одной или более раковых клетках у указанного индивидуума).
В одном из вариантов осуществления изобретения, «более низкая» или «низкая» фракция субклональных неоантигенов может означать фракцию 25% или менее, например, фракцию 20, 15, 10, 5, 3, 2 или 1% или менее.
В предпочтительном варианте осуществления изобретения, способ может включать определение числа клональных неоантигенов и отношения клональных:субклональных неоантигенов или фракции субклональных неоантигенов. Как показано в примере, объединение величин для неоантигенной нагрузки и фракции субклональных неоантигенов позволяет предсказать восприимчивость к пембролизумабу лучше, чем это может быть осуществлено с использованием одной из величин (см. фиг. 4С), а результате лечения она может быть предсказана почти во всех случаях (см. фиг. 4G-H).
В соответствии с этим, настоящее изобретение относится к способу идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, где указанный способ включает:
(i) определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума; и
(ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более, чем одной раковой клетке у указанного индивидуума;
где более высокое число клональных неоантигенов и более высокое отношение клональных:субклональных неоантигенов или более низкая (или низкая) фракция субклональных неоантигенов являются показателем восприимчивости к лечению с использованием иммунных сверочных точек.
Кроме того, авторами настоящего изобретения было неожиданно обнаружено, что опухолевые клетки с высоким числом клональных неоантигенов обладают профилями экспрессии, аналогичными профилям молекул иммунных сверочных точек, то есть, они обнаруживают общий профиль экспрессии молекул иммунных сверочных точек. Таким образом, методы идентификации конкретных молекул иммунных сверочных точек, экспрессия которых увеличиваются или уменьшаются по сравнению с не-раковыми клетками, могут быть также применены для идентификации пациентов, которые, вероятно, являются восприимчивыми к терапии посредством блокады сверочных точек.
Следовательно, в одном из своих аспектов, настоящее изобретение относится к способу идентификации индивидуумов с раковым заболеванием, которые, вероятно, будут более восприимчивы к терапии с использованием иммунных сверочных точек, где указанный способ включает определение профиля экспрессии молекул иммунных сверочных точек в раковых клетках указанного индивидуума или в опухолях определенного типа.
В одном аспекте изобретения, способ включает определение профиля экспрессии молекул иммунных сверочных точек в опухоли, например, путем идентификации дифференциально экспрессированных генов, например, по отношению к подходящему контрольному образцу. Контрольный образец для определения дифференциальной экспрессии молекулы иммунных сверочных точек может представлять собой не-раковые клетки или опухоли (например, с низкой клональной неоантигенной нагрузкой) или лимфоциты периферической крови.
Так, например, профиль экспрессии молекул иммунных сверочных точек может быть оценен путем:
(i) определения последовательности РНК образца, выделенного из опухоли; и/или
(ii) проведения анализа дифференциальной экспрессии гена для всей транскриптомы в целях идентификации дифференциальной экспрессии генов, родственных генам иммунных сверочных точек (например, с коррекцией до р <0,05). Данные для не-раковых клеток могут быть использованы для сравнения, например, с данными, полученными от того же самого пациента, или с стандартной нормой.
Настоящее изобретение также относится к способу определения профиля экспрессии молекул иммунных сверочных точек в раковой опухоли конкретного типа, где указанный способ включает стадии:
(i) получения данных РНК-секвенирования из портала данных Атласа генома рака (TCGA) для группы пациентов с представляющим интерес раком;
(ii) получения данных относительно уровня генов level_3 для каждого пациента;
(iii) ввода исходных значений «ридов» в пакет программ DESeq2 для анализа; и
(iv) проведения анализа дифференциальной экспрессии гена для всей транскриптомы в целях идентификации значимо дифференциальной экспрессии (например, с коррекцией до р <0,05) генов, родственных генам иммунных сверочных точек.
Таким образом, настоящее изобретение относится к способу идентификации индивидуумов с раковым заболеванием, которые, вероятно, будут более восприимчивы к терапии с использованием иммунных сверочных точек, где указанный способ включает определение профиля экспрессии молекул иммунных сверочных точек в раковых клетках указанного индивидуума или в опухолях определенного типа с применением указанного способа.
В предпочтительном аспекте изобретения были идентифицированы дифференциально экспрессированные гены опухолей с высокой клональной неоантигенной нагрузкой и низкой клональной неоантигенной нагрузкой (см., например, Фигуру 1E). Таким образом, данные о количестве клональных неоантигенов являются информативными и облегчают объединение двух подходов, а именно, идентификации и нацеленной терапии индивидуумов/опухолей с большим количеством клональных неоантигенов, с последующим исследованием экспрессии генов молекул иммунных сверочных точек у этих индивидуумов/опухолей с высоким уровнем клональных неоантигенов. Это облегчает проведение «двухстадийной» терапевтической атаки.
В одном из аспектов изобретения, указанной дифференциальной иммунной экспрессией является активация или высокий уровень экспрессии молекулы иммунных сверочных точек, которая представляет собой ингибирующий рецептор или костимулирующий рецептор по сравнению с подходящим контрольным образцом, где такая активация или такой высокий уровень экспрессии является показателем восприимчивости к лечению с использованием иммунных сверочных точек, нацеленному на молекулу иммунных сверочных точек, которая была активирована или имеет высокий уровень экспрессии.
Профили экспрессии генов могут быть, например, определены методом, описанным в примере 1 настоящего изобретения.
В предпочтительном варианте осуществления изобретения, молекулой иммунных сверочных точек является PD-1 и/или LAG-3. В особенно предпочтительном варианте осуществления изобретения, индивидуум страдает раком легких, а предпочтительно немелкоклеточным раком легких.
В альтернативном варианте осуществления изобретения, молекулой иммунных сверочных точек является CTLA4.
В предпочтительном варианте осуществления изобретения, раком является рак легких или меланома, а предпочтительно, немелкоклеточный рак легких или меланома.
Этот способ также может быть также применен в комбинации с уже описанными способами идентификации индивидуума с раком, который, вероятно, является восприимчивым к лечению с использованием иммунных сверочных точек.
В соответствии с этим, настоящее изобретение относится к способу идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием иммунных сверочных точек, где указанный способ включает:
(i) определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума; и
(ii) определение профиля экспрессии молекул иммунных сверочных точек в раковых клетках и/или в опухоль-инфильтрирующих иммунных клетках указанного индивидуума или типа опухоли,
где более высокое число клональных неоантигенов и дифференциальная экспрессия молекул иммунных сверочных точек по сравнению с контрольным образцом являются показателем ответа на лечение с использованием иммунных сверочных точек.
Метод прогнозирования
Авторами настоящего изобретения был сделан важный и неожиданный вывод, что раковые пациенты с более высоким числом клональных неоантигенов и/или с более высоким отношением клональных:субклональных неоантигенов или низкой фракцией субклональных неоантигенов имеют лучший прогноз.
Из контекста настоящего изобретения, специалисту в данной области будет очевидно, что индивидуумы с высоким или более высоким числом клональных неоантигенов, например, в группе индивидуумов или в пределах, идентифицированных с использованием ряда различных индивидуумов или групп, могут иметь большую продолжительность жизни, чем индивидуумы с меньшим числом клональных неоантигенов.
Стандартное значение для числа клональных неоантигенов может быть определено с применением нижеследующего способа, где термины «высокое число» или «более высокое число» определены выше.
Указанный способ может включать определение часла клональных неоантигенов, предсказанных для группы индивидуумов с раком, и либо:
(i) определение медианного числа клональных неоантигенов, предсказанных в этой группе, где медианное число представляет собой стандартную величину; либо
(ii) определение минимального числа клональных неоантигенов, предсказанных в верхнем квартиле для этой группы, где минимальное число представляет собой стандартную величину. (См., например, анализ данных TCGA в примерах настоящего изобретения).
Такое «медианное число» или «минимальное количество, входящее в верхний квартиль» может быть определено для любой группы пациентов с раком per se, или, альтернативно, для рака релевантного/конкретного типа.
Альтернативно, «высокое число» или «более высокое число» клональных неоантигенов может быть определено как 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 или более клональных неоантигенов.
Специалистам в данной области должно быть очевидно, что определение «высокое» или «более высокое» число клональных неоантигенов может зависеть от конкретных условий, и может быть оценено путем проведения соответствующего анализа.
Таким образом, настоящее изобретение также относится к способу предсказания или определения прогноза у индивидуума с раком, где указанный способ включает определение числа клональных неоантигенов в одной или более раковых клетках у указанного индивидуума; где более высокое число клональных неоантигенов по сравнению с числом в группе, обсуждаемой выше, является показателем улучшения прогноза. В предпочтительном варианте осуществления изобретения, раком является рак легких или меланома, а предпочтительно, немелкоклеточный рак легких или меланома.
В своем альтернативном варианте, настоящее изобретение включает способ предсказания или определения прогноза у индивидуума с раком, где указанный способ включает определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более, чем одной раковой клетке у указанного индивидуума, где более высокое отношение клональных:субклональных неоантигенов и/или более низкая/низкая фракция субклональных неоантигенов, например, по сравнению с группой, обсуждаемой выше, является показателем улучшения прогноза. В предпочтительном варианте осуществления изобретения, раком является меланома или рак легких, а предпочтительно, меланома или немелкоклеточный рак легких.
Лечение рака
Настоящее изобретение также относится к способу лечения или профилактики рака у индивидуума, где указанный способ включает следующие стадии:
i) идентификацию индивидуума с раком, который является подходящим для лечения с использованием иммунных сверочных точек в соответствии со способом согласно изобретению; и
ii) лечение указанного индивидуума с использованием иммунных сверочных точек.
Используемый здесь термин «лечение» означает ослабление, облегчение или устранение одного или более симптомов заболевания, расстройства или инфекции, которые подвергаются лечению, по сравнению с симптомами до начала лечения.
Термин «предупреждение» (или профилактика) означает задержку или предупреждение начала развития симптомов заболевания, расстройства или инфекции. Профилактика может быть абсолютной (то есть, когда заболевание не возникает), либо может быть эффективной только у некоторых индивидуумов или в течение ограниченного периода времени.
Используемый здесь термин «терапия с использованием иммунных сверочных точек» относится к любой терапии, которая индуцирует взаимодействие с молекулой иммунных сверочных точек или модулирует такую молекулу. Так, например, терапия с использованием иммунных сверочных точек может также называться здесь «терапией посредством блокады сверочных точек», «модулятором сверочных точек» или «ингибитором сверочных точек».
Термин «ингибитор» означает любое средство, предотвращающее ингибирование Т-клеточной активности посредством таких путей. Это может быть достигнуто с использованием антител или молекул, блокирующих взаимодействие рецептор-лиганд, ингибиторов путей внутриклеточной передачи сигнала и соединений, предотвращающих экспрессию молекул иммунных сверочных точек на поверхности Т-клеток.
Ингибиторами сверочных точек являются, например, но не ограничиваются ими, ингибиторы CTLA-4, ингибиторы PD-1, ингибиторы PD-L1, ингибиторы Lag-3, ингибиторы Tim-3, ингибиторы TIGIT и ингибиторы BTLA. Костимулирующими антителами, обеспечивающими передачу положительных сигналов посредством иммуннорегуляторных рецепторов, являются, но не ограничиваются ими, антитела против ICOS, CD137, CD27 ОХ-40 и GITR.
Примеры подходящих терапевтических средств для лечения с использованием иммунных сверочных точек являются пембролизумаб, ниволумаб, атезолизумаб и ипилимумаб.
Как показано в примере 1 (см. фигуры 5 и 7), опухоли легких с высоким числом клональных неоантигенов экспрессируют высокие уровни PD-1 и Lag-3, а при сохранении Т-клеток, реагирующих с клональными неоантигенами, у индивидуумов с раком легких также экспрессируются высокие уровни PD-1 и LAG-3. Коэкспрессия PD-1 и Lag-3 в опухолях с высокой клональной неоантигенной нагрузкой по сравнению с низкой клональной нагрузкой, позволяет предположить, что одновременное нацеливание на оба пути может давать максимальный эффект.
Следовательно, в одном из своих аспектов, настоящее изобретение относится к нацеливанию на пути PD-1 и Lag-3, например, при раке легких, либо посредством совместного введения ингибиторов, нацеленных на каждый путь, либо посредством введения одного реагента, нацеленного на оба пути. В последнем случае используются биспецифические антитела, которые могут связываться с PD-1 и Lag-3 или с PD-L1 и Lag-3.
В предпочтительном варианте осуществления настоящего изобретения, индивидуумами являются млекопитающие, а предпочтительно кошки, собаки, лошади, ослы, овцы, свиньи, козы, коровы, мыши, крысы, кролики или морские свинки, но наиболее предпочтительным индивидуумом является человек.
В одном из аспектов изобретения, способ лечения или профилактики рака согласно изобретению включает стадию идентификации пациента, нуждающегося в таком лечении или в такой терапии.
Рак может быть выбран, например, из рака мочевого пузыря, рака желудка, рака пищевода, рака молочной железы, рака прямой и ободочной кишки, рака шейки матки, рака яичника, рак эндометрия, рака почек (почечноклеточного рака), рака легких (мелкоклеточного, немелкоклеточного рака и мезотелиомы), рака головного мозга (например, глиомы, астроцитомы, глиобластомы), меланомы, лимфомы, рака тонкой кишки (двенадцатиперстной и тощей кишки), лейкоза, рака поджелудочной железы, гепатобилиарных опухолей, рака зародышевых клеток, рака предстательной железы, рак головы и шеи, рака щитовидной железы и саркомы.
В предпочтительном варианте осуществления изобретения, раком является рак легких. В особенно предпочтительном варианте осуществления изобретения, раком является немелкоклеточный рак легких.
В одном варианте осуществления изобретения, раком является меланома.
В одном из аспектов настоящего изобретения, индивидуумом является индивидуум с преинвазивным заболеванием или индивидуум, который был подвергнут резекции первичной опухоли, но которому может потребоваться адъювантная терапия, или у которого наблюдается благоприятный эффект от такой терапии согласно изобретению.
Лечение с применением способов согласно изобретению может также включать нацеливание на циркулирующие опухолевые клетки и/или метастазы, происходящие от такой опухоли.
Способы и их применение для лечения рака согласно изобретению могут быть осуществлены в комбинации с дополнительными противораковыми терапиями. В частности, терапия с использованием иммунных сверочных точек согласно изобретению может быть проведена в комбинации с терапией костимулирующими антителами, химиотерапией и/или лучевой терапией, направленной терапией или терапией моноклональными антителами.
Настоящее изобретение более подробно описано на нижеследующих примерах, которые приводятся для лучшего понимания изобретения и не рассматриваются как ограничение объема изобретения.
Примеры
Пример 1
Были исследованы клиническая значимость неоантигенов и иммунной модуляции в условиях ITH при НМРЛ и идентичность опухоль-инфильтрирующих Т-клеток, реагирующих с неоантигеном.
Материалы и методы
Описание групп пациентов
Образцы для секвенирования (L011 и L012) были получены у пациентов с диагнозом немелкоклеточный рак легких (НМРЛ), которые прошли полную хирургическую резекцию до проведения какой-либо формы адъювантной терапии, такой как химиотерапия или лучевая терапия. Было получено их информированное согласие по секвенированию генома. Оба образца были взяты из Клиники Лондонского Университета (UCLHRTB 10/H1306/42) и подвергнуты патологическому анализу для установления гистологического подтипа: одна опухоль была классифицирована как CK7+/TTF1+-аденокарцинома (L011), а другая опухоль (L012) была классифицирована как плоскоклеточная карцинома с помощью гистологического анализа. Подробные клинические характеристики приводятся в таблице S1.
Образцы, полученные из (1), относятся к группе пациентов с НМРЛ на стадии IV, и подробное описание этой группы пациентов, включая обработку опухоли, можно найти в дополнительном материале (1). Подробные клинические характеристики этой группы приводятся в таблице S3.
Клинический анализ эффективности
Клинический анализ эффективности проводили, как описано в (1). Вкратце, объективный ответ на пембролизумаб оценивался по критериям иммунного ответа (IRRC) при радиологическом исследовании. Как указано в протоколе, КТ-сканирование проводили через каждые девять недель. Частичные и полные ответы были подтверждены посредством повторной визуализации как минимум через 4 недели после первой идентификации ответа; неподтвержденные ответы рассматривались как стабильное или прогрессирующее заболевание в зависимости от результатов второго КТ-сканирования. Устойчивый клинический эффект (DCB) был определен как стабильное заболевание или частичный ответ, продолжающийся более 6 месяцев (27 недель - время оценки ответа в соответствии с третьим протоколом). Отсутствие устойчивого эффекта (NDB) было определено как прогрессирование заболевания через ≤6 месяцев после начала терапии. Для пациентов с постоянным ответом на экспериментальную терапию, продолжительность жизни без прогрессирования заболевания была подвергнута проверке на дату последней оценки посредством визуализации. Для выживших пациентов, общая продолжительность жизни была оценена на дату последнего известного контакта. Подробное описание ответа для каждого пациента можно найти в таблице S2.
Наборы данных экзома TCGA
Образцы опухоли, с запросом на мутации и HLA-типирования были взяты из Атласа генома рака (TCGA) для группы с аденокарциномой легких (АКЛ, n=124) и плоскоклеточной карциномой легких (ПККЛ, n=124). Данные SNV были взяты из портала TumourPortal (2) для групп с АКЛ и ПККЛ, TCGA (http://www.tumourportal.org/tumour_types?ttype=LUAD|LUSC). Один пациент с АКЛ, TCGA-05-4396, был исключен, поскольку у него наблюдалось 7000 запрошенных низкокачественных мутаций, главным образом, в области C[C>G]G. Пациент с ПККЛ, TCGA-18-3409, был исключен, поскольку у него наблюдался сильный УФ-ответ, не характерный для опухоли ПККЛ.
Обработка опухоли
Для обоих пациентов L011 и L012, патологом были отобраны четыре области первичных опухолей из одной массы опухоли, разделенных интервалом в 1 см, и прилегающая область нормальной ткани, а затем их фотографии были задокументированы, а образцы были быстро заморожены. Для метастазов опухолей головного мозга у L011, четыре области опухоли, определенные по окрашиванию гематоксилином и эозином (Н&Е), были отобраны патологом в форме тканевых блоков, фиксированных формалином и залитых в парафин (FFPE). Периферическую кровь брали во время хирургической операции у всех пациентов и быстро замораживали. Приблизительно 5´5´5 мм быстро замороженной опухолевой ткани и 500 мкл крови использовали для экстракции геномной ДНК с помощью набора DNeasy (Qiagen) в соответствии с протоколом производителя. Для ткани FFPE вручную проводили макродиссекцию бритвой для удаления нагруженных опухолью областей ткани, находящихся на расстоянии 10-40 мкм от неокрашенных предметных стекол, и ДНК экстрагировали с использованием набора для анализа крови и ткани DNeasy (Qiagen). ДНК количественно оценивали с помощью Qubit (Invitrogen), и целостность ДНК подтверждали с помощью электрофореза в агарозном геле. Подробное описание обработки для обследуемых и идентифицированных групп можно найти в дополнительном материале (1).
Секвенирование всего генома во множестве областей и запрос вариантов
L012
Для каждой области опухоли и соответствующей зародышевой линии от пациента L012, захват экзома осуществляли на 1-2 мкг ДНК с использованием набора Illumina Nextera в соответствии с протоколом производителя (Illumina). Образцы подвергали секвенированию на спаренных концах на Illumina HiSeq 2500 в лаборатории по расширенному секвенированию в LRI, как описано ранее (3, 4). Каждую захваченную библиотеку загружали на платформу Illumina и секвенировали на спаренных концах до достижения желаемой средней глубины секвенирования (среднего значения по экзомам=392,75). Исходные риды со спаренными концами (100 п.н.) в формате FastQ, созданном с помощью устройства Illumina, выравнивали с полным геномным набором hg19 (включая неизвестные контиги), полученным с помощью пакета программ GATK 2.8 (5), с использованием bwa mem (bwa-0.7.7) (6). Пакеты программ Picard v1.107 использовали для очистки, сортировки и слияния файлов от одной и той же области опухоли пациента и для удаления ридов-дубликатов (http: //broadinstitute.github.io/picard). Показатели контроля качества были получены с использованием комбинации пакетов программ Picard (1.107), GATK (2.8.1) и FastQC (0.10.1) (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/).
Пакет программ SAMtools mpileup (0.1.16) (7) был использован для определения локализации нестандартных положений в образцах опухоли и зародышевой линии. Основания с оценкой Phred <20 или риды с качеством картирования <20 были пропущены. Вычисление BAQ было отключено, а коэффициент снижения качества картирования был установлен на 50. Соматические варианты между опухолью и соответствующей зародышевой линией были определены с использованием программы VarScan2 Somatic (v2.3.6) (8) по выходному сигналу от SAMtools mpileup. Были использованы параметры по умолчанию, за исключением: минимальной зоны охвата для образца зародышевой линии, которая была установлена на 10; минимальной частоты варианта, которая была заменена на 0,01; и чистоты опухоли, которая была установлена на 0,5. Программа VarScan2 processSomatic была использована для удаления соматических вариантов. Полученные SNV-запросы были отфильтрованы по ложноположительным основаниям с использованием программы fpfilter.pl, сопряженной с Varscan2, и имеющей первый набор данных для подсчета блока запросов-ридов (0.5.1). Для последующего анализа были использованы только INDEL-запросы, классифицируемые как «высокодостоверные» по VarScan2 processSomatic.
Все варианты были рассмотрены вручную с использованием программы Integrated Genomics Viewers (IGV) (9), а варианты, обнаруживающие специфический профиль ошибок Illumina (10), удаляли. Остальные варианты были секвенированы на секвенаторе Ion Torrent PGM (Life Technologies) до медианной глубины 1513. Для этой цели была специально сконструирована панель AmpliSeqTM (Life Technologies) с использованием программы-дизайнера онлайн (www.ampliseq.com). Мультиплексные ПЦР проводили на ДНК каждой области в соответствии с протоколом производителя. Библиотеки секвенирования по штрих-кодам конструировали с использованием ТМ, и эти библиотеки секвенировали по всей длине ридов 200 п.н. на секвенаторе Ion Torrent PGM (Life Technologies). Выравнивание последовательностей с последовательностями областей-мишеней от генома hg19 осуществляли с использованием компьютерной программы IonTorrent TorrentSuiteTM. Были отобраны варианты, для которых зона охвата по меньшей мере в одной области составляла 50. При этом считалось, что вариант присутствует в области, если его частота составляла ≥0,01 для SNV и ≥0,02 для INDELS. И снова вручную осуществляли отбор в IGV, и варианты, прошедшие эту стадию, использовали для последующих анализов. Всем вариантам были присвоены названия с помощью ANNOVAR (11), а потенциальные драйверные мутации были определены, как описано в (12).
L011
Секвенирование и анализ зародышевой линии и областей первичной опухоли были описаны ранее в (13). Секвенирование метастатических областей осуществляли с помощью BGI Tech, в соответствии с протоколами, описанными в (13). Компьютерная обработка метастатических областей была осуществлена с применением методов, описанных выше для L012, со средней медианной глубиной по всем образцам, составляющей 93,7. Не-молчащие варианты оценивали вручную с использованием IGV, как для L012.
Запрос вариантов по данным Rizvi
Были получены файлы BAM, соответствующие областям зародышевой линии и областям опухоли от (i) 16 образцов, соответствующих идентифицированной группе и 18 образцов, соответствующих обследуемой группе (данные Rizvi), и эти файлы были преобразованы в формат FASTQ с использованием пакета программ Picard (1.107). Выравнивание SamToFastq и запрос вариантов осуществляли как описано выше для L012.
Клональный анализ
Для образцов по TCGA, клональный статус каждой мутации был оценен путем объединения величин для аллелей дикого типа и мутантных аллелей, абсолютных значений основных и второстепенных копий и величин чистоты опухоли как описано ранее в (14). Для L011 и L012, клональный статус каждой мутации оценивали после проведения анализа по секвенированию множества областей. Вкратце, каждая мутация была классифицирована как клональная, если она была идентифицирована и присутствовала во всех и в каждой области, секвенированной в опухоли. И наоборот, любые мутации, которые присутствовали не в каждой области опухоли, были классифицированы как субклональные.
Для идентификации и подтверждения опухоли для группы, включая данные, полученные, как описано в (1), фракция раковых клеток каждой мутации была оценена путем объединения числа локальных копий (полученных от ASCAT, см. ниже), чистоты опухоли (также полученной от ASCAT) и частоты аллельных вариантов. Короче говоря, для данной мутации сначала вычисляли число копий с наблюдаемыми мутациями, nmut, а затем фракцию опухолевых клеток, несущих данную мутацию, умножали на число хромосомных копий в этом локусе по следующей формуле:
nmut=VAF•1/p [pCNt+CNn(1-p)]
где VAF соответствует частоте аллельного варианта в мутированном основании, а p, CNt, CNn означают, соответственно, чистоту опухоли, число копий, специфичных для локуса опухоли и число копий, специфичных для нормального локуса. Затем авторы вычисляли ожидаемое число копий с мутациями, nchr с использованием VAF и присваивали мутацию одной из возможных копий с использованием максимального правдоподобия. Авторы также установили, что число копий с мутациями лучше определять по числу субклональных копий, если это возможно. В конечном счете, это позволило авторам получить модифицированный вариант и контрольные величины для каждой мутации, скорректированные по числу копий и чистоте опухоли. Затем все мутации были кластеризованы с использованием программы кластеризации Дирихле PyClone (15). Авторами было установлено, что если учесть, что число копий и чистота были уже скорректированы, и если число целых копий принять за 1, а чистоту принять за 1; то это позволит провести кластеризацию просто клональных и субклональные мутаций в группе. Авторами были сканированы мутации PyClone с 10000 повторами и отбраковкой 1000 с использованием параметров по умолчанию. Следует отметить, что для оценки статуса клональной мутации, эти мутации сначала были дополнительно отфильтрованы для гарантии надежной кластеризации. Короче говоря, были использованы только мутации с глубиной рида по меньшей мере 10 в зародышевых линиях и в опухоли, где пороговая величина р по Varscan2 Somatic равна 0,01. Для каждого варианта требуется минимум 5 чередующихся ридов, а также минимальная частота аллельных вариантов опухоли 1%. Мутации были также отфильтрованы так, чтобы максимальное число ридов зародышевой линии было равно 2, а частота аллельных вариантов зародышевой линии была равна 2%.
Для двух опухолей, ZA6965 и GR0134, достоверное число копий, оценка мутаций и чистоты не могли быть определены, а поэтому анализ клональной архитектуры был невозможен, и эти опухоли были исключены из анализа.
Анализ числа копий
Исходя из данных, полученных в (1), были собраны данные по SNP экзома обработанного образца и данные числа копий пары «опухоль-норма» с помощью VarScan2 (v2.3.6). Число копий по Varscan2 прогоняли с использованием параметров по умолчанию, за исключением минимального охвата (21221095) и отношения данных. Отношение данных вычислляли для каждого образца как описано в (22300766). Выходные данные Varscan обрабатывали с использованием ASCAT v2.3 (20837533) для получения данных числа сегментированных копий, а затем оценивали число клеток и плоидность для всех образцов исходя из данных последовательности экзома. Последующие параметры были изменены по сравнению с их значениями по умолчанию: пороговую величину для установки ACF на 1 изменяли с 0,2 на 0,15, и пакет программ был запущен с использованием параметра гамма 1. Для образцов по TCGA, данные SNP6.0 обрабатывали с получением информации о числе копий как описано у McGranahan, 2015.
Конструирование филогенетического дерева
Филогенетические деревья были построены с использованием бинарных матриц «наличие/отсутствие», сконструированных исходя из регионального распределения вариантов внутри опухоли, как описано в (12). Для опухоли L011, данные первичной опухоли повторно анализировали методом, описанным для метастатических областей L012 и L011, что позволило построить комбинированное дерево с использованием первичных и метастатических областей.
HLA-типирование образцов, взятых у пациентов
Для всех пациентов с TCGA, 4-значный тип HLA определяли с использованием POLYSOLVER (полиморфных локусов reSOLVER) (16). Пациенты L011 и L012 были серотипированы и одновременно генотипированы с использованием Optitype (17), который дал согласованные результаты.
Идентификация предполагаемых неоантигенов
Идентифицированные не-молчащие мутации были использованы для создания полного списка пептидов из 9-11 аминокислот, где мутированная аминокислота присутствовала в каждом возможном положении. Аффинность связывания каждого мутантного пептида и его соответствующего пептида дикого типа с аллелями HLA зародышевой линии пациента предсказывали с использованием netMHCpan-2.8 (18,19). Неоантигены-кандидаты идентифицировали как неоантигены с предсказанной силой связывания <500 нМ.
Анализ продолжительности жизни пациентов с TCGA-опухолью
Клинические данные пациентов с TCGA-опухолью оценивали исходя из портала данных TCGA и эти данные загружали из https://tcqadata.nci.nih.gov/tcqafiles/ftp auth/distro ftpusers/anonymous/tumour/CANCER.TYPE/bcr/biotab/clin/. Анализы на продолжительность жизни осуществляли в R с использованием пакета программ по оценке продолжительности жизни.
Анализ дифференциальной экспрессии генов
Данные секвенирования РНК были загружены из портала данных TCGA. Для каждого пациента с АКЛ получали все доступные данные по уровню гена «level_3». Необработанные величины ридов использовали в качестве исходных данных в пакете программ R DESeq2 для анализа. Был проведен анализ на дифференциальную экспрессию генов по всей транскриптоме и были идентифицированы значимо дифференциально экспрессируемые (скорректированные р <0,05) гены, родственные иммунным генам (перечисленным в таблице S1). Эти гены были кластеризованы по их коэкспрессии с использованием системы мер 1-r2.
Выделение опухоль-инфильтрирующих лимфоцитов (TIL) для L011 и L012
Опухоли были взяты непосредственно из операционной патологического отделения клиники, где образец был разделен на области. Затем образцы измельчали в стерильных условиях с последующим ферментативным расщеплением (RPMI-1640 (Sigma) экспериментальным ферментом либеразой TL (Roche) и ДНКазой I (Roche)) при 37°C в течение 30 минут, после чего проводили механическую диссоциацию с использованием gentleMACS (Miltenyi Biotech). Полученные моноклеточные суспензии обогащали лейкоцитами путем пропускания через градиент Фиколла-Пака (GE Healthcare). Живые клетки подсчитывали и замораживали в человеческой сыворотке АВ (Sigma) с 10% диметилсульфоксидом при -80°C, а затем переносили в жидкий азот.
In vitro размножение опухоль-инфильтрующих лимфоцитов для L011 и L012
TIL размножали в соответствии с протоколом быстрого размножения (REP) в колбах Т25, содержащих среду EX-VIVO (Lonza) с добавлением 10% человеческой сыворотки АВ (Sigma), растворимого анти-CD3 антитела (ОКТ3, BioXCell), 6000 МЕ/мл рекомбинантного человеческого rhlL-2 (PeproTech) и 2´107 облученных МКПК (30 Грей), взятых у 3 аллогенных здоровых доноров. Свежие среды, содержащие rhlL-2 при 3000 МЕ/мл, добавляли чере каждые три дня по мере необходимости. После 2-недельного размножения, TIL подсчитывали, фенотипировали с помощью проточной цитометрии и замораживали в человеческой сыворотке АВ (Sigma) при -80°C до использования в соответствующих анализах или хранили в течение длительного периода времени в жидком азоте.
Получение МНС-мультимера и комбинаторный анализ кодирующих последовательностей с помощью проточной цитометрии
MHC-мультимеры, содержащие предсказанные неоэпитопы, были получены в лаборатории (Технического Университета Дании, в лаборатории SRH). Синтетические пептиды были закуплены у PEPSCAN Presto, NL. Молекулы HLA, соответствующие HLA-экспрессии L011 (HLA-A1101, A2402 и B3501) и L012 (HLA-A1101, A2402 и B0702), подвергали рефолдингу с использованием УФ-чувствительного пептида и заменяли на представляющие интерес пептиды после УФ-облучения (20-23). Вкратце, HLA-комплексы, нагруженные УФ-чувствительным пептидом, подвергали УФ-облучению на 366 нм (CAMAG) в течение одного часа при 4°C в присутствии неоантигенного пептида-кандидата в 384-луночном планшете. Мультимеры пептид-MHC получали с использованием всего 9 различных флуоресцентных стрептавидиновых (SA) конъюгатов: PE, APC, PE-Cy7, PE-CF594, бриллиантового фиолетового (BV), 421, BV510, BV605, BV650, бриллиантового ультрафиолетового (BUV) 395 (BioLegend). MHC-мультимеры были получены с использованием двух различных стрептавидиновых конъюгатов, специфичных к каждому пептиду, что позволило провести комбинаторное кодирование каждых антиген-распознающих Т-клеток и, тем самым, параллельно провести анализы на реакцию с 36 различными пептидами (24, 25).
Идентификация CD8+-T-клеток, реагирующих с неоантигеном
МНС-мультимерный анализ проводили на in vitro размноженных CD8+-T-лимфоцитах, выделенных из область-специфических образцов рака легких и смежной нормальной ткани легких. Было синтезировано 290 и 355 мутантных пептидов-кандидатов (с предсказанной аффинностью связывания с HLA <500 нМ, включая множество возможных пептидных вариантов от одной и той же миссенс-мутации), и эти пептиды были использованы для скрининга размноженных TIL L011 и L012, соответственно. Для окрашивания размноженных CD8+-T-лимфоцитов, образцы оттаивали, обрабатывали ДНКазой в течение 10 минут, промывали и окрашивали панелями MHC-мультимеров в течение 15 минут при 37°C. Затем клетки окрашивали красителем LIVE/DEAD®, имеющимся в наборе для окрашивания погибших клеток, фиксированным реагентом, проявляющимся при излучении в ближнем ИК-диапазоне с возбуждением на 633 или 635 нм (Invitrogen, Life Technologies), CD8-PerCP (Invitrogen, Life Technologies), и ФИТЦ-связанными антителами против панели CD4, CD14, CD16, CD19 (все от BD Pharmingen) и CD40 (ABD Serotec) еще в течение 20 минут при 4°C. Сбор данных проводили на проточном цитометре LCRII (Becton Dickinson) с использованием компьютерной программы FACSDiva 6. Величины отсечки для определения позитивных ответов составляли ≥0,005% от общего числа CD8+-T-клеток и ≥10 событий.
Было обнаружено, что у пациента L011, мультимеры, происходящие от MTFR2 HLA-B3501, связывались с мутированной последовательностью FAFQEYDSF (суммарная оценка связывания с MHC: 22), но не с последовательностью FAFQEDDSF дикого типа (суммарная оценка связывания с MHC: 10) (фиг. 11, В и D, фиг. 9С). Каких-либо ответов на перекрывающиеся пептиды AFQEYDSFEK и KFAFQEYDSF не обнаруживалось. Для пациента L012, мультимеры, происходящие от CHTF18 HLA-A1101, связывались с мутированной последовательностью LLLDIVAPK (суммарная оценка связывания с MHC: 37), но не с последовательностью LLLDILAPK дикого типа: (суммарная оценка связывания с MHC: 41) (фиг. 11, С и Е, фиг. 9С). Каких-либо ответов на перекрывающиеся пептиды CLLLDIVAPK и IVAPKLRPV не обнаруживалось. И наконец, мультимеры, происходящие от MYADM HLA-B0702, связывались с мутированной последовательностью SPMIVGSPW (суммарная оценка связывания с MHC: 15), а также с последовательностью дикого типа SPMIVGSPR (суммарная оценка связывания с MHC: 1329). Каких-либо ответов на перекрывающиеся пептиды SPMIVGSPWA, SPMIVGSPWAL, SPWALTQPLGL и SPWALTQPL не обнаруживалось.
МНС-мультимерный анализ и мультипараметрическое проточное цитометрическое фенотипирование базовых неразмноженных образцов опухоли L011 и L012
Образцы опухоли оттаивали, промывали и сначала окрашивали специально приготовлеными MHC-мультимерами в течение 10-15 минут при 37°C в темноте. Затем клетки переносили на влажный лед и окрашивали в течение 30 минут в темноте панелью поверхностных антител, используемой для рекомендованного производителями разведения: CD8-V500, клона SK1 (BD Biosciences), PD-1-BV605, клона EH12.2H7 (BioLegend), CD3-BV785, клона ОКТ3 (BioLegend), LAG-3-РЕ, клона 3DS223H (eBioscience). Клетки пропитывали в течение 20 минут с использованием внутриклеточной фиксации и набора буферов для пропитки от eBioscience. Панель для внутриклеточного окрашивания наносили на лед и оставляли на 30 минут в темноте, и эта панель состояла из нижеследующих антител, используемых для рекомендованного изготовителями разведения: гранзима В-V450, клона GB11 (BD Biosciences), FoxP3-PerCP-Cy5.5, клона РСН101 (eBioscience), Ki67-ФИТЦ, клона B56 (BD Biosciences) и CTLA-4-APC, клона L3D10 (BioLegend). Сбор данных проводили на проточном цитометре BD FACSAria III (BD Biosciences) и анализировали с помощью программы Flowjo версии 10.0.8 (Tree Star Inc.).
Иммуногистохимический анализ образцов L011 и L012
Образцы от пациентов L011 и L012 и реактивных человеческих миндалин фиксировали в забуференном формалине и заливали в парафин в соответствии со стандартными протоколами гистологических анализов. 2-5-микрометровые срезы ткани из парафиновых блоков вырезали и переносили на электрически заряженные предметные стекла для проведения иммуногистохимического анализа. Подробная информация об используемых «первых» антителах приводятся ниже в таблице. Для определения оптимальных условий окрашиания (т.е., времени разведения и инкубирования антител, протоколов выделения антигенов, выбора подходящего хромогена), каждое антитело тестировали и оптимизировали на срезах реактивных человеческих миндалин по одному стандартному протоколу иммуногистохимического анализа с использованием автоматизированных платформ BenchMark Ultra (Ventana/Roche) и автоматического окрашивателя Bond-III (Leica Microsystems) в соответствии с протоколом, описанным в литературе (26, 27).
По меньшей мере два различных антитела против одного и того же белка, если они имелись в наличии, анализировали в миндалинах для подтверждения специфичности паттерна их окрашивания. Многократное окрашивание осществляли в соответствии с протоколом, описанным в литературе (28). Для оценки коэкспрессии белка в цитоплазме или в клеточной мембране регистрировали изменение цвета одного хромогена, то есть, синий и красный давали пурпурную и коричневую окраску, а синий давал почти черную окраску. Иммуногистохимические образцы и паттерны реактивности белка оценивали по ТМ. Подсчет множества иммуноокрашенных образцов проводили совместно с AF. Разрешение на это исследование было было получено от Национальной Службы Исследований по Этике, Исследовательским Комитетом по Этике 4 (REC, регистрационный номер 09/H0715/64).
PD-L1
LAG-3
гранзима В
Результаты
Высокая опухолевая неоантигенная нагрузка может улучшать распознавание опухоли Т-клетками, что снижает возможность «ускользания» от иммунного надзора (12). В подтверждение клинической значимости опухолевых неоантигенов (7), было установлено, что высокая неоантигенная нагрузка в образцах (определяемая как верхний квартиль числа неоантигенов, предсказанных в группе) была ассоциирована с более высокой общей продолжительностью жизни у пациентов с АКЛ в соответствии с клиническими данными (n=117) по сравнению с опухолями в остальных квартилях (фиг. 1B, логранговая величина р=0,011; 5А).
Для того, чтобы определить, может ли неоантигенный клональный статус (наличие неоантигена во всей опухоли (клональный) по сравнению с субсерией опухолевых клеток (субклональный)) повлиять на его взаимосвязь с продолжительностью жизни, была вычислена фракция раковых клеток (число раковых клеток, каждая из которых имеет мутацию) и каждый предполагаемый неоантиген был классифицирован как клональный или субклональный (13). Опухоли, несущие высокое число предсказанных клональных неоантигенов (определенных как верхний квартиль в группе), ассоциировались с более длительной общей продолжительностью жизни по сравнению со всеми другими опухолями в группе (фиг. 1C, логранговая величина р=0,0077; фиг. 5В). И наоборот, число предсказанных субклональных неоантигенов не обнаруживало существенной взаимосвязи с общей продолжительностью жизни (фиг. 1D, логранговая величина р=0,12; фиг. 5С). Хотя неоантигенная нагрузка была связана с мутационной нагрузкой, однако, авторами настоящего изобретения наблюдалась более тесная взаимосвязь между общей продолжительностью жизни и количеством неоантигенов по сравнению с числом мутаций (фиг. 6). Эти данные показали, что наличие большого количества клональных неоантигенов при АКЛ может способствовать эффективному иммунологическому надзору. У группы с ПККЛ наблюдался более узкий диапазон предполагаемых неоантигенов (фиг. 7А) со средним абсолютным отклонением 50 и межквартильным диапазоном 71, но у пациентов этой группы не наблюдалось статистически значимой взаимосвязи между общей продолжительностью жизни и неоантигенной нагрузкой (фиг. 7 B-G). Это может создавать трудности в исследовании клональной архитектуры опухолей в отдельных образцах (14).
Анализ экспрессии генов выявил 27 иммуноассоциированных генов, дифференциально экспрессирующихся у групп с низким уровнем клональных неоантигенов (определяемых как нижняя квартиль числа клональных неоантигенов, предсказанных в группе) и высоким уровнем клональных неоантигенов (таблица S1). CD8А (р=0,005), и гены, ассоциированные с презентацией антигена (TAP-1 р=0,003, STAT-1 р<0,001), Т-клеточная инфильтрация (CXCL-10 р=0,005, CXCL-9 р=р<0,001) и эффекторная Т-клеточная функция (IFN-g р<0,001, гранзимы В р<0,001 и Н р=0,008) активировались у группы с высоким уровнем клональных неоантигенов и были кластеризованы вместе (фиг. 1Е). В этом кластере также были идентифицированы PD-1 (р=0,02) и ген активации лимфоцитов 3 (LAG-3, р <0,001), то есть, негативные регуляторы Т-клеточной функции (15). PD-L1 также значительно активировался (р <0,001) у группы с высоким уровнем клональных неоантигенов и был кластеризован с PD-L2. При сравнении опухолей с высоким уровнем клональных неоантигенов со всеми другими опухолями в этой группе, PD-L1 был идентифицирован как иммунный ген с наиболее значимой дифференциальной экспрессией (фиг. 8, р <0,001).
Эти данные свидетельствуют о том, что высокая клональная неоантигенная нагрузка связана с наличием активированных эффекторных Т-клеток, потенциально регулируемых экспрессией специфических белков иммунных сверочных точек (PD-1, LAG-3, PD-L1/2).
Была предпринята еще одна попытка определить, могут ли CD8+-T-клетки, реагирующие с клональными неоантигенами, присутствовать в первичных опухолях НМКРЛ. Две опухоли на ранней стадии у L011 и L012, подвергнутые секвенированию экзома во множестве областей (13), позволяли провести филогенетический анализ и анализ на неоантигены в каждой области первичной опухоли (фиг. 2А). У L011 наблюдались метастазы в головном мозге, которые были удалены через 14 месяцев после проведения первой операции, и эти метастазы были подвергнуты секвенированию во множестве областей. Хотя обе эти опухоли наблюдались у курящих женщин (>40 пачек в год), их мутационная нагрузка и степень гетерогенности отличалась (фиг. 2А). У пациента L011 с аденокарциномой была обнаружена гомогенная первичная опухоль и метастазы в головной мозг (М1-М4), вероятно, происходящие от области опухоли R3 (фиг. 2A). В первичной опухоли было предсказано всего 313 неоантигенов, 88% из которых были клональными и идентифицировались в каждой области первичной опухоли (фиг. 2В). И наоборот, у L012, то есть, с плоскоклеточной карциномой, наблюдалась низкая мутационная нагрузка и обширная гетерогенность, причем, 75% предсказанных неоантигенов были субклональными (фиг. 2A, C).
MHC-мультимеры, нагруженные предсказанными неоантигенами, были использованы для скрининга CD8+-T-клеток, размноженных из различных областей опухоли и смежной нормальной легочной ткани (13). У L011, CD8+-T-клетки, реагирующие с мутантным MTFR2D326Y (FAFQEYDSF), клональная мутация с высокой уровнем предсказанного HLA-связывания в формах дикого типа (10 нМ) и в мутантных формах (22 нМ) (фиг. 2В) были идентифицированы во всех областях опухоли (2,8-4,4%) и при более низкой частоте в нормальных областях (0,1%) (фиг. 2D). У L012, CD8+-T-клетки, реагирующие с мутантными CHTF18L769V (LLDIVAPK) и MYADMR30W (SPMIVGSPW), были идентифицированы во всех областях опухоли и с меньшей частотой в нормальной ткани (фиг. 2E). Обе эти опухоли имели клональные мутации CHTF18 с высоким уровнем предсказанного HLA-связывания (<50 нМ) в мутантных формах и в формах дикого типа, и MYADM с более низким уровнем предсказанного связывания в формах дикого типа (>1000 нМ) по сравнению с мутантной формой (<50 нМ)(фиг.2С).
У L011, MTFR2-реактивные CD8+-T-клетки могут также детектироваться в неразмноженных TIL (опухоль-инфильтрирующих лимфоцитах) (фиг. 3А), происходящих от всех областей первичных опухолей (0,79-1,35%), и с более низкой частотой в нормальной ткани (0,16%) и в мононуклеарных клетках периферической крови (МКПК) (0,02%). Аналогичным образом, CHTF18-реактивные и MYADM-реактивные CD8+-T-клетки были идентифицированы в неразмноженных образцах всех областей опухоли у L012 (CHTF18 0,16-0,58%, MYADM 2,25-2,31%) и с более низкой частотой в нормальной ткани легких (CHTF18 0,02%, MYADM 0,17%) и в МКПК (CHTF18 0,02%, MYADM 0,01%) (фиг. 3А).
Дополнительная характеризация реагирующих с неоантигеном Т-клеток в неразмноженных образцах была проведена с помощью проточной цитометрии. Хотя на низких уровнях, экспрессия CTLA-4 была ограничена опухоль-инфильтрирующими CD8+-T-клетками для обоих L011 и L012, однако, гораздо более высокие уровни были идентифицированы на MTFR2-, CHTF18- и MYADM-реактивных Т-клетках (фиг. 3В, фиг.9А). Высокие уровни PD-1 экспрессировались на >99% в MTFR2-, CHTF18- и MYADM-реактивных опухоль-инфильтрирующих CD8+-T-клеток (фиг. 3В, фиг. 9А), а более низкие уровни наблюдались на Т-клетках, негативных по CD8+MHC-мультимеру, в опухоли, в нормальной ткани и в МКПК. У L011, экспрессия LAG-3 была выше во всех опухоль-инфильтрирующих CD8+-T-клетках, включая MTFR2-реактивные клетки, по сравнению с нормальной тканью и МКПК (фиг.3В). Экспрессия LAG-3 также наблюдалось у L012, хотя и на более низких уровнях (фиг. 9А). Иммуногистохимические (ИГХ) исследования дополнительно подтвердили эти результаты, а именно, идентификацию CD8+-T-клеток, коэкспрессирующих LAG-3 у обоих пациентов L011 и L012 с первичными опухолями (фиг. 3D). Ki67 экспрессировался на более высоких уровнях на опухоль-инфильтрирующих CD8+-T-клетах, чем в нормальной ткани или в МКПК (фиг. 3В, фиг.9А), однако фракция пролиферирующих клеток была низкой для клеток, реагирующих с неоантигеном и клеток, негативных по МНС-мультимеру (<25%). В отличие от этого, гранзим В (GzmB) экспрессировался на высоких уровнях во всех исследованных субсериях CD8+-T-клеток. Важно отметить, что хотя большая часть Т-клеток, реагирующих с неоантигеном в опухолях, обнаруживала в высокой степени активную экспрессию GzmB, однако, большинство этих клеток коэкспрессировали PD-1 (>60%) и находились под пролиферативным контролем исходя из уровней Ki67 (фиг. 3C, фиг. 9В).
Экспрессия LAG-3 и PD-1 на Т-клетках, реагирующих с клональными неоантигенами, вместе с экспрессией опухоли PD-L1 (фиг. 3D), явно подтверждает иммунные сигнатуры, идентифицированные в опухолях легких с высоким уровнем клональных неоантигенов (фиг. 1Е). Эти данные подтвердили возможную роль этих специфических сверочных точек в ограничении активности Т-клеток, распознающих клональные неоантигены, и будущие исследования будут направлены на эти сверочные точки для лечения НМКРЛ с высокой клональной неоантигенной нагрузкой.
Затем было проведено исследование для того, чтобы определить, может ли клональный статус предполагаемых неоантигенов быть связан с изменением чувствительности к блокаде PD-1 при НМКРЛ. Были получены данные по секвенированию экзома в недавно проведенном исследовании, в котором пациенты с НМКРЛ в двух независимых группах принимали пембролизумаб (2) (Таблица S2), и была определена клональная архитектура каждой опухоли путем оценки фракции раковых клеток для каждой мутации (13) (фиг. 10). Как сообщалось ранее (2), неоантигенная нагрузка ассоциировалась с клинической эффективностью пембролизумаба в идентифицированной и в обследуемой группах, причем, высокий неоантигенный репертуар ассоциировался с улучшением исхода лечения (данные не приводятся).
Такая взаимосвязь также зависит от клональной архитектуры каждой опухоли (фиг. 4A-H). В идентифицированной группе, каждая опухоль, обнаруживающая длительный клинический эффект (DCB, определенный в (2) как частичный ответ или стабильное заболевание, продолжающееся >6 месяцев), имела высокую клональную неоантигенную нагрузку (определенную как число, превышающее или равное медианному числу клональных неоантигенов в идентифицированной группе, 91) и субклональную фракцию неоантигенов ниже, чем 5% (фиг. 4A-B). И наоборот, каждая опухоль, обнаруживающая непродолжительный эффект (NDB), имела либо низкий клональный неоантигенный репертуар (<91), либо высокую субклональную фракцию неоантигенов (>5%). Таким образом, в идентифицированной группе, объединение неоантигенного репертуара и неоантигенной гетерогенности (т.е., отношение клональных:субклональных неоантигенов или мутаций) позволило предсказать чувствительность к пембролизумабу лучше, чем любой из вариантов, взятых отдельно (фиг. 4С).
Аналогичным образом, в обследуемой группе, пять из шести опухолей с высокой клональной неоантигенной нагрузкой (определенной как число, превышающее или равное медианному числу в обследуемой группе, 69) и низкой субклональной фракцией неоантигенов (<5%) были ассоциированы с DCB (фиг. 4D-F). И наоборот, восемь из десяти опухолей с низкой клональной неоантигенной нагрузкой или с высокой неоантигенной гетерогенностью были ассоциированы с NDB. Так, например, несмотря на высокую неоантигенную нагрузку, опухоль ZA6505 давала непродолжительный клинический ответ и рецидивировала через 2 месяца. Опухоль ZA6505 была одной из самых гетерогенных опухолей в группе, причем более, чем 80% мутаций были классифицированы как субклональные.
В итоге, следует отметить, что если степень неоантигенной гетерогенности и клональной неоантигенной нагрузки рассмотривать вместе, то результат может быть предсказан почти во всех случаях (фиг. 4G-H).
Кроме того, в соответствии с TCGA-анализом (фиг. 1Е), авторами настоящего изобретения также наблюдалась более высокая экспрессия PD-L1 в опухолях, несущих высокую клональную неоантигенную нагрузку и низкую неоантигенную гетерогенность по сравнению с опухолями, имеющими низкую неоантигенную нагрузку или высокую неоантигенную гетерогенность (Р=0,0017, χ2-критерий, фиг. 11). Эти результаты оставались неизменными при рассмотрении всех мутаций, кроме предполагаемых неоантигенов, рестриктированных по МНС класса I (фиг. 12), что подтверждает мнение, что неидентифицированные неоантигены, рестриктированные по МНС класса II, также могут играть важную роль в иммунной реактивности (6), а поэтому необходимо уточнить алгоритмы предсказания неоантигенов (16), отвечающих на терапию анти-PD-1 антителом. Ранее проведенный анализ лимфоцитов периферической крови (ЛПК) из CA9903, то есть, опухоли с исключительным ответом на пембролизумаб, выявил популяцию CD8+-T-клеток в аутологичных ЛПК, распознающих предсказанный неоантиген в результате мутации HERC1P3278S (ASNASSAAK) (2). В соответствии с релевантностью клональных неоантигенов, эта мутация, вероятно, присутствует в 100% раковых клеток в секвенированной опухоли (фиг. 4I-J).
Р-величина
(Иден. и обсл.)
(годы)
в год
ÙÙ
мг/
ÙÙÙ
ÙÙÙÙ
Библиография
1. N. A. Rizvi et al., Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science (New York, N.Y 348, 124-128 (2015).
2. M. S. Lawrence et al., Discovery and saturation analysis of cancer genes across 21 tumour types. Nature 505, 495-501 (2014).
3. M. Gerlinger et al., Genomic architecture and evolution of clear cell renal cell carcinomas defined by multiregion sequencing. Nature genetics 46, 225-233 (2014).
4. M. Gerlinger et al., Intratumour heterogeneity and branched evolution revealed by multiregion sequencing. The New England journal of medicine 366, 883-892 (2012).
5. A. McKenna et al., The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome research 20, 1297-1303 (2010).
6. H. Li, R. Durbin, Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics 25, 1754-1760 (2009).
7. H. Li et al., The Sequence Alignment/Map format and SAMtools. Bioinformatics 25, 2078- 2079 (2009).
8. D. C. Koboldt et al., VarScan 2: somatic mutation and copy number alteration discovery in cancer by exome sequencing. Genome research 22, 568-576 (2012).
9. J. T. Robinson et ai, Integrative genomics viewer. Nature biotechnology 2 , 24-26 (2011).
10. K. Nakamura et al., Sequence-specific error profile of lllumina sequencers. Nucleic Acids Res 39, e90 (2011).
11. K. Wang, M. Li, H. Hakonarson, ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data. Nucleic Acids Res 38, e164 (2010).
12. N. Murugaesu et al., Tracking the genomic evolution of esophageal adenocarcinoma through neoadjuvant chemotherapy. Cancer discovery, (2015).
13. E. C. de Bruin et al., Spatial and temporal diversity in genomic instability processes defines lung cancer evolution. Science (New York, N.Y. 346, 251-256 (2014).
14. N. McGranahan et al., Clonal status of actionable driver events and the timing of mutational processes in cancer evolution. Sci Transl Med 7, 283ra254 (2015).
15. C. L. Hodgkinson et al., Tumourigenicity and genetic profiling of circulating tumour cells in small-cell lung cancer. Nature medicine 20, 897-903 (2014).
16. S. A. Shukla et al., Comprehensive analysis of cancer-associated somatic mutations in class I HLA genes. Nature biotechnology (In press).
17. A. Szolek et al., OptiType: precision HLA typing from next-generation sequencing data. Bioinformatics 30, 3310-3316 (2014).
18. I. Hoof et al., NetMHCpan, a method for MHC class I binding prediction beyond humans. lmmunogenetics 6, 1-13 (2009).
19. M. Nielsen et al., NetMHCpan, a method for quantitative predictions of peptide binding to any HLA-A and -B locus protein of known sequence. PloS one 2, e796 (2007).
20. M. Toebes et al., Design and use of conditional MHC class I ligands. Nature medicine 12, 246-251 (2006).
21. A. H. Bakker et al., Conditional MHC class I ligands and peptide exchange technology for the human MHC gene products HLA-A1, -A3, -A11, and -B7. Proceedings of the National Academy of Sciences of the United States of America 105, 3825-3830 (2008).
22. T. M. Frosig et al., Design and validation of conditional ligands for HLAB*08:01, HLA-B*15:01, HLA-B*35:01, and HLA-B*44:05. Cytometry A, (2015).
23. C. X. Chang et al., Conditional ligands for Asian HLA variants facilitate the definition of CD8+ T-cell responses in acute and chronic viral diseases. Eur J Immunol 43, 1109-1120 (2013).
24. S. R. Hadrup et al., Parallel detection of antigen-specific T-cell responses by multidimensional encoding of MHC multimers. Nat Methods 6, 520-526 (2009).
25. R. S. Andersen et al., Parallel detection of antigen-specific T cell responses by combinatorial encoding of MHC multimers. Nature protocols 7, 891-902 (2012).
26. T. Marafioti et al., Novel markers of normal and neoplastic human plasmacytoid dendritic cells. Blood 111, 3778-3792 (2008).
27. A. U. Akarca et al., BRAF V600E mutation-specific antibody, a sensitive diagnostic marker revealing minimal residual disease in hairy cell leukaemia. Br J Haematol 162, 848-851 (2013).
28. T. Marafioti et al., Phenotype and genotype of interfollicular large B cells, a subpopulation of lymphocytes often with dendritic morphology. Blood 102, 2868-2876 (2003).
Все цитируемые здесь документы во всей своей полноте вводятся в настоящее описание посредством ссылки в тот раздел изобретения, к которому они относятся. В настоящее изобретение могут быть введены различные модификации и варианты описанных способов и систем согласно изобретению, не выходящие за рамки существа и объема изобретения. Хотя, настоящее изобретение описано со ссылкой на особенно предпочтительные варианты его осуществления, однако, следует отметить, что заявленное изобретение не должно быть чрезмерно ограничено такими конкретными вариантами его осуществления. Действительно, различные модификации описанных способов осуществления изобретения, которые очевидны для специалиста в области молекулярной биологии, клеточной иммунологии или в смежных областях, входят в объем прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Cancer Research Technology Limited
<120> Метод
<130> P107091PCT2
<140> PCT/EP2016/071471
<141> 2016-09-12
<150> GB 1516047.6
<151> 2015-09-10
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Неоантиген MTFR2D326Y
<400> 1
Phe Ala Phe Gln Glu Tyr Asp Ser Phe
1 5
<210> 2
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Неоантиген CHTF18 L769V
<400> 2
Leu Leu Leu Asp Ile Val Ala Pro Lys
1 5
<210> 3
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Неоантиген MYADMR30W
<400> 3
Ser Pro Met Ile Val Gly Ser Pro Trp
1 5
<210> 4
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Неоантиген HERC1P3278S
<400> 4
Ala Ser Asn Ala Ser Ser Ala Ala Lys
1 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
Phe Ala Phe Gln Glu Asp Asp Ser Phe
1 5
<210> 6
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 6
Ala Phe Gln Glu Tyr Asp Ser Phe Glu Lys
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 7
Lys Phe Ala Phe Gln Glu Tyr Asp Ser Phe
1 5 10
<210> 8
<211> 9
<212> PRT
<213> Homo sapiens
<400> 8
Leu Leu Leu Asp Ile Leu Ala Pro Lys
1 5
<210> 9
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 9
Cys Leu Leu Leu Asp Ile Val Ala Pro Lys
1 5 10
<210> 10
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 10
Ile Val Ala Pro Lys Leu Arg Pro Val
1 5
<210> 11
<211> 9
<212> PRT
<213> Homo sapiens
<400> 11
Ser Pro Met Ile Val Gly Ser Pro Arg
1 5
<210> 12
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 12
Ser Pro Met Ile Val Gly Ser Pro Trp Ala
1 5 10
<210> 13
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 13
Ser Pro Met Ile Val Gly Ser Pro Trp Ala Leu
1 5 10
<210> 14
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 14
Ser Pro Trp Ala Leu Thr Gln Pro Leu Gly Leu
1 5 10
<210> 15
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Перекрывающаяся пептидная последовательность
<400> 15
Ser Pro Trp Ala Leu Thr Gln Pro Leu
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2770447C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ АКТИВИРОВАННЫХ T-КЛЕТОК | 2016 |
|
RU2729362C2 |
| Выбор раковых мутаций для создания персонализированной противораковой вакцины | 2019 |
|
RU2809620C2 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ ЛИМФОЦИТОВ, ОБОГАЩЕННЫХ ОПУХОЛЬ-СПЕЦИФИЧНЫМИ КЛОНАМИ Т-ЛИМФОЦИТОВ, И КЛЕТОЧНЫЕ КУЛЬТУРЫ, ПОЛУЧЕННЫЕ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО СПОСОБА | 2022 |
|
RU2808595C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПРОИЗВОДСТВА Т-КЛЕТОК | 2018 |
|
RU2793344C2 |
| ДЕТЕРМИНАНТЫ ОТВЕТА РАКОВОЙ ОПУХОЛИ НА ИММУНОТЕРАПИЮ | 2014 |
|
RU2707530C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2782261C2 |
| СПОСОБЫ ПРОГНОЗИРОВАНИЯ ПРИМЕНИМОСТИ СПЕЦИФИЧНЫХ ДЛЯ ЗАБОЛЕВАНИЯ АМИНОКИСЛОТНЫХ МОДИФИКАЦИЙ ДЛЯ ИММУНОТЕРАПИИ | 2018 |
|
RU2799341C2 |
| Способы и композиции для лечения опухолей | 2017 |
|
RU2741786C2 |
| ИДЕНТИФИКАЦИЯ, ПРОИЗВОДСТВО И ПРИМЕНЕНИЕ НЕОАНТИГЕНОВ | 2016 |
|
RU2729116C2 |
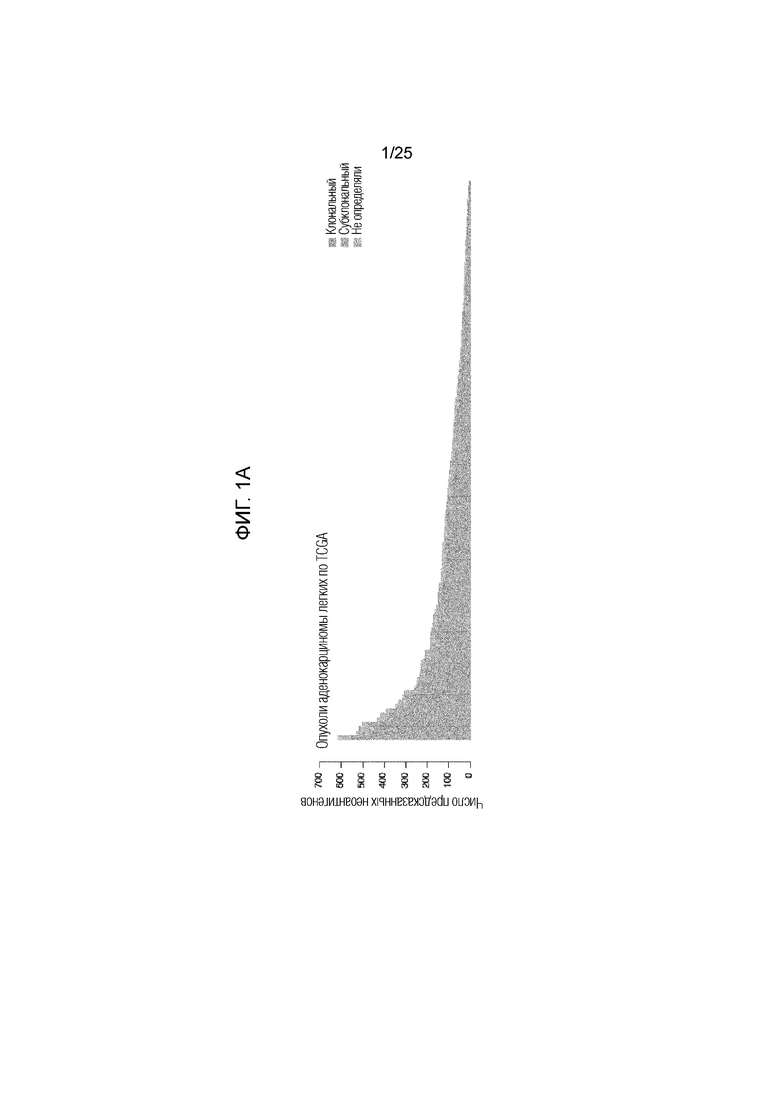
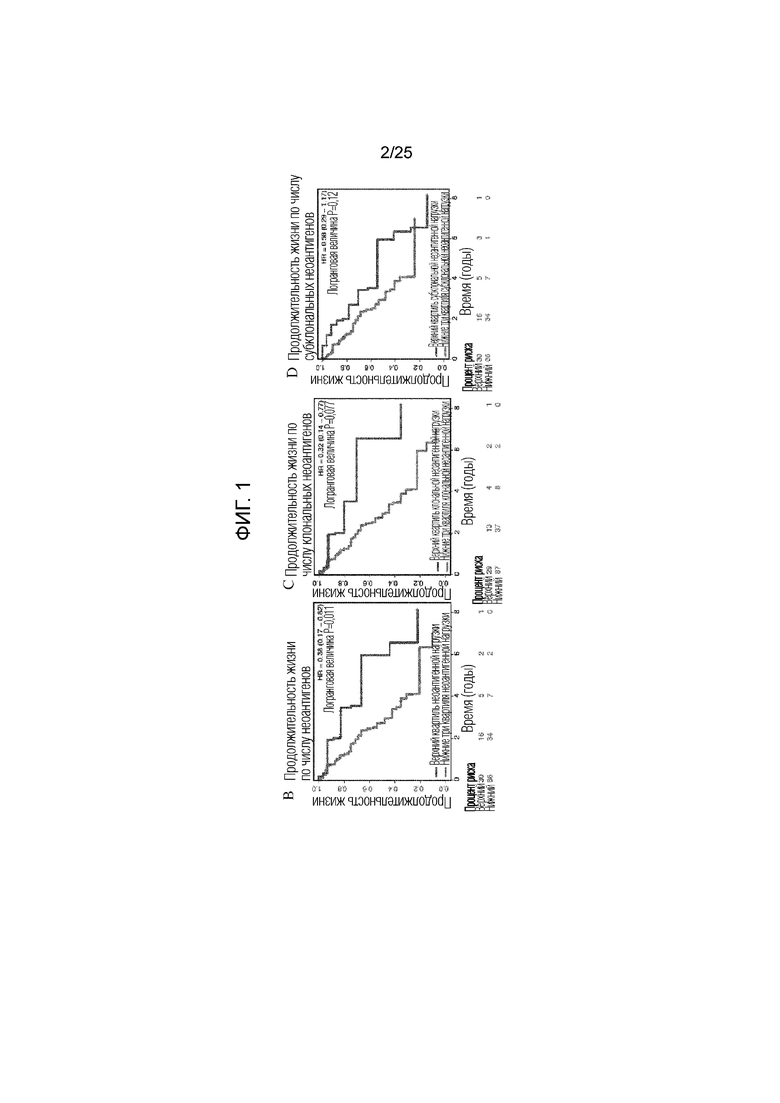
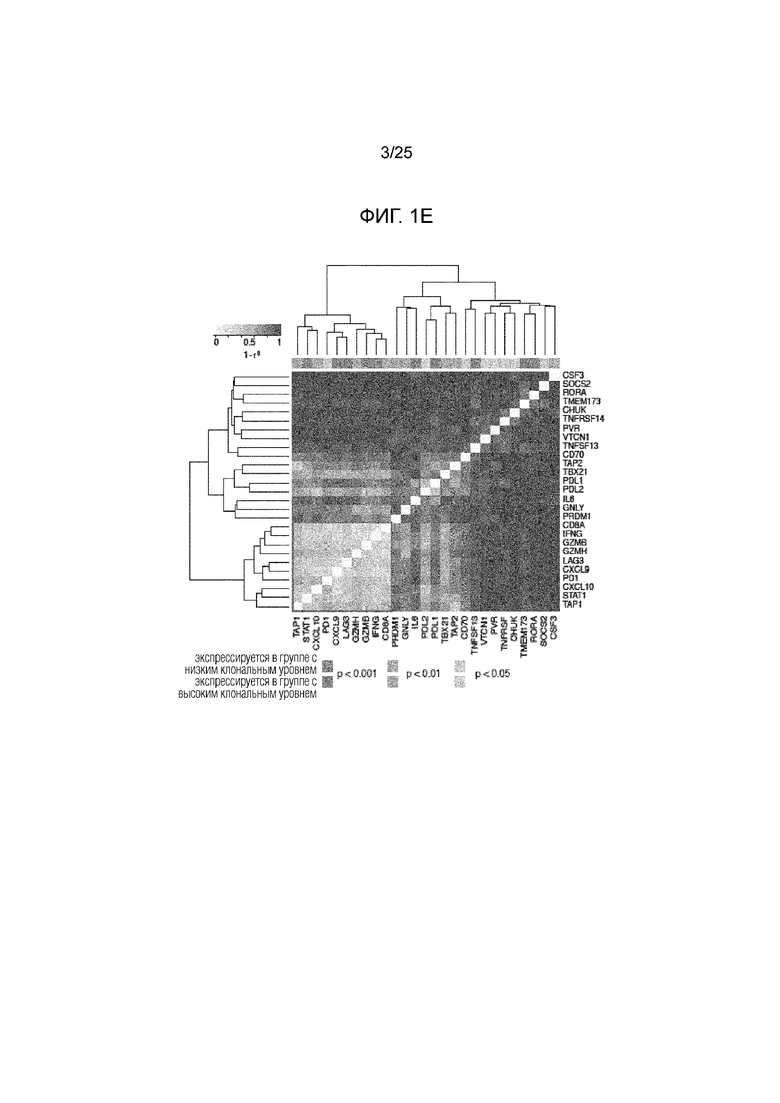
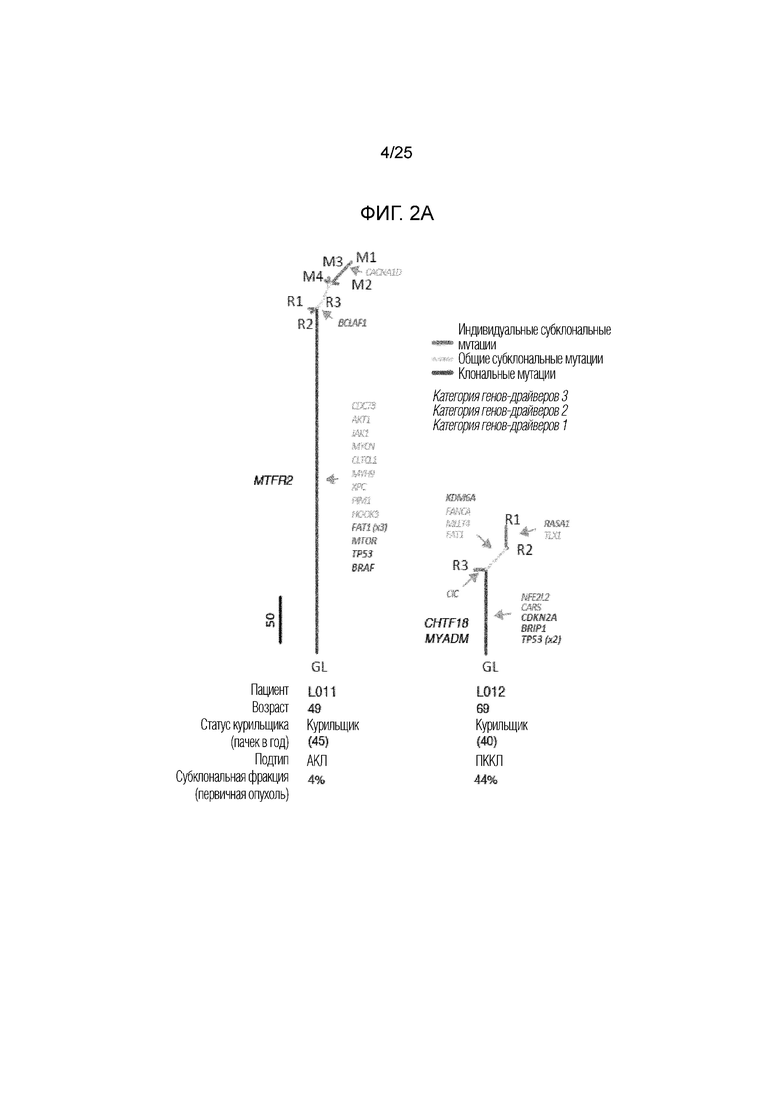

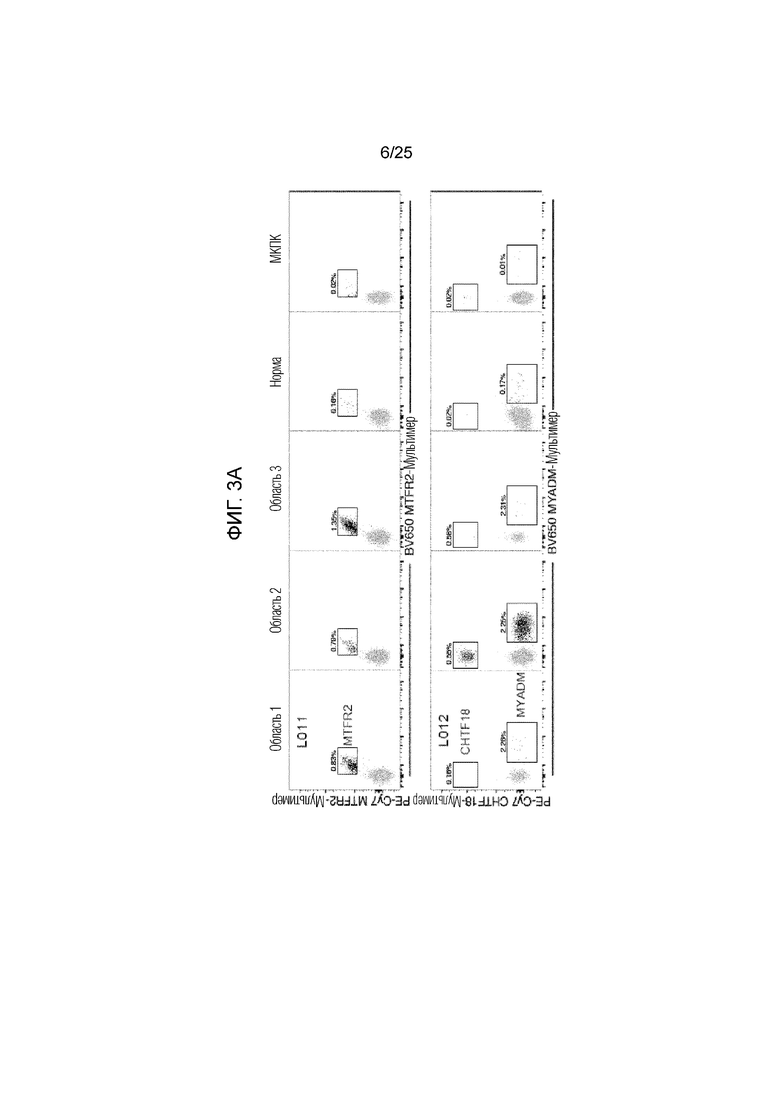
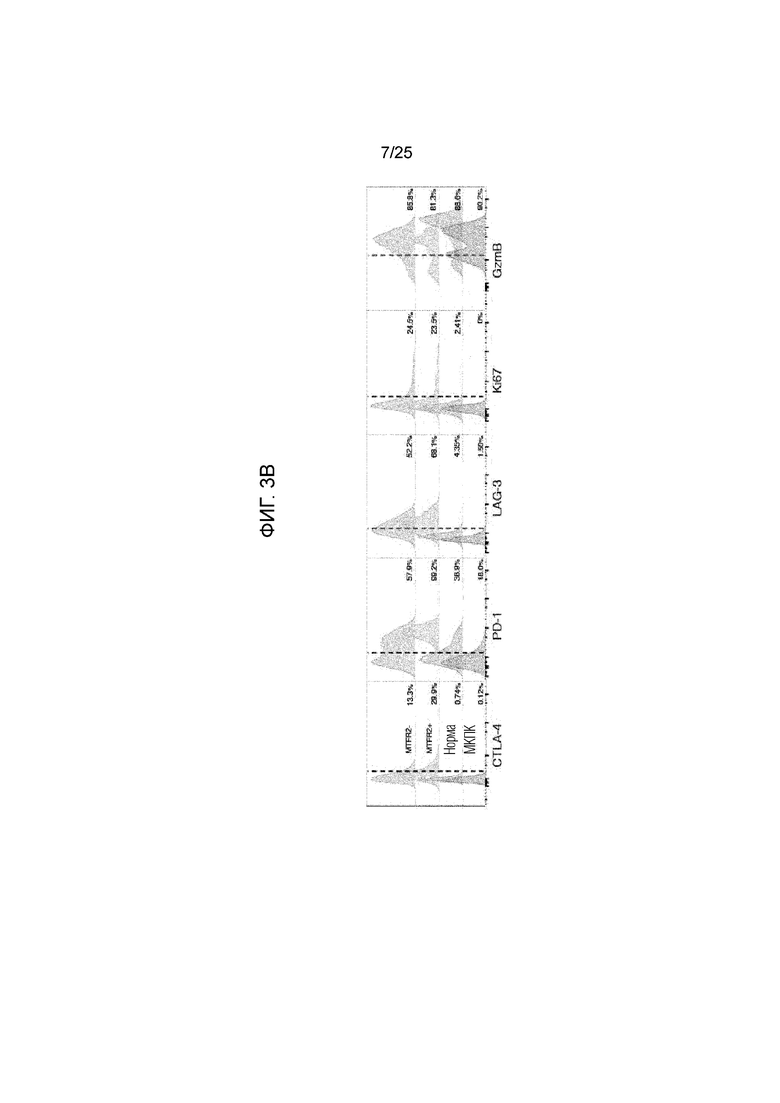
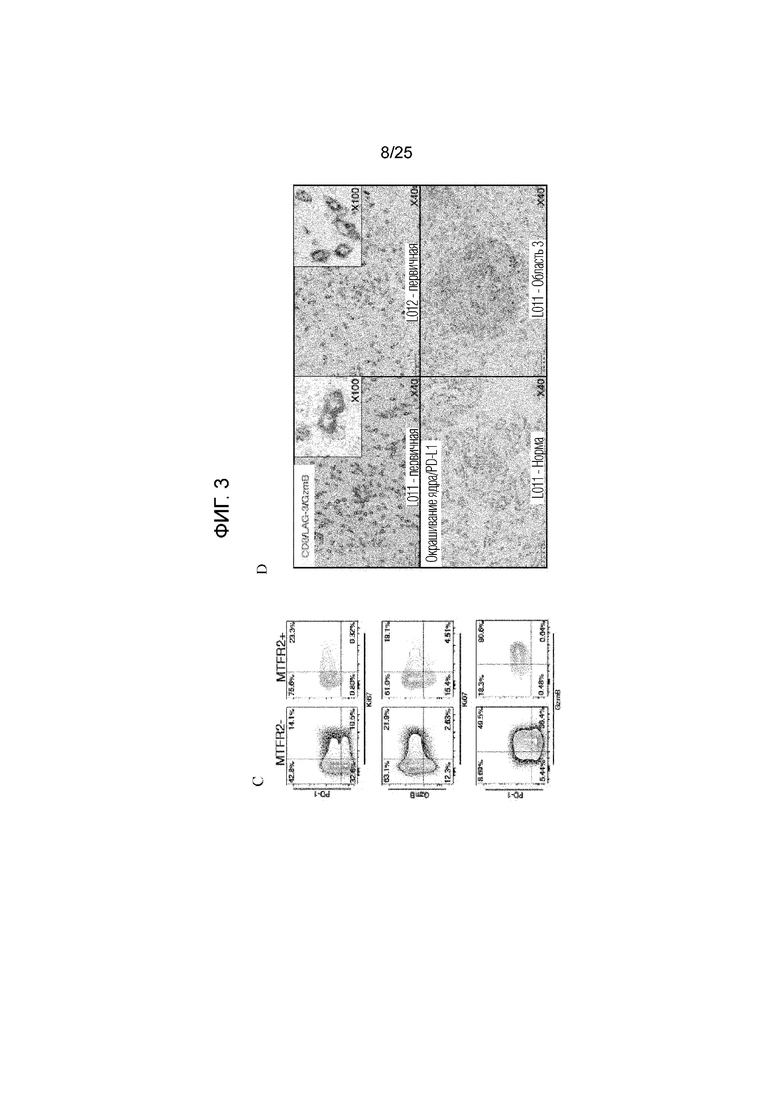
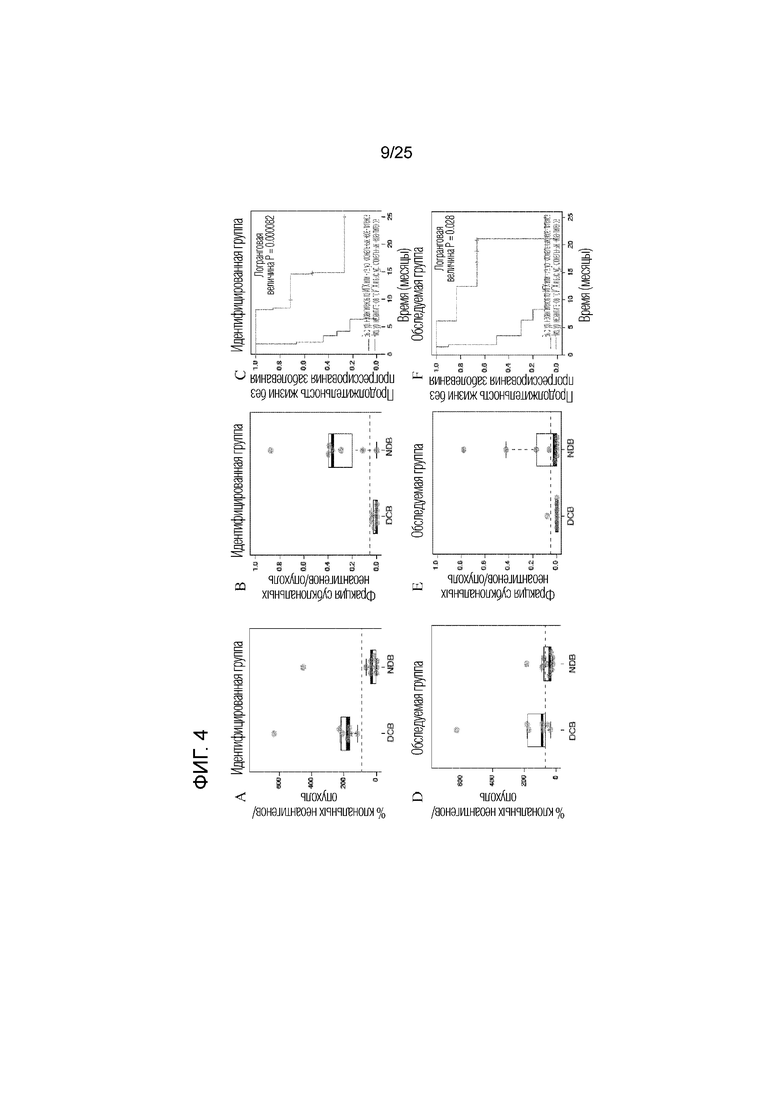
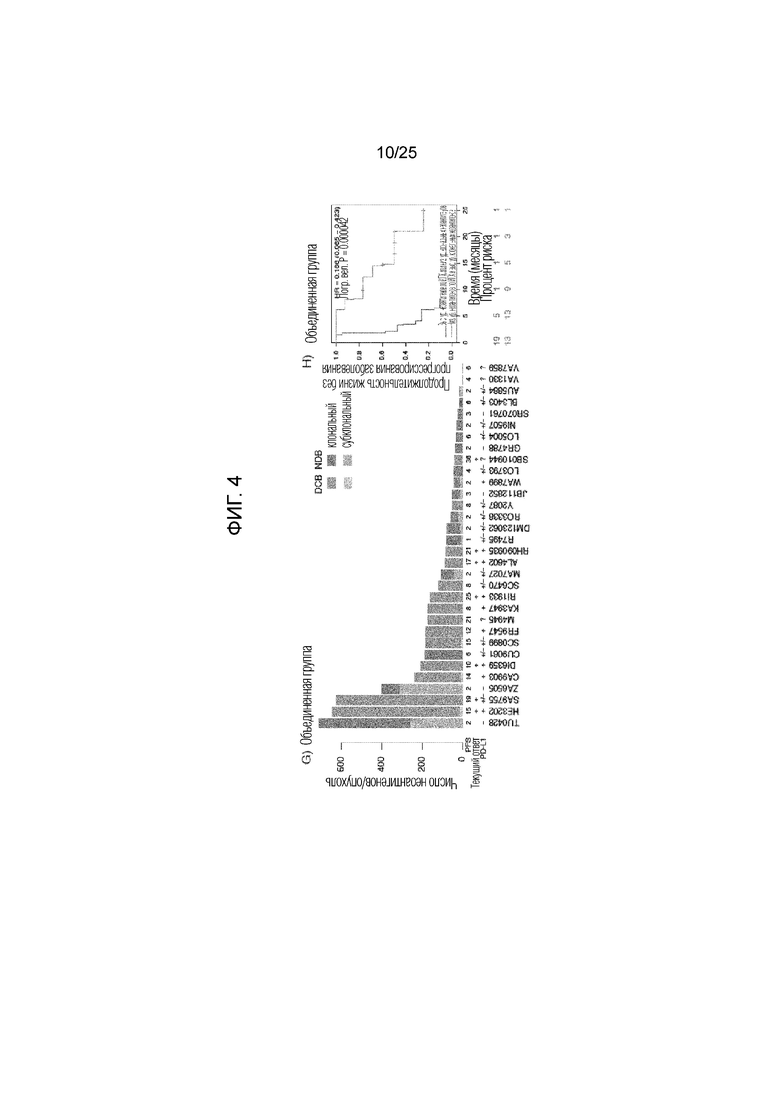

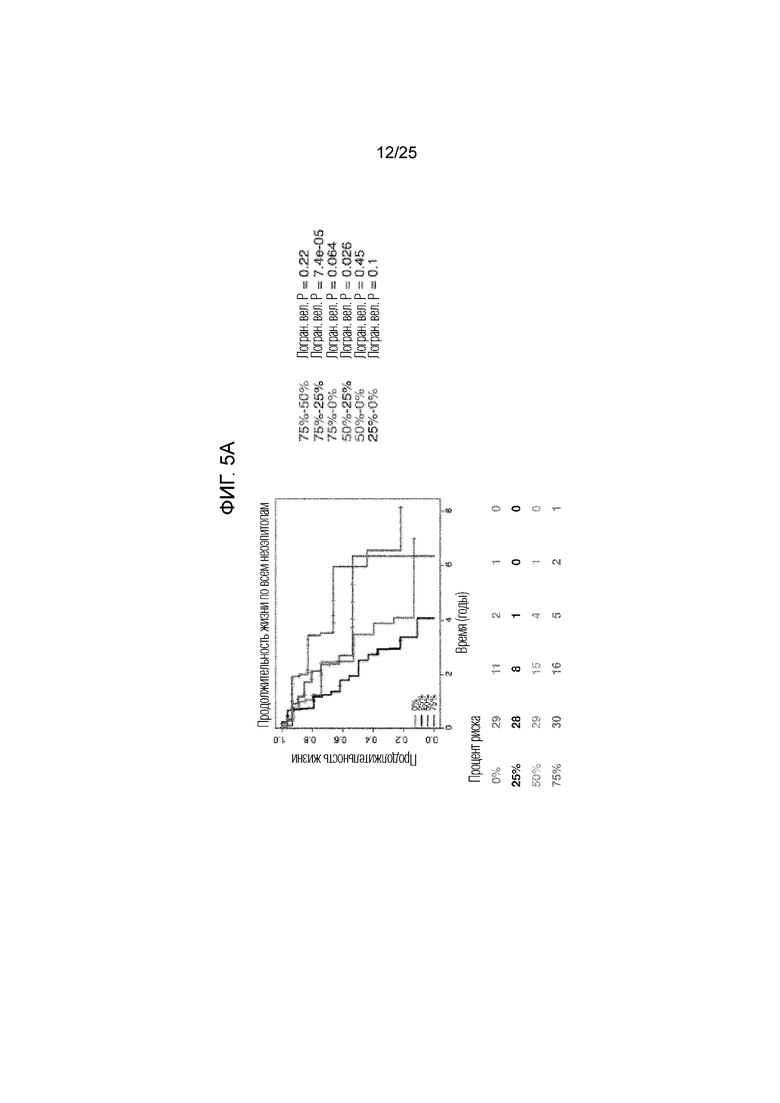
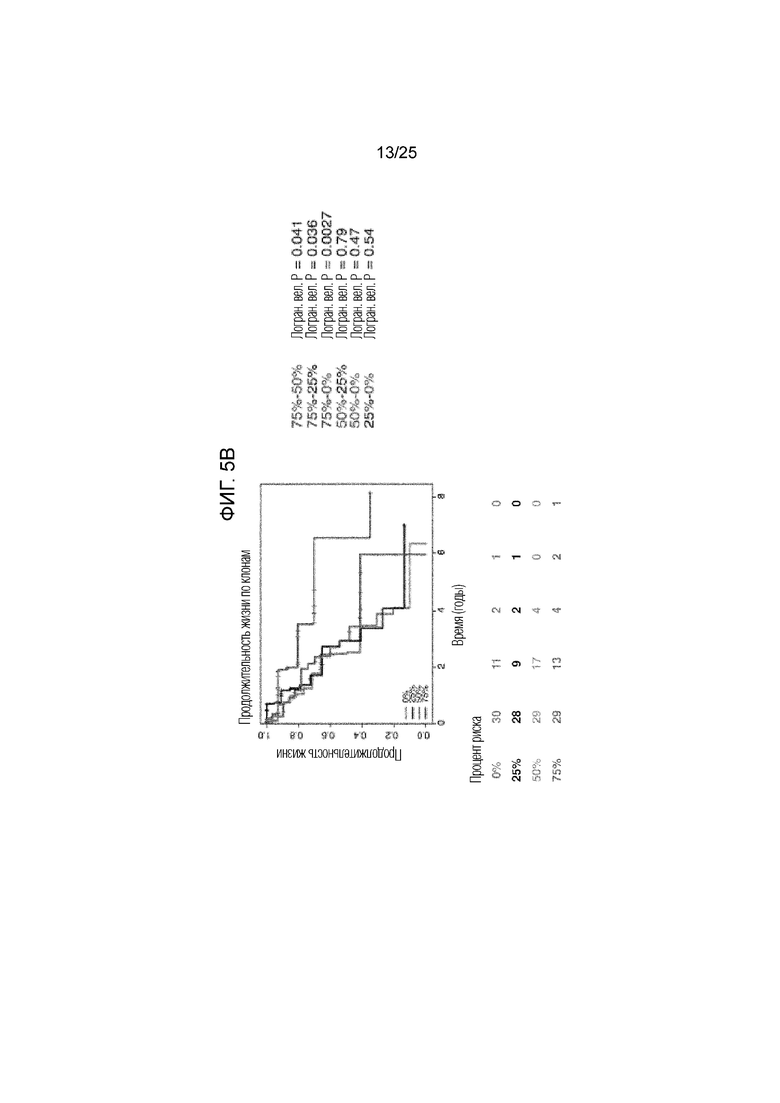


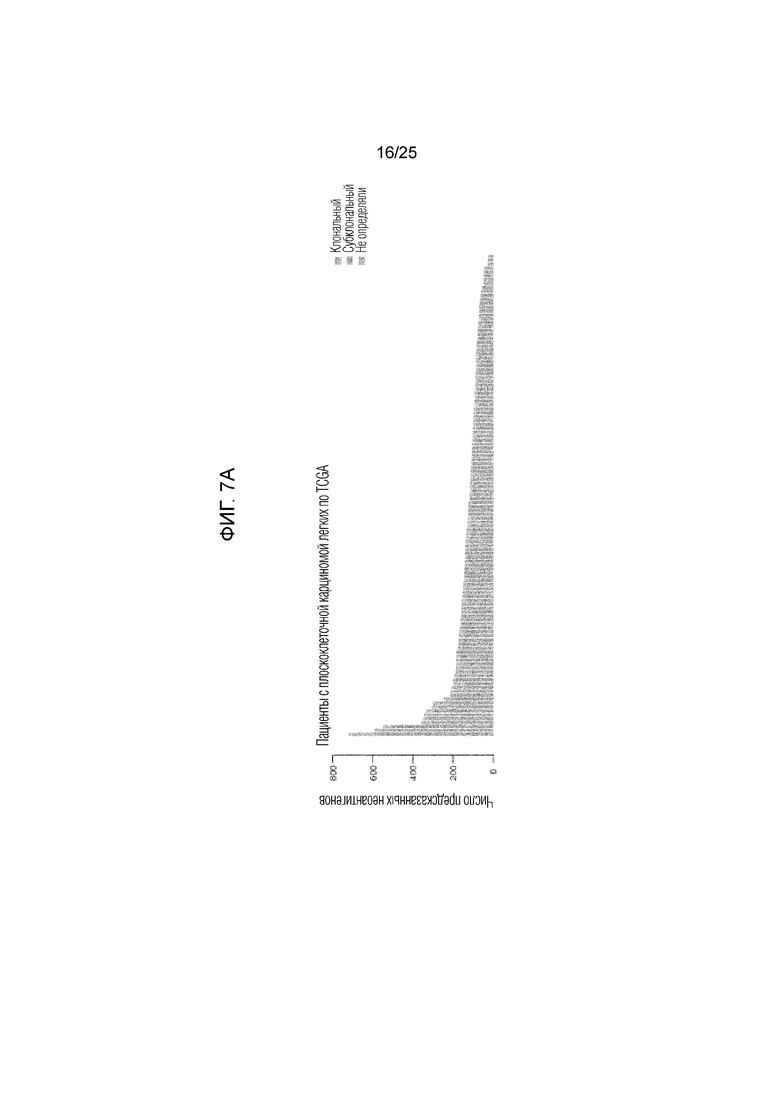
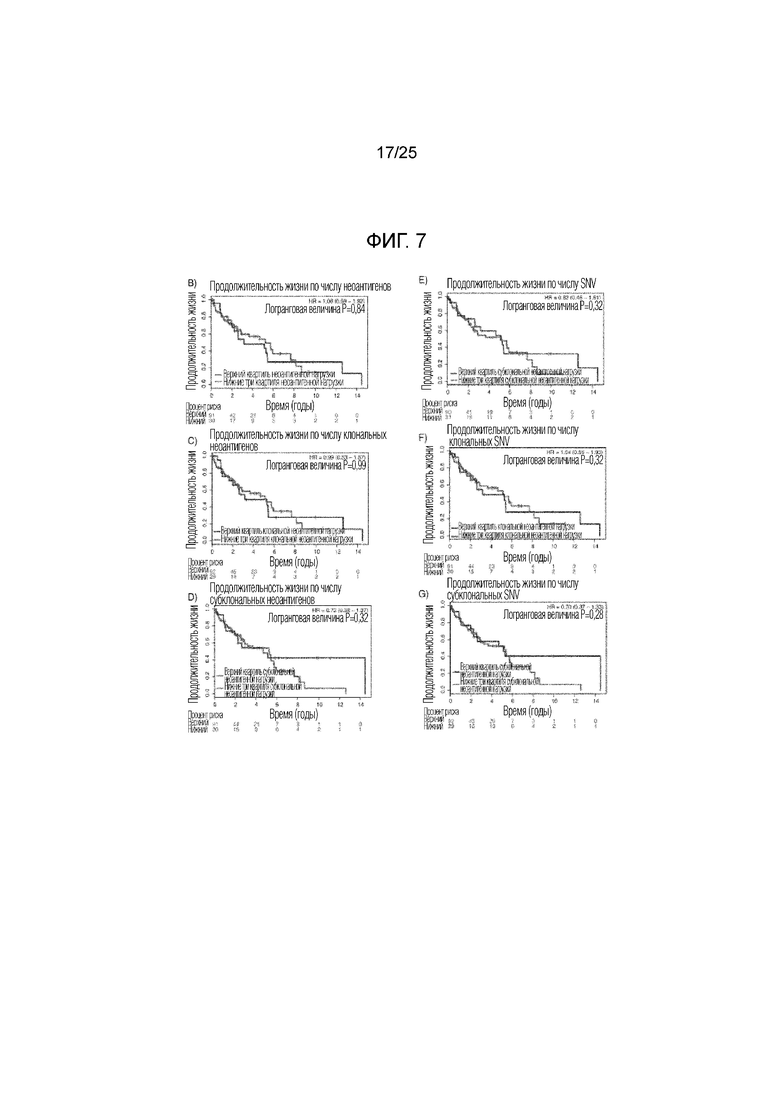
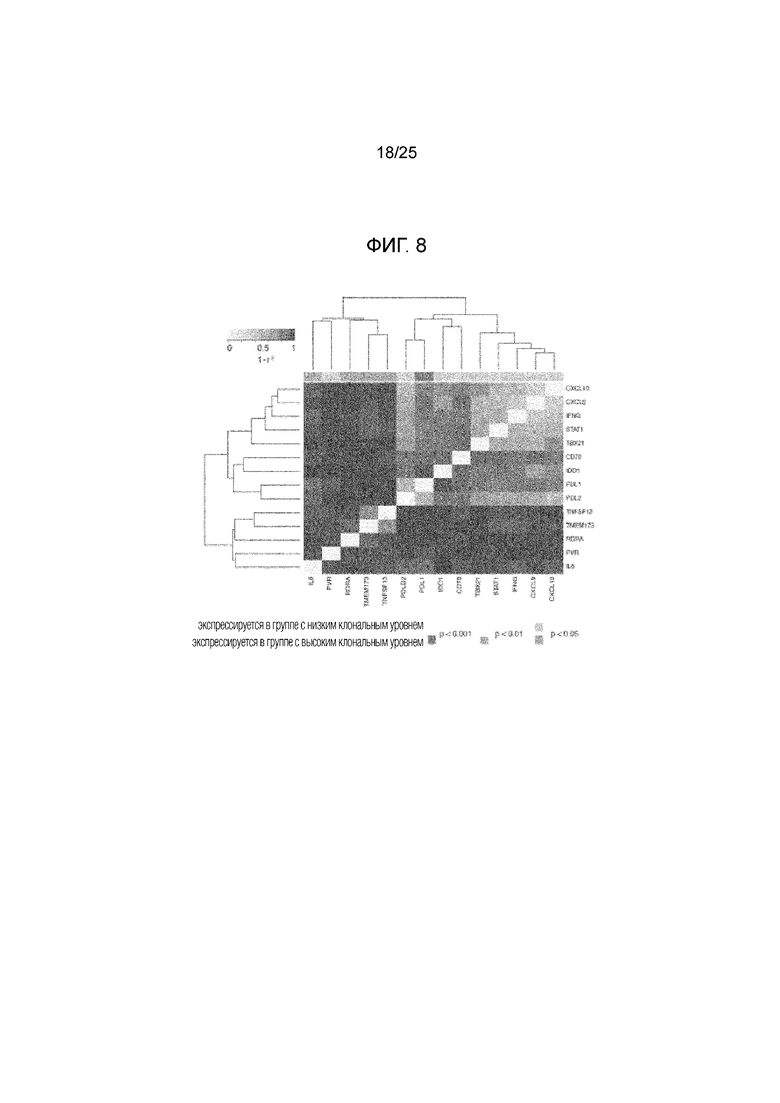
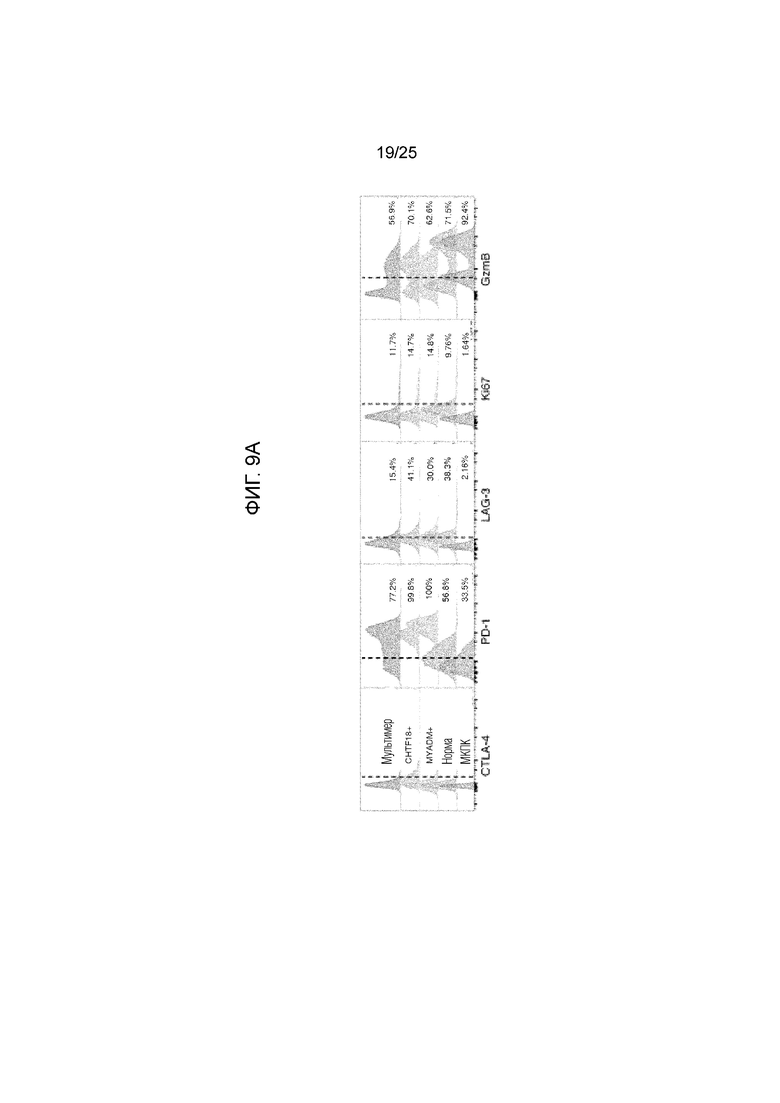

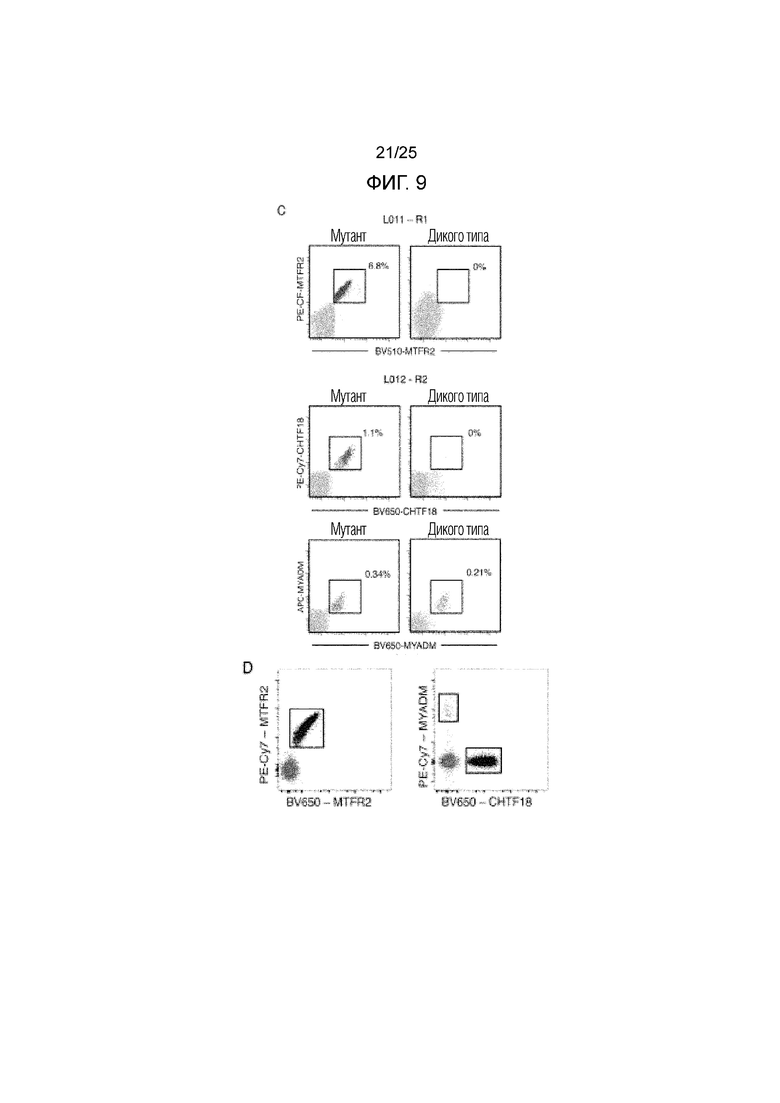

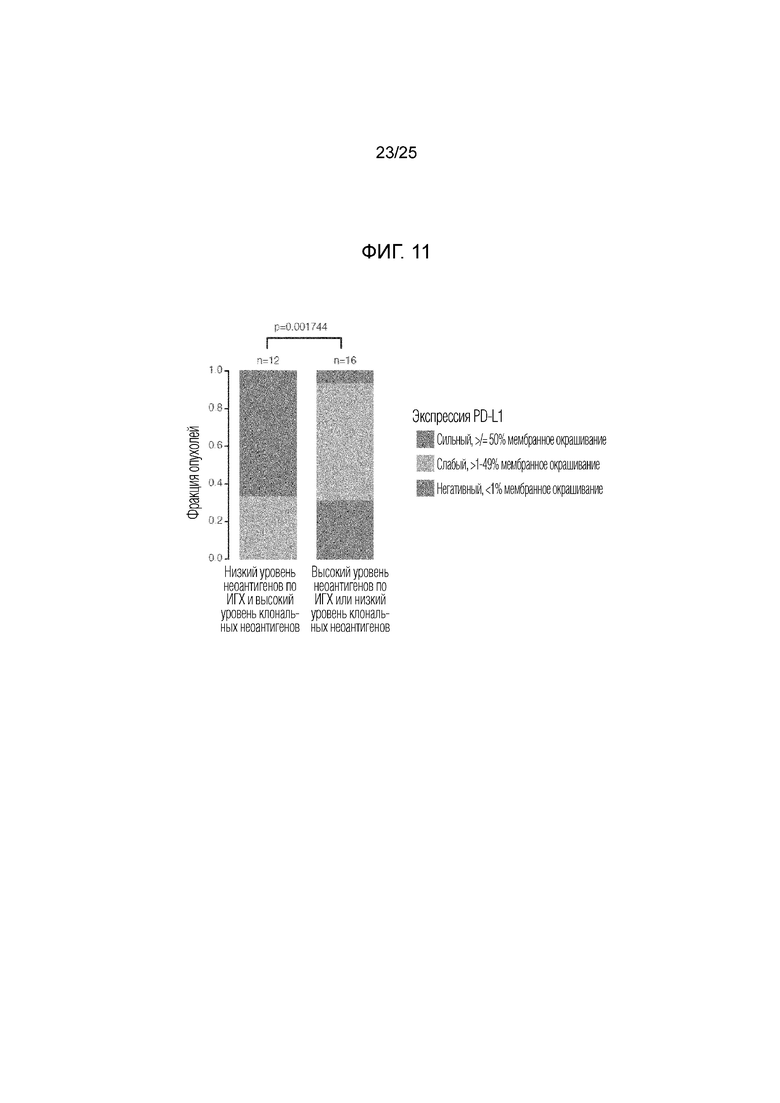
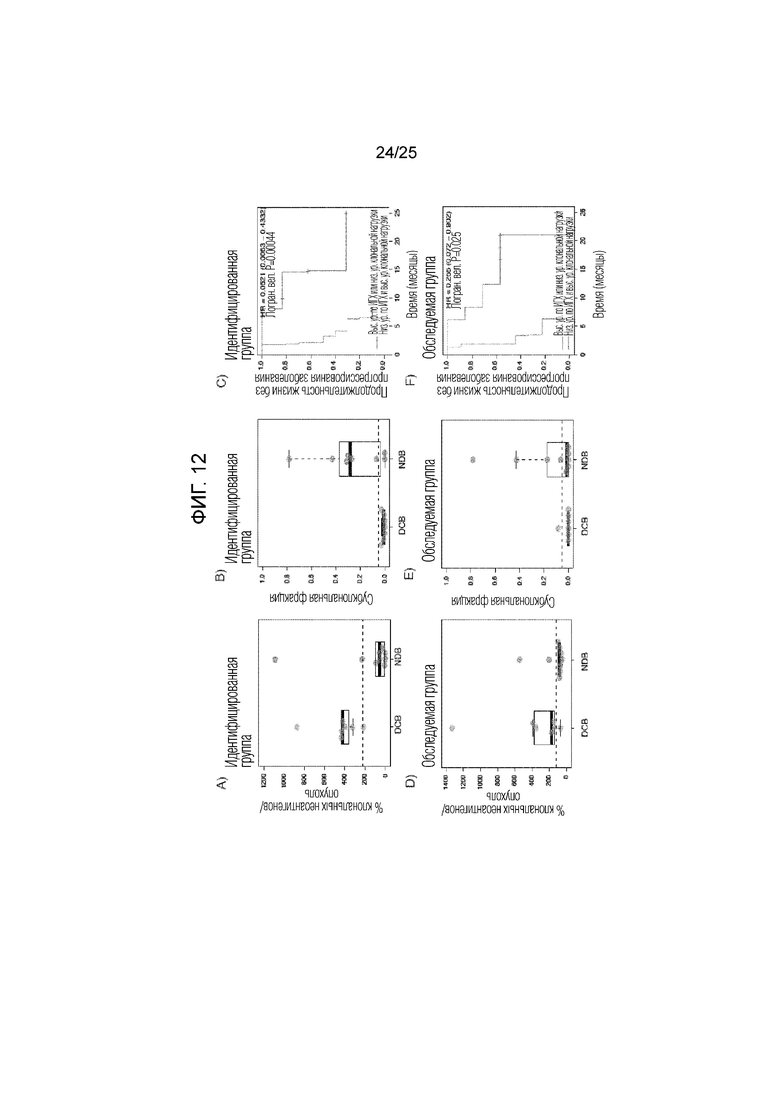
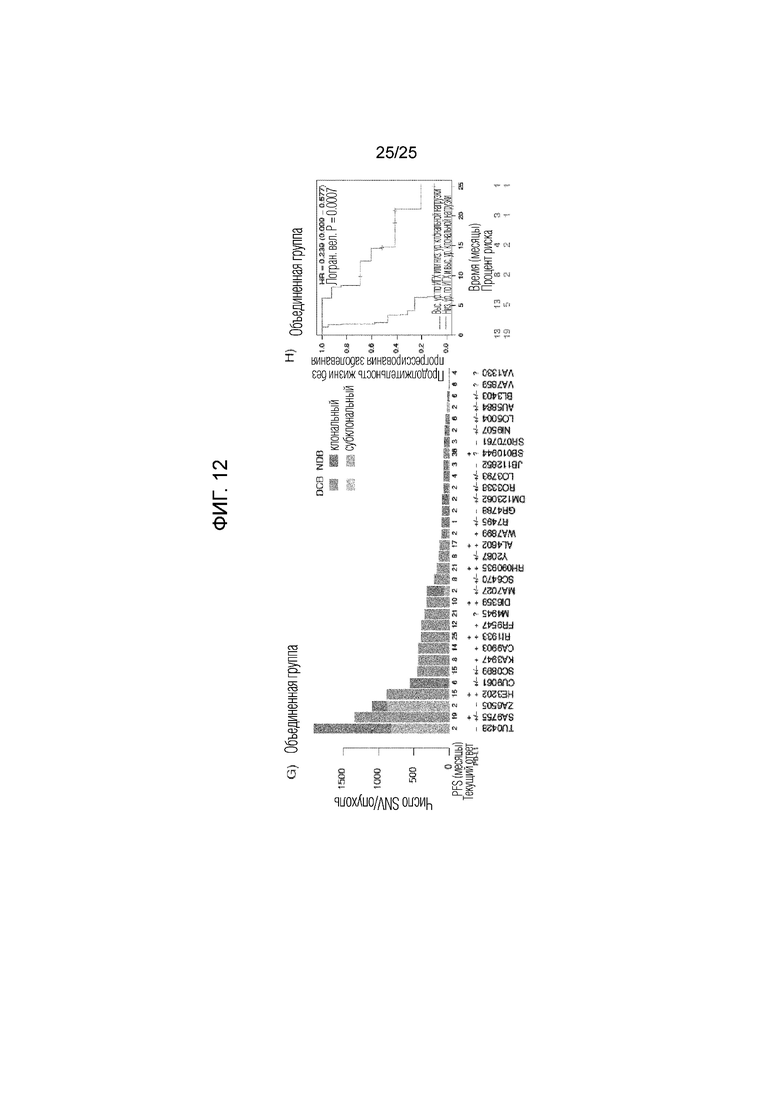
Группа изобретений относится к области медицины, а именно к онкологии и иммунологии, и предназначена для идентификации страдающего раком индивидуума, который является подходящим для лечения с использованием контрольных иммунных точек, а также к способам лечения таких индивидуумов. Способ идентификации страдающего онкологическим заболеванием индивидуума, который подходит для лечения путем воздействия на контрольные иммунные точки, где способ включает: (i) определение числа клональных неоантигенов в одной или более злокачественных клетках указанного индивидуума; и/или (ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более чем одной злокачественной клетке указанного индивидуума. Более высокое, чем медианное, число клональных неоантигенов, и/или более высокое, чем медианное, отношение клональных:субклональных неоантигенов, или более низкая, чем медианная, фракция субклональных неоантигенов по сравнению с контрольной группой онкологических пациентов является показателем ответа на лечение путем воздействия на контрольные иммунные точки. Для лечения или профилактики онкологического заболевания у индивида осуществляют следующие стадии: i) идентификацию страдающего онкологическим заболеванием индивидуума, который подходит для лечения путем воздействия на контрольные иммунные точки указанным выше способом; и ii) лечение указанного индивидуума путем воздействия на контрольные иммунные точки. Использование группы изобретений позволяет повысить эффективность лечения страдающего раком индивидуума. 6 н. и 22 з.п. ф-лы, 12 ил., 3 табл., 1 пр.
1. Способ идентификации страдающего онкологическим заболеванием индивидуума, который подходит для лечения путем воздействия на контрольные иммунные точки, где способ включает:
(i) определение числа клональных неоантигенов в одной или более злокачественных клетках указанного индивидуума; и/или
(ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более чем одной злокачественной клетке указанного индивидуума,
где более высокое, чем медианное, число клональных неоантигенов, и/или более высокое, чем медианное, отношение клональных:субклональных неоантигенов, или более низкая, чем медианная, фракция субклональных неоантигенов по сравнению с контрольной группой онкологических пациентов является показателем ответа на лечение путем воздействия на контрольные иммунные точки.
2. Способ по п.1, дополнительно предусматривающий определение профиля экспрессии молекул контрольных иммунных точек в злокачественных клетках и/или в опухоль-инфильтрирующих иммунных клетках указанного индивидуума, или типа опухоли, где дифференциальная экспрессия молекул контрольных иммунных точек по сравнению с контрольным образцом являются показателем ответа на лечение путем воздействия на контрольные иммунные точки.
3. Способ по п.1, где определение профиля экспрессии молекул контрольных иммунных точек осуществляют с помощью анализа на дифференциальную экспрессию гена по всей транскриптоме для идентификации генов, ассоциированных с дифференциальной экспрессией контрольных иммунных точек.
4. Способ по п.1 или 2, где влияние на иммунные контрольные точки включает воздействие на CTLA4, PD-1, PD-L1, Lag-3, Tim-3, TIGIT или BTLA.
5. Способ по п.4, где влияние на иммунные контрольные точки осуществляют пембролизумабом, ниволумабом, атезолизумабом или ипилимумабом.
6. Способ по любому из пп.1-5, где онкологическим заболеванием является немелкоклеточный рак легких (NSCLC) или меланома.
7. Способ по любому из пп.1-6, где индивидуумом является человек.
8. Способ прогнозирования онкологического заболевания или определения его прогноза у индивидуума, страдающего онкологическим заболеванием, где способ включает:
(i) определение числа клональных неоантигенов в одной или более злокачественных клетках указанного индивидуума; и/или
(ii) определение отношения клональных:субклональных неоантигенов и/или фракции субклональных неоантигенов в более чем одной злокачественной клетке указанного индивидуума;
где более высокое, чем медианное, число клональных неоантигенов, и/или более высокое, чем медианное, отношение клональных:субклональных неоантигенов, или более низкая, чем медианная, фракция субклональных неоантигенов по сравнению с контрольной группой онкологических пациентов является показателем благоприятного прогноза.
9. Способ по п.8, где влияние на иммунные контрольные точки включает воздействие на CTLA4, PD-1, PD-L1, Lag-3, Tim-3, TIGIT или BTLA.
10. Способ по п.9, где влияние на иммунные контрольные точки осуществляют пембролизумабом, ниволумабом, атезолизумабом или ипилимумабом.
11. Способ по любому из пп.8-10, где онкологическим заболеванием является немелкоклеточный рак легких (NSCLC) или меланома.
12. Способ по любому из пп.8-11, где индивидуумом является человек.
13. Способ лечения или профилактики онкологического заболевания у индивида, где указанный способ включает следующие стадии:
i) идентификацию страдающего онкологическим заболеванием индивидуума, который подходит для лечения путем воздействия на контрольные иммунные точки способом по п.1 или 2; и
ii) лечение указанного индивидуума путем воздействия на контрольные иммунные точки.
14. Способ лечения или профилактики онкологического заболевания у индивидуума, который включает лечение индивидуума, страдающего онкологическим заболеванием, путем воздействия на контрольные иммунные точки, где индивидуум был идентифицирован как:
(i) имеет более высокое, чем медианное, число клональных неоантигенов по сравнению с контрольной группой онкологических больных; и/или
(ii) имеющий более высокое, чем медианное, отношение клональных:субклональных неоантигенов или более низкую, чем медианная, фракцию субклональных неоантигенов по сравнению с контрольной группой онкологических больных.
15. Способ по п.14, где индивид был также идентифицирован как имеющий дифференциальную экспрессию молекулы контрольных иммунных точек в злокачественных клетках и/или в опухоль-инфильтрирующих иммунных клетках указанного индивидуума по сравнению с контрольным образцом незлокачественных клеток.
16. Способ по п.15, где определение профиля экспрессии молекул контрольных иммунных точек осуществляют с помощью анализа на дифференциальную экспрессию гена по всей транскриптоме для идентификации генов, ассоциированных с дифференциальной экспрессией контрольных иммунных точек.
17. Способ по любому из пп.13-15, где влияние на иммунные контрольные точки включает воздействие на CTLA4, PD-1, PD-L1, Lag-3, Tim-3, TIGIT или BTLA.
18. Способ по п.17, где влияние на иммунные контрольные точки осуществляют пембролизумабом, ниволумабом, атезолизумабом или ипилимумабом.
19. Способ по любому из пп.13-18, где онкологическим заболеванием является немелкоклеточный рак легких (NSCLC) или меланома.
20. Способ по любому из пп.13-19, где индивидуумом является человек.
21. Применение воздействия на контрольные иммунные точки в способе лечения или профилактики онкологического заболевания у индивидуума, где способ включает:
i) идентификацию страдающего онкологическим заболеванием индивидуума, который подходит для лечения путем воздействия на контрольные иммунные точки способом по любому из пп.1-3; и
ii) лечение указанного индивидуума путем воздействия на контрольные иммунные точки.
22. Применение воздействия на контрольные иммунные точки в способе лечения или профилактики онкологического заболевания у индивидуума, где индивидуум:
(i) имеет более высокое, чем медианное, число клональных неоантигенов по сравнению с контрольной группой онкологических больных; и/или
(ii) имеет более высокое, чем медианное, отношение клональных:субклональных неоантигенов или более низкую, чем медианная, фракцию субклональных неоантигенов по сравнению с контрольной группой онкологических больных.
23. Применение по п.22, где индивид также имеет дифференциальную экспрессию молекулы контрольных иммунных точек в злокачественных клетках и/или в опухоль-инфильтрирующих иммунных клетках указанного индивидуума по сравнению с контрольным образцом незлокачественных клеток или опухоли.
24. Применение по п.23, где определение профиля экспрессии молекул контрольных иммунных точек осуществляют с помощью анализа на дифференциальную экспрессию гена по всей транскриптоме для идентификации генов, ассоциированных с дифференциальной экспрессией контрольных иммунных точек.
25. Применение по любому из пп.21-23, где влияние на иммунные контрольные точки включает воздействие на CTLA4, PD-1, PD-L1, Lag-3, Tim-3, TIGIT или BTLA.
26. Применение по п.25, где влияние на иммунные контрольные точки осуществляют пембролизумабом, ниволумабом, атезолизумабом или ипилимумабом.
27. Применение по любому из пп.21-26, где онкологическим заболеванием является немелкоклеточный рак легких (NSCLC) или меланома.
28. Применение по любому из пп.21-27, где индивидуумом является человек.
| WO 2015103037 А2, 09.07.2015 | |||
| WO 2011143656 А2, 17.11.2011 | |||
| WO 2012159643 А1, 29.11.2012 | |||
| N | |||
| MCGRANAHAN ET AL, "Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade", SCIENCE (AMERICAN ASSOCIATION FOR THE ADVANCEMENT OF SCIENCE), WASHINGTON DC USA, (20160325), vol | |||
| Деревобетонный каток | 1916 |
|
SU351A1 |
| Авиа-шрапнель | 1922 |
|
SU6280A1 |
Авторы
Даты
2020-12-21—Публикация
2016-09-12—Подача