ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущество приоритета по международной заявке № PCT/CN2015/074227, поданной 13 марта 2015 г., содержание которой полностью включено в настоящий документ путем ссылки.
ПРЕДОСТАВЛЕНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ASCII
Содержание следующего предоставленного текстового файла ASCII полностью включено в настоящий документ путем ссылки: машиночитаемая форма (CRF) перечня последовательностей (название файла: 744852000141SEQLIST.TXT, дата записи: 11 марта 2016 г., размер: 7,83 КБ).
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунотерапии рака. Более конкретно, в данном изобретении предложены способы, композиции и наборы для лечения рака у субъекта с применением активированных T-клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Тело человека имеет сложную иммунную систему для защиты от заболеваний, включая злокачественные опухоли внутренних органов. Следовательно, давно существующим идеальным вариантом лечения и предотвращения рака в онкологии стало высвобождение возможностей собственной иммунной системы организма. Естественный иммунный ответ против опухоли обычно вызывается опухолевыми антигенами, включая мутантные белки, экспрессируемые исключительно в раковых клетках, и связанные с опухолью антигены (TAA), сверхэкспрессированные в пораженной раком ткани, но при этом не полностью распознаваемые как «собственные». Антигенпредставляющие клетки (APC), особенно дендритные клетки (DC), которые встречаются с опухолевыми антигенами, могут обрабатывать и представлять опухолевые антигены на своей клеточной поверхности. После созревания DC, нагруженные опухолевыми антигенами, могут запускать Т-клеточный ответ против раковых клеток, несущих опухолевые антигены, в котором задействованы цитотоксические Т-клетки, хелперные Т-клетки, функционально отличные эффекторные Т-клетки и Т-клетки памяти. Особенно сильный тип Т-клеточного ответа включает продукцию цитотоксических Т-клеток, которые могут уничтожать раковые клетки посредством высвобождения цитокинов, ферментов и цитотоксинов или посредством индуцирования проапоптозного сигнального каскада посредством межклеточных взаимодействий.
Противораковые иммунотерапевтические средства направлены на использование преимущества описанного выше процесса лечения рака, но до недавнего времени успех их применения был довольно ограничен. Первоначальные попытки были сосредоточены на разработке противораковых вакцин на основе конкретных антигенных пептидов, полноразмерных антигенных белков или вирусных векторов, кодирующих опухолевые антигены. Немногие созданные противораковые вакцины попали в клиники, а еще меньшее их число оказало впечатляющий клинический результат. В отличие от традиционной противораковой терапии, такой как химиотерапия, лучевая терапия и хирургическая резекция, в целом реакция организма на лечение с использованием противораковых иммунотерапевтических средств, особенно противораковых вакцин, является сильно замедленной, поскольку для того, чтобы APC обработали и представили антиген T-клеткам, а также для того, чтобы T-клетки созрели и вызвали иммунный ответ, необходимо время. Если у пациента есть опухоль, раковые клетки в опухоли уже имеют механизмы, чтобы избежать надзора, осуществляемого иммунной системой. Таким образом, успешная вакцина против опухоли должна обладать способностью обойти недостатки иммунного надзора, чтобы вызвать сильный иммунный ответ. Кроме того, противораковые вакцины имеют несколько серьезных недостатков, которые предотвращают появление специфических и стойких клинических эффектов. Во-первых, генетический состав и профиль экспрессии раковых клеток даже одного гистологического типа являются довольно неоднородными у разных пациентов и среди разных поражений у одного и того же пациента - явление, хорошо задокументированное с наличием множества генетических данных, полученных в недавно проведенных экспериментах секвенирования следующего поколения, которые проводили на раковых клетках (данные доступны в литературе и публичных базах данных). Следовательно, ограниченное число опухолевых антигенов при лечении конкретной противораковой вакциной вряд ли будет представлять широкий спектр антигенов, характерных для отдельных опухолей у всех пациентов. Во-вторых, многие антигенные фрагменты в противораковых вакцинах не загружены на APC эффективно из-за проблем с периодами полужизни и биодоступности в сыворотке. В-третьих, даже когда APC правильно праймированы антигенами, содержащимися в противораковых вакцинах, отсутствие приемлемых сигналов активации и микроокружения может привести к продукции неправильного подмножества Т-клеток, особенно иммуносупрессорных регуляторных Т-клеток (Treg), которые ингибируют иммунный ответ против опухолей вместо его стимуляции. Причина последних двух проблем связана с полным отсутствием контроля со стороны лечащих врачей реального ответа пациентов на любую противораковую вакцину после ее введения.
Подход клеточной иммунотерапии рака облегчает некоторые из вышеупомянутых проблем противораковых вакцин за счет введения пациентам иммуноопосредованных клеток или продуктов клеток, которые получают в относительно определенных и контролируемых условиях. В частности, большой интерес вызвали способы на основе DC, особенно после того как в апреле 2010 г. Управление по санитарному надзору за качеством пищевых продуктов и лекарственных средств (FDA) США одобрило применение препарата PROVENGE® (сипулейцел-Т) для лечения распространенного рака предстательной железы. Типичный способ иммунотерапии на основе DC включает выделение DC от пациента с раком, загрузку DC опухолевым антигеном (или антигенами, включая лизаты опухолевых клеток и общую мРНК) ex vivo и последующее введение DC обратно пациенту, чтобы вызвать Т-клеточный ответ, уничтожающий рак. PROVENGE®, например, включает воздействие на мононуклеарные клетки периферической крови пациента (PBMC) гибридным белком, содержащим полученный из опухоли антиген, связанный с цитокином (например, GM-CSF), и последующее введение пациенту путем инфузии PBMC (предположительно содержащих активированные DC, которые могут представлять Т-клеткам полученный из опухоли антиген) (см. патенты США № 5,976,546, № 6,080,409 и № 6,210,662). В основном исследовании фазы III (Kantoff PW, Higano CS et al. (2010) Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N J Med 363:411-22) был получен особый вариант осуществления PROVENGE® с использованием рекомбинантного белка простатической кислой фосфатазы (PAP), антигена, связанного с раком предстательной железы, слитого с цитокином GM-CSF, который, как известно, привлекает и индуцирует DC. Хотя благодаря применению PROVENGE® удалось продлить медианную выживаемость пациентов в экспериментальной группе (25,8 месяца) по сравнению с контрольной группой (21,7 месяца), результаты клинических испытаний не свидетельствовали о статистически достоверной задержке прогрессирования опухоли или уменьшении размера опухоли. Более тревожным является тот факт, что при лечении PROVENGE® выживание отдельных пациентов, по-видимому, не коррелирует со специфичными Т-клеточными ответами на гибридный белок или PAP (Cheever MA, Higano CS (2011) PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine. Clin. Cancer Res. 17:3520-6).
Второй способ подхода клеточной иммунотерапии, называемый «адоптивной лимфоцитарной терапией», включает выделение из опухоли пациента лимфоцитов, инфильтрирующих опухоль (TIL), выращивание TIL ex vivo и последующее обратное введение TIL пациенту путем инфузии после истощения нативных немиелоидных лимфоцитов пациента. При клиническом применении адоптивной лимфоцитарной терапии у пациентов с меланомой наблюдались выраженные клинические реакции, включая полный регресс опухоли и длительную безрецидивную выживаемость (Restifo NP, Dudley ME, and Rosenberg SA. (2012) Adoptive immunotherapy for cancer: harnessing the T cell response. Nat. Rev. Immunol. 12: 269-81). Дополнительно было показано, что клинические преимущества TIL связаны или являются результатом присутствующих в популяции TIL опухолеспецифических T-клеток (Robbins PF et al. (2013) Mining exomic sequencing data to identify mutated antigens recognized by adoptively transferred tumor-reactive T cells. Nature Biotechnol 19: 747-752; и Tran E et al. (2014) Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer Science 344: 641-645). Недавно Т-клетки со сконструированными Т-клеточными рецепторами, имеющими модифицированную аффинность к определенным опухолевым антигенам, или химерными антигенными рецепторами (CAR-T) дополнительно расширили возможности способа адоптивной лимфоцитарной терапии посредством модификации микроокружения взаимодействий Т-клеток и опухоли. Основная проблема применяемых в настоящее время способов адоптивной лимфоцитарной терапии связана с многочисленными сообщениями из клинических исследований о тяжелых неблагоприятных явлениях, включая токсичность в отношении ЦНС, которые, вероятно, связаны с неправильным выбором мишеней (так называемым «эффектом воздействия на мишени вне опухоли») и искаженным увеличением популяции T-клеток. Еще одна проблема подхода заключается в отсутствии долговременного ответа у некоторых пациентов из-за быстрого развития иммунологической толерантности к опухолеспецифическим антигенам, представленным на введенных путем инфузии Т-лимфоцитах, а также из-за ускользания раковых клеток от иммунного ответа.
Иммунологическая толерантность и ускользание от иммунного ответа часто опосредованы молекулами контрольных точек или коингибирующими сигналами на клетках, взаимодействующих с Т-клетками в микроокружении очага опухоли, в дополнение к повышенному уровню иммуносупрессорных клеток, таких как Treg и MDSC (миелоидные супрессорные клетки). Хорошо изученная пара молекул контрольных точек включает иммуноингибирующий рецептор PD-1 на T-клетках и лиганд PD-L1 на APC (например, DC), MDSC и раковых клетках. Связывание PD-L1 с PD-1 запускает сигнал ингибирования продукции провоспалительных цитокинов (например, IL-2) и пролиферации цитотоксических Т-клеток. Во многих сценариях связывание PD-L1 с PD-1 запускает апоптоз цитотоксических Т-клеток. С другой стороны, сигнализация PD-1/PD-L1 индуцирует клетки Treg, которые действуют для дополнительного ингибирования T-клеток с потенциалом атаки опухоли. В настоящее время несколькими фармацевтическими компаниями разрабатываются антитела к PD-1, PD-L1 и другим молекулам контрольных точек (таких как CTLA-4 на T-клетках) в качестве отдельного подхода иммунотерапии рака, основанного на теории о том, что блокада контрольных точек T-клеток может помочь в преодолении иммунологической толерантности и ускользания от иммунного ответа в очаге опухоли. Стоит отметить, что противоопухолевые эффекты подхода блокады контрольной точки требуют предварительного существования опухолеспецифических Т-клеток in vivo (Boussiotis VA (2014) Somatic mutations and immunotherapy outcome with CTLA-4 blockade in melanoma N. Engl. J. Med. 371:2230-2232; Wolchok JD and Chan TA, (2014) Cancer: antitumor immunity gets a boost Nature 515: 496-498).
Принимая во внимание перспективы и проблемы различных подходов к иммунотерапии рака, которые описаны выше, желательно предложить новый способ иммунотерапии рака, в котором будут сочетаться преимущества существующих способов и возможность избежать известных «ловушек».
Описания всех публикаций, патентов, патентных заявок и опубликованных патентных заявок, на которые даны ссылки в настоящем документе, полностью включены в настоящий документ путем ссылки.
Краткое изложение сущности изобретения
В настоящем изобретении предложены способы, композиции и наборы для лечения рака у субъекта с применением активированных T-клеток, индуцированных антигенпредставляющими клетками (такими как дендритные клетки), загруженными множеством опухолевых антигенных пептидов.
В одном аспекте настоящей заявки предложен способ лечения рака у субъекта (например, у субъекта-человека), включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления дендритные клетки вводят перед введением активированных Т-клеток (например, в период от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или от приблизительно 7 суток до приблизительно 21 суток перед введением).
В некоторых вариантах осуществления по любому из описанных выше способов перед этапами введения способ дополнительно включает получение активированных Т-клеток посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток).
В некоторых вариантах осуществления по любому из описанных выше способов перед совместным культивированием популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
В некоторых вариантах осуществления по любому из описанных выше способов способ дополнительно включает получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками.
В некоторых вариантах осуществления по любому из описанных выше способов популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от субъекта, получающего лечение.
В одном аспекте настоящей заявки предложен способ получения популяции активированных T-клеток, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции РВМС от субъекта. В некоторых вариантах осуществления этап b) включает приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками. В некоторых вариантах осуществления этап b) дополнительно включает приведение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в контакт с множеством агонистов Toll-подобного рецептора (TLR) (таких как polyIC, MALP, R848 или любая их комбинация) для индуцирования созревания популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления этап c) дополнительно включает приведение популяции активированных T-клеток в контакт с множеством цитокинов и необязательно с антителом к CD3 для индуцирования пролиферации и дифференциации популяции активированных T-клеток. В некоторых вариантах осуществления множество цитокинов содержит IL-2, IL-7, IL-15 или IL-21. В некоторых вариантах осуществления перед совместным культивированием популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки. В некоторых вариантах осуществления этап c) включает совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
Дополнительно предложен способ лечения рака у субъекта (например, у субъекта-человека), включающий введение субъекту эффективного количества популяции активированных T-клеток, полученных посредством любого из способов, описанных в предшествующем абзаце. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака активированные T-клетки вводят субъекту по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных Т-клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев (например, от приблизительно 0,5 месяца до приблизительно 2 месяцев).
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят в дозе, составляющей по меньшей мере приблизительно 3×109 клеток/субъект. В некоторых вариантах осуществления активированные T-клетки вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением дендритных клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев (например, от приблизительно 0,5 месяца до приблизительно 2 месяцев).
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки вводят в дозе от приблизительно 1×106 до приблизительно 5×106 клеток/субъект.
В одном аспекте настоящей заявки предложен способ лечения рака у субъекта (например, субъекта-человека), включающий: a) приведение популяции BMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; и b) введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления этап (a) включает приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев (например, от приблизительно 0,5 месяца до приблизительно 2 месяцев). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления активированные PBMC вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
В некоторых вариантах осуществления по любому из описанных выше способов каждый из множества опухолевых антигенных пептидов имеет длину от приблизительно 20 до приблизительно 40 аминокислот. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-I. В некоторых вариантах осуществления по меньшей мере один пептид, содержащий эпитоп MHC-I, дополнительно содержит дополнительные аминокислоты, фланкирующие эпитоп на N-конце, C-конце или на обоих концах.
В некоторых вариантах осуществления по любому из описанных выше способов множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-II. В некоторых вариантах осуществления по меньшей мере один пептид, содержащий эпитоп MHC-II, дополнительно содержит дополнительные аминокислоты, фланкирующие эпитоп на N-конце, C-конце или на обоих концах.
В некоторых вариантах осуществления по любому из описанных выше способов множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов дополнительно содержит вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит от приблизительно 10 до приблизительно 20 общих опухолевых антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит от приблизительно 1 до приблизительно 10 специфичных для типа рака антигенных пептидов.
В некоторых вариантах осуществления по любому из описанных выше способов множество опухолевых антигенных пептидов содержит неоантигенный пептид. В некоторых вариантах осуществления неоантигенный пептид выбирают на основании генетического профиля образца опухоли, полученного от субъекта.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака рак выбирают из группы, состоящей из гепатоцеллюлярной карциномы, рака шейки матки, рака легких, колоректального рака, лимфомы, рака почки, рака молочной железы, рака поджелудочной железы, рака желудка, рака пищевода, рака яичников, рака предстательной железы, рака носоглотки, меланомы и рака головного мозга.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака субъекта выбирают для способа лечения на основании мутационной нагрузки в раковой опухоли. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку в раковой опухоли. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку в одном или более генах MHC. В некоторых вариантах осуществления субъект имеет не более чем приблизительно 10 мутаций в одном или более генах MHC. В некоторых вариантах осуществления один или более генов MHC представляют собой гены MHC класса I. В некоторых вариантах осуществления, в которых субъект представляет собой субъекта-человека, один или более генов MHC выбирают из группы, состоящей из HLA-A, HLA-B, HLA-C и B2M. В некоторых вариантах осуществления субъект не имеет мутации в B2M. В некоторых вариантах осуществления субъект не имеет мутации в функциональных областях (таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3) одного или более генов MHC. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака субъекта выбирают для способа лечения на основании наличия одного или более неоантигенов в раковой опухоли. В некоторых вариантах осуществления субъект имеет по меньшей мере 5 неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию ракового неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит неоэпитоп в неоантигене. В некоторых вариантах осуществления неоантиген идентифицируют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления указанное секвенирование представляет собой целевое секвенирование связанных с раком генов. В некоторых вариантах осуществления способ дополнительно включает определение аффинности неоэпитопа к молекуле MHC. В некоторых вариантах осуществления способ дополнительно включает определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору. В некоторых вариантах осуществления молекула MHC представляет собой молекулу MHC класса I. В некоторых вариантах осуществления молекулу MHC получают от субъекта.
В некоторых вариантах осуществления по любому из описанных выше способов лечения рака способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток или активированных PBMC. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ лечения повторяют с применением множества специализированных опухолевых антигенных пептидов.
В одном аспекте настоящей заявки предложен способ клонирования опухолеспецифического Т-клеточного рецептора, включающий: (a) проведение лечения субъекта любым из описанных выше способов лечения рака; (b) выделение у субъекта Т-клетки, которая специфически распознает опухолевый антигенный пептид во множестве опухолевых антигенных пептидов; и (c) клонирование из Т-клетки Т-клеточного рецептора с получением опухолеспецифического Т-клеточного рецептора. В некоторых вариантах осуществления для субъекта характерен сильный специфический иммунный ответ против опухолевого антигенного пептида. В некоторых вариантах осуществления Т-клетку выделяют из образца PBMC, полученного от субъекта. В некоторых вариантах осуществления опухолевый антигенный пептид представляет собой неоантигенный пептид.
Также предложены опухолеспецифический Т-клеточный рецептор, клонированный с использованием любого из описанных выше способов клонирования опухолеспецифического Т-клеточного рецептора, выделенная Т-клетка, содержащая опухолеспецифический Т-клеточный рецептор, и способ лечения рака у субъекта, включающий введение субъекту эффективного количества выделенной Т-клетки.
Дополнительно предложена выделенная популяция клеток (например, активированных T-клеток или активированных PBMC), полученная посредством любого из описанных выше способов получения.
В одном аспекте настоящей заявки предложена выделенная популяция клеток, содержащая активированные T-клетки, причем менее приблизительно 1% активированных Т-клеток являются регуляторными Т-клетками (Treg).
В некоторых вариантах осуществления по любой из описанных выше выделенных популяций клеток выделенная популяция клеток содержит от приблизительно 0,3% до приблизительно 0,5% клеток CD4+CD25+Foxp3+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 65% до приблизительно 75% клеток CD3+CD8+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 16% до приблизительно 22% клеток CD3+CD4+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 13% до приблизительно 15% клеток CD3+CD56+.
В некоторых вариантах осуществления по любой из описанных выше выделенных популяций клеток активированные T-клетки способны вызывать специфический ответ на множество опухолевых антигенных пептидов in vivo или ex vivo. В некоторых вариантах осуществления активированные T-клетки экспрессируют множество провоспалительных молекул. В некоторых вариантах осуществления множество провоспалительных молекул содержит IFNγ, TNFα, гранзим B или перфорин.
В некоторых вариантах осуществления по любой из описанных выше выделенных популяций клеток активированные T-клетки не экспрессируют или имеют низкий уровень экспрессии множества иммуносупрессорных цитокинов. В некоторых вариантах осуществления множество иммуносупрессорных цитокинов содержит IL-10 или IL-4.
В некоторых вариантах осуществления по любой из описанных выше выделенных популяций клеток менее приблизительно 5% активированных Т-клеток экспрессируют иммуноингибирующую молекулу PD-1.
В некоторых вариантах осуществления по любой из описанных выше выделенных популяций клеток по меньшей мере приблизительно 90% клеток в выделенной популяции клеток представляют собой активированные T-клетки.
В одном аспекте настоящей заявки предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-35. В некоторых вариантах осуществления по меньшей мере 10 опухолевых антигенных пептидов выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
Дополнительно предложены наборы, лекарственные средства и промышленные изделия, содержащие любую из композиций (таких как выделенные популяции клеток или композиции опухолевых антигенных пептидов), как описано выше.
Данные и другие аспекты и преимущества настоящего изобретения станут очевидными из приведенного ниже описания и прилагаемой формулы изобретения. Следует понимать, что одна, несколько или все характерные особенности различных вариантов осуществления, описанных в настоящем документе, можно объединять с образованием других вариантов осуществления настоящего изобретения.
Краткое описание рисунков
На ФИГ. 1 показаны два предпочтительных варианта осуществления способа специфичной к нескольким антигенам клеточной терапии (MASCT), включая расчет времени на этапы получения DC и T-клеток и введение (-ия) конкретных композиций на основе клеток. Стрелки под строкой времени указывают на этапы введения.
На ФИГ. 2A-2C показан способ изготовления клеток для примера способа MASCT, описанного в примере 1. На ФИГ. 2A представлена принципиальная схема, иллюстрирующая способ изготовления клеток предпочтительного варианта осуществления способа MASCT. На ФИГ. 2B показан пример композиции пула антигенных пептидов HCC, загруженных в DC, для лечения пациентов с HCC с использованием способа MASCT. Некоторые опухолевые антигенные пептиды использовали в клинических исследованиях противораковой иммунотерапии; включены ссылки на такие DC-вакцины, адоптивный перенос клеток (ACT) и пептидные вакцины. OC: рак яичников; BC: рак молочной железы; PC: рак поджелудочной железы; LC: рак легких; RCC: рак почки; HCC: гепатоцеллюлярная карцинома. На ФИГ. 2C показан список эпитопов, содержащихся в пуле пептидов HCC.
На ФИГ. 3 показано клеточное поглощение опухолевых антигенных пептидов клетками iDC. На полученные из человеческих моноцитов iDC оказывали импульсное воздействие флуоресцентно мечеными пептидами сурвивина (второй столбец слева, 2,5 мкг/мл) в течение 2 часов, после чего метили DAPI (первый столбец слева) и LYSOTRACKER® (второй столбец справа) для идентификации ядер и лизосом соответственно. Флуоресцентные изображения регистрировали с помощью конфокальной микроскопии (Leica TCSST5), масштабная шкала составляла 7,5 мкм, а изображения представляли четыре независимых эксперимента.
На ФИГ. 4A-4B показаны характеристики зрелых DC, полученных в примере 1. На ФИГ. 4A показаны результаты проточной цитометрии до (серые пики) и после (черные пики) созревания DC с агонистами TLR. Молекулярные маркеры, на которые нацелены антитела, используемые для разделения клеток в экспериментах проточной цитометрии, указаны выше каждой хроматограммы. Процент DC с высокими уровнями экспрессии (в пределах отмеченного диапазона) каждого молекулярного маркера указан внутри каждой панели. Результаты показывают, что большая часть зрелых DC показывает сигнатуру клеточной поверхности для активации цитотоксических Т-клеток. DC экпрессируют молекулы MHC класса II и костимулирующие сигнальные лиганды CD86, CD80 и CD83, а также рецептор созревания CCR7, но с низким уровнем экспрессии CD14, который обычно экспрессируется в незрелых DC. На ФИГ. 4B показан уровень секреции цитокинов зрелыми DC, полученными в примере 1. Как и ожидалось от функциональных зрелых DC, эти DC секретировали провоспалительный цитокин IL-12 на высоком уровне, а иммуносупрессорный цитокин IL-10 -на низком уровне.
На ФИГ. 5A-5E показаны характеристики активированных Т-клеток, полученных в примере 1. На ФИГ. 5A показан рост T-клеток после от 14 до 17 суток культивирования на основе подсчета клеток с использованием метода исключения красителя трипанового синего. Показана медиана образцов от 10 пациентов. На ФИГ. 5B показаны процентные доли подмножеств Т-клеток в совместной культуре, указывающие на чрезвычайно низкий уровень клеток Treg (CD4+CD25+Foxp3+, 0,4% ± 0,1%) среди активированных T-клеток. На ФИГ. 5C показаны круговые диаграммы, отображающие процентные доли подмножеств T-клеток, которые коэкспрессируют цитокины (IFNγ и TNFα) и фермент гранзим B. Для каждой группы показано среднее значение ± стандартная ошибка измерения (SEM) для пяти пациентов. Троекратные производители: темно-серый; двукратные производители: светло-серый; однократные производители: черные; непроизводители: белый. На ФИГ. 5D показаны полученные с помощью проточной цитометрии трехмерные хроматограммы активированных Т-клеток, полученных из PBMC от пациентов, и совместно культивированных с импульсными DC, которые дополнительно стимулировали форбол-12-миристат-13-ацетатом (PMA) в течение приблизительно 4 часов. Данные представляют результаты пяти независимых экспериментов. Активированные T-клетки содержали большое подмножество цитотоксических T-клеток CD3+CD8+, хелперных Т-клеток CD3+CD4+ и Т-клеток-NK CD3+CD56+, для большинства из которых была характерна высокая внутриклеточная продукция провоспалительных цитокинов (IFNγ и TNFα) и протеазы гранзима B. На ФИГ. 5E показаны полученные с помощью проточной цитометрии трехмерные хроматограммы выделенных от пациентов неактивированных Т-клеток, стимулированных PMA, в течение приблизительно 4 часов. Неактивированные T-клетки имели только низкие уровни экспрессии IFNγ, TNFα и гранзима B.
На ФИГ. 6A-6F показаны молекулярные и функциональные характеристики активированных Т-клеток, полученных в примере 1. На ФИГ. 6A показана секреция различных цитокинов активированными T-клетками. Полученные от пациентов с HCC клетки секретировали значительное количество IFNγ и TNFα, но незначительное количество (или отсутствие секреции) IL10 и IL4. Показано среднее значение ± SEM от 6 пациентов. На ФИГ. 6B-6C показана уменьшенная частота экспрессии PD-1 на поверхности подмножеств Т-клеток CD3+CD8+ (ФИГ. 6B) и CD3+CD4+ (ФИГ. 6C), выделенных от пациентов с HCC, в сравнении со здоровыми донорами. Представлен процент экспрессии и статистические данные от 7 пациентов. На ФИГ. 6D показано уменьшение частоты T-клеток, экспрессирующих PD-1, в подмножествах T-клеток CD3+CD8+ после активации ex vivo. На ФИГ. 6E показано уменьшение частоты T-клеток, экспрессирующих PD-1, в подмножествах T-клеток CD3+CD4+ после активации ex vivo. Представлен процент экспрессии и статистические данные от 7 пациентов. На ФИГ. 6F показана ограниченная HLA (или MHC) цитотоксичность активированных Т-клеток. Активированные T-клетки получали из PBMC пациентов с HLA-A2+ (n=7, группа слева), которые показывали более высокие уровни цитотоксической активности в отношении клеточной линии HCC HepG2 (белые столбцы, HLA-A2+), чем в отношении клеток HuH-7 (заштрихованные столбцы, HLA-A2-), в то время как активированные T-клетки, полученные из PBMC пациентов с HLA-A2- (n=7, группа справа), показывали аналогичные уровни цитотоксичности в отношении этих двух клеточных линий. Относительное соотношение эффекторных T-клеток (полученных активированных T-клеток) и клеток-мишеней (клеток HepG2 или HuH-7; соотношение E: T) в каждом эксперименте лизиса клеток составляло приблизительно 40: 1.
На ФИГ. 7A показана блок-схема, иллюстрирующая включение пациентов в ретроспективный анализ клинических данных по лечению MASCT и исключение из этого анализа, как описано в примере 1.
На ФИГ. 7B показана принципиальная схема ретроспективного анализа пациентов с HCC стадии B (по классификации стадий рака печени клиники Барселоны), в отношении которых проводили непрерывное лечение и регулярное наблюдение.
На ФИГ. 8A показаны характеристики, лечение и оценка по шкале RECIST пациентов с гепатоцеллюлярной карциномой (стадия B) в контрольной группе, которая проанализирована в примере 1.
На ФИГ. 8B показаны характеристики, виды лечения и оценка по шкале RECIST пациентов с гепатоцеллюлярной карциномой (стадия B), которые получали только стандартную терапию в течение 1 года после постановки диагноза (группа Con, n=17).
На ФИГ. 9A показаны характеристики, лечение и оценка по шкале RECIST пациентов с гепатоцеллюлярной карциномой (стадия B) в группе лечения MASCT, которая проанализирована в примере 1.
На ФИГ. 9B показаны характеристики, лечение и оценка по шкале RECIST пациентов с гепатоцеллюлярной карциномой (стадия B), получавших множество курсов лечения MASCT в течение 1 года после постановки диагноза (группа Con+MASCT, n=15).
На ФИГ. 10A показано краткое сравнение пациентов контрольной группы и группы лечения MASCT, проанализированных в примере 1.
На ФИГ. 10B показаны характеристики пациентов с гепатоцеллюлярной карциномой (стадия B), включенных в ретроспективный анализ.
На ФИГ. 11A-11F показаны иммунные ответы, возникшие у пациентов с HCC после лечения (-ий) MASCT, как описано в примере 1. На ФИГ. 11A показано значительное снижение процента Treg в PBMC у 4 пациентов после получения 3 курсов лечения MASCT. Представлен процент экспрессии и статистические данные от 4 пациентов. На ФИГ. 11B показано увеличение процента пролиферирующих Т-клеток в образцах РВМС от 7 различных пациентов с НСС, которые получали лечение MASCT. На ФИГ. 11C показано увеличение процента INFγ-продуцирующих цитотоксических Т-клеток (CD8+ INFγ+) в образцах РВМС от 7 различных пациентов с HCC, которые получали лечение MASCT. На ФИГ. 11D показаны полученные с помощью проточной цитометрии хроматограммы образца PBMC от пациента с HCC, который получал лечение MASCT. Эти результаты указывают, что INFγ-продуцирующие цитотоксические Т-клетки (CD8+ INFγ+) коэкспрессировали CD27 и CD28, что позволяет предположить возможность высокого потенциала приобретения иммунной памяти HCC-специфичного Т-клеточного ответа. На ФИГ. 11E показано повышение внутриклеточной продукции IFNγ Т-клетками CD8+, полученными от пациентов с HCC, после проведения 3 курсов лечения MASCT. PBMC выделяли от пациентов перед и после проведения 3 курсов MASCT соответственно для измерения Т-клеточного ответа. На ФИГ. 11F показана специфическая пролиферация Т-клеток, которая последовательно увеличивается у пациентов во время множества курсов лечения с применением клеточной терапии MASCT. PBMC выделяли от пациентов перед и после проведения 1 курса и 3 курсов лечения MASCT соответственно. T-клеточную пролиферацию у 2 пациентов измеряли посредством окрашивания EdU (5-этинил-2'-дезоксиуридин). Как показано на ФИГ. 11B-11F, специфические Т-клеточные ответы измеряли после стимуляции PBMC пулом антигенных пептидов HCC (HCC-pep). Контрольные ответы измеряли после стимуляции РВМС пулом нерелевантных пептидов (ir-pep, контроль). Все кратные изменения рассчитывали посредством нормализации значения специфического ответа к значению контрольного ответа.
На ФИГ. 12A-12D показаны специфические иммунные ответы против антигенных пептидов HCC у пациентов из примера 1. Средние показатели иммунных ответов против отдельных антигенных пептидов HCC у пациентов с HCC после множества курсов лечения MASCT (ФИГ. 12A; n=6) и у пациентов с HCC, которым не проводили ни одного курса лечения MASCT (ФИГ. 12B; n=5). На ФИГ. 12C показан специфический иммунный ответ против каждого вида антигенных пептидов HCC у одного пациента перед (незакрашенный столбец) и после 3 курсов лечения MASCT (заштрихованный столбец). На ФИГ. 12D показано последовательное увеличение специфического иммунного ответа против каждого вида антигенных пептидов HCC у второго пациента с HCC во время проведения множества курсов лечения MASCT (белый столбец: перед лечением; серый: после 1 курса лечения; заштрихованный столбец: после 3 курсов лечения). Секрецию IFNγ PBMC пациента, стимулированных отдельными антигенными пептидами HCC, рассчитывали с помощью анализа ELISPOT. Результаты показаны как среднее значение ± SEM кратности изменений секреции IFNγ по сравнению с нестимулированными PBMC. Цифрами указано количество ответивших пациентов/общее количество пациентов. Расположенная выше пунктирная линия указывает на значение отсечения 1,5-кратного повышения. W/O: без стимуляции.
На ФИГ. 13A-13D показаны клинические данные пациента WJ с метастатическим раком шейки матки, который получал 7 курсов лечения MASCT. На ФИГ. 13A, ФИГ. 13B и ФИГ. 13D представлены результаты ECT, полученные у пациента в декабре 2013 г. (перед началом лечения MASCT), в июне 2014 г. (после проведения 10 процедур локальной лучевой терапии с последующими 3 курсами лечения MASCT) и в декабре 2014 г. (после проведения всех 7 курсов лечения MASCT). Стрелками и кругами указаны места метастазирования на правой крестцово-подвздошной кости, демонстрирующие уменьшение метастатической опухоли и отсутствие дополнительных метастазов в ответ на лечение MASCT. На ФИГ. 13C показан специфический иммунный ответ против пула антигенных пептидов рака шейки матки (пул CC pep) и каждый тип антигенных пептидов в пуле после лечения MASCT. PBMC выделяли от пациента перед проведением лечения MASCT и после проведения всех 6 курсов лечения MASCT и стимулировали пулом CC pep и каждым отдельным антигенным пептидом в пределах пула. Каждый столбец представляет уровень иммунного ответа РВМС пациента после проведения лечения MASCT в зависимости от каждого антигенного пептида (или пула CC pep), измеренного по кратности изменений IFNγ (ось Y) относительно соответствующего ответа PBMC пациента перед лечением MASCT. W/O=ответ без стимуляции каким-либо антигенным пептидом. ENV относится к эксперименту с нерелевантным пептидом. Пунктирная линия указывает порог отсутствия повышенного иммунного ответа, измеряемого посредством кратности изменений IFNγ. Стрелками показаны специфические антигенные пептиды, вызвавшие повышенный иммунный ответ по результатам измерения кратности изменений IFNγ.
На ФИГ. 14 показан краткий обзор истории лечения пациента, описанного в примере 2.
На ФИГ. 15 показана схема примера проведения эксперимента по получению активированных Т-клеток.
На ФИГ. 16A показаны результаты цитометрии посредством сортировки клеток с активацией флуоресценции (FACS) зрелых дендритных клеток с использованием антитела к PD-L1 и антитела к CD11c. На ФИГ. 16B показаны уровни экспрессии PD-1 T-клетками в образцах PBMC, полученных от четырех разных доноров, перед активацией и через 8 суток после активации.
На ФИГ. 17A показана процентная доля специфичных в отношении пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной или 2-кратной стимуляцией антигенными пептидами в присутствии антитела к PD-1 (ниволумаба) или в его отсутствие. На ФИГ. 17B показана процентная доля специфичных в отношении функционального пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной или 2-кратной стимуляцией антигенными пептидами в присутствии антитела к PD-1 или в его отсутствие. На ФИГ. 17C показана процентная доля специфичных в отношении пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной или 2-кратной стимуляцией антигенными пептидами в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие. На ФИГ. 17D показана процентная доля специфичных в отношении функционального пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной или 2-кратной стимуляцией антигенными пептидами в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие.
На ФИГ. 18 показана схема примера проведения эксперимента по получению активированных Т-клеток.
На ФИГ. 19A показана процентная доля специфичных в отношении пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной стимуляцией антигенными пептидами и культивированием от 5 суток до 10 суток в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие. На ФИГ. 19B показана процентная доля специфичных в отношении пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной стимуляцией антигенными пептидами и культивированием в течение 10 суток или с 2-кратной стимуляцией антигенными пептидами и культивированием после второй стимуляции в течение 5 суток в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие. На ФИГ. 19C показана процентная доля специфичных в отношении функционального пептида Т-клеток CD8+ в образцах совместной культуры с 1-кратной стимуляцией антигенными пептидами и культивированием в течение 10 суток или с 2-кратной стимуляцией антигенными пептидами и культивированием после второй стимуляции в течение 5 суток в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие.
На ФИГ. 20A-20B показано общее количество T-клеток в совместных культурах из PBMC от двух различных доноров с течением времени в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие.
На ФИГ. 21A-21B показана процентная доля клеток, экспрессирующих на клеточной поверхности PD-1, в совместных культурах из PBMC от двух различных доноров с течением времени в присутствии антитела к PD-1 (SHR-1210 или ниволумаба) или в его отсутствие.
На ФИГ. 22 показаны статистические данные секвенирования следующего поколения (NGS) 333 связанных с раком генов в образцах опухоли и клинические оценки 5 пациентов, описанных в примере 5.
На ФИГ. 23A-23B показан классификационный анализ посредством модели полиномиальной смеси Дирихле (DMM) для 35 образцов опухоли. На ФИГ. 23A показано число групп с наилучшим образом подходящей классификацией. На ФИГ. 23B показан график классификации DMM для 35 образцов опухоли. 14 образцов были объединены в группу DMM 1 (красный цвет, в рамке A), а 21 образец был объединен в группу DMM 0 (зеленый цвет, в рамке B).
На ФИГ. 24A-24B показан кластерный анализ 35 образцов опухолевой ткани на основе мутационной нагрузки 333 онкогенов в каждом образце. На ФИГ. 24A показана тепловая карта 35 образцов опухоли, объединенных на основе мутационной нагрузки, обнаруженной в каждом из 333 связанных с раком генов, в зависимости от клинического типа рака, типа дефицита репарации ошибочно спаренных оснований MMR (0: дефицит MMR, 1: избыток MMR) и маркированных групп DMM. На ФИГ. 24B показана гистограмма мутационной нагрузки гена HLA-I каждого образца, упорядоченной с тем же порядковым соответствием, которое показано на ФИГ. 24A. Черной линией отмечены 6 мутаций в мутационной нагрузке HLA-I.
На ФИГ. 25A-25B показан статистический анализ мутационной нагрузки гена HLA-I каждого образца опухолевой ткани в двух группах DMM.
На ФИГ. 26A-26E показаны сканограммы компьютерной томографии (КТ) пациента 3-HJL в 5 временных точках. На сканограммах КТ на ФИГ. 26A показан саркоидоз в обеих долях легкого, причем самый большой очаг имеет диаметр 2 см. На ФИГ. 26B показан тот же саркоидоз после проведения 2 циклов химиотерапии. На ФИГ. 26C показано отсутствие улучшений саркоидоза легкого после проведения 4 циклов химиотерапии. На сканограммах КТ на ФИГ. 26D показано уменьшение размеров очагов саркоидоза легкого на ~ 50% после проведения 3 циклов комбинированной терапии ингибитором PD-1 (KEYTRUDA®) и MASCT. На ФИГ. 26E показано исчезновение очагов саркоидоза в обеих долях легкого после проведения 5 циклов комбинированной терапии ингибитором PD-1 (KEYTRUDA®) и MASCT.
На ФИГ. 27A-27D показаны сканограммы КТ пациента 4-LKS в 4 временных точках. На сканограммах КТ на ФИГ. 27A показан метастаз в головном мозге с размером опухоли ~ 3 см. На ФИГ. 27B показано уменьшение опухоли после лучевой терапии. При повторном рассмотрении сканограмм КТ на ФИГ. 27C показано уменьшение опухоли и ослабление отека головного мозга. На ФИГ. 27D показано дополнительное уменьшение опухоли и ослабление состояния отека.
На ФИГ. 28 показана обзорная блок-схема примера точной MASCT с использованием неоантигенных пептидов, спрогнозированных на основании результатов секвенирования образца опухоли пациента, и прогноза, основанного на статусе мутации HLA.
На ФИГ. 29A показаны потенциальные неоантигены пациента на основании анализа секвенирования образца опухоли пациента. На ФИГ. 29B показаны результаты непрерывного наблюдения за циркулирующими опухолевыми клетками (CTC) у пациента перед и после проведения лечения MASCT. На ФИГ. 29C показаны результаты анализа ELISPOT клеток PBMC от пациента, на которые воздействовали разными антигенными пептидами, после того как по отношению к пациенту проводили три цикла лечения точной MASCT.
На ФИГ. 30A показаны клинические характеристики 45 пациентов с гепатоцеллюлярной карциномой (HCC), по отношению к которым проводили лечение MASCT.
На ФИГ. 30B показаны результаты общего анализа крови 45 пациентов перед и после проведения лечения MASCT.
На ФИГ. 3°C представлены функциональные печеночные и почечные показатели 45 пациентов перед и после проведения лечения MASCT.
На ФИГ. 30D показаны уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) у 8 пациентов с HCC перед проведением лечения MASCT и в ходе 5 курсов лечения MASCT.
подробное описание изобретения
В настоящем изобретении описаны новые способы клеточной иммунотерапии, вместе называемые «специфичной к нескольким антигенам клеточной терапией» (MASCT), которые используются для лечения различных видов рака, а также для задержки прогрессирования, предотвращения рецидива или метастазирования и/или облегчения симптомов рака у субъекта. В способах некоторых вариантов осуществления используют активированные T-клетки, индуцированные дендритными клетками (DC), загруженными множеством опухолевых антигенных пептидов. T-клетки и DC можно получить, например, из собственных мононуклеарных клеток периферической крови (PBMC) субъекта. Загруженные множеством антигенов DC можно получить посредством воздействия на DC (например, на незрелые DC) множеством опухолевых антигенных пептидов, содержащих общие опухолевые антигенные пептиды и необязательно специфичные для типа рака антигенные пептиды. Активированные T-клетки можно получить посредством совместного культивирования популяции Т-клеток с загруженными множеством антигенов DC. Необязательно перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки. Активированные T-клетки вводят субъекту, что может вызывать адоптивный иммунный ответ против опухолевых антигенов in vivo. Необязательно субъекту можно вводить загруженные множеством антигенов DC, чтобы инициировать активный иммунитет против опухолевых антигенов. В альтернативном варианте осуществления представлены способы MASCT на основе PBMC, которые включают введение активированных PBMC. Для лечения рака у субъекта можно использовать любой из способов MASCT, описанных в настоящем документе, отдельно или в комбинации с ингибитором иммунной контрольной точки (таким как ингибитор PD-1).
В настоящем изобретении дополнительно предложены способы лечения точной MASCT с учетом индивидуальных особенностей субъекта, получающего лечение, таких как генетический профиль опухоли субъекта. Например, субъект может быть выбран для лечения MASCT на основании мутационной нагрузки (например, в одном или более генов MHC) в опухоли субъекта. Субъект также может быть выбран для лечения MASCT на основании числа неоантигенов, обнаруженных в опухоли субъекта. В некоторых случаях один или более неоантигенов можно идентифицировать посредством секвенирования образца опухоли, полученного от субъекта. На основе неоантигенов субъекта можно разработать неоантигенные пептиды, которые можно включать во множество опухолевых антигенных пептидов, чтобы обеспечить точную MASCT для субъекта. В некоторых вариантах осуществления после цикла лечения MASCT у субъекта проводят наблюдение за специфическим иммунным ответом против каждого опухолевого антигенного пептида, чтобы на основании специфического иммунного ответа обеспечить изменение множества опухолевых антигенных пептидов в соответствии с индивидуальными потребностями для проведения циклов лечения MASCT в будущем. Кроме того, опухолеспецифические Т-клеточные рецепторы (TCR), которые специфически распознают эпитоп в опухолевом антигенном пептиде и вызывают сильный специфический иммунный ответ, можно клонировать от субъекта после реализации MASCT и использовать для дальнейшей точной иммунотерапии у субъекта.
Способы и композиции MASCT (включая MASCT на основе PBMC и точную MASCT), предложенные в настоящем документе, могут облегчить многие технические проблемы, проявляющиеся в существующих способах иммунотерапии рака, описанных в разделе, посвященном предпосылкам создания изобретения. Например, после воздействия на DC пула опухолевых антигенных пептидов in vitro клетки DC представляют множество опухолевых антигенов в отличие от одного опухолевого антигена, представленного во многих противораковых вакцинах или в PROVEGENE®, что обеспечивает более широкий спектр ответа против опухолей с различными профилями экспрессии антигена у одного и того же субъекта или у разных субъектов, при условии, что опухоли имеют один или более общих специфических опухолевых антигенов в пуле. Для достижения оптимальных терапевтических эффектов при каждом лечении пул опухолевых антигенных пептидов можно дополнительно изменить в соответствии со специфическими состояниями каждого субъекта, такими как тип рака, статус вирусной инфекции и ответ на отдельные антигенные пептиды. В отличие от противораковых вакцин и терапевтических средств на основе DC способы лечения MASCT включают введение активированных T-клеток с обходом присутствующего в существующих видах иммунотерапии этапа индукции T-клеток in vivo, который у онкологических пациентов обычно связан с ослабленным ответом из-за различных иммунных дефектов, вызванных опухолевыми клетками; таким образом, способ MASCT может вызывать сильный быстрый и специфический ответ Т-клеток против раковых клеток. Кроме того, активированные T-клетки имеют очень низкий уровень Treg и низкую экспрессию PD-1, что приводит к снижению иммуносупрессии Т-клеток, атакующих раковые клетки, тем самым задерживая ускользание раковых клеток от иммунного ответа. В совокупности настоящее изобретение обеспечивает эффективный, долговременный и широко применимый способ иммунотерапии рака, чтобы удовлетворить огромные неудовлетворенные медицинские потребности онкологических пациентов, особенно в тех случаях, когда действующие стандарты лечения оказываются неэффективными или недоступными.
Определения
Если не определено иное, термины, используемые в настоящем документе, по существу соответствуют применению в данной области.
В настоящем документе термин «лечение» представляет собой подход к достижению благоприятных или желательных результатов, включая клинические результаты. В целях этого изобретения благоприятные или желательные результаты включают, без ограничений, один или более из следующих результатов: уменьшение одного и более симптомов, вызванных заболеванием, уменьшение степени заболевания, стабилизацию заболевания (например, предотвращение или задержку ухудшения заболевания), предотвращение или задержку распространения (например, метастазирования) заболевания, предотвращение или задержку появления или рецидива заболевания, отсрочку или задержку прогрессирования заболевания, облегчение состояния заболевания, обеспечение ремиссии (частичной или полной) заболевания, уменьшение дозы одного или более других лекарственных средств, необходимых для лечения заболевания, задержку прогрессирования заболевания, улучшение качества жизни и/или продление выживания. Термин «лечение» также охватывает уменьшение патологических последствий рака. Способы изобретения предусматривают любой один или более из этих аспектов лечения.
Термин «субъект» или «пациент» используется в настоящем документе как синоним для описания млекопитающего, включая человека. Субъект представляет собой, без ограничений, человека, крупный рогатый скот, лошадь, кошку, собаку, грызуна или примата. В некоторых вариантах осуществления субъект представляет собой человека. В некоторых вариантах осуществления субъект страдает от заболевания, такого как рак. В некоторых вариантах осуществления субъекту требуется лечение.
В настоящем документе «задержка» развития рака означает отсрочку, препятствие, замедление, торможение, стабилизацию и/или откладывание развития заболевания. Эта задержка может иметь различную продолжительность, которая зависит от анамнеза заболевания и/или субъекта, получающего лечение. Как очевидно специалисту в данной области, достаточная или значительная задержка фактически может охватывать профилактику в том случае, если у субъекта не развивается заболевание. Способ, который «задерживает» развитие ракового заболевания, представляет собой способ, который уменьшает вероятность развития заболевания в данный период времени и/или уменьшает степень заболевания в данный период времени по сравнению с ситуацией без применения способа. Такие сравнения, как правило, основаны на клинических исследованиях с использованием статистически достоверного числа субъектов. Развитие рака можно обнаружить с использованием стандартных способов, включая, без ограничений, компьютерную аксиальную томографию (CAT Scan), магнитно-резонансную томографию (МРТ), ультразвуковое исследование органов брюшной полости, тесты на свертывание крови, артериографию или биопсию. Развитие может также относиться к прогрессированию рака, которое может первоначально не обнаруживаться, и включает возникновение, рецидив и проявление.
Как понимается в данной области, «эффективное количество» относится к количеству композиции (например, загруженным множеством антигенов DC, активированным T-клеткам, активированным PMBC или выделенным T-клеткам), терапии первой линии, терапии второй линии или комбинированной терапии, достаточной для достижения желаемого терапевтического результата (например, снижения тяжести или продолжительности, стабилизации тяжести или устранения одного или более симптомов рака). Для терапевтического применения благоприятные или желательные результаты включают, например, уменьшение одного или более (биохимических, гистологических и/или психологических) симптомов, вызванных заболеванием, включая их осложнения и промежуточные патологические фенотипы, представленные в ходе развития заболевания, улучшение качества жизни пациентов, страдающих от заболевания, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства, задержку прогрессирования заболевания и/или продление выживания пациентов.
Способы могут быть реализованы на практике в условиях адъювантной терапии. Термин «условия адъювантной терапии» относится к клиническим условиям, в которых у субъекта имелся анамнез пролиферативного заболевания, в частности рака, и по существу (но необязательно) он отвечал на терапию, которая включает, без ограничений, хирургическое вмешательство (такое как хирургическая резекция), лучевую терапию и химиотерапию. Однако из-за наличия в анамнезе пролиферативного заболевания (например, рака) эти субъекты считаются подверженными риску развития заболевания. Лечение или введение в «условиях адъювантной терапии» относится к дальнейшему способу лечения. Степень риска (т. е. оценка субъекта в условиях адъювантной терапии как имеющего «высокий риск» или «низкий риск») зависит от нескольких факторов, чаще всего от степени заболевания при первом лечении.
Способы, предложенные в настоящем документе, могут также осуществляться на практике в «условиях неоадъювантной терапии», т. е. способ может быть реализован до проведения первичной/радикальной терапии. В некоторых вариантах осуществления субъект ранее получал лечение. В некоторых вариантах осуществления субъект ранее не получал лечения. В некоторых вариантах осуществления лечение представляет собой терапию первой линии.
В настоящем документе термин «комбинированная терапия» означает, что первый агент вводят в сочетании с другим агентом. Выражение «в сочетании с» относится к применению одного метода лечения в дополнение к другому методу лечения, например введению активированных T-клеток или PBMC, описанных в настоящем документе, в дополнение к введению другого агента (такого как ингибитор иммунной контрольной точки) одному и тому же субъекту. Таким образом, «в сочетании с» относится к применению одного метода лечения до, во время или после обеспечения субъекта другим видом лечения. Такие комбинации считаются частью одной схемы лечения.
В настоящем документе термин «одновременное введение» означает, что первое терапевтическое средство и второе терапевтическое средство в комбинированной терапии вводят с временным разделением не более приблизительно 15 минут, например не более чем любой период из приблизительно 10, 5 или 1 минуты. При одновременном введении первого и второго терапевтического средства первое и второе терапевтические средства могут содержаться в одной композиции (например, композиции, содержащей как первое, так и второе терапевтическое средство) или в отдельных композициях (например, первое терапевтическое средство содержится в одной композиции, а второе терапевтическое средство содержится в другой композиции).
В настоящем документе термин «последовательное введение» означает, что первое терапевтическое средство и второе терапевтическое средство в комбинированной терапии вводят с временным разделением более приблизительно 15 минут, например более чем любой период из приблизительно 20, 30, 40, 50, 60 или более минут. Первым можно вводить первое терапевтическое средство или второе терапевтическое средство. Первое и второе терапевтические средства содержатся в отдельных композициях, которые могут содержаться в одних и тех же или разных упаковках или наборах.
В настоящем документе термин «одновременное введение» означает, что введение первого терапевтического средства и второго терапевтического средства в комбинированной терапии накладывается друг на друга.
В настоящем документе термин «фармацевтически приемлемый» или «фармакологически совместимый» относится к веществу, которое не является биологически или иным образом нежелательным, например, вещество может быть включено в фармацевтическую композицию, которую вводят субъекту так, что не вызывает каких-либо значительных нежелательных биологических эффектов или вредного взаимодействия с любым другим компонентом композиции, в состав которой оно входит. Фармацевтически приемлемые носители или эксципиенты предпочтительно удовлетворяют требуемым стандартам токсикологических и производственных испытаний и/или включены в Руководство по неактивным ингредиентам, подготовленное Управлением по санитарному надзору за качеством пищевых продуктов и лекарственных средств США.
В настоящем документе термин «неблагоприятное явление», или «НЯ», относится к любому неблагоприятному медицинскому случаю у субъекта, принимающего продаваемый фармацевтический продукт, или у субъекта, который участвует в клиническом исследовании и получает исследуемый или неисследуемый фармацевтический агент. НЯ необязательно имеет причинную связь с лечением субъекта. Таким образом, НЯ может представлять собой любой неблагоприятный и непреднамеренный признак, симптом или заболевание, которые временно связаны с применением лекарственного средства, независимо от того, считаются ли они вызванными лекарственным средством или нет. НЯ включает, без ограничений, обострение ранее существовавшего заболевания; увеличение частоты или интенсивности предшествующего эпизодического события или состояния; состояние, обнаруженное или диагностированное после введения исследуемого лекарственного средства, даже в случае возможного наличия этого состояния перед началом исследования; и постоянное устойчивое заболевание или симптомы, которые присутствовали на исходном уровне и усугубились после начала исследования. НЯ по существу не включает медицинские или хирургические процедуры (например, хирургическое вмешательство, эндоскопию, удаление зуба или переливание крови); однако состояние, приводящее к проведению процедуры, считается неблагоприятным явлением; ранее существовавшие заболевания, состояния или отклонения от нормы лабораторных показателей, имеющихся или выявленных в начале исследования, которые не ухудшаются; госпитализации или процедуры, которые проводятся в плановом режиме, не связаны с неблагоприятным медицинским событием (например, госпитализации для косметической или плановой хирургии или социальные/удобные госпитализации); изучаемое заболевание или признаки/симптомы, связанные с заболеванием, если они не становятся более тяжелыми для состояния субъекта, чем ожидалось; и передозировки исследуемого лекарственного средства без каких-либо клинических признаков или симптомов.
В настоящем документе термин «серьезное неблагоприятное явление», или «СНЯ», относится к любому неблагоприятному медицинскому событию, возникшему при применении любой дозы, включая, без ограничений, событие, которое: a) является летальным; b) опасно для жизни (определяется как непосредственный риск смерти от произошедшего события); c) приводит к постоянной или значимой инвалидности или недееспособности; d) требует госпитализации в стационар или продлевает существующую госпитализацию (исключение: госпитализация для планового лечения ранее существовавшего состояния, которое не ухудшалось во время исследования, не считается неблагоприятным явлением: осложнения, возникающие во время госпитализации, являются НЯ, и если осложнение продлевает госпитализацию, то явление считается серьезным); e) является врожденной аномалией/врожденным дефектом у потомства субъекта, получавшего лекарственное средство; или f) представляет собой состояния, не включенные в приведенные выше определения, но которые могут подвергать субъекта опасности или требовать вмешательства для предотвращения одного из перечисленных выше исходов, если они явно не связаны с основным заболеванием субъекта. «Недостаточность эффективности» (прогрессирующее заболевание) не считается НЯ или СНЯ. Признаки и симптомы или клинические осложнения, связанные с недостаточностью эффективности, должны сообщаться, если они соответствуют определениям НЯ или СНЯ.
Для оценки на основании ответа целевых поражений можно использовать следующие определения: «полный ответ», или CR, означает исчезновение всех целевых поражений; «частичный ответ», или PR, относится по меньшей мере к 30% уменьшению суммы самых длинных диаметров (SLD) целевых поражений, принимая в качестве контроля исходный уровень SLD; «стабильное заболевание», или SD, означает отсутствие достаточного уменьшения целевых поражений для расценивания как PR, а также отсутствие достаточного увеличения для расценивания как PD, принимая в качестве контроля самый низкий уровень SLD с начала лечения; и «прогрессирующее заболевание», или PD, относится по меньшей мере к 20% увеличению SLD целевых поражений, принимая в качестве контроля самый низкий уровень SLD, зарегистрированный с начала лечения, или к появлению одного или более новых поражений.
Для оценки нецелевого поражения можно использовать следующие определения оценок ответа: «полный ответ», или CR, означает исчезновение всех нецелевых поражений; «стабильное заболевание», или SD, означает сохранение одного или более нецелевых поражений, которое не расценивается как CR или PD; и «прогрессирующее заболевание», или PD, которое относится к «явному прогрессированию» существующего (-их) нецелевого (-ых) поражения (-ий) или к появлению одного или более новых поражений, считается прогрессирующим заболеванием (если PD у субъекта оценивается для момента времени исключительно на основании прогрессирования нецелевого (-ых) поражения (-ий), то требуется соответствие дополнительным критериям).
«Выживаемость без прогрессирования» (PFS) указывает на продолжительность времени в ходе лечения и после его окончания, в течение которого не происходит роста ракового поражения. Выживаемость без прогрессирования включает продолжительность времени, в течение которого у субъектов наблюдался полный ответ или частичный ответ, а также продолжительность времени, в течение которого у субъектов наблюдалось стабильное заболевание.
В настоящем документе термин «прогнозирование» или «прогноз» используется для обозначения вероятности благоприятного или неблагоприятного ответа субъекта на назначенную схему лечения.
В настоящем документе термин «во время начала лечения» или «на исходном уровне» относится к периоду времени в начале первого воздействия лечения или перед ним.
В настоящем документе термин «образец» относится к композиции, которая содержит молекулу, которая должна быть охарактеризована и/или идентифицирована, например, на основе физических, биохимических, химических, физиологических и/или генетических характеристик.
В контексте настоящего документа следует понимать, что термин «клетки» относится не только к конкретной клетке, но и к производным или потенциальным производным этой клетки. Так как в последующих поколениях могут возникнуть некоторые модификации вследствие либо мутации, либо воздействий среды, такое потомство фактически может быть неидентичным исходной клетке, но оно все же может быть включено в объем используемого в настоящем документе термина.
Термин «пептид» относится к аминокислотному полимеру, состоящему из не более приблизительно 100 аминокислот (включая фрагменты белка), которые могут быть линейными или разветвленными, могут содержать модифицированные аминокислоты и/или могут прерываться неаминокислотами. Термин также охватывает аминокислотный полимер, который был модифицирован естественным путем или путем вмешательства, включая, например, образование дисульфидной связи, гликозилирование, липидирование, ацетилирование, фосфорилирование или любые другие манипуляции или модификации. Термин также включает, например, полипептиды, содержащие один или более аналогов аминокислот (включая, например, неприродные аминокислоты и т. п.), а также другие модификации, известные в данной области. Пептиды, описанные в настоящем документе, могут быть встречающимися в природе, т. е. полученными из природного источника (например, крови), или синтезированными (например, химически синтезированными или синтезированными с помощью методов рекомбинантной ДНК).
В настоящем документе термины «множество опухолевых антигенных пептидов», «множественные опухолевые антигенные пептиды», «пул опухолевых антигенных пептидов» и «совокупность опухолевых антигенных пептидов» используются взаимозаменяемо для обозначения комбинации, состоящей из более чем одного опухолевого антигенного пептида.
В настоящем документе термины «дендритные клетки, загруженные множеством опухолевых антигенных пептидов» и «дендритные клетки, загруженные множественными опухолевыми антигенными пептидами» используются взаимозаменяемо для обозначения дендритных клеток, которые имеют повышенное представление более чем одного опухолевого антигенного пептида из множества опухолевых антигенных пептидов. Аналогично термин «APC, загруженные множеством опухолевых антигенных пептидов» используется взаимозаменяемо с термином «загруженные множественными опухолевыми антигенными пептидами APC» в отношении антигенпредставляющих клеток, которые имеют повышенное представление более чем одного опухолевого антигенного пептида из множества опухолевых антигенных пептидов.
В настоящем документе термин «активированные T-клетки» относится к популяции моноклональных (например, кодирующих одинаковый TCR) или поликлональных (например, с клонами, кодирующими различные TCR) T-клеток, которые имеют Т-клеточные рецепторы, распознающие по меньшей мере один опухолевый антигенный пептид. Активированные T-клетки могут включать один или более подтипов Т-клеток, включая, без ограничений, цитотоксические T-клетки, хелперные T-клетки, T-клетки, которые представляют собой натуральные клетки-киллеры, T-клетки-γδ, регуляторные T-клетки и T-клетки памяти.
В настоящем документе «ингибитор иммунной контрольной точки» относится к молекуле или агенту (включая антитело), который ингибирует или блокирует ингибирующую молекулу иммунной контрольной точки на иммунной клетке (такой как Т-клетка или РВМС) или опухолевой клетке. Термин «молекулы иммунной контрольной точки» включает молекулы, которые активируют иммунный сигнал (т. е. являются «костимулирующими молекулами»), или молекулы, которые выключают иммунный сигнал (т. е. «ингибирующие молекулы иммунной контрольной точки») против опухолевой клетки.
В настоящем документе термин «мутационная нагрузка» относится к общему числу мутаций, накопленных в одном или более локусах (таких как ген) в геноме клетки (такой как опухолевая клетка). Мутации включают, без ограничений, точечную мутацию, вставку, делецию, мутацию сдвига рамки считывания, слияние генов и изменение числа копий. Эти мутации могут оказывать или не оказывать неблагоприятное влияние на физические/химические свойства и/или функции продукта, кодируемого локусом.
В настоящем документе термин «Т-клеточный рецептор», или TCR, относится к эндогенному или сконструированному Т-клеточному рецептору, содержащему внеклеточный антигенсвязывающий домен, который связывается со специфическим антигенным эпитопом, связанным с молекулой МНС. TCR может содержать полипептидную цепь TCR-α и полипептидную цепь TCR-β. Термин «опухолеспецифический TCR» относится к TCR, который специфически распознает опухолевый антиген, экспрессируемый опухолевой клеткой.
В настоящем документе термин HLA, или «антиген лейкоцитов человека», относится к человеческим генам, которые кодируют белки MHC (главный комплекс гистосовместимости) на поверхности клеток, ответственных за регуляцию иммунной системы. HLA-I, или HLA класса I, относится к человеческим генам MHC класса I, включая локусы HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G и β2-микроглобулина. HLA-II, или HLA класса II, относится к человеческим генам MHC класса II, включая локусы HLA-DPA1, HLA-DPB1, HLA-DQA1, HLA-DQB1, HLA-DRA1, HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DM, HLA-DOA и HLA-DOB.
В настоящем документе термин «антитело» используется в широком смысле и конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), мультиспецифические антитела (например, биспецифические антитела) и фрагменты антитела, при условии, что они показывают желаемую биологическую активность.
Термин «фрагменты антитела» относится к части интактного антитела, предпочтительно содержащей его антигенсвязывающую область. В некоторых вариантах осуществления фрагмент антитела, описанный в настоящем документе, представляет собой антигенсвязывающий фрагмент. К примерам фрагментов антитела относятся фрагменты Fab, Fab', F(ab')2 и Fv, диатела, линейные антитела, одноцепочечные фрагменты антитела и мультиспецифичные антитела, образованные из фрагментов антитела.
В настоящем документе термин «специфически связывается с», «распознает», «специфически распознает», «нацелен» или «специфичен в отношении» относится к измеримым и воспроизводимым взаимодействиям, таким как связывание между мишенью и антителом, или рецептором и лигандом, или рецептором и комплексом эпитоп/МНС, которые являются определяющими для присутствия мишени при наличии гетерогенной популяции молекул, включая биологические молекулы. Например, антитело, которое связывается или специфически связывается с мишенью (которая может быть эпитопом), представляет собой антитело, которое связывает эту мишень с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими мишенями. В одном варианте осуществления степень связывания антитела с неродственной мишенью составляет менее приблизительно 10% от связывания антитела с мишенью, как измерено, например, посредством радиоиммунологического анализа (RIA). В некоторых вариантах осуществления антитело, которое специфически связывается с антигенным пептидом (или эпитопом), имеет константу диссоциации (Kd) ≤ 1 мкM, ≤ 100 нM, ≤ 10 нM, ≤ 1 нM или ≤ 0,1 нM. В некоторых вариантах осуществления антитело специфически связывается с эпитопом на белке, который является консервативным среди белков отличающихся видов. В другом варианте осуществления специфическое связывание может включать, но необязательно, эксклюзивное связывание.
Следует понимать, что аспект и варианты осуществления изобретения, описанные в настоящем документе, включают «состоящие» и/или «состоящие по существу из» аспектов и вариантов осуществления.
Ссылка на «приблизительно» в отношении значения или параметра в настоящем документе включает (и описывает) изменения, которые относятся к этому значению или параметру как таковому. Например, описание, относящееся к «приблизительно X», включает описание X.
В настоящем документе термин «приблизительно X-Y» имеет то же значение, что и «от приблизительно X до приблизительно Y».
В настоящем документе указание на «не» в отношении значения или параметра обычно означает и описывает ситуации «кроме» значения или параметра. Например, описание того, что способ не используется для лечения рака типа X, означает, что этот способ используется для лечения рака других типов, кроме X.
В настоящем документе и прилагаемой формуле изобретения формы единственного числа допускают использование форм множественного числа, если контекстом явно не предусмотрено иное.
Способ MASCT
В настоящем изобретении предложены способы клеточной иммунотерапии для лечения рака у субъекта, вместе называемые «специфичной к нескольким антигенам клеточной терапией» (MASCT). В способах используют антигенпредставляющие клетки (APC, такие как дендритные клетки), загруженные множеством опухолевых антигенных пептидов, и активированные T-клетки, индуцированные загруженными множеством антигенов APC. Как загруженные множеством антигенов APC, так и активированные T-клетки способны вызывать специфический в отношении опухолевого антигена Т-клеточный ответ in vivo и ex vivo, включая ответ цитотоксических Т-клеток и хелперных Т-клеток, а также создание иммунной памяти посредством T-клеток памяти. Таким образом, в различных вариантах осуществления способа MASCT загруженные множеством антигенов APC (такие как дендритные клетки), активированные T-клетки, совместные культуры APC и T-клеток (включая активированные PBMC) или любую их комбинацию можно вводить субъекту для лечения рака или неопластического состояния или для предотвращения рецидива, прогрессирования или метастазирования опухоли.
В одном аспекте настоящего изобретения предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию антигенпредставляющих клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию антигенпредставляющих клеток получают от субъекта, получающего лечение. В некоторых вариантах осуществления популяция антигенпредставляющих клеток представляет собой популяцию дендритных клеток, B-клеток или макрофагов. В некоторых вариантах осуществления антигенпредставляющие клетки представляют собой дендритные клетки.
В некоторых вариантах осуществления представлен способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов, и при этом ранее субъекту вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления интервал между введением антигенпредставляющих клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления антигенпредставляющие клетки вводят подкожно. В некоторых вариантах осуществления антигенпредставляющие клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию антигенпредставляющих клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию антигенпредставляющих клеток получают от субъекта, получающего лечение. В некоторых вариантах осуществления популяция антигенпредставляющих клеток представляет собой популяцию дендритных клеток, B-клеток или макрофагов. В некоторых вариантах осуществления антигенпредставляющие клетки представляют собой дендритные клетки.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) введение субъекту эффективного количества антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов; и (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления антигенпредставляющие клетки вводят перед введением активированных Т-клеток в период от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления антигенпредставляющие клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию антигенпредставляющих клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию антигенпредставляющих клеток получают от субъекта, получающего лечение. В некоторых вариантах осуществления популяция антигенпредставляющих клеток представляет собой популяцию дендритных клеток, B-клеток или макрофагов. В некоторых вариантах осуществления антигенпредставляющие клетки представляют собой дендритные клетки.
В способах MASCT можно использовать любые приемлемые антигенпредставляющие клетки, включая, без ограничений, дендритные клетки, B-клетки и макрофаги. В некоторых вариантах осуществления антигенпредставляющие клетки представляют собой дендритные клетки.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, перед введением. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию дендритных клеток получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и при этом ранее субъекту вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления дендритные клетки вводят перед введением активированных Т-клеток в период от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию дендритных клеток получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления дендритные клетки вводят перед введением активированных Т-клеток в период от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления активированные T-клетки и/или популяцию дендритных клеток получают от субъекта, получающего лечение.
Помимо этапа(-ов) введения, некоторые варианты осуществления способа MASCT дополнительно включают один или два следующих этапа получения клеток: 1) получение популяции антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов; и 2) получение активированных Т-клеток. В некоторых вариантах осуществления активированные T-клетки получают перед введением посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток, приблизительно 14 суток или приблизительно 21 суток). В некоторых вариантах осуществления популяцию антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции антигенпредставляющих клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию антигенпредставляющих клеток приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками. В некоторых вариантах осуществления перед совместным культивированием популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией антигенпредставляющих клеток в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления популяцию Т-клеток и популяцию антигенпредставляющих клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток и популяцию антигенпредставляющих клеток получают от субъекта, получающего лечение.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (b) введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток, приблизительно 14 суток или приблизительно 21 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (b) введение субъекту эффективного количества активированных Т-клеток, причем ранее субъекту вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (c) введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 10 суток, от приблизительно 10 суток до приблизительно 15 суток, от приблизительно 15 суток до приблизительно 21 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (c) введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (c) введение субъекту эффективного количества активированных Т-клеток, причем ранее субъекту вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции Т-клеток с получением популяции активированных T-клеток; и (d) введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC; и (d) введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (d) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC, и при этом ранее субъекту вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию PBMC и/или дендритных клеток получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (e) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
Описанные в настоящем документе способы подходят для лечения различных видов рака, таких как виды рака, описанные в настоящем документе, включая рак, который выбирают из группы, состоящей из гепатоцеллюлярной карциномы, рака шейки матки, рака легких, колоректального рака, лимфомы, рака почки, рака молочной железы, рака поджелудочной железы, рака желудка, рака пищевода, рака яичников, рака предстательной железы, карциномы носоглотки, меланомы и рака головного мозга. Эти способы применимы к раковым заболеваниям всех стадий, включая раннюю стадию, стадию распространенного заболевания и метастатический рак. В некоторых вариантах осуществления рак представляет собой солидную опухоль. В некоторых вариантах осуществления рак представляет собой гемобластоз.
В некоторых вариантах осуществления способ уменьшает тяжесть одного или более симптомов, связанных с раком по меньшей мере на любую величину из приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с соответствующим симптомом у того же субъекта перед лечением или по сравнению с соответствующим симптомом у других субъектов, по отношению к которым не применяли этот способ лечения. В некоторых вариантах осуществления способ задерживает прогрессирование рака.
Примеры раковых заболеваний, которые можно лечить посредством способов, описанных в настоящем документе, включают, без ограничений, карциному коры надпочечников, агногенную миелоидную метаплазию, анальный рак, рак аппендикса, астроцитому (например, мозжечковую и мозговую), базально-клеточный рак, рак желчных протоков (например, внепеченочных), рак мочевого пузыря, рак костей (остеосаркому и злокачественную фиброзную гистиоцитому), опухоль головного мозга (например, глиому, глиому ствола мозга, мозжечковую или мозговую астроцитому (например, волосовидную астроцитому, диффузную астроцитому, анапластическую (злокачественную) астроцитому), злокачественную глиому, эпендимому, олигодендроглиому, менингиому, краниофарингиому, гемангиобластомы, медуллобластомы, супратенториальные примитивные нейроэктодермальные опухоли, глиому и глиобластому зрительного нерва и гипоталамуса), рак молочной железы, бронхиальные аденомы/карциноиды, карциноидную опухоль (например, карциноидную опухоль желудочно-кишечного тракта), карциному с неизвестной первичной опухолью, лимфому центральной нервной системы, рак шейки матки, рак толстой кишки, колоректальный рак, хронические миелопролиферативные расстройства, рак эндометрия (например, рак матки), эпендимому, рак пищевода, семейство опухолей Юинга, рак глаза (например, внутриглазную меланому и ретинобластому), рак желчного пузыря, рак желудка, карциноидную опухоль желудочно-кишечного тракта, опухоль стромы желудочно-кишечного тракта (GIST), герминогенную опухоль (например, внечерепную, внегонадную, яичников), гестационную трофобластическую опухоль, рак головы и шеи, гепатоцеллюлярный (печеночный) рак (например, печеночную карциному и гепатому), рак нижней части глотки, рак островковых клеток (эндокринной части поджелудочной железы), рак гортани, лейкоз (кроме T-клеточного лейкоза), рак губ и ротовой полости, рак полости рта, рак печени, рак легких (например, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), лимфому (кроме T-клеточной лимфомы), медуллобластому, меланому, мезотелиому, метастатический плоскоклеточный рак шеи, рак полости рта, синдром множественной эндокринной неоплазии, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, рак носовой полости и околоносовых пазух, карциному носоглотки, нейробластому, нейроэндокринный рак, рак ротоглотки, рак яичников (например, рак эпителия яичников, герминогенную опухоль яичников, опухоль яичников с низким злокачественным потенциалом), рак поджелудочной железы, рак паращитовидной железы, рак полового члена, рак брюшины, рак глотки, феохромоцитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, плевролегочную бластому, первичную лимфому центральной нервной системы (микроглиому), легочный лимфангиомиоматоз, рак толстой кишки, рак почки, рак почечной лоханки и мочеточника (переходноклеточный рак), рабдомиосаркому, рак слюнной железы, рак кожи (например, немеланому (например, плоскоклеточный рак), меланому и карциному из клеток Меркеля), рак тонкой кишки, плоскоклеточный рак, рак яичек, рак горла, рак щитовидной железы, туберозный склероз, рак уретры, рак влагалища, рак вульвы, опухоль Вильмса, аномальную пролиферацию сосудов, связанную с факоматозами, отек (например, связанный с опухолями головного мозга) и синдром Мейгса.
Таким образом, в некоторых вариантах осуществления предложен способ лечения гепатоцеллюлярной карциномы (HCC) у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления HCC представляет собой HCC на ранней стадии, неметастатическую HCC, первичную HCC, распространенную HCC, местно-распространенную HCC, метастатическую HCC, HCC в стадии ремиссии или рецидивирующую HCC. В некоторых вариантах осуществления локализация HCC позволяет провести ее резекцию (т. е. опухоли ограничены частью печени, что позволяет провести их полное хирургическое удаление), локализация не позволяет провести резекцию (т. е. локализованные опухоли могут быть неоперабельными из-за включения в них структур важных кровеносных сосудов или из-за повреждения печени), или опухоль является неоперабельной (т. е. опухоль охватывает все доли печени и/или распространяется с вовлечением других органов (например, легкого, лимфатических узлов, кости). В некоторых вариантах осуществления в соответствии с классификацией TNM опухоль HCC представляет собой опухоль I стадии (одиночная опухоль без инвазии сосудов), опухоль II стадии (одиночная опухоль с инвазией сосудов или множественные опухоли, размер которых не превышает 5 см), опухоль III стадии (множественные опухоли, размер любой из них превышает 5 см, или опухоли с вовлечением основной ветви воротной или печеночной вены), опухоль IV стадии (опухоли с прямой инвазией соседних органов, кроме желчного пузыря, или с проникновением в висцеральную брюшину), опухоль N1 (метастазы в региональные лимфатические узлы) или опухоль M1 (отдаленные метастазы). В некоторых вариантах осуществления HCC в соответствии с критериями стадирования согласно классификации Американского объединенного комитета по онкологическим заболеваниям (AJCC) относится к HCC стадии Tl, T2, T3 или T4. В некоторых вариантах осуществления HCC представляет собой любую из карцином печеночных клеток, фиброламеллярных вариантов HCC и смешанных гепатоцеллюлярных холангиокарцином. В некоторых вариантах осуществления HCC вызвана инфекцией вируса гепатита B (ВГB).
В некоторых вариантах осуществления предложен способ лечения рака легких у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления рак легких представляет собой немелкоклеточный рак легких (NSCLC). Примеры NCSLC включают, без ограничений, крупноклеточный рак (например, крупноклеточный нейроэндокринный рак, комбинированный крупноклеточный нейроэндокринный рак, базалоидный рак, лимфоэпителиомаподобный рак, светлоклеточный рак и крупноклеточный рак с рабдоидным фенотипом), аденокарциному (например, ацинарную, папиллярную (например, бронхиолоальвеолярную карциному, немуцинозную, муцинозную, смешанную муцинозную и немуцинозную и неопределенного клеточного типа), солидную аденокарциному с муцином, аденокарциному со смешанными подтипами, высокодифференцированную фетальную аденокарциному, муцинозную (коллоидную) аденокарциному, муцинозную цистаденокарциному, перстневидно-клеточную аденокарциному и светлоклеточную аденокарциному), нейроэндокринные опухоли легких и плоскоклеточную карциному (например, папиллярную, светлоклеточную, мелкоклеточную и базалоидную). В некоторых вариантах осуществления NSCLC согласно классификации TNM может иметь стадию T опухоли (первичная опухоль), стадию N опухоли (региональные лимфатические узлы) или стадию M опухоли (отдаленные метастазы).
В некоторых вариантах осуществления рак легких представляет собой карциноид (типичный или атипичный), аденосквамозную карциному, цилиндрому или карциному слюнной железы (например, аденокистозную карциному или мукоэпидермоидную карциному). В некоторых вариантах осуществления рак легких представляет собой карциному с плеоморфными, саркоматоидными или саркоматозными элементами (например, карциномы с веретеновидными и/или гигантскими клетками, веретеноклеточную карциному, гигантоклеточную карциному, карциносаркому или пульмональную бластому). В некоторых вариантах осуществления рак легких представляет собой мелкоклеточный рак легких (SCLC; также называемый овсяно-клеточной карциномой). Мелкоклеточный рак легких может иметь стадию ограниченного заболевания, стадию распространенного заболевания или может представлять собой рецидивирующий мелкоклеточный рак легких. В некоторых вариантах осуществления субъект может представлять собой человека, который имеет ген, генетическую мутацию или полиморфизм, которые предположительно (или как показано) связаны с раком легких (например, SASH1, LATS1, IGF2R, PARK2, KRAS, PTEN, Kras2, Krag, Pas1, ERCC1, XPD, IL8RA, EGFR, α1-AD, EPHX, MMP1, MMP2, MMP3, MMP12, IL1β, RAS и/или AKT), или имеет одну или более дополнительных копий гена, связанного с раком легких.
В некоторых вариантах осуществления предложен способ лечения рака шейки матки у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления рак шейки матки представляет собой рак шейки матки на ранней стадии, неметастатический рак шейки матки, местно-распространенный рак шейки матки, метастатический рак шейки матки, рак шейки матки в стадии ремиссии, неоперабельный рак шейки матки, рак шейки матки в условиях проведения адъювантной терапии или рак шейки матки в условиях проведения неоадъювантной терапии. В некоторых вариантах осуществления рак шейки матки вызван вирусом папилломы человека (ВПЧ). В некоторых вариантах осуществления рак шейки матки согласно классификации TNM может иметь стадию T опухоли (первичная опухоль), стадию N опухоли (региональные лимфатические узлы) или стадию M опухоли (отдаленные метастазы). В некоторых вариантах осуществления рак шейки матки может представлять собой рак шейки матки на любой из стадий: стадии 0, стадии I (Tis, N0, M0), стадии IA (T1a, N0, M0), стадии IB (T1b, N0, M0), стадии IIA (T2a, N0, M0), стадии IIB (T2b, N0, M0), стадии IIIA (T3a, N0, M0), стадии IIIB (T3b, N0, M0 или T1-3, N1, M0) стадии IVA (T4, N0, M0) или стадии IVB (T1-T3, N0-N1, M1). В некоторых вариантах осуществления рак шейки матки представляет собой плоскоклеточный рак шейки матки, аденокарциному шейки матки или аденосквамозную карциному.
В некоторых вариантах осуществления предложен способ лечения рака молочной железы у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления рак молочной железы представляет собой рак молочной железы на ранней стадии, неметастатический рак молочной железы, местно-распространенный рак молочной железы, метастатический рак молочной железы, гормон-рецептор-позитивный метастический рак молочной железы, рак молочной железы в стадии ремиссии, рак молочной железы в условиях проведения адъювантной терапии, протоковую карциному in situ (DCIS), инвазивную протоковую карциному (IDC) или рак молочной железы в условиях проведения неоадъювантной терапии. В некоторых вариантах осуществления рак молочной железы представляет собой гормон-рецептор-позитивный метастический рак молочной железы. В некоторых вариантах осуществления рак молочной железы (который может быть HER2-позитивным или HER2-негативным) представляет собой распространенный рак молочной железы. В некоторых вариантах осуществления рак молочной железы представляет собой протоковую карциному in situ. В некоторых вариантах осуществления субъект может представлять собой человека, который имеет ген, генетическую мутацию или полиморфизм, связанный с раком молочной железы (например, BRCA1, BRCA2, ATM, CHEK2, RAD51, AR, DIRAS3, ERBB2, TP53, AKT, PTEN и/или PI3K), или имеет одну или более дополнительных копий гена (например, одну или более дополнительных копий гена HER2), связанного с раком молочной железы.
В некоторых вариантах осуществления предложен способ лечения рака поджелудочной железы у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления рак поджелудочной железы включает, без ограничений, серозную микрокистозную аденому, внутрипротоковую папиллярную муцинозную неоплазму, муцинозную кистозную неоплазму, солидно-псевдопапиллярную неоплазму, аденокарциному поджелудочной железы, протоковую карциному поджелудочной железы или панкреатобластому. В некоторых вариантах осуществления рак поджелудочной железы представляет собой любой из рака поджелудочной железы на ранней стадии, неметастатического рака поджелудочной железы, первичного рака поджелудочной железы, резецированного рака поджелудочной железы, распространенного рака поджелудочной железы, местно-распространенного рака поджелудочной железы, метастатического рака поджелудочной железы, неоперабельного рака поджелудочной железы, рака поджелудочной железы в стадии ремиссии, рецидивирующего рака поджелудочной железы, рака поджелудочной железы в условиях проведения адъювантной терапии или рака поджелудочной железы в условиях проведения неоадъювантной терапии.
В некоторых вариантах осуществления предложен способ лечения рака яичников у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления перед введением активированных Т-клеток способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления рак яичников представляет собой эпителиальный рак яичников. Примеры гистологической классификации эпителиального рака яичников включают серозные цистомы (например, серозные доброкачественные цистаденомы, серозные цистаденомы с пролиферативной активностью эпителиальных клеток и аномалиями ядер, но без признаков инфильтративного деструктивного роста или серозные цистаденокарциномы), муцинозные цистомы (например, доброкачественные муцинозные цистаденомы, муцинозные цистаденомы с пролиферативной активностью эпителиальных клеток и аномалиями ядер, но без признаков инфильтративного деструктивного роста или муцинозные цистаденокарциномы), эндометриоидные опухоли (например, доброкачественные эндометриоидные кисты, эндометриоидные опухоли с пролиферативной активностью эпителиальных клеток и аномалиями ядер, но без признаков инфильтративного деструктивного роста или эндометриоидные аденокарциномы), светлоклеточные (мезонефроидные) опухоли (например, доброкачественные светлоклеточные опухоли, светлоклеточные опухоли с пролиферативной активностью эпителиальных клеток и аномалиями ядер, но без признаков инфильтративного деструктивного роста или светлоклеточные цистаденокарциномы), неклассифицированные опухоли, которые не могут быть отнесены ни к одной из вышеперечисленных групп, или другие злокачественные опухоли. В различных вариантах осуществления эпителиальный рак яичников может иметь следующие стадии: стадию I (например, стадию IA, IB или IC), стадию II (например, стадию IIA, IIB или IIC), стадию III (например, стадию IIIA, IIIB или IIIC) или стадию IV. В некоторых вариантах осуществления субъект может представлять собой человека, который имеет ген, генетическую мутацию или полиморфизм, связанный с раком яичников (например, BRCA1 или BRCA2), или имеет одну или более дополнительных копий гена, связанного с раком яичников (например, одну или более дополнительных копий гена HER2). В некоторых вариантах осуществления рак яичников представляет собой герминогенную опухоль яичников. Примеры гистологических подтипов включают дисгерминомы или другие герминогенные опухоли (например, опухоли эндодермального синуса, такие как опухоли гепатоидного или интестинального типа, эмбриональные карциномы, полиэмбриомы, хориокарциномы, тератомы или смешанные формы опухолей). Примеры тератом представляют собой незрелые тератомы, зрелые тератомы, солидные тератомы и кистозные тератомы (например, дермоидные кисты, такие как зрелые кистозные тератомы и дермоидные кисты с малигнизацией). Некоторые тератомы являются монодермальными и высокоспециализированными, такими как струма яичников, карционоид, струма яичников и карционоид или т. п. (например, злокачественные нейроэктодермальные опухоли и эпендимомы). В различных вариантах осуществления герминогенная опухоль яичников может иметь следующие стадии: стадию I (например, стадию IA, IB или IC), стадию II (например, стадию IIA, IIB или IIC), стадию III (например, стадию IIIA, IIIB или IIIC) или стадию IV.
Способы MASCT, описанные в настоящем документе, в некоторых вариантах осуществления не применяются у пациентов с раковыми заболеваниями Т-клеточного происхождения, такими как T-клеточная лимфома.
Несколько вирусов связаны с раком у людей. Например, вирус гепатита В (ВГB) может вызвать хроническую инфекцию печени, увеличивая вероятность развития у субъекта рака печени или гепатоцеллюлярной карциномы (HCC). Вирусы папилломы человека (ВПЧ) представляют собой группу из более150 родственных вирусов, которые при инфицировании и росте на коже или слизистых оболочках, например, ротовой полости, горла или влагалища, вызывают папилломы или бородавки. Известно, что несколько типов ВПЧ (включая типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 6) вызывают рак шейки матки. ВПЧ также играют определенную роль в индуцировании или этиологии других раковых заболеваний гениталий и связаны с некоторыми видами рака ротовой полости и горла. Вирус Эпштейна-Барра (ВЭБ) представляет собой тип вируса герпеса, который хронически инфицирует В-лимфоциты и сохраняется в них в латентном состоянии. Инфекция ВЭБ повышает риск развития карциномы носоглотки и некоторых типов быстрорастущих лимфом, таких как лимфома Беркитта. ВЭБ также связан с лимфомой Ходжкина и некоторыми случаями рака желудка. Вирусные инфекции, такие как инфекции с ВГВ, ВПЧ и ВЭБ, не только являются причиной возникновения рака или увеличивают риск развития рака, но и могут приводить к повреждению тканей или органов, что может увеличить нагрузку заболевания у человека, страдающего от рака, и способствовать прогрессированию рака.
В данной области известно, что организм человека можно стимулировать для установления эффективного и специфического иммунного ответа, включая ответ цитотоксических Т-клеток, против нескольких связанных с раком вирусов, таких как ВГВ, ВПЧ и ВЭБ, включая их различные подтипы. Таким образом, в некоторых вариантах осуществления предложен способ лечения связанного с вирусом ракового заболевания у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления субъекту ранее вводили эффективное количество антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества антигенпредставляющих клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления вирус представляет собой ВПЧ, ВГB или ВЭБ. В некоторых вариантах осуществления рак представляет собой связанную с ВПЧ гепатоцеллюлярную карциному, связанный с ВПЧ рак шейки матки или связанную с ВЭБ карциному носоглотки.
Способы, описанные в настоящем документе, можно использовать для достижения любой одной или более из следующих целей: ослабление одного или более симптомов рака, задержка прогрессирования рака, уменьшение размера раковой опухоли, разрыв (например, разрушение) стромы рака, ингибирование роста раковой опухоли, продление общей выживаемости, продление безрецидивной выживаемости, продление времени до прогрессирования ракового заболевания, предотвращение или замедление метастазирования раковой опухоли, уменьшение (например, устранение) ранее существовавших метастазов раковой опухоли, снижение заболеваемости или нагрузки ранее существовавших метастазов раковой опухоли, предотвращение рецидива рака и/или улучшение клинических преимуществ в отношении рака.
APC, T-клетка и опухолевый антигенный пептид
В способах, описанных в настоящем документе, в некоторых вариантах осуществления применяют антигенпредставляющие клетки (APC) и активированные T-клетки. APC являются клетками иммунной системы, которые способны активировать T-клетки. APC включают, без ограничений, некоторые макрофаги, В-клетки и дендритные клетки (DC). Дендритные клетки являются представителями многообразной популяции морфологически подобных типов клеток, обнаруженных в лимфоидных или нелимфоидных тканях. Эти клетки характеризуются особой морфологией и высокими уровнями экспрессии поверхностных молекул МНС класса I и класса II, белков, которые представляют антигенные пептиды Т-клеткам. DC, другие APC и T-клетки можно выделить или получить (например, дифференцировать) из ряда тканевых источников и соответственно из периферической крови, например из мононуклеарных клеток периферической крови (PBMC), которые получают из периферической крови.
Т-клетки или Т-лимфоциты играют центральную роль в клеточноопосредованном иммунитете. Каждый клон активированных T-клеток экспрессирует на поверхности особый Т-клеточный рецептор (TCR), который отвечает за распознавание антигенов, связанных с молекулами MHC на АРС и на клетках-мишенях (таких как раковые клетки). Т-клетки подразделяются на несколько типов, каждый из которых экспрессирует уникальную комбинацию поверхностных белков и имеет особую функцию.
Цитотоксические T-клетки (TC) участвуют в иммунном ответе и разрушении опухолевых клеток и других инфицированных клеток, таких как инфицированные вирусом клетки. Как правило, TC-клетки функционируют посредством распознавания антигена, представленного MHC класса I на APC или любой клетке-мишени. Стимуляция TCR наряду с костимулятором (например, CD28 на T-клетках, связывающихся с B7 на APC, или стимуляция хелперной Т-клеткой) приводит к активации TC-клетки. Активированная ТС-клетка может затем пролиферировать и высвобождать цитотоксины, тем самым разрушая АРС или клетку-мишень (такую как раковая клетка). Зрелые ТС-клетки обычно экспрессируют поверхностные белки CD3 и CD8. Цитотоксические Т-клетки принадлежат к Т-клеткам CD3+CD8+.
Хелперные Т-клетки (TH) представляют собой Т-клетки, которые способствуют активности других иммунных клеток, высвобождая цитокины Т-клеток, которые могут регулировать или подавлять иммунные ответы, индуцировать цитотоксические Т-клетки и максимально увеличивать активность макрофагов по уничтожению клеток. Как правило, TH-клетки функционируют посредством распознавания антигена, представленного MHC класса II на APC. Зрелые II-клетки экспрессируют поверхностные белки CD3 и CD4. Хелперные Т-клетки принадлежат к Т-клеткам CD3+CD4+.
Натуральные Т-клетки-киллеры (NK) представляют собой неоднородную группу Т-клеток, которые обладают свойствами как Т-клеток, так и натуральных клеток-киллеров. Активация Т-клеток-NK приводит к продукции провоспалительных цитокинов, хемокинов и клеточных факторов. Они экспрессируют CD56, поверхностную молекулу, обычно экспрессируемую на натуральных клетках-киллерах. Т-клетки-NK принадлежат к Т-клеткам CD3+CD56+.
Регуляторные Т-летки (клетки Treg) обычно модулируют иммунную систему, повышая толерантность к собственным антигенам, тем самым ограничивая аутоиммунную активность. При иммунотерапии рака клетки Treg влияют на ускользание раковых клеток от иммунного ответа. Клетки Treg по существу экспрессируют CD3, CD4, CD7, CD25, CTLA4, GITR, GARP, FOXP3 и/или LAP. Т-клетки CD4+CD25+Foxp3+ представляют собой один класс клеток Treg.
Т-клетки памяти (Tm) представляют собой Т-клетки, которые ранее встречались со специфическими антигенами и реагировали на них, или Т-клетки, которые дифференцировались из активированных Т-клеток. Хотя опухолеспецифические Tm составляют небольшую часть общего количества Т-клеток, они выполняют важные функции надзора за опухолевыми клетками в течение всей жизни человека. Если опухолеспецифические Tm встречаются с опухолевыми клетками, экспрессирующими специфические для них опухолевые антигены, происходит немедленная активация и увеличение количества Tm посредством клонирования. Активированные и увеличившиеся в количестве Т-клетки дифференцируются в эффекторные Т-клетки, чтобы с высокой эффективностью уничтожать опухолевые клетки. Т-клетки памяти важны для установления и поддержания долгосрочных специфических в отношении опухолевых антигенов ответов Т-клеток.
Обычно антигеном для Т-клеток является белковая молекула или линейный фрагмент белковой молекулы, который может распознаваться T-клеточным рецептором (TCR), чтобы вызывать специфический Т-клеточный ответ. Антиген можно получить из чужеродного источника, такого как кодированный вирусом белок, или эндогенного источника, такого как экспрессируемый внутри клетки или на поверхности клетки белок. Минимальный фрагмент антигена, который непосредственно участвует во взаимодействии с конкретным TCR, известен как эпитоп. В одном антигене может существовать множество эпитопов, причем каждый эпитоп распознается отдельным TCR, кодируемым конкретным клоном Т-клеток.
Чтобы быть распознанным TCR, антигенный пептид или фрагмент антигена можно переработать в эпитоп с помощью APC (такой как дендритная клетка), а затем связать в расширенной конформации внутри молекулы главного комплекса гистосовместимости (MHC) с образованием комплекса MHC-пептид на поверхности APC (такой как дендритная клетка). Молекулы MHC у людей также известны как антигены лейкоцитов человека (HLA). MHC обеспечивает увеличенную поверхность связывания для сильной ассоциации между TCR и эпитопом, тогда как комбинация уникальных аминокислотных остатков внутри эпитопа обеспечивает специфичность взаимодействия между TCR и эпитопом. Молекулы MHC человека делятся на два типа - MHC класса I и MHC класса II - на основании их структурных характеристик, особенно длины эпитопов, связанных внутри соответствующих комплексов MHC. Эпитопы MHC-I представляют собой эпитопы, связанные и представленные молекулой МНС класса I. Эпитопы MHC-II представляют собой эпитопы, связанные и представленные молекулой МНС класса II. Эпитопы MHC-I обычно имеют длину от приблизительно 8 до приблизительно 11 аминокислот, тогда как эпитопы MHC-II имеют длину от приблизительно 13 до приблизительно 17 аминокислот. Вследствие генетического полиморфизма среди популяции людей существуют различные подтипы как молекул MHC класса I, так и молекул MHC класса II. Т-клеточный ответ на специфический антигенный пептид, представленный молекулой МНС класса I или МНС класса II на АРС или клетке-мишени, известен как ограниченный МНС Т-клеточный ответ.
Опухолевые антигенные пептиды получают из опухолевых антигенных белков (также называемых в настоящем документе «опухолевыми антигенами»), которые сверхэкспрессируются в раковых клетках, но в нормальных клетках имеют отсутствующие или низкие уровни экспрессии (например, менее приблизительно 10, 100, 1000 или 5000 копий на клетку). Некоторые опухолевые антигенные пептиды получают из опухолеспецифических антигенов (TSA), дифференцировочных антигенов или сверхэкспрессированных антигенов (также известных как «связанные с опухолью антигены», или TAA). Некоторые опухолевые антигенные пептиды получают из мутантных белковых антигенов, которые присутствуют только в раковых клетках, но отсутствуют в нормальных клетках.
Антигенная загрузка дендритных клеток
В настоящем изобретении предложен способ получения популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, с использованием для того, чтобы вызывать ограниченный MHC Т-клеточный ответ у субъекта, включающий приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. Дендритные клетки, полученные посредством этого способа, могут применяться в любом варианте осуществления способов MASCT, описанном в настоящем документе, или для получения активированных T-клеток, или для совместного культивирования дендритных клеток и T-клеток, как описано в следующем разделе.
В некоторых вариантах осуществления способов получения дендритных клеток, загруженных множеством антигенов, популяцию дендритных клеток приводят в контакт с любым количеством из более приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию дендритных клеток приводят в контакт с множеством опухолевых антигенных пептидов, содержащих по меньшей мере любое количество из приблизительно 1, 5, 10, 15, 20, 25, 30, 35 или 40 эпитопов, которые выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления популяцию дендритных клеток приводят в контакт с любым количеством из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления популяцию дендритных клеток приводят в контакт с любым количеством из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более опухолевых антигенных пептидов, полученных из белков, которые выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA1, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления дендритные клетки представляют собой зрелые дендритные клетки, которые представляют один или более опухолевых антигенных пептидов из множества опухолевых антигенных пептидов. Зрелые дендритные клетки, полученные посредством любого из способов, описанных в настоящем документе, могут представлять любой один из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 опухолевых антигенных пептидов. По сравнению с наивными дендритными клетками или дендритными клетками, которые не были загружены множеством опухолевых антигенных пептидов, дендритные клетки, загруженные множеством антигенов, могут иметь повышенный уровень представления любого количества из более приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 опухолевых антигенных пептидов. В некоторых вариантах осуществления зрелые дендритные клетки имеют повышенный уровень представления любого количества из более приблизительно 1, 5, 10, 15, 20, 25, 30, 35 или 40 эпитопов, которые выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления зрелые дендритные клетки имеют повышенный уровень представления из более чем десяти опухолевых антигенных пептидов. В некоторых вариантах осуществления зрелые дендритные клетки имеют повышенный уровень представления любого количества из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более опухолевых антигенных пептидов, как показано на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления зрелые дендритные клетки имеют повышенный уровень представления любого количества из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более опухолевых антигенных пептидов, полученных из белков, которые выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA1, KRAS, PARP4, MLL3 и MTHFR.
Пример осуществления контакта популяции дендритных клеток с множеством опухолевых антигенных пептидов включает импульсное добавление множества опухолевых антигенных пептидов в популяцию дендритных клеток, таких как незрелые дендритные клетки или дендритные клетки, содержащиеся в PBMC или полученные (например, дифференцированые) из PBMC. Как известно в данной области, импульсное добавление относится к процессу смешивания клеток, таких как дендритные клетки, с раствором, содержащим антигенные пептиды, и необязательно последующего удаления антигенных пептидов из смеси. Популяцию дендритных клеток можно приводить в контакт с множеством опухолевых антигенных пептидов в течение периода, измеряемого в секундах, минутах или часах, например в течение любого периода приблизительно 30 секунд, 1 минуты, 5 минут, 10 минут, 15 минут, 20 минут, 30 минут, 1 часа, 5 часов, 10 часов, 12 часов, 14 часов, 16 часов, 18 часов, 20 часов, 22 часов, 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, одной недели, 10 или более суток. Концентрация каждого опухолевого антигенного пептида, используемого на этапе приведения в контакт, может представлять собой любую концентрацию из приблизительно 0,1, 0,5, 1, 2, 3, 5 или 10 мкг/мл. В некоторых вариантах осуществления концентрация опухолевых антигенных пептидов составляет приблизительно 0,1-200 мкг/мл, включая, например, любую концентрацию из приблизительно 0,1-0,5, 0,5-1, 1-10, 10-50, 50-100, 100-150 или 150-200 мкг/мл.
В некоторых вариантах осуществления популяцию дендритных клеток приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками. В некоторых вариантах осуществления в раствор, содержащий множество опухолевых антигенных пептидов, могут быть включены соединения, материалы или композиции, которые способствуют поглощению пептидов дендритными клетками. Соединения, материалы или композиции, способствующие поглощению множества опухолевых антигенных пептидов дендритными клетками, включают, без ограничений, молекулы липидов и пептиды с множеством положительно заряженных аминокислот. В некоторых вариантах осуществления популяцией дендритных клеток поглощается любое количество из более приблизительно 50%, 60%, 70%, 80%, 90% или 95% опухолевых антигенных пептидов. В некоторых вариантах осуществления любое количество из более приблизительно 50%, 60%, 70%, 80%, 90% или 95% дендритных клеток в популяции поглощает по меньшей мере один опухолевый антигенный пептид.
В некоторых вариантах осуществления предложен способ получения популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, включающий приведение популяции незрелых дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает индуцирование созревания популяции незрелых дендритных клеток множеством агонистов Toll-подобного рецептора (TLR). В некоторых вариантах осуществления способ включает приведение популяции незрелых дендритных клеток в контакт с множеством агонистов TLR и множеством опухолевых антигенных пептидов с получением популяции зрелых дендритных клеток, загруженных множеством опухолевых антигенных пептидов. Примеры агонистов TLR включают, без ограничений, polyIC, MALP и R848. На этапе созревания в культуральные среды можно дополнительно включать цитокины и другие подходящие молекулы. Созревание популяции незрелых дендритных клеток можно индуцировать агонистами TLR в течение по меньшей мере любого периода приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 суток. В некоторых вариантах осуществления созревание популяции незрелых дендритных клеток индуцируют в течение приблизительно 8 суток.
Дендритные клетки (такие как незрелые дендритные клетки) можно получить из различных источников, включая аутологичные источники, т. е. от субъекта, получающего лечение. Подходящим источником дендритных клеток являются РВМС из периферической крови. Например, моноциты (тип лейкоцитов) являются широко распространенными РВМС, составляющими приблизительно 10-30% от общего количества РВМС. Моноциты можно индуцировать для дифференцирования в дендритные клетки, такие как незрелые дендритные клетки, с использованием цитокинов. В некоторых вариантах осуществления незрелые дендритные клетки получают посредством получения популяции РВМС, получения из популяции РВМС популяции моноцитов и приведения популяции моноцитов в контакт с множеством цитокинов с получением популяции незрелых дендритных клеток. Примеры цитокинов, которые можно использовать для индуцирования дифференцирования моноцитов, включают, без ограничений, GM-CSF и IL-4, в известных в данной области условиях (например, концентрации, температура, уровень CO2 и т. п.). Адгезивная фракция PBMC содержит большинство моноцитов из РВМС. В некоторых вариантах осуществления моноциты из адгезивной фракции PBMC приводят в контакт с цитокинами с получением популяции незрелых дендритных клеток. РВМС можно легко получить посредством центрифугирования образца периферической крови или с использованием афереза для взятия образца от субъекта. В некоторых вариантах осуществления популяцию PBMC получают посредством центрифугирования в градиенте плотности образца периферической крови человека. В некоторых вариантах осуществления образец получают от субъекта, который получает дендритные клетки, загруженные множеством антигенов, активированные T-клетки или другие иммунотерапевтические композиции, полученные с использованием дендритных клеток, загруженные множеством антигенов.
В некоторых вариантах осуществления предложен способ получения популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, с использованием для того, чтобы вызывать у субъекта ограниченный МНС Т-клеточный ответ, включающий этапы получения от субъекта популяции мононуклеарных клеток периферической крови (PBMC), получение из популяции PBMC популяции моноцитов, получение из популяции моноцитов популяции дендритных клеток и приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления предложен способ получения популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, с использованием для того, чтобы вызывать у субъекта ограниченный МНС Т-клеточный ответ, включающий этапы получения от субъекта (например, индивидуума) популяции PBMC, получение из популяции PBMC популяции моноцитов, приведение популяции моноцитов в контакт с множеством цитокинов (таких как GM-CSF и IL-4) с получением популяции незрелых дендритных клеток и приведение популяции незрелых дендритных клеток в контакт с множеством агонистов TLR и множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Дополнительно в настоящем изобретении предложена выделенная популяция дендритных клеток, полученная посредством любого из вариантов осуществления способов, описанных в настоящем документе. В некоторых вариантах осуществления выделенная популяция дендритных клеток способна вызывать ограниченный МНС Т-клеточный ответ in vivo или ex vivo. В некоторых вариантах осуществления ограниченный МНС Т-клеточный ответ опосредован как молекулами MHC класса I, так и молекулами MHC класса II. В некоторых вариантах осуществления выделенная популяция дендритных клеток способна индуцировать дифференциацию и пролиферацию специфичных в отношении опухолевого антигена Т-клеток.
Получение активированных T-клеток
Дополнительно в настоящем изобретении предложен способ получения популяции активированных T-клеток, используемых для лечения рака у субъекта, включающий совместное культивирование популяции Т-клеток с популяцией антигенпредставляющих клеток (таких как дендритные клетки), загруженных множеством опухолевых антигенных пептидов. Любой вариант осуществления дендритных клеток, загруженных множеством антигенов, описанный в предыдущем разделе, можно использовать для получения активированных T-клеток. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта, например от онкологического субъекта (например, с раковым заболеванием от низкой до умеренной степени). В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток или обе популяции получают из аутологичных источников, т. е. от субъекта, который получает активированные T-клетки, дендритные клетки, загруженные множеством антигенов, или те и другие.
В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, совместно культивируют в течение по меньшей мере любого периода приблизительно 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30 суток. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 7 суток до приблизительно 10 суток, от приблизительно 10 суток до приблизительно 15 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток, 14 суток, 16 суток, 18 суток или 21 суток). В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение приблизительно 10 суток. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение приблизительно 14 суток.
Популяцию Т-клеток, используемую в любом варианте осуществления способов, описанных в настоящем документе, можно получить из различных источников. Подходящим источником Т-клеток являются РВМС из периферической крови человека. Популяцию Т-клеток можно выделить из PBMC, или альтернативно в совместной культуре может использоваться популяция PBMC, обогащенная T-клетками (например, посредством добавления специфичных для T-клетки антител и цитокинов). В некоторых вариантах осуществления популяцию Т-клеток, используемую в совместной культуре, получают из неадгезивной фракции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления PBMC получают посредством центрифугирования в градиенте плотности образца периферической крови. В некоторых вариантах осуществления популяцию Т-клеток получают посредством культивирования неадгезивной фракции PBMC по меньшей мере с одним цитокином (таким как IL-2) с антителом к CD3 (таким как OKT3) или без него (процесс, упомянутый в настоящем документе как «поддержание Т-клеток»). В некоторых вариантах осуществления неадгезивную фракцию PBMC культивируют в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3. Неадгезивную фракцию PBMC можно культивировать в течение по меньшей мере любого периода из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более суток. В некоторых вариантах осуществления популяцию активированных T-клеток получают посредством получения популяции неадгезивных PBMC и совместного культивирования популяции неадгезивных PBMC с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов (например, в присутствии по меньшей мере одного цитокина (такого как IL-2), и необязательно антитела к CD3, и необязательно ингибитора иммунной контрольной точки).
Совместная культура может дополнительно включать цитокины и другие соединения, способствующие активации, созреванию и/или пролиферации Т-клеток, а также праймированию Т-клеток для последующей дифференциации в T-клетки памяти. Примеры цитокинов, которые можно использовать на этом этапе, включают, без ограничений, IL-7, IL-15, IL-21 и т. п. Некоторые цитокины могут способствовать подавлению процента Treg в популяции активированных T-клеток в совместной культуре. Например, в некоторых вариантах осуществления используют высокую дозу (например, по меньшей мере любую из приблизительно 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200 или 1500 Е/мл) цитокина (такого как IL-2) для совместного культивирования популяции Т-клеток и популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, с получением популяции активированных T-клеток с низким процентным содержанием клеток Treg.
Совместная культура может также включать один или более (например, любое количество из 1, 2, 3 или более) ингибиторов иммунной контрольной точки. В некоторых вариантах осуществления перед совместным культивированием популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки. Например, популяция Т-клеток может представлять собой выделенные T-клетки или Т-клетки, присутствующие в смеси клеток, например в неадгезивной фракции РВМС. В некоторых вариантах осуществления перед совместным культивированием популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки. В некоторых вариантах осуществления популяцию Т-клеток или неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки в течение по меньшей мере любого периода приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14 или более суток. В некоторых вариантах осуществления популяцию Т-клеток или неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки в течение от приблизительно 5 суток до приблизительно 14 суток. В некоторых вариантах осуществления PBMC приводят в контакт с ингибитором иммунной контрольной точки в течение приблизительно 8 суток.
В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор ингибирующей молекулы контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, PD-L2, CTLA-4, BLTA, TIM-3 и LAG-3. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-1, такое как ниволумаб (например, OPDIVO®), пембролизумаб (например, KEYTRUDA®) или SHR-1210. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-L1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-L1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор CTLA-4. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к CTLA-4, такое как ипилимумаб (например, YERVOY®).
Популяцию Т-клеток можно стимулировать популяцией DC, загруженных множеством опухолевых антигенных пептидов, любое количество раз, например любое количество из 1, 2, 3 или более раз. В некоторых вариантах осуществления популяцию Т-клеток стимулируют один раз. В некоторых вариантах осуществления популяцию Т-клеток стимулируют по меньшей мере два раза. В некоторых вариантах осуществления для каждой стимуляции в совместную культуру добавляют популяцию DC, загруженных множеством опухолевых антигенных пептидов. Популяция DC может быть получена недавно и подвергнута импульсному воздействию множества опухолевых антигенных пептидов, или она может быть получена из исходной популяции DC, полученной для начальной стимуляции.
Соответственно, предложен способ получения популяции активированных T-клеток, включающий: (a) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (b) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию дендритных клеток и популяцию неадгезивных PBMC получают из популяции PBMC от субъекта. В некоторых вариантах осуществления совместное культивирование проводят в присутствии множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация). В некоторых вариантах осуществления совместное культивирование проводят в присутствии антитела к CD3 (такого как OKT3) и множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3). В некоторых вариантах осуществления способ дополнительно включает получение популяции PBMC от субъекта.
В некоторых вариантах осуществления предложен способ получения популяции активированных T-клеток, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции РВМС от субъекта. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, приводят в контакт с множеством агонистов TLR для индуцирования созревания популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления совместное культивирование проводят в присутствии множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация). В некоторых вариантах осуществления совместное культивирование проводят в присутствии антитела к CD3 (такого как OKT3) и множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3). В некоторых вариантах осуществления способ дополнительно включает любой один этап или комбинацию этапов: (i) получение от субъекта популяции PBMC; (ii) получение популяции моноцитов из популяции PBMC; и (iii) получение популяции неадгезивных PBMC из популяции PBMC.
В некоторых вариантах осуществления предложен способ получения популяции активированных T-клеток, включающий получение популяции мононуклеарных клеток периферической крови (PBMC) от субъекта, получение из популяции PBMC популяции моноцитов, индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4), приведение популяции незрелых дендритных клеток в контакт с множеством агонистов Toll-подобного рецептора (TLR) и множеством опухолевых антигенных пептидов с получением популяции зрелых дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получение популяции неадгезивных PBMC из популяции PBMC и совместное культивирование популяции зрелых дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC в присутствии множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация), необязательно антитела к CD3 (такого как OKT3) и необязательно ингибитора иммунной контрольной точки (такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3) с получением популяции активированных T-клеток.
Дополнительно в настоящем изобретении предложена выделенная популяция активированных T-клеток, полученная посредством любого из вариантов осуществления способов, описанных в настоящем документе. В настоящем документе также предложена совместная культура, используемая для лечения рака у субъекта, содержащая популяцию Т-клеток и популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления совместной культуры популяцию Т-клеток и популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают от одного и того же субъекта, например от субъекта, получающего лечение. В некоторых вариантах осуществления совместной культуры популяцию дендритных клеток, загруженных множеством антигенов, получают посредством любого варианта осуществления способов получения, описанных в предыдущем разделе, например, посредством импульсного добавления множества опухолевых антигенных пептидов в популяцию дендритных клеток или посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции (например, молекул липидов или пептидов с множеством положительно заряженных аминокислот), которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками. Выделенную популяцию активированных T-клеток и совместную культуру, описанные в этом разделе, можно использовать в любом варианте осуществления способов MASCT. В настоящем документе предложены иммунотерапевтические композиции, содержащие выделенную популяцию активированных T-клеток или совместную культуру, используемые для лечения рака, предотвращения прогрессирования или метастазирования опухоли или для уменьшения ускользания рака от иммунного ответа. Выделенную популяцию активированных T-клеток и совместную культуру можно также использовать при изготовлении лекарственного средства для лечения рака, предотвращения прогрессирования или метастазирования опухоли или для уменьшения ускользания рака от иммунного ответа.
Предполагается, что любой из этапов и параметров, описанных в настоящем документе в отношении получения популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, или в отношении получения популяции активированных T-клеток, можно комбинировать с любым из этапов и параметров, описанных в настоящем документе, в отношении способа MASCT, как если бы каждая комбинация была описана отдельно.
Например, в некоторых вариантах осуществления предложена выделенная популяция активированных T-клеток, полученная посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию дендритных клеток получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3). В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают из одного источника (например, от субъекта, получающего лечение активированными T-клетками).
В некоторых вариантах осуществления предложена выделенная популяция активированных T-клеток, полученная посредством: (a) индуцирования дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) совместного культивирования популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции РВМС от субъекта. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, приводят в контакт с множеством агонистов TLR для индуцирования созревания популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления совместное культивирование проводят в присутствии множества цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно антитела к CD3 (такого как OKT3). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3). В некоторых вариантах осуществления способ дополнительно включает любой один этап или комбинацию этапов: (i) получение от субъекта популяции PBMC; (ii) получение популяции моноцитов из популяции PBMC; и (iii) получение популяции неадгезивных PBMC из популяции PBMC.
MASCT на основе PBMC
В варианте способа MASCT, называемом «MASCT на основе PBMC», для применения в лечении рака у субъекта непосредственно используют PBMC, содержащие APC и T-клетки, без выделения или получения клеток APC (таких как дендритные клетки) или T-клеток.
Соответственно, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий приведение популяции мононуклеарных клеток периферической крови (PBMC) в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3. В некоторых вариантах осуществления популяцию активированных PBMC приводят в контакт с IL-2. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
Способ MASCT на основе PBMC подходит для лечения любого вида рака (включая различные типы или этапы), который можно лечить посредством других вариантов осуществления способа MASCT, описанных в предыдущих разделах. В некоторых вариантах осуществления способа MASCT на основе PBMC рак выбирают из группы, состоящей из гепатоцеллюлярной карциномы, рака шейки матки, рака легких, колоректального рака, лимфомы, карциномы почки, рака молочной железы, рака поджелудочной железы, рака желудка, рака пищевода, рака яичников, рака предстательной железы, карциномы носоглотки, меланомы и рака головного мозга.
В некоторых вариантах осуществления PBMC являются аутологичными, т. е. полученными от субъекта, получающего лечение. В некоторых вариантах осуществления в периферической крови, полученной от субъекта, наблюдается низкое количество дендритных клеток или T-клеток. В некоторых вариантах осуществления PBMC приводят в контакт с цитокинами, такими как IL-2, GM-CSF и т. п., чтобы индуцировать дифференциацию, созревание или пролиферацию некоторых клеток (таких как дендритные клетки, T-клетки или их комбинация) в PBMC одновременно с этапом приведения в контакт или после него. В некоторых вариантах осуществления после этапа приведения в контакт происходит удаление множества опухолевых антигенных пептидов. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в течение любого из перечисленных периодов по меньшей мере приблизительно 10 минут, 15 минут, 20 минут, 30 минут, 1 часа, 5 часов, 10 часов, 12 часов, 14 часов, 16 часов, 18 часов, 20 часов, 22 часов, 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, одной недели, 10 или более суток. В некоторых вариантах осуществления PBMC приводят в контакт с цитокинами по меньшей мере на любой период приблизительно 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30 суток. В некоторых вариантах осуществления PBMC приводят в контакт с цитокинами на период приблизительно 14-21 суток. В некоторых вариантах осуществления PBMC приводят в контакт с цитокинами на период приблизительно 14 суток.
В любом из способов MASCT на основе PBMC, описанных выше, PBMC приводят в контакт с одним или более ингибиторов иммунной контрольной точки. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки. В некоторых вариантах осуществления PBMC приводят в контакт с ингибитором иммунной контрольной точки по меньшей мере на любой период приблизительно 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30 суток. В некоторых вариантах осуществления PBMC приводят в контакт с ингибитором иммунной контрольной точки в течение периода от приблизительно 14 суток до приблизительно 21 суток.
Комбинированная терапия с ингибитором иммунной контрольной точки
Способы, описанные в настоящем документе в отношении лечения рака, можно использовать как в виде монотерапии, так и в виде комбинированной терапии с другим агентом. Например, любой из способов MASCT (включая способы MASCT на основе PBMC), описанных в настоящем документе, можно комбинировать с введением одного или более (например, любого количества из 1, 2, 3, 4 или более) ингибиторов иммунной контрольной точки.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества ингибитора иммунной контрольной точки. В некоторых вариантах осуществления активированные T-клетки и ингибитор иммунной контрольной точки вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор иммунной контрольной точки вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) введение субъекту эффективного количества ингибитора иммунной контрольной точки, при этом популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления активированные T-клетки и ингибитор иммунной контрольной точки вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор иммунной контрольной точки вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) введение субъекту эффективного количества ингибитора иммунной контрольной точки. В некоторых вариантах осуществления активированные PBMC и ингибитор иммунной контрольной точки вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные PBMC и ингибитор иммунной контрольной точки вводят последовательно. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию активированных PBMC дополнительно приводят в контакт с IL-2. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-1. Примеры антител к PD-1 включают, без ограничений, ниволумаб, пембролизумаб, пидилизумаб, BMS-936559 и атезолизумаб, пембролизумаб, MK-3475, AMP-224, AMP-514, STI-A1110 и TSR-042. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ниволумаб (например, OPDIVO®). В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой пембролизумаб (например, KEYTRUDA®). В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой SHR-1210.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества ингибитора PD-1. В некоторых вариантах осуществления ингибитор PD-1 представляет собой антитело к PD-1. В некоторых вариантах осуществления ингибитор PD-1 выбирают из группы, состоящей из ниволумаба, пембролизумаба и SHR-1210. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-1 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) введение субъекту эффективного количества ингибитора PD-1, при этом популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления ингибитор PD-1 представляет собой антитело к PD-1. В некоторых вариантах осуществления ингибитор PD-1 выбирают из группы, состоящей из ниволумаба, пембролизумаба и SHR-1210. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-1 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) введение субъекту эффективного количества ингибитора PD-1. В некоторых вариантах осуществления ингибитор PD-1 представляет собой антитело к PD-1. В некоторых вариантах осуществления ингибитор PD-1 выбирают из группы, состоящей из ниволумаба, пембролизумаба и SHR-1210. В некоторых вариантах осуществления активированные PBMC и ингибитор PD-1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные PBMC и ингибитор PD-1 вводят последовательно. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию активированных PBMC дополнительно приводят в контакт с IL-2. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-1. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества пембролизумаба (например, KETRUDA®). В некоторых вариантах осуществления активированные T-клетки и пембролизумаб вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и пембролизумаб вводят последовательно. В некоторых вариантах осуществления пембролизумаб вводят внутривенно (например, посредством инфузии в течение более чем приблизительно 30 минут). В некоторых вариантах осуществления пембролизумаб вводят в дозе приблизительно 2 мг/кг. В некоторых вариантах осуществления пембролизумаб вводят приблизительно один раз каждые 3 недели. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) введение субъекту эффективного количества пембролизумаба (например, KETRUDA®), при этом популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления активированные T-клетки и пембролизумаб вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и пембролизумаб вводят последовательно. В некоторых вариантах осуществления пембролизумаб вводят внутривенно (например, посредством инфузии в течение более чем приблизительно 30 минут). В некоторых вариантах осуществления пембролизумаб вводят в дозе приблизительно 2 мг/кг. В некоторых вариантах осуществления пембролизумаб вводят приблизительно один раз каждые 3 недели. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) введение субъекту эффективного количества пембролизумаба (такого как KETRUDA®). В некоторых вариантах осуществления активированные PBMC и пембролизумаб вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные PBMC и пембролизумаб вводят последовательно. В некоторых вариантах осуществления пембролизумаб вводят внутривенно (например, посредством инфузии в течение более чем приблизительно 30 минут). В некоторых вариантах осуществления пембролизумаб вводят в дозе приблизительно 2 мг/кг. В некоторых вариантах осуществления пембролизумаб вводят приблизительно один раз каждые 3 недели. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию активированных PBMC дополнительно приводят в контакт с IL-2. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-1. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-L1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-L1. Примеры антител к PD-L1 включают, без ограничений, KY-1003, MCLA-145, RG7446, BMS935559, MPDL3280A, MEDI4736, авелумаб или STI-A1010.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества ингибитора PD-L1. В некоторых вариантах осуществления ингибитор PD-L1 представляет собой антитело к PD-L1. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-L1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-L1 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию T-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-L1). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) введение субъекту эффективного количества ингибитора PD-L1, при этом популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления ингибитор PD-L1 представляет собой антитело к PD-L1. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-L1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор PD-L1 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-L1). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) введение субъекту эффективного количества ингибитора PD-L1. В некоторых вариантах осуществления ингибитор PD-L1 представляет собой антитело к PD-L1. В некоторых вариантах осуществления активированные PBMC и ингибитор PD-L1 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные PBMC и ингибитор PD-L1 вводят последовательно. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию активированных PBMC дополнительно приводят в контакт с IL-2. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-L1. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор CTLA-4. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к CTLA-4. Примеры антител к CTLA-4 включают, без ограничений, ипилимумаб, тремелимумаб и KAHR-102. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ипилимумаб (например, YERVOY®).
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества ингибитора CTLA-4. В некоторых вариантах осуществления ингибитор CTLA-4 представляет собой антитело к CTLA-4, например ипилимумаб. В некоторых вариантах осуществления активированные T-клетки и ингибитор CTLA-4 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор CTLA-4 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления популяцию Т-клеток получают из неадгезивной части популяции мононуклеарных клеток периферической крови (PBMC). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию T-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) введение субъекту эффективного количества ингибитора CTLA-4, при этом популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC. В некоторых вариантах осуществления ингибитор CTLA-4 представляет собой антитело к CTLA-4, например ипилимумаб. В некоторых вариантах осуществления активированные T-клетки и ингибитор CTLA-4 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные T-клетки и ингибитор CTLA-4 вводят последовательно. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток или приблизительно 10 суток). В некоторых вариантах осуществления совместное культивирование дополнительно включает приведение активированных T-клеток в контакт с множеством цитокинов (таких как IL-2, IL-7, IL-15, IL-21 или любая их комбинация) и необязательно с антителом к CD3. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор CTLA-4). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) введение субъекту эффективного количества ингибитора CTLA-4. В некоторых вариантах осуществления ингибитор CTLA-4 представляет собой антитело к CTLA-4, например ипилимумаб. В некоторых вариантах осуществления активированные PBMC и ингибитор CTLA-4 вводят одновременно, например, в одной и той же композиции. В некоторых вариантах осуществления активированные PBMC и ингибитор CTLA-4 вводят последовательно. В некоторых вариантах осуществления PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов антигенпредставляющими клетками (такими как дендритные клетки) в PBMC. В некоторых вариантах осуществления популяцию активированных PBMC дополнительно приводят в контакт с IL-2. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор CTLA-4. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение.
В некоторых вариантах осуществления активированные T-клетки (или активированные PBMC) и ингибитор иммунной контрольной точки вводят одновременно. В некоторых вариантах осуществления активированные T-клетки (или активированные PBMC) и ингибитор иммунной контрольной точки вводят в одной композиции. В некоторых вариантах осуществления ингибитор иммунной контрольной точки присутствует в совместной культуре. В некоторых вариантах осуществления активированные T-клетки (или активированные PBMC) и ингибитор иммунной контрольной точки смешивают перед (например, непосредственно перед) введением. В некоторых вариантах осуществления активированные T-клетки (или активированные PBMC) и ингибитор иммунной контрольной точки вводят одновременно в отдельных композициях.
В некоторых вариантах осуществления активированные T-клетки (или активированные PBMC) и ингибитор иммунной контрольной точки вводят последовательно. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят перед введением активированных Т-клеток (или активированных PBMC). В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят после введения активированных Т-клеток (или активированных PBMC).
Множество опухолевых антигенных пептидов
Во всех способах MASCT (включая способы MASCT на основе PBMC) и способах получения клеток, описанных в настоящем документе, используют множество опухолевых антигенных пептидов (включая неоантигенные пептиды) для получения APC (таких как дендритные клетки) и активированных T-клеток или активированных PBMC, которые могут запускать специфический Т-клеточный ответ ex vivo и in vivo.
В некоторых вариантах осуществления каждый опухолевый антигенный пептид в способе MASCT содержит любое количество из приблизительно 1, 2, 3, 4, 5 или 10 эпитопов из одного белкового антигена (включая неоантиген). В некоторых вариантах осуществления каждый опухолевый антигенный пептид во множестве опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, распознаваемый Т-клеточным рецептором. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один опухолевый антигенный пептид, который содержит по меньшей мере 2 эпитопа из одного белкового антигена. Опухолевый антигенный пептид может представлять собой полученный природным образом фрагмент пептида из белкового антигена, содержащего один или более эпитопов, или искусственно сконструированный пептид с одним или более природными эпитопными последовательностями, причем между соседними эпитопными последовательностями может быть необязательно помещен линкерный пептид. В некоторых предпочтительных вариантах осуществления эпитопы, содержащиеся в одном и том же опухолевом антигенном пептиде, получают из одного белкового антигена.
Опухолевый антигенный пептид (включая неоантигенный пептид) может содержать по меньшей мере один эпитоп MHC-I, по меньшей мере один эпитоп MHC-II или как эпитоп (-ы) MHC-I, так и эпитоп (-ы) MHC-II. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-I. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-II. В некоторых вариантах осуществления по меньшей мере один опухолевый антигенный пептид во множестве опухолевых антигенных пептидов содержит как эпитоп MHC-I, так и эпитоп MHC-II.
Для оптимизации иммунного ответа на дендритные клетки, загруженные опухолевыми антигенными пептидами, к последовательности опухолевых антигенных пептидов (включая неоантигенные пептиды) могут применяться специальные стратегии разработки. Обычно пептид, который длиннее точного эпитопного пептида, может увеличивать поглощение пептида антигенпредставляющими клетками (такими как дендритные клетки). В некоторых вариантах осуществления эпитопная последовательность MHC-I или MHC-II удлиняется на N-конце или С-конце или на обоих концах в соответствии с природной последовательностью белка, несущего эпитоп, с получением удлиненной последовательности, причем удлиненная последовательность может быть представлена как молекулами МНС класса I, так и класса II, а также различными подтипами молекул МНС у разных субъектов. В некоторых вариантах осуществления эпитопная последовательность удлиняется на одном или обоих концах на любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15 или 20 аминокислотных остатков с получением удлиненного эпитопа. В некоторых вариантах осуществления пептиды, содержащие эпитоп MHC-I или MHC-II, дополнительно содержат дополнительные аминокислоты, фланкирующие эпитоп на N-конце, C-конце или на обоих концах. В некоторых вариантах осуществления каждый опухолевый антигенный пептид во множестве опухолевых антигенных пептидов имеет любую длину из приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или 100 аминокислот. Различные опухолевые антигенные пептиды во множестве опухолевых антигенных пептидов могут иметь одинаковую длину или разную длину. В некоторых вариантах осуществления каждый из множества опухолевых антигенных пептидов имеет длину приблизительно 20-40 аминокислот.
В некоторых вариантах осуществления аминокислотные последовательности одного или более эпитопных пептидов, используемых для конструирования опухолевого антигенного пептида настоящей заявки, основаны на последовательностях, известных в данной области или доступных в публичных базах данных, таких как база данных пептидов (van der Bruggen P et al. (2013) Peptide database: T cell-defined tumor antigens. Cancer Immunity. URL: www.cancerimmunity.org/peptide/). В некоторых вариантах осуществления аминокислотные последовательности одного или более эпитопных пептидов выбирают из группы, состоящей из SEQ ID NO: 1-35.
В некоторых вариантах осуществления аминокислотные последовательности одного или более эпитопных пептидов спрогнозированы на основе последовательности антигенного белка (включая неоантигены) с использованием инструмента биоинформатики для прогнозирования Т-клеточного эпитопа. Примеры инструментов биоинформатики для прогнозирования Т-клеточного эпитопа известны в данной области, например, см. публикацию Yang X. and Yu X. (2009) An introduction to epitope prediction methods and software Rev. Med. Virol. 19(2): 77-96. В некоторых вариантах осуществления последовательность антигенного белка известна в данной области или доступна в публичных базах данных. В некоторых вариантах осуществления последовательность антигенного белка (включая неоантигены) определяют путем секвенирования образца (такого как образец опухоли) от субъекта, получающего лечение.
В настоящем изобретении рассматриваются опухолевые антигенные пептиды, полученные из любых опухолевых антигенов и эпитопов, известных в данной области, включая неоантигены и неоэпитопы или специально разработанные или спрогнозированные изобретателями с использованием инструментов биоинформатики.
В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов дополнительно содержит вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления неоантигенные пептиды являются специфичными для типа рака антигенными пептидами. В некоторых вариантах осуществления множество опухолевых антигенных пептидов состоит из первой основной группы общих опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов состоит из первой основной группы общих опухолевых антигенных пептидов и второй группы специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов состоит только из неоантигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и один или более неоантигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов, вторую группу специфичных для типа рака антигенных пептидов и один или более неоантигенных пептидов.
Первую основную группу общих опухолевых антигенных пептидов получают из опухолевых антигенов, обычно экспрессируемых или сверхэкспрессируемых на поверхности множества видов рака различных типов. Таким образом, первую основную группу общих опухолевых антигенных пептидов используют для получения дендритных клеток или активированных T-клеток, применяемых в любом из способов MASCT (включая способы MASCT на основе PBMC), или в других способах лечения, или в способах получения клеток, описанных в настоящем документе, для лечения субъектов с различными типами рака. Например, в некоторых вариантах осуществления первую основную группу общих опухолевых антигенных пептидов используют для описанных в настоящем документе способов лечения различных видов рака, таких как рак легких, рак толстой кишки, рак желудка, рак предстательной железы, меланома, лимфома, рак поджелудочной железы, рак яичников, рак молочной железы, глиома, рак пищевода, карцинома носоглотки, рак шейки матки, рак почки или гепатоцеллюлярная карцинома. Примеры опухолевых антигенных пептидов первой основной группы включают, без ограничений, пептиды, полученные из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR и CDCA1. Первая основная группа может содержать пептиды, полученные из любого количества из более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 опухолевых антигенов. Первая основная группа может содержать любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 общих опухолевых антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит более одного общего опухолевого антигенного пептида. В некоторых вариантах осуществления первая основная группа содержит от приблизительно 10 до приблизительно 20 общих опухолевых антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит общие опухолевые антигенные пептиды, имеющие более одного эпитопа, который выбирают из группы, состоящей из SEQ ID NO: 1-24.
Вторую группу специфичных для типа рака антигенных пептидов получают из опухолевых антигенов, экспрессируемых или сверхэкспрессируемых только в одном или в ограниченном количестве типов рака. Таким образом, вторую группу специфичных для типа рака антигенных пептидов используют для получения дендритных клеток, активированных T-клеток, применяемых в любом из способов MASCT, или в других способах лечения, или в способах получения клеток, описанных в настоящем документе, для лечения субъектов с конкретным видом рака. Примеры специфичных для типа рака антигенных пептидов для лечения гепатоцеллюлярной карциномы (HCC) включают, без ограничений, пептиды, полученные из AFP и GPC3. В некоторых вариантах осуществления один или более специфичных для рака антигенных пептидов представляют собой вирусспецифичные антигенные пептиды, полученные из вируса, который может индуцировать рак или относиться к развитию ракового заболевания у субъекта при инфицировании. В некоторых вариантах осуществления вирусспецифичный антигенный пептид специфичен в отношении подтипа инфицирующего субъекта вируса. Примеры вирусспецифичных антигенных пептидов для лечения пациента с HCC с сопутствующей ВГВ-инфекцией включают, без ограничений, пептиды, полученные из ядерного антигена ВГВ, и ДНК-полимеразы ВГВ. В некоторых вариантах осуществления вирусспецифичные антигенные пептиды содержат по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 31-35. В некоторых вариантах осуществления вторая группа содержит вирусспецифичные антигенные пептиды, полученные из антигенов ВГВ, причем способ предназначен для лечения гепатоцеллюлярной карциномы у субъекта. В некоторых вариантах осуществления вторая группа содержит вирусспецифичные антигенные пептиды, полученные из антигенов ВПЧ, причем способ предназначен для лечения рака шейки матки у субъекта. В некоторых вариантах осуществления вторая группа содержит вирусспецифичные антигенные пептиды, полученные из антигенов ВЭБ, причем способ предназначен для лечения карциномы носоглотки у субъекта. Вторая группа специфичных для типа рака антигенных пептидов может содержать пептиды, полученные из любого количества из более чем приблизительно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 специфичных для типа рака антигенов. Вторая группа специфичных для типа рака антигенных пептидов может содержать любое количество из более чем приблизительно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит более одного специфичного для типа рака антигенного пептида. В некоторых вариантах осуществления вторая группа содержит от приблизительно 1 до приблизительно 10 специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит специфичные для типа рака антигенные пептиды, содержащие по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 25-35, причем рак представляет собой гепатоцеллюлярную карциному. В некоторых вариантах осуществления тип рака, на который нацелены специфичные для типа рака антигенные пептиды, выбирают из группы, по существу состоящей из гепатоцеллюлярной карциномы, рака шейки матки, карциномы носоглотки, рака молочной железы и лимфомы.
В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более (например, любое количество из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) неоантигенных пептидов. Неоантигенные пептиды получают из неоантигенов. Неоантигены представляют собой вновь приобретенные и экспрессированные антигены, присутствующие в опухолевых клетках субъекта, такого как субъект, подлежащий лечению от рака. В некоторых вариантах осуществления неоантигены получают из мутантных белковых антигенов, которые присутствуют только в раковых клетках, но отсутствуют в нормальных клетках. Неоантигены могут присутствовать исключительно в опухолевых клетках (таких как все опухолевые клетки или часть опухолевых клеток) субъекта, получающего лечение от рака, или присутствовать у субъектов, у которых типы рака подобны типам рака субъекта, получающего лечение. В некоторых вариантах осуществления неоантиген представляет собой клональный неоантиген. В некоторых вариантах осуществления неоантиген представляет собой субклональный неоантиген. В некоторых вариантах осуществления неоантиген присутствует по меньшей мере в любом количестве из приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более опухолевых клеток субъекта. В некоторых вариантах осуществления неоантигенный пептид содержит ограниченный MHC-I неоэпитоп. В некоторых вариантах осуществления неоантигенный пептид содержит ограниченный MHC-II неоэпитоп. В некоторых вариантах осуществления неоантигенный пептид разработан для облегчения представления неоэпитопа молекулами MHC как I, так и II класса, например, посредством удлинения неоэпитопа на N- и C- концах. Примеры неоантигенных пептидов включают, без ограничений, неоэпитоп, полученный из мутанта KRAS (например, KRASG12A), PARP4 (например, PARP4T1170I), MLL3 (например, MLL3C988F) и MTHFR (например, MTHFRA222V). В некоторых вариантах осуществления неоантигенный пептид содержит эпитоп, имеющий точечную мутацию в последовательности, которую выбирают из группы, состоящей из SEQ ID No: 41-45. В некоторых вариантах осуществления неоантигенный пептид содержит эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 36-40.
Неоантигенные пептиды можно выбирать на основе генетического профиля одного или более очагов опухоли у субъекта, получающего лечение. В некоторых вариантах осуществления генетический профиль образца опухоли содержит информацию о последовательности полного генома. В некоторых вариантах осуществления генетический профиль образца опухоли содержит информацию о последовательности экзома. В некоторых вариантах осуществления генетический профиль образца опухоли содержит информацию о последовательности связанных с раком генов.
Неоантигенные пептиды, которые подходят для применения в настоящем изобретении, можно получить из любых мутантных белков, таких как белки, которые кодируются мутантными связанными с раком генами, в опухолевых клетках. В некоторых вариантах осуществления неоантигенный пептид содержит единственный неоэпитоп, полученный из связанного с раком гена. В некоторых вариантах осуществления неоантигенный пептид содержит более одного (например, 2, 3 или более) неоэпитопа, полученного из связанного с раком гена. В некоторых вариантах осуществления неоантигенный пептид содержит более одного (например, 2, 3 или более) неоэпитопа, полученного из более чем одного (например, 2, 3 или более) связанного с раком гена. В некоторых вариантах осуществления множество опухолевых антигенов содержит множество неоантигенных пептидов, полученных из единственного связанного с раком гена. В некоторых вариантах осуществления множество опухолевых антигенов содержит множество неоантигенных пептидов, полученных из более чем одного (например, 2, 3, 4, 5 или более) связанного с раком гена.
Связанные с раком гены представляют собой гены, которые сверхэкспрессируются или экспрессируются исключительно в раковых клетках, но не в нормальных клетках. Примеры связанных с раком генов включают, без ограничений, гены ABL1, AKT1, AKT2, AKT3, ALK, ALOX12B, APC, AR, ARAF, ARID1A, ARID1B, ARID2, ASXL1, ATM, ATRX, AURKA, AURKB, AXL, B2M, BAP1, BCL2, BCL2L1, BCL2L12, BCL6, BCOR, BCORL1, BLM, BMPR1A, BRAF, BRCA1, BRCA2, BRD4, BRIP1, BUB1B, CADM2, CARD11, CBL, CBLB, CCND1, CCND2, CCND3, CCNE1, CD274, CD58, CD79B, CDC73, CDH1, CDK1, CDK2, CDK4, CDK5, CDK6, CDK9, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CEBPA, CHEK2, CIITA, CREBBP, CRKL, CRLF2, CRTC1, CRTC2, CSF1R, CSF3R, CTNNB1, CUX1, CYLD, DDB2, DDR2, DEPDC5, DICER1, DIS3, DMD, DNMT3A, EED, EGFR, EP300, EPHA3, EPHA5, EPHA7, ERBB2, ERBB3, ERBB4, ERCC2, ERCC3, ERCC4, ERCC5, ESR1, ETV1, ETV4, ETV5, ETV6, EWSR1, EXT1, EXT2, EZH2, FAM46C, FANCA, FANCC, FANCD2, FANCE, FANCF, FANCG, FAS, FBXW7, FGFR1, FGFR2, FGFR3, FGFR4, FH, FKBP9, FLCN, FLT1, FLT3, FLT4, FUS, GATA3, GATA4, GATA6, GLI1, GLI2, GLI3, GNA11, GNAQ, GNAS, GNB2L1, GPC3, GSTM5, H3F3A, HNF1A, HRAS, ID3, IDH1, IDH2, IGF1R, IKZF1, IKZF3, INSIG1, JAK2, JAK3, KCNIP1, KDM5C, KDM6A, KDM6B, KDR, KEAP1, KIT, KRAS, LINC00894, LMO1, LMO2, LMO3, MAP2K1, MAP2K4, MAP3K1, MAPK1, MCL1, MDM2, MDM4, MECOM, MEF2B, MEN1, MET, MITF, MLH1, MLL (KMT2A), MLL2 (KTM2D), MPL, MSH2, MSH6, MTOR, MUTYH, MYB, MYBL1, MYC, MYCL1 (MYCL), MYCN, MYD88, NBN, NEGR1, NF1, NF2, NFE2L2, NFKBIA, NFKBIZ, NKX2-1, NOTCH1, NOTCH2, NPM1, NPRL2, NPRL3, NRAS, NTRK1, NTRK2, NTRK3, PALB2, PARK2, PAX5, PBRM1, PDCD1LG2, PDGFRA, PDGFRB, PHF6, PHOX2B, PIK3C2B, PIK3CA, PIK3R1, PIM1, PMS1, PMS2, PNRC1, PRAME, PRDM1, PRF1, PRKAR1A, PRKCI, PRKCZ, PRKDC, PRPF40B, PRPF8, PSMD13, PTCH1, PTEN, PTK2, PTPN11, PTPRD, QKI, RAD21, RAF1, RARA, RB1, RBL2, RECQL4, REL, RET, RFWD2, RHEB, RHPN2, ROS1, RPL26, RUNX1, SBDS, SDHA, SDHAF2, SDHB, SDHC, SDHD, SETBP1, SETD2, SF1, SF3B1, SH2B3, SLITRK6, SMAD2, SMAD4, SMARCA4, SMARCB1, SMC1A, SMC3, SMO, SOCS1, SOX2, SOX9, SQSTM1, SRC, SRSF2, STAG1, STAG2, STAT3, STAT6, STK11, SUFU, SUZ12, SYK, TCF3, TCF7L1, TCF7L2, TERC, TERT, TET2, TLR4, TNFAIP3, TP53, TSC1, TSC2, U2AF1, VHL, WRN, WT1, XPA, XPC, XPO1, ZNF217, ZNF708 и ZRSR2.
В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 5, 10, 15, 20, 25, 30, 35 или 40) эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 5, 10, 15, 20 или 24) эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-24. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, любое количество из приблизительно 1, 2, 3, 4, 5 или 6) эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 25-30. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, любое количество из приблизительно 1, 2, 3, 4 или 5) эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 31-35. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, любое количество из приблизительно 1, 2, 3, 4, или 5) эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 36-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) из общих опухолевых антигенных пептидов, показанных на ФИГ. 2B или 2C. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 2, 3, 4 или 5) неоантигенный пептид, показанный на ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более) опухолевый антигенный пептид, показанный на ФИГ. 2B, 2C или 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один (например, по меньшей мере любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или более) опухолевый антигенный пептид, причем каждый из них содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-24. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2B. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере один неоантигенный пептид, показанный на ФИГ. 29A.
В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-24. В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2B. В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит эпитоп, кодируемый связанным с раком геном, который выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложена выделенная популяция дендритных клеток, загруженных множеством опухолевых антигенных пептидов, полученная посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов, причем множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложен способ получения популяции активированных T-клеток, включающий совместное культивирование популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, причем множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления предложена выделенная популяция активированных T-клеток, полученная посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, причем множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложен способ получения популяции активированных T-клеток, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления предложена выделенная популяция активированных T-клеток, полученная посредством (a) индуцирования дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) совместного культивирования популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC, причем множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию PBMC приводят в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования (например, в присутствии ингибитора иммунной контрольной точки) популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, при этом множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта. В некоторых вариантах осуществления популяцию Т-клеток, популяцию дендритных клеток, популяцию PBMC или любую их комбинацию получают от субъекта, получающего лечение. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (e) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, содержащих первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов, каждый из которых содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из генов hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
Точная MASCT
В настоящем документе дополнительно предложены способы точной MASCT, которые адаптированы в соответствии с потребностям субъекта, получающего лечение, на основании генетических особенностей и терапевтического ответа субъекта. Любые из описанных выше способов MASCT, можно адаптировать, чтобы обеспечить способ точной MASCT.
Способы MASCT, описанные в настоящем документе, в некоторых вариантах осуществления особенно подходят для определенной популяции субъектов, например для субъектов с низкой мутационной нагрузкой (например, в генах MHC) раковой опухоли (например, всех раковых клеток или их подмножества) и/или для субъектов с одним или более неоантигенами.
Мутационная нагрузка
В некоторых вариантах осуществления способы MASCT особенно подходят для субъекта с низкой общей мутационной нагрузкой в раковой опухоли субъекта. В некоторых вариантах осуществления способы MASCT особенно подходят для субъекта с низкой мутационной нагрузкой в связанных с раком генах в раковой опухоли субъекта. В некоторых вариантах осуществления способы MASCT особенно подходят для субъекта с низкой мутационной нагрузкой в иммунных генах, связанных с Т-клеточным ответом, в раковой опухоли субъекта. В некоторых вариантах осуществления способы MASCT особенно подходят для субъекта с низкой мутационной нагрузкой в генах MHC в раковой опухоли субъекта. Мутационная нагрузка может представлять собой мутационную нагрузку во всех раковых клетках или в подмножестве раковых клеток, например в первичном или метастатическом очаге опухоли, например в клетках образца биопсии опухоли.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и при этом субъект имеет низкую мутационную нагрузку в раковой опухоли. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для применения способа на основании мутационной нагрузки в раковой опухоли; (b) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и при этом субъекта выбирают для проведения лечения на основании наличия низкой мутационной нагрузки в раковой опухоли. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (e) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом субъект имеет низкую мутационную нагрузку в раковой опухоли. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для применения способа на основании мутационной нагрузки в раковой опухоли; (b) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (c) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (f) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта). В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (e) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом субъекта выбирают для проведения лечения на основании наличия низкой мутационной нагрузки в раковой опухоли. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (b) введение субъекту эффективного количества активированных PBMC, причем субъект имеет низкую мутационную нагрузку в раковой опухоли. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для применения способа на основании мутационной нагрузки в раковой опухоли; (b) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (c) введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (b) введение субъекту эффективного количества активированных PBMC, причем субъекта выбирают для проведения лечения на основании наличия низкой мутационной нагрузки в раковой опухоли. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления субъект имеет низкую мутационную нагрузку (например, не более приблизительно 10 мутаций, отсутствие мутаций в B2M и/или отсутствие мутаций в функциональных областях) в одном или более генах MHC (таких как гены MHC-I) в раковой опухоли.
В некоторых вариантах осуществления низкая мутационная нагрузка одного или более генов представляет собой небольшое число мутаций, накопленных в одном или более генах. В некоторых вариантах осуществления общее число мутаций, не превышающее приблизительно 500, 400, 300, 200, 100, 50, 40, 30, 20, 10, 5 или менее, указывает на низкую мутационную нагрузку. В некоторых вариантах осуществления любое число мутаций в одном или более генах MHC, не превышающее приблизительно 50, 40, 30, 25, 20, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1, указывает на низкую мутационную нагрузку одного или более генов MHC. В некоторых вариантах осуществления низкая мутационная нагрузка одного или более генов представляет собой низкое соотношение между числом мутаций, накопленных в одном или более генах (например, в генах MHC), и общим числом мутаций в выбранном наборе генов (например, в связанных с раком генах) или в полном геноме. В некоторых вариантах осуществления любое соотношение между числом мутаций в одном или более генах MHC и общим числом из 333 связанных с раком генов, описанных в примере 5, не превышающее приблизительно 1: 10, 1: 15, 1: 20, 1: 25, 1: 30, 1: 40, 1: 50, 1: 60, 1: 70, 1: 80, 1: 90, 1: 100, 1: 200 или менее, указывает на низкую мутационную нагрузку одного или более генов MHC.
В некоторых вариантах осуществления один или более генов MHC представляют собой гены (или локусы) MHC класса I. В некоторых вариантах осуществления один или более генов MHC представляют собой гены (или локусы) MHC класса II. В некоторых вариантах осуществления, в которых субъект представляет собой субъекта-человека, один или более генов MHC выбирают из группы, состоящей из HLA-A, HLA-B, HLA-C и B2M.
Примеры мутаций включают, без ограничений, делецию, мутацию сдвига рамки считывания, вставку, инсерционно-делеционную мутацию (индел), миссенс-мутацию, нонсенс-мутацию, точечную мутацию, изменение числа копий, однонуклеотидную вариацию (SNV), молчащую мутацию, мутацию участка сплайсинга, вариант сплайсинга, слияние генов и транслокацию. В некоторых вариантах осуществления изменение числа копий гена MHC обусловлено структурной перестройкой генома, включая делеции, дупликации, инверсию и транслокацию хромосомы или ее фрагмента. В некоторых вариантах осуществления мутации в одном или более генах MHC выбирают из точечных мутаций, мутаций сдвига рамки считывания, слияний генов и изменений числа копий. В некоторых вариантах осуществления мутации находятся в кодирующей белок области генов MHC. В некоторых вариантах осуществления мутация представляет собой несинонимичную мутацию. В некоторых вариантах осуществления мутация не является полиморфизмом. В некоторых вариантах осуществления мутация присутствует в нормальных клетках субъекта. В некоторых вариантах осуществления мутация не присутствует в нормальных клетках субъекта. В некоторых вариантах осуществления мутация влияет на физико-химические или функциональные свойства, такие как стабильность или аффинность связывания, молекулы МНС, кодируемой поврежденным геном. В некоторых вариантах осуществления мутация приводит к необратимому дефициту в молекуле МНС. В некоторых вариантах осуществления мутация снижает аффинность связывания молекулы МНС с Т-клеточными эпитопами и/или Т-клеточными рецепторами. В некоторых вариантах осуществления мутация представляет собой мутацию с потерей функции. В некоторых вариантах осуществления мутация приводит к обратимому дефициту в молекуле МНС. В некоторых вариантах осуществления мутация не влияет на аффинность связывания молекулы МНС с Т-клеточными эпитопами и/или Т-клеточными рецепторами. В некоторых вариантах осуществления мутация представляет собой соматическую мутацию. В некоторых вариантах осуществления мутация представляет собой мутацию зародышевой линии.
Мутации, учтенные в мутационной нагрузке, могут присутствовать во всех раковых клетках или в подмножестве раковых клеток. В некоторых вариантах осуществления мутации присутствуют во всех раковых клетках у субъекта. В некоторых вариантах осуществления мутации присутствуют во всех раковых клетках очага опухоли. В некоторых вариантах осуществления мутации являются клональными. В некоторых вариантах осуществления мутации являются субклональными. В некоторых вариантах осуществления мутации присутствуют по меньшей мере в любом количестве раковых клеток субъекта из приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более.
Мутации в определенных генах MHC и/или в определенных доменах или положениях одного или более генов MHC могут оказывать более глубокое влияние на клиническую реакцию субъекта на способы MASCT, описанные в настоящем документе. Например, мутации с потерей функции могут происходить в лидерной пептидной последовательности, домене a3 (который связывается с корецептором CD8 Т-клеток), домене, связывающемся с пептидом a1, или домене, связывающемся с пептидом a2 молекулы HLA; см., например, публикацию Shukla S. et al. Nature Biotechnology 33, 1152-1158 (2015), включенную в настоящий документ путем ссылки. Мутации в гене B2M (β2-макроглобулин) также могут способствовать ускользанию фенотипов опухоли. См., например, публикации Monica B et al. Cancer Immunol. Immu., (2012) 61: 1359-1371. В некоторых вариантах осуществления наличие любого числа мутаций (например, 1, 2, 3, 4, 5 или более) в функциональных областях одного или более генов MHC, таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3, указывает на высокую мутационную нагрузку. В некоторых вариантах осуществления наличие любого числа мутаций с потерей функции (например, 1, 2, 3, 4, 5 или более) в одном или более генах MHC (например, в генах HLA-A, HLA-B или HLA-C субъектов-людей) указывает на высокую мутационную нагрузку. В некоторых вариантах осуществления при низкой мутационной нагрузке в одном или более генах MHC не содержится мутация в функциональных областях, включая лидерную пептидную последовательность, домен a1 (например, остатки, находящиеся в прямом контакте с корецептором CD8), домен a2 и домен a3 (например, остатки, находящиеся в прямом контакте с эпитопом) одного или более генов MHC (например, генов HLA-A, HLA-B или HLA-C). В некоторых вариантах осуществления наличие любого числа мутаций (таких как мутации с потерей функции) в гене B2M указывает на высокую мутационную нагрузку. В некоторых вариантах осуществления при низкой мутационной нагрузке в одном или более генах MHC не содержится мутация в гене B2M.
Мутационную нагрузку одного или более генов (таких как гены MHC) можно определить любыми известными способами в данной области, включая, без ограничений, секвенирование геномной ДНК, секвенирование экзома или другие способы секвенирования ДНК с использованием платформ секвенирования по Сэнгеру или секвенирования следующего поколения; анализы полимеразной цепной реакции; анализы гибридизации in situ; и микрочипы ДНК.
В некоторых вариантах осуществления мутационную нагрузку одного или более генов MHC определяют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления секвенирование представляет собой секвенирование следующего поколения. В некоторых вариантах осуществления секвенирование представляет собой секвенирование полного генома. В некоторых вариантах осуществления секвенирование представляет собой секвенирование экзома. В некоторых вариантах осуществления секвенирование представляет собой целевое секвенирование генов-кандидатов, например связанных с раком генов и генов HLA. Например, тест ONCOGXONE™ Plus (Admera Health) доступен для секвенирования связанных с раком генов и локусов HLA с большой глубиной секвенирования. В некоторых вариантах осуществления для определения мутационной нагрузки одного или более генов MHC и для идентификации неоантигенов у субъекта можно использовать аналогичные данные секвенирования.
В некоторых вариантах осуществления образец опухоли представляет собой образец ткани. В некоторых вариантах осуществления образец опухоли представляет собой образец пункционной биопсии опухолевых клеток или образец опухолевых клеток (например, включая строму опухоли), полученных посредством лапароскопии. В некоторых вариантах осуществления образец опухоли представляет собой свежеполученный образец. В некоторых вариантах осуществления образец опухоли заморожен. В некоторых вариантах осуществления образец опухоли представляет собой зафиксированный в формальдегиде и залитый парафином (FFPE) образец. В некоторых вариантах осуществления образец опухоли представляет собой образец клетки. В некоторых вариантах осуществления образец опухоли содержит циркулирующую метастатическую раковую клетку. В некоторых вариантах осуществления образец опухоли получают посредством сортировки циркулирующих опухолевых клеток (CTC) из крови. В некоторых вариантах осуществления для анализа секвенирования из образца опухоли экстрагируют нуклеиновые кислоты (такие как ДНК и/или РНК). В некоторых вариантах осуществления для выявления мутаций и определения мутационной нагрузки в опухолевых клетках данные секвенирования образца опухоли сравнивают с данными секвенирования эталонного образца, такого как образец здоровой ткани от того же субъекта или образец от здорового субъекта. В некоторых вариантах осуществления для выявления мутаций и определения мутационной нагрузки в опухолевых клетках данные секвенирования образца опухоли сравнивают с эталонными последовательностями из базы данных геномов.
Неоантигенные пептиды
В некоторых вариантах осуществления способы MASCT, описанные в настоящем документе, особенно подходят для лечения субъекта с одним или более неоантигенами. Любой из способов MASCT, описанных в настоящем документе, в котором используют один или более неоантигенных пептидов во множестве опухолевых антигенных пептидов, может дополнительно включать этапы отбора субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов и/или этапы: (i) идентификации неоантигена у субъекта; и (ii) введения неоантигенного пептида, полученного из неоантигена, во множество опухолевых антигенных пептидов для применения в способе MASCT.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) совместное культивирование популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (f) введение субъекту эффективного количества активированных T-клеток, при этом субъект имеет один или более неоантигенов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов; (b) идентификацию неоантигена у субъекта; (c) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (d) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (f) совместное культивирование популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (g) введение субъекту эффективного количества активированных T-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) совместное культивирование популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (f) введение субъекту эффективного количества активированных T-клеток, при этом субъекта выбирают для способа лечения на основании наличия одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (d) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (f) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (g) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом субъект имеет один или более неоантигенов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов субъекта. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов; (b) идентификацию неоантигена у субъекта; (c) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (d) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (e) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (f) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (g) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (h) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта). В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов субъекта. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (d) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (e) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (f) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (g) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом субъекта выбирают для способа лечения на основании наличия одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов субъекта. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (d) введение субъекту эффективного количества активированных PBMC, причем субъект имеет один или более неоантигенов. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов; (b) идентификацию неоантигена у субъекта; (c) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (d) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (e) введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) идентификацию неоантигена у субъекта; (b) введение неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп; (c) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (d) введение субъекту эффективного количества активированных PBMC, причем субъекта выбирают для способа лечения на основании наличия одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
Субъект может иметь любое число (например, любое из по меньшей мере 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 50, 100 или более) неоантигенов, чтобы получить преимущество от применения способа MASCT с использованием множества опухолевых антигенных пептидов, содержащих неоантигенный пептид. В некоторых вариантах осуществления способ MASCT особенно подходит для субъекта, имеющего по меньшей мере любое число из приблизительно 4, 5, 6, 7, 8, 10, 15, 20, 50, 100 или более неоантигенов. В некоторых вариантах осуществления неоантиген содержит один или более неоэпитопов. В некоторых вариантах осуществления способ MASCT особенно подходит для субъекта, имеющего по меньшей мере любое число из приблизительно 4, 5, 6, 7, 8, 10, 15, 20, 50, 100 или более неоэпитопов. В некоторых вариантах осуществления T-клеточные эпитопы представляют собой ограниченные MHC-I эпитопы. В некоторых вариантах осуществления неоэпитоп имеет более высокую аффинность к молекулам MHC субъекта, чем соответствующий T-клеточный эпитоп дикого типа. В некоторых вариантах осуществления неоэпитоп имеет более высокую аффинность к Т-клеточному рецептору модели, чем соответствующий T-клеточный эпитоп дикого типа. В некоторых вариантах осуществления неоантиген (или неоэпитоп) представляет собой клональный неоантиген. В некоторых вариантах осуществления неоантиген (или неоэпитоп) представляет собой субклональный неоантиген. В некоторых вариантах осуществления неоантиген (или неоэпитоп) присутствует по меньшей мере в любом количестве из приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более опухолевых клеток субъекта.
Ряд неоантигенов можно комбинировать с другими биомаркерами или критериями отбора для отбора субъекта для применения любого из способов MASCT, описанных в настоящем документе. В некоторых вариантах осуществления способ MASCT особенно подходит для субъекта, имеющего низкую мутационную нагрузку (например, в одном или более генах MHC) в раковых клетках и по меньшей мере любое число из приблизительно 4, 5, 6, 7, 8, 10 или более неоантигенов (например, неоантигенов с высокоаффинными ограниченными MHC-I неоэпитопами).
В некоторых вариантах осуществления предложен способ обеспечения прогноза для субъекта на основании мутационной нагрузки в раковой опухоли субъекта и/или числа неоантигенов у субъекта, причем прогноз предсказывает клинический ответ субъекта на любой из способов MASCT, описанных в настоящем документе. В некоторых вариантах осуществления на основании прогноза субъекта определяют в одну из следующих трех категорий: (1) субъект, который получит преимущество при проведении ограниченного МНС вмешательства (такого как лечение MASCT); (2) субъект, который получит потенциальное преимущество от ограниченного МНС вмешательства (такого как лечение MASCT); и (3) субъект, который не получит преимуществ от ограниченного МНС вмешательства (такого как лечение MASCT). В некоторых вариантах осуществления прогнозируется, что субъект получит преимущество при проведении ограниченного МНС вмешательства (такого как лечение MASCT), если субъект не имеет мутации в гене B2M, не имеет мутации в функциональных областях (таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3) генов MHC, имеет не более 2 мутаций в гене MHC-I (таком как ген HLA-I A, B и/или C) и/или не более 5 мутаций. В некоторых вариантах осуществления прогнозируется, что субъект потенциально получит преимущество при проведении ограниченного МНС вмешательства (такого как лечение MASCT), если субъект не имеет мутации в гене B2M, не имеет мутации в функциональных областях (таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3) генов MHC, имеет не более приблизительно 10 мутаций в генах MHC-I (таких как ген HLA-I A, B и/или C) и/или не более 5 мутаций. В некоторых вариантах осуществления прогнозируется, что субъект не получит преимуществ от ограниченного МНС вмешательства (такого как лечение MASCT), если субъект имеет мутацию в B2M или имеет высокую мутационную нагрузку (например, по меньшей мере 10 мутаций) в генах MHC (таких как гены MHC-I). В некоторых вариантах осуществления субъекта выбирают для способа MASCT, если прогнозируется, что субъект получит преимущество или потенциально получит преимущество от ограниченного МНС вмешательства (такого как лечение MASCT).
Любое число (например, любое число из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) неоантигенных пептидов можно сконструировать на основе неоантигенов субъекта и включить во множество опухолевых антигенных пептидов для применения в любом из способов MASCT, описанных в настоящем документе. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит единственный неоантигенный пептид. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. Каждый неоантигенный пептид может содержать один или более неоэпитопов из неоантигена субъекта. В некоторых вариантах осуществления неоэпитоп представляет собой Т-клеточный эпитоп. Способы конструирования неоантигенного пептида на основании неоантигена описаны в разделе «Множество опухолевых антигенных пептидов».
Неоантигены у субъекта можно идентифицировать с использованием любых способов, известных в данной области. В некоторых вариантах осуществления неоантиген идентифицируют на основании генетического профиля образца опухоли, полученного от субъекта. Каждый неоантиген содержит один или более неоэпитопов. В некоторых вариантах осуществления один или более неоэпитопов в неоантигене идентифицированы на основании генетического профиля образца опухоли. Для обеспечения генетического профиля образца опухоли можно использовать любые известные способы генетического профилирования, такие как способы секвенирования следующего поколения (NGS), микрочипы или протеомные способы.
В некоторых вариантах осуществления неоантиген идентифицируют посредством секвенирования образца опухоли, полученного от субъекта. В некоторых вариантах осуществления секвенирование представляет собой секвенирование следующего поколения. В некоторых вариантах осуществления секвенирование представляет собой секвенирование полного генома. В некоторых вариантах осуществления секвенирование представляет собой секвенирование экзома. В некоторых вариантах осуществления секвенирование представляет собой целевое секвенирование генов-кандидатов, например связанных с раком генов. Для секвенирования связанных с раком генов с большой глубиной секвенирования доступно множество коммерческих панелей NGS рака, например ONCOGXONE™ Plus (Admera Health).
В некоторых вариантах осуществления образец опухоли представляет собой образец ткани. В некоторых вариантах осуществления образец опухоли представляет собой образец пункционной биопсии опухолевых клеток или образец опухолевых клеток (например, включая строму опухоли), полученных посредством лапароскопии. В некоторых вариантах осуществления образец опухоли представляет собой свежеполученный образец. В некоторых вариантах осуществления образец опухоли заморожен. В некоторых вариантах осуществления образец опухоли представляет собой зафиксированный в формальдегиде и залитый парафином (FFPE) образец. В некоторых вариантах осуществления образец опухоли представляет собой образец клетки. В некоторых вариантах осуществления образец опухоли содержит циркулирующую метастатическую раковую клетку. В некоторых вариантах осуществления образец опухоли получают посредством сортировки циркулирующих опухолевых клеток (CTC) из крови. В некоторых вариантах осуществления для анализа секвенирования из образца опухоли экстрагируют нуклеиновые кислоты (такие как ДНК и/или РНК). В некоторых вариантах осуществления для анализа секвенирования из образца опухоли экстрагируют белки.
В некоторых вариантах осуществления для выявления потенциальных мутантных генов в опухолевых клетках генетический профиль образца опухоли сравнивают с генетическим профилем эталонного образца, такого как образец здоровой ткани от того же субъекта или образец от здорового субъекта. В некоторых вариантах осуществления для выявления потенциальных мутантных генов в опухолевых клетках генетический профиль образца опухоли сравнивают с эталонными последовательностями из базы данных геномов. В некоторых вариантах осуществления потенциальные мутантные гены представляют собой связанные с раком гены. В некоторых вариантах осуществления каждый потенциальный мутантный ген содержит одну или более мутаций, таких как несинонимичные замены, индел (вставка или делеция) или слияние генов, которые могут вызывать появление неоантигена. Обычные однонуклеотидные полиморфизмы (SNP) исключены из потенциальных мутаций.
В некоторых вариантах осуществления идентификацию неоэпитопов в неоантигенах проводят из потенциальных мутантных белков. В некоторых вариантах осуществления неоэпитопы спрогнозированы in silico. Примеры инструментов биоинформатики для прогнозирования Т-клеточного эпитопа известны в данной области, например, см. публикацию Yang X. and Yu X. (2009) An introduction to epitope prediction methods and software Rev. Med. Virol. 19(2): 77-96. Факторы, рассматриваемые в алгоритмах прогнозирования Т-клеточного эпитопа, включают, без ограничений, подтип MHC у субъекта, определенные при секвенировании физико-химические свойства Т-клеточного эпитопа, связывающий мотив MHC, схему протеасомного расщепления, транспортер, связанный с эффективностью транспортирования антигена (TAP), аффинность связывания MHC, стабильность комплекса пептид-MHC и аффинность связывания T-клеточного рецептора. В некоторых вариантах осуществления неоэпитоп представляет собой ограниченный MHC-I эпитоп. В некоторых вариантах осуществления неоэпитоп представляет собой ограниченный MHC-II эпитоп.
В некоторых вариантах осуществления неоэпитоп имеет высокую аффинность к молекулам MHC субъекта. В некоторых вариантах осуществления способ дополнительно включает определение подтипа MHC субъекта, например, по данным секвенирования для идентификации одной или более молекул MHC субъекта. В некоторых вариантах осуществления способ дополнительно включает определение аффинности неоэпитопа к молекуле MHC, такой как молекула MHC класса I. В некоторых вариантах осуществления способ включает определение аффинности неоэпитопа к одной или более молекулам MHC (например, MHC класса I) у субъекта. В некоторых вариантах осуществления аффинность неоэпитопа к одной или более молекулам MHC субъекта сравнивают с аффинностью соответствующего эпитопа дикого типа к одной или более молекулам MHC субъекта. В некоторых вариантах осуществления неоэпитоп выбирают при наличии более высокой аффинности (например, по меньшей мере в любое количество раз из приблизительно 1,5, 2, 5, 10, 15, 20, 25, 50, 100 или более) к одной или более молекулам MHC (например, молекулам MHC-I) субъекта, чем у соответствующего эпитопа дикого типа. В некоторых вариантах осуществления аффинность связывания MHC прогнозируют in silico с использованием любых инструментов или способов, известных в данной области. В некоторых вариантах осуществления аффинность связывания MHC определяют экспериментально, например, с использованием анализа связывания in vitro.
В некоторых вариантах осуществления способ дополнительно включает определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC (например, молекулу MHC класса I субъекта), к Т-клеточному рецептору. В некоторых вариантах осуществления аффинность комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору сравнивают с аффинностью комплекса, содержащего соответствующий эпитоп дикого типа и молекулу MHC. В некоторых вариантах осуществления молекулу MHC получают от субъекта. В некоторых вариантах осуществления Т-клеточный рецептор находится на поверхности одной или более T-клеток субъекта. В некоторых вариантах осуществления неоэпитоп выбирают за наличие более высокой аффинности (например, по меньшей мере в любое количество раз из приблизительно 1,5, 2, 5, 10, 15, 20, 25, 50, 100 или более) к Т-клеточному рецептору в модели комплекса, содержащего неоэпитоп и молекулу MHC, по сравнению с соответствующим эпитопом дикого типа. В некоторых вариантах осуществления аффинность связывания TCR прогнозируют in silico с использованием любых инструментов или способов, известных в данной области. В некоторых вариантах осуществления аффинность связывания TCR определяют экспериментально, например, посредством определения Т-клеточного ответа против неоэпитопа.
В некоторых вариантах осуществления неоантиген (или неоэпитоп) дополнительно идентифицируют на основании уровня экспрессии неоантигена (или неоэпитопа) в образце опухоли. Уровень экспрессии неоантигена (или неоэпитопа) можно определить с использованием любых способов количественного определения уровней мРНК или белков, известных в данной области, таких как ОТ-ПЦР, анализы на основе антител, масс-спектрометрия. В некоторых вариантах осуществления уровень экспрессии неоантигена (или неоэпитопа) определяют по данным секвенирования образца опухоли. В некоторых вариантах осуществления уровень экспрессии неоантигена (или неоэпитопа) в опухолевых клетках составляет по меньшей мере любое количество копий на клетку из приблизительно 10, 20, 50, 100, 200, 500, 1000, 2000, 5000, 104 или более. В некоторых вариантах осуществления уровень экспрессии неоантигена (или неоэпитопа) в опухолевых клетках больше, чем у соответствующего белка дикого типа (или у соответствующего эпитопа дикого типа), в любое количество раз из более приблизительно 1,5, 2, 5, 10, 20, 50, 100 или более раз.
В некоторых вариантах осуществления неоантигенный пептид отбирают или идентифицируют посредством этапов, включающих: (a) секвенирование образца опухоли от субъекта для идентификации неоантигена; (b) идентификацию неоэпитопа в неоантигене; необязательно (c) определение подтипа MHC субъекта (например, с использованием данных секвенирования) для идентификации молекулы MHC субъекта; необязательно (d) определение аффинности неоэпитопа к молекуле MHC субъекта; необязательно (e) определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору; и (f) получение пептида, содержащего неоэпитоп, для обеспечения неоантигенного пептида. В некоторых вариантах осуществления неоэпитоп имеет более высокую аффинность к молекуле МНС (например, к молекуле MHC-I) субъекта и/или более высокую аффинность к TCR комплекса, содержащего неоэпитоп и молекулу MHC, по сравнению с комплексом, содержащим соответствующий Т-клеточный эпитоп дикого типа и молекулу MHC. В некоторых вариантах осуществления неоэпитоп удлиняется на N-конце, или С-конце, или на обоих концах в соответствии с природной последовательностью неоантигена, несущего эпитоп, с получением удлиненной последовательности, причем удлиненная последовательность поддается представлению как молекулами МНС класса I, так и молекулами МНС класса II. Любой из способов MASCT, описанных в настоящем документе, в котором используется один или более неоантигенных пептидов, может дополнительно включать любой один или более этапов отбора/идентификации неоантигенов.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) секвенирование образца опухоли от субъекта для идентификации неоантигена; (b) идентификацию неоэпитопа в неоантигене; необязательно (c) определение подтипа MHC субъекта (например, с использованием данных секвенирования) для идентификации молекулы MHC субъекта; необязательно (d) определение аффинности неоэпитопа к молекуле MHC субъекта; необязательно (e) определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору; (f) введение неоантигенного пептида, содержащего неоэпитоп, во множество опухолевых антигенных пептидов; (g) получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (h) необязательно введение эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (i) совместное культивирование популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (j) введение субъекту эффективного количества активированных T-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах способ дополнительно включает выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) секвенирование образца опухоли от субъекта для идентификации неоантигена; (b) идентификацию неоэпитопа в неоантигене; необязательно (c) определение подтипа MHC субъекта (например, с использованием данных секвенирования) для идентификации молекулы MHC субъекта; необязательно (d) определение аффинности неоэпитопа к молекуле MHC субъекта; необязательно (e) определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору; (f) введение неоантигенного пептида, содержащего неоэпитоп, во множество опухолевых антигенных пептидов; (g) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (h) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (i) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (j) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; и (k) введение субъекту эффективного количества активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта), и при этом субъект имеет один или более неоантигенов. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов субъекта. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах способ дополнительно включает выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) секвенирование образца опухоли от субъекта для идентификации неоантигена; (b) идентификацию неоэпитопа в неоантигене; необязательно (c) определение подтипа MHC субъекта (например, с использованием данных секвенирования) для идентификации молекулы MHC субъекта; необязательно (d) определение аффинности неоэпитопа к молекуле MHC субъекта; необязательно (e) определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору; (f) введение неоантигенного пептида, содержащего неоэпитоп, во множество опухолевых антигенных пептидов; (g) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC (например, в присутствии ингибитора иммунной контрольной точки); и (h) введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит множество неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли.
Наблюдение после проведения MASCT
Любой из способов MASCT, описанных в настоящем документе, может дополнительно включать этап наблюдения после получения субъектом лечения MASCT. Наблюдение после лечения может иметь преимущества для корректировки схемы лечения субъекта для оптимизации результатов лечения.
Например, множество опухолевых антигенных пептидов, описанных в настоящем документе, можно скорректировать или адаптировать на основании специфического иммунного ответа субъекта против каждого множества опухолевых антигенных пептидов и/или клинического ответа субъекта на активированные T-клетки или активированные PBMC, чтобы обеспечить множество специализированных опухолевых антигенных пептидов, которые можно использовать для повторного (-ых) лечения (-ий) MASCT. В некоторых вариантах осуществления опухолевые антигенные пептиды, которые не вызывают сильный специфический иммунный ответ, можно удалить из пула антигенных пептидов для будущих препаратов импульсных DC, активированных Т-клеток или активированных PBMC. В некоторых вариантах осуществления, если субъект не отвечает на лечение MASCT с использованием одного пула антигенных пептидов (например, наблюдаются признаки прогрессирования заболевания, метастазирования и т. п.), то для применения во втором цикле лечения MASCT пул антигенных пептидов можно скорректировать или в пул антигенных пептидов можно ввести неоантигены.
Таким образом, в некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) наблюдение за субъектом после введения активированных Т-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ наблюдения за лечением активированными Т-клетками у субъекта с раковым заболеванием, включающий определение числа циркулирующих опухолевых клеток (CTC) у субъекта и/или обнаружение специфического иммунного ответа против каждого из множества опухолевых антигенных пептидов у субъекта, причем активированные Т-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и при этом лечение включает необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах способ дополнительно включает выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта), обеспечение неоантигенного пептида на основе неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления лечение повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; (e) введение субъекту эффективного количества активированных Т-клеток; и (f) наблюдение за субъектом после введения активированных Т-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта). В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ наблюдения за лечением активированными Т-клетками у субъекта с раковым заболеванием, включающий определение числа циркулирующих опухолевых клеток (CTC) у субъекта и/или обнаружение специфического иммунного ответа против каждого из множества опухолевых антигенных пептидов у субъекта, причем активированные Т-клетки получают посредством этапов, включающих: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции в контакт дендритных клеток с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и (c) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта); и при этом лечение включает необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных Т-клеток. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах способ дополнительно включает выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта), обеспечение неоантигенного пептида на основе неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления лечение повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов (например, в присутствии ингибитора иммунной контрольной точки) с получением популяции активированных PBMC; (b) введение субъекту эффективного количества активированных PBMC; и (c) наблюдение за субъектом после введения активированных PBMC. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных PBMC. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ наблюдения за лечением активированными PBMC у субъекта с раковым заболеванием, включающий определение числа циркулирующих опухолевых клеток (CTC) у субъекта и/или обнаружение специфического иммунного ответа против каждого из множества опухолевых антигенных пептидов у субъекта, причем активированные PBMC получают посредством приведения популяции PBMC в контакт с множеством опухолевых антигенных пептидов (например, в присутствии ингибитора иммунной контрольной точки), и при этом лечение включает введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах способ дополнительно включает выбор субъекта для применения способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта), обеспечение неоантигенного пептида на основе неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления лечение повторяют с применением множества специализированных опухолевых антигенных пептидов.
Специфический иммунный ответ против отдельного опухолевого антигенного пептида можно определять с использованием любых способов, известных в данной области, например, посредством измерения уровней цитотоксического фактора (например, перфорина или гранзима B) или высвобождения цитокина (такого как IFNγ или TNFα) из T-клеток (или PBMC) после стимуляции отдельного опухолевого антигенного пептида. Для количественной оценки уровней цитотоксического фактора или цитокина (такого как IFNγ) можно использовать анализ на основе антител, такой как ELISPOT. Примеры осуществления анализа ELISPOT описаны в разделе «Примеры». В некоторых вариантах осуществления уровень высвобождения цитокина (такого как IFNγ) из T-клеток (или PBMC) в ответ на опухолевый антигенный пептид нормализуют к эталонному уровню, например к исходному уровню высвобождения цитокина или к уровню высвобождения неспецифического цитокина из T-клеток (или PBMC) в ответ на нерелевантный пептид, с получением значения кратности изменения уровня цитокина (такого как IFNγ). В некоторых вариантах осуществления любое значение кратности изменения уровня цитокина (такого как IFNγ) из более приблизительно 1,2, 1,5, 2, 2,5, 3, 4, 5, 6, 8, 10 или более в анализе ELISPOT указывает на сильный специфический иммунный ответ против опухолевого антигенного пептида. В некоторых вариантах осуществления опухолевый антигенный пептид, для которого в анализе ELISPOT кратность изменения уровня цитокина (такого как IFNγ) составляет любое значение из менее приблизительно 10, 8, 6, 5, 4, 3, 2,5, 2, 1,5, 1,2 или менее, удаляют из множества опухолевых антигенных пептидов для получения множества специализированных опухолевых антигенных пептидов для будущей MASCT.
Клинический ответ субъекта на способы MASCT врач может оценить с помощью способов, известных в данной области, таких как способы визуализации, анализы крови, оценка биомаркеров и проведение биопсии. В некоторых вариантах осуществления наблюдение за клиническим ответом осуществляется посредством определения числа циркулирующих опухолевых клеток (CTC) у субъекта перед и после применения MASCT. В некоторых вариантах осуществления CTC отделяются от первичной опухоли и циркулируют в биологической жидкости. В некоторых вариантах осуществления CTC отделяются от первичной опухоли и циркулируют в кровотоке. В некоторых вариантах осуществления CTC являются показателем метастазирования. Количество CTC можно определять посредством множества способов, известных в данной области, включая, без ограничений, способ CellSearch, способ Epic Science, IsoFlux и Maintrac. В некоторых вариантах осуществления в образце крови субъекта определяют количество единичных CTC, включая конкретные подтипы CTC. В некоторых вариантах осуществления любое количество из более приблизительно 10, 20, 50, 100, 150, 200, 300 или более единичных CTC на миллилитр образца крови субъекта после получения MASCT указывает на повышенный риск метастазирования и/или плохой клинический ответ на MASCT. В некоторых вариантах осуществления повышенное количество (например, по меньшей мере любая кратность увеличения из приблизительно 1,5, 2, 3, 4, 5, 10 или более) единичных CTC у субъекта после получения MASCT по сравнению с количеством до проведения MASCT указывает на плохой клинический ответ на лечение MASCT. В некоторых вариантах осуществления в образце крови субъекта определяют количество кластеров CTC. В некоторых вариантах осуществления обнаружение по меньшей мере любого количества из приблизительно 1, 5, 10, 50, 100 или более кластеров CTC в образце крови субъекта после получения MASCT указывает на повышенный риск метастазирования и/или плохой клинический ответ на MASCT. В некоторых вариантах осуществления повышенное количество (например, по меньшей мере любая кратность увеличения из приблизительно 1,5, 2, 3, 4, 5, 10 или более) кластеров CTC у субъекта после получения MASCT по сравнению с количеством до проведения MASCT указывает на плохой клинический ответ на лечение MASCT.
Дозы и способ введения
По существу дозы, схемы и пути введения активированных Т-клеток, популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и активированных PBMC можно определить в соответствии с размером и состоянием субъекта и в соответствии со стандартной фармацевтической практикой. Примеры путей введения включают внутривенный, внутриартериальный, внутрибрюшинный, внутрилегочный, внутрипузырный, внутримышечный, внутритрахеальный, подкожный, внутриглазной, интратекальный или трансдермальный путь введения. В некоторых вариантах осуществления способа MASCT дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления способа MASCT активированные Т-клетки вводят внутривенно. В некоторых вариантах осуществления способа MASCT на основе PBMC активированные PBMC вводят внутривенно.
Доза клеток, вводимых субъекту, может изменяться, например, в зависимости от конкретного типа вводимых клеток, пути введения и конкретного типа и стадии рака, получающего лечение. Количество должно быть достаточным для получения желаемого ответа, такого как терапевтический противораковый ответ, но без развития тяжелой токсичности или неблагоприятных явлений. В некоторых вариантах осуществления количество активированных Т-клеток или дендритных клеток, предназначенное для введения, является терапевтически эффективным количеством. В некоторых вариантах осуществления количество клеток (например, дендритных клеток, загруженных множеством антигенов, активированных Т-клеток или активированных PBMC) представляет собой количество, достаточное для уменьшения размера опухоли, уменьшения числа раковых клеток или уменьшения скорости роста опухоли по меньшей мере на любое количество из приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с соответствующим размером опухоли, числом раковых клеток или скоростью роста опухоли у того же субъекта перед лечением или по сравнению с соответствующей активностью у других субъектов, не получающих лечение. Для измерения величины этого эффекта можно использовать стандартные способы, например анализы in vitro с очищенным ферментом, анализы на основе клеток, модели на животных или исследования с участием людей.
В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, вводят в любой дозе из по меньшей мере приблизительно 1×105, 5×105, 1×106, 2×106, 3×106, 4×106, 5×106, 6×106, 7×106, 8×106, 9×106, 1×107 или 5×107 клеток/субъект. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, вводят в любой дозе из приблизительно 1×105-5×105, 5×105-1×106, 1×106-2×106, 2×106-3×106, 3×106-4×106, 4×106-5×106, 5×106-6×106, 6×106-7×106, 7×106-8×106, 8×106-1×108, 1×106-3×106, 3×106-5×106, 5×106-7×106, 2×106-4×106, 1×106-5×106 или 5×106-1×107 клеток/субъект. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят в дозе по меньшей мере приблизительно 1×106 клеток/субъект. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят в дозе от приблизительно 1×106 до приблизительно 5×106 клеток/субъект.
В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, вводят в любой дозе из по меньшей мере приблизительно 1×104, 5×104, 1×105, 2×105, 4×105, 6×105, 8×105, 1×106, 2×106 или 1×107 клеток/кг. В некоторых вариантах осуществления популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, вводят в любой дозе из приблизительно 1×104-5×104, 5×104-1×105, 1×105-2×105, 2×105-4×105, 4×105-6×105, 6×105-8×105, 8×105-1×106, 1×106-2×106, 2×106-1×107, 1×104-1×105, 1×105-1×106, 1×106-1×107, 1×104-1×106 или 1×105-1×107 клеток/кг. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят в дозе по меньшей мере приблизительно 2×105 клеток/кг. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят в дозе от приблизительно 2×105 до приблизительно 1×106 клеток/кг.
В некоторых вариантах осуществления активированные Т-клетки вводят в дозе, составляющей по меньшей мере приблизительно любую из следующих доз: 1×108, 5×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 1,5×1010, 2×1010 или 5×1010 клеток/субъект. В некоторых вариантах осуществления активированные Т-клетки вводят в любой из доз от приблизительно 1×108 до приблизительно 5×108, от приблизительно 5×108 до приблизительно 9×108, от приблизительно 9×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 2×109, от приблизительно 2×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 4×109, от приблизительно 4×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 6×109, от приблизительно 6×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 7×109, от приблизительно 7×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 1×1010, от приблизительно 3×109 до приблизительно 7×109, от приблизительно 1×1010 до приблизительно 1,5×1010, от приблизительно 1×1010 до приблизительно 2×1010 или от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект. В некоторых вариантах осуществления активированные Т-клетки вводят в дозе по меньшей мере приблизительно 3×109 клеток/субъект. В некоторых вариантах осуществления активированные Т-клетки вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
В некоторых вариантах осуществления активированные Т-клетки вводят в дозе, составляющей по меньшей мере приблизительно любую из следующих доз: 1×107, 1×108, 2×108, 4×108, 6×108, 8×108, 1×109, 2×109, 4×109, 6×109, 8×109, 1×1010 клеток/кг. В некоторых вариантах осуществления активированные Т-клетки вводят в любой из доз от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 2×108, от приблизительно 2×108 до приблизительно 4×108, от приблизительно 4×108 до приблизительно 6×108, от приблизительно 6×108 до приблизительно 8×108, от приблизительно 8×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 2×109, от приблизительно 2×109 до приблизительно 4×109, от приблизительно 4×109 до приблизительно 1×1010, от приблизительно 2×108 до приблизительно 6×108, от приблизительно 6×108 до приблизительно 1×109, от приблизительно 1×108 до приблизительно 2×108, от приблизительно 2×108 до приблизительно 2×109, от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 1×1010 или от приблизительно 1×107 до приблизительно 1×109 клеток/кг. В некоторых вариантах осуществления активированные Т-клетки вводят в дозе по меньшей мере приблизительно 6×108 клеток/кг. В некоторых вариантах осуществления активированные Т-клетки вводят в дозе от приблизительно 2×108 до приблизительно 2×109 клеток/кг.
В некоторых вариантах осуществления активированные PBMC вводят в дозе, составляющей по меньшей мере приблизительно любую из следующих доз: 1×108, 5×108, 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 1,5×1010, 2×1010 или 5×1010 клеток/субъект. В некоторых вариантах осуществления активированные PBMC вводят в любой из доз от приблизительно 1×108 до приблизительно 5×108, от приблизительно 5×108 до приблизительно 9×108, от приблизительно 9×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 2×109, от приблизительно 2×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 4×109, от приблизительно 4×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 6×109, от приблизительно 6×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 7×109, от приблизительно 7×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 1×1010, от приблизительно 3×109 до приблизительно 7×109, от приблизительно 1×1010 до приблизительно 1,5×1010, от приблизительно 1×1010 до приблизительно 2×1010 или от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект. В некоторых вариантах осуществления активированные PBMC вводят в дозе по меньшей мере приблизительно 1×109 клеток/субъект. В некоторых вариантах осуществления активированные PBMC вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
В некоторых вариантах осуществления активированные PBMC вводят в дозе, составляющей по меньшей мере приблизительно любую из следующих доз: 1×107, 1×108, 2×108, 4×108, 6×108, 8×108, 1×109, 2×109, 4×109, 6×109, 8×109, 1×1010 клеток/кг. В некоторых вариантах осуществления активированные PBMC вводят в любой из доз от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 2×108, от приблизительно 2×108 до приблизительно 4×108, от приблизительно 4×108 до приблизительно 6×108, от приблизительно 6×108 до приблизительно 8×108, от приблизительно 8×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 2×109, от приблизительно 2×109 до приблизительно 4×109, от приблизительно 4×109 до приблизительно 1×1010, от приблизительно 2×108 до приблизительно 6×108, от приблизительно 6×108 до приблизительно 1×109, от приблизительно 1×108 до приблизительно 2×108, от приблизительно 2×108 до приблизительно 2×109, от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 1×1010 или от приблизительно 1×107 до приблизительно 1×109 клеток/кг. В некоторых вариантах осуществления активированные PBMC вводят в дозе от приблизительно 2×108 до приблизительно 2×109 клеток/кг.
В некоторых вариантах осуществления при введении вместе с активированными Т-клетками, популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и/или активированными клетками PBMC используют стабилизирующий агент или эксципиент, такой как человеческий альбумин.
Дозу и схему дозирования клеток в способе MASCT (включая способ MASCT на основе PBMC) можно корректировать в ходе лечения на основании решения лечащего врача, назначающего введение. В некоторых вариантах осуществления активированные Т-клетки вводят спустя любой период из приблизительно 1 суток, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 14 суток, 15 суток, 16 суток, 17 суток, 18 суток, 19 суток, 20 суток, 21 суток или 1 месяца после введения дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления активированные Т-клетки вводят одновременно с дендритными клетками. В некоторых вариантах осуществления активированные Т-клетки вводят приблизительно через 14-21 сутки после введения дендритных клеток. В некоторых примерах осуществления активированные Т-клетки вводят приблизительно через 14 суток после введения дендритных клеток. Примеры осуществления способов MASCT с примерами схем введения показаны на ФИГ. 1 и ФИГ. 2A.
Способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) может включать один курс лечения или повторение лечения. В некоторых вариантах осуществления активированные Т-клетки вводят любое количество из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 раз. В некоторых вариантах осуществления активированные Т-клетки вводят по меньшей мере 3 раза. В некоторых вариантах осуществления дендритные клетки вводят любое количество из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 раз. В некоторых вариантах осуществления дендритные клетки вводят по меньшей мере 3 раза. В некоторых вариантах осуществления способа MASCT на основе PBMC активированные PBMC вводят любое количество из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 раз. В некоторых вариантах осуществления способа MASCT на основе PBMC активированные PBMC вводят по меньшей мере 3 раза. В некоторых вариантах осуществления этапы получения одной или более клеток (например, загруженной антигеном дендритной клетки или активированных Т-клеток) повторяют перед повторным введением дендритных клеток, активированных Т-клеток или и тех, и других. В некоторых вариантах осуществления способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) повторяют один раз в неделю, один раз в 2 недели, один раз в 3 недели, один раз в 4 недели, один раз в месяц, один раз в 2 месяца, один раз в 3 месяца, один раз в 4 месяца, один раз в 5 месяцев, один раз в 6 месяцев, один раз в 7 месяцев, один раз в 8 месяцев, один раз в 9 месяцев или один раз в год. В некоторых вариантах осуществления интервал между каждым введением дендритных клеток, активированных Т-клеток или PBMC может быть любым от приблизительно 1 недели до 2 недель, от 2 недель до 1 месяца, от 2 недель до 2 месяцев, от 1 месяца до 2 месяцев, от 1 месяца до 3 месяцев, от 3 месяцев до 6 месяцев или от 6 месяцев до года. В некоторых вариантах осуществления интервал между каждым введением дендритных клеток, активированных Т-клеток или PBMC составляет от приблизительно 0,5 до приблизительно 5 месяцев, например от приблизительно 2 недель до приблизительно 2 месяцев или от приблизительно 2 месяцев до приблизительно 5 месяцев. В некоторых примерах осуществления в случае субъекта со стабильным заболеванием все этапы способа MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) повторяют один раз в месяц в течение первых 6 месяцев лечения, каждые два месяца в течение вторых 6 месяцев лечения и каждые полгода после первых 12 месяцев лечения. Любой вариант осуществления способа MASCT, описанный в настоящем документе (включая способ MASCT на основе PBMC и способ точной MASCT), можно комбинировать с любым другим вариантом осуществления способа MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) во время проведения полного курса повторного лечения.
Предложенный в настоящем документе способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) можно применять как первый вид терапии, второй вид терапии, третий вид терапии или как комбинированную терапию с другими видами противораковой терапии, известными в данной области, такими как химиотерапия, хирургическое вмешательство, лучевая терапия, генная терапия, иммунотерапия, трансплантация костного мозга, трансплантация стволовых клеток, нацеленная терапия, криотерапия, ультразвуковая терапия, фотодинамическая терапия, радиочастотная абляция и т. п., в условиях адъювантной терапии или в условиях неоадъювантной терапии. В некоторых вариантах осуществления в настоящем изобретении предложен способ лечения рака у субъекта, включающий проведение первой терапии, включающей введение субъекту эффективного количества активированных Т-клеток, причем T-клетки активированы посредством совместного культивирования с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способа, используемого в качестве первого вида терапии, не существует другой утвержденной противораковой терапии для субъекта. В некоторых вариантах осуществления способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) используют в качестве второго вида терапии, причем субъекту ранее проводили резекцию, радиочастотную абляцию, химиотерапию, лучевую терапию или другие виды противораковой терапии. В некоторых вариантах осуществления у субъекта наблюдалось прогрессирование заболевания, или он не мог переносить стандартную противораковую терапию. В некоторых вариантах осуществления субъект получал другие виды противораковой терапии перед, одновременно или после проведения лечения (-ий) MASCT. Например, способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) может предшествовать или следовать за другой противораковой терапией (такой как химиотерапия, лучевая терапия, хирургическое вмешательство или их комбинация) с интервалами в диапазоне от минут, суток, недель до месяцев. В некоторых вариантах осуществления интервал между первым и вторым видом терапии является таким, чтобы активированные Т-клетки способа MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) и другая противораковая терапия (например, химиотерапия, лучевая терапия, хирургическое вмешательство или их комбинация) могли обеспечить преимущественное комбинированное воздействие на субъекта. В некоторых вариантах осуществления для лечения рака у субъекта способ MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) используется в сочетании с другой противораковой терапией (такой как химиотерапия, лучевая терапия, хирургическое вмешательство или их комбинация). Способы комбинированной терапии, описанные в настоящем документе, могут проводиться отдельно или в сочетании с другой терапией, такой как хирургическое вмешательство, лучевая терапия, генная терапия, иммунотерапия, трансплантация костного мозга, трансплантация стволовых клеток, гормональная терапия, нацеленная терапия, криотерапия, ультразвуковая терапия, фотодинамическая терапия, химиотерапия и т. п. Кроме того, лицо, имеющее больший риск развития пролиферативного заболевания, может получить лечение для ингибирования и/или замедления развития заболевания.
В некоторых вариантах осуществления способ представляет собой способ ингибирования пролиферации раковых клеток (например, роста опухоли) у субъекта, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ ингибирования пролиферации раковых клеток (например, роста опухоли) у субъекта, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ ингибирования пролиферации раковых клеток (например, роста опухоли) у субъекта, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления пролиферация клеток ингибируется по меньшей мере приблизительно на 10% (включая, например, по меньшей мере любое количество из приблизительно 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%).
В некоторых вариантах осуществления способ представляет собой способ ингибирования метастазирования опухоли у субъекта, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ ингибирования метастазирования опухоли у субъекта, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ ингибирования метастазирования опухоли у субъекта, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления метастазирование ингибируется по меньшей мере приблизительно на 10% (включая, например, по меньшей мере любое количество из приблизительно 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%). В некоторых вариантах осуществления предложен способ ингибирования метастазирования в лимфоузел.
В некоторых вариантах осуществления способ представляет собой способ уменьшения размера опухоли у субъекта, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ уменьшения размера опухоли у субъекта, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ уменьшения размера опухоли у субъекта, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления размер опухоли уменьшается по меньшей мере приблизительно на 10% (включая, например, по меньшей мере любое количество из приблизительно 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%).
В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта без прогрессирования рака, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта без прогрессирования рака, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта без прогрессирования рака, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления способ продлевает период до прогрессирования заболевания по меньшей мере на любой срок из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель.
В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта, имеющего рак, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта, имеющего рак, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления способ представляет собой способ продления выживаемости у субъекта, имеющего рак, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления способ продлевает период до прогрессирования заболевания по меньшей мере на любой срок из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель. В некоторых вариантах осуществления способ продлевает выживаемость субъекта по меньшей мере на любой срок из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18 или 24 месяцев.
В некоторых вариантах осуществления любого из способов способ представляет собой способ уменьшения НЯ и СНЯ у субъекта, имеющего рак, включающий введение субъекту эффективного количества активированных Т-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления любого из способов способ представляет собой способ уменьшения НЯ и СНЯ у субъекта, имеющего рак, включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления любого из способов способ представляет собой способ уменьшения НЯ и СНЯ у субъекта, имеющего рак, включающий приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC и введение субъекту эффективного количества активированных PBMC. В некоторых вариантах осуществления активированные T-клетки или PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3.
В некоторых вариантах осуществления способ позволяет прогнозировать и/или приводить к объективному ответу (такому как частичный ответ или полный ответ). В некоторых вариантах осуществления способ позволяет прогнозировать и/или приводить к улучшенному качеству жизни.
Некоторые виды противораковой иммунотерапии ассоциируются со связанными с иммунитетом неблагоприятными явлениями (связанными с иммунитетом НЯ) в дополнение к наиболее частым неблагоприятным явлениям, которые по существу ассоциируются с другими видами противораковой терапии. Связанные с иммунитетом НЯ обычно механистически связаны либо с целевой токсичностью T-клеток по отношению к антигенам-мишеням, которые экспрессируются в нормальной неопухолевой ткани, так называемый «эффект воздействия на мишени вне опухоли», либо с внецелевыми эффектами, такими как нарушение аутотолерантности или перекрестная реакция эпитопов. Связанные с иммунитетом НЯ могут приводить к тяжелым симптомам и состояниям со стороны кожи, желудочно-кишечного тракта, эндокринной системы, печени, глаз, нервной системы, а также других тканей или органов. Типичные связанные с иммунитетом НЯ, зарегистрированные для способов иммунотерапии рака, известных в данной области, включают летальный иммуноопосредованный дерматит, пневмонию, колит, лимфоцитарный гипофизит, панкреатит, лимфаденопатию, эндокринные нарушения, токсичность для ЦНС и т. п. В некоторых вариантах осуществления способы MASCT (включая способы MASCT на основе PBMC), описанные в настоящем документе, связаны с низкой частотой возникновения неблагоприятных явлений, таких как связанные с иммунитетом НЯ. В некоторых вариантах осуществления любое количество из менее приблизительно 50%, 40%, 30%, 20%, 10%, 5%, 4%, 3%, 2% или 1% субъектов испытывают связанные с иммунитетом НЯ, такие как связанные с иммунитетом НЯ 2-5 степени тяжести.
Ингибиторы иммунной контрольной точки
В способах MASCT в некоторых вариантах осуществления используются ингибиторы иммунной контрольной точки, например, при получении активированных Т-клеток или PBMC (например, перед и/или во время этапа совместного культивирования) и/или в комбинированной терапии. Можно использовать любые известные ингибиторы иммунной контрольной точки, включая, без ограничений, ингибиторы иммунной контрольной точки, описанные в этом разделе.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой природный или сконструированный лиганд ингибирующей молекулы иммунной контрольной точки, включая, например, лиганды CTLA-4 (например, B7.1, B7.2), лиганды TIM-3 (например, галектин-9), лиганды рецептора A2a (например, аденозин, регаденозон), лиганды LAG-3 (например, молекулы MHC класса I или MHC класса II), лиганды BTLA (например, HVEM, B7-H4), лиганды KIR (например, молекулы MHC класса I или MHC класса II), лиганды PD-1 (например, PD-L1, PD-L2), лиганды IDO (например, NKTR-218, индоксимод, NLG919) и лиганды CD47 (например, рецептор SIRP-альфа).
Ингибиторы иммунной контрольной точки могут иметь любую подходящую молекулярную модальность, включая, без ограничений, малые молекулы, нуклеиновые кислоты (такие как ДНК, РНКи или аптамер), пептиды или белки (такие как антитела).
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело (такое как антагонистическое антитело), которое нацелено на ингибирующий иммунную контрольную точку белок, который выбирают из группы, состоящей из антитела к CTLA-4 (например, ипилимумаба, тремелимумаба, KAHR-102), антитела к TIM-3 (например, F38-2E2, ENUM005), антитела к LAG-3 (например, BMS-986016, IMP701, IMP321, C9B7W), антитела к KIR (например, лирилумаба и IPH2101), антитела к PD-1 (например, ниволумаба, пидилизумаба, пембролизумаба, BMS-936559, атезолизумаба, пембролизумаба, MK-3475, AMP-224, AMP-514, STI-A1110, TSR-042), антитела к PD-L1 (например, KY-1003 (EP20120194977), MCLA-145, RG7446, BMS-936559, MEDI-4736, MSB0010718C, AUR-012, STI-A1010, PCT/US2001/020964, MPDL3280A, AMP-224, дапиролизумаба пегол (CDP-7657), MEDI-4920), антитела к CD73 (например, AR-42 (OSU-HDAC42, HDAC-42, AR42, AR 42, OSU-HDAC 42, OSU-HDAC-42, NSC D736012, HDAC-42, HDAC 42, HDAC42, NSCD736012, NSC-D736012), MEDI-9447), антитела к B7-H3 (например, MGA271, DS-5573a, 8H9), антитела к CD47 (например, CC-90002, TTI-621, VLST-007), антитела к BTLA, антитела к VISTA, антитела к A2aR, антитела к B7-1, антитела к B7-H4, антитела к CD52 (например, алемтузумаба), антитела к IL-10, антитела к IL-35 и антитела к TGF-β (например, фрезолимумаба). В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой полноразмерное антитело. В некоторых вариантах осуществления антитело представляет собой антигенсвязывающий фрагмент, который выбирают из группы, состоящей из Fab, Fab', F(ab')2, Fv, scFv, BiTE, нанотела и других антигенсвязывающих подпоследовательностей полноразмерного антитела или их сконструированных комбинаций. В некоторых вариантах осуществления антитело представляет собой человеческое антитело, гуманизированное антитело или химерное антитело. В некоторых вариантах осуществления антитело представляет собой биспецифическое или мультиспецифическое антитело.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-1. Примеры антител к PD-1 включают, без ограничений, ниволумаб, пембролизумаб, пидилизумаб, BMS-936559 и атезолизумаб, пембролизумаб, MK-3475, AMP-224, AMP-514, STI-A1110 и TSR-042. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ниволумаб (например, OPDIVO®). В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой пембролизумаб (например, KEYTRUDA®). В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой SHR-1210.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор PD-L1. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к PD-L1. Примеры антител к PD-L1 включают, без ограничений, KY-1003, MCLA-145, RG7446, BMS935559, MPDL3280A, MEDI4736, авелумаб или STI-A1010.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ингибитор CTLA-4. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой антитело к CTLA-4. Примеры антител к CTLA-4 включают, без ограничений, ипилимумаб, тремелимумаб и KAHR-102. В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой ипилимумаб (например, YERVOY®).
Подходящая концентрация ингибитора иммунной контрольной точки в культуральных средах составляет, без ограничений, по меньшей мере любую концентрацию из приблизительно 1 мкг/мл, 10 мкг/мл, 15 мкг/мл, 25 мкг/мл, 50 мкг/мл, 100 мкг/мл, 200 мкг/мл, 500 мкг/мл или 1 мг/мл. В некоторых вариантах осуществления концентрация ингибитора иммунной контрольной точки в культуральных средах составляет любую концентрацию от приблизительно 1 мкг/мл до приблизительно 10 мкг/мл, от приблизительно 10 мкг/мл до приблизительно 25 мкг/мл, от приблизительно 25 мкг/мл до приблизительно 50 мкг/мл, от приблизительно 50 мкг/мл до приблизительно 100 мкг/мл, от приблизительно 100 мкг/мл до приблизительно 200 мкг/мл, от приблизительно 200 мкг/мл до приблизительно 500 мкг/мл, от приблизительно 100 мкг/мл до приблизительно 1 мг/мл, от приблизительно 10 мкг/мл до приблизительно 100 мкг/мл или от приблизительно 1 мкг/мл до приблизительно 100 мкг/мл.
Любой из описанных выше способов MASCT (включая способы MASCT на основе PBMC и способы точной MASCT) может применяться в комбинации с введением одного или более ингибиторов иммунной контрольной точки. Примеры путей введения ингибитора иммунной контрольной точки включают, без ограничений, внутриопухолевый, внутрипузырный, внутримышечный, внутрибрюшинный, внутривенный, внутриартериальный, внутричерепной, внутриплевральный, подкожный и эпидермальный пути, или его можно доставлять в лимфатические узлы, полости тела, органы или ткани, которые, как известно, содержат живые раковые клетки. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят внутривенно. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят путем инфузии. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят путем инфузии в течение любого периода, составляющего по меньшей мере приблизительно 10 минут, 30 минут, 1 час, 2 часа, 4 часа, 6 часов или более. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят тем же путем введения, что и активированные Т-клетки или активированные PBMC. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят другим путем введения, отличным от пути введения активированных Т-клеток или активированных PBMC.
Подходящая доза ингибитора иммунной контрольной точки включает, без ограничений, любую дозу из приблизительно 1 мг/м2, 5 мг/м2, 10 мг/м2, 20 мг/м2, 50 мг/м2, 100 мг/м2, 200 мг/м2, 300 мг/м2, 400 мг/м2, 500 мг/м2, 750 мг/м2, 1000 мг/м2 или более. В некоторых вариантах осуществления доза ингибитора иммунной контрольной точки представляет собой любую дозу от приблизительно 1 до приблизительно 5 мг/м2, от приблизительно 5 до приблизительно 10 мг/м2, от приблизительно 10 до приблизительно 20 мг/м2, от приблизительно 20 до приблизительно 50 мг/м2, от приблизительно 50 до приблизительно 100 мг/м2, от приблизительно 100 мг/м2 до приблизительно 200 мг/м2, от приблизительно 200 до приблизительно 300 мг/м2, от приблизительно 300 до приблизительно 400 мг/м2, от приблизительно 400 до приблизительно 500 мг/м2, от приблизительно 500 до приблизительно 750 мг/м2 или от приблизительно 750 до приблизительно 1000 мг/м2. В некоторых вариантах осуществления доза ингибитора иммунной контрольной точки представляет собой любую дозу из приблизительно 1 мкг/кг, 2 мкг/кг, 5 мкг/кг, 10 мкг/кг, 20 мкг/кг, 50 мкг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 1 мг/кг, 2 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 50 мг/кг, 100 мг/кг или более. В некоторых вариантах осуществления доза ингибитора иммунной контрольной точки представляет собой любую дозу от приблизительно 1 мкг/кг до приблизительно 5 мкг/кг, от приблизительно 5 мкг/кг до приблизительно 10 мкг/кг, от приблизительно 10 мкг/кг до приблизительно 50 мкг/кг, от приблизительно 50 мкг/кг до приблизительно 0,1 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 0,2 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 0,3 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 0,4 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 0,5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 1 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, от приблизительно 5 мг/кг до приблизительно 10 мг/кг, от приблизительно 10 мг/кг до приблизительно 20 мг/кг, от приблизительно 20 мг/кг до приблизительно 50 мг/кг, от приблизительно 50 мг/кг до приблизительно 100 мг/кг или от приблизительно 1 мг/кг до приблизительно 100 мг/кг.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят ежедневно. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят по меньшей мере любое количество раз из приблизительно 1, 2, 3, 4, 5, 6 или 7 раз (т. е. ежедневно) в неделю. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят еженедельно. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят еженедельно без перерывов; еженедельно в течение двух из трех недель; еженедельно в течение трех из четырех недель; один раз каждые две недели; один раз каждые 3 недели; один раз каждые 4 недели; один раз каждые 6 недель; один раз каждые 8 недель, ежемесячно или от каждых двух до 12 месяцев. В некоторых вариантах осуществления интервалы между каждым введением имеют продолжительность менее любого периода из приблизительно 6 месяцев, 3 месяцев, 1 месяца, 20 суток, 15 суток, 12 суток, 10 суток, 9 суток, 8 суток, 7 суток, 6 суток, 5 суток, 4 суток, 3 суток, 2 суток или 1 суток. В некоторых вариантах осуществления интервалы между каждым введением имеют продолжительность более любого периода из приблизительно 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 8 месяцев или 12 месяцев. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят один раз каждые 3 месяца. В некоторых вариантах осуществления в схеме дозирования нет перерывов. В некоторых вариантах осуществления интервал между каждым введением не превышает приблизительно недели. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят в соответствии с той же схемой дозирования, что и активированные Т-клетки или активированные PBMC. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят в соответствии с другой схемой дозирования, отличной от схемы дозирования активированных Т-клеток или активированных PBMC.
В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят в каждом цикле лечения MASCT. Например, ингибитор иммунной контрольной точки можно вводить любое количество раз из приблизительно 1, 2, 3, 4, 5, 6 или более раз в каждом цикле лечения MASCT. В некоторых вариантах осуществления ингибитор иммунной контрольной точки не вводят в каждом цикле лечения MASCT. Например, ингибитор иммунной контрольной точки можно вводить один раз в любом количестве из приблизительно 1, 2, 3, 4, 5 или более циклов лечения MASCT.
Введение ингибитора иммунной контрольной точки можно осуществлять в течение длительного периода времени, например от приблизительно одного месяца до приблизительно семи лет. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят в течение любого периода из по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36, 48, 60, 72 или 84 месяцев. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят за один раз. В некоторых вариантах осуществления ингибитор иммунной контрольной точки вводят повторно. В некоторых вариантах осуществления введение ингибитора иммунной контрольной точки повторяют до прогрессирования заболевания.
Т-клеточные рецепторы (TCR)
В одном аспекте в настоящем изобретении дополнительно предложен способ клонирования опухолеспецифического Т-клеточного рецептора от субъекта, получившего лечение любым из способов MASCT (включая MASCT на основе PBMC и точную MASCT), описанных в настоящем документе.
Таким образом, в некоторых вариантах осуществления предложен способ клонирования опухолеспецифического Т-клеточного рецептора, включающий: (a) необязательно введение субъекту, имеющему рак, эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (b) введение субъекту эффективного количества активированных T-клеток, причем активированные Т-клетки получают путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) выделение у субъекта Т-клетки, которая специфически распознает опухолевый антигенный пептид во множестве опухолевых антигенных пептидов; и (d) клонирование из Т-клетки Т-клеточного рецептора с получением опухолеспецифического Т-клеточного рецептора. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию дендритных клеток и популяцию Т-клеток получают от одного и того же субъекта, такого как субъект, подлежащий лечению. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ клонирования опухолеспецифического Т-клеточного рецептора, включающий: (a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток (например, в присутствии GM-CSF и IL-4); (b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов (например, в присутствии множества агонистов Toll-подобного рецептора (TLR)) с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (c) необязательно введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов; (d) совместное культивирование (например, в присутствии множества цитокинов и необязательно антитела к CD3) популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток; причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции PBMC (например, от субъекта); (e) введение субъекту эффективного количества активированных Т-клеток; (f) выделение у субъекта Т-клетки, которая специфически распознает опухолевый антигенный пептид во множестве опухолевых антигенных пептидов; и (g) клонирование из Т-клетки Т-клеточного рецептора с получением опухолеспецифического Т-клеточного рецептора. В некоторых вариантах осуществления интервал между введением дендритных клеток и введением активированных Т-клеток составляет от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток, от приблизительно 14 суток до приблизительно 21 суток, приблизительно 10 суток или приблизительно 14 суток). В некоторых вариантах осуществления совместное культивирование проводят в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток). В некоторых вариантах осуществления перед и/или во время совместного культивирования популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки (таким как ингибитор PD-1, PD-L1 или CTLA-4). В некоторых вариантах осуществления активированные T-клетки вводят внутривенно. В некоторых вариантах осуществления активированные T-клетки вводят по меньшей мере три раза. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно. В некоторых вариантах осуществления дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления предложен способ клонирования опухолеспецифического Т-клеточного рецептора, включающий: (a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов (например, в присутствии ингибитора иммунной контрольной точки) с получением популяции активированных PBMC; (b) введение субъекту, имеющему раковое заболевание, эффективного количества PBMC; (c) выделение у субъекта Т-клетки, которая специфически распознает опухолевый антигенный пептид во множестве опухолевых антигенных пептидов; и (d) клонирование Т-клеточного рецептора из Т-клетки с получением опухолеспецифического Т-клеточного рецептора. В некоторых вариантах осуществления активированные PBMC вводят по меньшей мере три раза. В некоторых вариантах осуществления интервал между каждым введением активированных PBMC составляет от приблизительно 2 недель до приблизительно 5 месяцев (например, приблизительно 3 месяца). В некоторых вариантах осуществления активированные PBMC вводят внутривенно. В некоторых вариантах осуществления популяцию PBMC получают от субъекта, получающего лечение. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и необязательно вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит один или более неоантигенных пептидов. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки, такого как ингибитор PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA или LAG-3. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия низкой мутационной нагрузки (например, в одном или более генах MHC) в раковой опухоли. В некоторых вариантах осуществления субъекта выбирают для способа лечения на основании наличия у субъекта одного или более (например, по меньшей мере 5) неоантигенов. В некоторых вариантах осуществления способ дополнительно включает идентификацию неоантигена у субъекта (например, посредством секвенирования образца опухоли, полученного от субъекта) и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп. В некоторых вариантах осуществления способ дополнительно включает наблюдение за субъектом после введения активированных PBMC. В некоторых вариантах осуществления наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC). В некоторых вариантах осуществления наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов. В некоторых вариантах осуществления способ повторяют с применением множества специализированных опухолевых антигенных пептидов.
В некоторых вариантах осуществления TCR клонируют от субъекта, ответившего на способ MASCT, например от субъекта, у которого после проведения MASCT наблюдается уменьшенное количество CTC или низкое количество CTC, от субъекта, имеющего по результатам клинической оценки стабильное заболевание (SD), полный ответ (CR) или частичный ответ (PR). В некоторых вариантах осуществления TCR клонируют от субъекта, не ответившего на способ MASCT. В некоторых вариантах осуществления для субъекта характерен сильный специфический иммунный ответ против опухолевого антигенного пептида. Специфический иммунный ответ против отдельного опухолевого антигенного пептида можно определять с использованием любых способов, известных в данной области, например посредством измерения уровней цитотоксического фактора (например, перфорина или гранзима B) или высвобождения цитокина (такого как IFNγ или TNFα) из T-клеток (или PBMC) после стимуляции отдельного опухолевого антигенного пептида. Для количественной оценки уровней цитотоксического фактора или цитокина (такого как IFNγ) можно использовать анализ на основе антител, такой как ELISPOT. В некоторых вариантах осуществления уровень высвобождения цитокина (такого как IFNγ) из T-клеток (или PBMC) в ответ на опухолевый антигенный пептид нормализуют к эталонному уровню, например к исходному уровню высвобождения цитокина или к уровню высвобождения неспецифического цитокина из T-клеток (или PBMC) в ответ на нерелевантный пептид, с получением значения кратности изменения уровня цитокина (такого как IFNγ). В некоторых вариантах осуществления любое значение кратности изменения уровня цитокина (такого как IFNγ) из более приблизительно 1,2, 1,5, 2, 2,5, 3, 4, 5, 6, 8, 10 или более в анализе ELISPOT указывает на сильный специфический иммунный ответ против опухолевого антигенного пептида. В некоторых вариантах осуществления способ клонирования TCR дополнительно включает определение специфического иммунного ответа каждого из множества опухолевых антигенных пептидов у субъекта, например, в образце PBMC субъекта.
Т-клетку можно выделить из биологического образца субъекта после получения MASCT. В некоторых вариантах осуществления биологический образец получают от субъекта после проведения одного цикла MASCT. В некоторых вариантах осуществления биологический образец получают от субъекта после проведения по меньшей мере любого количества из 2, 3, 4, 5 или более циклов MASCT. В некоторых вариантах осуществления биологический образец получают от субъекта после проведения MASCT через по меньшей мере приблизительно любой период в 1 неделю, 2 недели, 3 недели, 4 недели 5 недель, 6 недель, 2 месяца или 3 месяца. В некоторых вариантах осуществления биологический образец получают от субъекта после проведения MASCT не позднее чем через по меньшей мере приблизительно любой период в 6 месяцев, 3 месяца, 2 месяца, 1 месяц или менее. В некоторых вариантах осуществления биологический образец представляет собой образец крови. В некоторых вариантах осуществления биологический образец представляет собой образец PBMC. В некоторых вариантах осуществления биологический образец представляет собой образец T-клетки. В некоторых вариантах осуществления биологический образец представляет собой образец опухоли, содержащий CTL. Т-клетки можно выделить из биологического образца с использованием любых способов, известных в данной области, например с помощью проточной цитометрии или центрифугирования. В некоторых вариантах осуществления проводят скрининг множества Т-клеток, полученных из биологического образца, на специфический иммунный ответ против множества опухолевых антигенных пептидов, например, посредством окрашивания мультимерами (такими как пентамеры или декстрамеры) или путем определения уровня цитотоксического фактора (такого как перфорин или гранзим B) или высвобождения цитокина (такого как IFNγ или TNFα).
Опухолевый антигенный пептид, который специфично распознается Т-клеткой, может представлять собой любой из пула опухолевых антигенных пептидов. В некоторых вариантах осуществления опухолевый антигенный пептид содержит ограниченный MHC-I эпитоп. В некоторых вариантах осуществления опухолевый антигенный пептид содержит ограниченный MHC-II эпитоп. В некоторых вариантах осуществления опухолевый антигенный пептид представляет собой общий антигенный пептид раковой опухоли. В некоторых вариантах осуществления опухолевый антигенный пептид представляет собой специфичный для типа рака опухолевый антигенный пептид. В некоторых вариантах осуществления опухолевый антигенный пептид представляет собой неоантигенный пептид. В некоторых вариантах осуществления опухолевый антигенный пептид содержит эпитоп, полученный из CEA или hTERT.
TCR можно клонировать из Т-клеток с использованием любых способов, известных в данной области, включая, без ограничений, способы ПЦР с использованием праймеров со специфической ренатурацией до известных вариабельных доменов TCR. В некоторых вариантах осуществления для клонирования опухолеспецифических TCR используют мультипраймерную ПЦР с сохранением ампликона (или arm-ПЦР). См., например, патент США № 7,999,092. Для клонирования TCR также можно использовать способы клонирования специфических в отношении опухолевого антигена TCR из одиночных Т-клеток. См., например, публикацию E. Kobayashi et al. Nature Medicine 19.11 (2013): 1542-1546. В некоторых вариантах осуществления Т-клетку секвенируют для определения последовательности генов TCR, что позволяет клонировать TCR.
В некоторых вариантах осуществления клонированные TCR дополнительно вводят в экспрессионный вектор. В некоторых вариантах осуществления дополнительно проводят трансдукцию клонированных TCR (например, вирусным вектором или физическими или химическими способами) в клетке-хозяине (такой как Т-клетка) для экспрессии TCR. В некоторых вариантах осуществления клетка-хозяин представляет собой Т-клетку. В некоторых вариантах осуществления проводят анализ клетки-хозяина, экспрессирующей TCR, для проверки специфического иммунного ответа на опухолевый антигенный пептид. В некоторых вариантах осуществления клетку-хозяина получают из клеточной линии. В некоторых вариантах осуществления клетка-хозяин представляет собой первичную клетку. В некоторых вариантах осуществления клетка-хозяин представляет собой Т-клетку. В некоторых вариантах осуществления клетку-хозяина получают от онкологического пациента.
В настоящем изобретении дополнительно предложены опухолеспецифические TCR, клонированные с использованием любого из способов, описанных в настоящем документе. В некоторых вариантах осуществления опухолеспецифический TCR дополнительно сконструирован для улучшения физических/химических свойств и/или функций TCR. Например, сконструированный опухолеспецифический TCR может иметь повышенный уровень экспрессии, улучшенную стабильность, повышенную аффинность связывания с пептидными комплексами MHC-опухолеспецифический антиген и/или усиленную передачу сигналов. В некоторых вариантах осуществления опухолеспецифические TCR конструируют на основании подтипа MHC у субъекта, получающего иммунотерапевтическое лечение с применением опухолеспецифических TCR. В некоторых вариантах осуществления конструирование включает мутацию в одном или более положениях в вариабельных участках клонированного опухолеспецифического TCR. В некоторых вариантах осуществления конструирование включает получение гибридного белка, содержащего один или более доменов или фрагментов клонированного опухолеспецифического TCR.
В некоторых вариантах осуществления предложена выделенная нуклеиновая кислота, кодирующая опухолеспецифический TCR, или его компоненты, или производные (например, цепь TCRα, цепь TCRβ или сконструированный опухолеспецифический TCR). В некоторых вариантах осуществления предложен экспрессионный вектор, кодирующий опухолеспецифический TCR, или его компоненты, или производные (например, цепь TCRα, цепь TCRβ или сконструированный опухолеспецифический TCR). В некоторых вариантах осуществления предложена выделенная клетка-хозяин, экспрессирующая опухолеспецифический TCR, или его компоненты, или производные (например, цепь TCRα, цепь TCRβ или сконструированный опухолеспецифический TCR).
В некоторых вариантах осуществления предложена выделенная Т-клетка, содержащая опухолеспецифический TCR, или его компоненты, или производные (например, цепь TCRα, цепь TCRβ или сконструированный опухолеспецифический TCR). В некоторых вариантах осуществления проведен нокаут эндогенного TCR выделенной Т-клетки. В некоторых вариантах осуществления выделенная Т-клетка представляет собой T-клетку TCR. В некоторых вариантах осуществления предложена фармацевтическая композиция, содержащая выделенную Т-клетку и фармацевтически приемлемый эксципиент. В некоторых вариантах осуществления выделенную T-клетку получают от субъекта, имеющего рак. В некоторых вариантах осуществления выделенную T-клетку получают от субъекта, получающего лечение выделенной T-клеткой или фармацевтической композицией с ней.
Выделенные Т-клетки или фармацевтические композиции с ними могут применяться для лечения субъекта, от которого для клонирования был получен опухолеспецифический TCR, или для лечения другого субъекта, такого как аллогенный субъект или субъект, имеющий такой же генотип MHC и/или экспрессирующий на раковых клетках такой же эпитоп. В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества любой из выделенных Т-клеток, описанных в настоящем документе, или фармацевтической композиции с ними. Для достижения желаемого клинического результата иммунотерапию с применением выделенной T-клетки, содержащей клонированный опухолеспецифический TCR, можно использовать отдельно или в комбинации с другими видами лечения, такими как использование ингибитора иммунной контрольной точки, MASCT (включая MASCT на основе PBMC и точную MASCT), химиотерапия, лучевая терапия, хирургическое вмешательство, нацеленная терапия и т. п.
Активированные Т-клетки
В настоящем изобретении дополнительно предложена выделенная популяция клеток, содержащая активированные T-клетки, причем менее приблизительно 1% активированных Т-клеток являются регуляторными Т-клетками (Treg). Выделенную популяцию клеток, описанных в настоящем документе, можно получить посредством любого из способов получения популяции активированных Т-клеток, описанных в предыдущем разделе. Выделенную популяцию клеток, описанную в настоящем документе, применяют для лечения рака у субъекта, предотвращения прогрессирования опухоли или уменьшения ускользания от иммунного ответа.
Выделенная популяция клеток, описанная в настоящем документе, содержит в основном активированные T-клетки. В некоторых вариантах осуществления по меньшей мере приблизительно 90% клеток в выделенной популяции представляют собой активированные Т-клетки. В некоторых вариантах осуществления по меньшей мере любое количество из приблизительно 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99% клеток в популяции представляет собой активированные Т-клетки. В некоторых вариантах осуществления любое количество из 50-60%, 60-70%, 70-80%, 80-90%, 90-95%, 95-98%, 50-70%, 60-80%, 90-99%, 50-80%, 80-99%, 50-90%, 60-90%, 70-99% или 50-99% клеток в выделенной популяции представляет собой активированные Т-клетки.
В некоторых вариантах осуществления выделенная популяция клеток содержит клетки CD4+CD25+Foxp3+. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10%, 5%, 3%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,01% клеток CD4+CD25+Foxp3+. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 5-10%, 3-5%, 1-3%, 0,9-1%, 0,8-0,9%, 0,7-0,8%, 0,6-0,7%, 0,5-0,6%, 0,4-0,5%, 0,3-0,4%, 0,2-0,3%, 0,1-0,2%, 0,1-0,5%, 0,5-1%, 0,2-0,6%, 0,4-0,8%, 0,3-0,7% или 0,3-0,5% клеток CD4+CD25+Foxp3+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 0,3% до приблизительно 0,5% клеток CD4+CD25+Foxp3+.
В некоторых вариантах осуществления выделенная популяция клеток содержит регуляторные T-клетки (Treg). В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10%, 5%, 3%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,01% клеток Treg. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 5-10%, 3-5%, 1-3%, 0,9-1%, 0,8-0,9%, 0,7-0,8%, 0,6-0,7%, 0,5-0,6%, 0,4-0,5%, 0,3-0,4%, 0,2-0,3%, 0,1-0,2%, 0,1-0,5%, 0,5-1%, 0,2-0,6%, 0,4-0,8%, 0,3-0,7% или 0,3-0,5% клеток Treg. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 0,3% до приблизительно 0,5% клеток Treg.
В некоторых вариантах осуществления выделенная популяция клеток содержит клетки CD3+CD8+. В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 50%, 55%, 60%, 65%, 70%, 75% или 80% клеток CD3+CD8+. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 50-60%, 60-65%, 65-70%, 70-75%, 75-80%, 50-65%, 65-80%, 65-70% или 65-75% клеток CD3+CD8+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 65% до приблизительно 75% клеток CD3+CD8+.
В некоторых вариантах осуществления выделенная популяция клеток содержит цитотоксические Т-клетки. В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 50%, 55%, 60%, 65%, 70%, 75% или 80% цитотоксических Т-клеток. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 50-60%, 60-65%, 65-70%, 70-75%, 75-80%, 50-65%, 65-80%, 65-70% или 65-75% цитотоксических Т-клеток. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 65% до приблизительно 75% цитотоксических Т-клеток.
В некоторых вариантах осуществления выделенная популяция клеток содержит клетки CD3+CD4+. В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 10%, 13%, 16%, 18%, 20%, 22%, 25% или 30% клеток CD3+CD4+. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10-13%, 13-16%, 16-18%, 18-20%, 20-22%, 22-25%, 25-30%, 16-20%, 18-22% или 16-22% клеток CD3+CD4+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 16% до приблизительно 22% клеток CD3+CD4+.
В некоторых вариантах осуществления выделенная популяция клеток содержит хелперные Т-клетки. В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 10%, 13%, 16%, 18%, 20%, 22%, 25% или 30% хелперных Т-клеток. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10-13%, 13-16%, 16-18%, 18-20%, 20-22%, 22-25%, 25-30%, 16-20%, 18-22% или 16-22% хелперных Т-клеток. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 16% до приблизительно 22% хелперных Т-клеток.
В некоторых вариантах осуществления выделенная популяция клеток содержит клетки CD3+CD56+. В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 10%, 12%, 13%, 13,5%, 14%, 14,5%, 15% или 20% клеток CD3+CD56+. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10-12%, 12-13%, 13-13,5%, 13,5-14%, 14-14,5%, 14,5-15%, 15-20%, 13-14%, 14-15%, 13,5-14,5% или 13-15% клеток CD3+CD56+. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 13% до приблизительно 15% клеток CD3+CD56+.
В некоторых вариантах осуществления выделенная популяция клеток содержит натуральные Т-клетки-киллеры (NK). В некоторых вариантах осуществления выделенная популяция клеток содержит любое количество из приблизительно 10%, 12%, 13%, 13,5%, 14%, 14,5%, 15% или 20% Т-клеток-NK. В некоторых вариантах осуществления выделенная популяция клеток содержит менее любого количества из приблизительно 10-12%, 12-13%, 13-13,5%, 13,5-14%, 14-14,5%, 14,5-15%, 15-20%, 13-14%, 14-15%, 13,5-14,5% или 13-15% Т-клеток-NK. В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 13% до приблизительно 15% Т-клеток-NK.
В некоторых вариантах осуществления выделенная популяция клеток содержит от приблизительно 0,3% до приблизительно 0,5% клеток CD4+CD25+Foxp3+, от приблизительно 65% до приблизительно 75% клеток CD3+CD8+ и от приблизительно 16% до приблизительно 22% клеток CD3+CD4+. В некоторых вариантах осуществления выделенная популяция клеток содержит приблизительно 0,3% клеток Treg, от приблизительно 65% до приблизительно 75% цитотоксических Т-клеток и от приблизительно 16% до приблизительно 22% хелперных Т-клеток. В некоторых вариантах осуществления выделенная популяция клеток дополнительно содержит Т-клетки памяти.
В некоторых вариантах осуществления активированные Т-клетки в любом варианте осуществления выделенной популяции клеток способны вызывать специфический иммунный ответ на множество опухолевых антигенных пептидов in vivo или ex vivo. В некоторых вариантах осуществления активированные Т-клетки способны увеличивать активность цитотоксических Т-клеток у человека против более чем одного из опухолевых антигенных пептидов. В некоторых вариантах осуществления активированные Т-клетки характеризуются высоким уровнем экспрессии или секреции провоспалительных сигнальных молекул и низким уровнем экспрессии или секреции иммуносупрессорных цитокинов. В некоторых вариантах осуществления уровень экспрессии или секреции определяют посредством сравнения уровня экспрессии или секреции молекулы (такой как провоспалительная сигнальная молекула или иммуносупрессорный цитокин) активированных Т-клеток с контрольным уровнем экспрессии или секреции. В некоторых вариантах осуществления контрольный уровень экспрессии или секреции молекулы представляет собой уровень экспрессии или секреции молекулы в контрольной популяции Т-клеток, измеренный в тех же условиях проведения анализа. В некоторых вариантах осуществления контрольная популяция Т-клеток представляет собой популяцию Т-клеток, индуцированную множеством нерелевантных пептидов (таких как пептиды, которые не соответствуют антигенам Т-клеточного рецептора, или случайные пептиды). В некоторых вариантах осуществления контрольный уровень экспрессии или секреции молекулы представляет собой средний или медианный уровень экспрессии или секреции молекулы во множестве контрольных популяций Т-клеток. В некоторых вариантах осуществления высокий уровень экспрессии или секреции молекулы в активированных Т-клетках превышает контрольный уровень экспрессии или секреции по меньшей мере в любое количество из приблизительно 1,5, 2, 2,5, 3, 4, 5, 10, 20, 50, 100, 1000 или более раз. В некоторых вариантах осуществления низкий уровень экспрессии или секреции молекулы в активированных Т-клетках меньше контрольного уровня экспрессии или секреции в любое количество раз из 0,001, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,75 или 0,8 раза.
В некоторых вариантах осуществления активированные Т-клетки экспрессируют множество провоспалительных молекул, таких как IFNγ, TNFα, гранзим B, перфорин или любая их комбинация. В некоторых вариантах осуществления активированные Т-клетки не экспрессируют или имеют низкий уровень экспрессии иммуносупрессорных цитокинов, таких как IL-10 и/или IL-4. В некоторых вариантах осуществления частота встречаемости активированных Т-клеток (таких как клетки CD3+CD4+ или клетки CD3+CD8+), экспрессирующих иммуноингибирующие молекулы, например PD-1, является низкой. В некоторых вариантах осуществления частота встречаемости активированных Т-клеток, экспрессирующих PD-1, составляет менее приблизительно любое число из 10%, 5%, 3%, 2% или 1%. В некоторых вариантах осуществления менее приблизительно 5% активированных Т-клеток экспрессируют иммуноингибирующую молекулу PD-1.
Выделенную популяцию клеток, описанную в настоящем документе, можно использовать для создания специфической иммунной памяти при введении субъекту. В некоторых вариантах осуществления субъект имеет Т-клетки памяти, которые могут вызывать специфический Т-клеточный ответ против множества опухолевых антигенных пептидов через любой период из приблизительно 2 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 6 месяцев, 12 месяцев или более после введения выделенной популяции клеток.
Выделенную популяцию клеток, описанную в настоящем документе, также можно использовать для изменения иммуноингибирующих сигналов in vivo. В некоторых вариантах осуществления при введении субъекту выделенная популяция клеток снижает частоту экспрессии иммуноингибирующей молекулы (такой как PD-1) на T-клетках (таких как цитотоксические Т-клетки или хелперные Т-клетки). В некоторых вариантах осуществления выделенная популяция клеток уменьшает иммунологическую толерантность или ускользание от иммунного ответа раковых клеток у субъекта. Соответственно, предложен способ уменьшения частоты экспрессии иммуноингибирующей молекулы, такой как PD-1, в T-клетках субъекта, включающий введение субъекту эффективного количества любого варианта осуществления выделенной популяции клеток, описанной в настоящем документе. В настоящем документе также предложена иммунотерапевтическая композиция, содержащая любой из вариантов осуществления выделенной популяции клеток, содержащая активированные Т-клетки, и применение любого варианта осуществления выделенной популяции клеток при изготовлении лекарственного средства для лечения рака у субъекта.
Композиции, наборы и промышленные изделия
В настоящем изобретении дополнительно предложены наборы, композиции (такие как фармацевтические композиции) и коммерческие партии опухолевых антигенных пептидов для применения в любом варианте осуществления способа MASCT (включая способ MASCT на основе PBMC и точную MASCT) или способы получения клеток (таких как загруженные антигенами DC, активированные Т-клетки или активированные PBMC), описанные в настоящем документе.
В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов. В некоторых вариантах осуществления набор содержит любое количество из более приблизительно 10, 15, 20, 25, 30, 35, 40, 45 или 50 опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов. В некоторых вариантах осуществления множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов и вторую группу специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит от приблизительно 10 до приблизительно 20 общих опухолевых антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит более 1 из общих опухолевых антигенных пептидов. В некоторых вариантах осуществления первая основная группа содержит любое количество из более приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 общих опухолевых антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит от приблизительно 1 до приблизительно 10 специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит любое количество из более приблизительно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 специфичных для типа рака антигенных пептидов. В некоторых вариантах осуществления вторая группа содержит любое количество из более приблизительно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 вирусспецифичных антигенных пептидов. В некоторых вариантах осуществления набор дополнительно содержит любое количество из приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 25, 30, 40 или 50 неоантигенных пептидов.
В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40. В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-24. В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов, которые выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2B. В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов, причем по меньшей мере 10 опухолевых антигенных пептидов выбирают из группы, состоящей из опухолевых антигенных пептидов, показанных на ФИГ. 2C и ФИГ. 29A. В некоторых вариантах осуществления предложен набор, используемый для иммунотерапии рака, который содержит по меньшей мере 10 опухолевых антигенных пептидов, полученных из белков, которые выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA1, KRAS, PARP4, MLL3 и MTHFR.
Специалист в данной области может использовать любые комбинации опухолевых антигенных пептидов из первой основной группы и необязательно любые комбинации специфичных для типа рака антигенных пептидов из второй группы и/или неоантигенных пептидов для загрузки популяции дендритных клеток, которые можно дополнительно использовать для получения активированных Т-клеток, применяемых для лечения рака у субъекта. Набор можно также использовать для способов MACT на основе PBMC, способов точной MASCT или для клонирования опухолеспецифического TCR от субъекта, получающего MASCT.
Набор может содержать дополнительные компоненты, такие как контейнеры, реагенты, культуральные среды, цитокины, буферы, антитела и т. п., для облегчения реализации любого варианта осуществления способа MASCT (включая способ MASCT на основе PBMC и способ точной MASCT) или способов клонирования опухолеспецифического TCR от субъекта, получающего MASCT. Например, в некоторых вариантах осуществления набор дополнительно содержит аппарат для взятия и хранения периферической крови, который можно использовать для взятия периферической крови субъекта. В некоторых вариантах осуществления набор дополнительно содержит контейнеры и реагенты центрифугирования в градиенте плотности периферической крови, которые можно использовать для выделения PBMC из образца периферической крови человека. В некоторых вариантах осуществления набор дополнительно содержит культуральные среды, цитокины или буферы для получения дендритных клеток из периферической крови. В некоторых вариантах осуществления набор дополнительно содержит культуральные среды, агонисты TLR, реагенты и буферы для загрузки первой основной группы и необязательно второй группы в дендритные клетки с получением дендритных клеток, загруженных множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления набор дополнительно содержит цитокин, антитело к CD3, буферы, ингибитор иммунной контрольной точки или культуральные среды для совместного культивирования T-клеток, полученных из периферической крови, с дендритными клетками, загруженными множеством опухолевых антигенных пептидов. В некоторых вариантах осуществления набор дополнительно содержит реагенты для определения мутационной нагрузки (например, в одном или более генов MHC) в раковых клетках. В некоторых вариантах осуществления набор дополнительно содержит ингибитор иммунной контрольной точки для комбинированной терапии с MASCT. В некоторых вариантах осуществления набор дополнительно содержит реагенты для идентификации неоантигена (например, посредством секвенирования) в образце опухоли. В некоторых вариантах осуществления набор дополнительно содержит компоненты для проведения анализа ELISPOT для оценки специфического иммунного ответа против множества опухолевых антигенных пептидов. В некоторых вариантах осуществления набор дополнительно содержит реагенты для клонирования опухолеспецифического TCR.
Наборы в соответствии с изобретением находятся в подходящей упаковке. Подходящие упаковки включают, без ограничений, флаконы, бутылочки, банки, гибкие упаковки (например, пленку майлар или пластиковые мешочки) и т. п. В наборах необязательно могут присутствовать дополнительные компоненты, такие как буферы, и объясняющая информация. Таким образом, настоящая заявка также относится к промышленным изделиям, которые включают флаконы (такие как герметично закрываемые флаконы), бутылочки, банки, гибкие упаковки и т. п.
Инструкции могут также содержать инструкции, относящиеся к применению опухолевых антигенных пептидов (и необязательно описанных выше дополнительных компонентов). В некоторых вариантах осуществления набор дополнительно содержит обучающее руководство, например руководство, в котором описан протокол варианта осуществления способов MASCT (включая способы MASCT на основе PBMC и способы точной MASCT), варианта осуществления способов получения клеток, описанных в настоящем документе, или варианта осуществления способа клонирования опухолеспецифического TCR. Инструкции также могут включать информацию относительно дозы, схемы дозирования и пути введения антигенпредставляющих клеток (таких как дендритные клетки), активированных T-клеток и/или активированных PBMC, полученных с использованием набора для предполагаемого лечения. В некоторых вариантах осуществления набор дополнительно содержит инструкции по отбору субъекта для способа MASCT. В некоторых вариантах осуществления набор дополнительно содержит инструкции по определению мутационной нагрузки раковых клеток и/или по определению количества неоантигенов у субъекта. В некоторых вариантах осуществления набор дополнительно содержит инструкции по введению ингибитора иммунной контрольной точки в комбинации с MASCT, включая, например, информацию в отношении дозы, схемы дозирования и пути введения ингибитора иммунной контрольной точки. В некоторых вариантах осуществления набор дополнительно содержит инструкции по идентификации неоантигена (например, посредством секвенирования) в образце опухоли. В некоторых вариантах осуществления набор дополнительно содержит инструкции по наблюдению за субъектом после проведения MASCT. В некоторых вариантах осуществления набор дополнительно содержит инструкции по клонированию опухолеспецифического TCR.
Контейнеры могут содержать стандартные дозы, представлять собой упаковки, содержащие большую массу препарата (например, многодозовые упаковки), или субстандартные дозы. Например, могут быть предложены наборы, содержащие достаточное количество опухолевых антигенных пептидов, описанных в настоящем документе, для получения достаточного количества активированных Т-клеток и/или загруженных антигенами дендритных клеток (таких как дендритные клетки) для обеспечения эффективного лечения субъекта в течение продолжительного периода, например любого из 3 недель, 6 недель, 9 недель, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 8 месяцев, 9 месяцев, 1 года или более.
Наборы также могут включать множество стандартных доз опухолевых антигенных пептидов и инструкции по применению, которые упакованы в количествах, достаточных для хранения и применения в аптеках, например больничных аптеках и рецептурно-производственных аптеках.
В некоторых вариантах осуществления предложена коммерческая партия популяции опухолевых антигенных пептидов или набор, как описано в настоящем документе. В контексте настоящего документа термин «коммерческая партия» относится к размеру партии, составляющей по меньшей мере приблизительно 10 мг. В некоторых вариантах осуществления коммерческая партия составляет по меньшей мере любое количество из приблизительно 10, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 5000 или 10 000 мг. В некоторых вариантах осуществления коммерческая партия содержит множество флаконов, содержащих любую из композиций (например, популяцию опухолевых антигенных пептидов или наборы), описанных в настоящем документе. В некоторых вариантах осуществления коммерческая партия содержит по меньшей мере любое количество из приблизительно 5, 10, 15, 20, 25, 50, 75, 100, 200, 300, 400, 500, 1000, 2000, 5000 или 10 000 флаконов. Например, каждый флакон содержит по меньшей мере приблизительно 0,1 мг опухолевых антигенных пептидов. В некоторых вариантах осуществления опухолевые антигенные пептиды находятся в жидкой суспензии. В некоторых вариантах осуществления опухолевые антигенные пептиды представлены в виде порошка, например лиофилизированного порошка.
Дополнительно предложены композиции (например, фармацевтические композиции) и коммерческие партии любой выделенной популяции клеток (таких как дендритные клетки, активированные Т-клетки, активированные PBMC или выделенные T-клетки, содержащие опухолеспецифические TCR), описанные в настоящем документе.
Выделенную популяцию клеток, описанную в настоящем документе, можно использовать в фармацевтических композициях или составах с обеспечением комбинации описанной выделенной популяции клеток с фармацевтически приемлемым носителем, эксципиентами, стабилизирующими агентами и/или другими агентами, известными в данной области, для применения в способах лечения, способах введения и схемах лечения, описанных в настоящем документе. В некоторых вариантах осуществления в качестве фармацевтически приемлемого носителя используется человеческий альбумин.
Подходящие фармацевтические носители включают стерильную воду; физиологический раствор; декстрозу; раствор декстрозы в воде или физиологическом растворе; продукты конденсации касторового масла и этиленоксида, в которых комбинируют от приблизительно 30 до приблизительно 35 моль этиленоксида на один моль касторового масла; жидкую кислоту; низшие алканолы; масла, такие как кукурузное масло, арахисовое масло, кунжутное масло и т. п., с эмульгаторами, такими как моно- или диглицерид жирной кислоты или фосфатид, например лецитин и т. п.; гликоли; полиалкиленгликоли; водные несущие среды в присутствии суспендирующего агента, например натрийкарбоксиметилцеллюлозы; альгинат натрия; поли(винилпиролидон) и т. п., отдельно или с подходящими диспергирующими агентами, такими как лецитин; полиоксиэтиленстеарат и т. п. Носитель может также содержать адъюванты, такие как консервирующие стабилизирующие, смачивающие, эмульгирующие агенты и т. п. вместе с усилителем проникновения. Конечная форма может быть стерильной и может также легко проходить через инъекционное устройство, такое как полая игла. Соответствующую вязкость можно достигнуть и поддерживать правильным выбором растворителей или эксципиентов.
Фармацевтические композиции, описанные в настоящем документе, могут включать другие агенты, эксципиенты или стабилизаторы для улучшения свойств композиции. Примеры подходящих эксципиентов и разбавителей включают, без ограничений, лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, физиологический раствор, сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. В некоторых вариантах осуществления фармацевтическую композицию готовят так, чтобы ее значение pH находилось в диапазоне от приблизительно 4,5 до приблизительно 9,0, включая, например, любые диапазоны pH из от приблизительно 5,0 до приблизительно 8,0, от приблизительно 6,5 до приблизительно 7,5 или от приблизительно 6,5 до приблизительно 7,0. В некоторых вариантах осуществления фармацевтическую композицию также можно приготовить так, чтобы она была изотонична крови, добавлением подходящего модификатора тоничности, такого как глицерин.
В некоторых вариантах осуществления композиции выделенных клеток (например, фармацевтические композиции) подходят для введения человеку. В некоторых вариантах осуществления композиции (например, фармацевтические композиции) подходят для введения человеку посредством парентерального пути введения. Составы, подходящие для парентерального введения, включают водные и неводные изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические препараты и растворимые вещества, которые делают составы совместимыми с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Препараты могут быть представлены в герметичных контейнерах, содержащих однократную дозу или множество доз, таких как ампулы и флаконы, для применения в способах лечения, способах введения и схемах лечения, описанных в настоящем документе, и могут храниться в состоянии, требующем только добавления стерильного жидкого эксципиента (т. е. воды для инъекций) непосредственно перед применением. В некоторых вариантах осуществления композиции (например, фармацевтические композиции) содержатся в одноразовом флаконе, таком как одноразовый герметичный флакон. В некоторых вариантах осуществления в каждом одноразовом флаконе содержится приблизительно 109 активированных Т-клеток. В некоторых вариантах осуществления в каждом одноразовом флаконе содержится достаточно активированных Т-клеток для увеличения до приблизительно 109 активированных Т-клеток. В некоторых вариантах осуществления композиции (например, фармацевтические композиции) содержатся во флаконе для многоразового использования. В некоторых вариантах осуществления композиции (например, фармацевтические композиции) содержатся в контейнере в виде основной массы.
Также предложены стандартные дозированные формы, содержащие композиции выделенных клеток (например, фармацевтические композиции) и составы, описанные в настоящем документе. Эти стандартные дозированные формы могут храниться в подходящей упаковке в виде однократной или многократной стандартной дозированной формы, а также их можно дополнительно стерилизовать и герметизировать. В некоторых вариантах осуществления композиция (например, фармацевтическая композиция) также включает одно или более других соединений (или их фармацевтически приемлемых солей), используемых для лечения рака. В различных вариантах число активированных Т-клеток в фармацевтической композиции включено в любой из следующих диапазонов: от приблизительно 1×108 до приблизительно 5×108, от приблизительно 5×108 до приблизительно 9×108, от приблизительно 9×108 до приблизительно 1×109, от приблизительно 1×109 до приблизительно 2×109, от приблизительно 2×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 4×109, от приблизительно 4×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 6×109, от приблизительно 6×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 3×109, от приблизительно 3×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 7×109, от приблизительно 7×109 до приблизительно 1×1010, от приблизительно 1×109 до приблизительно 5×109, от приблизительно 5×109 до приблизительно 1×1010, от приблизительно 3×109 до приблизительно 7×109, от приблизительно 1×1010 до приблизительно 1,5×1010, от приблизительно 1×1010 до приблизительно 2×1010 или от приблизительно 1×109 до приблизительно 1×1010 клеток. В некоторых вариантах осуществления активированные Т-клетки являются единственным фармацевтически активным агентом для лечения рака, который содержится в композиции.
В некоторых вариантах осуществления предложена дозированная форма (например, стандартная дозированная форма) для лечения рака, содержащая любую из композиций выделенных клеток (таких как фармацевтические композиции), описанных в настоящем документе. В некоторых вариантах осуществления предложены промышленные изделия, содержащие композиции (такие как фармацевтические композиции), составы и стандартные дозированные формы, описанные в настоящем документе, в подходящей упаковке для применения в способах лечения, способах введения и схемах лечения, описанных в настоящем документе. Подходящие упаковки для композиций (таких как фармацевтические композиции), описанных в настоящем документе, известны в данной области и включают, например, флаконы (такие как герметично закрываемые флаконы), сосуды (такие как герметично закрываемые сосуды), ампулы, бутылочки, банки, гибкие упаковки (например, герметично запаянную пленку майлар или пластиковые мешочки) и т. п. Такие промышленные изделия можно дополнительно стерилизовать и/или герметично закрыть.
В настоящей заявке дополнительно предложены наборы, содержащие любой компонент из выделенной популяции клеток, композиций (таких как фармацевтические композиции), составов, стандартных дозированных форм и промышленных изделий, описанных в настоящем документе, для применения в способах лечения, способах введения и схемах лечения, описанных в настоящем документе. Наборы, описанные в настоящем документе, включают один или более контейнеров, содержащих активированные Т-клетки.
В некоторых вариантах осуществления предложена коммерческая партия активированных T-клеток, описанных в настоящем документе. В контексте настоящего документа термин «коммерческая партия» относится к коммерческой партии, составляющей по меньшей мере приблизительно 1×109 активированных Т-клеток. В некоторых вариантах осуществления коммерческая партия содержит по меньшей мере любое количество из 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109, 9×109, 1×1010, 2×1010, 5×1010 или 1×1011 клеток. В некоторых вариантах осуществления коммерческая партия содержит множество флаконов, содержащих любую из композиций (например, фармацевтических композиций), описанных в настоящем документе. В некоторых вариантах осуществления коммерческая партия содержит по меньшей мере любое количество из приблизительно 5, 10, 15, 20, 25, 50, 75 или 100 флаконов. Например, каждый флакон содержит по меньшей мере приблизительно 1×109 активированных Т-клеток.
Примеры и примеры осуществления, приведенные ниже, предназначены исключительно для иллюстрации изобретения и, следовательно, не должны рассматриваться как каким-либо образом ограничивающие изобретение. Следующие примеры и подробное описание предлагаются в качестве иллюстрации, а не в качестве ограничения.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ
Вариант осуществления 1. В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 2. В некоторых дополнительных вариантах осуществления варианта осуществления 1 субъекту ранее вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 3. В некоторых дополнительных вариантах осуществления варианта осуществления 1 способ дополнительно включает введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 4. В некоторых дополнительных вариантах осуществления варианта осуществления 3 дендритные клетки вводят перед введением активированных Т-клеток.
Вариант осуществления 5. В некоторых дополнительных вариантах осуществления варианта осуществления 4 дендритные клетки вводят перед введением активированных Т-клеток в период от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток).
Вариант осуществления 6. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-5 способ дополнительно включает получение активированных Т-клеток посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 7. В некоторых дополнительных вариантах осуществления варианта осуществления 6 популяцию Т-клеток совместно культивируют с популяцией дендритных клеток в течение периода от приблизительно 7 суток до приблизительно 21 суток (например, от приблизительно 7 суток до приблизительно 14 суток или от приблизительно 14 суток до приблизительно 21 суток).
Вариант осуществления 8. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-7 перед совместным культивированием популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки.
Вариант осуществления 9. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-8 популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в присутствии ингибитора иммунной контрольной точки.
Вариант осуществления 10. В некоторых дополнительных вариантах осуществления варианта осуществления 8 или варианта осуществления 9 ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
Вариант осуществления 11. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-10 способ дополнительно включает получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 12. В некоторых дополнительных вариантах осуществления варианта осуществления 11 популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов.
Вариант осуществления 13. В некоторых дополнительных вариантах осуществления варианта осуществления 12 популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками.
Вариант осуществления 14. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-13 популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта.
Вариант осуществления 15. В некоторых дополнительных вариантах осуществления варианта осуществления 14 популяцию Т-клеток и популяцию дендритных клеток получают от субъекта, получающего лечение.
Вариант осуществления 16. В некоторых вариантах осуществления предложен способ получения популяции активированных T-клеток, который включает: a) индуцирование дифференциации популяции моноцитов в популяцию дендритных клеток; b) приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов с получением популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов; и c) совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC с получением популяции активированных T-клеток, причем популяцию моноцитов и популяцию неадгезивных РВМС получают из популяции РВМС от субъекта.
Вариант осуществления 17. В некоторых дополнительных вариантах осуществления варианта осуществления 16 этап b) включает приведение популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками.
Вариант осуществления 18. В некоторых дополнительных вариантах осуществления варианта осуществления 16 или варианта осуществления 17 этап d) дополнительно включает приведение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в контакт с множеством агонистов Toll-подобного рецептора (TLR) для индуцирования созревания популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
Вариант осуществления 19. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 16-18 этап f) дополнительно включает приведение популяции активированных T-клеток в контакт с множеством цитокинов для индуцирования пролиферации и дифференциации популяции активированных T-клеток.
Вариант осуществления 20. В некоторых дополнительных вариантах осуществления варианта осуществления 19 множество цитокинов содержит IL-2, IL-7, IL-15 или IL-21.
Вариант осуществления 21. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 16-20 перед совместным культивированием популяцию неадгезивных PBMC приводят в контакт с ингибитором иммунной контрольной точки.
Вариант осуществления 22. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 16-21 этап c) включает совместное культивирование популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов, и популяции неадгезивных PBMC в присутствии ингибитора иммунной контрольной точки.
Вариант осуществления 23. В некоторых дополнительных вариантах осуществления варианта осуществления 21 или варианта осуществления 22 ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
Вариант осуществления 24. В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества популяции активированных T-клеток, полученных посредством любого из способов, описанных в вариантах осуществления 16-23.
Вариант осуществления 25. В некоторых дополнительных вариантах осуществления варианта осуществления 24 популяцию PBMC получают от субъекта, получающего лечение.
Вариант осуществления 26. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-25 активированные Т-клетки вводят субъекту по меньшей мере три раза.
Вариант осуществления 27. В некоторых дополнительных вариантах осуществления варианта осуществления 26 интервал между каждым введением активированных Т-клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
Вариант осуществления 28. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-27 активированные Т-клетки вводят внутривенно.
Вариант осуществления 29. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-28 активированные Т-клетки вводят в дозе по меньшей мере приблизительно 3×109 клеток/субъект.
Вариант осуществления 30. В некоторых дополнительных вариантах осуществления варианта осуществления 29 активированные Т-клетки вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
Вариант осуществления 31. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 2-15 и 24-30 дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза.
Вариант осуществления 32. В некоторых дополнительных вариантах осуществления варианта осуществления 31 интервал между каждым введением дендритных клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
Варианты осуществления 33. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 2-15 и 24-32 дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно.
Вариант осуществления 34. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 2-15 и 24-33 дендритные клетки вводят в дозе от приблизительно 1×106 до приблизительно 5×106 клеток/субъект.
Вариант осуществления 35. В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий: a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; и b) введение субъекту эффективного количества активированных PBMC.
Вариант осуществления 36. В некоторых дополнительных вариантах осуществления варианта осуществления 35 этап (a) включает приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки.
Вариант осуществления 37. В некоторых дополнительных вариантах осуществления варианта осуществления 36 ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
Вариант осуществления 38. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 35-37 активированные PBMC вводят по меньшей мере три раза.
Вариант осуществления 39. В некоторых дополнительных вариантах осуществления варианта осуществления 38 интервал между каждым введением активированных PBMC составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
Вариант осуществления 40. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 35-39 активированные PBMC вводят внутривенно.
Вариант осуществления 41. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 35-40 активированные PBMC вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
Вариант осуществления 42. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-41 каждый из множества опухолевых антигенных пептидов имеет длину от приблизительно 20 до приблизительно 40 аминокислот.
Вариант осуществления 43. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-42 множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-I.
Вариант осуществления 44. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-43 множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-II.
Вариант осуществления 45. В некоторых дополнительных вариантах осуществления варианта осуществления 43 или варианта осуществления 44 по меньшей мере один пептид, содержащий эпитоп MHC-I или эпитоп MHC-II, дополнительно содержит дополнительные аминокислоты, фланкирующие эпитоп на N-конце, C-конце или на обоих концах.
Вариант осуществления 46. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-45 множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов.
Вариант осуществления 47. В некоторых дополнительных вариантах осуществления варианта осуществления 46 множество опухолевых антигенных пептидов дополнительно содержит вторую группу специфичных для типа рака антигенных пептидов.
Вариант осуществления 48. В некоторых дополнительных вариантах осуществления любого одного варианта осуществления 46 или варианта осуществления 47 первая основная группа содержит от приблизительно 10 до приблизительно 20 общих опухолевых антигенных пептидов.
Вариант осуществления 49. В некоторых дополнительных вариантах осуществления варианта осуществления 47 или варианта осуществления 48 вторая группа содержит от приблизительно 1 до приблизительно 10 специфичных для типа рака антигенных пептидов.
Вариант осуществления 50. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-49 множество опухолевых антигенных пептидов содержит неоантигенный пептид.
Вариант осуществления 51. В некоторых дополнительных вариантах осуществления варианта осуществления 50 неоантигенный пептид выбирают на основании генетического профиля образца опухоли, полученного от субъекта.
Вариант осуществления 52. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-51 рак выбирают из группы, состоящей из гепатоцеллюлярной карциномы, рака шейки матки, рака легких, колоректального рака, лимфомы, рака почки, рака молочной железы, рака поджелудочной железы, рака желудка, рака пищевода, рака яичников, рака предстательной железы, рака носоглотки, меланомы и рака головного мозга.
Вариант осуществления 53. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-52 способ дополнительно включает введение субъекту эффективного количества ингибитора иммунной контрольной точки.
Вариант осуществления 54. В некоторых дополнительных вариантах осуществления варианта осуществления 53 ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1 и CTLA-4.
Вариант осуществления 55. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-54 субъекта выбирают для способа лечения на основании мутационной нагрузки в раковой опухоли.
Вариант осуществления 56. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-55 субъект имеет низкую мутационную нагрузку в раковой опухоли.
Вариант осуществления 57. В некоторых дополнительных вариантах осуществления варианта осуществления 56 субъект имеет низкую мутационную нагрузку в одном или более генах MHC.
Вариант осуществления 58. В некоторых дополнительных вариантах осуществления варианта осуществления 57 субъект имеет не более приблизительно 10 мутаций в одном или более генах MHC.
Вариант осуществления 59. В некоторых дополнительных вариантах осуществления варианта осуществления 57 или варианта осуществления 58 субъект не имеет мутации в B2M.
Вариант осуществления 60. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 57-59 субъект не имеет мутации в функциональных областях одного или более генов MHC.
Вариант осуществления 61. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 55-60 мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта.
Вариант осуществления 62. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-61 субъекта выбирают для способа лечения на основании наличия одного или более неоантигенов в раковой опухоли.
Вариант осуществления 63. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-62 субъект имеет по меньшей мере 5 неоантигенов.
Вариант осуществления 64. В некоторых дополнительных вариантах осуществления варианта осуществления 62 или варианта осуществления 63 способ дополнительно включает идентификацию ракового неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп.
Вариант осуществления 65. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 62-64 неоантиген идентифицируют посредством секвенирования образца опухоли, полученного от субъекта.
Вариант осуществления 66. В некоторых дополнительных вариантах осуществления варианта осуществления 65 указанное секвенирование представляет собой целевое секвенирование связанных с раком генов.
Вариант осуществления 67. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 64-66 способ дополнительно включает определение аффинности неоэпитопа к молекуле MHC.
Вариант осуществления 68. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 64-67 способ дополнительно включает определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору.
Вариант осуществления 69. В некоторых дополнительных вариантах осуществления варианта осуществления 67 или варианта осуществления 68 молекула MHC представляет собой молекулу MHC класса I.
Вариант осуществления 70. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 67-69 молекулу MHC получают от субъекта.
Вариант осуществления 71. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-70 способ дополнительно включает наблюдение за субъектом после введения активированных Т-клеток или активированных PBMC.
Вариант осуществления 72. В некоторых дополнительных вариантах осуществления варианта осуществления 71 наблюдение включает определение у субъекта числа циркулирующих опухолевых клеток (CTC).
Вариант осуществления 73. В некоторых дополнительных вариантах осуществления варианта осуществления 71 или варианта осуществления 72 наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов.
Вариант осуществления 74. В некоторых дополнительных вариантах осуществления варианта осуществления 73 множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов.
Вариант осуществления 75. В некоторых дополнительных вариантах осуществления варианта осуществления 74 способ лечения повторяют с применением множества специализированных опухолевых антигенных пептидов.
Вариант осуществления 76. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 1-15 и 24-75 субъект представляет собой субъекта-человека.
Вариант осуществления 77. В некоторых вариантах осуществления предложен способ клонирования опухолеспецифического Т-клеточного рецептора, включающий: (a) проведение лечения субъекта способом по любому одному из вариантов осуществления 1-15 и 24-76; (b) выделение у субъекта Т-клетки, которая специфически распознает опухолевый антигенный пептид во множестве опухолевых антигенных пептидов; и (c) клонирование из Т-клетки Т-клеточного рецептора с получением опухолеспецифического Т-клеточного рецептора.
Вариант осуществления 78. В некоторых дополнительных вариантах осуществления варианта осуществления 77 у субъекта наблюдается сильный специфический иммунный ответ против опухолевого антигенного пептида.
Вариант осуществления 79. В некоторых дополнительных вариантах осуществления варианта осуществления 77 или варианта осуществления 78 Т-клетку выделяют из образца PBMC, полученного от субъекта.
Вариант осуществления 80. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 77-79 опухолевый антигенный пептид представляет собой неоантигенный пептид.
Вариант осуществления 81. В некоторых вариантах осуществления предложен опухолеспецифический Т-клеточный рецептор, клонированный с использованием способа по любому одному из вариантов осуществления 77-80.
Вариант осуществления 82. В некоторых вариантах осуществления предложена выделенная Т-клетка, содержащая опухолеспецифический Т-клеточный рецептор по варианту осуществления 81.
Вариант осуществления 83. В некоторых вариантах осуществления предложен способ лечения рака у субъекта, включающий введение субъекту эффективного количества выделенной Т-клетки по варианту осуществления 82.
Вариант осуществления 84. В некоторых вариантах осуществления предложена выделенная популяция клеток, полученная посредством способа по любому одному из вариантов осуществления 16-23 и 42-51.
Вариант осуществления 85. В некоторых вариантах осуществления предложена выделенная популяция клеток, содержащая активированные T-клетки, причем менее приблизительно 1% активированных Т-клеток представляют собой регуляторные Т-клетки (Treg).
Вариант осуществления 86. В некоторых дополнительных вариантах осуществления варианта осуществления 84 или варианта осуществления 85 выделенная популяция клеток содержит от приблизительно 0,3% до приблизительно 0,5% клеток CD4+CD25+Foxp3+.
Вариант осуществления 87. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-86 выделенная популяция клеток содержит от приблизительно 65% до приблизительно 75% клеток CD3+CD8+.
Вариант осуществления 88. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-87 выделенная популяция клеток содержит от приблизительно 16% до приблизительно 22% клеток CD3+CD4+.
Вариант осуществления 89. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-88 выделенная популяция клеток содержит от приблизительно 13% до приблизительно 15% клеток CD3+CD56+.
Вариант осуществления 90. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-89 активированные Т-клетки способны вызывать специфический ответ на множество опухолевых антигенных пептидов in vivo или ex vivo.
Вариант осуществления 91. В некоторых дополнительных вариантах осуществления варианта осуществления 90 активированные Т-клетки экспрессируют множество провоспалительных молекул.
Вариант осуществления 92. В некоторых дополнительных вариантах осуществления варианта осуществления 91 множество провоспалительных молекул содержит IFNγ, TNFα, гранзим B или перфорин.
Вариант осуществления 93. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-92 активированные Т-клетки не экспрессируют или имеют низкий уровень экспрессии множества иммуносупрессорных цитокинов.
Вариант осуществления 94. В некоторых дополнительных вариантах осуществления варианта осуществления 93 множество иммуносупрессорных цитокинов содержит IL-10 или IL-4.
Вариант осуществления 95. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-94 менее приблизительно 5% активированных Т-клеток экспрессируют иммуноингибирующую молекулу PD-1.
Вариант осуществления 96. В некоторых дополнительных вариантах осуществления любого одного из вариантов осуществления 84-95 по меньшей мере приблизительно 90% клеток в выделенной популяции представляют собой активированные Т-клетки.
Вариант осуществления 97. В некоторых вариантах осуществления предложена композиция, содержащая по меньшей мере 10 опухолевых антигенных пептидов, причем каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит по меньшей мере один эпитоп, который выбирают из группы, состоящей из SEQ ID NO: 1-40.
Вариант осуществления 98. В некоторых дополнительных вариантах осуществления варианта осуществления 56 каждый из по меньшей мере 10 опухолевых антигенных пептидов содержит один или более эпитопов, кодируемых связанным с раком геном, который выбирают из группы, состоящей из hTERT, p53, сурвивина, NY-ESO-1, CEA, CCND1, MET, RGS5, MMP7, VEGFR, AFP, GPC3, HBVc, HBVp, CDCA, KRAS, PARP4, MLL3 и MTHFR.
ПРИМЕРЫ
Примеры, описанные в настоящем документе, не предназначены для представления того, что приведенные ниже эксперименты представляют собой все или только выполненные эксперименты. Были приложены усилия для обеспечения точности использованных чисел (например, количеств, температуры и т. п.), но следует учитывать некоторые погрешности и отклонения в экспериментах. При отсутствии особых указаний части представляют собой массовые части, молекулярная масса представляет собой средневесовую молекулярную массу, температура указана в градусах по шкале Цельсия, а давление является атмосферным или близким к атмосферному.
ПРИМЕР 1. Клиническое и механистическое исследование MASCT при лечении HCC
Введение
Гепатоцеллюлярная карцинома (HCC) является одним из видов рака с высокой смертностью и часто встречается у пациентов из Китая с хронической инфекцией вируса гепатита B (ВГВ). Хотя текущий стандарт лечения (SOC), такой как резекция, трансплантация печени, транскатетерная артериальная химиоэмболизация (TACE), может улучшать выживаемость пациентов, HCC редко излечивается и имеет высокий риск рецидивирования и метастазирования. В данном исследовании авторы изобретения применяли способ MASCT для лечения группы китайских пациентов, страдающих HCC с сопутствующей инфекцией ВГВ.
Аутологичные Т-клетки, активированные множественными опухолевыми антигенами, получали ex vivo из PBMC пациентов в соответствии с вариантом осуществления способа MASCT и вводили пациентам путем инфузии. При применении стратегии MASCT исследователи избирательно активировали и амплифицировали специфические в отношении опухолевого антигена Т-клетки из аутологичных репертуаров Т-клеток пациентов с подходящими опухолевыми антигенными пептидами. Это гарантирует, что полученные клетки будут специфически распознавать опухолевые клетки без перекрестной реактивности относительно здоровой ткани, поскольку эти Т-клетки выжили после центрального отбора в тимусе, где были удалены все сильные аутореактивные Т-клетки, которые являются вредными для хозяев. Исследователи обнаружили, что активированные Т-клетки приводили к увеличению количества HCC-специфических Т-клеток, включая как эффекторные Т-клетки, так и Т-клетки памяти in vivo, и у пациентов с HCC улучшали исход заболевания без прогрессирования.
Результаты
Производственный процесс и характеристики MASCT
Способ получения клеток для клеточной терапии MASCT показан на ФИГ. 2A. Вкратце, незрелые дендритные клетки (iDC), дифференцированные из моноцитов, выделенных из PBMC пациента, подвергали импульсному воздействию пула опухолевых антигенных пептидов, чтобы с помощью агонистов TLR получить зрелые DC (mDC). Аутологичные Т-клетки из того же источника РВМС поддерживали в цитокинах и проводили совместное культивирование с mDC, полученными, как описано выше, в течение еще 7-10 суток. Пул антигенных пептидов состоял из множества связанных с опухолью антигенов, которые были сверхэкспрессированы в раковых гепатоцитах пациентов с HCC. Некоторые из них уже использовались в клинических испытаниях (ФИГ. 2B) (1-15). Пул антигенных пептидов HCC включал десять связанных с опухолью антигенов (TAA), таких как сурвивин, NY-ESO-1, карциноэмбриональный антиген (CEA) и т. п., которые были сверхэкспрессированы в многочисленных видах опухолевых клеток, включая HCC; и два HCC-специфических антигена под названием альфа-фетопротеин (AFP) и глипикан-3 (GPC3), которые обычно экспрессируются в раковых гепатоцитах пациентов с HCC. Два из связанных с ВГВ антигенов, называемых ядерным антигеном ВГВ и ДНК-полимеразой ВГВ, также были включены в пул пептидов, поскольку в Китае у пациентов с HCC заболевание в основном коррелировало с хронической инфекцией вируса гепатита B (ВГВ). Кроме того, каждый из пептидов был синтезирован длиной 20-40 аминокислот и содержал несколько ранее идентифицированных эпитопов распознавания Т-клеток (ФИГ. 2C) для молекул HLA обоих классов: класса I и класса II. Пептиды были химически синтезированы в условиях надлежащей производственной практики (GMP).
Эксперименты показали, что пептиды эффективно интернализуются с помощью iDC и в основном локализуются в цитозоле (ФИГ. 3), что, следовательно, способствует перекрестному представлению молекулами MHC I. После стимуляции лигандами Toll-подобного рецептора (TLR) mDC продемонстрировали полные иммунные функциональные свойства, особенно в отношении высокого уровня секреции IL12 (ФИГ. 4 A-B).
После совместного культивирования пролиферация полученных Т-клеток увеличилась по меньшей мере в 45 раз, от среднего показателя 8,9×107 клеток (диапазон 5×107 ~ 1,6×108 клеток) до среднего показателя 6,2×109 клеток (диапазон 4,1×109 ~ 9×109 клеток; Фиг. 5A). Полученные клетки почти исключительно представляли собой Т-клетки CD3+ (95% ± 1%) с основным фенотипом CD3+CD8+ (70% ± 5%) и незначительной частью CD3+CD4+ (19% ± 3%) и CD3+CD56+ (14% ± 1%), но практически с отсутствием регуляторных Т-клеток CD4+CD25+Foxp3+ (Treg, 0,4% ± 0,1%) (ФИГ. 5B).
Иммунологическая функция полученных Т-клеток
Анализ подмножеств полученных Т-клеток выявил полифункциональные свойства в основном подмножестве цитотоксических Т-клеток CD3+CD8+, а также в малых подмножествах хелперных Т-клеток CD3+CD4+ и T-клеток-NK CD3+CD56+ (16), характеризующихся коэкспрессией IFNγ, TNFα и гранзима B (ФИГ. 5C, D) по сравнению с неактивированными Т-клетками, выделенными от пациентов (ФИГ. 5E). В супернатантах полученных клеток также были обнаружены провоспалительные цитокины, такие как IFNγ и TNFα, но при этом были обнаружены лишь такие иммуносупрессорные цитокины, как IL10 и IL4 (ФИГ. 6A). Другие исследователи (17, 18) и авторы настоящего изобретения обнаружили более высокую частоту экспрессии иммуноингибирующей молекулы PD-1 на поверхности подмножеств Т-клеток как CD3+CD8+, так и CD3+CD4+, полученных от пациентов с HCC, по сравнению с клетками от здоровых доноров, что позволяет предположить истощение T-клеток у пациентов с HCC (ФИГ. 6B-C). Однако этот статус иммунологической толерантности Т-клеток можно по существу обратить в обоих подмножествах, как подмножестве T-клеток CD3+CD8+ (n=7, p=0,02), так и подмножестве T-клеток CD3+CD4+ (n=7, p < 0,01), посредством стимуляции DC импульсным добавлением множества опухолевых антигенов (ФИГ. 6D-E). Кроме того, активированные Т-клетки, полученные от пациентов HLA-A2+, проявляли превосходную цитотоксическую активность в отношении клеточной линии HCC HepG2 HLA-A2+ по сравнению с клетками HLA-A2-Huh-7, что позволяет предположить ограниченное HLA уничтожение клеток. Полученные от пациентов T-клетки HLA-A2- (n=7) демонстрировали аналогичную цитотоксическую активность в отношении клеточных линий HCC HLA-A2+ и HLA-A2-, что может способствовать неспецифическому уничтожению, осуществляемому T-клетками-NK CD3+CD56+ (ФИГ. 6F).
Индуцированные MASCT антигенспецифические иммунные ответы у пациентов с HCC
Чтобы выяснить, может ли лечение MASCT привести к улучшению иммунной среды у пациентов с HCC, исследователи измеряли частоту Treg в PBMC пациентов и обнаружили существенную супрессию этих клеток после трех применений MASCT (ФИГ. 11A). Исследователи также обнаружили пролиферацию (ФИГ. 11B) и продукцию IFNγ (ФИГ. 11C) специфическими Т-клетками против опухолевых антигенов в РВМС пациентов после стимуляции пулом пептидов по сравнению со стимуляцией нерелевантными пептидами. Исследователи также наблюдали значительно усиленный ответ в РВМС пациентов с НСС (n=6) после стимуляции пулом HCC-антигенных пептидов по сравнению с РВМС, стимулированными нерелевантными пептидами (антигенспецифическая пролиферация: p=0,027; продукция антигенспецифического IFNγ: p=0,024, ФИГ. 11B и 11C). Продуцирующие IFNγ HCC-специфические Т-клетки CD8+ на своей поверхности также коэкспрессируют CD27 и CD28 (ФИГ. 11D), что позволяет предположить высокий потенциал приобретения фенотипа иммунной памяти (19, 20). Кроме того, для исследования наличия или отсутствия индуцирования или усиления пролиферации специфических для антигенов HCC Т-клеток и продукции IFNγ в ходе лечения MASCT исследователи сравнивали иммунные ответы PBMC пациентов до и после проведения 3 курсов лечения MASCT. Результаты показывают, что HCC-специфическая пролиферация T-клеток и продукция IFNγ были устойчивыми, и после многократного лечения MASCT у пациентов были обнаружены постепенно накапливающиеся иммунные ответы (ФИГ. 11E и 11F). Таким образом, у пациентов, получавших лечение MASCT, были обнаружены как супрессия Treg, так и стимуляция опухолеспецифических T-клеток, что демонстрирует улучшение иммунной среды у пациентов с HCC после лечения MASCT.
Индуцированные MASCT иммунные ответы против каждого антигенного пептида в пуле
Для дальнейшего изучения специфического ответа против каждого вида опухолевого антигенного пептида из пула после проведения многократных курсов клеточной терапии MASCT от 6 пациентов с НСС (все из них были ВГВ+) выделяли РВМС и стимулировали отдельными антигенными пептидами. Продукцию IFNγ измеряли с помощью анализа ELISPOT. Специфические ответы против опухолевых антигенных пептидов были явно повышены у всех 6 пациентов (ВГВ+), в то время как модель специфического иммунного ответа против каждого из антигенных пептидов была различной. Большинство пациентов ответили на CEA (5/6), ядерный антиген ВГВ (5/6) сурвивин (4/6), VEGFR (4/6), AFP (4/6), GPC3 (4/6) и ДНК-полимеразу ВГВ (4/6). Но на p53 (2/6), CCDN1 (2/6) и MET (1/6) ответили меньше пациентов (ФИГ. 12A), что может быть обусловлено разнообразием экспрессии антигена в опухолях и различиями в иммунной среде у разных пациентов. Однако без проведения клеточной терапии MASCT у пациентов (n=5) наблюдалось очень мало иммунных ответов против этих опухолевых антигенов (ФИГ. 12B). Кроме того, исследователи в течение длительного времени изучали динамические изменения иммунных ответов у 2 пациентов с HCC (стадией B) во время их лечения с применением клеточной терапии MASCT и обнаружили, что специфические иммунные ответы против опухолевых антигенных пептидов постепенно увеличивались, а модели иммунных ответов у 2 пациентов были разными (ФИГ. 12C, 12D). Исследователи смогли обнаружить специфические в отношении опухолевых антигенов ответы Т-клеток у пациентов более чем через 4 месяца после последнего курса лечения MASCT (данные показаны), что позволяет предположить установление долгосрочного иммунного ответа Т-клеток памяти. Как повышение уровня специфических в отношении опухолевых антигенов Т-клеток, так и снижение уровня Treg могут привести к лучшему клиническому результату для пациентов.
Промежуточный анализ клинических преимуществ MASCT
Чтобы исследовать клинические преимущества клеточной терапии MASCT, исследователи ретроспективно изучали обстоятельства прогрессирования рака у пациентов с HCC. С 2012 г. и по настоящее время у 100 пациентов была диагностирована HCC стадии В (ФИГ. 7A). Из всех пациентов дополнительно проанализировали 33 пациента, поскольку они получали постоянное лечение в течение по меньшей мере 1 года. 15 из них получали только стандартные виды лечения HCC, такие как резекция, TACE и RFA (ФИГ. 8A). Другие 16 пациентов в дополнение к стандартному лечению получали клеточную терапию MASCT. 13 пациентов из них получали повторные курсы клеточной терапии MASCT (≧ 3) каждые 1-3 месяца в комбинации со стандартными видами лечения (ФИГ. 9A); дополнительный анализ не проводили у 3 пациентов, которые проходили только один курс клеточной терапии MASCT, поскольку они не соответствовали протоколу повторных курсов лечения. Во время каждого лечения посредством инфузии вводили 2-5×107клеток/кг массы тела (или по меньшей мере 1×109 на пациента). Явной токсичности не наблюдалось. Если при проведении компьютерной томографии (КТ) обнаруживали рецидивы, рост или метастазы опухоли, пациенты оценивались как имеющие PD (прогрессирующее заболевание). Были указаны время и полученные способы лечения от постановки диагноза до прогрессирования заболевания. Если опухоли не были прогрессирующими, указывали оценку пациентов на момент времени 1 год после постановки диагноза, а также курсы лечения, полученные в течение всего 1 года. Два пациента были исключены из анализа, поскольку у одного пациента не было оценки на момент 1 год, а другой пациент не получал никакого лечения до прогрессирования заболевания. Частота прогрессирования заболевания у пациентов, которые получали множество курсов лечения клеточной терапией MASCT, значительно уменьшилась (p < 0,0001), поскольку только 1 пациент (n=13, PD: 7,69%) имел прогрессирующее заболевание (таблица 1). Исследователи также обнаружили, что у пациентов, получавших только стандартные виды лечения, средний период времени до прогрессирования заболевания был меньше (медиана: 6 месяцев), хотя среднее количество видов лечения, полученных каждым пациентом, было относительно выше (11 месяцев, таблица 1 и ФИГ. 10A). Кроме того, применение в этой когорте пациентов единственного курса клеточной терапии MASCT не смогло улучшить какой-либо исход заболевания без прогрессирования (данные не показаны), что позволяет предположить, что причина эффекта лучшего клинического результата связана с проведением множества курсов лечения посредством клеточной терапии MASCT у пациентов с HCC, так что эффект может быть связан с общим количеством активированных Т-клеток.
Таблица 1. Сравнение оценок по шкале RECIST у пациентов с гепатоцеллюлярной карциномой (стадии B) с проведением или без проведения множества курсов клеточной терапии MASCT в течение 1 года после постановки диагноза
n=13
n=15
Полный ответ (CR)
Частичный ответ (PR)
1 (7,7)
1 (7,7)
1 (6,7)
0 (Н/П)
Н/П: не применимо; Н/И: не испытывали; a: анализ с помощью точного критерия Фишера (2-сторонний); b: анализ с помощью критерия хи-квадрат по Пирсону (2-сторонний)
Данное исследование впервые продемонстрировало, что специфические ответы Т-клеток против опухолевых антигенов можно устойчиво повысить in vivo, это позволяет предположить, что клеточная терапия MASCT представляет собой безопасную и целесообразную иммунотерапию, улучшающую иммунологическую функцию и клинический исход пациентов с HCC.
Второй анализ клинических преимуществ MASCT
Исследователи ретроспективно изучили показатель контроля заболевания (DCR) у пациентов с HCC стадии B, которым был поставлен диагноз после 2012 г. и которые непрерывно получали лечение (с применением MASCT или без него) и в течение периода, превышающего один год, регулярно проходили последующее наблюдение (Фиг. 7B и таблица 2). После анализа медицинских карт исследователи обнаружили, что семнадцать пациентов получали стандартные виды лечения (группа Con), такие как резекция, TACE и RFA (радиочастотная абляция) (ФИГ. 8B). В то же время пятнадцать пациентов каждые 2-3 месяца повторно получали лечение MASCT (≥ 3) в дополнение к стандартным видам лечения (группа Con+MASCT, ФИГ. 9B). Этим 15 пациентам исследователи проводили общие анализы крови и биохимические исследования крови до и после лечения. При этом не были зарегистрированы кожная сыпь, утомляемость, лихорадка, диарея, анемия, тромбоцитопения или другие серьезные побочные эффекты, что указывает на хорошую переносимость MASCT. Через один год после постановки диагноза показатель DCR в группе Con+MASCT составлял 80% (12 из 15), включая 4 пациентов с общими ответами (1 пациент с CR и 3 пациента с PR) и 8 пациентов со стабильным заболеванием (SD). Этот показатель DCR был значительно лучше (р < 0,0001), чем показатель DCR в группе Con (17,65%), в которой только у 3 из 17 пациентов наблюдалось контролируемое заболевание (таблица 2 и Фиг.9B). Кроме того, исследователи сравнивали медианное время до прогрессирования заболевания в обеих группах у пациентов, которым дали оценку PD, и обнаружили, что для пациентов из группы Con+MASCT (11 месяцев) время было большим, чем в группе Con (6 месяцев). Среднее количество стандартных видов лечения, полученных каждым пациентом из группы Con+MASCT, составило 2,6 (ФИГ. 10B) в сравнении со средним количеством для группы Con, которое составило 3,71. Эти данные явно показали, что лечение MASCT обеспечивает клинические преимущества пациентам с HCC стадии В.
Таблица 2. Сравнение показателя контроля заболевания (DCR) у пациентов с HCC стадии B, получавших стандартные виды лечения в комбинации с множеством курсов клеточной терапии MASCT (Group Con+MASCT) или без такой комбинации (Group Con) в течение 1 года после постановки диагноза.
(n=15):
(n=17):
· Полный ответ (CR)
· Частичный ответ (PR)
1 (6,67%)
3 (20%)
1 (5,88%)
0
0,726a
0,092a
a: анализ с помощью точного критерия Фишера (2-сторонний); b: анализ с помощью критерия хи-квадрат по Пирсону (2-сторонний)
Материалы и способы
Пациенты
Пациенты с HCC из отделения заболеваний печени больницы Nanfang Hospital медицинского университета Southern Medical University, которые получали клеточную терапию MASCT, перед лечением должны были подписать информированное согласие пациентов. Всем этим пациентам каждые 1-3 месяца вводили путем инфузии полученные Т-клетки в дозе 5-10×107 клеток/кг массы тела. Критерии пригодности для участия в исследовании включали: возраст от 25 до 80 лет, оценку общего состояния по шкале Восточной кооперативной онкологической группы (ECOG) не более 2, ожидаемую продолжительность жизни более 3 месяцев и отсутствие серьезных сердечно-сосудистых заболеваний, аутоиммунных заболеваний или беременности.
Дизайн исследования для промежуточного анализа
Проанализировали медицинские карты пациентов с HCC из компьютеризированной базы данных отделения заболеваний печени больницы Nanfang Hospital медицинского университета Southern Medical University. В этой базе данных регистрировалась информация о клинической патологии у этих пациентов, включающая данные о возрасте, поле, характеристиках опухоли, стадии BCLC, лечении и исходе. После 2012 г. у 100 пациентов в отделении была диагностирована HCC стадии В. 33 пациента из них были включены в это исследование, поскольку они постоянно проходили лечение в отделении по меньшей мере в течение 1 года. Для 3 из этих пациентов, которые проходили только один курс клеточной терапии MASCT, не проводили дополнительный анализ, поскольку они не соответствовали протоколу повторных курсов лечения. Остальных пациентов (n=30) распределяли в одну из двух групп лечения в соответствии с предпочтениями пациентов: пациенты в группе 1 получали только стандартную терапию, в то время как пациенты в группе 2 получали стандартное лечение в комбинации с множеством курсов клеточной терапии MASCT. Один пациент в группе 1 (n=13) был исключен из исследования, поскольку у этого пациента не было оценки в момент времени 1 год. Другой пациент в группе 2 (n=15) был исключен из исследования, поскольку он не получал никакого лечения до прогрессирования заболевания. Характеристики пациентов в этих двух группах показаны на ФИГ. 8A и ФИГ. 9A. Первичной конечной точкой было исследование доли пациентов с прогрессирующим заболеванием (PD) через один год и время до PD. Это исследование было одобрено Этическим комитетом больницы Nanfang Hospital медицинского университета Southern Medical University.
Конечная точка безопасности в промежуточном анализе
Для 15 пациентов, которые проходили множество курсов клеточной терапии MASCT, исследователи проводили общие анализы крови и биохимические исследования крови до и после лечения посредством клеточной терапии MASCT соответственно. Не было обнаружено существенной разницы для показателей, связанных с воспалением, таких как количество лейкоцитов, количество нейтрофилов и количество лимфоцитов. Кроме того, не было обнаружено явного разнообразия показателей функции печени, таких как АСТ, АЛТ и общий билирубин. Кроме того, не наблюдалось кожной сыпи, утомляемости, лихорадки, диареи, анемии и тромбоцитопении.
Второй ретроспективный анализ
Во время второго ретроспективного анализа использовали медицинские карты пациентов из компьютеризированной базы данных Центра заболеваний печени больницы Nanfang Hospital медицинского университета Southern Medical University. В этой базе данных регистрировалась информация о клинической патологии у всех пациентов, включающая данные о возрасте, поле, характеристиках опухоли, стадии, лечении и оценке по шкале RECIST. Исследователи проанализировали показатель DCR у пациентов, которым после 2012 г. был поставлен диагноз HCC стадии B и по отношению к которым проводили непрерывное лечение и регулярное наблюдение в этом центре по меньшей мере в течение одного года (ФИГ. 7B). В общей сложности критериям соответствовали 53 пациента. 17 пациентов из них получали лечение SOC, но не MASCT, и они были распределены в группу Con. Другие 36 пациентов с HCC стадии B в дополнение к стандартным видам лечения получали MASCT. Однако 21 пациент из них был исключен, поскольку пациенты не закончили требования повторных курсов лечения (≥ 3) MASCT в течение одного года. Оставшиеся 15 пациентов были распределены в группу Con+MASCT. Характеристики пациентов в этих двух группах показаны на ФИГ. 8B и 9B. В соответствии со шкалой Критериев оценки ответа солидных опухолей на терапию (RECIST вер. 1.1) и результатами компьютерной томографии (КТ) пациентов определяли как имеющих полный ответ (CR), частичный ответ (PR), стабильное заболевание (SD) или прогрессирующее заболевание (PD). Первичная цель заключалась в том, чтобы исследовать показатель контроля заболевания пациентов с HCC стадии B через год после постановки диагноза. Это исследование было одобрено Этическим комитетом больницы Nanfang Hospital медицинского университета Southern Medical University.
Получение клеток
Мононуклеарные клетки периферической крови (PBMC) от пациентов с HCC получали посредством центрифугирования в градиенте плотности на центрифуге Lymphoprep (Nycomed Pharma, г. Осло, Норвегия). Адгезивные моноциты продолжали культивировать в среде AIM-V с добавлением 1000 Е/мл GM-CSF и 500 Е/мл IL-4 для дифференциации в незрелые дендритные клетки (DC). Полученные незрелые DC обрабатывали импульсным добавлением пула множественных опухолевых антигенных пептидов (1 мкг/мл/пептид) и затем агонистами TLR для дифференциации в зрелые DC. В то же время неадгезивные PBMC поддерживали в среде AIM-V с добавлением антитела к CD3 (eBioscience, г. Сан-Диего, штат Калифорния) и интерлейкина-2 (rIL-2; R&D Systems, г. Миннеаполис, штат Миннесота), после чего совместно культивировали со зрелыми DC в течение 7-14 суток (например, в течение 7-10 суток или 9-13 суток) в присутствии цитокинов. Пациентам каждые 1-3 месяца вводили инфузии полученных Т-клеток в дозе 5-10×107 клеток/кг массы тела.
Иммунофлуоресцентный анализ
Дендритные клетки (DC) культивировали в системе Chamber slides (Thermo Scientific, США) и обрабатывали импульсным добавлением меченных FITC пептидов с инкапсулированием в липосомах или без. Через 2 ч DC метили DAPI (Molecular Probes) и LYSOTRACKER™(Molecular Probes) для идентификации ядер и лизосом соответственно. Флуоресцентные изображения регистрировали с помощью конфокальной лазерной сканирующей микроскопии (TCS SP5II, Leica, Ernst-Leitz-Strasse, Германия).
Проточная цитометрия
Антитела для окрашивания поверхности клетки приобретали в компании BD Biosciences (антитела к человеческим CD3-PE, CD3-FITC, CD8-PerCP, CD8-APC, CD56-PE, NKG2D-APC, CD4-FITC, CD4-PerCP, CD107a-FITC, CD25-APC, CD45RO-FITC, CD27-PerCPCY5.5, CD57-APC, CCR7-PE, PD-1-PE). Антитела для окрашивания поверхности моноцитов и дендритных клеток также приобретали в компании BD Biosciences (антитела к человеческим CD14-APC, CD80-PE, CD83-APC, CD86-FITC, HLA-DR-FITC). Антитела для внутриклеточного окрашивания цитокинов приобретали в компании BD Biosciences (антитела к человеческим IFN-γ-APC, TNF-α-PECY7, гранзиму B-FITC, FoxP3-PE). Внутриклеточное окрашивание цитокинов осуществляли путем фиксации и пермеабилизации клеток цитофиксом/цитопермом (BD Biosciences). Проточную цитометрию выполняли с использованием проточных цитометров FACS CantoII (BD Biosciences), а данные анализировали с помощью программного обеспечения Flowjo.
ELISA для обнаружения цитокинов
Супернатанты зрелых DC или культивированных Т-клеток центрифугировали для удаления остатков клеток в виде частиц и хранили до использования при -80 °C. Уровни IL-12p70 и IL-10 измеряли с использованием специфических наборов для ELISA (eBioscience) в соответствии с протоколами производителя. Обнаружение IFN-γ, TNF-α и IL-4 проводили посредством мультиплексных иммуноанализов Procarta Plex Multiplex Immunoassays (Affymetrix).
Исследования на функциональность и цитотоксичность
Клетки HepG2 или Huh7 культивировали в модифицированной по способу Дульбекко среде Игла (DMEM) с добавлением 10% инактивированной эмбриональной бычьей сыворотки, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина, глутамакса, MEM NEAA, (Gibico, г. Карлсбад, штат Калифорния). Анализ на цитотоксичность проводили так, как описано в руководстве производителя. Клетки HepG2 или Huh7 промывали D-PBS (Invitrogen) и совместно культивировали с эффекторными Т-клетками пациента на эффекторной мишени (E: T) при соотношении 40: 1 в 96-луночных круглодонных планшетах в трех повторах в среде AIM-V в течение 4 часов. Цитотоксичность наблюдали в виде доли максимального высвобожденного после лизиса LDH и измеряли с помощью набора для анализа Cytotox 96 (Promega G1780, Канада).
Анализ пролиферации и продукции IFNγ антигенспецифическими T-клетками
PBMC, полученные от пациентов, высевали (1×106 клеток/лунка) в среду AIM-V, содержащую 50 Е/мл IL-2, и стимулировали пулом пептидов в концентрации 10 мкг/мл в течение 3 суток. Для определения процента пролиферирующих специфических Т-клеток проводили анализ FACS, как описано в инструкции к набору для анализа проточной цитометрии Click-iT EdU Alexa Fluor 488 Flow Cytometry Assay Kit (Invitrogen). Продукцию IFNγ специфическими T-клетками также обнаруживали посредством внутриклеточного окрашивания цитокинов и анализа FACS. PBMC, инкубированные с 10 мкг/мл нерелевантного пептида, использовали в качестве отрицательных контролей. Результаты представлены в виде показателя кратности, рассчитанного по соотношению группа специфических пептидов: группа нерелевантных пептидов.
Анализ ELISPOT
PBMC, полученные от пациентов, высевали (1×106 клеток/лунка) в среду AIM-V без цитокинов в планшет для культивирования клеток и дополнительно стимулировали нерелевантными пептидами, пулом антигенных пептидов MASCT и отдельными антигенными пептидами соответственно в течение 48 ч. После этого PBMC переносили в 96-луночный планшет для проведения анализа ELISPOT (U-CyTech Biosciences) для обнаружения IFNγ. PBMC дополнительно стимулировали пептидами в течение еще 16 ч. Анализ ELISPOT выполняли в соответствии с инструкциями производителя. Количество пятнообразующих единиц определяли с помощью компьютерного программного обеспечения для анализа изображений (ChampSpot; Saizhi). Ответы показаны как пятнообразующие единицы на 105 PBMC/клетка. Результаты были показаны в виде показателя кратности продукции IFNγ, рассчитанного по соотношению стимуляции специфическими пептидами к стимуляции нерелевантными пептидами.
Обсуждение
В последнее время адоптивная клеточная терапия (ACT) была хорошо принята в качестве эффективной альтернативной терапии для лечения онкологических пациентов, особенно тех, по отношению к которым неэффективными оказались стандартные виды противоракового лечения, такие как хирургическое вмешательство, лучевая терапия и химиотерапия. Хотя опухолеспецифические TIL успешно применяли для лечения пациентов с метастатической меланомой с более чем 50% общих ответов [21], а T-клетки, модифицированные химерным антигенным рецептором (CAR) антитела к CD19, показали исключительные клинические преимущества как при хроническом лимфолейкозе (CLL), так и при остром лимфолейкозе (ALL) [22, 23], ACT с использованием опухолеспецифических Т-клеток по-прежнему сталкивается с серьезными проблемами. В среде опухоли на опухолевые клетки, которые экспрессируют и представляют на своей поверхности конкретный опухолевый антиген, могут оказывать целевое воздействие инфильтрирующие опухоль Т-клетки, которые специфически распознают эпитопы конкретного опухолевого антигена. После распознавания Т-клетки высвобождают цитотоксические факторы для лизиса опухолевых клеток, такие как перфорин и гранзим В, а также функциональные цитокины, такие как IFNγ и TNFα. Однако у онкологических пациентов высока вероятность того, что этот механизм иммунного надзора не будет работать. Этому нарушению может способствовать большое количество ингибиторных клеток, таких как Treg, отсутствие опухолеспецифических TIL и потеря экспрессии опухолевых антигенов в опухолевых клетках.
В настоящем документе авторы изобретения представили новую и целесообразную стратегию, MASCT, осуществляемую посредством получения ex vivo из PBMC пациентов активированных множеством опухолевых антигенов Т-лимфоцитов. В стратегии MASCT авторы настоящего изобретения использовали длинные антигенные пептиды вместо белка опухолевого антигена или лизата опухоли. Авторы настоящего изобретения продемонстрировали, что одновременная стимуляция Т-клеток множеством эпитопов опухолевых антигенов может эффективнее предотвращать ускользание опухолевых клеток от иммунного ответа, вызванное потерей экспрессии определенного опухолевого антигена. В этом исследовании у разных пациентов с HCC после множества курсов лечения MASCT наблюдались различные модели специфических Т-клеточных ответов против каждого вида опухолевых антигенов. Это может быть связано с многообразием экспрессии и представления антигена, а также с изменчивостью микроокружения опухоли. Это явление также указывает на необходимость использования множества антигенов для нацеливания на опухолевые клетки вместо использования одного опухолевого антигена. Кроме того, каждый опухолевый антигенный пептид был сконструирован таким образом, чтобы содержать 20-40 аминокислот, что позволяет представлять на DC пациентов с различными видами подтипов HLA как молекулы HLA класса I, так и молекулы HLA класса II. Действительно, авторы настоящего изобретения наблюдали специфические иммунные ответы против опухолевых антигенов у разных пациентов с НСС как при проведении анализа пролиферации Т-клеток, так и в анализе стимуляции IFNγ, а также уменьшение Treg в PBMC пациентов после множества курсов лечения MASCT. И эти иммунные ответы постепенно усиливались во время проведения множества курсов лечения MASCT, что указывает на то, что повторное лечение может коррелировать с лучшим клиническим результатом.
Сообщается, что 240 миллионов человек во всем мире (включая одну десятую населения в Китае) хронически инфицированы ВГВ, что подвергает их высокому риску развития HCC в дальнейшем на протяжении жизни. HCC в Китае является видом рака с высокой заболеваемостью и смертностью, для терапии которого существует несколько эффективных стандартных видов лечения. Пытаясь решить эту проблему, авторы изобретения применяли MASCT у пациентов с HCC, чтобы стимулировать специфические Т-клеточные ответы против опухолевых антигенов и связанных с ВГВ антигенов, с намерением улучшить клинический исход у пациентов путем применения комбинированного лечения MASCT и стандартной терапии. С помощью ретроспективного анализа авторы изобретения исследовали клинические эффекты после прохождения множества курсов лечения MASCT у пациентов с HCC стадии B. Показатель DCR за один год значительно повысился в группе пациентов, получавших лечение MASCT каждые 2-3 месяца в сочетании со стандартной терапией (группа Con+MASCT), по сравнению с контрольной группой (80% в сравнении с 17,65%). Авторы настоящего изобретения проводили дополнительный анализ показателя DCR через два года после постановки диагноза 12 пациентам из группы Con+MASCT, которые в течение первого года продемонстрировали контроль заболевания. За исключением двух пациентов, продолжительность заболевания у которых составляла менее двух лет, 9 из 10 пациентов все еще демонстрировали контроль заболевания (данные не показаны).
Это исследование впервые продемонстрировало, что специфические ответы Т-клеток против опухолевых антигенов могут быть сильно индуцированы и увеличены in vivo с помощью MASCT и что лечение MASCT у пациентов с HCC является хорошо переносимой иммунотерапией для улучшения как иммунологической функции, так и контроля заболевания. Тот же принцип и методология применяются для продолжающегося перспективного и рандомизированного клинического исследования, проводимого у пациентов с НСС (NCT02026362), и в настоящее время также применяются для изучения других опухолей. Кроме того, авторы настоящего изобретения предполагают, что лечение MASCT можно комбинировать с терапией блокирования иммунной контрольной точки, такой как антитело к PD1, с учетом того факта, что терапия антителом против PD1 обеспечивает клинические преимущества в среднем только у 20% пациентов с различными видами рака. Считается, что 80% пациентов, не ответивших на терапию, не имеют достаточного количества ранее существовавших опухолеспецифических Т-клеток, которые могут быть восстановлены при лечении MASCT.
Список литературы
1.A. J. Gehring et al., Gastroenterology 137, 682 (2009).
2.E. Mizukoshi et al., Hepatology 43, 1284 (2006).
3.V. R. Cicinnati et al., Int J Cancer 119, 2851 (2006).
4.S. Idenoue et al., Clin Cancer Res 11, 1474 (2005).
5.T. Ito et al., Hepatology 31, 1080 (2000).
6.J. L. Chen et al., J Immunol 165, 948 (2000).
7.J. L. Marshall et al., J Clin Oncol 23, 720 (2005).
8.S. Walter et al., Nat Med 18, 1254 (2012).
9.N. Nishida et al., Cancer Res 54, 3107 (1994).
10.K. Schag et al., Clin Cancer Res 10, 3658 (2004).
11.C. N. Boss et al., Clin Cancer Res 13, 3347 (2007).
12.H. Suzuki et al., J Transl Med 11, 97 (2013).
13.L. H. Butterfield et al., Clin Cancer Res 12, 2817 (2006).
14.H. Komori et al., Clin Cancer Res 12, 2689 (2006).
15.A. J. Gehring et al., J Hepatol 55, 103 (2011).
16.J. Yuan et al., Proc Natl Acad Sci U S A 105, 20410 (2008).
17.B. Martin et al., J Hepatol (2014).
18.A. Schurich et al., Hepatology 53, 1494 (2011).
19.A. G. Chapuis et al., Proc Natl Acad Sci U S A 109, 4592 (20 марта 2012 г.).
20.D. J. Powell, Jr., M. E. Dudley, P. F. Robbins, S. A. Rosenberg, Blood 105, 241 (2005).
21. Restifo NP, Dudley ME, Rosenberg SA. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews Immunology 2012;12:269-281.
22. Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med 2011;365:725-733.
23. Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med 2013;368:1509-1518.
ПРИМЕР 2. Разбор конкретного случая у пациента с метастатическим раком шейки матки, которого лечили посредством MASCT и клонирования опухолеспецифических Т-клеточных рецепторов
Рак шейки матки является второй по частоте гинекологической злокачественной опухолью и часто встречается у пациентов с инфекцией вируса папилломы человека (ВПЧ). Эффективное лечение рака шейки матки (включая хирургическое вмешательство и сопутствующую химиолучевую терапию) может привести к излечению у 80% женщин с ранней стадией заболевания (стадия I-II). Однако сосудистая инвазия, неполная лимфаденэктомия являются наиболее распространенными факторами, прогнозирующими на ранних стадиях рака шейки матки неблагоприятный прогноз. Пациенты с сосудистой инвазией, подтвержденной при исследовании патологических образцов, более склонны к развитию метастатического заболевания вскоре после хирургического вмешательства. В настоящем документе авторы изобретения представляют иммунотерапию под названием MASCT (множественная антигенстимулирующая клеточная терапия) для лечения пациентов с метастатическим раком шейки матки ВПЧ+ дендритными клетками (DC), подвергнутыми импульсному воздействию множества опухолевых антигенов, и T-лимфоцитами, стимулированными этими DC.
У пациента WJ женского пола в возрасте 41 год был диагностирован рак шейки матки с сосудистой инвазией, и в анализе было выявлено наличие ДНК вируса папилломы человека (ВПЧ). Ему проводили радикальную резекцию и пятимесячную химиолучевую терапию. Для пациента выполняли второй тест на ДНК ВПЧ и получили отрицательный результат ДНК ВПЧ в сыворотке крови.
Приблизительно через два года после радикальной резекции и химиолучевой терапии пациенту был поставлен диагноз метастазирования опухоли в правую крестцово-подвздошную кость по результатам магнитно-резонансной томографии (МРТ) и эмиссионной компьютерной томографии (ЭКТ) (ФИГ. 13A). После этого пациент получал десять процедур локальной лучевой терапии, после чего проводили три курса MASCT (введение осуществляли один раз в месяц). При лечении MASCT применяли PBMC из собственной периферической крови пациента для получения дендритных клеток, которые подвергали импульсному воздействию пула из 18 антигенных пептидов, включая основную группу из 12 связанных с опухолью антигенных пептидов, а также группу из 6 антигенных пептидов, специфических в отношении рака шейки матки, полученных из вирусных белков ВПЧ. Вкратце, моноциты из PBMC пациента дифференцировали в незрелые DC и затем подвергали импульсному воздействию множества синтетических пептидных антигенов, включая связанные с опухолью антигены и антигены ВПЧ. Полузрелые DC дополнительно стимулировали лигандами TLR для дифференциации в зрелые DC (mDC). Половину mDC вводили пациенту посредством подкожной инъекции. Поддерживающие Т-клетки получали посредством культивирования неадгезивных PBMC с антителом к CD3 (например, OKT3) и IL2. Другую половину mDC совместно культивировали с поддерживающими Т-клетками в течение еще 7-9 суток перед инфузией. У пациента было подтверждено наличие серотипа HLA-A2 (HLA-A0201+).
После трех курсов MASCT результаты ЭКТ пациента показали, что метастаз в правой крестцово-подвздошной кости уменьшился, и при этом не было обнаружено новых метастазов (ФИГ. 13B), что указывает на положительный результат лечения MASCT. Пациент получил четыре дополнительных курса лечения MASCT с интервалом приблизительно 1 месяц или 2 месяца. После проведения в общей сложности 6 курсов лечения MASCT от пациента получали образец PBMC и исследовали его с помощью анализа ELISPOT, чтобы определить, имел ли пациент терапевтически эффективный ограниченный МНС Т-клеточный ответ на пул антигенных пептидов и каждый из антигенных пептидов в пределах пула. Результаты анализа ELISPOT (ФИГ. 13E) продемонстрировали усиленный Т-клеточный ответ на пул антигенных пептидов рака шейки матки и отдельные антигенные пептиды как в пределах основной группы опухолеспецифических антигенных пептидов (таких как hTERT, р53, СЕА и RGS5), так и группы специфических для рака шейки матки опухолевых антигенных пептидов (таких как HPV-3 и HPV-5). ЭКТ пациента после проведения в общем 7 курсов MASCT показала дальнейшее уменьшение метастаза в правой крестцово-подвздошной кости и отсутствие новых очагов метастазирования (ФИГ. 13C). Это указывает на то, что схема лечения MASCT была успешной для снижения опухолевой нагрузки у пациента и для предотвращения прогрессирования опухоли и дальнейшего метастазирования.
На основании специфического иммунного ответа пациента пул антигенных пептидов адаптировали для обеспечения специфического для пациента пула антигенных пептидов посредством сохранения реактивных пептидов, которые индуцировали специфические ответы, и удаления нереактивных пептидов, которые не индуцировали специфические ответы. Пациент дополнительно проходил 3 цикла MASCT с использованием пула специфических для пациента антигенных пептидов (в настоящем документе употребляется название «точная MASCT»). После трех курсов точной MASCT результаты ЭКТ пациента показали отсутствие развития метастаза в правой крестцово-подвздошной кости, и при этом не было обнаружено новых очагов метастазирования (ФИГ. 13D). Пациент оценивался как имеющий стабильное заболевание (SD). Как показано посредством анализа ELISPOT, специфический для пациента пул антигенных пептидов дополнительно усиливал специфические ответы (ФИГ. 13F). В частности, несколько пептидов hTERT, пептид p53-1, пептиды CEA и пептид RGS5 обеспечивали наиболее сильный специфический ответ. Авторы настоящего изобретения в настоящее время работают над процедурой клонирования CEA и теломеразоспецифичных TCR от этого пациента.
Пул антигенных пептидов дополнительно корректировали на основании специфического иммунного ответа пациента, и пациенту проводили лечение 2 курсом точной MASCT, используя дополнительно скорректированный пул антигенных пептидов.
Краткое описание истории лечения пациента показано на ФИГ. 14.
В данном исследовании терапия MASCT представлена как безопасное лечение, которое уменьшило метастазирование у пациента с раком шейки матки. Специфические в отношении опухолевых антигенов Т-клеточные ответы можно устойчиво повысить у пациентов с раком шейки матки после лечения MASCT и еще больше повысить после отбора специфичных для пациентов антигенов. Кроме того, это исследование обеспечивает многообещающий способ клонирования опухолеспецифических TCR от онкологических пациентов, которые продемонстрировали повышенные иммунологические ответы, а также клинические преимущества после иммунотерапии специфическими в отношении пациента антигенами.
ПРИМЕР 3. Краткое описание протокола клинического исследования MASCT фазы 1/2
Клиническое исследование MASCT фазы 1/2 под названием «Специфичная к нескольким антигенам клеточная терапия (MASCT) у пациентов с гепатоцеллюлярной карциномой (HCC) после радикальной резекции или радиочастотной абляции (RFA)» стартовало в июле 2013 г. и зарегистрировано в онлайн-базе данных ClinicalTrials.gov с идентификатором NCT02026362. Описание некоторых аспектов исследования, которые включены в настоящий документ посредством ссылки, можно найти по адресу в Интернете https://clinicaltrials.gov/ct2/show/NCT02026362. Это клиническое исследование продолжается.
Исследование MASCT фазы 1/2 представляет собой рандомизированное 1: 1 открытое многоцентровое исследование, цель которого заключается в исследовании безопасности и эффективности варианта осуществления способа MASCT при лечении пациентов с гепатоцеллюлярной карциномой (HCC), по отношению к которым ранее в качестве терапии против HCC выполняли радикальную резекцию, такую как хирургическая резекция или RFA. Исследование проводится во множестве исследовательских центров в Китае, включая больницу Nanfang Hospital медицинского университета Southern Medical University (г. Гуанчжоу, КНР), больницу Third Affiliated Hospital университета Sun Yat-Sen University (г. Гуанчжоу, КНР), онкологический центр университета Sun Yat-Sen University (г. Гуанчжоу, КНР), больницу PLA 302 Hospital of China (г. Пекин, КНР) и онкологическую больницу Fujian Cancer Hospital (г. Фучжоу, КНР). Пациентов случайным образом стратифицируют в контрольную группу и группу исследования (соотношение количества пациентов в двух группах составляет 1: 1) на основании стандартных факторов прогноза, таких как возраст, пол, предыдущая схема лечения и клинический статус. Пациенты в контрольной группе получают стандартное лечение (SOC) в соответствии с существующей медицинской практикой, включая проведение защитного лечения печени и антивирусной терапии против вируса гепатита B (ВГВ) с использованием лекарственных средств, которые являются нуклеозидными аналогами. В Китае HCC в значительной степени связана с инфекцией ВГВ. Пациенты в группе исследования получают такое же лечение SOC, а также лечение MASCT, которое включает введение дендритных клеток, загруженных в общей сложности 14 антигенами, включая hTERT, сурвивин, p53 и CEA, и активированных Т-клеток, индуцированных дендритными клетками. Лечение MASCT повторяют каждые три недели в общей сложности три раза. Каждый пациент в двух группах исследования будет получать лечение в течение приблизительно 9 недель, если у пациента не разовьется прогрессирование заболевания или неприемлемая токсичность. Если через 9 недель у пациента не возникнет прогрессирования заболевания, по усмотрению исследователя лечение может быть продолжено. Пациенты будут находиться под наблюдением в течение приблизительно 2,5 лет, или до наступления смерти, или до прогрессирования заболевания у всех пациентов, в зависимости от того, что произойдет раньше.
Планируется, что в исследование будут включены, получат лечение и пройдут оценку приблизительно 100 пациентов. Для включения в исследование пациенты должны соответствовать всем перечисленным ниже критериям.
1. Пациенту поставлен диагноз гепатоцеллюлярной карциномы (HCC).
2. Пациенту проведена радикальная операция по поводу НСС в пределах 8 недель до регистрации для участия в исследовании.
3. Количество новообразований не превышает 2.
4. Отсутствует раковая эмболия в основной воротной вене, первой ветви печеночного протока, первой ветви печеночной вены или нижней полой вене.
5. Отсутствуют метастазы в портальных лимфатических узлах.
6. Отсутствуют внепеченочные метастазы.
7. Была проведена полная резекция опухоли, при этом на границах хирургического иссечения нет остаточной опухоли, что подтверждается усиленной КТ или МРТ в пределах 4 недель (включая 4 недели) после радикальной операции.
8. Если перед радикальной операцией у пациента было обнаружено повышение уровня альфа-фетопротеина (AFP) в сыворотке, необходимо, чтобы в течение 8 недель уровень AFP вернулся к нормальным показателям.
9. Оценка по шкале Чайлд-Пью составляет ≤ 9.
10. Оценка общего состояния пациента по шкале ECOG (ECOG-PS) составляет ≤ 2.
11. Ожидаемое время выживания составляет более 2 лет.
12. Анализы крови, печеночные и почечные пробы отвечают следующим критериям:
a. лейкоциты > 3 × 109/л;
b. количество нейтрофилов > 1,5 × 109/л;
c. уровень гемоглобина ≥ 85 г/л;
d. количество тромбоцитов ≥ 50 × 109/л;
e. протромбиновое время (ПВ) в пределах нормальных показателей, или время продления ≺ 3 с;
f. азот мочевины крови превышает верхнюю границу нормальных показателей не более чем в 1,5 раза;
g. креатинин в сыворотке превышает верхнюю границу нормальных показателей не более чем в 1,5 раза.
13. Согласие пациента получено и подписано в соответствии с требованиями, предъявляемыми местным институционным и/или университетским Комитетом по проведению экспериментов с участием людей, и/или центральным Экспертным советом организации (IRB), или другими соответствующими организациями.
Пациенты, соответствующие любому из перечисленных ниже критериев, не имеют права на участие в исследовании.
1. Беременные или кормящие женщины или женщины, планирующие беременность в пределах 2 лет.
2. Наличие внепеченочных метастазов или остаточной опухоли в печени.
3. Наличие раковой эмболии в основной воротной вене, первой ветви печеночного протока, первой ветви печеночной вены или нижней полой вене.
4. За 6 месяцев до регистрации для участия в исследовании: длительность системного и непрерывного применения иммуномодуляторов (таких как интерферон, тимозин, традиционная китайская медицина) составляла более 3 месяцев.
5. За 6 месяцев до регистрации для участия в исследовании: длительность системного и непрерывного применения иммуносупрессорных лекарственных средств (таких как кортикостероидные лекарственные средства) превышала 1 месяц.
6. Получение какой-либо клеточной терапии (включая NK, CIK, DC, CTL, терапию стволовыми клетками) в пределах 6 месяцев до регистрации для участия в исследовании.
7. Положительный анализ на антитела к HIV или HCV.
8. Наличие в анамнезе иммунодефицитных или аутоиммунных заболеваний (таких как ревматоидный артрит, болезнь Бюргера, рассеянный склероз или диабет 1 типа).
9. Пациенты, которые имели другие злокачественные опухоли в пределах 5 лет до регистрации для участия в исследовании (кроме рака кожи, локализованного рака предстательной железы или рака шейки матки).
10. Пациенты с органной недостаточностью.
11. Пациенты с серьезными психическими заболеваниями.
12. Наркотическая зависимость в пределах 1 года до регистрации для участия в исследовании, включая алкоголизм.
13. Участие в других клинических исследованиях в пределах 3 месяцев до скрининга.
14. Другие причины, которые исследователи считают неприемлемыми для участия в исследовании.
Основная цель исследования заключалась в том, чтобы продемонстрировать превосходство применения лечения MASCT+SOC над применением только основного лечения в отношении: (1) числа пациентов с рецидивом или метастазированием опухоли в пределах 2 лет в качестве показателя эффективности; (2) времени от хирургического вмешательства до рецидива или метастазирования опухоли в пределах 2 лет в качестве показателя эффективности; (3) числа пациентов, имеющих неблагоприятные явления в пределах 2 лет в качестве показателя эффективности. Вторичная цель исследования заключается в том, чтобы сравнить применение MASCT и основного лечения с применением только основного лечения относительно их влияния на: (1) маркеры ВГВ, включая HBeAg; (2) нагрузку ДНК ВГВ в сыворотке; и (3) качество жизни пациентов. Будут сравниваться дополнительные клинические конечные точки, такие как показатель общего ответа (RR), полный ответ (CR), частичный ответ (PR) и показатель стабильного заболевания (SDR) в двух группах пациентов. Ответ и прогрессирование опухоли будут оцениваться с использованием критериев RECIST (вер. 1.1). Безопасность будет оцениваться на основании жизненно важных признаков, результатов лабораторных исследований и неблагоприятных явлений, оцененных в соответствии с критериями NCI CTCAE версии 4.02 от 15 октября 2009 г.
Другие клинические исследования, изучающие клиническую эффективность и токсичность вариантов осуществления способа MASCT, аналогичные клиническому исследованию лечения MASCT при HCC фазы 1/2, будут проводиться для лечения пациентов, страдающих раком печени, раком легких, раком толстой кишки, раком шейки матки, лимфомой, раком почки, раком молочной железы, раком поджелудочной железы, раком желудка, раком пищевода, раком яичников и раком головного мозга.
ПРИМЕР 4. Протоколы активации T-клеток
В этом примере сравниваются специфичность и функция in vitro цитотоксических Т-клеток, полученных с использованием различных примеров протоколов активации T-клеток, включающих различную продолжительность и циклы совместного культивирования T-клеток и наличие либо отсутствие ингибитора иммунной контрольной точки, такого как моноклональные антитела к PD-1, во время совместного культивирования.
Применение антитела к PD-1
На ФИГ. 15 показана схема проведения эксперимента по получению активированных Т-клеток. Мононуклеарные клетки периферической крови (PBMC) от пациентов с HCC и с наличием ВГВ получали посредством центрифугирования в градиенте плотности на центрифуге Lymphoprep (Nycomed Pharma, г. Осло, Норвегия) на 0 сутки. Адгезивные моноциты продолжали культивировать в среде AIM-V с добавлением 1000 Е/мл GM-CSF и 500 Е/мл IL-4 для дифференциации в незрелые дендритные клетки (DC). Незрелые DC обрабатывали импульсным добавлением пептида ядерного антигена ВГВ (5 мкг/мл) и также агонистов TLR для дифференциации в зрелые DC. Фракцию РВМС также подвергали импульсному воздействию того же антигенного пептида и фиксировали. В то же время неадгезивные PBMC поддерживали в среде AIM-V с добавлением антитела к CD3 (eBioscience, г. Сан-Диего, штат Калифорния) и интерлейкина-2 (rIL-2; R&D Systems, г. Миннеаполис, штат Миннесота) до 8 суток с получением поддерживающих Т-клеток. После этого с 9 суток до 13 суток поддерживающие Т-клетки совместно культивировали только со зрелыми DC или в комбинации с антителом к PD-1 (ниволумабом или SHR-1210) или отрицательным контролем IgG4 в присутствии цитокинов с получением активированных Т-клеток (т. е. цитотоксических T-лимфоцитов или CTL). На 14 сутки фиксированные РВМС, подвергнутые импульсному воздействию пептидов, добавляли к CTL и совместно культивировали в течение 5 суток для проведения второго цикла стимуляции Т-клеток. Альтернативно для второго цикла стимуляции Т-клеток вместо фиксированных PBMC, подвергнутых импульсному воздействию пептидов, можно использовать вторую партию зрелых DC, подвергнутых импульсному воздействию пептидов.
Подвергнутые импульсному воздействию пептидов зрелые DC и T-клетки на 8 сутки анализировали с использованием FACS, чтобы провести количественное определение подмножеств, которые экспрессируют PD-L1 или PD-1 соответственно. На 13 сутки и 18 сутки из совместных культур получали образцы активированных Т-клеток и анализировали их путем окрашивания пентамерами с последующим проведением анализа FACS. Окрашивание пентамерами и другими мультимерами (такими как декстрамеры) указывает на присутствие на активированных Т-клетках TCR, специфически распознающих комплексы МНС-пептид, тем самым обеспечивая определение показателя специфичности активированных Т-клеток. Активированные Т-клетки на 13 сутки и 18 сутки также стимулировали пулом опухолевых антигенных пептидов и определяли продукцию IFNγ активированными Т-клетками посредством внутриклеточного окрашивания цитокинов с последующим анализом FACS. Поскольку IFNγ продуцировался Т-клетками, специфически активированными опухолевыми антигенными пептидами, анализ продукции IFNγ обеспечивает определение показателя цитотоксической функции специфичных в отношении пептида Т-клеток.
Как показано на ФИГ. 16A, приблизительно 89,1% зрелых DC, подвергнутых импульсному воздействию пептидов, экспрессируют PD-L1. На ФИГ. 16B показано значительное повышение процента T-клеток PD1+ среди всех T-клеток CD3+ в PBMC от четырех разных доноров к 8 суткам.
Когда в совместную культуру Т-клеток и DC вводили антитела к PD1, происходило значительное увеличение специфичности и функции активированных Т-клеток in vitro (ФИГ. 17A-17D) по сравнению с активированными Т-клетками, полученными без антител к PD-1 или с отрицательным контролем IgG4. В частности, SHR-1210 (Hengrui Medicine) усиливает продукцию IFNγ in vitro активированными Т-клетками по сравнению с ниволумабом (ФИГ. 17D).
Продолжительность и число стимуляций
На ФИГ. 18 показана схема проведения эксперимента по получению активированных Т-клеток. Мононуклеарные клетки периферической крови (PBMC) от здоровых доноров с наличием ВЭБ получали посредством центрифугирования в градиенте плотности на центрифуге Lymphoprep (Nycomed Pharma, г. Осло, Норвегия) на 0 сутки. Адгезивные моноциты продолжали культивировать в среде AIM-V с добавлением 1000 Е/мл GM-CSF и 500 Е/мл IL-4 для дифференциации в незрелые дендритные клетки (DC). Незрелые DC обрабатывали импульсным добавлением пула множественных опухолевых антигенных пептидов (1 мкг/мл/пептид) и также агонистов TLR для дифференциации в зрелые DC. Фракцию РВМС также подвергали импульсному воздействию того же пула опухолевых антигенных пептидов и фиксировали. В то же время неадгезивные PBMC поддерживали в среде AIM-V с добавлением IL2, IL7, IL15 и IL21 с получением поддерживающих Т-клеток до 8 суток. После этого с 9 суток до 18 суток поддерживающие Т-клетки совместно культивировали только со зрелыми DC или в комбинации с антителом к PD-1 (ниволумабом или SHR-1210) или отрицательным контролем IgG4 в присутствии цитокинов с получением активированных Т-клеток (т. е. цитотоксических T-лимфоцитов или CTL). На 14 сутки фракцию активированных Т-клеток смешивали с фиксированными PBMC, подвергнутыми импульсному воздействию пептидов, и культивировали в течение 5 суток для проведения второго цикла стимуляции Т-клеток. Альтернативно для второго цикла стимуляции Т-клеток вместо фиксированных PBMC, подвергнутых импульсному воздействию пептидов, можно использовать вторую партию зрелых DC, подвергнутых импульсному воздействию пептидов.
На 13 сутки и 18 сутки из совместных культур получали образцы активированных Т-клеток и анализировали их путем окрашивания пентамерами или декстрамерами с последующим проведением анализа FACS. Активированные Т-клетки на 13 сутки и 18 сутки также стимулировали пулом опухолевых антигенных пептидов и определяли продукцию IFNγ активированными Т-клетками посредством внутриклеточного окрашивания цитокинов с последующим анализом FACS.
Как показано на ФИГ. 19A, после 10 суток стимуляции в совместной культуре присутствовал более высокий процент специфичных в отношении пептида Т-клеток по сравнению с 5 сутками стимуляции. Из всех протестированных условий культивирования 10 суток совместного культивирования с однократной стимуляцией в присутствии антител к PD1 приводят к самой высокой специфичности и цитотоксической функции Т-клеток CD8+ по результатам окрашивания мультимерами (ФИГ. 19B) и продукции IFNγ (ФИГ. 19C).
Общее количество Т-клеток в образцах, полученных на 8 сутки, 10 сутки, 13 сутки и 15 сутки совместного культивирования с однократной стимуляцией, определяли количественно в двух препаратах с использованием PBMC от двух разных доноров. Как показано на ФИГ. 20A-20B, из всех протестированных образцов наибольшее количество общих Т-клеток было обнаружено в совместной культуре, отобранной на 15 сутки, в присутствии антитела к PD1 SHR-1210.
Кроме того, поверхностную экспрессию PD-1 определяли количественно в неадгезивных клетках PBMC, обработанных антителом к PD1 (ниволумабом или SHR-1210) или отрицательным контролем IgG4, и PMA на 0 сутки. PBMC, обработанные антителами к PD1, продемонстрировали сниженный уровень экспрессии PD-1 на клеточной поверхности, что было бы ожидаемым, если бы антитела к PD1 могли интернализовать поверхность PD1 (ФИГ. 21A-21B).
Для подведения итогов относительно вышеописанных характеристик in vitro Т-клеток, активированных с использованием различных протоколов получения, следует отметить, что использование моноклональных антител к PD1 при культивировании PBMC улучшало специфичность и функцию активированных цитотоксических Т-клеток. Казалось, что моноклональные антитела к PD1 усиливали общую пролиферацию Т-клеток in vitro и способствовали интернализации молекул PD1, которые обычно экспрессируются на поверхности Т-клеток. По сравнению с ниволумабом антитело к PD1 SHR-1210 приводило к получению активированных Т-клеток с более высокой специфичностью и функцией. Для получения активированных Т-клеток с усиленной специфичностью и цитотоксической функцией вместо антител к PD1 можно использовать другие ингибиторы иммунной контрольной точки, такие как антитела к PD-L1 или антитела к CTLA-4.
ПРИМЕР 5. Анализ конкретного случая применения на практике точной противораковой иммунотерапии
В этом примере описано исследование, цель которого заключается в прогнозировании показателя ответа и эффективности иммунотерапии, ограниченной главным комплексом гистосовместимости (MHC) класса I, например, с применением ингибитора PD-I или множественной антигенспецифической противораковой терапии (MASCT), путем оценки мутации драйвера раковой клетки и мутационной нагрузки гена антигена лейкоцитов человека (HLA) класса I с использованием секвенирования следующего поколения (NGS).
По результатам секвенирования следующего поколения (NGS) 333 связанных с раком генов, 35 образцов рака объединили в две подгруппы с использованием пакета модели полиномиальной смеси Дирихле в программном обеспечении для классификации RStudio. В каждом образце оценивали мутационную нагрузку генов HLA-I и выполняли прогнозирование неоантигенов по несинонимичным точечным мутациям. Комбинированную мутационную информацию использовали для прогнозирования ответа на ограниченную MHC-I иммунотерапию у 35 онкологических пациентов. Из 35 пациентов, чьи образцы были секвенированы и проанализированы, пять пациентов получали монотерапию ингибитором PD-1, монотерапию MASCT или комбинированную терапию. Два пациента, имевших высокую мутационную нагрузку гена HLA-I (с прогнозом отсутствия ответа на терапию), получали ингибитор PD-1 (KEYTRUDA®) и комбинированную терапию MASCT или монотерапию MASCT более трех раз. По клиническим оценкам эти два пациента имели прогрессирующее заболевание (PD). Три пациента, имевших низкую мутационную нагрузку гена HLA-I и больше неоантигенов (с прогнозом ответа на терапию), получали ингибитор PD-1 (KEYTRUDA®) и комбинированную терапию MASCT или монотерапию MASCT более четырех раз. По клиническим оценкам два из трех пациентов имели частичный ответ (PR), а один пациент по оценке имел стабильное заболевание (SD).
Анализ мутации в связанных с раком генах посредством NGS, описанный в этом примере, успешно предсказал клинический ответ на ограниченную MHC-I иммунотерапию у пациентов, которые получали монотерапию MASCT или комбинированную терапию MASCT с ингибитором PD-1. Способ прогнозирования позволяет повысить эффективность и точность иммунотерапии для отдельных онкологических пациентов.
Введение
С помощью секвенирования следующего поколения (NGS) можно выполнить секвенирование опухолевой ткани быстрым и высокопроизводительным способом, чтобы обеспечить большое количество данных о мутациях в опухолевой ткани. Для получения информации о клинически значимых мутациях к данным о мутациях можно применять способы биоинформатики, таким образом, онкологическому пациенту может быть предоставлена полезная информация в следующих областях: 1. клиническая и молекулярная стратификация; 2. выбор подходящих целевых лекарственных средств; и 3. прогнозирование эффективности ограниченной MHC-I иммунотерапии. Такая информация может обеспечить точное вмешательство для каждого пациента и привести иммунотерапию рака к эпохе точной медицины. Точная иммунотерапия рака, например, такая как точная клеточная иммунотерапия, точная иммунологическая лекарственная терапия, обещают стать важным прорывом в точной терапии рака со значительным улучшением качества жизни пациентов и увеличением времени выживания пациента (см., например, Qian Qijun, Mengchao Wu. Precision cancer immunotherapy: From theory to practice [J]. Chin J Cancer Biother, 2015, 22(2):151-158).
Материалы и способы
Источник образцов
Проводили секвенирование образцов опухоли от 35 пациентов. Среди пациентов было 18 мужчин, 17 женщин в возрасте 27-88 лет, средний возраст составлял 56 лет. Полученные от пациентов образцы опухоли использовали для анализа секвенирования OncoGxOne™, фокусирующегося на 333 связанных с раком генах и генах HLA-I. Секвенирование следующего поколения (NGS) выполняли для получения информации о генетической мутации в опухолевой ткани, такой как точечная мутация, индел, слияние, изменение числа копий и т. п., с фокусом на 333 связанных с раком генах. Пять из 35 пациентов в дальнейшем получали монотерапию ингибитором PD-1 (Keytruda), монотерапию MASCT или комбинированную терапию (ФИГ. 22). От пациентов было получено информированное согласие на проведение всех клинических исследований.
Определение подтипов HLA-I
Из необработанных данных секвенирования удаляли показатели низкого качества и адаптивные последовательности, после чего использовали инструмент для анализа Polysolver (см., например, Shukla SA, Rooney MS, Rajasagi M, et al. Comprehensive analysis of cancer-assoicated somatic mutations in class I HLA genes. Nature Biotechnology, 2015,33:1152-1158) для прогнозирования результатов определения подтипов HLA-I.
Прогнозирование неоантигенов
На основании результатов определения подтипов HLA-I у каждого пациента использовали множество алгоритмов, включая NetMHC 3.4, для анализа аминокислотных последовательностей локусов точечных мутаций в 333 связанных с раком генах из опухолевой ткани. Была спрогнозирована аффинность мутантных аминокислот к соответствующим молекулам HLA-I пациента, было проведено сравнение отличий аффинности между антигенными пептидами дикого типа и мутантными антигенными пептидами, и были выбраны мутантные антигенные пептиды с более высокой аффинностью, чем у дикого типа. После этого была спрогнозирована аффинность связывания T-клеточного рецептора (TCR) с использованием мутантных антигенных пептидов, выбранных в соответствии с представленным выше описанием, имеющих высокую аффинность к молекулам HLA-I, и было проведено сравнение различий аффинности связывания TCR между антигенными пептидами дикого типа и мутантными антигенными пептидами. Мутантные антигенные пептиды с более высокой аффинностью связывания с TCR по сравнению с антигенами дикого типа выбрали в качестве спрогнозированных неоантигенов, которые могут индуцировать иммунный ответ. Последовательности этих предсказанных неоантигенов наносили на карту всего человеческого генома здоровых субъектов, а неоантигены с потенциальными перекрестно реагирующими последовательностями были удалены из пула, чтобы избежать неблагоприятных эффектов в клинических испытаниях.
Статистические данные
1.1 Для проведения анализа количества локусов точечных мутаций, количества генов с точечной мутацией, количества локусов с инделами, количества генов с инделами, количества гибридных генов, количества генов с изменением числа копий и общего количества мутированных локусов и генов использовали программное обеспечение RStudio версии 0.99.473 с открытым исходным кодом. Эти мутагенетические характеристики использовали для стратифицированного анализа 35 образцов опухоли с помощью модели полиномиальной смеси Дирихле (DMM) (см., например, Holmes IK, Quince C.Harris. Dirichlet Multinomial Mixtures: Generative Models for Microbial Metagenomics [J]. PLoS ONE, 2012, 7(2):e30126).
1.2 Для создания графика кластеризации для 35 образцов опухолевой ткани на основании мутационной нагрузки каждого из 333 связанных с раком генов использовали пакет программного обеспечения Pheatmap. К графику кластеризации добавляли характерную информацию для каждого образца опухоли, например информацию о группировке в клинических исследованиях, информацию о группировке наличия или отсутствия дефицита репарации ошибочно спаренных оснований (MMR) ДНК и информацию о группировке DMM.
1.3 С помощью программного обеспечения RStudio с использованием критерия ранговых сумм Манна-Уитни было проверено исследование статистического различия количества мутаций гена HLA-I в каждой группе DMM, при этом значение p < 0,05 считалось статистически достоверным.
Результаты
Стратифицированный кластерный анализ 333 связанных с раком генов
Для каждого образца опухоли выполняли статистический анализ данных по мутагенетическим характеристикам для 333 связанных с раком генов, включая количество локусов точечных мутаций, количество генов с точечной мутацией, количество локусов с инделами, количество генов с инделами, количество гибридных генов, количество генов с изменением числа копий и общее количество мутированных локусов и генов, и эти данные использовали для стратифицированного анализа DMM 35 образцов опухолевой ткани. Как показано на ФИГ. 23A, самый лучший кластер из 35 образцов состоит из двух групп. Маркированная кластеризация каждого образца показана на ФИГ. 23B, на которой показано эффективное разделение представителей двух групп на основании расстояния минимального интервала разделения в пространстве (MDS1): 14 образцов опухоли объединили в группу DMM 1, а 21 образец опухоли объединили в группу DMM 0.
Была создана диаграмма «тепловая карта» для 35 образцов опухоли на основании количества точечных мутаций, количества локусов с инделами и количества локусов с изменением числа копий, обнаруженных для каждого из 333 связанных с раком генов в каждом образце опухоли, и для образцов и генов выполняли кластерный анализ. Как показано на ФИГ. 24A, для 35 образцов опухоли наблюдали две основные кластерные ветви. После добавления к каждому образцу клинической или молекулярной маркировки кластерный результат оказался несогласованным с клиническими типами рака: образцы опухоли из одного и того же клинического типа рака имеют разные мутагенетические спектры, в то время как в некоторых образцах опухоли из различных клинических типов рака имеются сходные мутации. Различие между молекулярной классификацией рака и клиническими типами, наблюдаемое в этом исследовании, согласуется с другими отчетами (см., например, Golub TR, Slonim DK, Tamayo P, et al. Molecular classification of cancer: class discovery and class prediction by gene expression monitoring [J]. Science, 1999, 286(5439):531-537). Кластеризация, основанная на типе дефицита MMR, также не соответствует результатам кластеризации, показанным в тепловой карте. Однако было отмечено, что группы DMM имели классификацию, схожую с результатами кластеризации, только один образец показал несогласованность между классификацией DMM и кластеризацией (ФИГ. 24A).
Посредством измерения общего количества мутаций в локусах HLA-A, HLA-B и HLA-C, обнаруженных в каждом образце опухоли, и сравнения с результатом кластеризации опухолевой ткани на тепловой карте между двумя группами DMM была выявлена существенная разница в мутационной нагрузке гена HLA-I (ФИГ. 24B).
Процентная доля мутаций гена HLA-I в общем количестве мутаций
Дополнительный анализ количества мутаций гена HLA-I показал статистически существенную разницу между двумя группами DMM. Мутационная нагрузка гена HLA-I в 14 образцах опухоли в группе 1 DMM (красный цвет) значительно превышает мутационную нагрузку 21 образца опухоли в группе 0 DMM (зеленый цвет), причем p-значение составляет 1,076e-5 (ФИГ. 25A). Более того, отношение мутационной нагрузки гена HLA-I к общей мутационной нагрузке в группе 1 DMM значительно превышает это отношение в группе 0 DMM (ФИГ. 25A), что позволяет предположить, что мутация гена HLA-I может быть основной внутренней мутацией раковых клеток в группе 1 DMM. Высокая мутационная нагрузка гена HLA-I может облегчать ускользание раковых клеток от иммунного надзора, приводя к возможной неэффективности ограниченной MHC-I иммунотерапии.
Пять из 35 онкологических пациентов получали монотерапию ингибитором PD-1 (KEYTRUDA®), монотерапию MASCT или комбинированную терапию (ФИГ. 22, 25B). Было спрогнозировано, что два пациента с высокой мутационной нагрузкой генов HLA-I (группа 1 DMM) не будут отвечать на ограниченную MHC-I иммунотерапию. После проведения по меньшей мере 3 циклов лечения посредством комбинированной терапии ингибитором PD-1 (KEYTRUDA®) и MASCT или монотерапии MASCT при клинической оценке у этих двух пациентов в соответствии с прогнозом определили наличие прогрессирующего заболевания (PD) или неэффективный в отношении клинических преимуществ ответ (CBR). Было спрогнозировано, что три пациента с низкой мутационной нагрузкой генов HLA-I (группа 0 DMM) будут отвечать на ограниченную MHC-I иммунотерапию. Двум из этих трех пациентов проводили 5 циклов лечения с применением монотерапии ингибитором PD-1 (Keytruda) или комбинированной терапии (Keytruda) и MASCT, и по клиническим оценкам они имели частичный ответ (PR) или явный CBR; одному из трех пациентов проводили 4 цикла лечения MASCT, и по клиническим оценкам в соответствии с прогнозом он имел стабильное заболевание.
Анализ конкретного случая у типичных пациентов
Пациент ID 1-LQL
Пациент ID 1-LQL имел аденокарциному легкого, и, как было спрогнозировано на основании кластерного анализа, его отнесли к группе 1 DMM. В локусах гена HLA-I у него было обнаружено 55 мутаций, и это классифицировали как высокую мутационную нагрузку HLA-I (ФИГ. 22). Была спрогнозирована клиническая неэффективность ограниченной MHC-I иммунотерапии.
После проведения 3 циклов лечения ингибитором PD-1 (KEYTRUDA®) и 4 циклов лечения MASCT у пациента наступила дыхательная недостаточность, и он умер из-за неэффективного контроля заболевания и плеврального выпота. По результатам клинической оценки этот пациент имел прогрессирующее заболевание (PD), как было спрогнозировано в кластерном анализе.
Пациент ID 2-SJS
Пациент ID 2-SJS имел рак пищевода, и, как было спрогнозировано на основании кластерного анализа, его отнесли к группе 1 DMM. В локусах гена HLA-I у него было обнаружено 8 мутаций, и это классифицировали как высокую мутационную нагрузку HLA-I (ФИГ. 22), что позволяло предположить неэффективность ограниченной MHC-I иммунотерапии.
После проведения 3 циклов монотерапии MASCT этот пациент по результатам клинической оценки имел прогрессирующее заболевание (PD), как было спрогнозировано в кластерном анализе.
Пациент ID 3-HJL
Пациент ID 3-HJL женского пола в возрасте 73 лет имел транзиторно-клеточную карциному левой почечной лоханки с множественными метастазами в левый надпочечник, левые надключичные и средостенные лимфатические узлы и оба легких. На основании результатов секвенирования следующего поколения (NGS) этого пациента отнесли к группе 0 DMM, причем у него были обнаружены 2 мутации в локусах гена HLA-I, и это классифицировали как низкую мутационную нагрузку HLA-I. На основании определения у пациента подтипов HLA-I были спрогнозированы 6 неоантигенов. Таким образом, по прогнозам ограниченная MHC-I иммунотерапия обеспечивала этому пациенту эффективный CBR.
Этому пациенту был поставлен диагноз транзиторно-клеточной карциномы левой почечной лоханки и проведено радикальное хирургическое вмешательство. Через 2 года был обнаружен метастаз в левом надпочечнике, и поэтому была проведена радиочастотная абляция (RFA). ПЭТ-КТ после RFA показала множественные метастазы в левых надключичных и средостенных лимфатических узлах и двух легких, при этом самый большой размер опухоли составлял ~ 2 см в диаметре, поэтому пациент начал получать химиотерапию. После четвертого курса химиотерапии проводили повторное исследование КТ, результаты которого указывали на неэффективный контроль ракового заболевания посредством химиотерапии (ФИГ. 26A-C). После этого этому пациенту проводили лечение ингибитором PD-1 (KEYTRUDA®) и комбинированной терапией MASCT. После 3 циклов комбинированной терапии по результатам КТ было обнаружено, что размер опухоли уменьшился на ~ 50% (ФИГ. 26D). После 5 циклов лечения ингибитором PD-1 (KEYTRUDA®) и применения комбинированной терапии MASCT результаты КТ указывали на исчезновение опухолей в легких, стабильное заболевание в средостенных лимфатических узлах и исчезновение отечности левых надключичных лимфоузлов. По результатам клинической оценки состояние заболевания - частичный ответ (PR, ФИГ. 26E). Клинические результаты соответствовали прогнозу.
Пациент ID 4-LKS
Пациент ID 4-LKS мужского пола в возрасте 61 года имел умеренно дифференцированную аденокарциному левого легкого IV стадии после радикального хирургического вмешательства, а также метастазы в головной мозг и средостенные лимфатические узлы. На основании результатов NGS этого пациента отнесли к группе 0 DMM, причем у него были обнаружены 2 мутации в локусах HLA-I, и это классифицировали как низкую мутационную нагрузку HLA-I. На основании определения у пациента подтипов HLA-I были спрогнозированы 6 неоантигенов. Таким образом, по прогнозам ограниченная MHC-I иммунотерапия обеспечивала этому пациенту эффективный CBR.
13 лет назад по отношению к этому пациенту выполняли радикальное хирургическое вмешательство из-за опухоли в левом легком с последующим проведением 4 циклов адъювантной химиотерапии и КТ органов средостения. Внутричерепные метастазы были обнаружены во время повторного обследования, причем размер опухоли составлял ~ 3 см (ФИГ. 27A), что сопровождалось правой гемиплегией. После проведения 20 циклов нацеленной лучевой терапии (информация о дозе недоступна) размер опухоли уменьшился (ФИГ. 27B). Пациенту проводили монотерапию ингибитором PD-1 (KEYTRUDA®). После 2 циклов лечения повторное обследование КТ показало дальнейшее уменьшение внутричерепной опухоли (ФИГ. 27C), а клинические симптомы показали постепенное восстановление мышечной силы на стороне гемипареза. После проведения 6 циклов монотерапии ингибитором PD-1 (KEYTRUDA®) при повторном обследовании КТ наблюдалось дальнейшее улучшение состояния внутричерепной опухоли и отека (ФИГ. 27D), а клинические симптомы показали постепенное восстановление мышечной силы на стороне гемипареза и способность к выполнению мелких движений. После завершения лучевой терапии и 6 месяцев монотерапии ингибитором PD-1 (KEYTRUDA®) этот пациент по результатам клинической оценки имел частичный ответ (PR). Этот клинический результат соответствовал прогнозу, сделанному по результатам описанного анализа секвенирования.
Обсуждение
У пациентов c «обратимой недостаточностью HLA-I» после проведения адоптивной T-клеточной иммунотерапии T-клетки могут локально секретировать IFN-γ и стимулировать экспрессию молекул HLA-I. Следовательно, перед применением адоптивной T-клеточной иммунотерапии больший клинический смысл будет иметь оценка наличия у пациентов «необратимой недостаточности HLA-I».
Результаты, полученные на основании секвенирования пяти образцов опухолевой ткани, описанные выше, позволяют предположить более слабую корреляцию между CBR после получения ингибитора PD-1 (KEYTRUDA®) и/или MASCT и статусом дефицита MMR ДНК (мутации, обнаруженные в локусах MLH1, MSH2, MSH6 и PMS2) по сравнению с корреляцией между CBR и мутационной нагрузкой гена HLA-I. Дефицит MMR может приводить к повышенной скорости мутаций в раковых клетках, что, в свою очередь, теоретически может приводить к увеличению количества неоантигенов. Однако, если эти раковые клетки имеют низкий уровень экспрессии или не экспрессируют молекулы HLA-I, неоантигены не будут эффективно представлены для распознавания и запуска цитотоксического эффекта иммунными клетками. Таким образом, доступность молекул HLA-I для эффективного представления неоантигенов в раковых клетках является одним из требований для обеспечения эффективности ограниченной MHC-I иммунотерапии. Случай пациента 1.LQL поддержал эту гипотезу: хотя в опухолевой ткани обнаружено большое количество мутаций (всего было обнаружено 3243 мутации), поскольку мутационная нагрузка гена HLA-I также была довольно высокой, терапия ингибитором PD-1 (KEYTRUDA®) или MASCT не оказывала значимого клинического эффекта.
Поскольку гены HLA-I обладают высоким полиморфизмом, после получения информации о мутации гена HLA-I в опухолевой ткани необходимо провести дополнительное тестирование, чтобы определить, будет ли мутация аминокислот в определенном локусе влиять на представление антигена молекулами HLA-I и какова степень возможного влияния. В этом исследовании для проведения стратифицированного анализа онкологических пациентов выполняли статистический анализ и на основании мутационной нагрузки гена HLA-I в опухолевой ткани каждого пациента пациентов разделяли на группы: одну группу, отвечавшую на ограниченную MHC-I иммунотерапию, и другую группу, не отвечавшую на эту терапию, таким образом можно было измерить корреляцию между клиническим ответом и мутационной нагрузкой гена HLA-I. В соответствии с 5 конкретными случаями 3 пациента с низкой мутационной нагрузкой HLA-I продемонстрировали эффективный CBR на ограниченную MHC-I иммунотерапию, в то время как 2 пациента с высокой мутационной нагрузкой HLA-I не продемонстрировали эффективный CBR на такую терапию. В этом примере зарегистрировано первое клиническое открытие: для обеспечения прогноза иммунотерапии рака (например, с использованием ингибитора PD-1 KEYTRUDA®) и адоптивной T-клеточной терапии (такой как MASCT) можно выполнять анализ с помощью метода биоинформатики по данным NGS образцов от пациента на основании количества неоантигенов и мутационной нагрузки гена HLA-I, тем самым обеспечивая пациентам точную иммунотерапию. Для подтверждения этого открытия проводятся клинические исследования с большим размером выборки.
ПРИМЕР 6. Разбор конкретного случая у пациента с колоректальным раком, получавшего лечение неоантигенами-MASCT
Пациенту XMZ мужского пола в возрасте 58 лет был поставлен диагноз рака толстой кишки и выполнена колэктомия. Гистологический анализ показал рак толстой кишки II стадии. Через три года после колэктомии для пациента выполняли контрольный анализ CTC, в котором количество CTC составило 194 клетки/10 мл. Пациент получал три цикла лечения точной MASCT, как показано на ФИГ. 28.
Вкратце, на первом этапе образец биопсии опухоли от пациента был секвенирован и проанализирован с использованием панели связанных с раком генов ONCOGXONE™ и HLA (Admera Health). Для панели ONCOGXONE™ и HLA использовали платформу для секвенирования Illumina MiSeq или HiSeq, чтобы секвенировать приблизительно 150-400 генов, специфичных для типа рака, включая локусы HLA. Для обогащения целевых последовательностей в образце использовали набор для обогащения мишеней Agilent SURESELECT™. Области целевой последовательности охватывали приблизительно 2-5,4 Мб каждого локуса генов, охватывая все экзоны, UTR и соответствующие интронные области. Средняя глубина охвата была приблизительно 100-кратной. На основании данных секвенирования были определены геномные вариации, включая точечные мутации, инделы, перегруппировки и вариации числа копий (CNV).
Анализ ONCOGXONE™ и HLA образца пациента показал, что у пациента была точечная мутация G12A в гене KRAS, которая может снижать чувствительность пациента к лечению моноклональными антителами к EGFR, такими как цетуксимаб или панитумумаб. У пациента наблюдалась точечная мутация в остатке Q399 гена XRCC1, что позволяет предположить потенциально усиленный ответ на химиотерапевтические лекарственные средства на основе платины. Пациент имел мутации в MTHFR и TYMS, что позволяет предположить потенциально усиленный ответ на 5-ФУ (5-фторурацил). Пациент имел мутации в CYP2D6, что позволяет предположить потенциально сниженный ответ на тамоксифен или опиоидные анальгетики. Лекарственные средства с потенциальным преимуществом, предсказанные на основании результатов секвенирования, включают антитела кPD-1 (такие как OPDIVO® или KEYTRUDA®), PD-0332991 (палбоциклиб) и траметиниб (например, MEKINIST®).
Кроме того, определение подтипов HLA и мутационный анализ по результатам секвенирования показали, что у пациента было две делеционные мутации в генах HLA-I, в том числе одна в локусе HLA-A и одна в локусе HLA-C. Результаты определения подтипов HLA-I и мутационной нагрузки в образце опухоли от пациента показаны ниже в таблицах 3 и 4. Функциональный анализ локусов HLA пациента показал, что для пациента может быть эффективной ограниченная MHC-I терапия, например терапия на основе Т-клеток.
Таблица 3. Результаты определения подтипов HLA-I
Таблица 4. Мутации в генах HLA-I класса
На основании анализа секвенирования выявили четыре потенциальных неоантигена (ФИГ. 29A). На основе неоантигенов MTHR-A222V и MLL3-C988F сконструировали два новых антигенных пептида соответственно. Кроме того, из собственной библиотеки антигенных пептидов выбрали неоантигенный пептид KRAS_G12V. Всего в пул антигенных пептидов для лечения MASCT были включены 16 антигенных пептидов (включая hTERT, p53, сурвивин, NY-ESO-1, MET, MUC1, Kras-3, неоантиген 1+2), которые были специфичны для опухоли сигмовидного отдела толстой кишки пациента.
После трех циклов лечения точной MASCT с применением пула антигенных пептидов, содержащего неоантигенные пептиды, количество циркулирующих опухолевых клеток (CTC) у пациента снизилось (ФИГ. 29B). Для оценки антигенспецифических Т-клеточных ответов с помощью анализа ELISPOT проанализировали образцы PBMC, полученные от пациента. Результаты анализа ELISPOT (ФИГ. 29C) показали, что PBMC пациента имели Т-лимфоциты, проявляющие сильный специфический ответ против MUC1 и неоантигенов (неоантиген 1+1, Kras-3), тогда как специфический ответ против hTERT, p53, сурвивина, NY-ESO-1 и MET также был значительным. В РВМС пациента присутствовали специфические Т-клетки против опухолевых неоантигенов и связанных с опухолью антигенов, и в ходе лечения MASCT происходила их пролиферация. После получения трех циклов лечения MASCT пациент сообщал о повышении энергичности и увеличении физической силы, а также об изменениях внешнего вида (например, волосы и борода приобрели черную окраску).
ПРИМЕР 7. Прогноз и стратификация пациентов для лечения MASCT
В этом примере представлен пример модели для обеспечения прогнозирования и стратификации пациентов, получающих ограниченную MHC терапию, например лечение MASCT (включая точную MASCT), на основании количества неоантигенов (т. е. неоантигенной нагрузки) и мутационной нагрузки молекул HLA у пациентов.
Определяли мутационную нагрузку молекул HLA и неоантигенов в образцах опухоли от 40 онкологических пациентов и проводили анализ с использованием способов, описанных в примере 5. По прогнозам ожидалось, что пациенты получат преимущество от ограниченной MHC терапии, если они: (1) не имеют мутации в гене B2M; (2) не имеют мутации в функциональных областях (таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3) генов HLA; (3) имеют менее 2 мутаций в генах HLA-I A, B или C; и (4) имеют более 5 неоантигенов. По прогнозам ожидалось, что пациенты получат потенциальное преимущество от ограниченной MHC терапии, если они: (1) не имеют мутации в гене B2M; (2) не имеют мутации в функциональных областях (таких как лидерная пептидная последовательность, домен a1, домен a2 или домен a3) генов HLA; (3) имеют по меньшей мере 2 мутации, но менее 10 мутаций в генах HLA-I A, B или C; и (4) имеют менее 5 неоантигенов. По прогнозам ожидалось, что пациенты не получат преимущество от ограниченной MHC терапии, если они имеют: (1) одну или более мутаций в гене B2M; или (2) по меньшей мере 10 мутаций в генах HLA-I A, B или C. 9 пациентов получили ограниченную МНС терапию, включая MASCT и/или терапию блокирования иммунной контрольной точки. Ниже в таблице 5 показан клинический ответ пациентов в трех группах прогноза.
Таблица 5. Прогноз ограниченной МНС терапии для пациентов
ПРИМЕР 8. Безопасность MASCT у пациентов с гепатоцеллюлярной карциномой
45 пациентам с гепатоцеллюлярной карциномой проводили лечение MASCT и выполняли ретроспективный анализ собранных клинических данных, включая клинический ответ, функции печени и почек, результаты общего анализа крови и неблагоприятные реакции. Пациенты не получали другую иммунотерапию, и последний получаемый ими курс лечения перед применением MASCT (хирургическое вмешательство, лучевая терапия, химиотерапия) был завершен по меньшей мере за один месяц до проведения MASCT. На ФИГ. 30A показаны клинические характеристики 45 пациентов.
Для проведения MASCT клетки получали согласно способу, описанному в примере 1. Вкратце, на 1 сутки от каждого пациента выделяли PBMC и индуцировали адгезивные клетки в DC. DC загружали 14 типами множества антигенных пептидов с получением зрелых DC (mDC). На 8 сутки пациентам посредством подкожной инъекции вводили небольшую часть mDC. Неадгезивные клетки из образца РВМС совместно культивировали с остальными mDC с 7 суток и индуцировали в цитотоксических Т-клетках (CTL), которые вводили посредством внутривенной инфузии на 26 сутки. Для гарантии контроля качества определяли характеристики mDC и CTL. В mDC процентная доля клеток CD80+ составила 98,5 ± 5%, процентная доля клеток CD83+ составила 88 ± 10%, процентная доля клеток CD86+ составила 98,4 ± 3%, а процентная доля клеток HLA-DR+ составила 98,8 ± 2%. Клетки mDC секретировали высокий уровень IL-12 (985 ± 312 пг/мл) и низкий уровень IL-10 (53 ± 10 пг/мл). В CTL процентная доля клеток CD3+CD8+ составила 83 ± 10%, а процентная доля клеток CD3+CD56+ составила 24 ± 5%. CTL секретировали высокий уровень IFN-γ (1222 ± 650 пг/мл) и низкий уровень IL-10 (6,8 ±5,0 пг/мл).
У всех 45 пациентов после лечения MASCT произошло улучшение клинического состояния в разной степени. Большинство пациентов сообщили о повышении энергичности, аппетита, сна и физической силы. Основным неблагоприятным явлением после инфузии активных иммуноцитов была умеренная лихорадка (2 случая, 4,44%). Лихорадка возникала приблизительно через 1 час после инфузии CTL, и в обоих случаях температура тела не превышала 38,5 °C. Температура тела у пациентов вернулась к нормальным показателям после отдыха, питья воды и физического охлаждения. Другие тяжелые неблагоприятные явления не наблюдались.
На ФИГ. 30B показаны результаты общего анализа крови 45 пациентов перед началом лечения MASCT и после проведения последнего курса лечения MASCT. Ни у одного пациента не наблюдалось отклонений от нормы показателей общего анализа крови. До и после лечения MASCT наблюдали значительные изменения количеств лейкоцитов (P=0,0411) и нейтрофилов (P=0,0015), но они находились в пределах нормы и, следовательно, не приводили к значительным клиническим эффектам. Не наблюдалось статистически достоверного изменения уровня гемоглобина и количества тромбоцитов. Статистический анализ с использованием t-критерия выполняли с помощью программного обеспечения SPSS 19.0.
На ФИГ. 3°C показаны уровни АЛТ, АСТ, общего билирубина, креатинина и азота мочевины в крови у 45 пациентов перед началом лечения MASCT и после проведения последнего лечения MASCT. Ни у одного пациента не наблюдалось отклонений от нормы показателей функции печени или почек. Данные для 2 пациентов до лечения MASCT отсутствуют. После лечения MASCT было продемонстрировано статистически достоверное изменение уровней АСТ (p=0,0198) и общего билирубина (p=0,0177), также наблюдалась тенденция повышения уровня АЛТ, имеющая клиническую значимость. После лечения MASCT не наблюдалось статистически достоверного изменения уровней креатинина и азота мочевины крови.
После проведения 4-6 курсов лечения MASCT были доступны данные анализов функционирования печени для 6 посещений (от исходного уровня до уровня после проведения 5 курсов лечения MASCT). На ФИГ. 30D показано изменение уровней АЛТ и АСТ у 10 пациентов при проведении 5 курсов лечения MASCT. Из анализа исключили 2 пациента с большими колебаниями уровней, в том числе одного пациента, которому проводили трансплантацию печени к 6 посещению, что привело к повышению уровня АЛТ до 288 МЕ/л; а второй пациент получал терапию TACE, что привело к увеличению уровня к 6 посещению до 572 МЕ/л. При сравнении уровней АЛТ и АСТ у пациентов с течением времени статистически достоверных изменений не наблюдалось.
Результаты демонстрируют, что лечение MASCT является безопасным для пациентов с HCC.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПРОИЗВОДСТВА Т-КЛЕТОК | 2018 |
|
RU2793344C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ВПЧ | 2019 |
|
RU2799784C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2770447C2 |
| НЕОАНТИГЕННЫЕ КОМПОЗИЦИИ И ИХ ИСПОЛЬЗОВАНИЕ | 2020 |
|
RU2832574C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
| ДОСТАВКА БИОМОЛЕКУЛ В КЛЕТКИ ИММУННОЙ СИСТЕМЫ | 2015 |
|
RU2739794C2 |
| КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ РАКА ИЛИ ИНФЕКЦИИ | 2016 |
|
RU2777945C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ T-КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2835034C2 |
| Способы и композиции для лечения опухолей | 2017 |
|
RU2741786C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ И ОПУХОЛЕЙ | 2007 |
|
RU2540490C2 |
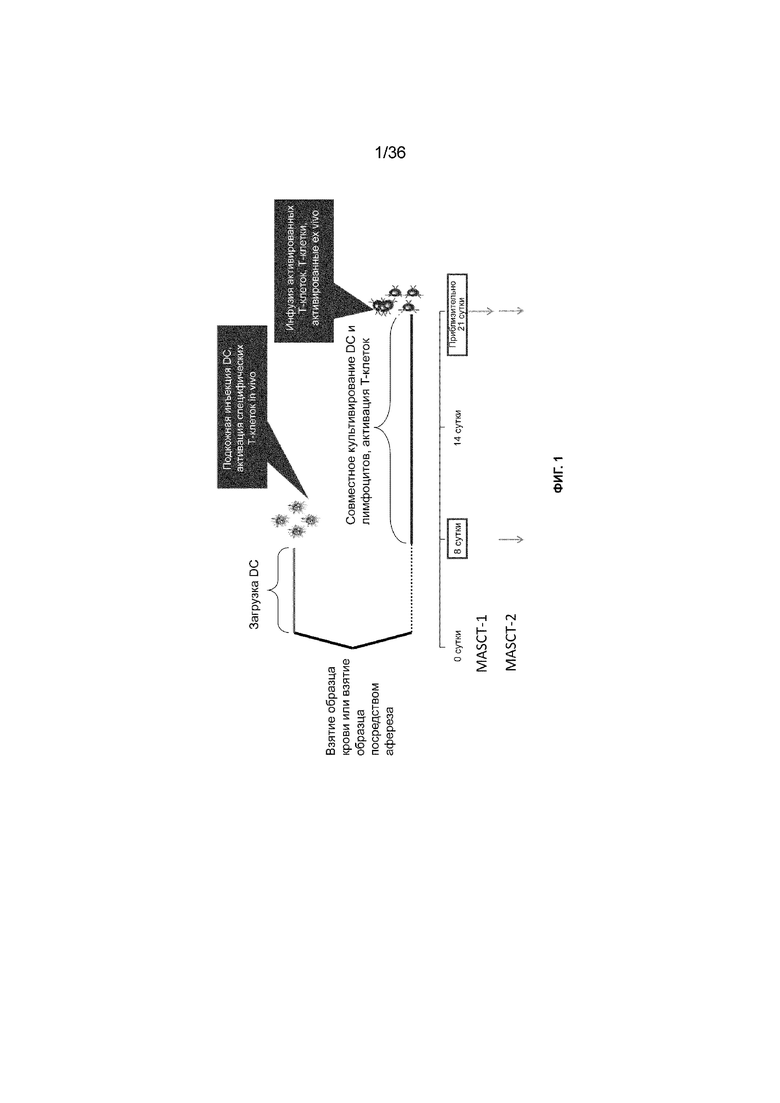
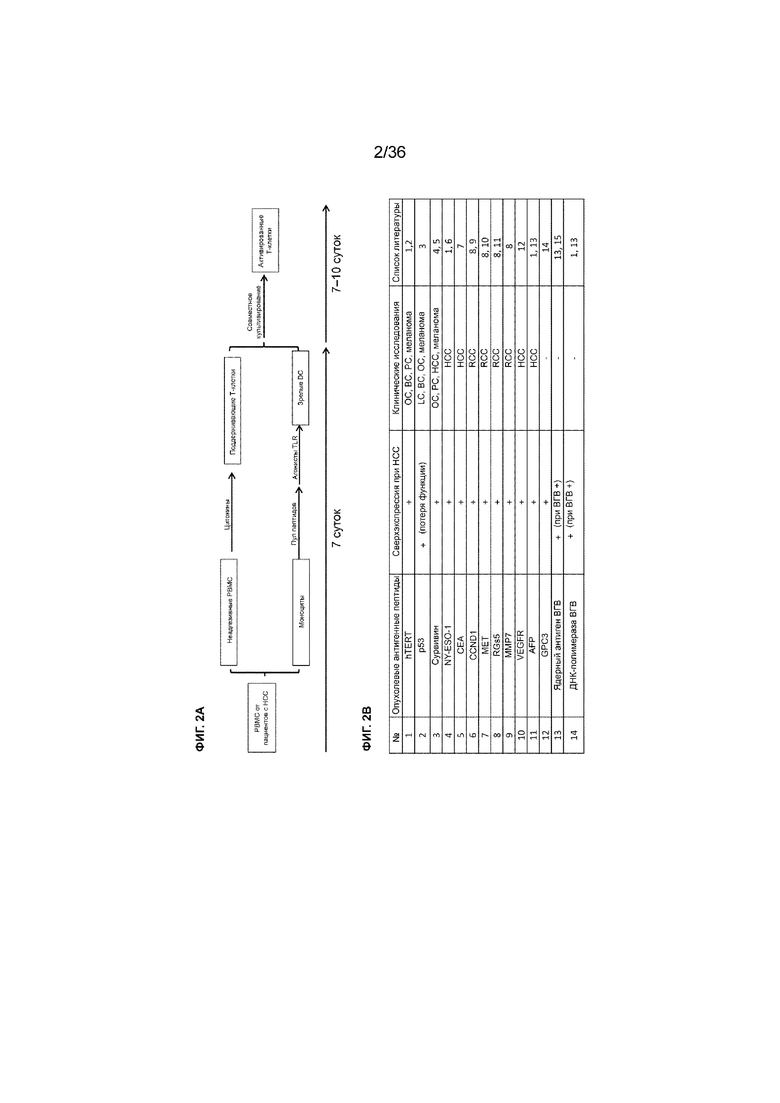
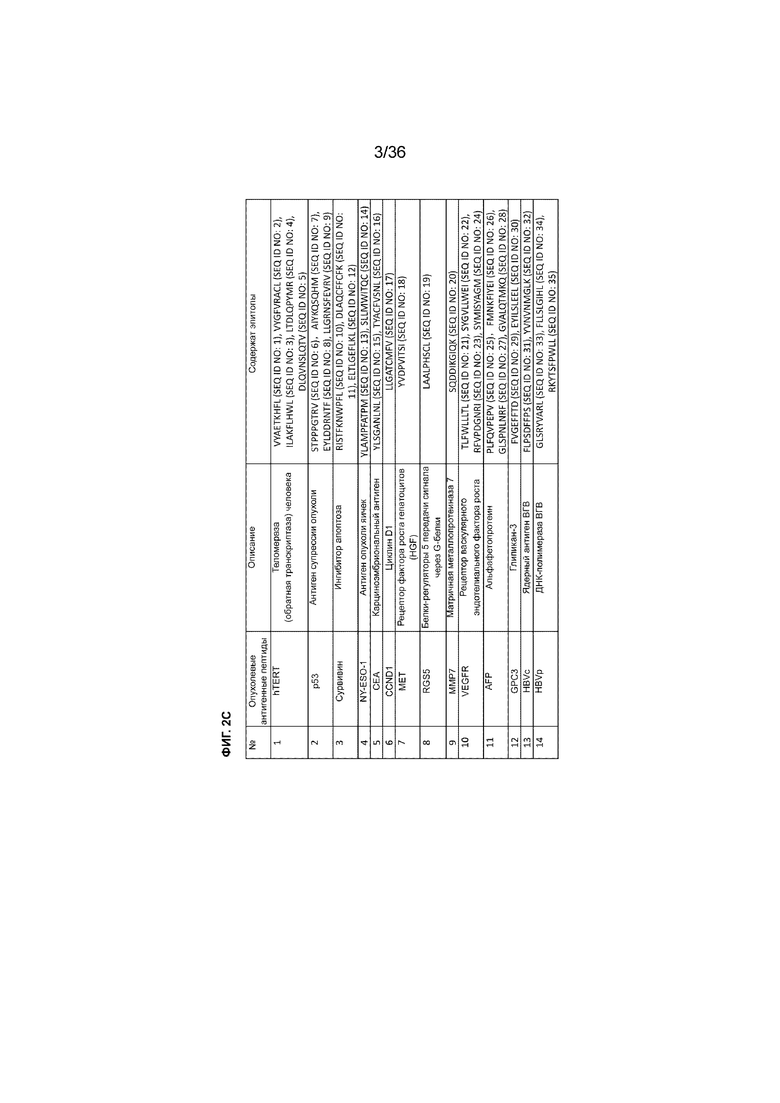

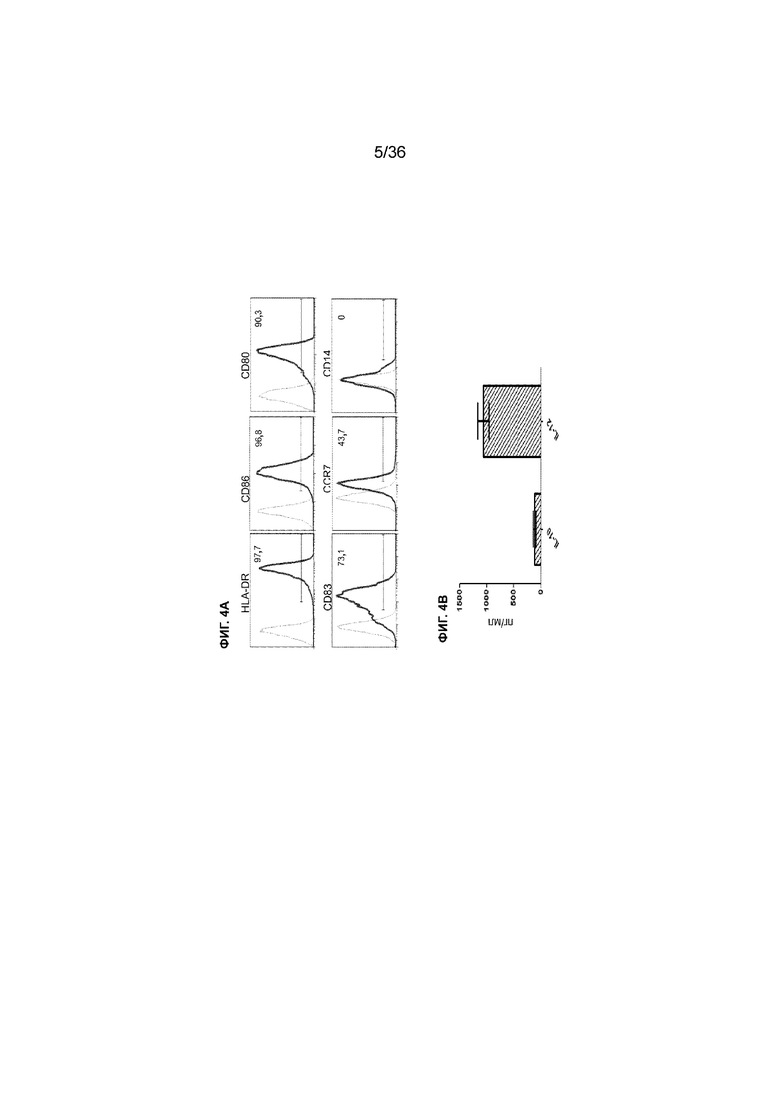
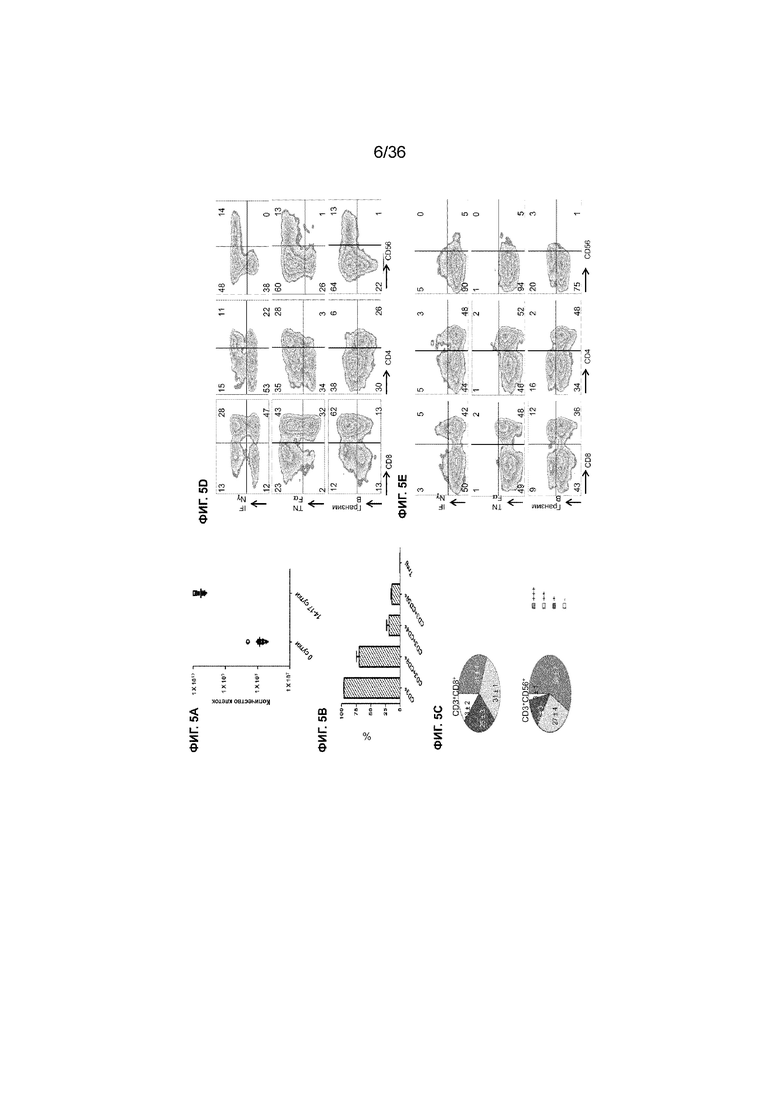
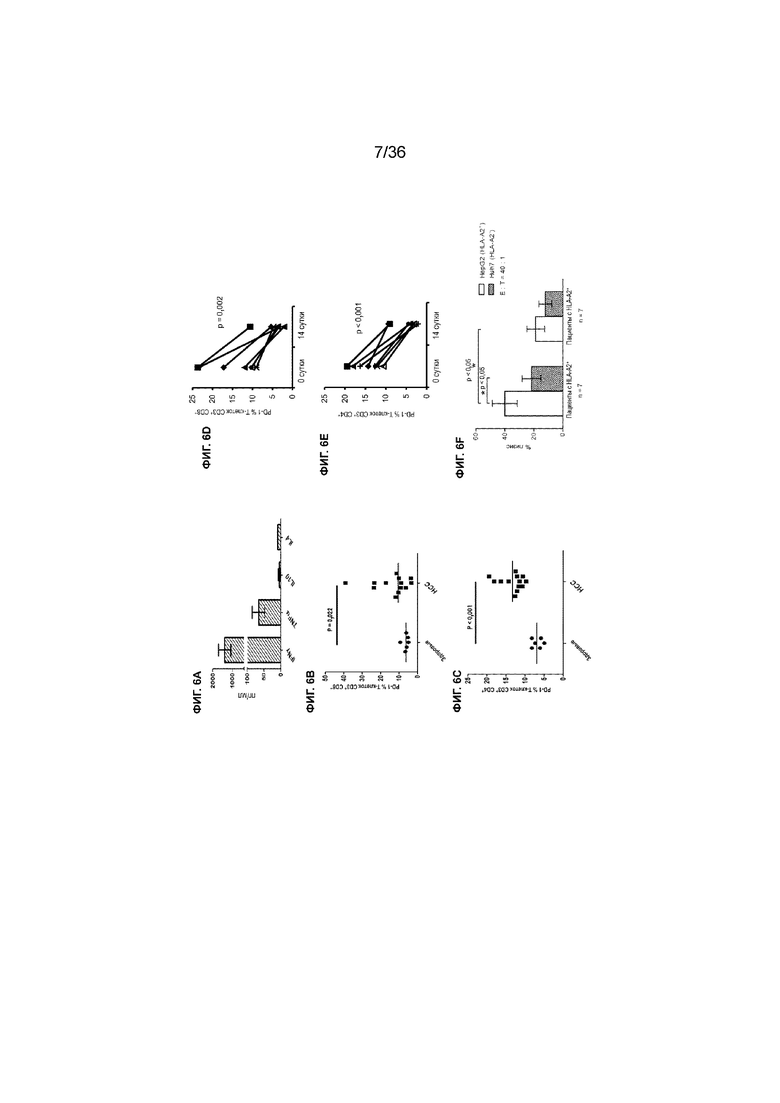
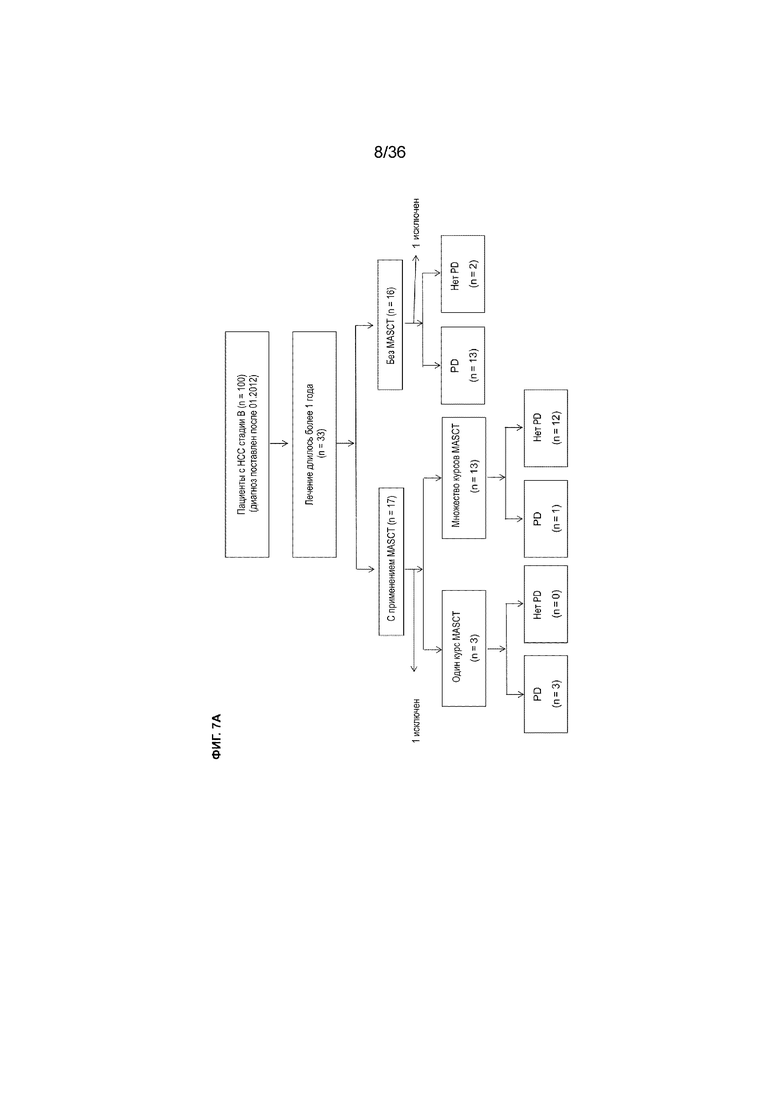
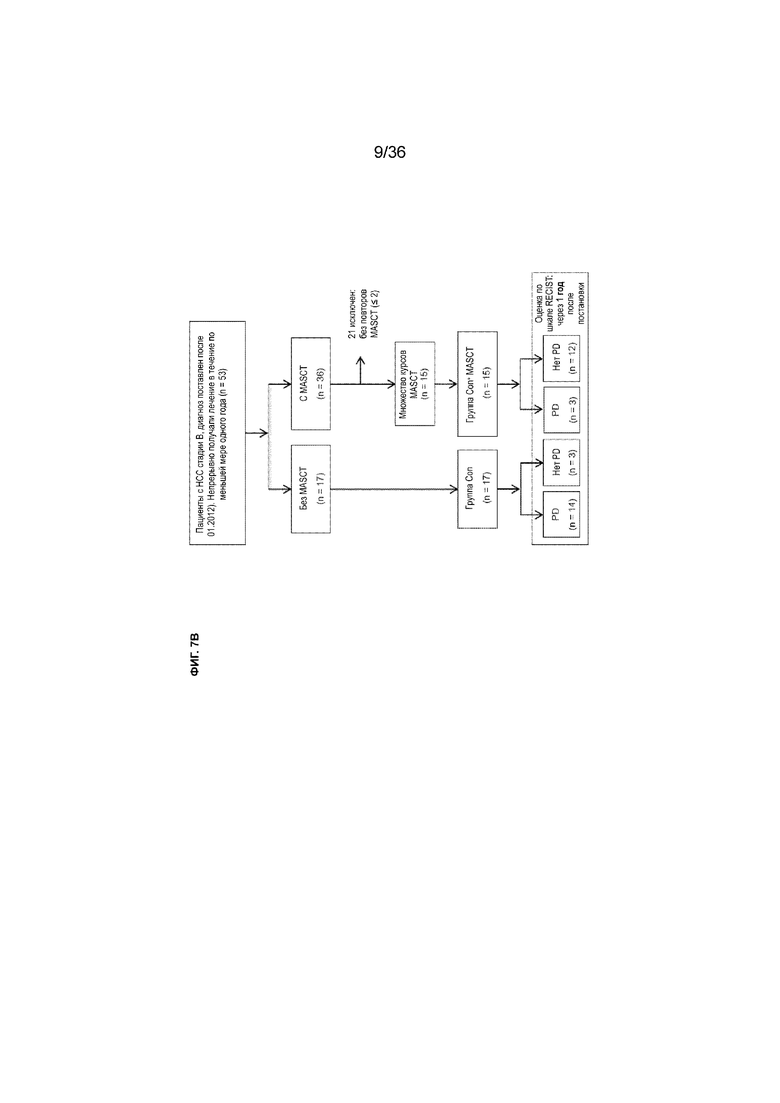






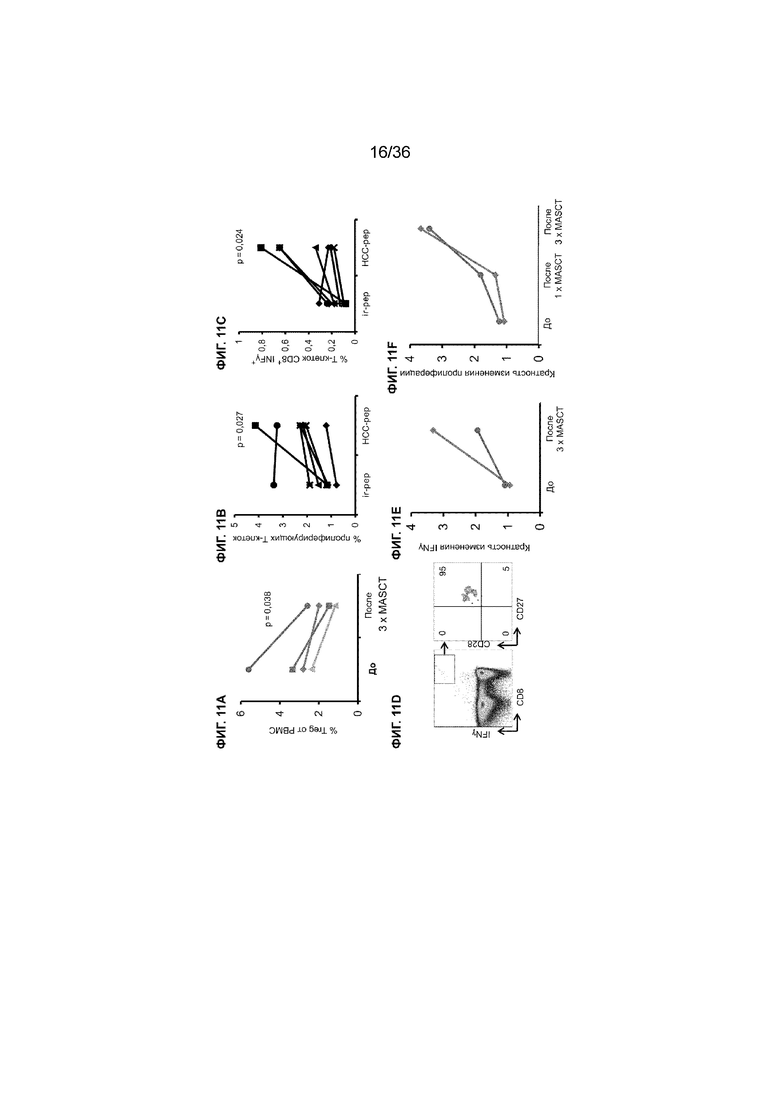
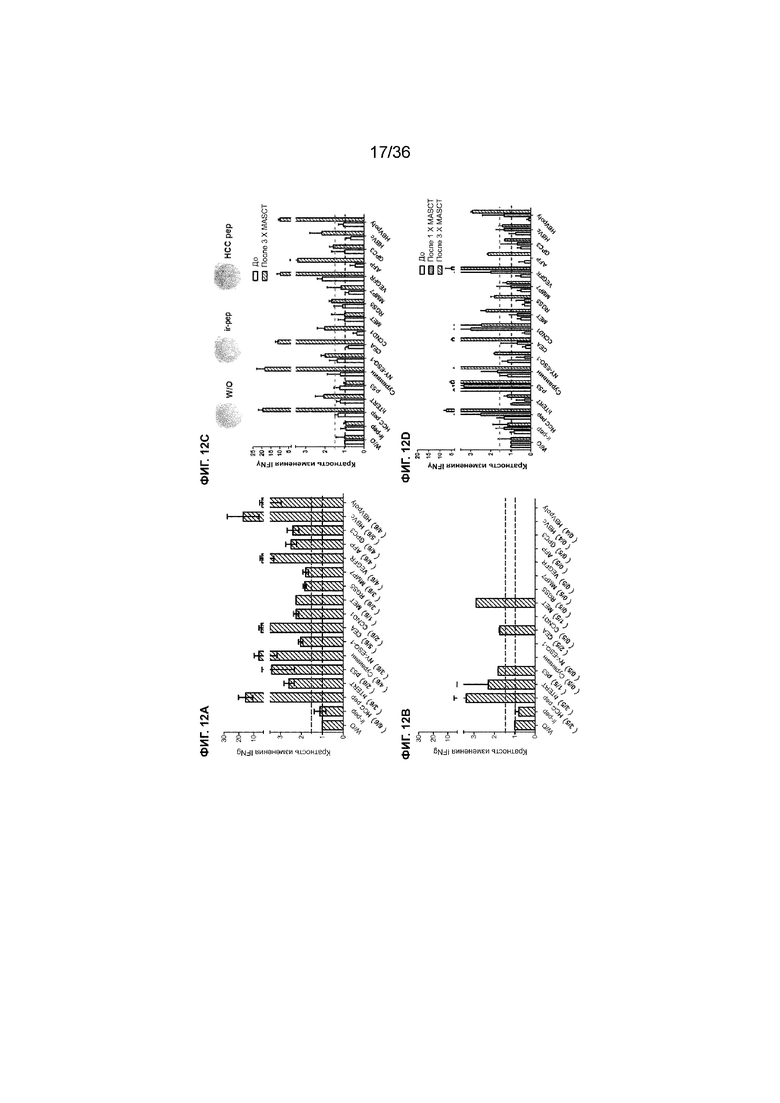
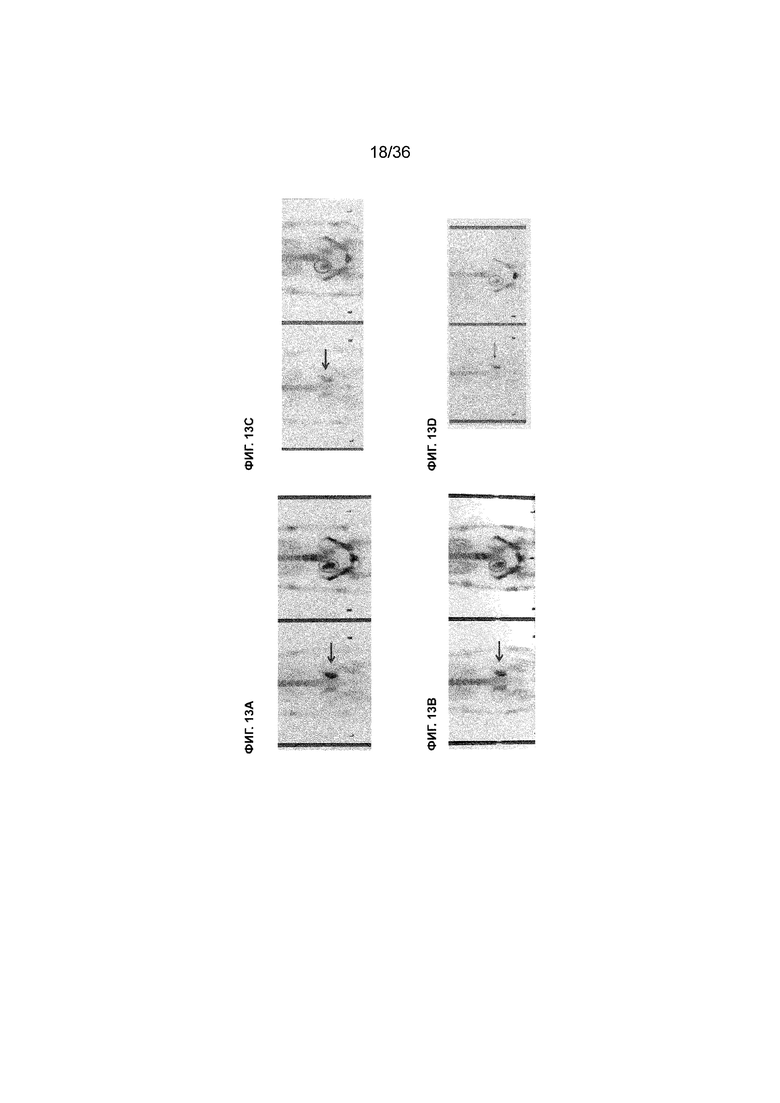
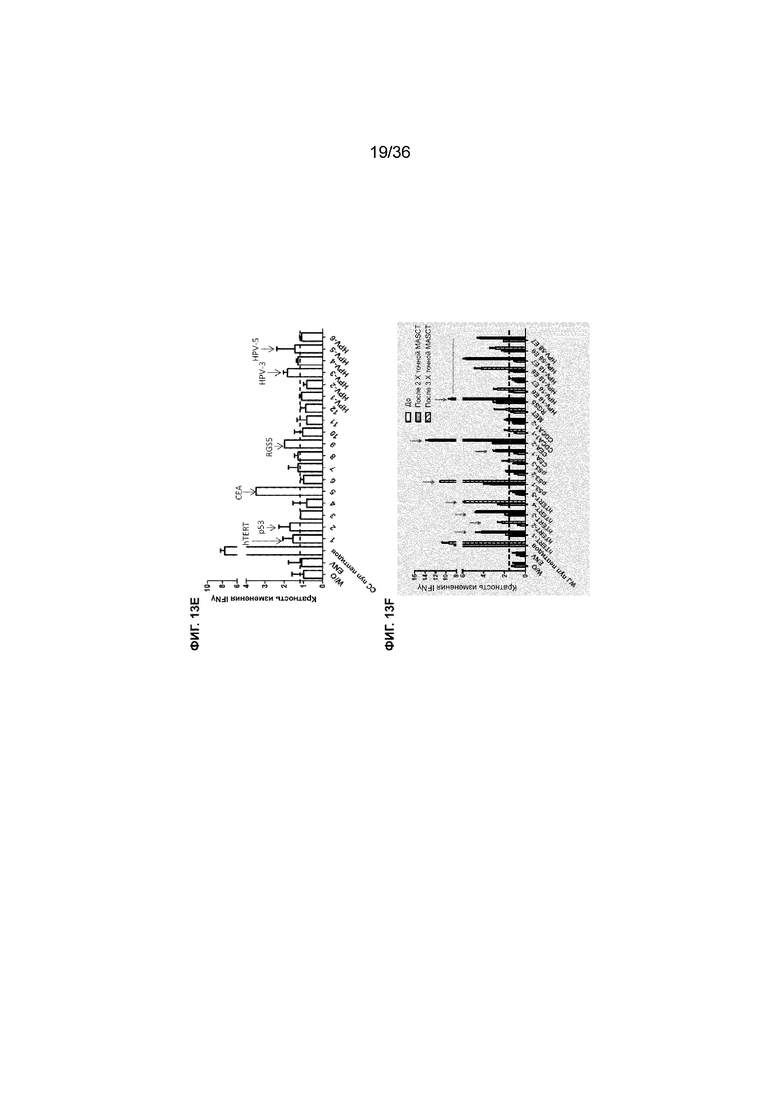
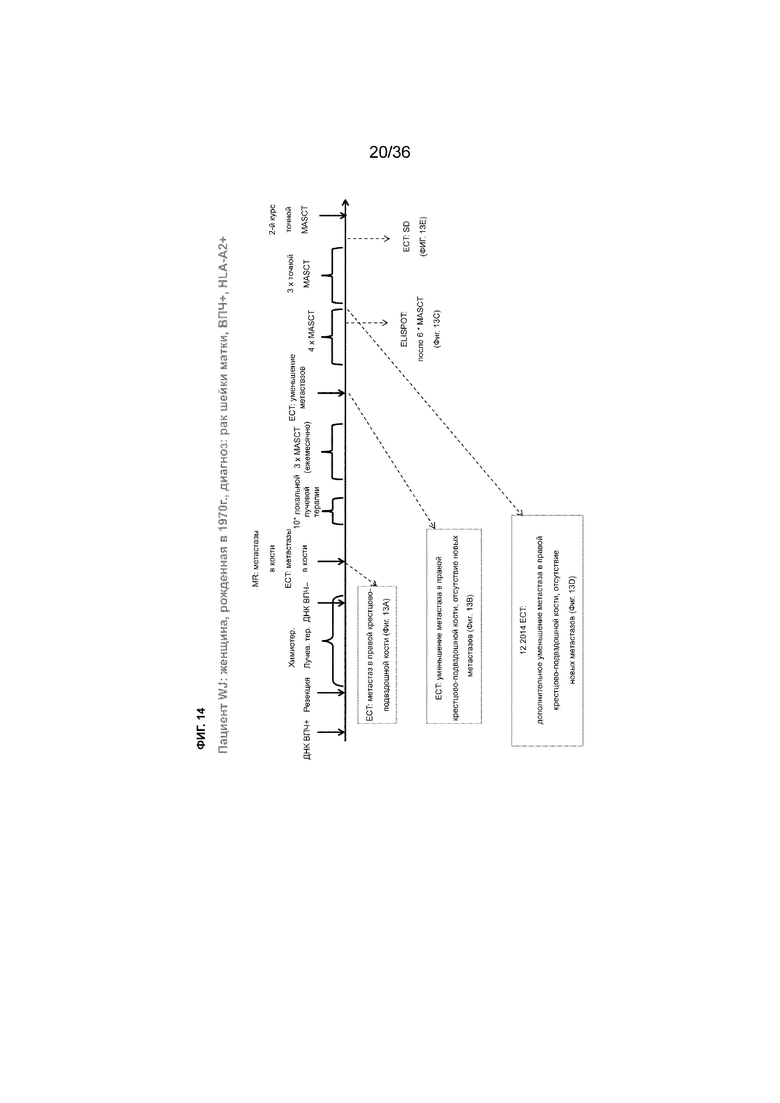
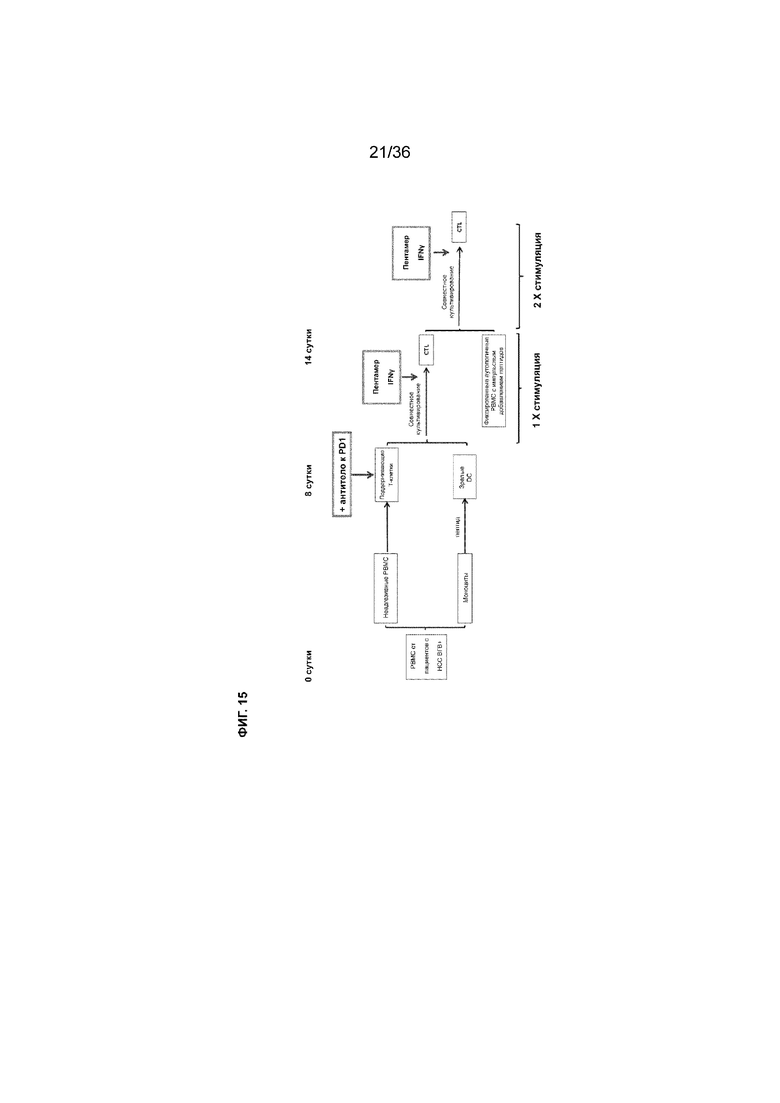
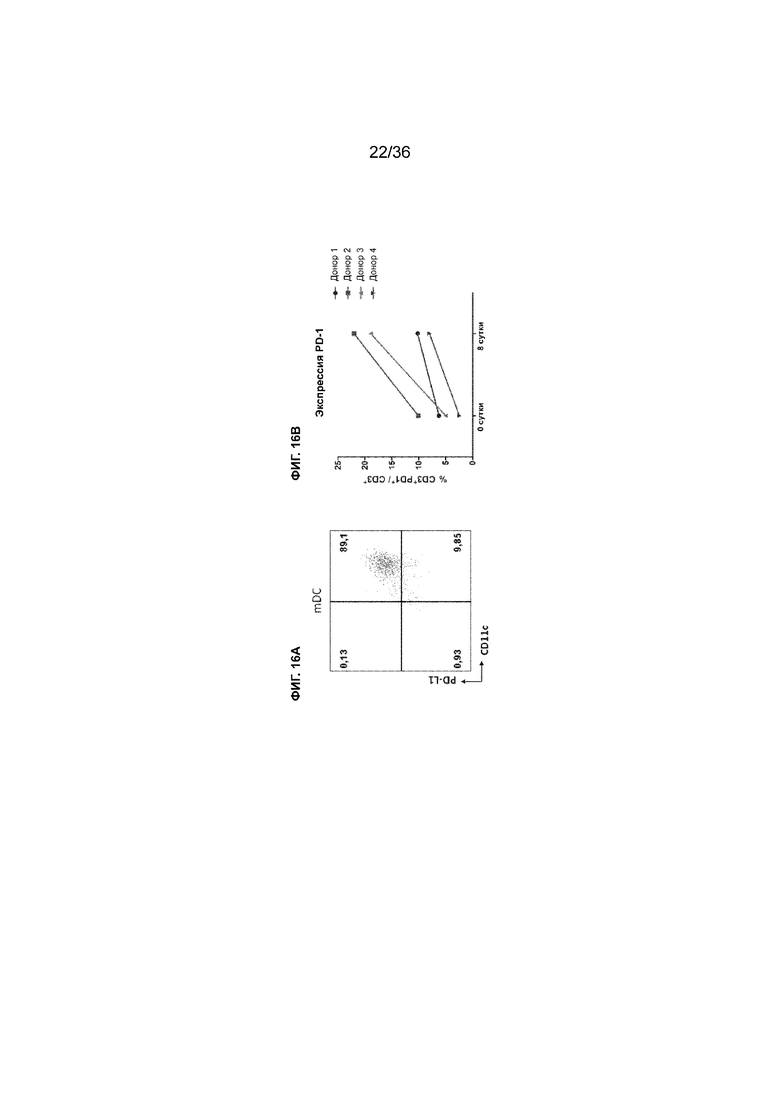
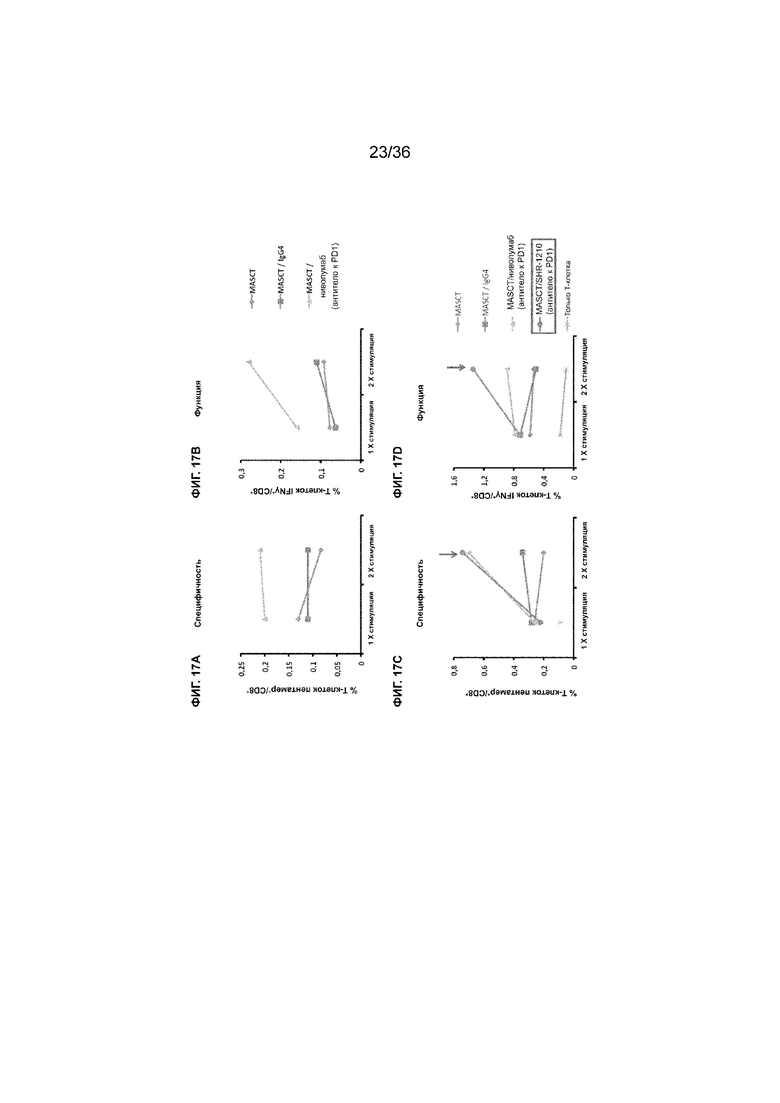
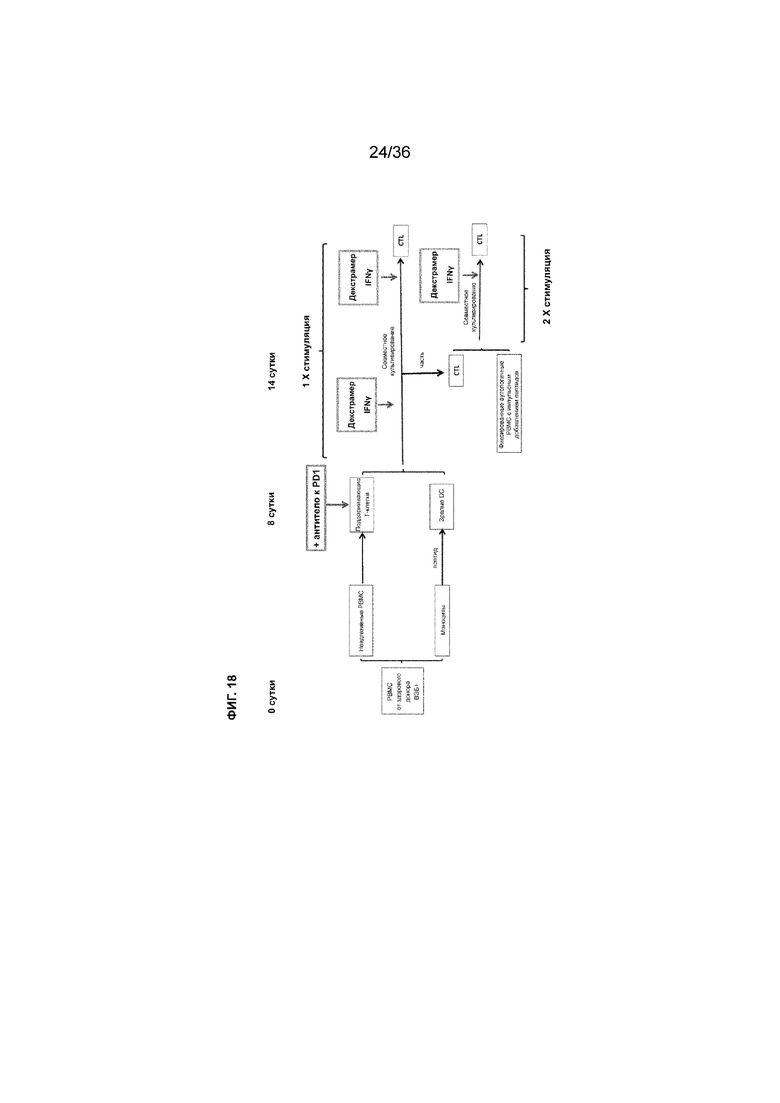

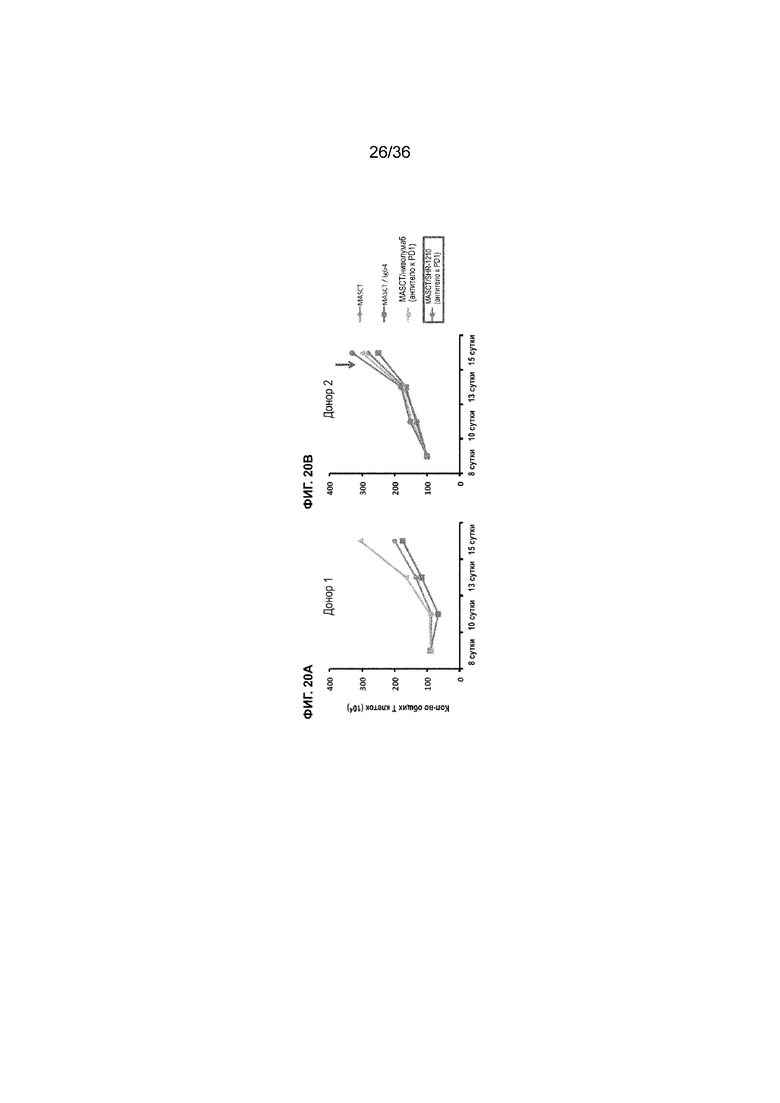
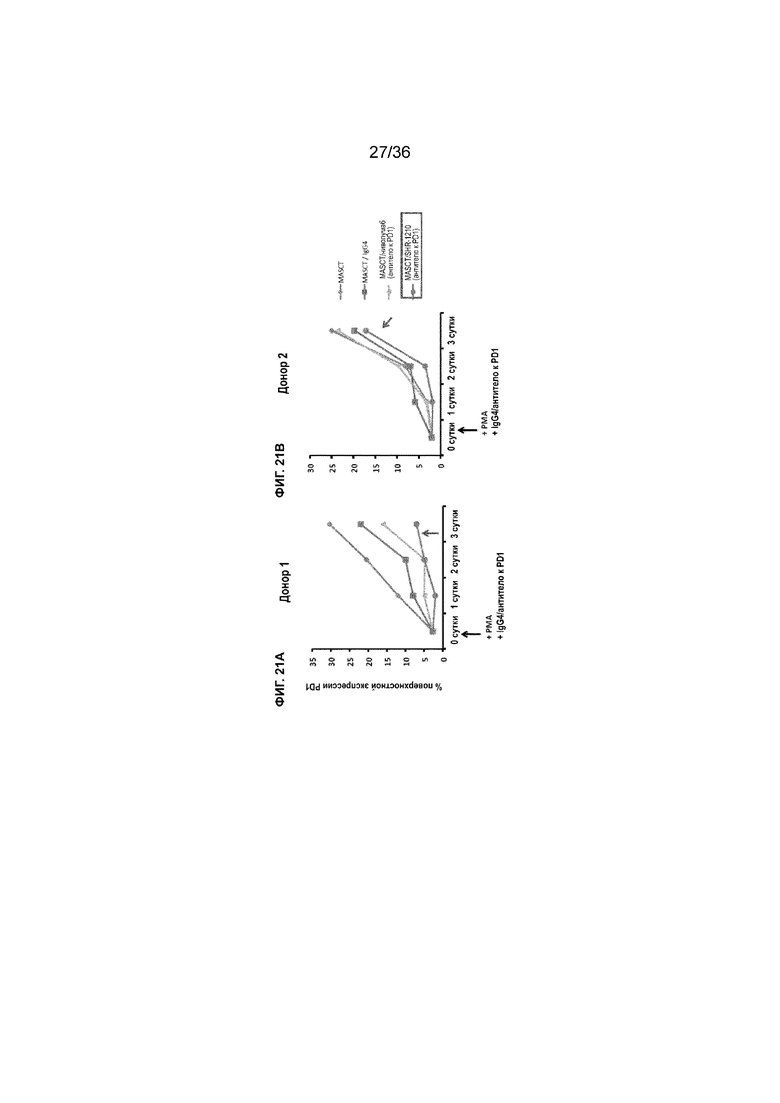

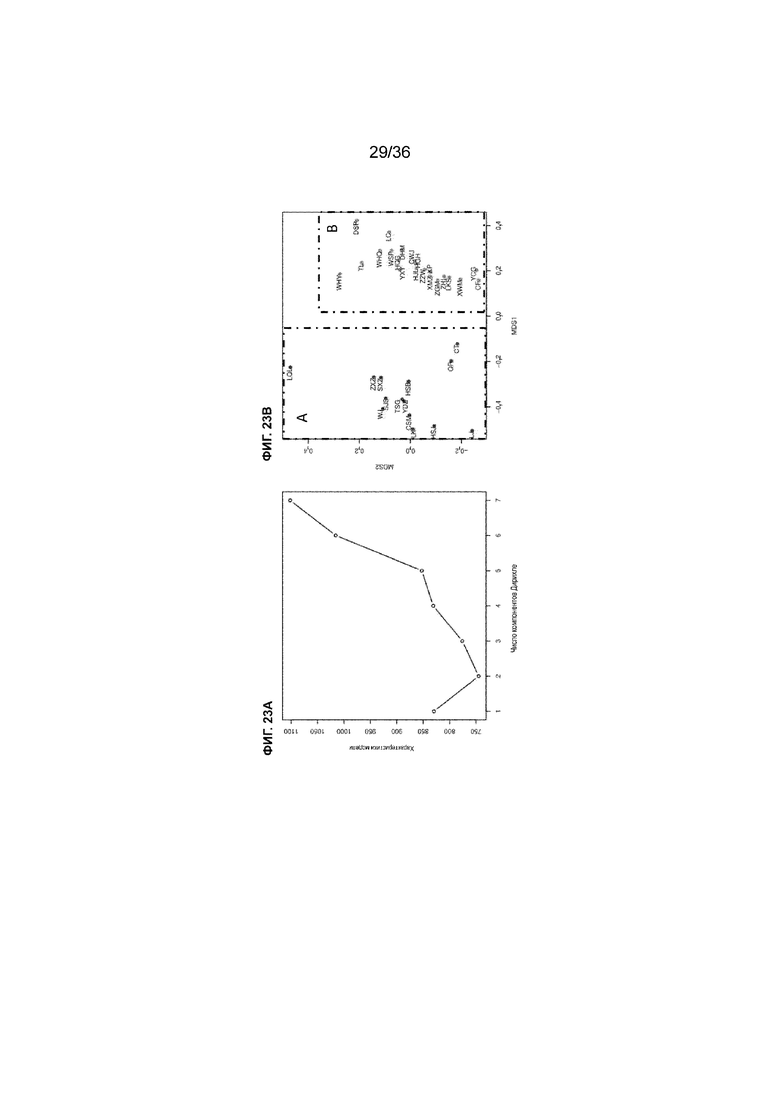

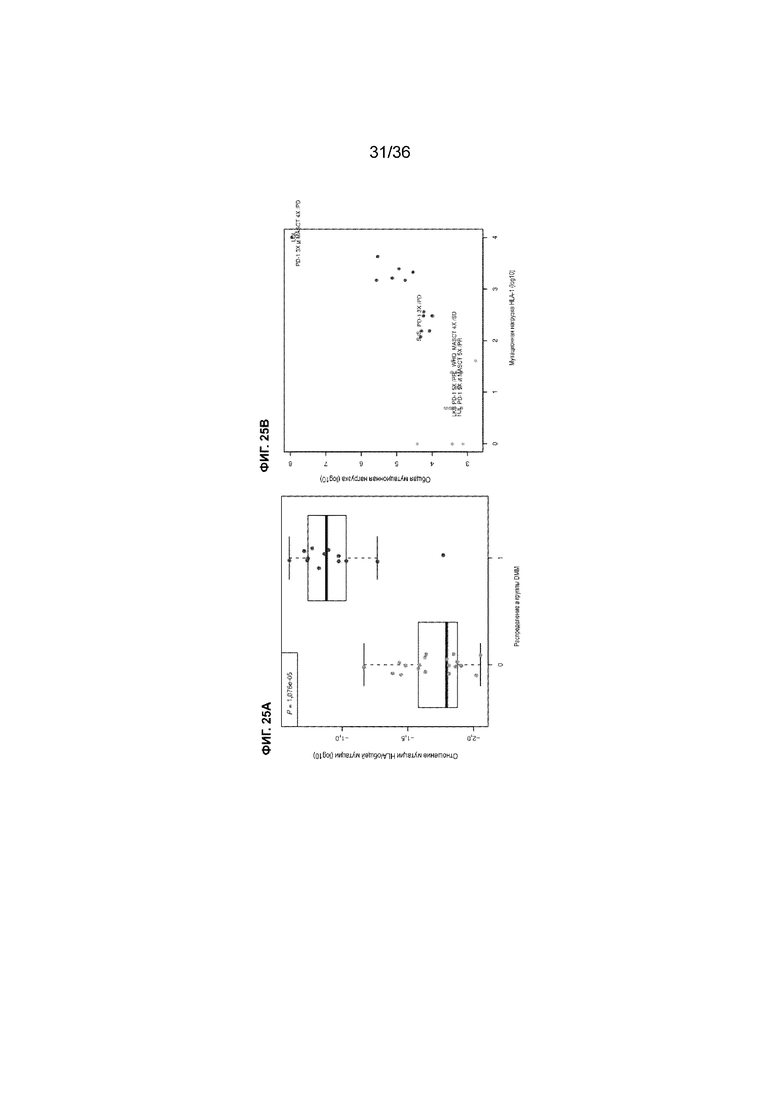





Изобретение относится к области биотехнологии, а именно к лечению рака у субъекта. Способ включает введение субъекту эффективного количества активированных T-клеток или активированных PBMC, полученных путем совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов или приведения популяции PBMC в контакт с множеством опухолевых антигенных пептидов. Изобретение позволяет расширить арсенал имеющихся технических средств. 2 н. и 67 з.п. ф-лы, 5 табл., 8 пр., 36 ил.
1. Способ лечения рака у субъекта, включающий введение субъекту эффективного количества активированных T-клеток, причем активированные T-клетки получают посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
2. Способ по п. 1, в котором субъекту ранее вводили эффективное количество дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
3. Способ по п. 1, дополнительно включающий введение субъекту эффективного количества дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
4. Способ по п. 3, в котором дендритные клетки вводят перед введением активированных Т-клеток.
5. Способ по п. 4, в котором перед введением активированных Т-клеток дендритные клетки вводят в период от приблизительно 7 суток до приблизительно 21 суток.
6. Способ по любому из пп. 1-5, который дополнительно включает получение активированных Т-клеток посредством совместного культивирования популяции Т-клеток с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
7. Способ по п. 6, в котором популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в течение периода от приблизительно 7 суток до приблизительно 21 суток.
8. Способ по любому из пп. 1-7, в котором перед совместным культивированием популяцию Т-клеток приводят в контакт с ингибитором иммунной контрольной точки.
9. Способ по любому из пп. 1-8, в котором популяцию Т-клеток совместно культивируют с популяцией дендритных клеток, загруженных множеством опухолевых антигенных пептидов, в присутствии ингибитора иммунной контрольной точки.
10. Способ по п. 8 или 9, в котором ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3.
11. Способ по любому из пп. 1-10, который дополнительно включает получение популяции дендритных клеток, загруженных множеством опухолевых антигенных пептидов.
12. Способ по п. 11, в котором популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов.
13. Способ по п. 12, в котором популяцию дендритных клеток, загруженных множеством опухолевых антигенных пептидов, получают посредством приведения популяции дендритных клеток в контакт с множеством опухолевых антигенных пептидов в присутствии композиции, которая способствует поглощению множества опухолевых антигенных пептидов дендритными клетками.
14. Способ по любому из пп. 1-13, в котором популяцию Т-клеток и популяцию дендритных клеток получают от одного и того же субъекта.
15. Способ по п. 14, в котором популяцию Т-клеток и популяцию дендритных клеток получают от субъекта, получающего лечение.
16. Способ по любому из пп. 1-15, в котором активированные Т-клетки вводят субъекту по меньшей мере три раза.
17. Способ по п. 16, в котором интервал между каждым введением активированных Т-клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
18. Способ по любому из пп. 1-17, в котором активированные Т-клетки вводят внутривенно.
19. Способ по любому из пп. 1-18, в котором активированные Т-клетки вводят в дозе по меньшей мере приблизительно 3×109 клеток/субъект.
20. Способ по п. 19, в котором активированные T-клетки вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
21. Способ по любому из пп. 2-20, в котором дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят по меньшей мере три раза.
22. Способ по п. 21, в котором интервал между каждым введением дендритных клеток составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
23. Способ по любому из пп. 2-22, в котором дендритные клетки, загруженные множеством опухолевых антигенных пептидов, вводят подкожно.
24. Способ по любому из пп. 2-23, в котором дендритные клетки вводят в дозе от приблизительно 1×106 до приблизительно 5×106 клеток/субъект.
25. Способ лечения рака у субъекта, включающий:
a) приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов с получением популяции активированных PBMC; и
b) введение субъекту эффективного количества активированных PBMC.
26. Способ по п. 25, в котором этап (a) включает приведение популяции PBMC в контакт с множеством опухолевых антигенных пептидов в присутствии ингибитора иммунной контрольной точки.
27. Способ по п. 26, в котором ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3.
28. Способ по любому из пп. 25-27, в котором активированные PBMC вводят по меньшей мере три раза.
29. Способ по п. 28, в котором интервал между каждым введением активированных PBMC составляет от приблизительно 0,5 месяца до приблизительно 5 месяцев.
30. Способ по любому из пп. 25-29, в котором активированные PBMC вводят внутривенно.
31. Способ по любому из пп. 25-30, в котором активированные PBMC вводят в дозе от приблизительно 1×109 до приблизительно 1×1010 клеток/субъект.
32. Способ по любому из пп. 1-31, в котором каждый из множества опухолевых антигенных пептидов имеет длину от приблизительно 20 до приблизительно 40 аминокислот.
33. Способ по любому из пп. 1-32, в котором множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-I.
34. Способ по любому из пп. 1-33, в котором множество опухолевых антигенных пептидов содержит по меньшей мере один пептид, содержащий эпитоп MHC-II.
35. Способ по п. 33 или 34, в котором по меньшей мере один пептид, содержащий эпитоп MHC-I или эпитоп MHC-II, дополнительно содержит дополнительные аминокислоты, фланкирующие эпитоп на N-конце, C-конце или на обоих концах.
36. Способ по любому из пп. 1-35, в котором множество опухолевых антигенных пептидов содержит первую основную группу общих опухолевых антигенных пептидов.
37. Способ по п. 36, в котором множество опухолевых антигенных пептидов дополнительно содержит вторую группу специфичных для типа рака антигенных пептидов.
38. Способ по п. 36 или 37, в котором первая основная группа содержит от приблизительно 10 до приблизительно 20 общих опухолевых антигенных пептидов.
39. Способ по п. 37 или 38, в котором вторая группа содержит от приблизительно 1 до приблизительно 10 специфичных для типа рака антигенных пептидов.
40. Способ по любому из пп. 1-39, в котором множество опухолевых антигенных пептидов содержит неоантигенный пептид.
41. Способ по п. 40, в котором неоантигенный пептид выбирают на основании генетического профиля образца опухоли, полученного от субъекта.
42. Способ по любому из пп. 1-41, в котором рак выбирают из группы, состоящей из гепатоцеллюлярной карциномы, рака шейки матки, рака легких, колоректального рака, лимфомы, рака почки, рака молочной железы, рака поджелудочной железы, рака желудка, рака пищевода, рака яичников, рака предстательной железы, рака носоглотки, меланомы и рака головного мозга.
43. Способ по любому из пп. 1-42, дополнительно включающий введение субъекту эффективного количества ингибитора иммунной контрольной точки.
44. Способ по п. 43, в котором ингибитор иммунной контрольной точки представляет собой молекулу ингибитора иммунной контрольной точки, которую выбирают из группы, состоящей из PD-1, PD-L1, CTLA-4, IDO, TIM-3, BTLA, VISTA и LAG-3.
45. Способ по любому из пп. 1-44, в котором субъекта выбирают для способа лечения на основании мутационной нагрузки в раковой опухоли.
46. Способ по любому из пп. 1-45, в котором субъект имеет низкую мутационную нагрузку в раковой опухоли.
47. Способ по п. 46, в котором субъект имеет низкую мутационную нагрузку в одном или более генах MHC.
48. Способ по п. 47, в котором субъект имеет не более приблизительно 10 мутаций в одном или более генах MHC.
49. Способ по п. 47 или 48, в котором субъект не имеет мутации в B2M.
50. Способ по любому из пп. 47-49, в котором субъект не имеет мутации в функциональных областях одного или более генов MHC.
51. Способ по любому из пп. 45-50, в котором мутационную нагрузку рака определяют посредством секвенирования образца опухоли, полученного от субъекта.
52. Способ по любому из пп. 1-51, в котором субъекта выбирают для способа лечения на основании наличия одного или более неоантигенов в раковой опухоли.
53. Способ по любому из пп. 1-52, в котором субъект имеет по меньшей мере 5 неоантигенов.
54. Способ по п. 52 или 53, дополнительно включающий идентификацию ракового неоантигена и встраивание неоантигенного пептида во множество опухолевых антигенных пептидов, причем неоантигенный пептид содержит в неоантигене неоэпитоп.
55. Способ по любому из пп. 52-54, в котором неоантиген идентифицируют посредством секвенирования образца опухоли, полученного от субъекта.
56. Способ по п. 55, в котором указанное секвенирование представляет собой целевое секвенирование связанных с раком генов.
57. Способ по любому из пп. 52-54, дополнительно включающий определение аффинности неоэпитопа к молекуле MHC.
58. Способ по п. 57, дополнительно включающий определение аффинности комплекса, содержащего неоэпитоп и молекулу MHC, к Т-клеточному рецептору.
59. Способ по п. 57 или 58, в котором молекула MHC представляет собой молекулу MHC класса I.
60. Способ по любому одному из пп. 57-59, в котором молекулу MHC получают от субъекта.
61. Способ по любому из пп. 1-60, дополнительно включающий наблюдение за субъектом после введения активированных Т-клеток или активированных PBMC.
62. Способ по п. 61, в котором наблюдение включает определение у субъекта количества циркулирующих опухолевых клеток (CTC).
63. Способ по п. 61 или 62, в котором наблюдение включает обнаружение у субъекта специфического иммунного ответа против множества опухолевых антигенных пептидов.
64. Способ по п. 63, в котором множество опухолевых антигенных пептидов регулируют на основе специфического иммунного ответа для обеспечения множества специализированных опухолевых антигенных пептидов.
65. Способ по п. 64, в котором способ лечения повторяют с применением множества специализированных опухолевых антигенных пептидов.
66. Способ по любому из пп. 1-65, в котором субъект представляет собой субъекта-человека.
67. Способ по любому из пп. 1-66, где множество опухолевых антигенных пептидов имеет заранее определенные аминокислотные последовательности.
68. Способ по любому из пп. 1-67, где множество опухолевых антигенных пептидов являются синтетическими.
69. Способ по любому из пп. 1-68, где концентрация каждого опухолевого антигенного пептида в множестве опухолевых антигенных пептидов составляет приблизительно 0,1-200 мкг/мл.
| NUI H., et al | |||
| "Experimental and Clinical Research of Dendritic Cell and Syngeneic Immunotherapy of Brain Glioma", Chinese-German J Clin Oncol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| WO 200057705 A1, 05.10.2000 | |||
| WO 2011028531 A1, 10.03.2011 | |||
| ЦЫГАН В.Н | |||
| "Иммунная система против рака", Обзоры по клин | |||
| фармаков | |||
| и лек | |||
| терапии., 2004; | |||
Авторы
Даты
2020-08-06—Публикация
2016-03-11—Подача