Изобретение относится к медицине, а именно к пульмонологии и может быть использовано для диагностики аутоиммунного воспаления у впервые выявленных больных саркоидозом с целью назначения коррекции терапии.
Поиск характерных признаков аутоиммунного воспаления при саркоидозе привел к выявлению различных антител (антимитохондриальных антител, антиядерных антител, ревматоидного фактора, антител к виментину и т.д.) (Kobak S., 2015; Zissel G., 2016). Результаты проведенных исследований послужили поводом для изучения эффективности препаратов, применяемых в терапии ревматологической патологии, в том числе ингибиторов ФНО-альфа (инфиликсимаба, адалимумаба) и цитостатических препаратов (метотрексата, лефлуномида, азатиоприна) при саркоидозе легких (Визель А.А., 2019; Le V., 2018; Patterson K., 2018).
В последние несколько лет в качестве наиболее значимого аутоантигена стал рассматриваться виментин, филаментный белок, экспрессируемый во всех мезенхимальных клетках. Возникновение аутоантител к данному белку описано в патогенезе ревматоидного артрита, системной красной волчанки и многих других заболеваний соединительной ткани. Показано, что виментин у больных с саркоидозом может выступать как аутоантиген для Т-клеток, в особенности при гаплотипе HLA-DRB1*03, наличии Vα2.3/Vβ22 Т-клеточного рецептора или при развитии синдрома Лефгрена. Однако, виментин также может играть роль и в аутоиммунном ответе, опосредованном В-клетками, что делает его изучение важным для больных с аутоиммунной патологией (Kinloch A.J. et al, 2018). Важно отметить, что модификация данного белка (цитруллинирование, ацетилирование и др.) обладает особенной иммуногенной активностью, что находит подтверждение в современной литературе (Musaelian A. et al, 2018).
Наиболее близкой к предполагаемому изобретению является работа (In Situ Humoral Immunity to Vimentin in HLA-DRB1*03+ Patients With Pulmonary Sarcoidosis /Andrew J. Kinloch, Ylva Kaiser, Don Wolfgeher, Junting Ai, Anders Eklund, Marcus R. Clark, Johan Grunewald // Frontiers in Immunology. - 2018 - Vol. 9, №9. - P. 1516), авторы которой проводили комплексное клиническое, лабораторное, инструментальное обследование больных с острой формой саркоидоза (с-м Лефгрена), где определяли уровень аутоантител к виментину без модификаций основываясь на его показателях в крови принятых у больных ревматоидным артритом, а также жидкости промывных вод бронхов в сочетании с уровнем В-клеток в жидкости промывных водах бронхов и сопоставляли данные с особенностями распределения аллелей HLA-DRB1*. Полученные коллегами данные могут иметь диагностическую ценность только для больных с острым началом заболевания, которое не требует назначения какой-либо терапии. Таким образом, необходимость проведения эндоскопического исследования, получение данных об уровне виментина в бронхоальвеолярном лаваже, уровне В-клеток и генотипирования неоправданно трудоемок без какой-либо практической значимости для пациентов.
В настоящее время не разработано четких критериев диагностики аутоиммунного воспаления у впервые выявленных больных саркоидозом. До настоящего времени подобный способ не применялся.
Задачей предлагаемого изобретения является разработка способа диагностики аутоиммунного воспаления у впервые выявленных больных саркоидозом с целью назначения патогенетической терапии.
Задача решается за счет того, что в периферической крови пациентов определяют уровень аутоантител к модифицированному цитруллинированному виментину и уровень В клеток и при повышении уровня аутоантител к виментину от 10 ед/мл и выше, а уровня CD5+CD27 более 12,45% и соотношения наивных В клеток к клеткам памяти более 2:1, диагностируют аутоиммунное воспаление, требующее назначения патогенетического лечения.
Способ иллюстрируется чертежами. Фиг. 1 - ROC кривая для пациентов с саркоидозом относительно групп сравнения и контроля. Фиг. 2 - Повышение числа CD5+CD27- и снижение числа CD27+ клеток памяти В клеток у больных саркоидозом.
Пошаговый протокол исследования.
Этап I: регистрация аутоатител к модифицированному цитруллинированному виментину.
У пациентов проводится забор крови в вакуумную пробирку с активатором свертывания сыворотки без наполнителя проводится забор 6 мл венозной крови в утреннее время, до приема пищи, для определения уровня аутоантител к модифицированному цитруллинированному виментину (анти-MCV). Антитела к модифицированному цитруллинированному виментину определяются с помощью метода иммуноферментного анализа. Положительным результатом теста является обнаружение анти-MCV более 10,5 Ед / мл.
Этап II: проведение иммунофенотипирования В-клеток периферической крови.
200 мкл цельной периферической крови окрашивались на поверхностные антигены при помощи следующей панели моноклональных антител, конъюгированных с флуорохромами: anti-IgD Alexa Fluor 488 (clone IA6-2, isotype - Mouse IgG2a, κ), anti-CD38 PE (clone LS198-4-3, isotype - IgG1 Mouse), anti-CD 183 (CXCR3) PE/Dazzle™ 594 (clone G025H7, isotype - Mouse IgG1, κ), anti-CD27 PC7 (clone 1A4CD27, isotype - IgG1 Mouse), anti-CD24 APC (clone J3-119, isotype - IgG1 Mouse), anti-CD19 APC/Cy7 (clone HIB19, isotype - Mouse IgG1, κ), anti-CD5 Pacific Blue (clone BLla, isotype - IgG2a Mouse) и anti-CD45 Krome Orange (clone J33, isotype - IgG1 Mouse). Использовались моноклональные антитела против IgD, CXCR3 и CD 19 производства BioLegend, Inc. (USA), а против CD38, CD27, CD24, CD5 и CD45 производства Beckman Coulter, Inc (USA). После инкубации с антителами при комнатной температуре в темноте в течение 10 минут проводился лизис эритроцитов при помощи 2 мл VersaLyse Lysing Solution (Beckman Coulter, Inc., USA) с добавлением 50 мкл IOTest 3 Fixative Solution (Beckman Coulter, Inc., USA) в течение 15 минут. После этого клетки дважды отмывали избытком забуференного фосфатами физиологического раствора (ЗФР) (центрифугирование 7 min 330 g), содержащего 2% термоинактивированной сыворотки крупного рогатого скота (Sigma-Aldrich, USA) ресуспендировали в 0.5 мл ЗФР, содержащего 2% формалина (Sigma-Aldrich, USA). Анализ образцов проводился при помощи проточного цитофлуориметра Navios (Beckman Coulter, Inc., USA), оснащенного тремя лазерам с длинами волн излучени 405, 488 and 638 нм. В каждом образце анализировалось не менее 5000 CD19+ В-клеток. Тактика гейтирования для выделения субпопуляций В-клеток. Полученные данные анализировались при помощи программного обеспечения Kaluza software (Beckman Coulter, Inc., USA).
Этап III: анализ полученных результатов.
Выявление уровня аутоантител к модифицированному цитруллинированному виментину от 10 ед/мл и выше в сочетании с высоким уровнем В клеток CD5+CD27- более 12,45% и изменением соотношения наивных В клеток к клеткам памяти более 2:1 свидетельствует об аутоиммунном характере воспаления у больных саркоидозом.
Техническим результатом предлагаемого способа является то, что на базе ФГБУ «Санкт-Петербургский НИИ фтизиопульмонологии» Минздрава РФ и СПб ГБУЗ «Городская многопрофильная больница №2» обследовано 270 пациентов, которые были распределены на четыре группы: I основная группа (n=114) - больные с впервые выявленным саркоидозом легких II стадии (СЛ); II группа (n=55) - пациенты с неспецифическими заболеваниями легких: с хроническим обструктивным бронхитом (ХОБЛ) (n=25); с гранулематозным полиангиитом (n=15); с различными альвеолитами (n=15) и группа контроля (n=41) - здоровые лица. Все включенные участники дали информированное согласие на участие в исследование и хранение биологического материла.
Все пациенты прошли стандартный комплекс обследования, включающий: оценку анамнеза жизни, клинической симптоматики, результатов иммунологических тестов, результаты мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки, бактериологического обследования для выявления микобактерий туберкулеза (МБТ), молекулярно-генетических методов определения ДНК МБТ, гистологической верификации патологических изменений в легких и/или внутригрудных лимфатических узлах по показаниям с применением чрезбронхиальной биопсии легочной ткани, видеоторакоскопической биопсии легочной ткани и/или ткани лимфатического узла, биопсии лимфатических узлов с применением метода чрезбронхиальной биопсии под контролем ультразвука (EBUS).
В сыворотке всех включенных в исследование участников был определен уровень антител к модифицированному цитрулинированному виментину (modified citrullinated Vimentin, anti-MCV). Антитела к anti-MCV определялись с применением ELISA (ORGENTEC, Germany). Все измерения были выполнены с помощью планшетного ИФА спектрофотометра BIO-TEK ELx800.
Проводилось иммунофенотипирования В-клеток периферической крови. 200 мкл цельной периферической крови окрашивались на поверхностные антигены при помощи следующей панели моноклональных антител, конъюгированных с флуорохромами: anti-IgD Alexa Fluor 488 (clone IA6-2, isotype - Mouse IgG2a, κ), anti-CD38 PE (clone LSI98-4-3, isotype - IgG1 Mouse), anti-CD183 (CXCR3) PE/Dazzle™ 594 (clone G025H7, isotype -Mouse IgG1, κ), anti-CD27 PC7 (clone 1A4CD27, isotype - IgG1 Mouse), anti-CD24 APC (clone J3-119, isotype - IgG1 Mouse), anti-CD19 APC/Cy7 (clone HIB19, isotype - Mouse IgG1, κ), anti-CD5 Pacific Blue (clone BLla, isotype - IgG2a Mouse) и anti-CD45 Krome Orange (clone J33, isotype - IgG1 Mouse). Использовались моноклональные антитела против IgD, CXCR3 и CD19 производства BioLegend, Inc. (USA), а против CD38, CD27, CD24, CD5 и CD45 производства Beckman Coulter, Inc (USA). После инкубации с антителами при комнатной температуре в темноте в течение 10 минут проводился лизис эритроцитов при помощи 2 мл VersaLyse Lysing Solution (Beckman Coulter, Inc., USA) с добавлением 50 мкл IOTest 3 Fixative Solution (Beckman Coulter, Inc., USA) в течение 15 минут. После этого клетки дважды отмывали избытком забуференного фосфатами физиологического раствора (ЗФР) (центрифугирование 7 min 330 g), содержащего 2% термоинактивированной сыворотки крупного рогатого скота (Sigma-Aldrich, USA) ресуспендировали в 0.5 мл ЗФР, содержащего 2% формалина (Sigma-Aldrich, USA). Анализ образцов проводился при помощи проточного цитофлуориметра Navios (Beckman Coulter, Inc., USA), оснащенного тремя лазерам с длинами волн излучени 405, 488 and 638 нм. В каждом образце анализировалось не менее 5000 CD19+ В-клеток. Тактика гейтирования для выделения субпоплуяций В-клеток представлена на рисунке 1 приложения. Полученные данные анализировались при помощи программного обеспечения Kaluza software (Beckman Coulter, Inc., USA).
При анализе уровня антител к anti-MCV при использовании стандартных значений (более 20 ед/мл) высокий уровень антител определяется достоверно часто у больных саркоидозом по сравнению с группой контроля (табл. 1).
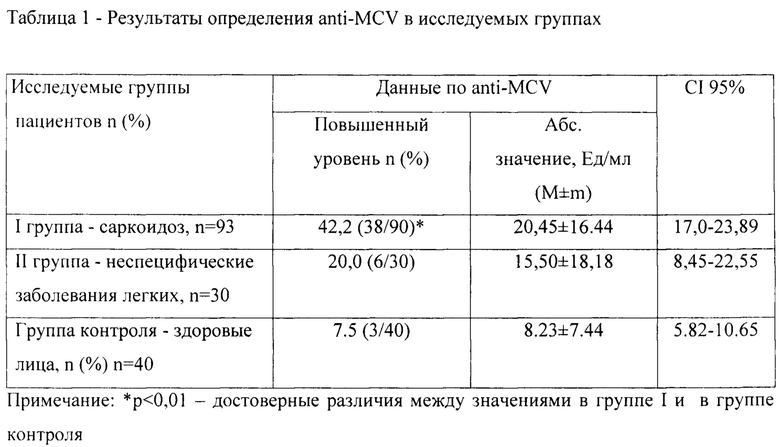
Однако расчет показателей проводился с применением стандартных значений уровня anti-MCV, принятых для больных с ревматоидным артритом. Далее нами впервые проведен расчет данного показателя с применением ROC-анализа для пациентов с саркоидозом (AUC=0.8), согласно результатам которого значения anti-MCV для данных заболеваний были в два раза ниже принятых значений (от 10 Ед/мл и выше).
Согласно ROC анализу сравнения группы пациентов с саркоидозом относительно группы сравнения и контроля для пациентов с саркоидозом можно выделить cut-off для anti-MCV от 10 ед/мл, что в два раза ниже общепринятых значений (диагностическая чувствительность - 77%, диагностическая специфичность - 70%) (Фиг. 1).
Результаты определения anti-MCV с использованием референтного значения от 10 ед/мл представлены в таблице 2.
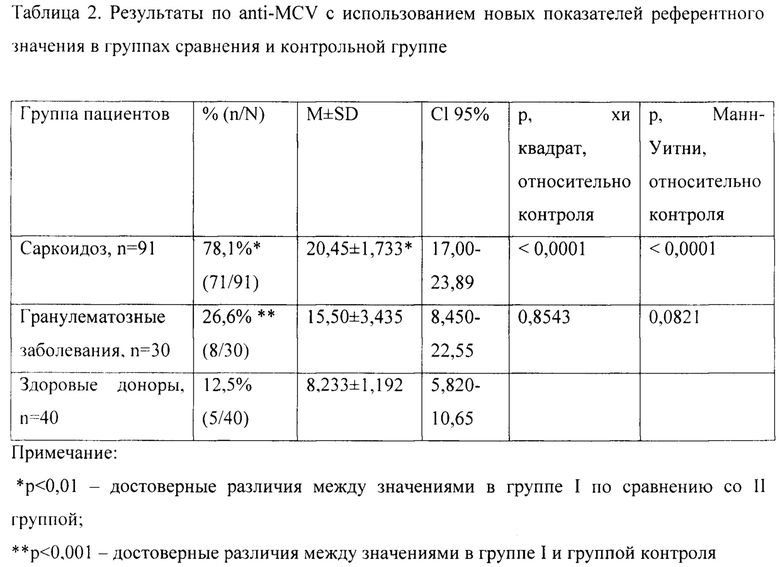
Как видно из табл. 2, отмечаются достоверные различия между уровнем anti-MCV в группах. При этом у больных саркоидозом высокий уровень антител определялся в два раза выше с применением новых референтных значений (78,1% против 42,2%).
Поскольку В-клетки являются одним из значимых критериев определения аутоиммунного воспаления, нами проведен анализ субпопуляционного состава В-клеток.
На следующем этапе было выделено несколько субпопуляций В-клеток памяти (клетки памяти с непереключенным классом синтезируемых антител («unswitched» IgD+CD27+), клетки памяти с переключенным классом синтезируемых антител («class-switched» memory cells, IgD-CD27+) и, так называемые, «дважды-негативные» клетки памяти (IgD-CD27-)).
Было обнаружено, что у больных саркоидозом имеется повышенный уровень В-регуляторных клеток с фенотипом CD5+CD27- по сравнению с группой контроля (17,41% (CI 95% 12,28 - 21,45) и 8,21% (CI 95% 5,55 - 12,01), соответственно, р<0,001) (Фиг. 2).
Для саркоидоза диагностически значимым фактором является повышение уровня В-клеток CD5+CD27- более 12,45% (диагностическая чувствительность - 91,0%, диагностическая специфичность - 88,0%) и изменение соотношения «наивных» В-клеток к клеткам памяти более 2:1, что характеризует аутоиммунный характер воспаления.
Примеры использования предлагаемого способа. Клинический пример 1.
Пациентка К., женщина 34 лет, амбулаторно обратилась к пульмонологу в феврале 2017 г. с жалобами на повышение температуры до 37,2 С, слабость, утомляемость, кашель с небольшим количеством прозрачной мокроты, боли в голеностопных и коленных суставах, отеки голеней, явления узловатой эритемы на передней поверхности голеней. При спиральной компьютерной томографии органов грудной клетки от 13.02.17 г. выявлена двусторонняя симметричная внутригрудная лимфаденопатия (паратрахеальные лимфатические узлы до 9*18 мм, трахеобронхиальные до 11*18 мм, бифуркационные до 19 мм. В S2, S10 правого легкого и S3, S10 левого легкого выявлены очаги по типу матового стекла, в S3 правого легкого единичный перибронховаскулярный очаг с четкими неровными контурами размерами 5*8 мм.
Выполнено обследование для исключения туберкулезной инфекции: диаскинтест - отрицательный, проба Манту с 2 ТЕ - р 5 мм, исследование мокроты с применением лабораторных и молекулярно-генетических методов, микобактерий туберкулеза не выявило (микроскопия, ПЦР на ДНК МБТ, посев) отрицательное. На основании клинико-рентгенологической картины, отсутствия признаков туберкулезной инфекции, пациентке был установлен диагноз саркоидоз легких, 2 стадия. При анализе медицинской истории выявлено наличие отягощенного аллергического анамнеза (поллиноз). Наследственный анамнез отягощен по аутоиммунным заболеваниям - мать пациентки страдает эозинофильным гранулематозным васкулитом (синдром Чердж-Стросса).
При оценке возможного влияния триггерных факторов было выявлено, что в ноябре 2016 году пациентке были установлены силиконовые импланты молочных желез, в июле 2016 года выполнены инъекции гиалуроновой кислоты.
Пациентка была дополнительно обследована с забором крови и определением уровня аутоантител исследовании сыворотки крови было обнаружено повышение уровня модифицированного цитруллинированного виментина (19 ед/мл), уровень В клеток CD5+CD27- более 14,7% и изменение соотношения наивных В клеток наивных к клеткам памяти 70% к 30%, что соответствовало критерию 2:1. Также у больной диагностировано повышение уровня ревматоидного фактора (до 55,12 МЕ/мл, при норме до 14 МЕ/мл).
Совокупность полученных данных свидетельствовала о наличии аутоиммунного воспаления, что потребовало назначения гормональной терапии.
Контрольное обследование через 3 месяца от начала заболевания показало регресс узловатой эритемы, лихорадки, суставного синдрома, уменьшение выраженности изменений в легких, при этом сохранялась утомляемость, постуральная гипотензия, присоединилось снижение веса на 6 кг за 3 месяца. Далее к 6 месяцам лечения получена положительная динамика. Клинический пример 2.
Пациент М., мужчина 28 лет, был направлен к пульмонологу в ноябре 2018 г. С изменениями на рентгенограмме грудной клетки в виде увеличения внутригрудных лимфатических узлов средостения и очаговыми изменениями в легких. При спиральной компьютерной томографии органов грудной клетки от 27.05.18 г. выявлена реакция паравазальной и бифуркационной группы лимфоузлов средостения с единичными очагами в левом и правом легком размерами 6*8 мм.
Выполнено обследование для исключения туберкулезной инфекции: диаскинтест - отрицательный, проба Манту с 2 ТЕ - отрицательная, исследование мокроты с применением лабораторных и молекулярно-генетических методов, микобактерий туберкулеза не выявило (микроскопия, ПЦР на ДНК МБТ, посев) отрицательное. На основании клинико-рентгенологической картины, отсутствия признаков туберкулезной инфекции был установлен диагноз саркоидоз легких 2 стадии. Аллергологический анамнез не отягощен, не курит. Наследственный анамнез по аутоиммунным заболеваниям не отягощен.
Данные обследования: уровень антител к anti-MCV был 7 ед/мл, уровень В клеток CD5+CD27- более 10,5% и соотношение наивных В клеток наивных к клеткам памяти составил 45% к 37%, что соответствовало примерно 1:1 - не свидетельствуют о наличии аутоиммунного воспаления.
Пациенту рекомендовано наблюдение в динамике без назначения терапии. При контрольном обследовании через три месяца было выявлено значительное уменьшение размеров внутригрудных лимфатических узлов без очаговых изменений в легких. Через 6 месяцев после выявления у пациента не отмечалось изменений в легких и во внутригрудных лимфатических узлах.
Список источников.
1. Фтизиатрия. Национальные клинические рекомендации / под ред. П.К. Яблонского. - М.: ГЭОТАР-Медиа, 2016. - 240 с.
2. Arango M, Perricone С, Kivity S, Cipriano E, Ceccarelli F, Valesini G, Shoenfeld Y. HLA-DRB1 the notorious gene in the mosaic of autoimmunity. Immunol Res. 2017; 65(1):82-98.
3. Ang SC, Moscovic EA. Cross-reactive and species specific Mycobacterium tuberculosis antigens in the immunoprofile of Schaumann bodies: a major clue to the etiology of sarcoidosis. Histol Histopathol. 1996; 11(1): 125-34.
4. Cain H, Kraus B. Immunofluorescence microscopic demonstration of vimentin filaments in asteroid bodies of sarcoidosis. A comparison with electron microscopic findings. Virchows Arch В Cell Pathol Incl Mol Pathol. 1983; 42(2): 213-26.
5. Chen ES,  Song Z, Willett MH,
Song Z, Willett MH,  , Yung RC, West EE, McDyer JF. Zhang Y, Eklund A, Grunewald J, Moller DR. T Cell Responses to Mycobacterial Catalase-Peroxidase Profile a Pathogenic Antigen in Systemic Sarcoidosisl J Immunol. 2008; 181(12): 8784-8796.
, Yung RC, West EE, McDyer JF. Zhang Y, Eklund A, Grunewald J, Moller DR. T Cell Responses to Mycobacterial Catalase-Peroxidase Profile a Pathogenic Antigen in Systemic Sarcoidosisl J Immunol. 2008; 181(12): 8784-8796.
6. Elkington P, Tebruegge M, Mansour S. Tuberculosis: an Infection-Initiated Autoimmune Disease? Trends Immunol. 2016; 37(12): 815-818.
7. Elkayam O, Caspi D, Lidgi M, Segal R. Auto-antibody profiles in patients with active pulmonary tuberculosis. Int J Tuberc Lung Pis. 2007 Mar;11(3):306-10.
8. Ribeiro FM, Goldenberg T. Mycobacteria and autoimmunity. Lupus. 2015; 24: 374-381.
9. Fagan EA, Moore-Gillon JC, Turner-Warwick M. Multiorgan granulomas and mitochondrial antibodies. J Med 1983; 308:572-75.
10. Mariya V. Samsonova A, Chernyaev L. Granulomatous lung diseases Pulmonology. 2017; 27 (2): 250-261.
11. Musaelyan A, Lapin S, Nazarov V, Tkachenko O, Gilburd B, Mazing A, Mikhailova L. Shoenfeld Y. Vimentin as antigenic target in autoimmunity: a comprehensive review. Autoimmun Rev. 2018;17(9):926-934.
12. Scadding JG. Mycobacterium tuberculosis in the aetiology of sarcoidosis. BMJ 1960; 2:1617-1623
13.Sester M, Kampmann B. What defines latent infection with Mycobacterium tuberculosis in patients with autoimmune diseases? Thorax. 2016; Vol 71: 64-72.
14. Shapira Y, Agmon-Levin N, Shoenfeld Y. Mycobacterium Tuberculosis, Autoimmunity, and Vitamin DClinic Rev Allerg Immunol. 2010. 38:169-177.
15. Shoenfeld Y, Vilner Y, Coates ARM, Rauch J, Lavie G, Shaul D, Pinkhas J. Monoclonal antituberculosis antibodies react with DNA, and monoclonal anti-DNA autoantibodies react with Mycobacterium tuberculosis. Clin. exp. Immunol. (1986) 66, 255-261.
16. Valesini G, Gerardi MC, Iannuccelli C, Pacucci VA, Pendolino M, Shoenfeld Y. Review Citrullination and autoimmunity. Autoimmun Rev. 2015; 14(6): 490-7.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ПУЗЫРЧАТКИ У МЫШЕЙ МЕТОДОМ ВВЕДЕНИЯ ИММУНОГЛОБУЛИНОВ КЛАССА G | 2015 |
|
RU2613718C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АУТОАНТИТЕЛ К ТРОМБОЦИТАМ | 2012 |
|
RU2488114C1 |
| СПОСОБ ДИАГНОСТИКИ РЕВМАТОИДНОГО АРТИРИТА ПО НАЛИЧИЮ АНТИТЕЛ К МОДИФИЦИРОВАННОМУ ЦИНТРУЛЛИНИРОВАННОМУ ВИМЕНТИНУ (Anti-MCV) В РОТОВОЙ ЖИДКОСТИ | 2012 |
|
RU2523413C1 |
| Способ прогнозирования развития рецидива при медикаментозном лечении болезни Грейвса | 2021 |
|
RU2778614C1 |
| Способ определения конверсии молекулярно-биологического подтипа совокупности циркулирующих опухолевых клеток относительно молекулярно-биологического подтипа первичной опухоли у больных раком молочной железы | 2022 |
|
RU2797698C1 |
| Способ прогнозирования длительности безметастатического периода у больных инвазивной карциномой молочной железы неспецифического типа | 2024 |
|
RU2838685C1 |
| Способ определения и оценки местного иммунитета у больных псориазом | 2022 |
|
RU2804243C1 |
| Способ дифференциальной диагностики системной красной волчанки и болезни Шегрена | 2023 |
|
RU2817079C1 |
| Способ диагностики аллергической бронхиальной астмы | 2021 |
|
RU2780687C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЕЛЕКТИВНОГО ИММУНОСОРБЕНТА ДЛЯ УДАЛЕНИЯ АНТИТЕЛ-IgG К ДЕСМОГЛЕИНУ 3 ТИПА ИЗ СЫВОРОТКИ КРОВИ БОЛЬНЫХ ПУЗЫРЧАТКОЙ | 2015 |
|
RU2622005C2 |

Изобретение относится к области медицины, а именно к пульмонологии, и предназначено для диагностики аутоиммунного воспаления у впервые выявленных больных саркоидозом. Способ заключается в определении уровня аутоантител к модифицированному цитруллинированному виментину (анти-MCV) и уровня В-клеток. При повышении анти-MCV от 10 ед./мл и выше, а уровня CD5+CD27 - более 12,45% и при изменении соотношения наивных В-клеток к клеткам памяти более 2:1 диагностируют аутоиммунное воспаление. Использование изобретения обеспечивает высокий уровень специфичности (88%) и чувствительности (91%) и позволяет своевременно назначить больному патогенетическую терапию, что улучшит течение заболевания, предотвратит хроническое течение и снизит число рецидивов. 2 ил., 2 табл., 2 пр.
Способ диагностики аутоиммунного воспаления у впервые выявленных больных саркоидозом путем проведения лабораторных исследований, отличающийся тем, что в периферической крови пациентов определяют уровень аутоантител к модифицированному цитруллинированному виментину и уровень В-клеток и при повышении уровня аутоантител к виментину от 10 ед./мл и выше, а уровня CD5+CD27- более 12,45% и соотношения наивных В-клеток к клеткам памяти более 2:1 диагностируют аутоиммунное воспаление.
| KINLOCH AJ et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Front Immunol, 2018, 9 (9), p.1516 | |||
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА И САРКОИДОЗА ОРГАНОВ ДЫХАНИЯ | 2004 |
|
RU2256916C1 |
| СПОСОБ ДИАГНОСТИКИ РЕВМАТОИДНОГО АРТИРИТА ПО НАЛИЧИЮ АНТИТЕЛ К МОДИФИЦИРОВАННОМУ ЦИНТРУЛЛИНИРОВАННОМУ ВИМЕНТИНУ (Anti-MCV) В РОТОВОЙ ЖИДКОСТИ | 2012 |
|
RU2523413C1 |
| ЕРШОВ Г.А | |||
| и др | |||
| О возможной аутоиммунной природе саркоидоза: какие аутоантигены вовлечены и почему? Клиническая патофизиология, 2007, N3, c.77-82 | |||
Авторы
Даты
2020-12-23—Публикация
2019-12-30—Подача