ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка, согласно Кодексу законов США, раздел 35, § 119(e) испрашивает приоритет предварительной заявки на патент США №62/073,548, поданной 31 октября 2014 г. которая полностью включена в настоящий документ посредством ссылки.
Заявление об исследовании, спонсируемом правительством
Настоящее изобретение сделано при поддержке правительства в виде грантов №GM101420, AI112521, AI111595 и AI069259, выданных Национальным институтом здравоохранения США. Правительство обладает определенными правами на настоящее изобретение.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области доставки материалов в клетки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка включает посредством ссылок нуклеотидные и/или аминокислотные последовательности, приведенные в файле с названием «38172-508001WO_Sequence_Listing.txt», размер которого составляет 2,31 килобайта, созданном 30 октября 2015 года на компьютере IBM-PC с операционной системой, совместимой с MS-Windows, который содержится в текстовом файле, поданном 30 октября 2015 г. в составе настоящей заявки.
УРОВЕНЬ ТЕХНИКИ
Доставка макромолекул, например, полисахаридов, белков или нуклеиновых кислот в цитоплазму клетки может временно или на постоянной основе изменить функцию клетки в исследовательских или терапевтических целях. Однако существующие способы внутриклеточной доставки веществ к первичным клеткам иммунной системы, особенно к покоящимся лимфоцитам, обладают ограничениями. Электропорация оказывает значительное токсическое действие на клетки. Вирусные векторы не могут инфицировать покоящиеся лимфоциты. Пептиды, проникающие через клеточную мембрану (или трансдуцирующие пептиды), не способны эффективно трансфицировать первичные лимфоциты. Комплексы и конъюгаты «антитело-лекарственное вещество» требуют использования специфических антител для каждого типа клеток и различной конструкции для переноса различной полезной нагрузки. Кроме того, получение является дорогостоящим, и указанные соединения являются потенциально иммуногенными. Показано, что химерные РНК «аптамер-миРНК» вызывают нокдаун гена-мишени in vivo, не приводя к токсическим эффектам или иммунной активации, однако их применяли только для доставки малых РНК, и они требуют получения специфического аптамера для каждой исследуемой клетки. Достижения в области технологий, основанных на наночастицах и липосомах, привели к усовершенствованиям внутриклеточной доставки лекарственных средств и антигенов к фагоцитарным антиген-презентирующим клеткам, например, дендритным клеткам и моноцитам/макрофагам, однако указанные технологии являются неэффективными по отношению к лимфоцитам. Большинство этих способов приводят к поглощению полезной нагрузки эндосомами, и лишь очень небольшая часть указанной нагрузки (по оценкам, ~1-2%) избегает эндосом и попадает в цитозоль, куда она должна транспортироваться для проявления биологической активности. Многие из этих способов также приводят к накоплению небиоразлагаемого материала оболочек или материала для доставки в клетке, что может влиять на функцию клетки. Таким образом, существует потребность в альтернативных способах эффективной и нетоксичной доставки различных макромолекул в клетки иммунной системы.
Сущность изобретения
В настоящем изобретении предложено решение ранее существующей проблемы, связанной с доставкой соединений или композиций в клетки иммунной системы. До момента создания настоящего изобретения введение соединений, например, белков, нуклеиновых кислот, углеводов, было затруднено и являлось неэффективным и/или требовало присутствия нежелательных медиаторов, например, токсичных соединений или вирусных векторов. Согласно настоящему изобретению, способ конструирования функции клеток иммунной системы включает внутриклеточную доставку соединений путем временного повреждения (нарушения целостности) мембраны, окружающей цитоплазму клетки иммунной системы. Например, способ преимущественной доставки соединения в цитозоль клетки иммунной системы, не предусматривающий использования вирусных векторов, включает этап пропускания клеточной суспензии, содержащей целевую клетку иммунной системы, через микрожидкостное устройство, и приведение в контакт суспензии с доставляемым соединением(ями) или полезной нагрузкой. Устройство содержит сужение длиной 10-60 мкм и шириной 3-8 мкм, например, 3-4 мкм или 4 мкм.
Например, устройство содержит сужение диаметром от 2 до 10 мкм. В предпочтительных вариантах реализации, относящихся к наивным Т- и В-клеткам, устройство содержит сужение длиной приблизительно 10, 15, 20, 25, 30 или 10-30 мкм, шириной приблизительно 3, 3,5, 4 или 3-4 мкм, глубиной приблизительно 15, 20, 25 или 15-25 мкм и/или углом наклона 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 5-15 градусов.
После пропускания через участок сужения количество соединения, доставляемого в клетку иммунной системы, по меньшей мере на 10% (например, на 20%, 50%, в 2 раза, 5 раз, 10 раз или более) превышает количество, доставляемое в клетку, не являющуюся клеткой иммунной системы, или количество, доставляемое в клетку иммунной системы при отсутствии сдавливания клеток, например, только посредством эндоцитоза. Например, клетка иммунной системы включает В-клетку, Т-клетку, макрофаг или дендритную клетку. Типичное устройство для преимущественной доставки полезной нагрузки в клетки иммунной системы характеризуется одним или несколькими каналами, содержащими сужение длиной 30 мкм и шириной 4 мкм, через которые проходят клетки.
При обработке клеток используют температуру от 0 до 45 градусов Цельсия, например, 0-25°C. Например, обработку наивных Т-клеток, В-клеток и/или моноцитов выполняют при температуре 4-8°С, например, на льду. В еще одном примере дендритные клетки, активированные Т-клетки и/или активированные В-клетки обрабатывают с использованием устройства при температурах 20-25°С, например, при обычной комнатной температуре.
Полезная нагрузка включает любую молекулу или соединение, которое должно быть доставлено в цитоплазму клетки иммунной системы. Например, указанное соединение включает антиген, например, антиген, ассоциированный с заболеванием, например, антиген опухоли, антиген вируса, антиген бактерии или антиген гриба. Антиген может быть очищен или присутствовать в смеси других компонентов, например, антиген присутствует в клеточном лизате, например, лизате опухолевых клеток или лизате биоптата инфицированной или пораженной заболеванием ткани субъекта, например, субъекта, страдающего инфекционным заболеванием. В некоторых примерах антиген содержит полноразмерный полноразмерный (или необработанный (непроцессированный)) белковый антиген, например, белок или пептид, длина которого превышает 7, 8, 9 или 10 аминокислот. Другие молекулы нагрузки включают нуклеиновые кислоты, например, миРНК, мРНК, микроРНК, кодирующие или некодирующие олигонуклеотиды, а также низкомолекулярные соединения, например, низкомолекулярные зонды. Кроме того, таким способом выполняют доставку нуклеиновых кислот, например, ДНК, например, векторов для экспрессии, например, плазмид, без необходимости применения вирусного вектора.
В некоторых примерах клетка иммунной системы находится в состоянии покоя по сравнению с активированным состоянием. Например, клетки характеризуются экспрессией следующих маркеров: CD25, KLRG1, CD80, CD86, PD-1, PDL-1, CTLA-4, CD28, CD3, MHC-I, MHC-II, CD62L, CCR7, CX3CR1 и CXCR5, каждый из которых можно модулировать (усиливать или ослаблять экспрессию путем введения молекул в клетки иммунной системы с использованием описанных способов). Клеточные суспензии включают обработанные клетки, например, ресуспендированные клетки лейкотромбоцитарного слоя (фракционированные лейкоциты), или цельную кровь. Наивные клетки иммунной системы, например, Т-клетки, характеризуются сравнительно низкими уровнями экспрессии CD25, CD80, CD86, PD-1 и CTLA-4 и сравнительно высоким уровнем CCR7 (по сравнению с активированными клетками).
Устройство для преимущественного введения соединения в клетку иммунной системы, но не клетку, не являющуюся клеткой иммунной системы, содержит по меньшей мере один микрожидкостной канал, например, в виде шприца, или множество каналов, например, в виде микрочипа или микрожидкостного устройства. Например, указанный канал содержит сужение длиной 30 мкм и шириной 4 мкм.
Настоящее изобретение также включает способ конструирования функции клеток иммунной системы путем внутриклеточной доставки соединений, доставка которых опосредована временным разрушением мембраны, окружающей цитоплазму клетки иммунной системы, и доставкой антигена в цитозоль. Например, длина антигена составляет более 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, и клетка иммунной системы перерабатывает антиген в пептид длиной менее 11 аминокислот. Затем клетка иммунной системы представляет на своей поверхности укороченный процессированный пептид - процессированную ограниченную антигеном (рестриктированную по антигену) комплекса гистосовместимости класса I форму антигена. Например, длина процессированных пептидов для презентации MHC/HLA класса I CD8+ Т-клеткам или цитотоксическим Т-клеткам, находится в диапазоне 8-10 остатков, а длина пептидов, процессированных для презентации MHC/HLA класса II CD4+ Т-клеткам или хелперам, находятся в диапазоне 14-20 остатков. Пептиды короче 8 остатков (например, 2, 3, 4, 5, 6 или 7 остатков) пригодны для презентации другим типам Т-клеток или NK-клеткам.
Например, клеточную мембрану нарушают путем пропускания клетки иммунной системы через сужение диаметром от 2 до 10 мкм. Антиген, доставляемый путем сдавливания клеток в цитозоль, представляет собой полноразмерный непроцессированный белок или пептид, который необходимо переработать до размера/длины, подходящих для связывания с антигеном гистосовместимости с целью презентации антигена антиген-презентирующей клеткой. Способ конструирования функции клетки иммунной системы может дополнительно включать приведение в контакт клетки иммунной системы, загруженной антигеном, с эффекторной Т-клеткой, и активацию цитотоксического Т-клеточного иммунного ответа. В некоторых примерах подвергнутая сдавливанию клетка иммунной системы, загруженная антигеном, включает В-клетку, дендритную клетку или макрофаг. В других примерах подвергнутая сдавливанию клетка иммунной системы, загруженная антигеном, включает T-клетку. В любом случае подвергнутая сдавливанию клетка иммунной системы, загруженная антигеном, содержит по меньшей мере на 10%, на 25%, на 50%, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, в 50 или более раз больше антигена или другой полезной композиции по сравнению с клеткой иммунной системы, контактировавшей с тем же самым антигеном или полезной нагрузкой в отсутствие сжатия, например, при поглощении только за счет эндоцитоза или пиноцитоза.
Функция, активность или состояние активации клетки иммунной системы изменяются после такой обработки. Например, способ придания антиген-презентирующего фенотипа Т-клетке осуществляют путем доставки антигена, например, полноразмерного непроцессированного белка или его фрагмента, в цитозоль Т-клетки путем пропускания Т-клетки через микрожидкостное устройство, как описано выше. Например, устройство содержит сужение диаметром приблизительно от 2 до 10 мкм, а Т-клетка содержит на поверхности Т-клетки после пропускания через микрожидкостное устройство процессированную ограниченную антигеном комплекса гистосовместимости класса I форму антигена. Способ может дополнительно включать приведение в контакт первой (подвергнутой сдавливанию, загруженной антигеном) Т-клетки со второй Т-клеткой, причем вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном комплекса гистосовместимости класса I. Типичные антигены включают один или более опухолевых антигенов, например, смесь опухолевых антигенов, например, лизат биоптата опухоли, или вирусный антиген. Полученные таким способом загруженныех антигеном Т-клетки используют in vitro и/или in vivo для стимуляции цитотоксического Т-клеточного ответа. Таким образом, настоящее изобретение включает применение подвергнутой сдавливанию, загруженной антигеном Т-клетки для активации антиген-специфического цитотоксического Т-клеточного ответа. Например, такие Т-клетки оказывают клинически благоприятное воздействие, уничтожая опухолевые клетки и/или уничтожая клетки, инфицированные вирусом, в зависимости от доставленного/загруженного антигена.
Композиции, описанные в настоящем документе, являются очищенными. Очищенные соединения составляют по меньшей мере 60 масс. % (сухого веса) исследуемого соединения. Предпочтительно, препарат составляет по меньшей мере 75%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно - по меньшей мере 99% массы исследуемого соединения. Чистоту измеряют любым подходящим стандартным способом, например, колоночной хроматографией, электрофорезом в полиакриламидном геле или ВЭЖХ-анализом. Например, соединение, например, белковый антиген, отделяют из одного или более соединений, с которыми оно встречается в природе. В случае клеток очищенная популяция составляет по меньшей мере 75%, 85%, 90%, 95%, 98%, 99% или 100% выбранного типа клеток. Хорошо известны способы очистки или обогащения определенного типа клеток, включая сегрегацию по размеру или экспрессии маркеров клеточной поверхности с использованием такого устройства, как аппарат для сортировки клеток.
Другие свойства и преимущества настоящего изобретения будут понятны из дальнейшего описания предпочтительных вариантов его реализации, а также из формулы изобретения. Все ссылки, цитируемые в настоящем документе, включены в настоящий документ посредством ссылки.
Краткое описание чертежей
Фигура 1А представляет собой серию диаграмм, на которых показана система доставки. Для настройки системы каждый микрожидкостный чип устанавливают в держатель, который позволяет ему соприкасаться с поликарбонатными резервуарами с жидкостью. Для эксплуатации системы доставляемые макромолекулы смешивают с клетками, загружают в резервуар устройства в объеме приблизительно 30-150 мкл, а затем подключают к источнику давления для запуска потока через микрожидкостные каналы. Фигура 1В представляет собой диаграмму, на которой показана деформация клетки и доставка полезной нагрузки. Когда клетки проходят через каналы, они деформируются в области сужений, что приводит к повреждению мембраны. Затем макромолекулы в жидкости диффундируют через нарушенную мембрану и остаются в клетке после восстановления ее мембраны. На этих фигурах продемонстрирована доставка путем сдавливания клеток.
Фигуры 2А и В представляют собой график и гистограмму, на которых показана доставка декстрана и антитела в клетки иммунной системы мыши. На Фигуре 2А представлены типичные графики количества Т-клеток, В-клеток и миелоидных клеток (CD11b +), обработанных устройством CellSqueeze для доставки IgG1, меченного APC. На Фигуре 2B показана эффективность доставки. Все результаты измеряли проточной цитометрией в течение часа после обработки. Мертвые клетки исключали путем окрашивания иодидом пропидия. Данные на фигуре 2В (среднее ± СО) получены из 3 независимых экспериментов. Необработанные клетки не пропускали через устройство или не подвергали воздействию биомолекул. Образцы «без устройства» инкубировали с биомолекулами, но не обрабатывали с помощью устройства. Этот контроль предназначен для учета поверхностного связывания, эндоцитоза и других фоновых эффектов.
Фигуры 3A-D представляют собой графики, на которых показана доставка декстранов, антител и миРНК в клетки иммунной системы человека. На Фигуре 3A тестировали доставку 3-кДа декстрана, меченного каскадным синим, 70-кДа декстрана, меченного флуоресцеином, и IgG1, меченного APC, в Т-клетки и МДК человека. Показаны типичные графики для устройства 30-4 (T-клетки) и 10-7 (МДК) (слева) и повторности между конструктивными вариантами устройств (справа). На Фигуре 3B показан миРНК-опосредованный нокдаун уровней белка CD4 и DC-SIGN в CD4+ Т-клетках и МДК, соответственно. Протестировали различные концентрации миРНК и конструктивные варианты устройств для оценки зависимости от дозы или размера сужения. На Фигуре 3С показано, что регуляторные Т-клетки человека также демонстрировали значительное снижение экспрессии CD4 в ответ на обработку с использованием устройства 30-4. Мертвые клетки исключали из экспериментов по доставке или анализу нокдауна. На фигуре 3D показано сравнение производительности устройства на примере T-клеток с нуклеофекцией с использованием Amaxa. Для двух систем показана экспрессия белка через 72 часа после доставки миРНК против CD4. Кроме того, показана жизнеспособность клеток после обработки этими двумя способами.
Фигуры 4А-В представляют собой графики, на которых показано ингибирование ВИЧ-инфекции путем адресного нокдауна эндогенных и вирусных генов. На Фигуре А внутриклеточное окрашивание антигена р24 использовали в качестве индикатора уровня ВИЧ-инфекции в обработанных CD4+ Т-клетках человека через 24 часа после заражения. В этих исследованиях миРНК vif и/или gag доставляли за 24 часа до заражения, тогда как миРНК CD4 доставляли за 48 часов до заражения. На Фигуре 4В показана средняя интенсивность флуоресценции окрашивания антигена р24 в повторностях (мин. N = 4) при различных условиях эксперимента. Данные представлены как среднеарифметическое + 1 стандартная ошибка.
На Фигуре 5 показана схема способа вакцинации.
Фигура 6 представляет собой серию линейных графиков, на которых показано поглощение 3-кДа и 70-кДа декстрана и антитела первичными клетками иммунной системы мыши. Показано гейтирование, используемое для расчета значений эффективности доставки. Эти данные соответствуют экспериментам, представленным на Фигуре 2. Графики с серой заливкой представляют собой необработанные клетки, черные - клетки, подвергавшиеся воздействию материалов, но не обработанные с помощью устройства, серые графики без заливки представляют собой клетки, обработанные с помощью устройства в присутствии целевых биомолекул.
Фигура 7 представляет собой набор графиков, на которых показаны данные по жизнеспособности клеток, соответствующие экспериментам, представленным на Фигуре 2. ***обозначает значение p < 0,001 при сравнении жизнеспособности клеток, обработанных с помощью устройства 30-4, с клетками «без устройства» или необработанными клетками. Изменения жизнеспособности В-клеток и миелоидных клеток, обработанных с помощью устройства, существенно не отличались от показателей для необработанных клеток или клеток «без устройства».
Фигура 8 представляет собой серию графиков, на которых показана доставка декстрана и антител в дендритные клетки костного мозга (BMDC). BMDC получали из организма мыши C57BL6 путем культивирования клеток костного мозга в среде, содержащей ГМКСФ, в течение 8 дней. 3-кДа декстран, меченный каскадным синим, 70-кДа декстран, меченный флуоресцеином, и IgG1, меченный APC, доставляли с использованием двух конструктивных вариантов устройства - 10-6 и 30-6.
Фигура 9 представляет собой график, на котором показана корреляция доставки антитела и декстрана. Доставку декстрана (3-кДа и 70-кДа) и антитела в Т-клетки с использованием устройства 30-4 (серые точки, в центре, вверху справа) сравнивали с инкубированием с материалом, т.е. без устройства (черные точки, снизу слева).
Фигура 10 представляет собой гистограмму, на которой показана жизнеспособность CD4+ Т-клеток человека. Клетки, прошедшие через устройство, обладают пониженной жизнеспособностью по сравнению с необработанными контрольными клетками, однако лучшей жизнеспособностью по сравнению с клетками, подвергавшимися нуклеофекции. Для расчета статистической значимости использовали односторонний дисперсионный анализ с последующим тестом Бонферрони. * означает значение p < 0,05, а *** означает значение p < 0,001. Другие группы сравнения не демонстрировали значительных различий в жизнеспособности (т.е. 10-4 по сравнению с необработанными или 30-4 и 30-4 по сравнению с нуклеофекцией).
Фигура 11 представляет собой серию гистограмм, на которых показана доставка (вверху) и жизнеспособность (внизу) Результаты получены при анализе различных конструктивных вариантов устройств и МДК человека. 3-кДа декстран, меченный каскадным синим, 70-кДа декстран, меченный флуоресцеином, и изотипические контрольные антитела IgG1, меченные APC, доставляли с использованием 6 различных конструктивных вариантов устройства и нуклеофекции с использованием Amaxa. Результаты по жизнеспособности и доставке измеряли непосредственно после обработки.
Фигура 12 представляет собой серию графиков, на которых показана одновременная доставка миРНК, меченной Alexa 488 или Alexa 647, и 3-кДа декстрана, меченного каскадным синим, в CD4 T-клетки человека с помощью устройства 10-4i и в B-клетки мыши с помощью устройства 30-5x5i. Данные показывают близкую корреляцию доставки двух указанных материалов. Этот результат согласуется с предполагаемым диффузионным механизмом доставки, т.е. эффективность доставки в основном зависит от размера материала, а не его химической структуры.
Фигура 13 представляет собой график, на котором показана экспрессия CD45RA. миРНК против CD45RA доставляли в Т-клетки человека с помощью устройства 10-4. Нокдаун измеряли проточной цитометрией через 72 часа после обработки.
Фигура 14 представляет собой гистограмму, на которой показан нокдаун мРНК CD4 (измеренный посредством ПЦР через 48 часов после доставки).
Фигура 15 представляет собой серию гистограмм, на которых показаны уровни экспрессии CD4 в CD4+ T клетках человека в течение 2 недель после обработки, измеренные посредством проточной цитометрии. Кроме того, измеряли уровни CD3 в качестве контрольного гена.
Фигура 16 представляет собой серию графиков, на которых показана доставка модельной загрузки (декстрана) в моноциты человека. Моноциты получили из крови человека. 3-кДа декстран, меченный каскадным синим, и 70-кДа декстран, меченный флуоресцеином, доставляли с использованием четырех различных конструктивных вариантов устройства при двух различных значениях рабочего давления. Случай Opsi соответствует контрольным клеткам, которые лишь подвергали воздействию декстрана, но не обрабатывали с помощью устройства. Жизнеспособность измеряли путем окрашивания иодидом пропидия.
Фигура 17 представляет собой серию графиков, на которых показана доставка декстрана в В-клетки человека. В-клетки получили из крови человека. 3-кДа декстран, меченный каскадным синим, и 2-МДа декстран, меченный флуоресцеином, доставляли с использованием пяти различных конструктивных вариантов устройства при двух различных значениях рабочего давления. Случай Opsi соответствует контрольным клеткам, которые лишь подвергали воздействию декстрана, но не обрабатывали с помощью устройства. Жизнеспособность измеряли путем окрашивания иодидом пропидия.
Фигура 18 представляет собой гистограмму, на которой показаны уровни белка DC-Sign через 72 часа после обработки. Нокдаун белка измеряли на примере 6 различных конструктивных вариантов устройства и сравнивали с нуклеофекцией. Обратите внимание, что нуклеофекция, по-видимому, вызывает ~50% неспецифической нокдаун DC-Sign даже в случае доставки контрольной миРНК. Это может указывать на неспецифические эффекты, обусловленные электропорацией, т.е. воздействием на клетки электрического поля, повреждающим клетки, конкретно белки-мишени, что приводило к измеренному снижению уровня экспрессии в отсутствие миРНК, мишенью которой является белок. Эти результаты показывают, что способ деформации мембраны является более специфичным по сравнению со способами электропорации/нуклеофекции, которые ассоциированы с неспецифическими эффектами.
Фигура 19 представляет собой серию графиков, на которых показаны данные, касающиеся доставки неспособного проникать в клетки 10-кДа декстрана, меченного Alexa-488, в клетки цельной крови. Красители, меченные флуоресцентной меткой, смешивали с цельной кровью, смесь цельной крови и меченого красителя прогоняли через устройство, а затем измеряли доставку в клетки крови посредством FACS после лизиса эритроцитов. Результаты демонстрируют успешную доставку красителей в клетки и эффективную доставку соединений загрузки, которые характеризовались отсутствием способности проникать в клетки, в клетки иммунной системы с использованием сдавливания клеток. Неожиданно выяснилось, что процесс доставки работает в цельной крови. Цельная кровь с большим трудом поддается манипуляциям без очистки, например, фракционирования или отделения мононуклеаров периферической крови от эритроцитов, однако устройства, описанные в настоящем документе, способны эффективно доставлять соединения в клетки иммунной системы в цельной крови. В качестве неограничивающего примера см. Фигуры 33 и 34.
Фигура 20 представляет собой диаграмму микрожидкостной системы повреждения мембран.
Фигуры 21А-B представляют собой точечные графики, на которых показана экспрессия мРНК через день после доставки с помощью чипа 10-4 при давлении 120 фунтов на кв. дюйм в буфере Optimem.
Фигура 22A представляет собой диаграмму, а Фигура 22B представляет собой гистограму, на которой показана доставка 10-кДа декстрана, меченного Alexa 488, при различных давлениях с различными углами чипов. Число в скобках представляет собой угол сужения. Угол чипа находится в диапазоне от 0 до 180 градусов, например, 11-105 градусов. На схеме показан угол чипа. Параметр глубины колеблется от 2 мкм до 1 мм, например, ~20 мкм, и дополнительно описан в публикации патента США №20140287509 (включенной в настоящий документ посредством ссылки). Типичные параметры включают длину 0-30 мкм / ширину 3-4 мкм / глубину 20 мкм / угол 11 градусов для наивных T- и B-клеток.
Фигура 23 представляет собой линейный график, на котором показана доставка фактора транскрипции в NK-клетки и pDC. Экспрессию мРНК Oct4 измеряли через 4 часа после доставки рекомбинантного белка Oct4 в NK-клетки селезенки мыши. Эти данные показывают, что фактор транскрипции активен и способен индуцировать экспрессию эндогенного Oct4. Фактор транскрипции Oct4 является одним из четырех факторов, необходимых для получения iPS (Oct4, Klf4, cMyc, Sox2) и регулирует собственную экспрессию по принципу положительной обратной связи. Доставка активного белка Oct4 приводит к увеличению экспрессии мРНК Oct4. Доставка активных факторов транскрипции является важным шагом в процессе перепрограммирования для способов, основанных на использовании белков. Эти способы обладают многочисленными преимуществами перед системами на основе вирусов и ДНК, поскольку они минимизируют риск интеграции.
Фигуры 24А-B представляют собой линейные графики, показывающие отсутствие обнаруживаемого ингибирования нормальной функции ДК в ответ на сдавливание. Фигура 24A: ДК селезенки культивировали в LPC (1 мкг/мл) после обработки посредством сдавливания, посредством только эндоцитоза антигена; необработанные клетки продемонстрировали отсутствие обнаружимых различий в способности стимулировать экспрессию CD80 и CD86. Условия нестимулированного эндоцитоза и необработанные клетки, поддерживавшиеся при 4°C, использовали в качестве контрольных образцов. Фигура 24B: ДК селезенки CD45-конгенных мышей вводили в подушечку стопы мышей C57BL6 с LPS (1 мкг/мл) и выделяли из дренирующих лимфоузлов через 18 часов после инъекции. Существенных различий в способности лимфоузлов к хомингу не обнаружили.
Фигуры 25А-D представляют собой графики, на которых показано, что использование системы устройств и способов мембранной деформации и приводит к более эффективной презентации антигена по сравнению с другими подходами к доставке антигена. Фигура 25A: пролиферация адаптивно перенесенных CD8+ OT-I T-клеток in vivo в ответ на подкожную вакцинацию ДК. BMDC, обработанные с помощью устройства (0,1 мг/мл Ova) продемонстрировали значительное увеличение (P < 0,0001) пролиферации Т-клеток по отношению к клеткам, поглощавшим антиген путем эндоцитоза. Фигура 25В: пролиферация in vitro CD8+ OT-I T-клеток, совместно культивировавшихся с BMDC, обработанными лизатом Ova-экспрессирующей линии клеток меланомы (B16F10). «%» обозначают фракцию материала клеточного лизата, добавленную в суспензию клеток BMDC до обработки с помощью устройства 10-6 CellSqueeze. CD8 Т-клетки метили сукцинимидиловым эфиром карбоксифлуоресцеина (CFSE) до контакта с APC. Если они подвергались пролиферации, краситель CFSE распространялся среди дочерних клеток, что приводило к пониженной интенсивности флуоресценции на клетку. Непролиферировавшие Т-клетки сохраняли высокую интенсивность CFSE. Фигура 25С: измерение фракции антигенспецифических ИФНγ-секретирующих CD8 T-клеток. В этих экспериментах мышей вакцинировали против Ova в отсутствие адоптивно переносимых OT-I T-клеток. Эндогенный антигенспецифический ответ измеряли путем выделения селезенок вакцинированных мышей через 7 дней после вакцинации и повторной стимуляции их in vitro пептидом SIINFEKL (эпитоп OVA). Антигенспецифические CD8 T-клетки секретировали ИФНγ в ответ на повторную стимуляцию. Фигура 25D: пролиферация in vitro CD8+ OT-I T-клеток, совместно культивировавшихся с B-клетками, обработанными с использованием двух различных конструктивных вариантов устройства (0,1 мг/мл Ova). В качестве адъюванта в данных экспериментах использовали CpG.
Фигура 26 представляет собой график, на котором показаны результаты анализа пролиферации CFSE in vivo: На данном графике показано измерение пролиферации антигенспецифических CD8 T-клеток. Поскольку CD8 T-клетки активировались и подвергались пролиферации в организме мыши, они характеризовались разбавленной концентрацией красителя CFSE и пониженной интенсивностью флуоресценции. В этом случае донорные T-клетки, обработанные с помощью устройства, или положительный контроль характеризовались гораздо большей активацией и пролиферацией CD8 T-клеток в организме мыши-реципиента. Контрольные клетки, использовавшие эндоцитоз, напротив, продемонстрировали минимальный эффект.
Фигура 27 представляет собой серию графиков, на которых показана пролиферация антиген-специфических OT-I T-клеток в организме мыши в ответ на вакцинацию Т-клетками дикого типа, обработанными антигеном. Ответы в виде пролиферации Т-клеток измеряли по окрашиванию CFSE, причем по мере пролиферации клеток происходило разбавление красителя. Более низкие значения интенсивности указывают на более выраженные ответы, более высокие пики интенсивности указывают на отсутствие/меньшую величину ответа. В каждом столбце представлены повторные эксперименты с лимфоузлами и селезенкой одной и той же мыши. Каждый столбец включает эксперименты с использованием 3 мышей (в общей сложности 9 мышей).
Фигуры 28A-B представляют собой графики, на которых показано гейтирование как DQ-OVA+, так и 3-кДа-декстран+ Т-клеток.
Фигура 29 представляет собой гистограмму, на которой продемонстрировано использование Т-клеток мыши в качестве антиген-презентирующих клеток. Т-клетки, обработанные путем сдавливания с целью загрузки непроцессированного антигена-овальбумина, культивировали с OT-1 (SIINFEKL-специфическая линия Т-клеток) и выполняли оценку маркеров активации CD25 и CD69.
Фигура 30 представляет собой схему типичной процедуры получения антиген-презентирующих B-клеток посредством сдавливания и исследования их характеристик.
Фигура 31 представляет собой серию графиков, на которых показано, что B-клетки, обработанные посредством сдавливания, индуцировали мощную пролиферацию CD8+ T-клеток.
Фигура 32 представляет собой серию графиков, на которых показано, что дендритные клетки, обработанные посредством сдавливания (с целью доставки OVA), секретировали гамма-интерферон.
На Фигуре 33 показаны данные и схематичный рисунок, на котором показана доставка 10-кДа материала в B- и T-клетки человека непосредственно в немодифицированной цельной крови.
Фигура 34 представляет собой график, на котором показана жизнеспособность и эффективность доставки в цельной крови.
Подробное описание изобретения
Безвекторную микрожидкостную платформу доставки (CellSqueeze) используют для доставки макромолекул непосредственно в цитозоль первичных клеток иммунной системы, например, мыши или человека, при минимальной цитотоксичности. Принцип, лежащий в основе этого подхода, представляет собой временное повреждение мембраны за счет быстрой механической деформации, или сдавливания, клетки-мишени, что дает возможность поглощения макромолекул в текучей среде путем диффузии, с последующим восстановлением клеточной мембраны (см., например, публикацию патента США №20140287509, включенную в настоящий документ посредством ссылки. Используя библиотеку микрожидкостных конструкций, выполнили доставку тестируемых соединений, например, декстрановых полимеров, антител и малых интерферирующих РНК (миРНК) в первичные Т-клетки, B-клетки, моноциты/макрофаги и дендритные клетки человека и мыши. Результаты демонстрируют полезность данной платформы для доставки макромолекул различного размера и типа. Эффективная доставки материала в клетки иммунной системы различных классов, характеризующихся широким спектром диаметра клеток (~ 8-30 мкм), различающейся морфологией, анизотропией и гибкостью мембран, требует выявления специфических условий для различных типов клеток. При сдавливании клеток ширина сужения является критическим параметром, но на доставку загрузки также могут влиять и другие параметры, например, геометрические элементы, скорость, буфер и температура. Типичная ширина сужения для доставки загрузки в наивные T- или B-клетки находится в диапазоне 3-4 мкм; для доставки в активированные T- или B-клетки - 4-6 мкм; а для доставки в дендритные клетки - 6-8 мкм.
Доставка миРНК приводила к надежному нокдауну гена. Кроме того, доставка противовирусных миРНК в CD4+ T-клетки ингибировала репликацию ВИЧ, демонстрируя функциональную полезность микрожидкостной доставки. Аналогичным образом, доставка антигенных белков в дендритные клетки и B-клетки привела к более эффективной презентации антигена и более выраженной активации/пролиферации антигенспецифических CD8+ T-клеток in vitro и in vivo. Обеспечивая платформу для надежной внутриклеточной доставки с минимальными потерями жизнеспособности, сдавливание клеток представляет собой гибкий и полезный инструмент для исследования и управления функциями клеток иммунной системы для научных исследований и клинического применения.
Внутриклеточная доставка биомолекул, например, белков и миРНК в первичные клетки иммунной системы, особенно в покоящиеся лимфоциты, является трудной задачей. Безвекторная микрожидкостная платформа, описанная в настоящем документе, вызывает временное повреждение мембраны за счет быстрой механической деформации клетки, что приводит к внутриклеточной доставке макромолекул в клетки иммунной системы, например, T-клетки, B-клетки, моноциты/макрофаги и дендритные клетки. Библиотеку из 16 конструктивных вариантов микрожидкостного устройства протестировали на предмет возможности доставки декстрановых полимеров, миРНК и антител в клетки иммунной системы человека и мыши. Активность доставленного материала проверяли путем измерения миРНК-опосредованного нокдауна белков CD45, DC-SIGN и CD4. Микрожидкостная доставка, не требующая электрического поля или вирусных векторов, привела к сопоставимой или улучшенной по сравнению с электропорацией доставке с менее выраженным токсическим действием на клетки. Полезность данной методики при заболеваниях продемонстрировали путем ингибирования репликации ВИЧ в первичных CD4 T-клетках человека, обработанных миРНК против вирусных генов vif и gag. Таким образом, безвекторная микрожидкостная доставки предоставляет собой способ преодоления сложностей цитозольной доставки макромолекул в клетки, инженерия которых в прошлом являлась трудной задачей (например, первичные клетки иммунной системы). Таким образом, указанные способы и устройство можно применять для конструирования функции клеток иммунной системы.
В некоторых аспектах настоящее изобретение относится к способам преимущественной доставки соединения в цитозоль клетки иммунной системы, включающим пропускание суспензии клеток, содержащей клетки иммунной системы, через микрожидкостное устройство, и приведение в контакт суспензии с соединением, причем указанное устройство содержит сужение диаметром приблизительно 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм или 2 мкм-10 мкм, и количество соединения, доставленное в клетки иммунной системы, по меньшей мере на 10% больше количества, доставленного в клетки, не являющиеся клетками иммунной системы. В некоторых аспектах настоящее изобретение относится к способу доставки соединения в цитозоль клетки иммунной системы, включающим пропускание суспензии клеток, содержащей клетку иммунной системы, через микрожидкостное устройство, и приведение в контакт суспензии с соединением, причем указанное устройство содержит сужение диаметром приблизительно 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм или 2 мкм-10 мкм.
Термин «сдавливание клеток» относится к способу, включающему пропускание суспензии клеток через микрожидкостное устройство, содержащее сужение. В некоторых вариантах реализации суспензию клеток приводят в контакт с соединением до, одновременно, или после пропускания через микрожидкостное устройство. В некоторых вариантах реализации клетка иммунной системы после пропускания через устройство содержит по меньшей мере на 10%, 25%, 50%, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, в 50 раз или более повышенное количество соединения по сравнению с клеткой иммунной системы, контактировавшей с соединением без пропускания через устройство.
Конструирование функций клеток иммунной системы
Посредством доставки материала во внутриклеточное пространство клеток иммунной системы за счет временного повреждения или деформации целостности мембраны можно исследовать и выполнять оценку характеристик внутренних механизмов и манипулировать их функциями или изменять их в рамках разнообразных вариантов применения.
Эффективный способ модификации функции клеток и/или изучения их внутренних механизмов представляет собой введение материала (например, биологически активных веществ) в клетку и непосредственные манипуляции внутриклеточными процессами. Способы, описанные в настоящем документе, обладают преимуществами по сравнению с существующими или предшествующими подходами, которые главным образом сводятся к манипуляциям составом среды, в которой находятся клетки, и/или сигнальными путями посредством связывания с поверхностными рецепторами. Внутриклеточная доставка в клетки иммунной системы является сложной задачей при использовании существующих или предыдущих технологий. Платформа CellSqueeze, описанная в настоящем документе, обеспечивает доставку разнообразного материала в клетки иммунной системы и продемонстрировала способность влиять на функции клетки in vivo и in vitro. Эти способы можно использовать для программирования (или перепрограммирования) функций клеток иммунной системы для клинического применения, например, терапии путем адоптивного переноса. Кроме того, эти способы можно использовать для тестирования и исследования иммунологических механизмов с целью выявления мишеней лекарственных веществ и/или диагностики.
Аспекты настоящего изобретения имеют отношение к неожиданному открытию, что возможна доставка соединений в клетки иммунной системы (например, B- и T-клетки человека), находящиеся в цельной крови. Цельная кровь с трудом поддается манипуляциям без очистки, например, фракционирования или отделения мононуклеаров периферической крови от эритроцитов. В то же время устройства и способы, описанные в настоящем документе, позволяют выполнять доставку соединений в клетки иммунной системы в цельной крови. Настоящее изобретение обеспечивает доставку соединений в клетки иммунной системы без необходимости отделения клеток иммунной системы от цельной крови перед пропусканием гетерогенной смеси (клеток иммунной системы, эритроцитов, сыворотки/плазмы) через устройство сдавливания клеток. Этот замечательный результат позволяет реализовать важные технические преимущества и в некоторых случаях обеспечивает прикроватное лечение больных, а также возможность обработки клеток в ситуациях без доступа к фракционированию клеток, например, на поле боя. Например, у субъекта можно взять цельную кровь, обработать ее с помощью устройства согласно настоящему изобретению и затем вновь влить пациенту, например, в непрерывном процессе. Поскольку выделение или обогащение клеток иммунной системы не требуется, данный способ требует меньшего количества манипуляций с клетками, и клетки не нуждаются в обработке средами, например, искусственными средами. Кроме того, возможна обработка клеток иммунной системы в цельной крови с высокой эффективностью при сохранении высокого уровня жизнеспособности. См., например, Фигуры 33 и 34.
В некоторых вариантах реализации, которые можно объединить с предыдущими вариантами реализации, суспензия клеток содержит клетки млекопитающих. В некоторых вариантах реализации суспензия клеток содержит смешанную популяцию клеток. В некоторых вариантах реализации суспензия клеток представляет собой цельную кровь. В некоторых вариантах реализации суспензия клеток содержит клетки лейкотромбоцитарного слоя. В некоторых вариантах реализации суспензия клеток представляет собой лимфу. В некоторых вариантах реализации суспензия клеток содержит мононуклеары периферической крови. В некоторых вариантах реализации суспензия клеток содержит очищенную популяцию клеток. В некоторых вариантах реализации клетка представляет собой первичную клетку или клетку линии клеток. В некоторых вариантах реализации клетка представляет собой клетку крови. В некоторых вариантах реализации клетка крови представляет собой клетку иммунной системы. В некоторых вариантах реализации клетка иммунной системы представляет собой лимфоцит. В некоторых вариантах реализации клетка иммунной системы представляет собой Т-клетку, B-клетку, естественный киллер (NK-клетку), дендритную клетку (ДК), NKT-клетку, тучную клетку, моноцит, макрофаг, базофил, эозинофил или нейтрофил. В некоторых вариантах реализации клетка иммунной системы представляет собой адаптивную клетку иммунной системы, например, Т-клетку или В-клетку. В некоторых вариантах реализации клетка иммунной системы представляет собой клетку врожденной иммунной системы. Типичные клетки врожденной иммунной системы включают врожденные лимфоидные клетки (ILC1, ILC2, ILC3), базофилы, эозинофилы, тучные клетки, NK-клетки, нейтрофилы и моноциты. В некоторых вариантах реализации клетка иммунной системы представляет собой клетку памяти. В некоторых вариантах реализации клетка иммунной системы представляет собой первичную Т-клетку человека. В некоторых вариантах реализации клетка является клеткой мыши, собаки, кошки, лошади, крысы, козы, обезьяны или кролика. В некоторых вариантах реализации клетка представляет собой клетку человека. В некоторых вариантах реализации суспензия клеток содержит клетки животных, не являющихся млекопитающими. В некоторых вариантах реализации клетка представляет собой клетку курицы, лягушки, насекомого или нематоды.
В некоторых примерах клетка иммунной системы находится в состоянии покоя по сравнению с активированным состоянием, например, клетки в активированном состоянии, как правило, характеризуются большим диаметром по сравнению с клетками аналогичного фенотипа в состоянии покоя. Например, клетки характеризуются экспрессией следующих маркеров: CD25, KLRG1, CD80, CD86, PD-1, PDL-1, CTLA-4, CD28, CD3, MHC-I, MHC-II, CD62L, CCR7, CX3CR1 и CXCR5, каждый из которых можно модулировать (усиливать или ослаблять экспрессию путем введения молекул в клетки иммунной системы с использованием описанных способов). В некоторых вариантах реализации экспрессию одного или более маркеров усиливают в клетках иммунной системы посредством доставки соединений в клетки иммунной системы. В некоторых вариантах реализации экспрессию одного или более маркеров снижают в клетках иммунной системы посредством доставки соединения в клетки иммунной системы. В некоторых вариантах реализации экспрессию одного или более маркеров усиливают и экспрессию одного или более маркеров снижают в клетках иммунной системы посредством доставки соединений в клетки иммунной системы. В некоторых вариантах реализации клетка иммунной системы представляет собой наивную клетку иммунной системы. Наивные клетки иммунной системы, например, Т-клетки, характеризуются сравнительно низкими уровнями экспрессии CD25, CD80, CD86, PD-1 и CTLA-4 и сравнительно высоким уровнем CCR7 по сравнению с уровнем экспрессии в активированных клетках иммунной системы.
Аспекты настоящей темы имеют отношение к главному комплексу гистосовместимости (MHC). Основная функция MHC - связывание с пептидными фрагментами, полученными из патогенных агентов, и их представление на поверхности клеток для распознавания соответствующими Т-клетками. MHC человека также называют человеческими лейкоцитарными антигенами (HLA). HLA, соответствующие MHC класса I (HLA-A, HLA-B и HLA-C), презентируют пептиды изнутри клетки. Например, если клетка заражена вирусом, система HLA выносит фрагменты вируса на поверхность клетки таким образом, что данная клетка может быть разрушена иммунной системой. Эти пептиды продуцируются из гидролизованных белков, которые разрушаются в протеасомах. В общем случае и по отношению к MHC-1, данные конкретные пептиды являются небольшими полимерами длиной приблизительно 8-10 аминокислот. Чужеродные антигены, презентируемые MHC класса I, привлекают киллерные Т-клетки (также называемые CD8-положительными или цитотоксическими Т-клетками), которые разрушают клетки. HLA, соответствующие MHC класса II (HLA-DP, HLA-DM, HLA-DOA, HLA-DOB, HLA-DQ и HLA-DR), презентируют пептиды извне клетки T-лимфоцитам. Данные конкретные антигены стимулируют размножение Т-хелперов, которые, в свою очередь, стимулируют продукцию антител против данного конкретного антигена антителопродуцирующими B-клетками. Аутоантигены подавляются регуляторными Т-клетками.
В некоторых аспектах настоящее изобретение относится к способам доставки соединения или композиции в клетку. В некоторых вариантах реализации соединение представляет собой одиночное соединение. В некоторых вариантах реализации соединение представляет собой смесь соединений. В некоторых вариантах реализации соединение содержит нуклеиновую кислоту. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту. Типичные нуклеиновые кислоты включают, без ограничения, рекомбинантные нуклеиновые кислоты, ДНК, рекомбинантную ДНК, кДНК, геномную ДНК, РНК, миРНК, мРНК, саРНК, микроРНК, днРНК, тРНК и кшРНК. В некоторых вариантах реализации нуклеиновая кислота гомологична нуклеиновой кислоте, содержащейся в клетке. В некоторых вариантах реализации нуклеиновая кислота гетерологична нуклеиновой кислоте, содержащейся в клетке. В некоторых вариантах реализации соединение представляет собой плазмиду. В некоторых вариантах реализации нуклеиновая кислота представляет собой терапевтическую нуклеиновую кислоту. В некоторых вариантах реализации нуклеиновая кислота кодирует терапевтический полипептид.
В некоторых вариантах реализации нуклеиновая кислота кодирует репортерный или селективный маркер. Типичные репортерные маркеры включают, без ограничения, зеленый флуоресцентный белок (GFP), красный флуоресцирующий белок (RFP), экворин, бета-галактозидазу, уропорфириноген(уроген)-III-метилтрансферазу (UMT) и люциферазу. Типичные селективные маркеры включают, без ограничения, бластицидин, G41 8/генетицин, гигромицин B, пуромицин, зеоцин, аденинфосфорибозилтрансферазу и тимидинкиназу. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту, кодирующую MHC-комплекс. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту, кодирующую MHC-комплекс I или класса II. В некоторых вариантах реализации нуклеиновая кислота кодирует химерный рецептор антигена, например, химерный Т-клеточный рецептор. В некоторых вариантах реализации нуклеиновая кислота кодирует рекомбинантный Т-клеточный рецептор. Например, нуклеиновые кислоты, кодирующие химерные рецепторы антигенов, вводят в Т-клетки без использования вирусов, т. е. путем сдавливания клеток, с целью поддержания экспрессии CAR-T. Например, выполняют введение ДНК без использования вирусных частиц. В то же время, нуклеотидные конструкты могут содержать элементы вирусного генома, которые могут способствовать интеграции или поддерживаться в качестве нехромосомной нуклеиновой кислоты.
В некоторых вариантах реализации соединение содержит белок или полипептид. В некоторых вариантах реализации соединение представляет собой белок или полипептид. В некоторых вариантах реализации белок или полипептид представляет собой терапевтический белок, антитело, гибридный белок, антиген, синтетический белок, репортерный маркер или селективный маркер. В некоторых вариантах реализации белок представляет собой белок для редактирования генов или нуклеазу, например, нуклеазу с доменом «цинкового пальца» (ZFN), эффекторную нуклеазу, подобную фактору транскрипции (TALEN), мегануклеазу или рекомбиназу CRE. В некоторых вариантах реализации гибридные белки могут включать, без ограничения, химерные белковые лекарственные средства, например, конъюгаты «антитело-лекарственное вещество» или рекомбинантные гибридные белки, например, белки, меченные GST или стрептавидином. В некоторых вариантах реализации соединение представляет собой фактор транскрипции. Типичные факторы транскрипции включают, без ограничения, Oct5, Sox2, c-Myc, Klf-4, T-bet, GATA3, FoxP3 и RORɣt. В некоторых вариантах реализации нуклеиновая кислота представляет собой транспозон. Транспозон, или мобильный генетический элемент, представляет собой сегмент ДНК, который вставляет себя в другое положение внутри генома.
В некоторых вариантах реализации соединение содержит антиген. В некоторых вариантах реализации соединение представляет собой антиген. Антиген - это вещество, которое стимулирует специфический иммунный ответ, например, иммунный ответ, опосредованный клетками или антителом. Антигены связываются с рецепторами, экспрессируемыми клетками иммунной системы, например, T-клеточными рецепторами (TCR), специфичными к конкретному антигену или антиген-презентирующим молекулам, например, гетеродимерам MHC/HLA. Связывание антиген-рецептор впоследствии переключает внутриклеточные сигнальные пути, ведущие к нижележащим иммунных эффекторным путям, например, активации клеток, продукции цитокинов, миграции клеток, секреции цитотоксических факторов и продукции антител. В некоторых вариантах реализации соединение содержит антиген, ассоциированный с заболеванием. В некоторых вариантах реализации антигены получают из чужеродных источников, например, бактерий, грибков, вирусов или аллергенов. В некоторых вариантах реализации антигены получают из внутренних источников, например, опухолевых клеток или белков организма (т. е. аутоантигены). В некоторых вариантах реализации опухолевый антиген представляет собой лизат опухоли. Аутоантигены представляют собой антигены, присутствующие в собственных клетках организма. Аутоантигены обычно не стимулируют иммунный ответ, но могут быть связаны с аутоиммунными заболеваниями, например, диабетом I типа или ревматоидным артритом, рассеянным склерозом (и другими демиелинизирующими расстройствами). В некоторых вариантах реализации антиген представляет собой неоантиген. Неоантигены - это антигены, которые отсутствуют в нормальном геноме человека, но возникают в онкогенных клетках в результате опухолеспецифических модификаций ДНК, которые приводят к образованию новых белковых последовательностей. Типичные вирусные антигены включают антигены ВИЧ, антиген Эбола, антигены ВПЧ и антигены ВЭБ, которые очищают или доставляют в виде смеси или в виде убитых или ослабленных вирусов или вирусных фрагментов. В некоторых вариантах реализации антигены ВПЧ получают из онкогенов E6 и E7 ВПЧ16. В некоторых вариантах реализации соединение содержит клеточный лизат ткани, инфицированной неизвестным патогеном. В некоторых вариантах реализации антиген представляет собой небелковый антиген, например, липид, гликолипид или полисахарид.
В некоторых вариантах реализации белок или полипептид представляет собой репортерный или селективный маркер. Типичные репортерные маркеры включают, без ограничения, зеленый флуоресцентный белок (GFP), красный флуоресцирующий белок (RFP), экворин, бета-галактозидазу, уропорфириноген(уроген)-III-метилтрансферазу (UMT) и люциферазу. Типичные селективные маркеры включают, без ограничения, бластицидин, G418/генетицин, гигромицин B, пуромицин, зеоцин, аденинфосфорибозилтрансферазу и тимидинкиназу.
В некоторых вариантах реализации соединение содержит низкомолекулярное соединение. В некоторых вариантах реализации соединение представляет собой низкомолекулярное соединение. Типичные низкомолекулярные соединения включают, без ограничения, флуоресцентные маркеры, красители, фармацевтические агенты, метаболиты или радионуклеотиды. В некоторых вариантах реализации фармацевтический агент представляет собой терапевтическое лекарственное средство и/или цитотоксический агент. В некоторых вариантах реализации соединение содержит наночастицу. Примеры наночастиц включают наночастицы золота, квантовые точки, углеродные нанотрубки, нанооболочки, дендримеры и липосомы. В некоторых вариантах реализации наночастица содержит или связана (ковалентно или нековалентно) с терапевтической молекулой. В некоторых вариантах реализации наночастица содержит нуклеиновую кислоту, например, мРНК или кДНК. В некоторых вариантах реализации наночастица содержит метку, например, флуоресцентную или радиоактивную метку.
Аспекты настоящего изобретения относятся к усовершенствованной доставке внутриклеточных антител. Неограничивающие примеры внутриклеточных антител описаны в патенте США №6004940, выданном 21 декабря 1999 г.; патенте США №6329173, выданном 11 декабря 2001 г.; публикации патента США №2010/0143371, опубликованной 10 июня 2010 г.; и публикации патента США №2006/0034834, опубликованной 16 февраля 2006 г., содержание каждого из которых включено в настоящий документ посредством ссылок. Ограничение, влияющее на полезность внутриклеточных антител, представляет собой их экспрессию в клетках, представляющих интерес, включая клетки в цельной крови. Настоящее изобретение позволяет преодолеть это ограничение и доставлять выделенные антитела или конструкты, кодирующие антитела, в цитозоль клеток иммунной системы.
Настоящее изобретение охватывает не только доставку интактного моноклонального антитела, но и иммунологически активного фрагмента антитела, например, Fab- или (Fab)2-фрагмента; рекомбинантной одноцепочечной Fv-молекулы; или химерной молекулы, например, антитела, обладающего специфичностью связывания одного антитела, например, мышиного происхождения, и содержащего остальные фрагменты другого антитела, например, человеческого происхождения. В еще одном примере химерная молекула представляет собой гибрид одноцепочечного вариабельного фрагмента (scFv), полученного из моноклонального антитела и объединенного с CD3-дзета трансмембранным доменом и эндодоменом. Такие молекулы приводят к передаче дзета-сигнала в ответ на распознавание scFv его мишени. Вариабельные фрагменты тяжелой и легкой цепи иммуноглобулина объединяют с помощью гибкого линкера с образованием scFv. Этому scFv предшествует сигнальный пептид, направляющий образующийся белок в эндоплазматический ретикулум и обеспечивающий последующую экспрессию на поверхности. Гибкий спейсер позволяет scFv ориентироваться в различных направлениях, обеспечивая связывание антигена. Трансмембранный домен представляет собой типичную гидрофобную альфа-спираль, обычно происходящую из исходной молекулы сигнального эндодомена, которая выступает в клетку и передает желательный сигнал. Такие химерные рецепторы антигенов доставляют в Т-клетки с использованием микрожидкостного способа сдавливания, описанного в настоящем документе.
В некоторых вариантах реализации соединение содержит химерный рецептор антигена (CAR). В некоторых вариантах реализации соединение представляет собой химерный рецептор антигена (CAR). В некоторых вариантах реализации CAR представляет собой гибрид внеклеточного распознающего домена (например, антигенсвязывающего домена), трансмембранного домена и одного или более внутриклеточных сигнальных доменов. При взаимодействии с антигеном внутриклеточный сигнальный фрагмент CAR может инициировать связанный с активацией ответ в клетке иммунной системы, например, высвобождение цитокинов или цитолитических молекул. В некоторых вариантах реализации CAR представляет собой химерный Т-клеточный рецептор антигена. В некоторых вариантах реализации CAR содержит антигенсвязывающий домен, специфичный по отношению к опухолевому антигену. В некоторых вариантах реализации антигенсвязывающий домен CAR представляет собой одноцепочечный вариабельный фрагмент антитела (scFv). В некоторых вариантах реализации соединение усиливает функцию Т-клеток. В некоторых вариантах реализации соединение, усиливающее функцию Т-клеток, является ингибитором контрольной точки пути иммунного ответа. Типичные ингибиторы контрольной точки пути иммунного ответа включают, без ограничения, ингибиторы пути белка запрограммированной гибели-1, ингибиторы пути лиганда белка запрограммированной гибели-1 и ингибиторы пути антигена цитотоксических Т-лимфоцитов-4. Например, мишенью ингибиторов контрольной точки пути иммунного ответа может являться SHP2, тирозинфосфатаза, участвующая в сигнальных путях PD-1 и CTLA-4.
В некоторых вариантах реализации соединение содержит молекулу, меченную флуоресцентной меткой. В некоторых вариантах реализации соединение представляет собой молекулу, меченную флуоресцентной меткой, например, молекулу, меченную флюорохромом, например, Pacific Blue, Alexa 288, Cy5 или каскадным синим. В некоторых вариантах реализации соединение представляет собой радионуклеотид, декстрановую частицу, магнитную гранулу или краситель, неспособный проникать в клетку. В некоторых вариантах реализации соединение представляет собой частицу 3-кДа-декстрана, меченную PacBlue. В некоторых вариантах реализации соединение представляет собой частицу 10-кДа-декстрана, меченную Alexa488. В некоторых вариантах реализации соединение представляет собой белок, меченный низкомолекулярным флуорофором. В некоторых вариантах реализации соединение представляет низкомолекулярное соединение, меченное Alexa647. В некоторых вариантах реализации соединение содержит вирус или вирусоподобную частицу. В некоторых вариантах реализации вирус представляет собой терапевтический вирус. В некоторых вариантах реализации вирус представляет собой онколитический вирус. В некоторых вариантах реализации вирус или вирусоподобная частица содержит нуклеиновую кислоту, кодирующую терапевтическую молекулу, например, терапевтический полипептид.
В некоторых вариантах реализации соединение содержит толерогенный фактор. В некоторых вариантах реализации соединение содержит адъювант. В некоторых вариантах реализации соединение содержит фактор дифференцировки. Типичные факторы дифференцировки, которые можно доставлять в цитозоль Т-клеток для стимуляции дифференцировки и/или активации/созревания Т-клеток, включают в себя факторы транскрипции семейства T-box (T-bet и эомезодермин (Eomes)), NFκB и / или фактор транскрипции семейства forkhead box P3 (FOXP3).
Типичные соединения и композиции для внутриклеточной доставки включают:
• Нуклеиновые кислоты, в частности: ДНК (плазмиды или другие олигонуклеотиды) и РНК (например, миРНК, мРНК, тРНК, маРНК, днРНК, микроРНК, гидовую РНК), модифицированные химически, биологически или иным образом. Белки: например, антитела, ингибиторы, ферменты (например, киназы), факторы транскрипции, рибосомы, антигены, клеточные лизаты;
• Пептиды: длинные (100-10000 аминокислот) и короткие (1-100 аминокислот) Наноматериалы: например, наночастицы на основе липидов, полимерные наночастицы, углеродные нанотрубки, квантовые точки, металлические наночастицы (в том числе золота);
• Вирус: Цитоплазматическая доставка вирусных (или вирусоподобных) частиц приводит к успешной доставке гена в клетки, которые в остальном устойчивы к инфекции. Использование вируса, некомпетентного по репликации, представляет собой дополнительное средство для манипулирования функцией клетки;
• Другие материалы: полимеры, красители, TrisNTA, низкомолекулярные лекарственные средства, адъюванты, зонды;
• Смеси любой комбинации вышеприведенных веществ.
Типичные клетки, в которые доставляют соединения/композиции (все клетки адаптивной и врожденной иммунной системы), включают:
• Все виды млекопитающих, например, человека, мышь, собаку, кошку, лошадь, обезьяну
• В-клетки (например, наивные В-клетки, плазмобласты);
• Т-клетки (например, Th1, Th17, Th2, Treg, CD8, CD4, Trm, Tern, Tcm);
• Дендритные клетки (например, pDC, моноцитарные ДК, cDC, CD8+ ДК, CD11b+ ДК;
• Моноциты, макрофаги;
• Нейтрофилы, NK-клетки, врожденные лимфоидные клетки (ILC1, ILC2, ILC3), базофилы, гранулоциты и тучные клетки.
• Клетки-предшественники (кроветворные стволовые клетки, CLP, мезенхимальные стволовые клетки).
Конструирование функции презентации антигена у клеток иммунной системы
Некоторые аспекты настоящего изобретения относятся к способу конструирования функции клеток иммунной системы, включающего внутриклеточную доставку соединений путем временного повреждения мембраны, окружающей цитоплазму клетки иммунной системы, и доставку антигена в цитозоль. В некоторых вариантах реализации длина антигена составляет более 7, 8, 9 или 10 аминокислот, причем клетка иммунной системы обрабатывает антиген и представляет процессированную форму антигена, ограниченную антигеном комплекса гистосовместимости класса I, на поверхности клетки иммунной системы.
Некоторые аспекты настоящего изобретения относятся к способу конструирования функции клеток иммунной системы, включающего внутриклеточную доставку соединения путем пропускания клетки иммунной системы через микрожидкостное устройство, содержащее сужение, и приведение в контакт клетки иммунной системы с соединением. В некоторых вариантах реализации соединение содержит антиген, а клетка иммунной системы обрабатывает антиген и представляет антиген на поверхности клетки иммунной системы. В некоторых вариантах реализации клетка иммунной системы представляет на своей поверхности процессированную ограниченную антигеном гистосовместимости класса I форму антигена. В некоторых вариантах реализации клетка иммунной системы представляет на своей поверхности процессированную ограниченную антигеном гистосовместимости класса II форму антигена. В некоторых вариантах реализации клеточную мембрану нарушают путем пропускания клетки иммунной системы через сужение диаметром от 2 до 10 мкм. В некоторых вариантах реализации антиген содержит полноразмерный непроцессированный белок. В некоторых вариантах реализации клетку иммунной системы приводят в контакт с эффекторной Т-клеткой, например, CD8+ T-клеткой, и активирует цитотоксический Т-клеточный иммунный ответ. В некоторых вариантах реализации клетку иммунной системы приводят в контакт с эффекторной Т-клеткой, например, CD4+ T-клеткой, и активирует хелперный Т-клеточный иммунный ответ. В некоторых вариантах реализации клетку иммунной системы приводят в контак с эффекторной Т-клеткой и активируют толерогенный Т-клеточный иммунный ответ. В некоторых примерах клетка иммунной системы включает В-клетку, дендритную клетку или макрофаг. В некоторых вариантах реализации клетка иммунной системы включает Т-клетку.
Некоторые аспекты настоящего изобретения относятся к способу придания антиген-презентирующего фенотипа Т-клетке, включающему доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение диаметром 2 мкм-10 мкм, а Т-клетка содержит процессированную ограниченную антигеном комплекса гистосовместимости класса I форму антигена на поверхности клетки иммунной системы после пропускания через микрожидкостное устройство. Некоторые аспекты настоящего изобретения относятся к способу придания антиген-презентирующего фенотипа Т-клетке, включающему доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение диаметром 2 мкм-10 мкм, а Т-клетка содержит процессированную ограниченную антигеном комплекса гистосовместимости класса II форму антигена на поверхности клетки иммунной системы после пропускания через микрожидкостное устройство. В некоторых вариантах реализации антиген включает опухолевый антиген или вирусный антиген. В некоторых вариантах реализации Т-клетку затем приводят в контакт со второй Т-клеткой, причем вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном комплекса гистосовместимости класса I. В некоторых вариантах реализации Т-клетку затем приводят в контакт со второй Т-клеткой, причем вторая Т-клетка характеризуется фенотипом хелперной Т-клетки, ограниченным по антигену комплекса гистосовместимости класса II.
Некоторые аспекты настоящего изобретения относятся к применению загруженной антигеном Т-клетки, обработанной сдавливанием, для активации антиген-специфического цитотоксического Т-клеточного ответа. Некоторые аспекты настоящего изобретения относятся к применению загруженной антигеном Т-клетки, обработанной сдавливанием, для активации антиген-специфического хелперного Т-клеточного ответа. Некоторые аспекты настоящего изобретения относятся к применению загруженных антигеном Т-клеток, обработанных сдавливанием, для индукции антиген-специфического толерогенного Т-клеточного ответа.
Конструирование хоминга клеток иммунной системы
Некоторые аспекты настоящего изобретения относятся к способу придания хомингового фенотипа клетке иммунной системы, включающему доставку соединения в цитозоль Т-клетки путем пропускания клетки иммунной системы через микрожидкостное устройство, причем указанное устройство содержит сужение диаметром 2 мкм-10 мкм, а соединение стимулирует экспрессию хомингового фенотипа у клетки иммунной системы. Например, доставленные соединения могут увеличивать экспрессию хемокиновых рецепторов, которые направляют хоминг к определенной области, и подавлять экспрессию конфликтующих хемокиновых рецепторов.
В некоторых вариантах реализации соединение содержит нуклеиновую кислоту. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту. Типичные нуклеиновые кислоты включают, без ограничения, рекомбинантные нуклеиновые кислоты, ДНК, рекомбинантную ДНК, кДНК, геномную ДНК, РНК, миРНК, мРНК, саРНК, микроРНК, днРНК, тРНК и кшРНК.
В некоторых вариантах реализации соединение содержит белок или полипептид. В некоторых вариантах реализации соединение представляет собой белок или полипептид. В некоторых вариантах реализации белок представляет собой белок для редактирования генов или нуклеазу, например, нуклеазу с доменом «цинкового пальца» (ZFN), эффекторную нуклеазу, подобную фактору транскрипции (TALEN), мегануклеазу или рекомбиназу CRE. В некоторых вариантах реализации соединение представляет собой фактор транскрипции. Типичные факторы транскрипции включают, без ограничения, OctS, Sox2, c-Myc, Klf-4, T-bet, GATA3, FoxP3 и RORɣt. В некоторых вариантах реализации фактор транскрипции индуцирует клеточную экспрессию MHC-комплексов.
В некоторых вариантах реализации соединение содержит химерный рецептор антигена (CAR). В некоторых вариантах реализации соединение представляет собой химерный рецептор антигена (CAR). В некоторых вариантах реализации CAR представляет собой гибрид внеклеточного распознающего домена (например, антигенсвязывающего домена), трансмембранного домена и одного или более внутриклеточных сигнальных доменов. При взаимодействии с антигеном внутриклеточный сигнальный фрагмент CAR может инициировать связанный с активацией ответ в клетке иммунной системы, например, хоминг по отношению к конкретной ткани или физиологическому местоположению. В некоторых вариантах реализации CAR представляет собой химерный Т-клеточный рецептор антигена.
Конструирование толерантности у клеток иммунной системы
Некоторые аспекты настоящего изобретения относятся к способу придания толерогенного фенотипа клетке иммунной системы, включающему доставку соединения в цитозоль Т-клетки путем пропускания клетки иммунной системы через микрожидкостное устройство, причем указанное устройство содержит сужение диаметром 2 мкм-10 мкм, а соединение индуцирует дифференцировку клетки иммунной системы в клетку с толерогенным фенотипом. В некоторых вариантах реализации соединение содержит нуклеиновую кислоту. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту. Типичные нуклеиновые кислоты включают, без ограничения, рекомбинантные нуклеиновые кислоты, ДНК, рекомбинантную ДНК, кДНК, геномную ДНК, РНК, миРНК, мРНК, саРНК, микроРНК, днРНК, тРНК и кшРНК.
Некоторые аспекты настоящего изобретения относятся к способу лечения пациента путем введения клеток иммунной системы, модифицированных в соответствии с описанными способами, в организм пациента. В некоторых вариантах реализации клетки иммунной системы предназначены для применения в иммуносупрессивной терапии. В некоторых вариантах реализации клетки выделяют из организма пациента, модифицируют в соответствии с описанными в настоящем документе способами и вводят обратно в организм пациента. В некоторых вариантах реализации пациенту дополнительно вводят ингибитор контрольной точки иммунного ответа.
Конструирование камикадзе-клеток иммунной системы
Некоторые аспекты настоящего изобретения относятся к способу получения клетки иммунной системы-камикадзе, включающему доставку самоамплифицирующейся РНК в цитозоль Т-клетки путем пропускания клетки иммунной системы через микрожидкостное устройство, причем указанное устройство содержит сужение диаметром 2 мкм-10 мкм, а самоамплифицирующаяся РНК обеспечивает непрерывную продукцию кодируемого белка. В некоторых вариантах реализации соединение содержит нуклеиновую кислоту. В некоторых вариантах реализации соединение представляет собой нуклеиновую кислоту. В некоторых вариантах реализации нуклеиновая кислота представляет собой самоамплифицирующуюся РНК (саРНК).
Скрининг антигенов для разработки вакцин
В некоторых вариантах реализации клетки иммунной системы, модифицированные в соответствии с описанными в настоящем документе способами, используют для скрининга антигенов для разработки вакцин. Например, лизат опухолевых клеток доставляют в антиген-презентирующие клетки, Т-клетки или B-клетки с помощью способа сдавливания, описанного в настоящем документе. APC инкубируют с Т-клетками пациента или клонами/линиями T-клеток с целью определения сходства вакцинных антигенов-кандидатов. В еще одном подходе антиген, процессированный и презентированный с использованием APC, загруженных лизатом опухоли, идентифицируют с помощью масс-спектрометрии. Антигены, выявленные таким образом, впоследствии используют для вакцинации.
Перемещение клеток иммунной системы
Некоторые аспекты настоящего изобретения относятся к способу определения перемещения Т-клеток в организме пациента, включая доставку метки в T-клетку согласно способам, описанным в настоящем документе, и введение меченных Т-клеток в организм пациента, причем перемещение Т-клеток в организме пациента можно определить путем обнаружения меченных Т-клеток. В некоторых вариантах реализации метка является флуоресцентной или радиоактивной меткой. В некоторых вариантах реализации перемещение Т-клеток представляет собой перемещение в опухоль. Например, Т-клетки можно выделить из организма пациента, пропустить через микрожидкостное устройство для доставки изотопа в Т-клетки и ввести обратно в организм пациента. Кроме того, для обнаружения метки и отслеживания перемещения Т-клеток в организме можно использовать способы визуализации, например, ПЭТ-сканирование.
Презентация антигена для вакцин
Поскольку система обеспечивает преимущественную доставку белков в клетки иммунной системы, полезно сконструировать такие клетки для использования при вакцинации пациента (человека, мыши, примата, не являющегося человеком и т. д.) против исследуемой мишени. Доставка специфических антигенных белков (или смесей антигенных белков, смесей белков и адъюванта или пептидов, соответствующих фрагментам белков) непосредственно в цитозоль клетки-мишени (например, ДК, T- или B-клетки) индуцирует презентацию антигена MHC класса I, что впоследствии стимулирует опосредованный CD8 T-клетками иммунитет против заболевания-мишени, например, рака или патогенной микробной инфекции, например, вирусной инфекции. Необязательное использование адъювантов в данном способе усиливает ответ (например, совместная доставка материала повышает эффективность инкубирования клеток в присутствии адъювантного фактора). Возможность манипулировать клетками иммунной системы, которые до изобретения с трудом поддавались или не поддавались конструированию, позволяет применять терапевтические и профилактические вакцины, что было невозможно до изобретения, особенно для таких трудноизлечимых в настоящее время заболеваний, как рак и ВИЧ. Другие проявления включают совместную доставку материалов для повышения выживаемости клеток, чтобы клетки могли осуществлять презентацию антигена в течение более продолжительного времени; одновременную вакцинацию против нескольких антигенов; вакцинацию в комбинации с доставкой (или воздействием) активирующих факторов для получения адъювантных эффектов и усиления иммунного ответа; и/или получение вакцин быстрого реагирования с использованием лизатов клеток в качестве источника антигена. В последнем примере (вакцинация против новых неизвестных возбудителей/заболеваний) получают зараженные или раковые клетки из организма пациента, например, путем отбора ткани или биопсии, и лизат этих клеток доставляют в клетки иммунной системы, используя вышеописанную стратегию. Этот подход стимулирует иммунный ответ против антигенов, ассоциированных с этим неизвестным заболеванием, без априорного знания о природе антигенов.
Вакцинные адъюванты
Для усиления ответа клеток иммунной системы, например, Т-клеток, на вакцинный антиген используют адъюванты или активаторы/усилители иммунного ответа. В некоторых вариантах реализации клетку иммунной системы приводят в контакт с адъювантом до, одновременно или после пропускания через микрожидкостное устройство. Например, клетку приводят в контакт с адъювантом через от приблизительно 5 минут до приблизительно 2 часов после пропускания через микрожидкостное устройство, или через любое время или диапазон времени между этими величинами. Например, клетку приводят в контакт с адъювантом через от приблизительно 5 минут до приблизительно 1,5 часов, от приблизительно 5 минут до приблизительно 1 часа, от приблизительно 5 минут до приблизительно 45 минут, от приблизительно 5 минут до приблизительно 30 минут, от приблизительно 5 минут до приблизительно 15 минут, или от приблизительно 5 минут до приблизительно 10 минут после пропускания через микрожидкостное устройство. В некоторых вариантах реализации клетку приводят в контакт с адъювантом в течение от приблизительно 10 минут до приблизительно 2 часов, от приблизительно 15 минут до приблизительно 2 часов, от приблизительно 30 минут до приблизительно 2 часов, от приблизительно 45 минут до приблизительно 2 часов, от приблизительно 1 часа до приблизительно 2 часов, или от приблизительно 1,5 часов до приблизительно 2 часов после пропускания через микрожидкостное устройство. Помимо классических адъювантов, например, квасцов или эмульсий типа «вода в масле» (например, неполного адъюванта Фрейнда и MF59®), другие адъюванты, например, лиганды рецепторов распознавания образов (PRR), действуют, индуцируя врожденный иммунитет, направляя APC и, следовательно, влияя на адаптивный иммунный ответ. Члены почти всех семейств PRR являются мишенями адъювантов. К ним относятся Toll-подобные рецепторы (TLR), NOD-подобные рецепторы (NLRB), RIG-I-подобные рецепторы (RLR) и лектиновые рецепторы С-типа (CLR). Они используют сигнальные пути, включающие различные адаптерные молекулы, что приводит к активации различных факторов транскрипции. Факторы транскрипции (NF-κB, IRF3) индуцируют продукцию цитокинов и хемокинов, которые играют ключевую роль в предварительной иммунизации, усилении и поляризации иммунных реакций. Активация некоторых членов семейства NLR, например, NLRP3 и NLRC4, вызывает образование белкового комплекса, под названием «инфламмасома», участвующего в индукции провоспалительных цитокинов ИЛ-1β и ИЛ-18. Инфламмасомы NLRP3 и NLRC4 участвуют в механизмах врожденного иммунитета, индуцируемых некоторыми адъювантами, однако их механизм действия остается неясным.
Естественные лиганды или синтетические агонисты PRR, по отдельности или с различными составами. Активация PRR стимулирует продукцию провоспалительных цитокинов/хемокинов и ИФН I типа, которые повышают способность организма устранять патогенные микроорганизмы. Включение патоген-ассоциированных молекулярных структур (PAMP) в вакцины улучшает и ускоряет индукцию вакцина-специфичных реакций. При использовании в комбинации с квасцами или классическими эмульсионными адъювантами PAMP можно применять для направления иммунного ответа в сторону Th1-ответа.
Лиганды TLR3 и RLR. Двуцепочечная РНК (дцРНК), образующаяся в процессе репликации большинства вирусов, является мощным индуктором врожденного иммунитета. Синтетические аналоги дцРНК, например, поли(I: C), можно использовать в качестве адъювантов. Они действуют за счет TLR3 и RIG-I/MDA-5, индуцируя продукцию ИЛ-12 и ИФН I типа, облегчая перекрестную презентацию антигена молекулам MHC класса II и улучшая образование цитотоксических Т-клеток.
Лиганды TLR4. Бактериальные липополисахариды (LPS), являющиеся лигандами TLR4, давно считаются мощными адъювантами, однако их пирогенная активность препятствует их клиническому применению. Разработка менее токсичных производных включает монофосфориллипид А (МПЛА). МПЛА можно использовать в качестве адъюванта для направления иммунного ответа в сторону Th1-ответа.
Лиганды TLR5. Лиганд TLR5, бактериальный флагеллин, является мощным антигеном для Т-клеток и обладает потенциалом вакцинного адъюванта. В отличие от других агонистов TLR, флагеллин создает тенденцию к получению смешанных Th1- и Th2-ответов, а не только Th1-ответов. Флагеллин можно использовать в качестве адъюванта, смешивая его с антигеном или объединяя с рекомбинантным вакцинным антигеном.
Лиганды TLR7/8. Эти лиганды, специализирующиеся на распознавании одноцепочечной вирусной РНК, также можно использовать в качестве вакцинных адъювантов. Например, имидазохинолины (т. е. имиквимод, гардиквимод и R848) являются синтетическими соединениями, активирующими TLR7/8 в нескольких субпопуляциях дендритных клеток, что приводит к продукции ИФН-α и ИЛ-12, стимулирующей Th1-ответ.
Лиганды TLR9. TLR9 распознает олигодезоксинуклеотиды, содержащие специфические CpG-мотивы (CpG ODN, например, ODN 1826 и ODN 2006). Они усиливают продукцию антител, а также направляют/стимулируют Th-клеточные ответы в сторону Th1- и от Th2-ответов.
Лиганды NOD2. Фрагменты стенок бактериальных клеток, например, мурамилдипептид (MDP), являются хорошо известными адъювантами. MDP активирует NOD2 и NLRP3-инфламмасомы.
Эти классы адъювантов, например, модуляторы PRR-путей, можно применять в составе вакцин из-за их способности индуцировать сильный клеточный иммунитет. Предпочтительные адъюванты включают CpG-олигодезоксинуклеотид, R848, липополисахарид (LPS), rhIL-2, антитело против CD40 или CD40L, ИЛ-12 и/или дициклические нуклеотиды.
Конструирование Т-клеток для иммунотерапии
Некоторые аспекты настоящего изобретения относятся к способу лечения пациента путем введения клеток иммунной системы, модифицированных в соответствии с описанными способами, в организм пациента. В некоторых вариантах реализации клетки иммунной системы предназначены для применения в иммунотерапии. Например, за счет доставки различных материалов в T-клетки конструируют функцию адресного воздействия Т-клеток на исследуемое заболевание. Например, за счет доставки химерных рецепторов антигенов или ДНК/мРНК TCR, мишенью которого является исследуемый антиген, получают Т-клетки, специфичные по отношению к антигену указанного заболевания, и ускоренный киллерный (и/или хелперный) Т-клеточный ответ. Другие материалы, например, NF-κB, Bcl-2, Bcl 3, Bcl-xl, стимуляторы экспрессии CD3/CD28, CpG, R848, супрессоры PD-1, супрессоры PDL-1, супрессоры CTLA-4 доставляют для повышения активности и выживаемости клеток.
Например, одна распространенная проблема текущей адоптивной терапии за счет переноса Т-клеток состоит в том, что на активированные Т-клетки действует иммуносупрессивное микроокружение опухоли, истощая/подавляя их, что снижает их эффективность. Внутриклеточную доставку с использованием описанных способов используют для нарушения путей иммуносупрессии [например, путем делеции иммуносупрессивных генов CTLA-4, PD-1, PD-2, PD1-1, PD1-2 или миРНК-опосредованного нокдауна или супрессии на основе низкомолекулярных ингибиторов/антител с использованием известных способов, например, подходов на основе эффекторных нуклеаз, подобных активаторам транскрипции (TALEN), или нуклеаз с доменом «цинкового пальца» (ZFN))], что позволяет указанным T-клеткам сохранить свое высокоактивное, киллерное состояние в опухолевом окружении. Кроме того, этот подход используется для стимуляции превращения Т-клеток в клетки памяти посредством совместной доставки соответствующих факторов для направления дифференцировки к указанному фенотипу (тем самым обеспечивая более долгосрочную защиту). При обычном адоптивном переносе Т-клетки, вводимые в организм пациента, уже находятся в активированном полуистощенном состоянии вследствие пролиферации. Для сброса их фенотипа к наивному состоянию используют способы, описанные в настоящем документе. Таким образом, клетки становятся способны гораздо дольше пролиферировать in vivo после переноса и более не находятся в истощенном состоянии.
В некоторых вариантах реализации способы согласно настоящему изобретению используют для получения антигенспецифичных T-клеток ex vivo. Например, антиген доставляют в клетки иммунной системы, например, ДК, а затем культивируют клетки иммунной системы, загруженные антигеном, с Т-клетками пациента с целью их активации in vitro. Затем эти Т-клетки можно размножить посредством дальнейшей стимуляции перед повторной инъекцией в организм пациента.
Презентация антигена для толерантности:
Для индукции толерантности к антигену, презентируемому клетками, клетки дополнительно приводят в контакт с толерогенным агентом, например, лимфопоэтином стромы тимуса, дексаметазоном, витамином D, ретиноевой кислотой, рапамицином, аспирином, трансформирующим фактором роста-бета, интерлейкином-10 или вазоактивным интестинальным пептидом вместе с антигеном(ами); это может привести к индукции толерантности вместо иммунного ответа.
Опухоли и толерантность Т-клеток
В микроокружении опухоли Т-клетки, реакционноспособные по отношению к опухоли, могут стать толерантными. Это объясняется несколькими супрессивными механизмами, включая толерогенную активность других клеток, ассоциированных с развитием опухоли (Anderson et al., J Immunol 2007, 178: 1268-1276; Probst et al., Nat Immunol 2005, 6: 280-286). Лекарственные средства на основе антител, блокирующие сигнальные пути рецепторов контрольной точки, например, CTLA-4 и PD-1, приводят к противоопухолевому ответу как при первичном, так и при метастатическом заболевании. Злокачественные опухоли, реагирующие на блокаду контрольных точек, характеризуются высокой частотой мутаций и инфильтрируются Т-клетками, реакционноспособными по отношению к раковым антигенам (Taneja, J Urol 2012, 188: 2148-2149; Brahmer et al., N Engl J Med 2012, 366: 2455-2465; Wolchok et al., N Engl J Med 2013, 369: 122-133). Хотя этот подход позволил добиться успеха при определенных показаниях, существование множественных ингибиторных поверхностных рецепторов контрольных точек может снизить эффективность применения ограниченной на данный момент панели функциональных блокирующих антител, доступных для иммунотерапии. Кроме того, требование системного лечения с применением множественных блокирующих антител может привести к увеличению токсичности (Ribas et al., N Engl J Med 2013, 368: 1365-1366; Weber et al., Cancer 2013, 119: 1675-1682), особенно при комбинированном применении (обзор в Postow et al., J Clin Oncol 2015, 33: 1974-1982 и Gao et al., Oncogene 2015). В некоторых аспектах настоящего изобретения резкое улучшение результатов лечения пациентов достигалось лишь за счет подавления ингибиторных путей в T-клетках, реакционноспособных по отношению к опухоли. В неограничивающих примерах этого можно достичь путем ингибирования или генетического нокдауна или нокаута ингибиторного пути в Т-клетках, используемых в подходах адоптивного переноса, например, противоопухолевых эффекторных лимфоцитах (TIL), рекомбинантных TCR и Т-клеток с химерным рецептором антигена (CAR).
SHP2 является широко распространенной тирозинфосфатазой, которая при активации Т-клеток подавляет сигнальный путь TCR и, в свою очередь, Т-клеточный ответ против раковых клеток. Сигнальный путь SHP2, использующий несколько рецепторов контрольной точки иммунной системы, снижает активность Т-клеток. Ингибиторные рецепторы, активирующие SHP2, включают PD-1 (Yokosuka et al., J Exp Med 2012, 209: 1201-1217), CTLA-4 (Marengere et al., Science 1996, 272: 1170-1173), BTLA (Watanabe et al., Nat Immunol 2003, 4: 670-679) и LAIR-1 (Lebbink et al., J Immunol 2004, 172: 5535-5543) (также см. обзор Nirschl et al., Clin Cancer Res 2013, 19: 4917-4924). В некоторых вариантах реализации генетическая инактивация или подавление экспрессии (например, с помощью РНК-интерференции) SHP2 в T-клетках, реакционноспособных по отношению к опухоли, обеспечивает противоопухолевый ответ, аналогичный блокирующему сигнальному пути нескольких ингибиторных рецепторов контрольных точек. Такие варианты реализации могут обеспечивать преимущества (например, снижение побочных эффектов) перед терапевтическим применением стибоглюконата натрия (SSG), фармакологического ингибитора тирозинфосфатаз, включая SHP-1 и -2, в комбинации с другими противоопухолевыми иммунотерапевтическими средствами (Yi et al., Oncotarget 2011, 2: 1155-1164; Naing et al., J Cancer 2011, 2: 81¬89; Pathak et al., J Immunol 2001, 167: 3391-3397). Показано, что SHP2 играет случайную роль в Т-клетках, и ингибирование этой молекулы в Т-клетках может специфически устранить любые потенциальные побочные эффекты, связанные с системным ингибированием ее функции. Кроме того, за счет адресного воздействия на множественные ингибиторные сигнальные пути через генетические нарушения или подавление экспрессии одной внутриклеточной сигнальной молекулы в Т-клетках достигается большая эффективность, чем за счет комбинации адоптивного переноса Т-клеток и системной блокады контрольных точек. В некоторых вариантах реализации белки и нуклеиновые кислоты, например, миРНК, низкомолекулярный ингибитор, антитело, эффекторную нуклеазу, подобную активатору транскрипции, или нуклеазу с доменом «цинкового пальца», доставляют в клетки иммунной системы, например, Т-клетки, с целью модуляции экспрессии гена или активности продукта гена, например, SHP2, и модификации поведения или функции Т-клетки. Например, CD8 T-клетки с недостаточностью Shp2 обладают более высокой активностью при контроле прогрессирования опухоли, чем клетки без недостаточности.
Проблемы модуляции экспрессии генов в Т-клетках, связанные с более ранними подходами, преодолены с помощью устройств CellSqueeze и способов, описанных в настоящем документе. Неограничивающие аспекты устройств CellSqueeze обсуждаются в Proceedings of the National Academy of Sciences (Sharei et al., Proc Nail Acad Sci USA 2013, 110: 2082-2087) и Nano Letters (Lee et al., Nano Lett 2012, 12: 6322-6327) содержимое каждого из которых включено включены в настоящий документ посредством ссылки. Например, технология CellSqueeze может включать микрожидкостной чип, способный быстро деформировать клетки при их пропускании через сужение с целью временного повреждения их мембран и активации возможности транспорта целевого материала в цитоплазму клетки. Кроме того, за счет устранения потребности в использовании электрического поля (например, в некоторых вариантах реализации, устройство и способ не предполагают воздействия электрического поля или помещения клеток в электрическое поле) или потенциально токсичных экзогенных материалов, технология CellSqueeze минимизирует возможность токсического действия на клетки и неспецифических эффектов. Конструктивные варианты микрожидкостного устройства и способы обработки, описанные в настоящем документе, позволяют получить более эффективно сконструированные терапевтические средства на основе Т-клеток для различных онкологических показаний.
Конструирование Т-клеток для иммунносупрессии
В аутоиммунных заболеваниях часто участвуют аутореактивные клетки иммунной системы, повреждающие здоровые ткани. Внутриклеточную доставку FoxP3 (и/или других факторов) в T-клетки используют для получения регуляторных Т-клеток с целью противодействия аутоиммунитету. Эти Treg получают для широкой системной иммуносупрессии или перепрограммирования аутоантиген-специфических Т-клеток на фенотип Treg. Последнее действие приводит к хомингу Treg в области-мишени хоминга клеток, закрепляющих аутоиммунитет, и локализованной супрессии их активности.
Самоамплифицирующиеся РНК (саРНК)
Самоамплифицирующиеся РНК обеспечивают уникальные возможности, поскольку они не только экспрессируют исследуемый белок, но и реплицируют свою последовательность в цитоплазме без риска интеграции в геном хозяина. Таким образом, введение самоамплифицирующейся РНК в клетку иммунной системы можно применять для конструирования функций клетки иммунной системы. Некоторые конкретные проявления включают клетки иммунной системы-камикадзе, альтернативы доставке белка или непрерывное модулирование функции клеток; каждый из этих вариантов описан ниже.
Клетки иммунной системы-камикадзе
Для реализации стратегий вакцинации или иммуносупрессии, аналогичных вышеописанным технологиям, саРНК, кодирующие исследуемый(е) антиген(ы), доставляют в клетки иммунной системы, характеризующиеся хомингом по отношению к желательной области. Например, доставка саРНК, кодирующей раковый антиген, в Т-клетки (или B-клетки, моноциты, ДК или макрофаги) и инъекция этих клеток в организм пациента приводит к быстрой продукции антигена в Т-клетках и возможной гибели этих Т-клеток за счет быстрой репликации саРНК. Эти вспышки гибели Т-клеток, загруженных целевым антигеном, имитируют инфекцию и приводят к поглощению материала клетками врожденной иммунной системы в тканях-мишенях и первичной вакцинной иммунизации против антигена-мишени. В зависимости от ткани-мишени, наличия адъювантов и общего воспалительного состояния пациента, эту стратегию также используют для индукции толерантности. Для индукции толерантности конструируют вышеупомянутые клетки-камикадзе, высвобождающие толерогенные факторы и антиген или контактирующие с толерогенными факторами, например, ТФР-бета и ИЛ-10. Например, T- или B-клетки-камикадзе можно загружать мРНК, ДНК или саРНК, сверхэкспрессирующими желательный антиген и также экспрессирующими толерогенные факторы (например, секрецию ТФР-бета и ИЛ-10). Эти клетки затем мигрируют в лимфоидные органы перед гибелью, сопровождающейся высвобождением антигенов и толерогенных факторов в окружающую среду, что способствует индукции толерантности к антигену-мишени. Это может помочь устранить аутореактивные эффекторные T-клетки и стимулировать продукцию T-reg, способных обеспечить защиту против аутореакционной способности. В одном неограничивающем примере применяли этот подход с использованием антигена ревматоидного артрита.
Альтернатива доставке белка
саРНК, мРНК или экспрессирующие векторы, например, плазмиды, обеспечивают постоянную продукцию белка в течение срока вакцинной терапии, в отличие от импульсной доставки белка
Непрерывное модулирование функции клеток
При использовании способов лечения на основе адоптивного переноса Т-клеток в качестве примера, разработка улучшенных Т-клеточных терапевтических средств осуществляется с помощью саРНК, кодирующих ингибиторы иммуносупрессивных путей. саРНК также используют для экспрессии стимулирующих белков с целью поддержания высоких уровней активации Т-клеток и/или антиапоптозных белков с целью увеличения продолжительности выживаемости. Неограничивающие примеры супрессии ингибиторов включают любые материалы, блокирующие PD-1, PD-L1, CTLA-4 или другие ингибиторы контрольных точек. При экспрессии ИЛ-2, NF-Kb, ИЛ-7, ИЛ-15, ИЛ-12 и т. д. можно сохранить высокую активность Т-клеток; такие белки, как Bcl2 и Bclx1, могут помочь продлить выживаемость.
Перепрограммирование функций клеток иммунной системы
Клетки иммунной системы используются в качестве источника аутологичных клеток. Клетки перепрограммируют с целью реализации функций, обеспечивающих лечение различных заболеваний. Например, в случае артрита, материалы доставляют в Т-клетки с целью индукции экспрессии фенотипа совместного хоминга и программирования высвобождения факторов (например, ИЛ-4, ИЛ-6, ИЛ-10, ИЛ-13, ИЛ-11, ТФРb, ретиноевой кислоты и стимуляторов контрольных точек), способных облегчить симптомы, или, в случае болезни Паркинсона, материалы доставляют в T-клетки или B-клетки для индукции экспрессии рецепторов хоминга в головном мозге и секреции факторов для улучшения результатов лечения пациентов. При артрите также можно использовать удаление провоспалительных цитокинов, например, Т-клетка с высоким сродством к ИЛ-2 будет поглощать цитокин, который требуется аутореактивным эффекторным клеткам.
Для получения данных, описанных в данном документе, использовали следующие материалы и способы.
Микрожидкостные устройства CellSqueeze
Платформа CellSqueeze состоит из трех основных компонентов: а) микрожидкостного чипа из кремния и стекла, содержащего несколько параллельных каналов, каждый из которых содержит по меньшей мере один участок сужения b) систему резервуаров, которая взаимодействует с чипом и позволяет загружать/собирать суспензию клеток c) систему регулирования давления для накачивания резервуаров и облегчения потока жидкости через чип. В типичном рабочем процессе (Фиг. 1а) целевой доставляемый материал смешивают с желательными клетками (в виде суспензии) и загружают в резервуар. Затем к резервуару подключают нагнетательный трубопровод и нагнетают давление в камере до желательного уровня с целью запуска потока жидкости. После обработки клетки можно собрать на выходе резервуара и инкубировать при желательной температуре в течение некоторого времени, например, по меньшей мере 1, 2, 3, 4, 5 минут или более, для надлежащего восстановления мембраны перед дальнейшей обработкой.
Устройства CellSqueeze и вспомогательное оборудование получили из SQZ Biotechnologies, США. Устройства собрали и использовали в соответствии с протоколами производителя. Sharei, A., N. Cho, S. Mao, E. Jackson, R. Poceviciute, A. Adamo, J. Zoldan, R. Langer, and K. F. Jensen. 2013. Cell squeezing as a robust, microfluidic intracellular delivery platform. Journal of visualized experiments: JoVE: e50980.
Например, отдельные устройства CellSqueeze и связанные с ними системы резервуаров хранили в 70% этаноле для поддержания стерильности. Для каждого эксперимента нужное устройство CellSqueeze подключали к резервуарам и использовали 70 мкл PBS для промывки системы до использования с образцами клеток.
В ходе эксперимента по доставке клетки-мишени, устройство + резервуар и планшет для сбора хранили на льду (Т-клетки и B-клетки) или при комнатной температуре (дендритные клетки). Клетки (в концентрации 2×106-1×107 кл/мл в PBS или культуральной среде) смешивали с целевым доставляемым материалом в желательной концентрации до добавления в жидкостной резервуар. Подключали нагнетательный трубопровод, в системе устанавливали желательное рабочее давление, и запускали поток путем нагнетания давления в резервуаре, содержащем образец. После пропускания через чип клетки собирали из резервуара для сбора и переносили в 96-луночный планшет. Этот процесс необязательно повторяли. Для минимизации засорения направление потока в чипе чередовали между образцами. Образцы оставляли для инкубирования на льду на 5 мин после обработки, а затем добавляли среду и переносили клетки для дальнейшей обработки.
CAR Т-клетки
Модифицируя Т-клетки с целью экспрессии химерного рецептора антигена (CAR), распознающего раковые специфические антигены, можно выполнить первичную иммунизацию клеток, распознающих и уничтожающих опухолевые клетки, которые в противном случае могли бы избежать обнаружения иммунной системой. Этот процесс включает выделение Т-клеток пациента, их трансфекцию геном CAR, а затем повторное введение трансфицированных клеток в организм пациента.
Эти искусственные Т-клеточные рецепторы (также известные как химерные Т-клеточные рецепторы, химерные иммунорецепторы или CAR) представляют собой сконструированные рецепторы, трансплантация которых придает произвольную специфичность эффекторным клеткам иммунной системы. Как правило, эти рецепторы используют для придания специфичности моноклонального антитела Т-клетке. До изобретения перенос кодирующей нуклеотидной последовательности обычно облегчали за счет применения ретровирусных векторов. Способы, описанные в настоящем документе, не используют и не включают вирусные векторы. Кодирующую последовательности или белок CAR доставляют в цитозоль клетки иммунной системы, например, Т-клетки, с использованием сдавливания клеток с помощью описанного устройства без необходимости использования вирусного вектора.
Для терапевтического применения получают Т-клетки пациента (и при необходимости обогащают или очищают их) из периферической крови и модифицируют их с целью экспрессии искусственного (химерного) рецептора, специфичного по отношению к определенному антигену, ассоциированному с раком. После модификации Т-клетки распознают и уничтожают рак. Например, типичный CAR распознает CD19, антиген, экспрессирующийся при B-клеточных злокачественных гемобластозах. После модификации Т-клеток с целью экспрессии CAR модифицированные Т-клетки вводят пациенту. Сконструированные клетки распознают и уничтожают раковые клетки. Такую терапию применяли при ОЛЛ, неходжкинской лимфоме и хроническом лимфолейкозе (ХЛЛ); она подходит для лечения для любого типа рака, в том числе гемобластозов, например, лейкозов, B-клеточных злокачественных заболеваний (например, острого лимфобластного лейкоза (ОЛЛ) и хронического лимфоцитарного лейкоза), а также солидных раковых опухолей. Описанные в настоящем документе способы обработки клеток представляют собой улучшенный процесс получения CAR Т-клеток.
Аутологичные T-клетки экспрессируют белки CAR, которые придают сконструированным Т-клеткам способность распознавать специфический антиген на опухолевых клетках. Такие опухолеассоциированные антигены выявлены и известны в данной области техники (см. таблицы ниже). Затем сконструированные CAR Т-клетки размножают в лаборатории, и расширенную популяцию CAR Т-клеток вводят пациенту. Т-клетки размножаются в организме пациента, распознают, связывают и уничтожают раковые клетки, несущие опухолеассоциированные антигены на своей поверхности. С CAR Т-клетками необязательно можно объединять ингибиторы контрольных точек иммунной системы, например, ингибиторы белка запрограммированной смерти-1 (PD-1) или ингибиторы его лиганда (PD-L1) и/или лекарственные средства против антигена-4 цитотоксических Т-лимфоцитов (CTLA4).
Лечение опухолей
Клетки иммунной системы обрабатывали, как описано выше, с целью введения соединений или композиций в цитозоль для лечения опухолей, например, путем выявления опухолеспецифичного иммунного ответа, опосредованного Т-клетками, для уничтожения или ингибирования пролиферации опухоли. Данный способ применим к любому типу опухоли, поскольку устройства и способы внедрения опухольспецифических / опухолеассоциированных антигенов или их смесей, например, клеточных лизатов биоптатов опухолей в клетки иммунной системы. Например, типы опухолей включают рак мочевого пузыря, рак молочной железы, рак толстой и прямой кишки, рак эндометрия, рак почек, лейкоз, рак легких, меланому, неходжкинскую лимфому, рак поджелудочной железы, рак предстательной железы, рак щитовидной железы, которые широко распространены среди населения США. (American Cancer Society: Cancer Facts and Figures, 2015, Atlanta, Ga: American Cancer Society, 2015. Доступно в сети.) Другие типы опухолей, которые можно лечить с использованием обработанных клеток иммунной системы, включают рак головного мозга (глиобластому), печени (гепатоцеллюлярную карциному), а также метастатический рак, возникающий в анатомических областях или тканях в организме, отличающихся от области или ткани первичной опухоли.
В предпочтительных вариантах реализации опухоль представляет собой рак поджелудочной железы, рак яичников, меланому, рак легких, глиому или глиобластому. В некоторых вариантах реализации мишенью является опухоль конкретного пациента. Например, лизат опухоли пациента можно использовать в качестве антигенов, доставляемых в клетки иммунной системы с использованием сдавливания клеток.
Антигены опухолевых клеток
Очищенные опухолеассоциированные антигены или лизаты опухоли пациента (гетерогенные смеси антигенов) можно использовать в качестве антигенов, доставляемых в клетки иммунной системы с использованием сдавливания клеток. Лизаты клеток опухоли получают из опухолевых линий клеток или биоптатов опухолевой ткани, полученных из организма субъекта с диагнозом опухоли, и/или выделяют для лечения патологических злокачественных новообразований. Получение лизатов опухолевых клеток известно в данной области техники. Такие препараты лизатов опухолей подходят для доставки в цитозоль клеток иммунной системы на основе сдавливания клеток
Например, опухолевую ткань вырезают из организма субъекта и измельчают. Опухолевые клетки обрабатывают, например, фракционируют, обогащают или очищают/выделяют. В случае несолидной опухоли, гемобластоза (первичного или метастатического), или линии клеток, обогащенных клеток) клетки получают из биологической жидкости, например, периферической крови, и дополнительно обогащают или очищают с целью концентрирования опухолевых клеток по сравнению с неопухолевыми клетками. Опухолевые клетки (или популяции клеток, обогащенные по отношению к опухолевым клеткам) обрабатывают, получая лизат опухолевых клеток (например, как описано в статье Hatfield et al., J Immunother. 2008 Sep; 31(7): 620-632.) Например, клетки подвергают циклическому замораживанию-размораживанию (например, 1, 2, 3, 4, 5, 10 или более циклам замораживания/размораживания). Этапы обработки необязательно включают удаление твердых остатков и фильтрацию, например, через 0,2-мкм фильтр, для получения смеси антигенов опухолевых клеток, специфичных для пациента.
В неограничивающем примере клетки лизируют посредством множественных (например, 4) последовательных циклов замораживания/размораживания с использованием жидкого азота. Затем клетки обрабатывают ультразвуком в течение приблизительно 10, 15, или 20 секунд, а затем центрифугируют при 1000 x g для удаления нерастворимых остатков. Супернатант используют для доставки лизата. Липиды и/или нуклеиновые кислоты необязательно удаляют из лизата до доставки в клетки иммунной системы. Перед доставкой необязательно добавляют адъюванты для усиления функции APC.
В некоторых вариантах реализации удаляют распространенные эндогенные белки, например, актин, для селективного увеличения доли раковых антигенов в лизате. В некоторых вариантах реализации к композиции лизированных клеток добавляют мягкое поверхностно-активное вещество, способствующее предотвращению формирования белковых агрегатов, которые может быть трудно доставить или процессировать для презентации клеткой.
Лизат аутологичных опухолевых клеток также можно получить с помощью коммерчески доступных устройств/способов, например, gentleMACS™ Dissociator (Miltenyi Biotec GmbH).
Опухолеассоциированные антигены известны в данной области техники, и такие антигены можно подвергать биохимической очистке, рекомбинантной экспрессии или иным видам очистки/выделения. Примеры таких антигенов показаны ниже в таблицах.
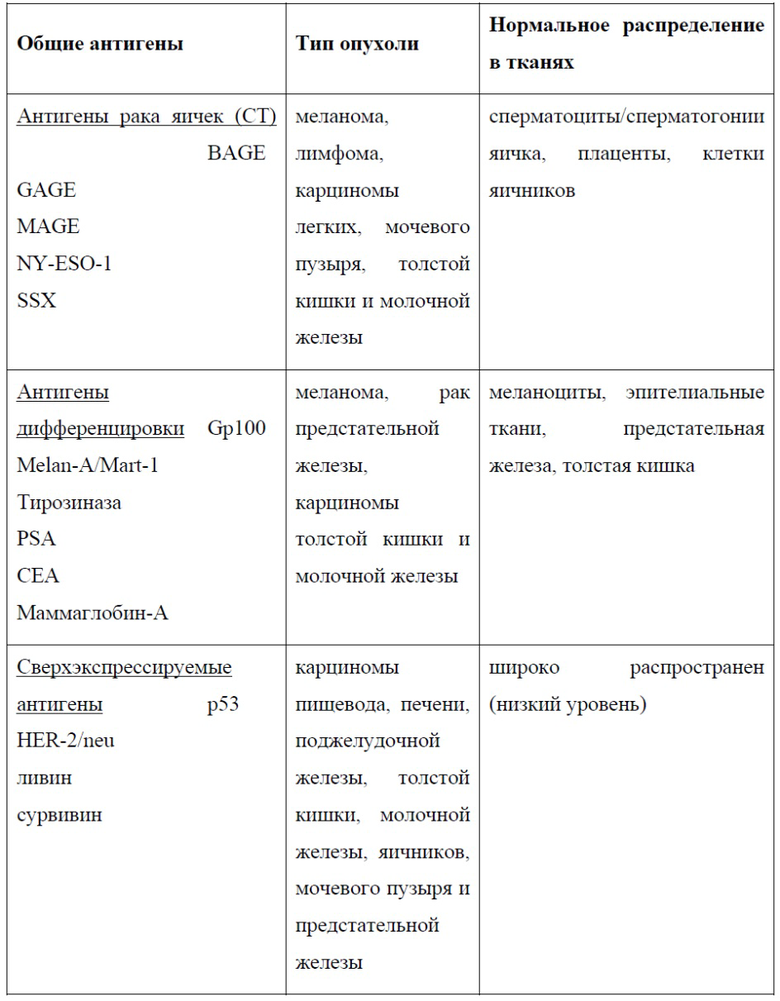
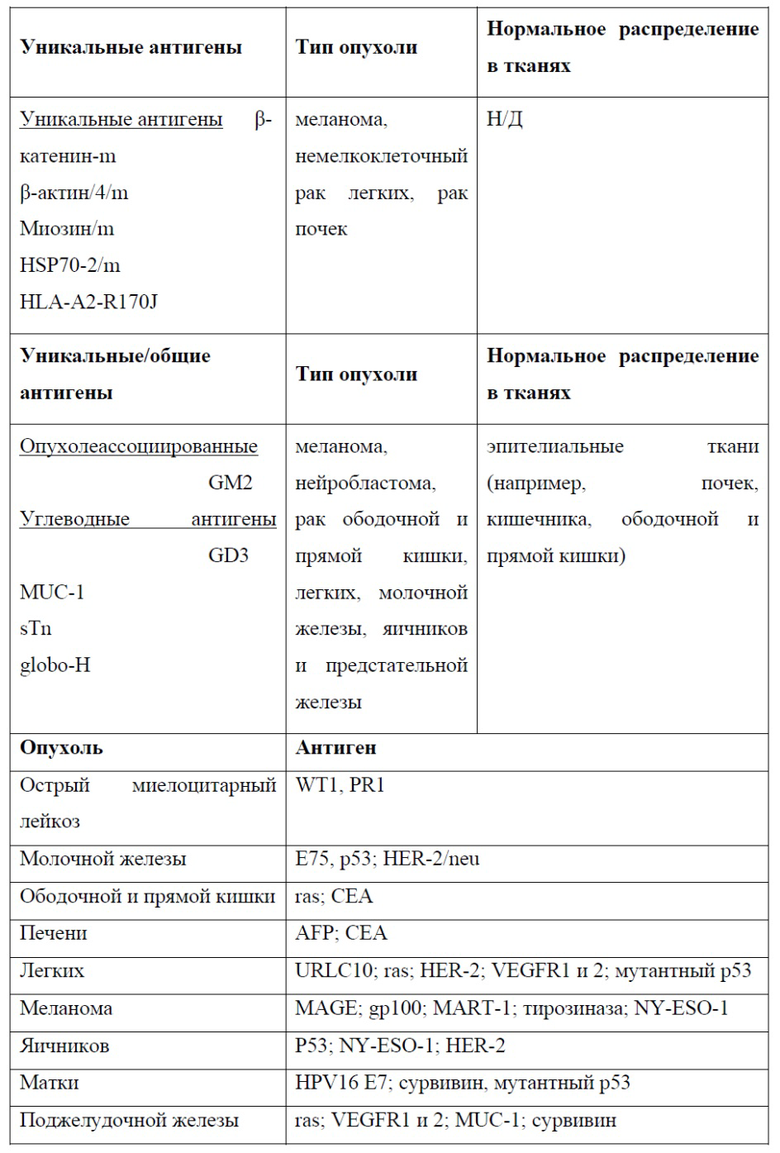
(Buonaguro et al., Clin Vaccine Immunol. 2011 Jan; 18(1): 23-34.)
В данной области техники известны другие очищенные опухолевые антигены, например, описанные в Tumor-Associated Antigens. Edited by Olivier Gires and Barbara Seliger, 2009, WILEY-VCH Verlag GmbH & Co., KGaA, Weinheim.
Вирусные антигены
Антигены, ассоциированные с вирусами, можно доставлять в клетки иммунной системы, используя сдавление клеток. Антигены, ассоциированные с вирусами, известны в данной области техники, и такие антигены можно подвергать биохимической очистке, рекомбинантной экспрессии или иным видам очистки/выделения. Примеры вирусных антигенов показаны ниже в таблице.
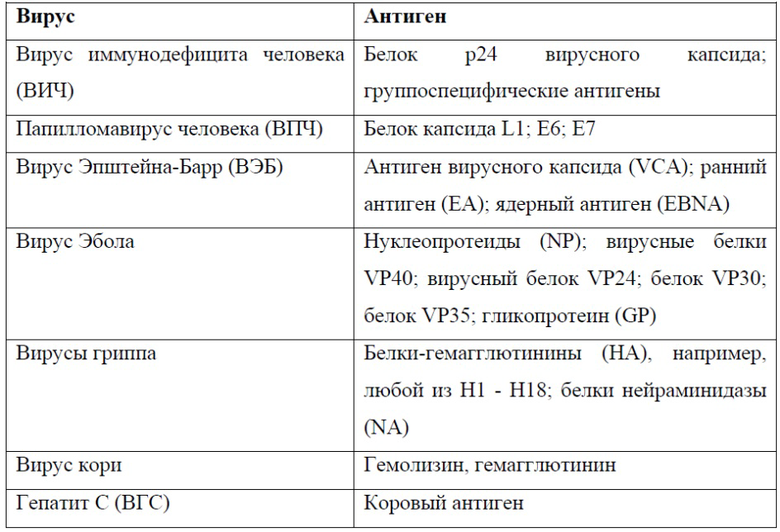

Бактериальные антигены
Бактериальные антигены также можно доставлять в клетки иммунной системы, используя сдавление клеток. В предпочтительных вариантах реализации бактериальные антигены ассоциированы с внутриклеточными бактериями, например, Mycoplasma sp., Mycobacterium sp. (например, M. tuberculosis) или Listeria monocytogenes.
Для получения данных, описанных в данном документе, использовали следующие материалы и способы.
Выделение клеток иммунной системы мыши
T- и B-клетки выделяли из селезенки мышей C57BL6/J дикого типа с использованием известных способов, например, наборов для выделения, специфичных по отношению к видам клеток, от Stemcell Technologies (Ванкувер, Канада) на основании инструкции производителя (методика отрицательного отбора). Моноциты/макрофаги выделяли из брюшной полости мышей C57BL6/J дикого типа через 3 дня после внутрибрюшинного введения 1 мл раствора тиогликолата. Клетки очищали с помощью набора для положительного отбора CD11 b от Stemcell Technologies (Ванкувер, Канада) на основании инструкции производителя. Клетки культивировали в глутаминсодержащей среде RPMI 1640 с добавлением 10% эмбриональной телячьей сыворотки, 1% антибиотиков/противогрибковых средствам, 0,5% бета-меркаптоэтанола, 1% неосновных аминокислот, 1 мМ пирувата натрия и 10 мМ HEPES-буфера (все реагенты получены в (Life Technologies, Нью-Йорк, США)).
Первичные T-клетки и дендритные клетки моноцитарного происхождения человека
МПК человека выделяли с использованием известных способов, например, центрифугированием в градиенте плотности Ficoll-Paque (GE Healthcare, Уппсала, Швеция) из цельной крови. CD4+ Т-клетки отделяли от CD14-отрицательной фракции МПК с помощью CD14 и CD4 магнитных микрогранул (MACS Miltenyi Biotec, Оберн, штат Калифорния, США). Т-клетки культивировали в среде RPMI 1640 (Cellgro, Манассас, штат Виргиния, США), содержащей 10% человеческую сыворотку (AB) (GemCell, Вест-Сакраменто, штат Калифорния, США), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата (среда H 10) с добавлением 5 нг/мл rhIL-15 (R&D Systems, Миннеаполис, штат Миннесота, США) для поддержания жизнеспособности клеток без их активации. Моноцитарные дендритные клетки человека (МДК) получали из CD14-положительных моноцитов, отобранных из мононуклеаров периферической крови с помощью магнитных микрогранул с антителом против CD14 (MACS Miltenyi Biotec) и культивировали в течение 6 дней с добавлением 100 нг/мл интерлейкина-4 и 50 нг/мл гранулоцитарно-макрофагального колониестимулируюего фактора (R & D Systems).
Трансфекция клеток
миРНК CD45 человека: смысловая, 5’-AF488 CUGGCUGAAUUUCAGAGCAdTdT-3’ (SEQ ID NO: 1), миРНК CD4 человека: смысловая, 5’-GAUCAAGAGACUCCUCAGUdTdT-3’ (SEQ ID NO: 2) (Alnylam, Кембридж, штат Массачусетс, США); миРНК vif: смысловая, 5’-CAGAUGGCAGGUGAUGAUUGT-3’, (SEQ ID NO: 3) миРНК gag: смысловая, 5’-GAUUGUACUGAGAGACAGGCU-3’ (SEQ ID NO: 4) (Huang et al., 2013, Nature Biotechnology 31: 350-356); (GenePharma, Шанхай, Китай); контрольная рандомизированная (scrambled) миРНК: 5’-GCCAAGCACCGAAGUAAAUUU-3’ (SEQ ID NO: 5), миРНК DC-SIGN человека: смысловая, 5’-GGAACUGGCACGACUCCAUUU-3’ (SEQ ID NO: 6) (Dharmacon, ThermoScientific, Питтсбург, штат Пенсильвания, США).
Нуклеофекция
В описанных экспериментах по электропорации использовали Amaxa Nucleofector II (Lonza Inc., Аллендейл, штат Нью-Джерси, США) согласно рекомендациям производителя. Эксперименты с Т-клетками человека выполняли с помощью программы для нестимулированных Т-клеток человека с высокой жизнеспособностью U-014 и набора для Т-клеток человека. Для МДК человека авторы изобретения использовали программу для дендритных клеток человека U-002 с набором для МДК человека. Вкратце, 2×106 клеток суспендировали в 100 мкл раствора для нуклеофекции с 200 пмоль миРНК и выполняли нуклеофекцию в аппарате. Для проверки доставки белка авторы изобретения использовали IgG1 мыши, меченый APC (cl. MOPC-21, Biolegend) в концентрации 0,02 мг/мл для экспериментов с CellSqueeze и нуклеофекцией. Авторы изобретения также использовали 3-кДа декстран, меченый каскадным синим, и 70-кД декстран, меченый флуоресцеином, в концентрации 0,2 мг/мл (Invitrogen).
Регуляторные Т-клетки
Регуляторные Т-клетки (Treg) выделяли и дифференцировали с помощью известных способов. Например, МПК, обогащенные CD4+ Т-клетками, выделяли из периферической крови здоровых людей центрифугированием в градиенте плотности с помощью набора RosetteSep для обогащения CD4+ T-клеток (Sigma-Aldrich и STEMCELL Technologies) и метили антителами против CD3-PE-Cy7, CD4-FITC, CD25-APC и CD127-PE. CD3+CD4+CD25+CD127низк Treg сортировали на сортировщике клеток FACS Aria (BD Biosciences), стимулировали микрогранулами, покрытыми антителом против CD3/антителом против CD28 (Invitrogen) и культивировали с ИЛ-2 (300 Ед/мл).
Для доставки миРНК на 7 день культивирования Treg смывали и ресуспендировали в концентрации 1,0×107 кл/мл в среде X-VIVO 15 (Lonza). Для каждого варианта условий использовали 1,0 x 106 клеток. миРНК CD4 (5’-GAUCAAGAGACUCCUCAGU-3’ (SEQ ID NO: 7), Alnylam) и контрольную миРНК (пул № 1 неспецифической миРНК siGENOME, Thermo Fisher) использовали в концентрации 1 мкМ с конструктивным вариантом чипа 30-4 при давлении 100 фунтов/кв. дюйм.
Через 2 дня после доставки миРНК клетки окрашивали с использованием набора для окрашивания мертвых клеток LIVE/DEAD® Fixable Violet Dead Cell Stain Kit (Life Technologies) и антитела против CD4-APC. Данные получали на проточном цитометре LSR2 (BD Biosciences) и анализировали на FlowJo (Treestar).
Проточная цитометрия
Клетки мыши окрашивали следующими антителами: против CD8-Pacific Blue, против CD4-APC, против CD11b-PE (cl. M1/70), против CD11c-APC. Для исключения мертвых клеток использовали иодид пропидия. Данные получали с помощью FACS CantoII, LSR II или LSRFortessa (BD Biosciences) и анализировали с помощью FlowJo (Tree Star, Ашленд, штат Орегон, США).
Клетки человека окрашивали следующими антителами: против CD3-APC (c1.OKT3), против CD45RA-PE-Cy7 (cl. HI100) и против CD4-AF488 (c1.OKT4) от Biolegend (Сан-Диего, штат Калифорния, США) и против DC-SIGN-APC (c1.9E9A8) (R & D Systems, Миннеаполис, штат Миннесота, США). Мертвые клетки исключали с помощью красителя для мертвых клеток Sytox blue и 7-AAD (7-аминоактиномицин D) (Invitrogen). Данные получали с помощью FACS CantoII (BD Biosciences) и анализировали с помощью FlowJo (Tree Star, Ашленд, штат Орегон, США).
ВИЧ-инфекция и внутриклеточное окрашивание антигена p24
Первичные CD4+ T-клетки обрабатывали 5 мкМ миРНК, используя чип 10-4. миРНК для нокдауна CD4 доставляли за 48 часов до заражения, в то время как миРНК, мишенью которой являлись вирусные гены vif и gag, доставляли за 24 часов до заражения. Затем клетки стимулировали в течение ночи с использованием 5 пг/мл фитогемагглютинина (ФГА) и заражали HIVIIIB в 96-луночных планшетах из расчета 2×105 клеток/лунку с ВИЧ IIIB (400 нг/мл p24). ВИЧ IIIB получили из программы реагентов NIH AIDS Reagent Program, рабочий раствор вируса получали, как описано выше (18). Инфекцию усиливали за счет добавления полибрена в концентрации 5 мкг/мл и инокулирования с центрифугированием при 1200 × g в течение 2 часов при 37°C (19). Внутриклеточное окрашивание антигена p24 выполняли через 24 часа с использованием антитела против p24 KC57-FITC (Beckman Coulter, Фуллертон, штат Калифорния, США) и набора для пермеабилизации клеток Fix & Penn Kit for Cell penneabilization (Invitrogen) и анализировали проточной цитометрией.
Количественная ОТ-ПЦР
Общую РНК выделяли из Т-клеток с помощью набора RNeasy Mini Kit (Qiagen), копию ДНК синтезировали с помощью Superscript III и случайных гексамеров (Invitrogen). ПЦР в реальном масштабе выполняли с использованием смеси SsoFast EvaGreen Supemix и амплификатора для ПЦР в реальном времени Bio-Rad CFX96 (Bio-Rad Laboratories, Херкулиз, штат Калифорния, США). Праймеры представляли собой: Прямой праймер Gapdh: 5’-AGCCACATCGCTCAGACAC -3’ (SEQ ID NO: 8), обратный праймер Gapdh: 5’-GCCCAATACGACCAAATCC -3’ (SEQ ID NO: 9), прямой праймер CD4: 5’-GGCAGTGTCTGCTGAGTGAC - 3’ (SEQ ID NO: 10), обратный праймер CD4: 5’-GACCATGTGGGCAGAACCT - 3’ (SEQ ID NO: 11).
Статистический анализ
Выполняли односторонний дисперсионный анализ (ANOVA) с критерием множественных сравнений Бонферрони при сравнении нескольких групп, или оценку двустороннего t-критерия Стьюдента при сравнении 2 групп с использованием программного обеспечения GraphPad Prism 4 (GraphPad Software, Сан-Диего, штат Калифорния, США). *, ** и *** указывают на значения P менее 0,05, 0,01 и 0,001 при использовании критерия множественных сравнений Бонферрони, а ### указывает на значения P менее 0,001 при использовании двустороннего t-критерия Стъюдента. Данные представлены как среднеарифметическое ± 1 стандартное отклонение, если не указано иное.
Доставка за счет механического повреждения мембраны
Протестированные микрожидкостные устройства содержали 45-75 микрожидкостных параллельных каналов с различной длиной (10-50 мкм), шириной сужения (4-9 мкм) и количеством сужений на канал (1-5 сужений). (Sharei et al., 2013, Proceedings of the National Academy of Sciences of the United States of America 110: 2082-2087; Sharei et al., 2014, Integrative biology: quantitative biosciences from nano to macro 6: 470-475).
Система требовала для работы включения в микрожидкостной чип монтажного компонента, закреплявшего резервуары с жидкостью на устройстве из кремния и стекла, и системы регулирования давления, контролирующей давление газа, используемого для движения жидкости через систему. В некоторых вариантах реализации устройство содержит шприц или источник давления для запуска потока через микрожидкостной канал.
Процедура эксплуатации показана на Фигуре 1А. По мере пропускания клеток в потоке через микрожидкостные каналы (Фигура 1B) они достигают точки сужения канала (приблизительно на 50% менее диаметра большинства обрабатываемых клеток), что приводит к быстрой механической деформации (типичные размеры точки сужения для клеток-мишеней составляют для T-клеток (покоящихся: 7-8 мкм, активированных (7-15 мкм), макрофагов (покоящихся и активированных: 10-30 мкм), дендритных клеток (покоящихся и активированных: 10-30 мкм), или сдавливанию клеток. При надлежащем размере сужения канала деформация временно нарушает мембрану клетки (например, процесс деформации занимает от 0,1 мкс до 1 мс, однако повреждение мембраны может сохраняться до 5 мин). Макромолекулы, присутствующие в окружающем буфере, проникают в цитозоль клетки, если они достаточно малы, чтобы пройти через область повреждения мембраны. В течение ~5 мин мембрана восстанавливает свою целостность, и макромолекулы, поглощенные клеткой, остаются в цитозоле клетки. Предыдущие исследования позволили установить, что длина (L), ширина сужения (W) и скорость жидкости (V, обратите внимание, что скорость жидкости определяется рабочим давлением) являются важными параметрами, влияющими на эффективность доставки и жизнеспособность клеток. (Sharei et al., 2013, Proceedings of the National Academy of Sciences of the United States of America 110: 2082-2087).
Библиотеку из 16 различных конструктивных вариантов сужения протестировали при различных условиях потока. Библиотека конструктивных вариантов протестированных устройств. Первое число обозначает длину сужения, последующие числа после тире обозначают ширину сужения. Наличие нескольких идентичных последовательных сужений обозначают как «x», после чего указывают количество сужений. Например, 10-5-4-5 содержит 3 последовательных сужения длиной 10 мкм и шириной 5 мкм, 4 мкм и 5 мкм. 10-4 x 5 содержит 5 последовательных сужений длиной 10 мкм и шириной 4 мкм каждое.
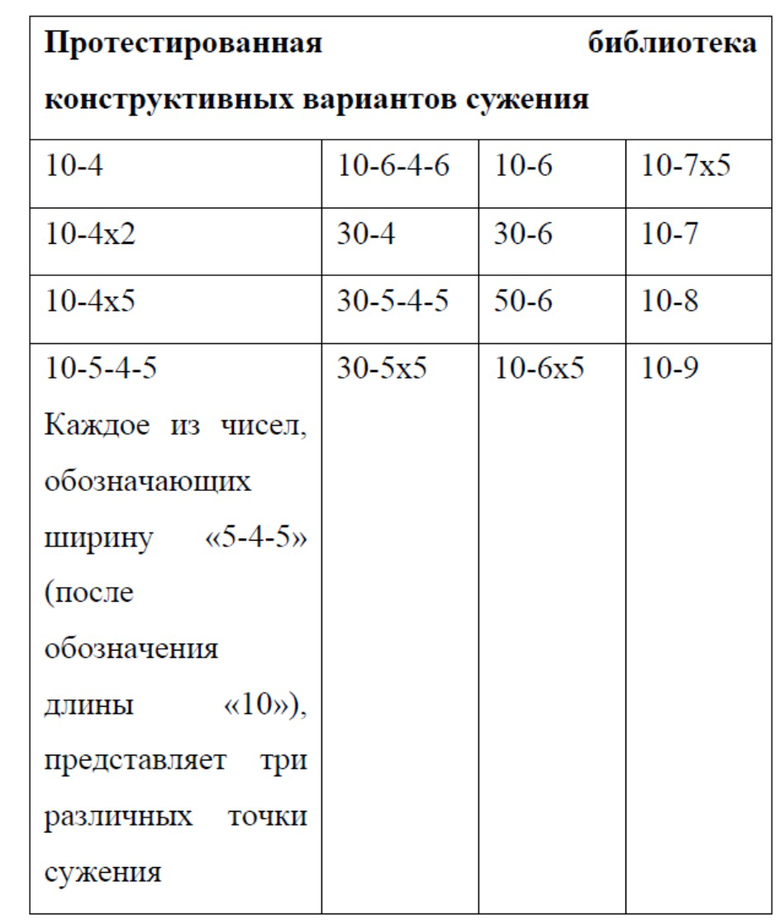
Эти переменные включали изменения давления (для изменения скорости потока) и температуры для оптимизации доставки макромолекул и минимизации токсического действия на клетки. Обнаружено, что все протестированные буферы (PBS, PBS + 2% сыворотки, полная культуральная среда и цельная кровь человека) были совместимы с системой, что указывает на то, что любая физиологически совместимая жидкость или раствор подходят для суспендирования клеток в устройстве и процессе доставки.
Конструктивные варианты 30-5x5, 10-4x2, 10-5-4-5, 10-6-4-6, 30-5-4-5 и 10-4 x 5 образцов также протестировали на Т-клетках мыши и человека, но ни один вариант не превосходил производительность варианта 30-4.
Таблица 2: Параметры доставки и их влияние на производительность

В некоторых вариантах реализации устройство содержит сужение, длина которого составляет от приблизительно 5 мкм до приблизительно 50 мкм или любое значение или диапазон значений длины между указанными величинами. Например, длина сужения составляет от приблизительно 5 мкм до приблизительно 40 мкм, например, от приблизительно 5 мкм до приблизительно 30 мкм, от приблизительно 5 мкм до приблизительно 20 мкм, или от приблизительно 5 мкм до приблизительно 10 мкм. В некоторых вариантах реализации длина сужения составляет от приблизительно 10 мкм до приблизительно 50 мкм, например, от приблизительно 20 мкм до приблизительно 50 мкм, от приблизительно 30 мкм до приблизительно 50 мкм, или от приблизительно 40 мкм до приблизительно 50 мкм. В некоторых вариантах реализации глубина сужения составляет от приблизительно 2 мкм до приблизительно 200 мкм или любое значение или диапазон значений глубины между указанными величинами. Например, глубина сужения составляет от приблизительно 2 мкм до приблизительно 150 мкм, от приблизительно 2 мкм до приблизительно 100 мкм, от приблизительно 2 мкм до приблизительно 50 мкм, от приблизительно 2 мкм до приблизительно 25 мкм, от приблизительно 2 мкм до приблизительно 15 мкм, или от приблизительно 2 мкм до приблизительно 10 мкм. В некоторых вариантах реализации глубина сужения составляет от приблизительно 10 мкм до приблизительно 200 мкм, например, от приблизительно 25 мкм до приблизительно 200 мкм, от приблизительно 50 мкм до приблизительно 200 мкм, от приблизительно 100 мкм до приблизительно 200 мкм или от приблизительно 150 мкм до приблизительно 200 мкм. В некоторых вариантах реализации угол входа или выхода из сужения составляет от приблизительно 0 градусов до приблизительно 90 градусов или любое значение или диапазон значений угла между указанными величинами. Например, угол составляет приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 30, приблизительно 40, приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80 или приблизительно 90 градусов или более. В некоторых вариантах реализации давление составляет от приблизительно 50 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм или любое значение или диапазон значений давления между указанными величинами. Например, давление составляет от приблизительно 50 фунтов/кв. дюйм до приблизительно 150 фунтов/кв. дюйм, от приблизительно 50 фунтов/кв. дюйм до приблизительно 125 фунтов/кв. дюйм, от приблизительно 50 фунтов/кв. дюйм до приблизительно 100 фунтов/кв. дюйм, или от приблизительно 50 фунтов/кв. дюйм до приблизительно 75 фунтов/кв. дюйм. В некоторых вариантах реализации давление составляет от приблизительно 75 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм, от приблизительно 100 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм, от приблизительно 125 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм, от приблизительно 150 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм, или от приблизительно 175 фунтов/кв. дюйм до приблизительно 200 фунтов/кв. дюйм. В некоторых вариантах реализации устройство содержит сужение, ширина которого составляет от приблизительно 2 мкм до приблизительно 10 мкм или любое значение или диапазон значений ширины между указанными величинами. Например, ширина сужения может составлять любое значение из приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм, или приблизительно 7 мкм.
Доставка в первичные клетки мыши
Для оценки возможностей этой платформы по внутриклеточной доставке в первичные клетки иммунной системы Т-клетки, В-клетки и моноциты/макрофаги мыши пропускали через микрожидкостные устройства в присутствии декстрана (3, 70 и 2000 кДа) и антител (приблизительно 150 кДа), меченых флуоресцентной меткой. Эти материалы были выбраны в качестве моделей для низкомолекулярных соединений, полисахаридов и белков, соответственно. По меньшей мере четыре конструктивных варианта устройства и два рабочих давления протестировали на клетках каждого типа. Первоначальный выбор размеров сужения был основан на работе с линиями клеток, первичных фибробластов и эмбриональных стволовых клеток. (Sharei et al., 2013, Proceedings of the National Academy of Sciences of the United States of America 110: 2082¬2087). В частности, ширину сужения выбрали из расчета ~ 50% от среднего диаметра клеток-мишеней. Доставка с помощью конструктивного варианта 30-4 (т. е. длина сужения составляет 30 мкм, а ширина - 4 мкм) была наиболее эффективной для лимфоцитов и миелоидных клеток (Фигуры 2A-C).
Доставку биомолекул (Фигуры 2A-C и Фигура 6) и жизнеспособность клеток (Фигура 7) измеряли проточной цитометрией через 1-2 часа после обработки. На Фигурах 2A-C показаны типичные графики доставки антитела (A), эффективности доставки 3-кДа декстрана, 70-кДа декстрана и антител в независимых экспериментах (B) и типичные данные по медианной интенсивности (С). Эффективность доставки (определяемую как процент живых клеток с флуоресценцией выше фоновой) и медианную интенсивность флуоресценции использовали в качестве основных показателей доставки. 3-кДа декстран доставили в 66,2±13,4%, 67,5±13,9% и 80,8±3,46% Т-клеток, B-клеток и миелоидных клеток, соответственно. Поглощение более крупного 70-кДа декстрана и Ат было менее эффективным, чем поглощение 3-кДа декстрана, как и ожидалось, что указывает на более эффективную доставку молекул меньшего размера. Жизнеспособность Т-клеток, но не B-клеток или миелоидных клеток, была несколько хуже по сравнению с необработанными клетками. Изменения жизнеспособности В-клеток и миелоидных клеток, обработанных с помощью устройства, существенно не отличались от показателей для необработанных клеток или клеток «без устройства». Дендритные клетки, полученные из костного мозга, поглощали декстран и антитело с ограниченной потерей жизнеспособности при использовании большей ширины сужения (6 мкм) из-за их увеличенного размера (Фигура 8). Одновременная доставка декстрана (3 кДа и 70 кДа) и антитела показала, что доставка этих молекул осуществляется в пропорциональном соотношении, т. е. клетки, которые получили антитело, также получили сопоставимое количество молекул декстрана (Фигура 9).
Доставка в клетки иммунной системы человека
Для изучения применимости данного подхода к клеткам иммунной системы человека протестировали конструктивные варианты устройства с шириной сужения 4-6 мкм для Т-клеток и 6-9 мкм для моноцитарных дендритных клеток (МДК). Типичные графики доставки антитела и данные по эффективности для различных биомолекул показаны на Фигуре 3A. Наиболее эффективные конструктивные варианты обеспечивали доставку 3-кДа декстрана в 70% ± 9% Т-клеток (размер сужения 4 мкм) и 60% ± 4,5% МДК (размер сужения 7 мкм) (Фигура 3A). 70-кДа декстран доставили в 71% ± 11% Т-клеток и 40% ± 14% МДК, а белок (антитело) доставили в 65% ± 15% Т-клеток и 38% ± 7% МДК. Доставка миРНК, меченной флуоресцентной меткой (миРНК CD45RA – Alexa-Fluor-488), позволила получить аналогичные результаты (Фигуры 12, 13).
Для тестирования нокдауна белка миРНК против CD4 или CD45RA человека доставляли в Т-клетки крови и наблюдали нокдаун уровня белка в зависимости от дозы через 72 часа после обработки с использованием 5, 1 и 0,2 мкМ миРНК, хотя контрольная миРНК не оказывала значимого эффекта (Фигура 3B, Фигуры 12, 13). Уровень мРНК CD4 также снижался, согласно измерению посредством кОТ-ПЦР через 48 часов после обработки (Фигура 14). Кроме того, протестировали продолжительность нокдауна CD4 в Т-клетках, обработанных 5 мкМ миРНК CD4. Нокдаун продолжался в течение ~ 10 дней (Фигура 14). Доставка миРНК, мишенью которой являлся маркер дендритных клеток DC-SIGN, также привела к значимому, специфичному по отношению к последовательности нокдауну экспрессии белка DC-SIGN в МДК при использовании различных конструктивных вариантов устройства. Уровень нокдауна при использовании различных конструктивных вариантов устройства коррелировал с эффективностью доставки декстрана/Ат. Типичные графики экспрессии белка и обобщенные данные по нокдауну из независимых экспериментов с CD4 Т-клетками и МПК указаны на Фигуре 3B. Этот подход оказался также применимым к регуляторным T-клеткам (Фигура 3С), В-клеткам и моноцитам человека (Фигуры 16, 17, 18).
Для сравнения производительности микрожидкостного устройства и нуклеофекции (подхода к доставке нуклеиновых кислот на основе электропорации) CD4 T-клетки человека обрабатывали миРНК параллельно с использованием платформы CellSqueeze или аппарата для нуклеофекции, и измеряли нокдаун белка через 72 часа проточной цитометрией. Хотя степень нокдауна CD4 была аналогична для двух данных подходов (Фигура 3D), жизнеспособность T-клеток после нуклеофекции была значительно хуже, чем жизнеспособность клеток, обработанных с использованием микрожидкостного устройства (P < 0,05). Выполнено сравнение эффективности двух платформ для доставки меченных декстранов и белков. Сравнение производительности устройства для деформации с нуклеофекцией на примере МДК позволило получить результаты, аналогичные результатам для Т-клеток. Конкретно, наилучшее микрожидкостное устройство (30-4 для Т-клеток, 10-6 для МДК) продемонстрировало преимущества в отношении жизнеспособности клеток и доставки (Фигура 18). Сравнение эффективности миРНК-нокдауна между двумя методиками также показало, что сдавливание клеток вызывает меньшие неспецифические эффекты (Фигура 19) и улучшает долговременную жизнеспособность.
Ингибирование инфекции ВИЧ-1 в первичных Т-клетках человека
Выполнили исследования с целью определения возможности применения микрожидкостного подхода для ингибирования инфекции и репликации ВИЧ в первичных CD4+ T-клетках человека путем доставки миРНК, мишенью которой являются вирусные гены. миРНК против генов vif и gag, успешно подавлявшую репликацию вируса в более ранних исследованиях, доставили в клетки за 24 часа до заражения ВИЧ. В качестве положительного контроля использовали миРНК, мишенью которой являлся рецептор ВИЧ - CD4. миРНК CD4 доставили за 48 часов до инфекции с целью снижения поверхностного уровня CD4, тем самым ингибируя инфекцию. Репликацию ВИЧ определяли путем окрашивания внутриклеточного антигена p24 и измеряли проточной цитометрией. Типичные графики и обобщенные результаты независимых экспериментов по заражению показаны на Фигурах 4A-B. В Т-клетках, обработанных миРНК против vif и gag по отдельности и в комбинации, наблюдали значительное снижение антигена p24 (p < 0,01). Данный ингибиторный эффект превышал эффект, выхванный нокдауном CD4 (p < 0,05) (Фигуры 4A-B).
Доставка соединений в цитозоль клетки иммуной системы ex vivo с помощью устройства для изменения формы клетки
Внутриклеточная доставка макромолекул в клетки иммунной системы являлась сложной задачей до появления данного изобретения. Результаты, показанные в настоящем документе, продемонстрировали полезность безвекторного способа повреждения мембраны для доставки низкомолекулярных соединений, а также крупных макромолекул в эукариотические клетки, например, клетки иммунной системы мыши и человека. Результаты являются неожиданными и особенно актуальными для клинического применения, поскольку клетки иммунной системы не поддаются другим способам доставки композиций в цитоплазму этих клеток. Данные, описанные в настоящем документе, демонстрируют: (i) возможность доставки разнообразных биологически значимых макромолекул (полисахаридов, белков и нуклеиновых кислот); (ii) эффективность по отношению к наиболее клинически значимым субпопуляциям клеток иммунной системы (Т-клеткам, B-клеткам, ДК, моноцитам/макрофагам) (Фигуры 2A-C и 3A-D); (iii) независимость от векторного материала и электрических полей, что позволяет преодолеть некоторые из проблем, связанные с токсичностью при эндоцитозном захвате и электропорации; и (iv) одновременную доставку макромолекул нескольких классов в клетки-мишени (Фигуры 2С, 9, 12, 13).
Эти неожиданные и значительные преимущества дают возможность ранее недоступных манипуляций с клетками иммунной системы и вариантов клинического применения. Например, эта система является платформой для доставки терапевтических средств на основе пептидов или белков в лимфоциты, по отношению к которой существующие способы, например, электропорация, обладают ограниченной эффективностью. Одновременную доставки с помощью данной системы также можно использовать для параллельного скрининга множества терапевтических кандидатов с целью ускорения процесса скрининга и потенциального выявления взаимодополняющих эффектов. Кроме того, использование меченных молекул аналогичного размера в качестве индикаторов позволяет независимо отслеживать эффективность доставки немеченого целевого материала. С помощью данной системы также можно выполнять доставку других агентов для визуализации, например, квантовых точек, что облегчает прямое наблюдение за молекулярными взаимодействиями в живых клетках для более глубокого понимания биологических процессов.
В неограничивающем примере квантовую точку или магнитную наночастицу доставляют для облегчения визуализации перенесенных клеток иммунной системы in vivo. Например, МРТ может обнаружить локализацию адоптивно перенесенных Т-клеток, загруженных магнитными частицами.
Зависимость производительности доставки от параметров системы, например, геометрии сужения, температуры, рабочего давления и состава буфера адаптируют для доставки соединений/композиций в клетки иммунной системы или смеси клеток иммунной системы, например, клетки в цельной крови. Например, типичные параметры устройства для клеток иммунной системы включают (Т-клетки, 30-4 для покоящихся, 10-4 для активированных), B-клетки (30-4 для покоящихся, 10-4 для активированных), макрофаги (10-6), дендритные клетки (10-6), а также смеси, например, фракция лейкоцитов/клетки лейкотромбоцитарного слоя или клетки цельной крови. Диапазон конструктивных вариантов сужения для всех случаев составляет 2-10 мкм ширины, 0,1-90 мкм длины). Таким образом, можно оптимизировать производительность платформы для целевых популяций лимфоцитов и миелоидных клеток путем разработки архитектуры и операционных протоколов системы с использованием правил проектирования, установленных для других типов клеток. Например, можно повысить эффективность доставки путем изготовления устройств с более длинными и узкими сужениями. Кроме того, можно увеличить пропускную способность системы, в настоящее время составляющую 100000-1000000 клеток в секунду, путем включения большего количества параллельных каналов в устройство или увеличения рабочего давления. В некоторых вариантах реализации увеличивают глубину канала или добавляют дополнительные параллельные каналы для увеличения пропускной способности. Рабочее давление можно менять в зависимости от конструкции устройства. В некоторых вариантах реализации давление составляет от 1 фунта/кв. дюйм до 1000 фунтов/кв. дюйм.
Исследования нокдауна vif и gag продемонстрировали возможности этого подхода по изменению фенотипа клетки и влиянию на биологические процессы, имеющие значение для хода заболевания, например, репликацию вируса (например, ВИЧ) (Фигуры 4A, B). Этот результат не только демонстрирует полезность данного подхода при лечении заболеваний и изучении механизмов заболевания (например, зависимость репликации вируса от конкретных генов), но и демонстрирует возможность конструирования клеток иммунной системы для клинического применения путем адресного воздействия га специфические функции/пути клетки-хозяина без использования потенциально токсичных векторов для доставки. Факторы транскрипции белка, доставляемые посредством сдавливания, например, IRF5, можно применять для увеличения продукции ИФН-α в pDC человека, тем самым демонстрируя, что белки, доставленные посредством сдавливания, также являются функциональными и могут влиять на фенотип клетки. Таким образом, данную систему внутриклеточной доставки можно применять для конструирования клеток иммунной системы с возможностями, превышающими возможности подходов на основе использования внеклеточных антител и цитокинов.
Данные, описанные в настоящем документе, демонстрируют неожиданную эффективность микрожидкостного подхода, не предусматривающего использование вирусных векторов, к цитозольной доставке в клетки иммунной системы, до появления данного изобретения с трудом поддававшиеся конструированию и цитозольной доставке соединений/композиций. Кроме того, эти данные демонстрируют возможности этого подхода по облегчению доставки различных макромолекул, в том числе полисахаридов, белков и нуклеиновых кислот, в Т-клетки, B-клетки, миелоидные клетки (CD11b+) и дендритные клетки. Функциональность доставленного материала проверяли путем исследований миРНК-опосредованного нокдауна пяти различных генов. Наконец, исследования заражения ВИЧ подчеркивают полезность такого подхода к изменению фенотипа клетки и влиянию на репликацию вируса для подавления инфекционных заболеваний. Безвекторная система доставки, описанная в настоящем документе, предлагает безопасный, надежный и эффективный способ конструирования функции клеток иммунной системы и/или изменения их фенотипа, функции, состояния активации.
Система вакцин быстрого реагирования для неизвестных патогенных агентов
Возбудители инфекций представляют серьезную угрозу для солдат и мирных жителей. Для защиты от возможных биологических атак и эволюции пандемических вирусов необходимо разработать возможность надежной вакцинации быстрого реагирования. Даже с учетом возможности выделения и исследования характеристик вирулентного штамма, на разработку эффективных вакцин с использованием современных технологий могут уйти годы и миллиарды долларов. Несмотря на десятилетия исследований, для многих смертельно опасных возбудителей заболеваний, например, вируса Эбола и ВИЧ, до сих пор не разработаны современные методологии вакцинации. В настоящем изобретении предложены способы и устройства для быстрой, многоцелевой персонализированной защиты от патогенных агентов посредством прямого конструирования клеток иммунной системы индивида с использованием безвекторной платформы внутриклеточной доставки, описанной в настоящем документе. Этот способ обеспечивает эффективную вакцинацию местного населения из группы риска в течение нескольких часов после выявления вновь инфицированных лиц и обладает рядом преимуществ перед предыдущими подходами, как показано ниже в Таблице 3.
Таблица 3
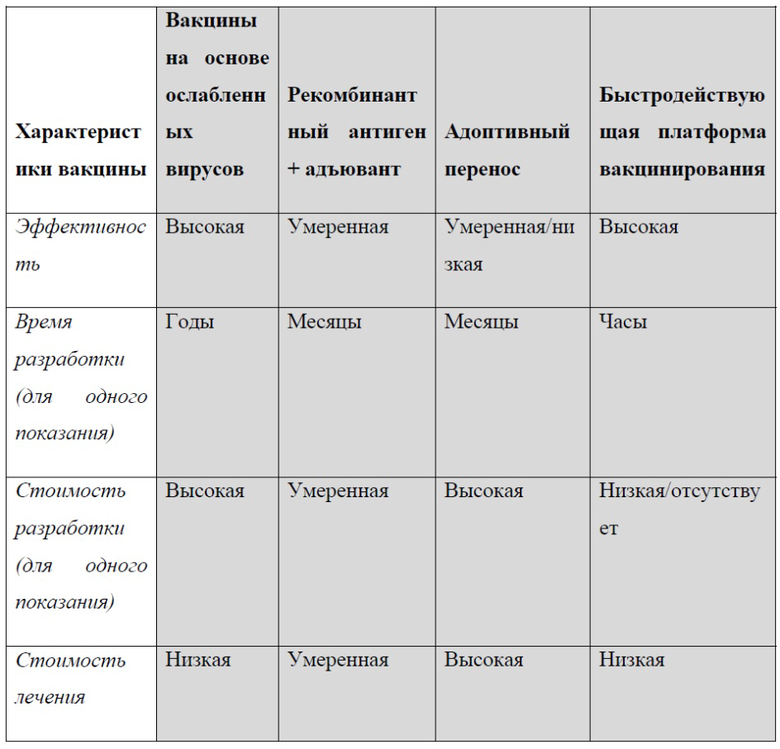

Прямая доставка антигенных белков в цитоплазму APC индивида (например, B-клеток, ДК и перепрограммированных Т-клеток) устраняет потребность в идентификации и разработке ослабленных вирусных векторов, обеспечивая более эффективную защиту за счет индукции многоцелевых иммунных реакций, необходимых для преодоления устойчивости вируса. Платформа вакцинации, способная к работе в полевых условиях, ликвидирует вспышку заболевания в течение нескольких часов, а не месяцев/лет.
При подозрении на присутствие возбудителя в организме индивида вначале получают биоптат инфицированной ткани. Эту ткань, содержащую возбудитель, лизируют таким образом, что молекулярные компоненты (т. е. антигены) остаются интактными, в то время как возбудитель деактивируется в процессе лизиса. Затем эту смесь антигенов доставляют в клетки иммунной системы здорового индивида, взяв у него кровь и пропустив его клетки через микрожидкостное устройство внутриклеточной доставки (3), а затем снова введя их в кровоток. Этот процесс доставки вводит антигены, ассоциированные с возбудителем, в цитоплазму APC, присутствующих в крови, которые включают T-клетки, B-клетки, дендритные клетки и моноциты. Затем фрагменты антигена презентируются MHC-I и активируют цитотоксические Т-клетки (CTL), специфичные по отношению к данному заболеванию, обеспечивая защиту. Лизис можно выполнить в течение 1-2 часов после получения инфицированного биоптата (получение доз для нескольких здоровых пациентов из одного биоптата), а последующая прививка здоровых пациентов потребует < 5 минут на человека. (Фигура 5). Кроме того, если возбудитель изучен, например, в случае ВИЧ или вируса Эбола, в качестве источника антигенов можно использовать не лизат клеток, а синтетические пептиды известного химического состава, тем самым устраняя потенциальные проблемы с безопасностью, связанные с использованием лизатов.
Платформа получения вакцин быстрого реагирования обеспечивает первую линию обороны против ряда биологических угроз, если традиционный дорогостоящий многолетний процесс разработки может привести к гибели людей. Данный подход к вакцинированию также применим к лечению онкологических и инфекционных заболеваний.
Микрожидкостное сдавливание для внутриклеточной загрузки антигена в B-клетки
Антиген-презентирующие клетки (APC) представляют собой разнородную субпопуляцию клеток иммунной системы (включающую дендритные клетки, макрофаги, B-клетки), которые захватывают чужеродные или собственные белки и пептиды из тканей и активируют адаптивные клетки иммунной системы, генерируя воспалительный или толерогенный иммунный ответ против этих антигенов. APC поглощают белки in vivo посредством жидкостной фазы отбора образцов их окружения или рецептор-опосредованного поглощения чужеродных микроорганизмов или остатков мертвых клеток. Поглощенные белки разрушаются до пептидных фрагментов (антигенов), которые обрабатываются и презентируются T-клеткам с совместными стимулирующими сигналами, управляя активацией наивных Т-клеток на основе специфических сигналов, полученных APC, и презентируемых антигенов. Из-за своей критической роли в активации Т-клеток очищенные APC, загруженные антигеном и активированные ex vivo, можно применять для размножения функциональных Т-клеток в культуре (например, для адоптивной Т-клеточной терапии) или в качестве эффективных клеточных вакцин in vivo. Показано, что манипуляции с APC ex vivo с использованием микрожидкостной системы являются эффективным альтернативным подходом к созданию определенных типов иммунитета, особенно цитотоксических Т-лимфоцитов (CTL) при таких заболеваниях, как рак и ВИЧ, где адресное уничтожение патогенных клеток является важным, а функция эндогенных APC активно подавляется. Несмотря на перспективные доклинические исследования, клиническому применению клеточных вакцин препятствуют несколько ограничений. Микрожидкостное устройство и связанные с ним способы доставки антигена в цитозоль клетки иммунной системы решает многие проблемы и недостатки более ранних подходов.
Предыдущие клинические исследования клеточных вакцин были сосредоточены на дендритных клетках (ДК), называемых «профессиональными» APC из-за их эффективности при первичной иммунизации CTL и способности к высокоактивному поглощению внеклеточных белков и процессированию антигенов. Однако применение ДК в качестве платформы для клинического применения ограничивается их относительно небольшим количеством в крови человека, гетерогенностью субпопуляции, коротким сроком жизни и неспособностью к пролиферации. Эти проблемы привели к рассмотрению возможности использования других видов клеток, в том числе макрофагов и B-клеток, для разработки клеточных APC-вакцин. B-клетки являются желательной популяцией клеток для этой цели из-за их уникальных свойств, характерных для лимфоцитов, и возможности преодоления многих ограничений ДК. Например, B-клетки присутствуют в кровотоке в большом количестве (до 0,5 миллионов клеток/мл крови), могут пролиферировать после клеточной активации и характеризуются эффективным хомингом к вторичным лимфоидным органам при внутривенном введении.
Эти преимущества B-клеток как APC компенсируются за счет ограничений способности B-клеток поглощать и процессировать антиген для первичной иммунизации Т-клеток. B-клетки экспрессируют генетически реаранжированные B-клеточные рецепторы (BCR), участвующие в связывании с антигеном-мишенью, способствующие поглощению антигена и активации В-клеток. Хотя B-клетки способны поглощать антигены посредством BCR и стимулировать ответ первичных Т-клеток, поглощение ими неспецифических антигенов (т. е. антигенов, не распознаваемых их BCR) плохо сопоставимо с возможностями макрофагов и ДК, которые эффективно осуществляют пиноцитоз и фагоцитоз антигенов из своего окружения. Кроме того, первичная иммунизация CTL происходит посредством презентации пептида молекулой MHC класса I, которые, как правило, загружаются только антигенами, находящимися в цитозоле (где преимущественно располагаются механизмы обработки, используемые MHC класса I). Напротив, белки, поглощаемые посредством BCR в эндолизосомы, как правило, направляются на путь презентации MHC класса II для презентации CD4 + Т-клеткам. В качестве альтернативы, B-клетки и другие профессиональные APC могут загружать молекулы MHC класса I с пептидами посредством перекрестной презентации, при которой комплекс «пептид-MHC класса I» продуцируется из антигенов, поглощенных за счет эндоцитоза, посредством протеасомного процессинга или вакуолярного разрушения белка, однако этот процесс, как правило, крайне неэффективен.
Несмотря на разработанные способы усиления поглощения антигена и перекрестной презентации в B-клетках, эти стратегии во многом основаны на адресном воздействии на специфические рецепторы для эндоцитозного поглощения, активации В-клеток в комбинации с контактом с белком в жидкостной фазе для усиления неспецифического эндоцитоза, доставке антигена в виде иммуностимулирующего комплекса, или получении гибридных белков для управления функцией B-клеток. Эти подходы ограничены тем, что поглощение антигена связано с другими изменениями состояния B-клетки, опосредованными сигнальными путями за счет вовлечения рецептора-мишени, что подразумевает невозможность управления загрузкой антигена и активацией B-клеток по отдельности. Например, показано, что покоящиеся B-клетки являются толерогенными для наивных CD8+ Т-клеток, что является потенциально полезным свойством при лечении аутоиммунных заболеваний, и активация B-клеток при таком варианте применения проблематична. Трансфекция B-клеток ДНК, РНК33 или вирусными векторами, кодирующими антигены, также является перспективным подходом, но ограничена со стороны хозяина такими проблемами, как токсичность при электропорации, способность к упаковке вирусного вектора, эффективность трансдукции, стабильность и иммунитет против вектора. Способы, описанные в настоящем документе, обеспечивают решение этих недостатков более ранних подходов.
Прямая цитозольная доставка полноразмерного белка, т. е. непроцессированного антигена, в живые B-клетки посредством временного повреждения/разрыва плазматической мембраны осуществляется при пропускании B-клеток через сужение в микроразмерных каналах микрожидкостного устройства (механическое повреждение). При использовании хорошо изученного и признанного в данной области модельного антигена - овальбумина (OVA) данный способ позволяет осуществлять доставку полноразмерного белка даже в покоящиеся B-клетки с надежной первичной стимуляцией эффекторных CTL in vitro и in vivo. Этот способ доставки полноразмерного белка и презентации антигена MHC класса I представляет собой первый способ доставки антигена в B-клетки, который отделяет загрузку антигена от процесса активации B-клеток, обеспечивая раздельную оптимизацию этих двух процессов для получения иммуногенных или толерогенных вакцин. Сдавливание клеток обеспечивает альтернативную модульную платформу, выполняющую первичную активацию аутологичных B-клеток для размножения CTL in vitro, а также облегчения разработки вакцин на основе B-клеток.
Для получения данных, имеющих отношение к презентации антигена, использовали следующие материалы и способы.
Реагенты. 3-кДа декстраны, меченные TRITC и каскадным синим, приобрели в Life Technologies. 40-кДа декстран, меченный FITC, приобрели в Chondrex. Модельный антиген - белок овальбумина с низким содержанием эндотоксинов - приобрели в Worthington Biochemical Corporation. CpG ODN 1826 (CpG B), CpG ODN 2395 (CpG C) и LPS Escherichia coli K12 (LPS) приобрели в Invivogen. Мультимерный/мегаCD40L приобрели в Adipogen и Enzo Life Sciences.
Выделение клеток. Способы и процедуры выделения/очистки или обогащения клеток иммунной системы или субпопуляций клеток иммунной системы общеизвестны в данной области техники. Например, мононуклеары периферической крови человека получают из цельной крови, полученной посредством венепункции, и с помощью стандартных протоколов выделяют субпопуляции клеток иммунной системы, например, B-клетки, T-клетки, дендритные клетки, макрофаги. В качестве источника клеток иммунной системы также используют костный мозг.
Для выделения B-клеток в примерах, описанных в настоящем документе, собирали селезенки мышей и измельчали их через сито с размером ячеек 70 мкм. Эритроциты лизировали, покоящиеся B-клетки выделяли из суспензии клеток с помощью набора для выделения B-клеток мыши B-Cell Isolation Kit (Miltenyi Biotec), следуя инструкциям производителя. После выделения суспензия B-клеток содержала > 95% B220+ клеток, согласно измерению проточной цитометрией. Для выделения CD8+ Т-клеток собирали и измельчали селезенки и паховые лимфатические узлы. После лизиса эритроцитов выделяли CD8a+ T-клетки с помощью набора для выделения CD8a+ Т-клеток мыши CD8a+T-cell Isolation Kit (Millenyi Biotec) согласно инструкциям производителя. Выделение CD4+ Т-клеток выполняли с помощью набора для выделения CD4+ Т-клеток мыши CD4+T-cell Isolation Kit (Millenyi Biotec) из суспензий селезенки и паховых лимфатических узлов. T-клетки всегда были на > 90% чистыми, согласно измерению окрашивания CD8a или CD4 и проточной цитометрии. Культивирование всех клеток выполняли в среде для Т-клеток (RPMI с 10% FBS, пенициллином, стрептомицином, 1X пируватом натрия) с добавлением 1 мкл/мл 55 мМ раствора β-меркаптоэтанола.
Доставка белка путем сдавливания клеток. Доставку полноразмерного белкового антигена в покоящиеся B-клетки выполняли с использованием микрожидкостного устройства CellSqueeze и нагнетательной системы (SQZ Biotech); используемые конструктивные варианты чипа включали 30-4 × 1, 10-4 × 1 и 30-5 × 5, где X - Y × Z обозначает Z последовательных сужений канала длиной X мкм и диаметром Y мкм. B-клетки суспендировали из расчета 5 × 106 клеток/мл в среде с 100 мкг/мл овальбумина, 0,3 мг/мл 3 кДа декстрана, меченного TRITC - Pacific Blue или 0,3 мг/мл 40 кДа декстрана, меченного FITC, и помещали на лед. Набор микрожидкостных чипов и держателей также помещали на водяную баню со льдом до охлаждения. Суспензию клеток пропускали через устройство в 200-мкл аликвотах при давлении 120 фунтов/кв. дюйм. Для контроля эндоцитоза B-клетки получали идентично в среде с OVA, но не пропускали через микрожидкостное устройство. После загрузки антигена клетки оставляли при комнатной температуре на 5 минут и дважды промывали PBS. Для оценки эффективности доставки измеряли поглощение антигенов или других доставляемых соединений проточной цитометрией (обнаружение композиций, меченных флуоресцентной меткой).
Культивирование клеток in vitro, анализы активации и пролиферации. Для исследования активации механопорированных В-клеток in vitro клетки, прошедшие через устройство SQZ, и клетки для контроля эндоцитоза инкубировали в 96-луночном планшете с U-образным дном при концентрации 5 × 105клеток/мл с 5 мкМ CpG B, 5 мкМ CpG C или 100 нг/мл LPS. Проточную цитометрию выполняли через 24 и 48 часов для определения уровней CD86, CD40, CD69, МНС класса I и МНС класса II на поверхности клеток. Для анализа пролиферации in vitro OT-I CD8+ (ограниченные МНС класса I) или OT-II CD4+ Т-клетки (ограниченные MHC класса II), специфичные по отношению к очищенному пептиду SIINFEKL овальбумина, суспендировали при концентрации 107 клеток/мл и метили CFSE (5 мкМ, Life Technologies) в течение 10 мин. После однократной промывки Т-клетки и В-клетки высевали в соотношении 1: 0,8 в 200 мкл среды для Т-клеток в 96-луночный планшет с U-образным дном. В соответствующие лунки добавляли CpG B, CpG C или LPS, а Dynabeads с антителом против CD3/CD28 (Life Technologies) добавляли в положительные контрольные лунки из расчета 1 гранула/Т-клетку. Сбор супернатанта для анализа цитокинов и проточной цитометрии с целью оценки пролиферации Т-клеток выполняли на 2 и 4 день.
Анализ пролиферации in vivo. В -1 день 106 покоящихся OT-I Thy1.1 CD8+ Т-клеток, меченных CFSE (5 мкМ), ретроорбитально (р/о) вводили мышам C57BL/6. На следующий день (день 0) животным р/о вводили 1-3 миллионов CD45.1+ B-клеток, накануне загруженных OVA с использованием микрожидкостного устройства SQZ и инкубированных в течение ночи с 5 мкМ CpG B, или загруженных OVA путем механического повреждения непосредственно перед инъекцией и не подвергавшихся воздействию лиганда TLR. Животных подвергали некропсии на 4 день и собирали их селезенки, паховые лимфатические узлы и цервикальные лимфатические узлы. Органы измельчали через сито для клеток. Суспензии одиночных клеток инкубировали с антителом мыши против CD16 / CD32 (eBioscience) для ослабления неспецифического связывания антител и окрашивали антителом против CD8-APC, антителом против B220-PE-Cy7, антителом против CD45.1-PerCP-Cy5.5 и антителом против Thy1.1-APC-Cy7. Проточную цитометрию для определения количества клеток и/или разбавления CFSE выполняли с использованием известных способов.
Механическое повреждение (микрожидкостное сдавливание клеток) обеспечивает быструю и эффективную доставку макромолекул
Процесс механического повреждения для загрузки В-клеток антигеном осуществляли с использованием устройства, описанного в настоящем документе. Живые клетки пропускали через параллельные микрожидкостные каналы в кремниевом устройстве; в каждом канале 1 или более сужений создают временные поры или разрывы в мембранах клеток, проходящих через устройство. Макромолекулярная загрузка, присутствующая в окружающей жидкости, диффундирует в клетку во время этого временного разрыва/повреждения мембраны, что приводит к внутриклеточной загрузке. Механическое повреждение эффективно стимулирует цитозольную доставку макромолекул в различные клетки, включая первичные В-клетки мыши; эффективная доставка достигалась при 5 последовательных сужениях длиной 30 мкм и шириной 5 мкм. Конструкцию устройства можно менять (за счет увеличения количества параллельных каналов с сужениями до 75, удлинения области входа, обратимости и т. д.) для пользовательской настройки параметров механического повреждения с целью доставки белка в В-клетки и последующей презентации антигена. Эксперименты по оптимизации показали, что микрожидкостные чипы 30-4 × 1 (1 сужение на канал длиной 30 мкм и диаметром 4 мкм), работающие при давлении 120 фунтов/кв. дюйм, являются эффективным конструктивным вариантом чипа для механического повреждения B-клеток мыши, обеспечивающим эффективную доставку и высокую жизнеспособность клеток при концентрации 5 × 106 B-клеток/мл. В настоящем документе описаны другие конфигурации, например, 30-5 x 5 и30-4 x 1. Клетки при этом давлении проходили через устройство со скоростью приблизительно 1 миллион клеток в секунду. Микрожидкостное сдавливание способствовало значительному увеличению поглощения декстрана по сравнению с эндоцитозом, при этом интернализация увеличивалась в ~ 65 раз и ~ 25 раз для 3- и 40-кДа декстранов, соответственно. Это представляло собой доставку обоих декстранов в 75-90% всех клеток по сравнению с эндоцитозом обнаруживаемого количества загрузки в менее чем 10% покоящихся В-клеток. Жизнеспособность восстановившихся после механического повреждения клеток составляла ~ 95%, аналогично контролю эндоцитоза. Максимальное количество клеток, которое можно пропустить через эти одноразовые микрожидкостные чипы, составляет от 1 до 5 миллионов клеток на устройство; однако устройства работали с несколькими аликвотами клеток (1 миллион клеток на запуск) до засора, и максимальное количество клеток, прошедших через каждое отдельное устройство в данном эксперименте, часто значительно превышало 5 миллионов клеток. С первого запуска до засорения устройства наблюдалась низкая изменчивость в доле доставляемых клеток, что указывает на минимальную изменчивость в пределах устройства. Производительность доставки по нескольким устройствам в одном и том же экспериментальном сеансе (изменчивость между устройствами) была весьма стабильной. Учитывая, что при некоторых вариантах применения может потребоваться большее количество В-клеток, эффективность микрожидкостных устройств при разных плотностях клеток. Эффективность внутриклеточной доставки декстрана в значительной степени не зависела от концентрации клеток до по меньшей мере 50×106 клеток на мл, что указывает на возможность полноценной масштабируемости.
Схематическое изображение В-клеток, обработанных для функционирования в качестве улучшенных антиген-презентирующих клеток, показано на Фигуре 30.
Поликлональные В-клетки после сдавливания, несущие целый белок, способствуют размножению антигенспецифических CD8+ Т-клетки, секретирующие эффекторные цитокины in vitro
Чтобы определить, может ли механическое разрушение способствовать доставке белка к цитозольным механизмам процессинга и презентации антигена MHC класса I, авторы изобретения использовали оптимальные условия, описанные выше, для доставки модельного белка - овальбумина (OVA) в покоящиеся очищенные поликлональные B-клетки путем пропускания клеток через микрожидкостное устройство в присутствии избытка OVA в окружающей среде. Затем В-клетки после сдавливания совместно культивировали с CFSE-мечеными OT-I CD8+ Т-клетками, несущими трансгенный Т-клеточный рецептор, специфичный по отношению к OVA-пептиду SIINFEKL, ограниченному МНС класса I, в присутствии или в отсутствие CpG в качестве активатора B-клеток. Разбавление CFSE в OT-I Т-клетках анализировали проточной цитометрией с целью оценки пролиферации/размножения Т-клеток в ответ на антиген, презентируемый В-клетками. Было обнаружено, что доставка полноразмерного белка в В-клетки путем сдавливания клеток обеспечивает надежную презентацию антигена МНС класса I и антигенспецифическую первичную стимуляцию CD8+ Т-клеток in vitro. Сдавливание клеток, описанное в настоящем документе, главным образом направляет антиген в цитозоль, а не в эндосомальные компартменты, где происходит загрузка МНС класса II. В соответствии с этим данные свидетельствуют о том, что ни покоящиеся, ни CpG-активированные механопорированные В-клетки не могли способствовать размножению OVA-специфических OT-II CD4+ T-клеток после 4 дней совместного культивирования. Функциональность популяций CD8+ Т-клеток, стимулированных B-клетками, анализировали путем измерения секреции эффекторных молекул на 2 и 4 день совместного культивирования. Как покоящиеся, так и активированные В-клетки, загруженные антигеном путем сдавливания, выполняли первичную стимуляцию Т-клеток, что приводило к секреции значительных количеств гранзима B, ИФН-γ и ФНО-α, в то время как В-клетки, загруженные антигеном за счет эндоцитоза, продуцировали базальные уровни цитокинов.
В-клетки после сдавливания выполняют первичную активацию антигенспецифических CD8+ Т-клеток in vivo
В дополнение к платформе размножения антигенспецифических Т-клеток in vitro, В-клетки, обработанные в соответствии с описанием, можно использовать как альтернативу дендритным клеткам в качестве клеточных вакцин. Для оценки производительности in vivo CFSE-меченые OT-I CD8+ Т-клетки, экспрессирующие Thy1.1 в качестве конгенного маркера, адоптивно переносили в организмы мышей-реципиентов в качестве репортеров презентации антигена. Через день вводили покоящиеся В-клетки непосредственно после загрузки антигена, опосредованной механическим повреждением, либо вводили В-клетки, загруженные посредством механического повреждения и затем активированные в течение 24 ч с использованием CpG in vitro. Покоящиеся B-клетки, загруженные антигеном путем эндоцитоза, использовали в качестве контроля немедленно либо после 24-часовой активации с использованием CpG. Через четыре дня после переноса В-клеток мышей умерщвляли, а селезенки и паховые лимфатические узлы анализировали на предмет пролиферации OT-I с помощью проточной цитометрии. В соответствии с результатами in vitro, механопорированные В-клетки были способны вызывать деление адоптивно перенесенных OT-I T-клеток, тогда как контроль эндоцитоза демонстрировал только базальное деление. Как CpG-активированные, так и покоящиеся В-клетки после сдавливания вызывали пролиферацию OT-I в селезенках (~ 45% и ~ 35% делений во введенных OT-I Т-клетках при р < 0,001 и р = 0,001 при сравнении SQZ с эндоцитозом, соответственно). CpG-активированные и покоящиеся В-клетки после сдавливания также вызывали аналогичную усиленную пролиферацию OT-I в лимфоузлах по сравнению с В-клетками после эндоцитоза (~ 40% и ~ 35% делений во введенных OT-I Т-клетках за счет CpG-активированных и покоящихся В-клеток, соответственно; р < 0,001 при сравнении SQZ с эндоцитозом как для покоящихся, так и для CpG-активированных клеток). Контроль эндоцитоза демонстрировал ~ 4% базальное деление в лимфатических узлах. Эти результаты показали, что В-клетки, загруженные посредством микрожидкостного механического повреждения, можно использовать в клеточных вакцинах.
Результаты дополнительно подтверждали экспериментами по оценке состояния активации реагирующих CD8+ Т-клеток (Фигура 29).
Таким образом, В-клетки, загруженные специфическими антигенами, как описано в настоящем документе, можно использовать в качестве АРС для клеточных вакцин и в качестве аутологичных реагентов для размножения антигенспецифических Т-клеток, обеспечивающих значительные преимущества по сравнению с дендритными клетками, особенно в отношении их доступности в больших количествах в периферической крови и их способности к дальнейшему размножению в культуре. До настоящего изобретения способы эффективной загрузки антигена в В-клетки, особенно для презентации MHC класса I, являлись основным препятствием для разработки поликлональных B-клеток в качестве APC для применения in vitro или in vivo. Устройства и способы, описанные в настоящем документе, представляют собой простой подход, основанный на микрожидкостной механической деформации и пассивной диффузии, что приводит к надежной загрузке белковых антигенов непосредственно в цитозоль покоящихся или активированных B-клеток и к презентации MHC класса I пептидов, полученных из нативного полноразмерного белка. Многочисленные преимущества, связанные с механическим повреждением, включают доставку нативных белков без обработки, конструирования или модификации, быстрый характер процесса, относительно высокую эффективность доставки и функциональных результатов, а также способность доставлять материал в покоящиеся клетки без связи с такими аспектами клеточной биологии, как программирующий стимул или адресное воздействие на рецепторы.
Способность доставлять полноразмерный нативный белок или полипептиды непосредственно в цитозоль для процессинга и презентации MHC класса I позволяет осуществлять презентацию нескольких пептидов после процессинга нативного антигена без систематической ошибки. Микрожидкостное устройство для сдавливания клеток также обеспечивает доставку смесей белков, включая лизаты опухолей, например, лизаты биоптатов опухолей или другие источники белка сложного состава. Вышеизложенная демонстрация доставки белков для процессинга MHC класса I независимо от состояния активации клетки является основным преимуществом такого подхода, и этот подход позволяет разделить загрузку белка и клеточное программирование, облегчая независимую регуляцию каждого компонента.
Типичный конструктивный вариант содержит 75 параллельных каналов с сужениями; однако увеличение количества каналов или одновременная эксплуатация нескольких устройства резко улучшает пропускную способность. Простота использования и быстрая обработка, обеспечиваемая этим подходом (например, скорость потока через устройство ~1×106 клеток/с в течение < 2 ч на протяжении всего эксперимента) обеспечивает преимущества для клинического применения, например, уменьшение времени и ресурсов, необходимых для получения клеточного терапевтического средства.
При использовании В-клеток в качестве APC количество крови пациента, необходимое для получения одной дозы клеточной вакцины, значительно снижается по сравнению с подходами на основе ДК. Экономится время, необходимое для загрузки белка посредством процессов поглощения клеткой, например, эндоцитоза или пиноцитоза. Результаты, полученные in vitro, продемонстрировали значительный потенциал B-APC в качестве альтернативной платформы для размножения эффекторных CTL, и B-клетки после сдавливания также функционировали как эффективные APC in vivo. Эти способы также можно использовать для совместной загрузки путей презентации антигена за счет MHC как класса I, так и класса II с целью получения CD4+ Т-клеток.
Процессинг и презентация В-клетками антигена, ограниченного классом I
Таким образом, В-клетки обрабатывали путем сдавливания клеток для получения аутологичных антиген-презентирующих клеток (АРС) с целью первичной стимуляции антигенспецифических Т-клеток как in vitro, так и in vivo. Этот микромасштабный процесс сдавливания клеток создает временные разрывы или поры в плазматической мембране, обеспечивая внутриклеточную доставку полноразмерных белков из окружающей среды в В-клетки посредством механического повреждения. Как покоящиеся, так и активированные В-клетки процессируют и презентируют антигены, доставленные посредством механического повреждения, исключительно антигенспецифическим CD8+ Т-клеткам, а не к CD4+ Т-клеткам. В-клетки после сдавливания стимулировали и способствовали размножению большого количества эффекторных CD8+ Т-клеток in vitro, продуцировавших эффекторные цитокины, критически важные для цитолитической функции, включая гранзим В и интерферон-у. После сдавливания В-клетки, загруженные антигеном, также могли выполнять первичную стимуляцию антигенспецифических CD8+ Т-клеток in vivo при адоптивном переносе в организмы мышей. Эти данные показывают, что механическое повреждение/разрыв мембраны является полезным и высокоэффективным методом загрузки В-клеток антигенами, первичной стимуляции антигенспецифических CD8+ Т-клеток и разделения поглощения антигена и активации В-клеток.
Т-клетки в качестве антиген-презентирующих клеток для иммунной стимуляции или толерантности
До настоящего изобретения презентация антигена в целях иммунной стимуляции или толерантности обычно считалась областью селективной субпопуляции клеток, называемых антиген-презентирующими клетками, например, В-клеток, дендритных клеток и макрофагов, и не включала Т-клетки, поскольку предполагалось, что они не обладают необходимыми механизмами для процессинга и презентации антигенов в условиях, которые способствовали бы иммунной стимуляции или толерантности. Устройства и загрузка антигена в клетки, опосредованная сдавливанием, привели к неожиданному открытию, что доставка антигенных белков непосредственно в цитозоль Т-клеток придает таким обработанным клеткам антиген-презентирующий фенотип.
Данные способы позволяют регулировать иммунные ответы Т-клеток in vivo не описанным ранее образом. Модельный антиген, овальбумин, доставляли в первичные Т-клетки мыши, используя платформу на основе устройства Cellsqueeze, и указанные клетки вводили в организм хозяина для измерения ответов CD8+ Т-клеток. Загруженные антигеном Т-клетки были способны генерировать выраженные CD8+ Т-клеточные ответы, измеряемые проточной цитометрией, что указывает на то, что Т-клетки, нагруженные антигенами с помощью внешнего механизма, например, сдавливания клеток, действительно могут презентировать эпитопы на своей поверхности, связываться с другими Т-клетками и генерировать измеримый иммунный ответ. Этот ответ был значительно больше, чем контрольный ответ, и был сопоставим с ответами, наблюдаемыми в экспериментах с использованием профессиональных АРС, например, дендритных клеток.
Это открытие было неожиданным и имеет большое значение для иммунологии и иммунотерапии, поскольку оно демонстрирует возможность использования Т-клеток в качестве эффективных антиген-презентирующих агентов для терапевтического и исследовательского применения. До настоящего изобретения ДК были единственными клетками, общепринятыми для этого применения, и, как описано выше, подход на основе сдавливания клеток можно использовать для быстрого, эффективного и значительно усиленного получения В-клеток для этой цели. Поскольку Т-клетки более многочисленны и доступны, чем ДК, они обеспечивают повышенную клиническую эффективность и способствуют более широкому воздействию современных дорогостоящих, сложных при производстве клеточных вакцин. Таким образом, Т-клетку теперь можно использовать в качестве антиген-презентирующей клетки для презентации антигена любого типа, для любой цели (толерогенности или иммунной стимуляции), любых путей введения, для клинических, а также исследовательских вариантов применения.
Т-клетки мыши, обработанные полноразмерным, непроцессированным антигеном с использованием сдавливания клеток, функционируют в качестве антиген-презентирующих клеток (Фигура 29). Т-клетки мыши выделяли из селезенки мыши, OVA доставляли в Т-клетки в RPMI при концентрациях OVA 250, 50, 10 мкг/мл с использованием типичных конфигураций устройства 10-3 и 30-4. Затем эти Т-клетки культивировали с OT-1 Т-клетками (специфичными по отношению к пептидному эпитопу SIINFEKL) и выполняли оценку маркеров активации CD25 и CD69. Эти результаты показывают, что Т-клетки, в которые выполнили цитозольную доставку полноразмерного, непроцессированного антигена, например, полноразмерного овальбумина, с использованием сдавливания клеток, как ни странно, эффективно презентируют антиген и активируют эпитоп-специфичные эффекторные CD8+ Т-клетки.
Дополнительные данные демонстрируют доставку DQ-Ova (DQ™ овальбумин, № по каталогу D-12053, Molecular Probes, Inc.) в первичные Т-клетки человека, выделенные из крови (Фигуры 28A и B). DQ-ova представляет собой химически конъюгированный вариант белка овальбумина, флуоресцирующий на канале FITC после обработки; однако флуоресценция отсутствует, если белок не процессирован клеткой. Таким образом, появление сигнала FITC у клеток, обработанных с помощью устройства, указывает на процессинг антигена DQ-Ova клетками, что дополнительно подтверждает наблюдение, что полученные антиген-презентирующие Т-клетки (Т-клетки, действующие в качестве APC) функционируют в системе клеток человека в дополнение к системе клеток мыши, описанной выше. В некоторых экспериментах совместно доставляли краситель на основе 3kDa-декстрана, флуоресцирующий на канале pacific blue. Результаты демонстрируют различия в процессинге Ova между CD4 и CD8 T-клетками и значительное улучшение по сравнению с контролем эндоцитоза. Эти данные показывают, что процессинг антигена осуществляется Т-клетками человека при доставке антигена непосредственно в цитозоль T-клетки. Данные, свидетельствующие о том, что антиген DQ-Ova изменяет свои флуоресцентные свойства, показывают, что антиген процессируется в Т-клетках человека и, таким образом, презентируется антигенами гистосовместимости Т-эффекторным клеткам.
Кроме того, продемонстрирована активация эпитопспецифичных Т-клеток in vivo. На Фигуре 26 показаны результаты CFSE-анализа пролиферации in vivo (пролиферации антиген-специфических CD8+ Т-клеток). Поскольку CD8 T-клетки активировались и подвергались пролиферации в организме мыши, они характеризовались разбавленной концентрацией красителя CFSE и пониженной интенсивностью флуоресценции. В этом случае донорные T-клетки, обработанные с помощью устройства, или положительный контроль характеризовались значительно большей активацией и пролиферацией CD8 T-клеток в организме мыши-реципиента. Контрольные клетки, использовавшие эндоцитоз, напротив, продемонстрировали минимальный эффект.
Пролиферация антиген-специфических OT-I T-клеток в организме мыши в ответ на вакцинацию Т-клетками дикого типа, обработанными антигеном, также продемонстрирована in vivo (Фигура 27). Пролиферативные ответы Т-клеток измеряли по CFSE-окрашиванию. По мере пролиферации клеток происходит разбавление красителя; таким образом, более низкие значения интенсивности указывают на более выраженные ответы, более высокие пики интенсивности указывают на отсутствие/меньшую величину ответа. В каждом столбце представлены повторные эксперименты с лимфоузлами и селезенкой одной и той же мыши. Каждый столбец включает эксперименты с использованием 3 мышей (в общей сложности n = 9 мышей).
Материалы и способы, описанные ниже, использовали для получения данных, имеющих отношение к функционированию Т-клеток в качестве антиген-презентирующих клеток для иммунной стимуляции или толерантности, описанных выше.
График эксперимента. Использовали следующий график эксперимента: День 0: Ввести CFSE/CellTraceViolet-меченные OT-1 CD45.1 T-клетки в наивные организмы B6 День 1: Доставить антиген в Т-клетки APCS (Tc-APC), ввести Tc-APC и контрольные APC в организмы B6 День 5/6: Собрать селезенки и лимфатические узлы у иммунизированных мышей, выполнить анализ пролиферации Т-клеток с помощью проточной цитометрии
Выделение Т-клеток (для адоптивного переноса). Материалы: 100-мкм сито для клеток Falcon; 70-мкм сито для клеток Falcon; аммоний-хлоридно-калиевый (АХК) лизирующий буфер; набор для выделения CD8a+ T-клеток (Miltenyi Biotec); колонка MACS для разделения клеток. Среда для Т-клеток (RPMI с 10% FBS, пенициллином, стрептомицином, 1x пируватом натрия, 50 мкМ b-меркаптоэтанолом); MACS-буфер (0,5% БСА, 2 мМ ЭДТА в PBS). Способы: Селезенки и дренирующие лимфатические узлы собирали у OT-1 CD45.1 Rag 2-/- мышей с фоновым генотипом C57BL/6J и протирали через влажное 100-мкм сито для клеток в 50-мл пробирку Falcon. Фильтры промывали MACS-буфером, затем центрифугировали при 500 rcf в течение 4 минут. Супернатанты аспирировали, а затем добавляли 3 мл лизирующего АХК-буфера для лизиса эритроцитов. Реакцию останавливали 12 мл MACS-буфера, затем центрифугировали при 500 rcf в течение 4 минут. Клеточный осадок ресуспендировали в 40 мкл MACS-буфера на 1x107 клеток, а затем фильтровали через 70-мкм сито для клеток в 50-мл пробирку Falcon. Добавляли 10 мкл коктейля антител против CD8a+ Т-клеток на 1x107 клеток и инкубировали в течение 10 минут на льду. Добавляли 30 мкл MACS-буфера на 1x107 клеток, затем добавляли 20 мкл гранул стрептавидина на 1x107 клеток и инкубировали на льду в течение 15 минут. Клетки центрифугировали при 800 rcf в течение 5 минут, супернатант аспирировали, а затем ресуспендировали осадок в 3 мл MACS-буфера. Колонку для разделения клеток подготавливали путем пропускания 3 мкл MACS-буфера, а затем 3 мкл суспензии клеток через 70-мкм сито для клеток в 15-мл пробирку Falcon. Колонку трижды промывали 3 мл MACS-буфера, объединенный элюат центрифугировали при 500 rcf в течение 4 минут. Супернатант аспирировали, а обогащенные CD8+ Т-клетки суспендировали в среде для Т-клеток. > 90% чистоту проверяли путем окрашивания CD8a и анализа путем проточной цитометрии.
Мечение CellTrace Violet/CFSE. Материалы: CFSE в ДМСО (Life Technologies, Гранд-Айленд, штат Нью-Йорк, США); CellTrace Violet в ДМСО (Life Technologies, Гранд-Айленд, штат Нью-Йорк, США); очищенные OT-I CD45.1 CD8+ T-клетки; стерильный PBS; стерильная эмбриональная телячья сыворотка. Способы: OT-1 CD45.1 CD8+ Т-клетки обогащали, как описано выше, и суспендировали в 2,5 мл теплого PBS в 15-мл пробирке Falcon. CellTrace Violet или CFSE в ДМСО растворяли в теплом PBS в концентрации 10 мкМ, затем 2,5 мл добавляли к суспензии клеток (конечная концентрация 5 мкМ). Клетки оставляли при 37 °С в теплой водяной бане на 10 минут, затем добавляли 7 мл PBS для остановки реакции. 2 мл FBS наносили слоем на дно с помощью стерильной стеклянной пипетки, затем центрифугировали при 500 rcf в течение 4 минут. Супернатант аспирировали, клетки повторно промывали 10 мл PBS, затем центрифугировали при 500 rcf и ресуспендировали из расчета 2x107 клеток на 100 мкл PBS.
Выделение Т-клеток (в виде Tc-APC). Материалы: 100-мкм сито для клеток Falcon; 70-мкм сито для клеток Falcon; лизирующий АХК-буфер; набор для выделения Т-клеток Pan T cell isolation kit (Miltenyi Biotec, Сан-Диего, штат Калифорния, США); MACS-колонка для разделения клеток; среда для T-клеток (RPMI с 10% FBS, пенициллином, стрептомицином, 1x пируватом натрия, 50 мкМ b-меркаптоэтанола); MACS-буфер (0,5% БСА, 2 мМ ЭДТА в PBS). Способы: Селезенки и дренирующие лимфатические узлы собирали у мышей C57BL/61 и протирали через влажное 100-мкм сито для клеток в 50-мл пробирку Falcon. Фильтры промывали MACS-буфером, затем центрифугировали при 500 rcf в течение 4 минут. Супернатанты аспирировали, а затем добавляли 3 мл лизирующего АХК-буфера для лизиса эритроцитов. Реакцию останавливали 12 мл MACS-буфера, затем центрифугировали при 500 rcf в течение 4 минут. Клеточный осадок ресуспендировали в 40 мкл MACS-буфера на 1x107 клеток, а затем фильтровали через 70-мкм сито для клеток в 50-мл пробирку Falcon. Добавляли 20 мкл коктейля антител против Т-клеток (Pan T cell antibody cocktail) на 1x107 клеток и инкубировали в течение 10 минут на льду. Добавляли 30 мкл MACS-буфера на 1x107 клеток, затем добавляли 20 мкл гранул стрептавидина на 1x107 клеток и инкубировали на льду в течение 15 минут. Клетки центрифугировали при 800 rcf в течение 5 минут, супернатант аспирировали, а затем ресуспендировали осадок в 3 мл MACS-буфера. Колонку для разделения клеток подготавливали путем пропускания 3 мкл MACS-буфера, а затем 3 мкл суспензии клеток через 70-мкм сито для клеток в 15-мл пробирку Falcon. Колонку трижды промывали 3 мл MACS-буфера, объединенный элюат центрифугировали при 500 rcf в течение 4 минут. Супернатант аспирировали, а обогащенные Т-клетки суспендировали в среде для Т-клеток. > 90% чистоту проверяли путем окрашивания CD3e и анализа путем проточной цитометрии.
Доставка и активация Т-клеточного антигена in vitro. Материалы: Очищенные T-клетки; чипы 30-4 CellSqueeze; устройство CellSqueeze; липополисахарид (LPS); среда для T-клеток (RPMI с 10% FBS, пенициллином, стрептомицином, 1x пируватом натрия, 50 мкМ b-меркаптоэтанола); белок OVA; пептид SIINFEKL. Способы: Очищенные Т-клетки инкубировали в среде для Т-клеток с 1 мкг/мл LPS в течение 30 мин на льду. Т-клетки дважды промывали средой для Т-клеток и центрифугировали при 500 rcf в течение 4 минут, затем инкубировали с 0,01 мг/мл - 0,1 мг/мл OVA или 1 мкг/мл SIINFEKL на льду. Аппарат CellSqueeze собирали в соответствии со стандартным протоколом с использованием чипа 30-4, затем через каждый чип пропускали 200 мкл среды для T-клеток при давлении 100 фунтов/кв. дюйм. Половину Т-клеток пропускали через устройство CellSqueeze при давлении 100 фунтов/кв. дюйм, а другую половину оставляли на льду (контроль эндоцитоза). Выходной поток собирали в 96-луночный планшет и оставляли на льду на 15 минут для восстановления клеточных мембран. Клетки центрифугировали при 350 rcf в течение 10 минут, супернатант удаляли. Клетки реактивировали в 1 мкг/мл LPS в течение 10 минут перед инъекцией в организм хозяина.
Обогащение клеток иммунной системы пациента
Сдавливание клеток также можно использовать для обогащения или размножения клеток иммунной системы пациента ex vivo для последующего переноса обратно в организм пациента. Например, антиген доставляли посредством механического повреждения в цитозоль антиген-презентирующих клеток (дендритных клеток, В-клеток, Т-клеток, макрофагов). Эти антиген-презентирующие клетки процессировали и презентировали процессированный антиген в контексте гетеродимеров MHC/HLA на своей поверхности для стимуляции и размножения Т-клеток. Затем размноженные популяции Т-клеток повторно вводили в организм пациента для усиления терапевтического иммунного ответа. Например, антиген представляет собой опухолевый антиген (или лизат) для усиления противоопухолевого ответа. В качестве альтернативы, антиген представляет собой бактериальный или вирусный антиген (или его фрагменты, или ослабленные или убитые бактериальные клетки, или вирусные частицы) для лечения инфекционного заболевания. В еще одном примере антиген представляет собой аутоантиген, презентирующийся вместе с толерогеном (как описано выше) для придания толерантности, а затем размножения популяции толерантных иммунных клеток для введения обратно в организм пациента с целью подавления патологического, например, аутоиммунного ответа.
Использование Т-клеток в качестве антиген-презентирующих клеток
Иммунотерапия рака, основанная на активации Т-клеток пациента с использованием терапевтических средств на основе антител, продемонстрировала успех при этих показаниях с высокой частотой мутаций и при ранее существовавшем Т-клеточном ответе на опухолеассоциированные антигены (TAA) (Topalian et al., Cancer Cell 2015; 27: 450-461; Hodi et al., N Engl J Med 2010; 363: 711-723; Topalian et al., Cell 2015; 161: 185-186). Поскольку многие виды рака характеризуются низкой частотой мутаций и низкой частотой спонтанных Т-клеточных реакций, использование противораковых вакцин можно использовать для стимуляции Т-клеточных реакций на TAA (Melief et al., J Clin Invest 2015; 125: 3401-3412). Противораковые вакцины можно использовать в качестве монотерапии (Ly et al., Cancer Res 2010; 70: 8339-8346; Kantoff et al., N Engl J Med 2010; 363: 411-422), в комбинации с терапевтической блокадой контрольных точек (Agarwalla et al. J Immunother 2012; 35: 385-389), или в комбинации с адоптивной Т-клеточной терапией (Lou et al., Cancer Res 2004; 64: 6783-6790).
В доклинических условиях стратегии использования профессиональных антиген-презентирующих клеток (APC) для вакцинации против рака продемонстрировали, что антиген-сенсибилизированные дендритные клетки (ДК) могут вызывать защитный иммунитет против опухолей (Celluzzi et al., J Exp Med 1996; 183: 283-287; Mayordomo et al., Nat Med 1995; 1: 1297-1302; 7489412; Flamand et al., Eur J Immunol 1994; 24: 605¬610). Клинические исследования, проведенные при различных видах рака (Nestle et al., Nat Med 1998; 4: 328¬332; Hu et al., Cancer Res 1996; 56: 2479-2483; Hsu et al., Nat Med 1996; 2: 52-58; Reichardt et al., Blood 1999; 93: 2411-2419; Morse et al., Clin Cancer Res 1999; 5: 1331-1338; Yu et al., Cancer Res 2001; 61: 842-847), указывают, что моноцитарные ДК способны вызывать антигенспецифический иммунитет у людей, однако клинические ответы являются низкими. Например, первая одобренная FDA противораковая вакцина на основе ДК (Sipuleucel-T, Provenge, Dendreon, Seattle, WA) продемонстрировала четырехмесячную выживаемость пациентов с гормонорефрактерным раком предстательной железы (Kantoff et al., N Engl J Med 2010; 363: 411-422; Higano et al., Cancer 2009; 115: 3670-3679). Среди гипотез, объясняющих, почему эта вакцина обладает столь низким клиническим благоприятным действием, процедура, используемая для загрузки ДК Sipuleucel-T антигеном, могла приводить к преимущественной презентации антигена MHC класса II, а не презентации MHC как класса I, так и класса II. Таким образом, низкая активность цитотоксических Т-клеток, возможно, сыграла роль в низкой эффективности этого продукта.
Способы, разработанные для доставки TAA в ДК, используют платформу CellSqueeze для оптимальной презентации антигена молекулами гистосовместимости MHC как класса I, так и класса II. За счет преодоления ограничений существующих методик загрузки антигена способы, описанные в настоящем документе, приводят к более сильным цитотоксическим и хелперным Т-клеточным реакциям in vivo. Данная платформа включает микрожидкостной чип, способный быстро деформировать клетки при их пропускании через сужение с целью временного повреждения их мембран и активации возможности транспорта целевого материала в цитоплазму клетки. За счет исключения необходимости в электрических полях или экзогенных усилителях или материалах-носителях описанные способы минимизирют потенциальную токсичность для клеток и неспецифические эффекты.
Адресное воздействие на вирусные или неоантигены
Поскольку к аутоантигенам можно индуцировать центральную толерантность, предпочтительными мишенями терапевтических вакцинаций в настоящее время являются неоантигены (Gubin et al., J Clin Invest 2015; 125: 3413-3421; Gubin et al., Nature 2014; 515: 577-581; Yadav et al., Nature 2014; 515: 572-576; Quakkelaar et al., Adv Immunol 2012; 114: 77-106; Castle et al., Cancer Res 2012; 72: 1081-1091) и вирусные антигены (Melief et al., J Clin Invest 2015; 125: 3401-3412; Quakkelaar et al., Adv Immunol 2012; 114: 77-106).
Для выявления и оценки антигенов получили коктейль из девяти синтетических длинных перекрывающихся пептидов (SLP) онкогенов E6 и E7 ВПЧ16 (ВПЧ16-SLP), в котором представлена вся длина этих двух онкобелков, и продемонстрировали ответы в доклинических моделях, а также у пациентов с предраком, использованных для оценки иммунных ответов. Платформу CellSqueeze использовали для загрузки ДК коктейлем ВПЧ16-SLP, что позволяло направлять пептиды в пути презентации MHC как класса I, так и класса II и, таким образом, индуцировать антигенспецифическое размножение CD4 и CD8 T-клеток. Таким образом, этот подход вызывает многоэпитопный ответ, что позволяет преодолеть ограничения HLA-специфических коротких пептидов, и обеспечивает более эффективную терапию.
Обработка ДК человека и мыши с помощью устройства CellSqueeze с ВПЧ16-SLP: Различные параметры CellSqueeze тестировали для доставки коктейля ВПЧ16-SLP в ДК человека и мыши. Выполнили оценку конструктивных вариантов чипов с разной длиной сужения, шириной сужения, количеством сужений и углом приближения к сужению. Из параметров процесса исследовали концентрацию клеток, среду доставки, концентрацию пептида в среде доставки, температуры обработки, рабочее давление и количество проходов через чип. Экспериментальный подход к оптимизации процесса также включает мечение пептидного коктейля ВПЧ16-SLP флуоресцентной меткой для учета количества пептида, доставленного в клетки. Кроме того, учитывали оптимальные процессинг и презентацию пептидов в контексте классов I и II путем обнаружения презентированных пептидов с TCR-специфическими тетрамерами посредством проточной цитометрии. Этот подход сравнивали с загрузкой ДК короткими пептидами, специфическими по отношению к HLA класса I, для перекрестной презентации.
В данном исследовании выявили конструктивные варианты чипов и условия доставки, обеспечивавшие эффективную загрузку ДК человека и мыши антигенами пептидов ВПЧ16-SLP или смесями антигенов, например, коктейлем вирусных антигенов, например, включая условия для эффективного процессинга длинных пептидов и загрузки антигенов APC, например, дендритными клетками.
Оценка эффективности ДК, обработанных сдавливанием с ВПЧ16-SLP, при стимуляции размножения антигенспецифических Т-клеток in vitro и in vivo
Протестировали способность ДК, загруженных пептидным коктейлем в нескольких условиях, стимулировать размножение антигенспецифических Т-клеток. Например, антигенспецифические Т-клетки индуцировали путем иммунизации мышей ВПЧ16-SLP и CpG. Через восемь дней после бустер-иммунизации выделяли Т-клетки из селезенки иммунизированных мышей и использовали их для совместного культивирования с ДК, загруженными ВПЧ16-SLP, с целью определения способности загруженных клеток запускать размножение антигенспецифических CD4 и CD8 Т-клеток и продукцию цитокинов. Для тестирования загруженных ДК человека совместно культивировали клоны T-клеток человека, реакционноспособные по отношению к ВПЧ16, и ДК человека, загруженные коктейлем ВПЧ16-SLP, при нескольких условиях. Выполнили оценку размножения антигенспецифических Т-клеток и продукции цитокинов. Протестировали функциональность и способность загруженных ДК человека и/или мыши стимулировать размножение антигенспецифических Т-клеток in vitro. ДК, загруженные короткими пептидами, специфичными по отношению к HLA класса I, использовали в качестве контроля. Т-клетки, сингенные по HLA-антигенам, использовали в качестве реагирующих клеток.
После этого и для проверки эффективности вакцины на основе ДК, полученной с помощью CellSqueeze и предназначенной для получения противоопухолевых ответов против ВПЧ-16 in vivo, мышей вакцинировали ДК, загруженными ВПЧ16-SLP, и стимулировали опухолями TC1 (фибробласт легкого мыши C57BL/6, трансдуцированный с помощью ретровируса онкогенами E6 и E7 ВПЧ и c-H-ras). Показателем являлась выживаемость стимулированных мышей.
Эти исследования показывают, что вакцина на основе ДК, полученная с помощью технологии CellSqueeze, запускает защитные противоопухолевые Т-клеточные и/или противовирусные ответы in vivo.
ДРУГИЕ ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Патентная и научная литература, упомянутая в настоящем документе, устанавливает знания, доступные для специалистов в данной области техники. Все патенты США и опубликованные или неопубликованные заявки на патент США, цитируемые в настоящем документе, включены в него посредством ссылок. Все опубликованные зарубежные патенты и патентные заявки, процитированные в настоящем документе, полностью включены в настоящий документ посредством ссылки. Все другие опубликованные источники, документы, манускрипты и научная литература, процитированные в настоящем документе, полностью включены в настоящий документ посредством ссылки. Хотя настоящее изобретение было подробно показано и описано со ссылками на предпочтительные варианты его реализации, специалистам в данной области техники будет понятно, что в нем могут быть сделаны различные изменения в форме и деталях без отступления от сущности и объема настоящего изобретения, определяемого прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА | 2012 |
|
RU2656156C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОЛОГИЧЕСКИХ МОЛЕКУЛ ДЛЯ ИНДУЦИРОВАНИЯ ТОЛЕРАНТНОСТИ | 2017 |
|
RU2770492C2 |
| СПОСОБЫ EX VIVO ЭКСПАНСИИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2814083C2 |
| МОДИФИЦИРОВАННЫЕ МОНОЦИТЫ/МАКРОФАГИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2766690C2 |
| ПОЛИПЕПТИДЫ ТРАНСПОЗАЗЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2735700C2 |
| СИСТЕМА И СПОСОБ ПОЛУЧЕНИЯ И ХРАНЕНИЯ АКТИВИРОВАННЫХ ЗРЕЛЫХ ДЕНДРИТНЫХ КЛЕТОК | 2011 |
|
RU2575978C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ И ОПУХОЛЕЙ | 2007 |
|
RU2540490C2 |
| МУТАНТНЫЕ ПОЛИПЕПТИДЫ СУАА И ПРОИЗВОДНЫЕ ПОЛИПЕПТИДОВ, ПОДХОДЯЩИЕ ДЛЯ ДОСТАВКИ ИММУНОГЕННЫХ МОЛЕКУЛ В КЛЕТКУ | 2010 |
|
RU2585216C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОМОЛЕКУЛ ДЛЯ ИНДУКЦИИ ТОЛЕРАНТНОСТИ | 2017 |
|
RU2747878C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ИСТОЩЕНИЯ Т-КЛЕТОК | 2018 |
|
RU2804282C2 |
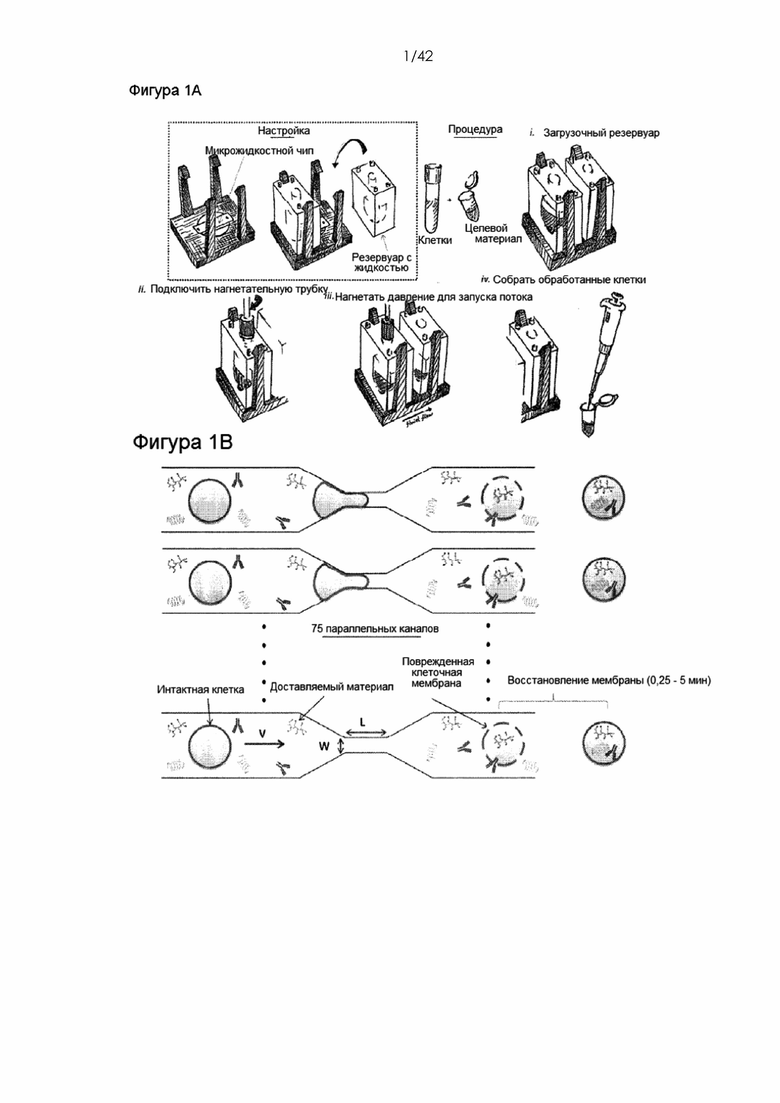
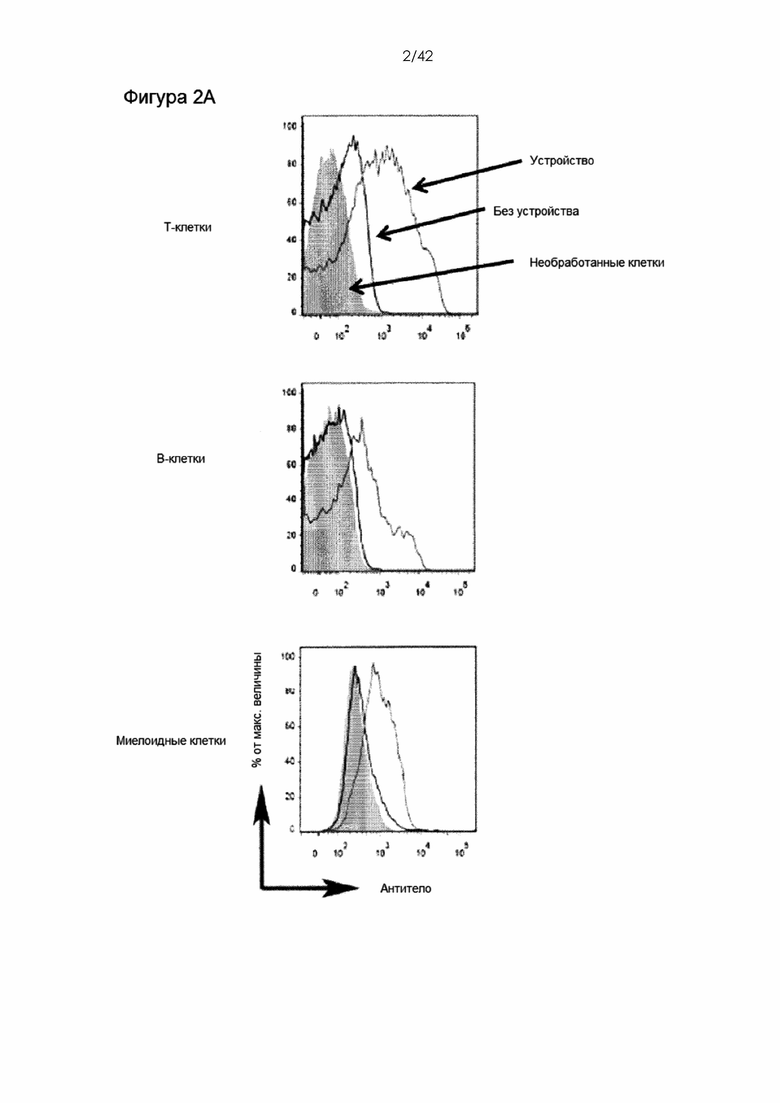
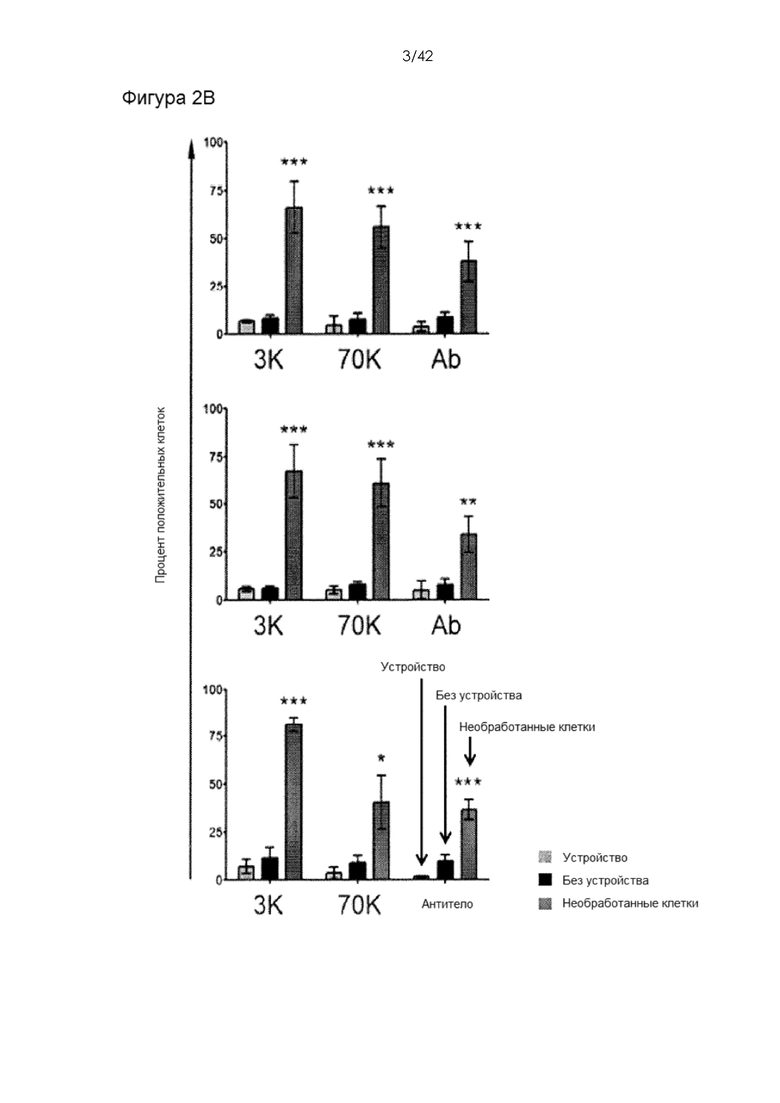
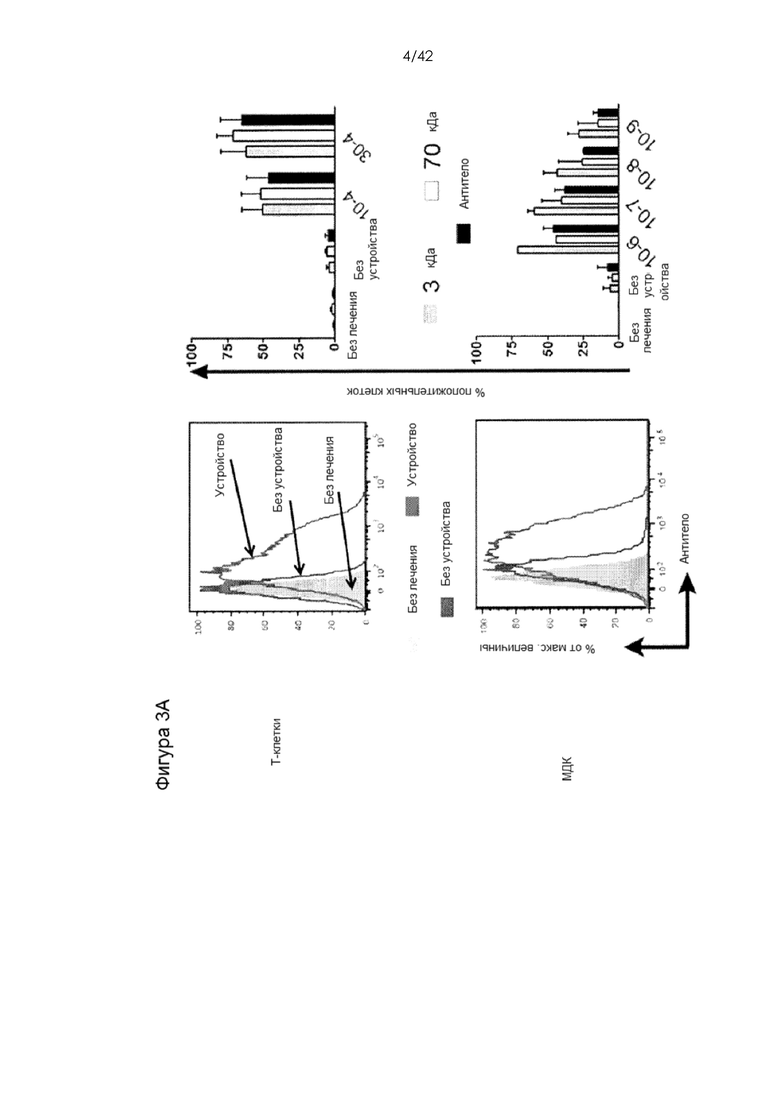
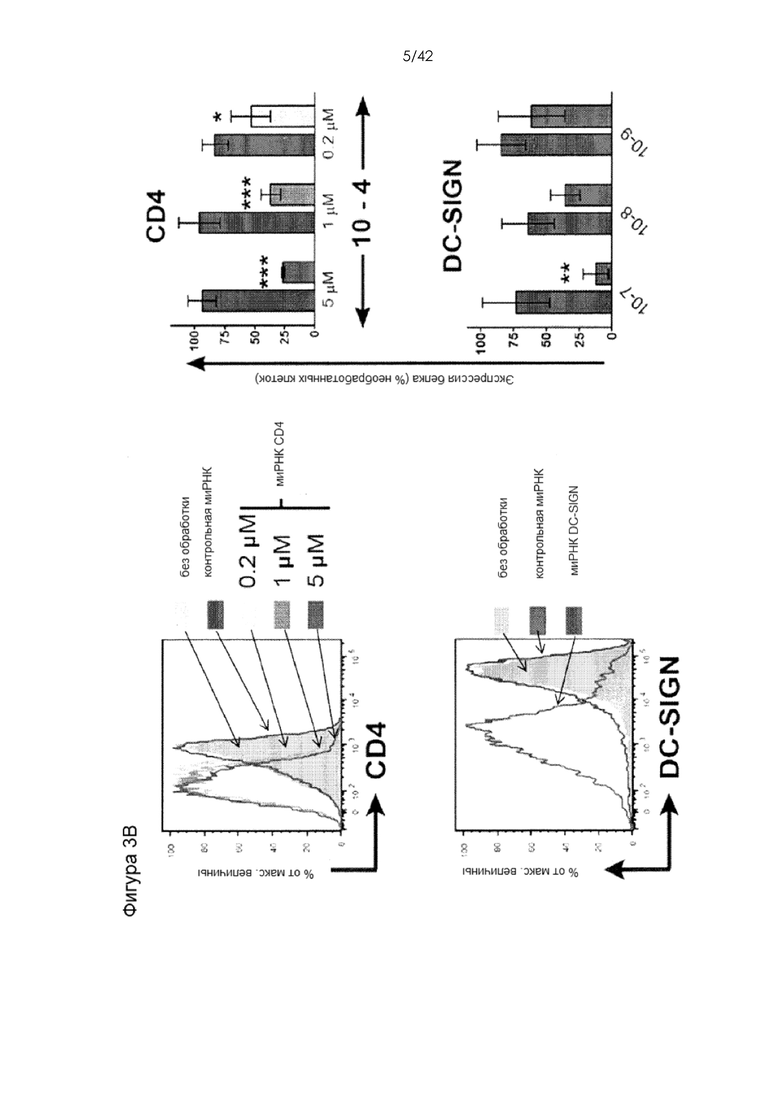
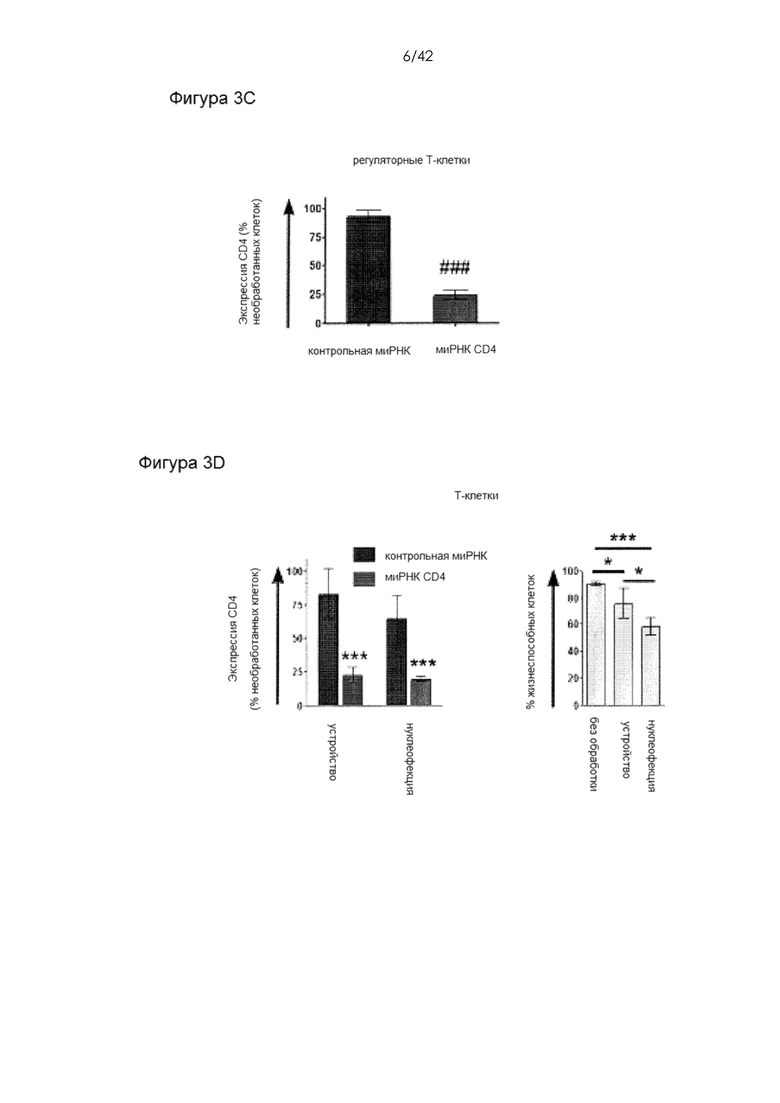
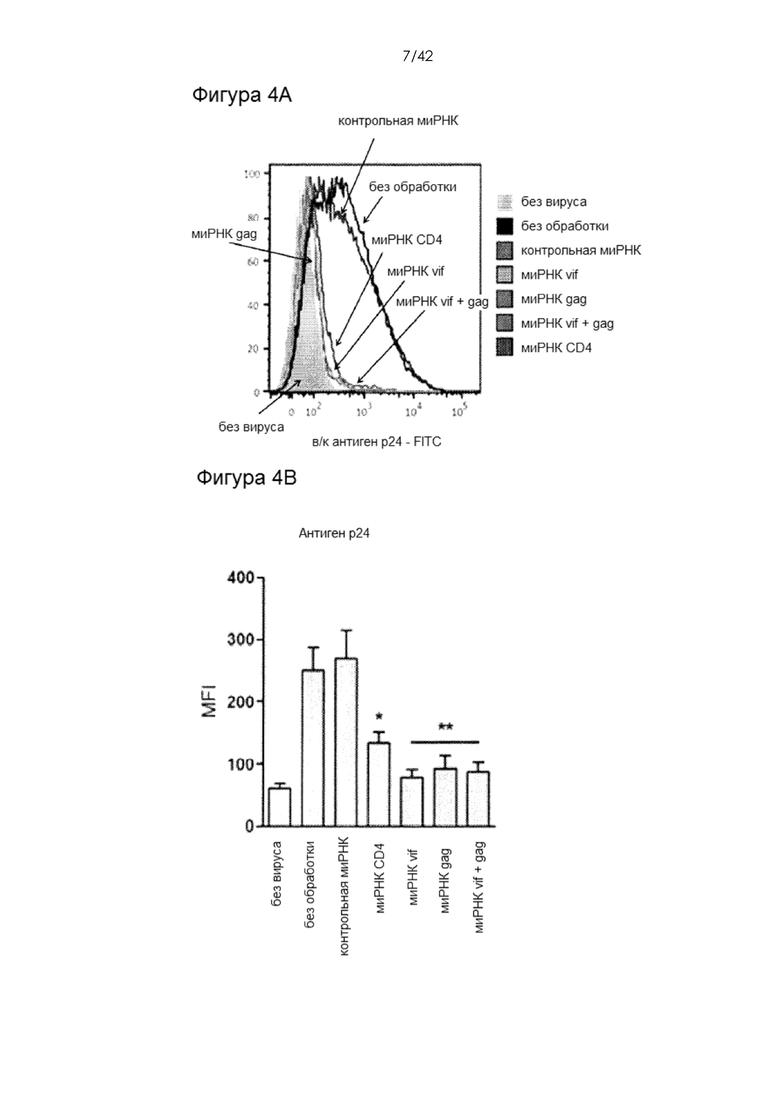
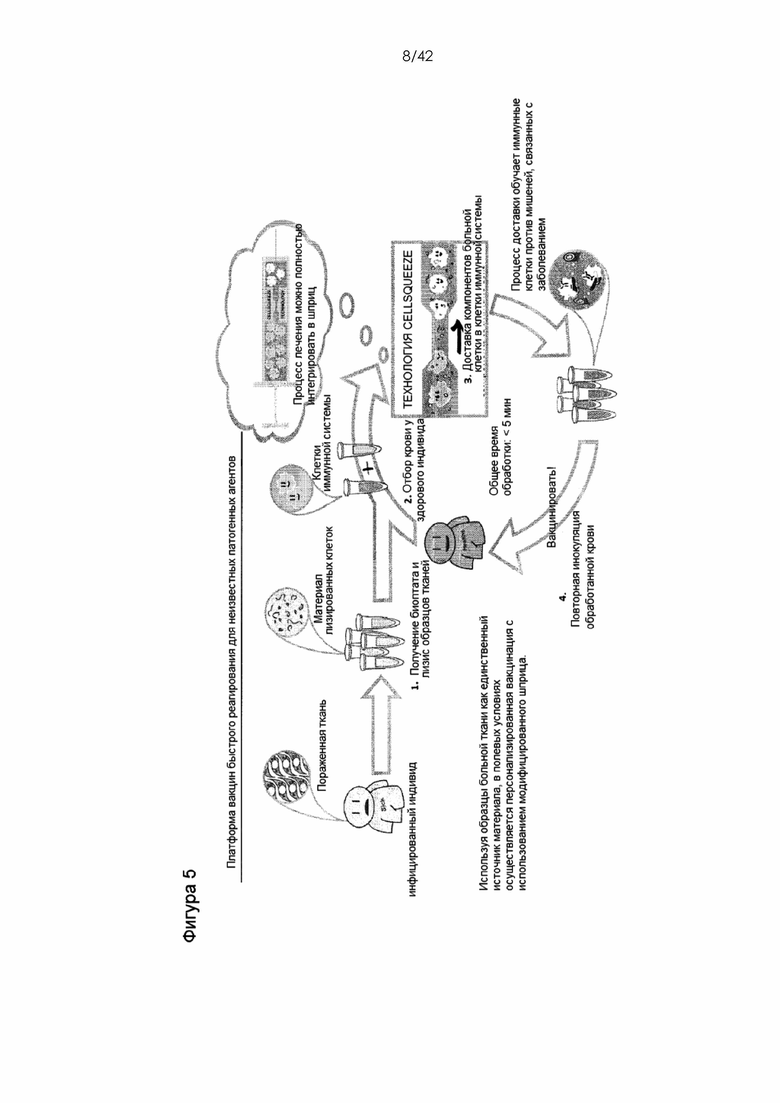

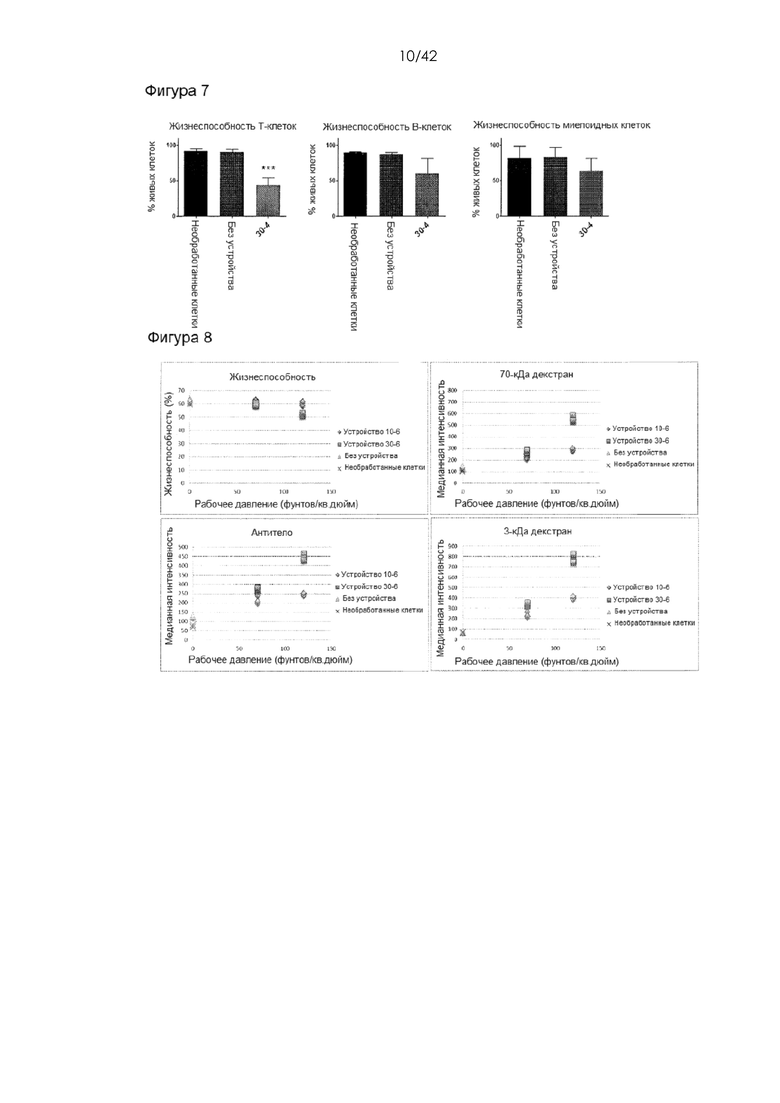
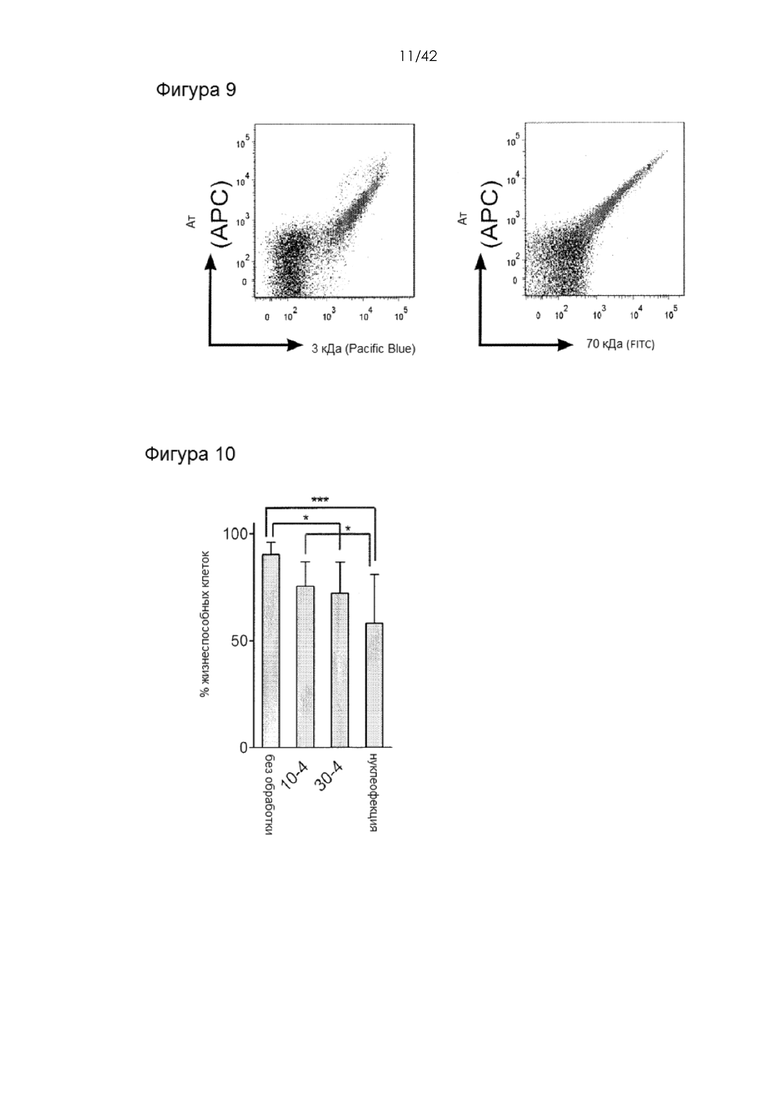
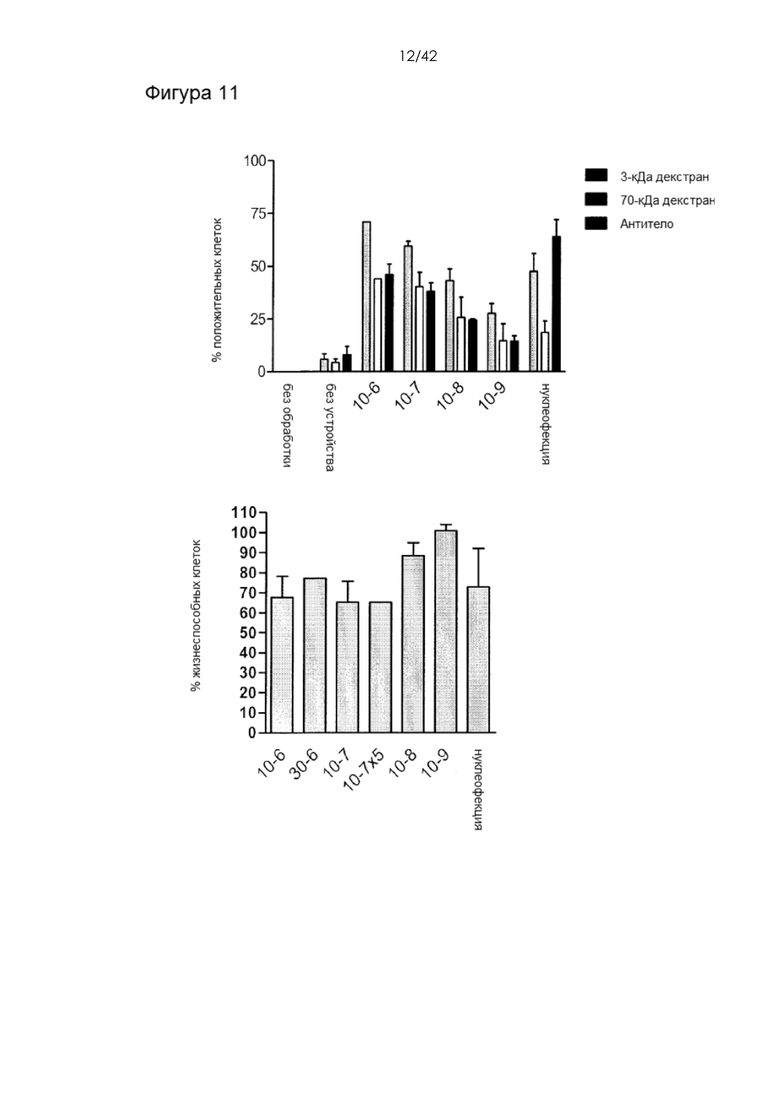
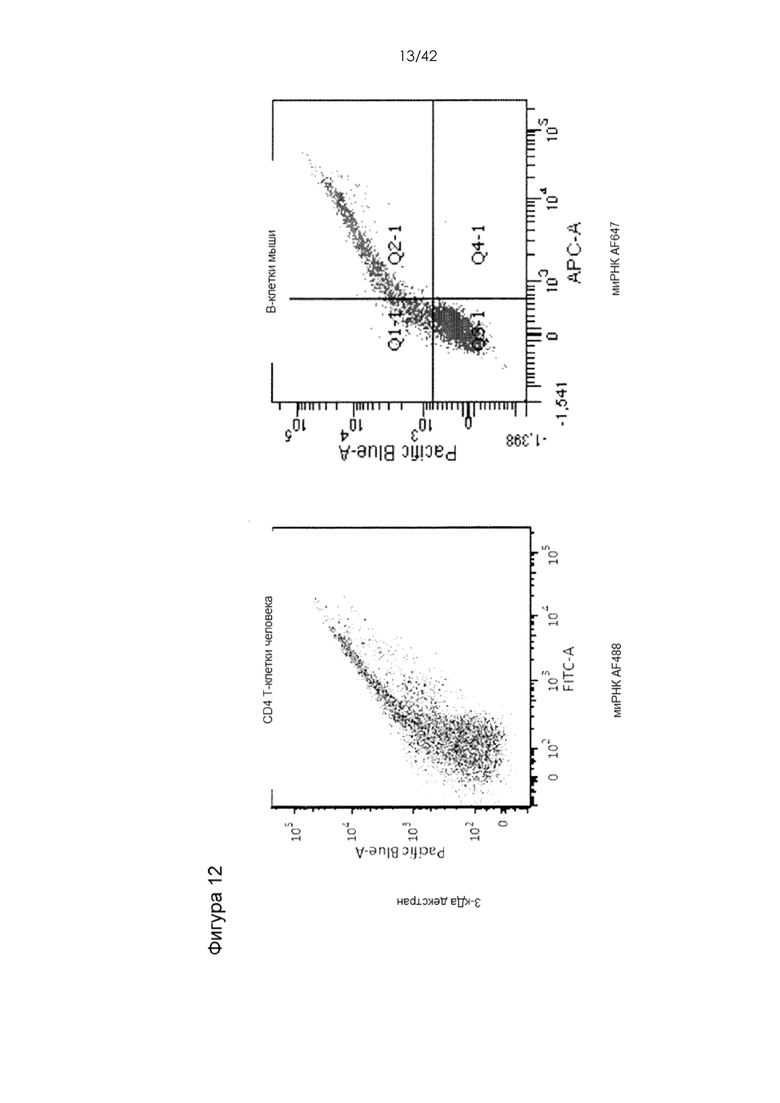
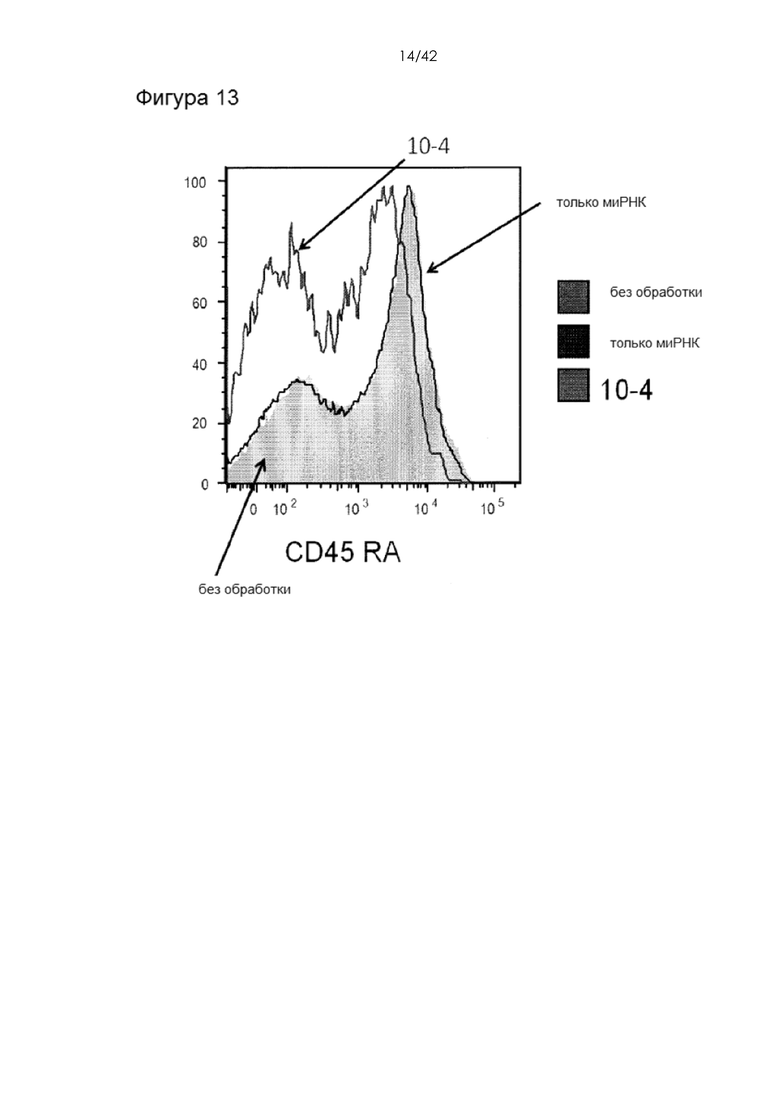
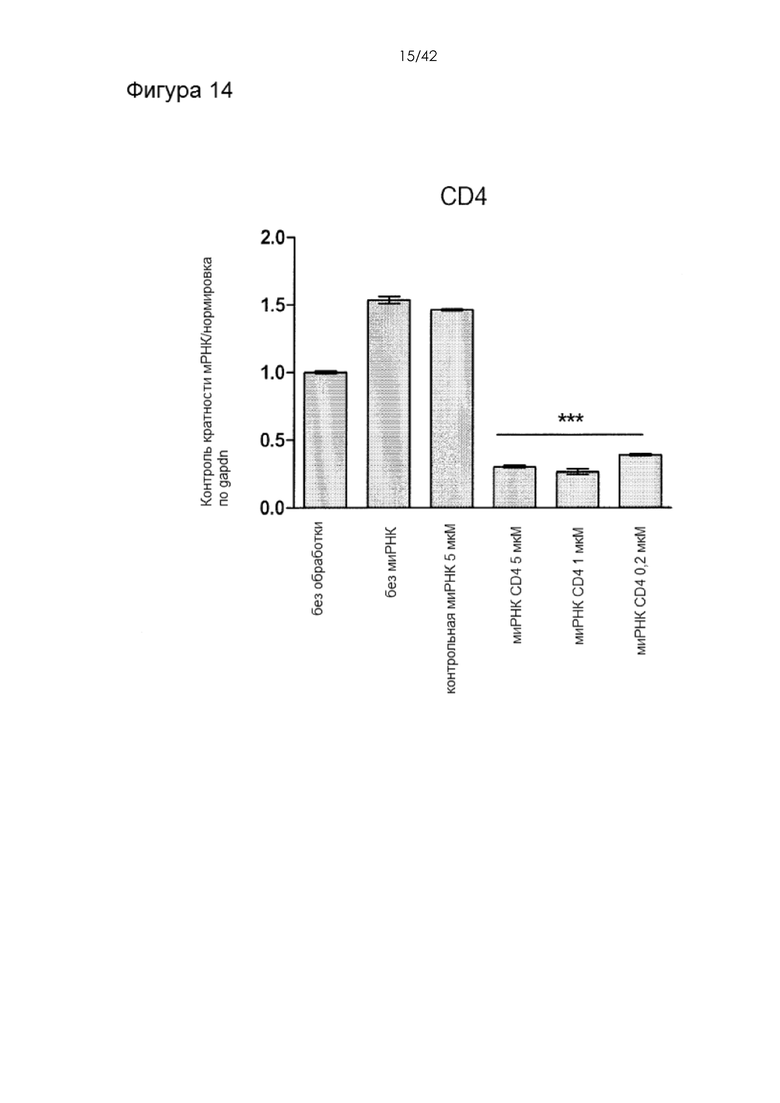
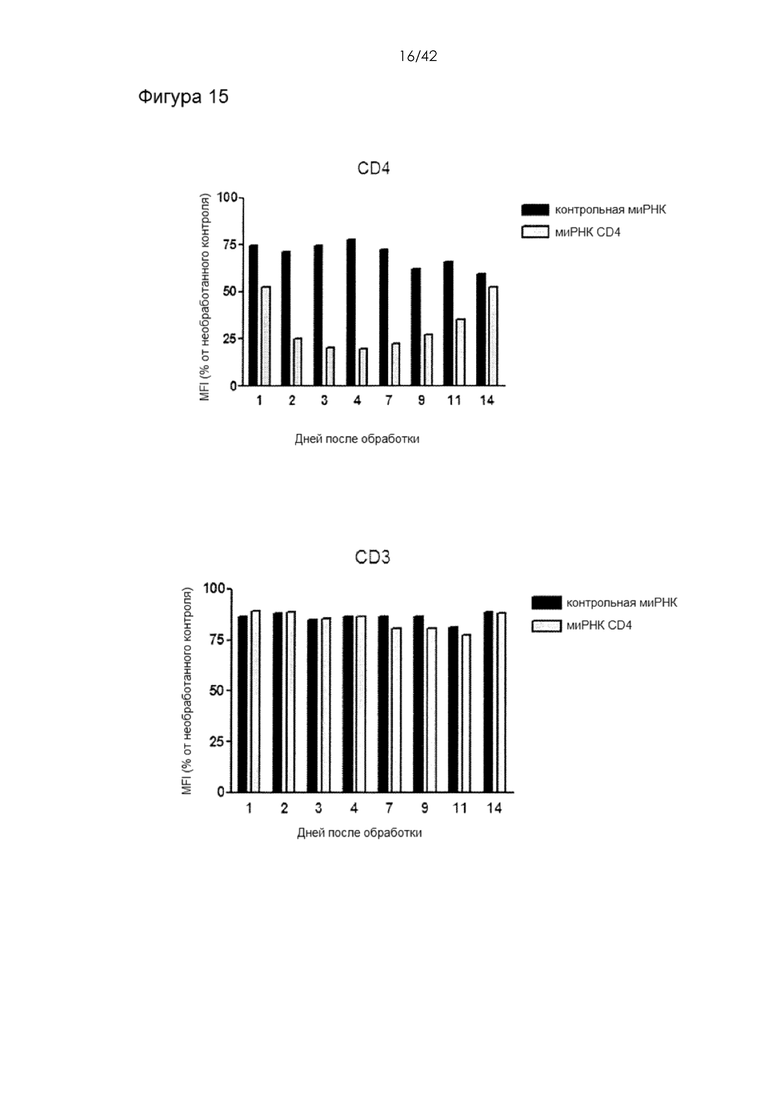

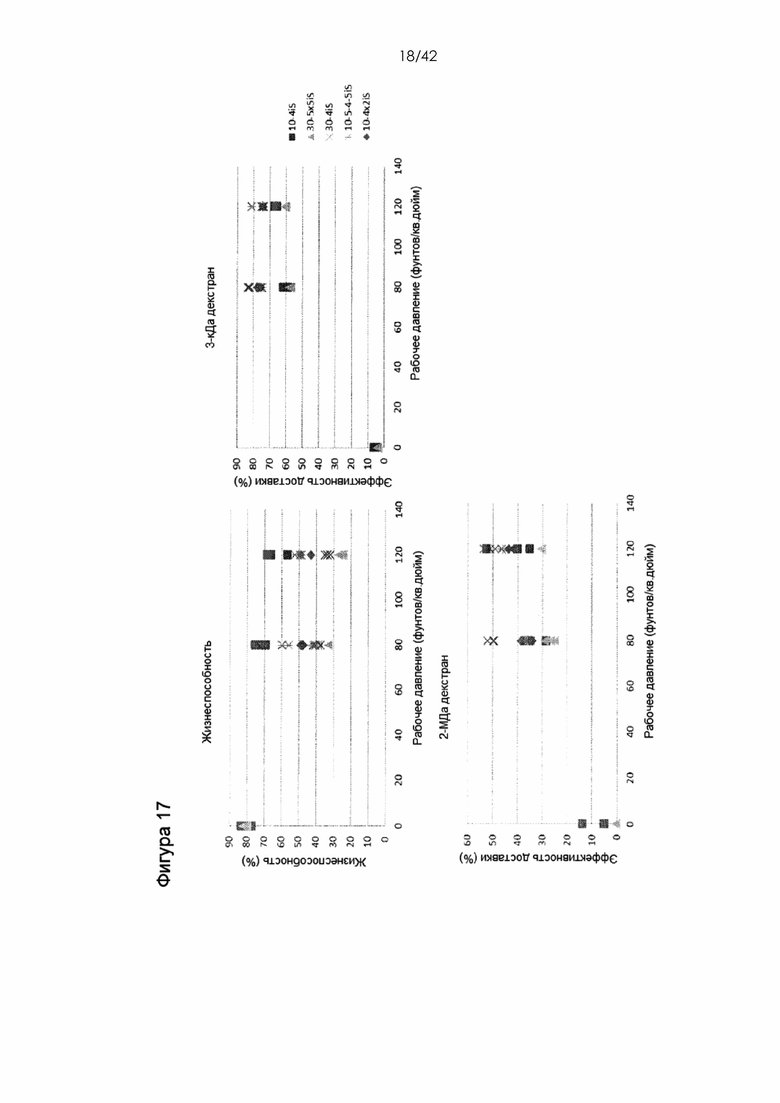
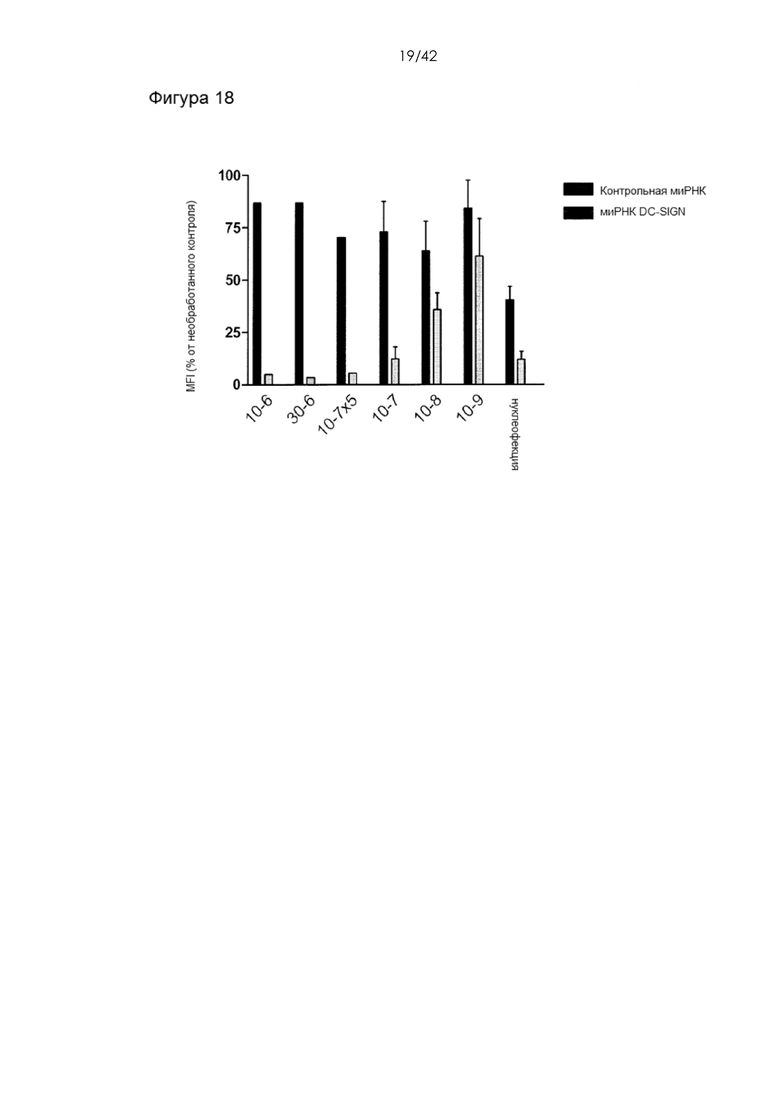
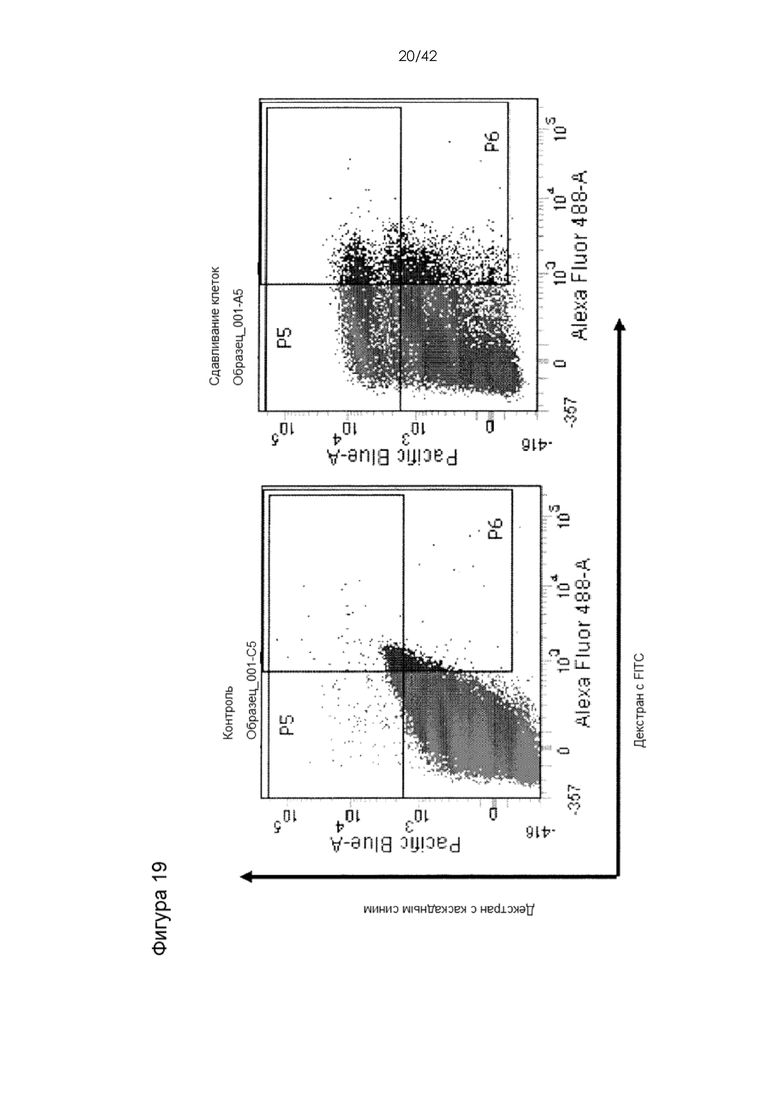
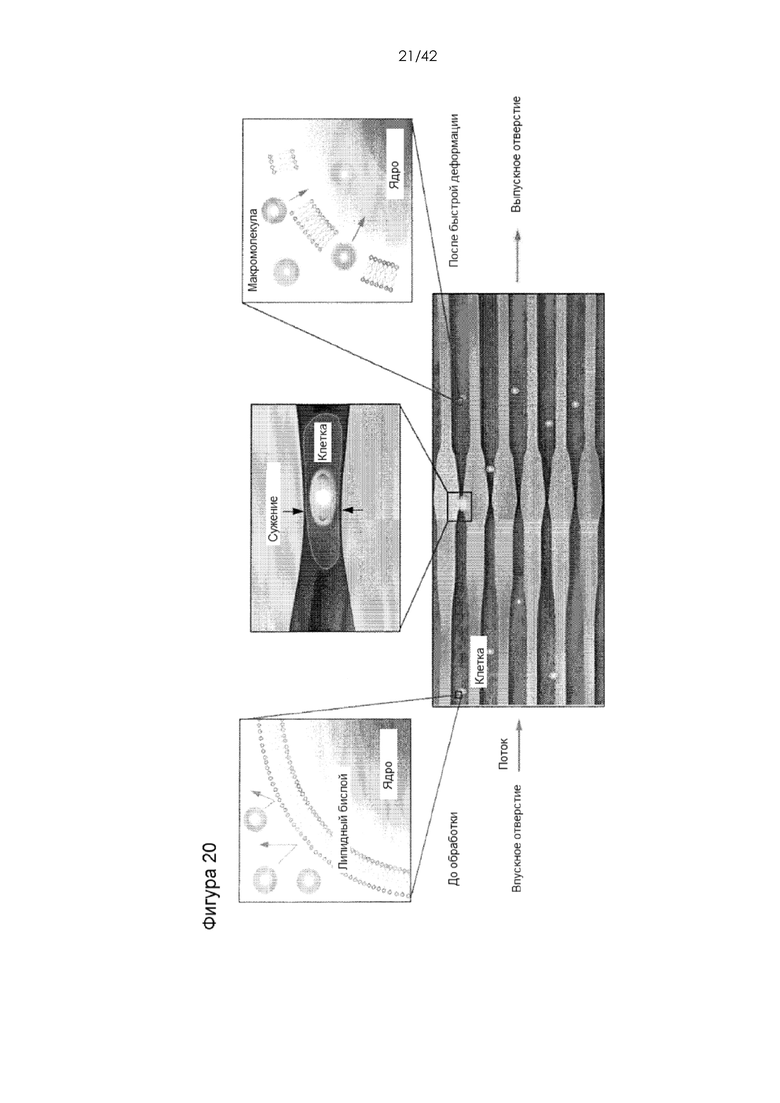
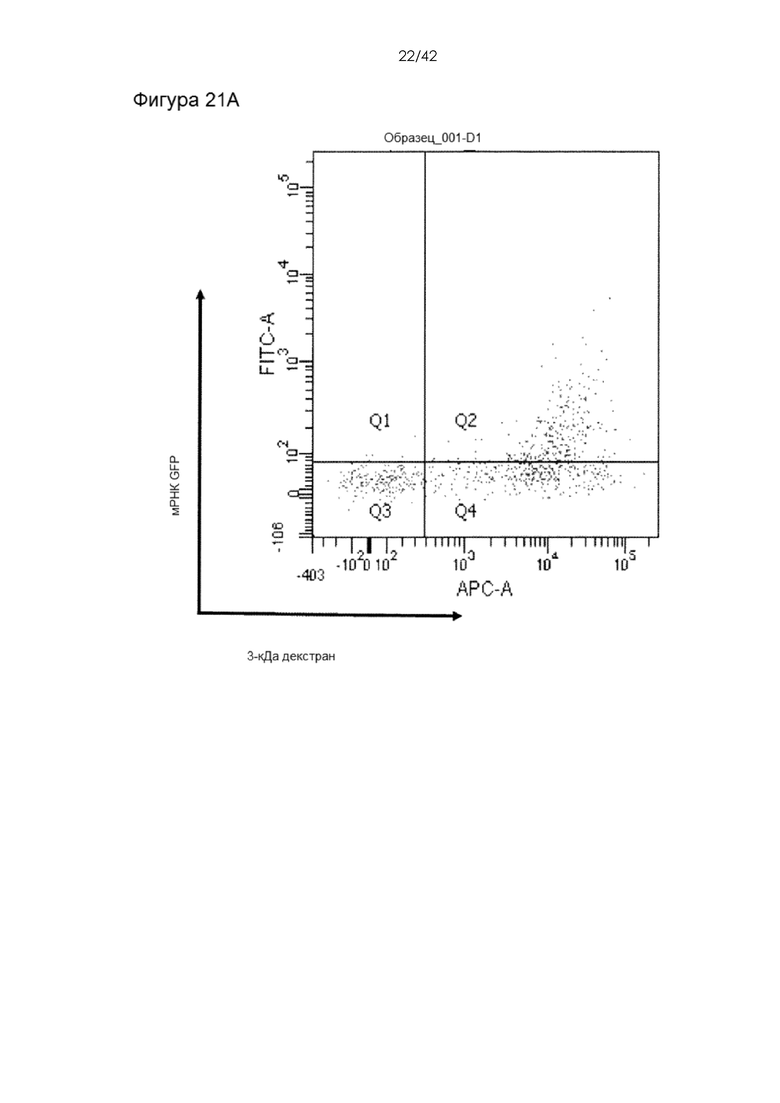
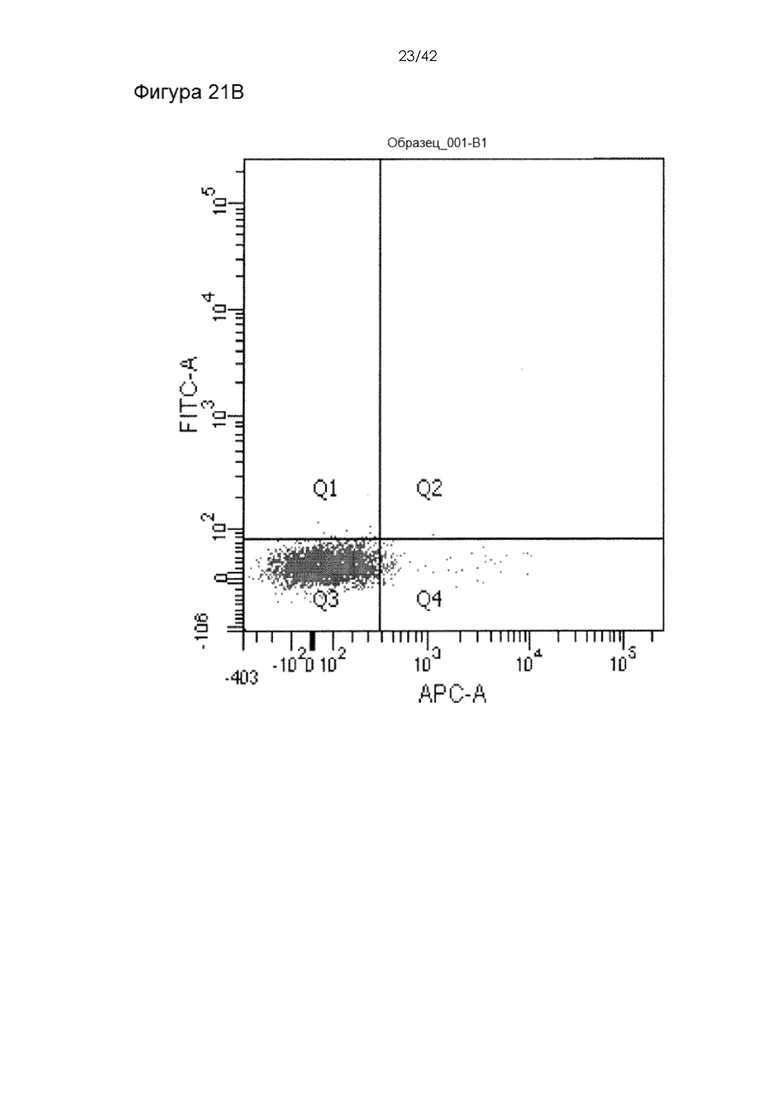
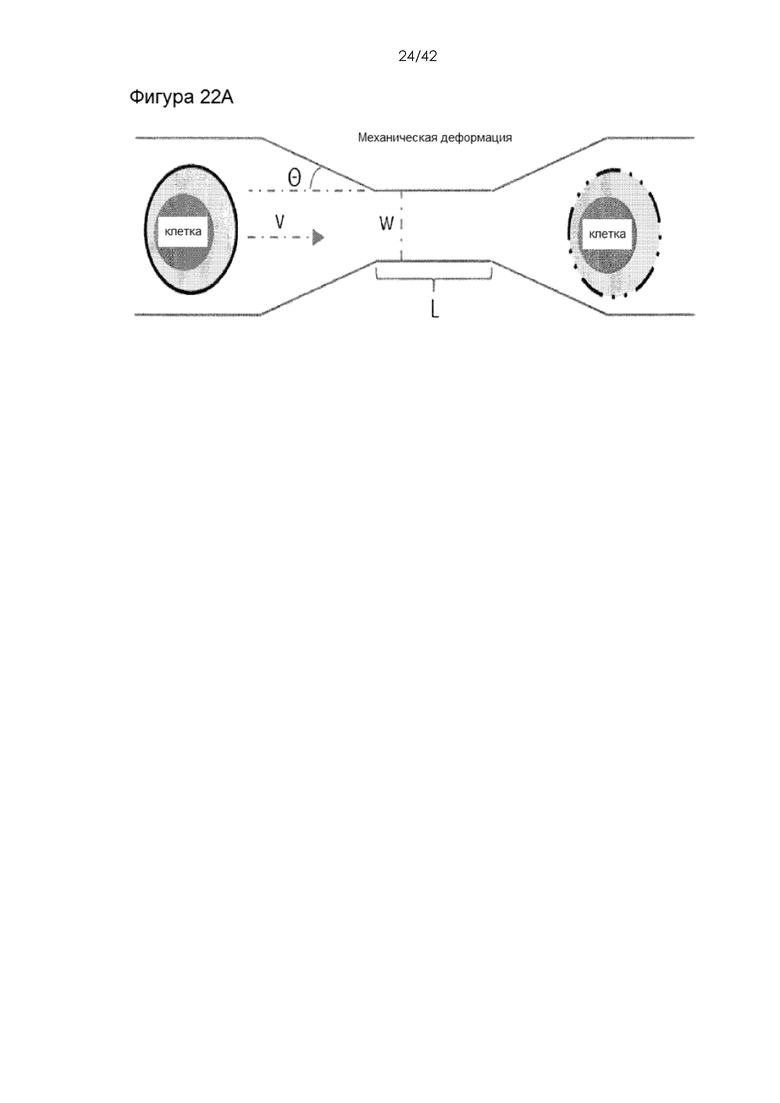
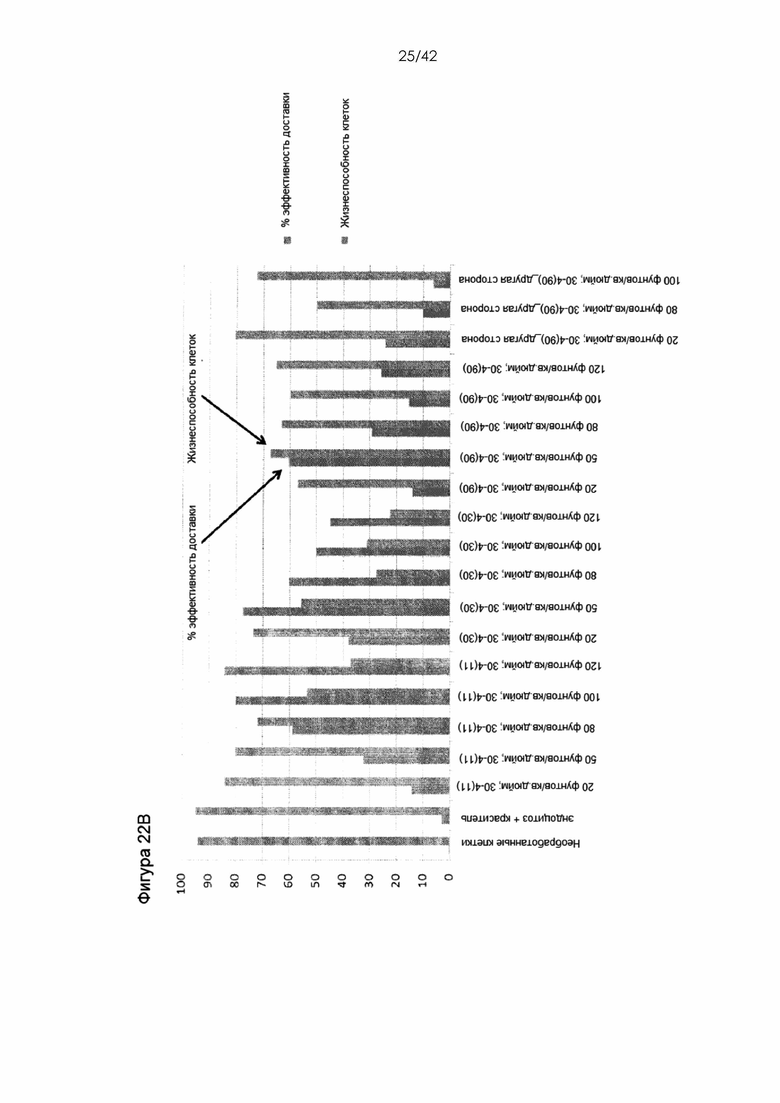
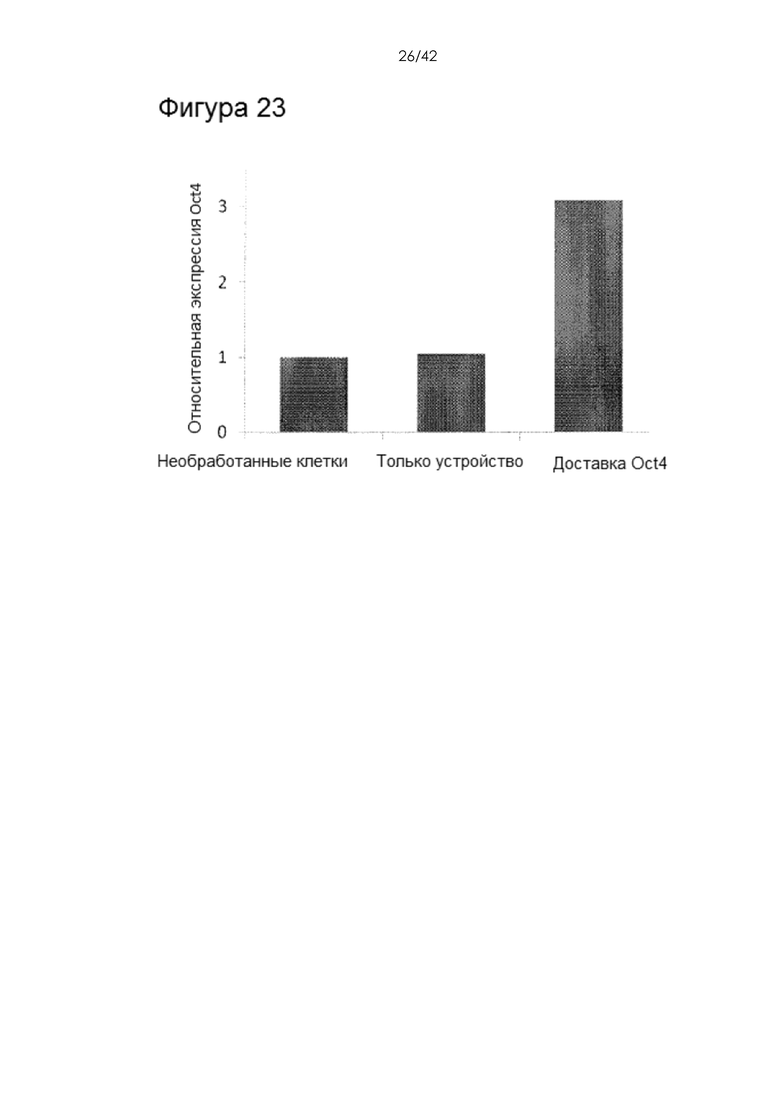
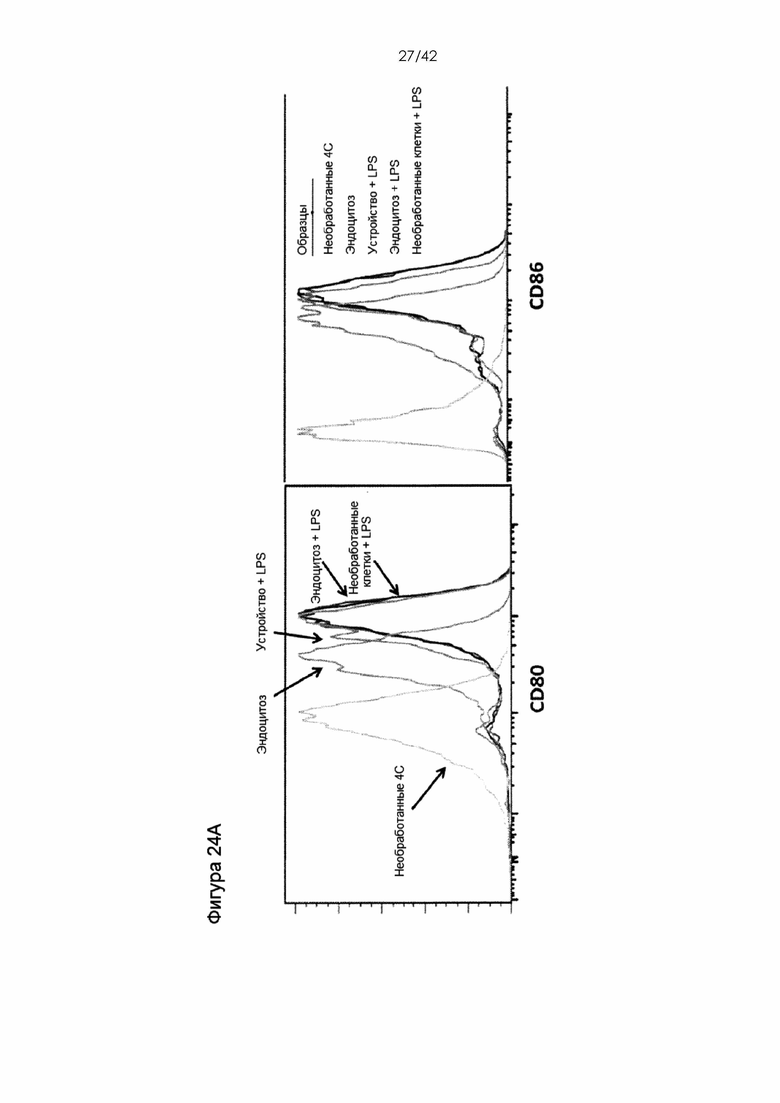
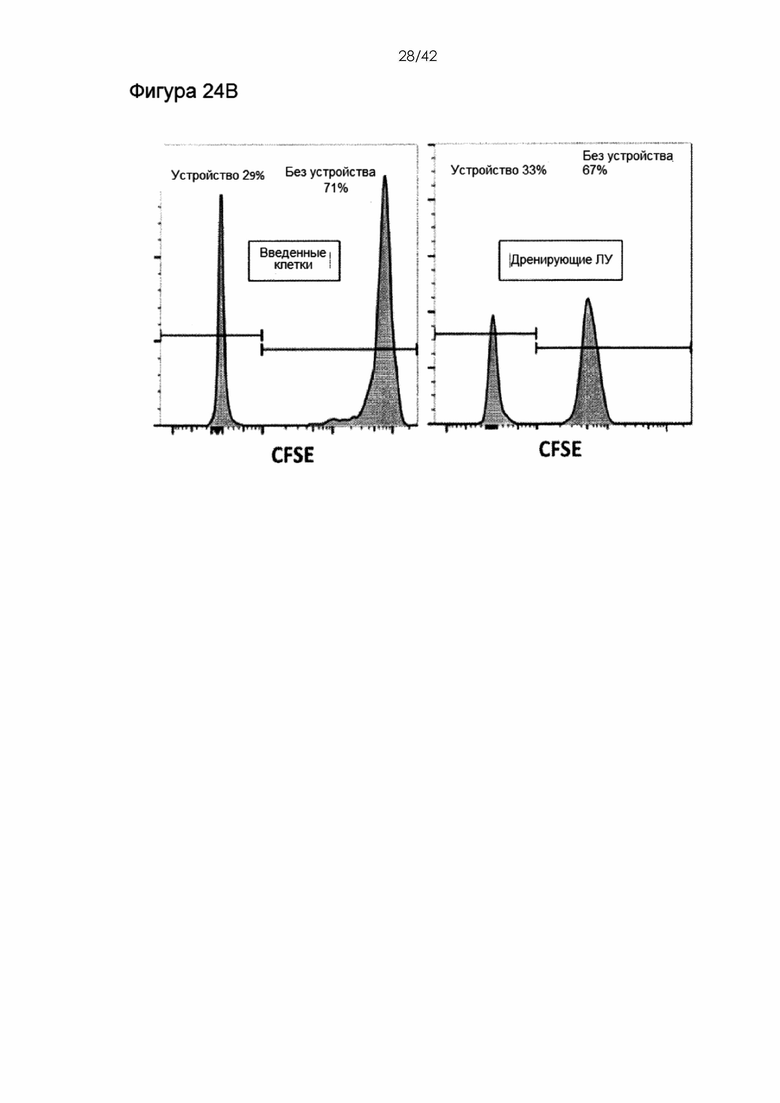

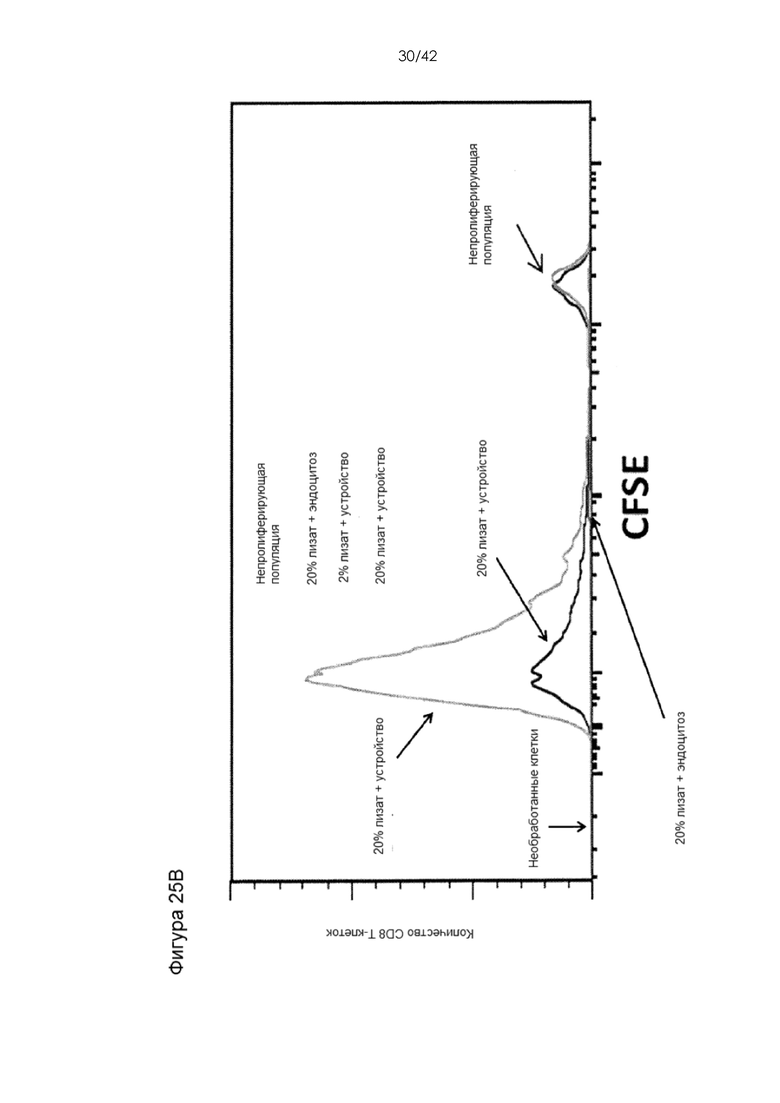
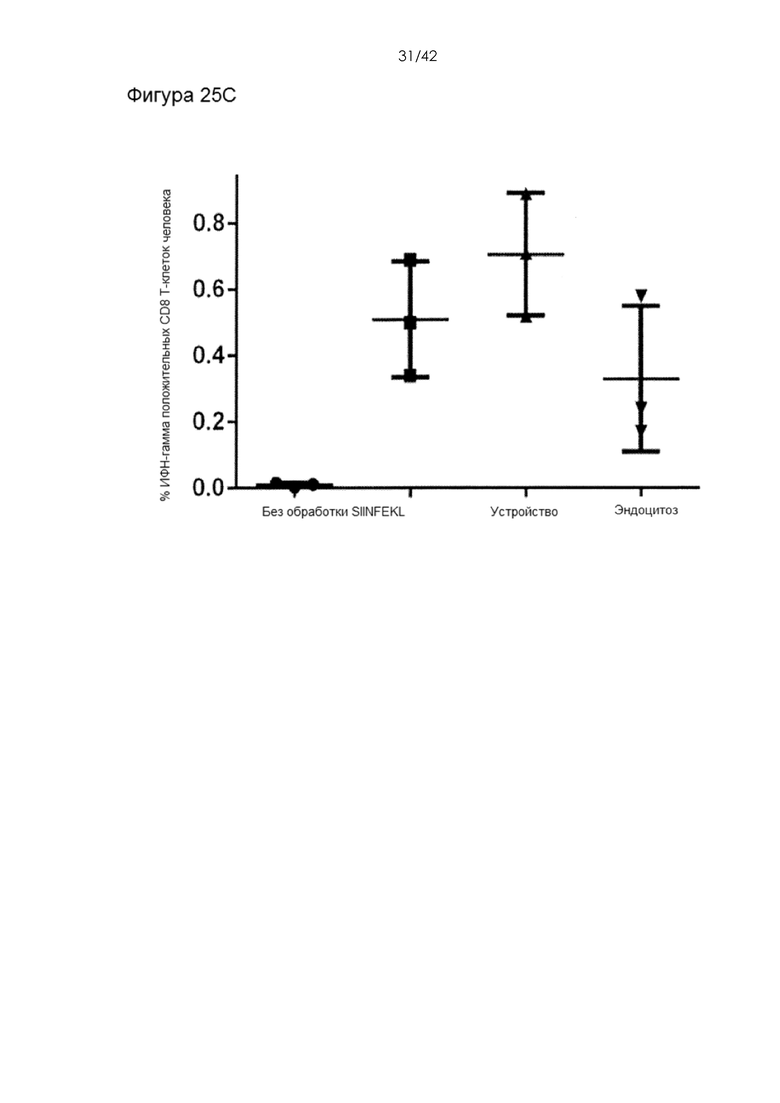
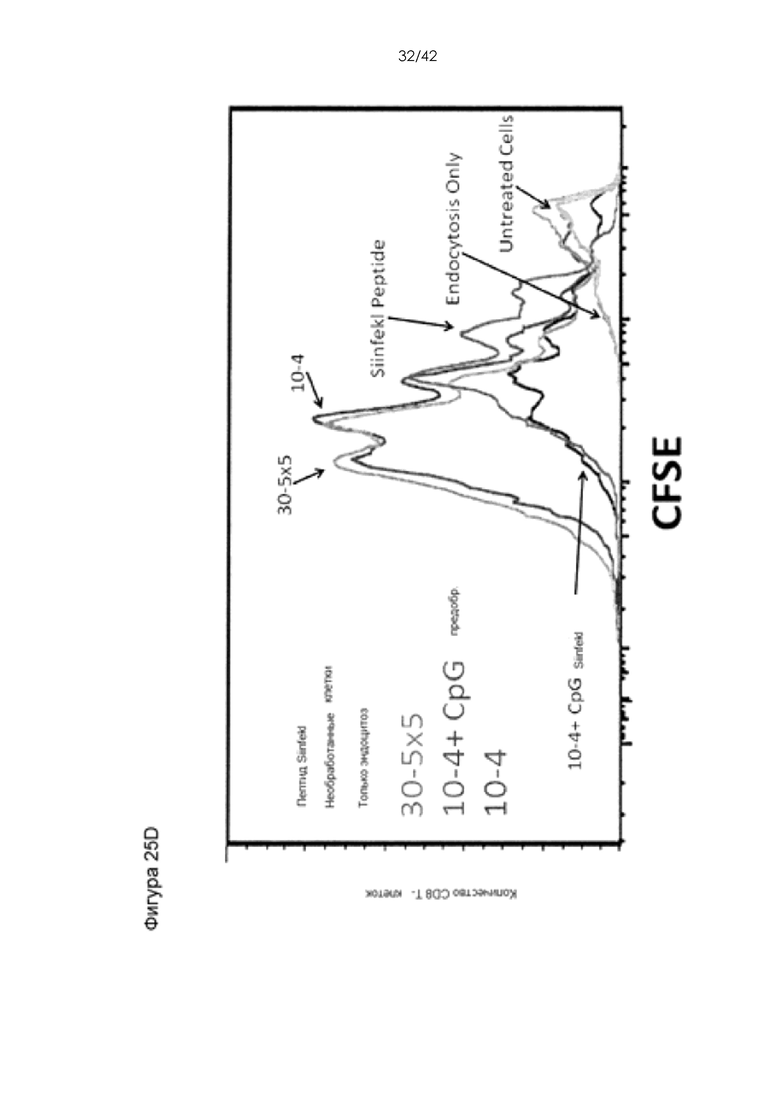
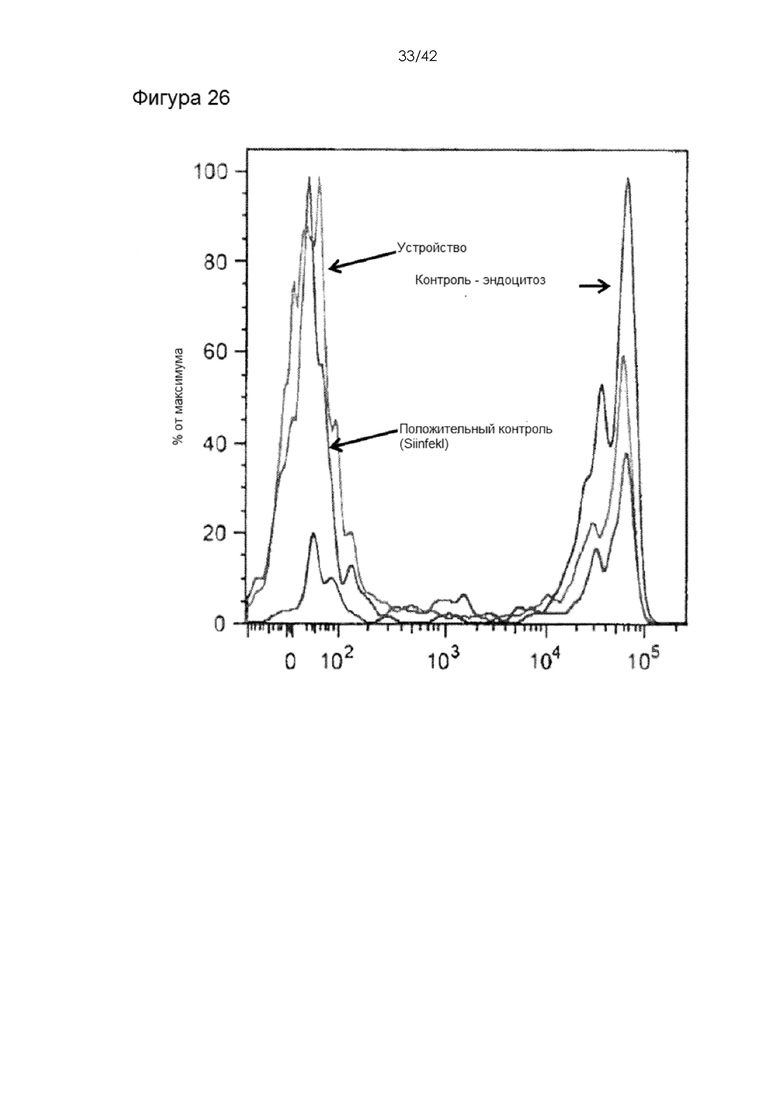
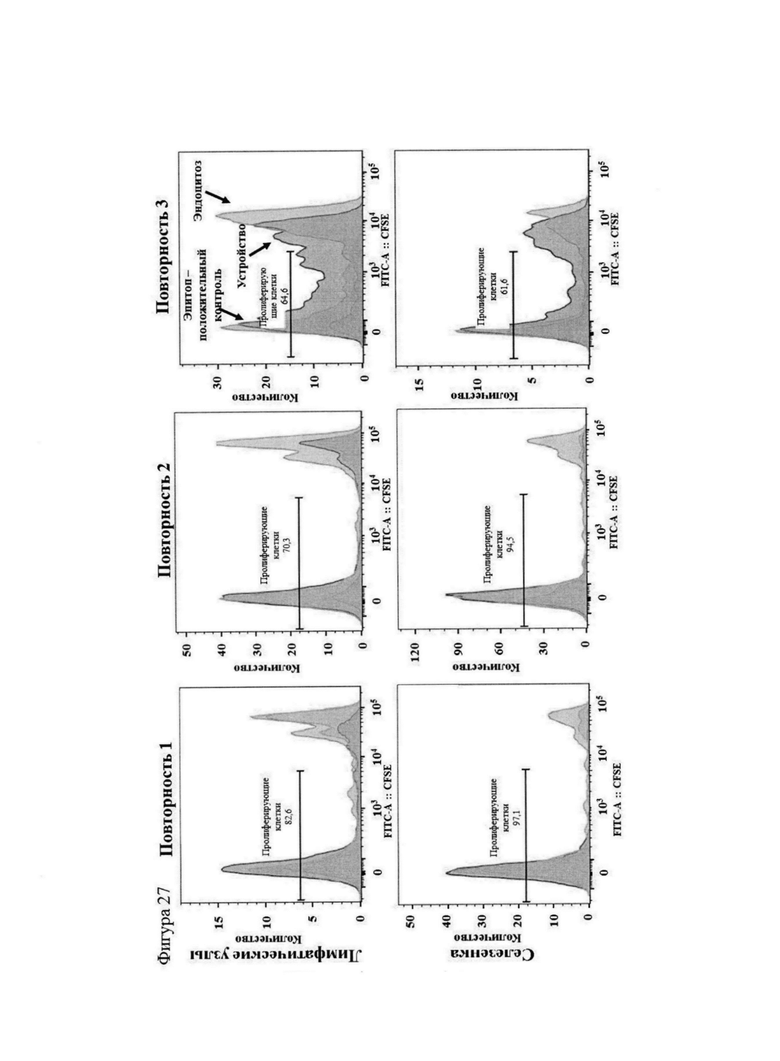
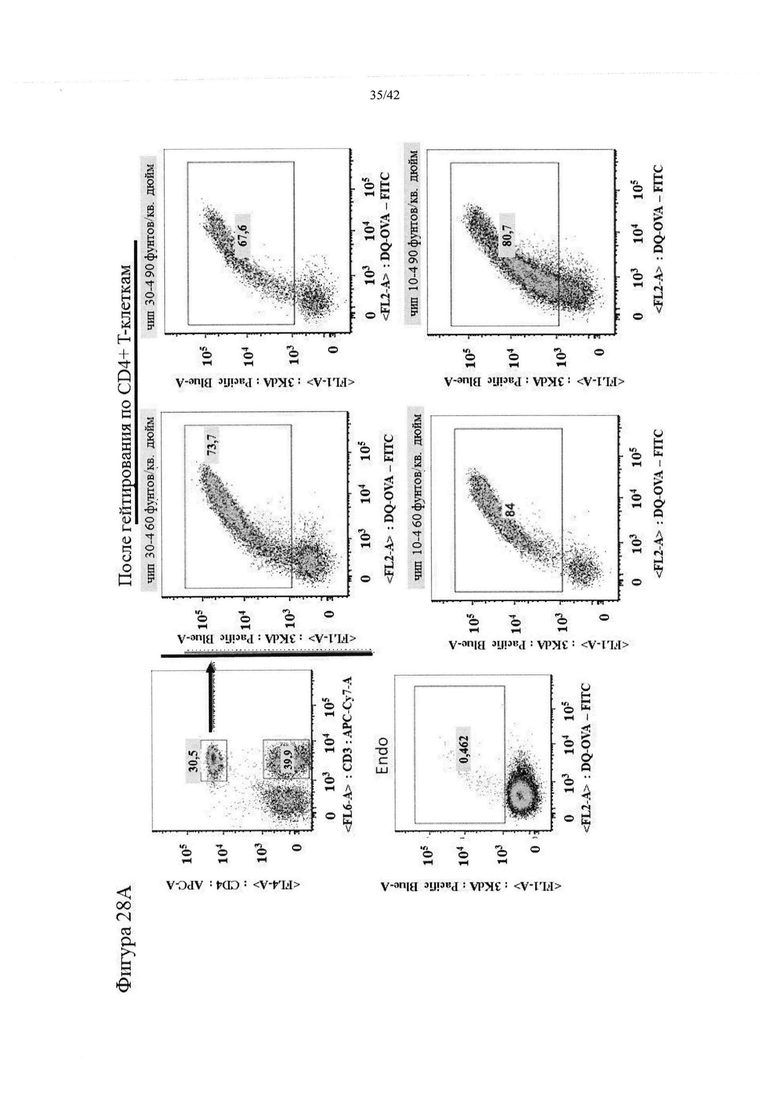
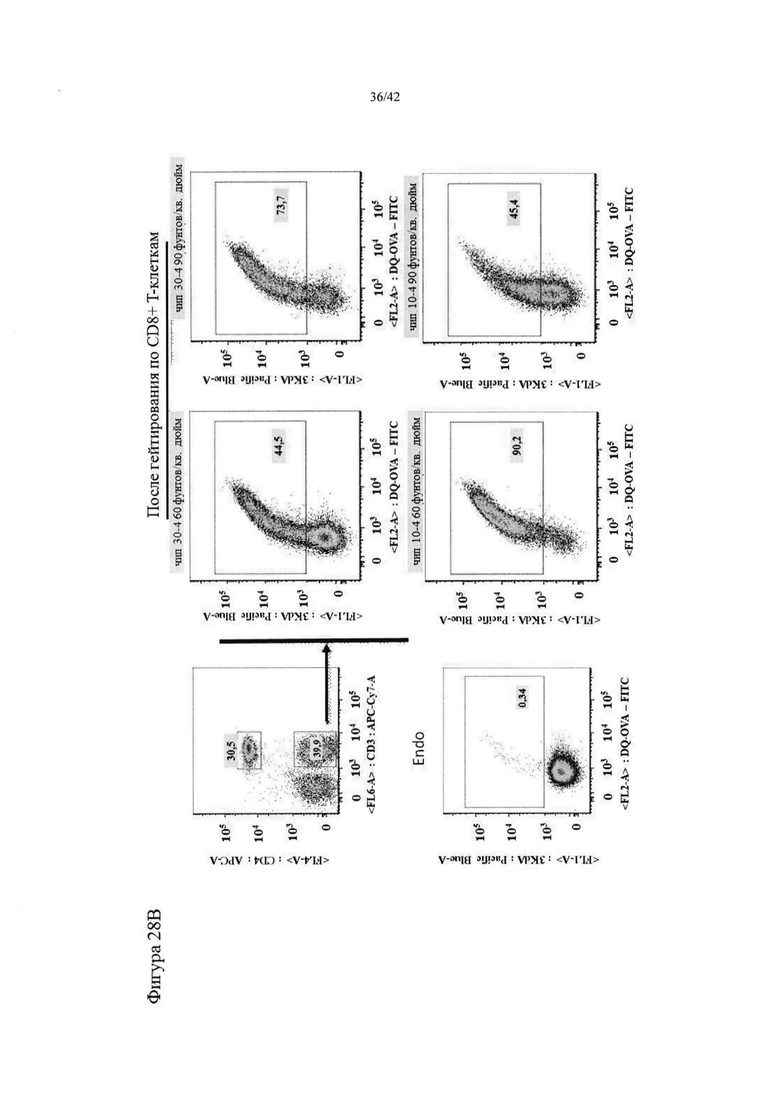
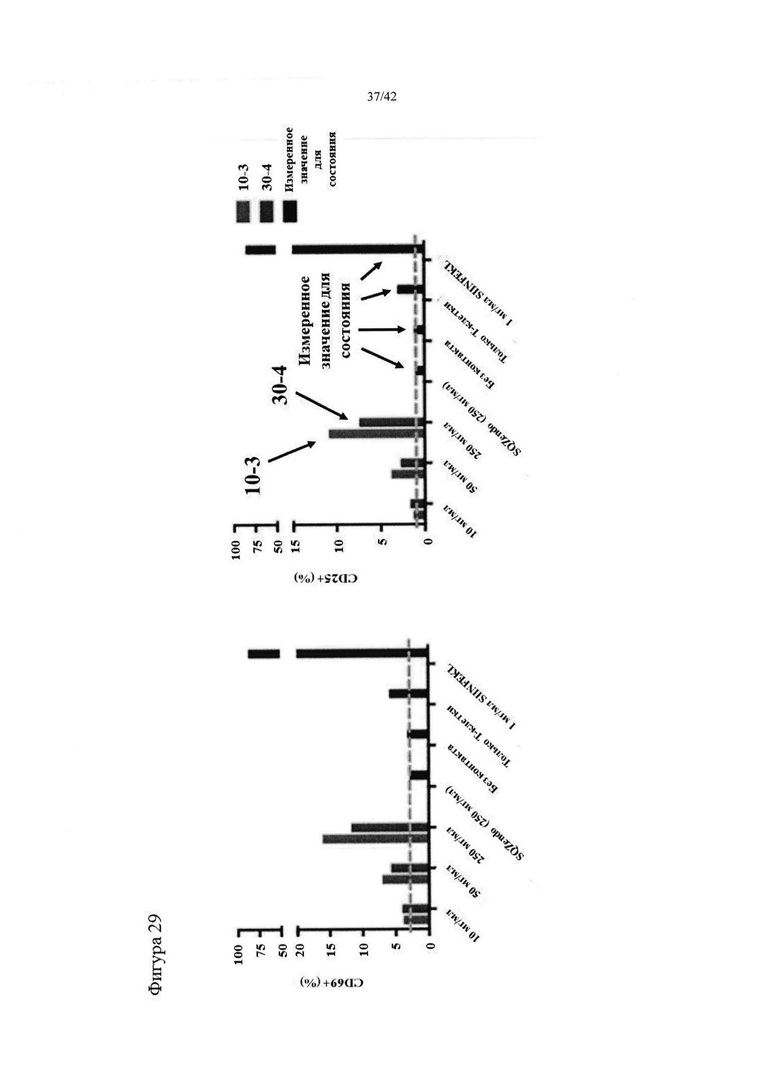
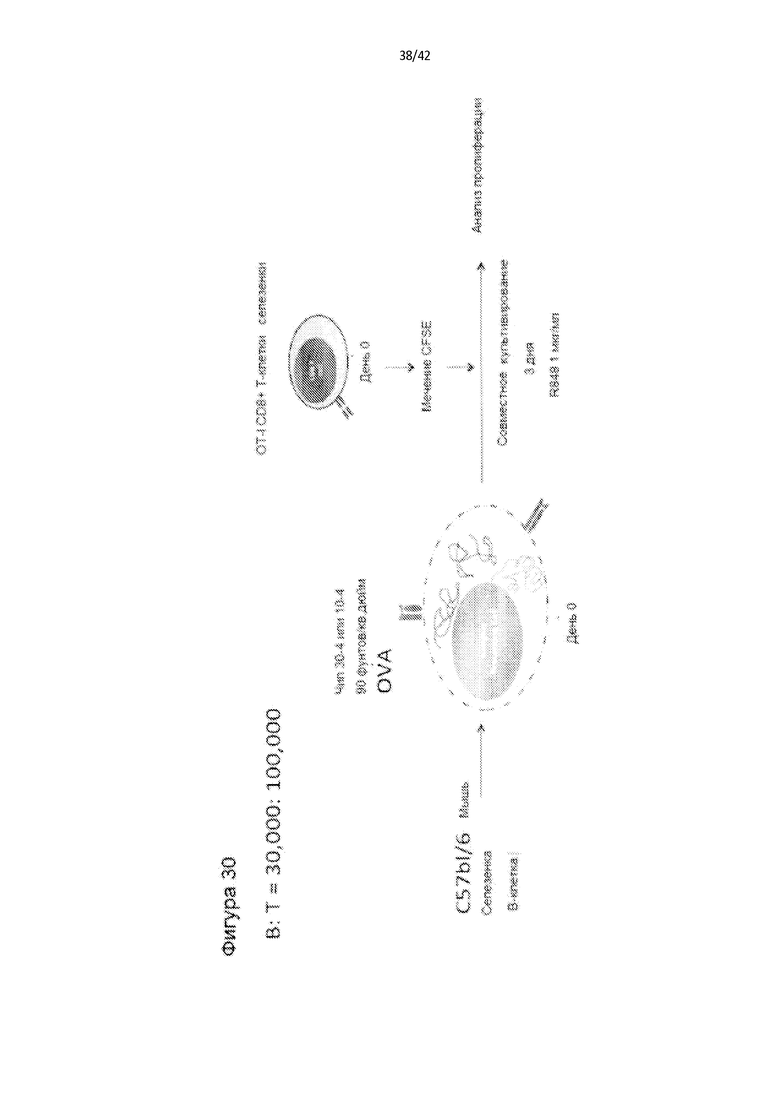
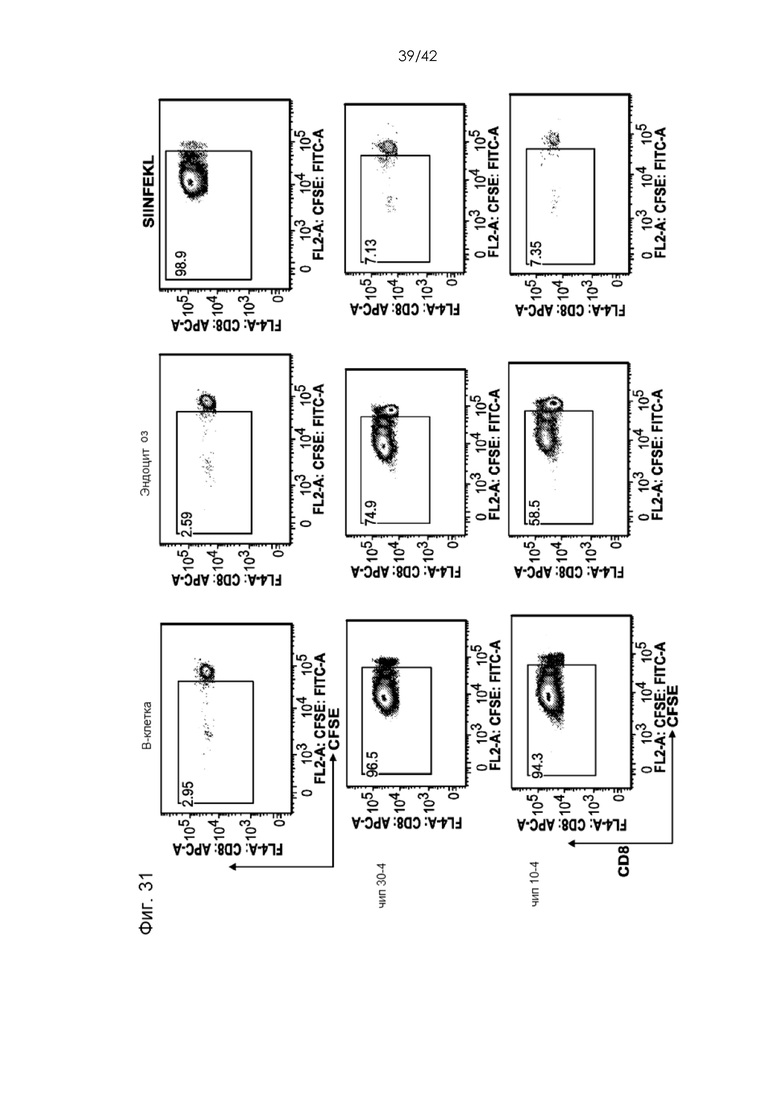
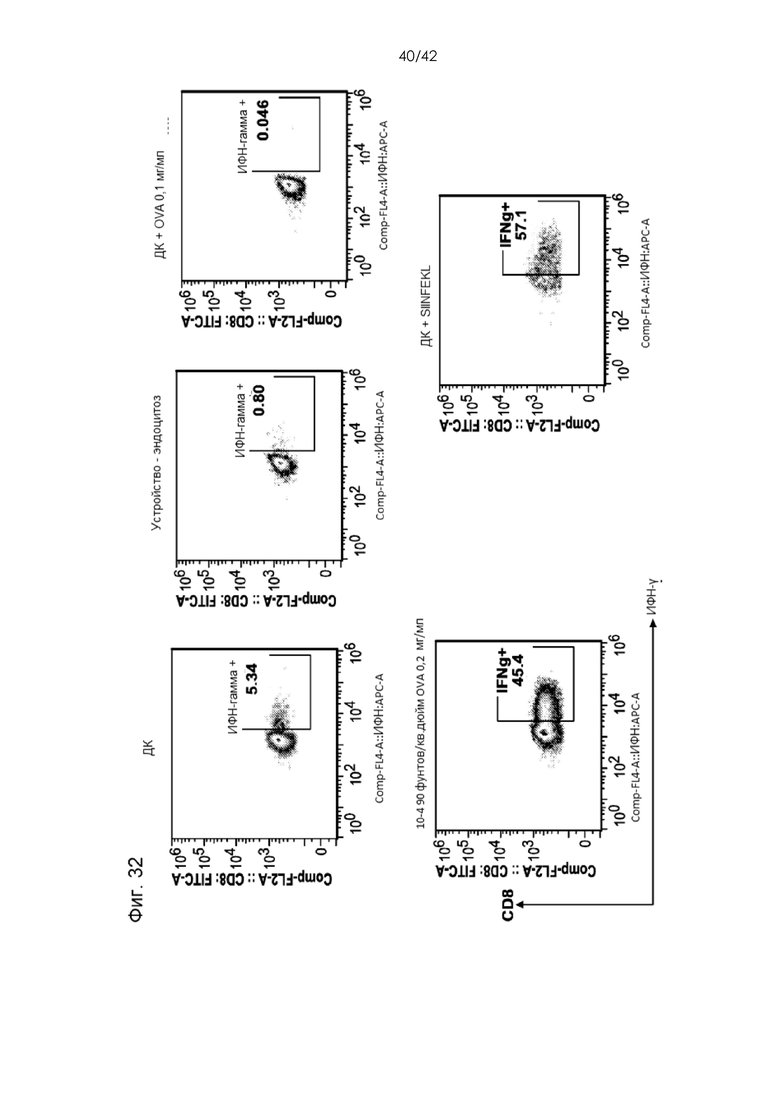

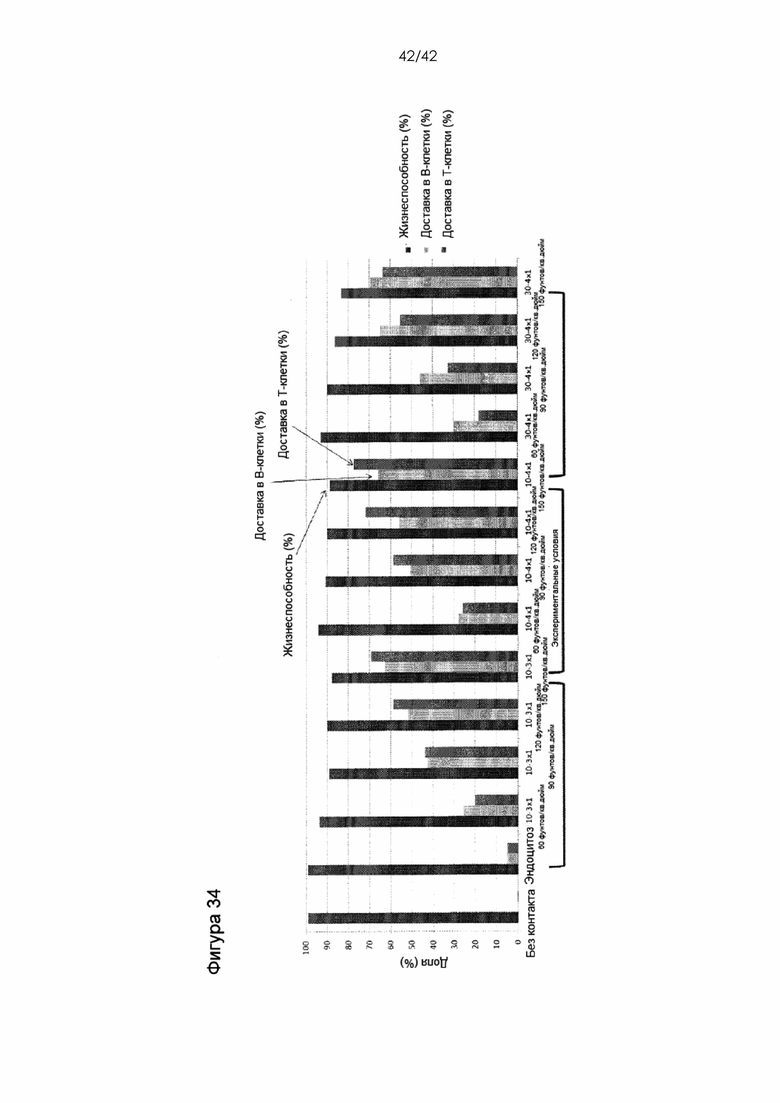
Настоящее изобретение относится к конструированию функции клетки иммунной системы, загруженным антигеном Т-клеткам для лечения заболевания, ассоциированного с вирусами, применению указанных клеток для активации цитотоксического Т-клеточного ответа и хелперного Т-клеточного ответа, индукции толерогенного Т-клеточного ответа, а также лечению пациента, страдающего заболеванием, ассоциированным с вирусами. Способ включает внутриклеточную доставку соединений путем временного повреждения мембраны, окружающей цитоплазму указанной клетки иммунной системы, и доставку соединения в цитозоль, причем указанное соединение содержит одно или более из антигена рака печени, антигена рака легких, антигена рака мочевого пузыря, антигена рака молочной железы, антигена рака толстой кишки, антигена рака прямой кишки, антигена рака эндометрия, антигена рака почек, антигена лейкоза, антигена меланомы, антигена неходжкинской лимфомы, антигена рака поджелудочной железы, антигена рака предстательной железы, антигена рака щитовидной железы, антигена рака яичников или антигена рака матки; или антигена вируса, антигена бактерии, аутоантигена или антигена гриба; или химерного рецептора антигена или нуклеиновой кислоты, кодирующей химерный рецептор антигена; или толерогенного фактора; или адъюванта; или нуклеиновой кислоты, представляющей собой плазмиду или транспозон; или нуклеиновой кислоты, кодирующей MHC-комплекс; или белка или пептида, где белок или пептид содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу, рекомбиназу CRE или фактор транскрипции; или вируса или вирусоподобной частицы. Затем осуществляют введение полученных указанным образом клеток пациенту. 28 н. и 202 з.п. ф-лы, 3 табл., 34 ил.
1. Способ конструирования функции клетки иммунной системы, включающий внутриклеточную доставку соединений путем временного повреждения мембраны, окружающей цитоплазму указанной клетки иммунной системы, и доставку соединения в цитозоль, причем указанное соединение содержит одно или более из:
a) антигена рака печени, антигена рака легких, антигена рака мочевого пузыря, антигена рака молочной железы, антигена рака толстой кишки, антигена рака прямой кишки, антигена рака эндометрия, антигена рака почек, антигена лейкоза, антигена меланомы, антигена неходжкинской лимфомы, антигена рака поджелудочной железы, антигена рака предстательной железы, антигена рака щитовидной железы, антигена рака яичников или антигена рака матки; или
b) антигена вируса, антигена бактерии, аутоантигена или антигена гриба; или
c) химерного рецептора антигена или нуклеиновой кислоты, кодирующей химерный рецептор антигена; или
d) толерогенного фактора; или
e) адъюванта; или
f) нуклеиновой кислоты, представляющей собой плазмиду или транспозон; или
g) нуклеиновой кислоты, кодирующей MHC-комплекс; или
h) белка или пептида, где белок или пептид содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу, рекомбиназу CRE или фактор транскрипции; или
i) вируса или вирусоподобной частицы.
2. Способ по п. 1, отличающийся тем, что:
a) указанное соединение содержит антиген вируса, причем антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или
b) указанное соединение содержит химерный рецептор антигена или нуклеиновую кислоту, кодирующую химерный рецептор антигена, причем химерный рецептор антигена представляет собой химерный Т-клеточный рецептор.
3. Способ по п. 1 или 2, отличающийся тем, что он дополнительно включает доставку дополнительного соединения, содержащего:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном; или
d) нуклеиновую кислоту; или
e) белок или пептид.
4. Способ по п. 3, отличающийся тем, что указанное дополнительное соединение содержит нуклеиновую кислоту, причем указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, маРНК или кшРНК.
5. Способ по любому из пп. 1-4, отличающийся тем, что указанное соединение содержит один или более антигенов, определенных в п. 1(a) или 1(b), и тем, что указанное соединение содержит:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли, антиген вируса, антиген бактерии, аутоантиген или антиген гриба; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанное соединение содержит антиген, причем указанный антиген содержит белок или пептид длиной, составляющей более 7, 8, 9 или 10 аминокислот, при этом указанная клетка иммунной системы процессирует указанный антиген и представляет процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, на поверхности указанной клетки иммунной системы.
7. Способ по любому из пп. 1-5, отличающийся тем, что указанную мембрану повреждают путем пропускания указанной клетки иммунной системы через сужение, имеющее диаметр от 2 мкм до 10 мкм.
8. Способ по любому из пп. 1-6, отличающийся тем, что указанный антиген содержит полноразмерный непроцессированный белок.
9. Способ по любому из пп. 1-5, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию цитотоксического Т-клеточного иммунного ответа.
10. Способ по любому из пп. 1-5, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию хелперного Т-клеточного иммунного ответа.
11. Способ по любому из пп. 1-5, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию толерогенного Т-клеточного иммунного ответа.
12. Способ по п. 1, отличающийся тем, что указанная клетка иммунной системы представляет собой В-клетку, NK-клетку, моноцит, нейтрофил, гранулоцит, дендритную клетку или макрофаг.
13. Способ по любому из пп. 1-5, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку.
14. Способ по любому из пп. 7-11 и 13, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает придание антиген-презентирующего фенотипа Т-клетке и включает доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом после пропускания через указанное микрожидкостное устройство указанная Т-клетка содержит процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, и/или процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II, на поверхности указанной клетки иммунной системы.
15. Способ по п. 14, отличающийся тем, что указанный антиген включает антиген опухоли или антиген вируса.
16. Способ по п. 14, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном гистосовместимости класса I.
17. Способ по п. 14, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом хелперной Т-клетки, ограниченным антигеном комплекса гистосовместимости класса II.
18. Способ по любому из пп. 1-6 и 14, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с толерогеном.
19. Способ по п. 18, отличающийся тем, что указанный толероген представляет собой лимфопоэтин стромы тимуса, дексаметазон, витамин D, ретиноевую кислоту, рапамицин, аспирин, трансформирующий ростовой фактор-бета, интерлейкин-10 или вазоактивный интестинальный пептид.
20. Способ по любому из пп. 1-6, 14, 16 и 17, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с адъювантом.
21. Способ по п. 20, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным адъювантом после пропускания указанной иммунной клетки через указанное микрожидкостное устройство.
22. Способ по п. 20, отличающийся тем, что указанный адъювант включает лиганд или агонист toll-подобного рецептора, агонист NOD-подобного рецептора, агонист RIG-I-подобных рецепторов, агонист рецепторов лектина С-типа или гидроксид алюминия.
23. Способ по п. 20, отличающийся тем, что указанный адъювант включает CpG-олигодезоксинуклеотид, R848, липополисахарид (LPS), rhIL-2, антитело против CD40 или CD4OL, ИЛ-12 и/или дициклические нуклеотиды.
24. Способ по любому из пп. 1-23, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным соединением до, одновременно или после пропускания через указанное микрожидкостное устройство.
25. Способ по любому из пп. 1-23, отличающийся тем, что указанная клетка иммунной системы после пропускания через указанное устройство содержит по меньшей мере в 1,1 раза, в 1,25 раз, в 1,5 раза, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, или более чем в 50 раз увеличенное количество указанного соединения по сравнению с клеткой иммунной системы, которую приводили в контакт с указанным соединением без пропускания через указанное устройство.
26. Способ по любому из пп. 1-23, отличающийся тем, что указанная клетка иммунной системы входит в состав суспензии клеток, содержащей цельную кровь, при этом клетку иммунной системы пропускают через микрожидкостное устройство.
27. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит клетки лейкотромбоцитарного слоя.
28. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит смешанную популяцию клеток.
29. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит очищенную популяцию клеток.
30. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит клетки млекопитающих.
31. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит клетки человека, мыши, собаки, кошки, лошади, обезьяны или крысы.
32. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит клетки, не являющиеся клетками млекопитающих.
33. Способ по любому из пп. 1-23, отличающийся тем, что указанная суспензия клеток содержит клетки курицы, лягушки, насекомого или нематоды.
34. Способ по любому из пп. 1-23, отличающийся тем, что указанное микрожидкостное устройство содержит сужение, имеющее длину 30 мкм и ширину 4 мкм.
35. Способ по любому из пп. 1-23, отличающийся тем, что указанный способ выполняют при температуре от 0°C до 45°C.
36. Способ конструирования функции клетки иммунной системы, включающий внутриклеточную доставку соединений путем временного повреждения мембраны, окружающей цитоплазму указанной клетки иммунной системы, и доставку соединения в цитозоль, причем указанное соединение содержит одно или более из:
a) антигена, ассоциированного с заболеванием; или
b) антигена опухоли, антигена вируса, антигена бактерии, аутоантигена или антигена гриба; или
c) антигена рака печени, антигена рака легких, антигена рака мочевого пузыря, антигена рака молочной железы, антигена рака толстой кишки, антигена рака прямой кишки, антигена рака эндометрия, антигена рака почек, антигена лейкоза, антигена меланомы, антигена неходжкинской лимфомы, антигена рака поджелудочной железы, антигена рака предстательной железы, антигена рака щитовидной железы, антигена рака яичников или антигена рака матки; или
d) лизата опухолевых клеток или клеточного лизата ткани, инфицированной патогеном; или
e) химерного рецептора антигена или нуклеиновой кислоты, кодирующей химерный рецептор антигена; или
f) толерогенного фактора; или
g) адъюванта; или
h) нуклеиновой кислоты, представляющей собой плазмиду или транспозон; или
i) нуклеиновой кислоты, кодирующей MHC-комплекс; или
j) белка или пептида, где белок или пептид содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу, рекомбиназу CRE или фактор транскрипции; или
k) вируса или вирусоподобной частицы;
причем указанная клетка иммунной системы представляет собой В-клетку, Т-клетку, NK-клетку, моноцит, макрофаг, нейтрофил, гранулоцит, врожденную лимфоидную клетку, базофил, эозинофил или тучную клетку.
37. Способ по п. 36, отличающийся тем, что:
a) указанное соединение содержит антиген вируса, причем антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или
b) указанное соединение содержит химерный рецептор антигена или нуклеиновую кислоту, кодирующую химерный рецептор антигена, причем химерный рецептор антигена представляет собой химерный Т-клеточный рецептор.
38. Способ по п. 36 или 37, отличающийся тем, что он дополнительно включает доставку дополнительного соединения, содержащего:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном; или
d) нуклеиновую кислоту; или
e) белок или пептид.
39. Способ по п. 38, отличающийся тем, что указанное дополнительное соединение содержит нуклеиновую кислоту, причем указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, маРНК или кшРНК.
40. Способ по любому из пп. 36-39, отличающийся тем, что указанное соединение содержит один или более антигенов, определенных в п. 36(a) или 36(b), и тем, что указанное соединение содержит:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли, антиген вируса, антиген бактерии, аутоантиген или антиген гриба; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном.
41. Способ по любому из пп. 36-40, отличающийся тем, что указанное соединение содержит антиген, причем указанный антиген содержит белок или пептид длиной, составляющей более 7, 8, 9 или 10 аминокислот, при этом указанная клетка иммунной системы процессирует указанный антиген и представляет процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, на поверхности указанной клетки иммунной системы.
42. Способ по любому из пп. 36-40, отличающийся тем, что указанную мембрану повреждают путем пропускания указанной клетки иммунной системы через сужение, имеющее диаметр от 2 мкм до 10 мкм.
43. Способ по любому из пп. 36-41, отличающийся тем, что указанный антиген содержит полноразмерный непроцессированный белок.
44. Способ по любому из пп. 36-40, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию цитотоксического Т-клеточного иммунного ответа.
45. Способ по любому из пп. 36-40, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию хелперного Т-клеточного иммунного ответа.
46. Способ по любому из пп. 36-40, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию толерогенного Т-клеточного иммунного ответа.
47. Способ по любому из пп. 36-40, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку.
48. Способ по любому из пп. 42-47, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает придание антиген-презентирующего фенотипа Т-клетке и включает доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом после пропускания через указанное микрожидкостное устройство указанная Т-клетка содержит процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, и/или процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II, на поверхности указанной клетки иммунной системы.
49. Способ по п. 48, отличающийся тем, что указанный антиген включает антиген опухоли или антиген вируса.
50. Способ по п. 48, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном гистосовместимости класса I.
51. Способ по п. 48, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом хелперной Т-клетки, ограниченным антигеном комплекса гистосовместимости класса II.
52. Способ по любому из пп. 36-41 и 48, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с толерогеном.
53. Способ по п. 52, отличающийся тем, что указанный толероген представляет собой лимфопоэтин стромы тимуса, дексаметазон, витамин D, ретиноевую кислоту, рапамицин, аспирин, трансформирующий ростовой фактор-бета, интерлейкин-10 или вазоактивный интестинальный пептид.
54. Способ по любому из пп. 36-41, 48, 50 и 51, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с адъювантом.
55. Способ по п. 54, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным адъювантом после пропускания указанной иммунной клетки через указанное микрожидкостное устройство.
56. Способ по п. 54, отличающийся тем, что указанный адъювант включает лиганд или агонист toll-подобного рецептора, агонист NOD-подобного рецептора, агонист RIG-I-подобных рецепторов, агонист рецепторов лектина С-типа или гидроксид алюминия.
57. Способ по п. 54, отличающийся тем, что указанный адъювант включает CpG-олигодезоксинуклеотид, R848, липополисахарид (LPS), rhIL-2, антитело против CD40 или CD4OL, ИЛ-12 и/или дициклические нуклеотиды.
58. Способ по любому из пп. 36-57, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным соединением до, одновременно или после пропускания через указанное микрожидкостное устройство.
59. Способ по любому из пп. 36-57, отличающийся тем, что указанная клетка иммунной системы после пропускания через указанное устройство содержит по меньшей мере в 1,1 раза, в 1,25 раз, в 1,5 раза, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, или более чем в 50 раз увеличенное количество указанного соединения по сравнению с клеткой иммунной системы, которую приводили в контакт с указанным соединением без пропускания через указанное устройство.
60. Способ по любому из пп. 36-57, отличающийся тем, что указанная клетка иммунной системы входит в состав суспензии клеток, содержащей цельную кровь, при этом клетку иммунной системы пропускают через микрожидкостное устройство.
61. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит клетки лейкотромбоцитарного слоя.
62. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит смешанную популяцию клеток.
63. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит очищенную популяцию клеток.
64. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит клетки млекопитающих.
65. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит клетки человека, мыши, собаки, кошки, лошади, обезьяны или крысы.
66. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит клетки, не являющиеся клетками млекопитающих.
67. Способ по любому из пп. 36-57, отличающийся тем, что указанная суспензия клеток содержит клетки курицы, лягушки, насекомого или нематоды.
68. Способ по любому из пп. 36-57, отличающийся тем, что указанное микрожидкостное устройство содержит сужение, имеющее длину 30 мкм и ширину 4 мкм.
69. Способ по любому из пп. 36-57, отличающийся тем, что указанный способ выполняют при температуре от 0°C до 45°C.
70. Загруженная антигеном Т-клетка для лечения заболевания, ассоциированного с вирусами, подвергнутая сдавливанию, полученная способом по п. 14, где антиген представляет собой антиген вируса.
71. Загруженная антигеном Т-клетка, подвергнутая сдавливанию, по п. 70, где антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ.
72. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 70 для активации цитотоксического Т-клеточного ответа, специфичного по отношению к указанному антигену.
73. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 70 для активации хелперного Т-клеточного ответа, специфичного по отношению к указанному антигену.
74. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 70 для индукции толерогенного Т-клеточного ответа, специфичного по отношению к указанному антигену.
75. Загруженная антигеном Т-клетка для лечения заболевания, ассоциированного с вирусами, подвергнутая сдавливанию, полученная способом по п. 48, где антиген представляет собой антиген вируса.
76. Загруженная антигеном Т-клетка, подвергнутая сдавливанию, по п. 75, где антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ.
77. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 75 для активации цитотоксического Т-клеточного ответа, специфичного по отношению к указанному антигену.
78. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 75 для активации хелперного Т-клеточного ответа, специфичного по отношению к указанному антигену.
79. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 75 для индукции толерогенного Т-клеточного ответа, специфичного по отношению к указанному антигену.
80. Способ лечения пациента, страдающего заболеванием, ассоциированным с вирусами, путем введения клеток иммунной системы, сконструированных согласно любому из пп. 1-6, 14 и 16-35, указанному пациенту, где антиген представляет собой антиген вируса.
81. Способ по п. 80, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммунотерапии.
82. Способ по п. 80, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммуносупрессивной терапии.
83. Способ по п. 80, дополнительно включающий введение ингибитора контрольной точки иммунного ответа указанному пациенту.
84. Способ по п. 80, отличающийся тем, что указанные иммунные клетки выделяют из организма указанного пациента.
85. Способ по любому из пп. 80-84, отличающийся тем, что антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или заболевание, ассоциированное с вирусами, представляет собой вирусную инфекцию или рак, ассоциированный с вирусами.
86. Способ лечения пациента, страдающего заболеванием, ассоциированным с вирусами, путем введения клеток иммунной системы, сконструированных согласно любому из пп. 36-41, 48 и 50-69, указанному пациенту, где антиген представляет собой антиген вируса.
87. Способ по п. 86, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммунотерапии.
88. Способ по п. 86, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммуносупрессивной терапии.
89. Способ по п. 86, дополнительно включающий введение ингибитора контрольной точки иммунного ответа указанному пациенту.
90. Способ по п. 86, отличающийся тем, что указанные клетки иммунной системы выделяют из организма указанного пациента.
91. Способ по любому из пп. 86-90, отличающийся тем, что антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или заболевание, ассоциированное с вирусами, представляет собой вирусную инфекцию или рак, ассоциированный с вирусами.
92. Применение клеток иммунной системы, сконструированных в соответствии с любым из пп. 1-6, 14 и 16-35, для скрининга антигенов для разработки вакцин.
93. Применение клеток иммунной системы, сконструированных в соответствии с любым из пп. 36-41, 48 и 50-69, для скрининга антигенов для разработки вакцин.
94. Способ конструирования функции клетки иммунной системы, включающий внутриклеточную доставку соединения путем пропускания клетки иммунной системы через микрожидкостное устройство, содержащее сужение, и приведение в контакт указанной клетки иммунной системы с указанным соединением, причем указанное соединение содержит одно или более из:
a) антигена рака печени, антигена рака легких, антигена рака мочевого пузыря, антигена рака молочной железы, антигена рака толстой кишки, антигена рака прямой кишки, антигена рака эндометрия, антигена рака почек, антигена лейкоза, антигена меланомы, антигена неходжкинской лимфомы, антигена рака поджелудочной железы, антигена рака предстательной железы, антигена рака щитовидной железы, антигена рака яичников или антигена рака матки; или
b) антигена вируса, антигена бактерии, аутоантигена или антигена гриба; или
c) химерного рецептора антигена или нуклеиновой кислоты, кодирующей химерный рецептор антигена; или
d) толерогенного фактора; или
e) адъюванта; или
f) нуклеиновой кислоты, представляющей собой плазмиду или транспозон; или
g) нуклеиновой кислоты, кодирующей MHC-комплекс; или
h) белка или пептида, где белок или пептид содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу, рекомбиназу CRE или фактор транскрипции; или
i) вируса или вирусоподобной частицы.
95. Способ по п. 94, отличающийся тем, что:
a) указанное соединение содержит антиген вируса, причем антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или
b) указанное соединение содержит химерный рецептор антигена или нуклеиновую кислоту, кодирующую химерный рецептор антигена, причем химерный рецептор антигена представляет собой химерный Т-клеточный рецептор.
96. Способ по п. 94 или 95, отличающийся тем, что он дополнительно включает доставку дополнительного соединения, содержащего:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном; или
d) нуклеиновую кислоту; или
e) белок или пептид.
97. Способ по п. 96, отличающийся тем, что указанное дополнительное соединение содержит нуклеиновую кислоту, причем указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, маРНК или кшРНК.
98. Способ по любому из пп. 94-97, отличающийся тем, что указанное соединение содержит один или более антигенов, определенных в п. 94(a) или 94(b), и тем, что указанное соединение содержит:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли, антиген вируса, антиген бактерии, аутоантиген или антиген гриба; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном.
99. Способ по любому из пп. 94-98, отличающийся тем, что указанное соединение содержит антиген, и при этом указанная клетка иммунной системы процессирует указанный антиген и представляет указанный антиген на поверхности указанной клетки иммунной системы.
100. Способ по п. 99, отличающийся тем, что указанная клетка иммунной системы представляет на поверхности указанной клетки иммунной системы процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I.
101. Способ по п. 99, отличающийся тем, что указанная клетка иммунной системы представляет на поверхности указанной клетки иммунной системы процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II.
102. Способ по любому из пп. 94-98, отличающийся тем, что указанное соединение содержит фактор дифференцировки.
103. Способ по любому из пп. 94-102, отличающийся тем, что указанную мембрану повреждают путем пропускания указанной клетки иммунной системы через сужение, имеющее диаметр от 2 до 10 мкм.
104. Способ по любому из пп. 99-101, отличающийся тем, что указанный антиген содержит полноразмерный непроцессированный белок.
105. Способ по любому из пп. 94-100, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию цитотоксического Т-клеточного иммунного ответа.
106. Способ по любому из пп. 94-99 и 101, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию хелперного Т-клеточного иммунного ответа.
107. Способ по любому из пп. 94-102, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию толерогенного Т-клеточного иммунного ответа.
108. Способ по любому из пп. 94-102, отличающийся тем, что указанная клетка иммунной системы представляет собой В-клетку, NK-клетку, моноцит, нейтрофил, гранулоцит, дендритную клетку или макрофаг.
109. Способ по любому из пп. 94-102, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку.
110. Способ по любому из пп. 94-100, 103-107 и 109, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает придание антиген-презентирующего фенотипа Т-клетке и включает доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом после пропускания через указанное микрожидкостное устройство указанная Т-клетка содержит процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, и/или процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II, на поверхности указанной клетки иммунной системы.
111. Способ по п. 110, отличающийся тем, что указанный антиген включает антиген опухоли или антиген вируса.
112. Способ по п. 110, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном гистосовместимости класса I.
113. Способ по п. 110, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом хелперной Т-клетки, ограниченным антигеном комплекса гистосовместимости класса II.
114. Способ по любому из пп. 94-102 и 110, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с толерогеном.
115. Способ по п. 114, отличающийся тем, что указанный толероген представляет собой лимфопоэтин стромы тимуса, дексаметазон, витамин D, ретиноевую кислоту, рапамицин, аспирин, трансформирующий ростовой фактор-бета, интерлейкин-10 или вазоактивный интестинальный пептид.
116. Способ по любому из пп. 94-102, 110, 112 и 113, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с адъювантом.
117. Способ по п. 116, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным адъювантом после пропускания указанной иммунной клетки через указанное микрожидкостное устройство.
118. Способ по п. 116, отличающийся тем, что указанный адъювант включает лиганд или агонист toll-подобного рецептора, агонист NOD-подобного рецептора, агонист RIG-I-подобных рецепторов, агонист рецепторов лектина С-типа или гидроксид алюминия.
119. Способ по п. 116, отличающийся тем, что указанный адъювант включает CpG-олигодезоксинуклеотид, R848, липополисахарид (LPS), rhIL-2, антитело против CD40 или CD4OL, ИЛ-12 и/или дициклические нуклеотиды.
120. Способ по любому из пп. 94-98 и 109, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ включает доставку соединения в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанное соединение стимулирует экспрессию хомингового фенотипа у указанной клетки иммунной системы.
121. Способ по п. 120, отличающийся тем, что указанное соединение содержит нуклеиновую кислоту.
122. Способ по п. 121, отличающийся тем, что указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, саРНК или кшРНК.
123. Способ по п. 121, отличающийся тем, что указанная нуклеиновая кислота представляет собой плазмиду.
124. Способ по п. 120, отличающийся тем, что указанное соединение содержит белок или пептид.
125. Способ по п. 124, отличающийся тем, что указанный белок содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу или рекомбиназу CRE.
126. Способ по п. 125, отличающийся тем, что указанный белок представляет собой фактор транскрипции.
127. Способ по п. 120, отличающийся тем, что указанное соединение содержит химерный рецептор антигена.
128. Способ по п. 127, отличающийся тем, что указанный химерный рецептор антигена представляет собой химерный Т-клеточный рецептор.
129. Способ по п. 121, отличающийся тем, что указанная нуклеиновая кислота кодирует химерный рецептор антигена.
130. Способ по п. 121, отличающийся тем, что указанная нуклеиновая кислота кодирует рекомбинантный Т-клеточный рецептор.
131. Способ по любому из пп. 94-98 и 109, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ включает доставку соединения в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанное соединение индуцирует дифференцировку клетки иммунной системы в клетку с толерогенным фенотипом.
132. Способ по п. 131, отличающийся тем, что указанное соединение содержит нуклеиновую кислоту.
133. Способ по п. 132, отличающийся тем, что указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, саРНК или кшРНК.
134. Способ по п. 132, отличающийся тем, что указанная нуклеиновая кислота представляет собой плазмиду.
135. Способ по п. 131, отличающийся тем, что указанное соединение содержит белок или пептид.
136. Способ по п. 135, отличающийся тем, что указанный белок содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу или рекомбиназу CRE.
137. Способ по п. 135, отличающийся тем, что указанный белок представляет собой фактор транскрипции.
138. Способ по любому из пп. 94-98 и 109, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает получение клетки иммунной системы-камикадзе из Т-клетки и включает доставку самоамплифицирующейся РНК в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанная самоамплифицирующаяся РНК обеспечивает непрерывную продукцию кодируемого белка.
139. Способ по любому из пп. 120-138, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным соединением до, одновременно, или после пропускания через указанное микрожидкостное устройство.
140. Способ по любому из пп. 120-138, отличающийся тем, что указанная клетка иммунной системы после пропускания через указанное устройство содержит по меньшей мере в 1,1 раза, в 1,25 раза, в 1,5 раза, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, или более чем в 50 раз увеличенное количество указанного соединения по сравнению с клеткой иммунной системы, которую приводили в контакт с указанным соединением без пропускания через указанное устройство.
141. Способ по любому из пп. 120-138, отличающийся тем, что указанная клетка иммунной системы входит в состав суспензии клеток, содержащей цельную кровь, при этом клетку иммунной системы пропускают через микрожидкостное устройство.
142. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит клетки лейкотромбоцитарного слоя.
143. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит смешанную популяцию клеток.
144. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит очищенную популяцию клеток.
145. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит клетки млекопитающих.
146. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит клетки человека, мыши, собаки, кошки, лошади, обезьяны или крысы.
147. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит клетки, не являющиеся клетками млекопитающих.
148. Способ по любому из пп. 120-138, отличающийся тем, что указанная суспензия клеток содержит клетки курицы, лягушки, насекомого или нематоды.
149. Способ по любому из пп. 120-138, отличающийся тем, что указанное микрожидкостное устройство содержит сужение, имеющее длину 30 мкм и ширину 4 мкм.
150. Способ по любому из пп. 120-138, отличающийся тем, что указанный способ выполняют при температуре от 0°C до 45°.
151. Способ конструирования функции клетки иммунной системы, включающий внутриклеточную доставку соединения путем пропускания клетки иммунной системы через микрожидкостное устройство, содержащее сужение, и приведение в контакт указанной клетки иммунной системы с указанным соединением, причем указанное соединение содержит одно или более из:
a) антигена, ассоциированного с заболеванием; или
b) антигена опухоли, антигена вируса, антигена бактерии, аутоантигена или антигена гриба; или
c) антигена рака печени, антигена рака легких, антигена рака мочевого пузыря, антигена рака молочной железы, антигена рака толстой кишки, антигена рака прямой кишки, антигена рака эндометрия, антигена рака почек, антигена лейкоза, антигена меланомы, антигена неходжкинской лимфомы, антигена рака поджелудочной железы, антигена рака предстательной железы, антигена рака щитовидной железы, антигена рака яичников или антигена рака матки; или
d) лизата опухолевых клеток или клеточного лизата ткани, инфицированной патогеном; или
e) химерного рецептора антигена или нуклеиновой кислоты, кодирующей химерный рецептор антигена; или
f) толерогенного фактора; или
g) адъюванта; или
h) нуклеиновой кислоты, представляющей собой плазмиду или транспозон; или
i) нуклеиновой кислоты, кодирующей MHC-комплекс; или
j) белка или пептида, где белок или пептид содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу, рекомбиназу CRE или фактор транскрипции; или
k) вируса или вирусоподобной частицы;
причем указанная клетка иммунной системы представляет собой В-клетку, Т-клетку, NK-клетку, моноцит, макрофаг, нейтрофил, гранулоцит, врожденную лимфоидную клетку, базофил, эозинофил или тучную клетку.
152. Способ по п. 151, отличающийся тем, что он дополнительно включает доставку дополнительного соединения, содержащего:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном; или
d) нуклеиновую кислоту; или
e) белок или пептид.
153. Способ по п. 152, отличающийся тем, что указанное дополнительное соединение содержит нуклеиновую кислоту, причем указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, маРНК или кшРНК.
154. Способ по любому из пп. 151-153, отличающийся тем, что указанное соединение содержит один или более антигенов, определенных в п. 151(a) или 151(b), и тем, что указанное соединение содержит:
a) антиген, ассоциированный с заболеванием; или
b) антиген опухоли, антиген вируса, антиген бактерии, аутоантиген или антиген гриба; или
c) лизат опухолевых клеток или клеточный лизат ткани, инфицированной патогеном.
155. Способ по любому из пп. 151-154, отличающийся тем, что указанное соединение содержит антиген, и при этом указанная клетка иммунной системы процессирует указанный антиген и представляет указанный антиген на поверхности указанной клетки иммунной системы.
156. Способ по п. 155, отличающийся тем, что указанная клетка иммунной системы представляет на поверхности указанной клетки иммунной системы процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I.
157. Способ по п. 155, отличающийся тем, что указанная клетка иммунной системы представляет на поверхности указанной клетки иммунной системы процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II.
158. Способ по любому из пп. 151-154, отличающийся тем, что указанное соединение содержит фактор дифференцировки.
159. Способ по любому из пп. 151-158, отличающийся тем, что указанную мембрану повреждают путем пропускания указанной клетки иммунной системы через сужение, имеющее диаметр от 2 до 10 мкм.
160. Способ по любому из пп. 155-157, отличающийся тем, что указанный антиген содержит полноразмерный непроцессированный белок.
161. Способ по любому из пп. 151-156, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию цитотоксического Т-клеточного иммунного ответа.
162. Способ по любому из пп. 151-155 и 157, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию хелперного Т-клеточного иммунного ответа.
163. Способ по любому из пп. 151-158, дополнительно включающий приведение в контакт указанной клетки иммунной системы с эффекторной Т-клеткой, и активацию толерогенного Т-клеточного иммунного ответа.
164. Способ по любому из пп. 151-158, отличающийся тем, что указанная клетка иммунной системы представляет собой В-клетку, NK-клетку, моноцит, нейтрофил, гранулоцит, дендритную клетку или макрофаг.
165. Способ по любому из пп. 151-158, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку.
166. Способ по любому из пп. 151-156, 159-163 и 165, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает придание антиген-презентирующего фенотипа Т-клетке и включает доставку полноразмерного непроцессированного антигена в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом после пропускания через указанное микрожидкостное устройство указанная Т-клетка содержит процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса I, и/или процессированную форму указанного антигена, ограниченную антигеном комплекса гистосовместимости класса II, на поверхности указанной клетки иммунной системы.
167. Способ по п. 166, отличающийся тем, что указанный антиген включает антиген опухоли или антиген вируса.
168. Способ по п. 166, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом цитотоксической Т-клетки, ограниченным антигеном гистосовместимости класса I.
169. Способ по п. 166, дополнительно включающий приведение в контакт указанной T-клетки со второй Т-клеткой, причем указанная вторая Т-клетка характеризуется фенотипом хелперной Т-клетки, ограниченным антигеном комплекса гистосовместимости класса II.
170. Способ по любому из пп. 151-158 и 166, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с толерогеном.
171. Способ по п. 170, отличающийся тем, что указанный толероген представляет собой лимфопоэтин стромы тимуса, дексаметазон, витамин D, ретиноевую кислоту, рапамицин, аспирин, трансформирующий ростовой фактор-бета, интерлейкин-10 или вазоактивный интестинальный пептид.
172. Способ по любому из пп. 151-158, 166, 168 и 169, отличающийся тем, что указанную клетку иммунной системы дополнительно приводят в контакт с адъювантом.
173. Способ по п. 172, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным адъювантом после пропускания указанной иммунной клетки через указанное микрожидкостное устройство.
174. Способ по п. 172, отличающийся тем, что указанный адъювант включает лиганд или агонист toll-подобного рецептора, агонист NOD-подобного рецептора, агонист RIG-I-подобных рецепторов, агонист рецепторов лектина С-типа или гидроксид алюминия.
175. Способ по п. 172, отличающийся тем, что указанный адъювант включает CpG-олигодезоксинуклеотид, R848, липополисахарид (LPS), rhIL-2, антитело против CD40 или CD4OL, ИЛ-12 и/или дициклические нуклеотиды.
176. Способ по любому из пп. 151-154 и 165, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ включает доставку соединения в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанное соединение стимулирует экспрессию хомингового фенотипа у указанной клетки иммунной системы.
177. Способ по п. 176, отличающийся тем, что указанное соединение содержит нуклеиновую кислоту.
178. Способ по п. 177, отличающийся тем, что указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, саРНК или кшРНК.
179. Способ по п. 177, отличающийся тем, что указанная нуклеиновая кислота представляет собой плазмиду.
180. Способ по п. 176, отличающийся тем, что указанное соединение содержит белок или пептид.
181. Способ по п. 180, отличающийся тем, что указанный белок содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу или рекомбиназу CRE.
182. Способ по п. 181, отличающийся тем, что указанный белок представляет собой фактор транскрипции.
183. Способ по п. 176, отличающийся тем, что указанное соединение содержит химерный рецептор антигена.
184. Способ по п. 183, отличающийся тем, что указанный химерный рецептор антигена представляет собой химерный Т-клеточный рецептор.
185. Способ по п. 177, отличающийся тем, что указанная нуклеиновая кислота кодирует химерный рецептор антигена.
186. Способ по п. 177, отличающийся тем, что указанная нуклеиновая кислота кодирует рекомбинантный Т-клеточный рецептор.
187. Способ по любому из пп. 151-154 и 165, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ включает доставку соединения в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанное соединение индуцирует дифференцировку клетки иммунной системы в клетку с толерогенным фенотипом.
188. Способ по п. 187, отличающийся тем, что указанное соединение содержит нуклеиновую кислоту.
189. Способ по п. 188, отличающийся тем, что указанная нуклеиновая кислота представляет собой или кодирует миРНК, мРНК, микроРНК, днРНК, тРНК, саРНК или кшРНК.
190. Способ по п. 188, отличающийся тем, что указанная нуклеиновая кислота представляет собой плазмиду.
191. Способ по п. 187, отличающийся тем, что указанное соединение содержит белок или пептид.
192. Способ по п. 191, отличающийся тем, что указанный белок содержит белок TALEN, нуклеазу с доменом «цинкового пальца», мегануклеазу или рекомбиназу CRE.
193. Способ по п. 191, отличающийся тем, что указанный белок представляет собой фактор транскрипции.
194. Способ по любому из пп. 151-154 и 165, отличающийся тем, что указанная клетка иммунной системы представляет собой Т-клетку, при этом способ предусматривает получение клетки иммунной системы-камикадзе из Т-клетки и включает доставку самоамплифицирующейся РНК в цитозоль Т-клетки путем пропускания указанной Т-клетки через микрожидкостное устройство, причем указанное микрожидкостное устройство содержит сужение, имеющее диаметр от 2 мкм до 10 мкм, и при этом указанная самоамплифицирующаяся РНК обеспечивает непрерывную продукцию кодируемого белка.
195. Способ по любому из пп. 176-194, отличающийся тем, что указанную клетку иммунной системы приводят в контакт с указанным соединением до, одновременно или после пропускания через указанное микрожидкостное устройство.
196. Способ по любому из пп. 176-194, отличающийся тем, что указанная клетка иммунной системы после пропускания через указанное устройство содержит по меньшей мере в 1,1 раза, в 1,25 раза, в 1,5 раза, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 25 раз, или более чем в 50 раз увеличенное количество указанного соединения по сравнению с клеткой иммунной системы, которую приводили в контакт с указанным соединением без пропускания через указанное устройство.
197. Способ по любому из пп. 176-194, отличающийся тем, что указанная клетка иммунной системы входит в состав суспензии клеток, содержащей цельную кровь, при этом клетку иммунной системы пропускают через микрожидкостное устройство.
198. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит клетки лейкотромбоцитарного слоя.
199. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит смешанную популяцию клеток.
200. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит очищенную популяцию клеток.
201. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит клетки млекопитающих.
202. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит клетки человека, мыши, собаки, кошки, лошади, обезьяны или крысы.
203. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит клетки, не являющиеся клетками млекопитающих.
204. Способ по любому из пп. 176-194, отличающийся тем, что указанная суспензия клеток содержит клетки курицы, лягушки, насекомого или нематоды.
205. Способ по любому из пп. 176-194, отличающийся тем, что указанное микрожидкостное устройство содержит сужение, имеющее длину 30 мкм и ширину 4 мкм.
206. Способ по любому из пп. 176-194, отличающийся тем, что указанный способ выполняют при температуре от 0°C до 45°.
207. Загруженная антигеном Т-клетка для лечения заболевания, ассоциированного с вирусами, подвергнутая сдавливанию, полученная способом по п. 110, где антиген представляет собой антиген вируса.
208. Загруженная антигеном Т-клетка, подвергнутая сдавливанию, по п. 207, где антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ.
209. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 207 для активации цитотоксического Т-клеточного ответа, специфичного по отношению к указанному антигену.
210. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 207 для активации хелперного Т-клеточного ответа, специфичного по отношению к указанному антигену.
211. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 207 для индукции толерогенного Т-клеточного ответа, специфичного по отношению к указанному антигену.
212. Загруженная антигеном Т-клетка для лечения заболевания, ассоциированного с вирусами, подвергнутая сдавливанию, полученная способом по п. 166, где антиген представляет собой антиген вируса.
213. Загруженная антигеном Т-клетка, подвергнутая сдавливанию, по п. 212, где антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ.
214. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 212 для активации цитотоксического Т-клеточного ответа, специфичного по отношению к указанному антигену.
215. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 212 для активации хелперного Т-клеточного ответа, специфичного по отношению к указанному антигену.
216. Применение загруженной антигеном Т-клетки, подвергнутой сдавливанию, по п. 212 для индукции толерогенного Т-клеточного ответа, специфичного по отношению к указанному антигену.
217. Способ лечения пациента, страдающего заболеванием, ассоциированным с вирусами, путем введения клеток иммунной системы, сконструированных согласно любому из пп. 94-102, 110 и 112-150, указанному пациенту, где антиген представляет собой антиген вируса.
218. Способ по п. 217, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммунотерапии.
219. Способ по п. 217, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммуносупрессивной терапии.
220. Способ по п. 217, дополнительно включающий введение ингибитора контрольной точки иммунного ответа указанному пациенту.
221. Способ по п. 217, отличающийся тем, что указанные иммунные клетки выделяют из организма указанного пациента.
222. Способ по любому из пп. 217-221, отличающийся тем, что антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или заболевание, ассоциированное с вирусами, представляет собой вирусную инфекцию или рак, ассоциированный с вирусами.
223. Способ лечения пациента, страдающего заболеванием, ассоциированным с вирусами, путем введения клеток иммунной системы, сконструированных согласно любому из пп. 151-158, 166 и 168-206, указанному пациенту, где антиген представляет собой антиген вируса.
224. Способ по п. 223, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммунотерапии.
225. Способ по п. 223, отличающийся тем, что указанные клетки иммунной системы предназначены для применения в иммуносупрессивной терапии.
226. Способ по п. 223, дополнительно включающий введение ингибитора контрольной точки иммунного ответа указанному пациенту.
227. Способ по п. 223, отличающийся тем, что указанные иммунные клетки выделяют из организма указанного пациента.
228. Способ по любому из пп. 223-227, отличающийся тем, что антиген вируса представляет собой антиген ВИЧ, антиген Эбола, антиген ВПЧ или антиген ВЭБ; и/или заболевание, ассоциированное с вирусами, представляет собой вирусную инфекцию или рак, ассоциированный с вирусами.
229. Применение клеток иммунной системы, сконструированных в соответствии с любым из пп. 94-102, 110 и 112-150, для скрининга антигенов для разработки вакцин.
230. Применение клеток иммунной системы, сконструированных в соответствии с любым из пп. 151-158, 166 и 168-206, для скрининга антигенов для разработки вакцин.
| US 20140287509 A, 25.09.2014 | |||
| US 20140287509 A, 25.09.2014 | |||
| HILLERDAL V., et al | |||
| "Systemic treatment with CAR-engineered T cells against PSCA delays subcutaneous tumor growth and prolongs survival of mice", BMC Cancer | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ОГУРЦОВ А.Н | |||
| Бионанотехнология | |||
| Принципы и применение: уч.пособие | |||
| - Х.: НТУ "ХПИ", | |||
Авторы
Даты
2020-12-28—Публикация
2015-10-30—Подача