Область техники
Настоящее изобретение относится к новой противоопухолевой терапии иммунными клетками с использованием слитого белка и естественных киллеров для повышения миграции естественных киллеров в рак и максимизации антителозависимой клеточной цитотоксичности (ADCC).
Кроме того, настоящее изобретение относится к способу лечения рака с помощью слитого белка, а также различному применению слитого белка.
Уровень техники
Естественный киллер (NK) является эффекторной клеткой, действующей в первой линии защитного механизма иммунной системы in vivo, например, выполняющей функцию удаления опухолевых клеток и клеток организма–хозяина, инфицированного бактериями, внутриклеточными паразитами или вирусами, без предшествующей сенсибилизации антигенами, отторжения неподходящих трансплантатов костного мозга, регуляции иммунного ответа T–клеток и т.п.
Иммунологическая функция NK–клеток зависит от баланса стимуляторного сигнала для индукции их функции цитолиза и ингибиторного сигнала для ингибирования функции цитолиза. В частности, NK–клетка, получающая сильный стимуляторный сигнал, атакует и удаляет клетку–мишень, и NK–клетка, получающая сильный ингибиторный сигнал, оставляет клетку–мишень живой.
Функция цитолиза NK–клетки представляет собой антителозависимую клеточную цитотоксичность (ADCC) и естественный лизис. Для ADCC и естественного лизиса общей является необходимость активации белковой тирозинкиназы (PTK) и то, что они блокируются ингибиторным сигналом, передаваемым ингибиторным рецептором NK–клетки. Функция цитолиза NK–клетки зависит от баланса стимуляторного сигнала и ингибиторного сигнала, и, таким образом, NK–клетка может различать нормальные клетки–хозяева и инфицированные или злокачественные клетки для их удаления.
NK–клетки можно классифицировать по уровню экспрессии CD56, и по меньшей мере 90% CD56dim NK–клеток являются NK–клетками периферической крови. Известно, что CD56dim клетки имеют более высокую цитотоксичность, чем другие CD56–экспрессирующие NK–клетки, и демонстрируют высокую экспрессию Ig–подобных рецепторов естественных киллеров (KIR), являющихся активирующими рецепторами NK–клетки, и перфорина. Также известно, что CD56bright NK–клетки более малочисленны и имеют более низкую цитотоксическую активность, чем CD56dim NK–клетки. Однако описано, что CD56bright NK–клетки обладают не только высокой иммунорегуляторной функцией (ИФН–гамма, ФНО–альфа и т.д.), но также и высокой функцией ADCC (The Journal of Immunology, 2011, 186:6753–6761). В частности, ожидают, что CD56bright NK–клетки будут иметь улучшенный эффект при комбинированном лечении в отношении антител и рака.
С другой стороны, хорошо известно, что опухоль может экспрессировать уникальный белок, ассоциированный с их злокачественным фенотипом, или может гиперэкспрессировать конкретный белок в большем количестве, чем нормальные клетки. Экспрессия уникального белка на поверхности опухолевой клетки делает возможным исследование опухоли на идентичность фенотипа и биохимическую композицию и активность, таким образом, обеспечивая возможность диагностики и характеризации заболевания, или также позволяет направленно воздействовать на опухолеспецифический антиген и, таким образом, разрабатывать новый способ терапии опухоли.
Известно, что антитело, в случае которого наблюдают реакцию антиген–антитело, специфическую для опухолеспецифического антигена, атакует злокачественные клетки и вызывает гибель клеток посредством индукции различных иммунных ответов in vivo (активность антителозависимой клеточной цитотоксичности (ADCC), активность комплемент–зависимой клеточной цитотоксичности (CDC) и т.д.). Таким образом, в настоящее время разрабатывают антитело, которое можно использовать в лечении опухоли и т.д., но проводится мало исследований для повышения его терапевтической эффективности.
При этом существует необходимость проведения исследований и разработки способа эффективного лечения рака с использованием NK–клеток и антигенов злокачественных опухолей, специфически экспрессирующихся на поверхности злокачественных клеток.
[Ссылка на известный уровень техники]
[Патентные документы]
Патентная публикация Кореи № 10–2006–0079180
Патентная публикация Кореи № 10–2015–0063145
Подробное описание изобретения
Техническая задача
Настоящее изобретение относится к слитому полипептиду, содержащему:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер и
белок, индуцирующий естественные киллеры (NK), из CXCL16.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей слитый полипептид, вектору, содержащему ее, или клетке–хозяину, содержащему вектор.
Настоящее изобретение также относится к фармацевтической композиции для профилактики или лечения рака, содержащей слитый полипептид, содержащий:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер и
белок, индуцирующий NK–клетки, из CXCL16.
Настоящее изобретение также относится к фармацевтической композиции для профилактики или лечения рака, содержащей слитый полипептид, содержащий:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер, и
белок, индуцирующий NK–клетки, из CXCL16,
и NK–клетки.
Настоящее изобретение также относится к композиции, содержащей слитый полипептид, предназначенной для применения в лечении рака.
Настоящее изобретение также относится к применению слитого полипептида в получении лекарственного средства для рака.
Настоящее изобретение также относится к применению слитого полипептида для лечения рака.
Настоящее изобретение также относится к способу лечения рака посредством введения пациенту композиции, содержащей слитый полипептид, в фармацевтически эффективном количестве.
Решение технической задачи
Авторы настоящего изобретения осуществляли исследования и разработку способа эффективного введения естественного киллера (NK), иммуноцитарного терапевтического средства, в злокачественную ткань. В результате, авторы настоящего изобретения определили, что среди рецепторов индуцирующего активность вещества, экспрессирующихся на поверхности NK–клетки, CXCR3 и CXCR6 являются гиперэкспрессированными, а затем определили, что из их лигандов, CXCL16 является эффективным в отношении миграции NK–клеток, и а затем определили, что индуцирование NK–клеток в отношении злокачественного новообразования значительно повышено и, таким образом, имеет значительный эффект в отношении лечения злокачественных опухолей посредством получения и введения слитого белка, специфического для опухолеспецифического антигена, а также CXCL16, имеющего свойства индукции NK–клеток, таким образом, осуществляя настоящее изобретение.
В рамках изобретения термин "опухолеспецифический антиген" означает антиген, не экспрессирующийся на нормальной клетке или гиперэкспрессирующийся только на опухолевой клетке в отличие от нормальной клетки, предпочтительно, специфически экспрессирующийся на поверхности опухолевой клетки, где такой антиген относится к антигенному веществу, продуцируемому опухолевыми клетками.
Опухолеспецифический антиген, специфически экспрессирующийся на опухоли, может включать, в качестве неограничивающих примеров, 4–1BB (CD137), 5T4, AGS–5, AGS–16, ангиопоэтин 2, CD19 (кластер дифференцировки 19), B7.1 (CD80), B7.2 (CD86), B7DC, B7H1, B7H2, B7H3, BT–062, BTLA, CAIX, карциноэмбриональный антиген, CTLA4, Cripto, ED–B, ErbB1, ErbB2, ErbB3, ErbB4, EGFL7, EpCAM, EphA2, EphA3, EphB2, FAP, фибронектин, рецептор фолата, ганглиозид GM3, GD2, глюкокортикоид–индуцируемый рецептор фактора некроза опухоли (GITR), gp100, gpA33, GPNMB, ICOS, IGFIR, интегрин αυ, интегрин αυβ, KIR, LAG–3, антиген Льюиса Y, мезотелин, c–MET, Her2 (EGFR–родственный белок человека 2), карбоангидразу MN IX, MUC1, MUC16, нектин–4, NKGD2, NOTCH, OX40, OX40L, PD–1, PD–L1 (лиганд программируемой гибели 1), PSCA, PSMA, RANKL, ROR1, ROR2, SLC44A4, синдекан–1, TACI, TAG–72, тенасцин, TIM3, TRAILR1, TRAILR2, EGFR, VEGFR–1, VEGFR–2, VEGFR–3 или т.п. В одном из примеров по настоящему изобретению идентифицировали эффект слитого полипептида в отношении мезотелина, PD–L1, Her2, CD19, MUC1, EGFR и VEGFR.
В рамках изобретения термин "антитело" включает целое антитело, фрагмент антитела, сохраняющий способность к распознаванию и связыванию антигена, моноклональное антитело, поликлональное антитело и антитело–подобное вещество. Антитело может являться IgM, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgD, IgA или IgE.
В рамках изобретения термин "фрагмент антитела" означает часть целого антитела, как правило, молекулу, содержащую антигенсвязывающую или вариабельную область целого антитела. Пример фрагмента антитела включает Fab–, Fab'–, F(ab')2– и Fv–фрагмент и однодоменное антитело.
"Антитело или его фрагмент" могут специфически или предпочтительно связываться с опухолевой клеткой по сравнению с неопухолевой клеткой или нормальной клеткой, предпочтительно, опухолеспецифическим антигеном, специфически экспрессирующимся в опухоли. В настоящем описании термины "специфически связывается" или "предпочтительно связывается" означают, что связывание между двумя партнерами по связыванию (например, антителом и его партнером по связыванию, т.е. антигеном) является селективным в отношении двух партнеров по связыванию, и его можно отличать от нежелательных или неспецифических взаимодействий.
В рамках изобретения термин "одноцепочечный Fv" или "scFv (одноцепочечный вариабельный фрагмент)" относится к антителу, в котором вариабельные домены тяжелой цепи и легкой цепи общепринятого двухцепочечного антитела связываются друг другом с образованием одной цепи. Как правило, между двумя цепями встраивают линкерный пептид, чтобы сделать возможным правильный фолдинг и образование активного участка связывания.
В рамках изобретения термин "антитело, связывающееся с антигеном" относится к антителу, которое можно использовать в качестве терапевтического средства, в котором антитело направленно воздействует на антиген посредством связывания с антигеном с достаточной активностью.
В рамках изобретения термин "линкер" означает пептид, соединяющий первую молекулу (например, антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном) со второй молекулой (белком, индуцирующим NK–клетки, из CXCL16) посредством химического связывания и т.д.
В рамках изобретения термин "рак" или "опухоль" означает патологическое состояние у людей, отличающееся неконтролируемой пролиферацией клеток. Рак или опухоль включает, в качестве неограничивающих примеров, карциному, лимфому, бластому и лейкоз. Более конкретные неограничивающие примеры рака включают рак легких (мелкоклеточный и немелкоклеточный), рак молочной железы, рак предстательной железы, карциноид, рак мочевого пузыря, рак желудка, рак поджелудочной железы, рак печени (печеночноклеточный), гепатобластому, рак толстого кишечника, плоскоклеточную карциному головы и шеи (HNSCC), рак пищевода, рак яичников, рак шейки матки, соленому, мезотелиому, меланому, саркому, остеосаркому, липосаркому, рак щитовидной железы, десмому, острый миелогенный лейкоз (AML) и хронический миелогенный лейкоз (CML).
В рамках изобретения термин "экспрессирующий вектор" включает нуклеотидную последовательность, кодирующую интересующую молекулу, агонистически связанную с промотором.
В рамках изобретения термины "полипептид", "пептид" и "белок" используют взаимозаменяемо, и они включают ссылку на полимер аминокислотных остатков. Термины используют не только по отношению к полимерам природных аминокислот, но также и к полимерам искусственных аминокислот, являющихся химическими аналогами природных аминокислот, которым соответствует по меньшей мере один аминокислотный остаток. Термины также используют по отношению к полимерам, содержащим консервативную замену аминокислоты таким образом, что белок может оставаться агонистическим.
В рамках изобретения термин "клетка–хозяин" означает клетку, способную поддерживать репликацию или экспрессию экспрессирующего вектора. Клетка–хозяин может представлять собой прокариотические клетки, например, Escherichia coli, или эукариотические клетки, например, дрожжи, клетки насекомых, амфибий или млекопитающих.
Что касается роста или прогрессирования опухоли или рака, термины "ингибирующий" и "снижающий" относятся к ингибированию роста, распространения или метастазирования опухоли или злокачественного новообразования пациента на измеримое количество при использовании любого известного в этой области способа. Рост, прогрессирование или распространение опухоли или рака ингибируют или снижают, если размер опухоли снижается по меньшей мере на приблизительно 10%, 20%, 30%, 50%, 80% или 100% по сравнению с размером опухоли, измеряемым, например, до совместного введения слитого полипептида по настоящему изобретению и NK–клеток, иммуноцитарного терапевтического средства, или до введения слитого полипептида.
Настоящее изобретение относится к слитому полипептиду, содержащему: антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16.
Слитый полипептид по настоящему изобретению может специфически связываться с поверхностью клетки опухоли благодаря тому, что он содержит антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, и может также индуцировать NK–клетку в отношении опухолевой клетки–мишени посредством CXCL16, т.е. белка, индуцирующего NK–клетку, расщепляемого и высвобождающегося после связывания антигена и антитела.
Слитый полипептид по настоящему изобретению связывается с поверхностным антигеном для таргетинга опухоли благодаря тому, что он содержит антитело или его фрагмент, специфически связывающиеся с опухолеспецифическим антигеном. Поверхностный антиген для таргетинга опухоли широко известен в этой области и может представлять собой, в качестве неограничивающих примеров, мезотелин, PD–L1, Her2, CD19, MUC1, EGFR, VEGFR, B7H1, B7H2, B7H3, BT–062, BTLA, CAIX, 4–1BB, 5T4, AGS–5 или AGS–16.
Антитело или его фрагмент, специфически связывающиеся с опухолеспецифическим антигеном, включает одноцепочечный Fv (scFv), Fab, Fab', F(ab')2, стабилизированное дисульфидными связями антитело и т.д., и, в частности, может представлять собой одноцепочечный Fv (scFv).
Антитело или его фрагмент, специфически связывающиеся с опухолеспецифическим антигеном, можно получать известным в этой области способом получения.
В примере варианта осуществления настоящего изобретения антитело является одноцепочечным Fv (scFv). Области VH и VL антитела scFv содержат одну цепь, свернутую с образованием антигенсвязывающего участка, схожего с участком, обнаруживаемым в двухцепочечном антителе. После фолдинга одноцепочечное антитело стабилизируется посредством нековалентного взаимодействия. В более конкретном примере варианта осуществления scFv образуется посредством рекомбинации. Консервативный вариант антитела по настоящему изобретению можно получать общепринятым образом, и консервативный вариант, используемый в scFv–фрагменте, будет сохранять важный аминокислотный остаток, необходимый для точного фолдинга и стабилизации областей VH и VL.
В примере варианта осуществления настоящего изобретения scFv является scFv против мезотелина, имеющим аминокислотную последовательность, представленную в SEQ ID NO: 1, и, в частности, его может кодировать последовательность оснований, представленная в SEQ ID NO: 2.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против PD–L1, который может содержать тяжелую цепь (VH) с аминокислотной последовательностью, представленной в SEQ ID NO: 3, в частности, кодируемой последовательностью основания, представленной в SEQ ID NO: 4; и легкую цепь (VL) с аминокислотной последовательностью, представленной в SEQ ID NO: 5, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 6, и опухолеспецифический антиген, т.е. PD–L1, может являться антигеном, кодируемым последовательностью оснований, представленной в SEQ ID NO: 7.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против Her2, который может содержать тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 8, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 9; и легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 10, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 11, и опухолеспецифический антиген, т.е. Her2, может являться антигеном, кодируемым последовательностью оснований, представленной в SEQ ID NO: 12.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против CD19, который может содержать тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 28, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 29; и легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 30, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 31.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против MUC–1, который может содержать тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 32, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 33; и легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 34, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 35.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против EGFR, который может содержать тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 36, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 37; и легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 38, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 39.
В другом примере варианта осуществления настоящего изобретения scFv, в качестве неограничивающих примеров, является scFv против VEGFR, который может содержать тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 40, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 41; и легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 42, в частности, кодируемой последовательностью оснований, представленной в SEQ ID NO: 43.
Антитело scFv можно напрямую связывать с пептидным линкером через легкую цепь, и их можно связывать через Fc–область, с которой связан scFv.
В примере варианта осуществления настоящего изобретения Fc (константная область), в качестве неограничивающих примеров, может иметь аминокислотную последовательность SEQ ID NO: 13 и, в частности, может кодироваться последовательностью оснований, представленной в SEQ ID NO: 14.
Линкер по настоящему изобретению не будет иметь конкретную биологическую активность, за исключением связывания областей в качестве пептидного линкера или сохранения некоторого минимального расстояния или другой пространственной взаимосвязи между областями, но составляющие его аминокислоты можно выбирать так, чтобы они влияли на некоторые свойства молекул, например, фолдинг, суммарный заряд или гидрофобность. Кроме того, линкер может содержать расщепляемую последовательность таким образом, что CXCL16 может отделяться после связывания антитела с опухолеспецифическим антигеном. Антитело или его фрагмент, специфически связывающиеся с опухолеспецифическим антигеном, можно соединять посредством пептидного линкера, имеющего длину не более 50 аминокислот, как правило, не более 40 аминокислот, предпочтительно – не более 30 аминокислот, более предпочтительно – не более 20 аминокислот, и гораздо более предпочтительно – от 1 до 10 аминокислот.
Например, пептидный линкер может содержать последовательность, расщепляемую любой протеазой и, в частности, может являться пептидным линкером, в качестве неограничивающих примеров, содержащим последовательные аминокислотные остатки RVKR, расщепляемого фурином.
В примере варианта осуществления настоящего изобретения слитый полипептид по настоящему изобретению содержит участок расщепления фурином, расщепляемый фурином, т.е. участок расщепления фурином, содержащий последовательные аминокислотные остатки, которые могут расщепляться фурином, таким образом, что белок, индуцирующий NK–клетки, может высвобождаться из злокачественной клетки.
Участок расщепления фурином может являться любым полипептидным участком, который может расщепляться фурином. Как описано Duckert и т.д. ([Duckert et al., Protein Engineering, Design & Selection 17(1):107–112 (2004)], включенной в настоящее описание в качестве ссылки в полном объеме), фурин является ферментом "на основе эволюционно консервативной, специфической в отношении двухосновных и одноосновных аминокислот, CA2+–зависимой сериновой протеазы, также названной субтилизин/кексин–подобной пропротеинконвертазой".
Последовательность участка расщепления фурином, известная из этой статьи и т.д., включена в настоящее описание и, в частности, соответствует аминокислотной последовательности SEQ ID NO: 15 и, в качестве неограничивающих примеров, может кодироваться последовательностью оснований, представленной в SEQ ID NO: 16.
Антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, можно связываться последовательность расщепления фурином через амино–конец участка расщепления фурином и его можно напрямую связывать с легкой цепью, тяжелой цепью, Fc (константной областью) или каркасными областями антитела.
Слитый белок по настоящему изобретению содержит белок, индуцирующий NK–клетки, из CXCL16, таким образом, что слитый белок по настоящему изобретению может индуцировать в отношении опухолевой клетке NK–клетку, содержащую антитело, связанное с опухолеспецифическим антигеном.
Термин "белок, индуцирующий NK–клетки" по настоящему изобретению означает белок для индуцирования NK–клетки в отношении опухолевой клетке, т.е. CXCL16, являющийся белком, способным вызывать миграцию NK–клетки к злокачественной клетке посредством хемокина.
В частности, CXCL16 может иметь аминокислотную последовательность SEQ ID NO: 17. CXCL16 может кодироваться последовательностью оснований SEQ ID NO: 18.
Белок, индуцирующий NK–клетки, можно связывать с антителом или его фрагментом с помощью пептидного линкера. Линкер по настоящему изобретению не будет иметь конкретную биологическую активность, за исключением связывания областей в качестве пептидного линкера или сохранения некоторого минимального пространства или другой пространственной взаимосвязи между областями, но составляющие его аминокислоты можно выбирать так, чтобы они влияли на некоторые свойства молекул, например, фолдинг, суммарный заряд или гидрофобность. Кроме того, линкер может содержать расщепляемую последовательность, например, последовательность, расщепляемую любой протеазой, таким образом, что CXCL16 может отделяться после связывания антитела с опухолеспецифическим антигеном.
В примере варианта осуществления настоящего изобретения, пептидный линкер содержит участок расщепления фурином, расщепляемый фурином, т.е. участок расщепления фурином, содержащий последовательные аминокислотные остатки, которые могут расщепляться фурином.
Слитый полипептид по настоящему изобретению можно получать нерекомбинантным или рекомбинантным способом, известным в этой области, предпочтительно, рекомбинантным способом.
Другими словами, экспрессирующий вектор можно получать посредством встраивания кДНК, кодирующей антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16, в вектор.
В примере варианта осуществления настоящего изобретения экспрессирующий вектор получают посредством встраивания последовательности оснований, содержащей scFv против мезотелина и Fc, в вектор, в частности, вектор pcDNA3.1, и посредством встраивания участка расщепления фурином и последовательности оснований, кодирующей белок, индуцирующий NK–клетки, после последовательности иммуноглобулина. Пример полученного экспрессирующего вектора представлен на фиг. 2.
Полученный экспрессирующий вектор можно экспрессировать в бактериальных, растительных и дрожжевых клетках, клетках насекомых и клетках млекопитающих. Специалисты в этой области могут получать слитый полипептид с использованием ряда систем экспрессии, которые можно использовать для экспрессии белков, включая Escherichia coli, другие бактериальные клетки–хозяева, дрожжи и различные клетки высших эукариот, например, линии клеток COS, CHO, HeLa и линии клеток миеломы.
В примере варианта осуществления настоящего изобретения слитый полипептид можно получать посредством трансфекции клетки CHO, из которой удален фурин, с использованием экспрессирующего вектора.
Из полученного слитого полипептида можно получать целевой слитый полипептид посредством очистки способом, стандартным в этой области, включая осаждение сульфатом аммония, использованием аффинной колонки, хроматографию на колонках и т.д.
Настоящее изобретение относится к нуклеиновой кислоте, кодирующей слитый полипептид.
Настоящее изобретение относится к экспрессирующему вектору, содержащему последовательность нуклеиновой кислоты, кодирующую слитый полипептид. В частности, вектор по настоящему изобретению может представлять собой экспрессирующий вектор, имеющий структуру, показанную на фиг. 2, которая может иметь последовательность оснований SEQ ID NO: 19.
Настоящее изобретение относится к клетке–хозяину, содержащей экспрессирующий вектор. В частности, такая клетка–хозяин может являться клеткой, в качестве неограничивающих примеров, выбранной из линий клеток COS, CHO, HeLa и линий клеток миеломы.
Настоящее изобретение относится к фармацевтической композиции для профилактики или лечения рака, содержащей слитый полипептид, содержащий: антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16.
Фармацевтическая композиция для профилактики или лечения рака по настоящему изобретению является иммуноцитарным терапевтическим средством, в частности, где такая композиция имеет значительный эффект в отношении профилактики или лечения рака посредством индуцирования NK–клеток в отношении к раку. Фармацевтическая композиция для профилактики или лечения рака по настоящему изобретению не только имеет прямой терапевтический эффект, но также действует как противоопухолевый адъювант.
В примере варианта осуществления настоящего изобретения определено, что распределение NK–клеток изменяется с CD56dim на CD56bright под действием CXCL16 из слитого полипептида, полученного по настоящему изобретению, а также определено, что фармацевтическая композиция по настоящему изобретению эффективна для профилактики или лечения рака благодаря дифференцировке в CD56bright клетки, имеющие более высокий эффект ADCC по сравнению с CD56dim.
Настоящее изобретение также относится к фармацевтической композиции для профилактики или лечения рака, содержащей слитый полипептид, содержащий: антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16, и NK–клетки.
По настоящему изобретению совместное введение слитого полипептида вместе с NK–клетками, иммуноцитарным терапевтическим средством, значительно повышает миграцию NK–клеток в рак, таким образом, имея значительный эффект в отношении профилактики или лечения рака.
Фармацевтическую композицию, предназначенную для использования в настоящем изобретении, можно составлять в лекарственной форме стандартным способом с использованием по меньшей мере одного физиологически приемлемого носителя или эксципиента. Подходящий фармацевтический носитель описан в настоящем изобретении и литературе (Remington: The Science and Practice of Pharmacy, 21st Ed., University of the Sciences in Philadelphia, Lippencott Williams & Wilkins (2005)).
Такую фармацевтическую композицию можно составлять в лекарственной форме таким образом, что слитый полипептид и/или NK–клетки по изобретению можно вводить любым подходящим путем, например, ингаляционным, местным, назальным, пероральным, парентеральным или ректальным путем. Таким образом, введение фармацевтической композиции, упомянутой выше, можно осуществлять внутрикожным, подкожным, внутривенным, внутримышечным, интраназальным, ингаляционным, внутримозговым, эндотрахеальным, внутриартериальным, интраперитонеальным, внутрипузырным, внутриплевральным, внутрикоронарным путем, посредством подкожной или внутриопухолевой инъекции или с использованием шприца или других устройств. Также рассматривают чрезкожное введение вместе с ингаляцией или аэрозольным введением. Таблетку и капсулу можно вводить перорально, ректально или вагинально.
Фармацевтическая композиция будет содержать слитый полипептид или слитый полипептид и NK–клетки, который общепринятым образом растворяют в фармацевтически приемлемом носителе, предпочтительно, водном носителе. Слитый полипептид и NK–клетки можно предоставлять вместе или раздельно. Можно использовать различные водные носители, например, забуференный водный раствор соли, и т.д. такой раствор обладает бактерицидными свойствами и, как правило, не содержит нежелательные вещества. Такую композицию можно стерилизовать общепринятым, широко известным способом стерилизации. Композиция может содержать фармацевтически приемлемое вспомогательное вещество, необходимое для соответствия физиологическим условиям, например, регулятор pH и буфер, корректирующее токсичность вещество, и т.д. например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.д. Концентрация слитого полипептида в такой лекарственной форме может варьироваться в широких пределах, и ее можно выбирать, в основном, с учетом объема жидкости, вязкости, массы и т.д. в соответствии с выбранным путем введения и потребностями пациента.
Фармацевтическая композиция по настоящему изобретению подходит для парентерального введения, включая внутривенное или интрацеломическое введение.
Слитый полипептид и/или NK–клетки по настоящему изобретению можно составлять в лекарственной форме для парентерального введения посредством инъекции, например, болюсной или непрерывной инъекции. Лекарственная форма для инъекции может находиться вместе с добавочным консервантом в однодозовом контейнере, например, ампуле, или многодозовом контейнере. Инъецируемая композиция, предпочтительно, является водным изотоническим раствором или суспензией, и суппозиторий, предпочтительно, получают из липидной эмульсии или суспензии. Композицию можно стерилизовать, и/или она может содержать вспомогательное вещество, например, консервант, стабилизатор, увлажнитель или эмульгатор, усилитель растворимости, осморегуляторную соль и/или буфер. С другой стороны, активный компонент может находиться в форме порошка, который составляют перед использованием с помощью подходящего носителя, например, стерильной воды, не содержащей пирогены. Кроме того, активный компонент может содержать другие терапевтически значимые вещества. Композиции получают общепринятым способом смешивания, грануляции или покрывания, соответственно, и они содержат приблизительно от 0,1 до 75%, предпочтительно – от 1 до 50% активного компонента.
В случае перорального введения фармацевтическая композиция или лекарственное средство могут иметь форму таблетки или капсулы, получаемой, например, общепринятыми способами, вместе с фармацевтически приемлемым эксципиентом. Предпочтительно, такая фармацевтическая композиция или лекарственное средство должна быть таблеткой и желатиновой капсулой, содержащей активный компонент, т.е. композицию по настоящему изобретению вместе с: (a) дилюентом или наполнителем, например, лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой (например, этилцеллюлозой и микрокристаллической целлюлозой), глицином, пектином, полиакрилатом и/или гидроортофосфатом кальция и сульфатом кальция; (b) смазочным средством, например, диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью, стеаратом металла, коллоидным диоксидом кремния, гидрогенизированным растительным маслом, кукурузным крахмалом, бензоатом натрия, ацетатом натрия и/или полиэтиленгликоля; кроме того, в случае таблетки (c) связывающим средством, например, силикатом магния алюминия, крахмальной пастой, желатином, трагакантовой камедью, метилцеллюлозой, натрий–карбоксиметилцеллюлозой, поливинилпирролидоном и/или гидроксипропилметилцеллюлозой; в некоторых случаях (d) средством для повышения распадаемости, например, крахмалом (например, картофельным крахмалом или крахмалгликолятом натрия), гликолятом, агаром, альгиновой кислотой или ее натриевой солью или шипучей смесью; (e) увлажнителем, например, лаурилсульфатом натрия и/или (f) абсорбентом, красителем, ароматизатором и подсластителем.
По настоящему изобретению фармацевтическую композицию вводят пациенту в терапевтически эффективной дозе для профилактики, лечения или ингибирования заболевания, такого как рак или злокачественное состояние. Фармацевтическую композицию вводят пациенту в количестве, достаточном для вызывания эффективного терапевтического или диагностического ответа у пациента. Термин "эффективный терапевтический или диагностический ответ" относится к ответу, который по меньшей мере частично ингибирует или замедляет развитие симптомов или осложнений заболевания или злокачественного состояния. Подходящее количество для осуществления такого введения определяют как "терапевтически эффективное количество".
Доза слитого полипептида и/или NK–клеток, подлежащих введению, варьируется в зависимости от вида млекопитающего, массы, возраста, состояния индивидуума, площади поверхности области, подлежащей лечению, и типа введения. Величину дозы также можно определять по наличию, свойствам и степени любого побочного эффекта у конкретного пациента, сопутствующего введению конкретного соединения.
Единица дозирования, подлежащая введению млекопитающему массой приблизительно от 50 до 80 кг, предпочтительно, человеку, может содержать слитый полипептид в количестве приблизительно от 1 мг/кг до 5 мг/кг и NK–клетки в количестве приблизительно от 1×105 клеток/кг до 2×107 клеток/кг.
Как правило, доза композиции по настоящему изобретению является дозой, достаточной для достижения целевого эффекта. Оптимальный режим введения можно определять посредством измерения слитого полипептида и/или NK–клеток и вычисления их накопления в организме пациента. Такую композицию можно вводить по меньшей мере раз в сутки, неделю, месяц или год. Специалисты в этой области легко могут определять оптимальную дозу, способ введения и частоту повторений. Специалисты в этой области могут определять оптимальное введение слитого полипептида и/или NK–клеток людям общепринятым способом, известным в этой области и представленным в настоящем описании. Однако следует понимать, что точную дозу эффективного компонента следует определять с учетом различных факторов, таких как заболевание, подлежащее лечению, тяжесть заболевания, способ введения, масса пациента, возраст, пол и т.п., и, таким образом, дозу не следует истолковывать как ограничение объема настоящего изобретения в каком–либо аспекте.
Настоящее изобретение также относится к композиции, содержащей слитый полипептид, предназначенной для применения в лечении рака.
Настоящее изобретение также относится к применению слитого полипептида в получении лекарственного средства для лечения рака.
Настоящее изобретение также относится к применению слитого полипептида для лечения рака.
Настоящее изобретение также относится к способу лечения рака посредством введения композиции, содержащей слитый полипептид, пациенту в фармацевтически эффективном количестве. Способ терапии рака можно осуществлять посредством совместного введения NK–клеток, таким образом, достигая улучшенного терапевтического эффекта.
Объекты, упомянутые в отношении применения, композиции и терапевтического способа по настоящему изобретению, используют в равной степени, если они не противоречат друг другу.
Полезные эффекты
Слитый белок для профилактики или лечения рака по настоящему изобретению содержит слитый полипептид, содержащий: антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16, где совместное введение слитого полипептида с NK–клетками, иммуноцитарным терапевтическим средством, значительно повышает миграцию NK–клеток в злокачественное новообразование, экспрессирующее конкретный антиген, таким образом, имея значительный эффект в отношении профилактики или лечения рака.
Краткое описание чертежей
Фиг. 1 является графиком, на котором показаны результаты определения степени миграции выращенных естественных киллеров (NK) в зависимости от типа хемокина.
Фиг. 2 является схемой, на которой показан экспрессирующий вектор для получения слитого полипептида по настоящему изобретению.
Фиг. 3 является графиком, на котором показаны результаты определения того, что слитый полипептид, полученный по настоящему изобретению, распознает и связывается с мезотелином, присутствующим на поверхности линии клеток рака поджелудочной железы, с помощью мезотелин–распознающего участка.
Фиг. 4 является графиком, на котором показаны результаты определения того, что слитый полипептид, полученный по настоящему изобретению, распознает и связывается с PD–L1, присутствующим на поверхности линии клеток рака поджелудочной железы, с помощью PD–L1–распознающего участка.
Фиг. 5 является графиком, на котором показаны результаты определения того, что слитый полипептид, полученный по настоящему изобретению, распознает и связывается с Her2, присутствующим на поверхности линии клеток рака поджелудочной железы, с помощью Her2–распознающего участка.
Фиг. 6 является графиком, на котором показаны результаты определения того, что слитый полипептид, полученный по настоящему изобретению, связывается с линией клеток рака поджелудочной железы с высвобождением CXCL16.
Фиг. 7 является графиком, на котором показаны результаты определения того, что способность NK–клеток к миграции повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с мезотелином.
Фиг. 8 является графиком, на котором показаны результаты определения того, что миграция NK–клеток повышается при обработке линии клеток Panc–1 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с PD–L1.
Фиг. 9 является графиком, на котором показаны результаты определения того, что миграция NK–клеток повышается при обработке линии клеток HT–29 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с PD–L1.
Фиг. 10 является графиком, на котором показаны результаты определения того, что миграция NK–клеток повышается при обработке линии клеток Panc–1 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с Her2.
Фиг. 11 является графиком, на котором показаны результаты определения того, что миграция NK–клеток повышается при обработке линии клеток MCF7 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с Her2.
Фиг. 12 является графиком, на котором показаны результаты определения того, что способность NK–клеток к миграции повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с CD19.
Фиг. 13 является графиком, на котором показаны результаты определения того, что способность NK–клеток к миграции повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с MUC–1.
Фиг. 14 является графиком, на котором показаны результаты определения того, что способность NK–клеток к миграции повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с EGFR.
Фиг. 15 является графиком, на котором показаны результаты определения того, что способность NK–клеток к миграции повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с VEGFR.
Фиг. 16 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с мезотелином.
Фиг. 17 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке линии клеток Panc–1 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с PD–L1.
Фиг. 18 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке линии клеток HT–29 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с PD–L1.
Фиг. 19 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке линии клеток Panc–1 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с Her2.
Фиг. 20 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке линии клеток MCF7 слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с Her2.
Фиг. 21 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с CD19.
Фиг. 22 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с MUC–1.
Фиг. 23 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с EGFR.
Фиг. 24 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышается при обработке различных линий злокачественных клеток слитым полипептидом по настоящему изобретению, содержащим антитело, связывающееся с VEGFR.
Фиг. 25 является графиком, на котором показаны результаты определения того, что способность NK–клеток к инвазии повышают с помощью слитого полипептида (NRP–антитела scFv против Her2), полученного для распознавания Her2 по настоящему изобретению.
Фиг. 26 является графиком, на котором показана индукция NK–клеток в отношении злокачественной ткани при введении слитого полипептида, полученного по настоящему изобретению, а также NK–клеток.
Фиг. 27 является графиком, на котором показаны результаты определения терапевтического эффекта посредством введения слитого полипептида scFv против мезотелина, полученного по настоящему изобретению, в модели на животных с трансплантированными клетками рака поджелудочной железы вместе с NK–клетками.
Фиг. 28 является графиком, на котором показаны результаты определения терапевтического эффект посредством введения слитого полипептида scFv против PD–L1, полученного по настоящему изобретению, в модели на животных с трансплантированными клетками рака поджелудочной железы вместе с NK–клетками.
Фиг. 29 является графиком, на котором показаны результаты определения терапевтического эффекта посредством введения слитого полипептида scFv против Her2, полученного по настоящему изобретению, в модели на животных с трансплантированными клетками рака поджелудочной железы вместе с NK–клетками.
Фиг. 30 является графиком, на котором показано изменение распределения NK–клеток после обработки NK–клеток CXCL16 и ИЛ–2 в течение короткого периода времени.
Фиг. 31 является графиком, на котором показано изменение распределения NK–клеток после обработки NK–клеток CXCL16 и ИЛ–2 в течение длительного периода времени
Фиг. 32 является графиком, на котором показаны результаты определения повышения гибели клеток посредством CD56bright CD16+ NK–клеток, распространяющихся после обработки NK–клеток слитым полипептидом, полученным по настоящему изобретению.
Принцип изобретения
Далее в настоящем описании настоящее изобретение будет подробно описано с помощью предпочтительных примеров для лучшего понимания настоящего изобретения. Однако следующие примеры представлены исключительно для иллюстрирования настоящего изобретения, и, таким образом, настоящее изобретение не ограничено ими.
<Пример 1> Определение миграции выращенных естественных киллеров с помощью хемокина
Для определения степени миграции выращенных естественных киллеров (NK) в зависимости от типа хемокина выращенные NK–клетки собирали и центрифугировали при 1500 об./мин. Затем удаляли супернатант и промывали их PBS, после чего подсчитывали количество клеток. Хемокины CXCL9, CXCL10, CXCL11 и CXCL16 добавляли по 10 нМ на нижний слой камеры Бойдена, а выращенные NK–клетки в количестве 2×105 клетки добавляли на верхний слой камеры Бойдена. После этого полученные клетки культивировали в инкубаторе с CO2 при 37°C в течение двух часов, затем собирали нижний слой и центрифугировали при 1500 об./мин. Затем промывали PBS, окрашивали CD56–PE при 4°C в течение 30 минут и промывали PBS. Для анализа FAC частицы Count Bright Absolute Counting Beads (Invitrogen) разделяли на аликвоты по 50 мкл и осуществляли анализ FACS.
Результаты показаны на фиг. 1.
Как показано на фиг. 1, определяли, что CXCL16 имел значительный эффект в отношении миграции выращенных NK–клеток по сравнению с другими типами хемокинов.
<Пример 2> Получение и очистка слитого полипептида [антитела с белком для рекрутирования NK–клеток (NRP)]
Получали рекомбинантный вектор, с которым связывали следующее: последовательность scFv для распознавания антигена для таргетинга рака; последовательность фурина в качестве линкера и CXCL16 (белка для рекрутирования NK–клеток; NRP) для индукции миграции NK–клеток с наибольшей эффективностью.
Структура конкретного рекомбинантного вектора, с которым связана последовательность scFv для распознавания мезотелина в качестве антигена–мишени, показана на фиг. 2.
Вектор pcDNA3.1 расщепляли ферментом Sfi1 в течение двух часов и очищали для получения вектора для лигирования. Для получения scFv против мезотелина осуществляли амплификацию посредством ПЦР с использованием последовательности праймеров, представленных в следующей таблице 1, для получения последовательности оснований scFv против мезотелина SEQ ID NO: 2, после чего смешивали вектор, образец вставки и лигазу T4 и культивировали при 25°C в течение двух часов для осуществления лигирования вектора и вставки. Полученный продукт встраивали в участок фермента Sfi1 в векторе pcDNA3.1.
[Таблица 1]
Последовательность праймеров для получения scFv против мезотелина
Прямой праймер
Обратный праймер
Для получения scFv против PD–L1 осуществляли амплификацию посредством ПЦР с использованием последовательности праймеров, представленных в следующей таблице 2, для получения последовательности оснований scFv против PD–L1, содержащей тяжелую цепь SEQ ID NO: 4 и легкую цепь SEQ ID NO: 6, после чего осуществляли лигирование вектора и вставки тем же способом, что и для получения указанного вектора, с которым связан scFv против мезотелина, таким образом, что полученный продукт встраивали в участок фермента Sfi1 в векторе pcDNA3.1.
[Таблица 2]
Последовательность праймеров для получения PD–L1 scFv
Прямой праймер
Обратный праймер
Для получения scFv против Her2 осуществляли амплификацию посредством ПЦР с использованием последовательности праймеров, представленных в следующей таблице 3, для получения последовательности оснований scFv против Her2, содержащей тяжелую цепь SEQ ID NO: 9 и легкую цепь SEQ ID NO: 11, после чего осуществляли лигирование вектора и вставки тем же способом, что и для получения указанного вектора, с которым связан scFv против мезотелина, таким образом, что полученный продукт встраивали в участок фермента Sfi1 в векторе pcDNA3.1.
[Таблица 3]
Последовательность праймеров для получения Her2 scFv
Прямой праймер
Обратный праймер
Кроме того, для получения scFv против CD19, MUC–1, EFGR и VEGFR, осуществляли синтез последовательности оснований scFv (scFv CD19, содержащего тяжелую цепь SEQ ID NO: 29 и легкую цепь SEQ ID NO: 31; scFv против MUC–1, содержащего тяжелую цепь SEQ ID NO: 33 и легкую цепь SEQ ID NO: 35; scFv против EGFR, содержащего тяжелую цепь SEQ ID NO: 37 и легкую цепь SEQ ID NO: 39; и scFv против VEGFR, содержащего тяжелую цепь SEQ ID NO: 41 и легкую цепь SEQ ID NO: 43) с учетом аминокислотной последовательности каждого scFv, после чего осуществляли лигирование вектора и вставки тем же способом, что и для получения указанного вектора, с которым связан scFv против мезотелина, таким образом, что полученный продукт встраивали в участок фермента Sfi1 в векторе pcDNA3.1.
CXCL16 и участок расщепления фурином амплифицировали посредством ПЦР с учетом последовательности праймеров, представленных в следующей таблице 4, и использовали участок фермента Not1 после последовательности иммуноглобулина, находящейся в векторе. Вектор, в который встраивают scFv для распознавания антигена–мишени, расщепляли ферментом Not1 в течение двух часов и очищали, после чего смешивали вектор, вставку, т.е. образец CXCL16, и фермент лигазу и культивировали при 25°C в течение двух часов для осуществления лигирования вектора и вставки.
[Таблица 4]
Последовательность праймеров для получения CXCL16 и участка расщепления фурином
Прямой праймер
Обратный праймер
Слитый полипептид (NRP–антитело) массово получали посредством трансфекции клеток CHO (яичника китайского хомяка), из которых удаляли фурин, с использованием полученного экспрессирующего вектора. Клетки CHO, трансфицированные с использованием указанного экспрессирующего вектора, культивировали в планшете 150 мм, затем культивировали в инкубаторе для роллерных бутылей в течение 72 часов, а затем собирали их. Собранную культуральную жидкость центрифугировали, после чего супернатант очищали с использованием колонки с протеином A–агарозой из системы очистки белков AKTA (GE Healthcare Life Sciences), таким образом, что получали слитый полипептид.
<Пример 3> Определение связывания слитого полипептида с антигеном
Мезотелин–распознающий слитый полипептид (NRP–антитело с scFv против мезотелина) (0,1–2 мкг/мл), полученный в примере 2 выше, добавляли к 2×105 клеток Panc–1, являющихся линией клеток рака поджелудочной железы, и культивировали при 4°C в течение 20 минут. После этого клетки собирали и промывали PBS, после чего к ним добавляли антитела FC (1 мкг/мл), с которыми связан FITC, и культивировали при 4°C в течение 20 минут. После этого клетки снова собирали, промывали PBS, а затем анализировали посредством FACS.
Результаты показаны на фиг. 3.
Как показано на фиг. 3, определяли, что мезотелин, присутствующий на поверхности линии клеток рака поджелудочной железы, распознается мезотелин–распознающим участком слитого полипептида, полученного в примере 2 выше, таким образом, что слитый полипептид связывается с поверхностью клеток.
Кроме того, для определения того, что слитый полипептид по настоящему изобретению связывается с поверхностью целевой линии клеток, даже если антиген–распознающие участки отличаются, осуществляли анализ FACS с использованием слитого полипептида с scFv против PD–L1 и слитого полипептида с scFv против Her2, полученных в примере 2 выше, в тех же условиях, что и эксперименте по связыванию антигена указанным слитым полипептидом с scFv против мезотелина, результаты показаны на фиг. 4 (NRP–антитело с scFv против PD–L1) и фиг. 5 (NRP–антитело с scFv против Her2).
Как показано на фиг. 4 и 5, определяли, что NRP–антитело с scFv против PD–L1 и NRP–антитело с scFv против Her2 распознают PD–L1 или Her2, присутствующие на поверхности линии клеток рака поджелудочной железы соответственно, с помощью антиген–распознающего участка, и слитый полипептид специфически связывается с поверхностью клеток, и, таким образом, для слитого полипептида по настоящему изобретению определено, что антитело, специфически связывающееся с антигеном–мишенью, можно по–разному использовать в зависимости от целевого опухолеспецифического антигена.
<Пример 4> Определение характеристик высвобождения CXCL16
С помощью ELISA на CXCL16 человека определяли, расщепляется ли участок расщепления фурином в слитом полипептиде (NRP–антителе), полученном в примере 2 выше, фурином из линии злокачественных клеток, и высвобождается ли CXCL16.
ELISA на CXCL16 осуществляли способом с использованием набора ELISA на CXCL16 человека (#DCX160) (R&D system). Для анализа ELISA слитый полипептид с scFv против мезотелина (NRP–антитело с scFv против мезотелина) добавляли в количестве 0,5 мкг/мл и 50 мкл/лунку в 96–луночный планшет для ELISA (R&D) и оставляли при комнатной температуре на два часа, таким образом, что для анализа использовали абсорбированный белок. Указанный планшет промывали, после чего в него добавляли пероксидазную метку в количестве 200 мкл/лунку в виде вторичного антитела и оставляли при комнатной температуре на два часа. Указанный планшет промывали Tween–PBS, после чего в него добавляли раствор субстрата ABTS для проявления цвета, таким образом, что измеряли поглощение при OD 415 нм с использованием спектрофотометра для чтения планшетов.
Результаты показаны на фиг. 6.
Как показано на фиг. 6, определяли, что слитый полипептид (NRP–антитело) связывается с мезотелином из линии клеток рака поджелудочной железы, т.е. Panc–1, после чего участок расщепления фурином в слитом полипептиде расщепляется фурином из злокачественной клетки, таким образом, что высвобождается CXCL16.
<Пример 5> Определение повышения способности NK–клеток к миграции в зависимости от CXCL16, высвобождающегося из слитого полипептида
Для определения того, распознает ли слитый полипептид, полученный в примере 2 выше, и связывается ли со злокачественным новообразованием, экспрессирующим антиген–мишень, после чего CXCL16, белок для индукции миграции NK–клеток, высвобождается для повышения миграции NK–клеток, использовали систему камеры Бойдена.
Линии клеток HPDE, Panc–1 (ATCC, кат. № CRL–1469), HCT116 (ATCC, кат. № CCL–247), MCF7 (ATCC, кат. № HTB–22) и HT–29 (ATCC, кат. № HTB–38) добавляли в количестве 2×105 на нижний слой камеры Бойдена (Fisher Scientific, #07–200–155) и культивировали в инкубаторе с CO2 при 37°C в течение двух часов. Слитый полипептид с scFv против мезотелина добавляли в количестве 1 мкг/мл в каждую из указанных выше линий клеток и культивировали в инкубаторе с CO2 при 37°C в течение четырех часов. NK–клетки метили CFSE (BioLegend, #RUO 423801), затем добавляли в количестве 2×105 на верхний слой, а затем культивировали в инкубаторе с CO2 при 37°C в течение четырех часов. После этого клетки собирали из нижнего слоя и с помощью FACS определяли распределение CFSE–меченых NK–клеток.
Результаты показаны на фиг. 7.
Как показано на фиг. 7, определяли, что способность выращенных NK–клеток человека к миграции повышалась под действием CXCL16, высвобождающегося из слитого полипептида с scFv против мезотелина, и дополнительно определяли, что степень повышения миграции NK–клеток варьируется в зависимости от типа линии злокачественных клеток.
Кроме того, слитый полипептид с scFv против PD–L1 и слитый полипептид с scFv против Her2, полученные в примере 2 выше, добавляли к линиям клеток Panc–1, HT–29 или MCF7 и, таким образом, определяли, что миграция NK–клеток в системе камеры Бойдена повышается в тех же условиях, что и в эксперименте с указанным слитым полипептидом с scFv против мезотелина, результаты показаны на фиг. 8 (NRP–антитело с scFv против PD–L1 в случае Panc–1), фиг. 9 (NRP–антитело с scFv против PD–L1 в случае HT–29), фиг. 10 (NRP–антитело с scFv против Her2 в случае Panc–1) и фиг. 11 (NRP–антитело с scFv против Her2 в случае MCF7).
Как показано на фиг. 8–11, определяли, что способность выращенных NK–клеток человека к миграции повышалась под действием CXCL16, высвобождающегося из каждого слитого полипептида, так же, как и в случае слитого полипептида с scFv против мезотелина.
Кроме того, слитые полипептиды с scFv против CD–19, MUC–1, EGFR и VEGFR, полученные в примере 2 выше, добавляли к линиям клеток HPDE, K562 (ATCC, кат. № CCL–243), HCT116 (ATCC, кат. № CCL–247), Panc–1 (ATCC, кат. № CRL–1469) или MCF7 (ATCC, кат. № HTB–22) и, таким образом, определяли, повышена ли миграция NK–клеток или нет в тех же условиях, что и в эксперименте с указанным слитым полипептидом с scFv против мезотелина в системе камеры Бойдена, результаты показаны на фиг. 12 (NRP–антитело с scFv против CD19), фиг. 13 (NRP–антитело с scFv против MUC–1), фиг. 14 (NRP–антитело с scFv против EGFR) и фиг. 15 (NRP–антитело с scFv против VEGFR), соответственно.
Как показано на фиг. 12–15, определяли, что способность выращенных NK–клеток человека к миграции повышалась под действием CXCL16, высвобождающегося из слитого полипептида, и дополнительно определяли, что степень повышения миграции NK–клеток варьируется в зависимости от типа линии злокачественных клеток.
<Пример 6> Определение способности NK–клеток к инвазии в зависимости от CXCL16, высвобождающегося из слитого полипептида
Анализ инвазии использовали для определения того, распознает ли каждый слитый полипептид, полученный в примере 2 выше, и связывается ли с антигеном–мишенью, экспрессирующимся на злокачественной клетке, после чего CXCL16, белок для индукции миграции NK–клеток, высвобождается для повышения способности NK–клеток к инвазии в злокачественные клетки.
В частности, линии клеток HPDE, Panc–1, HCT116, MCF7, HT–29 и K562 добавляли в количестве 2×105 на нижний слой камеры Бойдена (Fisher Scientific, #07–200–155) и культивировали в инкубаторе с CO2 при 37°C в течение двух часов, после чего слитый полипептид, полученный в примере 2, добавляли в количестве 1 мкг/мл к каждой из указанных выше линий клеток. Верхний слой обрабатывали матригелем (BD, #354234), после чего к нему добавляли NK–клетки в количестве 2×105 и культивировали в инкубаторе с CO2 при 37°C в течение 48 часов. После этого, собирали верхний слой и окрашивали кристаллвиолетом в течение одного часа, после чего делали фотографии трех частей верхнего слоя, таким образом, что измеряли способность NK–клеток к инвазии с помощью программного обеспечения ImageJ.
Результаты для каждого слитого полипептида показаны на фиг. 16–24, соответственно.
Как показано на фиг. 16–24, определяли, что инвазивность выращенных NK–клеток человека повышалась под действием CXCL16, высвобождающегося из слитого полипептида, и дополнительно определяли, что степень повышения способности NK–клеток к инвазии варьируется в зависимости от типа линии злокачественных клеток.
<Пример 7> Определение индуцированной гибели линий злокачественных клеток под действием индуцированных NK–клеток
Определяли эффективность антителозависимой клеточной цитотоксичности (ADCC) в отношении индукции гибели линий злокачественных клеток под действием NK–клеток, индукция которых повышалась после высвобождения CXCL16 из слитого полипептида, полученного в примере 2 выше.
Линии клеток Panc–1 добавляли в количестве 2×105 в 96–луночный планшет и культивировали в инкубаторе с CO2 при 37°C в течение двух часов. Клетки–мишени обрабатывали слитым полипептидом с scFv против мезотелина в количестве 1 мкг/мл и культивировали в инкубаторе с CO2 при 37°C в течение двух часов. NK–клетки добавляли в количестве 2×105 для достижения соотношения клеток–мишеней и эффекторных клеток 1:1 и культивировали в инкубаторе с CO2 при 37°C в течение четырех часов. Клетки собирали, затем промывали PBS, затем окрашивали аннексином V (1 мкг/мл) и PI (1 мкг/мл) в течение 30 минут, а затем анализировали посредством FACS.
Результаты показаны на фиг. 25.
Как показано на фиг. 25, определяли, что гибель злокачественных клеток значительно повышалась под действием NK–клеток, индукция которых повышалась после высвобождения CXCL16.
<Пример 8> Определение терапевтической эффективности слитого полипептида в модели на животных с трансплантированными злокачественными клетками
Слитый полипептид, полученный в примере 2, инъецировали в модели на животных с трансплантированными злокачественными клетками для определения их эффекта in vivo.
Для эксперимента in vivo использовали самок мышей NSG (NOD.Cg–PrkdcscidIl2rgtm1wjl/SzJ) возрастом шесть недель. С животными обращались в соответствии с требованиями Комитета по содержанию и использованию животных Центра по содержанию лабораторных животных Корейского исследовательского института бионауки и биотехнологии. Panc–1 инъецировали в поджелудочную железу мыши, после чего опухоль образовывалась в течение двух недель, и интраперитонеально инъецировали слитый полипептид с scFv против мезотелина, PD–L1 или Her2 (5 мг/кг) с интервалом в пять дней.
Для эксперимента по росту опухоли NK–клетки инъецировали I.V. в количестве 1×107/мышь. Для наблюдения за ростом опухоли наблюдали за ростом Panc–1, экспрессирующих люциферазу, с использованием программного обеспечения IVIS Living Image 3.0. Для эксперимента по способности NK–клеток к миграции NK–клетки, окрашенные DiR, внутривенно инъецировали в количестве 1×107/мышь и определяли их с использованием программного обеспечения IVIS Fluorescence Image и FACS.
Результаты показаны на фиг. 26–29. На фиг. 26 показана индукция NK–клеток в отношении злокачественной ткани в зависимости от введения слитого полипептида, полученного в примере 2 выше, а также NK–клеток, и на фиг. 27, 28 и 29 показаны результаты определения терапевтического эффекта посредством введения NRP–антитела с scFv против мезотелина, NRP–антитела с scFv против PD–L1 и NRP–антитела с scFv против Her2, соответственно, вместе с NK–клетками.
Как показано на A на фиг. 26, миграция NK–клеток в злокачественную ткань значительно повышалась под действием NRP–антитела. Как показано на B на фиг. 26, такой агонистический эффект возникал только при добавлении NRP–антитела.
Кроме того, как показано на фиг. 27–29, в случае введения слитого полипептида, полученного в примере 2, вместе с NK–клетками, значительно ингибировали рост опухоли и значительно повышали миграцию NK–клеток в опухолевую ткань.
Учитывая представленные выше результаты, определяли, что слитый полипептид по настоящему изобретению повышает миграцию NK–клеток, иммуноцитарного терапевтического средства, таким образом, демонстрируя значительный эффект в отношении лечения злокачественных опухолей.
<Пример 9> Определение характерного изменения NK–клеток в зависимости от обработки CXCL16
Для определения характерного изменения NK–клеток с помощью CXCL16, высвобождающегося из слитого полипептида, NK–клетки обрабатывали ИЛ–2 и CXCL16, способствующими росту NK–клеток, в концентрации 200 Ед. и 100 нМ, соответственно, в течение 0, 1, 2, 8 или 16 часов и определяли распределение CD56dim и CD56bright посредством FACS, результаты показаны на фиг. 30, и клетки в квадрате наверху справа соответствуют CD56bright клеткам.
Как показано на фиг. 30, определяли, что распределение клеток изменяли с CD56dim на CD56bright с помощью обработки CXCL16 в зависимости от времени обработки.
Кроме того, обработку ИЛ–2 и CXCL16 осуществляли одновременно в течение длительного периода времени (14 дней) аналогично экспериментальному способу, описанному выше, после чего определяли изменение экспрессии CD56, результаты показаны на фиг. 31.
Как показано на фиг. 31, изменение в CD56bright клетки определяли в экспериментальной группе, которой совместно вводили ИЛ–2 и CXCL16 (ИЛ–2+CXCL16 на фиг. 31A и CXCL16 на фиг. 31B).
Учитывая указанные выше результаты, определяли, что CXCL16 изменяет CD56dim в CD56bright, имеющие значительный эффект ADCC, таким образом, оказывая влияние на характеристики NK–клеток.
<Пример 10> Характерное изменение NK–клеток в зависимости от обработки слитым полипептидом (NRP–антителом)
Определяли изменение эффективности ADCC, индуцирующей гибели злокачественных клеток, в зависимости от распределения NK–клетки, измененного с помощью CXCL16.
Линию клеток Panc–1 в количестве 2×105 добавляли в 96–луночный планшет и культивировали в инкубаторе с CO2 при 37°C в течение двух часов. К ним добавляли NK–клетки в количестве 2×105 для достижения соотношения клеток–мишеней и эффекторных клеток 1:1 и культивировали в инкубаторе с CO2 при 37°C в течение четырех часов. Клетки собирали, промывали PBS, окрашивали аннексином V (1 мкг/мл) и PI (1 мкг/мл) в течение 30 минут, а затем анализировали посредством FACS.
Результаты показаны на фиг. 32.
Как показано на фиг. 32, определяли, что гибель злокачественных клеток повышалась под действием CD56bright CD16+ NK–клеток, повышенных с помощью CXCL16 из слитого полипептида.
--->
<110> Korea Research Institute of Bioscience and Biotechnology
<120> АКТИВИРУЮЩИЙ NK-КЛЕТКИ СЛИТЫЙ БЕЛОК, NK-КЛЕТКИ И ФАРМАЦЕВТИЧЕСКАЯ
КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ИХ
<130> P18013-KRI
<150> KR 10/2017/0043988
<151> 2017-04-05
<160> 43
<170> KoPatentIn 3.0
<210> 1
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> scFV против мезотелина
<400> 1
Met Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Glu Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly
20 25 30
Tyr Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp
35 40 45
Ile Gly Leu Ile Thr Pro Tyr Asn Gly Ala Ser Ser Tyr Asn Gln Lys
50 55 60
Phe Arg Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Asp Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Gly Gly Tyr Asp Gly Arg Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Gly Val Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala
130 135 140
Ile Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala
145 150 155 160
Ser Ser Ser Val Ser Tyr Met His Trp Tyr Gln Gln Lys Ser Gly Thr
165 170 175
Ser Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val
180 185 190
Pro Gly Arg Phe Ser Gly Ser Gly Ser Gly Asn Ser Tyr Ser Leu Thr
195 200 205
Ile Ser Ser Val Glu Glu Ala Glu Asp Asp Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln Trp Ser Gly Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu
225 230 235 240
Ile Lys
<210> 2
<211> 723
<212> ДНК
<213> Искусственная последовательность
<220>
<223> scFV против мезотелина
<400> 2
atgcaggtac aactgcagca gtctgggcct gagctggaga agcctggcgc ttcagtgaag 60
atatcctgca aggcttctgg ttactcattc actggctaca ccatgaactg ggtgaagcag 120
agccatggaa agagccttga gtggattgga cttattactc cttacaatgg tgcttctagc 180
tacaaccaga agttcagggg caaggccaca ttaactgtag acaagtcatc cagcacagcc 240
tacatggacc tcctcagtct gacatctgaa gactctgcag tctatttctg tgcaaggggg 300
ggttacgacg ggaggggttt tgactactgg ggccaaggga ccacggtcac cgtctcctca 360
ggtgtaggcg gttcaggcgg cggtggctct ggcggtggcg gatcggacat cgagctcact 420
cagtctccag caatcatgtc tgcatctcca ggggagaagg tcaccatgac ctgcagtgcc 480
agctcaagtg taagttacat gcactggtac cagcagaagt caggcacctc ccccaaaaga 540
tggatttatg acacatccaa actggcttct ggagtcccag gtcgcttcag tggcagtggg 600
tctggaaact cttactctct cacaatcagc agcgtggagg ctgaagatga tgcaacttat 660
tactgccagc agtggagtgg ttaccctctc acgttcggtg ctgggacaaa gttggaaata 720
aaa 723
<210> 3
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против PD-L1
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asp Val His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Leu His Ala Asp Thr Gly Ile Thr Lys Phe Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Gln Leu Trp Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 4
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против PD-L1
<400> 4
caggtccaac ttgtgcagtc tggggctgag gtgaagaagc ctggggcctc agtgaaggtt 60
tcctgcaagg cttctggata caccttcact agctatgatg tacattgggt gcgccaggcc 120
cccggacaaa ggcttgagtg gatgggatgg ctccacgctg acactggtat cacaaaattt 180
tcacagaagt tccagggcag agtcaccatt accagggaca catccgcgag cacagcctac 240
atggagctga gcagcctgag atctgaagac acggctgtgt attactgtgc gagggagagg 300
atacagctat ggtttgacta ctggggccag ggaaccctgg tcaccgtctc ctca 354
<210> 5
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против PD-L1
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 6
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против PD-L1
<400> 6
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca gggtattagc agctggttag cctggtatca gcagaaacca 120
gagaaagccc ctaagtccct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgccaacag tataatagtt acccgtacac ttttggccag 300
gggaccaagc tggagatcaa a 321
<210> 7
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<223> PD-L1
<400> 7
aacataaccg gacagagcca ccaccctaca ggtcttcctc agagatcagc ttctgctcga 60
attccacgag gctggctcct ccacgcagca cggtcacttt tgtgccggtg ccgaacactc 120
tggtgctgct gcttgtgtag ctgctgcagt agtagtcggc ctcgtcctcg gcctgcagtc 180
cgctgatggt caggctggcg gtgttgccgc tcttgctgcc gctgaatctg ttggacacgc 240
cgctgggccg gttggacacg tcgtagatca tcagcttggg ggccttgccg gggtgctgct 300
gataccagga cacgtagttg tagccgccca cgtcgctgct ggtgcctgtg cagctgatgg 360
tgatgctctg gccagggctg ccggacacgc tggcaggctg tgtcagggcg ctctgggaac 420
ccacaccgct ggatccaccg gagcctcctc cgccactacc tcctcctccg aggcccccga 480
ggccagagga cacggtgacc agggtgccct ggccccagta gtccacggtg gtcacggtgc 540
ccagcttgat ccgggcgcag tagtacacgg cggtgtcctc ggcccgcagg ctgttcatct 600
gcaggtacag ggtgttcttg ctgttgtccc ggctgatggt gaaccggccc ttcacggtgt 660
cggcgtagaa ggtgatgccg ccgctggggt agatgctgga cacccattcc aggcccttgc 720
caggggcctg tcggacccac atcatgatat agctgctgaa tgtgaagccg ctggcggcgc 780
aagacagtct caggctgccg ccaggctgca ccagtcctcc gccgctttcc agcagctgca 840
cctcggccat ggccggctgg gccgcgagta ataacaatcc agcggctgcc gtaggcaata 900
ggtatttcat gatttgccct cgttatctag aaattcgtaa tcatggtcat agctgtttcc 960
tgtgtgaaat tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg 1020
taaagcctgg ggtgcctaat gagtgagcta actcacatta attgcgttga ggtgggctgc 1080
aaaacaaaac ggcctcctgt caggaagccg cttttatcgg gtaccgctca ctggccgctt 1140
tccagtcggg aaacctgtct tgccagctgc attaatgaat cggccaaccc ccggggaaaa 1200
ggcggttttc gttttggggg cccagggggg tttttttttt tccccgggga acgggggaca 1260
acctgatatg ccctttaccg cctgggcccc ggaaaaaatt taaaaaaagg ggccacccct 1320
ggtttgcccc acaagggaaa aaacttgtgt ttg 1353
<210> 8
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против Her2
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Asx Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против Her2
<400> 9
atggaggttc agctggtgga gtctggcggt ggcctggtgc agccaggggg ctcactccgt 60
ttgtcctgtg cagcttctgg cttcaacatt aaagacacct atatacactg ggtgcgtcag 120
gccccgggta agggcctgga atgggttgca aggatttatc ctacgaatgg ttatactaga 180
tatgccgata gcgtcaaggg ccgtttcact ataagcgcag acacatccaa aaacacagcc 240
tacctgcaga tgaacagcct gcgtgctgag gacactgccg tctattattg ttctagatgg 300
ggaggggacg gcttctatgc tatggacgtg tggggtcaag gaaccctggt caccgtctcc 360
tcg 363
<210> 10
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против Her2
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против Her2
<400> 11
gatatccaga tgacccagtc cccgagctcc ctgtccgcct ctgtgggcga tagggtcacc 60
atcacctgcc gtgccagtca ggatgtgaat actgctgtag cctggtatca acagaaacca 120
ggaaaagctc cgaaactact gatttactcg gcatccttcc tcgagtctgg agtcccttct 180
cgcttctctg gatccagatc tgggacggat ttcactctga ccatcagcag tctgcagccg 240
gaagacttcg caacttatta ctgtcagcaa cattatacta ctcctcccac gttcggacag 300
ggtaccaagg tggagatcaa a 321
<210> 12
<211> 3768
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Her2
<400> 12
atggagctgg cggccttgtg ccgctggggg ctcctcctcg ccctcttgcc ccccggagcc 60
gcgagcaccc aagtgtgcac cggcacagac atgaagctgc ggctccctgc cagtcccgag 120
acccacctgg acatgctccg ccacctctac cagggctgcc aggtggtgca gggaaacctg 180
gaactcacct acctgcccac caatgccagc ctgtccttcc tgcaggatat ccaggaggtg 240
cagggctacg tgctcatcgc tcacaaccaa gtgaggcagg tcccactgca gaggctgcgg 300
attgtgcgag gcacccagct ctttgaggac aactatgccc tggccgtgct agacaatgga 360
gacccgctga acaataccac ccctgtcaca ggggcctccc caggaggcct gcgggagctg 420
cagcttcgaa gcctcacaga gatcttgaaa ggaggggtct tgatccagcg gaacccccag 480
ctctgctacc aggacacgat tttgtggaag gacatcttcc acaagaacaa ccagctggct 540
ctcacactga tagacaccaa ccgctctcgg gcctgccacc cctgttctcc gatgtgtaag 600
ggctcccgct gctggggaga gagttctgag gattgtcaga gcctgacgcg cactgtctgt 660
gccggtggct gtgcccgctg caaggggcca ctgcccactg actgctgcca tgagcagtgt 720
gctgccggct gcacgggccc caagcactct gactgcctgg cctgcctcca cttcaaccac 780
agtggcatct gtgagctgca ctgcccagcc ctggtcacct acaacacaga cacgtttgag 840
tccatgccca atcccgaggg ccggtataca ttcggcgcca gctgtgtgac tgcctgtccc 900
tacaactacc tttctacgga cgtgggatcc tgcaccctcg tctgccccct gcacaaccaa 960
gaggtgacag cagaggatgg aacacagcgg tgtgagaagt gcagcaagcc ctgtgcccga 1020
gtgtgctatg gtctgggcat ggagcacttg cgagaggtga gggcagttac cagtgccaat 1080
atccaggagt ttgctggctg caagaagatc tttgggagcc tggcatttct gccggagagc 1140
tttgatgggg acccagcctc caacactgcc ccgctccagc cagagcagct ccaagtgttt 1200
gagactctgg aagagatcac aggttaccta tacatctcag catggccgga cagcctgcct 1260
gacctcagcg tcttccagaa cctgcaagta atccggggac gaattctgca caatggcgcc 1320
tactcgctga ccctgcaagg gctgggcatc agctggctgg ggctgcgctc actgagggaa 1380
ctgggcagtg gactggccct catccaccat aacacccacc tctgcttcgt gcacacggtg 1440
ccctgggacc agctctttcg gaacccgcac caagctctgc tccacactgc caaccggcca 1500
gaggacgagt gtgtgggcga gggcctggcc tgccaccagc tgtgcgcccg agggcactgc 1560
tggggtccag ggcccaccca gtgtgtcaac tgcagccagt tccttcgggg ccaggagtgc 1620
gtggaggaat gccgagtact gcaggggctc cccagggagt atgtgaatgc caggcactgt 1680
ttgccgtgcc accctgagtg tcagccccag aatggctcag tgacctgttt tggaccggag 1740
gctgaccagt gtgtggcctg tgcccactat aaggaccctc ccttctgcgt ggcccgctgc 1800
cccagcggtg tgaaacctga cctctcctac atgcccatct ggaagtttcc agatgaggag 1860
ggcgcatgcc agccttgccc catcaactgc acccactcct gtgtggacct ggatgacaag 1920
ggctgccccg ccgagcagag agccagccct ctgacgtcca tcgtctctgc ggtggttggc 1980
attctgctgg tcgtggtctt gggggtggtc tttgggatcc tcatcaagcg acggcagcag 2040
aagatccgga agtacacgat gcggagactg ctgcaggaaa cggagctggt ggagccgctg 2100
acacctagcg gagcgatgcc caaccaggcg cagatgcgga tcctgaaaga gacggagctg 2160
aggaaggtga aggtgcttgg atctggcgct tttggcacag tctacaaggg catctggatc 2220
cctgatgggg agaatgtgaa aattccagtg gccatcaaag tgttgaggga aaacacatcc 2280
cccaaagcca acaaagaaat cttagacgaa gcatacgtga tggctggtgt gggctcccca 2340
tatgtctccc gccttctggg catctgcctg acatccacgg tgcagctggt gacacagctt 2400
atgccctatg gctgcctctt agaccatgtc cgggaaaacc gcggacgcct gggctcccag 2460
gacctgctga actggtgtat gcagattgcc aaggggatga gctacctgga ggatgtgcgg 2520
ctcgtacaca gggacttggc cgctcggaac gtgctggtca agagtcccaa ccatgtcaaa 2580
attacagact tcgggctggc tcggctgctg gacattgacg agacagagta ccatgcagat 2640
gggggcaagg tgcccatcaa gtggatggcg ctggagtcca ttctccgccg gcggttcacc 2700
caccagagtg atgtgtggag ttatggtgtg actgtgtggg agctgatgac ttttggggcc 2760
aaaccttacg atgggatccc agcccgggag atccctgacc tgctggaaaa gggggagcgg 2820
ctgccccagc cccccatctg caccattgat gtctacatga tcatggtcaa atgttggatg 2880
attgactctg aatgtcggcc aagattccgg gagttggtgt ctgaattctc ccgcatggcc 2940
agggaccccc agcgctttgt ggtcatccag aatgaggact tgggcccagc cagtcccttg 3000
gacagcacct tctaccgctc actgctggag gacgatgaca tgggggacct ggtggatgct 3060
gaggagtatc tggtacccca gcagggcttc ttctgtccag accctgcccc gggcgctggg 3120
ggcatggtcc accacaggca ccgcagctca tctaccagga gtggcggtgg ggacctgaca 3180
ctagggctgg agccctctga agaggaggcc cccaggtctc cactggcacc ctccgaaggg 3240
gctggctccg atgtatttga tggtgacctg ggaatggggg cagccaaggg gctgcaaagc 3300
ctccccacac atgaccccag ccctctacag cggtacagtg aggaccccac agtacccctg 3360
ccctctgaga ctgatggcta cgttgccccc ctgacctgca gcccccagcc tgaatatgtg 3420
aaccagccag atgttcggcc ccagccccct tcgccccgag agggccctct gcctgctgcc 3480
cgacctgctg gtgccactct ggaaagggcc aagactctct ccccagggaa gaatggggtc 3540
gtcaaagacg tttttgcctt tgggggtgcc gtggagaacc ccgagtactt gacaccccag 3600
ggaggagctg cccctcagcc ccaccctcct cctgccttca gcccagcctt cgacaacctc 3660
tattactggg accaggaccc accagagcgg ggggctccac ccagcacctt caaagggaca 3720
cctacggcag agaacccaga gtacctgggt ctggacgtgc cagtgtga 3768
<210> 13
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FC
<400> 13
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Phe Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Ile Leu Gln Ile Ser Ile Thr Leu
225 230 235
<210> 14
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<223> FC
<400> 14
gacaaaactc acacatgccc accgtgccca gcacctgaac tcctgggggg accgtcagtc 60
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 120
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 180
ggcgtggagg tgcataatgc caagacaaag cggcgggagg agcagtacaa cagcacgtac 240
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 300
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 360
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 420
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 480
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 540
gacggctcct tcttcttcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 600
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 660
ctctccctgt ctccgggtaa aattctgcag atatccatca cactg 705
<210> 15
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Фурин
<400> 15
Arg Val Lys Arg
1
<210> 16
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Фурин
<400> 16
acgggtgaag cgg 13
<210> 17
<211> 89
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CXCL16
<400> 17
Asn Glu Gly Ser Val Thr Gly Ser Cys Tyr Cys Gly Lys Arg Ile Ser
1 5 10 15
Ser Asp Ser Pro Pro Ser Val Gln Phe Met Asn Arg Leu Arg Lys His
20 25 30
Leu Arg Ala Tyr His Arg Cys Leu Tyr Tyr Thr Arg Phe Gln Leu Leu
35 40 45
Ser Trp Ser Val Cys Gly Gly Asn Lys Asp Pro Trp Val Gln Glu Leu
50 55 60
Met Ser Cys Leu Asp Leu Lys Glu Cys Gly His Ala Tyr Ser Gly Ile
65 70 75 80
Val Ala His Gln Lys His Leu Leu Pro
85
<210> 18
<211> 270
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CXCL16
<400> 18
aacgagggca gcgtcactgg aagttgttat tgtggtaaaa gaatttcttc cgactccccg 60
ccatcggttc agttcatgaa tcgtctccgg aaacacctga gagcttacca tcggtgtcta 120
tactacacga ggttccagct cctttcctgg agcgtgtgtg gaggcaacaa ggacccatgg 180
gttcaggaat tgatgagctg tcttgatctc aaagaatgtg gacatgctta ctcggggatt 240
gtggcccacc agaagcattt acttccttag 270
<210> 19
<211> 8748
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Экспрессирующий вектор для слитого белка
<400> 19
gacggatcgg gagatctccc gatcccctat ggtcgactct cagtacaatc tgctctgatg 60
ccgcatagtt aagccagtat ctgctccctg cttgtgtgtt ggaggtcgct gagtagtgcg 120
cgagcaaaat ttaagctaca acaaggcaag gcttgaccga caattgcatg aagaatctgc 180
ttagggttag gcgttttgcg ctgcttcgcg atgtacgggc cagatatacg cgttgacatt 240
gattattgac tagttattaa tagtaatcaa ttacggggtc attagttcat agcccatata 300
tggagttccg cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc 360
cccgcccatt gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc 420
attgacgtca atgggtggac tatttacggt aaactgccca cttggcagta catcaagtgt 480
atcatatgcc aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt 540
atgcccagta catgacctta tgggactttc ctacttggca gtacatctac gtattagtca 600
tcgctattac catggtgatg cggttttggc agtacatcaa tgggcgtgga tagcggtttg 660
actcacgggg atttccaagt ctccacccca ttgacgtcaa tgggagtttg ttttggcacc 720
aaaatcaacg ggactttcca aaatgtcgta acaactccgc cccattgacg caaatgggcg 780
gtaggcgtgt acggtgggag gtctatataa gcagagctct ctggctaact agagaaccca 840
ctgcttactg gcttatcgaa attaatacga ctcactatag ggagacccaa gcttggtacc 900
gagctcggat ccatgggatg gagctatatc atcctctttt tggtagcaac agctacagat 960
gtccactcgg cccagccggc catggccgac caggtacaga tgcagctggt agagtctggg 1020
gctgaagtga agaagcctgg ggcttcagtg aagctgtcct gcaaggcttc tggctacacc 1080
ttcagcagct actggatgca ctgggtgcgc caggcccctg gacaacgcct tgagtggatg 1140
ggagagatta atcctggcaa cggtcatact aactacaacg agaagttcaa gtcacgcgtg 1200
acaatcactg tagacaaatc cgcgagcaca gcctacatgg agctcagcag cctgagatct 1260
gagaacacgg cggtctatta ctgtgcaaga tcttttacta cggcacgggc gtttgcttac 1320
tggggccaag ggactctggt caccgtctcc tcaggcctcg gatgcaggta caactgcagc 1380
agtctgggcc tgagctggag aagcctggcg cttcagtgaa gatatcctgc aaggcttctg 1440
gttactcatt cactggctac accatgaact gggtgaagca gagccatgga aagagccttg 1500
agtggattgg acttattact ccttacaatg gtgcttctag ctacaaccag aagttcaggg 1560
gcaaggccac attaactgta gacaagtcat ccagcacagc ctacatggac ctcctcagtc 1620
tgacatctga agactctgca gtctatttct gtgcaagggg gggttacgac gggaggggtt 1680
ttgactactg gggccaaggg accacggtca ccgtctcctc aggtgtaggc ggttcaggcg 1740
gcggtggctc tggcggtggc ggatcggaca tcgagctcac tcagtctcca gcaatcatgt 1800
ctgcatctcc aggggagaag gtcaccatga cctgcagtgc cagctcaagt gtaagttaca 1860
tgcactggta ccagcagaag tcaggcacct cccccaaaag atggatttat gacacatcca 1920
aactggcttc tggagtccca ggtcgcttca gtggcagtgg gtctggaaac tcttactctc 1980
tcacaatcag cagcgtggag gctgaagatg atgcaactta ttactgccag cagtggagtg 2040
gttaccctct cacgttcggt gctgggacaa agttggaaat aaaagggccc atcggccggt 2100
gggccctggt gccgcgcggc agcgctagcg acaaaactca cacatgccca ccgtgcccag 2160
cacctgaact cctgggggga ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc 2220
tcatgatctc ccggacccct gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc 2280
ctgaggtcaa gttcaactgg tacgtggacg gcgtggaggt gcataatgcc aagacaaagc 2340
ggcgggagga gcagtacaac agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc 2400
aggactggct gaatggcaag gagtacaagt gcaaggtctc caacaaagcc ctcccagccc 2460
ccatcgagaa aaccatctcc aaagccaaag ggcagccccg agaaccacag gtgtacaccc 2520
tgcccccatc ccgggatgag ctgaccaaga accaggtcag cctgacctgc ctggtcaaag 2580
gcttctatcc cagcgacatc gccgtggagt gggagagcaa tgggcagccg gagaacaact 2640
acaagaccac gcctcccgtg ctggactccg acggctcctt cttcttctac agcaagctca 2700
ccgtggacaa gagcaggtgg cagcagggga acgtcttctc atgctccgtg atgcatgagg 2760
ctctgcacaa ccactacacg cagaagagcc tctccctgtc tccgggtaaa attctgcaga 2820
tatccatcac actggcggcc gcacgggtga agcggaacga gggcagcgtc actggaagtt 2880
gttattgtgg taaaagaatt tcttccgact ccccgccatc ggttcagttc atgaatcgtc 2940
tccggaaaca cctgagagct taccatcggt gtctatacta cacgaggttc cagctccttt 3000
cctggagcgt gtgtggaggc aacaaggacc catgggttca ggaattgatg agctgtcttg 3060
atctcaaaga atgtggacat gcttactcgg ggattgtggc ccaccagaag catttacttc 3120
cttaggcggc cgctcgagat tccgcccctc tccctccccc ccccctaacg ttactggccg 3180
aagccgcttg gaataaggcc ggtgtgcgtt tgtctatatg tgattttcca ccatattgcc 3240
gtcttttggc aatgtgaggg cccggaaacc tggccctgtc ttcttgacga gcattcctag 3300
gggtctttcc cctctcgcca aaggaatgca aggtctgttg aatgtcgtga aggaagcagt 3360
tcctctggaa gcttcttgaa gacaaacaac gtctgtagcg accctttgca ggcagcggaa 3420
ccccccacct ggcgacaggt gcctctgcgg ccaaaagcca cgtgtataag atacacctgc 3480
aaaggcggca caaccccagt gccacgttgt gagttggata gttgtggaaa gagtcaaatg 3540
gctctcctca agcgtattca acaaggggct gaaggatgcc cagaaggtac cccattgtat 3600
gggatctgat ctggggcctc ggtgcacatg ctttacatgt gtttagtcga ggttaaaaaa 3660
acgtctaggc cccccgaacc acggggacgt ggttttcctt tgaaaaacat cgatgataat 3720
atggttcgac cattgaactg catcgtcgcc gtgtcccaaa atatggggat tggcaagaac 3780
ggagacctac cctggcctcc gctcaggaac gagttcaagt acttccaaag aatgaccaca 3840
acctcttcag tggaaggtaa acagaatctg gtgattatgg gtaggaaaac ctggttctcc 3900
attcctgaga agaatcgacc tttaaaggac agaatcaata tagttctcag tagagaactc 3960
aaagaaccac cacgaggagc tcattttctt gccaaaagtt tggatgatgc cttaagactt 4020
attgaacaac cggaattggc aagtaaagta gacatggttt ggatagtcgg aggcagttct 4080
gtttaccagg aagccatgaa tcaaccaggc cacctcagac tctttgtgac aaggatcatg 4140
caggaatttg aaagtgacac gtttttccca gaaattgatt tggggaaata taaacttctc 4200
ccagaatacc caggcgtcct ctctgaggtc caggaggaaa aaggcatcaa gtataagttt 4260
gaagtctacg agaagaaaga ctaatctaga gggccctatt ctatagtgtc acctaaatgc 4320
tagagctcgc tgatcagcct cgactgtgcc ttctagttgc cagccatctg ttgtttgccc 4380
ctcccccgtg ccttccttga ccctggaagg tgccactccc actgtccttt cctaataaaa 4440
tgaggaaatt gcatcgcatt gtctgagtag gtgtcattct attctggggg gtggggtggg 4500
gcaggacagc aagggggagg attgggaaga caatagcagg catgctgggg atgcggtggg 4560
ctctatggct tctgaggcgg aaagaaccag ctggggctct agggggtatc cccacgcgcc 4620
ctgtagcggc gcattaagcg cggcgggtgt ggtggttacg cgcagcgtga ccgctacact 4680
tgccagcgcc ctagcgcccg ctcctttcgc tttcttccct tcctttctcg ccacgttcgc 4740
cggctttccc cgtcaagctc taaatcgggg catcccttta gggttccgat ttagtgcttt 4800
acggcacctc gaccccaaaa aacttgatta gggtgatggt tcacgtagtg ggccatcgcc 4860
ctgatagacg gtttttcgcc ctttgacgtt ggagtccacg ttctttaata gtggactctt 4920
gttccaaact ggaacaacac tcaaccctat ctcggtctat tcttttgatt tataagggat 4980
tttggggatt tcggcctatt ggttaaaaaa tgagctgatt taacaaaaat ttaacgcgaa 5040
ttaattctgt ggaatgtgtg tcagttaggg tgtggaaagt ccccaggctc cccaggcagg 5100
cagaagtatg caaagcatgc atctcaatta gtcagcaacc aggtgtggaa agtccccagg 5160
ctccccagca ggcagaagta tgcaaagcat gcatctcaat tagtcagcaa ccatagtccc 5220
gcccctaact ccgcccatcc cgcccctaac tccgcccagt tccgcccatt ctccgcccca 5280
tggctgacta atttttttta tttatgcaga ggccgaggcc gcctctgcct ctgagctatt 5340
ccagaagtag tgaggaggct tttttggagg cctaggcttt tgcaaaaagc tcccgggagc 5400
ttgtatatcc attttcggat ctgatcaaga gacaggatga ggatcgtttc gcatgattga 5460
acaagatgga ttgcacgcag gttctccggc cgcttgggtg gagaggctat tcggctatga 5520
ctgggcacaa cagacaatcg gctgctctga tgccgccgtg ttccggctgt cagcgcaggg 5580
gcgcccggtt ctttttgtca agaccgacct gtccggtgcc ctgaatgaac tgcaggacga 5640
ggcagcgcgg ctatcgtggc tggccacgac gggcgttcct tgcgcagctg tgctcgacgt 5700
tgtcactgaa gcgggaaggg actggctgct attgggcgaa gtgccggggc aggatctcct 5760
gtcatctcac cttgctcctg ccgagaaagt atccatcatg gctgatgcaa tgcggcggct 5820
gcatacgctt gatccggcta cctgcccatt cgaccaccaa gcgaaacatc gcatcgagcg 5880
agcacgtact cggatggaag ccggtcttgt cgatcaggat gatctggacg aagagcatca 5940
ggggctcgcg ccagccgaac tgttcgccag gctcaaggcg cgcatgcccg acggcgagga 6000
tctcgtcgtg acccatggcg atgcctgctt gccgaatatc atggtggaaa atggccgctt 6060
ttctggattc atcgactgtg gccggctggg tgtggcggac cgctatcagg acatagcgtt 6120
ggctacccgt gatattgctg aagagcttgg cggcgaatgg gctgaccgct tcctcgtgct 6180
ttacggtatc gccgctcccg attcgcagcg catcgccttc tatcgccttc ttgacgagtt 6240
cttctgagcg ggactctggg gttcgaaatg accgaccaag cgacgcccaa cctgccatca 6300
cgagatttcg attccaccgc cgccttctat gaaaggttgg gcttcggaat cgttttccgg 6360
gacgccggct ggatgatcct ccagcgcggg gatctcatgc tggagttctt cgcccacccc 6420
aacttgttta ttgcagctta taatggttac aaataaagca atagcatcac aaatttcaca 6480
aataaagcat ttttttcact gcattctagt tgtggtttgt ccaaactcat caatgtatct 6540
tatcatgtct gtataccgtc gacctctagc tagagcttgg cgtaatcatg gtcatagctg 6600
tttcctgtgt gaaattgtta tccgctcaca attccacaca acatacgagc cggaagcata 6660
aagtgtaaag cctggggtgc ctaatgagtg agctaactca cattaattgc gttgcgctca 6720
ctgcccgctt tccagtcggg aaacctgtcg tgccagctgc attaatgaat cggccaacgc 6780
gcggggagag gcggtttgcg tattgggcgc tcttccgctt cctcgctcac tgactcgctg 6840
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 6900
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 6960
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag 7020
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 7080
caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 7140
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcaatg ctcacgctgt 7200
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 7260
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 7320
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 7380
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aaggacagta 7440
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 7500
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 7560
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 7620
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 7680
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 7740
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 7800
cgttcatcca tagttgcctg actccccgtc gtgtagataa ctacgatacg ggagggctta 7860
ccatctggcc ccagtgctgc aatgataccg cgagacccac gctcaccggc tccagattta 7920
tcagcaataa accagccagc cggaagggcc gagcgcagaa gtggtcctgc aactttatcc 7980
gcctccatcc agtctattaa ttgttgccgg gaagctagag taagtagttc gccagttaat 8040
agtttgcgca acgttgttgc cattgctaca ggcatcgtgg tgtcacgctc gtcgtttggt 8100
atggcttcat tcagctccgg ttcccaacga tcaaggcgag ttacatgatc ccccatgttg 8160
tgcaaaaaag cggttagctc cttcggtcct ccgatcgttg tcagaagtaa gttggccgca 8220
gtgttatcac tcatggttat ggcagcactg cataattctc ttactgtcat gccatccgta 8280
agatgctttt ctgtgactgg tgagtactca accaagtcat tctgagaata gtgtatgcgg 8340
cgaccgagtt gctcttgccc ggcgtcaata cgggataata ccgcgccaca tagcagaact 8400
ttaaaagtgc tcatcattgg aaaacgttct tcggggcgaa aactctcaag gatcttaccg 8460
ctgttgagat ccagttcgat gtaacccact cgtgcaccca actgatcttc agcatctttt 8520
actttcacca gcgtttctgg gtgagcaaaa acaggaaggc aaaatgccgc aaaaaaggga 8580
ataagggcga cacggaaatg ttgaatactc atactcttcc tttttcaata ttattgaagc 8640
atttatcagg gttattgtct catgagcgga tacatatttg aatgtattta gaaaaataaa 8700
caaatagggg ttccgcgcac atttccccga aaagtgccac ctgacgtc 8748
<210> 20
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для scFV против мезотелина
<400> 20
ggcccagccg gccatgcagg tacaactgca gcag 34
<210> 21
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер scFV против мезотелина
<400> 21
ggcccttggt ggaggcactc gagacggtga ccagggttc 39
<210> 22
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для scFv против PD-L1
<400> 22
ggcccagccg gccatgcagg tccaacttgt gcagtc 36
<210> 23
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для scFv против PD-L1
<400> 23
ggcccttggt ggaccaagct ggagatcaaa 30
<210> 24
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для scFv против Her2
<400> 24
ggcccagccg gccatggagg ttcagctggt gga 33
<210> 25
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер scFv против Her2
<400> 25
ggcccttggt accaaggtgg agatcaaa 28
<210> 26
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для CXCL16, участка расщепления фурином
<400> 26
cacactggcg gccgcacggg tgaagcggaa cgagggcag 39
<210> 27
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для CXCL16, участка расщепления фурином
<400> 27
aatctcgagc ggccgcctaa ggaagtaaat gcttctggtg 40
<210> 28
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против CD19
<400> 28
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Glu Asp Thr Asn Tyr Ser Gly Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Leu Leu Tyr Gly Asp Tyr Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 29
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против CD19
<400> 29
caggtgcagc tgcagcagag cggcccggaa ctggtgaaac cgggcgcgag cgtgaaaatt 60
agctgcaaag cgagcggcta tgcgtttagc agcagctgga tgaactgggt gaaacagcgc 120
ccgggcaaag gcctggaatg gattggccgc atttatccgg gcgatgaaga taccaactat 180
agcggcaaat ttaaagataa agcgaccctg accgcggata aaagcagcac caccgcgtat 240
atgcagctga gcagcctgac cagcgaagat agcgcggtgt atttttgcgc gcgcagcctg 300
ctgtatggcg attatctgga ttattggggc cagggcacca ccctgaccgt gagcagc 357
<210> 30
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против CD19
<400> 30
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Phe Leu Thr Ile Asn Asn Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Asn Ile Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 31
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против CD19
<400> 31
cagattgtgc tgacccagag cccggcgatt atgagcgcga gcccgggcga aaaagtgacc 60
atgacctgca gcgcgagcag cagcgtgagc tatatgcatt ggtatcagca gaaaagcggc 120
accagcccga aacgctggat ttatgatacc agcaaactgg cgagcggcgt gccggatcgc 180
tttagcggca gcggcagcgg caccagctat tttctgacca ttaacaacat ggaagcggaa 240
gatgcggcga cctattattg ccagcagtgg aacattaacc cgctgacctt tggcgcgggc 300
accaaactgg aactgaaacg c 321
<210> 32
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против MCU-1
<400> 32
Gln Val Lys Leu Gln Gln Ser Gly Thr Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Asp Ile Asp Trp Val Arg Gln Thr Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Glu Gly Ser Thr Glu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Ser Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Thr Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asp Tyr Tyr Arg Arg Tyr Phe Asp Leu Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser
115
<210> 33
<211> 353
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против MCU-1
<400> 33
caggtgaaac tgcagcagag cggcaccgaa gtggtgaaac cgggcgcgag cgtgaaactg 60
agctgcaaag cgagcggcta tatttttacc agctatgata ttgattgggt gcgccagacc 120
ccggaacagg gcctggatgg attggctgga tttttccggg cgaaggcagc accgaatata 180
acgaaaaatt taaaggccgc gcgaccctga gcgtggataa aagcagcagc accgcgtata 240
tggaactgac ccgcctgacc agcgaagata gcgcggtgta tttttgcgcg cgcggcgatt 300
attatcgccg ctattttgat ctgtggggcc agggcaccac cgtgaccgtg agc 353
<210> 34
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против MCU-1
<400> 34
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Ser Ala Ser Ser Ser Ile Arg Tyr Ile
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Tyr Asp
35 40 45
Thr Ser Asn Val Ala Pro Gly Val Pro Phe Arg Phe Ser Gly Ser Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Asn Arg Met Glu Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Glu Trp Ser Gly Tyr Pro Tyr Thr Phe
85 90 95
Gly Gly Gly Thr Lys Leu Glu Leu Lys Arg Ala Ala Ala
100 105
<210> 35
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против MCU-1
<400> 35
gatattgaac tgacccagag cccggcgatt atgagcgcga gcccgggcga acgcgtgacc 60
atgacctgca gcgcgagcag cagcattcgc tatatttatt ggtatcagca gaaaccgggc 120
agcagcccgc gcctgctgta tgataccagc aacgtggcgc cgggcgtgcc gtttcgcttt 180
agcggcagcg gcagcggcac cagctatagc ctgaccatta accgcatgga agcggaagat 240
gcggcgacct attattgcca ggaatggagc ggctatccgt atacctttgg cggcggcacc 300
aaactggaac tgaaacgcgc ggcggcg 327
<210> 36
<211> 129
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против EGFR
<400> 36
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Leu Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Tyr Met
35 40 45
Gly Leu Ile Tyr Pro Gly Asp Ser Asp Thr Lys Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Pro Ser Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg His Asp Val Gly Tyr Cys Ser Ser Ser Asn Cys Ala Lys Trp
100 105 110
Pro Glu Tyr Phe Gln His Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser
<210> 37
<211> 387
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против EGFR
<400> 37
caggtgcagc tggtgcagag cggcgcggaa gtgaaaaaac cgggcgaaag cctgaaaatt 60
agctgcaaag gcagcggcta tagctttacc agctattggc tggcgtgggt gcgccagatg 120
ccgggcaaag gcctggaata tatgggcctg atttatccgg gcgatagcga taccaaatat 180
agcccgagct ttcagggcca ggtgaccatt agcgtggata aaagcgtgag caccgcgtat 240
ctgcagtgga gcagcctgaa accgagcgat agcgcggtgt atttttgcgc gcgccatgat 300
gtgggctatt gcagcagcag caactgcgcg aaatggccgg aatattttca gcattggggc 360
cagggcaccc tggtgaccgt gagcagc 387
<210> 38
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против EGFR
<400> 38
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly His Thr Asn Arg Pro Ala Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Phe Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Ser Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 39
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против EGFR
<400> 39
cagagcgtgc tgacccagcc gccgagcgtg agcgcggcgc cgggccagaa agtgaccatt 60
agctgcagcg gcagcagcag caacattggc aacaactatg tgagctggta tcagcagctg 120
ccgggcaccg cgccgaaact gctgatttat ggccatacca accgcccggc gggcgtgccg 180
gatcgcttta gcggcagcaa aagcggcacc agcgcgagcc tggcgattag cggctttcgc 240
agcgaagatg aagcggatta ttattgcgcg gcgtgggatg atagcctgag cggctgggtg 300
tttggcggcg gcaccaaact gaccgtgctg ggc 333
<210> 40
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против VEGFR
<400> 40
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Thr Pro Ala Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Val Phe Phe Leu Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His
225
<210> 41
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь scFv против VEGFR
<400> 41
gaagtgcagc tggtggaaag cggcggcggc ctggtgcagc cgggcggcag cctgcgcctg 60
agctgcgcgg cgagcggctt taccattagc gattattgga ttcattgggt gcgccaggcg 120
ccgggcaaag gcctggaatg ggtggcgggc attaccccgg cgggcggcta tacctattat 180
gcggatagcg tgaaaggccg ctttaccatt agcgcggata ccagcaaaaa caccgcgtat 240
ctgcagatga acagcctgcg cgcggaagat accgcggtgt attattgcgc gcgctttgtg 300
ttttttctgc cgtatgcgat ggattattgg ggccagggca ccctggtgac cgtgagcagc 360
gcgagcacca aaggcccgag cgtgtttccg ctggcgccga gcagcaaaag caccagcggc 420
ggcaccgcgg cgctgggctg cctggtgaaa gattattttc cggaaccggt gaccgtgagc 480
tggaacagcg gcgcgctgac cagcggcgtg catacctttc cggcggtgct gcagagcagc 540
ggcctgtata gcctgagcag cgtggtgacc gtgccgagca gcagcctggg cacccagacc 600
tatatttgca acgtgaacca taaaccgagc aacaccaaag tggataaaaa agtggaaccg 660
aaaagctgcg ataaaaccca t 681
<210> 42
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против VEGFR
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Thr Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 43
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь scFv против VEGFR
<400> 43
gatattcaga tgacccagag cccgagcagc ctgagcgcga gcgtgggcga tcgcgtgacc 60
accacctgcc gcgcgagcca ggatgtgagc accgcggtgg cgtggtatca gcagaaaccg 120
ggcaaagcgc cgaaactgct gatttatagc gcgagctttc tgtatagcgg cgtgccgagc 180
cgctttagcg gcagcggcag cggcaccgat tttaccctga ccattagcag cctgcagccg 240
gaagattttg cgacctatta ttgccagcag agctatacca ccccgccgac ctttggccag 300
ggcaccaaag tggaaattaa acgcaccgtg gcggcgccga gcgtgtttat ttttccgccg 360
agcgatgaac agctgaaaag cggcaccgcg agcgtggtgt gcctgctgaa caacttttat 420
ccgcgcgaag cgaaagtgca gtggaaagtg gataacgcgc tgcagagcgg caacagccag 480
gaaagcgtga ccgaacagga tagcaaagat agcacctata gcctgagcag caccctgacc 540
ctgagcaaag cggattatga aaaacataaa gtgtatgcgt gcgaagtgac ccatcagggc 600
ctgagcagcc cggtgaccaa aagctttaac cgcggcgaat gc 642
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-NK-КЛЕТКИ | 2020 |
|
RU2795443C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-T-КЛЕТКИ | 2020 |
|
RU2762942C1 |
| КЛЕТКА | 2015 |
|
RU2768019C2 |
| ВОВЛЕКАЮЩИЕ NK МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812481C2 |
| NK-клеточная линия, экспрессирующая PSMA-специфический химерный антигенный рецептор и секретирующая блокатор взаимодействия CD47/SIRPa | 2020 |
|
RU2757353C1 |
| АКТИВИРУЕМЫЕ ПРОТЕАЗОЙ СВЯЗЫВАЮЩИЕ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ | 2017 |
|
RU2830288C2 |
| Вирус-кодируемые регулируемые агенты, связывающие T-клетки (CATVERT) или NK-клетки (CATVERN), нацеленные на рак | 2020 |
|
RU2827779C2 |
| КРИОКОНСЕРВИРОВАННЫЕ КЛЕТКИ-ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ, ПРЕДВАРИТЕЛЬНО НАГРУЖЕННЫЕ КОНСТРУКЦИЕЙ АНТИТЕЛА | 2019 |
|
RU2819927C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОТИВОРАКОВОГО ЛЕЧЕНИЯ, СОДЕРЖАЩАЯ NK-КЛЕТКИ И СЛИТЫЙ БЕЛОК, КОТОРЫЙ СОДЕРЖИТ БЕЛОК IL-2 И БЕЛОК CD80 | 2020 |
|
RU2832136C1 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2809125C2 |
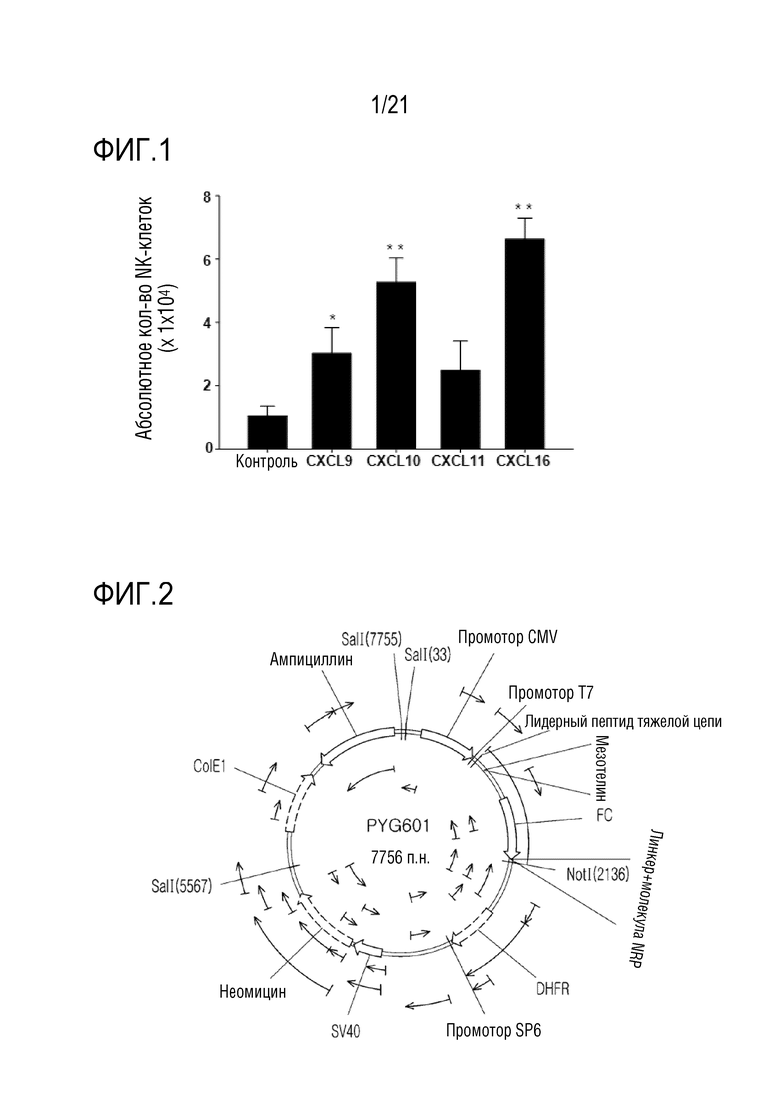
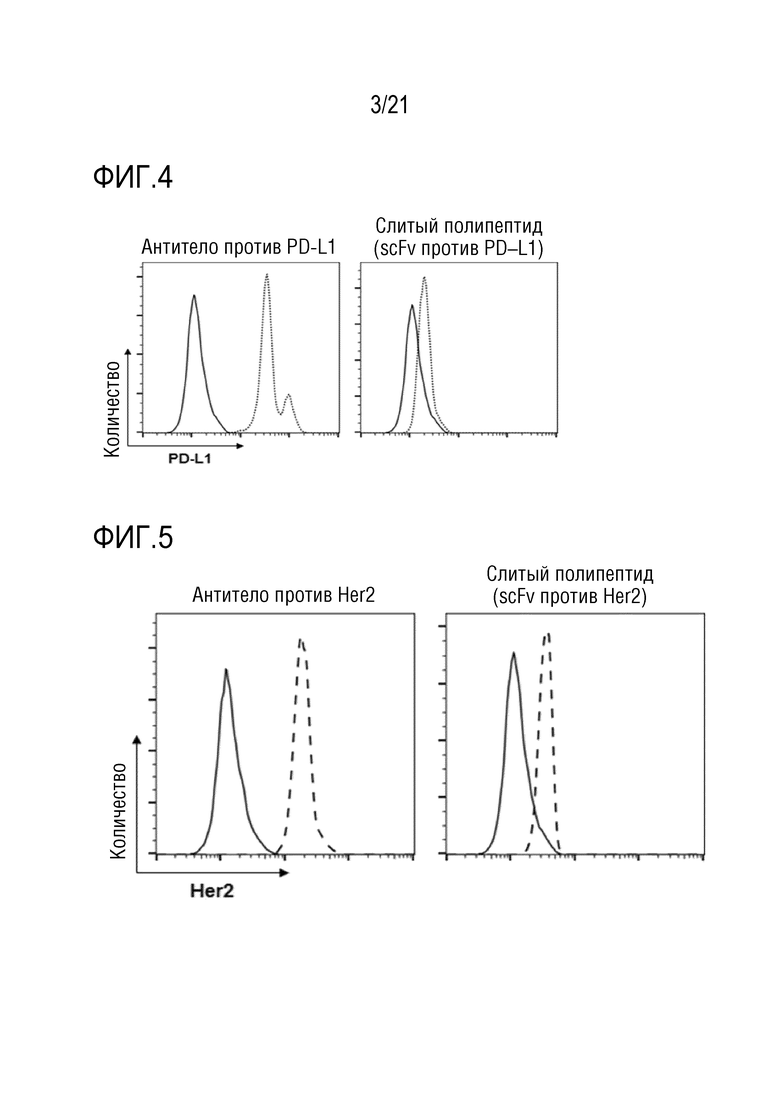
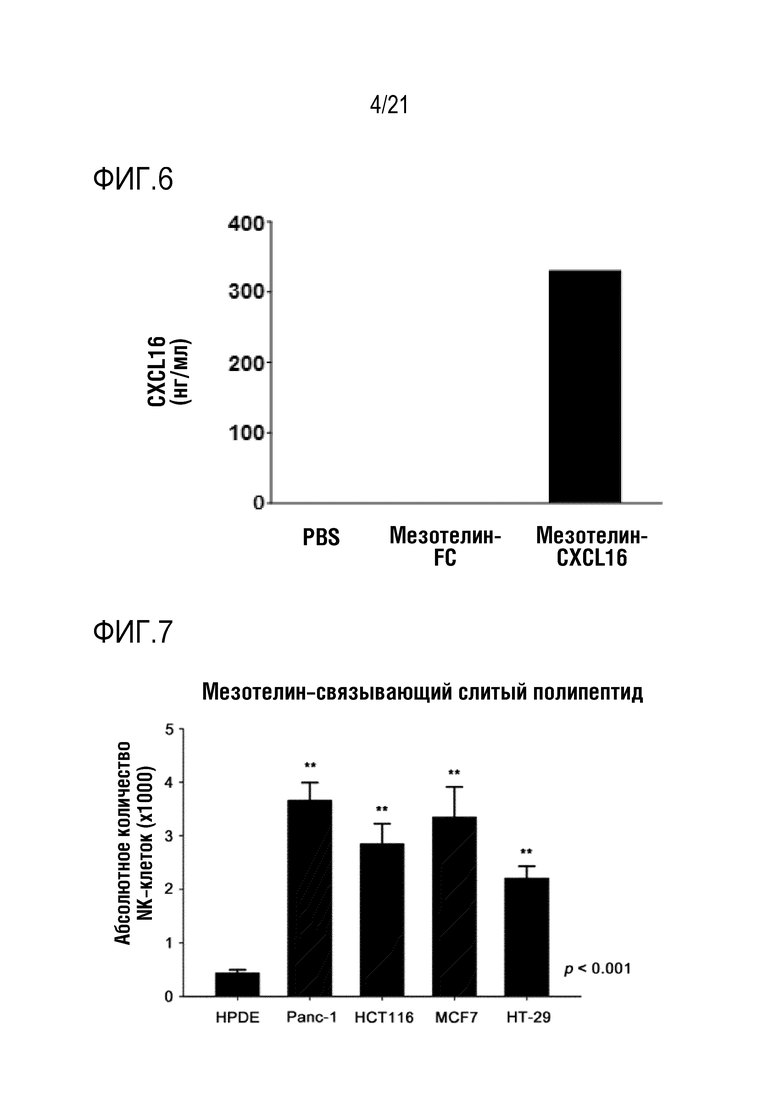
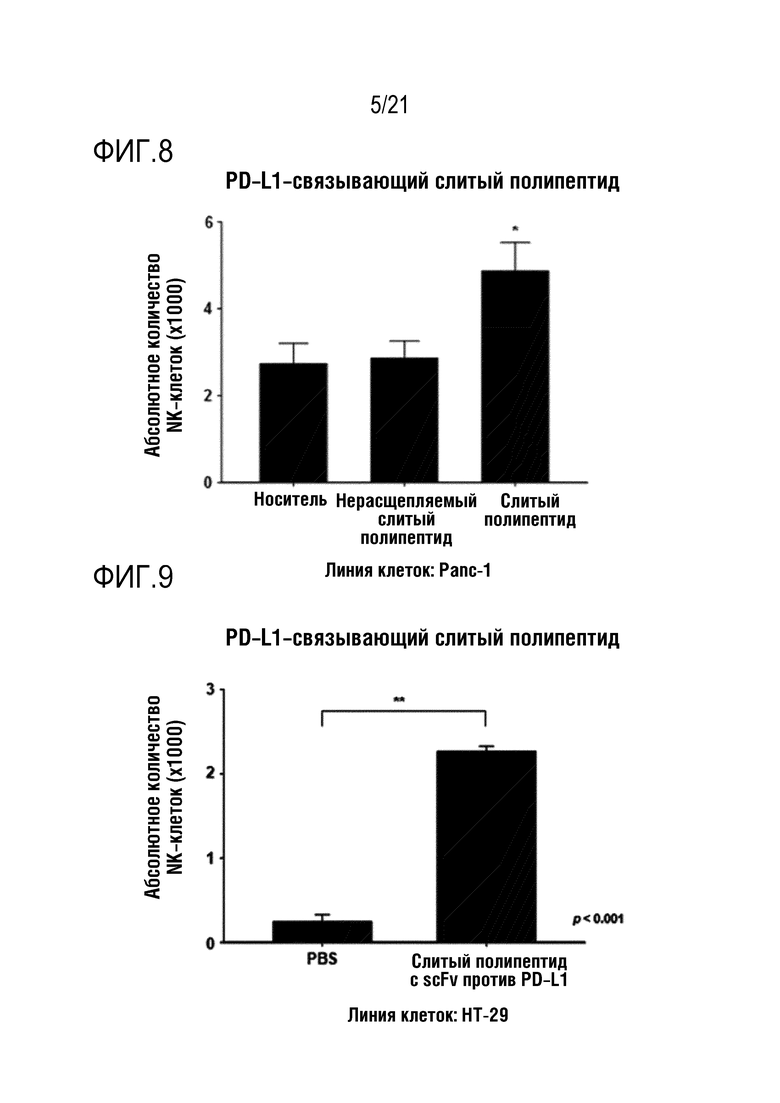
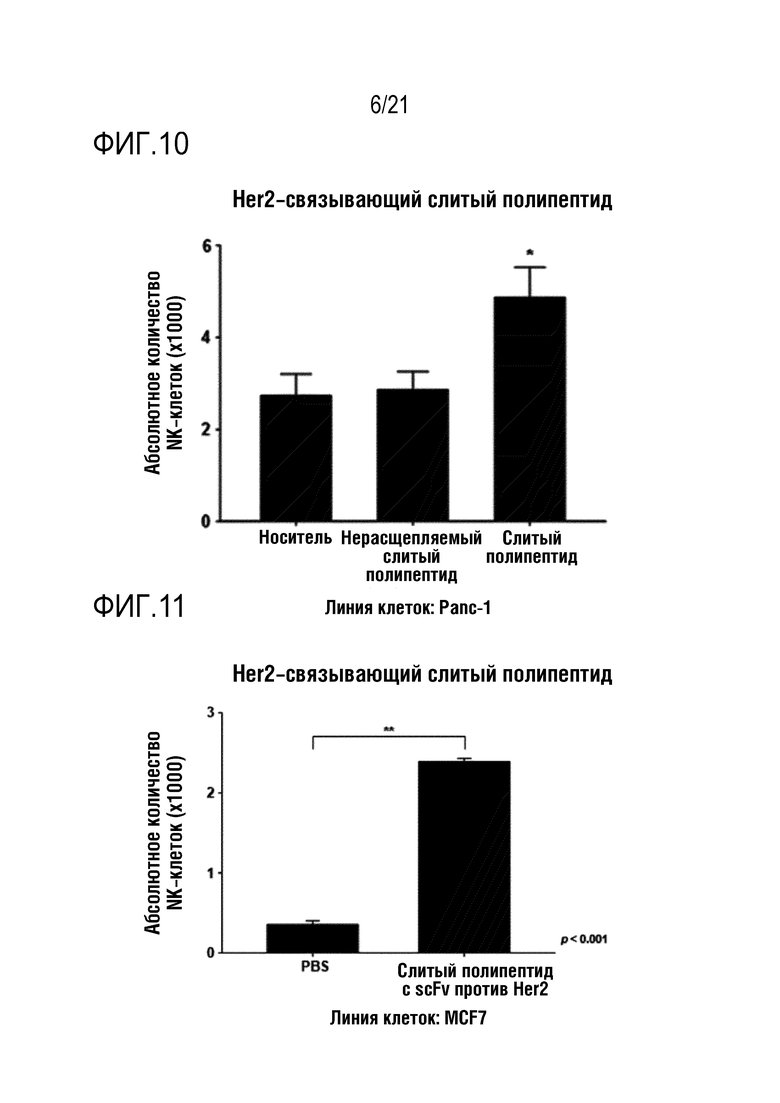
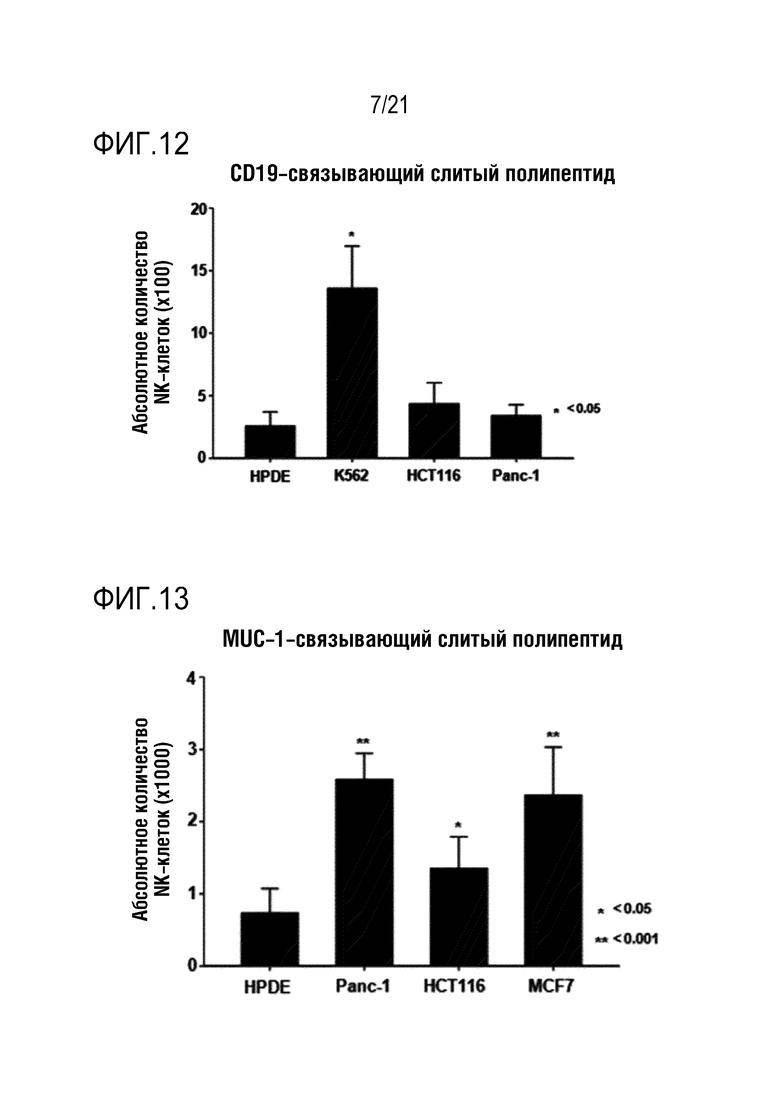
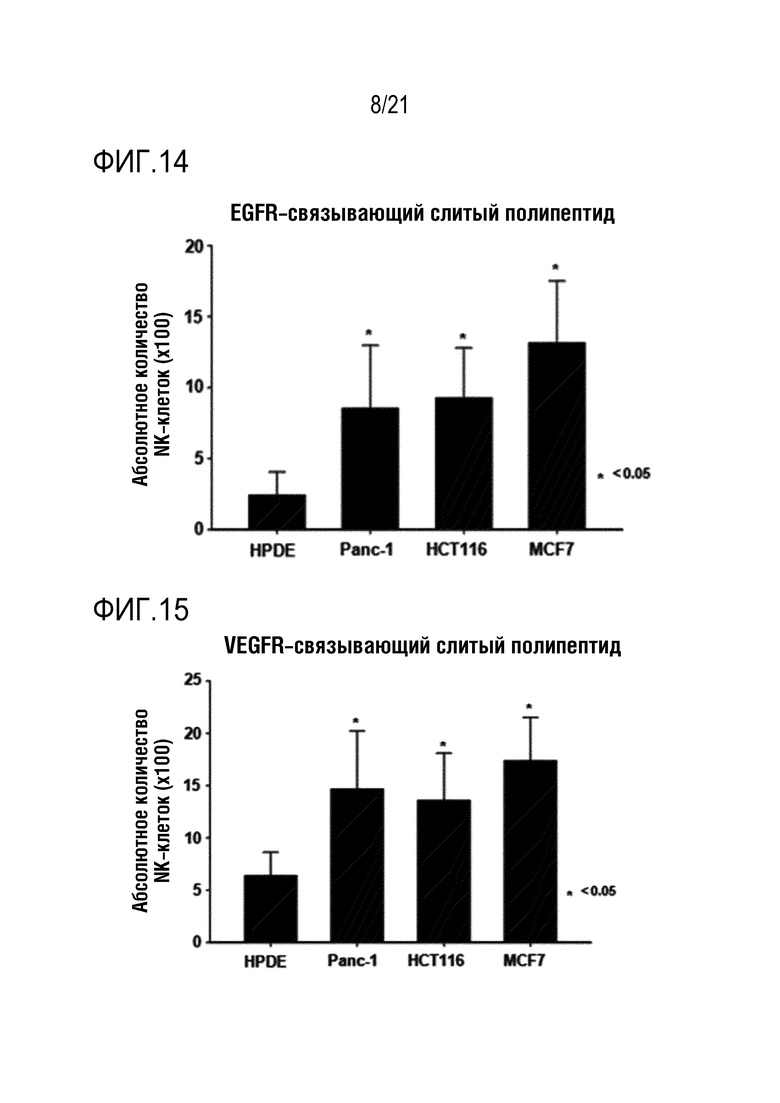
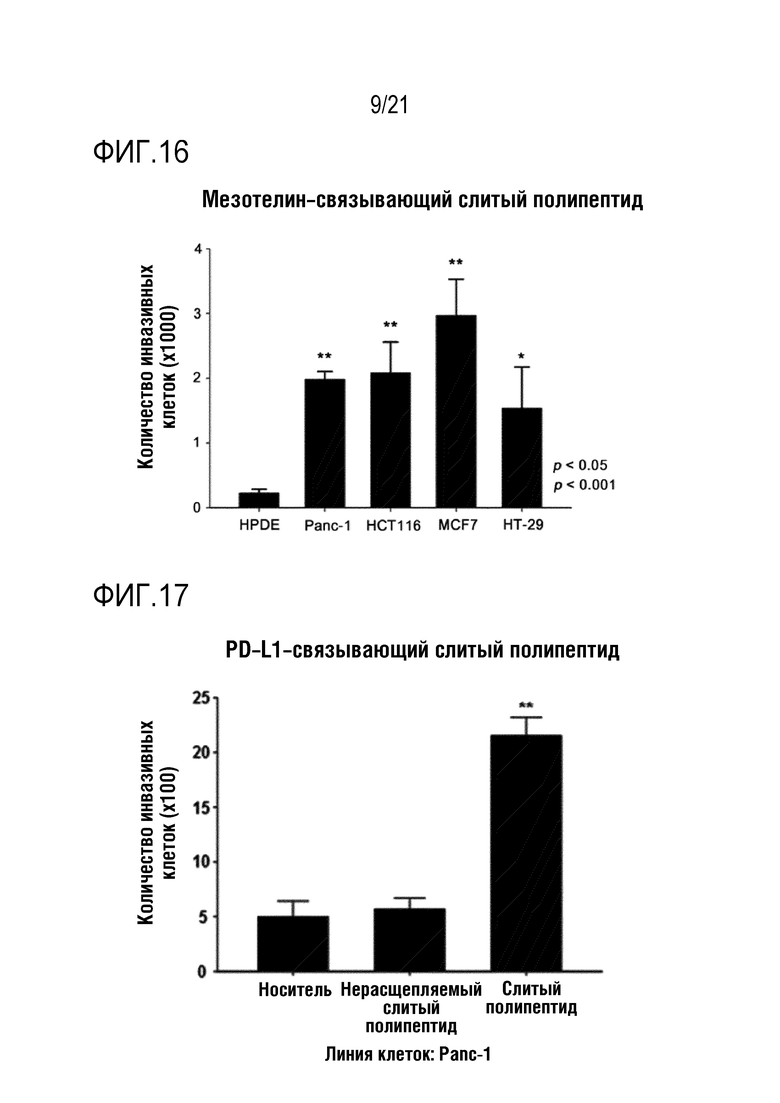
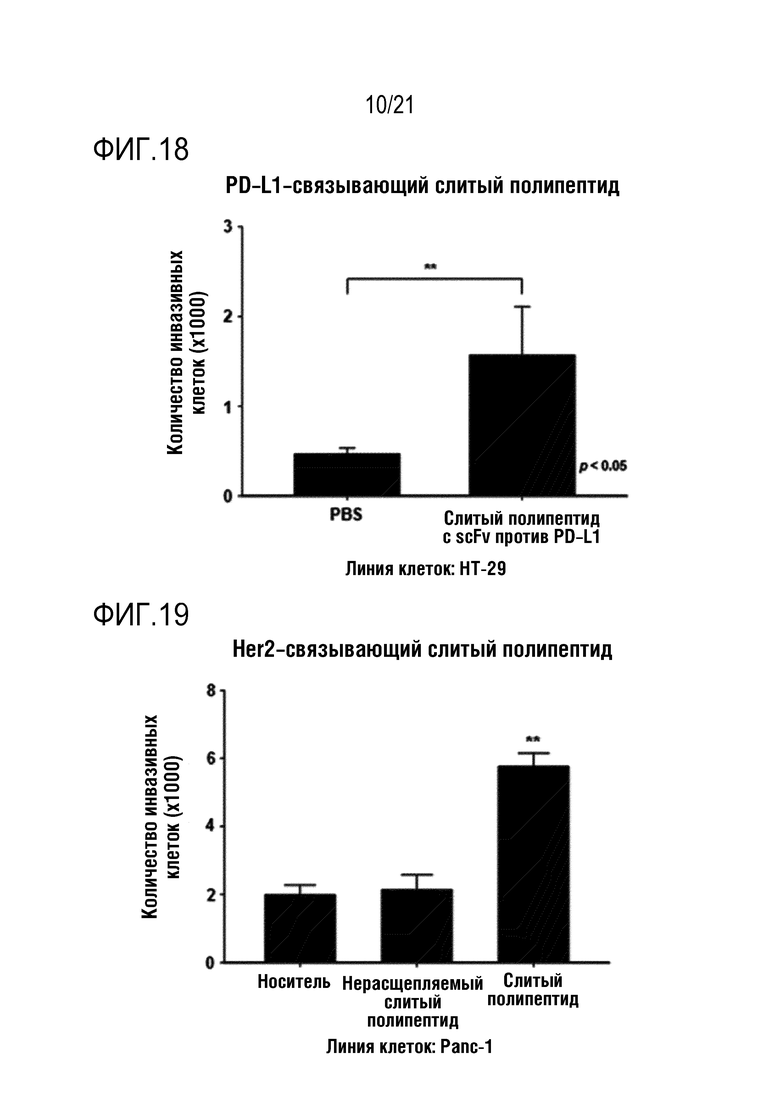
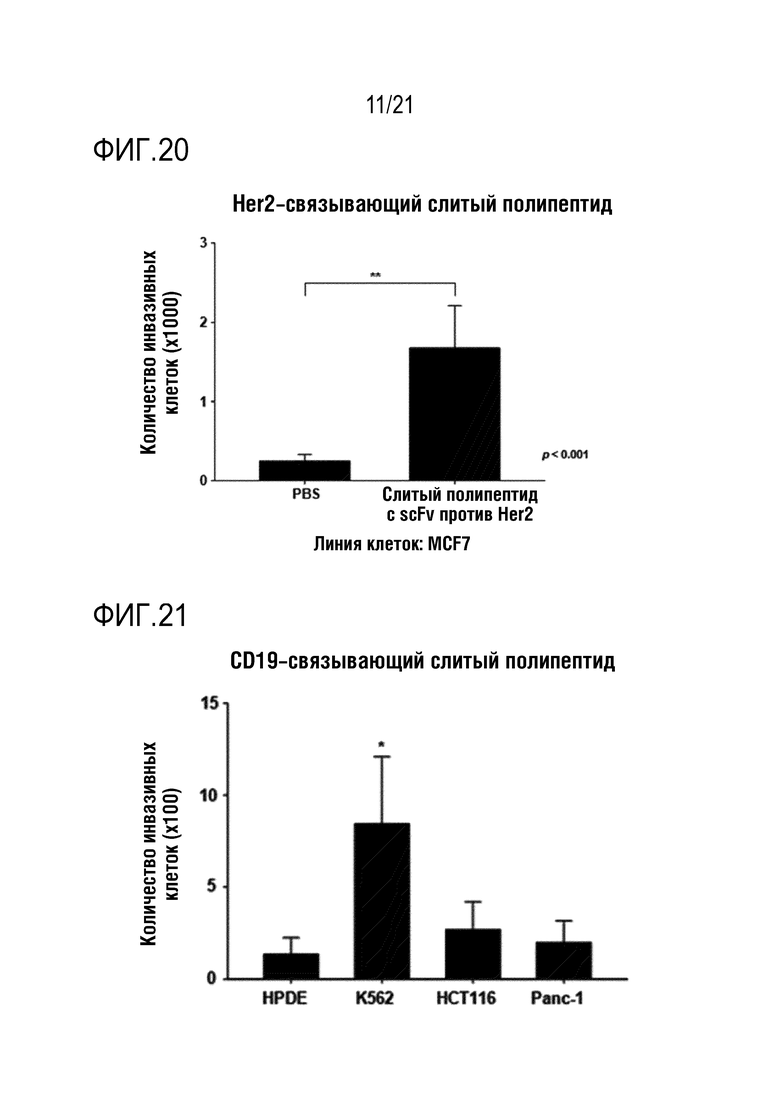
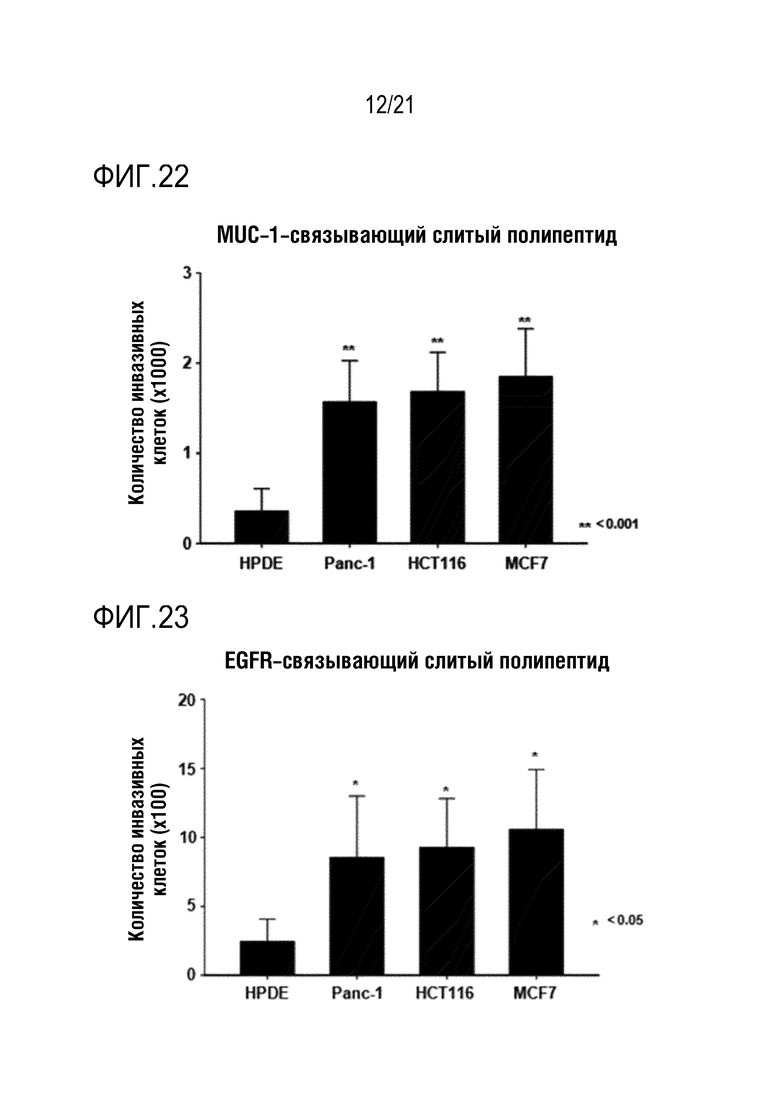
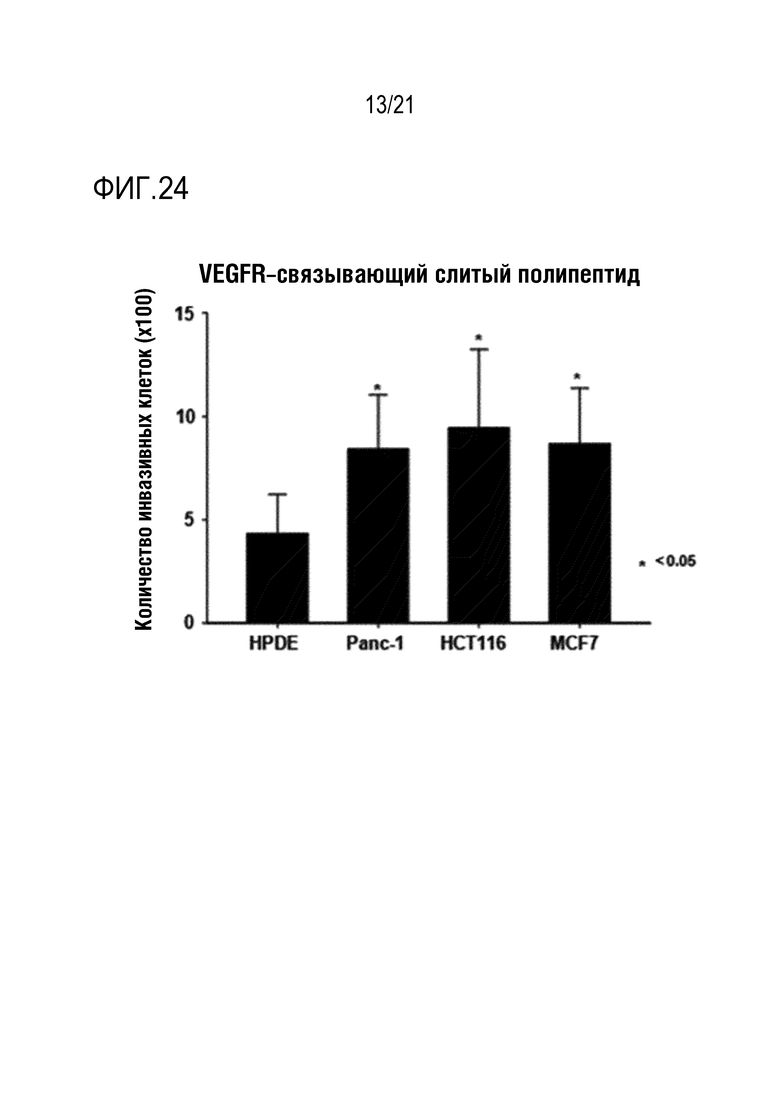
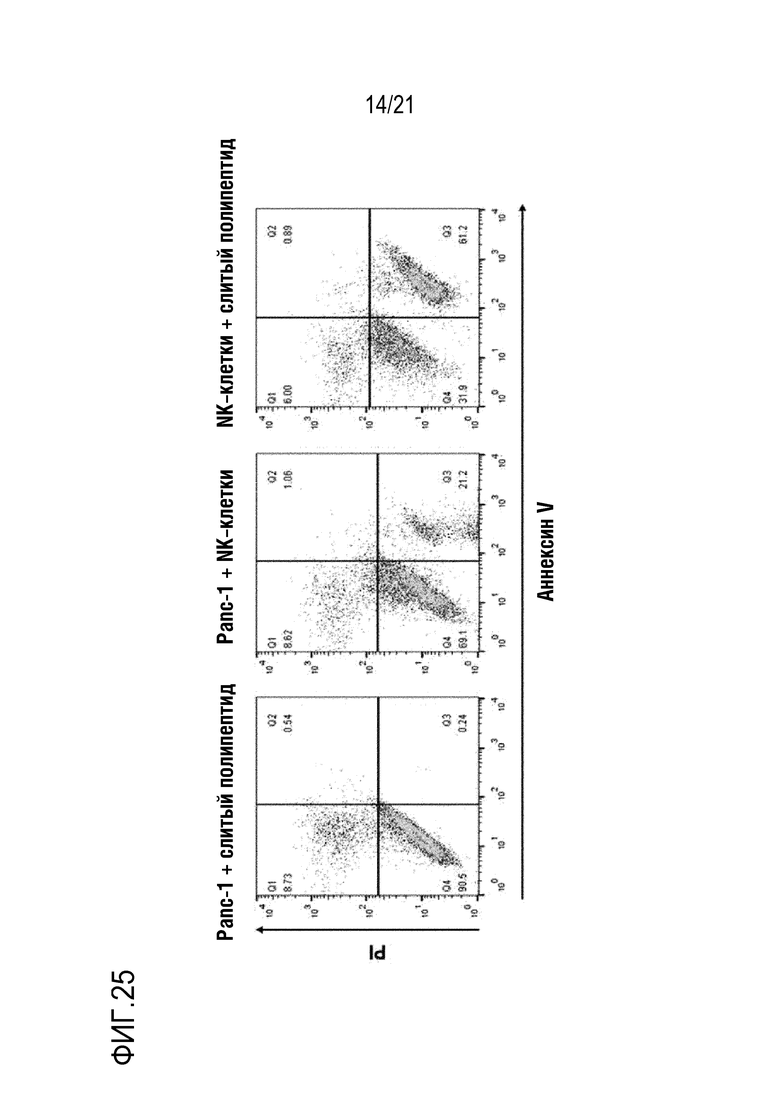
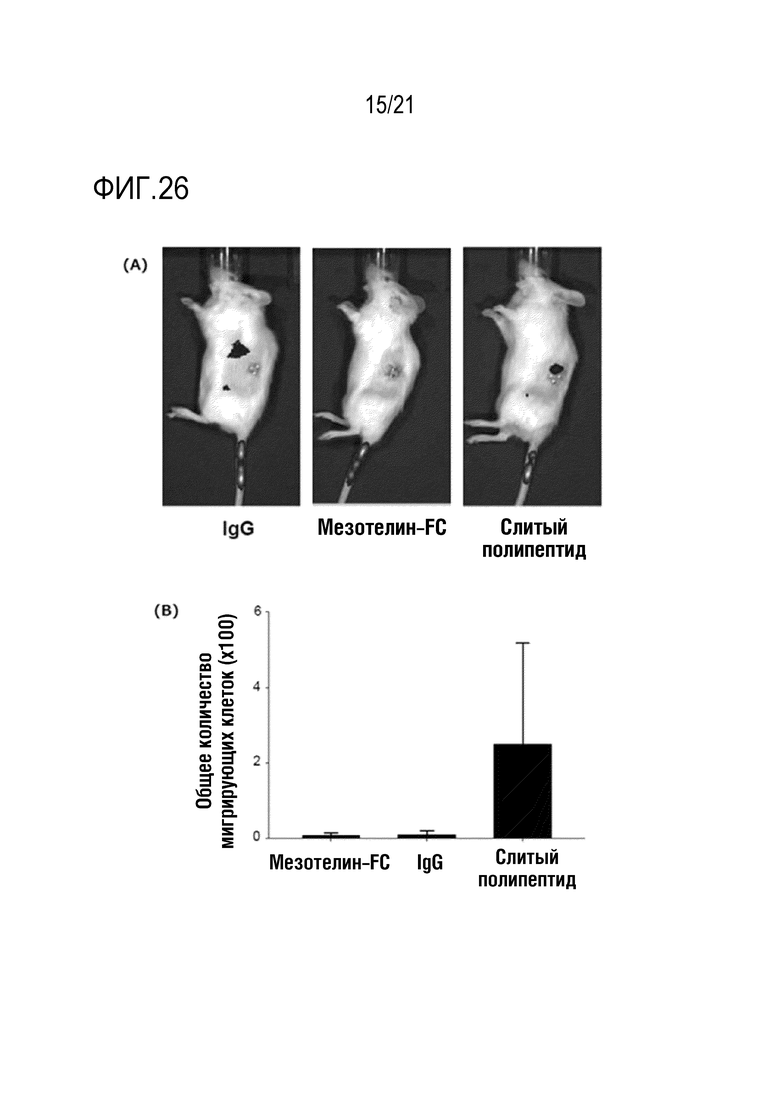
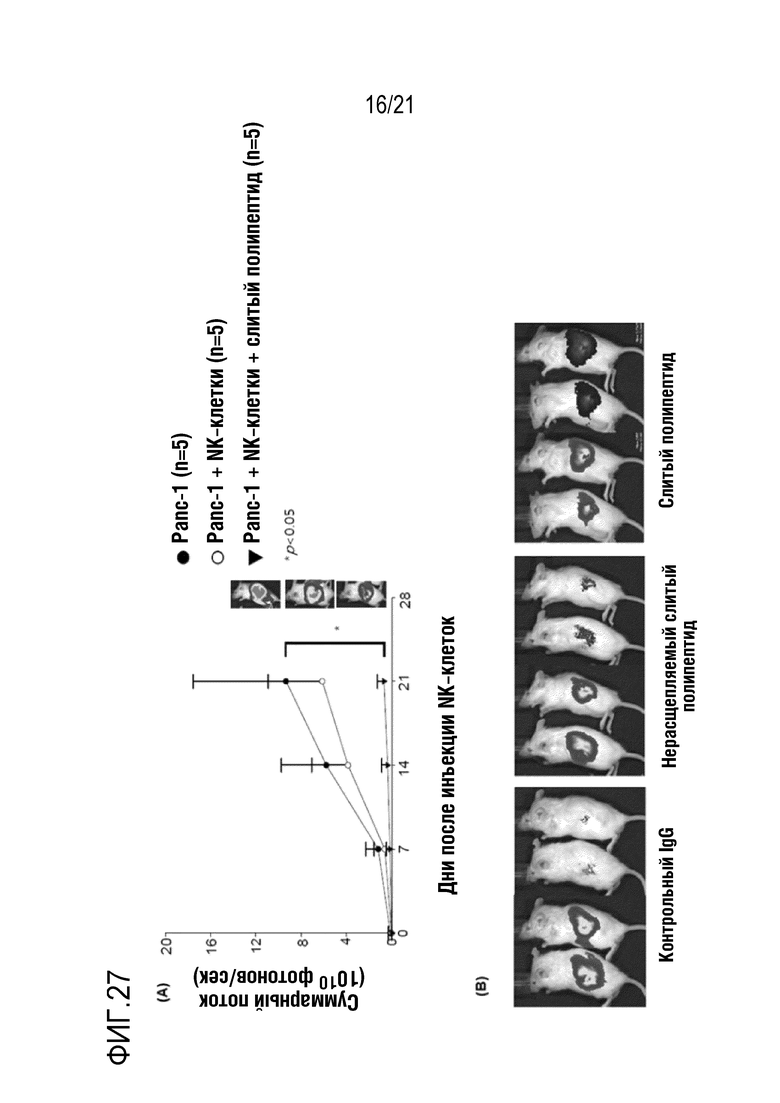
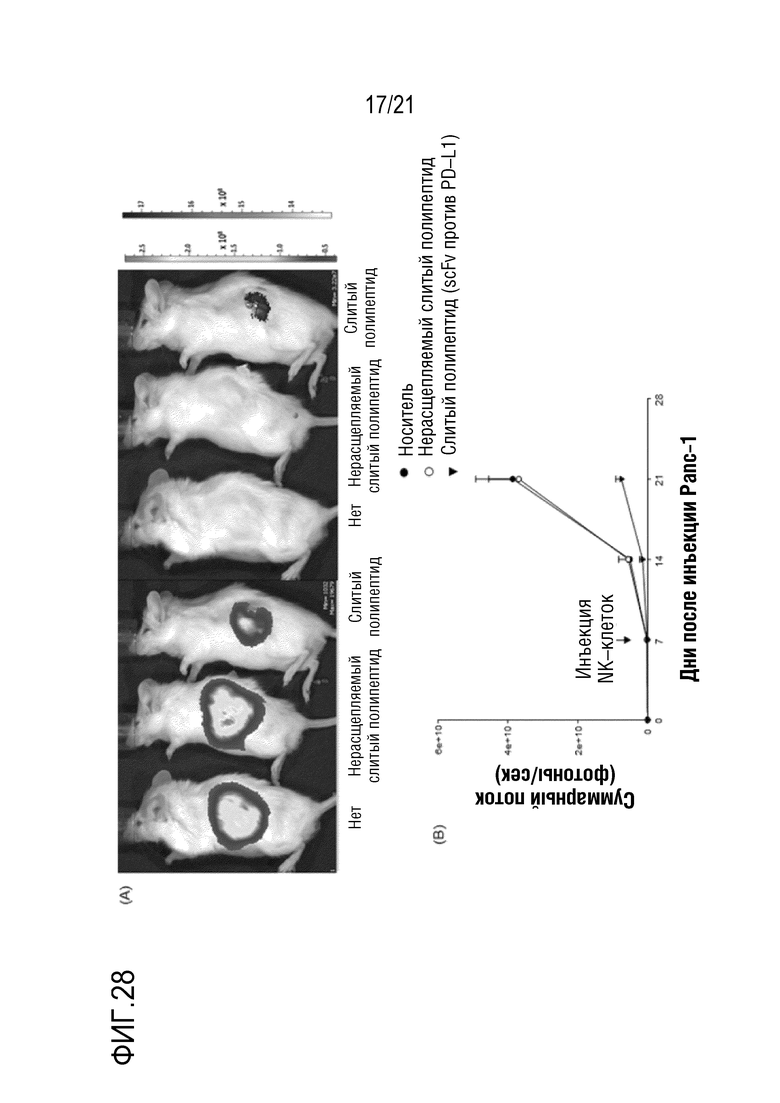
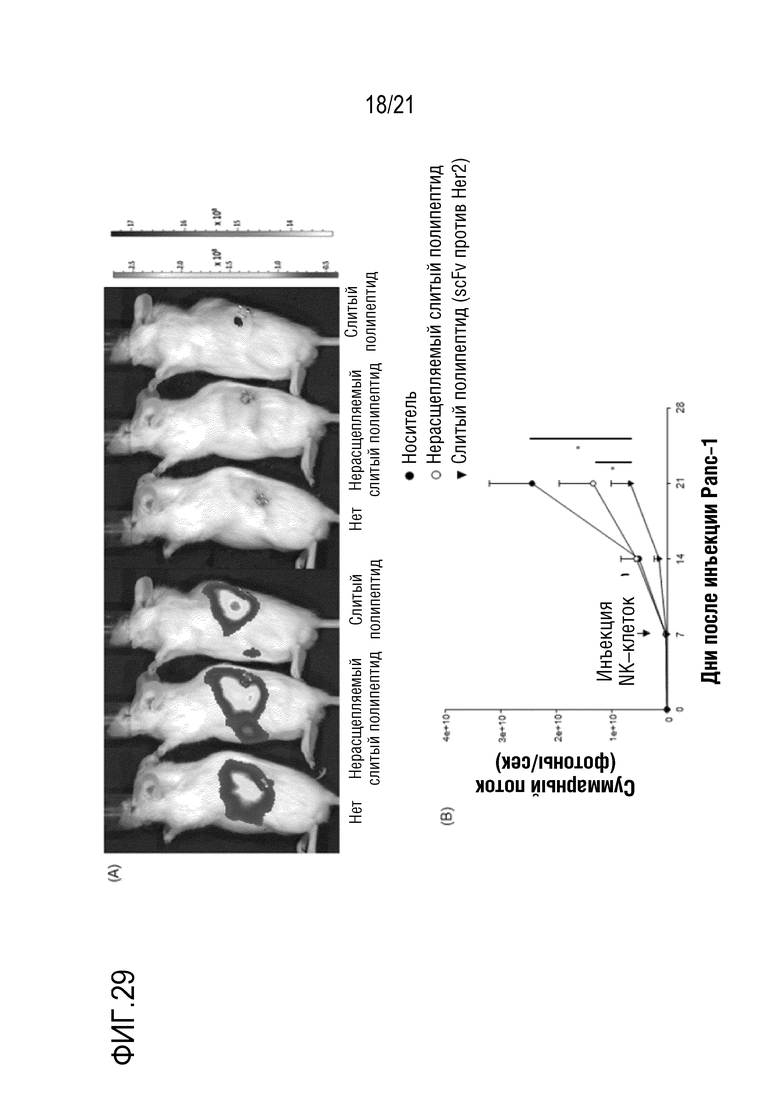
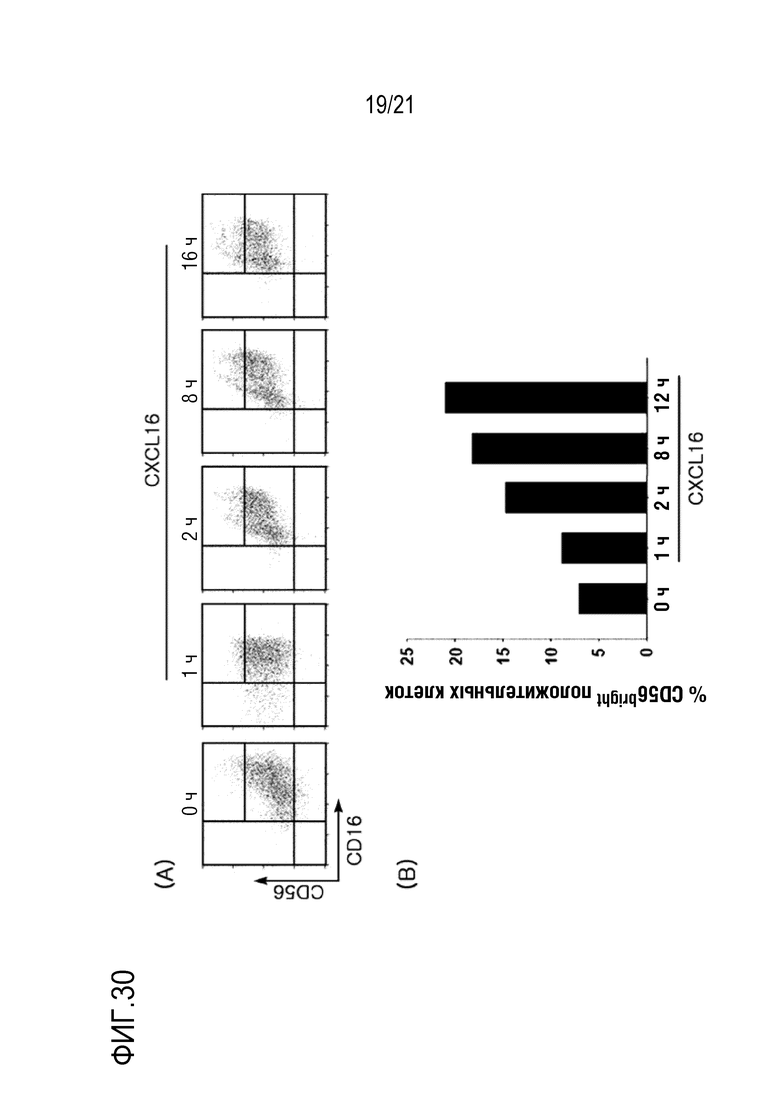
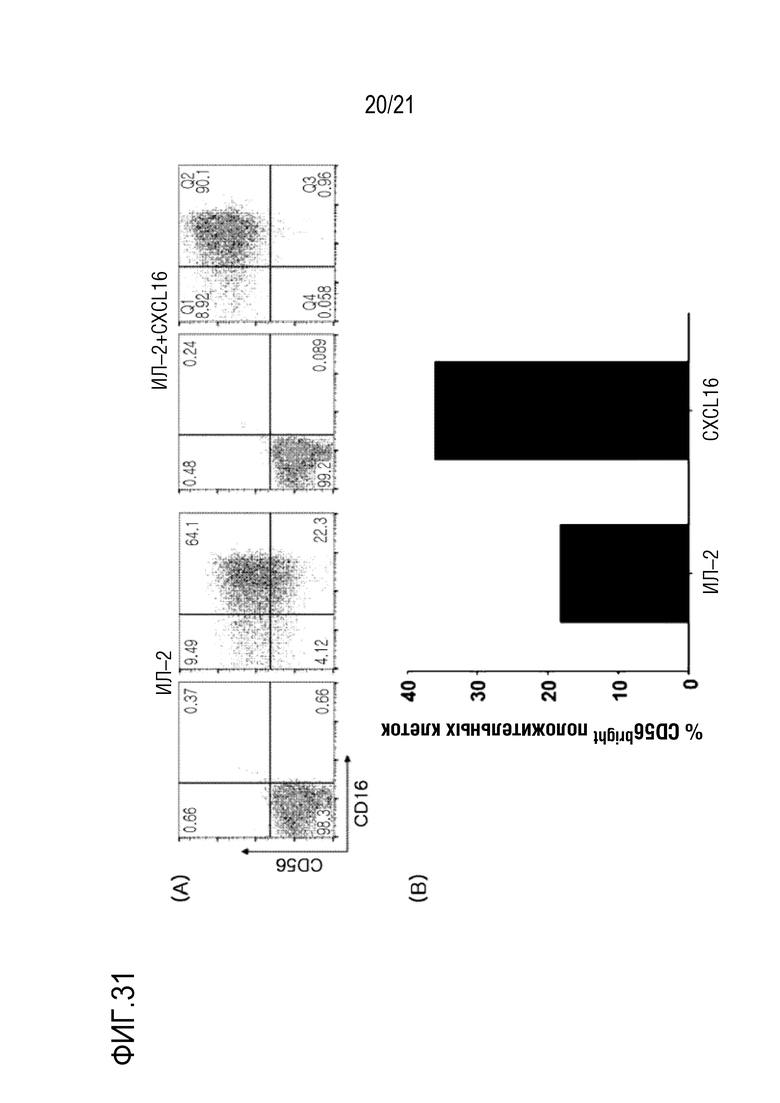
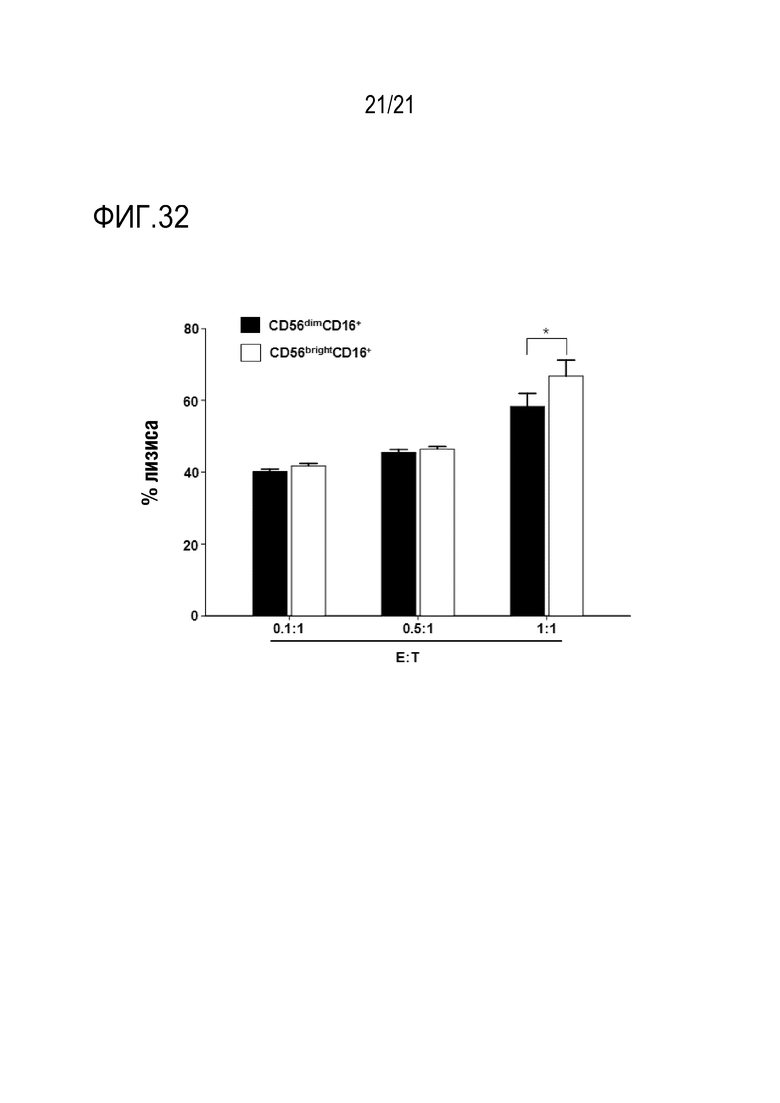
Изобретение относится к области биотехнологии, конкретно к слитым белкам с противоопухолевой активностью, и может быть использовано в медицине для противораковой терапии. Слитый полипептид содержит антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, выбранным из мезотелина, PD–L1 (лиганда программируемой гибели 1), Her2 (EGFR–родственного белка человека 2), CD19, MUC1, EGFR и VEGFR; линкер и белок, индуцирующий естественные киллеры (NK), из CXCL16. Слитый пептид может быть получен рекомбинантным путем. Предложены также фармацевтические композиции, содержащие указанный слитый пептид, и способ терапии рака. Изобретение обеспечивает противораковый эффект за счет индукции миграции NK-клеток. 7 н. и 5 з.п. ф-лы, 32 ил., 4 табл., 10 пр.
1. Слитый полипептид для индукции миграции NK-клеток, содержащий:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер и
белок, индуцирующий естественные киллеры (NK), из CXCL16,
где антитело или его фрагмент содержат одноцепочечный Fv фрагмент (scFv),
где одноцепочечный Fv фрагмент (scFv) содержит SEQ ID NO: 1; SEQ ID NO: 3 и 5; SEQ ID NO: 8 и 10; SEQ ID NO: 28 и 30; SEQ ID NO: 32 и 34; SEQ ID NO: 36 и 38 или SEQ ID NO: 40 и 42,
где линкер содержит участок расщепления фурином, содержащий SEQ ID NO: 15, и
где CXCL16 содержит SEQ ID NO: 17 и связан с антителом или его фрагментом через линкер.
2. Слитый полипептид по п. 1, где опухолеспецифический антиген является по меньшей мере одним антигеном, выбранным из группы, состоящей из мезотелина, PD–L1 (лиганда программируемой гибели 1), Her2 (EGFR–родственного белка человека 2), CD19, MUC1, EGFR и VEGFR.
3. Нуклеиновая кислота, кодирующая слитый полипептид по любому из пп. 1 и 2.
4. Экспрессирующий вектор, содержащий нуклеиновую кислоту, кодирующую слитый полипептид по п. 1.
5. Экспрессирующий вектор по п. 4, где нуклеиновая кислота содержит:
нуклеиновую кислоту, кодирующую антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
нуклеиновую кислоту, кодирующую линкер; и
нуклеиновую кислоту, кодирующую белок, индуцирующий естественные киллеры (NK), из CXCL16,
где нуклеиновая кислота, кодирующая антитело или его фрагмент, содержит нуклеиновую кислоту, кодирующую одноцепочечный Fv фрагмент (scFv),
где нуклеиновая кислота, кодирующая одноцепочечный Fv фрагмент (scFv), содержит SEQ ID NO: 2; SEQ ID NO: 4 и 6; SEQ ID NO: 9 и 11; SEQ ID NO: 29 и 31; SEQ ID NO: 33 и 35; SEQ ID NO: 37 и 39 или SEQ ID NO: 41 и 43,
где нуклеиновая кислота, кодирующая линкер, включает нуклеиновую кислоту, кодирующую участок расщепления фурином, содержащий SEQ ID NO: 16, и
где нуклеиновая кислота, кодирующая CXCL16, содержит SEQ ID NO: 18 и связана с нуклеиновой кислотой, кодирующей линкер.
6. Клетка–хозяин для получения слитого полипептида по п. 1, содержащая экспрессирующий вектор по любому из пп. 4 или 5.
7. Клетка–хозяин по п. 6, где клетка–хозяин является клеткой, выбранной из группы, состоящей из клеток COS, CHO, HeLa и клеток миеломы.
8. Фармацевтическая композиция для профилактики или лечения рака, содержащая эффективное количество слитого полипептида, где слитый полипептид содержит:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер и
белок, индуцирующий NK–клетки, из CXCL16,
где антитело или его фрагмент содержат одноцепочечный Fv фрагмент (scFv),
где одноцепочечный Fv фрагмент (scFv) содержит SEQ ID NO: 1; SEQ ID NO: 3 и 5; SEQ ID NO: 8 и 10; SEQ ID NO: 28 и 30; SEQ ID NO: 32 и 34; SEQ ID NO: 36 и 38 или SEQ ID NO: 40 и 42,
где линкер содержит участок расщепления фурином, содержащий аминокислотную последовательность SEQ ID NO: 15, и
где CXCL16 содержит SEQ ID NO: 17 и связан с антителом или фрагментом антитела через линкер.
9. Фармацевтическая композиция для профилактики или лечения рака по п. 8, где антиген является по меньшей мере одним антигеном, выбранным из группы, состоящей из мезотелин, PD–L1, Her2, CD19, MUC1, EGFR и VEGFR.
10. Фармацевтическая композиция для профилактики или лечения рака по п. 8, где рак выбран из группы, состоящей из рака поджелудочной железы, рака молочной железы, рака предстательной железы, рака желудка, рака печени и рака легких.
11. Фармацевтическая композиция для профилактики или лечения рака, содержащая слитый полипептид, где слитый полипептид содержит: антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном, линкер и белок, индуцирующий NK–клетки, из CXCL16, и естественные киллеры NK-клетки,
где антитело или его фрагмент содержат одноцепочечный Fv фрагмент (scFv),
где одноцепочечный Fv фрагмент (scFv) содержит SEQ ID NO: 1; SEQ ID NO: 3 и 5; SEQ ID NO: 8 и 10; SEQ ID NO: 28 и 30; SEQ ID NO: 32 и 34; SEQ ID NO: 36 и 38 или SEQ ID NO: 40 и 42,
где линкер содержит участок расщепления фурином, содержащий аминокислотную последовательность SEQ ID NO: 15, и
где CXCL16 содержит SEQ ID NO: 17 и связан с антителом или фрагментом антитела через линкер.
12. Способ профилактики или лечения рака, включающий введение индивидууму эффективного количества слитого полипептида, где слитый полипептид содержит:
антитело или его фрагмент, связывающиеся с опухолеспецифическим антигеном;
линкер и
белок, индуцирующий NK–клетки, из CXCL16,
где антитело или его фрагмент содержат одноцепочечный Fv фрагмент (scFv),
где одноцепочечный Fv фрагмент (scFv) содержит SEQ ID NO: 1; SEQ ID NO: 3 и 5; SEQ ID NO: 8 и 10; SEQ ID NO: 28 и 30; SEQ ID NO: 32 и 34; SEQ ID NO: 36 и 38 или SEQ ID NO: 40 и 42,
где линкер содержит участок расщепления фурином, содержащий аминокислотную последовательность SEQ ID NO: 15, и
где CXCL16 содержит SEQ ID NO: 17 и связан с антителом или фрагментом антитела через линкер.
| WO 2014043523 А1, 20.03.2014 | |||
| WO 2012166588 A2, 06.12.2012 | |||
| WO 2016176756 A1, 10.11.2016 | |||
| Резиновая заготовка для подошв | 1929 |
|
SU19344A1 |
| ORLANDO M., Modification of proteins and low molecular weight substances with hydroxyethyl starch (HES), Inauguraldissertation, Giesen, 2003, p.166 | |||
| CHEN X | |||
| et al., Fusion protein linkers: property, design and functionality, Advanced | |||
Авторы
Даты
2021-01-14—Публикация
2018-04-05—Подача