ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает преимущество и приоритет предварительной заявки на патент США № 62/456535, поданной 8 февраля 2017 г., полное содержание которой включено в настоящее описание в качестве ссылки для всех целей.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит список последовательностей, который представлен в электронном виде в формате ASCII и включен в настоящее описание посредством ссылки в полном объеме. Указанная копия ASCII, созданная 6 февраля 2018 года, называется DFY-001PC_SL.txt и имеет размер 71 169 байт.
ОБЛАСТЬ ТЕХНИКИ
[0003] Изобретение относится к полиспецифическим связывающим белкам, которые связываются с опухолеспецифическим антигеном, рецептором NKG2D и CD16.
Уровень техники
[0004] Злокачественное новообразование продолжает оставаться серьезной проблемой для здоровья, несмотря на значительные исследовательские усилия и научные достижения для лечения этого заболевания, о которых сообщается в литературе. Некоторые из наиболее часто диагностируемых видов злокачественных новообразований включают рак предстательной железы, рак молочной железы и рак легких. Рак предстательной железы является наиболее распространенной формой злокачественных новообразований у мужчин. Рак молочной железы остается основной причиной смерти у женщин. Существующие варианты лечения этих видов злокачественных новообразований не эффективны для всех пациентов и/или могут иметь существенные побочные эффекты. Другие виды злокачественных новообразований также остаются сложными для лечения с использованием существующих вариантов лечения.
[0005] Противоопухолевая иммунотерапия желательна, потому что она высокоспецифична и может способствовать разрушению опухолевых клеток с использованием собственной иммунной системы пациента. Слитые белки, такие как биспецифичные белки, рекрутеры T-клеток, представляют собой противоопухолевую иммунотерапию, описанную в литературе, которая связывается с опухолевыми клетками и T-клетками для облегчения разрушения опухолевых клеток. Антитела, которые связываются с некоторыми опухолеспецифическими антигенами и с некоторыми иммунными клетками, описаны в литературе. См., например, WO 2016/134371 и WO 2015/095412.
[0006] Клетки-натуральные киллеры (NK) являются компонентом врожденной иммунной системы и составляют приблизительно 15% циркулирующих лимфоцитов. NK-клетки проникают практически во все ткани и первоначально характеризовались своей способностью эффективно уничтожать опухолевые клетки без необходимости предварительной сенсибилизации. Активированные NK-клетки уничтожают клетки-мишени с помощью средств, аналогичных цитотоксическим Т-клеткам, то есть с помощью цитолитических гранул, которые содержат перфорин и гранзимы, а также посредством путей рецепторов смерти. Активированные NK-клетки также секретируют воспалительные цитокины, такие как IFN-гамма и хемокины, которые способствуют рекрутированию других лейкоцитов в ткани-мишени.
[0007] NK-клетки реагируют на сигналы через различные активирующие и ингибирующие рецепторы на своей поверхности. Например, когда NK-клетки встречают здоровые аутоклетки, их активность ингибируется активацией иммуноглобулино-подобных рецепторов клеток-киллеров (KIR). Альтернативно, когда NK-клетки встречают чужеродные клетки или опухолевые клетки, они активируются через свои активирующие рецепторы (например, NKG2D, NCR, DNAM1). NK-клетки также активируются константной областью некоторых иммуноглобулинов через рецепторы CD16 на их поверхности. Общая чувствительность NK-клеток к активации зависит от суммы стимулирующих и ингибирующих сигналов.
Сущность изобретения
[0008] Изобретение относится к полиспецифическим связывающим белкам, которые связываются с опухолеспецифическим антигеном на опухолевой клетке и рецептором NKG2D и рецептором CD16 на клетках-натуральных киллерах для активации клеток-натуральных киллеров, к фармацевтическим композициям, содержащим такие полиспецифические связывающие белки, и к терапевтическим способам, использующим такие полиспецифические белки, и к фармацевтическим композицим, в том числе для лечения злокачественного новообразования. Такие белки могут взаимодействовать более чем с одним типом рецепторов, активирующих NK, и могут блокировать связывание природных лигандов с NKG2D. В некоторых вариантах осуществления белок может быть агонистом NK-клеткок у людей и у других видов, таких как грызуны и яванские макаки. Различные аспекты и варианты осуществления изобретения описаны более подробно ниже.
[0009] В некоторых вариантах осуществления полиспецифический связывающий белок может включать первый антигенсвязывающий сайт, который связывается с NKG2D; второй антигенсвязывающий сайт, который связывается с опухолеспецифическим антигеном; и Fc-домен антитела, его часть, достаточную для связывания CD16, или третий антигенсвязывающий сайт, который связывается с CD16.
[0010] В некоторых вариантах осуществления полиспецифический связывающий белок является трехвалентным, который включает первый и второй антигенсвязывающий сайт, которые оба связываются с одним и тем же опухолеспецифическим антигеном; третий антигенсвязывающий сайт, который связывается с NKG2D; и Fc-домен антитела, его часть, которой достаточно для связывания с CD16.
[0011] В некоторых вариантах осуществления полиспецифический связывающий белок является четырехвалентным, который включает первый и второй антигенсвязывающие сайты, которые оба связываются с одним и тем же опухолеспецифическим антигеном; третий и четвертый антигенсвязывающий сайт, которые оба связываются с NKG2D; и Fc-домен антитела, его часть, которой достаточно для связывания с CD16.
[0012] Каждый антигенсвязывающий сайт может включать вариабельный домен тяжелой цепи антитела и вариабельный домен легкой цепи антитела (например, расположенный как в антителе, или слитый вместе с scFv), или один или более антигенсвязывающих сайтов могут быть однодоменным антителом, таким как антитело VHH, такое как верблюжье антитело, или антитело VNAR, подобное тем, которые обнаружены у хрящевых рыб. В некоторых случаях опухолеспецифический антиген может быть выбран из группы, состоящей из HER2, CD20, CD33, антигена созревания В-клеток (BCMA), EpCAM, CD2, CD19, CD30, CD38, CD40, CD52, CD70, EGFR/ERBB1, IGF1R, HER3/ERBB3, HER4/ERBB4, MUC1, cMET, SLAMF7, PSCA, MICA, MICB, TRAILR1, TRAILR2, MAGE-A3, B7.1, B7.2, CTLA4 и PD1.
[0013] Другой аспект изобретения относится к способу лечения злокачественного новообразования у пациента. Способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества описанного в настоящем документе полиспецифического связывающего белка для лечения злокачественного новообразования. Типичные виды злокачественного новообразования для лечения с использованием полиспецифических связывающих белков включают, например, карциному, клетки которой экспрессируют HER2.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0014] ФИГ. 1 представляет собой полиспецифический связывающий белок, который содержит NKG2D-связывающий домен (правое плечо), опухолеспецифический антигенсвязывающий домен (левое плечо) и Fc-домен или его часть, которая связывается с CD16.
[0015] ФИГ. 2 представляет собой полиспецифический связывающий белок, который содержит NKG2D-связывающий домен в формате scFv (правое плечо), опухолеспецифический антигенсвязывающий домен (левое плечо) и Fc-домен или его часть, которая связывается с CD16.,
[0016] ФИГ. 3 представляет собой TriNKET в форме Triomab, который представляет собой трифункциональное биспецифичное антитело, которое поддерживает IgG-подобную форму. Эта химера состоит из двух половинных антител, каждое с одной легкой и одной тяжелой цепью, которые происходят от двух родительских антител. Форма Triomab может представлять собой гетеродимерную конструкцию, содержащую 1/2 антитела крысы и 1/2 антитела мыши.
[0017] ФИГ. 4 представляет собой TriNKET в форме KiH общая легкая цепь (LC), где используется технология «выступы-во-впадины» (KIH). KiH представляет собой гетеродимер, содержащий 2 Fab, связывающихся с мишенью 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации. TriNKET в формате KiH может представлять собой гетеродимерную конструкцию с 2 fab, связывающимися с мишенью 1 и мишенью 2, содержащую 2 разных тяжелых цепи и общую легкую цепь, которая спаривается с обеими HC.
[0018] ФИГ. 5 представляет собой TriNKET в форме иммуноглобулина с двумя вариабельными доменами (DVD-Ig™), который объединяет домены, связывающиеся с мишенью двух моноклональных антител через гибкие встречающиеся в природе линкеры с получением четырехвалентной IgG-подобной молекулы. DVD-Ig™ представляет собой гомодимерную конструкцию, в которой вариабельный домен, нацеленный на антиген 2, слит с N-концом вариабельного домена Fab, нацеленного на антигена 1. Конструкция содержит нормальный Fc.
[0019] ФИГ. 6 представляет собой TriNKET в форме интерфейса ортогонального Fab (Орто-Fab), который представляет собой гетеродимерную конструкцию, которая содержит 2 Fab, связывающихся с мишенью 1 и мишенью 2, слитых с Fc. Спаривание LC-HC обеспечивается ортогональным интерфейсом. Гетеродимеризация обеспечивается мутациями в Fc.
[0020] ФИГ. 7 представляет собой TrinKET в формате 2 в 1 Ig.
[0021] ФИГ. 8 представляет собой TriNKET в форме ES, которая представляет собой гетеродимерную конструкцию, содержащую 2 различных Fab, связывающихся с мишенью 1 и мишенью 2, слитых с Fc. Гетеродимеризация обеспечивается мутациями электростатического взаимодействия в Fc.
[0022] ФИГ. 9 представляет собой TriNKET в форме с обменом Fab-фрагментами: антитела, которые обмениваются Fab-фрагментами путем замены тяжелой цепи (HC) и присоединенной легкой цепи (LC) (полу-молекулы) с парой тяжелых-легких цепей из другой молекулы, с получением биспецифичных антител. Форма с обменом Fab-фрагментами (cFae) представляет собой гетеродимер, содержащий 2 Fab, связывающихся с мишенью 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации.
[0023] ФИГ. 10 представляет собой TriNKET в форме SEED-body, который представляет собой гетеродимер, содержащий 2 Fab, связывающихся с мишенью 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации.
[0024] ФИГ. 11 представляет собой TriNKET в форме LuZ-Y, в котором домен лейциновой застежки используется для индуцирования гетеродимеризации двух различных HC. LuZ-Y форма представляет собой гетеродимер, содержащий 2 разных scFab, связывающихся с мишенью 1 и 2, слитых с Fc. Гетеродимеризация обеспечивается благодаря мотивам лейциновой застежки, слитым с С-концом Fc.
[0025] ФИГ. 12 представляет собой TriNKET в форме Cov-X-Body.
[0026] ФИГ. 13A-13B представляют собой TriNKET в формах κλ-Body, которые представляют собой гетеродимерные конструкции с двумя различными Fab, слитыми с Fc, стабилизированными мутациями гетеродимеризации: Fab1, нацеленный на антиген 1, содержит каппа LC, а второй Fab, нацеленный на антиген 2, содержит лямбда LC. ФИГ. 13А является иллюстративным изображением одной формы κλ-Body; ФИГ. 13B является иллюстративным изображением другого κλ-Body.
[0027] ФИГ. 14 представляет собой график, демонстрирующий аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с человеческим рекомбинантным NKG2D в анализе ИФА.
[0028] ФИГ. 15 представляет собой график, демонстрирующий аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с рекомбинантным NKG2D яванской макаки в анализе ИФА.
[0029] ФИГ. 16 представляет собой график, демонстрирующий аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с рекомбинантным NKG2D мыши в анализе ИФА.
[0030] ФИГ. 17 представляет собой график, демонстрирующий связывание NKG2D-связывающих доменов (перечисленных в виде клонов) с клетками EL4, экспрессирующими NKG2D человека, с помощью проточной цитометрии, показывающей превышение средней интенсивности флуоресценции (MFI) относительно фона.
[0031] ФИГ. 18 представляет собой график, демонстрирующий связывание NKG2D-связывающих доменов (перечисленных в виде клонов) с клетками EL4, экспрессирующими мышиный NKG2D, с помощью проточной цитометрии, показывающей превышение средней интенсивности флуоресценции (MFI) относительно фона.
[0032] ФИГ. 19 представляет собой график, демонстрирующий специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с рекомбинантным человеческим NKG2D-Fc путем конкуренции с природным лигандом ULBP-6.
[0033] ФИГ. 20 представляет собой график, демонстрирующий специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с рекомбинантным человеческим NKG2D-Fc путем конкуренции с природным лигандом MICA.
[0034] ФИГ. 21 представляет собой график, демонстрирующий специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных в виде клонов) с рекомбинантным мышиным NKG2D-Fc путем конкуренции с природным лигандом Rae-1 дельта.
[0035] ФИГ. 22 представляет собой график, показывающий активацию человеческого NKG2D посредством NKG2D-связывающих доменов (перечисленных в виде клонов) путем количественного определения процента TNF-альфа-положительных клеток, которые экспрессируют слитые белки человеческих NKG2D-CD3 дзета.
[0036] ФИГ. 23 представляет собой график, показывающий активацию мышиного NKG2D с помощью NKG2D-связывающих доменов (перечисленных в виде клонов) путем количественного определения процента TNF-альфа-положительных клеток, которые экспрессируют слитые белки мышиного NKG2D-CD3 дзета.
[0037] ФИГ. 24 представляет собой график, показывающий активацию человеческих NK-клеток NKG2D-связывающими доменами (перечислены в виде клонов).
[0038] ФИГ. 25 представляет собой график, показывающий активацию человеческих NK-клеток NKG2D-связывающими доменами (перечислены в виде клонов).
[0039] ФИГ. 26 представляет собой график, показывающий активацию мышиных NK-клеток NKG2D-связывающими доменами (перечислены в виде клонов).
[0040] ФИГ. 27 представляет собой график, показывающий активацию мышиных NK-клеток NKG2D-связывающими доменами (перечислены в виде клонов).
[0041] ФИГ. 28 представляет собой график, показывающий цитотоксический эффект NKG2D-связывающих доменов (перечисленных в виде клонов) в отношении опухолевых клеток.
[0042] ФИГ. 29 представляет собой график, показывающий температуру плавления NKG2D-связывающих доменов (перечисленных в виде клонов), измеренную с помощью дифференциальной сканирующей флуориметрии.
[0043] ФИГ. 30 представляет собой график, показывающий усиленную активацию человеческих NK-клеток полиспецифическими связывающими белками.
[0044] ФИГ. 31 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней человеческими NK-клетками.
[0045] ФИГ. 32 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней человеческими NK-клетками.
[0046] ФИГ. 33 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней человеческими NK-клетками.
[0047] ФИГ. 34 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней человеческими NK-клетками.
[0048] ФИГ. 35 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней мышиными NK-клетками.
[0049] ФИГ. 36 представляет собой график, показывающий полиспецифические связывающие белки, индуцированные более высоким уровнем цитотоксичности в отношении опухолевых клеток-мишеней мышиными NK-клетками.
[0050] ФИГ. 37 представляет собой профиль связывания CD33-нацеленных TriNKET с NKG2D, экспрессируемыми на клетках EL4. На ФИГ. 37 показано связывание двух TriNKET, когда CD33-связывающий домен используется в качестве второго нацеливающего фрагмента.
[0051] ФИГ. 38 представляет собой профиль связывания HER2-нацеленных TriNKET с NKG2D, экспрессируемыми на клетках EL4. На ФИГ. 38 показаны те же два NKG2D-связывающих домена, теперь соединенных со вторым фрагментом, нацеленным на HER2.
[0052] ФИГ. 39 представляет собой профиль связывания BCMA-нацеленных TriNKET с NKG2D, экспрессируемыми на клетках EL4.
[0053] ФИГ. 40 представляет собой гистограмму CD20-нацеленных TriNKET, которые связываются с NKG2D, экспрессируемыми на клетках EL4. Неокрашенные клетки EL4 использовали в качестве отрицательного контроля для сигнала флуоресценции. Не окрашенные: закрашено; CD20-TriNKET-F04: сплошная линия; CD20-TriNKET-C26: пунктирная линия.
[0054] ФИГ. 41 представляет собой профиль связывания CD33-нацеленных TriNKET с CD33, экспрессируемым на клетках AML человека, MV4-11.
[0055] ФИГ. 42 представляет собой профиль связывания HER2-нацеленных TriNKET с HER2, экспрессируемым на клетках почечно-клеточной карциномы человека 786-O.
[0056] ФИГ. 43 представляет собой профиль связывания BCMA-нацеленных TriNKET с BCMA, экспрессируемым на клетках миеломы человека MM.1S.
[0057] ФИГ. 44 представляет собой гистограмму CD20-нацеленных TriNKET, которые связываются с CD20, экспрессируемым на человеческих клетках лимфомы Raji. Неокрашенные клетки использовали в качестве отрицательного контроля для флуоресцентного сигнала. Не окрашенные: закрашено; CD20-TriNKET-F04: сплошная линия; CD20-TriNKET-C26: пунктирная линия.
[0058] ФИГ. 45A- 45C представляют собой гистограммы синергетической активации NK-клеток с использованием CD16 и NKG2D. Фиг. 45А демонстрирует уровень CD107a; ФИГ. 45B демонстрирует уровень IFNγ; ФИГ. 45C демонстрирует уровень CD107a и IFNγ. Графики показывают среднее (n=2) ± SD. Данные представляют пять независимых экспериментов с использованием пяти разных здоровых доноров.
[0059] ФИГ. 46 представляет собой гистограмму, показывающую активацию NK-клеток с использованием TriNKET, нацеленных на NKG2D и CD16. Тестируемые антитела относятся к человеческому изотипу IgG1. Графики показывают среднее (n=2) ± SD.
[0060] ФИГ. 47A-47C представляют собой гистограммы, демонстрирующие, что TriNKET и трастузумаб были способны активировать первичные человеческие NK-клетки в совместной культуре с HER2-положительными опухолевыми клетками человека, на что указывает увеличение дегрануляции CD107a и продуцироание цитокина IFNγ. По сравнению с моноклональным антителом трастузумабом оба TriNKET продемонстрировали превосходную активацию человеческих NK-клеток с использованием различных человеческих опухолевых клеток HER2. На ФИГ. 47А показано, что человеческие NK-клетки активируются TriNKET при культивировании с клетками SkBr-3. На ФИГ. 47B показано, что человеческие NK-клетки активируются TriNKET при культивировании с клетками Colo201. ФИГ. 47C показывает, что человеческие NK-клетки активируются TriNKET при культивировании с клетками HCC1954.
[0061] ФИГ. 48A-48B представляют собой линейные графики, демонстрирующие TriNKET-опосредованную активацию покоящихся или IL-2-активированных человеческих NK-клеток в совместной культуре с CD33-экспрессирующей клеточной линией AML MV4-11 человека. На ФИГ. 48А показана TriNKET-опосредованная активация покоящихся человеческих NK-клеток. На ФИГ. 48B показана TriNKET-опосредованная активация IL-2-активированных человеческих NK-клеток от того же донора.
[0062] ФИГ. 49A-49B представляют собой графики, демонстрирующие повышение цитотоксической активности TriNKET с использованием IL-2-активированных и покоящихся человеческих NK-клеток. На ФИГ. 49А показан процент специфического лизиса опухолевых клеток SkBr-3 покоящимися NK-клетками человека. На ФИГ. 49B показан процент специфического лизиса опухолевых клеток SkBr-3 IL-2-активированными NK-клетками человека.
[0063] ФИГ. 50A-50B представляют собой графики, демонстрирующие, что TriNKET обеспечивают большее преимущество против злокачественных новообразований со средним и низким уровнем HER2 по сравнению с трастузумабом. На ФИГ. 50А показано уничтожение активированных NK-клеток человека опухолевыми клетками SkBr-3 с высоким уровнем HER2. На ФИГ. 50B показано уничтожение NK-клетками человека опухолевых клеток 786-O с низким уровнем HER2. TriNKET обеспечивают большее преимущество по сравнению с трастузумабом против опухолевых клеток с низким уровнем экспрессии HER2.
[0064] ФИГ. 51A-51C представляют собой гистограммы, показывающие, что экспрессия высокоаффинного FcRγI (CD64) на трех линиях клеток AML человека, клеточной линии Molm-13 (ФИГ. 51A), клеточной линии Mv4-11 (ФИГ. 51B) и клеточной линии THP-1 (ФИГ. 51C).
[0065] ФИГ. 52A-52B представляют собой линейные графики моноклональных антител или TriNKET-опосредованной активации человеческих NK-клеток в совместной культуре с другими клетками Molm-13 (ФИГ. 52B) или THP-1 (ФИГ. 52A).
[0066] ФИГ. 53A-53C представляют собой линейные графики анализов цитотоксичности NK-клеток человека с использованием трех линий клеток AML человека в качестве мишеней. На ФИГ. 53А показано, что клетки Mv4-11, которые экспрессируют CD64, но на более низком уровне, чем THP-1, показали пониженную эффективность с моноклональным антителом против CD33. ФИГ. 53B демонстрирует, что моноклональное антитело против CD33 демонстрирует хорошую эффективность против клеток Molm-13, которые не экспрессируют CD64. ФИГ. 53C демонстрирует, что клетки THP-1 не проявляют эффекта с моноклональным антителом против CD33 индивидуально. Идентичность линейных графиков, отмеченных на ФИГ. 53C также применимы к линейным графикам на ФИГ. 53А-53В.
[0067] ФИГ. 54A и 54B представляют собой гистограммы, показывающие, что B-клетки здорового донора чувствительны к TriNKET-опосредованному лизису.
[0068] ФИГ. 54C и 54D представляют собой гистограммы, показывающие, что миелоидные клетки устойчивы к TriNKET-опосредованному лизису.
[0069] ФИГ. 55 представляет собой линейные графики TriNKET-опосредованного hPBMC-уничтожения опухолевых клеток SkBr-3 в продолжительных совместных культурах.
[0070] ФИГ. 56 представляет собой блок-схему плана исследования эффективности подкожной SC2.2 для RMA/S-HER2.
[0071] ФИГ. 57 представляют собой линейные графики, показывающие, что SC2.2 не влияет на рост подкожной опухоли RMA/S-HER2.
[0072] ФИГ. 58A-58B представляют собой графики, показывающие связывание in vitro с помощью mcFAE-C26.99 TriNKET. 60 мкг/мл указанных антител с четырехкратными разведениями добавляли к 2×105 опухолевых клеток B16F10 (ФИГ. 58A) или клеток EL4-mNKG2D (ФИГ. 58B). Связывание оценивали с использованием вторичного антитела козьего антимышиного PE с последующим анализом проточной цитометрией.
[0073] ФИГ. 59 представляет собой график, показывающий повышенную цитотоксичность NK, опосредованную mCFAE-C26.99 TriNKET.
[0074] На ФИГ. 60A-60B показана противоопухолевая эффективность mcFAE-C26.99 TriNKET в моделях s.c. B16F10. Мышей обрабатывали внутрибрюшинно (ФИГ. 60A) мышиным контролем изотипа IgG2a mab C1.18.4 и мышиным моноклональным антителом против Tyrp-1 или (ФИГ. 60B) мышиным контролем изотипа IgG2a mab C1.18.4 и mcFAE-C26.99 TriNKET, которые вводили в дозе 150 мкг (дни 6, 8, 10, 12, 14, 16 и 21). Рост опухоли оценивали в течение 28 дней. Графики показывают кривые роста опухоли у отдельных мышей.
[0075] На ФИГ. 61A-61B показана противоопухолевая эффективность mcFAE-C26.99 TriNKE T на моделях i.v. B16F10. ФИГ. 61А представляет опухолевую нагрузку, когда антитела вводили в дозе 150 мкг (дни 4, 6, 8, 11, 13, 15). ФИГ. 61B представляет опухолевую нагрузку, когда антитела вводили в дозе 150 мкг (дни 7, 9, 11, 13, 15). Через 18 дней после инфицирования опухолью мышей умерщвляли и оценивали поверхностные метастазы в легких.
[0076] ФИГ. 62 представляет собой гистограмму, показывающую, что человеческие NK-клетки активируются TriNKET при культивировании с CD20+ клетками Raji.
[0077] ФИГ. 63 представляет собой гистограмму, показывающую активацию человеческих NK в культуре с BCMA-положительными клетками миеломы человека MM.1S.
[0078] ФИГ. 64 представляет собой график, показывающий, что TriNKET усиливают лизис человеческими NK-клетками клеток миеломы KMS12-PE.
[0079] ФИГ. 65 представляет собой график, показывающий, что BCMA-нацеленные TriNKET с различными NKG2D-связывающими доменами усиливают лизис NK-клетками человека клеток миеломы KMS12-PE.
[0080] ФИГ. 66 представляет собой линейный график, показывающий, что триспецифическое связывание в одной молекуле важно для максимальной активности NK-клеток.
[0081] ФИГ. 67 представляет собой гетеродимерную конструкцию Oasc-Fab, которая включает связывание Fab с мишенью 1 и связывание scFab с мишенью 2, слитых с Fc. Гетеродимеризация обеспечивается мутациями в Fc.
[0082] ФИГ. 68 представляет собой DuetMab, который представляет собой гетеродимерную конструкцию, содержащую 2 разных Fab, связывающихся с антигеном 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации. Fab 1 и 2 содержат различные SS-мостики, которые обеспечивают правильное спаривание LC и HC.
[0083] ФИГ. 69 представляет собой CrossmAb, который представляет собой гетеродимерную конструкцию с 2 различными Fab, связывающимися с мишенью 1 и 2, слитыми с Fc, стабилизированным гетеродимеризацией. Домены CL и CH1 и домены VH и VL переключаются, например, CH1 сливается в одной линии с VL, в то время как CL сливается в одной линии с VH.
[0084] ФИГ. 70 представляет собой Fit-Ig, который представляет собой гомодимерные конструкции, в которых Fab, связывающийся с антигеном 2, слит с N-концом HC Fab, который связывается с антигеном 1. Конструкция содержит Fc дикого типа.
ПОДРОБНОЕ ОПИСАНИЕ
[0085] Изобретение относится к полиспецифическим связывающим белкам, которые связываются с опухолеспецифическим антигеном на опухолевой клетке и с рецептором NKG2D и рецептором CD16 на клетках-натуральных киллерах, чтобы активировать клетку-натуральную киллер, к фармацевтическим композициям, содержащим такие полиспецифические связывающие белки, и к терапевтическим способам с использованием таких полиспецифических белков, и к фармацевтическим композициям, в том числе для лечения злокачественного новообразования. Различные аспекты изобретения изложены ниже в разделах; однако аспекты изобретения, описанные в одном конкретном разделе, не должны быть ограничены каким-либо конкретным разделом.
[0086] Чтобы облегчить понимание настоящего изобретения, ряд терминов и фраз определены ниже.
[0087] Термины в единственном числе, используемые в настоящем описании, означают «один или более» и включают множественное число, если контекст не является неподходящим.
[0088] Используемый в настоящем описании термин «антигенсвязывающий сайт» относится к части молекулы иммуноглобулина, которая участвует в связывании антигена. В антителах человека антигенсвязывающий сайт образуется аминокислотными остатками N-концевых вариабельных («V») областей тяжелой («H») и легкой («L») цепей. Три высоко дивергентных участка в V-областях тяжелой и легкой цепей называются «гипервариабельными областями», которые располагаются между более консервативными фланкирующими участками, известными как «каркасные области» или «FR». Таким образом, термин «FR» относится к аминокислотным последовательностям, которые в природе присутствуют в иммуноглобулинах между гипервариабельными областями и по соседству с ними. В молекуле человеческого антитела три гипервариабельные области легкой цепи и три гипервариабельные области тяжелой цепи располагаются относительно друг друга в трехмерном пространстве, с образованием антигенсвязывающей поверхности. Антигенсвязывающая поверхность комплементарна трехмерной поверхности связанного антигена, и три гипервариабельные области каждой из тяжелой и легкой цепей обозначаются как «области, определяющие комплементарность», или «CDR». У некоторых животных, таких как верблюды и хрящевые рыбы, антигенсвязывающий сайт сформирован одной цепью антитела с образованием «однодоменного антитела». Антигенсвязывающие сайты могут существовать в интактном антителе, в антигенсвязывающем фрагменте антитела, который сохраняет антигенсвязывающую поверхность, или в рекомбинантном полипептиде, таком как scFv, с использованием пептидного линкера для соединения вариабельного домена тяжелой цепи с вариабельным доменом легкой цепи в одном полипептиде.
[0089] Используемый в настоящем описании термин «опухолеспецифический антиген» означает любой антиген, включая, но не ограничиваясь этим, белок, гликопротеин, ганглиозид, углевод, липид, который ассоциирован со злокачественным новообразованием. Такой антиген может экспрессироваться на злокачественных клетках или в микроокружении опухоли, как например на кровеносных сосудах, ассоциированных с опухолью, внеклеточном матриксе, мезенхимальной строме или иммунных инфильтратах.
[0090] Используемые в настоящем описании термины «субъект» и «пациент» относятся к организму, подлежащему лечению способами и композициями, описанными в настоящем документе. Такие организмы предпочтительно включают, но не ограничиваются ими, млекопитающих (например, мышей, обезьян, лошадей, крупный рогатый скот, свиней, собак, кошек и тому подобное) и, более предпочтительно, включают человека.
[0091] Используемый в настоящем описании термин «эффективное количество» относится к количеству соединения (например, соединения по настоящему изобретению), достаточному для достижения полезных или целевых результатов. Эффективное количество может быть введено за одно или более введений, применений или дозировок и не предназначено для ограничения конкретным составом или путем введения. Используемый в настоящем описании термин «лечение» включает любой эффект, например уменьшение, снижение, модуляцию, улучшение или устранение, которые приводят к улучшению состояния, заболевания, расстройства и т. п. или ослаблению его симптома.
[0092] Используемый в настоящем описании термин «фармацевтическая композиция» относится к комбинации активного агента с носителем, инертным или активным, что делает композицию особенно подходящей для диагностического или терапевтического применения in vivo или ex vivo.
[0093] Используемый в настоящем описании термин «фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, таких как фосфатно-буферный солевой раствор, вода, эмульсии (например, такие как эмульсии масло/вода или вода/масло) и различные типы смачивающих агентов. Композиции также могут включать стабилизаторы и консерванты. Для примеров носителей, стабилизаторов и адъювантов см., например, Martin, Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975].
[0094] Используемый в настоящем описании термин «фармацевтически приемлемая соль» относится к любой фармацевтически приемлемой соли (например, кислоте или основанию) соединения по настоящему изобретению, которая при введении пациенту способна обеспечить соединение по настоящему изобретению или активный метаболит или его остаток. Как известно специалистам в данной области техники, «соли» соединений по настоящему изобретению могут быть получены из неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничиваются ими, соляную, бромоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоту и тому подобное. Другие кислоты, такие как щавелевая кислота, которые сами по себе не являются фармацевтически приемлемыми, могут быть использованы при получении солей, полезных в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых кислотно-аддитивных солей.
[0095] Типичные основания включают, но не ограничиваются ими, гидроксиды щелочных металлов (например, натрия), гидроксиды щелочноземельных металлов (например, магния), аммиак и соединения формулы NW4+, где W представляет собой C1-4алкил и тому подобное.
[0096] Примеры солей включают, но не ограничиваются ими: ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, флукогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и тому подобное. Другие примеры солей включают анионы соединений по настоящему изобретению, соединенные с подходящим катионом, таким как Na+, NH4+ и NW4+ (где W представляет собой C1-4алкильную группу), и тому подобное.
[0097] Для терапевтического применения соли соединений по настоящему изобретению рассматриваются как фармацевтически приемлемые. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения.
[0098] Во всем описании, где композиции описаны как имеющие, включающие или содержащие конкретные компоненты, или где процессы и способы описаны как имеющие, включающие или содержащие конкретные стадии, предполагается, что дополнительно существуют композиции по настоящему изобретению, которые состоят по существу или состоят из перечисленных компонентов, и что существуют процессы и способы согласно настоящему изобретению, которые состоят по существу или состоят из перечисленных стадий обработки.
[0099] Как правило, если в композиции указан процент, то это процент по массе, если не указано иное. Кроме того, если переменная не сопровождается определением, то предыдущее определение переменной является приоритетным.
I. Белки
[00100] Изобретение относится к полиспецифическим связывающим белкам, которые связываются с опухолеспецифическим антигеном на опухолевой клетке и с рецептором NKG2D и рецептором CD16 на клетках-натуральных киллерах для активации клеток-натуральных киллеров. Полиспецифические связывающие белки пригодны для фармацевтических композиций и терапевтических способов, описанных в настоящем документе. Связывание полиспецифического связывающего белка с рецептором NKG2D и рецептором CD16 на клетке-натуральном киллере усиливает активность клетки-натурального киллера в отношении разрушения опухолевой клетки. Связывание полиспецифического связывающего белка с опухолеспецифическим антигеном на опухолевой клетке приводит к тому, что опухолевая клетка приближается к клетке-натуральному киллеру, что облегчает прямое и косвенное разрушение опухолевой клетки клеткой-натуральным киллером. Дальнейшее описание примеров полиспецифических связывающих белков приведено ниже.
[00101] Первый компонент полиспецифических связывающих белков связывается с клетками, экспрессирующими рецептор NKG2D, которые могут включать, но не ограничиваются ими, NK-клетки, γδ T-клетки и CD8+ αβ T-клетки. После связывания NKG2D полиспецифические связывающие белки могут блокировать природные лиганды, такие как ULBP6 и MICA, от связывания с NKG2D.
[00102] Второй компонент полиспецифических связывающих белков связывается с одним или более опухолеспецифическими антигенами, которые могут включать, но не ограничиваются ими, HER2, CD20, CD33, BCMA, EpCAM, CD2, CD19, CD30, CD38, CD40, CD52, CD70, EGFR/ERBB1, IGF1R, HER3/ERBB3, HER4/ERBB4, MUC1, cMET, SLAMF7, PSCA, MICA, MICB, TRAILR1, TRAILR2, MAGE-A3, B7.1, B7.2, CTLA4 и PD1.
[00103] Третий компонент для полиспецифических связывающих белков связывается с клетками, экспрессирующими CD16, Fc-рецептор на поверхности лейкоцитов, включающих клетки-натуральные киллеры, макрофаги, нейтрофилы, эозинофилы, тучные клетки и фолликулярные дендритные клетки.
[00104] Полиспецифические связывающие белки могут принимать несколько форматов, как показано, но не ограничиваются приведенными ниже примерами. Один формат представляет собой гетеродимерное полиспецифическое антитело, включающее первую тяжелую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина и легкую цепь иммуноглобулина. Первая тяжелая цепь иммуноглобулина включает первый Fc-домен (шарнир-CH2-CH3), первый вариабельный домен тяжелой цепи и необязательно первый домен тяжелой цепи CH1. Легкая цепь иммуноглобулина включает вариабельный домен легкой цепи и константный домен легкой цепи; вместе с первой тяжелой цепью иммуноглобулина легкая цепь иммуноглобулина образует антигенсвязывающий сайт, который связывается с NKG2D. Вторая тяжелая цепь иммуноглобулина содержит второй Fc-домен (шарнир-CH2-CH3), второй вариабельный домен тяжелой цепи и необязательно второй домен тяжелой цепи CH1, который может спариваться с легкой цепью иммуноглобулина, идентичной той, которая спаривается с первой тяжелой цепью иммуноглобулина, за исключением того, когда легкая цепь иммуноглобулина спаривается со второй тяжелой цепью иммуноглобулина, причем полученный антигенсвязывающий сайт связывается с опухолевым антигеном. Первый Fc-домен и второй Fc-домен вместе могут связываться с CD16 (ФИГ.1).
[00105] Другой примерный формат включает гетеродимерное полиспецифическое антитело, которое включает в себя первую тяжелую цепь иммуноглобулина, легкую цепь иммуноглобулина и вторую тяжелую цепь иммуноглобулина. Первая тяжелая цепь иммуноглобулина включает в себя первый Fc-домен (шарнир-CH2-CH3), слитый либо посредством линкера, либо шарнира антитела с одноцепочечным Fv (scFv), который связывается с NKG2D. Различные линкеры могут быть использованы для связывания scFv с первым доменом Fc или внутри самого scFv. Кроме того, scFv может включать мутации, которые делают возможным образование дисульфидной связи для стабилизации общей структуры scFv. ScFv также может включать мутации для модификации изоэлектрической точки всей первой тяжелой цепи иммуноглобулина и/или для обеспечения более легкой последующей очистки. Вторая тяжелая цепь иммуноглобулина включает второй Fc-домен (шарнир-CH2-CH3) и второй вариабельный домен тяжелой цепи и второй необязательный домен тяжелой цепи CH1. Легкая цепь иммуноглобулина включает вариабельный домен легкой цепи и константный домен легкой цепи. Вторая тяжелая цепь иммуноглобулина спаривается с легкой цепью иммуноглобулина и связывается с опухолевым антигеном. Первый Fc-домен и второй Fc-домен вместе могут связываться с CD16 (ФИГ. 2).
[00106] Альтернативный формат гетеродимерных полиспецифических белков включает первую тяжелую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина, первую легкую цепь иммуноглобулина и вторую легкую цепь иммуноглобулина. Первая тяжелая цепь иммуноглобулина включает первый Fc-домен (шарнир-CH2-CH3), первый вариабельный домен тяжелой цепи и необязательно первый домен CH1 тяжелой цепи. Первая легкая цепь иммуноглобулина включает вариабельный домен легкой цепи и константный домен легкой цепи. Вместе с первой тяжелой цепью иммуноглобулина первая легкая цепь иммуноглобулина образует антигенсвязывающий сайт, который связывается с опухолевым антигеном. Вторая тяжелая цепь иммуноглобулина содержит второй Fc-домен (шарнир-CH2-CH3), второй вариабельный домен тяжелой цепи и необязательно второй домен тяжелой цепи CH1. Вторая легкая цепь иммуноглобулина включает вариабельный домен легкой цепи и константный домен легкой цепи. Вместе со второй тяжелой цепью иммуноглобулина легкая цепь иммуноглобулина образует антигенсвязывающий сайт, который связывается с тем же опухолевым антигеном. Вторая тяжелая цепь иммуноглобулина может спариваться с легкой цепью иммуноглобулина, которая может быть идентична легкой цепи иммуноглобулина, которая спаривается с первой тяжелой цепью иммуноглобулина, за исключением того, когда легкая цепь иммуноглобулина спаривается со второй тяжелой цепью иммуноглобулина, причем получающийся в результате антигенсвязывающий сайт является вторым антигенсвязывающим сайтом, который связывается с опухолевым антигеном. В некоторых вариантах осуществления первый Fc-домен и второй Fc-домен вместе могут связываться с CD16 (ФИГ.1).
[00107] Один или более дополнительных мотивов связывания могут быть слиты с С-концом домена СН3 константной области, необязательно через линкерную последовательность. В некоторых вариантах осуществления антигенсвязывающий сайт может представлять собой одноцепочечную или стабилизированную дисульфидом вариабельную область (ScFv) или может образовывать четырехвалентную или трехвалентную молекулу.
[00108] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме Triomab, который представляет собой трифункциональное биспецифичное антитело, которое поддерживает IgG-подобную форму. Эта химера состоит из двух половинных антител, каждое с одной легкой и одной тяжелой цепью, которые происходят от двух родительских антител.
[00109] В некоторых вариантах осуществления полиспецифический связывающий белок представляет собой форму с общей легкой цепью (LC) KiH, в которой используется технология «выступы во впадины» (KIH). KIH включает сконструированные домены CH3 для создания либо «выступа», либо «впадины» в каждой тяжелой цепи для содействия гетеродимеризации. Концепция технологии Fc «выступы-во-впадины (KiH)» заключалась в том, чтобы ввести «выступ» в одном домене CH3 (CH3A) путем замены небольшого остатка на объемный (то есть T366WCH3A в нумерации EU). Чтобы приспособить «выступ», на другом домене CH3 (CH3B) была создана комплементарная поверхность «впадины» путем замены ближайших соседних к выступу остатков на меньшие (т. е. T366S/L368A/Y407VCH3B). Мутация «впадины» была оптимизирована путем структурно-управляемого скрининга фаговой библиотеки (Atwell S, Ridgway JB, Wells JA, Carter P. Stable heterodimers from remodeling the domain interface of a homodimer using a phage display library. J Mol Biol (1997) 270(1):26-35). Рентгенокристаллические структуры вариантов KiH Fc (Elliott JM, Ultsch M, Lee J, Tong R, Takeda K, Spiess C, et al., Antiparallel conformation of knob and hole aglycosylated half-antibody homodimers is mediated by a CH2-CH3 hydrophobic interaction. J Mol Biol (2014) 426(9):1947-57; Mimoto F, Kadono S, Katada H, Igawa T, Kamikawa T, Hattori K. Crystal structure of a novel asymmetrically engineered Fc variant with improved affinity for FcgammaRs. Mol Immunol (2014) 58 (1): 132-8) продемонстрировали, что гетеродимеризация термодинамически поддерживается гидрофобными взаимодействиями, обусловленными стерической комплементарностью в коровом интерфейсе между CH3-доменами, тогда как интерфейсы выступ-выступ и впадина-впадина не благоприятствуют гомодимеризация вследствие стерических помех и нарушения благоприятных взаимодействий, соответственно.
[00110] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме иммуноглобулина с двумя вариабельными доменами (DVD-Ig™), который объединяет домены связывания мишеней двух моноклональных антител через гибкие природные линкеры с получением четырехвалентной IgG-подобной молекулы.
[00111] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме ортогонального Fab-интерфеса (Орто-Fab). В подходе орто-Fab IgG (Lewis SM, Wu X, Pustilnik A, Sereno A, Huang F, Rick HL, et al. Generation of bispecific IgG antibodies by structure-based design of an orthogonal Fab interface. Nat. Biotechnol. (2014) 32 (2): 191-8), региональный дизайн на основе структуры вводит комплементарные мутации в интерфейсе LC и HCVH-CH1 только в одном Fab без каких-либо изменений в другом Fab.
[00112] В некоторых вариантах осуществления полиспецифический связывающий белок имеет формат «2 в 1 Ig». В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме ES, которая представляет собой гетеродимерную конструкцию, содержащую 2 различных Fab, связывающихся с мишенью 1 и мишенью 2, слитых с Fс. Гетеродимеризация обеспечивается мутациями электростатического взаимодействия в Fc. В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме Bodyλ-Body, которая представляет собой гетеродимерные конструкции с 2 различными Fab, слитыми с Fc, стабилизированными мутациями гетеродимеризации: Fab1, нацеленный на антиген 1, содержит каппа-LC, тогда как второй Fab, нацеленный на антиген 2, содержит лямбда LC. ФИГ. 13А является примерным представлением одной формы κλ-Body; ФИГ. 13B является примерным представлением другого κλ-Body.
[00113] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме с обменом Fab-фрагментов (антитела, которые обмениваются Fab-фрагментами путем замены тяжелой цепи и присоединенной легкой цепи (полу-молекулы) на пару тяжелых-легких цепей из другой молекулы, что приводит к получению биспецифичных антител). В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме SEED-Body (доменная платформа сконструированного с обменом цепей (SEED) была разработана для генерирования асимметричных и биспецифичных антителоподобных молекул, что позволяет расширять терапевтические применения природных антител. Эта платформа, созданная белковой инженерией, основана на обмене структурно родственных последовательностей иммуноглобулина в консервативных доменах СН3. Конструкция SEED позволяет эффективно генерировать гетеродимеры AG/GA, в то же время препятствуя гомодимеризации доменов CH3 AG и GA SEED. (Muda M. et al., Protein Eng. Des. Sel. (2011, 24 (5): 447-54). В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме LuZ-Y, в которой домен лейциновой застежки используется для индуцирования гетеродимеризации двух разных HC. (Wranik, BJ. Et al., J. Biol. Chem. (2012), 287: 43331-9).
[00114] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме Cov-X-Body (в биспецифичных CovX-Body два разных пептида соединяются вместе с использованием разветвленного азетидинонового линкера и сливаются с каркасным антителом в мягких условиях сайтспецифичным образом. В то время как фармакофоры отвечают за функциональную активность, каркас антител обеспечивает длительный период полужизни и Ig-подобное распределение. Фармакофоры могут быть химически оптимизированы или заменены другими фармакофорами для получения оптимизированных или уникальных биспецифичных антител. (Doppalapudi VR et al., PNAS (2010), 107 (52); 22611-22616).
[00115] В некоторых вариантах осуществления полиспецифический связывающий белок находится в гетеродимерной форме Oasc-Fab, которая включает Fab, связывающийся с мишенью 1, и scFab, связывающийся с мишенью 2, слитые с Fc. Гетеродимеризация обеспечивается мутациями в Fс.
[00116] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме DuetMab, которая представляет собой гетеродимерную конструкцию, содержащую 2 различных Fab, связывающихся с антигеном 1 и 2, и Fс, стабилизированный мутациями гетеродимеризации. Fab 1 и 2 содержат различные SS-мостики, которые обеспечивают корректное спаривание LC и HC.
[00117] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме CrossmAb, которая представляет собой гетеродимерную конструкцию с 2 различными Fab, связывающимися с мишенью 1 и 2, слитыми с Fc, стабилизированными гетеродимеризацией. Домены CL и CH1 и домены VH и VL переключаются, например, CH1 сливается в одном полипептиде с VL, в то время как CL сливается в одном полипептиде с VH.
[00118] В некоторых вариантах осуществления полиспецифический связывающий белок находится в форме Fit-Ig, которая представляет собой гомодимерные конструкции, где Fab, связывающийся с антигеном 2, слит с N-концом HC Fab, который связывается с антигеном 1. Конструкция содержит Fc дикого типа.
[00119] В Таблице 1 перечислены пептидные последовательности вариабельных доменов тяжелой цепи и вариабельных доменов легкой цепи, которые в комбинации могут связываться с NKG2D.
(SEQ ID NO:1)
(SEQ ID NO:2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(A40)
(SEQ ID NO:5)
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
(C26)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
(SEQ ID NO:23)
(SEQ ID NO:24)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:27)
(SEQ ID NO:28)
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:37)
(SEQ ID NO:38)
(F47)
(SEQ ID NO:39)
(SEQ ID NO:40)
(SEQ ID NO:41)
(SEQ ID NO:42)
(F43)
(SEQ ID NO:43)
(SEQ ID NO:44)
(A44)
(SEQ ID NO:45)
CDR1 (SEQ ID NO:51) - FTFSSYAMS
CDR2 (SEQ ID NO:52) - AISGSGGSTYYADSVKG
CDR3 (SEQ ID NO:53) - AKDGGYYDSGAGDY
(SEQ ID NO:46)
CDR1 (SEQ ID NO:54) - RASQGIDSWLA
CDR2 (SEQ ID NO:55) - AASSLQS
CDR3 (SEQ ID NO:56) - QQGVSYPRT
(A49)
(SEQ ID NO:47)
CDR1 (SEQ ID NO:57) - FTFSSYSMN
CDR2 (SEQ ID NO:58) - SISSSSSYIYYADSVKG
CDR3 (SEQ ID NO:59) - ARGAPMGAAAGWFDP
(SEQ ID NO:48)
CDR1 (SEQ ID NO:60) - RASQGISSWLA
CDR2 (SEQ ID NO:61) - AASSLQS
CDR3 (SEQ ID NO:62) - QQGVSFPRT
(F63)
(SEQ ID NO:49)
CDR1 (SEQ ID NO:63) - YTFTGYYMH
CDR2 (SEQ ID NO:64) - WINPNSGGTNYAQKFQG
CDR3 (SEQ ID NO:65) - ARDTGEYYDTDDHGMDV
(SEQ ID NO:50)
CDR1 (SEQ ID NO:66) - RASQSVSSNLA
CDR2 (SEQ ID NO:67) - GASTRAT
CDR3 (SEQ ID NO:68) - QQDDYWPPT
(F04)
(SEQ ID NO:78)
(SEQ ID NO:79)
(SEQ ID NO:80)
(SEQ ID NO:81)
[00120] Альтернативно, вариабельный домен тяжелой цепи, определенный SEQ ID NO: 69, может спариваться с вариабельным доменом легкой цепи, определенным SEQ ID NO: 70, с образованием антигенсвязывающего сайта, который может связываться с NKG2D, как проиллюстрировано в патенте США 9273136.
SEQ ID NO:69
QVQLVESGGGLVKPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAFIRYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDRGLGDGTYFDYWGQGTTVTVSS
SEQ ID NO: 70 QSALTQPASVSGSPGQSITISCSGSSSNIGNNAVNWYQQLPGKAPKLLIYYDDLLPSGVSDRFSGSKSGTSAFLAISGLQSEDEADYYCAAWDDSLNGPVFGGGTKLTVL
[00121] Альтернативно, вариабельный домен тяжелой цепи, определенный SEQ ID NO: 71, может спариваться с вариабельным доменом легкой цепи, определенным SEQ ID NO: 72, с образованием антигенсвязывающего сайта, который может связываться с NKG2D, как проиллюстрировано в патенте США 7879985.
SEQ ID NO:71
QVHLQESGPGLVKPSETLSLTCTVSDDSISSYYWSWIRQPPGKGLEWIGHISYSGSANYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCANWDDAFNIWGQGTMVTVSS
SEQ ID NO: 72 EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPWTFGQGTKVEIK
[00122] Внутри Fc-домена связывание CD16 опосредуется шарнирной областью и доменом CH2. Например, в человеческом IgG1 взаимодействие с CD16 главным образом сосредоточено на аминокислотных остатках Asp 265 - Glu 269, Asn 297 - Thr 299, Ala 327 - Ile 332, Leu 234 - Ser 239 и углеводном остатке N-ацетил-D-глюкозамин в домене СН2 (см. Sondermann et al., Nature, 406 (6793): 267-273). На основе известных доменов могут быть выбраны мутации для усиления или уменьшения аффинности связывания с CD16, как например, с использованием библиотек фагового дисплея или библиотек кДНК дрожжевого дисплея, или мутации могут быть сконструированы на основе известной трехмерной структуры взаимодействия.
[00123] Сборка тяжелых цепей гетеродимерных антител может быть осуществлена путем экспрессии двух разных последовательностей тяжелых цепей антител в одной и той же клетке, что может привести к сборке гомодимеров каждой тяжелой цепи антитела, а также сборке гетеродимеров. Содействие преимущественной сборке гетеродимеров может быть достигнуто путем включения различных мутаций в домен СН3 каждой константной области тяжелой цепи антитела, как показано в US13/494870, US16/028850, US11/533709, US12/875015, US13/289934, US14/773418, US12/811207, US13/866756, US14/647480, US14/830336. Например, мутации могут быть сделаны в домене CH3 на основе человеческого IgG1 и включают различные пары аминокислотных замен в первом полипептиде и втором полипептиде, которые позволяют этим двум цепям селективно гетеродимеризоваться друг с другом. Положения аминокислотных замен, показанные ниже, пронумерованы в соответствии с индексом EU, как в Kabat.
[00124] В одном сценарии аминокислотная замена в первом полипептиде заменяет исходную аминокислоту более крупной аминокислотой, выбранной из аргинина (R), фенилаланина (F), тирозина (Y) или триптофана (W) и, по меньшей мере, одна аминокислотная замена во втором полипептиде заменяет исходную аминокислоту (аминокислоты) меньшей аминокислотой(аминокислотами), выбранной из аланина (A), серина (S), треонина (T) или валина (V), так что более крупная аминокислотная замена (выпуклость) вписывается в поверхность более мелких аминокислотных замен (полость). Например, один полипептид может включать замену T366W, а другой может включать три замены, включая T366S, L368A и Y407V.
[00125] Вариабельный домен тяжелой цепи антитела по изобретению необязательно может быть связан с аминокислотной последовательностью, по меньшей мере, на 90% идентичной константной области антитела, такой как константная область IgG, включая шарнирные домены, домены СН2 и СН3 с доменом СН1 или без него. В некоторых вариантах осуществления аминокислотная последовательность константной области, по меньшей мере, на 90% идентична константной области человеческого антитела, такой как константная область человеческого IgG1, константная область IgG2, константная область IgG3 или константная область IgG4. В некоторых других вариантах осуществления аминокислотная последовательность константной области по меньшей мере на 90% идентична константной области антитела другого млекопитающего, такого как кролик, собака, кошка, мышь или лошадь. Одна или более мутаций могут быть включены в константную область по сравнению с константной областью человеческого IgG1, например, в Q347, Y349, L351, S354, E356, E357, K360, Q362, S364, T366, L368, K370, N390, K392, T394, D399, S400, D401, F405, Y407, K409, T411 и/или K439. Типичные замены включают, например, Q347E, Q347R, Y349S, Y349K, Y349T, Y349D, Y349E, Y349C, T350V, L351K, L351D, L351Y, S354C, E356K, E357Q, E357L, E357W, K360E, K360W, Q362E, S364K, S364E, S364H, S364D, T366V, T366I, T366L, T366M, T366K, T366W, T366S, L368E, L368A, L368D, K370S, N390D, N390E, K392L, K392M, K392V, K392F, K392D, K392E, T394F, T394W, D399R, D399K, D399V, S400K, S400R, D401K, F405A, F405T, Y407A, Y407I , Y407V, K409F, K409W, K409D, T411D, T411E, K439D и K439E.
[00126] В некоторых вариантах осуществления мутации, которые могут быть включены в CH1 константной области человеческого IgG1, могут находиться в аминокислоте V125, F126, P127, T135, T139, A140, F170, P171 и/или V173. В некоторых вариантах осуществления мутации, которые могут быть включены в Cκ константной области IgG1 человека, могут находиться в аминокислоте E123, F116, S176, V163, S174 и/или T164.
[00127] Альтернативно, аминокислотные замены могут быть выбраны из следующих наборов замен, представленных в Таблице 2.
[00128] Альтернативно, аминокислотные замены могут быть выбраны из следующих наборов замен, представленных в Таблице 3.
[00129] Альтернативно, аминокислотные замены могут быть выбраны из следующего набора замен, представленных в Таблице 4.
[00130] Альтернативно, по меньшей мере, одна аминокислотная замена в каждой полипептидной цепи может быть выбрана из Таблицы 5.
[00131] Альтернативно, по меньшей мере, одна аминокислотная замена может быть выбрана из следующего набора замен в Таблице 6, где положение(я), указанное в столбце «Первый полипептид», заменено любой известной отрицательно заряженной аминокислотой, и положение(я), указанное в столбце «Второй полипептид», заменено любой известной положительно заряженной аминокислотой.
[00132] Альтернативно, по меньшей мере, одна аминокислотная замена может быть выбрана из следующего набора в Таблице 7, где положение(я), указанное в столбце «Первый полипептид», заменено любой известной положительно заряженной аминокислотой, и указанное положение(я), указанное в столбце «Второй полипептид», заменено любой известная отрицательно заряженной аминокислотой.
[00133] Альтернативно, аминокислотные замены могут быть выбраны из следующего набора в Таблице 8.
[00134] Альтернативно или дополнительно, структурная стабильность гетеромультимерного белка может быть повышена путем введения S354C либо на первой либо на второй полипептидной цепи, и Y349C на противоположной полипептидной цепи, которая образует искусственный дисульфидный мостик внутри интерфейса двух полипептидов.
[00135] Полиспецифичные белки, описанные выше, могут быть получены с использованием технологии рекомбинантных ДНК, хорошо известных специалисту в данной области. Например, первая последовательность нуклеиновой кислоты, кодирующая первую тяжелую цепь иммуноглобулина, может быть клонирована в первый экспрессирующий вектор; вторая последовательность нуклеиновой кислоты, кодирующая вторую тяжелую цепь иммуноглобулина, может быть клонирована во второй экспрессирующий вектор; третью последовательность нуклеиновой кислоты, кодирующую легкую цепь иммуноглобулина, можно клонировать в третий экспрессирующий вектор; первый, второй и третий экспрессирующие векторы могут вместе стабильно трансфецироваться в клетки-хозяева для продуцирования мультимерных белков.
[00136] Для достижения наибольшего выхода полиспецифического белка можно поэкспериментировать с различными соотношениями первого, второго и третьего экспрессирующего вектора, чтобы определить оптимальное соотношение для трансфекции в клетки-хозяева. После трансфекции отдельные клоны могут быть выделены для генерации банка клеток с использованием методов, известных в данной области, таких как лимитированное разведение, ИФА, FACS, микроскопия или Clonepix.
[00137] Клоны можно культивировать в условиях, подходящих для масштабирования для биореактора и поддержания экспрессии полиспецифического белка. Полиспецифические белки могут быть выделены и очищены с использованием методов, известных в данной области, включая центрифугирование, глубинную фильтрацию, лизис клеток, гомогенизацию, замораживание-оттаивание, аффинную очистку, гель-фильтрацию, ионообменную хроматографию, обменную хроматографию гидрофобного взаимодействия и смешанный режим хроматографии.
II. Характеристики TriNKET
[00138] В определенных вариантах осуществления описанные в настоящем документе TriNKET, которые включают в себя NKG2D-связывающий домен и связывающий домен для опухолеспецифического антигена, связываются с клетками, экспрессирующими NKG2D человека. В некоторых вариантах осуществления TriNKET, которые включают NKG2D-связывающий домен и связывающий домен для опухолеспецифического антигена, связываются с опухолеспецифическим антигеном на уровне, сопоставимом с уровнем для моноклонального антитела, имеющего тот же опухолеспецифический антигенсвязывающий домен. Например, TriNKET, которые включают в себя NKG2D-связывающий домен и HER2-связывающий домен из трастузумаба, могут связываться с HER2, экспрессируемым на клетках, на уровне, сопоставимом с уровнем трастузумаба.
[00139] Однако описанные в настоящем документе TriNKET более эффективны в снижении роста опухоли и уничтожении опухолевых клеток. Например, TriNKET по настоящему изобретению, который нацелен на HER2-экспрессирующие опухоли/опухолевые клетки, более эффективен, чем SC2.2 - одноцепочечная биспецифическая молекула, сконструированная из scFv, полученного из трастузумаба, связанного с ULBP-6, лигандом для NKG2D. SC2.2 связывается с HER2+ опухолевыми клетками и NKG2D+ NK-клетками одновременно. Поэтому была исследована эффективность SC2.2 в снижении количества HER2+ опухолевых клеток. Исследования активации и цитотоксичности in vitro показали, что SC2.2 была эффективна в активации и уничтожении NK-клеток. Однако SC2.2 не смогла продемонстрировать эффективность в модели подкожной опухоли RMA/S-HER2. Эффективность SC2.2 также тестировали in vivo с использованием сингенной мышиной модели со сверхэкспрессией RMA/S-HER2. В этой мышиной модели SC2.2 не смогла продемонстрировать контроль роста опухоли по сравнению с контролем носителя. Таким образом, хотя SC2.2 была способна активировать и уничтожать NK-клетки и связываться с HER2+ опухолевыми клетками, этих свойств было недостаточно для эффективного контроля роста HER2+ опухоли.
[00140] В определенных вариантах осуществления описанные в настоящем документе TriNKET, которые включают NKG2D-связывающий домен и связывающий домен для опухолеспецифического антигена, активируют первичные человеческие NK-клетки при культивировании с опухолевыми клетками, экспрессирующими антиген. Активация NK-клеток отмечена увеличением дегрануляции CD107a и продууированием цитокинов IFNγ. Кроме того, по сравнению с моноклональным антителом, которое включает опухолеспецифический антигенсвязывающий домен, TriNKET демонстрируют превосходную активацию человеческих NK-клеток в присутствии опухолевых клеток, экспрессирующих антиген. Например, по сравнению с моноклональным антителом трастузумабом, TriNKET по настоящему изобретению, имеющие HER2-связывающий домен, обладают превосходной активацией человеческих NK-клеток в присутствии HER2-экспрессирующих опухолевых клеток.
[00141] В определенных вариантах осуществления описанные в настоящем документе TriNKET, которые включают NKG2D-связывающий домен и связывающий домен для опухолеспецифического антигена, усиливают активность покоящихся и IL-2-активированных NK-клеток человека в присутствии опухолевых клеток, экспрессирующих антиген. Покоящиеся NK-клетки показали меньшее фоновое продуцирование IFNγ и дегрануляцию CD107a, чем IL-2-активированные NK-клетки. В некоторых вариантах осуществления покоящиеся NK-клетки демонстрируют большее изменение продуцирования IFNγ и дегрануляции CD107a по сравнению с IL-2-активированными NK-клетками. В некоторых вариантах осуществления IL-2-активированные NK-клетки демонстрируют больший процент клеток, становящихся IFNγ+; CD107a+ после стимулирования с помощью TriNKET.
[00142] В определенных вариантах осуществления описанные в настоящем документе TriNKET, которые включают NKG2D-связывающий домен и связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2), усиливают цитотоксическую активность покоящихся и IL-2-активированных человеческих NK-клеток в присутствии опухолевых клеток, экспрессирующих антиген. Кроме того, TriNKET (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), которые включают связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2), более эффективно усиливают ответ прямо активированных и покоящихся NK-клеток против опухолевых клеток по сравнению с моноклональным антителом, которое включает тот же сайт связывания опухолеспецифического антигена. В некоторых вариантах осуществления TriNKET обладают преимуществом в отношении опухолевых клеток, экспрессирующих опухолевые антигены на среднем и низком уровне, по сравнению с моноклональными антителами, которые включают тот же сайт связывания опухолевого антигена. Следовательно, терапия, включающая TriNKET, может превосходить терапию моноклональными антителами.
[00143] В определенных вариантах осуществления, по сравнению с моноклональными антителами, TriNKET, описанные в настоящем документе (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), которые включают связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2), пригодны при лечении злокачественного новообразования с высокой экспрессией рецептора Fc (FcR) или злокачественных новообразований, находящихся в микроокружении опухоли с высоким уровнем FcR. Моноклональные антитела оказывают свое влияние на рост опухоли посредством множества механизмов, включая, среди прочего, ADCC, CDC, фагоцитоз и сигнальную блокаду. Среди FcγR CD16 имеет самую низкую аффинность к Fc IgG; FcγRI (CD64) является высокоаффинным FcR, который связывается примерно в 1000 раз сильнее с IgG Fc, чем с CD16. CD64 обычно экспрессируется на многих клетках гемопоэтических линий, таких как миелоидная линия, и может экспрессироваться на опухолях, происходящих из этих типов клеток, таких как острый миелолейкоз (AML). Иммунные клетки, инфильтрующиеся в опухоль, такие как MDSC и моноциты, также экспрессируют CD64 и, как известно, инфильтруются в микроокружение опухоли. Экспрессия CD64 опухолью или в микроокружении опухоли может оказывать вредное влияние на терапию моноклональными антителами. Экспрессия CD64 в микроокружении опухоли затрудняет взаимодействие этих антител с CD16 на поверхности NK-клеток, поскольку антитела предпочитают связываться с высокоаффинным рецептором. TriNKET, направленно воздействуя на два активирующих рецептора на поверхности NK-клеток, могут преодолеть пагубное влияние экспрессии CD64 (либо на опухоль, либо на микроокружение опухоли) на терапию моноклональными антителами. Независимо от экспрессии CD64 на опухолевых клетках, TriNKET способны опосредовать ответы человеческих NK-клеток против всех опухолевых клеток, поскольку двойное нацеливание двух активирующих рецепторов на NK-клетки обеспечивает более сильное специфическое связывание с NK-клетками.
[00144] В некоторых вариантах осуществления описанные в настоящем документе TriNKET (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), которые включают связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2) обеспечивают лучший профиль безопасности благодаря уменьшению побочных эффектов, связанных с ошибочным нацеливанием вне опухоли. Клетки-натуральные киллеры и CD8 T-клетки способны непосредственно лизировать опухолевые клетки, хотя механизмы, посредством которых NK-клетки и CD8 T-клетки отличают собственные здоровые клетки от опухолевых клеток, различаются. Активность NK-клеток регулируется балансом сигналов от активирующих (NCR, NKG2D, CD16 и т. д.) и ингибирующих (KIR, NKG2A и т. д.) рецепторов. Баланс этих активирующих и ингибирующих сигналов позволяет NK-клеткам определять здоровые собственные клетки из подвергнутых стрессовому воздействию, инфицированных вирусом или трансформированных собственных клеток. Этот «встроенный» механизм аутотолерантности поможет защитить нормальную здоровую ткань от ответов NK-клеток. Чтобы расширить этот принцип, аутотолерантность NK-клеток позволит TriNKET нацеливаться на антигены, экспрессируемые как на собственных клетках, так и на опухоли, без побочных эффектов, связанных с ошибочным нацеливанием вне опухоли, или с увеличенным терапевтическим окном. В отличие от клеток-натуральных киллеров, Т-клетки требуют распознавания специфического пептида, презентированного молекулами МНС для активации и эффекторных функций. Т-клетки были основной целью иммунотерапии, и было разработано много стратегий для перенаправления Т-клеточных ответов против опухоли. Биспецифические Т-клетки, ингибиторы контрольных точек и CAR-T-клетки одобрены FDA, но часто страдают от дозолимитирующей токсичности. Биспецифические Т-клетки и CAR-T-клетки функционируют вокруг системы распознавания TCR-MHC, используя связывающие домены для нацеливания на антигены на поверхности опухолевых клеток и используя сконструированные сигнальные домены для передачи сигналов активации в эффекторную клетку. Несмотря на то, что эти методы лечения эффективны для выявления противоопухолевого иммунного ответа, они часто сочетаются с синдромом высвобождения цитокинов (CRS) и побочными эффектами, связанными с ошибочным нацеливанием вне опухоли. В этом контексте TriNKET уникальны, так как они не «перекрывают» естественные системы активации и ингибирования NK-клеток. Вместо этого TriNKET предназначены для изменения баланса и обеспечения дополнительных сигналов активации для NK-клеток, сохраняя при этом NK-толерантность к собственным клеткам.
[00145] В некоторых вариантах осуществления описанные в настоящем документе TriNKET, включающие NKG2D-связывающий домен (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), которые включают связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2), более эффективно задерживают прогрессирование опухоли, чем моноклональные антитела, которые включают тот же самый опухолевый антигенсвязывающий домен. В некоторых вариантах осуществления TriNKET, включающие NKG2D-связывающий домен и опухолевый антигенсвязывающий домен, более эффективны против метастазов рака, чем моноклональные антитела, которые включают тот же опухолевый антигенсвязывающий домен.
[00146] Вышеприведенное описание описывает множество аспектов и вариантов осуществления изобретения. В заявке на патент конкретно рассматриваются все комбинации и перестановки аспектов и вариантов осуществления.
III. Терапевтические применения
[00147] Изобретение относится к способам лечения злокачественного новообразования с использованием описанного в настоящем документе полиспецифического связывающего белка (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), которые включают связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2), и/или к фармацевтической композиции, описанной в настоящем документе. Способы могут быть использованы для лечения различных видов злокачественных новообразований, включая солидную опухоль, лимфому и лейкоз. Тип злокачественного новообразования, подлежащего лечению, желательно сопоставлять с типом опухолевой клетки, с которой связывается полиспецифический связывающий белок. Например, лечение злокачественного новообразования, клетки которого экспрессируют молекулу адгезии эпителиальных клеток (EpCAM), такого как рак толстой кишки, экспрессирующий EpCAM, желательно лечить с использованием описанного в настоящем документе полиспецифического связывающего белка, который связывается с ней. Дополнительные аспекты и варианты осуществления терапевтических способов описаны ниже.
[00148] Соответственно, один аспект изобретения относится к способу лечения злокачественного новообразования у пациента, где способ включает введение пациенту, нуждающемуся в этом, терапевтически эффективного количества полиспецифического связывающего белка, описанного в настоящем документе (например, A40-TriNKET, A44- TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), который включает связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2) для лечения злокачественного новообразования. Примеры злокачественного новообразования, подлежащего лечению, включают солидную опухоль, лейкоз и лимфому.
[00149] Терапевтический способ может быть охарактеризован в зависимости от злокачественного новообразования, подлежащего лечению. Например, в определенных вариантах осуществления злокачественное новообразование представляет собой солидную опухоль. В некоторых других вариантах осуществления злокачественное новообразование представляет собой рак мозга, рак мочевого пузыря, рак молочной железы, рак шейки матки, рак толстой кишки, колоректальный рак, рак эндометрия, рак пищевода, лейкоз, рак легких, рак печени, меланому, рак яичников, рак поджелудочной железы, рак простаты рак прямой кишки, рак почки, рак желудка, рак яичка или рак матки. Еще в других вариантах осуществления злокачественное новообразование представляет собой васкуляризованную опухоль, плоскоклеточный рак, аденокарциному, мелкоклеточный рак, меланому, глиому, нейробластому, саркому (например, ангиосаркому или хондросаркому), рак гортани, рак околоушной железы, рак желчных путей, рак щитовидной железы, акральн-лентигинозную меланому, актинический кератоз, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, аденоидно-кистозную карциному, аденомы, аденосаркому, железисто-плоскоклеточную карциному, рак анального канала, анальный рак, ректальный рак, астроцитарную опухоль, карциному бартолиновой железы, базальноклеточную карциному, рак печени, рак костей, рак костного мозга, рак бронхов, карциному бронхиальной железы, карциноид, холангиокарциному, хондосаркому, хориодпапиллому/карциному, хронический лимфолейкоз, хронический миелоидный лейкоз, светлоклеточный рак, рак соединительной ткани, цистаденому, рак пищеварительной системы, рак двенадцатиперстной кишки, рак эндокринной системы, опухоль эндодермальной пазухи, гиперплазию эндометрия, стромальную саркому эндометрия, эндометриоидную аденокарциному, эндотелиальный рак, эпендимальный рак, эпителиально-клеточный рак, саркому Юинга, рак глаз и глазной орбиты, рак женских половых органов, фокальную нодулярную гиперплазию, рак желчного пузыря, рак полости желудка, рак дна желудка, гастриному, глиобластому, глюкагоному, рак сердца, гемангибластомы, гемангиоэндотелиому, гемангиомы, печеночную аденому, печеночный аденоматоз, гепатобилиарный рак, гепатоцеллюлярную карциному, болезнь Ходжкина, рак подвздошной кишки, инсулиному, интраэпителиальную неоплазию, интраэпителиальную плоскоклеточную неоплазию, рак внутрипеченочных желчных протоков, инвазивную плоскоклеточную карциному, рак тонкой кишки, рак соединительной ткани, саркому Капоши, рак малого таза, крупноклеточный рак, рак толстой кишки, лейомиосаркому, лентиго-меланому, лимфому, рак мужских половых органов, злокачественную меланому, злокачественные мезотелиальные опухоли, медуллобластому, медуллоэпителиому, менингеальный рак, мезотелиальный рак, метастатический рак, рак полости рта, мукоэпидермоидную карциному, множественную миелому, рак мышц, рак носового канала, рак нервной системы, нейроэпителиальную аденокарциному, нодулярную меланому, неэпителиальный рак кожи, неходжкинскую лимфому, овсяно-клеточный рак, олигодендроглиальный рак, рак полости рта, остеосаркому, папиллярную серозную аденокарциному, опухоли гипофиза, плазмоцитому, псевдосаркому, легочную бластому, рак прямой кишки, почечно-клеточный рак, рак дыхательной системы, ретинобластому, рабдомиосаркому, саркому, серозную карциному, рак пазухи, рак кожи, мелкоклеточный рак, рак тонкого кишечника, рак мягких тканей, соматостатин-секретирующую опухоль, рак позвоночника, плоскоклеточную карциному, рак поперечно-полосатых мышц, субмезотелиальный рак, меланому поверхностного распространения, Т-клеточный лейкоз, рак языка, недифференцированный рак, рак мочеточника, рак мочеиспускательного канала, рак мочевого пузыря, рак мочеполовой системы, рак шейки матки, рак тела матки, увеальную меланому, рак влагалища, бородавчатый рак, Випому, рак вульвы, хорошо дифференцированную карциному или опухоль Вильмса.
[00150] В некоторых других вариантах осуществления злокачественное новобразование представляет собой неходжкинскую лимфому, такую как В-клеточная лимфома или Т-клеточная лимфома. В некоторых вариантах осуществления неходжкинская лимфома представляет собой В-клеточную лимфому, такую как диффузная крупноклеточная В-клеточная лимфома, первичная средостенная В-клеточная лимфома, фолликулярная лимфома, малкоклеточная лимфоцитарная лимфома, лимфома мантийных клеток, В-клеточная лимфома маргинальной зоны, B-клеточная лимфома экстранодальной маргинальной зоны, B-клеточная лимфома узловой маргинальной зоны, B-клеточная лимфома маргинальной зоны селезенки, лимфома Беркитта, лимфоплазмоцитарная лимфома, волосатоклеточный лейкоз или лимфома первичной центральной нервной системы (ЦНС). В некоторых других вариантах осуществления неходжкинская лимфома представляет собой Т-клеточную лимфому, такую как лимфобластная лимфома предшественников Т-клеток, периферическая Т-клеточная лимфома, кожная Т-клеточная лимфома, ангиоиммунобластная Т-клеточная лимфома, экстранодальная лимфома клеток-натуральных киллеров/Т-клеток, узловая Т-клеточная лимфома, кожная Т-клеточная лимфома, Т-клеточная лимфома энтеропатического типа, Т-клеточная лимфома типа подкожного панникулита, анапластическая крупноклеточная лимфома или узловая Т-клеточная лимфома.
[00151] Злокачественное новообразование, подлежащее лечению, можно охарактеризовать в соответствии с наличием определенного антигена, экспрессируемого на поверхности опухолевой клетки. В некоторых вариантах осуществления опухолевая клетка экспрессирует один или более из следующих: HER2, CD20, CD33, BCMA, EpCAM, CD2, CD19, CD30, CD38, CD40, CD52, CD70, EGFR/ERBB1, IGF1R, HER3/ERBB3, HER4/ERBB4, MUC1, cMET, SLAMF7, PSCA, MICA, MICB, TRAILR1, TRAILR2, MAGE-A3, B7.1, B7.2, CTLA4 и PD1.
[00152] В определенных вариантах осуществления белок по настоящему изобретению используется в способе усиления гибели опухолевых клеток (синонимично с лизисом, уничтожением, абляцией, снижением выживаемости или пролиферации клеток и т. п.) прямо или косвенно, или для производства лекарственного средства для использования в способе усиления гибели опухолевых клеток (синонимичном с лизисом, уничтожением, абляцией, уменьшением выживаемости или пролиферации клеток и т. п.) прямо или косвенно, путем воздействия на опухолевые клетки и клетки-натуральные киллеры белка по настоящему изобретению (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), который включает связывающий домен для опухолеспецифического антигена (не ограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2). Опухолевая клетка, которая реагирует на белок, как описано выше, экспрессирует опухолеспецифический антиген, с которым связывается второй антигенсвязывающий сайт белка. Например, в примерном варианте осуществления C26-TriNKET-CD20 используется для нацеливания на экспрессирующую CD20 опухолевую клетку (либо покоящуюся, либо активированную); в другом типичном варианте осуществления C26-TriNKET-BMCA используется для нацеливания на BMCA-экспрессирующую опухолевую клетку (либо покоящуюся, либо активированную).
[00153] В некоторых вариантах осуществления белок по настоящему изобретению используется в способе лечения злокачественного новообразования у пациента, нуждающегося в этом, или в производстве лекарственного средства для использования в способе лечения злокачественного новообразования у пациента, нуждающегося в этом, который включает введение пациенту белка или состава, включающего белок по настоящему изобретению (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), который включает связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2). Опухолевая клетка, реагирующая на белок, как описано выше, экспрессирует опухолеспецифический антиген, с которым связывается второй антигенсвязывающий сайт белка. Например, в примерном варианте осуществления C26-TriNKET-CD20 используется для нацеливания на CD20-экспрессирующую опухолевую клетку (либо покоящуюся, либо активированную); в другом типичном варианте осуществления C26-TriNKET-BMCA используется для нацеливания на BMCA-экспрессирующую опухоль или опухолевую клетку (либо покоящуюся, либо активированную).
IV. Комбинированная терапия
[00154] Еще один аспект изобретения предусматривает комбинированную терапию. Полиспецифические связывающие белки, описанные в настоящем документе, используются в комбинации с дополнительными терапевтическими агентами для лечения злокачественного новообразования.
[00155] Типичные терапевтические агенты, которые могут быть использованы в качестве части комбинированной терапии при лечении злокачественного новообразования, включают, например, облучение, митомицин, третиноин, рибомустин, гемцитабин, винкристин, этопозид, кладрибин, митобронит, метотрексат, доксорубицин, карбоквон, пентостатин, нитракрин, зиностатин, цетрореликс, летрозол, ралтитрексед, даунорубицин, фадрозол, фотемустин, тималфазин, собузоксан, недаплатин, цитарабин, бикалутамид, винорелбина, веснаринон, аминоглютетимид, амсакрин, проглумид, эллиптиния ацетат, кетансерин, доксифлуридин, этретинат, изотретиноин, стрептозоцин, нимустин, виндезины, флутамид, дрогенил, бутоцин, кармофур, разоксан, сизофилан, карбоплатин, митолактол, тегафур, ифосфамид, преднимустин, пицибанил, левамизол, тенипозид, импросульфан, эноцитабин, лизурид, оксимететолон, тамоксифен, прогестерон, мепитиостан, эпитиостанол, форместан, интерферон альфа, интерферон-2 альфа, интерферон-бета, интерферон-гамма, колониестимулирующий фактор-1, колониестимулирующий фактор-2, денилейкин дифитокс, интерлейкин-2, фактор высвобождения лютеинизирующего гормона и вариации вышеупомянутых агентов, которые могут проявлять дифференциальное связывание с их родственным рецептором, а также увеличивать или уменьшать период полужизни в сыворотке.
[00156] Дополнительный класс агентов, которые могут быть использованы в качестве части комбинированной терапии при лечении злокачественного новообразования, относится к ингибиторам иммунной контрольной точки. Типичные ингибиторы иммунной контрольной точки включают агенты, которые ингибируют один или более из (i) антигена 4 (CTLA-4), ассоциированного с цитотоксическими Т-лимфоцитами, (ii) белка 1 программированной клеточной смерти (PD1), (iii) PDL1, (iv) LAG-3, (v) B7-H3, (vi) B7-H4 и (vii) TIM3. Ингибитор CTLA4 ипилимумаб был одобрен Управлением по контролю за продуктами и лекарствами США для лечения меланомы.
[00157] Другие агенты, которые могут быть использованы в качестве части комбинированной терапии при лечении злокачественного новообразования, представляют собой агенты моноклональных антител, которые нацелены на мишени, отличные от контрольных точек (например, герцептин), и нецитотоксические агенты (например, ингибиторы тирозинкиназы).
[00158] Другие категории противоопухолевых агентов включают, например: (i) ингибитор, выбранный из ингибитора ALK, ингибитора ATR, антагониста A2A, ингибитора репарации исключения оснований, ингибитора Bcr-Abl тирозинкиназы, ингибитора тирозинкиназы Брутона, ингибитора CDC7, ингибитора CHK1, ингибитора циклин-зависимой киназы, ингибитора DNA-PK, ингибитора как DNA-PK, так и mTOR, ингибитора DNMT1, ингибитора DNMT1 плюс 2-хлор-дезоксиаденозин, ингибитора HDAC , ингибитора сигнального пути Hedgehog, ингибитора IDO, ингибитора JAK, ингибитора mTOR, ингибитора MEK, ингибитора MELK, ингибитора MTH1, ингибитора PARP, ингибитора фосфоинозитид-3-киназы, ингибитора обоих PARP1 и DHODH, протеосомного ингибитора, ингибитора топоизомеразы-II, ингибитора тирозинкиназы, ингибитора VEGFR и ингибитора WEE1; (ii) агонист OX40, CD137, CD40, GITR, CD27, HVEM, TNFRSF25 или ICOS; и (iii) цитокин, выбранный из IL-12, IL-15, GM-CSF и G-CSF.
[00159] Белки по изобретению также можно использовать в качестве дополнения к хирургическому удалению первичного поражения.
[00160] Количество полиспецифического связывающего белка и дополнительного терапевтического агента и относительные сроки введения могут быть выбраны для достижения желаемого комбинированного терапевтического эффекта. Например, при назначении комбинированной терапии пациенту, нуждающемуся в таком введении, терапевтические агенты в комбинации или фармацевтическую композицию или композиции, содержащие терапевтические агенты, можно вводить в любом порядке, таком как, например, последовательно, одновременно, вместе, одновременно и тому подобное. Кроме того, например, полиспецифический связывающий белок может быть введен в течение времени, когда дополнительный терапевтический агент(ы) оказывает свое профилактическое или терапевтическое действие, или наоборот.
V. Фармацевтические композиции
[00161] Настоящее раскрытие также относится к фармацевтическим композициям, которые содержат терапевтически эффективное количество белка, описанного в настоящем документе (например, A40-TriNKET, A44-TriNKET, A49-TriNKET, C26-TriNKET, F04-TriNKET, F43-TriNKET, F47-TriNKET и F63-TriNKET), который включает связывающий домен для опухолеспецифического антигена (неограничивающие примеры опухолеспецифических антигенов включают CD20, BCMA и HER2). Композиция может быть приготовлена для использования в различных системах доставки лекарственных средств. Одно или более физиологически приемлемых вспомогательных веществ или носителей также могут быть включены в композицию для подходящего состава. Подходящие составы для использования в настоящем раскрытии есть в Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, PA , 17th ed., 1985. Для краткого обзора способов доставки лекарственных средств см., например, Langer (Science 249: 1527-1533, 1990).
[00162] Композиция для внутривенной доставки лекарственного средства по настоящему изобретению может содержаться в пакете, ручке или шприце. В некоторых вариантах осуществления пакет может быть соединен с каналом, содержащим трубку и/или иглу. В определенных вариантах осуществления состав может представлять собой лиофилизированный состав или жидкий состав. В определенных вариантах осуществления состав может быть заморожен-высушен (лиофилизирован) и может содержаться примерно в 12-60 флаконах. В некоторых вариантах осуществления композиция может быть лиофилизирована, и 45 мг лиофилизированной композиции может содержаться в одном флаконе. В некоторых вариантах осуществления примерно 40-100 мг лиофилизированной композиции может содержаться в одном флаконе. В некоторых вариантах осуществления лиофилизированный состав из 12, 27 или 45 флаконов объединяют для получения терапевтической дозы белка в составе внутривенного лекарственного средства. В некоторых вариантах осуществления композиция может представлять собой жидкую композицию и храниться в концентрации примерно от 250 мг/флакон примерно до 1000 мг/флакон. В определенных вариантах осуществления композиция может представлять собой жидкую композицию и храниться в концентрации примерно 600 мг/флакон. В некоторых вариантах осуществления композиция может представлять собой жидкую композицию и храниться в концентрации примерно 250 мг/флакон.
[00163] Настоящее раскрытие может существовать в жидкой форме в виде водного раствора фармацевтической композиции, включающей терапевтически эффективное количество белка в буферном растворе с образованием композиции.
[00164] Эти композиции могут быть стерилизованы обычными методами стерилизации или могут быть стерильно отфильтрованы. Полученные водные растворы могут быть упакованы для использования как есть или лиофилизированы, причем лиофилизированный препарат объединяют со стерильным водным носителем перед введением. РН препаратов обычно составляет от 3 до 11, более предпочтительно от 5 до 9 или от 6 до 8, и наиболее предпочтительно от 7 до 8, например от 7 до 7,5. Полученные композиции в твердой форме могут быть упакованы в виде нескольких однодозовых единиц, каждая из которых содержит фиксированное количество вышеупомянутого агента или агентов. Композиция в твердой форме также может быть упакована в контейнер для переменного количества.
[00165] В определенных вариантах осуществления настоящее раскрытие относится к составу с увеличенным сроком хранения, включающему белок по настоящему изобретению в сочетании с маннитом, моногидратом лимонной кислоты, цитратом натрия, дигидратом динатрийфосфата, дигидратом дигидрофосфата натрия, хлоридом натрия, полисорбатом 80, водой и гидроксидом натрия.
[00166] В определенных вариантах осуществления готовят водный состав, включающий белок по настоящему изобретению в рН-буферном растворе. Буфер данного изобретения может иметь рН в диапазоне примерно от 4 примерно до 8, например, примерно от 4,5 примерно до 6 или примерно от 4,8 примерно до 5,5, или может иметь рН примерно от 5 примерно до 5,2. Диапазоны, промежуточные по отношению к указанным выше значениям pH, также должны быть частью настоящего раскрытия. Например, диапазоны значений, использующие комбинацию любого из приведенных выше значений в качестве верхнего и/или нижнего пределов, предназначены для включения. Примеры буферов, которые будут контролировать рН в этом диапазоне, включают ацетатные (например, ацетат натрия), сукцинатные (такие как сукцинат натрия), глюконатные, гистидиновые, цитратные и другие буферы органических кислот.
[00167] В определенных вариантах осуществления композиция включает буферную систему, которая содержит цитрат и фосфат для поддержания рН в диапазоне примерно от 4 примерно до 8. В некоторых вариантах осуществления диапазон рН может составлять примерно от 4,5 примерно до 6, или примерно от рН 4,8 примерно до 5,5, или диапазон рН может составлять примерно от 5 примерно до 5,2. В некоторых вариантах осуществления буферная система включает моногидрат лимонной кислоты, цитрат натрия, дигидрат динатрийфосфата и/или дигидрат дигидрофосфата натрия. В некоторых вариантах осуществления буферная система включает в себя примерно 1,3 мг/мл лимонной кислоты (например, 1,305 мг/мл), примерно 0,3 мг/мл цитрата натрия (например, 0,305 мг/мл), примерно 1,5 мг/мл динатрийфосфата. дигидрат (например, 1,53 мг/мл), примерно 0,9 мг/мл дигидрата дигидрофосфата натрия (например, 0,86) и примерно 6,2 мг/мл хлорида натрия (например, 6,165 мг/мл). В некоторых вариантах осуществления буферная система включает от 1 до 1,5 мг/мл лимонной кислоты, от 0,25 до 0,5 мг/мл цитрата натрия, от 1,25 до 1,75 мг/мл дигидрата динатрийфосфата, от 0,7 до 1,1 мг/мл дигидрата дигидрофосфата натрия и от 6 до 6,4 мг/мл хлорида натрия. В некоторых вариантах осуществления pH композиции доводят с помощью гидроксида натрия.
[00168] Полиол, который действует как тонизирующий агент и может стабилизировать антитело, также может быть включен в состав. Полиол добавляют к составу в количестве, которое может варьироваться в зависимости от целевой изотоничности состава. В некоторых вариантах осуществления водная композиция может быть изотонической. Количество добавляемого полиола также может быть изменено по отношению к молекулярной массе полиола. Например, может быть добавлено меньшее количество моносахарида (например, маннита) по сравнению с дисахаридом (таким как трегалоза). В некоторых вариантах осуществления полиол, который может быть использован в составе в качестве средства для повышения тоничности, представляет собой маннит. В некоторых вариантах осуществления концентрация маннита может составлять примерно от 5 примерно до 20 мг/мл. В некоторых вариантах осуществления концентрация маннита может составлять примерно 7,5-15 мг/мл. В некоторых вариантах осуществления концентрация маннита может составлять примерно 10-14 мг/мл. В некоторых вариантах осуществления концентрация маннита может составлять примерно 12 мг/мл. В некоторых вариантах осуществления полиол сорбит может быть включен в состав.
[00169] Детергент или поверхностно-активное вещество также могут быть добавлены в состав. Типичные детергенты включают неионогенные детергенты, такие как полисорбаты (например, полисорбаты 20, 80 и т. д.) или полоксамеры (например, полоксамер 188). Количество добавляемого детергента таково, что оно уменьшает агрегацию антитела в составе и/или сводит к минимуму образование частиц в составе, и/или уменьшает адсорбцию. В определенных вариантах осуществления состав может включать поверхностно-активное вещество, которое представляет собой полисорбат. В некоторых вариантах осуществления композиция может содержать детергент полисорбат 80 или Tween 80. Tween 80 - это термин, используемый для описания полиоксиэтилен (20) сорбитанмоноолеата (см. Fiedler, Lexikon der Hifsstoffe, Editio Cantor Verlag Aulendorf, 4th ed., 1996). В некоторых вариантах осуществления композиция может содержать примерно от 0,1 примерно до 10 мг/мл полисорбата 80 или примерно от 0,5 примерно до 5 мг/мл. В некоторых вариантах осуществления в композицию можно добавлять примерно 0,1% полисорбата 80.
[00170] В некоторых вариантах осуществления белковый продукт по настоящему изобретению приготовлен в виде жидкой композиции. Жидкий состав может быть представлен в концентрации 10 мг/мл во флаконе любого типа USP/Ph Eur типа I 50R, закрытом резиновой пробкой и запечатанном с использованием алюминиевого обжимного уплотнения. Пробка может быть изготовлена из эластомера, соответствующего USP и Ph Eur. В некоторых вариантах осуществления флаконы могут быть заполнены 61,2 мл раствора белкового продукта, чтобы обеспечить экстрагируемый объем 60 мл. В некоторых вариантах осуществления жидкая композиция может быть разбавлена 0,9% солевым раствором.
[00171] В некоторых вариантах осуществления жидкая композиция по изобретению может быть приготовлена в виде раствора с концентрацией 10 мг/мл в комбинации с сахаром на стабилизирующем уровне. В некоторых вариантах осуществления жидкая композиция может быть приготовлена в водном носителе. В некоторых вариантах осуществления стабилизатор может быть добавлен в количестве, не превышающем того, которое может привести к вязкости, нежелательной или непригодной для внутривенного введения. В некоторых вариантах осуществления сахар может представлять собой дисахариды, например сахарозу. В некоторых вариантах осуществления жидкая композиция также может включать один или более из буферного агента, поверхностно-активного вещества и консерванта.
[00172] В некоторых вариантах осуществления pH жидкого состава может быть установлено путем добавления фармацевтически приемлемой кислоты и/или основания. В некоторых вариантах осуществления фармацевтически приемлемая кислота может представлять собой соляную кислоту. В некоторых вариантах осуществления основание может представлять собой гидроксид натрия.
[00173] В дополнение к агрегации, дезамидирование является распространенным вариантом продукта пептидов и белков, который может возникать во время ферментации, сбора/осветления клеток, очистки, хранения лекарственного вещества/лекарственного продукта и во время анализа образца. Дезамидирование представляет собой потерю NH3 из белка с образованием промежуточного сукцинимида, который может подвергаться гидролизу. Промежуточный сукцинимид приводит к снижению массы исходного пептида на 17 дальтон. Последующий гидролиз приводит к увеличению массы на 18 дальтон. Выделение промежуточного сукцинимида затруднено из-за нестабильности в водных условиях. По существу, дезамидирование обычно определяется как увеличение массы на 1 дальтон. Дезамидирование аспарагина приводит к получению аспарагиновой или изоаспарагиновой кислоты. Параметры, влияющие на скорость дезамидирования, включают pH, температуру, диэлектрическую постоянную растворителя, ионную силу, первичную последовательность, локальную конформацию полипептида и третичную структуру. Аминокислотные остатки, соседствующие с Asn в пептидной цепи, влияют на скорости дезамидирования. Gly и Ser, следующие за Asn в белковых последовательностях, приводят к более высокой чувствительности к дезамидированию.
[00174] В некоторых вариантах осуществления жидкая композиция по настоящему изобретению может быть сохранена в условиях pH и влажности для предотвращения дезаминирования белкового продукта.
[00175] Представляющий интерес водный носитель в настоящем документе является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и пригодным для приготовления жидкой композиции. Иллюстративные носители включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), рН-буферный раствор (например, фосфатно-буферный солевой раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
[00176] Консервант может быть необязательно добавлен в составы настоящего документа для уменьшения бактериального действия. Добавление консерванта может, например, способствовать получению многоразового (многодозового) состава.
[00177] Внутривенные (IV) составы могут быть предпочтительным путем введения в конкретных случаях, например, когда пациент находится в больнице после трансплантации, получая все лекарственные средства посредством IV пути. В некоторых вариантах осуществления жидкую композицию разбавляют 0,9% раствором хлорида натрия перед введением. В некоторых вариантах осуществления разбавленный лекарственный продукт для инъекций является изотоническим и пригодным для введения путем внутривенной инфузии.
[00178] В некоторых вариантах осуществления соли или буферные компоненты могут быть добавлены в количестве 10-200 мМ. Соли и/или буферы являются фармацевтически приемлемыми и получены из различных известных кислот (неорганических и органических) с металлами или аминами, образующими основание. В некоторых вариантах осуществления буфер может представлять собой фосфатный буфер. В некоторых вариантах осуществления буфер может представлять собой глицинатный, карбонатный, цитратный буферы, и в этом случае ионы натрия, калия или аммония могут служить в качестве противоионов.
[00179] Консервант необязательно может быть добавлен в составы для уменьшения бактериального действия. Добавление консерванта может, например, способствовать получению многоразового (многодозового) состава.
[00180] Представляющий интерес водный носитель в настоящем описании является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и полезным для приготовления жидкой композиции. Иллюстративные носители включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), рН-буферный раствор (например, фосфатно-буефрный солевой раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
[00181] Настоящее раскрытие может существовать в форме лиофилизированной композиции, включающей белки и лиопротектор. Лиопротектором может быть сахар, например дисахариды. В некоторых вариантах осуществления лиопротектор может представлять собой сахарозу или мальтозу. Лиофилизированный состав может также включать один или более из буферного агента, поверхностно-активного вещества, наполнителя и/или консерванта.
[00182] Количество сахарозы или мальтозы, полезное для стабилизации лиофилизированного лекарственного продукта, может составлять в массовом соотношении по меньшей мере 1:2 белка к сахарозе или мальтозе. В некоторых вариантах осуществления массовое соотношение белок/сахароза или мальтоза может составлять от 1:2 до 1:5.
[00183] В некоторых вариантах осуществления pH композиции перед лиофилизацией может быть установлено путем добавления фармацевтически приемлемой кислоты и/или основания. В определенных вариантах осуществления фармацевтически приемлемая кислота может представлять собой соляную кислоту. В некоторых вариантах осуществления фармацевтически приемлемым основанием может быть гидроксид натрия.
[00184] Перед лиофилизацией pH раствора, содержащего белок по настоящему изобретению, можно доводить в диапазоне от 6 до 8. В некоторых вариантах осуществления диапазон pH для лиофилизированного лекарственного продукта может составлять от 7 до 8.
[00185] В некоторых вариантах осуществления соли или буферные компоненты могут быть добавлены в количестве 10-200 мМ. Соли и/или буферы являются фармацевтически приемлемыми и получены из различных известных кислот (неорганических и органических) с металлами или аминами, образующими основание. В некоторых вариантах осуществления буфер может представлять собой фосфатный буфер. В некоторых вариантах осуществления буфер может представлять собой глицинатный, карбонатный, цитратный буферы, и в этом случае ионы натрия, калия или аммония могут служить в качестве противоионов.
[00186] В некоторых вариантах осуществления может быть добавлен «наполнитель». «Наполнитель» представляет собой соединение, которое добавляет массу к лиофилизированной смеси и способствует физической структуре лиофилизированной таблетки (например, облегчает производство по существу однородной лиофилизированной таблетки, которая поддерживает структуру с открытыми порами). Иллюстративные наполнители включают маннит, глицин, полиэтиленгликоль и сорбит. Лиофилизированные составы по настоящему изобретению могут содержать такие наполнители.
[00187] Консервант необязательно может быть добавлен в составы для уменьшения бактериального действия. Добавление консерванта может, например, способствовать получению многоразового (многодозового) состава.
[00188] В некоторых вариантах осуществления лиофилизированный лекарственный продукт может состоять из водного носителя. Представляющий интерес водный носитель настоящего описания является фармацевтически приемлемым (например, безопасным и нетоксичным для введения человеку) и пригодным для приготовления жидкой композиции после лиофилизации. Иллюстративные разбавители включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), рН-буферный раствор (например, фосфатно-буферный солевой раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
[00189] В некоторых вариантах осуществления лиофилизированный лекарственный продукт по настоящему изобретению восстанавливается либо стерильной водой для инъекций, USP (SWFI), либо 0,9% инъекцией хлорида натрия, USP. Во время восстановления лиофилизированный порошок растворяется в растворе.
[00190] В некоторых вариантах осуществления лиофилизированный белковый продукт по настоящему изобретению состоит из примерно 4,5 мл воды для инъекций и разбавляется 0,9% солевым раствором (раствор хлорида натрия).
[00191] Фактические уровни дозировки активных ингредиентов в фармацевтических композициях могут варьироваться так, чтобы получить количество активного ингредиента, которое эффективно для достижения искомого терапевтического ответа для конкретного пациента, композиции и режима введения, без токсичности для пациента.
[00192] Конкретная доза может представлять собой унифицированную дозу для каждого пациента, например, 50-5000 мг белка. Альтернативно, доза для пациента может быть адаптирована к приблизительной массе тела или площади поверхности пациента. Другие факторы в определении подходящей дозировки могут включать заболевание или состояние, которое подлежит лечению или предотвращению, тяжесть заболевания, способ введения, а также возраст, пол и состояние здоровья пациента. Специалисты в данной области обычно проводят дальнейшее уточнение расчетов, необходимых для определения подходящей дозировки для лечения, особенно в свете информации о дозировке и анализов, раскрытых в настоящем документе. Дозировка также может быть определена путем использования известных анализов для определения доз, используемых в сочетании с соответствующими данными доза-ответ. Дозировка индивидуального пациента может быть скорректирована по мере наблюдения за развитием заболевания. У пациента могут быть измерены уровни в крови нацеливающей конструкции или комплекса, чтобы увидеть, нужно ли корректировать дозировку для достижения или поддержания эффективной концентрации. Фармакогеномика может быть использована для определения того, какие нацеливающие конструкции и/или комплексы и их дозы наиболее вероятно будут эффективны для данного индивидуума (Schmitz et al., Clinica Chimica Acta 308: 43-53, 2001; Steimer et al. Clinica Chimica Acta 308: 33-41, 2001).
[00193] Как правило, дозы на основе массы тела, составляют примерно от 0,01 мкг примерно до 100 мг на кг массы тела, например, примерно от 0,01 мкг примерно до 100 мг/кг массы тела, примерно от 0,01 мкг примерно до 50 мг/кг массы тела, примерно от 0,01 мкг примерно до 10 мг/кг массы тела, примерно от 0,01 мкг примерно до 1 мг/кг массы тела, примерно от 0,01 мкг примерно до 100 мкг/кг массы тела, примерно от 0,01 мкг примерно до 50 мкг/кг массы тела, примерно от 0,01 мкг примерно до 10 мкг/кг массы тела, примерно от 0,01 мкг примерно до 1 мкг/кг массы тела, примерно от 0,01 мкг примерно до 0,1 мкг/кг массы тела, примерно от 0,1 мкг примерно до 100 мг/кг массы тела, примерно от 0,1 мкг примерно до 50 мг/кг массы тела, примерно от 0,1 мкг примерно до 10 мг/кг массы тела, примерно от 0,1 мкг примерно до 1 мг/кг массы тела, примерно от 0,1 мкг примерно до 100 мкг/кг массы тела, примерно от 0,1 мкг примерно до 50 мкг/кг массы тела, примерно от 0,1 мкг примерно до 10 мкг/кг массы тела, примерно от 0,1 мкг примерно до 1 мкг/кг массы тела, примерно от 1 мкг примерно до 100 мг/кг массы тела, примерно от 1 мкг примерно до 50 мг/кг массы тела, примерно от 1 мкг примерно до 10 мг/кг массы тела, примерно от 1 мкг примерно до 1 мг/кг массы тела, примерно от 1 мкг примерно до 100 мкг/кг массы тела, примерно от 1 мкг примерно до 50 мкг/кг массы тела, примерно от 1 мкг примерно до 10 мкг/кг массы тела, примерно от 10 мкг примерно до 100 мг/кг массы тела, примерно от 10 мкг примерно до 50 мг/кг массы тела, примерно от 10 мкг примерно до 10 мг/кг массы тела, примерно от 10 мкг примерно до 1 мг/кг массы тела, примерно от 10 мкг примерно до 100 мкг/кг массы тела, примерно от 10 мкг примерно до 50 мкг/кг массы тела, примерно от 50 мкг примерно до 100 мг/кг массы тела, примерно от 50 мкг примерно до 50 мг/кг массы тела, примерно от 50 мкг примерно до 10 мг/кг массы тела, примерно от 50 мкг примерно до 1 мг/кг массы тела, примерно от 50 мкг примерно до 100 мкг/кг массы тела, примерно от 100 мкг примерно до 100 мг/кг массы тела, примерно от 100 мкг примерно до 50 мг/кг массы тела, примерно от 100 мкг примерно до 10 мг/кг массы тела, примерно от 100 мкг примерно до 1 мг/кг массы тела, примерно от 1 мг примерно до 100 мг/кг массы тела, примерно от 1 мг примерно до 50 мг/кг массы тела, примерно от 1 мг примерно до 10 мг/кг массы тела, примерно от 10 мг примерно до 100 мг/кг массы тела, примерно от 10 мг примерно до 50 мг/кг массы тела, примерно от 50 мг примерно до 100 мг/кг массы тела.
[00194] Дозы могут вводиться один или более раз в день, еженедельно, ежемесячно или ежегодно, или даже один раз каждые 2-20 лет. Специалисты в данной области техники могут легко оценить частоту повторения для дозирования на основании измеренного времени удерживания и концентраций нацеливающей конструкции или комплекса в жидкостях или тканях организма. Введение по настоящему изобретению может быть внутривенным, внутриартериальным, внутрибрюшинным, внутримышечным, подкожным, внутриплевральным, интратекальным, внутриполостным, путем перфузии через катетер или путем прямой внутриклеточной инъекции. Это может осуществляться один или более раз в день, один или более раз в неделю, один или более раз в месяц и один или более раз в год.
[00195] Вышеприведенное описание описывает множество аспектов и вариантов осуществления изобретения. В заявке на патент конкретно рассматриваются все комбинации и перестановки аспектов и вариантов осуществления.
ПРИМЕРЫ
[00196] Настоящее изобретение теперь в целом описано, оно будет более понятно с помощью ссылок на следующие примеры, которые включены только в целях иллюстрации некоторых аспектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения изобретения каким-либо образом.
Пример 1 - NKG2D-связывающие домены связываются с NKG2D
NKG2D-связывающие домены связываются с очищенным рекомбинантным NKG2D
[00197] Последовательности нуклеиновых кислот эктодоменов NKG2D человека, мыши или яванской макаки были слиты с последовательностями нуклеиновых кислот, кодирующими Fc-домены IgG1 человека, и введены в клетки млекопитающих для экспрессии. После очистки слитые белки NKG2D-Fc были адсорбированы в лунках микропланшетов. После блокирования лунок бычьим сывороточным альбумином для предотвращения неспецифического связывания NKG2D-связывающие домены титровали и добавляли в лунки, на которые предварительно адсорбировали слитые белки NKG2D-Fc. Связывание первичного антитела определяли с использованием вторичного антитела, которое конъюгировано с пероксидазой хрена и специфически распознает легкую цепь каппа человека, чтобы избежать перекрестной реактивности Fc. 3,3',5,5'-тетраметилбензидин (TMB), субстрат для пероксидазы хрена, добавляли в лунки для визуализации сигнала связывания, поглощение которого измеряли при 450 нМ и корректировали при 540 нМ. Клон NKG2D-связывающего домена, контроль изотипа или положительный контроль (выбранный из SEQ ID NO: 45-48 или антимышиные клоны NKG2D, MI-6 и CX-5, доступные в eBioscience) добавляли в каждую лунку.
[00198] Контроль изотипа показал минимальное связывание с рекомбинантными белками NKG2D-Fc, в то время как положительный контроль наиболее сильно связывался с рекомбинантными антигенами. NKG2D-связывающие домены, продуцируемые всеми клонами, демонстрировали связывание с рекомбинантными белками NKG2D-Fc человека (ФИГ. 14), мыши (ФИГ. 16) и яванской макаки (ФИГ. 15), хотя с разными аффинностями от клона к клону. Как правило, каждый анти-NKG2D-клон связывается с рекомбинантным NKG2D-Fc человека (ФИГ. 14) и яванской макаки (ФИГ. 15) с аналогичной аффинностью, но с более низкой аффинностью к рекомбинантному NKG2D-Fc мыши (ФИГ. 16).
NKG2D-связывающие домены связываются с клетками, экспрессирующими NKG2D
[00199] Клеточные линии мышиной лимфомы EL4 были сконструированы для экспрессии химерного антигена NKG2D-CD3-дзета-сигнальный домен человека или мыши. NKG2D-связывающий клон, изотипический контроль или положительный контроль использовали в концентрации 100 нМ для окрашивания внеклеточного NKG2D, экспрессированного на клетках EL4. Связывание антител определяли с использованием вторичных антител против человеческого IgG, конъюгированных с флуорофором. Клетки анализировали с помощью проточной цитометрии и рассчитывали превышение относительно фона (fold-over-background) (FOB) с использованием средней интенсивности флуоресценции (MFI) NKG2D-экспрессирующих клеток по сравнению с родительскими клетками EL4.
[00200] NKG2D-связывающие домены, продуцируемые всеми клонами, связанными с клетками EL4, экспрессирующими NKG2D человека и мыши. Антитела положительного контроля (выбранные из SEQ ID NO: 45-48 или анти-мышиные клоны NKG2D, MI-6 и CX-5, доступные на eBioscience) давали лучший сигнал связывания FOB. Аффинность связывания NKG2D для каждого клона была сходной между клетками, экспрессирующими NKG2D человека (ФИГ. 17) и мыши (ФИГ. 18) (ФИГ. 17-18, соответственно).
Пример 2 - NKG2D-связывающие домены блокируют связывание природного лиганда с NKG2D
Конкуренция с ULBP-6
[00201] Рекомбинантные белки NKG2D-Fc человека адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для снижения неспецифического связывания. Насыщенную концентрацию ULBP-6-His-биотин добавляли в лунки с последующим добавлением клонов NKG2D-связывающего домена. После 2-часовой инкубации лунки промывали и ULBP-6-His-биотин, который оставался связанным с лунками, покрытыми NKG2D-Fc, детектировали стрептавидином, конъюгированным с пероксидазой хрена, и субстратом TMB. Поглощение измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc рассчитывали по проценту ULBP-6-His-биотина, который блокировался от связывания с белками NKG2D-Fc в лунках. Антитело положительного контроля (выбранное из SEQ ID NO: 45-48) и различные NKG2D-связывающие домены блокировали связывание ULBP-6 с NKG2D, в то время как изотипический контроль показал небольшую конкуренцию с ULBP-6 (ФИГ. 19).
Конкуренция с MICA
[00202] Рекомбинантные белки MICA-Fc человека адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для уменьшения неспецифического связывания. NKG2D-Fc-биотин добавляли в лунки, после чего следовало добавление NKG2D-связывающих доменов. После инкубации и промывания NKG2D-Fc-биотин, который оставался связанным с лунками, покрытыми MICA-Fc, детектировали с использованием субстрата стрептавидин-HRP и TMB. Поглощение измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc рассчитывали по проценту NKG2D-Fc-биотина, который блокировался от связывания с MICA-Fc в лунках. Антитело положительного контроля (выбранное из SEQ ID NO: 45-48) и различные NKG2D-связывающие домены блокировали связывание MICA с NKG2D, в то время как изотипический контроль показал небольшую конкуренцию с MICA (ФИГ. 20).
Конкуренция с Rae-1 дельта
[00203] Рекомбинантный мышиный Rae-1delta-Fc (приобретенный у R & D Systems) адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для снижения неспецифического связывания. Мышиный NKG2D-Fc-биотин добавляли в лунки с последующим добавлением NKG2D-связывающих доменов. После инкубации и промывания NKG2D-Fc-биотин, который оставался связанным с лунками, покрытыми Rae-1delta-Fc, детектировали с использованием субстрата стрептавидин-HRP и TMB. Поглощение измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc рассчитывали по проценту NKG2D-Fc-биотина, который блокировался от связывания с лунками, покрытыми Rae-1delta-Fc. Положительный контроль (выбранный из SEQ ID NO: 45-48 или анти-мышиных клонов NKG2D, MI-6 и CX-5, доступных на eBioscience) и различные клоны NKG2D-связывающего домена блокировали связывание Rae-1-дельта с мышиным NKG2D, в то время как антитело изотипического контроля демонстрировало небольшую конкуренцию с Rae-1delta (ФИГ. 21).
Пример 3 - клоны NKG2D-связывающего домена активируют NKG2D
[00204] Последовательности нуклеиновой кислоты NKG2D человека и мыши были слиты с последовательностями нуклеиновой кислоты, кодирующими сигнальный домен CD3 дзета, с получением конструкций химерного антигенного рецептора (CAR). Конструкции NKG2D-CAR затем клонировали в ретровирусный вектор с использованием сборки Гибсона и трансфецировали в клетки expi293 с получением ретровируса. Клетки EL4 инфицировали вирусами, содержащими NKG2D-CAR вместе с 8 мкг/мл полибрена. Через 24 часа после инфекции уровни экспрессии NKG2D-CAR в клетках EL4 анализировали проточной цитометрией и отбирали клоны, которые экспрессируют на высоком уровне NKG2D-CAR на клеточной поверхности.
[00205] Чтобы определить, активируют ли NKG2D-связывающие домены NKG2D, их адсорбировали в лунки микропланшета, и клетки NKG2D-CAR EL4 культивировали в лунках, покрытых фрагментом антитела, в течение 4 часов в присутствии брефельдина-A и монензина. Внутриклеточное продуцирование TNF-альфа, индикатора активации NKG2D, анализировали с помощью проточной цитометрии. Процент TNF-альфа-положительных клеток был нормализован по отношению к клеткам, обработанным положительным контролем. Все NKG2D-связывающие домены активировали как NKG2D человека (ФИГ. 22), так и мыши (ФИГ. 23).
Пример 4 - NKG2D-связывающие домены активируют NK-клетки
Первичные человеческие NK-клетки
[00206] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли с использованием отрицательного отбора с помощью магнитных гранул из PBMC, и чистота выделенных NK-клеток обычно составляла> 95%. Затем выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2, в течение 24-48 часов, после чего их переносили в лунки микропланшета, на котором были адсорбированы NKG2D-связывающие домены, и культивировали в среде, содержащей конъюгированное с флуорофором антитело против CD107a, брефелдин-А и монензин. После культивирования NK-клетки анализировали проточной цитометрией с использованием антител, конъюгированных с флуорофором, против CD3, CD56 и IFN-гамма. Окрашивание CD107a и IFN-гамма анализировали в клетках CD3-CD56+ для оценки активации NK-клеток. Увеличение количества CD107a/IFN-гамма-двойных положительных клеток свидетельствует о лучшей активации NK-клеток за счет рекрутирования двух активирующих рецепторов, а не одного рецептора. NKG2D-связывающие домены и положительный контроль (выбранный из SEQ ID NO: 45-48) показали более высокий процент NK-клеток, становящихся CD107a+ и IFN-гамма+, чем изотипический контроль (ФИГ. 24 и ФИГ. 25 представляют два независимых эксперимента, в каждом из которых использовали разных доноров PBMC для приготовления NK-клеток).
Первичные мышиные NK-клетки
[00207] Селезенки получали от мышей C57Bl/6 и измельчали через сито для клеток 70 мкм для получения суспензии отдельных клеток. Клетки осаждали и ресуспендировали в лизирующем буфере ACK (приобретенном у Thermo Fisher Scientific # A1049201; 155 мМ хлорида аммония, 10 мМ бикарбоната калия, 0,01 мМ EDTA) для удаления эритроцитов. Оставшиеся клетки культивировали с 100 нг/мл hIL-2 в течение 72 часов, а затем собирали и готовили для выделения NK-клеток. NK-клетки (CD3-NK1.1+) затем выделяли из клеток селезенки с использованием метода отрицательного истощения с использованием магнитных гранул с чистотой> 90%. Очищенные NK-клетки культивировали в среде, содержащей 100 нг/мл mIL-15, в течение 48 часов, после чего их переносили в лунки микропланшета, на котором были адсорбированы NKG2D-связывающие домены, и культивировали в среде, содержащей конъюгированное с флуорофором антитело против CD107a, брефелдин-А и монензин. После культивирования в лунках, покрытых NKG2D-связывающим доменом, NK-клетки анализировали проточной цитометрией с использованием антител, конъюгированных с флуорофором, против CD3, NK1.1 и IFN-гамма. Окрашивание CD107a и IFN-гамма анализировали в клетках CD3-NK1.1+ для оценки активации NK-клеток. Увеличение количества CD107a/IFN-гамма-двойных положительных клеток свидетельствует о лучшей активации NK-клеток за счет рекрутирования двух активирующих рецепторов, а не одного рецептора. NKG2D-связывающие домены и положительный контроль (выбранный из анти-мышиных NKG2D-клонов, MI-6 и CX-5, доступных в eBioscience) показали более высокий процент NK-клеток, становящихся CD107a+ и IFN-гамма+, чем изотипический контроль (ФИГ. 26 и ФИГ. 27 представляют два независимых эксперимента, в каждом из которых использовали разных мышей для приготовления NK-клеток).
Пример 5 - NKG2D-связывающие домены обеспечивают цитотоксичность опухолевых клеток-мишеней
[00208] Анализы активации первичных NK-клеток человека и мыши демонстрируют повышенный уровень маркеров цитотоксичности для NK-клеток после инкубации с NKG2D-связывающими доменами. Чтобы определить, приводит ли это к усилению лизиса опухолевых клеток, был использован клеточный анализ, в котором каждый NKG2D-связывающий домен превращался в моноспецифическое антитело. Fc-область использовали в качестве одного нацеливающего фрагмента, тогда как Fab-область (NKG2D-связывающий домен) действовала как другой нацеливающий фрагмент для активации NK-клеток. Клетки THP-1, которые имеют человеческое происхождение и экспрессируют на высоком уровне Fc-рецепторы, использовали в качестве мишени для опухоли и использовали набор для цитотоксичности Perkin Elmer DELFIA. Клетки THP-1 метили реагентом BATDA и ресуспендировали в количестве 105/мл в культуральной среде. Меченые клетки THP-1 затем объединяли с антителами NKG2D и выделенными мышиными NK-клетками в лунках микропланшета при 37°С в течение 3 часов. После инкубации удаляли 20 мкл культурального супернатанта, смешивали с 200 мкл раствора европия и инкубировали при встряхивании в течение 15 минут в темноте. Флуоресценцию измеряли во времени с помощью планшет-ридера PheraStar, оборудованного модулем флуоресценции с разрешением по времени (возбуждение 337 нм, излучение 620 нм), и специфический лизис рассчитывали в соответствии с инструкциями набора.
[00209] Положительный контроль, ULBP-6 - естественный лиганд для NKG2D, показал повышенный специфический лизис клеток-мишеней THP-1 мышиными NK-клетками. Антитела NKG2D также увеличивали специфический лизис клеток-мишеней THP-1, тогда как антитело изотипического контроля показало снижение специфического лизиса. Пунктирная линия указывает на специфический лизис клеток THP-1 мышиными NK-клетками без добавления антител (ФИГ. 28).
Пример 6 - антитела NKG2D показывают высокую термостабильность
[00210] Температуру плавления NKG2D-связывающих доменов анализировали с использованием дифференциальной сканирующей флуориметрии. Экстраполированные кажущиеся температуры плавления являются высокими по сравнению с типичными антителами IgG1 (ФИГ. 29).
Пример 7. Полиспецифические связывающие белки проявляют повышенную способность активировать NK-клетки.
[00211] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли с использованием отрицательного отбора с помощью магнитных гранул из PBMC, и чистота выделенных NK-клеток обычно составляла> 95%. Затем выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2, в течение 24-48 часов, после чего их переносили в лунки микропланшета, на котором были адсорбированы полиспецифические и биспецифические связывающие белки, соответственно, и культивировали в среде, содержащей конъюгированное с флуорофором антитело против CD107a, брефелдин-А и монензин. После культивирования NK-клетки анализировали проточной цитометрией с использованием антител, конъюгированных с флуорофором, против CD3, CD56 и IFN-гамма. Окрашивание CD107a и IFN-гамма анализировали в клетках CD3-CD56+ для оценки активации NK-клеток. Увеличение количества CD107a/IFN-гамма-двойных положительных клеток свидетельствует о лучшей активации NK-клеток. AL2.2 является полиспецифическим связывающим белком, содержащим HER2-связывающий домен (трастузумаб), NKG2D-связывающий домен (ULBP-6) и Fc-домен человеческого IgG1. Это было сделано с помощью контролируемой реакции обмена Fab-фрагментов (cFAE), начиная с гомодимера трастузумаба и гомодимера ULBP-6-Fc (см. Labrijn et al. Nature Protocols 9, 2450-2463). SC2.2 представляет собой одноцепочечный белок, включающий scFv, полученный из трастузумаба, и ULBP-6 (SEQ ID NO: 73).
SEQ ID NO: 73
MAAAAIPALLLCLPLLFLLFGWSRARRDDPHSLCYDITVIPKFRPGPRWCAVQGQVDEKTFLHYDCGNKTVTPVSPLGKKLNVTMAWKAQNPVLREVVDILTEQLLDIQLENYTPKEPLTLQARMSCEQKAEGHSSGSWQFSIDGQTFLLFDSEKRMWTTVHPGARKMKEKWENDKDVAMSFHYISMGDCIGWLEDFLMGMDSTLEPSAGAPLAMSSGTTQLRATATTLILCCLLIILPCFILPGI
[00212] Анализ окрашивания CD107a и IFN-гамма показал, что изотипический контроль IgG не показал активации NK-клеток, в то время как более высокий процент NK-клеток становится CD107a+ и IFN-гамма+ после стимулирования полиспецифическим связывающим белком по сравнению с биспецифичным белком, демонстрируя более сильную активацию NK-клеток за счет рекрутирования двух активирующих рецепторов (NKG2D и CD16), а не только одного (NKG2D) (ФИГ. 30). Ожидается, что это увеличение активации NK-клеток приведет к более сильному уничтожению опухолевых клеток.
Пример 8. Полиспецифические связывающие белки проявляют повышенную цитотоксичность в отношении опухолевых клеток-мишеней.
Анализ цитотоксичности первичных NK-клеток человека
[00213] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли с использованием отрицательного отбора с помощью магнитных гранул из PBMC, и чистота выделенных NK-клеток обычно составляла> 95%. Затем NK-клетки культивировали в течение ночи в среде, содержащей 100 нг/мл IL-2, перед использованием в анализах на цитотоксичность. На следующий день NK-клетки ресуспендировали в количестве 5×105/мл в свежей культуральной среде. Клетки клеточной линии SkBr-3 рака молочной железы человека метили реагентом BATDA в соответствии с набором цитотоксичности Perkin Elmer DELFIA и ресуспендировали в количестве 5×104/мл в культуральной среде. Готовили различные разведения полиспецифических связывающих белков в культуральной среде. NK-клетки, меченые клетки SkBr-3 и полиспецифические связывающие белки затем объединяли в лунках микропланшета и инкубировали при 37°С в течение 3 часов. После инкубации удаляли 20 мкл культурального супернатанта, смешивали с 200 мкл раствора европия и инкубировали при встряхивании в течение 15 минут в темноте. Флуоресценцию измеряли во времени с помощью планшет-ридера PheraStar, оборудованного модулем флуоресценции с разрешением по времени (возбуждение 337 нм, излучение 620 нм), и специфический лизис рассчитывали в соответствии с инструкциями набора. AL0.2 является полиспецифическим связывающим белком, содержащим HER2-связывающий домен (трастузумаб), NKG2D-связывающий домен (выбранный из SEQ ID NO: 1-44)) и Fc-домен человеческого IgG1. Это было сделано с помощью контролируемой реакции обмена Fab-фрагментов (cFAE), начиная с гомодимера трастузумаба и гомодимера против NKG2D. AL0.2si основан на AL0.2 и содержит дополнительную мутацию D265A в Fc-домене, которая отменяет связывание CD16. Трастузумаб-si основан на трастузумабе и содержит дополнительную мутацию D265A в Fc-домене, которая отменяет связывание CD16. AL2.2 является полиспецифическим связывающим белком, содержащим HER2-связывающий домен (трастузумаб), NKG2D-связывающий домен (ULBP-6) и Fc-домен человеческого IgG1. SC2.2 представляет собой одноцепочечный белок, включающий scFv, полученный из трастузумаба, и ULBP-6.
[00214] AL0.2 показал усиленный лизис клеток-мишеней SkBr-3 человеческими NK-клетками по сравнению с трастузумабом дозозависимым образом, с р-значением 0,0311 при ЕС50 (ФИГ.31). AL0.2si (ФИГ. 32) и трастузумаб-si (ФИГ. 33) показали снижение как активности, так и максимального специфического лизиса клеток SkBr-3 по сравнению с AL0.2, с p-значением 0,0002 и 0,0001 при EC50, соответственно (ФИГ.32-33). Кроме того, AL0.2 показал усиленный дозозависимый лизис клеток SkBr-3, чем AL2.2, (ФИГ. 34). Изотипический контроль IgG не показал увеличения специфического лизиса при любой из протестированных концентраций. Вместе данные продемонстрировали, что полиспецифические связывающие белки, рекрутирующие 2 активирующих рецептора на NK-клетках и один опухолевый антиген, индуцируют более сильное уничтожение опухолевых клеток человеческими NK-клетками по сравнению с биспецифичными белками, рекрутирующими один активирующий рецептор на NK-клетках и один опухолевый антиген.
Анализ на цитотоксичность первичных мышиных NK-клеток
[00215] Селезенки получали от мышей C57Bl/6 и измельчали через сито для клеток 70 мкм для получения суспензии отдельных клеток. Клетки осаждали и ресуспендировали в лизирующем буфере ACK (приобретенном у Thermo Fisher Scientific # A1049201; 155 мМ хлорида аммония, 10 мМ бикарбоната калия, 0,01 мМ EDTA) для удаления эритроцитов. Оставшиеся клетки культивировали с 100 нг/мл hIL-2 в течение 72 часов, а затем собирали и готовили для выделения NK-клеток. NK-клетки (CD3-NK1.1+) затем выделяли из клеток селезенки с использованием метода отрицательного истощения с использованием магнитных гранул с чистотой> 90%. Очищенные NK-клетки культивировали в среде, содержащей 100 нг/мл mIL-15, в течение 48 часов, затем ресуспендировали в культуральной среде в количестве 106/мл для анализов на цитотоксичность. RMA-HER2-dTomato, линия опухолевых клеток мыши, сконструированная для экспрессии HER2 и dTomato, и ее контрольный аналог, клетки RMA, экспрессирующие zsGreen, использовали в качестве мишеней. Их ресуспендировали в концентрации 2×105/мл в культуральной среде и высевали в лунки микропланшета в соотношении 1:1. Разведения полиспецифического белка вносили в культуральную среду и добавляли к клеткам RMA вместе с NK-клетками. После инкубации в течение ночи при 37°С с 5% СО2. Процент клеток RMA-HER2-dTomato и RMA-zsGreen определяли с помощью проточной цитометрии с использованием флуоресцентного репортера для идентификации двух типов клеток. Специфическая гибель клеток-мишеней = (1- ((% RMA-Ca2T-dTomato клеток в группе обработки * % RMA-zsGreen клеток в контрольной группе)/(% RMA-Ca2T-dTomato клеток в контрольной группе * % RMA-zsGreen клеток в группе обработки))) * 100%.
[00216] AL2.2 более эффективен в перенаправлении ответов NK-клеток на опухолевые мишени, чем SC2.2 (ФИГ. 36) и трастузумаб (ФИГ. 35). Контрольный белок показал небольшое влияние на специфическую гибель мишени. Эти данные демонстрируют, что полиспецифические связывающие белки, рекрутирующие 2 активирующих рецептора на NK-клетках и один опухолевый антиген, индуцируют более сильное уничтожение опухолевых клеток мышиными NK-клетками по сравнению с биспецифичными белками, рекрутирующими один активирующий рецептор на NK-клетках и один опухолевый антиген.
Пример 9 - Полиспецифические связывающие белки связываются с NKG2D
[00217] Клеточные линии мышиной лимфомы EL4, сконструированные для экспрессии триспецифических связывающих белков NKG2D человека (TriNKET), каждый из которых содержит NKG2D-связывающий домен, опухолеспецифический антигенсвязывающий домен (такой как CD33-, HER2-, CD20- или BCMA-связывающий домен) и Fc-домен, который связывается с CD16, как показано на ФИГ. 1, тестировали на их аффинность к внеклеточному NKG2D, экспрессированному на клетках EL4. Связывание полиспецифических связывающих белков с NKG2D определяли, используя конъюгированные с флуорофором вторичные антитела против человеческого IgG. Клетки анализировали с помощью проточной цитометрии и рассчитывали превышение относительно фона (fold-over-background) (FOB) с использованием средней интенсивности флуоресценции (MFI) NKG2D-экспрессирующих клеток по сравнению с родительскими клетками EL4.
[00218] Тестированные TriNKET включают CD33-TriNKET-C26 (ADI-28226 и CD33-связывающий домен), CD33-TriNKET-F04 (ADI-29404 и CD33-связывающий домен), HER2-TriNKET-C26 (ADI-28226 и HER2- связывающий домен), HER2-TriNKET-F04 (ADI-29404 и HER2-связывающий домен), CD20-TriNKET-C26 (ADI-28226 и CD20-связывающий домен), CD20-TriNKET-F04 (ADI-29404 и CD20 -связывающий домен), BCMA-TriNKET-C26 (ADI-28226 и BCMA-связывающий домен), BCMA-TriNKET-F04 (ADI-29404 и BCMA-связывающий домен), BCMA-TriNKET-F43 (ADI-29443 и BCMA-связывающий домен) и BCMA-TriNKET-F47 (ADI-29447 и BCMA-связывающий домен). HER2-связывающий домен, используемый в тестируемых молекулах, состоял из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи трастузумаба. CD33-связывающий домен состоял из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, перечисленных ниже.
SEQ ID NO:74:

SEQ ID NO:75:

CD20-связывающий домен, используемый в тестируемых молекулах, состоял из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи. BCMA-связывающий домен, используемый в тестируемых молекулах, состоял из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, как указано ниже.
Вариабельный домен тяжелой цепи EM-801 (SEQ ID NO: 82):

Вариабельный домен легкой цепи EM-801 (SEQ ID NO: 83):

Вариабельный домен тяжелой цепи EM-901 (SEQ ID NO: 76)

Вариабельный домен легкой цепи EM-901 (SEQ ID NO: 77)
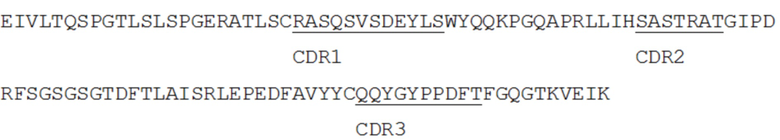
[00219] Данные показывают, что TriNKET по настоящему изобретению связывается с NKG2D, когда белок включает опухолевый антигенсвязывающий домен, такой как CD33, HER2, CD20 и BCMA.
Пример 10 - Полиспецифические связывающие белки связываются с опухолевыми антигенами человека
Триспецифические связывающие белки связываются с CD33, HER2, CD20 и BCMA
[00220] Клеточную линию AML человека MV4-11, экспрессирующую CD33, использовали для анализа связывания TriNKET с опухолеспецифическим антигеном. TriNKET и родительское моноклональное антитело против CD33 инкубировали с клетками, и связывание детектировали с использованием вторичных антител против человеческого IgG, конъюгированных с флуорофором. Клетки анализировали с помощью проточной цитометрии и рассчитывали превышение относительно фона (FOB), используя среднюю интенсивность флуоресценции (MFI) от TriNKET и родительского моноклонального антитела против CD33, нормализованного к контролям вторичных антител. CD33-TriNKET-C26 и CD33-TriNKET-F04 показали сопоставимые уровни связывания с CD33 по сравнению с родительским антителом против CD33 (ФИГ. 41).
[00221] Линии опухолевых клеток человека, экспрессирующие HER2, использовали для анализа связывания TriNKET с опухолеспецифическим антигеном. Клеточная линия почечно-клеточного рака 786-O экспрессирует HER2 на низком уровне. TriNKET и, необязательно, родительское моноклональное антитело против HER2 (трастузумаб) инкубировали с клетками и связывание определяли, используя конъюгированные с флуорофором вторичные антитела против человеческого IgG. Клетки анализировали с помощью проточной цитометрии и рассчитывали превышение относительно фона (FOB), используя среднюю интенсивность флуоресценции (MFI) из TriNKET и трастузумаба, нормализованных к контролю вторичных антител. HER2-TriNKET-C26 и HER2-TriNKET-F04 демонстрировали сопоставимые уровни связывания с HER2, экспрессируемыми на клетках 786-O, по сравнению с трастузумабом (ФИГ. 42).
[00222] Клетки миеломы человека MM.1S, экспрессирующие ВСМА, использовали для анализа связывания TriNKET с опухолеспецифическим антигеном ВСМА. TriNKET и, необязательно, родительское моноклональное антитело против ВСМА (ЕМ-801) инкубировали с клетками, и связывание детектировали с использованием конъюгированных с флуорофором вторичных антител против человеческого IgG. Клетки анализировали с помощью проточной цитометрии и рассчитывали превышение относительно фона (FOB), используя среднюю интенсивность флуоресценции (MFI) из TriNKET и EM-801, нормализованных к контролю вторичных антител. C26 - TriNKET-BCMA, F04-TriNKET-BCMA, F43-TriNKET-BCMA и F47-TriNKET-BCMA показали сопоставимые уровни связывания с BCMA, экспрессируемыми наклетках MM.1S, по сравнению с EM-801 (ФИГ. 43).
[00223] Клетки лимфомы Raji человека, экспрессирующие CD20, использовали для анализа связывания TriNKET с опухолеспецифическим антигеном CD20. TriNKET инкубировали с клетками, и связывание детектировали с использованием вторичных антител против человеческого IgG, конъюгированных с флуорофором. Клетки анализировали проточной цитометрией и строили гистограмму. Как показано на ФИГ. 44, CD20-TriNKET-C26 и CD20-TriNKET-F04 одинаково хорошо связываются с CD20.
Пример 11 - Полиспецифические связывающие белки активируют NK-клетки
[00224] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли с использованием отрицательного отбора с помощью магнитных гранул из PBMC, и чистота выделенных NK-клеток обычно составляла> 90%. Выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2 для активации, или оставляли на ночь без цитокина. IL-2-активированные NK-клетки использовали в течение 24-48 часов после активации.
[00225] Опухолевые клетки человека, экспрессирующие опухолевый антиген, собирали и ресуспендировали в культуральной среде в концентрации 2×106/мл. Моноклональные антитела или TriNKET, нацеленные на опухолевый антиген, разводили в культуральной среде. Активированные NK-клетки собирали, промывали и ресуспендировали в концентрации 2×106/мл в культуральной среде. Затем опухолевые клетки смешивали с моноклональными антителами/TriNKET и активировали NK-клетки в присутствии IL-2. Брефельдин-А и монензин также добавляли в смешанную культуру для блокирования транспорта белка из клетки для внутриклеточного окрашивания цитокинов. Конъюгированный с флуорофором антитела против CD107a добавляли к смешанной культуре и культуру инкубировали в течение 4 часов перед тем, как образцы были подготовлены для анализа FACS с использованием конъюгированных с флуорофором антител против CD3, CD56 и IFN-гамма. Окрашивание CD107a и IFN-гамма анализировали в клетках CD3-CD56+ для оценки активации NK-клеток. Увеличение количества CD107a/IFN-гамма-двойных положительных клеток свидетельствует о лучшей активации NK-клеток за счет вовлечения двух активирующих рецепторов, а не одного рецептора.
[00226] TriNKET опосредуют активацию человеческих NK-клеток, культивируемых совместно с HER2-экспрессирующими клетками SkBr-3 (ФИГ. 47A), клетками Colo201 (ФИГ. 47B) и клетками HCC1954 (ФИГ. 47C), соответственно, как показано увеличением дегрануляции CD107a и продуцированием IFN-гамма. Клетки SkBr-3 и клетки HCC1954 имеют высокий уровень поверхностной экспрессии HER2, а Colo201 имеет среднюю экспрессию HER2. По сравнению с моноклональным антителом трастузумабом, TriNKET демонстрируют превосходную активацию человеческих NK-клеток в присутствии опухолевых клеток человека. NK-клетки индивидуально, NK-клетки плюс клетки SkBr-3 используют в качестве отрицательных контролей.
[00227] TriNKET (C26-TriNKET-HER2 и F04-TriNKET-HER2) опосредуют активацию человеческих NK-клеток, совместно культивированных с CD33-экспрессирующими человеческими клетками AML Mv4-11, как показано увеличением дегрануляции CD107a и продуцированием IFN-гамма. По сравнению с моноклональным антителом против CD33 TriNKET (C26-TriNKET-HER2 и F04-TriNKET-HER2) показали превосходную активацию человеческих NK-клеток в присутствии опухолевых клеток человека, экспрессирующих HER2 (ФИГ. 47A-47C).
Первичные человеческие NK-клетки активируются TriNKET в совместной культуре с опухолевыми клеточными линиями человека, экспрессирующими мишень.
[00228] Совместное культивирование первичных человеческих NK-клеток с CD20-положительными человеческими опухолевыми клетками приводило к TriNKET-опосредованной активации первичных человеческих NK-клеток (ФИГ. 62). TriNKET, нацеленные на CD20 (например, C26-TriNKET-CD20 и F04-TriNKET-CD20), опосредовали активацию человеческих NK-клеток, совместно культивируемых с CD20-положительными клетками Raji, о чем свидетельствует увеличение дегрануляции CD107a и продуцирование цитокинов IFNγ (ФИГ. 62). По сравнению с моноклональным антителом ритуксимабом оба TriNKET (например, C26-TriNKET-CD20 и F04-TriNKET-CD20) показали превосходную активацию человеческих NK-клеток (ФИГ. 62).
Ритуксимаб_vH

Ритуксимаб_vL

[00229] Совместное культивирование первичных человеческих NK-клеток с BCMA-положительными клетками миеломы MM.1S приводило к TriNKET-опосредованной активации первичных человеческих NK-клеток. TriNKET, нацеленные на BCMA (например, C26-TriNKET-BMCA и F04-TriNKET-BMCA), опосредовали активацию человеческих NK-клеток, совместно культивированных с клетками миеломы MM.1S, о чем свидетельствует увеличение дегрануляции CD107a и продуцирование цитокинов IFNγ (ФИГ. 63). По сравнению с изотипом TriNKET, TriNKET, нацеленные на BCMA (например, A44-TriNKET-BMCA, A49-TriNKET-BMCA, C26-TriNKET-BMCA, F04-TriNKET-BMCA, F43-TriNKET-BMCA, F43-TriNKET-BMCA, F47-TriNK -BMCA и F63-TriNKET-BMCA) показали повышенную активность NK-клеток (ФИГ. 63).
Пример 12. Триспецифические связывающиеся белки обеспечивают цитотоксичность опухолевых клеток-мишеней.
[00230] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли с использованием отрицательного отбора с помощью магнитных гранул из PBMC, и чистота выделенных NK-клеток обычно составляла> 90%. Выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2 для активации, или оставляли на ночь без цитокина. IL-2-активированные или покоящиеся NK-клетки использовали на следующий день в анализах на цитотоксичность.
[00231] Чтобы проверить способность человеческих NK-клеток лизировать опухолевые клетки в присутствии TriNKET, использовали анализ нерадиоактивной цитотоксичности cyto Tox 96 от Promega (G1780) в соответствии с инструкциями производителя. Вкратце, опухолевые клетки человека, экспрессирующие опухолевый антиген, собирали, промывали и ресуспендировали в культуральной среде в концентрации 1-2×105/мл. Покоящиеся и/или активированные NK-клетки собирали, промывали и ресуспендировали при 105-2×106/мл в той же культуральной среде, что и опухолевые клетки. В каждой лунке 96-луночного планшета 50 мкл суспензии опухолевых клеток смешивали с 50 мкл суспензии NK-клеток вместе или без TriNKET, нацеленных на опухолевый антиген, экспрессируемый на опухолевых клетках. После инкубации при 37°C с 5% CO2 в течение 3 часов и 15 минут 10-кратный буфер для лизиса добавляли в лунки, содержащие только опухолевые клетки, и в лунки, содержащие только среды для максимального лизиса и отрицательного контроля реагентов, соответственно. Затем планшет помещали обратно в инкубатор на дополнительные 45 минут, чтобы достичь в общей сложности 4 часов инкубации. Затем клетки осаждали и культуральный супернатант переносили в новый 96-луночный планшет и смешивали с субстратом для проявки. Новый планшет инкубировали в течение 30 минут при комнатной температуре, и оптическую плотность считывали при 492 нм на SpectraMax i3x. Процент специфического лизиса опухолевых клеток рассчитывали следующим образом: % Специфического лизиса = ((экспериментальный лизис - самопроизвольный лизис из одних NK-клеток - самопроизвольный лизис из одних опухолевых клеток)/(Максимальный лизис - отрицательный контроль реагентов)) x 100%.
[00232] TriNKET опосредуют цитотоксичность NK-клеток человека против CD33-положительной Molm-13 клеточной линии AML человека. Как показано на ФИГ. 53B, покоящиеся человеческие NK-клетки были смешаны с опухолевыми клетками Molm-13, и TriNKET (например, C26-TriNKET-CD33 и F04-TriNKET-CD33) способны усиливать цитотоксическую активность покоящихся человеческих NK-клеток дозозависимым образом против опухолевых клеток. Пунктирная линия указывает на цитотоксическую активность покоящихся NK-клеток без TriNKET. Активированные человеческие NK-клетки смешивали с опухолевыми клетками Molm-13, и TriNKET еще более усиливают цитотоксическую активность активированных человеческих NK-клеток, по сравнению с антителом против CD33, дозозависимым образом против опухолевых клеток (ФИГ. 53B).
[00233] TriNKET усиливают цитотоксичность NK-клеток в отношении мишеней с низкой поверхностной экспрессией по сравнению с цитотоксической активностью трастузумаба, моноклонального антитела против HER2. Покоящиеся человеческие NK-клетки смешивали с опухолевыми клетками SkBr, экспрессирующими на высоком уровне HER2, и опухолевыми клетками 786-O, экспрессирующими на низком уровне HER2, и анализировали способность TriNKET усиливать цитотоксическую активность покоящихся человеческих NK-клеток против опухолевых клеток, экспрессирующих HER2 на высоком и на низком уровне дозозависимым образом. Пунктирные линии на ФИГ. 50А и ФИГ. 50B указывают на цитотоксическую активность покоящихся NK-клеток против опухолевых клеток в отсутствие TriNKET. Как показано на ФИГ. 50B, после смешивания активированных человеческих NK-клеток с клетками 786-O, экспрессирующими HER2 на низком уровне, и TriNKET (например, CD26-TriNKET-HER2 и F04-TriNKET-HER2), наблюдали дозозависимую цитотоксическую активность активированных человеческих NK-клеток против опухолевых клеток.
[00234] Анализировали TriNKET-опосредованный лизис BCMA-положительных клеток миеломы. ФИГ. 64 показывает TriNKET-опосредованный лизис BCMA-положительных клеток миеломы KMS12-PE покоящимися эффекторными NK-клетками человека. Два TriNKET (cFAE-A49.801 и cFAE-A49.901), использующие один и тот же NKG2D-связывающий домен (A49), но разные нацеленные на BCMA домены, были протестированы на эффективность in vitro. Оба TriNKET в одинаковой степени усиливали лизис NK-клетками клеток KMS12-PE, но TriNKET с использованием домена, нацеленного на EM-901, обеспечивали повышенную активность.
[00235] ФИГ. 65 показывает цитотоксическую активность нескольких TriNKET с использованием разных NKG2D-связывающих доменов (A40, A44, A49, C26 и F47), но одного и того же домена, нацеленного на BCMA. Изменение NKG2D-связывающего домена в TriMAKET, нацеленном на BCMA, приводило к изменениям максимального уничтожения, а также эффективности TriNKET. Все TriNKET продемонстрировали повышенное уничтожение клеток-мишеней KMS12-PE по сравнению с моноклональным антителом EM-901 (ФИГ. 65).
Пример 13
[00236] Исследовали синергическую активацию человеческих NK-клеток путем перекрестного связывания NKG2D и CD 16.
Анализ активации первичных человеческих NK-клеток
[00237] Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. NK-клетки очищали из РВМС с использованием отрицательных магнитных гранул (StemCell # 17955). NK-клетки были> 90% CD3-CD56+, как определено проточной цитометрией. Затем клетки наращивали 48 часов в среде, содержащей 100 нг/мл hIL-2 (Peprotech # 200-02), перед использованием в анализах активации. Антитела наносили на 96-луночный планшет с плоским дном в концентрации 2 мкг/мл (анти-CD16, Biolegend # 302013) и 5 мкг/мл (анти-NKG2D, R & D # MAB139) в 100 мкл стерильного PBS в течение ночи при 4°С с последующим тщательным промыванием лунок для удаления избытка антител. Для оценки дегрануляции IL-2-активированные NK-клетки ресуспендировали в концентрации 5×105 клеток/мл в культуральной среде, дополненной 100 нг/мл hIL2 и 1 мкг/мл APC-конъюгированного анти-CD107a mAb (Biolegend # 328619). Затем в планшеты, покрытые антителами, добавляли 1×105 клеток/лунку. Ингибиторы транспорта белка Брефельдин А (BFA, Biolegend # 420601) и Монензин (Biolegend # 420701) добавляли в конечном разведении 1:1000 и 1:270, соответственно. Посеянные клетки инкубировали в течение 4 часов при 37°С в 5% СО2. Для внутриклеточного окрашивания IFN-γ NK-клетки метили анти-CD3 (Biolegend # 300452) и анти-CD56 mAb (Biolegend # 318328), а затем фиксировали и пермеабилизовали и метили анти-IFN-γ mAb (Biolegend # 506507), NK-клетки анализировали на экспрессию CD107a и IFN-γ методом проточной цитометрии после гейтинга живых CD56+CD3- клеток.
[00238] Чтобы исследовать относительную эффективность комбинации рецепторов, проводили перекрестное связывание NKG2D или CD16 и совместное перекрестное связывание обоих рецепторов посредством стимулирования в состоянии, связанном с планшетом. Как показано на ФИГ.45 (ФИГ.45A- 45C), комбинированное стимулирование CD16 и NKG2D приводило к сильно повышенному уровню CD107a (дегрануляция) (ФИГ. 45A) и/или продуцированию IFN-γ (ФИГ. 45B). Пунктирные линии представляют аддитивный эффект отдельных стимулирований каждого рецептора.
[00239] Уровни CD107a и внутриклеточное продуцирование IFN-γ IL-2-активированных NK-клеток анализировали через 4 часа стимулирования в состоянии, связанном с планшетом, с помощью анти-CD16, анти-NKG2D или комбинацией обоих моноклональных антител. Графики показывают среднее (n=2) ± SD. ФИГ. 45А демонстрирует уровни CD107a; ФИГ. 45B демонстрирует уровни IFNγ; ФИГ. 45C демонстрирует уровни продуцирования CD107a и IFN-γ. Данные, показанные на ФИГ. 45A- 45C представляют пять независимых экспериментов с использованием пяти различных здоровых доноров.
[00240] Дегрануляцию CD107a и внутриклеточное продуцирование IFN-γ IL-2-активированных NK-клеток анализировали после 4 часов стимулирования в состоянии, связанном с планшетом, с помощью трастузумаба, анти-NKG2D или TriNKET, полученным из связывающих доменов трастузумаба и антитела против NKG2D (ФИГ. 46). Во всех случаях тестированные антитела имели человеческий изотип IgG1. Графики показывают среднее (n=2) ± SD.
Пример 14
Оценка связывания TriNKET с экспрессируемым в клетках человеческим NKG2D
[00241] Клетки EL4, трансдуцированные человеческим NKG2D, использовали для тестирования связывания с экспрессируемым в клетках человеческим NKG2D. TriNKET разбавляли до 20 мкг/мл, а затем разбавляли последовательно. Разведения mAb или TriNKET использовали для окрашивания клеток, а связывание TriNKET или mAb определяли с использованием вторичного антитела против человеческого IgG, конъюгированного с флуорофором. Клетки анализировали проточной цитометрией, связывание MFI было нормализовано к вторичным контрольным антителам для получения превышения относительно фоновых значений.
Оценка связывания TriNKET с опухолевыми антигенами человека, экспрессированными клетками
[00242] Опухолевые клеточные линии человека, экспрессирующие CD33 или HER2, использовали для оценки связывания опухолевого антигена с TriNKET, полученными из различных клонов, нацеленных на NKG2D. Клеточную линию AML человека MV4-11 использовали для оценки связывания TriNKET с экспрессируемым в клетке CD33. Клеточная линия 786-О почечно-клеточного рака человека экспрессирует HER2 на низком уровне, и ее использовали для оценки связывания TriNKET с клеточно-экспрессированным HER2. TriNKET разбавляли до 20 мкг/мл и инкубировали с соответствующими клетками. Связывание TriNKET детектировали с использованием вторичного антитела против человеческого IgG, конъюгированного с флуорофором. Клетки анализировали проточной цитометрией, связывание MFI с экспрессированным в клетке CD33, и HER2 нормализовали к контролям вторичных антител для получения превышения относительно фоновых значений.
Определение способности антител связываться с HER2-положительными клетками опухолевых клеточных линий человека
[00243] Измеряли способность связывания антител (ABC) HER2-положительных клеток опухолевых клеточных линий человека. Использовали набор Quantum Simply Cellular от Bangs Lab (# 815), и для изготовления гранул, меченных антителами, следовали инструкциям производителя. Вкратце, каждую из четырех популяций гранул окрашивали насыщающим количеством антитела против HER2, а клеточные популяции также окрашивали насыщающим количеством того же антитела. Данные выборки были получены для каждой популяции гранул, а также для клеточных популяций. Протокол QuickCal, поставляемый с набором, использовали для генерации стандартной кривой и экстраполяции значений ABC для каждой из клеточных линий.
Активация первичных NK-клеток с помощью TriNKET
[00244] РВМС выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. Выделенные РВМС промывали и готовили для выделения NK-клеток. NK-клетки выделяли, используя метод отрицательной селекции с магнитными гранулами; чистота выделенных NK-клеток обычно составляла> 90% CD3-CD56+. Выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2 для активации, или оставляли на ночь без цитокина. IL-2-активированные NK-клетки использовали через 24-48 часов; покоящиеся NK-клетки всегда использовали на следующий день после очистки.
[00245] Линии опухолевых клеток человека, экспрессирующие интересующий опухолевый антиген-мишень, собирали из культуры, и клетки доводили до 2×106/мл. Моноклональные антитела или TriNKET, нацеленные на интересующую опухоль-мишень, разводили в культуральной среде. Покоящиеся и/или активированные NK-клетки собирали из культуры, клетки отмывали и ресуспендировали в концентрации 2×106/мл в культуральной среде. IL-2 и конъюгированное с флуорофором антитело против CD107a добавляли к NK-клеткам для активации культуры. Брефелдин-А и монензин разводили в культуральной среде для блокирования транспорта белка из клетки для внутриклеточного окрашивания цитокинов. В 96-луночный планшет добавляли 50 мкл опухолевых мишеней, mAb/TriNKET, BFA/монензин и NK-клетки до общего объема культуры 200 мкл. Планшет культивировали в течение 4 часов, прежде чем образцы были подготовлены для анализа FACS.
[00246] После 4-часовой активации культуры клетки готовили для анализа проточной цитометрии с использованием конъюгированных с флуорофором антител против CD3, CD56 и IFNγ. Окрашивание CD107a и IFNγ анализировали в популяциях CD3-CD56+ для оценки активации NK-клеток.
Анализ цитотоксичности первичных NK-клеток человека
[00247] РВМС выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. Выделенные РВМС промывали и готовили для выделения NK-клеток. NK-клетки выделяли, используя метод отрицательной селекции с магнитными гранулами; чистота выделенных NK-клеток обычно составляла> 90% CD3-CD56+. Выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2, или оставляли на ночь без цитокинов. IL-2-активированные или покоящиеся NK-клетки использовали на следующий день в анализах на цитотоксичность.
Анализ высвобождения Cyto Tox 96 LHD:
[00248] Способность человеческих NK-клеток лизировать опухолевые клетки измеряли с добавлением или без добавления TriNKET с использованием анализа нерадиоактивной цитотоксичности cyto Tox 96 от Promega (G1780). Клеточные линии клеток человека, экспрессирующих интересующую опухолевую мишень, собирали из культуры, клетки промывали PBS и ресуспендировали в культуральной среде в концентрации 1-2×105/мл для использования в качестве клеток-мишеней. 50 мкл суспензии клеток-мишеней добавляли в каждую лунку. Моноклональные антитела или TriNKET, нацеленные на интересующий опухолевый антиген, разводили в культуральной среде, в каждую лунку добавляли 50 мкл разведенного mAb или TriNKET. Покоящиеся и/или активированные NK-клетки собирали из культуры, клетки промывали и ресуспендировали в концентрации 105-2×106/мл в культуральной среде в зависимости от желаемого соотношения E:T. 50 мкл NK-клеток добавляли в каждую лунку планшета, чтобы получить в общей сложности 150 мкл культурального объема. Планшет инкубировали при 37°C с 5% CO2 в течение 3 часов и 15 минут. После инкубации 10-кратный буфер для лизиса добавляли в лунки только с клетками-мишенями и в лунки, содержащие только среду, для максимального лизиса и контроля объема. Затем планшет помещали обратно в инкубатор на дополнительные 45 минут, чтобы довести общее время инкубации до проявки до 4 часов.
[00249] После инкубации планшет извлекали из инкубатора и клетки осаждали центрифугированием при 200 g в течение 5 минут. 50 мкл культурального супернатанта переносили в чистый микропланшет, и 50 мкл раствора субстрата добавляли в каждую лунку. Планшет защищали от света и инкубировали в течение 30 минут при комнатной температуре. В каждую лунку добавляли 50 мкл стоп-раствора и измеряли оптическую плотность при 492 нм на SpectraMax i3x. % Специфического лизиса рассчитывали следующим образом:% Специфического лизиса = ((Экспериментальное высвобождение - Самопроизвольное высвобождение из эффектора - Самопроизвольное высвобождение из мишени)/(Максимальное высвобождение - Самопроизвольное высвобождение)) * 100%.
Анализ цитотоксичности DELFIA:
[00250] Клеточные линии опухолевых клеток человека, экспрессирующих интересующую мишень, собирали из культуры, клетки промывали PBS и ресуспендировали в ростовой среде в концентрации 106/мл для мечения реагентом BATDA (Perkin Elmer AD0116). Следовали инструкциям производителя по мечению клеток-мишеней. После мечения клетки промывали 3 раза PBS и ресуспендировали при 0,5-1×105/мл в культуральной среде. Для приготовления фоновых лунок отбирали аликвоту меченых клеток и клетки извлекали из среды. 100 мкл среды осторожно добавляли в лунки в трех экземплярах, чтобы не повредить осажденные клетки. 100 мкл BATDA-меченных клеток добавляли в каждую лунку 96-луночного планшета. Лунки приберегали для спонтанного высвобождения из клеток-мишеней, и лунки готовили для максимального лизиса клеток-мишеней путем добавления 1% Triton-X. Моноклональные антитела или TriNKET против интересующей опухоли-мишени разводили в культуральной среде и в каждую лунку добавляли 50 мкл разведенного mAb или TriNKET. Покоящиеся и/или активированные NK-клетки собирали из культуры, клетки промывали и ресуспендировали в концентрации 105-2×106/мл в культуральной среде в зависимости от желаемого соотношения E:T. 50 мкл NK-клеток добавляли в каждую лунку планшета, чтобы получить в общей сложности 200 мкл культурального объема. Планшет инкубировали при 37°C с 5% CO2 в течение 2-3 часов, прежде чем проводить анализ.
[00251] После культивирования в течение 2-3 часов планшет извлекали из инкубатора и клетки осаждали центрифугированием при 200 g в течение 5 минут. 20 мкл супернатанта культуры переносили в чистый микропланшет, предоставленный производителем, в каждую лунку добавляли 200 мкл раствора европия комнатной температуры. Планшет защищали от света и инкубировали на шейкере для планшетов при 250 об/мин в течение 15 минут. Планшет считывался с использованием инструментов Victor 3 или SpectraMax i3X. % Специфического лизиса рассчитывали следующим образом:% Специфического лизиса = ((Экспериментальное высвобождение - спонтанное высвобождение)/(Максимальное высвобождение - спонтанное высвобождение)) * 100%.
Долгосрочный анализ на цитотоксичность человеческих PBMC:
[00252] Клетки-мишени SkBr-3 метили с помощью BacMam 3.0 NucLight Green (# 4622) для отслеживания клеток-мишеней. Для мечения клеток-мишеней SkBr-3 следовали протоколу производителя. Аннексин V красный (Essen Bioscience # 4641) разбавляли и готовили в соответствии с инструкциями производителя. Моноклональные антитела или TriNKET разводили в культуральной среде. 50 мкл mAb или TriNKET, аннексина V и покоящихся NK-клеток добавляли в лунки 96-луночного планшета, уже содержащего меченые клетки SkBr-3; Добавляли 50 мкл полной культуральной среды до общего объема культуры 200 мкл.
[00253] Сбор изображений был настроен на IncuCyte S3. Изображения для фазового, зеленого и красного каналов собирали каждый час, по 2 изображения на лунку. Анализ изображений проводили с использованием программного обеспечения IncuCyte S3. Экраны для зеленого и красного каналов создавали для подсчета количества опухолевых клеток и аннексина V-положительных клеток, соответственно. Для расчета % аннексин-V-положительных клеток-мишеней Mv4-11 использовали следующую формулу. % Аннексин-V-положительных клеток SkBr-3 = ((количество перекрывающихся объектов)/(количество зеленых объектов)) * 100%.
Сравнение TriNKET, который нацелен на HER+ опухолевые клетки, с SC2.2
[00254] TriNKET, нацеленный на HER2, более эффективен, чем трастузумаб, в снижении количества клеток SkBr-3, и только 60% клеток с нулевого момента времени осталось через 60 часов. TriNKET по настоящему изобретению, которые нацелены на HER2-экспрессирующие опухоли/опухолевые клетки, более эффективен, чем SC2.2 - одноцепочечная биспецифичная молекула, сконструированная из scFv, полученного из трастузумаба, связанного с ULBP-6, лигандом для NKG2D. SC2.2 связывает HER2+ опухолевые клетки и NKG2D+ NK-клетки одновременно. Поэтому была исследована эффективность SC2.2 в снижении количества опухолевых клеток HER2+. Исследования активации и цитотоксичности in vitro показали, что SC2.2 был эффективен в активации и уничтожении NK-клеток. Однако SC2.2 не смог продемонстрировать эффективность в модели подкожной опухоли RMA/S-HER2. Эффективность SC2.2 также тестировали in vivo с использованием модели сингенной мыши со сверхэкспрессией RMA/S-HER2. В этой мышиной модели SC2.2 не смог продемонстрировать контроль роста опухоли по сравнению с контролем носителя. Таким образом, хотя SC2.2 был способен активировать и уничтожать NK-клетки и связываться с HER2+ опухолевыми клетками, эти свойства были недостаточны для эффективного контроля роста опухоли HER2+.
Оценка периода полужизни SC2.2 из сыворотки у мышей C57Bl/6
[00255] Для определения периода полужизни в сыворотке SC2.2 у мышей C57Bl/6 SC2.2 метили флуоресцентной меткой для отслеживания его концентрации in vivo. SC2.2 метили IRDye 800CW (Licor # 929-70020). Меченый белок вводили внутривенно 3 мышам C57Bl/6, кровь брали у каждой мыши в указанные моменты времени. После сбора кровь центрифугировали при 1000 g в течение 15 минут и из каждого образца отбирали сыворотку и хранили при 4°С до тех пор, пока не были собраны все временные точки.
[00256] Сыворотку визуализировали с использованием инфракрасной системы визуализации Odyssey CLx, количественно определяли флуоресцентный сигнал из канала 800 с использованием программного обеспечения Image J. Интенсивности изображения нормализовали к первому моменту времени, и данные приводили в соответствие уравнению двухфазного распада. В этой экспериментальной системе был рассчитан период полужизни бета SC2.2, составляющий примерно 7 часов.
In vivo тестирование SC2.2 против подкожных опухолей RMA/S-HER2
[00257] Исследование in vivo было разработано в соответствии с ФИГ. 56, чтобы проверить эффективность SC2.2 против подкожных опухолей RMA/S-HER2. 106 клеток RMA/S, трансдуцированных человеческим HER2, инъецировали подкожно в бок 20 мышей C57Bl/6. Начиная со 2-го дня после инокуляции опухоли, SC2.2 ежедневно вводили внутрибрюшинно. SC2.2 дозировали в высоких и низких концентрациях наряду с контролем носителя. Начиная с 4-го дня после инокуляции опухоли, опухоли измеряли в понедельник, среду и пятницу на протяжении всего исследования. Объем опухоли рассчитывали по следующей формуле: объем опухоли=длина х ширина х высота
TriNKET связываются с клетками, экспрессирующими человеческий NKG2D
[00258] Была определена способность TriNKET связываться с клетками, экспрессирующими человеческий NKG2D. На ФИГ. 37 и ФИГ. 38 показано дозозависимое связывание двух TriNKET, содержащих разные NKG2D-связывающие домены. На ФИГ. 37 показано связывание двух TriNKET, когда CD33-связывающий домен используется в качестве второго нацеливающего фрагмента. На ФИГ. 38 показаны те же два NKG2D-связывающих домена, теперь соединенных со вторым нацеливающим фрагментом HER2. Шесть NKG2D-связывающих доменов сохраняют один и тот же профиль связывания с обоими нацеливающими на опухоль доменами.
TriNKET связываются с клетками, экспрессирующими человеческие опухолевые антигены
[00259] Была определена способность TriNKET связываться с клетками, экспрессирующими опухолевые антигены человека. На ФИГ. 41 и ФИГ. 42 показано связывание TriNKET с CD33, экспрессированным клетками (ФИГ. 41) и HER2 (ФИГ. 42). Связывание TriNKET с антигеном, экспрессированным клетками, согласовывалось между NKG2D-связывающими доменами. TriNKET связывались на сопоставимом уровне как родительское моноклональное антитело.
Способность антител связываться с человеческими HER2-положительными клетками опухолевых клеточных линий человека
[00260] В Таблице 9 приведены результаты количественного определения поверхностного HER2. Было установлено, что клетки SkBr-3 и HCC1954 имеют высокий (+++) уровень поверхностного HER2. ZR-75-1 и Colo201 показали средние уровни (++) поверхностного HER2, а 786-O показал самый низкий уровень HER2 (+).
[00261]
Таблица 9: ABC HER2-положительных опухолевых клеточных линий
Первичные человеческие NK-клетки активируются TriNKET в совместной культуре с опухолевыми клеточными линиями человека, экспрессирующими HER2 на различном уровне
[00262] На ФИГ. 47A-47C показано, что TriNKET и трастузумаб были способны активировать первичные человеческие NK-клетки в совместной культуре с HER2-положительными опухолевыми клетками человека, на что указывает увеличение дегрануляции CD107a и продуцирование цитокинов IFNγ. По сравнению с моноклональным антителом трастузумабом оба TriNKET продемонстрировали превосходную активацию человеческих NK-клеток различными опухолевыми клетками HER2 человека.
[00263] На ФИГ. 47А показано, что человеческие NK-клетки активируются TriNKET при культивировании с клетками SkBr-3. На ФИГ. 47B показано, что человеческие NK-клетки активируются TriNKET при культивировании с клетками Colo201. На ФИГ. 47C показано, что человеческие NK-клетки активируются TriNKET при культивировании с клетками HCC1954.
TriNKET усиливают активность покоящихся и IL-2-активированных NK-клеток человека
[00264] На ФИГ. 48A-48B показана TriNKET-опосредованная активация покоящихся или IL-2-активированных человеческих NK-клеток в совместной культуре с CD33-экспрессирующей человеческой клеточной линией AML MV4-11. На ФИГ. 48А показана TriNKET-опосредованная активация покоящихся человеческих NK-клеток. На ФИГ. 48B показана TriNKET-опосредованная активация IL-2-активированных человеческих NK-клеток от того же донора. Покоящиеся NK-клетки показали меньшее фоновое продуцирование IFNγ и дегрануляцию CD107a, чем IL-2-активированные NK-клетки. Покоящиеся NK-клетки показали большее изменение продуцирования IFNγ и дегрануляции CD107a по сравнению с IL-2-активированными NK-клетками. IL-2-активированные NK-клетки показали больший процент клеток, становящихся IFNγ+; CD107a+ после стимулирования с помощью TriNKET.
TriNKET усиливают цитотоксичность покоящихся и IL-2-активированных человеческих NK-клеток
[00265] На ФИГ. 49A - 49B показано усиление TriNKET цитотоксической активности с использованием IL-2-активированных и покоящихся человеческих NK-клеток. На ФИГ. 49А показан процент специфического лизиса опухолевых клеток SkBr-3 покоящимися NK-клетками человека. На ФИГ. 49B показан процент специфического лизиса опухолевых клеток SkBr-3 IL-2-активированными NK-клетками человека. IL-2-активированные и покоящиеся популяции NK-клеток ведут происхождение от одного и того же донора. По сравнению с трастузумабом TriNKET более эффективно направляют ответы против клеток SkBr-3 либо активированными, либо покоящимися популяциями NK-клеток.
TriNKET усиливают цитотоксичность NK-клеток в отношении мишеней с низкой поверхностной экспрессией
[00266] На ФИГ. 50A-50B показано, что TriNKET обеспечивают большее преимущество против злокачественных новообразований со средним и с низким уровнем HER2 по сравнению с трастузумабом. На ФИГ. 50А показано уничтожение активированными NK-клетками человека опухолевых клеток SkBr-3 с высоким уровнем HER2. На ФИГ. 50B показано уничтожение NK-клетками человека опухолевых клеток 786-O с низким уровнем HER2. TriNKET обеспечивают большее преимущество по сравнению с трастузумабом против опухолевых клеток с низкой экспрессией HER2. TriNKET обеспечивают наибольшее преимущество против мишеней с низкой поверхностной экспрессией.
Преимущество TriNKET в лечении злокачественного новообразования с высоким уровнем экспрессии FcR или в микроокружении опухоли с высоким уровнем FcR
[00267] Терапия моноклональными антителами была одобрена для лечения многих типов злокачественных новообразований, включая как гематологические, так и солидные опухоли. Хотя использование моноклональных антител в лечении злокачественного новообразования улучшило результаты лечения пациентов, все еще существуют ограничения. Механистические исследования продемонстрировали, что моноклональные антитела оказывают свое влияние на рост опухоли посредством множества механизмов, включая среди прочего, ADCC, CDC, фагоцитоз и сигнальную блокаду.
[00268] В частности, считается, что ADCC является основным механизмом, посредством которого моноклональные антитела оказывают свое влияние. ADCC основан на взаимодействии Fc антител низкоаффинного Fc γRIII (CD16) на поверхности клеток-натуральных киллеров, которые обеспечивают прямой лизис опухолевой клетки. Среди FcγR CD16 обладает наименьшей аффинностью к Fc IgG, FcγRI (CD64) является FcR с высокой аффинностью и связывается примерно в 1000 раз сильнее с Fc IgG, чем CD16.
[00269] CD64 обычно экспрессируется на клетках многих гемопоэтических линий, таких как миелоидная линия, и может экспрессироваться на опухолях, происходящих из этих типов клеток, таких как острый миелоидный лейкоз (AML). Иммунные клетки, инфильтрующиеся в опухоль, такие как MDSC и моноциты, также экспрессируют CD64 и, как известно, инфильтруются в микроокружение опухоли. Экспрессия CD64 опухолью или в микроокружении опухоли может оказывать вредное влияние на терапию моноклональными антителами. Экспрессия CD64 в микроокружении опухоли затрудняет взаимодействие этих антител с CD16 на поверхности NK-клеток, поскольку антитела предпочитают связываться с высокоаффинным рецептором. Посредством нацеливания на два активирующих рецептора на поверхности NK-клеток TriNKET могут преодолеть пагубное влияние экспрессии CD64 на терапию моноклональными антителами.
Экспрессия FcRγI (CD64) на трех клеточных линиях AML
[00270] Была разработана система культивирования in vitro для тестирования активности TriNKET и моноклональных антител против опухолей с высоким и низким уровнями поверхностной экспрессии CD64. Molm-13 и THP-1 представляют собой две линии клеток AML человека, которые имеют сходную экспрессию поверхностного CD33, но клетки Molm-13 не экспрессируют CD64, в то время как клетки THP-1 экспрессируют CD64 на своей поверхности (ФИГ.51А - 51С). Используя моноклональные антитела или TriNKET, направленные на мишень CD33, тестировали влияние экспрессии CD64 опухолью на моноклональные антитела или терапию TriNKET. На ФИГ. 51A- 51C показана экспрессия высокоаффинного FcRγI (CD64) на трех линиях клеток AML человека, клеточной линии Molm-13 (ФИГ. 51A), клеточной линии Mv4-11 (ФИГ. 51B) и клеточной линии THP-1. (ФИГ. 51C). Клетки Molm-13 не экспрессируют CD64, в то время как клетки Mv4-11 имеют низкий уровень, а THP-1 имеют высокий уровень CD64 на клеточной поверхности.
TriNKET имеют преимущество в нацеливании на опухолевые клетки с высокой поверхностной экспрессией FcR
[00271] На ФИГ. 52A-52B показана опосредованная моноклональными антителами или TriNKET активация человеческих NK-клеток в совместной культуре с клетками либо Molm-13 (ФИГ. 52B), либо THP-1 (ФИГ. 52A). Моноклональное антитело против CD33 человека продемонстрировало хорошую активацию человеческих NK-клеток в системе совместного культивирования Molm-13, о чем свидетельствует повышенная дегрануляция CD107a и продуцирование IFN γ. Моноклональное антитело не имеет эффекта в системе совместного культивирования THP-1, где в опухоли присутствует высокий уровень CD64. Интересно, что TriNKET были эффективны против клеток как Molm-13 (ФИГ. 52B), так и THP-1 (ФИГ. 52A), в то время как моноклональные антитела не способны активировать NK-клетки в культуре с клетками FcR-Hi THP-1, что указывает на способность TriNKET преодолеть связывание с CD64 на опухоли и эффективно нацелить NK-клетки для активации.Двойное нацеливание двух активирующих рецепторов на NK-клетки обеспечивало более сильное специфическое связывание с NK-клетками. Моноклональные антитела, которые нацелены только на CD16 на NK-клетках, могут связываться с другими высокоаффинными FcR и предотвращать рекрутинг CD16 на NK-клетках.
[00272] Анализы цитотоксичности NK-клеток человека с использованием систем совместного культивирования Molm-13 и THP-1 предоставляют дополнительные доказательства, подтверждающие эффективность TriNKET в присутствии высокого уровня CD64. В этих анализах цитотоксичности была использована третья линия клеток AML человека, Mv4-11. Клетки Mv4-11 (ФИГ. 51B) экспрессируют CD64 на низком уровне и попадают между клетками THP-1 (ФИГ. 51C) и Molm-13 (ФИГ. 51A) по уровню CD64 на их поверхности.
TriNKET демонстрируют эффективность на клеточных линиях AML независимо от экспрессии FcγRI
[00273] На ФИГ. 53A-53C показаны анализы цитотоксичности NK-клеток человека с использованием трех линий клеток AML человека в качестве мишеней. Моноклональное антитело против CD33 показывает хорошую эффективность против клеток Molm-13 (ФИГ. 53B), которые не экспрессируют CD64. Клетки Mv4-11 (ФИГ. 53A), которые экспрессируют CD64, но на более низком уровне, чем THP-1, показали пониженную эффективность с моноклональным антителом против CD33. Клетки THP-1 (ФИГ. 53C) не проявляли эффекта только с моноклональным антителом против CD33. Независимо от экспрессии CD64 на опухолевых клетках, TriNKET были способны опосредовать ответы человеческих NK-клеток против всех опухолевых клеток, протестированных в настоящем описании.
[00274] На ФИГ. 53A- 53C показано, что клетки THP-1 были защищены от терапии моноклональными антителами из-за высокого уровня высокоаффинной экспрессии FcR на их поверхности. TriNKET обошли эту защиту, воздействуя на два активирующих рецептора на поверхности NK-клеток. Данные по цитотоксичности напрямую коррелировали с тем, что было замечено в экспериментах по активации совместного культивирования. TriNKET были способны обойти защиту от mAb-терапии, наблюдаемую с клетками THP-1, и индуцировать лизис, опосредованный NK-клетками, несмотря на высокий уровень FcR.
Уничтожение нормальных миелоидных и нормальных В-клеток в культурах РВМС: TriNKETs обеспечивают лучший профиль безопасности благодаря меньшему количеству ошибочного нацеливания вне опухоли
[00275] Клетки-натуральные киллеры и CD8 T-клетки способны непосредственно лизировать опухолевые клетки, хотя механизмы, посредством которых NK-клетки и CD8 T-клетки распознают собственные здоровые клетки от опухолевых клеток, отличаются. Активность NK-клеток регулируется балансом сигналов от активирующих (NCR, NKG2D, CD16 и т.д.) и ингибирующих (KIR, NKG2A и т.д.) рецепторов. Баланс этих активирующих и ингибирующих сигналов позволяет NK-клеткам определять здоровые собственные клетки из подвергнутых стрессу, инфицированных вирусом или трансформированных собственных клеток. Этот «встроенный» механизм аутотолерантности поможет защитить нормальную здоровую ткань от ответов NK-клеток. Чтобы расширить этот принцип, аутотолерантность NK-клеток позволит TriNKET нацеливаться как на антигены, экспрессируемые собственными клетками, так и на опухолевые, без побочных эффектов, связанных с ошибочным нацеливанием вне опухоли или с увеличенным терапевтическим окном.
[00276] В отличие от клеток-натуральных киллеров, Т-клетки требуют распознавания специфического пептида, презентированного молекулами МНС для активации и эффекторных функций. Т-клетки были основной целью иммунотерапии, и было разработано много стратегий для перенаправления Т-клеточных ответов против опухоли. Биспецифические Т-клетки, ингибиторы контрольных точек и CAR-T-клетки одобрены FDA, но часто страдают от дозолимитирующей токсичности. Биспецифические Т-клетки и CAR-T-клетки функционируют вокруг системы распознавания TCR-MHC, используя связывающие домены для нацеливания на антигены на поверхности опухолевых клеток и используя сконструированные сигнальные домены для передачи сигналов активации в эффекторную клетку. Несмотря на то, что эти методы лечения эффективны для выявления противоопухолевого иммунного ответа, они часто сочетаются с синдромом высвобождения цитокинов (CRS) и побочными эффектами, связанными с ошибочным нацеливанием вне опухоли. В этом контексте TriNKET уникальны, так как они не «перекрывают» естественные системы активации и ингибирования NK-клеток. Вместо этого TriNKET предназначены для изменения баланса и обеспечения дополнительных сигналов активации для NK-клеток, сохраняя при этом NK-толерантность к собственным клеткам.
[00277] РВМС выделяли из цельной крови центрифугированием в градиенте плотности. Любые загрязняющие эритроциты лизировали путем инкубации в буфере для лизиса ACK. PBMC промывали 3 раза в PBS, и подсчитывали общее количество PBMC. РВМС доводили до 106/мл в среде для культивирования первичных клеток. 1 мл PBMC высевали в лунки 24-луночного планшета, указанные TriNKET или mAb добавляли в культуры PBMC в концентрации 10 мкг/мл. Клетки культивировали в течение ночи при 37°С с 5% СО2. На следующий день (спустя 24 часа) PBMC собирали из культуры и готовили для анализа FACS. Процент CD45+; CD19+ B-клеток и CD45+; CD33+; CD11b+ миелоидных клеток анализировали в разных группах обработки.
[00278] На ФИГ. 54B и 54D показано, что аутологичные миелоидные клетки защищены от TriNKET-опосредованных ответов NK-клеток. На ФИГ. 54А и 54В показано, что В-клетки здорового донора чувствительны к лизису, опосредованному TriNKET, в то время как миелоидные клетки устойчивы к лизису TriNKET. PBMC, обработанные TriNKET, нацеленными на CD20, показали пониженную частоту CD19+ B-клеток с популяцией CD45+ лимфоцитов (ФИГ. 54A), но не влияли на популяцию CD45+, CDD3-, CD56-лимфоцитов (ФИГ. 54C). В этих культурах частота CD45+, CD19+ миелоидных клеток (ФИГ. 54B) или частота CD33+, CD33+, CD11b+ миелоидных клеток (ФИГ. 54D) не изменялась.
TriNKET опосредуют уничтожение hPBMC опухолевых клеток SkBr-3 в длительных совместных культурах
Анализ на цитотоксичность первичных PBMC человека
[00279] На ФИГ. 55 показано долгосрочное уничтожение клеток SkBr-3 в культуре с РВМС человека. При культивировании отдельно клетки SkBr-3 пролиферируют и почти удваиваются за 60 часов. Когда человеческие PBMC добавляют к клеткам SkBr-3 в культуре, скорость пролиферации замедляется, и когда добавляется контрольный изотип TriNKET, нацеленный на CD33, пролиферация также замедляется, но в меньшей степени. При обработке культур трастузумабом SkBr-3 больше не размножаются, и через 60 часов остается только 80% клеток относительно нулевого момента времени. Поскольку клетки SkBr-3 чувствительны к блокаде сигнала HER2, влияние на рост клеток SkBr-3 может быть опосредовано блокадой сигнала HER2 или с помощью эффекторных функций Fc, таких как ADCC.
Пример 15
Противоопухолевая эффективность mcFAE-C26.99 TriNKET in vitro
[00280] Чтобы проверить активность связывания мышиного cFAE-C26.99 TriNKET, прямое связывание измеряли по сравнению с его моноклональными антителами с помощью анализов проточной цитометрии против Tyrp-1-положительных клеток меланомы B16F10 (фигура 58A) и линии EL4 клеток, сверхэкспрессирующих мышиный NKG2D (EL4-mNKG2D, ФИГ. 58B).
[00281] Чтобы проверить, сохраняют ли mcFAE-C26.99 TriNKET способность опосредовать цитотоксичность, измеряли уничтожение Tyrp-1-положительных опухолевых мишеней B16F10 мышиными IL-2-активированными NK-клетками. Как показано на ФИГ. 59, мышиные NK-клетки увеличивали свою цитотоксическую активность в присутствии mcFAE-C26.99. Важно отметить, что моноклональное антитело против Tyrp-1 TA99 проявляло только незначительные эффекты.
Повышенная цитотоксичность NK, опосредованная mcFAE-C26.99 TriNKET
[00282] Примерно 5×103 клеток меланомы B16F10 на лунку высевали за два дня до анализа. В день эксперимента добавляли 5×104 мышиных IL-2-активированных NK-клеток в присутствии TA99 mab или mcFAE-C26.99 TriNKET (mcFAE-C26.99 представляет собой гетеродимер mC26 и TA99 с мышиным IgG2c в качестве Fc. Мутации Gm относятся к мутациям гетеродимеризации, используемым для получения гетеродимера). Использовали 20 мкг/мл антител с четырехкратными разведениями. Через 4 часа совместного культивирования процент цитотоксичности оценивали с использованием набора CytoTox96 для высвобождения LDH. Пунктирная линия представляет базовую цитотоксичность в отсутствие антител.
mC26_hvL_mCL (жирный шрифт) (выделенные курсивом подчеркнутые аминокислоты являются мутациями гетеродимеризации, используемыми для получения гетеродимера):
DIQMTQSPSTLSASVGDRVTITCRASQSISSWLAWYQQKPGKAPKLLIYKASSLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYGSFPITFGGGTKVEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:86)
mC26_hvH_IgG2CGmB
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIRQPPGKGLEWIGEIDHSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARARGPWSFDPWGQGTLVTVSSAKTTAPSVYPLAPVCGGTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPALLQSGLYTLSSSVTVTSNTWPSQTITCNVAHPASSTKVDKKIEPRVPITQNPCPPLKECPPCAAPDLLGGPSVFIFPPKIKDVLMISLSPMVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNRALPSPIEKTISKPRGPVRAPQVYVLPPPAEEMTKKEFSLTCMIKGFLPAEIAVDWTSNGRTEQNYKNTATVLDSDGSYFMYSRLRVQKSTWERGSLFACSVVHEGLHNHLTTKTISRSLGK (SEQ ID NO:87)
TA99_mvL_mCL
DIQMSQSPASLSASVGETVTITCRASGNIYNYLAWYQQKQGKSPHLLVYDAKTLADGVPSRFSGSGSGTQYSLKISSLQTEDSGNYYCQHFWSLPFTFGSGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC (SEQ ID NO:88)
TA99_mvH_IgG2CGmA
EVQLQQSGAELVRPGALVKLSCKTSGFNIKDYFLHWVRQRPDQGLEWIGWINPDNGNTVYDPKFQGTASLTADTSSNTVYLQLSGLTSEDTAVYFCTRRDYTYEKAALDYWGQGASVIVSSAKTTAPSVYPLAPVCGGTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPALLQSGLYTLSSSVTVTSNTWPSQTITCNVAHPASSTKVDKKIEPRVPITQNPCPPLKECPPCAAPDLLGGPSVFIFPPKIKDVLMISLSPMVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNRALPSPIEKTISKPRGPVRAPQVYVLPPPAEEMTKKEFSLTCMITGFLPAEIAVDWTSNGRTEQNYKNTATVLDSDGSYLMYSKLTVQKSTWERGSLFACSVVHEGLHNHLTTKTISRSLGK (SEQ ID NO:89)
Пример 16
Противоопухолевая эффективность mcFAE-C26.99 TriNKET in vivo
[00283] Чтобы проверить, вызывает ли mcFAE-C26.99 противоопухолевые функции in vivo, мышам C57BL/6 подкожно инъецировали 2×105 опухолевых клеток B16F10. Мышей обрабатывали либо контрольным изотипом, моноклональным антителом TA99, либо TriNKET mcFAE-C26.99. Обработка моноклональным антителом TA99 показала такое же прогрессирование опухоли, что и в контрольной группе, получавшей обработку изотипом. Однако введение mNFAE-C26.99 TriNKET приводило к задержке прогрессирования опухоли по сравнению с группой, получавшей изотип. Примерно 2×105 клеток меланомы B16F10 инъецировали подкожно в бок мышей C57BL/6. На 6 день после инокуляции опухоли мышей рандомизировали (n=10 на группу). Мышей обрабатывали внутрибрюшинно (ФИГ. 60A) изотипическим контрольным мышиным IgG2a mab C1.18.4 и мышиным моноклональным антителом против Tyrp-1 или (ФИГ. 60B) изотипическим контрольным мышиным IgG2a ma C1.18.4 и mcFAE-C26.99 TriNKET, которые инъецировали в дозе 150 мкг (дни 6, 8, 10, 12, 14, 16 и 21). Рост опухоли оценивали в течение 28 дней. Графики показывают кривые роста опухоли у отдельных мышей.
[00284] В дополнение к модели подкожной опухоли B16F10, mcFAE-C26.99 TriNKET также был протестирован на его противоопухолевую эффективность в условиях диссеминированной опухоли. 1×105 клеток B16F10 вводили мышам внутривенно. Обработку начинали либо на 4, либо на 7 день с низкой (300 мкг/инъекция) и высокой (600 мкг/инъекция) дозы антитела. На 18 день после инокуляции подсчитывали метастазы в легкие. Обработка, начатая на 4 и 7 день после инокуляции опухоли, привела к уменьшению количества метастазов в легкие, когда моноклональное антитело TA99 или mcFAE-C26.99 TriNKET использовалось в высокой концентрации по сравнению с контрольной группой, получавшей изотип. При низких концентрациях только mcFAE-C26.99 TriNKET уменьшал опухолевую нагрузку (ФИГ. 61A). Подобные эффекты наблюдались, когда антитела вводили, начиная с 7-го дня после инокуляции опухоли. В целом, терапия mcFAE-C26.99 TriNKET привела к снижению количества метастазов в легких по сравнению с моноклональным антителом TA99 во всех тестируемых условиях. Примерно 1×105 клеток меланомы B16F10 вводили внутривенно в хвостовую вену мышей C57BL/6 (n=8 на группу). Мышей либо оставляли необработанными, либо обрабатывали внутрибрюшинно контрольным mab (изотип, клон C1.18.4), моноклональным антителом TA99 или Tri99KET TA99 (mcFAE-C26.99). ФИГ. 61А представляет опухолевую нагрузку, когда антитела вводили в дозе 150 мкг (дни 4, 6, 8, 11, 13, 15). ФИГ. 61B представляет собой опухолевую нагрузку, когда антитела вводили в дозе 150 мкг (дни 7, 9, 11, 13, 15). Через 18 дней после заражения опухолью мышей умерщвляли и метастазы в поверхностные легкие оценивали (ФИГ. 61B).
Пример 17
Цитотоксическая активность покоящихся человеческих NK-клеток, опосредованная TriNKET, моноклональными антителами или биспецифичными антителами против HER2-положительных клеток
[00285] РВМС выделяли из лейкотромбоцитарного слоя периферической крови с использованием центрифугирования в градиенте плотности. Выделенные РВМС промывали и готовили для выделения NK-клеток. NK-клетки выделяли, используя метод отрицательной селекции с магнитными гранулами; чистота выделенных NK-клеток обычно составляла> 90% CD3-CD56 +. Выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2, или оставляли на ночь без цитокинов. IL-2-активированные или покоящиеся NK-клетки использовали на следующий день в анализах на цитотоксичность.
[00286] Анализ цитотоксичности DELFIA:
[00287] Линии опухолевых клеток человека, экспрессирующие представляющую интерес мишень, собирали из культуры, клетки промывали HBS и ресуспендировали в ростовой среде в концентрации 106 мл/мл для мечения реагентом BATDA (Perkin Elmer AD0116). Следовали инструкциям производителя по мечению клеток-мишеней. После мечения клетки промывали 3 раза HBS и ресуспендировали в концентрации 0,5-1×105/мл в культуральной среде. Для приготовления фоновых лунок отбирали аликвоту меченых клеток, и клетки извлекали из среды. 100 мкл среды осторожно добавляли в лунки в трех экземплярах, чтобы не повредить осажденные клетки. 100 мкл BATDA-меченных клеток добавляли в каждую лунку 96-луночного планшета. Лунки сохраняли для спонтанного высвобождения из клеток-мишеней, и лунки были подготовлены для максимального лизиса клеток-мишеней путем добавления 1% Triton-X. Моноклональные антитела или TriNKET против интересующей опухоли-мишени разводили в культуральной среде и в каждую лунку добавляли 50 мкл разведенного mAb или TriNKET. Покоящиеся и/или активированные NK-клетки собирали из культуры, клетки промывали и ресуспендировали в концентрации 105-2×106/мл в культуральной среде в зависимости от желаемого соотношения E:T. 50 мкл NK-клеток добавляли в каждую лунку планшета, чтобы получить в общей сложности 200 мкл культурального объема. Планшет инкубировали при 37°С с 5% СО2 в течение 2-3 часов, прежде чем проводить анализ.
[00288] После культивирования в течение 2-3 часов планшет извлекали из инкубатора и клетки осаждали центрифугированием при 200 g в течение 5 минут. 20 мкл культурального супернатанта переносили в чистый микропланшет, предоставленный производителем, и 200 мкл раствора европия при комнатной температуре добавляли в каждую лунку. Планшет защищали от света и инкубировали на шейкере для планшетов при 250 об/мин в течение 15 минут. Планшет считывался с использованием инструментов Victor 3 или SpectraMax i3X. % Специфического лизиса рассчитывали следующим образом: % Специфического лизиса = ((Экспериментальное высвобождение - спонтанное высвобождение)/(Максимальное высвобождение - спонтанное высвобождение)) * 100%.
Комбинация моноклонального антитела и биспецифического рекрутера NK-клеток не повторяет активность TriNKET:
[00289] На ФИГ. 66 показана цитотоксическая активность покоящихся человеческих NK-клеток, опосредованная TriNKET, моноклональными антителами или биспецифичными антителами против HER2-положительной клеточной линии Colo-201. TriNKET (ADI-29404 (F04)), нацеленный на HER2, индуцировал максимальный лизис клеток Colo-201 покоящимися NK-клетками человека. Мутацию D265A вводили в домен CH2 TriNKET для отмены связывания FcR. HER2-TriNKET (ADI-29404 (F04)) - D265A не способен опосредовать лизис клеток Colo-201, демонстрируя важность двойного нацеливания CD16 и NKG2D на NK-клетки. Чтобы дополнительно продемонстрировать важность двойного нацеливания на NK-клетки, моноклональное антитело трастузумаб использовали для нацеливания на HER2 и опосредования ADCC NK-клетками, один трастузумаб был способен увеличивать лизис NK-клеток клеток Colo-201, но максимальный лизис, достигаемый одним только трастузумабом, был примерно в 4 раза ниже по сравнению с TriNKET. Чтобы понять важность нацеливания CD16 и NKG2D на одну и ту же молекулу, активность TriNKET (ADI-29404 (F04)) сравнивали с активностью биспецифичного антитела, нацеленного на HER2 и NKG2D, в сочетании с трастузумабом. При использовании в эквимолярных концентрациях комбинация биспецифического антитела и трастузумаба не способна обеспечить максимальный лизис клеток Colo-201 покоящимися NK-клетками человека. Недостаток комбинации трастузумаб+биспецифичное антитело демонстрирует важность содержания триспецифического связывания TriNKET в одной молекуле.
ВКЛЮЧЕНИЕ С ПОМОЩЬЮ ССЫЛКИ
[00290] Полное раскрытие каждого из патентных документов и научных статей, упомянутых в настоящем документе, включено в качестве ссылки для всех целей.
Эквиваленты
[00291] Изобретение может быть воплощено в других конкретных формах без отклонения от его сущности или существенных характеристик. Таким образом, вышеприведенные варианты осуществления следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие изобретение, описанное в настоящем документе. Таким образом, объем изобретения обозначен прилагаемой формулой изобретения, а не предшествующим описанием, и все изменения, которые входят в значение и диапазон эквивалентности формулы изобретения, предназначены для включения в нее.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ADIMAB, LLC.
<120> ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-
НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ
ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ
<130> DFY-001PC
<140>
<141>
<150> 62/456,535
<151> 2017-02-08
<160> 89
<170> PatentIn version 3.5
<210> 1
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 1
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 3
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 4
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 5
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 6
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 7
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 8
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 9
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 10
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 11
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 12
Glu Leu Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asp Ile Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 13
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 13
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 14
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 15
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 15
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 16
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 17
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 18
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 19
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 20
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ile Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 21
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 22
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 23
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 25
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 27
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Phe Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 29
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Ser Tyr Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 31
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 31
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 33
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 33
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 35
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 37
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 38
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Leu Tyr Ser Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 39
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Thr Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Ser Ser Ile Arg His Ala Tyr Tyr Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 42
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 42
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 43
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 43
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Ser Asp Arg Phe His Pro Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 44
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 44
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Asp Thr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 45
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Gly Gly Tyr Tyr Asp Ser Gly Ala Gly Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 46
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asp Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 47
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 47
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 48
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Phe Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 49
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Gly Glu Tyr Tyr Asp Thr Asp Asp His Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 50
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 50
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Tyr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 51
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 51
Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5
<210> 52
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 52
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 53
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 53
Ala Lys Asp Gly Gly Tyr Tyr Asp Ser Gly Ala Gly Asp Tyr
1 5 10
<210> 54
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 54
Arg Ala Ser Gln Gly Ile Asp Ser Trp Leu Ala
1 5 10
<210> 55
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 55
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 56
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 56
Gln Gln Gly Val Ser Tyr Pro Arg Thr
1 5
<210> 57
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 57
Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5
<210> 58
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 58
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 59
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 59
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro
1 5 10 15
<210> 60
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 60
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 61
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 61
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 62
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 62
Gln Gln Gly Val Ser Phe Pro Arg Thr
1 5
<210> 63
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 63
Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5
<210> 64
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 64
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 65
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 65
Ala Arg Asp Thr Gly Glu Tyr Tyr Asp Thr Asp Asp His Gly Met Asp
1 5 10 15
Val
<210> 66
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 66
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 67
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 67
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 68
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 68
Gln Gln Asp Asp Tyr Trp Pro Pro Thr
1 5
<210> 69
<211> 121
<212> Белок
<213> Homo sapiens
<400> 69
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Gly Leu Gly Asp Gly Thr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 70
<211> 110
<212> Белок
<213> Homo sapiens
<400> 70
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Phe Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 71
<211> 115
<212> Белок
<213> Homo sapiens
<400> 71
Gln Val His Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Asp Asp Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly His Ile Ser Tyr Ser Gly Ser Ala Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Asn Trp Asp Asp Ala Phe Asn Ile Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 72
<211> 108
<212> Белок
<213> Homo sapiens
<400> 72
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 73
<211> 246
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 73
Met Ala Ala Ala Ala Ile Pro Ala Leu Leu Leu Cys Leu Pro Leu Leu
1 5 10 15
Phe Leu Leu Phe Gly Trp Ser Arg Ala Arg Arg Asp Asp Pro His Ser
20 25 30
Leu Cys Tyr Asp Ile Thr Val Ile Pro Lys Phe Arg Pro Gly Pro Arg
35 40 45
Trp Cys Ala Val Gln Gly Gln Val Asp Glu Lys Thr Phe Leu His Tyr
50 55 60
Asp Cys Gly Asn Lys Thr Val Thr Pro Val Ser Pro Leu Gly Lys Lys
65 70 75 80
Leu Asn Val Thr Met Ala Trp Lys Ala Gln Asn Pro Val Leu Arg Glu
85 90 95
Val Val Asp Ile Leu Thr Glu Gln Leu Leu Asp Ile Gln Leu Glu Asn
100 105 110
Tyr Thr Pro Lys Glu Pro Leu Thr Leu Gln Ala Arg Met Ser Cys Glu
115 120 125
Gln Lys Ala Glu Gly His Ser Ser Gly Ser Trp Gln Phe Ser Ile Asp
130 135 140
Gly Gln Thr Phe Leu Leu Phe Asp Ser Glu Lys Arg Met Trp Thr Thr
145 150 155 160
Val His Pro Gly Ala Arg Lys Met Lys Glu Lys Trp Glu Asn Asp Lys
165 170 175
Asp Val Ala Met Ser Phe His Tyr Ile Ser Met Gly Asp Cys Ile Gly
180 185 190
Trp Leu Glu Asp Phe Leu Met Gly Met Asp Ser Thr Leu Glu Pro Ser
195 200 205
Ala Gly Ala Pro Leu Ala Met Ser Ser Gly Thr Thr Gln Leu Arg Ala
210 215 220
Thr Ala Thr Thr Leu Ile Leu Cys Cys Leu Leu Ile Ile Leu Pro Cys
225 230 235 240
Phe Ile Leu Pro Gly Ile
245
<210> 74
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 74
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Val Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Arg Tyr Glu Val Tyr Gly Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 75
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 75
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Thr Ala Ser Ser Ser Val Asn Tyr Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Val Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Pro Val Glu Ala Asn
65 70 75 80
Asp Thr Ala Asn Tyr Tyr Cys Gln Gln Trp Arg Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 76
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 76
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Asn
20 25 30
Ala Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Pro Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Leu Gly Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 77
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 77
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Asp Glu
20 25 30
Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile His Ser Ala Ser Thr Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Tyr Pro Pro
85 90 95
Asp Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 78
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 78
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 79
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 79
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Glu Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 80
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 80
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Arg Lys Ala Ser Gly Ser Phe Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 81
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 81
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Glu Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Pro Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 82
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 82
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Leu Gly Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 83
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 83
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Tyr Pro Pro
85 90 95
Asp Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 84
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 84
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Arg Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Thr Tyr Tyr Gly Gly Asp Trp Tyr Phe Asn Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser Ala
115 120
<210> 85
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 85
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Ile
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Thr Ser Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 86
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 86
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 87
<211> 452
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 87
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Val Cys Gly Gly Thr Thr Gly Ser Ser Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser
145 150 155 160
Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Leu Leu Gln Ser
165 170 175
Gly Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Asn Thr Trp
180 185 190
Pro Ser Gln Thr Ile Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr
195 200 205
Lys Val Asp Lys Lys Ile Glu Pro Arg Val Pro Ile Thr Gln Asn Pro
210 215 220
Cys Pro Pro Leu Lys Glu Cys Pro Pro Cys Ala Ala Pro Asp Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu
245 250 255
Met Ile Ser Leu Ser Pro Met Val Thr Cys Val Val Val Asp Val Ser
260 265 270
Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu
275 280 285
Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr
290 295 300
Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser
305 310 315 320
Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Arg Ala Leu Pro Ser Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Pro Arg Gly Pro Val Arg Ala Pro Gln
340 345 350
Val Tyr Val Leu Pro Pro Pro Ala Glu Glu Met Thr Lys Lys Glu Phe
355 360 365
Ser Leu Thr Cys Met Ile Lys Gly Phe Leu Pro Ala Glu Ile Ala Val
370 375 380
Asp Trp Thr Ser Asn Gly Arg Thr Glu Gln Asn Tyr Lys Asn Thr Ala
385 390 395 400
Thr Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Arg Leu Arg
405 410 415
Val Gln Lys Ser Thr Trp Glu Arg Gly Ser Leu Phe Ala Cys Ser Val
420 425 430
Val His Glu Gly Leu His Asn His Leu Thr Thr Lys Thr Ile Ser Arg
435 440 445
Ser Leu Gly Lys
450
<210> 88
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 88
Asp Ile Gln Met Ser Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Gly Asn Ile Tyr Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro His Leu Leu Val
35 40 45
Tyr Asp Ala Lys Thr Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Ser Ser Leu Gln Thr
65 70 75 80
Glu Asp Ser Gly Asn Tyr Tyr Cys Gln His Phe Trp Ser Leu Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 89
<211> 456
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический полипептид
<400> 89
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Leu Val Lys Leu Ser Cys Lys Thr Ser Gly Phe Asn Ile Lys Asp Tyr
20 25 30
Phe Leu His Trp Val Arg Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asn Pro Asp Asn Gly Asn Thr Val Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Thr Ala Ser Leu Thr Ala Asp Thr Ser Ser Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Ser Gly Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Arg Asp Tyr Thr Tyr Glu Lys Ala Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Ala Ser Val Ile Val Ser Ser Ala Lys Thr Thr Ala Pro Ser
115 120 125
Val Tyr Pro Leu Ala Pro Val Cys Gly Gly Thr Thr Gly Ser Ser Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu
145 150 155 160
Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala
165 170 175
Leu Leu Gln Ser Gly Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr
180 185 190
Ser Asn Thr Trp Pro Ser Gln Thr Ile Thr Cys Asn Val Ala His Pro
195 200 205
Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Val Pro Ile
210 215 220
Thr Gln Asn Pro Cys Pro Pro Leu Lys Glu Cys Pro Pro Cys Ala Ala
225 230 235 240
Pro Asp Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile
245 250 255
Lys Asp Val Leu Met Ile Ser Leu Ser Pro Met Val Thr Cys Val Val
260 265 270
Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val
275 280 285
Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp
290 295 300
Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln
305 310 315 320
Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Arg Ala
325 330 335
Leu Pro Ser Pro Ile Glu Lys Thr Ile Ser Lys Pro Arg Gly Pro Val
340 345 350
Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Ala Glu Glu Met Thr
355 360 365
Lys Lys Glu Phe Ser Leu Thr Cys Met Ile Thr Gly Phe Leu Pro Ala
370 375 380
Glu Ile Ala Val Asp Trp Thr Ser Asn Gly Arg Thr Glu Gln Asn Tyr
385 390 395 400
Lys Asn Thr Ala Thr Val Leu Asp Ser Asp Gly Ser Tyr Leu Met Tyr
405 410 415
Ser Lys Leu Thr Val Gln Lys Ser Thr Trp Glu Arg Gly Ser Leu Phe
420 425 430
Ala Cys Ser Val Val His Glu Gly Leu His Asn His Leu Thr Thr Lys
435 440 445
Thr Ile Ser Arg Ser Leu Gly Lys
450 455
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ, СВЯЗЫВАЮЩИЕ CD33, NKG2D И CD16 | 2018 |
|
RU2820603C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ВСМА, NKG2D И CD16 | 2018 |
|
RU2805254C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2788531C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2826991C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА CAIX, ANO1, МЕЗОТЕЛИН, TROP2, СEA ИЛИ КЛАУДИН-18.2 | 2018 |
|
RU2792671C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА NKG2D, CD16 И TROP2 | 2018 |
|
RU2820629C2 |
| Белки, связывающие NKG2D, CD16 и опухолеассоциированный антиген | 2018 |
|
RU2816716C2 |
| МОДИФИЦИРОВАННЫЕ НЕПРИРОДНЫЕ ЛИГАНДЫ NKG2D, КОТОРЫЕ ИЗБИРАТЕЛЬНО ДОСТАВЛЯЮТ ПРИСОЕДИНЕННЫЕ ГЕТЕРОЛОГИЧНЫЕ МОЛЕКУЛЫ К НЕПРИРОДНЫМ РЕЦЕПТОРАМ NKG2D НА CAR-КЛЕТКАХ | 2020 |
|
RU2823728C2 |
| УСЕЧЕННЫЕ ХИМЕРНЫЕ РЕЦЕПТОРЫ NKG2D И ПУТИ ИХ ПРИМЕНЕНИЯ В ИММУНОТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ | 2018 |
|
RU2830556C2 |
| МОДИФИЦИРОВАННЫЕ ДОМЕНЫ α1-α2 НЕПРИРОДНЫХ ЛИГАНДОВ NKG2D, КОТОРЫЕ СВЯЗЫВАЮТСЯ С НЕПРИРОДНЫМИ РЕЦЕПТОРАМИ NKG2D | 2019 |
|
RU2815278C2 |


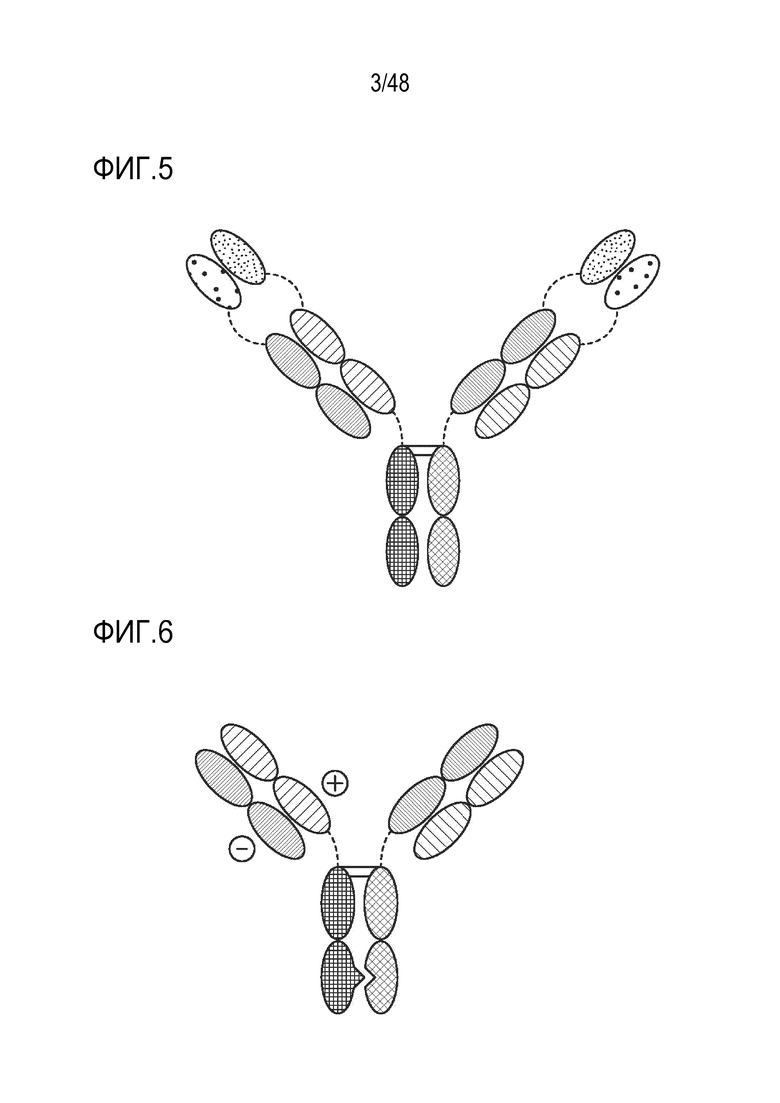
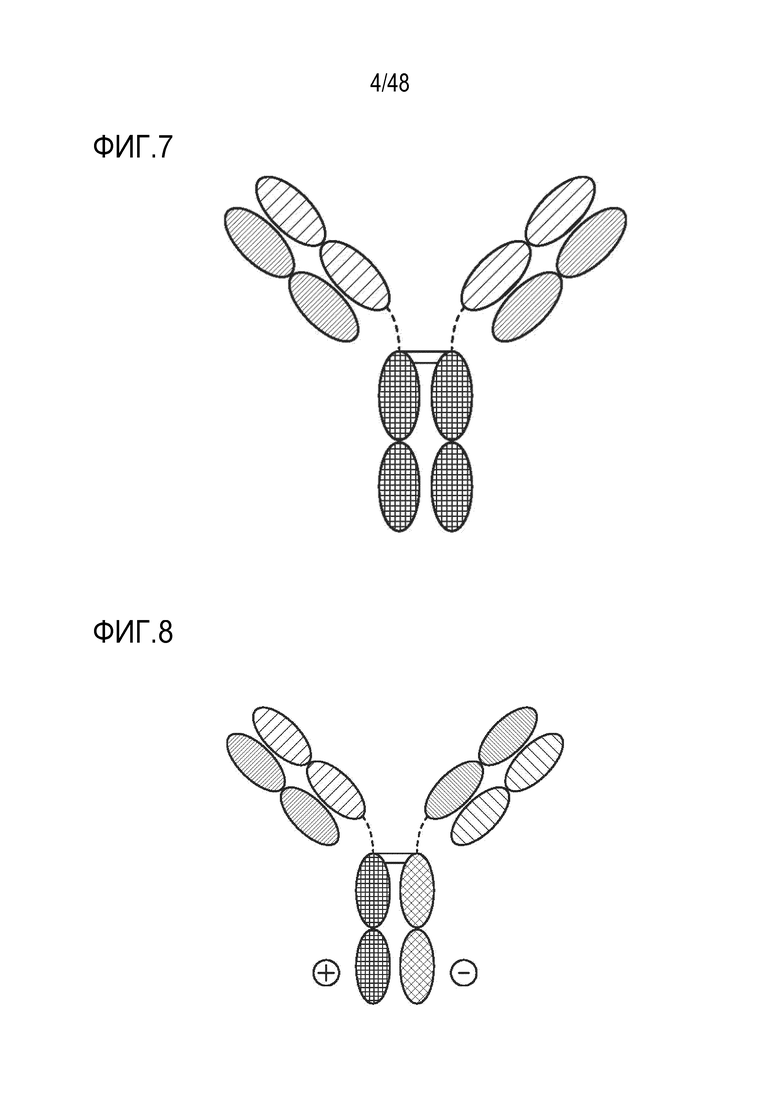
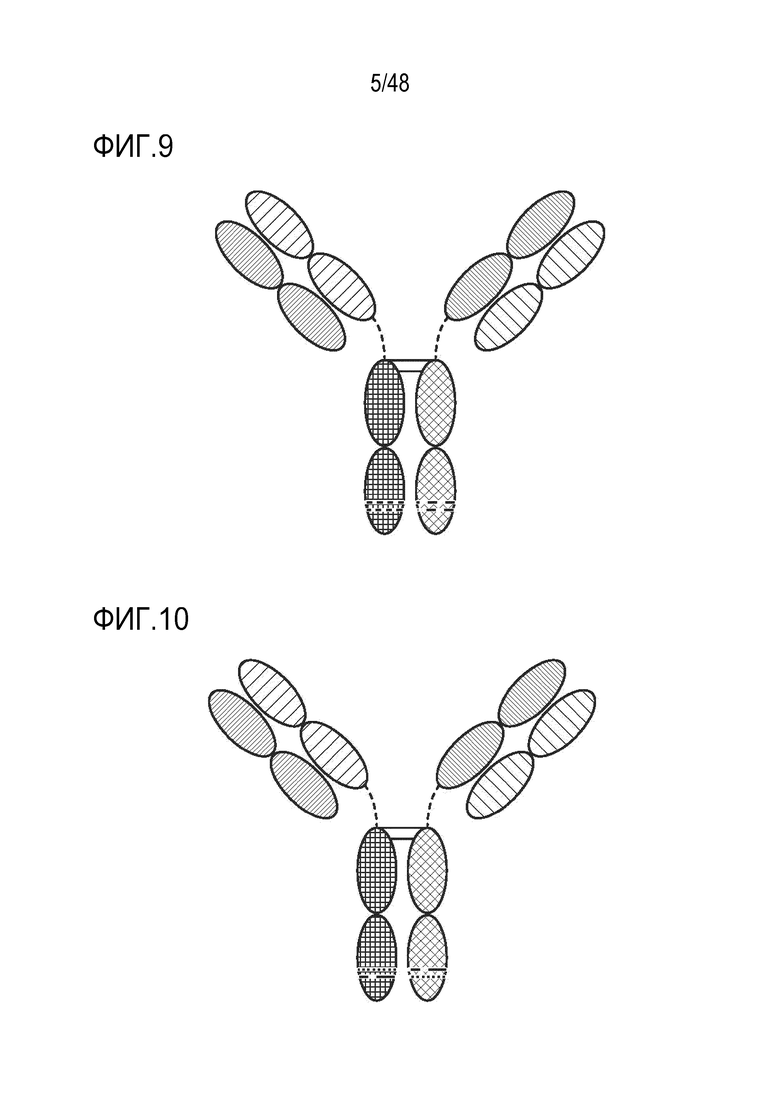
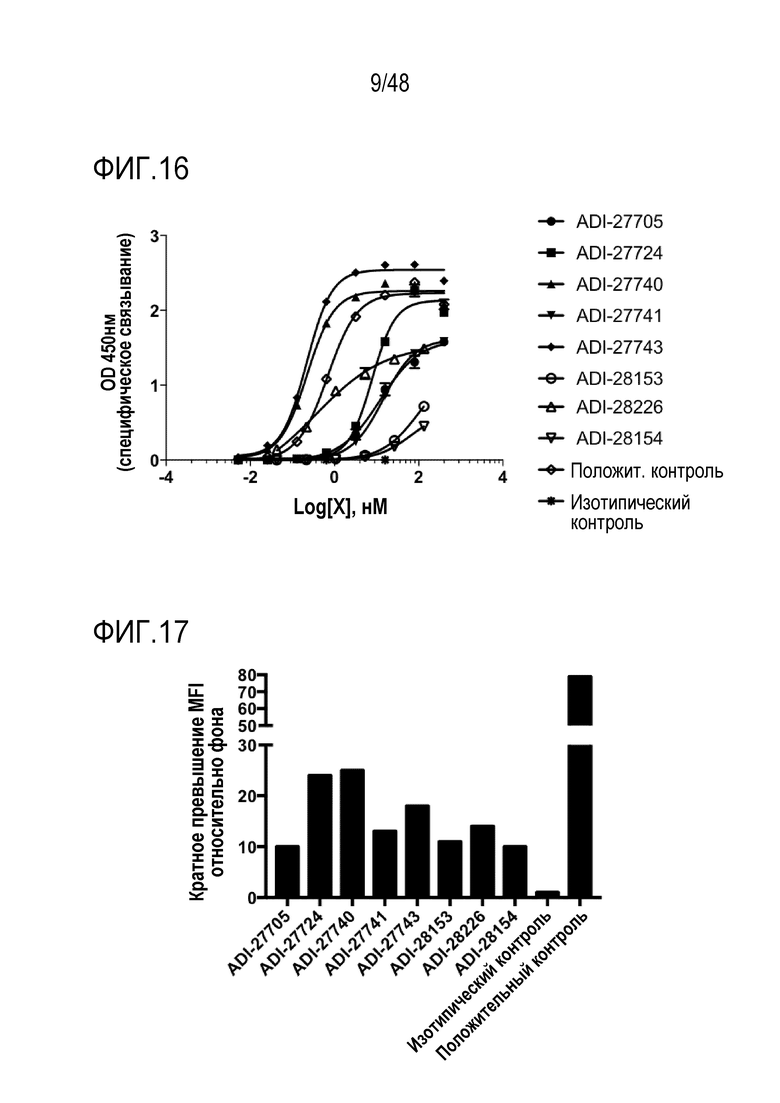
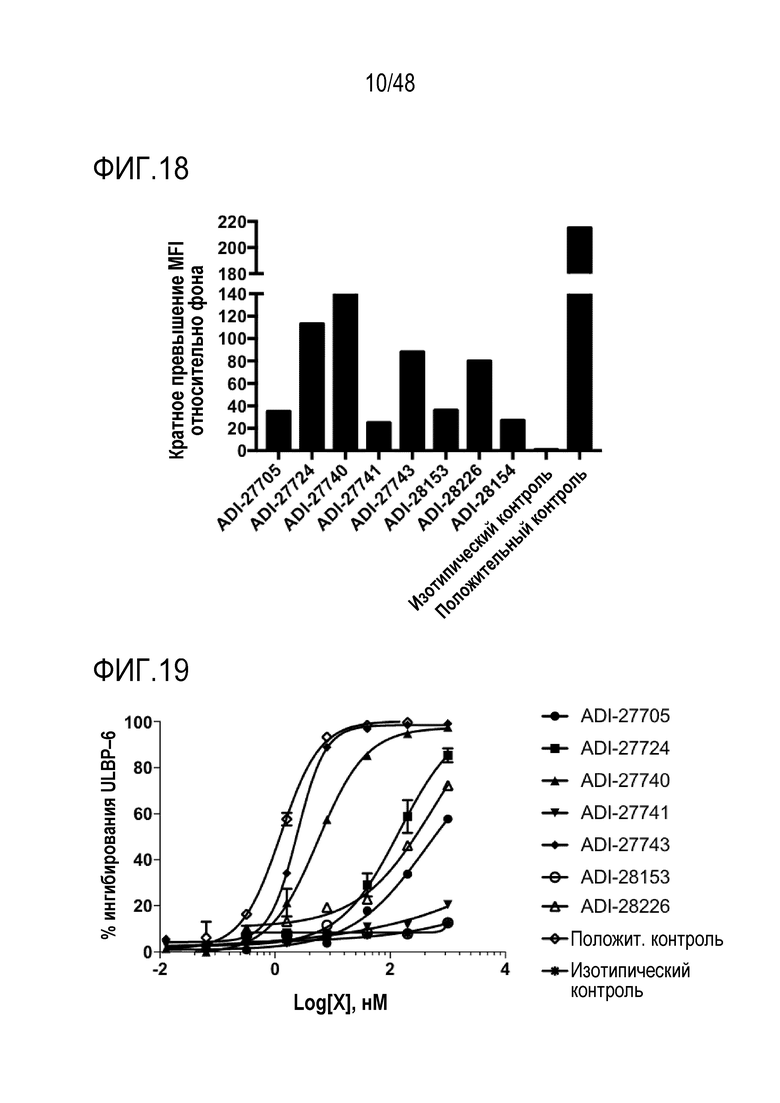
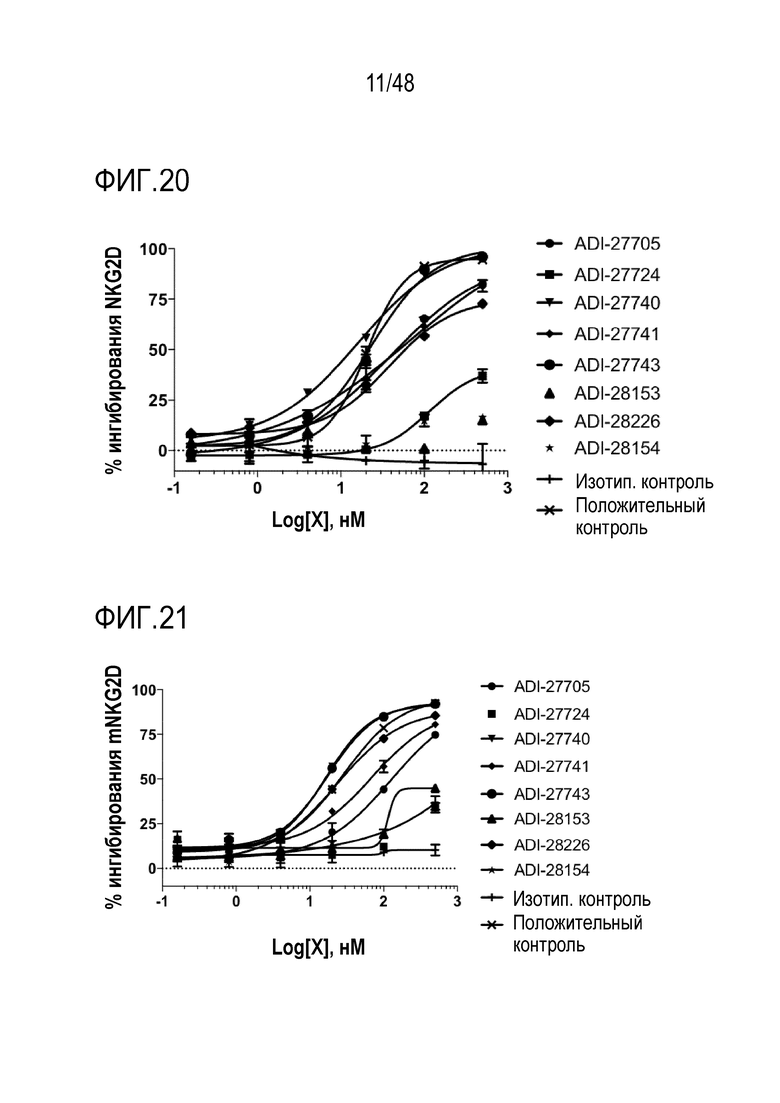
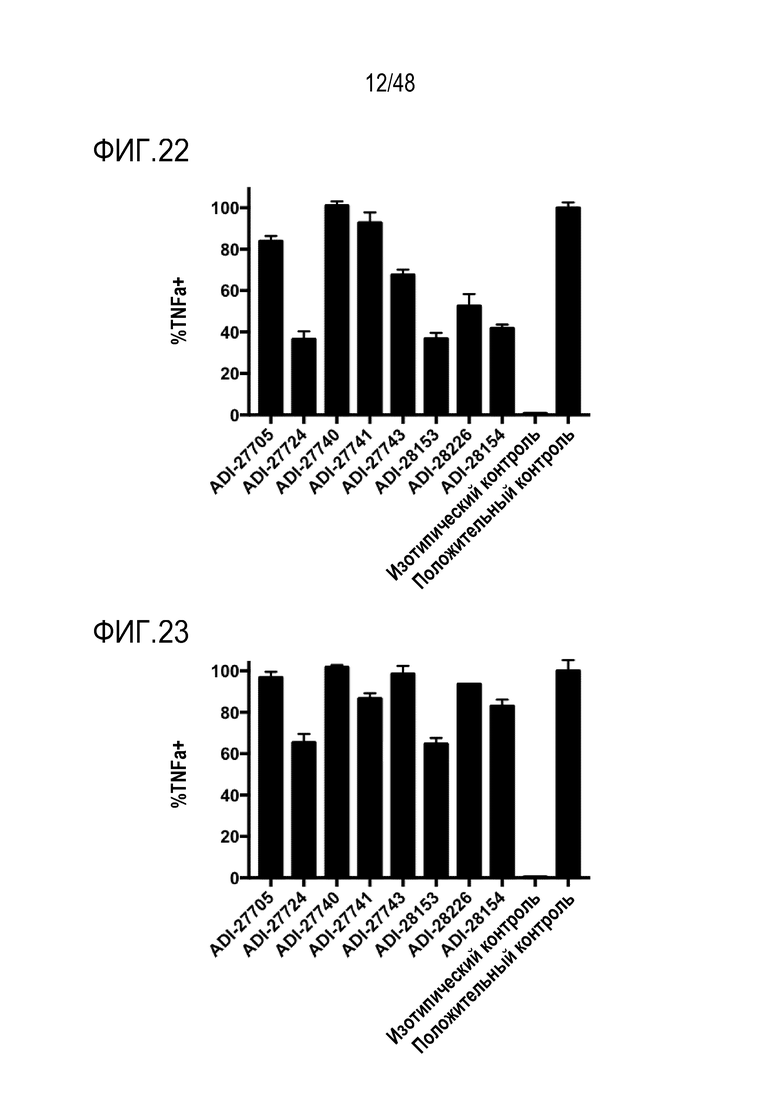

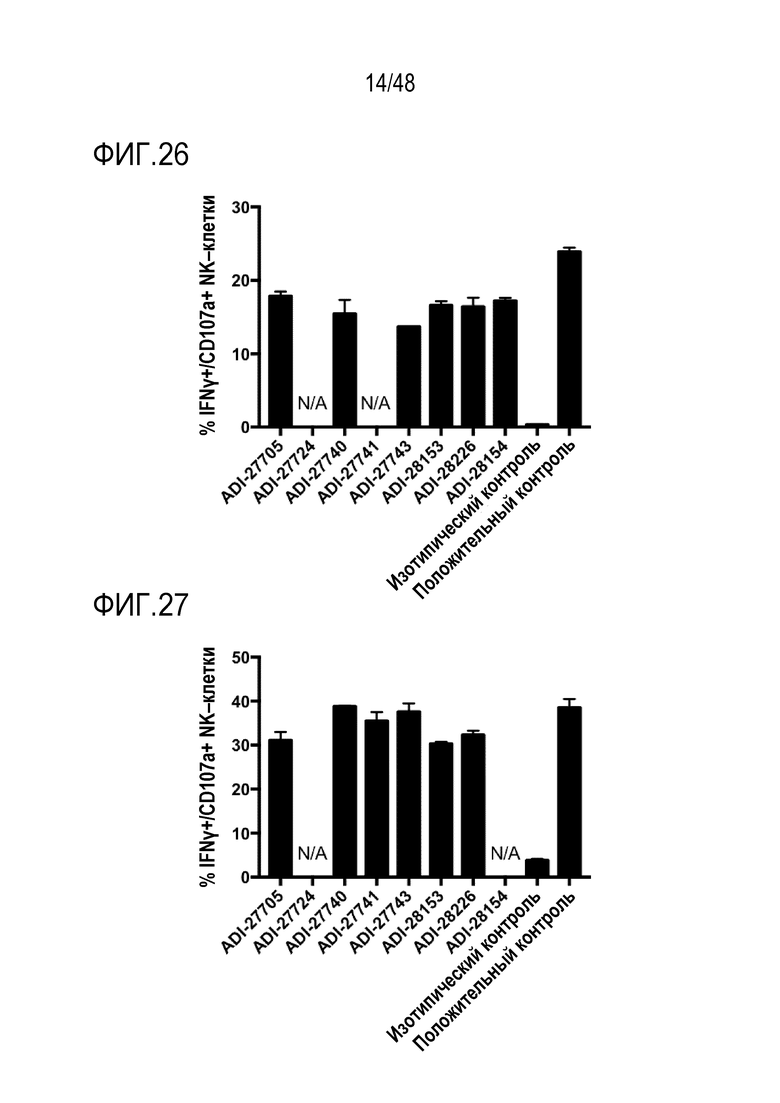
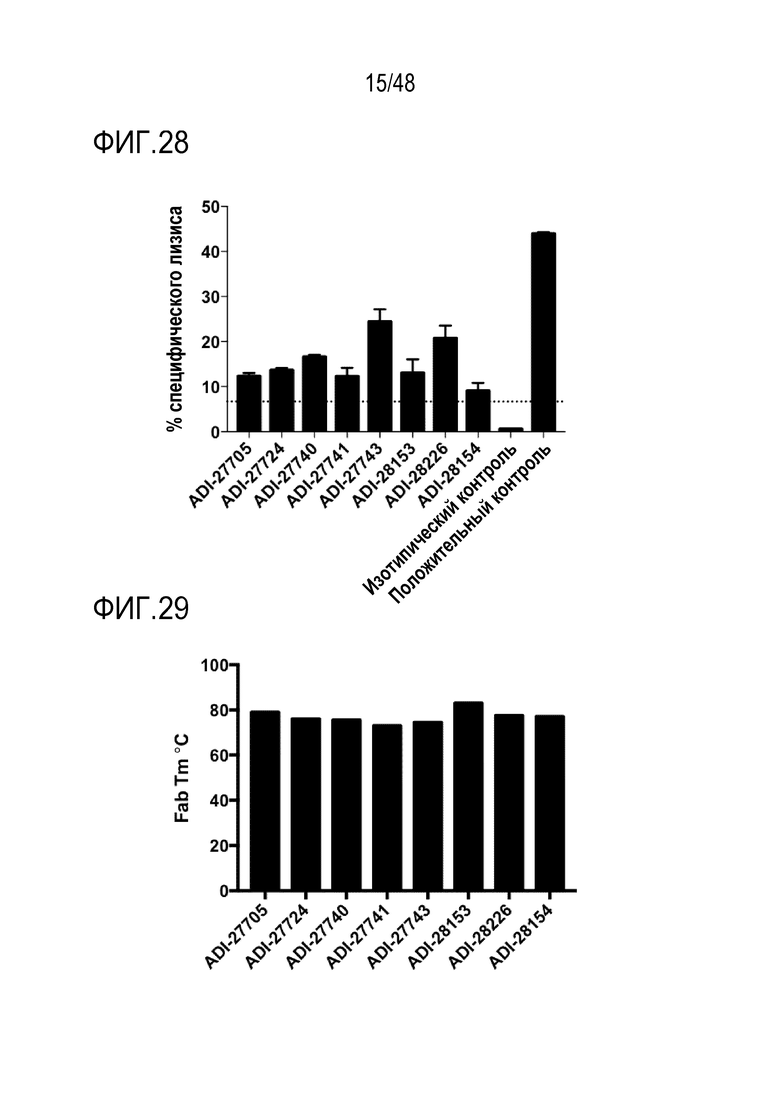
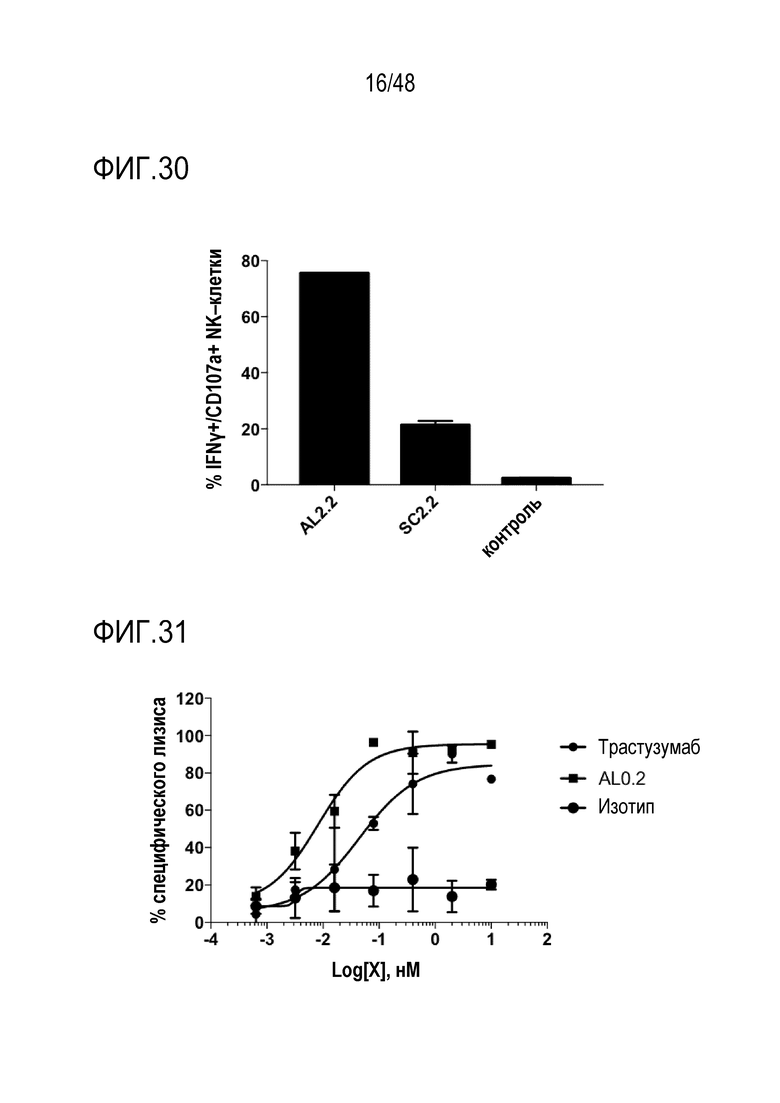
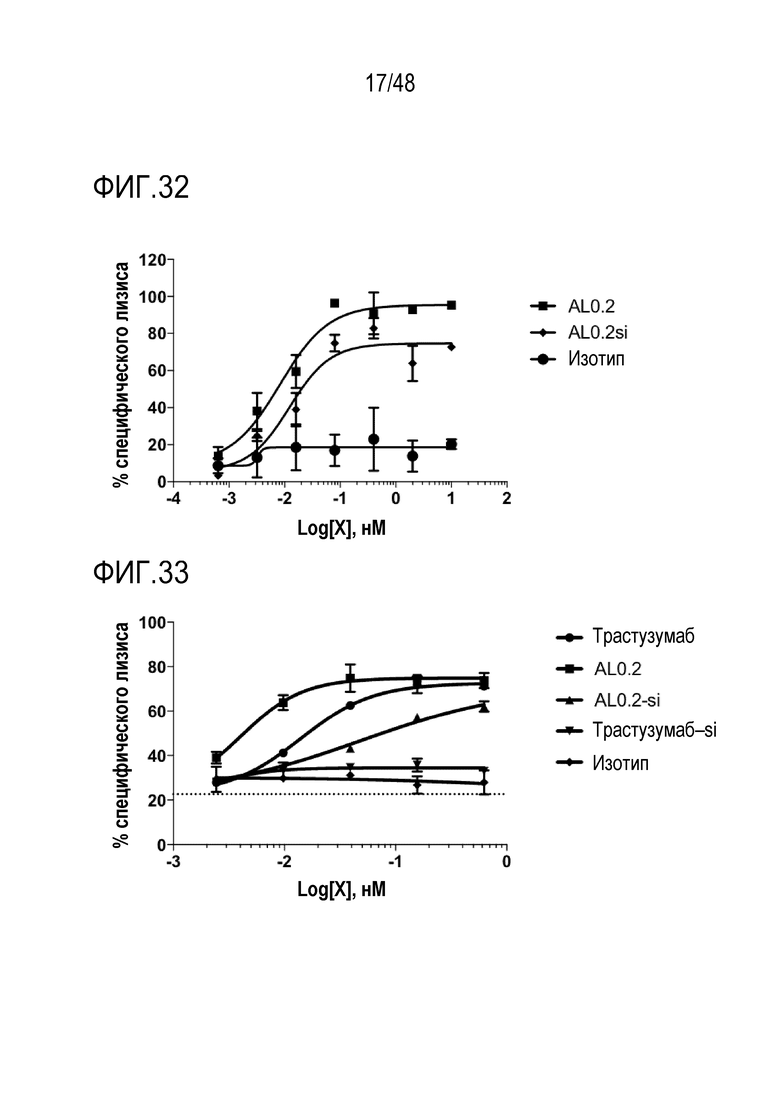
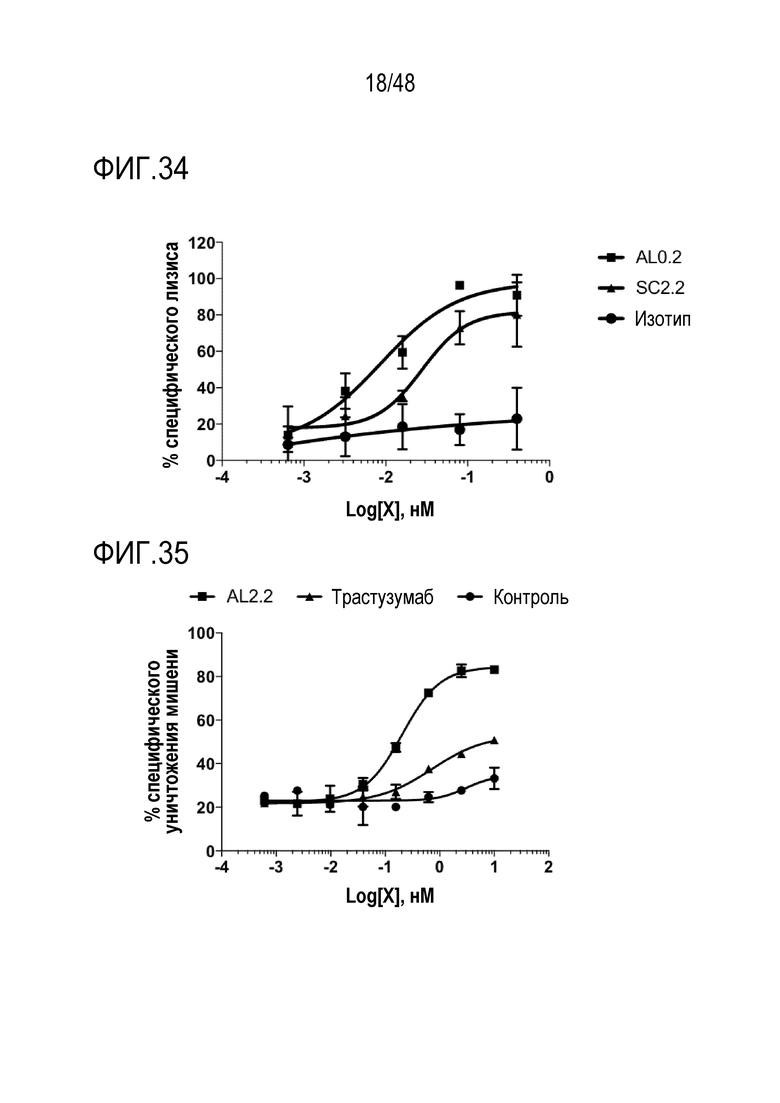
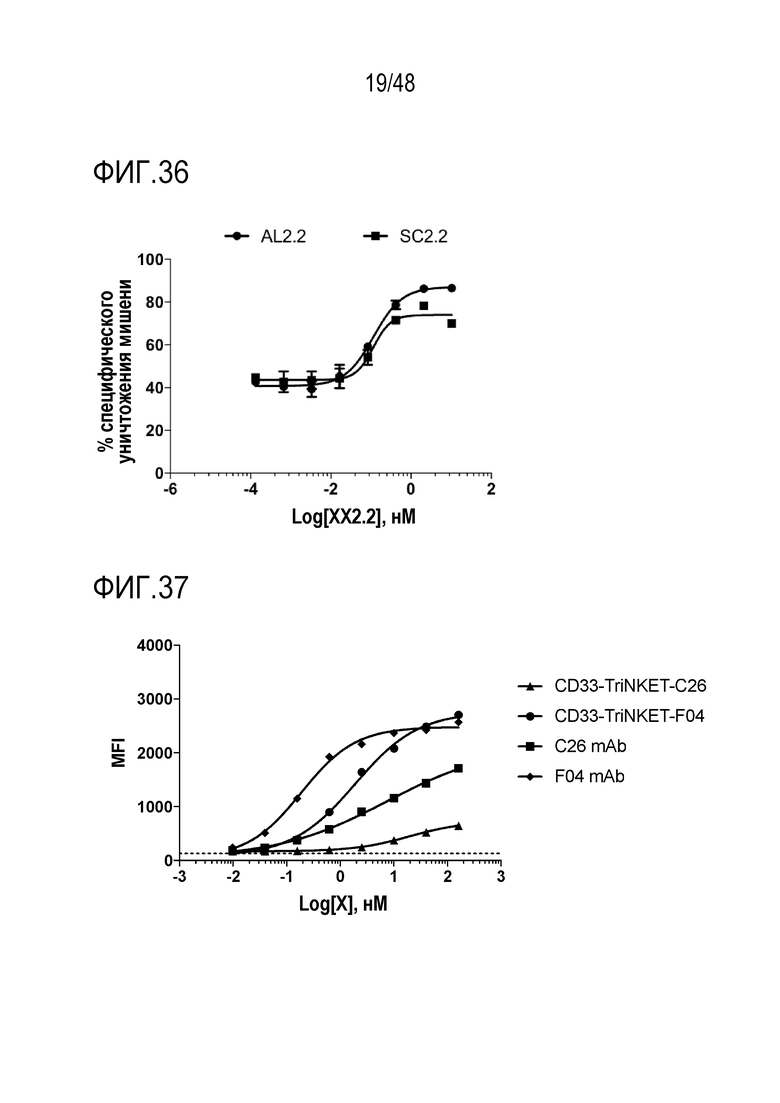
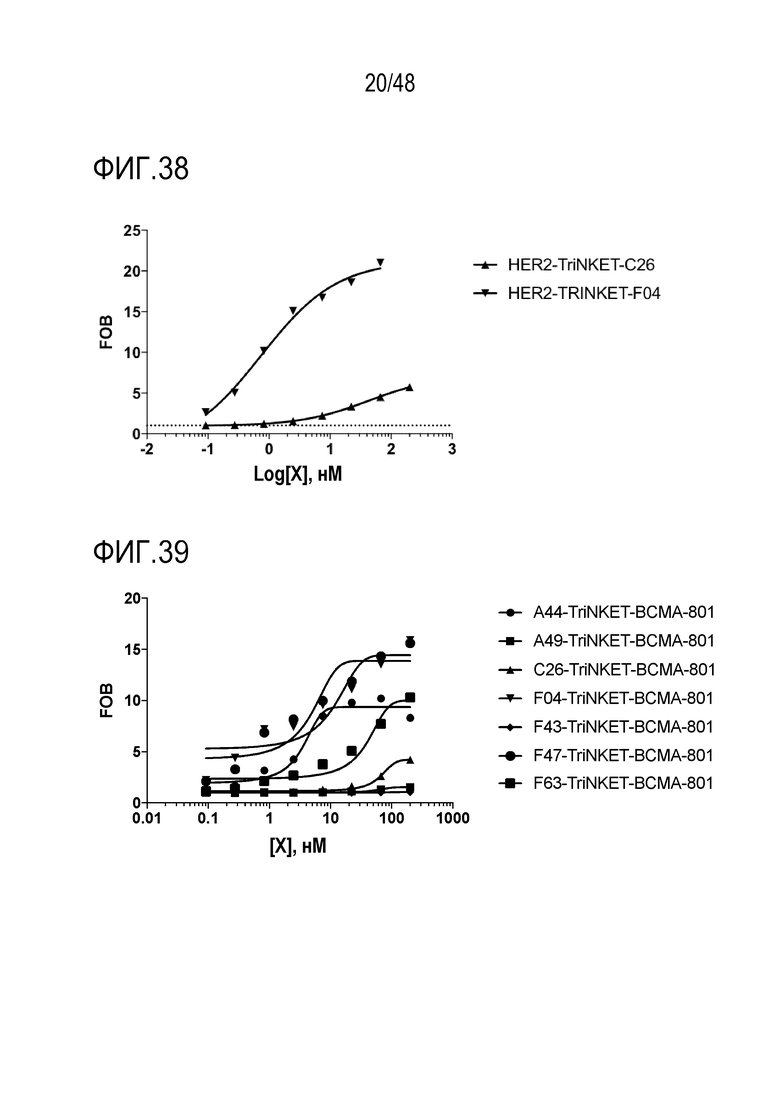
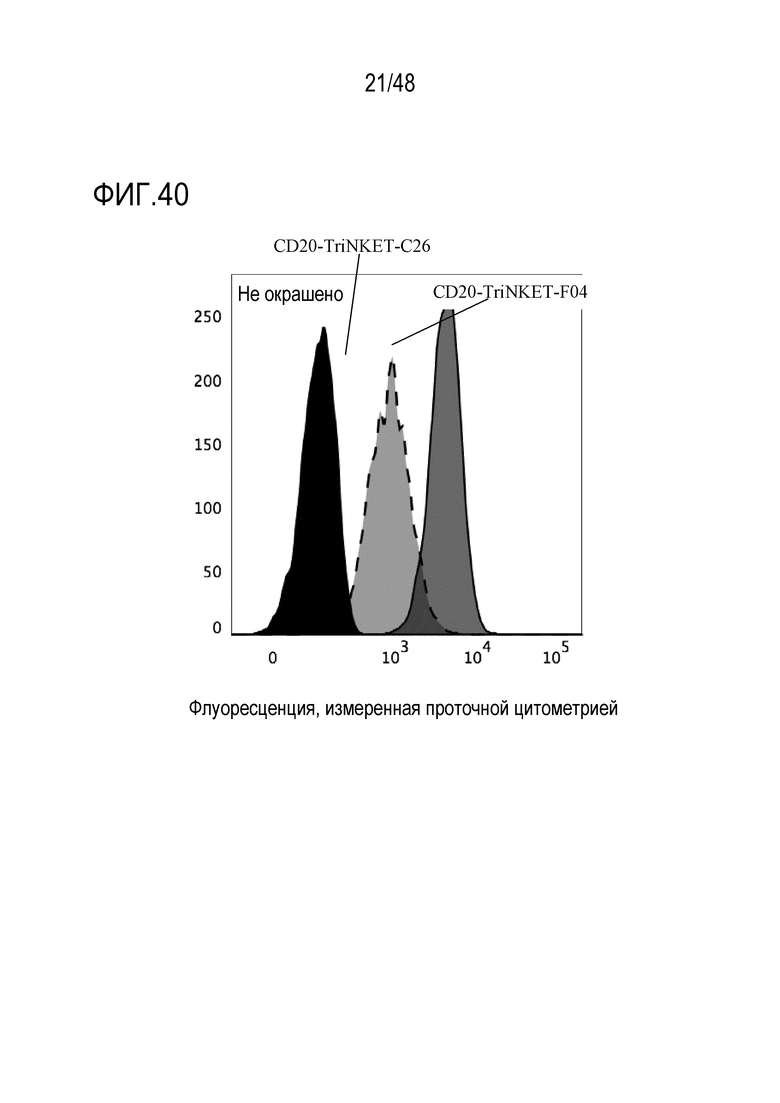
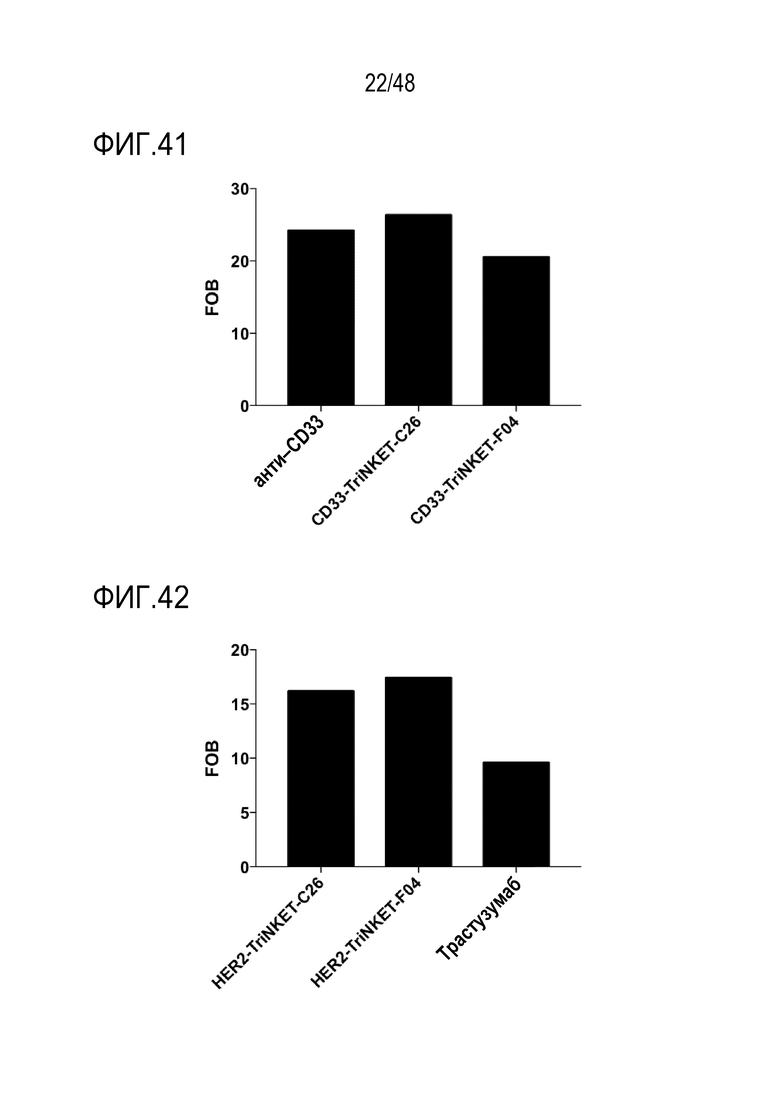
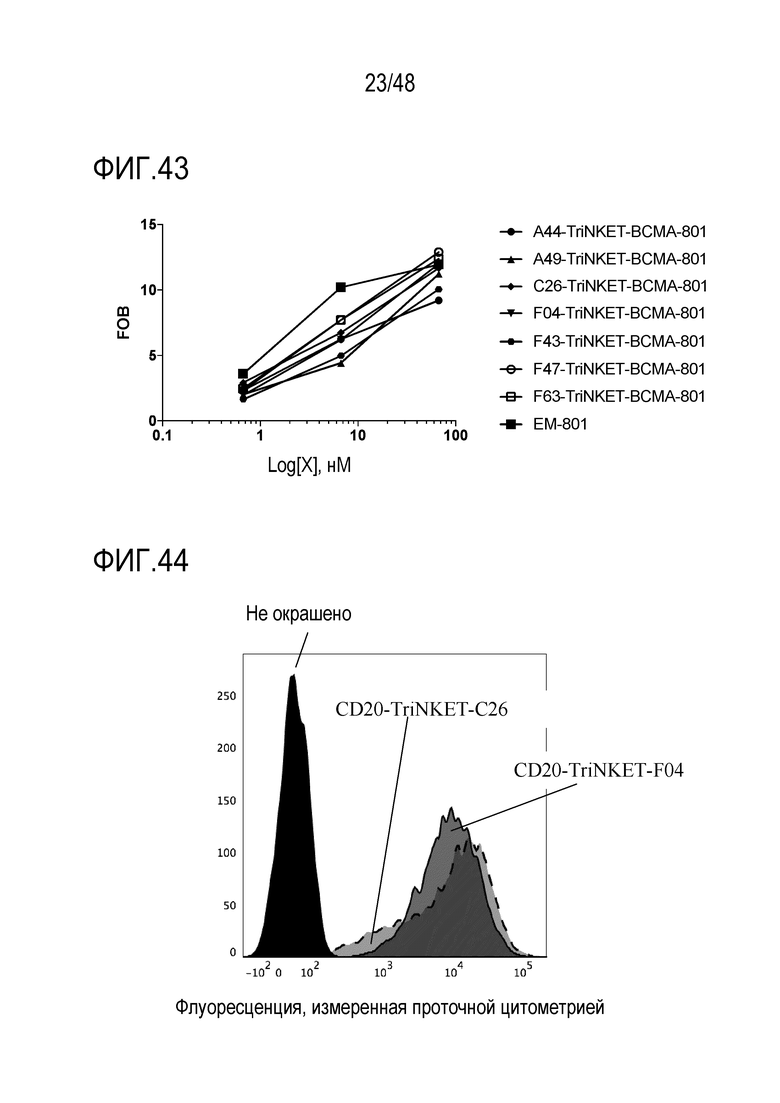
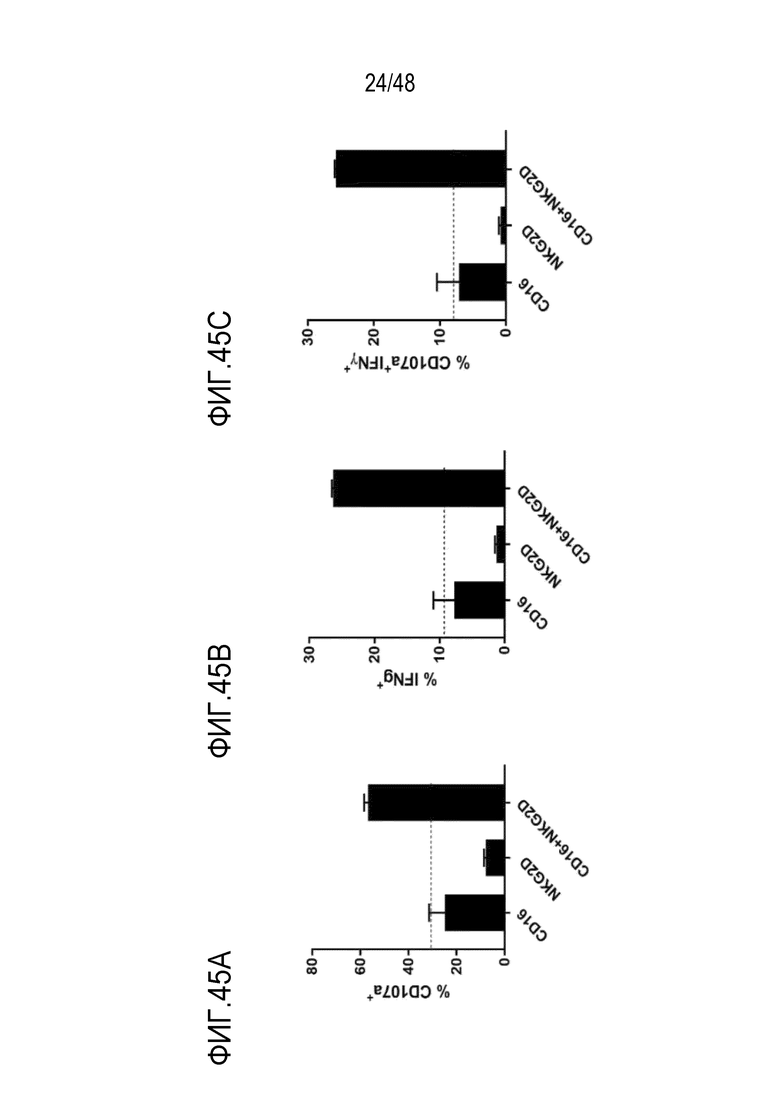
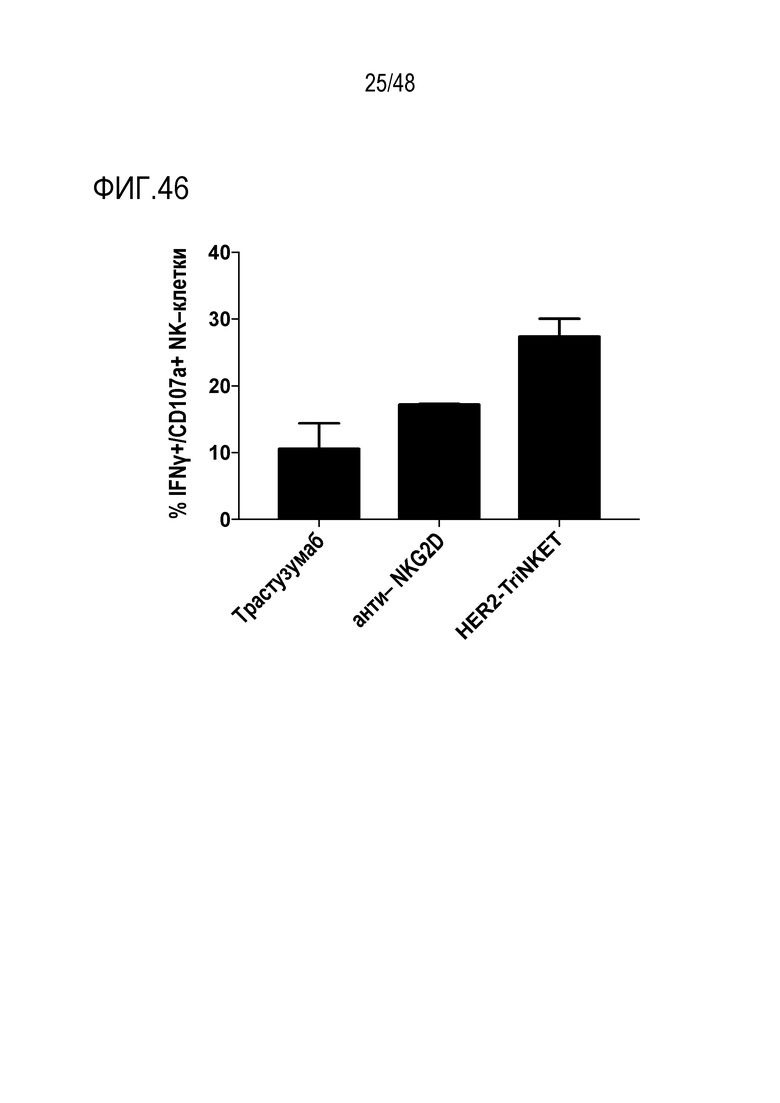
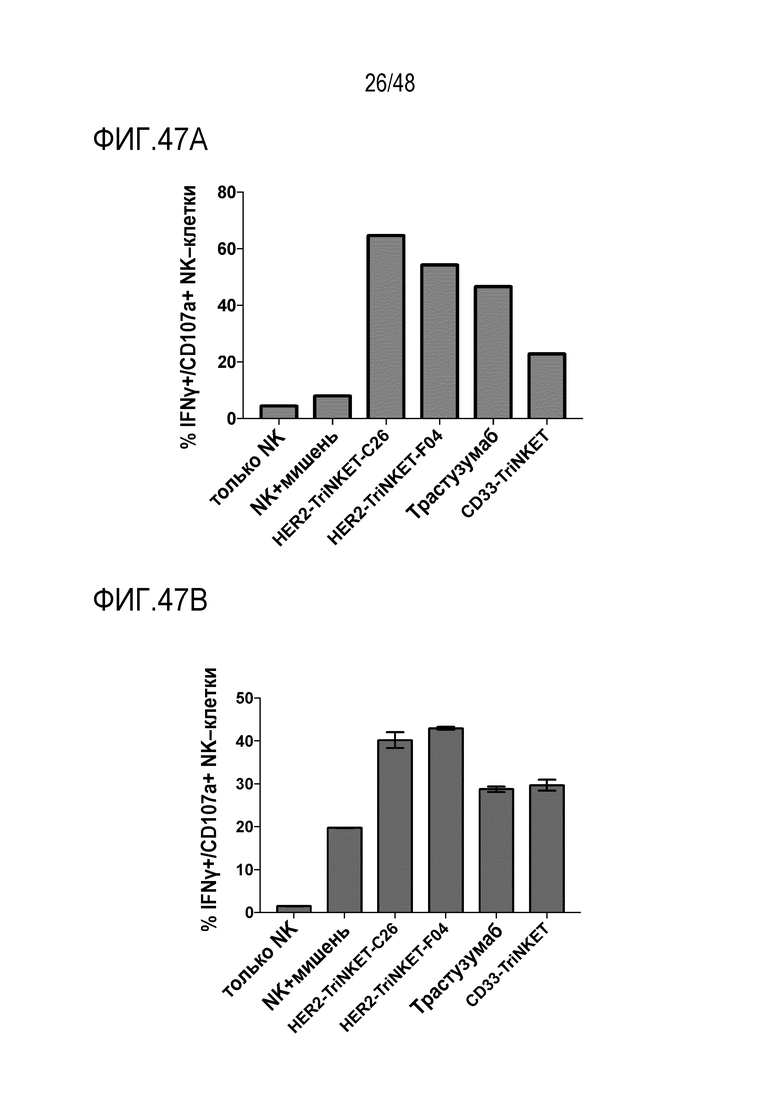
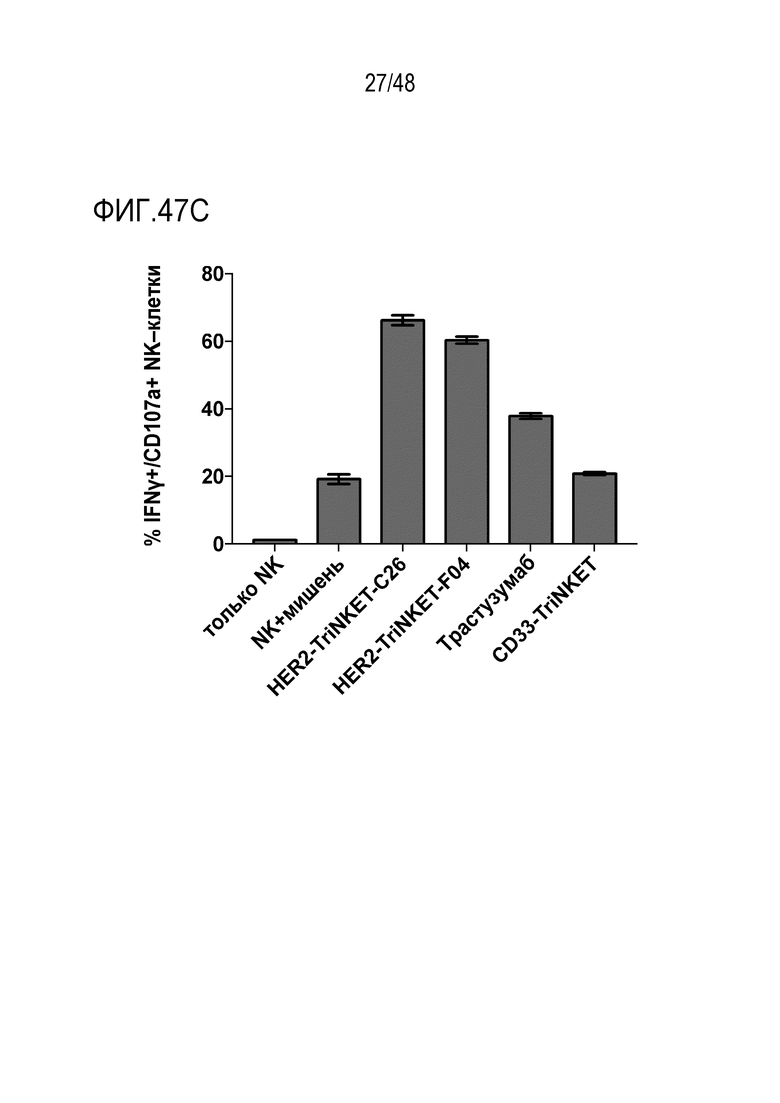
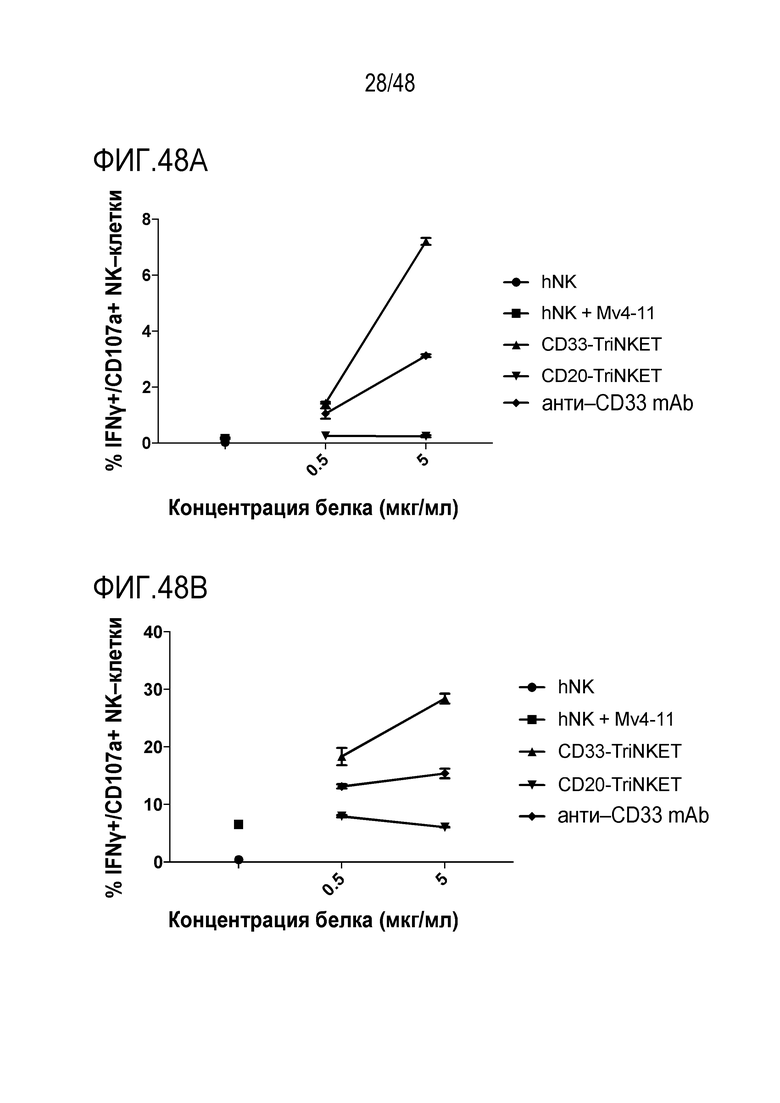
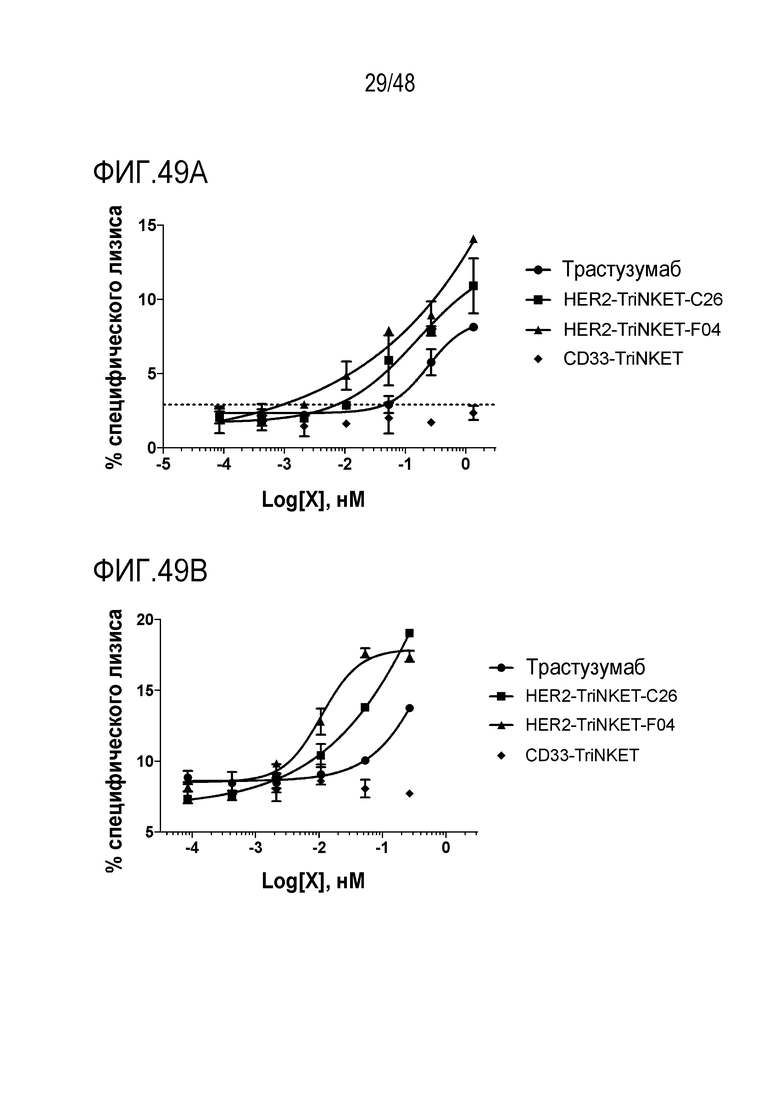
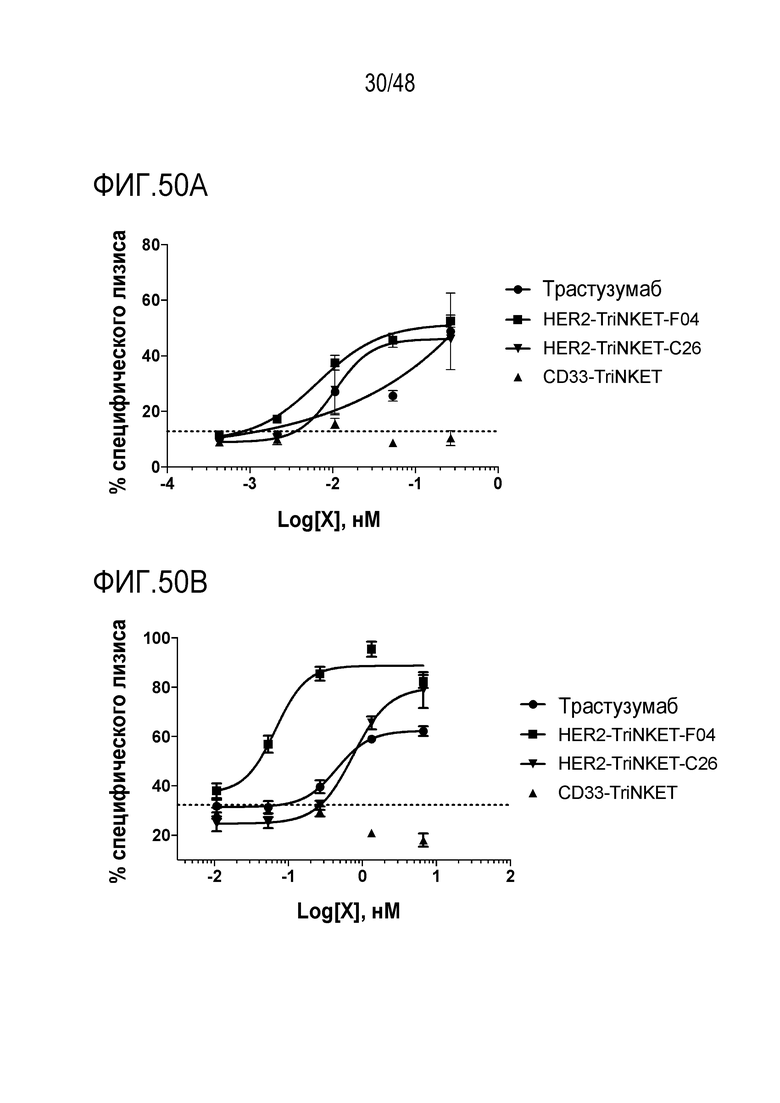
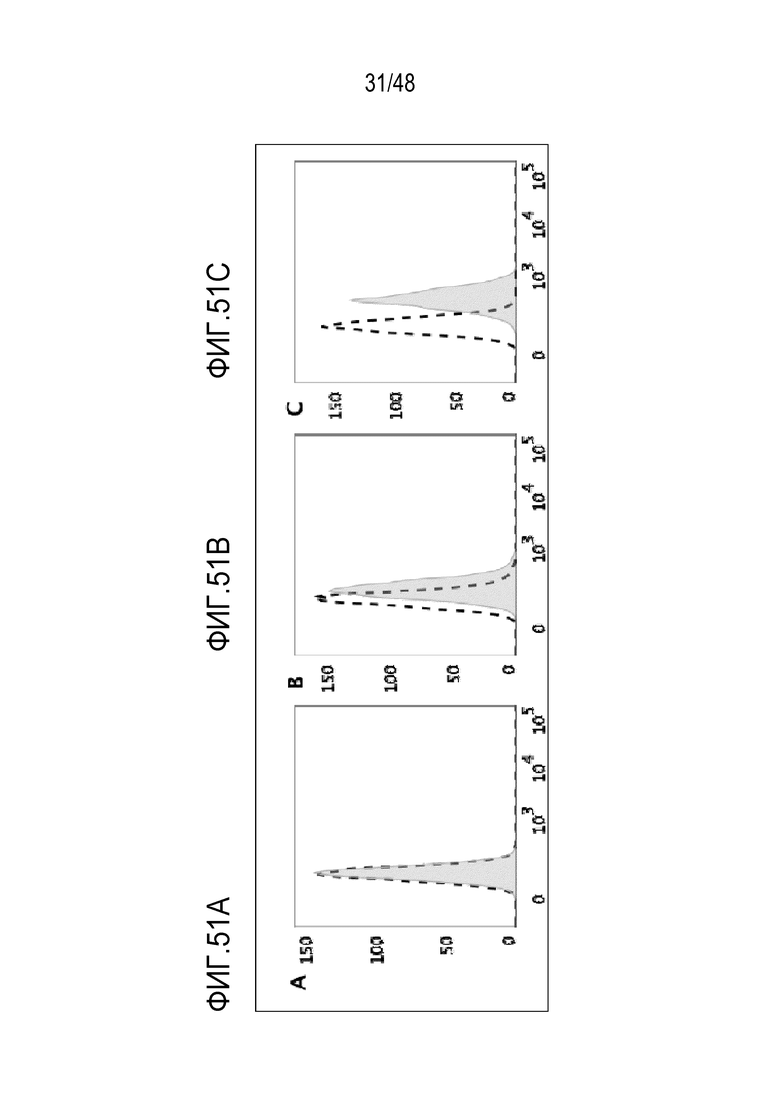
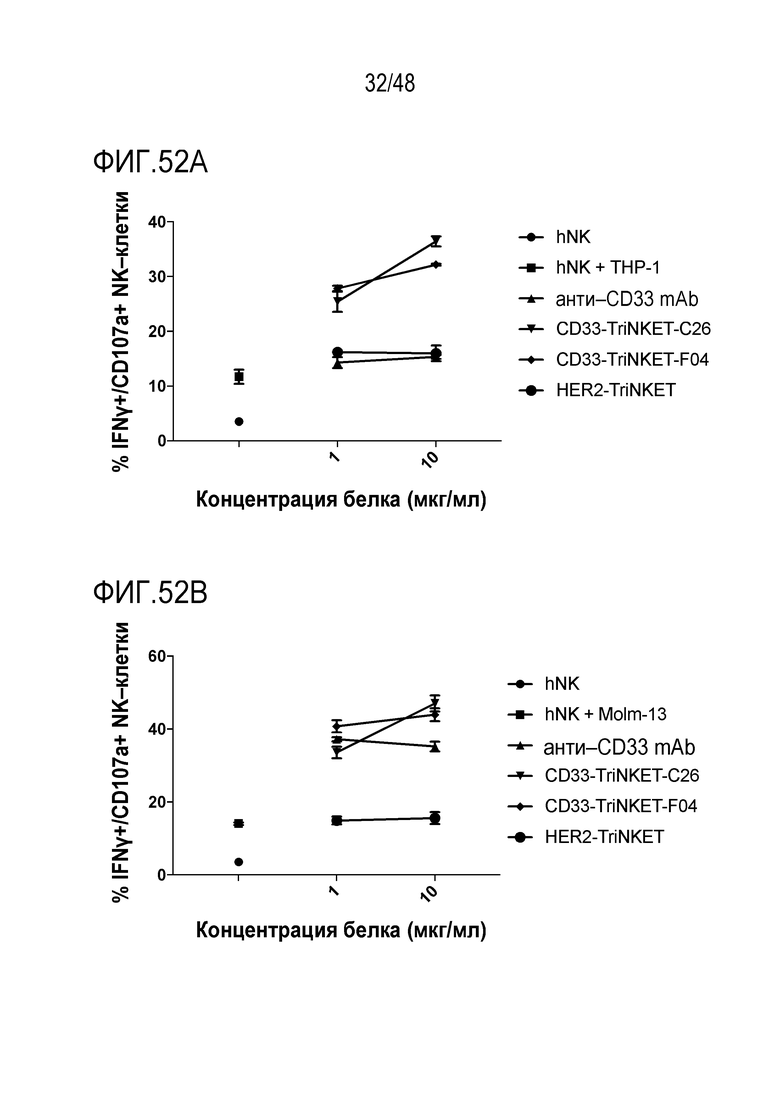
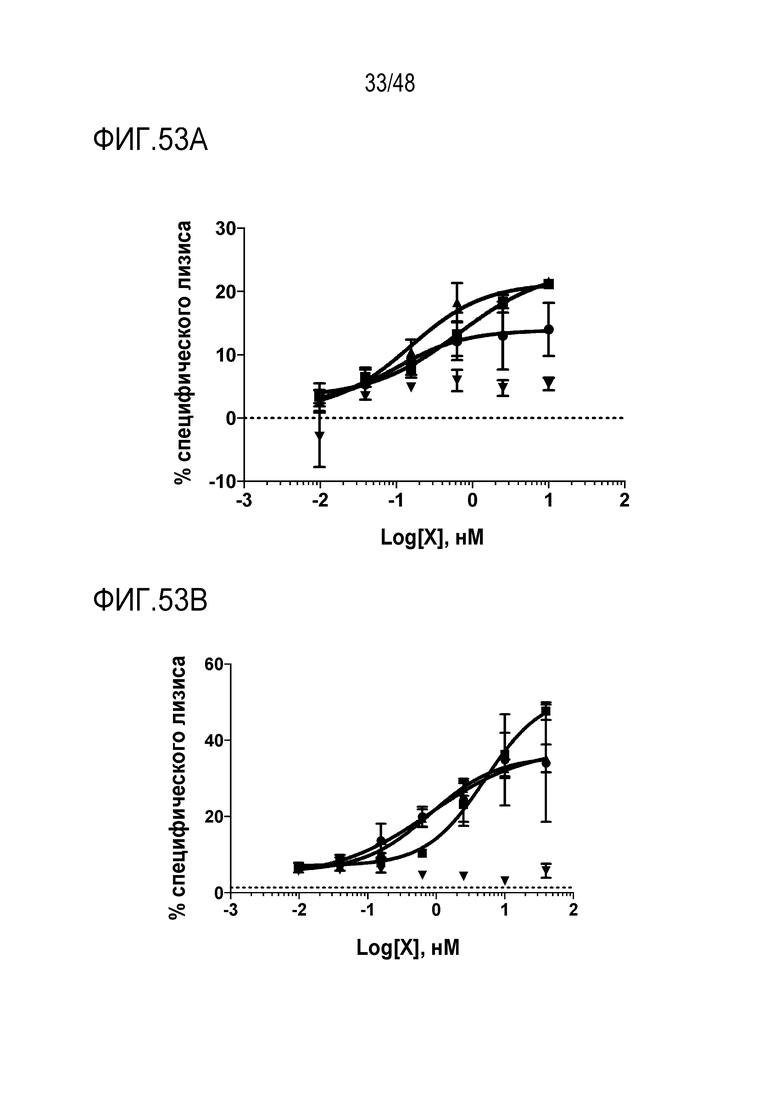
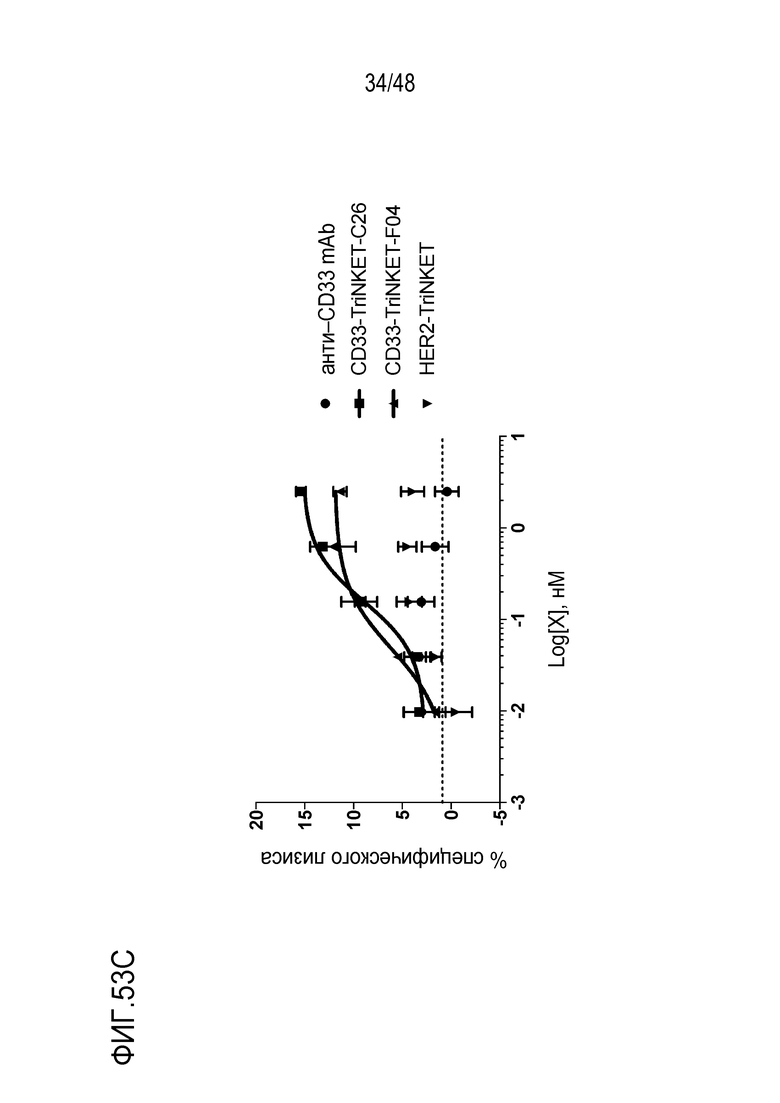
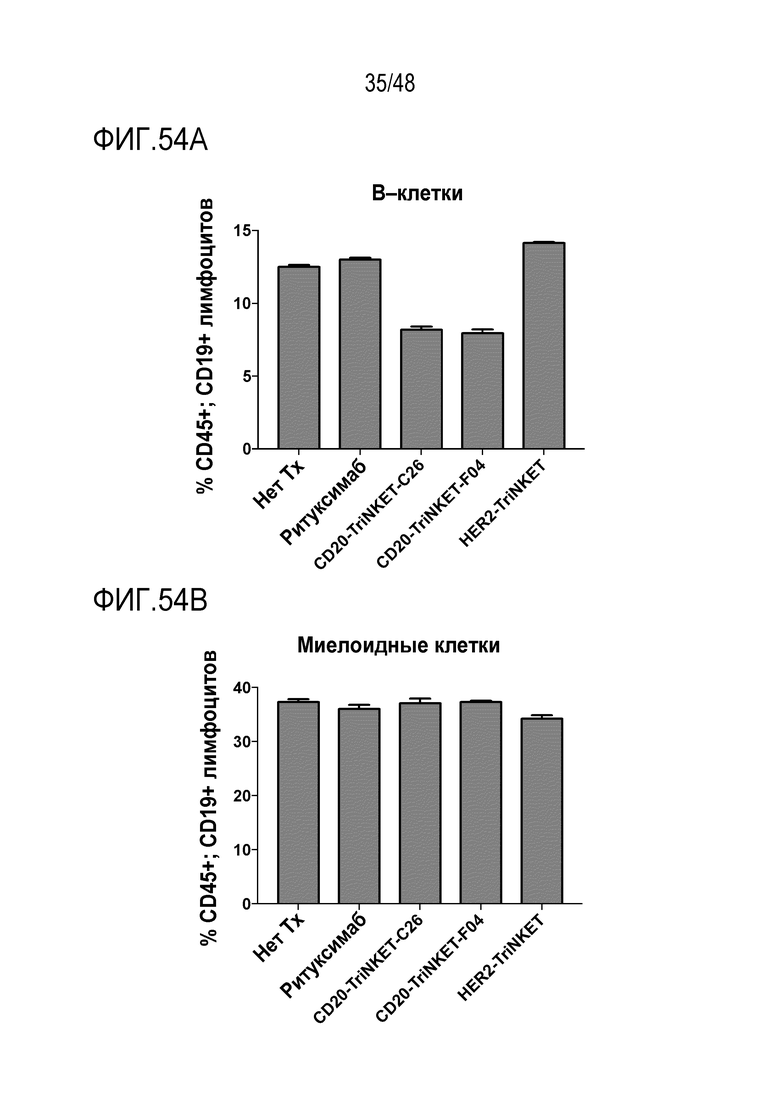
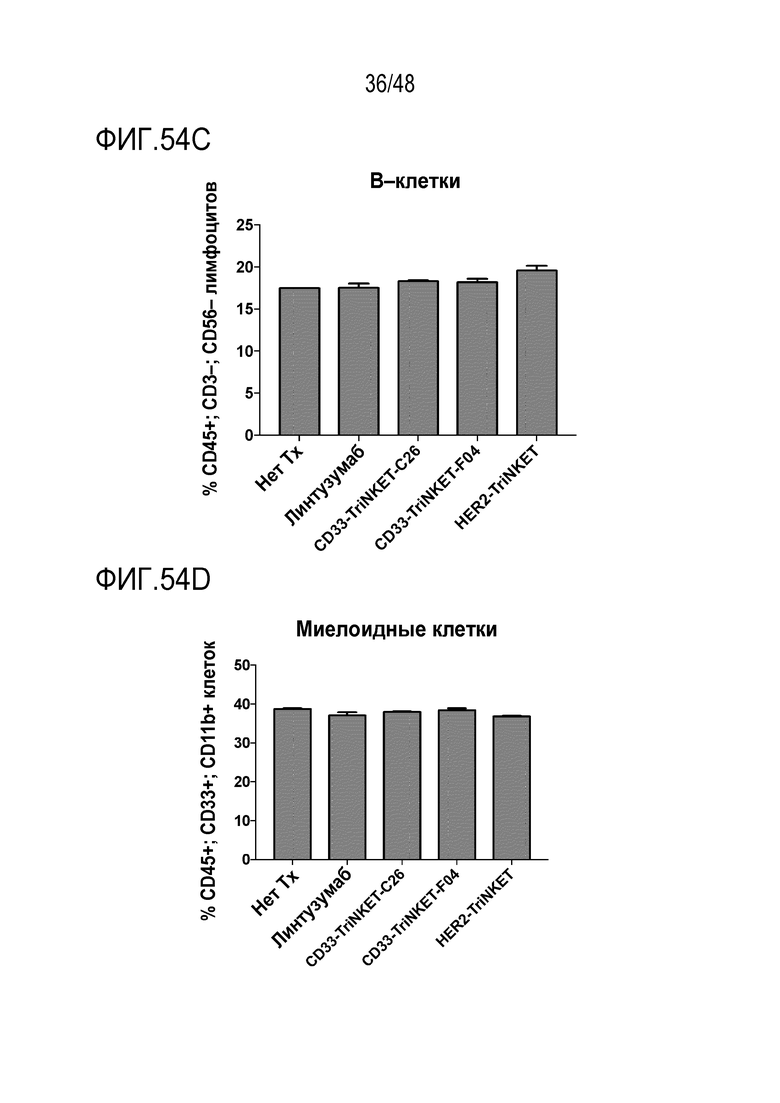
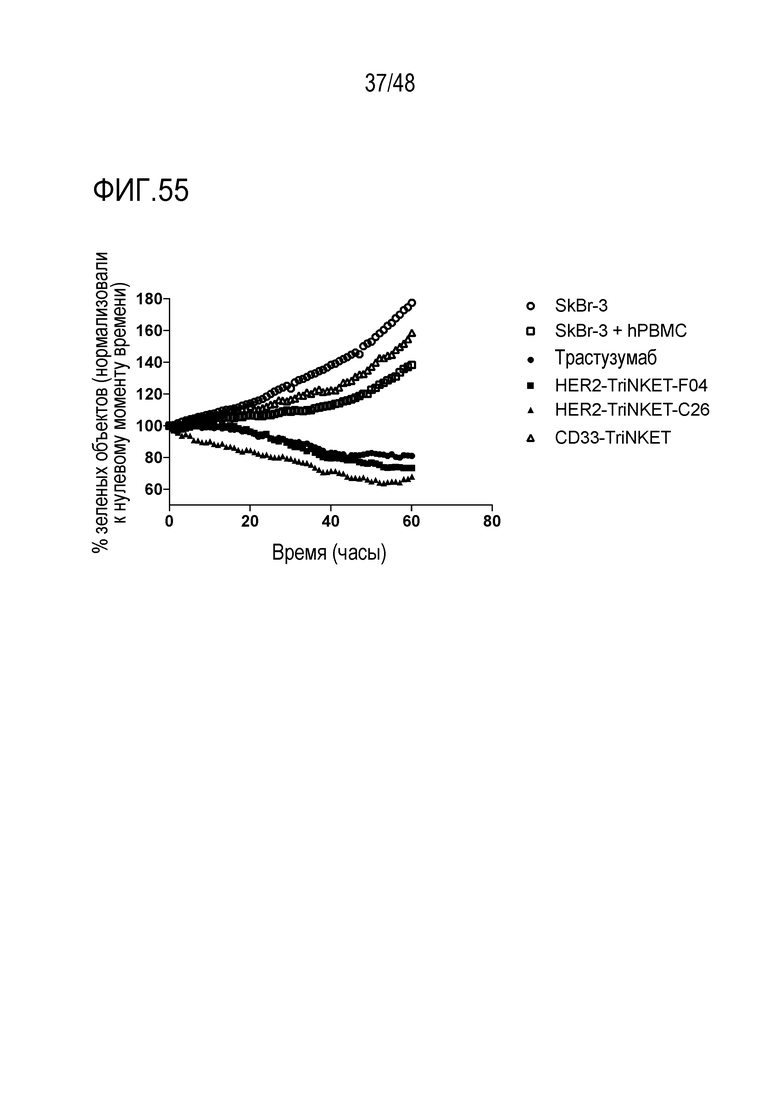
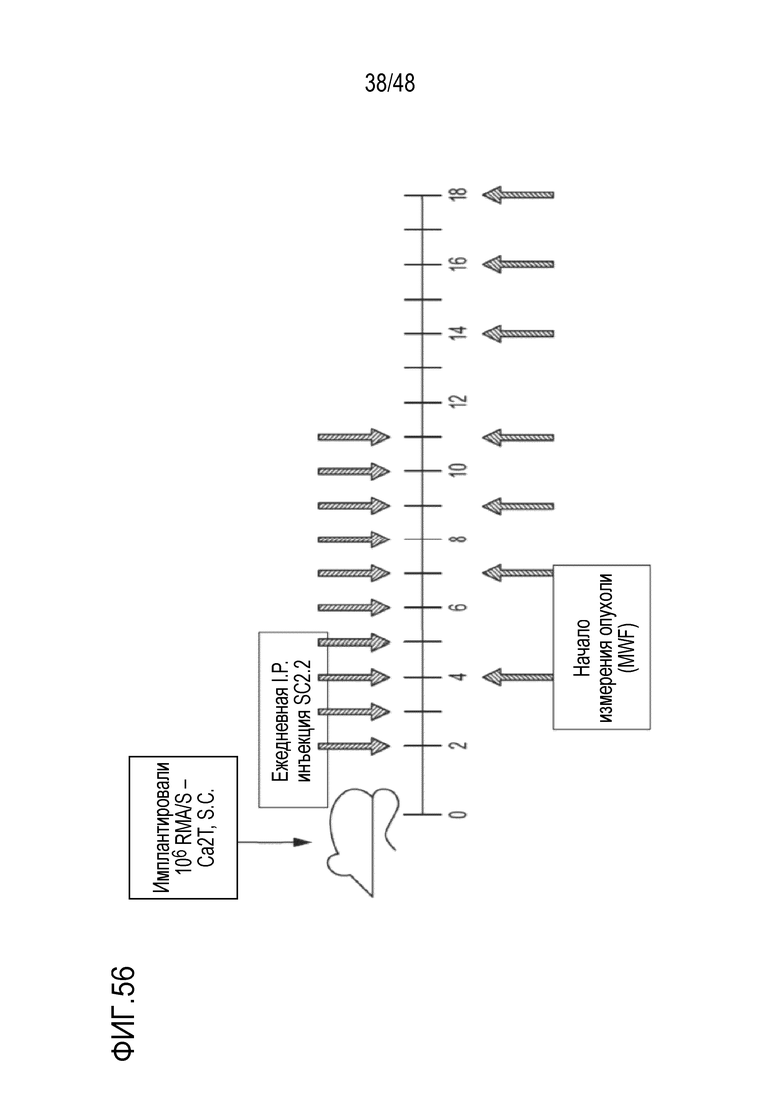
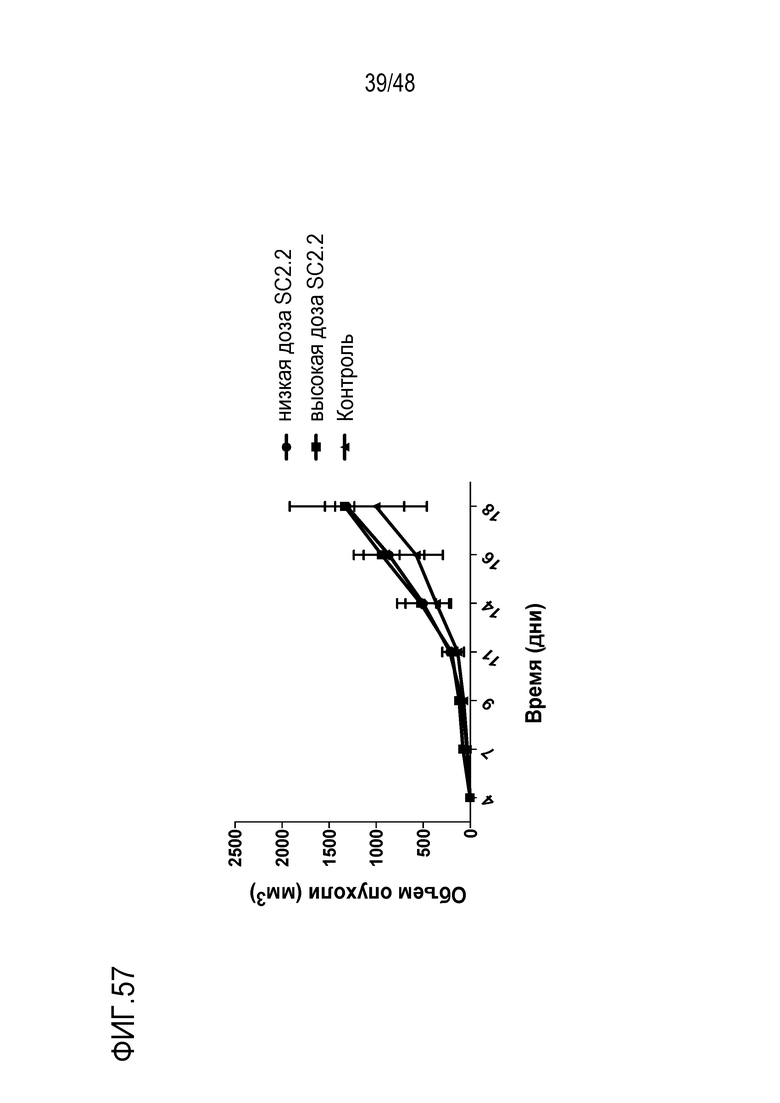
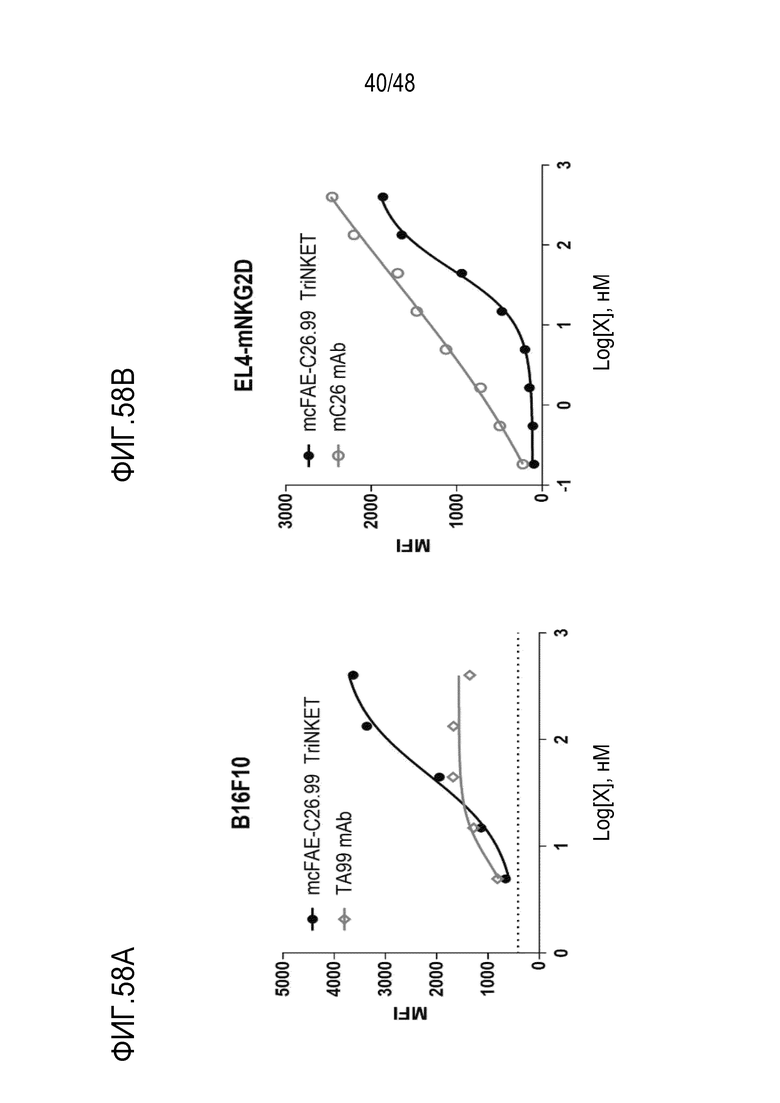
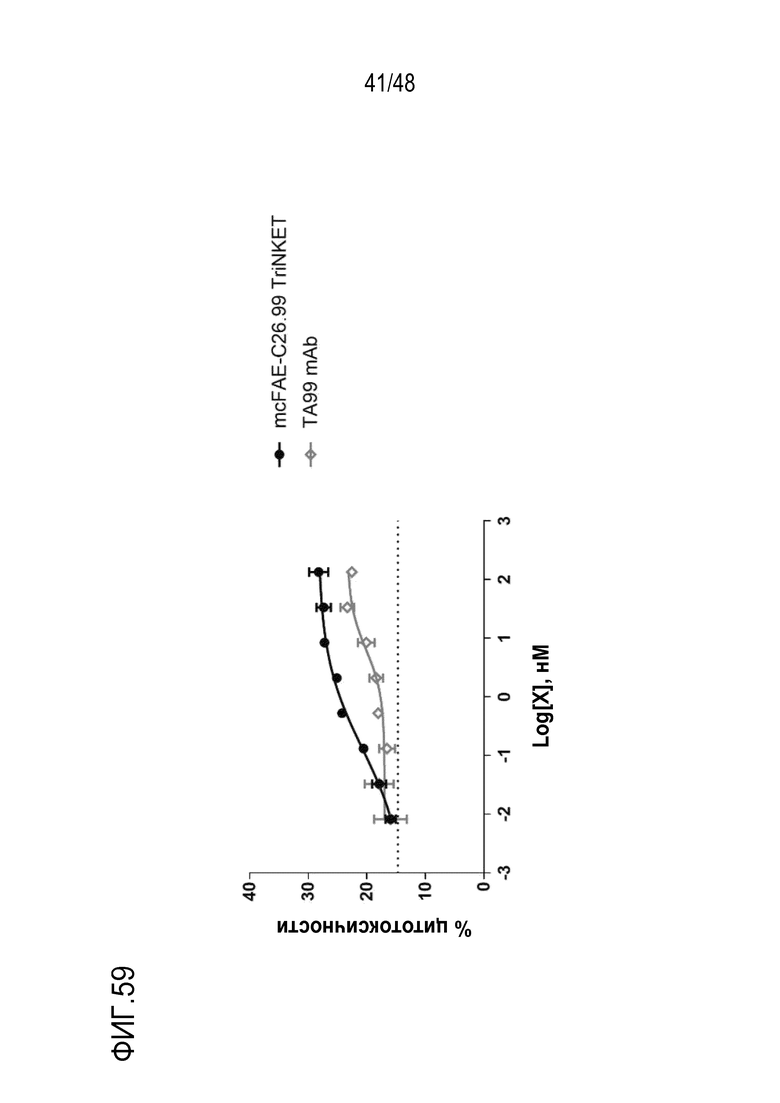
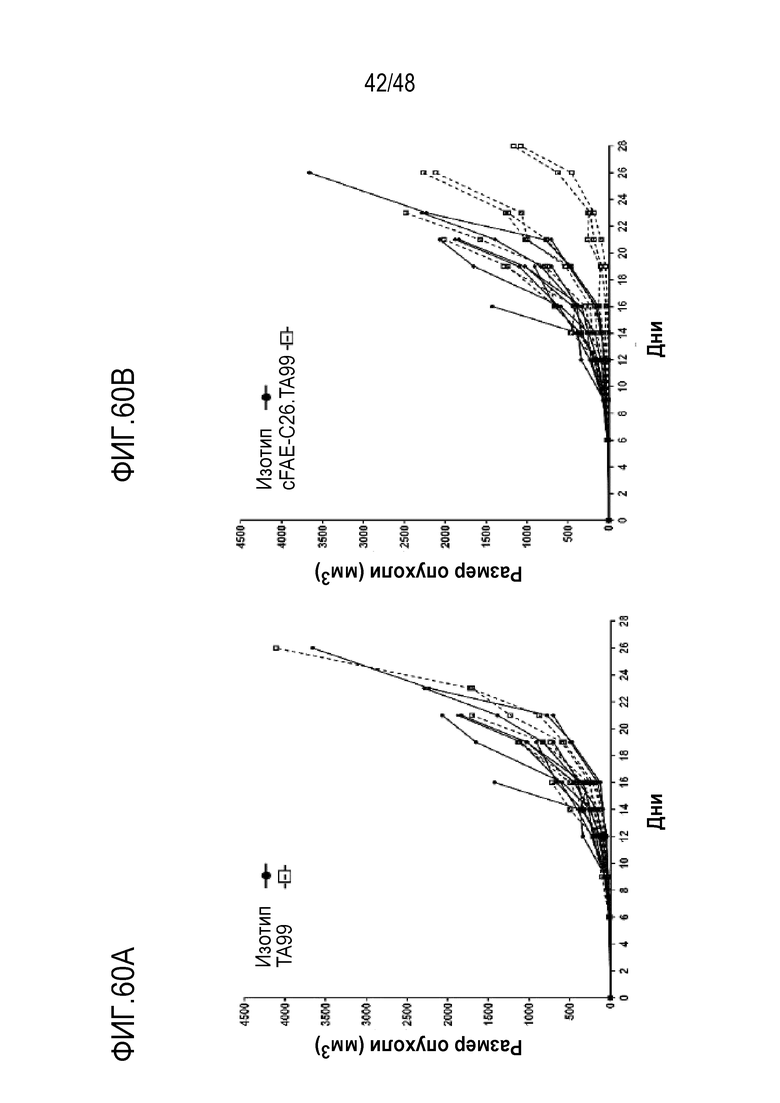
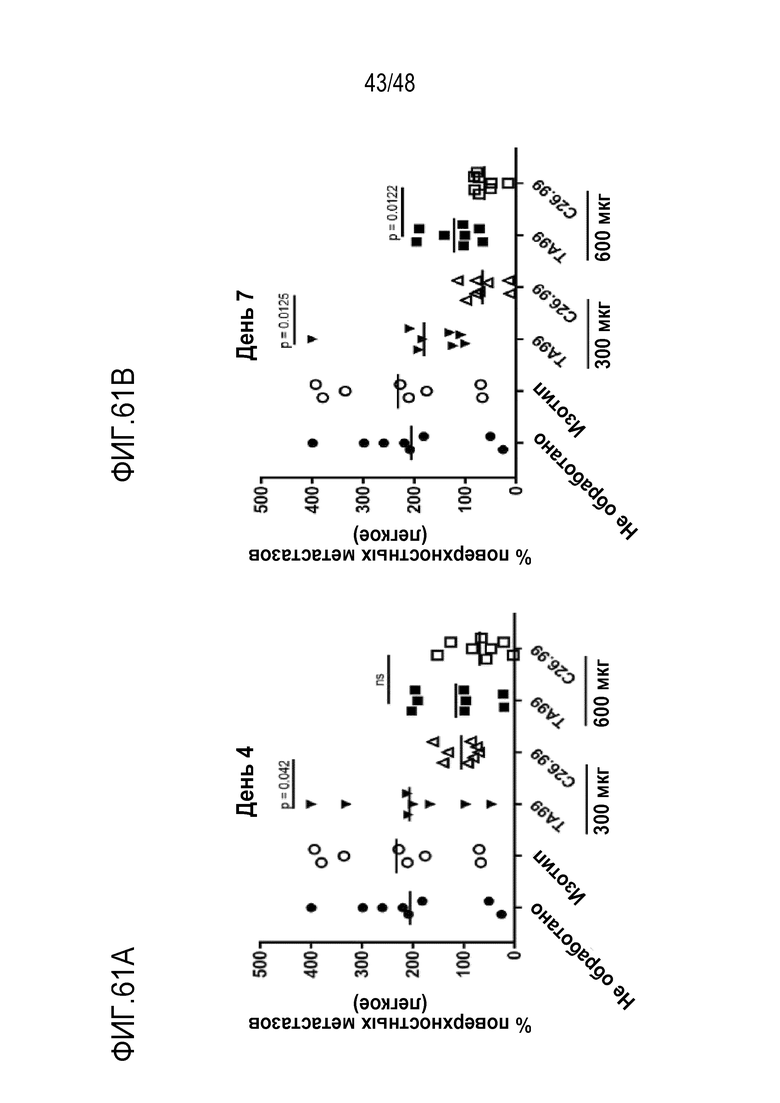
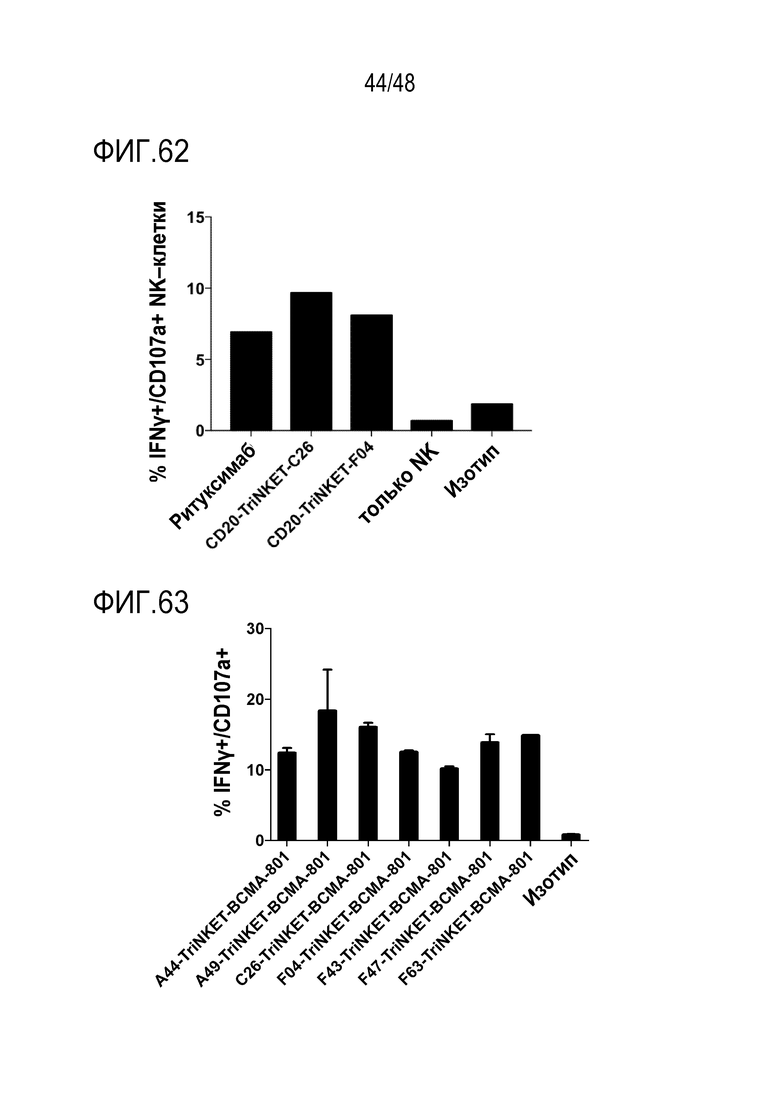
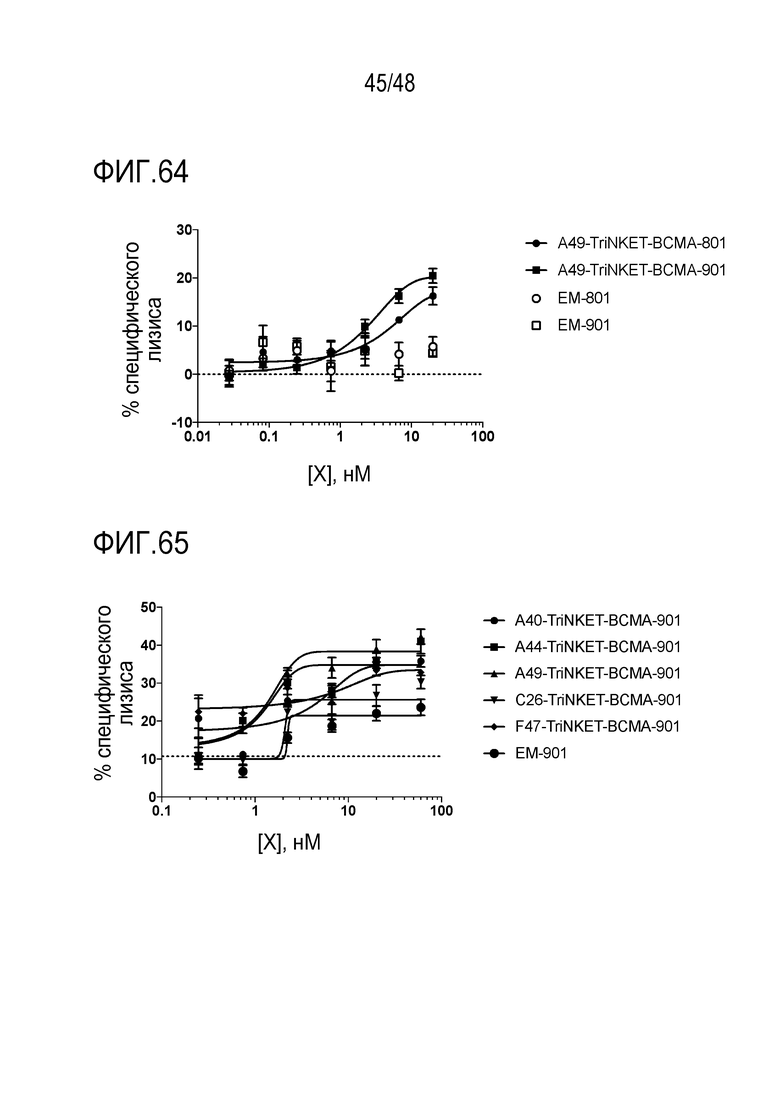
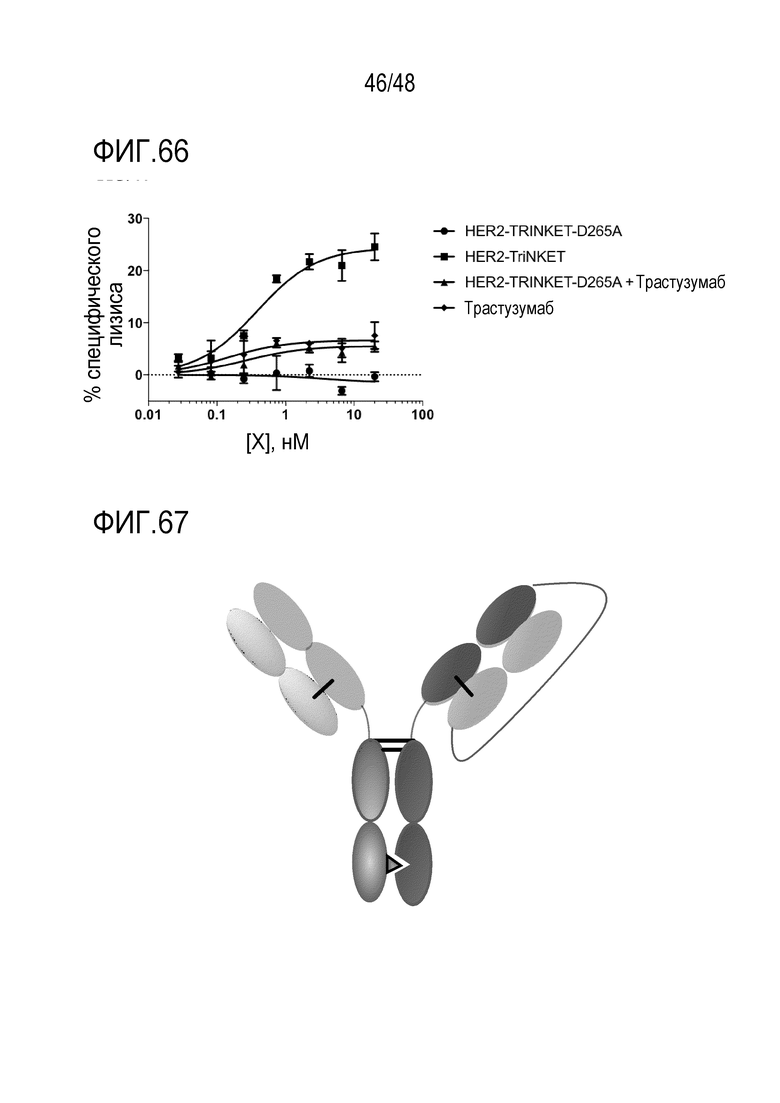

Изобретение относится к области биохимии, в частности к полиспецифическому связывающему белку, который связывается с NKG2D, CD16 и опухолеспецифическим антигеном. Также раскрыта фармацевтическая композиция, содержащая указанный белок. Раскрыты способ усиления гибели опухолевых клеток; способ лечения злокачественного новообразования. Изобретение позволяет эффективно лечить злокачественные новообразования. 4 н. и 12 з.п. ф-лы, 9 табл., 70 ил., 17 пр.
1. Полиспецифический связывающий белок, который связывается с NKG2D, CD16 и опухолеспецифическим антигеном, содержащий:
(а) первый антигенсвязывающий сайт, содержащий вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела против NKG2D;
(b) второй антигенсвязывающий сайт, содержащий VH и VL антитела, который связывается с указанным опухолеспецифическим антигеном; и
(c) первый Fc–домен антитела и второй Fc–домен антитела, которые вместе связывают CD16,
где VH или VL первого антигенсвязывающего сайта слиты с N-концом первого Fc–домена антитела, а VH или VL второго антигенсвязывающего сайта слиты с N-концом второго Fc–домена антитела.
2. Полиспецифический связывающий белок по п.1, где первый антигенсвязывающий сайт связывается с NKG2D у человека, приматов, отличных от человека, и грызунов.
3. Полиспецифический связывающий белок по п.1 или 2, где VH и VL первого антигенсвязывающего сайта присутствуют в одном и том же полипептиде.
4. Полиспецифический связывающий белок по любому из пп.1-3, где VL первого антигенсвязывающего сайта имеет аминокислотную последовательность, идентичную аминокислотной последовательности VL второго антигенсвязывающего сайта.
5. Полиспецифический связывающий белок по любому из пп.1-4, где VH первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 1.
6. Полиспецифический связывающий белок по любому из пп.1–4, где VH первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 41, и VL первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 42.
7. Полиспецифический связывающий белок по любому из пп.1–4, где VH первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 43, и VL первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 44.
8. Полиспецифический связывающий белок по любому из пп.1–4, где VH первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 69, и VL первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 70.
9. Полиспецифический связывающий белок по любому из пп.1–4, где VH первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 71, и VL первого антигенсвязывающего сайта содержит аминокислотную последовательность SEQ ID NO: 72.
10. Полиспецифический связывающий белок по любому из пп.1-9, где опухолеспецифический антиген представляет собой HER2 или CD20.
11. Полиспецифический связывающий белок по любому из пп.1-10, где и первый, и второй Fc–домены антитела содержат шарнирный и CH2–домены.
12. Полиспецифический связывающий белок по любому из пп.1–10, где белок содержит аминокислотную последовательность, по меньшей мере, на 90% идентичную аминокислотам 234–332 антитела IgG1 человека.
13. Фармацевтическая композиция для лечения злокачественного новообразования, содержащая эффективное количество полиспецифического связывающего белка по любому из пп.1-12 и фармацевтически приемлемый носитель, где опухолеспецифический антиген экспрессируется на злокачественной клетке или в опухолевом микроокружении злокачественного новообразования.
14. Способ усиления гибели опухолевых клеток, причем способ включает воздействие на опухолевую клетку и на клетку–натурального киллера полиспецифического связывающего белка по любому из пп.1–12, где опухолеспецифический антиген экспрессируется на опухолевой клетке.
15. Способ лечения злокачественного новообразования, где указанный способ включает введение пациенту полиспецифического связывающего белка по любому из пп.1–12 или фармацевтической композиции по п.13, где опухолеспецифический антиген экспрессируется на злокачественной клетке или в опухолевом микроокружении злокачественного новообразования.
16. Способ по п.15, где злокачественное новообразование выбирают из группы, состоящей из острого миелоидного лейкоза, острого миеломоноцитарного лейкоза, В–клеточной лимфомы, рака мочевого пузыря, рака молочной железы, колоректального рака, диффузной крупноклеточной В–клеточной лимфомы, рака пищевода, саркомы Юинга, фолликулярной лимфомы, рака желудка, рака желудочно–кишечного тракта, желудочно–кишечных стромальных опухолей, глиобластомы, рака головы и шеи, меланомы, мезотелиомы, множественной миеломы, миелодиспластического синдрома, почечно–клеточного рака, нейробластомы, немелкоклеточного рака легкого, нейроэндокринных опухолей, рака яичников и рака поджелудочной железы, рака предстательной железы, саркомы, мелкоклеточного рака легких, Т–клеточной лимфомы, рака яичка, карциномы тимуса, рака щитовидной железы, уротелиального рака, злокачественных новообразований, инфильтрованных клетками–супрессорами миелоидного происхождения, злокачественных новообразований с накоплением внеклеточного матрикса, злокачественных новообразований с высоким уровнем реактивной стромы и злокачественных новообразований с неоангиогенезом.
| SMITS and et al | |||
| Designing multivalent proteins based on natural killer cell receptors and their ligands as immunotherapy for cancer, 2016, Expert Opin Biol Ther, n.16(9), pp | |||
| СПОСОБ ПОСЛЕДОВАТЕЛЬНОГО СОЕДИНЕНИЯ ДВУХ ИЛИ НЕСКОЛЬКИХ ЭЛЕКТРОДВИГАТЕЛЕЙ ПОСТОЯННОГО ТОКА, СНАБЖЕННЫХ КОНТАКТНЫМИ КОЛЬЦАМИ, ДЛЯ ПОЛУЧЕНИЯ СИНХРОННОГО ИХ ВРАЩЕНИЯ | 1919 |
|
SU1105A1 |
| WO 2010080124 A2, 15.07.2010 | |||
| WO 2010017103 A2, 11.02.2010 | |||
| ПЕПТИД ИЛИ ПЕПТИДНЫЙ КОМПЛЕКС, СВЯЗЫВАЮЩИЙСЯ С альфа2-ИНТЕГРИНОМ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ УКАЗАННОГО ВЕЩЕСТВА | 2011 |
|
RU2588668C2 |
Авторы
Даты
2023-12-07—Публикация
2018-02-08—Подача