Область техники
[0001] Настоящее изобретение относится к способу анализа матричной нуклеиновой кислоты, способу анализа вещества-мишени, набору для анализа матричной нуклеиновой кислоты или вещества-мишени и анализатору для матричной нуклеиновой кислоты или вещества-мишени.
Уровень техники
[0002] В анализе генов широко используют способ анализа с использованием амплификации матричной нуклеиновой кислоты с использованием праймера и обнаружения амплифицированного продукта или обнаружения гибридизации между полученным амплифицированным продуктом и зондом. При анализе используют зонд, который обнаруживает реакцию амплификации матричной нуклеиновой кислоты, вещество, которое интеркалирует в амплифицированный продукт, зонд, который генерирует или гасит флуоресценцию посредством гибридизации с амплифицированным продуктом, и т. п. Этот способ позволяет осуществлять, например, анализ присутствия или отсутствия последовательности-мишени (качественный анализ), анализ количества последовательности-мишени (количественный анализ), типирование сайта полиморфизма в последовательности-мишени и т. п. Типирование позволяет определять, например, тип основания (например, дикий тип или мутантный тип) в сайте полиморфизма, генотип (гомозиготный или гетерозиготный) и т. п.
[0003] Однако в анализе генов с использованием амплификации матричной нуклеиновой кислоты, иногда возникает амплификация и отклонение амплификации последовательности нуклеиновой кислоты, отличной от матричной нуклеиновой кислоты, что вызывает проблемы со специфичностью, количественностью, чувствительностью и т. п. В области медицины существует необходимость обнаруживать небольшое количество матричной нуклеиновой кислоты в образце. Таким образом, существует потребность в способе анализа генов с более высокой точностью.
Краткое изложение сущности изобретения
Проблема, подлежащая решению с помощью изобретения
[0004] Таким образом, настоящее изобретение предназначено предоставить способ анализа матричной нуклеиновой кислоты, способ анализа вещества-мишени, набор для анализа матричной нуклеиновой кислоты или вещества-мишени и анализатор для матричной нуклеиновой кислоты или вещества-мишени, которые обладают превосходящей точностью.
Средство решения проблемы
[0005] Для того чтобы достигать вышеуказанной цели, настоящее изобретение предусматривает способ анализа матричной нуклеиновой кислоты, включающий стадии: фракционирования образца, содержащего матричную нуклеиновую кислоту, на множество фракций матричной нуклеиновой кислоты; амплификации последовательности-мишени и комплементарной ей последовательности в матричной нуклеиновой кислоте в отношении каждой из множества фракций матричной нуклеиновой кислоты в присутствии реактива для амплификации нуклеиновой кислоты; обнаружения генерации или гашения сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности в отношении каждой из множества фракций матричной нуклеиновой кислоты после стадии амплификации; и различения фракции матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность, где реактив для амплификации нуклеиновой кислоты содержит набор праймеров, которые амплифицируют последовательность-мишень и комплементарную последовательность, и генерирующее сигнал вещество, которое генерирует или гасит сигнал в ответ на амплификацию, и генерирующее сигнал вещество генерирует сигнал в состоянии, в котором оно связано в зависимости от последовательности, и гасит сигнал в состоянии, в котором оно не связано, или гасит сигнал в состоянии, в котором оно связано в зависимости от последовательности, и генерирует сигнал в состоянии, в котором оно не связано, и генерация и гашение сигнала обратимы.
[0006] Настоящее изобретение также относится к способу анализа вещества-мишени, включающему стадии: приведения образца, содержащего по меньшей мере одно вещество-мишень, в контакт с по меньшей мере одним флуорогенным зондом для каждого вещества-мишени в реакционном растворе; и обнаружения генерации или гашения сигнала флуорогенного зонда в ответ на связывание между нуклеиновой кислотой-мишенью и флуорогенным зондом.
[0007] Настоящее изобретение также относится к набору для анализа матричной нуклеиновой кислоты или вещества-мишени, который позволяет выполнять способ анализа в соответствии с настоящим изобретением.
[0008] Настоящее изобретение также относится к анализатору для матричной нуклеиновой кислоты или вещества-мишени, который позволяет выполнять способ анализа в соответствии с настоящим изобретением.
Эффекты изобретения
[0009] В соответствии с настоящим изобретением, матричную нуклеиновую кислоту можно анализировать точно.
Краткое описание фигур
[0010] [ФИГ. 1] На фиг. 1 представлен схематический вид, показывающий принцип разработки праймеров и зондов в настоящем изобретении.
[ФИГ. 2] На фиг. 2A представлена диаграмма, показывающая измеряемое значение числа копий ДНК в случае, когда число полученных копий ДНК матрицы составляет 375 или 750 в примере 1; и на фиг. 2B представлена диаграмма, показывающая время обнаружения в случае, когда число полученных копий ДНК матрицы составляет 375 или 750 с сравнительном примере 1
[ФИГ. 3] На фиг. 3 представлен график, показывающий сравнение между соотношением концентраций для модели нуклеиновой кислоты случая/контроля и соотношением уровней вариации флуоресценции TO/TP в примере 2.
[ФИГ. 4] На фиг. 4A и 4B представлены изображения, каждое из которых показывает генерацию сигнала в примере 3.
[ФИГ. 5] На фиг. 5 представлен график, показывающий измеряемую концентрацию вещества-мишени, вычисляемую по сигналу флуоресценции в реакционном растворе в примере 3.
[ФИГ. 6] На фиг. 6 представлен график, показывающий измеряемую концентрацию вещества-мишени, вычисляемую по сигналу флуоресценции в реакционном растворе в примере 4.
[ФИГ. 7] На фиг. 7 представлен график, показывающий измеряемую концентрацию вещества-мишени, вычисляемую по сигналу флуоресценции в реакционном растворе в примере 5.
Вариант осуществления изобретения
[0011] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, генерирующее сигнал вещество включает генерирующее сигнал связывающее вещество, включающее генерирующее сигнал вещество. Генерирующее сигнал связывающее вещество представляет собой вещество, которое специфически связывается с последовательностью-мишенью или комплементарной последовательностью. Также генерирующее сигнал связывающее вещество представляет собой вещество, которое генерирует сигнал в состоянии, в котором оно связано с мишенью, и гасит сигнал в состоянии, в котором оно диссоциировано с мишенью, или вещество, которое гасит сигнал в состоянии, в котором оно связано с мишенью, и генерирует сигнал в состоянии, в котором оно диссоциировано с мишенью.
[0012] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, генерирующее сигнал вещество включает флуорогенный зонд, содержащий генерирующее сигнал вещество. Флуорогенный зонд представляет собой зонд, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или зонд, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
[0013] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, флуорогенный зонд содержит по меньшей мере две флуоресцентные атомные группы, которые проявляют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу.
[0014] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, матричная нуклеиновая кислота представляет собой матричную нуклеиновую кислоту в состоянии, в котором она связана с веществом, которое специфически связывается с матричной нуклеиновой кислотой. Связывание между матричной нуклеиновой кислотой и веществом, которое специфически связывается с матричной нуклеиновой кислотой, может представлять собой, например, связывание на основании специфичности связывающего вещества или связывание не на основании специфичности связывающего вещества. В последнем случае связывающее вещество может представлять собой, например, связывающее вещество, меченное матричной нуклеиновой кислотой.
[0015] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, набор праймеров содержит флуорогенный праймер, содержащий генерирующее сигнал вещество. Флуорогенный праймер представляет собой праймер, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или праймер, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
[0016] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, флуорогенный праймер содержит по меньшей мере две флуоресцентные атомные группы, которые проявляют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу.
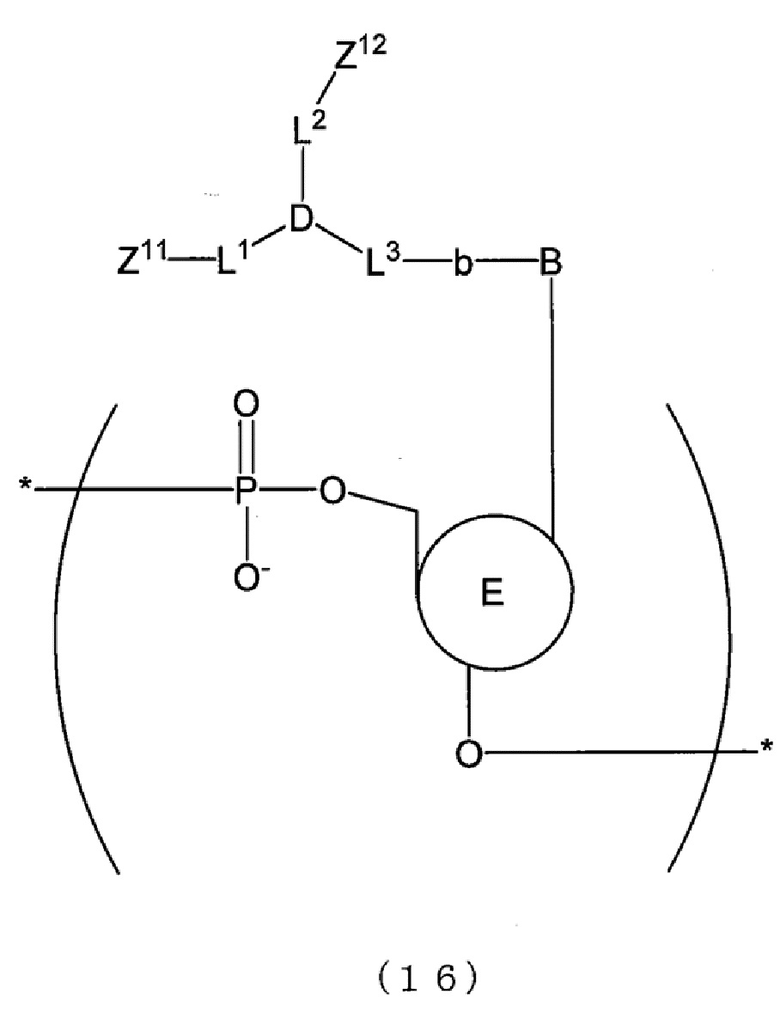
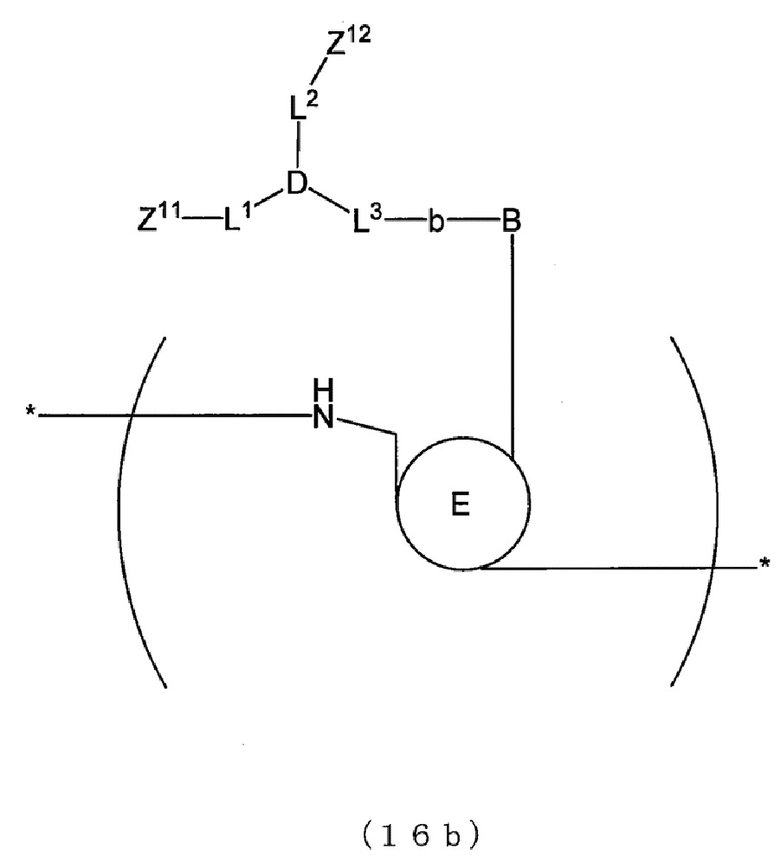
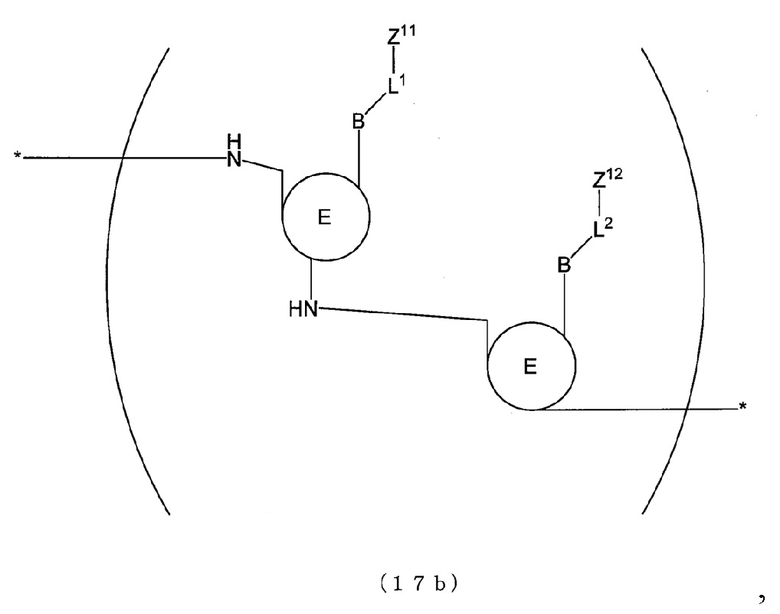
[0017] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, основание, которое содержит пару флуоресцентных атомных групп, которые проявляют экситонный эффект, имеет структуру, представленную следующей формулой (16), (16b), (17) или (17b).

[0018] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, способ амплификации, применяемый на стадии амплификации, представляет собой по меньшей мере одно из способа изотермальной амплификации и способа ПЦР.
[0019] Способ анализа матричной нуклеиновой кислоты по настоящему изобретению дополнительно включает, например, стадию извлечения амплифицированной фракции из множества фракций матричной нуклеиновой кислоты после стадии различения.
[0020] Способ анализа матричной нуклеиновой кислоты по настоящему изобретению дополнительно включает, например, стадию амплификации последовательности-мишени и комплементарной последовательности в матричной нуклеиновой кислоте в отношении амплифицированной фракции после стадии различения, где стадия амплификации представляет собой вторую амплификацию. Способ амплификации, применяемый на второй стадии амплификации, представляет собой, например, по меньшей мере одно из способа изотермальной амплификации и способа ПЦР.
[0021] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадию обнаружения проводят посредством анализа кривой плавления.
[0022] Способ анализа матричной нуклеиновой кислоты по настоящему изобретению дополнительно включает, например, стадию проведения анализа посредством анализа кривой плавления после стадии обнаружения.
[0023] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, образец, содержащий матричную нуклеиновую кислоту, содержит реактив для амплификации нуклеиновой кислоты. На стадии фракционирования образец, содержащий матричную нуклеиновую кислоту и реактив для амплификации нуклеиновой кислоты, фракционируют на множество фракций матричной нуклеиновой кислоты.
[0024] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадия фракционирования предусматривает то, что каждая из множества фракций матричной нуклеиновой кислоты содержит реактив для амплификации нуклеиновой кислоты.
[0025] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадия фракционирования представляет собой стадию формирования эмульсии из образца, фракция матричной нуклеиновой кислоты представляет собой каплю образца, диспергированного в эмульсии, и стадия обнаружения представляет собой стадию обнаружения генерации или гашения сигнала в отношении капли в эмульсии.
[0026] На стадии обнаружения способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, эмульсию пропускают через канал потока, и генерацию или гашение сигнала обнаруживают в отношении капли в предварительно определяемом месте канала потока, когда капля в эмульсии проходит через канал потока.
[0027] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, эмульсия представляет собой эмульсию вода-в-масле (типа W/O).
[0028] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством распределения образца на чипе, на котором предусмотрено множество частей формирования фракций матричной нуклеиновой кислоты на его поверхности.
[0029] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, на чипе, поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной. Стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством нанесения образца на поверхность чипа для того, чтобы разделять образец в части формирования фракции матричной нуклеиновой кислоты.
[0030] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, на чипе, часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа, и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку. Стадия фракционирования представляет собой стадию фракционирования образца посредством введения образца в выемку на поверхности чипа.
[0031] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, на чипе, часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа, внутренняя поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной, область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку, и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной.
[0032] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, реактив для амплификации нуклеиновой кислоты располагают в части формирования фракции матричной нуклеиновой кислоты чипа. Стадия фракционирования предусматривает то, что фракция матричной нуклеиновой кислоты содержит реактив для амплификации нуклеиновой кислоты в части формирования фракции матричной нуклеиновой кислоты чипа.
[0033] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадия обнаружения представляет собой стадию получения изображения множества фракций матричной нуклеиновой кислоты по меньшей мере на одном чипе и стадия различения представляет собой стадию различения фракции матричной нуклеиновой кислоты на чипе, в которой генерация или гашение сигнала обнаружены на изображении, в качестве амплифицированной фракции.
[0034] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством капания образца.
[0035] На стадии фракционирования способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, усредненный объем множества фракций матричной нуклеиновой кислоты составляет от 0,0001 до 5000 нл.
[0036] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, образец содержит по меньшей мере две матричные нуклеиновые кислоты, реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и по меньшей мере два генерирующих сигнал вещества, каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот, и каждое из по меньшей мере двух генерирующих сигнал веществ имеет одно и то же флуоресцентное свойство и генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот.
[0037] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, образец содержит по меньшей мере две матричные нуклеиновые кислоты, реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и по меньшей мере два генерирующих сигнал вещества, каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот и каждое из по меньшей мере двух генерирующих сигнал веществ имеет флуоресцентное свойство, отличающееся от другого, и генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот.
[0038] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, образец содержит по меньшей мере две матричные нуклеиновые кислоты, реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и нефлуорогенный зонд, каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот, и каждое из генерирующего сигнал вещества и нефлуорогенного зонда генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот.
[0039] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении каждой из множества фракций матричной нуклеиновой кислоты перед стадией амплификации. На стадии различения, посредством сравнения сигнала, обнаруживаемого перед стадией амплификации, и сигнала, обнаруживаемого после стадии амплификации, фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты различают в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность.
[0040] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении образца, содержащего матричную нуклеиновую кислоту перед стадией фракционирования. На стадии различения, посредством сравнения сигнала, обнаруживаемого перед стадией фракционирования, и сигнала, обнаруживаемого после стадии амплификации, фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты, различают в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность.
[0041] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ модификации матричной нуклеиновой кислоты. Способ анализа матричной нуклеиновой кислоты по настоящему изобретению дополнительно включает стадию предварительной обработки матричной нуклеиновой кислоты перед стадией амплификации.
[0042] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ метилирования матричной нуклеиновой кислоты, и стадия предварительной обработки представляет собой стадию превращения неметилированного остатка цитозина матричной нуклеиновой кислоты в остаток урацила или остаток производного урацила.
[0043] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, превращение проводят с использованием бисульфита.
[0044] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ метилирования матричной нуклеиновой кислоты, и стадия предварительной обработки представляет собой стадию расщепления неметилированной области или метилированной области матричной нуклеиновой кислоты.
[0045] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, расщепление проводят с использованием рестрикционного фермента.
[0046] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ метилирования матричной нуклеиновой кислоты, и стадия предварительной обработки представляет собой стадию обогащения метилированной матричной нуклеиновой кислоты.
[0047] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, с использованием по меньшей мере одного из связывающего метилированную ДНК белка и антитела против метилцитозина, метилированную матричную нуклеиновую кислоту обогащают посредством связывания по меньшей мере одного из связывающего метилированную ДНК белка и антитела против метилцитозина с метилированной матричной нуклеиновой кислотой.
[0048] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ гидроксиметилирования матричной нуклеиновой кислоты, и стадия предварительной обработки представляет собой стадию превращения остатка гидроксиметилцитозина матричной нуклеиновой кислоты в остаток негидроксиметилированного основания.
[0049] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, остаток гидроксиметилцитозина превращают в остаток тимина или остаток производного тимина с использованием вольфрамового окислителя.
[0050] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, остаток гидроксиметилцитозина превращают в остаток урацила или остаток производного урацила с использованием перрутената калия (KRuO4) и бисульфита.
[0051] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ гидроксиметилирования матричной нуклеиновой кислоты. Стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированной матричной нуклеиновой кислоты; и расщепления гликозилированной области гидроксиметилированной матричной нуклеиновой кислоты.
[0052] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, расщепление проводят с использованием чувствительного к гликозилированию рестрикционного фермента.
[0053] В способе анализа матричной нуклеиновой кислоты по настоящему изобретению, например, анализ матричной нуклеиновой кислоты представляет собой анализ гидроксиметилирования матричной нуклеиновой кислоты. Стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированной матричной нуклеиновой кислоты; и обогащения гликозилированной гидроксиметилированной матричной нуклеиновой кислоты.
[0054] На стадии предварительной обработки способа анализа матричной нуклеиновой кислоты по настоящему изобретению, например, с использованием антитела к гликозилированию и гидроксиметилированию, гликозилированную гидроксиметилированную матричную нуклеиновую кислоту обогащают посредством связывания антитела с гликозилированной гидроксиметилированной матричной нуклеиновой кислотой.
[0055] В способе анализа вещества-мишени по настоящему изобретению, например, вещество-мишень представляет собой нуклеиновую кислоту или последовательность нуклеиновой кислоты.
[0056] В способе анализа вещества-мишени по настоящему изобретению, например, флуорогенный зонд представляет собой зонд, который содержит генерирующее сигнал вещество, и представляет собой зонд, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или зонд, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
[0057] В способе анализа вещества-мишени по настоящему изобретению, например, генерирующее сигнал вещество является флуорогенным.
[0058] В способе анализа вещества-мишени по настоящему изобретению, например, флуорогенный зонд содержит по меньшей мере две флуоресцентные атомные группы, которые проявляют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу.
[0059] В способе анализа вещества-мишени по настоящему изобретению, например, основание, которое содержит пару флуоресцентных атомных групп, которые проявляют экситонный эффект, имеет структуру, представленную следующей формулой (16), (16b), (17) или (17b).




[0060] В способе анализа вещества-мишени по настоящему изобретению, например, стадия обнаружения представляет собой стадию обнаружения яркости или интенсивности сигнала по меньшей мере одного типа в реакционном растворе.
[0061] В способе анализа вещества-мишени по настоящему изобретению, например, стадия обнаружения представляет собой стадию обнаружения сигнала по меньшей мере одного типа в реакционном растворе посредством подсчета флуорогенного зонда на молекулярном уровне.
[0062] В способе анализа вещества-мишени по настоящему изобретению, например, анализируют по меньшей мере два вещества-мишени и вещества-мишени по меньшей мере двух типов являются смежными друг с другом, используют по меньшей мере два флуорогенных зонда для веществ-мишеней, и каждый из флуорогенных зондов содержит генерирующее сигнал вещество, имеющее флуоресцентное свойство, отличное от другого, и генерирует или гасит сигнал в ответ на связывание с различными веществами-мишенями с резонансным переносом энергии флуоресценции.
[0063] В способе анализа вещества-мишени по настоящему изобретению, например, анализируют по меньшей мере два вещества-мишени и вещества-мишени по меньшей мере двух типов являются смежными друг с другом, используют по меньшей мере два флуорогенных зонда для веществ-мишеней, и каждый из флуорогенных зондов содержит генерирующее сигнал вещество, имеющее флуоресцентное свойство, отличное от другого, генерирует или гасит сигнал в ответ на связывание с различными веществами-мишенями и обнаруживает присутствие или отсутствие пространственного перекрытия сигналов многих типов.
[0064] На стадии контактирования и стадии обнаружения способа анализа вещества-мишени по настоящему изобретению, например, управляют температурой реакционного раствора.
[0065] В способе анализа вещества-мишени по настоящему изобретению, например, вещество-мишень представляет собой вещество-мишень в состоянии, в котором связано с веществом, которое специфически связывается с веществом-мишенью. Связывание между веществом-мишенью и веществом, которое специфически связывается с веществом-мишенью, может представлять собой, например, связывание на основании специфичности вещества-мишени связывающего вещества или связывание не на основании специфичности вещества-мишени связывающего вещества. В последнем случае, связывающее вещество может представлять собой, например, связывающее вещество, меченное веществом-мишенью.
[0066] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ модификации вещества-мишени. Способ анализа вещества-мишени по настоящему изобретению дополнительно включает стадию предварительной обработки вещества-мишени перед стадией обнаружения.
[0067] Способ анализа вещества-мишени по настоящему изобретению дополнительно включает, например, стадию амплификации предварительно обработанного вещества-мишени после стадии предварительной обработки и перед стадией обнаружения. Амплифицированный продукт, получаемый на стадии амплификации, используют в качестве вещества-мишени на стадии обнаружения.
[0068] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ метилирования вещества-мишени, и стадия предварительной обработки представляет собой стадию превращения неметилированного остатка цитозина вещества-мишени в остаток урацила или остаток производного урацила.
[0069] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, превращение проводят с использованием бисульфита.
[0070] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ метилирования вещества-мишени, и стадия предварительной обработки представляет собой стадию расщепления неметилированной области или метилированной области вещества-мишени.
[0071] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, расщепление проводят с использованием рестрикционного фермента.
[0072] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ метилирования вещества-мишени, и стадия предварительной обработки представляет собой стадию обогащения метилированного вещества-мишени.
[0073] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, с использованием по меньшей мере одного из связывающего метилированную ДНК белка и антитела против метилцитозина, метилированное вещество-мишень обогащают посредством связывания по меньшей мере одного из связывающего метилированную ДНК белка и антитела против метилцитозина с метилированным веществом-мишенью.
[0074] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ гидроксиметилирования вещества-мишени, и стадия предварительной обработки представляет собой стадию превращения остатка гидроксиметилцитозина вещества-мишени в остаток негидроксиметилированного основания.
[0075] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, остаток гидроксиметилцитозина превращают в остаток тимина или остаток производного тимина с использованием вольфрамового окислителя.
[0076] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, остаток гидроксиметилцитозина превращают в остаток урацила или остаток производного урацила с использованием перрутената калия (KRuO4) и бисульфита.
[0077] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ гидроксиметилирования вещества-мишени. Стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированного вещества-мишени; и расщепления гликозилированной области гидроксиметилированного вещества-мишени.
[0078] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, расщепление проводят с использованием чувствительного к гликозилированию рестрикционного фермента.
[0079] В способе анализа вещества-мишени по настоящему изобретению, например, анализ вещества-мишени представляет собой анализ гидроксиметилирования вещества-мишени. Стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированного вещества-мишени; и обогащения гликозилированного гидроксиметилированного вещества-мишени.
[0080] На стадии предварительной обработки способа анализа вещества-мишени по настоящему изобретению, например, с использованием антитела к гликозилированию и гидроксиметилированию, гликозилированное гидроксиметилированное вещество-мишень обогащают посредством связывания антитела с гликозилированным гидроксиметилированным веществом-мишенью.
[0081] В настоящем изобретении, «фракционирование» обозначает фракционирование, которое проводят посредством деления образца, содержащего матричную нуклеиновую кислоту (далее в настоящем описании также обозначаемого как «образец»), на множество фракций. В настоящем изобретении, «флуорогенный» обозначает, например, генерацию сигнала в состоянии специфического связывания с веществом-мишенью и гашение сигнала в состоянии не связывания или гашение сигнала в состоянии специфического связывания с веществом-мишенью и генерацию сигнала в состоянии не связывания. Генерация и гашение сигнала являются обратимыми. В отношении вещества-мишени подробности описаны далее. В случае, когда вещество-мишень представляет собой нуклеиновую кислоту, «флуорогенный» обозначает, например, генерацию сигнала в состоянии связывания с нуклеиновой кислотой в зависимости от последовательности и гашение сигнала в состоянии не связывания или гашение сигнала в состоянии связывания с нуклеиновой кислотой в зависимости от последовательности и гашение сигнала в состоянии не связывания. Генерация и гашение сигнала являются обратимыми. Последовательность обозначает, например, последовательность нуклеиновой кислоты, которая представляет собой вещество-мишень.
[0082] В настоящем изобретении зонд может представлять собой какое-либо вещество до тех пор, пока он специфически связывается с веществом-мишенью, и примеры зонда включают нуклеиновые кислоты, антитела, аффитела и аптамеры. В случае, когда вещество-мишень представляет собой нуклеиновую кислоту, зонд может представлять собой, например, зонд нуклеиновой кислоты, антитело, аффитело, аптамер или тому подобное, которые комплементарны последовательности вещества-мишени.
[0083] Настоящее изобретение описано далее со ссылкой на конкретные примеры. Однако настоящее изобретение не ограничено следующим описанием. В способе анализа, описанном далее, например, примеры каждой стадии можно комбинировать с примерами других стадий, если не указано иное.
[0084] <Способ анализа матричной нуклеиновой кислоты>
Способ анализа матричной нуклеиновой кислоты по настоящему изобретению, как описано выше, включает стадии фракционирования образца, содержащего матричную нуклеиновую кислоту, на множество фракций матричной нуклеиновой кислоты; амплификации последовательности-мишени и комплементарной ей последовательности в матричной нуклеиновой кислоте в отношении каждой из множества фракций матричной нуклеиновой кислоты в присутствии реактива для амплификации нуклеиновой кислоты; обнаружения генерации или гашения сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, в отношении каждой из множества фракций матричной нуклеиновой кислоты после стадии амплификации; и различения фракции матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты, в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность, где реактив для амплификации нуклеиновой кислоты содержит набор праймеров, которые амплифицируют последовательность-мишень и комплементарную последовательность, и генерирующее сигнал вещество, которое генерирует или гасит сигнал в ответ на амплификацию, и генерирующее сигнал вещество генерирует сигнал в состоянии, в котором оно связано в зависимости от последовательности, и гасит сигнал в состоянии, в котором оно не связано, или гасит сигнал в состоянии, в котором оно связано в зависимости от последовательности, и генерирует сигнал в состоянии, в котором оно не связано, и генерация и гашение сигнала обратимы.
[0085] Способ анализа по настоящему изобретению отличается тем, что образец, содержащий матричную нуклеиновую кислоту, фракционируют на множество фракций матричной нуклеиновой кислоты на стадии фракционирования и генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении каждой из множества фракций матричной нуклеиновой кислоты на стадии обнаружения после стадии амплификации, и другие стадии и условия конкретно не ограничены. В способе анализа по настоящему изобретению, посредством фракционирования образца, содержащего матричную нуклеиновую кислоту, на множество фракций матричной нуклеиновой кислоты, например, последовательность-мишень и комплементарную последовательность амплифицируют после фракционирования множества матричных нуклеиновых кислот в образце на отдельные фракции матричной нуклеиновой кислоты. Кроме того, амплификацию обнаруживают с использованием генерирующего сигнал вещества, которое является флуорогенным, в отношении каждой фракции матричной нуклеиновой кислоты. Таким образом, в соответствии со способом анализа по настоящему изобретению, например, даже когда концентрация матричной нуклеиновой кислоты, содержащейся в образце, является низкой до такой степени, что не может быть обнаружена нормальным способом анализа генов, посредством фракционирования образца на множество фракций матричную нуклеиновую кислоту можно обогащать во фракции матричной нуклеиновой кислоты, содержащей матричную нуклеиновую кислоту. Следовательно, в соответствии со способом анализа по настоящему изобретению, матричную нуклеиновую кислоту можно анализировать точно. Кроме того, поскольку способ анализа по настоящему изобретению с использованием генерирующего флуорогенный сигнал вещества позволяет обнаруживать матричную нуклеиновую кислоту с высокой специфичностью, матричную нуклеиновую кислоту можно анализировать более точно.
[0086] Настоящее изобретение можно применять к любому анализу матричной нуклеиновой кислоты до тех пор, пока в нем используют обнаружение амплификации последовательности-мишени или комплементарной последовательности, и содержимое анализа матричной нуклеиновой кислоты конкретно не ограничено. Обнаружение амплификации может представлять собой, например, обнаружение амплифицированного продукта или обнаружение ассоциации амплифицированного продукта и зонда или диссоциации ассоциата.
[0087] В настоящем изобретении, в отношении «генерации сигнала в состоянии связывания с нуклеиновой кислотой в зависимости от последовательности и гашения сигнала в состоянии не связывания» или «гашения сигнала в состоянии связывания с нуклеиновой кислотой в зависимости от последовательности и генерации сигнала в состоянии не связывания», связывание может быть, например, прямым и зависящим от последовательности или непрямым и зависящим от последовательности. Первый случай может представлять собой, например, гашение или генерацию сигнала генерирующего сигнал вещества в ответ на зависящее от последовательности связывание самого генерирующего сигнал вещества флуорогенного зонда или флуорогенного праймера, описанного далее. Последний случай может представлять собой, например, гашение или генерацию сигнала интеркалятора в ответ на зависящее от последовательности связывание нефлуорогенного зонда или нефлуорогенного праймера.
[0088] Первый пример анализа матричной нуклеиновой кислоты в настоящем изобретении может представлять собой анализ присутствия или отсутствия матричной нуклеиновой кислоты (качественный анализ) или анализ количества (количественный анализ). В этом случае амплифицируют последовательность-мишень и комплементарную ей последовательность в матричной нуклеиновой кислоте, посредством обнаружения полученного амплифицированного продукта можно анализировать ассоциацию полученного амплифицированного продукта и зонда или диссоциацию ассоциата, присутствие или отсутствие или количество матричной нуклеиновой кислоты.
[0089] Второй пример анализа матричной нуклеиновой кислоты в настоящем изобретении может представлять собой анализ мутации нуклеиновой кислоты, присутствующей в сайте мутации нуклеиновой кислоты в матричной нуклеиновой кислоте, что является так называемым типированием. Сайт мутации нуклеиновой кислоты может представлять собой, например, сайт полиморфизма, например, однонуклеотидного полиморфизма. Конкретные примеры анализа мутации нуклеиновой кислоты включают различение между диким типом и мутантным типом в сайте мутации нуклеиновой кислоты, различение между различными мутантными типами в сайте мутации нуклеиновой кислоты и различение между гомозиготой и гетерозиготой. В этом случае амплифицируют последовательность-мишень и комплементарную ей последовательность в матричной нуклеиновой кислоте, обнаруживают ассоциацию полученного амплифицированного продукта и зонда или диссоциацию ассоциата, и можно проводить типирование сайта мутации нуклеиновой кислоты, исходя из условий (например, температуры, pH, концентрации денатурирующего средства, концентрации соли и т. д.), при которых происходит ассоциация или диссоциация.
[0090] В способе анализа по настоящему изобретению последовательность-мишень представляет собой последовательность области, содержащей произвольный сайт в последовательности матрицы, и комплементарная последовательность представляет собой последовательность, комплементарную последовательности-мишени. В способе анализа по настоящему изобретению последовательность-мишень и комплементарную последовательность амплифицируют на стадии амплификации. Для произвольного сайта нет конкретного ограничения.
[0091] Когда настоящее изобретение применяют к типированию, произвольный сайт представляет собой, например, сайт мутации нуклеиновой кислоты. Сайт мутации нуклеиновой кислоты представляет собой, например, сайт, в котором предполагаемая мутация нуклеиновой кислоты, подлежащая обнаружению, присутствует в матричной нуклеиновой кислоте. В этом случае последовательность-мишень представляет собой последовательность области, содержащей сайт мутации нуклеиновой кислоты в матричной нуклеиновой кислоте, и комплементарная последовательность представляет собой последовательность, комплементарную последовательности-мишени.
[0092] В способе анализа по настоящему изобретению образец конкретно не ограничен, и можно использовать образцы, которые могут содержать матричную нуклеиновую кислоту или вещество-мишень, описанные далее. Примеры вещества-мишени включают различные нуклеиновые кислоты, такие как ДНК и РНК. Примеры образца включают образцы, происходящие из организма, образцы, происходящие из пищи и напитков, и образцы, происходящие из окружающей среды. Организм конкретно не ограничен, и его примеры включают животных, в том числе человека; не относящихся к человеку млекопитающих, таких как крупный рогатый скот, свиньи, овцы, мыши, крысы, кролики и лошади; птицы; и рыбы. Примеры образца, происходящего из организма, включают текучие вещества организма, ткани и клетки в организмах. Примеры текучего вещества организма включают кровь, такую как цельная кровь, клетки крови, плазму крови, сыворотку крови и т. п.; внутриглазную жидкость, такую как водянистая влага и т. п.; лимфу; цереброспинальную жидкость; слезы; пот; семя; слюну; слизь; мочу; отделяемое носа; и мазок из носа. Примеры ткани включают внутриглазные ткани, такие как стекловидное тело и т. п.; и ткани, имеющие патоген, такие как опухоль и т. п. Примеры образца, происходящего из пищи или напитка, включают напитки, пищу и пищевое сырье. Настоящее изобретение, например, можно применять для проверки на инфекцию, проверки отравления пищи и т. п. Примеры образца, происходящего из окружающей среды, включают воду; морскую воду; свежую воду; речную воду; озерную воду; грунтовую воду; сточные воды; нечистоты; почву; атмосферу; и прилипшее вещество на пищевых производствах, кухнях и т. п. Образец содержит, например, матричную нуклеиновую кислоту, вещество-мишень, описанное выше, и т. п. Источник образца конкретно не ограничен и может представлять собой, например, человека, не относящихся к человеку животных и т. п.
[0093] В способе анализа по настоящему изобретению, матричная нуклеиновая кислота может представлять собой, например, образец нуклеиновой кислоты или тому подобное. Образец нуклеиновой кислоты может представлять собой, например, одноцепочечную нуклеиновую кислоту или двухцепочечную нуклеиновую кислоту. В первом случае, например, одноцепочечная нуклеиновая кислота представляет собой матричную нуклеиновую кислоту. В последнем случае, например, одну из пары одноцепочечных нуклеиновых кислот, которые составляют двухцепочечную нуклеиновую кислоту, можно принимать в качестве матричной нуклеиновой кислоты, содержащей последовательность-мишень. В частности, например, смысловую цепь из пары одноцепочечных нуклеиновых кислот можно принимать в качестве матричной нуклеиновой кислоты, содержащей последовательность-мишень, или антисмысловую цепь из пары одноцепочечных нуклеиновых кислот можно принимать в качестве матричной нуклеиновой кислоты содержащей последовательность-мишень.
[0094] Примеры матричной нуклеиновой кислоты включают нуклеиновые кислоты, такие как ДНК и РНК. Нуклеиновая кислота представляет собой, например, нуклеиновую кислоту, происходящую из образца. ДНК, происходящая из образца, может представлять собой, например, ДНК, содержащуюся в образце, или кДНК, созданную из РНК, содержащейся в образце посредством обратной транскрипции. Примеры РНК, содержащейся в образце, включают общую РНК и мРНК. Нуклеиновая кислота может представлять собой, например, циркулирующую опухолевую ДНК (ctDNA) и циркулирующую опухолевую РНК (ctRNA).
[0095] В способе анализа по настоящему изобретению матричная нуклеиновая кислота может представлять собой, например, комплекс матричной нуклеиновой кислоты, содержащий вещества, отличные от нуклеиновой кислоты. В частности, комплекс матричной нуклеиновой кислоты дополнительно может содержать вещество-мишень и связывающее вещество, которое специфически связывается с веществом-мишенью, например. В этом случае, например, связывающее вещество непосредственно связывают с матричной нуклеиновой кислотой, и его можно называть как связывающее вещество, меченное матричной нуклеиновой кислотой. Непосредственная связь представляет собой, например, ковалентную связь. Вещество-мишень конкретно не ограничено, и можно дать ссылку, например, на описание ниже. Связывающее вещество может представлять собой какое-либо вещество до тех пор, например, пока оно может специфически связываться с веществом-мишенью. В частности, можно дать ссылку на описание в отношении зонда. Комплекс матричной нуклеиновой кислоты можно формировать посредством приведения образца, содержащего вещество-мишень, в контакт, например, со связывающим веществом, меченным матричной нуклеиновой кислотой. В случае, когда матричная нуклеиновая кислота представляет собой комплекс матричных нуклеиновых кислот, предпочтительно, матричная нуклеиновая кислота представляет собой ДНК, которая имеет последовательность, которую, например, искусственно разрабатывают.
[0096] В настоящем изобретении, число типов матричной нуклеиновой кислоты, содержащейся в образце, составляет по меньшей мере 1, и составляет, например, по меньшей мере 2, по меньшей мере 5 или по меньшей мере 20. Верхний предел числа типов матричной нуклеиновой кислоты конкретно не ограничен и составляет, например, самое большее 200, самое большее 100 и самое большее 50, и диапазон составляет, например, от 1 до 200, от 2 до 100 или от 5 до 50.
[0097] В способе анализа по настоящему изобретению реактив для амплификации нуклеиновой кислоты можно различать, например, на основании способа амплификации, применяемого на стадии амплификации, описанной далее. В частности, реактив для амплификации нуклеиновой кислоты содержит набор праймеров, которые амплифицируют последовательность-мишень и комплементарную последовательность, и генерирующее сигнал вещество, которое генерирует или гасит сигнал в ответ на амплификацию. Тип набора праймеров конкретно не ограничен, и можно дать ссылку, например, на примеры типа матричной нуклеиновой кислоты. Число типов набора праймеров может представлять собой, например, то же число, что и число типов матричной нуклеиновой кислоты, или число, отличающееся от него. Когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, набор праймеров можно разрабатывать так, что один набор праймеров позволяет амплифицировать по меньшей мере две матричные нуклеиновые кислоты, например. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров, каждый из наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в одной и той же матричной нуклеиновой кислоте или позволяет амплифицировать последовательность-мишень и комплементарную последовательность в различных матричных нуклеиновых кислотах, и последнее является предпочтительным.
[0098] Набор праймеров описан подробно. Далее в настоящем описании, в наборе праймеров, праймер, с помощью которого синтезируют последовательность-мишень, также обозначают как «первый праймер», и праймер, с помощью которого синтезируют комплементарную последовательность, также обозначают как «второй праймер».
[0099] В способе анализа по настоящему изобретению, полимераза, работающая от 3'-конца первого праймера, синтезирует последовательность-мишень, и полимераза, работающая от 3'-конца второго праймера, синтезирует комплементарную последовательность. Первый праймер и второй праймер можно определять надлежащим образом, например, в соответствии с последовательностью матричной нуклеиновой кислоты.
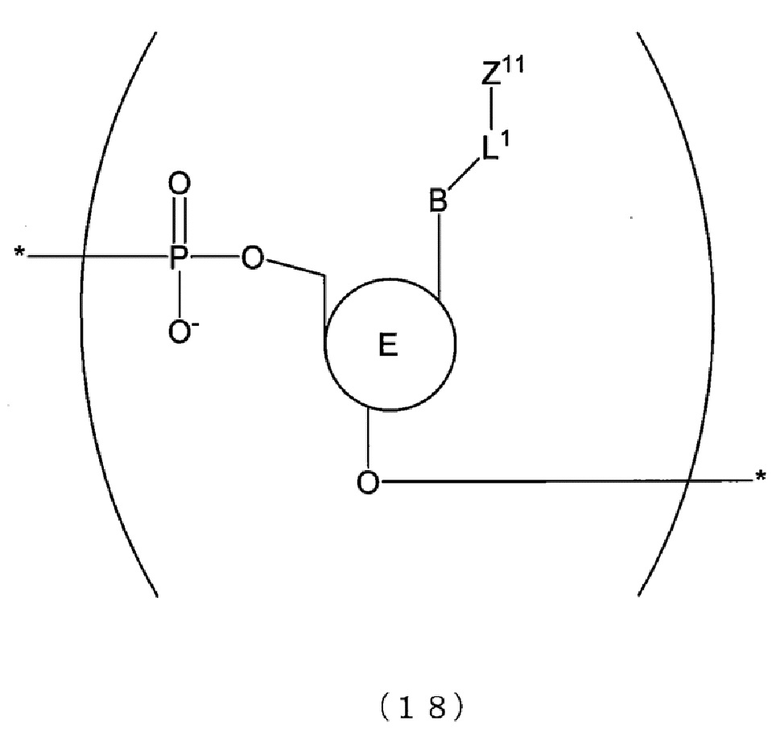
[0100] В отношении первого праймера и второго праймера, например, можно дать ссылку на фиг. 1. На фиг. 1 представлен схематический вид, показывающий взаимоотношения между матричной нуклеиновой кислотой и первым праймером и взаимоотношения между матричной нуклеиновой кислотой и вторым праймером. На фиг. 1 обведенная область обозначает область, которая имеет ту же последовательность, что и соответствующий сайт матричной нуклеиновой кислоты, и залитая область обозначает область, которая имеет последовательность, комплементарную соответствующему сайту матричной нуклеиновой кислоты (далее в настоящем описании применимо аналогичное). Как показано на фиг. 1, первый праймер, например, имеет ту же последовательность, что и область выше по направлению считывания от произвольного сайта (например, сайта мутации нуклеиновой кислоты) в матричной нуклеиновой кислоте. Первый праймер может содержать, например, только ту же последовательность или может содержать ту же последовательность и другую последовательность(и). В последнем случае предпочтительно первый праймер имеет ту же последовательность в его 3'-концевой области. Второй праймер имеет последовательность, например, комплементарную области ниже по направлению считывания от произвольного сайта (например, сайта мутации нуклеиновой кислоты) в матричной нуклеиновой кислоте. Второй праймер может содержать, например, только комплементарную последовательность или может содержать комплементарную последовательность и другую последовательность(и). В последнем случае предпочтительно второй праймер имеет комплементарную последовательность в его 3'-концевой области. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров, первые праймеры из по меньшей мере двух наборов праймеров могут представлять собой последовательности, комплементарные одной и той же последовательности, или последовательности, комплементарные различным последовательностям, и последнее является предпочтительным. Также вторые праймеры из по меньшей мере двух наборов праймеров могут представлять собой последовательности, комплементарные одной и той же последовательности, или последовательности, комплементарные различным последовательностям, и последнее является предпочтительным.
[0101] В способе анализа по настоящему изобретению генерирующее сигнал вещество может представлять собой любое вещество до тех пор, пока оно является флуорогенным. Генерирующее сигнал вещество предпочтительно добавляют, например, к связывающему веществу, которое специфически связывается с последовательностью-мишенью или комплементарной последовательностью. То есть, генерирующее сигнал вещество предпочтительно используют в качестве генерирующего сигнал связывающего вещества, содержащего генерирующее сигнал вещество, или праймера, содержащего генерирующее сигнал вещество. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два генерирующих сигнал вещества, генерирующие сигнал вещества могут представлять собой генерирующие сигнал вещества одного и того же типа или могут представлять собой генерирующие сигнал вещества различных типов. Тип генерирующего сигнал вещества конкретно не ограничен, и, например, можно дать ссылку на примеры типа матричной нуклеиновой кислоты. Число типов генерирующего сигнал вещества может составлять, например, то же число, что и число типов матричной нуклеиновой кислоты и/или набора праймеров, или число, отличное от него. Когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, например, одно генерирующее сигнал вещество может генерировать или гасить сигнал в ответ на амплификацию последовательностей-мишеней и комплементарных последовательностей по меньшей мере в двух матричных нуклеиновых кислотах. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два генерирующих сигнал вещества, например, каждое из генерирующих сигнал веществ может иметь то же флуоресцентное свойство, или флуоресцентное свойство, отличное от другого, и последнее является предпочтительным, поскольку это позволяет просто анализировать по меньшей мере две матричные нуклеиновых кислоты. Примеры флуоресцентного свойства включают длину волны возбуждения и длину волны флуоресценции. Обладание тем же флуоресцентным свойством обозначает, например, обладанием той же длиной волны возбуждения и той же длиной волны флуоресценции. Обладание отличающимся флуоресцентным свойством обозначает, например, обладание отличающейся длиной волны возбуждения или отличающейся длиной волны флуоресценции. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два генерирующих сигнал вещества, предпочтительно каждое генерирующее сигнал вещество генерирует или гасит в ответ на амплификацию каждой из последовательностей-мишеней и комплементарных последовательностей в различных матричных нуклеиновых кислотах, поскольку это позволяет просто анализировать по меньшей мере две матричные нуклеиновые кислоты. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два генерирующих сигнал вещества, в отношении генерации или гашения сигнала, например, можно использовать или можно не использовать резонансный перенос энергии флуоресценции (FRET).
[0102] Генерирующее сигнал связывающее вещество, содержащее генерирующее сигнал вещество может представлять собой, например, вещество, которое специфически связывается с последовательностью-мишенью или комплементарной последовательностью. Генерирующее сигнал связывающее вещество, содержащее генерирующее сигнал вещество, может представлять собой, например, вещество, которое генерирует сигнал в состоянии, в котором оно связано с мишенью, и гасит сигнал в состоянии, в котором оно диссоциировано с мишенью, или вещество, которое гасит сигнал в состоянии, в котором оно связано с мишенью, и генерирует сигнал в состоянии, в котором оно диссоциировано с мишенью. В частности, генерирующее сигнал связывающее вещество, содержащее генерирующее сигнал вещество, может представлять собой, например, флуорогенный зонд, содержащий генерирующее сигнал вещество. В этом случае, флуорогенный зонд может представлять собой, например, зонд, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или зонд, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
[0103] Генерирующее сигнал вещество флуорогенного зонда может представлять собой, как описано выше, любое вещество до тех пор, пока оно является флуорогенным. Конкретные примеры генерирующего сигнал вещества включают вещество, которое проявляет феномен гашения флуоресценции, и флуоресцентную атомную группу, которая проявляет экситонный эффект. Конкретные примеры флуорогенного зонда включают зонд, содержащий вещество, которое проявляет феномен гашения флуоресценции (зонд с феноменом гашения (далее в настоящем описании, также обозначаемый как «Г-зонд»)), зонд, содержащий по меньшей мере две флуоресцентные атомные группы, которые проявляют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу (далее в настоящем описании также обозначаемый как «Э-зонд»), и молекулярный маяк. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два флуорогенных зонда, флуорогенные зонды могут представлять собой флуорогенные зонды одного и того же типа или могут представлять собой флуорогенные зонды различных типов.
[0104] Флуорогенный зонд может представлять собой зонд, который образует гибрид с последовательностью-мишенью, содержащей произвольный сайт, или зонд, который образует гибрид с комплементарной последовательностью. Зонд можно определять надлежащим образом, например, в соответствии с последовательностью матричной нуклеиновой кислоты. Когда реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два флуорогенных зонда, флуорогенные зонды могут представлять собой зонды, которые образуют гибриды с одной и той же последовательностью, или зонды, которые образуют гибриды с различными последовательностями, и последнее является предпочтительным. Первый зонд имеет последовательность, например, которая образует гибрид с последовательностью-мишенью. Зонд может содержать только последовательность, которая образует гибрид с последовательностью-мишенью, или может содержать последовательность, которая образует гибрид с последовательностью-мишенью и другой последовательностью(ями). Последний зонд имеет последовательность, например, которая образует гибрид с комплементарной последовательностью. Зонд может содержать только последовательность, которая образует гибрид с комплементарной последовательностью, или может содержать последовательность, которая образует гибрид с комплементарной последовательностью и другой последовательностью(ями).
[0105] Относительно зонда, например, можно дать ссылку на фиг. 1. На фиг. 1 представлен схематический вид, показывающий взаимоотношения между матричной нуклеиновой кислотой и зондами. Как показано на фиг. 1, когда зонд представляет собой зонд, который образует гибрид с последовательностью-мишенью (зонд Tseq), например, зонд можно разрабатывать так, чтобы он содержал последовательность, комплементарную области, содержащей произвольный сайт N (например, сайт мутации нуклеиновой кислоты) в матричной нуклеиновой кислоте. В зонде Tseq сайт, соответствующий произвольному сайту N в матричной нуклеиновой кислоте, содержит Nc, комплементарное произвольному сайту N. Когда зонд представляет собой зонд, который образует гибрид с комплементарной последовательностью (зонд Cseq), например, зонд можно разрабатывать так, чтобы он содержал ту же последовательность, что и область, содержащая произвольный сайт (например, сайт мутации нуклеиновой кислоты) в матричной нуклеиновой кислоте.
[0106] Когда способ анализа по настоящему изобретению применяют к типированию, основание в сайте мутации нуклеиновой кислоты в матричной нуклеиновой кислоте может представлять собой, например, дикий тип или мутантный тип. Когда имеет место множество мутантных типов, основание может представлять собой какой-либо из мутантных типов.
[0107] Когда способ анализа по настоящему изобретению применяют к типированию, можно говорить, что зонд представляет собой, например, типирующий зонд. В отношении зонда, например, имеют место следующие первый вариант осуществления и второй вариант осуществления. В первом варианте осуществления температура диссоциации или температура ассоциации различаются между случаем, когда зонд не совпадает с сайтом мутации нуклеиновой кислоты, и случаем, когда зонд полностью совпадает с сайтом мутации нуклеиновой кислоты, и зонд может обнаруживать мутацию нуклеиновой кислоты в сайте мутации нуклеиновой кислоты на основании температуры диссоциации или температуры ассоциации. Зонд по первому варианту осуществления позволяет определять, не совпадает ли зонд с сайтом мутации нуклеиновой кислоты или полностью совпадает с сайтом мутации нуклеиновой кислоты, на основании температуры диссоциации или температуры ассоциации. Как результат, зонд по первому варианту осуществления позволяет обнаруживать, представляет ли основание собой предполагаемую мутацию (например, мутантный тип или дикий типа) в сайте мутации нуклеиновой кислоты. Когда зонд представляет собой, например, зонд mt, который полностью совпадает с сайтом мутации нуклеиновой кислоты мутантного типа, зонд mt демонстрирует более высокую силу ассоциации с последовательностью-мишенью mt мутантного типа, имеющей сайт мутации нуклеиновой кислоты, с которой зонд полностью совпадает, чем с последовательностью-мишенью wt дикого типа, имеющей сайт мутации нуклеиновой кислоты, с которой зонд не совпадает. Таким образом, температура ассоциации зонда mt и последовательности-мишени mt мутантного типа выше, чем температура ассоциации зонда mt и последовательности-мишени wt дикого типа.
[0108] Во втором варианте осуществления температура диссоциации или температура ассоциации различается между случаем, когда зонд не совпадает с сайтом мутации нуклеиновой кислоты, и случаем, когда зонд не совпадает с сайтом мутации нуклеиновой кислоты с отличающимся значением температуры плавления (Tm), и зонд позволяет обнаруживать мутацию нуклеиновой кислоты в сайте мутации нуклеиновой кислоты на основании температуры диссоциации или температуры ассоциации. Зонд по второму варианту осуществления может определять, которое из несовпадений имеет место, на основании температуры диссоциации или температуры ассоциации. Как результат, зонд по второму варианту осуществления позволяет обнаруживать, является основание в сайте мутации нуклеиновой кислоты предполагаемой мутацией (например, мутантного типа или дикого типа).
[0109] Э-зонд, как описано выше, представляет собой зонд, который содержит по меньшей мере две флуоресцентные атомные группы, которые проявляют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу. Относительно Э-зонда, например, можно дать ссылку на японский патент № 4370385 и WO2014/013954.
[0110] В последовательности оснований зонда, которая составляет Э-зонд, положение связывания, в котором связаны две флуоресцентные атомные группы, не ограничено конкретными положениями, и может представлять собой любое положение. Положение связывания может представлять собой, например, одно и то же основание или два смежных основания в зонде. Две флуоресцентные атомные группы можно, например, непосредственно связывать с зондом или опосредованно связывать с зондом. В последнем случае две флуоресцентные атомные группы связаны с зондом, например, через линкер.
[0111] Э-зонд представляет собой зонд, в который вводят две флуоресцентные атомные группы (например, тиазоловый оранжевый и подобное ему вещество). Э-зонд обладает свойством слабого испускания флуоресценции из-за экситонного эффекта, получаемого, когда две флуоресцентные атомные группы образуют эксиплекс в случае одной цепи, но сильного испускания флуоресценции с разрешением экситонного эффекта, когда две флуоресцентные атомные группы перемещаются друг от друга при их гибридизации с мишенью. Здесь следует отметить, что, хотя «Э-зонд» («E-probe») является торговым названием продукта Kabushiki Kaisha DNAFORM («Eprobe» представляет собой зарегистрированный товарный знак), «Э-зонд» в настоящем изобретении может быть идентичен продукту, получившему торговое название «Э-зонд» или «Eprobe», или отличаться от него.
[0112] 3'-конец Э-зонда можно модифицировать, например, так, что его нельзя будет продлить. В частности, например, 3'-конец Э-зонда можно модифицировать химически с использованием линкерной группы OH.
[0113] В Э-зонде каждая из флуоресцентных атомных групп, которые проявляют экситонный эффект, представляет собой:
(i) ту, которая испускает флуоресценцию, с двумя плоскими химическими структурами, содержащимися в одной молекуле, которые существуют не в одной и той же плоскости, но под определенным углом, образованным между ними, которые располагают с тем, чтобы они находились в одной и той же плоскости, когда молекула подвергается интеркаляции в нуклеиновую кислоту или связыванию в ее бороздке,
(ii) ту, которая состоит из по меньшей мере двух молекулярных групп красителей, которые не демонстрируют испускание флуоресценции из-за экситонного эффекта, достигаемого, когда по меньшей мере две молекулы красителя образуют агрегат параллельно друг другу, но демонстрируют испускание флуоресценции при разрешении состояния агрегирования, когда молекулы подвергаются интеркаляции в молекулу-мишень например, нуклеиновую кислоту, или связыванию в ее бороздке, или
(iii) ту, которая отличается наличием химической структуры по меньшей мере двух молекул красителя, содержащейся в одной молекуле, причем по меньшей мере две молекулы красителя не демонстрируют испускания флуоресценции из-за экситонного а, достигаемого, когда они образуют агрегат параллельно друг другу, но демонстрируют испускание флуоресценции при разрешении состояния агрегирования, когда молекулы подвергаются интеркаляции в молекулу-мишень, например, нуклеиновую кислоту, или связыванию в ее канавке.
В случае (ii) или (iii) предпочтительно молекула красителя представляет собой молекулу, описанную в (i).
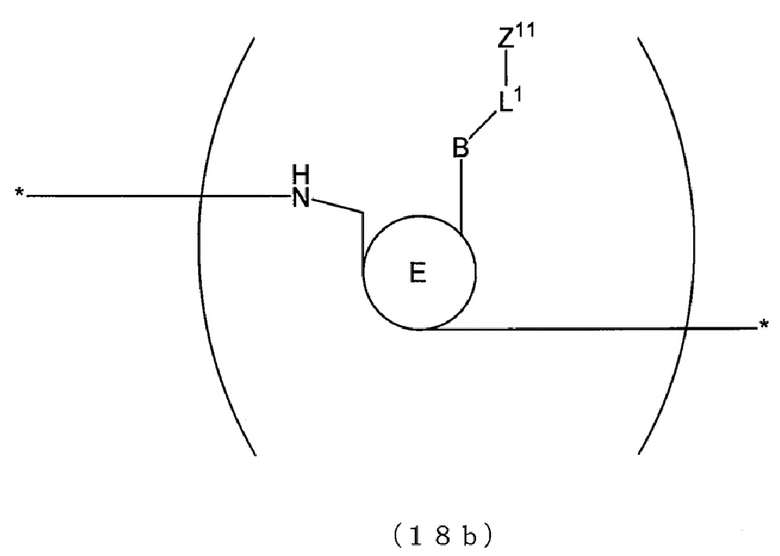
[0114] В Э-зонде структура молекулы нуклеиновой кислоты может представлять собой, например, меченную нуклеиновую кислоту, содержащую по меньшей мере одну из структур, представленных следующими формулами (16), (16b), (17), (17b), (18) и (18b). В настоящем изобретении меченная нуклеиновая кислота также охватывает таутомеры и стереоизомеры этих структур, а также соли этих структур, таутомеров и стереоизомеров. Далее в настоящем описании каждую из структур, представленных следующими соответствующими формулами и имеющих атомные группы Z11 и Z12, которые демонстрируют флуоресценцию, можно обозначать как «меченную структуру». Меченную нуклеиновую кислоту, содержащую меченную структуру, можно обозначать как «меченный зонд».
[0115]




[0116] В формулах (16), (16b), (17), (17b), (18) и (18b)
B представляет собой атомную группу, имеющую остов природных нуклеиновых оснований (аденин, гуанин, цитозин, тимин или урацил) или остов искусственного нуклеинового основания,
E представляет собой:
(i) атомную группу, имеющую остов дезоксирибозы, остов рибозы или структуру, полученную из любого одного из них, или
(ii) атомную группу, имеющую пептидную структуру или пептоидную структуру,
каждое из Z11 и Z12 представляет собой атомную группу, демонстрирующую флуоресценцию, и может быть идентично друг другу или отличаться друг от друга,
каждое L1, L2 и L3 представляет собой линкер (линкерный атом или атомную группу), длина главной цепи (число атомов главной цепи) которого является произвольным, каждый L1, L2 и L3 может содержать или не содержать каждый из C, N, O, S, P и Si в главной цепи, каждый L1, L2 и L3 может содержать или не содержать каждое из одинарной связи, двойной связи, тройной связи, амидной связи, сложноэфирной связи, дисульфидной связи, иминогруппы, простой эфирной связи, простой тиоэфирной связи и сложной тиоэфирной связи в главной цепи, и L1, L2 и L3 могут быть идентичными друг другу или отличаться друг от друга,
D представляет собой CR, N, P, P=O, B или SiR, где R представляет собой атом водорода, алкильную группу или произвольный заместитель, и
b представляет собой одинарную связь, двойную связь или тройную связь,
или альтернативно,
в формулах (16) и (16b) каждое L1 и L2 представляет собой линкер, L3, D и b могут отсутствовать и L1 и L2 могут быть связаны непосредственно с B при условии, что:
в формулах (16), (17) и (18) E представляет собой атомную группу, описанную в п. (i), и по меньшей мере один атом O в связи фосфорной кислоты можно заменять на атом S;
в формулах (16b), (17b) и (18b) E представляет собой атомную группу, описанную в п. (ii); и
в формулах (17) и (17b) соответствующие B могут быть идентичны друг другу или отличаться друг от друга и соответствующие E могут быть идентичны друг другу или отличаться друг от друга.
[0117] В формулах (16), (17), (16b), (17b), (18) и (18b) длина главной цепи (число атомов главной цепи) каждого из L1, L2 и L3 предпочтительно представляет собой целое, равное 2 или больше. Его верхний предел конкретно не ограничен и составляет, например, 100 или меньше, более предпочтительно 30 или меньше и особенно предпочтительно 10 или меньше.
[0118] Z11 и Z12 представляют собой флуоресцентные атомные группы, которые демонстрируют экситонный эффект. Это позволяет менять окружающую среду около флуоресцентных красителей, когда зонд связан с последовательностью-мишенью, например, значительно увеличивать флуоресценцию при формировании структуры двойной спирали, чтобы последовательность-мишень можно было обнаруживать более эффективно.
[0119] Z11 и Z12 конкретно не ограничены до тех пор, пока они представляют собой флуоресцентные атомные группы, которые демонстрируют экситонный эффект. Более предпочтительно, каждое Z11 и Z12 независимо представляет собой, например, группу, получаемую из любого из тиазолового оранжевого, оксазолового желтого, цианина, гемицианина, других цианиновых красителей, метилового красного, азокрасителей и их производных. Кроме того, группу, получаемую из любого другого известного красителя, также можно использовать в зависимости от ситуации. Сообщалось о многих флуоресцентных красителях, которые меняют интенсивность флуоресценции посредством связывания с нуклеиновыми кислотами, такими как ДНК. В типичном примере известно, что бромистый этидий демонстрирует сильную флуоресценцию посредством интеркаляции в структуру двойной спирали ДНК, и его часто используют для обнаружения ДНК. Кроме того, также известны флуоресцентные красители, интенсивностью флуоресценции которых можно управлять в соответствии с микроскопической полярностью, такие как пиренкарбоксиамид и продан. Тиазоловый оранжевый представляет собой флуоресцентный краситель с бензотиазоловым кольцом и хинолиновым кольцом, которые связаны друг с другом метиновой группой. Обычно он демонстрирует слабую флуоресценцию, но дает сильное испускание флуоресценции посредством интеркаляции в ДНК, которая имеет структуру двойной спирали. Другие примеры включают красители, такие как флуоресцеин и Cy3.
[0120] Более предпочтительно, каждое Z11 и Z12 независимо представляет собой атомную группу, представленную любой одной из следующих формул с (7) до (9).
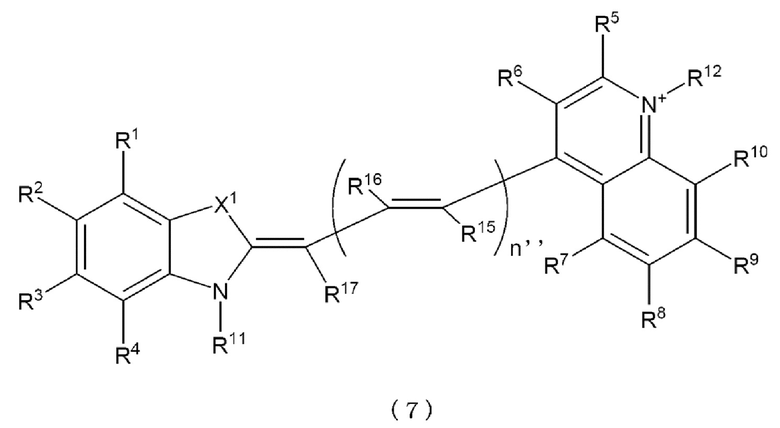
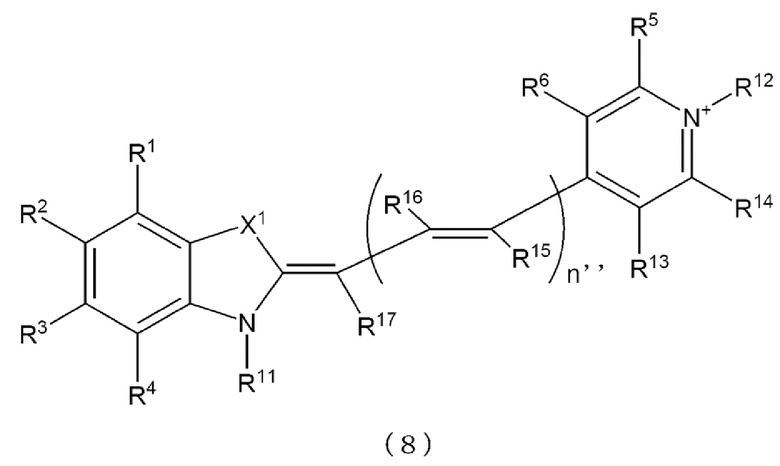

[0121] в формулах с (7) до (9)
X1 и X2 представляют собой S, O или Se,
n'' равно 0 или положительному целому,
каждое от R1 до R10 и от R13 до R21 независимо представляет собой атом водорода, атом галогена, низшую алкильную группу, низшую алкоксильную группу, нитрогруппу или аминогруппу,
одно из R11 и R12 представляет собой линкерную группу, которая связана с L1 или L2 в формулах (16), (17), (16b), (17b), (18) и (18b), и другое представляет собой атом водорода или низшую алкильную группу,
когда множество R15 присутствует в формулах (7), (8) или (9), они могут быть идентичны друг другу или отличаться друг от друга,
когда множество R16 присутствует в формулах (7), (8) или (9), они могут быть идентичны друг другу или отличаться друг от друга, и
X1, X2 и от R1 до R21 в Z11 и X1, X2 и от R1 до R21 в Z12 могут быть идентичны друг другу или отличаться друг от друга, соответственно.
[0122] В формулах с (7) до (9) более предпочтительно в от R1 до R21 низшая алкильная группа представляет собой линейную или разветвленную алкильную группу с углеродным числом от 1 до 6 и низшая алкоксильная группа представляет собой линейную или разветвленную алкоксильную группу с углеродным числом от 1 до 6.
[0123] В формулах с (7) до (9) более предпочтительно в R11 и R12 линкерная группа представляет собой полиметиленкарбонильную группу с углеродным числом по меньшей мере 2, и она связана с L1 или L2 в формулах в формулах (16), (17), (16b), (17b), (18) или (18b) во фрагменте карбонильной группы. Верхний предел углеродного числа полиметиленкарбонильной группы конкретно не ограничен и составляет, например, 100 или меньше, предпочтительно 50 или меньше, более предпочтительно 30 или меньше и особенно предпочтительно 10 или меньше.
[0124] Когда каждое из Z11 и Z12 представлено любой одной из формул с (7) до (9), более предпочтительно каждое из них, например, независимо представляет собой группу, представленную формулами (19) или (20).
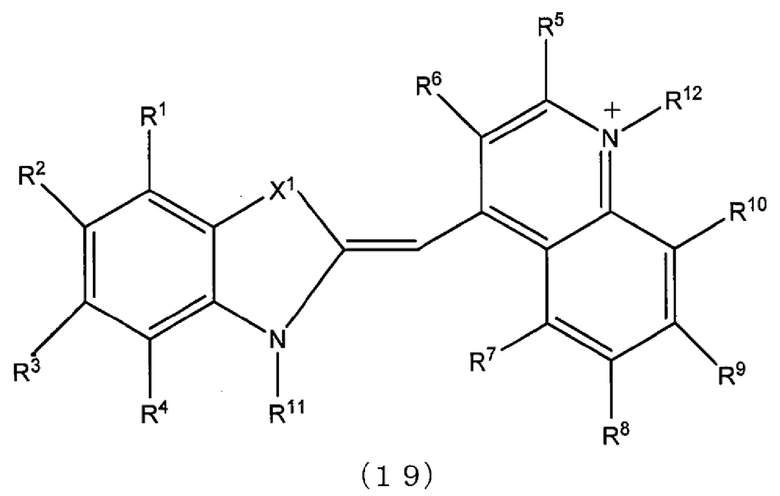

[0125] В формулах (19) и (20) X1 обозначает -S- или -O-. Каждое из от R1 to R10 и R13 и R14 независимо обозначает атом водорода, атом галогена, низшую алкильную группу, низшую алкоксильную группу, нитрогруппу или аминогруппу. Одно из R11 и R12 представляет собой линкерную группу, которая связана с L1 или L2 в формулах (16), (17), (16b), (17b), (18) и (18b), и другое представляет собой атом водорода или низшую алкильную группу.
[0126] Особенно предпочтительно каждое из Z11 и Z12 независимо представляет собой атомную группу, представленную любой одной из следующих химических формул.

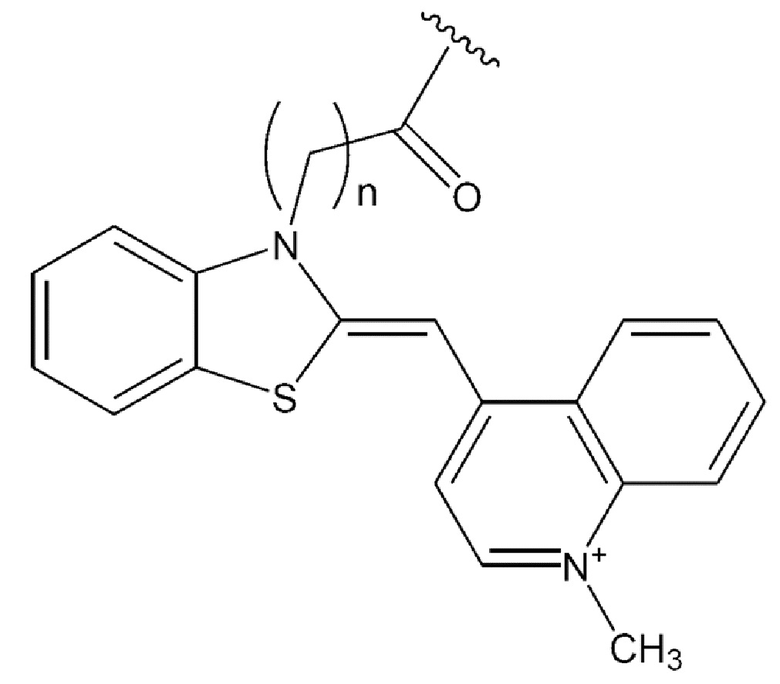

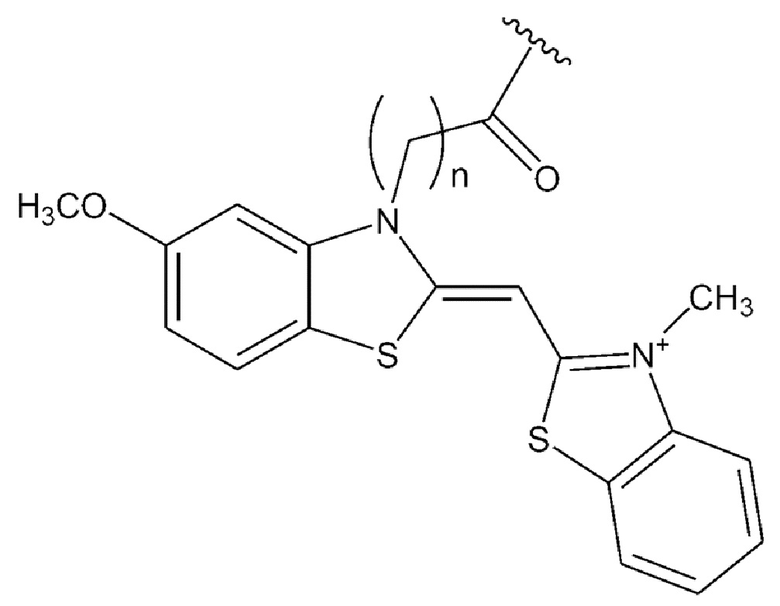
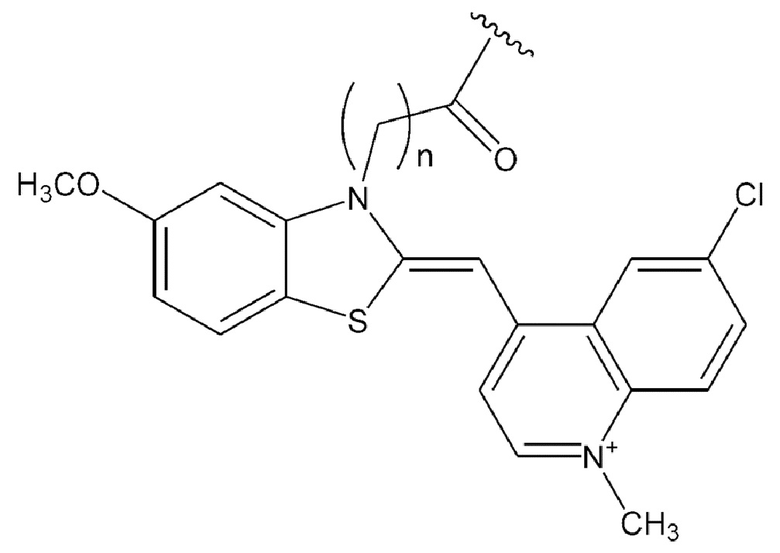

[0127] В каждой из приведенных выше химических формул особенно предпочтительно n представляет собой положительное целое в диапазоне от 2 до 6.
[0128] В формулах (16), (17), (16b), (17b), (18) и (18b) B может иметь остов природного нуклеинового основания, а также, как описано выше, может иметь остов искусственного нуклеинового основания. Например, B предпочтительно представляет собой структуру, представленную с помощью Py (пиримидинового кольца), производного Py, Pu (пуринового кольца) или производного Pu. Py представляет собой атомную группу, имеющую ковалентную связь с E в 1 положении и ковалентную связь с линкерным фрагментом в 5 положении в шестичленном кольце, представленном следующей формулой (11). Производное Py представляет собой атомную группу, в которой по меньшей мере один из всех атомов шестичленного кольца Py заменен на атом N, C, S или O, и атом N, C, S или O необязательно может иметь электрический заряд, атом водорода или заместитель. Pu представляет собой атомную группу, имеющую ковалентную связь с E в 9 положении и ковалентную связь с линкерным фрагментом в 8 положении в конденсированном кольце, представленном следующей формулой (12). Производное Pu представляет собой атомную группу, в которой по меньшей мере один из всех атомов пятичленного кольца Pu заменен на атом N, C, S или O, и атом N, C, S или O необязательно может иметь электрический заряд, атом водорода или заместитель.
[0129]

[0130] Молекула нуклеиновой кислоты в Э-зонде может содержать, например, по меньшей мере одну из структур, представленных следующими химическими формулами 106, 110, 113, 117, 120, 122, 123, 124 и 114-2, их геометрические изомеры и стереоизомеры и их соли.
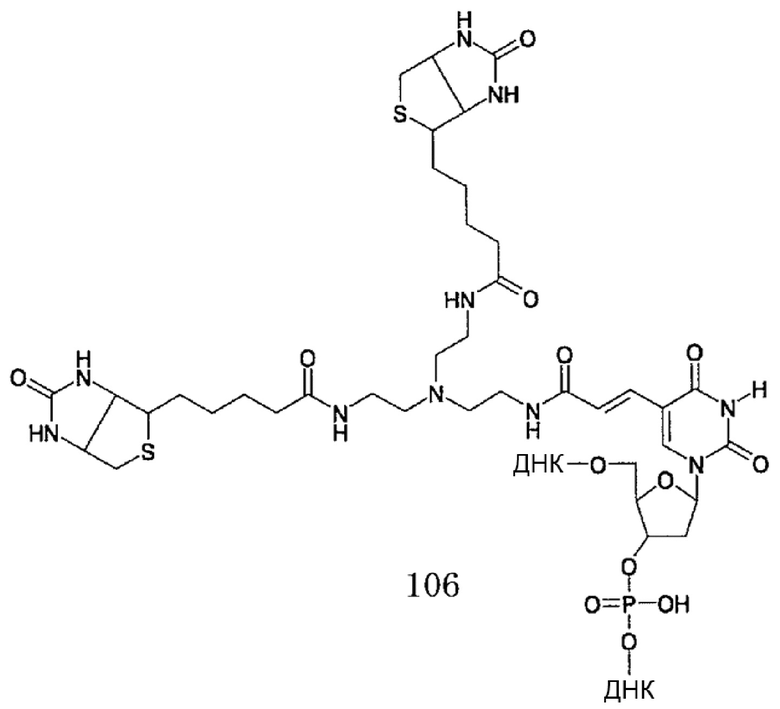


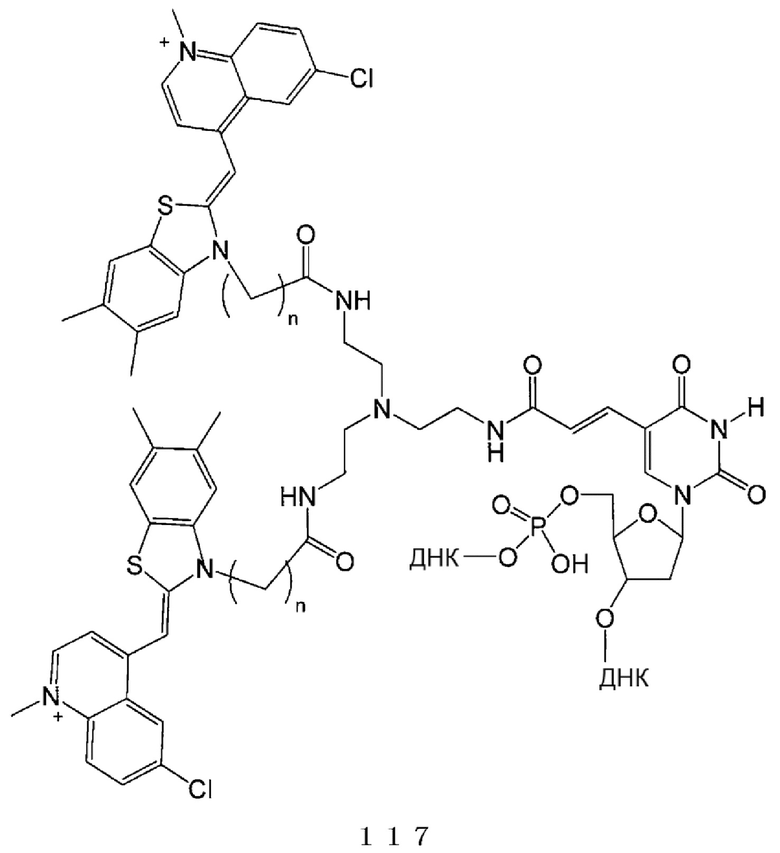



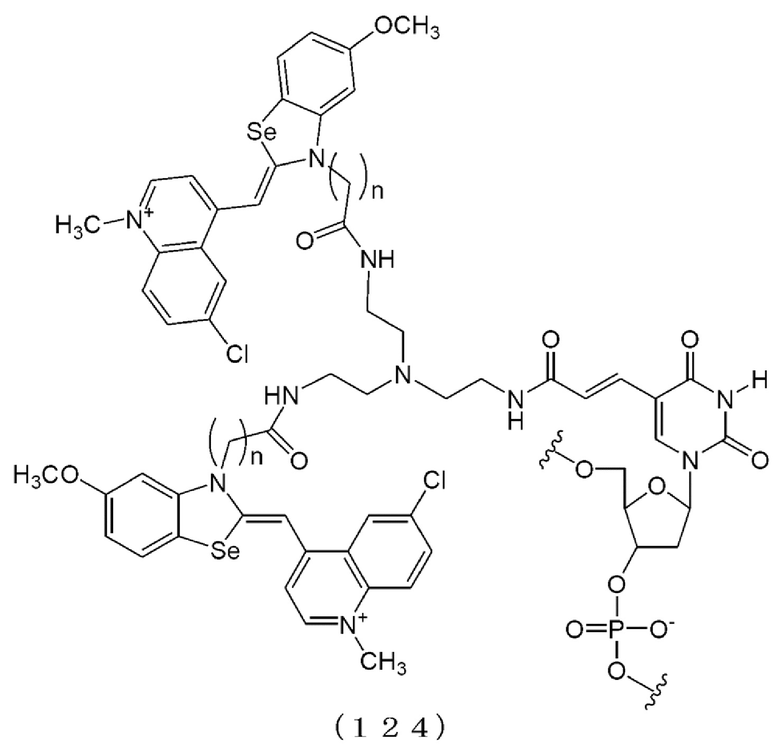

[0131] В химических формулах 106, 110, 113, 117, 120, 122, 123, 124 и 114-2 длина линкера n предпочтительно представляет собой положительное целое и в диапазоне от 2 до 6.
[0132] Число меченных структур, содержащихся в Э-зонде, конкретно не ограничено, и составляет, например, приблизительно от 1 до 100 или приблизительно от 1 до 20. В Э-зонде сайт, в котором содержится меченная структура, также конкретно не ограничен.
[0133] Зонд может содержать, например, любой один из природного нуклеотидного остатка, ненуклеотидного остатка, модифицированного нуклеотидного остатка и неприродного основного остова, и зонд может содержать один, два, три или четыре из них. Неприродный основной остов конкретно не ограничен, и его примеры включают LNA, PNA и нуклеиновые кислоты, имеющие модифицированную фосфодиэфирную связь. Кроме того, модифицированный нуклеотидный остаток конкретно не ограничен и может представлять собой фосфоротиоатный нуклеотидный остаток, и нуклеотидный остаток может содержать атом серы (S) или может быть модифицирован атомом серы (S).
[0134] Остов оснований зонда конкретно не ограничен. Его примеры включают олигонуклеотиды, модифицированные олигонуклеотиды, олигонуклеозиды, модифицированные олигонуклеозиды, полинуклеотиды, модифицированные полинуклеотиды, полинуклеозиды, модифицированные полинуклеозиды, ДНК, модифицированную ДНК, РНК, модифицированную РНК, LNA, PNA (пептидо-нуклеиновые кислоты), их химерные молекулы и другие структуры. Кроме того, остов оснований нуклеиновой кислоты может быть природным или искусственно синтезированным. Когда нуклеиновая кислота представляет собой зонд, нуклеиновая кислота конкретно не ограничена до тех пор, например, пока она может обеспечивать спаривание оснований. Когда нуклеиновая кислота представляет собой образец нуклеиновой кислоты или последовательность нуклеиновой кислоты-мишени, нуклеиновая кислота конкретно не ограничена до тех пор пока, например, она служит в качестве матрицы для синтеза комплементарной цепи. Следовательно, нуклеиновая кислота может представлять собой производное нуклеотида, например, которое частично или полностью состоит из полностью искусственной структуры. Примеры искусственных оснований, которые составляют нуклеиновую кислоту, включают, но не ограничиваясь этим, 2-амино-6-(N,N-диметиламино)пурин пиридин-2-он, 5-метилпиридин-2-он, 2-амино-6-(2-тиенил)пурин, пиррол-2-карбальдегид, 9-метилимидазо[(4,5)-b]пиридин, 5-йод-2-оксо(1H)пиридин 2-оксо-(1H)пиридин, 2-амино-6-(2-тиазолил)пурин и 7-(2-тиенил)-имидазо[4,5-b]пиридин.
[0135] В способе анализа по настоящему изобретению «нуклеотид» может представлять собой, например, дезоксинуклеотид или рибонуклеотид и каждый «олигонуклеотид» и «полинуклеотид» может состоять из одного из дезоксинуклеотида и рибонуклеотида или может содержать их обоих. В зонде число оснований, которые составляют нуклеиновую кислоту, конкретно не ограничено. В целом, термин «нуклеиновая кислота» является синонимом термина «полинуклеотид». В целом, термин «олигонуклеотид» используют в качестве термина, обозначающего полинуклеотид, состоящего, в частности, из небольшого числа оснований, среди прочего. В целом, полинуклеотид, например, от 2 до 100 оснований, в более общем смысле приблизительно от 2 до 50 оснований обозначают как «олигонуклеотид», но он не ограничен этими числовыми значениями. В первом способе анализа термин «полинуклеотид» также следует интерпретировать как охватывающий, например, полинуклеотид и олигонуклеотид, а также искусственно синтезированные нуклеиновые кислоты, такие как пептидо-нуклеиновая кислота, морфолиновая нуклеиновая кислота, метилфосфонатная нуклеиновая кислота и S-олигонуклеиновая кислота.
[0136] В целом, пептидо-нуклеиновая кислота (PNA) имеет структуру, в которой главная дезоксирибозная цепь олигонуклеотида заменена на главную пептидную цепь. Примеры пептидной главной цепи включают повторяющееся звено N-(2-аминоэтил)глицина, связанное амидной связью. Примеры основания, связываемого с главной пептидной цепью в PNA, включают, но не ограничиваясь этим: встречающиеся в природе основания, такие как тимин, цитозин, аденин, гуанин, инозин, урацил, 5-метилцитозин, тиоурацил и 2,6-диаминопурин; и искусственные основания, такие как бромтимин, азааденин и азагуанин.
[0137] В целом, LNA представляет собой нуклеиновую кислоту, которая имеет две циклические структуры, где в сахаро-фосфатном остове, атом кислорода в положении 2' и атом углерода в положении 4' рибозы связаны друг с другом посредством метиленовой сшивки. Когда олигонуклеотид, содержащий LNA, ренатурирует с ДНК, происходит изменение двухцепочечной конформации, в соответствии с чем происходит усовершенствование тепловой стабильности. LNA имеет более высокую аффинность связывания с нуклеиновой кислотой, чем обыкновенный олигонуклеотид. Таким образом, например, надлежащим образом задавая условия разработки олигонуклеотида, можно достигать более надежной и прочной гибридизации.
[0138] Число оснований, содержащихся в зонде, конкретно не ограничено и может составлять, например, приблизительно от 5 приблизительно до 100, приблизительно от 6 до 50 или приблизительно от 6 до 25.
[0139] Набор флуорогенных праймеров, содержащих генерирующее сигнал вещество, может представлять собой, например, праймер, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или праймер, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
[0140] Генерирующее сигнал вещество флуорогенного праймера может представлять собой, как описано выше, любое вещество до тех пор, пока оно является флуорогенным. Конкретные примеры генерирующего сигнал вещества включают вещество, которое демонстрирует феномен гашения флуоресценции, и флуоресцентную атомную группу, которая демонстрирует экситонный эффект. Конкретные примеры флуорогенного праймера включают праймер, содержащий вещество, который демонстрирует феномен гашения флуоресценции (праймер с феноменом гашения (далее в настоящем описании также обозначаемый как «Г-праймер»)), и праймер, содержащий по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу (далее в настоящем описании также обозначаемую как «Э-праймер»).
[0141] Э-праймер представляет собой, как описано выше, праймер, содержащий по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект в качестве генерирующего сигнал вещества, на молекулу. В отношении Э-праймера можно дать ссылку на описание Э-зонда, заменив «Э-зонд» на «Э-праймер» и «зонд» на «праймер», если не указано иное. Число меченных структур, содержащихся в Э-праймере, конкретно не ограничено и составляет, например, от 1 до 100 или от 1 до 20. В Э-праймере сайт, содержащий меченную структуру, конкретно не ограничен.
[0142] Число оснований, содержащихся в праймере, конкретно не ограничено и может составлять, например, приблизительно от 5 приблизительно до 100, приблизительно от 6 до 50 или приблизительно от 6 до 25.
[0143] В способе анализа по настоящему изобретению реактив для амплификации нуклеиновой кислоты может содержать, например, другие реактивы. Примеры другого реактива включают нефлуорогенный зонд, фермент, такой как полимераза, и мономер нуклеиновой кислоты (dNTP) для амплификации. Например, образец, содержащий матричную нуклеиновую кислоту, можно предварительно включать в реактив для амплификации нуклеиновой кислоты, образец, содержащий матричную нуклеиновую кислоту, можно включать в реактив для амплификации нуклеиновой кислоты на стадии фракционирования, каждую из фракций матричной нуклеиновой кислоты можно включать в реактив для амплификации нуклеиновой кислоты на стадии фракционирования или каждую из фракций матричной нуклеиновой кислоты можно включать в реактив для амплификации нуклеиновой кислоты после стадии фракционирования и перед стадией амплификации. Когда образец, содержащий матричную нуклеиновую кислоту, содержит реактив для амплификации нуклеиновой кислоты, образец, содержащий матричную нуклеиновую кислоту и реактив для амплификации нуклеиновой кислоты, можно фракционировать на множество фракций на стадии фракционирования, описанной далее.
[0144] Нефлуорогенный зонд представляет собой зонд, который генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в матричной нуклеиновой кислоте. Нефлуорогенный зонд представляет собой зонд, который не является флуорогенным, и может представлять собой, например, зонд, который не является флуорогенным зондом. Примеры нефлуорогенного зонда включают меченные флуоресценцией зонды, меченные флуоресцентными веществами. В частности, примеры включают зонд TaqMan®, циклический зонд, зонд Alexa Fluor® и Qdot®. В способе анализа по настоящему изобретению, вместо нефлуорогенного зонда можно использовать, например, интеркалятор, такой как SYBR® Green. В отношении положения и последовательности нефлуорогенного зонда, подлежащего гибридизации с предполагаемой последовательностью, например, можно дать ссылку на описание положения и последовательности флуорогенного зонда, подлежащего гибридизации с предполагаемой последовательностью. Когда реактив для амплификации нуклеиновой кислоты содержит нефлуорогенный зонд, тип нефлуорогенного зонда конкретно не ограничен, и можно дать ссылку, например, на примеры типа матричной нуклеиновой кислоты. Общее число типов нефлуорогенного зонда и типов генерирующего сигнал вещества предпочтительно является, например, таким же, как число типов матричной нуклеиновой кислоты. Когда реактив для амплификации нуклеиновой кислоты содержит нефлуорогенный зонд, генерирующее сигнал вещество и нефлуорогенный зонд могут генерировать или гасить сигналы в ответ на амплификацию последовательности-мишени и комплементарной последовательности в одной и той же матричной нуклеиновой кислоте или могут генерировать или гасить сигналы в ответ на амплификацию последовательностей-мишеней и комплементарных последовательностей в различных матричных нуклеиновых кислотах, и последнее является предпочтительным, поскольку это позволяет просто анализировать по меньшей мере две матричные нуклеиновые кислоты.
[0145] На стадии фракционирования усредненный объем множества фракций матричной нуклеиновой кислоты конкретно не ограничен и составляет, например, от 0,0001 до 5000 нл, от 0,0001 до 2000 нл, от 0,005 до 2000 нл, от 0,005 до 1000 нл, от 0,01 до 1000 нл, от 0,05 до 500 нл, от 0,1 до 500 нл, от 0,2 до 500 нл, от 0,5 до 500 нл, от 0,5 до 200 нл, от 0,5 до 100 нл, от 1 до 100 нл, от 1 до 50 нл, от 2 до 50 нл или от 5 до 50 нл.
[0146] В способе анализа по настоящему изобретению, предпочтительно каждую стадию осуществляют, например, в реакционном растворе. Реакционный раствор может содержать необходимый реактив надлежащим образом, например, в соответствии с типом способа амплификации.
[0147] 1. Стадия фракционирования
На стадии фракционирования образец, содержащий матричную нуклеиновую кислоту, фракционируют на множество фракций матричной нуклеиновой кислоты. На стадии фракционирования способ фракционирования образца конкретно не ограничен, и способ может представлять собой, например, способ фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством капания образца. В качестве конкретного примера, стадия фракционирования включает, например, следующую стадию (1-1) или стадию (1-2).
(1-1) Стадия формирования эмульсии из образца
(1-2) Стадия фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством распределения образца по чипу, на поверхности которого предусмотрено множество частей формирования фракций
[0148] Стадия (1-1)
На стадии (1-1) из образца формируют эмульсию. В эмульсии фракция матричной нуклеиновой кислоты представляет собой каплю образца, диспергированную в эмульсии. Эмульсию можно формировать с использованием водонерастворимого растворителя и водорастворимого растворителя (водного растворителя), которые формируют эмульсию, посредством приведения водонерастворимого растворителя в контакт с водорастворимым растворителем в присутствии образца для того, чтобы формировать множество капель в водонерастворимом растворителе. В отношении контакта, например, водорастворимый растворитель можно приводить в контакт с водонерастворимым растворителем или водонерастворимый растворитель можно приводить в контакт с водорастворимым растворителем. Способ формирования может представлять собой, например, способ формирования капелек с использованием канала микропотока (например, система RainDrop® производства RainDnace Technologies, система QX200® AutoDG® Droplet Digital PCR производства BIO-RAD, и т. д.). Образец может содержаться, например, в водонерастворимом растворителе или в водорастворимом растворителе. Когда матричная нуклеиновая кислота представляет собой, например, образец, диспергированный в водорастворимом растворителе, образец можно использовать в виде водорастворимого растворителя. В отношении формирования эмульсии, можно использовать обыкновенный способ формирования эмульсии. Способ формирования эмульсии конкретно не ограничен, и можно использовать, например, эмульгирующее устройство. Эмульгирующее устройство может представлять собой, например, канал потока, в котором предусмотрен канал потока образца, канал потока реактива для амплификации нуклеиновой кислоты, канал потока водонерастворимого растворителя, соединяющая их часть и канал потока доставки, доставляемого из соединяющей части. Когда используют эмульгирующее устройство, например, водонерастворимый растворитель вводят в соединяющую часть из канала потока водонерастворимого растворителя и затем образец вводят из канала потока образца и реактив для амплификации нуклеиновой кислоты вводят из канала потока реактива для амплификации нуклеиновой кислоты в соединяющую часть, в которую введен водонерастворимый растворитель. Затем, например, водонерастворимый растворитель, образец и реактив для амплификации нуклеиновой кислоты приводят в контакт друг с другом в соединяющей части и их смесь эмульгируют и доставляют из соединяющей части в канал потока доставки в виде эмульсии. В отношении образца и реактива для амплификации нуклеиновой кислоты, например, один из них может содержаться в водонерастворимом растворителе и другой может содержаться в водорастворимом растворителе или оба они могут содержаться в одном из водонерастворимого растворителя и водорастворимого растворителя. Реактив для амплификации нуклеиновой кислоты может содержаться, как описано выше, в образце. В этом случае эмульсию можно формировать аналогичным образом, как описано выше, с использованием эмульгирующего устройства, в котором предусмотрены, например, канал потока образца, канал потока водонерастворимого растворителя, соединяющая часть и канал потока доставки, доставляемого из соединяющей части.
[0149] Примеры водонерастворимого растворителя включают масло, минеральное масло, хлороформ и ароматические соединения. Можно использовать отдельно один из водонерастворимых растворителей или два или больше из них можно использовать в комбинации.
[0150] Примеры водорастворимого растворителя включают воду, буферные растворы и растворы водорастворимых полимеров. Можно использовать отдельно один из водорастворимых растворителей или два или больше из них можно использовать в комбинации.
[0151] На стадии (1-1) объемное соотношение (N:A) водонерастворимого растворителя (N) и водорастворимого растворителя (A), подлежащих приведению в контакт друг с другом, составляет, например, 1:0,00001-2,1:0,0001-1 или 1:0,001-0,5.
[0152] Эмульсия, сформированная на стадии (1-1), представляет собой, например, эмульсию вода-в-масле (типа W/O). Усредненный объем капли в эмульсии составляет, например, от 0,0001 до 50000 нл, от 0,001 до 500 нл или от 0,01 до 50 нл. Число капель в эмульсии не ограничено до тех пор пока оно составляет больше чем одну, и составляет, например, от 2 до 1000000000, от 1000 до 1000000000 или от 10000 до 1000000000. Концентрации матричной нуклеиновой кислоты и реактива для амплификации нуклеиновой кислоты, содержащихся в капле, конкретно не ограничены. Концентрация матричной нуклеиновой кислоты в капле составляет, например, от 0 до 5000 мкг/л, от 0 до 500 мкг/л или от 0 до 50 мкг/л.
[0153] Стадия (1-2)
На стадии (1-2) образец фракционируют на множество фракций матричной нуклеиновой кислоты посредством распределения образца по поверхности чипа, на которой предусмотрено множество частей формирования фракций. Чип, используемый на стадии (1-2), может представлять собой любой чип до тех пор, пока не его поверхности предусмотрено множество частей формирования фракций. Конкретные примеры чипа включают следующие чип (A), чип (B) и чип (C). Далее в настоящем описании стадию (1-2) обозначают как стадию (1-2A), когда используют чип (A), стадию (1-2) обозначают как стадию (1-2B), когда используют чип (B), и стадию (1-2) обозначают как стадию (1-2C), когда используют чип (C).
(A) Чип, в котором поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной.
(B) Чип, в котором часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа, и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку.
(C) Чип, в котором часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку чипа и внутренняя поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной, и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной.
[0154] Стадия (1-2A)
Стадия (1-2A) представляет собой стадию использования чипа (A). В чипе (A) поверхность части формирования фракции является гидрофильной и поверхность области, не содержащей часть формирования фракции является гидрофобной. Таким образом, посредством нанесения образца на поверхность чипа, образец отделяют в гидрофильные части формирования фракции матричной нуклеиновой кислоты с тем, чтобы образец можно было фракционировать на множество фракций матричной нуклеиновой кислоты.
[0155] В чипе (A) часть формирования фракции можно формировать, например, посредством нанесения растворителя, содержащего гидрофильное вещество, и растворителя, содержащего гидрофобное вещество, на подложку чипа. Когда подложка является гидрофильной или гидрофобной, часть формирования фракции можно формировать посредством нанесения растворителя, содержащего гидрофобное вещество, или растворителя, содержащего гидрофильное вещество, на подложку. Гидрофильное вещество и гидрофобное вещество конкретно не ограничены, и можно использовать общеизвестные вещества. В чипе (A) число частей формирования фракций конкретно не ограничено до тех пор, пока оно составляет больше единицы. Когда имеет место множество частей формирования фракций, расстояние между частями формирования фракций можно определять надлежащим образом, например, в соответствии с размером каждой фракции матричной нуклеиновой кислоты. В частности, расстояние может представлять собой расстояние, на котором фракции матричной нуклеиновой кислоты не контактируют друг с другом.
[0156] Стадия (1-2B)
Стадия (1-2B) представляет собой стадию использования чипа (B). В чипе (B) часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку. Таким образом, посредством нанесения образца на поверхность чипа, образец вводят в части формирования фракции матричной нуклеиновой кислоты, которые представляют собой выемки на чипе, с тем, чтобы образец можно было фракционировать на множество фракций матричной нуклеиновой кислоты.
[0157] В чипе (B) часть формирования фракции можно формировать, например, посредством резания подложки чипа. В чипе (B) число частей формирования фракций конкретно не ограничено до тех пор, пока оно составляет больше единицы. Внутреннее произведение части формирования фракции конкретно не ограничен, и его можно определять надлежащим образом в соответствии с усредненным объемом фракций матричной нуклеиновой кислоты, например.
[0158] Стадия (1-2C)
Стадия (1-2C) представляет собой стадию использования чипа (C). В чипе (C) часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку чипа и внутренняя поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной, и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, является не выемкой и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной. Таким образом, посредством нанесения образца на поверхность чипа, образец разделяется в гидрофильные части формирования фракции матричной нуклеиновой кислоты, с тем, чтобы образец можно было фракционировать на множество фракций матричной нуклеиновой кислоты. Чип (C) позволяет фракционировать образец на множество фракций матричной нуклеиновой кислоты быстро и точно вследствие комбинации выемки и гидрофильности в частях формирования фракций и комбинации не выемки и гидрофобности в области, не содержащей части формирования фракций.
[0159] В отношении способа формирования, числа и внутренних произведений частей формирования фракций чипа (C) можно дать ссылку на описания в отношении чипа (A) и чипа (B).
[0160] На стадии (1-2) реактив для амплификации нуклеиновой кислоты можно располагать в части формирования фракции матричной нуклеиновой кислоты чипа и во фракцию матричной нуклеиновой кислоты можно вносить реактив для амплификации нуклеиновой кислоты в части формирования фракции матричной нуклеиновой кислоты на чипе на стадии фракционирования. Число чипов, используемых на стадии (1-2), конкретно не ограничено, и его можно определять надлежащим образом в соответствии с числом фракций матричной нуклеиновой кислоты, подлежащих фракционированию на стадии фракционирования. В частности, число чипов, используемых на стадии (1-2), может равняться одному или больше чем одному.
[0161] 2. Стадия амплификации
На стадии амплификации последовательность-мишень и комплементарную ей последовательность в матричной нуклеиновой кислоте амплифицируют в присутствии реактива для нуклеиновой кислоты в отношении каждой из множества фракций матричной нуклеиновой кислоты. В частности, стадию амплификации проводят, воздействуя на водонерастворимый растворитель условиями реакции амплификации нуклеиновой кислоты. Тем самым, последовательность-мишень и комплементарную ей последовательность в матричной нуклеиновой кислоте амплифицируют с каждого из первого праймера и второго праймера в отношении фракции матричной нуклеиновой кислоты, содержащей матричную нуклеиновую кислоту и реактив для амплификации нуклеиновой кислоты, среди множества фракций матричной нуклеиновой кислоты.
[0162] В способе анализа по настоящему изобретению способ амплификации, применяемый на стадии амплификации, может представлять собой, например, способ изотермальной амплификации и неизотермальной амплификации. Способ изотермальной амплификации может представлять собой, например, способ SmartAmp (NATURE METHODS (2007) том 4 №3 стр. 257, японский патент № 3897805), способ амплификации замещением цепей (SDA) (JP H7(1995)-114718 B), модифицированный способ SDA (патент США № 5824517, WO 99/09211, WO 95/25180), способ амплификации последовательности нуклеиновой кислоты (NASBA) (японский патент № 2650159), способ петлевой изотермальной амплификации (LAMP) (японский патент № 3313358, Nucleic Acids Research, 2000, том 28, №12, e63), изотермальную и инициируемую химерными праймерами амплификацию нуклеиновых кислот (ICAN) (WO 02/16639), способ самоподдерживающейся репликации последовательностей (3SR), способ транскрипционно-опосредованной амплификации (TMA), способ Invader и способ амплификации по типу катящегося кольца (RCA). Стадии и условия изотермальной амплификации конкретно не ограничены, и можно использовать стадии и условия стандартных изотермальных реакций амплификации. Способом неизотермальной амплификации может быть, например, способ ПЦР. Стадии и условия неизотермальной амплификации конкретно не ограничены, и можно использовать стадии и условия стандартных неизотермальных реакций амплификации. Кроме того, как описано ниже, например, в случае анализа метилирования матричной нуклеиновой кислоты, гидроксиметилирования матричной нуклеиновой кислоты или тому подобного, способ амплификации может представлять собой, например, способ специфической ПЦР концов (ESPCR), способ хелпер-зависимой цепной реакции (HDCR) и т. п. Стадии и условия способа ESPCR и способа HDCR конкретно не ограничены, и можно использовать стандартные стадии и условия.
[0163] Как описано выше, способ амплификации по настоящему изобретению дополнительно может включать стадию создания кДНК из РНК посредством обратной транскрипции, например, когда матричная нуклеиновая кислота на стадии амплификации представляет собой кДНК. В этом случае, например, РНК представляет собой матричную нуклеиновую кислоту для обратной транскрипции на стадии обратной транскрипции и кДНК, получаемая на стадии обратной транскрипции, представляет собой матричную нуклеиновую кислоту для реакции амплификации на стадии амплификации. РНК может представлять собой, как описано выше, например, РНК, содержащуюся в образце организма.
[0164] 3. Стадия обнаружения
На стадии обнаружения, генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении множества фракций, после стадии амплификации. Тип сигнала конкретно не ограничен, и его можно определять надлежащим образом в соответствии с типом генерирующего сигнал вещества. Примеры типа сигнала включают флуоресценцию и люминесценцию. На стадии обнаружения, например, степень амплификации можно обнаруживать посредством измерения интенсивности сигнала. Описание по настоящему изобретению далее приведено со ссылкой на сигнал флуоресценции в качестве сигнала, если не указано иное. Настоящее изобретение, однако, не ограничено этим, и «сигнал флуоресценции» можно заменять, например, на «сигнал люминесценции».
[0165] На стадии обнаружения, как описано выше, обнаружение сигнала, который отражает амплификацию, может представлять собой, например, обнаружение амплифицированного продукта, получаемого с использованием праймера, или обнаружение ассоциации амплифицированного продукта и зонда или диссоциации ассоциата. В первом случае, обнаружение сигнала может представлять собой, например, обнаружение формирования или диссоциации двухцепочечной структуры. Способ обнаружения формирования или диссоциации двухцепочечной структуры конкретно не ограничен. В последнем случае, обнаружение сигнала, который отражает амплификацию, может представлять собой, например, обнаружение ассоциации зонда и амплифицированного продукта или диссоциации ассоциата в соответствии с изменением температуры, изменением pH, изменением концентрации или изменением концентрации соли денатурирующего средства. В целом, известно, что пара одноцепочечных нуклеиновых кислот, имеющих последовательности, комплементарные друг другу, ассоциируют (формирование двухцепочечной структуры) или диссоциируют (диссоциация двухцепочечной структуры на одноцепочечные структуры) в соответствии с описанными выше изменениями. На стадии обнаружения, способ обнаружения ассоциации или диссоциации ассоциата в соответствии с изменением температуры, изменением pH и изменением концентрации или изменением концентрации соли денатурирующего средства конкретно не ограничен, и может представлять собой, например, способ обнаружения, проводимый анализа кривой плавления.
[0166] На стадии обнаружения, способ обнаружения сигнала в отношении множества фракций матричной нуклеиновой кислоты конкретно не ограничен, и его можно определять надлежащим образом в соответствии с типом сигнала. Способ обнаружения может представлять собой, например, обнаружение с использованием проточного цитометра, флуоресцентного микроскопа, флуоресцентного спектрометра или тому подобного. Кроме того, способ обнаружения может представлять собой высокоточный способ обнаружения, который допускает интенсивность флуоресценции на молекулу во фракции матричной нуклеиновой кислоты, подлежащей анализу, поскольку он повышает чувствительность обнаружения сигнала и допускает более точный анализ матричной нуклеиновой кислоты. Примеры высокоточного способа обнаружения включают флуоресцентную корреляционную спектроскопию (FCS), анализ распределения интенсивности флуоресценции (FIDA), FIDA поляризацию (FIDA-PO) и сканирующий подсчет отдельных молекул (SSMC).
[0167] Когда стадия фракционирования представляет собой стадию (1-1), генерацию или гашение сигнала обнаруживают в отношении капли в эмульсии на стадии обнаружения. Способ обнаружения сигнала конкретно не ограничен, и может представлять собой, например, способ обнаружения эмульсии, которая проходит через канал потока, способ обнаружения эмульсии после ее проявки в плоской форме и т. п.
[0168] В случае обнаружения эмульсии, проходящей через канал потока, предпочтительно, эмульсию пропускают через канал потока, и генерацию или гашение сигнала обнаруживают в отношении капли в предварительно определяемом месте канала потока, когда капля в эмульсии проходит через канал потока. В канале потока предварительно определяемое место можно задавать в любом положении. Нет конкретных ограничений геометрической формы и длины канала потока. Внутренний диаметр канала потока конкретно не ограничен и может составлять, например, средний диаметр капли. Канал потока может иметь, например, фиксированный внутренний диаметр в целом или может частично иметь различные внутренние диаметры. Канал потока может представлять собой, например, канал потока, имеющий внутренний диаметр в предварительно определяемом месте, что позволяет каплям проходить по меньшей мере одна за одной. Посредством конструирования канала потока, имеющего такой внутренний диаметр, например, каждую из множества капель можно обнаруживать в предварительно определяемом месте, что допускает более точный анализ матричной нуклеиновой кислоты.
[0169] Кроме того, в случае обнаружения эмульсии, проходящей через канал потока, можно извлекать капли, в каждой из которых обнаружена амплификация (амплифицированные фракции), посредством стадии извлечения на стадии обнаружения способа анализа по настоящему изобретению. На стадии извлечения, также можно извлекать капли, в каждой из которых не обнаружена амплификация. В частности, в случае извлечения капель, в каждой из которых амплификация обнаружена, и капель, в каждой из которых амплификация не обнаружена, на стадии обнаружения, канал потока содержит, от стороны выше по потоку в направлении стороны ниже по потоку, первый канал потока и второй канал потока и третий канал потока, которые отходят от конца первого канала потока на стороне ниже по потоку. Первый канал потока представляет собой канал потока, через который проходит водонерастворимый растворитель, который подвергали стадии обнаружения, второй канал потока представляет собой канал потока, через который проходят капли, в каждой из которых амплификация обнаружена на стадии обнаружения, и третий канал потока представляет собой канал потока, через который проходят капли, в каждой из которых амплификация не обнаружена на стадии обнаружения. Кроме того, первый канал потока содержит предварительно определяемое место в концевой область его стороны ниже по потоку и стадию извлечения, на которой извлекают капли, в каждой из которых амплификация обнаружена, и капли, в каждой из которых амплификация не обнаружена. На стадии обнаружения капли, проходящие через предварительно определяемое место первого канала потока, вводят во второй канал потока посредством стадии извлечения при обнаружении амплификации и вводят в третий канал потока посредством стадии извлечения при обнаружении отсутствия амплификации. Первый способ анализа с каналом потока, имеющим такую структуру, позволяет извлекать капли, в каждой из которых амплификация обнаружена, и капли, в каждой из которых амплификация не обнаружена, посредством стадии извлечения. Таким образом, например, капли, в каждой из которых амплификация обнаружена, можно анализировать повторно, что позволяет анализировать матричную нуклеиновую кислоту более точно. В концевой области ниже по направлению считывания необходимо только располагать предварительно определяемое место и стадию извлечения с тем, чтобы стадия извлечения позволяла извлекать капли на основании обнаружения амплификации в капле. Например, в концевой области ниже по направлению считывания предварительно определяемое место располагают на стороне выше по потоку первого канала потока относительно стадии извлечения.
[0170] На стадии обнаружения, способ извлечения капель, в каждой из которых амплификация обнаружена, и капель, в каждой из которых амплификация не обнаружена, конкретно не ограничен и можно использовать общеизвестный способ извлечения капелек. Примеры способа извлечения включают способ извлечения капель посредством всасывания и способ извлечения капель посредством зарядов. На стадии извлечения, например, капли можно заряжать положительно или отрицательно. В случае извлечения капель посредством зарядов, стадия извлечения может представлять собой, например, заряжающий блок, который заряжает капли, подлежащие введению в первый канал потока, или капли, которые введены в первый канал потока. В последнем случае, стадия извлечения может представлять собой, например, заряжающий блок, который заряжает капли, которые прошли через предварительно определяемое место. В этом случае, второй канал потока содержит любой один из положительного электрода и отрицательного электрода, а третий канал потока содержит другой. На стадии обнаружения, когда обнаружена амплификация капли, которая прошла через предварительно определяемое место первого канала потока, каплю заряжают с противоположной полярностью второго канала потока и вводят во второй канал потока посредством стадии извлечения. На стадии обнаружения, когда не обнаружена амплификация капли, которая прошла через предварительно определяемое место первого канала потока, каплю заряжают с обратной полярностью третьего канала потока и вводят в третий канал потока посредством стадии извлечения. На стадии извлечения капли можно заряжать положительно или отрицательно. В этом случае, каждый из второго канала потока и третьего канала потока имеет электрод, который должен быть заряжен положительно или отрицательно. Когда обнаружена амплификация капли, которая заряжена посредством стадии извлечения и прошла через предварительно определяемое место первого канала потока, второй канал потока заряжают с обратной полярностью капли и каплю вводят во второй канал потока. Когда не обнаружена амплификация капли, которая заряжена посредством стадии извлечения и прошла через предварительно определяемое место первого канала потока, третий канал потока заряжают с обратной полярностью капли и каплю вводят в третий канал потока.
[0171] В случае обнаружения сигнала посредством проявки эмульсии в плоской форме, предпочтительно, на стадии обнаружения получают изображение капель в эмульсии, которая проявлена в плоской форме. Изображение капель можно получать, например, посредством общеизвестного блока визуализации, такого как флуоресцентный микроскоп.
[0172] Когда стадия фракционирования представляет собой стадию (1-2), изображение множества фракций матричной нуклеиновой кислоты по меньшей мере на одном чипе получают на стадии обнаружения. Изображение множества фракций матричной нуклеиновой кислоты можно получать, например, посредством описанного выше блока визуализации.
[0173] Когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, на стадии обнаружения генерацию или гашение сигнала, который отражает амплификацию, можно обнаруживать отдельно в отношении каждой из матричных нуклеиновых кислот, генерацию или гашение сигнала можно обнаруживать одновременно в отношении нескольких матричных нуклеиновых кислот и отдельно в отношении остальных матричных нуклеиновых кислот или генерацию или гашение сигнала можно обнаруживать одновременно в отношении всех матричных нуклеиновых кислот. В частности, когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, например, амплификацию каждой из матричных нуклеиновых кислот можно обнаруживать посредством обнаружения генерирующего сигнал вещества, которое генерирует или гасит сигнал в отношении каждой из матричных нуклеиновых кислот.
[0174] Когда реактив для амплификации нуклеиновой кислоты содержит нефлуорогенный зонд, на стадии обнаружения амплификацию матричной нуклеиновой кислоты можно обнаруживать, например, посредством обнаружения генерации или гашения сигнала нефлуорогенного зонда.
[0175] В настоящем изобретении, например, стадию обнаружения можно проводить во время стадии амплификации. В этом случае генерацию или гашение сигнала можно обнаруживать, например, по меньшей мере один раз в течение стадии амплификации.
[0176] 4. Стадия различения
На стадии различения фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты различают в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность. Стадию различения можно осуществлять, например, на основании присутствия или отсутствия сигнала или интенсивности сигнала. В последнем случае, например, задают порог интенсивности сигнала, и фракцию матричной нуклеиновой кислоты, в которой обнаружена интенсивность сигнала, которая равна порогу или больше него, или интенсивность сигнала, которая равна порогу или меньше него, различают в качестве амплифицированной фракции. В качестве конкретного примера, когда сигнал генерируют посредством амплификации, фракцию матричной нуклеиновой кислоты, в которой обнаружена интенсивность сигнала, равная порогу или больше него, различают в качестве амплифицированной фракции, и фракцию матричной нуклеиновой кислоты, в которой обнаружена интенсивность сигнала, которая меньше чем порог, не различают в качестве амплифицированной фракции.
[0177] Когда изображение капель получают на стадии обнаружения, на стадии стадия различения каплю в эмульсии, в которой обнаружена генерация или гашение сигнала на изображении, различают в качестве амплифицированной фракции. На стадии обнаружения, когда получают изображение множества фракций матричной нуклеиновой кислоты, на стадии различения фракцию матричной нуклеиновой кислоты на чипе, в которой обнаружена генерация или гашение сигнала на изображении, различают в качестве амплифицированной фракции. Различение можно осуществлять, например, на основании присутствия или отсутствия сигнала или интенсивности сигнала.
[0178] Когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, на стадии различения можно различать фракцию матричной нуклеиновой кислоты, в которой обнаружена амплификация одной матричной нуклеиновой кислоты, в качестве амплифицированной фракции, различать фракцию матричной нуклеиновой кислоты, в которой обнаружена амплификация по меньшей мере двух матричных нуклеиновых кислот, в качестве амплифицированной фракции или различать фракцию матричной нуклеиновой кислоты, в которой обнаружена амплификация всех матричных нуклеиновых кислот, в качестве амплифицированной фракции.
[0179] Когда реактив для амплификации нуклеиновой кислоты содержит нефлуорогенный зонд, например, на стадии различения можно различать фракцию матричной нуклеиновой кислоты, в которой обнаружена амплификация матричной нуклеиновой кислоты, в качестве амплифицированной фракции посредством обнаружения генерации или гашения сигнала нефлуорогенного зонда.
[0180] В способе анализа по настоящему изобретению, комбинация генерирующего сигнал вещества, стадии фракционирования и стадии амплификации конкретно не ограничена и может представлять собой, например, комбинации с (i) до (xii), представленные в следующей таблице 1. В таблице 1 генерирующее сигнал вещество, стадию фракционирования и стадию амплификации, используемые в комбинациях с (i) до (xii), обозначают «пустыми кругами (○)».
[0181] [Таблица 1]
[0182] Когда матричная нуклеиновая кислота представляет собой комплекс матричной нуклеиновой кислоты, содержащий вещество-мишень и связывающее вещество, способ анализа по настоящему изобретению может включать стадию формирования комплекса матричной нуклеиновой кислоты посредством приведения образца, содержащего вещество-мишень, в контакт со связывающим веществом, меченным матричной нуклеиновой кислотой, перед стадией фракционирования. Кроме того, когда матричная нуклеиновая кислота представляет собой комплекс матричной нуклеиновой кислоты, содержащий вещество-мишень и связывающее вещество, например, определение присутствия или отсутствия вещества-мишени (качественный анализ), определение количества вещества-мишени (количественный анализ) и т. п. можно осуществлять на основании результата, получаемого на стадии определения, описанной далее.
[0183] В способе анализа по настоящему изобретению, например, генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, можно обнаруживать в отношении каждой из множества фракций матричной нуклеиновой кислоты перед стадией амплификации, и фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты, можно различать в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность, посредством сравнения сигнала, обнаруживаемого перед стадией амплификации, и сигнала, обнаруживаемого после стадии амплификации, на стадии различения. Кроме того, в способе анализа по настоящему изобретению генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, можно обнаруживать в отношении каждой из множества фракций матричной нуклеиновой кислоты перед стадией фракционирования, и фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты можно различать в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность, посредством сравнения сигнала, обнаруживаемого перед стадией фракционирования, и сигнала, обнаруживаемого после стадии амплификации, на стадии различения. В соответствии со способом анализа по настоящему изобретению, например, влияния фона при различении можно избегать посредством различения амплифицированной фракции на стадии различения с использованием сигнала, обнаруживаемого перед стадией фракционирования или перед стадией амплификации, что позволяет более точно анализировать матричную нуклеиновую кислоту. В частности, в случае, когда сигнал генерируют посредством амплификации и различение осуществляют, посредством установления порога интенсивности сигнала, различение можно осуществлять с использованием разности интенсивностей сигнала, получаемой посредством вычитания интенсивности сигнала, обнаруживаемого перед стадией амплификации, или интенсивности сигнала, обнаруживаемого перед стадией фракционирования, из интенсивности сигнала, обнаруживаемого после стадии амплификации. Более конкретно, фракцию матричной нуклеиновой кислоты, в которой разность интенсивностей сигнала равна порогу или больше него, различают в качестве амплифицированной фракции, и фракцию матричной нуклеиновой кислоты, в которой разность интенсивностей сигнала меньше порога, не различают в качестве амплифицированной фракции.
[0184] В способе анализа по настоящему изобретению комбинация генерирующего сигнал вещества, стадии фракционирования, стадии амплификации и стадии обнаружения конкретно не ограничена и может представлять собой, например, комбинации от (i-1) до (xii-3), представленные в следующей таблице 2. В таблице 2 генерирующее сигнал вещество, стадия фракционирования, стадия амплификации и стадия обнаружения, используемые в комбинациях от (i-1) до (xii-3), обозначают «пустыми кругами (○)».
[0185] [Таблица 2]
[0186] Способ анализа по настоящему изобретению дополнительно может включать, например, стадию проведения анализа посредством анализа кривой плавления после стадии обнаружения. В соответствии со способом анализа по настоящему изобретению, например, амплификацию последовательности-мишени или комплементарной последовательности можно анализировать более конкретно и точно посредством объединения генерирующего флуорогенный сигнал вещества и стадии анализа, проводимой посредством анализа кривой плавления, что позволяет более точно анализировать матричную нуклеиновую кислоту.
[0187] Способ анализа по настоящему изобретению дополнительно может включать, например, после стадии различения, стадию извлечения амплифицированной фракции, в которой обнаружена амплификация последовательности-мишени или комплементарной последовательности на стадии различения. В способе анализа по настоящему изобретению, благодаря стадии извлечения, например, амплифицированную фракцию, в которой обнаружена амплификация, можно анализировать повторно, что позволяет анализировать матричную нуклеиновую кислоту более точно. Стадию извлечения можно осуществлять, например, посредством блока извлечения.
[0188] На стадии различения, когда амплификацию последовательности-мишени или комплементарной последовательности различают на основании изображения капель, на стадии извлечения извлекают каплю, которую различили в качестве амплифицированной фракции, из эмульсии, проявленной в плоской форме. Кроме того, на стадии различения, когда амплификацию последовательности-мишени или комплементарной последовательности различают на основании изображения множества фракций матрицы, на стадии извлечения извлекают фракцию матричной нуклеиновой кислоты, которую различили в качестве амплифицированной фракции, из чипа. На стадии извлечения можно использовать, например, общеизвестный раствор аппарат для извлечения и т. п.
[0189] Когда способ анализа по настоящему изобретению включает стадию извлечения, предпочтительно, способ анализа дополнительно включает стадию амплификации последовательности-мишени и комплементарной последовательности в матричной нуклеиновой кислоте в отношении амплифицированной фракции. Эту амплификацию обозначают как вторую стадию амплификации. В способе анализа по настоящему изобретению, благодаря второй стадии амплификации, например, сигнал амплифицированной фракции можно усиливать, что позволяет анализировать матричную нуклеиновую кислоту более точно. Вторую стадию амплификации можно проводить, например, аналогичным образом, как и стадию амплификации.
[0190] Способ анализа по настоящему изобретению дополнительно может включать, например, стадию определения матричной нуклеиновой кислоты на основании результата обнаружения, получаемого на стадии обнаружения. Следует отметить, что определение матричной нуклеиновой кислоты конкретно не ограничено, и его примеры включают определение присутствия или отсутствия матричной нуклеиновой кислоты (качественный анализ), определение количества матричной нуклеиновой кислоты (количественный анализ) и определение типа основания в сайте мутации нуклеиновой кислоты в матричной нуклеиновой кислоте (типирование), как описано выше. Когда образец содержит по меньшей мере две матричные нуклеиновые кислоты, можно определять одну матричную нуклеиновую кислоту, можно определять по меньшей мере две матричные нуклеиновые кислоты или можно определять все матричные нуклеиновые кислот на стадии определения матричной нуклеиновой кислоты. Кроме того, когда реактив для амплификации нуклеиновой кислоты содержит нефлуорогенный зонд, например, матричную нуклеиновую кислоту можно определять на основании результата обнаружения, получаемого с использованием нефлуорогенного зонда в дополнение к результату обнаружения, получаемому с использованием генерирующего сигнал вещества. Кроме того, когда обнаружены генерация или гашение сигнала, который отражает амплификацию, перед стадией фракционирования или перед стадией амплификации, матричную нуклеиновую кислоту можно определять на стадии определения на основании сигнала, обнаруживаемого перед стадией фракционирования, и сигнала, обнаруживаемого на стадии обнаружения после стадии амплификации.
[0191] В способе анализа по настоящему изобретению, предварительную обработку, например, можно применять к матричной нуклеиновой кислоте, содержащейся в образце, в соответствии с целью анализа. Предварительную обработку, например, можно осуществлять перед стадией амплификации, в частности, перед стадией фракционирования, или можно осуществлять после стадии фракционирования и перед стадией амплификации. В последнем случае, например, реактив, необходимый для предварительной обработки, можно вводить во фракцию. Предпочтительно, предварительную обработку осуществляют, например, перед стадией фракционирования. То есть, в способе анализа по настоящему изобретению, предпочтительно, после применения предварительной обработки к матричной нуклеиновой кислоте, содержащейся в образце, осуществляют стадию фракционирования и впоследствии осуществляют стадию амплификации.
[0192] В случае анализа модификации матричной нуклеиновой кислоты посредством способа анализа по настоящему изобретению, предпочтительно, предварительную обработку применяют к матричной нуклеиновой кислоте на стадии предварительной обработки. Примеры модификации включают метилирование и гидроксиметилирование. В случае анализа модификации матричной нуклеиновой кислоты примеры предварительной обработки включают следующие способы с (1) до (3):
(1) предварительная обработка для превращения немодифицированного основания X или модифицированного основания X в матричной нуклеиновой кислоте в другое основание Y;
(2) предварительная обработка для обогащения модифицированной матричной нуклеиновой кислоты с использованием связывающего вещества, которое связывается с модифицированной нуклеиновой кислотой; и
(3) предварительная обработка для расщепления немодифицированной области или модифицированной области.
[0193] В случае способа (1), например, если X в конкретном сайте в матричной нуклеиновой кислоте не модифицировано, конкретный сайт превращают в основание Y, и если основание X в конкретном сайте модифицировано, конкретный сайт не превращают в основание Y. Альтернативно, например, если основание X в конкретном сайте в матричной нуклеиновой кислоте модифицировано, конкретный сайт превращают в основание Y, и если основание X в конкретном сайте не модифицировано, конкретный сайт не превращают в основание Y. Соответственно, модификацию в матричной нуклеиновой кислоте можно анализировать на основании различия в превращении.
[0194] В случае способа (2), например, модифицированную матричную нуклеиновую кислоту среди матричных нуклеиновых кислот можно обогащать с использованием связывающего вещества, которое связывается с нуклеиновой кислотой, в которой основание X в конкретном сайте модифицируют посредством связывания связывающего вещества с модифицированной матричной нуклеиновой кислотой. Используя обогащенную матричную нуклеиновую кислоту, можно анализировать модификацию в матричной нуклеиновой кислоте.
[0195] В случае способа (3), например, в случае расщепления немодифицированной области, не расщепляют модифицированную матричную нуклеиновую кислоту и расщепляют немодифицированную матричную нуклеиновую кислоту, и в случае расщепления модифицированной области, расщепляют модифицированную матричную нуклеиновую кислоту и не расщепляют немодифицированную матричную нуклеиновую кислоту. Кроме того, например, в случае расщепления модифицированной области, не расщепляют немодифицированную матричную нуклеиновую кислоту и расщепляют модифицированную матричную нуклеиновую кислоту, и в случае расщепления немодифицированной области, расщепляют немодифицированную матричную нуклеиновую кислоту и не расщепляют модифицированную матричную нуклеиновую кислоту. Модификацию в матричной нуклеиновой кислоте можно анализировать на основании того, расщеплена ли матричная нуклеиновая кислота.
[0196] Сначала, в качестве конкретного примера, описан пример предварительной обработки в случае анализа метилированной матричной нуклеиновой кислоты.
[0197] В случае способа (1), предпочтительно, например, неметилированный остаток цитозина матричной нуклеиновой кислоты превращают в остаток урацила или остаток производного урацила (далее в настоящем описании также обозначаемые как превращенный остаток) на стадии предварительной обработки. Реактив, используемый для превращающей обработки, не ограничен конкретными реактивами и может представлять собой, например, бисульфит и т. п. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: например, анализ кривой плавления можно осуществлять в качестве стадии обнаружения после стадии амплификации; и, например, стадию обнаружения можно осуществлять на стадии амплификации после проведения мультиплексной амплификации нуклеиновых кислот для матричной нуклеиновой кислоты, имеющей остаток метилцитозина, и матричной нуклеиновой кислоты, имеющей превращенный остаток.
[0198] В случае способа (3), предпочтительно, например, неметилированную область или метилированную область матричной нуклеиновой кислоты расщепляют на стадии предварительной обработки. Реактив, используемый для расщепления, не ограничен конкретными реактивами, и может представлять собой, например, рестрикционный фермент. В качестве рестрикционного фермента можно использовать, например, чувствительный к метилированию рестрикционный фермент, который может расщеплять предварительно определяемую последовательность, если она не метилирована, и не может расщеплять предварительно определяемую последовательность, если она метилирована, зависимый от метилирования рестрикционный фермент, который может расщеплять предварительно определяемую последовательность, если она метилирована, и т. п. В качестве рестрикционного фермента можно использовать, например, один или оба из чувствительного к метилированию рестрикционного фермента и зависимого от метилирования рестрикционного фермента. В случае расщепления неметилированной области, например, предпочтительно, рестрикционный фермент представляет собой рестрикционный фермент, который расщепляет неметилированную область более эффективно, чем метилированную область, и зависит от неметилированной области (или чувствителен к метилированной области). В случае расщепления метилированной области, например, предпочтительно, рестрикционный фермент представляет собой рестрикционный фермент, который расщепляет метилированную область более эффективно, чем неметилированную область, и зависит от метилированной области (или чувствителен к неметилированной области). Примеры метилцитозин-чувствительного рестрикционного фермента включают AatII, ApaI и BstUI. Примеры метилцитозин-зависимого рестрикционного фермента включают MspJI и GlaI. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: например, стадию обнаружения можно осуществлять, например, после осуществления способа ESPCR, способа HDCR и способа амплификации с использованием химерного праймера и блокирующего средства в качестве стадии амплификации; и стадию обнаружения можно осуществлять после осуществления мультиплексной амплификации нуклеиновых кислот на стадии амплификации. В настоящем изобретении, в случае анализа метилирования с использованием расщепления неметилированной области или метилированной области, например, можно дать ссылку на следующие публикации исследований.
Sensitive measurement of unmethylated repeat DNA sequences by end-specific PCR, Keith N. Rand et al., BioTechniques 2010, 49(4)
Sensitive and selective amplification of methylated DNA sequences using helper-dependent chain reaction in combination with a methylation-dependent restriction enzymes, Keith N. Rand et al., Nucleic Acids Research, 2013, 41(1), e15
Кроме того, например, мультиплексную амплификацию нуклеиновых кислот для матричной нуклеиновой кислоты, имеющей остаток метилцитозина, и матричной нуклеиновой кислоты, имеющей превращенный остаток, можно осуществлять на стадии амплификации.
[0199] В случае способа (2), например, предпочтительно, метилированную матричную нуклеиновую кислоту обогащают на стадии предварительной обработки. Способ обогащения метилированной матричной нуклеиновой кислоты не ограничен конкретными способами, и, например, метилированную матричную нуклеиновую кислоту можно обогащать, используя связывающее вещество, которое связывается с метилированной матричной нуклеиновой кислотой, посредством связывания связывающего вещества с метилированной матричной нуклеиновой кислотой. Примеры связывающего вещества включают связывающий метилированную ДНК белок и антитело против метилцитозина. Связывающий метилированную ДНК белок может представлять собой, например, MECP2 и т. п. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: например, анализ кривой плавления можно осуществлять на стадии обнаружения после стадии амплификации; и, например, стадию обнаружения можно осуществлять после осуществления мультиплексной амплификации нуклеиновых кислот на стадии амплификации. В настоящем изобретении, в случае анализа метилирования с использованием связывающего метилированную ДНК белка, например, можно осуществлять анализ извлечения метилированных CpG-островков (MIRA). Кроме того, в настоящем изобретении, в случае анализа метилирования с использованием антитела против метилцитозина, например, можно осуществлять иммунопреципитацию метилированной ДНК (MeDIP).
[0200] Далее, в качестве конкретного примера, описан пример предварительной обработки в случае анализа гидроксиметилирования матричной нуклеиновой кислоты.
[0201] В случае способа (1), например, предпочтительно, остаток гидроксиметилцитозина в матричной нуклеиновой кислоте превращают в остаток негидроксиметилированного основания на стадии предварительной обработки. Гидроксиметилцитозин может представлять собой, например, остаток 5-гидроксиметилцитозина. Остаток негидроксиметилированного основания может представлять собой, например, остаток тимина, остаток производного тимина, остаток урацила или остаток производного урацила (далее в настоящем описании также обозначаемый как превращенный остаток). Реактив, используемый для превращающей обработки, не ограничен конкретными реактивами. В качестве конкретного примера, в случае превращения в остаток тимина или остаток производного тимина, например, можно использовать вольфрамовый окислитель или тому подобное. Вольфрамовый окислитель может представлять собой, например, пероксовольфрамовый биядерный комплекс. Кроме того, в случае превращения в остаток урацила или остаток производного урацила, например, перрутенат калия (KRuO4) и бисульфит можно использовать в комбинации. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: например, анализ кривой плавления можно осуществлять в качестве стадии обнаружения после стадии амплификации; и, например, стадию обнаружения можно осуществлять после осуществления мультиплексной амплификации нуклеиновых кислот для матричной нуклеиновой кислоты, имеющей остаток метилцитозина, и матричной нуклеиновой кислоты, имеющей превращенный остаток, на стадии амплификации. В настоящем изобретении, в случае анализа гидроксиметилирования с использованием вольфрамового окислителя, например, можно дать ссылку на следующую публикацию исследования.
Chem Commun (Camb). Okamoto A, Sugizaki K, Nakamura A, Yanagisawa H, Ikeda S. 2011; 47(40): 11231-3.
Кроме того, в настоящем изобретении, в случае анализа гидроксиметилирования с использованием перрутената калия (KRuO4) и бисульфит в комбинации, например, можно дать ссылку на следующую публикацию исследования.
Bioorganic & Medical Chemistry Letters.Seketsu Fukuzawa, Kazuo Tachibana, Shoji Tajima, Isao Suetake. 2015, 25, 5667-5671
[0202] В случае способа (3), например, предпочтительно, стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированной матричной нуклеиновой кислоты; и расщепления гликозилированной области гидроксиметилированной матричной нуклеиновой кислоты. На стадии гликозилирования, например, 5-гидроксиметилцитозин (5-hmC) гликозилируют до гликозилированного 5-hmC. Гликозилирование можно осуществлять, например, с использованием β-гликозилтрансферазы. Реактив, используемый для расщепления, не ограничен конкретными реактивами, и может представлять собой, например, рестрикционный фермент. В качестве рестрикционного фермента, например, можно использовать чувствительный к гликозилированию рестрикционный фермент, который может расщеплять предварительно определяемую последовательность, если она не гликозилирована, и не может расщеплять предварительно определяемую последовательность, если она гликозилирована, зависимый от гликозилирования рестрикционный фермент, который может расщеплять предварительно определяемую последовательность, если она гликозилирована, и т. п. В качестве рестрикционного фермента можно использовать, например, один или оба из чувствительного к гликозилированию рестрикционного фермента и зависимого от гликозилирования рестрикционного фермента. Предпочтительно, рестрикционный фермент представляет собой, например, рестрикционный фермент, который расщепляет гликозилированную область более эффективно, чем негликозилированную область, и рестрикционный фермент, который зависит от гликозилированной области (или чувствителен к гликозилированной области). Примеры чувствительного к гликозилированному 5-hmC рестрикционного фермента включают MspI и HaeIII. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: стадию обнаружения можно осуществлять, например, после осуществления способа ESPCR, способ HDCR и способа амплификации с использованием химерного праймера и блокирующего средства в качестве стадии амплификации; и стадию обнаружения можно осуществлять, например, после осуществления мультиплексной амплификации нуклеиновых кислот на стадии амплификации. Кроме того, на стадии амплификации, например, можно осуществлять мультиплексную амплификацию нуклеиновых кислот для матричной нуклеиновой кислоты, имеющей остаток метилцитозина, и матричной нуклеиновой кислоты, имеющей превращенный остаток.
[0203] В случае способа (2), например, предпочтительно, стадия предварительной обработки включает стадии гликозилирования гидроксиметилированной области гидроксиметилированной матричной нуклеиновой кислоты; и обогащения гликозилированной гидроксиметилированной матричной нуклеиновой кислоты. В отношении стадии гликозилирования, например, можно дать ссылку на описание в отношении способа (3). Способ обогащения гликозилированной гидроксиметилированной матричной нуклеиновой кислоты не ограничен конкретными способами, и, например, гликозилированную гидроксиметилированную матричную нуклеиновую кислоту можно обогащать с использованием связывающего вещества, которое связывается с гликозилированной гидроксиметилированной матричной нуклеиновой кислотой, посредством связывания связывающего вещества с гликозилированной гидроксиметилированной матричной нуклеиновой кислотой. Связывающее вещество может представлять собой, например, связывающий гликозилированную гидроксиметилированную ДНК белок или антитело. Антитело может представлять собой, например, антитело против гликозилированного 5-hmC. Стадии после стадии предварительной обработки конкретно не ограничены, и можно дать ссылку на приведенное выше описание. Конкретные примеры стадии представляют собой следующее: например, анализ кривой плавления можно осуществлять на стадии обнаружения после стадии амплификации; и, например, стадию обнаружения можно осуществлять после осуществления мультиплексной амплификации нуклеиновых кислот на стадии амплификации.
[0204] <Способ анализа вещества-мишени>
Способ анализа вещества-мишени по настоящему изобретению, как описано выше, включает стадии приведения образца, содержащего по меньшей мере одно вещество-мишень, в контакт с по меньшей мере одним флуорогенным зондом для каждого вещества-мишени в реакционном растворе; и обнаружения генерации или гашения сигнала флуорогенного зонда в ответ на связывание между нуклеиновой кислотой-мишенью и флуорогенным зондом. Способ анализа вещества-мишени по настоящему изобретению отличается тем, что он включает стадии приведения образца, содержащего по меньшей мере одно вещество-мишень, в контакт с по меньшей мере одним флуорогенным зондом для каждого вещества-мишени в реакционном растворе; и обнаружения генерации или гашения сигнала флуорогенного зонда в ответ на связывание между нуклеиновой кислотой-мишенью и флуорогенным зондом, и другие стадии и условия конкретно не ограничены. В отношении способа анализа вещества-мишени по настоящему изобретению, например, можно дать ссылку на описание в отношении способа анализа матричной нуклеиновой кислоты по настоящему изобретению, если не указано иное. В соответствии со способом анализа вещества-мишени по настоящему изобретению, вещество-мишень можно анализировать точно.
[0205] Вещество-мишень не ограничено конкретными веществами, и его примеры включают нуклеиновые кислоты, белки, сахар и липид. Когда вещество-мишень представляет собой нуклеиновую кислоту, вещество-мишень также можно обозначать, например, как нуклеиновая кислота-мишень. Нуклеиновая кислота-мишень может представлять собой, например, описанные выше матричные нуклеиновые кислоты. Вещество-мишень может представлять собой, например, вещество-мишень в состоянии, в котором оно связано с веществом, которое специфически связывается с веществом-мишенью. Флуорогенный зонд может представлять собой, например, описанный выше флуорогенный зонд. Необходимо только чтобы зонд, который составляет флуорогенный зонд, представлял собой вещество, которое специфически связывается с веществом-мишенью, как описано выше, и конкретные примеры зонда включают нуклеиновые кислоты, антитела, аффитела и аптамеры. Хотя настоящее изобретение описано далее со ссылкой на случай, когда вещество-мишень представляет собой нуклеиновую кислоту, в отношении вещества-мишени можно дать ссылку на следующее описание, заменяя «нуклеиновую кислоту-мишень» на «вещество-мишень».
[0206] Количество нуклеиновой кислоты-мишени, содержащейся в реакционном растворе конкретно, не ограничено и составляет, например, 100 нг или меньше. Объем реакционного раствора конкретно не ограничен и составляет, например, 2 нл или меньше.
[0207] Образец и флуорогенный зонд можно приводить в контакт друг с другом, например, посредством добавления флуорогенного зонда к образцу, посредством добавления образца к флуорогенному зонду или посредством добавления флуорогенного зонда и образца к водорастворимому растворителю.
[0208] Генерацию сигнала или гашение сигнала можно обнаруживать, например, с помощью способа обнаружения, используемого на стадии обнаружения способа анализа матричной нуклеиновой кислоты по настоящему изобретению. Конкретные примеры обнаружения включают обнаружение яркости или интенсивности сигнала по меньшей мере одного типа в реакционном растворе и подсчет сигнала по меньшей мере одного типа в реакционном растворе на молекулярном уровне флуорогенного зонда. Подсчет на молекулярном уровне может представлять собой, например, описанный выше высокоточный способ обнаружения.
[0209] При контакте и обнаружении температура реакционного раствора конкретно не ограничена, и ее можно определять надлежащим образом, например, в соответствии с типом нуклеиновой кислоты-мишени и флуорогенным зондом. Температурой реакционного раствора можно управлять, например, при контакте и обнаружении.
[0210] Когда вещество-мишень представляет собой нуклеиновую кислоту, например, способ анализа вещества-мишени по настоящему изобретению позволяет обнаруживать небольшое количество нуклеиновой кислоты-мишени и не требует включения стадии амплификации нуклеиновой кислоты-мишени.
[0211] Когда анализируют вещества-мишени по меньшей мере двух типов, для нуклеиновых кислот-мишеней можно использовать флуорогенные зонды по меньшей мере двух типов, и способ анализа вещества-мишени по настоящему изобретению может включать стадию вычисления соотношения концентраций или относительного содержания каждой нуклеиновой кислоты-мишени по значению обнаруживаемого сигнала флуорогенных зондов по меньшей мере двух типов, обнаруживаемых на стадии обнаружения. Значение обнаруживаемого сигнала может представлять собой, например, яркость, интенсивность и т. п. сигнала. Способ вычисления концентрации или количества нуклеиновой кислоты-мишени на основании значения обнаруживаемого сигнала не ограничен конкретными способами и может представлять собой, например, способ вычисления на основании калибровочной кривой, получаемой с использованием стандартного образца.
[0212] Когда анализируют по меньшей мере две нуклеиновые кислоты-мишени и нуклеиновые кислоты-мишени по меньшей мере двух типов являются смежными друг с другом, предпочтительно, используют по меньшей мере два флуорогенных зонда для веществ-мишеней, и каждый из флуорогенных зондов содержит генерирующее сигнал вещество, обладающее флуоресцентным свойством, отличным от другого, и генерирует или гасит сигнал в ответ на связывание с различными нуклеиновыми кислотами-мишенями. В этом случае, для генерации или гашения сигнала, например, можно использовать или можно не использовать FRET.
[0213] <Набор для анализа матричной нуклеиновой кислоты или вещества-мишени>
Набор для анализа матричной нуклеиновой кислоты или вещества-мишени по настоящему изобретению, как описано выше, предусматривает способ анализа по настоящему изобретению. Набор для анализа по настоящему изобретению отличается тем, что он предусматривает способ анализа по настоящему изобретению, и другие композиции и условия конкретно не ограничены. В отношении набора для анализа матричной нуклеиновой кислоты или вещества-мишени по настоящему изобретению, например, можно дать ссылку на описание в отношении способа анализа матричной нуклеиновой кислоты по настоящему изобретению, если не указано иное.
[0214] <Анализатор для матричной нуклеиновой кислоты или вещества-мишени>
Анализатор для матричной нуклеиновой кислоты или вещества-мишени по настоящему изобретению, как описано выше, обеспечивает способ анализа по настоящему изобретению. Анализатор по настоящему изобретению отличается тем, что он обеспечивает способ анализа по настоящему изобретению, и другие композиции и условия конкретно не ограничены. В отношении анализатора для матричной нуклеиновой кислоты или вещества-мишени по настоящему изобретению, например, можно дать ссылку на описание в отношении способа анализа матричной нуклеиновой кислоты по настоящему изобретению, если не указано иное.
Примеры
[0215] Примеры настоящего изобретения описаны далее. Однако настоящее изобретение не ограничено примерами, приведенными далее. Коммерчески доступные реактивы использовали на основании их протоколов, если не указано иное.
[0216] [Пример 1]
Подтверждали тот факт, что матричную нуклеиновую кислоту можно точно анализировать с помощью способа анализа матричной нуклеиновой кислоты по настоящему изобретению.
[0217] (1) Образец ДНК
Плазмидную ДНК, имеющую последовательность гена MDM2 человека мутантного типа 309G, описанного в следующем справочном документе 1, смешивали с водой, не содержащей РНКазу, тем самым получая раствор образца.
Справочный документ 1: Enokida Y et al. «Rapid Detection of SNP (c.309T>G) in the MDM2 Gene by the Duplex SmartAmp Method», PLOS ONE, 2013, том 8, выпуск 4, e60151
[0218] (2) Получение реактива
Реактив получали со ссылкой на справочный документ 1 в отношении системы реакции изотермальной амплификации для обнаружения мутации 309G гена MDM2 человека. В частности, сначала праймеры смешивали с тем, чтобы получать композицию, представленную в следующей таблице 3, тем самым получая смесь праймеров. В следующей смеси праймеров, MDM2.Bf.202-13.M.E8 (Э-праймер) представляет собой генерирующее сигнал вещество. Кроме того, компоненты смешивали с тем, чтобы получать композицию, представленную в следующей таблице 4, тем самым получая предварительную смесь в количестве, которое позволяет получать реакционный раствор для реакции 4,4 раза (14,5 мкл × 4,4). Как показано в следующей таблице 4, в виде предварительной смеси, предварительные смеси каждого из двух типов получали так, что реакционный раствор содержит 375 или 750 копий ДНК матрицы на реакцию.
[0219] [Таблица 3]
(Смесь праймеров)

[0220] [Таблица 4]
(Предварительная смесь)
[0221] (3) Анализ
Предварительную смесь и фермент (полимеразу) смешивали с тем, чтобы получать композицию, представленную в следующей таблице 5, тем самым получая реакционный раствор.
[0222] [Таблица 5]
(Реакционный раствор)
[0223] Затем собирали 14,5 мкл каждого из реакционных растворов двух типов и каждый реакционный раствор вводили в чип (QuantStudio 3D Digital PCR Chip, продукт Applied Biosystems) и тем самым осуществляли фракционирование на двадцать тысяч фракций. После фракционирования чип располагали на нагревательном блоке при 60°C и последовательность-мишень и комплементарную ей последовательность в ДНК матрице амплифицировали в течение 30 минут в отношении каждой фракции. После амплификации, сигнал флуоресценции каждой фракции обнаруживали с использованием оптического измерительного аппарата (QuantStudio 3D Digital PCR Instrument, продукт Applied Biosystems). В отношении полученных данных, считали число фракций, положительных по эталонному красителю (ROX) и положительных по сигналу флуоресценции, испускаемой Э-праймером, с использованием аналитического программного обеспечения (QuantStudio 3DAnalysis Suite, продукт Applied Biosystems), тем самым вычисляя измеряемое значение числа копий ДНК матрицы, содержащихся в реакционном растворе. Посредством измерения ROX в отношении каждой фракции проверяли, должным ли образом каждый миниатюрный реакционный сосуд в выемке в чипе заполнен реактивом для реакции (сформирована ли фракция должным образом).
[0224] В качестве способа анализа для сравнительного примера 1, 14,5 мкл каждого из реакционных растворов двух типов собирали для 3 реакций (14,5 мкл × 3), и каждый реакционный раствор вводили в ПЦР пробирку, не проводя фракционирования. Впоследствии, посредством обнаружения сигнала с течением времени при условиях 60°C в каждой из пробирок с использованием термоциклера (StepOne® Real-Time PCR System, продукт Applied Biosystems), измеряли время обнаружения от момента начала реакции до момента получения обозначенной интенсивности сигнала.
[0225] Результаты представлены на фиг. 2A и 2B. На фиг. 2A представлена диаграмма, показывающая измеряемое значение числа копий ДНК матрицы в случае, когда число полученных копий ДНК матрицы составляет 375 или 750 копий/реакция, в способе анализа в примере 1. На фиг. 2B представлен график, показывающий время обнаружения в случае, когда число полученных копий ДНК матрицы составляет 375 или 750, в способе анализа в сравнительном примере 1. На фиг. 2A вертикальная ось обозначает измеряемое значение числа копий ДНК матрицы. На фиг. 2B вертикальная ось обозначает время обнаружения. На каждой из фиг. 2A и 2B столбцы показывают, слева, результат для реакционной системы в случае, когда число полученных копий ДНК матрицы составляет 375 копий/реакция, и результат для реакционной системы в случае, когда число полученных копий ДНК матрицы составляет 750 копий/реакция. Как показано на фиг. 2B, в способе анализа для сравнительного примера 1 время обнаружения не значительно менялось даже при удвоении числа полученных копий ДНК матрицы в реакционном растворе. С другой стороны, как показано на фиг. 2A, в способе анализа в примере 1, измеряемое значение числа копий ДНК матрицы возрастало в 2,13 раза при удвоении числа полученных копий ДНК матрицы, что показывает корреляцию между измеряемым значением числа копий ДНК матрицы и числом полученных копий ДНК матрицы. Эти результаты показывают, что способ анализа матричной нуклеиновой кислоты по настоящему изобретению позволяет точно анализировать матричную нуклеиновую кислоту, например, даже в случае, когда концентрация матричной нуклеиновой кислоты-мишени составляет всего 1000 копий или меньше и число копий не может быть сравнено с помощью способа анализа в сравнительном примере 1, который не имеет стадии фракционирования.
[0226] [Пример 2]
Подтверждали тот факт, что нуклеиновую кислоту-мишень можно анализировать точно посредством способа анализа вещества-мишени по настоящему изобретению с использованием множества зондов.
[0227] (1) Образец ДНК и обнаруживающий зонд
Модель нуклеиновой кислоты случая и модель нуклеиновой кислоты контроля, представленные в следующей таблице 6, получали в качестве образцов ДНК, и меченный тиазоловым оранжевым Э-зонд (TO зонд) для обнаружения модели нуклеиновой кислоты случая и меченный тиазоловым розовым Э-зонд (TP зонд) для обнаружения модели нуклеиновой кислоты контроля, представленные в следующей таблице 6, получали в качестве обнаруживающих зондов (флуорогенные зонды).
[0228] [Таблица 6]
[0229] (2) Экспериментальный способ
Зонды добавляли в воду, не содержащую РНКазу, с тем, чтобы достигать 0,25 мкмоль/л TO зонда и 0,25 мкмоль/л TP зонда, тем самым получая смесь зондов TO/TP. Затем модель нуклеиновой кислоты случая и модель нуклеиновой кислоты контроля добавляли в воду, не содержащую РНКазу, с тем, чтобы достигать соотношения концентраций для моделей нуклеиновой кислоты случая/контроля, представленного в следующей таблице 7, тем самым получая образцы моделей шести типов. Затем 50 мкл смеси зондов TO/TP и 50 мкл каждого из образцов моделей смешивали при нормальной температуре (25°C). После смешивания, используя флуоресцентный спектрометр (продукт JASCO), измеряли интенсивность флуоресценции (интенсивность TO флуоресценции) при длине волны 510 нм в случае, когда смесь возбуждали возбуждающим светом, имеющим длину волны 488 нм, и интенсивность флуоресценции (интенсивность TP флуоресценции) при длине волны 600 нм в случае, когда смесь возбуждали возбуждающим светом, имеющим длину волны 570 нм. Для стандартизации измеряемой интенсивности флуоресценции, получали модели нуклеиновой кислоты случая/контроля, каждая из которых имела соотношение между конечной концентрацией модели нуклеиновой кислоты случая (Ca) и конечной концентрацией модели нуклеиновой кислоты контроля (Co) (Ca/Co) 0 мкмоль/л/0 мкмоль/л, 0,25 мкмоль/л/0 мкмоль/л или 0 мкмоль/л/0,25 мкмоль/л и измеряли интенсивность TO флуоресценции и интенсивность TP флуоресценции. В отношении каждого образца модели, уровень вариации TO флуоресценции и уровень вариации TP флуоресценции вычисляли на основании следующих уравнений (1) и (2).
[0230] [Таблица 7]
[0231]
Уровень вариации TO флуоресценции=(STO - TOmin)/(TOmax - TOmin) (1)
STO: интенсивность TO флуоресценции образца модели
TOmin: интенсивность TO флуоресценции модели нуклеиновой кислоты случая/контроля, имеющей соотношение Ca/Co, равное 0 мкмоль/л/0 мкмоль/л
TOmax: интенсивность TO флуоресценции модели нуклеиновой кислоты случая/контроля, имеющей соотношение Ca/Co, равное 0,25 мкмоль/л/0 мкмоль/л
Уровень вариации TP флуоресценции=(STP - TPmin)/(TPmax - TPmin) (2)
STP: интенсивность TP флуоресценции образца модели
TPmin: интенсивность TP флуоресценции модели нуклеиновой кислоты случая/контроля, имеющей соотношение Ca/Co, равное 0 мкмоль/л/0 мкмоль/л
TPmax: интенсивность TP флуоресценции модели нуклеиновой кислоты случая/контроля, имеющей соотношение Ca/Co, равное 0 мкмоль/л/0,25 мкмоль/л
[0232] (3) Результаты
Результаты представлены в таблице 8. Кроме того, на фиг. 3 представлен график, показывающий сравнение между соотношением концентраций для моделей нуклеиновой кислоты случая/контроля, представленных в таблице 7, и соотношения уровней вариации флуоресценции TO/TP, представленных в таблице 8. На фиг. 3 горизонтальная ось обозначает соотношение концентраций для модели нуклеиновой кислоты случая/контроля, вертикальная ось обозначает соотношение уровней вариации флуоресценции TO/TP, прямая линия и уравнение показывают уравнение линейной регрессии и R2 обозначает квадрат значения коэффициента корреляции. Как показано на фиг. 3, соотношение уровней вариации флуоресценции TO/TP показывает значимо высокую корреляцию с соотношением концентраций для модели нуклеиновой кислоты случая/контроля. Эти результаты показывают, что способ анализа вещества-мишени по настоящему изобретению позволяет точно анализировать нуклеиновую кислоту-мишень.
[0233]
[Таблица 8]
[0234] [Пример 3]
Проверяли влияние фонового сигнала с использованием флуорогенного праймера или интеркалятора в качестве генерирующего сигнал вещества.
[0235] В случае обнаружения одной молекулы вещества-мишени, для получения сигнала, превышающего предел обнаружения от одной молекулы вещества-мишени, например, реакцию амплификации осуществляют дольше, чем в случае, когда присутствует множество молекул-мишеней. Таким образом, используя флуорогенный праймер или интеркалятор и применяя SmartAmp с обратной транскрипцией (RT) в качестве способа амплификации, проверяли увеличение фонового сигнала в соответствии с увеличением времени амплификации.
[0236] [Таблица 9]
(Смесь праймеров)
[0237] (4 × реакционный буфер № 6)
5,6 ммоль/л dNTP
80 ммоль/л Tris-HCl (pH8)
40 ммоль/л (NH4)2SO4
32 ммоль/л MgSO4
0,4% Tween 20
120 ммоль/л CH3COOK
[0238] [Таблица 10]
(Композиция реакционного раствора 1)
[0239] (Флуорогенный праймер)
Э-праймер FluA_MP1.Br.194-16.E10
ACCACnAGATTTCCAG (SEQ ID № 16)
(n: тимин, меченный тиазоловым оранжевым)
[0240] [Таблица 11]
(Композиция реакционного раствора 2)
[0241] Использовали смесь праймеров для обнаружения FluA в соответствии со SmartAmp с обратной транскрипцией (RT). Реакционный раствор получали в соответствии с композицией реакционного раствора 1 или композицией реакционного раствора 2 так, что каждый реакционный раствор не имеет вещества-мишени (FluA) (n=3 в каждом растворе). Затем, каждый из реакционных растворов переносили на чип для фракционирования раствора в системе QuantStudio 3D Digital PCR (продукт ABI), реакцию в реакционном растворе проводили при 67°C в течение предварительно определяемого времени (0, 20, 40 или 60 минут) и затем реакционный раствор охлаждали до нормальной температуры. После охлаждения, в отношении каждого чипа, содержащего реакционный раствор, сигнал флуорогенного праймера или сигнал интеркалятора (SYBR Green) количественно определяли с использованием описанной выше системы.
[0242] Результаты представлены на фиг. 4 и 5. На фиг. 4 представлены изображения сигналов на чипах (эксперименты 1, 2 и 3), которые с течением времени количественно определяли с помощью описанной выше системы. На фиг. 4A представлены результаты, полученные с использованием интеркалятора (SYBR Green). Каждое из A1, A2 и A3 на фиг. 4A отражает результаты для каждого из трех реакционных растворов. На фиг. 4B представлен результат, полученный с использованием флуорогенного праймера (Э-праймера). Каждое из B1, B2 и B3 на фиг. 4B отражает результаты для каждого из трех реакционных растворов. Следует отметить, что когда цвет изображения темнее, чем время реакции (0 мин), это обозначает, что создают независимую амплификацию и генерируют сигнал. На фиг. 5 представлен график, показывающий измеряемую концентрацию (мкл), вычисляемую по флуоресценции реакционного раствора в каждое время реакции. Каждый «сплошной круг ( )» обозначает результат, получаемый с использованием интеркалятора (SYBR Green), и каждый «сплошной квадрат (
)» обозначает результат, получаемый с использованием интеркалятора (SYBR Green), и каждый «сплошной квадрат ( )» обозначает результат, получаемый с использованием флуорогенного праймера (Э-праймера).
)» обозначает результат, получаемый с использованием флуорогенного праймера (Э-праймера).
[0243] Как показано на фиг. 4A, в случае использования интеркалятора, цвет изображения при времени реакции 40 минут и цвет изображения при времени реакции 60 минут темнее, чем цвет изображения при времени реакции 0 минут, тогда как цвет изображения при времени реакции 20 минут был почти таким же, как цвет изображения при времени реакции 0 минут. Также на фиг. 5, где представлены результаты ее измерения, измеряемая концентрация возрастала, когда время реакции превышало 40 минут, при этом измеряемая концентрация была едва ли повышенным при времени реакции 20 минут. Эти результаты показывают, что в случае использования интеркалятора, например, задавая время реакции приблизительно 20 минут, можно достаточно подавлять фон.
[0244] В случае использования флуорогенного праймера, как показано на фиг. 4, даже когда время реакции амплификации истекало, изображения были такими же, как изображение при времени реакции 0 минут, что показывает, что неспецифическая амплификация не генерировала сигнала флуоресценции. Также на графике на фиг. 5, где представлены результаты ее измерения, даже когда истекало время реакции амплификации, сигнал флуоресценции был едва ли повышенным, и измеряемое значение никогда не превышало 10 копий/мкл, даже оп истечении 60 минут. Эти результаты показывают, что, в случае использования флуорогенного праймера, например, даже когда продлевают время амплификации для увеличения сигнала, подлежащего генерации, можно достаточно подавлять сигнал фона.
[0245] [Пример 4]
РНК (FluA) обнаруживали с использованием флуорогенного праймера.
[0246] Концентрацию измеряли на основании реакции амплификации при 67°C в течение предварительно определяемого времени (0, 20 или 40 минут), и измерение сигнала аналогичным образом, как в примере 3, за исключением того, что предварительно определяемое число копий (0, 1500 или 3000 копий) FluA/РНК (PLoS one 2012, 7(1), e30236) смешивали в реакционном растворе (композиция реакционного раствора 1) из примера 3 (n=1). Затем получали значение коррекции посредством вычитания измеряемого значения реакционного раствора, в котором число копий в момент начала реакции составляло 0, из измеряемого значения для каждого из реакционных растворов, в которых число копий в момент начала реакции составляло 1500 копий и 3000 копий.
[0247] Результаты представлены на фиг. 6. На фиг. 6 представлен график, показывающий скорректированную измеряемую концентрацию (копий/мкл), вычисляемую по флуоресценции реакционного раствора при каждом времени реакции. Измеряемое значение реакционного раствора, в котором число копий составляло 1500 копий, и измеряемое значение реакционного раствора, в котором число копий составляло 3000 копий в момент начала реакции, были значительно увеличены и достигали максимального значения при времени реакции 40 минут. Измеряемое значение реакционного раствора, в котором число копий составляло 3000 копий в момент начала реакции, было в 1,7 раза выше измеряемого значения реакционного раствора, в котором число копий составляло 1500 копий, в момент начала реакции, при времени реакции 40 минут.
[0248] [Пример 5]
РНК (FluA) обнаруживали с использованием интеркалятора.
[0249] Концентрацию измеряли на основании реакции амплификации при 67°C в течение предварительно определяемого времени (0 или 40 минут), и измерение сигнала аналогичным образом как в примере 3, за исключением того, что предварительно определяемое число копий (0 или 3000 копий) FluA/РНК (PLoS one 2012, 7(1), e30236) смешивали в реакционном растворе (композиция реакционного раствора 2) из примера 3, используя интеркалятор (n=1).
[0250] Результаты представлены на фиг. 7. На фиг. 7 представлен график, показывающий измеряемую концентрацию (копии/мкл), вычисляемую по флуоресценции реакционного раствора при каждом времени реакции. Измеряемое значение реакционного раствора, в котором число копий составляло 0 копий в момент начала реакции, едва ли увеличивалось даже после 20 минут от начала реакции, тогда как измеряемое значение реакционного раствора, в котором число копий составляло 3000 копий в момент начала реакции, значительно возрастало через 20 минут после начала реакции.
[0251] Хотя настоящее изобретение описано выше со ссылкой на варианты осуществления и примеры, различные изменения и модификации, которые могут быть видны специалистам в данной области, можно создавать, не отступая от объема настоящего изобретения. Все раскрытие документов, таких как патентные документы, научные документы и т. п., цитируемые в описании настоящего изобретения, включены в настоящее описание посредством ссылки.
[0252] По этой заявке испрашивают право приоритета: японской патентной заявки № 2015-169833, поданной 28 августа 2015 года, и японской патентной заявки № 2016-096998, поданной 13 мая 2016 года. Все раскрытие этих японских патентных заявок включено в настоящее описание посредством ссылки.
Промышленная применимость
[0253] В соответствии с настоящим изобретением, матричную нуклеиновую кислоту можно анализировать точно.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> RIKEN
Kabushiki Kaisha DNAFORM
<120> СПОСОБ АНАЛИЗА МАТРИЧНОЙ НУКЛЕИНОВОЙ КИСЛОТЫ, СПОСОБ АНАЛИЗА
ВЕЩЕСТВА-МИШЕНИ, НАБОР ДЛЯ АНАЛИЗА МАТРИЧНОЙ НУКЛЕИНОВОЙ КИСЛОТЫ
ИЛИ ВЕЩЕСТВА-МИШЕНИ И АНАЛИЗАТОР ДЛЯ МАТРИЧНОЙ НУКЛЕИНОВОЙ
КИСЛОТЫ ИЛИ ВЕЩЕСТВА-МИШЕНИ
<130> 161535A
<150> JP2015-169833
<151> 2015-08-28
<150> JP2016-096998
<151> 2016-05-13
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 1
cgcgggaggt cagcgttcac actagtgacc c 31
<210> 2
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 2
accttctata ccctcagaag gtcgggagtt cagggtaaag gt 42
<210> 3
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 3
tcgcaggtgc ctgtc 15
<210> 4
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 4
ggctgcgggg cc 12
<210> 5
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 5
caatcccgcc cagactac 18
<210> 6
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<220>
<221> смешанные признаки
<222> (6)..(6)
<223> n представляет собой тиамин, меченный экситоном
<400> 6
cggggnccgc tgc 13
<210> 7
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> олигонуклеотид
<400> 7
ctacgccacc agct 14
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> олигонуклеотид
<400> 8
gagaaagaga aagatacaca 20
<210> 9
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> зонд
<220>
<221> смешанные признаки
<222> (12)..(12)
<223> n представляет собой тимин, меченный тиазоловым оранжевым
<400> 9
agctggtggc gnag 14
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> зонд
<220>
<221> смешанные признаки
<222> (9)..(9)
<223> n представляет собой тимин, меченный тиазоловым розовым
<400> 10
tgtgtatcnt tctctttctc 20
<210> 11
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 11
ttccattgcg aatgcacatt cgaagcaac 29
<210> 12
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 12
gcattcgcga aatgataata ccagatcc 28
<210> 13
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 13
accactagat ttccag 16
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 14
acactagtag agccgggaga 20
<210> 15
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<400> 15
ctggtgttta tagcaccctt 20
<210> 16
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер
<220>
<221> смешанные признаки
<222> (6)..(6)
<223> n представляет собой тимин, меченный тиазоловым оранжевым
<400> 16
accacnagat ttccag 16
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АМПЛИФИКАЦИИ МАТРИЧНОЙ НУКЛЕИНОВОЙ КИСЛОТЫ | 2001 |
|
RU2284357C2 |
| ОБНАРУЖЕНИЕ МИШЕНИ TSG-ПРАЙМЕРОМ | 2010 |
|
RU2551321C2 |
| СПОСОБ ВЫЯВЛЕНИЯ В ОБРАЗЦЕ НУКЛЕИНОВОЙ КИСЛОТЫ-МИШЕНИ (ВАРИАНТЫ) | 2001 |
|
RU2265058C2 |
| МУЛЬТИПЛЕКСНОЕ ДЕТЕКТИРОВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ | 2014 |
|
RU2733887C2 |
| НУКЛЕИНОВО-КИСЛОТНЫЙ ЗОНД | 2014 |
|
RU2668154C2 |
| СПОСОБ И ПРОДУКТ ДЛЯ ЛОКАЛИЗОВАННОЙ ИЛИ ПРОСТРАНСТВЕННОЙ ДЕТЕКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ В ОБРАЗЦЕ ТКАНИ | 2012 |
|
RU2603074C2 |
| КОМПОЗИЦИИ, СПОСОБЫ И НАБОРЫ ДЛЯ СИНТЕЗА И ОБНАРУЖЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2757416C2 |
| ДИСКРИМИНИРУЮЩИЙ МИШЕНЬ ЗОНД, СПОСОБ ЕГО КОНСТРУИРОВАНИЯ И СПОСОБ ДЕТЕКЦИИ НУКЛЕИНОВОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ-МИШЕНИ (ВАРИАНТЫ) | 2010 |
|
RU2542478C2 |
| ПАНЕЛЬ И СПОСОБ ПОЛУЧЕНИЯ ПРОСТРАНСТВЕННОЙ ИНФОРМАЦИИ О НУКЛЕИНОВЫХ КИСЛОТАХ | 2020 |
|
RU2803202C2 |
| ДЕТЕКЦИЯ НУКЛЕИНОВОКИСЛОТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ-МИШЕНЕЙ В АНАЛИЗЕ С РАСЩЕПЛЕНИЕМ И УДЛИНЕНИЕМ РТО | 2012 |
|
RU2566562C2 |
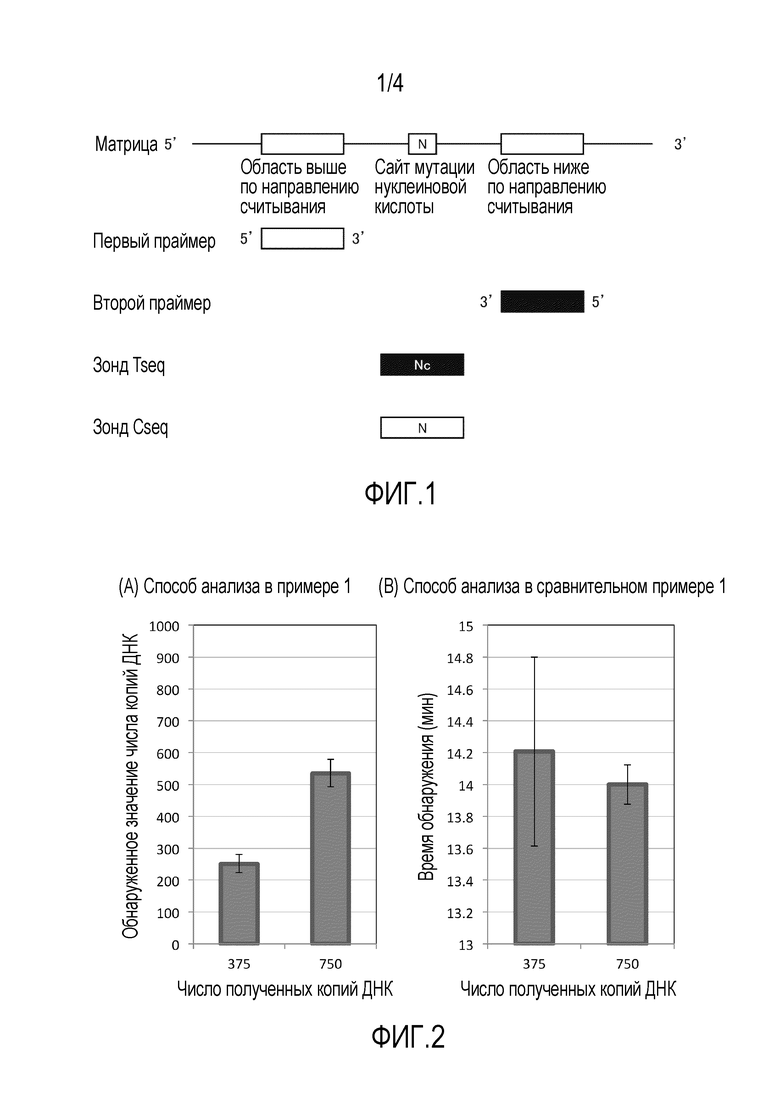
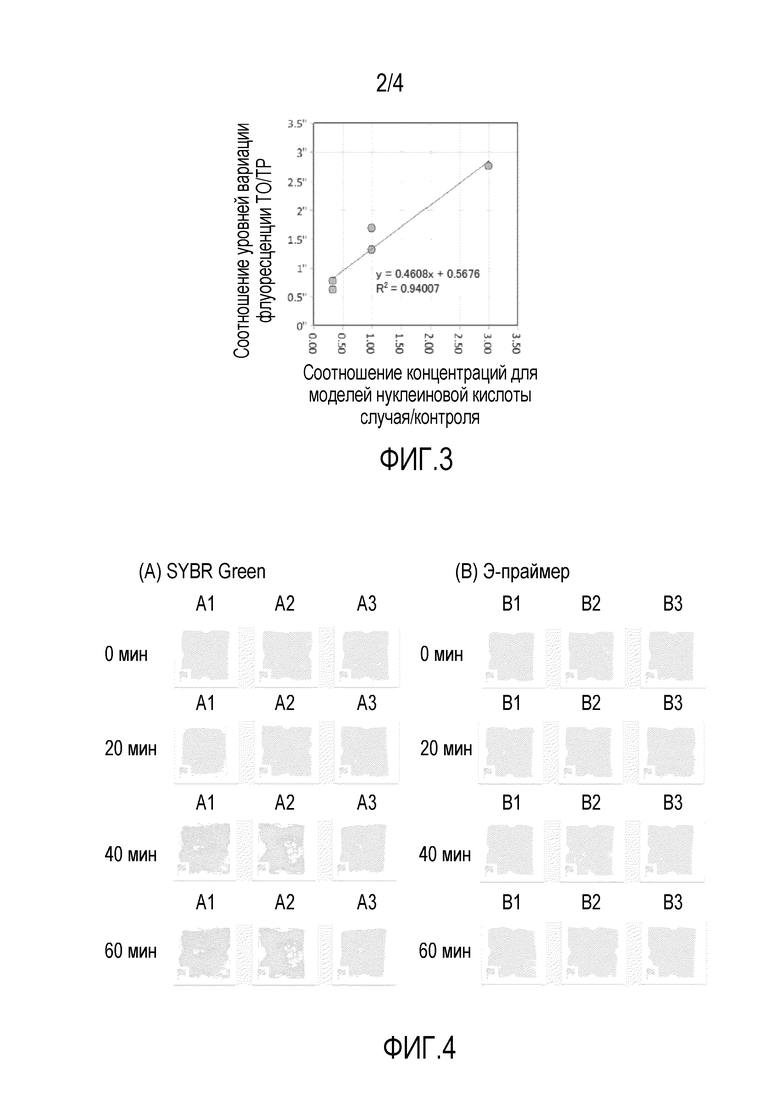
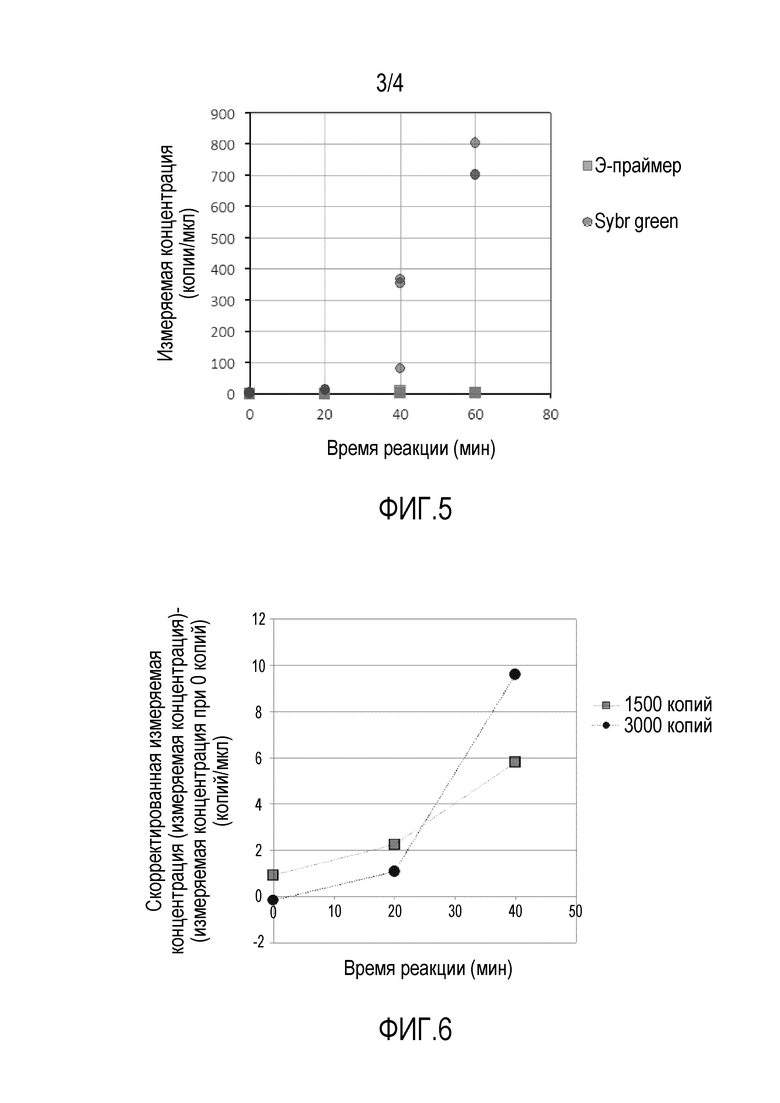

Изобретение относится к биотехнологии, в частности к способу анализа матричной нуклеиновой кислоты, способу анализа вещества-мишени, набору или анализатору для анализа вещества-мишени, которые имеют повышенную точность. Изобретение отображает способ, где реактив для амплификации нуклеиновой кислоты содержит набор праймеров, которые амплифицируют последовательность-мишень и комплементарную последовательность, и генерирующее сигнал вещество, которое генерирует или гасит сигнал в ответ на амплификацию, и генерирующее сигнал вещество генерирует сигнал в состоянии, в котором оно связано в зависимости от последовательности, и гасит сигнал в состоянии, в котором оно не связано, или гасит сигнал в состоянии, в котором оно связано в зависимости от последовательности, и генерирует сигнал в состоянии, в котором оно не связано, и генерация и гашение сигнала обратимы. 3 н. и 12 з.п. ф-лы, 7 ил., 11 табл., 3 пр.
1. Способ анализа матричной нуклеиновой кислоты, включающий стадии:
фракционирования образца, содержащего матричную нуклеиновую кислоту, на множество фракций матричной нуклеиновой кислоты;
амплификации последовательности-мишени и комплементарной ей последовательности в матричной нуклеиновой кислоте в отношении каждой из множества фракций матричной нуклеиновой кислоты в присутствии реактива для амплификации нуклеиновой кислоты;
обнаружения генерации или гашения сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, в отношении каждой из множества фракций матричной нуклеиновой кислоты после стадии амплификации; и
различения фракции матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность, где
реактив для амплификации нуклеиновой кислоты содержит набор праймеров, которые амплифицируют последовательность-мишень и комплементарную последовательность, и генерирующее сигнал вещество, которое генерирует или гасит сигнал в ответ на амплификацию, и
генерирующее сигнал вещество генерирует сигнал в состоянии, в котором оно связано в зависимости от последовательности, и гасит сигнал в состоянии, в котором оно не связано, или гасит сигнал в состоянии, в котором оно связано в зависимости от последовательности, и генерирует сигнал в состоянии, в котором оно не связано, и генерация и гашение сигнала обратимы;
где генерирующее сигнал вещество включает флуорогенный зонд, содержащий по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, в качестве генерирующего сигнал вещества на молекулу, и указанные по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, содержатся в основании, которое содержит пару флуоресцентных атомных групп, которые демонстрируют экситонный эффект, и содержит структуру, представленную следующей формулой (16), (16b), (17) или (17b):
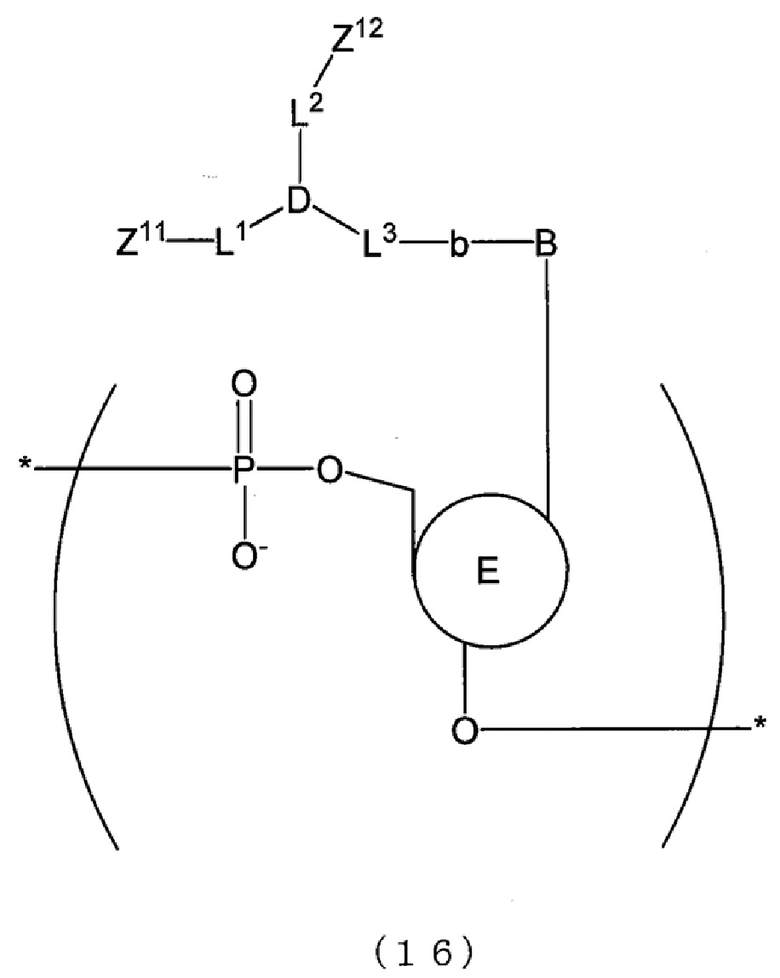



где в формулах (16), (16b), (17), (17b)
B представляет собой атомную группу, имеющую остов природных нуклеиновых оснований (аденин, гуанин, цитозин, тимин или урацил) или остов искусственного нуклеинового основания,
E представляет собой:
(i) атомную группу, имеющую остов дезоксирибозы, остов рибозы или структуру, полученную из любого одного из них, или
(ii) атомную группу, имеющую пептидную структуру или пептоидную структуру,
каждое из Z11 и Z12 представляет собой атомную группу, демонстрирующую флуоресценцию, и может быть идентично друг другу или отличаться друг от друга,
каждое L1, L2 и L3 представляет собой линкер (линкерный атом или атомную группу), длина главной цепи (число атомов главной цепи) которого является произвольным, каждый L1, L2 и L3 может содержать или не содержать каждый из C, N, O, S, P и Si в главной цепи, каждый L1, L2 и L3 может содержать или не содержать каждое из одинарной связи, двойной связи, тройной связи, амидной связи, сложноэфирной связи, дисульфидной связи, иминогруппы, простой эфирной связи, простой тиоэфирной связи и сложной тиоэфирной связи в главной цепи и L1, L2 и L3 могут быть идентичными друг другу или отличаться друг от друга,
D представляет собой CR, N, P, P=O, B или SiR, где R представляет собой атом водорода, алкильную группу или произвольный заместитель, и
b представляет собой одинарную связь, двойную связь или тройную связь,
или альтернативно,
в формулах (16) и (16b) каждое L1 и L2 представляет собой линкер, L3, D и b могут отсутствовать и L1 и L2 могут быть связаны непосредственно с B при условии, что:
в формулах (16) и (17) E представляет собой атомную группу, описанную в (i), и по меньшей мере один атом O в связи фосфорной кислоты можно заменять на атом S;
в формулах (16b) и (17b) E представляет собой атомную группу, описанную в (ii); и
в формулах (17) и (17b) соответствующие B могут быть идентичны друг другу или отличаться друг от друга и соответствующие E могут быть идентичны друг другу или отличаться друг от друга.
2. Способ по п. 1 или 2, где набор праймеров содержит флуорогенный праймер, содержащий генерирующее сигнал вещество, и флуорогенный праймер представляет собой праймер, который генерирует сигнал в состоянии, в котором он связан с мишенью, и гасит сигнал в состоянии, в котором он диссоциирован с мишенью, или праймер, который гасит сигнал в состоянии, в котором он связан с мишенью, и генерирует сигнал в состоянии, в котором он диссоциирован с мишенью.
3. Способ по п. 1 или 2, где
(a) способ амплификации, используемый на стадии амплификации, представляет собой по меньшей мере один из способа изотермальной амплификации и способа ПЦР;
(b) указанный способ дополнительно включает стадию
извлечения амплифицированной фракции из множества фракций матричной нуклеиновой кислоты после стадии различения;
и необязательно дополнительно включает стадию
амплификации последовательности-мишени и комплементарной последовательности в матричной нуклеиновой кислоте в отношении амплифицированной фракции после стадии различения, где амплификация представляет собой вторую стадию амплификации; и/или
(c) стадию обнаружения проводят посредством анализа кривой плавления; и/или
(d) указанный способ дополнительно включает стадию
проведения анализа посредством анализа кривой плавления после стадии обнаружения.
4. Способ по любому из предшествующих пунктов, где
(a) образец, содержащий матричную нуклеиновую кислоту, содержит реактив для амплификации нуклеиновой кислоты, и
на стадии фракционирования образец, содержащий матричную нуклеиновую кислоту и реактив для амплификации нуклеиновой кислоты, фракционируют на множество фракций матричной нуклеиновой кислоты;
(b) стадия фракционирования предусматривает то, что каждая из множества фракций матричной нуклеиновой кислоты содержит реактив для амплификации нуклеиновой кислоты; и/или
(c) стадия фракционирования включает стадию формирования эмульсии из образца,
фракция матричной нуклеиновой кислоты представляет собой каплю образца, диспергированную в эмульсии, и
стадия обнаружения представляет собой стадию обнаружения генерации или гашения сигнала в отношении капли в эмульсии, необязательно где
эмульсию пропускают через канал потока и
генерацию или гашение сигнала обнаруживают в отношении капли в предварительно определяемом месте канала потока, когда капля в эмульсии проходит через канал потока; и/или
эмульсия представляет собой эмульсию вода-в-масле (типа W/O); и/или
(d) стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством распределения образца по чипу, на поверхности которого предусмотрено множество частей формирования фракций матричной нуклеиновой кислоты.
5. Способ по п. 4, где
(A) (a) в чипе поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной, и
стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством нанесения образца на поверхность чипа для того, чтобы разделять образец в части формирования фракции матричной нуклеиновой кислоты;
(b) в чипе часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа и область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку, и
стадия фракционирования представляет собой стадию фракционирования образца посредством введения образца в выемки на поверхности чипа; или
(c) в чипе часть формирования фракции матричной нуклеиновой кислоты представляет собой выемку на поверхности чипа и внутренняя поверхность части формирования фракции матричной нуклеиновой кислоты является гидрофильной, область, не содержащая часть формирования фракции матричной нуклеиновой кислоты, представляет собой не выемку и поверхность области, не содержащей часть формирования фракции матричной нуклеиновой кислоты, является гидрофобной; и/или
(B) (a) реактив для амплификации нуклеиновой кислоты располагают в части формирования фракции матричной нуклеиновой кислоты в чипе, и
стадия фракционирования предусматривает то, что фракция матричной нуклеиновой кислоты содержит реактив для амплификации нуклеиновой кислоты в части формирования фракции матричной нуклеиновой кислоты в чипе; или
(b) стадия обнаружения представляет собой стадию получения изображения множества фракций матричной нуклеиновой кислоты по меньшей мере на одном чипе, и
стадия различения представляет собой стадию различения фракции матричной нуклеиновой кислоты на чипе, в которой генерацию или гашение сигнала обнаружили на изображении, в качестве амплифицированной фракции.
6. Способ по любому из предшествующих пунктов, где
(a) стадия фракционирования представляет собой стадию фракционирования образца на множество фракций матричной нуклеиновой кислоты посредством капания образца;
(b) на стадии фракционирования усредненный объем множества фракций матричной нуклеиновой кислоты составляет от 0,0001 до 5000 нл;
(c) образец содержит матричные нуклеиновые кислоты по меньшей мере двух типов,
реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и по меньшей мере два генерирующих сигнал вещества,
каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот, и
каждое из по меньшей мере двух генерирующих сигнал веществ имеет одно и то же флуоресцентное свойство и генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот;
(d) образец содержит по меньшей мере две матричные нуклеиновые кислоты,
реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и по меньшей мере два генерирующих сигнал вещества,
каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот, и
каждое из по меньшей мере двух генерирующих сигнал веществ имеет флуоресцентное свойство, отличающееся от другого, и генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот;
(e) образец содержит по меньшей мере две матричные нуклеиновые кислоты,
реактив для амплификации нуклеиновой кислоты содержит по меньшей мере два набора праймеров и нефлуорогенный зонд,
каждый из по меньшей мере двух наборов праймеров позволяет амплифицировать последовательность-мишень и комплементарную последовательность в каждой из различных матричных нуклеиновых кислот, и
каждый из генерирующего сигнал вещества и нефлуорогенного зонда генерирует или гасит сигнал в ответ на амплификацию последовательности-мишени и комплементарной последовательности в каждой из различных матричных нуклеиновых кислот;
(f) генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении каждой из множества фракций матричной нуклеиновой кислоты перед стадией амплификации, и
на стадии различения, посредством сравнения сигнала, обнаруживаемого перед стадией амплификации, и сигнала, обнаруживаемого после стадии амплификации, фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты различают в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность; и/или
(g) генерацию или гашение сигнала, который отражает амплификацию последовательности-мишени или комплементарной последовательности, обнаруживают в отношении образца, содержащего матричную нуклеиновую кислоту, перед стадией фракционирования, и
на стадии различения, посредством сравнения сигнала, обнаруживаемого перед стадией фракционирования, и сигнала, обнаруживаемого после стадии амплификации, фракцию матричной нуклеиновой кислоты, в которой обнаружены генерация или гашение сигнала, который отражает амплификацию, среди множества фракций матричной нуклеиновой кислоты различают в качестве амплифицированной фракции, в которой амплифицирована последовательность-мишень или комплементарная последовательность.
7. Способ анализа вещества-мишени, включающий стадии:
приведения образца, содержащего по меньшей мере одно вещество-мишень, в контакт с по меньшей мере одним флуорогенным зондом, который генерирует сигнал в состоянии, в котором он специфически связан с веществом-мишенью, и гасит сигнал в состоянии, в котором он не связан с веществом-мишенью, или гасит сигнал в состоянии, в котором он специфически связан с веществом-мишенью, и генерирует сигнал в состоянии, в котором он не связан в реакционном растворе, чтобы приводить по меньшей мере один флуорогенный зонд в контакт с каждым флуорогенным зондом; и
обнаружения генерации или гашения сигнала флуорогенного зонда в ответ на связывание между нуклеиновой кислотой-мишенью и зондом;
где флуорогенный зонд содержит по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, в качестве генерирующего сигнал вещества на молекулу и указанные по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, содержатся в основании, которое содержит пару флуоресцентных атомных групп, которые демонстрируют экситонный эффект, и содержит структуру, представленную следующей формулой (16), (16b), (17) или (17b):




где в формулах (16), (16b), (17), (17b)
B представляет собой атомную группу, имеющую остов природных нуклеиновых оснований (аденин, гуанин, цитозин, тимин или урацил) или остов искусственного нуклеинового основания,
E представляет собой:
(i) атомную группу, имеющую остов дезоксирибозы, остов рибозы или структуру, полученную из любого одного из них, или
(ii) атомную группу, имеющую пептидную структуру или пептоидную структуру,
каждое из Z11 и Z12 представляет собой атомную группу, демонстрирующую флуоресценцию, и может быть идентично друг другу или отличаться друг от друга,
каждое L1, L2 и L3 представляет собой линкер (линкерный атом или атомную группу), длина главной цепи (число атомов главной цепи) которого является произвольным, каждый L1, L2 и L3 может содержать или не содержать каждый из C, N, O, S, P и Si в главной цепи, каждый L1, L2 и L3 может содержать или не содержать каждое из одинарной связи, двойной связи, тройной связи, амидной связи, сложноэфирной связи, дисульфидной связи, иминогруппы, простой эфирной связи, простой тиоэфирной связи и сложной тиоэфирной связи в главной цепи и L1, L2 и L3 могут быть идентичными друг другу или отличаться друг от друга,
D представляет собой CR, N, P, P=O, B или SiR, где R представляет собой атом водорода, алкильную группу или произвольный заместитель, и
b представляет собой одинарную связь, двойную связь или тройную связь,
или альтернативно,
в формулах (16) и (16b) каждое L1 и L2 представляет собой линкер, L3, D и b могут отсутствовать и L1 и L2 могут быть связаны непосредственно с B при условии, что:
в формулах (16) и (17) E представляет собой атомную группу, описанную в (i), и по меньшей мере один атом O в связи фосфорной кислоты можно заменять на атом S;
в формулах (16b) и (17b) E представляет собой атомную группу, описанную в (ii); и
в формулах (17) и (17b) соответствующие B могут быть идентичны друг другу или отличаться друг от друга и соответствующие E могут быть идентичны друг другу или отличаться друг от друга.
8. Способ по п. 7, где вещество-мишень
представляет собой нуклеиновую кислоту или последовательность нуклеиновой кислоты и/или
представляет собой вещество-мишень в состоянии, в котором оно связано с веществом, которое специфически связывается с указанным веществом-мишенью.
9. Способ по п. 7 или 8, где
(a) стадия обнаружения представляет собой стадию обнаружения яркости или интенсивности сигнала по меньшей мере одного типа в реакционном растворе;
(b) стадия обнаружения представляет собой стадию обнаружения сигнала по меньшей мере одного типа в реакционном растворе посредством подсчета на молекулярном уровне флуорогенного зонда;
(c) анализируют вещества-мишени по меньшей мере двух типов,
используют флуорогенные зонды по меньшей мере двух типов для веществ-мишеней, и способ включает стадию
вычисления соотношения концентраций или относительного содержания каждого вещества-мишени по значению обнаруживаемого сигнала флуорогенных зондов по меньшей мере двух типов, обнаруживаемого на стадии обнаружения;
(d) анализируют по меньшей мере два вещества-мишени и вещества-мишени по меньшей мере двух типов являются смежными друг с другом, и
используют по меньшей мере два флуорогенных зонда для веществ-мишеней, и
каждый из флуорогенных зондов содержит генерирующее сигнал вещество, имеющее флуоресцентное свойство, отличное от другого, и генерирует или гасит сигнал в ответ на связывание с различными веществами-мишенями с резонансным переносом энергии флуоресценции;
(e) анализируют по меньшей мере два вещества-мишени и вещества-мишени по меньшей мере двух типов являются смежными друг с другом, и
используют по меньшей мере два флуорогенных зонда для веществ-мишеней, и
каждый из флуорогенных зондов содержит генерирующее сигнал вещество, обладающее флуоресцентным свойством, отличным от другого, генерирует или гасит сигнал в ответ на связывание с различными веществами-мишенями и обнаруживает присутствие или отсутствие пространственного перекрытия сигналов нескольких типов; и/или
(f) на стадии контактирования и стадии обнаружения управляют температурой реакционного раствора.
10. Способ анализа вещества-мишени по п. 7, где
анализ вещества-мишени представляет собой анализ модификации вещества-мишени, и
способ дополнительно включает стадию
предварительной обработки вещества-мишени перед стадией обнаружения и необязательно дополнительно включает стадии:
амплификации предварительно обработанного вещества-мишени после стадии предварительной обработки и перед стадией обнаружения, где амплифицированный продукт, получаемый на стадии амплификации, используют в качестве вещества-мишени на стадии обнаружения.
11. Способ по любому из пп. 1-6, где
анализ матричной нуклеиновой кислоты представляет собой анализ модификации матричной нуклеиновой кислоты, и
способ дополнительно включает стадию
предварительной обработки матричной нуклеиновой кислоты перед стадией фракционирования.
12. Способ по п. 10 или 11, где
(a) анализ вещества-мишени или матричной нуклеиновой кислоты представляет собой анализ метилирования вещества-мишени или матричной нуклеиновой кислоты и
стадия предварительной обработки представляет собой стадию превращения неметилированного остатка цитозина вещества-мишени или матричной нуклеиновой кислоты в остаток урацила или остаток производного урацила, необязательно где
на стадии предварительной обработки превращение проводят с использованием бисульфита;
(b) анализ вещества-мишени или матричной нуклеиновой кислоты представляет собой анализ метилирования вещества-мишени или матричной нуклеиновой кислоты и
стадия предварительной обработки представляет собой стадию расщепления неметилированной области или метилированной области вещества-мишени или матричной нуклеиновой кислоты, необязательно где
на стадии предварительной обработки расщепление проводят с использованием рестрикционного фермента;
(c) анализ вещества-мишени или матричной нуклеиновой кислоты представляет собой анализ метилирования вещества-мишени или матричной нуклеиновой кислоты и
стадия предварительной обработки представляет собой стадию обогащения метилированного вещества-мишени или метилированной матричной нуклеиновой кислоты, необязательно где
на стадии предварительной обработки, используя по меньшей мере один из связывающего метилированную ДНК белка и антитела против метилцитозина, метилированное вещество-мишень или метилированную матричную нуклеиновую кислоту обогащают посредством связывания по меньшей мере одного из связывающего метилированную ДНК белка и антитела против метилцитозина с метилированным веществом-мишенью или метилированной матричной нуклеиновой кислотой;
(d) анализ вещества-мишени или матричной нуклеиновой кислоты представляет собой анализ гидроксиметилирования вещества-мишени или матричной нуклеиновой кислоты и
стадия предварительной обработки представляет собой стадию превращения остатка гидроксиметилцитозина вещества-мишени или матричной нуклеиновой кислоты в остаток негидроксиметилированного основания, необязательно где
на стадии предварительной обработки (i) остаток гидроксиметилцитозина превращают в остаток тимина или остаток производного тимина с использованием вольфрамового окислителя или (ii) остаток гидроксиметилцитозина превращают в остаток урацила или остаток производного урацила с использованием перрутената калия (KRuO4) и бисульфита;
(e) анализ вещества-мишени или матричной нуклеиновой кислоты представляет собой анализ гидроксиметилирования вещества-мишени или матричной нуклеиновой кислоты и
стадия предварительной обработки включает стадии:
гликозилирования гидроксиметилированной области гидроксиметилированного вещества-мишени или гидроксиметилированной матричной нуклеиновой кислоты; и
расщепления гликозилированной области гидроксиметилированного вещества-мишени или гидроксиметилированной матричной нуклеиновой кислоты, необязательно где расщепление проводят с использованием чувствительного к гликозилированию рестрикционного фермента; или обогащения гликозилированных гидроксиметилированного вещества-мишени или гидроксиметилированной матричной нуклеиновой кислоты, необязательно где гликозилированные гидроксиметилированное вещество-мишень или гидроксиметилированную матричную нуклеиновую кислоту обогащают посредством связывания антитела с гликозилированными гидроксиметилированным веществом-мишенью или гидроксиметилированной матричной нуклеиновой кислотой.
13. Способ по любому из пп. 2-12, где
флуорогенный праймер содержит по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, в качестве генерирующего сигнал вещества на молекулу.
14. Способ по п. 2 или 13, где
указанные по меньшей мере две флуоресцентные атомные группы, которые демонстрируют экситонный эффект, содержатся в основании, которое содержит пару флуоресцентных атомных групп, которые демонстрируют экситонный эффект, и содержит структуру, представленную следующей формулой (16), (16b), (17) или (17b):




где в формулах (16), (16b), (17), (17b)
B представляет собой атомную группу, имеющую остов природных нуклеиновых оснований (аденин, гуанин, цитозин, тимин или урацил) или остов искусственного нуклеинового основания,
E представляет собой:
(i) атомную группу, имеющую остов дезоксирибозы, остов рибозы или структуру, полученную из любого одного из них, или
(ii) атомную группу, имеющую пептидную структуру или пептоидную структуру,
каждое из Z11 и Z12 представляет собой атомную группу, демонстрирующую флуоресценцию, и может быть идентично друг другу или отличаться друг от друга,
каждое L1, L2 и L3 представляет собой линкер (линкерный атом или атомную группу), длина главной цепи (число атомов главной цепи) которого является произвольным, каждый L1, L2 и L3 может содержать или не содержать каждый из C, N, O, S, P и Si в главной цепи, каждый L1, L2 и L3 может содержать или не содержать каждое из одинарной связи, двойной связи, тройной связи, амидной связи, сложноэфирной связи, дисульфидной связи, иминогруппы, простой эфирной связи, простой тиоэфирной связи и сложной тиоэфирной связи в главной цепи и L1, L2 и L3 могут быть идентичными друг другу или отличаться друг от друга,
D представляет собой CR, N, P, P=O, B или SiR, где R представляет собой атом водорода, алкильную группу или произвольный заместитель, и
b представляет собой одинарную связь, двойную связь или тройную связь,
или альтернативно,
в формулах (16) и (16b) каждое L1 и L2 представляет собой линкер, L3, D и b могут отсутствовать и L1 и L2 могут быть связаны непосредственно с B при условии, что:
в формулах (16) и (17) E представляет собой атомную группу, описанную в (i), и по меньшей мере один атом O в связи фосфорной кислоты можно заменять на атом S;
в формулах (16b) и (17b) E представляет собой атомную группу, описанную в (ii); и
в формулах (17) и (17b) соответствующие B могут быть идентичны друг другу или отличаться друг от друга и соответствующие E могут быть идентичны друг другу или отличаться друг от друга.
15. Набор или анализатор для анализа вещества-мишени, который позволяет осуществлять способы анализа по любому из пп. 1-14.
| Рудницкая Г | |||
| Е., Евстрапов А | |||
| А., МИКРОЧИПОВЫЕ УСТРОЙСТВА ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | |||
| Ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ОСНОВНЫЕ ПРИНЦИПЫ ПЦР; КОНСТРУКЦИЯ И МАТЕРИАЛЫ МИКРОЧИПОВ (ОБЗОР), Научное приборостроение, 2008, том 18, номер 3, стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Бородулин Владимир Борисович и др., "Технология и применение ДНК-биочипов" Известия высших учебных заведений | |||
Авторы
Даты
2021-01-22—Публикация
2016-08-26—Подача