ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка претендует на приоритет временной патентной заявки США №62/044592, поданной 2 сентября 2014 г., которая включена в данный документ посредством ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
Антитела, которые специфически связывают опухолевые поверхностные антигены, используются для доставки цитотоксических лекарственных средств в форме конъюгатов антитело-лекарственное средство (ADC). Цитотоксические лекарственные средства типично конъюгируются с антителами по цистеиновым или лизиновым остаткам. Число молекул лекарственного средства, конъюгированных с антителом, также называемое соотношением лекарственное средство-антитело ("DAR"), типично представляет собой распределение различных форм со значениями в диапазоне 0-8. DAR для производственной партии ADC определяют эмпирически с помощью спектрофотометрических измерений, и терапевтические композиции ADC типично содержат смесь разных форм ADC, различающихся по содержанию лекарственного средства. Таким образом, значение DAR для партии ADC представляет собой среднее DAR для разных форм ADC в партии.
Как противораковые терапевтические средства на основе ADC, так и противораковые терапевтические средства на основе антител составляются на основании номинальной концентрации белка антитела и должны соответствовать спецификации. Хотя на этикетке готовой лекарственной формы приводится информация о "номинальной" или целевой концентрации белка, концентрация лекарственного средства во флаконе может изменяться по отношению к целевой концентрации антитела из-за допустимых отклонений DAR, даже несмотря на соответствие критериям пригодности. Активность ADC в общем линейно зависит от концентрации. В отличие от антител, ADC имеют дополнительные потенциальные возможности изменчивости активности из-за DAR. Типичная спецификация на концентрацию антитела и DAR допускает некоторую изменчивость концентрации цитотоксического лекарственного средства во флаконах с готовым ADC из разных партий, когда определение дозировки для пациента основано на номинальной концентрации антитела.
Важно, чтобы пациенты получали дозу ADC, которая является как безопасной, так и эффективной. Усовершенствованные способы составления композиций ADC будут предпочтительно снижать изменчивость активности, эффективности и/или токсичности между разными партиями и обеспечивать получение пациентами ADC в пределах назначенного терапевтического диапазона.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает новый способ составления терапевтической композиции, содержащей конъюгат антитело-лекарственное средство ("ADC"), основанный на концентрации лекарственного средства, тем самым позволяющий сузить пределы изменчивости активности между разными партиями ADC, минимизируя токсичность и увеличивая эффективность композиций лекарственного средства, составленных в соответствии с данным способом.
Настоящее изобретение основано, по крайней мере частично, на открытии того, что эффективность и токсичность некоторых ADC обеспечивается полностью или преимущественно, концентрацией вводимого лекарственного средства, а не концентрацией антитела. Обычные способы составления лекарственного средства на основе антитела, включая фармацевтические композиции, содержащие ADC, основаны на определении дозы для пациента на основании концентрации антитела. Хотя это может быть полезным для композиций, которые содержат только антитело, составление композиций ADC с использованием концентрации антител может привести к непостоянству концентрации лекарственных средств и, потенциально, выходу за пределы желательного диапазона. Активность ADC в общем линейно зависит от концентрации присоединенного лекарственного средства, которая может зависеть как от концентрации антитела, так и от DAR, как видно из формулы [лекарственное средство] = DAR * [антитело]. Величины DAR, концентраций антитела и лекарственного средства могут все меняться пределах заданного и приемлемого диапазона значений, указанного в спецификации для данного ADC. Однако, поскольку лекарственное средство и антитело связаны друг с другом, колебания значений одного компонента отражаются на другом. Например, колебания концентрации антитела на ±10-20%, которые по промышленным стандартам находятся в приемлемом диапазоне значений, будут вызывать отклонения концентрации лекарственного средства на ±10-20%, которые могут приводить к непостоянству активности готовой лекарственной формы во флаконе в пределах ±20-40%. Колебания DAR на ±15% будут приводить к дополнительным изменениям активности, поскольку они будут допускать отклонения концентрации лекарственного средства на 15% в большую или меньшую сторону. Этот эффект может быть особенно значимым для конкретной подгруппы ADC, в которой было продемонстрировано, что концентрация лекарственного средства является основным фактором, влияющим на токсичность и эффективность.
ADC связаны с цитотоксическими агентами, также известными как молекулы "лекарственного средства", и число молекул лекарственного средства, конъюгированных с молекулой антитела, описывается термином "соотношение лекарственного средства и антитела" ("DAR"). Величину DAR для производственной партии ADC определяют эмпирически с использованием спектрофотометрических измерений, путем определения соотношения концентрации лекарственного средства к концентрации антитела. DAR для конкретной партии ADC представляет собой среднее число (молекул) лекарственных средств, присоединенных к каждой молекуле антитела в данной партии. Типичные требования к DAR для клинической разработки предусматривают диапазон значений ± 10-15%). Обычно, начальная стадия разработки композиции ADC заключается в определении молярной концентрации лекарственного средства и антитела и в расчете DAR. ADC затем доводят до целевой концентрации антитела, позволяя концентрации лекарственного средства меняться в соответствии с технологическим значением DAR, согласно:
[лекарственное средство] = DAR × [антитело],
В отличие от этого, настоящее изобретение основано на открытии того, что путем составления композиции ADC на основе целевой концентрации лекарственного средства, определенной при заданной концентрации антитела и заданном значении DAR, можно минимизировать изменчивость активности и токсичности. Таким образом, в тех случаях, когда было продемонстрировано, что активность, эффективность и/или токсичность ADC определяются преимущественно количеством вводимого лекарственного средства, усовершенствованные способы снижения изменчивости цитотоксической концентрации лекарственного средства будут полезными. Соответственно, способы составления композиций, описанные ниже, включают определение целевой концентрации лекарственного средства при заданной концентрации антитела и заданном значении DAR, и составление композиции конъюгата антитело-лекарственное средство для достижения целевой концентрации лекарственного средства. Такие усовершенствованные способы составления композиций обеспечивают введение пациентам доз в узком диапазоне намеченного лекарственного средства без дополнительного риска неэффективности партии.
В одном аспекте, настоящее изобретение в общем предлагает способ снижения (например, по меньшей мере на около 5%, 10%, 20% или больше) изменчивости активности в композиции конъюгата антитело-лекарственное средство, включающий определение целевой концентрации лекарственного средства при заданной концентрации антитела и соотношении лекарственное средство-антитело; и составление композиции конъюгата антитело-лекарственное средство для достижения целевой концентрации лекарственного средства, тем самым снижая изменчивость активности в композиции. В одном варианте реализации, изменчивость концентрации лекарственного средства составляет около ± 10%. В различных вариантах реализации, изменчивость составляет менее чем около ± 5, 6, 7, 8 или 9%. В одном варианте реализации, способ снижает различия в активности между разными партиями (например, по меньшей мере на около 5%, 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, или больше). Следует отметить, что в тех случаях, когда изменчивость обозначена с помощью ±, она должна описывать отклонения на указанный % в большую или меньшую сторону от приведенного значения. В тех случаях, когда изменчивость представлена одним суммарным значением (например, по меньшей мере 10%), она должна описывать разницу между максимальным и минимальным возможными значениями. В другом варианте реализации, композиция представляет собой готовую лекарственную форму. В еще одном варианте реализации, концентрация лекарственного средства меняется в пределах, установленных в спецификации на антитело. В одном варианте реализации, концентрация антитела равна целевой концентрации антитела ± менее чем около 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10%. В другом варианте реализации, концентрация антитела равна целевой концентрации антитела ± менее чем около 10%, 12%, 15%, или 20%.
В другом отдельном аспекте, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство. Способ включает составление композиции конъюгата антитело-лекарственное средство путем установления целевой концентрации лекарственного средства, попадающей в середину области перекрывания нормативных пределов концентрации антитела и нормативных пределов концентрации лекарственного средства, тем самым снижая изменчивость активности в композиции. В этом отношении, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство, включающий: (а) измерение DAR для композиции конъюгата антитело-лекарственное средство; (b) определение верхнего нормативного предела для антитела и нижнего нормативного предела для антитела, где верхний нормативный предел для антитела представляет собой целевую концентрацию антитела плюс максимальное допустимое нормативное отклонение, и нижний нормативный предел для антитела представляет собой целевую концентрацию антитела минус максимальное допустимое нормативное отклонение; (с) определение заданного верхнего нормативного предела для лекарственного средства и заданного нижнего нормативного предела для лекарственного средства, где заданный верхний нормативный предел для лекарственного средства представляет собой целевую концентрацию лекарственного средства плюс максимальное допустимое нормативное отклонение, и заданный нижний нормативный предел для лекарственного средства представляет собой целевую концентрацию лекарственного средства минус максимальное допустимое нормативное отклонение; (d) определение расчетного верхнего нормативного предела для лекарственного средства (ВНП (лекарственное средство)) следующим образом:
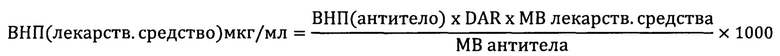
(е) определение расчетного нижнего нормативного предела для лекарственного средства (ННП (лекарственное средство)) следующим образом:

(f) сравнение расчетного ВНП (лекарственное средство) по стадии (d) с заданным верхним нормативным пределом для лекарственного средства стадии (с), и выбор меньшего из двух значений в качестве эффективного верхнего нормативного предела для лекарственного средства; (g) сравнение расчетного ННП (лекарственное средство) по стадии (е) с заданным нижним нормативным пределом для лекарственного средства стадии (с), и выбор большего из двух значений в качестве эффективного нижнего нормативного предела для лекарственного средства; и (h) составление композиции конъюгата антитело-лекарственное средство с целевой концентрацией лекарственного средства, являющейся средней точкой между эффективным верхним нормативным пределом для лекарственного средства и эффективным нижним нормативным пределом для лекарственного средства, тем самым снижая изменчивость активности в композиции. В одном варианте реализации, способ сужает интервал между верхним и нижним нормативными пределами для лекарственного средства до около ± 3-9%. В другом варианте реализации, способ сужает интервал между верхним и нижним нормативными пределами для лекарственного средства до около ± 4%. В одном варианте реализации, максимальное допустимое нормативное отклонение на стадии (b) составляет около ± 15%. В другом варианте реализации, максимальное допустимое нормативное отклонение на стадии (b) составляет менее чем около ± 10, 11, 12, 13 или 14%. В одном варианте реализации, максимальное допустимое нормативное отклонение на стадии (с) составляет около ± 15%. В другом варианте реализации, максимальное допустимое нормативное отклонение на стадии (с) составляет менее чем около ±10, 11, 12, 13 или 14%. В различных вариантах реализации, антитело представляет собой нефункциональное антитело. В различных вариантах реализации, значение DAR соответствует нижнему пределу DAR по спецификации или верхнему пределу DAR по спецификации. В различных вариантах реализации, нижний предел DAR по спецификации равен 2,3, 2,4 или 2,5. В различных вариантах реализации, верхний предел DAR по спецификации равен 2,9, 3,0 или 3,1.
В родственном аспекте, например, когда антитело представляет собой функциональное антитело, настоящее изобретение также предлагает способ составления композиции конъюгата антитело-лекарственное средство путем установления целевой концентрации антитела, попадающей в середину области перекрывания нормативных пределов концентрации антитела и нормативных пределов концентрации лекарственного средства, тем самым устанавливая концентрацию антитела, позволяющую обеспечить наименьшие колебания концентрации лекарственного средства при составлении композиции ADC. Это позволяет обеспепечить более жесткий контроль концентрации антитела в композиции ADC.
В другом аспекте, настоящее изобретение предлагает способ составления композиции конъюгата антитело-лекарственное средство, включающий определение целевой концентрации лекарственного средства при заданной концентрации антитела и соотношении лекарственное средство-антитело; и составление композиции конъюгата антитело-лекарственное средство для достижения целевой концентрации лекарственного средства.
В еще одном аспекте, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-майтанзиноид, включающий определение целевой концентрации майтанзиноида при заданной концентрации антитела и соотношении майтанзиноид-антитело; и составление композиции конъюгата антитело-майтанзиноид для достижения целевой концентрации майтанзиноида, тем самым снижая изменчивость активности в композиции.
В еще одном аспекте, настоящее изобретение предлагает способ составления композиции конъюгата антитело-майтанзиноид, включающий определение целевой концентрации майтанзиноида при заданной концентрации антитела и соотношении майтанзиноид-антитело; и составление композиции конъюгата антитело-майтанзиноид для достижения целевой концентрации майтанзиноида.
В еще одном аспекте, настоящее изобретение предлагает способ составления композиции конъюгата антитело-бензодиазепин (например, пирролобензодиазепин или индолинобензодиазепин), включающий определение целевой концентрации бензодиазепина при заданной концентрации антитела и соотношении бензодиазепин-антитело; и составление композиции конъюгата антитело-бензодиазепин для достижения целевой концентрации бензодиазепина.
В другом отдельном аспекте, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-бензодиазепин (например, пирролобензодиазепин или индолинобензодиазепин), включающий: (а) измерение DAR для композиции конъюгата антитело-бензодиазепин (например, пирролобензодиазепин или индолинобензодиазепин); (b) определение верхнего нормативного предела для антитела и нижнего нормативного предела для антитела, где верхний нормативный предел для антитела представляет собой целевую концентрацию антитела плюс максимальное допустимое нормативное отклонение и нижний нормативный предел для антитела представляет собой целевую концентрацию антитела минус максимальное допустимое нормативное отклонение; (с) определение заданного верхнего нормативного предела для бензодиазепина и заданного нижнего нормативного предела для бензодиазепина, где заданный верхний нормативный предел для бензодиазепина представляет собой целевую концентрацию бензодиазепина плюс максимальное допустимое нормативное отклонение и заданный нижний нормативный предел для бензодиазепина представляет собой целевую концентрацию бензодиазепина минус максимальное допустимое нормативное отклонение; (d) определение расчетного верхнего нормативного предела для бензодиазепина (ВНП (лекарственное средство)) следующим образом:

(е) определение расчетного нижнего нормативного предела для бензодиазепина (ННП (лекарственное средство)) следующим образом:

(f) сравнение расчетного ВНП (лекарственное средство) по стадии (d) с заданным верхним нормативным пределом для бензодиазепина стадии (с), и выбор меньшего из двух значений в качестве эффективного верхнего нормативного предела для бензодиазепина; (g) сравнение расчетного ННП (лекарственное средство) по стадии (е) с заданным нижним нормативным пределом для бензодиазепина стадии (с), и выбор большего из двух значений в качестве эффективного нижнего нормативного предела для бензодиазепина; и (h) составление композиции конъюгата антитело-бензодиазепин с целевой концентрацией бензодиазепина, являющейся средней точкой между эффективным верхним нормативным пределом для бензодиазепина и эффективным нижним нормативным пределом для бензодиазепина, тем самым снижая изменчивость активности в композиции.
В еще одном аспекте, настоящее изобретение предлагает способ введения субъекту дозы в узком заданном диапазоне значений, включающий обеспечение композиции конъюгата антитело-лекарственное средство, составленной в соответствии со способом по любому из предшествующих аспектов, и введение указанной композиции субъекту.
В еще одном аспекте, настоящее изобретение предлагает фармацевтическую композицию, содержащую конъюгат антитело-лекарственное средство, составленную в соответствии со способом по предшествующему аспекту, в котором номинальная концентрация лекарственного средства (например, майтанзиноида, бензодиазепиновые соединения, ауристатин) указана на этикетке.
В различных вариантах реализации по любому из предшествующих аспектов или любому другому аспекту настоящего изобретения, описанному в данном документе, лекарственное средство представляет собой цитотоксический агент. Цитотоксические агенты включают, но не ограничиваясь ими, ингибиторы тубулина, ДНК-повреждающие агенты, ДНК-сшивающие агенты, ДНК-алкилирующие агенты, и средства, нарушающие клеточный цикл или митоз. Неограничительные примеры цитотоксических агентов включают майтанзиноиды; бензодиазепиновые соединения, такие как пирролобензодиазепины и индолинобензодиазепины; и ауристатины). В конкретных вариантах реализации предшествующих аспектов, способ снижает различия в активности между разными партиями (например, по меньшей мере на около 5%, 10%, 20%, 25%, 30%, 35%), 40%, 45%, 50% или больше). В других вариантах реализации, композиция представляет собой готовую лекарственную форму. В других вариантах реализации, концентрация антитела изменяется в пределах концентрации антитела согласно спецификации. В других вариантах реализации предшествующих аспектов, способ снижает изменчивость активности между разными партиями при производстве конъюгата антитело-майтанзиноид. В различных вариантах реализации предшествующих аспектов, активность композиции может изменяться на около 10-40% (например, 10, 15, 20, 25, 30, 35, 40%). В других вариантах реализации предшествующих аспектов, активность композиции может изменяться на около 10-20%) (например, 10, 12, 15, 18, 20%). В других вариантах реализации вышеуказанных аспектов, концентрация антитела согласно спецификации равняется целевой ± менее чем около 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10%>. В других вариантах реализации, концентрация антитела согласно спецификации равняется целевой ± менее чем около 10%, 12%, 15% или 20%. В различных вариантах реализации предшествующих аспектов, изменчивость активности композиции снижается по сравнению со случаем, когда композицию конъюгата антитело-лекарственное средство составляют на основании концентрации антитела. В различных вариантах реализации предшествующих аспектов, концентрация антитела и концентрация конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) определяются с помощью спектрофотометрических измерений. В различных вариантах реализации предшествующих аспектов, соотношение лекарственное средство-антитело определяют методом эксклюзионной хроматографии (SEC) или SEC в сочетании с масс-спектрометрией (SEC-MS). В других вариантах реализации предшествующих аспектов, эффективность или токсичность композиции является независимой от соотношения лекарственное средство-антитело или концентрации антитела, но зависит от полной введенной дозы конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В других вариантах реализации предшествующих аспектов, эффективность композиции является независимой от или в значительной степени независимой от соотношения лекарственное средство-антитело. В различных вариантах реализации предшествующих аспектов, токсичность композиции является независимой от или в значительной степени независимой от соотношения лекарственное средство-антитело. В различных вариантах реализации предшествующих аспектов, эффективность или токсичность зависит от или в значительной степени зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, токсичность зависит, в существенной степени зависит, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, эффективность является независимой от, по существу независимой от, или по крайней мере частично независимой от концентрации антитела. В различных вариантах реализации предшествующих аспектов, токсичность является независимой от, по существу независимой от, или по крайней мере частично независимой от концентрации антитела. В различных вариантах реализации предшествующих аспектов, эффективность и токсичность зависят от, в существенной степени зависят от, или по крайней мере частично зависят от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела. В различных вариантах реализации предшествующих аспектов, эффективность и токсичность в меньшей степени зависят от концентрации антитела, чем от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела. В различных вариантах реализации предшествующих аспектов, токсичность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела. В различных вариантах реализации предшествующих аспектов, эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела, и токсичность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства. В различных вариантах реализации предшествующих аспектов, эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела, и токсичность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации антитела. В различных вариантах реализации предшествующих аспектов, токсичность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина) и от концентрации антитела, и эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, токсичность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации антитела, и эффективность зависит от, в существенной степени зависит от, или по меньшей мере частично зависит от концентрации конъюгированного лекарственного средства (например, майтанзиноида, бензодиазепиновых соединений, ауристатина). В различных вариантах реализации предшествующих аспектов, композиция конъюгата антитело-лекарственное средство предназначена для инфузии. В различных вариантах реализации предшествующих аспектов, композицию конъюгата антитело-лекарственное средство составляют с использованием фармацевтически приемлемого парентерального носителя. В различных вариантах реализации предшествующих аспектов, композицию конъюгата антитело-лекарственное средство составляют в виде стандартной лекарственной формы для инъекции.
В различных вариантах реализации по любому из предшествующих аспектов или любому другому аспекту настоящего изобретения, описанному в данном документе, способ включает определение верхнего нормативного предела (ВНП) и нижнего нормативного предела (ННП). В определенных вариантах реализации, расчетные ВНП и ННП определяют с использованием приведенных ниже формул:


В других вариантах реализации любых из вышеуказанных аспектов, цитотоксическое соединение или лекарственное средство представляет собой ингибитор тубулина, ДНК-повреждающий агент, ДНК-сшивающий агент, ДНК-алкилирующий агент, или средство, нарушающее клеточный цикл или митоз.
В других вариантах реализации любых из вышеуказанных аспектов, лекарственное средство включает, но не ограничиваясь ими, майтанзиноиды и аналоги майтанзиноидов, бензодиазепиновые соединения (например, пирролобензодиазепины и индолинобензодиазепины; см. также Таблицу 1: соединения D1-D10 и DGN462), таксоиды, аналоги СС-1065 и СС-1065, дуокармицины и аналоги дуокармицинов, энедиины, такие как калихеамицины, доластатин и аналоги доластатинов, включая ауристатины, производные томаймицина, производные лептомицина, метотрексат, цисплатин, карбоплатин, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил и морфолино-доксорубицин.
В различных вариантах реализации предшествующих аспектов, майтанзиноид представляет собой DM1, DM3 или DM4. В различных вариантах реализации предшествующих аспектов, бензодиазепиновые соединения выбирают из типичных цитотоксических агентов D1-D10 и DGN462, перечисленных в Таблице 1 ниже.

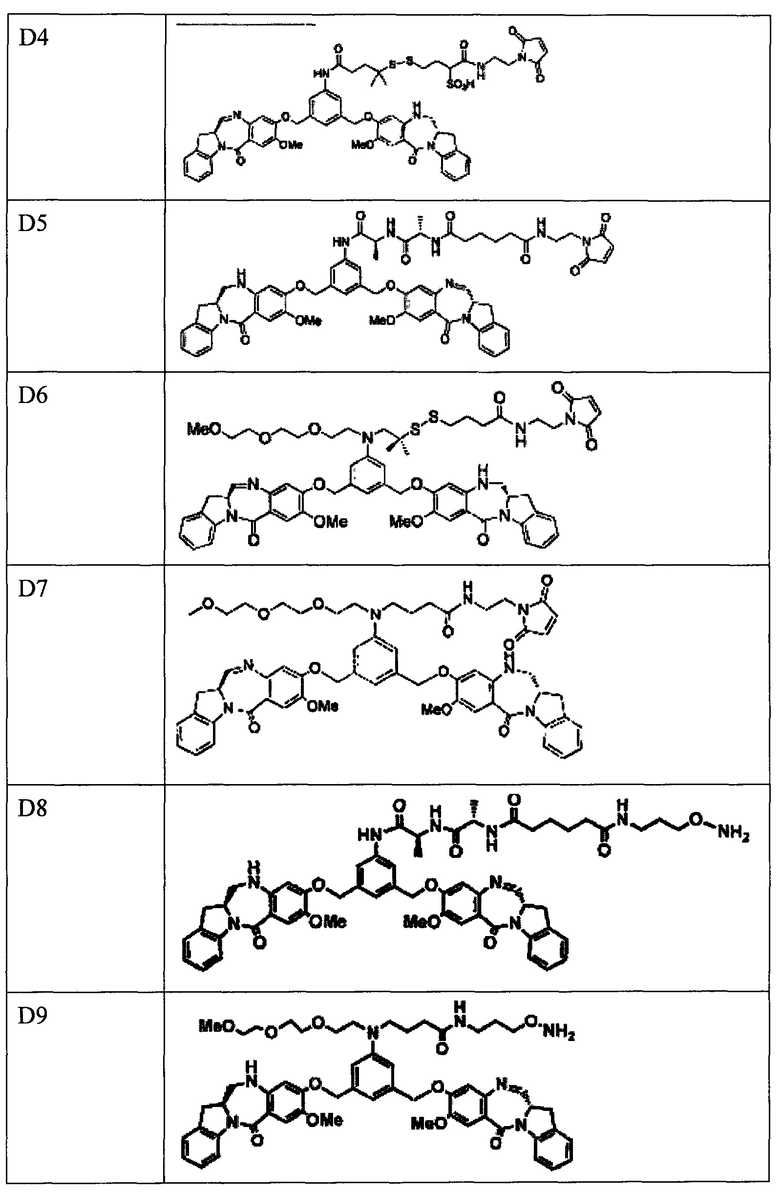
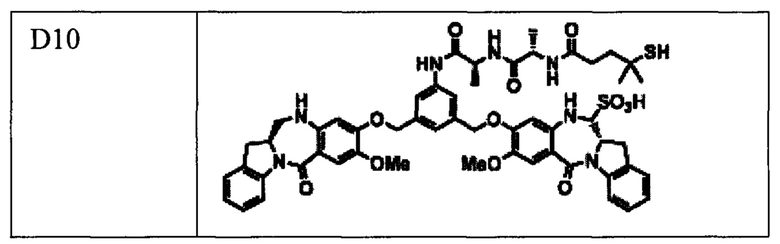
Обращаем внимание на то, что другие варианты (например, сульфонированные варианты) соединений, перечисленных в Таблице 1, также предполагаются и будут очевидны квалифицированному специалисту в данной области техники.
В различных вариантах реализации предшествующих аспектов, антитело может быть функциональным антителом или нефункциональным антителом. Нефункциональные антитела включают, например, huDS6 и антитела, проявляющие только эффектор-медиируемый цитотоксический эффект, такие как huMov19 (M9346A), huAnti- CD123, huMy9-6 (Z4681A) и huB4. Функциональные антитела включают, например, huEGFR-7R и huCD37-3. В определенных вариантах реализации, лекарственное средство представляет собой бензодиазепиновое соединение и антитело представляет собой нефункциональное антитело. В определенных вариантах реализации, лекарственное средство представляет собой майтанзиноид и антитело представляет собой нефункциональное антитело.
В различных вариантах реализации предшествующих аспектов, линкер представляет собой расщепляемый линкер, такой как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB), N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноат (сульфо-SPDB), или N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP). В различных вариантах реализации предшествующих аспектов, линкер представляет собой нерасщепляемый линкер, такой как 2-иминотиолан, ацетилянтарный ангидрид, сукцинимидил-4-(малеимидометил)циклогексанкарбоксилат (SMCC). В качестве расщепляемых или нерасщепляемых линкеров могут быть использованы универсальные линкеры 2-иминотиолан и ацетилянтарный ангидрид.
В различных вариантах реализации предшествующих аспектов, конъюгат линкер-антитело-лекарственное средство представляет собой huMov19-сульфо-SPDB-DM4, huMov19-сульфо-SPDB-D1, huMov19-D2, huMov19-сульфо-SPDB-D10, huMov19-сульфо-SPDB-DGN462, huMy9-6-сульфо-SPDB-D1, huMy9-6-D2, huMy9-6-сульфо-SPDB-D10, huMy9-6-сульфо-SPDB-DGN462, huAnti-CD123-сульфо-SPDBD1, huAnti-CD123-D2, huAnti-CD123-сульфо-SPDB-D10, huAnti-CD123-сульфо-SPDBDGN462, huB4-SPDB-DM4, huDS6-SPDB-DM4, huCD37-3-SMCC-DM1, huCD37-50-SMCC-DM1, или huEGFR-7R-SMCC-DM1.
Другие признаки и преимущества настоящего изобретения будут понятны из детального описания и из формулы изобретения.
Определения
Если не будет указано иное, все технические и научные термины, используемые в данном документе, имеют значения, понятные квалифицированному специалисту в области техники, к которой относится настоящее изобретение. Следующие источники содержат общие определения многих терминов, используемых в данном изобретении: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.),Springer Verlag (1991); и Hale & Marham, The Harper Collins Dictionary of Biology (1991). В используемом в данном документе значении, следующие термины имеют значения, приведенные для них ниже, если не будет указано иное.
Термин "уточненный идеальный вес тела (УИВТ)" относится к дескриптору размера, учитывающему пол, общий вес тела и рост. УИВТ может быть рассчитан, например, с использованием формулы УИВТ = ИВТ + 0,4(вес в кг - ИВТ) где:
идеальный вес тела (ИВТ)
1. ИВТ1 (мужчины) = 0,9H1-88
2. ИВТ1 (женщины) = 0,9H1-92.
(1H = рост в см; В = вес в кг)
ИВТ, LBW и ADJ обсуждаются более детально в Green and Duffull, British Journal of Clinical Pharmacology 55: 119-133 (2004), которая включена в данное описание посредством ссылки в полном объеме.
"Цитотоксический агент" означает химическое соединение с малой молекулой, пептид или молекулу нуклеиновой кислоты, токсичные для клеток. В некоторых вариантах реализации, описанных в данном документе, для простоты понимания, термин "лекарственное средство" используется для указания на цитотоксический агент. Например, в конъюгате антитело-лекарственное средство (ADC), термин "лекарственное средство" используется взаимозаменяемо с термином "цитотоксический агент". В конкретных вариантах реализации, цитотоксический агент (или "лекарственное средство") конъюгирован с антителом. В одном конкретном варианте реализации, цитотоксический агент представляет собой майтанзиноид, такой как DM1, DM3 или DM4. В других вариантах реализации, цитотоксические агенты включают, но не ограничиваясь ими, бензодиазепиновые соединения (например, пирролобензодиазепины и индолинобензодиазепины; см. также Таблицу 1: соединения D1-D10 и DGN462), таксоиды, аналоги СС-1065 и СС-1065, дуокармицины и аналоги дуокармицинов, энедиины, такие как калихеамицины, доластатин и аналоги доластатинов, включая ауристатины, производные томаймицина, производные лептомицина, метотрексат, цисплатин, карбоплатин, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил и морфолино-доксорубицин.
"Соотношение лекарственное средство-антитело (DAR)" означает среднее число молекул "лекарственного средства" (т.е., цитотоксического агента), конъюгированных с антителом. DAR характеризуется с использованием любого способа, известного специалистам, включая, но не ограничиваясь ими, спектроскопию, динамическое светорассеивание, эксклюзионную хроматографию (SEC), эксклюзионную хроматографию в сочетании с масс-спектрометрией (SEC-MS) и масс-спектрометрию.
"Соотношение майтанзиноид-антитело (MAR)" означает среднее число молекул майтанзиноида, конъюгированных с антителом.
"Целевая концентрация антитела" означает желательную концентрацию антитела.
"Целевая концентрация лекарственного средства" или "целевая концентрация цитотоксического агента" означает желательную концентрацию лекарственного средства или цитотоксического агента. Следует отметить, что концентрация лекарственного средства или цитотоксического агента преимущественно рассчитывается на основе конъюгированной формы лекарственного средства, но может включать незначительные количества свободного или неконъюгированного лекарственного средства, присутствующего в образце.
"Целевая концентрация майтанзиноида" означает желательную концентрацию майтанзиноида.
"Изменчивость активности" означает разные активности, наблюдающиеся в разных партиях лекарственной формы. Изменчивость активности желательно снижается по меньшей мере на около 5%, 10%, 20%, 25%, 30%, 40%, 50% или больше.
"Лекарственная форма" означает готовую лекарственную форму, содержащую активный фармацевтический ингредиент. В одном варианте реализации, готовая лекарственная форма представляет собой контейнер (например, флакон), содержащий конъюгат антитело-лекарственное средство по настоящему изобретению, сам или в комбинации с эксципиентом.
"Спецификация" означает набор критериев, которым должны соответствовать лекарственное средство или лекарственная форма для обеспечения их приемлемости для предполагаемого применения. Спецификация типично предлагается производителем и утверждается регуляторным органом (например, FDA (Управление по контролю за пищевыми продуктами и медикаментами США)).
В используемом в данном документе значении, "функциональное антитело" означает указание на антитело, вызывающее гибель клеток по механизму прямого уничтожения клеток, такому как апоптоз или некроз. Функциональные антитела обладают способностью прямого уничтожения клеток in vivo, не будучи конъюгированными с лекарственным средством ("голое антитело"). Неограничительные примеры функциональных антител включают антитело huEGFR-7R и антитело huCD37-3. В используемом в данном документе значении, "нефункциональное антитело" означает указание на антитело, которое (i) не проявляет известной способности уничтожать клетки in vivo (например, отсутствие прямого или опосредованного уничтожения клеток в виде голого антитела, например, huDS6) или (ii) проявляет опосредованную способность уничтожать клетки в результате эффекторной функции, например, антитело-зависимую клеточно медиируемую цитотоксичность (ADCC), антитело-зависимый клеточный фагоцитоз (ADCP) и комплемент-зависимую цитотоксичность (CDC), или (iii) проявляет повышенную активность конъюгирования in vivo при повышенной эффекторной функции, или любую комбинацию (i), (ii) и (iii). Нефункциональное антитело может обладать антипролиферативной активностью, например, путем блокирования связывания пролиферативного агента (например, фактора роста). Неограничительные примеры нефункциональных антител, обладающих опосредованной способностью уничтожать клетки, включают huMov19, huMy9-6 и huB4.
"huB4" означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает CD 19, такие как человеческие CD 19. Типичные примеры антитела huB4 по настоящему изобретению могут включать следующие CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huB4 LC

huB4HC

"huB4-SPDB-DM4" означает конъюгат антитело-лекарственное средство, включающий антитело huB4, которое специфически связывает CD 19, конъюгированное с цитотоксическим майтанзиноидом, N2-деацетил-N2’-(4-меркапто-4-метил-1-оксопентил)майтанзин (DM4) с помощью линкера N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB). huB4-SPDB-DM4 описан, например, в патенте США №8435528 и публикации международной патентной заявки № WO 2004/103272, которые включены в данный документ посредством ссылок в полном объеме.
"huMov19" (также называемый "М9346А") означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает фолатный рецептор альфа (также известный как фолатный рецептор 1 или называемый "FOLR1" в данном документе). Детально последовательности huMov19 описаны в патентах США №8557966 и 8709432, и международной патентной заявке №: WO 2011/106528, которые включены в данный документ посредством ссылок в полном объеме. Типичные примеры антитела huMOV19 по настоящему изобретению могут включать следующие CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huMov19 LC v1.00

huMov19 LC v1.60

huMov19 НС


"huMov19-сульфо-SPDB-DM4" (также называемый "IMGN853") означает конъюгат антитело-лекарственное средство, включающий антитело huMov19, специфически связывающее FOLRI, конъюгированное с цитотоксическим майтанзиноидом, N2’-деацетил-N2’-(4-меркапто-4-метил-1-оксопентил)майтанзином (DM4) с помощью дисульфид-содержащего линкера N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноата (sSPDB). ADC huMov19-сульфо-SPDB-DM4 описан, например, в Ab et al., AACR; Cancer Res 2011; 71 (8 Suppl): Abstract number 4576, и патентах США №8557966 и 8709432, и международной патентной заявки №: WO 2011/106528, которые все включены в данный документ посредством ссылок в полном объеме.
"huDS6" означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает сиалогликотоп СА6 на муциновом рецепторе Muc1 (например, человеческом Muc1), экспрессируемом раковыми клетками. Типичные примеры последовательностей huDS6 описаны в патенте США №7834155 и международных патентных заявках №: WO 2005/009369 и WO 2007/024222, которые включены в данный документ посредством ссылок в полном объеме. Типичные примеры антитела huDS6 по настоящему изобретению могут включать или состоять из следующих CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huDS6 LC

huDS6 НС

"huMy9-6" (также называемый "Z4681A") означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает дифференцирующий антиген лейкоцитов CD33, такой как человеческий CD33. Типичные примеры последовательностей участка вариабельной области тяжелой цепи huMy9-6 описаны в публикации патента США №20060177455, который включен в данный документ посредством ссылки в полном объеме. Типичные примеры последовательностей участка вариабельной области легкой цепи huMy9-6 известны специалистам и описаны в патентах США №7557189, 7342110, 8119787 и 8337855, которые включены в данный документ посредством ссылок в полном объеме. Типичное антитело huMy9-6 по настоящему изобретению может включать или состоять из следующих CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huMy9-6 LC

huMy9-6 НС


"huMy9-6-сульфо-SPDB-DGN462" (также называемый "IMGN779") означает анти-huCD33 антитело, конъюгированное с димером индолинобензодиазепина, содержащим моноиминовый фрагмент, обозначаемый DGN462, с помощью расщепляемого дисульфидного линкера.

"huEGFR-7R" (также называемый "J2898A") означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает EGFR, такой как человеческий EGFR. Типичное антитело huEGFR-7R по настоящему изобретению может включать или состоять из следующих CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huEGFR-7R LC v1.0

huEGFR-7R LC v1.01

huEGFR-7R HC

"huEGFR-7R-SMCC-DM1" (также называемый "IMGN289") означает конъюгат антитело-лекарственное средство, который содержит антитело huEGFR-7R, специфически связывающее EGFR, конъюгированное с майтанзиноидом N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)майтанзином (DM1) с помощью линкера N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилата (SMCC). ADC huEGFR-7R-SMCC-DM1 описан, например, в патенте США №8790649 и международной патентной заявке № WO 2012/058588, которые включены в данный документ посредством ссылок в полном объеме.
"huCD37-3" означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает CD37, такой как человеческий CD37. Типичные примеры последовательностей huCD37-3 описаны в патенте США №8765917 и международной патентной заявке № WO 2011/112978, которые включены в данный документ посредством ссылок в полном объеме. Типичное антитело huCD37-3 по настоящему изобретению может включать или состоять из следующих CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huCD37-3 LC

huCD37-3 HC v1.0

huCD37-3 НС v1.1

"huCD37-3-SMCC-DM1" (также называемый "IMGN529") означает конъюгат антитело-лекарственное средство, который содержит гуманизированное антитело IgG1 K7153A, специфически связывающее CD37, ковалентно связанное с помощью нерасщепляемого малеимидно-тиоэфирного линкера сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата (SMCC) с майтанзиноидом N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)майтанзином (DM1).
"huCD37-50" означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает CD37, такой как человеческий CD37. Типичные примеры последовательностей huCD37-50 описаны в патенте США №8765917 и международной патентной заявке № WO 2011/112978, которые включены в данный документ посредством ссылок в полном объеме. Типичное антитело huCD37-50 по настоящему изобретению может включать или состоять из следующих CDR (выделены жирным шрифтом и подчеркиванием) или следующих последовательностей легкой цепи (LC) и тяжелой цепи (НС):
huCD37-50 LC

huCD37-50 НС

"huAnti-CD123" означает гуманизированное антитело или его эпитопсвязывающий фрагмент, которое специфически связывает CD123, такой как человеческий CD123. Типичные примеры антитела huAnti-CD123 описаны во временной патентной заявке США №62/186161, которая включена в данный документ посредством ссылки в полном объеме.
Термин "антитело" означает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид или их комбинации, через по меньшей мере один антигенраспознающий сайт в вариабельной области молекулы иммуноглобулина. В используемом в данном документе значении, термин "антитело" охватывает интактные поликлональные антитела, интактные моноклональные антитела, эпитоп-связывающие фрагменты антител (такие как фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты Fv (scFv), антитела новых иммуноглобулиновых антигенных рецепторов (IgNARs), которые включают фрагменты одноцепочечных вариабельных новых антигенных рецепторных доменов антител (домены VNARS, или VNAR), унитела, в которых была удалена шарнирная область, нанотела, фрагменты антител, состоящие из одноцепочечного мономерного вариабельного домена антитела (Ablynx), минитела, представляющие собой генетически модифицированные фрагменты антитела, содержащие scFv, связанный с СН-доменом (Hu et al., Cancer Res. 56: 3055-3061, 1996), дуотела (DuoBodies®), которые представляют собой биспецифические модифицированные антитела IgG1, включающие (i) стабильную шарнирную область, не позволяющую проводить обмен Fab-фрагментами in vivo и (ii) IgG4-подобный СН3-домен, модифицированный с целью обеспечения возможности обмена Fab-фрагментами in vivo. (см., например, WO 2008/119353 и WO 2011/131746), мультиспецифические антитела, такие как биспецифические антитела, полученные из по меньшей мере двух интактных антител, протела, которые представляют собой рекомбинантные "замаскированные" моноклональные антитела, которые остаются инертными в здоровой ткани, но специфически активируются в микросреде болезни (например, путем расщепления протеазой, присутствующей в больших количествах или специфической в микросреде болезни) (см. Desnoyers et al., Sci Transl Med 5: 207ral44, 2013), химерные антитела, гуманизированные антитела, человеческие антитела, гибридные белки, содержащие антиген определяющий участок антитела, и любые другие модифицированные молекулы иммуноглобулина, содержащие антигенраспознающий сайт, при условии, что антитела проявляют желательную биологическую активность. Антитело может принадлежать к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, или их подклассов (изотипов) (например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), определяемых на основании идентичности константных доменов их тяжелых цепей, обозначенных альфа, дельта, эпсилон, гамма и мю, соответственно. Разные классы иммуноглобулинов имеют разные и хорошо изученные структуры субъединиц и трехмерные конфигурации. "Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, взятой отдельно или в комбинации. Вариабельные области тяжелой и легкой цепей, каждые, состоят из четырех каркасных участков (FR), соединенных тремя участками, определяющими комплементарность (CDR), также известными как гипервариабельные участки. CDR в каждой цепи удерживаются на близком расстоянии с помощью FR и, вместе с CDR другой цепи, участвуют в образовании антигенсвязывающего сайта антител. Существует по меньшей мере две методики определения CDR: (1) подход, основанный на перекрестно-видовой вариабельности последовательностей (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991. National Institutes of Health, Bethesda Md.)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273: 927-948). Кроме этого, комбинации этих двух подходов иногда используются специалистами для определения CDR.
Термин "фрагмент антитела" используется по отношению к части интактного антитела и относится к определяющим антигенность вариабельным областям интактного антитела. Примеры фрагментов антител включают, но не ограничиваясь ими, фрагменты Fab, Fab', F(ab')2, и Fv, линейные антитела, одноцепочечные антитела и мультиспецифические антитела, образованные из фрагментов антител.
Термины "рак" и "раковый" относятся к или описывают физиологическое состояние у млекопитающих, при котором популяция клеток характеризуется нерегулируемым клеточным ростом. Рак может включать гематологический рак или солидную опухоль. Более конкретно, рак представляет собой лейкоз (например, острый миелоидный лейкоз (AML), острый моноцитарный лейкоз, промиелоцитарный лейкоз, эозинофильный лейкоз, острый лимфобластный лейкоз (ALL) такой как острый В-лимфобластный лейкоз (B-ALL), хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL)) или лимфому (например, неходжкинскую лимфому), миелодиспластический синдром (MDS), меланому, рак легкого (например, немелкоклеточный рак легкого; NSCLC), рак яичников, рак эндометрия, перитонеальный рак, рак поджелудочной железы, рак молочной железы, рак простаты, плоскоклеточную карциному головы и шеи, и рак шейки матки.
"Аналог" означает молекулу, которая не является идентичной, но обладает аналогичными функциональными или структурными признаками. Например, аналог полипептида сохраняет биологическую активность соответствующего природного полипептида, в то же время имея определенные биохимические модификации, усиливающие функцию аналога по сравнению с природным полипептидом. Такие биохимические модификации могут увеличивать резистентность аналога к действию протеазы, проницаемость через мембраны или период полувыведения, без изменения, например, связывания с лигандами. Аналог может содержать неприродную аминокислоту.
Термин "химерные антитела" относится к антителам, в которых аминокислотная последовательность молекулы иммуноглобулина получена от двух или больше видов. Типично, вариабельная область как легкой, так и тяжелой цепей соответствует вариабельной области антител, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.) с желательными специфичностью, аффинностью и характеристиками, в то время как константные области являются гомологичными с последовательностями антител, полученных от другого вида(обычно человека), чтобы избежать возникновения иммунной реакции у этого вида.
В данном описании, "содержит", "содержащий", "вмещающий" и "имеющий" и т.п. могут иметь значение, присвоенное им в патентном законодательстве США и могут означать "включает", "включающий" и т.п.; "состоящий по существу из" или "состоящий по существу" аналогично имеют значение, присвоенное им в патентном законодательстве США, причем термин является неограничительным, позволяющим присутствие (объектов) сверх перечисленных, при условии, что основные или новые характеристики перечисляемого не изменяются вследствие присутствия объектов сверх перечисленных, но исключающим варианты реализации известного уровня техники.
"Детектировать" относится к определению присутствия, отсутствия или количества детектируемого аналита.
"Болезнь" означает любое состояние или расстройство, нарушающее или препятствующее нормальной функции клетки, ткани или органа. Примеры болезней включают неоплазии и раки, которые можно лечить композицией по настоящему изобретению.
"Эффективное количество" означает количество агента, необходимое для облегчения симптомов болезни по сравнению с пациентом, не получающим лечения. Эффективное количество активного агента (агентов) (например, конъюгата антитело-лекарственное средство (ADC) или лекарственного средства), используемого в практике настоящего изобретения для терапевтического лечения болезни, меняется в зависимости от способа введения, возраста, веса тела и общего состояния здоровья субъекта. В конечном счете, лечащий врач или ветеринар будет определять требуемое количество и схему приема. Такое количество называется "эффективным" количеством.
Термины "эпитоп" или "антигенная детерминанта" используются взаимозаменяемо в данном документе и относятся к части антигена, способной распознаваться и специфически связываться конкретным антителом. В тех случаях, когда антиген представляет собой полипептид, эпитопы могут быть сформированы как из последовательно расположенных аминокислот, так и из несмежныхаминокислот, совмещенных в результате укладки третичной структуры белка. Эпитопы, сформированные из последовательно расположенных аминокислот, типично сохраняются при денатурации белка, тогда как эпитопы, сформированные в результате укладки третичной структуры, как правило исчезают при денатурации белка. Эпитоп типично включает по меньшей мере 3, и чаще по меньшей мере 5 или 8-10 аминокислот с уникальной пространственной конформацией.
"Составлять композицию" означает способ, используемый для получения лекарственной формы.
Термин "гуманизированное антитело" относится к формам не-человеческого (например, мышиного) антитела, представляющим собой специфические иммуноглобулиновые цепи, химерные иммуноглобулины или их фрагменты, содержащие минимальные не-человеческие (например, мышиные) последовательности. Как правило, гуманизированные антитела представляют собой человеческие иммуноглобулины, в которых остатки из участка, определяющего комплементарность (CDR), замещены на остатки из CDR вида, не являющегося человеком (например, мыши, крысы, кролика, хомячка), обладающего желательной специфичностью, аффинностью и характеристиками (Jones et al., 1986, Nature, 321: 522-525; Riechmann et al., 1988. Nature, 332: 323-327; Verhoeyen et al., 1988. Science, 239: 1534-1536). В некоторых случаях, остатки каркасной области Fv (FR) человеческого иммуноглобулина замещены на соответствующие остатки антитела вида, не являющегося человеком, обладающего желательными специфичностью, аффинностью и характеристиками. Гуманизированное антитело может быть дополнительно модифицировано путем замещения дополнительных остатков либо в каркасном участке Fv и/или в участках замещенных не принадлежащими человеку остатками для улучшения и оптимизации специфичности, аффинности и/или характеристик антитела. В общем, гуманизированное антитело будет включать по существу все из по меньшей мере одного, и типично, двух или трех, вариабельных доменов, включающих все или по существу все участки CDR, соответствующие не принадлежащему человеку иммуноглобулину, при этом все или по существу все области FR являются консенсусными последовательностями человеческого иммуноглобулина. Гуманизированное антитело может также включать по меньшей мере часть константной области или домена (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Примеры способов, используемых для получения гуманизированных антител, описаны в патенте США №5225539.
Целью гуманизации является снижение иммуногенности ксеногенного антитела, такого как мышиное антитело, для введения человеку, при сохранении полной аффинности связывания антигена и специфичности антитела.
Гуманизированные антитела могут быть получены с использованием нескольких технологий, таких как переформатирование поверхности и прививка CDR. В используемом в данном документе значении, технология переформатирования поверхности использует комбинацию молекулярного моделирования, статистического анализа и мутагенеза для изменения не относящихся к CDR поверхностей вариабельных областей антитела таким образом, чтобы они были похожи на поверхности известных антител целевого хозяина.
Стратегии и способы переформатирования поверхности антител, и другие способы снижения иммуногенности антител в другом хозяине, раскрыты в патенте США №5639641 (Pedersen et al.), который настоящим включен в данный документ в полном объеме посредством ссылки. Вкратце, в предпочтительном способе, (1) генерируют выравнивание положений пула вариабельных областей тяжелой и легкой цепей антитела для получения набора доступных поверхностных позиций каркасных участков вариабельной области тяжелой и легкой цепей, причем положения выравниваний для всех вариабельных областей являются по меньшей мере на около 98% идентичными; (2) определяют набор доступных поверхностных аминокислотных остатков каркасных участков вариабельной области тяжелой и легкой цепей для антитела грызуна (или его фрагмента); (3) идентифицируют набор доступных поверхностных аминокислотных остатков каркасных участков вариабельной области тяжелой и легкой цепей, в наибольшей степени идентичных набору доступных поверхностных аминокислотных остатков грызуна; (4) набор доступных поверхностных аминокислотных остатков каркасных участков вариабельной области тяжелой и легкой цепей, определенный на стадии (2), замещают на набор доступных поверхностных аминокислотных остатков каркасных участков вариабельной области тяжелой и легкой цепей, идентифицированных на стадии (3), за исключением аминокислотных остатков, расположенных не далее чем 5 ангстрем от любого атома любого остатка участков, определяющих комплементарность, антитела грызуна; и (5) получают гуманизированное антитело грызуна, обладающее специфичностью связывания.
Антитела могут быть гуманизированы с использованием различных других методик, включая CDR-прививку (ЕР 0239400; WO 91/09967; патенты США №5530101; и 5585089), рекомбинирование поверхностных остатков или переформатирование поверхности (ЕР 0592106; ЕР 0519596; Padlan E.A., 1991, Molecular Immunology 28(4/5): 489-498; Studnicka G.M. et al, 1994, Protein Engineering 7(6): 805-814; Roguska M.A. et al., 1994, PNAS 91: 969-973), и рекомбинация цепи (патент США №5565332). Человеческие антитела могут быть получены различными способами, известными специалистам, включая способы фагового дисплея. См. также патенты США №4444887, 4716111, 5545806 и 5814318; и международные патентные заявки №: WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741 (указанные источники включены посредством ссылок в полном объеме).
Термин "человеческое антитело" означает антитело, продуцируемое человеком, или антитело, имеющее аминокислотную последовательность, соответствующую антителу, продуцируемому человеком, полученную с использованием любой методики, известной специалистам. Это определение человеческого антитела включает интактные или полноразмерные антитела, их фрагменты и/или антитела, содержащие по меньшей мере один полипептид человеческой тяжелой и/или легкой цепи, такие как, например, антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи.
Термин "конъюгат антитело-лекарственное средство" или "ADC", в используемом в данном документе значении, относится к соединению, которое связано с агентом, связывающимся с клетками (т.е., антителом или его фрагментом). Типично, агент, связывающийся с клетками (например, антитело), ковалентно связан с лекарственным средством с помощью линкера.
Термины "выделенный", "очищенный" или "биологически чистый" относятся к материалу, в различных степенях освобожденному от компонентов, нормально сопровождающих его в нативном состоянии. "Выделять" означает степень отделения из исходного источника или окружающей среды. "Очищать" означает более высокую степень отделения, чем выделение. "Очищенный" или "биологически чистый" белок в достаточной степени освобожден от других материалов, так чтобы любые примеси не оказывали существенного влияния на биологические свойства белка или не вызывали других неблагоприятных последствий. Таким образом, нуклеиновая кислота или пептид по настоящему изобретению является очищенным, если он по существу не содержит клеточного материала, вирусного материала или питательной среды при получении методами рекомбинантной ДНК, или химических прекурсоров или других химикатов при химическом синтезе. Чистоту и гомогенность типично определяют с использованием методов аналитической химии, например, электрофореза на полиакриламидном геле или высокоэффективной жидкостной хроматографии. Термин "очищенный" может означать, что нуклеиновая кислота или белок дает по существу одну полосу в электрофоретическом геле. Для белка, который может быть подвергнут модификациям, например, фосфорилированию или гликозилированию, разные модификации могут приводить к разным выделяемым белкам, которые могут быть очищены раздельно.
"Линкер" представляет собой любой химический фрагмент, способный связывать соединение с белком. В одном варианте реализации, линкер связывает лекарственное средство, такое как майтанзиноид, с агентом, связывающимся с клетками, таким как антитело или его фрагмент, с образованием стабильной ковалентной связи. Линкеры могут быть чувствительными или быть по существу стойкими к кислотному разложению, разложению под действием света, разложению пептидазами, разложению эстеразами и разложению дисульфидной связи, в условиях, при которых соединение или антитело сохраняет активность. Пригодные линкеры хорошо известны специалистам и включают, например, дисульфидные группы, тиоэфирные группы, кислотно-лабильные группы, фотолабильные группы, лабильные в присутствии пептидаз группы и лабильные в присутствии эстераз группы. Линкеры также включают заряженные линкеры и их гидрофильные формы, как описано в данном документе и известно специалистам.
Типичные примеры расщепляемых линкеров включают, но не ограничиваясь ими: N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB), N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноат (сульфо-SPDB), и дисульфид-N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP). Типичные примеры нерасщепляемых линкеров включают, но не ограничиваясь ими: 2-иминотиолан, ацетилянтарный ангидрид и сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат (SMCC). В качестве расщепляемых или нерасщепляемых линкеров могут быть использованы универсальные линкеры 2-иминотиолан и ацетилянтарный ангидрид.
"Моноклональное антитело" относится к гомогенной популяции антител, задействованной в высокоспецифическом распознавании и связывании одной определенной антигенной детерминанты или эпитопа. Этим они отличаются от поликлональных антител, которые типично включают разные антитела, нацеленные на разные антигенные детерминанты. Термин "моноклональное антитело" охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (scFv) мутанты, гибридные белки, содержащие участок антитела, и любые другие модифицированные молекулы иммуноглобулина, содержащие антигенраспознающий сайт. Кроме того, "моноклональное антитело" относится к таким антителам, полученным любыми способами, включая, но не ограничиваясь ими, использование гибридом, фагового отбора, рекомбинантной экспрессии и трансгенных животных.
"Специфически связывает" относится к соединению или антителу, которое распознает и связывает полипептид, представляющий интерес, но по существу не распознает и не связывает другие молекулы в образце, например, биологическом образце, содержащем в природных условиях полипептид по настоящему изобретению.
Молекулы нуклеиновой кислоты, пригодные для использования в способах по настоящему изобретению, включают любую молекулу нуклеиновой кислоты, которая кодирует полипептид, представляющий интерес, или его фрагмент. Такие молекулы нуклеиновой кислоты не должны обязательно быть на 100% идентичными последовательности эндогенной нуклеиновой кислоты, но типично будут демонстрировать значительную степень идентичности. Полинуклеотиды, имеющие "значительную степень идентичности" с эндогенной последовательностью, типично способны гибридизоваться с по меньшей мере одной цепью двухцепочечной молекулы нуклеиновой кислоты. Молекулы нуклеиновой кислоты, пригодные для использования в способах по настоящему изобретению, включают любую молекулу нуклеиновой кислоты, которая кодирует полипептид по настоящему изобретению или его фрагмент. Такие молекулы нуклеиновой кислоты не должны обязательно быть на 100% идентичными последовательности эндогенной нуклеиновой кислоты, но типично будут демонстрировать значительную степень идентичности. Полинуклеотиды, имеющие "значительную степень идентичности" с эндогенной последовательностью, типично способны гибридизоваться с по меньшей мере одной цепью двухцепочечной молекулы нуклеиновой кислоты.
"По существу идентичный" относится к полипептиду или молекуле нуклеиновой кислоты, демонстрирующим по меньшей мере 50% идентичности с референсной аминокислотной последовательностью (например, любой из аминокислотных последовательностей, описанных в данном документе) или последовательностью нуклеиновой кислоты (например, любой из последовательностей нуклеиновой кислоты, описанных в данном документе). Предпочтительно, такая последовательность является по меньшей мере на 60%, более предпочтительно, на 80% или 85%, и более предпочтительно, на 90%, 95% или даже 99%, идентичной на уровне аминокислот или нуклеиновых кислот с последовательностью, используемой для сравнения.
Идентичность последовательностей типично измеряют с использованием прикладных программ для анализа последовательностей (например, пакета программ для анализа последовательностей (Sequence Analysis Software Package, Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705), программ BLAST, BESTFIT, GAP или PILEUP/PRETTYBOX). Такие прикладные программы сопоставляют идентичные или схожие последовательности путем присваивания определенных степеней гомологии различным замещениям, делециям и/или другим модификациям. Консервативные замещения типично включают замещения внутри следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В типичном подходе к определению степени идентичности может быть использована программа BLAST с показателем вероятности в диапазоне от е-3 до е-100, указывающим на близкородственные последовательности.
"Субъект" означает млекопитающее, включая, но не ограничиваясь ими, человека или млекопитающее, не являющееся человеком, такое как относящееся к бычьим, лошадиным, собачьим, овечьим или кошачьим.
Термин "терапевтически эффективное количество" относится к количеству антитела или другого лекарственного средства, эффективного для "лечения" болезни или расстройства у субъекта или млекопитающего. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е., замедлять в некоторой степени или останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е., замедлять в некоторой степени или останавливать) метастазирование опухоли; ингибировать, в некоторой степени, рост опухоли; и/или облегчать в некоторой степени один или несколько симптомов, ассоциированных с раком. См. приведенное в данном документе определение "лечения". В той степени, в которой лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. "Профилактически эффективное количество" относится к количеству, эффективному, в дозах и в периоды времени, необходимые, для достижения желательного профилактического результата. Типично, но не обязательно, поскольку профилактическая доза используется для субъектов до начала или на ранней стадии болезни, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Диапазоны значений, приведенные в данном документе, следует понимать как сокращенное обозначение всех значений в данном диапазоне. Например, диапазон значений от 1 до 50 следует понимать как включающий любое число, комбинацию чисел, или поддиапазон группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50.
В используемом в данном документе значении, термины "лечить", "лечащий", "лечение" и т.п. относятся к уменьшению или облегчению расстройства и/или симптомов, ассоциированных с ним. Следует понимать, что лечение расстройства или состояния не требует, чтобы расстройство, состояние или ассоциированные с ними симптомы были полностью устранены, хотя и не исключает этого.
Если конкретно не указано или не очевидно из контекста, в используемом в данном документе значении, термин "или" следует понимать как инклюзивный. Если конкретно не указано или не очевидно из контекста, в используемом в данном документе значении, термины в единственном числе следует понимать как термины в единственном или во множественном числе.
Если конкретно не указано или не очевидно из контекста, в используемом в данном документе значении, термин "около" следует понимать как находящийся в пределах нормального в данной области техники допуска, например, в пределах 2 среднеквадратических отклонений от среднего. "Около" можно понимать как отклоняющийся не более чем на 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05%, или 0,01% от указанного значения. Если иное не очевидно из контекста, все численные значения, приведенные в данном документе, видоизменены с помощью термина около.
Изложение перечисления химических групп в любом определении переменной в данном документе включает определения этой переменной как любой отдельно взятой группы или комбинации перечисленных групп. Изложение варианта реализации для переменной или аспекта в данном документе включает такой вариант реализации как любой отдельно взятый вариант реализации или в комбинации с любыми другими вариантами реализации или их частями.
Любые композиции или способы, предложенные в данном документе, могут быть объединены с одним или несколькими из любых других композиций и способов, предложенных в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Зависимость цитотоксической активности от MAR для huMov19-сульфо-SPDB-DM4 (зависимость активности от MAR). Фиг. 1 представляет собой график, иллюстрирующий зависимость цитотоксической активности от соотношения майтанзиноид-антитело (MAR) для huMov19-сульфо-SPDB-DM4, который является иммуноконъюгатом, включает гуманизированное моноклональное анти-FOLR1 антитело (huMov19), конъюгированное с цитотоксическим майтанзиноидом DM4 с помощью линкера сульфо-SPDB. Цитотоксическую активность измеряют по сравнению с эталонным стандартом huMov19-сульфо-SPDB-DM4, имеющим значение MAR, равное 3,4. Процент активности = ЕС50 эталон/EC50 тестируемый образец*100%.
Фиг. 2 представляет собой график, илюстрирующий зависимость цитотоксической активности от концентрации huMov19-сульфо-SPDB-DM4 (Зависимость цитотоксической активности от концентрации huMov19-сульфо-SPDB-DM4).
Фиг. 3 (Влияние DAR на глазную токсичность) показывает две диаграммы рассеивания и таблицу, моделирующие вероятный эффект соотношения лекарственное средство-антитело (DAR) на глазную токсичность. УИВТ относится к уточненному идеальному весу тела. Величины DAR были рассчитаны на основе уровней дозирования лекарственного средства.
Фиг. 4 (Влияние DAR и концентрации на глазную токсичность) показывает диаграмму рассеивания и таблицу, моделирующие вероятный эффект соотношения лекарственное средство-антитело (DAR) и концентрации на глазную токсичность. Величины DAR являются расчетными и соответствующие ADC в действительности не вводились пациентам.
Фиг. 5 включает два графика, иллюстрирующие отсутствие эффекта DAR на медианный объем опухоли в мышиных моделях ксенотрансплантатов KB и IGROV-1 при введении конъюгата huMov19-сульфо-SPDB-DM4 с одинаковой дозой DM4. Доза DM4 25 мкг/кг, переменная доза антитела. Мышам вводили huMov19-Sspdb-DM4. Все конъюгаты дозировали из расчета 25 мкг/кг DM4 и при переменной дозе антитела (более высокой для конъюгатов с низкими значениями DAR и более низкой для конъюгатов с высокими значениями DAR). Наблюдалась аналогичная противоопухолевая активность независимо от переменных значений DAR и дозы антитела.
Фиг. 6 (влияние DAR на максимальную переносимую дозу huMov19-сульфо-SPDB-DM4, сравнение DAR 3,6 и DAR 9,0) представляет собой график, иллюстрирующий схожий эффект дозы DM4 на вес тела мышей для конъюгата, имеющего DAR, равное 9,0, по сравнению с DAR, равным 3,6, при введении одинаковой дозы DM4. Мыши получали 1400 мкг/кг DM4, переменная доза антитела. Все конъюгаты вводили в дозе 1,4 мг/кг DM4 при переменной дозе антитела (более высокой для конъюгатов с низкими значениями DAR и более низкой для конъюгатов с высокими значениями DAR).
Фиг. 7 (влияние DAR на токсичность huEGFR-7R-SMCC-DM1) представляет собой график, иллюстрирующий схожий эффект для дозы DM1 на изменение среднего веса тела для конъюгатов, имеющих разные соотношения майтанзиноид-антитело при введении одинаковой дозы DM1. Все конъюгаты вводили в дозе 3,0 мг/кг DM1 с переменной дозой антитела (более высокой для конъюгатов с низкими значениями DAR и более низкой для конъюгатов с высокими значениями DAR). Для всех конъюгатов токсичность была схожей, независимо от DAR.
Фиг. 8 представляет собой график, иллюстрирующий in vivo исследования токсичности у мышей, получавших конъюгаты антитело-SPDB-DM4 с различными значениями DAR, включая ADC huDS6-SPDB-DM4 ("huDS6-DM4"); huB4-SPDB-DM4 ("huB4-DM4"); и huMy9-6-SPDB-DM4 ("huMy9-6-DM4"). Каждое исследование: один конъюгат, 3-4 разные дозы. Данное исследование: пять конъюгатов (разные DAR), доза антитела 80 мг/кг.
Фиг. 9А (преимущество приготовления композиции ADC на основе концентрации DM4) и 9B (требования спецификации по концентрации антитела не выполняются при крайне высоких и низких значениях) представляют собой таблицы, иллюстрирующие преимущество приготовления композиции ADC на основе концентрации DM4. Фиг. 9А показывает допустимые концентрации DM4 в мкг/мл, получаемые при составлении композиции конъюгата антитело-лекарственное средство с целевой концентрацией антитела (5,0±1,0 мг/мл) и DAR 3,4±0,5 (обведено кружком). Концентрация DM4 равна 91,1 при целевой концентрации антитела 5,0 мг/мл и целевом значении DAR 3,4 (обведено рамкой). Более низкие колебания активности (обведенная рамкой область концентраций DM4) могут быть получены при составлении композиции на основе концентрации DM4 с ±10% от заданного значения. Целевые значения DAR, концентраций антитела и DM4 обведены рамками. На Фиг. 9B, концентрация антитела не соответствует спецификации при высоких-низких крайних значениях DAR (обведенные рамкой области). Целевые значения DAR, концентраций антитела и DM4 обведены рамками.
Фиг. 10А-10С (10А: Влияние приготовления композиции ADC по постоянному значению DGN462 на коцентрацию антитела; зависимость изменчивости антитела от DAR при постоянном целевом значении DGN462; 10B: зависимость изменчивости антитела от DAR при постоянном целевом значении DGN462; 10C: зависимость изменчивости антитела от DAR при постоянном целевом значении DGN462) представляют собой графики, иллюстрирующие влияние составления композиции в партии конъюгата антитело-лекарственное средство (ADC), путем изменения концентрации антитела для достижения целевой концентрации лекарственного средства (DGN462). "ВНП" и "ННП" обозначают верхний и нижний нормативные пределы для концентрации антитела. В качестве примера лекарственного средства использовали DGN462. Вертикальная линия (удлиненная "I") обозначает верхний и нижний пределы концентрации лекарственного средства. "DAR" обозначает соотношение лекарственное средство-антитело. Фиг. 10B. При целевом DAR и при DAR, близких к целевому, диапазоны DGN462 и антитела перекрываются. Фиг. 10С. При смещении DAR от целевого значения, постоянный целевой DGN462 достигается только при сдвиге концентрации антитела к нормативному пределу.
Фиг. 11А-11С (11А-11B: зависимость изменчивости антитела от DAR при постоянном целевом значении DGN462; 11С: график изменчивости для рассчетного антитела) представляют собой графики, показывающие, что составление композиции ADC с изменением концентрации антитела и лекарственного средства (незаштрихованные овалы) сужает допустимые нормативные пределы для антитела и лекарственного средства, по сравнению с изменением нормативов только для антитела для достижения целевой концентрации лекарственного средства (серые ромбики). Фиг. 11А. При крайних нормативных значениях DAR, концентрации DGN462 и антитела более не накладываются друг на друга. Верхний нормативный предел определяют по точке пересечения концентраций DGN462 и антитела. Фиг. 11B. При крайних значениях DAR и целевом DGN462 показатели для антитела не соответсвуют спецификации снизу и приближаются к нормативному пределу сверху. Фиг. 11С. Переменное целевое значение DGN462 модулирует обе концентрации, поддерживая их в более узком диапазоне.
ДЕТАЛЬНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает усовершенствованные способы составления терапевтической композиции, содержащей конъюгат антитело-лекарственное средство ("ADC"), тем самым позволяя сузить пределы изменчивости активности между разными партиями ADC и/или сузить диапазоны изменения спецификаций лекарственного средства и антитела в более широком интервале значений соотношения лекарственное средство-антитело (DAR).
В одном аспекте, настоящее изобретение основано, по крайней мере, частично, на открытии того, что эффективность и токсичность некоторых ADC вызвана полностью или частично дозой вводимого лекарственного средства, а не дозой антитела. Составление композиций ADC на основании целевой концентрации лекарственного средства желательным образом минимизирует колебания активности в готовой лекарственной форме и обеспечивает введение пациентам доз в узком заданном диапазоне значений.
Обычно, терапевтические композиции конъюгата антитело-лекарственное средство составляются на основании концентрации антитела. Составление композиций конъюгатов антитело-лекарственное средство на основании концентрации антитела приводит к определенной изменчивости даже при поддержании допустимых диапазонов значений в соответствии с данной спецификацией. В частности, в конце технологического процесса производства ADC, измеряют концентрацию антитела в конъюгате, и конъюгат разбавляют для достижения целевой концентрации лекарственного средства, определяемой на основании заданной концентрации антитела. На практике, в готовой лекарственной форме допускается отклонение концентрации антитела от целевой концентрации. В качестве примера, спецификация на состав допускает ±20% отклонения концентрации, рассчитываемой по антителу (например, 4,0-6,0 мг/мл считается допустимым для целевой концентрации антитела 5,0 мг/мл). Таким образом, в зависимости от DAR, активность ADC в готовой лекарственной форме может изменяться в пределах до ±35% и потенциально выходить за пределы желательного диапазона значений.
Способы составления композиций, описанные ниже в данном документе, включают определение концентрации лекарственного средства при заданной концентрации антитела и постоянном соотношении лекарственное средство-антитело, и составление композиции конъюгата антитело-лекарственное средство для достижения желательной концентрации лекарственного средства. Вкратце, составление композиции ADC на основании концентрации лекарственного средства и добавление ограничений на концентрацию лекарственного средства, например, ±10%, в значительной степени сужает диапазон колебаний активности готовой лекарственной формы до ±10% от целевой концентрации лекарственного средства (±10% от спецификации). При составлении композиции ADC на основании концентрации лекарственного средства и ограничении отклонений концентрации лекарственного средства не более 10%, активность может изменяться в пределах всего лищь ±10%). Таким образом, новые способы составления композиций по настоящему изобретению устраняют зависимость активности от DAR путем задания узкого диапазона концентраций лекарственного средства. Такая стратегия составления композиции лишь незначительно увеличивает риск того, что концентрация антитела будет выходить за пределы спецификации и, таким образом, риск несоответствия партии условиям спецификации будет довольно низким. Такие усовершенствованные способы составления композиций обеспечивают введение пациентам доз в узком заданном диапазоне значений без существенного увеличения риска того, что партия ADC не будет соответствовать спецификации.
В еще одном аспекте, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство. Способ включает составление композиции конъюгата антитело-лекарственное средство путем установления целевой концентрации как лекарственного средства, так и антитела (т.е. задания малых диапазонов отклонения (±4-9%) для обоих значений концентрации, а не больших изменений одной концентрации (±10-15%) в области перекрывания обоих спецификаций, тем самым снижая изменчивость активности в композиции. В одном варианте реализации, малое отклонение составляет около 4, 5, 6, 7, 8 или 9%. В других вариантах реализации, большое изменение составляет около 10, 11, 12, 13, 14 или 15%.
В другом аспекте, настоящее изобретение предлагает способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство. Способ включает составление композиции конъюгата антитело-лекарственное средство путем установления целевой концентрации лекарственного средства или антитела в диапазоне значений, в котором обе спецификации перекрываются, тем самым снижая изменчивость активности в композиции.
Составление композиции конъюгата антитело-лекарственное средство
Композиции противораковых терапевтических средств на основе ADC составляют аналогично противораковым терапевтическим средствам на основе антител; то есть, на основании концентрации белка антитела. Хотя на этикетке готовой лекарственной формы приведена информация о "номинальной" или целевой концентрации, которая является основой для дозирования (например, в мг/кг или мг/м2), типичная спецификация на концентрацию антитела предусматривает целевое значение ±10-20%. Активность ADC в общем линейно зависит от концентрации, поэтому активность готовой лекарственной формы может меняться в пределах ±20%. ADC, в отличие от антител, имеют дополнительный потенциал непостоянства активности из-за соотношение лекарственное средство-антитело (DAR). Типичные спецификации на DAR для ранней стадии клинической разработки предусматривают целевое значение ±15%, что позволяет количеству связанного цитотоксического средства изменяться при данной концентрации антитела. Для большинства ADC можно продемонстрировать наличие линейной зависимости между DAR и активностью, указывающей на то, что активность частично или полностью определяется концентрацией введенного конъюгированного лекарственного средства.
Для многих ADC может быть продемонстрировано на грызунах, что токсичность полностью зависит от дозы введенного конъюгированного лекарственного средства, независимо от дозы антитела. Таким образом, токсичность является независимой от DAR при условии, что введенная доза конъюгированного лекарственного средства остается неизменной. Для некоторых ADC, если антитело не обладает собственной противоопухолевой активностью, эффективность полностью зависит от дозы лекарственного средства. В таких случаях, эффективность будет постоянной независимо от DAR, при условии, что введенная доза конъюгированного лекарственного средства остается неизменной. Однако, типичная спецификация на концентрацию антитела и DAR допускает некоторые отклонения концентрации конъюгированного лекарственного средства. Для некоторых ADC, даже в тех случаях, когда антитело обладает собственной противоопухолевой активностью или, например, считается функциональным антителом, эффективность ADC может все-таки в большей степени определяться дозой лекарственного средства, а не антителом.
В тех случаях, когда можно продемонстрировать, что эффективность и токсичность ADC определяются преимущественно количеством введенного конъюгированного лекарственного средства, полезный эффект может обеспечиваться сужением указанного в спецификации диапазона концентраций конъюгированного лекарственного средства, а не антитела. Соответственно, настоящее изобретение предлагает способы составления терапевтической композиции на основании концентрации лекарственного средства, а не концентрации антитела. Целевой концентрацией лекарственного средства будет расчетная концентрация лекарственного средства при заданной концентрации антитела и заданном значении DAR. Установление в спецификации значений, близких к целевой концентрации конъюгированного лекарственного средства, будет определять допустимые колебания активности во флаконе с готовой лекарственной формой. Таким образом, задание в спецификации на концентрацию лекарственного средства величины ±10% будет сужать допустимые отклонения активности до ±10%.
В других вариантах реализации, терапевтическая композиция может быть составлена путем установления целевой концентрации лекарственного средства на основании значения DAR и спецификации на антитело для получения терапевтической композиции на основе ADC, попадающей в центральную часть диапазона эффективных нормативных пределов для концентрации антитела и лекарственных средств, в которой концентрации лекарственного средства и антитела перекрываются. Значения DAR в пределах ±5% от целевого в центре эффективного диапазона, достигаемые путем установления целевой концентрации лекарственного средства, могут быть по существу схожими с показателями готового препарата, если используется фиксированная концентрация лекарственного средства. Улучшения достигаются, когда значения DAR изменяются в пределах диапазона ±5-15% от целевого значения DAR. При таких верхнем и нижнем пределах DAR, составление терапевтической композиции путем установления целевой концентрации лекарственного средства может обеспечить меньшую изменчивость по отношению к концентрации как лекарственного средства (например, около ±4%), так и антитела (например, около ±10%) по сравнению с установлением фиксированной концентрации лекарственного средства, при которой концентрация антитела будет изменяться в пределах около ±15%. Такие диапазоны пригодны для использования при составлении композиций ADC, примеры которых включают huMy9-6-сульфо-SPDB-DGN462. В одном варианте реализации, настоящее изобретение предлагает использование описанных в данном документе способов составления композиций huMy9-6-сульфо-SPDB-DGN462, представляющего собой конъюгат антитело-лекарственное средство, содержащий DGN462, конъюгированный с анти-CD33 антителом huMy9-6, с помощью расщепляемого дисульфидного линкера s-SPDB. Другие лекарственные средства, пригодные для использования в настоящем изобретении, включают бензодиазепины, такие как представленные в Таблице 1 или их варианты, и следующими структурными формулами:

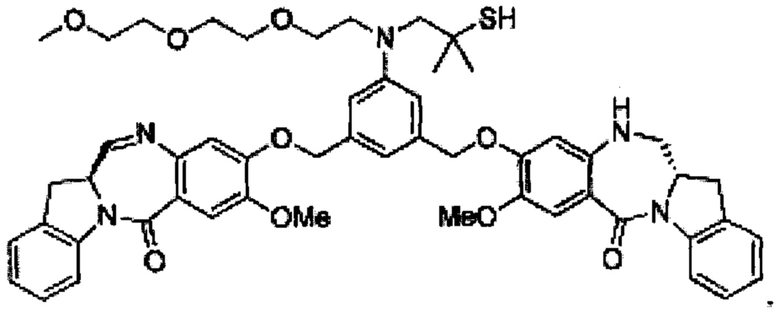
Конъюгаты антитело-лекарственное средство
Настоящее изобретение касается усовершенствованных способов составления композиций ADC, содержащих антитело (например, антитело, связывающее опухолевый антиген) или фрагмент антитела, и их функциональные эквиваленты, как раскрыто в данном документе, связанные или конъюгированные с цитотоксическим агентом (например, лекарственным средством или пролекарством). Различные антитела могут быть использованы в способах по настоящему изобретению. В конкретных вариантах реализации, антитело специфически связывает антиген или лиганд, такой как FOLR1 (также известный как FRα), CD33, CD123, CD19, MUC1, CA6, CD37, EGFR, и фрагменты любых из вышеперечисленных полипептидов. В конкретных вариантах реализации, настоящее изобретение включает, но не ограничиваясь им, ADC, содержащий любое из следующих антител: huMov19, huMy9-6, huAnti-CD123, huB4, huDS6, huCD37-50, huCD37-3, и huEGFR-7R.
Пригодные лекарственные средства или пролекарства известны специалистам. Лекарственное средства или пролекарства могут быть цитотоксическими. Цитотоксическое лекарственное средство, используемое в ADC по настоящему изобретению, может быть любым соединением, приводящим к гибели клетки (например, раковой клетки), или индуцирующим гибель клеток, или каким-либо образом снижающим жизнеспособность клетки, и включает, например, ингибиторы тубулина, ДНК-повреждающие агенты, ДНК-сшивающие агенты, ДНК-алкилирующие агенты, и средства, нарушающие клеточный цикл. В конкретных вариантах реализации, пригодные цитотоксические лекарственные средства включают майтанзиноиды и аналоги майтанзиноидов. Другие пригодные цитотоксические лекарственные средства включают, например, бензодиазепины (например, пирролобензодиазепины и индолинобензодиазепины; см. также Таблицу 1: соединения D1-D10 и DGN462), таксоиды, аналоги СС-1065 и СС-1065, дуокармицины и аналоги дуокармицинов, энедиины, такие как калихеамицины, доластатин и аналоги доластатинов, включая ауристатины, производные томаймицина, производные лептомицина, метотрексат, цисплатин, карбоплатин, даунорубицин, доксорубицин, винкристин, винбластин, мелфалан, митомицин С, хлорамбуцил и морфолино-доксорубицин.
ADC могут быть получены с использованием связующей группы для связывания лекарственного средства или пролекарства с антителом или функциональным эквивалентом. Пригодные связующие группы хорошо известны специалистам и включают, например, дисульфидные группы, тиоэфирные группы, кислотно-лабильные группы, фотолабильные группы, лабильные в присутствии пептидаз группы и лабильные в присутствии эстераз группы.
Лекарственное средство или пролекарство могут, например, быть связаны с антителом или его фрагментом с помощью дисульфидной связи. Линкерная молекула или сшивающий агент могут включать реакционноспособную химическую группу, которая может реагировать с антителом или его фрагментом. Реакционноспособными химическими группами для реакции со связывающим клетки агентом могут быть, например, N-сукцинимидильные сложные эфиры и N-сульфосукцинимидильные сложные эфиры. Дополнительно, линкерная молекула содержит реакционноспособную химическую группу, такую как дитиопиридильная группа, которая реагирует с лекарственным средством с образованием дисульфидной связи. Линкерные молекулы включают, например, N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (см., например, Carlsson et al., Biochem. J., 173:723-737 (1978)), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB) (см., например, патент США №4563304), N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноат (сульфо-SPDB) (см. публикацию США №20090274713), N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP) (см., например, регистрационный номер CAS 341498-08-6), 2-иминотиолан, или ацетилянтарный ангидрид, сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат (SMCC). Например, антитело или агент, связывающийся с клетками, могут быть модифицированы сшивающими реагентами, и антитело или агент, связывающийся с клетками, содержащие полученные таким образом свободные или защищенные тиольные группы, вводят затем в реакцию с содержащим дисульфид или тиол майтанзиноидом для получения конъюгатов. Конъюгаты могут быть очищены методом хроматографии, включая, но не ограничиваясь ими, ВЭЖХ, очистку фильтрацией через пористый гель, адсорбцию, ионный обмен и аффинный захват, диализ или проточную фильтрацию вдоль потока.
В одном аспекте настоящего изобретения, антитело связано с цитотоксическими лекарственными средствами с помощью дисульфидных связей и полиэтиленгликольного соединительного элемента для повышения активности, растворимости или эффективности ADC. Такие расщепляемые гидрофильные линкеры описаны, например, в WO 2009/0134976. Дополнительным полезным эффектом такого строения линкера является желательное высокое соотношение мономеров и минимальная агрегация конъюгата антитело-лекарственное средство. Данный аспект конкретно предусматривает конъюгаты связывающих клетки агентов и лекарственных средств, связанные с помощью дисульфидной группы (-S-S-), несущие полиэтиленгликольные соединительные элементы ((CH2CH2O)n=1-14), с узким диапазоном содержания лекарственного средства, равным 2-8, которые демонстрируют относительно высокую биологическую активность по отношению к раковым клеткам и имеют желательные биохимические свойства высокого выхода продукта конъюгации и высокого соотношения мономеров при минимальной агрегации белка.
Многие линкеры, раскрытые в данном документе, описаны детально в патентах США №7989598; 8163888; 8198417; 8236319; 8563509; патентной публикации США №: 20130029900 и публикациях международных патентных заявок № WO 2009/0134976; WO 2009/134977; и WO 2012/177837; содержание всех вышеупомянутых патентов и заявок в полном объеме включены в данный документ посредством ссылок.
Настоящее изобретение включает аспекты, в которых от около 2 до около 8 молекул лекарственного средства, например, майтанзиноидов, бензодиазепиновых соединений, ауристатинов, алкилирующих ДНК агентов или других соединений, представляющих интерес, связаны с антителом или его фрагментом, причем противоопухолевый эффект конъюгата значительно выше, чем у конъюгатов с меньшим или большим содержанием лекарственного средства, связанных с тем же самым связывающимся с клетками агентом.
В одном аспекте, соотношение лекарственное средство-антитело составляет в среднем от около 2 до около 8 (например, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1). Практически любое цитотоксическое лекарственное средство может быть использовано в ADC. В определенных вариантах реализации, цитотоксические агенты, пригодные для использования по настоящему изобретению, представляют собой майтанзиноиды и аналоги майтанзиноидов. Примеры пригодных майтанзиноидов включают сложные эфиры майтанзинола и аналоги майтанзинола. Включены любые лекарственные средства, которые ингибируют образование микротрубочек, и которые являются высокотоксичными для клеток млекопитающих, такие как майтанзинол и аналоги майтанзинола.
В конкретных вариантах реализации, ADC по настоящему изобретению содержит майтанзиноид. Майтанзиноиды, пригодные для использования по настоящему изобретению, включают, но не ограничиваясь ими, N2'-деацетил-N2'-(3-меркапто-1-оксопропил)майтанзин (DM1), N2'-деацетил-N2'-(4-меркапто-1-оксопентил)майтанзин (называемый DM3), и N2'-деацетил-N2'-(4-меркапто-4-метил-1-оксопентил)майтанзин (DM4).
DM1 имеет следующую структурную формулу:
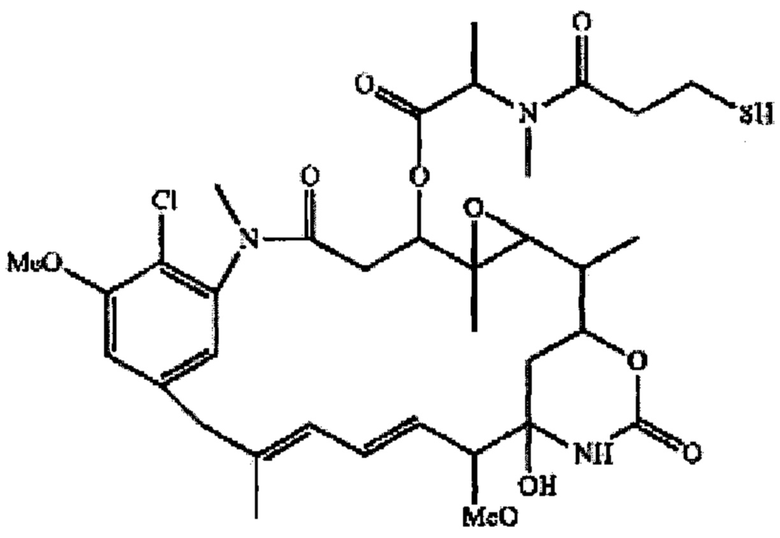
См. также патент США №20130156796.
DM4 имеет следующую структурную формулу:
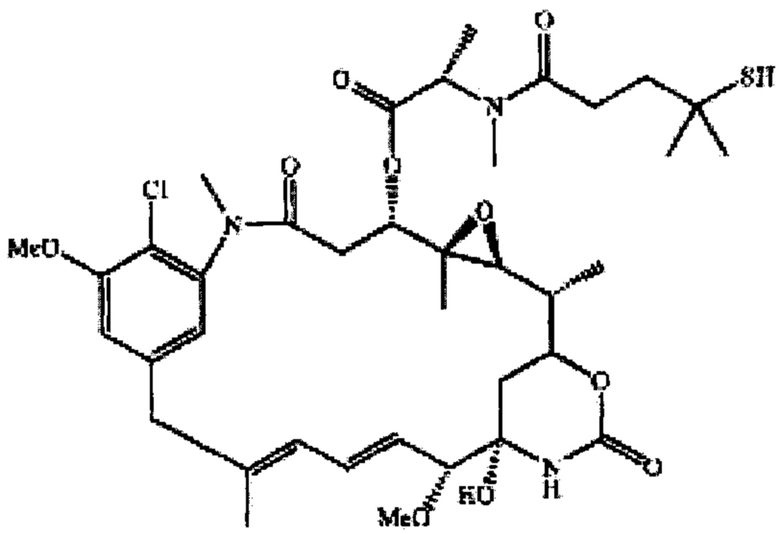
См. также патент США №20130156796.
Примеры пригодных сложных эфиров майтанзинола включают соединения, имеющие модифицированное ароматическое кольцо, и соединения, имеющие модификации в других положениях. Такие пригодные майтанзиноиды раскрыты в патентах США №4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 5208020; 5416064; 5475092; 5585499; 5846545; 6333410; 7276497 и 7473796.
Другим майтанзиноидом, содержащим боковую цепь со стерически затрудненной тиольной связью, является N2'-деацетил-N2' (4-меркапто-1-оксопентил)майтанзин (называемый DM3), представленный следующей структурной формулой (V):

Все майтанзиноиды, описанные в патентах США №5208020 и 7276497, также могут быть использованы в конъюгате по настоящему изобретению. В этом отношении, полные описания патента США №5208020 и патента США №7276697 включены в данный документ посредством ссылок. Положения атомов углерода в типичной структуре майтанзиноида указаны ниже:
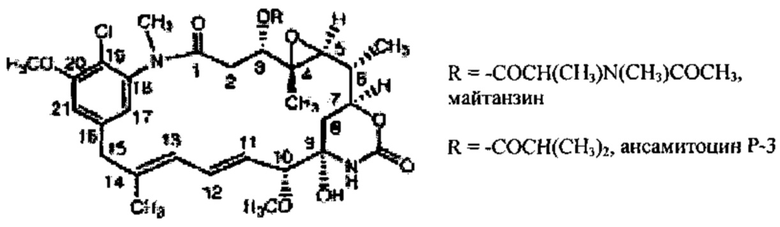
Многие положения в майтанзиноидах могут служить местами образования химических связей со связующим фрагментом. Например, ожидается, что пригодными могут быть положение С-3, содержащее гидроксильную группу, положение С-14, модифицированное гидроксиметилом, положение С-15, модифицированное гидроксилом, и положение С-20, содержащее гидроксильную группу. В некоторых вариантах реализации, положение С-3 служит местом образования химической связи со связующим фрагментом, и в некоторых конкретных вариантах реализации, положение С-3 майтанзинола служит местом образования химической связи со связующим фрагментом.
Несколько описаний получения таких конъюгатов антитело-майтанзиноид приведены в патентах США №6333410, 6441163, 6716821 и 7368565, каждый из которых включен в данный документ в полном объеме.
В общем, раствор антитела в водном буфере может инкубироваться с молярным избытком майтанзиноидов, содержащих дисульфидный фрагмент, несущий реакционноспособную группу. Реакционную смесь могут гасить прибавлением избытка амина (такого как этаноламин, таурин и т.д.). Конъюгат майтанзиноид-антитело затем может быть очищен гель-фильтрацией.
Среднее число молекул майтанзиноида, связывающихся с молекулой антитела, может быть определено путем спектрофотометрических измерений поглощения при 252 нм и 280 нм и определения молярной концентрации антитела и молярной концентрации лекарственного средства. Типичный пример расчетов приведен ниже для huMov19-сульфо-SPDB-DM4. Среднее число молекул майтанзиноида на антитело затем рассчитывают путем деления молярной концентрации лекарственного средства на молярную концентрацию антитела. Среднее число молекул майтанзиноида/антитело может составлять, например, 1-10 или 2-5. В некоторых вариантах реализации, среднее число молекул майтанзиноида/антитело составляет 3,4.
В конкретных вариантах реализации, ADC по настоящему изобретению содержит бензодиазепин. Бензодиазепины, пригодные для использования по настоящему изобретению, включают, например, пирролобензодиазепины и индолинобензодиазепины (см. также Таблицу 1: соединения D1-D10 и DGN462). В различных вариантах реализации предшествующих аспектов, бензодиазепиновые соединения выбирают из типичных цитотоксических агентов D1-D10 и DGN462, приведенных в Таблице 1. DGN462 описан, например, в патенте США №8765740, который включен в данный документ посредством ссылки в полном объеме. Соединение D2 описано, например, во временной заявке США №62/045236 и в "Antibody-Drug Conjugates (ADCs) of Indolino-Benzodiazepine DNA-Alkylating Agents", 2015 AACR, реферат №652. Соединение D2 описано, например, во временной заявке США №62/045248 и в "Antibody-Drug Conjugates (ADCs) of Indolino-Benzodiazepine DNA-Alkylating Agents", 2015 AACR, реферат №652.
Фармацевтические композиции
Настоящее изобретение дополнительно предлагает фармацевтические композиции, содержащие один или несколько ADC, описанных в данном документе. В определенных вариантах реализации, фармацевтические композиции дополнительно содержат фармацевтически приемлемый носитель. Такие фармацевтические композиции находят применение для ингибирования роста опухолей и лечения рака у людей.
Типичные примеры конъюгатов антитело-лекарственное средство, используемых в фармацевтических композициях по настоящему изобретению, включают, но не ограничиваясь ими: huMov19-сульфо-SPDB-DM4, huMov19-сульфо-SPDB-D1, huMov19-D2, huMov19-сульфо-SPDB-D10, huMov19-сульфо-SPDB-DGN462, huMy9-6-сульфо-SPDB-D1, huMy9-6-D2, huMy9-6-сульфо-SPDB-D10, huMy9-6-сульфо-SPDB-DGN462, huAnti-CD123-сульфо-SPDB-D1, huAnti-CD123-D2, huAnti-CD123-сульфо-SPDB-D10, huAnti-CD123-сульфо-SPDB-DGN462, huB4-SPDB-DM4, huDS6-SPDB-DM4, huCD37-3-SMCC-DM1, huCD37-50-SMCC-DM1, или huEGFR-7R-SMCC-DM1.
В определенных вариантах реализации, композиции готовят для хранения и использования путем объединения очищенного ADC по настоящему изобретению с фармацевтически приемлемым носителем (например, носителем, эксципиентом) (Remington, The Science and Practice of Pharmacy 20th Edition Mack Publishing, 2000). Настоящее изобретение предлагает составление составов таких композиции на основании концентрации лекарственного средства. В некоторых вариантах реализации, ADC по настоящему изобретению предусматривается в пригодном носителе, разбавителе и/или эксципиенте, таком как 0,9% солевой раствор (0,9% масс./об. NaCl), 5% (масс./об.) декстрозы; и может также содержать стабилизатор, такой как Tween 20. В конкретных вариантах реализации, ADC предлагается в пакете для внутривенного (IV) введения или во флаконе с лекарственным средством.
Другие пригодные фармацевтически приемлемые носители включают, но не ограничиваясь ими, нетоксичные буферы, такие как фосфатные, цитратные, ацетатные, сукцинатные и на основе других органических кислот; соли, такие как хлорид натрия, антиоксиданты, включая аскорбиновую кислоту и метионин; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; углеводы, такие как моносахариды, дисахариды, глюкоза, манноза или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит.
Фармацевтические композиции по настоящему изобретению могут быть введены любыми путями для проведения местного или системного лечения. Введение может быть парентеральным, включая внутривенное, интраартериальное или путем инфузии; пероральным; трансдермальным; или интракраниальным (например, интратекальным или интравентрикулярным) введением.
Комплекты, содержащие конъюгаты антитело-лекарственное средство
Настоящее изобретение предлагает комплекты, содержащие конъюгаты антитело-лекарственное средство (ADC), которые могут быть использованы для осуществления способов, описанных в данном документе. В определенных вариантах реализации, комплект содержит ADC в одном или нескольких контейнерах, причем количество ADC определяется на основании концентрации лекарственного средства, и количество ADC отклоняется от спецификации не более чем на ±10%. Квалифицированному специалисту в данной области техники хорошо понятно, что раскрытые ADC могут быть легко включены в один из принятых форматов комплектов, хорошо известных из уровня техники. При желании, комплект может включать инструкцию по применению ADC для лечения пациента. Инструкция может быть напечатана непосредственно на контейнере (если он используется), или иметь вид этикетки, прикрепленной к контейнеру, или отдельного листка, брошюры, карточки или рекламного проспекта, вложенных в контейнер или приложенных к нему.
В практике настоящего изобретения используются, если не указано иное, обычные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, цитологии, биохимии и иммунологии, хорошо известные квалифицированному специалисту. Такие методы подробно описаны в литературе, например, в "Molecular Cloning: A Laboratory Manual", second edition (Sambrook, 1989); "Oligonucleotide Synthesis" (Gait, 1984); "Animal Cell Culture" (Freshney, 1987); "Methods in Enzymology" "Handbook of Experimental Immunology" (Weir, 1996); "Gene Transfer Vectors for Mammalian Cells" (Miller and Calos, 1987); "Current Protocols in Molecular Biology" (Ausubel, 1987); "PCR: The Polymerase Chain Reaction", (Mullis, 1994); "Current Protocols in Immunology" (Coligan, 1991). Эти методы применяются для получения полинуклеотидов и полипептидов по настоящему изобретению и, по существу, могут быть предложены для использования в реализации и в практике настоящего изобретения. Особенно полезные методы для конкретных вариантов реализации будут описаны в следующих разделах.
Следующие примеры приведены для того, чтобы снабдить рядового специалиста полным раскрытием и описанием проведения и использования анализов, скрининга и терапевтических способов по настоящему изобретению, и не должны ограничивать объем того, что авторы считают своим изобретением.
ПРИМЕРЫ
Пример 1: Активность ADC in vitro зависит от количества лекарственного средства, доставляемого в клетку или вводимого субъекту
Фрагмент моноклонального анти-FOLR1 антитела из huMov19-сульфо-SPDB-DM4 нацелен на и связывается с антигеном клеточной поверхности FOLR1 (также известным как FRα). После взаимодействия антитело-антиген и интернализации, иммуноконъюгат высвобождает DM4, который связывается с тубулином и нарушает динамику сборки/разрушения микротрубочек, тем самым ингибируя деление клеток и рост экспрессирующих FOLR1 опухолевых клеток. FOLR1, член семейства фолатных рецепторов, сверхэкспрессируется на различных раковых клетках эпителиального происхождения.
In vitro активность конъюгата антитело-лекарственное средство (ADC) линейно зависит от соотношения лекарственное средство-антитело (DAR), также называемого соотношением майтанзиноид-антитело (MAR) (Фиг. 1). Данные, представленные на Фиг. 1 и 2, были получены с использованием huMov19-сульфо-SPDB-DM4 в качестве типичного примера ADC. Фактически, наблюдалось изменение активности на тридцать один процент при изменении DAR на единицу (конкретнее, от 2,9 до 3,9), вызванное расчетным различием дозировки DM4 на 29% Изменение активности на примерно 30% на единицу MAR (Фиг. 1). Фиг. 2 показывает в общем зависимость цитотоксической активности от концентрации huMov19-сульфо-SPDB-DM4. В тех случаях, когда концентрацию конъюгата разбавляют до половины концентрации эталонного стандарта, цитотоксическая активность составляет половину от значения для эталонного стандарта. Аналогично, если исходная концентрация конъюгата вдвое превышает соответствующее значение для эталонного стандарта, цитотоксическая активность удваивается по сравнению с эталонным стандартом. Детальное описание анализа удельной цитотоксичности приведено ниже в Примере 6.
При целевом значении DAR, равном 3,4, приемлемый диапазон изменчивости допускает изменения фактического DAR в готовой лекарственной форме в пределах от 2,9 до 3,9 (Фиг. 3).
Пример 2: Доза DM4 определяет in vivo токсичность и эффективность
В случае huMov19-сульфо-SPDB-DM4, желательно получить как можно более высокий уровень ADC для обеспечения эффективности без приближения к порогу глазной токсичности. Как показано на Фиг. 3, когда величина DAR для huMov19-сульфо-SPDB-DM4 была равна приблизительно 3,4, и диапазон дозировки составлял от 3,3 до 7 мг/кг, у 32% пациентов было обнаружено превышение уровня глазной токсичности. В тех случаях, когда величина DAR для huMov19-сульфо-SPDB-DM4 была равна 2,9, и диапазон дозировок составляет от 3,3 до 7 мг/кг, у 13% пациентов следует ожидать превышение уровня глазной токсичности. В тех случаях, когда величина DAR для huMov19-сульфо-SPDB-DM4 равна 3,4, и диапазон дозировок составляет от 3,3 до 7 мг/кг, у 32% пациентов ожидается превышение уровня глазной токсичности из-за пониженной дозы DM4, которую они получат. В тех случаях, когда величина DAR для huMov19-сульфо-SPDB-DM4 равна 3,9, и диапазон дозировок составляет от 3,3 до 7 мг/кг, у 48% пациентов ожидается превышение уровня глазной токсичности из-за повышенной дозы DM4, которую они получат.
При 5 мг/кг huMov19-сульфо-SPDB-DM4 (уточненный идеальный вес тела), когда DAR равно 2,9, порог глазной токсичности не был превышен ни у кого из пациентов. Однако, если DAR равно 3,4 или 3,9 при 5 мг/кг huMov19-сульфо-SPDB-DM4, у 14% и 57% пациентов, соответственно, порог глазной токсичности был превышен. Фактические клинические данные показаны для когорты DAR 3,4 на Фиг. 4 (закрашенные кружки на графике). Остальные данные отображают анализ моделирования дозы.
Фиг. 4 демонстрирует важность обеспечения того, чтобы пациенты получали дозу, находящуюся в узком заданном диапазоне значений. Идеально, для обеспечения максимальной эффективности и безопасности, пациенты должны получать дозу huMov19-сульфо-SPDB-DM4, приближающуюся к порогу глазной токсичности, но не превышающую его.
Как описано в Примерах 3 и 4, для huMov19-сульфо-SPDB-DM4 токсичность зависит от количества введенного DM4. Доклинические исследования эффективности с использованием huMov19-сульфо-SPDB-DM4 показали отсутствие зависимости от DAR при постоянной величине дозы DM4. Более того, доклинические исследования токсичности с использованием huMov19-сульфо-SPDB-DM4 и многих других конъюгатов показали, что токсичность определяется дозой связанного DM4, независимо от DAR.
Пример 3: Противоопухолевая активность huMov19-сульфо-SPDB-DM4 была независимой от DAR
Были проведены in vivo исследования по анализу активности huMov19-сульфо-SPDB-DM4 (Фиг. 5) в мышиных моделях ксенотрансплантатов KB и IGROV-1. Клеточная линия KB была получена путем заражения опухоли клетками HeLa. Она используется в качестве модели опухоли, потому что она образует у голых мышей опухоль с воспроизводимыми характеристиками и сверхэкспрессирует фолатный рецептор. Модель опухоли IGROV-1 получена из карциномы яичника человека.
huMov19-сульфо-SPDB-DM4 с разными DAR, в диапазоне от 2,5 до 4,1, вводили мышам с ксенотрансплантатами опухолей KB или IGROV-1, при дозе DM4 25 мкг/кг и переменных дозах антитела. Как показано на Фиг. 5, при введении одинаковых доз DM4, значение DAR не влияло на эффективность. Результаты этого анализа показывают, что дозировка DM4 определяет эффективность в моделях опухолей FOLR1-позитивных KB и IGROV-1, независимо от величины DAR.
Пример 4: Токсичность была независимой от соотношения лекарственное средство-антитело
Были проведены in vivo исследования для оценки влияния соотношения лекарственное средство-антитело на максимальную переносимую дозу (МПД) huMov19-сульфо-SPDB-DM4 (Фиг. 6). Мышам вводили huMov19-сульфо-SPDB-DM4 при постоянной дозе DM4, равной 1400 мкг/кг, и переменной дозе антитела. Контролировали вес тела мышей как меру токсичности. Используемые для введения ADC имели изменяющееся в широких пределах соотношение лекарственное средство-антитело (например, DAR 9,0 по сравнению с DAR 3,6). Интересно, что, при условии введения постоянной дозы DM4, величина DAR не влияла на токсичность в диапазоне значений 3,6-9,0. Таким образом, токсичность была независима от DAR.
В другом in vivo анализе токсичности, ADC huEGFR-7R-SMCC-DM1 вводили при постоянной дозе DM1, равной 3,0 мг/кг. Значения DAR изменялись (например, 2,3, 3,5, 6,3, 10,1), но дозировка DM1 поддерживалась постоянной. Контролировали изменение среднего веса тела (BW) как показатель токсичности. Потеря веса тела была схожей для конъюгатов с разными DAR, что указывает на независимость токсичности от DAR при условии, что доза DM1 поддерживалась постоянной (Фиг. 7).
Этот in vivo анализ был расширен на конъюгаты антитело-SPDB-DM4, включая huDS6-SPDB-DM4, huB4-SPDB-DM4 и huMy9-6-SPDB-DM4 (Фиг. 8). ADC huDS6-SPDB-DM4 (также известный как "huDS6-DM4") представляет собой гуманизированное моноклональное антитело, huDS6, связанное с DM4, сильнодействующим цитотоксическим майтанзиноидом, с помощью расщепляемого дисульфидного сшивающего агента N-сукцинимидил-4-2-пиридилдитиобутаноата (SPDB). ADC huDS6-SPDB-DM4 нацелен на солидные опухоли, такие как карциномы яичников, молочной железы, шейки матки, легкого и поджелудочной железы. ADC huB4-SPDB-DM4 (также известный как "huB4-DM4") представляет собой новый конъюгат антитело-лекарственное средство, который состоит из гуманизированного моноклонального анти-CD19 антитела IgG1 (huB4), присоединенного к DM4 с помощью расщепляемого дисульфидного сшивающего агента N-сукцинимидил-4-2-пиридилдитиобутаноата (SPDB). ADC huMy9-6-SPDB-DM4 (также известный как "huMy9-6-DM4") представляет собой ADC, который специфически связывает CD33, антиген семейства siglec, экспрессируемого преимущественно на миелоидных клетках. ADC huMy9-6-SPDB-DM4 проходил клиническую оценку на использование для лечения острого миелоидного лейкоза.
Как показано на Фиг. 8, указанный конъюгат вводили в 3-4 разных дозах и измеряли выживание мышей как показатель токсичности. Диапазон значений DAR для 4 конъюгатов был узким (от 3,49 до 4,0); таким образом, диапазон LD50 (доза, летальная для 50% животных) также был узким (доза DM4 в диапазоне 1,6-2 мг/кг). Конъюгаты, имеющие разные DAR, вводили при дозе антитела 80 мг/кг, и выживание мышей измеряли как показатель токсичности (Фиг. 8). Аналогичные результаты, полученные для всех конъюгатов, независимо от DAR, показывают, что токсичность определяется общей дозой введенного DM4. Таким образом, в диапазоне значений DAR от 2,1 до 5,1 токсичность не зависит от различных DAR.
Пример 5: Составление терапевтических композиций ADC на основании концентрации лекарственного средства минимизирует колебания активности, вызванные различиями DAR.
Обычно, терапевтические композиции конъюгата антитело-лекарственное средство составляются на основании концентрации антитела. Фиг. 9А показывает изменчивость, наблюдающуюся при составлении композиций конъюгатов антитело-лекарственное средство на основании концентрации антитела, даже при выдерживании допустимых отклонений в соответствии со спецификацией. В частности, в конце технологического процесса производства ADC, измеряют концентрацию антитела и антитело разбавляют для достижения целевой концентрации антитела, составляющей 5,0 мг/мл для huMov19-сульфо-SPDB-DM4. на Фиг. 9А, целевая концентрация антитела (5,0 мг/мл) обведена рамкой, а целевое значение DAR (3,4) для huMov19-сульфо-SPDB-DM4 обведено кружком. При такой целевой концентрации антитела, концентрация DM4 составляет 91,1 мкг/мл. На практике, в готовой лекарственной форме допускается отклонение концентрации антитела от целевой концентрации. Концентрация антитела в готовом продукте может составлять всего 4,0 мг/мл или достигать 6,0 мг/мл. Таким образом, как показывает обведенная рамкой область концентраций DM4, в зависимости от DAR, концентрация DM4 в готовой лекарственной форме может составлять всего 62,1 мкг/мл или достигать 125,4 мкг/мл.
Составление композиции ADC на основании концентрации DM4 и добавление нормативных ограничений на концентрацию DM4, составляющих +/-10%, в значительной степени сужает диапазон изменений активности готовой лекарственной формы до +/-10%, соответствующих целевой концентрации DM4 (выделено цветом; +/-10% от спецификации).
Непригодность партий, не соответствующих спецификации, показана на Фиг. 9B, где целевые значения концентрации DM4 и DAR выделены цветом. Концентрация DM4 указана сверху, значения DAR указаны слева, и полученная концентрация антитела показана в рамке, выделенной цветом (5,0 мг/мл). В тех случаях, когда концентрация антитела изменяется более чем на ±20% от целевого значения, партия не соответствует спецификации. Концентрация антитела в партиях, не соответствующих спецификации, выделена жирным шрифтом (Фиг. 9B). Риск несоответствия партий спецификации является довольно низким.
В общем, текущая спецификация на состав допускает ±20% отклонений для концентрации, рассчитываемой по антителу (4,0-6,0 мг/мл). Таким образом, активность ADC может изменяться в пределах до ±35% в зависимости от величины DAR. При составлении композиции ADC на основании концентрации DM4 и допустимых отклонениях концентрация DM4 не более чем ±10%, допустимые изменения активности будут составлять всего ±10%). Таким образом, новый способ составления композиций устраняет зависимость активности от DAR за счет установления узкого диапазона концентраций DM4. Такая стратегия составления композиций лишь незначительно увеличивает риск несоответствия партий спецификации вследствие выхода концентрации антитела за установленные спецификацией пределы.
Пример 6: Составление композиции DAR конъюгата
ADC huMov19-сульфо-SPDB-DM4, содержащий антитело huMov19, линкер SPDB и цитотоксическое лекарственное средство, DM4, является примером ADC, у которого in vitro активность, in vivo эффективность, и in vivo токсичность являются независимыми от DAR и определяются полностью введенной концентрацией DM4. Таким образом, huMov19-сульфо-SPDB-DM4 является хорошим кандидатом для составления композиций на основании концентрации DM4, а не huMov19. Для проверки гипотезы о том, что это позволит сузить диапазон активности готовой лекарственной формы, был приготовлен ряд конъюгатов huMov19-сульфо-SPDB-DM4 с диапазоном значений DAR. Конъюгаты были очищены в основном буфере для приготовления композиции (10 мМ ацетата натрия, 9% (масс./об.) сахарозы, pH 5,0) и значение DM4 и концентрацию антитела huMov19 для каждого образца измеряли спектрофотометрически на длинах волн 252 нм и 280 нм, соответственно. Молярную концентрацию DM4 и антитела huMov19, входящих в состав конъюгата, рассчитывают следующим образом:


Каждый конъюгат с разными значениями DAR готовили двумя разными способами: один разводили основным буфером для приготовления композиции до достижения целевых концентраций антитела huMov19 в заданном спецификацией диапазоне 5,0 мг/мл ±20%. Кроме этого, конъюгаты с разными значениями DAR составляли для получения целевой концентрации DM4, находящейся в предлагаемом диапазоне 91,1 мкг/мл ±10%. Все образцы подвергали анализу на удельную цитотоксичность.
Анализ удельной цитотоксичности включает инкубирование клеток, позитивных по отношению к фолатному рецептору 1 (FOLR1) (KB), в присутствии среды, содержащей серийные разведения конъюгата лекарственного средства huMov19-сульфо-SPDB-DM4, в двух параллельных лунках стерильного 96-луночного плоскодонного черного планшета для культур тканей с прозрачным дном. Каждый планшет для проведени анализа включал серии эталона, контроля и тестируемого продукта с идентичными разбавлениями в лунках с клетками KB и холостые образцы со средой. После инкубирования в течение 4 дней при 37°C±2°C, планшеты доставали из инкубатора и уравновешивали при комнатной температуре в течение 1 часа, после чего прибавляли люминесцентный реагент для определения жизнеспособности клеток CellTiter-Glo™. Планшеты инкубировали дополнительно еще 2 часа, после чего проводили анализ и регистрировали люминесцентный сигнал с помощью планшет-ридера Victor III. CellTiter-Glo™ использует уникальную стабильную форму люциферазы для измерения АТФ (АТР) как показателя жизнеспособности клеток. Продуцируемый люминесцентный сигнал прямо пропорционален числу жизнеспособных клеток, присутствующих в лунке и, аналогично, обратно пропорционален цитотоксичности лекарственного средства в данной лунке. Поскольку люциферазная реакция требует присутствия АТФ, условия были подобраны таким образом, чтобы количество продуцируемого света было пропорционально количеству присутствующего АТФ, соответствующему числу жизнеспособных клеток. Файл с данными для трех планшетов импортировали в программу PLA 2,0 и значения ЕС50 для эталона и тестируемого образца определяют путем аппроксимации 4-параметрической логистической кривой с наложенными ограничениями с использованием всех 6 параллельных измерений для каждого образца. Для образцов, соответствующих критериям пригодности по отличию наклона и параллелизму, % относительной активности тестируемого образца определяется по значениям IC50, полученным путем аппроксимации 4-параметрической логистической (4PL) кривой с наложенными ограничениями. Процент активности рассчитывают следующим образом.

Если значение ЕС50 тестируемого образца ниже, чем ЕС50 эталонного стандарта, то это указывает на то, что тестируемый образец имеет большую активность, чем эталонный стандарт, и расчетный % активности будет больше 100%. Наоборот, если ЕС50 тестируемого образца больше, чем ЕС50 эталонного стандарта, то это указывает на то, что тестируемый образец имеет меньшую активность, чем эталонный стандарт, и расчетный % активности будет ниже 100%.
Результаты этих расчетов приведены в Таблице 2 и Таблице 3 (ниже). Эталонным стандартом, используемым для анализов активности в Таблице 2, был образец А, тогда как эталонным стандартом, используемым для анализов активности в Таблице 3, был образец F. Серийные разбавления для каждого образца проводили, принимая номинальную концентрацию huMov19 равной 5 мг/мл для моделирования способа дозирования ADC в клинических условиях. В тех случаях, когда композиция huMov19-сульфо-SPDB-DM4 ADCs составлялась по целевой концентрации huMov19, равной 5 мг/мл (Таблица 2), наблюдался широкий диапазон активностей, как и ожидалось: 59,8-124,6% с общей примерно 2-кратной разницей между наибольшей и наименьшей активностями ADC. Это хорошо согласуется с ожидаемым диапазоном ±35%. В отличие от этого, если композиции ADC huMov19-сульфо-SPDB-DM4 с различными значениями DAR составляются по целевой концентрации DM4, равной 91,0 мг/мл, получаемый диапазон относительной активности является значительно более узким: 80,9-106,5%, что в общем отвечает примерно однозначному соответствию (~1Х). Это хорошо согласуется с ожидаемым диапазоном ±10%. Большая часть измеренных значений активности не отклонялись от ожидаемой величины более чем на 15%, при расчетах по концентрации DM4. Этот результат находится в пределах суммарной погрешности эксперимента для анализов измерений активности и концентрации. Вместе эти результаты показывают преимущество составления композиции по целевой концентрации DM4, а не по целевой концентрации huMov19, как обычно делается для ADC.


Пример 7: Установление заданных пределов отклонений концентраций антитела и лекарственного средства сужает диапазон нормативных значений в более широком диапазоне значений DAR.
В некоторых случаях, может быть желательным допустить возможность отклонений целевой концентрации лекарственного средства с целью достижения меньших отклонений концентраций как лекарственного средства, так и антитела, а не больших отклонений концентрации, не имеющей заданного целевого значения (например, концентрация антитела). Составление композиции ADC с использованием такого способа увеличивает до максимума нормативные пределы путем установления средней части диапазона, в которой концентрации как антитела, так и лекарственного средства перекрываются при определенном значении DAR. На практике, нормативно установленные пределы для лекарственного средства являются более узкими, чем для антитела (например, ±10% для лекарственного средства против ±15% для антитела). Таким образом, допуск на меньшие по размеру отклонения концентраций антитела и лекарственных средств обеспечивают возможность дополнительной стратегии контроля, для достижения более жестких пределов отклонений концентрации лекарственного средства (а не абсолютного целевого значения) при минимизации риска получения партий, которые, несмотря на несоответствие спецификации, будут совершенно безопасными для использования.
Желательность составления ADC с использованием описанного выше способа продемонстрирована для huMy9-6-сульфо-SPDB-DGN462, который представляет собой нацеленный на CD33 конъюгат антитело-лекарственное средство, содержащий антитело huMy9-6, конъюгированное с новым ДНК-алкилирующим агентом, DGN462, с помощью расщепляемого дисульфидного линкера, сульфо-SPDB.
На каждой из Фиг. 10А, 10B и 10С, верхний и нижний нормативные пределы для антитела показаны пунктирной линией, по оси X отложены значения DAR для партии лекарственного средства, причем целевое значение DAR равно 2,7; вертикальные линии показывают верхний и нижний нормативные пределы для DGN462 при данном DAR, и темно-серый ромбик на каждой вертикальной линии показывает перекрывание между нормативными пределами для DGN462 и нормативными пределами для антитела при конкретном значении DAR. На Фиг. 11А, при значении DAR для партии, равном 2,7, центр диапазона нормативных пределов для DGN462 попадает точно в центр диапазона для антитела. На Фиг. 10B, когда значение DAR для партии близко к целевому значению DAR, концентрация антитела, необходимая для достижения постоянной целевой концентрации DGN462, хорошо укладывается в интервал между верхним и нижним нормативными пределами для антитела. На Фиг. 10С, когда значение DAR для партии приближается к верхнему и нижнему нормативным пределам для DAR, 3,0-3,1 и 2,3-2,4, соответственно, постоянная концентрация DGN462 расположена близко к или выходит за пределы заданной концентрации антитела согласно спецификации, потому что количество антитела, необходимое для достижения целевой концентрации DGN462, приближается к верхнему и нижнему нормативным пределам для концентрации антитела. Таким образом, желательны усовершенствованные способы составления композиций.
Фиг. 11А-11С показывают улучшение, которое может быть достигнуто в результате допуска отклонения концентраций как DGN462, так и антитела - особенно в случае, когда значение DAR приближается к верхнему и нижнему нормативным пределам DAR (например, 3,0-3,1 и 2,3-2,4). Задание вариабельной концентрации лекарственного средства определяет среднюю часть диапазона перекрывания нормативных пределов концентрации антитела и нормативных пределов концентрации лекарственного средства (Фиг. 11А). Центр эффективного диапазона общего лекарственного средства находится значительно ниже верхнего нормативного предела для антитела. Таким образом, при верхнем и нижнем нормативных пределах DAR, способ задания вариабельного DGN462 ограничивает отклонения целевой концентрации антитела величиной +/-10% от целевого значения вместо полных ±15%, что приводит к получению продукта с более стабильными свойствами. В отличие от этого, для партий, в которых значение DAR приближается к верхнему и нижнему пределам, изменения концентрации антитела для достижения постоянной целевой концентрации DGN462 приводят к большим отклонениям от целевой концентрации антитела и увеличению риска изменчивости активности и токсичности (Фиг. 11А и 11B). Фиг. 11С иллюстрирует улучшение, достигаемое при использовании способа задания вариабельной концентрации лекарственного средства на верхнем и нижнем нормативных пределах DAR, когда концентрация DGN462 и концентрация антитела поддерживаются в более узких пределах 4% (незаштрихованные овалы) по сравнению со случаем, когда концентрация антитела используется для достижения целевой концентрации лекарственного средства (серые ромбики), при котором постоянное целевое общее количество лекарственного средства превышает верхний нормативный предел для антитела при DAR, равном 2,3.
Следующие уравнения могут использоваться для расчета верхних нормативных пределов и нижних нормативных пределов для лекарственного средства.


Таблица 4 иллюстрирует способы, используемые для расчета верхнего и нижнего нормативных пределов для DGN462 (ВНП DGN462, ННП DGN462). Верхний нормативный предел концентрации антитела является постоянным. DAR эмпирически определяют для партии конъюгата антитело-лекарственное средство. Расчеты в соответствии с желательными верхним и нижним нормативными пределами проводят следующим образом:

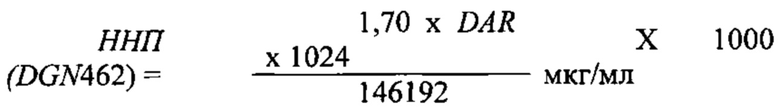
Величины "2,30" и "1,70" обозначают верхний и нижний нормативные пределы для антитела. Знаменатель представляет собой молекулярный вес антитела.
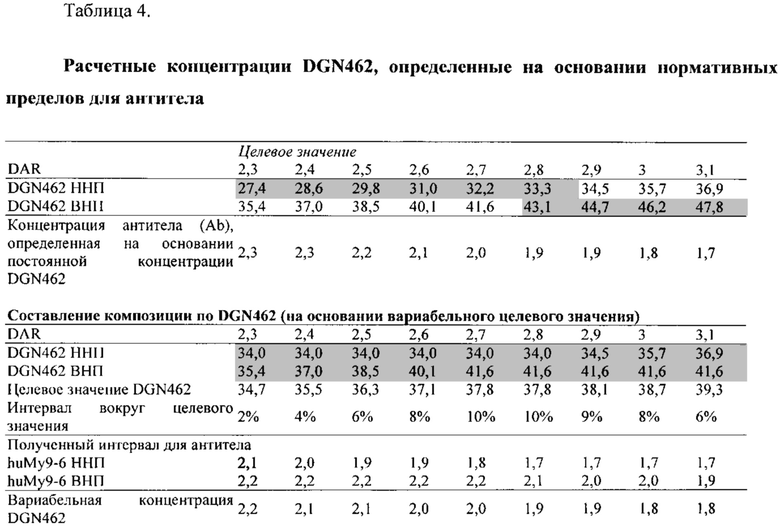
- При расчете ННП и ВНП для определенных точек эти предельные значения будут выходить за пределы предложенных нормативных значений
- Такие выходящие значения могут быть заменены на ННП (34,0 мг/мл) или ВНП (41,5 мг/мл) с использованием правила > или <
- При составлении композиций предлагается указывать значение DAR до второго десятичного разряда
В следующем примере, композицию ADC составляют путем задания вариабельной концентрации лекарственного средства. В данном случае, ADC включает нефункциональное антитело, huMov19 (MB 145676 г/моль), конъюгированное с D2 (MB 961,05 г/моль), с целевым значением DAR, равным 2,7, концентрацией антитела 2,0 мг/мл, и концентрацией цитотоксического агента 39,2 мкг/мл. Композицию ADC составляют с заданием вариабельной концентрации лекарственного средства для минимизации отклонений от целевого значения концентрации антитела. Как показано на Фиг. 11А, задание вариабельной концентрации лекарственного средства приводит к изменению получаемой концентрации антитела на ±10% (1,8-2,2) по сравнению с ±15% в случае, использования постоянной концентрации лекарственного средства (Фиг. 11А; см., например, Таблицы 4-7). Задание вариабельной (концентрации) лекарственного средства определяет среднюю часть диапазона, в котором перекрываются нормативные пределы для антитела и нормативные пределы для лекарственного средства (Фиг. 11A; см., например, Таблицы 4-7).
Таблица 5 ниже иллюстрирует способы используемые для расчета верхнего и нижнего нормативных пределов для D2 (ВНП D2, ННП D2). Верхний и нижний нормативные пределы концентрации антитела являются постоянными и значение DAR определяют эмпирически.

В другом примере, композицию ADC составляют путем задания вариабельной концентрации цитотоксического агента. В данном случае, ADC включает функциональное антитело, huEGFR-7R (MB 144975 г/моль), конъюгированное с D1 (MB 838 г/моль), с целевым значением DAR, равным 2,7, концентрацией антитела 2,0 мг/мл, и концентрацией цитотоксического агента 34,3 мкг/мл. Композицию ADC составляют с заданием вариабельной концентрации цитотоксического агента для минимизации отклонений от целевого значения концентрации антитела.
Таблица 6 ниже иллюстрирует способы используемые для расчета верхнего и нижнего нормативных пределов для D1 (ВНП D1, ННП D1). Верхний и нижний нормативные пределы концентрации антитела являются постоянными и значение DAR определяют эмпирически.
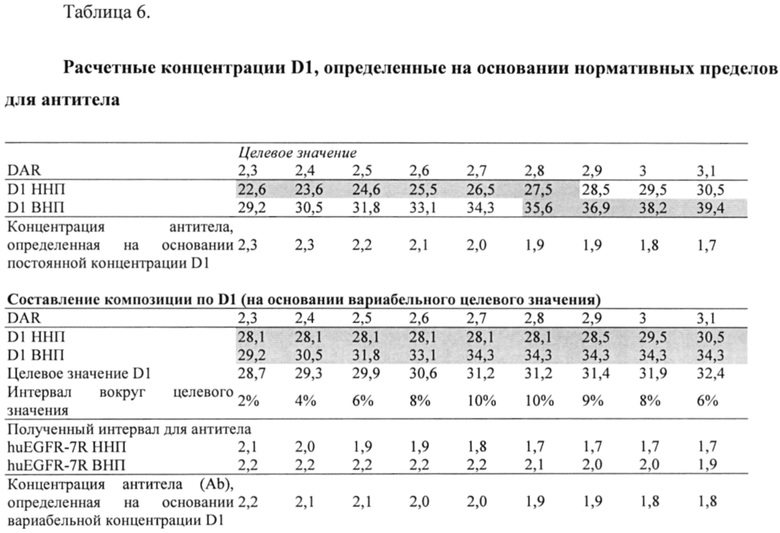
В еще одном примере, композицию ADC составляют путем задания вариабельной концентрации цитотоксического агента. В данном случае, ADC включает функциональное антитело, huMy9-6 (MB 146192 г/моль), конъюгированное с D10 (MB 1062,22 г/моль), с целевым значением DAR, равным 2,7, концентрацией антитела 2,0 мг/мл, и концентрацией цитотоксического агента 44,0 мкг/мл. Композицию ADC составляют с заданием вариабельной концентрации цитотоксического агента для минимизации отклонений от целевого значения концентрации антитела.
Таблица 7 ниже иллюстрирует способы, используемые для расчета верхнего и нижнего нормативных пределов для D1 (ВНП D1, ННП D1). Верхний и нижний нормативные пределы концентрации антитела являются постоянными и значение DAR определяют эмпирически.

Другие варианты реализации
Из приведенного выше описания будет понятно, что могут быть выполнены варианты и модификации настоящего изобретения, описанного в данном документе, для его адаптации к различным применениям и условиям. Такие варианты реализации также входят в объем приведенной далее формулы изобретения.
Изложение перечня элементов в любом определении переменной в данном документе включает определения этой переменной как любого отдельно взятого элемента или как комбинации (или субкомбинации) перечисленных элементов. Изложение варианта реализации в данном документе включает этот вариант реализации как любой отдельно взятый вариант реализации или в комбинации с любыми другими вариантами реализации или их частями.
Все патенты и публикации, упоминаемые в данном описании изобретения, настоящим включаются посредством ссылки в такой же степени, как если бы для каждого независимого патента и публикации было конкретно и индивидуально указано, что он включается посредством ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> IMMUNOGEN, INC.
<120> СПОСОБЫ СОСТАВЛЕНИЯ КОМПОЗИЦИЙ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ
СРЕДСТВО
<130> 365738.1009WO1 (00022)
<140> PCT/US2015/048152
<141> 2015-09-02
<150> 62/044,592
<151> 2014-09-02
<160> 17
<170> PatentIn version 3.5
<210> 1
<211> 211
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 1
Glu Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Ser Ala Ser Ser Gly Val Asn Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Arg Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Gly Ser Tyr Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu Cys
210
<210> 2
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Gln Val Gln Leu Val Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Asn Phe
50 55 60
Gln Gly Lys Ala Lys Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Asn Pro Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 3
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 3
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Asn Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 4
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 4
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Pro Ala Ile Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Phe Ala
20 25 30
Gly Thr Ser Leu Met His Trp Tyr His Gln Lys Pro Gly Gln Gln Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ala Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Lys Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Pro Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 5
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Phe Met Asn Trp Val Lys Gln Ser Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile His Pro Tyr Asp Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala His
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Phe Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Asp Gly Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 6
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 6
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Ser Ala His Ser Ser Val Ser Phe Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Ser Leu Ala Ser Gly Val Pro Ala Arg Phe Gly Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ser Phe Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 7
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 7
Gln Ala Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Gly Asn Gly Ala Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Ile Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asp Ser Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 8
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 8
Glu Ile Val Leu Thr Gln Ser Pro Gly Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Val Phe Phe Ser
20 25 30
Ser Ser Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Ile Pro Gly Gln
35 40 45
Ser Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Pro Glu Asp Leu Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Leu Ser Ser Arg Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 9
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 9
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile His Trp Ile Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Val
35 40 45
Gly Val Ile Tyr Pro Gly Asn Asp Asp Ile Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Val Arg Leu Arg Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 10
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu His Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Leu Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 11
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu His Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Leu Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 12
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Cys Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Thr Tyr Thr Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Arg Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Ala Pro Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 13
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Val
35 40 45
Asn Val Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Tyr Trp Gly Thr Thr Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 14
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 14
Gln Val Gln Val Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Ser
20 25 30
Gly Val Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Asp Gly Ser Thr Asn Tyr His Pro Ser Leu Lys
50 55 60
Ser Arg Leu Ser Ile Lys Lys Asp His Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Leu Asn Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Lys Gly Gly Tyr Ser Leu Ala His Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 15
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 15
Gln Val Gln Val Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Ser
20 25 30
Gly Val Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Asp Gly Ser Thr Asn Tyr His Ser Ser Leu Lys
50 55 60
Ser Arg Leu Ser Ile Lys Lys Asp His Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Leu Asn Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Lys Gly Gly Tyr Ser Leu Ala His Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 16
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 16
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Ser Ala Thr Ser Ser Val Thr Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Pro Tyr Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Asp Asn Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 17
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 17
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Leu Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Phe Ala Trp His Trp Ile Arg Gln His Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Leu Tyr Ser Gly Ser Thr Val Tyr Ser Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn His Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Tyr Gly Tyr Gly Ala Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИПАРАТОПНЫЕ FR-АЛЬФА АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2020 |
|
RU2832083C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ, ОЧИСТКИ И СОСТАВЛЕНИЯ КОНЪЮГАТОВ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2019 |
|
RU2801229C2 |
| ПРИМЕНЕНИЕ ИММУНОКОНЪЮГАТОВ К CEACAM5 ДЛЯ ЛЕЧЕНИЯ РАКА ЛЕГКОГО | 2020 |
|
RU2828374C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2740479C2 |
| КОНЪЮГАТЫ АНТИТЕЛА К CCR7 И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2018 |
|
RU2777662C2 |
| СХЕМЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТА АНТИ-FOLR1 | 2014 |
|
RU2801307C1 |
| КОНЪЮГАТЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2016 |
|
RU2841168C2 |
| САЙТ-СПЕЦИФИЧЕСКИЕ КОНЪЮГАТЫ АНТИТЕЛА К HER2 И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2745565C2 |
| КОНЪЮГАТЫ АНТИ-HER2 БИПАРАТОПНЫХ АНТИТЕЛ-ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2806049C2 |
| АНТИТЕЛА ПРОТИВ EDB И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2758632C2 |
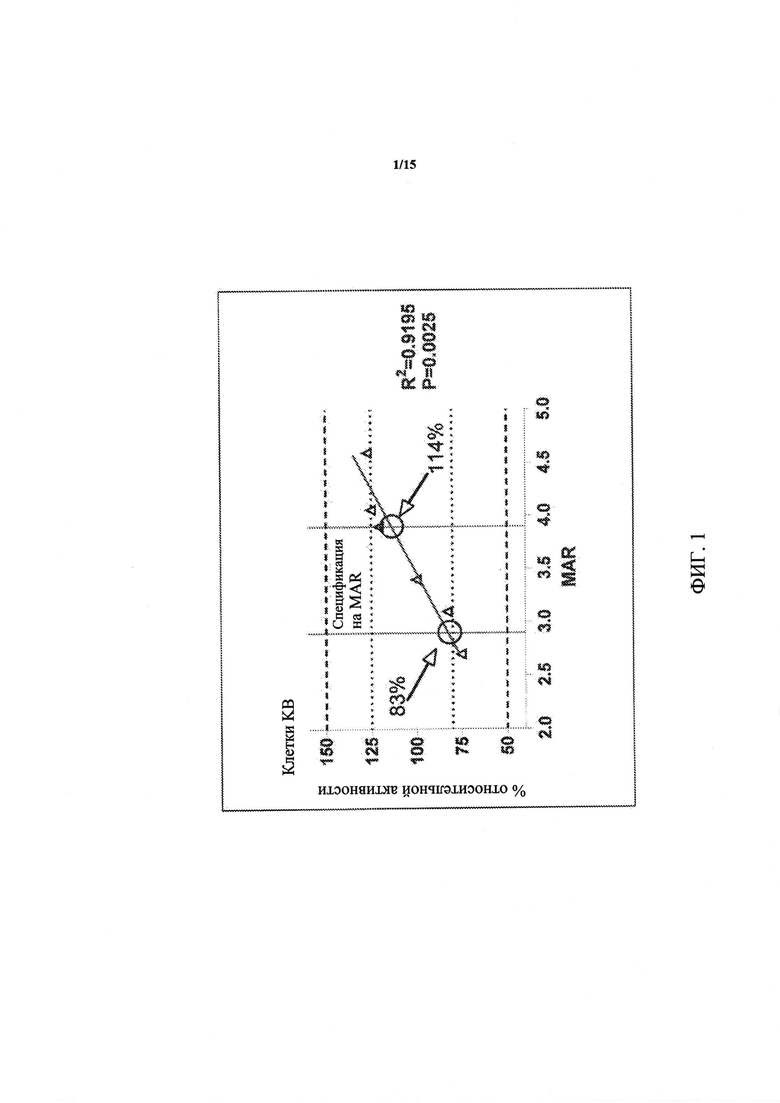





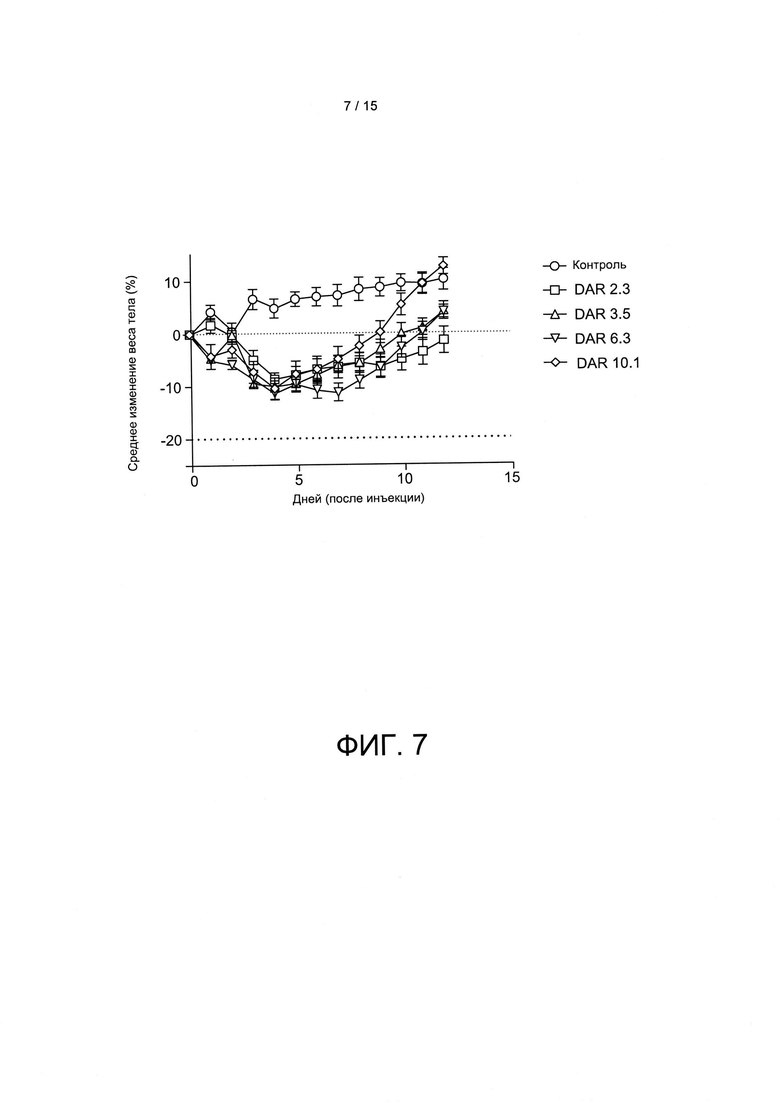

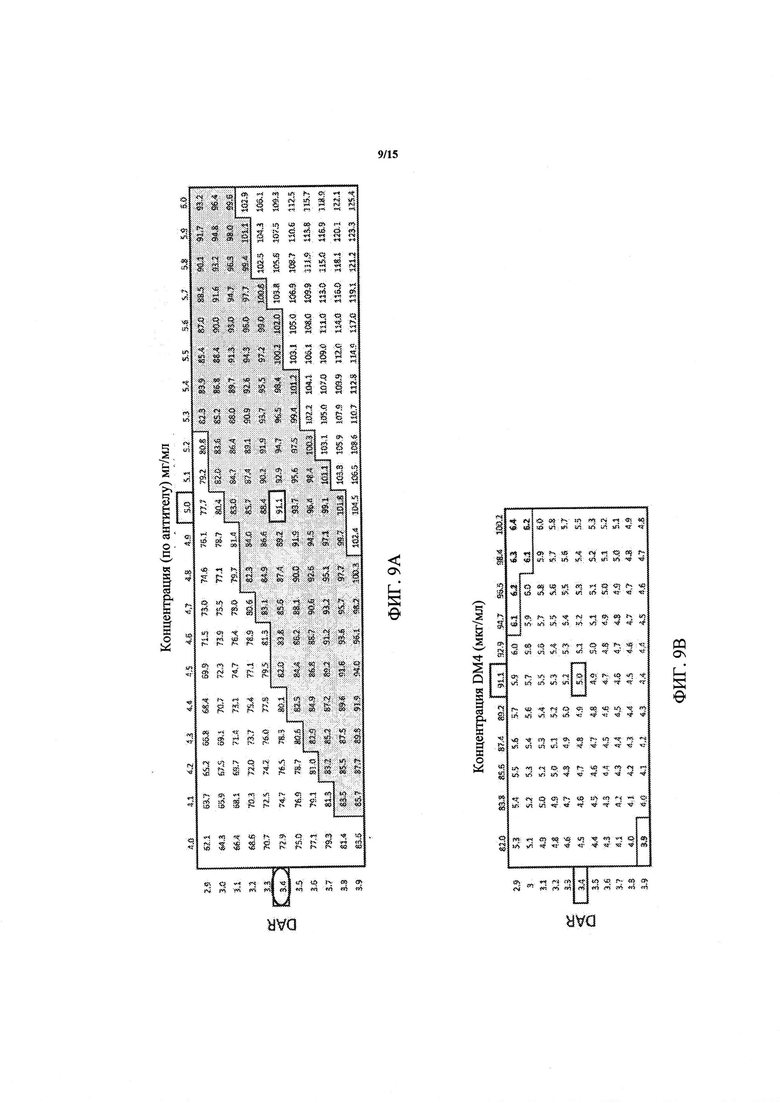
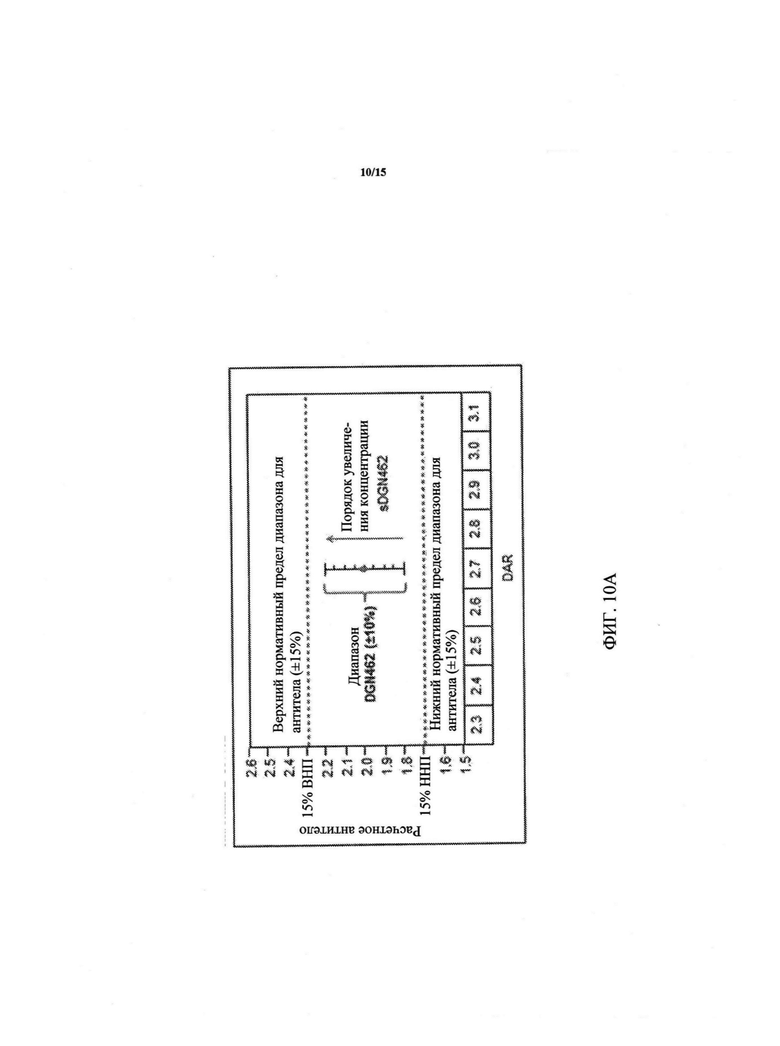




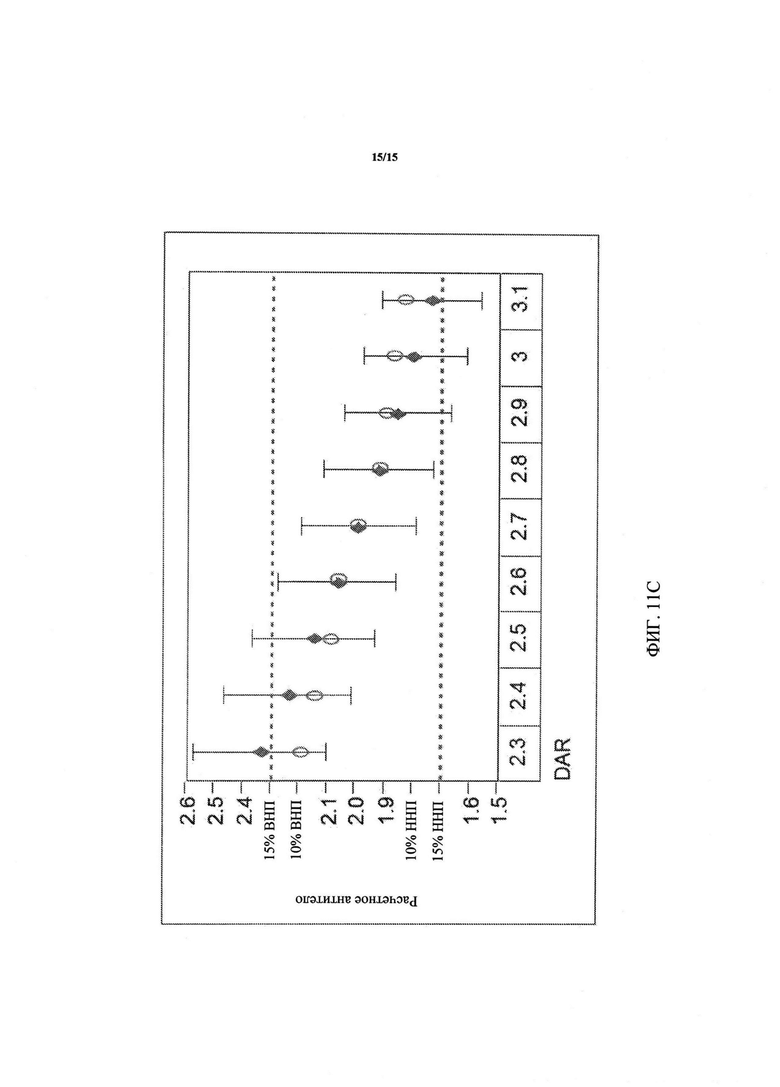
Группа изобретений предлагает усовершенствованные способы составления терапевтических композиций, содержащих конъюгат антитело-лекарственное средство ("ADC"), которые уменьшают изменчивость активности между разными партиями ADC и обеспечивают возможность введения таких терапевтических композиций в узком заданном диапазоне значений. Способ снижения изменчивости активности в композиции конъюгата антитело-лекарственное средство включает стадии, в которых (a) определяют целевую концентрацию лекарственного средства и (b) составляют композицию конъюгата антитело-лекарственное средство путем изменения концентрации указанного лекарственного средства в указанной композиции для достижения целевой концентрации лекарственного средства, тем самым снижая изменчивость активности в указанной композиции. Группа изобретений обеспечивает минимизирование токсичности и увеличение эффективности композиций лекарственного средства. 8 н. и 17 з.п. ф-лы, 11 ил., 7 табл., 6 пр.
1. Способ снижения изменчивости активности в композиции конъюгата антитело-лекарственное средство, включающий стадии, в которых:
(a) определяют целевую концентрацию лекарственного средства; и
(b) составляют композицию конъюгата антитело-лекарственное средство путем изменения концентрации указанного лекарственного средства в указанной композиции для достижения целевой концентрации лекарственного средства, тем самым снижая изменчивость активности в указанной композиции.
2. Способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство, включающий стадии, в которых:
(a) определяют концентрацию лекарственного средства;
(b) задают вариабельную концентрацию лекарственного средства, которая определяет среднюю точку области перекрывания нормативных пределов концентрации антитела и нормативных пределов концентрации лекарственного средства;
(c) составляют композицию конъюгата антитело-лекарственное средство путем изменения концентрации указанного лекарственного средства в указанной композиции для достижения заданной вариабельной концентрации лекарственного средства, тем самым снижая изменчивость активности в композиции.
3. Способ по п. 1 или 2, отличающийся тем, что изменчивость концентрации лекарственного средства составляет приблизительно ± 10% или менее чем приблизительно ± 5, 6, 7, 8 или 9%.
4. Способ по п. 2, отличающийся тем, что изменчивость концентрации антитела составляет приблизительно ± 10% или менее чем приблизительно ± 5, 6, 7, 8 или 9%.
5. Способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-лекарственное средство, включающий стадии, в которых:
(a) измеряют соотношение лекарственное средство-антитело (DAR) для композиции конъюгата антитело-лекарственное средство;
(b) определяют верхний нормативный предел для антитела и нижний нормативный предела для антитела, причем верхний нормативный предел для антитела представляет собой целевую концентрацию антитела плюс максимальное допустимое нормативное отклонение и нижний нормативный предел для антитела представляет собой целевую концентрацию антитела минус максимальное допустимое нормативное отклонение;
(c) определяют заданный верхний нормативный предел для лекарственного средства и заданный нижний нормативный предел для лекарственного средства, причем заданный верхний нормативный предел для лекарственного средства представляет собой целевую концентрацию лекарственного средства плюс максимальное допустимое нормативное отклонение и заданный нижний нормативный предел для лекарственного средства представляет собой целевую концентрацию лекарственного средства минус максимальное допустимое нормативное отклонение;
(d) определяют расчетный верхний нормативный предел для лекарственного средства (ВНП (лекарственное средство)) следующим образом:

(e) определяют расчетный нижний нормативный предел для лекарственного средства (ННП (лекарственное средство)) следующим образом:

(f) сравнивают расчетный ВНП (лекарственное средство) по стадии (d) с заданным верхним нормативным пределом для лекарственного средства по стадии (c) и выбирают меньшее из двух значений в качестве эффективного верхнего нормативного предела для лекарственного средства;
(g) сравнивают расчетный ННП (лекарственное средство) по стадии (e) с заданным нижним нормативным пределом для лекарственного средства по стадии (c) и выбирают большее из двух значений в качестве эффективного нижнего нормативного предела для лекарственного средства; и
(h) составляют композицию конъюгата антитело-лекарственное средство путем изменения концентрации указанного лекарственного средства в указанной композиции для достижения целевой концентрации лекарственного средства, являющейся средней точкой между эффективным верхним нормативным пределом для лекарственного средства и эффективным нижним нормативным пределом для лекарственного средства, тем самым снижая изменчивость активности в указанной композиции.
6. Способ по п. 5, отличающийся тем, что способ сужает интервал между верхним и нижним нормативными пределами для лекарственного средства и антитела до приблизительно ± 3-9%.
7. Способ по любому из пп. 1, 2 или 5, отличающийся тем, что концентрация лекарственного средства меняется в пределах нормативной концентрации антитела.
8. Способ по любому из пп. 2 или 5, отличающийся тем, что допускается, что концентрация антитела и концентрация лекарственного средства меняются.
9. Способ составления композиции конъюгата антитело-лекарственное средство, включающий стадии, в которых:
(a) определяют целевую концентрацию лекарственного средства; и
(b) составляют композицию конъюгата антитело-лекарственное средство путем изменения концентрации указанного лекарственного средства в указанной композиции для достижения целевой концентрации лекарственного средства по стадии (a).
10. Способ по любому из пп. 1, 2, 5, 9, отличающийся тем, что лекарственное средство выбрано из группы, состоящей из ингибитора тубулина, ДНК-повреждающего агента, ДНК-сшивающего агента, ДНК-алкилирующего агента, и средства, нарушающего клеточный цикл.
11. Способ по любому из пп. 1, 2, 5, 9, отличающийся тем, что лекарственное средство выбрано из группы, состоящей из майтанзиноида, бензодиазепинового соединения и ауристатина.
12. Способ по п. 11, отличающийся тем, что бензодиазепиновое соединение представляет собой пирролобензодиазепин или индолинобензодиазепин.
13. Способ по любому из пп. 1, 2, 5, 9, отличающийся тем, что указанное лекарственное средство представляет собой бензодиазепиновое соединение, и антитело представляет собой нефункциональное антитело, или указанное лекарственное средство представляет собой майтанзиноид, и антитело представляет собой нефункциональное антитело.
14. Способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-майтанзиноид, включающий стадии, в которых:
(a) определяют целевую концентрацию майтанзиноида; и
(b) составляют композицию конъюгата антитело-майтанзиноид путем изменения концентрации майтанзиноида в указанной композиции для достижения целевой концентрации майтанзиноида, тем самым снижая изменчивость активности в указанной композиции.
15. Способ по любому из пп. 1, 2, 5, 9 или 14, отличающийся тем, что способ снижает изменчивость активности между разными партиями при производстве конъюгата антитело-лекарственное средство или конъюгата антитело-майтанзиноид.
16. Способ составления композиции конъюгата антитело-майтанзиноид, включающий стадии, в которых:
(a) определяют целевую концентрацию майтанзиноида; и
(b) составляют композицию конъюгата антитело-майтанзиноид путем изменения концентрации майтанзиноида в указанной композиции для достижения целевой концентрации майтанзиноида.
17. Способ снижения изменчивости активности в композиции, содержащей конъюгат антитело-бензодиазепин, включающий стадии, в которых:
(a) измеряют DAR для композиции конъюгата антитело-бензодиазепин;
(b) определяют верхний нормативный предел для антитела и нижний нормативный предел для антитела, причем верхний нормативный предел для антитела представляет собой целевую концентрацию антитела плюс максимальное допустимое нормативное отклонение, и нижний нормативный предел для антитела представляет собой целевую концентрацию антитела минус максимальное допустимое нормативное отклонение;
(c) определяют заданный верхний нормативный предел для бензодиазепина и заданный нижний нормативный предел для бензодиазепина, причем заданный верхний нормативный предел для бензодиазепина представляет собой целевую концентрацию бензодиазепина плюс максимальное допустимое нормативное отклонение, и заданный нижний нормативный предел для бензодиазепина представляет собой целевую концентрацию бензодиазепина минус максимальное допустимое нормативное отклонение;
(d) определяют расчетный верхний нормативный предел для бензодиазепина (ВНП (лекарственное средство)) следующим образом:

(e) определяют расчетный нижний нормативный предел для бензодиазепина (ННП (лекарственное средство)) следующим образом:

(f) сравнивают расчетный ВНП (лекарственное средство) по стадии (d) с заданным верхним нормативным пределом для бензодиазепина по стадии (c) и выбирают меньшее из двух значений в качестве эффективного верхнего нормативного предела для бензодиазепина;
(g) сравнивают расчетный ННП (лекарственное средство) по стадии (e) с заданным нижним нормативным пределом для бензодиазепина по стадии (c) и выбирают большее из двух значений в качестве эффективного нижнего нормативного предела для бензодиазепина; и
(h) составляют композицию конъюгата антитело-бензодиазепин путем изменения концентрации бензодиазепина в указанной композиции для достижения целевой концентрации бензодиазепина, являющейся средней точкой между эффективным верхним нормативным пределом для бензодиазепина и эффективным нижним нормативным пределом для бензодиазепина, тем самым снижая изменчивость активности в указанной композиции.
18. Способ по п. 5 или 17, отличающийся тем, что значение DAR соответствует нижнему нормативному пределу DAR или верхнему нормативному пределу DAR.
19. Способ по п. 14, отличающийся тем, что майтанзиноид представляет собой DM1, DM3 или DM4.
20. Способ по любому из пп. 1, 2, 5, 9, 14, 16 или 17, отличающийся тем, что конъюгат антитело-лекарственное средство, конъюгат антитело-майтанзиноид или конъюгат бензодиазепин-антитело содержит расщепляемый линкер.
21. Способ по п. 20, отличающийся тем, что расщепляемый линкер представляет собой N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), N-сукцинимидил-4-(2-пиридилдитио)бутаноат (SPDB), N-сукцинимидил-4-(2-пиридилдитио)-2-сульфобутаноат (сульфо-SPDB) или дисульфид-N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP).
22. Способ по любому из пп. 1, 2, 5, 9, 14, 16 или 17, отличающийся тем, что конъюгат антитело-лекарственное средство, конъюгат антитело-майтанзиноид или конъюгат бензодиазепин-антитело содержит нерасщепляемый линкер, который выбран из группы, состоящей из 2-иминотиолана, ацетилянтарного ангидрида и сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилата (SMCC).
23. Способ по любому из пп. 1, 2, 5, 9, 14, 16 или 17, отличающийся тем, что конъюгат антитело-лекарственное средство выбран из группы, состоящей из: huMov19-сульфо-SPDB-DM4, huMov19-сульфо-SPDB-D1, huMov19-D2, huMov19-сульфо-SPDB-D10, huMov19-сульфо-SPDB-DGN462, huMy9-6-сульфо-SPDB-D1, huMy9-6-D2, huMy9-6-сульфо-SPDB-D10, huMy9-6-сульфо-SPDB-DGN462, huAnti-CD123-сульфо-SPDB-D1, huAnti-CD123-D2, huAnti-CD123-сульфо-SPDB-D10, huAnti-CD123-сульфо-SPDB-DGN462, huB4-SPDB-DM4, huDS6-SPDB-DM4, huCD37-3-SMCC-DM1, huCD37- 50-SMCC-DM1 и huEGFR-7R-SMCC-DM1.
24. Способ по п. 23, отличающийся тем, что указанный конъюгат антитело-лекарственное средство представляет собой huMov19-сульфо-SPDB-DM4.
25. Применение композиции, составленной в соответствии со способом согласно любому из пп. 1-24 для лечения субъекта.
| US 8557966 B2, 15.10.2013 | |||
| US 20130302359 A1, 14.11.2013 | |||
| K.R.WHITEMAN et al | |||
| IMGN779: A CD33-TARGETED ANTIBODY-DRUG CONJUGATE (ADC) UTILIZING A NOVEL DNA ALKYLATOR, DGN462, IS HIGHLY ACTIVE IN VITRO AGAINST PRIMARY PATIENT AML CELLS AND IN VIVO AGAINST AML XENOGRAFTS IN MICE / 19th Congress - European Hematology Association, 12-15 June 2014 |
Авторы
Даты
2021-01-26—Публикация
2015-09-02—Подача