ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее описание относится к области противораковых терапевтических средств и, в частности, конъюгатам антител-лекарственных средств, содержащих бипаратопных анти-HER2 антител и аналогу ауристатина.
УРОВЕНЬ ТЕХНИКИ
[002] HER2 (ErbB2) представляет собой трансмембранную поверхностно связанную рецепторную тирозинкиназу, которая является представителем семейства ErbB рецепторных тирозинкиназ и обычно вовлечена в сигнальную трансдукцию путей, ведущих к клеточному росту и дифференцировке. HER2 представляет собой перспективную цель для лечения рака молочной железы, которая, как было обнаружено, сверхэкспрессируется в приблизительно одной четвертой пациентов с раком молочной железы (Bange et al, Nature Medicine 7:548 (2001)).
[003] Herceptin® (трастузумаб, патент США № 5,821,337) был первым моноклональным антителом, разработанным для лечения HER2-положительного рака молочной железы, и повысил временные периоды выживаемости у пациентов таким образом, что они теперь такие же как у пациентов с HER2-отрицательным раком молочной железы. Пертузумаб (Perjeta®, патент США № 7,862,817) представляет собой гуманизированное моноклональное антитело, которое разработано для специфического предотвращения спаривания (димеризации) HER2-рецептора с другими HER-рецепторам (EGFR/HER1, HER3 и HER4) на поверхности клеток, считается, что этот процесс играет важную роль в опухолевом росте и выживаемости. Предполагается, что комбинация Perjeta, Herceptin и химиотерапии обеспечивает более интенсивную блокаду сигнальных путей HER. Пертузумаб связывается с доменом II HER2, необходимым для димеризации, тогда как трастузумаб связывается с внеклеточным доменом IV HER2.
[004] У Li et al (Cancer Res., 73:6471–6483 (2013)) описаны биспецифические, бивалентные антитела к HER2, которые основаны на нативных последовательностях трастузумаба и пертузумаба и которые преодолевают резистентность к трастузумабу. Были описаны другие биспецифические анти-HER2 антитела (международная публикация патентной заявки № WO 2015/077891 и WO 2016/179707; публикации заявок на патент США № 2014/0170148, 2015/0284463, 2017/0029529 и 2017/0291955; патент США № 9,745,382). Был описан также конъюгат антитела-лекарственного вещества, содержащий HER2-нацеливающееся бипаратопное антитело, сайт-специфически конъюгировано с производным тубулизина (Li et al., Cancer Cell, 29:117–129 (2016)).
[005] Ауристатины представляют собой синтетические аналоги доластатина 10, который является мощным ингибитором сборки микротрубочек с противораковой активностью. Были описаны конъюгаты антител-лекарственных веществ, содержащие нагрузочные вещества ауристатины, такие как монометилауристатин E (MMAE) или монометилауристатин F (MMAF) (патент США № 7,498,298 и 7,659,241; международная публикация патентной заявки № WO 2002/088172 и WO 2016/041082). В международной публикации патентной заявки № WO 2106/041082 описывается модифицированные N-ацилсульфонамидом ауристатины и их применение как нагрузочных веществ конъюгатов антител-лекарственных веществ.
[006] Эта вводная информация предоставляется с целью предоставления известной информации, которая, по мнению заявителя, может иметь отношение к настоящему раскрытию. Не предполагается ни признания в обязательном порядке, ни должно быть истолкования того, что любая предшествующая информация представляет собой предшествующий уровень техники в отношении заявленного изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] В данном документе описаны конъюгаты анти-HER2 бипаратопных антител-лекарственных веществ и способы их применения. В одном аспекте изобретения, настоящее описание относится к конъюгату антитела-лекарственного средства, содержащему анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера (L), с низким средним соотношением лекарственное вещество-к-антителу (DAR), причем анти-HER2 бипаратопное антитело содержит первую антигенсвязывающую полипептидную конструкцию, которая связывает первый эпитоп HER2 и вторую антигенсвязывающую полипептидную конструкцию, которая связывает второй эпитоп HER2, первый и второй эпитопы HER2 являются различными эпитопами, и при этом низкое значение среднего DAR представляет собой среднее DAR менее 3,9.
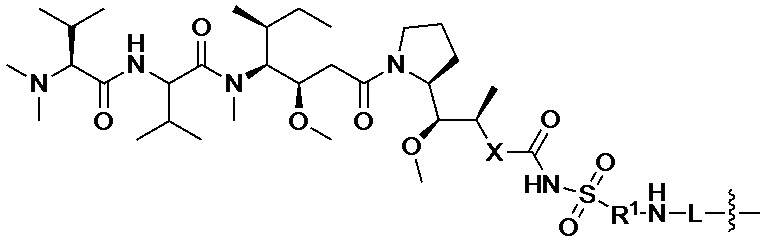
[008] В некоторых вариантах осуществления изобретения конъюгат антитела-лекарственного вещества c аналогом ауристатина-линкером имеет общую формулу (II):
(II)
где:
X представляет собой -C(O)NHCH(CH2R2)-, или X отсутствует;
R1 выбран из:
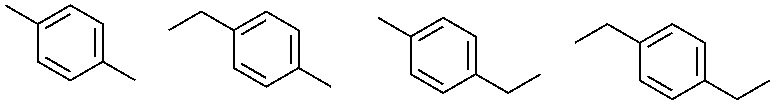 и
и 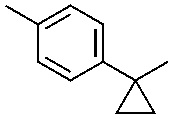 ;
;
L представляет собой линкер, и
 представляет точку присоединения линкер-токсина к анти-HER2 бипаратопному антителу;
представляет точку присоединения линкер-токсина к анти-HER2 бипаратопному антителу;
причем анти-HER2 бипаратопное антитело содержит первую антигенсвязывающую полипептидную конструкцию, которая связывает первый эпитоп HER2, и вторую антигенсвязывающую полипептидную конструкцию, которая связывает второй эпитоп HER2, первый и второй эпитопы HER2 являются различными эпитопами, и
причем низкое значение среднего DAR представляет собой среднее DAR меньше 3,9.
[009] В некоторых вариантах осуществления изобретения низкое значение среднего DAR конъюгата антитела-лекарственного вещества составляет от 0,5 до 3,5 или от 0,5 до 2,5.
[0010] В некоторых вариантах осуществления изобретения конъюгат антитела-лекарственного вещества содержит 5% или больше типов DAR0, или 15% или больше типов DAR0. В некоторых вариантах осуществления изобретения конъюгат антитела-лекарственного вещества содержит от около 5% до около 50% типов DAR0 или от около 10% до около 30% типов DAR0, или от около 10% до около 25% типов DAR0, или от около 15% до около 25% типов DAR0.
[0011] В некоторых вариантах осуществления изобретения конъюгат антитела-лекарственного вещества содержит 25% или меньше DAR6 или более крупных типов, или 15% или меньше DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения конъюгат антитела-лекарственного вещества содержит от 0% до около 15% DAR6 или более крупных типов, или от около 0% до около 10% DAR6 или более крупных типов.
[0012] Другой аспект изобретения по настоящему описанию относится к фармацевтической композиции, содержащей конъюгат анти-HER2 бипаратопного антитела-лекарственного вещества, описанный в данном документе, и фармацевтически приемлемый носитель или разбавитель.
[0013] Другой аспект относится к способу ингибирования роста HER2-экспрессирующей раковой клетки, способ включает приведение в контакт раковой клетки с эффективным количеством конъюгата анти-HER2 бипаратопного антитела-лекарственного вещества, описанного в данном документе.
[0014] Другой аспект относится к способу лечения HER2-экспрессирующего ракового заболевания, включающему введение субъекту с HER2-экспрессирующим раковым заболеванием эффективного количества конъюгата анти-HER2 бипаратопного антитела-лекарственного вещества, описанного в данном документе.
[0015] Другой аспект относится к конъюгату антитела-лекарственного вещества, описанного в данном документе, для применение в терапии.
[0016] Другой аспект относится к конъюгату антитела-лекарственного вещества, описанного в данном документе, для применения при лечении HER2-экспрессирующего ракового заболевания у нуждающегося в этом субъекта.
[0017] Другой аспект относится к применению конъюгата антитела-лекарственного вещества, описанного в данном документе, в производстве лекарственного средства для лечения HER2-экспрессирующего ракового заболевания.
[0018] Другой аспект относится к композиции конъюгата антитела-лекарственного вещества, содержащей анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера (L), причем аналог ауристатина-линкер имеет общую формулу (II):

(II)
где:
X отсутствует;
R1 выбран из:
 и
и  ;
;
L представляет собой линкер, и
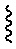 представляет точку присоединения аналога ауристатина-линкера к анти-HER2 бипаратопному антителу;
представляет точку присоединения аналога ауристатина-линкера к анти-HER2 бипаратопному антителу;
причем анти-HER2 бипаратопное антитело содержит первую антигенсвязывающую полипептидную конструкцию, которая связывает первый эпитоп HER2 на ECD4 HER2, и вторую антигенсвязывающую полипептидную конструкцию, которая связывает второй эпитоп HER2 на ECD2 HER2, и
при этом композиция конъюгата антитело-лекарственное средство имеет среднее DAR от 0,5 до 2,5 и содержит от около 10% до около 30% типов DAR0 и от 0% до около 15% DAR6 или более крупных типов.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0019] На Фиг. 1 показаны результаты электрофореза ДСН-ПААГ в невосстанавливающих и восстанавливающих условиях (A) v17597 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR4), и (B) v21252 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR2), каждый по сравнению с исходным анти-HER2 бипаратопным антителом (v10000).
[0020] На Фиг. 2 показаны кривые хроматографии гидрофобных взаимодействий (ХГВ) для (A) исходного анти-HER2 бипаратопного антитела v10000, (B) v17597 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001, демонстрирующего среднее DAR 3,92), и (C) v21252 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001, демонстрирующего среднее DAR 2,07). Отдельные вклады типов DAR0, DAR2, DAR4 и DAR6 в значение среднего DAR очищенных ADC показаны в виде (D) и (E).
[0021] На Фиг. 3 показаны кривые эксклюзионной хроматографии (SEC) для (A) исходного анти-HER2 бипаратопного антитела v10000, (B) v17597 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR4), и (C) v21252 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR2).
[0022] На Фиг. 4 показаны результаты анализов связывания методом проточной цитометрии на антигенположительных клетках, сравнения v17597 (анти-HER2 бипаратопное антитело, конъюгированное с линкер-токсином 001 при DAR4) и v10000 (исходное бипаратопное анти-HER2 антитело), связывания с (A) клетками карциномы молочной железы JIMT-1, и (B) клетками карциномы мочевого пузыря КТ-112, и (C) сравнения v21252 (анти-HER2 бипаратопное антитело, конъюгированное с линкер-токсином 001 при DAR2) и v10000 (исходное анти-HER2 бипаратопное антитело), связывающееся с клетками карциномы молочной железы JIMT-1.
[0023] На Фиг. 5 показаны результаты обработки HER2-экспрессирующих линий клеток карциномы молочной железы BT-474 (A), SK-BR-3 (B), HCC1954 (C), JIMT-1 (D) и ZR-75-1 (E), и HER2-отрицательной линии клеток MDA-MB-468 (F) с v17597 (анти-HER2 бипаратопное антитело, конъюгированное с линкер-токсином 001 при DAR4) и v21252 (анти-HER2 бипаратопное антитело, конъюгированное с линкер-токсином 001 при DAR2).
[0024] На Фиг. 6 показаны результаты обработки HER2-экспрессирующей линии клеток карциномы яичника SK-OV-3 (A) и линий клеток карциномы молочной железы ZR-75-1 (B) и JIMT-1 (C) с конъюгатами антител-лекарственных веществ, содержащими v10000, конъюгированное с линкер-токсином 001 с различными значениями средних DAR. Отдельные вклады типов DAR0, DAR2, DAR4 и DAR6 в значение среднего DAR ADC, имеющих средние DAR 0,7; 2,2 и 3,9, показаны в виде (D).
[0025] На Фиг. 7 показаны результаты лечения мышей q14d x2 с ксенотрансплантатом, производным от раковой опухоли HBCx-13b молочной железы пациента с помощью отмеченных доз (A) v17597 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR4) и (B) v21252 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR2). v15496 = носитель.
[0026] На Фиг. 8 показаны результаты лечения мышей qdx1 с ксенотрансплантатом, производным от раковой опухоли ST-910 молочной железы пациента с помощью отмеченных доз (A) v17597 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR4) и (B) v21252 (анти-HER2 бипаратопного антитела, конъюгированного с линкер-токсином 001 при DAR2). v15496 = носитель.
[0027] На Фиг. 9 показаны (A) профили средних значений (+СО) сывороточных концентраций v21252 в зависимости от времени и (B) профили средних значений (±СО) сывороточных концентраций всех антител в зависимости от времени после введения однократной дозы v21252 самкам яванского макака (n=3) при дозе 9 мг/кг или 12 мг/кг.
[0028] На Фиг. 10 показаны профилисредних значений (±СО) сывороточных концентраций v21252 в зависимости от времени на сутки 1 (A) и сутки 29 (B) после инфузии v21252 два раза в неделю яванским макакам (n=6) в дозе либо 12 мг/кг, либо 9 мг/кг.
[0029] На Фиг. 11 показаны профили средних значений (±СО) сывороточных концентраций всех антител в зависимости от времени на сутки 1 (A) и сутки 29 (B) после инфузии v21252 два раза в неделю яванским макакам (n=6) в дозе либо 12 мг/кг, либо 9 мг/кг.
[0030] На Фиг. 12 показаны профили средних значений (±СО) сывороточных концентраций в зависимости от времени как антитела v21252, так и всех антител, после инфузии v21252 два раза в неделю яванским макакам (n=6) в дозе либо 12 мг/кг, либо 9 мг/кг.
[0031] На Фиг. 13 показана интернализация pHAb-конъюгированного v21252 по сравнению с pHAb-конъюгированным трастузумаб-линкер-токсином 001 и отрицательного контроля внутрь (A) клеток SKBR3 и (B) клеток JIMT-1.
[0032] На Фиг. 14 показана интернализация pHAb-конъюгированного v21252 (A) по сравнению с pHAb-конъюгированным трастузумаб-линкер-токсином 001 (B) внутрь клеток SKBR3 в различные указанные моменты времени. Ядра показаны серым цветом, а pHAb показан белым.
[0033] На Фиг. 15 показано сравнительное воздействие на яванских макак и мышей, получивших лечение с помощью v21252 в указанных дозах: (A) воздействие на яванских макак и мышей, которым подкожно имплантировали полученную у пациента опухоль с высокой экспрессией HER2 (HBCx-13b), (B) воздействие на яванских макак и мышей, которым подкожно имплантировали полученную у пациента опухоль с низкой экспрессией HER2 (ST-910).
[0034] На Фиг. 16 показаны результаты лечения мышей qwk x4 с ксенотрансплантатом, производным от пациента с раком яичника LTL-654, с помощью 3 мг/кг носителя или v21252.
[0035] На Фиг. 17 представлены результаты выживаемости для мышей, которым внутрь черепа имплантировали опухолевые клетки BT-474 молочной железы после еженедельного в.в. введения носителя, контрольного конъюгата (гуманизированное антитело против респираторно-синцитиального вируса, конъюгированного с линкер-токсином 001), v21252, v7155 (T-DM1, DAR 3,5) и v24029 (трастузумаб, конъюгированный при DAR8 с экзатекан-производным ингибитором топоизомеразы I (DXd)), каждый при дозе 6 мг/кг еженедельно с общим получением 12 инъекций.
[0036] На Фиг. 18 представлены результаты выживаемости для мышей, которым внутрь черепа имплантировали опухолевые клетки BT-474 молочной железы после еженедельного в.в. введения носителя, контрольного конъюгата (гуманизированное антитело против респираторно-синцитиального вируса, конъюгированного с линкер-токсином 001) или v7155 (T-DM1, DAR3.5) при дозе 6 мг/кг еженедельно с общим получением 12 инъекций или v21252 или v24029 (трастузумаб, конъюгированный при DAR8 с экзатекан-производным ингибитором топоизомеразы I (DXd)), каждый при дозе 6 мг/кг раз в две недели с общим получением 6 инъекций.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0037] Настоящее описание относится к конъюгату анти-HER2 бипаратопного антитела-лекарственного вещества (ADC), в котором лекарственное вещество представляет собой аналог ауристатина и конъюгировано с антителом при низком значении среднего соотношения лекарственное вещество-к-антителу (DAR). ADC с низким значением среднего DAR (<3,9), описанные в данном документе, имеют лучшую переносимость и уменьшенную токсичность по сравнению с соответствующим ADC с DAR >3,9 при введении той же дозы токсина (аналога ауристатина). Особый интерес вызывают ADC, имеющие средние DAR около 2,5 или менее, например от около 1,8 до 2,5.
[0038] Настоящее описание также относится к способу применения ADC, описанных в данном документе, при лечении HER2-экспрессирующего ракового заболевания.
Определения
[0039] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно понимается специалистом в данной области техники.
[0040] Термин «субъект», используемый в данном документе, относится к животному, в некоторых вариантах осуществления, млекопитающему, которое представляет собой объект лечения, наблюдения или эксперимента. Животное может быть человеком, не являющимся человеком приматом, домашним животным (например, собака, кошка и т.п.), сельскохозяйственным животным (например, корова, овца, свинья, лошадь и т.п.) или лабораторным животным (например, крыса, мышь, морская свинка, не являющийся человеком примат и т.п.). В некоторых вариантах осуществления субъект является человеком.
[0041] Термин «млекопитающее», используемый в данном документе, включает в себя, но не ограничивается людьми, не являющимися человеком приматами, собаками, кошками, мышами, крупным рогатым скотом, лошадьми и свиньями. В некоторых вариантах осуществления млекопитающее является человеком.
[0042] Как используется в данном документе, термин «около» относится к приблизительно +/-10% вариации от данного значения. Следует понимать, что такая вариация всегда включена в любое данное значение, представленное в данном документе, независимо от ее конкретного упоминания.
[0043] Использование слова в единственном числе при применении в сочетании с термином «содержащий» может означать «один», но в некоторых вариантах осуществления изобретения оно также соответствует значению «один или более», «по меньшей мере один» или «один или более одного».
[0044] Как используется в данном документе, термины «включающий», «имеющий», «охватывающий» и «содержащий» и их грамматические вариации являются включающими или неограничивающими, и не исключают дополнительные неперечисленные элементы и/или этапы способов. Термин «по существу состоящий», при использовании в данном документе в связи с композицией, применением или способом, отмечает возможно присутствующие дополнительные элементы и/или этапы способа, но такие дополнения фактически не влияют на стиль, которым излагаются композиция, способ или применяемые функции. Термин «состоящий из», при использовании в данном документе в связи с композицией, применением или способом, исключает наличие дополнительных элементов и/или этапов способа. Композиция, применение или способ, описанные в данном документе как включающие определенные элементы и/или этапы, в некоторых вариантах осуществления, также могут по существу состоять из таких элементов и/или этапов, а в других вариантах осуществления состоят из таких элементов и/или этапов, независимо от конкретного упоминания в этих вариантах осуществления.
[0045] Предполагается, что любой вариант осуществления, обсуждаемый в данном документе, может быть реализован в отношении любого другого способа, применения или композиции, описанных в данном документе, и наоборот.
[0046] Признаки, структуры и/или характеристики, описанные в связи с раскрытым в данном документе варианте осуществления, могут быть объединены с особенностями, признаками и/или характеристиками, описанными в связи с другим вариантом осуществления, раскрытым в данном документе любым подходящим способом, для обеспечения одного или более дополнительных вариантов осуществления.
[0047] Следует также понимать, что положительное прочтение признака в одном вариант осуществления служит основанием для исключения этого признака в альтернативном варианте осуществления. Например, если перечень вариаций представлен для данного варианта осуществления или пункта формулы, следует понимать, что один или более вариантов могут быть удалены из этого перечня, а сокращенный перечень может образовывать альтернативный вариант осуществления, независимо от того, отмечается ли конкретно такой альтернативный вариант осуществления или нет.
КОНЪЮГАТЫ АНТИ-HER2 БИПАРАТОПНЫХ АНТИТЕЛ-ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
[0048] Конъюгаты антител-лекарственных веществ (ADC) по настоящему описанию содержат анти-HER2 бипаратопное антитело, конъюгированное с токсином посредством линкера при низком значении среднего соотношения лекарственное вещество-к-антителу (DAR), токсин является токсин на основе ауристатина (или «аналога ауристатина»). Примеры токсинов на основе ауристатина известны в данной области техники.
[0049] В некоторых вариантах осуществления изобретения аналог ауристатина представляет собой соединение общей формулы (I):
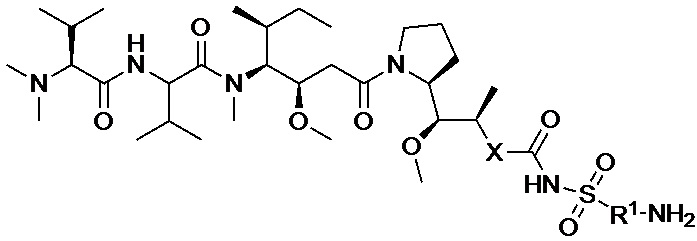
(I)
где:
X представляет собой -C(O)NHCH(CH2R2)-, или X отсутствует;
R1 выбран из:
 и
и  , и
, и
R2 представляет собой фенил.
[0050] Термин «низкое DAR», используемый в данном документе, определяется как среднее DAR менее 3,9; но более 0,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет менее 3,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет менее 3,4; например менее 3,3; менее 3,2 или менее 3,1. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет 3,0 или меньше. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет 2,9 или меньше; например 2,8 или меньше; 2,7 или меньше, или 2,6 или меньше. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет 2,5 или меньше; например 2,4 или меньше; 2,3 или меньше, или 2,2 или меньше. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет около 2,0.
[0051] В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 0,5 до 3,8; например от 0,5 до 3,5 или от 0,5 и 2,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 0,7 до 3,8; например от 0,7 до 3,5; от 0,7 до 3,0 или от 0,7 и 2,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 1,0 до 3,8; например от 1,0 до 3,5; от 1,0 до 3,0 или от 1,0 и 2,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 1,5 до 3,8; например от 1,5 до 3,5; от 1,5 до 3,0 или от 1,5 и 2,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 1,6 до 3,8; например от 1,6 до 3,5; от 1,6 до 3,0 или от 1,6 и 2,5. В некоторых вариантах осуществления изобретения среднее DAR ADC составляет от 1,8 до 2,8; например от 1,8 до 2,5.
[0052] Как отмечено выше, ADC с низким значением среднего DAR (<3,9), описанные в данном документе, имеют улучшенную переносимость и уменьшенную токсичность по сравнению с соответствующим ADC с DAR >3,9 при введении той же дозы токсина. Как известно в данной области техники, большинство способов конъюгации дает композицию ADC, которая включает в себя различные типы DAR, при этом указанное DAR является средним значением по отдельным типам DAR. Не ограничиваясь какой-либо конкретной теорией, более высокая переносимость и уменьшенная токсичность ADC с низким DAR могут быть вызваны одним или обоими факторами из снижения по высоким значениям типов DAR (6 или более) в композиции ADC и/или увеличения типов DAR0 в композиции ADC.
[0053] В некоторых вариантах осуществления изобретения композиции ADC, которые содержат некоторую долю типов DAR0 выше определенного порогового уровня, могут обладать преимуществом. Соответственно, в некоторых вариантах осуществления композиция ADC с низким DAR может содержать 5% или более типов DAR0. В некоторых вариантах осуществления композиция ADC с низким DAR может содержать 10% или более типов DAR0. В некоторых вариантах осуществления композиция ADC с низким DAR может содержать 15% или более типов DAR0 или, например, 20% или более типов DAR0. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от около 5% до около 50% типов DAR0. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от около 10% до около 50% типов DAR0, например от около 10% до около 40%, от около 10% до около 30% типов DAR0, или от около 10% до около 25% типов DAR0. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от около 12% до около 28% типов DAR0, например от около 12% до около 28% типов DAR0, или от около 15% до около 25% типов DAR0.
[0054] В некоторых вариантах осуществления изобретения композиции ADC, которые содержат некоторую долю DAR6 или более крупных типов ниже определенного порогового уровня, могут обладать преимуществом. Соответственно, в некоторых вариантах осуществления композиция ADC с низким DAR может содержать менее около 35% DAR6 или более крупных типов. В некоторых вариантах осуществления композиция ADC с низким DAR может содержать 30% или менее DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать 25% или менее DAR6 или более крупных типов, например 20% или менее, 15% или менее, или 10% или менее DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать 9% или менее DAR6 или более крупных типов, например 8% или менее, 7% или менее, 6% или менее, или 5% или менее DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от 0% до около 35% DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от 0% до около 30% DAR6 или более крупных типов, например от 0% до около 25%, или от 0% до около 20% DAR6 или более крупных типов. В некоторых вариантах осуществления изобретения композиция ADC с низким DAR может содержать от около 0% до около 15% DAR6 или более крупных типов, например от около 0% до около 10%, от около 0% до около 8%, или от 0% до около 5% DAR6 или более крупных типов.
[0055] Некоторые варианты осуществления относятся к ADC, которые включают в себя анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера (L) с низким значением среднего соотношения лекарственное вещество-к-антителу (DAR), аналог ауристатина-линкер с общей формулой (II):

(II)
где X и R1 являются такими, как определено для общей формулы (I);
L представляет собой линкер, и
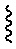 представляет точку присоединения аналога ауристатина-линкера к анти-HER2 бипаратопному антителу.
представляет точку присоединения аналога ауристатина-линкера к анти-HER2 бипаратопному антителу.
[0056] Некоторые варианты осуществления относятся к ADC с общей формулой (III):

(III)
где X и R1 являются такими, как определено для общей формулы (I);
L представляет собой линкер;
n представляет собой среднее соотношение лекарственное вещество-к-антителу (DAR), и оно составляет менее 3,9; и
Ab представляет собой анти-HER2 бипаратопное антитело.
Анти-HER2 бипаратопные антитела
[0057] Описанные в данном документе ADC включают в себя анти-HER2 бипаратопное антитело, которое связывается с двумя различными эпитопами HER2.
[0058] Термин «антитело», используемое в данном документе, в целом относится к белковой связывающей молекуле с иммуноглобулиноподобными функциями. Типичные примеры антитела представляют собой иммуноглобулины, а также производные или их функциональные фрагменты, которые еще сохраняют связывающую специфичность. Методики продуцирования антител хорошо известны в данной области техники. Термин «антитело» также может включать иммуноглобулины различных классов (т. е. IgA, IgG, IgM, IgD и IgE) и субклассов (такие как IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2). Иллюстративные примеры антитела представлены целыми антителами и их антигенсвязывающими фрагментами, такими как Fab-фрагменты, F(ab')2, Fv-фрагменты, одноцепочечные Fv-фрагменты (scFv), диатела, доменные антитела и их комбинации. Доменные антитела могут быть однодоменными антителами, антителами с одним вариабельным доменом или иммуноглобулином с одним вариабельным доменом, содержащим только один вариабельный домен, который может быть вариабельным доменом тяжелой цепи или вариабельным доменом легкой цепи, которые специфически связывают антиген или эпитоп независимо от других вариабельных областей или доменов. Термин «антител» также включает такие варианты осуществления как химерные, одноцепочечные и гуманизированные антитела.
[0059] Типичное антитело содержит по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (CH). Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов известны как α (IgA), δ (IgD), ε (IgE), γ (IgG) и μ (IgM). Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи. Константная область легкой цепи содержит только один домена: CL. Легкие цепи классифицируют на каппа или лямбда. Области VH и VL могут дополнительно подразделяться на области гипервариабельности, называемые определяющими комплементарность областями (CDR), перемежающиеся более консервативными областями, называемыми каркасными областями (FW). Каждая VH и VL состоит из трех CDR и четырех FW, расположенных от амино-конца к карбокси-концу в следующем порядке: FW1, CDR1, FW2, CDR2, FW3, CDR3, FW4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен (паратоп), который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с хозяйскими тканями или факторами, включая различные клетки иммунной системы (такие как эффекторные клетки) и C1q, которые представляет собой компонент системы комплемента.
[0060] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела для включения в состав ADC, описанные в данном документе, содержат две антигенсвязывающие полипептидные конструкции, каждая из которых связывается с отличающимся эпитопом HER2. Термин «антигенсвязывающая полипептидная конструкция», используемый в данном документе, может представлять собой конструкцию на основе иммуноглобулина, например фрагмент антитела, или она может представлять собой формат миметика антитела, не основанного на иммуноглобулине, такой как антикалин, финомер, аффимер, альфатело, DARPin или авимер. В некоторых вариантах осуществления изобретения антигенсвязывающие полипептидные конструкции, составленные анти-HER2 бипаратопным антителом, могут представлять собой конструкции на основе иммуноглобулинов. В некоторых вариантах осуществления изобретения антигенсвязывающие полипептидные конструкции, составленные анти-HER2 бипаратопным антителом, могут представлять собой фрагменты антител.
[0061] В некоторых вариантах осуществления изобретения антигенсвязывающие полипептидные конструкции, составленные анти-HER2 бипаратопным антителом, могут каждая независимо представлять собой Fab-фрагмент, Fab’-фрагмент, scFv или sdAb. В некоторых вариантах осуществления изобретения антигенсвязывающие полипептидные конструкции, составленные анти-HER2 бипаратопным антителом, могут каждая независимо представлять собой Fab-фрагмент или scFv. В некоторых вариантах осуществления изобретения одна антигенсвязывающая полипептидная конструкция, составленная анти-HER2 бипаратопным антителом, может представлять собой Fab-фрагмент, а другая антигенсвязывающая полипептидная конструкция может представлять собой scFv.
[0062] В некоторых вариантах осуществления изобретения по меньшей мере одна из антигенсвязывающих полипептидных конструкций, составленная анти-HER2 бипаратопным антителом, может представлять собой Fab-фрагмент или Fab’-фрагмент. «Fab фрагмент» содержит константный домен легкой цепи (CL) и первый константный домен тяжелой цепи (CH1) вместе с вариабельным доменом легкой и тяжелой цепи (VL и VH, соответственно). Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких аминокислотных остатков на C-конце домена CH1 тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Fab-фрагмент может также представлять собой одноцепочечную Fab-молекулу, т. е. Fab-молекулу, в которой легкая цепь Fab и тяжелая цепь Fab связаны пептидным линкером с образованием единой пептидной цепи. Например, C-конец легкой цепи Fab может быть связан с N-концом тяжелой цепи Fab в одноцепочечной молекуле Fab.
[0063] В некоторых вариантах осуществления изобретения по меньшей мере одна из антигенсвязывающих полипептидных конструкций, составленные анти-HER2 бипаратопным антителом, может представлять собой одноцепочечный Fv (scFv). Обозначение «ScFv» включает вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела в единой полипептидной цепи. Необязательно scFv может дополнительно содержать полипептидный линкер между доменами VH и VL, которые дают возможность scFv образовывать требуемую структуру для связывания антигенов. В некоторых вариантах осуществления scFv может включать VL, соединенный полипептидным линкером от своего C-конца до N-конца VH. В альтернативном варианте scFv может содержать VH, соединенный полипептидной цепью или линкером посредством своего C-конца до N-конца VL (см. обзор у Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269–315 (1994)).
[0064] В некоторых вариантах осуществления изобретения по меньшей мере одна из антигенсвязывающих полипептидных конструкций, составленная анти-HER2 бипаратопным антителом, может быть представлена в формате однодоменного антитела (sdAb). Формат sdAb относится к единичному иммуноглобулиновому домену. SdAb может быть, например, верблюжьего происхождения. У верблюжьих антител отсутствуют легкие цепи и их антигенсвязывающие сайты содержат единственный домен, называемый VHH. sdAb содержит три CDR/гипервариабельные петли, которые образуют антигенсвязывающий сайт: CDR1, CDR2 и CDR3. sdAb являются достаточно стабильными и легкими для экспрессии, например как гибрид с Fc-цепью антитела (см., например, Harmsen & De Haard, Appl. Microbiol Biotechnol. 77(1): 13–22 (2007)).
Форматы антител
[0065] Анти-HER2 бипаратопные антитела для включения в ADC, описанные в данном документе, могут иметь различные форматы. Минимальные компоненты анти-HER2 бипаратопного антитела представляют собой первую антигенсвязывающую полипептидную конструкцию, которая связывается с первым HER2 эпитопом, и вторую антигенсвязывающую полипептидную конструкцию, которая связывается со вторым эпитопом HER2, с различными первым и вторым эпитопами HER2. Антитело, которое содержит две антигенсвязывающие полипептидные конструкции, которые связываются с различными эпитопами HER2, могут считаться бивалентными, бипаратопными антителами. Некоторые варианты осуществления относятся к бивалентным, анти-HER2 бипаратопным антителам. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя одну или более дополнительных антигенсвязывающих полипептидных конструкций, каждая из которых связывается либо с первым, либо со вторым эпитопом HER2. Например, в некоторых вариантах осуществления анти-HER2 бипаратопное антитело может быть тривалентным или тетравалентным.
[0066] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело дополнительно содержит линкер, который связывает первую и вторую антигенсвязывающие полипептидные конструкции. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело дополнительно содержит каркас, и первая и вторая антигенсвязывающие полипептидные конструкции функционально связаны с данным каркасом. Термин «функционально связанный», используемый в данном документе, означает, что описанные компоненты находятся во взаимосвязи, обеспечивающей их функционирование ожидаемым для них путем.
[0067] Анти-HER2 бипаратопные антитела могут, таким образом, считаться имеющими модульную архитектуру, которая содержит два модуля антигенсвязывающих полипептидных конструкций и необязательно один или оба из линкерного модуля и каркасного модуля. Специалист в данной области поймет, что эти модули можно комбинировать различными путями для получения анти-HER2 бипаратопных антител, обладающих различными форматами. Эти форматы основаны в целом на форматах антител, известных в данной области техники (см., например, обзор от Brinkmann & Kontermann, MAB, 9(2):182-212 (2017), и Müller & Kontermann, “Bispecific Antibodies” в Handbook of Therapeutic Antibodies, Wiley-VCH Verlag GmbH & Co. (2014)).
[0068] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело содержит две антигенсвязывающие полипептидные конструкции, функционально связанные с каркасом. Подходящие каркасы описаны ниже. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело содержит две антигенсвязывающие полипептидные конструкции, функционально связанные с каркасом, и по меньшей мере одна из антигенсвязывающих полипептидных конструкций представляет собой scFv. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело содержит две антигенсвязывающие полипептидные конструкции, функционально связанные с каркасом, и по меньшей мере одна из антигенсвязывающих полипептидных конструкций представляет собой Fab.
[0069] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать три или четыре антигенсвязывающие полипептидные конструкции и каркас. В этом формате по меньшей мере первая и вторая антигенсвязывающие конструкции являются функционально связанными с каркасом. Третья и необязательная четвертая антигенсвязывающие полипептидные конструкции могут, каждая независимо, быть функционально связанными с каркасом или с первой антигенсвязывающей полипептидной конструкцией или со второй антигенсвязывающей полипептидной конструкцией.
[0070] Анти-HER2 бипаратопные антитела, у которых отсутствует каркас, как правило содержат две антигенсвязывающие полипептидные конструкции, функционально связанные одним или более линкерами. Антигенсвязывающие полипептидные конструкции могут находиться в форме scFv, Fab, sdAb или их комбинации. Например, используя scFv в качестве антигенсвязывающих полипептидных конструкций, можно конструировать такие форматы, как тандемный scFv ((scFv)2 или taFv), в которых scFv связаны вместе гибким линкером. Для конструирования форматов диатела, которые содержат соответственно два scFv, связанные коротким линкером (в длину обычно около 5 аминокислот). Ограниченная длина линкера приводит к димеризации scFv путем «голова-к-хвосту». В любом из предшествующих форматов scFv можно дополнительно стабилизировать включением междоменной дисульфидной связи. Например, дисульфидную связь можно вводить между VL и VH, посредством введения дополнительного цистеинового остатка в каждую цепь (например, в положение 44 в VH и 100 в VL) (см., например, Fitzgerald et al., Protein Engineering, 10:1221–1225 (1997)), или дисульфидную связь можно вводить между двумя VH для получения конструкции с форматом DART (см., например, Johnson et al., J Mol. Biol., 399:436–449 (2010)).
[0071] Сходным образом, в некоторых вариантах осуществления изобретения могут применяться форматы, содержащие два sdAb, такие как VH или VHH, соединенные вместе посредством подходящего линкера.
[0072] Другие примеры форматов анти-HER2 бипаратопных антител, у которых отсутствует каркас, включают основанные на Fab фрагменты, например форматы Fab2 и F(ab’)2, в которых Fab-фрагменты соединены посредством линкера или шарнирной области IgG.
[0073] Для создания альтернативных бескаркасных форматов могут также применять комбинации антигенсвязывающих полипептидных конструкций в различных форматах. Например, scFv или sdAb можно гибридизировать с C-концом любого или обоих Fab-фрагментов легкой и тяжелой цепи, что приводит к бивалентной (Fab-scFV/sdAb) конструкции.
[0074] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать две антигенсвязывающие полипептидные конструкции и один или более линкеров, и не содержит каркас. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело содержит две антигенсвязывающие полипептидные конструкции, которые представляют собой scFv, Fab, sdAb или их комбинации, и один или более линкеров, и не содержит каркас.
Каркасы
[0075] Анти-HER2 бипаратопные антитела, содержащие каркас, могут конструировать путем связывания двух антигенсвязывающих полипептидных конструкций с подходящим каркасом. Антигенсвязывающие полипептидные конструкции могут находиться в одной форме или комбинации форм, описанных выше (например, scFv, Fab и/или sdAb). Примеры подходящих каркасов описаны более подробно ниже и включают, но не ограничиваются ими, иммуноглобулиновые Fc-области, альбумин, аналоги и производные альбуминов, гетеродимеризующиеся пептиды (такие как лейциновые застежки-молнии, гетеродимеробразующие пептиды типа «застежка-молнии», полученные из Jun и Fos, домены CH1 и CL IgG или токсины барназа-барстар), цитокины, хемокины или факторы роста. Другие примеры включают антитела, основанные на технологии DOCK-И-LOCKTM (DNLTM), разработанной IBC Pharmaceuticals, Inc. и Immunomedics, Inc. (см., например, Chang, et al., Clin Cancer Res 13:5586s–5591s (2007)).
[0076] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела включают в себя две или более антигенсвязывающие полипептидные конструкции и каркас. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела содержат две антигенсвязывающие полипептидные конструкции, функционально связанные с каркасом.
[0077] Каркас может быть пептидом, полипептидом, полимером, наночастицей или другим химическим объектом. Когда каркас представляет собой полипептид, каждая антигенсвязывающая полипептидная конструкция анти-HER2 бипаратопного антитела может быть связана как с N-, так и с C-концом полипептидного каркаса. В некоторых вариантах осуществления также предполагаются анти-HER2 бипаратопные антитела, содержащие полипептидный каркас, в котором одна или более из антигенсвязывающих полипептидных конструкций связаны с областью, отличной от N- или C-конца, например посредством боковой цепи аминокислоты с помощью линкера или без него.
[0078] В вариантах осуществления, в которых каркас представляет собой пептид или полипептид, антигенсвязывающие полипептидные конструкции могут быть связаны с каркасом генетическим слиянием или химической конъюгацией. Как правило, когда каркас представляет собой пептид или полипептид, антигенсвязывающие полипептидные конструкции могут быть связаны с каркасом генетическим слиянием. В некоторых вариантах осуществления, когда каркас представляет собой полимер или наночастицу, антигенсвязывающие полипептидные конструкции могут быть связаны с каркасом химической конъюгацией.
[0079] Ряд белковых доменов, известных в данной области техники, содержат селективные пары двух различных полипептидов и могут применяться для образования каркаса. Примером являются домены лейциновой молнии, такие как Fos и Jun, которые селективно соединяются в пары вместе (Kostelny, et al., J Immunol, 148:1547–53 (1992); Wranik, et al., J. Biol. Chem., 287: 43331–43339 (2012)). Другие селективно спаривающиеся молекулярные пары включают, например, пару барназа-барстар (Deyev, et al., Nat Biotechnol, 21:1486–1492 (2003)), пары нитей ДНК (Chaudri, et al., FEBS Letters, 450(1–2):23–26 (1999)) и разделенные пары флуоресцентных белков (международная публикация патентной заявки № WO 2011/135040).
[0080] Другие примеры белковых каркасов включают иммуноглобулиновые Fc-области, альбумин, аналоги и производные альбуминов, токсины, цитокины, хемокины и факторы роста. Было описано применение белковых каркасов в комбинации с антигенсвязывающими фрагментами, например Müller et al., J Biol Chem, 282:12650–12660 (2007); McDonaugh et al., Mol Cancer Ther, 11:582–593 (2012); Vallera et al., Clin Cancer Res, 11:3879–3888 (2005); Song et al., Biotech Appl Biochem, 45:147–154 (2006) и публикации заявки на патент № US 2009/0285816.
[0081] Например, было показано, что слияние антигенсвязывающих фрагментов, таких как scFv, диател или одноцепочечных диател, с альбумином увеличивает период полувыведения из сыворотки данных антигенсвязывающих фрагментов (Müller et al., там же). Антигенсвязывающие фрагменты могут сливаться по N- и/или C-концу альбумина, необязательно посредством линкера.
[0082] Были описаны производные альбумина в форме гетеромультимеров, которые содержат два транспортерных полипептида, полученных сегментацией белка-альбумина, так что транспортерные полипептиды самостоятельно собираются с образованием квазинативного альбумина (см. международные публикации патентных заявок № WO 2012/116453 и WO 2014/012082). В результате сегментации альбумина гетеромультимер содержит четыре конца и, таким образом, может сливаться с до четырьмя различными антигенсвязывающими фрагментами, необязательно посредством линкеров.
[0083] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать белковый каркас. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на иммуноглобулиновой Fc-области, альбумине или аналоге или производном альбумина. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на иммуноглобулиновой Fc-области, например Fc-области IgG.
[0084] В некоторых вариантах осуществления анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на альбумине, например человеческом сывороточном альбумине (HSA) или аналоге или производном альбумина. В некоторых вариантах осуществления анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на производном альбумина, описанном в международной публикации патентной заявки № WO 2012/116453 или WO 2014/012082.
Fc-области
[0085] Термины «Fc-область», «Fc» или «Fc-домен», используемые в данном документе, относятся к C-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Этот термин включает нативную последовательность Fc-областей и варианты Fc-областей. Если в данном документе не указано иное, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, также называемой EU-индексом, описанной у Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).
[0086] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела могут содержать каркас, которые основан на иммуноглобулиновой Fc-области. В некоторых вариантах осуществления изобретения Fc-область может быть димерной и состоять из двух полипептидов Fc. В некоторых вариантах осуществления Fc-область может состоять из единственного полипептида.
[0087] «Полипептид Fc» из димерного Fc, относится к одному из двух полипептидов, образующих димерный Fc-домен, т. е. полипептид, содержащий одну или более C-концевых константных областей тяжелой цепи иммуноглобулина, которая способна к стабильной самостоятельной ассоциации. Термин «первый полипептид Fc» и «второй полипептид Fc» может применяться взаимозаменяемо при условии, что Fc-область содержит один первый полипептид Fc и один второй полипептид Fc.
[0088] Fc-область содержит домен CH3 или оба домена CH3 и CH2. Например, полипептид Fc димерной Fc-области IgG содержит последовательность константных доменов CH2 IgG и CH3 IgG. Домен CH3 содержит две последовательности CH3, по одной из каждого из двух полипептидов Fc димерной Fc-области. Домен CH2 содержит две последовательности CH2, по одной из каждого из двух полипептидов Fc димерной Fc-области.
[0089] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на Fc-области IgG. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на Fc-области человека. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на человека, например Fc-области IgG1 человека.
[0090] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на Fc-области IgG, которая представляет собой гетеродимерную Fc-область, содержащую первый полипептид Fc и второй полипептид Fc, каждый содержащий последовательность CH3, и необязательно последовательность CH2.
[0091] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на Fc-области, которая содержит первый и второй полипептиды Fc, и первая антигенсвязывающая полипептидная конструкция функционально связана с первым полипептидом Fc, а вторая антигенсвязывающая полипептидная конструкция функционально связана со вторым полипептидом Fc.
[0092] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на Fc-области, которая содержит первый и второй полипептиды Fc, в котором первая антигенсвязывающая полипептидная конструкция функционально связана с первым полипептидом Fc, а вторая антигенсвязывающая полипептидная конструкция функционально связана со вторым полипептидом Fc, и в котором первая и вторая антигенсвязывающая полипептидная конструкции независимо представляют собой Fab-фрагмент или scFv.
[0093] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на Fc-области, которая содержит две последовательности CH3, по меньшей мере одна из которых содержит одну или более аминокислотных модификаций. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может содержать каркас, основанный на Fc-области, которая содержит две последовательности CH3 и две последовательности CH2, по меньшей мере одна из последовательностей CH2 содержит одну или более аминокислотных модификаций.
[0094] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело содержит гетеродимерную Fc-область, содержащую модифицированный домен CH3, причем модифицированный домен CH3 представляет собой асимметрично модифицированный домен CH3. В целом, первый полипептид Fc содержит первую последовательность CH3, а второй полипептид Fc содержит вторую последовательность CH3.
[0095] Используемый в данном документе термин «асимметрическая аминокислотная модификация» относится к модификации, при которой аминокислота в конкретном положении на первой последовательности CH3 отличается от аминокислоты на второй последовательности CH3 в таком же положении. Для последовательностей CH3, содержащих асимметричные аминокислотные модификации, первая и вторая последовательности CH3 будут, как правило, предпочтительно спариваться с образованием гетеродимера, а не гомодимера. Эти асимметричные аминокислотные модификации могут возникать в результате модификации только одной из двух аминокислот в том же соответствующем аминокислотном положении на каждой последовательности, или же различные модификации обеих аминокислот на каждой последовательности в том же соответствующем положении на каждой из первой и второй последовательностях CH3. Каждая из первой и второй последовательности CH3 гетеродимерного Fc могут содержать одну или более, а не одну асимметричную аминокислотную модификацию.
[0096] В некоторых вариантах осуществления анти-HER2 бипаратопное антитело может содержать белковый каркас, который основан на модифицированной Fc-области, описанной в международной публикации патентной заявки № WO 2012/058768 или WO 2013/063702.
[0097] В таблице 1 предложена аминокислотная последовательность из последовательности Fc IgG1 человека (SEQ ID NO:1), соответствующая аминокислотам от 231 до 447 полноразмерной тяжелой цепи IgG1 человека. Последовательность CH3 содержит аминокислоты 341–447 полноразмерной тяжелой цепи IgG1 человека.
[0098] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, содержащий модифицированный домен CH3, который содержит асимметричную аминокислотную модификацию, которая способствует образованию гетеродимерного Fc, а не гомодимерного Fc. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, который содержит модификации в одном или более из следующих положений: L351, F405, Y407, T366, K392, T394, T350, S400 и/или N390, с использованием нумерации EU.
[0099] В некоторых вариантах осуществления анти-HER2 бипаратопное антитело содержит гетеродимерный Fc, включающий модифицированный домен CH3 с первой полипептидной последовательностью, которая содержит аминокислотные модификации в положениях F405 и Y407, и необязательно дополнительно содержит аминокислотную модификацию в положении L351, и второй полипептидной последовательностью, которая содержит аминокислотные модификации в положениях T366 и T394, и необязательно дополнительно содержит аминокислотную модификацию в положении K392. В некоторых вариантах осуществления первая полипептидная последовательность модифицированного домена CH3 содержит аминокислотные модификации в положениях F405 и Y407, и необязательно дополнительно содержит аминокислотную модификацию в положении L351, а вторая полипептидная последовательность модифицированного домена CH3 содержит аминокислотные модификации в положениях T366 и T394, и необязательно дополнительно содержит аминокислотную модификацию в положении K392, и аминокислотная модификация в положении F405 представляет собой F405A, F405I, F405M, F405S, F405T или F405V; аминокислотная модификация в положении Y407 представляет собой Y407I или Y407V; аминокислотная модификация в положении T366 представляет собой T366I, T366L или T366M; аминокислотная модификация в положении T394 представляет собой T394W; аминокислотная модификация в положении L351 представляет собой L351Y и аминокислотная модификация в положении K392 представляет собой K392F, K392L или K392M. В некоторых вариантах осуществления изобретения аминокислотная модификация в положении F405 представляет собой F405A, F405S, F405T или F405V.
[00100] В некоторых вариантах осуществления анти-HER2 бипаратопное антитело может содержать гетеромерный Fc, включающий модифицированный домен CH3, имеющий первую полипептидную последовательность Fc, содержащую аминокислотные модификации в положениях F405 и Y407, и необязательно дополнительно содержит аминокислотную модификацию в положении L351, а вторая полипептидная последовательность Fc содержит аминокислотные модификации в положениях T366 и T394, и необязательно дополнительно содержит аминокислотную модификацию в положении K392, и аминокислотная модификация в положении F405 представляет собой F405A, F405I, F405M, F405S, F405T или F405V; аминокислотная модификация в положении Y407 представляет собой Y407I или Y407V; аминокислотная модификация в положении T366 представляет собой T366I, T366L или T366M; аминокислотная модификация в положении T394 представляет собой T394W; аминокислотная модификация в положении L351 представляет собой L351Y, и аминокислотная модификация в положении K392 представляет собой K392F, K392L или K392M, и одна или обе из первой и второй полипептидных последовательностей Fc содержат аминокислотную модификацию T350V. В некоторых вариантах осуществления изобретения аминокислотная модификация в положении F405 представляет собой F405A, F405S, F405T или F405V.
[00101] В некоторых вариантах осуществления анти-HER2 бипаратопное антитело содержит гетеродимерный Fc, включающий модифицированный домен CH3, описанный выше, в котором первая полипептидная последовательность Fc содержит аминокислотные модификации в положениях F405 и Y407, и необязательно дополнительно содержит аминокислотную модификацию в положении L351, а вторая полипептидная последовательность Fc содержит аминокислотные модификации в положениях T366 и T394, и необязательно дополнительно содержит аминокислотную модификацию в положении K392, и в котором первая полипептидная последовательность Fc дополнительно содержит аминокислотную модификацию в одном или обоих положениях S400 или Q347, и/или вторая полипептидная последовательность Fc дополнительно содержит аминокислотную модификацию в одном или обоих положениях K360 или N390, причем аминокислотная модификация в положении S400 представляет собой S400E, S400D, S400R или S400K; аминокислотная модификация в положении Q347 представляет собой Q347R, Q347E или Q347K; аминокислотная модификация в положении K360 представляет собой K360D или K360E, и аминокислотная модификация в положении N390 представляет собой N390R, N390K или N390D. В некоторых вариантах осуществления изобретения аминокислотная модификация в положении F405 представляет собой F405A, F405S, F405T или F405V.
[00102] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, имеющий модифицированный домен CH3, содержащий модификации любого одного из вариант 1, вариант 2, вариант 3, вариант 4 или вариант 5, показанных в таблице 1.
Таблице 1. Последовательности Fc IgG1
(SEQ ID NO: 1)
[00103] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, имеющий модифицированный домен CH3 с первой последовательностью CH3, содержащей одну или более аминокислотных модификаций, выбранных из L351Y, F405A, и Y407V, и второй последовательностью CH3, содержащей аминокислотные модификации T366L или T366I; K392L или K392M, и T394W, и одна или две из первой и второй последовательностей CH3 могут необязательно дополнительно включать в себя аминокислотную модификацию T350V.
[00104] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, имеющий модифицированный домен CH3, содержащий асимметричные аминокислотные модификации, описанные выше, которые способствуют образованию гетеродимерного Fc, в котором гетеродимерный домен CH3 обладает стабильностью, которая сравнимая с гомодимерным доменом CH3 дикого типа. Стабильность домена CH3 можно оценивать путем измерения температуры плавления (Tm) домена CH3, например методом дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах осуществления одна или более асимметричных аминокислотных модификаций способствуют образованию гетеродимерного домена Fc, в котором домен CH3 обладает стабильностью, наблюдаемой посредством температуры плавления (Tm) в исследовании дифференциальной сканирующей калориметрии, значение которой находится в пределах около 8 oC, например в пределах около 7oC, около 6oC, около 5oC или около 4 °C, от температуры, наблюдаемой для соответствующего симметричного гомодимерного домена CH3 дикого типа.
[00105] В некоторых вариантах осуществления гетеродимерный Fc, содержащий модифицированные последовательности CH3, может образовываться в экспрессированном продукте с чистотой по меньшей мере около 75% по сравнению с гомодимерным Fc. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя гетеродимерный каркас Fc, имеющий модифицированный домен CH3, включающий асимметричные аминокислотные модификации, которые способствуют образованию гетеродимерного Fc с чистотой более около 80%, более около 85%, более около 90%, более около 95% или более около 97%.
[00106] Дополнительные способы модификации мономерных полипептидов Fc для облегчения образования гетеродимерных Fc хорошо известны в данной области и включают, например, описанные в международной публикации патентной заявки № WO 96/027011 (технология «выступы в углубления»), Gunasekaran et al. J Biol Chem, 285, 19637–46 (2010) (разработка электростатической структуры для достижения избирательной гетеродимеризации); Davis et al., Prot Eng Des Sel, 23(4):195-202 (2010) (технология обмена цепей сконструированного домена (SEED)) и Labrijn et al., Proc Natl Acad Sci USA, 110(13):5145-50 (2013) (обмен Fab-плечей).
[00107] В некоторых вариантах осуществления изобретения, в которых анти-HER2 бипаратопное антитело содержит гетеродимерный Fc-каркас, гетеродимер Fc также содержит домен CH2. В некоторых вариантах осуществления изобретения домен CH2 представляет собой модифицированный домен CH2. Один пример домена CH2 из Fc представляет собой аминокислоты 231–340 последовательности, показанной в таблице 1. Fc-рецепторами (FcR), которые связывают Fc антитела, опосредуются несколько эффекторных функций.
[00108] Fc-рецепторы (FcR) включают в себя рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативные сплайсинговые формы этих рецепторов. В некоторых вариантах осуществления изобретения термин FcR может также включать неонатальный рецептор, FcRn.
[00109] Модификации в домене CH2 могут влиять на связывание FcR с Fc. В данной области известен ряд аминокислотных модификаций в Fc-области для избирательного изменения аффинности Fc для различных Fcγ-рецепторов. В некоторых вариантах осуществления изобретения, в которых анти-HER2 бипаратопное антитело содержит гетеродимерный каркас Fc с модифицированным доменом CH2, модифицированный домен CH2 может включать в себя одну или более модификаций для облегчения селективного связывания Fcγ-рецепторов.
[00110] Неограничивающие примеры модификации, которые изменяют связывание Fc рецепторами FcR, включают S298A/E333A/K334A и S298A/E333A/K334A/K326A (Lu, et al., J Immunol Methods, 365(1-2):132-41 (2011)); F243L/R292P/Y300L/V305I/P396L and F243L/R292P/Y300L/L235V/P396L (Stavenhagen, et al., Cancer Res, 67(18):8882–90 (2007) и Nordstrom JL, et al., Breast Cancer Res, 13(6):R123 (2011)); F243L (Stewart, et al., Protein Eng Des Sel. 24(9):671–8 (2011)); S298A/E333A/K334A (Shields, et al., J Biol Chem, 276(9):6591–604 (2001)); S239D/I332E/A330L и S239D/I332E (Lazar, et al., Proc Natl Acad Sci USA, 103(11):4005–10 (2006)); S239D/S267E и S267E/L328F (Chu, et al., Mol Immunol, 45(15):3926–33 (2008)). Дополнительные модификации, которые влияют на связывание Fc рецепторами FcR, описаны в Therapeutic Antibody Engineering (Strohl & Strohl, Woodhead Publishing series в Biomedicine No 11, ISBN 1 907568 37 9, Oct 2012, page 283). Fc-области, содержащие асимметричные модификации, которые влияют на связывание рецепторами FcR, описаны в международной публикации патента № WO 2014/190441.
[00111] Дополнительные изменения могут быть внесены в Fc-области с целью улучшения их способности опосредовать эффекторную функцию. Такие модификации известны в данной области техники и включают афукозилирование или конструирование аффинности Fc в направлении активации рецептора, в основном FcγRIIIa в отношении АЗКЦ, и в направлении C1q в отношении КЗЦ. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя Fc-область, модифицированную для улучшения способности опосредовать эффекторную функцию.
[00112] Способы продуцирования антител с низким содержанием или без фукозы на сайте гликозилирования Fc (Asn 297, нумерация EU) с изменением аминокислотной последовательности являются хорошо известными в данной области техники. Например, технология GlymaX® (ProBioGen AG) (см. von Horsten et al., Glycobiology, 20(12):1607–18 (2010) и патент США № 8,409,572). В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя Fc-область, которая является агликозилированной. В этом контексте анти-HER2 бипаратопное антитело может быть полностью афукозилировано (т. е. оно не содержит выявляемой фукозы) или они может быть частично афукозилировано, так что анти-HER2 бипаратопное антитело содержит менее 95%, менее 85%, менее 75%, менее 65%, менее 55%, менее 45%, менее 35%, менее 25%, менее 15% или менее 5%, или любое количество в этих пределах фукозы, обычно выявляемого количества для сходной конструкции, продуцируемой экспрессионной системой млекопитающих.
[00113] Модификации Fc, снижающие связывание FcγR и/или комплемента, и/или эффекторную функцию, известны в данной области техники и включают описанные выше. В различных публикациях описаны стратегии, использованные для конструирования антител со сниженной или заглушенной эффекторной активностью (см., например, Strohl, Curr Opin Biotech 20:685–691 (2009), и Strohl & Strohl, “Antibody Fc engineering for optimal antibody performance” в Therapeutic Antibody Engineering, Cambridge: Woodhead Publishing (2012), pp 225–249). Эти стратегии включают снижение эффекторной функции посредством модификации гликозилирования, используя каркасы IgG2/IgG4 или введение мутаций в шарнир или области CH2 Fc (см. также публикацию патента США № 2011/0212087, международную публикацию патента № WO 2006/105338, публикацию патента США № 2012/0225058, публикацию патента США № 2012/0251531 и Strop et al., J. Mol. 420: 204-219 (2012)).
[00114] Конкретные неограничивающие примеры известных аминокислотных модификаций для снижения связывания FcγR или комплемента с Fc включают представленные в таблице 2.
Таблица 2. Модификации для снижения связывания FcγR или комплемента с Fc
[00115] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя Fc-область, которая содержит модифицированный домен CH2 с одной или более мутациями, идентифицированными в таблице 2. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя Fc-область, содержащую модифицированный домен CH2, имеющий аминокислотные модификации в положениях L234, L235 и/или D265. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело может включать в себя Fc-область, содержащую модифицированный домен CH2 с аминокислотными модификациями L234A, L235A и D265S.
Эпитопы HER2
[00116] Две антигенсвязывающие полипептидные конструкции, составленные анти-HER2 бипаратопным антителом, каждая связывается с отличающимся эпитопом HER2, а именно, первая антигенсвязывающая полипептидная конструкция связывается с первым эпитопом HER2, а вторая антигенсвязывающая полипептидная конструкция связывается со вторым эпитопом HER2. В контексте настоящего описания каждая из антигенсвязывающих полипептидных конструкций специфически связывается со своим целевым эпитопом.
[00117] Фраза «специфически связывает» или «специфически связывающий» означает, что связывание селективно для антигена и может быть отделено от нежелательных или не специфических взаимодействий. Способность антигенсвязывающей полипептидной конструкции к связыванию со специфическим эпитопом могут измерять, например, посредством твердофазного иммуноферментного анализа (ELISA), методик поверхностного плазмонного резонанса (SPR) (анализы на приборе BIAcore) (Liljeblad et al, Glyco J 17, 323–329 (2000)) или традиционного анализа связывания (Heeley, Endocr Res 28, 217–229 (2002)). В некоторых вариантах осуществления изобретения считается, что антигенсвязывающая полипептидная конструкция специфически связывается со своим целевым эпитопом, когда степень связывания антигенсвязывающей полипептидной конструкции с нерелевантным белком составляет менее около 10% связывания антигенсвязывающей полипептидной конструкции со своим целевым эпитопом, как измерено, например, методом SPR.
[00118] «HER2» (также известный как ErbB2) относится к белку HER2 человека, описанному, например, в Semba et al., PNAS (USA), 82:6497-6501 (1985) и Yamamoto et al., Nature, 319:230–234 (1986) (учетный номер X03363 Genbank). Термин «erbB2» и «neu» к гену, кодирующему белок HER2 человека. Термин p185 или p185neu также может применяться по отношению к белковому продукту гена neu.
[00119] HER2 содержит внеклеточный домен, который, как правило, связывает лиганд HER, липофильный трансмембранный домен, консервативный внутриклеточный тирозинкиназный домен и карбоксильно-концевой домен передачи сигнала, содержащий несколько тирозиновых остатков, которые могут фосфорилироваться. Внеклеточный домен (ecto) HER2 содержит четыре домена, домены I–IV. Последовательность HER2 представлена в таблице 3 (SEQ ID NO:2). Границы внеклеточного домена (ECD) следующие: домен I — приблизительно аминокислоты 1–165; домен II — приблизительно аминокислоты 166–322; домен III — приблизительно аминокислоты 323–488, и домен IV — приблизительно аминокислоты 489–607.
Таблица 3. Аминокислотная последовательность HER2 человека (SEQ ID NO:2)
61 YVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNGDPLNNTTPVTGASPGGLRELQL
121 RSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLALTLIDTNRSRACHPCSPMCKGS
181 RCWGESSEDCQSLTRTVCAGGCARCKGPLPTDCCHEQCAAGCTGPKHSDCLACLHFNHSG
241 ICELHCPALVTYNTDTFESMPNPEGRYTFGASCVTACPYNYLSTDVGSCTLVCPLHNQEV
301 TAEDGTQRCEKCSKPCARVCYGLGMEHLREVRAVTSANIQEFAGCKKIFGSLAFLPESFD
361 GDPASNTAPLQPEQLQVFETLEEITGYLYISAWPDSLPDLSVFQNLQVIRGRILHNGAYS
421 LTLQGLGISWLGLRSLRELGSGLALIHHNTHLCFVHTVPWDQLFRNPHQALLHTANRPED
481 ECVGEGLACHQLCARGHCWGPGPTQCVNCSQFLRGQECVEECRVLQGLPREYVNARHCLP
541 CHPECQPQNGSVTCFGPEADQCVACAHYKDPPFCVARCPSGVKPDLSYMPIWKFPDEEGA
601 CQPCPIN
[00120] «Эпитоп 2C4» представляет собой область во внеклеточном домене HER2, с которым связывается антитело 2C4 и содержит остатки из домена II во внеклеточном домене HER2 (также называемом ECD2). 2C4 и пертузумаб связываются с внеклеточным доменом HER2 у соединения доменов I, II и III (Franklin et al. Cancer Cell 5:317–328 (2004)).
[00121] «Эпитоп 4D5» представляет собой область во внеклеточном домене HER2 с которой связываются антитело 4D5 (ATCC CRL 10463) и трастузумаб. Этот эпитоп расположен рядом с трансмембранным доменом HER2 и находится в пределах домена IV HER2 (также называемого ECD4).
[00122] В целом, анти-HER2 бипаратопное антитело по настоящему описанию будет связываться с эпитопами в пределах внеклеточных доменов HER2. В некоторых вариантах осуществления изобретения первый и второй эпитопы HER2, связанные первой и второй антигенсвязывающими полипептидными конструкциями анти-HER2 бипаратопного антитела являются неперекрывающимися эпитопами. В некоторых вариантах осуществления изобретения первый и второй эпитопы HER2, связанные первой и второй антигенсвязывающими полипептидными конструкциями анти-HER2 бипаратопного антитела являются различными внеклеточными доменами HER2. В некоторых вариантах осуществления изобретения первая антигенсвязывающая полипептидная конструкция анти-HER2 бипаратопного антитела связывается с первым эпитопом HER2 на первом домене HER2, и вторая антигенсвязывающая полипептидная конструкция связывается со вторым эпитопом HER2 на втором домене HER2. В некоторых вариантах осуществления изобретения первый домен HER2 представляет собой ECD2 и второй домен HER2 представляет собой ECD4.
[00123] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, конкурирует с трастузумабом за связывание с HER2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, конкурирует с пертузумабом за связывание с HER2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, конкурирует с трастузумабом за связывание с HER2, и другая антигенсвязывающая полипептидная конструкция конкурирует с пертузумабом за связывание с HER2.
[00124] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, представлена в формате Fab или scFv и конкурирует с трастузумабом за связывание с HER2, и другая антигенсвязывающая полипептидная конструкция представлена в формате Fab или scFv и конкурирует с пертузумабом за связывание с HER2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, представлена в формате Fab и конкурирует с трастузумабом за связывание с HER2, и другая антигенсвязывающая полипептидная конструкция представлена в формате scFv и конкурирует с пертузумабом за связывание с HER2.
[00125] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, связывается с тем же эпитопом на HER2, что и трастузумаб. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, связывается с тем же эпитопом на HER2, что и пертузумаб. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, связывается с тем же эпитопом на HER2, что и трастузумаб, и другая антигенсвязывающая полипептидная конструкция связывается с тем же эпитопом на HER2, что и пертузумаб.
[00126] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций, содержащаяся в анти-HER2 бипаратопном антителе, содержит последовательности CDR трастузумаба или их вариант, включающие одну или более мутаций, которые, как известно, увеличивают связывание HER2, и другая антигенсвязывающая полипептидная конструкция содержит CDR пертузумаба или их вариант, включающие одну или более мутаций, которые, как известно, увеличивают связывание HER2. Известные в литературе мутации, которые усиливают связывание HER2 трастузумабом или пертузумабом, включать в себя описанные ниже в таблицах 4 и 5 (HC = тяжелая цепь; LC = легкая цепь). Подразумеваются также комбинации этих мутаций.
Таблица 4. Мутации в трастузумабе, увеличивающие связывание с HER2
Таблица 5. Мутации в пертузумабе, увеличивающие связывание с HER2
[00127] Различные анти-HER2 бипаратопные антитела известны в данной области техники, и они могут быть подходящими потенциальными антителами для включения в ADC, описанные в данном документе. Примеры включают антитела, описанные в публикациях заявок на патент США № 2014/0170148; 2015/0284463; 2016/0289335; 2017/0029529; 2017/0291955 и 2018/0022820, и международной публикации патентной заявки № WO 2016/179707.
[00128] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело представляет собой одно из бипаратопных антител, описанных в публикации заявки на патент США № 2016/0289335. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело представляет собой одно из v5019, v5020, v7091, v10000, v6902, v6903 или v6717 (см. таблицы 6, 6A и 6B, и таблицы с последовательностями). В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH и последовательность VL из ECD2-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH и последовательность VL из ECD2-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, и другая антигенсвязывающая полипептидная конструкция содержит последовательность VH и последовательность VL из ECD4-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717.
[00129] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательности CDR из ECD2-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательности CDR из ECD2-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, и другая антигенсвязывающая полипептидная конструкция содержит последовательности CDR из ECD4-связывающего плеча одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717.
[00130] Специалист в данной области поймет, что может вводиться ограниченное количество аминокислотных замен в последовательности CDR или в последовательности VH или VL известных антител без того, чтобы антитело теряло свою способность связывать свою мишень. Потенциальные аминокислотные замены могут идентифицировать с помощью компьютерного моделирования или известными методами, такими как аланиновое сканирование, при этом полученные варианты проверяются на активность связывания с помощью стандартных методик. Соответственно, в некоторых вариантах осуществления одна из антигенсвязывающих полипептидных конструкциях анти-HER2 бипаратопного антитела содержит набор CDR (т. е. CDR1, CDR2 и CDR3 тяжелой цепи, и CDR1, CDR2 и CDR3 легкой цепи), который обладает 90% или более, 95% или более, 98% или более, 99% или более, или 100% идентичностью последовательностей с набором CDR из ECD2-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем эта антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит вариант этих последовательностей CDR, содержащий от 1 до 10 аминокислотных замен среди шести CDR (т. е. CDR могут быть модифицированы путем включения до 10 аминокислотных замен, при этом может быть модифицирована любая комбинация CDR), например от 1 до 7 аминокислотных замен, от 1 до 5 аминокислотных замен, от 1 до 4 аминокислотных замен, от 1 до 3 аминокислотных замен, от 1 до 2 аминокислотных замен или 1 аминокислотная замена среди CDR, причем вариант сохраняет способность связывать ECD2. Как правило, такие аминокислотные замены будут консервативными аминокислотными заменами. Соответственно, в некоторых вариантах осуществления одна из антигенсвязывающих полипептидных конструкциях анти-HER2 бипаратопного антитела содержит набор CDR (т. е. CDR1, CDR2 и CDR3 тяжелой цепи, и CDR1, CDR2 и CDR3 легкой цепи), который обладает 90% или более, 95% или более, 98% или более, 99% или более, или 100% идентичностью последовательностей с набором CDR из ECD2-связывающего плеча из антитела v10000, причем эта антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2.
[00131] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VH из ECD2-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VL, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VL из ECD2-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2.
[00132] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VH из ECD2-связывающего плеча из антитела v10000, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VL, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VL из ECD2-связывающего плеча из антитела v10000, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD2.
[00133] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкциях анти-HER2 бипаратопного антитела содержит набор CDR (т. е. CDR1, CDR2 и CDR3 тяжелой цепи, и CDR1, CDR2 и CDR3 легкой цепи), который обладает 90% или более, 95% или более, 98% или более, 99% или более, или 100% идентичностью последовательностей с набором CDR из ECD4-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем эта антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит вариант этих последовательностей CDR, содержащий от 1 до 10 аминокислотных замен среди шести CDR (т. е. CDR могут быть модифицированы путем включения до 10 аминокислотных замен, при этом может быть модифицирована любая комбинация CDR), например от 1 до 7 аминокислотных замен, от 1 до 5 аминокислотных замен, от 1 до 4 аминокислотных замен, от 1 до 3 аминокислотных замен, от 1 до 2 аминокислотных замен или 1 аминокислотная замена среди CDR, причем вариант сохраняет способность связывать ECD4. Как правило, такие аминокислотные замены будут консервативными аминокислотными заменами. Соответственно, в некоторых вариантах осуществления одна из антигенсвязывающих полипептидных конструкциях анти-HER2 бипаратопного антитела содержит набор CDR (т. е. CDR1, CDR2 и CDR3 тяжелой цепи, и CDR1, CDR2 и CDR3 легкой цепи), который обладает 90% или более, 95% или более, 98% или более, 99% или более, или 100% идентичностью последовательностей с набором CDR из ECD4-связывающего плеча из антитела v10000, причем эта антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4.
[00134] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VH из ECD4-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VL, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VL из ECD4-связывающего плеча из одного из антител v5019, v5020, v7091, v10000, v6902, v6903 или v6717, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4.
[00135] В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VH из ECD4-связывающего плеча из антитела v10000, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VL, которая является на по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичной последовательности VL из ECD4-связывающего плеча из антитела v10000, причем антигенсвязывающая полипептидная конструкция сохраняет способность к связыванию ECD4.
Таблица 6. Примеры анти-HER2 бипаратопных антител
LC: Y96A
LC: Q124R
LC: Q124E_Q160E_T180E
LC: Q124R_Q1160K_T178R
LC: Q124E_Q160E_T180E
* Нумерация Fab или вариабельного домена в соответствии с Кабатом (Kabat et al., Sequences of proteins of immunological interest, 5th Edition, US Department of Health and Human Services, NIH Publication No. 91–3242, p.647, 1991)
§ Нумерация CH3 в соответствии с индексом EU, как по Кабату (Edelman et al., 1969, PNAS USA, 63:78–85)
Таблица 6A. Последовательности CDR ECD2-связывающего плеча вариантов v5019, v5020, v7091, v10000, v6902, v6903 и v6717
Таблица 6B. Последовательности CDR ECD4-связывающего плеча вариантов v5019, v5020, v7091, v10000, v6902, v6903 и v6717
[00136] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело представляет собой одно из бипаратопных антител, описанных в международной публикации патентной заявки № WO 2016/179707. В данной заявке описываются высокоаффинные варианты анти-HER2 антитела пертузумаб, включая бипаратопные антитела, содержащие последовательности из высокоаффинного варианта как один антигенсвязывающий домен. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело представляет собой одно из v7133, v15079, v15080, v15081, v15082, v15083, v15084 или v15085 (см. таблицы 7 и 7A, и таблицы последовательностей). В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH и последовательность VL из ECD2-связывающего плеча одного из антител v7133, v15079, v15080, v15081, v15082, v15083, v15084 или v15085. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательности CDR из ECD2-связывающего плеча одного из антител v7133, v15079, v15080, v15081, v15082, v15083, v15084 или v15085. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательность VH и последовательность VL из ECD2-связывающего плеча одного из антител v7133, v15079, v15080, v15081, v15082, v15083, v15084 или v15085, и другая антигенсвязывающая полипептидная конструкция содержит последовательность VH и последовательность VL из трастузумаба. В некоторых вариантах осуществления изобретения одна из антигенсвязывающих полипептидных конструкций анти-HER2 бипаратопного антитела содержит последовательности CDR из ECD2-связывающего плеча одного из антител v7133, v15079, v15080, v15081, v15082, v15083, v15084 или v15085, и другая антигенсвязывающая полипептидная конструкция содержит последовательности CDR из трастузумаба.
Таблица 7. Дополнительные примеры анти-HER2 бипаратопных антител
LC: Y96A
LC: Y49W_Y96G
LC: Y49W_Y96G
LC: Y49W_Y96G
LC: Y49W
LC: Y49W_Y96G
* Нумерация Fab или вариабельного домена в соответствии с Кабатом (Kabat et al., Sequences of proteins of immunological interest, 5th Edition, US Department of Health and Human Services, NIH Publication No. 91–3242, p.647, 1991)
§ Нумерация CH3 в соответствии с индексом EU, как по Кабату (Edelman et al., 1969, PNAS USA, 63:78–85)
Таблица 7A. Последовательности CDR ECD2-связывающего плеча вариантов v7133, v15079, v15080, v15081, v15082, v15083, v15084 и v15085
15080
Свойства анти-HER2 бипаратопных антител
[00137] Конъюгация токсина при низком DAR имеет особое преимущество для анти-HER2 бипаратопных антител, которые проявляют повышенное связывание с HER2 и/или более высокую интернализацию в HER2-экспрессирующих клетках по сравнению с соответствующим бивалентным моноспецифическим антителом. Соответствующие бивалентные моноспецифические антитела могут включать в себя две из первых антигенсвязывающей полипептидных конструкций, или две из вторых антигенсвязывающих полипептидных конструкций, которые составляют бипаратопное антитело.
[00138] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела проявляют повышенное связывание (т. е. связываются с более высокой аффинностью) с HER2 по сравнению с соответствующим бивалентным моноспецифическим антителом. Повышенное связывание может проявляться, например, путем уменьшения в константе диссоциации и/или увеличения в максимальном связывании.
[00139] Константа диссоциации (KD) относится к равновесной константе диссоциации конкретного взаимодействия лиганд-белок, такого как взаимодействия антитела-антигена. Значение KD измеряет способность двух белков (например, AB) обратимо диссоциировать на меньшие компоненты (A+B), и определяется как соотношение скорости диссоциации (также называемой «off-rate» или koff) к скорости ассоциации (также называемой «on-rate» или kon). Таким образом, значение KD равняется koff/kon и выражается как молярная концентрация (M). Из этого следует, что чем меньше значение KD, тем больше аффинность связывания. Значения KD для антител могут определять с использованием методов, хорошо обоснованных в данной области техники. Примеры таких методов включают поверхностный плазмонный резонанс (SPR), обычно применяющий биосенсорную систему, такую как систему Biacore®, и изотермическую титрационную калориметрию (ITC).
[00140] Кажущая KD, или кажущаяся равновесная константа диссоциации, представляет концентрацию антитела, при которой наблюдается половинное максимальное связывание клеток. Кажущаяся KD является зависимым от условий эксперимента по связыванию клеток, таких как различные уровни рецептора, экспрессируемого на клетках, и условий инкубации, и поэтому кажущаяся KD, в целом, отличается от значений KD, определяемых в бесклеточных молекулярных экспериментах, таких как SPR и ITC. Тем не менее, обычно существует хорошее согласование между различными методами.
[00141] Максимальный уровень связывания (или «Bmax») относится к максимальному уровню связывания антитела в клетках при насыщающих концентрациях антитела. Этот параметр может регистрироваться в произвольных единицах МИФ для относительных сравнений или преобразовываться в абсолютное значение, соответствующее количеству антител, связанных с клеткой с использованием стандартной кривой.
[00142] Bmax или кажущуюся KD могут определять различными методиками. Один пример представляет собой измерение связывания с клетками, экспрессирующими целевой антиген, методом проточной цитометрии. Как правило, в таком эксперименте клетки, экспрессирующие целевые антигены, инкубируют с антителами при различных концентрациях, промывают, инкубируют со вторичным агентом для обнаружения антитела, промывают и анализируют в проточном цитометре для измерения медианной интенсивности флуоресценции (МИФ), представляющей собой силу сигнала детекции на клетках, которая, в свою очередь, связана с количеством антител, связанных с клетками. Зависимость концентрации антител по сравнению с Затем подбирают данные МИФ под уравнение насыщающего связывания для получения значения Bmax и кажущейся KD.
[00143] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело демонстрирует увеличение по Bmax по отношению к клетке-мишени, отображающей HER2, по сравнению с соответствующим эталонным антителом. Для анти-HER2 бипаратопного антитела, содержащего первую антигенсвязывающую полипептидную конструкцию и вторую антигенсвязывающую полипептидную конструкцию, описанные в данном документе, соответствующее эталонное антитело должно быть бивалентным моноспецифическим антителом, которое содержит две из первых антигенсвязывающих полипептидных конструкций или две из вторых антигенсвязывающих полипептидных конструкций. В некоторых вариантах осуществления изобретения значение Bmax, определенное для анти-HER2 бипаратопного антитела, составляет по меньшей мере около 110% значения Bmax соответствующего эталонного антитела. В некоторых вариантах осуществления изобретения значение Bmax, определенное для анти-HER2 бипаратопного антитела, составляет по меньшей мере около 125% значения Bmax соответствующего эталонного антитела, например по меньшей мере около 150% значения Bmax соответствующего эталонного антитела, или по меньшей мере около 200% значения Bmax соответствующего эталонного антитела.
[00144] В некоторых вариантах осуществления изобретения значение Bmax, определенное для анти-HER2 бипаратопного антитела, составляет по меньшей мере 1,1; 1,2; 1,3; 1,4; 1,5; 1,6; 1,7; 1,8; 1,9 или 2,0 значения Bmax соответствующего эталонного антитела.
[00145] В некоторых вариантах осуществления изобретения анти-HER2 бипаратопные антитела проявляют более высокую интернализацию внутрь экспрессирующих HER2 клеток, чем соответствующее эталонное бивалентное моноспецифическое антитело. Анти-HER2 бипаратопные антитела интернализируются в HER2+ клетки посредством связывания с рецептором HER2. Анти-HER2 бипаратопные антитела, таким образом, могут считаться способными индуцировать рецепторную интернализацию в HER2+ клетки.
[00146] Интернализацию антител могут измерять с использованием известных в данной области техники методов, например путем метода прямой интернализации в соответствии с протоколом, подробно описанным в Schmidt, M. et al., Cancer Immunol Immunother, 57:1879–1890 (2008). Как известно в данной области техники, раковые клетки могут экспрессировать HER2 на различных уровнях. Одним методом классификации экспрессирующих HER2 клеток являются обозначения HER2 1+, 2+ или 3+ (низкая, средняя и высокая экспрессия, соответственно). В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело проявляет более высокую интернализацию, чем соответствующее эталонное бивалентное моноспецифическое антитело, в экспрессирующие HER2 на уровне 3+ клетки. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело проявляет более высокую интернализацию, чем соответствующее эталонное бивалентное моноспецифическое антитело, в экспрессирующие HER2 на уровне 2+ клетки. В некоторых вариантах осуществления изобретения анти-HER2 бипаратопное антитело проявляет более высокую интернализацию, чем соответствующее эталонное бивалентное моноспецифическое антитело, в экспрессирующие HER2 на уровне 1+ клетки. Примеры клеточных линий, экспрессирующих различные уровни HER2, описаны более подробно ниже.
[00147] В контексте настоящего описания считается, что анти-HER2 бипаратопное антитело демонстрирует более высокую интернализацию в HER2-экспрессирующие клетки, чем соответствующее эталонное бивалентное моноспецифическое антитело, когда количество анти-HER2 бипаратопного антитела, интернализированного в HER2-экспрессирующие клетки, оказывается по меньшей мере в 1,2 раза больше, чем количество эталонного бивалентного моноспецифического антитела, интернализированного в те же самые HER2-экспрессирующие клетки. В некоторых вариантах осуществления изобретения количество интернализированного антитела определяют методом прямой интернализации в соответствии с протоколом, подробно описанным в Schmidt, M. et al., Cancer Immunol Immunother, 57:1879–1890 (2008). В некоторых вариантах осуществления изобретения количество интернализированного антитела определяют в HER2-экспрессирующих клетках, которые экспрессируют HER2 на уровне 2+.
[00148] В некоторых вариантах осуществления изобретения считается, что анти-HER2 бипаратопное антитело демонстрирует более высокую интернализацию в HER2-экспрессирующие клетки, чем соответствующее эталонное бивалентное моноспецифическое антитело, когда количество анти-HER2 бипаратопного антитела, интернализированного в HER2-экспрессирующие клетки, оказывается по меньшей мере в 1,3 раза больше, чем количество эталонного бивалентного моноспецифического антитела, интернализированного в те же самые HER2-экспрессирующие клетки. В некоторых вариантах осуществления изобретения считается, что анти-HER2 бипаратопное антитело демонстрирует более высокую интернализацию в HER2-экспрессирующие клетки, чем соответствующее эталонное бивалентное моноспецифическое антитело, когда количество анти-HER2 бипаратопного антитела, интернализированного в HER2-экспрессирующие клетки, оказывается по меньшей мере в 1,4 раза больше, например по меньшей мере в 1,5 раз больше, по меньшей мере в 1,6 раз больше, по меньшей мере в 1,7 раз больше, по меньшей мере в 1,8 раз больше, по меньшей мере в 1,9 раз больше или по меньшей мере в 2,0 раз больше, чем количество эталонного бивалентного моноспецифического антитела, интернализированного в те же самые HER2-экспрессирующие клетки. В некоторых вариантах осуществления изобретения количество интернализированного антитела определяют методом прямой интернализации в соответствии с протоколом, подробно описанным в Schmidt, M. et al., Cancer Immunol Immunother, 57:1879–1890 (2008). В некоторых вариантах осуществления изобретения количество интернализированного антитела определяют в HER2-экспрессирующих клетках, которые экспрессируют HER2 на уровне 2+.
Аналоги ауристатина
[00149] Описанные в данном документе ADC включают в себя токсин на основе ауристатина (или «аналог ауристатина»). Различные аналоги ауристатина хорошо известны в данной области техники. Примеры включают, но не ограничиваются ими, монометилауристатин F (MMAF), монометилауристатин E (MMAE), ауристатин EB (AEB), ауристатин EVB (AEVB) и ауристатин F фенилендиамин (AFP). Синтез и структура различных ауристатиновых аналогов описаны в патентах США № 6,884,869; 7,098,308; 7,256,257 и 7,498,298.
[00150] В некоторых вариантах осуществления изобретения аналог ауристатина, включенный в ADC, описанные в данном документе, может представлять собой аналог ауристатина, описанный в международной публикации патентной заявки № WO 2016/041082. В некоторых вариантах осуществления изобретения аналог ауристатина, который содержат ADC, описанные в данном документе, представляет собой соединение общей формулы (I):

(I)
где:
X представляет собой -C(O)NHCH(CH2R2)-, или X отсутствует;
R1 выбран из:
 и
и  , и
, и
R2 представляет собой фенил.
[00151] В некоторых вариантах осуществления изобретения в соединениях общей формулы (I), R1 выбран из:
 и
и  .
.
[00152] В некоторых вариантах осуществления изобретения в соединениях общей формулы (I) отсутствует X.
[00153] В некоторых вариантах осуществления изобретения соединение общей формулы (I) представлено общей формулой(IV):
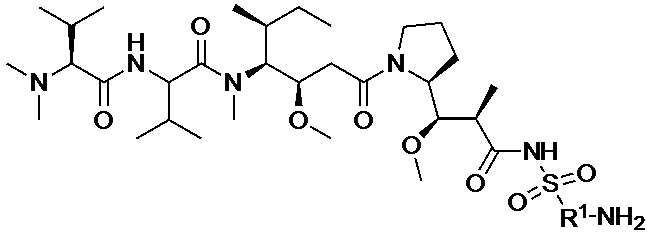
(IV)
где R1 является таким, как определено для общей формулы (I).
[00154] В некоторых вариантах осуществления изобретения в соединениях формулы (IV), R1 выбран из:
 и
и  .
.
[00155] В некоторых вариантах осуществления изобретения в соединениях формулы (IV), R1 представляет собой:
 или
или  .
.
[00156] В некоторых вариантах осуществления изобретения в соединениях формулы (IV), R1 представляет собой:
 .
.
[00157] В некоторых вариантах осуществления изобретения соединение общей формулы (I) представлено общей формулой(V):
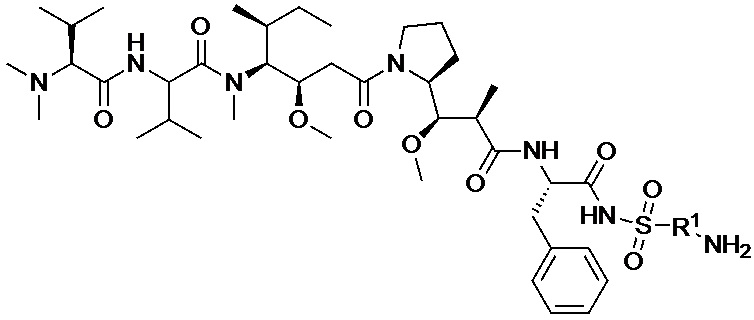
(V)
где R1 является таким, как определено для общей формулы (I).
[00158] В некоторых вариантах осуществления изобретения в соединениях формулы (V), R1 выбран из:
 и
и  .
.
[00159] В некоторых вариантах осуществления изобретения в соединениях формулы (V), R1 представляет собой:
 или
или  .
.
[00160] В некоторых вариантах осуществления изобретения в соединениях формулы (V), R1 представляет собой:
 .
.
[00161] Соединения общей формулы (I) могут получать по протоколам стандартного синтеза органической химии из коммерчески доступных исходных веществ. Типовые способы предложены в международной публикации патентной заявки № WO 2016/041082 и в ниже в разделе примеров.
[00162] Должно быть понятно, что ссылка на соединения общей формулы (I) во всей остальной части этого описания включает, в различных вариантах осуществления, соединения общей формулы (IV) и (V), в той же степени, как если бы варианты осуществления, упоминающие каждую из этих формул отдельно, цитировались специально.
[00163] В некоторых вариантах осуществления изобретения ADC по настоящему описанию содержит анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина (токсин) посредством линкера (L), в котором линкер-токсин имеет общую формулу (II):

(II)
где:
X представляет собой -C(O)NHCH(CH2R2)-, или X отсутствует;
R1 выбран из:
 и
и  ;
;
R2 представляет собой фенил;
L представляет собой линкер, и
 представляет точку присоединения линкер-токсина к анти-HER2 бипаратопному антителу.
представляет точку присоединения линкер-токсина к анти-HER2 бипаратопному антителу.
[00164] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (II), R1 выбран из:
 и
и  .
.
[00165] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (II) отсутствует X.
[00166] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (II) L представляет собой расщепляемый линкер.
[00167] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (II) L представляет собой пептид-содержащий линкер.
[00168] В некоторых вариантах осуществления изобретения линкер-токсин общей формулы (II) представлено общей формулой(X):

(X)
где R1, L и  являются такими, как определено выше для общей формулы (II).
являются такими, как определено выше для общей формулы (II).
[00169] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (X), R1 выбран из:
 и
и  .
.
[00170] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (X), R1 представляет собой:
 или
или  .
.
[00171] В некоторых вариантах осуществления изобретения в соединениях формулы (X), R1 представляет собой:
 .
.
[00172] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (X) L представляет собой расщепляемый линкер.
[00173] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (X) L представляет собой пептид-содержащий линкер.
[00174] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (X) L представляет собой протеазорасщепляемый линкер.
[00175] В некоторых вариантах осуществления изобретения линкер-токсин общей формулы (II) представлено общей формулой(XI):
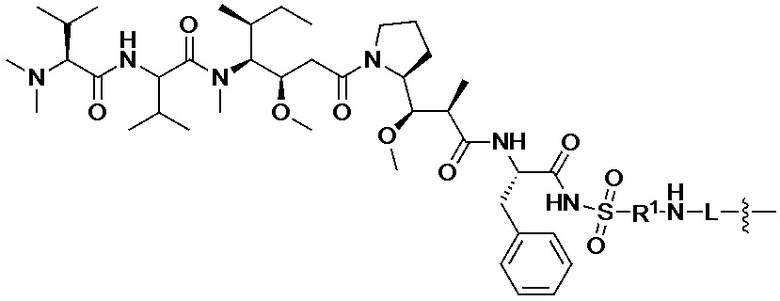
(XI)
где R1, L и  являются такими, как определено выше для общей формулы (II).
являются такими, как определено выше для общей формулы (II).
[00176] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI), R1 выбран из:
 и
и  .
.
[00177] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI), R1 представляет собой:
 или
или  .
.
[00178] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI), R1 представляет собой:
 .
.
[00179] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI) L представляет собой расщепляемый линкер.
[00180] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI) L представляет собой пептид-содержащий линкер.
[00181] В некоторых вариантах осуществления изобретения в линкер-токсине общей формулы (XI) L представляет собой протеазорасщепляемый линкер.
[00182] В данном документе также подразумеваются ADC, содержащие анти-HER2 бипаратопное антитело, конъюгированное с линкер-токсином общей формулы (II), формулы (X) или формулы (XI), в которых линкер имеет общую формулу (VIII) или (IX), как показано ниже.
[00183] В некоторых вариантах осуществления изобретения ADC содержит линкер-токсин со структурой:
 ,
,
где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу.
[00184] В некоторых вариантах осуществления изобретения ADC по настоящему описанию, содержащее анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина (токсин) посредством линкера (L), имеет общую формулу (III):

(III)
где X и R1 являются такими, как определено для общей формулы (II);
L представляет собой линкер;
n представляет собой среднее соотношение лекарственное вещество-к-антителу (DAR), и оно составляет менее 3,9; и
Ab представляет собой анти-HER2 бипаратопное антитело.
[00185] В некоторых вариантах осуществления изобретения в ADC общей формулы (III), R1 выбран из:
 и
и  .
.
[00186] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) отсутствует X.
[00187] В некоторых вариантах осуществления изобретения в ADC общей формулы (III), R1 представляет собой:
 или
или  , и
, и
отсутствует X.
[00188] В некоторых вариантах осуществления изобретения в ADC общей формулы (III), R1 представляет собой:
 , и
, и
отсутствует X.
[00189] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) X представляет собой -C(O)NHCH(CH2R2)-.
[00190] В некоторых вариантах осуществления изобретения в ADC общей формулы (III), R1 представляет собой:
 или
или  , и
, и
X представляет собой -C(O)NHCH(CH2R2)-.
[00191] В некоторых вариантах осуществления изобретения в ADC общей формулы (III), R1 представляет собой:
 , и
, и
X представляет собой -C(O)NHCH(CH2R2)-.
[00192] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) L представляет собой расщепляемый линкер.
[00193] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) L представляет собой пептид-содержащий линкер.
[00194] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) L представляет собой протеазорасщепляемый линкер.
[00195] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 0,5 до 3,8.
[00196] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 0,7 до 3,8; от 0,7 до 3,5; от 0,7 до 3,0 или от 0,7 до 2,5.
[00197] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 1,0 до 3,8; от 1,0 до 3,5; от 1,0 до 3,0 или от 1,0 до 2,5.
[00198] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 1,5 до 3,8; от 1,5 до 3,5; от 1,5 до 3,0 или от 1,5 до 2,5.
[00199] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 1,6 до 3,8; от 1,6 до 3,5; от 1,6 до 3,0 или от 1,6 до 2,5.
[00200] В некоторых вариантах осуществления изобретения в ADC общей формулы (III) значение n составляет от 1,8 до 2,8 или от 1,8 до 2,5.
[00201] Подразумеваются также комбинации любого из предыдущих вариантов осуществления для соединений общей формулы (III), и каждая комбинация образует отдельный вариант для целей настоящего раскрытия.
Линкеры
[00202] В описанных в данном документе ADC анти-HER2 бипаратопное антитело связано линкером с аналогом ауристатина (токсин). Линкеры являются бифункциональными или мультифункциональными фрагментами, способными связывать одну или более молекул токсина с антителом. Линкер может быть бифункциональным (или моновалентным), так что он связывает одно лекарственное вещество с одним сайтом на антителе, или он может быть мультифункциональным (или поливалентным), так что он связывает более одной молекулы токсина с одним сайтом на антителе. Линкеры, способные связать одну молекулу токсина с более чем одним сайтом на антителе, также могут считаться мультифункциональными.
[00203] Присоединение линкера с антителом могут выполнять различными путями, такими как посредством поверхностных лизинов на антителе, восстановительного сочетания с окисленными углеводами на антителе, или посредством цистеиновых остатков на антителе, освобожденных с помощью восстановления межцепных дисульфидных связей. В альтернативном варианте для обеспечения сайт-специфической конъюгации присоединение линкера к антителу могут достигать модификацией антитела таким образом, чтобы включать дополнительные цистеиновые остатки (см., например, патенты США № 7,521,541; 8,455,622 и 9,000,130) или не встречающиеся в природе аминокислоты, которые предоставляют реакционноспособные группы прикрепления, такие как селенометионин, п-ацетилфенилаланин, формилглицин или п-азидометил-L-фенилаланин (см., например, Hofer et al., Biochemistry, 48:12047–12057 (2009); Axup et al., PNAS, 109:16101–16106 (2012); Wu et al., PNAS, 106:3000–3005 (2009); Zimmerman et al., Bioconj. Chem., 25:351–361 (2014)).
[00204] Линкеры включают в себя функциональную группу, способную взаимодействовать с целевой группой или группой на антителе, и одну или более функциональных групп, способных взаимодействовать с целевой группой на токсине. Подходящие функциональные группы известны в данной области техники и включают те, которые описаны, например, в Bioconjugate Techniques (G.T. Hermanson, 2013, Academic Press).
[00205] К неограничивающим примерам функциональных групп для взаимодействия со свободными цистеинами или тиолами относятся малеимид, галогенацетамид, галогенацетил, активированные сложные эфиры, такие как сукцинимидные сложные эфиры, 4-нитрофенильные сложные эфиры, пентафторфенильные сложные эфиры, тетрафторфенильные сложные эфиры, ангидриды, хлорангидриды кислот, сульфонилхлориды, изоцианаты и изотиоцианаты. В этом контексте также подходящими являются «самостабилизирующие» малеимиды, описанные в Lyon et al., Nat. Biotechnol., 32:1059–1062 (2014).
[00206] К неограничивающим примерам функциональных групп для взаимодействия с поверхностными лизинами на антителе и свободными аминами на токсине, относятся активированные сложные эфиры, такие как N-гидроксисукцинамидные сложные эфиры (NHS), сульфо-NHS сложные эфиры, имидные сложные эфиры, такие как реагент Траута, изотиоцианаты, альдегиды и ангидриды кислот, такие как ангидрид диэтиленетриаминпентауксусной кислоты (DTPA). Другие примеры включают в себя сукцинимидо-1,1,3,3-тетра-метилурония тетрафторбората (TSTU) и бензотриазол-1-ил-окситрипирролидинофосфония гексафторфосфат (PyBOP).
[00207] Неограничивающие примеры функциональных групп, способных взаимодействовать с электрофильной группой на антителе или токсине (такой как, альдегидная или кетон-карбонильная группа), включают в себя гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид.
[00208] Другие линкеры включают в себя те, которые имеют функциональную группу, позволяющую соединять два межцепных цистеина на антителе, такую как линкер ThioBridgeTM (Badescu et al., Bioconjug. Chem., 25:1124–1136 (2014)), дитиомалеимидный (DTM) линкер (Behrens et al., Mol. Pharm., 12:3986–3998 (2015)), линкер на основе дитиоарил(TCEP)пиридазиндиона (Lee et al., Chem. Sci., 7:799-802 (2016)), линкер на основе дибромпиридазиндион (Maruani et al., Nat. Commun., 6:6645 (2015)) и другие известные в данной области техники линкеры.
[00209] Линкер может содержать один или более линкерных компонентов. Как правило, линкер будет содержать два или более линкерных компонентов. Примеры линкерных компонентов включают функциональные группы для проведения реакции с антителом, функциональными группами для проведения реакции с токсином, удлиняющими вставками, пептидными компонентами, саморасщепляющимися группами, само-удаляющимися группами, гидрофильными фрагментами и т. п. Различные линкерные компоненты известны в данной области техники, некоторые из них описаны ниже.
[00210] Определенные подходящие линкерные компоненты могут получать у различных коммерческих поставщиков, таких как Pierce Biotechnology, Inc. (сейчас Thermo Fisher Scientific, г. Уолтем, штат Массачусетс, США) и Molecular Biosciences Inc. (г. Боулдер, штат Колорадо, США) или могут синтезировать в соответствии с процедурами, описанными в данной области техники (см., например, Toki et al., J. Org. Chem., 67:1866–1872 (2002); Dubowchik, et al., Tetrahedron Letters, 38:5257–60 (1997); Walker, M. A., J. Org. Chem., 60:5352–5355 (1995); Frisch, et al., Bioconjugate Chem., 7:180–186 (1996); патент США № 6,214,345 и 7,553,816, и международную публикацию патентной заявки № WO 02/088172).
[00211] Примеры линкерных компонентов включают, но не ограничиваются ими, N-(β-малеимидпропилокси)-N-гидрокси сукцинимидный сложный эфир (BMPS), N-(ε-малеимидкапроилокси) сукцинимидный сложный эфир (EMCS), N-[γ-малеимидбутирилокси]сукцинимидный сложный эфир (GMBS), 1,6-гесан-бис-винилсульфон (HBVS), сукцинимидил 4-(N-малеимидметил)циклогексан-1-карбокси-(6-амидокапроат) (LC-SMCC), м-малеимидбензоил-N-гидроксисукцинимидный сложный эфир (MBS), гидразид 4-(4-N-малеимидфенил)масляной кислоты (MPBH), сукцинимидил 3-(бромацетамидо)пропионат (SBAP), сукцинимидил йодацетат (SIA), сукцинимидил (4-йодацетил)аминобензоат (STAB), N-сукцинимидил-3-(2-пиридилдитио) пропионат (SPDP), N-сукцинимидил-4-(2-пиридилдитио)пентаноат (SPP), сукцинимидил 4-(N-малеимидметил)циклогексан-1-карбоксилат (SMCC), сукцинимидил 4-(п-малеимидфенил)бутират (SMPB), сукцинимидил 6-[(β-малеимидпропионамидо)гексаноат] (SMPH), иминотиолан (IT), сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и сукцинимидил-(4-винилсульфон)бензоат (SVSB).
[00212] Дополнительные примеры включают такие бис-малеимидные реагенты, как дитиобисмалеимидэтан (DTME), бис-малеимид-триоксиэтилен гликоль (BMPEO), 1,4-бисмалеимидбутан (BMB), 1,4-бисмалеимидил-2,3-дигидроксибутан (BMDB), бисмалеимидгексан (BMH), бисмалеимидэтан (BMOE), BM(PEG)2 и BM(PEG)3; бифункциональные производные сложных имидоэфиров (например, диметил адипимидат HCl), активные сложные эфиры (например, дисукцинимидил суберат), альдегиды (например, глутаральдегид), бис-азидные соединения (например, бис-(п-азидобензоил) гександиамин), бис-диазониевые производные (например, бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (например, толуол-2,6-диизоцианат) и бис-активные фтор-соединения (например, 1,5-дифтор-2,4-динитробензол).
[00213] Подходящие линкеры, как правило, более химически устойчивые в условиях за пределами клетки, чем к условиям внутри клетки, хотя в определенных ситуациях могут предусматривать менее устойчивые линкеры, например когда токсин является селективным или нацеленным и имеет низкую токсичность к нормальным клеткам. Линкеры могут представлять собой «расщепляемые линкеры» или «нерасщепляемые линкеры». Расщепляемый линкер, как правило, чувствительный к расщеплению во внутриклеточных условиях, например посредством лизосомных процессов. Примеры включают линкеры, которые являются протеазочувствительными, кислоточувствительными, чувствительными к восстанавливающим условиях или фотолабильными. Нерасщепляемые линкеры, наоборот, рассчитаны на разрушение антитела в клетке, которое, как правило, приводит к высвобождению фрагмента аминокислота-линкер-токсин.
[00214] Подходящие расщепляемые линкеры включают, например, линкеры, содержащие пептидный компонент, который содержит две или более аминокислот, и является расщепляемым внутриклеточной протеазой, такой как лизосомная протеаза или эндосомная протеаза. Пептидный компонент может включать в себя аминокислотные остатки, которые встречаются естественным образом и/или минорные аминокислоты и/или не встречающиеся в природе аналоги аминокислот, такие как цитруллин. Пептидные компоненты могут конструировать и оптимизировать для ферментативного расщепления конкретным ферментом, например опухоле-ассоциированной протеазой, катепсином B, C или D, или плазминовой протеазой.
[00215] В некоторых вариантах осуществления изобретения линкер, включенный в состав ADC, может представлять собой дипептид-содержащий линкер, такой как линкер, содержащий валин-цитруллин (Val-Cit) или фенилаланин-лизин (Phe-Lys). Другие примеры подходящих дипептидов для включения в линкеры охватывают Val-Lys, Ala-Lys, Me-Val-Cit, Phe-homoLys, Phe-Cit, Leu-Cit, Ile-Cit, Trp-Cit, Phe-Arg, Ala-Phe, Val-Ala, Met-Lys, Asn-Lys, Ile-Pro, Ile-Val, Asp-Val, His-Val, Met-(D)Lys, Asn-(D)Lys, Val-(D)Asp, NorVal-(D)Asp, Ala-(D)Asp, Me3Lys-Pro, фенилGly-(D)Lys, Met-(D)Lys, Asn-(D)Lys, Pro-(D)Lys и Met-(D)Lys. Расщепляемые линкеры также могут включать в себя более длинные пептидные компоненты, такие как трипептиды, тетрапептиды или пентапептиды. Примеры охватывают, но не ограничиваются ими, трипептиды Met-Cit-Val, Gly-Cit-Val, (D)Phe-Phe-Lys и (D)Ala-Phe-Lys, и тетрапептиды Gly-Phe-Leu-Gly и Ala-Leu-Ala-Leu.
[00216] Дополнительные примеры расщепляемых линкеров включают дисульфид-содержащие линкеры, такие как, например, N-сукцинимидил-4-(2-пиридилдитио) бутаноат (SPBD) и N-сукцинимидил-4-(2-пиридилдитио)-2-сульфо бутаноат (сульфо-SPBD). Дисульфид-содержащие линкеры могут необязательно содержать дополнительные группы для обеспечения стерического препятствия рядом с дисульфидной связью с целью улучшить внеклеточную устойчивость линкера, например включением геминальной диметильной группы. Другие подходящие линкеры включают линкеры, гидролизируемые при специфическом значении pH или в пределах некоторого диапазона pH, такие как гидразоновые линкеры. Могут также использоваться линкеры, содержащие комбинации этих функциональных групп, например в данной области техники известны линкеры, содержащие как гидразон, так и дисульфид.
[00217] Дополнительный пример расщепляемого линкера представляет собой линкер, содержащий β-глюкуронид, который является расщепляемым β-глюкуронидазой, находящимся в лизосомах и промежуточной ткани опухолей (см., например, De Graaf et al., Curr. Pharm. Des., 8:1391–1403 (2002)).
[00218] Расщепляемые линкеры необязательно могут дополнительно включать в себя один или более дополнительных компонентов, таких как саморасщепляющиеся и само-удаляющиеся группы, удлиняющие вставки или гидрофильные фрагменты.
[00219] Саморасщепляющиеся и само-удаляющиеся группы, которые находят применение в линкерах включают в себя, например, группы п-аминобензилоксикарбонила (PABC) и п-аминобензильного простого эфира (PABE), и метилированный этилендиамин (MED). Другие примеры саморасщепляющихся групп включают, но не ограничиваются ими, ароматические соединения, которые по электронной конфигурации являются сходными с группами PABC или PABE, такие как гетероциклические производные, например производные 2-аминоимидазол-5-метанола, описанные в патенте США № 7,375,078. Другие примеры включают группы, которые подвергаются циклизации при гидролизе амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., Chemistry Biology, 2:223–227 (1995)) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al., J. Org. Chem., 55:5867–5877 (1990)).
[00220] Удлиняющие вставки, которые могут находить применение в линкерах для ADC, включают в себя, например, алкиленовые группы и удлиняющие вставки на основе алифатических кислот, дикислот, аминов или диаминов, таких как дигликолят, малонат, капроат и капроамид. Другие удлиняющие вставки включают, например, удлиняющие вставки на основе глицина, полиэтиленгликольные (PEG) удлиняющие вставки и монометоксиполиэтиленгликольные (mPEG) удлиняющие вставки. PEG и mPEG удлиняющие вставки также функционируют как гидрофильные фрагменты.
[00221] Примеры компонентов, обычно помещаемых в расщепляемые линкеры, которые могут находить применение в ADC по настоящему описанию, в некоторых вариантах осуществления изобретения включают в себя, но не ограничиваются ими, SPBD, сульфо-SPBD, гидразон, Val-Cit, малеидкапроил (MC или mc), mc-Val-Cit, mc-Val-Cit-PABC, Phe-Lys, mc-Phe-Lys, mc-Phe-Lys-PABC, малеидтриэтиленгликолят (MT), MT-Val-Cit, MT-Phe-Lys и адипат (AD).
[00222] В некоторых вариантах осуществления изобретения линкеры, включенные в состав ADC по настоящему описанию, представляют собой линкеры на основе пептидов с общей формулой (VI):

(VI)
где:
Z представляет собой функциональную группу, способную взаимодействовать с целевой группой на антителе;
Str представляет собой удлиняющую вставку;
AA1 и AA2 каждый независимо представляет собой аминокислоту, причем AA1-[AA2]m образует сайт расщепления протеазой;
X представляет собой саморасщепляющуюся группу;
D представляет собой точку присоединения к аналогу ауристатина;
s равно 0 или 1;
m представляет собой целое число от 1 до 4, и
o равно 0, 1 или 2.
[00223] В некоторых вариантах осуществления изобретения в общей формуле (VI) Z представляет собой:
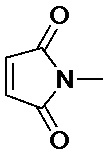 .
.
[00224] В некоторых вариантах осуществления изобретения в общей формуле (VI) Str выбран из:
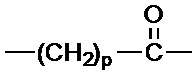 ;
; 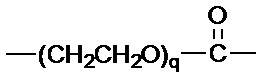 ;
; 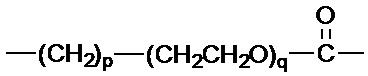 ;
;
 ;
; 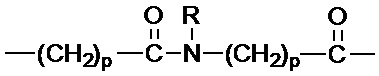 и
и 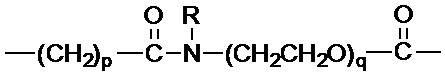 ,
,
где:
R представляет собой Н или (C1–C6)алкил;
p представляет собой целое число от 2 до 10; и
q представляет собой целое число от 1 до 10.
[00225] В некоторых вариантах осуществления изобретения в общей формуле (VI) Str представляет собой:
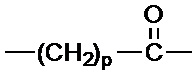 ,
, 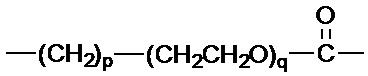 или
или  ,
,
где p и q такие, как определено выше.
[00226] В некоторых вариантах осуществления изобретения в общей формуле (VI) Str представляет собой:
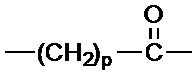 или
или  ,
,
где p представляет собой целое число от 2 до 6, и
q представляет собой целое число от 2 до 8.
[00227] В некоторых вариантах осуществления изобретения в общей формуле (VI), AA1-[AA2]m выбран из Val-Lys, Ala-Lys, Phe-Lys, Val-Cit, Phe-Cit, Leu-Cit, Ile-Cit, Trp-Cit, Phe-Arg, Ala-Phe, Val-Ala, Met-Lys, Asn-Lys, Ile-Pro, Ile-Val, Asp-Val, His-Val, Met-(D)Lys, Asn-(D)Lys, Val-(D)Asp, NorVal-(D)Asp, Ala-(D)Asp, Me3Lys-Pro, фенилGly-(D)Lys, Met-(D)Lys, Asn-(D)Lys, Pro-(D)Lys, Met-(D)Lys, Met-Cit-Val, Gly-Cit-Val, (D)Phe-Phe-Lys, (D)Ala-Phe-Lys, Gly-Phe-Leu-Gly и Ala-Leu-Ala-Leu.
[00228] В некоторых вариантах осуществления изобретения в общей формуле (VI) m равно 1 (т. е. AA1-[AA2]m является дипептидом).
[00229] В некоторых вариантах осуществления изобретения в общей формуле (VI), AA1-[AA2]m является дипептидом, выбранным из Val-Lys, Ala-Lys, Phe-Lys, Val-Cit, Phe-Cit, Leu-Cit, Ile-Cit и Trp-Cit.
[00230] В некоторых вариантах осуществления изобретения в общей формуле (VI) каждый X независимо выбран из п-аминобензилоксикарбонила (PABC), п-аминобензильного сложного эфира (PABE) и метилированного этилендиамина (MED).
[00231] В некоторых вариантах осуществления изобретения в общей формуле (VI) m равно 1, 2 или 3.
[00232] В некоторых вариантах осуществления изобретения в общей формуле (VI) s равно 1.
[00233] В некоторых вариантах осуществления изобретения в общей формуле (VI) o равно 0.
[00234] В некоторых вариантах осуществления изобретения в общей формуле (VI):
Z представляет собой 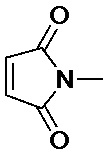 ;
;
Str представляет собой 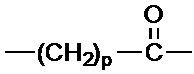 или
или  , где p является целым числом от 2 и 6, и Q представляет собой целое число от 2 до 8;
, где p является целым числом от 2 и 6, и Q представляет собой целое число от 2 до 8;
m равно 1 и AA1-[AA2]m является дипептидом, выбранным из Val-Lys, Ala-Lys, Phe-Lys, Val-Cit, Phe-Cit, Leu-Cit, Ile-Cit и Trp-Cit;
s равно 1, и
o равно 0.
[00235] В некоторых вариантах осуществления линкер представляет собой дисульфид-содержащий линкер и ADC имеет общую формулу (VII):
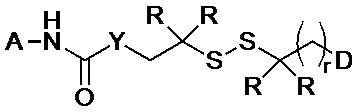
(VII)
где:
A представляет собой антитело;
D представляет собой аналог ауристатина;
Y представляет собой –(CH2)p- или –(CH2CH2O)q-, где p и q каждый независимо является целым числом от 1 до 10;
каждый R независимо представляет собой Н или (C1–C6)алкил;
r равно 1, 2 или 3; и
где 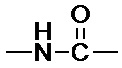 представляет собой амидную связь, образованную между линкером и ε-аминогруппой поверхностного лизина на антителе.
представляет собой амидную связь, образованную между линкером и ε-аминогруппой поверхностного лизина на антителе.
[00236] В некоторых вариантах осуществления изобретения в общей формуле (VII), p и q каждый независимо представляет собой целое число от 1 до 4.
[00237] В некоторых вариантах осуществления изобретения в общей формуле (VII), Y представляет собой –(CH2)p-, и p является целым числом от 1 до 4.
[00238] В некоторых вариантах осуществления изобретения в общей формуле (VII) каждый R независимо представляет собой H или Me.
[00239] В некоторых вариантах осуществления изобретения в общей формуле (VII) r равно 1 или 2.
[00240] Различные нерасщепляемые линкеры хорошо известны в данной области техники для связывания лекарственных веществ с антителами, и их могут применять в ADC по настоящему описанию в некоторых вариантах осуществления. Примеры нерасщепляемых линкеров включают линкеры, содержащие фрагмент N-сукцинимидильного сложного эфира или N-сульфосукцинимидильного сложного эфира для взаимодействия с антителом, а также фрагмент на основе малеимида или галогенацетила для взаимодействия с токсином, или наоборот. Пример такого нерасщепляемого линкера основан на сульфосукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилате (сульфо-SMCC). Другие неограничивающие примеры таких линкеров включают основанные на N-сукцинимидил 4-(малеимидметил)циклогексанкарбоксилате (SMCC), N-сукцинимидил-4-(N-малеимидметил)-циклогексан-1-карбокси-(6-амидокапроате) («длинноцепочечный» SMCC или LC-SMCC), κ-малеимидундекановой кислоты N-сукцинимидильном сложном эфире (KMUA), γ-малеимидмасляной кислоты N-сукцинимидильном сложном эфире (GMBS), ε-малеимидкапроновой кислоты N-гидроксисукцинимидильном сложном эфире (EMCS), м-малеимидбензоил-N-гидроксисукцинимидильном сложном эфире (MBS), N-(α-малеимидацетокси)-сукцинимидном сложном эфире (AMAS), сукцинимидил-6-(β-малеимидпропионамидо)гексаноат (SMPH), N-сукцинимидил 4-(п-малеимидфенил)-бутират (SMPB) и N-(п-малеимидфенил)изоцианат (PMPI). Другие примеры включают те, которые содержат функциональную группу на основе галогенацетила, такую как N-сукцинимидил-4-(йодацетил)-аминобензоат (SIAB), N-сукцинимидил йодацетат (SIA), N-сукцинимидил бромацетат (SBA) и N-сукцинимидил 3-(бромацетамидо)пропионат (SBAP).
[00241] Другие примеры нерасщепляемых линкеров включают малеимидкарбоновые кислоты, такие как малеимидкапроил (MC).
[00242] Выбор подходящего линкера для данного ADC может быть легко получен специалистом, компетентным в данной области техники, и принимая во внимание соответствующие факторы, такие как сайт присоединения к антителу, любые структурные ограничения токсина и гидрофобности токсина (см., например, обзор в Nolting, Chapter 5, Antibody-Drug Conjugates: Methods in Molecular Biology, 2013, Ducry (Ed.), Springer).
[00243] В некоторых вариантах осуществления изобретения линкер, включенный в состав ADC по настоящему описанию, имеет общую формулу (VIII):
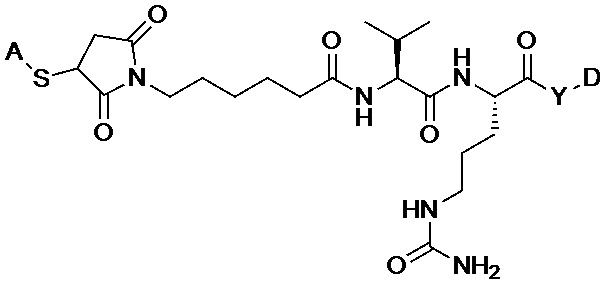
(VIII)
где:
A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу;
Y представляет собой один или более дополнительных линкерных компонентов, или отсутствует, и
D представляет собой точку присоединения к аналогу ауристатина.
[00244] В некоторых вариантах осуществления изобретения линкер, включенный в состав ADC по настоящему описанию, имеет общую формулу (IX):
(IX)
где:
A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу;
Y представляет собой один или более дополнительных линкерных компонентов, или отсутствует, и
D представляет собой точку присоединения к аналогу ауристатина.
Получение конъюгатов антител-лекарственных веществ
[00245] ADC по настоящему описанию могут получать одним из нескольких путей, известных в данной области техники, применяя реакции органической химии, условия и реагенты, известные специалистам в данной области техники (см., например, Bioconjugate Techniques (G.T. Hermanson, 2013, Academic Press, и предложенные в данном документе). Например, конъюгации можно достигать (1) реакцией нуклеофильной группы или электрофильной группы антитела с бифункциональным линкером с образованием промежуточного соединения антитело-линкер Ab-L посредством ковалентной связи, с последующей реакцией с активированным аналогом ауристатина (D), или (2) реакцией нуклеофильной группы или электрофильной группы аналога ауристатина с линкером с образованием линкер-токсина D-L посредством ковалентной связи, с последующей реакцией с нуклеофильной группой или электрофильной группой антитела. Методы конъюгации (1) и (2) могут применяться с различными антителами, аналогами ауристатина и линкерами для получения ADC, описанных в данном документе.
[00246] Как описано выше, для получения ADC могут конъюгировать аналоги ауристатина посредством соответствующего линкера с различными группами на антителе. Например, конъюгацию может осуществляться посредством поверхностных лизинов, посредством окисленных углеводов или посредством цистеиновых остатков, которые были высвобождены восстановлением одной или более межцепных дисульфидных связей. В альтернативном варианте антитело могут модифицировать для включения дополнительных цистеиновых остатков или не встречающихся в природе аминокислот, которые предоставляют реакционноспособные группы прикрепления, такие как селенометионин, п-ацетилфенилаланин, формилглицин или п-азидометил-L-фенилаланин. Такие модификации хорошо известны в данной области техники (см., например, патенты США № 7,521,541; 8,455,622 и 9,000,130; Hofer et al., Biochemistry, 48:12047–12057 (2009); Axup et al., PNAS, 109:16101–16106 (2012); Wu et al., PNAS, 106:3000–3005 (2009); Zimmerman et al., Bioconj. Chem, 25:351–361 (2014)).
[00247] В некоторых вариантах осуществления изобретения ADC по настоящему описанию содержат аналог ауристатина, конъюгированный посредством соответствующего линкера с цистеиновыми остатками, которые были высвобождены восстановлением одной или более межцепных дисульфидных связей.
[00248] В описанных в данном документе ADC анти-HER2 бипаратопное антитело конъюгировано с токсином посредством линкера при низком значении среднего соотношения лекарственное вещество-к-антителу (DAR), конкретно среднее DAR меньше 3,9, но больше 0,5; например, в некоторых вариантах осуществления, от около 1,5 до около 2,5.
[00249] В данной области техники известны различные способы получения ADC с низким значением среднего DAR (см., например, обзор McCombs and Owen, The AAPS Journal, 17(2):339–351 (2015) и ссылки в нем; Boutureira & Bernardes, Chem. Rev., 115:2174–2195 (2015)).
[00250] Например, для конъюгации с цистеиновыми остатками могут проводить частичное восстановление межцепных дисульфидных связей антитела с последующей конъюгацией с линкер-токсином. Частичного восстановления могут достигать ограничением количества восстановительного агента, применяемого в реакции восстановления (см., например, Lyon et al., Methods in Enzymology, 502:123–138 (2012) и примеры в ней, и предложенные в данном документе примеры). Подходящими восстановительными агентами являются известные в данной области техники вещества и включают, например, дитиотреитол (DTT), трис(2-карбоксиэтил)фосфин (TCEP), 2-меркаптоэтанол, цистеамин и ряд водорастворимых фосфинов. В альтернативном варианте или в дополнение, могут применяться меньшие эквиваленты линкер-токсина для получения низкого значения среднего DAR.
[00251] В альтернативном варианте, могут применять сконструированное антитело, в котором один или более цистеиновых остатков, которые образуют межцепные дисульфидные связи, заменяют сериновым остатком, что приводит к получению меньшего количества доступных для конъюгации цистеиновых остатков (см. McDonagh et al., Protein Eng. Des. Sel. PEDS, 19(7):299–307). Затем сконструированное антитело могут обрабатывать восстановительным агентом и конъюгировать с линкер-токсином.
[00252] Другой подход заключается в применении бис-тиольного линкера, который соединяет два цистеина, которые, в обычной ситуации, образуют межцепную дисульфидную связь. Использование бис-тиольного линкера, который несет только одну молекулу токсина, может создавать ADC с максимальным DAR4 для полноразмерного антитела, если все четыре межцепные дисульфидные связи восстановлены и замещены бис-тиольным линкером. Частичное восстановление межцепных дисульфидных связей и/или меньшие эквиваленты линкера могут применять в сочетании с бис-тиольным линкером с целью дополнительного уменьшения DAR. В данной области техники известны различные бис-тиольные линкеры (см., например, Badescu et al., Bioconjug. Chem., 25(6):1124–1136 (2014); Behrens et al., Mol. Pharm., 12:3986–3998 (2015); Lee et al., Chem. Sci., 7:799–802 (2016); Maruani et al., Nat. Commun., 6:6645 (2015)).
[00253] Подходы с цистеиновой инженерией также могут применять для создания ADC с низким значением среднего DAR. В таких подходах привлекают конструирование доступных для растворителя цистеинов в антителе с целью обеспечения сайт-специфической группы прикрепления для конъюгации. Для введения цистеинового остатка было выявлено ряд подходящих сайтов на структуре IgG, и они включают те, которые описаны в Junutula, et al., J. Immunol Methods, 332(1–2):41–52 (2008); Junutula, et al., Nat. Biotechnol., 26(8), 925–932 (2008), и патент США № 9,315,581; 9,000,130; 8,455,622; 8,507,654 и 7,521,541.
[00254] ADC с низкими значениями средних DAR также могут получать путем конъюгации лизина с использованием ограниченных количеств активированного линкер-токсина. Могут также применять селективную реакцию N-концевых аминокислот антитела.Например, N-концевой серин могут окислять до альдегида с помощью перйодата, затем проводить реакцию с линкер-токсином (см., например, Thompson, et al., Bioconjug. Chem., 26(10):2085-2096 (2015)). Сходным образом, N-концевые цистеиновые остатки могут селективно взаимодействовать с альдегидами с получением тиазолидонов (см., например, Bernardes, et al., Nature Protocols, 8:2079–2089).
[00255] Дополнительные подходы включают в себя конструирование антитела с включением одной или более не встречающихся в природе аминокислот, таких как п-ацетилфенилаланин (pAcPhe) или селеноцистеин (Sec). Кето-группа в pAcPhe может реагировать с линкер-токсином, содержащим концевой алкоксиамин или гидразид с образованием оксимной или гидразоновой связи (см., например, Axup, et al., PNAS USA, 109:16101–16106 (2012)). Sec-содержащие антитела могут взаимодействовать с содержащими малеимид- или йодацетамид линкер-токсины с образованием селеноэфирного конъюгата (см., например, Hofer, et al., Biochemistry, 48:12047–12057 (2009)).
[00256] Антитела также могут конструировать так, чтобы включать в себя пептидные маркеры, распознаваемые определенными ферментами для обеспечения фермент-катализируемой конъюгации. Например, сортаза-A (SortA) распознает последовательность LPXTG. Это пентапептид могут внедрять в N- или C-конец антитела для обеспечения SortA-опосредованной конъюгации (см., например, публикацию патентной заявки США № 2016/0136298; Kornberger and Skerra, mAbs, 6(2):354–366 (2014)). Трансглутаминазы также применяли для создания DAR2 ADC путем использования антител, которые были дегликолизированы в положении N297 (которое предоставляет Q295 для ферментативной конъюгации), или путем конструирования антител для включения «глутаминовой метки» (LLQG) (Jeger, et al., Angew. Chem., 49:9995–9997 (2010); Strop, et al., Chem. Biol., 20(2):161–167 (2013)). В другом подходе формилглициновый остаток могут вводить в антитело путем конструирования соответствующей консенсусной последовательности в антителе и коэкспрессии сконструированного антитела с формилглицин-образующим ферментом (FGE). Альдегидную функциональную группу введенного формилглицина затем можно использовать в качестве группы прикрепления для конъюгации токсина (см., например, Drake, et al., Bioconjug. Chem., 25(7):1331-1341 (2014)).
[00257] Другой подход, примененный для создания DAR2 ADC представляет собой конъюгацию линкер-токсина с нативными углеводами, находящимися на гликолизилированных антителах. Конъюгацию с гликозилированными антителами могут обеспечивать, например, окислением перйодатом концевых углеводных остатков с образованием альдегидов, которые затем могут конъюгироваться с соответствующим линкер-токсином, или путем гликоинжиниринговых подходов, в которых нативные углеводы модифицируют концевыми остатками сиаловых кислот, которые затем окисляют с образованием альдегидов для конъюгации с линкер-токсином (Zhou, et al., Bioconjug. Chem., 25(3):510-520 (2014)).
[00258] Сообщалось также о применении перекрестного связывания под действием УФ для конъюгации активных фрагментов с антителами. В этом методе используется нуклеотид-связывающий сайт (NBS) для сайт-специфической ковалентной функционализации антитела с помощью реакционноспособных тиольных фрагментов. Применяли конъюгированный вариант цистеина, индол-3-масляную кислоту (IBA), для сайт-специфического фотоперекрестного связывания реакционноспособного тиольного фрагмента с антителом в NBS. Затем тиольный фрагмент могут использовать для конъюгации линкер-токсина, содержащего тиольную реакционноспособную группу (Alves, et al., Bioconjug. Chem., 25(7):1198-1202 (2014)).
[00259] В альтернативном варианте, ADC с низким значением среднего DAR могут выделять из препарата ADC, содержащего смесь типов DAR с использованием методик хроматографического разделения, таких как хроматография гидрофобных взаимодействий (см., например, Hamblett, et al., Clin. Cancer Res., 10:7063-7070 (2004); Sun, et al., Bioconj Chem., 28:1371–81 (2017); публикация заявки на патент США № 2014/0286968).
[00260] Препараты ADC с низким значением среднего DAR также могут получать добавлением неконъюгированного (т. e. DAR0) антитела к препаратам ADC со средним DAR > 3,9. Как известно в данной области техники, большинство способов конъюгации дает препарат ADC, который включает в себя различные типы DAR, при этом указанное DAR является средним значением по отдельным типам DAR. В некоторых вариантах осуществления изобретения препараты ADC, которые содержат некоторую долю типов DAR0, могут обладать преимуществом. В некоторых вариантах осуществления изобретения препарат ADC со средним DAR менее 3,9 может включать по меньшей мере 5% типов DAR0. В некоторых вариантах осуществления изобретения препарат ADC может содержать по меньшей мере 10% типов DAR0, например по меньшей мере 15% типов DAR0 или по меньшей мере 20% типов DAR0. В некоторых вариантах осуществления изобретения препарат ADC может содержать от около 5% до около 50% типов DAR0. В некоторых вариантах осуществления изобретения препарат ADC может содержать от около 10% до около 50% типов DAR0, например от около 10% до около 40%, или от около 10% до около 30% типов DAR0.
[00261] Среднее DAR для ADC могут определять стандартными методиками, такими как УФ/ВС спектроскопический анализ, методики на основе ELISA, хроматографические методики, такие как хроматография гидрофобных взаимодействий (ХГВ), масс-спектрометрия (МС) UV-MALDI и МС MALDI-TOF. Кроме того, распределение форм со связанными лекарственными веществами (например, фракция типов DAR0, DAR1, DAR2 и т. д.) также могут анализировать различными методиками, известными в данной области техники, включая МС (в сопровождении стадии хроматографического разделения или без нее), хроматографию гидрофобных взаимодействий, обращенно-фазовой ВЭЖХ или гель-электрофорез с изоэлектрическим фокусированием (IEF) (см., например, Sun et al., Bioconj Chem., 28:1371–81 (2017); Wakankar et al., mAb, 3:161–172 (2011)).
[00262] В некоторых вариантах осуществления изобретения среднее DAR ADC определяют методиками хроматографии гидрофобных взаимодействий (ХГВ).
[00263] После конъюгации ADC могут очищать и отделять от неконъюгированных реагирующих веществ и/или любых конъюгатных агрегатов известными в данной области техники методами очистки. Такие методы включают, но не ограничиваются ими, эксклюзионную хроматографию (SEC), хроматографию гидрофобных взаимодействий (ХГВ), ионообменную хроматографию, хроматофокусирование, ультрафильтрацию, ультрафильтрацию на центрифуге и их комбинацию.
Тестирование
[00264] Противораковую активность ADC на HER2-экспрессирующих раковых клетках могут тестировать in vitro и/или in vivo с использованием стандартных методик.
[00265] Например, цитотоксическую активность ADC могут измерять, воздействуя на HER2-экспрессирующие раковые клетки с помощью ADC в среде для культивирования клеток, культивируя клетки в течение соответствующего периода времени (например, от около 6 часов до около 7 дней), затем измеряя жизнеспособность клеток. Не экспрессирующие HER2 клетки могут включать в исследование как контроль.
[00266] В данной области известны различные линии раковых клеток, экспрессирующих HER2 на разных уровнях, которые могут использовать для тестирования ADC, и многие линии коммерчески доступны (например, из Американской коллекции типовых культур, г. Манассас, штат Вирджиния, США; Addexbio Technologies, г. Сан-Диего, штат Калифорния, США; DSMZ, г. Брауншвейг, Германия). Примеры включают клеточные линии BT-474 (3+), SK-BR-3 (3+), HCC1954 (3+), JIMT-1 (2+) и ZR-75-1 (1+). Эти и другие примеры обобщены в таблице 8.
Таблица 8. Относительные уровни экспрессии HER2 в интересующих линиях клеток
[00267] Способность ADC ингибировать опухолевый рост in vivo могут определять в соответствующих животной модели с использованием стандартных методик, известных в данной области техники (см., например, Enna, et al., Current Protocols in Pharmacology, J. Wiley & Sons, Inc., New York, NY). В целом, текущие животные модели для скрининга противоопухолевых соединений представляют собой модели ксенотрансплантатов, в которых человеческую опухоль имплантируют в организм животного, как правило грызуна.
[00268] Например, ADC могут тестировать in vivo на HER2-экспрессирующих опухолях с использованием мышей, которым на сутки 0 подкожно прививают фрагмент опухоли, или имплантируют подходящее количество раковых клеток. Опухолям дают возможность развиваться до желаемого размера, животных с недостаточно развившимися опухолями исключают. Как правило, лечение ADC начинается с от 3 до 22 суток после прививания, в зависимости от типа опухоли. ADC могут вводить животным, например, внутривенной (в.в.) инъекцией. Опухоли измеряют либо после предварительно заданного периода времени либо непрерывно (например, 2 или 3 раза в неделю) до предварительно определенной конечной точки исследования, например когда опухоль достигает предварительно заданного размера или веса. В моделях с ксенотрансплантатом могут применять опухоли, экспрессирующие HER2 на различных уровнях. Особенно пригодны полученные от пациентов ксенотрансплантаты (PDX).
[00269] Токсические эффекты ADC in vivo первоначально могут оценивать на грызунах, например мышах или крысах, путем измерения их влияния на массу тела животных во время лечения. Гематологические профили и анализ ферментов печени также могут выполняться на образцах крови, отобранных у животных.
[00270] Токсичность и фармакинетику in vivo могут дополнительно анализировать на соответствующих животных моделях, например крысах или человекообразных приматах, придерживаясь стандартных протоколов. Яванские макаки являются особенно используемыми в этой связи, так как человек и яванский макак обладают 98% гомологией последовательностей HER2.
[00271] ADC, описанные в данном документе, имеют улучшенную переносимость и уменьшенную токсичность по сравнению с соответствующим ADC с DAR >3,9 при введении той же дозы токсина. В некоторых вариантах осуществления изобретения ADC демонстрируют больше чем 2x улучшение в переносимости по сравнению с соответствующим ADC с DAR >3,9 при введении той же дозы токсина. В некоторых вариантах осуществления изобретения ADC демонстрируют больше чем 2,2x; например 2,3x; 2,4x или 2,5x; улучшение в переносимости по сравнению с соответствующим ADC с DAR >3,9 при введении той же дозы токсина. Улучшение в переносимости могут определять, например, путем сравнения максимальной переносимой дозы (MTD), не вызывающего побочных эффектов уровня дозы (NOAEL) или наивысшей нетяжелой токсической дозы (HNSTD) для ADC по настоящему описанию и соответствующего ADC с DAR >3,9. Показатели MTD, NOAEL и/или HNSTD могут измерять стандартными методиками в подходящей животной модели, например на грызуне или человекообразном примате.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
[00272] Для терапевтического применения ADC могут предлагать в форме композиций, содержащих ADC и фармацевтически приемлемый носитель или разбавитель. Композиции могут готовить известными процедурами с использованием хорошо известных и легкодоступных ингредиентов.
[00273] Фармацевтические композиции могут составлять в виде лекарственной формы для введения субъекту, например, пероральным (включая, например, буккальный или сублингвальный), местным, парентеральным, ректальным или вагинальным путями, или в виде ингаляции или спрея. Термин «парентеральный», используемый в данном документе, включает в себя подкожную инъекцию, а также внутрикожную, внутрисуставную, внутримышечную, внутрисосудистую, внутригрудинную, интратекальную инъекцию или инфузию. Фармацевтическую композицию будут, как правило, составлять в формате, подходящем для введения субъекту, например в виде сиропа, элексира, таблетки, леденца, пастилки, твердую или мягкую капсулу, пилюлю, суппозиторий, масляную или водную суспензию, диспергируемый порошок или гранулу, эмульсию, инъекционный препарат или раствор. Фармацевтические композиции могут предлагать в виде однодозовых лекарственных форм.
[00274] В некоторых вариантах осуществления изобретения фармацевтические композиции, содержащие ADC составляют для парентерального введения в однодозовой инъекционной форме, например в виде лиофилизированных лекарственных форм или водных растворов.
[00275] Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов в применяемых дозировках и концентрациях. Примерами таких носителей являются, но не ограничиваются ими, буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, такие как аскорбиновая кислота и метионин; консерванты, такие как октадецилдиметилбензиламмония хлорид, гексаметония хлорид, бензалкония хлорид, бензетония хлорид, фенол, бутиловый спирт, бензиловый спирт, алкилпарабены (например, метил- или пропилпарабен), катехин, резорцин, циклогексанол, 3-пентанол и м-крезол; полипептиды с низкой молекулярной массой (менее около 10 остатков); белки, такие как сывороточный альбумин или желатин; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, такие как глюкоза, манноза или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами, такие как Zn-белковые комплексы, и неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG).
[00276] В некоторых вариантах осуществления изобретения композиции, содержащие ADC, могут предоставлять в форме стерильного инъекционного водного или масляного раствора или суспензии. Такие суспензии могут составлять с использованием подходящего диспергирующего или увлажняющего агентов и/или суспендирующего агента, которые известны в данной области техники. Стерильный инъекционный раствор или суспензия могут включать в себя ADC в нетоксичном приемлемом для парентерального введения разбавителе или носителе. Приемлемые разбавители и носители, которые могут применяться включают, например, 1,3-бутандиол, воду, раствор Рингера или изотонический раствор хлорида натрия. Кроме того, в качестве носителя могут применяться стерильные нелетучие масла. Для данной цели можно использовать различные легкие нелетучие масла, включая синтетические моно- или диглицериды. Кроме того, в препарате инъекционных лекарственных форм находят применение жирные кислоты, такие как олеиновая кислота. В инъекционный раствор или суспензию также могут включать такие адъюванты, как местные анестетики, консерванты и/или буферизирующие агенты.
[00277] В некоторых вариантах осуществления изобретения композицию, содержащую ADC, могут составлять для внутривенного введения людям. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости, композиция может также содержать солюбилизирующий агент и местный анестетик, такой как лигнокаин, для облегчения боли в месте инъекции. Обычно ингредиенты в единичную дозированную форму вводятся по отдельности или смешанными вместе, например в виде сухого лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере, таком как ампула или саше, с указанием количества действующего вещества. Когда предполагается введение композиции путем инфузии, ее можно наливать в бутылку для инфузий, содержащую воду или солевой раствор фармацевтического качества. Когда композицию вводят путем инъекции, то может прилагаться ампула со стерильной водой для инъекций или солевой раствор, чтобы ингредиенты можно было смешивать перед введением.
[00278] В данной области известны другие фармацевтические композиции и способы приготовления фармацевтических композиций, и это описано, например, в «Remington: The Science and Practice of Pharmacy» (раньше «Remingtons Pharmaceutical Sciences»); Gennaro, A., Lippincott, Williams & Wilkins, Philadelphia, PA (2000).
СПОСОБЫ ПРИМЕНЕНИЯ
[00279] Описанные в данном документе ADC могут применяться в способах ингибирования роста HER2-экспрессирующих опухолевых клеток. Клетки могут находиться in vitro или in vivo. В некоторых вариантах осуществления изобретения ADC могут применять в способах лечения HER2-экспрессирующего ракового заболевания или опухоли у субъекта.
[00280] Лечение HER2-экспрессирующего рака может привести к ослаблению одного или более симптомов, сокращению размера опухоли, подавлению роста опухоли, уменьшению одного или более прямых или косвенных патологических последствий заболевания, предотвращению метастазирования, снижению скорости прогрессирования заболевания, улучшению или временному облегчению состояния болезни, улучшению выживаемости, увеличению выживаемости без прогрессирования, ремиссии и/или улучшению прогноза.
[00281] В некоторых вариантах осуществления изобретения лечение HER2-экспрессирующего рака с помощью ADC, описанного в данном документе, замедляет прогрессирование заболевания. В некоторых вариантах осуществления изобретения лечение HER2-экспрессирующего рака с помощью ADC, описанного в данном документе, приводит к регрессии опухоли. В некоторых вариантах осуществления изобретения лечение HER2-экспрессирующего рака с помощью ADC, описанного в данном документе, приводит к подавлению роста опухоли.
[00282] HER2-экспрессирующие раковые заболевания, как правило, являются солидными опухолями. Примеры HER2-экспрессирующих солидных опухолей включают, но не ограничивается ими, рак молочной железы, рак яичника, рак легкого, рак желудка, рак пищевода, колоректальный рак, уротелиальный рак, рак поджелудочной железы, рак слюнной железы и рак головного мозга. HER2-экспрессирующий рак молочной железы включает отрицательный по эстрогенным рецепторам (ER-) и/или отрицательный по прогестеронным рецепторам (PR-) раковые заболевания молочной железы и трижды отрицательные (ER-, PR-, низкая экспрессия HER2) раковые заболевания молочной железы. HER2-экспрессирующие раковые заболевания легких включают немелкоклеточный рак легкого (НМРЛ) и мелкоклеточный рак легкого.
[00283] В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего рака молочной железы, рака яичника, рака легкого или рака желудка. В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего рака молочной железы. В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего рака молочной железы, который также является отрицательным по эстрогенным и прогестероновым рецепторам. В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего трижды отрицательного рака молочной железы (TNBC). В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего рака молочной железы, который метастазировал в головной мозг. В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении HER2-экспрессирующего рака яичника.
[00284] Как известно в данной области, HER2-экспрессирующие раковые заболевания могут характеризоваться по уровню HER2, которые они экспрессируют (т. е. по «статусу HER2»). Статус HER2 может оцениваться, например, методами иммуногистохимии (ИГХ), флуоресцентной гибридизации in situ (FISH) и хромогенной гибридизации in situ (CISH).
[00285] Методы ИГХ выявляют экспрессию белка HER2 на клеточной мембране. Залитые парафином срезы тканей, полученные в результате биопсии опухоли, могут подвергать ИГХ-анализу, и им могут присваивать критерии интенсивности окрашивания HER2, указанные ниже:
Оценка 0: отсутствие наблюдаемого окрашивания или наблюдается окрашивание мембран у менее 10% опухолевых клеток; как правило <20 000 рецепторов/клетку.
Оценка 1+: слабое/едва заметное окрашивание мембран выявляется у более 10% опухолевых клеток. Клетки окрашены лишь в части своих мембран. Как правило, около 100 000 рецепторов/клетку.
Оценка 2+: от слабого до умеренного окрашивания мембран выявляется у более 10% опухолевых клеток; как правило, около 500 000 рецепторов/клетку.
Оценка 3+: от умеренного до сильного окрашивания мембран выявляется у более 10% опухолевых клеток; как правило, около 2 000 000 рецепторов/клетку.
[00286] Опухоли с оценками 0 или 1+ для экспрессии HER2 характеризуют как HER2-отрицательные, тогда как опухоли с оценками 2+ или 3+ характеризуются как HER2-положительные.
[00287] Примеры FDA-одобренных коммерческих наборов, доступных для выявления HER2 с использованием ИГХ включают HercepTest™ (Dako Denmark A/S); PATHWAY (Ventana Medical Systems, Inc.); набор InSite™HER2/NEU (Biogenex Laboratories, Inc.) и ИГХ-систему Bond Oracle HER2 (Leica Biosystems).
[00288] Описанные в данном документе ADC могут применяться при лечении раковых заболеваний, которые экспрессируют HER2 на различных уровнях. В некоторых вариантах осуществления изобретения ADC могут применять при лечении раковых заболеваний, которые экспрессируют высокие уровни HER2 (ИГХ 3+). В некоторых вариантах осуществления изобретения ADC могут применять при лечении раковых заболеваний, которые экспрессируют высокие уровни HER2 (3+ ИГХ) или умеренные уровни HER2 (2+ ИГХ или 2+/3+ ИГХ). В некоторых вариантах осуществления изобретения ADC могут применять при лечении раковых заболеваний, которые экспрессируют высокие уровни HER2 (3+ ИГХ), умеренные уровни HER2 (2+ ИГХ или 2+/3+ ИГХ) или низкие уровни HER2 (1+ ИГХ или 1+/2+ ИГХ). В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять при лечении раковых заболеваний, которые оценены по ИГХ как HER2-отрицательные.
[00289] В некоторых вариантах осуществления изобретения уровни HER2 рака, который необходимо лечить с помощью ADC, определяются методом ИГХ. В некоторых вариантах осуществления изобретения уровни HER2 рака, который необходимо лечить с помощью ADC, определяются методом ИГХ, выполняемым с использованием анализа Herceptest™.
[00290] HER2-экспрессирующие раковые заболевания могут быть гомогенными по характеру (т. е. большинство опухолевых клеток экспрессируют сходные количества HER2), или они могут быть гетерогенными по характеру (т. е. содержать различные популяции опухолевых клеток, экспрессирующих различные уровни HER2). Подразумевается, что ADC могут применяться для лечения HER2-экспрессирующих раковых заболеваний, которые являются либо гомогенными, либо гетерогенными применительно к уровням HER2.
[00291] В некоторых вариантах осуществления изобретения ADC находят применение в способах лечения субъекта с HER2-экспрессирующим раком, который является резистентным или становится резистентным к другим терапевтическим средствам стандартов лечения. В некоторых вариантах осуществления изобретения ADC находят применение в способах лечения субъекта с HER2-экспрессирующим раком, который не поддается лечению одним или более действующими терапевтическим средствам, таким как трастузумаб (Herceptin®), пертузумаб (Perjeta®), T-DM1 (Kadcyla® или трастузумаб эмтансин) или таксаны (такие как такие как паклитаксел, доцетаксел, кабазитаксел и т. п.). В некоторых вариантах осуществления изобретения ADC находят применение в способах лечения субъекта с HER2-экспрессирующим раком, который является резистентным к трастузумабу. В некоторых вариантах осуществления изобретения ADC находят применение в способах лечения субъекта с HER2-экспрессирующим раком, который является резистентным к пертузумабу. В некоторых вариантах осуществления изобретения ADC находят применение в способах лечения субъекта с HER2-экспрессирующим раком, который является резистентным к T-DM1. В некоторых вариантах осуществления изобретения ADC находят применение при лечении метастатического рака, когда у пациента произошло прогрессирование после предыдущей анти-HER2 терапии.
[00292] Когда ADC используются при лечении субъектов с HER2-экспрессирующим раком, резистентным, рефрактерным и/или рецидивирующим после лечения другим терапевтическим агентом, то ADC могут быть частью терапии второй линии или терапией третьей или четвертой линии, в зависимости от количества предыдущих лечений, которые прошел субъект.
[00293] В некоторых вариантах осуществления изобретения описанные в данном документе ADC могут применять в сочетании с дополнительным противоопухолевым агентом при лечении субъектов с HER2-экспрессирующим раком. Дополнительный противоопухолевый агент может представлять собой терапевтическое антитело, такое как отмеченные выше, или химиотерапевтический агент. Химиотерапевтические агенты, обычно используемые для лечения HER2-экспрессирующих раковых заболеваний включают в себя, например, цисплатин, карбоплатин, паклитаксел, связанный с альбумином паклитаксел Abraxane®), доцетаксел, гемцитабин, винорелбин, иринотекан, этопозид, винбластин, пеметрексед, 5-фторурацил (с или без фолиновой кислоты), капецитабин, карбоплатин, эпирубицин, оксаплатин, фолфиринокс, циклофосфамид и различные комбинации этих агентов, известных в данной области. Субъекту могут вводит дополнительный(-ые) агент(-ы) параллельно или последовательно с ADC.
[00294] В некоторых вариантах осуществления изобретения подразумевается, что описанные в данном документе ADC могут применять для лечения субъекта с HER2-экспрессирующим раком, который не проходил какие-либо предварительные противораковые лечения (т. е. ADC могут использовать как терапию первой линии).
[00295] В некоторых вариантах осуществления изобретения субъект, проходящий лечение с помощью ADC вышеуказанными способами, может быть человеком, человекообразным приматом или другим млекопитающим. В некоторых вариантах осуществления изобретения субъект, проходящий лечение с помощью ADC вышеуказанными способами, является человеком.
[00296] Количество ADC, которое необходимо вводить субъекту, будет варьировать с учетом соответствующих обстоятельств, включающих состояние, требующее лечения, выбранный путь введения, вводимое в настоящее время соединение, возраст, вес и ответную реакцию конкретного субъекта, и тяжесть симптомов субъекта, на также и терапевтически эффективное количество.
[00297] Термин «терапевтически эффективное количество», используемый в данном документе, относится к количеству ADC, требуемому для введения с целью достижения задачи указанного способа, например облегчения одного или более симптомов заболевания, проходящего лечение. Количество ADC, описанных в данном документе, которые будут эффективными при лечении HER2-экспрессирующего рака, могут определять стандартными клиническими методиками. Кроме того, анализы in vitro необязательно могут использовать для облегчения определения оптимальных диапазонов доз. Эффективные дозы экстраполируют из кривых доза-ответ, полученных при испытаниях in vitro или на модельных системах с животными.
ФАРМАЦЕВТИЧЕСКИ НАБОРЫ
[00298] В некоторых вариантах осуществления предлагаются фармацевтические наборы, содержащие описанные в данном документе ADC.
[00299] Набор, как правило, содержит контейнер и размещенную с контейнером или находящуюся на нем этикетку и/или вкладыш в упаковку. Этикетка или вкладыш в упаковку содержит инструкции, в обычном порядке включенные в коммерческие упаковки терапевтических препаратов, предоставляющие информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических препаратов. Этикетка или вкладыш в упаковку могут дополнительно включать указание в предписанной государственным органом форме, регулирующее производство, применение или продажу фармацевтических или биологических препаратов, упоминание которого отображает одобрение этим органом производства, применения или продажи препарата для введения людям или животным. На этикетке или вкладыше в упаковку также указывается, что ADC предназначен для применения при лечении HER2-экспрессирующего ракового заболевания. В контейнере находится композиция, содержащая ADC, и, в некоторых варианте осуществления изобретения, контейнер имеет стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного введения или флакон с пробкой, которая может прокалываться иглой для внутрикожной инъекции).
[00300] В дополнению к контейнеру, содержащему композицию, включающую ADC, набор может включать в себя один или более дополнительных контейнеров, содержащих другие компоненты набора. Например, фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом солевой раствор, раствор Рингера или раствор декстрозы; другие буферные растворы или разбавители.
[00301] Подходящий контейнер включает, например, бутылки, флаконы, шприцы, пакеты для внутривенных растворов и т. п. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Если необходимо, один или более компонентов набора могут быть лиофилизированы или предоставлены в сухой форме, такой как порошок или гранулы, и набор может дополнительно содержать подходящий растворитель для восстановления лиофилизированного(-ых) или сухого(-их) компонентов.
[00302] Набор может дополнительно содержать другие материалы, желательные с коммерческой точки зрения и с точки зрения пользователя, включая фильтры, иглы и шприцы.
[00303] Следующие примеры являются исключительно иллюстративными и никоим образом не подразумевают ограничения объема данного изобретения.
ПРИМЕРЫ
ПРИМЕР 1. СИНТЕЗ ЛИНКЕР-ТОКСИНА
[00304] В следующих примерах описывается препарат типового линкер-токсина (линкер-токсин 001), который содержит следующий аналог ауристатина (соединение 9):
[00305] Могут применять сходные протоколы для получения линкер-токсинов, содержащих другие аналоги ауристатина, включая следующие типовые соединения (см. также международную публикацию патентной заявки № WO 2016/041082):

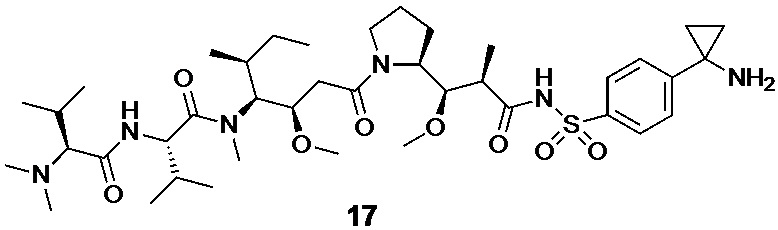
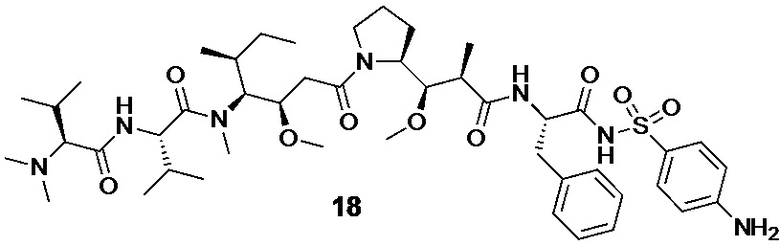
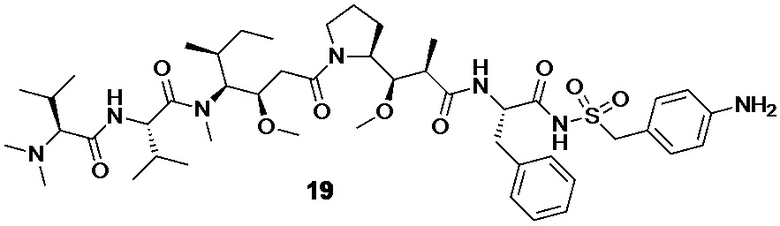
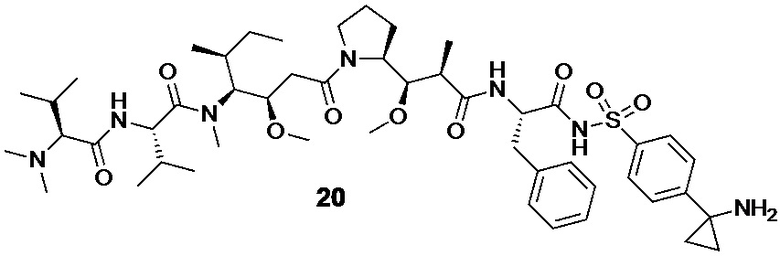
1.1 Этил (2R,3R)-3-метокси-2-метил-3-((S)-пирролидин-2-ил)пропаноат (соединение 1)
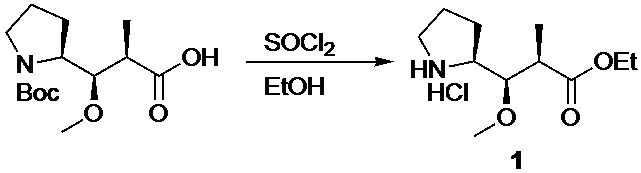
[00306] К перемешиваемому раствору (2R,3R)-3-((S)-1-(трет-бутоксикарбонил)пирролидин-2-ил)-3-метокси-2-метилпропановой кислоты (Boc-Dap-OH, 4,31 г, 15,0 ммоль) в абсолютном этаноле (27,0 мл) при 0oC добавляли по каплям тионилхлорид (3,0 мл). Полученному раствору дали возможность нагреться до комнатной температуры, и прохождение реакции отслеживали методом ВЭЖХ-МС. Через 18 часов не было обнаружено остаточного исходного вещества, и раствор концентрировали до сухого состояния под пониженным давлением. Полученное масло суспендировали в толуоле (10 мл) и дважды концентрировали под пониженным давлением, затем суспендировали в диэтиловом эфире (5 мл) и дважды концентрировали под пониженным давлением с получением белой твердой пены (3,78 г, количественный выход%). МС набл. m/z = 216,5 (M+1).
1.2 (3R,4S,5S)-4-((S)-2-(((бензилокси)карбонил)амино)-N,3-диметилбутанамидо)-3-метокси-5-метилгептановая кислота (соединение 3)
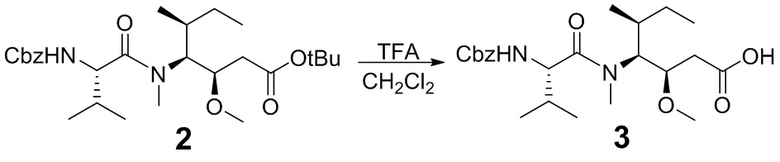
[00307] Соединение 2 получали как описано в международной публикации патентной заявки № WO 2016/041082.
[00308] К перемешиваемому раствору соединения 2 (6,965 г, 14,14 ммоль) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (5,0 мл). Реакцию отслеживали на завершение методом ВЭЖХ-МС, и через 40 часов исходное вещество израсходовалось. Реакционную смесь концентрировали под пониженным давлением, испаряя вместе с толуолом (2 x 10 мл) и дихлорметаном (2 x 10 мл) с получением пенистого белого твердого вещества (6,2 г, количественный выход с остаточной ТФК). Это вещество растворяли в 200 мл горячей смеси 1:3 EtOAc:гексаны и давали возможность охладиться до комнатной температуры. Во время охлаждения образовался осадок, а также немного мелких кристаллов. Добавили 5 мл EtOAc и суспензию снова нагрели, чтобы полностью растворить осадок. При охлаждении до комнатной температуры кристаллов образовалось больше, и колбу оставили на ночь при -30 °С. На следующее утро маточную жидкость декантировали, и кристаллы промывали гексанами 2 x 50 мл и высушивали под высоким вакуумом. Выделили 5,67 г кристаллического продукта. МС набл. m/z = 405,7 (M+1).
1.3 Этил (2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-(((бензилокси)карбонил)амино)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноат (соединение 4)

[00309] К перемешиваемому раствору соединения 3 (6,711 г, 15,37 ммоль, 1,025 эквив.) в смеси дихлорметана (5,0 мл) и N,N-диметилформамида (5,0 мл) при комнатной температуре добавляли HATU (5,732 г, 15,07 ммоль, 1,005 эквив.) и N,N-диизопропилэтиламин (7,84 мл, 3 эквив.). После 30 минут перемешивания при комнатной температуре добавляли по каплям раствор соединения 1 (3,776 г, 15,00 ммоль, 1,0 эквив) в смесь дихлорметана (1,0 мл) и N,N-диметилформамида (1,0 мл), смывая остатки соединения 1 дополнительными 3 мл смеси 1:1 дихлорметана:N,N-диметилформамида. Реакцию отслеживали методом ВЭЖХ-МС и через 15 минут не наблюдали оставшегося соединения 1. Реакционную смесь концентрировали под пониженным давлением, разбавляли этилацетатом (~125 мл), и органическую фазу извлекали 1 M HCl (2 x 50 мл), 1 x dH2O (1 x 50 мл), насыщенным NaHCO3 (3 x 50 мл), солевым раствором (25 мл). Кислотные и основные водные слои промывали 25 мл EtOAc. Затем все органические вещества объединяли и высушивали над MgSO4, фильтровали и концентрировали с образованием красного масла. Остаток растворяли в минимальном количестве дихлорметана (~10 мл), загружали на 360 г силикагелевой колонке Biotage® SNAP Ultra (система флеш-хроматографии Isolera™; Biotage AB, Швеция) для очистки (20–100% EtOAc в гексанах более 10 объемов колонки). Фракции, содержащие чистый продукт, объединяли с выделением 7,9 г пенистого белого твердого вещества. Фракции с примесями подвергали второй очистке на 100 г силикагелевой колонке Biotage® SNAP Ultra и объединяли с чистым продуктом с выделением белого пенистого твердого вещества (8,390 г, 88,3 %). МС набл. m/z = 634,7 (M+1).
1.4 (2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-(((бензилокси)карбонил)амино)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропановая кислота (соединение 5)
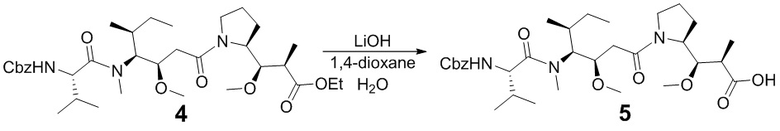
[00310] К перемешиваемому раствору соединения 4 (8,390 г, 13,24 ммоль) в 1,4-диоксане (158 мл) добавляли dH2O (39,7 мл) и моногидрат гидроксида лития (1 M в H2O, 39,7 мл, 3 эквив.). Реакционную смесь перемешивали при 4 °C и отслеживали методом ВЭЖХ-МС на расходование исходного вещества, что заняло 3 суток, пока не осталось лишь следов соединения 4. В ходе реакции в небольшом процентном соотношении в дополнение к требуемому веществу образовался новый продукт, соответствующий потере метанола (β-отщепление, <2%). Реакционную смесь подкисляли добавлением 1 M водного HCl (50 мл) и концентрировали под пониженным давлением для удаления диоксана. Оставшуюся реакционную смесь экстрагировали этилацетатом (4 x 50 мл), и органическую фазу объединяли, промывали солевым раствором (15 мл + 2 мл 2 M HCl), высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением с получением слабоокрашенного масла. Масло повторно растворяли в диэтиловом эфире (~50 мл) и концентрировали под пониженным давлением (3x) для облегчения удаления остаточного диоксана, получая указанный в заголовке продукт в густого масла (7,81 г, выход 97% с незначительным остатком диоксана и соединения 4). МС набл. m/z = 606,7 (M+1).
1.5 Бензил((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)карбамат (соединение 7)
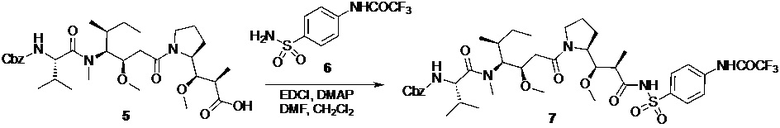
[00311] Соединение 6 получали как описано в международной публикации патентной заявки № WO 2016/041082.
[00312] К перемешиваемому раствору соединения 5 (7,12 г, 11,754 ммоль) в дихлорметане (20 мл) добавляли 2,2,2-трифтор-N-(4-сульфамоилфенил)ацетамид (соединение 6, 4,095 г, 1,3 эквив., растворенный в 3 мл ДМФ), N,N-диметилпиридин (1,867 г, 1,3 эквив.) и N,N-диметилформамид (1,5 мл) с образованием светло-желтой суспензии. Дополнительное добавление 5 мл ДМФ не сделало раствор прозрачным. N-(3-диметиламинопропил)-N′-этилкарбодиимида гидрохлорид (EDCI) (2,817 г, 1,25 эквив.) добавляли одной порцией и отслеживали реакцию методом ВЭЖХ-МС. Через 48 ч реакция переставала проходить и добавляли дополнительных 400 мг EDCI. Через 18 часов не наблюдалось остатка исходного вещества, и реакционную смесь концентрировали под пониженным давлением с получением желтого масла. Масло растворяли в этилацетате (~150 мл) и 1 M HCl (20 мл), и органическую фазу промывали холодной 2 M HCl (2 x 10 мл), насыщенным NaHCO3 (1 x 10 мл), солевым раствором (20 мл + 5 мл 2 M HCl). Кислотные и основные водные фракции экстрагировали с помощью EtOAc (1 x 20 мл), все органические фракции объединяли, высушивали над MgSO4 и концентрировали под пониженным давлением с получением маслянистой неочищенной массы (13 г). Остаток растворяли в дихлорметане (~10 мл), загружали на 360 г силикагелевой колонке Biotage® SNAP Ultra и очищали градиентом 10–100% EtOAc (2% AcOH) в гексанах более 12 объемов колонки с плато при 50% EtOAc 3-колоночными объемами. Фракции, содержащие чистый продукт, объединяли, концентрировали под пониженным давлением, растворяли и концентрировали из толуола (2 x 10 мл) и диэтилового эфира (2 x 10 мл) с получением требуемого продукта, 7,1 г пенистого белого твердого вещества. Фракции с примесями подвергали повторной очистке в условиях более пологого градиента с использованием 100 г силикагелевой колонке Biotage® SNAP Ultra на приборе Isolera™. Все чистые фракции объединяли для выделения чистого продукта в виде пенистого белого твердого вещества (8,60 г, 86%). МС набл. m/z = 856,7 (M+1).
1.6 (S)-2-амино-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфанамидо)пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (соединение 7a)
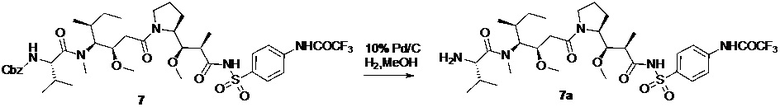
[00313] Соединение 7 (3,71 г, 4,33 ммоль) растворяли в 10% N,N-диметилформамид в этилацетате (30 мл) в круглодонной колбе, содержащей магнитную мешалку и оснащенную 3-ходовым переходником газопровода. Сосуд был дважды вакуумировали под пониженным давлением и заполняли газообразным азотом. Одной порцией добавляли 10% палладий на углероде (0,461 г, 0,1 эквив.), устанавливали на колбу 3-ходовой переходник, к переходнику подсоединяли баллон с водородом, и сосуд дважды вакуумировали под пониженным давлением и заполняли водородом. Оставляли реакционную смесь перемешиваться в течение 2 суток, за этот период времени баллон с водородом периодически заменяли. Через приблизительно 48 ч анализ ВЭЖХ-MS показал расходование исходного вещества. Реакционную смесь разбавляли метанолом (20 мл) и фильтровали через вставку с целитом. Целит промывали метанолом (2 x 50 мл). Все фильтраты объединяли и концентрировали под пониженным давлением, и полученное в результате масло растворяли и концентрировали из дихлорметана. После высыхания под пониженным давлением выделяли указанное в заголовке соединение в виде бесцветного порошка (3,10 г, 99%). МС набл. m/z = 722,6 (M+1).
1.7 (S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N-((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-2-метил-3-оксо-3-((4-(2,2,2-трифторацетамидо)фенил)сульфонамидо) пропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)-N,3-диметилбутанамид (соединение 8)
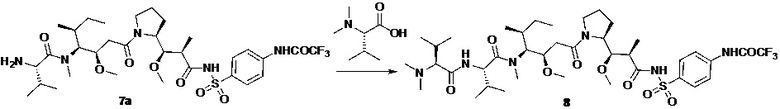
[00314] К перемешиваемому раствору N,N-(L)-диметилвалина (1,696 г, 9,35 ммоль) в N,N-диметилформамиде (10 мл) добавляли HATU (3,216 г, 8,46 ммоль) и ди-изопропилэтиламин (3,10 мл, 17,8 ммоль). Через 5 минут образовался прозрачный желтый раствор. Перемешивание продолжали еще дополнительных 10 минут, затем одной порцией добавляли соединение 7a (3,213 г, 4,45 ммоль). После дополнительного 1 ч перемешивания, метод ВЭЖХ-МС показал, что остались следовые количества соединения 7a, и реакцию продолжили на 16 ч. Затем реакционную смесь концентрировали под пониженным давлением, разбавляли этилацетатом (120 мл) и 40 мл 1:1 NaHCO3 (насыщ.): 5% LiCl и переносили в разделительную воронку. Удаляли водный слой и органическую фазу промывали LiCl (1 x 20 мл), NaHCO3 (насыщ., 2 x 20 мл). Водные слои объединяли и экстрагировали EtOAc (3 x 50 мл). Органические слои объединяли и промывали солевым раствором (1 x 20 мл), высушивали сульфатом натрия, фильтровали и концентрировали с получением разбавленного ДМФ масла, которое концентрировали с помощью ротационного испарителя для удаления остаточного ДМФ, получая 7 г неочищенного масла соломенной окраски. Масло растворяли в минимальном количестве 10% метанола в дихлорметане (~11 мл), загружали на 360 г силикагелевой колонке Biotage® SNAP Ultra для очистки (2–20% MeOH в CH2Cl2 более 15 объемов колонки, продукт элюировали примерно 10–13%). Фракции, содержащие требуемый продукт, объединяли и концентрировали под пониженным давлением с получением указанного в заголовке соединения в виде бесцветной пены. Фракции с примесями соединяли, выпаривали и подвергали повторной очистке на 100 г силикагелевой колонке Biotage® SNAP Ultra на приборе Isolera™ и соединяли с чистым продуктом из первой колонки с образованием бесцветного пенистого твердого вещества (3,78 г). МС набл. m/z = 850,6 (M+1).
1.8 (S)-N-((3R,4S,5R)-1-((S)-2-((1R,2R)-3-((4-аминофенил)сульфанамидо)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N,3-диметилбутанамид (соединение 9)
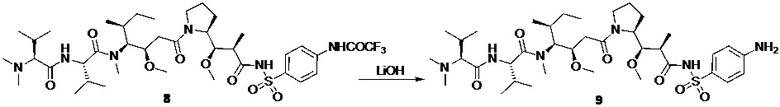
[00315] К перемешиваемому раствору соединения 8 (0,980 г, 1,154 ммоль) в 1,4-диоксанах (15 мл) добавляли воду (3,5 мл) и 1 M моногидрат гидроксида лития (3 эквив., 3,46 мл). Оставляли перемешиваться полученной легкой суспензии при 4 °C и контролировали ВЭЖХ-МС до расходования исходного вещества. После завершения превращения (~5 суток) реакционную смесь нейтрализовали 3,46 мл 1 M HCl и концентрировали под пониженным давлением для удаления диоксана. Полученную водную фазу разбавляли 60 мл EtOAc и 5 мл солевого раствора, затем экстрагировали этилацетатом (2 x 30 мл). Органические фракции объединяли, высушивали над Na2SO4, фильтровали и испаряли с получением указанного в заголовке соединения в виде желтовато-коричневого твердого вещества (0,930 г). Rf = 0,5 (8% MeOH в CH2Cl2). МС набл. m/z = 753,7 (M+1).
1.9 2,3,5,6-тетрафторфенил 3-(2-(2-(2-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)этокси)этокси)этокси)пропаноат (соединение 15)

[00316] В высушенной конической колбе объемом 50 мл растворяли 3-(2-(2-2(-аминоэтокси)этокси)этокси)пропановую кислоту (соединение 14, 1,000 г, 4,52 ммоль) и малеиновый ангидрид (0,443 г, 4,52 ммоль) в безводном N,N-диметилформамиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 часов в атмосфере N2, после чего охлаждали до 0 °C и добавляли по каплям син-коллидин (1,263 мл, 2,1 экв.). В отдельной высушенной конической колбе объемом 50 мл растворяли тетрафторфенол (3,002 г, 4 экв.) в безводном N,N-диметилформамиде (10 мл). Колбу охлаждали до 0 °C в ледяной ванне, и добавляли по каплям трифторуксусный ангидрид (2,548 мл, 4 экв.). Содержимое этой колбы перемешивали в течение 15 минут, после чего по каплям добавляли син-коллидин (2,407 мл, 4 экв.). Оставляли колбу перемешиваться еще 15 минут, а затем содержимое по каплям через шприц добавляли в первую колбу. Реакционной смеси дали возможность нагреться до комнатной температуры, и перемешивание продолжали в атмосфере N2. Реакционную смесь отслеживали методом ВЭЖХ-МС на расходование исходных веществ. Через 6 дней реакция завершилась полным расходованием соединения 14, оставив только соединение 15 и небольшое количество (~5%) промежуточного соединения бис-ТФФ малеинового амида. Реакцию переносили в разделительную воронку, разбавляли диэтиловым эфиром (75 мл) и промывали 5% LiCl (1 x 20 мл), 1 M HCl (2 x 20 мл), насыщ. NaHCO3 (5 x 20 мл) и солевым раствором (1 x 20 мл). Органический слой высушивали над Na2SO4, фильтровали и испаряли с получением коричневого неочищенного масла с остаточным ДМФ. Неочищенное масло растворяли в 8 мл 1:1 ДМФ:H2O + 0,1% ТФК, загружали на 60 г колонку Biotage® SNAP Ultra C18 (Biotage AB, г. Уппсала, Швеция) и очищали в условиях линейного градиента 30–100% ACN/H2O + 0,1% ТФК более 8 объемами колонки. Чистые фракции объединяли и разбавляли солевым раствором (20 мл), затем экстрагировали 3 x 50 мл Et2O. Объединенный органические вещества высушивали над MgSO4, фильтровали и испаряли для извлечения светло-желтого масла (1,34 г, выход 66%).
1.10 Трет-бутил ((S)-1-(((S)-1-((4-(N-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N, 3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)фенил)амино)-1-оксо-5-уреидопентан-2-ил)амино)-3-метил-1-оксобутан-2-ил)карбамат (соединение 12)
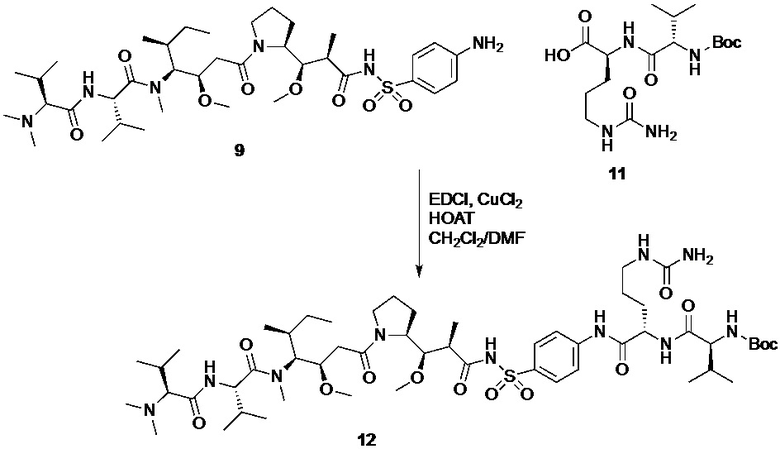
[00317] Соединение 11 получали как описано в международной публикации патентной заявки № WO 2016/041082.
[00318] В пустую грушевидную колбу объемом 25 мл добавляли соединение 11 (1,342 г, 3,58 ммоль, 3,0 эквив.), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (0,664 g, 3,46 ммоль, 2,9 эквив.) и 7-гидрокси-азабензотриазол (HOAT) (0,472 г, 3,46 ммоль, 2,9 эквив.). Эти твердые вещества растворяли в смеси N,N-диметилформамида (0,5 мл) и дихлорметана (4,5 мл) с перемешиванием при комнатной температуре на протяжении 30 минут. Отдельно растворяли соединение 9 (0,900 г, 1,20 ммоль) в смеси N,N-диметилформамида (0,2 мл) и дихлорметана (1,8 мл) и добавляли в грушевидную колбу, ополаскивая дихлорметаном (1,0 мл). Скорость перемешивания увеличивали до 1000 об/мин, создавая завихрение. В течение 2 минут после добавления одной порцией добавляли соединение 9, хлорид меди (II) (0,514 г, 3,83 ммоль, 3,2 эквив.) прямо в центр завихрения через узкую насыпную воронку. Первоначально светло-желтый раствор превращался в темно-коричневую суспензию, которая за 10 минут меняла цвет на темно-зеленую. Реакцию отслеживали на завершение методом ВЭЖХ-МС, и между взятыми через 30 минут и 1 час пробами не наблюдалось никаких изменений в ходе реакции (~95% завершения). Реакционную смесь оставляли перемешивать в течение ночи при комнатной температуре, затем добавляли 2-(2-аминоэтиламино)этанол (0,483 мл, 4,781 ммоль, 4 эквив.), EtOAc (10 мл) и dH2O (5 мл) к перемешиваемой суспензии, которая совершила изменение цвета на темно-синий. Суспензию энергично перемешивали в течение 4 часов по мере того, как суспендированные твердые частицы постепенно растворялись в двухфазной смеси. Эту смесь переносили в разделительную воронку и разбавляли EtOAc (100 мл) и солевым раствором (10 мл), и водный слой экстрагировали 10% IpOH/ EtOAc (4 x 50 мл). Органические слои объединяли и промывали солевым раствором (10 мл), высушивали над Na2SO4, и испаряли с получением слегка голубого неочищенного твердого вещества. Это неочищенное масло растворяли в смеси метанола (0,5 мл) и дихлорметана (6 мл) и очищали на 100 г силикагелевой колонке Biotage® SNAP Ultra (2–20% MeOH в CH2Cl2 более 10 объемов колонки, с последующим плато 8-колоночным объемом 20% MeOH). Продукт элюировался в виде широкого пика после 1–2 объемов колонки ~20% MeOH в CH2Cl2. Фракции, содержащие требуемое вещество, объединяли и концентрировали под пониженным давлением с получением указанного в заголовке соединения в виде белого твердого вещества (1,105 г, 83%). МС набл. m/z = 555,9 ((M+2)/2), 1109,8 (M+1).
1.11 (S)-2-((S)-2-амино-3-метилбутанамидо)-N-(4-(N-((2R,3R)-3-((S)-1-((3R,4S,5R)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N, 3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)фенил)-5-уреидопентанамид (соединение 13)
[00319] К раствору соединения 12 (0,926 г, 0,834 ммоль) добавляли смесь дихлорметана (10 мл) и трифторуксусной кислоты (2,0 мл). Реакционную смесь отслеживали методом ВЭЖХ-МС на расходование исходного вещества (~45 минут). Реакционную смесь выпаривали вместе с ацетонитрилом (2 x 10 мл) и дихлорметаном (2 x 10 мл) под пониженным давлением для удаления избытка трифторуксусной кислоты. Получаемый остаток растворяли в минимальном количестве дихлорметана и метанола (3:1, об./об., ~2 мл) и добавляли через пипетку по каплям к перемешиваемому раствору диэтилового эфира (200 мл) и гексанов (100 мл), получая суспензию белоснежных твердых веществ. Твердые вещества фильтровали и высушивали под вакуумом с получением указанного в заголовке соединения в форме белого порошка в виде трифторуксусной соли (1,04 г, количественный выход с некоторыми остаточными растворителями). МС набл. m/z = 505,8 ((M+2)/2).
1.12 (S)-N-(4-(N-((2R,3R)-3-((S)-1-((3R,4S,5R)-4-((S)-2-((S)-2-(диметиламино)-3-метилбутанамидо)-N, 3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропаноил)сульфамоил)фенил)-2-((S)-1-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)-14-изопропил-12-оксо-3,6,9-триокса-13-азапентадеканамидо)-5-уреидопентанамид (линкер-токсин 001)
[00320] К перемешиваемому раствору соединения 13 (0,722 г, 0,584 ммоль) в N,N-диметилформамиде (4 мл) добавляли соединение 15 (0,314 г, 1,2 эквив.) и диизопропилэтиламин (0,305 мл, 3,0 эквив.). Через 2 часа анализ ВЭЖХ-МС показал отсутствие остаточного исходного вещества. Реакционную смесь подкисляли ТФК (300 мкл), а затем разбавляли diH2O + 0,1% ТФК (9 мл). Полученный раствор загружали на 120 г колонку Biotage® SNAP Ultra C18 (Biotage AB, г. Уппсала, Швеция) и очищали в условиях линейного градиента ACN/H2O + 0,1% ТФК: 20–60% ACN более 10 объемами колонки, 60–100% ACN более 5 объемами колонки. Продукт элюировали приблизительно 40% ACN. Чистые фракции, идентифицированные методом ЖХМС, объединяли и лиофилизировали. Из лиофилизатора извлекали белое порошкообразное твердое вещество. Лиофилизацию повторяли при более высокой концентрации (приблиз. 50 мг/мл в 2:1 H2O/ACN) во флаконе с получением более плотного, менее хлопьевидного лиофилизированного твердого вещества (754,2 мг, 91%). МС набл. m/z = 647,4 ((M+2)/2), 1292,8 (M+1).
ПРИМЕР 2. КОНЪЮГАЦИЯ ЛИНКЕР-ТОКСИНА С БИПАРАТОПНЫМ АНТИТЕЛОМ
[00321] Конъюгаты антитела-лекарственного вещества (ADC) бипаратопного анти-HER2 mAb, v10000, и линкер-токсина 001 создавали частичным восстановлением межцепных дисульфидных связей антитела, с последующим кэпированием свободных цистеиновых остатков взаимодействием с малеимидным компонентом линкер-токсина. Посредством варьирования количеством TCEP, используемого для восстановления антитела, могут получать ADC со средними соотношениями лекарственное вещество-к-антителу от 0 до 6. ADC очищали для удаления загрязняющих малых молекул и характеризовали с демонстрацией DAR, чистоты, содержания мономера, уровней эндотоксина и связывания с антигенположительными опухолевыми клетками.
[00322] Препарат v10000 описан в международной публикации патентной заявки № WO 2015/077891. Подробные свойства этого антитела представлены в таблице 9 ниже. Последовательности представлены в таблицах последовательностей.
Таблица 9
* Нумерация Fab или вариабельного домена в соответствии с Кабатом (Kabat et al., Sequences of proteins of immunological interest, 5th Edition, US Department of Health and Human Services, NIH Publication No. 91–3242, p.647, 1991)
§ Нумерация CH3 в соответствии с индексом EU, как по Кабату (Edelman et al., 1969, PNAS USA, 63:78–85)
2.1 Конъюгация анти-HER2 антитела частичным восстановлением межцепных дисульфидных связей (v17597; DAR 3,9)
[00323] Восстанавливали раствор (138,9 мл) антитела v10000 (2,0 г) в 10 мМ ацетате натрия, 9% (мас./об.) сахарозы, pH 4,5 добавлением свежеприготовленной смеси 200 мМ Na2HPO4, pH 8,9 (15,4 мл), 5 мМ раствора DTPA (39,5 мл в ФСБ, pH 7,4) и 10 мМ раствора TCEP (3,68 мл, 2,3 экв.). Через 90 минут при 37 °C реакционную смесь охлаждали на льду перед добавлением избытка линкер-токсина 001 (6,41 мл; 8 экв.) из 20 мМ маточного раствора в ДМСО. Через 90 минут конъюгационную смесь гасили добавлением избытка 20 мМ раствора N-ацетилцистеина (4,81 мл; 6 экв.).
2.2 Конъюгация анти-HER2 антитела частичным восстановлением межцепных дисульфидных связей (v21252; DAR 2,1)
[00324] Корректировали pH раствора (138,9 мл) антитела v10000 (2,0 г) в 10 мМ ацетате натрия, 9% (мас./об.) сахарозы, pH 4,5 добавлением 200 мМ Na2HPO4, pH 8,9 (15,4 мл). После добавления раствора DTPA (44 мл в ФСБ, pH 7,4, конечная концентрация 1,0 мМ), производили восстановление межцепных дисульфидов добавлением 10 мМ раствора TCEP (1,68 мл, 1,05 экв.). Через 90 минут при 37 °C реакционную смесь охлаждали на льду перед добавлением избытка линкер-токсина 001 (4,81 мл; 6 экв.) из 20 мМ маточного раствора в ДМСО. Через 90 минут конъюгационную смесь гасили добавлением избытка 20 мМ раствора N-ацетилцистеина (4,81 мл; 6 экв.).
2.3 Очистка конъюгатов антител-лекарственных веществ v17597 и v21252
[00325] Погашенные растворы конъюгатов антител-лекарственных веществ (ADC) очищали 9–15 диаобъемами 10 мM ацетата натрия, 9% (мас./об.) сахарозы, pH 4,5 на приборе для фильтрации в тангенциальном потоке Millipore Labscale™ с использованием модуля для ультрафильтрации Pellicon® XL (Ultracel® 30 кДа 0,005 м2; Millipore Sigma). Элюированный раствор ADC подвергали стерильной фильтрации (0,22 мкм). ADC, полученные в малом масштабе, очищали на колонках Zeba™ с отсечением ММ 40 кДа (ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США), прекондиционированных либо ФСБ, либо 10 мM ацетатом натрия, 9% (мас./об.) сахарозы, pH 4,5.
[00326] После очистки концентрацию ADC определяли анализом BCA на основе стандартной кривой, полученной по антителу v10000. В альтернативном варианте концентрации оценивали измерением поглощения при 280 нм (ε = 195065 M-1 см-1).
[00327] Образцы ADC оценивали методом невосстанавливающего и восстанавливающего электрофореза ДСН-ПААГ (см. Фиг. 1). Сторонние полосы не наблюдались.
2.4 Хроматография гидрофобных взаимодействий
[00328] Антитело и ADC анализировали методом хроматографии гидрофобных взаимодействий (ХГВ) для оценки соотношения лекарственное вещество-к-антителу (DAR). Хроматографию выполняли на колонке Proteomix® HIC Ethyl (7,8x50 мм, 5 мкм) (Sepax Technologies Inc., г. Ньюарк, штат Делавэр, США), применяя градиент от 80% MPA/20% MPB до 35% MPA/65% MPB в течение периода 13,5 минут при скорости потока 1 мл/мин (MPA = 1,5 M (NH4)2SO4, 25 мM NaxPO4 и MPB = 75% 25 мM NaxPO4, 25% изопропанол).
[00329] Среднее соотношение лекарственного вещества к антителу (DAR) ADC может варьировать в зависимости от количества дисульфидных связей, высвобожденных при восстановлении антитела. Одна реакция конъюгации, которая дает ADC с конкретным средним DAR, создает смесь типов. Для антител v17597 и v21252, получается смесь из четырех типов: неконъюгированное антитело, ADC с DAR равным 2, ADC с DAR равным 4 и ADC с DAR равным 6.
[00330] Результаты анализа ХГВ показаны на Фиг. 2 и демонстрируют, что v17597 имеет среднее DAR равное 3,92 (Фиг. 2A), и v21252 имеет среднее DAR равное 2,07 (Фиг. 2B).
[00331] Отдельные доли участия типов DAR0, DAR2, DAR4 и DAR6 в среднем DAR очищенных ADC оценивали путем интегрирования хроматограммы ВЭЖХ-ХГВ. Каждый пик в хроматограмме ХГВ выделяли методом препаративной хроматографии, а идентичность пика подтверждали методом ЖХ-МС. Содержание в % отдельных типов DAR для каждого варианта (как определено методом ХГВ) показано в таблице 10 и на Фиг. 2D. Как видно из таблицы 10 и Фиг. 2D, v17597 содержит значительно больше типов DAR6, чем v21252, и v21252 содержит значительно больше типов DAR0, чем v17597.
[00332] На Фиг. 2E показано изменение относительных количеств типов DAR 0, 2, 4 и 6 у конъюгата v10000-линкер-токсин 001 для ряда препаратов ADC со средними значениями DAR от 0,5 до 6.
Таблица 10. Распределение DAR для v17597 и v21252
2.5 Эксклюзионная хроматография
[00333] Степень агрегации антител и ADC (~15 мкг, объем инъекции 5 мкл) оценивали методом эксклюзионной хроматографии (SEC) на колонке ACQUITY UPLC® Protein BEH SEC (200 ангстрем, 1,7 мкм, 4,6х150 мм) (Waters Corporation, г. Милфорд, штат Массачусетс, США) с использованием подвижной фазы, состоящей из 150 мМ фосфата, рН 6,8 и скорости потока 400 мкл/мин. Обнаружение осуществляли по поглощению при 280 нм.
[00334] Результаты показаны на Фиг. 3 и обобщены в таблице 11. По результатам анализа SEC mAb v10000 является в значительной степени мономерным. При конъюгации с линкер-токсином 001 не наблюдалось значительного увеличения в агрегации. Сравнение v21252 и v17597 указывает, что на степень агрегации не влияет увеличение DAR от 2 до 4.
Таблица 11. Обобщение результатов SEC
2.6 Количественное определение свободного токсина и линкер-токсина методом ЖХ-МС-МС
[00335] Остаточные концентрации свободного токсина (соединение 9), линкер-токсина 001 и погашенного лекарственного вещества-линкера N-ацетилцистеин-линкер-токсин 001 в лекарственных формах ADC оценивали разделением жидкостной хроматографией (ЖХ) и выявлением масс на основе стандартных кривых для каждого анализируемого вещества. Разделения выполняли на колонке PolymerX™ RP-1 (3 мкм, 100 ангстрем, 50x 4 мм) (Phenomenex Inc., г. Торранс, штат Калифорния, США), применяя скорость потока равную 0,4 мл/мин, температуру колонки 30oC и градиент от 75% MPA/25% MPB до 60% MPA/40% MPB в течение 7,8 минут (MPA = 0,1% водная муравьиная кислота, и MPB = 0,1% муравьиная кислота в ацетонитриле). Положительный режим выявления массы ESI-MRM осуществляли на масс-спектрометре Agilent 6470 с тройным квадруполем (Agilent Technologies, г. Санта-Клара, штат Калифорния, США).
[00336] Все образцы содержали < 0,1 мол.% анализируемого вещества относительно общей конъюгированной нагрузки.
2.7 Анализ связывания методом проточной цитометрии на антигенположительных клетках
[00337] Связывание ADC с антигенположительными линиями опухолевых клеток JIMT-1 (карцинома молочной железы, Addexbio Technologies, г. Сан-Диего, штат Калифорния, США) и КТ-112/84 (карцинома мочевого пузыря, Sigma-Aldrich, г. Сент-Луис, штат Миссури, США) сравнивали с исходным антителом (v10000) на связывание методом проточной цитометрии. Клетки культивировали согласно инструкциям поставщика. Вкратце, инкубировали клетки (50 000 клеток/лунку) с серийными разведениями антитела или ADC в течение 90 минут на льду. После этой инкубации клетки промывали дважды и затем инкубировали со вторичным реагентом анти-hIgG, конъюгированным с AlexaFluor® 647 (Jackson ImmunoResearch Inc., г. Вест Гров, штат Пенсильвания, США), в течение 60 минут на льду. Затем клетки промывали дважды и анализировали флуоресценцию методом проточной цитометрии (проточный цитометр LSRFortessa™ X-20, BD, г. Сан-Хосе, штат Калифорния, США).
[00338] Результаты показаны на Фиг. 4 и демонстрируют, что на связывание v17597 и v21252 с антигенположительными клетками не влияет конъюгация с токсином, причем оба ADC показывают сходное связывание с исходным антителом v10000.
2.8 Тестирование содержания эндотоксинов
[00339] Уровень эндотоксинов лекарственных форм ADC оценивали с использованием гель-тромб качественного анализа с лизатом амебоцитов мечехвоста (LAL) (единый тест-набор Genscript ToxinSensor™; GenScript, г. Пискатауэй, штат Нью-Джерси, США) с пороговым значением 0,125 Ед/мл. Все ADC, использованные в экспериментах in vivo (ниже) дозировали ниже 5 единиц эндотоксина на килограмм массы тела.
ПРИМЕР 3. АКТИВНОСТЬ IN VITRO БИПАРАТОПНЫХ ADC
[00340] Активность in vitro v17597 и v21252 измеряли анализом клеточной пролиферации на антигенположительных опухолевых клетках BT-474 (протоковая карцинома, ATCC, г. Манассас, штат Вирджиния, США (HTB-20)), SK-BR-3 (карцинома молочной железы, ATCC, г. Манассас, штат Вирджиния, США (HTB-30)), HCC-1954 (карцинома молочной железы, ATCC (CRL-2338)), JIMT-1 (карцинома молочной железы, Addexbio Technologies, г. Сан-Диего, штат Калифорния, США (C0006005)), ZR-75-1 (карцинома молочной железы, ATCC (CRL-1500)) и антигенотрицательных опухолевых клетках MDA-MB-468 (карцинома молочной железы, Addexbio Technologies (C0006003)). Клетки культивировали согласно инструкциям поставщика. Вкратце, за сутки до добавления ADC добавляли клетки (50 мкл/лунку, 1000 клеток/лунку) к стерильным, обработанным тканевым культурам (ТК), 384-луночные планшеты (ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США) и инкубировали в течение ночи при 37 °C/5% CO2, чтобы позволить клеткам прикрепиться к поверхности планшета. В стерильном 96-луночном планшете с U-образным дном 4,3-кратно разбавляли ADC в полной ростовой среде до желаемой конечной максимальной концентрации и титровали в 1:3 в той же среде, создавая 10-точечное титрование для определения зависимости ответа от дозы. На каждый 96-луночный планшет для микротитрования включали контрольные лунки без ADC (только ростовая среда). В каждую лунку 384-луночного планшета, содержащего высеянные клетки, добавляли 15 мкл из 10-точечной титрование для определения зависимости ответа от дозы в трех повторностях, и планшеты инкубировали при 37 oC/5% CO2 в течение 5 ночей. После 5-ночной инкубации количественно определяли жизнеспособность клеток добавлением 20 мкл/лунку CellTiter-Glo® (Promega, г. Мадисон, штат Висконсин, США) и инкубировали при комнатной температуре в течение 30 мин. Люминесценцию измеряли с помощью микропланшетного люминометра. Накопленные относительные световые единицы (ОСЕ) преобразовывали в % цитотоксичности с использованием контроля только ростовой среды, упомянутого выше (% цитотоксичности = 1- [ОСЕ лунки/среднее значение ОСЕ контролей с одной средой]). Данные подгонялись под кривые с помощью нелинейных методов регрессии, доступных в программном обеспечении Prism® (GraphPad Software, г. Ла-Хойя, штат Калифорния, США).
[00341] Результаты показаны на Фиг. 5 и обобщены в таблице 12. Результаты демонстрируют, что оба v17597 и v21252 демонстрируют избирательное уничтожение клеток. Экспрессирующие HER2 линии клеток BT-474, SK-BR-3, HCC1954, JIMT-1 и ZR-75-1 (Фиг. 5A–E) оказались чувствительными как к v17597, так и v21252. Оба v17597 и v21252 были неэффективны против клеток MDA-MB-468 (Фиг. 5F), которые получены из клеточной линии HER2-отрицательной карциномы молочной железы.
Таблица 12. Активность v17597 и v21252 in vitro
ПРИМЕР 4. АНАЛИЗ ПРОЛИФЕРАЦИИ IN VITRO v10000-ЛИНКЕР-ТОКСИНА 001 ПРИ РАЗЛИЧНЫХ СРЕДНИХ DAR
[00342] ADC, состоящие из v10000, конъюгированного с линкер-токсином 001 со средним DAR в диапазоне от 0,7 до 3,9, получали путем варьирования количества TCEP (от 0,5 до 10 молярных эквивалентов), используемого в реакции восстановления. Реакцию конъюгации проводили в соответствии с процедурами, отмеченными в примере 2 и получаемые ADC очищали с использованием колонки Zeba™ 40 кДа, предварительно уравновешенной с помощью ФСБ с pH 7,4.
[00343] Активность in vitro ADC измеряли анализом пролиферации клеток на антигенположительных опухолевых клетках SK-OV-3 (карцинома яичника, ATCC, г. г. Манассас, штат Вирджиния, США (HTB-77)), JIMT-1 (карцинома молочной железы, DSMZ, Брауншвейг, Германия (ACC 589)) и ZR-75-1 (карцинома молочной железы, ATCC (CRL-1500)). Клетки культивировали согласно инструкциям поставщика. Вкратце, за сутки до добавления ADC добавляли клетки (100 мкл/лунку, 2500 клеток/лунку) к стерильным, обработанным ТК, 96-луночные планшеты с матовыми стенками (Corning 3904) и инкубировали в течение ночи при 37 °C/5% CO2, чтобы позволить клеткам прикрепиться к поверхности планшета. На следующий день 5-кратно разбавляли ADC в полной ростовой среде (96-луночный планшет с U-образным дном) до желаемой конечной максимальной концентрации и титровали в 1:3 в той же среде в восемь шагов (всего 9 точек титрования соединения). Включали также контрольную точку титрования, содержащую только ростовую среду, создавая, в целом, 10-точечное титрования для определения ответа в зависимости от дозы. В каждую лунку 96-луночного планшета, содержащего высеянные клетки, добавляли 25 мкл из 10-точечной титрование для определения зависимости ответа от дозы в трех повторностях, и планшеты инкубировали при 37 °C/5% CO2 в течение 5 ночей. После инкубации количественно определяли жизнеспособность клеток добавлением 25 мкл/лунку CellTiter-Glo® (Promega Corporation, г. Мадисон, штат Висконсин, США) и инкубировали при комнатной температуре в течение 30 мин. Люминесценцию измеряли с помощью микропланшетного люминометра и преобразовывали накопленные относительные световые единицы (ОСЕ) в % цитотоксичности, как описано в примере 3.
[00344] Результаты показаны на Фиг. 6. ADC со средними DAR от 3,9 до 1,6 показали сравнительную активность среди трех клеточных линий. Однако ADC со средним DAR 0,7 показало значительное снижение активности. Приблизительные количества отдельных типов DAR, состоящие из ADC с DAR 0,7; DAR 2,2 и DAR 3,9 ; показаны в таблице 13 и на Фиг. 6D. Можно видеть, что ADC с DAR 0,7 содержит приблизительно в три раза больше типов DAR0 (приблизительно 65% по сравнению с приблиз. 20%), чем ADC с DAR 1,9. В свою очередь, ADC с DAR 2,2 содержит значительно больше типов DAR0, чем типов DAR 3,9 (приблиз. 20% по сравнению <3%). Однако ADC с DAR 2,2 показал сравнимую активность in vitro с ADC с DAR 3,9. Эти результаты дают основание предполагать, что может существовать пороговое значение для доли типов DAR0, которую препарат ADC может содержать до нарушения активности ADC.
Таблица 13. Приблизительное распределение DAR для ADC
ПРИМЕР 5. ИНТЕРНАЛИЗАЦИИ БИПАРАТОПНЫХ ADC В HER2-ЭКСПРЕССИРУЮЩИЕ КЛЕТКИ
[00345] Для определения интернализации v21252 соединяли краситель pHAb (Promega Corporation, г. Мадисон, штат Висконсин, США) с аминными остатками v21252, трастузумаб-линкер-токсина 001 и отрицательного контроля ADC в соответствии с рекомендованными производителем протоколами. Отрицательным контролем ADC было анти-RSV белка F антитело, конъюгированное с линкер-токсином 001.
[00346] Применяли также pHAb-конъюгированные антитела для отслеживания рецептор-опосредованной интернализации антител. Антитела, конъюгированные с красителем pHAb, связанные с антигеном на клеточной мембране проявляют минимальную флуоресценцию, но после рецептор-опосредованной интернализации и транспорта через эндосому и лизосомную систему, конъюгат антитела-pHAb подвергается более кислотному pH, вызывая флуоресценцию конъюгата антитело-pHAb.
[00347] pHAb-конъюгированное v21252, pHAb-конъюгированный трастузумаб-линкер-токсин 001 и pHAb-конъюгированный контроль инкубировали с экспрессирующими HER2 линиями клеток SKBR3 и JIMT-1. Вкратце, SKBR3 и JIMT-1 HER2+ опухолевые клетки высаживали на 384-луночные планшеты с черным оптически прозрачным (ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США) по 5000 клеток/лунку в аналитической среде. Планшет инкубировали в течение ночи при 37oC + 5% CO2. На следующие сутки добавляли pHAb-конъюгированные антитела к планшетам в аналитической среде в концентрации 10 мкг/мл и конечной 1 мкг/мл. Добавляли среду, содержащую фиолетовый краситель Vybrant® DyeCycle™ (ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США) в конечной концентрации 2 мкM для визуализации ядер. Планшет инкубировали при 37oC + 5% CO2 в промежуточные моменты времени. Лунки с образцами сканировали в различные моменты времени на платформе CellInsight™ CX5 High Content Screening (HCS) (ThermoFisher Scientific, г. Уолтем, штат Массачусетс, США). Планшет сканировали с использованием объектива 20x в режиме SpotAnalysis Bioapplication с 2 каналами. Канал 1 (385 нм, фиолетовый краситель Vybrant Dye Cycle) использовали как канал для фокусирования, а канал 2 (560 нм, pHAb) использовали для получения данных интернализации. Флуоресценцию интернализированных pHAb-конъюгированных антител измеряли с использованием параметра «средняя общая интенсивность пятна».
[00348] Результаты показаны на Фиг. 13 и 14 и демонстрируют, что v21252 интернализируется и переносится к лизосомам в экспрессирующих HER2 клетках на более высоком уровне, чем моноспецифический трастузумаб-линкер-токсин 001.
ПРИМЕР 6. АКТИВНОСТЬ IN VIVO БИПАРАТОПНЫХ ADC
6.1 ADC с v17597 и v21252 ингибируют рост ксенотрансплантата HBCx-13b, полученного от пациента с раком молочной железы
[00349] Самкам бестимусных мышей (Envigo, г. Хатингдон, Великобритания) подкожно имплантировали фрагмент опухоли объемом 20 мм3 (n=7 на группу). После достижения опухолями размеров от 75 до 200 мм3 животных распределяли на группы лечения и вводили дозы v17597, v21252 или плацебо внутривенной инъекцией в совокупности 2 доз на сутки 1 и сутки 15 (q14d x2) как указано на Фиг. 7. Измерение опухолей выполняли раз в две недели с помощью штангенциркуля. Умерщвляли мышей этичным способом, когда опухоли достигали размера 1764 мм3. Объемы опухолей описывали для каждой группы как среднее значение ± SEM.
[00350] На Фиг. 7A представлены результаты опухолевого ответа у мышей с подкожно имплантированными фрагментами опухолей HBCx-13b после в.в. введения носителя или v17597. На Фиг. 7B представлены результаты опухолевого ответа у мышей с подкожно имплантированными фрагментами опухолей HBCx-13b после в.в. введения носителя или v21252. Данные результаты показывают, что лечение мышей, привитых HBCx-13b, либо v17597, либо v21252 приводят к снижению объема опухолей дозозависимым образом.
6.2 ADC с v17597 и v21252 ингибируют рост ксенотрансплантата ST-910, полученного от пациента с раком молочной железы
[00351] Самкам бестимусных мышей (Charles Rivers Laboratories, г. Уилмингтон, штат Массачусетс, США) подкожно имплантировали ~70 мг фрагмента опухоли (n=6 на группу). После достижения опухолями размеров от 125 до 250 мм3 животных распределяли на группы лечения и вводили дозы v17597, v21252 или плацебо внутривенной инъекцией как указано на Фиг. 8. Измерение опухолей выполняли раз в две недели с помощью цифрового штангенциркуля. Умерщвляли мышей этичным способом, когда опухоли достигали размера 2000 мм3. Объемы опухолей описывали для каждой группы как среднее значение ± SEM.
[00352] На Фиг. 8A представлены результаты опухолевого ответа у мышей с подкожно имплантированными фрагментами опухолей ST-910 после в.в. введения носителя или v17597. На Фиг. 8B представлены результаты опухолевого ответа у мышей с подкожно имплантированными фрагментами опухолей ST-910 после в.в. введения носителя или v21252. Данные результаты показывают, что лечение мышей, привитых ST-910, либо v17597, либо v21252 приводят к снижению объема опухолей дозозависимым образом.
[00353] ST-910 представляет собой ксенотрансплантат, полученный от пациента (PDX), который представлять собой HER2 1+ рак молочной железы, тогда как HBCx-13b (примененный в примере 6.1) представляет собой PDX, который представляет собой HER2 3+ рак молочной железы. Примеры 6.1 и 6.2, таким образом, демонстрируют что оба v17597 и v21252 активны как для HER2 3+, так и HER2 1+ опухолей.
6.3 Фармакокинетический анализ
[00354] Для ксенотрансплантатов HBCx-13b и ST-910, полученных у пациентов, в заранее определенные моменты времени отбирали фармакокинетические образцы на суммарные антитела (неконъюгированные и конъюгированные антитела) и оценивали с использованием анализа на основе ELISA для количественного определения суммарных антител. Концентрации в сыворотке суммарных антител для v21252 или v17597 анализировали первым покрытием 384-луночного планшета для ELISA с козьим античеловеческим IgG Fc антителом (Jackson ImmunoResearch, г. Вест Гров, штат Пенсильвания, США) в ФСБ pH 7,4 и инкубировали при 4 °C в течение ночи. На следующие сутки планшеты промывали и блокировали с использованием аналитического разбавителя и инкубировали при КТ в течение 1 ч. После блокирования добавляли к планшетам образцы стандартной кривой, контроли и образцы разбавленной сыворотки и инкубировали при КТ в течение 1 ч. Затем добавляли на планшеты антитело для выявления, конъюгат HRP-козьего античеловеческого IgG F(ab')2 (Jackson ImmunoResearch), и после 1-часовой инкубации при КТ на планшеты добавляли субстрат пероксидазы хрена (HRP), 3,3',5,5'-тетраметилбензидин (ТМБ). TMB гасили с использованием HCl и измеряли поглощения при 450 нм с использованием считывателя планшетов. На Фиг. 15 показан профиль зависимости концентрации суммарных антител в сыворотке от времени для HBCx-13b (A) и ST-910 (B).
ПРИМЕР 7. ИССЛЕДОВАНИЕ ОДНОДОЗОВОЙ ФАРМАКОКИНЕТИКИ/ПЕРЕНОСИМОСТИ v17597 и v21252 НА ЯВАНСКИХ МАКАКАХ
[00355] Целью данного исследования было определение параметров фармакокинетики (ФК) и переносимости v17597 и v21252 на яванских макаках после однократного введения внутривенной (ВВ) инфузией. Выбирали яванских макак для неклинической оценки безопасности как v17597, так и v21252, на основе гомологии последовательностей и аффинности связывания. HER2 человека и яванского макака имеют 98% гомологию последовательностей, поэтому гомология последовательностей для HER2 собаки и мыши/крысы составляет 93% и 88%, соответственно. Кроме того, v17597 и v21252 связываются с HER2 яванского макака со сходной аффинностью HER2 человека (KD макака = 0,55x10-9; KD человека = 0,83x10-9) и не связываются с HER2 собаки, мыши или крысы.
[00356] Данное исследование демонстрирует, что хорошо переносилось однократное дозирование v17597 при дозах 3, 6 или 9 мг/кг, и что хорошо переносилось однократное дозирование v21252 при дозах 9 или 12 мг/кг.
Материалы и методы
Переносимость
[00357] Одну дозу v17597 (3, 6 или 9 мг/кг) или v21252 (9 мг/кг или 12 мг/кг) вводили путем ВВ инфузии на протяжении 60 минут самкам яванского макака (N=3). Общую переносимость оценивала по клиническим наблюдениям, массе тела, потреблению пищи и клинической патологии (гематологические анализы и анализы клинической химии). Кровь отбирали на протяжении всего исследования для биоаналитического анализа v17597 или v21252, определения суммарных антител и свободного токсина (соединение 9). Дизайн исследования обобщен в таблице 14.
Таблица 14. Дизайн исследования однодозовой фармакинетики и общей переносимости на яванских макаках
Биоаналитические методы
[00358] v17597 и v21252: Анализировали сывороточные концентрации v17597 или v21252 (DAR равное 1 или больше) с использованием электрохемилюминисцентного анализа на платформе Meso Scale Discovery (ECL/MSD) (Meso Scale Diagnostics, LLC, г. Роквилл, штат Мэриленд, США) с помощью мышиного IgG в качестве агента захвата и анти-пертузумаб сульфо-МАРКЕРа в качестве агента выявления.
[00359] Суммарные антитела: Биоаналитический анализ суммарных антител измерял антительный компонент v17597 или v21252 независимо от того, конъюгировано ли антитело с токсином (при всех значениях DAR) или нет. Анализировали сывороточные концентрации суммарных антител с использованием электрохемилюминисцентного анализа на платформе Meso Scale Discovery (ECL/MSD) (Meso Scale Diagnostics, LLC, г. Роквилл, штат Мэриленд, США) с помощью анти-пертузумаб антитела в качестве агента захвата и анти-трастузумаб сульфо-МАРКЕРа в качестве агента выявления.
[00360] Токсин (соединение 9): Концентрации в сыворотке токсина анализировали с использованием метода ЖХ-МС/МС. Образцы сыворотки осаждали ацетонитрилом/ метанолом (50:50, об./об.) и анализировали супернатанты. Использованная система жидкостной хроматографии применяла обращенно-фазную колонку с градиентным потоком, состоящим из воды/уксусной кислоты (100/0,05, об./об.) и ацетонитрила. Токсин и внутренний стандарт (токсин-d4; дейтерированное соединение 9) выявляли с помощью масс-спектрометра с тройным квадруполем, оснащенного источником с ионизацией электрораспылением (ESI), работающим в режиме генерации положительных ионов.
Фармакокинетический анализ
[00361] Применяли некомпартментный анализ биоаналитических результатов анализа образцов сыворотки для получения ФК параметров (максимальная сывороточная концентрация [Cmax], конечный период полувыведения [T1/2], клиренс [CL] и кажущийся объем распределение [Vss]).
Результаты
Фармакокинетика
[00362] v17597: Воздействие v17597, в целом, было пропорционально дозе от 3 до 9 мг/кг. Cmax достигалась в конце 60-минутной инфузии (медианное Tmax) и увеличивалась пропорционально дозе. Системное воздействие (AUC0–∞) увеличивалось немного больше, чем пропорционально дозе. Предварительное среднее конечное время полувыведения (T1/2) обычно увеличивалось с увеличением дозы, клиренс (CL) обычно сокращался с увеличением дозы, и кажущийся объем распределения (Vss), в целом, по-видимому, не изменялись с дозой.
[00363] v21252: Воздействие v21252, в целом, было пропорционально дозе от 9 до 12 мг/кг. Cmax достигалась в конце 60-минутной инфузии (медианное Tmax) и увеличивалась пропорционально дозе. Профиль зависимости концентрации v21252 в сыворотке от времени показан на Фиг. 9A. Системное воздействие (AUC0–∞) увеличивалось немного больше, чем пропорционально дозе. Предварительное среднее конечное время полувыведения (T1/2), клиренс (CL) и кажущийся объем распределения (Vss), в целом, по-видимому, не изменялись с дозой.
[00364] Суммарные антитела (конъюгированные и неконъюгированные): Максимальная концентрация в сыворотке суммарных антител (Cmax) достигалась в конце 60-минутной инфузии (медианное Tmax). Профиль для v21252 зависимости концентрации суммарных антител в сыворотке от времени показан на Фиг. 9B. Для получения ФК параметров применяли некомпартментную модель. Cmax увеличивалась пропорционально дозе, в то время как AUC0–∞ увеличилась немного больше, чем пропорционально дозе как для v17597, так и для v21252. Средний конечный период полувыведения v17597 увеличивался с увеличением дозы, в то время как клиренс из сыворотки (CL) и общий кажущийся объем распределения (Vss) суммарных антител уменьшались с увеличением дозы. Средний конечный период полувыведения и общий кажущийся объем распределения (Vss) v21252 увеличивался с увеличением дозы, в то время как клиренс из сыворотки (CL) суммарных антител уменьшался с увеличением дозы.
[00365] Токсин (соединение 9): После введения одной дозы v17597 (3, 6 или 9 мг/кг) или v21252 (9 мг/кг или 12 мг/кг) все концентрации токсина в сыворотке были ниже нижнего предела количественного определения (LLOQ, < 5,00 нг/мл).
Переносимость
[00366] Хорошо переносилось однократное дозирование v17597 (3, 6 или 9 мг/кг) или v21252 (9 или 12 мг/кг). В ходе исследования не было зарегистрировано ни одного летального случая. В клинических наблюдениях по потреблению пищи или массе тела не было отмечено никаких эффектов, связанных с лечением.
[00367] У некоторых животных наблюдались минимальные или умеренные изменения параметров клинической патологии, которые считались связанными с лечением. Среди конечных точек по гематологии ни в одной из групп лечения не было обнаружено эффектов, связанных с исследуемым препаратом. Все отклонения рассматривались в пределах ожидаемых диапазонов для биологических и/или связанных с процедурой отклонений, несмотря на любые явные различия между отдельными значениями.
ПРИМЕР 8. НЕ-GLP ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ v17597 НА ЯВАНСКИХ МАКАКАХ
[00368] Не-GLP исследование токсичности проводили для изучения токсикокинетики и токсичности v17597 на яванских макаках. Исследование было разработано на основе результатов исследования однодозовой фармакокинетически/переносимости у самок яванского макака (пример 6).
[00369] Исследование продемонстрировало, что введение v17597 еженедельно в дозах 2,25 и 4,5 мг/кг и раз в две недели в дозах 4,5 и 9 мг/кг не было хорошо переносимым у самцов и самок яванского макака. Не вызывающий побочных эффектов уровень дозы (NOAEL) и наивысшая нетяжелая токсическая доза (HNSTD) для v17597 после еженедельного или двухнедельного введения в течение до 6 недель считались ниже 2,25 мг/кг при введении еженедельно, или 4,5 мг/кг при введении раз в две недели.
Материалы и методы
[00370] Носитель или v17597 вводили путем 1-часовой ВВ инфузии еженедельно на сутки 1, 8, 15, 22, 29 и 36 в дозах 0, 2,25 и 4,5 мг/кг, и один раз в две недели на сутки 1, 15 и 29 в дозах 4,5 и 9 мг/кг. У всех животных оценивали изменения клинических признаков, потребление пищи, массу тела, артериальное давление, ЭКГ, частоту дыхания (визуально), клиническую патологию (гематологию, клиническую химию, коагуляцию, анализ мочи), массу органов и проводили макроскопическое/микроскопическое исследование тканей. Отбирали кровь для токсикокинетического анализа и анализа на антитела против лекарственного вещества (ADA). Исследование животных с еженедельным введением доз прекращали на сутки 42, и животных с введением доз раз в две недели — на сутки 36. Дизайн исследования представлен в таблице 15.
Таблица 15. Дизайн исследования
Результаты
[00371] На основании массы тела, клинических наблюдений и результатов по клинической патологии, конъюгат v17597 был признан неблагоприятным во всех дозах, проверенных в этом исследовании. Животные при дозе 9 мг/кг/дозу (раз в две недели) и одна самка при дозе 4,5 мг/кг/дозу (раз в две недели) были исключены из исследования досрочно и получали дозы только на сутки 1 и 15.
[00372] На основании результатов этого исследования не вызывающий побочных эффектов уровень дозы (NOAEL) и наивысшая нетяжелая токсическая доза (HNSTD) для v17597 после еженедельного или двухнедельного введения в течение до 6 недель считались ниже 2,25 мг/кг при введении еженедельно, или 4,5 мг/кг при введении раз в две недели.
ПРИМЕР 9. НЕ-GLP ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ v21252 НА ЯВАНСКИХ МАКАКАХ
[00373] Целью данного исследования было дальнейшее определение параметров токсикокинетики и токсичности v21252.
[00374] Исследование продемонстрировало, что введение v21252 на сутки 1, 15 и 29 в дозах до 12 мг/кг клинически хорошо переносилось у самцов и самок яванского макака. Не вызывающий побочных эффектов уровень дозы (NOAEL) составил 12 мг/кг и наивысшая нетяжелая токсическая доза (HNSTD) составила более 12 мг/кг.
Материалы и методы
[00375] В данном исследовании носитель или v21252 вводили самцам и самкам яванского макака путем 1-часовой ВВ инфузии один раз в две недели на сутки 1, 15 и 29 в дозах 0, 9 и 12 мг/кг (3 животных на один пол для каждого уровня дозы). У всех животных оценивали изменения клинических признаков, потребление пищи, массу тела, артериальное давление, ЭКГ, частоту дыхания (визуально), клиническую патологию (гематологию, клиническую химию, коагуляцию, анализ мочи), массу органов и проводили макроскопическое/микроскопическое исследование тканей. Отбирали кровь для токсикокинетического (ТК) анализа (v21252, суммарные антитела и свободный токсин (соединение 9)) и анализа на антитела против лекарственного вещества (ADA), и прекращали исследование животных на сутки 36. Другой группе животных вводили одну дозу равную 12 мг/кг v21252 на сутки 1 и прекращали исследование через 4, 8 и 15 суток после дозирования (n=2 на момент времени). Дизайн исследования представлен в таблице 16.
Таблица 16. Дизайн не-GLP исследования токсичности
Результаты
Фармакокинетика
[00376] v21252: Параметры фармакокинетики рассчитывали после повторного введения v21252. (Cmax) достигалась либо в конце 60-минутной инфузии, либо через 60 минут после завершения инфузии (медианное Tmax). Профиль зависимости концентрации v21252 в сыворотке от времени показан на Фиг. 10. На сутки 1 Cmax и системное воздействие (AUC0–168ч) увеличивалось немного больше, чем пропорционально дозе. На сутки 29 Cmax и системное воздействие (AUC0–168ч) увеличивалось приблизительно пропорционально дозе. Системное воздействие и AUC0–168ч, по-видимому, не изменялись и не показали накопления после повторных введений. Средние периоды полувыведения (T1/2) увеличивались от группы, получавшей 9 мг/кг, до группы, получавшей 12 мг/кг. Механизм насыщаемого клиренса для v21252 может объяснить разницу в T1/2 и разницу клиренса между группами, получавшими низкие (9 мг/кг) и высокие (12 мг/кг) дозы.
[00377] Суммарные антитела (конъюгированные и неконъюгированные): Суммарные антитела измеряли у яванских макак после повторных введений v21252. Cmax для суммарных антител достигалась в конце 60-минутной инфузии (медианное Tmax). Профиль зависимости концентрации суммарных антител в сыворотке от времени показан на Фиг. 11. На сутки 1 Cmax и системное воздействие (AUC0–168ч) увеличивалось немного больше, чем пропорционально дозе. На сутки 29 Cmax и системное воздействие (AUC0–168ч) увеличивалось приблизительно пропорционально дозе. Системное воздействие и AUC0–168ч не изменялись и не показали накопления после повторных введений. Аналогично v21252, средние периоды полувыведения (T1/2) для суммарных антител увеличивались от группы, получавшей 9 мг/кг, до группы, получавшей 12 мг/кг.
[00378] Фармакокинетика v21252, как показано профилями для v21252 и суммарных антител зависимости концентрации в сыворотке от времени, указывает на минимальную потерю линкер-токсина из v21252 in vivo (см. Фиг. 12).
[00379] Токсин (соединение 9): Содержание свободного токсина измеряли у яванских макак после повторных введений v21252. Все концентрации нагрузки (соединение 9) в сыворотке была ниже предела количественного определения (< 0,500 нг/мл), за исключением одной самки при дозе 12 мг/кг на сутки 1, одной самки при дозе 9 мг/кг на сутки 29 и одного самца при дозе 12 мг/кг на сутки 29.
[00380] Антитела против лекарственного вещества (ADA): Проводили скрининг анти-v21252 антител у яванских макак после повторных введений v21252. ADA выявили в сыворотке одной самки в когорте дозирования 9 мг/кг.
Токсичность
[00381] В целом, введение v21252 хорошо переносилось клинически при всех тестированных дозах. Никаких изменений, связанных с лечением, в мочеиспускании, параметрах ЭКГ или частоте дыхания не наблюдалось.
[00382] Спорадическое, минимальное влияние на массу тела отдельных особей отмечалось у животных, получавших повторные введения v21252 при 12 мг/кг/дозу. Эти животные полностью или частично восстановились на сутки 35. Все остальные животные либо поддерживали, либо набирали массу в течение всего исследования.
[00383] У некоторых животных наблюдались минимальные или легкие изменения клинических признаков, клинической патологии, массы органов или результатов макроскопического/микроскопического исследования тканей. Макроскопические наблюдения, рассмотренные в связи с v21252, ограничивались покраснением, наблюдаемым в месте инфузии у всех животных, в том числе контрольных. Связанные с исследуемым препаратом изменения массы ограничивались селезенкой. У животных, которых прекратили исследовать на сутки 36 после 3 дозирований раз в две недели, связанные с лечением микроскопические эффекты включали изменения в желудочно-кишечном тракте, печени, селезенке, лимфатических узлах, поджелудочной железе, коже и местах ВВ инфузий. Все они классифицировались как минимальные или умеренные. У животных, которых прекратили исследовать в различные моменты времени после однократной дозы 12 мг/кг, наблюдали аналогичные минимальные или умеренные эффекты, связанные с исследуемым препаратом.
[00384] ФК анализ подтвердил системное воздействие у животных, прошедших лечение v21252, и среднее системное воздействие увеличивалось с увеличением дозы пропорционально дозе для v21252 и суммарных антител, в то время как воздействие свободного токсина (соединение 9) наблюдалось лишь на низких уровнях у нескольких животных.
[00385] В таблицах 17-20 показано сравнение результатов исследований ФК/переносимости и не-GLP исследований повторных дозирований для v17597 и v21252.
Таблица 17. Сравнение летальности, наблюдаемой в однодозовом исследовании и исследовании повторных дозирований для v17597 и v21252 у яванских макак
Переносимость
Переносимость
Таблица 18. Сравнение NOAEL и HNSTD, определенных в исследовании повторных дозирований для v17597 и v21252 у яванских макак
(<2,25 мг/кг)
(<4,5 мг/кг)
(<2,25 мг/кг)
(<4,5 мг/кг)
Таблица 19. Биоаналитический анализ ADC
Первая доза
(ч*мкг/мл)
Последняя доза
(ч*мкг/мл)
# По сравнению с v17597 при 4,5 мг/кг
Таблица 20. Биоаналитический анализ суммарных антител
Первая доза
(ч*мкг/мл)
# По сравнению с v17597 при 4,5 мг/кг
Выводы
[00386] Аналоги ауристатина общей формулы (I) показали, что обладают хорошей переносимостью in vivo при введении мышам. Конъюгация соединения 9 с моноспецифическим анти-HER2 антителом трастузумабом со средним DAR4, создавала ADC, которая показала отличную переносимость у яванских макак с наивысшей нетяжелой токсической дозой (HNSTD) равной 18 мг/кг. Напротив, ADC, содержащий соединение 9, конъюгированное с бипаратопным анти-HER2 антителом, v10000, со средним DAR4 (v17597), показал значительно сниженную переносимость с HNSTD менее 4,5 мг/кг (пример 8). Не ограничиваясь какой-либо конкретной теорией, предлагается, что сниженная переносимость, наблюдаемая для v17597, может быть частично вызвана повышенным целевым связыванием и интернализацией бипаратопного антитела по сравнению с моноспецифическим трастузумабом, что приводит к повышенной целевой токсичности и/или сниженной доли DAR0 или оголенных типов со средним DAR4 (v17597) по сравнению со средним DAR2 (v21252), что увеличивает токсичность, связанную с более высокими значениями DAR (DAR2, DAR4 и DAR6), и/или увеличенная доля типов DAR6 со средним DAR4 по сравнению со средним DAR2 увеличивает токсичность, связанную с самыми типами с самыми высокими значениями DAR.
[00387] Однако было неожиданно обнаружено, что ADC, содержащий соединение 9, конъюгированное с v10000 со средним DAR2 (v21252), показал намного более улучшенную переносимость с HNSTD равной 12 мг/кг (пример 9). Этот результат является неожиданным, поскольку ранее было показано, что токсичность ADC, включающих либо монометилауристатин E (MMAE), либо майтанзиноид, напрямую коррелирует с общим количеством лекарственного вещества, прикрепленного к антителу, т. е. связь между DAR и максимально допустимой дозой для ADC является линейной (Hamblett, et al., Clin. Cancer Res., 10:7063–7070 (2004); Sun, et al., Bioconj Chem., 28:1371–81 (2017)). Конкретно, максимальная переносимая доза ADC с 8 молекулами лекарственных веществ на антитело составила 50 мг/кг и максимальная переносимая доза (MTD) ADC с 4 молекулами лекарственных веществ на антитело (т. е. с половинным количеством токсина) составила 100 мг/кг (Hamblett, et al., там же). А именно, ADC с половинным количеством токсина ADC DAR8, при введении с одной и той же дозой антител, показал MTD в два раза превышающую такую для DAR8 ADC.
[00388] Конъюгат v21252 имел DAR равное 2 и, таким образом, половинное количество токсина от v17597 при введении при той же дозы антитела. Поэтому, исходя из предыдущих исследований с v17597, ожидалось, что количество v21252, которое будет переноситься, будет менее 9 мг/кг (т. е. 2x максимальной дозой, переносимой для v17597). Тем не менее, как показано в примере 9, введенный яванским макакам v21252 переносился в дозах либо 9, либо 12 мг/кг каждые две недели в объеме трех доз, и дозу 12 мг/кг, приняли как не вызывающий побочных эффектов уровень (NOAEL).
[00389] Важно отметить, что v21252 обладает меньшей токсичностью и большей переносимостью по сравнению с v17597, когда выполняли дозирование раз в две недели, несмотря на то, что он обладает большим воздействием. На основании не-GLP токсикологического исследования на яванских макаках (пример 8), было установлено, что v17597 дает неблагоприятные показатели в дозировках 4,5 и 9 мг/кг, получаемых раз в две недели. Тем не менее, в аналогичном не-GLP исследовании (пример 9), v21252 не считалось дающим негативные показатели при дозировках раз в две недели как 9 мг/кг, так и 12 мг/кг, несмотря на приблизительно от 1,8 до 4,6 кратные увеличения воздействия (AUC0–336ч после первой дозы или AUC0–168чпоследней дозы) по сравнению с 4,5 мг/кг v17597 (данные обобщены в таблицах 19 и 20).
[00390] Кроме того, v21252 продемонстрировало эффективность in vivo на уровнях воздействия, которые, как показано, переносились у яванских макак. Конкретно, полные ответы достигались в моделях ксенотрансплантатов, полученных у пациентов, как для опухолей с высоким уровнем HER2, так и с низким уровнем HER2 при воздействиях, переносимых у яванских макак, как обобщено на Фиг. 15 (см. также, пример 6).
ПРИМЕР 10. НЕ-GLP ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ v21252 НА ЯВАНСКИХ МАКАКАХ
[00391] В последующем GLP исследовании токсичности вводили v21252 яванским макакам раз в каждые две недели в количестве 0, 6, 12 и 18 мг/кг в объеме 4 доз с периодом восстановления 6 недель. Определили наивысшую нетяжелую токсическую дозу (HNSTD) равную 18 мг/кг. Конъюгат v21252 хорошо переносился при всех дозах. Никакие клинические наблюдения не были сочтены неблагоприятными, и в этом GLP исследовании не наблюдалось летальности. Единственным систематическим клиническим наблюдением был усиленный понос. При всех дозах не наблюдалось изменение массы тела, и никакие показатели клинической патологии (функция печени — активность аспартат-трансаминазы и аланин-трансаминазы, гематология — нейтрофилы, тромбоциты, гемоглобин, лимфоциты) не считались неблагоприятными. Воздействие (Cmax и AUC0–168ч) v21252 было практически идентичным, воздействию v10000 (только антитело).Ниже приведено подробное описание исследования.
[00392] Целью данного GLP исследования было дальнейшее определение параметров токсикокинетики и токсичности v21252, вводимого 4 раза внутривенно яванским макакам.
[00393] В GLP исследовании токсичности вводили v21252 самцам и самкам яванского макака на сутки 1, 15, 29 и 43 в дозах 0, 6, 12 и 18 мг/кг с периодом восстановления 6 недель. Не вызывающий побочных эффектов уровень дозы (NOAEL) составил 12 мг/кг и наивысшая нетяжелая токсическая доза (HNSTD) составила 18 мг/кг.
Материалы и методы
[00394] В данном исследовании носитель или v21252 вводили самцам и самкам яванского макака путем 1-часовой ВВ инфузии один раз в две недели на сутки 1, 15, 29 и 43 в дозах 0, 6, 12 и 18 мг/кг (4 животных на один пол для каждого уровня дозы и дополнительно 2 животных на пол при 0, 12 и 18 мг/кг для оценки восстановления). У всех животных оценивали изменения клинических признаков, потребление пищи, массу тела, артериальное давление, ЭКГ, частоту дыхания (визуально), клиническую патологию (гематологию, клиническую химию, коагуляцию, анализ мочи), массу органов и проводили макроскопическое/микроскопическое исследование тканей. Отбирали кровь для токсикокинетического (ТК) анализа (v21252, суммарные антитела и свободный токсин (соединение 9)) и анализа на антитела против лекарственного вещества (ADA), и прекращали исследование животных на сутки 50 и через 6 недель восстановления на сутки 92. Дизайн исследования представлен в таблице 21.
Таблица 21. Дизайн GLP исследования токсичности
Результаты
Фармакокинетика
[00395] v21252: Медианные концентрации v21252 в сыворотке наблюдали через 1 час после начала инфузии (SOI) на сутки 1 и 43. После введения v21252 раз в две недели средние значения Cmax и AUC для v21252 увеличивались с увеличением дозы. Увеличения Cmax были приблизительно пропорциональными дозе на сутки 1. На сутки 1, 1:2:3 кратное увеличение дозы v21252 привело к приблизительно 1:2,3:3,3 кратному увеличению значений Cmax, приблизительно 1:2,6:3,8 кратному увеличению средних значений AUC0–168ч, и приблизительно 1:2,9:4,5 кратному увеличению значений AUC0–336ч. На сутки 43 Cmax и AUC,0–168ч были приблизительно пропорциональными. На сутки 43, 1:2:3 кратное увеличение дозы v21252 привело к приблизительно 1:2,5:3,5 кратному увеличению значений Cmax и приблизительно 1:3,2:4,7 кратному увеличению значений AUC0–168ч. Системное воздействие v21252, по-видимому, не изменилось после повторной ВВ инфузии раз в две недели при 6 мг/кг. Однако, в целом, оказалось, что воздействие увеличивалось после повторной ВВ инфузии раз в две недели при 12 и 18 мг/кг. Средние соотношения накопления AUC0–168ч составили 1,20; 1,47 и 1,50 при 6, 12 и 18 мг/кг, соответственно. Отдельные соотношения AUC0–168ч находились в диапазонах от 1,01 до 1,64 при 6 мг/кг, от 1,17 до 1,95 в дозе 12 мг/кг и от 0,983 до 2,08 при 18 мг/кг.
[00396] Суммарные антитела (конъюгированные и неконъюгированные): Медианные пиковые концентрации суммарных антител в сыворотке наблюдали через 1 час после SOI v21252 на сутки 1 и 43. После введения v21252 раз в две недели средние значения Cmax и AUC0–168ч для суммарных антител увеличивались с увеличением дозы. На сутки 1, 1:2:3 кратное увеличение дозы v21252 привело к приблизительно 1:2,1:3,3 кратному увеличению значений Cmax, приблизительно 1:2,4:3,8 кратному увеличению значений AUC0–168ч, и приблизительно 1:2,8:4,5 кратному увеличению средних значений AUC0–336ч. На сутки 43, 1:2:3 кратное увеличение дозы v21252 привело к приблизительно 1:2,6:3,9 кратному увеличению значений Cmax и приблизительно 1:3,1:4,8 кратному увеличению значений AUC0–168ч. Системное воздействие на содержание суммарных антител, по-видимому, не изменилось после повторной ВВ инфузии v21252 раз в две недели при 6 мг/кг. Однако обнаружилось его увеличение после повторной ВВ инфузии v21252 раз в две недели при 12 и 18 мг/кг. Средние соотношения накопления AUC0–168ч составили 1,20; 1,47 и 1,50 при 6, 12 и 18 мг/кг, соответственно.
[00397] Токсин (соединение 9): Содержание свободного токсина измеряли после повторных введений v21252. Наибольшие концентрации токсина (Соединения 9) в сыворотке были ниже количественного предела определения (< 0,500 нг/мл). Отмечены следующие исключения: у одной самки при 12 мг/кг на сутки 43 отмечена одна количественно определяемая концентрация токсина (соединение 9) (0,513 нг/мл через 72 ч после введения дозы); у одного самца при 18 мг/кг на сутки 29 отмечена одна количественно определяемая концентрация токсина (соединение 9) (0,532 нг/мл через 1 час после SOI); у каждого из двух самцов и двух самок при 18 мг/кг на сутки 43 отмечена одна количественно определяемая концентрация токсина (соединение 9) (0,555; 0,505; 0,556 и 0,653 нг/мл, соответственно, через 24 ч после SOI); и у одного самца при 18 мг/кг на сутки 43 отмечено четыре последовательных количественно определяемых концентраций токсина (соединение 9) со значением AUC0–168ч 125 ч*нг/мл.
[00398] Антитела против лекарственного вещества (ADA): Провели скрининг на ADA в совокупности 144 образцов для всех когорт дозирования. Семь образцов были определены как положительные в анализе подтверждения/иммуноистощения, включая одно контрольное животное и предварительно исследуемый образец, взятый у проходящего лечение животного. Эти два последних образца были сочтены относящимися к ранее существовавшим реактивным антителам и не связанными с воздействием v21252. Для пяти оставшихся положительных образцов у одной самки, получившей дозу 18 мг/кг, на сутки 43 был обнаружен выявляемый титр, а у остальных 4 животных (2 самки, получившие дозу 12 мг/кг, и один самец и одна самка, получившие дозу 18 мг/кг) на сутки 92 на момент восстановления обнаружены выявляемые титры. Хотя фактические результаты по анти-v21252 антителам не предполагают сильного иммуногенного ответа у большинства животных, циркулирующий v21252 может связываться с анти-v21252 антителами, ограничивая обнаружение антител в этом формате анализа. Однако, маловероятно, что ADA существенно влияли на ФК v21252, так как на сутки 43 дозирования по сравнению с сутками 1 дозирования никаких изменений данных зависимости концентрации в сыворотке от времени не наблюдалось.
Токсичность
[00399] Введение повторных доз v21252 (раз в две недели x4), в целом, хорошо переносилось. При офтальмологической и электрокардиографической оценках, визуальных показателях дыхания, мочеиспускания или оценках тропонина I не было зарегистрировано ни одного летального случая, связанного с v21252, и не было отмечено никаких эффектов. Во время лечения или периодов восстановления после приема v21252 не было отмечено никаких изменений параметров массы тела, связанных с v21252.
[00400] У животных, которым вводили повторные дозы v21252 ≥ 6 мг/кг, отмечена увеличенная частота образования мягких/водянистых фекалий. Кроме того, у самцов и самок иногда отмечалась спорадическая утрата аппетита при 18 мг/кг, а у самок сгорбленная поза при 18 мг/кг. После периода восстановления, потеря аппетита и сгорбленная поза отсутствовали, в то же время частота образования мягких/водянистых снизилась или они перестали образовываться, что свидетельствует о реверсии связанных с v21252 эффектов. В ходе исследования животным предоставляли жидкость/питательные добавки (замороженный рацион Gatorade и PeptoPro®) в связи с повторными наблюдениями появления мягких/жидких фекалий. Самкам, получавшим повторное введение v21252, давали жидкость и/или питательные добавки на сутки 4 (6 и 18 мг/кг) или на сутки 8 (12 мг/кг) до завершения периода лечения. Аналогичным образом, самцам, получавшим повторное введение v21252, давали жидкость и/или питательные добавки на сутки 8 (12 мг/кг) или на сутки 7 (18 мг/кг) до завершения периода лечения. Во время восстановления не предоставляли жидкостей или добавок.
[00401] Показатели клинической патологии не рассматривались как неблагоприятные из-за ограниченной тяжести и обратимости показателей. Изменения в гематологии, связанные с исследуемым препаратом, включали: увеличение количеств моноцитов, морфологические изменения у нейтрофилов, уменьшение количества ретикулоцитов и эритроцитарной массы (эритроцитов, гемоглобина и гематокрита) с сопутствующим увеличением ширины распределения эритроцитов. Отмечены от минимальных до умеренных увеличений средних концентраций фибриногена относительно средних значений исходного уровня на сутки от 8 до 50 у самцов при 18 мг/кг и у самок при ≥ 12 мг/кг. Эти изменения были связанными с исследуемым препаратом и являются показателем иммунного или воспалительного стимула. Эти изменения исчезли на сутки 92. Связанные с лечением изменения наблюдали по фосфору, общему белку, альбумину, глобулину и цитруллину.
[00402] В таблицах 22–25 показано сравнение результатов из не-GLP исследований повторных дозирований для v17597 и v21252, и GLP исследования для v21252.
Таблица 22. Сравнение летальности, наблюдаемой в исследовании повторных доз раз в две недели для v17597 и v21252 у яванских макак
Всего животных
Всего животных
0/12
0,96 мг/кг
Таблица 23. Сравнение NOAEL и HNSTD, определенных в исследовании повторных дозирований раз в две недели для v17597 и v21252 у яванских макак
(Кумулятивная доза токсина)
(Кумулятивная доза токсина)
(<0,54 мг/кг)
(0,96 мг/кг)
(<0,54 мг/кг)
(1,44 мг/кг)
Таблица 24. Сравнение ФК параметров ADC для v17597 DAR4 и v21252 DAR2 (доза токсина совпадает)
Первая доза
(ч*мкг/мл)
Первая доза
(часов)
(9 мг/кг)
# По сравнению с v17597 DAR4 при 4,5 и 9 мг/кг
Таблица 25. Сравнение ФК параметров суммарных антител для v17597 DAR4 и v21252 DAR2 (доза токсина совпадает)
Первая доза
(ч*мкг/мл)
Первая доза (часов)
# По сравнению с v17597 при 4,5 и 9 мг/кг
Выводы
[00403] Определили наивысшую нетяжелую токсическую дозу (HNSTD) v21252 равную 18 мг/кг. Конъюгат v21252 хорошо переносился при всех дозах. Никакие клинические наблюдения не были сочтены неблагоприятными, и в этом GLP исследовании не наблюдалось летальности. Единственным систематическим клиническим наблюдением был усиленный понос.При всех дозах не наблюдалось изменение массы тела, и никакие показатели клинической патологии (функция печени — активность аспартат-трансаминазы и аланин-трансаминазы, гематология — нейтрофилы, тромбоциты, гемоглобин, лимфоциты) не считались неблагоприятными. Эти результаты GLP токсикологии подтверждают клиническую дозировку, превышающую прогнозируемые эффективные дозы у людей.
[00404] Однако было неожиданно обнаружено, что ADC, содержащий соединение 9, конъюгированное v10000 со средним DAR2 (v21252), показал намного улучшенную переносимость по сравнению с ADC со средним DAR4 (v17597) с HNSTD равной 18 мг/кг. Этот результат является неожиданным, поскольку ранее было показано, что соединение 9 токсина, конъюгированное с v10000 при среднем DAR4 (v17597) при введении с дозой токсина 0,36 мг/кг, ассоциировалось с летальным исходом либо при сразу после дозирования (с одной дозой 9 мг/кг), либо при суб-длительном введении (с двумя дозами 4,5 мг/кг, разделенными двумя неделями) (пример 8). В отличие от этого, когда вводили v21252 (DAR2) при дозе 0,36 мг/кг токсина (соединения 9) в совокупности четырех доз (кумулятивная доза токсина 1,44 мг/кг), отсутствовала летальность и существенно снижалась токсичность по сравнению с v17597. К примеру, v21252, вводимое при кумулятивной дозе 0,96 мг/кг токсина (соединение 9), ассоциировали с отсутствием неблагоприятных показателей и определяли ее как не вызывающий побочных эффектов уровень (NOAEL). Кроме того, кумулятивную дозу 1,44 мг/кг токсина (соединение 9) вводили с 18 мг/кг v21252 в объеме 4 доз, и она была переносимой. Это в четыре раза более высокая доза, чем доза v17597, которая ассоциирована с летальностью (0,36 мг/кг).
[00405] Важно отметить, что, v21252 имеет меньшую токсичность и более высокую переносимость по сравнению с v17597 при дозировании раз в две недели, даже несмотря на то, что она обеспечивает приблизительно в два раза большее воздействие (AUC0–336ч после первой дозы) и имеет в два раза более длительный период полувыведения после первой дозы, по сравнению с дозами с совпадающим количеством токсина (4,5 мг/кг v17597 относит. 9 мг/кг v21252, и 9 мг/кг v17597 относит. 18 мг/кг v21252) (обобщено в таблицах 24 и 25).
ПРИМЕР 11. v21252 ИНГИБИРУЕТ IN VIVO РОСТ КСЕНОТРАНСПЛАНТАТА С НИЗКИМ УРОВНЕМ HER2, ПОЛУЧЕННЫМ У ПАЦИЕНТА
[00406] LTL-654 получен из серозной карциномы яичника пациента с метастазами и оценен методами иммуногистохимии (ИГХ) как HER2 отрицательный. Ранний биоптат оценен методом ИГХ как HER2 неопределенный.
[00407] Самкам мышей NOD Rag гамма (NRG) подкожно имплантировали через почечную капсулу двумя опухолевыми фрагментами LTL-654, приблизительно по 15 мм3 каждый. Животных случайным образом распределяли в одну из двух групп слепого лечения по шесть животных в каждой, когда средние объемы опухолей достигали 70,3-77,8 мм3.
[00408] Животных лечили либо носителем, либо 3 мг/кг v21252, который внутривенно вводили раз в неделю в общей совокупности четырех инъекций (qwx4) (таблица 21). Измеряли объем опухоли с использованием системы визуализации Vevo®3100 (FUJIFILM VisualSonics, Inc., г. Торонто, Канада) с использованием трехмерного (3D) режима. С помощью программного обеспечения Vevo® LAB v2.1.0 (FUJIFILM VisualSonics, Inc.) записывали и анализировали множество изображений (от 70 до 100 на опухоль) по всей опухоли. Размер опухоли измеряли раз в неделю после рандомизации вплоть до суток 24. Умерщвляли мышей этичным способом, когда отдельные опухоли достигали размера 1500 мм3. Объемы опухолей описывали для каждой группы как среднее значение +SEM.
[00409] На Фиг. 16 представлены результаты опухолевого ответа у мышей с подкожно имплантированными фрагментами опухолей LTL-654 после в.в. введения носителя или v21252, которые демонстрируют, что лечение привитых LTL-654 мышей с помощью v21252 ингибирует скорость роста опухолевых ксенотрансплантатов LTL-654.
[00410] Этот пример демонстрирует, что v21252 является эффективным для полученного от пациента ксенотрансплантата, в котором экспрессия HER2 значительно ниже для оценивания методом ИГХ как HER2 отрицательная.
Таблица 21. Дизайн исследования с PDX моделью рака яичника LTL-654
(мг/кг)
ПРИМЕР 12. v21252 ПРОДЛЕВАЕТ ВЫЖИВАЕМОСТЬ МЫШЕЙ, СОДЕРЖАЩИХ ИМПЛАНТИРОВАННЫЕ ВНУТРЬ ЧЕРЕПА ОПУХОЛИ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА IN VIVO
[00411] Конструкции, примененные в этом примере были следующими: контрольный конъюгат (гуманизированное антитело против респираторно-синцитиального вируса, конъюгированного с линкер-токсином 001), v21252, v7155 (T-DM1, DAR 3,5) и v24029 (трастузумаб, конъюгированный при DAR8 с экзатекан-производным ингибитором топоизомеразы I (DXd)). Имплантированные внутрь черепа опухоли BT-474 молочной железы человека, использованные в этом примере, служат в качестве модели метастазов в головной мозг HER2 положительного рака молочной железы.
[00412] Самок бестимусных мышей Balb/c (CByJ.Cg-Foxn1nu/J) облучали γ-источником (2 Гр, 60Co, BioMep, г. Бретеньер, Франция). Мышам под анестезией стереотаксически инъецировали 1x105 клеток BT-474 в 2 микролитрах среды RPMI 1640 без фенолового красного. Животных случайным образом распределяли на группы лечения и, начиная с суток 8, им внутривенно вводили носитель, контрольный конъюгат, v21252, v7155 или v24029 при дозе 6 мг/кг каждую неделю в общей совокупности двенадцати инъекций (таблица 26). Дважды в неделю регистрировали массу тела до суток 18, а затем, после этого, ежедневно. Мышей умерщвляли этичным способом, когда потеря массы тела соответствовала или превышала 20% в течение 3 последовательных дней.
[00413] На Фиг. 17 представлены результаты выживаемости для мышей, которым внутрь черепа имплантировали опухолевые клетки BT-474 после в.в. введения носителя, контрольного конъюгата, v21252, v7155 или v24029.
[00414] Двум дополнительным когортам животных, которым внутрь черепа имплантировали клетки BT-474, случайным образом также распределяли на группы лечения и, начиная с суток 8, им внутривенно вводили либо v21252, либо v24029 при дозе 6 мг/кг раз в две недели в общей совокупности шести инъекций. Дважды в неделю регистрировали массу тела до суток 18, а затем, после этого, ежедневно. Мышей умерщвляли этичным способом, когда потеря массы тела соответствовала или превышала 20% в течение 3 последовательных дней.
[00415] На Фиг. 18 представлены результаты выживаемости для мышей, которым внутрь черепа имплантировали опухолевые клетки BT-474 после еженедельного (qw) в.в. введения носителя, контрольного конъюгата или v7155, или в.в. введение каждые две недели (q2w) либо v21252, либо v24029.
[00416] Этот пример демонстрирует, что v21252 является эффективным в продлении выживаемости мышей с имплантированными внутрь черепа клетками опухоли BT-474 молочной железы.
Таблица 26. Дизайн исследования с моделью имплантированных внутрь черепа клеток BT-474 рака молочной железы человека
(мг/кг)
[00417] Описания всех патентов, заявок на патенты, публикаций и элементов баз данных, упомянутые в данном описании, тем самым конкретно включены в полном объеме в той же степени, как если бы каждый отдельный патент, заявка на патент, публикация и элемент базы данных были специально и отдельно указаны для включения в виде ссылки.
[00418] Предполагается, что модификации конкретных вариантов осуществления, описанные в данном документе, которые могут быть очевидны специалистам в данной области, должны быть включены в рамки объема следующей формулы изобретения.
Таблицы последовательностей
Таблица A. Количества клонов для вариантов v5019, v5020, v7091, v10000, v6903, v6902 и v6717
Таблица B. Количества клонов для вариантов v5019, v5020, v7091, v10000, v6903, v6902 и v6717 по количеству клонов
Таблица C. Последовательности для областей VH и VL вариантов v7133, v15082, v15085, v15083, v15080, v15079, v15084 и v15081
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЗАЙМВОРКС ИНК.
<120> Конъюгаты анти-HER2 бипаратопных антител-лекарственных веществ
и способы их применения
<130> V813602WO
<150> 62/642,483
<151> 13.03.2018
<150> 62/658,477
<151> 16.04.2018
<150> 62/743 884
<151> 10.10.2018
<160> 89
<170> PatentIn версия 3.5
<210> 1
<211> 217
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 1
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 2
<211> 607
<212> Белок
<213> Homo sapiens
<400> 2
Thr Gln Val Cys Thr Gly Thr Asp Met Lys Leu Arg Leu Pro Ala Ser
1 5 10 15
Pro Glu Thr His Leu Asp Met Leu Arg His Leu Tyr Gln Gly Cys Gln
20 25 30
Val Val Gln Gly Asn Leu Glu Leu Thr Tyr Leu Pro Thr Asn Ala Ser
35 40 45
Leu Ser Phe Leu Gln Asp Ile Gln Glu Val Gln Gly Tyr Val Leu Ile
50 55 60
Ala His Asn Gln Val Arg Gln Val Pro Leu Gln Arg Leu Arg Ile Val
65 70 75 80
Arg Gly Thr Gln Leu Phe Glu Asp Asn Tyr Ala Leu Ala Val Leu Asp
85 90 95
Asn Gly Asp Pro Leu Asn Asn Thr Thr Pro Val Thr Gly Ala Ser Pro
100 105 110
Gly Gly Leu Arg Glu Leu Gln Leu Arg Ser Leu Thr Glu Ile Leu Lys
115 120 125
Gly Gly Val Leu Ile Gln Arg Asn Pro Gln Leu Cys Tyr Gln Asp Thr
130 135 140
Ile Leu Trp Lys Asp Ile Phe His Lys Asn Asn Gln Leu Ala Leu Thr
145 150 155 160
Leu Ile Asp Thr Asn Arg Ser Arg Ala Cys His Pro Cys Ser Pro Met
165 170 175
Cys Lys Gly Ser Arg Cys Trp Gly Glu Ser Ser Glu Asp Cys Gln Ser
180 185 190
Leu Thr Arg Thr Val Cys Ala Gly Gly Cys Ala Arg Cys Lys Gly Pro
195 200 205
Leu Pro Thr Asp Cys Cys His Glu Gln Cys Ala Ala Gly Cys Thr Gly
210 215 220
Pro Lys His Ser Asp Cys Leu Ala Cys Leu His Phe Asn His Ser Gly
225 230 235 240
Ile Cys Glu Leu His Cys Pro Ala Leu Val Thr Tyr Asn Thr Asp Thr
245 250 255
Phe Glu Ser Met Pro Asn Pro Glu Gly Arg Tyr Thr Phe Gly Ala Ser
260 265 270
Cys Val Thr Ala Cys Pro Tyr Asn Tyr Leu Ser Thr Asp Val Gly Ser
275 280 285
Cys Thr Leu Val Cys Pro Leu His Asn Gln Glu Val Thr Ala Glu Asp
290 295 300
Gly Thr Gln Arg Cys Glu Lys Cys Ser Lys Pro Cys Ala Arg Val Cys
305 310 315 320
Tyr Gly Leu Gly Met Glu His Leu Arg Glu Val Arg Ala Val Thr Ser
325 330 335
Ala Asn Ile Gln Glu Phe Ala Gly Cys Lys Lys Ile Phe Gly Ser Leu
340 345 350
Ala Phe Leu Pro Glu Ser Phe Asp Gly Asp Pro Ala Ser Asn Thr Ala
355 360 365
Pro Leu Gln Pro Glu Gln Leu Gln Val Phe Glu Thr Leu Glu Glu Ile
370 375 380
Thr Gly Tyr Leu Tyr Ile Ser Ala Trp Pro Asp Ser Leu Pro Asp Leu
385 390 395 400
Ser Val Phe Gln Asn Leu Gln Val Ile Arg Gly Arg Ile Leu His Asn
405 410 415
Gly Ala Tyr Ser Leu Thr Leu Gln Gly Leu Gly Ile Ser Trp Leu Gly
420 425 430
Leu Arg Ser Leu Arg Glu Leu Gly Ser Gly Leu Ala Leu Ile His His
435 440 445
Asn Thr His Leu Cys Phe Val His Thr Val Pro Trp Asp Gln Leu Phe
450 455 460
Arg Asn Pro His Gln Ala Leu Leu His Thr Ala Asn Arg Pro Glu Asp
465 470 475 480
Glu Cys Val Gly Glu Gly Leu Ala Cys His Gln Leu Cys Ala Arg Gly
485 490 495
His Cys Trp Gly Pro Gly Pro Thr Gln Cys Val Asn Cys Ser Gln Phe
500 505 510
Leu Arg Gly Gln Glu Cys Val Glu Glu Cys Arg Val Leu Gln Gly Leu
515 520 525
Pro Arg Glu Tyr Val Asn Ala Arg His Cys Leu Pro Cys His Pro Glu
530 535 540
Cys Gln Pro Gln Asn Gly Ser Val Thr Cys Phe Gly Pro Glu Ala Asp
545 550 555 560
Gln Cys Val Ala Cys Ala His Tyr Lys Asp Pro Pro Phe Cys Val Ala
565 570 575
Arg Cys Pro Ser Gly Val Lys Pro Asp Leu Ser Tyr Met Pro Ile Trp
580 585 590
Lys Phe Pro Asp Glu Glu Gly Ala Cys Gln Pro Cys Pro Ile Asn
595 600 605
<210> 3
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Lys Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Leu
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 4
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 4
gaagtgcagc tggtcgaatc tggaggagga ctggtgcagc caggagggtc cctgcgcctg
60
tcttgcgccg ctagtggctt cacttttacc gactacacca tggattgggt gcgacaggca
120
cctggaaagg gcctggagtg ggtcgccgat gtgaacccaa atagcggagg ctccatctac
180
aaccagcggt tcaagggccg gttcaccctg tcagtggacc ggagcaaaaa caccctgtat
240
ctgcagatga atagcctgcg agccgaagat actgctgtgt actattgcgc ccggaatctg
300
gggccctcct tctactttga ctattggggg cagggaactc tggtcaccgt gagctccgcc
360
tccaccaagg gaccttctgt gttcccactg gctccctcta gtaaatccac atctggggga
420
actgcagccc tgggctgtct ggtgaagggc tacttcccag agcccgtcac agtgtcttgg
480
aacagtggcg ctctgacttc tggggtccac acctttcctg cagtgctgaa gtcaagcggg
540
ctgtacagcc tgtcctctgt ggtcaccgtg ccaagttcaa gcctgggaac acagacttat
600
atctgcaacg tgaatcacaa gccatccaat acaaaagtcg acaagaaagt ggaacccaag
660
tcttgtgata aaacccatac atgcccccct tgtcctgcac cagagctgct gggaggacca
720
agcgtgttcc tgtttccacc caagcctaaa gatacactga tgattagtag gaccccagaa
780
gtcacatgcg tggtcgtgga cgtgagccac gaggaccccg aagtcaagtt taactggtac
840
gtggacggcg tcgaggtgca taatgccaag actaaaccca gggaggaaca gtacaacagt
900
acctatcgcg tcgtgtcagt cctgacagtg ctgcatcagg attggctgaa cgggaaagag
960
tataagtgca aagtgagcaa taaggctctg cccgcaccta tcgagaaaac aatttccaag
1020
gcaaaaggac agcctagaga accacaggtg tacgtgctgc ctccatcaag ggatgagctg
1080
acaaagaacc aggtcagcct gctgtgtctg gtgaaaggat tctatccctc tgacattgct
1140
gtggagtggg aaagtaatgg ccagcctgag aacaattacc tgacctggcc ccctgtgctg
1200
gactcagatg gcagcttctt tctgtatagc aagctgaccg tcgacaaatc ccggtggcag
1260
caggggaatg tgtttagttg ttcagtcatg cacgaggcac tgcacaacca ttacacccag
1320
aagtcactgt cactgtcacc aggg
1344
<210> 5
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 6
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 6
Gly Phe Thr Phe Thr Asp Tyr Thr
1 5
<210> 7
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 7
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr
1 5 10
<210> 8
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 8
Val Asn Pro Asn Ser Gly Gly Ser
1 5
<210> 9
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 10
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 10
gatattcaga tgacccagtc cccaagctcc ctgagtgcct cagtgggcga ccgagtcacc
60
atcacatgca aggcttccca ggatgtgtct attggagtcg catggtacca gcagaagcca
120
ggcaaagcac ccaagctgct gatctatagc gcctcctacc ggtataccgg cgtgccctct
180
agattctctg gcagtgggtc aggaacagac tttactctga ccatctctag tctgcagcct
240
gaggatttcg ctacctacta ttgccagcag tactatatct acccatatac ctttggccag
300
gggacaaaag tggagatcaa gaggactgtg gccgctccct ccgtcttcat ttttccccct
360
tctgacgaac agctgaaaag tggcacagcc agcgtggtct gtctgctgaa caatttctac
420
cctcgcgaag ccaaagtgca gtggaaggtc gataacgctc tgcagagcgg caacagccag
480
gagtctgtga ctgaacagga cagtaaagat tcaacctata gcctgtcaag cacactgact
540
ctgagcaagg cagactacga gaagcacaaa gtgtatgcct gcgaagtcac acatcagggg
600
ctgtcctctc ctgtgactaa gagctttaac agaggagagt gt
642
<210> 11
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 12
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 12
Gln Asp Val Ser Ile Gly
1 5
<210> 13
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 13
Gln Gln Tyr Tyr Ile Tyr Pro Tyr Thr
1 5
<210> 14
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 14
Ser Ala Ser
<210> 15
<211> 222
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 15
Asp Tyr Lys Asp Asp Asp Asp Lys Asp Ile Gln Met Thr Gln Ser Pro
1 5 10 15
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
20 25 30
Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser
50 55 60
Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr
65 70 75 80
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
85 90 95
Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val
100 105 110
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Ser Asp Glu Arg Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
130 135 140
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
145 150 155 160
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
165 170 175
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
180 185 190
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
195 200 205
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 16
<211> 666
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 16
gactacaaag acgacgatga caaagatatc cagatgaccc agtcccctag ctccctgtcc
60
gcttctgtgg gcgatagggt cactattacc tgccgcgcat ctcaggacgt gaacaccgca
120
gtcgcctggt accagcagaa gcctgggaaa gctccaaagc tgctgatcta cagtgcatca
180
ttcctgtatt caggagtgcc cagccggttt agcggcagca gatctggcac cgatttcaca
240
ctgactattt ctagtctgca gcctgaggac tttgccacat actattgcca gcagcactat
300
accacacccc ctactttcgg ccaggggacc aaagtggaga tcaagcgaac tgtggccgct
360
ccaagtgtct tcatttttcc acccagcgat gaaagactga agtccggcac agcttctgtg
420
gtctgtctgc tgaacaattt ttaccccaga gaggccaaag tgcagtggaa ggtcgacaac
480
gctctgcaga gtggcaacag ccaggagagc gtgacagaac aggattccaa agactctact
540
tatagtctgt caagcaccct gacactgagc aaggcagact acgaaaagca taaagtgtat
600
gcctgtgagg tcacacatca ggggctgtca tcaccagtca ccaaatcatt caatcggggg
660
gagtgc
666
<210> 17
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 18
<211> 222
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 18
Asp Tyr Lys Asp Asp Asp Asp Lys Asp Ile Gln Met Thr Gln Ser Pro
1 5 10 15
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
20 25 30
Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser
50 55 60
Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr
65 70 75 80
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
85 90 95
Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val
100 105 110
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Ser Asp Glu Arg Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
130 135 140
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
145 150 155 160
Ala Leu Gln Ser Gly Asn Ser Lys Glu Ser Val Thr Glu Gln Asp Ser
165 170 175
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Arg Leu Thr Leu Ser Lys Ala
180 185 190
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
195 200 205
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 19
<211> 666
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 19
gactacaaag acgacgatga caaagatatc cagatgaccc agtcccctag ctccctgtcc
60
gcttctgtgg gcgatagggt cactattacc tgccgcgcat ctcaggacgt gaacaccgca
120
gtcgcctggt accagcagaa gcctgggaaa gctccaaagc tgctgatcta cagtgcatca
180
ttcctgtatt caggagtgcc cagccggttt agcggcagca gatctggcac cgatttcaca
240
ctgactattt ctagtctgca gcctgaggac tttgccacat actattgcca gcagcactat
300
accacacccc ctactttcgg ccaggggacc aaagtggaga tcaagcgaac tgtggccgct
360
ccaagtgtct tcatttttcc acccagcgat gaaagactga agtccggcac agcttctgtg
420
gtctgtctgc tgaacaattt ttaccccaga gaggccaaag tgcagtggaa ggtcgacaac
480
gctctgcaga gtggcaacag caaggagagc gtgacagaac aggattccaa agactctact
540
tatagtctgt caagcagact gacactgagc aaggcagact acgaaaagca taaagtgtat
600
gcctgtgagg tcacacatca ggggctgtca tcaccagtca ccaaatcatt caatcggggg
660
gagtgc
666
<210> 20
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 21
Gln Asp Val Asn Thr Ala
1 5
<210> 22
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 22
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 23
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 23
Ser Ala Ser
<210> 24
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 25
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 25
gatattcaga tgacccagtc cccaagctcc ctgagtgcct cagtgggcga ccgagtcacc
60
atcacatgca aggcttccca ggatgtgtct attggagtcg catggtacca gcagaagcca
120
ggcaaagcac ccaagctgct gatctatagc gcctcctacc ggtataccgg cgtgccctct
180
agattctctg gcagtgggtc aggaacagac tttactctga ccatctctag tctgcagcct
240
gaggatttcg ctacctacta ttgccagcag tactatatct acccagccac ctttggccag
300
gggacaaaag tggagatcaa gaggactgtg gccgctccct ccgtcttcat ttttccccct
360
tctgacgaac agctgaaaag tggcacagcc agcgtggtct gtctgctgaa caatttctac
420
cctcgcgaag ccaaagtgca gtggaaggtc gataacgctc tgcagagcgg caacagccag
480
gagtctgtga ctgaacagga cagtaaagat tcaacctata gcctgtcaag cacactgact
540
ctgagcaagg cagactacga gaagcacaaa gtgtatgcct gcgaagtcac acatcagggg
600
ctgtcctctc ctgtgactaa gagctttaac agaggagagt gt
642
<210> 26
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 27
Gln Asp Val Ser Ile Gly
1 5
<210> 28
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 28
Gln Gln Tyr Tyr Ile Tyr Pro Ala Thr
1 5
<210> 29
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 29
Ser Ala Ser
<210> 30
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Glu Val Thr Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 31
<211> 1347
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 31
gaggtgcagc tggtcgaaag cggaggagga ctggtgcagc caggagggtc actgcgactg
60
agctgcgcag cttccggctt caacatcaag gacacctaca ttcactgggt ccgccaggct
120
cctggaaaag gcctggagtg ggtggcacga atctatccaa ctaatggata cacccggtat
180
gccgactccg tgaagggccg gttcaccatt tctgcagata caagtaaaaa cactgcctac
240
ctgcagatga acagcctgcg agccgaagat acagccgtgt actattgcag ccgatgggga
300
ggcgacggct tctacgctat ggattattgg gggcagggaa ccctggtcac agtgagctcc
360
gcatcaacaa aggggcctag cgtgtttcca ctggccccct ctagtaaatc cacctctggg
420
ggaacagcag ccctgggatg tgaggtgacc gactacttcc cagagcccgt cactgtgagc
480
tggaactccg gcgccctgac atctggggtc catacttttc ctgctgtgct gcagtcaagc
540
ggcctgtaca gcctgtcctc tgtggtcact gtgccaagtt caagcctggg gactcagacc
600
tatatctgca acgtgaatca caagccatcc aataccaaag tcgacaagaa agtggaaccc
660
aagtcttgtg ataaaacaca tacttgcccc ccttgtcctg caccagagct gctgggagga
720
ccaagcgtgt tcctgtttcc acccaagcct aaagacaccc tgatgattag taggactcca
780
gaagtcacct gcgtggtcgt ggacgtgagc cacgaggacc ccgaagtcaa gttcaactgg
840
tacgtggatg gcgtcgaggt gcataatgcc aagacaaaac ccagggagga acagtacaac
900
tccacttatc gcgtcgtgtc tgtcctgacc gtgctgcacc aggactggct gaacggcaag
960
gagtataagt gcaaagtgag caataaggct ctgcccgcac ctatcgagaa aacaatttcc
1020
aaggctaaag ggcagcctag agaaccacag gtgtacgtgt accctccatc tagggacgag
1080
ctgaccaaga accaggtcag tctgacatgt ctggtgaaag ggttctatcc cagcgatatc
1140
gcagtggagt gggaatccaa tggacagcct gagaacaatt acaagaccac accccctgtg
1200
ctggactctg atggaagttt cgccctggtg agtaagctga ccgtcgataa atcacggtgg
1260
cagcagggca acgtgttcag ctgttcagtg atgcacgaag cactgcacaa ccactacacc
1320
cagaaaagcc tgtccctgtc ccccggc
1347
<210> 32
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 32
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 33
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 33
Gly Phe Asn Ile Lys Asp Thr Tyr
1 5
<210> 34
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 34
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 35
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 35
Ile Tyr Pro Thr Asn Gly Tyr Thr
1 5
<210> 36
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 36
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Phe Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 37
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 37
gaggtgcagc tggtggaatc aggagggggc ctggtgcagc ccggagggtc tctgcgactg
60
tcatgtgccg cttctgggtt cactttcgca gactacacaa tggattgggt gcgacaggcc
120
cccggaaagg gactggagtg ggtgggcgat gtcaacccta attctggcgg gagtatctac
180
aaccagcggt tcaaggggag attcactttt tcagtggaca gaagcaaaaa caccctgtat
240
ctgcagatga acagcctgag ggccgaagat accgctgtct actattgcgc tcgcaatctg
300
ggccccagtt tctactttga ctattggggg cagggaaccc tggtgacagt cagctccgct
360
agcactaagg ggccttccgt gtttccactg gctccctcta gtaaatccac ctctggaggc
420
acagctgcac tgggatgtct ggtgaaggat tacttccctg aaccagtcac agtgagttgg
480
aactcagggg ctctgacaag tggagtccat acttttcccg cagtgctgca gtcaagcgga
540
ctgtactccc tgtcctctgt ggtcaccgtg cctagttcaa gcctgggcac ccagacatat
600
atctgcaacg tgaatcacaa gccatcaaat acaaaagtcg acaagaaagt ggagcccaag
660
agctgtgata aaactcatac ctgcccacct tgtccggcgc cagaactgct gggaggacca
720
agcgtgttcc tgtttccacc caagcctaaa gacaccctga tgatttcccg gactcctgag
780
gtcacctgcg tggtcgtgga cgtgtctcac gaggaccccg aagtcaagtt caactggtac
840
gtggatggcg tcgaagtgca taatgccaag accaaacccc gggaggaaca gtacaactct
900
acctatagag tcgtgagtgt cctgacagtg ctgcaccagg actggctgaa tgggaaggag
960
tataagtgta aagtgagcaa caaagccctg cccgccccaa tcgaaaaaac aatctctaaa
1020
gcaaaaggac agcctcgcga accacaggtc tacgtctacc ccccatcaag agatgaactg
1080
acaaaaaatc aggtctctct gacatgcctg gtcaaaggat tctacccttc cgacatcgcc
1140
gtggagtggg aaagtaacgg ccagcccgag aacaattaca agaccacacc ccctgtcctg
1200
gactctgatg ggagtttcgc tctggtgtca aagctgaccg tcgataaaag ccggtggcag
1260
cagggcaatg tgtttagctg ctccgtcatg cacgaagccc tgcacaatca ctacacacag
1320
aagtccctga gcctgagccc tggc
1344
<210> 38
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 38
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Phe Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 39
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 39
Gly Phe Thr Phe Ala Asp Tyr Thr
1 5
<210> 40
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 40
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr
1 5 10
<210> 41
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 41
Val Asn Pro Asn Ser Gly Gly Ser
1 5
<210> 42
<211> 226
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 42
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala Thr Gly Ser Asp Ile Gln Met
1 5 10 15
Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
20 25 30
Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly Val Ala Trp Tyr
35 40 45
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser
50 55 60
Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
65 70 75 80
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
85 90 95
Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr Thr Phe Gly Gln
100 105 110
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
115 120 125
Ile Phe Pro Pro Ser Asp Glu Glu Leu Lys Ser Gly Thr Ala Ser Val
130 135 140
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
145 150 155 160
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Glu Glu Ser Val Thr
165 170 175
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Glu
180 185 190
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
195 200 205
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
210 215 220
Glu Cys
225
<210> 43
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 43
tatccctacg atgtgcctga ctacgctact ggctccgata tccagatgac ccagtctcca
60
agctccctga gtgcatcagt gggggaccga gtcaccatca catgcaaggc ttcccaggat
120
gtgtctattg gagtcgcatg gtaccagcag aagccaggca aagcacccaa gctgctgatc
180
tacagcgcct cctaccggta tactggggtg ccttccagat tctctggcag tgggtcagga
240
accgacttta ctctgaccat ctctagtctg cagcccgagg atttcgccac ctactattgc
300
cagcagtact atatctaccc ttataccttt ggccagggga caaaagtgga gatcaagagg
360
acagtggccg ctccaagtgt cttcattttt cccccttccg acgaagagct gaaaagtgga
420
actgcttcag tggtctgtct gctgaacaat ttctaccccc gcgaagccaa agtgcagtgg
480
aaggtcgata acgctctgca gagcggcaat tccgaggagt ctgtgacaga acaggacagt
540
aaagattcaa cttatagcct gtcaagcaca ctggagctgt ctaaggcaga ctacgagaag
600
cacaaagtgt atgcctgcga agtcacccat caggggctgt cctctcccgt gacaaagagc
660
tttaacagag gagagtgt
678
<210> 44
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 481
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr
145 150 155 160
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
165 170 175
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser
210 215 220
Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Ala Ala Glu Pro Lys Ser Ser Asp Lys
245 250 255
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
385 390 395 400
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
420 425 430
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
Lys
<210> 46
<211> 1443
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 46
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca ggacgttaac accgctgtag cttggtatca gcagaaacca
120
gggaaagccc ctaagctcct gatctattct gcatcctttt tgtacagtgg ggtcccatca
180
aggttcagtg gcagtcgatc tgggacagat ttcactctca ccatcagcag tctgcaacct
240
gaagattttg caacttacta ctgtcaacag cattacacta ccccacccac tttcggccaa
300
gggaccaaag tggagatcaa aggtggttct ggtggtggtt ctggtggtgg ttctggtggt
360
ggttctggtg gtggttctgg tgaagtgcag ctggtggagt ctgggggagg cttggtacag
420
cctggcgggt ccctgagact ctcctgtgca gcctctggat tcaacattaa agatacttat
480
atccactggg tccggcaagc tccagggaag ggcctggagt gggtcgcacg tatttatccc
540
acaaatggtt acacacggta tgcggactct gtgaagggcc gattcaccat ctccgcagac
600
acttccaaga acaccgcgta tctgcaaatg aacagtctga gagctgagga cacggccgtt
660
tattactgtt caagatgggg cggagacggt ttctacgcta tggactactg gggccaaggg
720
accctggtca ccgtctcctc agccgccgag cccaagagca gcgataagac ccacacctgc
780
cctccctgtc cagctccaga actgctggga ggacctagcg tgttcctgtt tccccctaag
840
ccaaaagaca ctctgatgat ttccaggact cccgaggtga cctgcgtggt ggtggacgtg
900
tctcacgagg accccgaagt gaagttcaac tggtacgtgg atggcgtgga agtgcataat
960
gctaagacaa aaccaagaga ggaacagtac aactccactt atcgcgtcgt gagcgtgctg
1020
accgtgctgc accaggactg gctgaacggg aaggagtata agtgcaaagt cagtaataag
1080
gccctgcctg ctccaatcga aaaaaccatc tctaaggcca aaggccagcc aagggagccc
1140
caggtgtaca catacccacc cagcagagac gaactgacca agaaccaggt gtccctgaca
1200
tgtctggtga aaggcttcta tcctagtgat attgctgtgg agtgggaatc aaatggacag
1260
ccagagaaca attacaagac cacacctcca gtgctggacg aggatggcag cttcgccctg
1320
gtgtccaagc tgacagtgga taaatctcga tggcagcagg ggaacgtgtt tagttgttca
1380
gtgatgcatg aagccctgca caatcattac actcagaaga gcctgtccct gtctcccggc
1440
aaa
1443
<210> 47
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 49
<211> 481
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr
145 150 155 160
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
165 170 175
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser
210 215 220
Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Ala Ala Glu Pro Lys Ser Ser Asp Lys
245 250 255
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ile
385 390 395 400
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
Lys
<210> 50
<211> 1443
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 50
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca ggacgttaac accgctgtag cttggtatca gcagaaacca
120
gggaaagccc ctaagctcct gatctattct gcatcctttt tgtacagtgg ggtcccatca
180
aggttcagtg gcagtcgatc tgggacagat ttcactctca ccatcagcag tctgcaacct
240
gaagattttg caacttacta ctgtcaacag cattacacta ccccacccac tttcggccaa
300
gggaccaaag tggagatcaa aggtggttct ggtggtggtt ctggtggtgg ttctggtggt
360
ggttctggtg gtggttctgg tgaagtgcag ctggtggagt ctgggggagg cttggtacag
420
cctggcgggt ccctgagact ctcctgtgca gcctctggat tcaacattaa agatacttat
480
atccactggg tccggcaagc tccagggaag ggcctggagt gggtcgcacg tatttatccc
540
acaaatggtt acacacggta tgcggactct gtgaagggcc gattcaccat ctccgcagac
600
acttccaaga acaccgcgta tctgcaaatg aacagtctga gagctgagga cacggccgtt
660
tattactgtt caagatgggg cggagacggt ttctacgcta tggactactg gggccaaggg
720
accctggtca ccgtctcctc agccgccgag cccaagagca gcgataagac ccacacctgc
780
cctccctgtc cagctccaga actgctggga ggacctagcg tgttcctgtt tccccctaag
840
ccaaaagaca ctctgatgat ttccaggact cccgaggtga cctgcgtggt ggtggacgtg
900
tctcacgagg accccgaagt gaagttcaac tggtacgtgg atggcgtgga agtgcataat
960
gctaagacaa aaccaagaga ggaacagtac aactccactt atcgcgtcgt gagcgtgctg
1020
accgtgctgc accaggactg gctgaacggg aaggagtata agtgcaaagt cagtaataag
1080
gccctgcctg ctccaatcga aaaaaccatc tctaaggcca aaggccagcc aagggagccc
1140
caggtgtaca cactgccacc cagcagagac gaactgacca agaaccaggt gtccctgatc
1200
tgtctggtga aaggcttcta tcctagtgat attgctgtgg agtgggaatc aaatggacag
1260
ccagagaaca gatacatgac ctggcctcca gtgctggaca gcgatggcag cttcttcctg
1320
tattccaagc tgacagtgga taaatctcga tggcagcagg ggaacgtgtt tagttgttca
1380
gtgatgcatg aagccctgca caatcattac actcagaaga gcctgtccct gtctcccggc
1440
aaa
1443
<210> 51
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 52
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 53
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Leu
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 54
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 54
gaagtgcagc tggtcgaatc tggaggagga ctggtgcagc caggagggtc cctgcgcctg
60
tcttgcgccg ctagtggctt cacttttacc gactacacca tggattgggt gcgacaggca
120
cctggaaagg gcctggagtg ggtcgccgat gtgaacccaa atagcggagg ctccatctac
180
aaccagcggt tcaagggccg gttcaccctg tcagtggacc ggagcaaaaa caccctgtat
240
ctgcagatga atagcctgcg agccgaagat actgctgtgt actattgcgc ccggaatctg
300
gggccctcct tctactttga ctattggggg cagggaactc tggtcaccgt gagctccgcc
360
tccaccaagg gaccttctgt gttcccactg gctccctcta gtaaatccac atctggggga
420
actgcagccc tgggctgtct ggtgaaggac tacttcccag agcccgtcac agtgtcttgg
480
aacagtggcg ctctgacttc tggggtccac acctttcctg cagtgctgca gtcaagcggg
540
ctgtacagcc tgtcctctgt ggtcaccgtg ccaagttcaa gcctgggaac acagacttat
600
atctgcaacg tgaatcacaa gccatccaat acaaaagtcg acaagaaagt ggaacccaag
660
tcttgtgata aaacccatac atgcccccct tgtcctgcac cagagctgct gggaggacca
720
agcgtgttcc tgtttccacc caagcctaaa gatacactga tgattagtag gaccccagaa
780
gtcacatgcg tggtcgtgga cgtgagccac gaggaccccg aagtcaagtt taactggtac
840
gtggacggcg tcgaggtgca taatgccaag actaaaccca gggaggaaca gtacaacagt
900
acctatcgcg tcgtgtcagt cctgacagtg ctgcatcagg attggctgaa cgggaaagag
960
tataagtgca aagtgagcaa taaggctctg cccgcaccta tcgagaaaac aatttccaag
1020
gcaaaaggac agcctagaga accacaggtg tacgtgctgc ctccatcaag ggatgagctg
1080
acaaagaacc aggtcagcct gctgtgtctg gtgaaaggat tctatccctc tgacattgct
1140
gtggagtggg aaagtaatgg ccagcctgag aacaattacc tgacctggcc ccctgtgctg
1200
gactcagatg gcagcttctt tctgtatagc aagctgaccg tcgacaaatc ccggtggcag
1260
caggggaatg tgtttagttg ttcagtcatg cacgaggcac tgcacaacca ttacacccag
1320
aagtcactgt cactgtcacc aggg
1344
<210> 55
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 56
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 56
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Tyr Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 57
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 57
gaagtgcagc tggtcgaatc tggaggagga ctggtgcagc caggagggtc cctgcgcctg
60
tcttgcgccg ctagtggctt cacttttacc gactacacca tggattgggt gcgacaggca
120
cctggaaagg gcctggagtg ggtcgccgat gtgaacccaa atagcggagg ctccatctac
180
aaccagcggt tcaagggccg gttcaccctg tcagtggacc ggagcaaaaa caccctgtat
240
ctgcagatga atagcctgcg agccgaagat actgctgtgt actattgcgc ccggaatctg
300
gggccctcct tctactttga ctattggggg cagggaactc tggtcaccgt gagctccgcc
360
tccaccaagg gaccttctgt gttcccactg gctccctcta gtaaatccac atctggggga
420
actgcagccc tgggctgtct ggtgaaggac tacttcccag agcccgtcac agtgtcttgg
480
aacagtggcg ctctgacttc tggggtccac acctttcctg cagtgctgca gtcaagcggg
540
ctgtacagcc tgtcctctgt ggtcaccgtg ccaagttcaa gcctgggaac acagacttat
600
atctgcaacg tgaatcacaa gccatccaat acaaaagtcg acaagaaagt ggaacccaag
660
tcttgtgata aaacccatac atgcccccct tgtcctgcac cagagctgct gggaggacca
720
agcgtgttcc tgtttccacc caagcctaaa gatacactga tgattagtag gaccccagaa
780
gtcacatgcg tggtcgtgga cgtgagccac gaggaccccg aagtcaagtt taactggtac
840
gtggacggcg tcgaggtgca taatgccaag actaaaccca gggaggaaca gtacaacagt
900
acctatcgcg tcgtgtcagt cctgacagtg ctgcatcagg attggctgaa cgggaaagag
960
tataagtgca aagtgagcaa taaggctctg cccgcaccta tcgagaaaac aatttccaag
1020
gcaaaaggac agcctagaga accacaggtg tacgtgtatc ctccatcaag ggatgagctg
1080
acaaagaacc aggtcagcct gacttgtctg gtgaaaggat tctatccctc tgacattgct
1140
gtggagtggg aaagtaatgg ccagcctgag aacaattaca agaccacacc ccctgtgctg
1200
gactcagatg gcagcttcgc gctggtgagc aagctgaccg tcgacaaatc ccggtggcag
1260
caggggaatg tgtttagttg ttcagtcatg cacgaggcac tgcacaacca ttacacccag
1320
aagtcactgt cactgtcacc aggg
1344
<210> 58
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 58
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 59
<211> 475
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr Thr Met Asp Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Asp Val Asn Pro Asn
165 170 175
Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe Lys Gly Arg Phe Thr Leu
180 185 190
Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asn Leu Gly Pro
210 215 220
Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser Ala Ala Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470 475
<210> 60
<211> 1425
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 60
gacattcaga tgacccagag ccctagctcc ctgagtgcct cagtcgggga cagggtgact
60
atcacctgca aggcttcaca ggatgtcagc attggcgtgg catggtacca gcagaagcca
120
gggaaagcac ccaagctgct gatctatagc gcctcctaca ggtatacagg cgtgccatcc
180
cgcttctctg gcagtgggtc aggaactgac tttacactga ctatttctag tctgcagccc
240
gaagatttcg ccacatacta ttgccagcag tactatatct acccttatac ttttggccag
300
gggaccaaag tggagattaa gggcggagga ggctccggag gaggagggtc tggaggagga
360
ggaagtgagg tccagctggt ggaatctgga ggaggactgg tgcagccagg agggtccctg
420
aggctgtctt gtgccgctag tggcttcacc tttacagact acacaatgga ttgggtgcgc
480
caggcaccag gaaagggact ggaatgggtc gctgatgtga accctaatag cggaggctcc
540
atctacaacc agcggttcaa aggacggttc accctgtcag tggaccggag caagaacacc
600
ctgtatctgc agatgaacag cctgagagcc gaggatactg ctgtgtacta ttgcgccagg
660
aatctgggcc caagcttcta ctttgactat tgggggcagg gaacactggt cactgtgtca
720
agcgcagccg aacccaaatc ctctgataag actcacacct gcccaccttg tccagctcca
780
gagctgctgg gaggacctag cgtgttcctg tttccaccca agccaaaaga cactctgatg
840
atttctagaa cccctgaagt gacatgtgtg gtcgtggacg tcagtcacga ggaccccgaa
900
gtcaaattca actggtacgt ggatggcgtc gaggtgcata atgccaagac caaaccccga
960
gaggaacagt acaactcaac ctatcgggtc gtgagcgtcc tgacagtgct gcatcaggac
1020
tggctgaacg gcaaggagta taagtgcaaa gtgagcaaca aggctctgcc tgcaccaatc
1080
gagaagacca tttccaaggc taaagggcag ccccgcgaac ctcaggtcta cgtgtatcct
1140
ccaagccgag atgagctgac aaaaaaccag gtctccctga cttgtctggt gaagggattt
1200
tacccaagtg acatcgcagt ggagtgggaa tcaaatggcc agcccgaaaa caattataag
1260
accacacccc ctgtgctgga ctctgatggg agtttcgcac tggtctccaa actgaccgtg
1320
gacaagtctc ggtggcagca gggaaacgtc tttagctgtt ccgtgatgca cgaggccctg
1380
cacaatcatt acacacagaa atctctgagt ctgtcacctg gcaag
1425
<210> 61
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 61
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 62
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 62
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 63
<211> 480
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 63
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Ser Gly Gly
100 105 110
Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr Tyr
145 150 155 160
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
165 170 175
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser
210 215 220
Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Ala Ala Glu Pro Lys Ser Ser Asp Lys
245 250 255
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Leu
385 390 395 400
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
<210> 64
<211> 1440
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 64
gacattcaga tgacacagag ccccagctcc ctgagtgctt cagtcggcga cagggtgact
60
atcacctgcc gcgcatccca ggatgtcaac accgctgtgg catggtacca gcagaagcct
120
ggaaaagccc caaagctgct gatctacagc gcttccttcc tgtattctgg cgtgccaagt
180
cggttttctg gaagtagatc aggcactgac ttcacactga ctatctctag tctgcagccc
240
gaagattttg ccacctacta ttgccagcag cactatacca caccccctac attcggacag
300
ggcactaaag tggagattaa gggcgggtca ggcggaggga gcggaggagg gtccggagga
360
gggtctggag gagggagtgg agaggtccag ctggtggaat ctggaggagg actggtgcag
420
cctggaggct cactgcgact gagctgtgcc gcttccggct ttaacatcaa agacacatac
480
attcattggg tcaggcaggc accagggaag ggactggaat gggtggcccg catctatccc
540
acaaatgggt acactcgata tgccgacagc gtgaaaggac ggtttaccat ttctgctgat
600
accagtaaga acacagcata cctgcagatg aacagcctgc gcgcagagga tacagccgtg
660
tactattgca gtcgatgggg gggagacggc ttctacgcca tggattattg gggccagggg
720
actctggtca ccgtgtcaag cgcagccgaa cctaaatcct ctgacaagac ccacacatgc
780
ccaccctgtc ctgctccaga gctgctggga ggaccatccg tgttcctgtt tcctccaaag
840
cctaaagata cactgatgat tagccgcact cccgaagtca cctgtgtggt cgtggacgtg
900
tcccacgagg accccgaagt caagttcaac tggtacgtgg acggcgtcga ggtgcataat
960
gccaagacta aaccaagaga ggaacagtac aattcaacct atagggtcgt gagcgtcctg
1020
acagtgctgc atcaggattg gctgaacggc aaggagtata agtgcaaagt gtctaacaag
1080
gccctgcccg ctcctatcga gaagactatt agcaaggcaa aagggcagcc acgggaaccc
1140
caggtctacg tgctgccccc tagcagagac gagctgacca aaaaccaggt ctccctgctg
1200
tgtctggtga agggctttta tcctagtgat atcgctgtgg agtgggaatc aaatgggcag
1260
ccagaaaaca attacctgac atggccaccc gtgctggaca gcgatgggtc cttctttctg
1320
tattccaaac tgactgtgga caagtctaga tggcagcagg gaaacgtctt cagctgttcc
1380
gtgatgcacg aggccctgca caatcattac acccagaagt ctctgagtct gtcacccggc
1440
<210> 65
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 67
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 67
Gln Asp Val Asn Thr Ala
1 5
<210> 68
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 68
Ser Ala Ser
<210> 69
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 69
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 70
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 70
Gly Phe Asn Ile Lys Asp Thr Tyr
1 5
<210> 71
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 71
Ile Tyr Pro Thr Asn Gly Tyr Thr
1 5
<210> 72
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 72
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 73
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 73
Val Asn Pro Asn Ser Gly Tyr Ser
1 5
<210> 74
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 74
Gly Phe Thr Phe Gln Asp Tyr Thr
1 5
<210> 75
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 75
Ala Arg Asn Leu Gly Pro Trp Phe Tyr Phe Asp Tyr
1 5 10
<210> 76
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 76
Gln Gln Tyr Tyr Ile Tyr Pro Gly Thr
1 5
<210> 77
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 77
Gly Phe Thr Phe Tyr Asp Tyr Thr
1 5
<210> 78
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 78
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ala Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 79
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 79
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 80
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Tyr Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Trp Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 81
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 82
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 82
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Trp Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 83
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 84
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 84
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Trp Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Gly
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 85
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 85
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Trp Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 86
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Tyr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Trp Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 87
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 87
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Tyr Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Trp Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 88
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 88
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Trp Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 89
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gln Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Tyr Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ КОНСТРУКЦИИ ПРОТИВ HER2 | 2014 |
|
RU2737882C2 |
| САЙТ-СПЕЦИФИЧЕСКИЕ КОНЪЮГАТЫ АНТИТЕЛА К HER2 И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2745565C2 |
| БИПАРАТОПНЫЕ FR-АЛЬФА АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2020 |
|
RU2832083C2 |
| САЙТ-СПЕЦИФИЧЕСКАЯ КОНЪЮГАЦИЯ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПОСРЕДСТВОМ ГЛИКОИНЖЕНЕРИИ | 2014 |
|
RU2831409C2 |
| АНТИТЕЛА И ФРАГМЕНТЫ АНТИТЕЛ ДЛЯ САЙТ-СПЕЦИФИЧЕСКОГО КОНЪЮГИРОВАНИЯ | 2016 |
|
RU2757815C2 |
| КОНЪЮГАТЫ СВЯЗУЮЩЕГО И АКТИВНОГО ВЕЩЕСТВА (ADC), ИМЕЮЩИЕ ФЕРМЕНТАТИВНО РАСЩЕПЛЯЕМЫЕ ГРУППЫ | 2017 |
|
RU2761390C2 |
| СПОСОБЫ СОСТАВЛЕНИЯ КОМПОЗИЦИЙ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2741470C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-STING АГОНИСТ И ИХ ПРИМЕНЕНИЕ В ИММУНОТЕРАПИИ | 2020 |
|
RU2826228C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ЭРИБУЛИНА И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2754369C2 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |

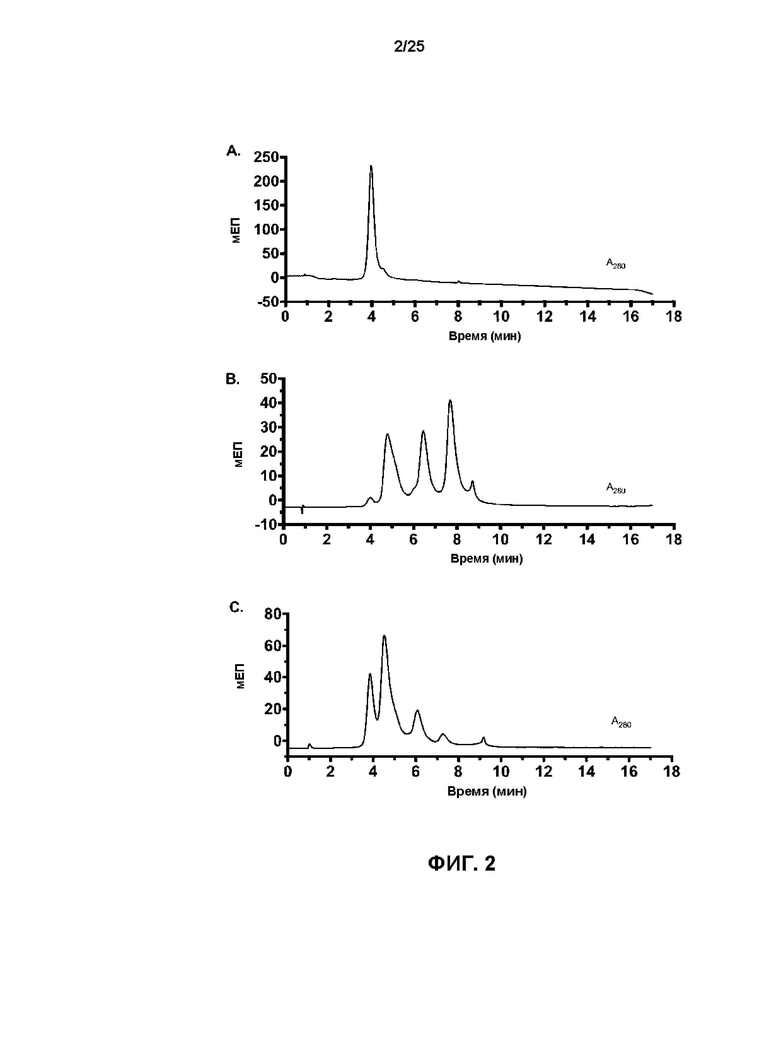
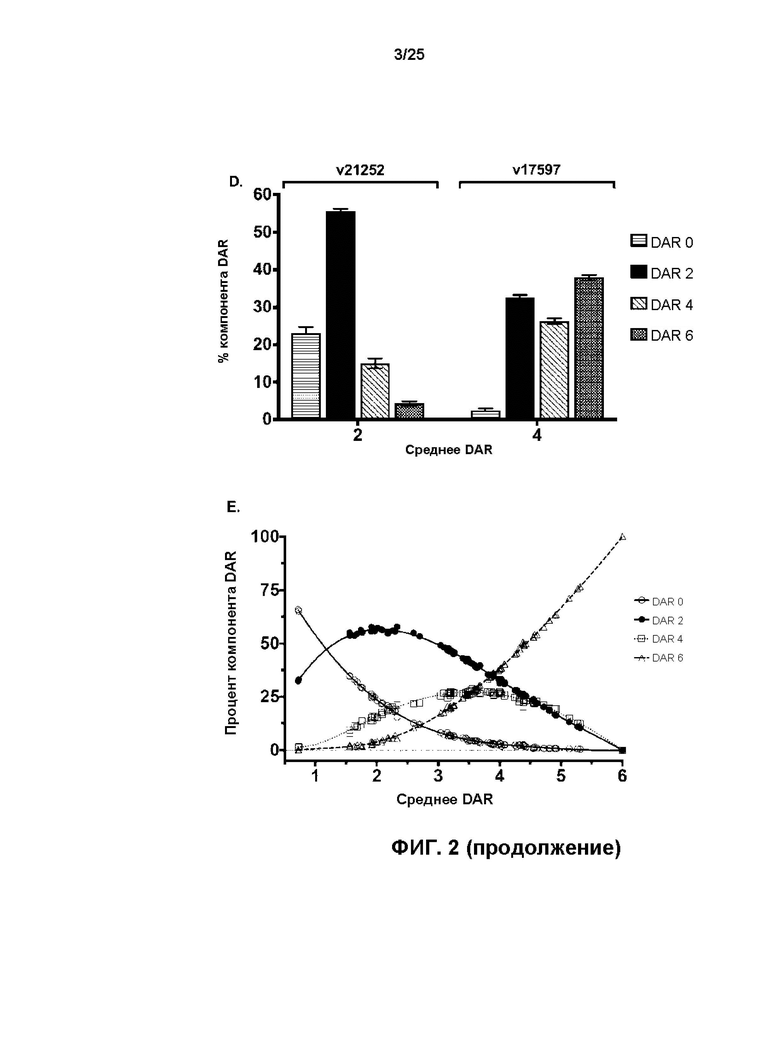
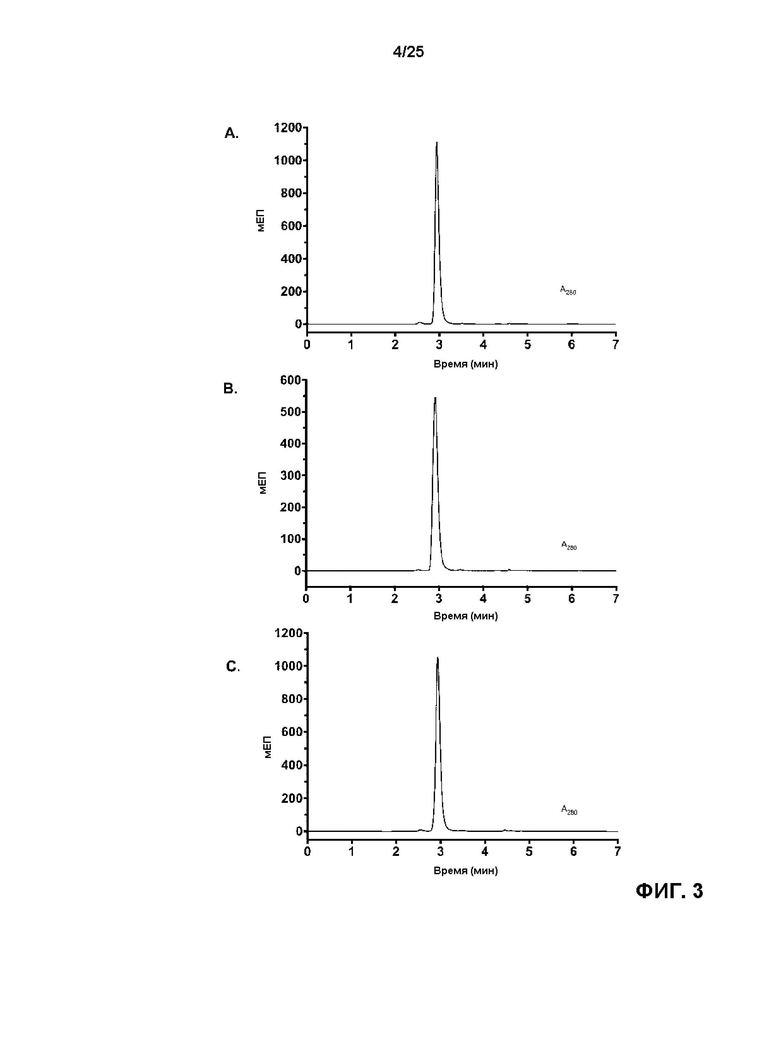
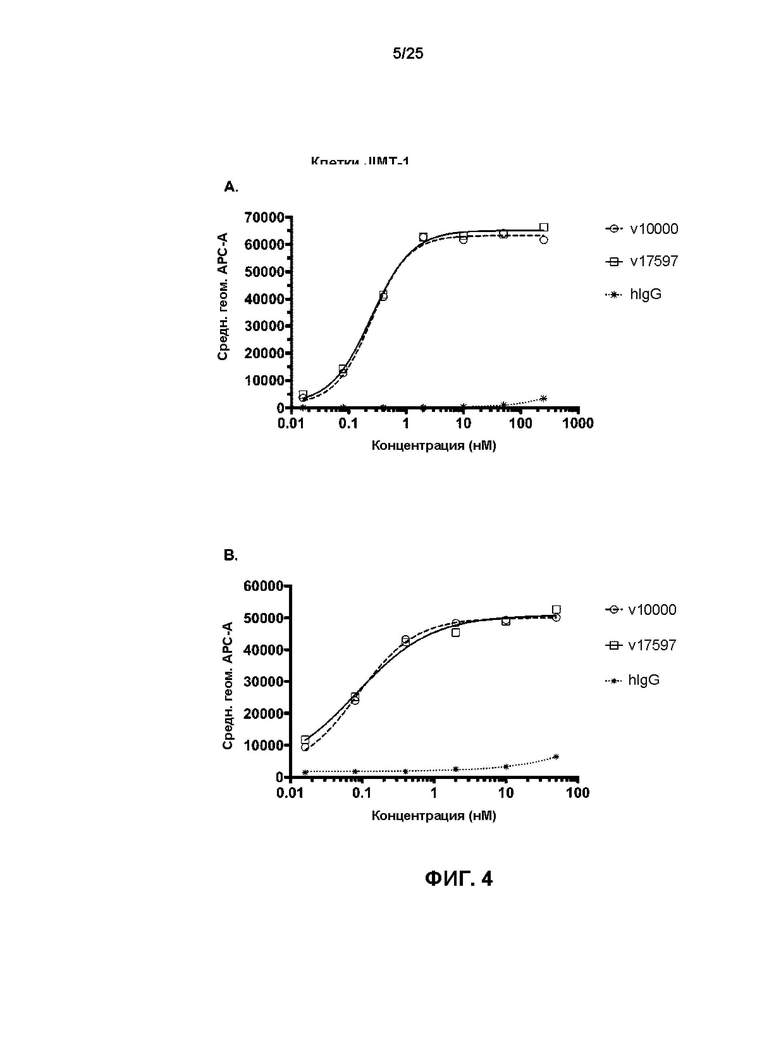

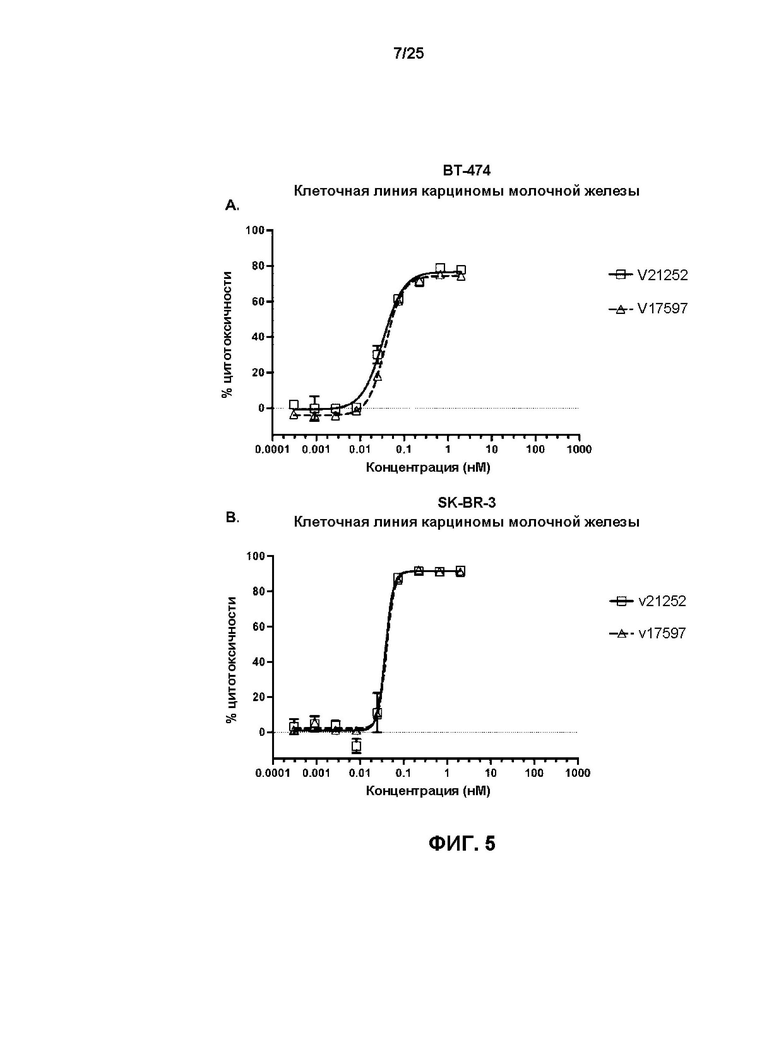
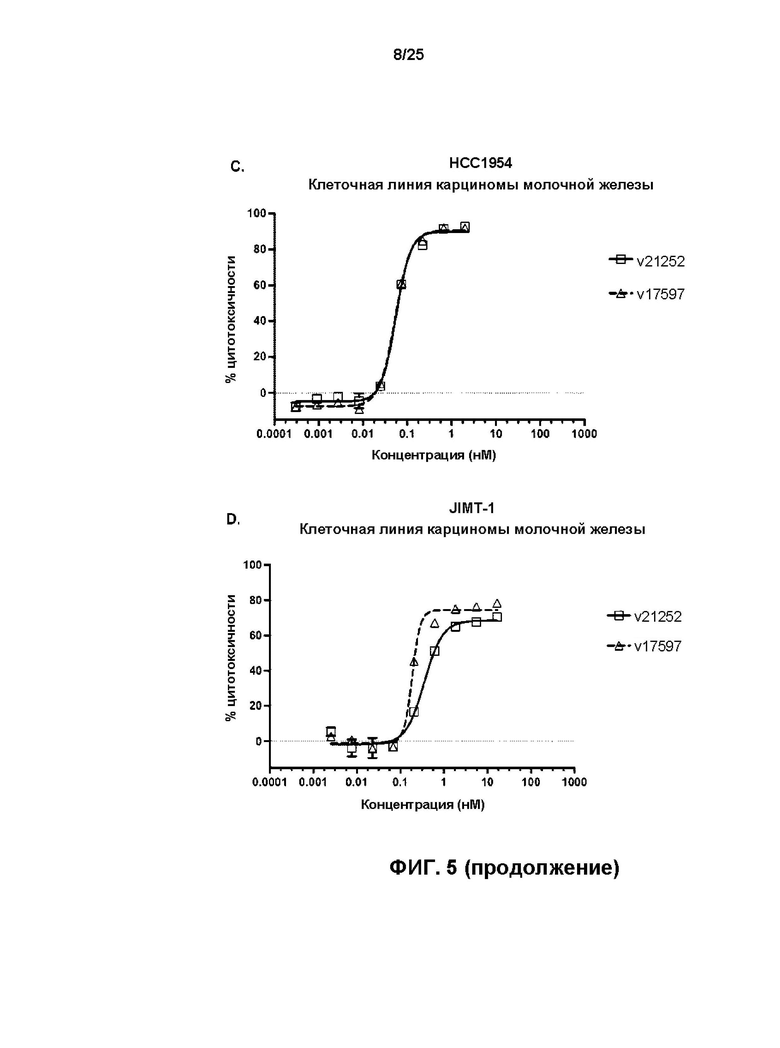
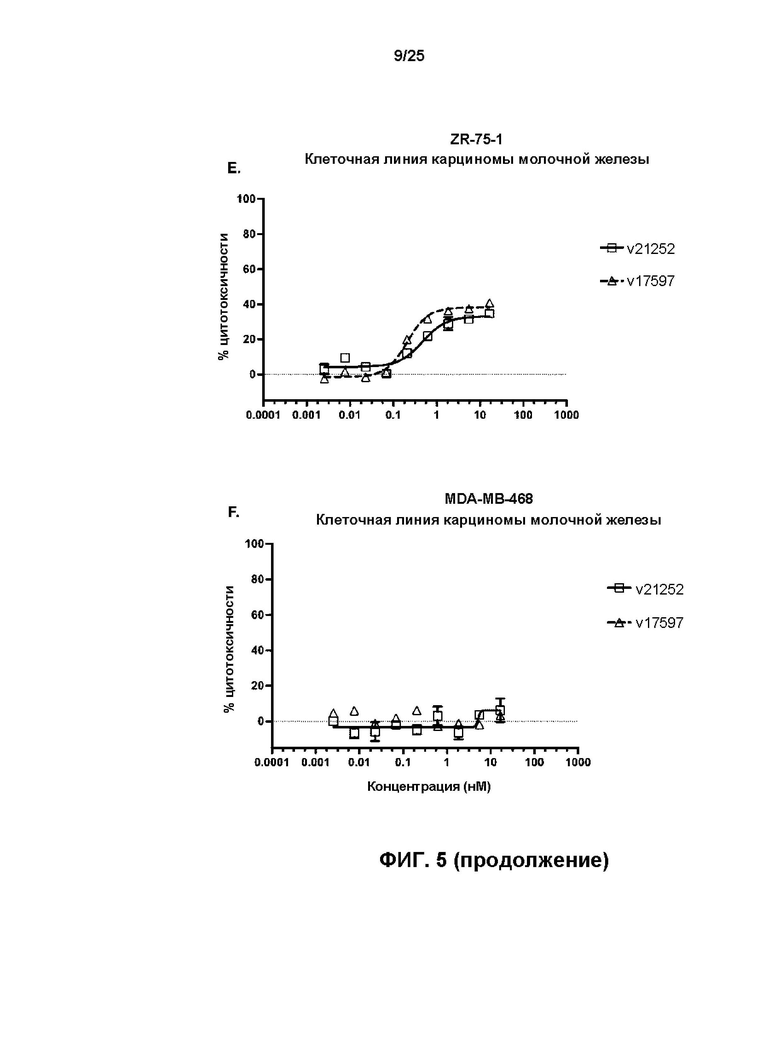
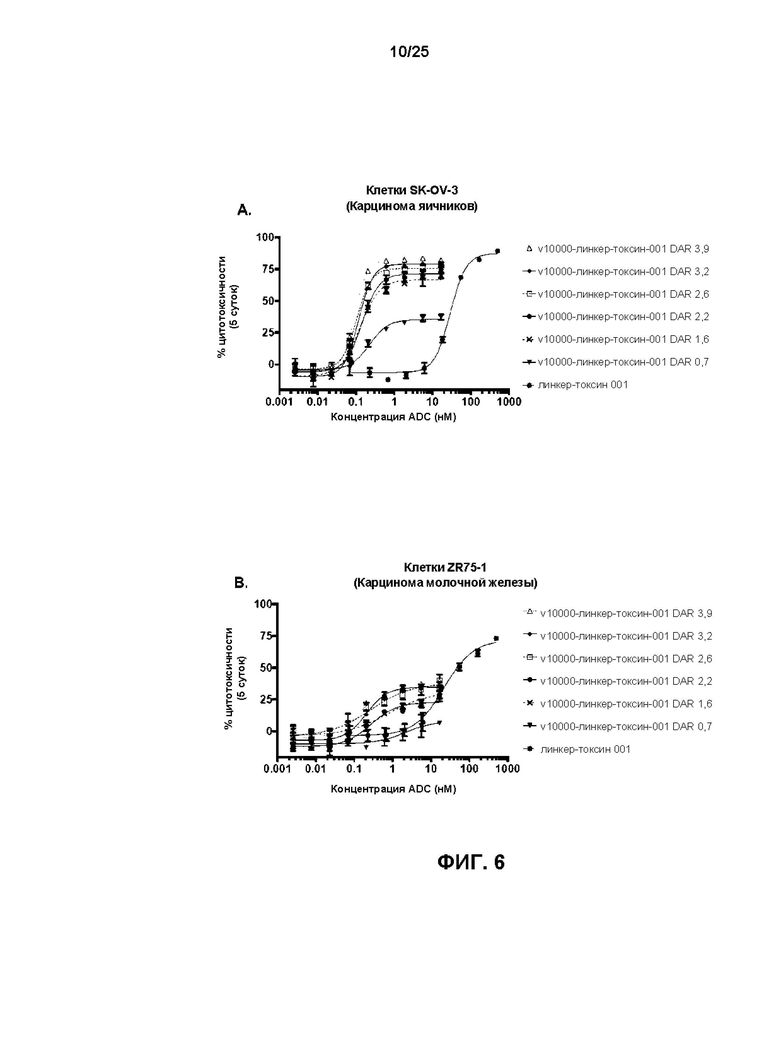
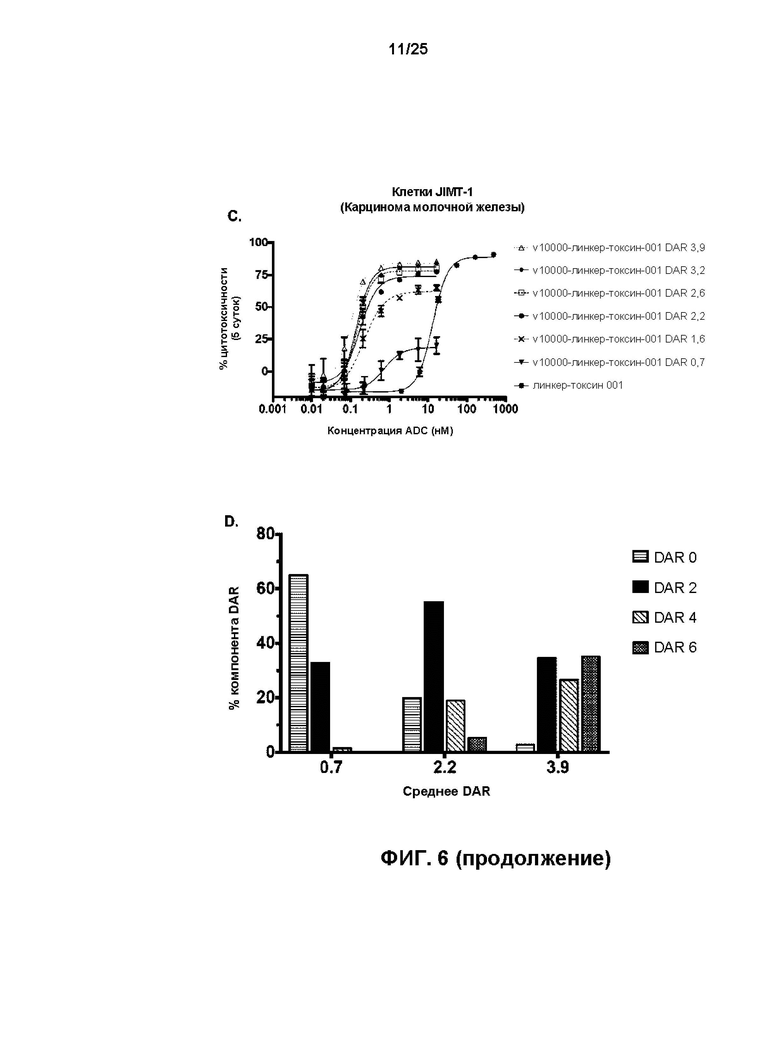
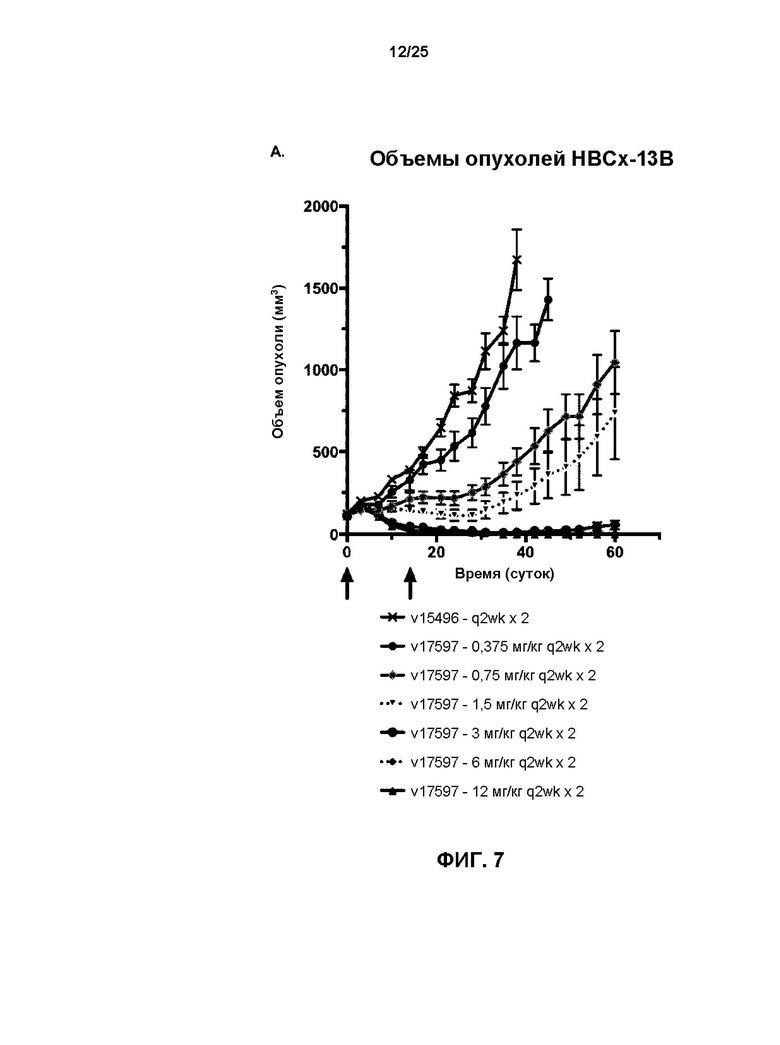
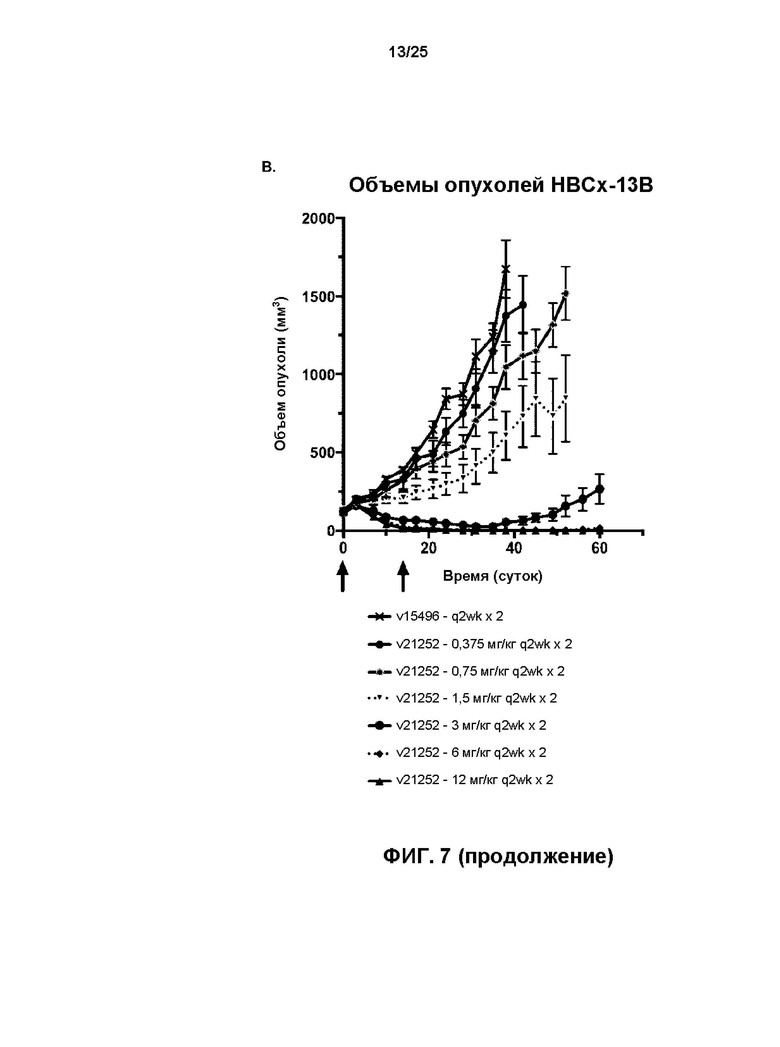
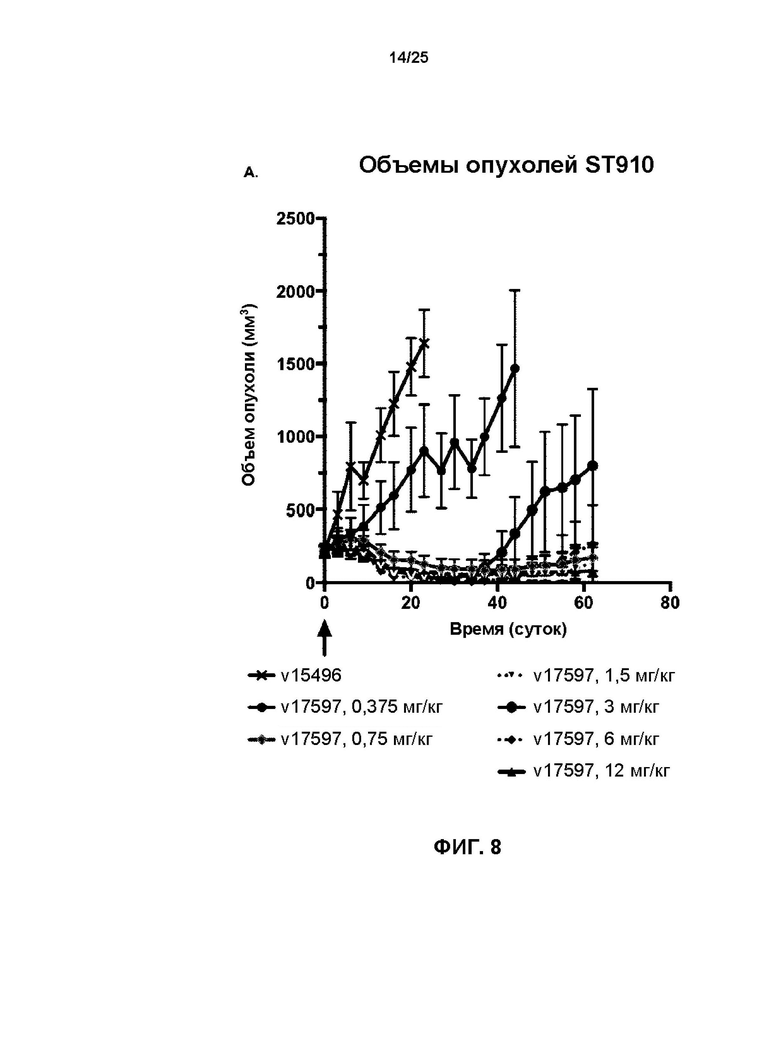

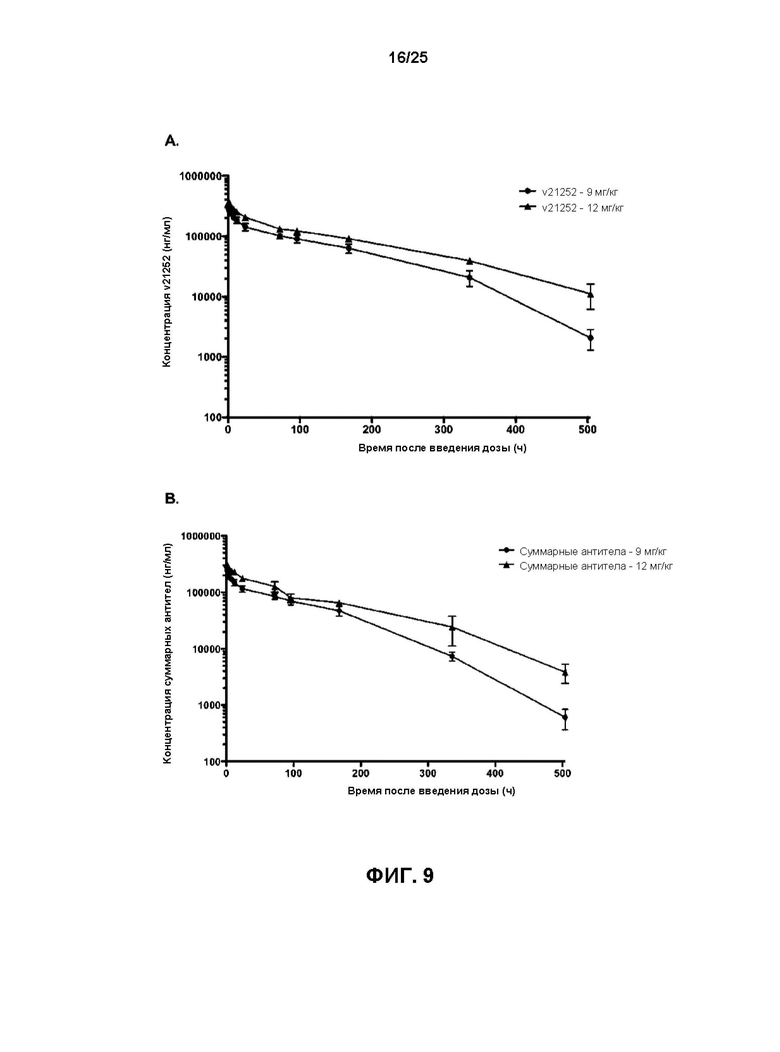
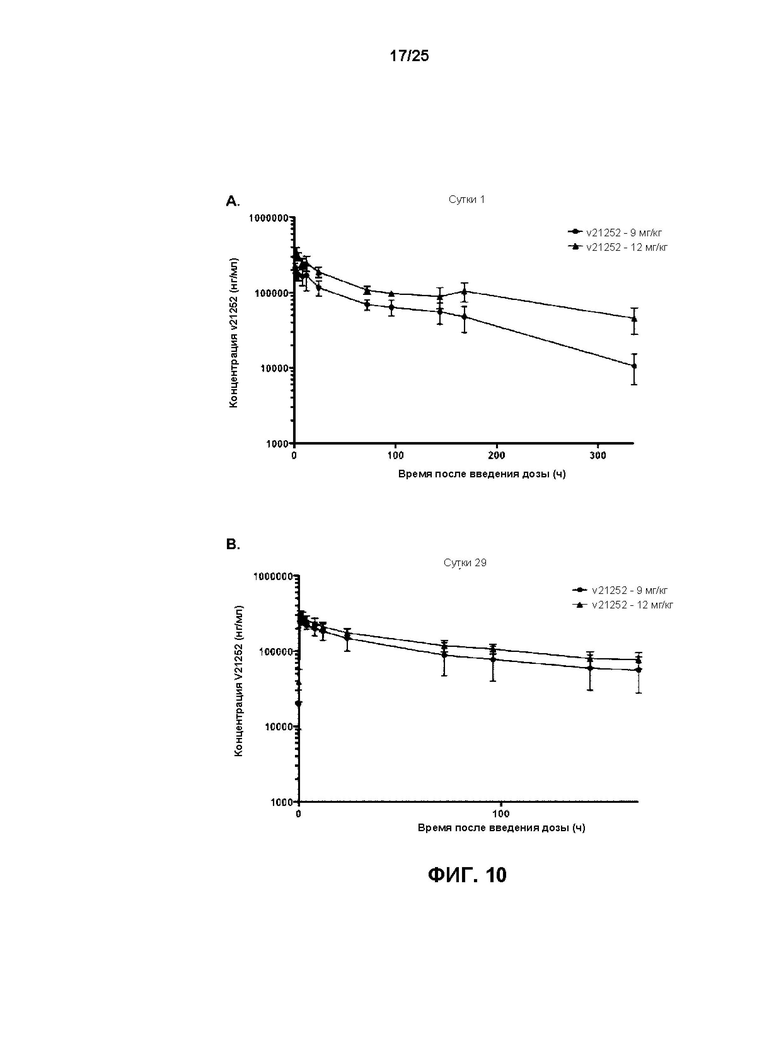
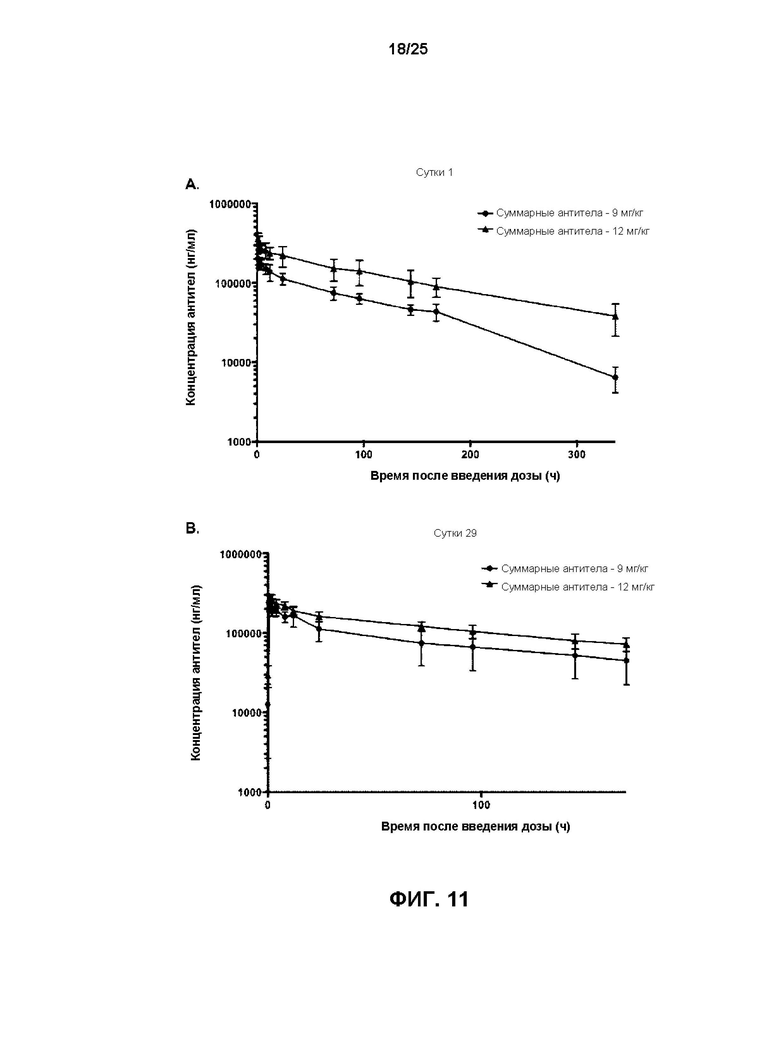
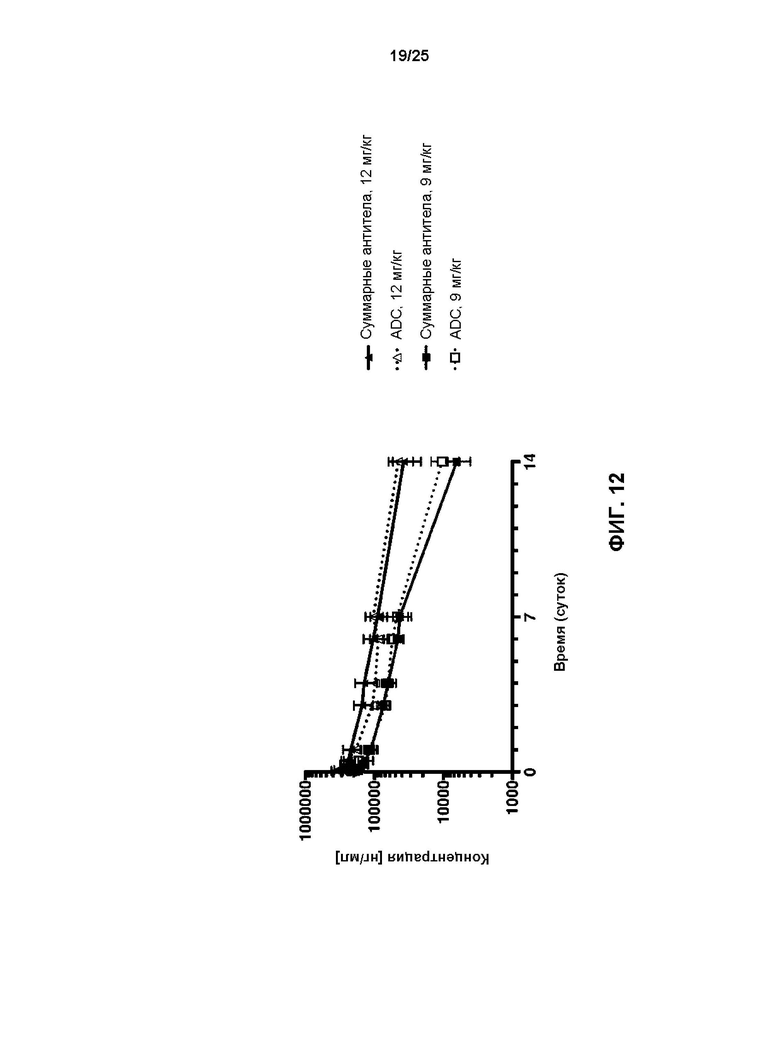
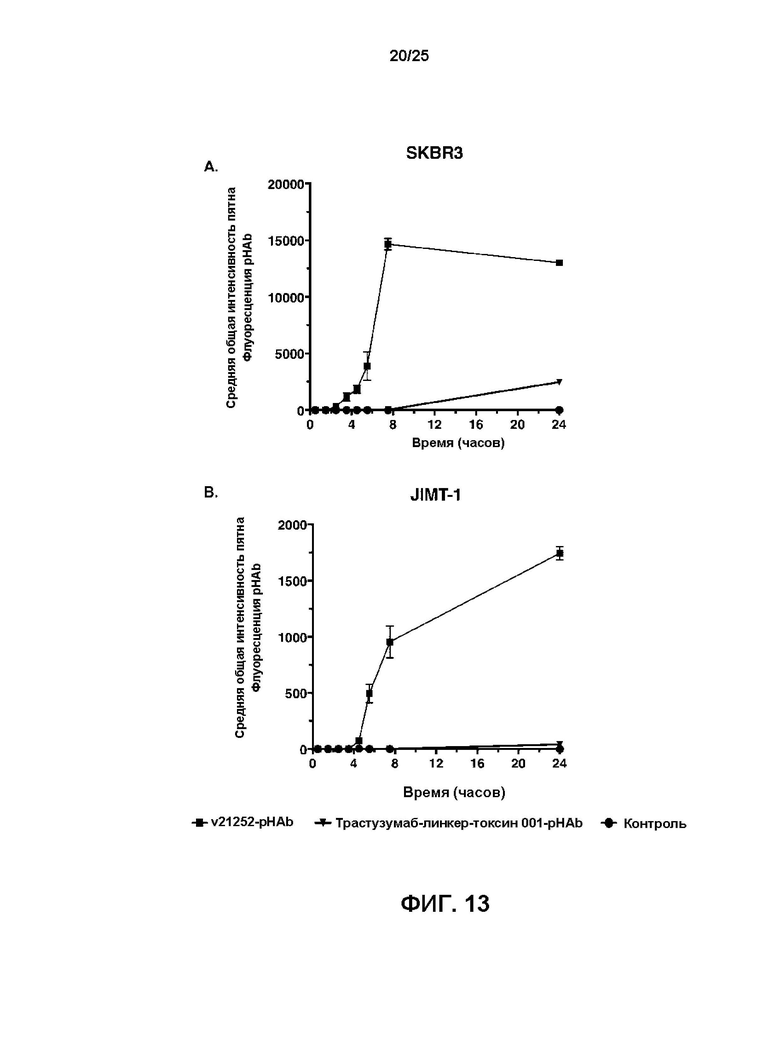

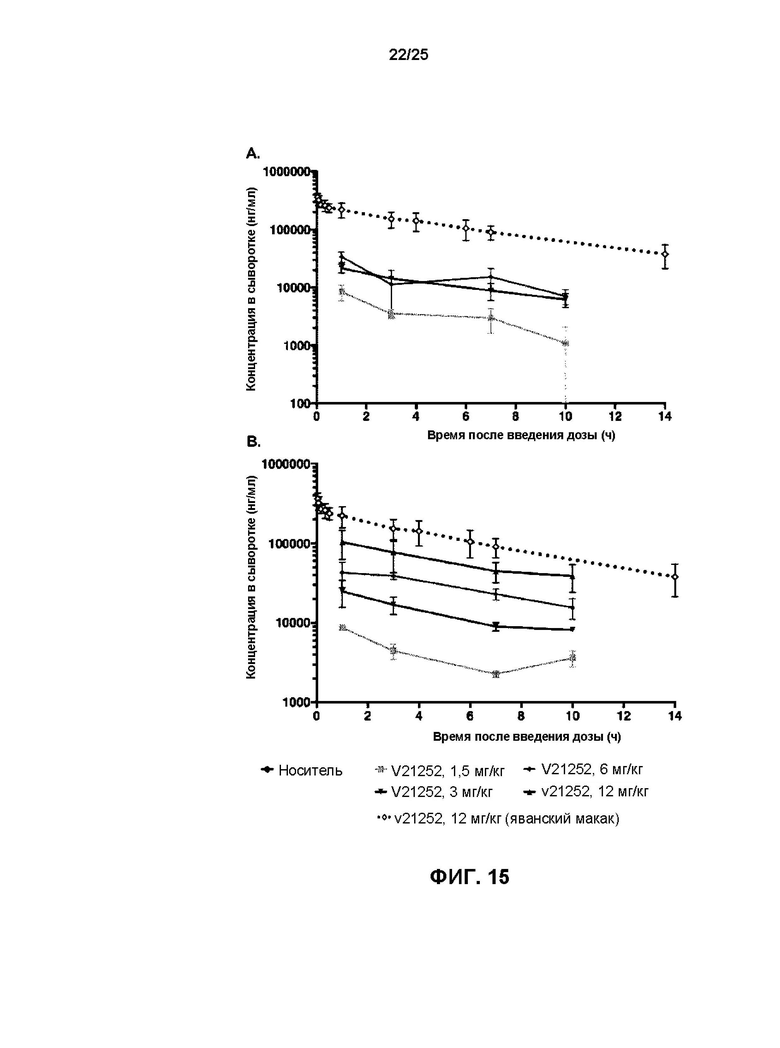
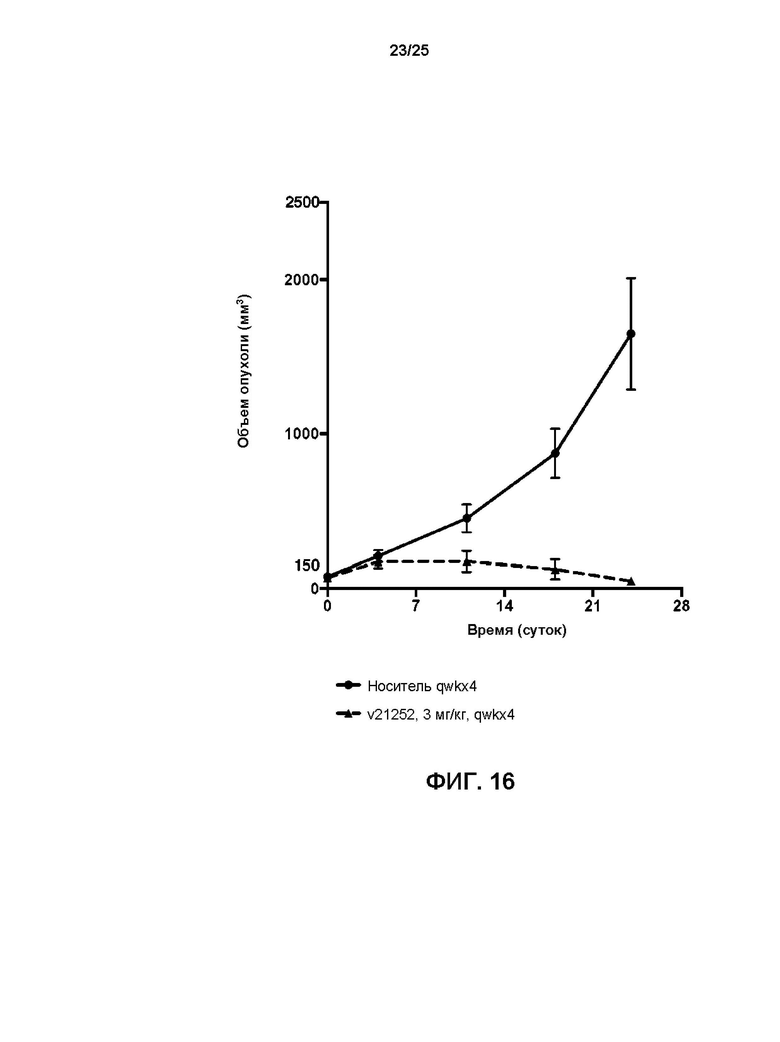
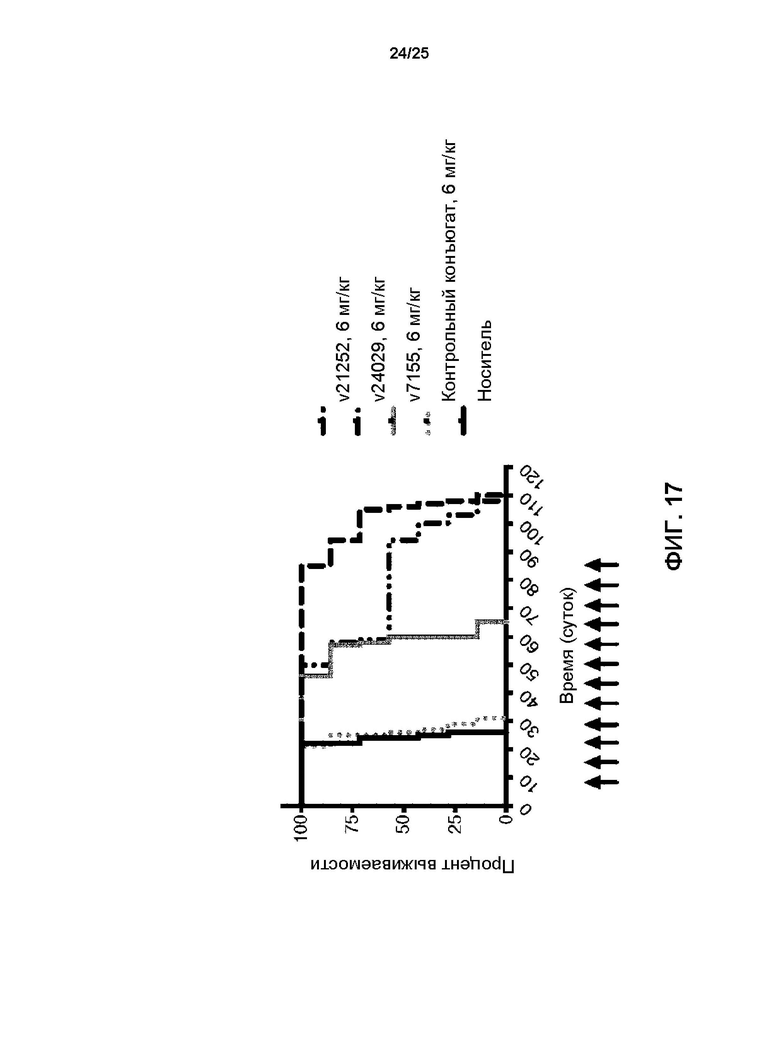
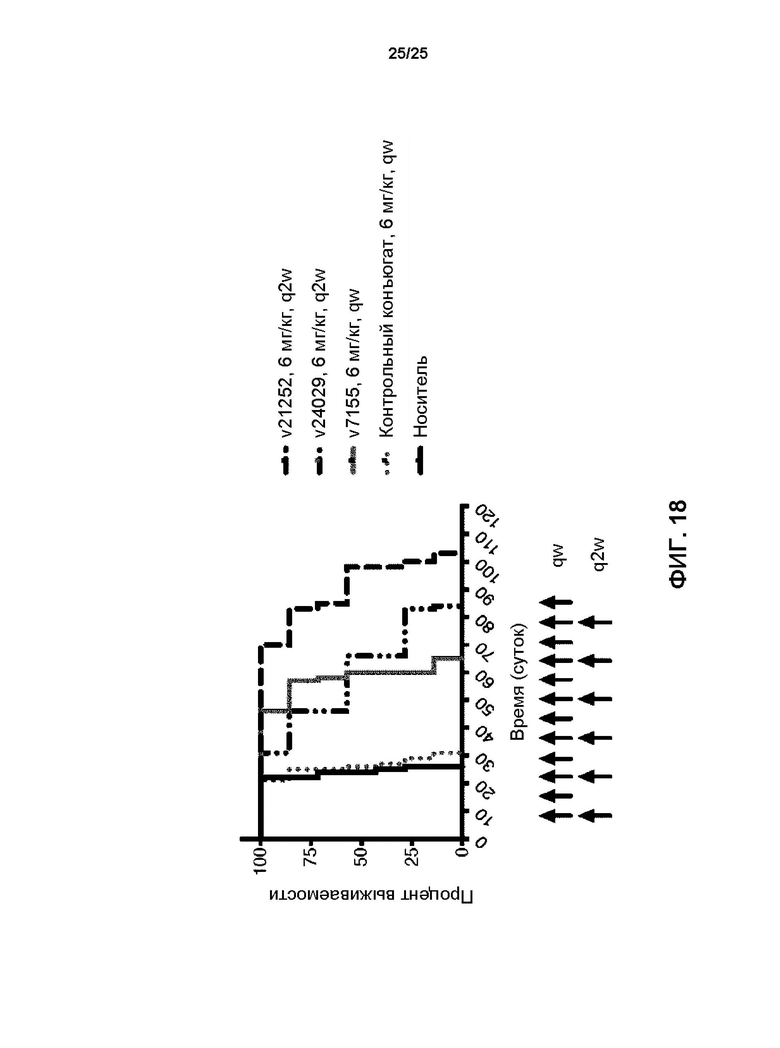
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая анти-HER2 конъюгат антитело-лекарственное средство (варианты), фармацевтическую композицию для лечения HER2-экспрессирующего рака, включающую вышеуказанный анти-HER2 конъюгат антитело-лекарственное средство, способ лечения HER2-экспрессирующего рака, включающий введение эффективного количества анти-HER2 конъюгата антитело-лекарственное средство, и применение анти-HER2 конъюгата антитело-лекарственное средство в производстве лекарственного средства для лечения HER2-экспрессирующего рака. В одном варианте реализации анти-HER2 конъюгат антитело-лекарственное средство содержит бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера, и имеет низкое значение среднего отношения лекарственного средства к антителу. Изобретение расширяет арсенал анти-HER2 средств. 5 н. и 31 з.п. ф-лы, 18 ил., 28 табл., 12 пр.
1. Анти-HER2 конъюгат антитело-лекарственное средство, содержащий анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера (L), с низким значением среднего отношения лекарственного средства к антителу (DAR),
причем анти-HER2 бипаратопное антитело содержит первую антигенсвязывающую полипептидную конструкцию, содержащую последовательности CDR, изложенные в SEQ ID NO: 67, 68, 69, 70, 71 и 72, и вторую антигенсвязывающую полипептидную конструкцию, содержащую последовательности CDR, изложенные в SEQ ID NO: 27, 28, 29, 39, 40 и 41,
причем аналог ауристатина и линкер имеет общую формулу (X)
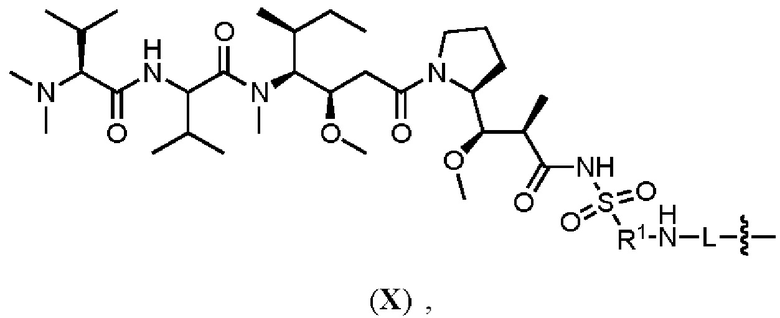
причем R1 выбран из:
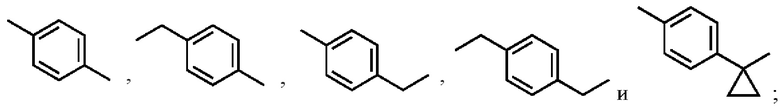
L представляет собой линкер; и
 представляет точку присоединения линкера к анти-HER2 бипаратопному антителу, и
представляет точку присоединения линкера к анти-HER2 бипаратопному антителу, и
причем низкое значение среднего DAR представляет собой среднее DAR от 1,5 до 2,5.
2. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1, в котором R1 представляет собой
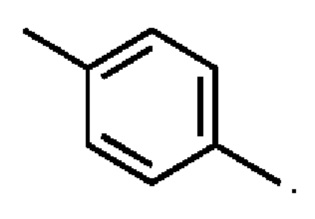
3. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором среднее DAR составляет от 1,8 до 2,5.
4. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором среднее DAR составляет около 2,0.
5. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, причем конъюгат содержит от около 10% до около 25% типов DAR0.
6. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, причем конъюгат содержит от около 15% до около 25% типов DAR0.
7. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, причем конъюгат содержит от около 0% и до около 10% DAR6 или более крупных типов.
8. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором L представляет собой расщепляемый линкер.
9. Анти-HER2 конъюгат антитело-лекарственное средство по п. 8, в котором L представляет собой протеазорасщепляемый линкер.
10. Анти-HER2 конъюгат антитело-лекарственное средство по п. 9, в котором L имеет общую формулу (VI)
где Z представляет собой функциональную группу, способную взаимодействовать с целевой группой на анти-HER2 бипаратопном антителе;
Str представляет собой удлиняющую вставку;
AA1 и АА2 каждый независимо представляет собой аминокислоту, причем AA1-[AA2]m образует сайт расщепления протеазой;
X представляет собой саморасщепляющуюся группу;
D представляет собой точку присоединения к аналогу ауристатина;
s равно 0 или 1;
m представляет собой целое число от 1 до 4; и
о равно 0, 1 или 2.
11. Анти-HER2 конъюгат антитело-лекарственное средство по п. 10, причем s представляет собой 1 и о представляет собой 0.
12. Анти-HER2 конъюгат антитело-лекарственное средство по п. 9, в котором L имеет общую формулу (IX)
где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу;
Y представляет собой один или более дополнительных линкерных компонентов или отсутствует; и
D представляет собой точку присоединения к аналогу ауристатина.
13. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1, в котором аналог ауристатина и линкер имеют структуру

где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу.
14. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором анти-HER2 бипаратопное антитело показывает более высокую интернализацию в HER2-экспрессирующие клетки по сравнению с соответствующим бивалентным моноспецифическим антителом.
15. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором первая антигенсвязывающая полипептидная конструкция представляет собой scFv и вторая антигенсвязывающая полипептидная конструкция представляет собой Fab.
16. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором первая антигенсвязывающая полипептидная конструкция содержит последовательность VH, изложенную в SEQ ID NO: 66, и последовательность VL, изложенную в SEQ ID NO: 65, а вторая антигенсвязывающая полипептидная конструкция содержит последовательность VH, изложенную в SEQ ID NO: 38, и последовательность VL, изложенную в SEQ ID NO: 26.
17. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором анти-HER2 бипаратопное антитело содержит первую тяжелую цепь (H1), вторую тяжелую цепь (Н2) и легкую цепь (L1),
причем H1 содержит первую антигенсвязывающую полипептидную конструкцию, а Н2 и L1 содержат вторую антигенсвязывающую полипептидную конструкцию, и
причем H1 содержит последовательность, изложенную в SEQ ID NO: 36, Н2 содержит последовательность, изложенную в SEQ ID NO: 63, и L1 содержит последовательность, изложенную в SEQ ID NO: 24.
18. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором анти-HER2 бипаратопное антитело дополнительно содержит каркас, который представляет собой Fc-область IgG, и в котором первая и вторая антигенсвязывающие полипептидные конструкции функционально связаны с данным каркасом.
19. Анти-HER2 конъюгат антитело-лекарственное средство по п. 18, в котором Fc-область IgG представляет собой гетеродимерную Fc-область, содержащую модифицированный домен СН3, и модифицированный домен СН3 содержит первую полипептидную последовательность и вторую полипептидную последовательность, и причем:
(a) первая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации L351Y, F405A и Y407V и вторая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T366L, K392M и T394W; или
(b) первая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации L351Y, F405A и Y407V и вторая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T366L, K392L и T394W; или
(c) первая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, L351Y, F405A и Y407V и вторая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, T366L, K392M и T394W; или
(d) первая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, L351Y, F405A и Y407V и вторая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, T366L, K392L и T394W; или
(e) первая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, L351Y, S400E, F405A и Y407V и вторая полипептидная последовательность модифицированного домена СН3 содержит аминокислотные модификации T350V, T366L, N390R, K392M и T394W.
20. Анти-HER2 конъюгат антитело-лекарственное средство по п. 17, в котором среднее DAR составляет от 1,8 до 2,5.
21. Анти-HER2 конъюгат антитело-лекарственное средство по п. 17, в котором конъюгат содержит от около 10% до около 25% типов DAR0.
22. Анти-HER2 конъюгат антитело-лекарственное средство по п. 17, в котором L представляет собой протеазорасщепляемый линкер.
23. Анти-HER2 конъюгат антитело-лекарственное средство по п. 22, в котором L имеет общую формулу (VI)
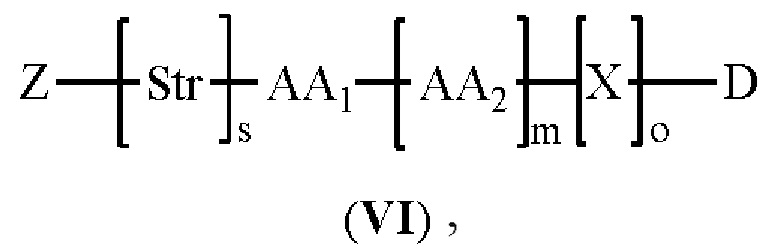
где Z представляет собой функциональную группу, способную взаимодействовать с целевой группой на анти-HER2 бипаратопном антителе;
Str представляет собой удлиняющую вставку;
AA1 и АА2 каждый независимо представляет собой аминокислоту, причем AA1-[AA2]m образует сайт расщепления протеазой;
X представляет собой саморасщепляющуюся группу;
D представляет собой точку присоединения к аналогу ауристатина;
s равно 0 или 1;
m представляет собой целое число от 1 до 4; и
о равно 0, 1 или 2.
24. Анти-HER2 конъюгат антитело-лекарственное средство по п. 23, причем s представляет собой 1 и о представляет собой 0.
25. Анти-HER2 конъюгат антитело-лекарственное средство по п. 17, в котором L имеет общую формулу (IX)

где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу;
Y представляет собой один или более дополнительных линкерных компонентов или отсутствует; и
D представляет собой точку присоединения к аналогу ауристатина.
26. Анти-HER2 конъюгат антитело-лекарственное средство по п. 1 или 2, в котором аналог ауристатина и линкер имеют структуру
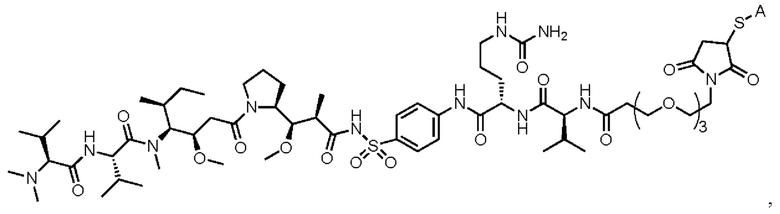
где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу.
27. Анти-HER2 конъюгат антитело-лекарственное средство, содержащий анти-HER2 бипаратопное антитело, конъюгированное с аналогом ауристатина посредством линкера, с низким значением среднего отношения лекарственного средства к антителу (DAR),
причем анти-HER2 бипаратопное антитело содержит первую тяжелую цепь (H1), содержащую последовательность, изложенную в SEQ ID NO: 36, вторую тяжелую цепь (Н2), содержащую последовательность, изложенную в SEQ ID NO: 63, и легкую цепь (L1), содержащую последовательность, изложенную в SEQ ID NO: 24,
причем аналог ауристатина и линкер имеют структуру
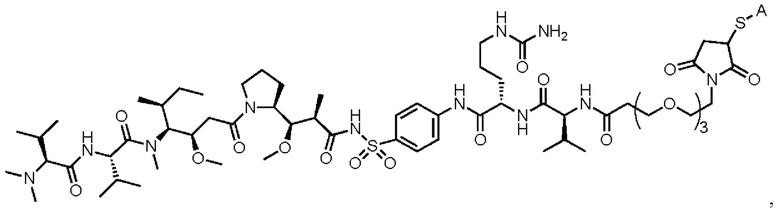
где A-S- представляет собой точку присоединения к анти-HER2 бипаратопному антителу и где низкое среднее DAR представляет собой среднее DAR, составляющее от 1,8 до 2,5.
28. Фармацевтическая композиция для лечения HER2-экспрессирующего рака, содержащая анти-HER2 конъюгат антитело-лекарственное средство по любому из пп. 1-27 и фармацевтически приемлемый носитель или разбавитель.
29. Способ лечения HER2-экспрессирующего рака, включающий введение субъекту с HER2-экспрессирующим раком эффективного количества анти-HER2 конъюгата антитело-лекарственное средство по любому из пп. 1-27.
30. Способ по п. 29, в котором HER2-экспрессирующий рак представляет собой рак молочной железы, рак яичника, рак легкого или рак желудка.
31. Способ по п. 29, в котором HER2-экспрессирующий рак представляет собой рак молочной железы.
32. Способ по п. 29, в котором HER2-экспрессирующий рак представляет собой рак яичника.
33. Применение анти-HER2 конъюгата антитело-лекарственное средство по любому из пп. 1-27 в производстве лекарственного средства для лечения HER2-экспрессирующего рака.
34. Применение по п. 33, в котором HER2-экспрессирующий рак представляет собой рак молочной железы, рак яичника, рак легкого или рак желудка.
35. Применение по п. 33, в котором HER2-экспрессирующий рак представляет собой рак молочной железы.
36. Применение по п. 33, в котором HER2-экспрессирующий рак представляет собой рак яичника.
| WO 2016041082 A1, 24.03.2016 | |||
| WO 2015077891 A1, 04.06.2015 | |||
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| Trail P | |||
| A., Dubowchik G | |||
| M., Lowinger T | |||
| B | |||
| Antibody drug conjugates for treatment of breast cancer: novel targets and diverse approaches in ADC design //Pharmacology & therapeutics, 2018, 181, р | |||
| Ударно-вращательная врубовая машина | 1922 |
|
SU126A1 |
Авторы
Даты
2023-10-25—Публикация
2019-03-12—Подача