Изобретение относится к медицине, в частности к ее разделу, посвященному моделированию патологических процессов. Предложен способ моделирования хронической сердечной недостаточности (ХСН), заключающийся в воспроизведении у мелких лабораторных животных (крысы) инфаркта миокарда строго определенной локализации (передний трансмуральный инфаркт), с последующей динамической оценкой при помощи эхокардиографии этапов развития моделируемой патологии и сроков ее окончательного формирования - 90 дней. Развитие ХСН подтверждено комплексом эхокардиографических, морфогистологических, биохимических и молекулярных методов исследования.
Хроническая сердечная недостаточность (ХСН) - сложный клинический синдром, который является исходом практически любого сердечно-сосудистого заболевания. Согласно данным ВОЗ, распространенность ХСН в общей популяции составляет 1,5-2%, а среди лиц старше 65 лет - 6-10%, и, несмотря на значительные успехи в лечении сердечно-сосудистых заболеваний, распространенность ХСН не только не снижается, но неуклонно возрастает. По данным Фрамингеймского исследования (Framingham Heart Study), средняя 5-летняя смертность во всей популяции больных ХСН (с учетом начальных и умеренных стадий) составляет 65% для мужчин и 47% - для женщин [Mahmood S.S., Levy D., Vasan R.S., Wang T.J. Lancet. 2014; 383(9921): 999-1008; Levy D., Kenchaiah S., Larson M.G. et al., N. Engl. J. Med. 2002; 347(18): 1397-402]. В Российской Федерации, согласно результатам эпидемиологических исследований ЭПОХА-О-ХСН и ЭПОХА-ХСН, распространенность ХСН I-IV функционального класса составила 7% (7,9 млн. человек) от общего числа населения [Фомин И.В. Российский кардиологический журнал. 2016; 8(136): 7-13]. Примерно половина больных ХСН умирает в течение первых 4 лет с момента верификации диагноза, а в тяжелых случаях - столько же в течение первого года, и это происходит несмотря на повсеместное внедрение в широкую медицинскую практику самых эффективных на современном этапе лекарственных средств: ингибиторов ангиотензин-превращающего фермента, β-блокаторов, антагонистов альдостерона и т.д. [Ferrero P., Iacovoni A.,  Е. et al. Int. J. Cardiol. 2015; 188: 1-9]. В настоящее время единственным эффективным способом лечения декомпенсированной ХСН является пересадка сердца [
Е. et al. Int. J. Cardiol. 2015; 188: 1-9]. В настоящее время единственным эффективным способом лечения декомпенсированной ХСН является пересадка сердца [ С., Jorde U.P.,
С., Jorde U.P.,  J. Rev. Esp. Cardiol. (Engl Ed). 2017; 70(5): 371-81.]. Таким образом, разработка и внедрение легко воспроизводимой трансляционной модели ХСН, несомненно, является актуальной.
J. Rev. Esp. Cardiol. (Engl Ed). 2017; 70(5): 371-81.]. Таким образом, разработка и внедрение легко воспроизводимой трансляционной модели ХСН, несомненно, является актуальной.
При анализе литературы, посвященной моделированию ХСН на крысах, в базе данных PubMed на запрос «heart failure rats model» были получены ссылки на 2497 научных статей. Далее слепым методом из них было отобрано и проанализировано 25 статей, опубликованных в период с 2000 по 2017 год, а также 9 систематических обзоров литературы, посвященных моделированию сердечно-сосудистой патологии у лабораторных животных. Как следует из результатов проведенного анализа, ХСН на мелких лабораторных животных воспроизводят различными способами. Для этой цели используют гиперосолевую [Ono Т., Kamimura N., Matsuhashi Т. et al. Sci. Rep. 2017; 7: 39752] и метиониновую [Liu В., Ma S., Wang T. et al. Am. J. Transl. Res. 2016; 8(1): 117-24] диеты; кардиотоксические агенты - цитостатики антрациклины [Cappetta D., Esposito G., Coppini R. et al. Br. J. Pharmacol. 2017; 174(21): 3696-712; Chen Т., Hu Y.Q., Deng L.R. et al. J. Tradit. Chin. Med. 2011; 31(3): 235-40], пирролизидиновый алкалоид монокроталин [Pasini E., Cargnioni A., Pastore F. et al. Pharmacol. Res. 2004; 49(1): 1-5]; несективный β-адреностимулятор изопротеренол [Zhou R., Ma P., Xiong A. et al. Cardiovasc. Ther. 2017; 35(2): e12241, Zhang X., Cheng H.J., Zhou P. et al. Int. J. Cardiol. 2017; 236: 405-12]; коарктацию грудного или абдоминального отделов аорты [Ku Н.С., Lee S.Y., Wu Y.A. et al. J. Vis. Exp. 2016; (118): e54818; Camacho P., Fan H., Liu Z., He J.Q. Am. J. Cardiovasc. Dis. 2016; 6(3): 70-80]. Однако в большинстве случаев моделирование ХСН производят путем одномоментной перевязки коронарной артерии [Kim H.S., No C.W., Goo S.H. et al. J. Korean Med. Sci. 2013; 28(5): 700-8; Camacho P., Fan H., Liu Z., He J.Q. Am. J. Cardiovasc. Dis. 2016; 6(3): 70-80; Weigand K., Witte R., Moukabary Т., et al. IEEE Trans. Biomed. Eng. 2017; 64(6): 1393-9]. Реже для этой цели используют окклюзию с последующей реперфузией коронарной артерии [Lassen T.R., Nielsen J.M., Johnsen J. et al. Basic Res. Cardiol. 2017; 112(3): 26]. Нет и единого подхода как к срокам формирования ХСН, так и к критериям оценки наличия/отсутствия моделируемой патологии. Сроки формирования ХСН в исследованиях различных авторов, вне зависимости от способа моделирования, варьируют от 10 до 70 дней [Zhou R., Ma P., Xiong A. et al. Cardiovasc. Ther. 2017; 35(2): e12241; Kim H.S., No C.W., Goo S.H., Cha T.J. J. Korean Med. Sci. 2013; 28(5): 700-8; Flierl U., Fraccarollo D., Micka J. et al. Pharmacol. Res. 2013; 74: 49-55], преимущественно 28-36 [Yoon N., Cho J.G., Kim K.H. et al. Exp. Ther. Med. 2013; 5(4): 1009-16; Krandycheva V., Kharin S., Strelkova M. et al. Clin. Exp. Pharmacol. Physiol. 2013; 40(7): 431-7] или 42-56 дней [Weigand K., Witte R., Moukabary Т., et al. IEEE Trans. Biomed. Eng. 2017; 64(6): 1393-9 Palus S., Schur R., Akashi Y.J. et al. PLoS One. 2011; 6(11): е2686515]. Как правило, о наличии/отсутствии ХСН судят по состоянию инотропной функции левого желудочка сердца, которую оценивают или при помощи эхокардиографии [Kim H.S., No C.W., Goo S.H. et al. J. Korean Med. Sci. 2013; 28(5): 700-8; Ono Т., Kamimura N., Matsuhashi T. et al. Sci. Rep. 2017; 7: 39752], или измеряют dp/dt в левом желудочке сердца [Chen Т., Hu Y.Q., Deng L.R. et al. J. Tradit. Chin. Med. 2011; 31(3): 235-40]. Помимо этого, в ряде случаев оценивают уровень содержания в плазме крови биохимического маркера ХСН - мозгового натрийуретического пептида [Zhou R., Ma P., Xiong A., Xu Y. et al. Cardiovasc. Ther. 2017; 35(2): e12241; Pasini E., Cargnioni A., Pastore F. et al. Pharmacol. Res. 2004; 49(1): 1-5] и/или биохимического маркера повреждения миокарда - тропонина I [Zhou R., Ma P., Xiong A. et al. Cardiovasc. Ther. 2017; 35(2): е12241]. Также оценивают массу миокарда и проводят морфометрическую оценку размеров сердца [Ono Т., Kamimura N., Matsuhashi Т. et al. Sci. Rep. 2017; 7: 39752]. Однако обращает на себя внимание тот факт, что авторы исследований не приводят каких-либо убедительных аргументов по поводу выбранных ими сроков формирования ХСН, используя в качестве основополагающего критерия уровень сократимости миокарда. Такой подход представляется достаточно спорным, поскольку хорошо известно, что ХСН представляет собой многофакторный симптомокомплекс, включающий в себя, помимо собственно снижения сократительной способности сердца, дилатацию его полостей, деструктивные изменения миокарда, поражение органов-мишеней, гиперактивность ренин-ангиотензин-альдостероновой и симпатоадреналовой систем и т.д. [McMurray J.J., Adamopoulos S., Anker S.D. et al. Eur. J. Heart Fail. 2012; 14 (80): 803-869]. Следует также отметить, что в проанализированных исследованиях оценка состояния инотропной функции сердца как основного критерия наличия/отсутствия ХСН, а также биохимических и/или каких-либо других показателей, как правило, проводится только в конечной временной точке эксперимента, то есть динамика формирования ХСН не отслеживается.
Таким образом, анализ литературы свидетельствует о том, что в настоящее время отсутствуют четкие критерии, позволяющие оценить у животных формирование «клинически значимой» ХСН. Целью настоящего изобретения является разработка трансляционной модели хронической постинфарктной хронической сердечной недостаточности у крыс, воспроизводящей основные клинико-диагностические признаки этого заболевания. Техническое решение задачи проиллюстрировано следующими примерами.
Пример 1. Воспроизведение у экспериментальных животных переднего трансмурального инфаркта миокарда.
Эксперименты проводили на беспородных белых крысах-самцах с начальной массой 160-180 г. Животных содержали в соответствии с приказом Минздрава России №199 от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики» и СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. №51. Все эксперименты с животными проводили в соответствии с международными правилами (European Communities Council Directive of November 24, 1986 (86/609/EEC)). У анестезированных животных (этиловый эфир для наркоза, ингаляционно), фиксированных на операционном столике в положении на спине, проводили торакотомию в 5-м межреберье, вскрывали перикард, надавливанием на грудную клетку проводили пролабирование сердца в рану. Под левую коронарную артерию сразу же после выхода ее из-под ушка подводили лигатуру (атравматическая игла, лавсан 3/0). У животных основной группы лигатуру перевязывали, полностью прекращая кровоток, у ложнооперированных - оставляли свободной. Затем сердцу придавали нормальное положение в грудной клетке и рану послойно ушивали. На вторые сутки после операции проводили эхокардиографическое исследование и в основную группу включали только тех животных, у которых диагностировался передний трансмуральный инфаркт миокарда.
Для оценки формирования ХСН проводили динамические эхокардиографические исследования. Основным критерием развития постинфарктной ХСН было статистически значимое, по сравнению со 2-ми сутками после перевязки коронарной артерии, снижение фракции выброса и развитие дилатации левого желудочка сердца. Наличие ХСН дополнительно подтверждалось при помощи комплекса морфогистологических, биохимических и молекулярных методов.
Следующие примеры иллюстрируют развитие у экспериментальных животных через 90 суток после воспроизведения острого переднего трансмурального инфаркта миокарда хронической сердечной недостаточности.
Пример 2. Неинвазивный эхокардиографический метод оценки формирования ХСН.
Наркотизированных животных (кетамин, 100 мг/кг) фиксировали в положении на спине на операционном столике. Измерения проводили в условиях закрытой грудной клетки и спонтанного дыхания в одномерном М- и двухмерном В-модальных режимах при положении датчика эхокардиографа в парастернальной позиции по длинной оси сердца. В М-модальном режиме оценивали конечно-систолический (КСР) и конечно-диастолический (КДР) размеры левого желудочка сердца, затем по методу Teichholz рассчитывали фракцию выброса (ФВ), фракцию укорочения (ФУ), конечно-систолический объем (КСО), конечно-диастолический объем (КДО) левого желудочка. Оценку показателей проводили, как минимум, по пяти последовательным сердечным циклам. Все измерения выполняли в соответствии с Рекомендациями Американского общества и Европейской ассоциации по эхокардиографии. В работе использовали цифровой ультразвуковой эхокардиограф DP-6600 (Mindray, Китай) с электронным микроконвексным датчиком 65С15ЕА (6,5/8,0 МГц).
Статистическая обработка. Для анализа динамики изменений эхокардиографических показателей использовали дисперсионный анализ повторных измерений с последующей обработкой методом множественных сравнений по Ньюмену-Кейлсу. Для определения статистической значимости различий между ложнооперированными и опытными крысами использовали t-критерий Стьюдента для независимых выборок. Результаты выражали в виде средних арифметических и их стандартных ошибок.
У ложнооперированных животных (n=8) на 2-е сут. после операции величины, характеризующие состояние внутрисердечной гемодинамики, не отличались от исходных (табл. 1). Так, величина КСР равнялась 1,67±0,10 мм, а ФВ была равна 88,6±1,8%. В дальнейшем в течение всего периода наблюдения величины КСР, КДР, ФУ и ФВ существенно не изменялись и к концу эксперимента (через 3 месяца) составляли 1,88±0,19 мм, 3,83±0,22 мм, 50,9±1,2% и 87,1±1,6%, соответственно (фиг. 1А). Во всех случаях p>0,05.
У животных основной группы (n=12) на 2-е сут. после воспроизведения инфаркта миокарда (в эту группу включены только животных с документально подтвержденным передним трансмуральным инфарктом миокарда) зарегистрированы существенные изменения в состоянии систолической функции левого желудочка сердца (табл. 1, фиг. 1Б) - статистически значимое по сравнению с ложнооперированными животными увеличение КСР (соответственно 2,49±0,08 и 1,67±0,10 мм, р=0,0018) и уменьшение ФВ (соответственно 63,9±1,6 и 88,6±1,8%, р=0,0001), тогда как КДР у животных основной группы и ложнооперированных крыс практически не различался (соответственно 3,56±0,11 и 3,55±0,13 мм, р=0.984). Эти данные свидетельствуют о том, что у животных уже со 2-х сут. начинает формироваться систолическая сердечная недостаточность.
Близкая картина зарегистрирована и к концу 1-го мес. от момента воспроизведения экспериментального инфаркта миокарда (табл. 1). Отмечается статистически значимое (р=0,0001) по сравнению со 2-ми сут. после операции увеличение КСР с 2,49±0,08 до 3,05±0,12 мм. Вместе с тем, существенных изменений КДР и ФВ левого желудочка сердца не происходит.
Через 2 мес. у животных основной группы состояние внутрисердечной гемодинамики претерпевает существенные негативные изменения: у них начинает формироваться дилатационная постинфарктная сердечная недостаточность (табл. 1). Об этом, в частности, свидетельствует не только динамическое увеличение КСР (за месяц с 3,05±0,12 до 3,36±0,15 мм), но и статистически значимое по сравнению со 2-ми сут. после воспроизведения экспериментального инфаркта миокарда увеличение КДР (соответственно 4,63±0,17 и 3,56±0,11 мм, р=0,0002). Однако ФВ левого желудочка сердца как по сравнению со 2-ми сут., так и сроком 1 мес. после операции, практически не меняется (соответственно 60,1±1,6; 60,6±1,5 и 63,9±1,6%; р=0.136). Эти наблюдения свидетельствуют о том, что выявленные к этому времени изменения геометрии левого желудочка носят компенсаторный характер, позволяющий поддерживать насосную функцию сердца на относительно удовлетворительном уровне: снижение ФВ по сравнению с со 2-ми сут. после операции - в пределах 5%.
Через 3 мес. после воспроизведения инфаркта миокарда у животных основной группы наблюдается дальнейшее динамическое увеличение КСР и КДР (соответственно с 2,49±0,08 до 3,91±0,17 мм, р=0,0002 и с 3,56±0,11 до 5,20±0,19 мм, р=0.0001), которое происходит на фоне статистически значимого по сравнению со 2-ми сут. снижения ФВ левого желудочка сердца (соответственно 53,9±1,4 и 63,9±1,6%, р=0,0008) (табл. 1, фиг. 1В).
Следует также отметить, что к этому периоду наблюдения у 4 из 12 животных формируется постинфарктная аневризма передней стенки левого желудочка сердца (фиг. 2А).
Таким образом, результаты динамического эхокардиографического исследования свидетельствуют о том, что у животных основной группы к концу 3-го мес. во всех случаях формируется смешанная дилатационная постинфарктная сердечная недостаточность, течение которой в 33% случаев отягощено развитием постинфарктной аневризмы передней стенки левого желудочка сердца.
Пример 3. Морфогистологическое подтверждение развития ХСН.
Морфогистологическую оценку состояния сердца, легких и печени производили у животных по окончании последнего эхокардиографического исследования. Для этих целей животных забивали, сердца, легкие и печень извлекали и фиксировали в 10%-ом забуференном растворе формалина для дальнейшего морфометрического и гистологического изучения. После окончания фиксации и стандартной проводки образцы заливали в парафиновые блоки. Готовили гистологические срезы толщиной 5 мкм, которые помещали на стекло с полилизиновым покрытием (Menzel), затем окрашивали галлоцианин-хромовыми квасцами с последующей докраской 1%-м водным раствором эозина. Гистологические препараты микроскопировали в проходящем свете (микроскоп Nikon eclipse 55i, увеличение x100, х200, х400, Япония). Гистологические срезы сердец фотографировали. Фотографии сердец сохраняли в формате Jpeg и анализировали с помощью программы Adobe Photoshop CS5, оценивая толщину стенок и площадь желудочков и их полостей. Морфометрические измерения проводили на поперечном срединном срезе сердца.
Статистическая обработка. При проведении морфометрического исследования сердца статистическую значимость различий между группами определяли с помощью t-критерия Стьюдента для независимых выборок. Результаты выражали в виде средних арифметических и их стандартных ошибок. При проведении гистологического анализа тканей проводили балльное шкалирование гидрофильной дистрофии печени и венозного застоя в легких. Данные, измеренные с помощью ординарной шкалы, обрабатывали с помощью критерия Манна-Уитни, результаты выражали в виде медиан и нижнего и верхнего квартилей.
Пример 3.1. Морфогистологическая оценка состояния сердца.
Визуально сердца животных основной группы увеличены в размерах и по своей форме значительно отличались от сердец ложнооперированных животных, поскольку имели не конусообразную, а шаровидную форму, полости левого и правого желудочков расширены.
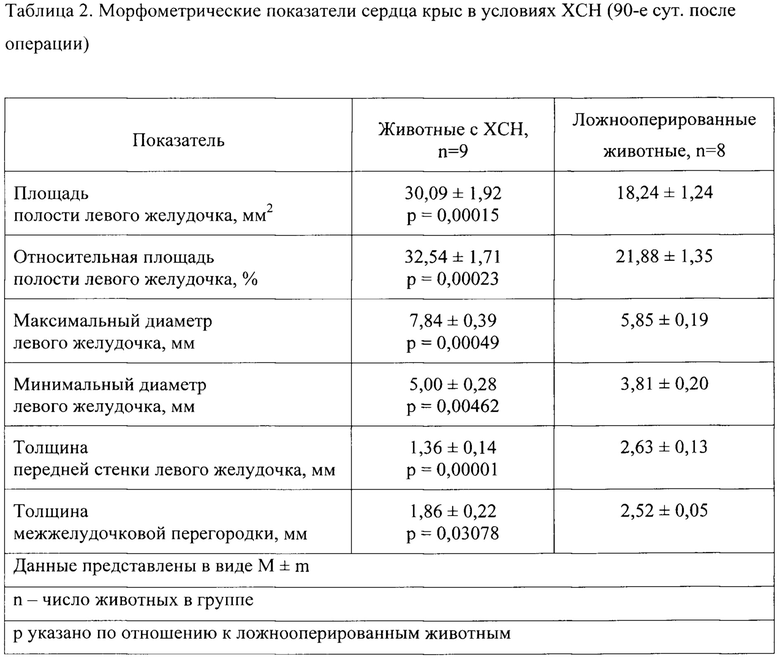
У животных основной группы выявлена статистически значимая дилатация полости и истончение стенок левого желудочка. Площадь левого желудочка сердца у животных основной группы почти в 2 раза больше, чем у ложнооперированных, тогда как размеры левого желудочка сердца у ложнооперированных животных находятся в пределах анатомической нормы (табл. 2, фиг. 3).
Миокард животных основной группы дряблой консистенции с глинистым оттенком. В передней стенке левого желудочка сердца располагается белесый трансмуральный рубец неправильной геометрической формы. У животных с аневризмой визуализируется мешковидное выпячивание истонченной стенки левого желудочка сердца, миокард левого желудочка сердца за пределами аневризмы утолщен (фиг. 2Б). При микроскопическом исследовании миокарда желудочков у животных основной группы выявляются очаги исчезновения поперечной исчерченности мышечных волокон, волнообразная деформация, вакуолизации и фрагментации кардиомиоцитов (фиг. 4).
Помимо этого, у животных основной группы, по сравнению с ложнооперированными, статистически значимо (р=0,001) увеличено количество кардиомиоцитов, содержащих мелкие ядра, что свидетельствует о преобладании в миокарде этих животных дистрофических процессов.
Полученные результаты морфогистологического анализа макро- и микропрепаратов сердец животных основной группы, с одной стороны, свидетельствуют о наличии компенсаторной гипертрофии миокарда, протекающей на фоне постинфарктного кардиосклероза, с другой стороны, наблюдаемые параллельно с гипертрофией миокарда дилатация полостей и исчезновение поперечной исчерченности части кардимиоцитов свидетельствуют о снижении их сократительной способности.
Пример 3.2. Морфогистологическая оценка состояния легких.
Визуально легкие животных основной группы увеличены в размерах, имеют более плотную консистенцию и бурый оттенок легочной ткани по сравнению с ложнооперированными животными. Также отмечается расширение легочных вен.
При микроскопическом исследовании легочной ткани животных основной группы показано, что, в отличие от ложнооперированных, капилляры межальвеолярных перегородок переполнены кровью, в альвеолах множественные диапедезные кровоизлияния (фиг. 5), обуславливающие начало формирования патогномоничного для венозного застоя в легких гемосидероза.
При проведении балльного шкалирования интенсивности кровенаполнения легких было показано, что у животных основной группы, по сравнению с ложнооперированными, проявления венозного застоя и эритростаза статистически значимо выше (р=0,02).
Пример 3.3. Морфогистологическая оценка состояния печени.
Визуально печень животных основной группы, по сравнению с печенью ложнооперированных животных, увеличена в размерах, края закруглены. При разрезе ткань более плотная, поверхность разреза имеет серо-желтый оттенок с темно-красными вкраплениями - патогномоничная для венозного застоя «мускатная печень».
При микроскопическом исследовании ткани печени животных основной группы показано, что, в отличие от ложнооперированных, сосуды полнокровны, центральные вены и прилегающие к ним отделы синусоидов расширены, отмечаются очаги кровоизлияний, дискомплексации печеночных балок, часть гепатоцитов имеет нечеткие контуры (фиг. 6). Полнокровие и отек периферических долек печени менее выражен.
Было проведено балльное шкалирование интесивности гидрофильной дистрофии печени. Показано, что у животных основной группы, по сравнению с ложнооперированными, интесивность гидрофильной дистрофии статистически значимо выше (р=0,001).
Таким образом, результаты морфогистологического анализа макро- и микропрепаратов тканей печени и легких животных основной группы свидетельствуют о наличии у них хронического венозного полнокровия, характерного для ХСН.
Пример 4. Оценка уровня биохимического маркера ХСН в плазме крови крыс.
В качестве биохимического маркера ХСН использовали мозговой натрийуретический пептид (BNP - brain natriuretic peptide). BNP преимущественно секретируется кардиомиоцитами желудочков и в настоящее время рассматривается как «золотой стандарт» в диагностике ХСН [Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Сердечная недостаточность. 2013; 14(7): 379-472]. Пробы крови для иммуноферментного определения содержания в плазме BNP забирали у животных из бедренной вены по окончании последнего эхокардиографического исследования. Определение содержания BNP проводили с помощью автоматического биохимического и иммуноферментного анализатора "Chem Well 2910 Combi" (США). В работе использовали набор для иммуноферментного определения BNP у крыс RMP900 (R&D Systems, США).
Показано, что у животных через 3 мес. после перевязки коронарной артерии концентрация BNP в плазме крови статистически значимо (р=0,014) выше, чем у ложнооперированных (фиг. 7). Увеличение содержания BNP (на 35%) в плазме крови животных основной группы является дополнительным свидетельством развития у животных ХСН.
Статистическую обработку результатов проводили по Стьюденту для независимых выборок. Данные выражали в виде средних арифметических и их стандартных ошибок.
Пример 5. Оценка экспрессии генов AT1A-R и β-AR в сердце крыс.
Хорошо известно, что ренин-ангиотензин-альдостероновая (РААС) и симпатоадреналовая (САС) системы занимают одно из ведущих мест в патогенезе ХСН [Antoine S., Vaidya G., Imam H., Villarreal D. Am. J. Med. Sci. 2017; 353(1): 27-30; Tannenbaum S., Sayer G.T. Curr. Opin. Cardiol. 2015; 30(3): 250-8]. В условиях сформировавшейся ХСН эти системы, действуя синергично, инициируют активацию ряда патологических внутриклеточных сигнальных каскадов, ответственных, в частности, за снижение инотропной функции, аритмогенез и ремоделирование сердечной мышцы.
Известно, что ангиотензин II (ATII) в ишемизированном миокарде выступает в качестве модулятора ремоделирования, способствуя развитию гипертрофии и/или фиброза миокарда [De Smet H.R., Menadue M.F., Oliver J.R., Phillips P.A. Clin. Exp. Pharmaco.l Physiol. 2003; 30(4): 278-283; Dasgupta C, Zhang L. Drug. Discov. Today. 2011; 16: 22-34]. ATII в кардиомиоцитах реализует свои внутриклеточные эффекты преимущественно за счет активации AT1A-R. Показано, что в постинфарктном периоде как в инфарктной зоне, так и в неповрежденных отделах сердца уровень экспрессии AT1-R существенно выше, чем AT2-R [Nio Y., Matsubara Н., Murasawa S. et al. J. Clin. Invest. 1995; 95(1): 46-54].
О состоянии PAAC и CAC судили по уровню экспрессии AT1A-R и β-адренорецепторов (β-AR).
Для молекулярно-биологических исследований забирали образцы миокарда левого желудочка. Образцы отмывали от крови в изотоническом растворе натрия хлорида при +4°С, после чего их помещали в раствор RNAlater (Ambion, США) и хранили до выделения РНК при температуре -20°С. Ткани, извлеченные из раствора RNAlater, гомогенизировали в жидком азоте и переносили в TRI®Reagent (Sigma, США). Выделение тотальной РНК осуществляли в соответствии с протоколом производителя TRI®Reagent. Концентрацию суммарной РНК в образцах определяли на спектрофотометре NanoDrop® ND-1000 (Thermo Fisher Scientific Inc., США). Для предотвращения контаминации геномной ДНК выделенную суммарную РНК обрабатывали ДНКазой I. Добавив все компоненты, смесь инкубировали при 37°С в течение 30 мин. Фермент инактивировали нагреванием при 65°С в течение 10 мин., предварительно добавив 25 мМ ЭДТА, из расчета 1 мкл на 10 мкл реакционной смеси, для предотвращения гидролиза РНК в процессе нагревания. Реакцию обратной транскрипции проводили с использованием гексамерных Random праймеров и обратной транскриптазы M-MuLV в составе набора RevertAid Н Minus First Strand cDNA Synthesis Kit (США) в соответствии с протоколом производителя. Для амплификации фрагментов кДНК исследуемых генов и генов «домашнего хозяйства» использовали наборы специфических праймеров и универсальный набор реактивов для проведения ПЦР «в реальном времени» (ПЦР-РВ) фирмы "Евроген" (Россия), содержащий референтный краситель ROX. В качестве гена «домашнего хозяйства» был использован ген β-актина. Праймеры для генов были предоставлены ООО "ДНК-Синтез" с дополнительным праймером-зондом, содержащим флуоресцентный краситель FAM и его тушитель BHQ1. ПЦР-РВ проводили в 96-и луночном ПЦР-планшете («Bio-Rad Laboratories, Inc.», США) на амплификаторе CFX96™ Real-Time PCR Detection Systems (Bio-Rad Laboratories, Inc., США). Предварительную обработку результатов проводили с использованием программного обеспечения, прилагаемого к прибору. Дальнейшая обработка проводилась с использованием алгоритма 2-ΔΔCt. Расчет уровня матричной РНК (мРНК) проводили с использованием алгоритма deltadelta(Ct), в основу которого положены относительные изменения пороговых циклов (Ct) исследуемого и референсного гена в опытных и контрольных образцах.
Для статистической обработки данных молекулярных исследований использовали t-критерий Стьюдента.
Показано, что у животных основной группы через 3 мес. после перевязки коронарной артерии уровень мРНК AT1A-R более чем на 40% превышает таковой, зафиксированный у ложнооперированных животных (фиг. 8А).
Уровень экспрессии генов β1-AR и β2-AR у животных основной группы через 3 мес. после перевязки коронарной артерии превышал таковой у ложнооперированных животных соответственно на 35 и 48% (рис. 8Б); различия статистически значимы - р=0,001 и р=0,0001. Увеличение мРНК β-AR, по-видимому, является следствием хронической активации симпатического отдела вегетативной нервной системы, патогномоничной для ХСН. На фоне снижения инотропной функции сердца (на 40%) увеличение экспрессии β-AR, вероятно, является ответной реакцией на десенситизацию этих рецепторов, характерную для ХСН [Авдонин П.В., Кожевникова Л.М. Биологические мембраны: Журнал мембранной и клеточной биологии. 2007; 24(1): 4-31]. Полученные данные также свидетельствуют о том, что к концу 3-го мес. после перевязки коронарной артерии начинает формироваться характерный для ХСН феномен обратной регуляции (down и up-regulation) - снижение плотности β1- и увеличение плотности β2-AR, встроенных в клеточную мембрану кардиомиоцитов.
Можно полагать, что увеличение в миокарде животных через 3 мес. после перевязки коронарной артерии экспрессии генов AT1A-R и β-AR свидетельствует об активации РААС и САС, играющих ключевую роль в патогенезе ХСН.

Заключение
Результаты комплекса эхокардиографических, морфогистологических, биохимических и молекулярно-биологических исследований свидетельствует о том, что у экспериментальных животных к 90-му дню после воспроизведения острого переднего трансмурального инфаркта миокарда развиваются патогномоничные для хронической сердечной недостаточности признаки. Таким образом, предложенная модель достаточно полно отражает ситуацию, наблюдаемую в клинике у пациентов с хронической сердечной недостаточностью, и может рассматриваться как трансляционная модель этого заболевания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Эхокардиограммы крыс: А - интактное животное; Б - 2-е сут. после воспроизведения переднего трансмурального ИМ; В - 90-е сут. после воспроизведения ИМ (животные со сформировавшейся ХСН).
1 - конечно-систолический размер, 2 - конечно-диастолический размер, 3 - передняя стенка, 4 - задняя стенка левого желудочка сердца.
Фиг. 2. Аневризма левого желудочка сердца. А - эхограмма; Б - макропрепарат.
3 - передняя стенка, 4 - задняя стенка левого желудочка сердца, 5 - аорта, 6 - верхушка сердца, 7 - левое предсердие, 8 - правый желудочек, 9 - аневризма.
Фиг. 3. Макропрепараты сердца крыс: А - интактные животные, Б - животные со сформировавшейся ХСН (90-ые сутки после воспроизведения ИМ).
Фиг. 4. Гистологическая картина миокарда у животных с ХСН. Окраска галлоцианин-эозином, x10. А - ХСН, зона некроза; Б - ХСН, периинфарктная зона; В - ложнооперированные.
10 - волнообразная деформация кардиомиоцитов; 11 - исчезновение поперечной исчерченности мышечных волокон.
Фиг. 5. Гистологическая картина легких у животных с ХСН. Окраска галлоцианин-эозином, x10. А - ХСН; Б - ложнооперированные.
12 - застойные явления в легких.
Фиг. 6. Гистологическая картина печени у животных с ХСН. Окраска галлоцианин-эозином, x10. А - ХСН; Б - ложнооперированные.
13 - гидропическая дистрофия гепатоцитов; 14 - отек перисинусоидальных пространств Диссе.
Фиг. 7. Содержание BNP в плазме крови крыс через 3 месяца после воспроизведения инфаркта миокарда.
По оси абсцисс - группа животных, по оси ординат - содержание BNP (пикограмм/мл).
Фиг. 8. Увеличение уровня мРНК AT1A-R (A), β1- и β2-AR (Б) в левом желудочке сердца крыс с ХСН.
По оси абсцисс - группа животных, по оси ординат - уровень экспрессии мРНК (относительные единицы).
| название | год | авторы | номер документа |
|---|---|---|---|
| Ингибиторы цинк-зависимых металлопротеиназ (ММП-2 и ММП-9) в ряду бензоиламино(фенилсульфонил)-замещенных циклических аминокислот как потенциальные лекарственные средства, препятствующие постинфарктному ремоделированию левого желудочка сердца | 2016 |
|
RU2646752C2 |
| Средство, ослабляющее постинфарктное ремоделирование миокарда | 2022 |
|
RU2830221C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ С ИБС В ПОСТИНФАРКТНЫЙ ПЕРИОД | 2004 |
|
RU2269922C1 |
| Способ прогнозирования развития ремоделирования левого желудочка после инфаркта миокарда с подъемом сегмента ST и сердечной недостаточности с использованием многофакторной регрессионной модели | 2022 |
|
RU2806237C1 |
| Средство, ослабляющее постинфарктное ремоделирование миокарда | 2020 |
|
RU2740895C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ НЕБЛАГОПРИЯТНЫХ СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА С ИШЕМИЧЕСКОЙ И/ИЛИ ПОСТИНФАРКТНОЙ ДИСФУНКЦИЕЙ МИОКАРДА НА ФОНЕ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ | 2014 |
|
RU2568577C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАНИЙ К ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ У БОЛЬНЫХ ИБС, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА | 2004 |
|
RU2269934C1 |
| Производные пиридинов со свойствами Epac-ингибиторов | 2023 |
|
RU2837899C1 |
| Способ многофакторного прогнозирования хронической сердечной недостаточности после первичного инфаркта миокарда с подъемом сегмента ST в течение 48-недельного наблюдения | 2021 |
|
RU2754798C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С КАРДИОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2476224C2 |




Изобретение относится к медицине, а именно к экспериментальной кардиологии, и может быть использовано для воспроизведения трансляционной модели хронической постинфарктной сердечной недостаточности у крыс. Воспроизводят инфаркт миокарда, для чего у животных проводят торакотомию, вскрывают перикард, надавливанием на грудную клетку проводят пролабирование сердца в рану, под левую коронарную артерию сразу же после выхода ее из-под ушка подводят лигатуру, которую перевязывают, полностью прекращая кровоток. Затем сердцу придают нормальное положение в грудной клетке и рану послойно ушивают. На вторые сутки после операции осуществляют отбор только тех животных, у которых неинвазивным эхокардиографическим методом диагностируют передний трансмуральный инфаркт миокарда. У всех отобранных животных по истечении 90-х суток от воспроизведения инфаркта миокарда диагностируют смешанную дилатационную постинфарктную сердечную недостаточность. Выявление формирования постинфарктной сердечной недостаточности включает анализ результатов эхокардиографии, морфометрии, гистологических, биохимических и молекулярных методов исследования. Способ обеспечивает возможность создания трансляционной модели хронической постинфарктной сердечной недостаточности у крыс, воспроизводящей основные клинико-диагностические признаки этого заболевания, за счет формирования к 90-му дню хронической сердечной недостаточности (ХСН), которая характеризуется значительным угнетением сократительной функции и значимой дилатацией левого желудочка и характерными для ХСН морфогистологическими признаками поражения сердца. 1 з.п. ф-лы, 8 ил., 2 табл., 5 пр.
1. Способ воспроизведения трансляционной модели хронической постинфарктной сердечной недостаточности у крыс, включающий воспроизведение инфаркта миокарда, для чего у животных проводят торакотомию, вскрывают перикард, надавливанием на грудную клетку проводят пролабирование сердца в рану, под левую коронарную артерию сразу же после выхода ее из-под ушка подводят лигатуру, которую перевязывают, полностью прекращая кровоток, затем сердцу придают нормальное положение в грудной клетке и рану послойно ушивают, на вторые сутки после операции осуществляют отбор только тех животных, у которых неинвазивным эхокардиографическим методом диагностируют передний трансмуральный инфаркт миокарда, у всех отобранных животных по истечении 90-х суток от воспроизведения инфаркта миокарда диагностируют смешанную дилатационную постинфарктную сердечную недостаточность.
2. Способ по п. 1, отличающийся тем, что выявление формирования постинфарктной сердечной недостаточности, транслирующей клинико-диагностические признаки этого заболевания, по истечении 90-х суток от воспроизведения инфаркта миокарда у животных включает анализ результатов эхокардиографии, морфометрии, гистологических, биохимических и молекулярных методов исследования.
| КРЫЖАНОВСКИЙ С.А | |||
| и др | |||
| Трансляционная модель хронической сердечной недостаточноcти у крыс | |||
| Патологическая физиология и экспериментальная терапия | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| RU 2011126854 A, 10.11.2013 | |||
| RU 2012126189 A, 27.12.2013 | |||
| CN 110613525 A, 27.12.2019 | |||
| CN 104000834 B, 25.05.2016 | |||
| CN 104983747 A, 21.10.2015 | |||
| ЭЙВАЗОВА Ш.Д | |||
| и др | |||
| Подходы к | |||
Авторы
Даты
2021-03-15—Публикация
2018-07-19—Подача