Область техники, к которой относится изобретение
Изобретение относится к созданию трехмерных биологических и тканеинженерных конструкторов. В частности, изобретение относится к созданию конструктов из различных биоматериалов путем магнитной левитационной сборки в космическом пространстве.
Предпосылки изобретения
Тканевая инженерия решает острую клиническую проблему - нехватку тканей и органов человека для трансплантации. Традиционная тканевая инженерия основана на концепции использования каркасов (скаффолдов), которая впервые появилась в статье Роберта Лангера и Джозефа Ваканти, опубликованной в журнале «Science» [Langer R. et al. Science. 1993 May 14;260(5110):920-6. Review]. Согласно этой статье каркас может быть определен как «временная и съемная опора», которая отличает его от не биоразлагаемых имплантатов и протезов.
Биоразлагаемый каркас считается важнейшим и существенным элементом концептуальной основы технологии тканевой инженерии, которая позволяет производить биофабрикацию трехмерных тканевых конструктов и развивать промышленную тканевую инженерию [Hutmacher DW. Biomaterials. 2000 Dec; 21(24):2529-43].
В последнее десятилетие появился новый альтернативный подход без использования каркасов [DuRaine GD. et al. Ann Biomed Eng. 2015 Mar; 43(3):543-54]. Несмотря на то, что разработчики этого нового подхода утверждают, что они используют подход без использования каркасов, на самом деле все же используются различные варианты «временной и съемной опоры», такие как съемные металлические иглы [Moldovan NI. et al. Tissue Eng Part В Rev. 2017 Jun; 23(3):237-244] или удаляемый гидрогель из агарозы [Norotte С. et al. Biomaterials. 2009 Oct; 30(30):5910-7], что, так или иначе, подрывает принципиальную концептуальную новизну предлагаемого подхода без использования каркасов. Таким образом, по крайней мере, концептуально, в этих методах используются традиционные временные каркасы и удаляемая опора.
При создании трехмерных биологических органических, неорганических и тканеинженерных конструктов широко применяются аддитивные технологии. Современные аддитивные технологии, основанные на послойном нанесении биоматериалов, используют различные диспенсеры, причем для поддержки биоматериалов в определенных точках пространства необходимы опорные временные структуры: гидрогели, полимеры, металлические стержни и др.
Применение аддитивных технологий обладает рядом недостатков:
- продолжительность процесса печати,
- использование поддерживающего материала (скаффолда),
- разрешающая способность печати зависит от применяемого инструмента печати.
Существующие методы биофабрикации предлагают различные решения для сборки клеток в процессе построения моделей тканей, однако все они связаны с воздействием силы гравитации на печатаемые объекты, и до сих пор не было продемонстрировано ни одного метода, с помощью которого можно бы изготавливать тканевые конструкты в отсутствии гравитации в космосе.
В этом контексте, использование физических полей, таких как магнитные, акустические и электрические поля, в качестве временной и съемной опоры является, вероятно, одним из наиболее интересных и многообещающих вариантов подхода без использования каркасов. Более того, биофабрикация, основанная на использовании физических полей вместо твердых каркасов, представляет собой действительно инновационный подход без каркасов в тканевой инженерии.
Первоначально магнитные поля привлекли гораздо больше внимания, чем другие физические поля в тканевой инженерии без скаффолдов и поддерживающих биоматериалов. Ошеломляющий феномен магнитной левитации живой лягушки в сильном магнитном поле, о котором сообщил Андре Гейм [Simon MD., Geim AK. Journal Applied Physics Vol. 87, N 9 1 May 2000 6200-6204], а также авторитетная работа группы Джорджа Уайтсайда [Mirica KA. et al. 2011 Sep 22; 23(36):4134-40] вызвали интерес и создали прочную основу для систематического изучения магнитной левитации различных объектов. Последующие прорывные исследования, демонстрирующие магнитную левитационную биосборку живых объектов, включая отдельные клетки и сфероиды тканей, были важной вехой в продвижении использования магнитных полей в биофабрикации и тканевой инженерии []. Новаторские работы из лаборатории Уткана Демирчи представили миниатюризацию технологии магнитной левитации до микрофлюидики [Tasoglu S. et al. Adv Healthc Mater. 2015 Jul 15;4(10): 1469-76, 1422]. Думрус с соавторами впервые продемонстрировали магнитную левитацию отдельных клеток и то, как их профиль изменяется при гибели клетки [Durmus NG. et al. Proc Natl Acad Sci USA. 2015 Jul 14; 112(28):Е3661-8]. Эти новые результаты были позже подтверждены несколькими группами, и наша группа, например, сообщила о магнитной левитационной биосборке трехмерных тканевых инженерных конструктов без применения каркасов, меток и диспенсеров с использованием тканевых сфероидов из клеток хряща или хондросфер в качестве строительных блоков [Parfenov VA. et al. Biofabrication. 2018 Jun 18; 10(3):034104].
Однако для реализации магнитной левитационной биосборки необходимо использовать относительно токсичную парамагнитную среду, содержащую соль гадолиния. Возможный токсический эффект солей гадолиния может подорвать потенциальную предполагаемую ценность биофабрикации тканевых инженерных конструктов с использованием магнитной левитационной биосборки в качестве надежных in vitro трехмерных моделей тканей для фундаментальных и прикладных исследований и, таким образом, представляет собой проблему в продвижении магнитной левитационной биосборки.
Таким образом, подход для создания трехмерных биологических органических, неорганических и тканеинженерных конструктов, основанный на управляемой магнитной седиментации или левитационной сборке конструкта в неоднородном магнитном поле из хаотично распределенных в рабочем объеме жидкой среды органических и неорганических материалов, является альтернативой к существующим. При этом магнитное поле выполняет функции временного физического каркаса. После фабрикации левитирующий конструкт продолжает находиться под воздействием поля до тех пор, пока не произойдет процесс его полной фабрикации (слияние с образованием единого конструкта).
Известна фабрикация конструктов из тканевых сфероидов путем магнитной левитационной сборки, описанная в статье Parfenov VA. et al. Biofabrication. 2018 Jun 18; 10(3):034104. Использовались тканевые сфероиды, в частности хондросферы, изготовленные из суставных хондроцитов. Описанный в статье способ биосборки заключается в следующем. Кювету, заполненную парамагнитной жидкостью с тканевыми сфероидами, помещали в центр кольцевых постоянных магнитов, ориентированных друг к другу одноименными полюсами. Магнитная система обеспечивает генерацию магнитного поля с градиентом до 2,2 Т/см с локальным минимумом в центре рабочей зоны. В центре конструкции перпендикулярно оси магнитных колец было сделано цилиндрическое отверстие для наблюдения за процессом фабрикации с помощью 2-х цифровых камер CMOS, источников света и системы линз. Установка помещена в инкубатор для обеспечения соответствующего температурного режима. Парамагнитная жидкость состояла из среды с концентрацией соли Gd3+ 50 мМ.
Однако данная магнитная система позволяет поддерживать жизнеспособность получаемого конструкта не более 24 часов из-за наличия в питательной среде солей гадолиния в высокой концентрации. Кроме того, для получения конструктов больших размеров такой концентрации солей гадолиния недостаточно.
Теоретически существует три возможных способа снижения нежелательного токсического действия парамагнитной среды: i) выработка малотоксичного гадолиния или альтернативной парамагнитной среды; ii) выполнение левитационной биосборки в сильном магнитном поле; и iii) выполнение магнитной левитационной биосборки в условиях микрогравитации. Все эти три способа являются предметом систематических исследований.
Таким образом, для фабрикации тканевых и органных конструктов больших размеров при нетоксичной концентрации парамагнетика необходимо либо использовать магнитные системы с интенсивностью магнитного поля до 30 Т (Магниты Биттера или сверхпроводящие магниты), обеспечивающие требуемый градиент магнитного поля на протяжении всего рабочего объема, либо использовать условия микрогравитации, например, на борту Международной Космической Станции (МКС). Однако данные решения остаются нерешенными и являются задачей биоинженерии.
Предположением настоящего изобретения является то, что магнитная левитационная биосборка в условиях микрогравитации в космосе может быть реализована при нетоксичных низких концентрациях солей гадолиния. Использование условий космической микрогравитации значительно снизит концентрацию солей Gd3+ и позволит также получать конструкты больших размеров. Таким образом, существует потребность в создании магнитного биопринтера, способного производить фабрикацию в условиях МКС с системой доставки биоматериалов на борт МКС, фиксации полученных конструктов в условиях космической микрогравитации и возврата конструктов на Землю.
Раскрытие сущности изобретения
Настоящее изобретение посвящено разработке способа биофабрикации конструктов, а также разработке конструкции магнитного биопринтера и кюветы, которая предоставляла бы возможность загрузки биоматериалов, могла быть использована для их доставки на МКС и/или космическое пространство, для установки в зону, в которой под действием магнитных сил будут собираться частицы и в течение времени образовывать неразрывный слитый конструкт, при необходимости производить фиксацию полученных конструктов, а также обеспечивать возврат полученных материалов на Землю.
Новый магнитный биопринтер был спроектирован, разработан и сертифицирован для проведения биологических исследований и разработок. Трехмерные тканевые конструкты впервые были изготовлены в космосе в условиях микрогравитации на основе тканевых сфероидов из хондроцитов человека с использованием магнитной левитационной биосборки при низких нетоксичных концентрациях парамагнитной среды.
Биосборка и последовательное слияние тканевых сфероидов показали хорошее соответствие разработанными прогнозными математическими моделями и компьютерному моделированию. Полученные трехмерные тканевые конструкты продемонстрировали хорошую жизнеспособность и высокую степень слияния сфероидов. Таким образом, представленные ниже данные убедительно свидетельствуют о том, что биофабрикация трехмерных тканевых конструктов без использования каркасов, основанная на использовании магнитных полей, является реальной альтернативой традиционным подходам, основанным на использовании каркасов, что указывает на новый перспективный путь исследований, который может значительно продвинуть разработку биофабрикации тканей. Магнитная левитационная биосборка трехмерных тканевых конструктов в космосе также может способствовать развитию науки о жизни в космосе, космической регенеративной медицины и обеспечению безопасного исследования космоса человеком.
Одной из технических задач настоящего изобретения является разработка способа биофабрикации трехмерных конструктов из биоматериала путем магнитной левитационной сборки в космическом пространстве, обеспечивающего получение жизнеспособных биологических конструктов различных типов и размеров.
Еще одной из технических задач настоящего изобретения является создание кюветы, которая должна быть предназначена для доставки, биофабрикации, фиксации и возврата биологических образцов на Землю. Кювета с биообразцами должна представлять собой конструкцию, состоящую из двух емкостей с рабочими растворами и камеры для биофабрикации. В некоторых частных вариантах воплощения изобретения каждая емкость с рабочим раствором должна иметь объем не менее 0,5 мл, а камера биофабрикации должна иметь объем не более 2 мл. В частных вариантах стенки камеры биофабрикации должны быть прозрачны.
В конструкции кюветы с биобразцами должны быть сформированы каналы для перетеснения рабочих растворов в камеру для биофабрикации. Каждая емкость с рабочим раствором должна иметь персональный независимый шток. В некоторых частных вариантах воплощения изобретения конструкция камеры биофабрикации должна обеспечивать компенсацию объема не менее 1 мл.
При этом разработанная кювета также может быть использована как для доставки и использования в космическом пространстве, так и в земных условиях.
Еще одной технической задачей настоящего изобретения является разработка магнитного биопринтера для печати в условиях космического пространства, в том числе на МКС и искусственных спутниках.
Магнитный биопринтер должен осуществлять сборку конструктов путем создания в рабочей зоне неоднородного магнитного поля с магнитной ямой в центре и размещения в рабочей зоне кювет с парамагнитной питательной средой и тканевыми сфероидами. Магнитный принтер должен иметь экранирующий от постоянного магнитного поля корпус. В некоторых вариантах воплощения изобретения уровень напряженности постоянного магнитного поля, создаваемый устройством, не должен превышать значения 8 кА/м на расстоянии 10 мм от корпуса прибора.
Магнитный биопринтер должен обеспечивать, по меньшей мере:
- возможность установки, по меньшей мере, одной кюветы, в некоторых частных вариантах воплощения изобретения - шести кювет, с биообразцами при проведении сеанса космического эксперимента;
- возможность извлечения и установки камер для видеорегистрации хода эксперимента;
- возможность освещения шести кювет с биообразцами. В некоторых частных вариантах воплощения изобретения освещение может быть реализовано светодиодами белого света, питание светодиодов может быть реализовано от автономных источников питания, например, батарейки типа АА;
- возможность установки и извлечения регистратора температуры.
Еще одной технической задачей настоящего изобретения является разработка способа доставки биоматериалов в космическое пространство, а также для фиксации и возврата полученных трехмерных конструктов на Землю, который в частных вариантах воплощения, но не ограничиваясь, может осуществляться с использованием описанной в настоящем описании кюветы, обеспечивающего сохранную доставку биоматериала и трехмерных конструктов.
Технические задачи (технический результат) достигаются за счет предлагаемого способа биофабрикации трехмерных конструктов из биоматериала в космическом пространстве, включающего следующие последовательные этапы:
- активация биоматериала, заключенного в неадгезивный термообратимый биосовместимый гидрогель внутри камеры для биофабрикации, путем его охлаждения до температуры золь-гель перехода,
- перетеснение питательной среды, содержащей парамагнитные соли, в камеру биофабрикации,
- помещение камеры для биофабрикации в магнитную систему биопринтера для магнитной левитационной сборки так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой биопринтера; причем магнитную левитационную сборку осуществляют в центральной области неоднородного магнитного поля с наименьшими параметрами напряженности поля из хаотично распределенного в рабочем объеме камеры для биофабрикации биоматериала, растворенного в питательной среде с парамагнитными свойствами,
- фиксация полученного трехмерного конструкта путем перетеснения фиксирующего раствора в камеру для биофабрикации.
В частных вариантах воплощения изобретения в качестве биоматериала используют тканевые сфероиды или клетки.
В частных вариантах воплощения изобретения питательная среда с парамагнитными по отношению к биоматериалам свойствами содержит соли гадолиния (Gd3+).
В частных вариантах воплощения изобретения гидрогель имеет температуру золь-гель перехода 15-17°С так, при температуре выше температуры перехода гидрогель имеет более твердую структуру (структура желеобразная), а при температуре ниже температуры перехода гидрогель имеет более жидкую структуру.
Технические задачи (технический результат) также достигаются за счет предлагаемой конструкции кюветы для биофабрикации трехмерных конструктов из биоматериала в космическом пространстве, которая содержит
- камеру для биофабрикации,
- по меньшей мере, одну емкость для фиксирующего раствора,
- по меньшей мере, одну емкость для питательной среды с парамагнитными свойствами, причем каждая из емкостей имеет поршень для перетеснения, соответственно, фиксирующего раствора или питательной среды с парамагнитными свойствами, и соединена с камерой биофабрикации через канал с клапанным узлом для перетеснения фиксирующего раствора или питательной среды с парамагнитными свойствами в камеру биофабрикации, соответственно,
причем емкости и камера биофабрикации выполнены с возможностью герметичного закрывания.
В частных вариантах воплощения изобретения клапан клапанного узла емкости для фиксирующего раствора выполнен по принципу поршня, а клапан клапанного узла емкости для питательного раствора выполнен по принципу ниппельного клапана.
В частных вариантах воплощения изобретения кювета имеет внутренний корпус, представляющий собой цельнолитую деталь, причем емкости с рабочими растворами сконфигурированы в верхней части корпуса, а камера биофабрикации сконфигурирована в нижней части корпуса.
В частных вариантах воплощения изобретения на нижней части внутреннего корпуса коаксиально установлены труба внутренняя, труба наружная, при этом один из торцов трубы наружной соединен со съемной крышкой, а внутри трубы внутренней установлен компенсатор.
В частных вариантах воплощения изобретения стенки трубы внутренней и трубы наружной выполнены из оптически прозрачного материала.
В частных вариантах воплощения изобретения на верхней части внутреннего корпуса установлен внешний корпус, соединенный с внутренним корпусом посредством фиксирующих элементов с возможностью их разъема.
В частных вариантах воплощения изобретения стенки камеры биофабрикации выполнены из оптически прозрачного материала.
В частных вариантах воплощения изобретения кювета включает одну емкость для фиксирующего раствора и одну емкость для питательной среды с парамагнитными свойствами.
Технические задачи (технический результат) также достигаются за счет предлагаемого биопринтера для фабрикации трехмерных конструктов из биоматериала в космическом пространстве, включающего
- основание, выполненное в сечении в виде полуокружности, в котором радиально расположена по меньшей мере одна магнитная система, которая состоит из, по меньшей мере, двух соединенных одноименными полюсами неодимовых кольцевых магнитов,
при этом на внешней поверхности основания расположен, по меньшей мере, один портал с закрепленной на нем диафрагмой для установки кюветы по п. 2 в магнитную систему так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой,
- боковые, передний и задний защитные экраны, расположенные со всех сторон биопринтера, для экранирования магнитного поля.
В частных вариантах воплощения изобретения в центре магнитной установки перпендикулярно оси кольцевых магнитов расположено сквозное отверстие для наблюдения за процессом фабрикации, а на переднем защитном экране напротив соответствующих отверстий для наблюдения за процессом фабрикации установлены цифровые камеры для мониторинга и фиксирования процесса фабрикации конструктов.
В частных вариантах воплощения изобретения биопринтер содержит шесть магнитных установок.
В частных вариантах воплощения изобретения биопринтер дополнительно содержит блок освещения для освещения процесса фабрикации, регистратор температуры для регистрации температуры в камере биофабрикации и блок питания для всех электрических компонентов биопринтера.
В частных вариантах воплощения изобретения биопринтер дополнительно содержит декоративные панели, расположенные с обеих сторон основания и установленные на переднем и заднем защитных экранах.
В частных вариантах воплощения изобретения геометрия кольцевых магнитов и геометрия сквозного отверстия выбирается исходя из требуемой формы конструкта.
Технические задачи (технический результат) также достигаются за счет предлагаемого применения вышеописанной кюветы для доставки биоматериалов в космическое пространство, а также для фиксации и возврата полученных трехмерных конструктов на Землю.
В частных вариантах воплощения изобретения биоматериал помещают в камеру биофабрикации кюветы вместе с неадгезивным термообратимым и биосовместимым гидрогелем, характеризующимся температурой золь-гель перехода 15-17°С так, при температуре выше температуры перехода гидрогель имеет более твердую структуру (структура желеобразная), а при температуре ниже температуры перехода гидрогель имеет более жидкую структуру.
Технические задачи (технический результат) также достигаются за счет предлагаемого способа доставки биоматериала в космическое пространство для биофабрикации трехмерных конструктов, в котором биоматериал помещают в емкость с неадгезивным термообратимым и биосовместимым гидрогелем, характеризующимся температурой золь-гель перехода 15-17°С так, что при температуре выше температуры перехода гидрогель имеет более твердую структуру (структура желеобразная), а при температуре ниже температуры перехода гидрогель имеет более жидкую структуру.
В частных вариантах воплощения изобретения в качестве гидрогеля используют гель на основе сополимера поли-N-изопропилакриламида и полиэтиленгликоля (PNIPAAm-PEG).
В частных вариантах воплощения изобретения емкость представляет собой камеру биофабрикации вышеописанной кюветы.
Магнитно-левитационная биосборка трехмерных тканевых конструктов была выполнена впервые в условиях микрогравитации в космосе при нетоксичной концентрации парамагнитной среды. Приведенные ниже данные демонстрируют возможность быстрой биофабрикации без каркасов, с использованием магнитных полей в качестве технологической альтернативы традиционным подходам на основе скаффолдов в тканевой инженерии. Микрогравитация в космосе может стать идеальной средой для быстрой тканевой инженерии тканей и органов на космических станциях и будущих планетарных поселениях. Она может значительно продвинуть исследования в области космической жизни, основанные на использовании биофабрикации тканей и органов человека в условиях микрогравитации, позволит исследовать потенциальное негативное воздействие космического излучения на ткани человека, позволит разработать и испытать эффективные контрмеры против излучения и создать прочную основу для появляющейся космической регенеративной медицины и дальнейшее безопасное исследование космоса человеком.
Краткое описание чертежей
Признаки изобретения станут более очевидными на основе последующего подробного описания, в котором сделана ссылка на прилагаемые чертежи, на которых:
На фиг. 1 изображены схематичный вид воплощения магнитной установки с характеристиками магнитного поля и с изображением поэтапной сборки конструктов из частиц в жидкости под действием конкретного варианта магнитного поля.
Фиг. 1а - магнитная установка; фиг. 1b - магнитное поле, создаваемое магнитной установкой; фиг. 1с - поэтапная сборка конструкта; фиг. 1d - форма конструкта после сборки; фиг. 1е - кинетика сборки конструкта при различных концентрациях гадобутрола и температуре.
На фиг. 2 изображено оборудование, состоящее из магнитного биопринтера и кювет. Фиг. 2а - разрез секции магнитного биопринтера. Фиг. 2b - схема установки кюветы в биопринтер. Фиг. 2с - внешний вид оборудования. Фиг. 2d - разрез секции кюветы. Фиг. 2е - электронный разрез установленной кюветы в биопринтер. Фиг. 2f - фотография космонавта с магнитным биопринтером со вставленными кюветами при установке биопринтера в термостат на 37°С.
На фиг. 3 изображен предпочтительный вариант осуществления магнитного биопринтера.
На фиг. 4 изображен предпочтительный вариант осуществления кюветы.
На фиг. 5 приведены результаты экспериментальных данных. На фиг. 5а и 5b изображены фазоконрастные изображения первичных хондроцитов в 20-культуре при разных уровнях монослойности. На фиг. 5b представлено изображение первичных хондроцитов в 20-культуре после продолжительного культивирования. На фиг. 5с изображена визуализация окрашенных альциановым синим хондрогенно-дифференцированных сфероидов. На фиг. 5d представлена экспрессия коллагена типа II в дифференцированных сфероидах с иммуногистохимическим окрашиванием (ИГХ).
На фиг. 6 представлена оценка влияния геля Мебиол (Mebiol Gel) на хондросферы. Фиг. 6а - хондросфера после 72-часовой инкубации в Мебиол геле (анализ живых/мертвых клеток, живые клетки окрашиваются в зеленый цвет); фиг. 6b - количественная оценка жизнеспособности хондросфер после 72-часовой инкубации в Мебиол геле и среде культивирования с использованием набора CellTiter-Glo; фиг. 6с - распределение диаметров 2-хдневных хондросфер, фиг. 6d - хондросфера после 72 часов инкубации в среде культивирования (контроль); фиг. 6е - временная кривая межсферных углов для пар хондросфер при слиянии; фиг. 6f - округлость 2-хдневных хондросфер; фиг. 6g - характеристики термочувствительного гидрогеля до разбавления; фиг. 6h - характеристики термочувствительного гидрогеля после разбавления; фиг. 6i - вязкость чистого и разбавленного гидрогеля.
На фиг. 7 представлены морфологические исследования трехмерных тканевых конструктов, полученных после магнитной левитации в космосе, и влияние различных концентраций гадобутрола на морфологию хондросфер. Фиг. 7а - компьютерное моделирование последовательных этапов биосборки тканевых сфероидов в трехмерную конструкцию из ткани с использованием программного обеспечения «Surface Evolver»; фиг. 7b - морфология, гистология (окрашивание гематоксилин-эозином, ГЭ) и иммуногистохимия (Ki-67, Casp3) трехмерных тканевых конструктов, полученных в космическом эксперименте; фиг. 7g - иммуногистохимическое окрашивание хондросфер, подвергшихся воздействию 10 мМ и 50 мМ гадобутрола в течение 24 часов; фиг. 7h - изображения ПЭМ клеток в хондросферах без выдерживания в гадолинии и после воздействия 10 мМ и 50 мМ гадобутрола.
На фиг. 8 схематически изображена схема космического эксперимента. Фиг. 8а - заправка кювет на Земле тканевыми сфероидами в термочувствительном неадгезивном гидрогеле, питательной средой с парамагнетиком и фиксирующим раствором (формалин); фиг. 8b - основные этапы проведения экспериментов на борту Российского сегмента МКС с использованием устройства для магнитной сборки и изготовления конструктов; фиг. 8с - кюветы, спустившиеся на Землю, уложенные в спускаемую укладку.
На фиг. 9 схематично изображена магнитная установка с использованием магнита Биттера.
Термины и определения
Определения некоторых терминов, используемых в данном описании, приведены ниже. Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
В данном контексте термин «тканевые сфероиды» (или «сфероиды») относится к тканевым сфероидам, которые могут быть созданы из различных типов клеток. Так, например, сфероиды могут состоять из фибробластов, хондроцитов, кератиноцитов, первичных астроцитов, тироцитов, ММСК (мультипотентные мезенхимальные стромальные клетки), клеток опухолевых линий (например, клеток человеческой меланомы), но не ограничиваясь ими. В некоторых вариантах воплощения метода могут быть использованы разные типы тканевых сфероидов (т.е. состоящих из разных типов клеток) для одновременной фабрикации.
В данном контексте термин «среда» относится к любой среде, предназначенной для культивирования и/или кристаллизации или перекристаллизации и выбираемой в зависимости от типа органических и/или неорганических материалов, используемых при создании конструктов.
Например, в качестве питательной среды может быть использована среда альфа-МЕМ для тканевых сфероидов из кератиноцитов, первичных астроцитов и клеток человеческой меланомы. В качестве питательной среды может быть использована среда DMEM для тканевых сфероидов из фибробластов, хондроцитов, ММСК, и клеток опухолевых линий. В качестве питательной среды может быть использована среда F-12 для тканевых сфероидов из тироцитов, культур клеток яичников китайского хомячка и клеток гибридомы. В качестве питательной среды может быть использована среда RPMI-1640 для тканевых сфероидов из лимфоидных клеток. В качестве питательной среды может быть использована среда DMEM/F12 для тканевых сфероидов из клеток поджелудочной железы.
При необходимости в среде могут быть растворены элементы, способствующие быстрому склеиванию органических и/или неорганических материалов после помещения в зону фабрикации.
Также в среде растворяются соли парамагнетика в различных концентрациях. Концентрация парамагнетика выбирается в зависимости от конечного получаемого конструкта. Например, для получения конструктов из тканевых сфероидов, полученных из различных типов клеток путем левитационной магнитной сборки используется 0,1-50 мМ Gd3+.
В настоящем описании и в формуле изобретения термины «включает», «включает в себя» и другие их грамматические формы не предназначены для истолкования в исключительном смысле, а, напротив, используются в неисключительном смысле (т.е. в смысле «имеющий в своем составе»). В качестве исчерпывающего перечня следует рассматривать только выражения типа «состоящий из».
Подробное описание вариантов воплощения изобретения
Настоящее изобретение, в целом, направлено на осуществление магнитной левитационной биосборки в нетоксичной концентрации парамагнитной среды в условиях микрогравитации.
Способ магнитной фабрикации различных органических и/или неорганических материалов путем магнитной левитационной сборки подразумевает использование диамагнитных частиц материалов, помещенных в парамагнитную среду, и зону, в которой под действием магнитных сил будут собираться частицы и в течение времени образовывать неразрывный конструкт.
В качестве органических и/или неорганических материалов используются тканевые сфероиды из различных типов клеток, а также клетки многоклеточных или одноклеточных организмов. Для придания среде парамагнитных свойств используются парамагнитные вещества, например, соли гадолиния (Gd3+) в различных концентрациях.
Для осуществления способа магнитной фабрикации была разработана принципиальная схема реализации способа магнитной левитационной сборки путем создания неоднородного магнитного поля с областью наименьшей напряженности поля в центре. Для этого была создана магнитная установка, которая позволяет одновременно выполнять шесть магнитных левитационных экспериментов. Магнитная установка состоит из двух соединенных одноименными полюсами неодимовых магнитных колец, выполненных из сплава N52. Для проведения одновременных экспериментов возможно объединение нескольких пар магнитов в единую сборку. В центре конструкции перпендикулярно оси магнитных колец сделано цилиндрическое отверстие для наблюдения за процессом фабрикации. На фиг. 1 изображена магнитная установка (фиг. 1а) и магнитное поле, создаваемое данной магнитной установкой (фиг. 1б).
Изменяя форму магнитов (добавление отверстий, изменение ширины каждого магнита и т.д.) биопринтер можно использовать для получения конструктов из разных материалов различной заданной формы.
Так как направление магнитной силы зависит от градиента квадрата поля, в центре конструкции во всех трех направлениях наблюдается минимум всех трех пространственных компонентов напряженности магнитного поля.
В центр магнитной системы помещают кюветы с различной средой с разной концентрацией парамагнетика (Gd3+) и хаотично распределенных органических и/или неорганических частиц в данной среде. Концентрация парамагнетика зависит от плотности частиц и от вязкости среды. Кювета помещается в отверстие магнитной установки вдоль оси х (фиг. 1а).
За счет разницы магнитных проницаемостей частиц и жидкости в неоднородном поле создается движущая магнитная сила в центр данной магнитной ловушки. В зависимости от соотношения проницаемостей, сила либо выталкивает частицы из области сильного магнитного поля в сторону слабого поля, либо действует в обратном направлении. Данная конструкция позволяет осуществлять процесс фабрикации или сборки единого конструкта из хаотично распределенных в среде различных органических и/или неорганических частиц. Тем самым происходит фабрикация различных органических и/или неорганических конструктов путем левитационной сборки в неоднородном магнитном поле. На фиг. 1с приведены изображения поэтапной сборки конструктов из частиц в жидкости под действием определенного варианта магнитного поля.
Форма конструкта после сборки приведена на фиг. 1d. На фиг. 1е отражена кинетика сборки конструкта при различных концентрациях гадобутрола и температурах (стрелкой показана теоретически допустимая концентрация парамагнетика, которую можно использовать для сборки конструкта).
Для применения способа магнитной фабрикации на Международной Космической Станции и/или в космическом пространстве используются следующие устройства:
- Магнитный биопринтер (фиг. 2с) «Organ.Aut», который внедрен и сертифицирован для использования на Международной космической станции (МКС),
- Кювета для биофабрикации, доставки частиц на Международную Космическую Станцию и/или космическое пространство и спуска полученных конструктов на Землю (разрез секции кюветы показан на фиг. 2d).
Трехмерный магнитный биопринтер «Organ.Aut» (рис. 2с) и прикрепленные 6 кювет были специально разработаны для космических экспериментов по изучению трехмерной биофабрикации тканеинженерных конструктов, лежащих в основе самосборки живых тканей и органов в условиях микрогравитации с помощью магнитного поля.
Данный конкретный вариант исполнения магнитного биопринтера осуществляет сборку конструктов путем создания в рабочей зоне неоднородного магнитного поля с магнитной ямой в центре. Данный конкретный вариант исполнения магнитного принтера имеет экранирующий от постоянного магнитного поля корпус.
Данный конкретный вариант исполнения магнитного биопринтера обеспечивает:
- возможность установки шести кювет с биообразцами при проведении сеанса магнитной фабрикации;
- возможность извлечения и установки камер для видеорегистрации хода эксперимента;
- возможность освещения шести кювет с биообразцами.
- возможность установки и извлечения регистратора температуры;
- возможность замены батареек типа АА.
На фиг. 2 изображено научное оборудование, состоящее из магнитного биопринтера 100 и кювет 200. Внешний вид оборудования представлен на фиг. 2с. Разрез секции магнитного биопринтера 100 показан на фиг. 2а, где условно обозначены: 110 - магнитная установка, состоящая из двух соединенных одноименными полюсами неодимовых магнитных колец; 120 - источник питания (в предпочтительном варианте осуществления источник питания выполнен в виде батареек типа АА), 130 - блок освещения; 140-портал для установки кюветы. Более подробно описание конструкции магнитного биопринтера будет приведено ниже.
Конструкция кюветы 200, которая устанавливается в один из порталов магнитного биопринтера 100 (схема установки приведена на фиг. 2b) отражена на фиг. 2d, где 210 - кнопки-поршни впрыска питательной среды и зажим; 220 - поршни вторичного контура безопасности; 230 - объем для замка; 240 - объем для питательной среды; 250 - клапан для питательной среды; 260 - поршневой клапан для фиксатора; 270 - объем для тканевых сфероидов и термочувствительного гидрогеля. Электронный разрез установленной кюветы в биопринтер изображен на фиг. 2е. На фиг. 2f представлена фотография космонавта с магнитным биопринтером со вставленными кюветами при установке биопринтера в термостат на 37°С.
Предпочтительный вариант осуществления магнитного биопринтера 100 в разборном состоянии приведен на фиг. 3. Основным элементом данного магнитного биопринтера является основание 150 (фиг. 3), в котором находятся шесть магнитных установок.
Основание 150 выполнено в сечении в виде полуокружности, в котором радиально расположена по меньшей мере одна магнитная система 151, которая состоит из, по меньшей мере, двух соединенных одноименными полюсами неодимовых кольцевых магнитов 120.
Корпус выполнен из алюминиевого сплава Д16Т ГОСТ 4784-98 путем механической обработки. Для фиксации магнитов используются прижимы, зафиксированные винтами М8 ГОСТ 11738-84 из нержавеющей стали 12Х18Н10Т. Усилие затяжки составляет 3Н*м. Прижимы выполнены из алюминиевого сплава Д16Т ГОСТ 4784-98 путем механической обработки.
Для экранирования магнитного поля предусмотрены задний и передний экраны 161, 162 (фиг. 3), боковые экраны 163 (фиг. 3), выполненные из магнитной нержавеющей стали 20X13 ГОСТ 5949-75. Крепление экранов к корпусу осуществляется винтами М4 из нержавеющей стали 12Х18Н10Т.
Для загрузки кювет 200 в биопринтер предусмотрены шесть порталов 170, выполненные в виде пластины и диафрагмы. Шесть порталов 170 снабжены механизмами открывания и закрывания и позволяют одновременно устанавливать до шести кювет в одном космическом эксперименте. Портал 170 (в закрытом виде) предназначен для защиты от попадания инородных частей в полости магнитного биопринтера.
Портал 170 (в открытом виде) служит для установки кювет 200 в магнитном биопринтере 100 и расположен на внешней поверхности основания 150 биопринтера так, чтобы рабочий объем камеры биофабрикации кюветы 200 находился в центре неоднородного магнитного поля, создаваемого магнитной системой 151.
Пластина портала 170 представляет собой прямоугольную деталь, которая выполнена из магнитной нержавеющей стали 20X13 ГОСТ 5949-75.
Пластина служит для экранирования магнитного поля и крепления диафрагмы с защитной декоративной накладкой.
Цифровая камера 130 предназначена для мониторинга и фиксирования процесса магнитной фабрикации конструктов.
Модель цифровой камеры в предпочтительном варианте осуществления биопринтера -GoPro Hero 4 Silver, которая предназначена для видеозаписи.
Для освещения зон биофабрикации был спроектирован блок освещения (не показан на фиг. 3).
Для питания блока освещения используются шесть батареек типа АА фирмы Durasell (не показаны на фиг. 3).
При работе блок освещения потребляет мощность 2 Вт.
Помимо этого, можно установить датчик температуры или рекордер.
Каждая кювета для доставки частиц на Международную Космическую Станцию и/или космическое пространство и спуска полученных конструктов на Землю предназначена для доставки, биофабрикации, фиксации и возврата конструктов. Каждая кювета должна содержать все необходимые материалы, обеспечивающие процессбиофабрикации, фиксацию результата и извлечение биологических образцов.
Кювета 200 представляет собой конструкцию, состоящую из трех объемов: емкости 240 для питательной среды (для среды культивирования) (фиг. 4), емкости 280 для фиксирующего раствора (фиг. 4) и емкости (камеры) биофабрикации 270 (фиг. 4). В частных вариантах воплощения данные емкости представляют собой единую деталь, выполненную из поликарбоната. Форма детали цилиндрическая.
Емкости могут быть выполнены в любой форме. В показанном варианте осуществления емкости имеют цилиндрическую форму со следующими характеристиками:
- Емкость для среды имеет объем 1±0,2 мл.
- Емкость для фиксирующего раствора имеет объем 0,5±0,1 мл.
- Камера биофабрикации имеет объем 2±0,2 мл. Стенки камеры биофабрикации прозрачны, что позволяет проводить визуальный осмотр и видеозапись экспериментов.
Две емкости 240, 280 индивидуально соединены с камерой биофабрикации 270, изолированной клапанами 240, 250 (фиг. 4), чтобы избежать нежелательной утечки среды культивирования и/или фиксирующего раствора в основную камеру. Емкости для питательной среды и фиксирующего раствора имеют свои собственные независимые внешние поршни 220 для нажатия пальцами.
В конструкции кюветы с биобразцами сформированы каналы для перетеснения рабочих растворов в камеру биофабрикации. Конструкция камеры биофабрикации обеспечивает компенсацию объема не менее 2 мл.
Емкость для среды и емкость для фиксирующего раствора имеют персональные независимые друг от друга поршни.
Для предотвращения непроизвольного перетекания жидкостей из емкости для среды и емкости для фиксирующего раствора в камеру биофабрикации в данном исполнении конструкции предусмотрены клапанные узлы. Два клапана работают по-разному. Клапан, установленный в емкости с питательной средой, использует принцип клапана Шредера, когда избыточное давление в камере (вызванное нажатием внешнего плунжера) расширяет резиновый элемент, позволяя жидкости течь в камеру биофабрикации. Другой клапан, установленный в емкости для фиксации раствора, работает аналогично запорному клапану, где повышение давления смещает поршень клапана в открытом положении, очищая отверстие, позволяющее перенос жидкости из емкости к камере биофабрикации.
Клапан 250 выполнен по принципу ниппельного клапана. При нажатии на поршень емкости питательной среды внутри емкости возникает избыточное давление, под действием которого ниппель клапана пропускает жидкость в камеру биофабрикации.
Клапан (поз. 6 фиг. 3b) выполнен по принципу поршня. При нажатии на поршень емкости с фиксирующим раствором внутри емкости возникает избыточное давление, под действием которого клапан сдвигается, открывая зазор для протекания жидкости.
Такая разница в исполнениях необходима для обеспечения гарантированной полной изоляции фиксирующего раствора.
Кювета помещается внутрь магнитного биопринтера (фиг. 2б) и после этого происходит процесс магнитной фабрикации. Более подробно, для сборки трехмерных тканевых конструктов кюветы с парамагнитной культуральной средой и тканевые сфероиды помещают в рабочую зону магнитного биопринтера, где к центру прикладывается неоднородное магнитное поле с магнитной ямой.
Описанные выше кюветы доставляют в космическое пространство, в частности, например, на МКС, на кораблях «Союз» и «Прогресс». Методика заправки кюветы следующая.
В первую очередь осуществляют разборку кюветы, извлекая ее внутренний корпус. Далее снимают трубку внутреннего корпуса и извлекают поршни и компенсатор. Все составные части кюветы стерилизуют. Для заправки устанавливают поршень одной из емкостей (емкость №2) таким образом, чтобы поршень выступал за пределы емкости. Заполняют вторую емкость (емкость №1) до полного уровня заполнения, используя механическую пипетку или шприц. После чего в емкости №1 устанавливают поршень таким образом, чтобы вылет обоих поршней был одинаковым. Путем выкручивания заглушки поршня емкости №2 заправляют емкость №2 до полного уровня заполнения. Заглушку обратно вкручивают в поршень.
Растворы для заправки кюветы представлены таблице 1.

В камеру для биофабрикации помещают предварительно охлажденный гель с биоматериалом. Качество сфероидов перед заправкой кювет контролируется по параметрам жизнеспособности клеток и способности сфероидов сливаться в тканевый конструкт. Далее устанавливают компенсатор и помещают сборку в центрифугу, после чего выкручивают заглушку компенсатора. Осуществляют проверку герметичности сборки.
После доставки кюветы на МКС ее помещают в соответствующую магнитную систему биопринтера. Конструкт формируется, находясь в магнитном принтере; время выдержки для разных материалов конструкта разное - от 1 дня до месяца. По завершению процесса фабрикации кювету извлекают.
Полученный конструкт извлекается путем полного разбора кюветы на Земле.
Процесс биофабрикации в кювете запускается нажатием кнопки «П1». После этого происходит перенос среды культивирования из ее емкости в зону камеры биофабрикации. Затем кювету помещают в порт магнитного биопринтера (фиг. 3b).
Установленная кювета показана на фиг. 3d. После сборки кювета извлекается из порта, нажимается кнопка «П2», чтобы начать фиксацию конструкции.
Принцип экспериментальной установки подразумевает создание локального минимума потенциала магнитного поля. Из-за неоднородности магнитного поля возникает магнитофоретическая сила. Это вызывает движение частиц от областей, где магнитное поле сильнее. Магнитная сила воздействует на частицы с нейтральными зарядами, которые имеют относительную проницаемость, отличную от фоновой жидкости. Тогда эффективная магнитная сила F, действующая на объект в неоднородном магнитном поле, будет описываться следующим соотношением:
F=2πr3μ0μƒK∇(H2),
где Н - магнитное поле, r - радиус частицы, μf - относительная проницаемость жидкости, μp - относительная проницаемость частицы (сфероидов), μ0 - магнитная постоянная, а K определяется как:
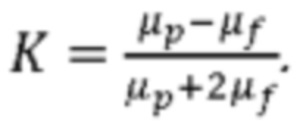
В описанном ниже эксперименте относительная проницаемость жидкости и сфероидов очень близка к 1, поэтому магнитная сила, действующая на частицы, приблизительно линейно зависит от разницы между ними. Разница μp-μf определяет направление действия магнитной силы. В результате объекты будут выталкиваться в область с меньшей напряженностью поля (магнитной ловушкой) под действием магнитной силы.
Изобретение также относится к способу доставки биоматериала в космическое пространство, в котором биоматериал помещают в емкость с неадгезивным термообратимым и биосовместимым гидрогелем, характеризующимся температурой золь-гель перехода 15-17°С так, что при температуре ниже температуры перехода гидрогель имеет структуру золя (т.е. жидкую), а при температуре выше температуры перехода гидрогель имеет структуру неподвижного геля. Другими словами, при охлаждении гель представляет собой золь (обладает свойствами жидкостей), но становится более жестким гидрогелем при более высоких температурах. Золь-гель переход (англ. sol gel transition) - процесс превращения золя в гель, протекающий при увеличении концентрации частиц дисперсной фазы в золе или под влиянием иных внешних воздействий (в частности, изменения температуры).
Гидрогели представляют собой класс полимерных материалов, характеризующихся своей сетчатой структурой и высоким содержанием воды. Гидрогели многих видов нашли широкое применение в медицине и биологических исследованиях, ориентированных, но не ограничиваясь, трехмерным культивированием клеток, тканевой инженерией и доставкой лекарств.
Для применения в доставке биоматериала в космическое пространство гидрогель должен обладать следующими свойствами:
неадгезивность (т.е. клетки или сфероиды не распластываются в данном геле),
термообратимость (т.е. при температуре 4-8°С й гель становиться жидким, при температуре выше 20°С гель затвердевает) и
биосовместимость (т.е. гель не наносит пагубного влияния на находящиеся в нем биоматериалы).
Также, при добавлении в такой гидрогель питательной среды сверх того объема, которое необходимо для формирования гидрогеля, гидрогель теряет свое свойство термообратимости и остается жидким и при температурах выше золь-гель перехода (в связи с увеличением концентрации частиц дисперсной фазы в золе).
Дополнительным требованием к гидрогелям является прозрачность (для наблюдения за процессом биофабрикации), отсутствие биологических веществ, которые могут загрязнять биоматериал.
В некоторых вариантах воплощения в качестве гидрогеля используют гель на основе сополимера поли-N-изопропилакриламида и полиэтиленгликоля (PNIPAAm-PEG).
В некоторых частных вариантах воплощения в качестве гидрогеля используют Mebiol Gel (Мебиол гель).
Изобретение также относится к применению гидрогеля на основе сополимера поли-N-изопропилакриламида и полиэтиленгликоля (PNIPAAm-PEG) для доставки биоматериала в космическое пространство, в частности, изобретение относится к применению для этих целей гидрогеля Мебиол гель.
Мебиол гель - термообратимый гелеобразующий полимер, представляющий собой сополимер, состоящий из термореактивных полимерных блоков [поли(N-изопропилакриламид-со-n-бутилметакрилат) поли(NIPAAm-со-ВМА)] и гидрофильные полимерные блоки (полиэтиленгликоль [ПЭГ]). Мебиол гель характеризуется его температурно-зависимыми динамическими вязкоупругими свойствами. Термореактивные блоки являются гидрофильными при температурах ниже температуры перехода золь-гель и гидрофобны при температурах, выше температуры золь-гель перехода. Гидрофобное взаимодействие приводит к образованию гомогенной трехмерной полимерной сети в воде. Температуру золь-гель-перехода можно контролировать, изменяя химическую композицию NIPAAm-co-BMA и PEG. Клетки или ткани могут быть помещены в жидкий раствор геля Мебиол при более низких температурах и культивированы.
Свойства, очень благоприятные для применения в клеточных культурах и тканевой инженерии, привели к коммерциализации Mebiol® Gel, сополимера поли (N-изопропилакриламида) и поли (этиленгликоля) (PNIPAAm-PEG) для исследовательских целей в начале 2000-х годов.
Отличительной особенностью Мебиол геля, в отличие от других коммерчески доступных гидрогелей, является его температурный золь-гель переход. При охлаждении Мебиол геля представляет собой золь (обращается как жидкость), но становится более жестким гидрогелем при более высоких температурах. На практике это означает чрезвычайно простую работу с клетками. Культуры высевают в охлажденный гель Мебиол и удобно извлекают путем охлаждения емкости для культивирования и центрифугирования. В гелеобразном состоянии высоколипофильная среда геля Мебиол представляет собой эффективную нишу для пролиферации клеток, взаимодействия между клетками, газо- и массообмена и защиты клеток и тканей от сил сдвига.
Особенности Мебиол геля:
• Простота в обращении.
• Нетоксичный, биосовместимый.
• 100% синтетический, без патогенов.
• Высокая прозрачность для наблюдения за клетками.
• Проверенная производительность.
Известные применения Мебиол геля включают в себя:
• Культивирование стволовых клеток и плюрипотентных стволовых клеток, наращивание и дифференцировка.
• Культивирование сфероидов.
• Имплантация клеток.
• Регенерация органов и тканей.
• Доставки лекарств.
• Применение для неклеточных культур.
• Физические свойства.
Мебиол гель готовят и используют согласно рекомендациям производителя.
1. Регидратация: добавляют 10 или 50 мл холодного водного раствора, подходящего для конкретного применения (например, среда для культивирования, PBS), смачивая весь порошок из упаковки производителя. Колбу размещают в горизонтальном положении и оставляют на несколько часов при температуре 4°С, периодически осторожно встряхивая.
2. Культивирование клеток и восстановление: клетки или ткани добавляют в охлажденный Мебиол гель (в виде золя). Культивируют при 37°С. Восстановите клеток и тканей осуществляют путем охлаждения емкости для культивирования и добавления 30-40 мл/150-200 мл холодной жидкости для предотвращения гелеобразования. Проводят центрифугирование в холоде.
Ниже приведены прогностические математические модели и компьютерное моделирование, описывающие магнитную левитационную биосборку и последовательные явления слияния сфероидов в тканях.
Взятые вместе, эти технологические достижения позволили впервые успешно внедрить магнитную левитационную биосборку на МКС при низких нетоксичных концентрациях гадолиния в тесном согласии с разработанными математическими моделями. Ниже представлены результаты первых экспериментов в области биофабрикации в космосе с помощью магнитной левитационной биосборки трехмерных тканевых конструктов из хондросфер в условиях микрогравитации в космосе.
Материалы и методы
Неадгезивный гидрогель и среда для культивирования клеток
При проведении экспериментов была использована агароза компании Helicon (Россия, кат. № Am-0710-0.1). Были использованы модифицированная по способу Дульбекко среда Игла (DMEM, кат. №12491-015), физиологический раствор Дульбекко с фосфатным буфером (PBS, кат. №18912-014), эмбриональная телячья сыворотка (FBS, кат. №16000-044), антибиотик-антимикотик (кат. №15240-062), трипсин/ЭДТА (кат. №25200-114) компании Gibco (США). Был использован L-глютамин (кат. №F032) компании Paneco (Россия). Был использован параформальдегид (кат. №P6148-500G) компании Sigma (США). Использовался Гадовист (гадобутрол) компании Bayer (Германия). Использовался Мебиол гель (Mebiol Gel) (кат. № MBG-PMW20-5001) компании Cosmo Bio (Япония). Также был использован набор для анализа жизнеспособности 3D культур клеток CellTiter-Glo® (кат. №G9682) компании Promega (США).
Клеточная культура
При проведении экспериментов были использованы клетки хондроцитов человека (НСН) компании PromoCell (кат. № С-12710), которые выращивались в среде DMEM, содержащей 10% FBS с добавлением антибиотика/антимикотика и 2 мМ L-глютамина. Клетки инкубировали при 37°С во влажной среде, содержащей 5% CO2 и регулярно разделяли (пассировали) при состоянии монослоя 85-95%. Перенос клеток и приготовление клеточных суспензий проводили с использованием мягкой ферментативной диссоциации с 0,25% раствором трипсина/0,53 мМ ЭДТА. Во время культивирования морфологию и пролиферацию клеток наблюдали, используя инвертированную фазово-контрастную микроскопию (Фиг. S1). Клетки были свободны от микоплазменного загрязнения, что подтверждено протоколом окрашивания Hoechst 33258 (Sigma, кат. №861405).
Формирование тканевых сфероидов с помощью 3D чашек Петри MicroTissues
Тканевые сфероиды из хондроцитов (далее называемые «хондросферы») были сформированы с использованием микролунок 3D чашки Петри MicroTissues (MicroTissues 3D Petri dish micro-molds компании Sigma Aldrich, cat. № Z764019-6EA, имеющие 81 круглую лунку 800×800 мкм). Концентрация хондроцитов человека составляла 3,4×106 на 1 мл, в результате конечная концентрация составляла 8000 клеток на лунку/сфероид. Тканевые сфероиды инкубировали при 37°С во влажной среде, содержащей 5% CO2, в течение 2-х дней.
Определение диаметра сфероидов и распределения округлости Диаметр и округлость хондросфер оценивались на второй день их формирования с помощью светлопольной микроскопии (инвертированный микроскоп Nikon Eclipse Ti-E, Япония) и оценены с использованием программного обеспечения Image J 1.48v (NIH, Bethesda, MD, USA).
Оценка влияния Мебиол геля на жизнеспособность тканевых сфероидов Чтобы обеспечить безопасную доставку жизнеспособных тканевых сфероидов с Земли в космос, был использован коммерчески доступный термообратимый гидрогель «Mebiol» (Cosmo Bio, Japan). Поскольку во время доставки на МКС тканевые сфероиды необходимо включать в гель Мебиол на несколько дней, было оценено потенциальное токсическое действие геля Мебиол на тканевые сфероиды. Было разработано устройство, обеспечивающее безопасную доставку жизнеспособных тканевых сфероидов с Земли в космос, которое предотвращает нежелательное преждевременное слияние и распластывание (расхождение, растекание) тканевых сфероидов при транспортировке в космос. Выращенные в течение 2-х дней тканевые сфероиды помещали в Мебиол гель при комнатной температуре на 72 часа. Контрольные сфероиды инкубировали в полной культуральной среде при 37°С во влажной среде, содержащей 5% СО2. Жизнеспособность тканевых сфероидов оценивали с использованием набора CellTiter-Glo 3D в соответствии с протоколом производителя. При использовании набора CellTiter-Glo 3D люминесценция регистрировалась через 60 минут инкубации с использованием многоканального планшет-ридера VICTOR Х3 (Perkin Elmer, США).
Качественную оценку жизнеспособности клеток в тканевых сфероидах проводили с использованием набора для окрашивания живых/мертвых клеток Live/Dead Cell Double Staining Kit (Sigma-Aldrich, США) в соответствии с протоколом производителя. Сфероиды инкубировали в растворе, содержащем красителей кальцеин AM и пропидиум йодид (PI), при 37°С в течение 1 часа. После промывания PBS, сфероиды визуализировали с помощью флуоресцентной микроскопии (Nikon Eclipse Ti-Е, Япония).
Анализ слияния сфероидов
Анализ слияния сфероидов проводили с использованием неадгезивных сфероидальных микропланшетов Corning (Corning, кат. №4520). Пары тканевых сфероидов помещали в одну лунку и инкубировали в течение 48 часов. Светлопольные изображения дублетов сфероидов были получены в точках 0,1,2, 4, 6, 24 и 48 часов с использованием микроскопа Nikon Eclipse Ti-Е. Межсферный угол измеряли с использованием программного обеспечения Image J 1.48v (NIH, Bethesda, MD, USA) и наносили на график как функцию времени с использованием программного обеспечения GraphPad Prism (GraphPad Software, Inc., La Jolla, CA).
Реологическое тестирование
Реологические измерения проводились в режиме колебательного сдвига с использованием ротационного реометра Anton-Paar MCR 501. Образцы чистого раствора Мебиол и рабочего раствора помещали между конусом (СР50-1 / TG-SN15826; d=0,05 мм) и пластиной диаметром 50 мм с зазором 0,5 мм. После охлаждения до +4°С края покрывали минеральным маслом для предотвращения обезвоживания. Температурная зависимость модуля накопления (С'), модуля потерь (G'') и комплексной вязкости (η*) измерялись с помощью температурной развертки (колебания) путем увеличения температуры от +4 до +37°С при скорости нагрева +5°С/мин. Частота и деформация сдвига поддерживались постоянными на уровне 10 рад/с и 1% соответственно. В каждой группе, были измерены по двадцать образцов.
Компьютерное моделирование магнитного поля
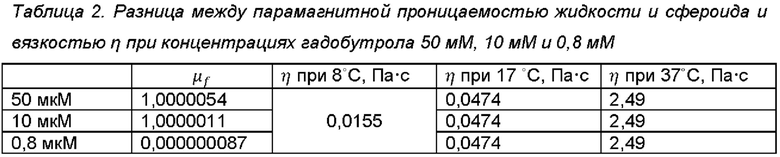
Трехмерное неоднородное статическое магнитное поле моделировалось с использованием мультифизической вычислительной программы COMSOL методом конечных элементов. Магнитное поле рассчитывали по материалу марки NdFeB магнита N38 (VG=1,21 Тл), а магнитные свойства парамагнитной среды были выбраны эквивалентными экспериментальным: они изменялись в зависимости от концентрации гадобутрола. Моделирование магнитного поля позволило рассчитать уравнение траектории частиц. Переходный расчет траекторий частиц проводился с использованием COMSOL «Модуль отслеживания частиц». Входе этого расчета были приняты во внимание следующие силы: магнитная сила, основанная на разнице между магнитной проницаемостью среды и частицы, сила сопротивления, влияющая на время сборки, и сила упругости взаимодействия частицы с частицей. Ввиду низких скоростей частиц для описания вязкого сопротивления использовался закон сопротивления Стокса. Физические характеристики частиц были выбраны в соответствии с предлагаемым экспериментом: диаметр частиц составлял 0,2 мм, их плотность принималась равной 1050 кг/м3, форма частиц предполагалась сферической, а общее количество моделируемых частиц составляло 400. Особенности парамагнитной жидкости были найдены экспериментально и оказались следующими: плотность составляла около 1000 кг/м3, динамическая вязкость п составляла 0,0474 Па⋅с при температуре 17°С. Рассчитанные скорости и траектории частиц хорошо соответствовали экспериментальным данным. Результирующие значения разницы между парамагнитной проницаемостью жидкости и сфероида μƒ - μp и вязкостью п при некоторых определенных температурах для концентраций 50 мкМ, 10 мкМ и 0,8 мкМ гадобутрола приведены в таблице 2.
Имитация эволюции поверхности
Процесс слияния тканевых сфероидов был проиллюстрирован с использованием программного обеспечения Surface Evolver с открытым исходным кодом, разработанного и подробно описанного ранее [Li F, Zhang С, Brakke KA, Lei Z. Sci Rep.2017; 7(1):1-11]. Тканевые сфероиды аппроксимировали и моделировали как шарообразные капли жидкости стандартного размера и объема. Первоначально положение близко контактирующих тканевых сфероидов было случайным. Процесс слияния тканевых сфероидов моделировался путем итерационного градиентного спуска, чтобы минимизировать поверхностную энергию с учетом ограничения постоянных объемов сфероидов, пока движение не остановилось. Скрипт эволюции создавал поверхности соприкосновения между сфероидами, где сфероиды соприкасались. Конфигурация достигла локального минимума энергии, но не обязательно глобального минимума. Были визуализированы прогрессивные изменения в форме одиночных сфероидов, контактирующих друг с другом, формирующих внутри уплотненные тканевые конструкты. Моделирование было выполнено с 40 тканевыми сфероидами.
Биомеханическое тестирование
Биомеханические свойства тканевых сфероидов измеряли с помощью микромасштабной системы тестирования сжатия параллельных пластин Microsquisher (CellScale, Канада) и соответствующего программного обеспечения SquisherJoy. Тканевые сфероиды были сформированы с использованием сфероидальных микропланшетов Corning (Corning, кат. №4520) в соответствии с протоколом производителя при конечных концентрациях 8000 клеток на сфероид. Сфероидальные микропланшеты Corning инкубировали при 37°С во влажной среде, содержащей 5% СО2 в течение 2-х дней. Затем 2х-дневные тканевые сфероиды помещали в Мебиол гель (Cosmo Bio, кат. № MBG-PMW20-5001) на 72 часа. Контрольные тканевые сфероиды инкубировали в полной культуральной среде при 37°С во влажной среде, содержащей 5% СО2. Для биомеханического тестирования тканевые сфероиды помещали в ванну, заполненную PBS, при 37°С и сжимали до 50% деформации в течение 20 с. Использовался микропучок диаметром 304,8 мкм (рекомендуемая максимальная сила 917 мН). Данные о силе-смещении, полученные в результате испытания на сжатие, были преобразованы в кривые напряжение-деформация, а нижняя часть кривой (деформация 0-20%) была использована для получения линии линейной регрессии и оценки модуля упругости. В каждой группе были измерены двадцать образцов тканевых сфероидов.
Гистология и иммуногистохимия
Образцы, фиксированные формалином, помещали в изготовленные на заказ агарозные формы для стереомикроскопии (Nikon SMZ18, Япония) и затем помещали в парафин (Biovitrum, Россия). Серийные срезы толщиной 4 мкм нарезали с помощью Microtome HMS 740 (Thermo Fisher Scientific, США) и размещали на стекле, покрытом поли-L-лизином. Депарафинизацию проводили в ксилоле и в нисходящей батарее спиртов, извлечение антигена проводили с использованием протеиназы К (Sigma-Aldrich, США) в течение 20 минут. Дальнейшие процедуры выполнялись автоматически в системе Autostainer 360 (Thermo Fisher Scientific, США). Протокол включал инкубацию в растворе, блокирующем пероксидазу (10 минут), в растворе, блокирующем белок (10 минут), 30 минут - с первичными антителами, 10 минут - с вторичными антителами и 5-тиминутную обработку 3,3'-диаминобензидином (DAB). Промывку осуществляли в Трис-буфере (рН 6,0) с Твином 20. Первичные поликлональные кроличьи антитела к крысиному и человеческому маркерам Ki-67 и каспаза-3 антитела (оба компании Abbiotec, США) использовали в разведениях 1: 100. Ядра окрашивали гематоксилином Майера. Наконец, срезы обезвоживали и помещали в Bio-Mount (Bio Optica Milano S.P.A., Италия). Некоторые срезы обычно окрашивали гематоксилин-эозином (BioVitrum, Россия) и затем исследовали с помощью световой микроскопии (Nikon Eclipse Ti-E, Япония).
Трансмиссионная электронная микроскопия
Для исследования с помощью просвечивающей электронной микроскопии (ПЭМ) тканевые сфероиды фиксировали в 2,5% растворе глутаральдегида в 0,1 М фосфатном буфере, затем обрабатывали 1% раствором OsO4 в 0,1 М фосфатном буфере, обезвоживали в нисходящих спиртах и, наконец, в пропиленоксиде. После обезвоживания тканевые сфероиды помещали в смесь пропиленоксида и аралдита и затем в аралдит. Полутонкие и ультратонкие срезы получали с использованием ультра ми кротом a Leica еМ UC7 (Leica, Германия). Ультратонкие срезы получали с использованием ультра ми кротом а LKB-III (LKB, Швеция), а затем окрашивали 4% (вес/объем) водным раствором уранилацетата (40 минут при 37°С) и 0,04% (вес/объем) водным раствором цитрата свинца (Reynolds 1963) в течение 20 минут при комнатной температуре. Срезы исследовали на просвечивающем электронном микроскопе JEM 100CX-II (Jeol, Япония), оборудованном цифровой камерой ES500W Erlangshen (Gatan, United Kingdom) с использованием ускоряющего напряжения 80 кВт. Полутонкие срезы нарезали ультрамикротомом LKB-III (LKB, Швеция), окрашивали 1% толуидиновым синим и исследовали на световом микроскопе Leica DM 2500, оборудованном цифровой камерой Leica DFC 290 (Leica, Германия).
Окрашивание альциановым синим
Фиксированные сфероиды промывали PBS и окрашивали в течение ночи раствором алцианового синего (1% в 0,1 н. HCl). Результаты исследовали с использованием инвертированного светового микроскопа AxioVert 2 (Zeiss), оснащенного DSLR-камерой Nikon D610 (Nikon).
Иммуногистохимическое окрашивание на коллаген II типа
Визуализацию коллагена типа II в сфероидах осуществляли с использованием набора системы обнаружения концентрированной пероксидазы Novocastra™ (код продукта RE7130-K, Leica Microsystems) в соответствии с протоколом производителя. Срезы сфероидов подвергали извлечению антигена путем инкубации в теплом (37°С) растворе трипсина в течение 30 мин. После промывки секций в деионизированной воде эндогенную пероксидазу нейтрализовали с помощью блока пероксидазы Novocastra™ (код продукта RE7101, Leica Microsystems). Неспецифическое связывание первичных и вторичных антител снижалось с помощью белкового блока Novocastra™ (код продукта RE7102, Leica Microsystems). Затем срезы инкубировали в течение 1 часа с оптимально разбавленным первичным антителом к коллагену типа II (код продукта NCL-COLL-Ilp, Novocastra™, Leica Microsystems) с последующей 30-минутной инкубацией с биотинилированным вторичным антителом (концентрированным биотинилированным вторичным антителом Novocastra™ (код продукта RE7108, Leica Microsystems) и 30-минутную инкубацию с конъюгатом стрептавидин-HRP Novocastra™ (код продукта RE7109, Leica Microsystems), конъюгатом стрептавидин-пероксидаза хрена (HRP), который связывается с биотином в молекуле антитела. Пероксидазная активность исследовалась с DAB (хромогенный субстрат HRP 3,3'-диаминобензидин), который был свежеприготовлен с использованием Novocastra™ DAB Chromogen (код продукта RE7105, Leica Microsystems) и Novocastra ™ субстратный буфер (код продукта RE7106, Leica Microsystems). После каждой инкубации (с блоком пероксидазы Novocastra ™, блоком белка Novocastra ™, первичным антителом, вторичным антителом и концентрированным стрептавидином-HRP Novocastra ™ срезы промывали в 0,5 М Трис-буфере, рН 7,6 (Sigma, США) в течение 2×5 минут. Наконец, срезы промывали в дистиллированной воде, окрашивали гематоксилином Novocastra™ (код продукта RE7107, Leica Microsystems), пропускали через серию возрастающих концентраций этанола (70%, 80%, 90%, 96%, 100%), инкубируют в ксилоле и погружают в Канадский бальзам (Canada balsam).
Статистический анализ
Статистические данные анализировали с использованием программного обеспечения GraphPad Prism (GraphPad Software, Inc., La Jolla, CA) и представляли как среднее значение ± S.E.M. Тест дисперсионного анализа (ANOVA) был использован для определения значимых различий между средними значениями трех групп с Р<0,0001.
Дизайн экспериментов в космосе
Экспериментальный план исследования включал несколько последовательных шагов (фиг. 8). Тканевые сфероиды были изготовлены из хондроцитов в лаборатории на Земле на космодроме Байконур (Казахстан), а затем помещены в кюветы специального дизайна (фиг. 4), заполненные термообратимым гидрогелем, который обеспечивал жизнеспособность тканевых сфероидов и предотвращал их нежелательное преждевременное слияние и распластывание. После этого кюветы вместе с оригинальным магнитным биопринтером «Organ.Aut» были доставлены на российский сегмент Международной Космической Станции (МКС) российским космическим кораблем «Союз МС-11». На МКС космонавт нажал кнопку «П1» на кюветах (тем самым произвел впрыск к сфероидам питательной среды с парамагнетиком) и произвел охлаждение кюветы с тканевыми сфероидами до 15°C с помощью термостата, что привело к превращению термообратимого гидрогеля из геля в золь и, таким образом, обеспечило свободное движение тканевых сфероидов. После этого кюветы были помещены в магнитный биопринтер на два дня для выполнения биосборки в условиях магнитной левитации и для обеспечения слияние собранного тканевого конструкта. Для записи магнитной левитационной биосборки использовалась видеокамера, встроенная в магнитный биопринтер. Полученные трехмерные тканевые конструкты фиксировали в формалине путем нажатия кнопки П2 на кювете и хранили при комнатной температуре. Через 2 недели кюветы с фиксированными формалином трехмерными тканевыми конструктами были доставлены на Землю и отправлены на анализ.
Математическое моделирование магнитного поля и компьютерное моделирование сборки конструктов
Магнитное поле первоначально моделировалось с использованием программного обеспечения COMSOL (фиг. 1). Пример у-компоненты магнитного поля в плоскости xz показан на фиг. 1b, а расположение магнитной ловушки соответствует центру установки. Это показало, что наиболее эффективный способ сборки сфероидов состоял в том, чтобы поместить их в короткую трубку в центре магнитного поля, потому что за пределами центральной половины магнитной области магнитная сила выталкивает частицы в стороны.
Моделирование также позволило оценить кинетику сборки (фиг. 1е) и полное время сборки. Было обнаружено, что время сборки сильно зависит от парамагнитной вязкости и магнитной проницаемости. Сравнение результатов компьютерного моделирования и эксперимента показало, что наблюдается хорошее соответствие между временем сборки при концентрации гадобутрола 50 мМ и 10 мМ и температуре 17°С.
Однако численное моделирование требует достаточно длительного времени для расчета единичного случая, поэтому для прогнозирования количественной зависимости времени сборки от параметров эксперимента была разработана теоретическая модель. Мы предположили, что на сфероиды воздействуют магнитные силы и препараты. В связи низкой скоростью движения зависимость описывалась законом Стокса. Затем можно написать уравнение движения частицы и оценить время сборки. По-видимому, это время зависит от начального положения каждой частицы, поэтому в общем случае можно найти соотношение, которое описывает продолжительность сборки с точностью до константы, и, кроме того, эта константа одинакова для частиц в аналогичном положении (или положения пробирки внутри магнита).
Результирующее уравнение для времени сборки выглядит следующим образом:

где L - ширина постоянного магнита, а Hmax - максимальное значение магнитного поля внутри магнитов. Из этого соотношения очевидно, что время сборки пропорционально отношению вязкости жидкости п к разности магнитной проницаемости μf - μp, которая линейно зависит от концентрации гадобутрола. Таким образом, зная точное время сборки для конкретной концентрации гадобутрола в среде, мы можем точно оценить время сборки той же системы с другой концентрацией гадобутрола. Ясно, что если Tass составляет несколько секунд или минут, то можно говорить о сборке частиц в конструкт, а если Tass составляет несколько часов или дней, то процесс сборки будет слишком медленным для целей эксперимента: при работе с биоматериалом частицы преобразовываются и становятся непригодными для использования быстрее, чем сливаются в конструкт.
Была рассчитана зависимость времени сборки от концентрации гадобутрола в широком диапазоне значений (фиг. 1е). Теоретическая зависимость хорошо коррелирует с экспериментальными данными при концентрациях 50 мМ (~ 10 мин) и 10 мМ (~ 40 мин). Более того, можно оценить время сборки в 0,8 мМ растворе - согласно теоретическим данным это было бы около 10 часов, что очень много. Однако для ускорения сборки конструкта, как видно на графике фиг. 3е, можно понижать температуру сборки. Так, при понижении температуры сборки до 8°С, время сборки конструкта можно сократить до 5 часов, соответственно, если опустить температуру до 4°С, время сборки составит менее часа, что приемлемо для постановки эксперимента и для жизнеспособности клеток.
Характеристика и жизнеспособность тканевых сфероидов
Хондросферы были сформированы из хондроцитов человека с использованием микролунок 3D чашки Петри MicroTissues. Для оценки цитотоксичности геля Мебиол, используемого для безопасной доставки сфероидов с Земли в космос, 2-хдневные хондросферы помещали в гель Мебиол при комнатной температуре на 72 часа, после чего их жизнеспособность оценивали с использованием набора для окрашивания живых/мертвых клеток Live/Dead Cell Double Staining Kit (фиг. 6a,d) и набора CellTiter-Glo 3D (фиг. 6b). Качественная оценка жизнеспособности хондроцитов выявила одинаковое количество живых клеток в сфероидах, инкубированных в геле Мебиол, и в контрольных сфероидах. Количественная жизнеспособность клеток составила 97±6%. Эти результаты подтвердили отсутствие токсичности у геля Мебиол и возможность его использования для доставки сфероидов в космос.
Использование сфероидов в качестве строительных блоков требует стандартизации их размера и формы. Диаметр сфероидов (фиг. 6c,f) и округлость измеряли через 2 дня культивирования. Средний диаметр сфероида составлял 299,3±13,32 мкм. Средняя округлость сфероида была 0,911±0,053. Эти данные показали, что хондросферы имеют единую стандартизированную геометрию и могут использоваться для биофабрикации трехмерных тканей.
Реологические свойства гидрогеля
Температурная развертка (колебания) проводилась путем нагрева образцов от 4°С до 37°С при скорости нагрева +5°С/мин (фиг. 6g,h). Для обоих вариантов произошла трансдукция «золь-гель», но, в отличие от чистого раствора Мебиол, температура трансдукции которого «золь-гель» была 16,5±0,5°С (фиг. 6g), температура трансдукции для рабочего раствора была повышенной до 27,1°С±0,7°С (фиг. 4h). Когда температура постепенно увеличивалась до температуры гелеобразования образцов, значения G' и G'' быстро увеличивались из-за образования гидрогеля. Стоит отметить, что значения G' и G'' при 37°С достигли 903±37 Па и 206±19 Па для чистого раствора Мебиол и 6,3±1,2 Па и 2,3±0,6 Па для рабочего раствора. Кроме того, измерения вязкости также показали аналогичную тенденцию (фиг. 6i). При 4°С значения комплексной вязкости чистого раствора Мебиол и рабочего раствора составляли 0,211±0,05 Па⋅с и 0,97±0,04 Па⋅с соответственно. А при 37°С значения комплексной вязкости чистого раствора Мебиол и рабочего раствора составляли 936±21 Па-с и 6,77±0,53 Па⋅с соответственно.
Магнитная левитационная биофабрикация трехмерных тканевых конструктов
Магнитная левитационная биофабрикация трехмерных тканевых конструктов из тканевых сфероидов включает в себя два последовательных этапа. Во-первых, конфигурация магнитного поля в магнитном биопринтере заставляет тканевые сфероиды двигаться в одно месте и формировать сборку. На этой стадии тканевые сфероиды плотно упакованы, но все еще не имеют плотных контактов между клетками на поверхности сфероидов. На второй стадии тканевые сфероиды начинают сливаться и формируют трехмерные тканевые конструкты с различным уровнем уплотнения (фиг. 5а). Используемое программное обеспечение «Surface Evolver» позволяет визуализировать последовательные этапы слияния тканевых сфероидов. Сравнение реального изображения с компьютерным моделированием показывает, что полученные трехмерные тканевые конструкты представляют собой продвинутые стадии слияния тканевых сфероидов. Согласно данным моделирования, уровень полноты процесса слияния тканей сфероидов более 50% и в определенной области достигает даже почти 100% полноты процесса слияния тканей. Принимая это во внимание, удлинение времени биофабрикации позволяет полностью объединить тканевые сфероиды в один неделимый трехмерный тканевой конструкт.
Жизнеспособность био-собранных трехмерных тканевых конструктов Демонстрация жизнеспособности трехмерных тканевых конструктов, изготовленных с использованием магнитной левитации при низкой концентрации потенциально токсичной парамагнитной среды - солей гадолиния - является критическим аспектом данного исследования. Жизнеспособность тканевых конструктов подтверждена различными методами. Гистологические и гистохимические исследования продемонстровали отсутствие признаков апоптоза и гибели клеток (фиг. 5b). Тот факт, что собранные в трехмерные тканевые конструкты тканевые сфероиды подвергаются процессу тканевого слияния, является еще одним прямым доказательством их жизнеспособности. Ранее было показано, что при токсических концентрациях солей гадолиния тканевые сфероиды не сливаются [Parfenov VA. et al. Biofabrication. 2018 Jun 18;10(3):034104]. В специально разработанных дополнительных экспериментах было показано, что при низких концентрациях солей гадолиния большинство клеток сохраняют неповрежденную нормальную ультраструктуру в тканевых сфероидах, тогда как при концентрации гадолиния (Gd) 50 мМ имеются свидетельства токсического действия в виде внутриклеточной дистрофии, включая маргинализацию хроматина, отек митохондрий и эндоплазматического ретикулума, накопление фагосом и множественных вакуолей внутриклеточной мембраны (фиг. 5с).
Магнитный биопринтер, используемый в настоящем исследовании, представляет собой новое устройство, разработанное специально для экспериментов с магнитной левитацией на МКС. Это первое устройство, которое позволяет проводить эксперименты по магнитной левитации в условиях микрогравитации в космосе в надежной замкнутой системе. Стоит отметить, что это устройство было официально сертифицировано для использования в российском сегменте МКС. Несмотря на свою компактность, магнитный биопринтер позволяет одновременно выполнять 6 экспериментов, что дает возможность получать воспроизводимые и статистически значимые данные. Он прост в использовании и не требует длительного обучения пользователя. Видеокамеры, встроенные в магнитный биопринтер, позволяют регистрировать процессы сборки конструктов в процессе эксперимента. Магнитный биопринтер останется на российском сегменте МКС как минимум на 5 лет для постановки дальнейших экспериментов. Таким образом, эксперименты по биофабрикации 3D-конструктов на основе других типов клеток могут быть дополнительно выполнены без необходимости доставки всей системы, что значительно снижает затраты на доставку. С определенным уровнем автоматизации и разработкой дополнительного биосенсора устройство может быть модернизировано для использования с целью изучения влияния космического излучения на ткани человека в космосе без участия человека. В случае разработки полностью автоматизированной системы биомониторинга и биосенсорного анализа в реальном времени возврат образцов на Землю будет даже не нужен. В следующих экспериментах можно будет модифицировать кювету ультразвуковыми преобразователями для проведения экспериментов по комбинации магнитного и акустического полей при изготовлении структур с более сложной геометрией.
Транспортировка жизнеспособных тканевых сфероидов с Земли на МКС и предотвращение нежелательного предварительного слияния тканей во время доставки была одной из основных задач этого проекта. Это было достигнуто с помощью коммерческого термообратимого гидрогеля, который представляет собой гель при температуре 37°С и превращается в золь при низкой температуре (16°С) в закрытых кюветах (фиг. 6), пригодных для использования космонавтами. Полученные данные показали, что тканевые сфероиды могут выживать в течение нескольких дней (до 7 дней) в кюветах, заполненных термообратимым гидрогелем. Альтернативные подходы, такие как изготовление тканевых сфероидов из монослоев клеток, меченных магнитными наночастицами [Souza GR et al. Nat Nanotechnol. 2010 Apr; 5(4):291-6], или спонтанное образование тканевых сфероидов из монослоя в космосе, описанные группой Даниэлы Гримм [Aleshcheva G et al. Basic Clin Pharmacol Toxicol. 2016 Oct;119 Suppl 3:26-33], не позволяют обеспечить формирование достаточного количества тканевых сфероидов стандартного размера и формы для воспроизводимых экспериментов. Более того, открытые системы для манипулирования тканевыми сфероидами не подходят для МКС из-за строгих санитарных правил. Применение таких систем требует специального оборудования для культивирования стерильных клеток, а также соответствующих навыков космонавта по работе с клеточными культурами.
Основной мотивацией для проведения описанных экспериментов на космической станции было логическое предположение, что в условиях микрогравитации будет возможно обеспечить магнитную левитацию сфероидов тканей даже при низкой нетоксичной концентрации парамагнитной среды. Мы столкнулись с очевидной дилеммой. С одной стороны, использование парамагнитной среды крайне важно для обеспечения возможности магнитной левитации. С другой стороны, токсическое действие солей гадолиния, используемых в качестве парамагнитной среды, хорошо известно и подтверждено с помощью просвечивающей электронной микроскопии. В предыдущих публикациях магнитная левитация тканевых сфероидов достигалась при таких концентрациях солей гадолиния, которые могут подорвать практическую ценность биофабрикации тканевых конструктов как надежной трехмерной модели тканей in vitro. Используя гадолиний в концентрации 50 мкг, мы увидели типичные изменения клеточной ультраструктуры, аналогичные ранее описанным в токсикологических исследованиях гадолиния, включая маргинализацию ядерного хроматина, отек митохондрий и эндоплазматического ретикулума, накопление фагосом и множественных мембранных вакуолей, которые можно рассматривать как очевидные признаки вызванной гадолинием внутриклеточной дистрофии (фиг. 7). Однако при низкой концентрации солей гадолиния ультраструктура клеток практически не повреждалась. Более того, высокий уровень жизнеспособности тканевых сфероидов при низкой концентрации гадолиния подтверждает их неизменную способность сливаться в трехмерные тканевые конструкты.
Соответственно, нужно стремиться к снижению концентрации парамагнетика, однако нельзя бесконечно снижать концентрации, так как при снижении концентрации увеличивается время сборки конструкта и время сборки конструкта. Соответственно, можно принять, что время сборки менее получаса является приемлемым, значит, существует некая минимальная концентрация парамагнетика. Ввиду того, что в конечном растворе остается разбавленный термочувствительный гидрогель, то вязкость данной среды сильно зависит от температуры, следовательно, и скорость сборки сильно зависит от температуры. Наши данные показывает, что теоретически концентрацию в данной системе можно понизить до 0,8 мМ, при условии, что сборка будет происходить при температуре 4°С. При таких условиях сборка произойдет ориентировочно за 30 минут.
В будущем данная технология может позволить получить комбинированные конструкты из клеточного и неорганического материала, например из тканевых сфероидов и гранул кальций фосфата. Ввиду значительного различия по плотности этих материалов получить с помощью магнитной левитационной сборки конструкты в Земных условиях, используя даже сверхпроводящие магнитные системы или магниты Биттера, представляется очень затруднительным из-за предполагаемого сильного различия применяемой интенсивности магнитного поля, которое обеспечивает левитацию этих материалов.
С другой стороны, комбинирование магнитного и акустического поля позволит получить конструкты более сложных геометрий, такие как кольцо или трубочка, что даст мощнейший скачок в развитии данного направления.
Таким образом, представленная здесь магнитная левитационная биосборка жизнеспособных тканевых инженерных конструктов была достигнута впервые при действительно нетоксичной концентрации гадолиния.
В результате проведенной работы была выполнена магнитная левитационная биосборка трехмерных тканевых конструктов из тканевых сфероидов (хондросфер) без использования каркасов, меток и диспенсеров в условиях микрогравитации. Было продемонстрировано, что использование термообратимого гидрогеля обеспечивает доставку жизнеспособных тканевых сфероидов на космическую станцию и предотвращает их нежелательное преждевременное слияние и распластывание. Новый оригинальный магнитный биопринтер был разработан, внедрен, сертифицирован и успешно протестирован для проведения биологических исследований в космосе. Магнитная левитационная биосборка жизнеспособных тканевых конструктов была выполнена в магнитном биопринтере при нетоксичной низкой концентрации парамагнитной среды - солей гадолиния. Биосборка тканевых конструктов и последовательное слияние тканевых сфероидов были реализованы в соответствии с разработанными прогностическими математическими моделями и компьютерным моделированием. Магнитная левитационная биосборка трехмерных тканевых конструктов из тканевых сфероидов в условиях микрогравитации при нетоксичной концентрации парамагнитной среды является важной вехой в продвижении нового подхода и открывает новые возможности для исследований в области тканевой инженерии - бескаркасной биофабрикации, основанной на использовании физических полей вместо традиционного подхода на основе твердых биоразлагаемых каркасов.
Предшествующее описание было приведено в виде реализации одного из вариантов настоящего устройства и метода. При этом следует понимать, что в такие варианты специалистом могут быть внесены многочисленные и различные модификации и изменения без отклонения от сущности настоящего устройства и метода, которая определяется исключительно прилагаемой формулой изобретения. Так, например, конструктивный элемент устройства, упомянутый здесь в единственном числе, следует понимать как не исключающий возможности наличия множественных элементов, если такое исключение не указано в явном виде или не следует из контекста.
Следует также отметить, что конкретная компоновка конструктивных элементов магнитного биопринтера и кюветы в проиллюстрированных вариантах воплощения может быть изменена на другие различные альтернативные варианты воплощения. В различных вариантах воплощения могут использоваться разные количества некоего модуля или блока, может использоваться другой тип или типы некоего модуля или блока, некий модуль или блок может быть добавлен, или же некий модуль или блок может быть исключен.
Следует четко понимать, что вышеприведенное описание предназначено для иллюстрации устройства настоящего устройства и метода, а не для ограничения объема его охраны. Например, вышеописанные варианты воплощения (и/или их признаки) могут использоваться в любой комбинации друг с другом. В дополнение к этому, могут быть проделаны многочисленные модификации для адаптации одного конкретного варианта воплощения к сведениям из различных других вариантов воплощения без отступления от объема охраны изобретения. Размеры, типы, ориентации, число и положения различных описанных здесь конструктивных элементов предназначены характеризовать параметры считающихся предпочтительными в настоящее время вариантов воплощения и являются ни в коем случае не ограничивающими, а просто примерными вариантами. После рассмотрения вышеприведенного описания специалисту в данной области техники станут очевидны многочисленные другие варианты и модификации изобретения в рамках сущности и объема охраны изобретения. Следовательно, объем охраны должен определяться с учетом лишь формулы изобретения, наряду с полным объемом эквивалентов, на которые эта формула изобретения дает право.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФАБРИКАЦИИ КОНСТРУКТОВ ИЗ ФОСФАТОВ КАЛЬЦИЯ | 2019 |
|
RU2725111C1 |
| СПОСОБ ФАБРИКАЦИИ ТРЕХМЕРНЫХ БИОПЛЕНОК МИКРООРГАНИЗМОВ | 2021 |
|
RU2769574C1 |
| УСТРОЙСТВО ДЛЯ БИОПЕЧАТИ ОДИНОЧНЫМИ ТКАНЕВЫМИ СФЕРОИДАМИ И ИСПОЛЬЗУЕМАЯ В НЕМ ПЕЧАТАЮЩАЯ ГОЛОВКА | 2018 |
|
RU2701330C1 |
| Роботизированная медицинская система и манипулятор для 3D-биопечати для полнослойного закрытия кожного дефекта | 2023 |
|
RU2814949C1 |
| ПЛАТФОРМА ДЛЯ ИНЖЕНЕРИИ ИМПЛАНТИРУЕМЫХ ТКАНЕЙ И ОРГАНОВ И СПОСОБЫ СОЗДАНИЯ (БИОФАБРИКАЦИИ) ЭТИХ ТКАНЕЙ И ОРГАНОВ | 2012 |
|
RU2623303C2 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| Имплантат ушной раковины | 2022 |
|
RU2790402C1 |
| Способ биофабрикации трансплантата в виде клеточных сфероидов для регенеративных технологий восстановления хряща субъекта на основе надхрящницы собственного реберного хряща субъекта и мультипотентных мезенхимальных стромальных клеток костного мозга этого же субъекта | 2022 |
|
RU2800991C2 |
| СПОСОБ ПРОИЗВОДСТВА КЛЕТОЧНЫХ СФЕРОИДОВ ДЛЯ ВОССТАНОВЛЕНИЯ ХРЯЩЕЙ | 2019 |
|
RU2731314C1 |
| Способ получения биочернил, обеспечивающих высокий уровень пористости в тканеинженерных конструкциях | 2021 |
|
RU2772734C2 |
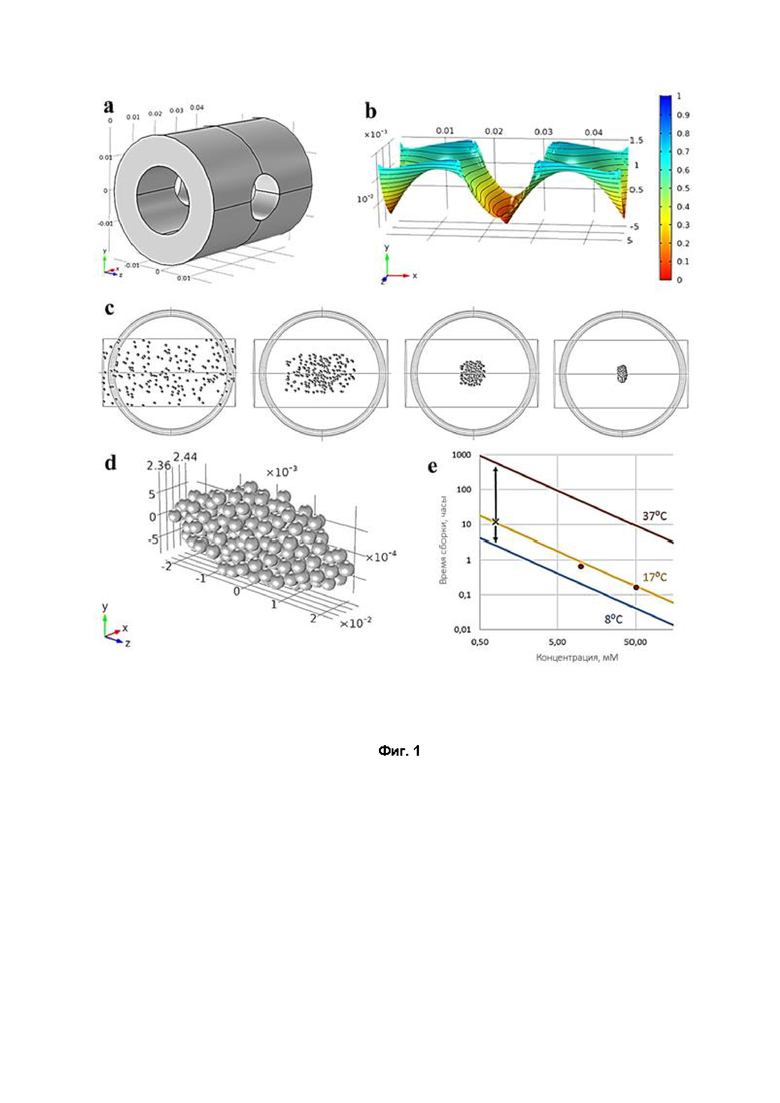





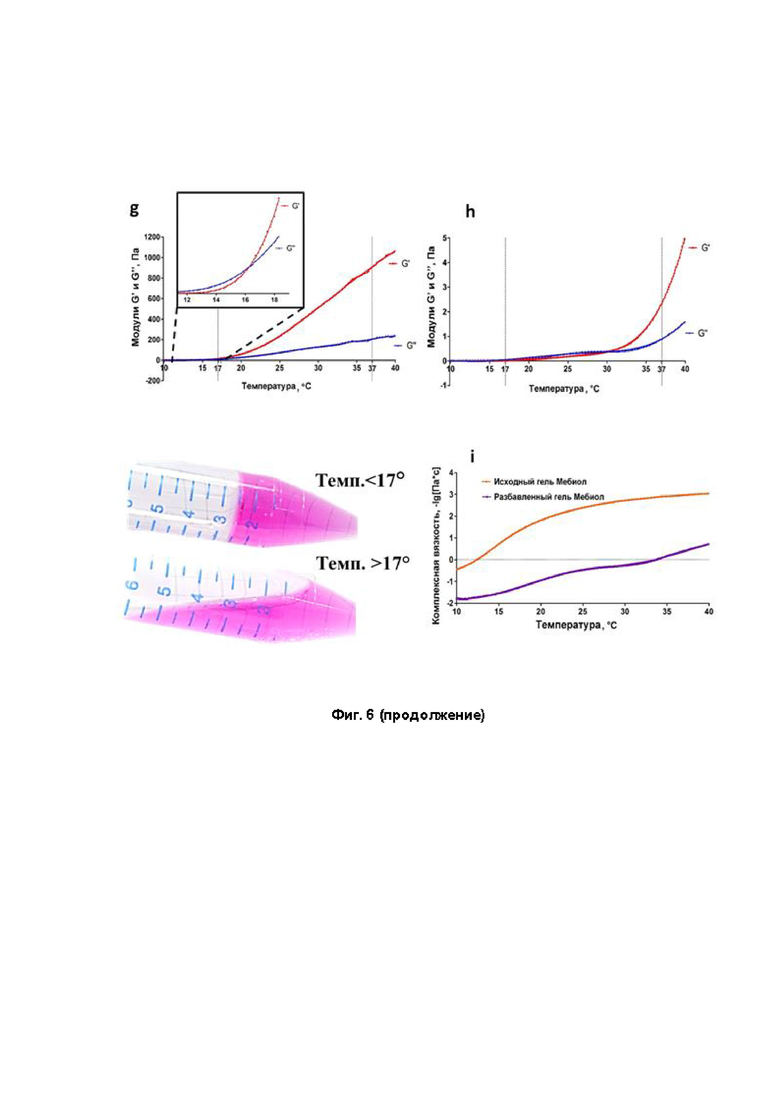

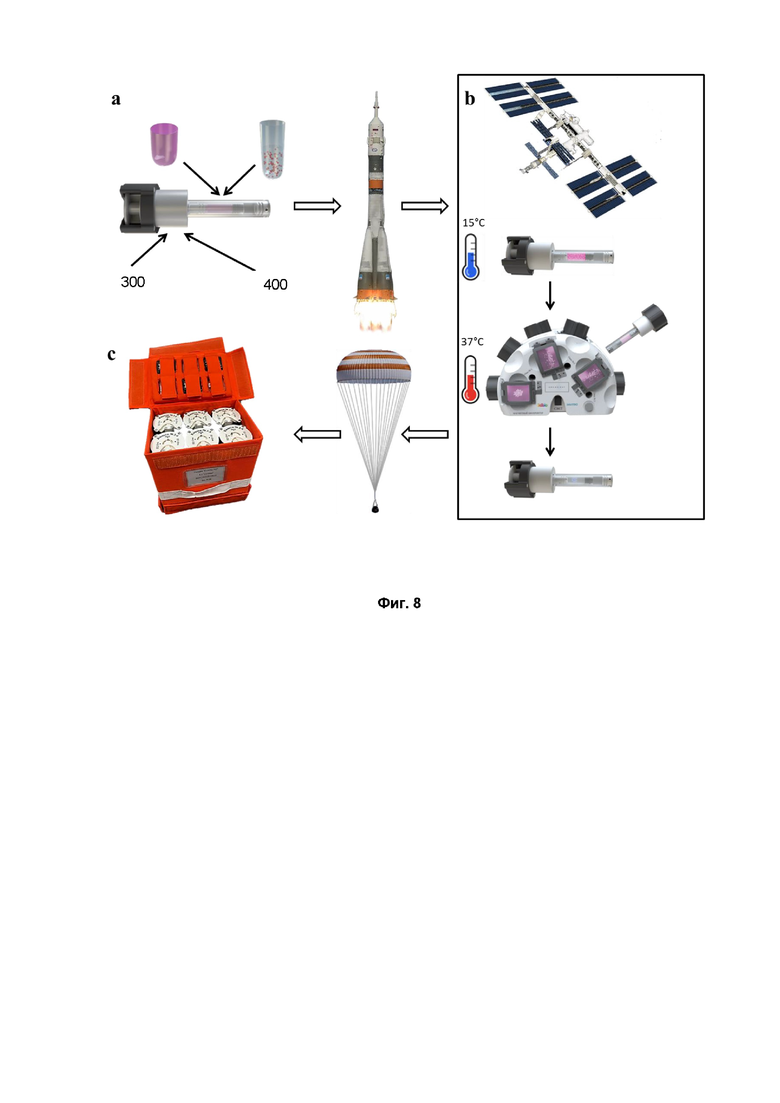

Изобретение относится к биотехнологии, тканевой инженерии и космической биомедицине. Способ биофабрикации трехмерного конструкта из биоматериала в космическом пространстве осуществляют следующим образом. Активируют биоматериал, заключенный в неадгезивный термообратимый биосовместимый гидрогель внутри камеры биофабрикации, путем его охлаждения до температуры золь-гель перехода. Осуществляют перетеснение питательной среды, содержащей парамагнитные соли, в камеру биофабрикации. Помещают камеры биофабрикации в магнитную систему биопринтера для магнитной левитационной сборки так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой биопринтера. Магнитную левитационную сборку осуществляют в центральной области неоднородного магнитного поля с наименьшими параметрами напряженности поля из хаотично распределенного в рабочем объеме камеры биофабрикации биоматериала, растворенного в питательной среде с парамагнитными свойствами. Фиксируют полученный трехмерный конструкт путем перетеснения фиксирующего раствора в камеру биофабрикации. В качестве биоматериала используют тканевые сфероиды или клетки. Кювета для биофабрикации трехмерного конструкта из биоматериала в космическом пространстве содержит камеру биофабрикации, по меньшей мере, одну емкость для фиксирующего раствора, по меньшей мере, одну емкость для питательной среды с парамагнитными свойствами. Каждая из емкостей имеет поршень для перетеснения фиксирующего раствора или питательной среды с парамагнитными свойствами и соединена с камерой биофабрикации через канал с клапанным узлом для перетеснения фиксирующего раствора или питательной среды с парамагнитными свойствами в камеру биофабрикации. Емкости и камера биофабрикации выполнены с возможностью герметичного закрывания. Биопринтер для фабрикации трехмерного конструкта из биоматериала в космическом пространстве включает основание, выполненное в сечении в виде полуокружности, в котором радиально расположена, по меньшей мере, одна магнитная система, которая состоит из, по меньшей мере, двух соединенных одноименными полюсами неодимовых кольцевых магнитов, боковые, передний и задний защитные экраны, расположенные со всех сторон биопринтера, для экранирования магнитного поля. На внешней поверхности основания расположен, по меньшей мере, один портал с закрепленной на нем диафрагмой для установки кюветы в магнитную систему так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой. Применение кюветы для доставки биоматериалов в космическое пространство, а также для фиксации и возврата полученного трехмерного конструкта на Землю. Группа изобретений позволяет осуществлять бескаркасную биофабрикацию тканеинженерных конструктов с использованием магнитных полей в качестве технологической альтернативы традиционным подходам на основе скаффолдов в тканевой инженерии, полученные трехмерные тканевые конструкты имеют хорошую жизнеспособность и высокую степень слияния сфероидов, разработку конструкции магнитного биопринтера и кюветы, которая предоставляла бы возможность загрузки биоматериалов, могла быть использована для их доставки на МКС и/или космическое пространство, и возврата полученных материалов на Землю. 4 н. и 16 з.п. ф-лы, 2 табл., 9 ил.
1. Способ биофабрикации трехмерных конструктов из биоматериала в космическом пространстве, включающий следующие последовательные этапы:
- активация биоматериала, заключенного в неадгезивный термообратимый биосовместимый гидрогель внутри камеры биофабрикации, путем его охлаждения до температуры золь-гель перехода,
- перетеснение питательной среды, содержащей парамагнитные соли, в камеру биофабрикации,
- помещение камеры биофабрикации в магнитную систему биопринтера для магнитной левитационной сборки так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой биопринтера;
причем магнитную левитационную сборку осуществляют в центральной области неоднородного магнитного поля с наименьшими параметрами напряженности поля из хаотично распределенного в рабочем объеме камеры биофабрикации биоматериала, растворенного в питательной среде с парамагнитными свойствами,
- фиксация полученного трехмерного конструкта путем перетеснения фиксирующего раствора в камеру биофабрикации.
2. Способ по п. 1, характеризующийся тем, что в качестве биоматериала используют тканевые сфероиды или клетки.
3. Способ по п. 1, характеризующийся тем, что питательная среда с парамагнитными по отношению к биоматериалам свойствами содержит соли гадолиния (Gd3+).
4. Способ по п. 1, в котором гидрогель имеет температуру золь-гель перехода 15-17°С, так при температуре выше температуры перехода гидрогель имеет структуру золя, а при температуре ниже температуры перехода гидрогель имеет структуру геля.
5. Кювета для биофабрикации трехмерных конструктов из биоматериала в космическом пространстве способом по п. 1, содержащая
- камеру биофабрикации,
- по меньшей мере, одну емкость для фиксирующего раствора,
- по меньшей мере, одну емкость для питательной среды с парамагнитными свойствами,
причем каждая из емкостей имеет поршень для перетеснения соответственно фиксирующего раствора или питательной среды с парамагнитными свойствами, и соединена с камерой биофабрикации через канал с клапанным узлом для перетеснения фиксирующего раствора или питательной среды с парамагнитными свойствами в камеру биофабрикации соответственно,
причем емкости и камера биофабрикации выполнены с возможностью герметичного закрывания.
6. Кювета по п. 5, характеризующаяся тем, что клапан клапанного узла емкости для фиксирующего раствора выполнен по принципу поршня, а клапан клапанного узла емкости для питательного раствора выполнен по принципу ниппельного клапана.
7. Кювета по п. 5, характеризующаяся тем, что она имеет внутренний корпус, представляющий собой цельнолитую деталь, причем емкости с рабочими растворами сконфигурированы в верхней части корпуса, а камера биофабрикации сконфигурирована в нижней части корпуса.
8. Кювета по п. 5, характеризующаяся тем, что на нижней части внутреннего корпуса коаксиально установлены труба внутренняя, труба наружная, при этом один из торцов трубы наружной соединен со съемной крышкой, а внутри трубы внутренней установлен компенсатор.
9. Кювета по п. 8, характеризующаяся тем, что стенки трубы внутренней и трубы наружной выполнены из оптически прозрачного материала.
10. Кювета по п. 5, характеризующаяся тем, что на верхней части внутреннего корпуса установлен внешний корпус, соединенный с внутренним корпусом посредством фиксирующих элементов с возможностью их разъема.
11. Кювета по п. 5, характеризующаяся тем, что стенки камеры биофабрикации выполнены из оптически прозрачного материала.
12. Кювета по п. 5, характеризующаяся тем, что она включает одну емкость для фиксирующего раствора и одну емкость для питательной среды с парамагнитными свойствами.
13. Биопринтер для фабрикации трехмерных конструктов из биоматериала в космическом пространстве, включающий
- основание, выполненное в сечении в виде полуокружности, в котором радиально расположена, по меньшей мере, одна магнитная система, которая состоит из, по меньшей мере, двух соединенных одноименными полюсами неодимовых кольцевых магнитов,
при этом на внешней поверхности основания расположен, по меньшей мере, один портал с закрепленной на нем диафрагмой для установки кюветы по любому из пп. 5-12 в магнитную систему так, чтобы рабочий объем указанной камеры находился в центре неоднородного магнитного поля, создаваемого магнитной системой,
- боковые, передний и задний защитные экраны, расположенные со всех сторон биопринтера, для экранирования магнитного поля.
14. Биопринтер по п. 13, характеризующийся тем, что в центре магнитной установки перпендикулярно оси кольцевых магнитов расположено сквозное отверстие для наблюдения за процессом фабрикации, а на переднем защитном экране напротив соответствующих отверстий для наблюдения за процессом фабрикации установлены цифровые камеры для мониторинга и фиксирования процесса фабрикации конструктов.
15. Биопринтер по п. 13, характеризующийся тем, что содержит шесть магнитных установок.
16. Биопринтер по п. 13, характеризующийся тем, что дополнительно содержит блок освещения для освещения процесса фабрикации, регистратор температуры для регистрации температуры в камере биофабрикации и блок питания для всех электрических компонентов биопринтера.
17. Биопринтер по п. 13, характеризующийся тем, что дополнительно содержит декоративные панели, расположенные с обеих сторон основания и установленные на переднем и заднем защитных экранах.
18. Биопринтер по п. 13, характеризующийся тем, что геометрия кольцевых магнитов и геометрия сквозного отверстия выбирается исходя из требуемой формы конструкта.
19. Применение кюветы по любому из пп. 8-12 для доставки биоматериалов в космическое пространство, а также для фиксации и возврата полученных трехмерных конструктов на Землю.
20. Применение по п. 19, в котором биоматериал помещают в камеру биофабрикации кюветы вместе с неадгезивным термообратимым и биосовместимым гидрогелем, характеризующимся температурой золь-гель перехода 10-17°С, так, что при температуре выше температуры перехода гидрогель имеет структуру золя, а при температуре ниже температуры перехода гидрогель имеет структуру геля.
| КАРАСЕВ С., Еда из 3D-биопринтера: на МКС планируется осуществить биопечать мяса, 3DNews, 05.03.2019; найдено в Интернет: { https://3dnews.ru/983791} , 13.10.2020 | |||
| GHIDINI T., Regenerative medicine and 3D bioprinting for human space exploration and planet colonisation, J Thorac Dis | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
Авторы
Даты
2021-04-08—Публикация
2019-10-04—Подача