Область техники
Изобретение относится к области медицины, а именно к тканевой инженерии, регенеративной медицине, травматологии и ортопедии.
Уровень техники
Целостность суставного хряща - непременное условие нормального функционирования сустава. Способность хряща (покрывающего суставную поверхность кости) к полноценному самовосстановлению ограничена, так как это аваскулярная и аневральная ткань, обедненная собственными камбиальными клетками (лишена надхрящницы). Из-за этих структурных особенностей циркулирующие клетки-предшественники, присутствующие в крови и костном мозге, не проникают в достаточном количестве поврежденную область, чтобы способствовать репаративному процессу. Вполне обоснованно мнение, что до настоящего времени эффективный способ восстановления целостности хряща еще не разработан.
Хрящевые и костно-хрящевые дефекты в настоящее время остаются открытой проблемой тканевой инженерии опорно-двигательной системы. Поэтому при существенном повреждении суставного хряща приходится удалять сустав пациента целиком и заменять его эндопротезом.
Проблема крайне актуальна, так как повреждение и деградация суставного хряща приводит к остеоартриту (ОА), преимущественно у пожилых людей, и это одна из ведущих причин боли и инвалидности в этой многочисленной возрастной группе населения.
Известны многочисленные способы заполнения хрящевых дефектов тканеинженерными конструктами, изготовленными с применением скаффолд-технологии - сокультивирования клеток с матрицами-носителями, в настоящее время называемые матрикс ассоциированной имплантацией хондроцитов (matrix-associated chondrocyte implantation - MACI). Предложены разные варианты матриц-носителей (скаффолдов), например, синтетическая матрица на основе бензилового эфира гиалуроновой кислоты (Hyalograft C, HYAFF 11) [1], синтетическая матрица на основе полиглактина и поли-n-диоксанона (Bioseed C) [2], мембрана из свиного коллагена (ChondroGiude) [3]. Существенными особенностями некоторых вариантов этих технологий являются попытки поддержания хондрогенной дифференцировки собственных хондроцитов в процессе культивирования за счет специальных хондрогенных дифференцировочных сред, сдерживающих наращивание клеточной массы, что усложняет наращивание хондроцитов взрослых людей в необходимых количествах. Организму приходится самостоятельно утилизировать каркас матрицы за счет воспалительной реакции на инородное тело, что затрудняет регенерацию хряща.
Недостатки культивирования любых клеток на матрицах (биодеградируемых носителях) общеизвестны. Клетки неравномерно распределены внутри матрицы, это связано с наличием градиентов парциальных давлений кислорода и углекислого газа, а также разной доступности питательных веществ и скорости удаления метаболитов в зависимости от глубины залегания клеток в тканеинженерном конструкте. Слабое звено подобных технологий - отсутствие естественных механизмов адгезии матрицы к реципиентным поверхностям (известные способы крепления ненадежны). Технология требует разрушить здоровую часть суставной поверхности для забора хряща для выделения клеток в лаборатории. Поэтому необходимо дополнительная артроскопическая операция и ее анестезиологическое сопровождение.
Известны бесскаффолдные технологии восстановления хрящей. Трехмерное культивирование хондроцитов в отсутствии пригодной для клеточной адгезии подложки приводит к формированию клеточных сфероидов (хондросфер) [4]. Хрящевые сфероиды обладают уникальной способностью к тканевому слиянию, способны к слиянию между собой с образованием более крупных сфероидов, а также к распластыванию на поверхности адгезивного пластика и реципиентного ложа [5].
Известен способ производства трехмерных живых хрящеподобных микротканей in vitro и их применения в качестве трансплантационного материала (US 7.887,843 B2 Method for in vitro production of three-dimentional vital cartilage tissue and use thereof as transplant material (co.don® AG, Teltow, DE). Данный способ включает в себя получение клеточных сфероидов из культивированных хондроцитов суставного хряща в 96-ти луночных планшетах из неадгезивного пластика. Требуется дополнительный технологический этап работы с клеточным материалом - взаимное слияние сфероидов в 24-хлуночном планшете для увеличения размеров сфероидов, что свидетельствует об ограниченном потенциале самостоятельного роста сфероидов, полученных таким путем. Полученные сфероиды используют для частичного замещения (заполнения в плотности от 3 до 70 сфероидов на см2) дефектов суставных поверхностей костей с целью формирования нового хряща в зоне повреждения. Длительное пребывание хондроцитов в 3D-культуре может приводить к гибели клеток, особенно в центре сфероидов. Хрящевая ткань сустава содержит единственную популяцию дифференцированных клеток - хондроцитов, пролиферативный потенциал которых ограничен.
Также из уровня техники известен способ производства сфероидов из клеток хряща в агарозных микропланшетах, содержащих 81 лунку диаметром 800 мкм или 256 лунок диаметром 300 мкм [5]. Сфероиды формировали из культивированных хондропрогениторных клеток носовой перегородки в хондрогенной дифференцировочной среде (DMEM, альбумин человеческий 1,25 мкг/мл, аскорбиновая кислота 50 мкг/мл, инсулин 6,25 мкг/мл, пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, инсулин-трансферрин - селенит (однократная концентрация)). Плотность посева составляла 2 млн клеток на микропланшет. Для сфероидов, полученных данным способом, характерно наличие фибриллярного внеклеточного матрикса - коллагена 2 типа. Также у сфероидов большого диаметра (полученных в 81-луночном планшете) наблюдалась тенденция к росту (увеличению диаметра по отношению к исходному). Существенным недостатком этого способа является ограниченное количество забираемого для выделения клеток исходного материала, которое можно получить из хряща перегородки носа, не создав заметный косметический дефект, что приводит к необходимости длительного культивирования клеток для накопления нужной биомассы клеток, при этом в процессе формирования сфероидов происходит постепенная гибель клеток, сфероиды уменьшаются в размерах.
Таким образом, несмотря на имеющиеся способы восстановления хрящей, все они характеризуются рядом недостатков и ограничений, поэтому сохраняется необходимость в разработке и создании новых способов и подходов к решению указанной проблемы.
Раскрытие изобретения
Задача настоящего изобретения состоит в разработке нового способа получения трансплантата на основе клеточных сфероидов для эффективного восстановления хряща, в частности, суставного хряща.
Предлагается получение трансплантата в виде клеточных сфероидов для восстановления хряща субъекта на основе клеток надхрящницы собственного реберного хряща субъекта.
Техническим результатом данного изобретения является получение трансплантата на основе клеточных сфероидов, обладающих выраженным регенеративным потенциалом, для эффективного восстановления хряща, в частности, суставного хряща, при этом получение сфероидов не сопровождается гибелью клеток в агарозных лунках. Кроме того, способ по изобретению исключает необходимость использования дифференцирующих хондрогенных сред, замедляющих наращивание клеточной биомассы. Помимо этого, настоящее изобретение обеспечивает снижение травматизации субъекта в процессе забора материала для восстановления хряща, при этом не требуется дополнительной госпитализации, анестезиологического пособия и исключается операционная травма неповрежденной части суставного хряща. Забор надхрящницы реберного хряща субъекта проводится в амбулаторных условиях под местной анестезией.
Дополнительно, способ по изобретению позволяет получить сфероиды из надхрящницы реберного хряща быстрее и большего объема по сравнению со сфероидами на основе клеток хряща. Использование трансплантата на основе более крупных сфероидов из надхрящницы облегчает их трансплантацию, а восстановление хряща происходит быстрее и эффективнее. Репаративная регенерация хряща происходит из камбиальных (прогениторных) клетки надхрящницы.
Достижение указанного технического результата обеспечивается при осуществлении способа получения трансплантата на основе клеточных сфероидов для восстановления хряща субъекта на основе клеток надхрящницы собственного реберного хряща субъекта, включающего следующие этапы:
а) выделение клеток из надхрящницы собственного реберного хряща субъекта;
б) культивирование выделенных на стадии а) клеток в адгезивной культуре без хондрогенной дифференцировочной среды;
в) перенесение клеток, полученных на стадии б), в агарозные планшеты и их последующее культивирование с образованием клеточных сфероидов.
В частных вариантах воплощения изобретения субъект представляет собой человека.
В частных вариантах воплощения изобретения хрящ представляет собой суставной хрящ, хрящи носа, гортани, трахеи и бронхов, ушной раковины или хрящ межпозвоночных дисков.
В частных вариантах воплощения изобретения культивирование клеток на стадии б) осуществляется в течение 20-30 дней. В частных вариантах воплощения изобретения перенесение клеток на стадии в) осуществляется из расчета 20 000 клеток на 1 лунку агарозного планшета.
В частных вариантах слияние клеток в клеточные сфероиды осуществляется в агарозных лунках (лунках агарозного планшета), где они пребывают до 21 дня. В частных вариантах воплощения изобретения слияние клеток в клеточные сфероиды осуществляется через 7-15 дней. В частных вариантах воплощения изобретения размер сфероидов составляет 250-700 мкм.
Настоящее изобретение также относится к трансплантату для восстановления хряща субъекта, включающему клеточные сфероиды на основе клеток надхрящницы собственного реберного хряща субъекта и полученному способом по изобретению.
В частных вариантах воплощения изобретения, хрящ представляет собой суставной хрящ, хрящи носа, гортани, трахеи и бронхов, ушной раковины или хрящ межпозвоночных дисков.
В частных вариантах воплощения изобретения субъект представляет собой человека.
В частных вариантах воплощения изобретения размер сфероидов составляет 250-700 мкм.
Технический результат настоящего изобретения также достигается за счет применения клеток надхрящницы собственного реберного хряща субъекта для получения трансплантата в виде клеточных сфероидов.
Краткое описание чертежей
Фигура 1. Динамика изменения размера сфероидов из суставного хряща и надхрящницы ребра в процессе их культивирования через 1, 7 и 14 дней.
Фигура 2. Динамика изменения размера сфероидов из суставного хряща и надхрящницы ребра в процессе их культивирования через 1, 7 и 14 дней:
а) суставной хрящ, концентрация 10000 клеток на сфероид;
б) суставной хрящ, концентрация 20000 клеток на сфероид;
в) надхрящница, концентрация 10000 клеток на сфероид;
г) надхрящница, концентрация 20000 клеток на сфероид.
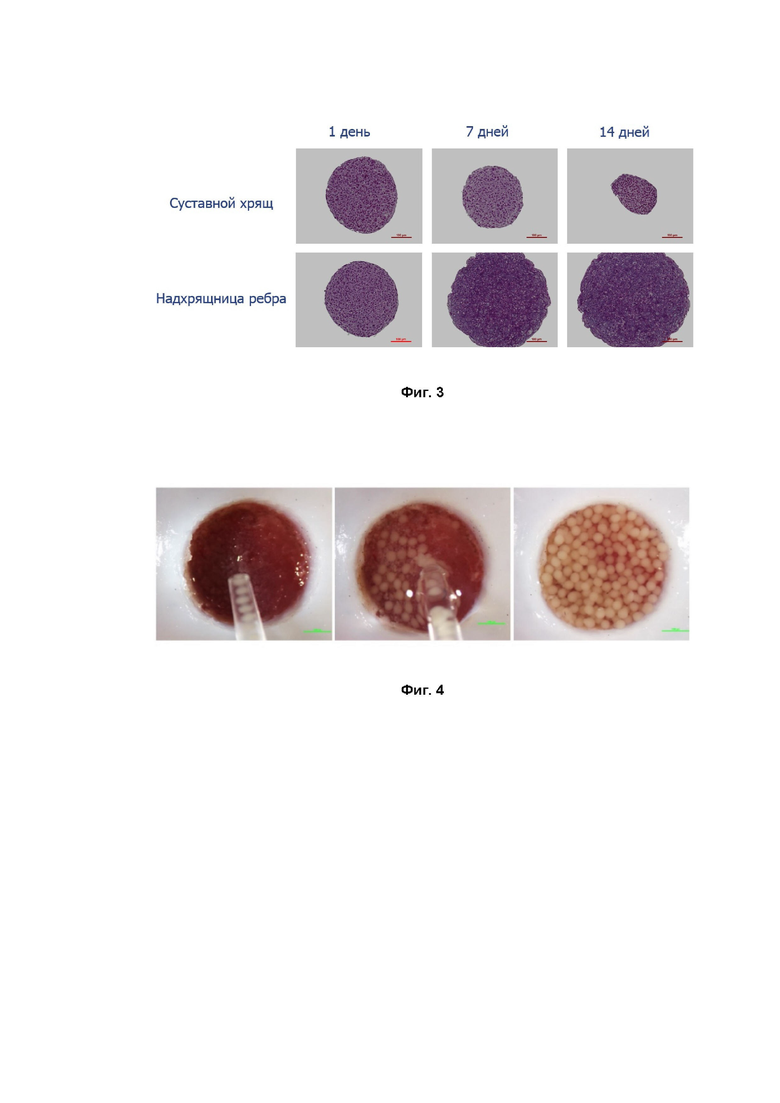
Фигура 3. Гистологическое строение сфероидов из суставного хряща и надхрящницы ребра в процессе их культивирования через 1, 7 и 14 дней.
Фигура 4. Процесс покрытия сфероидами, полученными способом по изобретению, зоны дефекта суставной поверхности субъекта.
Определения и термины
Различные термины, относящиеся к объектам настоящего изобретения, используются выше и также в описании и в формуле изобретения. Если иное не оговаривается, все технические и научные термины, используемые в данной заявке, имеют то же самое значение, которое понятно для специалистов в данной области. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
В описании данного изобретения термин «ткань» относится к системе клеток и неклеточных структур, обладающих общностью строения, в ряде случаев общностью происхождения, и специализированных на выполнении определенных функций.
Используемый в данной заявке термин «трансплантат» относится к сфероидам, а термин «трансплантация» - это пересадка указанных сфероидов в организм субъекта, как правило, для устранения дефекта хряща.
Используемый в данном документе термин «дефект хряща» относится к хрящевой ткани, если она отсутствует, уменьшено ее количество или она иначе повреждена. Дефект хрящевой ткани может быть, в том числе, результатом заболевания, лечения заболевания или травмы.
Используемый в данной заявке термин «хондрогенная среда» означает среду, необходимую для дифференцировки клеток в хондрогенном направлении.
Используемый в данной заявке термин «сфероиды» относится к плотно упакованным клеточным агрегатам шарообразной формы, сформированных путем трехмерного культивирования. Их важным свойством является способность к взаимной адгезии и последующему тканевому слиянию, а также к адгезии к элементам внеклеточного матрикса.
Подробное раскрытие изобретение
Технический результат достигается тем, что в качестве источника хондропрогениторных клеток для производства сфероидов используется надхрящница, являющаяся для хряща камбиальной зоной, поставляющей прогениторные клетки для его обновления и репаративной регенерации, и, следовательно, содержащая большее количество камбиальных клеток. Следует отметить, что реберный и суставной хрящи относятся к гиалиновой хрящевой ткани. При формировании сфероидов из клеток надхрящницы в этом случае не происходит уменьшения их диаметра.
Выделение хондропрогенитоных клеток из надхрящницы происходит путем ее механического измельчения на мелкие кусочки с последующей их ферментативной диссоциацией.
Для получения первичной культуры выделенные из надхрящницы клетки высевают в пластиковые флаконы с культуральной средой следующего состава: DMEM (или DMEM /F12) 450 мл, L-глутамин 292 мг, эмбриональная телячья сыворотка 50 мл, пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, при 100% влажности, температуре 37°С, 5% СО2 (данная среда и условия используются на всех этапах последующего культивирования).
Субкультивирование монослойной культуры хондропрогениторных клеток осуществляют до третьего пассажа со сменой среды каждые 2-3 дня.
После третьего пассажа клетки снимают с пластиковых флаконов трипсином/ЭДТА. Полученную клеточную взвесь отмывают от трипсина/ЭДТА, в том числе с помощью среды DMEM с 10% сывороткой с последующим центрифугированием (10 минут при 200g) и переносят в 81-луночные агарозные планшеты с диаметром лунки 800 мкм в концентрации до 1,6 млн клеток на планшет, где в лунках из культивируемых клеток начинают формироваться сфероиды. Таким образом, формирование клеточных сфероидов происходит в безскаффолдной 3-хмерной культуре клеток с использованием микроформованных неадгезивных гидрогелей (Scaffold-free 3-Dimensional Cell Culture Utilizing Micro-Molded Non-Adhesive Hydrogels).
Для получения агарозных планшетов используют силиконовую форму 3D Petri Dish (Microtissues®, США) в соответствии с протоколом производителя: раствор агарозы распределяют в силиконовые формы, в результате чего получается микроформованный (микромодулированный) неадгезивный агарозный гидрогель - агарозный (микро)планшет (форма, образованная из агарозного гидрогеля, имеющая лунки одинакового размера, в частном варианте воплощения - 81 лунку диаметром 800 мкм).
Сфероиды пребывают в лунках агарозного планшета на протяжении до 21 суток со сменой среды каждые 2-3 дня.
Для трансплантации сфероидов их собирают из планшетов и переносят в пробирку, где они осаждаются на дно без дополнительного центрифугирования. После этого сфероиды помещают в шприц и трансплантируют субъекту в зону дефекта через иглу или аппликатор, диаметром не менее 1 мм2. Трансплантация может производиться артроскопически.
Осуществление изобретения
Пример 1
Взятие надхрящницы осуществляли с реберного хряща овец. Для отделения надхрящницы от нижележащего хряща под нее вводили изотонический раствор. В качестве контроля у тех же животных с мыщелков бедренных костей были взяты фрагменты суставного хряща.
Выделение клеток из надхрящницы реберного и суставного хряща производили путем предварительного механического измельчения с последующей ферментативной диссоциацией кусочков тканей.
Для получения первичной культуры выделенные клетки высевали в пластиковые флаконы с культуральной средой следующего состава: DMEM 450 мл, L-глутамин 292 мг, эмбриональная телячья сыворотка 50 мл, пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, при 100% влажности, температуре 37°С, 5% СО2 (данная среда и условия используются на всех этапах последующего культивирования). Субкультивирование монослойной культуры хондропрогениторных клеток осуществляли до третьего пассажа со сменой среды каждые 2-3 дня.
После третьего пассажа клетки снимали с пластика (пластиковых флаконов) трипсином/ЭДТА. Полученную клеточную взвесь отмывали от трипсина/ЭДТА, в том числе средой DMEM с 10% сывороткой и с последующим центрифугированием (10 минут при 200g), затем переносили в 81-луночные агарозные планшеты с диаметром лунки 800 мкм в концентрации до 1,6 млн. клеток на планшет, после чего начинали формироваться сфероиды.
Культивирование сфероидов производили в течение 14 суток со сменой среды каждые 2-3 дня.
В результате сфероиды из надхрящницы вдвое увеличивались в размере в процессе культивирования, а сфероиды из суставного хряща - уменьшались (Фиг. 1, Фиг. 2). Обычно сфероиды, полученные из клеток хряща, уменьшаются в размерах внутри агарозных лунок со временем. Это связано с биологическими особенностями клеток хряща, неоптимальными условиями культивирования, гибелью части клеток и утратой структурных элементов. Поэтому результат, полученный с использованием клеток надхрящницы, не был абсолютно ожидаемым для специалиста.
Таким образом, при выращивании (получении) сфероидов согласно способу по изобретению в агарозных лунках получают сфероиды из надхрящницы реберного хряща, которые увеличивают свою биомассу в агарозных лунках, в отличие от сфероидов из суставного хряща.
Гистологически сфероиды из суставного хряща на сроке культивирования 14 суток состояли главным образом из клеток, в то время как сфероиды из надхрящницы согласно предлагаемому изобретению уже на 7 сутки культивирования содержали волокнистый внеклеточный матрикс. (Фиг. 3). Таким образом, в результате проведенного эксперимента показано, что равное исходное количество клеток произвело разную биомассу сфероидов: сфероидов, полученных способом по изобретению, из надхрящницы, было больше, чем сфероидов из суставного хряща, соответственно больший объем дефекта может быть заполнен. Кроме того, производство волокнистого внеклеточного матрикса при 3D-культивировании - свидетельство более высокой функциональной активности и жизнеспособности клеток.
Пример 2
В дефекты суставной поверхности диаметром 4 мм, сформированные на фрагментах мыщелков бедренных костей овец, помещали сфероиды из надхрящницы реберного хряща (гиалинового), полученные согласно предлагаемому изобретению, до полного покрытия ими зоны дефекта (Фиг. 4). В качестве контроля использованы сфероиды из гиалиновой хрящевой ткани - суставного хряща. После заполнения сфероидами фрагменты мыщелков бедренных костей овец культивировали в пластиковом флаконе со средой следующего состава: DMEM 450 мл, L-глутамин 292 мг, эмбриональная телячья сыворотка 50 мл, пенициллин 100 ед./мл, стрептомицин 100 мкг/мл, при 100% влажности, температуре 37°С, 5% СО2, в течение 7 дней со сменой среды каждые 3 дня.
Отмечено, что на первые сутки культивирования сфероиды из надхрящницы сливались между собой и взаимодействовали со структурами зоны дефекта, распластываясь на реципиентном ложе. К седьмым суткам культивирования дефект был полностью покрыт соединительной тканью из привнесенных сфероидов. Размер сфероидов из надхрящницы оптимален для эффективного закрытия дефекта суставной поверхности, а за счет пластичности (способности к слиянию между собой и распластыванию на поверхности дефекта) тканевое слияние сфероидов и приживление сфероидов происходит быстро.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Список литературы, которая включена в настоящее описание изобретения в качестве ссылок:
1. Marcacci M Zaffagnini S, Kon E, Visani A, Iacono F, Loreti I. Arthroscopic autologous chondrocyte transplantation: technical note. [Журнал] // Knee Surg Sports Traumatol Arthrosc. - 2002 г.. - 3 : Т. 10. - стр. 154-159.
2. Ossendorf C Kaps C, Kreuz PC, Burmester GR, Sittinger M, Erggelet C. Treatment of posttraumatic and focal osteoarthritic cartilage defects of the knee with autologous polymer-based three-dimensional chondrocyte grafts: 2-year clinical results. [Журнал] // Arthritis Res Ther. - 2007 г.. - 2 : Т. 9.
3. Behrens P Ehlers EM, Köchermann KU, Rohwedel J, Russlies M, Plötz W. New therapy procedure for localized cartilage defects. Encouraging results with autologous chondrocyte implantation [Журнал] // MMW Fortschr Med. . - 1999 г.. - 45 : Т. 141. - стр. 49-51.
4. Anderer U Libera J. In vitro engineering of human autogenous cartilage. [Журнал] // J Bone Miner Res. . - 2002 г.. - 8 : Т. 17. - стр. 1420-1429.
5. Stuart MP Matsui RAM, Santos MFS, Côrtes I, Azevedo MS, Silva KR, Beatrici A, Leite PEC, Falagan-Lotsch P, Granjeiro JM, Mironov V, Baptista LS. Successful Low-Cost Scaffold-Free Cartilage Tissue Engineering Using Human Cartilage Progenitor Cell Spheroids Formed by Micromolded Nonadhesive Hydrogel. [Журнал] // Stem Cells Int. . - 2017 г.


Группа изобретений относится к области медицины, а именно к тканевой инженерии, регенеративной медицине, травматологии и ортопедии, и раскрывает способ получения трансплантата в виде клеточных сфероидов и трансплантат для восстановления хряща субъекта, полученные указанным способом. Способ включает в себя выделение клеток из надхрящницы собственного реберного хряща субъекта, культивирование выделенных клеток, перенесение клеток в агарозные планшеты из расчета 20000 клеток на 1 лунку агарозного планшета и их последующее культивирование с образованием клеточных сфероидов. Изобретение позволяет получать трансплантат в виде клеточных сфероидов из надхрящницы ребра субъекта, обладающих выраженным регенерационным потенциалом, для эффективного восстановления хряща, в частности суставного хряща. 2 н. и 10 з.п. ф-лы, 4 ил., 2 пр.
1. Способ получения трансплантата в виде клеточных сфероидов для восстановления хряща субъекта на основе клеток надхрящницы собственного реберного хряща субъекта, включающий следующие этапы:
а) выделение клеток из надхрящницы собственного реберного хряща субъекта;
б) культивирование выделенных на стадии а) клеток без хондрогенной дифференцировочной среды, причем для получения первичной культуры выделенные клетки высевают в пластиковые флаконы с культуральной средой следующего состава: DMEM 450 мл, L-глутамин 292 мг, эмбриональная телячья сыворотка 50 мл, пенициллин 100 ед/мл, стрептомицин 100 мкг/мл, при 100% влажности, температуре 37°С, 5% СО2;
в) перенесение клеток, полученных на стадии б), в агарозные планшеты из расчета 20000 клеток на 1 лунку агарозного планшета и их последующее культивирование с образованием клеточных сфероидов.
2. Способ по п.1, в котором субъект представляет собой человека.
3. Способ по п.1, в котором хрящ представляет собой суставной хрящ, хрящ носа, гортани, трахеи, бронхов, ушной раковины или межпозвоночных дисков.
4. Способ по п.1, в котором культивирование клеток на стадии б) осуществляется в течение 20-30 дней.
5. Способ по п.1, в котором перенесение клеток на стадии в) осуществляется из расчета 20000 клеток на 1 лунку агарозного планшета.
6. Способ по п.1, в котором слияние клеток в клеточные сфероиды осуществляется в лунках агарозного планшета, где клетки пребывают до 21 дня.
7. Способ по п.6, в котором слияние клеток в клеточные сфероиды осуществляется через 7-15 дней.
8. Способ по п.1, в котором размер сфероидов составляет 250-700 мкм.
9. Трансплантат для восстановления хряща субъекта, включающий клеточные сфероиды на основе клеток надхрящницы собственного реберного хряща субъекта, полученные способом по п.1.
10. Трансплантат по п.1, в котором хрящ представляет собой суставной хрящ, хрящ носа, гортани, трахеи, бронхов, ушной раковины или межпозвоночных дисков.
11. Трансплантат по п.1, в котором субъект представляет собой человека.
12. Трансплантат по п.1, в котором размер сфероидов составляет 250-700 мкм.
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| Способ приготовления кормовой добавки из птичьего помета с применением штаммов бактерий Bacillus subtilis ТНП-3-ДЕП и Bacillus subtilis ТНП-5-ДЕП | 2016 |
|
RU2677027C1 |
| DE 60230593 D1, 12.02.2009 | |||
| CESARZ Z | |||
| et al | |||
| Spheroid Culture of Stem Cells | |||
| Stem Cells International, 2016, 1-11 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2020-09-01—Публикация
2019-10-30—Подача