Область техники, к которой относится изобретение
Настоящее изобретение относится к анти-мезотелин антителу или его функциональному фрагменту. Изобретение также относится к конъюгату лекарственное средство-антитело, содержащему анти-мезотелин антитело и низкомолекулярное лекарственное средство. Изобретение также относится к применению антитела и конъюгата по настоящему изобретению в производстве медикамента для лечения опухоли.
Предшествующий уровень техники
MSLN (мезотелин) представляет собой антиген, распознаваемый моноклональным антителом CAK1 в мезотелиальных клетках, мезотелиоме и раке яичников. Это гликопротеин клеточной поверхности размером 40 кДа с высокой экспрессией во многих опухолевых тканях, и, таким образом, этот белок является очень хорошим маркером-мишенью для терапевтических антител.
Хотя моноклональные антитела имеют высокую терапевтическую специфичность и низкие побочные эффекты, их эффективность ограничена когда их используют сами по себе. Конъюгат лекарственного средства образуется путем связывания токсина с антителом через линкер и обладает как сильной нацеливающей способностью, так и высокоэффективной цитотоксичностью, что делает применение нового лекарственного средства ADC одним из наиболее перспективных способов иммунотерапии и привлекает большое внимание в иммунотерапии рака.
Некоторые исследовательские группы создали конъюгаты антитело-лекарственное средство, нацеленные на MSLN, но эти конъюгаты антитело-лекарственное средство все еще имеют много недостатков, таких как: связывание тиоловых групп цистеинов на антителе приводит к потере исходной дисульфидной связи между пептидными цепями, и полученные ADC являются нестабильными, и как только ADC входит в систему кровообращения, его период полужизни сокращается, а его токсические побочные эффекты значительны; связывание аминогрупп лизинов на антителе делает сайты связывания случайными, что может повлиять на нацеливающую способность антитела.
Следовательно, в данной области все еще существует потребность в разработке антитела против MSLN, обладающего лучшими свойствами, и конъюгата лекарственное средство-антитело, содержащего антитело.
Содержание изобретения
Настоящее изобретение относится к анти-мезотелин антителу или его функциональному фрагменту и конъюгату лекарственное средство-антитело, содержащему антитело или его функциональный фрагмент. В частности, конъюгат антитело-лекарственное средство по изобретению обладает более высокой стабильностью и менее выраженными токсическими побочными эффектами и/или имеет более высокую аффинность к мезотелину.
В частности:
В одном аспекте настоящее изобретение относится к конъюгату антитело- лекарственное средство, где конъюгат антитело-лекарственное средство имеет следующую структурную формулу:
Ab-(L-D)n
в которой:
Ab представляет собой антитело или его функциональный фрагмент, который специфически связывается с MSLN;
L незаполнен или представляет собой любой линкер;
D представляет собой любое терапевтическое средство;
n представляет собой целое число, выбранное от 1 до 8, такое как 1, 2, 3, 4, 5, 6, 7 или 8, или интервал между любыми двумя из них.
Кроме того, антитело по настоящему изобретению или его функциональный фрагмент включают тяжелую цепь и легкую цепь, где (i) тяжелая цепь содержит, по меньшей мере, три области CDR, где аминокислотная последовательность, по меньшей мере, одной из областей CDR имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, 2 или 3, или последовательность, имеющую идентичность последовательности, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) с ней; и (ii) легкая цепь содержит, по меньшей мере, три области CDR, где аминокислотная последовательность, по меньшей мере, одной из областей CDR имеет аминокислотную последовательность, представленную в SEQ ID NO: 4, 5 или 6, или последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней. Предпочтительно антитело по настоящему изобретению или его функциональный фрагмент включают тяжелую цепь и легкую цепь, где (i) вариабельная область тяжелой цепи включает три области CDR, где области CDR имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, 2 или 3, соответственно; и/или (ii) вариабельная область легкой цепи включает три области CDR, где области CDR имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, 5 или 6, соответственно. Наиболее предпочтительно, CDR тяжелой цепи анти-мезотелин антитела, раскрытого в настоящем изобретении, имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно, и CDR вариабельной области легкой цепи имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
Кроме того, настоящее изобретение относится к анти-мезотелин антителу или его функциональному фрагменту, включающему вариабельную область тяжелой цепи и вариабельную область легкой цепи, где (i) вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 7 или последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней; и (ii) вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, или последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней. Предпочтительно, антитело включает тяжелую цепь и легкую цепь, где (i) вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, и/или (ii) вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8. Наиболее предпочтительно вариабельная область тяжелой цепи анти-мезотелин антитела, раскрытого в настоящем изобретении, содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, и вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
В некоторых конкретных воплощениях антитело по изобретению содержит тяжелую цепь и легкую цепь, где тяжелая цепь содержит аминокислотную последовательность, представленную в SEQ ID NO: 10, и легкая цепь содержит аминокислотную последовательность, представленную в SEQ ID №: 9.
В другом аспекте изобретение относится к конъюгату антитело-лекарственное средство, содержащему анти-мезотелин антитело или его функциональный фрагмент и терапевтический агент. Предпочтительно, конъюгат антитело-лекарственное средство по изобретению дополнительно включает линкер, который связывает анти-мезотелин антитело или его функциональный фрагмент с терапевтическим агентом.
В некоторых воплощениях линкер L по настоящему изобретению может быть связан с антителом любым способом, известным в данной области, предпочтительно тиольной группой и/или аминогруппой. В предпочтительном воплощении антитело по изобретению связано с линкером тиольной группой на антителе. Линкер L по настоящему изобретению может отсутствовать (то есть антитело напрямую связано с терапевтическим агентом D) или представлять собой любой из расщепляемых линкеров (т.е. линкер, который расщепляется в среде in vivo) или нерасщепляемых линкеров или их комбинации; предпочтительно, линкер может быть выбран из перечисленных в таблице 1 ниже.
Таблица 1: Линкеры, используемые в конъюгате антитела по настоящему изобретению
этокси) пропаноат
В некоторых воплощениях линкер по настоящему изобретению предпочтительно выбран из тех, которые перечислены в Таблице 2 ниже.
Таблица 2: Предпочтительные линкеры, используемые в конъюгате антитела по настоящему изобретению
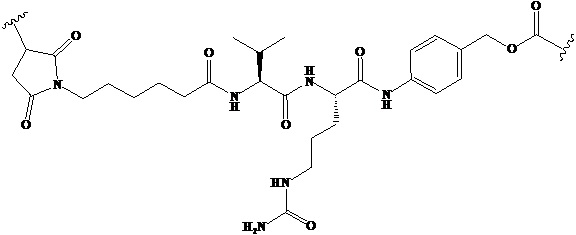
малеимидокапроил-валин-цитруллин-п-аминобензилоксикарбонил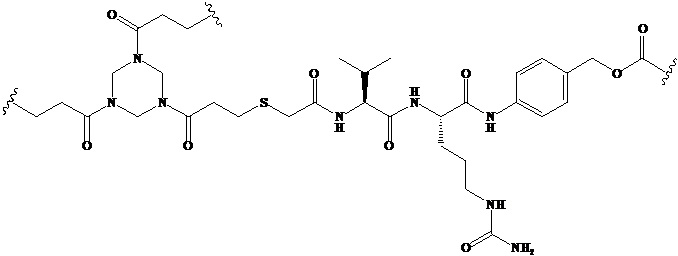
Триакрилоилгексагидро триазин-меркаптоуксусная кислота-валин-цитруллин-п-аминобензилоксикарбонил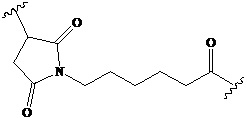
малеимидокапроил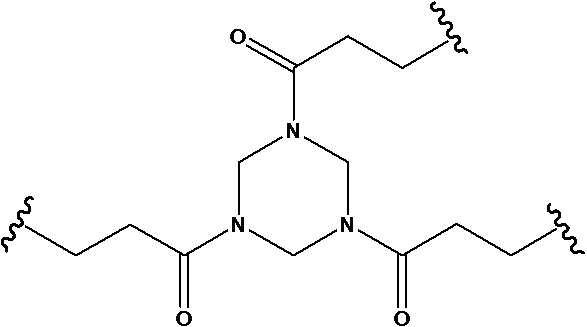
Триакрилоилгексагидротриазин
В некоторых воплощениях настоящего изобретения терапевтический агент D выбран из группы, состоящей из: соединений майтанзина, ингибиторов V-АТФазы, проапоптотических агентов, ингибиторов Be 12, ингибиторов McL1, ингибиторов HSP90, ингибиторов IAP, ингибиторов mTOr, стабилизаторов микротрубочек, дестабилизаторов микротрубочек, ауристатина, доластатина, MetAP (метионинаминопептидазы), ингибиторов ядерного экспорта белка CRM1, ингибиторов DPPIV, ингибиторов протеасом, ингибиторов реакции переноса фосфорила в митохондриях, ингибиторов синтеза белка, ингибиторов киназ, ингибиторов CDK2, ингибиторов CDK9, ингибиторов CDK9, ингибитров кинезина, ингибиторов HDAC, агентов повреждения ДНК, алкилирующих агентов ДНК, интеркаляторов ДНК, веществ, связывающихся с малыми бороздками ДНК, ингибиторов DHFR и пептидов доластатина.
В некоторых предпочтительных воплощениях изобретения терапевтическое средство D представляет собой цитотоксическое вещество (например, антиметаболит, противоопухолевый антибиотик, алкалоид), иммунопотенциатор или радиоизотоп. Предпочтительно терапевтический агент D может быть выбран из группы, состоящей из MMAD (монометилауристатина D) и его производных, MMAE (монометилауристатина E) и его производных, MMAF (монометилауристатина F) и его производных, производного мертанзина M1, производного мертанзина М4, дуокармицина, калихеамицина, PBDA (пирролобензодиазепинов), доксорубицина, алкалоидов барвинка, метротрексата, винбластина, даунорубицина; более предпочтительно терапевтический агент выбирают из мейтанзиноидов (например, ансамитоцина или мертанзина), доластатина и его производных; наиболее предпочтительно, терапевтический агент выбирают из группы, состоящей из MMAD и MMAE.
В некоторых воплощениях настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, и L выбирают из группы, состоящей из Py-MAA- Val-Cit-PAB, Mc-Val-Cit-PAB, D выбирают из MMAD или MMAE, а n представляет собой целое число, выбранное от 1 до 8, такое как 1, 2, 3, 4, 5, 6, 7, 8 или интервал между любыми двумя из них.
В некоторых конкретных воплощениях конъюгат антитело-лекарственное средство по изобретению имеет структуру, показанную в любой из следующих формул:
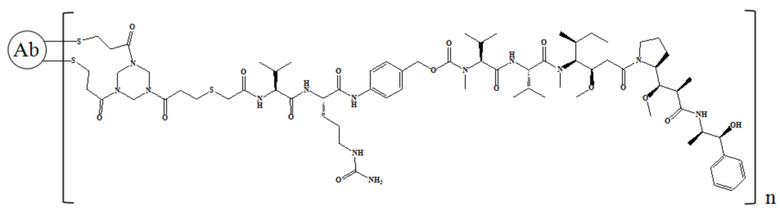
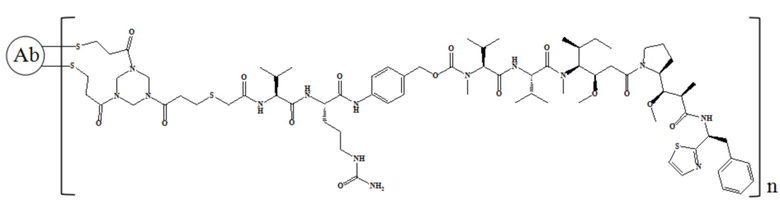
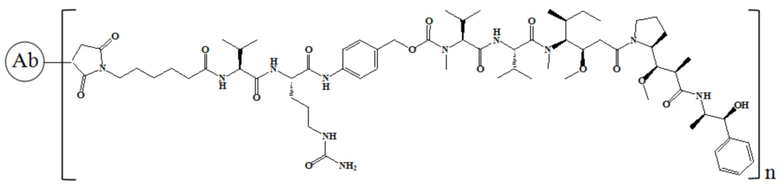
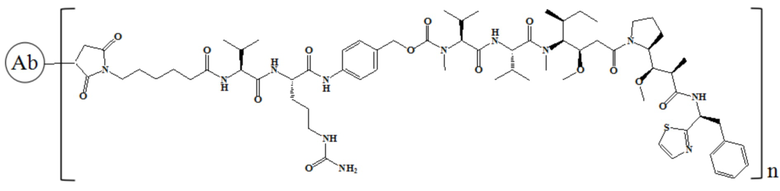
где n равно 1, 2, 3, 4, 5, 6, 7 или 8.
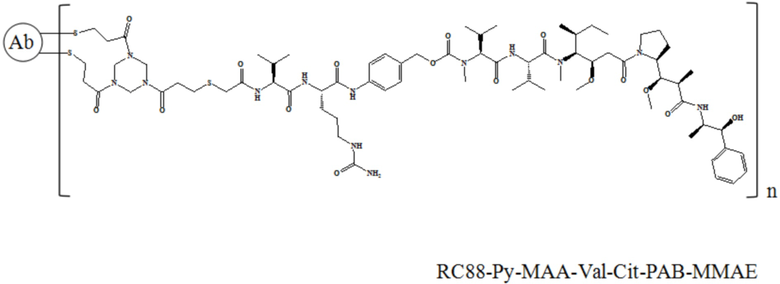
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, CDR вариабельной области тяжелой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно, и CDR вариабельной области легкой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно; L представляет собой Py-MAA-Val-Cit-PAB и D представляет собой MMAE. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Py-MAA-Val-Cit-PAB-MMAE, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7. или 8:
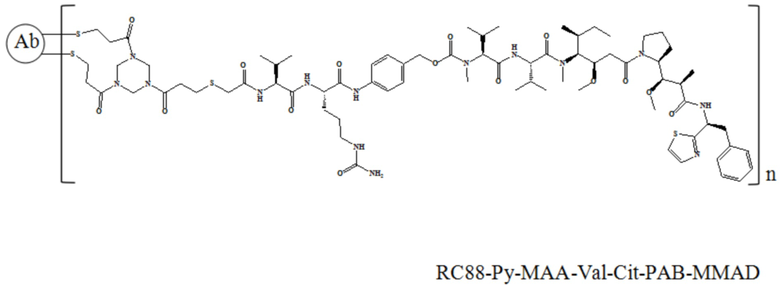
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, CDR вариабельной области тяжелой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3 соответственно, и CDR вариабельной области легкой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно; L представляет собой Py-MAA-Val-Cit-PAB и D представляет собой MMAD. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Py-MAA-Val-Cit-PAB-MMAD, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
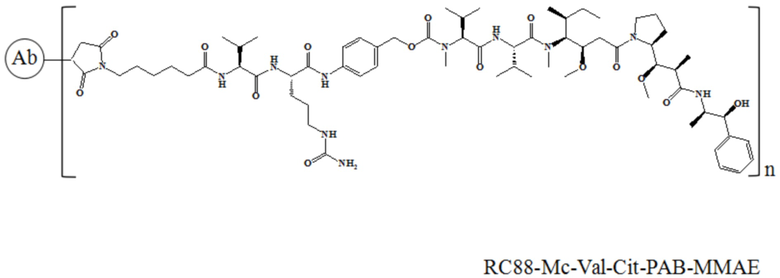
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(LD)n, где Ab представляет собой любое антитело против мезотелина по настоящему изобретению, CDR вариабельной области тяжелой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно, и CDR вариабельной области легкой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно; L означает Mc-Val-Cit-PAB, а D означает MMAE. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Mc-Val-Cit-PAB-MMAE, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
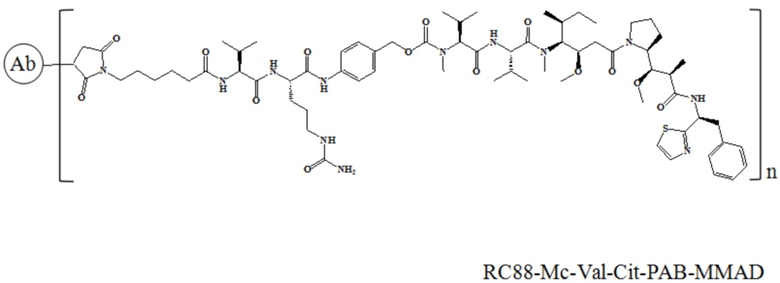
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, CDR вариабельной области тяжелой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3 соответственно, и CDR вариабельной области легкой цепи антитела имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6 соответственно; L означает Mc-Val-Cit-PAB, а D означает MMAD. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Mc-Val-Cit-PAB-MMAD, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, антитело имеет последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 7 и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 8; L означает Py-MAA-Val-Cit-PAB и D означает MMAE. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Py-MAA-Val-Cit-PAB-MMAE, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7. или 8:
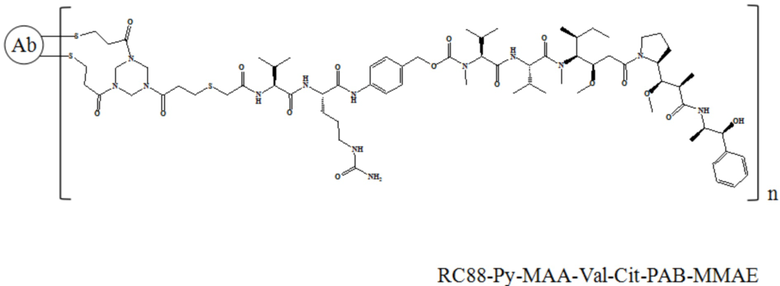
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, антитело имеет последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 7 и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 8; L означает Py-MAA-Val-Cit-PAB,а D означает MMAD. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Py-MAA-Val-Cit-PAB-MMAD, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
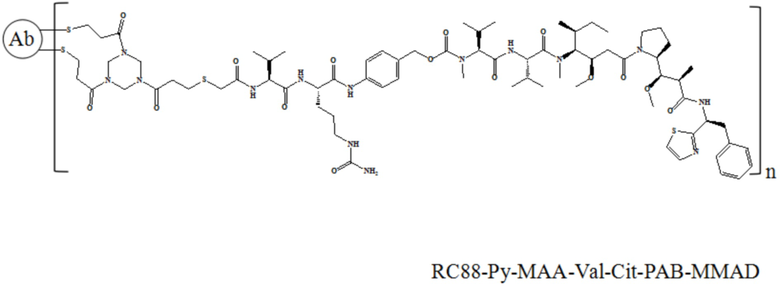
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, антитело имеет последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 7 и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 8; L означает Mc-Val-Cit-PAB, а D означает MMAE. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Mc-Val-Cit-PAB-MMAE, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
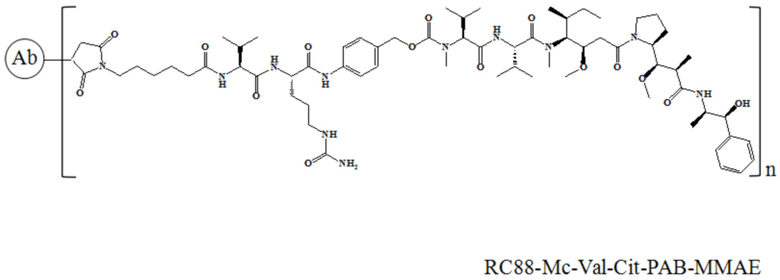
В частности, настоящее изобретение относится к конъюгату антитело-лекарственное средство общей формулы Ab-(L-D)n, где Ab представляет собой любое анти-мезотелин антитело по настоящему изобретению, антитело имеет последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 7 и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 8; L означает Mc-Val-Cit-PAB, а D означает MMAD. Более конкретно, конъюгат антитело-лекарственное средство по настоящему изобретению представляет собой RC88-Mc-Val-Cit-PAB-MMAD, имеющий структуру, показанную следующей формулой, где n равно 1, 2, 3, 4, 5, 6, 7 или 8:
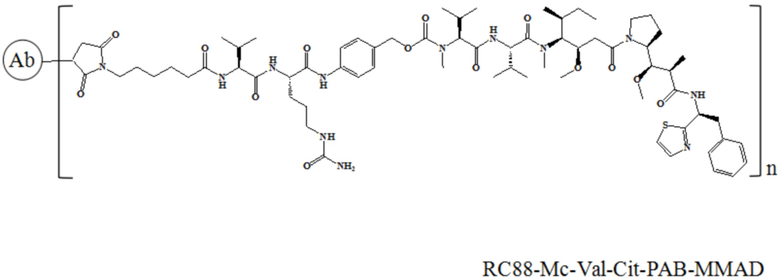
В другом аспекте настоящее изобретение относится к антителу или его функциональному фрагменту, способному связывать мезотелин, где антитело или его функциональный фрагмент содержит тяжелую цепь и легкую цепь, где
(i) тяжелая цепь содержит, по меньшей мере, три области CDR, где аминокислотная последовательность, по меньшей мере, одной из областей CDR имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, 2 или 3, или имеет последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичность последовательностей с ней; и/или
(ii) легкая цепь содержит, по меньшей мере, три области CDR, где аминокислотная последовательность, по меньшей мере, одной из областей CDR имеет аминокислотную последовательность, представленную в SEQ ID NO: 4, 5 или 6, или имеет последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней.
В некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент по настоящему изобретению включают тяжелую цепь и легкую цепь, где:
(i) вариабельная область тяжелой цепи включает три области CDR, где области CDR имеют аминокислотную последовательность, представленную в SEQ ID NO: 1, 2 или 3 соответственно; и/или
(ii) вариабельная область легкой цепи содержит три области CDR, где области CDR имеют аминокислотную последовательность, представленную в SEQ ID NO: 4, 5 или 6, соответственно.
В частности, аминокислотные последовательности областей CDR тяжелой цепи анти-мезотелин антитела, раскрытого в настоящем изобретении, представлены в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно.
В частности, аминокислотные последовательности областей CDR легкой цепи анти-мезотелин антитела, раскрытого в настоящем изобретении, показаны в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
Более конкретно, в анти-мезотелин антителе, раскрытом в настоящем изобретении, аминокислотные последовательности его областей CDR тяжелой цепи представлены в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно, и аминокислотные последовательности областей CDR вариабельной области легкой цепи приведены в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
В дополнительном аспекте настоящее изобретение относится к анти-мезотелин антителу или его функциональному фрагменту, который содержит тяжелую цепь и легкую цепь, где тяжелая цепь и легкая цепь содержат вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно:
(i) вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, или последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней; и
(ii) вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, или последовательность, имеющую, по меньшей мере, 80% (предпочтительно 85%, 90%, 95%, 98% или 99%) идентичности последовательностей с ней.
В некоторых конкретных воплощениях антитело включает тяжелую цепь и легкую цепь, где тяжелая цепь и легкая цепь содержат вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно, где
(i) вариабельная область тяжелой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, и/или
(ii) вариабельная область легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 8.
В частности, анти-мезотелин антитело по настоящему изобретению содержит тяжелую цепь и легкую цепь, где тяжелая цепь и легкая цепь содержат аминокислотные последовательности, указанные в SEQ ID NO: 10 и SEQ ID NO: 9, соответственно.
В некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент являются выделенными.
В некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело, антитело человека, одноцепочечное антитело (scFv) или биспецифическое антитело; в некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент представляет собой моноклональное антитело; в некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент представляет собой гуманизированное антитело; в некоторых конкретных воплощениях анти-мезотелин антитело или его функциональный фрагмент представляет собой антитело IgG1.
В дополнительном аспекте изобретение относится к выделенному полинуклеотиду, кодирующему антитело по настоящему изобретению.
В дополнительном аспекте изобретение относится к комбинации выделенных полинуклеотидов, причем эта комбинация включает полинуклеотид, кодирующий легкую цепь антитела по настоящему изобретению или его функциональный фрагмент, и полинуклеотид, кодирующий тяжелую цепь антитела по изобретению, или его функциональный фрагмент.
В дополнительном аспекте изобретение предоставляет экспрессирующий вектор или комбинацию экспрессирующих векторов, которая содержит полинуклеотид согласно настоящему изобретению или комбинацию полинуклеотидов согласно настоящему изобретению, причем полинуклеотид функционально связан с регуляторной последовательностью в клетке-хозяине или бесклеточной системе экспрессии, обеспечивающей экспрессию кодируемого им полипептида.
В дополнительном аспекте изобретение относится к фармацевтической композиции, содержащей антитело или его функциональный фрагмент в соответствии с настоящим изобретением и/или конъюгат в соответствии с настоящим изобретением и фармацевтически приемлемый носитель.
В дополнительном аспекте изобретение относится к способу лечения или профилактики рака, включающему введение объекту, нуждающемуся в этом, терапевтически эффективного количества антитела, полинуклеотида, комбинации полинуклеотидов, экспрессирующего вектора, конъюгата и/или фармацевтической композиции, в соответствии с настоящим изобретением.
В дополнительном аспекте изобретение относится к применению антитела, полинуклеотида, комбинации полинуклеотидов, экспрессирующего вектора, конъюгата и/или фармацевтической композиции, в соответствии с настоящим изобретением, в производстве лекарственного средства для лечения или профилактики рака.
В дополнительном аспекте изобретение предоставляет антитело, полинуклеотид, комбинацию полинуклеотидов, экспрессирующий вектор, конъюгат и/или фармацевтическую композицию в соответствии с настоящим изобретением для применения при лечении или профилактике рака.
В дополнительном аспекте изобретение относится к применению конъюгата антитело-лекарственное средство по любому из вышеуказанных воплощений при изготовлении лекарственного средства для лечения рака.
В определенных конкретных воплощениях онкологическое заболевание по изобретению представляет собой мезотелин-положительный рак.
Краткое описание чертежей
На Фигуре 1 показаны диаграммы полученные с помощью SDS-PAGE для RC88-PY-MAA-Val-Cit-PAB-MMAE и RC88-Mc-Val-Cit-PAB-MMAE, которые характеризовали сочетание антитела RC88 с линкером и конъюгат с лекарственным средством.
На Фигуре 2 показано соединение конъюгатов по настоящему изобретению, где на Фигуре А показаны результаты обнаружения соединения RC88-PY-MAA-Val-Cit-PAB-MMAE с помощью гидрофобной высокоэффективной жидкостной хроматографии (HIC-HPLC); На Фигуре B показаны результаты обнаружения соединения RC88-Mc-Val-Cit-PAB-MMAE с помощью гидрофобной высокоэффективной жидкостной хроматографии (HIC-HPLC).
На Фигуре 3 показаны цитотоксические эффекты конъюгатов по настоящему изобретению, причем на Фигуре А показаны кривые цитотоксического действия конъюгатов антитела RC88 по настоящему изобретению (т.е. RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD) в клетках Oval-Citar-3 с высокой экспрессией MSLN; На Фигуре B показаны кривые цитотоксического действия неконъюгированных линкеров антител и конъюгатов цитотоксинов (Py-Val-Cit-PAB-MMAE, Py-Val-Cit-PAB-MMAD, Mc-Val-Cit-PAB-MMAE, Mc- Val-Cit-PAB-MMAD) в клетках Oval-Citar-3 с высокой экспрессией MSLN; На Фигуре C показаны кривые цитотоксического действия цитотоксина MMAE, MMAD и PTX положительного контроля (паклитаксел) в клетках Oval-Citar-3 с высокой экспрессией MSLN; где абсцисса представляет собой логарифмическую концентрацию лекарственного средства, а ордината представляет собой максимальную степень ингибирования при соответствующей логарифмической концентрации лекарственного средства.
На Фигуре 4 показан график массы тела мышей с опухолями в зависимости от количества дней, в течение которых мышам вводили антитело RC88 (2 мг/кг), лекарственные конъюгаты антитела RC88 (RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD, 2 мг/кг) и MMAE (0,0716 мг/кг) (вводили один раз в неделю, всего 3 дозы), где абсцисса представляет количество дней, а ордината представляет массу тела мышей с опухолями после соответствующих дней введения. В этом тесте контрольными группами были физиологический раствор (контроль) и MMAE.
На Фигуре 5 показан график объема опухоли у мышей с опухолью как функция количества дней, в течение которых мышам вводили антитело RC88 (2 мг/кг), конъюгаты антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD, 2 мг/кг) и MMAE (0,0716 мг/кг) (вводится один раз в неделю, всего 3 дозы), где абсцисса представляет количество дней, а ордината представляет объем опухоли у мышей с опухолями после соответствующего количества дней введения. В этом тесте контрольными группами были физиологический раствор (контроль) и MMAE.
На Фигуре 6 показан график массы опухоли у мышей с опухолями, которым вводили антитело RC88 (2 мг/кг), конъюгаты антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD, 2 мг/кг) и MMAE (0,0716 мг/кг), один раз в неделю 3 раза всего, контрольными группами были физиологический раствор (контроль) и MMAE.
На Фигуре 7 показан график массы тела мышей с опухолями в зависимости от количества дней, в течение которых мышам вводили антитело RC88 (3 мг/кг), конъюгат антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE, 3 мг/кг, 1,5 мг/кг, 0,75 мг/кг), MMAE (0,06 мг/кг), антитело RC88 (3 мг/кг) + MMAE (0,06 мг/кг), IgG- MMAE (3 мг/кг), PTX (паклитаксел, 10 мг/кг) (PTX вводили два раза в неделю, всего 6 раз; другие вводили один раз в неделю, всего 3 раза), где абсцисса представляет количество дней, и ордината представляет массу тела мышей с опухолями после соответствующего количества дней введения. В этом тесте контрольными группами были физиологический раствор (контроль) и MMAE.
На Фигуре 8 показан график объема опухоли у мышей с опухолью как функцию количества дней, когда мышам вводили антитело RC88 (3 мг/кг), конъюгат антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE, 3 мг/кг, 1,5 мг/кг, 0,75 мг/кг), MMAE (0,06 мг/кг), антитело RC88 (3 мг/кг) + MMAE (0,06 мг/кг), IgG- MMAE (3 мг/кг), PTX (паклитаксел, 10 мг/кг) (вводили один раз в неделю, всего 3 раза объем опухоли у мышей с опухолью с лекарственным средством (PTX вводили два раза в неделю, всего 6 раз; другие вводили один раз в неделю, всего 3 раза), абсцисса представляет количество дней, а ордината представляет объем опухоли у мышей с опухолями после соответствующего количества дней введения. В этом тесте контрольными группами были физиологический раствор (контроль) и MMAE.
На Фигуре 9 показаны противоопухолевые эффекты конъюгата антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) в модели мыши, несущей клетки рака яичника человека Oval-Citar-3 с высокой экспрессией MSLN.
На Фигуре 10 показаны кривые аффинности антитела RC88 и конъюгата антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) с MSLN-положительными опухолевыми клетками с помощью анализа ELISA.
На Фигуре 11 показана аффинность конъюгата по настоящему изобретению к мишени, где на фигуре А показаны кривые аффинности антитела RC88 и конъюгата антитело-лекарственное средство RC88 (RC88-Py-MAA-Val-Cit-PAB-MMAE) с MSLN-положительными опухолевыми клетками с помощью анализа ELISA; На Фигуре B показаны кривые конкурентного связывания антитела RC88 и конъюгата антитело-лекарственное средство RC88 (RC88-Py-MAA-Val-Cit-PAB-MMAE) с рекомбинантным белком MSLN человека.
На Фигуре 12 показаны кривые конкурентного связывания антитела RC88 и конъюгата антитело RC88- лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) и CA125 с рекомбинантным белком MSLN человека.
Конкретные модели для осуществления изобретения
Определение
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, что и понимаемые специалистом в данной области. Для конкретных определений и терминологии в данной области, специалист может обратиться к Current Protocols in Molecular Biology (Ausubel). Аббревиатуры для аминокислотных остатков представляют собой стандартные 3-буквенные и/или 1-буквенные коды, используемые в данной области для обозначения одной из 20 обычно используемых L-аминокислот.
Хотя числовые диапазоны и аппроксимации параметров в широких областях показаны в настоящем изобретении, числовые значения в конкретных воплощениях описаны настолько точно, насколько это возможно. Однако любое числовое значение по своей природе содержит определенные ошибки из-за стандартных отклонений, присутствующих в их соответствующих измерениях. Кроме того, все раскрытые в данном документе диапазоны следует понимать как охватывающие любой и все поддиапазоны. Например, следует считать, что указанный диапазон «от 1 до 10» охватывает любые и все поддиапазоны между минимальным 1 и максимальным 10 (включая конечные точки); то есть все поддиапазоны, начинающиеся с минимального значения 1 или более, например, от 1 до 6,1, и поддиапазоны, заканчивающиеся максимальным значением 10 или менее, например, от 5,5 до 10. Кроме того, любая ссылка, которая упоминается как «включенная в настоящий документ», понимается как включенная во всей своей полноте.
Кроме того, следует отметить, что, при использовании в описании, форма единственного числа объекта, на который делается ссылка, будет охватывать форму множественного числа, если однозначно и явно не ограничена одним объектом. Термин «или» может использоваться взаимозаменяемо с термином «и/или», если контекст явно не указывает иное.
Используемый в данном документе термин «мезотелин», также известный как MSLN, относится к любому природному, зрелому мезотелину, полученному в результате процессинга белков-предшественников клеточного мезотелина. Термин охватывает мезотелин из любого источника позвоночных, включая млекопитающих, таких как приматы (например, люди, обезьяны и обезьяны) и грызуны (например, мыши и крысы), если не указано иное; и термин также охватывает любой встречающийся в природе вариант мезотелина, такой как сплайс-вариант или аллельный вариант.
Используемые в данном документе термины «фармацевтическая композиция», «комбинированное лекарственное средство» и «комбинация лекарственных средств» используются взаимозаменяемо и означают, по меньшей мере, одно лекарственное средство и, необязательно, фармацевтически приемлемый носитель или наполнитель, которые объединяют вместе для достижения конкретной цели. В определенных воплощениях фармацевтическая композиция включает комбинацию, которая разделена во времени и/или пространстве, при условии, что она способна действовать вместе для достижения цели настоящего изобретения. Например, компоненты (например, антитела, молекулы нуклеиновых кислот, комбинации молекул нуклеиновых кислот и/или конъюгаты по изобретению), содержащиеся в фармацевтической композиции, можно вводить объекту вместе или по отдельности. Когда компоненты, содержащиеся в фармацевтической композиции, вводятся объекту по отдельности, компоненты могут вводиться объекту единовременно или последовательно. Предпочтительно, фармацевтически приемлемым носителем является вода, буферный водный раствор, изотонический солевой раствор, такой как PBS (фосфатный буфер), глюкоза, маннит, декстроза, лактоза, крахмал, стеарат магния, целлюлоза, карбонат магния, 0,3% глицерин, гиалуроновая кислота, этанол или полиалкиленгликоли, такие как полипропиленгликоль, триглицериды и тому подобное. Тип используемого фармацевтически приемлемого носителя особенно зависит от того, составлена ли композиция согласно настоящему изобретению для перорального, назального, внутрикожного, подкожного, внутримышечного или внутривенного введения. Композиция согласно настоящему изобретению может содержать смачивающий агент, эмульгатор или буферное вещество в качестве добавки.
Фармацевтическую композицию, вакцину или фармацевтический препарат по настоящему изобретению можно вводить любым подходящим путем, например пероральным, назальным, внутрикожным, подкожным, внутримышечным или внутривенным введением.
Используемый в данном документе термин «терапевтический агент» относится к любому веществу или объекту, которые могут оказывать терапевтический эффект (например, лечение, профилактика, улучшение или ингибирование любого заболевания и/или расстройства), включает, без ограничения указанным: химиотерапевтические агенты, радиотерапевтические агенты иммунотерапевтические агенты, термотерапевтические агенты и тому подобное.
Используемый в данном документе термин «область CDR» или «CDR» относится к гипервариабельной области тяжелой цепи и легкой цепи иммуноглобулина, как определено Kabat et al. (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991, и более поздние версии). Существует три CDR тяжелой цепи и три CDR легкой цепи. Термин CDR или CDRs, при использовании в данном документе, используется для обозначения одной из этих областей или нескольких или даже всех этих областей, которые содержат большинство аминокислотных остатков, ответственных за связывание с помощью аффинности антитела с антигеном или его распознаваемым эпитопом.
Для целей настоящего изобретения «единообразие», «идентичность» или «сходство» между двумя последовательностями нуклеиновой кислоты или аминокислоты относится к проценту идентичных нуклеотидов или идентичных аминокислотных остатков между двумя сравниваемыми последовательностями, который получается после оптимального выравнивание, где процент является чисто статистическим, а различия между двумя последовательностями распределены случайным образом и охватывают их полную длину. Сравнение последовательностей между двумя нуклеотидными или аминокислотными последовательностями обычно выполняется путем сравнения последовательностей после того, как они были оптимально выровнены, и сравнение может быть выполнено по сегментам или «окну сравнения». В дополнение к выполнению вручную, оптимальное выравнивание для сравнения последовательностей также может быть выполнено с помощью алгоритма локальной гомологии Smith и Waterman (1981) [Ad. App. Math. 2: 482], по алгоритму локальной гомологии Neddleman и Wunsch (1970). [J. Mol. Biol. 48: 443], методом поиска сходства Pearson и Lipman (1988) [Proc. Natl. Acad. Sci. USA 85: 2444), или с помощью компьютерного программного обеспечения (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI, или с помощью программного обеспечения сравнения BLAST N или BLAST P) с использованием этих алгоритмов.
Используемый в данном документе термин «терапевтически эффективное количество» или «эффективное количество» относится к дозе, достаточной для демонстрации ее пользы для объекта, которому его вводят. Фактическое введенное количество, а также скорость и время введения будут зависеть от состояния и тяжести объекта, подлежащего лечению. Рецепт лечения (например, определение дозы и т. д.) в конечном счете является обязанностью врача общей практики и других врачей и зависит от их решения, обычно с учетом заболевания, которое лечат, состояния отдельного пациента, места рождения, способ введения и других известных факторов.
Используемый в данном документе термин «объект» относится к млекопитающему, такому как человек, но также может представлять собой других животных, таких как дикое животное (такое как цапля, аист, журавль и т.д.), домашний скот (такой как утка, гусь и т.д.) или экспериментальное животное (такое как орангутан, обезьяна, крыса, мышь, кролик, морская свинка, сурок, суслик и т. д.).
Используемый в данном документе термин «антитело» используется в его самом широком смысле и охватывает множество структур антител, включая, в частности, моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифичные антитела) и, в частности, фрагменты антител, «антитело» в контексте настоящего описания относится к белку, содержащему, по меньшей мере, две тяжелые (Н) цепи и две легкие (L) цепи, связанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно VH) и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена (СН1, СН2 и СН3). Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL). Области VH и VL также могут быть подразделены на множество областей с высокой вариабельностью, которые называются областями, определяющими комплементарность (CDR), с вкраплениями более консервативных областей, называемых каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Эти вариабельные области тяжелых цепей и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Константная область антитела опосредует связывание иммуноглобулина с тканью или фактором хозяина, включая различные клетки иммунной системы (такие как эффекторные клетки) и первый компонент (Clq) классической системы комплемента. Химерные или гуманизированные антитела также включены в антитела согласно настоящему изобретению.
Термин «гуманизированное антитело» относится к антителу, содержащему область CDR, полученную из нечеловеческого антитела, а другая часть молекулы антитела получена из одного (или нескольких) антител человека. Кроме того, чтобы сохранить аффинность связывания, некоторые остатки каркасной области (именуемой FR) могут быть модифицированы (Jones et al., Nature, 321: 522-525, 1986; Verhoeyen et al., Science, 239: 1534-1536, 1988; Riechmann et al., Nature, 332: 323-327, 1988). Гуманизированное антитело или его фрагменты в соответствии с настоящим изобретением могут быть получены способами, известными специалистам в данной области (например, как описано в следующих документах: Singer et al., J. Immun. 150: 2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10: 1-142, 1992; или Bebbington et al., Bio/Technology, 10: 169-175, 1992).
Термин «химерное антитело» относится к антителу, в котором его последовательность вариабельной области принадлежит одному виду, а последовательность константной области принадлежит другому виду, например, последовательность вариабельной области получена из антитела мыши, а последовательность константной области получена из человеческого антитела. Химерное антитело или его фрагмент в соответствии с настоящим изобретением могут быть получены с использованием методов генетической рекомбинации. Например, химерное антитело может быть получено путем клонирования рекомбинантной ДНК, содержащей промотор, последовательность, кодирующую вариабельную область нечеловеческого, в частности мышиного, моноклонального антитела в соответствии с настоящим изобретением, и последовательность, кодирующую константную область антитела человека. Химерное антитело по настоящему изобретению, кодируемое таким рекомбинантным геном, может представлять собой, например, химеру мыши-человека, специфичность которой определяется вариабельной областью, происходящей из мышиной ДНК, а изотип которой определяется константой областью, полученной из ДНК человека. Способы получения химерных антител могут ссылаться, например, на документ Verhoeyn et al. (BioEssays, 8: 74, 1988).
Термин «моноклональное антитело» относится к препарату молекулы антитела с одним молекулярным составом. Композиция моноклональных антител проявляет специфичность связывания и аффинность к конкретному эпитопу.
Используемый в данном документе термин «функциональный фрагмент» относится к фрагменту антитела, состоящему или включающему частичную последовательность тяжелой или легкой вариабельной цепи антитела, из которого оно получено, частичная последовательность является достаточной для сохранения той же специфичности связывания и достаточной аффинности как у антитела, из которого функциональный фрагмент получен; предпочтительно демонстрирует аффинность, по меньшей мере, равную 1/100 от аффинности антитела, из которого оно получено; и более предпочтительно, по меньшей мере, равную 1/10. Такой функциональный фрагмент содержит минимум 5 аминокислот, предпочтительно 10, 15, 25, 50 и 100 последовательных аминокислот последовательности антитела, из которой он получен.
Используемый в данном документе термин «DAR» относится к соотношению лекарственное средство-антитело в конъюгате антитело-лекарственное средство, которое представляет собой среднее число молекул лекарственного средства, конъюгированных с одним антителом. Предпочтительно конъюгаты антитело-лекарственное средство по настоящему изобретению имеют значение DAR от около 2 до около 6, например, около 2, 2,5, 3, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4 , 4,5, 5, 5,5, 6 или любой интервал между ними.
В общем, для получения моноклонального антитела или его функционального фрагмента, особенно мышиного моноклонального антитела или его функциональных фрагментов, можно обратиться к методам, конкретно описанным в руководстве «Антитела» (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988) или методам получения из клеток гибридомы, как описано Kohler и Milstein (Nature, 256: 495-497, 1975).
Моноклональное антитело или конъюгат антитело-лекарственное средство по настоящему изобретению могут быть очищены, например, могут быть очищены на аффинной колонке, в которой антиген MSLN или один из его фрагментов, содержащих эпитоп, специфически распознаваемый антителом в соответствии с настоящим изобретением, заранее иммобилизованы на аффинной колонке. Более конкретно, моноклональное антитело может быть очищено хроматографией на белке A и/или G, связанной с ионообменной хроматографией или без нее с целью удаления остаточных белковых загрязнений и ДНК и LPS, и связанной с эксклюзионной хроматографией или без нее на сефарозных гелях для устранения потенциальных агрегатов из-за присутствия димеров или других мультимеров. В более предпочтительных воплощениях все эти методы могут использоваться одновременно или последовательно.
Используемый в данном документе термин «доластатин» относится к полипептиду, выделенному из морского организма, Dollabella auricularia, включая, без ограничения указанным, доластатин 10 и доластатин 15. Пептиды доластатина являются ингибиторами митоза, которые проявляют сильную противоопухолевую активность и, следовательно, являются кандидатами на противоопухолевые лекарственные средства. Исследователи также обнаружили и синтезировали ряд производных доластатиновых пептидов, такие как MMAE и MMAF.
Используемый в данном документе термин «линкер» относится к части конъюгата антитело-лекарственное средство (то есть ADC), которая связывает антитело с лекарственным средством, и он может быть расщепляемым или нерасщепляемым. Расщепляемый линкер (то есть линкер, который может расщепляться, или линкер, который может быть биодеградирован) может расщепляться внутри или на клетке-мишени для высвобождения лекарственного средства. В некоторых воплощениях линкер по изобретению обладает очень хорошей стабильностью, значительно уменьшая высвобождение лекарственного средства во время доставки (например, в кровь) к цели, тем самым уменьшая побочные эффекты и токсичность. В некоторых конкретных воплощениях линкер по настоящему изобретению выбран из расщепляемого линкера, такого как линкер на основе дисульфида (который селективно расщепляет опухолевую клетку с более высокой концентрацией сульфгидрильной группы), пептидный линкер (который расщепляется посредством фермент в опухолевой клетке), гидразоновый линкер. В других конкретных воплощениях линкер по настоящему изобретению выбран из нерасщепляемых линкеров (то есть линкеров, которые не могут расщепляться), такого как тиоэфирный линкер. В других воплощениях линкер по настоящему изобретению представляет собой комбинацию расщепляемого линкера и нерасщепляемого линкера. Предпочтительно, линкер по настоящему изобретению выбран из группы, состоящей из Mc-Val-Cit-PAB и Py-MAA-Val-Cit-PAB.
Анти-MSLN антитело
Антитело в конъюгате антитело-лекарственное средство по изобретению характеризуется специфическим связыванием с MSLN человека. Предпочтительно, антитело связывается с MSLN с высокой аффинностью, например, с KD 1 × 10-7 М или менее. Антитело против MSLN предпочтительно проявляет одну или несколько из следующих характеристик:
(а) связывание с MSLN человека при KD 1 × 10-7 М или менее (например, 5 × 10-8 М или менее, 2 × 10-8 М или менее, 5 × 10-9 М или менее , 4 × 10-9 М или менее, 3 × 10-9 М или менее, 2 × 10-9 М или менее);
(b) связывание с клеткой Oval-Citar-3 с высокой экспрессией MSLN, например, при ЕС50 2000 нг/мл или менее (например, 1000 нг/мл или менее, 500 нг/мл или менее, 400 нг/мл или менее, 300 нг/мл или менее, 250 нг/мл или менее, 200 нг/мл или менее, 150 нг/мл или менее, 100 нг/мл или менее, 50 нг/мл или менее, 40 нг/мл или менее, 30 нг/мл или менее, 20 нг/мл или менее, 10 нг/мл или менее, 5 нг/мл или менее), предпочтительно EC50 определяют с использованием способа проточной цитометрии или способа ELISA; и
(c) ингибирование роста in vivo клетки, которая экспрессирует MSLN.
Моноклональное антитело RC88
Антитело, предпочтительно используемое в конъюгате антитело-лекарственное средство по настоящему изобретению, представляет собой человеческое моноклональное антитело RC88. Аминокислотные последовательности VH и VL RC88 показаны в SEQ ID NO: 7 и 8, соответственно.
В другом аспекте антитело по изобретению может содержать CDR1 CDR2 и CDR3 тяжелой цепи и легкой цепи RC88 или их комбинацию. Аминокислотные последовательности VHCDR1, VHCDR2 и VHCDR3 из RC88 показаны в SEQ ID NO: 1-3, соответственно. Аминокислотные последовательности VLCDR1, VLCDR2 и VLCDR3 RC88 показаны в SEQ ID NO: 4-6, соответственно. Области CDR описаны с использованием системы Kabat (Kabat, E.A., et al., (1991). Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication NO: 91-3242; именуемой в дальнейшем «Kabat'3242»).
Примеры
Ниже приведены примеры способов и композиций по настоящему изобретению. Следует понимать, что в свете вышеприведенных определений и общих описаний могут быть реализованы различные другие воплощения.
Пример 1: Анти-мезотелин антитело
Иммунизированных животных получали с использованием стандартных способов получения антител против мезотелина по настоящему изобретению, и источниками способов являются, например, Kohler & Milstein, (1975) Nature 256: 495-497, Kozbor et al. (1983) Immunol. Today 4: 72, и Cole, et al. в MONOCLONAL ANTIBODIES AND CANCER THERAPY, Alan R. Liss, Inc., 1985, pp. 77-96.
Мезотелин отделяли от клеток и очищали известными методами и использовали в качестве иммуногена для иммунизации животных, и источниками способов являются, например, Zola, MONOCLONAL ANTIBODIES: PREPARATION AND USE OF MONOCLONAL ANTIBODIES AND ENGINEERED ANTIBODY DERIVATIVES (BASICS: FROM BACKGROUND TO BENCH) Springer-Verlag Ltd., New York, 2000; BASIC METHODS IN ANTIBODY PRODUCTION AND CHARACTERIZATION, Chapter 11, "Antibody Purification Methods," Howard and Bethell, Eds., CRC Press, 2000; ANTIBODY ENGINEERING (SPRINGER LAB MANUAL.), Kontermann and Dubel, Eds., Springer- Verlag, 2001.
У иммунизированных животных забирали спленоциты и сливали с клеточной линией миеломы для получения гибридом. Затем путем скрининга получали анти-MSLN антитело с высокой аффинностью связывания.
Мышиные моноклональные анти-MSLN антитела были гуманизированы путем трансплантации CDR легкой или тяжелой цепи в каркасные области человеческого IgG1 или тяжелой цепи. CDR легкой и тяжелой цепей мышиного антитела против MSLN определяли с использованием системы Kabat. Путем выравнивания базы данных вариабельной области антитела, мы идентифицировали каркасную область человеческого IgG1 с высокой гомологией с мышиным анти-MSLN антителом. Таким образом, мы разработали различные последовательности вариабельной области легкой цепи гуманизированного анти-MSLN антитела и различные последовательности вариабельной области тяжелой цепи гуманизированного анти-MSLN антитела. В соответствии с этой конструкцией мы синтезировали последовательности вариабельной области гуманизированных тяжелой и легкой цепей и объединили с помощью ПЦР вариабельную область легкой цепи гуманизированного анти-MSLN антитела с константной областью каппа человека для того, чтобы получить полноразмерную гуманизированную легкую цепь MSLN; и мы объединили с помощью ПЦР гуманизированную вариабельную область тяжелой цепи MSLN с константной областью IgG, чтобы получить полноразмерную гуманизированную тяжелую цепь MSLN. Различные легкие и тяжелые цепи объединяли и экспрессировали, и очищенные гуманизированные антитела сравнивали с помощью ELISA с химерным антителом человека-мыши с точки зрения аффинности связывания, и получали скринингом гуманизированное антитело-кандидат (обозначенное как антитело RC88).
Таблица 3 ниже показывает аминокислотные последовательности CDR легкой и тяжелой цепей антитела RC88.
Таблица 3 Аминокислотные последовательности тяжелых и легких цепей антитела RC88
Аминокислотная последовательность вариабельной области тяжелой цепи антитела RC88 (SEQ ID NO: 7):

Аминокислотная последовательность вариабельной области легкой цепи антитела RC88 (SEQ ID NO: 8):

Аминокислотные последовательности легкой и тяжелой цепей антитела RC88 представлены в последовательности 9 (SEQ ID NO: 9) и последовательности 10 (SEQ ID NO: 10).
Пример 2: Получение конъюгата антитело-лекарственное средство (ADC)
Пример 2а. Приготовление конъюгата линкер-лекарственное средство.
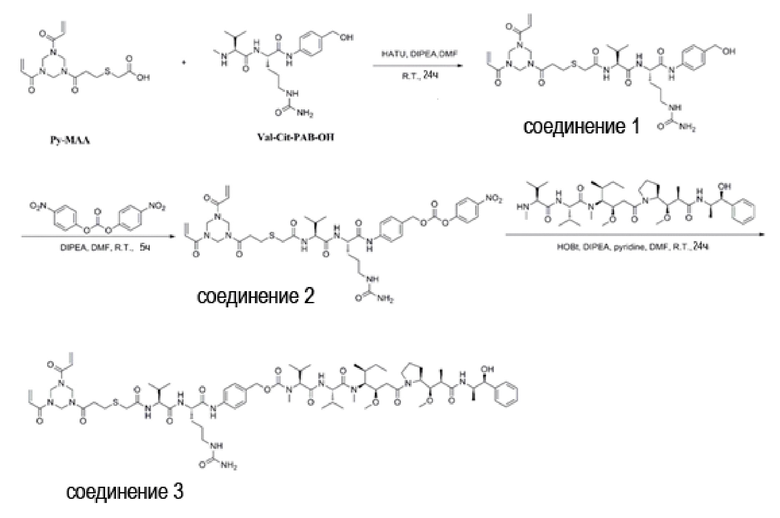
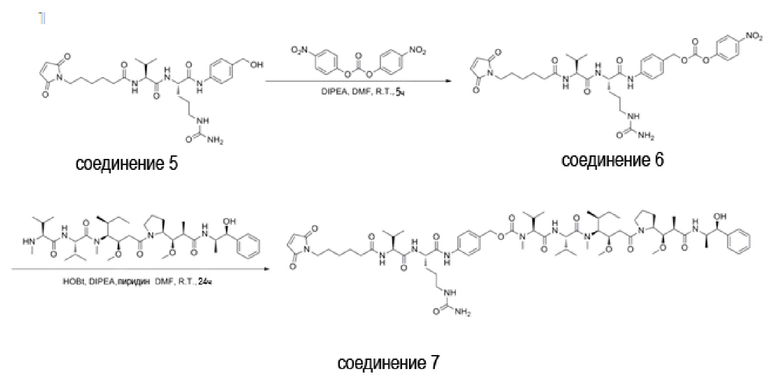
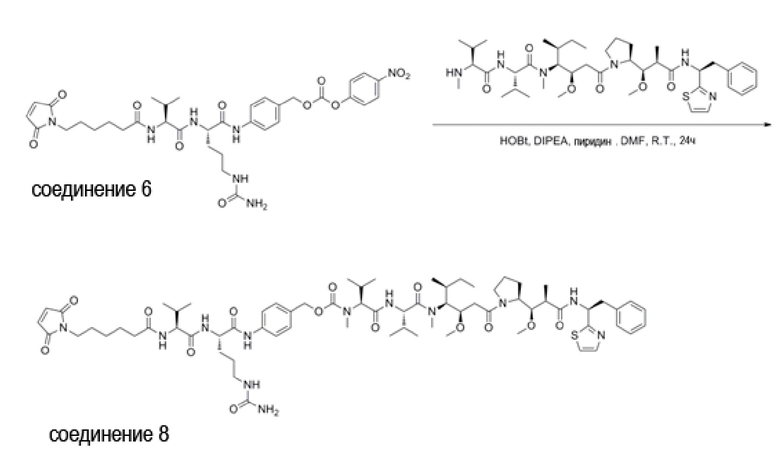
(1) Синтез Соединения 1 (Py-MAA-Val-Cit-PAB-OH)
Соединение Py-MAA (1,3,5-триакрилоилгексагидро-1,3,5-триазин-меркаптоуксусная кислота, 10,00 г, 29,3 ммоль) растворяли в DMF (200 мл), добавляли HATU (16,73 г, 44,0 ммоль) Val-Cit-PAB-OH (9,20 г, 23,4 ммоль), DIPEA (15,32 мл, 87,9 ммоль) и перемешивали при комнатной температуре в течение 24 часов, и ход реакции контролировали с помощью ТСХ. После завершения реакции растворитель выпаривали на роторном испарителе при пониженном давлении, и неочищенный продукт очищали препаративной высокоэффективной жидкостной хроматографией, и полученный раствор выпаривали на роторном испарителе при пониженном давлении, получая соединение 1 (6,67 г, 32,4%, белый твердый порошок).
(2) Синтез Соединения 2 (Py-MAA-Val-Cit-PAB-PNP)
Соединение 1 (7,02 г, 10,0 ммоль) растворяли в DMF (200 мл) и добавляли NPC (бис(п-нитрофенил) карбонат, 4,56 г, 15,0 ммоль) и DIPEA (2,09 мл, 12 ммоль); Реакцию проводили в течение 5 часов при комнатной температуре, и за ходом реакции следили с помощью ТСХ. После завершения реакции реакционную смесь выливали в петролейный эфир (1500 мл), перемешивали, фильтровали и полученный осадок на фильтре промывали петролейным эфиром (150 мл × 3) и сушили аспирацией, получая не совсем белый твердый порошок (6,57 г, 75,7%).
(3) Синтез Соединения 3 (Py-MAA-Val-Cit-PAB-MMAE)
Соединение 2 (1,74 г, 2,2 ммоль) растворяли в 20 мл DMF и добавляли MMAE (1,44 г, 2,0 ммоль), HOBt (0,27 г, 2,0 ммоль), DIPEA (0,70 мл, 4,0 ммоль) и пиридин (4 мл) под защитой газообразного азота. При перемешивании при комнатной температуре в течение 24 часов за ходом реакции следили с помощью ТСХ. После завершения реакции очистку осуществляли препаративной высокоэффективной хроматографией и полученный раствор выпаривали на роторном испарителе при пониженном давлении, получая Соединение 3 (белый твердый порошок, 1,35 г, 46,7%). ЖХ-МС m/z (ES +), 1446,35 (М+Н)+, ИК (3334,32 см-1, 2965,9 см-1, 1652,70 см-1, 1538,92 см-1, 1436,71 см-1).
(4) Синтез Cоединения 4 (Py-MAA-Val-Cit-PAB-MMAD)
Соединение 2 (0,87 г, 1,1 ммоль) растворяли в 10 мл DMF и добавляли MMAD (0,77 г, 1,0 ммоль), HOBt (0,14 г, 1,0 ммоль), DIPEA (0,35 мл, 2,0 ммоль) и пиридин (2 мл) под защитой газообразного азота. При перемешивании при комнатной температуре в течение 24 часов за ходом реакции следили с помощью ТСХ. После завершения реакции очистку проводили препаративной высокоэффективной хроматографией и полученный раствор выпаривали на роторном испарителе при пониженном давлении, получая Соединение 4 (белый твердый порошок, 0,65 г, 43,5%). ЖХ-МС m/z (ES +), 1499,76 (M+H)+.
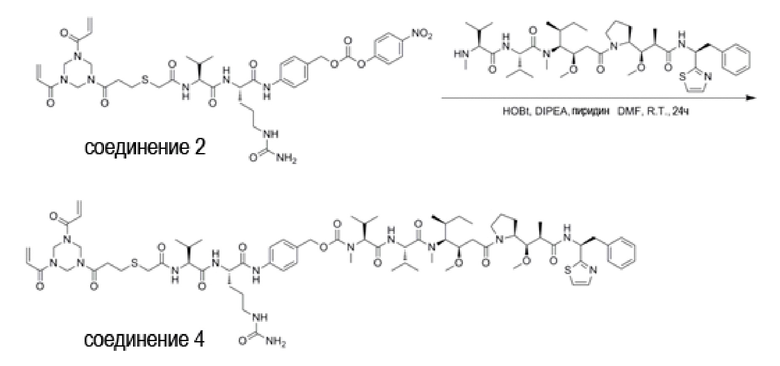
(5) Синтез Соединения 6 (Mc-Val-Cit-PAB-PNP)
Соединение 5 (Mc-Val-Cit-PAB, 4,58 г, 8,0 ммоль) растворяли в DMF (100 мл), добавляли NPC (бис(п-нитрофенил) карбонат, 3,65 г, 12,0 ммоль) и DIPEA (1,70 мл, 9,6 ммоль), прореагировали в течение 5 часов при комнатной температуре, и ход реакции контролировали с помощью ТСХ. После завершения реакции реакционную смесь выливали в петролейный эфир (1000 мл), перемешивали и фильтровали, и полученный осадок на фильтре промывали петролейным эфиром (60 мл × 3) и сушили аспирацией, получая не совсем белый твердый порошок (5,04 г, 85,2%).
(6) Синтез Соединения 7 (Mc-Val-Cit-PAB-MMAE)
Соединение 6 (1,19 г, 1,6 ммоль) растворяли в 12 мл DMF и добавляли MMAE (1,08 г, 1,5 ммоль), HOBt (0,21 г, 1,5 ммоль), DIPEA (0,55 мл, 3,0 ммоль) и пиридин (2,5 мл) под защитой газообразного азота. При перемешивании при комнатной температуре в течение 24 часов за ходом реакции следили с помощью ТСХ. После завершения реакции очистку проводили препаративной высокоэффективной хроматографией и полученный раствор выпаривали на роторном испарителе при пониженном давлении, получая Соединение 7 (белый твердый порошок, 0,891 г, 45,1%). LC-MS m/z (ES+), 1316.18 (M+H)+.
(7) Синтез Соединения 8 (Mc-Val-Cit-PAB-MMAD)
Соединение 6 (0,74 г, 1,1 ммоль) растворяли в 10 мл DMF и добавляли MMAD (0,77 г, 1,0 ммоль), HOBt (0,14 г, 1,0 ммоль), DIPEA (0,35 мл, 2,0 ммоль) и пиридин (2 мл) под защитой газообразного азота. При перемешивании при комнатной температуре в течение 24 часов за ходом реакции следили с помощью ТСХ. После завершения реакции очистку осуществляли препаративной высокоэффективной хроматографией и полученный раствор выпаривали на роторном испарителе при пониженном давлении, получая Соединение 8 (белый твердый порошок, 0,59 г, 42,8%). LC-MS m/z (ES+), 1369.38 (M+H)+.
Пример 2b: Получение конъюгатов антитело-лекарственное средство
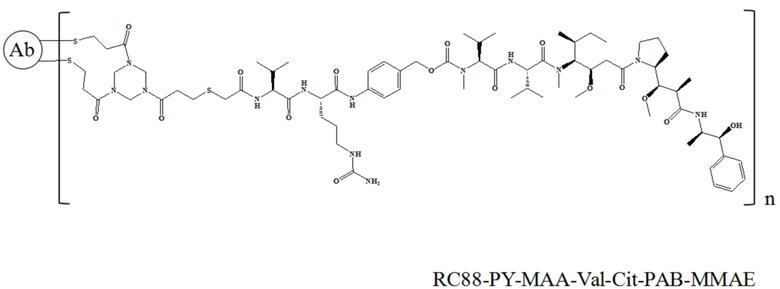
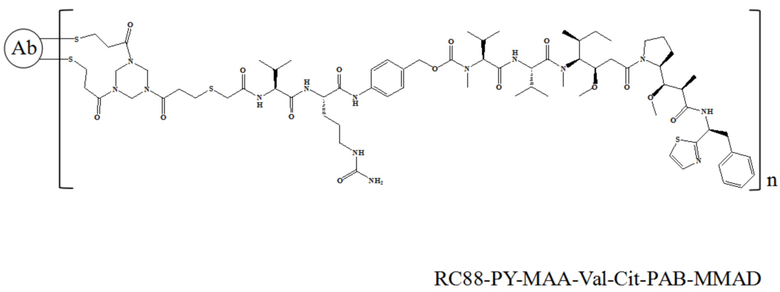
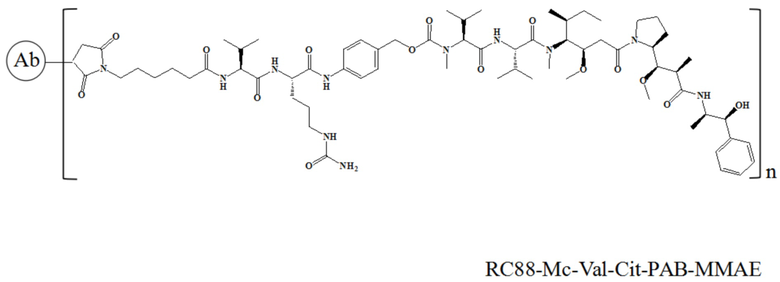
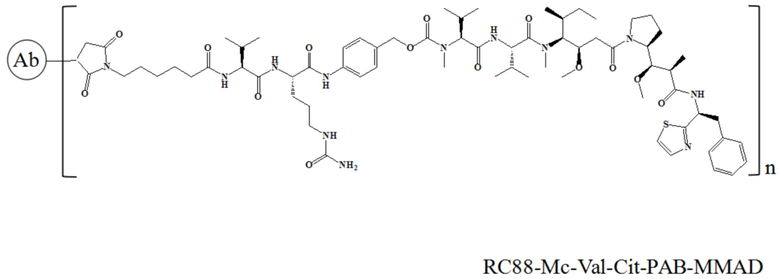
10 мг/мл антитела к RC88, 10 ммоль/л DTPA (диэтилентриаминпентацетатная кислота) и 5 кратных молярных количеств 5 ммоль/л TCEP (трис-2-карбоксиэтилфосфин) добавляли в пробирку для ПЦР, перемешивали при 25°C в течение 2 часов, затем добавляли при 0°C 25% DMSO (диметилсульфоксид) и 5 кратных молярных количеств 5 ммоль/л лекарственного средства (соединение 3, 4, 7 или 8), перемешивали при 25°C в течение 10 часов. После завершения реакции проводили ультрафильтрацию центрифугированием в буфере PBS 3 раза для очистки и удаления остаточного непрореагировавшего лекарственного средства и свободных малых молекул, таких как DMSO, и детектировали связывание с помощью электрофореза в SDS-PAGE и гидрофобной высокоэффективной жидкостной хроматографии (HIC-HPLC). RC88-PY-MAA-Val-Cit-PAB-MMAE и RC88-Mc-Val-Cit-PAB-MMAE характеризовали с помощью SDS-PAGE в восстанавливающих условиях, и в этом эксперименте использовался предварительно приготовленный гель Novex NuPAGE и общий объем для каждого образца составлял 10 мкл, а результаты представлены на Фигуре 1. Для RC88-PY-MAA-Val-Cit-PAB-MMAE, поскольку его мостиковый линкер снова связывает восстановленные дисульфидные связи с ковалентными связями, были разные полосы, среди которых 150 кДа представляла собой интактное антитело (LHHL), 125 кДа представляла собой антитело, у которого одна легкая цепь не связана (LHH), 100 кДа представляла собой антитело, у которого две тяжелые цепи были связаны (HH), 75 кДа представляла собой антитело, у которого одна легкая цепь и одна тяжелая цепь были связаны (LH), 50 кДа и 25 кДа были тяжелой и легкой цепями, соответственно. Для RC88-Mc-Val-Cit-PAB-MMAE у которого не было мостикового линкера, дисульфидную связь восстанавливали до двух сульфгидрильных групп и затем связывали с двумя линкер-токсинами соответственно, так что SDS-PAGE в восстанавливающих условиях показал только два полосы 50 кДа и 25 кДа. Сопряжение RC88-PY-MAA-Val-Cit-PAB-MMAE и RC88-Mc-Val-Cit-PAB-MMAE было обнаружено с помощью гидрофобной высокоэффективной жидкостной хроматографии (HIC-HPLC), результаты представлены на Фигуре 2А и Фигуре 2B, причем результаты показали, что значения DAR были равны 3,95 (RC88-PY-MAA-Val-Cit-PAB-MMAE) и 3,9 (RC88-Mc-Val-Cit-PAB-MMAE), соответственно.
Пример 3: Конструирование клеток Oval-Citar-3 с высокой экспрессией MSLN
Клетки Oval-Citar-3 (ATCC) с хорошим ростом инокулировали в 6-луночные планшеты при 3 × 105/лунку; после адгезии в течение ночи исходную среду отбрасывали и добавляли 400 мкл свежей среды, содержащей 10 мкг/мл полибрена (Sigma), и в промежуток времени добавляли 600 мкл лентивирусного вектора (pRRL-cmv), содержащего кодирующую последовательность MSLN человека в подходящей концентрации; после хорошего перемешивания культивирование продолжали в течение 24 часов. После окончания культивирования проводили замену свежей средой и размножение культуры, и с помощью проточного цитометра отбирали положительные клетки. Отобранные положительные клетки использовали для размножения культуры, экспрессию MSLN анализировали с помощью проточного цитометра, а клетки с самой высокой экспрессией MSLN (далее называемые Oval-Citar-3-MSLN) отбирали для последующих экспериментов.
Пример 4. Обнаружение цитотоксической активности антитела RC88 и конъюгата антитело-лекарственное средство RC88 и соответствующего линкера-лекарственного средства и лекарственного средства.
Клетки Oval-Citar-3-MSLN в хорошей стадии роста добавляли в 96-луночные планшеты для культивирования клеток (5 × 104 клеток/мл, 100 мкл/лунку) и инкубировали в течение ночи при 37°C в CO2-инкубаторе. Антитело RC88, конъюгаты антитело-лекарственное средство RC88 (RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Mc-Val-Cit-PAB-MMAE, RC88- Mc-Val-Cit-PAB-MMAD) и соответствующие конъюгаты линкер-лекарственное средство (Py-Val-Cit-PAB-MMAE, Py-Val-Cit-PAB-MMAD, Mc-Val-Cit-PAB-MMAE, Mc- Val-Cit-PAB-MMAD), лекарственные средства (MMAE, MMAD), PTX (паклитаксел) разводили полной средой в следующих концентрациях: для антитела RC88, конъюгатов антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB -MMAE, RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD), конечные концентрации составляли 0,32, 1,6 8, 16, 32, 64, 128, 640, 3200 нг/мл; для конъюгатов линкер-лекарственное средство (Py-Val-Cit-PAB-MMAE, Py-Val-Cit-PAB-MMAD, Mc-Val-Cit-PAB-MMAE, Mc-Val-Cit-PAB-MMAD), конечные концентрации составляли: 0,4, 2, 10, 20, 40, 80, 160, 800, 4000 нг/мл; для лекарственных средств (MMAE, MMAD) конечные концентрации составляли: 0,0016, 0,008, 0,04, 0,2, 0,4, 0,8, 1,6, 8, 40 нг/мл; для PTX (паклитаксел) конечные концентрации составляли: 0,004, 0,02, 0,098, 0,3, 0,89, 2,67, 8, 40, 200 нг/мл. После разбавления их добавляли в 96-луночные планшеты (100 мкл/лунку) и создавали пустую группу (равный объем среды без лекарственного средства) и три контрольные группы, после чего проводили инкубацию в CO2-инкубаторе с постоянной температурой при 37°C на 72 часа. Добавляли среду (без FBS), которая содержала 10 мкл CCK-8 в дозе 100 мкл/лунку, инкубировали при 37°C в течение от 2 до 4 часов в CO2-инкубаторе, и значения OD при 450 нм считывали с помощью устройства для считывания микропланшетов. Степень ингибирования рассчитывали по следующей формуле: IR% = (OD пустого контроля – OD лекарственного средства) × 100/OD пустого контроля. С использованием программного обеспечения Prism скорость ингибирования принималась как значение y, концентрация лекарственного средства использовалась как значение x, и выполнялась подгонка кривой с четырьмя параметрами; записывали значение концентрации лекарственного средства, соответствующее значению между максимальной скоростью ингибирования и минимальной скоростью ингибирования (значение IC50 было установлено по умолчанию программным обеспечением), результаты представлены на Фигуре 3 и в Таблице 4. Результаты показали, что RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Mc-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val- Cit-PAB-MMAE были эффективными при ингибировании роста Oval-Citar-3-MSLN.
Таблица 4: Результаты значений IC50 цитотоксичности, максимальных уровней ингибирования для антитела RC88, конъюгатов антитело RC88-лекарственное средство, соответствующих конъюгатов линкер-лекарственное средство и лекарственных средств (N = 3)
Пример 5. Противоопухолевый эксперимент с антителом RC88 и конъюгатами антитело RC88-лекарственное средство на модели мышей, несущих клетки рака яичника человека Oval-Citar-3 с высокой экспрессией MSLN
Клетки Oval-Citar-3-MSLN (2 × 106) в хорошем состоянии роста подкожно инокулировали голым мышам (Changzhou Cavans Laboratory Animal Co., Ltd., номер сертификата: 201611240, номер лицензии: SCXK (Su) 2011-0003) и животных рандомизировали после того, как объем опухоли вырастал до приблизительно 100-400 мм3. Антитело RC88 (2 мг/кг), конъюгаты антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit- PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD, 2 мг/кг) и MMAE (0,0716 мг/кг) вводили, соответственно, один раз в неделю, всего 3 раза, а группе отрицательного контроля вводили соответственно равный объем физиологического раствора в то же время. Результаты показаны на Фигурах 4, 5 и 6.
Результаты показали, что антитело RC88 и конъюгаты антитело RC88-лекарственное средство не влияют на прирост массы тела у мышей с опухолями; конъюгаты антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAD, RC88-Py-MAA-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAE, RC88-Mc-Val-Cit-PAB-MMAD (2 мг/кг) все показали значительное ингибирование ксенотрансплантата у мышей с опухолями, тогда как антитело RC88 не показало значительного противоопухолевого эффекта.
Пример 6. Противоопухолевый эксперимент с конъюгатами антитело RC88-лекарственное средство на модели мышей, несущих клетки рака яичника человека Oval-Citar-3 с высокой экспрессией MSLN
Клетки Oval-Citar-3-MSLN (2 × 106) в нормальном состоянии роста инокулировали подкожно мышам голых мышей (Changzhou Cavans Laboratory Animal Co., Ltd., номер сертификата: 201611240, номер лицензии: SCXK (Su) 2011-0003) и животных рандомизировали после того, как объем опухоли вырастал до приблизительно 100-400 мм3. Антитело RC88 (3 мг/кг), конъюгат антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE, 3 мг/кг, 1,5 мг/кг, 0,75 мг/кг), MMAE (0,06 мг/кг), антитело RC88 (3 мг/кг) + MMAE (0,06 мг/кг), сывороточный IgG человека - MMAE (3 мг/кг), PTX (паклитаксел) (10 мг/кг) вводили, соответственно, один раз в неделю, всего 3 раза (PTX вводили два раза в неделю, всего 6 раз), и группе отрицательного контроля вводили одинаковое количество физиологического раствора в одно и то же время. Результаты показаны на Фигурах 7, 8 и 9. Результаты показали, что для конъюгата антитело RC88-лекарственное средство у мышей с опухолями в группе 3 мг/кг и в группе 1,5 мг/кг наблюдалось значительное уменьшение опухоли через 7 дней после первого введения, в группе 3 мг/кг не выявили видимой опухоли после 10 дней введения, группа 1,5 мг/кг не показала видимой опухоли после 17 дней введения, а группа 0,75 мг/кг показала, что рост опухоли все еще был относительно быстрым после 3 раз введения, и не было статистической разницы в объеме опухоли после 21 дня введения по сравнению с контрольной (физиологический раствор) группой (P> 0,05) и T/C> 40%. Для группы паклитаксела (PTX) после 21 дня введения опухоли были полностью устранены (CR) у двух мышей с опухолями, и объем опухоли и RTV статистически отличались от контрольной (физиологический раствор) группы (P <0,05), и Т/С <40%. Не было статистической разницы между группой паклитаксела (PTX) и группой 3 мг/кг и группой 1,5 мг/кг конъюгата антитела RC88-лекарственного средства. Не было значительных различий между группой антитела RC88, группой MMAE, группой антитела RC88 + MMAE, группой IgG-MMAE и контрольной группой (физиологический раствор) (P> 0,05).
Пример 7. Обнаружение аффинности антитела RC88 и конъюгата антитела RC88-лекарственного средства к опухолевым клеткам, положительным по MSLN.
Проточный цитометр использовали для определения аффинности антитела RC88 и конъюгата антитела RC88-лекарственного средства (RC88-Py-MAA-Val-Cit-PAB-MMAE) к опухолевым клеткам, положительным по MSLN. Клетки Oval-Citar-3-MSLN в логарифмическая фазе роста центрифугировали в 1,5 мл EP-пробирках (4 × 105 на группу) при 1500 об/мин в течение 5 минут и тщательно промывали PBS, и отбрасывали фракцию надосадочной жидкости; клетки ресуспендировали в параформальдегиде (200 мкл, 4%), фиксировали при 25°С в течение 15 минут, один раз промывали PBS, центрифугировали при 2500 об/мин в течение 3 минут и фракцию надосадочной жидкости отбрасывали; антитело RC88 и конъюгат антитело RC88-лекарственное средство разводили холодным 1% буфером BSA-PBS (бычий сывороточный альбумин-PBS) в 3-кратных градиентах от 10000 нг/мл до 1,52 нг/мл и 200 мкл раствора при каждой концентрации использовали для ресуспендирования клеток. Клетки пустой контрольной группы непосредственно ресуспендировали в холодном 1% BSA-PBS, а клетки группы отрицательного контроля ресуспендировали в 5 мкг/мл hIgG (Zhongke Chenyu), приготовленного с 1% BSA. Инкубацию проводили при 4°С в течение 30 минут, и перемешивание вверх дном выполняли один раз каждые 10 минут для равномерной инкубации клеток; после инкубации клетки промывали один раз холодным PBS, центрифугировали при 2500 об/мин в течение 3 минут при 4°C и надосадочную жидкость отбрасывали; 200 мкл FITC (флуоресцеин-изотиоцианат) меченого козьего анти-человеческого IgG Fcγ (Jackson ImmunoResearch) 1: 200, разведенного холодным PBS, добавляли в каждую пробирку, инкубировали при 4°C в течение 30 минут и проводили перемешивание в обратном порядке один раз каждые 10 минут для равномерного инкубирования клеток. В конце инкубации клетки промывали один раз холодным PBS, центрифугировали при 2500 об/мин в течение 5 минут при 4°C, надосадочную жидкость отбрасывали; клетки ресуспендировали в 400 мкл PBS, переносили в проточный цитометр (BD Calibur) для обнаружения, результаты представлены на Фигуре 10. Результаты показали, что как антитело RC88, так и конъюгат антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) обладали сильной аффинностью связывания с опухолевыми клетками, положительными по MSLN, со значениями EC50 153,5 нг/мл и 251,4 нг/мл, соответственно.
Пример 8: Определение активности связывания антитела RC88 и конъюгата антитело RC88-лекарственное средство с опухолевыми клетками, положительными по MSLN
Активность связывания антитела RC88 и конъюгата антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) с опухолевыми клетками, положительными по MSLN, определяли способом ELISA. Клетки Oval-Citar-3-MSLN в логарифмической фазе роста добавляли в 96-луночные планшеты для культивирования клеток (4 × 105 клеток/мл, 100 мкл/лунку), инкубировали при 37°С в течение ночи в CO2-инкубаторе, фракцию надосадочной жидкости отбрасывали и промывали планшет 3 раза 0,05% буфером PBST (250 мкл/лунку); по 100 мкл 4% параформальдегида добавляли на лунку и фиксировали в течение 30 мин при 25°C, планшет промывали 3 раза 0,05% PBST-буфером (250 мкл/лунку); в каждую лунку добавляли 250 мкл 3% BAS-PBST (бычий сывороточный альбумин-PBST), и планшет промывали 3 раза 0,05% буфером PBST (250 мкл/лунку) после инкубации при комнатной температуре в течение 2 часов; загрузка образца: 1) кривая связывания: антитело RC88 и конъюгат антитело RC88- лекарственное средство разводили в 3-х кратных градиентах от 3000 нг/мл до 0,05 нг/мл 1% буфером BAS-PBST, а затем добавляли в 96-луночный планшет (100 мкл/лунку); 2) кривая конкуренции: рекомбинантный человеческий белок MSLN (Yiqiao Shenzhou) разводили от 10000 нг/мл до 0,51 нг/мл 1% BAS-PBST, антитело RC88 и конъюгат антитело RC88-лекарственное средство разбавляли до 20 нг/мл, затем смешивали с разведением белка MSLN в равном объеме и добавляют в 96-луночный планшет в 100 мкл/лунку; после инкубации при 25°С в течение 1 часа планшет промывали 3 раза; в каждую лунку добавляли 1% разбавленный BAS-PBST HRP (меченный пероксидазой хрена) козлиное антитело против Fc IgG человека (Bethyl) (1: 2000), после инкубации при 25°C в течение 1 часа планшет промывали 3 раза; Набор для проявления цвета TMB (Kangwei Century) использовали для проявления в темноте в течение 5-10 мин, 2М серную кислоту использовали для терминации, планшет считывали с помощью устройства для считывания микропланшетов, результаты показаны на Фигуре 11. Результаты показали, что как антитело RC88, так и к конъюгаты антитело RC88-лекарственное средство прочно связываются с MSLN-положительными опухолевыми клетками; конъюгат антитело RC88-лекарственное средство показал небольшое снижение по сравнению с антителом RC88, но существенной разницы не было, и их значения EC50 составляли 11,0 ± 0,81 нг/мл и 19,7 ± 5,80 нг/мл, соответственно. Экспериментальный анализ конкурентного связывания с рекомбинантным человеческим белком MSLN продемонстрировал, что антитело RC88 и конъюгат антитело RC88-лекарственное средство специфически связывались с MSLN на поверхности клеток Oval-Citar-3-MSLN.
Пример 9. Конкурентное связывание антитела RC88 и конъюгата антитело RC88-лекарственное средство и CA125 с MSLN.
Конкурентно-связывающую способность антитела RC88 и конъюгата антитело RC88-лекарственное средство (RC88-Py-MAA-Val-Cit-PAB-MMAE) и CA125 с MSLN определяли с помощью ELISA. Планшеты для ELISA покрывали рекомбинантным белком MSLN (Yiqiao Shenzhou, 200 нг/мл). Загрузка образца: антитело RC88 и конъюгат антитело RC88-лекарственное средство разбавляли буфером 1% BAS-PBST (бычий сывороточный альбумин-PBST) для достижения 10 баллов из 20 мкг/мл (50 мкл/лунку) рекомбинантный белок CA125 (his-метка, R&D) разбавляли 1% буфером BAS-PBST до 200 нг/мл (50 мкл/лунку); общая реакционная система составляла 100 мкл/лунку, вторичное антитело (мышиное анти-his моноклональное антитело, R&D) разводили в 5000 раз, 100 мкл/лунку, использовали TMB (3,3', 5,5'-тетраметилбензидин) для развития окраски в течение 5-7 минут, затем реакцию прекращали с помощью 2 М серной кислоты, планшет считывали при 450 нм с помощью устройства для считывания микропланшетов, результаты представлены на Фигуре 12. Результаты показали, что связывание рекомбинантного белка CA125 с рекомбинантным человеческим белком MSLN снижалось с увеличением концентрации антитела RC88 и конъюгата антитело RC88-лекарственное средство, указывая на то, что антитело RC88 и конъюгат антитело RC88-лекарственное средство могут блокировать связывание рекомбинантного человеческого белка CA125 с рекомбинантным человеческим белком MSLN.
Приведенные выше описания предназначены для предпочтительных воплощений, которые являются только примерами и не ограничивают комбинацию признаков, необходимых для практического применения изобретения. Предусмотренные заголовки не предназначены для ограничения различных воплощений изобретения. Такие термины, как «включающий», «содержащий» и «охватывающий» не предназначены для ограничения. Кроме того, если не указано иное, когда отсутствует цифровое изменение включаются формы множественного числа, а слово «или» относится к «и/или». Если иное не определено в данном документе, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимают специалисты в данной области.
Все публикации и патенты, упомянутые в этой заявке, включены ссылкой. Многочисленные модификации и вариации описанных способов и композиций по настоящему изобретению будут очевидны для специалистов в данной области. Хотя изобретение было описано с помощью конкретных предпочтительных воплощений, следует понимать, что настоящее изобретение не должно быть ограничено этими воплощениями. Фактически, многие вариации описанных способов осуществления изобретения, которые очевидны для специалистов в данной области техники, предназначены для включения в объем прилагаемой формулы изобретения.
--->
Список последовательностей
<110> REMEGEN, LTD.
<120> Anti-mesothelin antibody and antibody drug conjugate thereof
<130> IEC190132
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 10
<212> PRT
<213> Artificial sequence
<400> 1
Gly Phe Asp Phe Ser Arg Tyr Trp Met Ser
1 5 10
<210> 2
<211> 17
<212> PRT
<213> Artificial sequence
<400> 2
Glu Ile Asn Pro Asp Ser Ser Thr Ile Val Tyr Thr Pro Ser Leu Lys
1 5 10 15
Asp
<210> 3
<211> 14
<212> PRT
<213> Artificial sequence
<400> 3
Arg Gly Ser His Tyr Tyr Gly Tyr Arg Thr Gly Tyr Phe Asp
1 5 10
<210> 4
<211> 10
<212> PRT
<213> Artificial sequence
<400> 4
Ser Ala Ser Ser Ser Val Ser Tyr Met Tyr
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial sequence
<400> 5
Asp Thr Ser Asn Leu Ala Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> Artificial sequence
<400> 6
Gln Gln Trp Ser Ser Tyr Pro Pro Thr
1 5
<210> 7
<211> 124
<212> PRT
<213> Artificial sequence
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Val Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ser His Tyr Tyr Gly Tyr Arg Thr Gly Tyr Phe Asp
100 105 110
Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 106
<212> PRT
<213> Artificial sequence
<400> 8
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp His Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 233
<212> PRT
<213> Artificial sequence
<400> 9
Met Val Ser Pro Leu Gln Phe Leu Arg Leu Leu Leu Leu Trp Val Pro
1 5 10 15
Ala Ser Arg Gly Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser
20 25 30
Val Thr Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
35 40 45
Val Ser Tyr Met Tyr Trp His Gln Gln Lys Pro Asp Gln Ala Pro Lys
50 55 60
Leu Leu Ile Tyr Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Arg
85 90 95
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser
100 105 110
Tyr Pro Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 10
<211> 473
<212> PRT
<213> Artificial sequence
<400> 10
Met Glu Phe Gly Leu Ser Trp Val Phe Leu Val Ala Ile Leu Lys Gly
1 5 10 15
Val Gln Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe
35 40 45
Ser Arg Tyr Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Val Tyr Thr
65 70 75 80
Pro Ser Leu Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu
100 105 110
Tyr Tyr Cys Ala Arg Arg Gly Ser His Tyr Tyr Gly Tyr Arg Thr Gly
115 120 125
Tyr Phe Asp Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser Ala
130 135 140
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
145 150 155 160
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
165 170 175
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
180 185 190
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
195 200 205
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
210 215 220
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
225 230 235 240
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
245 250 255
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
260 265 270
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
275 280 285
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
290 295 300
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
305 310 315 320
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
325 330 335
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
340 345 350
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
355 360 365
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
370 375 380
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
385 390 395 400
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
405 410 415
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
420 425 430
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
435 440 445
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
450 455 460
Lys Ser Leu Ser Leu Ser Pro Gly Lys
465 470
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2814164C2 |
| КОНЪЮГАТ АНТИТЕЛО ПРОТИВ C-MET-ЛЕКАРСТВЕННОЕ СРЕДСТВО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2822497C1 |
| КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ЭРИБУЛИНА И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2754369C2 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
| АНТИТЕЛА К МЕЗОТЕЛИНУ | 2019 |
|
RU2837574C2 |
| САЙТ-СПЕЦИФИЧНАЯ КОНЪЮГАЦИЯ ЛИНКЕРНЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ С АНТИТЕЛАМИ И ПОЛУЧАЕМЫЕ В РЕЗУЛЬТАТЕ ADC | 2015 |
|
RU2773536C2 |
| ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К МЕЗОТЕЛИНУ И ИММУННЫЕ ЭФФЕКТОРНЫЕ КЛЕТКИ, НАЦЕЛЕННЫЕ НА МЕЗОТЕЛИН | 2016 |
|
RU2748281C2 |
| ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ГЕННОЙ ИНЖЕНЕРИИ АНТИТЕЛА С ЦИСТЕИНОВЫМИ ЗАМЕНАМИ И ИХ КОНЪЮГАТЫ | 2011 |
|
RU2755066C2 |
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА, СОДЕРЖАЩИЕ МОДУЛЯТОР СПЛАЙСИНГА НА ОСНОВЕ ГЕРБОКСИДИЕНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2820607C2 |
| СКРИНИНГ УЧАСТКОВ ПРИСОЕДИНЕНИЯ С ФИКСИРОВАННОЙ ТОЧКОЙ В КОНЪЮГАТЕ ЦИСТЕИН-МОДИФИЦИРОВАННОЕ АНТИТЕЛО-ТОКСИН (TDC) | 2018 |
|
RU2816510C2 |

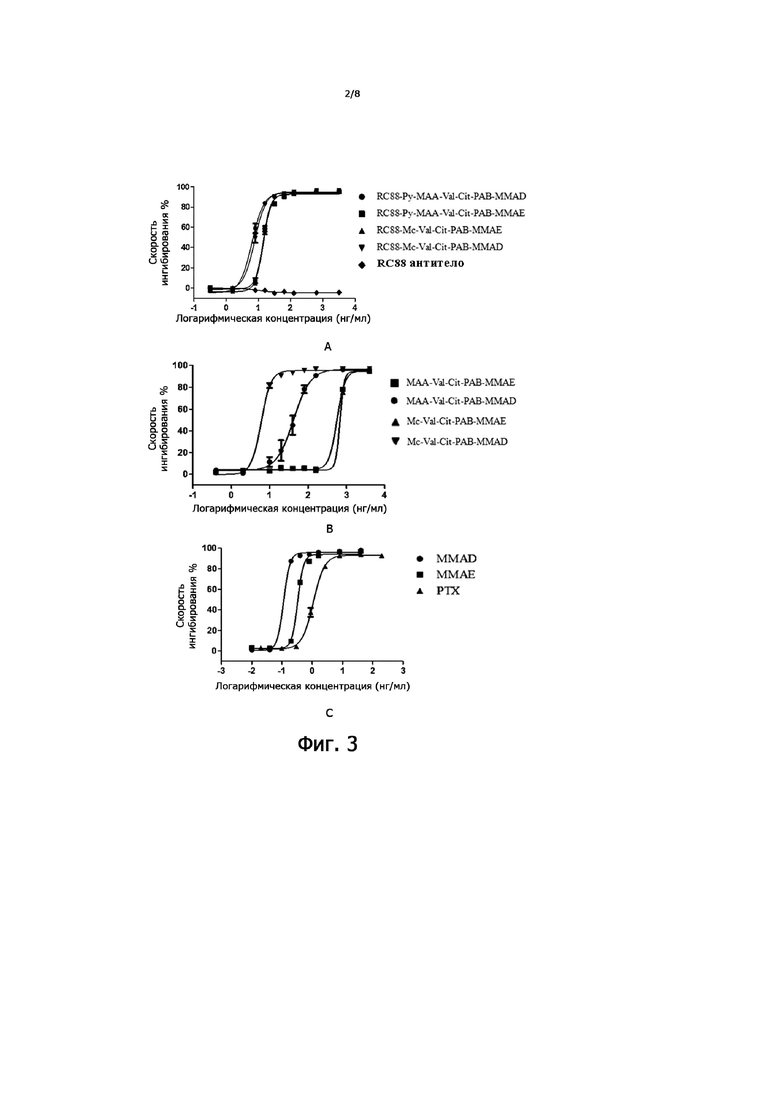

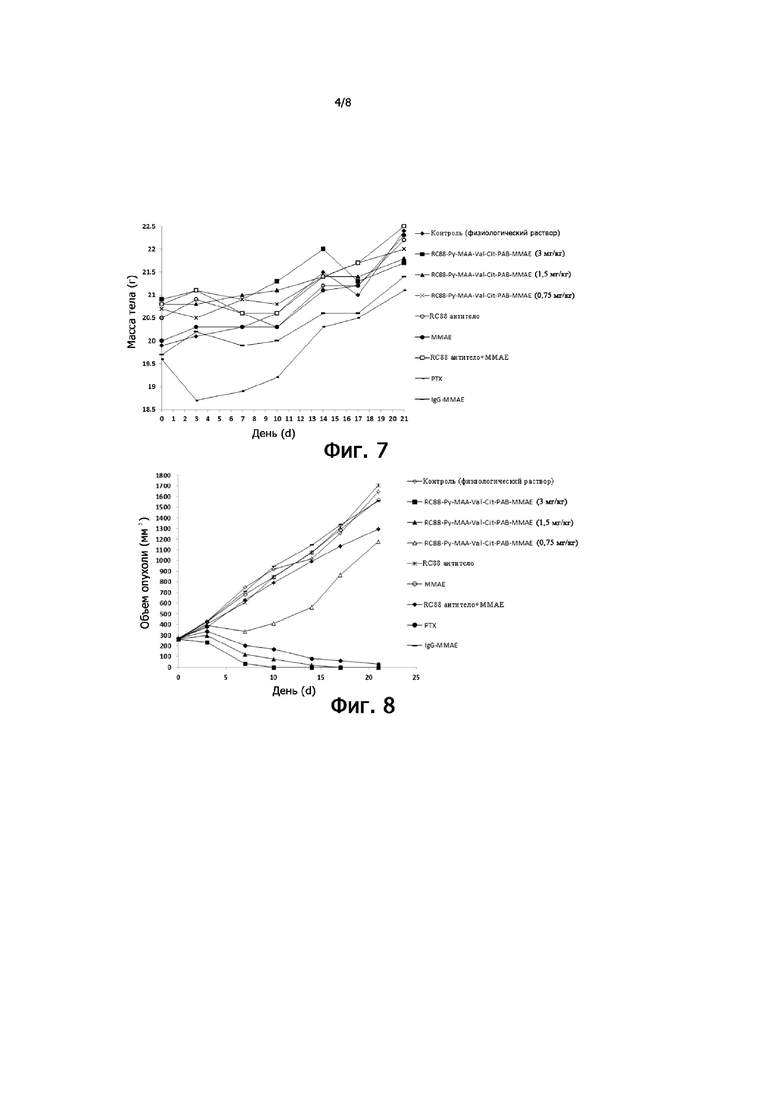

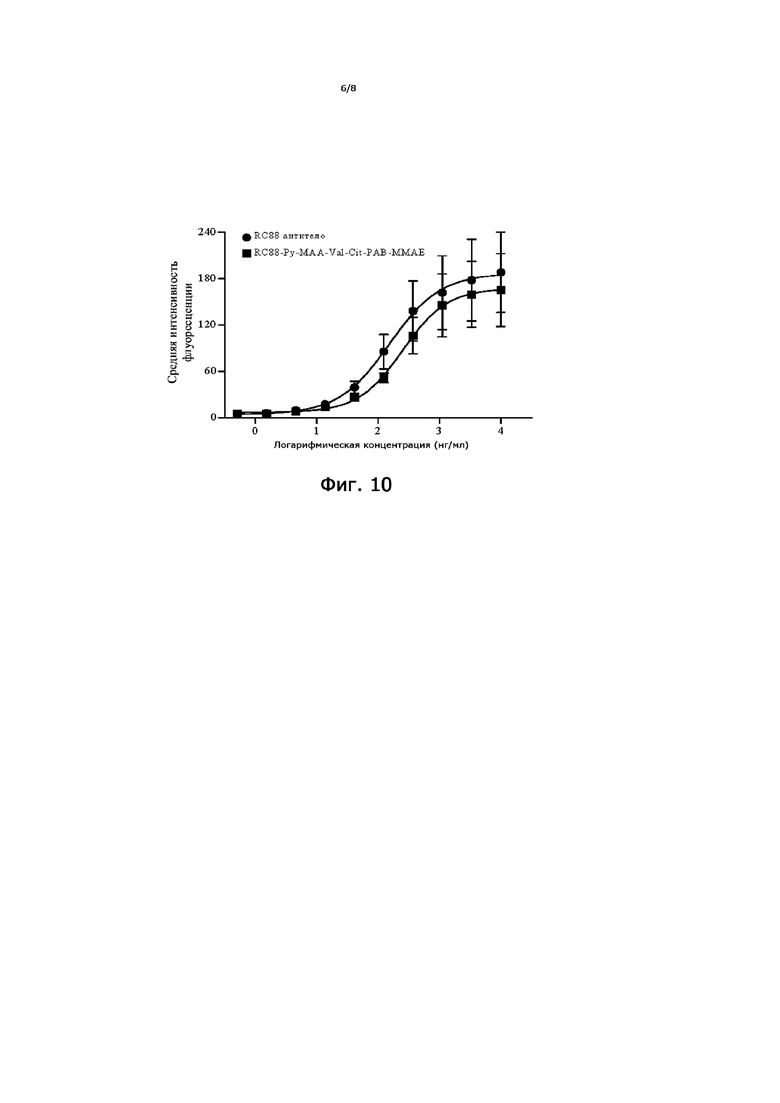
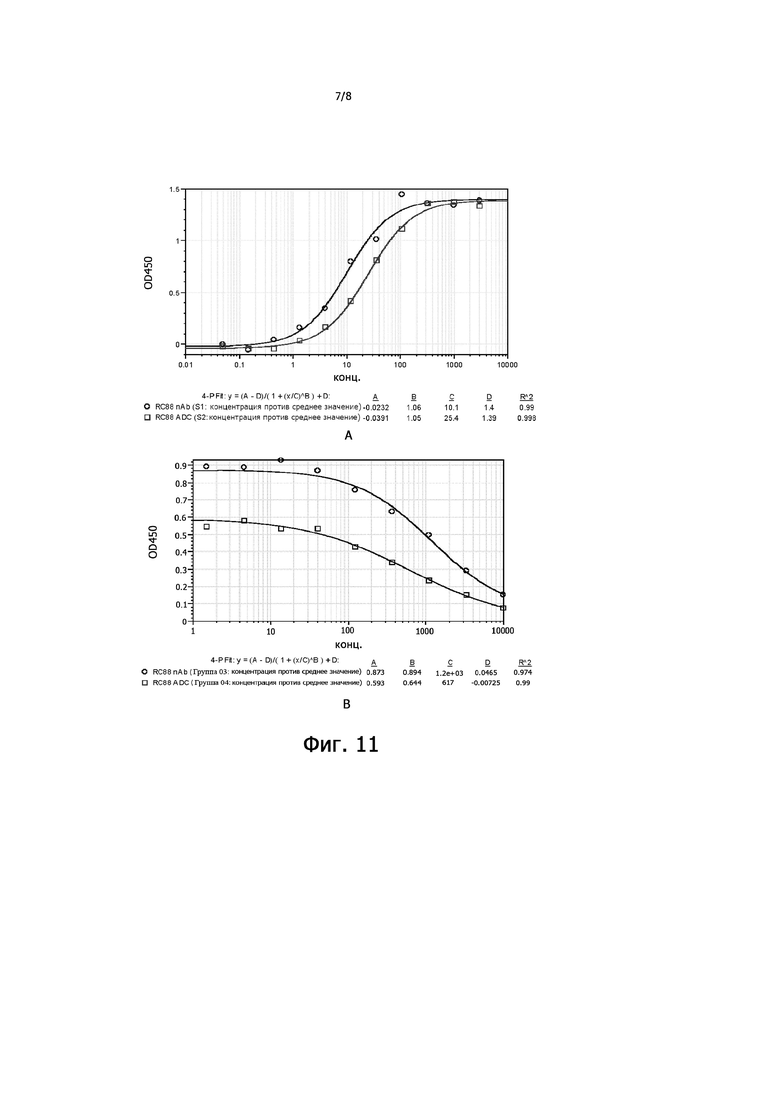
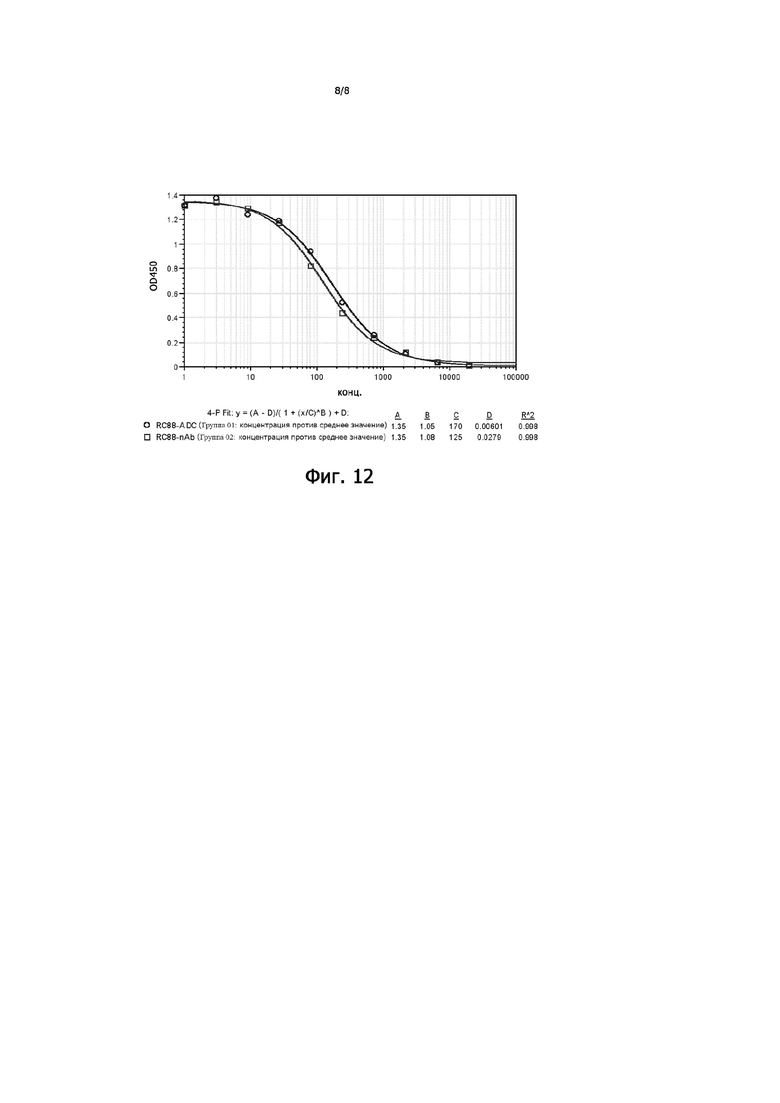
Изобретение относится к анти-мезотелин антителу и его функциональному фрагменту. Также изобретение раскрывает конъюгат антитело-лекарственное средство, которое нацелено на MSLN. Конъюгат содержит новое антитело против MSLN или его функциональный фрагмент, содержащий сконструированные тяжелые и легкие цепи, и низкомолекулярное лекарственное средство. В настоящем изобретении также раскрыт способ получения конъюгата антитело-лекарственное средство (ADC) и применение конъюгата для получения лекарственного средства для лечения опухоли. 7 н. и 8 з.п. ф-лы, 12 ил., 4 табл., 9 пр.
1. Конъюгат антитело-лекарственное средство, направленный на MSLN, имеющий формулу Ab-(L-D)n, где:
(а) Ab представляет собой антитело или его функциональный фрагмент, которые специфически связываются с MSLN;
(б) L является линкером или не существует;
(c) D представляет собой терапевтический агент; и
(d) n равно 1, 2, 3, 4, 5, 6, 7 или 8, где антитело, которое специфически связывается с MSLN, включает тяжелую цепь и легкую цепь, где
(i) тяжелая цепь включает VH CDR1, VH CDR2 и VH CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3; и
(ii) легкая цепь включает VL CDR1, VL CDR2 и VL CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6.
2. Конъюгат антитело-лекарственное средство по п. 1, где антитело, которое специфически связывается с MSLN, включает вариабельную область тяжелой цепи и вариабельную область легкой цепи, где
(i) вариабельная область тяжелой цепи включает аминокислотную последовательность, представленную в SEQ ID NO: 7, или последовательность, имеющую, по меньшей мере, 80% идентичности последовательностей с ней; и
(ii) вариабельная область легкой цепи включает аминокислотную последовательность, представленную в SEQ ID NO: 8, или последовательность, имеющую, по меньшей мере, 80% идентичности последовательностей с ней.
3. Конъюгат антитело-лекарственное средство по любому из пп. 1, 2, в котором антитело представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело, одноцепочечное антитело (scFv) или биспецифическое антитело.
4. Конъюгат антитело-лекарственное средство по любому из пп. 1-3, где терапевтическое средство представляет собой пептид доластатина, предпочтительно MMAD, MMAE или MMAF, более предпочтительно MMAE.
5. Конъюгат антитело-лекарственное средство по любому из пп. 1-4, в котором линкер и антитело связаны тиоловой группой на антителе.
6. Конъюгат антитело-лекарственное средство по любому из пп. 1-5, в котором линкер имеет структуру, показанную следующей формулой:
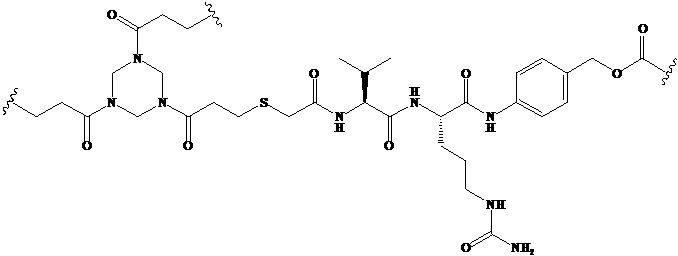 или линкер имеет структуру, показанную следующей формулой:
или линкер имеет структуру, показанную следующей формулой:
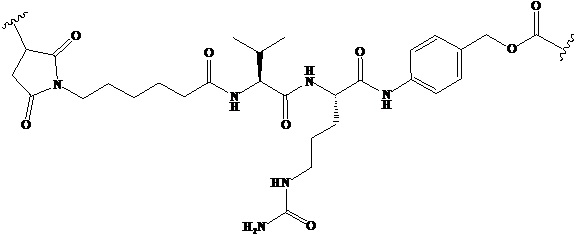
7. Конъюгат антитело-лекарственное средство по любому из пп. 1-6, который имеет структуру, показанную в одной из следующих формул:
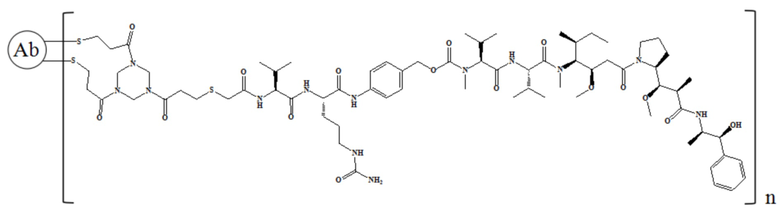
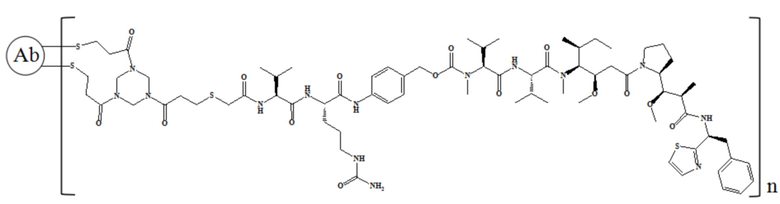
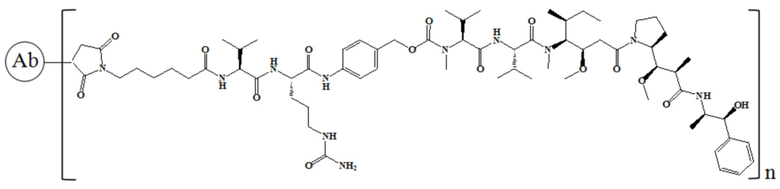
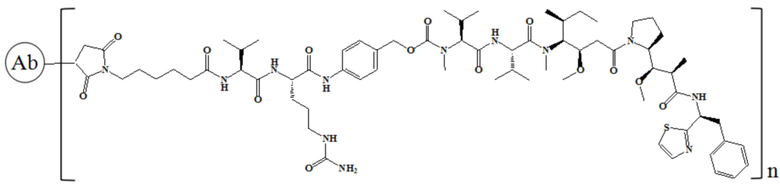
8. Антитело или его функциональный фрагмент, способные специфически связываться с мезотелином, где антитело включает тяжелую цепь и легкую цепь, где
(i) тяжелая цепь содержит VH CDR1, VH CDR2 и VH CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 1, 2 и 3;
(ii) легкая цепь содержит VL CDR1, VL CDR2 и VL CDR3, имеющие аминокислотные последовательности, представленные в SEQ ID NO: 4, 5 и 6.
9. Антитело или его функциональный фрагмент по п. 8, где антитело включает вариабельную область тяжелой цепи и вариабельную область легкой цепи,
(i) вариабельная область тяжелой цепи включает аминокислотную последовательность, представленную в SEQ ID NO: 7, или последовательность, имеющую, по меньшей мере, 80% идентичности последовательностей с ней;
(ii) вариабельная область легкой цепи включает аминокислотную последовательность, представленную в SEQ ID NO: 8, или последовательность, имеющую, по меньшей мере, 80% идентичности последовательностей с ней.
10. Антитело или его функциональный фрагмент по любому из пп. 8, 9, где антитело представляет собой моноклональное антитело, химерное антитело, гуманизированное антитело, одноцепочечное антитело (scFv) или биспецифическое антитело.
11. Выделенный полинуклеотид, который кодирует антитело или его функциональный фрагмент по любому из пп. 8-10.
12. Комбинация выделенных полинуклеотидов, которая включает полинуклеотид, кодирующий тяжелую цепь антитела или его функционального фрагмента по любому из пп. 8-10, и полинуклеотид, кодирующий легкую цепь антитела или его функционального фрагмента по любому из пп. 8-10.
13. Экспрессирующий вектор или комбинация экспрессирующих векторов, которая включает полинуклеотид по п. 11 или комбинацию полинуклеотидов по п. 12, причем полинуклеотид функционально связан с регуляторной последовательностью, обеспечивающей экспрессию кодируемого ими полипептида в клетке-хозяине или бесклеточной системе экспрессии.
14. Фармацевтическая композиция для лечения мезотелин-положительного рака, которая включает эффективное количество конъюгата по любому из пп. 1-7 и фармацевтически приемлемый носитель.
15. Применение конъюгата по любому из пп. 1-7 или фармацевтической композиции по п. 14 в производстве лекарственного средства для лечения мезотелин-положительного рака.
| WO 2010124797A1, 04.11.2010 | |||
| WO 2005081711 A2, 09.09.2005 | |||
| Деревянная труба для сточных вод | 1931 |
|
SU28744A1 |
Авторы
Даты
2021-05-18—Публикация
2019-05-15—Подача