ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее описание относится к области биомедицины и, в частности, относится к антителу против Клаудина 18.2 и его конъюгату антитело-лекарственное средство, и настоящее описание также относится к применению вышеупомянутого антитела и его конъюгата антитело-лекарственное средство.
УРОВЕНЬ ТЕХНИКИ
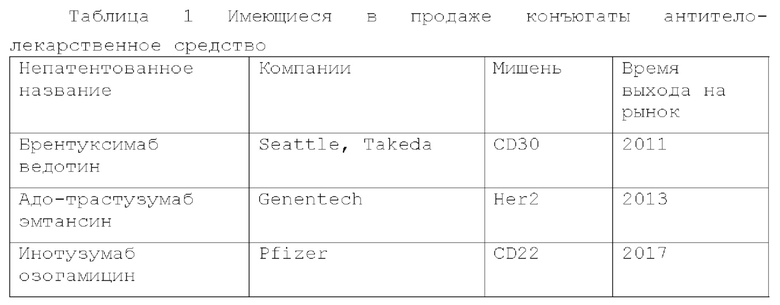
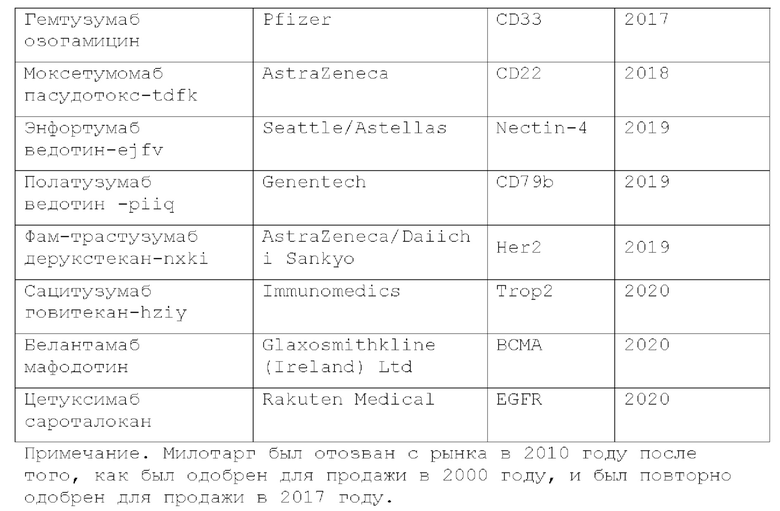
[0002] Б последние годы общая заболеваемость злокачественными опухолями в мире имеет непрерывную тенденцию к росту, серьезно угрожая здоровью и выживанию людей. В настоящее время клиническое лечение злокачественных опухолей в основном включает хирургическое вмешательство, химиотерапию и лучевую терапию, однако не дает удовлетворительного лечебного эффекта. Конъюгат антитело-лекарственное средство (ADC) относится к классу биологических лекарственных средств, образованных путем связывания биологически активного лекарственного средства с антителом через химический линкер. За последние несколько лет множество конъюгатов антитело-лекарство совершили прорыв в лечении злокачественных опухолей, что сделало их новым методом лечения после хирургического вмешательства, химиотерапии и лучевой терапии. Однако по состоянию на март 2021 года в мире было одобрено только 11 конъюгатов антитело-лекарственное средство (10 одобрены FDA США и один одобрен PMDA Японии) с несколькими одобренными показаниями, что далеко не соответствует текущим клиническим потребностям пациентов со злокачественными опухолями.
[0003] Клаудины межклеточных контактов (Клаудины или CLDN) широко распространены в различных эпителиальных тканях и являются важными структурными компонентами плотных контактов клеток. Исследования показали, что CLDN тесно связаны с поддержанием осмотического давления, барьерной функцией и клеточной полярностью в эпителиальных клетках (Документ 1: Gunzel D. Claudins: vital partners in transcellular and paracellular transport coupling[J]. Pflugers Arch, 2017, 469(1):35-44.) и участвуют в процессе иммунной защиты от патогенов (Документ 2: Colpitts СС, Baumert TF. Claudins in viral infection: from entry to spread[J]. Pflugers Arch, 2017, 469 (1): 27-34.). Кроме того, было подтверждено, что CLDN имеют изменения в паттернах экспрессии во время возникновения и развития многих опухолей, и исследования в области таргетной терапии с использованием линий CLDN в качестве специфических маркерных белков привлекло широкое внимание. Однако, хотя большинство CLDN широко экспрессируются, некоторые члены, такие как белок CLDN 18, часто с высокой степенью селективности экспрессируются в определенных тканях, таких как желудочно-кишечный тракт. Ген CLDN18 расположен на хромосоме 3 человека в области 3g22.3, и имеет два варианта первого экзона, таким образом образуя два разных сплайс-мутанта, экспрессирующих две изоформы белка, отличающиеся 6 9 аминокислотами на N-конце, а именно белок клаудин 18.1 и белок CLDN 18.2 (Документ 3: Hayashi D, Tamura A, Tanaka Н, et al. Deficiency of claudin-18 causes paracellular H+ leakage, up-regulation of interleukin-1p, and atrophic gastritis in mice [J]. Gastroenterology, 2012, 142(2):292-304.). Белок Клаудин 18.1 представляет собой специфический антиген, селективно экспрессируемый альвеолярными эпителиальными клетками, и он в высокой степени экспрессируется только в нормальной альвеолярной ткани и не обнаруживается в других нормальных тканях, включая проток поджелудочной железы (Документ 4: Li G, Flodby Р, Luo J, et al. Knockout mice reveal key roles for claudin 18 in alveolar barrier properties and fluid homeos t as i s [J]. Am J Respir Cell Mol Biol, 2014, 51(2): 210-222.). Белок Клаудин 18.2 также является высокоселективным маркерным белком, но ткани, в которых он распределяется, полностью отличаются от тканей белка Клаудин 18.1. Экспрессия белка Клаудин 18.2 сильно ограничена в нормальных здоровых тканях, но аберрантно активируется и избыточно экспрессируется в различных первичных злокачественных опухолях, таких как рак желудка, рак молочной железы, рак толстой кишки, рак печени, рак головы и шеи, рак бронхов и немелкоклеточный рак легкого, особенно при злокачественных опухолях системы пищеварения, включая рак желудка (70%), рак поджелудочной железы (50%), рак пищевода (30%) и т.д. (Документ 5: Kumar V, Soni Р, Garg М, et al. Emerging Therapies in the Managment of Advanced-Stage Gastric Cancer[J]. Front Pharmacol, 2018, 9:404). Другое исследование показало, что белок CLDN 18.2 экспрессируется не только в первичных поражениях, но также в высокой степени экспрессируется в метастатических поражениях и может участвовать в процессе пролиферации и хемотаксисе клеток злокачественных опухолей (Документ 6: Woll S, Schlitter AM, DhaeneK, et al. Claudin 18.2 is a target for IMAB362 antibody in pancreatic neoplasms [J]. Int J Cancer, 2014, 134(3):731-739; Документ 7: Jiang H, Shi Z, Wang P, et al. Claudinl 8.2-Speci f ic Chimeric Antigen Receptor Engineered T Cells for the Treatment of Gastric Cancer[J]. J Natl Cancer Inst, 2018, 111 (4):1-10.). Таким образом, Клаудин 18.2 является идеальным онкомаркером и мишенью для разработки противоопухолевых лекарственных средств, особенно при раке желудка, раке поджелудочной железы, раке пищевода, раке легких, раке яичников и т.д. Однако из-за особенностей мишени (структура очень похожа на структуру Клаудина 18.1 с точно таким же первым доменом внеклеточной области) разработка терапевтического антитела против Клаудина 18.2 очень затруднена, что также является основной причиной ограничения разработка лекарственных средств, нацеленных на Клаудин 18.2.
[0004] В настоящее время все конъюгаты антитело-лекарственное средство, нацеленные на Клаудин 18.2, находятся на стадии доклинических исследований, и ни один из них не продвинулся до клинической стадии. Поэтому необходимо срочно разработать конъюгаты антитело-лекарственное средство, нацеленные на Клаудин 18.2, чтобы предоставить больше клинических возможностей.
СУЩНОСТВ ИЗОБРЕТЕНИЯ
[0005] Настоящее описание относится к антителу, нацеленному на Клаудин 18.2, конъюгату антитело-лекарственное средство и их применению для лечения онкологического заболевания. Настоящее описание также относится к нуклеотиду, кодирующему вышеупомянутое антитело против Клаудина 18.2, к комбинации полинуклеотидов, экспрессирующему вектору и комбинации экспрессирующего вектора, к фармацевтической композиции, содержащей вышеупомянутое антитело против Клаудина 18.2 или конъюгат антитело-лекарственное средство, а также к их применению в производстве лекарственного средства для лечения или предотвращения онкологического заболевания.
[0006] В частности, настоящее описание относится к антителу против Клаудина 18.2 или его антигенсвязывающему фрагменту, где антитело или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. Вариабельная область тяжелой цепи и/или вариабельная область легкой цепи имеет последовательность CDR, идентичную последовательности CDR антитела, определенной следующей последовательностью, или полученной путем 1-2 аминокислотных замен CDR антитела, определенной следующей последовательностью:
(1) аминокислотная последовательность вариабельной области тяжелой цепи, представленная в SEQ ID NO: 1; и/или
(2) аминокислотная последовательность вариабельной области легкой цепи, представленная в SEQ ID NO: 2.
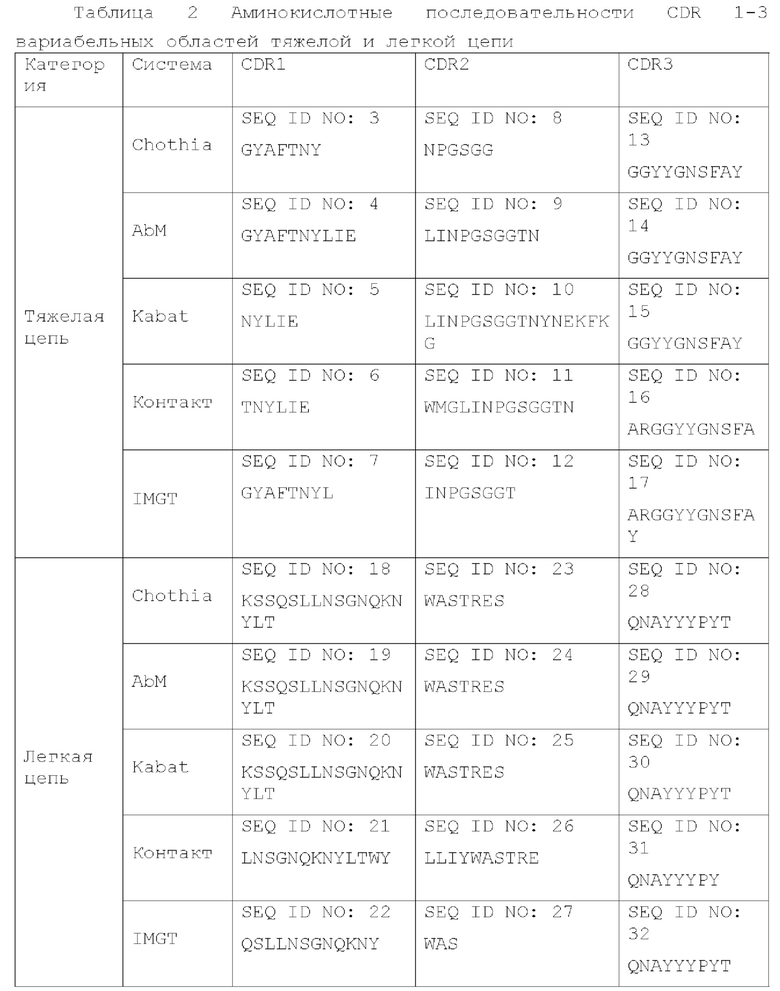
[0007] В конкретном варианте осуществления в соответствии с различными способами определения или системам идентификации определяющие комплементарность области (CDR) 1-3 соответствующих вариабельных областей тяжелой цепи и легкой цепи представлены в Таблице 2.
[0008] Кроме того, настоящее описание также относится к антителу против Клаудина 18.2 или его антигенсвязывающему фрагменту, которое в некоторых конкретных вариантах осуществления содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
(1) для вариабельной области тяжелой цепи CDR1 имеет аминокислотную последовательность, представленную в SEQ ID NO: 3, 4, 5, 6 или 7, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 3, 4, 5, 6 или 7; CDR2 имеет аминокислотную последовательность, представленную в SEQ ID NO: 8, 9, 10, 11 или 12, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 8, 9, 10, 11 или 12; CDR3 имеет аминокислотную последовательность представленную в SEQ ID NO: 13, 14, 15, 16 или 17, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 13, 14, 15, 16 или 17;
(2) для вариабельной области легкой цепи CDR1 имеет аминокислотную последовательность, представленную в SEQ ID NO: 18, 19, 20, 21 или 22, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 18, 19, 20, 21 или 22; CDR2 имеет аминокислотную последовательность, представленную в SEQ ID NO: 23, 24, 25, 26 или 27, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 23, 24, 25, 26 или 27; CDR3 имеет аминокислотную последовательность, представленную в SEQ ID NO: 28, 29, 30, 31 или 32, или полученную путем замены 1 или 2 аминокислот в SEQ ID NO: 28, 29, 30, 31 или 32.
[0009] Кроме того, в некоторых конкретных вариантах осуществления настоящее описание относится к антителу против Клаудина 18.2 или его антигенсвязывающий фрагмент, где:
(1) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 3, 8 и 13 или полученные путем замены 1 или 2 аминокислот в SEQ ID NO: 3, 8 и 13, и/или CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 18, 23 и 28 или полученные путем замены 1 или 2 аминокислот в SEQ ID NO: 18, 23 и 28;
(2) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 4, 9 и 14 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 4, 9 и 14, и/или CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 19, 24 и 29 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 19, 24 и 29;
(3) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 5, 10 и 15 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 5, 10 и 15, и/или CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 20, 25 и 30 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 20, 25 и 30;
(4) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 6, 11 и 16 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 6, 11 и 16, и/или CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 21, 2 6 и 31 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 21, 26 и 31;
(5) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 7, 12 и 17 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 7, 12 и 17, и/или CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 22, 27 и 32 или полученные путем замены 1 или 2 аминокислот SEQ ID NO: 22, 27 и 32.
[0010] В некоторых конкретных вариантах осуществления настоящее описание относится к антителу или его антигенсвязывающему фрагменту, содержащему вариабельную область, выбранную из следующей группы:
(1) вариабельная область тяжелой цепи, имеющая аминокислотную последовательность, представленную в SEQ ID NO: 1, или содержащую такие же CDR 1-3, что и в SEQ ID NO: 1, и более чем на 80%, 85%, 90%, 95%, 96%, 91%, 98% или 99% идентичную SEQ ID NO: 1; и/или
(2) вариабельная область легкой цепи, имеющая аминокислотную последовательность, представленную в SEQ ID NO: 2, или содержащую такие же CDR 1-3, что и в SEQ ID NO: 1, и более чем на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную SEQ ID NO: 2.
[0011] В конкретном варианте осуществления вариабельная область тяжелой цепи антитела против Клаудина 18.2 по настоящему описанию имеет следующую аминокислотную последовательность (SEQ ID NO: 1):

[0012] В конкретном варианте осуществления вариабельная область легкой цепи антитела против Клаудина 18.2 по настоящему описанию имеет следующую аминокислотную последовательность (SEQ ID NO: 2):
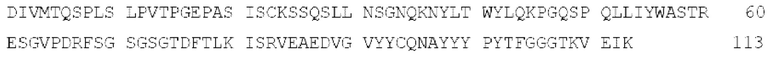
[0013] В конкретном варианте осуществления настоящее описание относится к антителу против Клаудина 18.2 или его антигенсвязывающему фрагменту, содержащему: (1) вариабельную область тяжелой цепи с аминокислотной последовательностью, представленной в SEQ ID NO: 1; и/или (2) вариабельную область легкой цепи с аминокислотной последовательностью, представленной в SEQ ID NO: 2.
[0014] В некоторых конкретных вариантах осуществления настоящее описание относится к антителу или его антигенсвязывающему фрагменту, где: (1) тяжелая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 33; и/или (2) легкая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 34.
[0015] Антитело по настоящему описанию может быть моноклональным антителом, Fab, Fab', Fab'-SH, F(ab')2, Fv, одноцепочечным Fv (scFv), диантителом, биспецифическим антителом, полиспецифическим антителом, химерным антителом, гуманизированным антителом или слитым белком, содержащим антигенсвязывающий фрагмент антитела; предпочтительно антитело представляет собой гуманизированное моноклональное антитело.
[0016] Антитело по настоящему описанию дополнительно содержит константную область человека или мыши; предпочтительно константную область выбирают из группы, состоящей из IgG1, IgG2, IgG3 и IgG4.
[0017] Настоящее описание также относится к конъюгату антитело-лекарственное средство, содержащему вышеупомянутое антитело или его антигенсвязывающий фрагмент.
[0018] Кроме того, конъюгат антитело-лекарственное средство имеет структуру, представленную формулой (I):
Ab-L-D (I)
где:
Ab представляет собой вышеупомянутое антитело или его антигенсвязывающий фрагмент;
D представляет собой активную лекарственную единицу;
L представляет собой любую связывающую группу, которая ковалентно связана с антителом или антигенсвязывающим фрагментом этого Ab и активной лекарственной единицей D, соответственно;
где Ab связано с одной или более активными лекарственными единицами D через одну или более связывающих групп L.
[0019] Кроме того, L ковалентно связана с амино- или тиольным остатком антитела Ab; предпочтительно L ковалентно связана с тиольным остатком антитела Ab; более предпочтительно L ковалентно связана с тиольным остатком, образованным разрывом межцепочечной дисульфидной связи антитела Ab.
[0020] Кроме того, L включает расщепляемый линкер и нерасщепляемый линкер.
[0021] Кроме того, расщепляемый линкер включает пептидную единицу, содержащую от 2 до 20 аминокислот, предпочтительно пептидный линкер выбирают из группы, состоящей из -валин-цитруллин-(-Val-Cit-), -глицин-глицин-фенилаланин-глицин-(-Gly-Gly-Phe-Gly-), -валин-аланин-(-Val-Ala-), -валин-лизин-(-Val-Lys-), -валин-аргинин-(-Val-Arg-), -фенилаланин-цитруллин-(-Phe-Cit-), -фенилаланин-лизин-(-Phe-Lys-), -фенилаланин-аргинин-(-Phe-Arg-) и их комбинации.
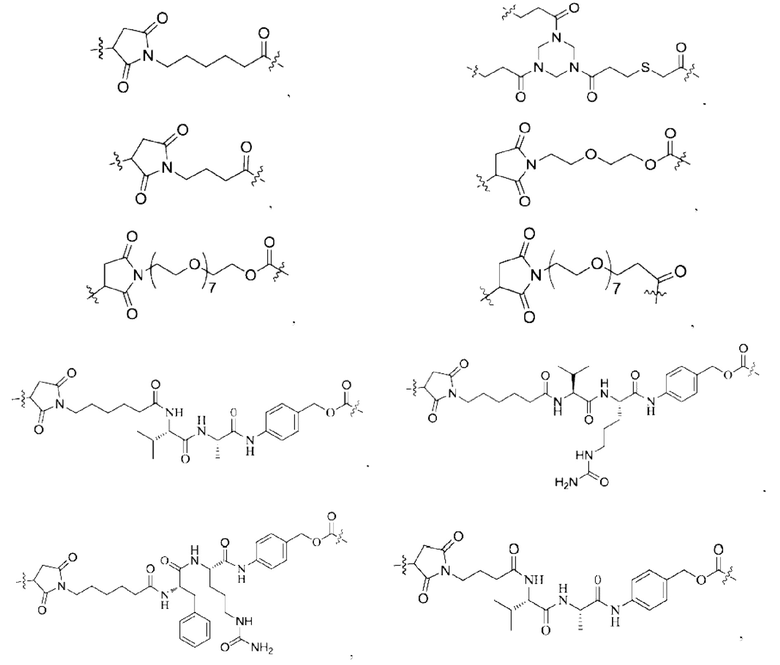
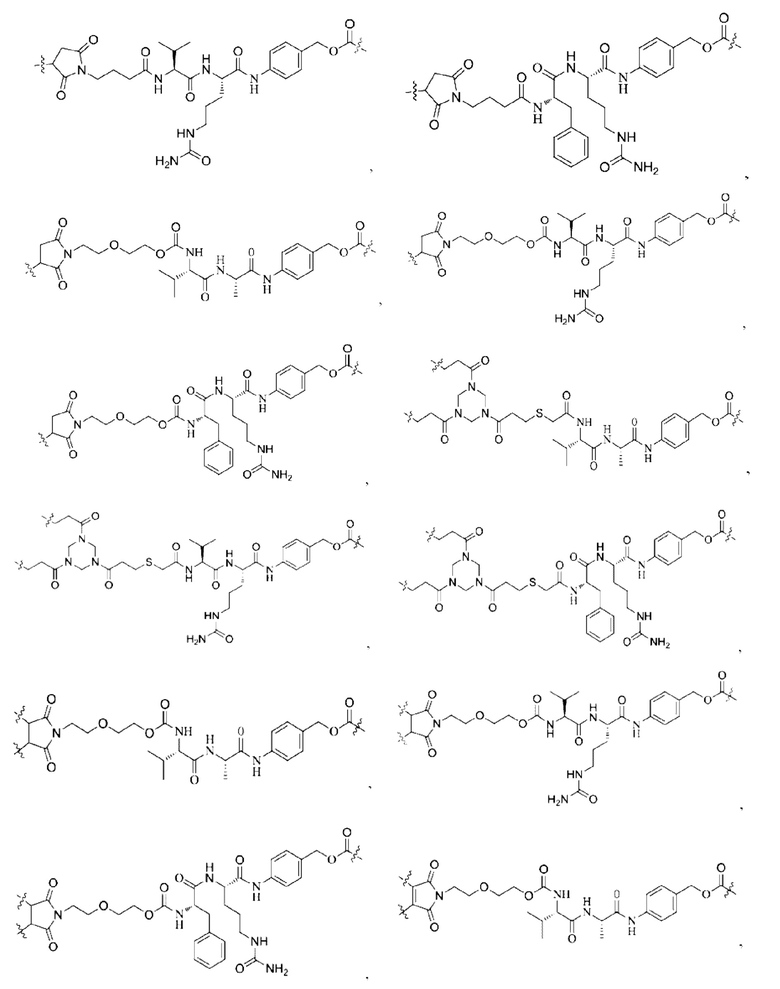
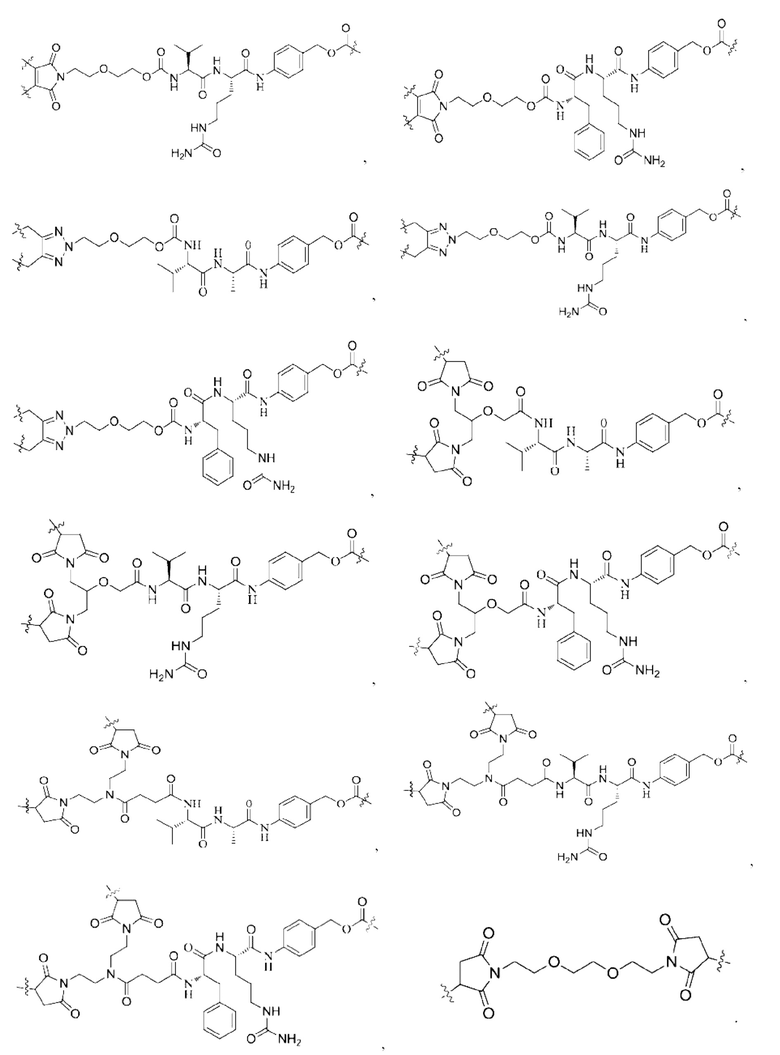
[0022] Кроме того, в вышеупомянутом конъюгате антитело-лекарственное средство L содержит структуру следующих существующих линкеров (страницы 7-10 описания в китайском патенте на изобретение №CN110997010A):
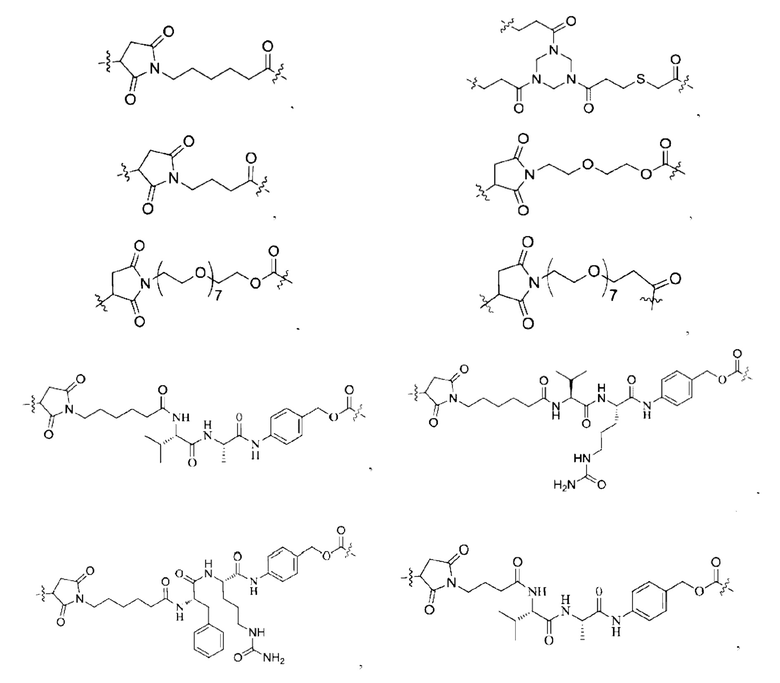
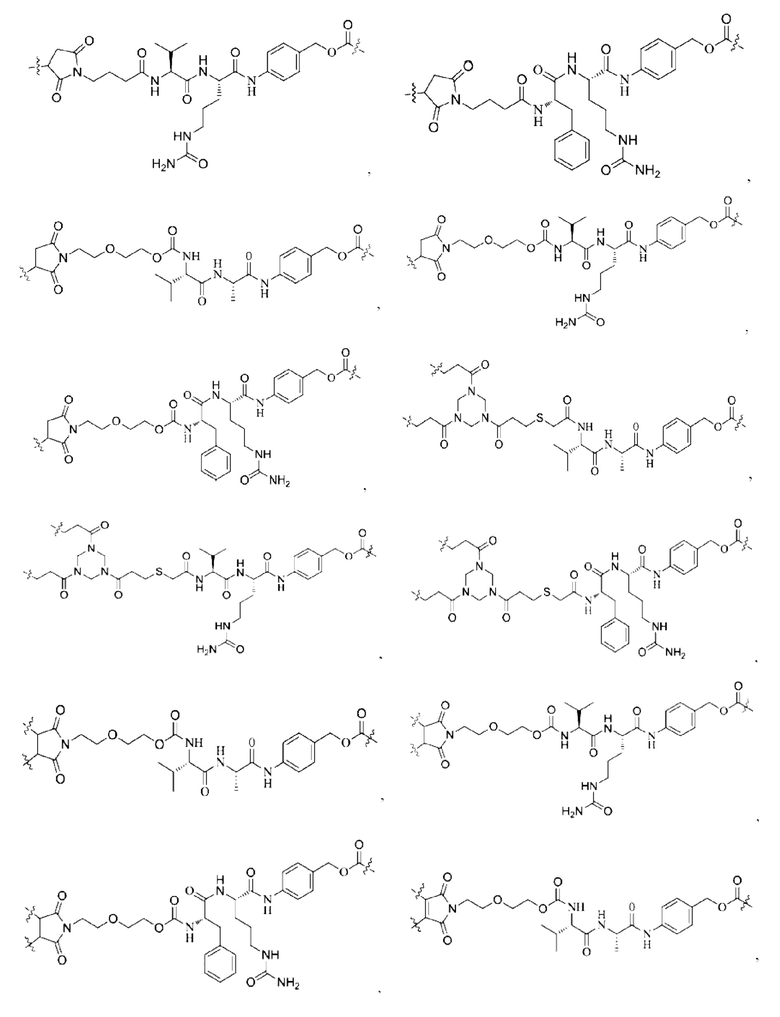
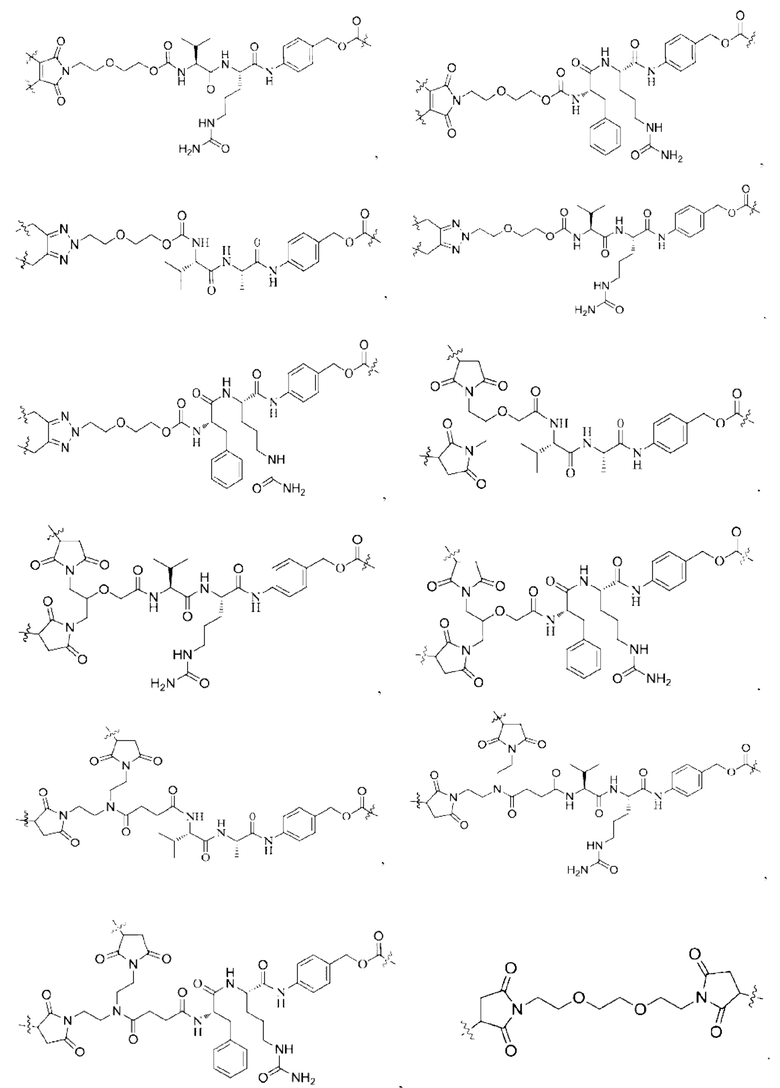
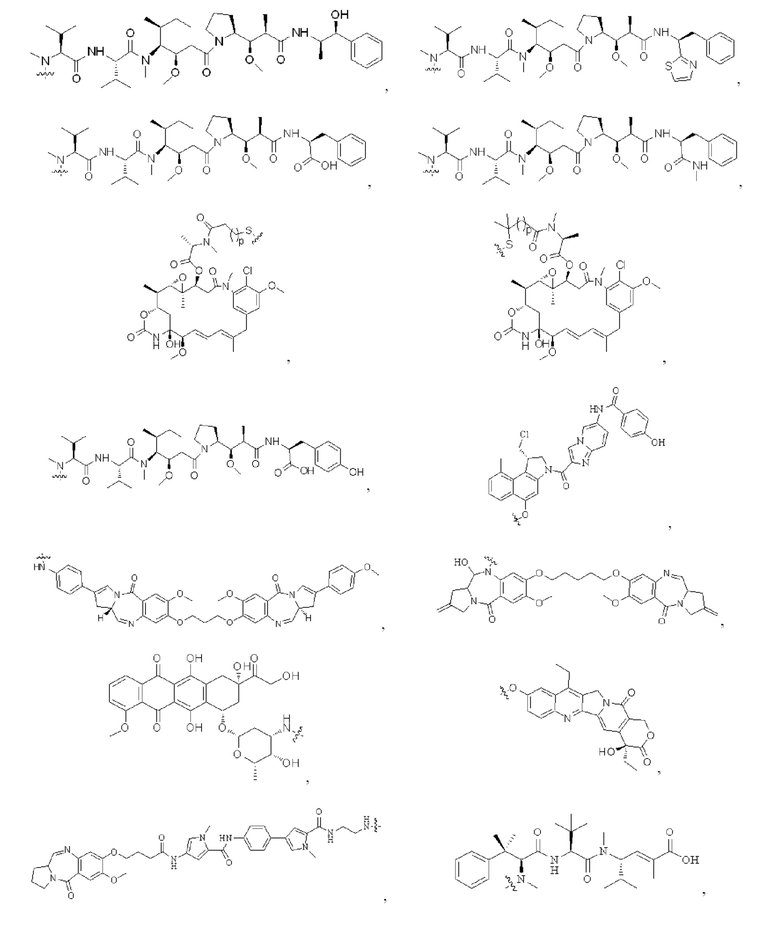
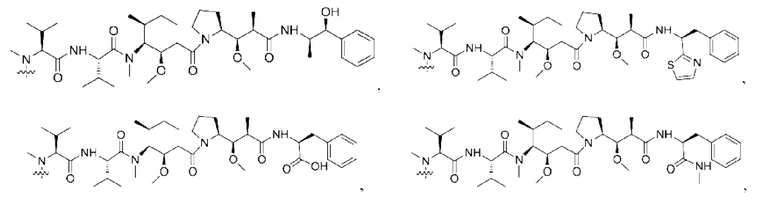
[0023] Кроме того, активная лекарственная единица D выбрана из группы, состоящей из цитотоксической молекулы, фактора клеточной дифференцировки, трофического фактора стволовых клеток, стероидного лекарственного средства, лекарственного средства для лечения аутоиммунных заболеваний, противовоспалительного лекарственного средства и лекарственного средства для лечения инфекционных заболеваний; предпочтительно цитотоксическая молекула включает, но не ограничивается ими, ингибитор тубулина или агент, повреждающий ДНК; ингибитор тубулина включает, но не ограничивается ими, цитотоксическую молекулу доластатинов и ауристатинов, цитотоксическую молекулу майтанзинов; агент, повреждающий ДНК, включает, но не ограничивается ими, токалихеамицины, дуокармицины, производное антрамицина пирролобензодиазепин (PBD), камптотецины и их производные и SN-38; более предпочтительно, молекула цитокинов ауристатинов включает, но не ограничивается ими, ММАЕ, MMAF или их производные; и цитотоксическая молекула майтанзинов включает, но не ограничивается ими, DM1, DM4 или их производные. Кроме того, активная лекарственная единица D включает следующие существующие активные лекарственные единицы, используемые в АБС (страницы 12-14 описания в китайском патенте на изобретение №CN110997010A):
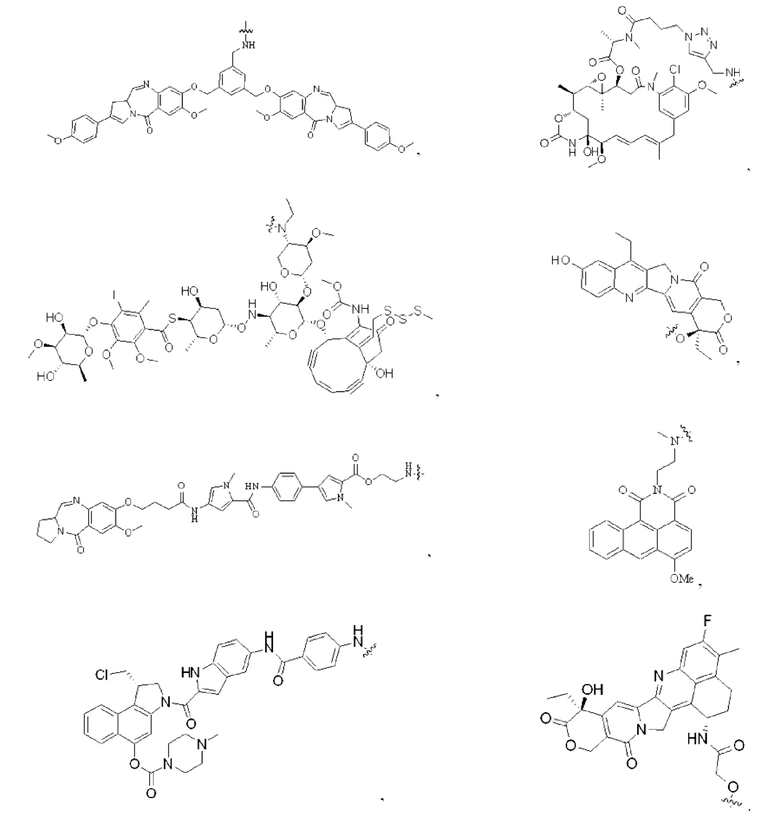
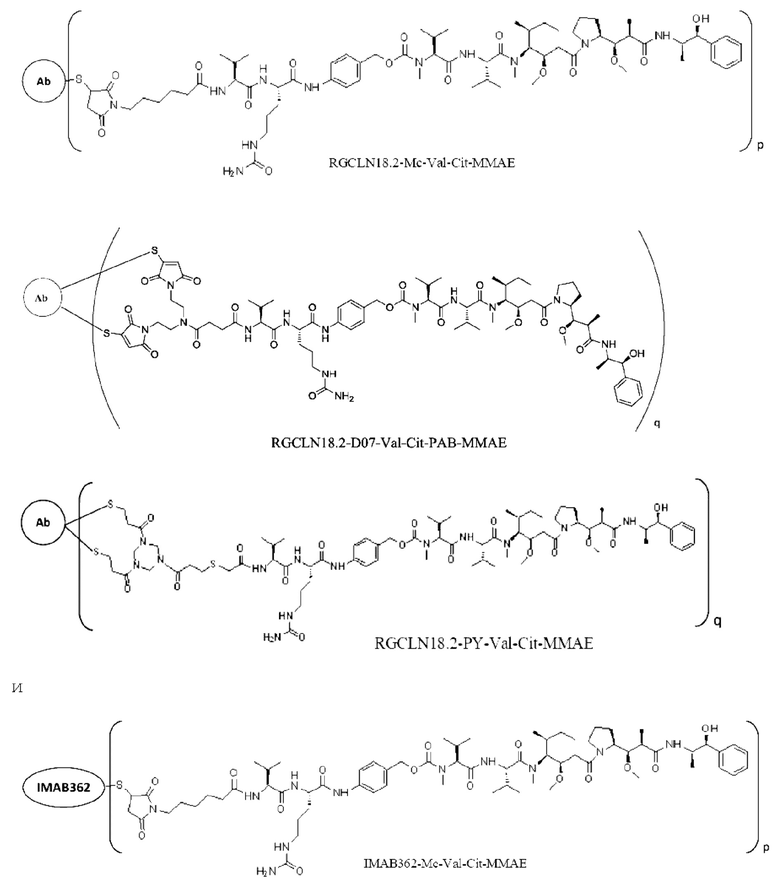
[0 024] В некоторых предпочтительных вариантах осуществления настоящее описание относится к конъюгату антитело-лекарственное средство, имеющему следующую структуру (т.е. Ab-Mc-Val-Cit-PAB-ММАЕ):
где р представляет собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7 и 8.
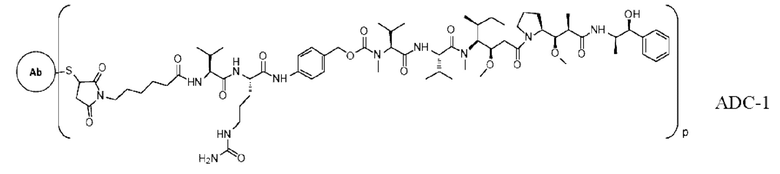
[0025] В других предпочтительных вариантах осуществления настоящее описание относится к конъюгату антитело-лекарственное средство, имеющему следующую структуру (т.е. Ab-D07-Val-Cit-РАВ-ММАЕ):
где q представляет собой целое число, выбранное из 1, 2, 3 и 4.
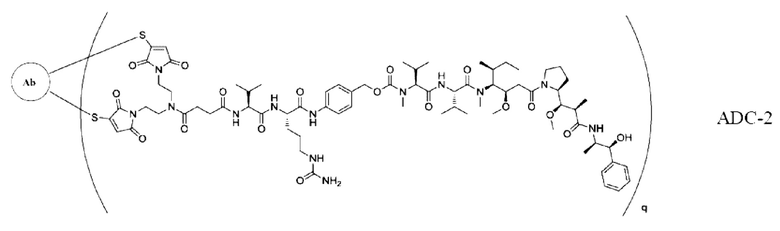
[0026] В других предпочтительных вариантах осуществления настоящее описание относится к конъюгату антитело-лекарственное средство, имеющему следующую структуру (т.е. Ab-PY-Val-Cit-ММАЕ):
где q представляет собой целое число, выбранное из 1, 2, 3 и 4.
[0027] Настоящее описание также относится к выделенному полинуклеотиду, кодирующему вышеупомянутое антитело или его антигенсвязывающий фрагмент.
[0028] Настоящее описание также относится к комбинации выделенного полинуклеотида, содержащего полинуклеотид, кодирующий тяжелую цепь вышеупомянутого антитела или его антигенсвязывающего фрагмента, и полинуклеотид, кодирующий легкую цепь вышеупомянутого антитела или его антигенсвязывающего фрагмента.
[002 9] Настоящее описание также относится к конструкции нуклеиновой кислоты, содержащей вышеупомянутый полинуклеотид.
[0030] Кроме того, конструкция нуклеиновой кислоты представляет собой вектор.
[0031] Настоящее описание также относится к клетке-хозяину, содержащей вышеупомянутую конструкцию нуклеиновой кислоты или вектор.
[0032] Кроме того, клетка-хозяин выбрана из группы, состоящей из прокариотической клетки, эукариотической клетки, дрожжевой клетки, клетки млекопитающего, клетки E. coli или клетки СНО, клетки NSO, клетки Sp2/0 и клетки ВНК.
[0033] Настоящее описание также относится к фармацевтической композиции, содержащей вышеупомянутое антитело или его антигенсвязывающий фрагмент и/или конъюгат антитело-лекарственное средство, и фармацевтически приемлемый носитель.
[0034] Настоящее описание также относится к способу получения антитела против Клаудина 18.2, включающему культивирование вышеупомянутой клетки-хозяина в условиях, подходящих для экспрессии вектора, кодирующего антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, и выделение антитела или фрагмента.
[0035] Настоящее описание относится к применению вышеупомянутого антитела или его антигенсвязывающего фрагмента, конъюгата антитело-лекарственное средство, полинуклеотида, комбинации полинуклеотидов, конструкции нуклеиновой кислоты, вектора или фармацевтической композиции в производстве лекарственного средства для лечения или предотвращения онкологического заболевания, где онкологическое заболевание представляет собой солидную опухоль; кроме того, солидная опухоль включает рак желудка и рак поджелудочной железы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
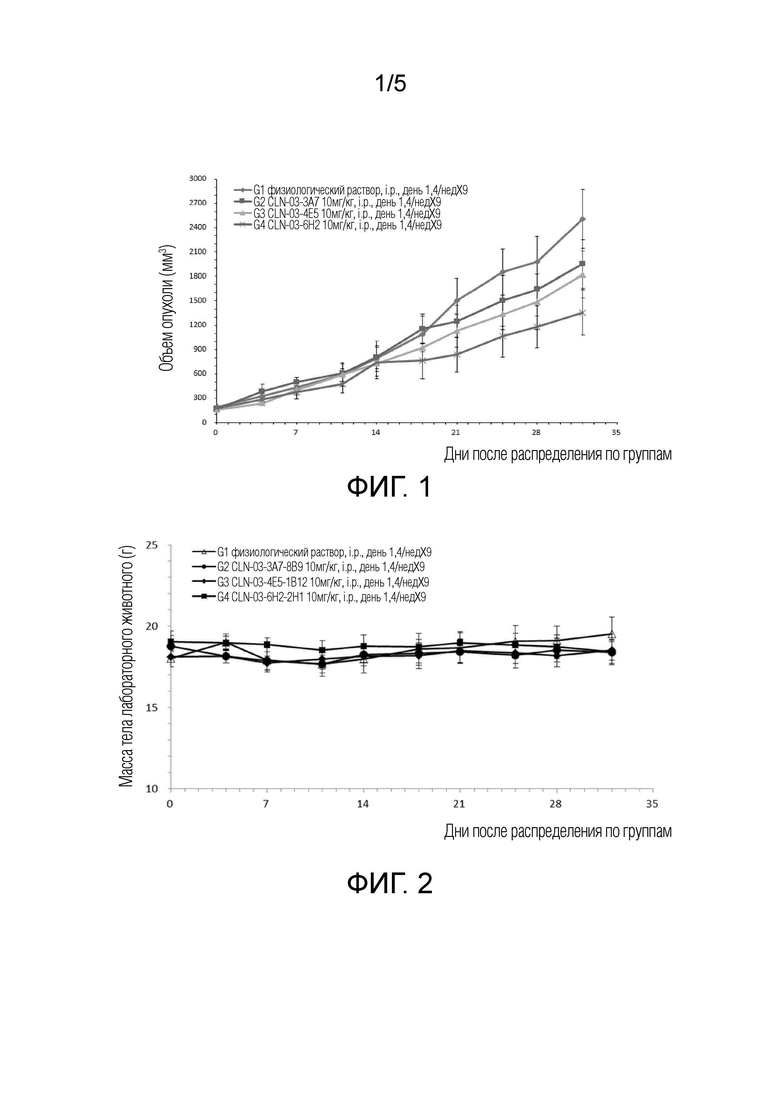
[0036] ФИГ. 1 представляет собой график, показывающий изменение объема опухоли у животных после введения мышиных антител против Клаудина 18.2 CLN-03-3A7, CLN-03-4E5 и CLN-03-6Н2;
[0037] ФИГ. 2 представляет собой график, показывающий изменение массы тела животных после введения мышиных антител против Клаудина 18.2 CLN-03-3A7, CLN-03-4E5 и CLN-03-6H2;
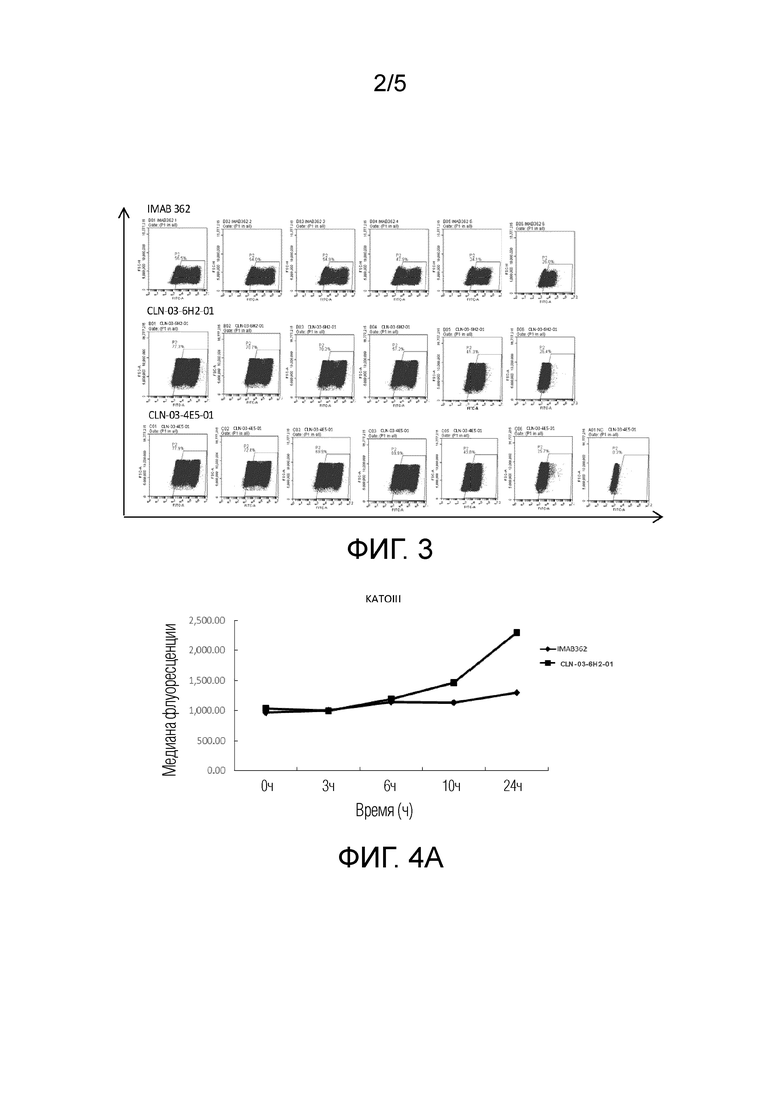
[0038] ФИГ. 3 представляет собой график, показывающий сравнение обнаруженной аффинности химерных антител CLN-03-4E5-01, CLN-03-6H2-01 и IMAB362;
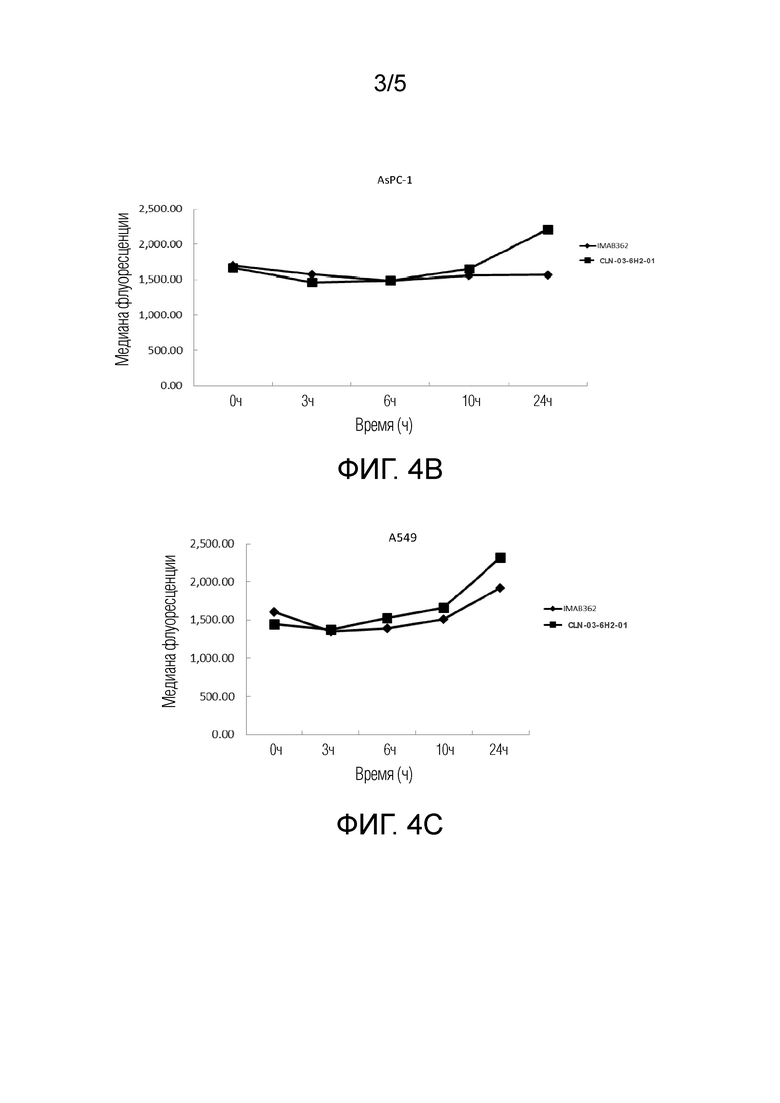
[0039] ФИГ. 4А представляет собой график, показывающий сравнение эффективности эндоцитоза CLN-03-6H2-01 и IMAB362 в модели рака желудка KATOIII;
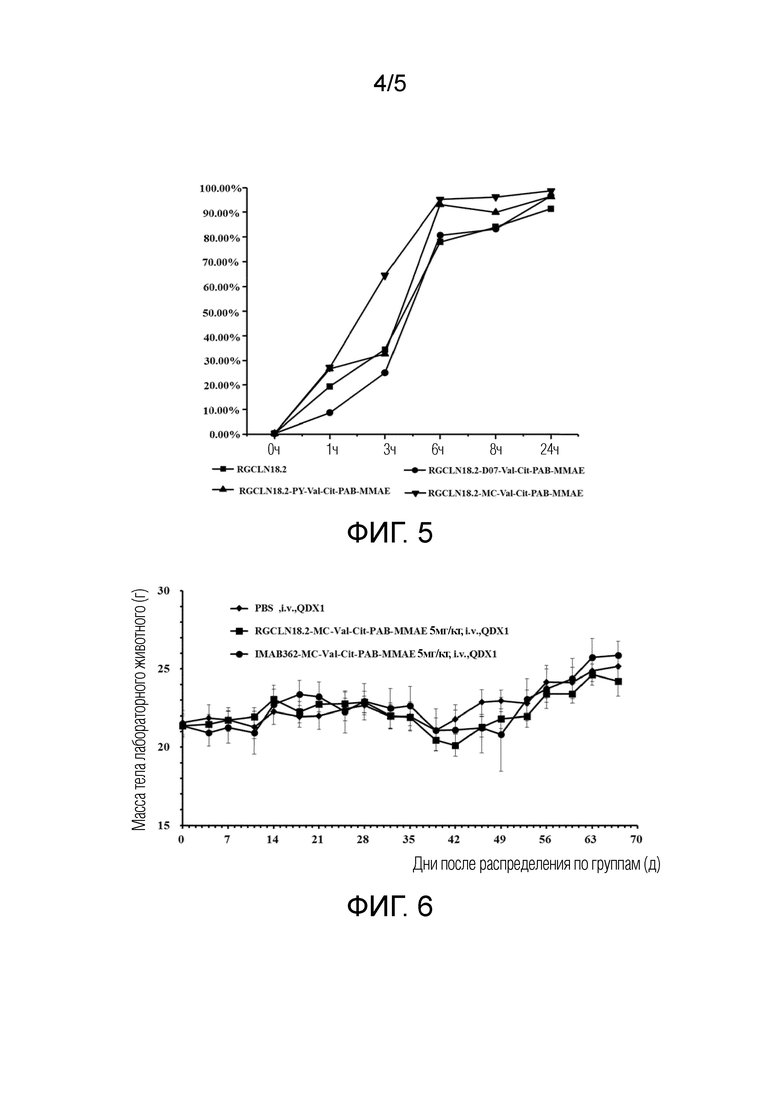
[0040] ФИГ. 4В представляет собой график, показывающий сравнение эффективности эндоцитоза CLN-03-6H2-01 и IMAB362 в модели рака поджелудочной железы AsPC-1;
[0041] ФИГ. 4С представляет собой график, показывающий сравнение эффективности эндоцитоза CLN-03-6H2-01 и IMAB362 в модели рака легкого А549;
[0042] ФИГ. 5 представляет собой график, показывающий сравнение эффекта эндоцитоза RGCLN18.2, RGCLN18.2-PY-Val-Cit-РАВ-ММАЕ, RGCLN18.2-MC-Val-Cit-PAB-MMAE, RGCLN18.2-D07-Val-Cit-РАВ-ММАЕ и IMAB362-MC-Val-Cit-MMAE, детектированного с помощью проточной цитометрии;
[0043] ФИГ. 6 представляет собой график, показывающий изменение массы тела животных после введения RGCLN18.2-MC-Val-Cit-PAB-MMAE, IMAB362-MC-Val-Cit-PAB-MMAE и PBS;
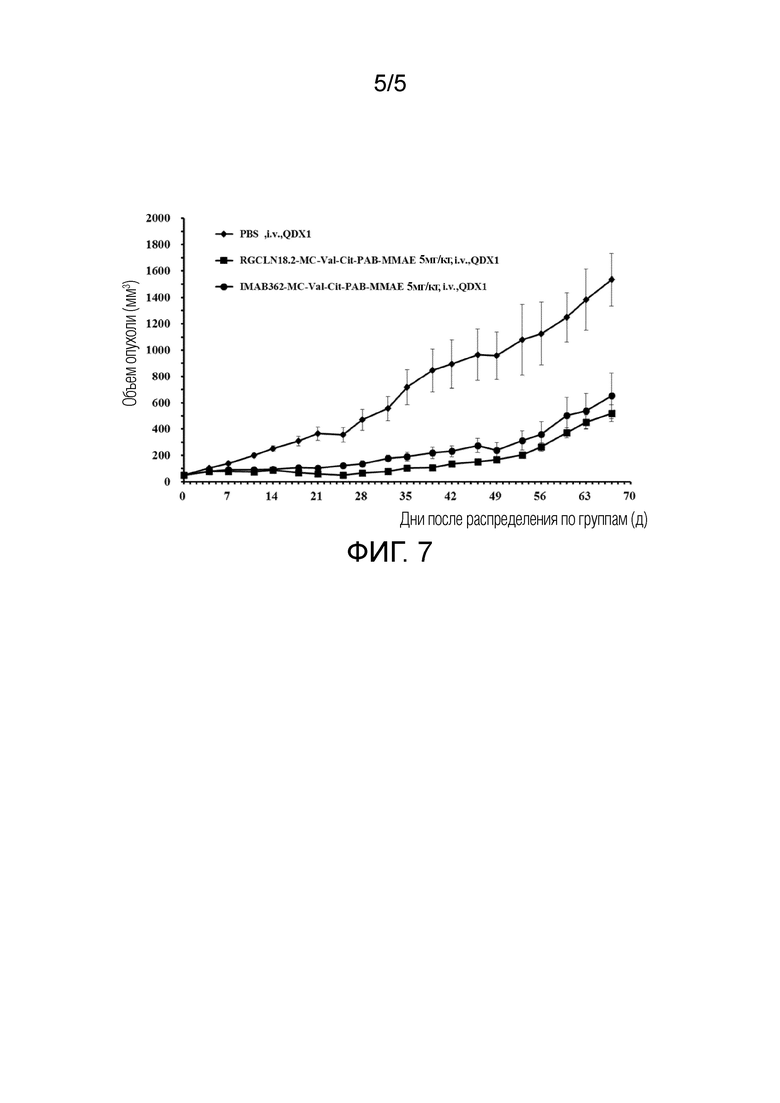
[004 4] ФИГ. 7 представляет собой график, показывающий изменение объема опухоли у животных после введения RGCLN18.2-МС-Val-Cit-РАВ-ММАЕ, IMAB362-MC-Val-Cit-PAB-MMAE и PBS.
ПОДРОБНОЕ ОПИСАНИЕ
[Определение]
[0045] Если не указано иное, все используемые здесь технические и научные термины имеют такое же значение, как их понимают специалисты в данной области техники. Что касается определений и терминов в данной области техники, можно сделать ссылку на Current Protocols in Molecular Biology (Ausubel). Стандартный трех- и/или однобуквенный код, используемый для обозначения одной из 20 стандартных L-аминокислот в данной области, принят в качестве аббревиатуры аминокислотного остатка.
[0046] В настоящем изобретении способ определения или нумерации определяющей комплементарность области (CDR) вариабельного домена антитела включает IMGT, Kabat, Chothia, AbM и Contact, которые хорошо известны в данной области.
[0047] Для целей настоящего изобретения «согласованность», «идентичность» или «сходство» между двумя последовательностями нуклеиновых кислот или аминокислот относится к проценту идентичных нуклеотидов или идентичных аминокислотных остатков между двумя последовательностями, подлежащими сравнению после оптимального выравнивания. Процент является чисто статистическим, и различия между двумя последовательностями распределяются случайным образом и охватывают всю их длину. Сравнение последовательностей между двумя последовательностями нуклеиновых кислот или аминокислот обычно выполняется путем сравнения этих последовательностей после того, как они были оптимально подобраны, и сравнение может быть выполнено на сегменте или в «окне сравнения». В дополнение к ручной реализации оптимальное выравнивание для сравнения последовательностей также может быть выполнено с помощью алгоритма локальной гомологии Смита и Уотермана (1981) [Ad.Арр.Math.2:482], алгоритма локальной гомологии Ниддлмана и Вунша (1970) [J.Mol.Biol. 4 8: 4 43], метода поиска сходства Пирсона и Липмана (1988) [Proc.Nat1.Acad.Sci.USA8 5: 2444) или компьютерного программного обеспечения, использующего эти алгоритмы (GAP, BESTFIT, FASTA и TFASTA в программном пакете Wiscons in Genetics Software Package, Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин, или в программном обеспечении для сравнения BLASTN или BLASTP).
[0048] Используемый в настоящем описании термин «антитело» используется в самом широком смысле и включает различные антитела, включая, помимо прочего, моноклональное антитело и полиспецифическое антитело (например, биспецифическое антитело). Используемый в настоящем описании термин «антигенсвязывающий фрагмент» относится к фрагменту антитела, состоящему из или включающему неполную последовательность вариабельной области тяжелой или легкой цепи антитела, из которого он получен, причем неполная последовательность способна сохранять ту же специфичность связывания, что и антитело, из которого она получена, и достаточную аффинность, предпочтительно равную по меньшей мере 1/100, более предпочтительно по меньшей мере 1/10 аффинности антитела, из которого она получена. Такой функциональный фрагмент содержит минимум 5 аминокислот, предпочтительно 10, 15, 25, 50 или 100 непрерывно расположенных аминокислот последовательности антитела, из которого он получен, включая (в частности) Fab, F (ab'), F (ab') 2, Fv, dAb, Fd, фрагмент определяющей комплементарность области (CDR), одноцепочечное антитело (scFv) и бивалентное одноцепочечное антитело, содержащее по меньшей мере фрагмент иммуноглобулина, достаточный для того, чтобы специфический антиген мог связываться с полипептидом. Вышеуказанные фрагменты могут быть получены синтетическим или ферментативным способом, или химическим расщеплением интактного иммуноглобулина, или могут быть генетически сконструированы с помощью технологии рекомбинантной ДНК. Способы их получения хорошо известны в данной области. Тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена: CHI, СН2 и СН3. Легкая цепь содержит вариабельную область легкой цепи (сокращенно VL) и константную область легкой цепи. Константная область легкой цепи содержит домен CL. Области VH и VL могут быть дополнительно подразделены на множество областей с высокой вариабельностью, называемых областями, определяющими комплементарность (CDR), перемежающимися более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, которые расположены от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Эти вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константная область антитела может опосредовать связывание иммуноглобулина с тканью или фактором хозяина, включая различные клетки иммунной системы (такие как эффекторные клетки) и первый компонент классической системы комплемента (Clq). Химерные или гуманизированные антитела также охвачены антителами по настоящему изобретению.
[0049] Термин «гуманизированное антитело» относится к антителу, которое содержит область CDR с происхождением из антитела, не являющегося человеческим, а остальные имеют происхождение из одного (или нескольких) человеческих антител. Более того, для сохранения аффинности связывания некоторые остатки в сегменте остова (называемые FR) могут быть модифицированы (Документ 8: Jones et al., Nature, 321: 522-525, 1986; Verhoeyen et al., Science, 239: 1534-1536, 1988; Riechmann et al., Nature, 332: 323-327, 1988). Гуманизированные антитела или их фрагменты по настоящему изобретению могут быть получены способами, известными специалистам в данной области (Документ 9: Singer et al., J. Immun. 150: 2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10: 1-142, 1992; или Bebbington et al., Bio/Technology, 10: 169-175, 1992).
[0050] Термин «химерное антитело» относится к антителу, в котором последовательность вариабельной области имеет происхождение из одного вида, тогда как последовательность константной области имеет происхождение из другого вида, например, к антителу, в котором последовательность вариабельной области имеет происхождение из мышиного антитела, а последовательность константной области из человеческого антитела. Химерное антитело или его фрагмент в соответствии с настоящим изобретением могут быть получены с использованием технологии генетической рекомбинации. Например, химерное антитело можно получить путем клонирования рекомбинантной ДНК, содержащей промотор и последовательность, кодирующую вариабельную область антитела, не являющегося человеческим, особенно мышиного моноклонального антитела по настоящему изобретению, и последовательность, кодирующую константную область человеческого антитела. Химерное антитело по настоящему изобретению, кодируемое таким рекомбинантным геном, будет представлять собой, например, химеру мышь-человек, специфичность которой определяется вариабельной областью, полученной из ДНК мыши, а изотип определяется константной областью, полученной из ДНК человека. Для способов получения химерного антитела, например, можно сделать ссылку на документ Verhoeyn et al. (BioEssays, 8:74, 1988).
[0051] Термин «моноклональное антитело» относится к препарату молекулы антитела, состоящего из одной молекулы. Композиции моноклональных антител демонстрируют единственную специфичность связывания и аффинность к конкретному эпитопу.
[0052] Термин «выделенная» молекула нуклеиновой кислоты относится к молекуле нуклеиновой кислоты, идентифицированной и отделенной по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, и которая в целом ассоциируется с загрязняющей молекулой нуклеиновой кислоты в природном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты отличается по форме или среде от того случая, когда она встречается в природе, и, следовательно, отличается от молекулы, существующей в клетках в природе. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, где обычно экспрессируется антитело, и где, например, оно расположено в хромосомном положении, отличном от положения в клетке в природе.
[0053] Как правило, для получения моноклонального антитела или его функционального фрагмента, особенно моноклонального антитела мышиного происхождения или его функционального фрагмента, можно сделать ссылку на технологию, специально описанную в руководстве «Antibodies» (Документ 10: Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988), или на метод получения из гибридомных клеток, описанный Kohler и Milstein (Nature, 256: 495-497, 1975).
[Пример]
[0054] Варианты осуществления настоящего изобретения будут подробно описаны ниже вместе с примерами. Однако специалистам в данной области техники будет понятно, что следующие примеры используются только для иллюстрации настоящего описания и не должны рассматриваться как ограничивающие объем настоящего описания.
[0055] Пример 1. Скрининг и определение аффинности мышиного антитела против Клаудина 18.2.
[0056] Мышей с нокаутом по Клаудину 18.2 (от Biocytogen (Beijing) Pharmaceutical Technology Co., Ltd.) иммунизировали клетками, содержащими плазмиду для экспрессии в эукариотических клетках, кодирующую первый внеклеточный домен Клаудина 18.2 в качестве иммуногена.
[0057] Всего было исследовано 22 мышиных антитела: CLN-4 0-3С8, CLN-07-4C3, CLN-39-8D11, CLN-39-1E1, CLN-03-6H2, CLN-03-4Е5, CLN-03-1A8, CLN-03-4A11, CLN-07-5B10, CLN-07-5G11, CLN-03-ЗА7, CLN-03-4C11, CLN-38-4H3, CLN-03-4G7, CLN-39-1B6, CLN-39-3Е7, CLN-03-1F5, CLN-38-8A1, CLN-39-7H7, CLN-03-6G10, CLN-40-6C9 и CLN-07-5D9.
[0058] Связывающую активность полученных 22 мышиных антител в отношении Клаудина 18.2 определяли с помощью FACS. Образцы разводили до конечной концентрации 10 мкг/мл, 1 мкг/мл, 0,1 мкг/мл, 0,01 мкг/мл и 0,001 мкг/мл и подвергали реакции с клетками CHO-Claudin 18.2 при 4°С в течение 30 мин, соответственно. После центрифугирования и удаления супернатанта в каждую лунку добавляли по 200 мкл PBS, центрифугировали при 2000 об/мин в течение 5 мин и дважды промывали. Затем в каждую лунку добавляли 50 мкл разбавленного 1:100 антитела против мышиного IgGFc-FITC (Abeam, кат.No. ab97264) при 4°С в течение 30 минут реакции, затем промывали один раз, повторяя стадию промывки, и, наконец, добавляли 200 мкл PBS для ресуспендирования для детектирования в автоматическом режиме. Результаты детектирования представлены в Таблице 3, что указывает на то, что множество антител показали хорошую связывающую активность.
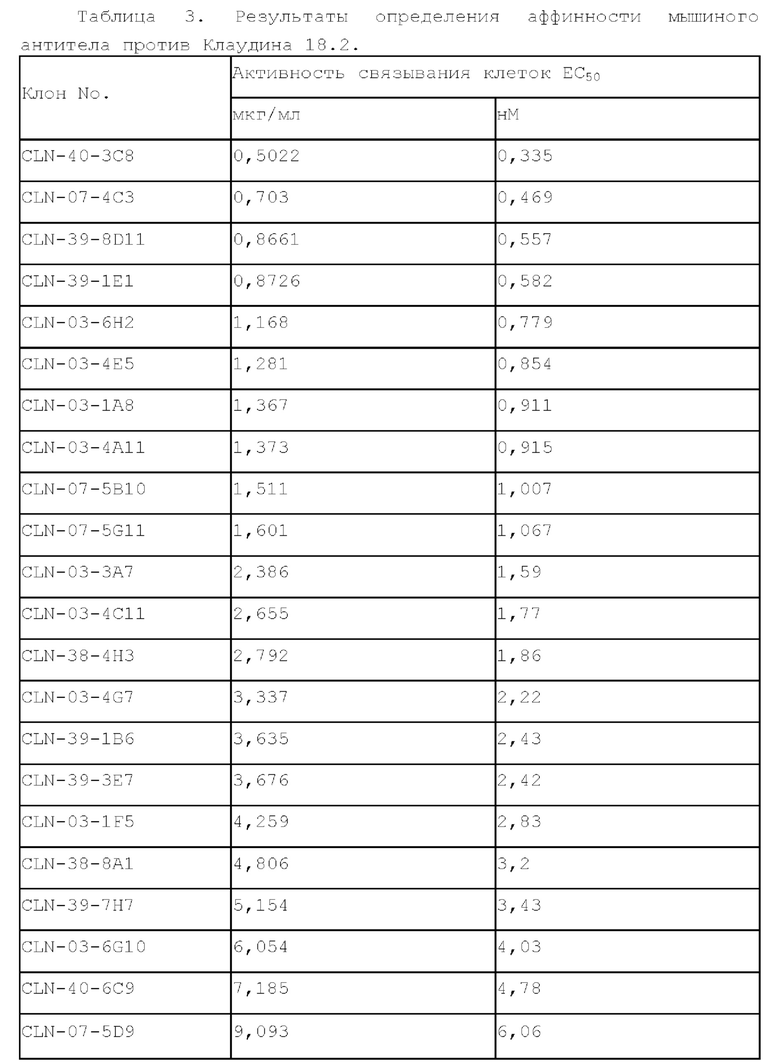
[0059] Пример 2. Оценка эффективности мышиного антитела против Клаудина 18.2 in vivo.
[0060] Отбирали 11 мышиных антител против Клаудина 18.2 с хорошей аффинностью (CLN-40-3C8, CLN-07-4C3, CLN-39-8D11, CLN-39-1Е1, CLN-03-6H2, CLN-03-4E5, CLN-03-1A8, CLN-03-4A11, CLN-07-5 В10, CLN-07-5G11 и CLN-03-3A7). На модели рака желудка PDX определяли терапевтический потенциал CLN-03-3A7, CLN-03-4E5 и CLN-03-6H2, и, таким образом, указанные выше три антитела подвергали последующей оценке эффективности in vivo.
[0061] Мышам B-NDG (эта модель мышей была предоставлена компанией Biocytogen Jiangsu Gene Biotechnology Co., Ltd.) подкожно инокулировали опухоль рака желудка и распределяли по группам, когда объем опухоли достигал 150 мм3, по 5 мышей в каждой экспериментальной группе. После распределения по группам мышиные антитела CLN-03-3A7, CLN-03-4E5 и CLN-03-6H2 с хорошими показателями эндоцитоза и связывания вводили в брюшную полость мышей в дозе 10 мг/кг два раза в неделю. Рост опухоли у мышей контролировали два раза в неделю (объем опухоли=0,5*длинный диаметр*короткий диаметр2). Конкретные результаты показаны на ФИГ. 1 и ФИГ. 2. Экспериментальные результаты показали, что мышиное антитело против Клаудина 18.2 оказывало значительное ингибирующее действие на опухоли и обладало хорошей безопасностью, при этом масса тела мышей существенно не менялась, а противоопухолевая активность трех мышиных антител была следующей: CLN -03-6H2>CLN-03-4E5>CLN-03-3A7.
[0062] Пример 3 Получение и определение аффинности химерного антитела
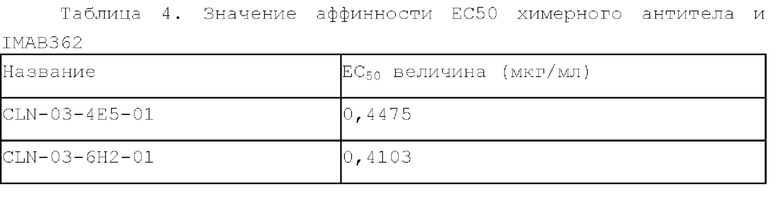
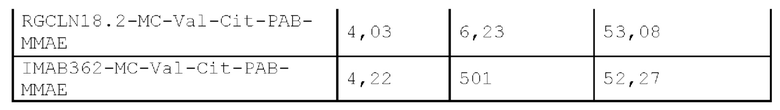
[0063] Два мышиных антитела CLN-03-4E5 и CLN-03-6H2 подвергали модификации с получением химерных антител CLN-03-4E5-01 и CLN-03-6H2-01, соответственно. Сравнивали аффинности CLN-03-4Е5-01, CLN-03-6H2-01 и IMAB362 (ь химерное моноклональное антитело человек-мышь, клаудиксимаб). Из результатов (как показано в Таблице 4 и на ФИГ. 3) видно, что CLN-03-4E5-01, CLN-03-6Н2-01 и IMAB362 показали хорошую аффинную активность, и оба химерных антитела CLN-03-4Е5-01 и CLN-03-6H2-01, представленные в настоящем описании, имели связывающую активность лучше, чем у IMAB3 62.

[0064] Пример 4 Определение эффективности эндоцитоза химерного антитела
[0065] Выявляли и сравнивали эффективность эндоцитоза химерного антитела CLN-03-6H2-01 и IMAB362 (химерное моноклональное антитело человек-мышь, клаудиксимаб). Очищенное химерное антитело метили в соответствии с инструкциями набора для мечения антител promega PHAb (Promega G9841), и концентрация антитела перед мечением составляла 2 мг/мл. Меченое антитело инкубировали с клетками модели рака желудка KATOIII (АТСС), модели рака поджелудочной железы AsPC-1 (АТСС) и модели рака легкого А54 9 (АТСС) в определенном градиенте концентрации при 37°С. Был установлен следующий временной градиент: 0 часов, 2 часа, 4 часа, 6 часов, 8 часов, 12 часов и 24 часа, и был установлен следующий градиент концентрации: 0,1 нМ, 1 нМ и 10 нМ. После отбора проб в фиксированной точке интенсивность флуоресценции определяли с помощью проточного цитометра. Экспериментальные результаты (см. ФИГ. 4А, ФИГ. 4В и ФИГ. 4С) показали, что химерное антитело CLN-03-6H2-01 обладало лучшим эффектом эндоцитоза, чем IMAB362, в различных линиях опухолевых клеток, где на ФИГ. 4А показано сравнение эффективности эндоцитоза CLN-03-6H2-01 и IMAB362 в модели рака желудка KATOIII, на ФИГ. 4В показано сравнение эффективности эндоцитоза CLN-03-6H2-01 и IMAB362 в модели рака поджелудочной железы AsPC-1, а на ФИГ. 4С показано сравнение эффективности эндоцитоза CLN-03-6Н2-01 и IMAB362 в модели рака легкого А549.
[0066] Пример 5. Гуманизация химерного антитела CLN-03-6H2-01.
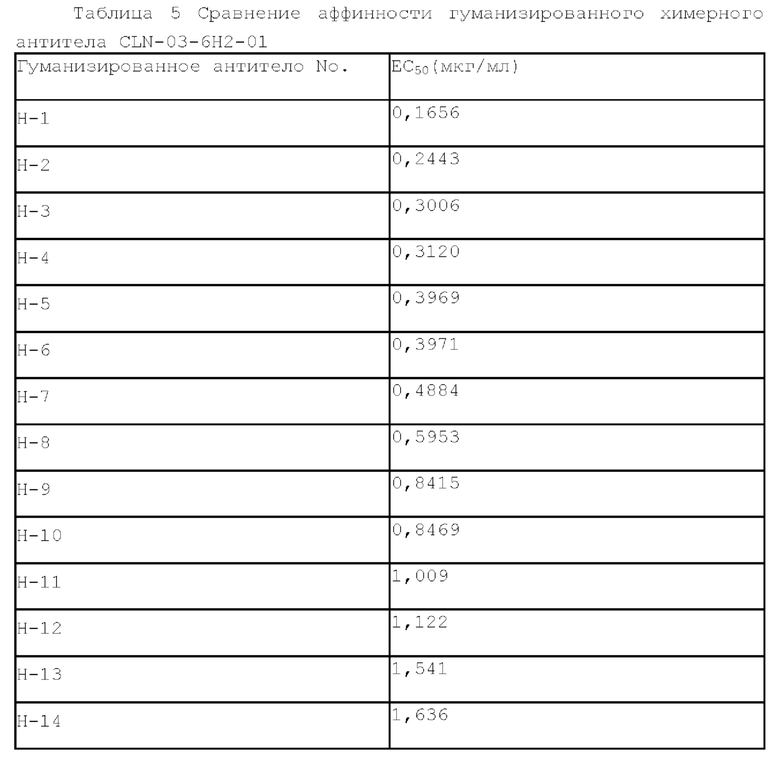
[0067] Химерное антитело CLN-03-6H2-01 гуманизировали путем трансплантации CDR легкой или тяжелой цепи в каркасную область легкой или тяжелой цепи иммуноглобулина. CDR легкой цепи и тяжелой цепи химерного антитела CLN-03-6H2-01 определяли с использованием системы Kabat. Каркасную область человеческого IgGl определяли путем выравнивания в базе данных вариабельных областей антител. Были сконструированы и синтезированы последовательности вариабельной области легкой цепи различных гуманизированных антител против Клаудина 18.2 и последовательности вариабельной области тяжелой цепи различных гуманизированных антител против Клаудина 18.2. Вариабельную область легкой цепи гуманизированного антитела против Клаудина 18.2 сливали с константной областью каппа-цепи человека с помощью ПЦР с получением полноразмерной легкой цепи гуманизированного антитела против Клаудина 18.2. Вариабельную область тяжелой цепи гуманизированного антитела против Клаудина 18.2 сливали с константной областью IgGl с помощью ПЦР с получением полноразмерной тяжелой цепи гуманизированного антитела против Клаудина 18.2. Различные легкие и тяжелые цепи объединяли и экспрессировали, а аффинность нескольких очищенных гуманизированных антител определяли с помощью проточной цитометрии (FACS) (см. Таблицу 5). Для секвенирования отбирали антитело Н-1, имеющее наилучшую аффинность (названное как антитело RGCLN18.2).

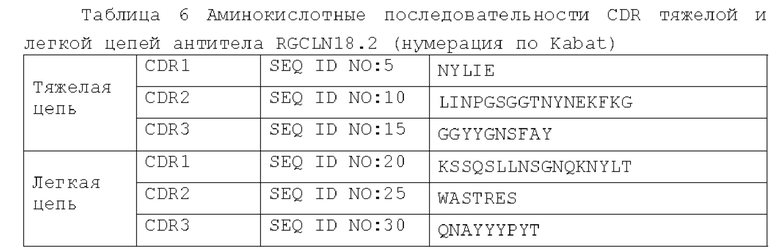
[0068] В Таблице 6 показаны аминокислотные
последовательности CDR легкой и тяжелой цепей антитела RGCLN18.2 (нумерация по Kabat).
[0069] Аминокислотная последовательность вариабельной области тяжелой цепи антитела RGCLN18.2 (SEQ ID NO: 1):

[0070] Аминокислотная последовательность вариабельной области легкой цепи антитела RGCLN18.2 (SEQ ID NO: 2):
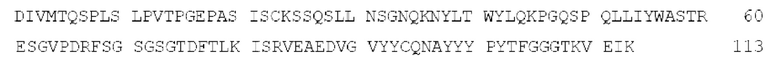
[0071] Аминокислотная последовательность тяжелой цепи антитела RGCLN18.2 (SEQ ID NO: 33):

[0072] Аминокислотная последовательность легкой цепи антитела RGCLN18.2 (SEQ ID NO: 34):

[0073] Пример 6. Получение конъюгата антитело-лекарственное средство (ADC).
[0074] Конъюгат антитело-лекарственное средство (ADC) готовили с использованием обычного метода сочетания: восстанавливающий агент и защитный агент были приготовлены с очищенной водой с использованием маточного раствора 1-20 мМ ТСЕР (трис-2-карбоксиэтилфосфин) и 1-20 мМ DTPA
(диэтилентриаминпентауксусная кислота). Восстанавливающий агент смешивали в количестве, варьирующемся в пределах определенного диапазона концентраций в соответствии с требуемой скоростью связывания, с определенной концентрацией (например, 5-30 мг/мл) моноклонального антитела в определенном объемном соотношении (1:1) при перемешивании при 25°С в течение 1 ч реакции, при мольном отношении конечной концентрации ТСЕР к антителу 0,5-6,0:1. Антитело с уменьшенным содержанием ТСЕР можно использовать непосредственно для конъюгации.
[0075] Соединение линкер-активная лекарственная единица готовили в определенной концентрации (5 мМ), растворяли в 25% ДМСО (диметилсульфоксид) и медленно добавляли лекарственное средство при молярном отношении лекарственного средства к тиолу 0,3-2,8:1 и перемешивали при 25°С в течение 1-4 ч реакции. После завершения реакции центрифугирование и ультрафильтрацию проводили 3 раза с буфером PBS для очистки, чтобы удалить остаточные непрореагировавшие лекарственные средства и свободные низкомолекулярные соединения, такие как ДМСО. Конъюгацию детектировали с помощью электрофореза SDS-PAGE и хроматографии гидрофобного взаимодействия-высокоэффективной жидкостной хроматографии (HIC-HPLC).
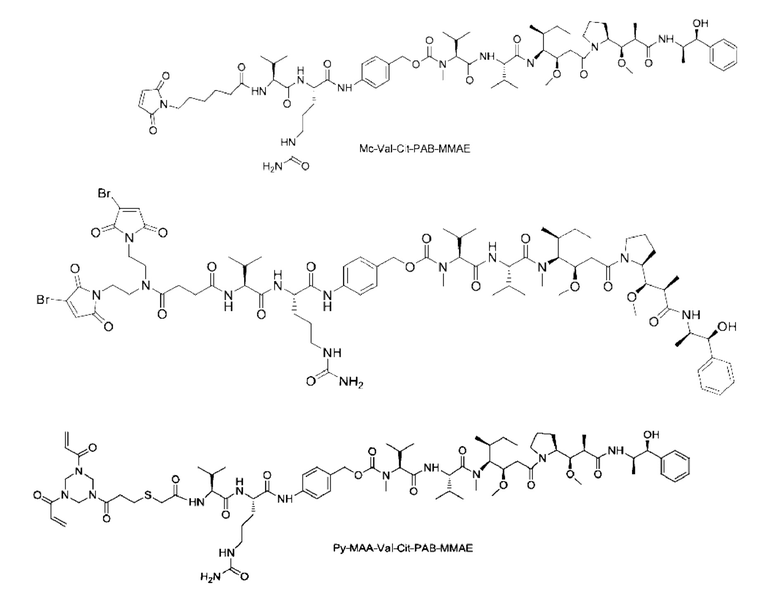
[0076] Соединения линкер-активная лекарственная единица, использованные в этом примере, представляли собой MC-Val-Cit-РАВ-ММАЕ, D07-Val-Cit-PAB-MMAE и Py-MAA-Val-Cit-РАВ-ММАЕ, которые имеют следующие структурные формулы соответственно (см. патентные заявки CN108853514A (страница 14 описания), CN111433188A (страница 53 описания) и W02019223579A1 (страницы 25-27 описания) для способов синтеза).
[0 077] Следующие ADC готовили описанным выше способом (р представляет собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7 и 8, q представляет собой целое число, выбранное из 1, 2, 3 и 4, и Ab представляет собой антитело RGCLN18.2, предложенное в настоящем описании), и средний DAR этих ADC составляет 3,5-4,5.
Пример 7. Эксперимент по эндоцитозу конъюгата антитело-лекарственное средство.
[007 8] Клетки клеточной линии рака желудка человека NCI-N87 суспендировали в лунках 6-луночного планшета в количестве приблизительно 1×105 клеток на лунку. RGCLN18.2, RGCLN18.2-PY-Val-Cit-PAB-MMAE, RGCLN18.2-MC-Val-Cit-PAB-MMAE, и RGCLN18.2-D07-Val-Cit-PAB-MMAE конъюгировали с pHAb, красителем, реагирующим с аминогруппой, соответственно, а затем разбавляли до 10 мкг/мл средой для культивирования клеток. К клеткам добавляли 100 мкл комплексов красителей RGCLN18.2 или ADC и инкубировали при 37°С в указанное время (0 ч, 1 ч, 3 ч, 5 ч, 21 ч и 24 ч). Эффект эндоцитоза RGCLN18.2 и АБС измеряли с помощью проточного цитометра, и результаты показаны на ФИГ. 5. По результатам эксперимента по эндоцитозу было установлено, что все, ADCsRGCLN18.2-PY-Val-Cit-PAB-MMAE, RGCLN18.2-MC-Val-Cit-РАВ-ММАЕ, и RGCLN18.2-D07-Val-Cit-РАВ-ММАЕ, имели скорость эндоцитоза примерно 98% через 24 часа. Результаты показали, что ADC RGCLN18.2 обладают очень хорошим эффектом эндоцитоза в клетках рака желудка человека NCI-N87.
[007 9] Пример 8. Оценка конъюгата антитело-лекарственное средство на клетках in vitro.
[0080] Суспензию клеток клеточной линии рака желудка человека NCI-N87 добавляли в лунки 9б-луночного планшета с плотностью 100 мкл/лунку и 5000 клеток/лунку, а затем культивировали в течение ночи при 37°С, увлажненного CO2-инкубатора. Конъюгаты антитело-лекарственное средство (RGCLN18.2-PY-Val-Cit-PAB-MMAE, RGCLN18.2-D07-Val-Cit-PAB-MMAE, RGCLN18.2-MC-Val-Cit-PAB-MMAE, IMAB362-MC-Val-Cit-MMAE) серийно разбавляли, добавляли в 96-луночный планшет, содержащий клетки в количестве 100 мкл/лунку, и культивировали еще 72 ч в инкубаторе при 37°С. Величину OD при 450 нм считывали с помощью устройства для считывания микропланшетов, а степень ингибирования рассчитывали как IR%=(OD пустой среды - OD лекарственного средства) × 100/OD пустой среды. Значение IC50 рассчитывали с помощью программного обеспечения для подбора кривой Softmax Pro7.0.3 Gxp, и результаты показаны в Таблице 7. Из приведенных выше экспериментальных данных теста эффективности in vitro было обнаружено, что ABC RGCLN18.2-PY-Val-Cit-РАВ-ММАЕ, RGCLN18.2-МС-Val-Cit-РАВ-ММАЕ, и RGCLN18.2-D07-Val-Cit-PAB-MMAE обладали лучшим ингибирующим действием на пролиферацию, чем IMAB362-MC-Val-Cit-MMAE.

Пример 9 Эксперимент на модели PDX (ксенотрансплантат, полученный от пациента) с конъюгатом антитело-лекарственное средство
[0081] Ткань рака поджелудочной железы человека промывали, разрезали на мелкие кусочки и инокулировали на правую лопатку спины бестимусных мышей с помощью троакара. При росте опухоли до 100-300 мм3 животных случайным образом разделяли на группы. Введение контрольной группы и экспериментальной группы показано в Таблице 8.

[0082] Экспериментальные результаты показаны на ФИГ. 6 и ФИГ. 7, где на ФИГ. 6 представлен график изменения массы тела животных контрольной и экспериментальной групп, а на ФИГ. 7 представлен график изменения объема опухоли у животных контрольной и экспериментальной групп. Результаты показали, что RGCLN18.2-MC-Val-Cit-PAB-MMAE оказывает более сильное противоопухолевое действие, чем IMAB362-MC-Val-Cit-PAB-MMAE, в модели PDX рака поджелудочной железы человека.
[0083] Вышеприведенное описание предназначено только для предпочтительных вариантов осуществления только в качестве примера и без ограничения комбинации признаков, необходимых для реализации настоящего описания. Представленные в настоящем описании заголовки не предназначены для ограничения различных вариантов осуществления настоящего описания. Такие термины, как «включающий» и «содержащий», не предназначены для ограничения. Кроме того, если не указано иное, форма единственного числа включает ссылки на множественное число, а «или» означает «и/или». Если иное не определено в настоящем описании, все технические и научные термины, используемые в настоящем описании, имеют то же значение, которое обычно понимают специалисты в данной области.
[0084] Все публикации и патенты, упомянутые в настоящей заявке, включены настоящее описание в качестве ссылки. Без отклонения от объема и сущности настоящего изобретения специалистам в данной области техники будут очевидны различные модификации и вариации описанного способа и композиции настоящего описания. Хотя настоящее изобретение было описано с использованием конкретных предпочтительных вариантов осуществления, следует понимать, что заявленное изобретение не должно быть чрезмерно ограничено этими конкретными вариантами осуществления. Фактически многие варианты описанных способов осуществления настоящего описания, очевидные для специалистов в данной области техники, предназначены для включения в объем прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> РЕМЕДЖЕН КО., ЛТД.
<120> АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО КОНЪЮГАТ
АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
<130> 2021
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Leu Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 2
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи
<400> 2
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 3
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 3
Gly Tyr Ala Phe Thr Asn Tyr
1 5
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 4
Gly Tyr Ala Phe Thr Asn Tyr Leu Ile Glu
1 5 10
<210> 5
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 5
Asn Tyr Leu Ile Glu
1 5
<210> 6
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 6
Thr Asn Tyr Leu Ile Glu
1 5
<210> 7
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 7
Gly Tyr Ala Phe Thr Asn Tyr Leu
1 5
<210> 8
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 8
Asn Pro Gly Ser Gly Gly
1 5
<210> 9
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 9
Leu Ile Asn Pro Gly Ser Gly Gly Thr Asn
1 5 10
<210> 10
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 10
Leu Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 11
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 11
Trp Met Gly Leu Ile Asn Pro Gly Ser Gly Gly Thr Asn
1 5 10
<210> 12
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 12
Ile Asn Pro Gly Ser Gly Gly Thr
1 5
<210> 13
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 13
Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr
1 5 10
<210> 14
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 14
Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr
1 5 10
<210> 15
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 15
Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr
1 5 10
<210> 16
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 16
Ala Arg Gly Gly Tyr Tyr Gly Asn Ser Phe Ala
1 5 10
<210> 17
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR тяжелой цепи
<400> 17
Ala Arg Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr
1 5 10
<210> 18
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 18
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 19
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 19
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 20
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 20
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 21
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 21
Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr
1 5 10
<210> 22
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 22
Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr
1 5 10
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 23
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 24
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 24
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 25
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 25
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 26
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 26
Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu
1 5 10
<210> 27
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 27
Trp Ala Ser
1
<210> 28
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 28
Gln Asn Ala Tyr Tyr Tyr Pro Tyr Thr
1 5
<210> 29
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 29
Gln Asn Ala Tyr Tyr Tyr Pro Tyr Thr
1 5
<210> 30
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 30
Gln Asn Ala Tyr Tyr Tyr Pro Tyr Thr
1 5
<210> 31
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 31
Gln Asn Ala Tyr Tyr Tyr Pro Tyr
1 5
<210> 32
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDR легкой цепи
<400> 32
Gln Asn Ala Tyr Tyr Tyr Pro Tyr Thr
1 5
<210> 33
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Leu Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Gly Asn Ser Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 34
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| АНТИ-МЕЗОТЕЛИН АНТИТЕЛО И ЕГО КОНЪЮГАТ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ | 2019 |
|
RU2747995C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2822550C2 |
| АНТИ-PD-L1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783685C2 |
| ЧЕТЫРЕХВАЛЕНТНЫЕ СИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2019 |
|
RU2807346C2 |
| КОНЬЮГАТ АНТИТЕЛА К КЛАУДИНУ И ЛЕКАРСТВЕННОГО СРЕДСТВА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2826119C1 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2815926C2 |
| АНТИТЕЛО К GIPR И ЕГО СЛИТЫЙ С GLP-1 БЕЛОК, А ТАКЖЕ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800370C2 |
Изобретение относится к области биотехнологии. Описаны антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, конъюгат антитело-лекарственное средство для лечения или профилактики онкологического заболевания, связанного с экспрессией Клаудина 18.2, выделенный полинуклеотид, кодирующий вышеуказанное антитело или его антигенсвязывающий фрагмент, конструкция нуклеиновой кислоты для лечения или профилактики онкологического заболевания, экспрессирующего Клаудин 18.2, клетка-хозяин, экспрессирующая антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, фармацевтическая композиция для лечения или профилактики онкологического заболевания, связанного с экспрессией Клаудина 18.2, способ получения антитела против Клаудина 18.2 или его антигенсвязывающего фрагмента и применение антитела или его антигенсвязывающего фрагмента, конъюгата антитело-лекарственное средство, полинуклеотида, конструкции нуклеиновой кислоты или фармацевтической композиции при производстве лекарственного средства для лечения или предотвращения онкологического заболевания, экспрессирующего Клаудин 18.2. Изобретение расширяет арсенал средств, связывающихся с Клаудином 18.2. 8 н. и 15 з.п. ф-лы, 9 ил., 8 табл., 9 пр.
1. Антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, где
(1) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 3, 8 и 13 и CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 18, 23 и 28;
(2) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 4, 9 и 14 и CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 19, 24 и 29;
(3) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 5, 10 и 15 и CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 20, 25 и 30;
(4) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 6, 11 и 16 и CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 21, 26 и 31; или
(5) CDR 1-3 вариабельной области тяжелой цепи имеют аминокислотные последовательности SEQ ID NO: 7, 12 и 17 и CDR 1-3 вариабельной области легкой цепи имеют аминокислотные последовательности SEQ ID NO: 22, 27 и 32.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где:
(1) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 1 или содержит те же CDR 1-3, что и в SEQ ID NO: 1, и более чем на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 1; и
(2) вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 2 или содержит те же CDR 1-3, что и в SEQ ID NO: 2, и более чем на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO: 2.
3. Антитело или его антигенсвязывающий фрагмент по п. 2, где
(1) тяжелая цепь имеет аминокислотную последовательность SEQ ID NO: 33 и
(2) легкая цепь имеет аминокислотную последовательность SEQ ID NO: 34.
4. Антитело или его антигенсвязывающий фрагмент по п. 1, где указанное антитело или его антигенсвязывающий фрагмент включает моноклональное антитело, Fab, Fab', Fab'-SH, F(ab')2, Fv, одноцепочечный Fv (scFv), биспецифическое антитело, полиспецифическое антитело, химерное антитело, гуманизированное антитело или слитый белок, содержащий антигенсвязывающий фрагмент антитела; предпочтительно антитело представляет собой гуманизированное моноклональное антитело.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-4, дополнительно содержащее константную область человека или мыши; предпочтительно константную область выбирают из группы, состоящей из IgG1, IgG2, IgG3 и IgG4.
6. Конъюгат антитело-лекарственное средство для лечения или профилактики онкологического заболевания, связанного с экспрессией Клаудина 18.2, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5.
7. Конъюгат антитело-лекарственное средство по п. 6, где конъюгат антитело-лекарственное средство имеет структуру, представленную формулой (I)
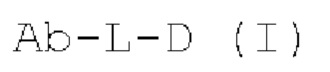 ,
,
где Ab представляет собой антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5;
D представляет собой активную лекарственную единицу;
L представляет собой любую связывающую группу, которая ковалентно связана с антителом или антигенсвязывающим фрагментом этого Ab и активной лекарственной единицей D, соответственно;
где Ab связано с одной или более активными лекарственными единицами D через одну или более связывающих групп L.
8. Конъюгат антитело-лекарственное средство по п. 7, где L ковалентно связана с амино- или тиольным остатком антитела Ab; предпочтительно L ковалентно связана с тиольным остатком антитела Ab; более предпочтительно L ковалентно связана с тиольным остатком, образованным разрывом межцепочечной дисульфидной связи антитела Ab.
9. Конъюгат антитело-лекарственное средство по п. 7, где L включает расщепляемый линкер и нерасщепляемый линкер.
10. Конъюгат антитело-лекарственное средство по п. 9, где расщепляемый линкер включает пептидную единицу, содержащую 2-20 аминокислот, предпочтительно пептидный линкер выбран из группы, состоящей из -валин-цитруллин-(-Val-Cit-), -глицин-глицин-фенилаланин-глицин-(-Gly-Gly-Phe-Gly-), -валин-аланин-(-Val-Ala-), валин-лизин-(-Val-Lys-), -валин-аргинин-(-Val-Arg-), -фенилаланин-цитруллин-(-Phe-Cit-), -фенилаланин-лизин-(-Phe-Lys-), -фенилаланин-аргинин-(-Phe-Arg-) и их комбинации.
11. Конъюгат антитело-лекарственное средство по любому из пп. 7-10, где L содержит структуру, выбранную из группы, состоящей из:
12. Конъюгат антитело-лекарственное средство по п. 7, где активная лекарственная единица D выбрана из группы, состоящей из цитотоксической молекулы, фактора клеточной дифференцировки, трофического фактора стволовых клеток, стероидного лекарственного средства, лекарственного средства для лечения аутоиммунных заболеваний, противовоспалительного лекарственного средства и лекарственного средства для лечения инфекционных заболеваний; предпочтительно цитотоксическая молекула включает, но не ограничивается ими, ингибитор тубулина или агент, повреждающий ДНК; ингибитор тубулина включает, но не ограничивается ими, цитотоксическую молекулу доластатинов и ауристатинов, цитотоксическую молекулу майтанзинов; агент, повреждающий ДНК, включает, но не ограничивается ими, калихеамицины, дуокармицины, производное антрамицина пирролобензодиазепин (PBD), камптотецины и их производные и SN-38; более предпочтительно, молекула цитокинов ауристатинов включает, но не ограничивается ими, ММАЕ, MMAF или их производные; и цитотоксическая молекула майтанзинов включает, но не ограничивается ими, DM1, DM4 или их производные.
13. Конъюгат антитело-лекарственное средство по п. 7, где активная лекарственная единица D имеет структуру, выбранную из группы, состоящей из:
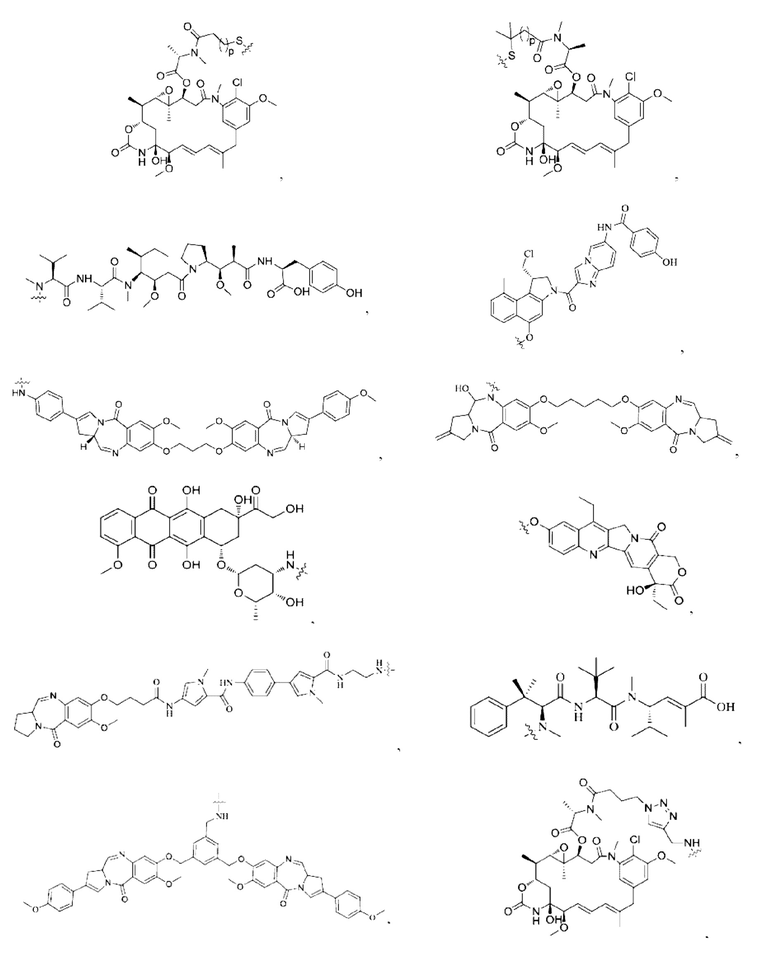
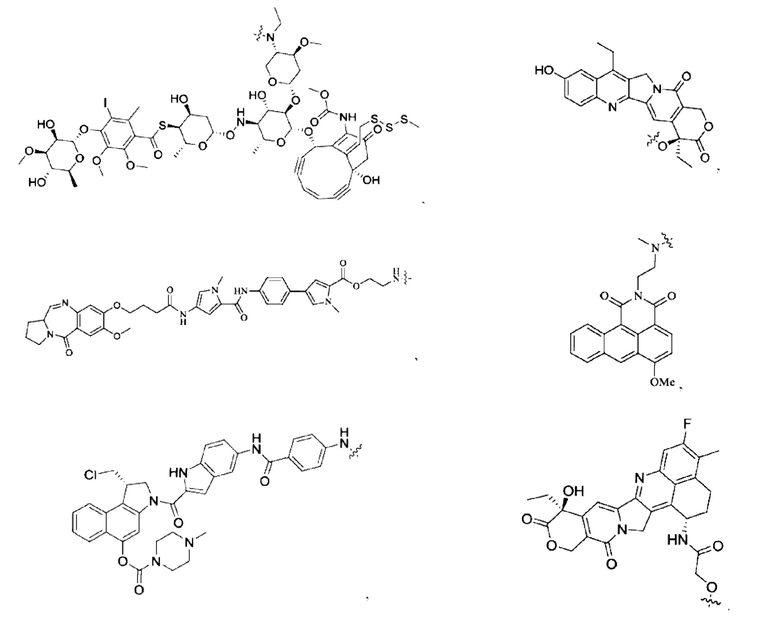
14. Конъюгат антитело-лекарственное средство по п. 7, где конъюгат антитело-лекарственное средство имеет структуру, выбранную из группы, состоящей из:
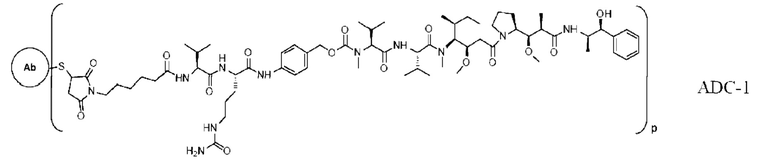
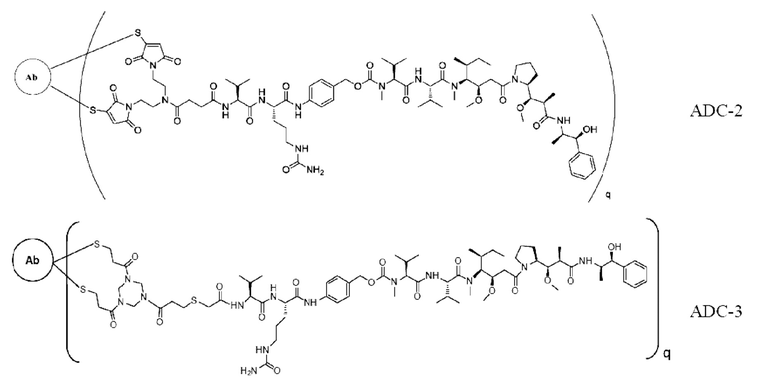
где р представляет собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7 и 8, и q представляет собой целое число, выбранное из 1, 2, 3 и 4.
15. Выделенный полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5.
16. Конструкция нуклеиновой кислоты для лечения или профилактики онкологического заболевания, экспрессирующего Клаудин 18.2, содержащая полинуклеотид по п. 15.
17. Конструкция нуклеиновой кислоты по п. 16, где конструкция нуклеиновой кислоты представляет собой вектор.
18. Клетка-хозяин, экспрессирующая антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, содержащая конструкцию нуклеиновой кислоты по п. 16 или 17.
19. Клетка-хозяин по п. 18, где клетка выбрана из группы, состоящей из прокариотической клетки, эукариотической клетки, дрожжевой клетки, клетки млекопитающего, клетки Е. coli или клетки СНО, клетки NS0, клетки Sp2/0 и клетки ВНК.
20. Фармацевтическая композиция для лечения или профилактики онкологического заболевания, связанного с экспрессией Клаудина 18.2, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5 и/или конъюгат антитело-лекарственное средство по п. 6 или 13 и фармацевтически приемлемый носитель.
21. Способ получения антитела против Клаудина 18.2 или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по п. 18 или 19 в условиях, подходящих для экспрессии вектора, кодирующего антитело против Клаудина 18.2 или его антигенсвязывающий фрагмент, и выделение антитела или фрагмента.
22. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-5, конъюгата антитело-лекарственное средство по пп. 6-13, полинуклеотида по п. 15, конструкции нуклеиновой кислоты по п. 16, вектора по п. 17 или фармацевтической композиции по п. 20 при производстве лекарственного средства для лечения или предотвращения онкологического заболевания, экспрессирующего Клаудин 18.2.
23. Применение по п. 22, где онкологическое заболевание представляет собой солидную опухоль; кроме того, солидная опухоль включает рак желудка и рак поджелудочной железы.
| EP 3808376 A1 21.04.2021 | |||
| WO 2020023679 A1 30.01.2020 | |||
| US 20190233511 A1 01.08.2019 | |||
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩАЯ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2014 |
|
RU2678700C2 |
Авторы
Даты
2024-02-27—Публикация
2022-05-07—Подача