СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0] Настоящая заявка включает список последовательностей, поданный в электронном виде в формате ASCII и включенный, таким образом, в заявку в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 20 апреля 2017 года, названа PCFC-1000-WO1_SL.txt и имеет размер 102679 байт.
СТОРОНЫ ДОГОВОРА О СОВМЕСТНОМ ИССЛЕДОВАНИИ
[1] Описываемое в настоящей заявке изобретение создано перечисленными ниже сторонами договора о совместном исследовании или от их имени. Договор о совместном исследовании действовал на дату создания описываемого в заявке изобретения или до нее, и описываемое в заявке изобретение получали в результате действий, предпринятых в рамках договора о совместном исследовании. Сторонами договора о совместном исследовании являются PARTNERS HEALTHCARE и PFIZER INC.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[2] Интерфероновое (IFN) семейство цитокинов исходно обнаружили по их способности защищать клетки от вирусных инфекций, но теперь считают, что это семейство эволюционно консервативных цитокинов может вызывать широкий спектр ответов. Семейство состоит из подсемейств IFN типа I, типа II и типа III, и IFN типа I являются наиболее разнообразным из всех семейств цитокинов. IFN типа I человека кодируются 13 генами для подтипов IFNα и отдельными генами для каждого из IFNβ, IFNω, IFNκ и IFNε. IFNβ и несколько изоформ IFNα являются наиболее изученными из IFN типа I. Большинство белков IFNα имеют идентичность 78-98%, и IFNβ имеют идентичность ~35% по отношению к консенсусной последовательности IFNα. IFNβ является природно гликозилированным, в то время как изоформы IFNα, как правило, лишь слабо гликозилированы. Все IFN типа I связываются с цитокиновым рецептором класса II IFNAR (состоящим из двух цепей IFNAR1 и IFNAR2) на поверхности клетки. IFNα имеет время полужизни в сыворотке 2-3 часа, но IFNβ является гидрофобным и его редко обнаруживают в сыворотке, и эти характеристики соответствуют представлению о том, что IFNα является системно эффективным, в то время как IFNβ действует локально аутокринным/паракринным образом.
[3] Продукцию IFN можно стимулировать посредством воздействия полученными из микроорганизмов патоген-ассоциированными молекулярными паттернами, включая нуклеиновые кислоты, липиды, белки и липопротеины микроорганизмов. Однако, возникает все больше доказательств того, что продукцию IFN также можно стимулировать с помощью эндогенных компонентов, высвобождающихся при патологических процессах, и это особенно важно в отношении системной красной волчанки (SLE) и других ревматоидных заболеваний, таких как дерматомиозит (DM). SLE зачастую характеризуется патологической гиперпродукцией IFN типа I, и IFNα определим в сыворотках ограниченного количества пациентов с SLE.
[4] Все больше доказательств также свидетельствуют о важности экспрессии интерферон-регулируемого гена (IRG) при манифестации активности/тяжести SLE, о чем свидетельствуют клинические результаты при использовании антитела против IFNAR анифролимаба. В плацебо-контролируемом исследовании фазы 2 анифролимаб снижал тяжесть заболевания в отношении множества клинических конечных точек, одновременно ингибируя сигнатуру IRG приблизительно на 90% при обеих дозах, тестируемых в этом исследовании.
[5] В дополнение к антителу против рецептора IFN анифролимабу (против IFNAR) в стадии клинической разработки находятся несколько антител против IFNα, таких как сифалимумаб, ронтализумаб и AGS-009. Эти попытки сфокусированы на IFNα, т.к. большой объем доказательств (включая генетические, иммунологические, серологические и клинические исследования) свидетельствует об ассоциации IFNα с аутоиммунными нарушениями. Однако, учитывая научные доказательства, имеющиеся к настоящему моменту, ожидают, что IFNβ будет играть в аутоиммунных нарушениях роль, схожую с IFNα. К настоящему моменту не описаны терапевтические антитела, специфически направленные на IFNβ (но не IFNα). Таким образом, существует неудовлетворенная потребность в антителе, специфически связывающемся с IFNβ, для применения для различных терапевтических или диагностических целей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[6] Изобретение относится к антителам и их антигенсвязывающим фрагментам, связывающимся с интерфероном бета (IFNβ), а также их применению и связанным с этим способам.
[7] С учетом представленного в настоящем описании специалистам в этой области будут понятны многие эквиваленты конкретных вариантов осуществления изобретения, представленных в настоящем описании, или они смогут установить их с использованием не более чем рутинного экспериментирования. Такие эквиваленты должны быть включены в следующие варианты осуществления (E).
E1. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с интерфероном β человека (IFNβ).
E2. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где указанное антитело или его антигенсвязывающий фрагмент, по существу, не связывается с IFNα человека.
E3. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 1, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD), составляющим по меньшей мере в 100 раз меньше, по меньшей мере в 200 раз меньше, по меньшей мере в 300 раз меньше, по меньшей мере в 400 раз меньше, по меньшей мере в 500 раз меньше, по меньшей мере в 600 раз меньше, по меньшей мере в 700 раз меньше, по меньшей мере в 800 раз меньше, по меньшей мере в 900 раз меньше, или по меньшей мере в 1000 раз меньше значения KD для IFNα человека.
E4. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с эпитопом IFNβ человека, где указанный эпитоп содержит один или несколько остатков из аминокислотных остатков 85-100 в соответствии с нумерацией SEQ ID NO: 41.
E5. Выделенное антитело или его антигенсвязывающий фрагмент по варианту осуществления 4, где указанный эпитоп содержит один или несколько остатков, выбранных из группы, состоящей из Ala89, Tyr92, His93 и His97 в соответствии с нумерацией SEQ ID NO: 41.
E6. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 4 или 5, где указанный эпитоп содержит остатки Ala89, Tyr92, His93 и His97 в соответствии с нумерацией SEQ ID NO: 41.
E7. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 4-6, где указанный эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Phe8, Leu9, Ser12, Gln16, Asn86, Asn90, Asp96 и Thr100 в соответствии с нумерацией SEQ ID NO: 41.
E8. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 4-7, где указанный эпитоп дополнительно содержит остатки Phe8, Leu9, Ser12, Gln16, Asn86, Asn90, Asp96 и Thr100 в соответствии с нумерацией SEQ ID NO: 41.
E9. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 4-8, где указанный эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Leu5, Leu6, Ser13, Phe15 и Thr82 в соответствии с нумерацией SEQ ID NO: 41.
E10. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-9, где указанное антитело или его антигенсвязывающий фрагмент, по существу, не связывается с IFNβ мыши.
E11. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-9, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD), составляющим по меньшей мере в 100 раз меньше, по меньшей мере в 200 раз меньше, по меньшей мере в 300 раз меньше, по меньшей мере в 400 раз меньше, по меньшей мере в 500 раз меньше, по меньшей мере в 600 раз меньше, по меньшей мере в 700 раз меньше, по меньшей мере в 800 раз меньше, по меньшей мере в 900 раз меньше или по меньшей мере в 1000 раз меньше значения KD для IFNβ мыши.
E12. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-11, где указанное антитело или его антигенсвязывающий фрагмент, по существу, не связывается с IFNβ крысы.
E13. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-11, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD), составляющим по меньшей мере в 100 раз меньше, по меньшей мере в 200 раз меньше, по меньшей мере в 300 раз меньше, по меньшей мере в 400 раз меньше, по меньшей мере в 500 раз меньше, по меньшей мере в 600 раз меньше, по меньшей мере в 700 раз меньше, по меньшей мере в 800 раз меньше, по меньшей мере в 900 раз меньше или по меньшей мере в 1000 раз меньше значения KD для IFNβ крысы.
E14. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-13, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD), составляющим по меньшей мере в 50 раз меньше, по меньшей мере в 100 раз меньше, по меньшей мере в 150 раз меньше или по меньшей мере в 200 раз меньше значения KD для IFNβ кролика.
E15. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-14, где указанное антитело или его антигенсвязывающий фрагмент также специфически связывается с IFNβ яванского макака.
E16. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 3, 11, 13 и 14, где указанное значение KD измеряют посредством поверхностного плазмонного резонанса (SPR), необязательно, с использованием устройства Biacore T200.
E17. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-16, содержащий вариабельную область тяжелой цепи (VH), содержащую:
(a) определяющую комплементарность область один VH (CDR-H1), содержащую аминокислотную последовательность SEQ ID NO: 37,
(b) определяющую комплементарность область два VH (CDR-H2) содержащую аминокислотную последовательность SEQ ID NO: 38; и
(c) определяющую комплементарность область три VH (CDR-H3) содержащую аминокислотную последовательность SEQ ID NO: 39.
E18. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-17, содержащее последовательности CDR-H1, CDR-H2, и CDR-H3 SEQ ID NO: 28.
E19. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее VH, содержащую:
(a) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 37,
(b) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 38; и
(c) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 39.
E20. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее VH, содержащую один или несколько остатков паратопов, выбранных из группы, состоящей из: Trp33 в CDR-H1, Tyr56 в CDR-H2, Tyr58 в CDR-H2 и Tyr97 в CDR-H3 в соответствии с нумерацией по Kabat.
E21. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 20, где указанная VH дополнительно содержит один или несколько остатков паратопов, выбранных из группы, состоящей из: Asp54 в CDR-H2, Gln61 в CDR-H2, Gly98 в CDR-H3 и Leu100 в CDR-H3 в соответствии с нумерацией по Kabat.
E22. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-21, содержащее каркас VH, полученный из каркасной последовательности VH3, VH1 или VH5 зародышевой линии человека.
E23. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-21, содержащее каркасную последовательность VH, полученную из каркасной последовательности IGHV3-7, IGHV3-23 или IGHV1-69 зародышевой линии человека.
E24. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-21, содержащее каркасную последовательность VH, полученную из каркасной последовательности DP10, DP-88, DP-25, DP-73, IGHV5-10-1*01, IGHV5-10-1*04, DP-14, DP-75, DP15, DP-8, DP-7 или IGHV7-4-1*02 зародышевой линии человека, предпочтительно, каркасной последовательности DP-88, DP-25, DP-73, IGHV5-10-1*01 или IGFV-10-1*04.
E25. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-24, содержащее VH, содержащую:
(a) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 37; CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 38; и CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 39; и
(b) каркас VH, содержащий последовательность, по меньшей мере на 73%, по меньшей мере на 75%, по меньшей мере на 79%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 93% или по меньшей мере на 99% идентичную каркасной последовательности DP10 зародышевой линии человека.
E26. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 25, где указанный каркас VH дополнительно содержит четыре или менее, три или менее или два или менее различия аминокислот по сравнению с каркасной последовательностью DP10 зародышевой линии человека в следующих положениях (в соответствии с нумерацией по Kabat): (A) H2, H47, H48, H49, H67, H69, H71, H73, H93 и H94; (B) H37, H39, H45, H47, H91 и H93; и (C) H24, H71 и H94.
E27. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-26, содержащее каркасную последовательность VH, полученную из DP10 зародышевой линии человека.
E28. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-21, содержащее консенсусную каркасную последовательность VH зародышевой линии человека.
E29. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-28, содержащее последовательность VH, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 28.
E30. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-29, содержащее вариабельную область легкой цепи (VL), содержащую:
(a) определяющую комплементарность область один VL (CDR-L1), содержащую аминокислотную последовательность SEQ ID NO: 34,
(b) определяющую комплементарность область два VL (CDR-L2), содержащую аминокислотную последовательность SEQ ID NO: 35; и
(c) определяющую комплементарность область три VL (CDR-L3), содержащую аминокислотную последовательность SEQ ID NO: 36.
E31. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-30, содержащее последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 1.
E32. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-29, содержащее VL, содержащую один или несколько остатков паратопов, выбранных из группы, состоящей из: Tyr32 в CDR-L1, Ile92 в CDR-L3 и Leu94 в CDR-L3 в соответствии с нумерацией по Kabat.
E33. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 32, где указанная VL дополнительно содержит один или несколько остатков паратопов, выбранных из группы, состоящей из: Gln27 в CDR-L1, Asp28 в CDR-L1, Ile29 в CDR-L1, Gly30 в CDR-L1 и Ile93 в CDR-L3 в соответствии с нумерацией по Kabat.
E34. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее последовательности CDR-H1, CDR-H2 и CDR-H3 SEQ ID NO: 28 и последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 1.
E35. Выделенное антитело или его антигенсвязывающий фрагмент, специфические связывающееся с IFNβ человека, содержащее:
(i) VH, содержащую:
(a) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 37,
(b) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 38; и
(c) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 39;
и (ii) VL, содержащую:
(a) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 34,
(b) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 35; и
(c) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 36.
E36. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее VL, содержащую один или несколько остатков паратопов, выбранных из группы, состоящей из: Tyr32 в CDR-L1, Ile92 в CDR-L3 и Leu94 в CDR-L3 в соответствии с нумерацией по Kabat.
E37. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 36, где указанная VL дополнительно содержит один или несколько остатков паратопов, выбранных из группы, состоящей из: Gln27 в CDR-L1, Asp28 в CDR-L1, Ile29 в CDR-L1, Gly30 в CDR-L1 и Ile93 в CDR-L3 в соответствии с нумерацией по Kabat.
E38. Выделенное антитело или его антигенсвязывающий фрагмент, специфические связывающееся с IFNβ человека, содержащее (нумерация по Kabat):
(i) VH, содержащую:
(a) CDR-H1, содержащую Trp33 и три или менее различия аминокислот по сравнению с SEQ ID NO: 37,
(b) CDR-H2, содержащую Asp54, Tyr56, Tyr58 и Gln61 и три или менее различия аминокислот по сравнению с ID NO: 38; и
(c) CDR-H3, содержащую Tyr97, Gly98 и Leu100 и три или менее различия аминокислот по сравнению с SEQ ID NO: 39; и
(ii) VL, содержащую:
(a) CDR-L1, содержащую Gln27, Asp28, Ile29, Gly30, Tyr32 и три или менее различия аминокислот по сравнению с SEQ ID NO: 34,
(b) CDR-L2, содержащую последовательность, содержащую три или менее различия аминокислот по сравнению с SEQ ID NO: 35; и
(c) CDR-L3, содержащую Ile92, Ile93 и Leu94 и три или менее различия аминокислот по сравнению с SEQ ID NO: 36.
E39. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 38, где указанные различия аминокислот в CDR-H1, CDR-H2, CDR-L1, CDR-L2 и CDR-L3 являются заменами в зародышевой линии человека, при которых остаток не принадлежащей человеку CDR заменяют соответствующим остатком зародышевой линии человека.
E40. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-39, содержащее каркас VL, полученный из каркасной последовательности Vκ или Vλ зародышевой линии человека.
E41. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-39, содержащее каркас VL, полученный из каркасной последовательности IGKV1-39 или IGKV3-20 зародышевой линии человека.
E42. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-39, содержащее каркас VL, полученный из каркасной последовательности DPK9, DPK5, DPK4, DPK1, IGKV1-5*01, DPK24, DPK21, DPK15, IGKV1-13*02, IGKV1-17*01, DPK8, IGKV3-11*01 или DPK22 зародышевой линии человека, предпочтительно, каркасной последовательности DPK5, DPK4, DPK1, IGKV1-5*01, DPK24, DPK21 или DPK15.
E43. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-42, содержащее VL, содержащую:
(a) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 34; CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 35; и CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 36; и
(b) каркас VL, содержащий последовательность, по меньшей мере на 66%, по меньшей мере на 74%, по меньшей мере на 76%, по меньшей мере на 80%, по меньшей мере на 96%, по меньшей мере на 97% или по меньшей мере на 99% идентичную каркасной последовательность DPK9 зародышевой линии человека.
E44. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 43, где указанный каркас VL дополнительно содержит одно различие аминокислот или не содержит различия аминокислот по сравнению с каркасной последовательностью DPK9 зародышевой линии человека в следующих положениях (в соответствии с нумерацией по Kabat): (A) L2, L4, L35, L36, L46, L47, L48, L49, L64, L66, L68, L69 и L71; (B) L36, L38, L44, L46 и L87; и (C) L2, L48, L64 и L71.
E45. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-44, содержащее каркасную последовательность VH, полученную из DPK9 зародышевой линии человека.
E46. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-39, содержащее консенсусную каркасную последовательность VL зародышевой линии человека.
E47. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-46, содержащее последовательность VL, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 1.
E48. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-47, содержащее последовательность константной области тяжелой цепи (CH), по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 29.
E49. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-48, содержащее последовательность константной области легкой цепи (CL), по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 30.
E50. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-49, содержащее Fc-домен.
E51. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 50, где указанный Fc-домен из IgA, такого как IgA1 или IgA2.
E52. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 50, где указанный Fc-домен получают из IgD.
E53. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 50, где указанный Fc-домен получают из IgE.
E54. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 50, где указанный Fc-домен получают из IgM.
E55. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 50, где указанный Fc-домен получают из IgG.
E56. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 55, где указанный IgG является IgG1, IgG2, IgG3 или IgG4.
E57. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-56, содержащее тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 33.
E58. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-57, содержащее легкую цепь, содержащую аминокислотную последовательность, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 32.
E59. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-58, содержащее последовательность VH, кодируемую вставкой в плазмиде, депонируемой в ATCC и имеющей регистрационный номер ATCC PTA-122727.
E60. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-59, содержащее последовательность VL, кодируемую вставкой в плазмиде, депонируемой в ATCC и имеющей регистрационный номер ATCC PTA-122726.
E61. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее (a) последовательности CDR-H1, CDR-H2 и CDR-H3 SEQ ID NO: 28, и (b)
i) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 2;
ii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 3;
iii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 4;
iv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 5;
v) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 6;
vi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 7;
vii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 8;
viii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 9;
ix) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 10;
x) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 11;
xi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 12;
xii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 13;
xiii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 14;
xiv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 15;
xv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 16;
xvi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 17;
xvii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 18;
xviii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 19;
xix) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 20;
xx) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 21;
xxi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 22;
xxii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 23;
xxiii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 24;
xxiv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 25;
xxv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 26; или
xxvi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 27.
E62. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее VH, содержащую аминокислотную последовательность SEQ ID NO: 28, и VL, содержащую аминокислотную последовательность из любой из SEQ ID NO: 2-27.
E63. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 61 или 62, содержащее Fc-домен.
E64. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 63, где указанный Fc-домен получают из IgA (например, IgA1 или IgA2), IgD, IgE, IgM или IgG (например, IgG1, IgG2, IgG3 или IgG4).
E65. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 61-64, содержащее CH, содержащую аминокислотную последовательность SEQ ID NO: 29.
E66. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 61-65, содержащую CL, содержащую аминокислотную последовательность SEQ ID NO: 30.
E67. Антитело или его антигенсвязывающий фрагмент, конкурирующее за специфическое связывание с IFNβ человека с антителом или его антигенсвязывающим фрагментом по любому из вариантов осуществления 1-66.
E68. Антитело или его антигенсвязывающий фрагмент, конкурирующее за специфическое связывание с IFNβ человека с CTI-AF1 или антигенсвязывающим фрагментом CTI-AF1.
E69. Антитело или его антигенсвязывающий фрагмент, конкурирующее за специфическое связывание с IFNβ человека с одним или несколькими антителами, выбранными из группы, состоящей из: CTI-AF2, CTI-AF3, CTI-AF4, CTI-AF5, CTI-AF6, CTI-AF7, CTI-AF8, CTI-AF9, CTI-AF10, CTI-AF11, CTI-AF12, CTI-AF13, CTI-AF14, CTI-AF15, CTI-AF16, CTI-AF17, CTI-AF18, CTI-AF19, CTI-AF20, CTI-AF21, CTI-AF22, CTI-AF23, CTI-AF24, CTI-AF25, CTI-AF26, CTI-AF27 и их антигенсвязывающих фрагментов.
E70. Антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, где указанное антитело или его антигенсвязывающий фрагмент связывается, по существу, с тем же эпитопом, что и CTI-AF1 или антигенсвязывающий фрагмент CTI-AF1.
E71. Антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, где указанное антитело или его антигенсвязывающий фрагмент связывается, по существу, с тем же эпитопом, что и одно или несколько антител или их антигенсвязывающих фрагментов, выбранных из группы, состоящей из: CTI-AF2, CTI-AF3, CTI-AF4, CTI-AF5, CTI-AF6, CTI-AF7, CTI-AF8, CTI-AF9, CTI-AF10, CTI-AF11, CTI-AF12, CTI-AF13, CTI-AF14, CTI-AF15, CTI-AF16, CTI-AF17, CTI-AF18, CTI-AF19, CTI-AF20, CTI-AF21, CTI-AF22, CTI-AF23, CTI-AF24, CTI-AF25, CTI-AF26 и CTI-AF27.
E72. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-71, где антитело или антигенсвязывающий фрагмент является Fc-слитым белком, монотелом, максителом, бифункциональным антителом, scFab, scFv, пептителом или антигенсвязывающим фрагментом любого из указанных выше.
E73. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-72, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD) не более приблизительно 5×10-9 M.
E74. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-73, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD) не более приблизительно 1×10-9 M.
E75. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-74, где указанное антитело или его антигенсвязывающий фрагмент связывается с IFNβ человека со значением аффинности связывания (KD) от приблизительно 1×10-9 M до приблизительно 1×10-14 M.
E76. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-75, где указанное антитело или антигенсвязывающий фрагмент (a) ингибирует связывание IFNβ и IFNAR; (b) снижает уровень экспрессии IFNβ-зависимого гена и/или (c) ингибирует IFNβ-индуцируемое фосфорилирование STAT1 или STAT2.
E77. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 76, где указанное антитело или его антигенсвязывающий фрагмент ингибирует связывание IFNβ с IFNAR со значением IC50 приблизительно 5×10-9 M или менее.
E78. Антитело или его антигенсвязывающий фрагмент по варианту осуществления 76, где указанное антитело или его антигенсвязывающий фрагмент ингибирует связывание IFNβ с IFNAR со значением IC50 от приблизительно 1×10-9 M до приблизительно 1×10-14 M.
E79. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78.
E80. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность SEQ ID NO: 166.
E81. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность SEQ ID NO: 167.
E82. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность вставки в плазмиде, депонируемой в ATCC и имеющей регистрационный номер PTA-122727.
E83. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность вставки в плазмиде, депонируемой в ATCC и имеющей регистрационный номер PTA-122726.
E84. Вектор, содержащий молекулу нуклеиновой кислоты по любому из вариантов осуществления 79-83.
E85. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по любому из вариантов осуществления 79-83 или вектор по варианту осуществления 84.
E86. Клетка-хозяин по варианту осуществления 85, где клетка представляет собой клетку млекопитающего.
E87. Клетка-хозяин по варианту осуществления 85 или 83, где клетка-хозяин является клеткой CHO, клеткой HEK-293 или клеткой Sp2.0.
E88. Способ получения антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по любому из вариантов осуществления 85-87 в условиях, где антитело или его антигенсвязывающий фрагмент продуцируется клеткой-хозяином.
E89. Способ по варианту осуществления 88, дополнительно включающий выделение антитела или его антигенсвязывающего фрагмента.
E90. Антитело или его антигенсвязывающий фрагмент, полученные способом по варианту осуществления 88 или 89.
E91. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 и фармацевтически приемлемый носитель.
E92. Способ снижения активности IFNβ, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91.
E93. Способ лечения ревматоидного заболевания, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91.
E94. Способ лечения системной красной волчанки (SLE), включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91.
E95. Способ лечения дерматомиозита (DM), включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91.
E96. Способ лечения интерферонопатии, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91.
E97. Способ по любому из вариантов осуществления 92-96, где указанный индивидуум является человеком.
E98. Способ по любому из вариантов осуществления 92-97, включающий внутривенное введение указанного антитела или его антигенсвязывающего фрагмента или фармацевтической композиции.
E99. Способ по любому из вариантов осуществления 92-98, включающий подкожное введение указанного антитела или его антигенсвязывающего фрагмента или фармацевтической композиции.
E100. Способ по любому из вариантов осуществления 92-99, где указанное антитело или его антигенсвязывающий фрагмент или фармацевтическую композицию вводят дважды в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в десять недель, дважды в месяц, один раз в месяц, один раз в два месяца или один раз в три месяца.
E101. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в качестве лекарственного средства.
E102. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в снижении активности IFNβ у индивидуума.
E103. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в лечении ревматоидного заболевания у индивидуума.
E104. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в лечении SLE у индивидуума.
E105. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в лечении DM у индивидуума.
E106. Антитело или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 для применения в лечении интерферонопатии у индивидуума.
E107. Антитело или антигенсвязывающий фрагмент или фармацевтическая композиция по любому из вариантов осуществления 101-106, где указанный индивидуум является человеком.
E108. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 для снижения активности IFNβ у индивидуума.
E109. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 в производстве лекарственного средства для снижения активности IFNβ у индивидуума.
E110. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 для лечения ревматоидного заболевания у индивидуума.
E111. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 в производстве лекарственного средства для лечения ревматоидного заболевания у индивидуума.
E112. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 для лечения SLE у индивидуума.
E113. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 в производстве лекарственного средства для лечения SLE у индивидуума.
E114. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 для лечения DM у индивидуума.
E115. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтическая композиция по варианту осуществления 91 в производстве лекарственного средства для лечения DM у индивидуума.
E116. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 для лечения интерферонопатии у индивидуума.
E117. Применение антитела или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-78 и 90 или фармацевтической композиции по варианту осуществления 91 в производстве лекарственного средства для лечения интерферонопатии у индивидуума.
E118. Применение по любому из вариантов осуществления 108-117, где указанный индивидуум является человеком.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[8] На фиг. 1 представлена вязкость антитела против IFNβ в буфере MOD1.
[9] Фиг. 2 представляет собой график дифференциальной сканирующей калориметрии (DSC) антитела CTI-AF1.
[10] На фиг. 3 представлен анализ эксклюзионной ВЭЖХ (SE-ВЭЖХ) агрегации CTI-AF1 в результате использования режима низкого pH.
[11] На фиг. 4A-4D представлен анализ SE-ВЭЖХ временных точек из исследований стабильности.
[12] На фиг. 5A-5D представлены графики, на которых показано, что CTI-AF1 являлось стабильным с течением времени при хранении при 40°C и не теряло способность нейтрализовать IFNβ. CTI-AF1 хранили при различных температурах и в течение различных периодов времени, затем оценивали способность антитела нейтрализовать IFNβ в IFN-зависимом репортерном анализе люциферазы. Материал, хранящийся в течение 1 недели при 40°C (фиг. 5A, T0 равно нулевому моменту времени при 40°C), не утрачивал нейтрализующую активность; хранение при 40°C в течение двух или трех недель не оказывало влияния на активность (фиг. 5C). Материал, полученный после трансфекции клеток CHO вместо клеток HEK293 или содержащий мутацию аминокислоты 44 из фенилаланина в пролин, не влиял на нейтрализацию (фиг. 5B). В конечном итоге, материал, хранящийся в течение четырех недель при 40°C или пяти недель при комнатной температуре (фиг. 5D), не влиял на способность CTI-AF1 нейтрализовать IFNβ-индуцированную активность.
[13] На фиг. 6 приведены данные, свидетельствующие об идентификации гибридом мыши против IFNβ человека, которые могут блокировать связывание IFNβ с IFNAR2 при интерферометрии биослоя (BLI) с использованием ForteBio Octet для измерения молекулярных взаимодействий. Сначала Ab мыши против IFNβ человека фиксировали на сенсоре с протеином G из кондиционированных сред для культивирования; затем связывается IFNβ человека (показано стрелкой+hIFN-β), затем комплексы Ab:IFNβ подвергали воздействию высокоаффинной цепи рецептора IFNAR2 человека (показано стрелкой+IFNAR2). Неблокирующие антитела демонстрировали положительный горб на кривой, свидетельствующий о дополнительном связывании (на что указывает стрелка "не-нейтрализатор", внизу), в то время как в случае нейтрализующих антител наблюдали относительно плоскую кривую (на что указывает стрелка "нейтрализатор, вверху). Несколько гибридом мыши демонстрировали способность к нейтрализации связывания IFNAR2 с IFNβ, и их выбирали для дальнейшей характеризации и, в конечном итоге, гуманизации.
[14] На фиг. 7 представлены данные, свидетельствующие об определении KD CTI-AF1 для IFNβ человека посредством поверхностного плазмонного резонанса (SPR). CTI-AF1 фиксировали на сенсорном чипе CM5, начиная с 2,5 нМ IFNβ, 6 точек, серии 2-кратного титрования рекомбинантного IFNβ человека позволяли протекать через CTI-AF1. Образцы анализировали в двух параллелях, и концентрация IFNβ указана справа от графика. Для каждой концентрации IFNβ тонкими серыми линиями показано связывание IFNβ в каждом повторном образце; более темной серой линией указана средняя аппроксимированная кривая, вычисленная с помощью программы для анализа. Определяли, что KD CTI-AF1 для IFNβ человека составляет приблизительно 36 пМ.
[15] На фиг. 8A-8B показано, что CTI-AF1 является мощным нейтрализатором IFNβ-индуцированной передачи сигнала во множестве анализов. На фиг. 8A показано, что клетки HEK293, стабильно трансдуцированные с использованием люциферазной репортерной конструкции IFN-стимулируемого отвечающего элемента (ISRE), стимулировали в присутствие IFNβ и титруемых количеств CTI-AF1. Дозозависимое ингибирование люминесценции свидетельствует о том, что IFNβ нейтрализован. Известно, что связывание IFNβ с рецептором интерферона (IFNAR) индуцирует фосфорилирование белка STAT1 в клетках U937. На фиг. 8B представлен анализ фосфорилирования STAT1. Клетки U937 подвергали воздействию IFNβ, предварительно инкубировали с титруемыми количествами CTI-AF1 в течение 15 минут, затем оценивали уровень фосфорилирования STAT1. Данные свидетельствуют о том, что имеет место дозозависимое ингибирование фосфорилирования STAT1, свидетельствующее о том, что CTI-AF1 нейтрализует IFNβ-зависимые сигналы.
[16] На фиг. 9 показано, что CTI-AF1 нейтрализовало экспрессию IFN-стимулируемого гена Mx1 (MxA) в первичных дермальных фибробластах человека (HDF). Существует ряд генов, которые, как известно, экспрессируются в ответ на стимуляцию IFN, IFN-стимулируемые гены (ISG). Mx1 (MxA) хорошо охарактеризован как ISG IFN типа I. Экспрессию гена Mx1 (MxA) после стимуляции рекомбинантным IFNβ оценивали в первичных HDF в присутствие или отсутствие указанных количеств CTI-AF1. Клетки стимулировали в течение 5 часов, затем выделяли РНК. РНК преобразовывали в кДНК, осуществляли количественную ПЦР (qPCR) для определения уровня экспрессии Mx1 (MxA) и использовали B2M в качестве контроля. Данные представлены в виде кратной индукции; наблюдали дозозависимое ингибирование экспрессии гена Mx1 (MxA), свидетельствующее о нейтрализации передачи сигнала IFNβ.
[17] На фиг. 10A-10B показано, что CTI-AF1 специфически нейтрализовало IFNβ. Клетки U937 стимулировали IFNβ (фиг. 10A) или IFNα (фиг. 10B) в течение 15 минут в присутствие нейтрализующих антител против IFNβ (CTI-AF1) или IFNα (сифалимумаба, SIF). CTI-AF1 ингибировало IFNβ-зависимое фосфорилирование STAT1 (панель A), но не влияло на IFNα-индуцируемое фосфорилирование STAT1 (панель B). В качестве контроля использовали нейтрализующее антитело против IFNα (SIF) в комбинации со стимуляцией IFNα для демонстрации того, что можно ингибировать IFNα-зависимое фосфорилирование STAT1.
[18] На фиг. 11 показано, что CTI-AF1 являлось мощным ингибитором эндогенного IFNβ, секретируемого первичными дермальными фибробластами человека (HDF). HDF стимулировали полиинозиновой:полицитидиловой кислотой (поли-I:C) в течение 24 часов для индукции экспрессии IFNβ в присутствие титруемых количеств CTI-AF1, а затем оценивали экспрессию гена Mx1 (MxA), как представлено на фиг. 9. Наблюдали дозозависимое ингибирование экспрессии гена Mx1 (MxA) с повышением количеств CTI-AF1, свидетельствующее о том, что антитело нейтрализовало эндогенно продуцируемый IFNβ.
[19] На фиг. 12A-12D представлены профили PK CTI-AF1 в сыворотке и профили покрытия IFNβ в коже у человека при 2 мг/кг IV Q4W. Представлены профили для соотношения IFNβ кожа:плазма 10 (фиг. 12A и 12C) и 100 (фиг. 12B и 12D). Необходимо отметить, что на PK CTI-AF1 в сыворотке не влияло соотношение IFNβ кожа:плазма и время кругооборота IFNβ. Пунктирными линиями на панелях C и D указано 95% покрытие IFNβ в коже.
[20] На фиг. 13A-13D представлены профили для соотношения IFNβ кожа:плазма 10 (фиг. 13A и 13C) и 100 (фиг. 13B и 13D). Необходимо отметить, что на PK в сыворотке не влияло соотношение IFNβ кожа:плазма и время кругооборота IFNβ. Пунктирными линиями на панелях C и D указано 95% покрытие IFNβ в коже.
[21] На фиг. 14 представлены средние концентрации CTI-AF1 в сыворотке у яванских макаков из исследования токсичности.
[22] На фиг. 15A представлена последовательность и вторичная структура IFNβ человека (SEQ ID NO: 41). На фиг. 15B представлено выравнивание последовательностей IFNβ человека (SEQ ID NO: 41), яванского макака (SEQ ID NO: 44), мыши (SEQ ID NO: 42), крысы (SEQ ID NO: 43) и кролика (SEQ ID NO: 45).
[23] На фиг. 16A представлена взаимосвязь между индексом распространенности и степени тяжести кожного дерматомиозита (CDASI) и балльной оценкой сигнатуры 10 генов в крови. Баллы CDASI ≥12 коррелируют в повышенной "сигнатурой 10 генов в крови IRG (коэффициент ранговой корреляции Спирмена r=0,61; p<0,0001). На фиг. 16B представлен сильный пороговый эффект, наблюдаемый при пороговом значении CDASI 12, ассоциированный с 3-кратным пороговым значением сигнатуры IRG (p=0,0004, тест Манна-Уитни).
[24] На фиг. 17 представлены образцы сыворотки 25 нормальных (здоровых) доноров, 19 доноров с DM с CDASI <12 и 38 доноров с DM с CDASI ≥12, анализируемые на наличие белка IFNβ с использованием высокочувствительного набора ELISA (PBL Assay Science) (критерий Уилкоксона "здоровые по сравнению с CDASI <12" p=0,39; критерий Уилкоксона "здоровые по сравнению с CDASI ≥12" p<0,0001).
[25] На фиг. 18A-18B представлены уровни мРНК IFNα или IFNβ (фиг. 18A) или сигнатуры IRG в образцах кожи здоровых относительно больных (фиг. 18B) в парных биоптатах кожи (т.е. непораженная и пораженная ткань), полученные из 5 пациентов с DM и оцениваемые с помощью сделанного на заказ анализа IFN типа I TaqMan Low Density Array (TLDA) (чип на 96 анализов). Каждая точка данных представляет собой среднее для 2 независимых реакций qPCR на образец; среднее±SEM. Панель A: значение p знакового рангового критерия Уилкоксона "IFNβ здоровых по сравнению с IFNβ больных"=0,06; значение p знакового рангового критерия Уилкоксона "IFNα здоровых по сравнению с IFNα больных"=1,0. Панель B: значение p знакового рангового критерия Уилкоксона "здоровые по сравнению с больными"=0,002.
[26] фиг. 19 является графиком, на котором показано дозозависимое ингибирование CTI-AF1 гибридных белков IFNα/β. Отсутствие ингибирования (CID1281) или сниженное ингибирование (CID1280) IFN-индуцированного фосфорилирования STAT1 свидетельствовали о том, что инсерция последовательности IFNα нарушала эпитоп в IFNβ, распознаваемый CTI-AF1.
[27] На фиг. 20A-20B представлена сокристаллическая структура IFNβ яванского макака и Fab CTI-AF1. Связывающие остатки эпитопа показаны серым на фиг. 20A, и связывающие остатки паратопов показаны серым на фиг. 20B.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. АНТИТЕЛА ПРОТИВ IFNβ
A. Интерферон бета (IFNβ)
[28] Интерферон бета (IFNβ), также известный как IFN фибробластов, является гликозилированным, секретируемым членом интерферонового семейства молекул типа I размером приблизительно 22 кДа. Последовательность предшественника IFNβ человека представлена как SEQ ID NO: 40. Сигнальный пептид (остатки 1-21 SEQ ID NO: 40) предшественника отщепляется с образованием зрелого IFNβ (SEQ ID NO: 41), имеющего 47% и 46% идентичности аминокислотных последовательностей относительно белков мышь и крысы, соответственно. Выравнивания IFNβ различных видов представлены на фигуре 15B. В последовательности, представленной ниже, подчеркнут сигнальный пептид.
MTNKCLLQIA LLLCFSTTAL SMSYNLLGFL QRSSNFQCQK LLWQLNGRLE YCLKDRMNFD IPEEIKQLQQ FQKEDAALTI YEMLQNIFAI FRQDSSSTGW NETIVENLLA NVYHQINHLK TVLEEKLEKE DFTRGKLMSS LHLKRYYGRI LHYLKAKEYS HCAWTIVRVE ILRNFYFINR LTGYLRN (предшественник IFNβ человека, SEQ ID NO: 40)
[29] Структура IFNβ содержит 5 α-спиралей, обозначенных как A (YNLLGFLQRSSNFQCQKLL; SEQ ID NO: 153 или остатки 3-21 SEQ ID NO: 41), B (KEDAALTIYEMLQNIFAIF; SEQ ID NO: 154 или остатки 52-70 SEQ ID NO: 41), C (ETIVENLLANVYHQINHLKTVLEEKL; SEQ ID NO: 155 или остатки 81-106 SEQ ID NO: 41), D (SLHLKRYYGRILHYLKA; SEQ ID NO: 156 или остатки 119-135 SEQ ID NO: 41) и E (HCAWTIVRVEILRNFYFINRLT; SEQ ID NO: 157 или остатки 140-161 SEQ ID NO: 41). Пять α-спиралей связаны петлями из 2-28 остатков, обозначенными как петли AB, BC, CD и DE (фигура 15A). Сообщают, что спираль A, петля AB и спираль E участвуют в связывании IFNβ с его рецептором, IFNAR.
B. Антитела против IFNβ
[30] Одним потенциальным недостатком антитела против IFNAR (например, анифролимаба) является то, что оба цитокина IFNα и IFNβ связываются с IFNAR. Хотя эти два типа цитокинов IFN вызывают схожие виды биологической активности в схожей степени, существуют значительные различия в мощности и активностях, специфических для типа клеток, между этими двумя типами IFN. Например, IFNβ вызывает значительно более высокий антипролиферативный ответ в некоторых типах клеток, таких как эмбриональная карцинома, меланома и меланоциты, чем IFNα. Также наблюдали более высокую мощность IFNβ при лечении рассеянного склероза и конкретных злокачественных новообразований. Однако блокирование активности IFNAR не модулирует селективно активности IFNβ. Существенно, что IFNα является важным цитокином, продуцирующимся в ответ на вирусные инфекции, таким образом, что блокирование его активности может иметь нежелательные эффекты. Таким образом, антитело, специфические связывающееся с IFNβ, но не IFNα, будет удовлетворять значительную неудовлетворенную потребность в лечении заболеваний, регулируемых, главным образом, IFNβ.
[31] В одном из аспектов изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с IFNβ человека. Последовательности примеров антител по изобретению представлены в таблице 11.
[32] Как показано в примерах, в определенных вариантах осуществления антитело по изобретению ингибирует связывание IFNβ с его рецептором, и, таким образом, его обозначают как "нейтрализующее" антитело. Без желания быть связанным какой-либо конкретной теорией, полагают, что данные свидетельствуют о том, что антитело или его антигенсвязывающий фрагмент блокируют или частично блокируют участки связывания рецептора IFNβ посредством конкуренции за эти или перекрывающиеся остатки из IFNAR или посредством создания стерического препятствия.
[33] Например, считают, что остатки из спирали A, петли AB и спирали E IFNβ участвуют в связывании IFNβ с его рецептором. Таким образом, в определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению связывается с эпитопом, содержащим один или несколько остатков, выбранных из группы, состоящей из: остатков 3-21 (спираль A), 22-51 (петля AB) и 140-161 (спираль E) в соответствии с нумерацией SEQ ID NO: 41.
[34] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент связываются с IFNβ человека со значением аффинности связывания (KD), составляющим по меньшей мере, 100 в раз меньше, чем значение KD для IFNα человека в, по существу, тех же условиях анализа. Например, соотношение KD для IFNβ относительно KD для IFNα может составлять 1:100 или менее, 1:250 или менее, 1:500 или менее, 1:1000 или менее, 1: 2500 или менее, 1:5000 или менее или 1:10000 или менее.
[35] В исследованиях мутагенеза и исследованиях кристаллической структуры также идентифицировали остатки эпитопов в IFNβ человека, распознаваемых антителами против IFNβ, представленными в настоящем описании. В частности, среди всех остатков IFNβ, находящихся в пределах 3,8 Å от тяжелого атома антитела ("потенциальные" остатки эпитопа), идентифицировано три разных типа: (i) "первичные" остатки эпитопа, охарактеризованные как глубоко погруженные остатки на поверхности контакта антитело-антиген с толерантностью последовательности к любым другим заменам аминокислот в этом положении от нулевой до низкой; (ii) "вторичные" остатки эпитопа, охарактеризованные как остатки со средней площадью погруженной поверхности на поверхности контакта и средней толерантностью последовательности к любым другим заменам аминокислот в этих положениях; и (iii) "необязательные" остатки эпитопа охарактеризованы как остатки с низкой площадью погруженной поверхности на поверхности контакта и высокой толерантностью последовательности к любым другим заменам аминокислот в этих положениях.
[36] Таким образом, в определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению специфически связываются с эпитопом в IFNβ человека, где указанный эпитоп содержит один или несколько остатков, выбранных из группы, состоящей из Ala89, Tyr92, His93 и His97 в соответствии с нумерацией SEQ ID NO: 41 ("первичные" остатки эпитопа). В определенных вариантах осуществления эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Phe8, Leu9, Ser12, Gln16, Asn86, Asn90, Asp96 и Thr100 в соответствии с нумерацией SEQ ID NO: 41 ("вторичные" остатки эпитопа). В определенных вариантах осуществления эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Leu5, Leu6, Ser13, Phe15 и Thr82 в соответствии с нумерацией SEQ ID NO: 41 ("необязательные" остатки эпитопа).
[37] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению также специфически связываются с IFNβ яванского макака в дополнение к IFNβ человека. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению специфически связываются с эпитопом в IFNβ яванского макака, где указанный эпитоп содержит один или несколько остатков, выбранных из группы, состоящей из Ala89, Tyr92, His93 и His97 в соответствии с нумерацией SEQ ID NO: 44 ("первичные" остатки эпитопа). В определенных вариантах осуществления эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Phe8, Leu9, Ser12, Gln16, Asn86, Asn90, Asp96, Thr100 и Tyr67 в соответствии с нумерацией SEQ ID NO: 44 ("вторичные" остатки эпитопа). В определенных вариантах осуществления эпитоп дополнительно содержит один или несколько остатков, выбранных из группы, состоящей из Leu5, Leu6, Ser13, Phe15 и Thr82 в соответствии с нумерацией SEQ ID NO: 44 ("необязательные" остатки эпитопа).
[38] Настоящее изобретение относится к антителу CTI-AF1 и его вариантам. Таким образом, в определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит следующие последовательности CDR тяжелой цепи: (i) CDR-H1, содержащую SEQ ID NO: 37, CDR-H2, содержащую SEQ ID NO: 38, и CDR-H3, содержащую SEQ ID NO: 39; и/или (ii) следующие последовательности CDR легкой цепи: CDR-L1, содержащую SEQ ID NO: 34, CDR-L2, содержащую SEQ ID NO: 35, и CDR-L3, содержащую SEQ ID NO: 36.
[39] Как показано в исследованиях кристаллической структуры, не все остатки в CDR участвуют в связывании антитела и антигена. Как показано в примере 7 и таблице 14, только ограниченное количество остатков CDR находится в пределах 3,8 Å от тяжелого атома антигена, и их рассматривают в качестве потенциальных остатков паратопов. Среди этих потенциальных остатков паратопов (i) "первичные" остатки паратопов являются остатками, охарактеризованными как глубоко погруженные остатки на поверхности контакта антитело-антиген с низкой толерантностью последовательности к любым другим заменам аминокислот в этом положении; и (ii) "вторичные" остатки паратопов характеризуют как остатки с более низкой площадью погруженной поверхности на поверхности контакта и более высокой толерантностью последовательности к заменам аминокислот в этих положениях.
[40] Таким образом, в определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению содержит цепь VH, содержащую один или несколько остатков паратопов, выбранных из группы, состоящей из: Trp33 в CDR-H1, Tyr56 в CDR-H2, Tyr58 в CDR-H2 и Tyr97 в CDR-H3 в соответствии с нумерацией по Kabat ("первичные" остатки паратопов). В определенных вариантах осуществления VH дополнительно содержит один или несколько остатков паратопов, выбранных из группы, состоящей из: Asp54 в CDR-H2, Gln61 в CDR-H2, Gly98 в CDR-H3 и Leu100 в CDR-H3 в соответствии с нумерацией по Kabat ("вторичные" остатки паратопов). В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению содержит VL, содержащую один или несколько остатков паратопов, выбранных из группы, состоящей из: Tyr32 в CDR-L1, Ile92 в CDR-L3 и Leu94 в CDR-L3 в соответствии с нумерацией по Kabat ("первичные" остатки паратопов). В определенных вариантах осуществления VH дополнительно содержит один или несколько остатков паратопов, выбранных из группы, состоящей из: Gln27 в CDR-L1, Asp28 в CDR-L1, Ile29 в CDR-L1, Gly30 в CDR-L1 и Ile93 в CDR-L3 в соответствии с нумерацией по Kabat ("вторичные" остатки паратопов). Антитело или его антигенсвязывающий фрагмент по изобретению также может содержать любую комбинацию остатков паратопов, представленных в настоящем описании.
[41] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат следующие последовательности CDR тяжелой цепи: (i) CDR-H1, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, или, по меньшей мере на 95% идентичную SEQ ID NO: 37, CDR-H2, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94% или по меньшей мере на 95% идентичную SEQ ID NO: 38, и CDR-H3, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94% или по меньшей мере на 95% идентичную SEQ ID NO: 39; и/или (ii) следующие последовательности CDR легкой цепи: CDR-L1, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94% или по меньшей мере на 95% идентичную SEQ ID NO: 34, CDR-L2, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94% или по меньшей мере на 95% идентичную SEQ ID NO: 35, и CDR-L3, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94% или по меньшей мере на 95% идентичную SEQ ID NO: 36. В определенных вариантах осуществления различия аминокислот по сравнению с SEQ ID NO: 37, 38, 39, 34, 35 и 36, соответственно, не являются различиями первичных или вторичных остатков паратопов, как представлено в таблице 14.
[42] В определенных вариантах осуществления в последовательности CDR-L1 относительно SEQ ID NO: 34 осуществляют не более 10, не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления в последовательности CDR-L2 относительно SEQ ID NO: 35 осуществляют не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления в последовательности CDR-L3 относительно SEQ ID NO: 36 осуществляют не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления в последовательности CDR-H1 относительно SEQ ID NO: 37 осуществляют не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления в последовательности CDR-H2 относительно SEQ ID NO: 38 осуществляют не более 16, не более 15, не более 14, не более 13, не более 12, не более 11, не более 10, не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления в последовательности CDR-H3 относительно SEQ ID NO: 39 осуществляют не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, не более 3, не более 2 или не более одной замены. В определенных вариантах осуществления замена не изменяет значение константы аффинности связывания (KD) более чем на 3 порядка величины, более чем 2 порядка величины или 1 порядок величины по сравнению с KD антитела или его антигенсвязывающего фрагмента без замены. В определенных вариантах осуществления замену осуществляют не в первичных или вторичных остатках паратопов, как представлено в таблице 14.
[43] В определенных вариантах осуществления замена является консервативной заменой, как представлено в таблице 1.
Таблица 1: Примеры консервативных замен
[44] В определенных вариантах осуществления, если антитело получают из не являющихся человеком видов, например, гуманизированное антитело, в котором CDR мыши пересаживают на каркас человека, замена является заменой зародышевой линии человека, при которой остаток не принадлежащей человеку CDR заменяют соответствующим остатком зародышевой линии человека. Одним из преимуществ такой замены является повышение содержания аминокислот человека и снижение потенциальной иммуногенности антитела, полученного из не являющихся человеком видов. Например, если используют каркас DPK9 зародышевой линии человека и пример антитела CTI-AF1, то выравнивание CDR-L1 из антитела CTI-AF1 и DPK9 зародышевой линии человека является следующим:
Таблица 2
В случае положений 24, 26, 27, 29, 32, 33 и 34 остаток зародышевой линии человека и соответствующий остаток CTI-AF1 являются одинаковыми, и замена не является необходимой в этих положениях. В случае положений 25, 28, 30 и 31 (указаны жирным шрифтом) остаток зародышевой линии человека и соответствующий остаток CTI-AF1 мыши отличаются. Остатки мыши в CTI-AF1 в этих положениях можно заменять соответствующим остатком DPK9 зародышевой линии человека для дополнительного повышения содержания аминокислотных остатков человека.
[45] Способы и библиотеки для встраивания остатков зародышевой линии человека в CDR антитела подробно описаны в Townsend et al., Augmented Binary Substitution: Single-pass CDR germlining and stabilization of therapeutic antibodies, PNAS, vol. 112, 15354-15359 (2015) и патентной заявке США № 2017-0073395 A1 (опубликованной 16 марта 2017 года), включенных в настоящее описание в качестве ссылок в полном объеме.
[46] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат каркасную последовательность человека. Например, каркасную последовательность тяжелой цепи можно получать из последовательности VH3 зародышевой линии, VH1 зародышевой линии, VH5 зародышевой линии или VH4 зародышевой линии человека. Предпочтительные каркасы тяжелой цепи зародышевой линии человека являются каркасами, полученными из последовательностей VH1, VH3 или VH5 зародышевой линии. Например, можно использовать каркасы VH из следующих хорошо известных последовательностей зародышевой линии: IGHV3-23, IGHV3-7 или IGHV1-69, где названия зародышевой линии основаны на определении IMGT зародышевой линии. Предпочтительные каркасы легкой цепи зародышевой линии человека являются каркасами, полученными из последовательностей Vκ или Vλ зародышевой линии. Например, можно использовать каркасы VL из следующих зародышевых линий: IGKV1-39 или IGKV3-20, где названия зародышевой линии основаны на определении IMGT зародышевой линии. Альтернативно или дополнительно, каркасная последовательность может являться консенсусной каркасной последовательностью зародышевой линии человека, такой как каркас консенсусной последовательности Vλ1 человека, консенсусной последовательности Vκ1, консенсусной последовательности Vκ2, консенсусной последовательности Vκ3, консенсусной последовательности VH3 зародышевой линии, консенсусной последовательности VH1 зародышевой линии, консенсусной последовательности VH5 зародышевой линии или консенсусной последовательности VH4 зародышевой линии.
[47] Последовательности каркасов зародышевой линии человека доступны в различных публичных базах данных, таких как V-base, IMGT, NCBI или Abysis.
[48] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK9 (название IMGT: IGKV1-39), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK9 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 46, 47, 48).
Таблица 3
89
91
93
95
101
103
110
[49] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK12 (название IMGT: IGKV2D-29), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK12 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 49, 50, 51).
[50] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK18 (название IMGT: IGKV2-30), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK18 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 52, 53, 54).
[51] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK24 (название IMGT: IGKV4-1), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK24 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 55, 56, 57).
[52] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом HK102_V1 (название IMGT: IGKV1-5), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками HK102_V1 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 58, 59, 60).
[53] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK1 (название IMGT: IGKV1-33), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK1 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 61, 62, 63).
[54] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK8 (название IMGT: IGKV1-9), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK8 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 64, 65, 66).
[55] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK21 (название IMGT: IGKV3-15), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK21 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 67, 68, 69).
[56] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом Vg_38K (название IMGT: IGKV3-11), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками Vg_38K зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 70, 71, 72).
[57] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK22 (название IMGT: IGKV3-20), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK22 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 73, 74, 75).
[58] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPK15 (название IMGT: IGKV2-28), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPK15 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 76, 77, 78).
[59] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPL16 (название IMGT: IGLV3-19), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPL16 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 79, 80, 81).
[60] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом DPL8 (название IMGT: IGLV1-40), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DPL8 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 82, 83, 84).
[61] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом V1-22 (название IMGT: IGLV6-57), и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками V1-22 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 85, 86, 87).
[62] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vλ человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vλ зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 88, 89, 90, 91, 92, 93). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[63] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vλ1 человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vλ1 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 94, 95, 96, 97). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[64] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vλ3 человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vλ3 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 98, 99, 100, 101). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[65] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vκ человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vκ зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 102, 103, 104, 105). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них.
[66] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vκ1 человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vκ1 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 106, 107, 108). В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[67] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vκ2 человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками Vκ2 зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 109, 110, 111, 112). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[68] В определенных вариантах осуществления каркас VL зародышевой линии человека является каркасом консенсусной последовательности Vκ3 человека, и один или несколько остатков в CDR-L1, CDR-L2 и CDR-L3 антител (и фрагментов) по изобретению можно заменять соответствующими остатками зародышевой линии, как представлено в таблице 3 (SEQ ID NO: 113, 114, 115). В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[69] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP54 (название IMGT: IGHV3-7), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 116, 117).
Таблица 4
141
143
146
[70] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP47 (название IMGT: IGHV3-23), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP47 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 118, 119).
[71] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP71 (название IMGT: IGHV4-59), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP71 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 120, 121).
[72] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP75 (название IMGT: IGHV1-2_02), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP75 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 122, 123).
[73] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP10 (название IMGT: IGHV1-69), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP10 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 124, 125).
[74] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP7 (название IMGT: IGHV1-46), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP7 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 126, 127).
[75] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP49 (название IMGT: IGHV3-30), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP49 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 128, 129).
[76] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP51 (название IMGT: IGHV3-48), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP51 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 130, 131).
[77] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP38 (название IMGT: IGHV3-15), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP38 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 132, 133).
[78] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP79 (название IMGT: IGHV4-39), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP79 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 134, 135).
[79] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP78 (название IMGT: IGHV4-30-4), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP78 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 136, 137).
[80] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом DP73 (название IMGT: IGHV5-51), и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими остатками DP73 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 138, 139).
[81] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом консенсусной последовательности VH зародышевой линии человека, и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками VH зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 140, 141, 142, 143). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[82] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом консенсусной последовательности VH3 зародышевой линии человека, и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками VH3 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 144, 145, 146). Альтернативные последовательности представлены для консенсусной последовательности с пропусками и без них. В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[83] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом консенсусной последовательности VH5 зародышевой линии человека, и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками VH5 зародышевой линии, как представлено в таблице 4 (SEQ ID NO: 147, 148). В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[84] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом консенсусной последовательности VH1 зародышевой линии человека, и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками VH1 зародышевой линии как представлено в таблице 4 (SEQ ID NO: 149, 150). В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[85] В определенных вариантах осуществления каркас VH зародышевой линии человека является каркасом консенсусной последовательности VH4 зародышевой линии человека, и один или несколько остатков в CDR-H1 и CDR-H2 антитела или его антигенсвязывающего фрагмента по изобретению можно заменять соответствующими консенсусными остатками VH4 зародышевой линии как представлено в таблице 4 (SEQ ID NO: 151, 152). В положениях, в которых нет консенсуса, остатки в скобках () являются остатками, привязанными к наиболее часто встречающимся остаткам, присутствующим в антителах человека.
[86] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению содержит (нумерация по Kabat):
(i) VH, содержащую: (a) CDR-H1, содержащую Trp33 и три или менее различия аминокислот по сравнению с SEQ ID NO: 37, (b) CDR-H2, содержащую Asp54, Tyr56, Tyr58 и Gln61 и три или менее различия аминокислот по сравнению с ID NO: 38; и (c) CDR-H3, содержащую Tyr97, Gly98 и Leu100 и три или менее различия аминокислот по сравнению с SEQ ID NO: 39; и
(ii) VL, содержащую: (a) CDR-L1, содержащую Gln27, Asp28, Ile29, Gly30, Tyr32 и три или менее различия аминокислот по сравнению с SEQ ID NO: 34, (b) CDR-L2, содержащую последовательность, содержащую три или менее различия аминокислот по сравнению с SEQ ID NO: 35; и(c) CDR-L3, содержащую Ile92, Ile93 и Leu94 и три или менее различия аминокислот по сравнению с SEQ ID NO: 36.
[87] В определенных вариантах осуществления различия аминокислот в CDR-H1, CDR-H2, CDR-L1, CDR-L2 и CDR-L3 являются заменами зародышевой линии человека, при которых остаток в не принадлежащей человеку CDR заменяют соответствующим остатком зародышевой линии человека (например, остатками зародышевой линии человека, как представлено в таблицах 3 и 4).
[88] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат (i) VH, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 28, и/или (ii) VL, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 1. Любая комбинация этих последовательностей VL и VH также включена в изобретение.
[89] В определенных вариантах осуществления каркас VH является DP10. Также прогнозируют, что другие схожие каркасные области будут приводить к получению предпочтительных антител или фрагментов антител по изобретению, содержащих CDR SEQ ID NO: 37, 38 и 39, включая: DP-88, DP-25, DP-73, IGHV5-10-1*01, IGHV5-10-1*04, DP-14, DP-75, DP15, DP-8, DP-7 и IGHV7-4-1*02, имеющие 99%, 93%, 75%, 73%, 73%, 92%, 90%, 90%, 89%, 93% и 79% идентичности последовательности, соответственно, относительно области FW DP10, и они содержат четыре или менее различия аминокислот с общими структурными признаками: (A) остатки непосредственно под CDR (зона Вернье), H2, H47, H48 и H49, H67, H69, H71, H73, H93, H94; (B) остатки, упаковывающие цепь VH/VL: H37, H39, H45, H47, H91, H93; и (C) канонические остатки структурной поддержки CDR H24, H71, H94 (все пронумерованы по Kabat). Особенно предпочтительными являются каркасные области DP-88, DP-25, DP-73, IGHV5-10-1*01 и IGFV-10-1*04, обладающие 99%, 93%, 75%, 73% и 73% идентичности последовательности относительно DP10, соответственно, и имеют два или менее различия аминокислот в этих общих структурных признаках.
[90] В определенных вариантах осуществления каркас VL являются DPK9. Также прогнозируют, что другие схожие каркасные области будут приводить к получению предпочтительных антител по изобретению, содержащих CDR SEQ ID NO: 34, 35 и 36, включая: DPK5, DPK4, DPK1, IGKV1-5*01, DPK24, DPK21, DPK15, IGKV1-13*02, IGKV1-17*01, DPK8, IGKV3-11*01 и DPK22, имеющие 99%, 97%, 97%, 96%, 80%, 76%, 66%, 97%, 97%, 96%, 76% и 74% идентичности последовательности, соответственно, относительно области FW DPK-9, и они содержат одно или менее различий аминокислот в общих структурных признаках: (A) остатки непосредственно под CDR (зона Вернье), L2, L4, L35, L36, L46, L47, L48, L49, L64, L66, L68, L69, L71; (B) остатки, упаковывающие цепь VH/VL: L36, L38, L44, L46, L87; и (C) канонические остатки структурной поддержки CDR L2, L48, L64, L71 (все пронумерованы по Kabat). Особенно предпочтительными являются каркасные области DPK5, DPK4, DPK1, IGKV1-5*01, DPK24, DPK21 и DPK15, имеющие 99%, 97%, 97%, 96%, 80%, 76% и 66% идентичности последовательности относительно DPK9, соответственно, и не имеют различий аминокислот в этих общих структурных признаках.
[91] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат (i) CDR-H1, содержащую SEQ ID NO: 37, CDR-H2, содержащую SEQ ID NO: 38, CDR-H3, содержащую SEQ ID NO: 39, CDR-L1, содержащую SEQ ID NO: 34; CDR-L2, содержащую SEQ ID NO: 35, и CDR-L3, содержащую SEQ ID NO: 36; и (ii) каркас VL, содержащий последовательность, по меньшей мере на 66%, по меньшей мере на 74%, по меньшей мере на 76%, по меньшей мере на 80%, по меньшей мере на 96%, по меньшей мере на 97%, или, по меньшей мере на 99% идентичную каркасной последовательности DPK9 зародышевой линии человека, и каркас VH, содержащий последовательность, по меньшей мере на 73%, по меньшей мере на 75%, по меньшей мере на 79%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 92%, по меньшей мере на 93% или по меньшей мере на 99% идентичную каркасной последовательности DP10 зародышевой линии человека.
[92] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат (i) CH, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 29; и/или (ii) CL, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 30. Любая комбинация этих последовательностей CH и CL также включена в изобретение.
[93] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат Fc-домен. Fc-домен можно получать из IgA (например, IgA1 или IgA2), IgG, IgE, или IgG (например, IgG1, IgG2,IgG3 или IgG4).
[94] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, содержат (i) тяжелую цепь, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 33, и/или (ii) легкую цепь, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 32. Любая комбинация этих последовательностей тяжелой цепи и легкой цепи также включена в изобретение.
[95] Настоящее изобретение также относится к дополнительным антителам (например, CTI-AF2-CTI-AF27), их антигенсвязывающим фрагментам и антигенсвязывающим вариантам. CTI-AF2-CTI-AF27 имеют одинаковую последовательность VH, но разные последовательности VL. Таким образом, в определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению содержит (i) VH, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную SEQ ID NO: 28, и/или (ii) VL, содержащую аминокислотную последовательность, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичную любой из SEQ ID NO: 2-27. Любая комбинация этих последовательностей VL и VH также включена в изобретение.
[96] Настоящее изобретение также относится к антителу или его антигенсвязывающему фрагменту, конкурирующим за связывание с IFNβ человека с любыми антителами или их антигенсвязывающими фрагментами, представленными в настоящем описании, такими как любое из антител, приведенных в таблице 11, или их антигенсвязывающие фрагменты. Например, если связывание антитела или его антигенсвязывающей части IFNβ человека снижает последующее связывание CTI-AF1 с IFNβ человека, антитело или его антигенсвязывающую часть считают конкурирующими с CTI-AF1 за связывание с IFNβ человека.
[97] Настоящее изобретение также относится к антителу или его антигенсвязывающему фрагменту, связывающемуся с тем же эпитопом IFNβ человека, что и любое антитело или его антигенсвязывающий фрагмент, представленные в настоящем описании, такое как любое антитело, представленное в таблице 11, или его антигенсвязывающие фрагменты. Например, анализ конкуренции антител (и анализ перекрывающихся эпитопов) можно осуществлять с использованием SPR, как подробно представлено в настоящем описании, или любого анализа конкурентного связывания, известного в этой области. Анализ связывания SPR, представленный в настоящем описании, является предпочтительным, неисключающим способом оценки связывания антитела по изобретению и любых других тестируемых антител.
[98] Антитела и их антигенсвязывающие фрагменты по изобретению включают моноклональные антитела, поликлональные антитела, фрагменты антител (например, Fab, Fab', F(ab')2, Fv, Fc, и т.д.), химерные антитела, биспецифические антитела, гетероконъюгированные антитела, одноцепочечные антитела (ScFv), их мутанты, слитые белки, содержащие часть антитела, доменные антитела (dAb), гуманизированные антитела и любую другую конфигурацию молекулы иммуноглобулина, содержащую участок распознавания антигена с необходимой специфичностью, включая варианты гликозилирования антител, варианты аминокислотной последовательности антител и ковалентно модифицированные антитела. Антитела и антигенсвязывающие фрагменты могут иметь мышиное, крысиное, человеческое или любое другое происхождение (включая химерные или гуманизированные антитела). В некоторых вариантах осуществления антитело является моноклональным антителом. В некоторых вариантах осуществления антитело является химерным, гуманизированным или человеческим антителом. В определенных вариантах осуществления антитело является полностью человеческим антителом. В определенных вариантах осуществления антитело является гуманизированным антителом.
[99] Аффинность связывания антитела можно выражать как значение KD, обозначающее скорость диссоциации при конкретном взаимодействии антиген-антитело. KD является соотношением скорости диссоциации, также называемой "скоростью обратной реакции (koff)", и скорости ассоциации или "скорости прямой реакции (kon)". Таким образом, KD равно koff/kon (диссоциации/ассоциации), и ее выражают как молярную концентрацию (M), и чем меньше KD, тем выше аффинность связывания. Значения KD для антител можно определять способами, хорошо известными в этой области. Если не указано иначе, термин "аффинность связывания" относится к моновалентным взаимодействиям (характерная активность; например, связывание антитела с антигеном посредством моновалентного взаимодействия).
[100] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению имеет значение аффинности (KD) не более приблизительно 1×10-7 M, такое как не более приблизительно 1×10-7 M, не более приблизительно 9×10-8 M, не более приблизительно 8×10-8 M, не более приблизительно 7×10-8 M, не более приблизительно 6×10-8 M, не более приблизительно 5×10-8 M, не более приблизительно 4×10-8 M, не более приблизительно 3×10-8 M, не более приблизительно 2×10-8 M, не более приблизительно 1×10-8 M, не более приблизительно 9×10-9 M, не более приблизительно 8×10-9 M, не более приблизительно 7×10-9 M, не более приблизительно 6×10-9 M, не более приблизительно 5×10-9 M, не более приблизительно 4×10-9 M, не более приблизительно 3×10-9 M, не более приблизительно 2×10-9 M, не более приблизительно 1×10-9 M, не более приблизительно 9×10-10 M, не более приблизительно 8×10-10 M, не более приблизительно 7×10-10 M, не более приблизительно 6×10-10 M, не более приблизительно 5×10-10 M, не более приблизительно 4×10-10 M, не более приблизительно 3×10-10 M, не более приблизительно 2×10-10 M, не более приблизительно 1×10-10 M, не более приблизительно 9×10-11 M, не более приблизительно 8×10-11 M, не более приблизительно 7×10-11 M, не более приблизительно 6×10-11 M, не более приблизительно 5×10-11 M, не более приблизительно 4×10-11 M, не более приблизительно 3×10-11 M, не более приблизительно 2×10-11 M, не более приблизительно 1×10-11 M, не более приблизительно 9×10-12 M, не более приблизительно 8×10-12 M, не более приблизительно 7×10-12 M, не более приблизительно 6×10-12 M, не более приблизительно 5×10-12 M, не более приблизительно 4×10-12 M, не более приблизительно 3×10-12 M, не более приблизительно 2×10-12 M, не более приблизительно 1×10-12 M, не более приблизительно 9×10-13 M, не более приблизительно 8×10-13 M, не более приблизительно 7×10-13 M, не более приблизительно 6×10-13 M, не более приблизительно 5×10-13 M, не более приблизительно 4×10-13 M, не более приблизительно 3×10-13 M, не более приблизительно 2×10-13 M, не более приблизительно 1×10-13 M, от приблизительно 1×10-7 M до приблизительно 1×10-14 M, от приблизительно 9×10-8 M до приблизительно 1×10-14 M, от приблизительно 8×10-8 M до приблизительно 1×10-14 M, от приблизительно 7×10-8 M до приблизительно 1×10-14 M, от приблизительно 6×10-8 M до приблизительно 1×10-14 M, от приблизительно 5×10-8 M до приблизительно 1×10-14 M, от приблизительно 4×10-8 M до приблизительно 1×10-14 M, от приблизительно 3×10-8 M до приблизительно 1×10-14 M, от приблизительно 2×10-8 M до приблизительно 1×10-14 M, от приблизительно 1×10-8 M до приблизительно 1×10-14 M, от приблизительно 9×10-9 M до приблизительно 1×10-14 M, от приблизительно 8×10-9 M до приблизительно 1×10-14 M, от приблизительно 7×10-9 M до приблизительно 1×10-14 M, от приблизительно 6×10-9 M до приблизительно 1×10-14 M, от приблизительно 5×10-9 M до приблизительно 1×10-14 M, от приблизительно 4×10-9 M до приблизительно 1×10-14 M, от приблизительно 3×10-9 M до приблизительно 1×10-14 M, от приблизительно 2×10-9 M до приблизительно 1×10-14 M, от приблизительно 1×10-9 M до приблизительно 1×10-14 M, от приблизительно 1×10-7 M до приблизительно 1×10-13 M, от приблизительно 9×10-8 M до приблизительно 1×10-13 M, от приблизительно 8×10-8 M до приблизительно 1×10-13 M, от приблизительно 7×10-8 M до приблизительно 1×10-13 M, от приблизительно 6×10-8 M до приблизительно 1×10-13 M, от приблизительно 5×10-8 M до приблизительно 1×10-13 M, от приблизительно 4×10-8 M до приблизительно 1×10-13 M, от приблизительно 3×10-8 M до приблизительно 1×10-13 M, от приблизительно 2×10-8 M до приблизительно 1×10-13 M, от приблизительно 1×10-8 M до приблизительно 1×10-13 M, от приблизительно 9×10-9 M до приблизительно 1×10-13 M, от приблизительно 8×10-9 M до приблизительно 1×10-13 M, от приблизительно 7×10-9 M до приблизительно 1×10-13 M, от приблизительно 6×10-9 M до приблизительно 1×10-13 M, от приблизительно 5×10-9 M до приблизительно 1×10-13 M, от приблизительно 4×10-9 M до приблизительно 1×10-13 M, от приблизительно 3×10-9 M до приблизительно 1×10-13 M, от приблизительно 2×10-9 M до приблизительно 1×10-13 M или от приблизительно 1×10-9 M до приблизительно 1×10-13 M.
[101] Значение KD можно определять напрямую хорошо известными способами и вычислять даже для сложных смесей способами, такими как способы, например, описанные в Caceci et al. (1984, Byte 9: 340-362). Например, KD можно определять с использованием анализа связывания с двойным нитроцеллюлозным фильтром, такого как описываемый в Wong & Lohman (1993, Proc. Natl. Acad. Sci. USA 90: 5428-5432). В этой области известны другие стандартные анализы для оценки способности связывать лиганды, такие как антитела против антигенов-мишеней, включая например, ELISA, вестерн-блоттинг, RIA и проточную цитометрию и другие анализы, примеры которых приведены где-либо в настоящем описании.
[102] Одним из примеров способа измерения значения аффинности связывания (KD) является поверхностный плазмонный резонанс (SPR), как правило, с использованием биосенсорной системы, такой как система BIACORE®. SPR относится к оптическому явлению, делающему возможным анализ биоспецифических взаимодействий в реальном времени посредством детекции изменений концентраций белка в матрице биосенсора, например, с использованием системы BIACORE®. Анализ кинетики BIAcore включает анализ связывания и диссоциации антигена из чипа с иммобилизованной молекулой (например, молекулой, содержащей антигенсвязывающий домен) на своей поверхности, или диссоциации антитела или его антигенсвязывающего фрагмента из чипа с иммобилизованным антигеном.
[103] В определенных вариантах осуществления измерение SPR осуществляют с использованием устройства BIACORE® T100 или T200. Например, стандартные условия анализа в случае поверхностного плазмонного резонанса могут быть основаны на иммобилизации антитела с приблизительно 100-500 единицами ответа (RU) IgG на чипе SPR. Очищенные белки-мишени разводят в буфере до диапазона конечных концентраций и инъецируют при необходимой скорости потока (например, 10-100 мкл/мин), чтобы сделать возможным вычисление Ka. Диссоциации позволяют происходить для определения скорости обратной реакции, затем добавляют 3 M MgCl2 (или 20 мМ NaOH) для регенерации поверхности чипа. Затем анализируют сенсограммы с использованием пакета программ для оценки кинетики. В примере варианта осуществления анализ SPR осуществляют в условиях, приведенных в примере 1.
[104] В определенных вариантах осуществления значение аффинности связывания (KD) измеряют с использованием анализа исключения кинетики на основе раствора (KinExA™). В конкретном варианте осуществления измерение KinExA осуществляют с использованием устройства KinExA™ 3200 (Sapidyne). Анализ исключения кинетики (KinExA™) является многоцелевой платформой для иммунологических анализов (по существу, проточным спектрофлуориметром), с помощью которой можно измерять равновесные константы диссоциации и константы скорости ассоциации и диссоциации для взаимодействий антиген/антитело. Т.к. KinExA™ осуществляют после достижения равновесия, он является предпочтительным способом для использования в измерении KD высокоаффинных взаимодействий, где скорость обратной реакции взаимодействия может быть очень низкой. Способ KinExA™, как правило, можно осуществлять, как описано в Drake et al (2004) Analytical Biochemistry 328, 35-43.
[105] Другим способом определения KD антитела является использование интерферометрии биослоя, как правило, с использованием технологии OCTET® (системы Octet QKe, ForteBio).
[106] В основном, антитело против IFNβ должно связываться с IFNβ с высокой аффинностью для эффективного блокирования активностей IFNβ. IFNβ связывается с IFNAR1 с KD приблизительно 50 нМ и с IFNAR2 с KD приблизительно 100 пМ. Таким образом, желательно, чтобы антитело против IFNβ имело аффинности связывания (KD) в наномолярном и пикомолярном диапазоне, такую как приблизительно 1×10-9 M или менее.
Анализы активности
[107] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению является нейтрализующим антителом, снижающим по меньшей мере одну активность IFNβ. Такая активность IFNβ включает, в качестве неограничивающих примеров, связывание с IFNAR, повышение экспрессии IFNβ-зависимого гена и/или индуцирование фосфорилирования, например, STAT1 и/или STAT2, помимо прочих активностей IFNβ, известных в этой области. С помощью ряда анализов можно оценивать то, снижает ли антитело или его антигенсвязывающий фрагмент активность IFNβ. Например, анализы можно использовать для определения того,: (a) ингибирует ли антитело или его антигенсвязывающий фрагмент связывание IFNβ с IFNAR; (b) снижает ли уровень экспрессии IFNβ-зависимого гена; и/или (c) ингибирует ли IFNβ-индуцируемое фосфорилирование, такое как фосфорилирование STAT1 и/или STAT2.
[108] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибирует связывание IFNβ с IFNAR (например, можно оценивать посредством конкурентного связывания с IFNβ). Например, в анализе можно сравнивать (i) связывание IFNβ с IFNAR в присутствие антитела или его антигенсвязывающего фрагмента со (ii) связыванием IFNβ с IFNAR в отсутствие антитела или его антигенсвязывающего фрагмента. Снижение связывания IFNβ с IFNAR может быть снижением по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99% в присутствие антитела против IFNβ или его антигенсвязывающего фрагмента. Ожидаемое связывание IFNβ с IFNAR в отсутствие антитела или его антигенсвязывающего фрагмента можно принимать за 100%.
[109] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибирует связывание IFNβ с IFNAR с полумаксимальной ингибиторной концентрацией (IC50) не более приблизительно 1×10-7 M, не более приблизительно 1×10-8 M, не более приблизительно 1×10-9 M, не более приблизительно 1×10-10 M, не более приблизительно 1×10-11 M, не более приблизительно 1×10-12 M, не более приблизительно 1×10-13 M, не более приблизительно 1×10-14 M, не более приблизительно 1×10-15 M, от приблизительно 1×10-7 M до приблизительно 5×10-14 M, от приблизительно 1×10-7 M до приблизительно 1×10-14 M, от приблизительно 1×10-7 M до приблизительно 5×10-13 M, от приблизительно 1×10-7 M до приблизительно 1×10-13 M, от приблизительно 1×10-7 M до приблизительно 5×10-12 M или от приблизительно 1×10-7 M до приблизительно 1×10-12 M.
[110] Активности антитела или его антигенсвязывающего фрагмента по изобретению также можно оценивать посредством измерения уровня экспрессии IFNβ-зависимого гена. Например, ген может являться нижележащим компонентом в IFNβ-опосредованном пути передачи сигнала (таким как CMPK2, IFIT1, IFI27, IFIH1, IFI44, IFI44L, IFI6, ISG15, LY6E, HERC5, MX1, OAS1, OAS2, OAS3, RSAD2, XAF1, CXCL10 или любая их комбинация). Альтернативно, ген может являться репортерным геном (например, репортерным геном люциферазы, как указано в примерах), где уровень экспрессии репортерного гена коррелирует с активностью IFNβ (например, репортерный ген функционально связан с IFNβ-зависимым элементом ответа). Уровень экспрессии нижележащего гена или репортерного гена можно оценивать различными способами, такими как измерение уровня РНК, уровня белка или уровня активности белка. В анализе можно сравнивать (i) уровень экспрессии IFNβ-зависимого гена в присутствие антитела или его антигенсвязывающего фрагмента с (ii) уровнем экспрессии IFNβ-зависимого гена в отсутствие антитела или его антигенсвязывающего фрагмента. Снижение уровня экспрессии нижележащего гена или репортерного гена может являться снижением по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99% в присутствие антитела против IFNβ или его антигенсвязывающего фрагмента. Исходный уровень экспрессии в отсутствие антитела или его антигенсвязывающего фрагмента можно принимать за 100%.
[111] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибирует экспрессию IFNβ-зависимого гена с полумаксимальной ингибиторной концентрацией (IC50) не более приблизительно 1×10-7 M, не более приблизительно 1×10-8 M, не более приблизительно 1×10-9 M, не более приблизительно 1×10-10 M, не более приблизительно 1×10-11 M, не более приблизительно 1×10-12 M, не более приблизительно 1×10-13 M, не более приблизительно 1×10-14 M, не более приблизительно 1×10-15 M, от приблизительно 1×10-7 M до приблизительно 5×10-14 M, от приблизительно 1×10-7 M до приблизительно 1×10-14 M, от приблизительно 1×10-7 M до приблизительно 5×10-13 M, от приблизительно 1×10-7 M до приблизительно 1×10-13 M, от приблизительно 1×10-7 M до приблизительно 5×10-12 M, или от приблизительно 1×10-7 M до приблизительно 1×10-12 M. В определенных вариантах осуществления IC50 от приблизительно 1×10-10 M до приблизительно 1×10-13 M является предпочтительной. В определенных вариантах осуществления IC50 от приблизительно 5×10-11 M до приблизительно 5×10-12 M является предпочтительной.
[112] Ингибиторную активность антитела или его антигенсвязывающего фрагмента также можно оценивать посредством измерения уровня IFNβ-индуцируемого фосфорилирования, такого как уровень фосфорилирования STAT1 и/или фосфорилирования STAT2. В анализе можно сравнивать (i) уровень фосфорилирования STAT1 и/или STAT2 в присутствие антитела или его антигенсвязывающего фрагмента с (ii) уровнем фосфорилирования STAT1 и/или STAT2 в отсутствие антитела или его антигенсвязывающего фрагмента. Снижение уровня фосфорилирования может являться снижением по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99% в присутствие антитела против IFNβ или его антигенсвязывающего фрагмента. Исходный уровень фосфорилирования STAT1 и/или фосфорилирования STAT2 в отсутствие антитела или его антигенсвязывающего фрагмента можно принимать за 100%.
[113] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент ингибирует IFNβ-индуцируемое фосфорилирование (такое как фосфорилирование STAT1 и/или фосфорилирование STAT2) с полумаксимальной ингибиторной концентрацией (IC50) не более приблизительно 1×10-7 M, не более приблизительно 1×10-8 M, не более приблизительно 1×10-9 M, не более приблизительно 1×10-10 M, не более приблизительно 1×10-11 M, не более приблизительно 1×10-12 M, не более приблизительно 1×10-13 M, не более приблизительно 1×10-14 M, не более приблизительно 1×10-15 M, от приблизительно 1×10-7 M до приблизительно 5×10-14 M, от приблизительно 1×10-7 M до приблизительно 1×10-14 M, от приблизительно 1×10-7 M до приблизительно 5×10-13 M, от приблизительно 1×10-7 M до приблизительно 1×10-13 M, от приблизительно 1×10-7 M до приблизительно 5×10-12 M или от приблизительно 1×10-7 M до приблизительно 1×10-12 M. В определенных вариантах осуществления IC50 от приблизительно 1×10-10 M до приблизительно 1×10-13 M является предпочтительной. В определенных вариантах осуществления IC50 от приблизительно 5×10-11 M до приблизительно 5×10-12 M является предпочтительной.
[114] В определенных вариантах осуществления характеристики антитела или его антигенсвязывающего фрагмента по изобретению дополнительно оценивают с использованием других анализов биологической активности, например, для оценки мощности, фармакологической активности и потенциальной эффективности в качестве терапевтического средства. Такие анализы известны в этой области и зависят от предполагаемого использования антитела. Примеры включают, например, анализы токсичности, анализы иммуногенности, анализы стабильности и/или профилирование PK/PD.
C. Нуклеиновые кислоты и способы получения антител против IFNβ
[115] Изобретение также относится к полинуклеотидам, кодирующим любые из антител, включая части антител и модифицированные антитела, представленные в настоящем описании. Изобретение также относится к способу получения любых из полинуклеотидов, представленных в настоящем описании. Полинуклеотиды можно получать и экспрессировать известными в этой области способами.
[116] Последовательность желаемого антитела или его антигенсвязывающего фрагмента и нуклеиновой кислоты, кодирующей такое антитело или его антигенсвязывающий фрагмент, можно определять стандартными способами секвенирования. Последовательность нуклеиновой кислоты, кодирующую желаемое антитело или его антигенсвязывающий фрагмент, можно встраивать в различные векторы (такие как клонирующие и экспрессирующие векторы) для рекомбинантного получения и характеризации. Нуклеиновую кислоту, кодирующую тяжелую цепь или антигенсвязывающий фрагмент тяжелой цепи, и нуклеиновую кислоту, кодирующую легкую цепь или антигенсвязывающий фрагмент легкой цепи, можно клонировать в один вектор или разные векторы.
[117] В одном из аспектов изобретение относится к полинуклеотидам, кодирующим аминокислотную последовательность любого из следующих антител против IFNβ и их антигенсвязывающих частей: CTI-AF1, CTI-AF2, CTI-AF3, CTI-AF4, CTI-AF5, CTI-AF6, CTI-AF7, CTI-AF8, CTI-AF9, CTI-AF10, CTI-AF11, CTI-AF12, CTI-AF13, CTI-AF14, CTI-AF15, CTI-AF16, CTI-AF17, CTI-AF18, CTI-AF19, CTI-AF20, CTI-AF21, CTI-AF22, CTI-AF23, CTI-AF24, CTI-AF25, CTI-AF26 и CTI-AF27.
[118] Изобретение также относится к полинуклеотидам, кодирующим антитело или его антигенсвязывающий фрагмент, связывающиеся, по существу, с тем же эпитопом, что и антитело, выбранное из группы, состоящей из: CTI-AF1, CTI-AF2, CTI-AF3, CTI-AF4, CTI-AF5, CTI-AF6, CTI-AF7, CTI-AF8, CTI-AF9, CTI-AF10, CTI-AF11, CTI-AF12, CTI-AF13, CTI-AF14, CTI-AF15, CTI-AF16, CTI-AF17, CTI-AF18, CTI-AF19, CTI-AF20, CTI-AF21, CTI-AF22, CTI-AF23, CTI-AF24, CTI-AF25, CTI-AF26 и CTI-AF27.
[119] Изобретение также относится к полинуклеотидам, кодирующим антитело или его антигенсвязывающий фрагмент, конкурирующие за связывание IFNβ с антителом, выбранным из группы, состоящей из: CTI-AF1, CTI-AF2, CTI-AF3, CTI-AF4, CTI-AF5, CTI-AF6, CTI-AF7, CTI-AF8, CTI-AF9, CTI-AF10, CTI-AF11, CTI-AF12, CTI-AF13, CTI-AF14, CTI-AF15, CTI-AF16, CTI-AF17, CTI-AF18, CTI-AF19, CTI-AF20, CTI-AF21, CTI-AF22, CTI-AF23, CTI-AF24, CTI-AF25, CTI-AF26 и CTI-AF27.
[120] Изобретение также относится к полинуклеотидам, содержащим последовательность, кодирующую белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: (i) SEQ ID NO: 1-27, (ii) SEQ ID NO: 28 и (iii) любой их комбинации.
[121] Изобретение также относится к полинуклеотидам, содержащим последовательность нуклеиновой кислоты, приведенную как SEQ ID NO: 166 или 167.
[122] Изобретение также относится к полинуклеотидам, содержащим последовательность нуклеиновой кислоты вставки ДНК в плазмиде, депонируемой в ATCC и имеющей регистрационный номер PTA-122727, или вставки ДНК в плазмиде, депонируемой в ATCC и имеющей регистрационный номер PTA-122726.
[123] В другом аспекте изобретение относится к полинуклеотидам и их вариантам, кодирующим антитело против IFNβ, где такие варианты полинуклеотидов имеют по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности относительно любой из конкретных последовательностей нуклеиновой кислоты, представленных в настоящем описании. Эти количества не являются ограничивающими, и приращения между указанными процентными долями конкретно предусмотрены как часть описания.
[124] В одном из вариантов осуществления домены VH и VL, или их антигенсвязывающая часть, или полноразмерная HC или LC кодируются отдельными полинуклеотидами. Альтернативно, VH и VL, или их антигенсвязывающая часть, или HC и LC кодируются одним полинуклеотидом.
[125] Полинуклеотиды, комплементарные любой из таких последовательностей, также включены в настоящее изобретение. Полинуклеотиды могут являться одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут являться молекулами ДНК (геномными, кДНК или синтетическими) или РНК. Молекулы РНК включают молекулы HnRNA, содержащие интроны и соответствующие молекуле ДНК один к одному, и молекулы мРНК, не содержащие интроны. Дополнительные кодирующие или некодирующие последовательности могут, необязательно, присутствовать в полинуклеотиде по настоящему изобретению, и полинуклеотид можно, необязательно, соединять с другими молекулами и/или материалами подложки.
[126] Полинуклеотиды могут содержать нативную последовательность (т.е. эндогенную последовательность, кодирующую антитело или его часть) или могут содержать вариант такой последовательности. Варианты полинуклеотидов содержат одну или несколько замен, добавлений, делеций и/или инсерций таким образом, что иммунореактивность кодируемого полипептида относительно нативной иммунореактивной молекулы не уменьшается. Эффект в отношении иммунореактивности кодируемого полипептида, как правило, можно оценивать, как представлено в настоящем описании. В некоторых вариантах осуществления варианты проявляют по меньшей мере приблизительно 70% идентичности, в некоторых вариантах осуществления - по меньшей мере приблизительно 80% идентичности, в некоторых вариантах осуществления - по меньшей мере приблизительно 90% идентичности, и в некоторых вариантах осуществления по меньшей мере - приблизительно 95% идентичности относительно полинуклеотидной последовательности, кодирующей нативное антитело или его часть. Эти количества не предназначены для ограничения, и приращения между указанными процентными долями конкретно предусмотрены как часть описания.
[127] Две полинуклеотидные или полипептидные последовательности указывают как "идентичные", если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой при выравнивании с максимальным соответствием, как описано ниже. Сравнение двух последовательностей, как правило, осуществляют посредством сравнения последовательностей в окне сравнения для идентификации и сравнения локальных областей сходства последовательностей. В рамках изобретения термин "окно сравнения" относится к сегменту из по меньшей мере приблизительно 20 смежных положений, как правило, от 30 до приблизительно 75 или от 40 до приблизительно 50 положений, в котором последовательность можно сравнивать с референсной последовательностью из такого же количества смежных положений после оптимального выравнивания двух последовательностей.
[128] Оптимальное выравнивание последовательностей для сравнения можно осуществлять с использованием программы MegAlign® в пакете биоинформатических программ Lasergene® (DNASTAR®, Inc., Madison, WI) с использованием параметров по умолчанию. В этой программе воплощено несколько схем выравнивания, описанных в следующих источниках: Dayhoff, M.O., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. и Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
[129] В некоторых вариантах осуществления "процент идентичности последовательности" определяют посредством сравнения двух оптимально выровненных последовательностей в окне сравнения из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления или делеции (т.е. пропуски) в 20 процентов или менее, как правило, от 5 до 15 процентов или от 10 до 12 процентов по сравнению с референсными последовательностями (не содержащими добавления или делеции) для оптимального выравнивания двух последовательностей. Процент вычисляют посредством определения количества положений, в которых идентичные основания нуклеиновых кислот или аминокислотные остатки встречаются в обеих последовательностях, для получения количества совпадающих положений, деления количества совпадающих положений на общее количество положений в референсной последовательности (т.е. размер окна) и умножения результатов на 100 для получения процента идентичности последовательности.
[130] Дополнительно или альтернативно, варианты могут быть, по существу, гомологичными нативному гену или его части или комплемента. Такие варианты полинуклеотидов могут гибридизоваться в умеренно строгих условиях с природной последовательностью ДНК, кодирующей нативное антитело (или комплементарную последовательность).
[131] Подходящие "умеренно строгие условия" включают предварительную промывку в растворе 5-кратного SSC, 0,5% SDS, 1,0 мМ ЭДТА (pH 8,0); гибридизацию при 50-65°C в 5-кратном SSC в течение ночи; последующую промывку дважды при 65°C в течение 20 минут каждым из 2-, 0,5- и 0,2-кратного SSC, содержащего 0,1% SDS.
[132] В рамках изобретения "очень строгие условия" или "условия с высокой строгостью" являются условиями, в которых: (1) используют низкую ионную силу и высокую температуру для промывки, например, 0,015 M хлорид натрия/0,0015 M цитрат натрия/0,1% додецилсульфат натрия при 50°C; (2) при гибридизации используют денатурирующее средство, такое как формамид, например, 50% (об./об.) формамид с 0,1% бычьим сывороточным альбумином/0,1% фиколлом/0,1% поливинилпирролидоном/50 мМ буфером фосфата натрия при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитратом натрия при 42°C; или (3) используют 50% формамид, 5-кратный SSC (0,75 M NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5-кратный раствор Денхардта, обработанную ультразвуком ДНК молок лососевых (50 мкг/мл), 0,1% SDS и 10% декстран сульфат при 42°C с промывкой при 42°C в 0,2-кратном SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C с последующей промывкой в условиях с высокой строгостью, состоящих из 0,1-кратного SSC, содержащего ЭДТА, при 55°C. Специалистам в этой области будет понятно, как корректировать температуру, ионную силу и т.д. по мере необходимости для адаптации к таким факторам, как длина зонда и т.п.
[133] Специалистам в этой области следует понимать, что в результате вырожденности генетического кода существует множество нуклеотидных последовательностей, кодирующих полипептид, представленный в настоящем описании. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, отличающиеся по причине различий в использовании кодонов, конкретно включены в настоящее изобретение. Кроме того, аллели генов, содержащие полинуклеотидные последовательности по настоящему изобретению, входят в объем настоящего изобретения. Аллели являются эндогенными генами, измененными в результате одной или нескольких мутаций, таких как делеции, добавления и/или замены нуклеотидов. Полученные мРНК и белок, необязательно, могут иметь измененную структуру или функцию. Аллели можно идентифицировать стандартными способами (такими как гибридизация, амплификация и/или сравнение с базами данных о последовательностях).
[134] Полинуклеотиды по изобретению можно получать с использованием химического синтеза, рекомбинантными способами или посредством ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в этой области, и нет необходимости подробно описывать их в настоящем описании. Специалист в этой области может использовать последовательности, представленные в настоящем описании, и коммерческий синтезатор ДНК для получения желаемой последовательности ДНК.
[135] Для получения полинуклеотидов рекомбинантными способами полинуклеотид, содержащий желаемую последовательность, можно встраивать в подходящий вектор, и вектор, в свою очередь, можно встраивать в подходящую клетку-хозяина для репликации и амплификации, как представлено далее в настоящем описании. Полинуклеотиды можно встраивать в клетки-хозяева любыми способами, известными в этой области. Клетки трансформируют посредством встраивания экзогенного полинуклеотида посредством прямого захвата, эндоцитоза, трансфекции, F-спаривания или электропорации. После встраивания экзогенный полинуклеотид можно поддерживать в клетке как неинтегрированный вектор (такой как плазмида) или интегрированный в геном клетки-хозяина. Полинуклеотид, амплифицированный таким образом, можно выделять из клетки-хозяина способами, хорошо известными в этой области. См., например, Sambrook et al., 1989.
[136] Альтернативно, ПЦР делает возможным воспроизведение последовательностей ДНК. Технология ПЦР хорошо известна в этой области и описана в патентах США №№ 4683195, 4800159, 4754065 и 4683202, а также PCR: Polymerase chain reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
[137] РНК можно получать с использованием выделенной ДНК в подходящем векторе и ее встраивания в подходящую клетку-хозяина. Когда клетка делится и ДНК транскрибируется в РНК, РНК можно выделять способами, хорошо известными специалистам в этой области, как указано в Sambrook et al., 1989, например.
[138] Подходящие клонирующие и экспрессирующие векторы могут включать различные компоненты, такие как промотор, энхансер и другие транскрипционные регуляторные последовательности. Вектор также можно конструировать так, чтобы сделать возможным последующее клонирование вариабельного домена антитела в различные векторы.
[139] Подходящие клонирующие векторы можно конструировать стандартными способами или их можно выбирать из большого количества клонирующих векторов, доступных в этой области. Хотя выбранный клонирующий вектор может варьироваться в зависимости от клетки-хозяина, подлежащей использованию, применимые клонирующие векторы, как правило, будут обладать способностью к саморепликации, могут иметь одну мишень для конкретной эндонуклеазы рестрикции и/или могут нести гены для маркера, которые можно использовать в селекции клонов, содержащих векторы. Подходящие примеры включают плазмиды и бактериальные вирусы, например, pUC18, pUC19, Bluescript (например, pBS SK+) и его производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговую ДНК, и челночные векторы, такие как pSA3 и pAT28. Эти и многие другие клонирующие векторы доступны у коммерческих поставщиков, таких как BioRad, Strategene и Invitrogen.
[140] Настоящее изобретение дополнительно относится к экспрессирующим векторам. Экспрессирующие векторы, как правило, являются реплицирующимися полинуклеотидными конструкциями, содержащими полинуклеотид по изобретению. Подразумевается, что экспрессирующий вектор должен реплицироваться в клетках-хозяевах как эписомы или интегральная часть хромосомной ДНК. Подходящие экспрессирующие векторы включают, в качестве неограничивающих примеров, плазмиды, вирусные векторы, включая аденовирусы, аденоассоциированные вирусы, ретровирусы, космиды и экспрессирующие векторы, описанные в публикации PCT № WO 87/04462. Компоненты вектора, как правило, могут включать, в качестве неограничивающих примеров, один или несколько из следующего: сигнальную последовательность; участок начала репликации; один или несколько маркерных генов; подходящие элементы транскрипционного контроля (такие как промоторы, энхансеры и терминатор). Для экспрессии (т.е. трансляции), как правило, также необходимы один или несколько элементов контроля трансляции, такие как участки связывания рибосомы, участки инициации трансляции и стоп-кодоны.
[141] Векторы, содержащие интересующие полинуклеотиды, и/или сами полинуклеотиды можно встраивать в клетку-хозяина любым из ряда походящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфекцию (например, если вектор является возбудителем инфекции, таким как вирус осповакцины). Выбор встраиваемых векторов или полинуклеотидов часто будет зависеть от признаков клетки-хозяина.
[142] Антитело или его антигенсвязывающий фрагмент можно получать рекомбинантно с использованием подходящей клетки-хозяина. Нуклеиновую кислоту, кодирующую антитело или его антигенсвязывающий фрагмент, можно клонировать в экспрессирующий вектор, который затем можно встраивать в клетку-хозяина, такую как клетка E. coli, дрожжевая клетка, клетка насекомого, клетка обезьяны COS, клетка яичника китайского хомяка (CHO) или миеломная клетка, где клетка в ином случае не продуцирует иммуноглобулиновый белок, для достижения синтеза антитела в рекомбинантной клетке-хозяине. Предпочтительные клетки-хозяева включают клетку CHO, клетку эмбриональной почки человека (HEK) 293 или клетку Sp2.0 помимо множества клеток, хорошо известных в этой области.
[143] Фрагмент антитела можно получать посредством протеолитической или другой деградации полноразмерного антитела, рекомбинантными способами или посредством химического синтеза. Полипептидный фрагмент антитела, особенно более короткие полипептиды до приблизительно 50 аминокислот, легко можно получать посредством химического синтеза. Способы химического синтеза для белков и пептидов известны в этой области и коммерчески доступны.
[144] Антитело или его антигенсвязывающий фрагмент по изобретению могут являться аффинно зрелыми. Например, аффинно зрелое антитело можно получать известными в этой области способами (Marks et al., 1992, Bio/Technology, 10:779-783; Barbas et al., 1994, Proc Nat. Acad. Sci, USA 91:3809-3813; Schier et al., 1995, Gene, 169:147-155; Yelton et al., 1995, J. Immunol., 155:1994-2004; Jackson et al., 1995, J. Immunol., 154(7):3310-9; Hawkins et al., 1992, J. Mol. Biol., 226:889-896; и WO2004/058184).
2. СОСТАВЫ И ПРИМЕНЕНИЕ
[145] Антитело или его антигенсвязывающий фрагмент по изобретению можно составлять в виде фармацевтической композиции. Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель, эксципиент и/или стабилизатор (Remington: The Science and practice of Pharmacy 20th Ed., 2000, Lippincott Williams and Wilkins, Ed. K. E. Hoover) в форме лиофилизированного состава или водного раствора. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в дозах и концентрациях и могут содержать буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и m-крезол); низкомолекулярные (менее приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстраны; хелатирующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексные соединения с металлами (например, комплексы Zn-белок); и/или неионные поверхностно-активные средства такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Фармацевтически приемлемые эксципиенты также представлены в настоящем описании.
[146] Антитело или его антигенсвязывающий фрагмент по изобретению можно использовать в различных терапевтических или диагностических целях. Например, антитело или его антигенсвязывающий фрагмент по изобретению можно использовать в качестве средств для аффинной очистки (например, для очистки IFNβ in vitro), в качестве диагностического средства (например, для детекции экспрессии IFNβ в конкретных клетках, тканях или сыворотке).
[147] Примеры терапевтического применения антитела или его антигенсвязывающего фрагмента по изобретению включают лечение ревматоидного заболевания (такого как SLE или DM) или интерферонопатии. Антитело или его антигенсвязывающий фрагмент по изобретению также можно использовать в профилактическом лечении (например, введении индивидууму, у которого не наблюдают симптом заболевания, но имеющего предрасположенность к ревматоидному заболеванию или интерферонопатии).
[148] В случае терапевтического применения антитело или его антигенсвязывающий фрагмент по изобретению можно вводить млекопитающему, особенно человеку, общепринятыми способами, например, внутривенно (в виде болюса или посредством непрерывной инфузии в течение периода времени), внутримышечно, интраперитонеально, интрацереброспинально, подкожно, внутрисуставно, интрасиновиально, интратекально, перорально, местно или посредством ингаляции. Антитело или его антигенсвязывающий фрагмент по изобретению также соответствующим образом вводят внутриопухолевым, периопухолевым, внутриочаговым или периочаговым путем.
[149] Таким образом, в одном из аспектов изобретение относится к способу снижения активности IFNβ, включающему введение нуждающемуся в этом индивидууму (например, человеку) терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по изобретению.
[150] В определенных вариантах осуществления индивидуум страдает или имеет предрасположенность к ревматоидному заболеванию. В определенных вариантах осуществления ревматоидное заболевание является SLE. В определенных вариантах осуществления ревматоидное заболевание является DM.
[151] В определенных вариантах осуществления индивидуум страдает или имеет предрасположенность к интерферонопатии.
[152] В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению вводят подкожно. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент по изобретению вводят внутривенно.
[153] Фармацевтические композиции можно вводить нуждающемуся в этом индивидууму с частотой, которая может варьироваться в зависимости от тяжести ревматоидного заболевания или интерферонопатии. В случае профилактической терапии частота может варьироваться в зависимости от предрасположенности индивидуума к ревматоидному заболеванию или интерферонопатии.
[154] Композиции можно вводить нуждающимся в этом пациентам в виде болюса или посредством непрерывной инфузии. Например, болюсное введение антитела, присутствующего в виде Fab-фрагмента, можно осуществлять в количестве от 0,0025 до 100 мг/кг массы тела, от 0,025 до 0,25 мг/кг, от 0,010 до 0,10 мг/кг или 0,10-0,50 мг/кг. В случае непрерывной инфузии антитело, присутствующее в виде Fab-фрагмента, можно вводить в количестве от 0,001 до 100 мг/кг массы тела/минуту, 0,0125 до 1,25 мг/кг/мин, 0,010 до 0,75 мг/кг/мин, 0,010 до 1,0 мг/кг/мин или 0,10-0,50 мг/кг/мин в течение периода 1-24 часов, 1-12 часов, 2-12 часов, 6-12 часов, 2-8 часов или 1-2 часов.
[155] В случае введения антитела, присутствующего в виде полноразмерного антитела (с полными константными областями), дозы могут составлять от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 3 мг/кг до приблизительно 10 мг/кг, от приблизительно 4 мг/кг до приблизительно 10 мг/кг, от приблизительно 5 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 20 мг/кг, от приблизительно 2 мг/кг до приблизительно 20 мг/кг, от приблизительно 3 мг/кг до приблизительно 20 мг/кг, от приблизительно 4 мг/кг до приблизительно 20 мг/кг, от приблизительно 5 мг/кг до приблизительно 20 мг/кг, приблизительно 1 мг/кг или более, приблизительно 2 мг/кг или более, приблизительно 3 мг/кг или более, приблизительно 4 мг/кг или более, приблизительно 5 мг/кг или более, приблизительно 6 мг/кг или более, приблизительно 7 мг/кг или более, приблизительно 8 мг/кг или более, приблизительно 9 мг/кг или более, приблизительно 10 мг/кг или более, приблизительно 11 мг/кг или более, приблизительно 12 мг/кг или более, приблизительно 13 мг/кг или более, приблизительно 14 мг/кг или более, приблизительно 15 мг/кг или более, приблизительно 16 мг/кг или более, приблизительно 17 мг/кг или более, приблизительно 19 мг/кг или более или приблизительно 20 мг/кг или более. Частота введения будет зависеть от тяжести состояния. Частота может находиться в диапазоне от трех раз в неделю до раза в две или три недели.
[156] Кроме того, композиции можно вводить пациентам посредством подкожной инъекции. Например, дозу антитела против IFNβ от 1 до 100 мг можно вводить пациентам посредством подкожной или внутривенной инъекции дважды в неделю, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель, один раз в восемь недель, один раз в девять недель, один раз в десять недель, дважды в месяц, один раз в месяц, один раз в два месяца или один раз в три месяца. Например, антитело CTI-AF1 имеет приблизительное время полужизни приблизительно 19 дней. Это время полужизни служит основой для подкожной или внутривенной инъекции каждые 2-6 недель, например, один раз в 2 недели или один раз в 4 недели.
[157] В определенных вариантах осуществления время полужизни антитела против IFNβ у человека составляет приблизительно 5 дней, приблизительно 6 дней, приблизительно 7 дней, приблизительно 8 дней, приблизительно 9 дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней, приблизительно 14 дней, приблизительно 15 дней, приблизительно 16 дней, приблизительно 17 дней, приблизительно 18 дней, приблизительно 19 дней, приблизительно 20 дней, приблизительно 21 день, приблизительно 22 дня, приблизительно 23 дня, приблизительно 24 дня, приблизительно 25 дней, приблизительно 26 дней, приблизительно 27 дней, приблизительно 28 дней, приблизительно 29 дней, приблизительно 30 дней, от приблизительно 5 дней до приблизительно 40 дней, от приблизительно 5 дней до приблизительно 35 дней, от приблизительно 5 дней до приблизительно 30 дней, от приблизительно 5 дней до приблизительно 25 дней, от приблизительно 10 дней до приблизительно 40 дней, от приблизительно 10 дней до приблизительно 35 дней, от приблизительно 10 дней до приблизительно 30 дней, от приблизительно 10 дней до приблизительно 25 дней, от приблизительно 15 дней до приблизительно 40 дней, от приблизительно 15 дней до приблизительно 35 дней, от приблизительно 15 дней до приблизительно 30 дней или от приблизительно 15 дней до приблизительно 25 дней,
[158] В определенных вариантах осуществления фармацевтическую композицию вводят подкожно или внутривенно каждые 2-6 недель в дозе от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 8 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 8 мг/кг, от приблизительно 1 мг/кг до приблизительно 8 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 8 мг/кг, от приблизительно 2 мг/кг до приблизительно 8 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 2 мг/кг до приблизительно 5 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1,0 мг/кг, приблизительно 1,5 мг/кг, приблизительно 2,0 мг/кг, приблизительно 2,5 мг/кг, приблизительно 3,0 мг/кг, приблизительно 3,5 мг/кг, приблизительно 4,0 мг/кг, приблизительно 4,5 мг/кг, приблизительно 5,0 мг/кг, приблизительно 5,5 мг/кг, приблизительно 6,0 мг/кг, приблизительно 6,5 мг/кг, приблизительно 7,0 мг/кг, приблизительно 7,5 мг/кг, приблизительно 8,0 мг/кг, приблизительно 8,5 мг/кг, приблизительно 9,0 мг/кг, приблизительно 9,5 мг/кг или приблизительно 10,0 мг/кг.
[159] В определенных вариантах осуществления фармацевтическую композицию вводят подкожно или внутривенно каждые 2-6 недель в дозе приблизительно 2,0 мг/кг. В определенных вариантах осуществления фармацевтическую композицию вводят подкожно или внутривенно каждые 2-6 недель в дозе от приблизительно 2,0 мг/кг до приблизительно 10,0 мг/кг.
[160] В одном примере варианта осуществления фармацевтическую композицию вводят подкожно каждые 2 недели.
[161] Антитело или его антигенсвязывающий фрагмент по изобретению можно использовать в качестве монотерапии или в комбинации с другими терапевтическими средствами для лечения ревматоидного заболевания.
3. ОПРЕДЕЛЕНИЯ
[162] Если в настоящем описании не указано иначе, научные и технические термины, используемые в отношении настоящего изобретения, должны иметь значения, общепринято понятные специалистам в этой области. Кроме того, если контекст не указывает на иное, термины в единственном числе должны включать термины во множественном числе, и термины во множественном числе должны включать термины в единственном числе. Как правило, номенклатура и способы культивирования клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики, химии белков и нуклеиновых кислот и гибридизации, представленные в настоящем описании, хорошо известны и общеупотребительны в этой области.
[163] Термин "антигенсвязывающий фрагмент" антитела относится к фрагменту полноразмерного антитела, сохраняющему способность специфически связываться с антигеном (предпочтительно, по существу, с той же аффинностью связывания). Примеры антигенсвязывающего фрагмента включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), состоящий из домена VH; и (vi) выделенную определяющую комплементарность область (CDR), соединенные дисульфидной связью Fv (dsFv), и антиидиотипические (против Id) антитело и интратело. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединять с использованием рекомбинантных способов с помощью синтетического линкера, позволяющего получать их в виде одной белковой цепи, в которой области VL и VH спариваются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv)); см. например, Bird et al. Science 242:423-426 (1988) и Huston et al., Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988)). Другие формы одноцепочечных антител, такие как диатела, также включены в настоящее изобретение. Диатела являются бивалентными, биспецифическими антителами, в которых домены VH и VL экспрессируются в виде единой полипептидной цепи, но с использованием линкера, слишком короткого, чтобы сделать возможным спаривание между двумя доменами на одной цепи, таким образом, заставляющего домены спариваться с комплементарными доменами другой цепи и создающего два антигенсвязывающих участка (см. например, Holliger et al. Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993); Poljak et al., 1994, Structure 2:1121-1123).
[164] Термин "вариабельный домен" антитела относится к вариабельной области легкой цепи (VL) антитела или вариабельной области тяжелой цепи (VH) антитела в отдельности или в комбинации. Как известно в этой области, каждая из вариабельных областей тяжелых и легких цепей состоит из трех определяющих комплементарность областей (CDR), соединена четырьмя каркасными областями (FR) и участвует в образовании антигенсвязывающего участка антител.
[165] Остатки в вариабельном домене пронумерованы по Kabat, что представляет собой систему нумерации, используемую для вариабельных доменов тяжелых цепей или вариабельных доменов легких цепей из компиляции антител. См., Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). При использовании этой системы нумерации точная линейная аминокислотная последовательность может содержать меньше или больше аминокислот, соответствующих укорачиванию или инсерции в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать инсерцию одной аминокислоты (остаток 52a по Kabat) после остатка 52 CDR-H2 и встроенные остатки (например остатки 82a, 82b и 82c по Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat можно определять для указанного антитела посредством выравнивания в областях гомологии последовательности антитела со "стандартной" пронумерованной по Kabat последовательностью. Доступны различные алгоритмы для осуществления нумерации по Kabat. Если не указано иначе, в настоящем описании для осуществления нумерации по Kabat вариабельных областей используют алгоритм, осуществленный в версии Abysis 2012 года (www.abysis.org).
[166] Конкретные положения аминокислотных остатков в антителе (таких как остатки паратопов) также пронумерованы по Kabat.
[167] "Определяющие комплементарность области" (CDR) можно идентифицировать по Kabat, Chothia, комбинации нумерации по Kabat и Chothia, AbM, с использованием системы Contact и/или посредством конформационного определения или любым способом определения CDR, хорошо известным в этой области. См., например, Kabat et al., 1991, Proteins of Immunological Interest, 5th Ed. (гипервариабельные области); Chothia et al., 1989, Nature 342:877-883 (структуры структурных петель). Определение AbM CDR представляет собой компромисс между системами Kabat и Chothia, и в нем используют программное обеспечение для моделирования антител Oxford Molecular's AbM (Accelrys®). Определение CDR с помощью системы "Contact" основано на наблюдаемых контактах антигена, как приведено в MacCallum et al., 1996, J. Mol. Biol., 262:732-745. "Конформационное" определение CDR основано на остатках, вносящих вклад в энтальпию связывания антигена (см., например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166). При других определениях границ CDR можно не следовать строго одному из указанных выше подходов, но, тем не менее, они будут перекрываться с, по меньшей мере, частью CDR по Kabat, хотя они могут быть укороченными или удлиненными с учетом прогнозирования или экспериментальных данных о том, что конкретные остатки или группы остатков или даже целые CDR не влияют значительно на связывание антигена. В рамках изобретения термин "CDR" может относиться к CDR, определенным с помощью подходов, известных в этой области, включая комбинации подходов.
[168] В примерах (см. таблицу 11) CDR определяют следующим образом (нумерация по Kabat; H: тяжелая цепь; L: легкая цепь):
CDR-H1: H26-H35B; CDR-H2: H50-H65; CDR-H3: H95-H102
CDR-L1: L24-L34; CDR-L2: L50-L56; CDR-L3: L89-L97
[169] "Каркасные" (FR) остатки являются остатками вариабельного домена антитела, иными, чем остатки CDR. Каркас домена VH или VL содержит четыре каркасные подобласти, FR1, FR2, FR3 и FR4, перемежающие с CDR в следующей структуре: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. В примерах (см. таблицу 11) остатки FR включают следующее (нумерация по Kabat; H: тяжелая цепь; L: легкая цепь):
Таблица 5
[170] Термин "эпитоп" относится к области антигена (Ag), с которой антитело специфически связывается, например, области, содержащей аминокислотные остатки, взаимодействующие с антителом (Ab). Эпитопы могут быть линейными или нелинейными (например, конформационными).
[171] Антитело или его антигенсвязывающий фрагмент связываются, по существу, с тем же эпитопом, что и другое антитело или его антигенсвязывающий фрагмент, если связывание соответствующих антител или их антигенсвязывающих фрагментов является взаимоисключающим. Т.е. связывание одного антитела или его антигенсвязывающего фрагмента исключает одновременное или последовательное связывание другого антитела или его антигенсвязывающего фрагмента. Эпитопы указывают как уникальные или, по существу, не одинаковые, если антиген способен одновременно осуществлять связывание обоих соответствующих антител или их антигенсвязывающих фрагментов.
[172] Термин "паратоп" получают из указанного выше определения "эпитопа" посредством изменения точки зрения, и он относится к области молекулы антитела, вовлеченной в связывание антигена, например, области, содержащей остатки, взаимодействующие с антигеном. Паратоп может быть линейным или конформационным (таким как прерывистые остатки в CDR).
[173] Эпитоп/паратоп для указанной связывающейся пары антитело/антиген можно определять и охарактеризовывать на различных уровнях с использованием множества экспериментальных и вычислительных способов картирования эпитопов. Экспериментальные способы включают мутагенез, рентгеновскую кристаллографию, спектроскопию ядерного магнитного резонанса (ЯМР), масс-спектрометрию с водород-дейтериевым обменом (HX-MS) и различные способы конкурентного связывания. Т.к. каждый способ основан на уникальном принципе, описание эпитопа тесно связано со способом, которым его определяют. Таким образом, эпитоп/паратоп для указанной пары антитело/антиген будут определять по-разному в зависимости от используемого способа картирования.
[174] На наиболее подробном уровне эпитоп/паратоп для взаимодействия между антителом (Ab) и антигеном (Ag) можно определять по пространственным координатам, определяющим атомные контакты, присутствующие при взаимодействии Ag-Ab, а также с помощью информации об их относительном вкладе в термодинамику связывания. На одном уровне остаток эпитопа/паратопа можно охарактеризовывать по пространственным координатам, определяющим атомные контакты между Ag и Ab. В одном из аспектов остаток эпитопа/паратопа можно определять с помощью конкретного критерия, например, расстояния между атомами в Ab и Ag (например, расстояния, меньшего или равного приблизительно 4 Å (такого как 3,8 Å, используемое в примерах) от тяжелого атома когнатного антитела и тяжелого атома антигена. В другом аспекте остаток эпитопа/паратопа можно охарактеризовывать как вносящий вклад в водородную связь с когнатным антителом/антигеном или с молекулой воды, также соединенной водородной связью с когнатным антителом/антигеном (опосредованной водой водородной связью). В другом аспекте остаток эпитопа/паратопа можно охарактеризовывать как образующий солевой мостик с остатком когнатного антитела/антигена. В еще одном аспекте остаток эпитопа/паратопа можно охарактеризовывать как остаток, имеющий ненулевое изменение площади погруженной поверхности (BSA) по причине взаимодействия с когнатным антителом/антигеном. На наименее подробном уровне эпитоп/паратоп можно охарактеризовывать по функции, например, по конкурентному связыванию с другими Ab. Эпитоп/паратоп также можно определять в более общем смысле как содержащий аминокислотные остатки, в случае которых замена другой аминокислотой будет изменять характеристики взаимодействия между Ab и Ag (например, аланиновое сканирование).
[175] Что касается рентгеновской кристаллической структуры, определенной по пространственным координатам комплекса между антителом, например, Fab-фрагментом или двумя Fab-фрагментами, и его антигеном, если не указано иначе, термин "остаток эпитопа" относится к остатку IFNβ, (i) имеющему тяжелый атом (т.е. неводородный атом), находящийся на расстоянии в пределах приблизительно 4 Å (например, 3,8 Å) от тяжелого атома когнатного антитела; (ii) участвующему в образовании водородной связи с остатком когнатного антитела или с молекулой воды, также образующей водородную связь с когнатным антителом (опосредованную водой водородную связь), (iii) участвующему в образовании солевого мостика с остатком когнатного антитела, и/или (iv) имеющему ненулевое изменения площади погруженной поверхности (BSA) по причине взаимодействия с когнатным антителом. В основном, используют пороговое значение для BSA во избежание исключения остатков с минимальными взаимодействиями. Таким образом, если не указано иначе, выбирают остатки эпитопа в категории (iv), если они имеют BSA 20 Å2 или более или вовлечены в электростатические взаимодействия, если антитело связывается с IFNβ. Аналогично, что касается рентгеновской кристаллической структуры, если не указано иначе или это не противоречит контексту, термин "остаток паратопа" относится к остатку антитела, (i) имеющему тяжелый атом (т.е. неводородный), находящий на расстоянии в пределах приблизительно 4 Å от тяжелого атома IFNβ, (ii) участвующему в образовании водородной связи с остатком IFNβ или с молекулой воды, также образующей водородную связь с IFNβ (опосредованную водой водородную связь), (iii) участвующему в образовании солевого мостика с остатком IFNβ и/или (iv) имеющему ненулевое изменения площади погруженной поверхности по причине взаимодействия с IFNβ. И снова, если не указано иначе, выбирают остатки паратопов в категории (iv), если они имеют BSA 20 Å2 или более или вовлечены в электростатические взаимодействия, если антитело связывается с IFNβ. Остатки, идентифицированные по (i) расстоянию или (iv) BSA, часто обозначают как "контактные" остатки.
[176] Из того факта, что описания и определения эпитопов зависят от используемого способа картирования эпитопа и их получают на различных уровнях детализации, следует, что сравнение эпитопов для различных Ab на одном Ag аналогично можно осуществлять на различных уровнях детализации. Например, эпитопы, описанные на уровне аминокислот, например, определенные из рентгеновской структуры, указывают как идентичные, если они содержат одинаковый набор аминокислотных остатков. Эпитопы, охарактеризованные по конкурентному связыванию, указывают как перекрывающиеся, если связывание соответствующих антител является взаимоисключающим, т.е. связывание одного антитела исключает одновременное или последовательное связывание другого антитела; и эпитопы указывают как отдельные (уникальные), если антиген способен осуществлять одновременное связывание обоих соответствующих антител.
[177] Эпитоп и паратоп для указанной пары антитело/антиген можно идентифицировать рутинными способами. Например, общую локализацию эпитопа можно определять посредством оценки способности антитела связываться с различными фрагментами или вариантами полипептидов IFNβ, как более полно представлено выше в настоящем описании. Конкретные остатки в IFNβ, контактирующие с конкретными остатками в антителе, также можно определять рутинными способами, такими как описываемые в примерах. Например, можно кристаллизовать комплекс антитело/антиген. Кристаллическую структуру можно определять и использовать для идентификации конкретных участков взаимодействия между антителом и антигеном.
[178] Термины "специфически связывается" и "специфическое связывание" являются терминами, хорошо известными в этой области, и способы определения такого специфического связывания также хорошо известны в этой области. Молекулу указывают как проявляющую "специфическое связывание", если она реагирует или связывается чаще, быстрее, с большей длительностью и/или большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело или его антигенсвязывающий фрагмент "специфически связывается" с мишенью (например, IFNβ), если оно связывается с большей аффинностью, авидностью, легче и/или с большей длительностью, чем с другими веществами.
[179] Например, антитело или его антигенсвязывающий фрагмент, специфически связывающиеся с IFNβ, является антителом, связывающимся с его когнатным антигеном (IFNβ) с большей аффинностью, авидностью, легче и/или с большей длительностью, чем с другими антигенами, такими как другие члены суперсемейства IFN (например, IFNα, IFNγ, IFNω) или другие неродственные молекулы. Например, антитело против IFNβ может специфически связываться с IFNβ человека в образце, но, по существу, не распознает или не связывается с другими молекулами в образце в стандартных условиях анализа связывания. Также следует понимать, что антитело или его антигенсвязывающий фрагмент, специфически связывающиеся с первой мишенью, может специфически связываться или не связываться со второй мишенью. В связи с этим, "специфическое связывание" не обязательно требует (хотя может включать) исключительного связывания. Как правило, но не обязательно, упоминание "связывания" означает специфическое связывание.
[180] Для выбора антитела или его антигенсвязывающего фрагмента, специфически связывающегося с интересующей молекулой, можно использовать различные форматы анализа. Например, твердофазный иммунологический анализ ELISA, иммунопреципитация, Biacore™ (GE Healthcare), KinExA, активируемая флуоресценцией сортировка клеток (FACS), Octet™ (FortéBio, Inc.) и анализ вестерн-блоттинга являются одними из многих анализов, которые можно использовать для идентификации антитела или его антигенсвязывающего фрагмента, специфически связывающегося с антигеном. Как правило, специфическое связывание будет по меньшей мере в два раза превышать фоновый сигнал или шум, как правило, по меньшей мере в 10 раз превышать фон, по меньшей мере в 50 раз превышать фон, по меньшей мере в 100 раз превышать фон, по меньшей мере в 500 раз превышать фон, по меньшей мере в 1000 раз превышать фон или по меньшей мере в 10000 раз превышать фон.
[181] Специфичность связывания антитела можно оценивать посредством определения и сравнения значений KD специфического связывания между антителом и IFNβ со значением KD контрольного антитела, о котором известно, что оно связывается с IFNβ. В основном, антитело указывают как "специфически связывающееся" с антигеном, если KD составляет приблизительно 1×10-5 M или менее.
[182] Антитело или его антигенсвязывающий фрагмент "по существу, не связывается" с антигеном, если оно не связывается с указанным антигеном в более высокой аффинностью, авидностью, легче и/или с большей длительностью, чем с другими антигенами. Как правило, связывание не будет превышать фоновый сигнал или шум более чем в два раза. В основном, они связываются с антигеном с KD 1×10-4 M или более, 1×10-3 M или более, 1×10-2 M или более или 1×10-1 M или более.
[183] В рамках изобретения термин "конкурирует" в отношении антитела означает, что связывание первого антитела или его антигенсвязывающей части с антигеном снижает последующее связывание того же антигена вторым антителом или его антигенсвязывающей частью. В основном, связывание первого антитела создает стерическое препятствие, конформационное изменение или связывание с общим эпитопом (или его частью), таким образом, что снижается связывание второго антитела с тем же антигеном. Для определения того, конкурируют ли два антитела друг с другом, можно использовать стандартные анализы конкурентного связывания.
[184] Один из подходящих анализов на конкуренцию антител включает использование технологии Biacore, с помощью которой можно измерять степень взаимодействий с использованием технологии поверхностного плазмонного резонанса (SPR), как правило, с использованием биосенсорной системы (такой как система BIACORE®). Например, SPR можно использовать в анализе конкурентного связывания/ингибирования in vitro для определения способности одного антитела ингибировать связывание второго антитела. В другом анализе для измерения конкуренции антитела используют подход на основе ELISA. Кроме того, в WO2003/48731 описывают высокопроизводительный способ "биннинга" антител в зависимости от их конкуренции. Конкуренция имеет место, если одно антитело или его антигенсвязывающий фрагмент снижают связывание другого антитела или его антигенсвязывающего фрагмента с IFNβ. Например, можно использовать анализ конкурентного последовательного связывания, при этом различные антитела добавляют последовательно. Первое антитело можно добавлять для достижения связывания, близкого к насыщению. Затем добавляют второе антитело. Если связывание второго антитела с IFNβ не определяют или оно значительно снижено (например, по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 80% или по меньшей мере на приблизительно 90%) по сравнению с параллельным анализом в отсутствие первого антитела (значение для которого можно принимать за 100%), два антитела считают конкурирующим друг с другом. Пример конкурентного анализа антител (и анализа перекрывающихся эпитопов) посредством SPR представлен в примере 1.
[185] Также можно осуществлять анализ конкурентного связывания, в котором связывание антитела с антигеном сравнивают со связыванием мишени другим партнером по связыванию этой мишени, таким как другое антитело или растворимый рецептор, в ином случае связывающимся с мишенью. Концентрация, при которой происходит 50% ингибирования, известна как Ki. В идеальных условиях Ki эквивалентна KD. Таким образом, в основном, измерение Ki можно, соответствующим образом, заменять для получения верхнего предела KD. Аффинности связывания, ассоциированные с различными молекулярными взаимодействиями, например, аффинности связывания различных антител для указанного антигена, можно сравнивать посредством сравнения значений KD для отдельных комплексов антитело/антиген. Значения KD для антител или других партнеров по связыванию можно определять способами, хорошо известными в этой области.
[186] "Fc-слитый" белок является белком, где один или несколько полипептидов функционально связаны с Fc-полипептидом. В Fc-слитом белке комбинируют Fc-область иммуноглобулина с партнером по слиянию. "Fc-область" может являться нативной последовательностью Fc-области или вариантом Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи IgG человека, как правило, определяют как простирающуюся от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. Нумерация остатков в Fc-области соответствует индексу EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc-область иммуноглобулина, в основном, содержит два константных домена, CH2 и CH3. Как известно в этой области, Fc-область может находиться в димерной или мономерной форме.
[187] Термин "терапевтически эффективное количество" означает количество антитела против IFNβ или его антигенсвязывающего фрагмента или комбинации, содержащей такое антитело или его антигенсвязывающий фрагмент, достаточное для достижения намеченной цели, такой как снижение связывания IFNβ с IFNAR, снижение фосфорилирования STAT1 и/или STAT2, снижение экспрессии IFNβ-зависимого гена, или иным образом вызывающее измеримый благоприятный эффект in vivo у нуждающегося в этом индивидуума. Точное количество будет зависеть от множества факторов, включая, в качестве неограничивающих примеров, компоненты и физические характеристики терапевтической композиции, намеченной выборки пациентов, индивидуальных соображений в отношении пациента и т.п., и их может определять специалист в этой области.
[188] Термин "лечение" включает профилактическое и/или терапевтическое лечение. Если его проводят до клинической манифестации заболевания, нарушения или состояния, лечение считают профилактическим. Терапевтическое лечение включает, например, улучшение или снижение тяжести заболевания, нарушения или состояния или уменьшение длительности заболевания, нарушения или состояния. Предпочтительно, заболевание, нарушение или состояние опосредовано или связано со связыванием IFNβ с IFNAR.
[189] В рамках изобретения термин "приблизительно" относится к величине ±10% от значения.
БИОЛОГИЧЕСКИЙ ДЕПОЗИТ
[190] Характерные материалы по настоящему изобретению депонировали в American Type Culture Collection, 10801 University Boulevard, Manassas, Va. 20110-2209, USA, на 18 декабря 2015 года. Вектор CTI-AF1-VH, имеющий регистрационный номер ATCC PTA-122727, содержит вставку ДНК, кодирующую вариабельную область тяжелой цепи антитела CTI-AF1, и вектор CTI-AF1-VL, имеющий регистрационный номер ATCC PTA-122726, содержит вставку ДНК, кодирующую вариабельную область легкой цепи антитела CTI-AF1. Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и соответствующими нормативными актами (Будапештский договор). Это обеспечивает поддержание жизнеспособной культуры депозита в течение 30 лет с даты начала депонирования. Депозит будет доступен в ATCC по условиям Будапештского договора и является предметом соглашения между Pfizer Inc. и ATCC, что гарантирует постоянную и неограниченную публичную доступность потомства культуры депозита после выдачи соответствующего патента США или после выкладки для публики любой патентной заявки США или иностранной патентной заявки, в зависимости от того, что наступит раньше, и гарантирует доступность потомства по определению Ведомства по патентам и торговым знакам США в соответствии с 35 U.S.C. раздел 122 и соответствующими нормативными актами Ведомства (включая 37 C.F.R. раздел 1.14 с конкретной ссылкой на 886 OG 638).
[191] Владелец настоящей заявки согласился, что если культура материалов в депозите должна умереть или она утрачена или разрушена при культивировании в подходящих условиях, материалы будут незамедлительно заменены другими после уведомления. Доступность депонируемого материала не следует истолковывать как лицензию на практическое осуществление изобретения в нарушение прав, предоставленных любым государством в соответствии с его патентным законодательством.
Примеры
[192] Настоящее изобретение далее будет подробно описано со ссылкой на следующие экспериментальные примеры. Эти примеры представлены исключительно в иллюстративных целях и не предназначены для ограничения изобретения, если не указано иначе. Таким образом, изобретение ни в коем случае не следует истолковывать как ограниченное следующими примерами, а скорее как включающее любые и все варианты, становящиеся очевидными в свете руководства, представленного в настоящем описании.
Пример 1. ПОЛУЧЕНИЕ антител против IFNβ
[193] Антитело CTI-AF1 является гуманизированным антителом IgG1 против растворимого цитокина интерферона бета (IFNβ). Моноклональное антитело мыши (mAb мыши) против IFNβ человека получали посредством стандартной иммунизации самок мышей BALB/c с использованием IFNβ человека и последующего скрининга гибридом.
[194] Два клона гибридом выбирали для гуманизации с учетом профиля кинетики связывания. Клоны демонстрировали значение KD приблизительно 20 нМ и IC50 приблизительно 20 нМ. Клоны гибридом гуманизировали с использованием каркасных последовательностей зародышевой линии человека из IGKV1-39 (вариабельный домен легкой цепи DPK9; регистрационный номер Gene Bank X59315) и IGHV1-69 (вариабельный домен тяжелой цепи DP10; регистрационный номер Gene Bank L22582).
[195] Для повышения аффинности антитела использовали множество раундов созревания аффинности. Последовательности области VL этих антител представлены в таблице 11. Все антитела в таблице 11 имеют одинаковую последовательность VH. В частности, в случае CTI-AF1 наблюдали снижение значения KD от 25 нМ до 29 пМ по причине внесения следующих мутаций в вариабельный домен легкой цепи: мутация S в G в положении 30, мутации H в I и T в I в положении 92 и 93, соответственно, и мутация L в I в положении 96. Не вносили мутации в вариабельный домен тяжелой цепи.
[196] Аффинности антител CTI-AF к интерферону бета человека (IFNβ) определяли посредством SPR следующим образом с использованием устройства Biacore T200. Антитела напрямую иммобилизовали на поверхности сенсорного чипа CM5 при комнатной температуре с использованием стандартного способа присоединения по аминогруппам. Уровни иммобилизации охватывали диапазон от 49 до 375 резонансных единиц (RU). Затем аналит, рекомбинантный IFNβ человека, инъецировали в серии разведений в диапазоне от 10 нМ до 0,078 нМ (2-кратное разведение) при скорости потока от 30 до 50 мкл в минуту в течение времени ассоциации в диапазоне от 65 до 300 секунд с последующей фазой диссоциации продолжительностью 10 минут. Каждую концентрацию оценивали в двух параллелях. Аналит удаляли посредством регенерации поверхности сенсорного чипа CM5 между циклами с использованием 3 M MgCl2 при pH 3,0 или 10 мМ глицин-HCl при pH 1,5 с последующей промывкой буфером. С помощью этой стадии регенерации удаляли связанный аналит и возвращали сигнал ответа к исходному уровню. Данные из референсной проточной кюветы (без аналита) вычитали из ответов со связыванием антигена для удаления системных артефактов. Кажущуюся аффинность связывания определяли с использованием модели взаимодействия 1:1 с помощью программного обеспечения для оценки Biacore T200 версии 2.0. Равновесную константу KD определяли как соотношение кинетических констант скорости, kd/ka. Связывание валидировали посредством повторения экспериментов по связыванию в течение множества дней с использованием двух отдельных устройств и разных проточных кювет на сенсорном чипе CM5. Результаты представлены в таблице 6.
Таблица 6: Виды биологической активности антител в таблице 11
ПРИМЕР 2. БИОФИЗИЧЕСКИЕ СВОЙСТВА АНТИТЕЛ ПРОТИВ IFNβ
[197] CTI-AF1 подвергали диализу и концентрировали до 150 мг/мл в буфере MOD1 с использованием восстановленной целлюлозной мембраны 10K MWCO. Материал ETS яванского макака подвергали ультрафильтрации/диафильтрации в том же буфере до конечной концентрации 72 мг/мл с минимальными потерями продукта. При составлении в PBS при pH 7,2 в ~50 мг/мл CTI-AF1 разделялось на фазы при 2-8°C и образовывало стабильную мутную эмульсию. После нагревания до комнатной температуры раствор снова становился прозрачным. В буфере MOD1 разделение фаз не происходил.
[198] Вязкость измеряли при 22°C с использованием вискозиметра mVROC. Инъекции осуществляли со скоростью 100 мкл/мин с использованием шприца Гамильтона 100 мкл. Зависимость вязкости от концентрации представлена на фигуре 1. Даже при максимальной концентрации вязкость все равно составляет менее 10 сП.
[199] Термическую стабильность оценивали с использованием MicroCal VP-DSC (Malvern). CTI-AF1 сканировали при концентрации белка 1 мг/мл в буфере MOD1 со скоростью 1 град/мин. Как показано на фигуре 2, первый переход плавления этой молекулы происходит при 69,4°C, что гораздо выше известного необходимого порога стабильности для производительности промышленного масштаба.
[200] Стабильность при низком pH оценивали посредством титрования совокупности протеина A с использованием лимонной кислоты до pH 2,8, 3,0 и 3,4 и инкубации в течение 5 часов при комнатной температуре до нейтрализации до pH 7,0. Как показано на фигуре 3, образование HMMS происходит только при pH 2,8, в то время как при более высоких уровнях pH продукт является стабильным. Эта стабильность будет делать возможной инактивацию оболочечных вирусов при низком pH, что необходимо для коммерческого производства.
[201] Исследование стабильности при замораживании/размораживании осуществляли с использованием количества 72 мг/мл в буфере MOD1, помещая пробирку Eppendorf, содержащую 1 мл продукта при -80°C в течение 10 мин, с последующим размораживанием при комнатной температуре. Не наблюдали значимую агрегацию после 3 циклов замораживания/размораживания.
[202] Исследования стабильности осуществляли с использованием количества 100 мг/мл в буфере MOD1 в течение 6 недель при 2-8°C (фигура 4A) и температуре окружающей среды (22°C, фигура 4C); с использованием количества 5 мг/мл в буфере MOD1 в течение 4 недель при 40°C (фигура 4B); в 20 мМ буфере (глутаминовая кислота, pH 4,0, гистидин, pH 5,8, Трис, pH 8,0) с использованием количества 4 мг/мл в течение 5 или 11 дней при 37°C (фигура 4D). Тестирование временных точек осуществляли посредством SE-ВЭЖХ. Не определяли значимого повышения HMW в любом из исследований. Аналогично, при анализе посредством CGE не наблюдали каких-либо значимых различий между временными точками. Гетерогенность заряда оценивали посредством iCE (таблица 7) и наблюдали повышение кислых молекул при 37°C (особенно при pH 8,0) и 40°C, что свидетельствует о некоторой степени дезамидирования и/или окисления. Однако не определяли существенных изменений для начала исследования посредством жидкостной хроматографии (LS)/масс-спектрометрии (MS). В другой серии исследований стабильности (2-8°C и температура окружающей среды) не наблюдали значимых изменений % кислых и % основных молекул по данным iCE.
[203] Временные точки из исследования стабильности серии с использованием 40°C тестировали с помощью клеточного анализа с измерением нейтрализации активности IFNβ (фигуры 5 A-D). В день 1 20000 клеток HEK293 ISRE-Luc (IFNβ-отвечающий люциферазный репортер) высевали в 100 мкл DMEM, содержащей 10% эмбриональную телячью сыворотку (FBS), на лунку в обработанных 96-луночных планшетах для культивирования ткани. Растворы антител получали в виде 2-кратных стоков, начиная с наиболее высокой концентрации 1 мкМ в DMEM/10% FBS, а затем получали серию 10-кратных разведений из 11 точек с использованием сред. Получали 20-кратный сток IFNβ (0,625 нг/мл) в средах и добавляли к стокам антител до конечной 2-кратной концентрации. Растворы антитело:IFNβ инкубировали в течение 2 часов при 37°C, затем добавляли 100 мкл раствора на лунку и культивировали планшеты в течение ночи при 37°C. В день 3 получали 150 мкг/мл раствор люциферина жука, калиевую соль и добавляли 20 мкл/лунку, планшеты инкубировали в течение 15 минут при 37°C. Люминесценцию анализировали с помощью многоканального спектрофотометра для чтения планшетов EnVision. Не определяли изменения нейтрализующей активности.
[204] CTI-AF1 совместимо с буфером для составления (20 мМ гистидин, 8,5% сахарозы, 0,05 мг/мл ЭДТА, pH 5,8) и сохраняет растворимость в количестве до 150 мг/мл с приемлемой вязкостью.
Таблица 7: Гетерогенность заряда в образцах в исследовании стабильности
ПРИМЕР 3. ФАРМАКОЛОГИЯ
Краткое описание
[205] CTI-AF1 является мощным и высокоселективным гуманизированным антителом IgG1 против растворимого цитокина интерферона бета (IFNβ). In vitro CTI-AF1 демонстрировало высокую аффинность к IFNβ человека (KD 36,7±12,4 пМ). Антитело демонстрировало схожую EC50 связывания для IFNβ человека и яванского макака (15,28±2,11 пМ и 25,04±5,11 пМ, соответственно). В функциональных анализах с использованием клеток человека CTI-AF1 демонстрировало мощную нейтрализацию IFNβ-индуцированного фосфорилирования STAT1 (IC50 от 7,7±5,0 до 29,8±6,9 пМ) и экспрессии стимулируемого интерфероном типа I люциферазного репортера в культивируемых клетках человека (анализ ISRE; IC50 28,8±7,6 пМ). CTI-AF1 также ингибировало IFNβ-регулируемую экспрессию MxA (Mx1) в анализах экспрессии генов (IC50 29,4±23,5 пМ) и было способно ингибировать IFNβ, эндогенно экспрессируемый дермальными фибробластами человека, связанным с заболеванием типом клеток, после стимуляции полиинозиновой:полицитидиловой кислотой (поли-I:C).
Первичная фармакология, in vitro
[206] При исходном скрининге гибридом антитела выбирали в зависимости от их способности блокировать связывание IFNβ с IFNAR2, высокоаффинным компонентом рецептора IFN типа I (фигура 6). При последующих скринингах после гуманизации и созревания аффинности селекция антитела зависела от функциональной нейтрализации IFNβ в клеточных анализах.
[207] SPR использовали для определения KD CTI-AF1 к IFNβ человека; эксперименты по связыванию осуществляли с использованием оптического биосенсора Biacore T200, оборудованного исследовательским сенсорным чипом CM5, и IFNβ человека (Peprotech). Регенерацию чипа осуществляли с использованием вымывающего буфера (3M MgCl2 при pH 3,0 или 10 мМ глицин при pH 1,5) с последующей промывкой буфером. CTI-AF1 иммобилизовали на поверхности сенсорного чипа CM5 при комнатной температуре. Уровень захвата охватывал диапазон от 50 до 375 единиц резонанса (RU). Затем аналит, IFNβ человека, инъецировали при скорости потока 30-50 мкл в минуту в течение времени ассоциации в диапазоне 65-300 секунд с последующей фазой диссоциации продолжительностью 10 минут. Кинетическую характеризацию взаимодействий осуществляли с помощью общепринятого многоциклового способа с использованием серии концентраций IFNβ человека от 10 нМ до 0,078125 нМ в серии 2-кратных разведений. Каждую концентрацию оценивали в двух параллелях. Аналит удаляли посредством регенерации поверхности чипа между циклами с использованием 3 M MgCl2 при pH 3,0 или 10 мМ глицин при pH 1,5 с последующей промывкой буфером. С помощью этой стадии регенерации удаляли связанный аналит и возвращали сигнал ответа к исходному уровню. Данные из референсной проточной кюветы (без аналита) вычитали из ответов со связыванием антигена для удаления системных артефактов. Кажущуюся аффинность связывания определяли с использованием модели взаимодействия 1:1 и равновесную константу KD определяли как соотношение кинетических констант скорости. Определяли, что кажущаяся аффинность связывания CTI-AF1 для IFNβ человека составляет 36,7±12,4 пМ (фигура 7).
[208] Связывание CTI-AF1 с IFNβ человека и ортологами яванского макака, кролика, крысы и мыши и тремя из ближайших гомологов типа I человека и IFNγ (тип II) оценивали посредством ELISA с использованием планшетов. Планшеты ELISA покрывали в течение ночи при 4°C 5 мкг/мл одного из следующих цитокинов: IFNβ человека, IFNβ яванского макака, IFNβ крысы, IFNα2 человека, IFNγ, IFNω человека; IFNβ мыши или IFNα14(H2) человека наносили в количестве 1 мкг/мл, и IFNβ кролика наносили в количестве 10 нг/мл. Все белки разводили в фосфатно-солевом буфере, не содержащем кальций и магний. Покрытые планшеты промывали фосфатно-солевым буфером, содержащим 0,05% Tween-20 (PBST), и блокировали в течение 1 часа при комнатной температуре с использованием блокирующего буфера (PBST+0,5% BSA). Планшеты снова промывали PBST и на планшет добавляли первичные антитела в начальной концентрации 30 нМ, а затем в разведениях 1:3 в блокирующем буфере. В случае антитела против IFNβ кролика осуществляли разведения 1:10. Планшеты инкубировали в течение 1 часа при комнатной температуре, а затем промывали PBST. Связывание определяли с использованием видоспецифических, связанных с пероксидазой вторичных антител и субстрата тетраметилбензидина (TMB1). Реакцию останавливали с использованием 0,18 M серной кислоты (H2SO4) и считывали поглощение при 450 нм с помощью многоканального спектрофотометра для чтения планшетов EnVision (PerkinElmer). В таблице 8 представлена схожая реактивность для IFNβ человека и яванского макака, в то время как реактивность для IFNβ кролика составляет в 200 раз меньше. Не наблюдали детектируемого связывания с IFNβ крысы или мыши, или с тремя ближайшими гомологами человека или IFNγ (тип II).
Таблица 8: Реактивность CTI-AF1 для ортологов IFNβ и ближайших гомологов типа I и IFNγ, измеренная посредством ELISA
"Отсутствие связывания": если поглощение при 450 нм составляло <2-кратного поглощения в пустых контрольных лунках.
[209] Два анализа in vitro использовали для демонстрации CTI-AF1-зависимого ингибирования IFNβ-индуцируемых сигналов. Сначала клетки HEK293, стабильно трансдуцированные с использованием люциферазного репортера ISRE человека, использовали в качестве меры IFNβ-зависимой экспрессии генов; в день 1 20000 клеток HEK293 ISRE-Luc (IFNβ-отвечающего люциферазного репортера) высевали в 100 мкл DMEM, содержащей 10% эмбриональную телячью сыворотку (FBS), на лунку в обработанных 96-луночных планшетах для культивирования тканей. Растворы антитела получали в виде 2-кратных стоков, начиная с самой высокой концентрации 1 мкМ, в DMEM/10% FBS. Получали серию 10-кратных разведений из 11 точек в средах. Получали 20-кратный сток IFNβ (28 нМ, конечная концентрация для анализа составляла 1,4 нМ, EC50) в средах и добавляли к стокам антител в конечной 2-кратной концентрации. Растворы антитело:IFNβ инкубировали в течение 2 часов при 37°C, затем добавляли 100 мкл на лунку и инкубировали планшеты в течение ночи при 37°C. В день 3 получали раствор люциферина жука 150 мкг/мл, калиевую соль, добавляли 20 мкл/лунку и инкубировали планшеты в течение 15 минут при 37°C. Люминесценцию анализировали с помощью многоканального спектрофотометра для чтения планшетов EnVision. На фигуре 8A представлено CTI-AF1-дозозависимое ингибирование IFNβ-индуцируемой активности люциферазы с IC50 28,8±7,6 пМ.
[210] Во-вторых, CTI-AF1-опосредованное ингибирование IFNβ-индуцируемого фосфорилирования STAT1 оценивали посредством Phosflow. Клетки U937, линию моноцитарных клеток человека, выращивали в RPMI 1640, содержащей 10% FBS и 2 мМ Glutamax (cRPMI). Стоки антител получали в 4-кратной концентрации, при этом наиболее высокая концентрация составляла 4 мкМ (конечная наиболее высокая концентрация составляла 1 мкМ), и получали серию 10-кратных разведений из 12 точек в cRPMI; добавляли 25 мкл/лунку в 96-луночный планшет для культивирования тканей с u-образным дном. К стокам антител добавляли равный объем 4-кратного IFNβ (200 пМ, конечная концентрация составляла 50 пМ, EC90) и инкубировали в течение 2 часов при 37°C. Контрольные лунки включали среды в отдельности (фон без стимуляции экспрессии pSTAT1) и только 50 пМ IFNβ (максимальный сигнал pSTAT1). Собирали клетки U937, центрифугировали их в течение 5 мин при 1500 об./мин. и комнатной температуре, а затем ресуспендировали в концентрации 2×106/мл в cRPMI, нагретой до 37°C; добавляли 50 мкл суспензии клеток на лунку и держали планшеты при 37°C в течение 15 минут. Затем добавляли 100 мкл предварительно нагретого буфера Cytofix и планшеты снова держали при 37°C в течение 15 минут. Планшеты убирали и центрифугировали, как описано выше. Из планшетов удаляли среды, клетки ресуспендировали и промывали в 200 мкл PBS и снова центрифугировали. Среды снова удаляли, затем клетки ресуспендировали в 100 мкл буфера IV для пермеабилизации и инкубировали при комнатной температуре в течение 15 минут. В конце инкубации клетки центрифугировали и промывали, как описано выше. После промывки PBS клетки ресуспендировали в 100 мкл PBS/5% FBS; добавляли 5 мкл TruStain FcX/лунку и инкубировали планшеты в течение 10 мин при 4°C. Добавляли десять микролитров конъюгированного с Alexa Fluor 674 (AF647) антитела против фосфо-STAT1 на лунку и инкубировали в течение 20 мин при 4°C. После инкубации добавляли 120 мкл буфера FACS на лунку и центрифугировали планшеты, как описано выше. Повторяли промывку 220 мкл буфера FACS и ресуспендировали клетки в 120 мкл буфера FACS. Для получения данных использовали цитометр Fortessa и осуществляли анализ с использованием программного обеспечения FlowJo. Вычисляли геометрическое среднее интенсивности флуоресценции (Geo MFI) по каналу AF647 и использовали программное обеспечение Prism для вычисления IC50. CTI-AF1 является мощным нейтрализатором IFNβ человека с IC50 29,8±6,9 пМ (фигура 8B).
[211] Для оценки способности CTI-AF1 нейтрализовать индуцируемую рекомбинантным IFNβ экспрессию гена MxA (Mx1) нормальные дермальные фибробласты человека (HDF) высевали во флакон T-150 в среде для культивирования фибробластов. Для начала анализа клетки удаляли из флакона с использованием раствора трипсина/ЭДТА и высевали в 48-луночный планшет, при этом выделяли три лунки на экспериментальное условие. В день 3 клетки стимулировали в течение 5 часов с использованием среды для культивирования, дополненной 0,15 пМ IFNβ, предварительно инкубированной в течение 2 часов с разведениями CTI-AF1 в диапазоне от 10 нМ до 0,016 нМ или без них. В качестве отрицательного контроля для эксперимента использовали комбинацию 0,15 пМ IFNβ и 50 нМ изотипического контрольного антитела. Через 5 часов клетки собирали, выделяли РНК с использованием набора RNeasy micro и синтезировали кДНК с использованием высокопроизводительного набора для обратной транскрипции кДНК. Осуществляли анализы ПЦР в реальном времени Taqman в системе Vii A7 (Thermo Fisher) с использованием специфических для гена человека праймеров и зондов для Mx1 и B2M. Относительное количество (кратное изменение) вычисляли из полученных значений Ct с использованием способа ΔΔCt следующим образом: для каждого условия значения Ct для эндогенного контрольного гена B2M) вычитали из соответствующих значений Ct для гена-мишени (Mx1). После этого осуществляли нормализацию относительно необработанного образца для вычисления значений ΔΔCt, которые затем использовали для вычисления кратного изменения (2ΔΔCt). Изотипическое антитело отрицательного контроля не влияло на экспрессию MxA (Mx1); однако, в присутствие CTI-AF1 наблюдали дозозависимое ингибирование транскрипции генов с IC50 29,4±23,5 пМ (фигура 9).
[212] Специфичность нейтрализации CTI-AF1 оценивали с использованием того же анализа pSTAT, как описано выше для фигуры 8B, однако, клетки U937 стимулировали конечной концентрацией 20 пМ IFNβ или 50 пМ IFNα. Выбирали различные концентрации IFN типа I для получения схожего уровня фосфорилирования STAT1, т.к. IFNα является менее мощным активатором передачи сигнала IFNAR. Схожую серию 10-кратных разведений из 12 точек получали с использованием сифалимумаба (SIF) в качестве положительного контроля для нейтрализации IFNα. Как можно видеть, CTI-AF1 специфически ингибировало IFNβ-индуцируемое фосфорилирование STAT1, но не ингибировало фосфорилирование, индуцируемое IFNα (фигуры 10 A и B, соответственно). Один эксперимент осуществляли с использованием IFNω (при 100 пМ) или IFNα14 (при 4 пМ), и CTI-AF1 не имело эффекта в отношении IFNω- или IFNα14-индуцируемого фосфорилирования STAT1.
[213] Для обеспечения того, что CTI-AF1 нейтрализовало эндогенно экспрессируемый IFNβ, нормальные дермальные фибробласты человека высевали в 48-луночный планшет, при этом выделяли три лунки на экспериментальное условие. В день 3 клетки стимулировали с использованием комбинации 1 мкг/мл поли-I:C и разведений CTI-AF1 (диапазон доз: 50 пМ-100 нМ) или без нее или 100 нМ сифалумумаба. Через 2,5 и 24 часа клетки собирали, выделяли РНК с использованием набора RNeasy micro и синтезировали кДНК с использованием высокопроизводительного набора для обратной транскрипции кДНК. ПЦР в реальном времени Taqman и вычисления кратного изменения осуществляли, как описано выше (фигура 9). Хотя количество IFNβ, индуцируемого посредством стимуляции поли-I:C, являлось неизвестным, наблюдали дозозависимое ингибирование экспрессии MxA (Mx1) в присутствие CTI-AF1 (фигура 11).
ПРИМЕР 4. ТРАНСЛЯЦИОННАЯ ФАРМАКОЛОГИЯ
[214] Взаимосвязь PK/PD для IFNβ при дерматомиозите (DM) не определена. Не существует релевантных транслируемых доклинических моделей, доступных для DM, и доклиническая эффективная концентрация (Ceff) непонятна. Сигнатуру генов интерферонов типа 1 будут использовать в клинических условиях в качестве механистического биомаркера фармакологической модуляции. Экспрессия генов интерферонов типа 1, как правило, повышена у пациентов с DM и SLE и среднее кратное изменение сигнатуры генов интерферонов тип 1 ранее использовали в клинических исследованиях mAb против IFNα (сифалимумаба и ронтализумаба) и против IFNAR (анифролумаба). Однако отсутствует количественное понимание модуляции сигнатуры генов и взаимосвязь между воздействием in vivo, связывание с мишенью, фармакология каскада и эффективность с течением времени непонятна. Проекты, касающиеся обоснованности эффективных доз у человека, основаны на способности CTI-AF1 нейтрализовать >95% IFNβ в коже.
[215] Анализ LC\MS\MS используют для измерения общего IFNβ в клинических образцах сыворотки и биоптатах ткани и в комбинации с клиническими данными о PK и KD CTI-AF1 и для оценки и подтверждения связывания с мишенью. Сигнатуру генов IFN типа 1 в крови и коже, а также IP-10 (CXCL10) оценивают в качестве механистических биомаркеров. В последующем исследовании доказательства механизма (PoM)/ранних признаков эффективности (ESoE) на пациентах с DM индекс распространенности и степени тяжести кожного дерматомиозита (CDASI) используют в качестве первичной конечной точки (биомаркер исхода) в дополнение к любым соответствующим механистическим биомаркерам.
Взаимосвязь фармакокинетики и фармакодинамики и доза для человека
[216] Фармакокинетические и фармакодинамические (PK/PD) взаимосвязи между воздействием лекарственного средства на основе антитела и IFNβ в случае CTI-AF1 симулировали с использованием опубликованных параметров PK для типичных терапевтических IgG1, равновесной константы связывания IFNβ-CTI-AF1, концентраций IFNβ в коже и сыворотке и времени кругооборота IFNβ.
[217] Модель PK/PD "место приложения действия" использовали для прогнозирования покрытия IFNβ у пациентов с DM. Покрытие IFNβ минимум >95% считали необходимым для достижения эффективности. Интерстициальные концентрации CTI-AF1 в коже принимали за концентрации в сыворотке 30%. Аффинность связывания CTI-AF1 с IFNβ, определяемую посредством SPR (Biacore KD=36,7 пМ), использовали для моделирования PK/PD. В соответствии с этим, в клеточных функциональных анализах CTI-AF1 демонстрировало мощную нейтрализацию IFNβ-индуцируемого фосфорилирования STAT1 (IC50 29,8 пМ).
[218] Медиана концентрация IFNβ в сыворотке пациентов с DM составляла 3 пг/мл (N=26); однако, концентрация IFNβ в коже пациентов с DM неизвестна. Таким образом, в модели исследовали влияние соотношений IFNβ кожа:плазма 10 и 100. Т.к. они являются чувствительным параметром для модели, эти соотношения использовали в качестве предлагаемых граничных условий для демонстрации влияния соотношения кожа:плазма на целевое покрытие.
[219] Время in vivo кругооборота IFNβ оценивали посредством аппроксимации 3-камерной модели к данным PK человека для IFNβ1a, включавшей 3 дозы IV. Эта аппроксимация приводила к получению двух других значений времени полужизни для кругооборота IFNβ, считающихся наиболее релевантными в зависимости от фазы и камер в диапазоне от 3 минут (с учетом начальной фазы) до 126 минут (с учетом эффективного времени полужизни). Для повышения достоверности этого параметра модели разрабатывали анализ IFNβ для сыворотки яванского макака для использования в отношении яванского макака.
[220] Соотношение IFNβ кожа:плазма и скорость кругооборота IFNβ являются чувствительными параметрами для модели PK/PD. Таким образом, оценку обоснованности эффективных доз у человека осуществляли с использованием диапазонов, описанных выше для соотношения IFNβ кожа:плазма и скорости кругооборота IFNβ. Примеры оценки двух вероятных клинических схем дозирования ESoE представлены на фигурах 12 A-D (IV Q4W) и фигурах 13A-D (SC Q1W). Растворимость CTI-AF1 в дозе 150 мг/мл сделает возможной клиническую дозу 2 мг/кг, и ее можно будет вводить с помощью шприца-ручки 1 мл. Таким образом, дозу 2 мг/кг использовали для оценки обоснованности эффективных доз, описанной ниже.
[221] На фигурах 12A-D показано, что при дозе 2 мг/кг IV Q4W, независимо от соотношения IFNβ кожа:плазма, только с помощью времени полужизни IFNβ 126 мин прогнозируют покрытие >95% IFNβ в коже. Если время полужизни IFNβ составляло 3 мин, прогнозируют, что покрытие >95% IFNβ в коже потребует доз выше 2 мг/кг. На фигурах 13A-D показано, что при дозе 2 мг/кг SC Q1W, независимо от соотношения IFNβ кожа:плазма, с помощью времени полужизни IFNβ 126 мин прогнозируют покрытие >95% IFNβ в коже. Если время полужизни IFNβ составляло 3 мин, то только соотношение IFNβ кожа:плазма 100 будет приводить к покрытию >95% IFNβ в коже при 2 мг/кг. В отличие от этого, если соотношение IFNβ кожа:плазма составляет 10, достижение покрытия >95% будет требовать доз выше 2 мг/кг.
PK человека/воздействие
[222] С учетом фармакокинетических профилей CTI-AF1 у яванского макака, ожидают, что фармакокинетика CTI-AF1 у человека будет схожей с сообщенными значениями для типичного терапевтического средства на основе IgG1. Значения 2-камерных фармакокинетических параметры приведены в таблице 9. Симулированные профили концентрация-время CTI-AF1 с предполагаемыми уровнями эффективных доз приведены на верхних панелях фигур 12A-D и 13A-D.
Таблица 9: Предполагаемые фармакокинетические параметры CTI-AF1 у человека
Неклиническая фармакокинетика
[223] Фармакокинетику CTI-AF1 IV и SC оценивали на яванских макаках с использованием данных из поискового исследования токсичности с однократным введением. Средние значения фармакокинетических параметров в сыворотке яванских макаков приведены в таблице 10 и средние концентрации CTI-AF1 в сыворотке приведены на фигуре 14.
Таблица 10: Сводная таблица фармакокинетики CTI-AF1 у яванских макаков
(ч)
ПРИМЕР 5. IFNβ В КАЧЕСТВЕ МИШЕНИ ПРИ SLE И DM
[224] Существует все больше доказательств того, что продукция IFN связана с SLE и другими ревматоидными заболеваниями, такими как DM. Кроме того, поддержание патологического процесса SLE, вероятно, включает дальнейшую продукцию IFN типа I и порочный круг патологии.
[225] DM является редким аутоиммунным заболеванием (приблизительно 20000 пациентов в США), отличающимся воспалением скелетных мышц и кожи, и, параллельно, слабостью скелетных мышц и кожной сыпью. DM, как правило, ассоциирован с аутоантителами, и патогенез заболевания может включать последовательное связывание этих аутоантител с эндотелиальным аутоантигеном, запуск активации комплемента и сосудистого воспаления, в конечном итоге, приводя к перифасцикулярной атрофии.
[226] Как показано на фигурах 16 A-B, данные свидетельствовали об ассоциации "сигнатуры" транскрипта интерферона типа I-регулируемого гена (IRG) в крови при DM с активностью кожной сыпи, измеряемой с помощью индекса распространенности и степени тяжести кожного дерматомиозита (CDASI). Высокоиндуцибельный IFNβ ген MxA (Mx1) экспрессируется в перифасцикулярных мышечных волокнах и капиллярах при DM, и IFNβ в сыворотке, но не IFNα или IFNω, ассоциирован с DM, но не с другими воспалительными миопатиями или нормальными сыворотками. Эти данные подтверждают предположение о том, что повреждение капилляров, мышечных волокон и кожи при DM является результатом патологической гиперпродукции мРНК и белка IFNβ. Данные также свидетельствуют об ассоциации между баллами CDASI и уровнями белка IFNβ в сыворотке (фигура 17). Анализы парных биоптатов кожи свидетельствуют о наличии мРНК IFNβ и положительной регуляции сигнатуры IRG только в пораженной ткани (фигуры 18 A-B). В совокупности, эти данные позволяют предполагать, что DM является IFNβ-регулируемым заболеванием.
[227] Учитывая, что во многих контекстах тканей продукция IFNβ может предшествовать продукции IFNα и инициировать патологическое повышение экспрессии сигнатуры IRG, а также представление о том, что DM может быть, в значительной степени, IFNβ-регулируемым заболеванием, полагают, что DM и SLE обладают множеством общих патологических признаков и характеристик. Фактически, повреждения кожи при DM трудно, если вообще возможно, гистологически отличить от повреждений при SLE, и для диагностики повреждений кожи при DM, как правило, необходимо клиническое определение повышения CD4+ и CXCR3+ клеток и эндотелиальной экспрессии Mx1. Кроме того, DM и SLE отличаются активацией B-клеток и опосредуемым аутоантителами воспалением и деструкцией ткани.
Таблица 11: Последовательности антител против IFNβ
(CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3 подчеркнуты, если это применимо)
(CDR-L1, CDR-L2, CDR-L3: SEQ ID NO: 34, 35, и 36, соответственно)
(CDR-H1, CDR-H2, CDR-H3: SEQ ID NOs 37, 38, и 39, соответственно)
ПРИМЕР 6. ЭПИТОПНОЕ КАРТИРОВАНИЕ
[228] Для определения эпитопа, распознаваемого CTI-AF1, получали гибридные белки IFNβ, в которых выбранные части последовательностей IFNβ заменяли последовательностью IFNα. CTI-AF1 специфически нейтрализует IFNβ, но не IFNα, таким образом, неспособность CTI-AF1 нейтрализовать указанный гибридный белок будет свидетельствовать об утрате эпитопа. Гибридные белки получали, очищали и подтверждали их способность индуцировать фосфорилирование STAT1 (таблица 12).
Таблица 12: Последовательности гибридных белков IFN
(подчеркнуты мутантные остатки)
[229] Все очищенные гибридные белки были способны индуцировать фосфорилирование STAT1, однако, три из них отличались по биологической активности. Каждый гибридный белок использовали в концентрации EC80 в следующем анализе фосфо-STAT1 (pSTAT1). Клетки U937, линию моноцитарных клеток человека, выращивали в RPMI 1640, содержащей 10% FBS (cRPMI). Получали стоки антител в 4-кратной концентрации, при этом наиболее высокая концентрация составляла 4-400 мкМ (конечная наиболее высокая концентрация составляла 1-100 мкМ), и получали серию 10-кратных разведений из 11 точек в cRPMI; добавляли 25 мкл/лунку в 96-луночный планшет для культивирования тканей с u-образным дном. Равный объем 4-кратного гибридного или контрольного IFNβ добавляли в соответствующей концентрации EC80 в стоки антител и инкубировали в течение 2 часов при 37°C. Контрольные лунки включали только среды (без стимуляции фоновой экспрессии pSTAT1) или без добавления антитела (максимальный сигнал pSTAT1). Клетки U937 собирали, центрифугировали в течение 5 мин при 1500 об./мин. и комнатной температуре, а затем ресуспендировали при концентрации 2×106/мл в cRPMI, нагретой до 37°C; добавляли 50 мкл суспензия клеток на лунку и планшеты держали при 37°C в течение 15 минут. Затем добавляли 100 мкл предварительно нагретого буфера Cytofix (BD Biosciences, кат. № 554655) и планшеты снова держали при 37°C в течение 15 минут. Планшеты убирали и центрифугировали, как описано выше. Удаляли среды из планшетов, клетки ресуспендировали и промывали в 200 мкл PBS и снова центрифугировали. Среды снова удаляли, клетки ресуспендировали в 100 мкл буфера для пермеабилизации IV (BD Biosciences) и инкубировали при комнатной температуре в течение 15 минут. В конце инкубации клетки центрифугировали и промывали, как описано выше. После промывки PBS клетки ресуспендировали в 100 мкл PBS/5% FBS (буфера FACS); добавляли 5 мкл TruStain FcX/лунку (BioLegend) и планшеты инкубировали в течение 10 мин при 4°C. Добавляли десять микролитров конъюгированного с Alexa Fluor 674 (AF647) Ab против фосфо-STAT1 (BD Biosciences) на лунку и инкубировали в течение 20 мин при 4°C. После инкубации добавляли 120 мкл буфера FACS на лунку и центрифугировали планшеты, как описано выше. Промывку повторяли с использованием 220 мкл буфера FACS и клетки ресуспендировали в 120 мкл буфера FACS; для получения данных использовали цитометр Fortessa (BD Biosciences) и анализ осуществляли с использованием программного обеспечения FlowJo (TreeStar). Вычисляли геометрическое среднее интенсивности флуоресценции (Geo MFI) по каналу AF647 и использовали программное обеспечение Prism для вычисления IC50. Данные нормировали как соотношение концентрации антитела/концентрации IFN и определяли процентную долю от максимального сигнала после вычитания фона.
[230] Клетки U937 стимулировали гибридными белками IFNα/IFNβ в течение 15 минут в присутствие CTI-AF1, после чего оценивали наличие фосфорилированного STAT1 посредством внутриклеточной проточной цитометрии. CTI-AF1 не ингибировало CID1280-зависимое фосфорилирование STAT1, и мощность нейтрализации CID1281-индуцируемого фосфорилирования STAT1 была значительно снижена. CTI-AF1 нейтрализовало фосфорилирование STAT1 в случае всех других гибридных белков IFN с равной мощностью относительно IFNβ человека. См. фиг. 19 и таблицу 13A. Эти данные в совокупности свидетельствуют о том, что остатки эпитопа, распознаваемые CTI-AF1, содержались в конструкциях CID1280 и CID1281, в которых замены последовательности IFNα охватывали аминокислоты 85-89 и 90-100, соответственно (см. таблицу 12).
Таблица 13A: IC50 и кратное изменение CTI-AF1-опосредованной нейтрализации индуцируемого IFN типа I фосфорилирования STAT1
ПРИМЕР 7. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА АНТИТЕЛ ПРОТИВ IFNβ
[231] Сокристаллы комплекса IFNβ яванского макака и Fab CTI-AF1 выращивали с использованием следующего раствора в качестве осадителя: 19% PEG 3350, 250 мМ цитрат натрия, 100 мМ бис-трис пропан, pH 8,5. Кристаллы принадлежат к пространственной группе P21 (параметры элементарной ячейки a=49,58 Å; b=91,76 Å; c=162,52 Å; b=94,86 град) и содержат две копии комплекса на группу асимметрии кристалла. Структуру определяли при разрешении 3,2 Å с использованием способа молекулярного замещения и уточнение осуществляли с использованием autoBUSTER.
[232] Fab CTI-AF1 связывается с IFNβ на стороне, образованной двумя α-спиралями, A и C, что определяет связывание эпитопа CTI-AF1 (таблица 13B)
Таблица 13B: Анализ эпитопов
[233] Все аминокислоты, находящиеся в пределах 3,8 Å от CTI-AF1, выбирали в качестве "потенциальных" остатков эпитопа. "Первичные" остатки эпитопа характеризуют как глубоко погруженные остатки на поверхности раздела CTI-AF1-IFNβ с толерантностью последовательности к любым другим заменам аминокислот в этом положении от нулевой до низкой. "Вторичные" остатки эпитопа характеризуют как остатки со средней площадью погруженной поверхности на поверхности раздела и средней толерантностью последовательности к любым другим заменам аминокислот в этих положениях. "Необязательные" остатки эпитопа характеризуют как остатки с низкой площадью погруженной поверхности на поверхности раздела и высокой толерантностью последовательности к любым другим заменам аминокислот в этих положениях.
[234] Связывающий паратоп состоит из пяти CDR вариабельных областей: CDR-H1, -H2, -H3 и CDR-L1, -L3 (таблица 14). Общая площадь поверхности, погруженной под связывающей поверхностью раздела, составляет 1,920 Å2. Анализ режима связывания CTI-AF1-IFNβ показал, что нейтрализующего эффекта CTI-AF1 достигают посредством прямого блокирования участка связывания IFNAR1.
Таблица 14: Анализ паратопов
[235] Все аминокислоты, находящиеся в пределах 3,8 Å от IFNβ, выбирали в качестве "потенциального" связывающего паратопа. "Первичные" остатки паратопов характеризуют как глубоко погруженные остатки на поверхности раздела CTI-AF1-IFNβ с низкой толерантностью последовательности к любым другим заменам аминокислот в этом положении. "Вторичные" остатки паратопов характеризуют как остатки с более низкой площадью погруженной поверхности на поверхности раздела и более высокой толерантностью последовательности к любым другим заменам аминокислот в этих положениях.
[236] В таблице 15 приведены взаимодействующие пары эпитоп-паратоп. В таблице 16 приведен анализ эпитопов и паратопов на основе BSA.
Таблица 15: Взаимодействующие пары эпитоп-паратоп
92L Ile
Ван-дер-ваальсовые взаимодействия
28L Asp, 93L Ile
Ван-дер-ваальсовые взаимодействия
94L Leu
Водородная связь
100H Leu,
92L Ile
Ван-дер-ваальсовые взаимодействия
Водородная связь
33H Trp
Водородная связь
Таблица 16: Анализ эпитопов и паратопов на основе BSA
ПРИМЕР 8. ПРОФИЛИ ЭКСПРЕССИИ ИНТЕРФЕРОНОВ ТИП I
[237] В этом примере авторы настоящего изобретения исследовали профили экспрессии IFN типа I соответствующих 4 линий клеток заболевания в ответ на стимуляцию лигандом Толл-подобного рецептора. Использовали четыре типа клеток: PBMC, линию клеток дермальных фибробластов, линию мышечных клеток и линию клеток почки, которые стимулировали агонистом TLR3, TLR4, TLR7/8 и TLR9 в присутствие и отсутствие антитела против IFNβ.
[238] Уровни экспрессии генов IFN типа I и Mx1 в различных первичных типах клеток человека измеряли с использованием количественной ПЦР. Первичные клетки культивировали в соответствующих средах следующим образом: нормальные дермальные фибробласты человека в средах FGM-2 BulletKit, нормальные мезангиальные клетки человека в средах MsGM BulletKit и первичные клетки, полученные из скелетных мышц человека, в среде для выращивания MyoTonic. Мононуклеарные клетки периферической крови (PBMC) выделяли посредством центрифугирования в градиенте Ficoll-Paque Plus. Мононуклеарные клетки культивировали в RPMI1640, дополненной 10% FBS и пенициллином-стрептомицином. Для измерения экспрессии генов IFN типа I клетки высевали, а затем стимулировали соответствующим лигандом TLR в течение 1, 2,5, 5, 8 и 24 часов. После культивирования собирали клетки, выделяли РНК и синтезировали кДНК. Экспрессию следующих генов оценивали с помощью ПЦР Taqman: IFNβ, Mx1, IFNα1, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNα14, IFNα16, IFNα17 и B2m. ПЦР в реальном времени Taqman и вычисления кратных изменений осуществляли, как описано выше (фигура 9).
[239] В таблице 17A показано, что IFNβ является преобладающим IFN типа I, продуцируемым различными первичными типами резидентных клеток человека после стимуляции лигандами Толл-подобного рецептора (TLR). Дермальные фибробласты, клетки скелетных мышц, гломерулярные мезангиальные клетки и PBMC от нормальных людей-доноров стимулировали поли-I:C (лиганд TLR3), LPS (лиганд TLR4), R848 (лиганд TLR7/8) и ODN2216 (лиганд TLR9) время- и дозозависимым образом. Относительные уровни экспрессии IFNβ, Mx1, IFNα (1, 2, 4, 5, 6, 7, 8, 14, 16 и 17) измеряли посредством количественной ПЦР с использованием B2M в качестве контроля. Относительная экспрессия каждого гена указана как сильная (+), слабая (+/-) или отсутствие экспрессии (-).
[240] Показано, что CTI-AF1 является мощным нейтрализатором эндогенно продуцируемого IFNβ из первичных клеток человека, стимулируемых лигандами TLR (поли-I:C, LPS, R848 или ODN2216). Клетки стимулировали различными лигандами TLR в отсутствие или присутствие титруемых количеств CTI-AF1. Экспрессию Mx1 измеряли через 24 часа после стимуляции, за исключением PBMC, стимулируемых LPS, в случае которых измерение проводили через 6 часов. Выделение РНК, синтез кДНК и количественную ПЦР осуществляли, как описано выше (фигура 9). Хотя количество IFNβ, индуцируемого любым типом клеток после стимуляции TLR, являлось неизвестным, наблюдали дозозависимое ингибирование экспрессии Mx1 в присутствие CTI-AF1.
[241] В таблице 17B показано, что CTI-AF1 является мощным ингибитором эндогенного IFNβ, секретируемого первичными клетками человека после стимуляции поли-I:C и LPS. Клетки стимулировали указанным лигандом TLR и осуществляли количественную ПЦР для определения уровня экспрессии Mx1 с использованием B2M в качестве контроля. Дозозависимое ингибирование экспрессии гена Mx1 посредством CTI-AF1 указывают как "+", в то время как отсутствие CTI-AF1-зависимого ингибирования экспрессии Mx1 указывают как "-". Условия, когда экспрессия IFN типа I являлась недостаточной для регуляции какого-либо значимого повышения экспрессии Mx1, которое потенциально можно нейтрализовать посредством CTI-AF1, указывают как "не определено".
Таблица 17A
Таблица 17 B
Таблица 18: Последовательности белков интерферонов β
[242] Различные признаки и варианты осуществления настоящего изобретения, относящиеся к отдельным разделам, представленным выше, применимы, при необходимости, к другим разделам с учетом необходимых изменений. Таким образом, признаки, указанные в одном разделе, при необходимости, можно комбинировать с признаками, указанными в других разделах. Все цитируемые в настоящем описании ссылки, включая патенты, патентные заявки, статьи, пособия и процитированные регистрационные номера последовательностей и цитируемые в них ссылки включены, таким образом, в качестве ссылок в полном объеме. В случае, когда один или несколько включенных литературных и схожих источников отличается или противоречит настоящей заявке, включая, в качестве неограничивающих примеров, определенные термины, использование терминов, описанные способы или т.п., настоящая заявка обладает приоритетом.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PFIZER INC.
THE BRIGHAM AND WOMEN'S HOSPITAL, INC.
<120> АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА БЕТА И ИХ ПРИМЕНЕНИЕ
<130> PCFC-1000-WO1
<140>
<141>
<150> 62/483,669
<151> 2017-04-10
<150> 62/339,709
<151> 2016-05-20
<150> 62/329,327
<151> 2016-04-29
<160> 167
<170> PatentIn version 3.5
<210> 1
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 2
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 3
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 4
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 6
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 8
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 10
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 12
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 13
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 14
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 15
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 16
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 18
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 20
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Val Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 22
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 24
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Thr Ile Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 26
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Thr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Asp Asn Phe
20 25 30
Leu Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Phe Ser Thr Ser Lys Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 28
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 28
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly His Ile Asp Pro Ser Asp Ser Tyr Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Asp Tyr Gly Asn Leu Leu Phe Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 29
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<220>
<221> ВАРИАНТ
<222> (330)..(330)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(330)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 29
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 30
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 30
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 31
<400> 31
000
<210> 32
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ile Ile Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 33
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<220>
<221> ВАРИАНТ
<222> (449)..(449)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(449)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly His Ile Asp Pro Ser Asp Ser Tyr Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Asp Tyr Gly Asn Leu Leu Phe Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 34
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 34
Arg Thr Ser Gln Asp Ile Gly Asn Tyr Leu Asn
1 5 10
<210> 35
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 35
Ser Thr Ser Arg Leu His Ser
1 5
<210> 36
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 36
Gln Gln Gly Ile Ile Leu Pro Ile Thr
1 5
<210> 37
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 37
Gly Tyr Thr Phe Ser Arg Tyr Trp Met His
1 5 10
<210> 38
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 38
His Ile Asp Pro Ser Asp Ser Tyr Thr Tyr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 39
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 39
Trp Asp Tyr Gly Asn Leu Leu Phe Glu Tyr
1 5 10
<210> 40
<211> 187
<212> БЕЛОК
<213> Homo sapiens
<400> 40
Met Thr Asn Lys Cys Leu Leu Gln Ile Ala Leu Leu Leu Cys Phe Ser
1 5 10 15
Thr Thr Ala Leu Ser Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg
20 25 30
Ser Ser Asn Phe Gln Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg
35 40 45
Leu Glu Tyr Cys Leu Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu
50 55 60
Ile Lys Gln Leu Gln Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile
65 70 75 80
Tyr Glu Met Leu Gln Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser
85 90 95
Ser Thr Gly Trp Asn Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val
100 105 110
Tyr His Gln Ile Asn His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu
115 120 125
Lys Glu Asp Phe Thr Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys
130 135 140
Arg Tyr Tyr Gly Arg Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser
145 150 155 160
His Cys Ala Trp Thr Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr
165 170 175
Phe Ile Asn Arg Leu Thr Gly Tyr Leu Arg Asn
180 185
<210> 41
<211> 166
<212> БЕЛОК
<213> Homo sapiens
<400> 41
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 42
<211> 161
<212> БЕЛОК
<213> Mus sp.
<400> 42
Ile Asn Tyr Lys Gln Leu Gln Leu Gln Glu Arg Thr Asn Ile Arg Lys
1 5 10 15
Cys Gln Glu Leu Leu Glu Gln Leu Asn Gly Lys Ile Asn Leu Thr Tyr
20 25 30
Arg Ala Asp Phe Lys Ile Pro Met Glu Met Thr Glu Lys Met Gln Lys
35 40 45
Ser Tyr Thr Ala Phe Ala Ile Gln Glu Met Leu Gln Asn Val Phe Leu
50 55 60
Val Phe Arg Asn Asn Phe Ser Ser Thr Gly Trp Asn Glu Thr Ile Val
65 70 75 80
Val Arg Leu Leu Asp Glu Leu His Gln Gln Thr Val Phe Leu Lys Thr
85 90 95
Val Leu Glu Glu Lys Gln Glu Glu Arg Leu Thr Trp Glu Met Ser Ser
100 105 110
Thr Ala Leu His Leu Lys Ser Tyr Tyr Trp Arg Val Gln Arg Tyr Leu
115 120 125
Lys Leu Met Lys Tyr Asn Ser Tyr Ala Trp Met Val Val Arg Ala Glu
130 135 140
Ile Phe Arg Asn Phe Leu Ile Ile Arg Arg Leu Thr Arg Asn Phe Gln
145 150 155 160
Asn
<210> 43
<211> 163
<212> БЕЛОК
<213> Rattus sp.
<400> 43
Ile Asp Tyr Lys Gln Leu Gln Phe Arg Gln Ser Thr Ser Ile Arg Thr
1 5 10 15
Cys Gln Lys Leu Leu Arg Gln Leu Asn Gly Arg Leu Asn Leu Ser Tyr
20 25 30
Arg Thr Asp Phe Lys Ile Pro Met Glu Val Met His Pro Ser Gln Met
35 40 45
Glu Lys Ser Tyr Thr Ala Phe Ala Ile Gln Val Met Leu Gln Asn Val
50 55 60
Phe Leu Val Phe Arg Ser Asn Phe Ser Ser Thr Gly Trp Asn Glu Thr
65 70 75 80
Ile Val Glu Ser Leu Leu Asp Glu Leu His Gln Gln Thr Glu Leu Leu
85 90 95
Glu Ile Ile Leu Lys Glu Lys Gln Glu Glu Arg Leu Thr Trp Val Thr
100 105 110
Ser Thr Thr Thr Leu Gly Leu Lys Ser Tyr Tyr Trp Arg Val Gln Arg
115 120 125
Tyr Leu Lys Asp Lys Lys Tyr Asn Ser Tyr Ala Trp Met Val Val Arg
130 135 140
Ala Glu Val Phe Arg Asn Phe Ser Ile Ile Leu Arg Leu Asn Arg Asn
145 150 155 160
Phe Gln Asn
<210> 44
<211> 166
<212> БЕЛОК
<213> Macaca fascicularis
<400> 44
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Ser Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Pro Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Tyr Ala Ile Phe Arg Gln Asp Leu Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asp
85 90 95
His Leu Lys Thr Ile Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Phe Val Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Phe Phe Ile Asn Lys Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 45
<211> 159
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 45
Met Ser Tyr Asn Ser Leu Gln Ile Gln Leu Trp His Gly Ser Leu Thr
1 5 10 15
Cys Ala Lys Leu Leu Leu Gln Leu Asn Gly Thr Thr Glu Asp Cys Leu
20 25 30
Asn Glu Arg Ile Asn Phe Lys Val Pro Lys Glu Ile Lys Glu Pro Gln
35 40 45
Gln Leu Gln Lys Glu Asp Thr Thr Leu Val Ile Phe Glu Met Leu Asn
50 55 60
Asn Ile Phe Asp Ile Phe Arg Lys Asn Phe Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Leu Val Glu Asn Leu Leu Gly Glu Thr His Leu Gln Ile His
85 90 95
His Leu Lys Ser Lys Ile Asn Lys Lys Val Thr Leu Glu Ser Ile Arg
100 105 110
Met Asn Leu Arg Leu Lys Ser Tyr Tyr Trp Arg Ile Met Asp Tyr Leu
115 120 125
Glu Thr Lys Gln Tyr Ser Asn Cys Ala Trp Lys Ile Val Gln Leu Glu
130 135 140
Ile Phe Arg Asn Phe Ser Phe Ile Ile Met Leu Ile Asp Tyr Leu
145 150 155
<210> 46
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 46
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 47
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 48
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 48
Gln Gln Ser Tyr Ser Thr Pro
1 5
<210> 49
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 49
Lys Ser Ser Gln Ser Leu Leu His Ser Asp Gly Lys Thr Tyr Leu Tyr
1 5 10 15
<210> 50
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 50
Glu Val Ser Asn Arg Phe Ser
1 5
<210> 51
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 51
Met Gln Ser Ile Gln Leu Pro
1 5
<210> 52
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 52
Arg Ser Ser Gln Ser Leu Val Tyr Ser Asp Gly Asn Thr Tyr Leu Asn
1 5 10 15
<210> 53
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 53
Lys Val Ser Asn Arg Asp Ser
1 5
<210> 54
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 54
Met Gln Gly Thr His Trp Pro
1 5
<210> 55
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 55
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 56
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 56
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 57
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 57
Gln Gln Tyr Tyr Ser Thr Pro
1 5
<210> 58
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 58
Arg Ala Ser Gln Ser Ile Ser Ser Trp Leu Ala
1 5 10
<210> 59
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 59
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 60
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 60
Gln Gln Tyr Asn Ser Tyr Ser
1 5
<210> 61
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 61
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 62
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 62
Asp Ala Ser Asn Leu Glu Thr
1 5
<210> 63
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 63
Gln Gln Tyr Asp Asn Leu Pro
1 5
<210> 64
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 64
Arg Ala Ser Gln Gly Ile Ser Ser Tyr Leu Ala
1 5 10
<210> 65
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 65
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 66
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 66
Gln Gln Leu Asn Ser Tyr Pro
1 5
<210> 67
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 67
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 68
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 68
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 69
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 69
Gln Gln Tyr Asn Asn Trp Pro
1 5
<210> 70
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 70
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 71
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 71
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 72
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 72
Gln Gln Arg Ser Asn Trp Pro
1 5
<210> 73
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 73
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 74
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 74
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 75
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 75
Gln Gln Tyr Gly Ser Ser Pro
1 5
<210> 76
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 76
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 77
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 77
Leu Gly Ser Asn Arg Ala Ser
1 5
<210> 78
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 78
Met Gln Ala Leu Gln Thr Pro
1 5
<210> 79
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 79
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 80
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 80
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 81
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 81
Asn Ser Arg Asp Ser Ser Gly Asn His
1 5
<210> 82
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 82
Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10
<210> 83
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 83
Gly Asn Ser Asn Arg Pro Ser
1 5
<210> 84
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 84
Gln Ser Tyr Asp Ser Ser Leu Ser Gly
1 5
<210> 85
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 85
Thr Arg Ser Ser Gly Ser Ile Ala Ser Asn Tyr Val Gln
1 5 10
<210> 86
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 86
Glu Asp Asn Gln Arg Pro Ser
1 5
<210> 87
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 87
Gln Ser Tyr Asp Ser Ser Asn
1 5
<210> 88
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 88
Thr Gly Ser Ser Ser Gly Gly Ser Tyr Tyr Val Ser
1 5 10
<210> 89
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 89
Thr Gly Ser Ser Ser Asp Val Gly Gly Ser Tyr Tyr Val Ser
1 5 10
<210> 90
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 90
Glu Asn Asp Ser Asn Arg Pro Ser
1 5
<210> 91
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Asp"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Gly"
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 91
Glu Asp Ser Asn Arg Ser Lys Gln Gln Lys Pro Ser
1 5 10
<210> 92
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Thr"
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 92
Gln Ser Trp Asp Ser Ser Ala Asn
1 5
<210> 93
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Val"
<220>
<221> ВАРИАНТ
<222> (11)..(11)
<223> /замена="Val"
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 93
Gln Ser Trp Asp Ser Ser Ala Asn Phe Phe Gly
1 5 10
<210> 94
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (11)..(11)
<223> /замена="Tyr"
<220>
<221> ВАРИАНТ
<222> (13)..(13)
<223> /замена="His" or "Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(13)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 94
Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn Ala Val Asn
1 5 10
<210> 95
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (12)..(12)
<223> /замена="Tyr"
<220>
<221> ВАРИАНТ
<222> (14)..(14)
<223> /замена="His" or "Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 95
Ser Gly Ser Ser Ser Asn Ile Ile Gly Asn Asn Ala Val Asn
1 5 10
<210> 96
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Asn" or "Gln"
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 96
Gly Asn Asn Lys Arg Pro Ser
1 5
<210> 97
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 97
Ala Ala Trp Asp Asp Ser Leu Asn Gly
1 5
<210> 98
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Val"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 98
Cys Ser Gly Asp Ala Leu Gly Lys Lys Tyr Ala His
1 5 10
<210> 99
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 99
Lys Asp Ser Glu Arg Pro Ser
1 5
<210> 100
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Asp" or "Thr" or "Ala"
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 100
Gln Ser Trp Asp Ser Ser Gly Asn
1 5
<210> 101
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Asp" or "Thr" or "Ala"
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 101
Gln Ser Trp Asp Ser Ser Gly Asn His
1 5
<210> 102
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 102
Arg Ala Ser Gln Ser Leu Leu His Ser Asp Gly Ile Ser Ser Tyr Leu
1 5 10 15
Ala
<210> 103
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 103
Arg Ala Ser Gln Gly Ile Ser Ser Tyr Leu Ala
1 5 10
<210> 104
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 104
Ala Ala Ser Ser Arg Ala Ser
1 5
<210> 105
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 105
Gln Gln Tyr Asn Ser Tyr Pro
1 5
<210> 106
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 106
Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala
1 5 10
<210> 107
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 107
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 108
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 108
Gln Gln Tyr Asn Ser Tyr Pro
1 5
<210> 109
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 109
Arg Ser Ser Gln Ser Leu Leu His Ser Asp Gly Asn Thr Tyr Leu Asp
1 5 10 15
<210> 110
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 110
Arg Ser Ser Gln Ser Leu Leu His Ser Asp Asp Gly Asn Thr Tyr Leu
1 5 10 15
Asp
<210> 111
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (2)..(2)
<223> /замена="Ile"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Phe"
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 111
Lys Val Ser Asn Arg Ala Ser
1 5
<210> 112
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 112
Met Gln Ala Thr Gln Phe Pro
1 5
<210> 113
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (6)..(7)
<223> /замена="Val"
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 113
Arg Ala Ser Gln Ser Ser Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 114
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 114
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 115
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Asn" or "Gly" or "His"
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 115
Gln Gln Tyr Ser Asn Trp Pro
1 5
<210> 116
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 116
Gly Phe Thr Phe Ser Ser Tyr Trp Met Ser
1 5 10
<210> 117
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 117
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 118
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 118
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 119
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 119
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 120
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 120
Gly Gly Ser Ile Ser Ser Tyr Tyr Trp Ser
1 5 10
<210> 121
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 121
Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
1 5 10 15
Ser
<210> 122
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 122
Gly Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5 10
<210> 123
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 123
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
1 5 10 15
Gln Gly
<210> 124
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 124
Gly Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5 10
<210> 125
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 125
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
1 5 10 15
Gln Gly
<210> 126
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 126
Gly Tyr Thr Gly Thr Ser Tyr Tyr Met His
1 5 10
<210> 127
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 127
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
1 5 10 15
Gln Gly
<210> 128
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 128
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 129
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 129
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 130
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 130
Gly Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5 10
<210> 131
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 131
Ser Tyr Ile Ser Ser Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 132
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 132
Gly Phe Thr Phe Ser Asn Ala Trp Met Ser
1 5 10
<210> 133
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 133
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
1 5 10 15
Pro Val Lys Gly
20
<210> 134
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 134
Gly Gly Ser Ile Ser Ser Ser Ser Tyr Tyr Trp Gly
1 5 10
<210> 135
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 135
Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
1 5 10 15
Ser
<210> 136
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 136
Gly Gly Ser Ile Ser Ser Gly Asp Tyr Tyr Trp Ser
1 5 10
<210> 137
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 137
Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
1 5 10 15
Ser
<210> 138
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 138
Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Gly
1 5 10
<210> 139
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 139
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
1 5 10 15
Gln Gly
<210> 140
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 140
Gly Phe Thr Phe Ser Ser Tyr Ala Met His
1 5 10
<210> 141
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 141
Gly Phe Thr Phe Ser Ser Tyr Ala Met His Trp Ser
1 5 10
<210> 142
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 142
Gly Trp Ile Ser Pro Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 143
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 143
Gly Trp Ile Ser Pro Lys Ala Asn Gly Gly Ser Thr Tyr Tyr Ala Asp
1 5 10 15
Ser Val Lys Gly
20
<210> 144
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 144
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5 10
<210> 145
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> /примечание="варианты остатков, указанные в последовательности
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 145
Ser Val Ile Ser Ser Asp Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 146
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 146
Ser Val Ile Ser Ser Lys Ala Asp Gly Gly Ser Thr Tyr Tyr Ala Asp
1 5 10 15
Ser Val Lys Gly
20
<210> 147
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (10)..(10)
<223> /замена="Gly" or "His"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 147
Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Ser
1 5 10
<210> 148
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (2)..(2)
<223> /замена="Ile" or "Ser"
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 148
Gly Arg Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
1 5 10 15
Gln Gly
<210> 149
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Tyr"
<220>
<221> ВАРИАНТ
<222> (9)..(9)
<223> /замена="Met"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 149
Gly Tyr Thr Phe Thr Ser Tyr Ala Ile His
1 5 10
<210> 150
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Tyr"
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 150
Gly Trp Ile Asn Pro Gly Asn Gly Asn Thr Asn Tyr Ala Gln Lys Phe
1 5 10 15
Gln
<210> 151
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Tyr"
<220>
<221> MISC_FEATURE
<222> (1)..(12)
<223> /примечание="варианты остатков, указанные в последовательности,
не имеют преимущества относительно остатков в аннотациях вариантов
положений"
<400> 151
Gly Gly Ser Ile Ser Ser Gly Asn Tyr Tyr Trp Ser
1 5 10
<210> 152
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический пептид"
<400> 152
Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
1 5 10 15
Ser
<210> 153
<211> 19
<212> БЕЛОК
<213> Homo sapiens
<400> 153
Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln Cys Gln
1 5 10 15
Lys Leu Leu
<210> 154
<211> 19
<212> БЕЛОК
<213> Homo sapiens
<400> 154
Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln Asn Ile Phe
1 5 10 15
Ala Ile Phe
<210> 155
<211> 26
<212> БЕЛОК
<213> Homo sapiens
<400> 155
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
1 5 10 15
His Leu Lys Thr Val Leu Glu Glu Lys Leu
20 25
<210> 156
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 156
Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg Ile Leu His Tyr Leu Lys
1 5 10 15
Ala
<210> 157
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<400> 157
His Cys Ala Trp Thr Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr
1 5 10 15
Phe Ile Asn Arg Leu Thr
20
<210> 158
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 158
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Arg Arg
1 5 10 15
Cys Leu Met Leu Leu Ala Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 159
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 159
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg His Asp Phe Gly Ile Pro Gln Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 160
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 160
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Asp Lys Leu Leu Thr Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 161
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 161
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Glu Val Tyr Gln Gln Ile Asn
85 90 95
Asp Leu Glu Ala Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 162
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 162
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ile Leu His Leu Arg Lys Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 163
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 163
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Glu Lys Lys Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 164
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 164
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser Pro Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 165
<211> 166
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полипептид"
<400> 165
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Ala Glu Ile Leu Arg Asn Phe Ser Leu Ile Thr Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 166
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полинуклеотид"
<400> 166
caggtgcagc tggtgcagag cggcgccgag gtgaagaagc ccggcagcag cgtgaaggtg 60
agctgcaagg ccagcggcta caccttcagc cggtactgga tgcactgggt gcggcaggcc 120
cccggccagg gcctggagtg gatgggccac atcgacccca gcgacagcta cacctactac 180
aaccagaagt tcaagggccg ggtgaccatc accgccgacg agagcaccag caccgcctac 240
atggagctga gcagcctgcg gagcgaggac accgccgtgt actactgcgc ccggtgggac 300
tacggcaacc tgctgttcga gtactggggc cagggcaccc tggtgaccgt ctcgagc 357
<210> 167
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности:
синтетический полинуклеотид"
<400> 167
gacatccaga tgacccagag ccccagcagc ctgagcgcca gcgtgggcga ccgggtgacc 60
atcacctgcc ggaccagcca ggacatcggc aactacctga actggtacca gcagaagccc 120
ggcaaggcct tcaagctgct gatctacagc accagccggc tgcacagcgg cgtgcccagc 180
cggttcagcg gcagcggcag cggcaccgac ttcaccctga ccatcagcag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag gggattattt tgcccattac cttcggcggc 300
ggcaccaagg tggagatcaa g 321
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕЖИМ ДОЗИРОВАНИЯ ДЛЯ АНТАГОНИСТОВ TFPI | 2019 |
|
RU2780590C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ GITR И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2795625C2 |
| АНТИТЕЛА В7-Н4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809243C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ TIGIT И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2776714C2 |
| АНТИТЕЛА И КОНЪЮГАТЫ АНТИТЕЛА-ЛЕКАРСТВЕННОГО СРЕДСТВА, СПЕЦИФИЧНЫЕ К CD123, И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2789150C2 |
| МОНОВАЛЕНТНЫЕ АНТИТЕЛА К ПРОПЕРДИНУ И ФРАГМЕНТЫ АНТИТЕЛ | 2018 |
|
RU2790103C2 |
| АНТИТЕЛА ПРОТИВ ANG-2, СОДЕРЖАЩИЕ ТОЛЬКО ТЯЖЕЛУЮ ЦЕПЬ | 2016 |
|
RU2749674C2 |
| СВЯЗЫВАЮЩИЕ ILT7 МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2756109C2 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| АНТИТЕЛА К PAC1 И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2781553C2 |
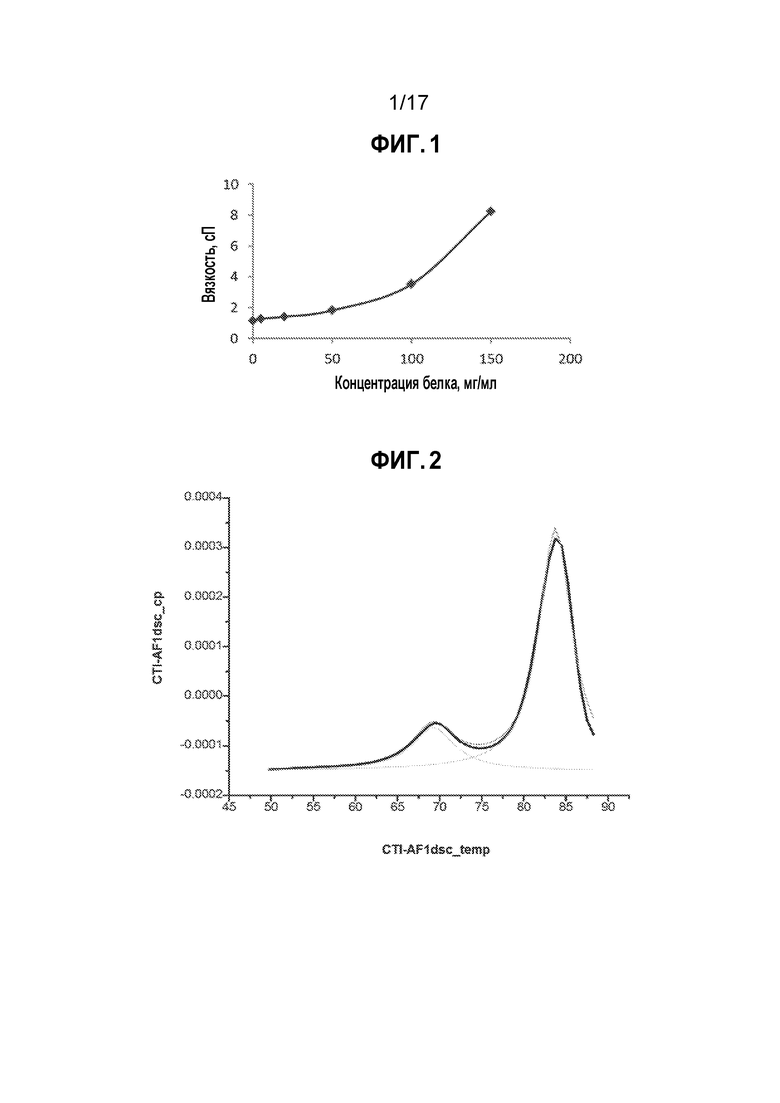
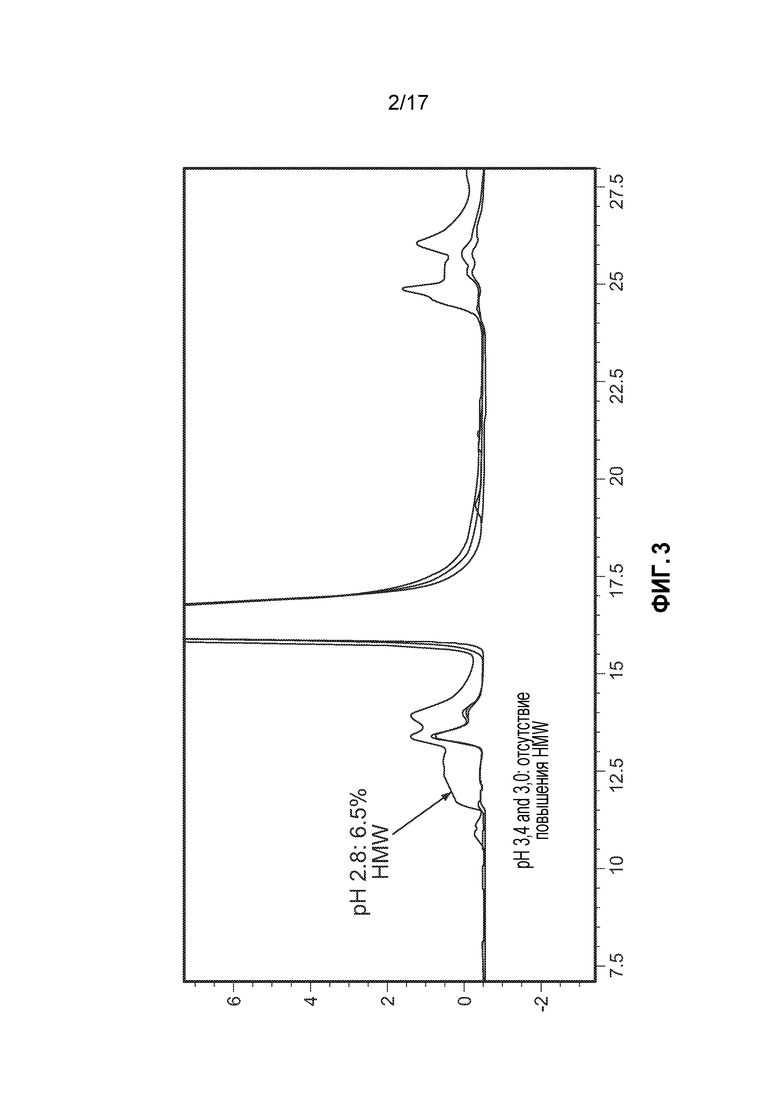
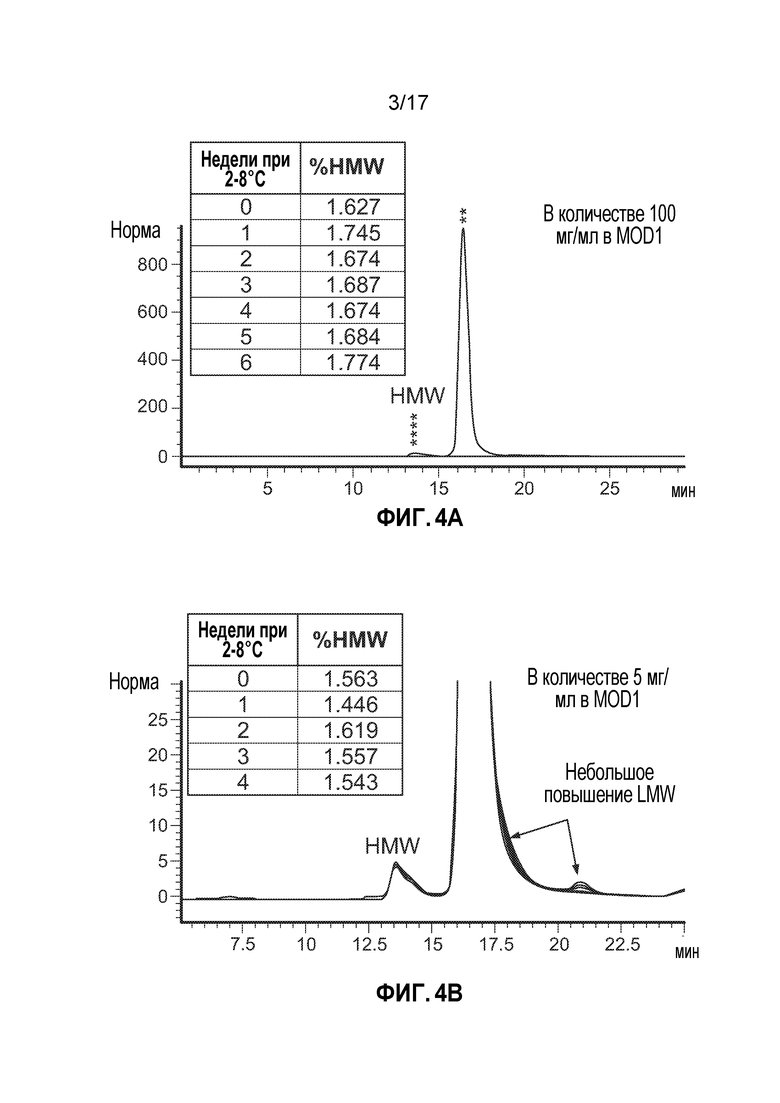
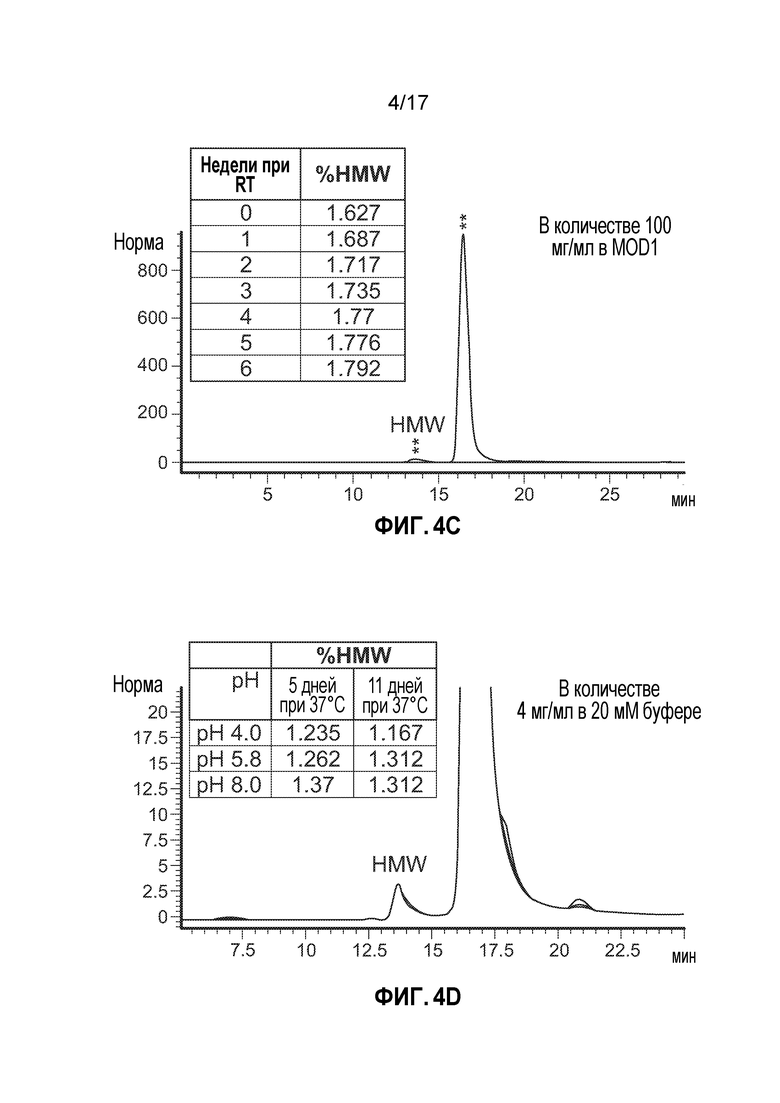
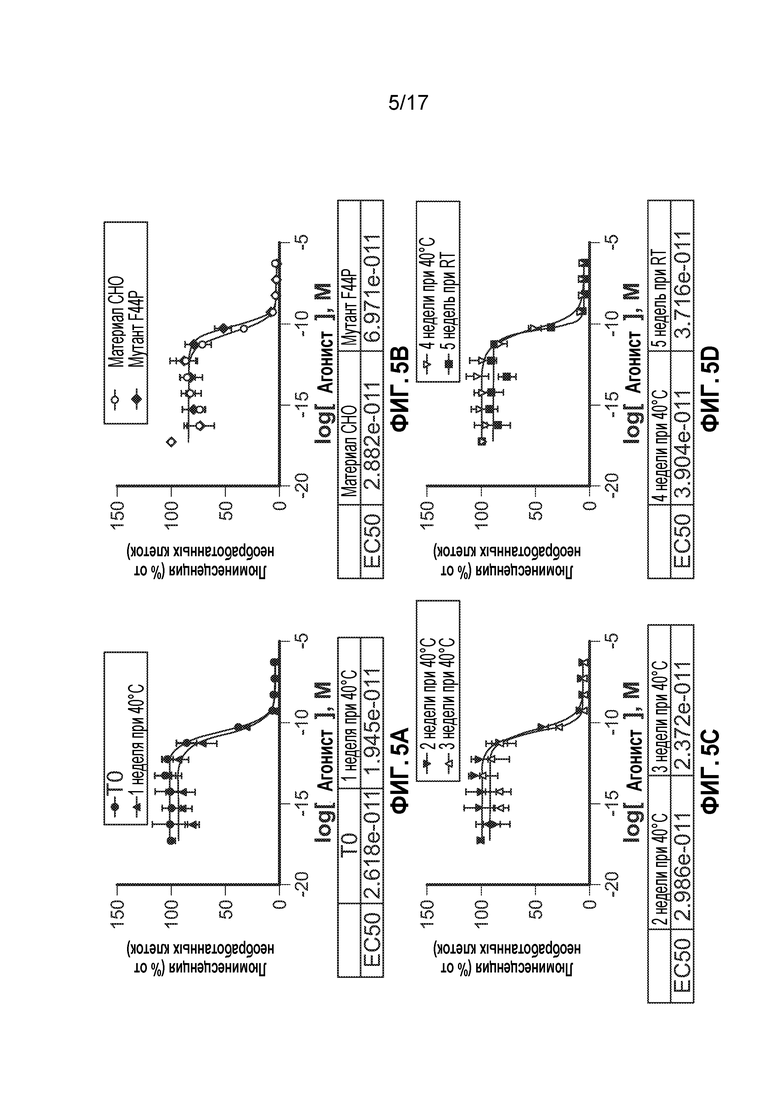
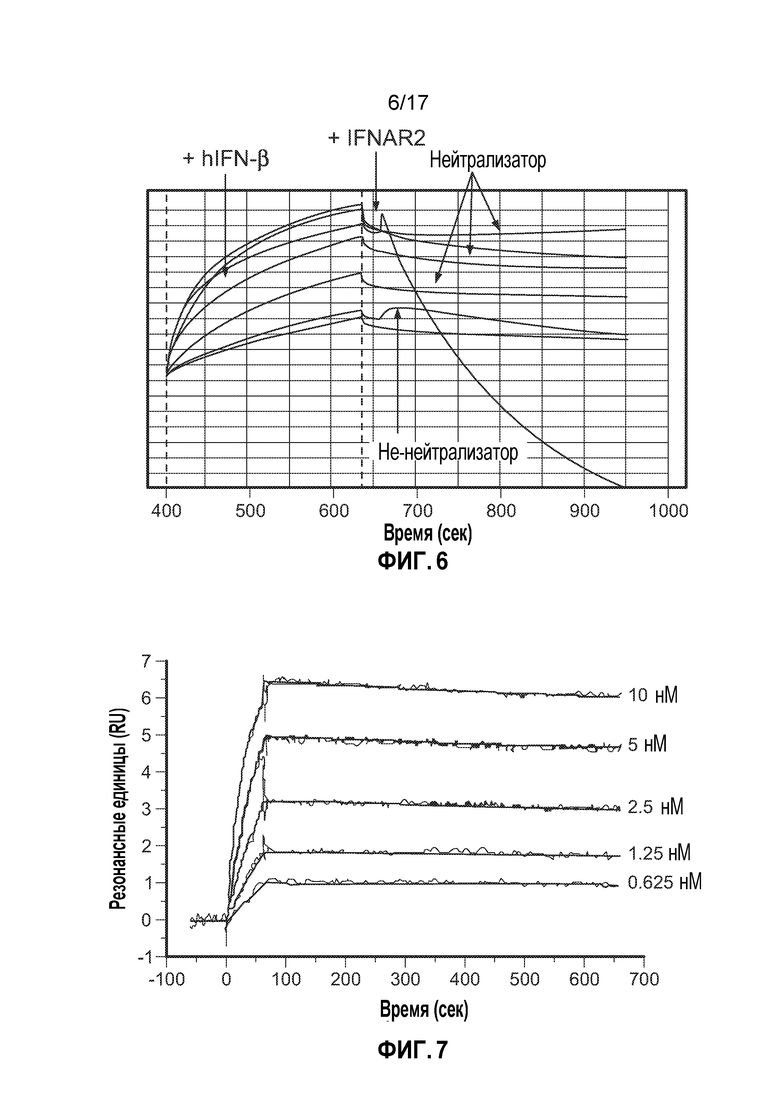
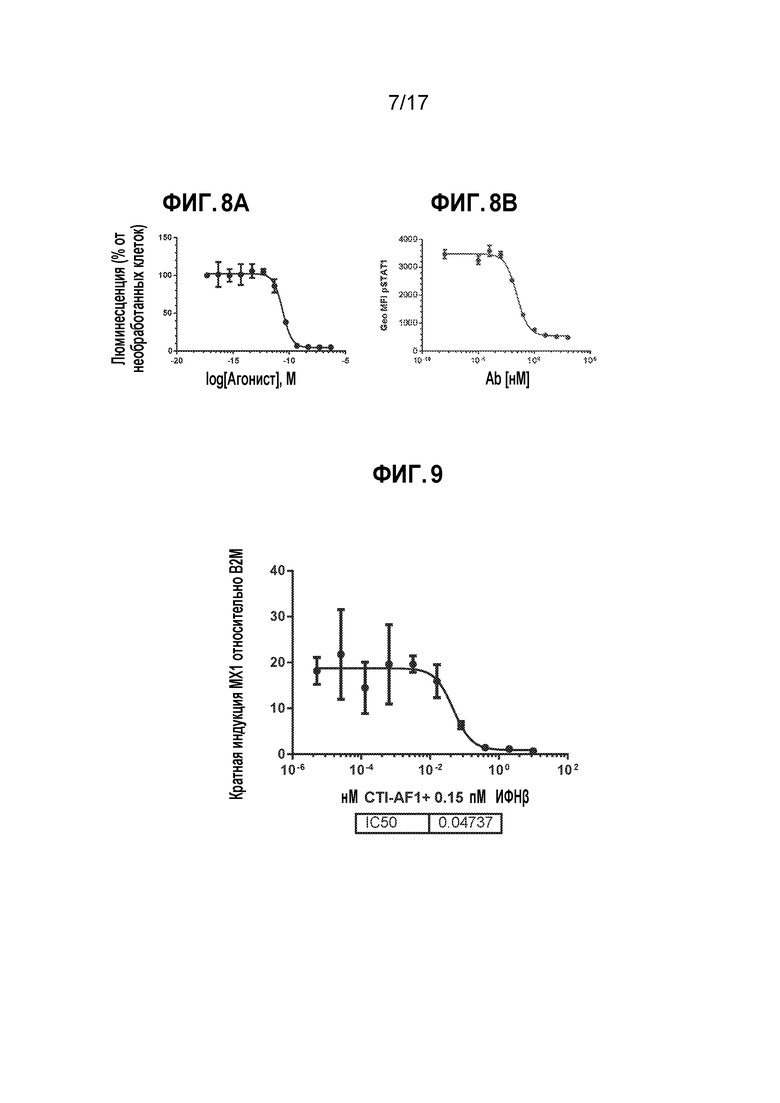
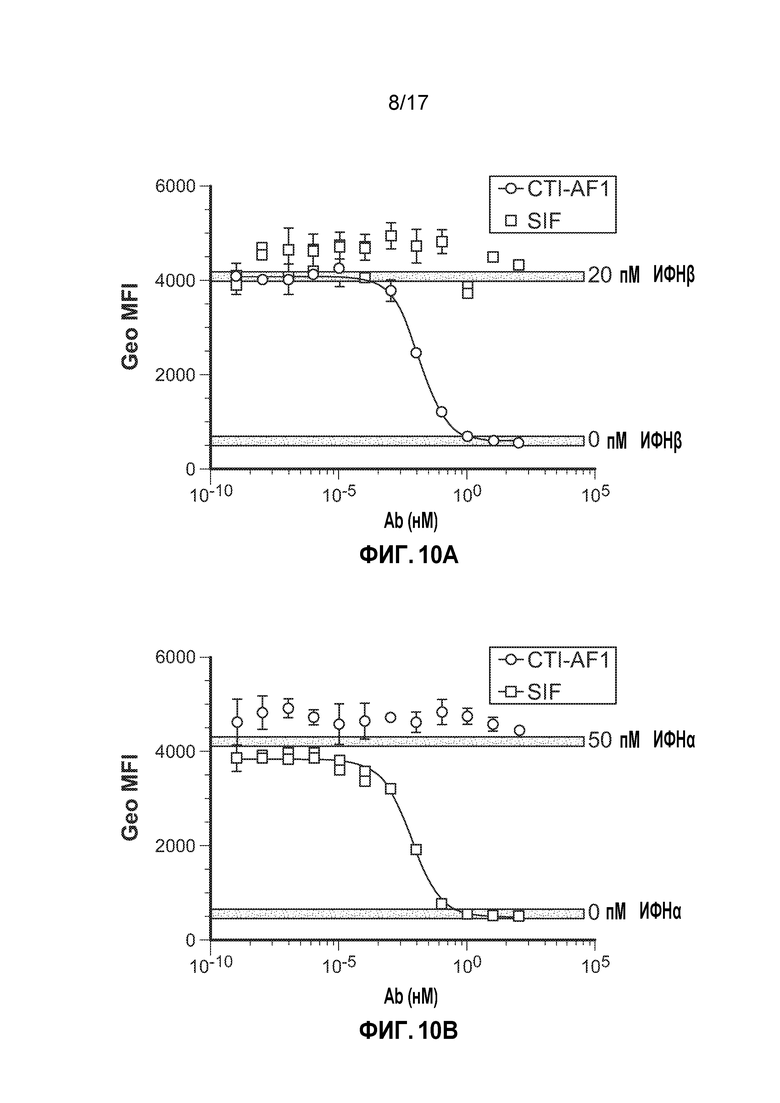
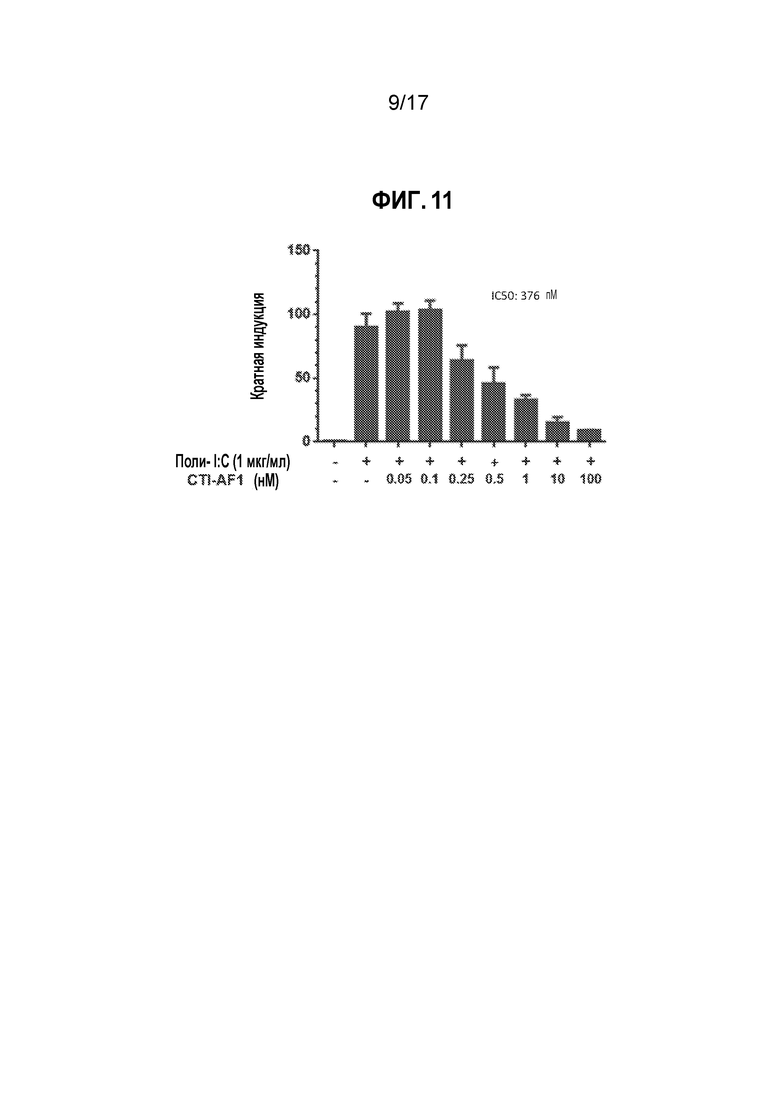
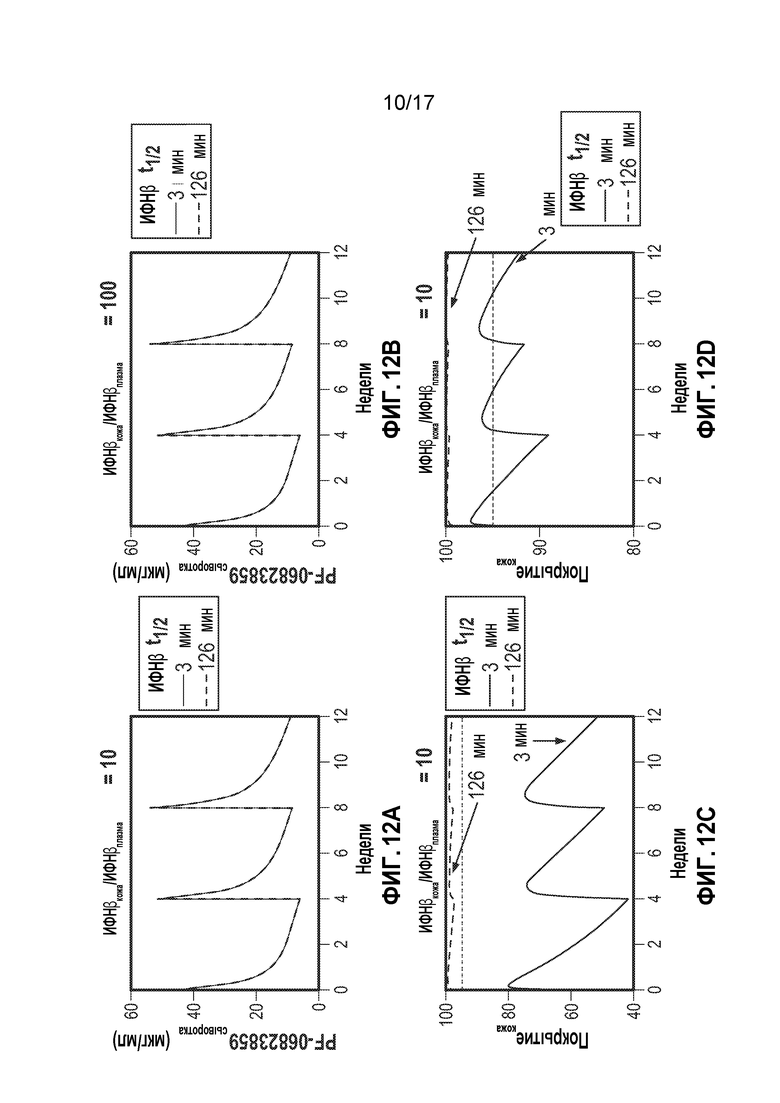
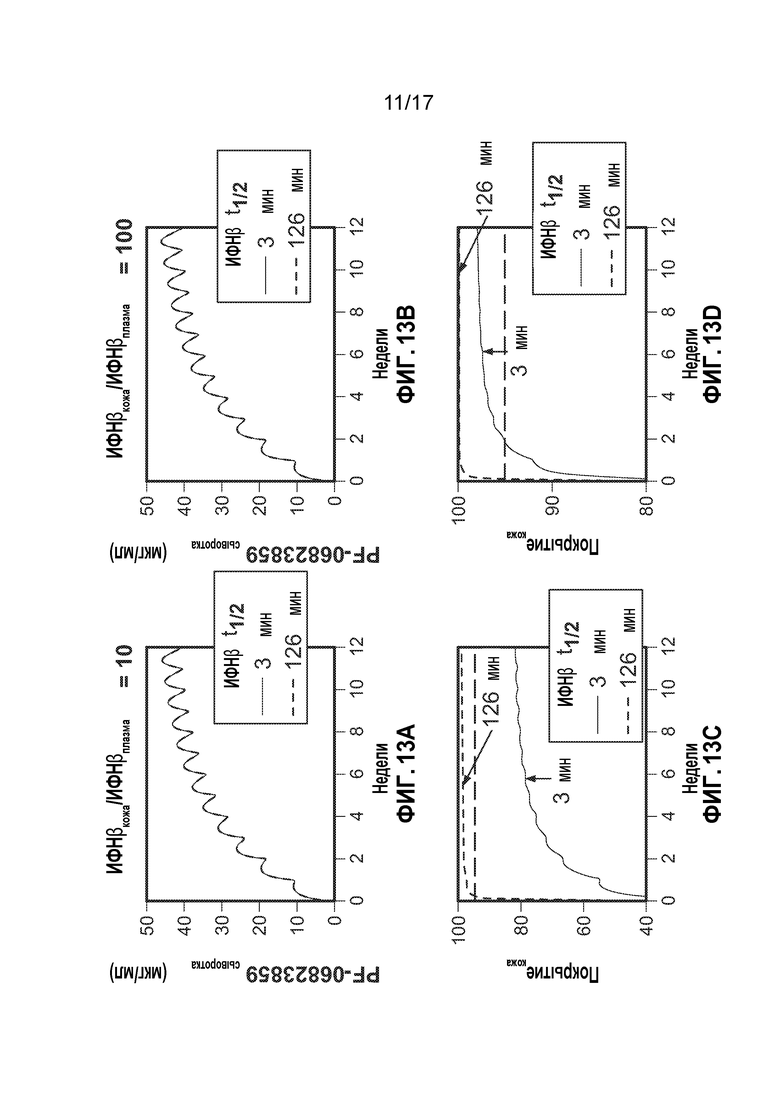
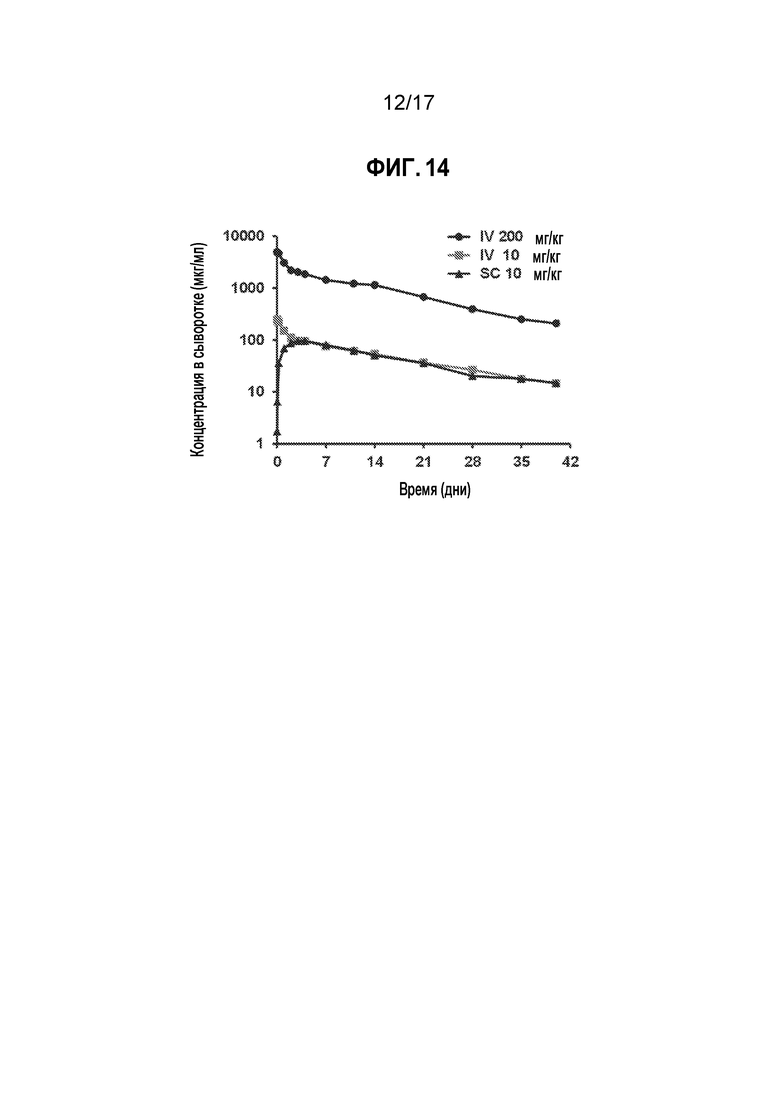


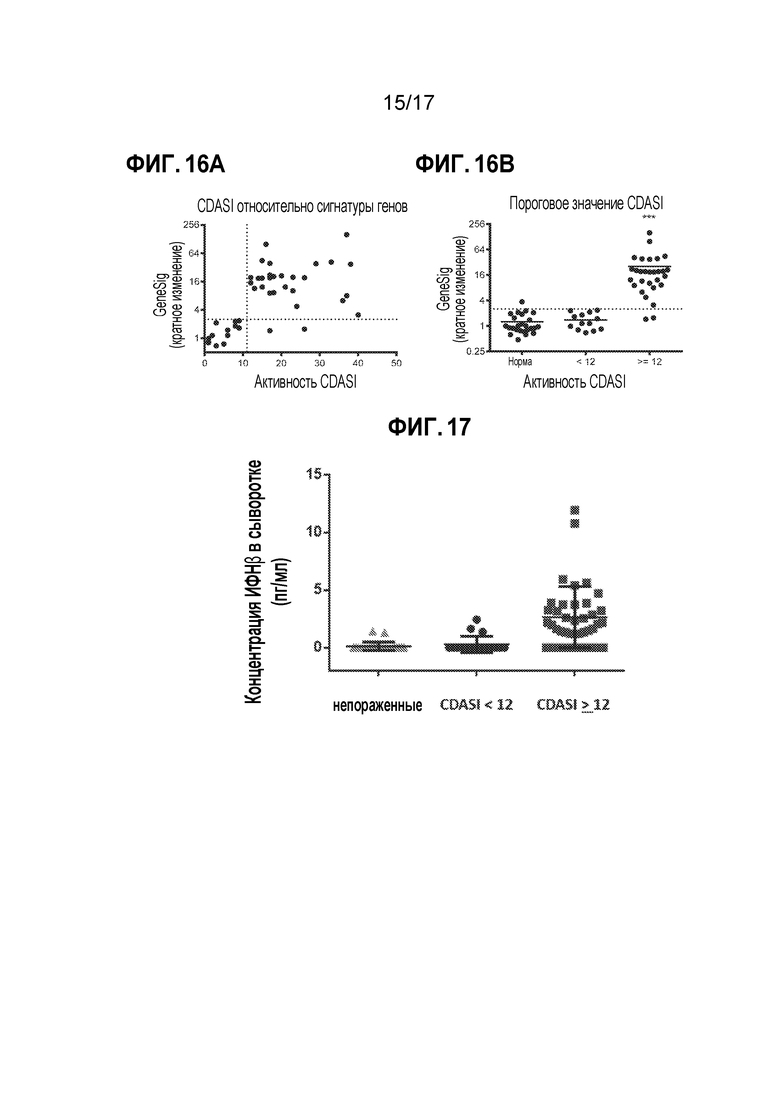
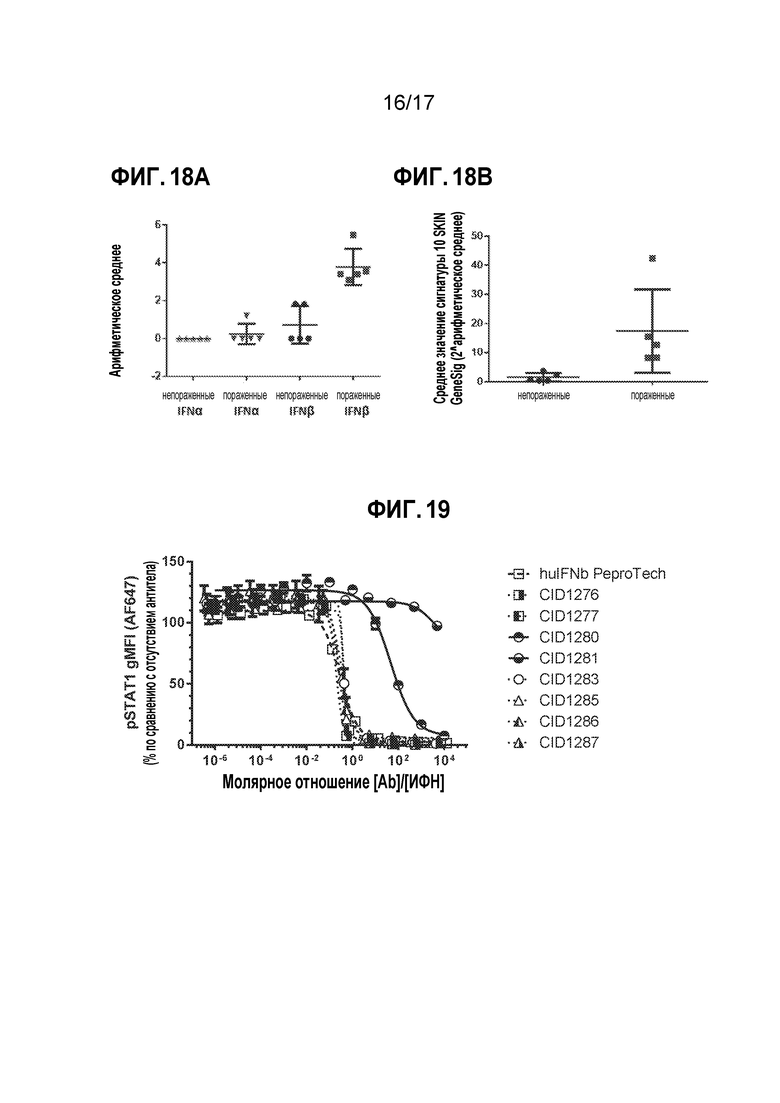
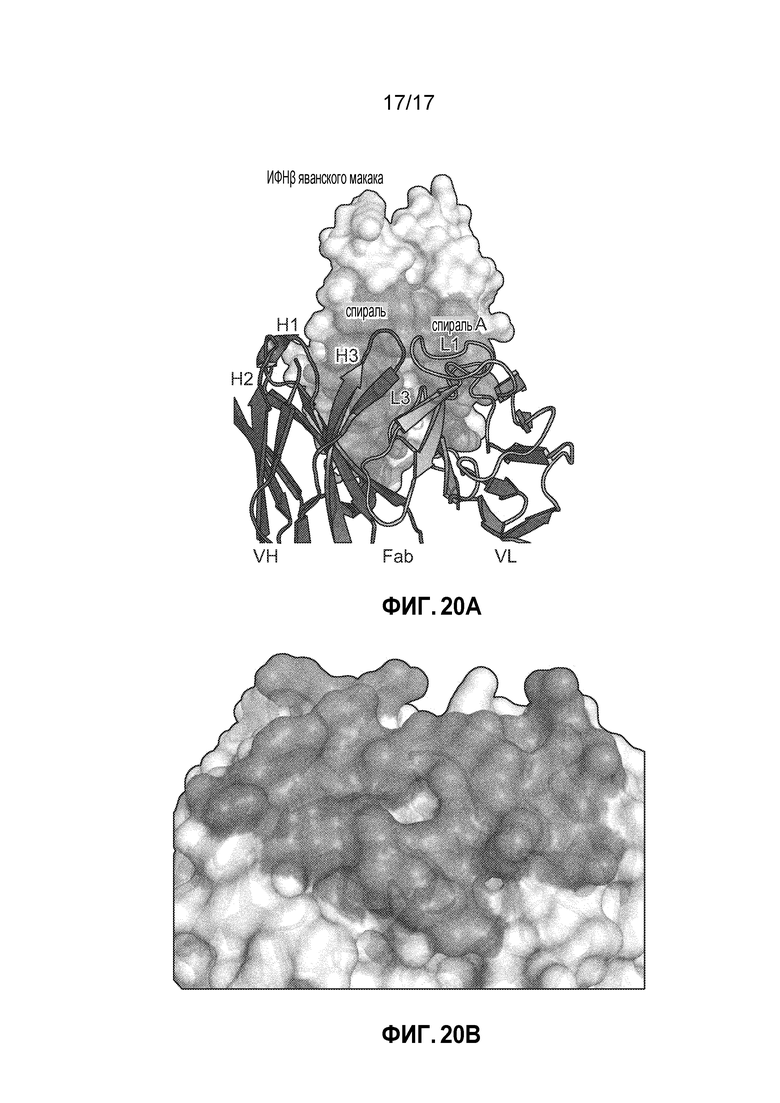
Изобретение относится биотехнологии и иммунологии, в частности к антителам или их антигенсвязывающим фрагментам, специфически связывающимся с интерфероном бета (IFNβ). Такие антитела или их антигенсвязывающие фрагменты применимы для различных терапевтических или диагностических целей, а именно для снижения активности IFNβ у индивидуума, для лечения ревматоидных заболеваний, для лечения системной красной волчанки. 16 н. и 11 з.п. ф-лы, 20 ил., 18 табл., 8 пр.
1. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее:
(i) вариабельную область тяжелой цепи (VH), содержащую:
(a) определяющую комплементарность область один VH (CDR-H1), содержащую аминокислотную последовательность SEQ ID NO: 37,
(b) CDR-H2 VH, содержащую аминокислотную последовательность SEQ ID NO: 38; и
(c) CDR-H3 VH, содержащую аминокислотную последовательность SEQ ID NO: 39; и
(ii) вариабельную область легкой цепи (VL), содержащую:
(a) определяющую комплементарность область один VL (CDR-L1), содержащую аминокислотную последовательность SEQ ID NO: 34,
(b) CDR-L2 VL, содержащую аминокислотную последовательность SEQ ID NO: 35; и
(c) CDR-L3 VL, содержащую аминокислотную последовательность SEQ ID NO: 36.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где указанное антитело содержит (i) каркас VH, содержащий каркасную последовательность DP10, DP-88, DP-25, DP-73, IGHV5-10-1*01, IGHV5-10-1*04, DP-14, DP-75, DP15, DP-8, DP-7 или IGHV7-4-1*02 зародышевой линии человека; (ii) каркас VL, содержащий каркасную последовательность DPK9, DPK5, DPK4, DPK1, IGKV1-5*01, DPK24, DPK21, DPK15, IGKV1-13*02, IGKV1-17*01, DPK8, IGKV3-11*01 или DPK22 зародышевой линии человека.
3. Антитело или его антигенсвязывающий фрагмент по п. 1 или 2, содержащее VH, содержащую аминокислотную последовательность SEQ ID NO: 28.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-3, содержащее константную область тяжелой цепи (CH), содержащую аминокислотную последовательность SEQ ID NO: 29.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-4, содержащее VL, содержащую аминокислотную последовательность SEQ ID NO: 1.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5, содержащее константную область легкой цепи (CL), содержащую аминокислотную последовательность SEQ ID NO: 30.
7. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-6, содержащее тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 33.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, содержащее легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 32.
9. Выделенное антитело или его антигенсвязывающий фрагмент специфически связывающееся с IFNβ человека, содержащее (a) последовательности CDR-H1, CDR-H2 и CDR-H3 SEQ ID NO: 28, и (b)
i) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 2;
ii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 3;
iii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 4;
iv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 5;
v) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 6;
vi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 7;
vii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 8;
viii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 9;
ix) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 10;
x) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 11;
xi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 12;
xii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 13;
xiii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 14;
xiv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 15;
xv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 16;
xvi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 17;
xvii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 18;
xviii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 19;
xix) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 20;
xx) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 21;
xxi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 22;
xxii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 23;
xxiii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 24;
xxiv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 25;
xxv) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 26;
xxvi) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 27; или
xxvii) последовательности CDR-L1, CDR-L2 и CDR-L3 SEQ ID NO: 1.
10. Выделенное антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащее VH, содержащую аминокислотную последовательность SEQ ID NO: 28, и VL, содержащую аминокислотную последовательность из любой из SEQ ID NO: 1-27.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-10, где указанное антитело или его антигенсвязывающий фрагмент специфически связывается с IFNβ со значением аффинности связывания (KD) от приблизительно 1×10-9 M до приблизительно 1×10-13 M.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-11, где указанное антитело или его антигенсвязывающий фрагмент (a) ингибирует связывание IFNβ с IFNAR; (b) снижает уровень экспрессии IFNβ-зависимого гена; и/или (c) ингибирует IFNβ-индуцируемое фосфорилирование STAT1 и/или фосфорилирование STAT2.
13. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-12, где указанное антитело или антигенсвязывающий фрагмент ингибирует связывание IFNβ с IFNAR со значением IC50 от приблизительно 1×10-9 M до приблизительно 1×10-13 M.
14. Выделенная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую антитело или его антигенсвязывающий фрагмент по любому из пп. 1-13.
15. Антитело или его антигенсвязывающий фрагмент по п. 1, содержащее последовательность VH, кодируемую:
a. вставкой ДНК в плазмиде, депонируемой в ATCC и имеющей регистрационный номер ATCC PTA-122727; или
b. нуклеиновой кислотой, содержащей последовательность SEQ ID NO: 166;
и дополнительно содержащее последовательность VL, кодируемую:
a. вставкой ДНК в плазмиде, депонируемой ATCC и имеющей регистрационный номер ATCC PTA-122726; или
b. нуклеиновой кислотой, содержащей последовательность SEQ ID NO: 167.
16. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент, специфически связывающееся с IFNβ человека, содержащие:
(i) VH, содержащую:
(a) CDR-H1 VH, содержащую аминокислотную последовательность SEQ ID NO: 37,
(b) CDR-H2 VH, содержащую аминокислотную последовательность SEQ ID NO: 38; и
(c) CDR-H3 VH, содержащую аминокислотную последовательность SEQ ID NO: 39; и
(ii) VL, содержащую:
(a) CDR-L1 VL, содержащую аминокислотную последовательность SEQ ID NO: 34,
(b) CDR-L2 VL, содержащую аминокислотную последовательность SEQ ID NO: 35; и
(c) CDR-L3 VL, содержащую аминокислотную последовательность SEQ ID NO: 36.
17. Выделенная нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент, которое специфически связывается с IFNβ человека, где выделенная нуклеиновая кислота содержит: (i) нуклеотидную последовательность SEQ ID NO: 166; или (ii) нуклеотидную последовательность SEQ ID NO: 167.
18. Вектор для экспрессии антитела или его антигенсвязывающего фрагмента, которое специфически связывается с IFNβ человека, где вектор содержит молекулу нуклеиновой кислоты по любому из пп. 14 и 16-17.
19. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента, которое специфически связывается с IFNβ человека, где клетка-хозяин содержит молекулу нуклеиновой кислоты по любому из пп. 14 и 16-17 или вектор по п. 18.
20. Способ получения антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по п. 19, в условиях, где антитело или его антигенсвязывающий фрагмент получают с помощью клетки-хозяина.
21. Фармацевтическая композиция для снижения активности IFNβ у индивидуума, где фармацевтическая композиция содержит антитело или его антигенсвязывающий фрагмент по любому из пп. 1-13 и 15 и фармацевтически приемлемый эксципиент.
22. Способ снижения активности IFNβ у нуждающегося в этом индивидуума, включающий введение указанного индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
23. Способ лечения ревматоидного заболевания, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
24. Способ лечения дерматомиозита (DM), включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
25. Способ лечения системной красной волчанки (SLE), включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
26. Способ лечения интерферонопатии, включающий введение нуждающемуся в этом индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
27. Способ лечения заболевания, нарушения или состояния, опосредованного или связанного с повышенной активностью IFNβ у нуждающегося в этом индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента по любому из пп. 1-13 и 15 или фармацевтической композиции по п. 21.
| CN 102898521 A, 30.01.2013 | |||
| AJITH SOMINANDA et al | |||
| Inhibition of endogenous interferon beta by neutralizing antibodies against recombinant interferon beta, Arch Neurol | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| АНТИТЕЛО ПРОТИВ ИНТЕРФЕРОН-α/β-СВЯЗЫВАЮЩЕГО БЕЛКА I (IFNAB-BPI) | 1995 |
|
RU2363705C2 |
Авторы
Даты
2021-06-28—Публикация
2017-04-28—Подача