[0001] Эта заявка испрашивает приоритет предварительной заявки на патент США №62/479042, зарегистрированной 30 марта 2017 года, содержание которой во всех смыслах включено в настоящее изобретение путем ссылки на нее.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] В изобретении предлагаются антигенсвязывающие белки (ABPs) со специфичностью связывания Т-клеточного иммунорецептора с доменами Ig и ITIM (TIGIT) и композиции, включающие такие ABPs, в том числе фармацевтические композиции, диагностические композиции, и наборы. Кроме того, предлагаются способы получения TIGIT ABPs и способы применения TIGIT ABPs, например, с целью проведения лечения, диагностики и научных исследований.
УРОВЕНЬ ТЕХНИКИ
[0003] TIGIT был идентифицирован в качестве коингибирующего рецептора, который лимитирует ответную реакцию T-клеток на рак и хроническую инфекцию. Смотрите публикацию Grogan et al., J Immunol., 2014, 192: (1 Supplement) 203,15., содержание которой включено в настоящее изобретение путем ссылки на нее. Было показано, что блокада TIGIT способствует усилению эффекторной функции CD8+ T-клеток и улучшению клиренса вируса и отторжения опухоли. Смотрите упомянутую выше публикацию.
[0004] Поэтому, существует необходимость в терапевтических средствах, которые могут оказывать антагонистическое действие в отношении TIGIT. В настоящем изобретении предлагаются ABPs, которые позволяют решить эту задачу.
[0005] Эта заявка имеет отношение к предварительной заявке на патент США №62/235990, зарегистрированной 1 октября 2015 года, к международной публикации № WO/2017/059095 и к патенту США №9713641, содержание которых во всех смыслах включено в настоящее изобретение путем ссылки на них.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] В изобретении предлагаются ABPs, которые специфически связывают TIGIT, и способы применения таких ABPs. В некоторых вариантах осуществления, TIGIT выбирают из TIGIT человека ("hTIGIT", SEQ ID NO: 1), TIGIT яванского макака ("cTIGIT", SEQ ID NO: 2) и TIGIT мыши ("mTIGIT", SEQ ID NO: 3 или 138).
[0007] В одном аспекте, предлагается выделенный антигенсвязывающий белок (ABP), который специфически связывает эпитоп TIGIT человека (hTIGIT; SEQ ID NO: 1) и который способен выполнять по меньшей мере одну из следующих функций: a) блокирование связывания MAB7, MAB9, MAB10, MAB11 и MAB12 с TIGIT человека; b) блокирование связывание TIGIT человека с CD155; и c) специфическое связывание с hTIGIT остатками H76, I77, S78 и P79.
[0008] В другом варианте осуществления, ABP специфически связывает один или более дополнительных hTIGIT остатков из группы, состоящей из T55, Q56, N58, L65, I68, N70, D72, L73, H111, T117, S129 и S130.
[0009] В другом варианте осуществления, ABP специфически не связывает hTIGIT остатки Q61, Q62, D63, Q64, Y113 или P114.
[0010] В одном варианте осуществления, ABP представляет собой MAB7, MAB9, MAB10, MAB11 или MAB12. В другом варианте осуществления, ABP способен выполнять по меньшей мере одну из следующих функций: a) блокирование связывания MAB1, MAB2, MAB3, MAB4 и MAB5 с TIGIT человека, блокирование связывания TIGIT человека с CD155; и специфическое связывание с hTIGIT остатками Q56 и I77. В другом варианте осуществления, ABP специфически не связывает hTIGIT остатки I68, L73, H76, S78 и P79.
[0011] В одном варианте осуществления, ABP способен выполнять по меньшей мере одну из следующих функций: a) блокирование связывания MAB13, MAB14, MAB15, MAB16, MAB17 и MAB18 с TIGIT человека; b) блокирование связывания TIGIT человека с CD155; и c) специфическое связывание с hTIGIT остатками Q56, I68, L73, H76 и I77. В одном варианте осуществления, ABP специфически не связывает hTIGIT остаток S78.
[0012] В одном варианте осуществления, ABP способен выполнять по меньшей мере одну из следующих функций: a) блокирование связывания MAB19, MAB20 и MAB21 с TIGIT человека; b) блокирование связывания TIGIT человека с CD155; и c) специфическое связывание с hTIGIT остатками Q56, I68, L73 и I77.
[0013] В одном варианте осуществления, ABP способен выполнять по меньшей мере одну из следующих функций: a) ингибирование связывания hTIGIT с CD112; b) повышение эффекторной функции T-клеток; c) повышение функции натуральных киллеров (NK); d) снижение числа регуляторных T-клеток в тканях или в кровотоке; e) подавление регуляторных T-клеток или активности регуляторных T-клеток; f) ингибирование ассоциации TIGIT и CD226; и g) неспецифическое связывания с нектин-4 (называемым также родственным рецептору полиовируса белком 4, PVRL4).
[0014] В другом варианте осуществления, ABP представляет собой MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB8, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 или MAB21.
[0015] В другом аспекте, предлагается способ лечения или предотвращения заболевания или состояния у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества: (i) ABP, который специфически связывает hTIGIT, выбранного из группы, состоящей из MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB7, MAB8, MAB9, MAB10, MAB11, MAB12, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 и MAB21; и одного или более из (ii) дополнительных иммунотерапевтических средств, которые блокируют активацию сигнального пути ингибирующего рецептора иммунной клетки или его лиганда; и (iii) дополнительного иммунотерапевтического средства, которое модулирует активацию сигнального пути костимулирующего рецептора, или нуклеиновой кислоты, кодирующей такое средство.
[0016] В одном варианте осуществления, ингибирующий рецептор или его лиганд выбирают из CTLA-4, PD-1, PD-L1, PD-L2, Tim-3, нейритина, BTLA, CECAM-1, CECAM-5, VISTA, LAIR1, CD160, 2B4, KIR и их комбинаций.
[0017] В одном варианте осуществления, костимулирующий рецептор представляет собой CD3, GITR OX40, ICOS, LAG-2, CD27, CD28, CD40 или 4-1BB.
[0018] В одном варианте осуществления, дополнительное терапевтическое средство представляет собой MAB22. В другом варианте осуществления, дополнительное терапевтическое средство представляет собой MAB23. В различных вариантах осуществления, ABP представляет собой MAB10, MAB2, MAB15 или MAB21.
[0019] В одном варианте осуществления, дополнительное иммунотерапевтическое средство представляет собой антитело против Tim-3, 4-1BB, GITR, PD-1 или PD-L1, или представляет собой OX40. В некоторых вариантах осуществления, комбинированная терапия позволяет достигать дополнительного или синергетического воздействия на иммунный ответ у субъекта, подвергающегося такой терапии.
[0020] В одном варианте осуществления, заболевание или состояние представляет собой рак, и рак выбирают из солидной опухоли и гематологической опухоли. В некоторых вариантах осуществления, рак представляет собой солидную опухоль.
[0021] В некоторых вариантах осуществления, дополнительное терапевтическое средство приготавливают в той же самой фармацевтической композиции вместе с ABP, и ABP и дополнительное терапевтическое средство вводят совместно. В другом варианте осуществления, дополнительное терапевтическое средство приготавливают в отдельной от ABP фармацевтической композиции, и ABP и дополнительное терапевтическое средство вводят раздельно. Такое раздельное введение может быть проведено в один и тот же день или в различные дни. В некоторых вариантах осуществления, ABP вводят перед введением дополнительного терапевтического средства; в других вариантах осуществления, дополнительное терапевтическое средство вводят перед введением ABP.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0022] На фигурах 1A-1L приведены в графическом виде результаты исследования пролиферации лимфоидных клеток с целью определения Т-клеточных иммунных реакций в положительных по цитомегаловирусу (CMV+) T-клетках, используя мононуклеарные клетки периферической крови (PBMCs) от индивидуальных доноров. Клетки стимулировали с помощью 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл лизата CMV и обрабатывали с помощью MAB10 и пембролизумаба, каждым индивидуально или в комбинации (фигуры 1A-1C, соответственно); клетки стимулировали с помощью 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл лизата CMV и обрабатывали с помощью MAB10 и антитела против TIM-3, каждым индивидуально или в комбинации (фигуры 1D-1F); клетки стимулировали с помощью 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл лизата CMV и обрабатывали с помощью MAB10 и антитела против 41BB, каждым индивидуально или в комбинации (фигуры 1G-1I); и клетки стимулировали с помощью 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл лизата CMV и обрабатывали с помощью MAB10 и rhOX40L, каждым индивидуально или в комбинации (фигуры 1J-1L). Статистически значимые различия рассчитывали как между двумя группами, подвергнутыми обработке индивидуальными препаратами, так и по сравнению с их аналогичными контрольными выборками, а также между двумя группами, подвергнутыми обработке индивидуальными препаратами, и группами, подвергнутыми обработке комбинацией этих препаратов, используя двухвыборочный t-критерий для независимых выборок (*=p<0,05, **=p<0,01, ***=p<0,005, ****=p<0,001).
[0023] На фигурах 2A-2B приведены в графическом виде результаты исследования диссоциированных опухолевых клеток (DTC) с целью определения Т-клеточных иммунных реакций в DTCs от не подвергавшихся лекарственной терапии пациентов со злокачественными новообразованиями. На фигуре 2A показана активация DTCs, взятых у мужчины в возрасте 50 лет с IV стадией меланомы, о чем свидетельствует продуцирование IFNγ. Клетки культивировали и стимулировали их с помощью контрольного OVA пептида (3 мкг/мл) или с помощью смеси пептида с меланомными клетками, состоящей из 1 мкг/мл NY-ESO-1+1 мкг/мл MelanA/MART-1+1 мкг/мл gp100. К стимулированным с помощью пептида образцам добавляли антитело MAB22 против GITR, пембролизумаб и антитело MAB10 против TIGIT, либо по отдельности, либо в комбинациях попарно. В качестве контроля, использовали равные количества изотипических контрольных антител. Для стимуляции одним антителом, суммарное количество антитела поддерживали постоянным путем добавления в образцы изотипического контрольного антитела. MAB10 и пембролизумаб использовали при конечной концентрации 10 мкг/мл, и MAB22 использовали при конечной концентрации 1 мкг/мл. Для оценки активации, клетки культивировали в течение 7 дней, собирали надосадочные жидкости и количественно определяли уровень продуцируемого IFNγ, используя AlphaLISA® (PerkinElmer). Статистическую значимость рассчитывали с использованием однофакторного дисперсионного анализа с множественными сравнениями. На фигуре 2B показана активация DTCs, взятых у мужчины в возрасте 80 лет с IIa стадией немелкоклеточного рака легкого (NSCLC). Клетки культивировали и оставляли нестимулированными (контроль) или стимулировали с помощью растворимых антител против CD3+CD28 в течение двух дней. В качестве контроля, использовали равное количество изотипического контрольного антитела (IgG4). Для стимуляции одним антителом, суммарное количество антитела поддерживали постоянным путем добавления в образцы изотипического контрольного антитела. MAB10 и пембролизумаб использовали при конечной концентрации 10 мкг/мл. Для оценки активации, в течение последних 5 часов культивирования к клеткам добавляли брефелдин A и проводили флуоресцентную сортировку клеток (FACS) и количественное определение CD4+ и CD8+ T-клеток, продуцирующих IFNγ, используя внутриклеточное окрашивание цитокинов (ICS). Статистическую значимость рассчитывали с использованием однофакторного дисперсионного анализа с множественными сравнениями.
[0024] На фигурах 3A-3D приведены в графическом виде результаты измерений объема опухоли в случае использования комбинации антитела против TIGIT и антитела против NRP-1 в экспериментальной модели EMT6 рака молочной железы на мышах. Комбинации mMAB23 с 1B4 в сравнении с mMAB23 монотерапией и αPD-1 монотерапией показаны на фигурах 3A (средняя величина объема опухоли) и 3C (индивидуальная величина объема опухоли для каждой мыши), и комбинации mMAB23 с 1B4 в сравнении с 1B4 монотерапией и aPD-1 монотерапией показаны на фигурах 3B (средняя величина объема опухоли) и 3D (индивидуальная величина объема опухоли). На фигурах 3A-3B, 1×105 мышиных клеток EMT6 имплантировали подкожно самкам мышей линии BALB/c. После достижения среднего размера опухоли 80-120 мм3, мышей случайным образом распределяли по группам обработки и вводили интраперитонеально указанные антитела при дозе 1000 мкг/животное (контроль IgG2b и 1B4), 500 мкг/животное (mMAB23 и 1B4), 250 мкг/животное (mMAB23 и 1B4) или 200 мкг/животное (αPD-1). Черные стрелки указывают дни проведения обработок. Для каждой группы обработки показано средняя величина +/- стандартная ошибка средней величины (SEM) объема опухоли для 8 мышей в группе. На 14-ый день рассчитывали статистическую значимость (различия средних значений, полученные методом наименьших квадратов с корректировкой по критерию множественных сравнений Тьюки-Крамера) для мыши, подвергнутой обработке, в сравнении с контрольной мышью. Оценивали кривые для контроля, крысиного антимышиного αPD-1 (клон RMPl-14), только одного средства (250 мкг) и комбинации (250 мкг каждое) от времени, используя анализ методом смешанных моделей. На фигурах 3C-3D, показаны индивидуальные объемы опухоли EMT6 для каждой из 8 мышей в группе для всех подвергавшихся обработке групп (указанных в верхней части каждого графика). Мышиные клетки опухоли EMT6 инъецировали самкам мышей линии BALB/c и случайным образом распределяли мышей по группам обработки при среднем размере опухоли 80-120 мм3. Обработку проводили случайным образом, и указанные антитела вводили интраперитонеально при дозе 1000 мкг/животное (контроль IgG2b и 1B4), 500 мкг/животное (mMAB23 и 1B4), 250 мкг/животное (mMAB23 и 1B4) или 200 мкг/животное (αPD-1). Черные стрелки указывают дни проведения обработок. По y-осям отложен объем опухоли, а по x-осям отложено время после начала обработки в днях. Исследование заканчивали на 40-ой день или когда объем опухоли достигал 2000 мм3 в зависимости от подвергаемой обработке группы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Определения
[0025] Если не указано иное, то предполагается, что все используемые в настоящем изобретении научно-технические термины, обозначения и другая научная терминология имеют значения, которые являются общепринятыми для специалистов в той области, к которой относится это изобретение. В ряде случаев, термины с общепринятыми значениями определяются в настоящем изобретении для более четкого понимания и/или для предоставления справочного материала, и включение таких определений в настоящее изобретение не следует истолковывать, как желание продемонстрировать их отличие от общепринятых в науке и техники определений. Технические приемы и порядок действий, которые описаны или которые упоминаются в изобретении, являются хорошо известными и обычно применяемыми специалистами с использованием традиционных методов, таких как, например, широко используемые методы клонирования молекул нуклеиновых кислот, описанные в руководстве Sam brook et al., Molecular Cloning: A Laboratory Manual 4th ed. (2012) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. В соответствующих случаях, методики, включающие использование производимых промышленностью наборов и реагентов, обычно осуществляют в соответствии с протоколами и условиями, определяемыми фирмой-производителем, если не указано иначе.
[0026] Используемые в настоящем изобретении формы единственного числа включают множественное число определяемых объектов, если из контекста в явном виде не следует иное. Предполагается, что термины "включает", "такие как" и другие подобные термины выражают включение без ограничения, если конкретно не указано иначе.
[0027] Используемый в изобретении термин "содержащий" также конкретно включает варианты применения "состоящий из" и "состоящий в основном из" названных элементов, если конкретно не указано иначе.
[0028] Термин "приблизительно" задает и охватывает указанную величину и область выше и ниже этой величины. В конкретных вариантах осуществления, термин "приблизительно" задает указанную величину ± 10%, ± 5% или ± 1%. В конкретных вариантах осуществления, в соответствующих случаях, термин "приблизительно" задает указанную величину (указанные величины) ± одно среднее квадратичное отклонение этой величины (этих величин).
[0029] Термины "TIGIT," "белок TIGIT" и "антиген TIGIT" используются в изобретении взаимозаменяемо для обозначения TIGIT человека или любых вариантов (например, сплайс-вариантов и аллельных вариантов), изоформ и межвидовых гомологов TIGIT человека, которые естественно экспрессируются клетками или которые экспрессируются клетками, трансфицированными с помощью гена TIGIT. В некоторых аспектах, белок TIGIT представляет собой белок TIGIT, естественно экспрессируемый приматом (например, обезьяной или человеком), грызуном (например, мышью или крысой), собакой, верблюдом, кошкой, коровой, козой, лошадью или овцой. В некоторых аспектах, белок TIGIT представляет собой TIGIT человека (hTIGIT; SEQ ID NO: 1). Не приводя в качестве подтверждения какую-либо теорию, тем не менее, можно предположить, что положения 1-21 последовательности SEQ ID NO: 1 кодируют сигнальный пептид; положения 22-141 последовательности SEQ ID NO: 1 кодируют внеклеточный домен зрелого белка TIGIT; положения 142-162 последовательности SEQ ID NO: 1 кодируют трансмембранный домен; и положения 163-244 последовательности SEQ ID NO: 1 кодируют цитоплазматический домен. Смотрите UniProt KB - Q495A1 (TIGIT_HUMAN), at www.uniprot.org/uniprot/Q495A1, accessed September 28, 2015. В некоторых аспектах, белок TIGIT представляет собой TIGIT яванского макака (cTIGIT; SEQ ID NO: 2). В некоторых аспектах, белок TIGIT представляет собой TIGIT грызуна (mTIGIT), имеющий последовательность, представленную в SEQ ID NO: 3. В некоторых аспектах, белок TIGIT представляет собой TIGIT грызуна (mTIGIT), имеющий последовательность, представленную в SEQ ID NO: 138. В настоящем изобретении, если SEQ ID NO не указана, то термины "mTIGIT," "TIGIT грызуна" и "TIGIT мыши" означает последовательность SEQ ID NO: 3 и/или SEQ ID NO: 138. В некоторых аспектах, белок TIGIT представляет собой полноразмерный или непроцессированный белок TIGIT. В некоторых аспектах, белок TIGIT представляет собой усеченный или процессированный белок TIGIT, продуцированный путем посттрансляционной модификации. Для термина TIGIT также известно ряд синонимов, в том числе WUCAM, VSIG9 и Vstm3.
[0030] Термин "иммуноглобулин" относится к классу структурно родственных белков, обычно содержащих две пары полипептидных цепей: одну пару легких (L) цепей и одну пару тяжелых (H) цепей. В "интактном иммуноглобулине" все четыре эти цепи взаимосвязаны дисульфидными связями. Структура иммуноглобулинов хороша изучена. Смотрите, например, монографию Paul, Fundamental Immunology 7th ed., Ch. 5 (2013) Lippincott Williams & Wilkins, Philadelphia, PA. Вкратце, каждая тяжелая цепь обычно включает вариабельную область (VH) тяжелая цепи и константную область (CH) тяжелой цепи. Константная область тяжелой цепи обычно включает три домена, сокращенно обозначаемые как CH1, CH2 и CH3. Каждая легкая цепь обычно включает вариабельную область (VL) легкой цепи и константную область легкой цепи. Константная область легкой цепи обычно включает один домен, сокращенно обозначаемый как CL.
[0031] Термин "антигенсвязывающий белок" (ABP) относится к белку, включающему один или более антигенсвязывающих доменов, которые специфически связываются с антигеном или эпитопом. В некоторых вариантах осуществления, антигенсвязывающий домен связывает антиген или эпитоп со специфичностью и аффинностью, аналогичными специфичности и аффинности природных антител. В некоторых вариантах осуществления, ABP включает антитело. В некоторых вариантах осуществления, ABP состоит из антитела. В некоторых вариантах осуществления, ABP состоит в основном из антитела. В некоторых вариантах осуществления, ABP включает альтернативный остов. В некоторых вариантах осуществления, ABP состоит из альтернативного остова. В некоторых вариантах осуществления, ABP состоит в основном из альтернативного остова. В некоторых вариантах осуществления, ABP включает фрагмент антитела. В некоторых вариантах осуществления, ABP состоит из фрагмента антитела. В некоторых вариантах осуществления, ABP состоит в основном из фрагмента антитела. "TIGIT ABP", "ABP против TIGIT" или "TIGIT-специфический ABP" представляет собой предлагаемый в изобретении ABP, который специфически связывается с антигеном TIGIT. В некоторых вариантах осуществления, ABP связывает внеклеточный домен в TIGIT. В конкретных вариантах осуществления, предлагаемый в изобретении TIGIT ABP связывается с эпитопом в TIGIT, который является консервативным между или среди белков TIGIT от различных видов живых организмов.
[0032] Используемый в изобретении термин "антитело" в его широком смысле включает конкретные типы молекул иммуноглобулина, содержащих один или более антигенсвязывающих доменов, которые специфически связываются с антигеном или эпитопом. Антитело конкретно включает интактные антитела (например, интактные иммуноглобулины), фрагменты антител и полиспецифические антитела. Антитело представляет собой один тип ABP.
[0033] Термин "антигенсвязывающий домен" означает часть ABP, которая способна специфически связываться с антигеном или эпитопом. Одним примером антигенсвязывающего домена является антигенсвязывающий домен, образованный VH-VL димером антитела. Другим примером антигенсвязывающего домене является антигенсвязывающий домен, образованный путем диверсификации конкретных петлевых фрагментов из 10-го домена фибронектина III типа аднектина.
[0034] Термины "полноразмерное антитело", "интактное антитело" и "полное антитело" используются в изобретении взаимозаменяемо для обозначения антитела, имеющего структуру, практически аналогичную структуре природного антитела, и имеющего тяжелые цепи, которые включают Fc область. Например, в случае использования для обозначения молекулы IgG, "полноразмерное антитело" представляет собой антитело, которое включает две тяжелых цепи и две легких цепи.
[0035] Термин "Fc-фрагмент" обозначает C-терминальную область тяжелой цепи иммуноглобулина, которая в природных антителах взаимодействует с Fc рецепторами и конкретными белками системы комплемента. Структуры Fc-фрагментов различных иммуноглобулинов и содержащиеся в них сайты гликозилирования хорошо изучены. Смотрите публикацию Schroeder and Cavacini, J Allergy Clin. Immunol., 2010, 125:S41-52, содержание которой включено в настоящее изобретение путем ссылки на нее. Fc-фрагмент может представлять собой природную Fc-фрагмент или модифицированную Fc-фрагмент, описанную для известного уровня техники или в другом месте этого изобретения.
[0036] VH и VL области могут быть дополнительно подразделены на области гипервариабельности ("гипервариабельные области (HVRs)", называемые также "определяющими комплементарность областями" (CDRs)), чередующиеся с областями, которые являются более консервативными. Более консервативными областями называют каркасные области (FRs). Каждая VH и VL обычно включает три CDRs и четыре FRs, расположенные в следующем порядке (от N-конца к C-концу): FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4. CDRs вовлечены в связывание антигена и влияют на антигенспецифичность и аффинность связывания антитела. Смотрите публикацию Kabat et al., Sequences of Proteins of Immunological Interest 5th ed. (1991) Public Health Service, National Institutes of Health, Bethesda, MD, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0037] Легкая цепь у любого вида позвоночных может быть отнесена к одному из двух типов, называемых каппа (κ) и лямбда (λ), исходя из последовательности ее константного домена.
[0038] Тяжелая цепь у любого вида позвоночных может быть отнесена к одному из пяти различных классов (или изотипов): IgA, IgD, IgE, IgG и IgM. Эти классы также обозначают как α, δ, ε, γ и μ, соответственно. Классы IgG и IgA дополнительно подразделяют на подклассы на основе различий в последовательности и функции. У людей экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA и IgA2.
[0039] Границы CDR из аминокислотных последовательностей могут быть определены любым специалистом путем использования любого номера из известных схем нумерации, в том числе схем нумерации, описанных в упомянутой выше публикации Kabat et al., (схема нумерации "Kabat"); в публикации Al-Lazikani et al., 1997, J Mal. Biol., 273:927-948 (схема нумерации "Chothia"; в публикации MacCallum et al., 1996,J Mal. Biol. 262:732-745 (схема нумерации "Contact"); в публикации Lefranc et al., Dev. Comp. Immunol., 2003, 27:55-77 (схема нумерации "IMGT"); и в публикации Honegge and Phickthun, J Mal. Biol., 2001, 309:657-70 (схема нумерации "AHo"); содержание которых включено в настоящее изобретение путем ссылки на них.
[0040] В таблице 1 приведены положения CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3, идентифицированные с помощью схем Kabat и Chothia. Для CDR-H1, нумерация остатка приводится с использованием как схемы нумерации Kabat, так и схемы нумерации Chothia.
[0041] CDRs могут быть определены, например, с использованием программного обеспечения для нумерации антитело антитела, такого как Abnum, доступного на сайте www.bioinf.org.uk/abs/abnum/ и описанного в публикации Abhinandan and Martin, Immunology, 2008, 45:3832-3839, содержание которой включено в настоящее изобретение путем ссылки на нее.
Таблица 1. Остатки в CDRs в соответствии со схемами нумерации Kabat и Chothia
* C-конец CDR-H1, в случае нумерации с использованием схемы нумерации Kabat, варьирует между H32 и H34, в зависимости от длины CDR.
[0042] "Схему нумерации EU" обычно используют при обозначении остатка константной области тяжелой цепи антитела (например, как описано в упомянутой выше публикации Kabat et al.). Если не указано иначе, то схему нумерации EU используют для обозначения остатков описанных в изобретении константных областей тяжелых цепей антител.
[0043] "Фрагмент антитела" включает часть интактного антитела, такую как антигенсвязывающую или вариабельную область интактного антитела. Фрагменты антител включают, например, Fv фрагменты, Fab фрагменты, F(ab')2 фрагменты, Fab' фрагменты, scFv (sFv) фрагменты и scFv-Fc фрагменты.
[0044] "Fv" фрагменты включают нековалентно связанный димер вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи.
[0045] "Fab" фрагменты включают, помимо вариабельных доменов тяжелой и легкой цепи, константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab фрагменты могут быть образованы, например, с помощью рекомбинантных методов или путем расщепления полноразмерного антитела ферментом папаином.
[0046] "F(ab')2" фрагменты содержат два Fab' фрагмента, соединенных вблизи шарнирной области дисульфидными связями. F(ab')2 фрагменты могут быть образованы, например, с помощью рекомбинантных методов или путем расщепления интактного антитела ферментом пепсином. F(ab') фрагменты могут быть диссоциированы, например, путем обработки с помощью β-меркаптоэтанола.
[0047] "Одноцепочечный Fv" или "sFv" или "scFv" фрагменты антител включают VH домен и VL домен в одной полипептидной цепи. VH и VL обычно соединены пептидным линкером. Смотрите публикацию Phickthun A. (1994). Может быть использован любой подходящий линкер. В некоторых вариантах осуществления, линкер представляет собой (GGGGS)n (SEQ ID NO: 127). В некоторых вариантах осуществления, n=1, 2, 3, 4, 5 или 6. Смотрите публикацию Antibodies from Escherichia coli. In Rosenberg M. & Moore G.P. (Eds.), The Pharmacology of Monoclonal Antibodies vol. 113 (pp. 269-315). Springer-Verlag, New York, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0048] "scFv-Fc" фрагменты включают scFv, присоединенный к Fc домену. Например, Fc домен может быть присоединен к C-терминальному scFv. Fc домен может следовать за VH или VL, в зависимости от ориентации вариабельных доменов в scFv (то есть, VH-VL или VL-VH). Может быть использован любой подходящий известный или описанный в изобретении Fc домен. В некоторых случаях, Fc домен включает IgG4 Fc домен.
[0049] "Моноспецифический ABP" представляет собой ABP, который включает один или более сайтов связывания, которые специфически связываются с одним эпитопом. Примером моноспецифического ABP является молекула природного IgG, который, будучи двухвалентным (то есть, имеющим два антигенсвязывающих домена), распознает один и тот же эпитоп в каждом из двух антигенсвязывающих доменах. Специфичность связывания может присутствовать при любой подходящей валентности.
[0050] Термин "моноклональное антитело" относится к антителу из популяции практически гомогенных антител. Популяция практически гомогенных антител включает антитела, которые являются практически аналогичными и которые связывают один и тот же эпитоп (эпитопы), за исключением вариантов, которые могут обычно возникать при продуцировании моноклонального антитела. Такие варианты обычно присутствуют только в незначительных количествах. Моноклональное антитело обычно получают с помощью процесса, который включает выбор индивидуального антитела из множества антител. Например, процесс выбора может представлять собой выбор уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов, дрожжевых клонов, бактериальных клонов или других рекомбинантных ДНК клонов. Выбранное антитело может быть дополнительно изменено, например, для повышения аффинности к мишени ("созревание аффинности"), для гуманизации антитела, для повышения его продукции в клеточной культуре и/или для снижения его иммуногенности у субъекта.
[0051] Термин "химерное антитело" относится к антителу, в котором часть тяжелой и/или легкой цепи образована из конкретного источника или вида, при этом оставшаяся часть тяжелой и/или легкой цепи образована из другого источника или вида.
[0052] "Гуманизированные" формы нечеловеческих антител представляют собой химерные антитела, которые содержат минимальную последовательность, образованную из нечеловеческого антитела. Гуманизированное антитело обычно представляет собой человеческое антитело (реципиентное антитело), в котором остатки от одной или более CDRs заменены остатками от одной или более CDRs нечеловеческого антитела (донорного антитела). Донорное антитело может представлять собой любое подходящее нечеловеческое антитело, такое как мышиное, крысиное, кроличье антитело, антитело цыпленка или антитело низшего примата, обладающее требуемой специфичностью, аффинностью или биологическим действием. В некоторых случаях, выбранные остатки каркасной области реципиентного антитела заменяют на соответствующие остатки каркасной области из донорного антитела. Гуманизированные антитела могут также включать остатки, которые не обнаруживаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации могут быть осуществлены с целью дополнительного улучшения функции антитела. Для более подробного ознакомления, смотрите публикации Jones et al., Nature, 1986, 321:522-525; Riechmann et al., Nature, 1988, 332:323-329; и Presta, Curr. Op. Struct. Biol., 1992, 2:593-596, содержание каждой из которых включено в настоящее изобретение путем ссылки на нее.
[0053] "Человеческое антитело" представляет собой антитело, которое обладает аминокислотной последовательностью, соответствующей аминокислотной последовательности антитела, продуцируемого человеком или клетками человека, или образованного из нечеловеческого источника, который использует репертуар человеческого антитела, или последовательности, кодирующие человеческое антитело (например, полученные из человеческих источников или сконструированные с самого начала). Человеческие антитела, в частности, включают гуманизированные антитела.
[0054] "Выделенный ABP" или "выделенная нуклеиновая кислота" представляет собой ABP или нуклеиновую кислоту, которая была отделена и/или извлечена из компонента его естественной среды. Компоненты естественной среды могут включать ферменты, гормоны и другие белковые или небелковые материалы. В некоторых вариантах осуществления, выделенный ABP очищают до такой степени, которая является достаточной для получения по меньшей мере 15 остатков N-терминальной или внутренней аминокислотной последовательности, например, путем использования секвенатора с вращающимся стаканом. В некоторых вариантах осуществления, выделенный ABP очищают до состояния гомогенности методом гель-электрофореза (например, SDS-PAGE) при восстановительных или невосстановительных условиях с детекцией путем окрашивания кумасси голубым или серебром. В некоторых вариантах осуществления, выделенный ABP может включать ABP, образующийся внутри рекомбинантных клеток, в связи с тем, что не присутствует по меньшей мере один компонент естественного окружения ABP. В некоторых аспектах, выделенный ABP или выделенную нуклеиновую кислоту приготавливают по меньшей мере за одну стадию очистки. В некоторых вариантах осуществления, выделенный ABP или выделенную нуклеиновую кислоту очищают по меньшей мере до чистоты 80%, 85%, 90%, 95% или 99% по массе. В некоторых вариантах осуществления, выделенный ABP или выделенную нуклеиновую кислоту очищают по меньшей мере до чистоты 80%, 85%, 90%, 95% или 99% по объему. В некоторых вариантах осуществления, выделенный ABP или выделенную нуклеиновую кислоту получают в форме раствора, включающего по меньшей мере 85%, 90%, 95%, 98%, от 99% до 100% ABP или нуклеиновой кислоты по массе. В некоторых вариантах осуществления, выделенный ABP или выделенную нуклеиновую кислоту получают в форме раствора, включающего по меньшей мере 85%, 90%, 95%, 98%, от 99% до 100% ABP или нуклеиновой кислоты по объему.
[0055] "Аффинность" обозначает силу всех совокупных взаимодействий между одним сайтом связывания молекулы (например, ABP) и его партнером по связыванию (например, антигеном или эпитопом). Если не указано иначе, то используемый в изобретении термин "аффинность" относится к собственной аффинности связывания, которая отражает 1:1 взаимодействие между членами связывающейся пары (например, ABP и антигеном или эпитопом). Аффинность молекулы X в отношении ее партнера Y может быть охарактеризована константой равновесия диссоциации (KD). Кинетические компоненты, которые влияют на константу равновесия диссоциации, описаны более подробно ниже. Аффинность может быть измерена хорошо известными методами, включающие методы, описанные в настоящем изобретении, такие как метод поверхностного плазмонного резонанса (SPR) (например, BIACORE®) или метод биослойной интерферометрии (например, FORTEBIO®).
[0056] Применительно к связыванию ABP с молекулой-мишенью, термины "связывать", "специфическое связывание", "специфически связывается с", "специфичен по отношению к", "селективно связывает" и "селективен по отношению" к конкретному антигену (например, полипептидной мишени) или к эпитопу на конкретном антигене обозначают связывание, которое значительно количественно отличается от неспецифического или неселективного взаимодействия (например, с молекулой, не являющейся мишенью). Специфическое связывание может быть измерено, например, путем измерения связывания с молекулой-мишенью и сравнения его со связыванием с молекулой, не являющейся мишенью. Специфическое связывание может быть также определено при конкуренции с контрольной молекулой, которая имитирует эпитоп, распознаваемый на молекуле-мишени. В этом случае, говорят о наличии специфического связывания, если связывание ABP с молекулой-мишенью конкурентно ингибируется контрольной молекулой. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 50% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 40% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 30% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 20% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 10% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 1% аффинности для TIGIT. В некоторых аспектах, аффинность TIGIT ABP для молекулы, не являющейся мишенью, составляет менее чем приблизительно 0,1% аффинности для TIGIT.
[0057] Используемый в изобретении термин "kd" (сек-1) относится к константе скорости диссоциации конкретного взаимодействия ABP-антиген. Эту величину также называют величиной koff.
[0058] Используемый в изобретении термин "ka" (M-1 × сек-1) относится к константе скорости ассоциации конкретного взаимодействия ABP-антиген. Эту величину также называют величиной kon.
[0059] Используемый в изобретении термин "KD" (M) относится к константе равновесия диссоциации конкретного взаимодействия ABP-антиген. KD=ka/kd. В некоторых вариантах осуществления, аффинность ABP описывается в терминах KD для взаимодействия между таким ABP и его антигеном. По определению, известно, что меньшая величина KD указывает на более высокую величину аффинности взаимодействия, в то время как большая величина KD указывает на более низкую величину аффинности взаимодействия.
[0060] Используемый в изобретении термин "KA" (M-1) относится к константе равновесия ассоциации конкретного взаимодействия ABP-антиген. KA=ka/kd.
[0061] ABP с "созревшей аффинностью" представляет собой ABP с одной или более альтерациями (например, в одной или более CDRs или FRs) относительно исходного ABP (то есть, ABP, из которого образован или сконструирован альтерированный ABP), что приводит к повышению аффинности ABP к его антигену, по сравнению с исходным ABP, который не имеет альтерации (альтераций). В некоторых вариантах осуществления, созревшая аффинность ABP имеет наномолярную или пикомолярную аффинность в отношении антигена-мишени. Созревшая аффинность ABPs может быть получена с помощью ряда известных методов. Например, в публикации Marks et al., Bio/Technology, 1992, 10:779-783, содержание которой включено в настоящее изобретение путем ссылки на нее, описано созревание аффинности в результате тасования VH и VL домена. Случайный мутагенез CDR и/или каркасных остатков описан, например, в публикациях Barbas et al., Proc. Nat. Acad. Sci. U.S.A., 1994, 91:3809-3813; Schier et al., Gene, 1995, 169:147-155; Yelton et al., J Immunol., 1995, 155:1994-2004; Jackson et al., J Immunol., 1995, 154:3310-33199; и Hawkins et al, J Mal. Biol., 1992, 226:889-896; содержание каждой из которых включено в настоящее изобретение путем ссылки на нее.
[0062] "Иммуноконъюгат" представляет собой ABP, конъюгированный с одной или более гетерологичными молекулами, такими как терапевтическое или диагностическое средство.
[0063] "Эффекторные функции" относятся к биологическим активностям, опосредованным Fc-фрагментом антитела, активности которой могут изменяться в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают C1q связывание активированной комплементзависимой цитотоксичности (CDC), связывание Fc рецептором активированной антителозависимой клеточно-обусловленной цитотоксичности (ADCC) и антителозависимого клеточного фагоцитоза (ADCP).
[0064] При упоминании в тексте изобретения двух или более ABPs, термин "конкурирует с" или "перекрестно конкурирует с" указывает на то, что два или более ABPs конкурируют за связывание с антигеном (например, TIGIT). В одном примере исследования, TIGIT наносят на поверхность и контактируют с первым TIGIT ABP, после чего добавляют второй TIGIT ABP. В другом примере исследования, первый TIGIT ABP наносят на поверхность и контактируют с TIGIT, и затем добавляют второй TIGIT ABP. Если присутствие первого TIGIT ABP уменьшает связывание второго TIGIT ABP, в обоих исследованиях, то тогда ABPs конкурируют друг с другом. Термин "конкурирует с" также включает комбинации ABPs, в которых один ABP уменьшает связывание другого ABP, но если не обнаруживается конкуренции при добавлении ABPs в обратном порядке. Однако, в некоторых вариантах осуществления, первый и второй ABPs ингибируют связывание друг друга, независимо от порядка, в котором их добавляют. В некоторых вариантах осуществления, один ABP уменьшает связывание другого ABP с его антигеном по меньшей мере на 25%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95%. Специалист в данной области может выбрать концентрации антител, используемых в исследованиях конкуренции, на основе аффинностей ABPs в отношении TIGIT и валентности ABPs. Описанные в этом изобретении методы исследований являются только иллюстрациями, и специалист в данной области может использовать любой подходящий метод исследования для определения возможной конкуренции антител друг с другом. Подходящие методы исследования описаны, например, в публикациях Cox et al., "Immunoassay Methods", in Assay Guidance Manual [Internet], Updated December 24, 2014 (www.ncbi.nlm.nih.gov/books/NBK92434/; accessed September 29, 2015); Silman et al., Cytometry, 2001, 44:30-37; и Finco et al., J Pharm. Biomed. Anal., 2011, 54:351-358; содержание каждой из которых включено в настоящее изобретение путем ссылки на нее.
[0065] Термин "эпитоп" обозначает часть антигена, которая специфически связывается с ABP. Эпитопы часто состоят из поверхностно-доступных аминокислотных остатков и/или боковых сахарных цепей, и они могут иметь специфические пространственные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются в том, что связывание для первого из вышеуказанных, но не для второго, может быть утрачено в присутствии денатурирующих растворителей. Эпитоп может включать аминокислотные остатки, которые непосредственно принимают участие в связывании, и другие аминокислотные остатки, которые не принимают непосредственного участия в связывании. Эпитоп, с которым связывается ABP, может быть определен с использованием известных методов для определения эпитопа, таких как, например, испытание на ABP связывание с TIGIT вариантами с различными точечными мутациями или с химерными TIGIT вариантами.
[0066] Аналогично, термин "паратоп" относится к аминокислотным остаткам в антителе, которые связываются с эпитопом белка-мишени.
[0067] Процент "идентичности" между полипептидной последовательностью и референсной последовательностью определяется как процент аминокислотных остатков в полипептидной последовательности, которые являются идентичными аминокислотным остатком в референсной последовательности, после выравнивания последовательностей и вставки пробелов, в случае необходимости, для достижения максимального процента идентичности последовательности. Выравнивание с целью определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые являются хорошо известными, например, путем использования общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, MEGALIGN (DNASTAR), CLUSTALW, CLUSTAL OMEGA или MUSCLE. Специалист в данной области может определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по все длине последовательностей, подвергаемых сравнению.
[0068] "Консервативная замена" или "консервативная аминокислотная замена" относится к замене аминокислоты на химически или функционально аналогичную аминокислоту. Таблицы консервативных замен, в которых предлагаются аналогичные аминокислоты, являются хорошо известными. Например, группы аминокислот, приведенные в таблицах 2-4 рассматриваются, в некоторых вариантах осуществления, в качестве консервативных замен друг для друга.
Таблица 2. Выбранные группы аминокислот, которые рассматриваются в качестве консервативных замен друг для друга в конкретных вариантах осуществления
Таблица 3. Дополнительные выбранные группы аминокислот, которые рассматриваются в качестве консервативных замен друг для друга в конкретных вариантах осуществления
Таблица 4. Дополнительные выбранные группы аминокислот, которые рассматриваются в качестве консервативных замен друг для друга в конкретных вариантах осуществления
[0069] Дополнительные консервативные замены можно найти, например, в монографии Creighton, Proteins: Structures and Molecular Properties 2nd ed. (1993) W.H. Freeman & Co., New York, NY. ABP, генерированный путем одной или более консервативных замен аминокислотных остатков в исходном ABP, называют "консервативно модифицированным вариантом".
[0070] Термин "аминокислота" относится к двадцати базовым природным аминокислотам. Природные аминокислоты включают аланин (Ala; A), аргинин (Arg; R), аспарагин (Asn; N), аспарагиновую кислоту (Asp; D), цистеин (Cys; C); глутаминовую кислоту (Glu; E), глутамин (Gin; Q), глицин (Gly; G); гистидин (His; H), изолейцин (Ile; I), лейцин (Leu; L), лизин (Lys; K), метионин (Met; M), фенилаланин (Phe; F), пралин (Pro; P), серин (Ser; S), треонин (Tur; T), триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V).
[0071] Используемый в изобретении термин "вектор" относится к молекуле нуклеиновой кислоты, способной репродуцировать другую нуклеиновую кислоту, с которой она связана. Термин включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он был введен. Конкретные векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называются в изобретении "экспрессионными векторами".
[0072] Термины "клетка хозяина", "линия клеток хозяина" и "культура клеток хозяина" используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, и к потомству таких клеток. Клетки хозяина включают "трансформанты" (или "трансформированные клетки") и "трансфектанты" (или "трансфицированные клетки"), каждая из которых включает первичную трансформированную или трансфицированную клетку и произведенное из нее потомство. Такое потомство может не быть полностью идентичным нуклеиновой кислоте, содержащейся в исходной клетке, и может содержать мутации.
[0073] Термин "лечение" (и его варианты, такие как "лечить" или "проведение лечения") относится к клиническому воздействию, целью которого является стремление изменить ход естественного развития заболевания или состояния у субъекта, нуждающегося в этом. Лечение может быть проведено как с целью профилактики, так и в процессе развития клинической патологии. Желательные эффекты лечения включают предотвращение возникновения или повторного проявления заболевания, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, уменьшение скорости развития болезни, улучшение или временное облегчение болезненного состояния и ремиссию или улучшение прогноза.
[0074] Используемый в изобретении термин "терапевтически эффективное количество" или "эффективное количество" относится к количеству предлагаемых в изобретении ABP или фармацевтической композиции, которое при введении его субъекту является эффективным для лечения заболевания или расстройства.
[0075] Используемый в изобретении термин "субъект" обозначает млекопитающего субъекта. Примеры субъектов включают людей, обезьян, собак, кошек, мышей, крыс, коров, лошадей, верблюдов, коз, кроликов и овец. В конкретных вариантах осуществления, субъектом является человек. В некоторых вариантах осуществления субъект имеет заболевание или состояние, которое может быть подвергнуто лечению с помощью предлагаемого в изобретении ABP. В некоторых аспектах, заболевание или состояние представляет собой рак. В некоторых аспектах, заболевание или состояние представляет собой вирусную инфекцию.
[0076] Термин "вложенная в упаковку инструкция по применения лекарственного препарата" используют для обозначения инструкций, традиционно вкладываемых в продаваемые упаковки терапевтических или диагностических продуктов (например, в наборы), которые содержат информацию по показаниям, применению, дозе, введению, комбинированной терапии, противопоказаниям и/или предупреждениям, касающихся применения таких терапевтических или диагностических продуктов.
[0077] Используемый в изобретении термин "цитотоксическое средство" относится к веществу, которое ингибирует или препятствует осуществлению функции клеток и/или вызывает гибель клеток или их деструкцию.
[0078] "Химиотерапевтическое средство" относится к химическому соединению, применяемому при лечении рака. Химиотерапевтические средства включают "антигормональные средства" или "эндокринные терапевтические препараты", действие которых направлено на регуляцию, уменьшение, блокирование или ингибирование воздействий гормонов, которые могут способствовать развитию рака.
[0079] Термин "цитостатическое средство" относится к соединению или композиции, которые задерживают рост клеток или in vitro, или in vivo. В некоторых вариантах осуществления, цитостатическое средство представляет собой средство, которое снижает процент клеток в S-фазе. В некоторых вариантах осуществления, цитостатическое средство снижает процент клеток в S-фазе по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 60%, или по меньшей мере приблизительно на 80%.
[0080] Термин "опухоль" относится к росту и пролиферации всех неопластических клеток, как злокачественных, так и доброкачественных, и всех предраковых и раковых клеток и тканей. Термины "рак", "раковый", "нарушение пролиферации клеток", "пролиферативное нарушение" и "опухоль" не являются взаимоисключающими при упоминании в изобретении. Термины "нарушение пролиферации клеток" и "пролиферативное нарушение" относятся к нарушениям, которые связаны в некоторой степени с аномальной пролиферацией клеток. В некоторых вариантах осуществления, нарушение пролиферации клеток представляет собой рак. В некоторых аспектах, опухоль представляет собой солидную опухоль. В некоторых аспектах, опухоль представляет собой гематологическую злокачественную опухоль.
[0081] Термин "фармацевтическая композиция" относится к препарату, который находится в такой форме, которая способствует эффективному проявлению биологического действия активного ингредиента, содержащегося в нем, при лечении субъекта, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта в количествах, присутствующих в фармацевтической композиции.
[0082] Термины "модулировать" и "модулирование" относятся к уменьшению или ингибированию или, наоборот, активации или увеличению указанного переменного фактора.
[0083] Термины "увеличивать" и "активировать" относятся к увеличению указанного переменного фактора на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, в 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 20 раз, 50 раз, 100 раз или более.
[0084] Термины "уменьшать" и "ингибировать" относятся к уменьшению указанного переменного фактора на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, в 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 20 раз, 50 раз, 100 раз или более.
[0085] Термин "агонизировать" относится к активации сигнального пути рецептора с целью индуцирования биологического ответа, связанного с активацией рецептора. "Агонист" представляет собой соединение, которое связывает и агонизирует рецептор.
[0086] Термин "антагонизировать" относится к ингибированию сигнального пути рецептора с целью ингибирования биологического ответа, связанного с активацией рецептора. "Антагонист" представляет собой соединение, которое связывает и антагонизирует рецептор.
[0087] Термин "эффекторная T-клетка" включает Т-хелперы (то есть, CD4+) и цитотоксические (то есть, CD8+) T-клетки. CD4+ эффекторные T-клетки способствуют развитию ряда иммунологических процессов, включающих созревание B-клеток в плазмоциты и B-клетки памяти и активацию цитотоксических T-клеток и макрофагов. CD8+ эффекторные T-клетки разрушают клетки, зараженные вирусом, и опухолевые клетки. Для получения дополнительной информации по эффекторным T-клеткам, смотрите публикацию Seder and Ahmed, Nature Immunol., 2003, 4:835-842, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0088] Термин "регуляторная T-клетка" включает клетки, которые регулируют иммунологическую толерантность, например, путем супрессирования эффекторных T-клеток. В некоторых аспектах, регуляторная T-клетка имеет CD4+CD25+Foxp3+ фенотип. В некоторых аспектах, регуляторная T-клетка имеет CD8+CD25+ фенотип. Для получения дополнительной информации по регуляторным T-клеткам, экспрессирующим TIGIT, смотрите публикацию Nocentini et al., Br. J Pharmacol., 2012, 165:2089-2099, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0089] Термин "дендритная клетка" относится к "профессиональным" антигенпредставляющим клеткам, способным активировать наивные T-клетки и стимулировать рост и дифференцировку B-клеток.
2. TIGIT антигенсвязывающие белки
2.1. TIGIT связывание и клетки-мишени
[0090] В изобретении предлагаются ABPs, которые специфически связываются с TIGIT. В некоторых аспектах, TIGIT представляет собой hTIGIT (SEQ ID NO: 1). В некоторых аспектах, TIGIT представляет cTIGIT (SEQ ID NO: 2). В некоторых аспектах, TIGIT представляет mTIGIT с последовательностью, представленной в SEQ ID NO: 3. В некоторых аспектах, TIGIT представляет собой mTIGIT с последовательностью, представленной в SEQ ID NO: 138.
[0091] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1), cTIGIT (SEQ ID NO: 2) и mTIGIT последовательности SEQ ID NO: 3. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1), cTIGIT (SEQ ID NO: 2) и mTIGIT последовательности SEQ ID NO: 138. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1) и cTIGIT (SEQ ID NO: 2). В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1). В некоторых вариантах осуществления, предлагаемые в изобретении ABPs не связывают mTIGIT последовательности SEQ ID NO: 3. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs не связывают mTIGIT последовательности SEQ ID NO: 138.
[0092] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с внеклеточным доменом TIGIT.
[0093] В некоторых вариантах осуществления, предлагаемый в изобретении ABP представляет собой антитело. В некоторых вариантах осуществления, предлагаемый в изобретении ABP представляет собой фрагмент антитела. В некоторых вариантах осуществления, предлагаемый в изобретении ABP представляет собой альтернативный остов.
[0094] TIGIT может экспрессироваться на поверхности любой подходящей клетки-мишени. В некоторых вариантах осуществления, клетка-мишень представляет собой T-клетку. В некоторых вариантах осуществления, клетка-мишень представляет собой эффекторную T- клетку. В некоторых вариантах осуществления, клетка-мишень представляет собой регуляторную T-клетку. В некоторых вариантах осуществления, клетка-мишень представляет собой естественную клетку-киллер (NK). В некоторых вариантах осуществления, клетка-мишень представляет собой естественную T-клетку-киллер (NKT).
[0095] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают молекулу иммуноглобулина. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из молекулы иммуноглобулина. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из молекулы иммуноглобулина. В некоторых аспектах, молекула иммуноглобулина включает антитело. В некоторых аспектах, молекула иммуноглобулина состоит из антитела. В некоторых аспектах, молекула иммуноглобулина состоит в основном из антитела.
[0096] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают легкую цепь. В некоторых аспектах, легкая цепь представляет собой каппа легкую цепь. В некоторых аспектах, легкая цепь представляет собой лямбда легкую цепь.
[0097] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают каппа легкую цепь, содержащую SEQ ID NO: 126.
[0098] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают тяжелую цепь. В некоторых аспектах, тяжелая цепь представляет собой IgA. В некоторых аспектах, тяжелая цепь представляет собой IgD. В некоторых аспектах, тяжелая цепь представляет собой IgE. В некоторых аспектах, тяжелая цепь представляет собой IgG. В некоторых аспектах, тяжелая цепь представляет собой IgM. В некоторых аспектах, тяжелая цепь представляет собой IgG1. В некоторых аспектах, тяжелая цепь представляет собой IgG2. В некоторых аспектах, тяжелая цепь представляет собой IgG3. В некоторых аспектах, тяжелая цепь представляет собой IgG4. В некоторых аспектах, тяжелая цепь представляет собой IgA1. В некоторых аспектах, тяжелая цепь представляет собой IgA2.
[0099] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают IgG4 тяжелая цепь, содержащую последовательность, выбранную из SEQ ID NO: 55 и SEQ ID NO: 56. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают IgG1 тяжелую цепь, содержащую последовательность, выбранную из SEQ ID NO: 57 и SEQ ID NO: 125.
[0100] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают фрагмент антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из фрагмента антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из фрагмента антитела. В некоторых аспектах, фрагмент антитела представляет собой Fv фрагмент. В некоторых аспектах, фрагмент антитела представляет собой Fab фрагмент. В некоторых аспектах, фрагмент антитела представляет собой F(ab')2 фрагмент. В некоторых аспектах, фрагмент антитела представляет собой Fab' фрагмент. В некоторых аспектах, фрагмент антитела представляет собой scFv (sFv) фрагмент. В некоторых аспектах, фрагмент антитела представляет собой scFv-Fc фрагмент. В некоторых аспектах, фрагмент антитела представляет собой фрагмент однодоменного антитела.
[0101] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела получают из предлагаемого в изобретении иллюстративного антитела. В некоторых вариантах осуществления, предлагаемые в изобретении фрагменты антител не получают из предлагаемого в изобретении иллюстративного антитела, и они могут, например, быть выделены с самого начала предлагаемыми в изобретении методами получения фрагментов антител.
[0102] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает hTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает cTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает mTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает hTIGIT и cTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает hTIGIT и mTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает cTIGIT и mTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела специфически связывает hTIGIT, cTIGIT и mTIGIT.
[0103] В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении hTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении cTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении обоих hTIGIT и cTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении обоих hTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении обоих cTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела. В некоторых вариантах осуществления, фрагмент антитела, полученный из предлагаемого в изобретении антитела, сохраняет аффинность, измеряемую величиной KD, в отношении всех трех hTIGIT, cTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого антитела.
[0104] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела сохраняет способность антагонизировать TIGIT, измеряемую с помощью одного или более метода исследования, или описанные в изобретении биологические эффекты. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела сохраняет способность предотвращать взаимодействие TIGIT с одним или более из описанных в изобретении его лигандов.
[0105] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела конкурирует за связывание TIGIT с антителом, выбранным из MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB7, MAB8, MAB9, MAB10, MAB11, MAB12, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 или MAB21, каждое из которых приведено в таблице 5 этого изобретения.
[0106] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела ингибирует связывание CD155 с TIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела ингибирует связывание CD112 с TIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела ингибирует ассоциацию CD226 с TIGIT.
[0107] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела активирует эффекторную Т-клетку или естественную клетку-киллер (NK). В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела снижает число регуляторных Т-клеток в ткани или в кровотоке. В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела ингибирует супрессию эффекторной Т-клетки регуляторной Т-клеткой.
[0108] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела не связывается специфически ни с одним из PVRL1, PVRL2, PVRL3 или PVRL4.
[0109] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела связывает TIGIT грызуна (mTIGIT; SEQ ID NO: 3) с аффинностью ниже (на что указывает более высокая величина KD), чем аффинность фрагмента антитела в отношении hTIGIT, или не связывает mTIGIT.
[0110] В некоторых вариантах осуществления, предлагаемый в изобретении фрагмент антитела связывает один и тот же эпитоп TIGIT, что и такое антитело.
[0111] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs представляют собой моноклональные антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs представляют собой поликлональные антитела.
[0112] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают химерное антитело. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из химерного антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из химерного антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают гуманизированное антитело. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из гуманизированного антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из гуманизированного антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают человеческое антитело. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из человеческого антитела. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из человеческого антитела.
[0113] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs представляют собой ABPs с созревшей аффинностью. В некоторых аспектах, ABPs с созревшей аффинностью представляют собой ABPs с созревшей аффинностью, полученные из предлагаемого в изобретении иллюстративного ABP.
[0114] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs включают альтернативный остов. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят из альтернативного остова. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs состоят в основном из альтернативного остова. Может быть использован любой подходящей альтернативный остов. В некоторых аспектах, альтернативный остов выбирают из аднектина™, iMab, антикалина®, EETI-II/AGRP, домена Куница, тиоредоксина пептидного аптамера, Affibody®, DARPin, аффилина, тетранектина, финомера и авимера.
[0115] В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание TIGIT с одним или более лигандами TIGIT. В некоторых аспектах, лиганд TIGIT выбирают из одного или более рецепторов полиовируса (PVR; CD155) и нектин-2 (CD112, PVRL2). В некоторых аспектах, ABP ингибирует связывание TIGIT с одним или более лигандами TIGIT по меньшей мере приблизительно на 50%. В некоторых аспектах, ABP ингибирует связывание TIGIT с одним или более лигандами TIGIT по меньшей мере приблизительно на 75%. В некоторых аспектах, ABP ингибирует связывание TIGIT с одним или более лигандами TIGIT по меньшей мере приблизительно на 90%. В некоторых аспектах, ABP ингибирует связывание TIGIT с одним или более лигандами TIGIT по меньшей мере приблизительно на 95%.
[0116] В некоторых вариантах осуществления, ABP по изобретению представляет собой ABP, который конкурирует с предлагаемым в изобретении иллюстративным ABP. В некоторых аспектах, ABP, который конкурирует с предлагаемым в изобретении иллюстративным ABP, связывает один и тот же эпитоп, что и предлагаемый в изобретении иллюстративный ABP.
[0117] В некоторых вариантах осуществления, предлагаемый в изобретении ABP не связывает PVRL4.
[0118] Известно, что при экспрессировании антитела в клетках, антитело модифицируется после трансляции. Примеры посттрансляционной модификации включают расщепление лизина на C-конце тяжелой цепи карбоксипептидазой, модификацию глутамина или глутаминовой кислоты на N-конце тяжелой цепи и легкой цепи в пироглутаминовую кислоту путем пироглутамилирования, гликозилирование, окисление, деамидирование и гликирование, и известно, что такие посттрансляционные модификации возникают в различных антителах (смотрите публикацию Journal of Pharmaceutical Sciences, 2008, Vol. 97, p. 2426-2447, содержание которой включено в настоящее изобретение путем ссылки на нее). В некоторых вариантах осуществления, ABP по изобретению представляет собой антитело или его антигенсвязывающий фрагмент, которые были подвергнуты посттрансляционной модификации. Примеры антитела или его антигенсвязывающего фрагмента, которые были подвергнуты посттрансляционной модификации, включают антитело или его антигенсвязывающие фрагменты, которые были подвергнуты пироглутамилированию на N-конце вариабельной области тяжелой цепи и/или делеции лизина на С-конце тяжелой цепи. Известно, что такая посттрансляционная модификация, обусловленная пироглутамилированием на N-конце и делецией лизина на С-конце, никак не влияет на активность антитела или его фрагмента (смотрите публикацию Analytical Biochemistry, 2006, Vol. 348, p. 24-39, содержание которой включено в настоящее изобретение путем ссылки на нее).
2.2. Последовательности TIGIT антигенсвязывающих белков
2.2.1. VH домены
[0119] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, выбранную из SEQ ID NOs: 4-24. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 4. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 5. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 6. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 7. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 8. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 9. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 1O. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 1 l. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 12. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 13. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 14. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 15. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 16. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 17. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 18. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 19. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 20. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 21. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 22. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 23. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 24.
[0120] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, имеющую по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% идентичность с иллюстративной VH последовательностью, представленной в SEQ ID NOs: 4-24. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, представленную в SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
2.2.2. VL домены
[0121] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность, выбранную из SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность SEQ ID NO: 28.
[0122] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность имеющую по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% идентичность с иллюстративной VL последовательностью, представленной в SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL последовательность, представленную в SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
2.2.3. VH - VL комбинации
[0123] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, выбранную из SEQ ID NOs: 4-24, и VL последовательность, выбранную из SEQ ID NOs: 25-28.
[0124] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 4 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 6 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 7 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 8 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 9 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 10 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 11 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 12 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 14 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 15 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 16 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 17 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 19 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 20 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 21 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 22 и VL последовательность SEQ ID NO: 28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 23 и VL последовательность SEQ ID NO: 28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 28.
[0125] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 4 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 4 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 4 и VL последовательность SEQ ID NO: 28.
[0126] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 28.
[0127] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 6 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 6 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 6 и VL последовательность SEQ ID NO: 28.
[0128] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 7 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 7 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 7 и VL последовательность SEQ ID NO: 28.
[0129] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 8 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 8 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 8 и VL последовательность SEQ ID NO: 28.
[0130] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 9 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 9 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 9 и VL последовательность SEQ ID NO: 28.
[0131] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 10 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 10 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 10 и VL последовательность SEQ ID NO: 28.
[0132] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 11 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 11 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 11 и VL последовательность SEQ ID NO: 28.
[0133] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 12 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 12 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 12 и VL последовательность SEQ ID NO: 28.
[0134] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 28.
[0135] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 14 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 14 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 14 и VL последовательность SEQ ID NO: 28.
[0136] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 15 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 15 и VL последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 15 и VL последовательность SEQ ID NO: 28.
[0137] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 16 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 16 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 16 и VL последовательность SEQ ID NO: 28.
[0138] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 17 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 17 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 17 и VL последовательность SEQ ID NO: 28.
[0139] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 28.
[0140] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 19 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 19 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 19 и VL последовательность SEQ ID NO: 28.
[0141] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 20 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 20 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 20 и VL последовательность SEQ ID NO: 28.
[0142] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 21 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 21 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 21 и VL последовательность SEQ ID NO: 28.
[0143] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 22 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 22 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 22 и VL последовательность SEQ ID NO: 27.
[0144] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 23 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 23 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 23 и VL последовательность SEQ ID NO: 27.
[0145] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 25. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 26. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 27.
[0146] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, имеющую по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% идентичность с иллюстративной VH последовательностью, представленной в SEQ ID NOs: 4-24, и VL последовательность, имеющую по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% идентичность с иллюстративной VL последовательностью, представленной в SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH последовательность, представленную в SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25, и VL последовательность, представленную в SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
2.2.4. CDRs
[0147] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от одной до трех CDRs VH домена, выбранного из SEQ ID NOs: 4-24. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от двух до трех CDRs VH домена, выбранного из SEQ ID NOs: 4-24. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает три CDRs VH домена, выбранного из SEQ ID NOs: 4-24. В некоторых аспектах, CDRs представляют собой Kabat CDRs. В некоторых аспектах, CDRs представляют собой Chothia CDRs. В некоторых аспектах, CDRs представляют собой IMGT CDRs.
[0148] В некоторых вариантах осуществления, CDRs представляют собой CDRs, имеющие по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичности с CDR-H1, CDR-H2 или CDR-H3 последовательностей SEQ ID NOs: 4-24. В некоторых вариантах осуществления, CDR-H1 представляет собой CDR-H1 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых вариантах осуществления, CDR-H2 представляет собой CDR-H2 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых вариантах осуществления, CDR-H3 представляет собой CDR-H3 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0149] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от одной до трех CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от двух до трех CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает три CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых аспектах, CDRs представляют собой Kabat CDRs. В некоторых аспектах, CDRs представляют собой Chothia CDRs. В некоторых аспектах, CDRs представляют собой IMGT CDRs.
[0150] В некоторых вариантах осуществления, CDRs представляют собой CDRs, имеющие по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L1, CDR-L2 или CDR-L3 последовательностей SEQ ID NOs: 25-28. В некоторых вариантах осуществления, CDR-L1 представляет собой CDR-L1 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5 или 6. В некоторых вариантах осуществления, CDR-L2 представляет собой CDR-L2 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3 или 4. В некоторых вариантах осуществления, CDR-L3 представляет собой CDR-L3 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0151] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от одной до трех CDRs VH домена, выбранного из SEQ ID NOs: 4-24, и от одной до трех CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает от двух до трех CDRs VH домена, выбранного из SEQ ID NOs: 4-24, и от двух до трех CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает три CDRs VH домена, выбранного из SEQ ID NOs: 4-24, и три CDRs VL домена, выбранного из SEQ ID NOs: 25-28. В некоторых аспектах, CDRs представляют собой Kabat CDRs. В некоторых аспектах, CDRs представляют собой Chothia CDRs. В некоторых аспектах, CDRs представляют собой IMGT CDRs.
[0152] В некоторых вариантах осуществления, CDRs представляют собой CDRs, имеющие по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H1, CDR-H2 или CDR-H3 последовательностей SEQ ID NOs: 4-24, и по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L1, CDR-L2 или CDR-L3 последовательностей SEQ ID NOs: 25-28.
В некоторых вариантах осуществления, CDR-H1 представляет собой CDR-H1 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5; CDR-H2 представляет собой CDR-H2 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; CDR-H3 представляет собой CDR-H3 VH домена, выбранного из SEQ ID NOs: 4-24, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; CDR-L1 представляет собой CDR-L1 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5 или 6; CDR-L2 представляет собой CDR-L2 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3 или 4; и CDR-L3 представляет собой CDR-L3 VL домена, выбранного из SEQ ID NOs: 25-28, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0153] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3, выбранную из SEQ ID NOs: 29-35. В некоторых аспектах, CDR-H3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H3 последовательностей SEQ ID NOs: 29-35. В некоторых аспектах, CDR-H3 представляет собой CDR-H3 в соответствии с системой нумерации IMGT. В некоторых вариантах осуществления, CDR-H3 представляет собой CDR-H3, выбранный из SEQ ID NOs: 29-35, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0154] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H2, выбранную из SEQ ID NOs: 36-47. В некоторых аспектах, CDR-H2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H2 последовательностей SEQ ID NOs: 36-47. В некоторых аспектах, CDR-H2 представляет собой CDR-H2 в соответствии с системой нумерации Kabat. В некоторых вариантах осуществления, CDR-H2 представляет собой CDR-H2, выбранную из SEQ ID NOs: 36-47, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0155] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62. В некоторых аспектах, CDR-H1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H1 последовательностей SEQ ID NOs: 48-54 или 58-62. В некоторых аспектах, CDR-H1 представляет собой CDR-H1, который перекрывает CDR-H1, определяемую обеими системами нумерации Chothia и Kabat. В некоторых вариантах осуществления, CDR-H1 представляет собой CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0156] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3, выбранную из SEQ ID NOs: 29-35, и CDR-H2, выбранную из SEQ ID NOs: 36-47. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3, выбранную из SEQ ID NOs: 29-35, CDR-H2, выбранную из SEQ ID NOs: 36-47, и CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62. В некоторых вариантах осуществления, CDR-H3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H3 последовательностей SEQ ID NOs: 29-35, CDR-H2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H2 последовательностей SEQ ID NOs: 36-47, и CDR-H1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H1 последовательностей SEQ ID NOs: 48-54 или 58-62. В некоторых вариантах осуществления, CDR-H3 представляет собой CDR-H3, выбранную из SEQ ID NOs: 29-35, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; CDR-H2 представляет собой DR-H2, выбранную из SEQ ID NOs: 36-47, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; и CDR-H1 представляет собой CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0157] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-L3, выбранную из SEQ ID NOs: 63-66. В некоторых аспектах, CDR-L3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L3 последовательностей SEQ ID NOs: 63-66. В некоторых аспектах, CDR-L3 представляет собой CDR-L3 в соответствии с системами нумерации Kabat, Chothia и IMGT. В некоторых вариантах осуществления, CDR-L3 представляет собой CDR-L3, выбранную из SEQ ID NOs: 63-66, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0158] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-L2, выбранную из SEQ ID NOs: 67-69. В некоторых аспектах, CDR-L2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L2 последовательностей SEQ ID NOs: 67-69. В некоторых аспектах, CDR-L2 представляет собой CDR-L2 в соответствии с системами нумерации Kabat и Chothia. В некоторых вариантах осуществления, CDR-L2 представляет собой CDR-L2, выбранную из SEQ ID NOs: 67-69, с числом аминокислотных замен, достигающих 1, 2, 3, или 4. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0159] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-L1, выбранную из SEQ ID NOs: 70-72. В некоторых аспектах, CDR-L1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L1 последовательностей SEQ ID NOs: 70-72. В некоторых аспектах, CDR-L1 представляет собой CDR-L1 в соответствии с системами нумерации Kabat и Chothia. В некоторых вариантах осуществления, CDR-L1 представляет собой CDR-L1, выбранную из SEQ ID NOs: 70-72, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5 или 6. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0160] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-L3, выбранную из SEQ ID NOs: 63-66, и CDR-L2, выбранную из SEQ ID NOs: 67-69. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-L3, выбранную из SEQ ID NOs: 63-66, CDR-L2, выбранную из SEQ ID NOs: 67-69, и CDR-L1, выбранную из SEQ ID NOs: 70-72. В некоторых вариантах осуществления, CDR-L3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L3 последовательностей SEQ ID NOs: 63-66, CDR-L2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L2 последовательностей SEQ ID NOs: 67-69, и CDR-L1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L1 последовательностей SEQ ID NOs: 70-72. В некоторых вариантах осуществления, CDR-L3 представляет собой CDR-L3, выбранную из SEQ ID NOs: 63-66, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5; CDR-L2 представляет собой CDR-L2, выбранную из SEQ ID NOs: 67-69, с числом аминокислотных замен, достигающих 1, 2, 3, или 4; и CDR-L1 представляет собой CDR-L1, выбранную из SEQ ID NOs: 70-72, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5 или 6. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0161] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3, выбранную из SEQ ID NOs: 29-35, CDR-H2, выбранную из SEQ ID NOs: 36-47, CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62, CDR-L3, выбранную из SEQ ID NOs: 63-66, CDR-L2, выбранную из SEQ ID NOs: 67-69, и CDR-L1, выбранную из SEQ ID NOs: 70-72. В некоторых вариантах осуществления, CDR-H3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H3 последовательностей SEQ ID NOs: 29-35, CDR-H2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H2 последовательностью SEQ ID NOs: 36-47, CDR-H1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-H1 последовательностей SEQ ID NOs: 48-54 или 58-62, CDR-L3 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L3 последовательностей SEQ ID NOs: 63-66, CDR-L2 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L2 последовательностей SEQ ID NOs: 67-69, и CDR-L1 имеет по меньшей мере приблизительно 50%, 75%, 80%, 85%, 90% или 95% идентичность с CDR-L1 последовательностей SEQ ID NOs: 70-72. В некоторых вариантах осуществления, CDR-H3 представляет собой CDR-H3, выбранную из SEQ ID NOs: 29-35, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; CDR-H2 представляет собой DR-H2, выбранную из SEQ ID NOs: 36-47, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5, 6, 7 или 8; CDR-H1 представляет собой CDR-H1, выбранную из SEQ ID NOs: 48-54 или 58-62, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5; CDR-L3 представляет собой CDR-L3, выбранную из SEQ ID NOs: 63-66, с числом аминокислотных замен, достигающих 1, 2, 3, 4 или 5; CDR-L2 представляет собой CDR-L2, выбранную из SEQ ID NOs: 67-69, с числом аминокислотных замен, достигающих 1, 2, 3, или 4; и CDR-L1 представляет собой CDR-L1, выбранную из SEQ ID NOs: 70-72, с числом аминокислотных замен, достигающих 1, 2, 3, 4, 5 или 6. В некоторых аспектах, аминокислотные замены представляют собой консервативные аминокислотные замены. В некоторых вариантах осуществления, описанные в этом разделе ABPs называют в изобретении "вариантами". В некоторых вариантах осуществления, такие варианты получают из предлагаемой в изобретении последовательности, например, путем созревания аффинности, сайтнаправленным мутагенезом, случайным мутагенезом или любым другим известным или описанным в изобретении методом. В некоторых вариантах осуществления, такие варианты не получают из предлагаемой в изобретении последовательности, и они могут быть выделены, например, с самого начала с помощью методов, предложенных в изобретении для получения ABPs.
[0162] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 29, CDR-H2 последовательности SEQ ID NO: 36, CDR-H1 последовательности SEQ ID NO: 48, CDR-L3 последовательности SEQ ID NO: 63, CDR-L2 последовательности SEQ ID NO: 67 и CDR-L1 последовательности SEQ ID NO: 70.
[0163] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 29, CDR-H2 последовательности SEQ ID NO: 37, CDR-H1 последовательности SEQ ID NO: 49, CDR-L3 последовательности SEQ ID NO: 63, CDR-L2 последовательности SEQ ID NO: 67 и CDR-L1 последовательности SEQ ID NO: 70.
[0164] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 29, CDR-H2 последовательности SEQ ID NO: 37, CDR-H1 последовательности SEQ ID NO: 50, CDR-L3 последовательности SEQ ID NO: 63, CDR-L2 последовательности SEQ ID NO: 67 и CDR-L1 последовательности SEQ ID NO: 70.
[0165] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 30, CDR-H2 последовательности SEQ ID NO: 37, CDR-H1 последовательности SEQ ID NO: 50, CDR-L3 последовательности SEQ ID NO: 63, CDR-L2 последовательности SEQ ID NO: 67 и CDR-L1 последовательности SEQ ID NO: 70.
[0166] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 29, CDR-H2 последовательности SEQ ID NO: 38, CDR-H1 последовательности SEQ ID NO: 50, CDR-L3 последовательности SEQ ID NO: 63, CDR-L2 последовательности SEQ ID NO: 67 и CDR-L1 последовательности SEQ ID NO: 70.
[0167] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 31, CDR-H2 последовательности SEQ ID NO: 39, CDR-H1 последовательности SEQ ID NO: 51, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0168] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 31, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 52, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0169] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 31, CDR-H2 последовательности SEQ ID NO: 41, CDR-H1 последовательности SEQ ID NO: 53, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0170] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 31, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0171] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 32, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0172] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 32, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0173] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 32, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71.
[0174] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 33, CDR-H2 последовательности SEQ ID NO: 42, CDR-H1 последовательности SEQ ID NO: 58, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0175] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 33, CDR-H2 последовательности SEQ ID NO: 42, CDR-H1 последовательности SEQ ID NO: 59, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0176] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 33, CDR-H2 последовательности SEQ ID NO: 43, CDR-H1 последовательности SEQ ID NO: 60, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0177] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 34, CDR-H2 последовательности SEQ ID NO: 43, CDR-H1 последовательности SEQ ID NO: 60, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0178] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 34, CDR-H2 последовательности SEQ ID NO: 44, CDR-H1 последовательности SEQ ID NO: 61, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0179] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 33, CDR-H2 последовательности SEQ ID NO: 44, CDR-H1 последовательности SEQ ID NO: 59, CDR-L3 последовательности SEQ ID NO: 65, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0180] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 35, CDR-H2 последовательности SEQ ID NO: 45, CDR-H1 последовательности SEQ ID NO: 62, CDR-L3 последовательности SEQ ID NO: 66, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0181] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 35, CDR-H2 последовательности SEQ ID NO: 46, CDR-H1 последовательности SEQ ID NO: 62, CDR-L3 последовательности SEQ ID NO: 66, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
[0182] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает CDR-H3 последовательности SEQ ID NO: 35, CDR-H2 последовательности SEQ ID NO: 47, CDR-H1 последовательности SEQ ID NO: 62, CDR-L3 последовательности SEQ ID NO: 66, CDR-L2 последовательности SEQ ID NO: 69 и CDR-L1 последовательности SEQ ID NO: 72.
2.2.5. Тяжелые цепи и легкие цепи
[0183] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VH, выбранную из VH последовательностей SEQ ID NO: 4-24 (или описанный в изобретении вариант), и константную область, выбранную из SEQ ID NOs: 55-57 или 125. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает VL, выбранную из VL последовательностей SEQ ID NO: 25-28 (или описанный в изобретении вариант), и константную область последовательности SEQ ID NO: 126.
[0184] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 79. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 80. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 79 и легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 80 и легкую цепь последовательности SEQ ID NO: 81.
[0185] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 82. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 83. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 82 и легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 83 и легкую цепь последовательности SEQ ID NO: 81.
[0186] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 84. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 85. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 84 и легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 85 и легкую цепь последовательности SEQ ID NO: 81.
[0187] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 86. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 87. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 86 и легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 87 и легкую цепь последовательности SEQ ID NO: 81.
[0188] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 88. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 89. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 88 и легкую цепь последовательности SEQ ID NO: 81. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 89 и легкую цепь последовательности SEQ ID NO: 81.
[0189] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 90. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 91. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 90 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 91 и легкую цепь последовательности SEQ ID NO: 92.
[0190] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 93. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 94. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 93 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 94 и легкую цепь последовательности SEQ ID NO: 92.
[0191] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 95. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 96. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 95 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 96 и легкую цепь последовательности SEQ ID NO: 92.
[0192] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 97. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 98. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 97 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 98 и легкую цепь последовательности SEQ ID NO: 92.
[0193] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 99. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 100. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 99 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 100 и легкую цепь последовательности SEQ ID NO: 92.
[0194] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 101. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 102. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 101 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 102 и легкую цепь последовательности SEQ ID NO: 92.
[0195] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 103. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 104. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 103 и легкую цепь последовательности SEQ ID NO: 92. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 104 и легкую цепь последовательности SEQ ID NO: 92.
[0196] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 105. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 106. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 105 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 106 и легкую цепь последовательности SEQ ID NO: 107.
[0197] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 108. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 109. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 108 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 109 и легкую цепь последовательности SEQ ID NO: 107.
[0198] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 110. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 111. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 110 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 111 и легкую цепь последовательности SEQ ID NO: 107.
[0199] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 112. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 113. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 112 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 113 и легкую цепь последовательности SEQ ID NO: 107.
[0200] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 114. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 115. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 114 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 115 и легкую цепь последовательности SEQ ID NO: 107.
[0201] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 116. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 117. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 116 и легкую цепь последовательности SEQ ID NO: 107. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 117 и легкую цепь последовательности SEQ ID NO: 107.
[0202] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 118. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 119. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает легкую цепь последовательности SEQ ID NO: 120. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 118 и легкую цепь последовательности SEQ ID NO: 120. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 119 и легкую цепь последовательности SEQ ID NO: 120.
[0203] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 121. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 122. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 121 и легкую цепь последовательности SEQ ID NO: 120. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 122 и легкую цепь последовательности SEQ ID NO: 120.
[0204] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 123. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 124. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 123 и легкую цепь последовательности SEQ ID NO: 120. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает тяжелую цепь последовательности SEQ ID NO: 124 и легкую цепь последовательности SEQ ID NO: 120.
2.2.6. Консенсусные последовательности
[0205] В некоторых вариантах осуществления, в изобретении предлагается первое семейство ABPs, где ABP такого семейства включает следующие шесть CDR последовательностей: (a) CDR-H3, имеющую последовательность A-R-D-G-V-L-X1-L-N-K-R-S-F-D-I, где X1 представляет собой A или T (SEQ ID NO: 128); (b) CDR-H2, имеющую последовательность S-I-Y-Y-S-G-X2-T-Y-Y-N-P-S-L-K-S, где X2 представляет собой S, Q или G (SEQ ID NO: 129); (c) CDR-H1, имеющую последовательность G-S-I-X3-S-G-X4-Y-Y-W-G, где X3 представляет собой E или A, и X4 представляет собой L, V или S (SEQ ID NO: 130); (d) CDR-L3, имеющую последовательность QQHTVRPPLT (SEQ ID NO: 64); (e) CDR-L2, имеющую последовательность GASSRAT (SEQ ID NO: 68); и (f) CDR-L1, имеющую последовательность RASQSVSSSYLA (SEQ ID NO: 71). В некоторых вариантах осуществления, в изобретении предлагается ABP, принадлежащий к такому первому семейству.
[0206] В некоторых вариантах осуществления, в изобретении предлагается второе семейство ABPs, где ABP из такого семейства включает следующих шесть CDR последовательностей: (a) CDR-H3, имеющую последовательность A-R-D-A-N-Y-Y-G-X1-A-W-A-F-D-P, где X1 представляет собой S или G (SEQ ID NO: 131); (b) CDR-H2, имеющую последовательность S-I-Y-Y-S-G-X2-T-F-Y-N-P-S-L-K-X3, где X2 представляет собой S или A, и X3 представляет собой S или G (SEQ ID NO: 132); (c) CDR-H1, имеющую последовательность G-S-I-X4-S-X5-X6-X7-Y-W-G, где X4 представляет собой S или T, X5 представляет собой S или T, X6 представляет собой S или K, и X7 представляет собой H или Y (SEQ ID NO: 133); (d) CDR-L3, имеющую последовательность QQHFNLPT (SEQ ID NO: 63); (e) CDR-L2, имеющую последовательность DASNRAT (SEQ ID NO: 67); и (f) CDR-L1, имеющую последовательность RASQSVSSYLA (SEQ ID NO: 70). В некоторых вариантах осуществления, в изобретении предлагается ABP, принадлежащий к такому второму семейству.
[0207] В некоторых вариантах осуществления, в изобретении предлагается третье семейство ABPs, где ABP из такого семейства включает следующих шесть CDR последовательностей: (a) CDR-H3, имеющую последовательность A-R-G-G-R-T-T-W-I-G-A-X1-D-I, где X1 представляет собой F или L (SEQ ID NO: 134); (b) CDR-H2, имеющую последовательность I-I-N-P-S-X2-G-L-T-S-Y-A-X3-K-F-Q-G, где X2 представляет собой L или I, и X3 представляет собой Q или R (SEQ ID NO: 135); (c) CDR-H1, имеющую последовательность Y-T-F-X4-X5-Y-Y-X6-H, где X4 представляет собой G, P или R, X5 представляет собой N, A или E, и X6 представляет собой M или I (SEQ ID NO: 136); (d) CDR-L3, имеющую последовательность QQYVVWPPLT (SEQ ID NO: 65); (e) CDR-L2, имеющую последовательность GASTRAT (SEQ ID NO: 69); и (f) CDR-L1, имеющую последовательность RASQSVSSNLA (SEQ ID NO: 72). В некоторых вариантах осуществления, в изобретении предлагается ABP, принадлежащий к такому третьему семейству.
[0208] В некоторых вариантах осуществления, в изобретении предлагается четвертое семейство ABPs, где ABP из такого семейства включает следующих шесть CDR последовательностей: (a) CDR-H3, имеющую последовательность ARLHVSGSYYPAYLDY (SEQ ID NO: 35); (b) CDR-H2, имеющую последовательность X1-I-N-P-S-M-G-A-T-S-Y-X2-Q-K-F-X3-G, где X1 представляет собой V или I, X2 представляет собой A или T, и X3 представляет собой Q или R (SEQ ID NO: 137); (c) CDR-H1, имеющую последовательность YTFTSHYMG (SEQ ID NO: 62); (d) CDR-L3, имеющую последовательность QQYIVFPWT (SEQ ID NO: 66); (e) CDR-L2, имеющую последовательность GASTRAT (SEQ ID NO: 69); и (f) CDR-L1, имеющую последовательность RASQSVSSNLA, (SEQ ID NO: 72). В некоторых вариантах осуществления, в изобретении предлагается ABP, принадлежащий к такому четвертому семейству.
2.2.7. Функциональные свойства вариантов ABP
[0209] Как описано выше и в других местах этого изобретения, в изобретении предлагаются варианты ABP, определяемые на основе процента идентичности с предлагаемой в изобретении иллюстративной ABP последовательностью, или на основе замены аминокислотных остатков при сравнении с предлагаемой в изобретении иллюстративной ABP последовательностью.
[0210] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении hTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении cTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении mTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении hTIGIT и cTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении hTIGIT и mTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении cTIGIT и mTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP имеет специфичность в отношении hTIGIT, cTIGIT и mTIGIT.
[0211] В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении hTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении cTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении hTIGIT и cTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении обоих hTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении обоих cTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP. В некоторых вариантах осуществления, вариант ABP, который получен из предлагаемой в изобретении иллюстративной ABP последовательности, сохраняет аффинность, измеряемую величиной KD, в отношении всех трех hTIGIT, cTIGIT и mTIGIT, которая приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз, приблизительно в 9 раз или приблизительно в 10 раз больше аффинности такого иллюстративного ABP.
[0212] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP сохраняет способность антагонизировать TIGIT, измеряемую с помощью одного или более метода исследования, или описанные в изобретении биологические эффекты. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP сохраняет способность предотвращать взаимодействие TIGIT с одним или более из описанных в изобретении его лигандов.
[0213] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP конкурирует за связывание TIGIT с антителом, выбранным из MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB7, MAB8, MAB9, MAB10, MAB11, MAB12, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 или MAB21, каждое из которых приведено в таблице 5 этого изобретения.
[0214] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP ингибирует связывание CD155 с TIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP ингибирует связывание CD112 с TIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP ингибирует ассоциацию CD226 с TIGIT.
[0215] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP активирует эффекторную Т-клетку или естественную клетку-киллер (NK). В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP снижает число регуляторных Т-клеток в ткани или в кровотоке. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP ингибирует супрессию эффекторной Т-клетки регуляторной Т-клеткой.
[0216] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP не связывается специфически ни с одним из PVRL1, PVRL2, PVRL3 или PVRL4.
[0217] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP связывает TIGIT грызуна (mTIGIT; SEQ ID NO: 3) с аффинностью ниже (на что указывает более высокая величина KD), чем аффинность ABP в отношении hTIGIT, или не связывает mTIGIT. В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP связывает TIGIT грызуна (SEQ ID NO: 138) с аффинностью ниже (на что указывает более высокая величина KD), чем аффинность ABP в отношении hTIGIT, или не связывает mTIGIT.
[0218] В некоторых вариантах осуществления, вариант предлагаемого в изобретении ABP связывает один и тот же эпитоп TIGIT, что и такой ABP.
2.2.8. Другие функциональные свойства ABPs
[0219] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет одну или более характеристик, приведенных в следующих пунктах (a)-(j): (a) конкурирует за связывание TIGIT с антителом, выбранным из MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB7, MAB8, MAB9, MAB10, MAB11, MAB12, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 или MAB21, каждое из которых приведено в таблице 5 в этом изобретении; (b) ингибирует связывание CD155 с TIGIT; (c) ингибирует связывание CD112 с TIGIT; (d) ингибирует ассоциацию CD226 с TIGIT; (e) активирует эффекторную Т-клетку или естественную клетку-киллер (NK); (f) снижает число регуляторных Т-клеток в ткани или в кровотоке; (g) ингибирует супрессию эффекторной Т-клетки регуляторной T-клеткой; (h) не связывается специфически с любым из PVRL1, PVRL2, PVRL3 или PVRL4; (i) специфически связывает TIGIT яванского макака (cTIGIT; SEQ ID NO: 2); или (j) связывает TIGIT грызуна (mTIGIT; SEQ ID NO: 3) с аффинностью ниже (на что указывает более высокая величина KD), чем аффинность ABP в отношении hTIGIT, или не связывает mTIGIT. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет две или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет три или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет четыре или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет пять или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет шесть или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет семь или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет восемь или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет девять или более из характеристик, приведенных в указанных выше пунктах (a)-(j). В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет все десять характеристик, приведенных в указанных выше пунктах (a)-(j).
[0220] В некоторых вариантах осуществления, предлагаемый в изобретении ABP демонстрирует комбинацию характеристик, приведенных в следующих пунктах (a)-(j): (a) конкурирует за связывание TIGIT с антителом, выбранным из MAB1, MAB2, MAB3, MAB4, MAB5, MAB6, MAB7, MAB8, MAB9, MAB10, MAB1l, MAB12, MAB13, MAB14, MAB15, MAB16, MAB17, MAB18, MAB19, MAB20 или MAB21, каждое из которых приведено в таблице 5 в этом изобретении; (b) ингибирует связывание CD155 с TIGIT; (c) ингибирует связывание CD112 с TIGIT; (d) ингибирует ассоциацию CD226 с TIGIT; (e) активирует эффекторную Т-клетку или естественную клетку-киллер (NK); (f) снижает число регуляторных Т-клеток в ткани или в кровотоке; (g) ингибирует супрессию эффекторной Т-клетки регуляторной T-клеткой; (h) не связывается специфически с любым из PVRL1, PVRL2, PVRL3 или PVRL4; (i) специфически связывает TIGIT яванского макака TIGIT (cTIGIT; SEQ ID NO: 2); или (j) связывает TIGIT грызуна (mTIGIT; SEQ ID NO: 3) с аффинностью ниже (на что указывает более высокая величина KD), чем аффинность ABP в отношении hTIGIT, или не связывает mTIGIT. В некоторых вариантах осуществления, такой ABP демонстрирует комбинацию характеристик, выбранную из (a и b), (a и c), (a и d), (a и e), (a и f), (a и g), (a и h), (a и i), (a и j), (b и a), (b и c), (b и d), (b и e), (b и f), (b и g), (b и h), (b и i), (b и j), (c и a), (c и b), (c и d), (c и e), (c и f), (c и g), (c и h), (c и i), (c и j), (d и a), (d и b), (d и c), (d и e), (d и f), (d и g), (d и h), (d и i), (d и j), (e и a), (e и b), (e и c), (e и d), (e и f), (e и g), (e и h), (e и i), (e и j), (f и a), (f и b), (f и c), (f и d), (f и e), (f и g), (f и h), (f и i), (f и j), (g и a), (g и b), (g и c), (g и d), (g и e), (g и f), (g и h), (g и i), (g и j), (h и a), (h и b), (h и c), (h и d), (h и e), (h и f), (h и g), (h и i), (h и j), (i и a), (i и b), (i и c), (i и d), (i и e), (i и f), (i и g), (i и h), (i и j), (j и a), (j и b), (j и c), (j и d), (j и e), (j и f), (j и g), (j и h) и (j и i). В некоторых вариантах осуществления, такой ABP демонстрирует комбинацию характеристик, выбранную из (a и b и c), (a и b и d), (a и b и e), (a и b и f), (a и b и g), (a и b и h), (a и b и i), (a и b и j), (a и c и b), (a и c и d), (a и c и e), (a и c и f), (a и c и g), (a и c и h), (a и c и i), (a и c и j), (a и d и b), (a и d и c), (a и d и e), (a и d и f), (a и d и g), (a и d и h), (a и d и i), (a и d и j), (a и e и b), (a и e и c), (a и e и d), (a и e и f), (a и e и g), (a и e и h), (a и e и i), (a и e и j), (a и f и b), (a и f и c), (a и f и d), (a и f и e), (a и f и g), (a и f и h), (a и f и i), (a и f и j), (a и g и b), (a и g и c), (a и g и d), (a и g и e), (a и g и f), (a и g и h), (a и g и i), (a и g и j), (a и h и b), (a и h и c), (a и h и d), (a и h и e), (a и h и f), (a и h и g), (a и h и i), (a и h и j), (a и i и b), (a и i и c), (a и i и d), (a и i и e), (a и i и f), (a и i и g), (a и i и h), (a и i и j), (a и j и b), (a и j и c), (a и j и d), (a и j и e), (a и j и f), (a и j и g), (a и j и h), (a и j и i), (b и a и j), (b и a и c), (b и a и d), (b и a и e), (b и a и f), (b и a и g), (b и a и h), (b и a и i), (b и c и j), (b и c и a), (b и c и d), (b и c и e), (b и c и f), (b и c и g), (b и c и h), (b и c и i), (b и d и j), (b и d и a), (b и d и c), (b и d и e), (b и d и f), (b и d и g), (b и d и h), (b и d и i), (b и e и j), (b и e и a), (b и e и c), (b и e и d), (b и e и f), (b и e и g), (b и e и h), (b и e и i), (b и f и j), (b и f и a), (b и f и c), (b и f и d), (b и f и e), (b и f и g), (b и f и h), (b и f и i), (b и g и j), (b и g и a), (b и g и c), (b и g и d), (b и g и e), (b и g и f), (b и g и h), (b и g и i), (b и h и j), (b и h и a), (b и h и c), (b и h и d), (b и h и e), (b и h и f), (b и h и g), (b и h и i), (b и i и j), (b и i и a), (b и i и c), (b и i и d), (b и i и e), (b и i и f), (b и i и g), (b и i и h), (b и j и i), (b и j и a), (b и j и c), (b и j и d), (b и j и e), (b и j и f), (b и j и g), (b и j и h), (c и a и i), (c и a и j), (c и a и b), (c и a и d), (c и a и e), (c и a и f), (c и a и g), (c и a и h), (c и b и i), (c и b и j), (c и b и a), (c и b и d), (c и b и e), (c и b и f), (c и b и g), (c и b и h), (c и d и i), (c и d и j), (c и d и a), (c и d и b), (c и d и e), (c и d и f), (c и d и g), (c и d и h), (c и e и i), (c и e и j), (c и e и a), (c и e и b), (c и e и d), (c и e и f), (c и e и g), (c и e и h), (c и f и i), (c и f и j), (c и f и a), (c и f и b), (c и f и d), (c и f и e), (c и f и g), (c и f и h), (c и g и i), (c и g и j), (c и g и a), (c и g и b), (c и g и d), (c и g и e), (c и g и f), (c и g и h), (c и h и i), (c и h и j), (c и h и a), (c и h и b), (c и h и d), (c и h и e), (c и h и f), (c и h и g), (c и i и h), (c и i и j), (c и i и a), (c и i и b), (c и i и d), (c и i и e), (c и i и f), (c и i и g), (c и j и h), (c и j и i), (c и j и a), (c и j и b), (c и j и d), (c и j и e), (c и j и f), (c и j и g), (d и a и h), (d и a и i), (d и a и j), (d и a и b), (d и a и c), (d и a и e), (d и a и f), (d и a и g), (d и b и h), (d и b и i), (d и b и j), (d и b и a), (d и b и c), (d и b и e), (d и b и f), (d и b и g), (d и c и h), (d и c и i), (d и c и j), (d и c и a), (d и c и b), (d и c и e), (d и c и f), (d и c и g), (d и e и h), (d и e и i), (d и e и j), (d и e и a), (d и e и b), (d и e и c), (d и e и f), (d и e и g), (d и f и h), (d и f и i), (d и f и j), (d и f и a), (d и f и b), (d и f и c), (d и f и e), (d и f и g), (d и g и h), (d и g и i), (d и g и j), (d и g и a), (d и g и b), (d и g и c), (d и g и e), (d и g и f), (d и h и g), (d и h и i), (d и h и j), (d и h и a), (d и h и b), (d и h и c), (d и h и e), (d и h и f), (d и i и g), (d и i и h), (d и i и j), (d и i и a), (d и i и b), (d и i и c), (d и i и e), (d и i и f), (d и j и g), (d и j и h), (d и j и i), (d и j и a), (d и j и b), (d и j и c), (d и j и e), (d и j и f), (e и a и g), (e и a и h), (e и a и i), (e и a и j), (e и a и b), (e и a и c), (e и a и d), (e и a и f), (e и b и g), (e и b и h), (e и b и i), (e и b и j), (e и b и a), (e и b и c), (e и b и d), (e и b и f), (e и c и g), (e и c и h), (e и c и i), (e и c и j), (e и c и a), (e и c и b), (e и c и d), (e и c и f), (e и d и g), (e и d и h), (e и d и i), (e и d и j), (e и d и a), (e и d и b), (e и d и c), (e и d и f), (e и f и g), (e и f и h), (e и f и i), (e и f и j), (e и f и a), (e и f и b), (e и f и c), (e и f и d), (e и g и f), (e и g и h), (e и g и i), (e и g и j), (e и g и a), (e и g и b), (e и g и c), (e и g и d), (e и h и f), (e и h и g), (e и h и i), (e и h и j), (e и h и a), (e и h и b), (e и h и c), (e и h и d), (e и i и f), (e и i и g), (e и i и h), (e и i и j), (e и i и a), (e и i и b), (e и i и c), (e и i и d), (e и j и f), (e и j и g), (e и j и h), (e и j и i), (e и j и a), (e и j и b), (e и j и c), (e и j и d), (f и a и e), (f и a и g), (f и a и h), (f и a и i), (f и a и j), (f и a и b), (f и a и c), (f и a и d), (f и b и e), (f и b и g), (f и b и h), (f и b и i), (f и b и j), (f и b и a), (f и b и c), (f и b и d), (f и c и e), (f и c и g), (f и c и h), (f и c и i), (f и c и j), (f и c и a), (f и c и b), (f и c и d), (f и d и e), (f и d и g), (f и d и h), (f и d и i), (f и d и j), (f и d и a), (f и d и b), (f и d и c), (f и e и d), (f и e и g), (f и e и h), (f и e и i), (f и e и j), (f и e и a), (f и e и b), (f и e и c), (f и g и d), (f и g и e), (f и g и h), (f и g и i), (f и g и j), (f и g и a), (f и g и b), (f и g и c), (f и h и d), (f и h и e), (f и h и g), (f и h и i), (f и h и j), (f и h и a), (f и h и b), (f и h и c), (f и i и d), (f и I и e), (f и i и g), (f и i и h), (f и i и j), (f и i и a), (f и i и b), (f и i и c), (f и j и d), (f и j и e), (f и j и g), (f и j и h), (f и j и i), (f и j и a), (f и j и b), (f и j и c), (g и a и d), (g и a и e), (g и a и f), (g и a и h), (g и a и i), (g и a и j), (g и a и b), (g и a и c), (g и b и d), (g и b и e), (g и b и f), (g и b и h), (g и b и i), (g и b и j), (g и b и a), (g и b и c), (g и c и d), (g и c и e), (g и c и f), (g и c и h), (g и c и i), (g и c и j), (g и c и a), (g и c и b), (g и d и c), (g и d и e), (g и d и f), (g и d и h), (g и d и i), (g и d и j), (g и d и a), (g и d и b), (g и e и c), (g и e и d), (g и e и f), (g и e и h), (g и e и i), (g и e и j), (g и e и a), (g и e и b), (g и f и c), (g и f и d), (g и f и e), (g и f и h), (g и f и i), (g и f и j), (g и f и a), (g и f и b), (g и h и c), (g и h и d), (g и h и e), (g и h и f), (g и h и i), (g и h и j), (g и h и a), (g и h и b), (g и i и c), (g и i и d), (g и i и e), (g и i и f), (g и i и h), (g и i и j), (g и i и a), (g и i и b), (g и j и c), (g и j и d), (g и j и e), (g и j и f), (g и j и h), (g и j и i), (g и j и a), (g и j и b), (h и a и c), (h и a и d), (h и a и e), (h и a и f), (h и a и g), (h и a и i), (h и a и j), (h и a и b), (h и b и c), (h и b и d), (h и b и e), (h и b и f), (h и b и g), (h и b и i), (h и b и j), (h и b и a), (h и c и b), (h и c и d), (h и c и e), (h и c и f), (h и c и g), (h и c и i), (h и c и j), (h и c и a), (h и d и b), (h и d и c), (h и d и e), (h и d и f), (h и d и g), (h и d и i), (h и d и j), (h и d и a), (h и e и b), (h и e и c), (h и e и d), (h и e и f), (h и e и g), (h и e и i), (h и e и j), (h и e и a), (h и f и b), (h и f и c), (h и f и d), (h и f и e), (h и f и g), (h и f и i), (h и f и j), (h и f и a), (h и g и b), (h и g и c), (h и g и d), (h и g и e), (h и g и f), (h и g и i), (h и g и j), (h и g и a), (h и i и b), (h и i и c), (h и i и d), (h и i и e), (h и i и f), (h и i и g), (h и i и j), (h и i и a), (h и j и b), (h и j и c), (h и j и d), (h и j и e), (h и j и f), (h и j и g), (h и j и i), (h и j и a), (i и a и b), (i и a и c), (i и a и d), (i и a и e), (i и a и f), (i и a и g), (i и a и h), (i и a и j), (i и b и a), (i и b и c), (i и b и d), (i и b и e), (i и b и f), (i и b и g), (i и b и h), (i и b и j), (i и c и a), (i и c и b), (i и c и d), (i и c и e), (i и c и f), (i и c и g), (i и c и h), (i и c и j), (i и d и a), (i и d и b), (i и d и c), (i и d и e), (i и d и f), (i и d и g), (i и d и h), (i и d и j), (i и e и a), (i и e и b), (i и e и c), (i и e и d), (i и e и f), (i и e и g), (i и e и h), (i и e и j), (i и f и a), (i и f и b), (i и f и c), (i и f и d), (i и f и e), (i и f и g), (i и f и h), (i и f и j), (i и g и a), (i и g и b), (i и g и c), (i и g и d), (i и g и e), (i и g и f), (i и g и h), (i и g и j), (i и h и a), (i и h и b), (i и h и c), (i и h и d), (i и h и e), (i и h и f), (i и h и g), (i и h и j), (i и j и a), (i и j и b), (i и j и c), (i и j и d), (i и j и e), (i и j и f), (i и j и g), (i и j и h), (j и a и i), (j и a и b), (j и a и c), (j и a и d), (j и a и e), (j и a и f), (j и a и g), (j и a и h), (j и b и i), (j и b и a), (j и b и c), (j и b и d), (j и b и e), (j и b и f), (j и b и g), (j и b и h), (j и c и i), (j и c и a), (j и c и b), (j и c и d), (j и c и e), (j и c и f), (j и c и g), (j и c и h), (j и d и i), (j и d и a), (j и d и b), (j и d и c), (j и d и e), (j и d и f), (j и d и g), (j и d и h), (j и e и i), (j и e и a), (j и e и b), (j и e и c), (j и e и d), (j и e и f), (j и e и g), (j и e и h), (j и f и i), (j и f и a), (j и f и b), (j и f и c), (j и f и d), (j и f и e), (j и f и g), (j и f и h), (j и g и i), (j и g и a), (j и g и b), (j и g и c), (j и g и d), (j и g и e), (j и g и f), (j и g и h), (j и h и i), (j и h и a), (j и h и b), (j и h и c), (j и h и d), (j и h и e), (j и h и f), (j и h и g), (j и i и h), (j и i и a), (j и i и b), (j и i и c), (j и i и d), (j и i и e), (j и i и f) и (j и i и g).
2.3. Зародышевые конфигурации
[0221] Предлагаемые в изобретении ABPs могут включать любые подходящие зародышевые конфигурации VH и VL последовательностей.
[0222] В некоторых вариантах осуществления, VH область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VH4. В некоторых вариантах осуществления, VH область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VH1.
[0223] В некоторых вариантах осуществления, VH область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VH4-39. В некоторых вариантах осуществления, VH область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VH4-3. В некоторых вариантах осуществления, VH область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VH1-46.
[0224] В некоторых вариантах осуществления, VL область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VK3.
[0225] В некоторых вариантах осуществления, VL область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VK3-11. В некоторых вариантах осуществления, VL область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VK3-20. В некоторых вариантах осуществления, VL область предлагаемого в изобретении ABP происходит из зародышевой конфигурации VK3-15.
[0226] Таблица 5. Последовательности и зародышевые конфигурации (GL) TIGIT ABPs.
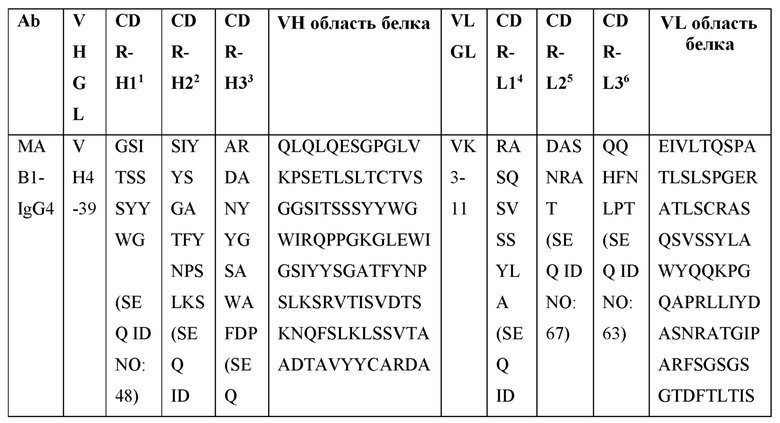
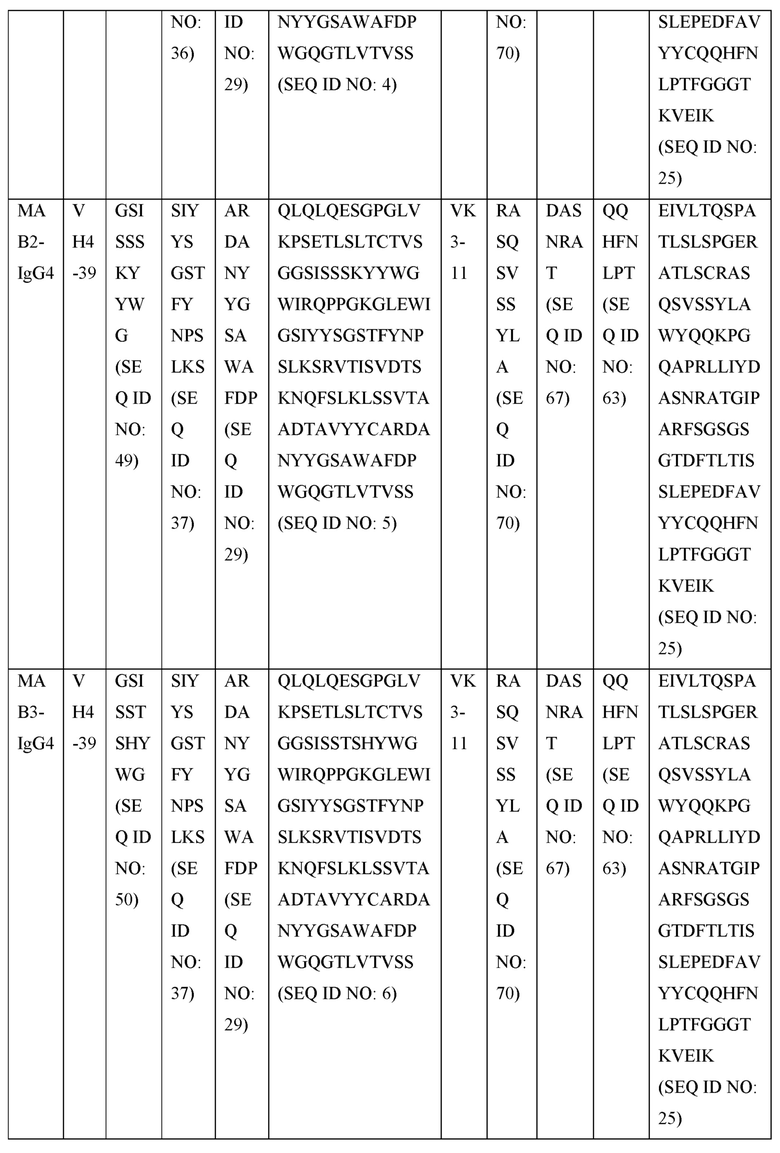
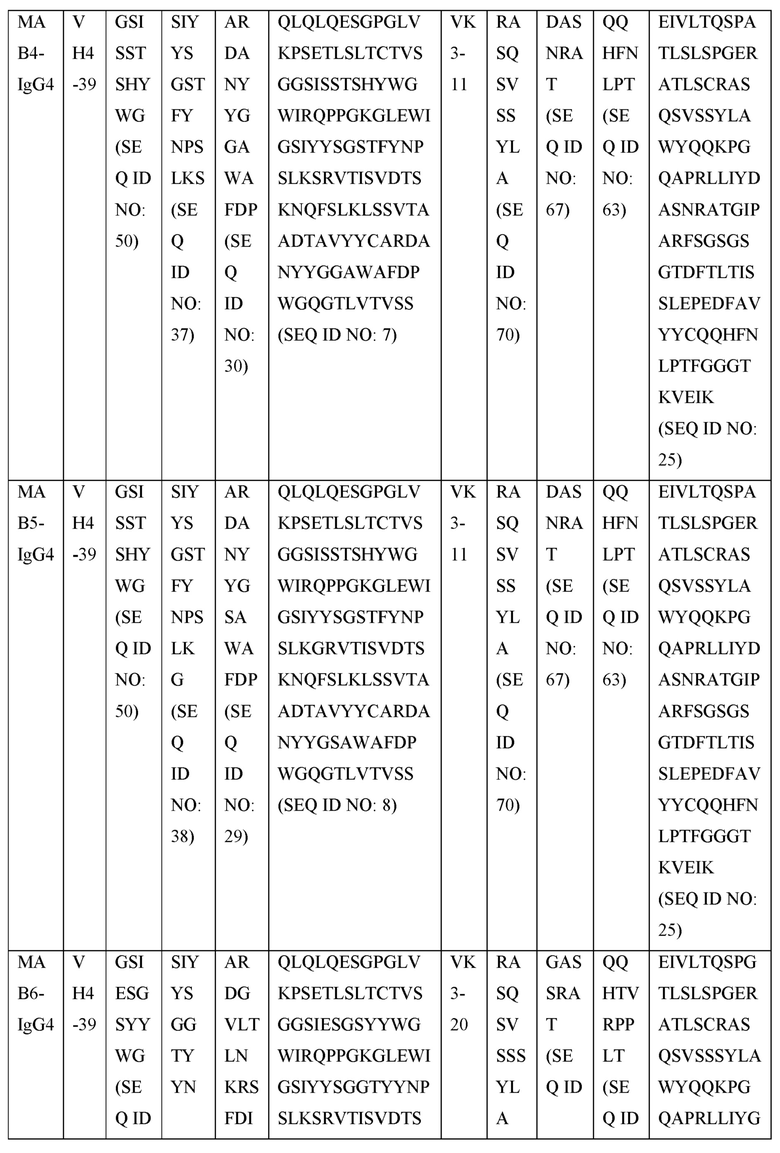
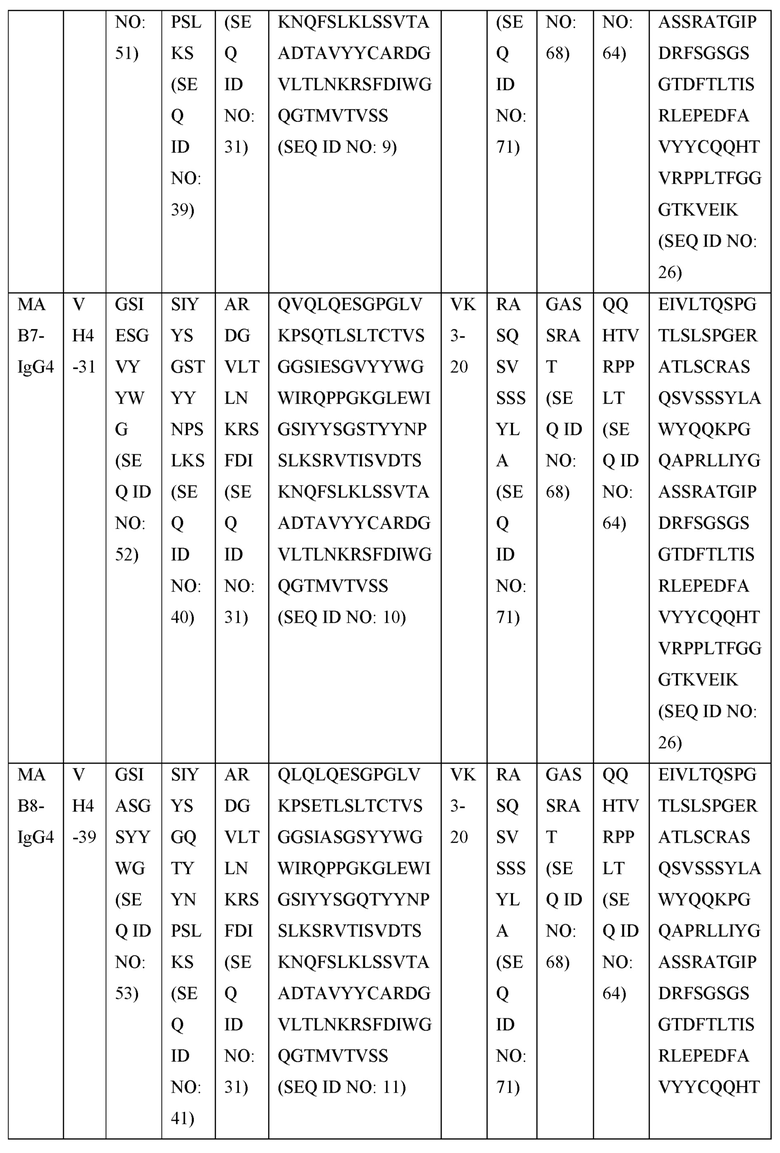
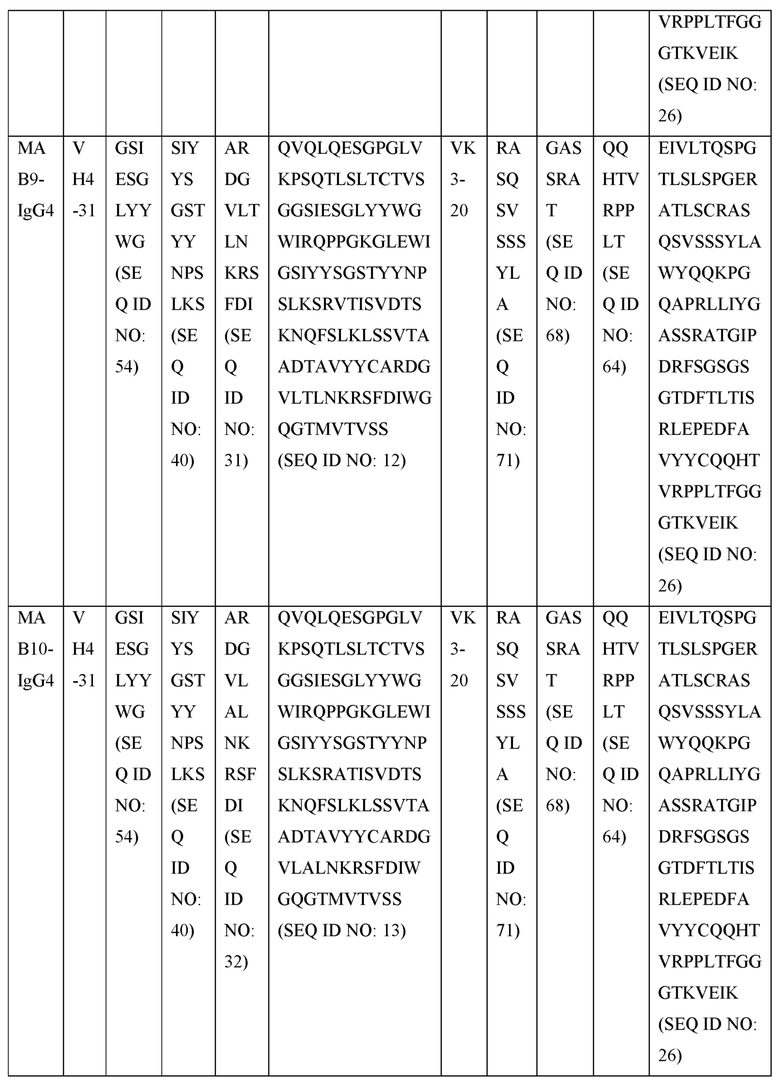
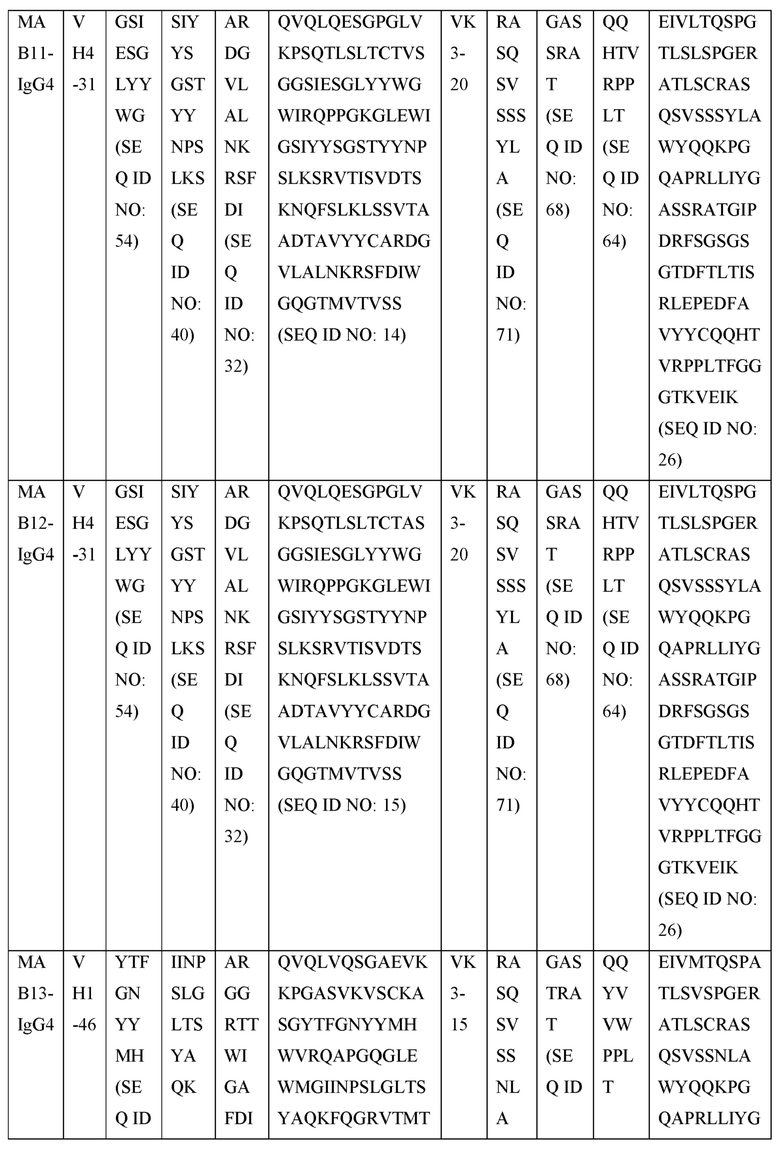

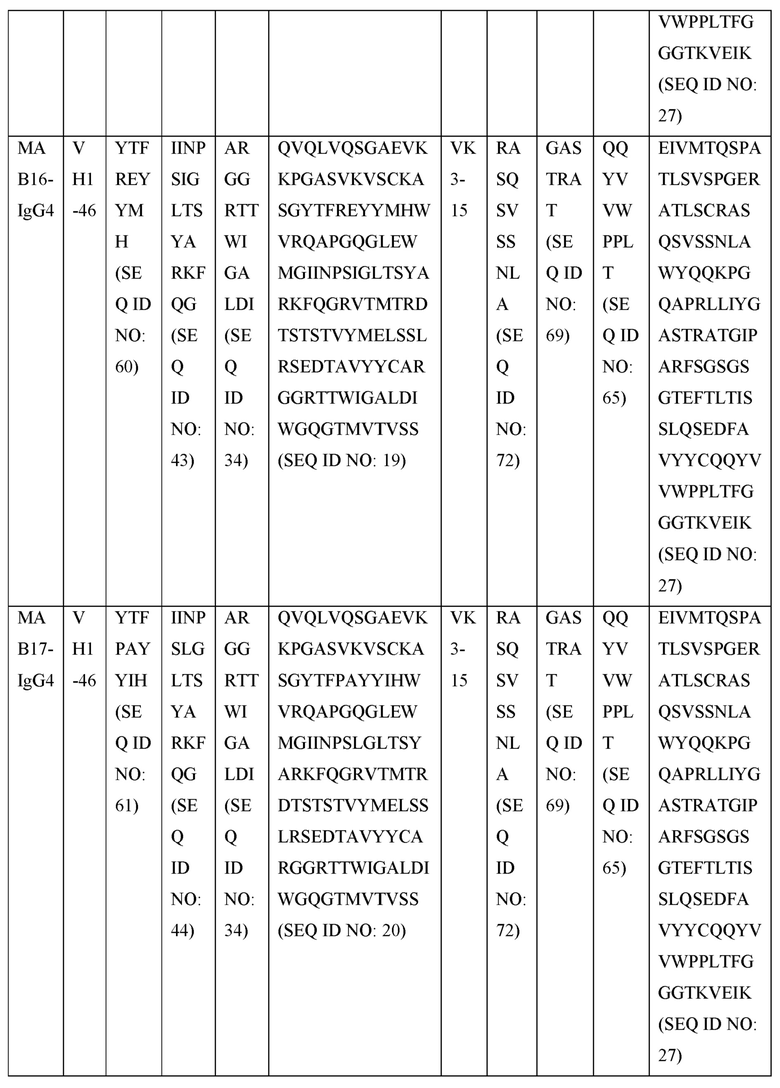
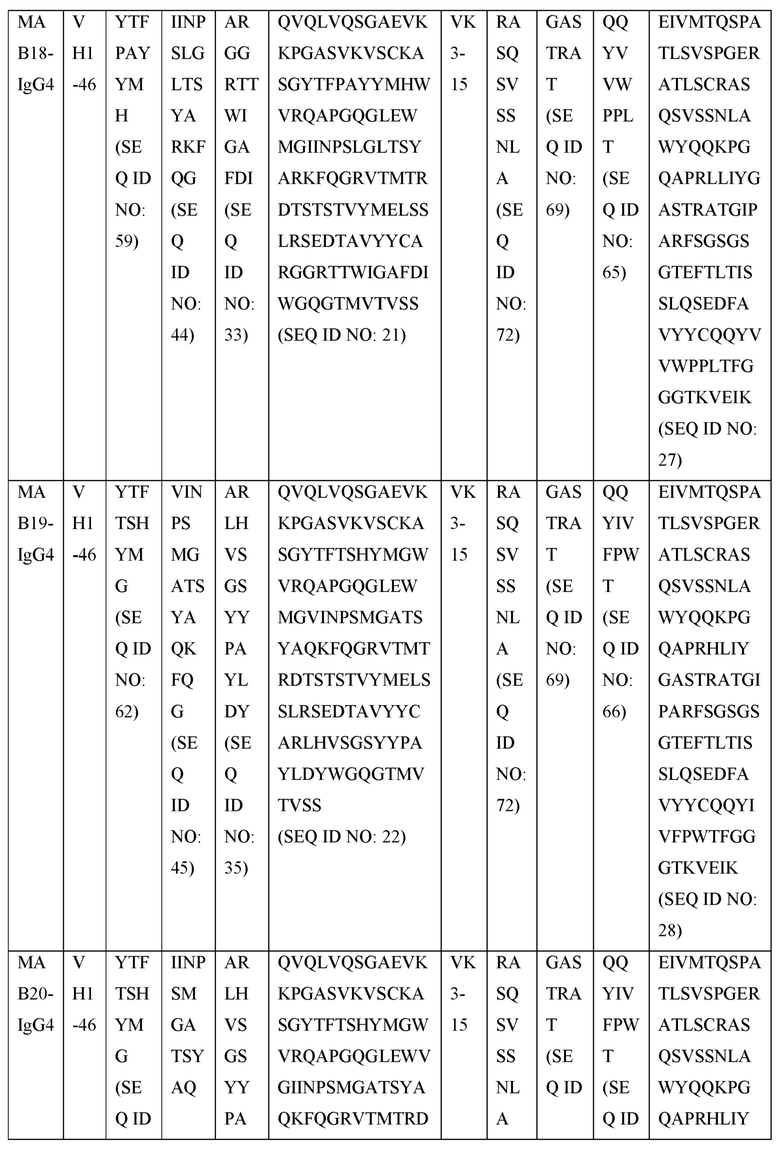
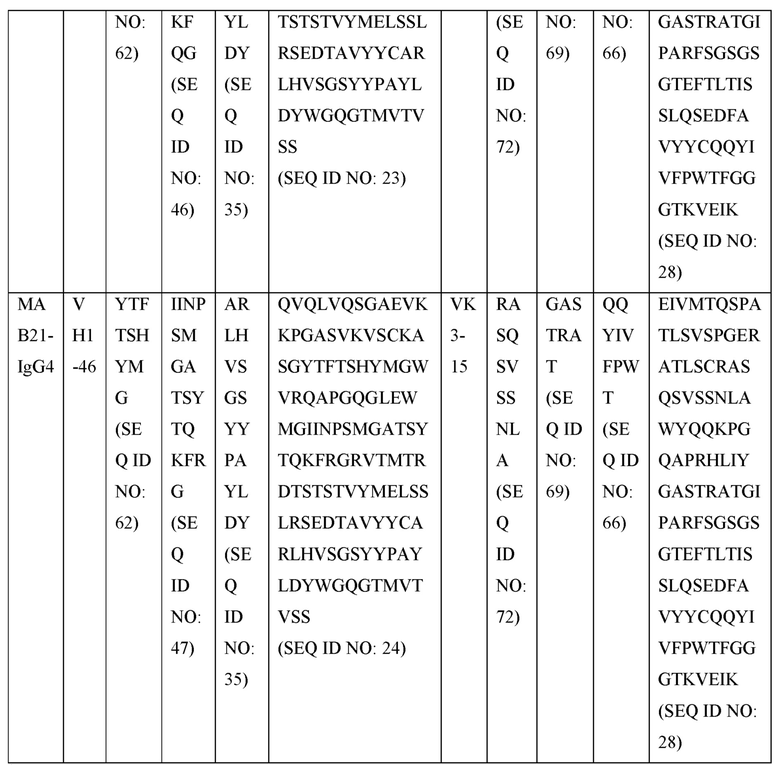
1 Включает CDR-H1, определяемую обеими системами нумерации Chothia и Kabat, в том числе и границы обеих систем нумерации.
2 В соответствии с системой нумерации Kabat.
3 В соответствии с системой нумерации IMGT.
4 В соответствии с системами нумерации Kabat и Chothia.
5 В соответствии с системами нумерации Kabat и Chothia.
6 В соответствии с системами нумерации Kabat, Chothia и IMGT.
2.4. Антагонистическое действие в отношении TIGIT
[0227] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs антагонизируют TIGIT в результате связывания.
[0228] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает димеризацию и/или активацию CD226 (также называемого как DNAM-1), костимулирующего рецептора, димеризация и функция которого нарушается в результате непосредственного взаимодействия с TIGIT. Смотрите публикацию Grogan et al., J Immunol., 2014, 192 (1 Supplement) 2013,15, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0229] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT увеличивает количество взаимодействующих CD226 и CD155, по сравнению с количеством, которое взаимодействует в отсутствии ABP.
[0230] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает активацию эффекторной Т-клетки. В некоторых аспектах, эффекторная Т-клетка представляет собой CD8+ T-клетку. В некоторых аспектах, эффекторная Т-клетка представляет собой CD4+ T-клетку.
[0231] В некоторых вариантах осуществления, В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает активацию NK-клетки. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает активацию NKT-клетки.
[0232] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает снижение ингибирующей активности регуляторной T-клетки в отношении эффекторной Т-клетки.
[0233] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает увеличение секреции IL-2, IL-6, GM-CSF, TNF, LT-α и/или IFN-γ клеткой-мишенью.
[0234] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT увеличивает пролиферацию, выживание и/или функцию эффекторной Т-клетки. В некоторых аспектах, эффекторная Т-клетка представляет собой CD4+ эффекторную Т-клетку. В некоторых аспектах, эффекторная Т-клетка представляет собой CD8+ эффекторную Т-клетку.
[0235] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT прекращает супрессию эффекторной Т-клетки регуляторной T-клеткой. В некоторых аспектах, регуляторная T-клетка представляет собой CD4+CD25+Foxp3+ регуляторную T-клетку. В некоторых аспектах, регуляторная T-клетка представляет собой CD8+CD25+ регуляторную T-клетку.
[0236] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT вызывает усиление иммунного ответа.
[0237] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к предотвращению возникновения опухоли. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к отсрочке начала возникновения опухоли. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к уменьшению размера опухоли. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к элиминации опухоли. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к уменьшению числа метастазов.
[0238] В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT позволяет предотвращать вирусное заболевание. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к отсрочке начала развития вирусного заболевания. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к снижению вирусной нагрузки у субъекта. В некоторых вариантах осуществления, антагонистическое действие предлагаемого в изобретении ABP в отношении TIGIT приводит к элиминации вирусной инфекции.
2.5. Аффинность и кинетика антигенсвязывающих белков в отношении TIGIT; активность
[0239] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении TIGIT измеряется с помощью методов, раскрытых в разделе "Примеры" патентных документов International Publication No. WO/2017/059095 и U.S. Patent No. 9713641, содержание которых включено в настоящее изобретение путем ссылки на них. В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении TIGIT, которая оценивается величиной KD, составляет менее чем приблизительно 10-5 M, менее чем приблизительно 10-6 M, менее чем приблизительно 10–7 M, менее чем приблизительно 10-8 M, менее чем приблизительно 10–9 M, менее чем приблизительно 10-10 M, менее чем приблизительно 10-11 M или менее чем приблизительно 10-12 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-7 M до 10-12 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-7 M до 10-11 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-7 M до 10-10 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-7 M до 10-9 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-7 M до 10-8 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-8 M до 10-12 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-8 M до 10-11 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-9 M до 10-11 M. В некоторых вариантах осуществления, аффинность ABP определяется величиной приблизительно от 10-10 M до 10-11 M.
[0240] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, которая оценивается величиной KD, измеренной с помощью системы ForteBio, выбирают из приблизительно 5,24×10-10 M, приблизительно 4,57×10-10 M, приблизительно 3,32×10-10 M, приблизительно 2,46×10-10 M, приблизительно 1,96×10-10 M, приблизительно 3,11×10-9 M, приблизительно 2,54×10-9 M, приблизительно 3,13×10-9 M, приблизительно 2,83×10-9 M, приблизительно 1,71×10-9 M, приблизительно 2,47×10-9 M, приблизительно 2,35×10-9 M, приблизительно 1,44×10-9 M, приблизительно 1,23×10-9 M, приблизительно 5,26×10-10 M, приблизительно 3,78×10-10 M, приблизительно 4,29×10-10 M или приблизительно 4,48×10-10 M. В некоторых вариантах осуществления, такая аффинность составляет величину в диапазоне от приблизительно 3,13×10-9 M до приблизительно 1,96×10-10 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 3,13×10-9 M или менее.
[0241] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении cTIGIT, которая оценивается величиной KD, измеренной с помощью системы ForteBio, выбирают из приблизительно 2,64×10–9 M, приблизительно 6,55×10-9 M, приблизительно 8,14×10-9 M, приблизительно 6,57×10–9 M, приблизительно 7,94×10-8 M, приблизительно 7,04×10-8 M, приблизительно 1,10×10–7 M, приблизительно 7,20×10-8 M, приблизительно 1,57×10–9 M, приблизительно 8,02×10–10 M, приблизительно 3,67×10-10 M, приблизительно 8,98×10-10 M, приблизительно 1,75×10-8 M или приблизительно 2,58×10–8 M, приблизительно 9,35×10-9 M. В некоторых вариантах осуществления, такая аффинность составляет величину в диапазоне от приблизительно 1,10×10-7 M до приблизительно 3,69×10-10 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 1,10×10-7 M или менее.
[0242] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, которая оценивается величиной KD, измеренной методами изучения равновесия в растворах (MSD–SET), выбирают из приблизительно 5,40×10–11 M, приблизительно 1,10×10-10 M, приблизительно 1,50×10-10 M, приблизительно 5,60×10–11 M, приблизительно 4,00×10-10 M, приблизительно 3,80×10-10 M, приблизительно 2,10×10–10 M, приблизительно 7,00×10-11 M, приблизительно 4,10×10-11 M, приблизительно 2,50×10–11 M, приблизительно 3,00×10-11 M, приблизительно 8,00×10-11 M, приблизительно 8,10×10–12 M, приблизительно 5,00×10-12 M или приблизительно 4,90×10–12 M. В некоторых вариантах осуществления, такая аффинность составляет величину в диапазоне от приблизительно 4,00×10–10 M до приблизительно 4,90×10-12 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 4,00×10–10 M или менее.
[0243] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении cTIGIT, которая оценивается величиной KD, измеренной методом MSD-SET, выбирают из приблизительно 3,20×10–10 M, приблизительно 2,30×10-10 M, приблизительно 3,50×10-11 M, приблизительно 1,50×10-11 M или приблизительно 4,60×10-11 M. В некоторых вариантах осуществления, такая аффинность составляет величину в диапазоне от приблизительно 3,20×10–10 M до приблизительно 1,50×10-11 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 3,20×10-10 M или менее.
[0244] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, которая оценивается величиной KD, измеренной с помощью системы ForteBio, выбирают из приблизительно 7,1×10–10 M, приблизительно 8,1×10–10 M, приблизительно 1,9×10–10 M, приблизительно 5,6×10–10 M, приблизительно 2,4×10–10 M, приблизительно 2,8×10–10 M, приблизительно 1,6×10–10 M, приблизительно 5,8×10–10 M, приблизительно 1,1×10–9 M, приблизительно 8,1×10-10 M, приблизительно 4,6×10–10 M или приблизительно 3,6×10–10 M. В некоторых вариантах осуществления, такая аффинность составляет величину в диапазоне от приблизительно 1,1×10–9 M до приблизительно 8,1×10–11 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 1,1×10–9 M или менее.
[0245] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, которая оценивается величиной KD, измеренной с помощью системы ForteBio, составляет приблизительно 2,4×10–10 M. В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении cTIGIT, которая оценивается величиной KD, измеренной с помощью системы ForteBio, составляет приблизительно 6,2×10–9 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 6,2×10–9 M или менее.
[0246] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, экспрессирующегося на поверхности клеток Jurkat, которая оценивается величиной KD, составляет приблизительно 5,1×10–10 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 5,1×10–10 M или менее.
[0247] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении cTIGIT, экспрессирующегося на поверхности клеток Jurkat, которая оценивается величиной KD, составляет приблизительно 4,0×10-10 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 4,0×10-10 M или менее.
[0248] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении mTIGIT (SEQ ID NO: 3), экспрессирующегося на поверхности клеток Jurkat, которая оценивается величиной KD, составляет приблизительно 9,8×10–9 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 9,8×10–9 M или менее. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 9,8×10–9 M или более.
[0249] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении hTIGIT, экспрессирующегося на поверхности человеческих CD8+ T-клеток, которая оценивается величиной KD, составляет приблизительно 1,3×10–9 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 1,3×10–9 M или менее.
[0250] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении cTIGIT, экспрессирующегося на поверхности CD8+ T-клеток яванского макака, которая оценивается величиной KD, составляет приблизительно 2,8×10–9 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 2,8×10–9 M или менее.
[0251] В некоторых вариантах осуществления, аффинность предлагаемого в изобретении ABP в отношении mTIGIT, экспрессирующегося на поверхности регуляторных T-клеток грызуна (то есть, в отношении mTIGIT, который естественным образом присутствует на таких клетках, независимо от того, имеет ли такой mTIGIT последовательность SEQ ID NO: 3 или 138, или нет, но включая такие последовательности SEQ ID Nos), которая оценивается величиной KD, составляет приблизительно 2,5×10–3 M. В некоторых вариантах осуществления, такая величина KD составляет приблизительно 2,5×10–3 M или менее.
[0252] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1) с величиной KD, составляющей X, и с cTIGIT (SEQ ID NO: 2) или с mTIGIT (SEQ ID NO: 3 или 138) с величиной KD, составляющей ≤10X. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1) с величиной KD, составляющей X, и с cTIGIT (SEQ ID NO: 2) или с mTIGIT (SEQ ID NO: 3 или 138) с величиной KD, составляющей ≤5X. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs специфически связываются с hTIGIT (SEQ ID NO: 1) с величиной KD, составляющей X, и с cTIGIT (SEQ ID NO: 2) или с mTIGIT (SEQ ID NO: 3 or 138) с величиной KD, составляющей ≤2X. В некоторых аспектах, X представляет собой любую величину KD, описанную в этом изобретении. В некоторых аспектах, X составляет 0,01 нМ, 0,1 нМ, 1 нМ, 10 нМ, 20 нМ, 50 нМ или 100 нМ.
[0253] В некоторых вариантах осуществления, отношение KD(hTIGIT) : KD(cTIGIT) для предлагаемого в изобретении ABP, измеренное с помощью системы ForteBio, выбирают из приблизительно 1,98×10–1, приблизительно 2,61×10–1, приблизительно 3,03×10–1, приблизительно 3,58×10–1, приблизительно 6,62×10–3, приблизительно 1,98×10–1, приблизительно 5,37×10–3, приблизительно 3,90×10–3, приблизительно 6,22×10–3, приблизительно 2,91×10–1, приблизительно 4,14×10–1, приблизительно 6,67×10–1, приблизительно 2,18×10–1, приблизительно 1,78×10–1, приблизительно 1,21×10–1 или приблизительно 3,03×10–1. В некоторых вариантах осуществления, такое отношение находится в диапазоне от приблизительно 3,90×10–3 до приблизительно 6,67×10–1.
[0254] В некоторых вариантах осуществления, отношение KD(hTIGIT) : KD(cTIGIT) для предлагаемого в изобретении ABP, измеренное с помощью системы ForteBio, составляет приблизительно 3,87×10–2.
0255] В некоторых вариантах осуществления, отношение KD(hTIGIT): KD(cTIGIT) для предлагаемого в изобретении ABP, измеренное методом MSD–SET, выбирают из приблизительно 3,33×10–1, приблизительно 2,31×10–1, приблизительно 1,09×10–1, приблизительно 1,07×10–1, или приблизительно 1,69×10–1. В некоторых вариантах осуществления, такое отношение находится в диапазоне от приблизительно 1,07×10–1 M до приблизительно 3,33×10–1 M.
[0256] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет порядок величины ka по меньшей мере приблизительно 104 M–1 x сек–1. В некоторых вариантах осуществления, ABP имеет порядок величины ka по меньшей мере [
приблизительно 105 M–1 x сек–1. В некоторых вариантах осуществления, ABP имеет порядок величины ka по меньшей мере приблизительно 106 M–1 x сек–1. В некоторых вариантах осуществления, ABP имеет порядок величины ka в диапазоне от приблизительно 104 M–1 x сек–1 до приблизительно 105 M–1 x сек–1. В некоторых вариантах осуществления ABP имеет порядок величины ka в диапазоне от приблизительно 105 M–1 x сек–1 до приблизительно 106 M–1 x сек–1. В некоторых вариантах осуществления, такой порядок величины ka составляет по меньшей мере приблизительно 105 M–1 x сек–1.
[0257] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT, измеренную с помощью системы ForteBio, выбранную из приблизительно 3,2×105 M–1 × сек–1, приблизительно 7,0×105 M–1 × сек–1, приблизительно 7,7×105 M–1 × сек–1, приблизительно 1,6×106 M–1 x сек–1, приблизительно 2,0×106 M–1 × сек–1, приблизительно 1,3×106 M–1 × сек–1, приблизительно 1,5×106 M–1 × сек–1, приблизительно 1,1×106 M–1 × сек–1, приблизительно 4,5×105 M–1 x сек–1, приблизительно 7,5×105 M–1 × сек–1, приблизительно 8,9×105 M–1 × сек–1 или приблизительно 1,4×106 M–1 × сек–1. В некоторых вариантах осуществления, такая величина ka находится в диапазоне от приблизительно 3,2×105 M–1 × сек–1 до приблизительно 2,0×106 M–1 × сек–1. В некоторых вариантах осуществления, такая величина ka составляет приблизительно 2,0×106 M или менее.
[0258] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT, измеренную с помощью системы ForteBio, приблизительно 2,0×106 M–1 × сек–1. В некоторых вариантах осуществления, такая величина ka составляет по меньшей мере приблизительно 2,0×106 M–1 × сек–1.
[0259] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для cTIGIT, измеренную с помощью системы ForteBio, приблизительно 7,9×105 M–1 × сек–1. В некоторых вариантах осуществления, такая величина ka составляет по меньшей мере приблизительно 7,9×105 M–1 × сек–1.
[0260] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину kd приблизительно 10–5 сек–1 или менее. В некоторых вариантах осуществления, ABP имеет величину kd приблизительно 10–4 сек–1 или менее. В некоторых вариантах осуществления, ABP имеет величину kd приблизительно 10–3 сек–1 или менее. В некоторых вариантах осуществления, ABP имеет величину kd в диапазоне от приблизительно 10–2 сек–1 до приблизительно 10–5 сек–1. В некоторых вариантах осуществления, ABP имеет величину kd в диапазоне от приблизительно 10–2 сек–1 до приблизительно 10–4 сек–1. В некоторых вариантах осуществления, ABP имеет величину kd в диапазоне от приблизительно 10–3 сек–1 до приблизительно 10–5 сек–1.
[0261] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину kd для hTIGIT, измеренную с помощью системы ForteBio, выбранную из приблизительно 2,3×10–4 сек–1, приблизительно 6,3×10–5 сек–1, приблизительно 1,4×10–4 сек–1, приблизительно 8,5×10–4 сек–1, приблизительно 3,8×10–4 сек–1, приблизительно 3,5×10–4 сек–1, приблизительно 2,4×10–4 сек–1, приблизительно 6,6×10–4 сек–1, приблизительно 5,9×10–4 сек–1 или приблизительно 5,0×10–4 сек–1. В некоторых вариантах осуществления, такая величина kd находится в диапазоне от приблизительно 6,3×10–5 сек–1 до приблизительно 8,5×10–4 сек–1. В некоторых вариантах осуществления, такая величина kd составляет приблизительно менее чем 8,5×10–4 сек–1.
[0262] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину kd для hTIGIT, измеренную с помощью системы ForteBio, приблизительно 3,8×10–4 сек–1. В некоторых вариантах осуществления, такая величина kd составляет приблизительно менее чем 3,8×10–4 сек–1.
[0263] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину kd для cTIGIT, измеренную с помощью системы ForteBio, приблизительно 4,6×10–3 сек–1. В некоторых вариантах осуществления, такая величина kd составляет приблизительно менее чем 4,6×10–3 sec–1.
[0264] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 3,2×105 M–1 x сек–1, величину kd for hTIGIT приблизительно 2,3×10–4 сек–1, и величину KD для hTIGIT приблизительно 7,1×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 7,0×105 M–1 x сек–1, величину kd для hTIGIT приблизительно 6,3×10–5 сек–1 и величину KD для hTIGIT приблизительно 8,1×10–11 M. В некоторых вариантах осуществления, ABP имеет величину ka для hTIGIT приблизительно 7,7×105 M–1 × сек–1, величину kd для hTIGIT приблизительно 1,4×10–4 сек–1 и величину KD для hTIGIT приблизительно 1,9×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 1,6×106 M–1 × сек–1, величину kd для hTIGIT приблизительно 8,5×10–4 сек–1 и величину KD для hTIGIT приблизительно 5,6×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 2,0×106 M–1 × сек–1, величину kd для hTIGIT приблизительно 3,8×10–4 сек–1 и величину KD для hTIGIT приблизительно 2,4×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 1,3×106 M–1 × сек–1, величину kd для hTIGIT приблизительно 3,5×10–4 сек–1 и величину KD для hTIGIT приблизительно 2,8×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 1,5×106 M–1 x сек–1, величину kd для hTIGIT приблизительно 2,4×10–4 сек–1 и величину KD для hTIGIT приблизительно 1,6×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 1,1×106 M–1 x сек–1, величину kd для hTIGIT приблизительно 6,6×10–4 сек–1 и величину KD для hTIGIT приблизительно 5,8×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 4,5×105 M–1 × сек–1, величину kd для hTIGIT приблизительно 3,5×10–4 сек–1 и величину KD для hTIGIT приблизительно 1,1×10–9 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 7,5×105 M–1 × сек–1, величину kd для hTIGIT приблизительно 5,9×10–4 сек–1 и величину KD для hTIGIT приблизительно 8,1×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 8,9×105 M–1 × сек–1, величину kd для hTIGIT приблизительно 3,8×10–4 сек–1 и величину KD для hTIGIT приблизительно 4,6×10–10 M. В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 1,4×106 M–1 x сек–1, величину kd для hTIGIT приблизительно 5,0×10–4 сек–1 и величину KD для hTIGIT приблизительно 3,6×10–10 M. В некоторых вариантах осуществления, такие величины ka, kd и KD определяют методами, описанными, например, в примере 6 патентного документа U.S. Patent No. 9713641.
[0265] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину ka для hTIGIT приблизительно 2,0×106 M–1 × сек–1, величину kd для hTIGIT приблизительно 3,8×10–4 сек–1, величину KD для hTIGIT приблизительно 2,4×10–10 M, величину ka для cTIGIT приблизительно 7,9×105 M–1 × сек–1, величину kd для cTIGIT приблизительно 4,6×10–3 сек–1, величину KD для cTIGIT приблизительно 6,2×10–9 М и величину KD для mTIGIT (SEQ ID NO: 3) более чем приблизительно 7,0×10–7 M. В некоторых вариантах осуществления, такие величины ka, kd и KD определяют методами, описанными, например, в примере 6 патентного документа U.S. Patent No. 9713641.
[0266] В некоторых вариантах осуществления, величины KD, ka и kd определяют методом поверхностного плазмонного резонанса (SPR). В некоторых аспектах, анализ методом SPR проводят на приборе BIACORE®. В некоторых аспектах, антиген иммобилизуют на биосенсорном чипе, покрытом слоем карбоксилированного декстрана (CM4 или CM5), и контактируют с предлагаемым в изобретении ABP. Константы скорости ассоциации и диссоциации могут быть рассчитаны с использованием программного обеспечения BIAevaluation® и модели Ленгмюра для связывания 1:1. В некоторых аспектах, исследование проводят при 25°C. В некоторых аспектах, исследование проводят при 37°C.
[0267] В некоторых вариантах осуществления, величины KD, ka и kd определяют методом биослойной интерферометрии (BLI). Может быть использован любой подходящий метод BLI. В некоторых аспектах, анализ методом BLI проводят на приборе FORTEBIO®. В некоторых аспектах, для фиксации ABPs на поверхности сенсора используют биосенсор с иммобилизованными антителами к Fc-фрагменту IgG (AHC). Затем, проводят мониторинг ассоциации ABP и антигена путем контактирования иммобилизированного ABP с различными концентрациями TIGIT. Затем измеряют диссоциацию антигена и ABP в буфере без TIGIT. Константы скорости ассоциации и диссоциации рассчитывают с использованием кинетических модулей программного обеспечения Analysis Software FORTEBIO®. В некоторых аспектах, исследование проводят при 30°C.
[0268] В других вариантах осуществления, величина KD может быть определена исследованием связывания меченого радиоактивным изотопом антигена, описанным в публикации Chen et al. J Mal. Biol., 1999, 293:865–881, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0269] В других вариантах осуществления, величина KD может быть определена методом MSD-SET, описанным, например, в примере 4 патентного документа U.S. Patent No. 9713641.
[0270] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC50, измеренную с помощью исследования IL-2 продукции при совместном культивировании TIGIT человека и линии Т-клеток Jurkat, описанного, например, в примере 7 патентного документа U.S. Patent No. 9713641, приблизительно 0,22 нМ, приблизительно 0,31 нМ, приблизительно 0,33 нМ, приблизительно 0,34 нМ, приблизительно 0,25 нМ, приблизительно 0,24 нМ, приблизительно 0,11 нМ, приблизительно 0,06 нМ, приблизительно 0,14 нМ, приблизительно 0,16 нМ, приблизительно 1,40 нМ, приблизительно 0,71 нМ, приблизительно 0,21 нМ, приблизительно 1,11 нМ, приблизительно 0,13 нМ, приблизительно 0,20 нМ, приблизительно 0,68 нМ или приблизительно 0,61 нМ. В некоторых вариантах осуществления, такая величина EC50 находится в диапазоне от приблизительно 0,06 нМ до приблизительно 1,40 нМ. В некоторых вариантах осуществления, такая величина EC50 составляет приблизительно 1,40 нМ или менее.
[0271] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC50, измеренную с помощью исследования IL-2 продукции при совместном культивировании TIGIT яванского макака и линии Т-клеток Jurkat, приблизительно 2,87 нМ. В некоторых вариантах осуществления, такое значение EC50 составляет приблизительно 2,87 нМ или менее. В некоторых вариантах осуществления, величина отношения EC50(cTIGIT): EC50(hTIGIT) в таком исследовании находится в диапазоне от приблизительно 2,05 до приблизительно 47,8.
[0272] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10, измеренную по продукции TNF в мононуклеарных клетках периферической крови (PBMCs), выделенных от человека-донора и обработанных, как описано, например, в примере 9 патентного документа U.S. Patent No. 9713641, в диапазоне от приблизительно 5,02 нМ до приблизительно 18,86 нМ. В некоторых вариантах осуществления, такая величина EC10 составляет приблизительно 18,86 нМ или менее.
[0273] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC50, измеренную по продукции TNF в PBMCs, выделенных от человека–донора, в диапазоне от приблизительно 12,60 нМ до приблизительно 20,60 нМ. В некоторых вариантах осуществления, такая величина EC50 составляет приблизительно 20,60 нМ или менее.
[0274] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC90, измеренную по продукции TNF в PBMCs, выделенных от человека-донора, в диапазоне от приблизительно 22,49 нМ до приблизительно 31,59 нМ. В некоторых вариантах осуществления, такая величина EC50 составляет приблизительно 31,59 нМ или менее.
[0275] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 в диапазоне от приблизительно 5,02 нМ до приблизительно 18,86 нМ, величину EC50 в диапазоне от приблизительно 12,60 нМ до приблизительно 20,60 нМ, и величину EC90 в диапазоне от приблизительно 22,49 нМ до приблизительно 31,59 нМ, в каждом случае измеренную по продукции TNF в PBMCs, выделенных от человека-донора.
[0276] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 11,94 нМ или менее, авеличину EC50 приблизительно 16,60 нМ или менее, и величину EC90 приблизительно 27,04 нМ или менее, в каждом случае измеренную по продукции TNF в PBMCs, выделенных от человека–донора.
[0277] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 18,86 нМ или менее, величину EC50 приблизительно 20,06 нМ или менее, и величину EC90 приблизительно 31,59 нМ или менее, в каждом случае измеренную по продукции TNF в PBMCs, выделенных от человека-донора.
[0278] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 5,02 нМ или менее, величину EC50 приблизительно 12,60 нМ или менее, и величину EC90 приблизительно 22,49 нМ или менее, в каждом случае измеренную по продукции TNF в PBMCs, выделенных от человека-донора.
[0279] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10, измеренную по продукции IFN-γ в CD4+ T-клетках, выделенных от человека-донора, в диапазоне от приблизительно 0,37 нМ до приблизительно 1,05 нМ. В некоторых вариантах осуществления, такая величина EC10 составляет приблизительно 1,05 нМ или менее.
[0280] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC50, измеренную по продукции IFN-γ в CD4+ T-клетках, выделенных от человека-донора, в диапазоне от приблизительно 0,94 нМ до приблизительно 1,12 нМ. В некоторых вариантах осуществления, такая величина EC50 составляет приблизительно 1,12 нМ или менее.
[0281] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC90, измеренную по продукции IFN-γ в CD4+ T-клетках, выделенных от человека-донора и обработанный, как описано в примере 9, в диапазоне от приблизительно 1,04 нМ до приблизительно 2,72 нМ. В некоторых вариантах осуществления, такая величина EC90 составляет приблизительно 2,72 нМ или менее.
[0282] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 в диапазоне от приблизительно 0,37 нМ до приблизительно 1,05 нМ, величину EC50 в диапазоне от приблизительно 0,94 нМ до приблизительно 1,12 нМ, и величину EC90 в диапазоне от приблизительно 1,04 нМ до приблизительно 2,72 нМ, в каждом случае измеренную по продукции IFN-γ в PBMCs, выделенных от человека-донора.
[0283] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 0,37 нМ или менее, величину EC50 приблизительно 1,00 нМ или менее, и величину EC90 приблизительно 2,72 нМ или менее, в каждом случае измеренную по продукции IFN-γ в PBMCs, выделенных от человека-донора.
[0284] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 0,85 нМ или менее, an EC50 приблизительно 0,94 нМ или менее и EC90 приблизительно 1,04 нМ или менее, в каждом случае измеренную по продукции IFN-γ в PBMCs, выделенных от человека-донора.
[0285] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 1,05 нМ или менее, an EC50 приблизительно 1,12 нМ или менее и EC90 приблизительно 1,19 нМ или менее, в каждом случае измеренную по продукции IFN-γ в PBMCs, выделенных от человека-донора.
[0286] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет величину EC10 приблизительно 0,75 нМ или менее, an EC50 приблизительно 1,02 нМ или менее и EC90 приблизительно 1,65 нМ или менее, в каждом случае измеренную по продукции IFN-γ в PBMCs, выделенных от человека-донора.
[0287] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 5,24×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 2,64×10–9 M (определенной методом ForteBio), hTIGIT с величиной KD приблизительно 5,40×10–11 M (определенной методом MSD-SET) и cTIGIT с величиной KD приблизительно 3,20×10–10 M (определенной методом MSD-SET).
[0288] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 4,57×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 1,57×10–9 M (определенной методом ForteBio), hTIGIT с величиной KD приблизительно 2,50×10-11 M (определенной методом MSD-SET) и cTIGIT с величиной KD приблизительно 2,30×10–10 M (определенной методом MSD-SET).
[0289] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 3,32×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 8,02×10–10 M (определенной методом ForteBio), hTIGIT с величиной KD приблизительно 8,10×10–12 M (определенной методом MSD-SET) и cTIGIT с величиной KD приблизительно 3,50×10–1 M (определенной методом MSD-SET).
[0290] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 2,46×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 3,69×10–10 M (определенной методом ForteBio), hTIGIT с величиной KD приблизительно 5,00×10–12 M (определенной методом MSD-SET) и cTIGIT с величиной KD приблизительно 1,50×10–11 M (определенной методом MSD-SET).
[0291] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 1,96×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 8,98×10–10 M (определенной методом ForteBio), hTIGIT с величиной KD приблизительно 4,90×10–12 M (определенной методом MSD-SET) и cTIGIT с величиной KD приблизительно 4,60×10–11 M (определенной методом MSD-SET).
[0292] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 3,11×10–9 M (определенной методом ForteBio) и cTIGIT с величиной KD приблизительно 1,75×10–5 M (определенной методом ForteBio).
[0293] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 2,54×10–9 M, определенной методом ForteBio.
[0294] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 3,13×10–9 M (определенной методом ForteBio) и cTIGIT с величиной KD приблизительно 2,58×10–8 M (определенной методом ForteBio).
[0295] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 2,83×10-9 M (определенной методом ForteBio) и cTIGIT с величиной KD приблизительно 9,35×10-9 M (определенной методом ForteBio).
[0296] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 1,71×10–9 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 6,55×10–9 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 1,10×10–10 M (определенной методом MSD-SET).
[0297] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 2,47×10–9 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 8,14×10–9 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 1,50×10–10 M (определенной методом MSD-SET).
[0298] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 2,35×10–9 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 6,57×10–9 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 5,60×10–11 M (определенной методом MSD-SET).
[0299] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 1,44×10–9 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 4,00×10–10 M (определенной методом MSD-SET).
[0300] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 1,23×10–9 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 3,80×10–10 M (определенной методом MSD-SET).
[0301] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 5,26×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 7,94×10–8 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 2,10×10–10 M (определенной методом MSD–SET).
[0302] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 3,78×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 7,04×10–8 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 7,00×10–11 M (определенной методом MSD–SET).
[0303] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 4,29×10–10 M (определенной методом ForteBio), cTIGIT с величиной KD приблизительно 1,10×10–7 M (определенной методом ForteBio) и hTIGIT с величиной KD приблизительно 4,10×10–11 M (определенной методом MSD-SET).
[0304] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 4,48×10–10 M (определенной методом ForteBio) и cTIGIT с величиной KD приблизительно 7,20×10–8 M (определенной методом ForteBio).
[0305] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 3,00×10–11 M.
[0306] В некоторых вариантах осуществления, предлагаемый в изобретении ABP связывает hTIGIT с величиной KD приблизительно 8,00×10–11 M.
[0307] В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,2 нМ, приблизительно 2,3 нМ, приблизительно 1,6 нМ, приблизительно 1,9 нМ, приблизительно 1,7 нМ, приблизительно 3,2 нМ, приблизительно 2,6 нМ, приблизительно 2,9 нМ, приблизительно 3,3 нМ, приблизительно 2 нМ, приблизительно 2,2 нМ, приблизительно 2,1 нМ, приблизительно 1,8 нМ, приблизительно 6,4 нМ или приблизительно 1 нМ. В некоторых вариантах осуществления, такая величина IC50 находится в диапазоне от приблизительно 1 нМ до приблизительно 6,4 нМ. В некоторых вариантах осуществления, такая величина IC50 составляет приблизительно 6,4 нМ или менее. В некоторых вариантах осуществления, такую величину IC50 определяют, как описано в примере 5 патентного документа U.S. Patent No. 9713641.
[0308] В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,4 нМ, приблизительно 1,3 нМ, приблизительно 1,2 нМ, приблизительно 1,6 нМ, приблизительно 2 нМ, приблизительно 1,2 нМ, приблизительно 1,1 нМ, приблизительно 1 нМ, приблизительно 1,8 нМ, приблизительно 1,9 нМ, приблизительно 2 нМ или приблизительно 0,8 нМ. В некоторых вариантах осуществления, такая величина IC50 находится в диапазоне от приблизительно 0,8 нМ до приблизительно 2 нМ. В некоторых вариантах осуществления, такая величина IC50 составляет приблизительно 2 нМ или менее.
[0309] В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,2 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,4 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,3 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,3 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,6 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,9 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,6 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,7 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,4 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 3,2 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,4 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,6 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,9 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,9 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,1 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 3,3 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,7 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,1 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,8 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,6 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,6 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,2 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,1 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,1 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,3 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,6 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,9 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1,8 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,9 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 6,4 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 2 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 2,3 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 1,9 нМ. В некоторых вариантах осуществления, предлагаемый в изобретении ABP ингибирует связывание PVR с TIGIT с величиной IC50 приблизительно 1 нМ и ингибирует связывание PVRL2 с TIGIT с величиной IC50 приблизительно 0,8 нМ. В некоторых вариантах осуществления, такая величина IC50 составляет приблизительно 2 нМ или менее.
2.5.1. Гликозилированные варианты
[0310] В конкретных вариантах осуществления, предлагаемый в изобретении ABP может быть изменен с целью увеличения, уменьшения или элиминирования степени гликозилирования. Гликозилирование полипептидов является или "N-связанным", или "O-связанным".
[0311] "N-связанное" гликозилирование относится к присоединению углеводного фрагмента к боковой цепи аспарагинового остатка. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту за исключением пралина, являются распознающими последовательностями для ферментного присоединения углеводного фрагмента к аспарагиновой боковой цепи. Поэтому, присутствие одной из этих трипептидных последовательностей в полипептиде создает потенциальный сайт для гликозилирования.
[0312] "O-связанное" гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего, к серину или треонину, хотя могут быть использованы и 5-гидроксипролин или 5-гидроксилизин.
[0313] Добавление сайтов N-связанного гликозилирования в предлагаемый в изобретении ABP или удаление из него этих сайтов может быть осуществлено путем альтерации аминокислотной последовательности, в результате которой создается или удаляется одна или более из описанных выше трипептидных последовательностей. Добавление или удаление сайтов O-связанного гликозилирования могут быть осуществлены путем добавления, удаления или замены одного или более сериновых или треониновых остатков в последовательности ABP или к последовательности ABP (в зависимости от конкретного случая).
[0314] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает мотив гликозилирования, который отличается от природного ABP. Любой подходящий природный мотив гликозилирования может быть модифицирован в предлагаемых в изобретении ABPs. Например, хорошо известны структурные свойства и свойства гликозилированных иммуноглобулинов, и более подробно с ними можно ознакомиться, например, в публикации, Schroeder and Cavacini, J Allergy Clin. Immunol., 2010, 125:S41-52, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0315] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает IgG1 Fc-фрагмент с модификацией олигосахарида, присоединенного к аспарагину 297 (Asn 297). Природные IgG1 антитела, продуцируемые клетками млекопитающих, обычно включают разветвленный, 2-антенарный олигосахарид, который обычно присоединен с помощью N-связи к Asn 297 в CH2 домене Fc-фрагмента. Смотрите публикацию Wright et al., TIBTECH, 1997, 15:26-32, содержание которой включено в настоящее изобретение путем ссылки на нее. Олигосахарид, присоединенный к Asn 297, может включать различные углеводы, такие как манноза, N-ацетилглюкозамин (GlcNAc), галактоза и сиаловая кислота, а также фукоза, присоединенная к GlcNAc в "стволе" структуры 2-антенарного олигосахарида.
[0316] В некоторых вариантах осуществления, олигосахарид, присоединенный к Asn 297, модифицируют для создания ABPs, имеющих измененный олигосахарид (ADCC). В некоторых вариантах осуществления, олигосахарид изменяют с целью улучшения ADCC. В некоторых вариантах осуществления, олигосахарид изменяют с целью восстановления ADCC.
[0317] В некоторых аспектах, предлагаемый в изобретении ABP включает IgG1 домен с пониженным содержанием фукозы в положении Asn 297 по сравнению с природным IgG1 доменом. Известно, что такие Fc домены имеют улучшенную ADCC. Смотрите публикацию Shields et al., J Biol. Chem., 2002, 277:26733-26740, содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых аспектах, такие ABPs не содержат никакой фукозы в положении Asn 297. Количество фукозы может быть определено любым подходящим методом, например, описанном в патентном документе WO 2008/077546, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0318] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает разделенный пополам олигосахарид, такой как 2-антенарный олигосахарид, присоединенный к Fc-фрагменту ABP, который разделен на одинаковые части с помощью GlcNAc. Такие варианты ABP могут иметь пониженное фукозилирование и/или улучшенную функцию ADCC. Примеры таких вариантов ABP описаны, например, в патентных документах WO 2003/011878; U.S. Pat. No. 6602684 и U.S. Pat. Pub. No. 2005/0123546; содержание каждого из которых включено в настоящее изобретение путем ссылки на него.
[0319] Другие иллюстративные варианты гликозилирования, которые могут быть введены в предлагаемые в изобретении ABPs, описаны, например, в патентных документах U.S. Pat. Pub. Nos. 2003/0157108, 2004/0093621, 2003/0157108, 2003/0115614, 2002/0164328, 2004/0093621, 2004/0132140, 2004/0110704, 2004/0110282, 2004/0109865; International Pat. Pub. Nos. 2000/61739, 2001/29246, 2003/085119, 2003/084570, 2005/035586, 2005/035778; 2005/053742, 2002/031140; публикациях Okazaki et al., J Mal. Biol., 2004, 336: 1239-1249; и Yamane-Ohnuki et al., Biotech. Bioeng., 2004, 87: 614-622; содержание каждой из которых включено в настоящее изобретение путем ссылки на нее.
[0320] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает Fc-фрагмент по меньшей мере с одним галактозным остатком в олигосахариде, присоединенным к Fc-фрагменту. Такие варианты ABP могут иметь улучшенную CDC функцию. Примеры таких вариантов ABP описаны, например, в патентных документах WO 1997/30087; WO 1998/58964; и WO 1999/22764; содержание каждого из которых включено в настоящее изобретение путем ссылки на него.
[0321] Примеры линии клеток, способных продуцировать дефукозилированные ABPs, включают Lec13 CHO клетки, которые являются дефицитными по фукозилированию белка (смотрите публикацию Ripka et al., Arch. Biochem. Biophys., 1986, 249:533-545; патентные документы U.S. Pat. Pub. No. 2003/0157108; WO 2004/056312; содержание каждого из которых включено в настоящее изобретение путем ссылки на нее) и линии нокаутных клеток, такие как CHO клетки, нокаутные по гену альфа-1,6-фукозилтрансферазы или FUT8 (смотрите публикации Yamane-Ohnuki et al., Biotech. Bioeng., 2004, 87: 614-622; Kanda et al., Biotechnol. Bioeng., 2006, 94:680-688; и WO 2003/085107, содержание каждой из которых включено в настоящее изобретение путем ссылки на нее).
[0322] В некоторых вариантах осуществления, предлагаемый в изобретении ABP представляет собой агликозилированный ABP. Агликозилированный ABP может быть получен любым известным или описанным в изобретении методом. В некоторых аспектах, агликозилированный ABP получают путем модификации ABP с удалением всех сайтов гликозилирования. В некоторых аспектах, сайты гликозилирования удаляют только из Fc-фрагмента ABP. В некоторых аспектах, агликозилированный ABP получают путем экспрессирования ABP в организме, который не способен осуществлять гликозилирование, таком как E. Coli, или путем экспрессирования ABP в бесклеточной реакционной смеси.
[0323] В некоторых вариантах осуществления, предлагаемый в изобретении ABP имеет константную область со сниженной эффекторной функцией по сравнению с нативным IgG1 антителом. В некоторых вариантах осуществления, аффинность константной области Fc-фрагмента предлагаемого в изобретении ABP в отношении Fc рецептора меньше чем аффинность нативной IgG1 константной области для такого Fc рецептора.
2.6. Варианты аминокислотных последовательностей Fc-фрагмента
[0324] В конкретных вариантах осуществления, предлагаемый в изобретении ABP включает Fc-фрагмент с одной или более аминокислотными заменами, вставками или делециями по сравнению с природным Fc-фрагментом. В некоторых аспектах, такие замены, вставки или делеции позволяют получать ABPs с измененной стабильностью, гликозилированием или другими характеристиками. В некоторых аспектах, такие замены, вставки или делеции позволяют получать агликозилированные ABPs.
[0325] В некоторых аспектах, Fc-фрагмент предлагаемого в изобретении ABP модифицирует с получением ABP с измененной аффинностью в отношении Fc рецептора, или ABP, который является более иммунологически инертным. В некоторых вариантах осуществления, предлагаемые в изобретении варианты ABP обладают некоторыми, но не всеми, эффекторными функциями. Такие ABPs могут применяться, например, в тех случаях, когда важным является период полувыведения ABP in vivo, но когда определенные эффекторные функции (например, активация комплемента и ADCC) не являются необходимыми или являются вредными.
[0326] В некоторых вариантах осуществления, Fc-фрагмент предлагаемого в изобретении ABP представляет собой Fc-фрагмент IgG4 человека, включающий одну или более из стабилизирующих мутаций S228P и L235E шарнирного участка. Смотрите публикацию Aalberse et al., Immunology, 2002, 105:9-19, содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых вариантах осуществления, IgG4 Fc-фрагмент включает одну или более из следующих мутаций: E233P, F234V и L235A. Смотрите публикацию Armour et al.,Mol. Immunol., 2003, 40:585-593, содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых вариантах осуществления, IgG4 Fc-фрагмент включает делецию в положении G236.
[0327] В некоторых вариантах осуществления, Fc-фрагмент предлагаемого в изобретении ABP представляет собой IgG1 Fc-фрагмент человека, включающий одну или более мутаций, для уменьшения связывания Fc рецептора. В некоторых аспектах, одна или более мутаций находятся в остатках, выбранных из S228 (например, S228A), L234 (например, L234A), L235 (например, L235A), D265 (например, D265A) и N297 (например, N297A). В некоторых аспектах, ABP включает PVA236 мутацию. PVA236 означает, что аминокислотная последовательность ELLG, из положение аминокислот 233-236 в IgG1 или EFLG в IgG4, заменена на PVA. Смотрите патентный документ U.S. Pat. No. 9150641, содержание которого включено в настоящее изобретение путем ссылки на него.
[0328] В некоторых вариантах осуществления, Fc-фрагмент предлагаемого в изобретении ABP модифицируют, как описано в публикации Armour et al., Eur. J Immunol., 1999, 29:2613-2624; патентных документах WO 1999/058572; и/или U.K. Pat. App. No. 98099518; содержание каждого из которых включено в настоящее изобретение путем ссылки на нее.
[0329] В некоторых вариантах осуществления, Fc-фрагмент предлагаемого в изобретении ABP представляет собой IgG2 Fc-фрагмент человека, включающий одну или более мутаций A330S и P331S.
[0330] В некоторых вариантах осуществления, Fc-фрагмент предлагаемого в изобретении ABP имеет аминокислотную замену в одном или более положений, выбранных из 238, 265, 269, 270, 297, 327 и 329. Смотрите патентный документ U.S. Pat. No. 6737056, содержание которого включено в настоящее изобретение путем ссылки на него. Такие Fc мутанты включают Fc мутанты с заменами в двух или более положений аминокислот 265, 269, 270, 297 и 327, в том числе так называемый Fc мутант "DANA" с заменой остатков 265 и 297 на аланин. Смотрите патентный документ U.S. Pat. No. 7332581, содержание которого включено в настоящее изобретение путем ссылки на него. В некоторых вариантах осуществления, ABP включает аланин в положении аминокислоты 265. В некоторых вариантах осуществления, ABP включает аланин в положении аминокислоты 297.
[0331] В конкретных вариантах осуществления, предлагаемый в изобретении ABP включает Fc-фрагмент с одной или более аминокислотными заменами, которые улучшают ADCC, такими как замена в одном или более из положений 298, 333 и 334 Fc-фрагмента. В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает Fc-фрагмент с одной или более аминокислотными заменами в положениях 239, 332 и 330, как описано в публикации Lazar et al., Proc. Natl. Acad. Sci. USA, 2006, 103:4005-4010, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0332] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает одну или более альтераций, которые улучшают или уменьшают Clq связывание и/или CDC. Смотрите патентные документы U.S. Pat. No. 6194551; WO 99/51642; и публикацию Idusogie et al., J Immunol., 2000, 164:4178-4184; содержание которых включено в настоящее изобретение путем ссылки на них.
[0333] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает одну или более альтераций для увеличения периода полувыведения. ABPs с повышенными периодами полувыведения и улучшенным связыванием с неонатальным Fc рецептором (FcRn) описаны, например, в публикации Hinton et al., J Immunol., 2006, 176:346-356; и в патентном документе U.S. Pat. Pub. No. 2005/0014934; содержание которых включено в настоящее изобретение путем ссылки на них. Такие Fc варианты включают Fc варианты с заменами в одном или более из остатков Fc-фрагмента: 238, 250, 256, 265, 272, 286, 303, 305, 307, 311, 312, 314, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424, 428 и 434 IgG.
[0334] В некоторых вариантах осуществления, предлагаемый в изобретении ABP включает один или более вариантов Fc-фрагмента, описанных в патентных документах U.S. Pat. Nos. 7371826, 5648260 и 5624821; в публикации Duncan and Winter, Nature, 1988, 322:738-740; и в патентном документе WO 94/29351; содержание которых включено в настоящее изобретение путем ссылки на них.
2.7. Пироглутамат
[0335] Как известно, как глутамат (E), так и глутамин (Q) на N-конце рекомбинантных белков могут спонтанно циклизироваться с образование пироглутамата (pE) in vitro и in vivo. Смотрите публикацию Liu et al., J Biol. Chem., 2011, 286:11211-11217, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0336] В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие полипептидную последовательность, имеющее pE остаток в N-терминальном положении. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие полипептидную последовательность, в которой N-терминальный остаток был превращен из Q в pE. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие полипептидную последовательность, в которой N-терминальный остаток был превращен из E в pE.
[0337] В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие VH последовательности, имеющие pE остаток в N-терминальном положении. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие VH последовательность, в которой N-терминальный остаток был превращен из Q в pE. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие VH последовательность, выбранную из SEQ ID NOs: 4-24, где N-терминальный Q остаток был превращен в pE. В некоторых вариантах осуществления, в изобретении предлагается композиция, включающая ABP, где ABP включает VH, выбранную из SEQ ID NOs: 4-24, в которых по меньшей мере прибизительно 20%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% N-терминальных остатков такой VH в такой композиции были превращены из Q в pE.
[0338] В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие VL последовательности, имеющие pE остаток в N-терминальном положении. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие VL последовательность, в которой N-терминальный остаток был превращен из E в pE. В некоторых вариантах осуществления, в изобретении предлагается ABP, включающий VL последовательность, выбранную из SEQ ID NOs: 25-28, где N-терминальный E остаток был превращен в pE. В некоторых вариантах осуществления, в изобретении предлагается композиция, включающая ABP, где ABP включает VL, выбранную из SEQ ID NOs: 25-28, в которых по меньшей мере приблизительно 20%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% N-терминальных остатков такой VL в такой композиции были превращены из E в pE.
[0339] В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие последовательности тяжелой цепи, имеющие pE остаток в N-терминальном положении. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие последовательность тяжелой цепи, в которой N-терминальный остаток был превращен из Q в pE. В некоторых вариантах осуществления, в изобретении предлагается ABP, включающий последовательность тяжелой цепи, выбранную из SEQ ID NOs: 79, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 121, 122, 123 или 124, где N-терминальный Q остаток был превращен в pE. В некоторых вариантах осуществления, в изобретении предлагается композиция, включающая ABP, где ABP включает тяжелую цепь, выбранную из SEQ ID NOs: 79, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 121, 122, 123 или 124, в которой по меньшей мере приблизительно 20%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% N-терминальных остатков такой тяжелой цепи в такой композиции были превращены из Q в pE.
[0340] В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие последовательности легкой цепи, имеющие pE остаток в N-терминальном положении. В некоторых вариантах осуществления, в изобретении предлагаются ABPs, включающие последовательность легкой цепи, в которой N-терминальный остаток был превращен из E в pE. В некоторых вариантах осуществления, в изобретении предлагается ABP, включающий последовательность легкой цепи, выбранную из SEQ ID NOs: 81, 92, 107 или 120, где N-терминальный E остаток был превращен в pE. В некоторых вариантах осуществления, в изобретении предлагается композиция, включающая ABP, где ABP включает легкую цепь, выбранную из SEQ ID NOs: 81, 92, 107 или 120, в которой по меньшей мере приблизительно 20%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% N-терминальных остатков такой легкой цепи в такой композиции были превращены из E в pE.
2.8. Сконструированные цистеиновые варианты антигенсвязывающего белка
[0341] В конкретных вариантах осуществления, в изобретении предлагаются сконструированные цистеиновые ABPs, также известные как "thioMAbs," в которых один или более остатков ABP заменены на цистеиновые остатки. В конкретных вариантах осуществления, замененные остатки встречаются в сайтах ABP, которые доступны для растворителя. В результате замены таких остатков на цистеин, в сайты ABP, которые доступны для растворителя, вводят реакционноспособные тиоловые группы, и они могут быть использованы для конъюгирования ABP с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, например, для создания иммуноконъюгата.
[0342] В конкретных вариантах осуществления, любой один или более из следующих остатков могут быть заменены на цистеин: V205 легкой цепи; A118 Fc-фрагмента тяжелой цепи; и S400 Fc-фрагмента тяжелой цепи. Сконструированные цистеиновые ABPs могут быть образованы, как описано, например, в патентном документе U.S. Pat. No. 7521541, содержание которого включено в настоящее изобретение путем ссылки на него.
2.8.1. Иммуноконъюгаты
2.8.1.1. Конъюгаты антигенсвязывающий белок-полимер
[0343] В некоторых вариантах осуществления, предлагаемый в изобретении ABP дериватизируют путем конъюгирования с полимером. Любой подходящий полимер может быть конъюгирован с ABP.
[0344] В некоторых вариантах осуществления, полимер представляет собой водорастворимый полимер. Иллюстративные примеры водорастворимых полимеров включают полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо статистические сополимеры), поли(n-винилпирролидон)-со-полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры оксид полипропилена/оксид этилена, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. В некоторых аспектах, полиэтиленгликоль-пропиональдегид может применяться при создании конъюгатов вследствие его стабильности в воде.
[0345] Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к каждому ABP, может варьироваться, и если присоединяется более чем один полимер, то эти полимеры могут быть одинаковыми или различными. Обычно, число и/или тип полимеров, используемых для дериватизации, могут быть определены на основе соображений, включающих конкретные свойства или функции ABP, которые следует улучшить, и предполагаемое применение ABP.
2.8.1.2. Конъюгаты антигенсвязывающий белок-лекарственное средство
[0346] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs конъюгируют с одним или более терапевтическими средствами. Любое подходящее терапевтическое средство может быть конъюгировано с ABP. Примеры терапевтических средств включают цитокины, хемокины и другие средства, которые индуцируют требуемую активность T-клеток, такие как OX40L, 4-1BBL, TNF-альфа (обозначаемый в изобретении как "TNF"), IL-2, слитый IL-15, CXCL9, CXCL10, IL-10, связанный с активацией TNF, IL-27, связанный с активацией TNF, и IL-35, связанный с активацией TNF. Цитокины, связанные с активацией TNF, и их применение хорошо известны и описаны, например, в публикации Economides et al., Nature Medicine, 2003, 9:47-52, содержание которой включено в настоящее изобретение путем ссылки на нее.
3. Способы получения TIGIT антигенсвязывающих белков
3.1. Получение антигена TIGIT
[0347] Антиген TIGIT, используемый для выделения предлагаемых в изобретении ABPs, может представлять собой интактный TIGIT или фрагмент TIGIT. Антиген TIGIT может находиться, например, в форме выделенного белка или белка, экспрессированного на поверхности клетки.
[0348] В некоторых вариантах осуществления, антиген TIGIT является не встречающимся в природе вариантом TIGIT, таким как белок TIGIT, имеющий аминокислотную последовательность или посттрансляционную модификацию, которые не встречаются в природе.
[0349] В некоторых вариантах осуществления, антиген TIGIT процессируют путем удаления, например, внутриклеточных или трансмембранных последовательностей или сигнальных последовательностей. В некоторых вариантах осуществления, антиген TIGIT рекомбинируют на его C-конце с IgG1 Fc доменом человека или полигистидиновым хвостом.
3.2. Методы получения моноклональных антител
[0350] Моноклональные антитела могут быть получены, например, путем использования гибридомного метода, впервые описанного в публикации Kohler et al., Nature, 1975, 256:495-497 (содержание которой включено в настоящее изобретение путем ссылки на нее) и/или методов рекомбинантных ДНК (смотрите, например, патентный документ U.S. Patent No. 4816567, содержание которого включено в настоящее изобретение путем ссылки на него). Моноклональные антитела могут быть также получены, например, путем использования библиотек фагового дисплея или дрожжевого дисплея. Смотрите, например, патентные документы U.S. Patent Nos. 8258082 и 8691730, содержание каждого из которых включено в настоящее изобретение путем ссылки на них.
[0351] В гибридомном методе, мышь или другое соответствующее животное-хозяин иммунизируют для извлечения лимфоцитов, которые продуцируют или которые способны продуцировать антитела, которые будут специфически связываются с белком, используемым для иммунизации. В качестве варианта, лимфоциты могут быть иммунизированы in vitro. Лимфоциты затем сливают с миеломными клетками, используя соответствующий реагент для проведения сливания, такой как полиэтиленгликоль, с получением гибридомных клеток. Смотрите монографию Goding J.W., Monoclonal Antibodies: Principles and Practice 3rd ed. (1986) Academic Press, San Diego, CA, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0352] Гибридомные клетки высевают и выращивают в соответствующей культуральной среде, которая содержит одно или более веществ, которые ингибируют рост или выживание неслитых исходных миеломных клеток. Например, если исходные миеломные клетки испытывают недостаток в ферменте гипоксантин-гуанинфосфорибозилтрансферазе (HGPRT или HPRT), то культуральная среда для гибридом будет обычно включать гипоксантин, аминоптерин и тимидин (среда HAT), вещества, которые предотвращают рост HGPRT-дефицитных клеток.
[0353] Подходящими миеломными клетками являются клетки, которые эффективно участвуют в сливании, поддерживают стабильно высокий уровень продукции антитела выбранными антитело-продуцирующими клетками и являются чувствительными к условиям среды, таким как присутствие или отсутствие среды HAT. Среди них, предпочтительными линиями миеломных клеток являются линии миеломных клеток грызунов, такие как миеломные клетки, полученные из опухолей мышей MOP-21 и MC-11 (которые могут быть приобретены в центре Salk Institute Cell Distribution Center, San Diego, CA) и SP-2 или X63-Ag8-653 клетки (которые могут быть приобретены в Американской коллекции типовых культур (American Type Culture Collection, Rockville, MD). Клеточные линии миеломы человека и клеточные линии гетеромиеломы мыши-человека также были описаны для продукции человеческих моноклональных антител. Смотрите, например, публикацию Kozbor, J Immunol., 1984, 133:3001, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0354] После идентификации гибридомных клеток, которые продуцируют антитела требуемой специфичности, аффинности и/или биологической активности, выбранные клоны могут быть субклонированы путем использования методик предельного разведения и выращены стандартными методами. Смотрите упомянутую выше публикацию Goding. Подходящая культуральная среда для этой цели включает, например, среду D-MEM и RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в форме асцитных опухолей у животного.
[0355] ДНК, кодирующие моноклональные антитела, могут быть легко выделены и секвенированы, используя традиционные методики (например, путем использования олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующие тяжелые и легкие цепи моноклональных антител). Поэтому, гибридомные клетки могут служить в качестве подходящего источника ДНК, кодирующих антитела, с требуемыми свойствами. После выделения, ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки хозяина, такие как бактерии (например, E. coli), дрожжи (например, Saccharomyces или Pichia sp.), COS клетки, клетки яичника китайского хомячка (CHO) или миеломные клетки, которые иным образом не продуцируют антитело, для продуцирования моноклональных антител.
3.3. Методы получения химерных антител
[0356] Иллюстративные методы получения химерных антител описаны, например, в патентном документе U.S. Pat. No. 4816567; и публикации Morrison et al., Proc. Natl. Acad. Sci. USA, 1984, 81:6851-6855; содержание которых включено в настоящее изобретение путем ссылки на них. В некоторых вариантах осуществления, химерное антитело получают путем использования рекомбинантных методов для объединения вариабельной области животного (например, вариабельной области, полученной от мыши, крысы, хомяка, кролика или низшего примата, такого как обезьяна) с константной областью человека.
3.4. Методы получения гуманизированных антител
[0357] Гуманизированные антитела могут быть образованы путем замены большинства или всех из структурных частей нечеловеческого моноклонального антитела на соответствующие последовательности человеческого антитела. В результате, получают гибридную молекулу, в которой только антигенспецифическая переменная или комплементарно определяемая область (CDR) состоит из нечеловеческой последовательности. Методы получения гуманизированных антител включают методы, описанные, например, в публикациях Winter and Milstein, Nature, 1991, 349:293-299; Rader et al., Proc. Nat. Acad. Sci. U.S.A., 1998, 95:8910-8915; Steinberger et al., J Biol. Chem., 2000, 275:36073-36078; Queen et al., Proc. Natl. Acad. Sci. U S.A., 1989, 86: 10029-10033; и патентных документах U.S. Patent Nos. 5585089, 5693761, 5693762 и 6180370; содержание которых включено в настоящее изобретение путем ссылки на них.
3.5. Методы получения человеческих антител
[0358] Человеческие антитела могут быть образованы с помощью ряда известных методов, например, путем использования трансгенных животных (например, гуманизированных мышей). Смотрите, например, публикации Jakobovits et al., Proc. Natl. Acad. Sci. U.S.A., 1993, 90:2551; Jakobovits et al., Nature, 1993, 362:255-258; Bruggermann et al., Year in Immuno., 1993, 7:33; и патентные документы U.S. Patent Nos. 5591669, 5589369 и 5545807; содержание которых включено в настоящее изобретение путем ссылки на них. Человеческие антитела могут быть также произведены из библиотек фагового дисплея (смотрите, например, публикацию Hoogenboom et al., J Mal. Biol., 1991, 227:381-388; Marks et al., J Mal. Biol., 1991, 222:581-597; и патентные документы U.S. Pat. Nos. 5565332 и 5573905; содержание которых включено в настоящее изобретение путем ссылки на них). Человеческие антитела могут также быть образованы in vitro активированными B-клетками (смотрите, например, патентные документы U.S. Patent. Nos. 5567610 и 5229275, содержание каждого из которых включено в настоящее изобретение путем ссылки на него). Человеческие антитела могут быть также произведены из библиотек дрожжевого дисплея (смотрите, например, патентный документ U.S. Patent No. 8691730, содержание которого включено в настоящее изобретение путем ссылки на него).
3.6. Методы получения фрагментов антител
[0359] Предлагаемые в изобретении фрагменты антител могут быть получены любым подходящим методом, включающим иллюстративные методы, описанные в изобретении, и хорошо известные методы. Подходящие методы включают рекомбинантные методы и протеолитическое расщепление целых антител. Иллюстративные методы получения фрагментов антител описаны, например, в публикации Hudson et al., Nat. Med., 2003, 9: 129-134, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения scFv антител описаны, например, в публикации  , in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); патентных документах WO 93/16185 и U.S. Pat. Nos. 5571894 и 5587458; содержание которых включено в настоящее изобретение путем ссылки на них.
, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); патентных документах WO 93/16185 и U.S. Pat. Nos. 5571894 и 5587458; содержание которых включено в настоящее изобретение путем ссылки на них.
3.7. Методы получения альтернативных остовов
[0360] Предлагаемые в изобретении альтернативные остовы могут быть получены любым подходящим методом, в том числе иллюстративными методами, описанными в изобретении, или известными методами. Например, методы получения аднектинов™ описаны в публикации Emanuel et al., mAbs, 2011, 3:38-48, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения iMabs описаны в патентном документе U.S. Pat. Pub. No. 2003/0215914, содержание которого включено в настоящее изобретение путем ссылки на него. Методы получения антикалинов® описаны в публикации Vogt and Skerra, Chem. Biochem., 2004, 5:191-199, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения доменов Куница описаны в публикации Wagner et al., Biochem. & Biophys. Res. Сомм., 1992, 186:118-1145, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения пептидных аптамеров тиоредоксина приведены в публикации Geyer and Brent, Meth. Enzymol., 2000, 328:171-208, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения белков-миметиков антител компании Affibody AB приведены в публикации Fernandez, Curr. Opinion in Biotech., 2004, 15:364-373, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения DARPins приведены в публикации Zahnd et al., J Mal. Biol., 2007, 369: 1015-1028, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения аффилинов приведены в публикации Ebersbach et al., J Mal. Biol., 2007, 372:172-185, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения тетранектинов приведены в публикации Graversen et al., J Biol. Chem., 2000, 275:37390-37396, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения авимеров приведены в публикации Silverman et al., Nature Biotech., 2005, 23:1556-1561, содержание которой включено в настоящее изобретение путем ссылки на нее. Методы получения финомеров приведены в публикации Silacci et al., J Biol. Chem., 2014, 289: 14392-14398, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0361] Дополнительная информация по альтернативным остовам приведена в публикациях Binz et al., Nat. Biotechnol., 2005 23: 1257-1268; и Skerra, Current Opin. in Biotech., 2007 18:295-304, содержание каждой из которых включено в настоящее изобретение путем ссылки на нее.
3.8. Методы получения вариантов
[0362] В некоторых вариантах осуществления, предлагаемый в изобретении ABP представляет собой вариант созревшей аффинности исходного ABP, который может быть генерирован, например, путем использования методов созревания аффинности на основе фагового дисплея. Вкратце, один или более CDR остатков могут быть мутированы, и варианты ABPs или их части, изображены на фаговом дисплее и подвергнуты скринингу на аффинность. Такие альтерации могут быть сделаны в CDR "горячих точках" или остатках, кодированных кодонами, которые подвергаются мутации с высокой частотой во время процесса соматического созревания (смотрите публикацию Chowdhury, Methods Mal. Biol., 2008, 207: 179-196, содержание которой включено в настоящее изобретение путем ссылки на нее), и/или остатках, которые контактируют с антигеном. Альтернативно, варианты созревшей аффинности исходного ABP могут быть генерированы или же выбраны для использования платформы презентирования на основе дрожжей (смотрите, например, патентные документы WO2009/036379, WO 2010/105256, WO 2012/009568 и публикацию Xu et al., Protein Eng Des Sel., Vol. 26(10), pp. 663-670 (2013)).
[0363] Любой подходящий метод может быть использован для введения вариабельности в полинуклеотидную последовательность (последовательности), кодирующую ABP, в том числе метод полимеразной цепной реакции (PCR) с внесением ошибок, метод рекомбинирования цепи и метод сайтнаправленного мутагенеза с использованием олигонуклеотидов, такой как метод сайтнаправленного мутагенеза с использованием тринуклеотидов (TRIM). В некоторых аспектах, несколько CDR остатков (например, 4-6 остатков одновременно) рандомизируют. CDR остатки, вовлеченные в антигенсвязывание, могут быть специфически идентифицированы, например, используя аланиновое сканирование или моделирование мутагенеза. CDR-H3 и CDR-L3, в частности, часто являются мишенями для мутации.
[0364] Введение разнообразия в вариабельные области и/или CDRs может быть использовано для продуцирования вторичной библиотеки. Затем проводят скрининг вторичной библиотеки для идентификации вариантов ABP с улучшенной аффинностью. Созревание аффинности путем конструирования и повторного выбора из вторичных библиотек было описано, например, в публикации Hoogenboom et al., Methods in Molecular Biology, 2001, 178:1-37, содержание которой включено в настоящее изобретение путем ссылки на нее.
3.9. Векторы, клетки хозяина и рекомбинантные методы
[0365] Кроме того, предлагаются выделенные нуклеиновые кислоты, кодирующие TIGIT ABPs, векторы, включающие нуклеиновые кислоты и клетки хозяина, включающие векторы и нуклеиновые кислоты, а также рекомбинантные методы получения ABPs.
[0366] Для рекомбинантного получения ABP, кодирующая его нуклеиновая кислота (кислоты) может быть выделена и вставлена в реплицируемый вектор для дальнейшего клонирования (то есть, амплификации ДНК) или экспрессии. В некоторых аспектах, нуклеиновая кислота может быть получена методом гомологической рекомбинации, например, описанном в патентном документе U.S. Patent No. 5204244, содержание которого включено в настоящее изобретение путем ссылки на него.
[0367] Известно много различных векторов. Компоненты вектора обычно включают один или более из следующих: сигнальную последовательность, точку начала репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминатора транскрипции, например, описанные в патентном документе U.S. Patent No. 5534615, содержание которого включено в настоящее изобретение путем ссылки на него.
[0368] Иллюстративные примеры подходящих клеток хозяина приведены ниже. Но подразумевается, что эти клетки хозяина не являются ограничениями для изобретения, и любая клетка хозяина может быть использована для продуцирования предлагаемых в изобретении ABPs.
[0369] Подходящие клетки хозяина включают любые прокариотные (например, бактериальные), низшие эукариотные (например, дрожжевые) или высшие эукариотные (например, млекопитающих) клетки. Подходящие прокариоты включают эубактерии, такие как грам-отрицательные или грам-положительные организмы, например, энтеробактерии, такие как эшерихия (кишечная палочка), энтеробактер, эрвиния, клебсиелла, протеус, сальмонелла (S. typhimurium), серрация (серрация марцесценс), шигеллы, бациллы (сенная палочка и B. licheniformis), псевдомонас (псевдомонас аэругиноза) и стрептомицеты. Одним подходящим клонирующим хозяином E. coli является E. coli 294, хотя могут также применяться и другие штаммы, такие как E. coli B, E. coli X1776 и E. coli W3110.
[0370] Помимо прокариотов, эукариотические микробы, такие как мицелиальные грибы или дрожжи являются также подходящими клонирующими или экспрессирующими хозяином для TIGIT ABP-кодирующих векторов. Saccharomyces cerevisiae или обычные пекарские дрожжи представляют собой традиционно используемые низшие эукариотические микроорганизмы хозяина. Однако, доступны и могут применяться и ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe, Kluyveromyces (K. lactis, K. fragilis, K. bulgaricus, K. wickeramii, K. waltii, K. drosophilarum, K. thermotolerans и K. marxianus), Yarrowia, Pichia pastoris, Candida (C. albicans), Trichoderma reesia, Neurospora crassa, Schwanniomyces (S. occidentalis) и мицелиальные грибы, такие как, например Penicillium, Tolypocladium и Aspergillus (A. nidulans и A. niger).
[0371] Подходящие клетки хозяина млекопитающего включают клетки COS-7, клетки HEK293, клетки почки новорожденного хомяка (BHK), клетки яичника китайского хомячка (CHO), поддерживающие клетки яичка мыши, клетки почки африканской зеленой мартышки (VERO-76) и другие подобные клетки.
[0372] Клетки хозяина, используемые для продуцирования TIGIT ABP по этому изобретению, могут быть культивированы в различных средах. Для культивирования клеток хозяина могут применяться выпускаемые промышленностью среды, такие как, например, Ham's F10, минимальная поддерживающая среда (MEM), RPMI-1640 и модифицированная по способу Дульбекко среда Игла (DMEM). Кроме того, может применяться любая из сред, описанных в публикациях Ham et al., Meth. Enz., 1979, 58:44; Barnes et al., Anal. Biochem., 1980, 102:255; и патентных документах U.S. Patent Nos. 4767704, 4657866, 4927762, 4560655 и 5122469 или WO 90/03430 и WO 87/00195, содержание которых включено в настоящее изобретение путем ссылки на них.
[0373] Любая из этих сред может быть дополнена, при необходимости, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлориды и фосфаты натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками, элементами в следовых количествах (определяемыми как неорганические соединения, обычно присутствующие при конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки, которые хорошо известны специалистам в данной области, могут быть также введены при соответствующих концентрациях.
[0374] Условия культивирования, такие как температура, pH и другие подобные параметры, являются условиями, ранее использовавшиеся для клеток хозяина, выбранных для экспрессии, и они хорошо известны любому специалисту в данной области.
[0375] При использовании рекомбинантных методов, ABP может быть продуцирован внутриклеточно, в периплазматическом пространстве или непосредственно секретирован в среду. Если ABP продуцируют внутриклеточно, для начала удаляют частицы дебриса, либо клеток хозяина, либо лизированных фрагментов, например, центрифугированием или ультрафильтрацией. Например, в публикации Carter et al., Bio/Technology, 1992, 10:163-167, содержание которой включено в настоящее изобретение путем ссылки на нее, описана методика выделения ABPs, которые секретируют в периплазматическом пространстве E. coli. Вкратце, клеточную массу размораживают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 минут. Клеточный дебрис может быть удален центрифугированием.
[0376] В некоторых вариантах осуществления, ABP продуцируют в бесклеточной системе. В некоторых аспектах, бесклеточная система представляет собой in vitro систему транскрипции и трансляции, описанную в публикации Yin et al., mAbs, 2012, 4:217-225, содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых аспектах, бесклеточная система использует бесклеточный экстракт из эукариотических клеток или из прокариотических клеток. В некоторых аспектах, прокариотическая клетка представляет собой E. coli. Бесклеточная экспрессия ABP может применяться, например, в тех случаях, когда ABP накапливается в клетке в форме нерастворимого агрегата или когда являются низкими величины выходов от периплазматической экспрессии.
[0377] Когда ABP секретируют в среду, надосадочные жидкости из таких экспрессирующих систем сначала обычно концентрируют, используя выпускаемый промышленностью фильтр для концентрирования белка, например, устройство для ультрафильтрации Amicon® или Millipore® Pellcon®. Ингибитор протеазы, такой как PMSF, может быть введен на любой из предшествующих стадий для ингибирования протеолиза, и могут быть введены антибиотики для предотвращения роста инородных примесей.
[0378] Композиция ABP, приготовленная из клеток, может быть очищена, например, методом хроматографии с гидроксиапатитом, гель-электрофореза, диализа и аффинной хроматографии, при этом метод аффинной хроматографии является особенно подходящим методом очистки. Возможность применения белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc домена иммуноглобулина, который присутствует в ABP. Белок A может быть использован для очистки ABPs, которые включают γ1, γ2 или γ4 тяжелые цепи человека (публикация Lindmark et al., J Immunol. Meth., 1983, 62:1-13, содержание которой включено в настоящее изобретение путем ссылки на нее). Белок G применяют для всех мышиных изотипов и для γ3 человека (публикация Guss et al., EMBO J, 1986, 5: 1567-1575, содержание которой включено в настоящее изобретение путем ссылки на нее).
[0379] Матрица, к которой присоединяют аффинный лиганд, представляет собой чаще всего арагозу, но доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или полистиролдивинилбензол, позволяют использовать более высокие скорости потока и более короткое время на обработку, чем в случае использования арагозы. В случае, когда ABP включает CH3 домен, для очистки применяют смолу BakerBond ABX®.
[0380] Кроме того, доступны другие методы для очистки белка, такие как фракционирование на колонке с ионообменной смолой, осаждение этанолом, высокоэффективная жидкостная хроматография с обращенной фазой, хроматография на силикагеле, хроматография на гепарин-сефарозе®, хроматофокусирование, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия и осаждение сульфатом аммония, и они могут быть применены любым специалистом в данной области.
[0381] После любой стадии (стадий) предварительной очистки, смесь, включающая соответствующий ABP и примеси, может быть подвергнута хроматографии с гидрофобным взаимодействием при низком значении pH, используя элюирующий буфер при pH от приблизительно 2,5 до приблизительно 4,5, которую обычно проводят при низких концентрациях солей (например, от приблизительно 0 до приблизительно 0,25 M соли).
4. Исследования
[0382] Для идентификации и анализа предлагаемых в изобретении ABPs для TIGIT может быть использован ряд хорошо известных исследований.
4.1. Исследования связывания, конкуренции и картирования эпитопа
[0383] Специфическая антигенсвязывающая активность предлагаемых в изобретении ABPs может быть оценена любым подходящим методом, включая использование методов SPR BLI, RIA и MSD-SET, описанных в разных местах в этом изобретении. Кроме того, антигенсвязывающая активность может быть оценена путем проведения исследований с помощью твердофазного иммуноферментного анализа (ELISA) и вестерн-блоттинга.
[0384] Исследования по измерению конкуренции между двумя ABPs или ABP и другой молекулой (например, одним или более лигандами TIGIT) описаны в разных местах в этом изобретении и, например, в руководстве Harlow and Lane, Antibodies: A Laboratory Manual ch.14, 1988, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y, содержание которого включено в настоящее изобретение путем ссылки на него.
[0385] Исследования по картированию эпитопов, с которыми связываются предлагаемые в изобретении ABPs, описаны, например, в публикации Morris "Epitope Mapping Protocols," in Methods in Molecular Biology vol. 66, 1996, Humana Press, Totowa, N.J., содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых вариантах осуществления, эпитоп определяют методом конкуренции пептидов. В некоторых вариантах осуществления, эпитоп определяют масс-спектроскопией. В некоторых вариантах осуществления, эпитоп определяют кристаллографическим методом.
[0386] В некоторых вариантах осуществления, "сканирование аланином" или "картирование с помощью аланина" используют для картирования эпитопов белка-мишени и/или паратопов антитела. Сканирование аланином используют для определения вклада указанного остатка в стабильность или функцию данного белка. Смотрите, например, публикацию Weiss et al., Proc Natl Acad Sci 2000 Aug l; 97(16): 8950-8954.
4.2. Исследования антагонизма в отношении TIGIT
[0387] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs подвергают скринингу для идентификации или анализа ABPs с антагонистической активностью в отношении TIGIT. Для идентификации или анализа таких ABPs может быть использовано любое подходящее исследование. В некоторых аспектах, исследование позволяет измерить количество цитокина, секретируемого эффекторной Т-клеткой после контактирования эффекторной Т-клетки с предлагаемым в изобретении ABP. В некоторых аспектах, цитокин выбирают из IL-2, IL-6, LT-α, TNF, GM-CSF, IFNγ и их комбинацией. В некоторых аспектах, цитокин выбирают из sCD40L, VEGF, TGF-α, RANTES, PDGF-AB/BB, PDGF-AA, MIP-1β, MIP-1α, MDC (CCL22), MCP-3, MCP-1, IP-10, IL-17A, IL-2Rα, IL-15, IL-13, IL-12 (p70), IL-12 (p40), IL-10, IL-9, IL-8, IL-7, IL-5, IL-4, IL-3, IL-2, IL-2Rα, IL-IRA, IL-1β, IL-1α, IFNγ, IFNα2, GRO, GM-CSF, G-CSF, фракталкина, лиганда Flt-3, FGF-2, эотаксина, EGF и их комбинаций.
[0388] В некоторых вариантах осуществления, эффекторные клетки костимулируют с агонистом CD3 для промотирования секреции цитокинов эффекторной клеткой. В некоторых аспектах, предлагается CD3 агонист при субмаксимальном уровне.
[0389] В некоторых аспектах, такие исследования позволяют измерять пролиферацию эффекторной Т-клетки после контактирования эффекторной Т-клетки с предлагаемым в изобретении ABP. В некоторых аспектах, пролиферацию эффекторной Т-клетки измеряют путем разбавления красителя (например, диацетатсукцинимидилового эфира карбоксифлуоресцеина; CFSE), по поглощению меченного тритием тимидина, путем проведения люминисцентных анализов выживаемости клеток или путем проведения других известных исследований.
[0390] В некоторых аспектах, такие исследования позволяют измерять дифференцировку, продукцию цитокинов, жизнеспособность (например, выживание), пролиферацию или супрессивную активность регуляторной T-клетки после контактирования регуляторной T-клетки с предлагаемым в изобретении ABP.
[0391] В некоторых аспектах, такие исследования позволяют измерять цитотоксическую активность NK-клетки после контактирования NK-клетки с предлагаемым в изобретении ABP. В некоторых аспектах, цитотоксическую активность NK-клетки измеряют, используя исследование цитоксичности, которое позволяет количественно определить NK-опосредованное уничтожение клеток-мишеней (например, клеточной линии K562). Смотрите публикацию Jang et al., Ann. Clin. Lab. Sci., 2012, 42:42-49, содержание которой включено в настоящее изобретение путем ссылки на нее.
[0392] В некоторых аспектах, такие исследования позволяют измерять количество гранзима B. В некоторых аспектах, такие исследования позволяют измерять количество перфорина.
4.3. Исследования эффекторных функций
[0393] Эффекторная функция после обработки с помощью предлагаемых в изобретении ABPs может быть оценена путем проведения ряда известных in vitro и in vivo исследований, включая исследования, описанные в публикациях и патентных документах Ravetch and Kinet, Annu. Rev. Immunol., 1991, 9:457-492; U.S. Pat. Nos. 5500362, 5821337; Hellstrom et al., Proc. Nat'l Acad. Sci. USA, 1986, 83:7059-7063; Hellstrom et al., Proc. Nat'l Acad. Sci. USA, 1985, 82: 1499-1502; Bruggemann et al.,J Exp. Med., 1987, 166:1351-1361; Clynes et al., Proc. Nat'l Acad. Sci. USA, 1998, 95:652-656; WO 2006/029879; WO 2005/100402; Gazzano-Santoro et al., J Immunol. Methods, 1996, 202:163-171; Cragg et al., Blood, 2003, 101:1045-1052; Cragg et al. Blood, 2004, 103:2738-2743; and Petkova et al., Int'l. Immunol., 2006, 18:1759-1769; содержание которых включено в настоящее изобретение путем ссылки на них.
5. Фармацевтические композиции
[0394] Предлагаемые в изобретении ABPs могут быть приготовлены в форме любой подходящей фармацевтической композиции и введены любым подходящим способом введения. Подходящие способы введения включают, но этим не ограничивая, интраартериальный, интрадермальный, внутримышечный, интраперитонеальный, внутривенный, назальный, парентеральный, пульмональный и подкожный способы введения.
[0395] Фармацевтическая композиция может включать один или более фармацевтических вспомогательных веществ. Может быть использовано любое подходящее фармацевтическое вспомогательное вещество, и любой специалист в данной области способен выбрать подходящие фармацевтические вспомогательные вещества. Соответственно, предполагается, что представленные ниже фармацевтические вспомогательные вещества являются только иллюстративными примерами и не огранивают настоящее изобретение. Дополнительные фармацевтические вспомогательные вещества включают, например, фармацевтические вспомогательные вещества, описанные в справочном руководстве Handbook of Pharmaceutical Excipients, Rowe et al. (Eds.) 6th Ed. (2009), содержание которого включено в настоящее изобретение путем ссылки на нее.
[0396] В некоторых вариантах осуществления, фармацевтическая композиция включает антивспениватель. Может быть использован любой подходящий антивспениватель. В некоторых аспектах, антивспениватель выбирают из спирта, эфира, масла, воска, силикона, поверхностно-активного вещества и их комбинаций. В некоторых аспектах, антивспениватель выбирают из минерального масла, растительного масла, этилен бис-стеарамида, твердого парафина, эфира воска, жирного спирта в форме воска, длинноцепочечного жирного спирта, жирнокислотного мыла, эфира жирной кислоты, силиконгликоля, фторсиликона, сополимера полиэтиленгликоль-полипропиленгликоль, полидиметилсилоксан-диоксида кремния, эфира, октилового спирта, каприлового спирта, сорбитан триолеата, этилового спирта, 2-этилгексанола, диметикона, олеилового спирта, симетикона и их комбинаций.
[0397] В некоторых вариантах осуществления, фармацевтическая композиция включает сорастворитель. Иллюстративные примеры сорастворителей включают этанол, полиэтиленгликоль, бутиленгликоль, диметилацетамид, глицерин, пропиленгликоль и их комбинации.
[0398] В некоторых вариантах осуществления, фармацевтическая композиция включает буфер. Иллюстративные примеры буферов включают ацетат, борат, карбонат, лактат, малат, фосфат, цитрат, гидроксид, диэтаноламин, моноэтаноламин, глицин, метионин, гуаровую камедь, глутамат натрия и их комбинации.
[0399] В некоторых вариантах осуществления, фармацевтическая композиция включает носитель или наполнитель. Иллюстративные примеры носителей или наполнителей включают лактозу, мальтодекстрин, маннит, сорбит, хитозан, стеариновую кислоту, ксантановую камедь, гуаровую камедь и их комбинации.
[0400] В некоторых вариантах осуществления, фармацевтическая композиция включает поверхностно-активное вещество. Иллюстративные примеры поверхностно-активных веществ включают d-альфа токоферол, бензалкония хлорид, бензетония хлорид, цетримид, цетилпиридиния хлорид, докузат натрий, глицерил бегенат, глицерил моноолеат, лауриновую кислоту, макрогол 15 гидроксистеарат, миристиловый спирт, фосфолипиды, алкиловые эфиры полиоксиэтилена, эфиры полиоксиэтиленсорбитана и жирных кислот, полиоксиэтиленстеараты, полиоксиглицериды, лаурилсульфат натрия, эфиры сорбитана, полиэтиленгликольсукцинат витамина E и их комбинации.
[0401] В некоторых вариантах осуществления, фармацевтическая композиция включает антислеживатель. Иллюстративные примеры антислеживателей включают фосфат кальция (триосновной), гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, оксид магния и их комбинации.
[0402] Другие вспомогательные вещества, которые могут быть использованы в фармацевтических композициях, включают, например, альбумин, антиоксиданты, антибактериальные средства, противогрибковые средства, биопоглощаемые полимеры, хелатообразующие средства, контролирующие высвобождение средства, разбавители, диспергирующие средства, усилители растворения, эмульгаторы, гелеобразователи, мазевые основы, вещества, способствующие проникновению, консерванты, солюбилизирующие средства, растворители, стабилизаторы, сахара и их комбинации. Конкретные примеры каждого из этих средств описаны, например, в справочном руководстве Handbook of Pharmaceutical Excipients, Rowe et al. (Eds.) 6th Ed. (2009), The Pharmaceutical Press, содержание которого включено в настоящее изобретение путем ссылки на него.
[0403] В некоторых вариантах осуществления, фармацевтическая композиция включает растворитель. В некоторых аспектах, растворитель представляет собой солевой раствор, такой как стерильные изотонический солевой раствор или раствор декстрозы. В некоторых аспектах, растворитель представляет собой воду для инъекции.
[0404] В некоторых вариантах осуществления, фармацевтические композиции находятся в форме частиц, таких как микрочастица или наночастица. Микрочастицы и наночастицы могут быть образованы из любого подходящего материала, такого как полимер или липид. В некоторых аспектах, микрочастицы или наночастицы представляют собой мицеллы, липосомы или полимерсомы.
[0405] Кроме того, в изобретении предлагаются безводные фармацевтические композиции и лекарственные формы, включающие ABP, так как вода может способствовать разложению некоторых ABPs.
[0406] Предлагаемые в изобретении безводные фармацевтические композиции и лекарственные формы могут быть приготовлены с использованием безводных или содержащих низкий процент влаги ингредиентов и в условиях с низким количеством враги или с низкой влажностью. Фармацевтические композиции и лекарственные формы, которые включают лактозу и по меньшей мере один активный ингредиент, который включает первичный или вторичный амин, могут быть безводными, если ожидается существенный контакт с влагой и/или влажностью в процессе приготовления, фасовки и/или хранения.
[0407] Безводную фармацевтическую композицию следует приготавливать и хранить таким образом, чтобы сохранялась ее безводная природа. Соответственно, безводные композиции могут быть расфасованы с использованием материалов, по поводу которых известно, что они предотвращают возможность воздействия воды, вследствие чего они могут быть включены в соответствующие фармакологические наборы. Примеры подходящей упаковки включают, но этим не ограничивая, герметически закрываемые материалы из фольги, пластики, контейнеры для разовой дозы (например, ампулы), блистерные упаковки и контурные упаковки.
5.1. Парентеральные лекарственные формы
[0408] В конкретных вариантах осуществления, предлагаемые в изобретении ABPs приготавливают в виде парентеральных лекарственных форм. Парентеральные лекарственные формы могут быть введены субъектам различными способами, включающими, но этим не ограничивая, подкожный, внутривенный (в том числе инфузии и болюсные инъекции), внутримышечный и интраартериальный способ введения. Так как их введение обычно осуществляется в обход природной защиты субъектов от загрязняющих примесей, парентеральные лекарственные формы являются обычно стерильными или их можно подвергать стерилизации перед введением субъекту. Примеры парентеральных лекарственных форм включают, но этим не ограничивая, готовые для инъекции растворы, сухие (например, лиофилизированные) продукты, легко растворимые или суспендируемые в фармацевтически приемлемой среде для инъекции, готовые для инъекции суспензии и эмульсии.
[0409] Подходящие среды, которые могут быть использованы для приготовления парентеральных лекарственных форм, хорошо известны специалистам в данной области. Примеры включают, но этим не ограничивая, воду для инъекции USP; водные среды, такие как, но этим не ограничивая, раствор хлорида натрия для инъекции, раствор Рингера для инъекции, раствор декстрозы для инъекции, раствор декстрозы и хлорида натрия для инъекции, и раствор Рингера с лактатом для инъекции; смешивающиеся с водой среды, такие как, но этим не ограничивая, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные среды, такие как, но этим не ограничивая, кукурузное масло, хлопковое масло, арахисовое масло, сезамовое масло, этилолеат, изопропилмиристат и бензилбензоат.
[0410] В парентеральные лекарственные формы могут быть также введены вспомогательные средства, которые увеличивают растворимость одного или более из раскрываемых в изобретении ABPs.
[0411] В некоторых вариантах осуществления, парентеральную лекарственную форму лиофилизируют. Примеры лиофилизированных препаратов описаны, например, в патентных документах U.S. Pat. Nos. 6267958 и 6171586; и WO 2006/044908, содержание каждого из которых включено в настоящее изобретение путем ссылки на него.
6. Доза и лекарственные формы с разовой дозой
[0412] При медикаментозном лечении человека, врач должен определить дозу, которую он считает наиболее подходящей для проведения профилактики или лечения с учетом возраста, массы тела, состояния и других факторов, специфических для субъекта, подвергаемого лечению.
[0413] В конкретных вариантах осуществления, предлагаемая в изобретении композиция представляет собой фармацевтическую композицию или лекарственную форму с разовой дозой. Предлагаемые в изобретении фармацевтические композиции и лекарственные формы с разовой дозой включают профилактически или терапевтически эффективное количество одного или более профилактических или терапевтических ABPs.
[0414] Количество ABP или композиции, которое будет являться эффективным при предотвращении или лечении расстройства или одного или более его симптомов, будет изменяться в зависимости от природы и тяжести заболевания или состояния и способа введения ABP. Частота дозирования и доза будут также изменяться в соответствии с факторами, специфическими для каждого субъекта, зависящими от вводимых конкретных терапевтических средств (например, терапевтические или профилактические средства), тяжести расстройства, заболевания или состояния, способа введения, а также возраста, массы тела, ответной реакции и истории болезни субъекта. Эффективные дозы могут быть экстраполированы из данных кривых зависимостей "доза-эффект", полученных в тест-системах in vitro или в экспериментальных моделях на животных.
[0415] В конкретных вариантах осуществления, примеры доз композиции включают миллиграммовые или микрограммовые количества ABP на килограмм массы субъекта или массы образца (например, от приблизительно 10 микрограмм на килограмм до приблизительно 50 миллиграмм на килограмм, от приблизительно 100 микрограмм на килограмм до приблизительно 25 миллиграмм на килограмм, или приблизительно от 100 микрограмм на килограмм до приблизительно 10 миллиграмм на килограмм). В конкретных вариантах осуществления, доза предлагаемого в изобретении ABP, в расчете на массу ABP, вводимая для профилактики, лечения, контроля течения или облегчения расстройства или одного или более его симптомов у субъекта составляет 0,1 мг/кг, 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 10 мг/кг или 15 мг/кг или более массы тела субъекта. В некоторых случаях, может возникать необходимость в использовании доз ABP вне раскрытых в изобретении диапазонов, что является очевидным для специалистов в данной области. Кроме того, следует отметить, что клиницист или лечащий врач хорошо представляет себе, как и когда прервать, скорректировать или закончить лечение с учетом ответной реакции субъект на лечение.
[0416] Различные терапевтически эффективные количества могут применяться в случае различных заболеваний и состояний, что является очевидным для обычных специалистов в данной области. Аналогично, количества, достаточные для профилактики, контроля, лечения или облегчения таких расстройств, но недостаточные для вызывания нежелательных побочных эффектов или достаточные для уменьшения нежелательных побочных эффектов, связанных с предлагаемыми в изобретении ABPs, также учитываются в предлагаемых в изобретении величинах доз и частоте дозирования. Кроме того, при введении субъекту многократных доз предлагаемой в изобретении композиции, необязательно, чтобы все дозы должны быть одинаковыми. Например, вводимая субъекту доза может быть увеличена для улучшения профилактического или терапевтического эффекта композиции, или она может быть понижена для ослабления одного или более побочных эффектов, которые испытывает конкретный субъект.
[0417] В конкретных вариантах осуществления, лечение или профилактика могут быть инициированы с использованием одной или более ударных доз предложенных в изобретении ABP или композиции, и затем использования одной или более поддерживающих доз.
[0418] В конкретных вариантах осуществления, доза предлагаемых в изобретении ABP или композиции может быть введена с целью достижения равновесной концентрации ABP в крови или сыворотке субъекта. Равновесная концентрация может быть определена путем измерения с помощью доступных для специалистов методов или может быть основана на физических характеристиках субъекта, таких как рост, масса и возраст.
[0419] В конкретных вариантах осуществления, введение одной и той же композиции может быть повторным, и введения могут быть разделены во времени по меньшей мере 1 днем, 2 днями, 3 днями, 5 днями, 10 днями, 15 днями, 30 днями, 45 днями, 2 месяцами, 75 днями, 3 месяцами или 6 месяцами.
[0420] Как было обсуждено более подробно в других местах этого изобретения, предлагаемый в изобретении ABP может быть необязательно введен с одним или более дополнительными средствами, применяемыми для предотвращения или лечения заболевания или расстройства. Эффективное количество таких дополнительных средств может зависеть от количества ABP, присутствующего в композиции, типа расстройства или лечения, и от других факторов, известных специалистами или описанных в изобретении.
7. Применение в терапевтических целях
[0421] Для терапевтического применения, ABPs по изобретению вводят млекопитающему, обычно, человеку, в фармацевтически приемлемой лекарственной форме, известной специалистам или описанной выше. Например, ABPs по изобретению могут быть введены человеку внутривенно в форме болюса или путем непрерывной инфузии в течение периода времени, внутримышечно, интраперитонеально, интрацереброспинально, подкожно, интраартикулярно, интрасиновиально, интратекально или интратуморально. ABPs также удобно вводить перитуморально, внутриочагово или в непосредственной близости от участка поражения для оказания местных, а также системных терапевтических воздействий. Интраперитонеальное введение может быть особенно полезным, например, при лечении опухоли яичника.
[0422] Предлагаемые в изобретении ABPs могут применяться для лечения любого заболевания или состояния, в которых принимает участие TIGIT. В некоторых вариантах осуществления, заболевание или состояние представляет собой заболевание или состояние, при которых может достигаться положительный результат при лечении с помощью ABP против TIGIT. В некоторых вариантах осуществления, заболевание или состояние представляет собой опухоль. В некоторых вариантах осуществления, заболевание или состояние представляет собой клеточное пролиферативное расстройство. В некоторых вариантах осуществления, заболевание или состояние представляет собой рак. В некоторых вариантах осуществления, заболевание или состояние представляет собой вирусную инфекцию.
[0423] В некоторых вариантах осуществления, предлагаемые в изобретении ABPs применяют в качестве лекарственного препарата. В некоторых вариантах осуществления, предлагаемые в изобретении ABPs применяют при производстве или приготовлении лекарственного препарата. В некоторых вариантах осуществления, лекарственный препарат предназначен для лечения заболевания или состояния, при которых может достигаться положительный результат при лечении с помощью ABP против TIGIT. В некоторых вариантах осуществления, заболевание или состояние представляет собой опухоль. В некоторых вариантах осуществления, заболевание или состояние представляет собой клеточное пролиферативное расстройство. В некоторых вариантах осуществления, заболевание или состояние представляет собой рак. В некоторых вариантах осуществления, заболевание или состояние представляет собой вирусную инфекцию.
[0424] В некоторых вариантах осуществления, в изобретении предлагается способ лечения заболевания или состояния у субъекта, нуждающегося в этом, путем введения эффективного количества предлагаемого в изобретении ABP субъекту. В некоторых аспектах, заболевание или состояние представляет собой рак. В некоторых аспектах, заболевание или состояние представляет собой вирусную инфекцию.
[0425] Любой подходящий вид рака может быть подвергнут лечению с помощью предлагаемых в изобретении ABPs. Иллюстративные примеры подходящих для лечения видов рака включают острый лимфобластный лейкоз (ALL), острый миелолейкоз (AML), адренокортикальную карциному, рак анального канала, рак апендикса, астроцитому, базальноклеточная карциному, опухоль головного мозга, рак желчного протока, рак мочевого пузыря, рак костей, рак молочной железы, бронхиальную опухоль, карцинома неизвестного первичного происхождения, кардиальную опухоль, рак шейки матки, хордому, рак толстой кишки, колоректальный рак, краниофарингиому, дуктальную карциному, эмбриональную опухоль, рак эндометрия, эпендимому, рак пищевода, эстезионейробластому, фиброзную гистиоцитому, саркому Юинга, рак глаза, эмбрионально-клеточную опухоль, рак желчного пузыря, рак желудка, гастроинтестинальную карциноидную опухоль, гастроинтестинальную стромальную опухоль, гестационную трофобластическую опухоль, глиому, рак головы и шеи, гепатоцеллюлярный рак, гистиоцитоз, лимфому Ходжкина, гипофарингеальный рак, интраокулярную меланому, инсулиному, саркому Капоши, рак почки, гистиоцитоз из клеток Лангерганса, рак гортани, рак губы и ротовой полости, рак печени, лобулярную карциному in situ, рак легкого, макроглобулинемию, злокачественную фиброзную гистиоцитому, меланому, карциному из клеток Меркеля, мезотелиому, метастатический сквамозный рак шеи неизвестного первичного происхождения, NUT-срединную карциному, рак рта, синдром множественных эндокринных неоплазий, множественную миелому, фунгоидный микоз, миелодиспластический синдром, миелодиспластическая/миелопролиферативная неоплазия, рак полости носа и околоносовых пазух, назофарингеальный рак, нейробластому, немелкоклеточный рак легкого, рак ротоглотки, остеосаркому, рак яичников, рак поджелудочной железы, папилломатоз, параганглиому, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромоцитому, опухоль гипофиза, плевролегочную бластому, первичную лимфому центральной нервной системы, рак предстательной железы, рак прямой кишки, почечно-клеточный рак, рак почечной лоханки и мочеточника, ретинобластому, палочковидную опухоль, рак слюнных желез, синдром Сезари, рак кожи, мелкоклеточный рак легкого, рак тонкой кишки, саркому мягких тканей, опухоль спинного мозга, рак желудка, T-клеточную лимфому, тератоидную опухоль, рак яичка, рак гортани, тимому и тимусную карциному, рак щитовидной железы, уретральный рак, рак матки, вагинальный рак, рак женских половых органов и опухоль Вильмса.
[0426] Любой подходящий вирус может быть подвергнут лечению с помощью предлагаемых в изобретении ABPs. Иллюстративные примеры подходящих для лечения вирусов включают, например, аденоассоциированный вирус, вирус Айти, лиссавирус австралийских летучих мышей, полиомавирус BK, вирус Банна, вирус леса Барма, вирус Bunyamwera, буньявирус Ла-Кросс, буньявирус американского зайца-беляка, герпесвирус мартышек, вирус Чандипура, вирус чикунгунья, косавирус A, вирус коровьей оспы, вирус Коксаки, вирус конго-крымской геморрагической лихорадки, вирус Денге, вирус Дхори, вирус Дугбе, вирус Duvenhage, вирус восточного лошадиного энцефалита, эболавирус, эховирус, вирус энцефаломиокардита, вирус Эпштейна-Барра, лиссавирус европейской летучей мыши, GB вирус C/вирус гепатита G, вирус Хантаан, вирус Хендра, вирус гепатита A, вирус гепатита B, вирус гепатита C, вирус гепатита E, вирус гепатита дельта, вирус оспы лошадей, аденовирус человека, астровирус человека, коронавирус человека, цитомегаловирус человека, энтеровирус человека, герпесвирус человека 1, герпесвирус человека 2, герпесвирус человека 6, герпесвирус человека 7, герпесвирус человека 8, вирус иммунодефицита человека, папилломавирус человека 1, папилломавирус человека 2, папилломавирус человека, парагрипп человека, парвовирус B19 человека, респираторный синцитиальный вирус человека, риновирус человека, коронавирус тяжелого острого респираторного синдрома человека, пенистый ретровирус человека, Т-лимфотропный вирус человека, торовирус человека, вирус гриппа A, вирус гриппа B, вирус гриппа C, вирус Исфахан, полиомавирус Джона Каннингема (JC), вирус японского энцефалита, аренавирус Хунина, полиомавирус KI, вирус Кунджин, вирус летучей мыши Лагос, вирус озера Виктория, вызывающий "марбургскую болезнь", вирус Лангат, вирус Ласса, вирус Лордсдэйл, вирус энцефаломиелита овец, вирус лимфоцитарного хориоменингита, вирус Мачупо, вирус Майаро, коронавирус ближневосточного респираторного синдрома, вирус кори, вирус энцефаломиокардита Менго, полиомавирус клеток Меркеля, вирус Мокола, вирус контагиозного моллюска, вирус оспы обезьян, вирус эпидемического паротита, вирус энцефалита долины Муррея, вирус Нью-Йорк, вирус Нипах, норовирус, вирус о'нъонг-нъонг, вирус контагиозного пустулезного дерматита, вирус Оропуч, вирус Пичинде, полиовирус, флебовирус Пунта-Торо, вирус Пуумала, вирус бешенства, вирус лихорадки долины Рифт, росавирус A, вирус реки Росс, ротавирус A, ротавирус B, ротавирус C, вирус коревой краснухи, вирус Сагияма, саливирус A, вирус сицилийской флеботомной лихорадки, вирус Саппоро, вирус леса Семлики, вирус Сеул, вирус пенистости обезьян, вирус обезьяны 5, вирус Синдбис, вирус Саутгемптон, вирус энцефалита Сент-Луис, передаваемый клещами вирус Повассан, вирус гепатита TTV, вирус тосканской лихорадки, вирус Уукуниеми, вирус осповакцины, вирус ветряной оспы, вирус натуральной оспы, вирус венесуэльского энцефалита лошадей, вирус везикулярного стоматита, вирус западного энцефалита лошадей, полиомавирус WU, вирус лихорадки Западного Нила, вирус опухолей обезьян Яба, вирус Яба-подобного заболевания, вирус желтой лихорадки и вирус Зика.
[0427] В некоторых вариантах осуществления, в изобретении предлагается способ агонизирования TIGIT в клетке-мишени субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP. В некоторых аспектах, антагонистическое воздействие предлагаемого в изобретении ABP в отношении TIGIT приводит к повышенной секреции IL-2, LT-α, IL-6, TNF, GM-CSF, IFNγ или их комбинаций клеткой-мишенью.
[0428] В некоторых вариантах осуществления, в изобретении предлагается способ повышения пролиферации, выживания и/или функции эффекторной Т-клетки у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP. В некоторых аспектах, эффекторная Т-клетка представляет собой CD4+ эффекторную Т-клетку. В некоторых аспектах, эффекторная Т-клетка представляет собой CD8+ эффекторную Т-клетку.
[0429] В некоторых вариантах осуществления, в изобретении предлагается способ прекращения супрессии эффекторной Т-клетки регуляторной T-клеткой у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP. В некоторых аспектах, регуляторная T-клетка представляет собой CD4+CD25+Foxp3+ регуляторную T-клетку. В некоторых аспектах, регуляторная T-клетка представляет собой CD8+CD25+ регуляторную T-клетку.
[0430] В некоторых вариантах осуществления, в изобретении предлагается способ повышения активности естественного киллера (NK) или Т-клетки естественного киллера (NKT) у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0431] В некоторых вариантах осуществления, в изобретении предлагается способ усиления иммунного ответа у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0432] В некоторых вариантах осуществления, в изобретении предлагается способ отсрочки начала развития опухоли у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0433] В некоторых вариантах осуществления, в изобретении предлагается способ предотвращения начала развития опухоли у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0434] В некоторых вариантах осуществления, в изобретении предлагается способ отсрочки начала развития рака у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0435] В некоторых вариантах осуществления, в изобретении предлагается способ предотвращения начала развития рака у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0436] В некоторых вариантах осуществления, в изобретении предлагается способ уменьшения размера опухоли у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0437] В некоторых вариантах осуществления, в изобретении предлагается способ снижения числа метастазов у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0438] В некоторых вариантах осуществления, в изобретении предлагается способ отсрочки начала развития вирусной инфекции у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0439] В некоторых вариантах осуществления, в изобретении предлагается способ предотвращения начала развития вирусной инфекции у субъекта у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0440] В некоторых вариантах осуществления, в изобретении предлагается способ уменьшения титра вируса субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0441] В некоторых вариантах осуществления, в изобретении предлагается способ элиминирования вируса у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0442] В некоторых вариантах осуществления, в изобретении предлагается способ увеличения периода общей выживаемости, среднего времени выживания или выживаемости без прогрессирования заболевания у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества предлагаемого в изобретении ABP.
[0443] В некоторых вариантах осуществления, в изобретении предлагается способ лечения субъекта, который стал резистентным к стандартному медикаментозному лечению, путем введения субъекту эффективного количества предлагаемого в изобретении ABP. В некоторых вариантах осуществления, стандартное медикаментозное лечение, к которому субъект стал резистентным, представляет собой лечение ингибитором PD-1. В других вариантах осуществления, стандартное медикаментозное лечение, к которому субъект стал резистентным, представляет собой лечение ингибитором PD-L1. В других вариантах осуществления, стандартное медикаментозное лечение, к которому субъект стал резистентным, представляет собой лечение ингибитором CTLA-4.
8. Комбинированные терапии
[0444] В некоторых вариантах осуществления, предлагаемый в изобретении ABP вводят по меньшей мере с одним дополнительным терапевтическим средством. С предлагаемым в изобретении ABP может быть введено любое подходящее дополнительное терапевтическое средство. В некоторых аспектах, дополнительное терапевтическое средство выбирают из лучевой терапии, цитотоксического средства, химиотерапевтического средства, цитостатического средства, антигормонального средства, ингибитора EGFR иммуностимулирующего средства, антиангиогенного средства и их комбинации.
[0445] В некоторых вариантах осуществления, предлагаемый в изобретении ABP вводят после хирургического удаления опухоли.
[0446] В некоторых вариантах осуществления, дополнительное терапевтическое средство включает эпигенетический модификатор. Примеры эпигенетических модификаторов включают ингибиторы ДНК-метилтрансферазы (DNMT), такие как 5-аза-2'-деоксицитидин или 5-азацитидин, которые были одобрены к применению в случаи миелодиспластического синдрома (MDS) и острого миелобластного лейкоза (AML), и ингибиторы гистондеацетилазы (HDis), включающие вориностат, ромидепсин, панобиностат, белиностат и энтиностат, которые, как было показано, проявляют активность при кожной Т-клеточной лимфоме и периферической Т-клеточной лимфоме. В некоторых вариантах осуществления по меньшей мере одно дополнительное терапевтического средство является эпигенетическим модификатором, объединенным с ингибитором PD-1 PD-L1.
[0447] В некоторых вариантах осуществления, дополнительное терапевтическое средство включает иммуностимулирующее средство.
[0448] В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой средство, которое блокирует активацию сигнального пути ингибирующего рецептора иммунной клетки или его лиганда. В некоторых аспектах, ингибирующий рецептор или его лиганд выбирают из цитотоксического Т-лимфоцит-ассоциированного белка (CTLA-4, также называемого CD152), запрограммированной гибели клетки белка 1 (также PD-1 или CD279), запрограммированной гибели лиганда 1 (также PD-L1 или CD274), трансформирующий ростовой фактор бета (TGFβ), гена-3 активации лимфоцитов (LAG-3, также CD223), Tim-3 (клеточного рецептора-2 вируса гепатита A или HAVCR2 or CD366), нейритина, аттенюатора B- и T-лимфоцитов (также BTLA или CD272), иммуноглобулин-подобных рецепторов клетки-киллера (KIRs) и их комбинаций. В некоторых аспектах, средство выбирают из антитела против PD-1 (например, пембролизумаба или ниволумаба) и антитела против PD-L1 (например, атезолизумаба), антитела против CTLA-4 (например, ипилимумаба), антителам против TIM3, молекул клеточной адгезии клеток карциноэмбрионального антигена 1 (CECAM-1, также CD66a) и 5 (CEACAM-5, также CD66e), v-set иммунорегуляторного рецептора (также VISR или VISTA), лейкоцит-связанного иммуноглобулин-подобного рецептора 1 (также LAIR1 или CD305), CD160, рецептора 2B4 природной клетки-киллера (также CD244 или SLAMF4) и их комбинаций. В некоторых аспектах, средство представляет собой пембролизумаб. В некоторых аспектах, средство представляет собой ниволумаб. В некоторых аспектах, средство представляет собой атезолизумаб.
[0449] В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой средство, которое ингибирует взаимодействие между PD-1 и PD-L1. В некоторых аспектах, дополнительное терапевтическое средство, которое ингибирует взаимодействие между PD-1 и PD-L1, выбирают из антитела, пептидомиметика и низкомолекулярного соединения. В некоторых аспектах, дополнительное терапевтическое средство, которое ингибирует взаимодействие между PD-1 и PD-L1, выбирают из пембролизумаба (KEYTRUDA), ниволумаба (OPDIVO), атезолизумаба, авелумаба, пидилизумаба, дурвалумаба, BMS-936559, сульфамонометоксина 1 и сульфаметизола 2. В некоторых вариантах осуществления, дополнительное терапевтическое средство, которое ингибирует взаимодействие между PD-1 и PD-L1, представляет собой любое терапевтическое средство, по поводу которого известно, что оно имеет такую активность, например, которое описано в публикации Weinmann et al., Chem Med Chem, 2016, 14:1576 (DOI: 10,1002/cmdc.201500566), содержание которой включено в настоящее изобретение путем ссылки на нее. В некоторых вариантах осуществления, средство, которое ингибирует взаимодействие между PD-1 и PD-L1, приготавливают в одной и той же с предлагаемым в изобретении ABP фармацевтической композиции. В некоторых вариантах осуществления, средство, которое ингибирует взаимодействие между PD-1 и PD-L1, приготавливают в отличной от предлагаемого в изобретении ABP фармацевтической композиции. В некоторых вариантах осуществления, средство, которое ингибирует взаимодействие между PD-1 и PD-L1, вводят перед введением предлагаемого в изобретении ABP. В некоторых вариантах осуществления, средство, которое ингибирует взаимодействие между PD-1 и PD-L1, вводят после введения предлагаемого в изобретении ABP. В некоторых вариантах осуществления, средство, которое ингибирует взаимодействие между PD-1 и PD-L1, вводят одновременно с предлагаемым в изобретении ABP, но средство и ABP вводят в раздельных фармацевтических композициях.
[0450] В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой агонист костимулирующего рецептора иммунной клетки. В некоторых аспектах, костимулирующий рецептор выбирают из GITR, OX40, ICOS, LAG-2, CD27, CD28, 4-1BB, CD40, STING, толл-подобного рецептора, RIG-1 и NOD-подобного рецептора. В некоторых вариантах осуществления, агонист представляет собой антитело.
[0451] В некоторых вариантах осуществления, иммуностимулирующее средство модулирует активность аргиназы, индоламин-2,3-диоксигеназы или аденозин A2A рецептора.
[0452] В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой цитокин. В некоторых аспектах, цитокин выбирают из IL-2, IL-5, IL-7, IL-12, IL-15, IL-21 и их комбинаций.
[0453] В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой онколитический вирус. В некоторых аспектах, онколитический вирус выбирают из вируса простого герпеса, вируса везикулярного стоматита, аденовируса, вируса псевдочумы птиц, вируса осповакцины и вирус Мараба.
[0454] В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой T-клетку с химерным антигенным рецептором (CAR-T клетку). В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой би- или полиспецифическое антитело, направленное на T-клетку. В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой антитело против TGF-β. В некоторых вариантах осуществления, иммуностимулирующее средство представляет собой ловушку для TGF-β.
[0455] В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой вакцину к опухолевому антигену. Любой подходящий антиген может быть таргетирован вакциной, при условии, что он присутствует в опухоли, подвергаемой методам лечения, которые предлагаются в изобретении. В некоторых аспектах, опухолевый антиген представляет собой опухолевый антиген, который сверхэкспрессируется по сравнению с уровнями его экспрессии в нормальной ткани. В некоторых аспектах, опухолевый антиген выбирают из антигена рака яичек, антигена дифференцировки, NY-ESO-1, MAGE-A1, MART и их комбинаций.
[0456] Кроме того, примеры дополнительных терапевтических средств включают таксан (например, паклитаксел или доцетаксел); средство на основе соединений платины (например, карбоплатин, оксалиплатин и/или цисплатин); ингибитор топоизомеразы (например, иринотекан, топотекан, этопозид и/или митоксантрон); фолиниевую кислоту (например, лейковорин) или нуклеозидный метаболический ингибитор (например, фторурацил, капецитабин и/или гемцитабин). В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой фолиниевую кислоту, 5-фторурацил и/или оксалиплатин. В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет 5-фторурацил и иринотекан. В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой таксан и средство на основе соединений платины. В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой паклитаксел и карбоплатин. В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой пеметрексат. В некоторых вариантах осуществления, дополнительное терапевтическое средство представляет собой таргетное терапевтическое средство, такое как EGFR, RAF или MEK-таргетное средство.
[0457] Дополнительное терапевтическое средство может быть введено любым подходящим способом. В некоторых вариантах осуществления, предлагаемый в изобретении ABP и дополнительное терапевтическое средство включают в одну и ту же фармацевтическую композиции. В некоторых вариантах осуществления, предлагаемый в изобретении ABP и дополнительное терапевтическое средство включают в разные фармацевтические композиции.
[0458] В вариантах осуществления, в которых предлагаемый в изобретении ABP и дополнительное терапевтическое средство включают в различные фармацевтические композиции, введение ABP может проводиться до, одновременно и/или после введения дополнительного терапевтического средства. В некоторых аспектах, введение предлагаемого в изобретении ABP и дополнительного терапевтического средства проводят с интервалом приблизительно в один месяц друг от друга. В некоторых аспектах, введение предлагаемого в изобретении ABP и дополнительного терапевтического средства проводят с интервалом приблизительно в одну неделю друг от друга. В некоторых аспектах, введение предлагаемого в изобретении ABP и дополнительного терапевтического средства проводят с интервалом приблизительно в один день друг от друга. В некоторых аспектах, введение предлагаемого в изобретении ABP и дополнительного терапевтического средства проводят с интервалом приблизительно двенадцать часов друг от друга. В некоторых аспектах, введение предлагаемого в изобретении ABP и дополнительного терапевтического средства проводят с интервалом приблизительно один час друг от друга.
[0459] В одном аспекте, в настоящем изобретении предлагается фармацевтическая композиция, включающая эффективное количество антитела против hTIGIT для лечения или предотвращения рака у субъекта, где композицию вводят в комбинации с антителом против Tim-3, 4-1BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает CDR-H3 последовательности SEQ ID NO: 32, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71. В одном аспекте, в настоящем изобретении предлагается фармацевтическая композиция, включающая эффективное количество антитела против hTIGIT антитело для лечения или предотвращения рака у субъекта, где композицию вводят в комбинации с антителом против Tim-3, 41BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает VH последовательности SEQ ID NO: 13 и VL последовательности SEQ ID NO: 26. В одном аспекте, в настоящем изобретении предлагается фармацевтическая композиция, включающая эффективное количество антитела против hTIGIT антитело для лечения или предотвращения рака у субъекта, где композицию вводят в комбинации с антителом против Tim-3, 41BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает тяжелую цепь последовательности SEQ ID NO: 99 и легкую цепь последовательности SEQ ID NO: 92.
[0460] В одном аспекте, в настоящем изобретении предлагается антитело против hTIGIT для применения при лечении или предотвращении рака у субъекта, где антитело против hTIGIT вводят в комбинации с антителом против Tim-3, 41BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает CDR-H3 последовательности SEQ ID NO: 32, CDR-H2 последовательности SEQ ID NO: 40, CDR-H1 последовательности SEQ ID NO: 54, CDR-L3 последовательности SEQ ID NO: 64, CDR-L2 последовательности SEQ ID NO: 68 и CDR-L1 последовательности SEQ ID NO: 71. В одном аспекте, в настоящем изобретении предлагается антитело против hTIGIT для применения при лечении или предотвращении рака у субъекта, где антитело против hTIGIT вводят в комбинации с антителом против Tim-3, 41BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 26. В одном аспекте, в настоящем изобретении предлагается антитело против hTIGIT для применения при лечении или предотвращении рака у субъекта, где антитело против hTIGIT вводят в комбинации с антителом против Tim-3, 41BB, GITR, PD-1 или PD-L1, или OX40L, где антитело против hTIGIT включает тяжелую цепь последовательности SEQ ID NO: 99 и легкую цепь последовательности SEQ ID NO: 92.
9. Методы диагностики
[0461] Кроме того, предлагаются методы детекции присутствия TIGIT на клетках, взятых у субъекта. Такие методы могут быть использованы, например, для предсказания и оценки восприимчивости к лечению с помощью предлагаемого в изобретении ABP.
[0462] В некоторых вариантах осуществления, у субъекта берут образец крови и определяют фракцию клеток, экспрессирующих TIGIT. В некоторых аспектах, определяют относительное количество TIGIT, экспрессированного такими клетками. Фракцию клеток, экспрессирующих TIGIT, и относительное количество TIGIT, экспрессированного такими клетками, может быть определено любым подходящим методом. В некоторых вариантах осуществления, для того чтобы провести такие измерения, используют проточную цитометрию. В некоторых вариантах осуществления, для того чтобы провести такое измерение, используют сортировку клеток с помощью флуоресценции (FACS). По поводу методов оценки экспрессии TIGIT в периферической крови смотрите публикацию Li et al., J Autoimmunity, 2003, 21:83-92.
10. Наборы
[0463] Кроме того, предлагаются наборы, включающие предлагаемые в изобретении ABPs. Наборы могут быть использованы для лечения, предотвращения и/или диагностики описанного в изобретении заболевания или расстройства.
[0464] В некоторых вариантах осуществления, набор включает контейнер и этикетку или вложенную в упаковку инструкцию по применению лекарственного препарата, находящуюся на контейнере или связанную с контейнером. Подходящие контейнеры включают, например, бутылки, ампулы, шприцы и пакеты для растворов для внутривенного введения. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе, или в комбинации с другой композицией, является эффективной при лечении, предотвращении и/или диагностике заболевания или расстройства. Контейнер может иметь стерильное входное отверстие. Например, если контейнер представляет собой пакет для раствора для внутривенного введения или флакон, он может иметь входное отверстие, которое может быть проколото иглой. По меньшей мере, одно активное средство в композиции представляет собой предлагаемый в изобретении ABP. Этикетка или вложенная в упаковку инструкция по применения лекарственного препарата указывает, что композиция предназначена для лечения указанного состояния.
[0465] В некоторых вариантах осуществления, набор включает (a) первый контейнер с содержащейся в нем первой композицией, где первая композиция включает предлагаемый в изобретении ABP; и (b) второй контейнер с содержащейся в нем второй композицией, где вторая композиция включает дополнительное терапевтическое средство. Набор в этом варианте осуществления изобретения может дополнительно включать вложенную в упаковку инструкцию по применению лекарственного препарата, указывающую, что композиции могут использоваться для лечения конкретного состояния.
[0466] В качестве варианта или дополнительно, набор может также включать второй (или третий) контейнер, содержащий фармацевтически приемлемое вспомогательное вещество. В некоторых аспектах, вспомогательное вещество представляет собой буфер. Кроме того, набор может включать другие материалы, необходимые с коммерческой точки зрения и с точки зрения потребителя, в том числе фильтры, иглы и шприцы.
ПРИМЕРЫ
[0467] Далее приведены примеры методов и композиций по изобретению. Следует иметь в виду, что могут применяться на практике и другие различные варианты осуществления в соответствие с приведенным в изобретении общим описанием.
Пример 1. Мутационный анализ для определения эпитопа
Сканирование аланином
[0468] Для идентификации эпитопа для связывания MAB10 с TIGIT человека были выполнены одноточечные мутации в 18 положении аланина. Белки экспрессировали в клетках HEK-293, секретировали в форме растворимого белка, очищали на смоле Ni-NTA и анализировали методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE). Связывание оценивали методом интерферометрии слоя биомолекул (BLI), используя платформу Octet. MAB10 захватывали на анти-человеческих Fc сенсорах, промывали и подвергали воздействию либо мономерного немутантного TIGIT человека, либо одного из выбранных точечных мутантов. Рассматриваемая часть остатков эпитопа связывания демонстрировала пониженное связывание (например, KD более чем в 5 раз ниже, чем в случае связывания с немутантным TIGIT человека). Аланиновая замена в остатках Q56, N58, L65, I68, N70, L73, H76, I77 и P79 приводила к понижению связывания. Аланиновая замена в остатках M23, T24, T55, Q62, S78, S80, K82, Y113 и P114 не приводила к снижению связывания.
[0469] Для идентификации эпитопа для связывания MAB2, MAB15 и MAB21 с TIGIT человека, оценивали связывание с аланином с точечными мутациями в положении 7, используя метод интерферометрии слоя биомолекул (BLI), описанный в предыдущем абзаце.
[0470] Для MAB2, аланиновая замена в остатках Q56 и I77 приводила к понижению связывания, и аланиновая замена в остатках I68, L73, H76, S78 и P79 не приводила к снижению связывания.
[0471] Для MAB15, аланиновая замена в остатках Q56, I68, L73, H76 и I77 приводила к снижению связывания, и аланиновая замена в остатках S78 и P79 не приводила к снижению связывания.
[0472] Для MAB21, аланиновая замена в остатках Q56, I68, L73 и I77 приводила к снижению связывания, и аланиновая замена в остатках H76, S78 и P79 не приводила к снижению связывания.
Масс-спектрометрия
[0473] Для идентификации эпитопа для MAB10 связывания с TIGIT человека, очищенное MAB10 и образцы TIGIT HIS человека передавали в компанию CovalX (Saugus, MA USA) для масс-спектрометрического анализа с использованием методологии перекрестных связей, которая позволяет осуществлять детекцию нековалентных взаимодействий. MAB10 и HIS TIGIT человека инкубировали с дейтерированными кросс-линкерами и подвергали мультиферментному расщеплению. После обогащения сшитых пептидов, образцы подвергали анализу методом масс-спектрометрии высокого разрешения. Протеолиз как с трипсином, так и эластазой не продуцировал ни каких сшитых пептидов, тогда протеолиз с химотрипсином, ASP-N и термолизином действительно обнаруживал по меньшей мере один сшитый пептид в объеме 11 сшитых пептидов. Результаты указывают, что эпитоп связывания включает остатки, которые были сшиты. Они включают остатки в двух областях, одну область, включающую остатки S78 и R84, и другую область, включающую остатки T117, S129 и S130.
Кристаллографический подход для определения эпитопа
[0474] Эпитоп связывания MAB10 также идентифицировали с помощью кристаллографических исследований. Образовывали комплекс MAB10 Fab с TIGIT человека, очищали гель-хроматографией и концентрировали до 10 мг/мл. Кристаллы выращивали из раствора 14% PEG4000, 0,1 MES pH 6, 10 мМ β-никотинамидаденин-динуклеотида гидрата, 0,5% н-додецил-β-D-мальтозида. Рентгеновский анализ проводили в Аргоннской национальной лаборатории (Argonne National Laboratories) (GM/CA CAT 231D-D) и полученные данные обрабатывали с использованием CCP4 (Collaborative Computational Project No. 4, Software for Macromolecular X-Ray Crystallography) и Phenix (Python-based Hierarchical ENvironment for Integrated Xtallography). TIGIT остатки на расстоянии контакта не более чем  от тяжелой и легкой цепи представляли собой рассматриваемую часть эпитопа связывания и включали T55, Q56, L65, D72, L73, H76, I77, S78, P79 и H111.
от тяжелой и легкой цепи представляли собой рассматриваемую часть эпитопа связывания и включали T55, Q56, L65, D72, L73, H76, I77, S78, P79 и H111.
Пример 2. Комбинированные терапии, включающие ABPs против TIGIT и иммунотерапевтические средства
[0475] Для оценки Т-клеточных иммунных реакций в цитомегаловирус-специфических (CMV+) T-клетках проводили исследование пролиферации лимфоидных клеток. Мононуклеарные клетки периферической крови (PBMCs) от индивидуальных доноров, которые были подвергнуты скринингу на CMV антигенную реактивность, были получены из Astarte Biologics (Bothell, WA). Клеточные лизаты из CMV-инфицированных клеток также были получены из Astarte Biologics. Мононуклеарные клетки периферической крови (PBMCs) высевали в планшетах при плотности 5×105 клеток/лунка, и проводили антигенспецифическую стимуляцию путем добавления клеточного лизата, который стимулирует CMV+ T-клетки в образце, при 1 мг/мл, 0,1 мг/мл или 0,01 мг/мл. В качестве контролей использовали нестимулированные клетки, стимулированные клетки без обработки иммунотерапевтическим средством и стимулированные клетки с обеими контрольными антителами для группы, подвергаемой комбинированной обработке. Экспериментальные группы обрабатывали с помощью MAB10 (20 мкг/мл) в сочетании с контрольным антителом для дополнительного иммунотерапевтического средства, с помощью дополнительного иммунотерапевтического средства с IgG4 контрольным антителом (в качестве контроля для MAB10) (смотрите таблица 6) или с помощью комбинации MAB10 и дополнительного терапевтического средства. Каждую обработку проводили на клетках, стимулированных с помощью всех трех концентраций лизата. Дозирование иммунотерапевтического средства определяли на основе комбинации опубликованных в литературе функциональных доз, величин ED50 и эмпирических данных. Клетки культивировали в течение четырех дней, и надосадочные жидкости собирали и анализировали на продуцирование эффекторного цитокина TNF в качестве количественной оценки активации.
Таблица 6.
Результаты
[0476] Результаты представлены на фигуре 1 в следующем виде: клетки стимулировали 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл CMV лизатом и обрабатывали с помощью MAB10 и пембролизумаба, каждым индивидуально или в комбинации (фигуры 1A-1C, соответственно); клетки стимулировали 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл CMV лизатом и обрабатывали с помощью MAB10 и антителом против TIM-3, каждым индивидуально или в комбинации (фигуры 1D-1F); клетки стимулировали 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл CMV лизатом и обрабатывали с помощью MAB10 и антителом против 41BB, каждым индивидуально или в комбинации (фигуры 1G-1I); и клетки стимулировали 1 мкг/мл, 0,1 мкг/мл или 0,01 мкг/мл CMV лизатом и обрабатывали с помощью MAB10 и rhOX40L, каждым индивидуально или в комбинации (фигуры 1J-1L). Каждая комбинированная обработка, включающая пембролизумаб, антитело против TIM-3, антитело против 41BB или лиганд OX40, продемонстрировала аддитивное действие на иммунную активацию (измеряемое по продукции TNFα) по сравнению с обработками только индивидуальными одним индивидуальным средством.
[0477] В случае обработки с помощью анти-LAG-3 и анти-TGF, обработки только одним индивидуальным средством приводили к более высоким результатам, и было невозможно определить, достигались ли в этом исследовании аддитивные или синергетические эффекты. Обработка только с помощью одного анти-CTLA-4 не приводила к повышению иммунного ответ и, поэтому, для определения любых потенциальных комбинационных эффектов следует использовать другое иное исследование.
[0478] Дополнительное определение способности комбинаций MAB10 активировать клетки проводили с использованием диссоциированных опухолевых клеток (DTCs, Conversant Bio) от не получавших медикаментозного лечения пациентов, страдающих раком. DTCs представляют собой суспензию отдельных клеток, содержащую все клетки от образца опухоли, в том числе иммунный клетки, опухолевые клетки и поддерживающие клетки.
[0479] DTCs от мужчины в возрасте 50 лет с IV стадией меланомы культивировали и стимулировали с помощью контрольного OVA пептида (3 мкг/мл, Miltenyi Biotec, Cat# 130-099-771) или с помощью смеси пептида с меланомными клетками, состоящей из 1 мкг/мл NY-ES0-1+1 мкг/мл MelanA/MART-1+1 мкг/мл gp100 (Miltenyi Biotec, Cat #s 130-095-381, 130-094-477 и 130-094-450, соответственно). Антитело против GITR, MAB22 (смотрите, например, находящийся в процессе одновременного рассмотрения патентный документ International Patent Application No. PCT/US 2017/062443), пембролизумаб и MAB10 добавляли к пептид-стимулированным образцам, либо по одиночке, либо парными комбинациями. В качестве контроля, использовали равные количества изотипных контрольных антител. В случае стимуляции только одним антителом, суммарное количество антитела поддерживали постоянным путем добавления изотипного контрольного антитела. MAB10 и пембролизумаб использовали при конечной концентрации 10 мкг/мл, и MAB22 использовали при конечной концентрации 1 мкг/мл. Для оценки активации, клетки культивировали в течение 7 дней, собирали надосадочные жидкости и количественно определяли продуцируемый уровень IFNγ, используя реагенты AlphaLISA® (PerkinElmer). Статистическую значимость вычисляли с использованием однофакторного дисперсионного анализа с множественными сравнениями.
Результаты
[0480] Как видно на фигуре 2A, каждая обработка путем комбинированной терапии приводила к большей стимуляции продукции IFNγ, чем обработка каждым средством по одиночке, что позволяет предположить о наличии аддитивного эффекта.
[0481] Далее, DTCs от женщины в возрасте 80 лет с IIa стадией немелкоклеточного рака легкого (NSCLC) культивировали и оставляли нестимулированными или стимулировали с помощью растворимых антител против CD3+ и против CD28 (Becton Dickenson Cat#s 555336 и 555726, соответственно) в течение двух дней. В качестве контроля, использовали равное количество изотипного контрольного антитела (IgG4). В случае стимуляции только одним антителом, суммарное количество антитела поддерживали постоянным путем добавления изотипного контрольного антитела. MAB10 и пембролизумаб использовали при конечной концентрации 10 мг/мл. Для оценки активации, к клеткам добавляли брефелдин A (EBioscience, Cat# 00-4506-51) в течение последних 5 часов культивации, и проводили анализ с помощью клеточного сортера с возбуждением флуоресценции (FACS) и количественную оценку продуцирования IFNγ CD4+ и CD8+ T-клетками, используя метод внутриклеточного окрашивания цитокинов. Статистическую значимость вычисляли с использованием однофакторного дисперсионного анализа с множественными сравнениями.
Результаты
[0482] Как видно на фигуре 2B, обработка клеток комбинацией MAB10 и пембролизумаба давала аддитивный эффект по сравнению с обработкой только одним средством, измеряемый по продукции IFNγ в обеих клетках CD4+ и CD8+ T-клетки.
Пример 3. Комбинированные терапии, включающие ABPs против TIGIT и иммунотерапевтическое средство, in vivo
[0483] Для определения, обеспечивает ли комбинация антитела против TIGIT и антитела против нейропилин-1 увеличение противоопухолевой активности по сравнению с одиночными средствами in vivo, комбинацию испытывали в экспериментальной модели рака грудной железы EMT6 на мышах (Charles River Labs).
[0484] Антитела против NRP-1 описаны, например, в находящимся в процессе одновременного рассмотрения патентном документе International Patent Application No. PCT/US2017/067782, filed December 21, 2017, в котором также раскрыта панель мышиных версий антител против NRP-1, которые испытывали в качестве химерных мышиных IgG2a антител, содержащих N297A мутацию, которая отменяет эффекторную функцию опосредованной антителами клеточной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC).
[0485] Для испытания комбинации антител против NRP и против TIGIT у мышей, мышиную версию антитела против человеческого NRP-1, MAB23 (мышиная версия "mMAB23", SEQ ID NOS: l43-144, приложение A), использовали в комбинации с антителом против TIGIT грызуна, 1B4 (мышиный IgG1, Cell Essentials). Использовавшееся контрольное антитело представляло собой мышиный IgG2b MPC-11 (BioXCell, Cat#BE0086).
Модель опухоли EMT6
[0486] Самкам мышей линии Balb/c инокулировали 1×105 клеток EMT6. Мышей рандомизировали по объему опухоли на 12 групп, после того, как опухоли достигали среднего размера 80-120 мм3. Обработку (терапевтическую обработку) начинали проводить в тот же самый день, в который проводили рандомизацию. Антитела вводили путем интраперитонеальных (i.p.) инъекций. Опухоли и массы тела измеряли три раза в неделю. Исследование заканчивали на 40-ой день, или когда средний объем опухоли достигал 2000 мм3 независимо от группы обработки.
Результаты
[0487] При исследовании опухоли EMT6 у мышей, комбинированная обработка с помощью mMAB23 и 1B4 ингибировала рост опухоли в большей степени, чем в случае только одного их контрольного средства (фигура 3A-3B). Комбинированная обработка, включающая 250 мкг мышиного mMAB23+250 мкг 1B4, позволяла достигать 57,4% TGI (ингибирования роста опухоли), и комбинированная обработка, включающая 500 мкг mMAB23+500 мкг 1B4, позволяла достигать 69,4% TGI по сравнению с обработкой контрольным антителом. Комбинированная обработка с помощью mMAB23+1B4 при обеих концентрациях была статистически значимой после 14 days обработки (p<0,05). Обработка с помощью анти-PD-1 позволяла достигать 60,2% TGI на день 14. Оценка кривых от времени для контроля, крысиного анти-мышиного αPD-1 (клон RMP1-14), только одного средства (250 мкг) и комбинации (250 мкг каждого) с использованием анализа смешанных моделей (аналогичного дисперсионному анализу с повторными измерениями (RM ANOVA)) показала, что обе αPD-1 и mMAB239+1B4 комбинированные обработки значимо отличались от контрольной группы и от обоих используемых по одиночке средств (p<0,03).
[0488] Анализ паутинообразных кривых роста индивидуальных опухолей от всех подвергнутых обработке мышей показал заметное замедление роста опухоли у мышей, подвергнутых обработке с помощью комбинации mMAB23 и 1B4 (фигура 3С-3D). Индивидуальные величины объемов опухоли EMT6 для каждой из 8 мышей в группе приведены для всех групп, подвергнутых обработке (указаны в верхней части каждого графика). Клетки мышиной опухоли EMT6 инъецировали самкам мышей линии BALB/c, и мышей рандомизировали по среднему размеру опухоли 80-120 мм3. Обработку начинали в случайном порядке, и указанные антитела вводили интраперитонеально при 1000 мкг/животное (контроль IgG2b и 1B4), 500 мкг/животное (mMAB23 и 1B4), 250 мкг/животное (mMAB23 и 1B4) или 200 мкг/животное (αPD-1). Стрелки черного цвета указывают на дни обработки. Исследование заканчивали на день 40, или когда средний объем опухоли достигал 2000 мм3 независимо от группы обработки.
[0489] Эти данные показывают, что комбинация mMAB23 и 1B4 позволяет повышать ингибирование роста опухоли по сравнению с применением средств по одиночке. У мышей, подвергнутых обработке с помощью этой комбинации, обнаруживалось заметное ингибирование роста опухоли (57,4% TGI и 69,4% TGI для 250 мкг и 500 мкг каждого антитела, соответственно), которое было аналогичным обработке с помощью анти-PD-1 (60,2% TGI).
ВКЛЮЧЕНИЕ В ОПИСАНИЕ ИЗОБРЕТЕНИЯ СОДЕРЖАНИЯ ЦИТИРУЕМЫХ ПУБЛИКАЦИЙ ПУТЕМ ССЫЛКИ НИХ
[0490] Содержание всех цитируемых патентных и непатентных публикаций включено во всех отношениях в настоящее изобретение путем ссылки на них.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[0491] Изложенное выше изобретение может охватывать множество отдельных изобретений с независимой полезностью. Несмотря на то, что каждое из этих изобретений было раскрыто в его предпочтительной форме (формах), тем не менее, его конкретные варианты осуществления, раскрытые и проиллюстрированные в этом изобретении, не должны рассматриваться в качестве ограничений, поскольку возможно существование многочисленных вариантов. Предмет изобретений включает в себя все новые и неочевидные комбинации и подкомбинации раскрытых в настоящем изобретении различных элементов, признаков, функций и/или свойств. Следующие далее пункты формулы изобретения конкретно указывают определенные комбинации и подкомбинации, которые признаются новыми и неочевидными. Изобретения, осуществленные в других комбинациях и подкомбинациях признаков, функций, элементов и/или свойств, могут быть заявлены в этом заявке, в заявках, испрашивающих приоритет этой заявки или в родственных заявках. Такие пункты формулы изобретения, независимо от того, относятся ли они к другому изобретению или к этому же изобретению, и являются ли они более широкими, узкими, одинаковыми или различными по объему по сравнению с исходными пунктами формулы изобретения, также считаются включенными в предмет настоящего изобретения.
ПРИЛОЖЕНИЕ A: ТАБЛИЦА РЕФЕРЕНСНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ

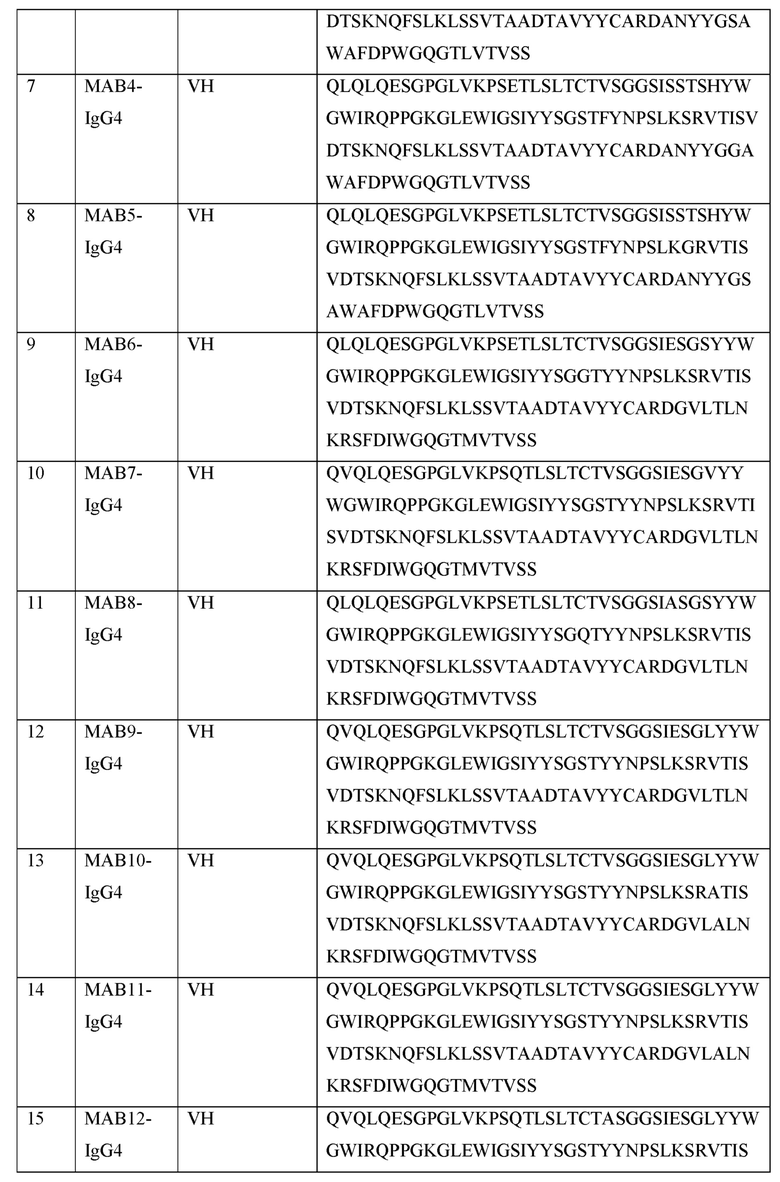
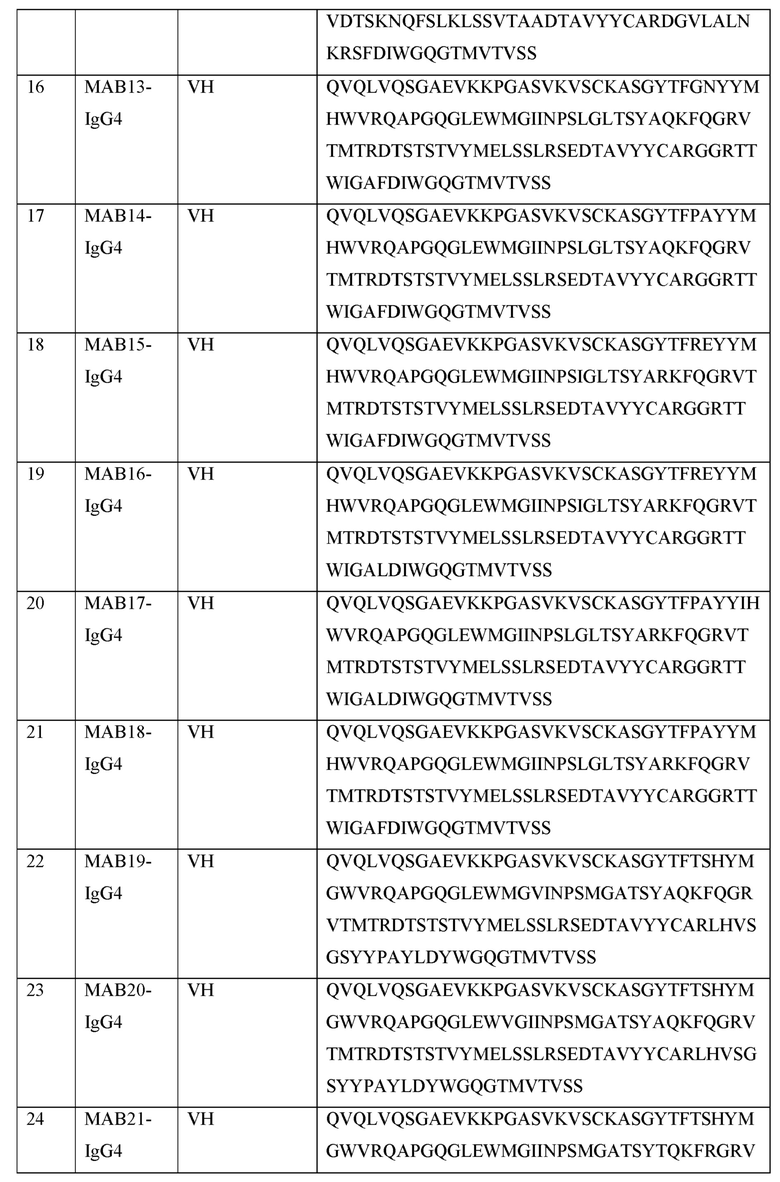
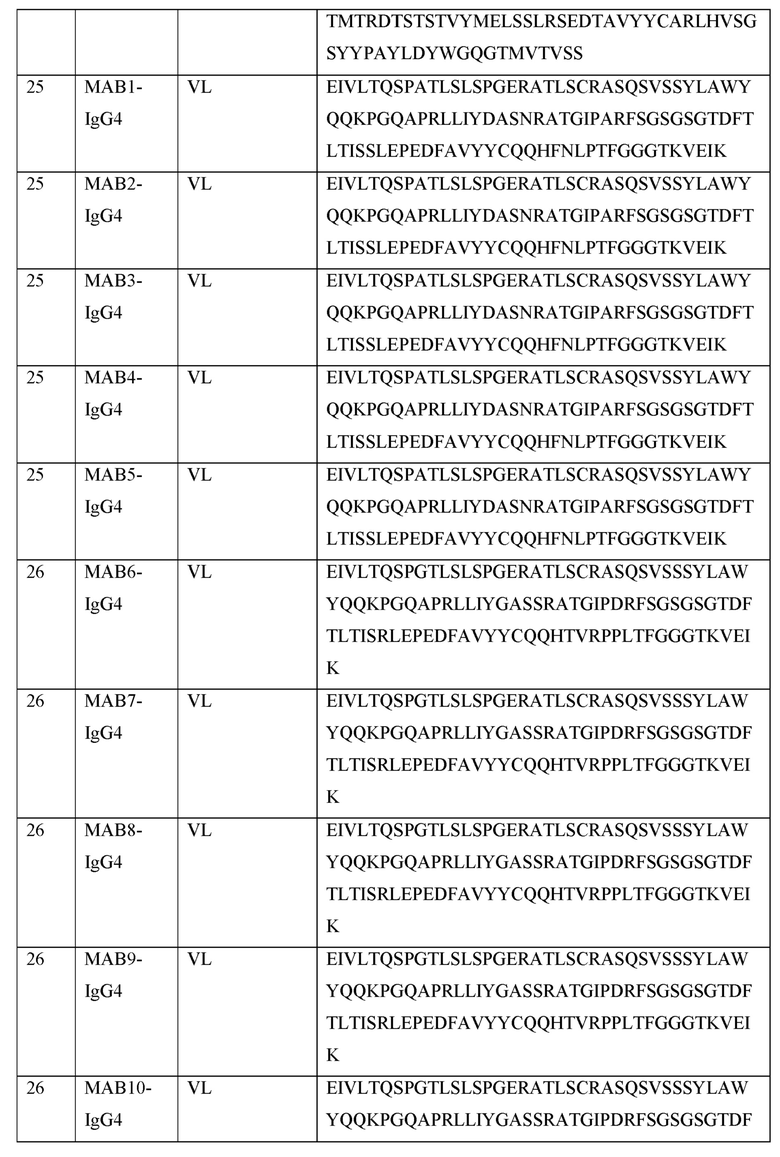
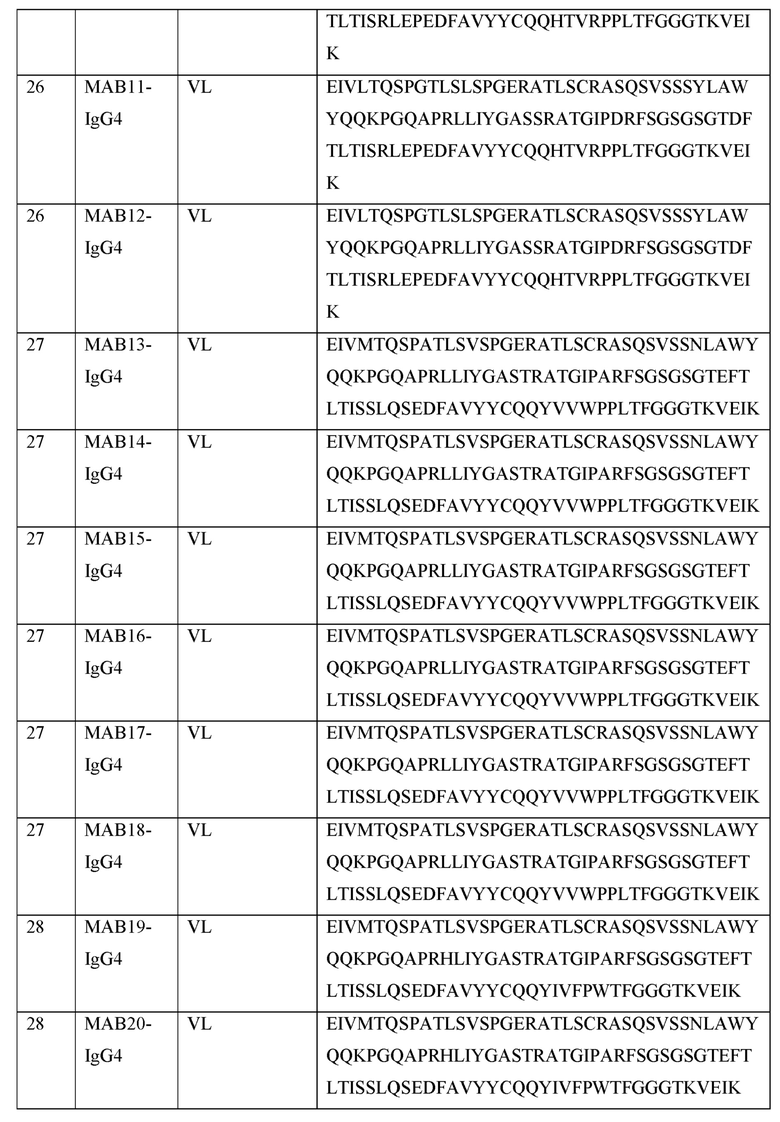
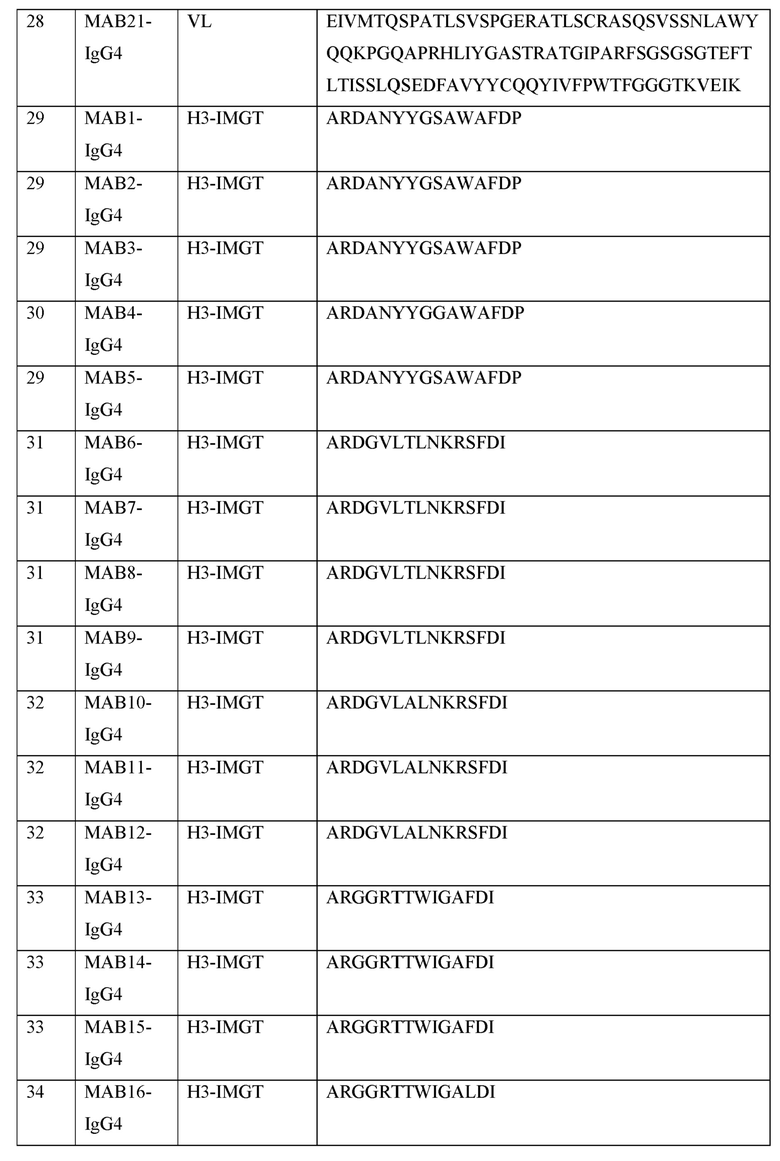

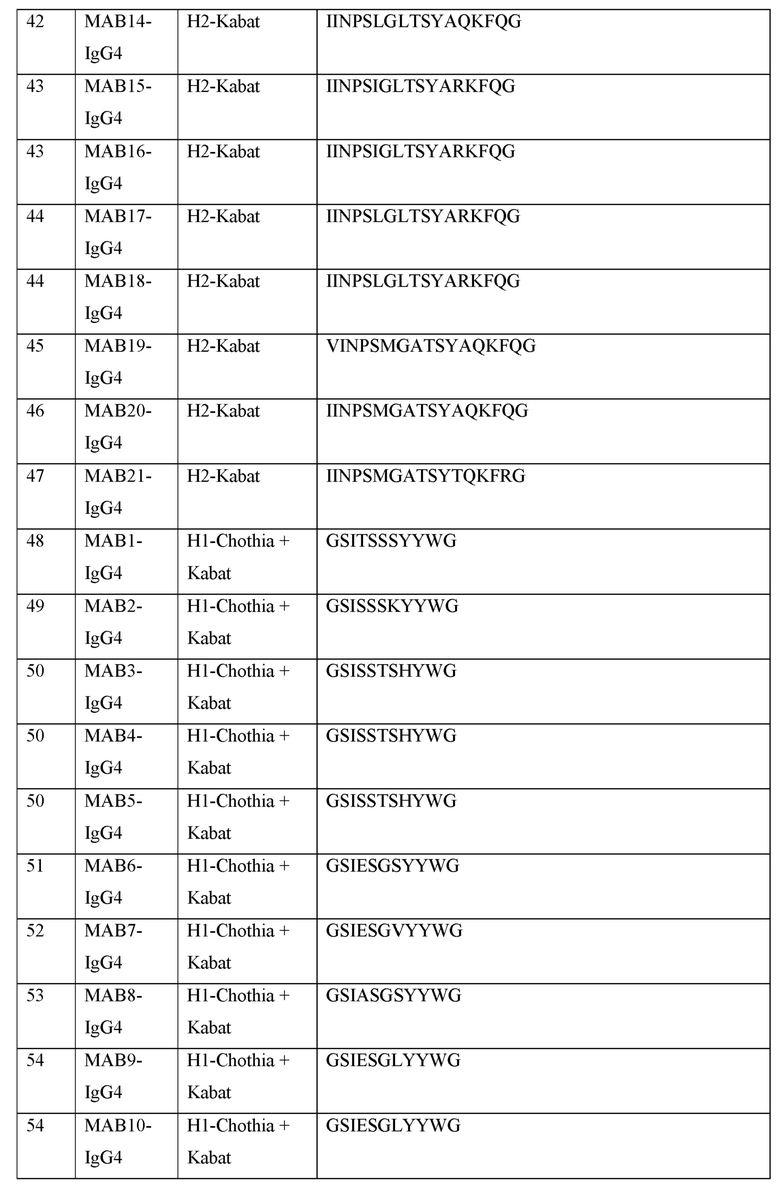
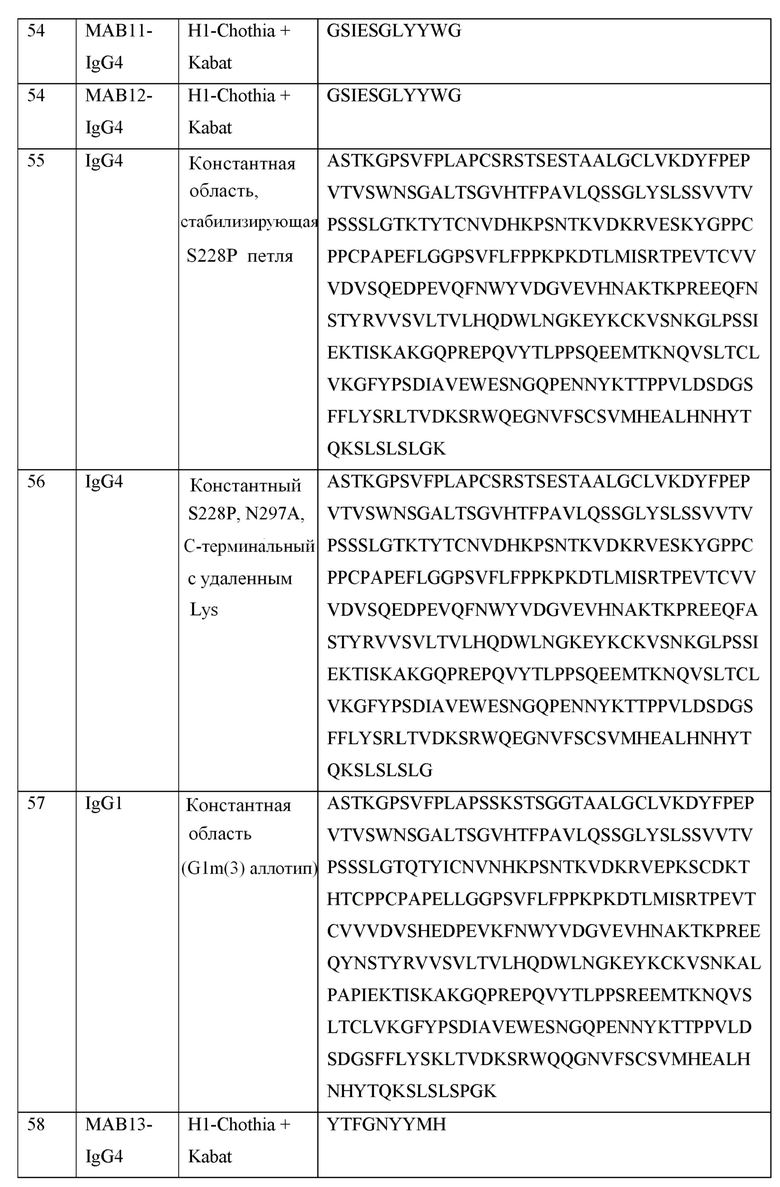
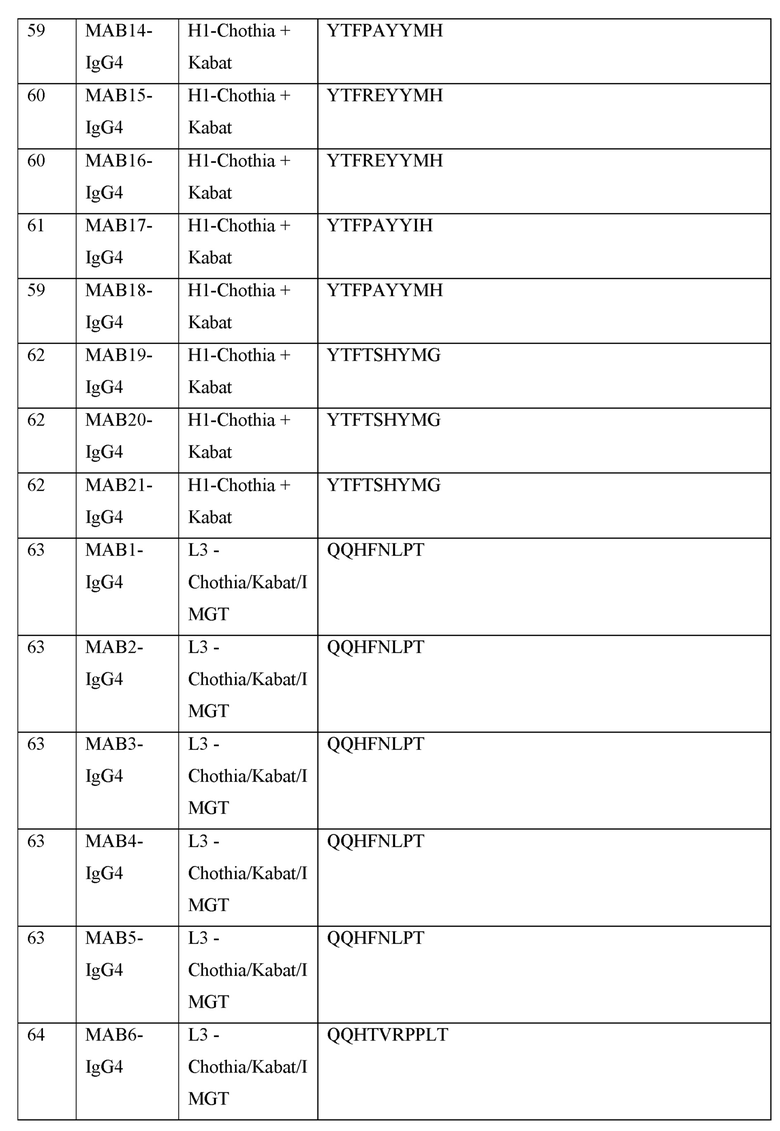
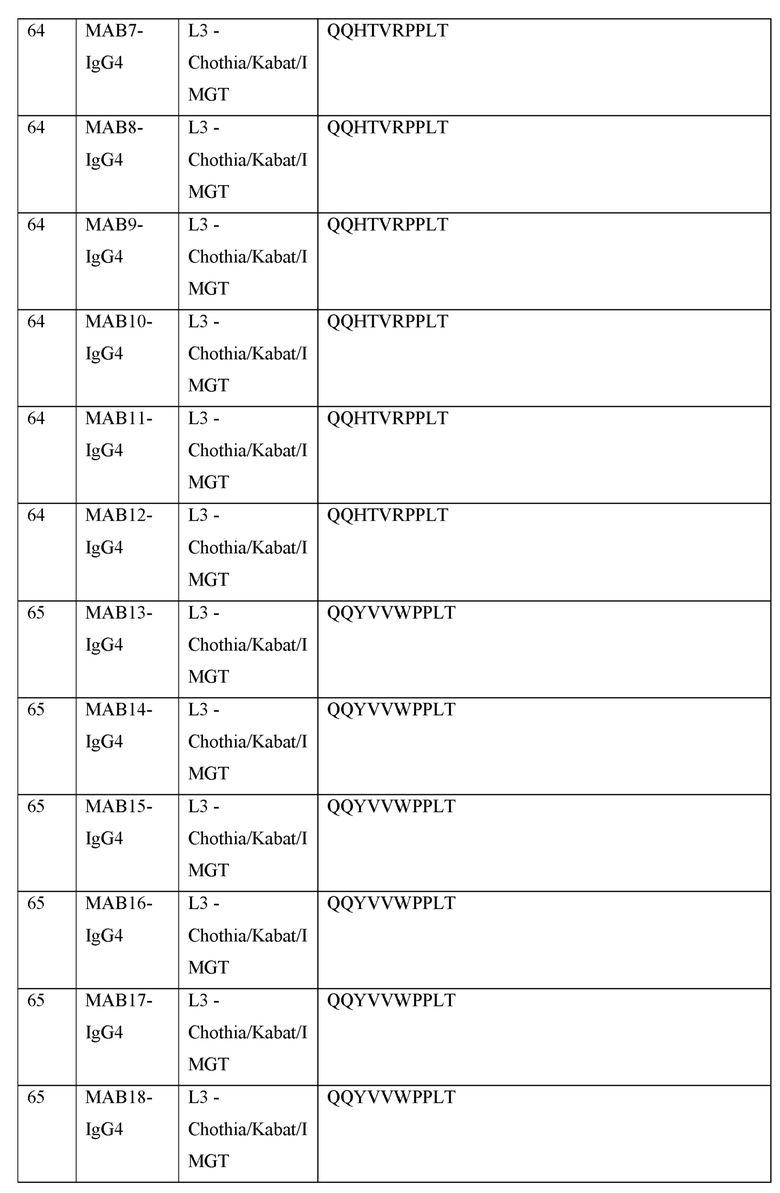
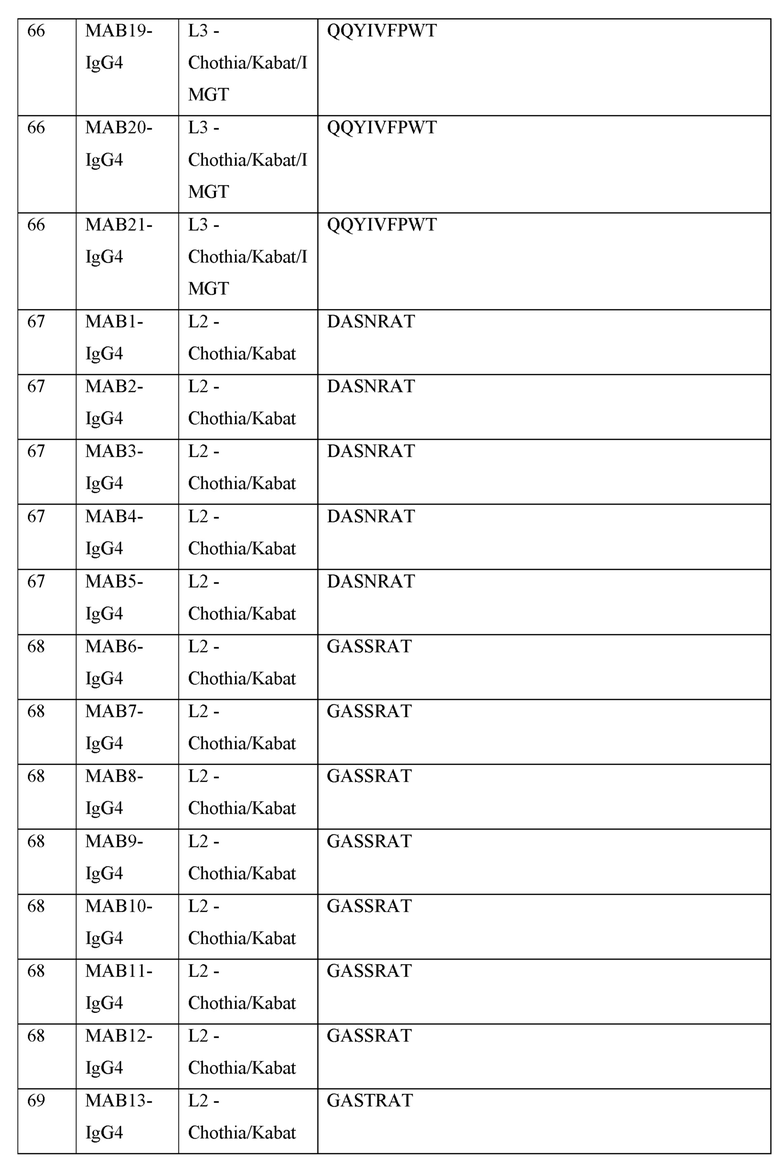
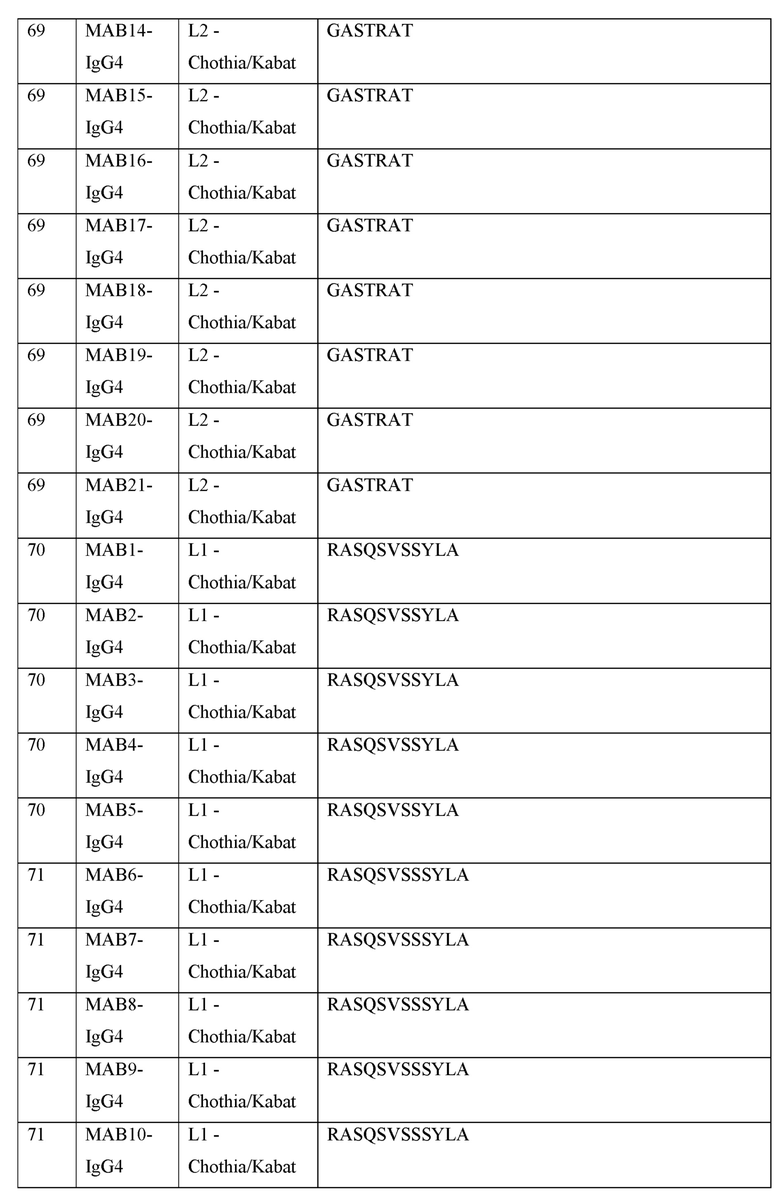
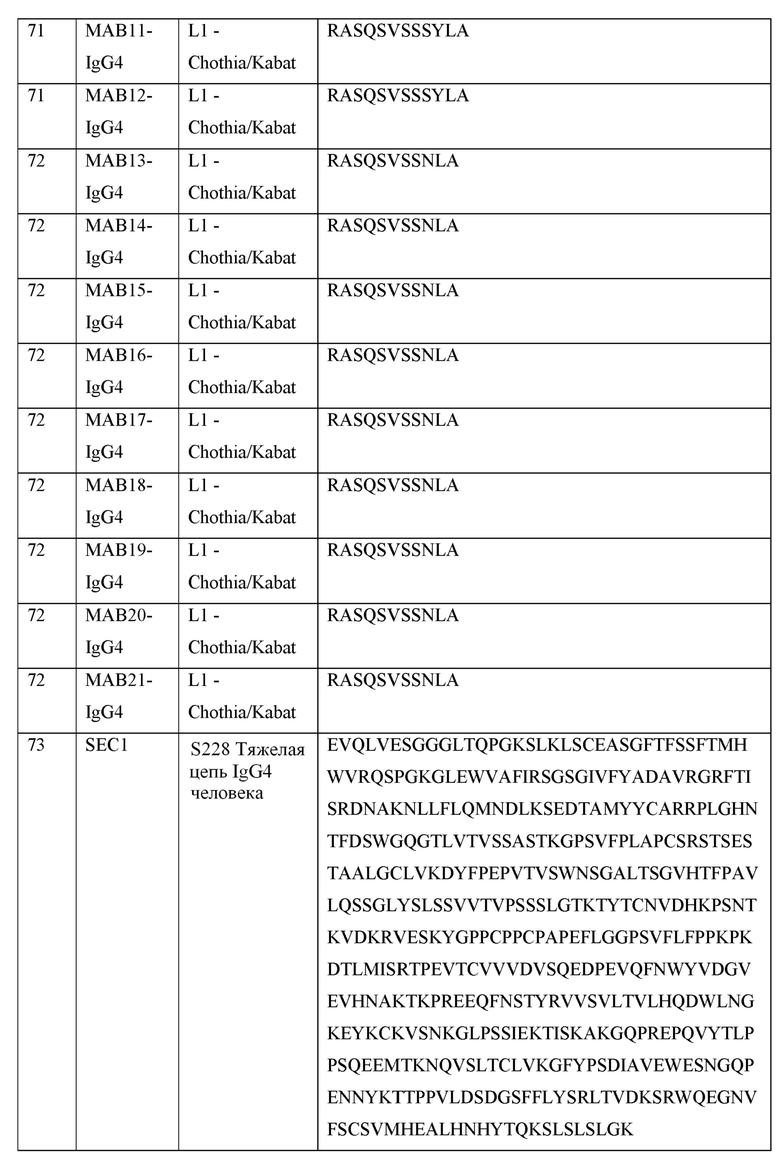
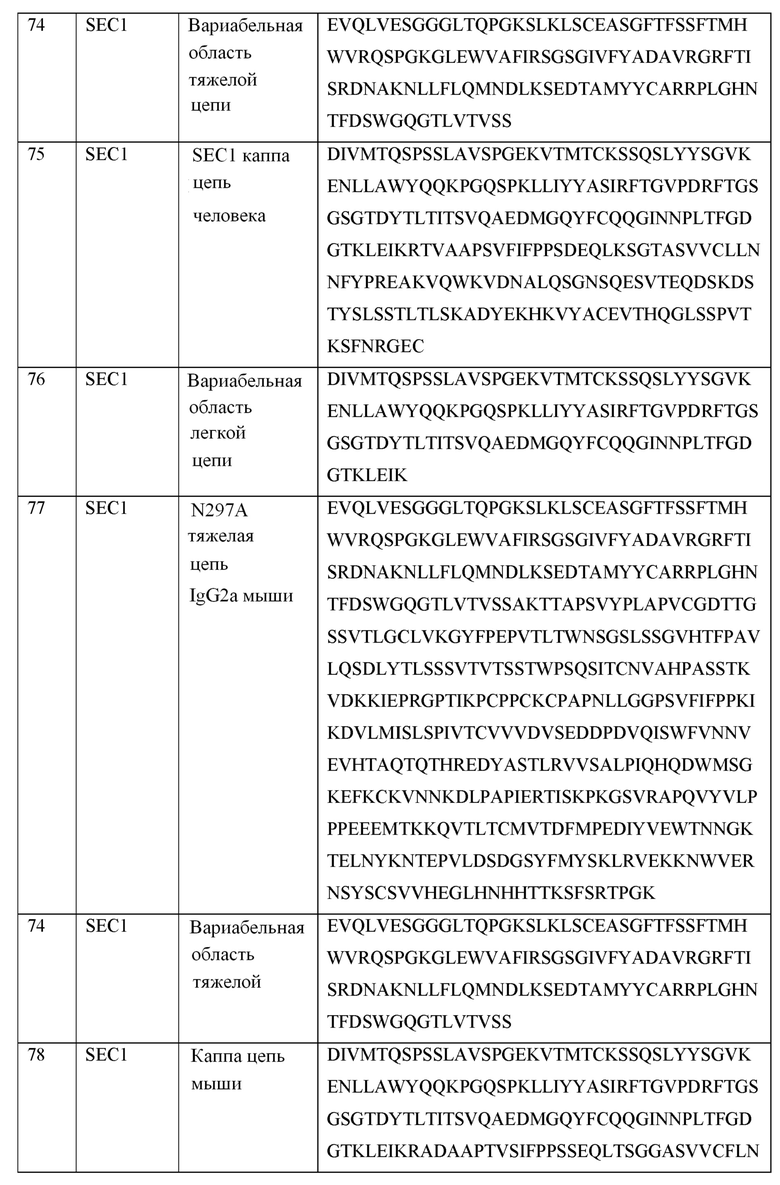
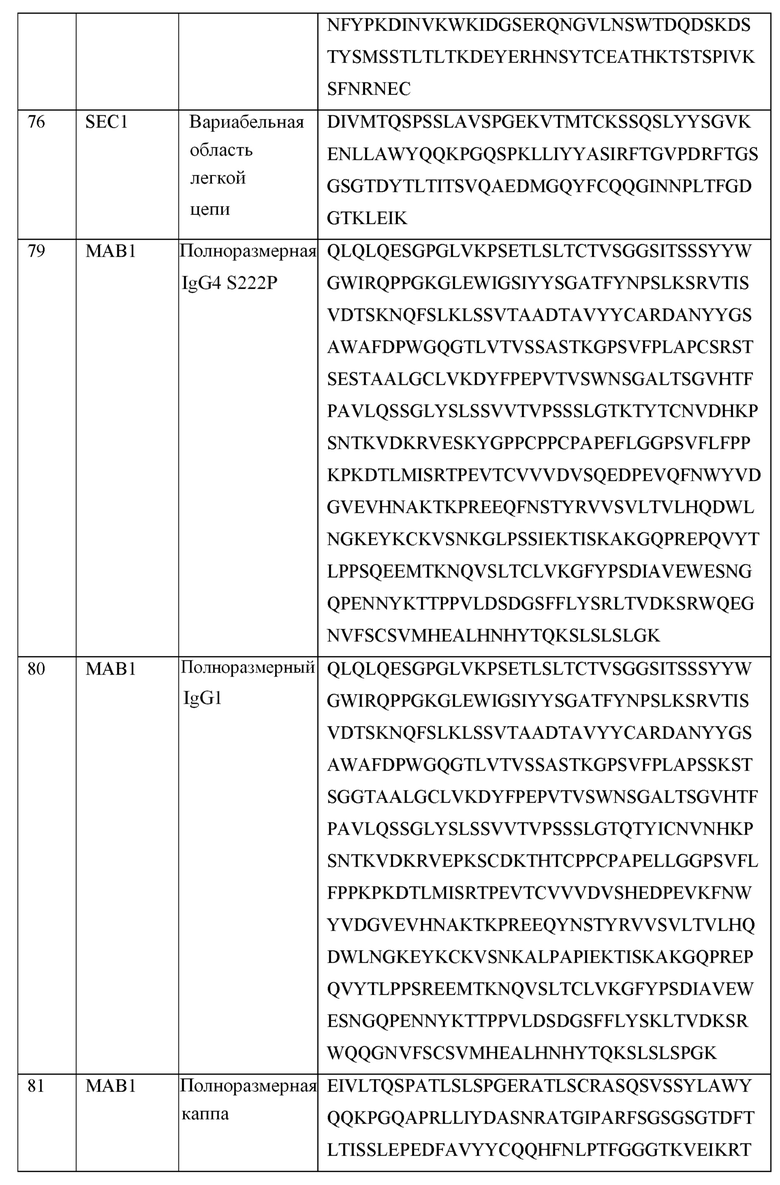
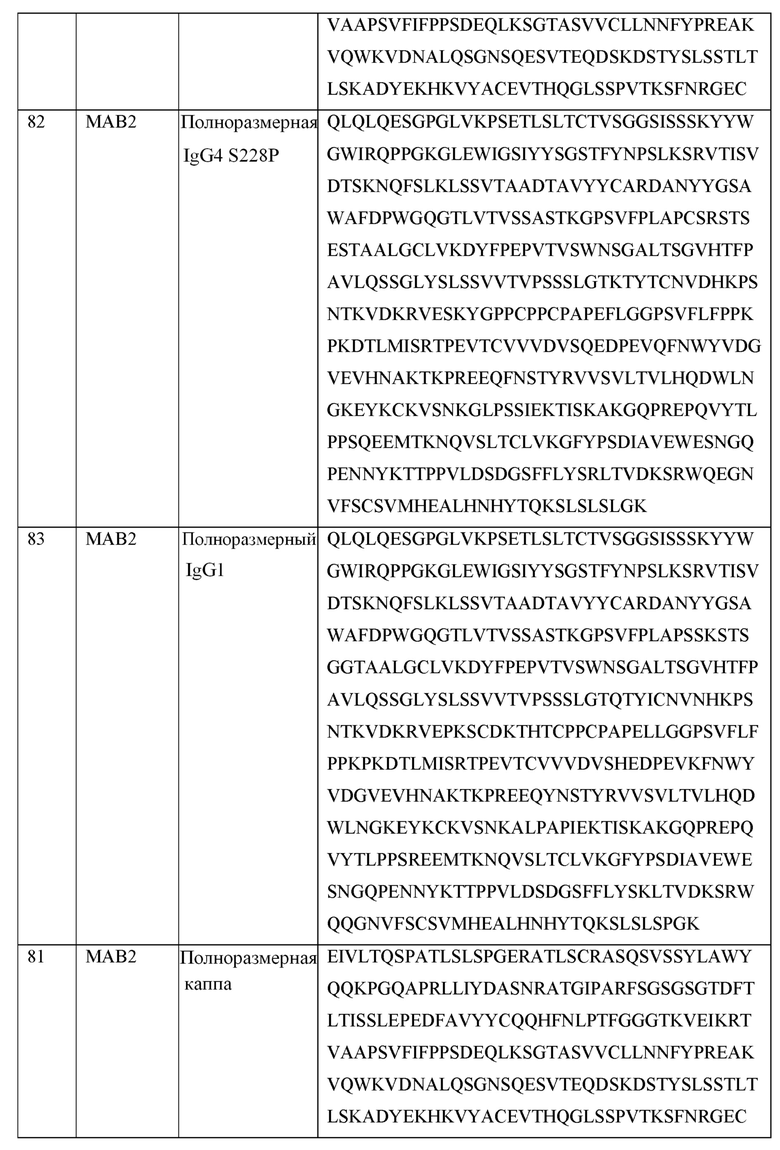
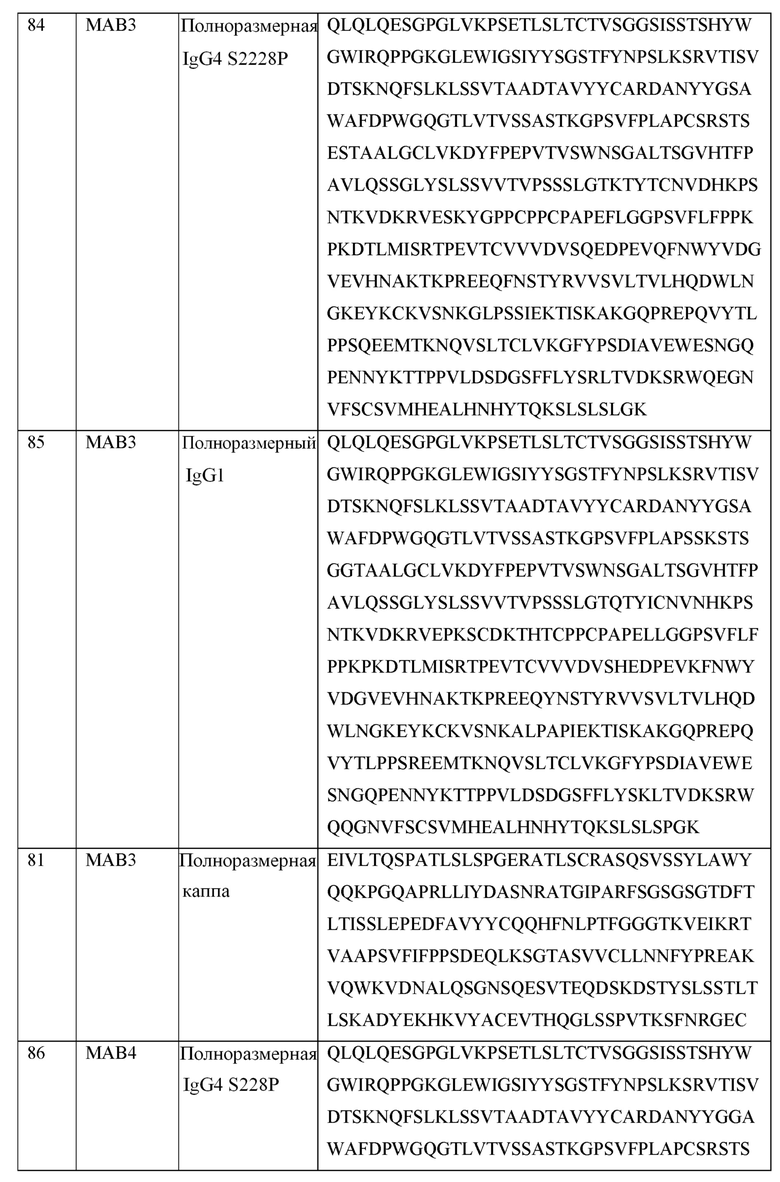

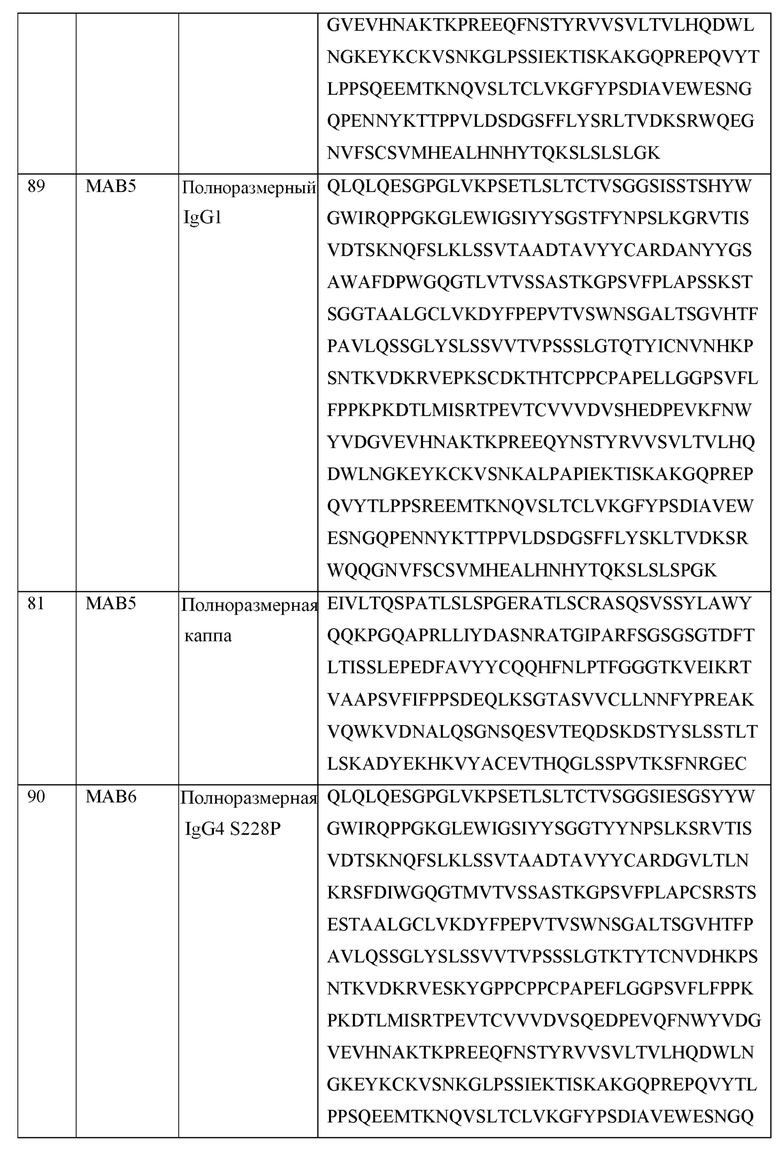
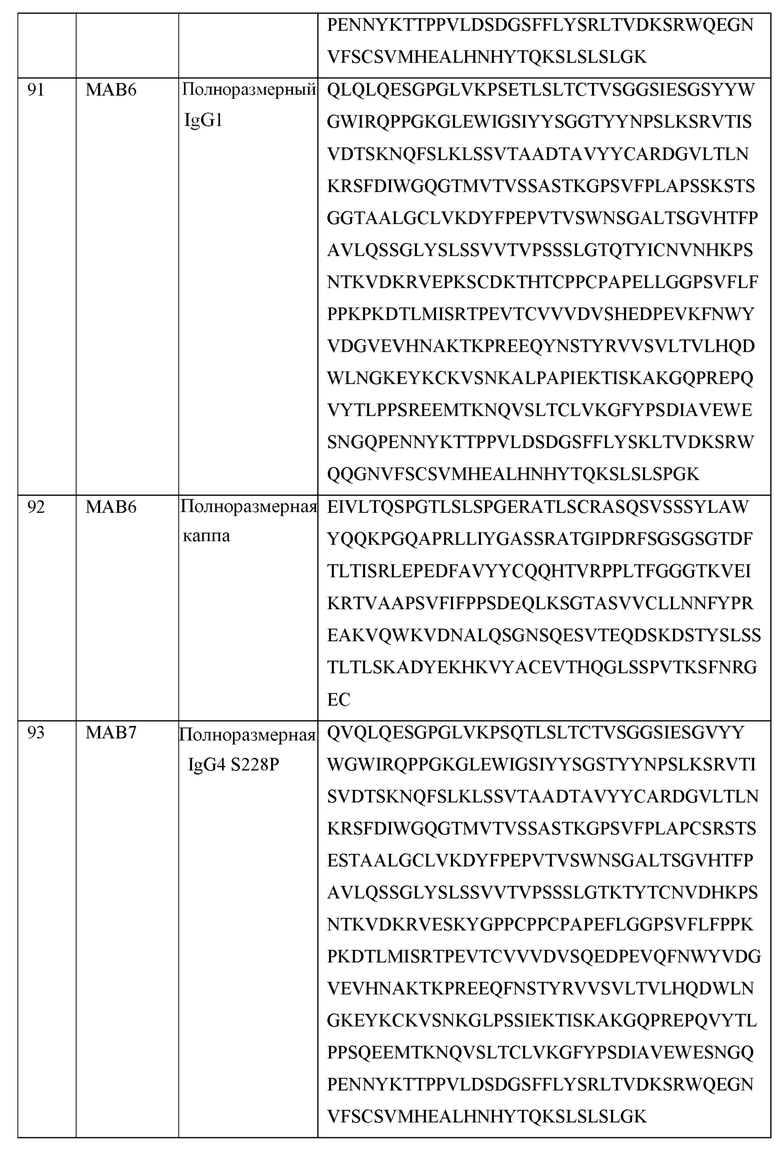
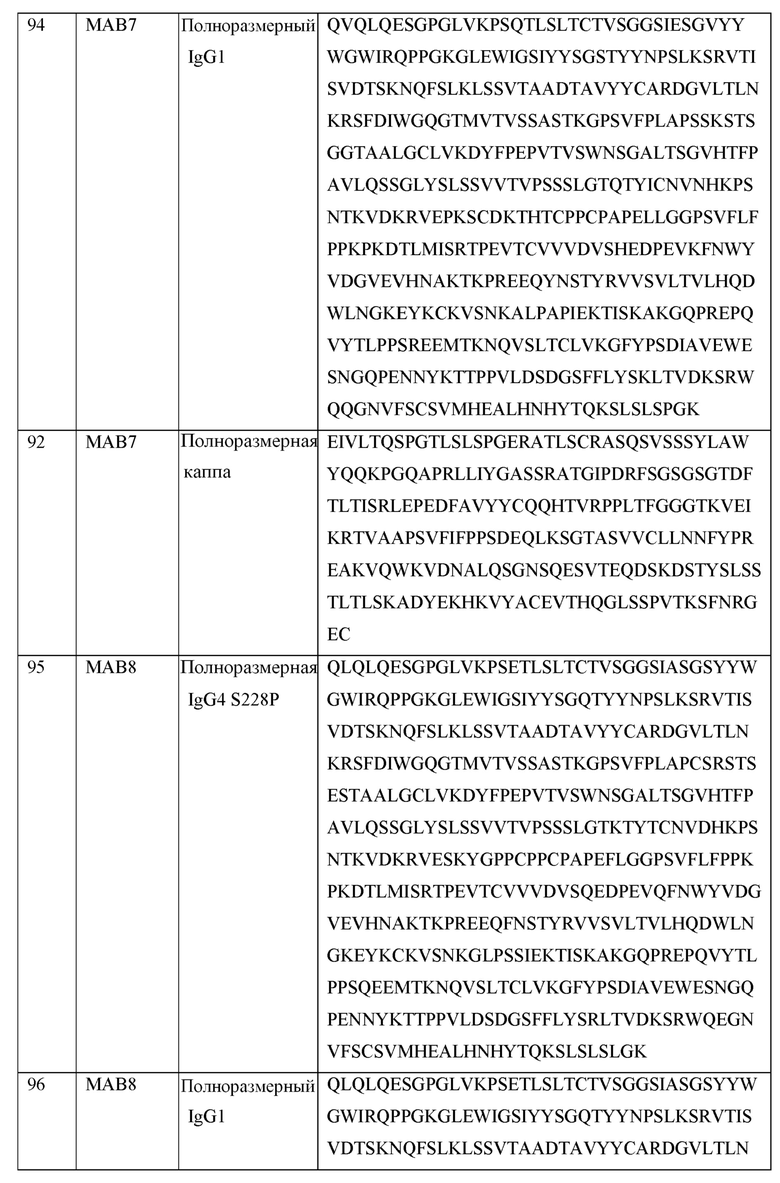
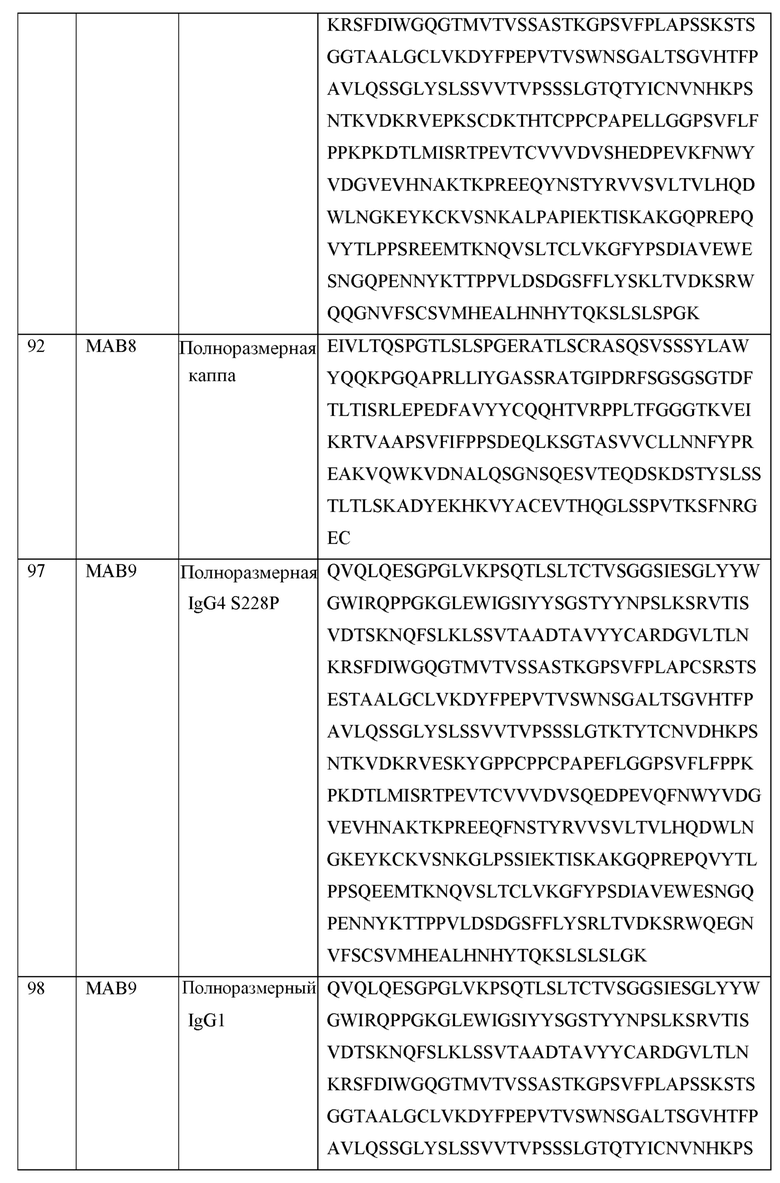
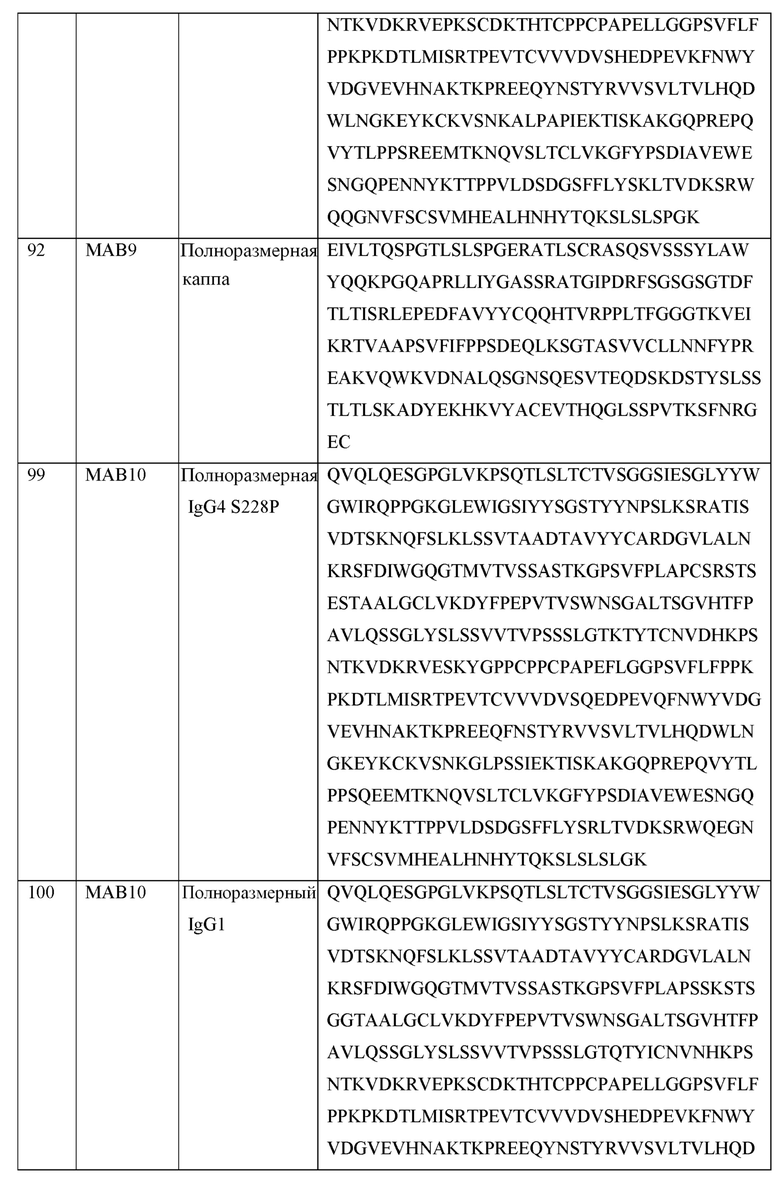
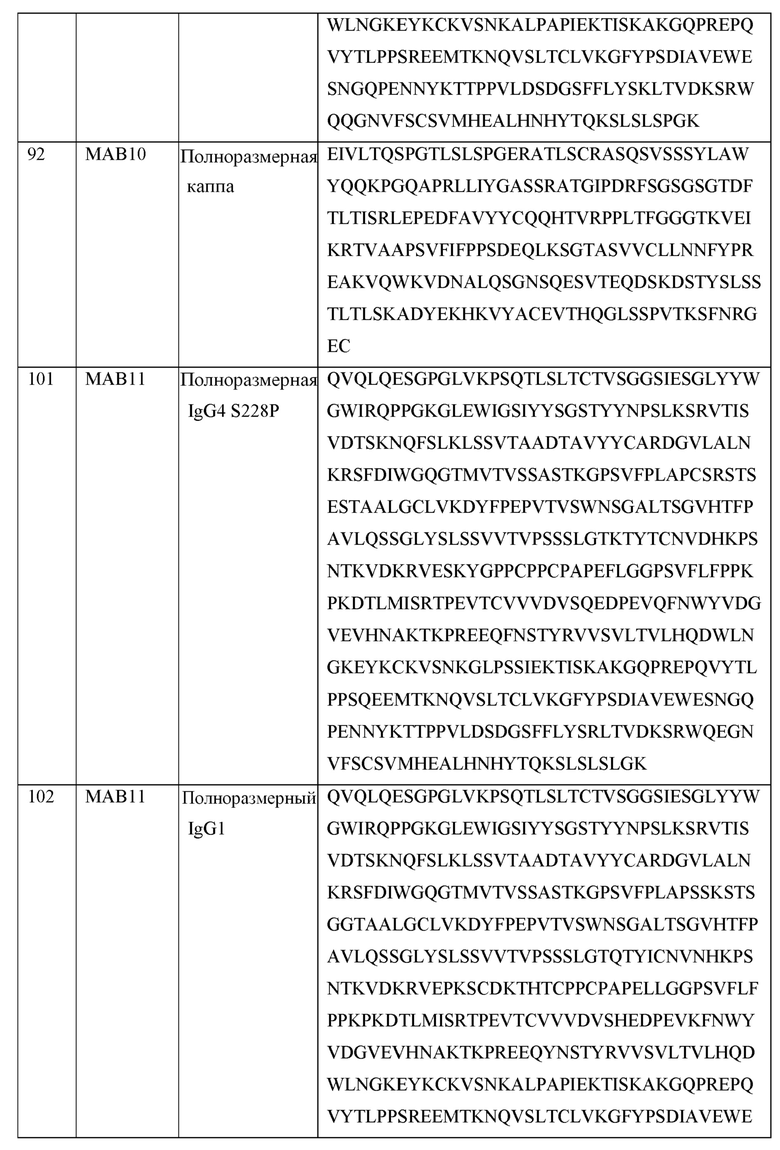
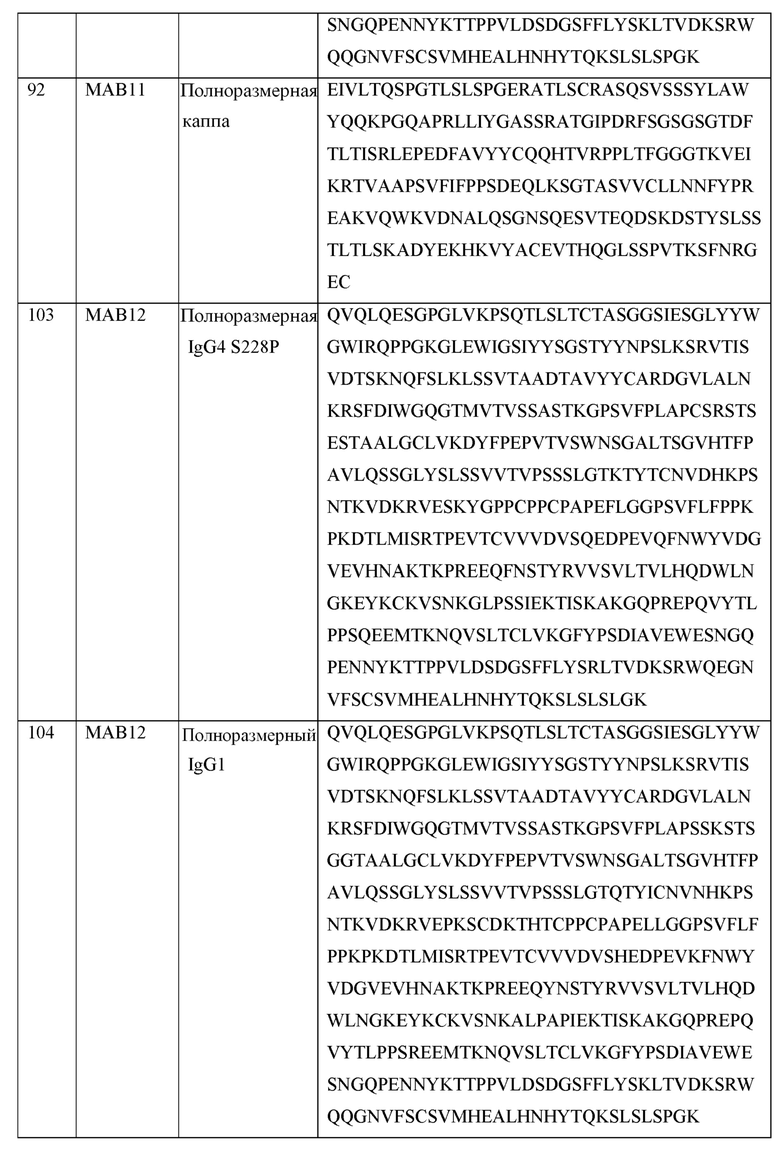

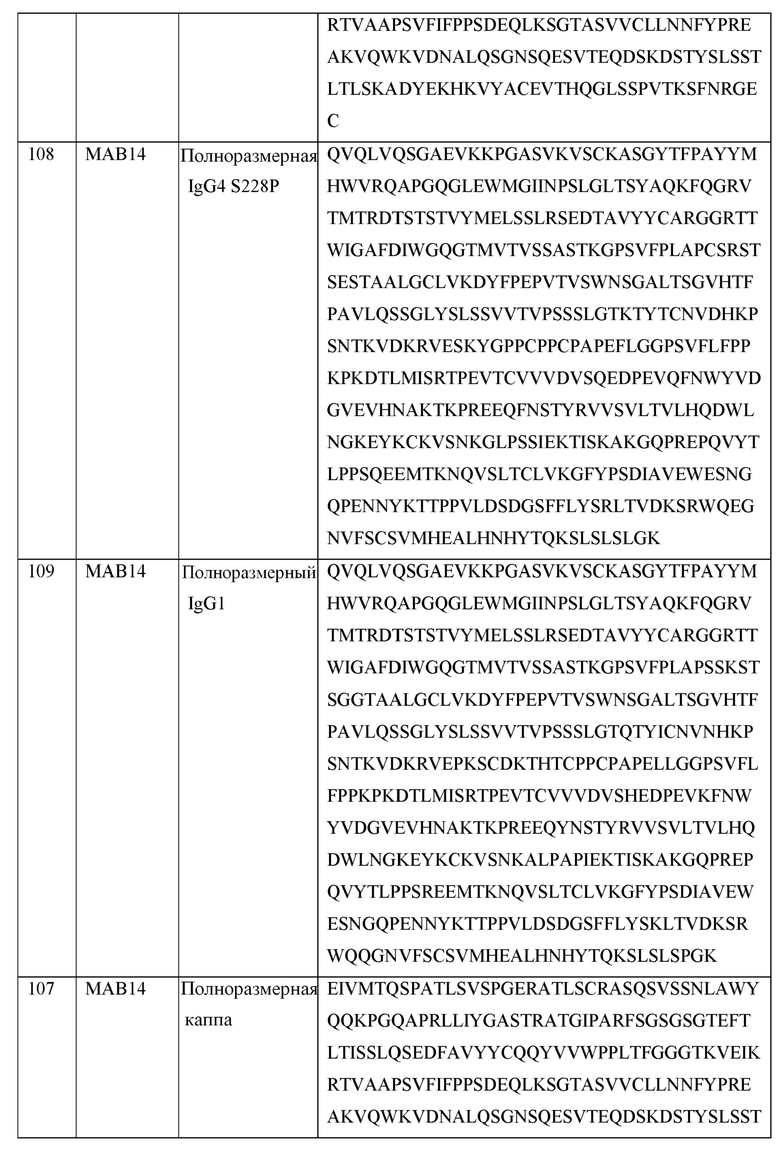
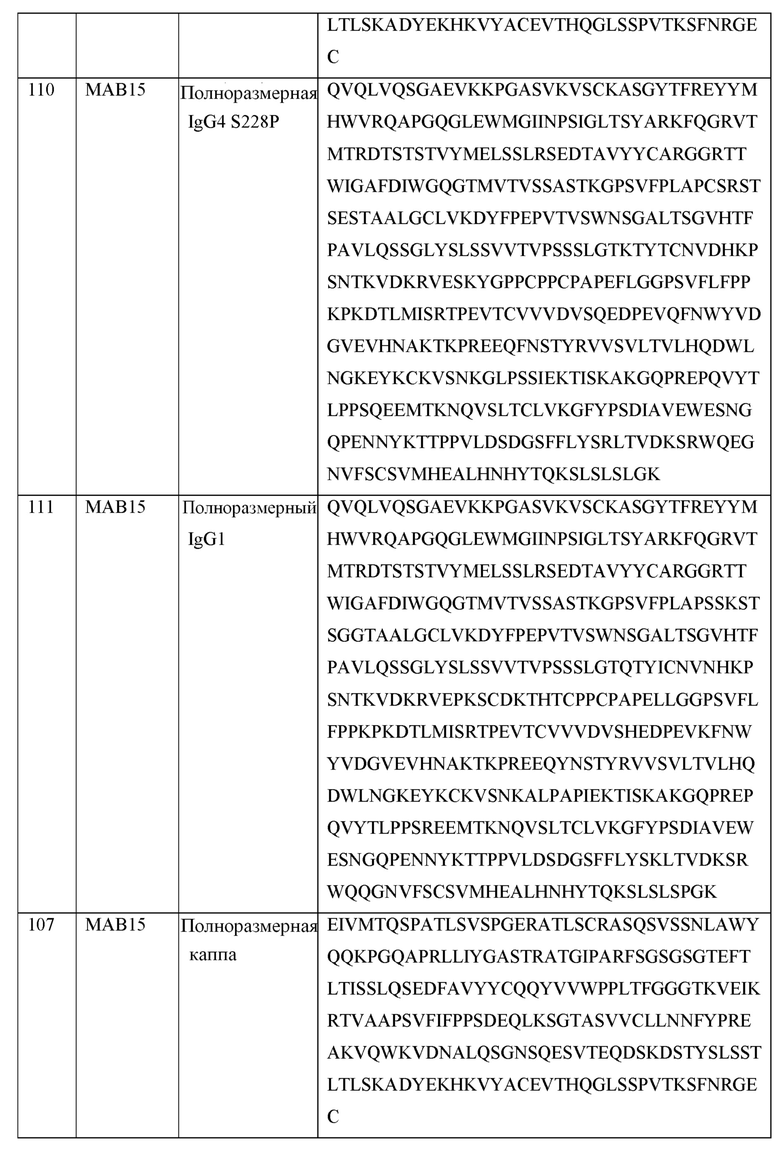
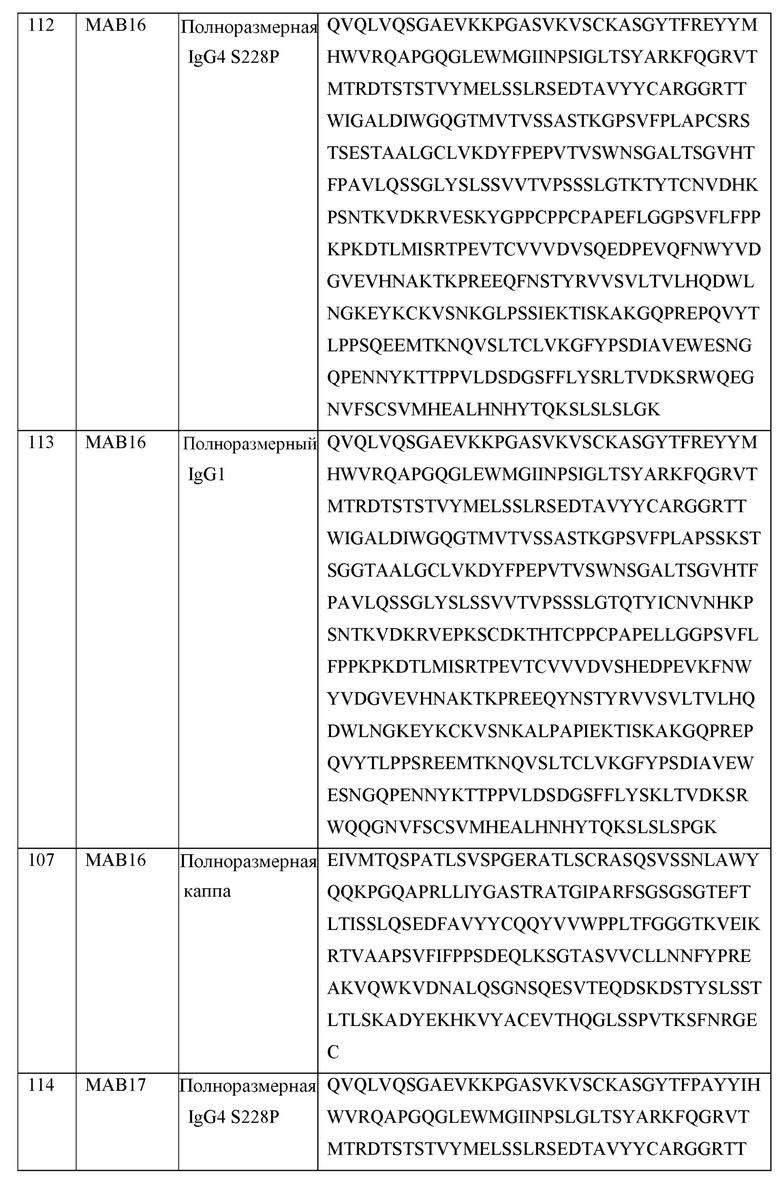

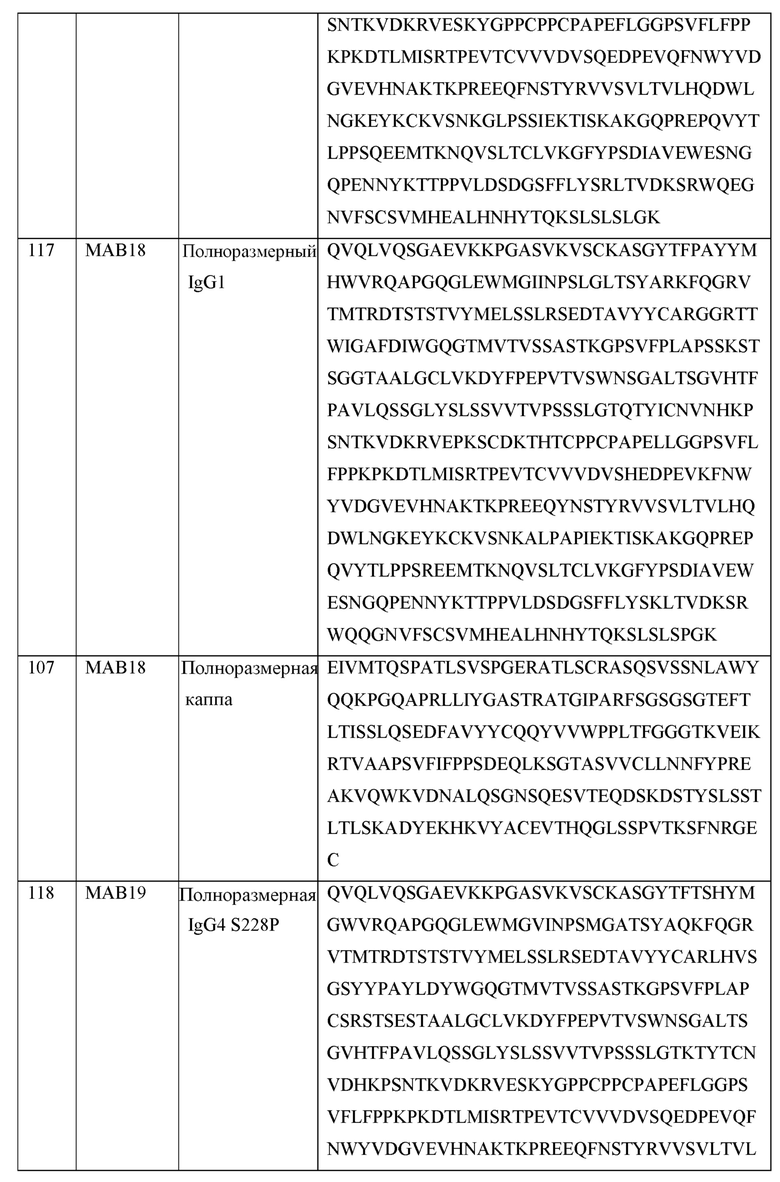
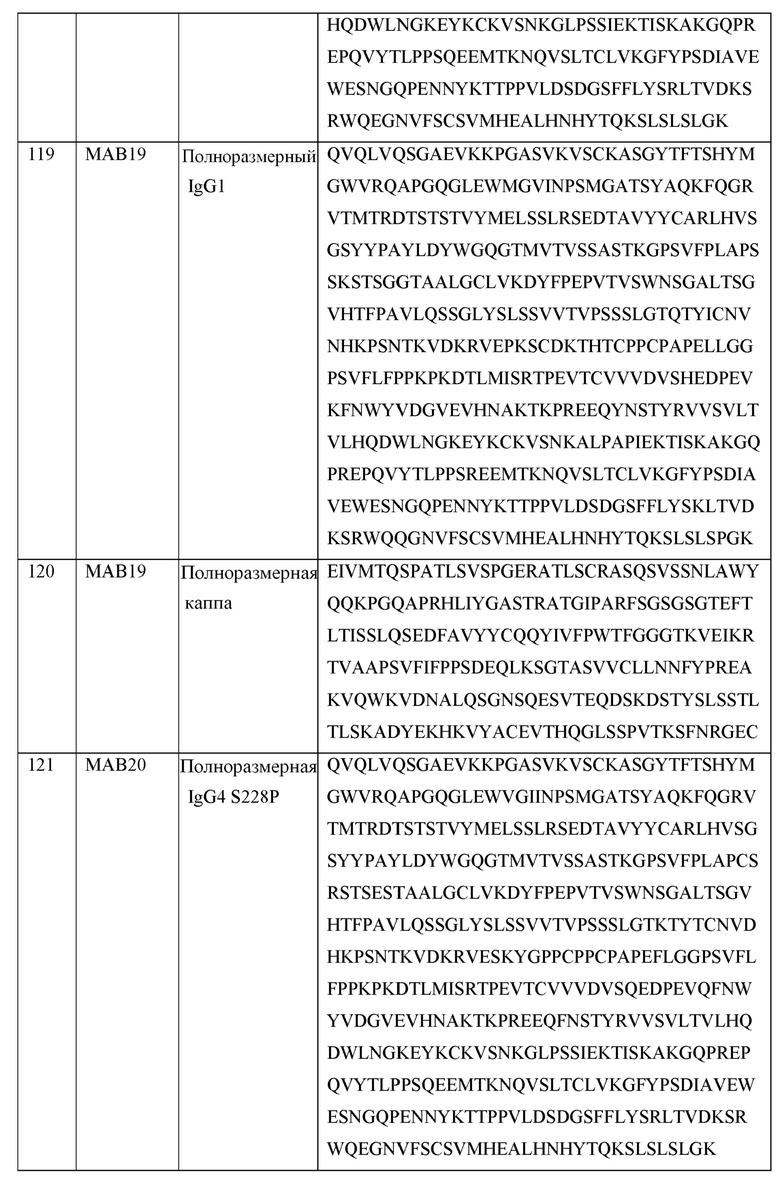


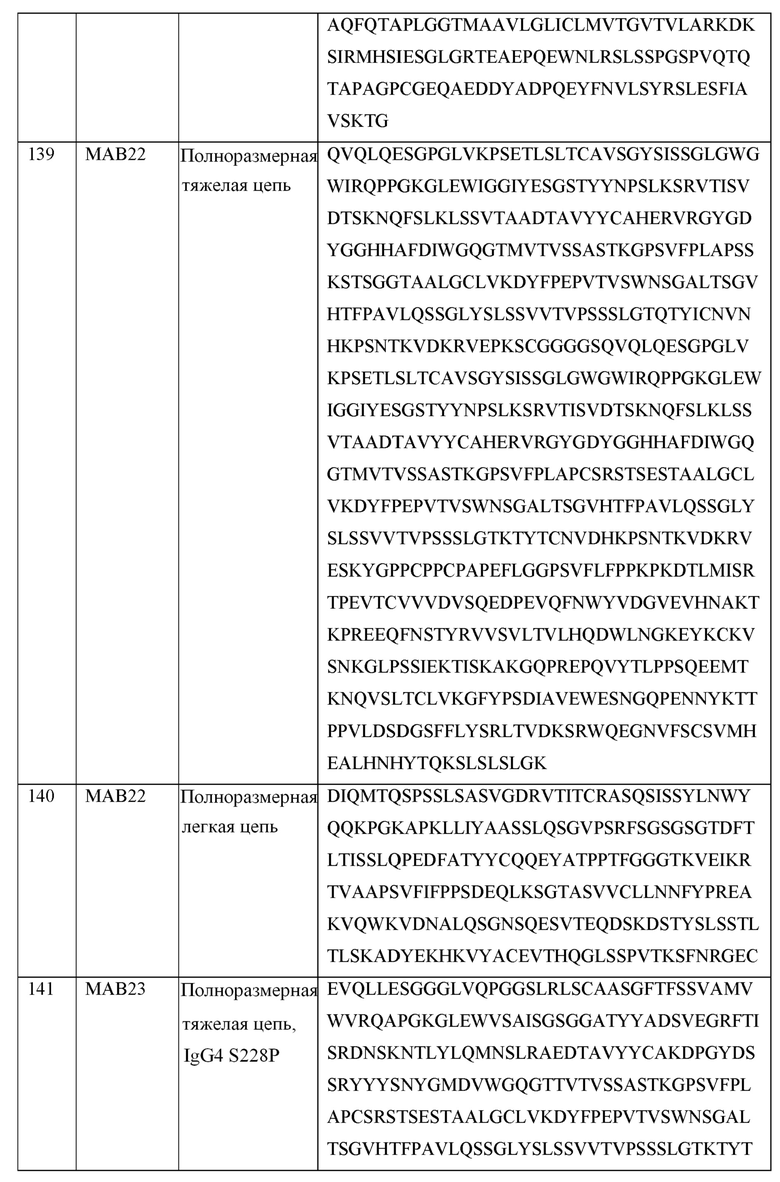
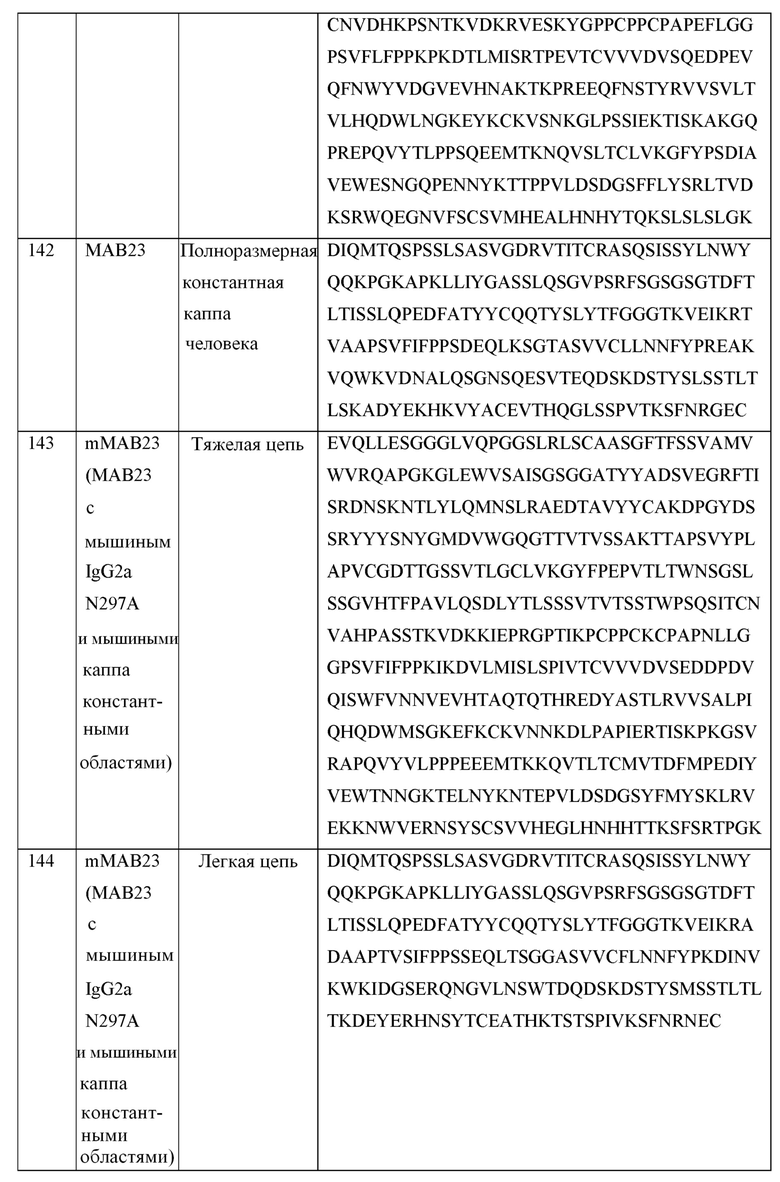
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПОТЕНЗА ТЕРАПЕВТИКС, ИНК.
<120> АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ TIGIT И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 32248-40232/WO
<140> PCT/US2018/025460
<141> 2018-03-30
<150> 62/479,042
<151> 2017-03-30
<160> 144
<170> PatentIn version 3.5
<210> 1
<211> 244
<212> БЕЛОК
<213> Хомо сапиенс
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (1)..(244)
<223> /примечание="hTIGIT"
<400> 1
Met Arg Trp Cys Leu Leu Leu Ile Trp Ala Gln Gly Leu Arg Gln Ala
1 5 10 15
Pro Leu Ala Ser Gly Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn
20 25 30
Ile Ser Ala Glu Lys Gly Gly Ser Ile Ile Leu Gln Cys His Leu Ser
35 40 45
Ser Thr Thr Ala Gln Val Thr Gln Val Asn Trp Glu Gln Gln Asp Gln
50 55 60
Leu Leu Ala Ile Cys Asn Ala Asp Leu Gly Trp His Ile Ser Pro Ser
65 70 75 80
Phe Lys Asp Arg Val Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu Gln
85 90 95
Ser Leu Thr Val Asn Asp Thr Gly Glu Tyr Phe Cys Ile Tyr His Thr
100 105 110
Tyr Pro Asp Gly Thr Tyr Thr Gly Arg Ile Phe Leu Glu Val Leu Glu
115 120 125
Ser Ser Val Ala Glu His Gly Ala Arg Phe Gln Ile Pro Leu Leu Gly
130 135 140
Ala Met Ala Ala Thr Leu Val Val Ile Cys Thr Ala Val Ile Val Val
145 150 155 160
Val Ala Leu Thr Arg Lys Lys Lys Ala Leu Arg Ile His Ser Val Glu
165 170 175
Gly Asp Leu Arg Arg Lys Ser Ala Gly Gln Glu Glu Trp Ser Pro Ser
180 185 190
Ala Pro Ser Pro Pro Gly Ser Cys Val Gln Ala Glu Ala Ala Pro Ala
195 200 205
Gly Leu Cys Gly Glu Gln Arg Gly Glu Asp Cys Ala Glu Leu His Asp
210 215 220
Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Gly Asn Cys Ser Phe Phe
225 230 235 240
Thr Glu Thr Gly
<210> 2
<211> 245
<212> БЕЛОК
<213> Макак-крабоед
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(245)
<223> /примечание="cTIGIT"
<400> 2
Met Arg Trp Cys Leu Phe Leu Ile Trp Ala Gln Gly Leu Arg Gln Ala
1 5 10 15
Pro Leu Ala Ser Gly Met Met Thr Gly Thr Ile Glu Thr Thr Gly Asn
20 25 30
Ile Ser Ala Lys Lys Gly Gly Ser Val Ile Leu Gln Cys His Leu Ser
35 40 45
Ser Thr Met Ala Gln Val Thr Gln Val Asn Trp Glu Gln His Asp His
50 55 60
Ser Leu Leu Ala Ile Arg Asn Ala Glu Leu Gly Trp His Ile Tyr Pro
65 70 75 80
Ala Phe Lys Asp Arg Val Ala Pro Gly Pro Gly Leu Gly Leu Thr Leu
85 90 95
Gln Ser Leu Thr Met Asn Asp Thr Gly Glu Tyr Phe Cys Thr Tyr His
100 105 110
Thr Tyr Pro Asp Gly Thr Tyr Arg Gly Arg Ile Phe Leu Glu Val Leu
115 120 125
Glu Ser Ser Val Ala Glu His Ser Ala Arg Phe Gln Ile Pro Leu Leu
130 135 140
Gly Ala Met Ala Met Met Leu Val Val Ile Cys Ile Ala Val Ile Val
145 150 155 160
Val Val Val Leu Ala Arg Lys Lys Lys Ser Leu Arg Ile His Ser Val
165 170 175
Glu Ser Gly Leu Gln Arg Lys Ser Thr Gly Gln Glu Glu Gln Ile Pro
180 185 190
Ser Ala Pro Ser Pro Pro Gly Ser Cys Val Gln Ala Glu Ala Ala Pro
195 200 205
Ala Gly Leu Cys Gly Glu Gln Gln Gly Asp Asp Cys Ala Glu Leu His
210 215 220
Asp Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Gly Ser Cys Ser Phe
225 230 235 240
Phe Thr Glu Thr Gly
245
<210> 3
<211> 241
<212> БЕЛОК
<213> Домовая мышь
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(241)
<223> /примечание="mTIGIT"
<400> 3
Met His Gly Trp Leu Leu Leu Val Trp Val Gln Gly Leu Ile Gln Ala
1 5 10 15
Ala Phe Leu Ala Thr Gly Ala Thr Ala Gly Thr Ile Asp Thr Lys Arg
20 25 30
Asn Ile Ser Ala Glu Glu Gly Gly Ser Val Ile Leu Gln Cys His Phe
35 40 45
Ser Ser Asp Thr Ala Glu Val Thr Gln Val Asp Trp Lys Gln Gln Asp
50 55 60
Gln Leu Leu Ala Ile Tyr Ser Val Asp Leu Gly Trp His Val Ala Ser
65 70 75 80
Val Phe Ser Asp Arg Val Val Pro Gly Pro Ser Leu Gly Leu Thr Phe
85 90 95
Gln Ser Leu Thr Met Asn Asp Thr Gly Glu Tyr Phe Cys Thr Tyr His
100 105 110
Thr Tyr Pro Gly Gly Ile Tyr Lys Gly Arg Ile Phe Leu Lys Val Gln
115 120 125
Glu Ser Ser Val Ala Gln Phe Gln Thr Ala Pro Leu Gly Gly Thr Met
130 135 140
Ala Ala Val Leu Gly Leu Ile Cys Leu Met Val Thr Gly Val Thr Val
145 150 155 160
Leu Ala Arg Lys Lys Ser Ile Arg Met His Ser Ile Glu Ser Gly Leu
165 170 175
Gly Arg Thr Glu Ala Glu Pro Gln Glu Trp Asn Leu Arg Ser Leu Ser
180 185 190
Ser Pro Gly Ser Pro Val Gln Thr Gln Thr Ala Pro Ala Gly Pro Cys
195 200 205
Gly Glu Gln Ala Glu Asp Asp Tyr Ala Asp Pro Gln Glu Tyr Phe Asn
210 215 220
Val Leu Ser Tyr Arg Ser Leu Glu Ser Phe Ile Ala Val Ser Lys Thr
225 230 235 240
Gly
<210> 4
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4; VH"
<400> 4
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Thr Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ala Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 5
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB2-IgG4; VH"
<400> 5
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Lys Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 6
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB3-IgG4; VH"
<400> 6
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB4-IgG4; VH"
<400> 7
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Gly Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB5-IgG4; VH"
<400> 8
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Gly Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4; VH"
<400> 9
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gly Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 10
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB7-IgG4; VH"
<400> 10
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Val Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 11
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB8-IgG4; VH"
<400> 11
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ala Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gln Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 12
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB9-IgG4; VH"
<400> 12
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 13
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB10-IgG4; VH"
<400> 13
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ala Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 14
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB11-IgG4; VH"
<400> 14
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 15
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB12-IgG4; VH"
<400> 15
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 16
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4; VH"
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Gly Asn Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 17
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB14-IgG4; VH"
<400> 17
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 18
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB15-IgG4; VH"
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 19
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB16-IgG4; VH"
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 20
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетическое - MAB17-IgG4; VH"
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 21
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB18-IgG4; VH"
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 22
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4; VH"
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 23
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB20-IgG4; VH"
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Val
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 24
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB21-IgG4; VH"
<400> 24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Thr Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 25
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4, MAB2-IgG4, MAB3-IgG4,
MAB4-IgG4, MAB5-IgG4; VL"
<400> 25
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Phe Asn Leu Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 26
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4, MAB7-IgG4, MAB8-IgG4,
MAB9-IgG4, MAB10-IgG4, MAB11-IgG4, MAB12-IgG4; VL"
<400> 26
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Thr Val Arg Pro
85 90 95
Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4, MAB15-IgG4,
MAB16-IgG4, MAB17-IgG4, MAB18-IgG4; VL"
<400> 27
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Val Val Trp Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 28
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4, MAB20-IgG4, MAB21-IgG4; VL"
<400> 28
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg His Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ile Val Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4, MAB2-IgG4, MAB3-IgG4,
MAB5-IgG4; H3-IMGT"
<400> 29
Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
1 5 10 15
<210> 30
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB4-IgG4; H3-IMGT"
<400> 30
Ala Arg Asp Ala Asn Tyr Tyr Gly Gly Ala Trp Ala Phe Asp Pro
1 5 10 15
<210> 31
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4, MAB7-IgG4, MAB8-IgG4,
MAB9-IgG4; H3-IMGT"
<400> 31
Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
1 5 10 15
<210> 32
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB10-IgG4, MAB11-IgG4, MAB12-IgG4;
H3-IMGT"
<400> 32
Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
1 5 10 15
<210> 33
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4, MAB15-IgG4,
MAB18-IgG4; H3-IMGT"
<400> 33
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile
1 5 10
<210> 34
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB16-IgG4, MAB17-IgG4; H3-IMGT"
<400> 34
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile
1 5 10
<210> 35
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4, MAB20-IgG4, MAB21-IgG4;
H3-IMGT"
<400> 35
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
1 5 10 15
<210> 36
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4; H2-Kabat"
<400> 36
Ser Ile Tyr Tyr Ser Gly Ala Thr Phe Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 37
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB2-IgG4, MAB3-IgG4, MAB4-IgG4;
H2-Kabat"
<400> 37
Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 38
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB5-IgG4; H2-Kabat"
<400> 38
Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser Leu Lys Gly
1 5 10 15
<210> 39
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4; H2-Kabat"
<400> 39
Ser Ile Tyr Tyr Ser Gly Gly Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 40
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB7-IgG4, MAB9-IgG4, MAB10-IgG4,
MAB11-IgG4, MAB12-IgG4; H2-Kabat"
<400> 40
Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 41
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB8-IgG4; H2-Kabat"
<400> 41
Ser Ile Tyr Tyr Ser Gly Gln Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 42
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4; H2-Kabat"
<400> 42
Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 43
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB15-IgG4, MAB16-IgG4; H2-Kabat"
<400> 43
Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe Gln
1 5 10 15
Gly
<210> 44
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB17-IgG4, MAB18-IgG4; H2-Kabat"
<400> 44
Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe Gln
1 5 10 15
Gly
<210> 45
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4; H2-Kabat"
<400> 45
Val Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 46
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB20-IgG4; H2-Kabat"
<400> 46
Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 47
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB21-IgG4; H2-Kabat"
<400> 47
Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Thr Gln Lys Phe Arg
1 5 10 15
Gly
<210> 48
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4; H1-Chothia + Kabat"
<400> 48
Gly Ser Ile Thr Ser Ser Ser Tyr Tyr Trp Gly
1 5 10
<210> 49
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB2-IgG4; H1-Chothia + Kabat"
<400> 49
Gly Ser Ile Ser Ser Ser Lys Tyr Tyr Trp Gly
1 5 10
<210> 50
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB3-IgG4, MAB4-IgG4, MAB5-IgG4;
H1-Chothia + Kabat"
<400> 50
Gly Ser Ile Ser Ser Thr Ser His Tyr Trp Gly
1 5 10
<210> 51
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4; H1-Chothia + Kabat"
<400> 51
Gly Ser Ile Glu Ser Gly Ser Tyr Tyr Trp Gly
1 5 10
<210> 52
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB7-IgG4; H1-Chothia + Kabat"
<400> 52
Gly Ser Ile Glu Ser Gly Val Tyr Tyr Trp Gly
1 5 10
<210> 53
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB8-IgG4; H1-Chothia + Kabat"
<400> 53
Gly Ser Ile Ala Ser Gly Ser Tyr Tyr Trp Gly
1 5 10
<210> 54
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB9-IgG4, MAB10-IgG4, MAB11-IgG4,
MAB12-IgG4; H1-Chothia + Kabat"
<400> 54
Gly Ser Ile Glu Ser Gly Leu Tyr Tyr Trp Gly
1 5 10
<210> 55
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетический - IgG4; константная, S228P стабилизирующая
петля"
<400> 55
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 56
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетический - IgG4; константная S228P, N297A,
C терминальный удаленный Lys"
<400> 56
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 57
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетический - IgG1; константная (G1m(3) аллотип)"
<400> 57
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 58
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4; H1-Chothia + Kabat"
<400> 58
Tyr Thr Phe Gly Asn Tyr Tyr Met His
1 5
<210> 59
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB14-IgG4, MAB18-IgG4; H1-Chothia
+ Kabat"
<400> 59
Tyr Thr Phe Pro Ala Tyr Tyr Met His
1 5
<210> 60
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB15-IgG4, MAB16-IgG4; H1-Chothia
+ Kabat"
<400> 60
Tyr Thr Phe Arg Glu Tyr Tyr Met His
1 5
<210> 61
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB17-IgG4; H1-Chothia + Kabat"
<400> 61
Tyr Thr Phe Pro Ala Tyr Tyr Ile His
1 5
<210> 62
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4, MAB20-IgG4, MAB21-IgG4;
H1-Chothia + Kabat"
<400> 62
Tyr Thr Phe Thr Ser His Tyr Met Gly
1 5
<210> 63
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4, MAB2-IgG4, MAB3-IgG4,
MAB4-IgG4, MAB5-IgG4; L3 - Chothia/Kabat/IMGT"
<400> 63
Gln Gln His Phe Asn Leu Pro Thr
1 5
<210> 64
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4, MAB7-IgG4, MAB8-IgG4,
MAB9-IgG4, MAB10-IgG4, MAB11-IgG4, MAB12-IgG4; L- Chothia/Kabat/IMGT"
<400> 64
Gln Gln His Thr Val Arg Pro Pro Leu Thr
1 5 10
<210> 65
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4, MAB15-IgG4,
MAB16-IgG4, MAB17-IgG4, MAB18-IgG4; L3 - Chothia/
Kabat/IMGT"
<400> 65
Gln Gln Tyr Val Val Trp Pro Pro Leu Thr
1 5 10
<210> 66
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19-IgG4, MAB20-IgG4, MAB21-IgG4;
L3 - Chothia/Kabat/IMGT"
<400> 66
Gln Gln Tyr Ile Val Phe Pro Trp Thr
1 5
<210> 67
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4, MAB2-IgG4, MAB3-IgG4,
MAB4-IgG4, MAB5-IgG4; L2 - Chothia/Kabat"
<400> 67
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 68
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4, MAB7-IgG4, MAB8-IgG4,
MAB9-IgG4, MAB10-IgG4, MAB11-IgG4, MAB12-IgG4; L2- Chothia/Kabat"
<400> 68
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 69
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4, MAB15-IgG4,
MAB16-IgG4, MAB17-IgG4, MAB18-IgG4, MAB19-IgG4, MAB20-IgG4, MAB21-IgG4;
L2 - Chothia/Kabat"
<400> 69
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 70
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1-IgG4, MAB2-IgG4, MAB3-IgG4,
MAB4-IgG4; L1 - Chothia/Kabat"
<400> 70
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 71
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6-IgG4, MAB7-IgG4, MAB8-IgG4,
MAB9-IgG4, MAB10-IgG4, MAB11-IgG4, MAB12-IgG4; L1 - Chothia/Kabat"
<400> 71
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 72
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13-IgG4, MAB14-IgG4, MAB15-IgG4,
MAB16-IgG4, MAB17-IgG4, MAB18-IgG4, MAB19-IgG4, MAB20
-IgG4, MAB21-IgG4; L1 - Chothia/Kabat"
<400> 72
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 73
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическая - SEC1; IgG4 S228P тяжелая цепь человека"
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Thr Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Thr Met His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Ser Gly Ser Gly Ile Val Phe Tyr Ala Asp Ala Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Leu Leu Phe
65 70 75 80
Leu Gln Met Asn Asp Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Pro Leu Gly His Asn Thr Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 74
<211> 119
<212> БЕЛОК
<213> Хомо сапиенс
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(119)
<223> /примечание="SEC1; вариабельная область тяжелой цепи"
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Thr Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Thr Met His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Ser Gly Ser Gly Ile Val Phe Tyr Ala Asp Ala Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Leu Leu Phe
65 70 75 80
Leu Gln Met Asn Asp Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Pro Leu Gly His Asn Thr Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 75
<211> 220
<212> БЕЛОК
<213> Хомо сапиенс
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(220)
<223> /примечание="SEC1 каппа цепь человека"
<400> 75
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Tyr Tyr Ser
20 25 30
Gly Val Lys Glu Asn Leu Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Tyr Ala Ser Ile Arg Phe Thr Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr
65 70 75 80
Ile Thr Ser Val Gln Ala Glu Asp Met Gly Gln Tyr Phe Cys Gln Gln
85 90 95
Gly Ile Asn Asn Pro Leu Thr Phe Gly Asp Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 76
<211> 113
<212> БЕЛОК
<213> Хомо сапиенс
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(113)
<223> /примечание="SEC1; вариабельная область легкой цепи"
<400> 76
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Tyr Tyr Ser
20 25 30
Gly Val Lys Glu Asn Leu Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Tyr Ala Ser Ile Arg Phe Thr Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr
65 70 75 80
Ile Thr Ser Val Gln Ala Glu Asp Met Gly Gln Tyr Phe Cys Gln Gln
85 90 95
Gly Ile Asn Asn Pro Leu Thr Phe Gly Asp Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 77
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическая - SEC1; мышиная IgG2a N297A тяжелая цепь"
<400> 77
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Thr Gln Pro Gly Lys
1 5 10 15
Ser Leu Lys Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Thr Met His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Ser Gly Ser Gly Ile Val Phe Tyr Ala Asp Ala Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Leu Leu Phe
65 70 75 80
Leu Gln Met Asn Asp Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Pro Leu Gly His Asn Thr Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser
180 185 190
Thr Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys
210 215 220
Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser
245 250 255
Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp
260 265 270
Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr
275 280 285
Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Ala Ser Thr Leu Arg Val
290 295 300
Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu
305 310 315 320
Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg
325 330 335
Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr
355 360 365
Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr
370 375 380
Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys
405 410 415
Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu
420 425 430
Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly
435 440 445
Lys
<210> 78
<211> 220
<212> БЕЛОК
<213> Домовая мышь
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(220)
<223> /примечание="SEC1; мышиная каппа цепь"
<400> 78
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Tyr Tyr Ser
20 25 30
Gly Val Lys Glu Asn Leu Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Tyr Ala Ser Ile Arg Phe Thr Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr
65 70 75 80
Ile Thr Ser Val Gln Ala Glu Asp Met Gly Gln Tyr Phe Cys Gln Gln
85 90 95
Gly Ile Asn Asn Pro Leu Thr Phe Gly Asp Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120 125
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn
130 135 140
Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu
145 150 155 160
Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr
180 185 190
Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr
195 200 205
Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215 220
<210> 79
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1; полноразмерный IgG4 S228P"
<400> 79
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Thr Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ala Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 80
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1; полноразмерный IgG1"
<400> 80
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Thr Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ala Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 81
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB1, MAB2, MAB3, MAB4, MAB5;
полноразмерная каппа"
<400> 81
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Phe Asn Leu Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 82
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB2; полноразмерный IgG4 S228P"
<400> 82
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Lys Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 83
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB2; полноразмерный IgG1"
<400> 83
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Lys Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 84
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB3; полноразмерный IgG4 S228P"
<400> 84
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 85
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB3; полноразмерный IgG1"
<400> 85
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 86
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB4; полноразмерный IgG4 S228P"
<400> 86
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Gly Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 87
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB4; полноразмерный IgG1"
<400> 87
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Gly Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 88
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB5; полноразмерный IgG4 S228P"
<400> 88
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Gly Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 89
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB5; полноразмерный IgG1"
<400> 89
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Thr
20 25 30
Ser His Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser
50 55 60
Leu Lys Gly Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 90
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6; полноразмерный IgG4 S228P"
<400> 90
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gly Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 91
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6; полноразмерный IgG1"
<400> 91
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gly Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 92
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB6, MAB7, MAB8, MAB9, MAB10,
MAB11, MAB12; полноразмерная каппа"
<400> 92
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Thr Val Arg Pro
85 90 95
Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 93
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB7; полноразмерный IgG4 S228P"
<400> 93
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Val Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 94
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB7; полноразмерный IgG1"
<400> 94
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Val Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 95
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB8; полноразмерный IgG4 S228P"
<400> 95
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ala Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gln Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 96
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB8; полноразмерный IgG1"
<400> 96
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ala Ser Gly
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Gln Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 97
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB9; полноразмерный IgG4 S228P"
<400> 97
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 98
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB9; полноразмерный IgG1"
<400> 98
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Thr Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 99
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB10; полноразмерный IgG4 S228P"
<400> 99
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ala Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 100
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB10; полноразмерный IgG1"
<400> 100
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ala Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 101
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB11; полноразмерный IgG4 S228P"
<400> 101
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 102
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB11; полноразмерный IgG1"
<400> 102
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 103
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB12; полноразмерный IgG4 S228P"
<400> 103
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 104
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB12; полноразмерный IgG1"
<400> 104
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Gly Ser Ile Glu Ser Gly
20 25 30
Leu Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 105
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13; полноразмерный IgG4 S228P"
<400> 105
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Gly Asn Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 106
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13; полноразмерный IgG1"
<400> 106
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Gly Asn Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 107
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB13, MAB14, MAB15, MAB16, MAB17,
MAB18; полноразмерная каппа"
<400> 107
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Val Val Trp Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 108
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB14; полноразмерный IgG4 S228P"
<400> 108
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 109
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB14; полноразмерный IgG1"
<400> 109
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 110
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB15; полноразмерный IgG4 S228P"
<400> 110
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 111
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB15; полноразмерный IgG1"
<400> 111
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 112
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB16; полноразмерный IgG4 S228P"
<400> 112
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 113
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB16; полноразмерный IgG1"
<400> 113
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Arg Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Ile Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 114
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB17; полноразмерный IgG4 S228P"
<400> 114
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 115
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB17; полноразмерный IgG1"
<400> 115
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 116
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB18; полноразмерный IgG4 S228P"
<400> 116
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 117
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB18; полноразмерный IgG1"
<400> 117
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ala Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Arg Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 118
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19; полноразмерный IgG4 S228P"
<400> 118
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 119
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19; полноразмерный IgG1"
<400> 119
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 120
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB19, MAB20, MAB21;
полноразмерная каппа"
<400> 120
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg His Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ile Val Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 121
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB20; полноразмерный IgG4 S228P"
<400> 121
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Val
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 122
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB20; полноразмерный IgG1"
<400> 122
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Val
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 123
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB21; полноразмерный IgG4 S228P"
<400> 123
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Thr Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 124
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическое - MAB21; полноразмерный IgG1"
<400> 124
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser His
20 25 30
Tyr Met Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Thr Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu His Val Ser Gly Ser Tyr Tyr Pro Ala Tyr Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 125
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетический - IgG1; константная (G1m(17,1)
аллотип, N297A"
<400> 125
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 126
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> источник
<223> /примечание="Синтетическая - каппа; константная"
<400> 126
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 127
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетический - линкер"
<400> 127
Gly Gly Gly Gly Ser
1 5
<210> 128
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H3"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Thr"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(15)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 128
Ala Arg Asp Gly Val Leu Ala Leu Asn Lys Arg Ser Phe Asp Ile
1 5 10 15
<210> 129
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H2"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Gln" или "Gly"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(16)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 129
Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 130
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H1"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Ala"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Val" или "Ser"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(11)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 130
Gly Ser Ile Glu Ser Gly Leu Tyr Tyr Trp Gly
1 5 10
<210> 131
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H3"
<220>
<221> ВАРИАНТ
<222> (9)..(9)
<223> /замена="Gly"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(15)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 131
Ala Arg Asp Ala Asn Tyr Tyr Gly Ser Ala Trp Ala Phe Asp Pro
1 5 10 15
<210> 132
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H2"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Ala"
<220>
<221> ВАРИАНТ
<222> (16)..(16)
<223> /замена="Gly"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(16)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 132
Ser Ile Tyr Tyr Ser Gly Ser Thr Phe Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 133
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H1"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /замена="Lys"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Tyr"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(11)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 133
Gly Ser Ile Ser Ser Ser Ser His Tyr Trp Gly
1 5 10
<210> 134
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H3"
<220>
<221> ВАРИАНТ
<222> (12)..(12)
<223> /замена="Leu"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(14)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 134
Ala Arg Gly Gly Arg Thr Thr Trp Ile Gly Ala Phe Asp Ile
1 5 10
<210> 135
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H2"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /замена="Ile"
<220>
<221> ВАРИАНТ
<222> (13)..(13)
<223> /замена="Arg"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(17)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 135
Ile Ile Asn Pro Ser Leu Gly Leu Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 136
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H1"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Pro" или "Arg"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Ala" или "Glu"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /замена="Ile"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(9)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 136
Tyr Thr Phe Gly Asn Tyr Tyr Met His
1 5
<210> 137
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<220>
<221> источник
<223> /примечание="Синтетическая - CDR-H2"
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /замена="Ile"
<220>
<221> ВАРИАНТ
<222> (12)..(12)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (16)..(16)
<223> /замена="Arg"
<220>
<221> ПРОЧИЙ_ ПРИЗНАК
<222> (1)..(17)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества по отношению к вариантным остаткам в аннотациях
для вариантных положений"
<400> 137
Val Ile Asn Pro Ser Met Gly Ala Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 138
<211> 249
<212> БЕЛОК
<213> Домовая мышь
<220>
<221> источник
<223> /примечание="mTIGIT2"
<400> 138
Met His Gly Trp Leu Leu Leu Val Trp Val Gln Gly Leu Ile Gln Ala
1 5 10 15
Ala Phe Leu Ala Thr Ala Ile Gly Ala Thr Ala Gly Thr Ile Asp Thr
20 25 30
Lys Arg Asn Ile Ser Ala Glu Glu Gly Gly Ser Val Ile Leu Gln Cys
35 40 45
His Phe Ser Ser Asp Thr Ala Glu Val Thr Gln Val Asp Trp Lys Gln
50 55 60
Gln Asp Gln Leu Leu Ala Ile Tyr Ser Val Asp Leu Gly Trp His Val
65 70 75 80
Ala Ser Val Phe Ser Asp Arg Val Val Pro Gly Pro Ser Leu Gly Leu
85 90 95
Thr Phe Gln Ser Leu Thr Met Asn Asp Thr Gly Glu Tyr Phe Cys Thr
100 105 110
Tyr His Thr Tyr Pro Gly Gly Ile Tyr Lys Gly Arg Ile Phe Leu Lys
115 120 125
Val Gln Glu Ser Ser Asp Asp Arg Asn Gly Leu Ala Gln Phe Gln Thr
130 135 140
Ala Pro Leu Gly Gly Thr Met Ala Ala Val Leu Gly Leu Ile Cys Leu
145 150 155 160
Met Val Thr Gly Val Thr Val Leu Ala Arg Lys Asp Lys Ser Ile Arg
165 170 175
Met His Ser Ile Glu Ser Gly Leu Gly Arg Thr Glu Ala Glu Pro Gln
180 185 190
Glu Trp Asn Leu Arg Ser Leu Ser Ser Pro Gly Ser Pro Val Gln Thr
195 200 205
Gln Thr Ala Pro Ala Gly Pro Cys Gly Glu Gln Ala Glu Asp Asp Tyr
210 215 220
Ala Asp Pro Gln Glu Tyr Phe Asn Val Leu Ser Tyr Arg Ser Leu Glu
225 230 235 240
Ser Phe Ile Ala Val Ser Lys Thr Gly
245
<210> 139
<211> 687
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 139
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Tyr Ser Ile Ser Ser Gly
20 25 30
Leu Gly Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Gly Ile Tyr Glu Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala His Glu Arg Val Arg Gly Tyr Gly Asp Tyr Gly Gly His His Ala
100 105 110
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
210 215 220
Glu Pro Lys Ser Cys Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu
225 230 235 240
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
245 250 255
Ala Val Ser Gly Tyr Ser Ile Ser Ser Gly Leu Gly Trp Gly Trp Ile
260 265 270
Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Gly Ile Tyr Glu
275 280 285
Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile
290 295 300
Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val
305 310 315 320
Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala His Glu Arg Val Arg
325 330 335
Gly Tyr Gly Asp Tyr Gly Gly His His Ala Phe Asp Ile Trp Gly Gln
340 345 350
Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
355 360 365
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
370 375 380
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
385 390 395 400
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
405 410 415
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
420 425 430
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
435 440 445
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
450 455 460
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
465 470 475 480
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
485 490 495
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
500 505 510
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
515 520 525
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
530 535 540
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
545 550 555 560
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
565 570 575
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
580 585 590
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
595 600 605
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
610 615 620
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
625 630 635 640
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
645 650 655
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
660 665 670
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
675 680 685
<210> 140
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Glu Tyr Ala Thr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 141
<211> 454
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 141
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Val
20 25 30
Ala Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ala Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Gly Tyr Asp Ser Ser Arg Tyr Tyr Tyr Ser Asn Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
130 135 140
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
195 200 205
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
325 330 335
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Leu Gly Lys
450
<210> 142
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 142
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Leu Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 143
<211> 457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 143
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Val
20 25 30
Ala Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ala Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Pro Gly Tyr Asp Ser Ser Arg Tyr Tyr Tyr Ser Asn Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly Asp
130 135 140
Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
180 185 190
Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile Thr
195 200 205
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
210 215 220
Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro
225 230 235 240
Ala Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
245 250 255
Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val
260 265 270
Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe
275 280 285
Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu
290 295 300
Asp Tyr Ala Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His
305 310 315 320
Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys
325 330 335
Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser
340 345 350
Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met
355 360 365
Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro
370 375 380
Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn
385 390 395 400
Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met
405 410 415
Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser
420 425 430
Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr Thr
435 440 445
Lys Ser Phe Ser Arg Thr Pro Gly Lys
450 455
<210> 144
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 144
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Tyr Ser Leu Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Ala Asp Ala Ala Pro
100 105 110
Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly
115 120 125
Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn
130 135 140
Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu Asn
145 150 155 160
Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser
165 170 175
Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr
180 185 190
Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser Phe
195 200 205
Asn Arg Asn Glu Cys
210
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ ПРОТИВ GITR И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2795625C2 |
| УЛУЧШЕННЫЕ АНТИ-FLT3 АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2830982C2 |
| АНТАГОНИСТЫ NGF ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2829812C2 |
| АНТИТЕЛО ПРОТИВ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ σ РЕЦЕПТОРНОГО ТИПА ЧЕЛОВЕКА | 2012 |
|
RU2715642C2 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С НЕОНАТАЛЬНЫМ FC-РЕЦЕПТОРОМ (FCRN) ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2830231C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| МОЛЕКУЛА РЕЦЕПТОРА IL4/IL13 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2795591C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
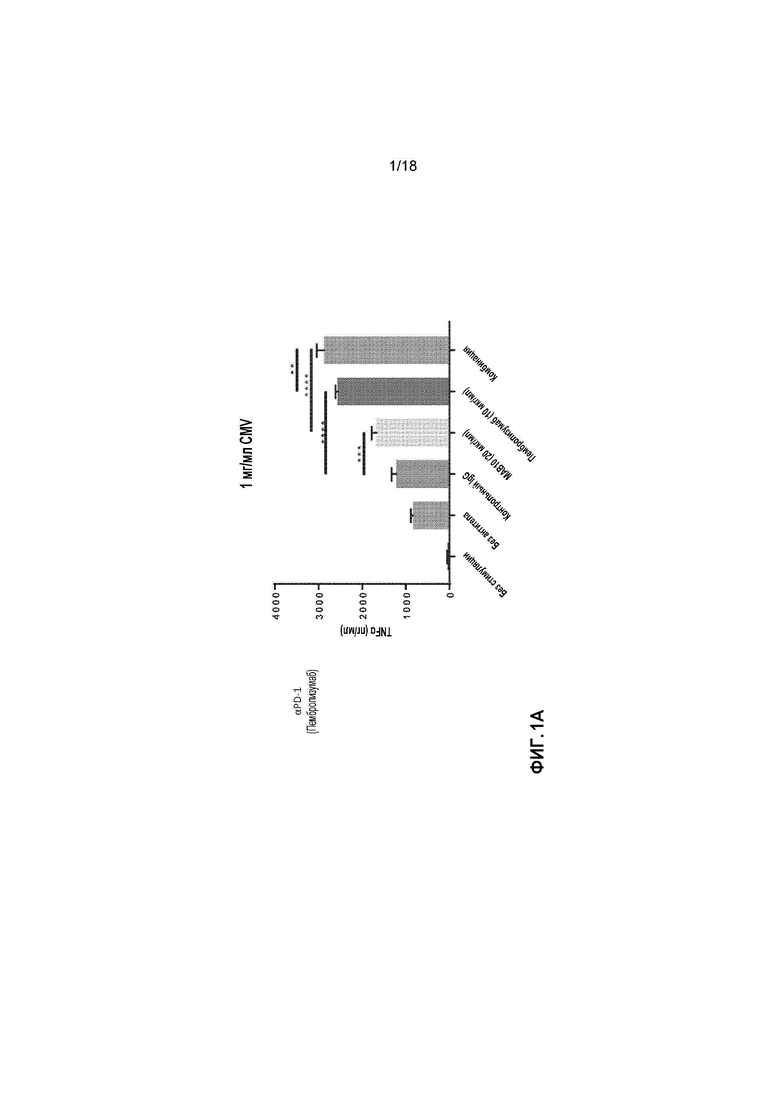


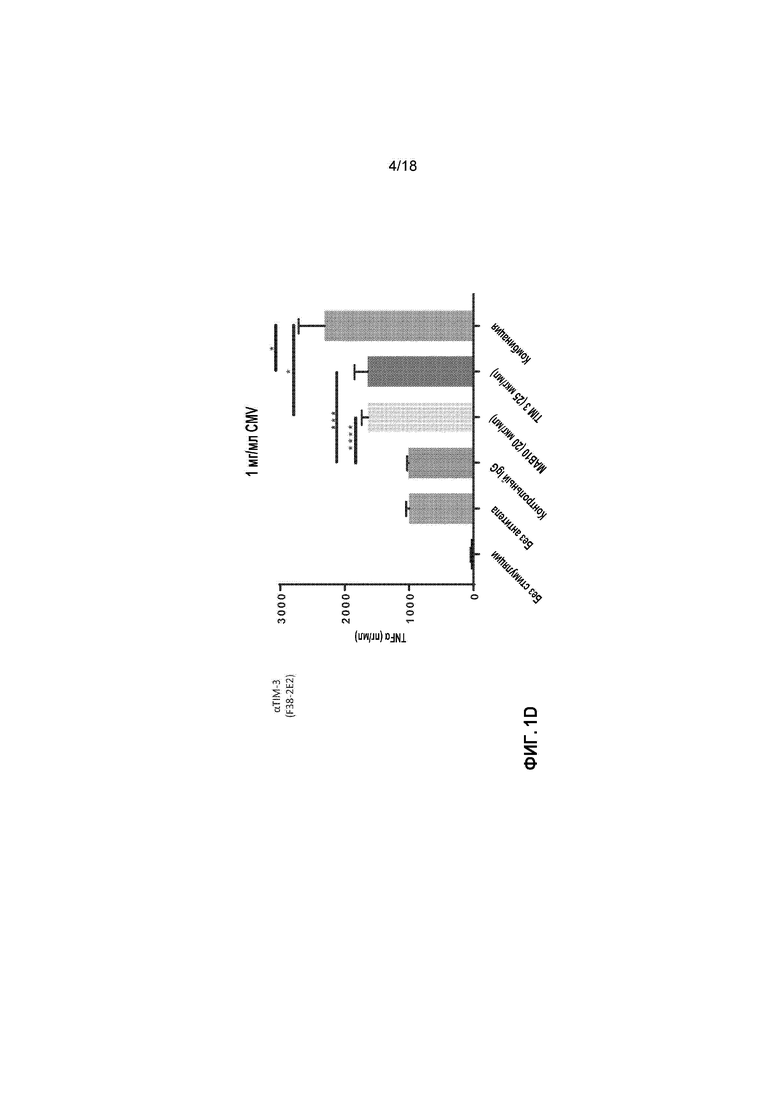


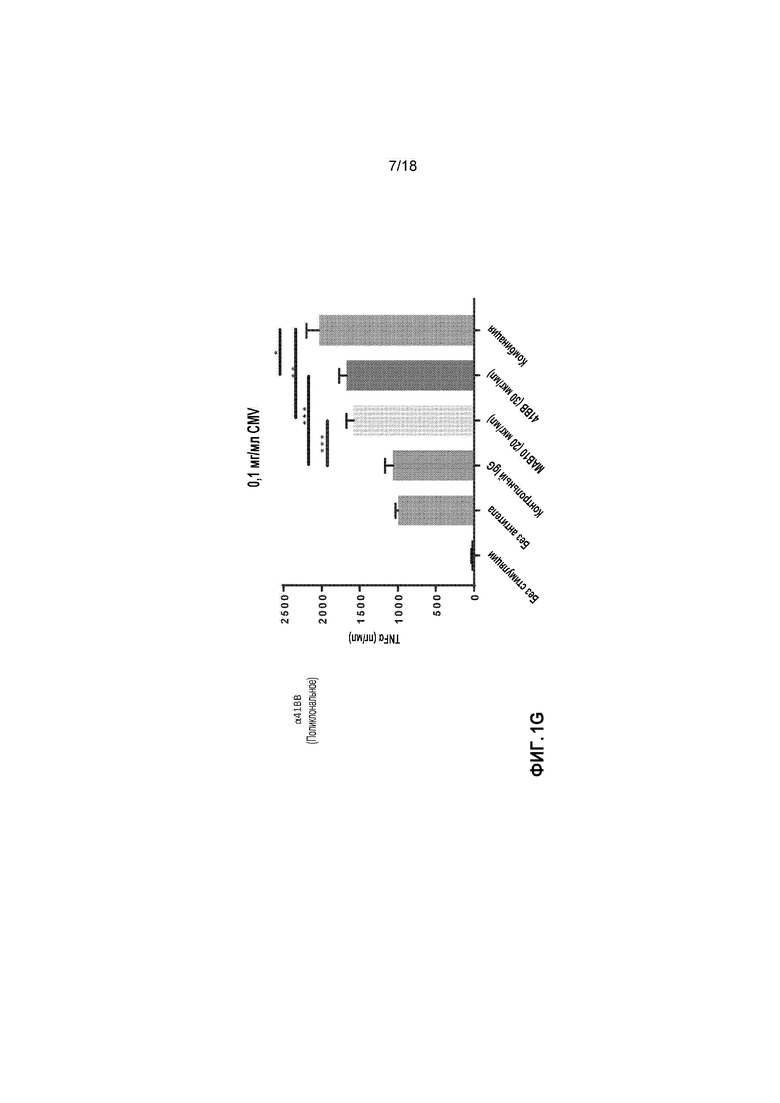
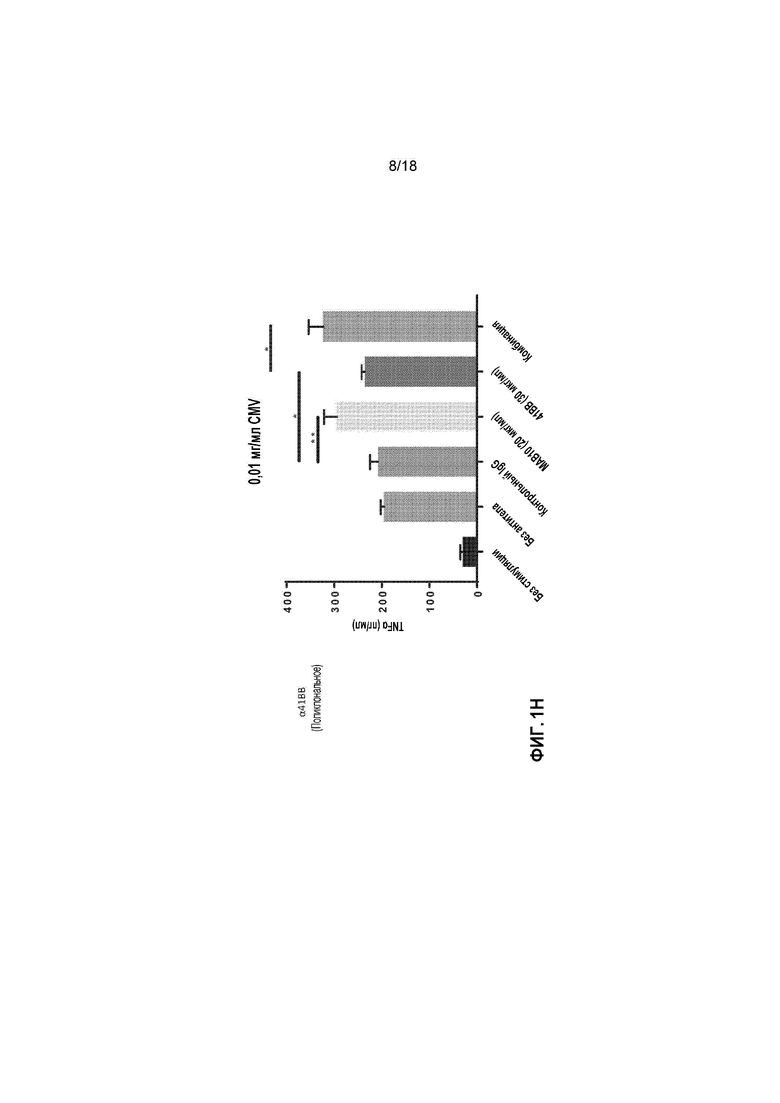


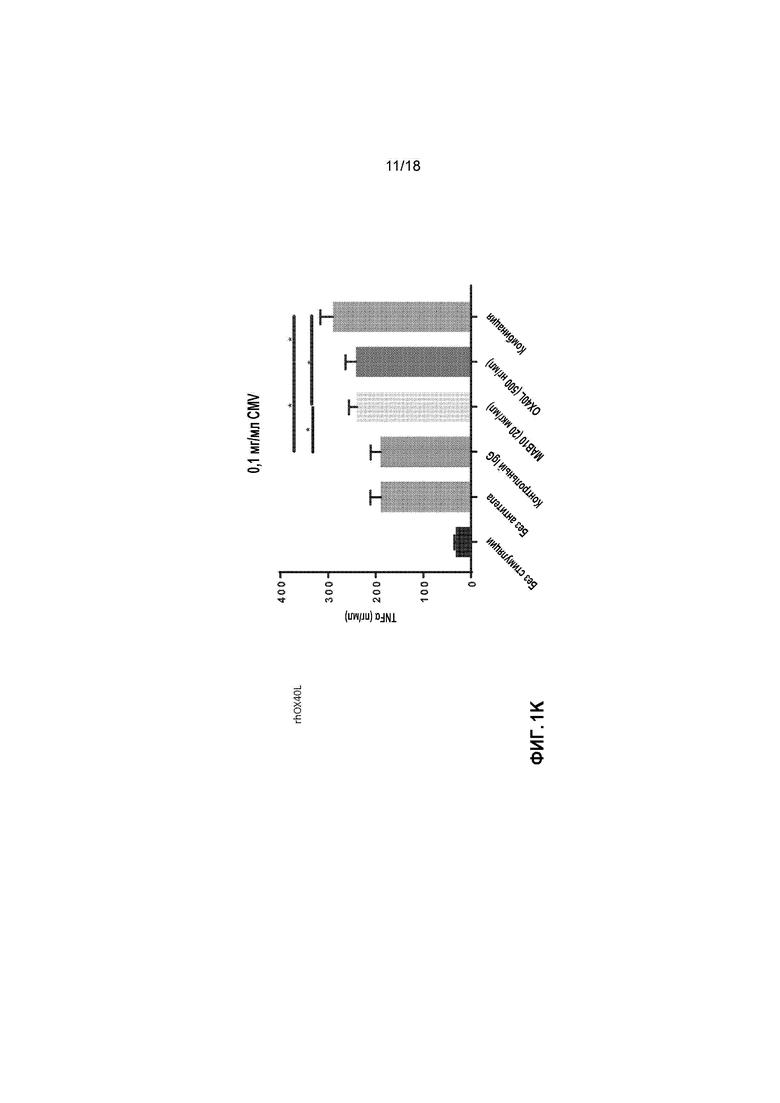
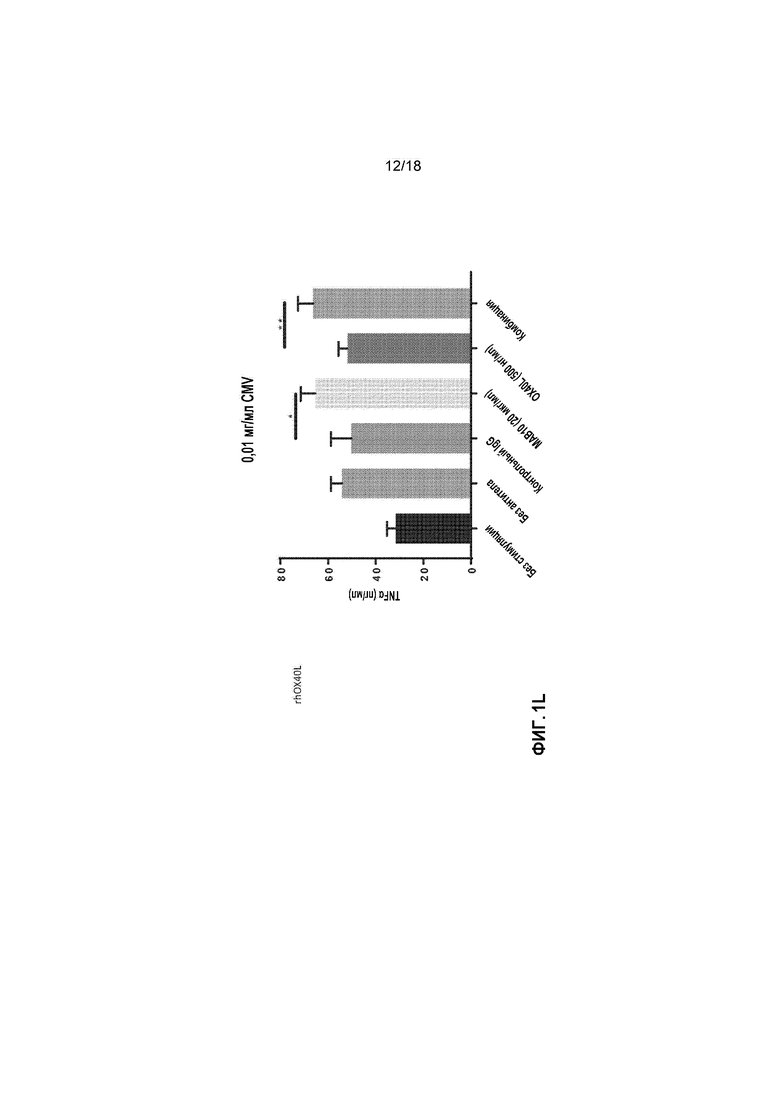

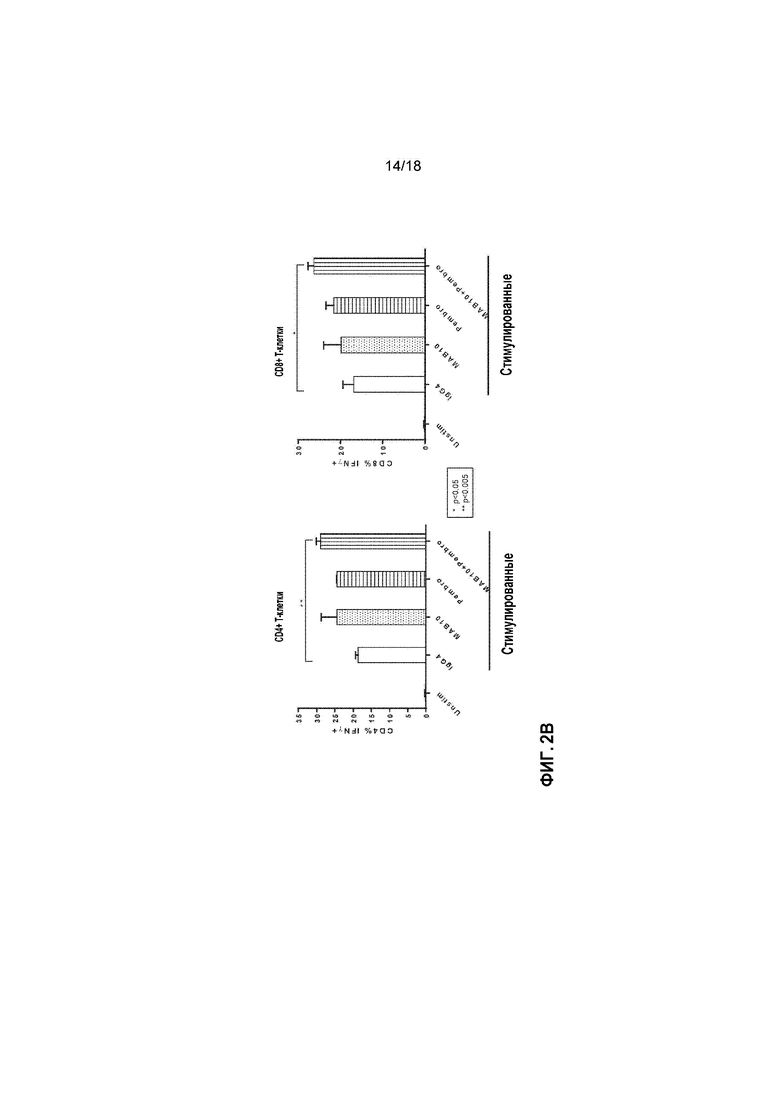


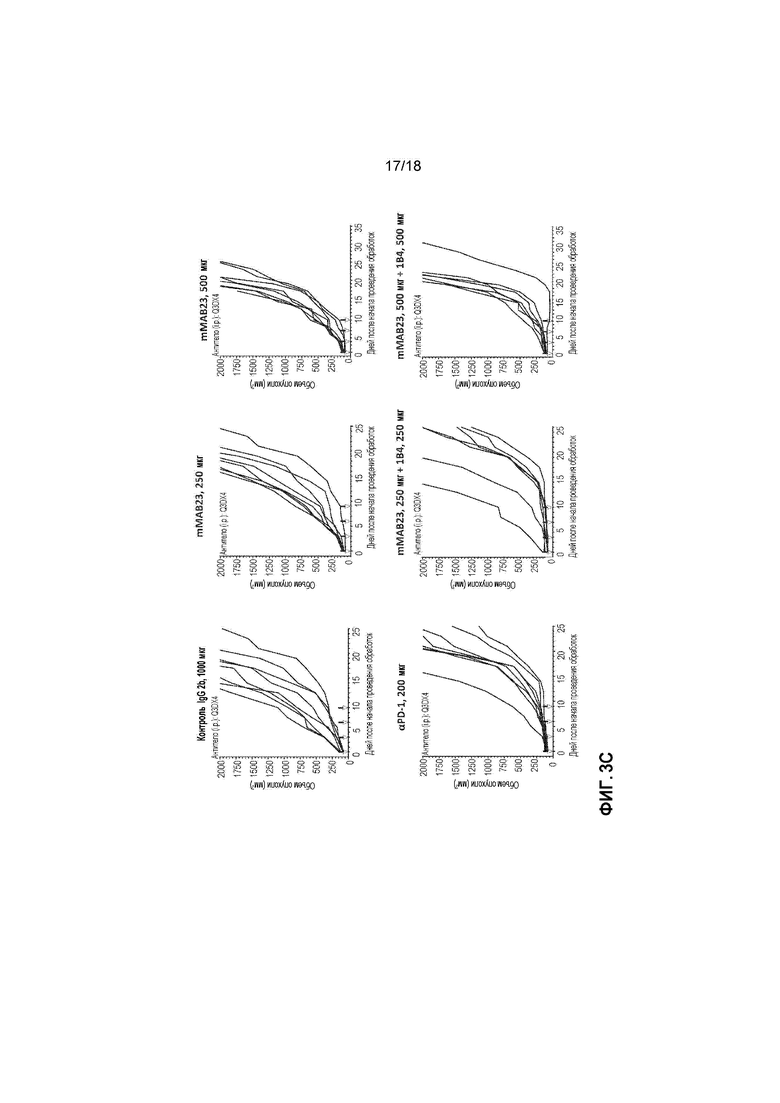
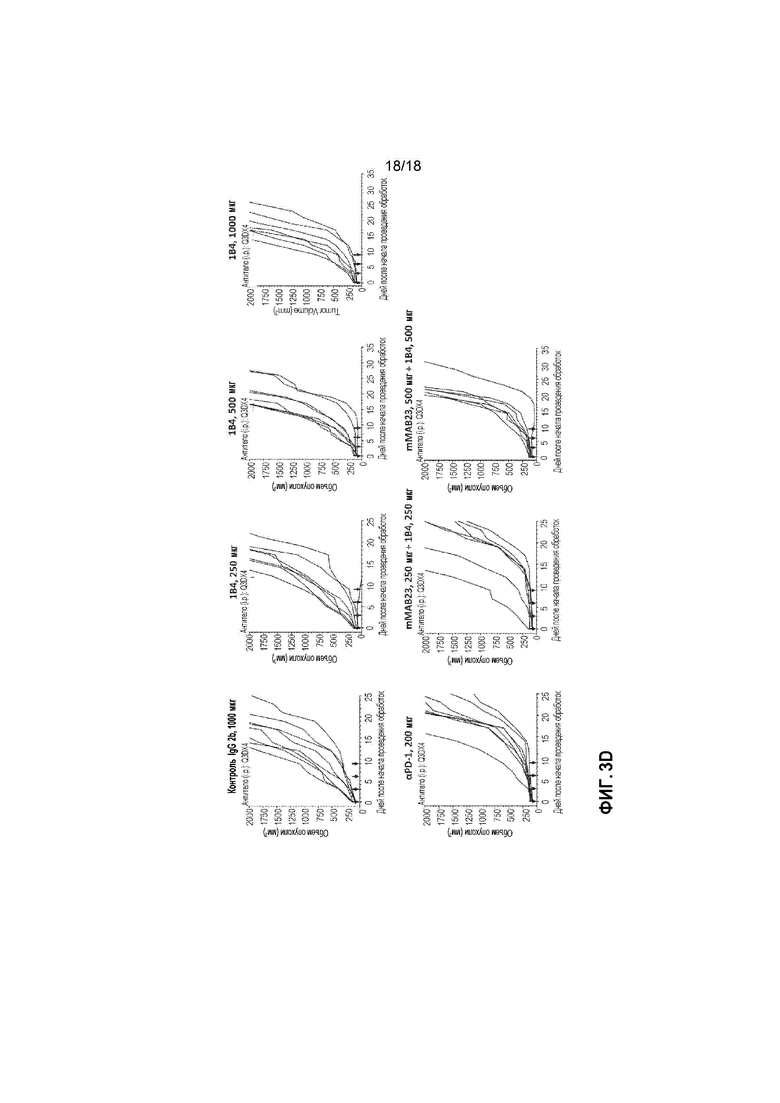
Изобретение относится к области биотехнологии, конкретно к способу лечения или предотвращения рака у субъекта. Предложенный способ включает введение субъекту эффективного количества антитела со специфичностью связывания Т-клеточного иммунорецептора с доменами Ig и ITIM (TIGIT) и иммунотерапевтического средства, содержащего антитело против NRP человека, и эффективно ингибирует рост опухоли. 21 з.п. ф-лы, 3 ил., 7 табл., 3 пр.
1. Способ лечения или предотвращения рака у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества:
(i) антитела или его антигенсвязывающего фрагмента, содержащего:
а) VH последовательность SEQ ID NO: 4 и VL последовательность SEQ ID NO: 25;
b) VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 25;
c) VH последовательность SEQ ID NO: 6 и VL последовательность SEQ ID NO: 25;
d) VH последовательность SEQ ID NO: 7 и VL последовательность SEQ ID NO: 25;
e) VH последовательность SEQ ID NO: 8 и VL последовательность SEQ ID NO: 25;
f) VH последовательность SEQ ID NO: 9 и VL последовательность SEQ ID NO: 26;
g) VH последовательность SEQ ID NO: 10 и VL последовательность SEQ ID NO: 26;
h) VH последовательность SEQ ID NO: 11 и VL последовательность SEQ ID NO: 26;
i) VH последовательность SEQ ID NO: 12 и VL последовательность SEQ ID NO: 26;
j) VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 26;
k) VH последовательность SEQ ID NO: 14 и VL последовательность SEQ ID NO: 26;
l) VH последовательность SEQ ID NO: 15 и VL последовательность SEQ ID NO: 26;
m) VH последовательность SEQ ID NO: 16 и VL последовательность SEQ ID NO: 27;
n) VH последовательность SEQ ID NO: 17 и VL последовательность SEQ ID NO: 27;
о) VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 27;
p) VH последовательность SEQ ID NO: 19 и VL последовательность SEQ ID NO: 27;
q) VH последовательность SEQ ID NO: 20 и VL последовательность SEQ ID NO: 27;
r) VH последовательность SEQ ID NO: 21 и VL последовательность SEQ ID NO: 27;
s) VH последовательность SEQ ID NO: 22 и VL последовательность SEQ ID NO: 28;
t) VH последовательность SEQ ID NO: 23 и VL последовательность SEQ ID NO: 28; или
u) VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 28; и
(ii) одно или более из дополнительных иммунотерапевтических средств, содержащих антитело против NRP человека.
2. Способ по п. 1, в котором одно или более из дополнительных иммунотерапевтических средств дополнительно содержат одно или более из иммунотерапевтических средств, выбранных из группы, состоящей из:
а) иммунотерапевтического средства, которое блокирует активацию сигнального пути ингибирующего рецептора иммунной клетки или его лиганда, или нуклеиновой кислоты, кодирующей иммунотерапевтическое средство; и
b) иммунотерапевтического средства, которое модулирует активацию сигнального пути костимулирующего рецептора, или нуклеиновой кислоты, кодирующей иммунотерапевтическое средство.
3. Способ по п. 2, в котором ингибирующий рецептор или его лиганд выбирают из CTLA–4, PD–1, PD–L1, PD–L2, Tim–3, нейритина, BTLA, CECAM–1, CECAM–5, VISTA, LAIR1, CD160, 2B4, KIR и их комбинаций.
4. Способ по п. 2, в котором костимулирующий рецептор представляет собой CD3, GITR OX40, ICOS, LAG–2, CD27, CD28, CD40 или 4–1BB.
5. Способ по любому из пп. 1–4, в котором рак выбирают из солидной опухоли и гематологической опухоли.
6. Способ по п. 5, в котором рак представляет собой солидную опухоль.
7. Способ по п. 1, в котором одно или более из дополнительных иммунотерапевтических средств дополнительно содержат антитело против Tim–3, 41BB, GITR, PD–1 или PD–L1 или дополнительно содержат OX40.
8. Способ по п. 1, в котором одно или несколько дополнительных иммунотерапевтических средств дополнительно содержат антитело против GITR, содержащее VH последовательность SEQ ID NO: 139 и VL последовательность SEQ ID NO: 140.
9. Способ по п. 1, в котором антитело против NRP человека содержит VH последовательность SEQ ID NO: 141 и VL последовательность SEQ ID NO: 142.
10. Способ по п. 8 или 9, в котором антитело или его антигенсвязывающий фрагмент содержит VH последовательность SEQ ID NO: 13 и VL последовательность SEQ ID NO: 26.
11. Способ по п. 8 или 9, в котором антитело или его антигенсвязывающий фрагмент содержит VH последовательность SEQ ID NO: 5 и VL последовательность SEQ ID NO: 25.
12. Способ по п. 8 или 9, в котором антитело или его антигенсвязывающий фрагмент содержит VH последовательность SEQ ID NO: 18 и VL последовательность SEQ ID NO: 27.
13. Способ по п. 8 или 9, в котором антитело или его антигенсвязывающий фрагмент содержит VH последовательность SEQ ID NO: 24 и VL последовательность SEQ ID NO: 27.
14. Способ по любому из пп. 1–4, в котором комбинированная терапия обладает аддитивным воздействием на иммунную активацию.
15. Способ по любому из пп. 1–4, в котором комбинированная терапия обладает синергетическим воздействием на иммунную активацию.
16. Способ по п. 14, в котором определение аддитивного или синергетического действия на иммунную активацию проводят путем исследования вторичного иммунного ответа на цитомегаловирус (CMV).
17. Способ по п. 14, в котором определение аддитивного или синергетического действия на иммунную активацию проводят путем исследования диссоциированных опухолевых клеток.
18. Способ по любому из пп. 1–4, в котором дополнительное терапевтическое средство приготавливают в одной и той же фармацевтической композиции, что и антитело или его антигенсвязывающий фрагмент.
19. Способ по любому из пп. 1–4, в котором дополнительное терапевтическое средство приготавливают в раздельной от фармацевтической композиции антитела или его антигенсвязывающего фрагмента.
20. Способ по любому из пп. 1–4, в котором дополнительное терапевтическое средство вводят до введения антитела или его антигенсвязывающего фрагмента.
21. Способ по любому из пп. 1–4, в котором дополнительное терапевтическое средство вводят после введения антитела или его антигенсвязывающего фрагмента.
22. Способ по любому из пп. 1–4, в котором дополнительное терапевтическое средство вводят одновременно с антителом или его антигенсвязывающим фрагментом.
| US 20160176963 A1, 23.06.2016 | |||
| WO 2016191643 A2, 01.12.2016 | |||
| RU 2015123032 A, 11.01.2017 | |||
| TOPALIAN S | |||
| L | |||
| et al., Safety, activity, and immune correlates of anti-PD-1 antibody in cancer, New England Journal of Medicine, 2012, V | |||
| Саморазгружающаяся железнодорожная платформа | 1921 |
|
SU366A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
Авторы
Даты
2022-07-25—Публикация
2018-03-30—Подача