В лечении заболеваний центральной нервной системы большие надежды возлагают на технологии, основанные на применении индуцированных плюрипотентных стволовых клеток (ИПСК), которые могут быть получены из зрелой соматической клетки путем трансдукции определенными генами [Некрасов Е.Д. и др., 2011]. Использование данных технологий позволяет получать аутогенные нейрональные и астроглиальные предшественники для применения в комплексном лечении нейродегенеративных заболеваний. Для разработки методов лечения с использованием ИПСК и внедрения продуктов на их основе в клиническую практику необходимы экспериментальные и предклинические исследования, направленные на выяснение молекулярных механизмов действия, определение популяций клеток с наибольшим терапевтическим эффектом, исследование дозозависимых эффектов, кратности введения и др. [Kim S.U. et all, 2009]. Современные протоколы дифференцировки ИПСК позволяют получать как нейроны, так и глиальные клетки [Chambers S.М. et all, 2009; Madhu V. et all, 2016; Wechsler-Reya R.J. et all, 1999; Hughes S.M. et al., 1988; Song M.R., 2004]. До недавних пор основное внимание в терапии нейродегенеративных заболеваний уделялось нейропротекции, поскольку считалось, что в ЦНС не происходит регенерации. Однако в последнее время стали появляться исследования, которые свидетельствуют о репаративных процессах в ЦНС в постнатальном периоде. Выяснилось, что в головном мозге существуют нейральные стволовые клетки (НСК), которые сосредоточены в субвентрикулярной зоне боковых желудочков и зубчатой извилине гиппокампа [Eriksson, P.S. et all 1998]. Повреждение головного мозга оказывает стимулирующее воздействие на пролиферативную активность НСК, их миграцию в зону повреждения и последующую дифференцировку в нейрональные и глиальные клетки, заместительная способность которых составляет только 0,2% от числа погибших клеток [Mattson М.Р. et all, 2000; Kernie S.G. et all, 2010]. Следующим этапом репаративного процесса является реорганизация нейрональной сети за счет пластичности нейронов. Данный процесс характеризуется изменением количества и длины нейрональных отростков и установлением новых синаптических связей [ Et all, 2017]. Неотъемлемыми частью репаративных процессов является также восстановление ГЭБ и неоваскуляризация [Xiong, Y. et all, 2010; Prakash R. et all, 2015]. Данные факты о способности ЦНС к репарации позволяют сделать заключение, что регенерация является важным механизмом неврологического восстановления после повреждения и является новой мишенью терапевтических воздействий. Клеточная терапия, как новое направление в терапии нейродегенеративных заболеваний, послужила основой для активного развития новых терапевтических стратегий лечения инсульта на основе применения стволовых клеток (СК). Однако долгое время клеточные технологии подвергались критике из-за отсутствия единой специфической мишени и понимания механизмов действия клеточного трансплантата. На сегодняшний день существует много данных о применении постнатальных клеток костного мозга, таких как гемопоэтические стволовые клетки, мезенхимальные стволовые клетки, эндотелиальные клетки-предшественники, а также фетальных стволовых клеток, которые оказывают терапевтическое действие при нейродегенеративных заболеваниях [Quittet М.S. et al., 2015; Giraldi-Guimaraes, et all, 2009; Napoli E. et all, 2016]. В последние годы была продемонстрирована способность стволовых клеток секретировать биологически активные вещества, которые положительно влияют на течение многих нейродегенеративных заболеваний. Кондиционированные среды (КС) являются источником большого количества паракринных факторов, в том числе нейротрофинов (BDNF, GDNF, NGF, NT3-5, CNTF и др), цитокинов [Prospect of Stem Cell Conditioned Medium in Regenerative Medicine. Jeanne Adiwinata Pawitan. BioMed Research International 2014, Article ID 965849], экзосом [Microvesicles from brain-extracttreated mesenchymal stem cells improve neurological functions in a rat model of ischemic stroke. Ji Yong Lee, Eiru Kim, Seong-Mi Choi, Dong-Wook Kim, Kwang Pyo Kim, Insuk Lee & Han-Soo Kim. Scientific Reports. Published: 09 September 2016] и способны оказывать комплексное воздействие при различных патологиях. Существуют результаты многочисленных исследований, свидетельствующие о важности роли нейротрофинов в развитии болезни Альцгеймера, и их способности оказывать нейропротекторное, антиапоптотическое, нейротрофическое воздействие. Цитокины, находящиеся в КС, способны оказывать противовоспалительное действие. Экзосомы, также содержащиеся в КС, могут влиять на элиминацию бета-амилоида из ткани мозга [Exosomes as Carriers of Alzheimer's Amyloid-β. Kohei Yuyama and Yasuyuki Igarashi Front. Neurosci., 25 April 2017]. Показано, что КС нейральных стволовых клеток (НСК) ингибировала апоптоз клеток SH-SY5Y в культуре, а также увеличивала процент дифференцированных клеток при совместном применении с ретиноевой кислотой [Human neural stem cell transplantation improves cognition in a murine model of Alzheimer's disease. Lisa M. McGinley1, Osama N. Kashlan2, Elizabeth S. Bruno1, Kevin S. Chen2, John M. Hayes1, Samy R. Kashlan1, Julia Raykin3, Karl Johe4, Geoffrey G. Murphy5 & Eva L. Feldman1. Scientific Reports, Article number: 14776 (2018)].
Et all, 2017]. Неотъемлемыми частью репаративных процессов является также восстановление ГЭБ и неоваскуляризация [Xiong, Y. et all, 2010; Prakash R. et all, 2015]. Данные факты о способности ЦНС к репарации позволяют сделать заключение, что регенерация является важным механизмом неврологического восстановления после повреждения и является новой мишенью терапевтических воздействий. Клеточная терапия, как новое направление в терапии нейродегенеративных заболеваний, послужила основой для активного развития новых терапевтических стратегий лечения инсульта на основе применения стволовых клеток (СК). Однако долгое время клеточные технологии подвергались критике из-за отсутствия единой специфической мишени и понимания механизмов действия клеточного трансплантата. На сегодняшний день существует много данных о применении постнатальных клеток костного мозга, таких как гемопоэтические стволовые клетки, мезенхимальные стволовые клетки, эндотелиальные клетки-предшественники, а также фетальных стволовых клеток, которые оказывают терапевтическое действие при нейродегенеративных заболеваниях [Quittet М.S. et al., 2015; Giraldi-Guimaraes, et all, 2009; Napoli E. et all, 2016]. В последние годы была продемонстрирована способность стволовых клеток секретировать биологически активные вещества, которые положительно влияют на течение многих нейродегенеративных заболеваний. Кондиционированные среды (КС) являются источником большого количества паракринных факторов, в том числе нейротрофинов (BDNF, GDNF, NGF, NT3-5, CNTF и др), цитокинов [Prospect of Stem Cell Conditioned Medium in Regenerative Medicine. Jeanne Adiwinata Pawitan. BioMed Research International 2014, Article ID 965849], экзосом [Microvesicles from brain-extracttreated mesenchymal stem cells improve neurological functions in a rat model of ischemic stroke. Ji Yong Lee, Eiru Kim, Seong-Mi Choi, Dong-Wook Kim, Kwang Pyo Kim, Insuk Lee & Han-Soo Kim. Scientific Reports. Published: 09 September 2016] и способны оказывать комплексное воздействие при различных патологиях. Существуют результаты многочисленных исследований, свидетельствующие о важности роли нейротрофинов в развитии болезни Альцгеймера, и их способности оказывать нейропротекторное, антиапоптотическое, нейротрофическое воздействие. Цитокины, находящиеся в КС, способны оказывать противовоспалительное действие. Экзосомы, также содержащиеся в КС, могут влиять на элиминацию бета-амилоида из ткани мозга [Exosomes as Carriers of Alzheimer's Amyloid-β. Kohei Yuyama and Yasuyuki Igarashi Front. Neurosci., 25 April 2017]. Показано, что КС нейральных стволовых клеток (НСК) ингибировала апоптоз клеток SH-SY5Y в культуре, а также увеличивала процент дифференцированных клеток при совместном применении с ретиноевой кислотой [Human neural stem cell transplantation improves cognition in a murine model of Alzheimer's disease. Lisa M. McGinley1, Osama N. Kashlan2, Elizabeth S. Bruno1, Kevin S. Chen2, John M. Hayes1, Samy R. Kashlan1, Julia Raykin3, Karl Johe4, Geoffrey G. Murphy5 & Eva L. Feldman1. Scientific Reports, Article number: 14776 (2018)].
Существуют данные, подтверждающие эффективность КС в моделях in vivo при неврологических заболеваниях, таких как ишемический инсульт - при введении КС НСК крысам с моделированным ишемическим инсультом показатели оценки неврологического статуса были выше, чем в контрольной группе, объем инфаркта снижался, по сравнению с контролем, так же были исследованы изменение уровня апоптотической активности методом TUNEL, который так же показал снижение клеточной гибели [Neural Stem Cell-Conditioned Medium Ameliorated Cerebral Ischemia-Reperfusion Injury in Rats HongNa Yang, Cuilan Wang, Hui Chen, Lan Li, Shuang Ma, Hao Wang, YaRu Fu, and Tingyu Qu. Stem Cells International. Published April 2018]. В модели спинальной травмы изучали действие КС НСК на жизнеспособность нейронов и регенерацию аксонов кортикоспинального тракта. Применение КС приводило к экстенсивному росту аксонов в шейном отделе и более чем утроило образование синаптических контактов между коллатералями кортикоспинального тракта и проприоспинальными интернейронами. КС также уменьшала экспрессию каспазы 3 и снижала гибель нейронов через 6 недель после травмы [Neural Stem Cell-Conditioned Medium Protects Neurons and Promotes Propriospinal Neurons Relay Neural Circuit Reconnection After Spinal Cord Injury. Peng Liang, Jiaren Liu, Jinsheng Xiong, Qing Liu, Jiaxin Zhao, Hongsheng Liang, Liwei Zhao, and Haitao Tang. Cell Transplantation, Vol. 23, Supplement 1, pp. S45-S56, 2014]. Кондиционированная среда мезенхимальных стволовых клеток жировой ткани в модели подвешивания за хвост восстанавливала сокращенное время неподвижности у трасгенных мышей 5xFAD до нормального уровня, таким образом оказывая антидепрессивное воздействие путем ингибирования Akt-сигнального пути и активации GSK-3β [Adipose-derived stem cell-conditioned medium ameliorates antidepression-related behaviors in the mouse model of Alzheimer's disease. Hiromitsu Yamazaki, Yu Jin, Ayako Tsuchiya, Takeshi Kanno, Tomoyuki Nishizaki. Neuroscience Letters. Available online 17 October 2015]. КС мезенхимальных стволовых клеток пульпы зуба была протестирована на модели экзогенного амилоидоза - интраназальное введение КС этого типа клеток привело к значительному улучшению когнитивных функций. Методом вестерн блотта и ПЦР в реальном времени оценивали маркеры, отвечающие за нейропротекцию, нейритогенез и противоспалительное действие на микроглию [Conditioned medium from the stem cells of human dental pulp improves cognitive function in a mouse model of Alzheimer's disease. Tsuneyuki Mitaa, Yoko Furukawa-Hibib, Hideyuki Takeuchic, Hisashi Hattoria, Kiyofumi Yamadab, Hideharu Hibia, Minoru Uedaa, Akihito Yamamotoa, Behavioural Brain Research. Available online 22 July 2015].
Также проведенные клинические испытания пептидного препарата Церебролизин, содержащего аминокислоты и полипептиды молекулярной массой до 10 кДа, свидетельствуют о его эффективности при сосудистых деменциях [Cerebrolysin for vascular dementia. Chen N, Yang M, Guo J, Zhou M, Zhu C, He L. Cochrane Database Syst Rev. 2013 Jan 31]. Более того, в последнее время появились данные о нейропротекторных свойствах белков теплового шока и возможной их секреции из клеток в окружающую среду. Предположительно, секреция белков теплового шока стволовыми и прогениторными клетками при воздействии повышенной температуры должна усилить нейропротекторное действие.
В настоящее время ИПСК рассматриваются как самый перспективный источник нейральных предшественников для регенеративной медицины, позволяющий получать клеточные популяции различных типов на разных, заранее запланированных этапах эмбрионального развития. И при этом проблемы дефицита донорского материала и этические вопросы, возникающие при применении эмбрионального материала и культур эмбриональных стволовых клеток, полностью отсутствуют. Получение ИПСК уже стало рутинной задачей, хотя экспериментальные исследования проводятся только последние 10 лет. В результате экспериментов по ретровирусной трансдукции генами различных транскрипционных факторов мышиных фибробластов были идентифицированы 4 гена - Oct-4, Sox2, с-Мус и Klf4, которые переводили их в плюрипотентное состояние. Клетки, полученные таким образом, назвали индуцированными плюрипотентными стволовыми клетками (ИПСК) [Takahashi K., Yamanaka S. 2006]. Затем ИПСК были успешно получены из фибробластов человека с использованием того же набора транскрипционных факторов [Takahashi K. et al., 2007]. Другой научной группой были получены ИПСК человека с использованием иного набора транскрипционных факторов: Oct4, Sox2, Nanog и Lin28 [Yu J. et al., 2007]. Дальнейшие исследования продемонстрировали возможность получения ИПСК как от различных млекопитающих: крыс [Li W. et al., 2009], макак-резусов [Liu Н. et al., 2008], свиней [Kwon D.-J. et al., 2013]; так и из различных типов соматических клеток человека: кератиноцитов [Aasen Т. et al., 2008], нейрональных клеток [Eminli S. et al., 2008.], клеток печени и клеток желудка [Aoi, 2008], терминально дифференцированных лимфоцитов, а также из эндотелия [Lagarkova М.А. et al., 2010]. Эти исследования продемонстрировали универсальность процесса репрограммирования соматических клеток до плюрипотентного состояния с помощью введения в клетки генов транскрипционных факторов. Целый ряд подходов был разработан для того чтобы доставлять репрограммирующие факторы в соматические клетки. Были также продемонстрированы и другие методы репрограммирования соматических клеток до плюрипотентного состояния без интеграции экзогенной ДНК в геном клетки-хозяина: с использованием piggyBac транспозона [Woltjen K. et al., 2009], синтетической РНК, аденовирусных векторов [Zhou W., Freed C.R., 2009], вируса Сендай [Fusaki N. et al., 2009], эписомных векторов [Yu J. et al., 2009], белков [Kim D. et al., 2009]. Тесты на способность к дифференцировке считают ключевыми в доказательстве плюрипотентности клеток. Для ИПСК человека в качестве основных тестов используются in vitro дифференцировки, формирование тератом при введении иммунодефицитным мышам и способность к образованию эмбриоидных телец. Плюрипотентные стволовые клетки (ПСК) обладают естественным свойством дифференцироваться во все типы клеток взрослого организма, но важнейшей экспериментальной задачей является осуществление дифференцировки плюрипотентных клеток in vitro в нужном направлении с использованием специальных условий культивирования, биологически активных химических соединений и белковых факторов. Эффективный метод дифференцировки ИПСК в нейральном направлении основан на блокировании BMP и TGF-β сигнальных путей такими молекулами, как Noggin, дорсоморфин, SB431542 и LDN193189 на ранних стадиях дифференцировки [Fingar D.С., et al., 2004]. Такой подход при длительном культивировании позволил получить до 90% клеток, которые экспрессировали маркеры нейроэктодермы РАХ6 и PSA-NCAM (молекула адгезии нервных клеток). Для дальнейшей дифференцировки в нейрональные предшественники необходима активация Shh сигнального пути, а также добавление в среду для культивирования фактора роста фибробластов FGF2. Полученные таким образом предшественники экспрессируют маркер незрелых нейронов β-тубулин III. Рутинный способ получения ИПСК, а также существование известных методов дифференцировки ИПСК в нейральном направлении делают применение нейрональных предшественников наиболее перспективными кандидатами при терапии ИИ. Возможность эффективной экспансии ИПСК позволит решить проблему дефицита донорского материала и снять ряд этических вопрос. На сегодняшний день большое количество научных групп ведут разработки в области нейральной дифференцировке ИПСК. Основными лидерами по данному направлению являются институт генетических болезней и геномных наук, Токио, Япония (Department of Genetic Diseases and Genomic Science, The Jikei University School of Medicine, Tokyo, Japan); Центр исследования и применения ИПСК, Университет Киото, Япония (Centre for iPS Cell Research and Application, Kyoto University, Japan); Центр клеточной биологии, Китай (Department of Cell Biology, Xuanwu Hospital of Capital Medical University, Beijing, China). Данные лаборатории проводят передовые исследования по дифференцировке ИПСК, рационализируют и создают протоколы дифференцировки ИПСК. Кроме того, проводятся экспериментальные разработки по введению дифференцированных в нейральном направлении ИПСК в органы-мишени. В этой связи стоит отметить Лабораторию Института Биоинженерии и нанотехнологии, Сингапур (Institute of Bioengineering and Nanotechnology, 31 Biopolis Way, The Nanos, Singapore 138669, Singapore), осуществляющую инновационные разработки в области дифференцировки ИПСК, и методов целенаправленной доставки в органы-мишени дифференцированных клеток, с использованием 3D микрофиброзных капсул, которые увеличивают эффективность доставки. Европейские лаборатории и лаборатории США, Канады занимают лидирующее положение по общему количеству проведенных исследовательских работ в области нейральной дифференцировки ИПСК. При изучении литературы часто встречаются современные разработки лаборатории Центра Генетики Университета шт. Висконсин совместно с институтом биомедицинских исследований, Кэмбридж (Waisman Center, Genome Center, Department of Anatomy, and Department of Neurology, School of Medicine and Public Health, University of Wisconsin, Madison. Whitehead Institute for Biomedical Research, Cambridge). В данных работах можно отметить передовые исследования по поиску новых регуляторных механизмов в области нейральной дифференцировки ИПСК.
Основная причина, ограничивающая эффективность и безопасность всех существующих нейропептидных препаратов, полученных из головного мозга млекопитающих - это их ксеногенное происхождение. При выделении нейропептидов из тканей головного мозга животных для снижения их иммуногенности (антигенных свойств) прибегают к кислотному или ферментативному гидролизу белков и высокомолекулярных полипептидов, тем самым уменьшая количество нейротрофических факторов роста белковой и полипептидной природы [Хабриева. У., 2005]. Пептидный препарат, полученный таким способом, содержит денатурированные продукты кислотного гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, что снижает его специфичность и биологическую активность, повышает его иммуногенность, вызывая аллергические реакции при применении.
Для решения данной проблемы нами предложено получить белково-пептидную композицию с выраженными ноотропными свойствами из секретома глиальных прогениторных клеток в условиях гипоксии, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека. Данная композиция характеризуется тем, что в ее состав входят белки и полипептиды с молекулярной массой от 3 кДа до 250 кДа, из которых 65% имеют молекулярную массу в диапазоне от 10 до 60 кДа, содержание белки теплого шока не менее 40% от общей массы белков, мозговой нейротрофический фактор (BDNF) не менее 140 пг/мл и глиального нейротрофического фактора (GDNF) не менее 60 пг/мл, фактор роста эндотелия сосудов (VEGF) не менее 80 пг/мл, суммарная масса белка не менее 1 мг/мл препарата, при этом клеточная культура глиальных прогениторных клеток, из которой получают композицию, демонстрирует экспрессию астроглиальных маркеров S100b, GFAP и состоит из 98±2% S100b+ - клеток.
Наиболее важным направлением современной медицины и биологии является выделение из клеточных культур биологически активных веществ, прежде всего молекул, запускающих каскад процессов регенерации и паракринной индукции репаративных процессов. Применение охарактеризованного и стандартизованного комплекса биологически активных веществ может обладать той же эффективностью, но гораздо большей безопасностью по сравнению с живыми клеточными культурами. Возможность эффективной экспансии ИПСК и их дифференцировки в разных направлениях, в том числе нейрональном, решают проблему дефицита донорского материала и снимают ряд этических вопросов.
Изобретение осуществляется следующим образом.
Пример 1. Получение белково-пептидного комплекса.
Забор биоптата кожи (размером от 0,5 до 1 см2) производят за ушной раковиной или с внутренней стороны предплечья. После отсечения с помощью микрохирургического лезвия, биоптат помещают в стерильный флакон, содержащий транспортную среду (F12 с амикацином, 0,5 г/л). Флакон с содержимым маркируют следующими данными: ФИО донора, дата и время забора. Транспортировку производят при температуре 2-6°С.
Полученный материал в стерильных условиях переносят в чашки Петри и трижды промывают раствором Хенкса с цефазолином (1 г/л), затем дезагрегируют путем инкубации в растворе Версена с добавлением 0,25% трипсина. В течение 1-1,5 часов при 37°С. После инкубации суспензию интенсивно перемешивают и центрифугируют в течение 10 минут при 1400 об/мин. Осадок разводят культуральной средой (DMEM/F12 1:1 с добавлением 10% сыворотки, 500 мг/л амикацина), перемешивают и переносят в культуральную посуду. Культуральные флаконы помещают в СО2-инкубатор (37°С, 5% СО2). Через 2-3 дня осуществляют замену культуральной среды на свежую. Наращивание и пересевы осуществляют раствором Версена с добавлением 0,25% трипсина и переносят в новые чашки Петри. Коэффициент рассева выбирают в зависимости от индивидуальных пролиферативных характеристик фибробластов. Культивируют не более четырех пассажей. Перед программированием необходимо провести контроль стабильности кариотипа и способность фибробластов синтезировать коллаген I типа (с помощью иммунофлуоресцентного окрашивания).
При необходимости длительного хранения полученные фибробласты подвергают криоконсервации. В боксе на ледяной бане (при 4°С) готовят криозащитный раствор, состоящий из 10%) ДМСО (диметилсульфоксид) и 90% аутогенной сыворотки. Клеточную культуру дезагрегируют раствором Версена с добавлением 0,25% трипсина, подсчитывают количество клеток с помощью счетчика и осаждают клетки центрифугированием (1400 об/мин, 10 мин). К осадку добавляют свежеприготовленный криозащитный раствор из расчета 1 мл на 5 млн. клеток, перемешивают и помещают полученную суспензию в криопробирки. Маркируют, указывая ФИО донора, номер пассажа, количество клеток, дату криозамораживания, данные ответственного исполнителя.
Образцы замораживают до - 80°C с помощью программного замораживателя, а затем помещают в сосуды Дьюара с жидким азотом и хранят при - 196°С.
Для разморозки криопробирки извлекают из сосуда Дьюара и размораживают при температуре 37°С на водяной бане. Клеточную суспензию из криопробирки переносят в центрифужную пробирку с культуральной средой, наполненной до десятикратного объема и центрифугируют при 1400 об/мин в течение 10 мин. Клеточный осадок переносят в культуральную посуду с полной ростовой средой.
Перед процедурой репрограммирования культуру фибробластов переводят на среду, не содержащую компоненты животного происхождения. Для этого, согласно протоколу, фибробласты 1-2 пассажа промывают фосфатно-солевым буфером и обрабатывают раствором Трипсин/Версен 1:1 в течение 3-5 минут для открепления клеток от подложки. Суспензию клеток центрифугируют 5 минут при 1100 об/мин, после чего отбирают супернатант, а к осадку добавляют среду DMEM с содержанием 10% эмбриональной телячьей сыворотки, 2 mM L-глутамина, пенициллина-стрептомицина 100 мг/л и рассаживают в количестве 1500-2000 клеток/см2 на чашки Петри диаметром 60 мм, покрытые коллагеном Coating Matrix Kit (Corning, США). Через 24 часа прикрепившиеся клетки промывают дважды фосфатно-солевым буфером и добавляют среду, состоящую из DMEM/F12, HEPES, натрия бикарбоната 4,8 г/мл, 10% заменителя сыворотки Knockout SR, фактора роста фибробластов человека bFGF 10 мкг/мл, эпидермального фактора роста человека EGF 1 мг/мл, 2 мкМ гидрокортизона. Для адаптации клеток к новой среде культивирование проводят в течение 1-2 пассажей.
Для репрограммирования фибробластов используют коммерческий набор для репрограммирования клеток человека «CTS CytoTune-iPS 2.1 Sendai Reprogramming Kit» (Invitrogen, США) на основе вируса Сендай. За день до репрограммирования фибробласты высевают в количестве 200 тысяч на лунку 6-луночного планшета, предварительно покрыв коллагеном, и культивируют в 2,5 мл среды без экзогенных компонентов. На следующий день добавляют вектора, несущие гены Oct4 и Sox2 (KOS), L-Myc (hL-Myc), Klf-4 (hKlf4) в количестве вирусных частиц на клетку (MOI) - 5, 5 и 3 соответственно. Через сутки производят замену среды для фибробластов без экзогенных компонентов, далее смена среды происходит ежедневно в течение 6 дней. На 7-ой день после репрограммирования клетки промывают дважды фосфатно-солевым буфером, открепляют их реагентом TrypLE Select и центрифугируют при 1100 об/мин в течение 5 минут. Полученный супернатант отбирают, а клеточный осадок пересаживают в количестве 100 тысяч на чашку Петри диаметром 60 мм, предварительно покрыв витронектином в концентрации 10 мкг/мл. Через 24 часа после посева производят замену среды на Essential 8 Medium для культивирования плюрипотентных клеток человека. Смену среды осуществляют каждый день.
Отбор образовавшихся колоний проводят по результатам прижизненного иммуноцитохимического окрашивания антителами к поверхностному маркеру плюрипотентных клеток - протеогликану TRA-1-60 с помощью коммерческого набора «TRA-1-60 Alexa Fluor 488 Conjugate Kit» (ThermoFisher Scientific, США). Колонии ИПСК, в которых визуализировалась высокая экспрессия протеогликана TRA-1-60 отбирают механически наконечником, предварительно обработав раствором Версена, далее сажают на 6-ти луночные планшеты, покрытые витронектином, и культивируют в среде Essential 8 Medium. Дальнейшие пересевы проводят только с помощью раствора Версена и с добавлением в среду ROCK-ингибитора Y27632 в концентрации 5 мкМ в течение суток.
При культивировании ИПСК ведется визуальный контроль за морфологическими характеристиками культур. ИПСК растут плотными колониями с ровными краями. Клетки мелкие, с крупными ядрышками. Культивирование осуществляют в чашках Петри диаметром 35 мм, используя культуральную среду Essential 8™ (Е8).
Клетки рассаживают по достижении плотности 50-70% монослоя. Из чашек удаляют культуральную среду и промывают 2 мл DPBS. Для дезинтеграции добавляют 1 мл раствора Версена и инкубируют 5-8 мин при комнатной температуре. Затем удаляют раствор Версена, добавляют 2 мл среды, взбалтывают и переносят клеточную суспензию на чашки, предварительно покрытые витронектином, и добавляют среды до 2 мл. Замену среды на свежую проводят каждый день.
Стандартизацию ИПСК проводят по экспрессии генов, специфичных для эмбриональных стволовых клеток ОСТ4, SOX2, NANOG, SSEA4, TRA-1-81, TRA-1-60 иммуноцихимическим методом и ПЦР с обратной транскрипцией и.
ИПСК подвергают криоконсервации. Готовят на льду криозащитный раствор из расчета на 1 чашку: 900 мкл среды Е8, 100 мкл DMSO и 1 мкл ингибитора Rho-киназы (сток 5 мМ). Из каждой чашки удаляют среду и промывают 2 мл DPBS. Добавляют 1 мл Версена и инкубируют 5-8 мин при комнатной температуре. Затем удаляют раствор Версена и добавляют 1 мл криозащитного раствора. Клетки снимают с поверхности чашки, перемешивают и переносят в криопробирку объемом 1,8 мл (1 мл на 1 пробирку). Образцы замораживают до - 80°C с помощью программного замораживателя, а затем помещают в сосуды Дьюара с жидким азотом и хранят при - 196°С.
Криопробирки с клеточным материалом извлекают из сосуда Дьюара и размораживают при температуре 37°С на водяной бане.
Клеточную суспензию из криопробирки (1 мл) по каплям переносят в центрифужную пробирку, доливают 9 мл теплой культуральной среды DMEM/F12 до десятикратного объема и центрифугируют при 800 об/мин в течение 5 мин.
Отмытые от криоконсерванта клетки переносят на чашки Петри, предварительно покрытые витронектином, с культуральной средой Е8, содержащей ингибитор Rho-киназы. При переносе сохраняют целостность колоний. Адаптация клеток после криоконсервации продолжается от 1 до 3 недель.
Для дифференцировки в нейрональном направлении ИПСК обрабатывают раствором Версена, центрифугируют при 800 об/мин в течение 5 минут. Супернатант удаляют, а клеточный осадок переносят в новые чашки Петри диаметром 60 мм, покрытые поли-1-орнитином 20 мкг/мл (Sigma-Aldrich, США) и ламинином 2,5 мкг/мл (Gibco, США). По достижению культуры 80% конфлюэнтности среду Essential 8 Medium меняли на DMEM/F12 с 1% N2, 2 мМ глутамина, пенициллин-стрептомицина 100 мг/л, 10 мкМ SB431542, 2 мкМ дорсоморфина. Среду меняют через день. Через 10-14 дней в культуре появляются розеткоподобные структуры. Полученную культуру пересевают на чашки Петри, покрытые поли-1-орнитином 20 мкг/мл и ламинином 2,5 мкг/мл, в плотности 250-400 тысяч клеток/см2 и культивировали в среде DMEM/F12 (Панэко, РФ), 2% добавки В27 (Gibco, США), 2 мМ глутамина (Панэко, РФ), пенициллин-стрептомицина 100 мг/л (Панэко, РФ), 10 нг/мл FGF-2 (ProSpec, Великобритания), 1 мкМ пурморфамина (Stemcell Technologies, США) в течение 14 суток, производя замену среды каждые 2 суток.
Стандартизацию нейральных клеток проводят по экспрессии генов РАХ6, FOXP2, NCAM1, ENO2, Nestin, TUBB3, SOX2.
Для моделирования теплового шока нейрональные предшественники культивируют в течение часа при 40°С, после чего производят замену среды на DMEM/F12 и культивируют в течение 6 часов. После чего кондиционированную среду собирают и центрифугируют при 300 об/мин в течение 5 минут. Супернатант отбирают и концентрируют в 24 раза с помощью 3 кДа мембран Amicon Ultra (Sigma-Aldrich, США). Полученный концентрат подвергают стерилизующей фильтрации. Композиция включает в себя белки и пептиды молекулярной массой в пределах от 3 до 250 кДа, средняя молекулярная фракция находится в пределах от 10 до 50 кДа не менее 60%.
Пример 2. Характеристика нейрональных прогениторных клеток.
Для подтверждения фенотипа, полученных культур нейрональных прогениторных клеток проводят иммуноцитохимическое окрашивание на нейральные маркеры. Клетки фиксировали 4% раствором формальдегида (Merck KGaA, Германия) 10 минут при комнатной температуре, затем промывали фосфатно-солевым буфером, инкубировали в фосфатно-солевом буфере с 0,25% Triton Х-100 (Sigma-Aldrich, США) и 1% бычьим сывороточным альбумином (AppliChem, Германия) 30 минут, а затем обрабатывали первичными антителами ночь при +4°С. Для нейральных стволовых клеток использовались антитела к белкам Рах6, Tubulin-IIIβ, Nestin и SOX2. Затем клетки промывали фосфатно-солевым буфером и инкубировали с вторичными антителами, меченными флуорохромами Alexa Fluor 488 anti-rabbit, Alexa Fluor 555 anti-mouse (Invitrogen, США) в темноте 60 минут. Ядра красили раствором DAPI (4,6-диамино-2-фенилиндол дигидрохлорид) 1 мкг/мл (Sigma-Aldrich, США) в фосфатно-солевом буфере. Для анализа использовали люминесцентный инвертированный микроскоп Axio Observer.D1с камерой AxioCam HRc (Carl Zeiss, Германия).
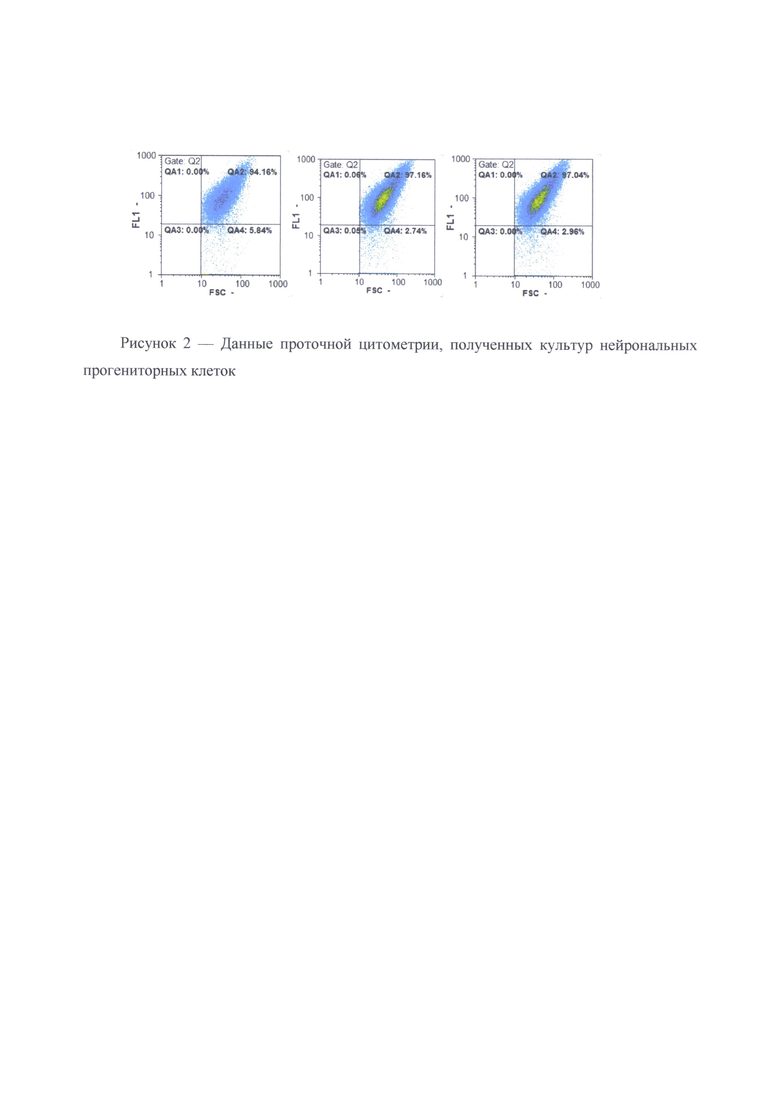
Количественную оценку проводят с помощью проточной цитометрии. Культуру снимали с помощью раствора Версена (Панэко, РФ) в случае НП или 0,05% раствора трипсина (Панэко, РФ) в случае ГП, центрифугируют 1600 об/мин в течение 5 минут, супернатант отбирают, а осадок промывают раствором Хенкса. После осаждения клетки 10 минут фиксируют 4%-ым раствором параформальдегида, затем клетки промывают фосфатно-солевым раствором. Пермеабилизацию проводят 70% метанолом на льду в течение 10 минут, после чего клетки промывают дважды в фосфатно-солевом растворе и осаждали центрифугированием 1800 об/мин 5 минут. Далее клетки окрашивают первичными антителами против β3-тубулина (разведение 1:500, Abcam), инкубация проходила при +4°С в течение 12 часов. Затем промывали фосфатно-солевым буфером, центрифугируют 1800 об/мин 5 минут и инкубируют с вторичными антителами, меченными флюорохромом Alexa Fluor 555 anti-mouse (разведение 1:600, Invitrogen, США) в темноте 60 минут. Полученную суспензию анализируют, используя проточный цитофлюориметр CyFlow ML, а количество TUBB3+ - клеток считали с помощью програмного обеспечения FloMax. По данным проточной цитометрии культуры нейрональных прогениторных клеток должна состоять не менее 99,5±2,45% TUBB3+ - клеток.
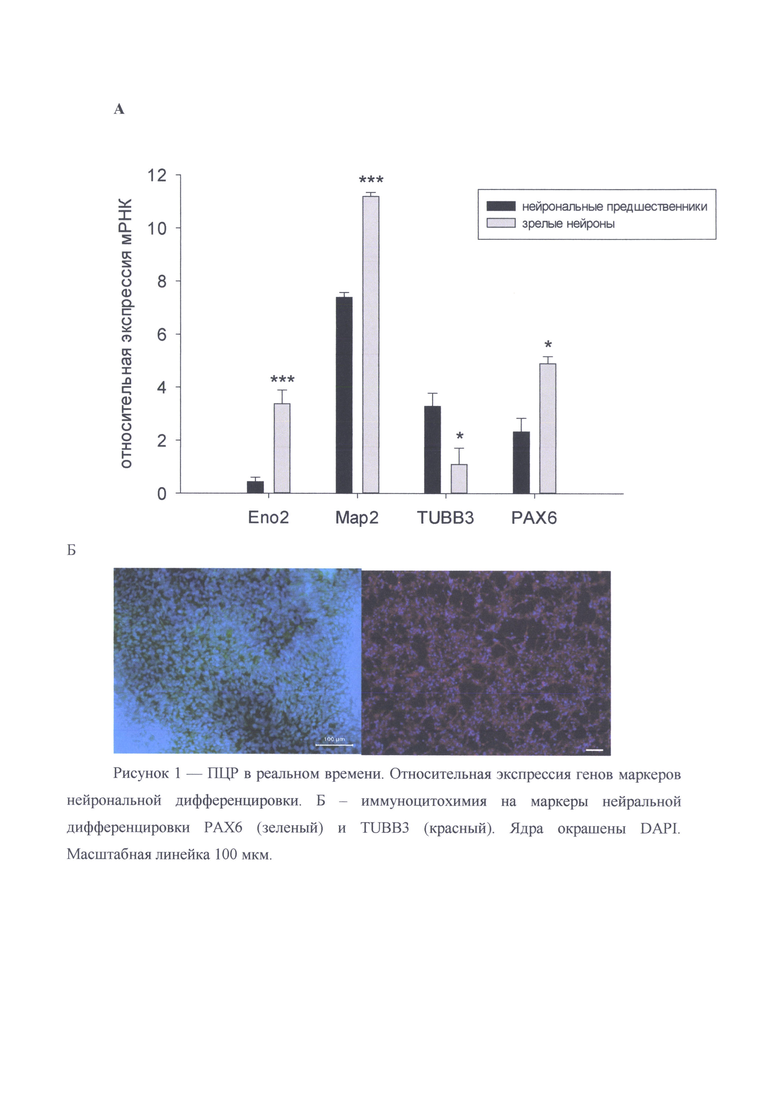
Для анализа экспрессии нейрональных генов маркеров проводят ПЦР. мРНК выделяли с помощью коммерческого набора «RNeasy Mini Kit» согласно инструкции производителя. Далее проводили синтез кДНК набором «RevertAid™ First Strand cDNA Synthesis Kit» по протоколу, приложенному в инструкции. Для ПЦР в реальном времени использовали готовую реакционную смесь с интеркалирующим красителем Sybr Green, амплификацию ставили в термоциклере BioRad iQ cycler. Схема реакции: первичная денатурация 95°С, 5 мин.; денатурация 95°С, 20 сек; отжиг праймеров 55-63°С, 20 сек; элонгация 72°С, 20 секунд (40 циклов). Уровень мРНК анализируемых генов выравнивали по отношению к усредненным данным амплификации двух генов домашнего хозяйства GAPDH (глицеральдегид-3-фосфат дегидрогеназа) и ActB (β-актин). Относительное количество мРНК рассчитывали с помощью ΔС (Т) метода.
В результате дифференцировки нейрональные прогениторные клетки демонстрируют экспрессию маркерных генов РАХ6, TUBB3, МАР2, ENO2, Nestin (Рисунок 1) как на уровне транскрипции, так и трансляции. Анализ показал, что до 95% полученных клеток экспрессировали нейрональный маркер TUBB3 (Рисунок 2).
Пример 3. Характеристика композиции
Композицию характеризуют по количеству в 1 мл общего белка и таких факторов, как мозговой нейротрофический фактор (Brain-Derived Neurotrophic Factor, BDNF), глиальный нейротрофический фактор (GDNF), фактор роста эндотелия сосудов (VEGF) и количества белков теплового шока. Для этого используют твердофазный иммуноферментный анализ. 1 мл суспензии центрифугируют, полученные в результате центрифугирования супернатанты апплицировали в лунки планшета с предварительно адсорбированными первичными антителами к BDNF, GDNF, VEGF и белкам теплового шока (Hsp60, Hsp70 и Hsp90) далее анализ проводят согласно инструкции производителя. Содержание факторов выражают в пг/мл композиции. Всего было исследовано 10 образцов композиции, получены результаты по содержанию BDNF не менее 120 пг/мл, GDNF не менее 40 пг/мл, VEGF не менее 60 пг/мл, Hsp60 не менее 15 нг/мл, Hsp70 не менее 10 нг/мл и Hsp90 не менее 2 нг/мл. Суммарная масса белка не менее 1 мг/мл препарата. Общий белок в 1 мл суспензии определяют методом Бредфорда.
Пример 4. Оценка эффективности использования композиции на in vitro модели химической гипоксии на клеточной линии SHSY-5Y
Для изучения нейротрофического и нейропротекторного действия ноотропных композиций на основе среды НП, полученных в стандартных условиях 1) и подвергнутых тепловому шоку (2) была, выбрана линия нейробластомы SHSY-5Y, широко используемая в качестве in vitro модели в нейробиологии. Клетки линии SHSY-5Y (АТСС, США) культивировали в среде DMEM/F12 с добавлением 10% фетальной бычьей сыворотки (ФБС). За неделю до эксперимента клетки пересевали в 12-луночные планшеты, покрытые раствором коллагена I типа в количестве 90 тысяч клеток на лунку и затем инкубировали в среде Opti-MEM, содержащей 10 мМ ретиноевой кислоты и 0,5% ФБС в течение двух дней. Далее среду меняли на DMEM/F12 с добавлением 50 нг/мл нейротрофического фактора BDNF и 2% В27. За 72 часа до моделирования гипоксии из среды убирали нейротрофический фактор BDNF.
В работе использовали модель химической гипоксии, которая является адекватной и взаимозаменяемой с моделью на основе применения газовой инкубационной камеры с пониженным содержанием кислорода. Для моделирования гипоксии был протестирован дихлорид кобальта CoCl2 в концентрациях от 150 до 300 мкМ. Клетки нейробластомы SHSY-5Y культивировали в 12 - луночных планшетах с CoCl2 в течение 4 часов, после чего промывали раствором Хенкса и добавляли среду DMEM/F12 с 2% В27. Для изучения протекторного действия ноотропных композиции (1,2), производили их добавление в среду культивирование (5% от объема лунки, раствор с концентрацией общего белка 0.5 мг/мл) за 24 часа до моделирования гипоксии.
Для определения жизнеспособности клеточной линии SHSY-5Y спустя 24 часа сокультивирования добавляли МТТ (3-[4,5диметилтиазол-2-ил]-2,5-дифенил-тетразолийбромид, ПанЭко, РФ) в концентрации 0,5 мг/мл и инкубировали в темноте при 37°С в течение 2 часов с последующим растворением кристаллов формазана ДМСО и измерением оптической плотности при 590 нм с помощью планшетного ридера. Все МТТ анализы были выполнены в трех повторах.
Для оценки нейритогенеза рассчитывали среднее значение площади клетки с использованием программы ImageJ. Для этого определяли общую площадь клеток, окрашенных антителами против β3-тубулина, и делили на общее количество ядер, меченных красителем DAPI, используя параметры цветового диапозона.
В результате инкубация с ноотропной композицией, полученной в стандартных условиях (1) увеличивает число живых клеток SH-SY5Y на 7,58±3,2% по сравнению с контролем. Добавление ноотропной композиции, полученной с применением моделирования теплового (2) шока увеличивает число живых клеток SH-SY5Y на 11,58±3,2%, при этом оказывая более выраженное действие на стимулирование роста нейритов у клеток нейробластомы, площадь которых превышает в 1,23 раза площадь группы 1.
Список использованных источников
1. Некрасов Е.Д., Лебедева О.С., Честков И.В., Сюсина М.А., Федотова Е.Ю., Лагарькова М.А., Киселев С.Л., Гривенников И.А., Иллариошкин С.Н. Получение и характеристика индуцированных плюрипотентных стволовых клеток человека из фибробластов кожи пациентов с нейродегенеративными заболеваниями // Гены и клетки. 2011. №4.
2. Kim S.U., Lee Н.J. Human Neural Stem Cell-Based Cell-and Gene-Therapy for Neurological Diseases // Stem Cells and Cell Therapy. - Springer, Dordrecht, 2014. - C. 21-48.
3. Chambers S.M. et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling // Nature biotechnology. - 2009. - T. 27. - №. 3. - P. 275.
4. Madhu V. et al. Dual inhibition of activin/nodal/TGF-β and BMP signaling pathways by SB431542 and dorsomorphin induces neuronal differentiation of human adipose derived stem cells // Stem Cells International. - 2016. - T. 2016.
5. Wechsler-Reya R.J., Scott M.P. Control of neuronal precursor proliferation in the cerebellum by Sonic Hedgehog // Neuron. - 1999. - T. 22. - №. 1. - P. 103-114.
6. Hughes, S.M. et al. Ciliary neurotrophic factor induces type-2 astrocyte differentiation in culture // Nature. - 1988. - V. 335. №. 6185. p. 70.
7. Song M.R., Ghosh A. FGF2-induced chromatin remodeling regulates the CNTF-mediated gene expression and astrocyte differentiation // Nature neuroscience. - 2004. - V. 7. - №. 3. - P. 229.
8. Eriksson, P.S. Neurogenesis in the adult human hippocampus / P.S. Eriksson, E. Perfilieva, T. Bjork-Eriksson et al. // Nat Med. - 1998. - Vol. 4. - P. 1313-1317.
9. Mattson, M.P. Apoptotic and antiapoptotic mechanisms in stroke / M.P. Mattson, C. Culmsee, Z.F. Yu // Cell Tissue Res. - 2000. - Vol. 301. - P. 173-187.
10. Kernie, S.G. Forebrain neurogenesis after focal ischemic and traumatic brain injury / S.G. Kernie, J.M. Parent // Neurobiol Dis. - 2010. - Vol. 37. - P. 267-274.
11.  , Antila H. Neuronal plasticity and neurotrophic factors in drug responses // Molecular psychiatry. - 2017. - T. 22. - №. 8. - P. 1085.
, Antila H. Neuronal plasticity and neurotrophic factors in drug responses // Molecular psychiatry. - 2017. - T. 22. - №. 8. - P. 1085.
12. Xiong, Y. Angiogenesis, neurogenesis and brain recovery of function following injury // Curr Opin Investig Drugs. - 2010. - Vol. 11. - P. 298-308.
13. Prakash R., Carmichael S.T. Blood-brain barrier breakdown and neovascularization processes after stroke and traumatic brain injury // Current opinion in neurology. - 2015. - Т. 28. - №. 6. - P. 556.
14. Quittet M.S. et al. Effects of mesenchymal stem cell therapy, in association with pharmacologically active microcarriers releasing VEGF, Acta biomaterialia. - 2015. - T. 15. - p. 77-88.
15. Giraldi-Guimaraes A., Rezende-Lima M., F.P. Bruno, R. Mendez-Otero // Brain Res. - 2009. - 1266. - P. 108-120.
16. Napoli E., Borlongan С.V. Recent advances in stem cell-based therapeutics for stroke. – 2016.
17. Prospect of Stem Cell Conditioned Medium in Regenerative Medicine. Jeanne Adiwinata Pawitan. BioMed Research International 2014, Article ID 965849.
18. Human neural stem cell transplantation improves cognition in a murine model of Alzheimer's disease. Lisa M. McGinley1, Osama N. Kashlan2, Elizabeth S. Bruno1, Kevin S. Chen2, John M. Hayes1, Samy R. Kashlan1, Julia Raykin3, Karl Johe4, Geoffrey G. Murphy5 & Eva L. Feldman1. Scientific Reports, Article number: 14776 (2018).
19. Microvesicles from brain-extracttreated mesenchymal stem cells improve neurological functions in a rat model of ischemic stroke. Ji Yong Lee, Eiru Kim, Seong-Mi Choi, Dong-Wook Kim, Kwang Pyo Kim, Insuk Lee & Han-Soo Kim. Scientific Reports. Published: 09 September 2016.
20. Exosomes as Carriers of Alzheimer's Amyloid-β. Kohei Yuyama and Yasuyuki Igarashi Front. Neurosci., 25 April 2017.
21. Human neural stem cell transplantation improves cognition in a murine model of Alzheimer's disease. Lisa M. McGinley, Osama N. Kashlan, Elizabeth S. Bruno, Kevin S. Chen, John M. Hayes, Samy R. Kashlan, Julia Raykin, Karl Johe, Geoffrey G. Murphy & Eva L. Feldman. ScientificReports, Article number: 14776 (2018).
22. Neural Stem Cell-Conditioned Medium Ameliorated Cerebral Ischemia-Reperfusion Injury in Rats HongNa Yang, Cuilan Wang, Hui Chen, Lan Li, Shuang Ma, Hao Wang, YaRu Fu, and Tingyu Qu. Stem Cells International. Published April 2018.
23. Neural Stem Cell-Conditioned Medium Protects Neurons and Promotes Propriospinal Neurons Relay Neural Circuit Reconnection After Spinal Cord Injury. Peng Liang, Jiaren Liu, Jinsheng Xiong, Qing Liu, Jiaxin Zhao, Hongsheng Liang, Liwei Zhao, and Haitao Tang. Cell Transplantation, Vol. 23, Supplement 1, pp. S45-S56, 2014.
24. Adipose-derived stem cell-conditioned medium ameliorates antidepression-related behaviors in the mouse model of Alzheimer's disease. Hiromitsu Yamazaki, Yu Jin, Ayako Tsuchiya, Takeshi Kanno, Tomoyuki Nishizaki. Neuroscience Letters. Available online 17 October 2015.
25. Conditioned medium from the stem cells of human dental pulp improves cognitive function in a mouse model of Alzheimer's disease. Tsuneyuki Mitaa, Yoko Furukawa-Hibib, Hideyuki Takeuchic, Hisashi Hattoria, Kiyofumi Yamadab, Hideharu Hibia, Minoru Uedaa, Akihito Yamamotoa, Behavioural Brain Research. Available online 22 July 2015.
26. Cerebrolysin for vascular dementia. Chen N, Yang M, Guo J, Zhou M, Zhu C, He L. Cochrane Database Syst Rev. 2013 Jan 31.
27. Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse factors and adult fibroblast by defined factors. // Cell. 2006. Vol. 126, No. 4. P. 663-67.
28. Takahashi K. et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. // Cell. 2007. Vol. 131, No 5. P. 861-872.
29. Yu J. et al. Induced pluripotent cell lines lines derived from human somatic cells. // Science. 2007. Vol. 318, No. 5858. P. 1917-1920.
30. Li W. et al. Generation of human-induced pluripotent stem cells in the absence of exogenous Sox2. // Stem Cells. 2009. Vol. 27, No 12. P. 2992-3000.
31. Liu H. et al. Generation of induced pluripotent stem cells from adult rhesus monkey fibroblasts. // Cell Stem Cell. 2008. Vol. 3, No 6. P. 587-590.
32. Kwon D.-J. et al. Generation of leukemia inhibitory factor-dependent induced pluripotent stem cells from the Massachusetts General Hospital miniature pig. // Biomed Res. Int. 2013. Vol. 2013. P. 140639.
33. Aasen T. et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. // Nat. Biotechnol. 2008. Vol. 26, No 11. P. 1276-1284.
34. Eminli S. et al. Reprogramming of neural progenitor cells in the inducible stem cells of the exogenous Sox2 expression. // Stem Cells. 2008. Vol. 26, No. 10. P. 2467-2474.
35. Aoi T. et al. Generation of pluripotent stem cells from adult mouse liver and stomach cells. // Science. 2008. Vol. 321, No 5889. P. 699-702.
36. Lagarkova M.A. et al. Induction of pluripotency in human endothelial cells resets epigenetic profile on genome scale. // Cell Cycle. 2010. Vol. 9, No 5. P. 937-946.
37. Woltjen K. et al. piggyBac transposition reprograms of fibroblasts to induced pluripotent stem cells. // Nature. 2009. Vol. 458, No. 7239. p. 766-770.
38. Zhou W., Freed C.R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. // Stem Cells. 2009. Vol. 27, No. 11. P. 2667-2674.
39. Zhou W., Freed C.R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. // Stem Cells. 2009. Vol. 27, No 11. P. 2667-2674.
40. Fusaki N. et al. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. // Proc. Jpn. Acad. Ser. B. Phys. Biol. Sci. 2009. Vol. 85, No 8. P. 348-362.
41. Yu J. et al. Induced pluripotent cell lines lines derived from human somatic cells. // Science. 2007. Vol. 318, No. 5858. P. 1917-1920.
42. Kim D. et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. // Cell Stem Cell. 2009. Vol. 4, No 6. P. 472-476.
43. Fingar d. C., blenis j. 2004. Target of rapamycin (tor): an integrator of cycle progression. Oncogene. 23: 3151-3171.
44. Chow, Ari M., et al. "Induction of heat shock proteins in cerebral cortical cultures by celastrol." Cell Stress and Chaperones 18.2 (2013): 155-160.
45. Kim, Jong Youl, et al. "70-kDa heat shock protein downregulates dynamin in experimental stroke: a new therapeutic target?." Stroke 47.8 (2016): 2103-2111.
46. De Maio, Antonio. "Extracellular Hsp70: export and function." Current Protein and Peptide Science 15.3 (2014): 225-231.
47. Kim, Jong Youl, and Midori A. Yenari. "The immune modulating properties of the heat shock proteins after brain injury." Anatomy & cell biology 46.1 (2013): 1-7.
48. Three-dimensional models of cancer for pharmacology and cancer cell biology: capturing tumor complexity in vitro/ex vivo.
49. Hickman JA, Graeser R, de Hoogt R, Vidic S, Brito C, Gutekunst M, van der Kuip H, Three-dimensional models of cancer for pharmacology and cancer cell biology: capturing tumor complexity in vitro/ex vivo. Consortium Biotechnol J. 2014 Sep; 9(9): 1115-28.
50. Bozkurt A, et al. In vitro assessment of axonal growth using dorsal root ganglia explants in a novel three-dimensional collagen matrix. Tissue Eng. 2007; 13:2971-2979.
51. Levenberg S, et al. Differentiation of human embryonic stem cells on three-dimensional polymer scaffolds. Proc Natl Acad Sci USA. 2003; 100:12741-12746. doi: 10.1073/pnas. 1735463100.
52.  , et al. Enhanced neuronal differentiation in a three-dimensional collagen-hyaluronan matrix. J Neurosci Res. 2007; 85:2138-2146.
, et al. Enhanced neuronal differentiation in a three-dimensional collagen-hyaluronan matrix. J Neurosci Res. 2007; 85:2138-2146.
53. Bozza A, et al. Neural differentiation of pluripotent cells in 3D alginate-based cultures. Biomaterials. 2014; 35:4636-4645.
54. Daud MF, Pawar KC, Claeyssens F, Ryan AJ, Haycock JW. An aligned 3D neuronal-glial co-culture model for peripheral nerve studies. Biomaterials. 2012; 33:5901-5913.
55. Du J, et al. Comparative evaluation of chitosan, cellulose acetate, and polyethersulfone nanofiber scaffolds for neural differentiation. Carbohydr Polym. 2014; 99:483-490.
56. Kallos MS, Behie LA. Inoculation and growth conditions for high-cell-density expansion of mammalian neural stem cells in suspension bioreactors. Biotechnol Bioeng. 1999; 63:473-483.
| название | год | авторы | номер документа |
|---|---|---|---|
| Ноотропная композиция на основе полипептидных комплексов, выделенных из глиальных прогениторных клеток в условиях теплового шока, и способ её получения | 2019 |
|
RU2732599C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях гипоксии, и способ ее получения | 2019 |
|
RU2732600C1 |
| УЛУЧШЕННЫЙ СПОСОБ ДИФФЕРЕНЦИРОВКИ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА В ДОФАМИНЭРГИЧЕСКИЕ НЕЙРОНЫ | 2023 |
|
RU2823290C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией NGF для терапии нейродегенеративных заболеваний | 2023 |
|
RU2829363C1 |
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ МОЗГОВЫХ ОРГАНОИДОВ | 2022 |
|
RU2784072C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| КОНВЕРСИЯ СОМАТИЧЕСКИХ КЛЕТОК В ИНДУЦИРОВАННЫЕ РЕПРОГРАМИРОВАННЫЕ НЕЙРОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ИРНСК) | 2011 |
|
RU2562111C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХРЯЩЕПОДОБНЫХ СТРУКТУР ИЗ СТВОЛОВЫХ КЛЕТОК С ИНДУЦИРОВАННОЙ ПЛЮРИПОТЕНТНОСТЬЮ И СТРУКТУРЫ, ПОЛУЧЕННЫЕ УКАЗАННЫМ СПОСОБОМ | 2023 |
|
RU2814248C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПАЦИЕНТ (ДОНОР)-СПЕЦИФИЧЕСКИХ ФИБРОБЛАСТОПОДОБНЫХ КЛЕТОК ИЗ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2014 |
|
RU2568059C1 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ДИФЕРЕНЦИРОВАННЫХ В ДОФАМИНЕРГИЧЕСКИЕ НЕЙРОНЫ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК БОЛЬНЫХ ПАРКИНСОНИЗМОМ | 2012 |
|
RU2501853C1 |
Изобретение относится к области биотехнологии, в частности к способу получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях теплового шока. Указанная композиция характеризуется тем, что в ее состав входят белки и полипептиды с молекулярной массой от 3 кДа до 250 кДа, из которых 60% имеют молекулярную массу в диапазоне от 10 до 50 кДа, мозговой нейротрофический фактор (BDNF) не менее 120 пг/мл и глиального нейротрофического фактора (GDNF) не менее 40 пг/мл, фактор роста эндотелия сосудов (VEGF) не менее 60 пг/мл, суммарная масса белка не менее 1 мг/мл препарата. При этом клеточная культура нейрональных прогениторных клеток, из которой получают композицию, демонстрирует экспрессию нейронального маркера β3-тубулина, молекулы адгезии нервных клеток (PSA-NCAM) и состоит из 99,5±2,45% TUBB3+-клеток. Изобретение позволяет эффективно получать белково-пептидную композицию, в которую будут включены не только небольшие пептиды, но и полноразмерные белковые нейрональные ростовые и дифференцировочные факторы, эффективность действия которых факторов заведомо выше, чем у коротких пептидов, а иммуногенность отсутствует. 2 н.п. ф-лы, 2 ил., 4 пр.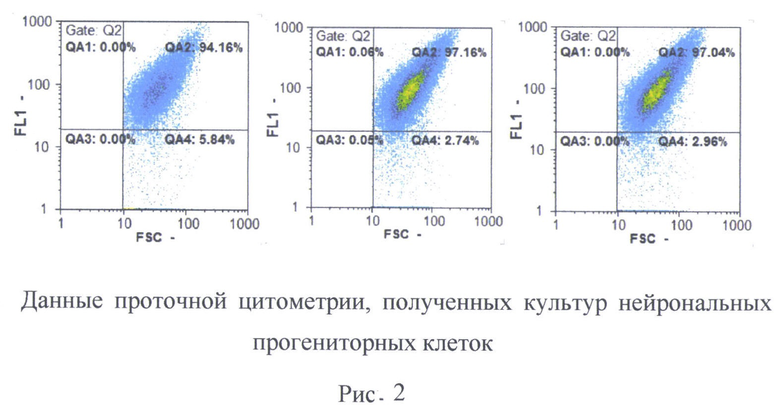
1. Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях теплового шока, включающий: забор биоптата кожи, получение культуры фибробластов, криоконсервацию культуры фибробластов, размораживание культуры фибробластов, адаптирование культуры фибробластов к xeno free условиям культивирования, репрограммирование фибробластов для получения индуцированных плюрипотентных стволовых клеток (ИПСК), культивирование ИПСК, криоконсервацию ИПСК, размораживание ИПСК, нейрональную дифференцировку ИПСК, культивирование нейрональных прогениторных клеток в условиях теплового шока, сбор кондиционированной среды и получение белково-пептидного комплекса,
где для моделирования теплового шока нейрональные прогениторные клетки культивируют в течение часа при 40°С в ростовой среде, содержащей DMEM/F12, 2% добавки В27, 10 нг/мл FGF-2, 1 мкМ пурморфамин, после чего производят замену среды на DMEM/F12 и культивируют в течение 6 часов, после чего кондиционированную среду собирают и центрифугируют при 300 об/мин в течение 5 минут, супернатант отбирают и концентрируют в 24 раза с помощью 3 кДа мембран Amicon Ultra, затем полученный концентрат подвергают стерилизующей фильтрации и получают ноотропную композицию.
2. Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях теплового шока, характеризующаяся тем, что в ее состав входят белки и полипептиды с молекулярной массой от 3 кДа до 250 кДа, из которых 60% имеют молекулярную массу в диапазоне от 10 до 50 кДа, мозговой нейротрофический фактор (BDNF) не менее 120 пг/мл и глиального нейротрофического фактора (GDNF) не менее 40 пг/мл, фактор роста эндотелия сосудов (VEGF) не менее 60 пг/мл, суммарная масса белка не менее 1 мг/мл препарата, при этом клеточная культура нейрональных прогениторных клеток, из которой получают композицию, демонстрирует экспрессию нейронального маркера β3-тубулина, молекулы адгезии нервных клеток (PSA-NCAM) и состоит из 99,5±2,45% TUBB3+-клеток.
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690846C1 |
| Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690498C1 |
| WO2001088104 A3, 20.06.2002 | |||
| US6455277 B1, 24.09.2002. | |||
Авторы
Даты
2021-08-11—Публикация
2019-12-26—Подача