Изобретение относится к области молекулярной генетики и может быть использовано для определения среднего количества копий митохондриальной ДНК человека, приходящегося на одну клетку, в различных биологических образцах человека, в том числе в ранее выделенных образцах тотальной ДНК из биологических материалов человека.
Митохондриальная ДНК человека (мтДНК) представляет собой небольшой кольцевой геном (16569 пар оснований), содержащийся в митохондриях, с множеством копий в каждой клетке. Он включает 37 генов, в том числе 13 генов, кодирующих компоненты митохондриальной цепи переноса электронов и комплекса АТФ-синтазы, 22 - митохондриальные транспортные РНК, и 2 - рибосомных РНК [1]. Количество митохондрий на клетку постоянно меняется в зависимости от потребности в энергии, окислительного стресса и патологических состояний [2]. Каждая митохондрия содержит 2-10 копий мтДНК, а в клетке число мтДНК может достигать 1000 [3].
Дисфункция митохондрий играет важную роль в развитии ряда заболеваний человека, связанных со старением, включая сердечно-сосудистые заболевания (ССЗ), нейродегенеративные и онкологические заболевания [4]. Низкие уровни количества мтДНК ассоциированы с риском развития ССЗ, включая ишемическую болезнь сердца (ИБС) и инсульт [5, 6], а также нейродегенеративных заболеваний, например, болезни Паркинсона и болезни Альцгеймера [7, 8]. Кроме того, низкий уровень количества мтДНК также наблюдается при нескольких типах онкологических заболеваний, таких как рак молочной железы, почек, печени и прямой кишки [9-11]. Кроме того, показано, что количество мтДНК в образцах ДНК периферической крови в среднем выше у женщин, снижается с возрастом и отрицательно коррелирует с количеством лейкоцитов [12-14].
В последние годы выдвигается предположение, что количество копий митохондриальной ДНК является потенциальным биомаркером митохондриальной дисфункции [15], а исследования, нацеленные на разнообразие митохондрий, значительно расширились. Количество митохондрий отражает потребность клетки в энергии, обеспечение которой нарушается в результате дисбаланса энергетического метаболизма [16]. Соотношение между митохондриальным и ядерным геномами (мтДНК / яДНК) является подходящей мерой для определения содержания мтДНК в клетке.
С другой стороны, отмечается, что неточности в существующей методологии измерения количества копий мтДНК могут быть отчасти ответственны за противоречивые результаты [15]. Более того, на измерение количества копий мтДНК могут влиять различные преаналитические факторы [17, 18]. В настоящее время методом выбора для определения количества копий мтДНК является количественная полимеразная цепная реакция (ПЦР) в реальном времени [15]. Существуют альтернативные методы измерения, позволяющие приблизительно оценить уровень количества копий мтДНК, такие как секвенирование следующего поколения (NGS) [19] и микроматрицы [14].
Однако эти три подхода дороги и чрезвычайно трудоемки, если их применять в эпидемиологических исследованиях с тысячами образцов, а также отличаются невысокой точностью подсчета числа копий. Методы NGS и микроматриц подвержены смещению из-за наличия так называемых «волнообразных паттернов» [20], которые могут затруднять точную оценку количества копий мтДНК и не могут быть полностью исправлены биоинформатически [21]. Кроме того, наличие большого числа ядерных псевдогенов мтДНК (NUMT) создает проблему специфичности ПЦР-праймеров.
Появление технологии цифровой ПЦР (digital PCR, dPCR), в том числе такого варианта как капельная цифровая ПЦР (digital droplet PCR, ddPCR), позволила получить точные (абсолютные) измерения количества копий участков ДНК (copy number variation, CNV) путём проведения двух флуоресцентных анализов (один для определения региона интереса, а другой для определения контрольного эталонного локуса с известным числом копий участка ДНК), одновременно протекающих в десятках тысяч независимых реакций (капель, лунок) [22, 23]. Технология построена таким образом, чтобы в одной реакции участвовала в среднем одна молекула исходной ДНК. Тем самым достигается точная оценка числа молекул ДНК, содержащих исследуемый регион ДНК, в определенном объеме образца. Эта значительно отличает её от эмульсионной ПЦР, в результате которой получаются капли различного объема.
Число копий по технологии dPCR рассчитывается путём сравнения количества флуоресцирующих молекул интересующего региона с количеством молекул эталонного локуса генома. Однако, в отличие от количественной ПЦР в режиме реального времени, измерение флуоресценции по технологии dPCR проводится не во время ПЦР, а «по конечной точке», т.е. по завершению ПЦР. Тем самым достигается высокая точность анализа, который позволяет определить целочисленное количество копий в локусах, по сравнению с другими технологиями [22-24].
Новая техническая задача заключается в подборе последовательностей (структуры) олигонуклеотидных проб и способа преаналитической подготовки образца ДНК, с разработкой протокола проведения цифровой ПЦР для абсолютной квантификации (точного определения количества) копий мтДНК, содержащейся в биологическом образце человека.
Данная задача решена путем разработки набора синтетических олигонуклеотидных последовательностей и проб, а также протокола проведения цифровой ПЦР для подсчета количества копий мтДНК человека в клетке.
Техническим результатом изобретения является повышение точности измерения количества копий мтДНК в интересующих биологических образцах человека, по сравнению с существующими аналогами.
Разработан набор праймеров и флюоресцентных пробы (по принципу TaqMan-проб) для генов MT-RNR2 (митохондриальная 16S рибосомальная субъединица) и HBB (бета-глобин, ядерный ген). Учитывая наличие ядерных копий митохондриальных генов, а также возможность делеций части митохондриальной ДНК, ген MT-RNR2 был выбран как участок, практически не подвергающийся делециям. Праймеры и пробы были протестированы на отсутствие сайтов отжига в ядерном геноме с помощью программы BLAST онлайн [25]. Концентрация рабочих растворов праймеров и зондов может варьировать от 100 до 600 нМ на 1 реакционную смесь. Оптимальной концентрацией является 450 нM для каждого праймера и 250 нM для зонда (таб. 1).
Генотипирование с помощью набора проб осуществляли по модифицированному протоколу генотипирования методом dPCR и ddPCR следующим образом:
1. В качестве материала для исследования используется препараты геномной ДНК биообразца индивида. Основным требованием к качеству используемой ДНК является отсутствие каких-либо признаков деградации (разрушения) ДНК. Проверка на качество ДНК обязательна с помощью любого метода ДНК электрофореза, при котором должен присутствовать только высокомолекулярный бэнд тотальной ДНК, отсутствие бэндов примесей РНК и любых «шмеров» - признаков деградации ДНК. Выполнение данного требования необходимо во избежание неточности измерений количества копий мтДНК.
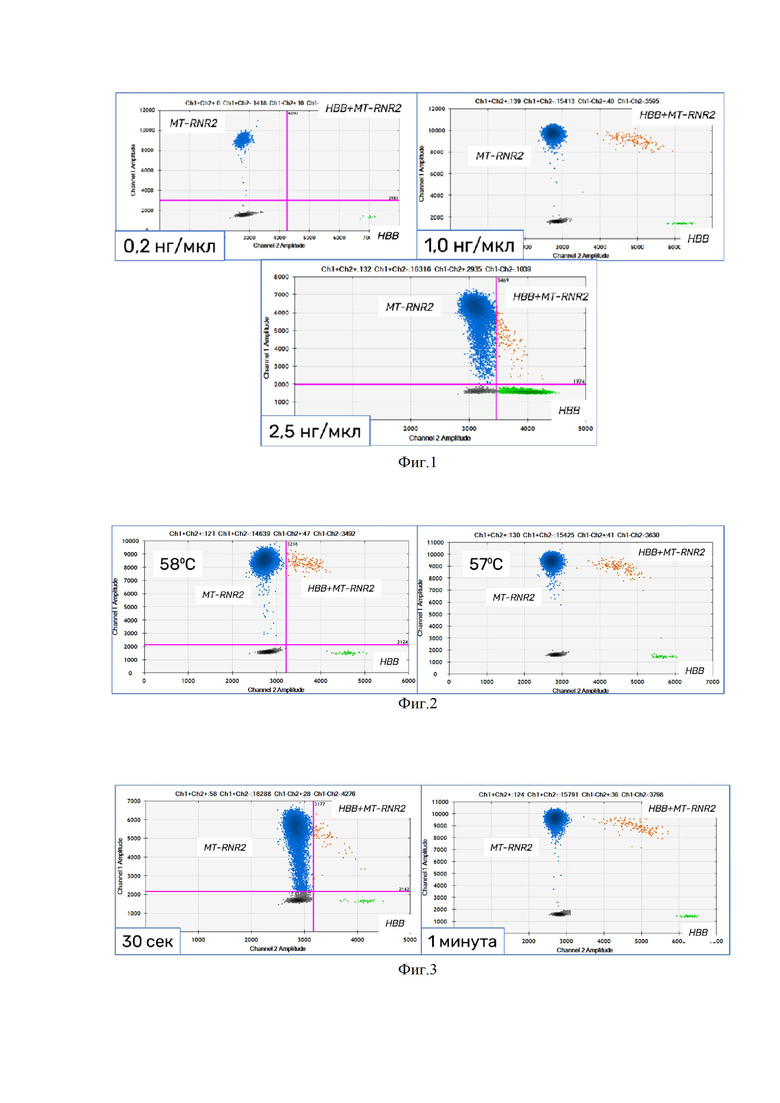
2. Образец исследуемой ДНК разводят до рабочей концентрации, варьирующей от 5 до 100 нг/мкл, для удобства последующих манипуляций. Образец исследуемой ДНК с рабочей концентрацией обработывают ферментами рестрикции, не разрезающими непосредственно ПЦР-продукты - например, HinfI, в количестве от 0,1 е.а. на образец и условиям инкубации согласно информации производителя. В реакционную смесь могут входить безнуклеазная вода, буферы для фермента рестрикции и иные компоненты, рекомендованные производителем. Фрагментация ДНК проводится с помощью ультразвуковой фрагментации согласно настройкам производителя, при котором средний размер фрагментированной ДНК должен составлять больше 130 п.о., и при этом не более 5% дисперсии фрагментов ниже 130 п.о. ввиду высокой вероятности фрагментации участков матрицы ДНК для формирования ПЦР продуктов и последующим ухудшением качества результатов (Фиг. 1).
3. Протокол программы ПЦР основан по принципу стандартной 2 шаговой ПЦР, включающая: этап денатурации при +94°С - +98°С, этап отжига и элонгации при +57°С (Фиг. 2). Этап денатурации составляет от 20 сек. Этап отжига и элонгации составляет от 1 мин. (Фиг. 3.). Этап «горячего старта» и «горячего завершения» согласно протоколу производителя. Хранение готовых продуктов ПЦР происходит от +4 °С до +12 °С, до суток.
4. Протокол программы ПЦР основан по принципу стандартной 2 шаговой ПЦР, включающая: этап денатурации при +94°С - +98°С, этап отжига и элонгации при +57°С. Этап денатурации может варьировать от 20 сек до 1 мин, оптимальным является 30 сек. Этап отжига и элонгации может длиться от 20 сек до 2 мин, оптимальным является 1 мин. Этап «горячего старта» и «горячего завершения» может быть добавлен согласно протоколу производителя. Хранение готовых продуктов ПЦР может происходить от +4 °С до +12 °С, до суток.
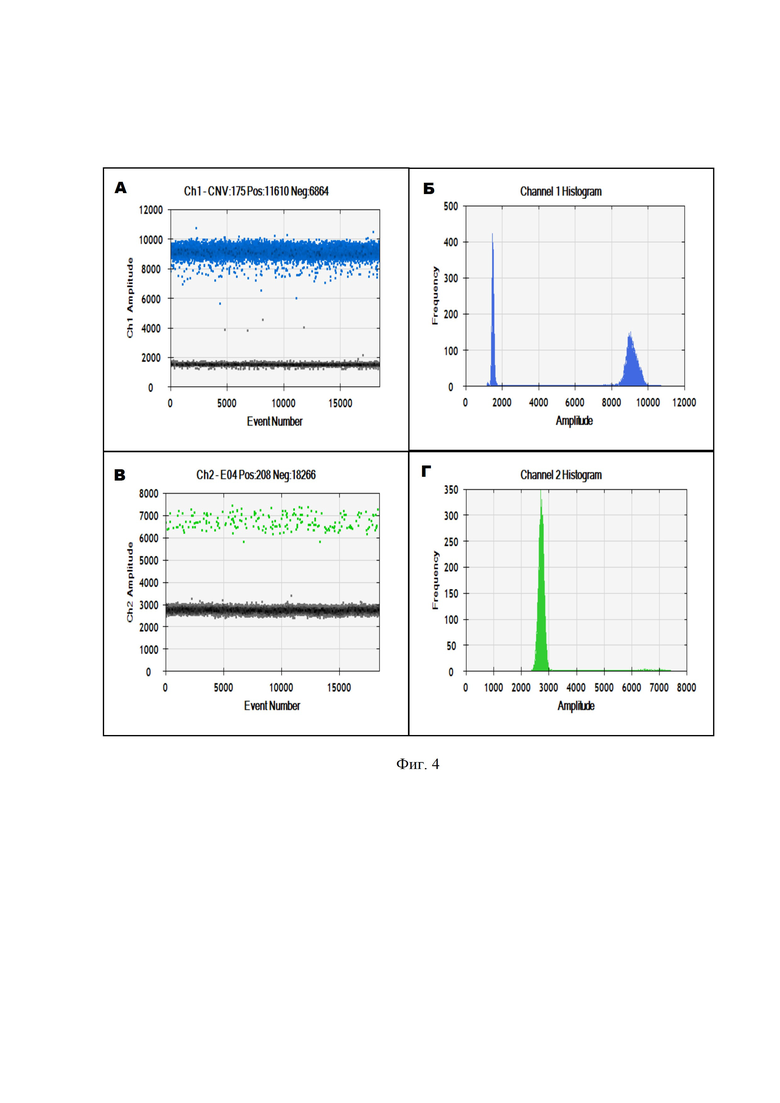
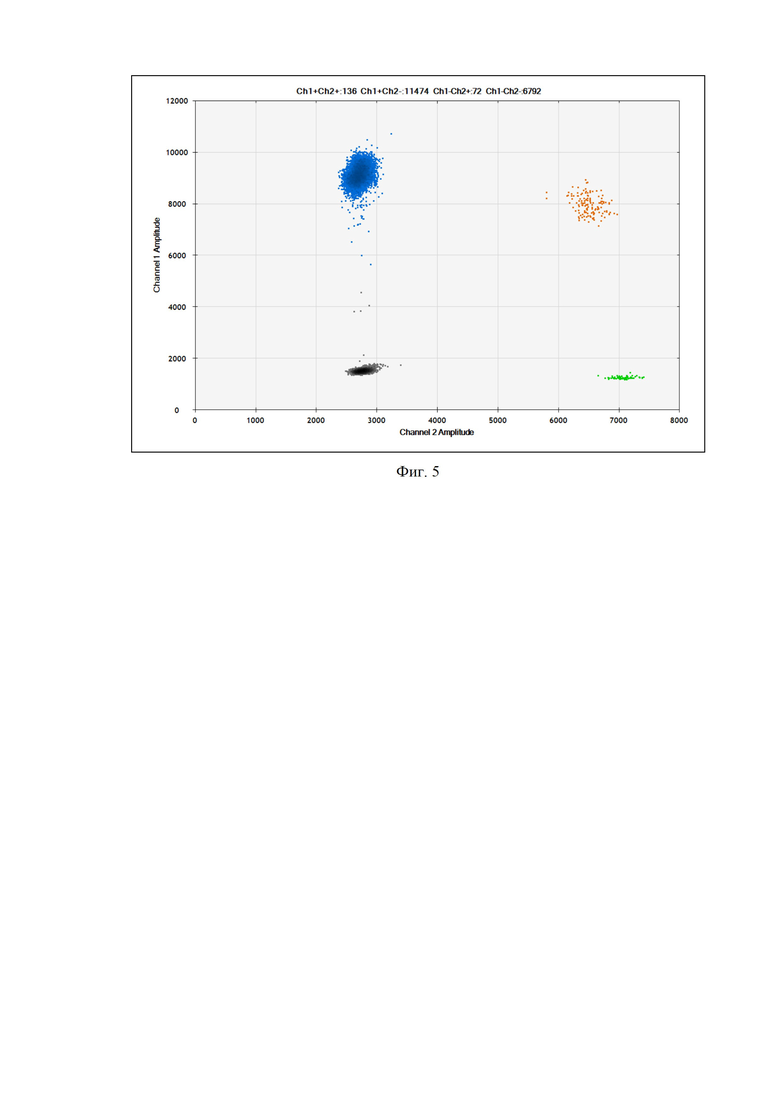
5. Общая методическая постановка dPCR (ddPCR) и получение сигналов флуоресценции производится согласно протоколу производителя технологии ddPCR (капельное, микрофлюидная) или dPCR (на микрокристалле, нанопланшете, иное) [26, 27]. Основным требованием для оценки сигналов флуоресценции нанореакций является достаточное общее количество нанореакций, которое может варьировать от 15000 и более на реакцию. Оптимальным количеством является 18000 сигналов на реакцию (фиг. 4, 5). Количество копий MT-RNR2 (мтДНК) рассчитывается как отношение к 2х копий гена НВВ (ядерной ДНК); полученный результат является количеством копий мтДНК на клетку в исследованном биологическом образце.
Источники информации, принятые во внимание при составлении описания:
1. Fernández-Silva P., Enriquez J.A., Montoya J. Replication and transcription of mammalian mitochondrial DNA // Experimental Physiology. Cambridge University Press, 2003. Vol. 88, № 1. P. 41–56.
2. Clay Montier L.L., Deng J.J., Bai Y. Number matters: control of mammalian mitochondrial DNA copy number // J. Genet. Genomics. 2009. Vol. 36, № 3. P. 125–131.
3. Robin E.D., Wong R. Mitochondrial DNA molecules and virtual number of mitochondria per cell in mammalian cells // J. Cell. Physiol. 1988. Vol. 136, № 3. P. 507–513.
4. Gómez-Serrano M. et al. Mitoproteomics: Tackling mitochondrial dysfunction in human disease // Oxidative Medicine and Cellular Longevity. Hindawi Limited, 2018. Vol. 2018.
5. Ashar F.N. et al. Association of mitochondrial DNA copy number with cardiovascular disease // JAMA Cardiol. American Medical Association, 2017. Vol. 2, № 11. P. 1247–1255.
6. Chen S. et al. Association between leukocyte mitochondrial DNA content and risk of coronary heart disease: A case-control study // Atherosclerosis. Elsevier Ireland Ltd, 2014. Vol. 237, № 1. P. 220–226.
7. Pyle A. et al. Reduced mitochondrial DNA copy number is a biomarker of Parkinson’s disease // Neurobiol. Aging. Elsevier Inc., 2015. Vol. 38. P. 216.e7-216.e10.
8. Wei W. et al. Mitochondrial DNA point mutations and relative copy number in 1363 disease and control human brains // Acta Neuropathol. Commun. 2017. Vol. 5, № 1. P. 13.
9. Reznik E. et al. Mitochondrial DNA copy number variation across human cancers // Elife. eLife Sciences Publications Ltd, 2016. Vol. 5, № FEBRUARY2016.
10. Hertweck K.L., Dasgupta S. The landscape of mtDNA modifications in cancer: A tale of two cities // Frontiers in Oncology. Frontiers Media S.A., 2017. Vol. 7, № NOV.
11. Thyagarajan B. et al. Mitochondrial copy number is associated with colorectal cancer risk // Cancer Epidemiol. Biomarkers Prev. 2012. Vol. 21, № 9. P. 1574–1581.
12. Knez J. et al. Correlates of Peripheral Blood Mitochondrial DNA Content in a General Population // Am. J. Epidemiol. Oxford University Press, 2016. Vol. 183, № 2. P. 138–146.
13. Tin A. et al. Association between mitochondrial DNA copy number in peripheral blood and incident CKD in the atherosclerosis risk in communities study // J. Am. Soc. Nephrol. American Society of Nephrology, 2016. Vol. 27, № 8. P. 2467–2473.
14. Ashar F.N. et al. Association of mitochondrial DNA levels with frailty and all-cause mortality // J. Mol. Med. Springer Verlag, 2015. Vol. 93, № 2. P. 177–186.
15. Malik A.N., Czajka A. Is mitochondrial DNA content a potential biomarker of mitochondrial dysfunction? // Mitochondrion. 2013. Vol. 13, № 5. P. 481–492.
16. Melser S., Lavie J., Bénard G. Mitochondrial degradation and energy metabolism // Biochimica et Biophysica Acta - Molecular Cell Research. Elsevier, 2015. Vol. 1853, № 10. P. 2812–2821.
17. Andreu A.L. et al. Quantification of mitochondrial DNA copy number: Pre-analytical factors // Mitochondrion. 2009. Vol. 9, № 4. P. 242–246.
18. Nacheva E. et al. DNA isolation protocol effects on nuclear DNA analysis by microarrays, droplet digital PCR, and whole genome sequencing, and on mitochondrial DNA copy number estimation // PLoS One. Public Library of Science, 2017. Vol. 12, № 7. P. e0180467.
19. Sims D. et al. Sequencing depth and coverage: Key considerations in genomic analyses // Nature Reviews Genetics. 2014. Vol. 15, № 2. P. 121–132.
20. van Heesch S. et al. Systematic biases in DNA copy number originate from isolation procedures // Genome Biol. BioMed Central Ltd., 2013. Vol. 14, № 4.
21. Diskin S.J. et al. Adjustment of genomic waves in signal intensities from whole-genome SNP genotyping platforms // Nucleic Acids Res. 2008. Vol. 36, № 19. P. 1–12.
22. Hindson B.J. et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number // Anal. Chem. 2011. Vol. 83, № 22. P. 8604–8610.
23. Pinheiro L.B. et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification // Anal. Chem. 2012. Vol. 84, № 2. P. 1003–1011.
24. Usher C.L. et al. Structural forms of the human amylase locus and their relationships to SNPs, haplotypes and obesity // Nat. Genet. Nature Publishing Group, 2015. Vol. 47, № 8. P. 921–925.
25. Ye J. et al. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. // BMC Bioinformatics. 2012. Vol. 13. P. 134.
26. Dong L. et al. Comparison of four digital PCR platforms for accurate quantification of DNA copy number of a certified plasmid DNA reference material // Sci. Rep. Nature Publishing Group, 2015. Vol. 5, № 1. P. 1–11.
27. Farr R.J. et al. Comparative analysis of diagnostic platforms for measurement of differentially methylated insulin DNA // J. Biol. Methods. Journal of Biological Methods, 2019. Vol. 6, № 2. P. 113.
Способ измерения числа копий митохондриальной ДНК методом цифровой полимеразной цепной реакции
Таблица 1. Структура набора синтетических олигонуклеотидных праймеров и проб
Фигура 1. Градиент входящего количество образца ДНК для проведения ПЦР
Фигура 2. Подбор оптимальной температуры для этапа отжига и элонгации.
Фигура 3. Подбор оптимального времени этапа отжига и элонгации.
Фигура 4. Одномерный график интенсивностей сигналов флуоресценции цифровой ПЦР и гистограммы распределения интенсивности флюоресценции для зондов на митохондриальный (краситель-1; А, Б) и ядерный (краситель-2; В, Г) гены.
Фигура 5. Распределения результатов анализа флюоресценции в цифровой ПЦР: синий цвет точек - FAM-положительные ПЦР-капли; зеленый - HEX-положительные, оранжевый - положительные по обоим красителям; серый - отрицательные по обоим красителям.
Таб.1
Примечание: * «краситель1» и «краситель2» являются флуоресцентными метками применяемых для мечения олигонуклеотидов. Подбор необходимо «красителя» осуществляется согласно спецификации производителя dPCR (ddPCR). Гаситель подбирается согласно выбранному красителю.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная плазмидная ДНК pGEM-TCRAC-sjTREC- sjKREC, содержащая нуклеотидные последовательности локуса гена Т-лимфоцитарного α-рецептора и сигнальные фрагменты эксцизионных колец Т- и В-клеточного рецепторов | 2022 |
|
RU2807806C1 |
| Способ определения делеции 7 экзона в гене SMN1 с определением количества копий гена SMN2 в образцах ДНК с помощью цифровой полимеразной цепной реакции | 2024 |
|
RU2838673C1 |
| Способ количественной оценки Т и В-лимфоцитов по содержанию эксцизионных колец TREC и KREC в образцах ДНК с помощью цифровой полимеразной цепной реакции | 2023 |
|
RU2822204C1 |
| Способ определения доли мтДНК с делециями в биологических образцах | 2018 |
|
RU2676897C1 |
| Пептид митохондриальной локализации, нуклеиновая кислота для аллотопической экспрессии гена MT-ND4, содержащий ее экспрессионный вектор и его применение | 2023 |
|
RU2817420C1 |
| Нуклеиновая кислота для аллотопической экспрессии гена MT-ND4 | 2023 |
|
RU2809065C1 |
| Способ получения полноразмерной последовательности митохондриальной ДНК человека с использованием набора олигонуклеотидов методом мультиплексной амплификации для работы с образцами деградированной ДНК | 2021 |
|
RU2818323C2 |
| ЛЕЧЕНИЕ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2745611C2 |
| СПОСОБ КОРРЕКЦИИ МИТОХОНДРИАЛЬНОЙ ДИСФУНКЦИИ С ПОМОЩЬЮ ГЕНЕТИЧЕСКОЙ КОНСТРУКЦИИ | 2016 |
|
RU2642972C1 |
| ЛЕЧЕНИЕ МИТОХОНДРИАЛЬНЫХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2834339C1 |
Изобретение относится к биотехнологии и может быть использовано для определения среднего количества копий митохондриальной ДНК человека, приходящегося на одну клетку, в различных биологических образцах человека, в том числе в ранее выделенных образцах тотальной ДНК из биологических материалов человека. 5 ил., 1 табл., 1 пр.
Способ измерения числа копий митохондриальной ДНК человека методом цифровой полимеразной цепной реакции, включающий выделение геномной ДНК из биологического материала, способом, позволяющим использовать ДНК в качестве матрицы в ПЦР, отличающийся тем, что на одну реакционную смесь с применением цифровой ПЦР используют 0,2-2 нг фрагментированной тотальной ДНК с применением мультиплексного набора праймеров и зондов, специфических для митохондриальной и ядерной ДНК, структура которых имеет следующие характеристики:
MT-RNR2-F: 5’-AGGTTCGTTTGTTCAACGATT-3’
MT-RNR2-R: 5’-TCGTACAGGGAGGAATTTGAA-3’
MT-RNR2-P: 5’-краситель1-CCGGAGTAATCCAGGTCGGTTTC-гаситель1-3’
HBB-F: 5’-CTGGGTAGCTCTAAACAATGTATTCA-3’
HBB-R: 5’-CCATGTACTAACAAATGTCTAAAATGGT-3’
HBB-P: 5’- краситель2-ATCTTGCCGCCTTCCCTCAA-гаситель2-3’
| Rooney J | |||
| P | |||
| et al | |||
| PCR based determination of mitochondrial DNA copy number in multiple species, Mitochondrial Regulation, Humana Press, New York, NY, 2015 | |||
| С | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Ashar F | |||
| N | |||
| et al | |||
| Association of mitochondrial DNA copy number with cardiovascular disease, JAMA cardiology, 2017, Т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Устройство для автоматического регулирования магнитного потока проходящего через якорь динамо-машины | 1923 |
|
SU1247A1 |
| Воропаев Е | |||
| В | |||
| и др | |||
| Метод | |||
Авторы
Даты
2021-09-20—Публикация
2021-04-07—Подача