Область техники, к которой относится изобретение
Изобретение относится к способу получения L-(+)-винной кислоты, включающему стадию ферментативного гидролиза цис-эпоксисукцината щелочного или щелочноземельного металла.
Уровень техники
Карбоновые и дикарбоновые кислоты, диолы и спирты находят все большее применение в различных отраслях промышленности. В том числе, это относится к L-(+)-винной кислоте. L-(+)-винную кислоту применяют в пищевой, косметической, текстильной, фармацевтической, химической и строительной промышленностях в качестве подкислителя, усилителя вкуса, антиоксиданта и химического растворителя. Традиционно L-(+)-винную кислоту получают из отходов виноделия.
Кроме того, L-(+)-винная кислота может быть получена химическим синтезом (см. документ US5087746 A (опубл. 11.02.1992, MONSANTO CO [US]) или ферментацией (см. Bhat H. K. et al., PRODUCTION OF TARTARIC ACID BY IMPROVED RESISTANT STRAIN OF GLUCONOBACTER-SUBOXYDANS // Research and Industry. - 1986. - Т. 31. - № 2. - С. 148-152) малеинового ангидрида и 5-оксоглуконовой кислоты или глюкозы в качестве исходного сырья.
В настоящее время наиболее эффективным способом является ферментативное получение L-(+)-винной кислоты из недорогого и легко доступного цис-эпоксисукцината (ЦЭС) с использованием цис-эпоксисукцинат гидролаз (ЦЭСГ), как описано, например, в документе US 4010072 A (опубл. 01.03.1977, TOKUYAMA SODA [JP]).
Эпоксидные гидролазы представляют собой биокатализаторы для асимметричного гидролиза эпоксидов, для которых не требуется ни кофакторов, ни ионов металлов.
Цис-эпоксисукцинат гидролазная активность была описана для широкой группы микроорганизмов: Acetobacter curtus, Achromobacter tartarogenes, Ach. acinus and Ach. sericatus, Acinetobacter tartarogenes, Agrobacterium aureum, Agr. viscosum, Alcaligenes epoxylytus, Alc. margaritae, Corynebacterium sp., Nocardia tartaricans, Pseudomonas sp., Rhizobium validum, Rhodococcus rhodochrous, Klebsiella sp. и Labrys sp.
Несмотря на достаточно широкое распространение ЦЭСГ среди бактерий, в базах данных представлены только 2 аминокислотные последовательности ЦЭСГ, для которых достоверно описана реакция преобразования ЦЭС в L-тартрат.
В документе US6379938 B1 (опубл. 30.02.2002 PURATOS NV [BE] определена первая полная последовательность белка ЦЭСГ из бактерии Rhodococcus rhodochrous LMGP-18079 и продемонстрировано, что белок гена обладает ЦЭСГидролазной активностью. Идентичная последовательность также обнаружена в бактерии Rhodococcus opacus (документ Liu Z. et al., Cloning, sequencing, and expression of a novel epoxide hydrolase gene from Rhodococcus opacus in Escherichia coli and characterization of enzyme //Applied microbiology and biotechnology. - 2007. - Т. 74. - №. 1. - С. 99-106), Nocardia tartaricans CAS-52 (Wang Z., Wang Y., Su Z. Purification and characterization of a cisepoxysuccinic acid hydrolase from Nocardia tartaricans CAS-52, and expression in Escherichia coli //Applied microbiology and biotechnology. - 2013. - Т. 97. - № 6. - С. 2433-2441). В настоящее время последовательность фермента представлена в базе данных NCBI (GenBank ID: JQ267565).
Второй известной последовательностью является последовательность гена ЦЭСГ из Klebsiella oxytoca (Cheng Y. et al., Purification and characterization of a novel cisepoxysuccinate hydrolase from Klebsiella sp. that produces L (+)-tartaric acid //Biotechnology letters. - 2014. - Т. 36. - № 11. - С. 2325-2330).
Несмотря на то, что данные последовательности обладают ЦЭСГ-активностью, процесс ферментативного раскрытия эпоксида требуется проводить при температуре не более 37° из-за не достаточной стабильности фермента. Использование более высоких температур позволит повысить эффективность процесса и снизить вероятность микробного заражения.
Таким образом, в настоящее время существует потребность в определении новых последовательностей, проявляющих ЦЭСГ-активность и позволяющих оптимизировать процесс получения тартратов из соответствующих ЦЭС с последующим селективным получение L-(+)-винной кислоты.
Сущность изобретения
Изобретение заключается в применении фермента, имеющего аминокислотную последовательность SEQ ID NO:1 в получении тартратов из цис-эпоксисукцинатов (ЦЭС) щелочных и щелочноземельных металлов.
Данный фермент получают из культуры клетки-хозяина, несущей плазмидную конструкцию, содержащую нуклеотидную последовательность SEQ ID NO:2.
Также изобретение относится к полинуклеотиду, кодирующему последовательность SEQ ID NO:1, плазмидной конструкции, содержащей полинуклеотид кодирующий фермент, содержащий аминокислотную последовательность SEQ ID NO:1.
Кроме того, изобретение относится к клетке-хозяину, содержащей полинуклеотид или плазмидную конструкцию, кодирующих фермент, содержащий аминокислотную последовательность SEQ ID NO:1.
В конечном итоге изобретение относится к способу получения L-(+)-винной кислоты путем гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов.
Техническим результатом изобретения является обеспечение стабильности фермента в процессе получения тартрата из ЦЭС щелочных и щелочноземельных металлов при температуре до 60°С.
Описание фигур
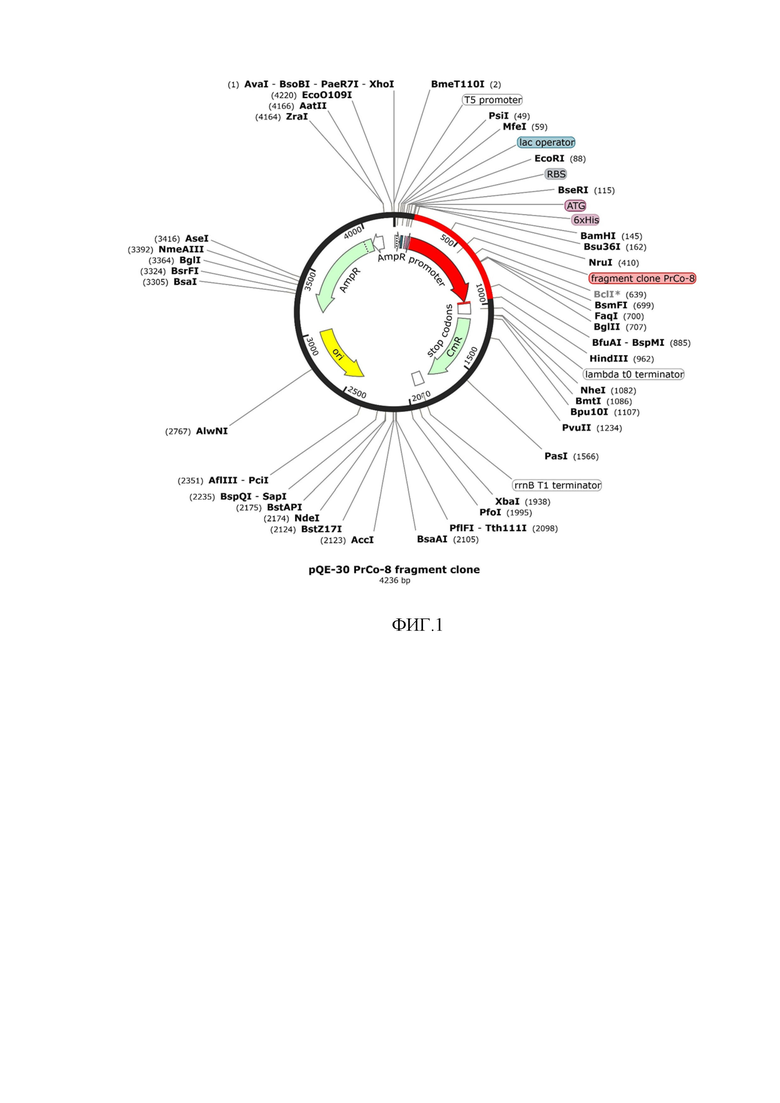
ФИГ.1. Карта плазмиды pQE30-PrCo, экспрессирующей ген ЦЭСГ Prauserella coralliicola.
ФИГ.2. Спектр ЯМР 1Н полученной винной кислоты в D2O.
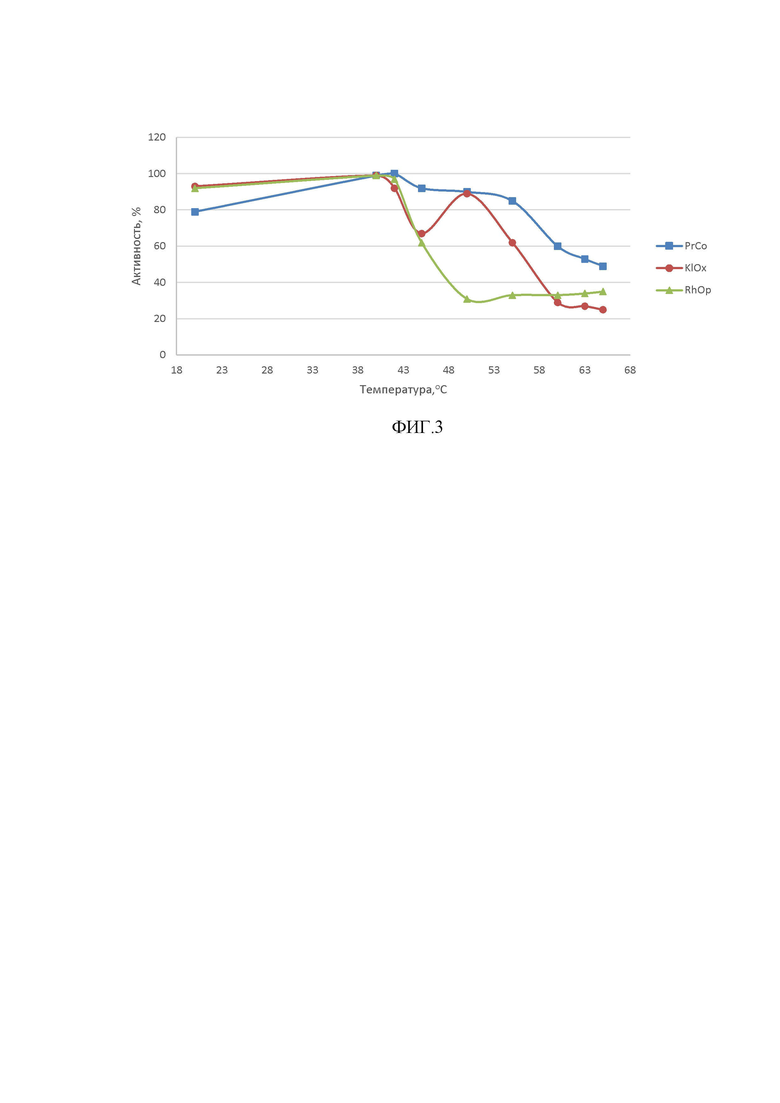
ФИГ.3. Профили активности фермента в зависимости от температуры инкубации раствора фермента перед добавлением субстрата.
Подробное описание изобретения
Далее приводится описание различных аспектов реализации настоящего изобретения.
В одном из вариантов осуществления изобретения раскрывается фермент, имеющий аминокислотную последовательность SEQ IN NO:1, применяемый для гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов.
Указанная последовательность может быть получена следующим образом.
1. Химический синтез нуклеотида, кодирующего указанную последовательность.
2. Необязательно оптимизацию нуклеотидной последовательности по составу кодонов (для повышения уровня экспрессии фермента клеткой хозяина).
3. Клонирование нуклеотида в плазмидную конструкцию.
4. Введение плазмидной конструкции в клетки микроорганизма.
5. Культивирование клеток.
6. Разрушение клеток с получением лизата, содержащего указанную последовательность.
Описанный способ получения последовательности приводится только в качестве примера и не ограничивает настоящее изобретение. Примерами конкретных стадий получения последовательности служат стадии получения, описанные в: Liu Z. et al., Cloning, sequencing, and expression of a novel epoxide hydrolase gene from Rhodococcus opacus in Escherichia coli and characterization of enzyme //Applied microbiology and biotechnology. - 2007. - Т. 74. - № 1. - С. 99-106, EP 2840135 A1 (опубл. 25.03.2015 HANGZHOU BIOKING BIOCHEMICAL ENGINEERING CO LTD [CN]), US 6379938 B1 (опубл. 30.04.2002 PURATOS NV [BE]).
Полученная последовательность может быть иммобилизована как описано, например, в Wang Z. et al. Production of tartaric acid using immobilized recominant cisepoxysuccinate hydrolase //Biotechnology letters. - 2017. – Т. 39. - № 12. - С. 1859-1863.
В другом варианте осуществления изобретения изобретение относится к полинуклеотиду, кодирующему фермент, имеющий аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах осуществления, полинуклоетид представлен нуклеотидной последовательностью SEQ ID NO:2.
В еще одном варианте осуществления изобретения изобретение относится к плазмидной конструкции для экспрессии фермента, имеющего аминокислотную последовательность SEQ ID NO:1, в которую была клонирована нуклеотидная последовательность SEQ ID NO:2.
В другом варианте осуществления изобретения изобретение относится к клетке-хозяину для экспрессии фермента, имеющего аминокислотную последовательность SEQ ID NO:1, в которую была клонирована нуклеотидная последовательность SEQ ID NO:2, или плазмидная конструкция, содержащая нуклеотидную последовательность SEQ ID NO:2.
В качестве клетки-хозяина могут быть использованы любые известные из уровня техники клетки, например, бактерии, грибы или дрожжи. Предпочтительно, в следствие технологического удобства и доступности, используют бактерии E.coli, в наиболее предпочтительном варианте осуществления изобретения, используют штамм E.coli депонированный во Всероссийской коллекции промышленных организмов (ВКПМ) под номером B-13524.
В одном из вариантов осуществления изобретения изобретение относится к применению фермента, содержащего аминокислотную последовательность SEQ ID NO:1, в производстве получения L-(+)-винной кислоты.
В еще одном варианте осуществления изобретения изобретение относится к способу получения L-(+)-винной кислоты путем ферментативного гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов, где в качестве фермента используется последовательность SEQ ID NO:1. В качестве последовательности в ферментативном гидролизе также используют последовательность более чем на 70%, предпочтительно более чем на 75%, более чем на 80%, более чем на 85%, более чем на 90%, более чем на 95%, более чем на 99% гомологичную вышеуказанной.
В качестве цис-эпоксисукцинатов щелочных и щелочноземельных металлов используют цис-эпоксисукцинаты натрия, кальция, бария и т.п. Предпочтительно используют цис-эпоксисукцинат кальция.
Ферментативный гидролиз проводят любым известным из уровня техники способом. Примерами таких способов являются, но не ограничивается ими: EP 2840135 A1 (опубл. 25.03.2015 HANGZHOU BIOKING BIOCHEMICAL ENGINEERING CO LTD [CN]), US 6379938 B1 (опубл. 30.04.2002 PURATOS NV [BE]), GB 1534195 A (опубл. 29.11.1978, Takeda Chemical Industries [JP]).
Отличительной особенностью способа получения L-(+)-винной кислоты по настоящему способу является возможность проводить ферментативный гидролиз при температуре выше 40° и до 60°.
L-(+)-винную кислоту используют как в пищевой промышленности в качестве усилителя вкуса и подсластителя, так и в строительстве в составе сухих строительных смесей и т.д.
Осуществление изобретения
Методики определения
Методика электрофореза в полиакриламидном геле (ПААГ) (одномерного белкового гель-электрофореза)
Для проведения электрофореза белков к клеточному осадку после промывки от среды добавляли 40 мкл лизирующего буфера додецилсульфата натрия (ДСН-буфера) для нанесения (0,05 М Трис-HCl pH 6,8; 2%-ный ДСН; 0,002%-ный бромфеноловый синий; 10%-ный глицерин; 5%-ный меркаптоэтанол), ресуспендировали и подвергали воздействию ультразвуковыми волнами в ультразвуковой ванне в течение 15 мин. Полученный лизат кипятили 5 мин при 95оС, центрифугировали 15 мин при 16100 g. После чего супернатант наносили на полиакриламидный ДСН-гель для проведения электрофореза по методу Лэммли (34) в мини-геле (8×10 см, толщиной 1 мм).
Для проведения электрофореза белков супернатанты после ультразвукового разрушения клеток в солевом буфере смешивали в соотношении 1:1 с буфером для нанесения (0,05 М Трис-HCl pH 6,8; 2%-ный ДСН; 0,002%-ный бромфеноловый синий; 10%-ный глицерин; 5%-ный меркаптоэтанол), затем кипятили в течение 5 минут.
Для проведения электрофореза белков после хроматографической очистки образцы смешивали в соотношении 2:1 с буфером для нанесения (0,05 М Трис-HCl pH 6,8; 2%-ный ДСН; 0,002%-ный бромфеноловый синий; 10%-ный глицерин; 5%-ный меркаптоэтанол), затем кипятили в течение 5 минут.
Концентрацию белка определяли по методу Брэдфорда (см. Bradford, M.M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding // Anal. Biochem. - 1976. - Vol. 72. - P. 248-254).
Получение последовательности гена
Для создания молекулярно-биологической конструкции SEQ ID NO:2, экспрессирующей белок ЦЭС-гидролазу PrCo, проводили химический синтез последовательности гена с оптимизированным для экспрессии в E.coli кодонным составом.
Полученный ген клонировали в плазмидную конструкцию pQE30 под контроль мощного Т5 промотора под регуляцией оператора лактозного оперона. Карта плазмиды pQE30-PrCo, экспрессирующей ген ЦЭСГ Prauserella coralliicola, представлена на ФИГ.1.
Получение трансформированных клеток E.coli
Молекулярно-генетическую конструкцию pQE30-PrCo вводили в клетки E.coli Xl-blue при помощи электропорации. Культивирование трансформированных клеток E.coli проводили следующим образом.
В качестве основы использовали минимальную солевую среду, содержащую 2,0 г/л Na2SO4, 6,12 г/л (NH4)2SO4, 0,50 г/л NH4Cl, 14,60 г/л K2HPO4, 3,60 г/л NaH2PO4·H2O, 1,00 г/л двухосновного цитрата натрия, 0,36 г/л MgSO4 и 0,1 г/л тиамина гидрохлорида. К приготовленной смеси добавляли 250 мкл раствора микроэлементов, содержащего 0,50 г/л CaCl2·2H2O, 0,18 г/л ZnSO4·7H2O, 0,10 г/л MnSO4·H2O, 20,1 г/л Na2-ЭДТА, 16,70 г/л FeCl3·6H2O, 0,16 г/л CuSO4·5H2O, 0,18 г/л CoCl2·6H2O. Уровень pH питательной среды доводили до значения 7.5. В качестве источника углерода использовали глицерин и глюкозу, 7,5 г/л и 2,5 г/л, соответственно.
Для индукции экспрессии белка через 24 часа инкубации в среду добавляли 150 мкл 1М водного раствора IPTG (изопропил-β-D-1-тиогалактопиранозид) и ампициллина из расчета 100 мкг/мл. Одновременно с началом индукции экспрессии белка к бактериальной культуре добавляли дополнительные источники углерода - глицерин и раствор, содержащий 100г/л триптона и 50 г/л дрожжевого экстракта.
Дальнейшую инкубацию культур проводили при температуре 32° в течение 7 часов. Оптическая плотность OD600 культуры по окончании культивирования составляла ~ 6,2. Клеточную культуру осаждали при 3000-4000 об/мин в течении 10 минут, промывали минимальной солевой средой, замораживали в жидком азоте и хранили при -70°С.
Аликвоту клеток из образца анализировали на предмет наличия рекомбинантного белка с помощью одномерного гель электрофореза в ПААГ.
Получение лизата
Культуру клеток 50 мл рекомбинантной E.coli XL blue (с плазмидой pQE30-PrCo) после индукции осаждали центрифугированием при 3000g в течении десяти минут. Клетки ресуспендировали в 10 мл минеральной среды и разрушали ультразвуком. Лизат центрифугировали при 16100g в течение десяти минут.
Для определения наличий ферментативной реакции 10 мкл лизата после центрифугирования добавляли к 90 мкл раствора, содержащего 25 г/л натрия цис-эпоксисукцината, и перемешивали на вортексе. Инкубировали смесь в течении 1 часа при 32°. После чего определяли наличие в растворе тартрата метаванадатным способом.
Исследуемый лизат демонстрирует наличие активности в сравнении с аналагочным лизатом полученным из штамма E.coli XL blue (с плазмидой pQE30 без встройки целевого гена).
Культивирование E.coli
Ночную культуру выращивали в конических колбах объемом 500 мл, в которые помещали 100 мл среды LB (1% пептон, 1% NaCl и 0,5% дрожжевой экстракт, рН среды 8,0) с добавлением ампициллина в концентрации 100 мкг/мл. Общий объем ночной культуры составлял 400 мл. Культивирование проводили при 37°, при 250 об/мин на шейкере-инкубаторе ЕS-20/60 (Biosan) в течение 16 часов.
Для культивирования в биореакторе использовали минеральную среду следующего состава: 2,0 г/л Na2SO4, 6,12 г/л (NH4)2SO4, 0,50 г/л NH4Cl, 14,60 г/л K2HPO4, 3,60 г/л NaH2PO4·H2O, 1,00 г/л двухосновного цитрата натрия, 0,36 г/л MgSO4 и 0,1 г/л тиамина гидрохлорида с добавлением к приготовленной смеси 1/1000 раствора микроэлементов, содержащего 0,50 г/л CaCl2·2H2O, 0,18 г/л ZnSO4·7H2O, 0,10 г/л MnSO4·H2O, 20,1 г/л Na2-ЭДТА, 16,70 г/л FeCl3·6H2O, 0,16 г/л CuSO4·5H2O, 0,18 г/л CoCl2·6H2O. Минеральную основу автоклавировали, микроэлементы стерилизовали фильтрованием через 0,22 мкм фильтры.
400 мл ночной культуры добавляли в пятилитровый биореактор Biostat B (Sartorius), содержащий 4 литра описанной выше минеральной среды с добавлением 2,5 г/л глюкозы и 7,5 г/л глицерина. Культивирование проводили при подаче воздуха: 2 литра на литр среды в минуту. Скорость вращения мешалки составляла 800 об/мин. рН среды поддерживали на оптимальный для роста E.coli уровне, равном 7,6. Перед добавлением ночной культуры среду прогревали до 37°, далее поддерживали эту же температуру на протяжении всего эксперимента.
Оптическую плотность культуры измеряли каждые 30 минут через 8 часов после начала культивирования. По достижению оптической плотности OD600 = 8,0 проводили индукцию. В среду добавляли 50 мл глицерина и 16 мл раствора (Триптон 100 г/л и дрожжевой экстракт 50 г/л). В качестве индуктора добавляли IPTG до концентрации 1 мкМ/мл. Культивировали при 32° в течение 6,5 часов.
Культуру клеток концентрировали при помощи тангенциальной ультрафильтрации на фильтрах с размером пор 0,2 мкм. Всего с четырех литров культуры получали 56 г клеток. Шесть граммов полученного клеточного осадка суспендировали в 40 мл дистиллированной воды, пробирку помещали в ледяную баню. Клетки разрушали ультразвуком. Лизат осветляли центрифугированием при 12000 g в течении 30 минут.
Цис-эпоксисукцинатгидролазную активность определяли по методике с использованием метаванадата аммония. Активность полученного фермента составила ~ 40 000 U/л культуральной жидкости.
Пример 1. Ферментативный гидролиз кальций цис-эпоксисукцината (СаЦЭС)
В 100 мл дистиллированной воды суспендировали 5,35 гр CaЦЭС.
К полученной суспензии добавляли 5 мл осветленного лизата препаративно наработанного фермента ЦЭС гидролазы PrCo и инкубировали в течении 20 часов при 28°C при постоянном перемешивании 150 об/мин на шейкере-инкубаторе ЕS-20/60 (Biosan).
По окончании культивирования осадок фильтровали и высушивали до воздушно-сухого состояния.
Проверка показала, что полученный порошок содержит 90 ± 5% четырехводного гидрата кальция L-тартрата.
Согласно данным анализа РФА полученный порошок содержит L-CaC4H4O6•4H2O и не содержит CaЦЭС, что говорит о полноте прохождения реакции.
Пример 2. Сравнение ферментативной активности в зависимости от температур.
Проводили качественное определение ЦЭСГ-активности в полученных растворах белков. Активность была продемонстрирована для осветленных лизатов культур клеток E.coli, несущих конструкции, экспрессирующие следующие ЦЭСГ: SEQ ID NO:3 (RhOp из Rhodococcus opacus); SEQ ID NO:4 (KlOx из Klebsiella oxytoca); SEQ ID NO:1 (PrCo из Prauserella coralliicola).
Результат определения представлен на ФИГ.3.
Как проиллюстрировано на ФИГ.3, последовательность, обнаруженная в Prauserella coralliicola, по сравнению с известными последовательностями, более стабильна в диапазоне температур, оптимальном для проведения ферментативного гидролиза (45-60°С). Вместе с тем, последовательность, обнаруженная в Prauserella coralliicola, проявляет высокую селективность в процессе гидролиза кальций цис-эпоксисукцината.
Изобретение относится к биотехнологии, в частности к области получения L-(+)-винной кислоты из цис-эпоксисукцинатов щелочных или щелочноземельных металлов. В частности, изобретение относится к применению фермента с аминокислотной последовательностью, идентичной по меньшей мере на 70% SEQ ID NO:1, для гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов. Изобретение позволяет эффективно получать L-(+)-винную кислоту. 2 н. и 3 з.п. ф-лы, 3 ил., 2 пр.
1. Применение фермента, имеющего аминокислотную последовательность, идентичную по меньшей мере на 70% SEQ ID NO:1, для гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов.
2. Применение по п.1 для гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов при получении L-(+)-винной кислоты.
3. Способ получения L-(+)-винной кислоты путем ферментативного гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов, отличающийся тем, что в качестве фермента используют фермент, имеющий аминокислотную последовательность, идентичную по меньшей мере на 70% SEQ ID NO:1, для гидролиза цис-эпоксисукцинатов щелочных и щелочноземельных металлов.
4. Способ по п.3, в котором ферментативный гидролиз проводят при температуре более 40°С.
5. Способ по п.3, в котором ферментативный гидролиз проводят при температуре до 60°С.
| ЭЛЕКТРОМЕХАНИЧЕСКАЯ СЧЕТНО-АНАЛИТИЧЕСКАЯ МАШИНА | 1938 |
|
SU60628A1 |
| WO 2019229064 A3, 05.12.2019 | |||
| US 4010072 A, 01.03.1977 | |||
| СИНГЕР М | |||
| и др., "Гены и геномы", Москва, "Мир", 1998, том 1, стр | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
Авторы
Даты
2021-09-28—Публикация
2020-09-16—Подача