Изобретение относится к электрометаллургии редких, цветных и рассеянных элементов, в частности к синтезу электролитов для получения покрытий и изделий из рения методом высокотемпературной гальванопластики в расплавах солей. Изделия из рения, полученные методом высокотемпературной гальванопластики, могут быть использованы в качестве заготовок сборочных единиц термокаталитических двигателей малой тяги.
Известен способ синтеза электролита для получения рения /1/ на основе расплавов галогенидов щелочных металлов (CsCl-KCl-NaCl), содержащего Cs2ReCl6 (5–11 мас. % Re в пересчете на металл). По способу /1/ синтез ренийсодержащего расплава производят хлорированием металлического рения в виде порошка в токе газообразного хлора. В результате полученные хлориды рения растворяются в расплаве CsCl-KCl-NaCl с образованием электролита заданной концентрации. Процесс протекает в установке хлорирования. Установка состоит из двух отсеков. В первом отсеке происходит выделение газообразного хлора, во втором – процесс хлорирования рения. Отсеки соединены между собой трубкой устойчивой к воздействию газообразного хлора. Температурный режим в обоих отсеках обеспечивается внешним подогревом. Температура в отсеке хлорирования составляет 700 oC. Температура в отсеке выделения хлора составляет 550 oC. Реакция выделения хлора инициируется и поддерживается при помощи постоянного электрического тока. Процесс состоит из электрохимической реакции и химической реакции, которые разнесены в пространстве.
Решение по способу /1/ является наиболее близким к заявляемому изобретению и обладает недостатками. Сложное аппаратурное оформление процесса, необходимость транспортировки и использование газообразного хлора повышают требования к финансовому и экологическому сопровождению процесса.
Технической задачей изобретения является снижение ресурсоемкости способа приготовления электролита и экологической нагрузки. Это приведёт к повышению технико-экономических показателей процесса.
Указанная задача решается за счет того, что формирование электролита проводится в единой электрохимической ячейке в рамках общей реакции, не допускающей выделения свободного газообразного хлора.
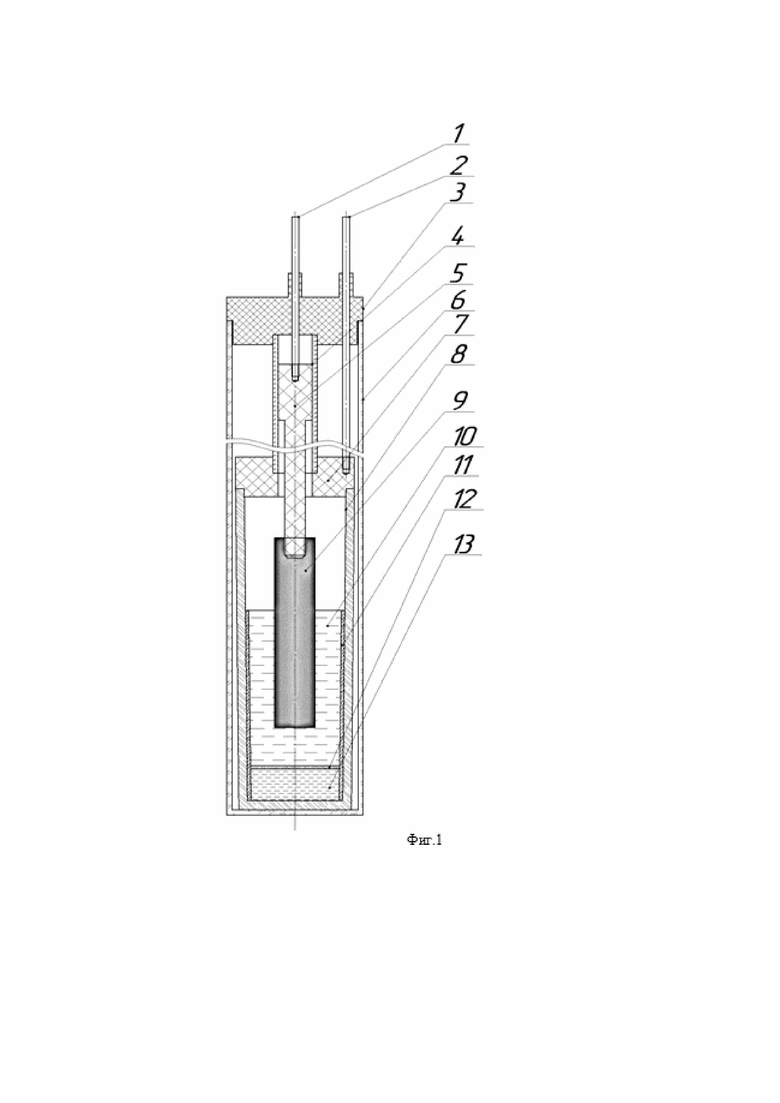
Заявляемая электрохимическая ячейка для проведения синтеза расплава CsCl-KCl-NaCl-Cs2ReCl6 состоит из анодного и катодного узлов, которые разделены между собой неэлектропроводящей диафрагмой и помещены в герметизируемую кварцевую реторту. Ячейка выполнена в виде стакана с крышкой, в которую установлен первый токоподвод, а через отверстие в центре крышки подведен второй токоподвод. Причем в стакан помещена кварцевая труба, полость внутри которой разделена диафрагмой. Под диафрагмой размещается католит, а над ней - анолит и металлический рений, закрепляемый на токопроводящем стержне, который установлен в размещенной в отверстии крышки стакана кварцевой трубке и соединен со вторым токоподводом.
Заявляемый способ синтеза электролита состава CsCl-KCl-NaCl-Cs2ReCl6 (5–11 мас. % Cs2ReCl6 в пересчете на металл Re) характеризуется проведением процесса электрохимического растворения рения и катодного восстановления ионов свинца под действием постоянного тока величиной 1,5–5 А при температуре процесса 600 или 700℃. Способ отличается тем, что для его реализации используется заявляемая электрохимическая ячейка, что позволяет упростить аппаратурное оформление и обеспечивает отсутствие в процессе газообразного хлора.
Таким образом, использование заявляемой ячейки позволяет производить электролит идентичного химического состава, что и по способу /1/, однако без использования газообразного хлора. В отличие от /1/ процесс может протекать в рамках единой электрохимической системы, в которой отсутствует необходимость транспортировки газообразного хлора, и, соответственно, не требуется отдельного отсека хлорирования, что упрощает аппаратурное оформление процесса.
Сущность группы изобретений поясняется фигурами, на которых изображено:
Фиг.1 - схематическое изображение ячейки,
Фиг.2 - таблица режимов синтеза электролита.
Заявляемая единая электрохимическая ячейка для проведения процесса синтеза расплава CsCl-KCl-NaCl-Cs2ReCl6 (5–11 мас. % Re в пересчете на металл) представляет собой контейнер, в котором анодное и катодное пространство разделено асбестовой диафрагмой 12. Под действием электрического тока протекает образование ионов рения в анодном пространстве и выделение металлического свинца в катодном. При этом диафрагма 12 может быть выполнена также из других материалов, которые устойчивы к температурам процесса и инертны по отношению к среде электролита.
Катодный узел представляет собой стакан 8 с плоской крышкой 7 с отверстием в центре с помещенной в стакан 8 кварцевой трубой 11, на дне которого размещается католит 13. Стакан 8 должен быть выполнен из материалов, устойчивых к температуре и среде процесса, например, молибден, никель, графит, углекон. Кварцевая труба 11 служит изолятором, который исключает подведение электрического тока через стенки стакана 8, а также отделяет анодный и катодный узлы. В крышку 7 стакана 8 монтируется первый токоподвод 2, отверстие в центре служит для подведения второго токоподвода 1.
Анодный узел представляет собой расплавленный анолит 10 с погруженным в него металлическим рением 9, закрепленном на токопроводящем стержне 5, помещенным в кварцевую трубку 4, которая размещается в отверстии в крышке 7 стакана 8 и исключает электрический контакт с крышкой 7. Вся ячейка помещается в кварцевую реторту 6, которая герметизируется крышкой 3, которую изготавливают, например, из фторопласта.
Схему процесса получения электролита в единой электрохимической ячейке можно описать следующим образом:
Re|CsCl-KCl-NaCl||PbCl2|C (1)
В основе процесса лежит электрохимическое растворение рения (анодный процесс) и катодное выделение свинца (катодный процесс), протекающие под действием постоянного тока. При этом пространство в ячейке разделено диафрагмой 12. Диафрагма 12 является неэлектропроводящей, однако, обеспечивает перенос по ионам и исключает конвекцию. Диафрагма 12 не взаимодействует с расплавом солей химически. Таким образом, в прианодной области происходит наработка расплава CsCl-KCl-NaCl, содержащего Cs2ReCl6 (5–11 мас. % Re в пересчете на металл). В прикатодной области происходит выделение жидкого свинца, а не выделение хлора.
Синтез электролита состава CsCl-KCl-NaCl-Cs2ReCl6 (5–11 мас. % Cs2ReCl6 в пересчете на металл Re) проводят под действием постоянного тока величиной 1,5–5 А (при других величинах тока процесс не идет) и при температуре процесса 600 или 700℃. При температуре менее 600 анолит не плавится (процесс идет в расплаве), а при температуре свыше 700 анолит «улетает» из зоны реакции в виде солевых возгонов, что негативно влияет на процесс.
Заявляемая группа изобретений осуществляется следующим образом.
В стакан 8 помещают кварцевую трубу 11, внешний диаметр которой равен или несколько меньше внутреннего диаметра стакана 8. На дно стакана 8 помещают необходимое количество католита 13 – хлорида свинца, поверх которого размещают диафрагму 12. Для исключения электрического контакта диафрагма 12 должна плотно прилегать ко внутренним стенкам кварцевой трубы 11. Над диафрагмой 12 размещают необходимое количество анолита 10 – смесь солей CsCl, KCl, NaCl эвтектического состава, после чего устанавливают крышку 7 стакана 8. Собранную конструкцию помещают в кварцевую реторту 6.
Через герметичные отверстия крышки 3 устанавливают токоподводы 1 и 2. На первый токоподвод 1 накручивают токопроводящий стержень 5, на котором закрепляют кварцевую трубку 4 и металлический рений 9. После этого крышку 3 устанавливают на реторту 6 и герметизируют. Токоподвод 2 вкручивают в крышку 7 стакана 8, а токоподвод 1 опускают через отверстие в крышке 7 таким образом, чтобы металлический рений 9 находился над поверхностью анолита 10, а кварцевая трубка 4 касалась внутренних стенок отверстия крышки 7.
Собранную единую ячейку помещают в печь таким образом, чтобы в зоне нагрева оказался стакан 8 с крышкой 7, и нагревают. После нагрева до заданной температуры ячейку выдерживают в течение часа для полного расплавления анолита и погружают в него металлический рений. Ячейку подключают к источнику постоянного тока и подают электрический ток заданной величины. При этом в прикатодном пространстве происходит разложение католита 13 на положительно заряженные ионы свинца и отрицательно заряженные ионы хлора, а в прианодном пространстве металлический рений 9 переходит в анолит 10 в виде положительно заряженных ионов рения. Ионы хлора проходят через диафрагму 12 и взаимодействуют с ионами рения, образуя переходное соединение ReCl62-. Переходное соединение взаимодействует с хлоридом цезия, образуя соединение Cs2ReCl6.
Для подтверждения возможности реализации изобретения выполнены эксперименты по синтезу расплавов.
Пример 1. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 600℃, в течение 25 часов. Под действием электрического тока величиной 3 А проходило растворение рения, в результате которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (11 мас. % Re в пересчете на металл).
Пример 2. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 700℃, в течение 25 часов. Под действием электрического тока величиной 3 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (11 мас. % Re в пересчете на металл).
Пример 3. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 600℃, в течение 25 часов. Под действием электрического тока величиной 1,5 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (5 мас. % Re в пересчете на металл).
Пример 4. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 700℃, в течение 25 часов. Под действием электрического тока величиной 1,5 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (5 мас. % Re в пересчете на металл).
Пример 5. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 700℃, в течение 15 часов. Под действием электрического тока величиной 5 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (11 мас. % Re в пересчете на металл).
Пример 6. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 700℃, в течение 11 часов. Под действием электрического тока величиной 5 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (8 мас. % Re в пересчете на металл).
Пример 7. Синтез расплава проводили в электрохимической ячейке. В качестве электролитов использовали: анолит – CsCl-KCl-NaCl; католит – PbCl2. Процесс проводили при температуре 700℃, в течение 9 часов. Под действием электрического тока величиной 5 А проходило растворение рения, в результате, которого был получен электролит состава CsCl-KCl-NaCl, содержащий Cs2ReCl6 (6,5 мас. % Re в пересчете на металл).
Таким образом, полученные экспериментальные данные подтверждают возможность достижения технического результата совокупностью существенных признаков заявленной группы изобретений. Группа изобретений пригодна для синтеза электролитов для получения рения, при этом схема способа и использование единой ячейки позволяют избежать использования газообразного хлора. Для функционирования электрохимической системы необходимо и достаточно только одной печи против двух по способу /1/. Это существенно снижает экологическую и энергетическую нагрузку. Существенно упрощается аппаратурное оформление процесса, и появляется возможности улучшить экономические показатели процесса.
Источники: 1. Температура ликвидуса и электропроводность расплавленной эвтектики CsCl-KCl-NaCl, содержащей ReCl4 (Liquidus temperature and electrical conductivity of molten eutectic CsCl-NaCl-KCl containing ReCl4) // J. Chem. Eng. Data. – 2019. – № 64. – P. 567–573.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭЛЕКТРОЛИТИЧЕСКОГО СИНТЕЗА ОСАДКОВ КРЕМНИЯ С РАЗВИТОЙ ПОВЕРХНОСТЬЮ ИЗ РАСПЛАВЛЕННЫХ СОЛЕЙ | 2024 |
|
RU2840651C1 |
| ЭЛЕКТРОЛИЗЕР ДЛЯ ПОЛУЧЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ | 1984 |
|
SU1840854A1 |
| Способ регенерации хлоридного электролита при электрохимической переработке отработавшего ядерного топлива | 2016 |
|
RU2647125C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ КАРБИДА ВОЛЬФРАМА С ПЛАТИНОЙ | 2011 |
|
RU2478142C1 |
| Способ электроосаждения сплошных осадков кремния из расплавленных солей | 2022 |
|
RU2795477C1 |
| Способ извлечения циркония из облученных циркониевых материалов для снижения объема высокоактивных радиоактивных отходов | 2022 |
|
RU2804570C1 |
| Способ электролитического получения кремния из расплавленных солей | 2020 |
|
RU2751201C1 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ГАДОЛИНИЯ | 2012 |
|
RU2507314C1 |
| ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО ПОРОШКА ГЕКСАБОРИДА ЦЕРИЯ | 2011 |
|
RU2466090C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ ПОРОШКА ИРИДИЯ С УДЕЛЬНОЙ ПОВЕРХНОСТЬЮ БОЛЕЕ 5 м/г | 2015 |
|
RU2600305C1 |

Изобретение относится к синтезу электролитов для получения покрытий и изделий из рения методом высокотемпературной гальванопластики в расплавах солей. Электрохимическая ячейка для проведения синтеза расплава CsCl-KCl-NaCl-Cs2ReCl6 состоит из анодного и катодного узлов, которые разделены между собой неэлектропроводящей диафрагмой и помещены в герметизируемую кварцевую реторту, при этом электрохимическая ячейка выполнена в виде стакана с крышкой, в которой установлен первый токоподвод, а через отверстие в центре крышки подведен второй токоподвод, причем в стакан помещена кварцевая труба, полость внутри которой разделена диафрагмой, под диафрагмой размещается католит, а над ней - анолит и металлический рений, закрепляемый на токопроводящем стержне, который установлен в размещенной в отверстии крышки стакана кварцевой трубке и соединен со вторым токоподводом. Техническим результатом является упрощение аппаратурного оформления процесса. 2 н.п. ф-лы, 2 ил.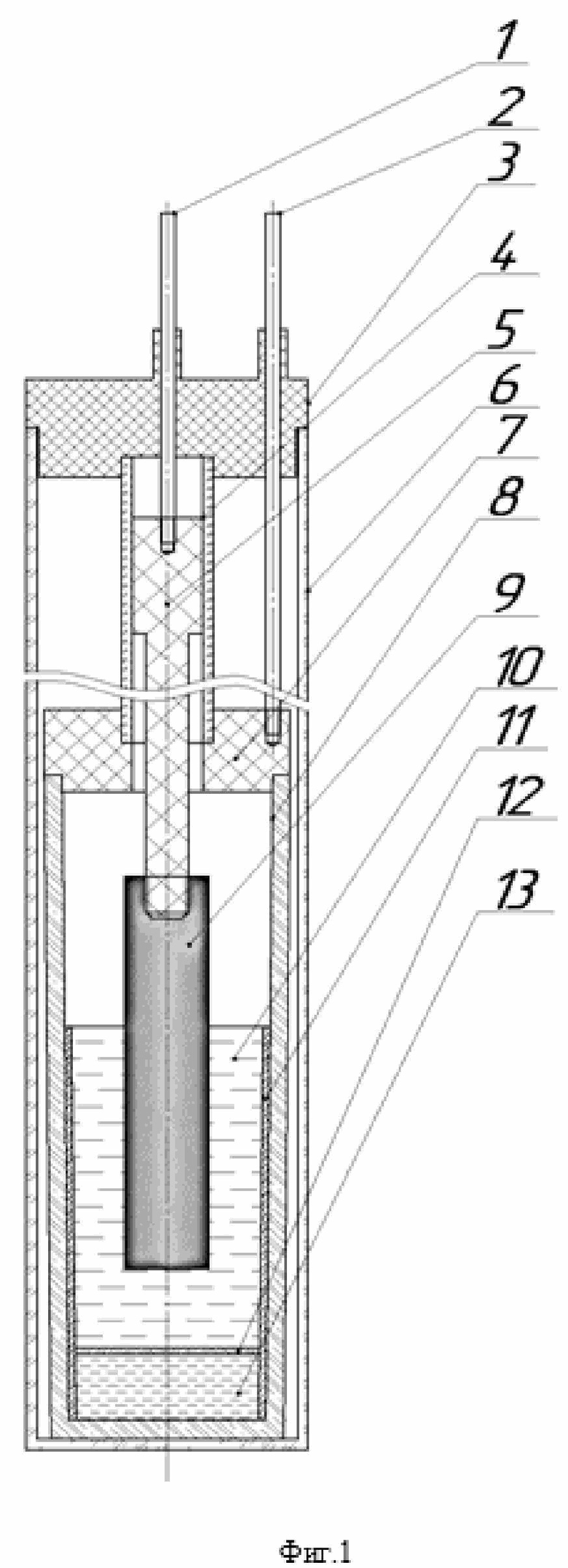
1. Электрохимическая ячейка для проведения синтеза расплава CsCl-KCl-NaCl-Cs2ReCl6, состоящая из анодного и катодного узлов, которые разделены между собой неэлектропроводящей диафрагмой и помещены в герметизируемую кварцевую реторту, характеризующаяся тем, что выполнена в виде стакана с крышкой, в которой установлен первый токоподвод, а через отверстие в центре крышки подведен второй токоподвод, причем в стакан помещена кварцевая труба, полость внутри которой разделена диафрагмой, под диафрагмой размещается католит, а над ней - анолит и металлический рений, закрепляемый на токопроводящем стержне, который установлен в размещенной в отверстии крышки стакана кварцевой трубке и соединен со вторым токоподводом.
2. Способ синтеза электролита состава CsCl-KCl-NaCl-Cs2ReCl6, 5–11 мас. % Cs2ReCl6 в пересчете на металл Re, характеризующийся проведением процесса электрохимического растворения рения и катодного восстановления ионов свинца под действием постоянного тока величиной 1,5–5 А при температуре процесса 600 или 700°С.
| ALEXEY RUDENKO, ANDREY ISAKOV, ALEXEY APISAROV, ALEXANDER CHERNYSHEV, OLGA TKACHEVA, AND YURII ZAIKOV "LIQUIDUS TEMPERATURE AND ELECTRICAL CONDUCTIVITY OF MOLTEN EUTECTIC CSCL-NACL-KCL CONTAINING RECL4", J | |||
| CHEM | |||
| ENG | |||
| DATA, N 64, PP | |||
| ДРОВОПИЛЬНО-ДРОВОКОЛЬНОЕ УСТРОЙСТВО | 1923 |
|
SU567A1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКО- И НАНОДИСПЕРСНОГО ПОРОШКА МЕТАЛЛОВ ИЛИ СПЛАВОВ | 2009 |
|
RU2423557C2 |
| WO 2016018433 A1, 04.02.2016 | |||
| JP 5719972 B2, 20.05.2015 | |||
| Безопасное приспособление для пуска ровничных и ленточных машин | 1930 |
|
SU21008A1 |
Авторы
Даты
2021-10-05—Публикация
2019-12-26—Подача