Область изобретения
Изобретение относится к медицине, в частности к фармакологии, и касается применения гексаметилендиамид бис-(-N-гексаноил-L-серил-L-лизина) (соединение ГТС-201) в качестве анальгетического, анксиолитического и антиаддиктивного средства.
Уровень техники
Нейротрофины принадлежат к семейству ростовых факторов, играющих важную роль в регуляции выживаемости, росте и дифференцировке нейронов (Davies, A.M. J. Neurobiol. 1994; 25:1334-1348; Snider W.D. Cell. 1994; 77:627-638), некоторые из которых являются мощными модуляторами синаптической передачи (Berninger В. and Poo M. Curr. Opin.Neurobiol. 1996; 6:324-330; Lewin G.R. and Barde Y.-A. Ann. Rev. Neurosci. 1996; 19:289-317). Среди членов семейства нейротрофинов выделяют мозговой нейротрофический фактор (brain-derived neurotrophic factor, BDNF), белок 12,4 кДа, взаимодействующий с тропомиозиновым тирозинкиназным рецептором В (TrkB) с последующей инициацией нисходящей сигнализации через митоген-активируемую протеинкиназу (MAPK), фосфолипазу Сγ (PLCγ) и фосфоинозитол 3-киназу (PI3K) (Kaplan D.R. and Miller F.D. Curr. Opin. Cell Biol. 1997; 9:213-221; Huang EJ, Reichardt LF Annu Rev Biochem. 2003; 72:609-42).
Полагают, что BDNF может служить медиатором, а не просто модулятором синаптической связи (Park H, Poo MM Nat Rev Neurosci. 2013; 14(1):7-23). Кроме того, BDNF и нейромедиаторные сигнальные каскады могут действовать в тесной взаимосвязи для оказания непосредственного влияния на функции синаптической пластичности (Фиг. 1). Основным источником BDNF в головном мозге является возбуждающий глутаматергический синапс, основной синапс синаптической пластичности, обучения и памяти. Во время вызывающей пластичность нейрональной активности BDNF и глутамат высвобождаются в синапсах, при этом секреция BDNF происходит более медленно, чем высвобождение глутамата. BDNF связывается со своим рецептором TrkB для активации модуляторных сигнальных каскадов. В пресинаптических окончаниях BDNF-TrkB усиливает высвобождение нейромедиаторов. На постсинаптических мембранах сигнализация BDNF/TrkB увеличивает функцию или вероятность открытия ионотропных глутаматных рецепторов. BDNF как медиатор может непосредственно влиять на поздние эффекты синаптической пластичности, например, на синтез белка или транскрипцию генов.
Специфическая интерференция с передачей сигналов, связанных с BDNF, сегодня рассматривается как ведущая стратегия стимуляции нейрональной пластичности для лечения неврологических и психиатрических нарушений (Nagahara АН, Tuszynski MH Nat Rev Drug Discov. 2011; 10(3):209-19).
Анализ научной литературы свидетельствует о влиянии BDNF на активность ноцицептивной системы на спинальном и супраспинальном уровнях (Malcangio M. and Lessmann V. Trends Pharmacol. Sci. 2003; 24:116-121; Pezet S. and McMahon S.B. Annu. Rev. Neurosci. 2006; 29: 507-538). Наличие специфических антител и современные технологии позволили определить локализацию и распределение BDNF и его высокоаффинного рецептора в центральных и периферических нейронах. Синтез и последующий антероградный аксональный транспорт BDNF и pro-BDNF неоднократно зафиксированы в нейронах. Так, центральные нейроны, синтезирующие и обеспечивающие транспортировку BDNF, найдены в коре, гиппокампе и голубом пятне (Altar С.А. et al. Nature. 1997; 389: 856-860; Conner, J.M. et al. J. Neurosci. 1997; 17: 2295-2313). Нейроны всех трех основных нисходящих путей, связанные с супраспинальной модуляцией ноцицептивной реакции, задействованы в экспрессии BDNF (Akbarian S.et al. J. Neurosci. 2002; 22: 4153-4162; Conner, J.M. et al. J. Neurosci. 1997; 17: 2295-2313; Madhav T.R. et al. Brain Res. Mol. Brain Res. 2001; 93:56-63.). Следует отметить, что практически все супраспинальные области, связанные с ноцицепцией, содержат TrkB-экспрессирующие нейроны, включая центры в таламусе, ретикулярной формации, гипоталамусе, парабрахиальном ядре (Arancibia S. et al. Neuroscience. 2007; 146: 864-873; Guo W. et al. J. Neurosci. 2006; 26: 126-137; Renn C.L. et al. Neuroreport. 2006; 17: 1175-1179; Silhol M. et al. Neuroscience. 2005; 132:613-624), а также в интегративных центрах коры (Bruns М.В. and Miller M.W. Exp. Neurol. 2007; 204: 680-692). Основополагающая статья Kafitz et al. (1999) была одной из первых, в которых показано, что BDNF возбуждает нейроны в гиппокампе, коре и мозжечке так же быстро, как и нейромедиатор глутамат (Kafitz K.W. et al. Nature. 1999; 401: 918-921). Хотя BDNF и TrkB были обнаружены в нескольких областях мозга, участвующих в ноцицепции, функциональная роль нейротрофина в модуляции боли на супраспинальном уровне еще слабо изучена.
Согласно ранним экспериментальным исследованиям, анальгетический эффект наблюдался при непосредственном введении BDNF в средний мозг, близко к околоводопроводному серому веществу (PAG) и dorsal raphe nuclei (DRNi), когда нейротрофин вызывал снижение реакции на термические и химические (формалин) раздражители, что сопровождалось повышением уровня ряда нейротрансмиттеров, включая эндогенные опиоиды, в головном и спинном мозге. Усиление активности серотонинергической системы позволило выдвинуть предположение о влиянии BDNF на синтез серотонина (Siuciak J.A. et al. Brain Res. 1994; 633: 326-330; Siuciak J.A. et al. Eur. J. Neurosci. 1995; 7: 663-670; Siuciak J.A. et al. J. Neurosci. Res. 1998; 52: 149-158). В соответствии с этими результатами, Frank et al. (1997) показали, что непрерывная инфузия высоких доз BDNF на уровне PAG и DRNi вызывала анальгезию, увеличивая латентный период реакции отдергивания хвоста в тесте «tail-flick» в течение 24 часов, при этом уровень белка TrkB, но не мРНК, снижался в месте инфузии после 6 и 12 дней введения BDNF без ослабления обезболивающего действия нейротрофина (Frank L. et al. Exp.Neurol. 1997; 145: 62-70). Выраженное антиноцицептивное действие BDNF при термической стимуляции ноцицепторов зарегистрировано после однократного внутримозгового введения нейротрофина (Cirulli F. et al. Neurosci. Lett. 2000; 287: 207).
Участие эндогенного BDNF в формировании ответа на острую боль остается спорным. Несмотря на то, что некоторые исследования показали изменение ноцицептивного поведения путем нейтрализации BDNF в dorsal horn, высокочастотный паттерн стимуляции, необходимый для высвобождения нейротрофина, противоречит роли BDNF в формировании ноцицептивной реакции. BDNF при интратекальном введении в одних случаях вызывает проноцицептивный ответ, в других - антиноцицептивный эффект (таблица 1).
Это несоответствие может объясняться разными использованными дозами BDNF и методиками. BDNF в высоких дозах, по-видимому, оказывает преимущественно антиноцицептивный эффект (Groth R. and Aanonsen L. Pain. 2002; 100:171-181; Guo W. et al. J.Neurosci. 2006; 26: 126-137), благодаря взаимодействию с низко аффинными сайтами и/или активации различных внутриклеточных путей.



В последние годы наблюдается растущий интерес к роли BDNF-сигналов в регуляции страха и тревоги, принимая во внимание значение в развитии тревожных расстройств ассоциативного синаптического обучения, возникающего при условно-рефлекторном формировании тревожной реакции (Mineka S, Oehlberg K. Acta Psychol (Amst). 2008; 127(3):567-80).
BDNF является одной из наиболее перспективных молекул для понимания неблагоприятного синаптического «обучения», лежащего в основе развития тревожных расстройств (Lonsdorf ТВ, Kalisch R Transl Psychiatry. 2011; 1():е41), а также важным фактором стресс-устойчивости. Так, например, мыши с вариантом полиморфизма BDNF Val66Met, который связан с гиперреактивностью гипоталамо-гипофизарно-надпочечниковой системы у людей и обнаружен у пациентов с депрессией, демонстрируют уязвимость к стрессу, о чем свидетельствует повышенная тревожность и депрессивно-подобное поведение в ответ на повторяющийся сдерживающий стресс (Yu H. et al., J Neurosci. 2012. 32:4092-4101). Более низкие мРНК BDNF и содержание белка зарегистрированы в гиппокампе у чувствительных к стрессу мышей по сравнению с устойчивыми к стрессу животными (Ieraci А. et al. Neural plasticity. 2016. 6212983). В исследовании Miao Z. et al (2018) установлено, что при моделировании психологического социального стресса у беременных самок мышей формируется тревожно-депрессивное поведение, которое коррелирует со снижением экспрессии BDNF в гиппокампе и префронтальной коре (Miao Z. et al. Mol Neurobiol. 2018;55(2):1097-1111). При рассмотрении взаимосвязи между снижением функции BDNF в гиппокампе и повышенной восприимчивостью к эмоционально-стрессовой реакции в пожилом возрасте группой ученых была выдвинута гипотеза, согласно которой сокращение BDNF наряду со старением индуцирует дисфункцию ГАМК-ергической нейропластичности, а применение экзогенного BDNF может обратить вспять тревожные расстройства, обусловленные процессом естественного старения, восстанавливая ГАМК-нейропластичность (Zhu G. et al. Behav Neurosci. 2019;133(2):212-224). Таким образом, многочисленные экспериментальные исследования свидетельствует о том, что снижение уровня BDNF провоцирует формирование тревожного поведения.
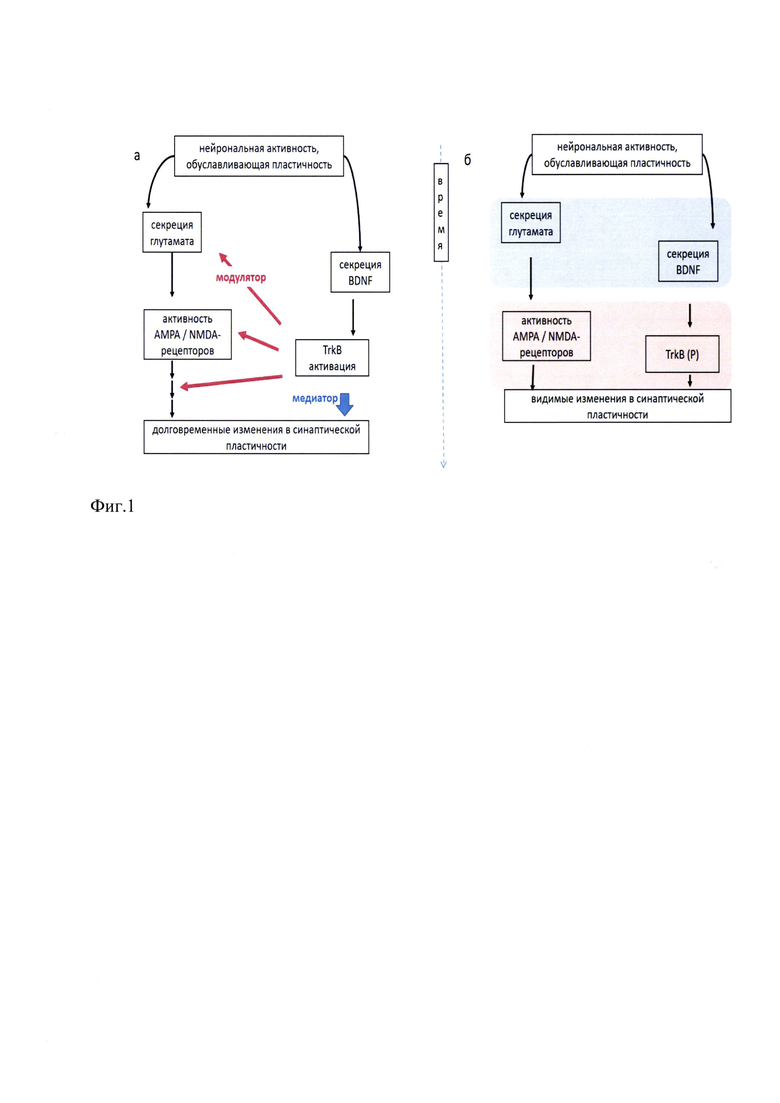
Одним из механизмов, иллюстрирующих связь между эмоционально-стрессовыми расстройствами и алкоголизмом, является модификация синаптической пластичности через нейроадаптацию (Фиг. 2).
Исследования показали, что воздействие этанола и связанные с ним симптомы отмены могут приводить к структурным и функциональным изменениям на синаптическом уровне в различных областях мозга, а также в нейрональных культурах (Carpenter-Hyland, Е.Р., and Chandler, l.J. Eur. J. Neurosci., 2006;24(12):3496-3506, Pandey et al., J.Neurosci. 2008; 28(10):2589-2600). Снижение нейротрофической активности гиппокампа вследствие хронического воздействия алкоголя, впервые показанное в работе Walker DW et al., (1992), позволило предположить взаимосвязь между функциональной активностью BDNF и алкоголем в мозге взрослого человека. Нейротрофический фактор головного мозга в дорсальном стриатуме был идентифицирован как центральный медиатор гомеостатического механизма, который активируется при остром воздействии алкоголя (этанола) и способствует снижению чувствительности грызунов к алкоголь-индуцированному поведению. Таким образом, этанол при однократном введении и хроническое потребление алкоголя в умеренных дозах, недостаточных для устойчивого повышения уровня алкоголя в крови, связанного с интоксикацией (>80 мг / дл) (Dole VP and Gentry RT. Proc Natl Acad Sci USA. 1984; 81:3543-3546), повышают BDNF в стриатуме, что, вероятно, приводит к высвобождению BDNF и TrkB-опосредованной активации нижележащих сигнальных путей. Экспериментальные данные демонстрируют, что BDNF в дорсолатеральном стриатуме «управляет» алкогольной мотивацией через TrkB-опосредованную активацию MAPK / ERK1/2 сигнальный путь, что приводит к усилению регуляции нисходящих эффекторных белков, таких как динорфин и рецептор дофамина D3, для поддержания умеренного уровня потребления алкоголя (Logrip ML et al. FASEB J. 2008; 22:2393-2404; Jeanblanc J, et al. J Neurosci. 2006; 26:1457-1464).
Напротив, интенсивное длительное воздействие этанола приводит к нарушению регуляции опосредованного BDNF защитного механизма, сопровождающегося повышенным потреблением этанола. Так, в работе Logrip ML et al. (2009) показано, что BDNF-путь, который активируется после однократного приема этанола, нарушается (ослабевает) к концу 6 недели алкоголизации и не восстанавливает свою защитную функцию после 2-х недельного периода алкогольной депривации (Logrip ML et al. J Neurochem. 2009 Jun;109(5):1459-68). Врожденно низкая экспрессия BDNF может располагать крыс к более высокому потреблению алкоголя, так как предпочитающие алкоголь крысы линии P демонстрируют снижение уровня белка BDNF в прилежащем ядре относительно малопьющих крыс линии NP (Yan QS et al. Brain Res. 2005;1035(2):215-8). Модуляция потребления алкоголя в условиях повышенной и пониженной экспрессии BDNF выявила роль BDNF в снижении алкогольной мотивации. Например, мыши, экспрессирующие половину нормального уровня BDNF в головном мозге, демонстрируют повышенное потребление алкоголя при неограниченном свободном выборе между этанолом и водой (Hensler JG et al. J Neurochem. 2003; 85:1139-1147) и после периода депривации (McGough NN, et al. J Neurosci. 2004; 24:10542-10552), а также повышенную алкоголь-индуцированную сенсибилизацию и выраженное предпочтение места, ассоциированное с действием этанола по сравнению с мышами дикого типа (McGough NN, et al. J Neurosci. 2004; 24:10542-10552).
Полученные результаты дают основание полагать, что устойчивость нарушенной BDNF-сигнализации может быть причиной регидности аддиктивного поведения, то есть продолжительный неограниченный доступ к алкоголю предполагает возможную потерю защитного механизма, а отсутствие индуцированной алкоголем экспрессии BDNF в дорсальном стриатуме наряду со снижением BDNF в коре и гиппокампе способствуют усилению алкогольной мотивации. Нельзя исключить, что в этих условиях регуляцию функциональной активности BDNF через внутриклеточный ERK1/2 сигнальный путь следует учитывать при выявлении новых кандидатов для разработки лекарственных средств для лечения аддиктивных расстройств, связанных с употреблением алкоголя.
В НИИ фармакологии имени В.В. Закусова сконструирован и синтезирован димерный дипептидный миметик 2-й петли BDNF гексаметилендиамид бис-(-N-гексаноил-L-серил-L-лизина), или соединение ГТС-201, которое проявляло нейропротективные свойства (Gudasheva Т.А. et al. Curr. Pharm. Design. 2019; 25:729-737) и активировало MAPK/ERK сигнальный путь при взаимодействии с TrkB рецептором (Логвинов И.О. и др. Экспериментальная и клиническая фармакология. 2018; 81(S): 145-146) в исследованиях in vitro.
В отличие от дипептидного миметика 4-й петли BDNF (ГСБ-106), обладающего антидепрессивной активностью, ГТС-201 в диапазоне доз 0.1-5.0 мг/кг при внутрибрюшинном введении не проявлял активности в тесте Порсолта, позволяющем выявить антидепрессивное действие на этапе скрининга (Сазонова Н.М. и др. Химико-фармацевтический журнал. 2018; 52(9): 14-21).
В настоящее время информация об анальгетических, анксиолитических и антиаддиктивных свойствах гексаметилендиамид бис-(-N-гексаноил-L-серил-L-лизина) отсутствует.
Сущность изобретения состоит в применении гексаметилендиамид бис-(-N-гексаноил-L-серил-L-лизина) в качестве анальгетического, анксиолитического и антиаддиктивного средства.
Цель изобретения - разработка новых средств с анальгетическими, анксиолитическими и антиаддиктивными свойствами. Эта цель была достигнута путем исследования фармакологических эффектов ГТС-201 в опытах in vivo в тестах «приподнятый крестообразный лабиринт», «горячая пластина», «этаноловый наркоз», влияние на этанол-индуцированное изменение двигательной активности и сформированную алкогольную мотивацию.
Техническим результатом изобретения стало расширение арсенала средств, одновременно обладающих уникальным фармакологическим профилем, включающим анальгетический, анксиолитический и антиаддиктивный эффекты.
Животные. Эксперименты выполнены на белых беспородных мышах-самцах CD-1 (n=112) с массой тела 18-20 г., инбредных мышах-самцах линии C57Bl/6 (n=105) и BALB/c (n=14) с массой тела 18-22 г и беспородных крысах-самках с массой тела 500-560 г в активной фазе эксперимента (n=81), подвергнутых алкоголизации в условиях свободного выбора между раствором этанола 10 vol % и питьевой водой (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Мышей содержали по 15 особей в клетке стандарта Т/3, крыс - в индивидуальных клетках стандарта Т/3 в условиях вивария ФГБНУ «НИИ фармакологии имени В.В. Закусова» (температура 21-23°С, относительная влажность воздуха 40-60%) при естественной освещенности и свободном доступе к воде и брикетированному корму в течение 10 суток до начала тестирования. Организация и проведение работ осуществлялись в соответствии с приказом Минздрава России №199 от 01 апреля 2016 года «Об утверждении правил надлежащей лабораторной практики». Животные содержались в соответствии с СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 29 августа 2014 г. № 51. Проведение экспериментов одобрено Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Препараты. ГТС-201 (субстанция, синтезированная в ФГБНУ «НИИ фармакологии имени В.В. Закусова»), который растворяли в воде для инъекций в дозах 0.1-5.0 мг/кг, внутрибрюшинно (в/б), вводили из расчета 0,1 мл/10 г (для мышей) и 0.1 мл/100 г (для крыс) веса животного… Животные контрольных групп получали воду для инъекций. Препараты сравнения: наркотический анальгетик морфина гидрохлорид 3.0 мг/кг, подкожно (п/к), бензодиазепиновый анксиолитик феназепам 0.5 мг/кг, интрагастрально, бензодиазепиновы анксиолитик диазепам 1.5 мг/кг, в/б, неселективный блокатор опиоидных рецепторов налоксон 1.0 мг/кг, в/б. Диазепам (Sigma) и феназепам в виде твердых субстанций сначала растворяли в 1-2 к.Твин-80 и далее в воде для инъекций. Налоксон (Sigma) растворяли в воде для инъекций
Методики
Тест «горячая пластина» использовали для оценки ноцицептивной реакции. С помощью анальгезиметра «Ugo Basile» (Италия) регистрировали латентное время реакции (лизание задней лапы или прыжок). За 1-2 ч до начала опыта отбирали мышей-самцов линии C57Bl/6 на основе базовой реактивности в условиях данной экспериментальной модели, исключая мышей, остававшихся на нагретой до 55±0.5°С пластине дольше 10 с. Латентный период в 20 с (максимальное время экспозиции) расценивали как 100% анальгезию. Фиксировали время появления реакции у мышей через 30, 60, 90 и 120 мин после однократного введения изучаемых препаратов. Полученные результаты выражали в виде максимально возможного эффекта (МВЭ) в %. МВЭ=(латентный период реакции после введения препарата минус фоновый латентный период реакции)/(максимальное время экспозиции минус фоновый латентный период реакции) X 100% (Le Bars D. et al. Pharmacol Rev. 2001;53(4):597-652).
Для определения анксиолитической активности использовался стандартный тест для определения уровня тревожности у грызунов «приподнятый крестообразный лабиринт» (ПКЛ), представляющий собой приподнятую на над уровнем пола площадку с рукавами, два из которых закрыты стенками и два оставшихся - открытые без перегородок. Исследуемые вещества вводили за 30 минут до начала тестирования. Мышей-самцов CD-1 помещали в центральную часть ПКЛ и фиксировали: 1) количество выходов в открытые (ОР) и закрытые рукава (ЗР), 2) время нахождения в открытых рукавах. Время экспозиции 5 минут. После эксперимента для каждого животного рассчитывали отношение времени, проведенного в открытых рукавах, по отношению к общему времени эксперимента, равному 300 секундам, в %. Увеличение времени нахождения в открытых рукавах при отсутствии изменений двигательной активности (общее число заходов в открытые и закрытые рукава) рассматривали как проявление анксиолитического эффекта (Walf АА, Frye СА. Nat Protoc. 2007;2(2):322-8: Колик Л.Г. и др. Бюллетень экспериментальной биологии и медицины. 2013;155(2): 163-166).
Тест «этаноловый наркоз». Мышам-самцам линии CD-1 вводили 25 vol % раствор этанола в тест-дозе 5.5 г/кг, в/б, вызывающей развитие алкогольного наркоза, который сохраняется в течение 1-2 часов, что позволяет выявить как ослабление, так и усиление действия этанола (Анохина И.П., Колик Л.Г. В кн.: Руководство по проведению доклинических исследований лекарственных средств ФГБУ «НЦЭСМП» Минздравсоцразвития России. Москва, 2012. С. 310-333). Мышей размещали на ровной горизонтальной поверхности и регистрировали время наступления и окончания алкогольного сна по принятию «бокового положения» и, соответственно, самостоятельному устойчивому выходу из него. Изучаемое вещество вводили после тест-дозы этанола через 15 минут. Контрольной группе животных вводили раствор этанола в тест-дозе в/б и изомерное количество растворителя, используемого для изучаемого вещества. Для приготовления раствора этанола использовали воду дистиллированную, для растворения изучаемого соединения ГТС-201 использовали воду для инъекций. В состав каждой группы входят не менее 10-12 особей. Данный тест является чувствительным к температуре окружающей среды и физиологическому состоянию животных.
Спонтанную двигательную активность мышей оценивали в актометре Opto-Varimex 4 (Columbus Instruments, США) (Besusso D. et al. Nat Commun. 2013;4:2031). Установка представляет собой квадратную плексигласовую арену со сторонами 42×42 см и высотой 20 см. По периметру арены расположены четыре пары чувствительных оптоэлектронных датчиков (λ=875 нм) на высоте 2 см от пола, автоматически регистрирующие параметры двигательной активности животных и передающие их на блок управления, соединенный с компьютером. Горизонтальную активность животных регистрировали непрерывно в течение 20 минут. Выбор времени экспозиции животных основан на данных литературы о действии этанола (2 г/кг, 20 vol % р-р) (Melon L.C. and Boehm S.L. Alcohol Clin. Exp Res. 2011; 35(7): 1351-1360). Исследуемое вещество вводили за 30 минут до этанола.
Моделирование хронической алкогольной интоксикации осуществляли на беспородных белых крысах-самках, которые содержались в индивидуальных клетках с предоставлением 10% раствора этанола и питьевой воды в течение 24 недель, крысы демонстрировали выраженное предпочтение к этанолу по показателю алкоголь-депривационного эффекта (0.99±0.06 г/кг в пересчете на этанол) и в условиях свободного выбора между этанолом и водой (5.05±0.04 г/кг в пересчете на этанол) (Vetter CS et al. Alcohol Clin Exp Res. 2007 Jul;31(7):1159-68). Исследуемые вещества вводили за 30 минут до предъявления 2-х бутылочной пробы в тесте на АДЭ. Уровень сформированной алкогольной мотивации у крыс-самок определяли через 48 ч после отмены этанола с помощью теста «алкоголь-депривационный эффект», согласно ранее описанной методике. В исследовании на предпочтение этанола при субхроническом действии миметика 2-й петли BDNF у алкоголизированных самок с сильной алкогольной мотивацией исследуемые вещества вводили один раз в сутки в течение 10 дней. (Колик Л.Г. и др. Бюллетень экспериментальной биологии и медицины. 2014; 157(1):61-65; Надорова А.В. и др. Нейрохимия. 2014; 31(2): 147-152).
Статистика. Обработку полученных результатов производили при помощи однофакторного дисперсионного анализа (ANOVA), дисперсионного анализа (ANOVA) для повторных измерений с последующим применением критерия Дункана, Т-критерия Стьюдента, Т-критерия для зависимых переменных. Критический уровень значимости α=0.05.
Пример 1. Оценка анальгетического действия ГТС-201 при термическом раздражении ноцицепторов
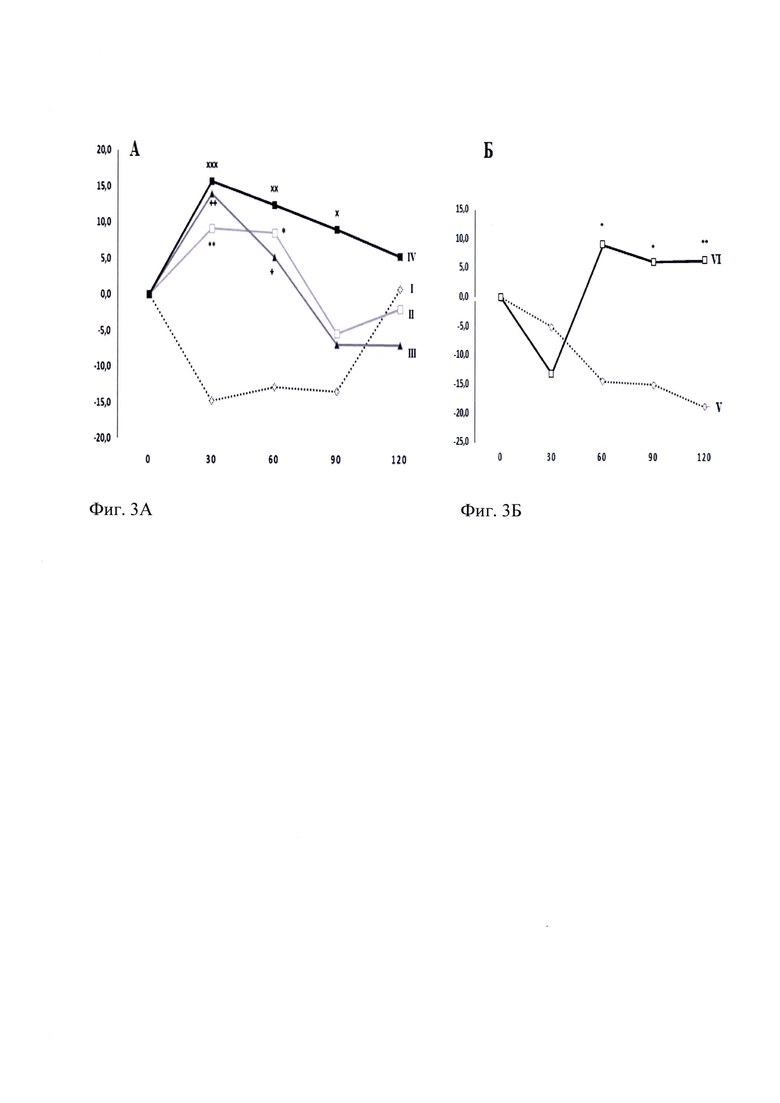
ГТС-201 в дозах 0.1 и 1.0 мг/кг увеличивал пороги ноцицептивной реакции с 30-й по 60-ю минуты тестирования (р<0.01 и р<0.05, соответственно), в дозе 5.0 мг/кг миметик 2-й петли BDNF увеличивал латентный период реакции на 30-й, 60-й и 90-й минутах после однократного введения по сравнению с контрольной группой (р<0.01, р<0.01, р<0.05 соответственно), что указывает на обезболивающее действие ГТС-201. На 120 мин наблюдения ГТС-201 ни в одной из изученных доз не проявлял антиноцицептивной активности (Фиг. 3А). По выраженности эффекта ГТС-201 был сопоставим с референтным препаратом морфином в дозе 3.0 мг/кг (Фиг. 3Б) через 60 и 90 мин после введения препаратов в тесте «горячая пластина», позволяющем оценить ноцицептивные реакции на супраспинальном уровне.
Пример 2. Оценка анксиолитического действия ГТС-201 в тесте «приподнятый крестообразный лабиринт»
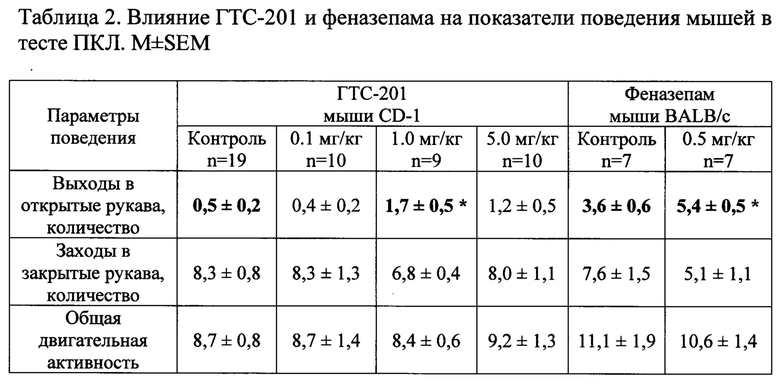
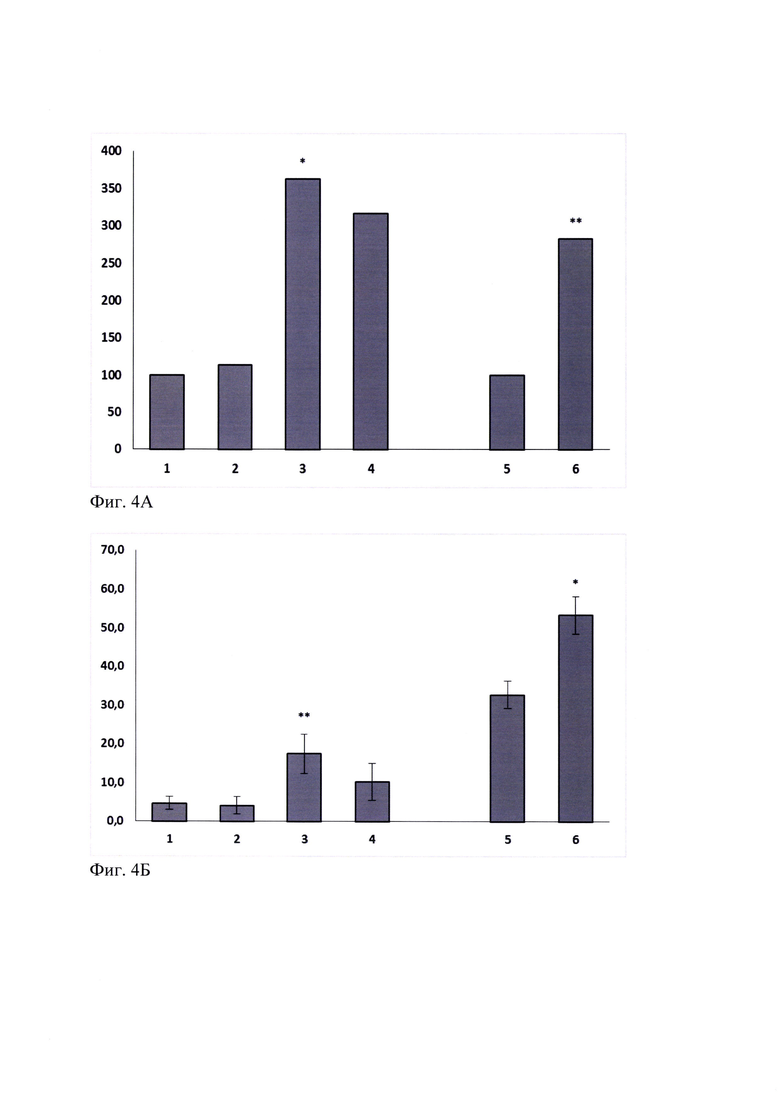
При оценке анксиолитической активности соединения ГТС-201 в диапазоне доз 0.1-5.0 мг/кг установлено, что миметик 2-й петли BDNF при однократном системном введении за 30 минут до тестирования в зависимой от дозы манере увеличивал число выходов в открытые рукава в эффективной дозе 1.0 мг/кг в 3.4 раза (р<0.05) и время, проведенное в открытых рукавах (р<0.05), не влияя на общую двигательную активность CD-1 мышей, что свидетельствует о противотревожном действии ГТС-201 (таблица 2, фиг. 4А, 4Б). При сопоставлении полученных данных с референтным препаратом из группы классических бензодиазепиновых транквилизаторов показано, что феназепам в анксиолитической дозе 0.5 мг/кг при пероральном введении за 60 мин до тестирования увеличивал время пребывания в открытых рукавах в 1.5 раза (р<0.05) по сравнению с соответствующей контрольной группой (таблица 2). Таким образом, по анксиолитической активности в тесте ПКЛ ГТС-201 в изученном диапазоне доз не уступает препарату сравнения.
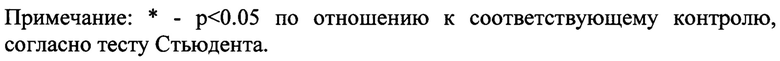
Пример 3. Оценка влияния ГТС-201 на продолжительность этанолового наркоза
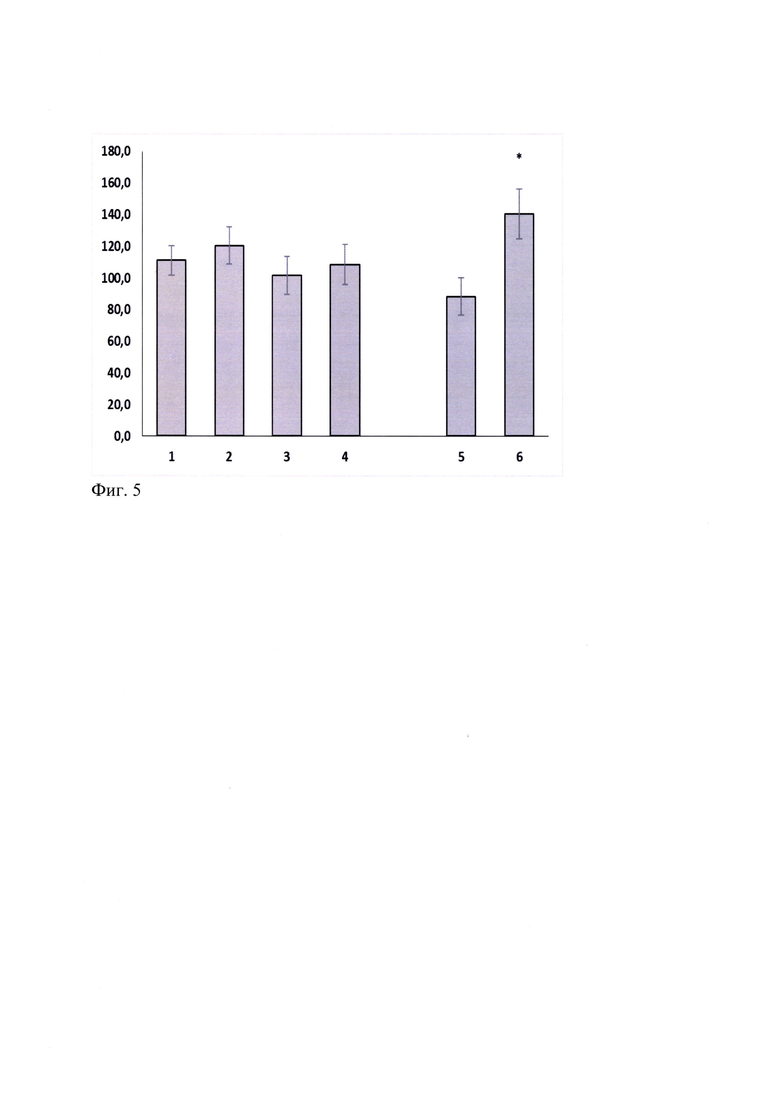
При оценке влияния ГТС-201 на острые эффекты этанола в тесте «этаноловый наркоз» у мышей CD-1 установлено отсутствие его влияния на продолжительность этанолового сна в отличие от бензодиазепинового анксиолитика диазепама, который статистически значимо (р<0.05) увеличивал время нахождения животных в «боковом положении» (Фиг. 5). Миметик 2-й петли BDNF в диапазоне доз 0.1-5.0 мг/кг при однократном системном введении за 30 мин до этанола не изменял продолжительность бокового положения у мышей CD-1, что позволяет исключить взаимодействие соединений с этанолом на фармакодинамическом уровне и продолжить исследование фармакологических свойств миметиков на моделях алкогольной зависимости (Фиг. 5).
Пример 4. Оценка влияния ГТС-201 на этанол-индуцированное угнетение двигательной активности
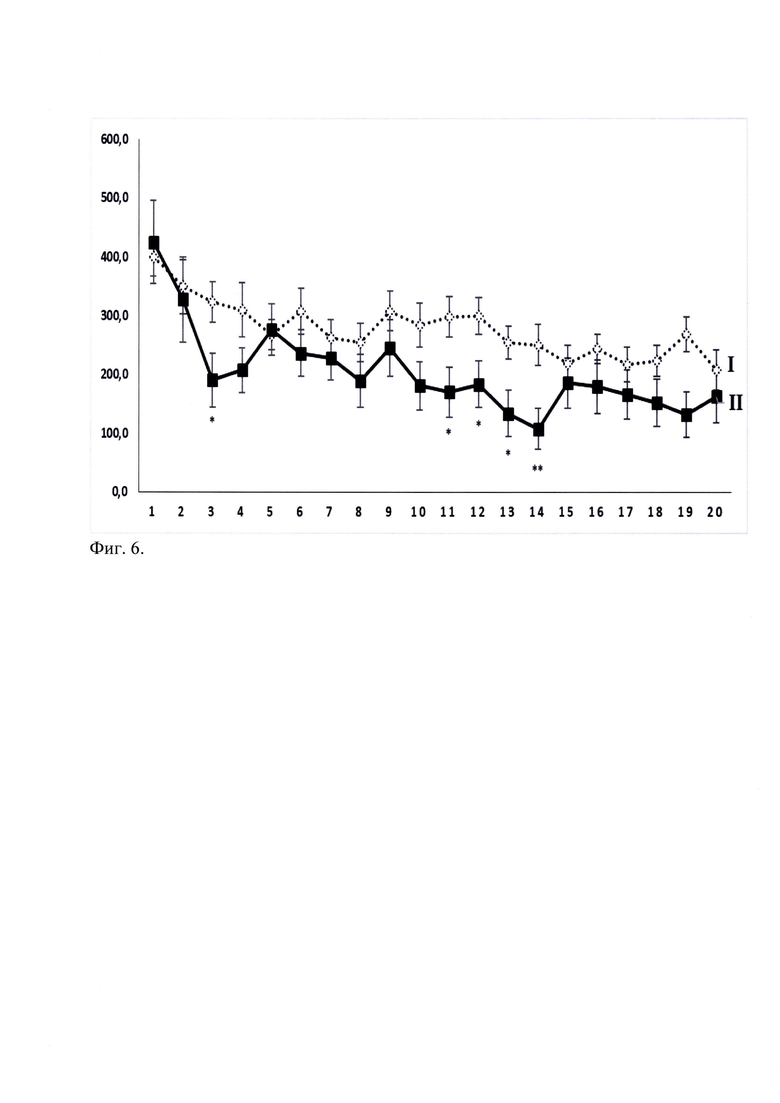
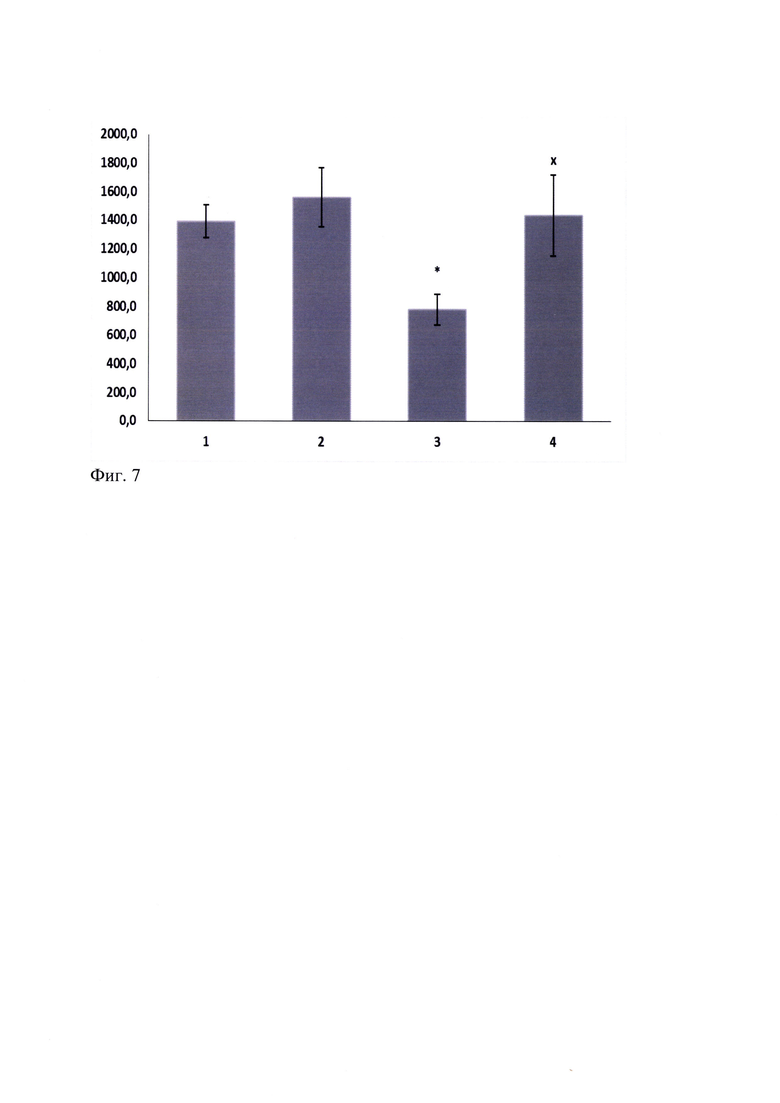
При оценке влияния этанола в дозе 2.0 г/кг при однократном внутрибрюшинном введении на двигательную активность мышей C57Bl/6 в актометре в течение 20 мин после введения показано, что с 11 по 14 мин наблюдения происходит статистически значимое снижение двигательной активности (Фиг. 4). В этот промежуток времени исследуемый миметик 2-й петли BDNF (ГТС-201) в дозе 5 мг/кг при введении за 30 мин до этанола статистически значимо (р<0.05) препятствовал этанол-индуцированному угнетению двигательной активности у мышей C57Bl/6 (Фиг. 7).
Пример 5. Оценка влияния ГТС-201 на алкоголь-депривационный эффект у хронически алкоголизированных в течение 24-х недель крыс
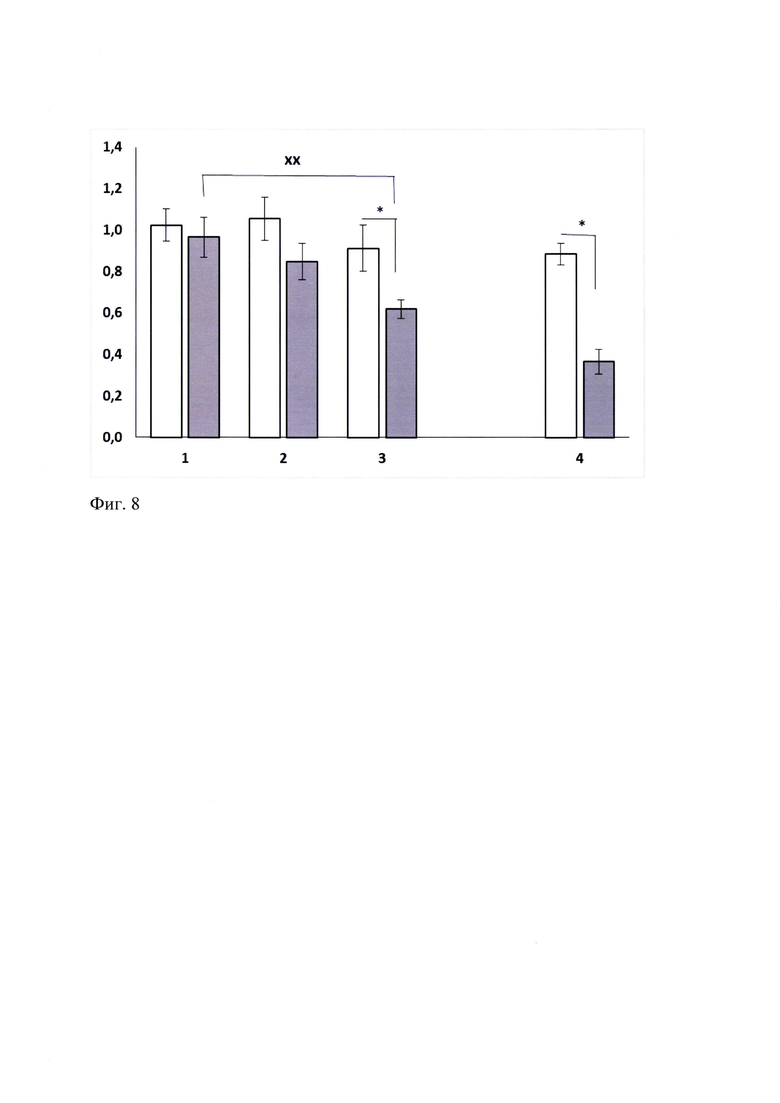
При оценке антиаддиктивного потенциала соединения ГТС-201 у самок крыс со сформированной алкогольной зависимостью в условиях добровольного потреблении 10% раствора этанола установлено, что миметик 2-й петли BDNF (ГТС-201) в дозе 5 мг/кг при однократном системном введении статистически значимо снижал уровень алкогольной мотивации во время предъявления 10% раствора этанола и питьевой воды после 48-и часов алкогольной депривации по сравнению с контрольной группой (р<0.01) и при сопоставлении с фоновым значением (р<0.05) (Фиг. 8). По выраженности эффекта ГТС-201 не уступал референтному препарату налоксону в дозе 1.0 мг/кг. Полученные данные свидетельствуют о способности ГТС-201 снижать подкрепляющее действие этанола в данных условиях моделирования состояния алкогольной зависимости.
Пример 6. Влияние ГТС-201 на сформированную алкогольную мотивацию
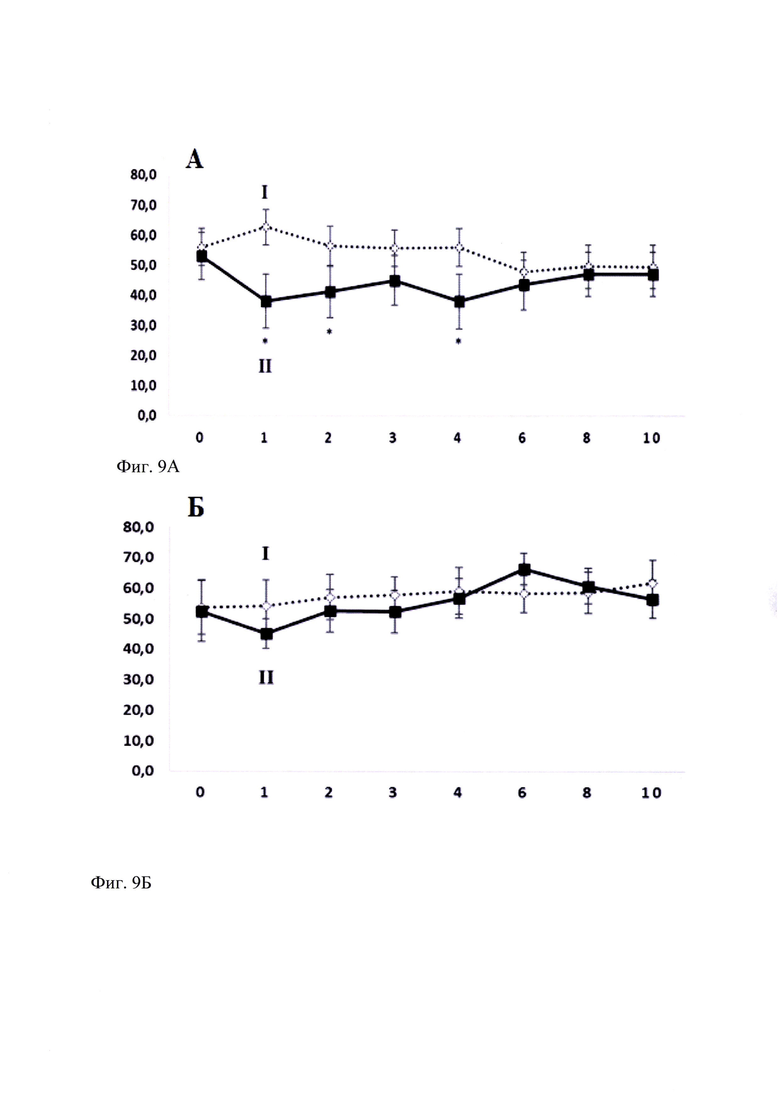
Миметик 2-й петли BDNF (ГТС-201) в эффективной дозе 5 мг/кг при субхроническом введении статистически значимо снижал предпочтение этанола с 1-го по 4-й дни введения при свободном доступе к раствору этанола и воде (Фиг. 9А), в отличие от налоксона, который в данных условиях эксперимента не проявлял антиаддиктивной активности, не снижая предпочтение к этанолу у крыс со сформированной зависимостью (Фиг. 9Б). Таким образом, полученные данные указывают на способность ГТС-201 ослаблять сформированную алкогольную мотивацию у крыс с высоким уровнем потребления этанола.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Общая схема сигнальных путей BDNF (с адаптацией Manju Sasi et al., Pflugers Arch. 2017; 469(5): 593-610).
Фиг. 2. Психиатрическая модель взаимосвязи между стрессом, тревогой и потреблением алкоголя и его модуляцией с помощью BDNF (с адаптацией Moonat S., Pandey SC. Alcohol Res. 2012;34(4):495-505).
Фиг. 3. Влияние ГТС-201 (А) и морфина (Б) на латентный период реакции мышей C57Bl/6 в тесте «горячая пластина».
3А.
По оси абсцисс - время развития эффекта (мин).
По оси ординат - максимально возможный эффект (МВЭ), %.
Экспериментальные группы:
I - «Контроль» - белый ромб, линия из точек;
II - "ГТС-201 0.1 мг/кг" - белый квадрат, светло-серая линия
III - "ГТС-201 1.0 мг/кг " - черный треугольник, темно-серая линия
IV - "ГТС-201 5.0 мг/кг " - черный квадрат, черная линия
ANOVA для повторных измерений: F(9, 105)=2,1532, р=0,03118
критерий Дункана:
* - р<0.05, ** - р<0.01 - статистически значимо по отношению к контролю для группы" ГТС-201 0.1";
+- р<0.05, ++-р<0.01 - статистически значимо по отношению к контролю для группы" ГТС-201 1.0";
х- р<0.05, хх- р<0.01, xxx- р<0.001 статистически значимо по отношению к контролю для группы 'ТТС-201 5.0".
3Б.
По оси абсцисс - время развития эффекта (мин).
По оси ординат - максимально возможный эффект (МВЭ), %.
Экспериментальные группы:
V - «Контроль» - белый ромб, линия из точек;
VI - "Морфин 3.0 мг/кг" - белый квадрат, черная линия
ANOVA для повторных измерений: F(3, 54)=6,9151, р=0,00050
критерий Дункана:
* - р<0.05, ** - р<0.01 - статистически значимо по отношению к контролю.
Фиг. 4А. Влияние ГТС-201 и феназепама на время, проведенное в открытых рукавах, у мышей в тесте «ПКЛ». M±SEM.
По оси абсцисс - экспериментальные группы.
Мыши CD-1: 1 - Контроль-1, 2 - ГТС-201 0.1 мг/кг, 3 - ГТС-201 1.0 мг/кг, 4 -ГТС-201 5.0 мг/кг;
Мыши BALB/c: 5 - Контроль-2, 6 - Феназепам 0.5 мг/кг.
По оси ординат - время, проведенное в открытых рукавах, в процентах от контроля;
* - р<0.05 по отношению к соответствующему контролю согласно критерию Стьюдента.
Фиг. 4Б. Влияние ГТС-201 и феназепама на выходы в открытые рукава ПКЛ у мышей. M±SEM.
По оси абсцисс - экспериментальные группы.
Мыши CD-1: 1 - Контроль, 2 - ГТС-201 0.1 мг/кг, 3 - ГТС-201 1.0 мг/кг, 4 -ГТС-201 5.0 мг/кг;
Мыши BALB/c: 5 - Контроль, 6 - Феназепам 0.5 мг/кг.По оси ординат - выходы в открытые рукава, %;
* - р<0.05 по отношению к соответствующему Контролю согласно критерию Стьюдента.
Фиг. 5. ГТС-201 в дозах 0.1, 1.0 и 5.0 мг/кг не влияют на продолжительность этанолового наркоза (25% р-р, 5.5 г/кг) беспородных мышей. M±SEM.
По оси абсцисс - Экспериментальные группы: 1 - «Контроль-1», 2 - "ГТС-201 0.1 мг/кг", 3 - ТТС-201 1.0 мг/кг ", 4 - "ГТС-201 5.0 мг/кг ", 5 - «Контроль-2», 6 - «Диазепам 1.5 мг/кг».
По оси ординат - продолжительность этанолового наркоза (мин).
* - р<0.05 по отношению к соответствующему Контролю. Тест Стьюдента.
Фиг. 6. Динамика изменения двигательной активности мышей С57 В1/6 при однократном введении этанола в дозе 2 г/кг. M±SEM.
По оси абсцисс - Время (мин);
По оси ординат - Пройденное расстояние (см).
Экспериментальные группы:
I - «Контроль» - белый ромб, линия из точек;
II - "Этанол 2 г/кг" - черный квадрат, черная линия
* - р<0.05 статистически значимо по отношению к соответствующей точке Контроля согласно критерию Стьюдента.
Фиг. 7. Влияние ГТС-201 (5.0 мг/кг) на восстановление двигательной активности у мышей линии C57Bl/6, сниженной под действием этанола (2 г/кг) с 10 по 14 минуту. M±SEM.
По оси абсцисс - Экспериментальные группы: 1 - «Контроль», 2 - «ГТС-201», 3 - «Этанол», 4 - «ГТС-201 + Этанол»; По оси ординат - Пройденное расстояние (см). ANOVA F(3, 43)=3,1154, р=0,03586
* - р<0.05 - статистически значимо по отношению к "Контролю"
x - р<0.05 - статистически значимо по отношению к группе "Этанол" согласно критерию Дункана.
Фиг. 8. Влияние ГТС-201 и налоксона при однократном введении на алкоголь-депривационный эффект у хронически алкоголизированных крыс. M±SEM.
По оси абсцисс - Экспериментальные группы: 1 - «Контроль», 2 - «ГТС-201 1.0 мг/кг», 3 - «ГТС-201 5.0 мг/кг», 4 - «Налоксон 1.0 мг/кг». По оси ординат - Алкоголь депривационный эффект (АДЭ), г/кг АДЭ (до опыта) - белый прямоугольник; АДЭ (опыт) - серый прямоугольник.
Однофакторный дисперсионный анализ ANOVA F(2, 25)=4,6500, р=0,01919
хх -р<0.05 согласно критерию Дункана
* - р<0.05 по отношению к соответствующему Контролю согласно Т-тесту для зависимых переменных.
Фиг. 9. Влияние ГТС-201 (А) и налоксона (Б) при субхроническом введении на предпочтение этанола у хронически алкоголизированных крыс. M±SEM.
9А.
По оси абсцисс - Дни эксперимента (сутки);
По оси ординат - Предпочтение этанола (%).
Экспериментальные группы:
I - «Контроль» - белый ромб, линия из точек;
II - "ГТС-201 5.0 мг/кг" - черный квадрат, черная линия
ANOVA для повторных измерений - F(7, 112)=2,7095, р=0,01241
* -р<0.05 по отношению к точке «фон» группы "ГТС-201 5 мг/кг" согласно критерию Дункана
9Б.
По оси абсцисс - Дни эксперимента (сутки);
По оси ординат - Предпочтение этанола (%).
Экспериментальные группы:
I - «Контроль» - белый ромб, линия из точек;
II - "Налоксон 1.0 мг/кг" - черный квадрат, черная линия
ANOVA для повторных измерений - F(7, 105)=1,0646, р=0,39150.
| название | год | авторы | номер документа |
|---|---|---|---|
| Низкомолекулярный миметик BDNF как средство для лечения опиоидной зависимости | 2019 |
|
RU2707301C1 |
| ДИМЕРНЫЕ ДИПЕПТИДНЫЕ МИМЕТИКИ НЕЙРОТРОФИНА-3 | 2022 |
|
RU2800369C1 |
| Низкомолекулярный миметик нейротрофина-3 в качестве средства для снижения болевой реакции и восстановления чувствительности при периферической нейропатии | 2024 |
|
RU2828668C1 |
| ДИМЕРНЫЙ ДИПЕПТИДНЫЙ МИМЕТИК BDNF КАК СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОПИОИДНОЙ ЗАВИСИМОСТИ | 2023 |
|
RU2823374C1 |
| СРЕДСТВО ДЛЯ КУПИРОВАНИЯ АЛКОГОЛЬНОГО АБСТИНЕНТНОГО СИНДРОМА | 2012 |
|
RU2521226C2 |
| Кардиотропное средство с анксиолитическими и анальгетическими свойствами | 2020 |
|
RU2773018C2 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ АЛКОГОЛЬНОЙ МОТИВАЦИИ ПРИ АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ | 2014 |
|
RU2582966C2 |
| Линейный замещенный глипролин с антидепрессивным и анальгетическим действием | 2019 |
|
RU2756449C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНКСИОЛИТИЧЕСКОЙ И ЦЕРЕБРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ, УМЕНЬШАЮЩЕЕ ВЛЕЧЕНИЕ К АЛКОГОЛЮ | 2008 |
|
RU2393855C1 |
| Фармацевтическая композиция на основе гексаметилендиамида бис-(N-моносукцинил-L-серил-L-лизина) (ГСБ-106) | 2018 |
|
RU2697254C1 |
Изобретение относится к применению гексаметилендиамида бис-(-N-гексаноил-L-серил-L-лизина) в качестве анальгетического, анксиолитического и антиаддиктивного средства. Гексаметилендиамид бис-(-N-гексаноил-L-серил-L-лизина) влияет на ноцицептивную реакцию, тревожное поведение и сформированную алкогольную мотивацию, увеличивает порог болевой реакции в тесте «горячая пластина», демонстрирует анксиолитическое действие. 2 табл., 9 ил., 6 пр.
Применение гексаметилендиамида бис-(-N-гексаноил-L-серил-L-лизина) в качестве анальгетического, анксиолитического и антиаддиктивного средства.
| АНАЛЬГЕЗИРУЮЩЕЕ СРЕДСТВО | 2018 |
|
RU2711968C1 |
| ПРОИЗВОДНЫЕ 1,4-БЕНЗОДИАЗЕПИН-2-ОНА И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2701557C2 |
| АНКСИОЛИТИЧЕСКОЕ СРЕДСТВО | 2019 |
|
RU2700576C1 |
| Фармацевтическая композиция нейропротекторного действия для парентерального применения на основе гексаметилендиамида бис-(N-моносукцинил-L-глутамил-L-лизина) в лиофилизированной лекарственной форме | 2017 |
|
RU2678203C2 |
| Низкомолекулярный миметик BDNF как средство для лечения опиоидной зависимости | 2019 |
|
RU2707301C1 |
Авторы
Даты
2021-11-08—Публикация
2020-04-29—Подача