Изобретение относится к области биотехнологии, предназначено для культивирования in vitro каллусной ткани лекарственных растений и может быть использовано в работах по клеточной и генной инженерии для повышения морфогенетической активности культивируемых клеток.
Одной из задач сельскохозяйственной биотехнологии, как вспомогательного инструмента селекции, является ускорение селекционного процесса. Это можно достичь за счет использования методов клеточной биотехнологии растений таких как: клеточная селекция, соматическая гибридизация, клональное микроразмножение, культура изолированных зародышей, оплодотворение in vitro и др. [Калашникова Е.А. Клеточная инженерия растений. Учебник и практикум / Е.А.Калашникова // Москва, изд-во Юрайт. 2020. - 378 с.]. Результативность данных методов основывается на реализации соматическими клетками морфогенетического потенциала. Однако, многими авторами показано, что при длительном культивировании каллусных клеток in vitro как в стрессовых, так и в стандартных условиях можно наблюдать снижение морфогенетической активности клеток, которая проявляется, прежде всего, в снижении способности клеток образовывать растения-регенеранты. Управлять морфогенетическим потенциалом клеток можно факторами химической и физической природы. Например, для этого применяют регуляторы роста в различных сочетаниях и соотношениях (вт.св. СССР N 1107799: А01Н 1/00, 15.06.1982; опубл. 15.10.1984; бюл. N 30; RU 2529837 А01Н 4/00, 27.09.2014; RU 2628091 С2, C12N 5/04 А01Н 5/00, 2017.08.14), минеральные соли и аминокислоты (RU №2203534 А01Н 4/00, C12N 5/04, 27.10.2001), а также различные источники освещения с разным спектральным составом света [Tarakanov, Ivan G.; Kosobryukhov, Anatoly A.; Tovstyko, Daria A.; Anisimov, Alexander A.; Shulgina, Alia A.; Sleptsov, Nikolay N.; Kalashnikova, Elena A.; Vassilev, Andon V.; Kirakosyan, Rima N.Effects of Light Spectral Quality on the Micropropagated Raspberry Plants during Ex Vitro Adaptation // Plants. - 2021. - T. 10. - №. 10. - C. 2071]. Однако предлагаемые технологии мало эффективны, так как они зависят от количества и качества исходного материала, а также от видовых особенностей растений.
Из существующего уровня техники известен способ повышения эффективности морфогенетической активности каллусной ткани сорго in vitro за счет получения эмбриогенной каллусной культуры на питательной среде по Мурасиге и Скугу, содержащей в своем составе ионы NO3- (61-88 mМ) и NH4 (48-78 mМ) и включающей индукторы каллусогенеза 2,4-Д и аминокислоты L-аспарагин и L-пролин. Для регенерации растений из каллусной ткани рекомендуется использовать индукторы морфогенеза ИУК и кинетин (RU(11) 99126312 А01Н 4/00, C12N 5/04, 11.10.2001). Недостатком известного аналога является применение 2,4-Д в качестве индуктора каллусогенеза, который по действующему веществу является гербицидом и может приводить к необратимым мутациям, проявляющихся, прежде всего, в ингибировании каллусной ткани к морфогенезу.
Известен другой способ размножения растений из длительно пассируемой каллусной ткани проса (Panicum miliaceum L.). Для получения каллусной ткани используют в качестве первичного экспланта незрелые соцветия, которые культивируют на питательной среде Мурасига и Скуга, дополненную витаминами среды В5, 2 мг/л 2,4-Д и 200-500 мг/л L-глутамина и 500 мг/л инозита. Полученная каллусная ткань, в дальнейшем переносится на питательную среду для регенерации растений, содержащую 10 мг/л 6-БАП и 0,5 мг/л НУК (RU №2203534, А01Н4/00, 10.05.2003). Недостатком заявленного изобретения является применение высоких концентраций 6-БАП, которые приводят, как правило, к формированию аномальных по морфологии и сильно оводненных растений.
Известен способ повышения морфогенетической активности каллусной ткани за счет применения света синего спектра. Способ предусматривает получение каллусной культуры из эксплантов интактных растений Centaurea scabiosa L. на питательной среде Мурасига-Скуга с добавлением 0,5-1 мг/л НУК (а-нафтилуксусной кислоты) и 0,2-0,5 мг/л БАП (6-бензиламинопурин) и культивированием в пластиковых чашках Петри, при освещении синим светом (380-560 нм) (RU (11) 2 458 121, МПК C12N 5/04, 2012.08.10). Изобретение позволяет повысить ростовой индекс каллусной культуры. Недостатком данного способа является применение синего света, который является индуктором морфогенеза только в сочетании с красным светом.
Известен другой способ получения растений-регенерантов из каллусной ткани. Способ предусматривает получение каллусной ткани люцерны на питательной среде, содержащей нанобиокомпозит на основе древесной зелени пихты, в состав, которого входят биологически активная сумма тритерпеновых кислот, в концентрации 1 мг/л для стимуляции развития побегов и корней, или в дозе 100 мг/л для ускорения роста стеблей и увеличения частоты ризогенеза (RU(11) 2013104660, МПК А01Н 4/00 В82 В 1/00, 20.08.2014 Бюл. No 23). Недостатком известного изобретения является применение нанобиокомпозита, который трудно получить и нельзя приобрести в специализированных компаниях, занимающихся оборудованием и расходными материалами для биотехнологических исследований.
Наиболее близким по технической сущности к предлагаемому способу, взятом за прототип, относится способ индукции каллусной ткани с последующим получением растений-регенерантов Melissa officinalis L., предусматривающий культивирование сегментов черешка и листа на питательной среде Мурасига и Скуга, содержащей 1 мг/л НУК в сочетании с 0,5 мг/л БАП (Якимова, О.В. Каллусогенез и морфогенез в культуре изолированных органов и тканей Melissa officinalis L. in vitro / О.В. Якимова, Н.А. Егорова // Ученые записки ТНУ им. В.И. Вернадского, серия биология и химия. - 2014 - Т. 27 (66), №5, Спецвыпуск. - С. 191-201.). Недостатком данного способа является низкая морфогенетическая активность каллусной ткани. Частота регенерации растений из каллусной ткани составила 20-28%. Кроме того, для получения первичных эксплантов, используемых для индукции каллусной ткани, потребуется 2-3 пассажа что бы получить микроклоны.
Анализ научной литературы и патентный поиск показал, что нет универсальной технологии, позволяющей с высокой эффективностью получать растения-регенеранты из каллусной ткани. В связи с этим существует необходимость усовершенствования таких технологий.
Следует отметить, что проблема повышения морфогенеза особо актуальна для лекарственных растений, которые являются ценным источником вторичных метаболитов, широко применяемых в медицине, фармакологии, пищевой и других областях народного хозяйства.
Технический результат предлагаемого изобретения - увеличение выхода растений-регенерантов за счет применения «кондиционирующего фактора».
О «кондиционирующем факторе» впервые было сообщено в 19 69 году Р.Г. Бутенко [Бутенко Р.Г. Культура изолированных тканей и физиологии морфогенеза растений. / Р.Г. Бутенко // М.: Наука, 1964. - 270 с.], и этот метод был применен только для культивирования одиночных клеток суспензионных культур моркови. На основании анализа литературных данных установлено, что, как правило, метод «кондиционирующего фактора» применяют в работах по культивированию клеток растений, относящихся к одному роду или одному виду. Что касается изучения совместного культивирования дифференцированных или дедифференцированных клеток растений разных семейств, то эксперименты такого плана ранее не проводились.
Для решения технической проблемы и достижения заявленного результата в способе регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro, включающем получение каллуса на питательной среде Мурасига и Скуга, регуляцию морфогенетической активности осуществляют путем совместного культивирования каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри на питательной среде Мурасига и Скуга, содержащей 1 мг/л дихлорфеноксиуксусной кислоты в сочетании с 0,5 мг/л 6-бензиламинопурина в одних условиях выращивания.
Конкретный пример осуществления предлагаемого способа.
Объектом исследования были семена растений семейства Яснотковые (Lamiaceae) - иссоп лекарственный (Hyssopus officinalis L.), мята перечная {Mentha piperita), базилик душистый (Ocimum basilicum L.), чабер садовый (Satureja L.,), душица обыкновенная (Origanum vulgare L.) и др. - многолетние эфиромасличные, пряно-лекарственные растения, которые обладают отхаркивающим, противоотечным, спазмолитическим, тонизирующим действием, а некоторые его разновидности проявляют сильное противовирусное действие, особенно против вируса герпеса. Благодаря своим биологическим свойствам данные растения все больше привлекают внимание ученых, особенно при изучении этих культур в условиях in vitro с целью получения вторичных метаболитов.
Семена лекарственных растений стерилизовали 0,1% раствором сулемы в течение 7 минут, после чего промывали в трех порциях стерильной дистиллированной воды и затем помещали на безгормональную питательную среду, содержащую минеральные соли по прописи Мурасига и Скуга (МС), а также сахарозу 3% и агар 0,8%. рН среды составил 5,6-5,8. Семена культивируют в чашках Петри, которые переносят в световую комнату, где поддерживается температура 23°С, 16-часовой фотопериод, освещение белыми люминесцентными лампами, интенсивность освещения 3,5 тыс. лк. Через 7-10 суток из семян формируются проростки, которые делят на сегменты гипокотиля и семядольных листьев. Полученные экспланты переносят на питательную среду для индукции образования каллусной ткани. Для этого питательная среды содержит минеральные соли по прописи Мурасига и Скуга (МС), 1 мг/л 2,4-Д + 0,5 мг/л БАП. Начало каллусогенеза отмечается на 15 сутки с начала культивирования. К концу пассажа (30 суток) формируется хорошо растущая каллусная ткань, для размножения которой вновь используют питательную среду МС с 1 мг/л 2,4-Д + 0,5 мг/л БАП.
Для повышения морфогенетической активности каллусной ткани предлагается применять совместное культивирование каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри на питательной среде Мурасига и Скуга, содержащей 1 мг/л дихлорфеноксиуксусной кислоты в сочетании с 0,5 мг/л 6-бензиламинопурина в одних условиях выращивания при температуре 23°С, 16-часовом фотопериоде, освещение белыми люминесцентными лампами с интенсивностью 3,5 тыс. лк.
Каллусную ткань моркови первоначально получают из сердцевидной части корнеплода. Сначала корнеплод моркови (любого сорта) промывают в мыльном растворе, потом под проточной водой и с помощью щетки удаляют остатки земли. После этого корнеплод стерилизуют в условиях ламинар-бокса 0,1%-ным раствором сулемы в течение 20 минут, промывают в трех порциях стерильной дистиллированной воды, после чего из корнеплода стерильным скальпелем вырезают сердцевидную часть (кусочки 0,5 на 0,5 см) и помещают ее в чашки Петри на питательную среду Мурасига и Скуга, содержащей 1 мг/л 2,4-Д + 0,5 мг/л БАП. В этих условиях к концу пассажа (30 суток) из кусочков сердцевины формируется хорошо растущая каллусная ткань.
Техника совместного выращивания каллусной ткани лекарственных растений и каллусной ткани моркови предусматривает следующие характеристики (этапы):
1. В центр чашки Петри помещают один каллус моркови.
2. Вокруг каллусной ткани моркови, на расстоянии 2 см располагают каллусную ткань иссопа лекарственнго (Hyssopus officinalis L.) или мяты перечной {Mentha piperita) или базилика душистого (Ocimum basilicum L.) или чабера садового (Satureja L.,) или душицы обыкновенной (Origanum vulgare L.) или др. лекарственных растений.
3. В каждую чашку Петри помещают по 5 шт. каллусной ткани лекарственных растений.
В качестве кондиционирующего фактора использовали каллусную ткань моркови не случайно, так как известно, что данная культура богата вторичными метаболитами и потенциально способна оказать влияние на морфогенетический потенциал культивируемых in vitro изолированных клеток и тканей растений.
Предлагаемая нами технология позволяет повысить морфогенетический потенциал каллусной ткани лекарственных растений на 34,9-36,0% и частота регенерации растений в этом случае достигает 54,9-64,2%. Данный технологический прием ранее не был использован в технологиях выращивания каллусной ткани лекарственных растений и не присутствует, как элемент технологии в прототипе.
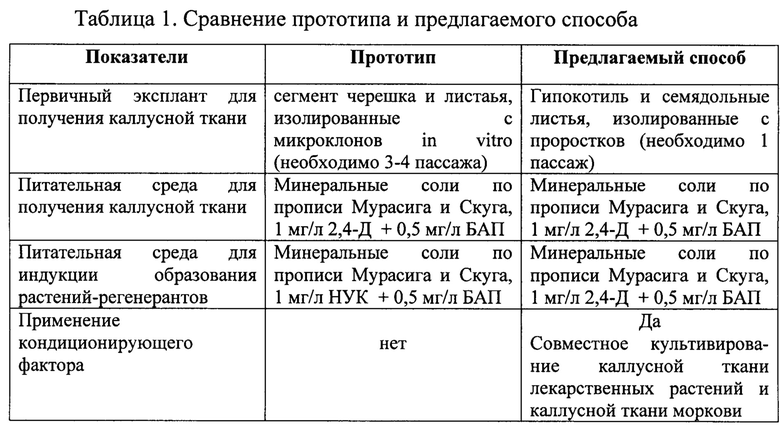
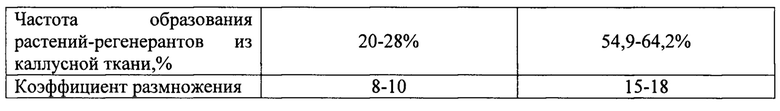
Предлагаемый способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro сочетает ряд положительных свойств, которые позволяют использовать ее в практической работе:
1. Способ предлагает получать каллусную культуру лекарственных растений уже на втором пассаже с начала культивирования семян in vitro.
2. Способ предлагает использовать в небольших количествах легкодоступный материал (всего один корнеплод моркови).
3. Присутствие в составе питательной среды минеральных солей по прописи МС, а также 1 мг/л 2,4-Д + 0,5 мг/л БАП (дешевая технология).
4. Предлагаемый способ совместного выращивания каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри легок в исполнении по сравнению с ранее предлагаемыми разработками авторов.
5. Предлагаемая технология позволяет повысить морфогенетическую активность каллусной ткани лекарственных растений на 34,9-36,0%.
6. Предлагаемый способ позволяет ускоренно получать растения-регенеранты лекарственных растений из каллусной ткани.
Заявляемое изобретение направлено на устранение недостатков, которые свойственны наиболее распространенным способам получения растений-регенерантов из каллусной ткани лекарственных растений. Известных в научно-технической и патентной литературе способов с аналогичной технологией не обнаружено. Результат, полученный у данного решения и обусловленный применением технологии совместного выращивания каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри, на одной питательной среде данной технологии, не достигался в известных решениях.
Использование изобретения позволит повысить морфогенетический потенциал каллусной ткани лекарственных растений и увеличить выход растений-регенерантов, что дает возможность получать высококачественный посадочный материал в достаточном количестве. Такие растения могут служить исходным материалом для проведения селекционных работ, направленных на получение новых сортов лекарственных растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения посадочного материала хризантемы в условиях in vitro | 2020 |
|
RU2743967C1 |
| Способ получения растений-регенерантов Brassica oleracea L. in vitro | 2021 |
|
RU2759735C1 |
| Способ получения каллусной культуры цикория (Cichorium intybus L.) | 2023 |
|
RU2804841C1 |
| Способ культивирования растений in vitro разных таксономических групп | 2023 |
|
RU2804965C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАПЛОИДНЫХ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИЗ РЕПРОДУКТИВНЫХ ОРГАНОВ BRASSICA OLERACEA L. IN VITRO | 2015 |
|
RU2607007C1 |
| Способ получения растений-регенерантов рода Brassica in vitro | 2020 |
|
RU2741647C1 |
| Способ получения безвирусного, генетически однородного посадочного материала батата (Ipomoea Batatas L.) in vitro | 2021 |
|
RU2783183C1 |
| Способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens L.) | 2023 |
|
RU2815450C1 |
| СПОСОБ ВВЕДЕНИЯ В КУЛЬТУРУ IN VITRO, ПОЛУЧЕНИЯ КАЛЛУСОВ И РАСТЕНИЙ-РЕГЕНЕРАНТОВ ВЗДУТОПЛОДНИКА СИБИРСКОГО (PHLOJODICARPUS SIBIRICUS (STEPH.) К.-POL.), С ИСПОЛЬЗОВАНИЕМ В КАЧЕСТВЕ ПЕРВИЧНЫХ ЭКСПЛАНТОВ ВЕГЕТАТИВНЫХ И ГЕНЕРАТИВНЫХ ОРГАНОВ | 2021 |
|
RU2771960C1 |
| Способ клонального микроразмножения кардамона черного (Amomum tsao-ko) | 2023 |
|
RU2814183C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro, относится к области биотехнологии, предназначено для культивирования in vitro каллусной ткани лекарственных растений и может быть использовано в работах по клеточной и генной инженерии для получения растений-регенерантов из каллусной ткани лекарственных растений (иссоп лекарственный (Hyssopus officinalis L.), мята перечная (Mentha piperita), базилик душистый (Ocimum basilicum L.), чабер садовый (Satureja L.), душица обыкновенная (Origanum vulgare L.) и др.). Изобретение позволяет массово получить растения-регенеранты из каллусной ткани лекарственных растений. Это достигается за счет применения совместного культивирования каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри на питательной среде Мурасига и Скуга, содержащей 1 мг/л дихлорфеноксиуксусной кислоты в сочетании с 0,5 мг/л 6-бензиламинопурина, в одних условиях выращивания при температуре 23°С, 16-часовом фотопериоде, освещении белыми люминесцентными лампами с интенсивностью 3,5 тыс. лк. 1 табл.
Способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro, включающий получение каллуса на питательной среде Мурасига и Скуга, отличающийся тем, что стимуляцию осуществляют путем совместного культивирования каллусной ткани лекарственных растений и каллусной ткани моркови в одной чашке Петри на питательной среде Мурасига и Скуга, содержащей 1 мг/л дихлорфеноксиуксусной кислоты в сочетании с 0,5 мг/л 6-бензиламинопурина, в одних условиях выращивания при температуре 23°С, 16-часовом фотопериоде, освещении белыми люминесцентными лампами с интенсивностью 3,5 тыс. лк.
| ЯКИМОВА О.В., Каллусогенез и морфогенез в культуре изолированных органов и тканей Melissa officinalis L | |||
| in vitro, Ученые записки ТНУ им | |||
| В.И | |||
| Вернадского, серия биология и химия, 2014, т | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Устройство непрерывного автоматического тормоза с сжатым воздухом | 1921 |
|
SU191A1 |
| БУТЕНКО Р.Г., Культура изолированных тканей и физиологии морфогенеза растений, М.: Наука, 1964, 270 с | |||
| MURASHIGE Т., et | |||
Авторы
Даты
2023-06-21—Публикация
2022-08-29—Подача