Изобретение относится к области сельскохозяйственной биотехнологии и может быть использовано для снижения трудозатрат и себестоимости при производстве удвоенных гаплоидов капусты белокочанной (B. oleracea L.) в культуре изолированных микроспор.
Известные способы получения удвоенных гаплоидов в культуре изолированных микроспор у капусты белокочанной (Plant Cell Tiss Organ Cult, 2012, 110, pp. 69-76, DOI: 10.1007/s11240-012-0131-z, Romanian Biotechnological Letters, 2013, 18, pp. 8677-8684, DOI - нет). Использование питательной среды на этапе выделения, очистки и индукции эмбриогенеза делает технологию более дорогой.
Наиболее близкой по технической сущности к заявляемому решению является технология производства эмбриоидов Plant Cell Tiss Organ Cult, 2012, 110, pp. 69-76, DOI: 10.1007/s11240-012-0131-z. Выделение микроспор из пыльников проводят в охлажденной до 4°С питательной среде В5 (Gamborg et al., 1968) с добавлением 130 г/л сахарозы, рН 5,8. После этого микроспоры очищают фильтрованием через двухслойный нейлоновый фильтр с диаметром пор 45 мкм, и троекратным центрифугированием суспензии микроспор при 4°С, 1000 оборотов/мин. в течение трех минут, заменяя питательную среду на свежую после каждого цикла. После последнего цикла центрифугирования микроспоры ресуспендируют в 2 мл охлажденной до 4°С среды NLN-13 (Lichter, 1982) с добавлением 130 г/л сахарозы, рН 5,8. Плотность микроспор определяют в камере Фукса-Розенталя и средой NLN-13 с добавлением 130 г/л сахарозы и рН 5,8 доводят плотность микроспор в суспензии до 4×104 микроспор/мл. Суспензию микроспор разливают в чашки Петри диаметром 60 мм по 3 мл. Чашки Петри с суспензией микроспор инкубируют в темноте в течение 72 ч. при 32±0,1°С, или 24 ч. при 32±0,1°С, затем температуру снижают до 25±1°С и продолжают инкубировать в темноте до появления эмбриоидов.
Использование питательной среды NLN-13 для выделения и очистки микроспор делает технологию производства удвоенных гаплоидов более трудоемкой и дорогостоящей, так как используется холодная фильтр-стерилизация питательной среды. Выделение и очистка микроспор с использованием питательной среды В5 с добавлением маннитола менее трудоемко и менее затратно, чем использование среды NLN-13, так как для ее стерилизации используется автоклавирование и не требуется использование дорогостоящих одноразовых стерильных фильтров и шприцов. В среднем выделение и очистка микроспор одного образца с использованием питательной среды В5 (Gamborg et al., 1968) обходится в 33-35 рублей, с использованием питательной среды NLN-13 - 37-40 руб., с использованием 13%-ного раствора сахарозы - 13-15 руб., таким образом снижение себестоимости выделения, очистки микроспор и индукции эмбриогенеза может составить 60-65%.
Технический результат предлагаемого изобретения - снижение трудоемкости получения удвоенных гаплоидов капусты при снижении себестоимости процесса с сохранением частоты эмбриогенеза микроспор на уровне стандартного протокола.
Для решения указанной проблемы и достижения заявленного результата в способе создания удвоенных гаплоидов капусты белокочанной выделение и очистку микроспор осуществляют в 13%-ном растворе сахарозы, рН 5,8, индукцию эмбриогенеза осуществляют в условиях инициирующего стресса в темноте при температуре 32,5±0,1°С, инкубируя микроспоры в течение 48 часов в 13%-ном растворе сахарозы, рН 5,8, после воздействия инициирующего стресса питательную среду заменяют на питательную среду NLN-13, рН 5,8, затем определяют плотность микроспор, доводят ее до 4×104 микроспор/мл и инкубируют в темноте до образования эмбриоидов при 25±1°С в климатической комнате.
В предложенном способе выделение, очистка микроспор и индукция эмбриогенеза микроспор капусты белокочанной проводится в 13%-ном растворе сахарозы, рН 5,8, что снижает себестоимость данных этапов технологии на 70-75% и не оказывает негативного влияния на частоту эмбриогенеза микроспор капусты белокочанной.
Существенными признаками, характеризующими изобретение, являются выделение и очистка микроспор с использованием 13% раствора сахарозы, индукция эмбриогенеза в 13% растворе сахарозы в условиях стандартного инициирующего стресса в течение 48 часов при 32,5±0,5°С.
Сведения, подтверждающие возможность осуществления способа.
Пример 1
Микроспоры 7 генотипов капусты белокочанной выделяли в охлажденном до 4°С 13%-ном растворе сахарозы, рН 5,8. После этого микроспоры фильтровали через двухслойный нейлоновый фильтр с диаметром пор 45 мкм, и троекратно центрифугировали суспензию микроспор при 4°С, 800 об/мин в течение четырех минут, заменяя раствор сахарозы на свежий после каждого цикла центрифугирования. После последнего цикла центрифугирования микроспоры ресуспендировали в пробирках объемом 15 мл в 10 мл 13% раствора сахарозы (рН 5,8) после чего инкубировали микроспоры в 13%) растворе сахарозы в темноте при температуре 32,5±0,5°С в течение 48 часов. После этого микроспоры в пробирках осаждали центрифугированием в течение 4 минут при 800 оборотов/мин., сливали надосадочную жидкость и добавляли 2 мл свежей питательной среды NLN-13 с добавлением 130 г сахарозы (рН 5,8), в которой ресуспендировали микроспоры. С помощью камеры Фукса-Розенталя определяли плотность микроспор в суспензии и доводили плотность до 4×104 микроспор/мл, питательной средой NLN-13 с добавлением 130 г сахарозы, рН 5,8. Далее суспензию микроспор разливали по чашкам Петри диаметром 60 мм по 3 мл в каждую, и инкубировали микроспоры в климатической комнате в темноте при 25±1°С до образования эмбриоидов.
Описанным выше способом были произведены эмбриоиды у следующих генотипов/образцов капусты белокочанной № 1 с, № 2 с, № 3 с, № 4 с и № 5 с.
В таблице 1 представлена частота эмбриогенеза микроспор (число эмбриоидов в 1 мл питательной среды) образцов капусты белокочанной (B. oleracea L.): 1) при использовании питательной среды В5 (рН 5,8) для выделения и очистки микроспор, и при индукции эмбриогенеза микроспор в питательной среде NLN-13 (рН 5,8) при 32,5±0,1°С в течение 48 час (контроль); 2) при использовании 13%-ного раствора сахарозы (рН 5,8) для выделения и очистки микроспор, и при индукции эмбриогенеза в 13%-ном растворе сахарозы (рН 5,8) при 32,5±0,1°С в течение 48 час.
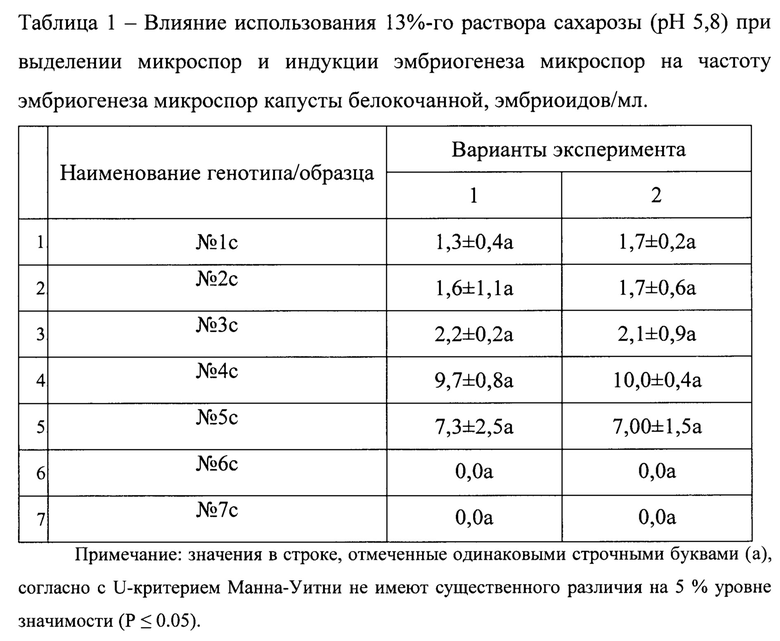
По сравнению с прототипом предложенный способ позволяет снизить затраты этапов выделения, очистки микроспор и индукции эмбриогенеза микроспор на 63% за счет замены дорогостоящих питательных сред 13%-ном раствором сахарозы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения растений-регенерантов Brassica oleracea L. in vitro | 2021 |
|
RU2759735C1 |
| Способ получения удвоенных гаплоидов моркови в культуре изолированных микроспор in vitro | 2020 |
|
RU2750959C1 |
| Способ получения растений-регенерантов рода Brassica in vitro | 2020 |
|
RU2741647C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАПЛОИДНЫХ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИЗ РЕПРОДУКТИВНЫХ ОРГАНОВ BRASSICA OLERACEA L. IN VITRO | 2015 |
|
RU2607007C1 |
| Способ создания удвоенных гаплоидов кабачка Cucurbita pepo L. в культуре изолированных семязачатков | 2023 |
|
RU2831839C1 |
| Способ удвоения хромосомного набора гаплоидов рапса (Brassica napus L.) | 2022 |
|
RU2808269C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГАПЛОИДНЫХ РАСТЕНИЙ ЯЧМЕНЯ ИЗ КУЛЬТИВИРУЕМЫХ МИКРОСПОР IN VITRO | 2013 |
|
RU2557389C2 |
| Способ изоляции микроспор для получения удвоенных гаплоидов семейства Brassicaceae в культуре микроспор in vitro | 2022 |
|
RU2807444C1 |
| Способ отбора дигаплоидных растений капусты белокочанной Brassica oleracea устойчивых к сосудистому бактериозу | 2018 |
|
RU2709991C1 |
| Способ культивирования растений in vitro разных таксономических групп | 2023 |
|
RU2804965C1 |
Способ создания удвоенных гаплоидов капусты белокочанной (Brassica oleracea L.) в культуре изолированных микроспор относится к области сельскохозяйственной биотехнологии и может быть использован для снижения трудоемкости получения удвоенных гаплоидов капусты в культуре изолированных микроспор. Способ, характеризующийся тем, что выделение и очистку микроспор осуществляют с использованием 13%-ного раствора сахарозы (рН 5,8), инициирующий стресс оказывают инкубированием выделенных и очищенных микроспор в 13%-ном растворе сахарозы (рН 5,8) в темноте при температуре 32,5±0,1°С в течение 48 часов, после воздействия инициирующего стресса раствор сахарозы заменяют на питательную среду NLN-13 (рН 5,8), затем определяют плотность суспензии микроспор, доводят ее до 4×104 микроспор/мл и инкубируют до формирования эмбриоидов в климатической комнате. Изобретение позволяет снизить трудоемкость получения удвоенных гаплоидов капусты с сохранением частоты эмбриогенеза микроспор на уровне стандартного протокола. 1 табл.
Способ создания удвоенных гаплоидов капусты белокочанной (Brassica oleracea L.) в культуре изолированных микроспор, включающий выделение микроспор из пыльников, их очистку, определение плотности суспензии микроспор, доведение ее до 4×104 микроспор/мл, инициацию эмбриогенеза и последующее инкубирование в темноте до появления эмбриоидов, отличающийся тем, что выделение и очистку микроспор осуществляют в 13%-ном растворе сахарозы, рН 5,8, индукцию эмбриогенеза осуществляют в условиях инициирующего стресса в темноте при температуре 32,5±0,1°С, инкубируя микроспоры в течение 48 часов в 13%-ном растворе сахарозы, рН 5,8, после воздействия инициирующего стресса раствор сахарозы заменяют на питательную среду NLN-13, рН 5,8, определяют плотность микроспор, доводят ее до 4×104 микроспор/мл и инкубируют в темноте до образования эмбриоидов при 25±1°С в климатической комнате.
| SU-XIA YUAN, et al., Effects of ph, MES, arabinogalactan-proteins on microspore cultures in white cabbage, Plant Cell Tiss Organ Cult (2012), 110:69-76, DOI: 10.1007.ы11240-012-0131-z | |||
| САВЕНКО Е.Г | |||
| и др | |||
| Метод культуры пыльников in vitro для создания удвоенных гаплоидов капусты белокочанной | |||
| Овощеводство | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| ШМЫКОВА Н.А | |||
| и | |||
Авторы
Даты
2022-04-06—Публикация
2021-07-19—Подача