Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к способам получения одноцепочечной РНК (оцРНК). Более того, настоящее изобретение относится к оцРНК, которую можно получить с помощью способов согласно настоящему изобретению, и применению такой оцРНК в терапии.
Предшествующий уровень техники настоящего изобретения
Во время синтеза иРНК с помощью in vitro транскрипции (IVT) с использованием РНК-полимеразы T7 (см. Yin et al., Cell 116 (2004), 393-404) производятся значительные количества аберрантных продуктов, включая в себя двухцепочечную РНК (дцРНК), вследствие нестандартной активности фермента (см. Triana-Alonso et al., JBC 270 (1995), 6298-6307; Cazenave et al., PNAS USA 91(1994), 6972-6976; Gong et al., JBC 281 (2006), 23533-23544). Поскольку дцРНК индуцирует воспалительные цитокины и активирует эффекторные ферменты (см. Karikó et al., Curr. Opin. Drug Discov. Devel. 10 (2007), 523-532), приводящие к ингибированию синтеза белка, важно удалять дцРНК из IVT иРНК, которую будут использовать в качестве терапевтического средства.
К настоящему времени описаны два различных способа удаления дцРНК из IVT иРНК. Один способ представляет собой очистку IVT иРНК с помощью ион-парной обращенно-фазовой ВЭЖХ (высокоэффективной жидкостной хроматографии) с использованием непористой (см. Weissman et al., Methods Mol. Biol. 969 (2013), 43-54) или пористой (см. патент США № US 8383340 B2) C-18 полистирол-дивинилбензольной (PS-DVB) матрицы. Тем не менее, способы с использованием ВЭЖХ для очистки РНК характеризуются некоторыми недостатками, такими как сложное оборудование; применение таких токсических растворителей, как ацетонитрил; длительная продолжительность стандартного цикла очистки; трудное масштабирование; себестоимость; и разложение длинной РНК из-за фрагментации.
Альтернативно был установлен ферментативный способ с использованием РНКазы III E. coli, которая специфически гидролизует дцРНК, но не оцРНК, тем самым устраняя примеси дцРНК из препаратов IVT иРНК (см. международную патентную публикацию WO 2013/102203 A1). Тем не менее, возможно, что РНКаза III индуцирует нежелательные реакции (такие как нежелательная иммунная реакция) у пациента, подлежащего лечению с помощью РНК. Таким образом, перед введением РНК пациенту необходимо удалить фермент, тем самым увеличивая сложность и стоимость способа. Более того, применение РНКазы III часто приводит к частичному разложению оцРНК, особенно длинной оцРНК, во время инкубации. Вероятно, это вызвано катализируемым РНКазой III гидролизом двухцепочечных вторичных структур, содержащихся в оцРНК.
В 1966 г. было описано неионное взаимодействие между порошком немодифицированной целлюлозы CF-11 и РНК в присутствии EtOH, и его использовали для отделения sРНК ("растворимой РНК") от рибосомной РНК (рРНК) с помощью хроматографии (Barber, R. Biochim. Biophys. Acta 114 (1966), 422-424). Наряду с тем, что sРНК элюировала с помощью 35% EtOH из колонки, рРНК можно селективно элюировать с помощью снижения концентрации EtOH хроматографического буфера до 15%.
Franklin с соавт. (PNAS USA 55 (1966), 1504-1511) использовали этот же принцип разделения для выделения репликативной промежуточной (RI) РНК РНК-бактериофага R17 из общей РНК E. coli. В этом документе связанную с целлюлозой RI РНК, идентифицированную как устойчивую к РНКазе A дцРНК, эффективно элюировали только в буфере, не содержащем EtOH. Эту технику адаптировали для выделения дцРНК из Cryphonectria parasitica, паразитического гриба каштана (Day et al., Phytopathology 67 (1977), 1393).
Morris и Dodds (Phytopathology 69 (1977), 854-858) упростили описанные ранее процедуры на основе целлюлозы с помощью селективной копреципитации вирусной дцРНК из растительных и грибковых РНК-изолятов в присутствии 15% (объем./объем.) EtOH. Эту процедуру использовали в течение десятилетий для выделения дцРНК и за эти годы ее подвергли лишь незначительным модификациям, например, с использованием коммерческих миниколонок, заполненных целлюлозой CF-11, для ускорения процесса и увеличения пропускной способности образцов (см. Castillo et al., Virol. J. 8 (2011), 38; Okada et al., Arch. Virol. 159 (2014), 807-809).
Цель настоящего изобретения состоит в обеспечении средств, направленных на решение одной или нескольких проблем, описанных выше. В частности, цель настоящего изобретения состоит в обеспечении альтернативного способа получения оцРНК, который является рентабельным, простым и менее трудоемким, чем способы на основе ВЭЖХ; который позволяет избежать использования токсических веществ; масштаб которого можно легко увеличить; который обеспечивает оцРНК с выходом и чистотой, сопоставимыми с оцРНК, получаемой с использованием ВЭЖХ; который не воздействует на длинные РНК и/или который не разлагает РНК. Указанные цели, лежащие в основе настоящего изобретения, решаются с помощью предмета изобретения, раскрытого или определенного где-либо в настоящем документе, например, с помощью предмета изобретения согласно прилагаемой формуле изобретения.
Краткое раскрытие настоящего изобретения
Согласно первому аспекту настоящее изобретение относится к способу получения оцРНК, предусматривающему (i) получение препарата РНК, содержащего оцРНК, полученную с помощью in vitro транскрипции; (ii) приведение в контакт препарата РНК с целлюлозным материалом при условиях, которые обеспечивают возможность связывания двухцепочечной РНК (дцРНК) с целлюлозным материалом; и (iii) отделение оцРНК от целлюлозного материала при условиях, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом.
Согласно одному варианту осуществления первого аспекта способ дополнительно предусматривает стадию получения препарата РНК, содержащего оцРНК, с помощью in vitro транскрипции.
Согласно первому основному варианту осуществления первого аспекта стадии (ii) и (iii) проводят при условиях, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом (этот основной вариант осуществления первого аспекта иногда в настоящем документе называется процедурой "отрицательной" очистки, поскольку она обеспечивает возможность селективного связывания дцРНК с целлюлозным материалом, тогда как оцРНК остается несвязанной).
Согласно одному варианту осуществления процедуры отрицательной очистки стадия (ii) предусматривает смешивание препарата РНК, содержащего оцРНК, с целлюлозным материалом при встряхивании и/или перемешивании, предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин.
Согласно одному варианту осуществления процедуры отрицательной очистки на стадии (ii) препарат РНК получают в виде жидкости, содержащей оцРНК и первый буфер, и/или целлюлозный материал получают в виде суспензии в первом буфере, причем первый буфер содержит воду, этанол и соль, предпочтительно хлорид натрия, в концентрации, которая обеспечивает возможность связывания дцРНК с целлюлозным материалом и которая не позволяет оцРНК связываться с целлюлозным материалом. Согласно одному варианту осуществления концентрация этанола в первом буфере составляет 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.). Согласно одному варианту осуществления концентрация соли в первом буфере составляет 15-70 мM, предпочтительно 20-60 мM. Согласно одному варианту осуществления первый буфер дополнительно содержит буферное вещество, предпочтительно трис(гидроксиметил)аминометан (TRIS), и/или хелатирующее средство, предпочтительно EDTA.
Согласно одному варианту осуществления процедуры отрицательной очистки на стадии (ii) и/или (iii) обеспечивают наличие в пробирке смеси препарата РНК, целлюлозного материала и первого буфера, и стадия (iii) предусматривает (1) приложение силы тяжести или центробежной силы к пробирке с тем, чтобы разделить жидкую и твердую фазы; и (2) либо сбор супернатанта, содержащего оцРНК, либо удаление целлюлозного материала. Согласно альтернативному варианту осуществления на стадии (ii) и/или (iii) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК, целлюлозного материала и первого буфера, и стадия (iii) предусматривает (1') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы; и (2') сбор стока, содержащего оцРНК.
Согласно одному варианту осуществления процедуры отрицательной очистки, стадии (ii) и (iii) повторяют один раз или два или больше раз, причем препарат оцРНК, полученный после стадии (iii) одного цикла стадий (ii) и (iii), используют как препарат РНК на стадии (ii) следующего цикла и на стадии (ii) каждого цикла стадий (ii) и (iii) используют свежий целлюлозный материал.
Согласно второму основному варианту осуществления первого аспекта стадию (ii) проводят при условиях, которые обеспечивают возможность связывания дцРНК и оцРНК с целлюлозным материалом; и стадию (iii) проводят при условиях, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом (этот второй основной вариант осуществления первого аспекта иногда в настоящем документе называется процедурой "положительной" очистки, так как сначала дцРНК и оцРНК связываются с целлюлозным материалом, а затем оцРНК селективно высвобождают из целлюлозного материала, тогда как дцРНК остается связанной).
Согласно одному варианту осуществления процедуры положительной очистки стадия (ii) предусматривает (1) смешивание препарата РНК, содержащего оцРНК, с целлюлозным материалом при встряхивании и/или перемешивании, предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин; и (2) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от остального.
Согласно одному варианту осуществления процедуры положительной очистки на стадии (ii) препарат РНК получают в виде жидкости, содержащей оцРНК и второй буфер, и/или целлюлозный материал получают в виде суспензии во втором буфере, причем второй буфер содержит воду, этанол и соль, предпочтительно хлорид натрия, в концентрации, которая обеспечивает возможность связывания дцРНК и оцРНК с целлюлозным материалом. Согласно одному варианту осуществления концентрация этанола во втором буфере составляет по меньшей мере 35% (объем./объем.), предпочтительно 38-42% (объем./объем.). Согласно одному варианту осуществления концентрация соли во втором буфере составляет 15-70 мM, предпочтительно 20-60 мM. Согласно одному варианту осуществления второй буфер дополнительно содержит буферное вещество, предпочтительно трис(гидроксиметил)аминометан (TRIS), и/или хелатирующее средство, предпочтительно EDTA.
Согласно одному варианту осуществления процедуры положительной очистки на стадии (ii)(1) и/или (ii)(2) обеспечивают наличие в пробирке смеси препарата РНК и целлюлозного материала, полученной на стадии (ii)(1), и стадия (ii)(2) предусматривает (2a) приложение силы тяжести или центробежной силы к пробирке с тем, чтобы разделить жидкую и твердую фазы; и (2b) либо удаление супернатанта, либо сбор целлюлозного материала, с которым связаны дцРНК и оцРНК. Согласно альтернативному варианту осуществления на стадии (ii)(1) и/или (ii)(2) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК и целлюлозного материала, полученной на стадии (ii)(1), и стадия (ii)(2) предусматривает (2a') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы; и (2b') отбрасывание стока.
Согласно одному варианту осуществления процедуры положительной очистки стадия (ii) дополнительно предусматривает (3) добавление аликвоты второго буфера с целлюлозным материалом, с которым связаны дцРНК и оцРНК; (4) инкубацию полученной смеси при встряхивании и/или перемешивании, предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин; и (5) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от жидкой фазы; и необязательно (6) повторение стадий (3) - (5) один раз или два или больше раз.
Согласно одному варианту осуществления процедуры положительной очистки стадия (iii) предусматривает (1) смешивание целлюлозного материала, с которым связаны дцРНК и оцРНК, с первым буфером при встряхивании и/или перемешивании, предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, причем первый буфер содержит воду, этанол и соль, предпочтительно хлорид натрия, в концентрации, которая обеспечивает возможность связывания дцРНК с целлюлозным материалом и не позволяет оцРНК связываться с целлюлозным материалом; и (2) отделение жидкой фазы, содержащей оцРНК, от целлюлозного материала. Согласно одному варианту осуществления концентрация этанола в первом буфере составляет 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.). Согласно одному варианту осуществления концентрация соли в первом буфере составляет 15-70 мM, предпочтительно 20-60 мM. Согласно одному варианту осуществления первый буфер дополнительно содержит буферное вещество, предпочтительно трис(гидроксиметил)аминометан (TRIS), и/или хелатирующее средство, предпочтительно EDTA.
Согласно одному варианту осуществления процедуры положительной очистки на стадии (iii) обеспечивают наличие в пробирке смеси целлюлозного материала и первого буфера, и стадия (iii)(2) предусматривает (2a) приложение силы тяжести или центробежной силы к пробирке с тем, чтобы разделить жидкую и твердую фазы; и (2b) либо сбор супернатанта, содержащего оцРНК, либо удаление целлюлозного материала. Согласно альтернативному варианту осуществления на стадии (iii) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси целлюлозного материала и первого буфера, и стадия (iii)(2) предусматривает (2a') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству; и (2b') сбор стока, содержащего оцРНК.
Согласно одному варианту осуществления процедуры положительной очистки стадии (ii) и (iii) повторяют один раз или два или больше раз, причем препарат оцРНК, полученный после стадии (iii) одного цикла стадий (ii) и (iii), используют как препарат РНК на стадии (ii) следующего цикла и на стадии (ii) каждого цикла стадий (ii) и (iii) используют свежий целлюлозный материал.
Согласно одному варианту осуществления процедуры положительной очистки на стадии (ii) обеспечивают наличие в колонке целлюлозного материала, стадия (ii) предусматривает загрузку препарата РНК на колонку при условиях, которые обеспечивают возможность связывания дцРНК и оцРНК с целлюлозным материалом, и стадия (iii) предусматривает элюирование оцРНК из целлюлозного материала при условиях, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом. Согласно одному варианту осуществления на стадии (ii) препарат РНК получают и загружают на колонку в виде жидкости, содержащей оцРНК и второй буфер, причем второй буфер содержит воду, этанол и соль, предпочтительно хлорид натрия, в концентрации, которая обеспечивает возможность связывания дцРНК и оцРНК с целлюлозным материалом. Согласно одному варианту осуществления концентрация этанола во втором буфере составляет по меньшей мере 35% (объем./объем.), предпочтительно 38-42% (объем./объем.). Согласно одному варианту осуществления концентрация соли во втором буфере составляет 15-70 мM, предпочтительно 20-60 мM. Согласно одному варианту осуществления второй буфер дополнительно содержит буферное вещество, предпочтительно трис(гидроксиметил)аминометан (TRIS), и/или хелатирующее средство, предпочтительно EDTA. Согласно одному варианту осуществления стадию (iii) проводят с использованием первого буфера в качестве элюента, причем первый буфер содержит воду, этанол и соль, предпочтительно хлорид натрия, в концентрации, которая обеспечивает возможность связывания дцРНК с целлюлозным материалом и не позволяет оцРНК связываться с целлюлозным материалом. Согласно одному варианту осуществления концентрация этанола в первом буфере составляет 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.). Согласно одному варианту осуществления концентрация соли в первом буфере составляет 15-70 мM, предпочтительно 20-60 мM. Согласно одному варианту осуществления первый буфер дополнительно содержит буферное вещество, предпочтительно трис(гидроксиметил)аминометан (TRIS), и/или хелатирующее средство, предпочтительно EDTA.
Согласно одному варианту осуществления первого аспекта препарат РНК получают с использованием РНК-полимеразы, выбранной из группы, состоящей из РНК-полимераз T3, T7 и SP6.
Согласно одному варианту осуществления первого аспекта перед стадией (ii) препарат РНК подвергают по меньшей мере одной обработке, предшествующей очистке. Согласно одному варианту осуществления по меньшей мере одна обработка, предшествующая очистке, предусматривает одно или несколько из следующего: осаждение нуклеиновых кислот, предпочтительно с использованием хлорида лития; связывание нуклеиновых кислот с магнитными гранулами; ультрафильтрация; и разложение ДНК, предпочтительно с использованием специфической для двойной спирали нуклеазы (DSN).
Согласно одному варианту осуществления первого аспекта оцРНК представляет собой иРНК или ингибирующую РНК (такую как антисмысловая РНК, киРНК (короткая интерферирующая РНК) или микроРНК).
Согласно одному варианту осуществления первого аспекта оцРНК характеризуется длиной, составляющей по меньшей мере 2700 нуклеотидов, предпочтительно по меньшей мере 2800 нуклеотидов, по меньшей мере 2900 нуклеотидов, по меньшей мере 3000 нуклеотидов, по меньшей мере 3100 нуклеотидов, по меньшей мере 3200 нуклеотидов, по меньшей мере 3300 нуклеотидов, по меньшей мере 3400 нуклеотидов, например, по меньшей мере 3500 нуклеотидов, по меньшей мере 3600 нуклеотидов, по меньшей мере 3700 нуклеотидов, по меньшей мере 3800 нуклеотидов, по меньшей мере 3900 нуклеотидов, по меньшей мере 4000 нуклеотидов, по меньшей мере 4100 нуклеотидов, по меньшей мере 4200 нуклеотидов, по меньшей мере 4300 нуклеотидов, по меньшей мере 4400 нуклеотидов или по меньшей мере 4500 нуклеотидов.
Согласно одному варианту осуществления первого аспекта целлюлозный материал содержит целлюлозные волокна, предпочтительно целлюлозные волокна степени чистоты, подходящей для применения в качестве реагента для распределительной хроматографии. Согласно одному варианту осуществления перед приведением в контакт с препаратом РНК на стадии (ii) целлюлозный материал получают в виде промытого целлюлозного материала. Согласно одному варианту осуществления промывка целлюлозного материала включает в себя (I) смешивание целлюлозного материала с промывочным раствором при встряхивании и/или перемешивании, предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин; и (II) либо удаление жидкости, либо сбор целлюлозного материала; и необязательно (III) повторение стадий (I) и (II) один раз или два или больше раз. Согласно одному варианту осуществления промывочный раствор характеризуется композицией (A) первого буфера, как определено выше или ниже, если стадию (ii) проводят при условиях, которые обеспечивают возможность связывания дцРНК с промытым целлюлозным материалом и не позволяют оцРНК связываться с промытым целлюлозным материалом (т.е. в вариантах осуществления процедуры "отрицательной" очистки), или (B) второго буфера, как определено выше или ниже, если стадию (ii) проводят при условиях, которые обеспечивают возможность связывания дцРНК и оцРНК с промытым целлюлозным материалом (т.е. в вариантах осуществления процедуры "положительной" очистки).
Согласно второму аспекту настоящее изобретение относится к оцРНК, которую можно получить с помощью любого способа согласно первому аспекту. Согласно одному варианту осуществления второго аспекта оцРНК по существу не содержит дцРНК и/или по существу не содержит ДНК, предпочтительно по существу не содержит дцРНК и ДНК.
Согласно третьему аспекту настоящее изобретение относится к оцРНК согласно второму аспекту для применения в терапии.
Дополнительные аспекты, а также преимущества и новые признаки настоящего изобретения станут очевидными из последующего подробного описания необязательно в сочетании с прилагаемыми графическими материалами.
Краткое описание графических материалов
Фигура 1: Копреципитация дцРНК из IVT РНК с помощью целлюлозы. После инкубации с целлюлозным материалом в присутствии 1× буфера STE, содержащего 16% (объем./объем.) EtOH, несвязанные и связанные фракции 50 мкг m1Ψ-модифицированной IVT РНК, длина которой составляет 2500 нуклеотидов, анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Для сравнения неочищенную РНК (вводимую) анализировали параллельно. 180 нг, 900 нг и 1800 нг РНК соответствующих РНК загружали для анализа методом дот-блот. Для контроля целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза.
Фигура 2: Влияние различных концентраций EtOH на эффективность удаления дцРНК из IVT РНК с помощью целлюлозы. После инкубации с целлюлозным материалом в присутствии 1× буфера STE, содержащего 16% (объем./объем.), 18% (объем./объем.) или 20% (объем./объем.) EtOH, несвязанные и связанные фракции 50 мкг составляющей 1500 нуклеотидов в длину Ψ-модифицированной и D2-кэпированной IVT РНК анализировали в отношении примесей дцРНК и гибрида РНК/ДНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 или специфического в отношении гибрида РНК-ДНК антитела S 9.6, соответственно. Для сравнения неочищенную РНК (вводимую) анализировали параллельно. 40 нг, 200 нг и 1000 нг РНК соответствующих РНК загружали на две отдельные мембраны, каждую из которых гибридизовали с указанными антителами в анализе методом дот-блот.
Фигура 3: Сравнение целлюлозной очистки IVT РНК с обработкой РНКазой III и очисткой с помощью ВЭЖХ. 100 мкг составляющей 2500 нуклеотидов в длину m1Ψ-модифицированной IVT РНК очищали 1-, 2- или 3-кратно с помощью целлюлозы с использованием микроцентрифужных спин-колонок и 1× буфера STE, содержащего 16% (объем./объем.) EtOH. 200 нг, 1000 нг и 3000 нг очищенной с помощью целлюлозы РНК анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Для сравнения те же количества неочищенной РНК, а также обработанных РНКазой III и очищенных с помощью ВЭЖХ РНК загружали на мембрану для дот-блоттинга. Сигналы гибридизации количественно определяли с помощью денситометрии и значения выражали как процентное отношение дцРНК, удаленной из неочищенной РНК. Для контроля целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза.
Фигура 4: Сравнение производительности различных типов целлюлозы в удалении дцРНК из IVT РНК. Несвязанные и связанные фракции по 100 мкг составляющей 1500 нуклеотидов в длину m1Ψ-модифицированной IVT РНК после 1 цикла очистки с использованием различных типов целлюлозы (Sigma, C6288; Macherey-Nagel, MN 100 и MN 2100), микроцентрифужных спин-колонок и 1× буфера STE, содержащего 16% (объем./объем.) EtOH, анализировали с помощью дот-блоттинга. Образцы по 80 нг, 400 нг и 2000 нг РНК анализировали в отношении примесей дцРНК с использованием специфического в отношении дцРНК антитела J2. Для сравнения такое же количество неочищенной РНК (вводимой РНК) загружали на мембрану для дот-блоттинга. Сигналы гибридизации количественно определяли с помощью денситометрии и значения выражают как процентное отношение дцРНК, удаленной из неочищенной РНК. Для мониторинга целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза.
Фигура 5: Целлюлозный способ очистки является масштабируемым. 5 мг составляющей 1900 нуклеотидов в длину D1-кэпированной IVT РНК очищали 1- или 2-кратно с помощью целлюлозы с использованием фильтровальных устройств с вакуумным приводом и 1× буфера STE, содержащего 16% (объем./объем.) EtOH. 40 нг, 200 нг и 1000 нг очищенной с помощью целлюлозы РНК анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Для сравнения такие же количества неочищенной РНК (вводимой РНК) загружали на мембрану для дот-блоттинга. Сигналы гибридизации количественно определяли с помощью денситометрии и значения выражают как процентное отношение дцРНК, удаленной из неочищенной РНК. Для контроля целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза. Указаны степени извлечения РНК для обоих образцов.
Фигура 6: Очистка IVT РНК с помощью различной длины с использованием процедуры "положительной" очистки. 400 мкг составляющей >10000 нуклеотидов в длину D1-кэпированной IVT РНК, составляющей 1300 нуклеотидов в длину D2-кэпированной IVT РНК (A) и составляющей 2500 нуклеотидов в длину IVT РНК (некэпированной) (B) использовали для 2 циклов целлюлозной очистки. Ни одна из РНК не содержала нуклеозидные модификации. Во время первого цикла РНК полностью связывались с целлюлозой с использованием 1× STE, содержащего 40% (объем./объем.) EtOH, перед элюированием с помощью содержащего 16% (объем./объем.) EtOH буфера и переносом на вторую микроцентрифужную колонку, содержащую целлюлозный материал ("положительная" очистка). Указанные количества очищенных РНК анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Для сравнения такие же количества неочищенных РНК загружали на мембраны для дот-блоттинга. Для мониторинга целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозные гели и разделяли с помощью электрофореза.
Фигура 7: Очистка IVT РНК с использованием буферов с различной ионной силой. 250 мкг (A) или 160 мкг (B) составляющей 1300 нуклеотидов в длину m1Ψ-модифицированной IVT РНК очищали с помощью целлюлозы с использованием 1× буферов STE, содержащих 25-150 мM NaCl (A) или 0-50 мM NaCl (B). Перед элюированием с помощью соответствующих буферов, содержащих 16% (объем./объем.) EtOH, с последующим элюированием с содержащими 0% (объем./объем.) EtOH буферами РНК была полностью связана с целлюлозой в присутствии 40% (объем./объем.) EtOH. 40 нг, 200 нг, 1,000 нг и 3000 нг элюированных РНК анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Вследствие низкого извлечения только 40 нг, 200 нг и 1000 нг РНК, элюированной с помощью 0% (объем./объем.) EtOH, можно загрузить для анализа методом дот-блот в (B). Для сравнения такие же количества неочищенной РНК (вводимой РНК) загружали на мембраны для дот-блоттинга. Сигналы гибридизации количественно определяли с помощью денситометрии и значения выражают как процентное отношение дцРНК, удаленной из неочищенной РНК. Для мониторинга целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозные гели и разделяли с помощью электрофореза.
Фигура 8: Целлюлозная очистка IVT РНК с помощью ЖХБР (жидкостной хроматографии быстрого разешения, FPLC). (A) Показана хроматограмма ЖХБР 500 мкг составляющей 1300 нуклеотидов в длину m1Ψ-модифицированной IVT РНК, причем РНК загружали на колонку XK 16/20, заполненную с помощью 4 г целлюлозного материала. Связывание проводили с помощью 1 × STE, содержащего 40% (объем./объем.) EtOH, примеси оцРНК и дцРНК элюировали с помощью уменьшения концентрации EtOH подвижного буфера до 16% (объем./объем.) и 0% (объем./объем.), соответственно. Собирали фракции, указанные в серой рамке на хроматограмме (F1: элюат 16% EtOH, F2: элюат 0% EtOH). (B) 40 нг, 200 нг, 1000 нг и 3000 нг РНК, извлеченных из фракций F1 и F2, анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Для сравнения такие же количества неочищенной РНК (вводимой РНК) загружали на мембрану для дот-блоттинга. Сигналы гибридизации количественно определяли с помощью денситометрии и значения выражают как процентное отношение дцРНК, удаленной из неочищенной РНК. Для мониторинга целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза.
Фигура 9: Очистка IVT РНК с использованием различных концентраций EtOH для элюирования оцРНК. 200 мкг составляющей 1500 нуклеотидов в длину D1-кэпированной IVT РНК очищали с помощью целлюлозы с использованием 1× буфера STE, содержащего 6%, 10%, 12%, 14%, 16, 18%, 20% или 24% (объем./объем.) EtOH, для элюирования оцРНК. Перед элюированием РНК были полностью связаны с целлюлозой в присутствии 40% (объем./объем.) EtOH. 200 нг, 1000 нг и 3000 нг элюированных оцРНК анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 (A). Для сравнения такие же количества неочищенной РНК (вводимой РНК) загружали на мембрану для дот-блоттинга. Для мониторинга целостности РНК 80 нг РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза. (B) Сигналы гибридизации количественно определяли с помощью денситометрии и значения (выраженные как процентное отношение дцРНК, удаленной из неочищенной РНК) наносили на график в зависимости от концентраций EtOH, используемых для элюирования (сплошная линия) и сравнивали со степенями РНК, извлеченных из индивидуальных элюатов (штриховая линия).
Фигура 10: Определение способности целлюлозы к связыванию РНК. 0,1 г целлюлозы (Sigma, C6288) инкубировали с 25 мкг, 50 мкг, 100 мкг, 250 мкг, 500 мкг, 750 мкг, 1000 мкг или 1500 мкг составляющей 1500 нуклеотидов в длину D1-кэпированной IVT РНК в 500 мкл 1× STE, содержащего 40% (объем./объем.) EtOH, в микроцентрифужной колонке. После разделение несвязанной РНК с помощью центрифугирования связанную с целлюлозой РНК элюировали поэтапно, сначала с помощью 1× STE, содержащего 16% (объем./объем.) EtOH, и в конце с помощью H2O (0% (объем./объем.) EtOH). После осаждения количества РНК, извлеченной из стока (A, B; 40% (объем./объем.) EtOH, сплошная линия), элюата 16% (объем./объем.) EtOH (A, B; штриховая линия) и элюата 0% (объем./объем.) EtOH (A, B; пунктирная линия) определяли с помощью спектрофотометрии и наносили на график в зависимости от общего количества РНК, используемого для очистки. Значения представляют в виде степени извлечения относительно общего количества используемой РНК (A) или в виде общего выхода извлеченной РНК (B). 200 нг, 1000 нг и 3000 нг РНК, извлеченной из 16% (объем./объем.) элюатов, анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 (C). Для сравнения такие же количества неочищенной РНК (вводимой РНК) загружали на мембрану для дот-блоттинга. Для мониторинга целостности РНК 80 нг указанных РНК загружали на 1,4% (масс./объем.) агарозный гель и разделяли с помощью электрофореза. Сигналы гибридизации количественно определяли с помощью денситометрии и значения (выраженные как процентное отношение дцРНК, удаленной из неочищенной РНК) наносили на график в зависимости от общего количества используемой для очистки РНК (D; сплошная линия) и сравнивали со степенями РНК, извлеченных из отдельных элюатов 16% (объем./объем.) EtOH (D; штриховая линия).
Фигура 11: Влияние целлюлозной очистки IVT РНК на ее способность к трансляции и иммуногенность. D1-кэпированную IVT РНК (200 мкг), кодирующую мышиный эритропоэтин (EPO), либо оставляли неочищенной, либо очищали с помощью 2-стадийной процедуры с использованием 2 спин-колонок, каждая из которых заполнена целлюлозным материалом: 1ая колонка: положительная очистка IVT РНК (т.е. связывание дцРНК и оцРНК с использованием 1× буфера STE, содержащего 40% (объем./объем.) EtOH; элюирование оцРНК с использованием 1× буфера STE, содержащего 16% (объем./объем.) EtOH); 2ая колонка: отрицательная очистка элюата из 1ой колонки (т.е. элюата, содержащего оцРНК и полученного из 1ой колонки с использованием 1× буфера STE, содержащего 16% EtOH)). Сток, полученный из 2ой колонки, осаждали с помощью изопропанола/ ацетата натрия и повторно растворяли в H2O. После введения в состав с TransIT (Mirus Bio) IVT РНК вводили с помощью интраперитонеальной инъекции мышам (n=4) в дозе, составляющей 3 мкг РНК/животное. Производили забор крови через 2, 6 и 24 ч после инъекции и собирали образцы плазмы. Контрольным мышам вводили инъекцию только TransIT. Содержания мышиного интерферона альфа (A) и мышиного EPO (B) измеряли с использованием специфических анализов ELISA (специфический к мышиному интерферону альфа ELISA (eBioscience); набор для специфического к мышиному EPO ELISA DuoSet ELISA Development kit (R&D)).
Подробное раскрытие настоящего изобретения
Несмотря на то, что настоящее изобретение дополнительно описано более подробно ниже, следует понимать, что настоящее изобретение не ограничено конкретными методиками, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьировать. Кроме того, также следует понимать, что терминология, используемая в настоящем документе, используется исключительно с целью описания конкретных вариантов осуществления, и не подразумевается, что она ограничивает объем настоящего изобретения, который будет ограничен лишь прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют такие же значения, что и значения, которые обычно понятны среднему специалисту в настоящей области техники.
Далее элементы согласно настоящему изобретению будут описаны более подробно. Указанные элементы перечислены вместе с конкретными вариантами осуществления, тем не менее следует понимать, что их можно комбинировать любым образом и в любом количестве для создания дополнительных вариантов осуществления. Различным образом описанные примеры и предпочтительные варианты осуществления не следует рассматривать как ограничивающие настоящее изобретение только явно описанными вариантами осуществления. Настоящее описание следует понимать как поддерживающее и охватывающее варианты осуществления, которые объединяют явно описанные варианты осуществления с любым количеством раскрытых и/или предпочтительных элементов. Более того, любые перестановки и комбинации всех описанных элементов в настоящей заявке следует рассматривать как раскрытые описанием настоящей заявки, если контекст не указывает иное. Например, если согласно предпочтительному варианту осуществления оцРНК содержит поли(A)-хвост, состоящий из 120 нуклеотидов, и согласно другому предпочтительному варианту осуществления оцРНК молекула содержит аналог 5'-кэп, то согласно предпочтительному варианту осуществления оцРНК содержит поли(A)-хвост, состоящий из 120 нуклеотидов и аналог 5'-кэп. Аналогично, если согласно предпочтительному варианту осуществления концентрация EtOH в первом буфере составляет 14-16% (объем./объем.), и согласно другому предпочтительному варианту осуществления концентрация хелатирующего средства в первом буфере составляет 15-40 мM, то согласно предпочтительному варианту осуществления первый буфер содержит EtOH в концентрации, составляющей 14-16% (объем./объем.), и хелатирующее средство в концентрации, составляющей 15-40 мM.
Предпочтительно используемые в настоящем документе термины определяют, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, and H. Kölbl, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
При осуществлении на практике настоящего изобретения будут использовать, если не указано иное, общепринятые способы химии, биохимии и техники рекомбинантной ДНК, которые объяснены в литературе в настоящей области техники (см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
По всему описанию настоящего изобретения и формуле изобретения, которая за ним следует, если контекст не требует иного, слово "содержат" и такие вариации, как "содержит" и "содержащий", будет подразумевать включение указанного представителя, целого числа или стадии или группы представителей, целых чисел или стадий, но не исключение любого другого представителя, целого числа или стадии или группы представителей, целых чисел или стадий. Термин "состоящий по существу из" означает исключение других представителей, целых чисел или стадий любого существенного значения. Термин "содержащий" охватывает термин "состоящий по существу из", который, в свою очередь, охватывает термин "состоящий из". Таким образом, в каждом случае в настоящей заявке термин "содержащий" можно заменить термином "состоящий по существу из" или "состоящий из". Аналогично, в каждом случае в настоящей заявке термин "состоящий по существу из" можно заменить термином "состоящий из".
Формы единственного числа, используемые в контексте описания настоящего изобретения (особенно в контексте формулы изобретения) следует рассматривать как охватывающие как формы единственного, так и множественного числа, если в настоящем документе не указано иное или это явно не противоречит контексту. Подразумевается, что перечисление диапазонов значений в настоящем документе служит исключительно как сокращенный способ обращения индивидуально к каждому отдельному значению, попадающему в указанный диапазон. Если в настоящем документе не указано иное, каждое индивидуальное значение включено в настоящее описание изобретения, как если бы оно было индивидуально перечислено в настоящем документе. Все способы, описанные в настоящем документе, можно провести в любом подходящем порядке, если в настоящем документе не указано иное или это иным образом явно не противоречит контексту. Применение любого и всех примеров или иллюстративного выражения (например, "такой как"), приведенных в настоящем документе, предусмотрено исключительно для того, чтобы лучше проиллюстрировать настоящее изобретение, и не представляет собой ограничение объема настоящего изобретения, заявленного иным образом. Никакое выражение в описании настоящего изобретения не следует толковать как указывающее на какой-либо не заявленный элемент, необходимый для осуществления настоящего изобретения на практике.
Несколько документов процитированы в тексте настоящего описания изобретения. Каждый из документов, процитированных в настоящем документе (включая в себя все патенты, заявки на выдачу патента, научные публикации, предоставленные производителем технические характеристики, инструкции и т.д.), будь то выше или ниже, полностью включены в настоящий документ посредством ссылки. Ничто в настоящем документе не должно быть истолковано как допущение того, что настоящее изобретение не наделено правом предшествовать такому раскрытию на основании предыдущего изобретения.
Используемое в настоящем документе выражение "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом" означают условия, которые способствуют (например, усиливают) прикреплению (предпочтительно нековалентному прикреплению или адсорбции) дцРНК к целлюлозному материалу, ингибируют высвобождение дцРНК, связанной с целлюлозным материалом, из целлюлозного материала и/или снижают количество свободной дцРНК (т.е. дцРНК, которая не связана с целлюлозным материалом). Указанные условия могут являться такими, что они позволяют или не позволяют РНК, отличным от дцРНК (например, оцРНК), связываться с целлюлозным материалом. Таким образом, согласно одному варианту осуществления выражение "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом" представляют собой "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом". Согласно этому варианту осуществления условия (i) способствуют (например, усиливают) прикреплению (предпочтительно нековалентному прикреплению или адсорбции) дцРНК к целлюлозному материалу, ингибируют высвобождение дцРНК, связанной с целлюлозным материалом, из целлюлозного материала и/или снижают количество свободной дцРНК (т.е. количество дцРНК, не связанной с целлюлозным материалом), и (ii) способствуют (например, усиливают) несвязанному состоянию оцРНК (т.е. состоянию оцРНК, не прикрепленной или адсорбированной на целлюлозном материале), снижают количество оцРНК, прикрепленной (предпочтительно нековалентно прикрепленной или адсорбированной) к целлюлозному материалу, и/или ингибируют прикрепление (предпочтительно нековалентное прикрепление или адсорбцию) оцРНК к целлюлозному материалу. Согласно альтернативному варианту осуществления выражение "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом" представляют собой "условия, которые обеспечивают возможность связывания дцРНК и оцРНК с целлюлозным материалом". Согласно этому альтернативному варианту осуществления условия способствуют (например, усиливают) прикреплению (предпочтительно нековалентному прикреплению или адсорбции) дцРНК и оцРНК к целлюлозному материалу, ингибируют высвобождение дцРНК и оцРНК, связанных с целлюлозным материалом, из целлюлозного материала и/или снижают количество свободной дцРНК и оцРНК (т.е. количество дцРНК и оцРНК, не связанных с целлюлозным материалом).
Описанные выше условия, которые позволяют или не позволяют дцРНК/оцРНК связываться с целлюлозным материалом, можно контролировать с помощью композиции среды (такой как композиция буфера), в которой препарат РНК, содержащий дцРНК/оцРНК, растворяют или которую добавляют к целлюлозному материалу. В этом отношении "композиция" означает тип и количество компонентов, содержащихся в среде (например, в буфере).
Таким образом, согласно одному варианту осуществления "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом" могут быть достигнуты с помощью первой среды (например, первого буфера), содержащей воду, этанол и соль в концентрации, которая обеспечивает возможность связывания дцРНК с целлюлозным материалом и которая не позволяет оцРНК связываться с целлюлозным материалом. Следовательно, для удовлетворения указанных условий на стадии (ii) препарат РНК можно получить в виде жидкости, содержащей оцРНК и первую среду (например, первый буфер); целлюлозный материал можно получить в виде суспензии в первой среде (например, первом буфере) (например, в виде промытого целлюлозного материала, причем первую среду (например, первый буфер) использовали в качестве промывочного раствора); препарат РНК можно получить в виде жидкости, содержащей оцРНК и первую среду (например, первый буфер), и целлюлозный материал можно получить в виде суспензия в первой среде (например, первом буфере); или препарат РНК можно получить в виде жидкости, содержащей оцРНК и первую среду (например, первый буфер), и целлюлозный материал можно получить в виде промытого целлюлозного материала (причем первую среду (например, первый буфер) использовали в качестве промывочного раствора), или в сухой форме, или в виде суспензии в первой среде (например, первом буфере).
Выражение "в концентрации, которая обеспечивает возможность связывания дцРНК с целлюлозным материалом и которая не позволяет оцРНК связываться с целлюлозным материалом" означает, что концентрация компонентов (в частности воды, этанола и соли) в первой среде (например, в первом буфере) является достаточной, чтобы (i) способствовать (например, усиливать) прикреплению (предпочтительно нековалентному прикреплению или адсорбции) дцРНК к целлюлозному материалу, ингибировать высвобождение дцРНК, связанной с целлюлозным материалом, из целлюлозного материала в первую среду (например, в первый буфер) и/или снижать количество свободной дцРНК (т.е. количество дцРНК, не связанной с целлюлозным материалом) в первой среде (например, в первом буфере), и (ii) способствовать (например, усиливать) несвязанному состоянию оцРНК (т.е. состоянию оцРНК, не прикрепленной или адсорбированной к целлюлозному материалу), снижать количество оцРНК, прикрепленной (предпочтительно нековалентно прикрепленной или адсорбированной) к целлюлозному материалу и/или ингибировать прикрепление (предпочтительно нековалентное прикрепление или адсорбцию) оцРНК к целлюлозному материалу.
Более того, согласно одному варианту осуществления "условия, которые обеспечивают возможность связывания дцРНК и оцРНК с целлюлозным материалом" могут быть достигнуты с помощью второй среды (например, второго буфера), содержащего воду, этанол и соль в концентрации, которая обеспечивает возможность связывания дцРНК и оцРНК с целлюлозным материалом. Следовательно, для удовлетворения указанных условий на стадии (ii) препарат РНК можно получить в виде жидкости, содержащей оцРНК и вторую среду (например, второй буфер); целлюлозный материал можно получить в виде суспензии во второй среде (например, втором буфере) (например, в виде промытого целлюлозного материала, причем вторую среду (например, второй буфер) использовали в качестве промывочного раствора); препарат РНК можно получить в виде жидкости, содержащей оцРНК и вторую среду (например, второй буфер), и целлюлозный материал можно получить в виде суспензии во второй среде (например, втором буфере); или препарат РНК можно получить в виде жидкости, содержащей оцРНК и вторую среду (например, второй буфер), и целлюлозный материал можно получить в виде промытого целлюлозного материала (причем вторую среду (например, второй буфер) использовали в качестве промывочного раствора), или в сухой форме, или в виде суспензии во второй среде (например, втором буфере).
Выражение "в концентрации, которая обеспечивает возможность связывания дцРНК и оцРНК с целлюлозным материалом" означает, что концентрация компонентов (в частности воды, этанола и соли) во второй среде (например, во втором буфере) является достаточной, чтобы способствовать (например, усиливать) прикреплению (предпочтительно нековалентному прикреплению или адсорбции) дцРНК и оцРНК к целлюлозному материалу, ингибировать высвобождение дцРНК и оцРНК, связанных с целлюлозным материалом, из целлюлозного материала во вторую среду (например, во второй буфер) и/или снижать количество свободной дцРНК и оцРНК (т.е. количество дцРНК и оцРНК, не связанных с целлюлозным материалом) во второй среде (например, во втором буфере).
Авторы настоящего изобретения неожиданно обнаружили, что дцРНК, но не оцРНК, селективно связывается с целлюлозным материалом в присутствии этанола в концентрации, составляющей 14-20% (объем./объем.). Таким образом, согласно одному варианту осуществления "условия, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом" могут быть достигнуты с помощью первой среды (например, первого буфера), как определено выше, которая содержит этанол в концентрации, составляющей 14-20% (объем./объем.), предпочтительно 14-19% (объем./объем.), более предпочтительно 14-18% (объем./объем.), например, 14-17% (объем./объем.), 14-16% (объем./объем.), 15-19% (объем./объем.), 15-18% (объем./объем.), 15-17% (объем./объем.), 16-19% (объем./объем.) или 16-18% (объем./объем.). Согласно одному варианту осуществления первая среда (например, первый буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах, соль в концентрации, составляющей 15-70 мM, предпочтительно 20-60 мM, например, 25-50 мM или 30-50 мM. Соль в первой среде (например, первом буфере) представляет собой предпочтительно хлорид натрия. Тем не менее, на основании информации и данных, представленных в настоящей заявке, специалист сможет легко определить другие соли и их концентрации, которые являются подходящими для первой среды (например, первого буфера), подлежащей использованию в способах согласно настоящему изобретению. Дополнительные необязательные компоненты первой среды (например, первого буфера) содержат буферное вещество (предпочтительно TRIS или HEPES, более предпочтительно TRIS) и/или хелатирующее средство (предпочтительно EDTA или нитрилотриуксусную кислоту, более предпочтительно EDTA). Согласно одному варианту осуществления концентрация буферного вещества в первой среде (например, первом буфере) составляет 5-40 мM, предпочтительно 6-30 мM, например, 8-20 мM или 10-15 мM. Согласно одному варианту осуществления pH первой среды (например, первого буфера) составляет 6,5-8,0, предпочтительно 6,7-7,8, например, 6,8-7,2 (например, если TRIS представляет собой буферное вещество) или 7,3-7,7 (например, если HEPES представляет собой буферное вещество). Согласно одному варианту осуществления концентрация хелатирующего средства в первой среде (например, первом буфере) составляет 10-50 мM, предпочтительно 15-40 мM, например, 20-30 мM.
Согласно одному варианту осуществления первая среда (например, первый буфер) содержит воду, этанол, TRIS и EDTA (например, воду, этанол, соль (предпочтительно хлорид натрия), TRIS и EDTA), предпочтительно в концентрациях, определенных выше для первой среды (например, первого буфера). Тем не менее, на основании информации и данных, представленных в настоящей заявке, специалист может легко определить буферные вещества, отличные от TRIS, и/или хелатирующие средства, отличные от EDTA, и/или соли, отличные от хлорида натрия, а также их концентрации, которые являются подходящими для первой среды (например, первого буфера), подлежащей использованию в способах согласно настоящему изобретению. Например, согласно одному варианту осуществления первая среда (например, первый буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах (т.е. 14-20% (объем./объем.) и т.д.), TRIS в количестве, составляющем 5-40 мМ, и соль (предпочтительно хлорид натрия) в количестве, составляющем 15-70 мM. Согласно другому варианту осуществления первая среда (например, первый буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах (т.е. 14-20% (объем./объем.) и т.д.), HEPES в количестве, составляющем 5-40 мМ, и соль (предпочтительно хлорид натрия) в количестве, составляющем 100-150 мM (например, 110-140 мM или 120-130 мM).
Согласно одному варианту осуществления "условия, которые обеспечивают возможность связывания дцРНК и оцРНК с целлюлозным материалом" могут быть достигнуты с помощью второй среды (например, второго буфера), как указано выше, который содержит этанол в концентрации, составляющей по меньшей мере 35% (объем./объем.), предпочтительно по меньшей мере 36% (объем./объем.), по меньшей мере 37% (объем./объем.), по меньшей мере 38% (объем./объем.), по меньшей мере 39% (объем./объем.), по меньшей мере 40% (объем./объем.), такие как 35-45% (объем./объем.), 36-45% (объем./объем.), 37-45% (объем./объем.), 38-45% (объем./объем.), 38-42% (объем./объем.) или 39-41% (объем./объем.). Согласно одному варианту осуществления вторая среда (например, второй буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах (т.е. по меньшей мере 35% (объем./объем.), по меньшей мере 36% (объем./объем.), по меньшей мере 37% (объем./объем.), по меньшей мере 38% (объем./объем.) и т.д.), соль в концентрации, составляющей 15-70 мM, предпочтительно 20-60 мM, например, 25-50 мM или 30-50 мM. Соль во второй среде (например, втором буфере) представляет собой предпочтительно хлорид натрия. Тем не менее, на основании информации и данных, представленных в настоящей заявке, специалист может легко определить другие соли и их концентрации, которые являются подходящими для второй среды (например, второго буфера), подлежащей использованию в способах согласно настоящему изобретению. Дополнительные необязательные компоненты второй среды (например, второго буфера) содержат буферное вещество (предпочтительно TRIS или HEPES, более предпочтительно TRIS), и/или хелатирующее средство (предпочтительно EDTA или нитрилотриуксусную кислоту, более предпочтительно EDTA). Согласно одному варианту осуществления концентрация буферного вещества во второй среде (например, втором буфере) составляет 5-40 мМ, предпочтительно 6-30 мM, например, 8-20 мM или 10-15 мM. Согласно одному варианту осуществления pH второй среды (например, второго буфера) составляет 6,5-8,0, предпочтительно 6,7-7,8, например, 6,8-7,2 (например, если TRIS представляет собой буферное вещество) или 7,3-7,7 (например, если HEPES представляет собой буферное вещество). Согласно одному варианту осуществления концентрация хелатирующего средства во второй среде (например, втором буфере) составляет 10-50 мM, предпочтительно 15-40 мM, например, 20-30 мM.
Согласно одному варианту осуществления вторая среда (например, второй буфер) содержит воду, этанол, TRIS и EDTA (например, воду, этанол, соль (предпочтительно хлорид натрия), TRIS и EDTA), предпочтительно в концентрациях, указанных выше для второй среды (например, второго буфера). Тем не менее, на основании информации и данных, представленных в настоящей заявке, специалист может легко определить буферные вещества, отличные от TRIS, и/или хелатирующее средства, отличные от EDTA, и/или соли, отличные от хлорида натрия, а также их концентрации, которые являются подходящими для второй среды (например, второго буфера), подлежащей использованию в способах согласно настоящему изобретению. Согласно одному варианту осуществления вторая среда (например, второй буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах (т.е. по меньшей мере 35% (объем./объем.), по меньшей мере 36% (объем./объем.), по меньшей мере 37% (объем./объем.), по меньшей мере 38% (объем./объем.) и т.д.), TRIS в количестве, составляющем 5-40 мМ, и соль (предпочтительно хлорид натрия) в количестве, составляющем 15-70 мM. Согласно другому варианту осуществления вторая среда (например, второй буфер) содержит, в дополнение к этанолу в раскрытых выше диапазонах (т.е. по меньшей мере 35% (объем./объем.), по меньшей мере 36% (объем./объем.), по меньшей мере 37% (объем./объем.), по меньшей мере 38% (объем./объем.) и т.д.), HEPES в количестве, составляющем 5-40 мМ, и соль (предпочтительно хлорид натрия) в количестве, составляющем 100-150 мM (например, 110-140 мM или 120-130 мM).
Согласно одному варианту осуществления первая и вторая среды (т.е. первый и второй буферы) отличаются не только по концентрации этанола, но также по типу и/или концентрации одного или нескольких других компонентов (таких как соль, необязательное буферное вещество и/или необязательное хелатирующее средство). Согласно одному предпочтительному варианту осуществления первая и вторая среды (т.е. первый и второй буферы) характеризуются одинаковой композицией (т.е. в отношении типа и концентрации компонентов, отличных от воды, таких как соль, необязательное буферное вещество и необязательное хелатирующее средство) за исключением концентрации этанола.
Используемое в настоящем документе выражение "отделение оцРНК от целлюлозного материала при условиях, которые обеспечивают возможность связывания дцРНК с целлюлозным материалом" означает, что фазу, содержащую оцРНК (причем указанная фаза является предпочтительно жидкой), следует выделить из целлюлозного материала, с которым связана дцРНК. Такое выделение/отделение можно осуществить несколькими путями, известными специалисту в настоящей области техники, например, путем селективного удаления только целлюлозного материала, с которым связана дцРНК (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами, и с использованием магнита), или сбора только фазы, содержащей оцРНК (например, с использованием пипетки).
Например, согласно одному варианту осуществления обеспечивают наличие в пробирке смеси препарата РНК, целлюлозного материала и первого буфера (согласно этому варианту осуществления предпочтительным является то, что (α) препарат РНК получают в виде жидкости, содержащей оцРНК и первый буфер, и/или (β) целлюлозный материал получают в виде промытого целлюлозного материала (причем первый буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии в первой среде (например, первом буфере), и/или (γ) препарат РНК, целлюлозный материал и первый буфер смешивают при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); наиболее предпочтительным является то, что (α) препарат РНК получают в виде жидкости, содержащей оцРНК и первый буфер, (β) целлюлозный материал получают в виде промытого целлюлозного материала (причем первый буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии в первой среде (например, первом буфере), и (γ) препарат РНК, целлюлозный материал и первый буфер смешивают при встряхивании и/или перемешивании, например, в течение 5-30 мин или 10-20 мин). Согласно этому варианту осуществления предпочтительным является то, что стадия (iii) предусматривает (1) приложение силы тяжести или центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин) к пробирке с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить); и (2) или сбор супернатанта, содержащего оцРНК (например, с использованием пипетки), или удаление целлюлозного материала (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами и с использованием магнита). Стадии (ii) и (iii) можно повторять один раз или два или больше раз (например, один раз, два раза или три раза). Если стадии (ii) и (iii) повторяют, препарат оцРНК, полученный после стадии (iii) одного цикла, используют в качестве препарата РНК на стадии (ii) последующего (т.е. непосредственно следующего) цикла и в каждом цикле используют свежий целлюлозный материал (предпочтительно свежий промытый целлюлозный материал).
Согласно альтернативному варианту осуществления обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК, целлюлозного материала и первого буфера (согласно этому варианту осуществления предпочтительным является то, что (α) препарат РНК получают в виде жидкости, содержащей оцРНК и первый буфер, и/или (β) целлюлозный материал получают в виде промытого целлюлозного материала (причем первый буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии в первой среде (например, первом буфере), и/или (γ) препарат РНК, целлюлозный материал и первый буфер смешивают при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); наиболее предпочтительным является то, что (α) препарат РНК получают в виде жидкости, содержащей оцРНК и первый буфер, (β) целлюлозный материал получают в виде промытого целлюлозного материала (причем первый буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии в первой среде (например, первом буфере), и (γ) препарат РНК, целлюлозный материал и первый буфер смешивают при встряхивании и/или перемешивании, например, в течении 5-30 мин или 10-20 мин). Согласно этому варианту осуществления предпочтительным является то, что стадия (iii) предусматривает (1') приложение силы тяжести, центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин), давления (например, 1000 гПа - 3000 гПа) или вакуума (например, 100 гПа - 900 гПа, такие как 200 гПа - 800 гПа) к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить); и (2') сбор стока, содержащего оцРНК. Стадии (ii) и (iii) можно повторять один раз или два или больше раз (такие как один раз, два раза или три раза). Если стадии (ii) и (iii) повторяют, препарат оцРНК, полученный после стадии (iii) одного цикла, используют в качестве препарата РНК на стадии (ii) последующего (т.е. непосредственно следующего) цикла и в каждом цикле используют свежий целлюлозный материал (предпочтительно свежий промытый целлюлозный материал).
Используемое в настоящем документе выражение "отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от остатка" означает, что твердую фазу (т.е. целлюлозный материал), к которой дцРНК и оцРНК являются прикрепленными (предпочтительно нековалентно прикрепленными или адсорбированными), следует выделить из другой фазы (причем указанная другая фаза является предпочтительно жидкой). Такое выделение/отделение можно осуществить несколькими путями, известными специалисту в настоящей области техники, например, путем селективного сбора только целлюлозного материала, с которым связаны дцРНК и оцРНК (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами, и с использованием магнита) или селективного удаления только другой фазы (например, с использованием пипетки).
Например, согласно одному варианту осуществления обеспечивают наличие в пробирке смеси препарата РНК, целлюлозного материала и второго буфера (согласно этому варианту осуществления предпочтительным является то, что (α') препарат РНК получают в виде жидкости, содержащей оцРНК и второй буфер, и/или (β') целлюлозный материал получают в виде промытого целлюлозного материала (причем второй буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии во второй среде (например, втором буфере), и/или (γ') препарат РНК, целлюлозный материал и второй буфер смешивают при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); наиболее предпочтительным является то, что (α') препарат РНК получают в виде жидкости, содержащей оцРНК и второй буфер, (β') целлюлозный материал получают в виде промытого целлюлозного материала (причем второй буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии во второй среде (например, втором буфере), и (γ') препарат РНК, целлюлозный материал и второй буфер смешивают при встряхивании и/или перемешивании, например, в течение 5-30 мин или 10-20 мин). Согласно этому варианту осуществления предпочтительным является то, что стадия (ii)(2) (т.е. "отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от остатка") предусматривает (2a) приложение силы тяжести или центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин) к пробирке с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить); и (2b) или удаление супернатанта (например, с использованием пипетки), или сбор целлюлозного материала, с которым связаны дцРНК и оцРНК (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами, и с использованием магнита). Стадия (ii) может дополнительно предусматривать (3) добавление аликвоты второго буфера (предпочтительно аликвоты, являющейся 0,5-3 - кратной (например, 1-2 - кратной) объему целлюлозного материала) к целлюлозному материалу, с которым связаны дцРНК и оцРНК; (4) инкубацию полученной смеси при встряхивании и/или перемешивании (предпочтительно в течение 5-20 мин или 10-15 мин); и (5) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от жидкой фазы (предпочтительно отделение проводят таким же способом, как указано в стадиях (2a) и (2b), выше); и необязательно (6) повторение стадий (3) - (5) один раз или два или больше раз (например, один раз, два раза или три раза). Стадия (iii) может предусматривать (1) смешивание целлюлозного материала, с которым связаны дцРНК и оцРНК, с первым буфером, как указано выше (например, характеризующимся концентрацией EtOH, составляющей 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.)) при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); и (2) отделение жидкой фазы, содержащей оцРНК, от целлюлозного материала (предпочтительно стадию отделения жидкой фазы, содержащей оцРНК, от целлюлозного материала проводят, как указано выше, например, путем приложения силы тяжести или центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин) к пробирке с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить); и (2) или сбор супернатанта, содержащего оцРНК (например, с использованием пипетки), или удаление целлюлозного материала (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами и с использованием магнита). Стадии (ii) и (iii) можно повторять один раз или два или больше раз (например, один раз, два раза или три раза). Если стадии (ii) и (iii) повторяют, препарат оцРНК, полученный после стадии (iii) одного цикла, используют в качестве препарата РНК на стадии (ii) последующего (т.е. непосредственно следующего) цикла и в каждом цикле используют свежий целлюлозный материал (предпочтительно свежий промытый целлюлозный материал).
Согласно альтернативному варианту осуществления обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК, целлюлозного материала и второго буфера (согласно этому варианту осуществления предпочтительным является то, что (α') препарат РНК получают в виде жидкости, содержащей оцРНК и второй буфер, и/или (β') целлюлозный материал получают в виде промытого целлюлозного материала (причем второй буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии во второй среде (например, втором буфере), и/или (γ') препарат РНК, целлюлозный материал и второй буфер смешивают при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); наиболее предпочтительным является то, что (α') препарат РНК получают в виде жидкости, содержащей оцРНК и второй буфер, (β') целлюлозный материал получают в виде промытого целлюлозного материала (причем второй буфер использовали в качестве промывочного раствора), либо в сухой форме, либо в виде суспензии во второй среде (например, втором буфере), и (γ') препарат РНК, целлюлозный материал и второй буфер смешивают при встряхивании и/или перемешивании, например, в течение 5-30 мин или 10-20 мин). Согласно этому варианту осуществления предпочтительным является то, что стадия (ii)(2) (т.е. "отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от остатка") предусматривает (2a') приложение силы тяжести, центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин), давления (например, 1000 гПа - 3000 гПа) или вакуума (например, 100 гПа - 900 гПа, например, 200 гПа - 800 гПа) к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить; и (2b') отбрасывание стока. Стадия (ii) может дополнительно предусматривать (3) добавление аликвоты второго буфера (предпочтительно аликвоты, являющейся 0,5-3 - кратной (например, 1-2 - кратной) объему целлюлозного материала) к целлюлозному материалу, с которым связаны дцРНК и оцРНК; (4) инкубацию полученной смеси при встряхивании и/или перемешивании (предпочтительно в течение 5-20 мин или 10-15 мин); и (5) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от жидкой фазы (предпочтительно отделение проводят таким же способом, как указано в стадиях (2a') и (2b') выше); и необязательно (6) повторение стадий (3) - (5) один раз или два или больше раз (например, один раз, два раза или три раза). Стадия (iii) может предусматривать (1) смешивание целлюлозного материала, с которым связаны дцРНК и оцРНК, с первым буфером, как указано выше (например, характеризующимся концентрацией EtOH, составляющей 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.)) при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-30 мин или 10-20 мин); и (2) отделение жидкой фазы, содержащей оцРНК, от целлюлозного материала (предпочтительно стадию отделения жидкой фазы, содержащей оцРНК, от целлюлозного материала, проводят, как указано выше, например, путем приложения силы тяжести, центробежной силы (например, 10000 × g - 15000 × g в течение 1-5 мин), давления (например, 1000 гПа - 3000 гПа) или вакуума (например, 100 гПа - 900 гПа, например, 200 гПа - 800 гПа) к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить); и сбор стока, содержащего оцРНК. Стадии (ii) и (iii) можно повторять один раз или два или больше раз (например, один раз, два раза или три раза). Если стадии (ii) и (iii) повторяют, препарат оцРНК, полученный после стадии (iii) одного цикла, используют в качестве препарата РНК на стадии (ii) последующего (т.е. непосредственно следующего) цикла и в каждом цикле используют свежий целлюлозный материал (предпочтительно свежий промытый целлюлозный материал).
Согласно одному варианту осуществления процедуры положительной очистки обеспечивают наличие в колонке целлюлозного материала (согласно этому варианту осуществления предпочтительным является то, что целлюлозный материал получают в виде промытого целлюлозного материала, причем второй буфер, как указано выше (т.е. характеризующийся концентрацией EtOH, составляющей по меньшей мере 35% (объем./объем.), по меньшей мере 36% (объем./объем.), по меньшей мере 37% (объем./объем.), по меньшей мере 38% (объем./объем.) и т.д.), использовали в качестве промывочного раствора). Согласно этому варианту осуществления предпочтительным является то, что перед тем, как препарат РНК загружают на колонку на стадии (ii), колонку, содержащую целлюлозный материал, уравновешивают (т.е. промывают) с помощью второго буфера, как указано выше (например, с помощью аликвоты указанного второго буфера). После этого препарат РНК (который предпочтительно получают в виде жидкости, содержащей оцРНК и указанный второй буфер) загружают на колонку (предпочтительно с помощью инъекции) и предпочтительно колонку промывают указанным вторым буфером (например, дополнительной аликвотой указанного второго буфера, предпочтительно 0,5-2 - кратным объемом целлюлозного материала, содержащегося в колонке). Эта стадия промывки является предпочтительной, поскольку она может промыть примеси, отличные от РНК (такие примеси, в частности, включают в себя следующее: начальные материалы, используемые для создания IVT РНК (которая является необязательно модифицированной), и их продукты разложения, например, матрица ДНК; РНК-полимераза (такая как T7, T3 или SP6); монорибонуклеотиды в немодифицированной форме (например, rATP, rGTP, rCTP, rUTP и их аналоги, характеризующиеся только одной или двумя фосфатными группами) или модифицированной форме (например, r(1mΨ)TP или rΨTP и их аналоги, характеризующиеся только одной или двумя фосфатными группами); пирофосфат; кэп-реагент (т.е. реагент для введения 5'-кэпа или аналога 5'-кэпа); и добавки, используемые для создания IVT РНК (например, буферные средства, соли, антиоксиданты, полиамины (такие как спермидин)). Стадию (iii) предпочтительно проводят с использованием первого буфера, как указано выше (т.е. характеризующегося концентрацией EtOH, составляющей 14-20% (объем./объем.), предпочтительно 14-16% (объем./объем.)), в качестве элюента, тем самым высвобождая оцРНК из целлюлозного материала. Соединения (в частности, оцРНК, необязательно также дцРНК), которые элюируют или промывают из колонки, можно обнаружить и/или подвергнуть мониторингу с использованием общепринятых средств (например, детектора в ультрафиолетовой и видимой части спектра, такого как диодно-матричный детектор), например, при длине волны, составляющей 260 нм (для обнаружения нуклеиновых кислот) и/или 215 нм (для обнаружения пептидов/белков) и/или 280 нм (для обнаружения пептидов/белков, содержащих ароматические аминокислоты).
оцРНК, полученную с помощью любого из способов согласно настоящему изобретению (в частности, независимо от того, использовали ли процедуру "отрицательной" или "положительной" очистки) можно подвергать дополнительным обработкам, таким как осаждение и/или модификация. Например, оцРНК, полученную с помощью способов согласно настоящему изобретению, можно осаждать с использованием общепринятых способов (например, с использованием способа осаждения с помощью ацетата натрия/изопропанола или способа осаждения с помощью LiCl), приводящих к получению препарата оцРНК в высушенной форме. Высушенную оцРНК можно хранить (например, при -70°C) или можно растворять в соответствующем растворителе (например, воде или буфере TE (10 мM TRIS, 1 мM EDTA)) и затем хранить (например, при -70°C) или использовать в дальнейшем (например, для получения фармацевтической композиции). Альтернативно или дополнительно оцРНК можно дополнительно модифицировать, например, путем удаления некэпированных 5'-трифосфатов и/или добавления кэп-структуры, перед ее хранением (например, при -70°C) или использованием (например, для получения фармацевтической композиции).
Как продемонстрировано в примерах настоящей заявки, способы согласно настоящему изобретению обеспечивают некоторые преимущества, такие как одно или несколько из следующего. Например, способы согласно настоящему изобретению предлагают широкий спектр различных техник очистки, включая в себя стадии простого центрифугирования, микроцентрифужные спин-колонки, фильтровальные системы с вакуумным приводом и ЖХБР. По сравнению со способами ВЭЖХ способы согласно настоящему изобретению являются рентабельными и простыми (отсутствует необходимость в сложном оборудовании), избегают токсических веществ (таких как ацетонитрил) и обеспечивают оцРНК со сравнительно высокой чистотой и выходом. Более того, поскольку целлюлоза представляет собой природный продукт, можно ожидать, что способ согласно настоящему изобретению, который основан на целлюлозе и который является эффективным в очистке оцРНК (в частности, IVT оцРНК), сталкивается с меньшими сложностями при переносе в окружающие условия, регулируемые GMP. Кроме того, в настоящей заявке было продемонстрировано, что способы согласно настоящему изобретению можно легко масштабировать и они являются менее трудоемкими, чем общепринятые способы ВЭЖХ. В этом отношении, следует отметить, что общепринятые способы ВЭЖХ (такие как раскрытые в Weissman с соавт., выше), как правило, ограничены размером колонки и проблемой обратного давления, связанной с использованием больших колонок. Это не относится к способам согласно настоящему изобретению. Например, как продемонстрировано в настоящей заявке (см. пример 5), очистка 50-100 мг IVT РНК может быть достигнута за меньше чем 2 ч при использовании способов согласно настоящему изобретению. Напротив, колонка ВЭЖХ, используемая в примере 3 (Semi-Prep RNASep 100 × 21,1 мм, Transgenomic), с объемом колонки, составляющим 35 мл, характеризуется максимальной связывающей способностью, составляющей 1 мг IVT РНК. Поскольку стандартный цикл очистки с использованием такой колонки ВЭЖХ занимает более чем 60 мин, очистка 50 мг IVT РНК будет занимать приблизительно 50 ч по сравнению с всего лишь 2 ч с использованием способов согласно настоящему изобретению. Более того, очистка длинных IVT РНК с использованием общепринятых способов на основе ВЭЖХ вызывает проблемы и часто приводит к (a) высокой потере IVT РНК (в частности, когда IVT РНК характеризуется длиной, составляющей по меньшей мере приблизительно 2700 нуклеотидов (предпочтительно по меньшей мере 2800 нуклеотидов, по меньшей мере 2900 нуклеотидов, по меньшей мере 3000 нуклеотидов, по меньшей мере 3100 нуклеотидов, по меньшей мере 3200 нуклеотидов, по меньшей мере 3300 нуклеотидов, по меньшей мере 3400 нуклеотидов, более предпочтительно по меньшей мере 3500 нуклеотидов, по меньшей мере 3600 нуклеотидов, по меньшей мере 3700 нуклеотидов, по меньшей мере 3800 нуклеотидов, по меньшей мере 3900 нуклеотидов, по меньшей мере 4000 нуклеотидов, по меньшей мере 4100 нуклеотидов, по меньшей мере 4200 нуклеотидов, по меньшей мере 4300 нуклеотидов, по меньшей мере 4400 нуклеотидов, более предпочтительно по меньшей мере 4500 нуклеотидов, по меньшей мере 4600 нуклеотидов, по меньшей мере 4700 нуклеотидов, по меньшей мере 4800 нуклеотидов, по меньшей мере 4900 нуклеотидов, по меньшей мере 5000 нуклеотидов), поскольку IVT РНК, характеризующиеся такой длиной, не элюируют в общепринятых способах на основе ВЭЖХ в виде определенного острого пика, но элюируют в виде широкого пика, тем самым требуя сбора элюата (содержащего оцРНК) в течение длительного периода времени для минимизации потери оцРНК) и/или, что более важно, (b) разложению IVT РНК (в частности, если длинная IVT РНК (например, характеризующаяся размером, составляющим по меньшей мере 3500 нуклеотидов, таким как по меньшей мере 4000 нуклеотидов, по меньшей мере 4500 нуклеотидов, по меньшей мере 5000 нуклеотидов, по меньшей мере 5500 нуклеотидов, по меньшей мере 6000 нуклеотидов, по меньшей мере 6500 нуклеотидов, по меньшей мере 7000 нуклеотидов, по меньшей мере 7500 нуклеотидов, по меньшей мере 8000 нуклеотидов, по меньшей мере 8500 нуклеотидов, по меньшей мере 9000 нуклеотидов или по меньшей мере 9500 нуклеотидов) подлежит очистке, вероятно, вследствие фрагментации во время пропускания длинных РНК через материал плотно заполненной колонки). Напротив, как продемонстрировано в настоящей заявке, использование способов согласно настоящему изобретению для очистки IVT РНК, характеризующихся размером, составляющим приблизительно 10000 нуклеотидов или больше, не приводит к разложению РНК. Более того, было обнаружено, что с использованием способов согласно настоящему изобретению возможно элюировать IVT оцРНК (в частности, IVT оцРНК, характеризующиеся длиной, составляющей по меньшей мере приблизительно 2700 нуклеотидов (предпочтительно по меньшей мере 2800 нуклеотидов, по меньшей мере 2900 нуклеотидов, по меньшей мере 3000 нуклеотидов, по меньшей мере 3100 нуклеотидов, по меньшей мере 3200 нуклеотидов, по меньшей мере 3300 нуклеотидов, по меньшей мере 3400 нуклеотидов, более предпочтительно по меньшей мере 3500 нуклеотидов, по меньшей мере 3600 нуклеотидов, по меньшей мере 3700 нуклеотидов, по меньшей мере 3800 нуклеотидов, по меньшей мере 3900 нуклеотидов, по меньшей мере 4000 нуклеотидов, по меньшей мере 4100 нуклеотидов, по меньшей мере 4200 нуклеотидов, по меньшей мере 4300 нуклеотидов, по меньшей мере 4400 нуклеотидов, более предпочтительно по меньшей мере 4500 нуклеотидов, по меньшей мере 4600 нуклеотидов, по меньшей мере 4700 нуклеотидов, по меньшей мере 4800 нуклеотидов, по меньшей мере 4900 нуклеотидов, по меньшей мере 5000 нуклеотидов)) из целлюлозного материала в определенном остром пике, тем самым снижая количество (т.е. объем) элюата (содержащего оцРНК), который необходимо собрать, до минимума. В итоге, целостность очищенной РНК делает способы согласно настоящему изобретению превосходными по сравнению с общепринятыми способами с использованием РНКазы III E.coli, которые часто приводят к частичному разложению оцРНК, особенно длинной оцРНК, во время инкубации (вероятно, вследствие катализируемого РНКазой III гидролиза двухцепочечных вторичных структур, содержащихся в оцРНК).
Используемый в настоящем документе термин "встряхивание и/или перемешивание" означает любое действие, которое является подходящим для смешивания (предпочтительно тщательного смешивания) смеси, например, смеси, содержащей твердую фазу (такую как целлюлозный материал) и жидкую фазу (такую как среда (например, буфер), промывочный раствор или препарат РНК, растворенный в среде (например, буфере)). Иллюстративные устройства для достижения "встряхивания и/или перемешивания" известны специалисту в настоящей области техники и включают в себя шейкер, смеситель (например, вихревой смеситель или статический смеситель), магнитную мешалку (включая в себя магнитный якорь) и палочку-мешалку, которые являются доступными в различных размерах в зависимости от объема смеси, которую следует смешать. Встряхивание и/или перемешивание смеси можно провести в течение времени, достаточного для достижения тщательного смешивания, например, в течение времени, составляющего по меньшей мере 1 мин (например, по меньшей мере 2 мин, по меньшей мере 3 мин, по меньшей мере 4 мин, по меньшей мере 5 мин, по меньшей мере 8 мин, по меньшей мере 10 мин). Максимальное время для встряхивания и/или перемешивания смеси может составлять вплоть до 40 мин (например, вплоть до 35 мин, вплоть до 30 мин, вплоть до 28 мин, вплоть до 26 мин, вплоть до 24 мин, вплоть до 22 мин или вплоть до 20 мин). Таким образом, иллюстративные временные диапазоны для встряхивания и/или перемешивания смеси представляют собой 5-40 мин, 5-30 мин, 5-20 мин, 10-40 мин, 10-30 мин, 10-20 мин, 15-40 мин, 15-30 мин или 15-20 мин. Как правило, продолжительность встряхивания и/или перемешивания будет зависеть от таких факторов, как предусмотренное применение (например, промывка целлюлозного материала или связывание РНК с целлюлозным материалом) и количество твердых веществ, подлежащих смешиванию. Например, для промывки целлюлозного материала продолжительность встряхивания и/или перемешивания может находиться в диапазоне, составляющем 1-15 мин, например, 5-10 мин. Для связывания РНК с целлюлозным материалом продолжительность встряхивания и/или перемешивания может находиться в диапазоне, составляющем 5-20 мин (например, 10-20 мин), если используют вплоть до 1 г целлюлозного материала, или в диапазоне, составляющем 10-30 мин (например, 15-30 мин), когда используют более чем 1 г целлюлозного материала. Аналогично для высвобождения РНК (в частности, оцРНК), связанной с целлюлозным материалом, из целлюлозного материала продолжительность встряхивания и/или перемешивания может находиться в диапазоне, составляющем 5-20 мин (например, 10-20 мин), когда используют вплоть до 1 г целлюлозного материала, или в диапазоне, составляющем 10-30 мин (например, 15-30 мин), когда используют более чем 1 г целлюлозного материала.
Термин "соль", используемый в отношении первой и второй сред (например, первого и второго буферов), означает любое ионное соединение, которое является результатом реакции нейтрализации кислоты и основания. Предпочтительно соль (i) не представляет собой буферное вещество, (ii) не представляет собой хелатирующее средство, или (iii) не представляет собой ни буферное вещество, ни хелатирующее средство. Иллюстративные кислоты включают в себя неорганические кислоты (такие как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, борная кислота и перхлорная кислота) и органические кислоты (например, монокарбоновые кислоты, предпочтительно те, которые характеризуются 1-5 (например, 1, 2 или 3) атомами углерода, например, муравьиная кислота, уксусная кислота и пропионовая кислота), предпочтительно неорганические кислоты. Иллюстративные основания включают в себя неорганические основания (такие как NH3, гидроксид аммония (NH4OH), и оксиды и гидроксиды металлов, предпочтительно оксиды и гидроксиды щелочных, земельных и щелочноземельных металлов (например, оксиды и гидроксиды Li, Na, K, Rb, Be, Mg, Ca, Sr, Al и Zn)) и органические основания (такие как амины, например, моноалкил-, диалкил- или триалкиламины), предпочтительно неорганические основания, более предпочтительно оксиды и гидроксиды Li, Na, K, Mg, Ca, Al и Zn, более предпочтительно оксиды и гидроксиды Li, Na, K и Zn, такие как оксиды и гидроксиды Li, Na и K. Иллюстративные соли, которые можно использовать в отношении первой и второй сред (например, первого и второго буферов) включают в себя LiCl, NaCl и KCl, и одна особенно предпочтительная соль в этом отношении представляет собой NaCl. Предпочтительно соль используют в первой и второй средах (например, первом и втором буферах) в концентрации, которая не приводит к осаждению РНК в указанной среде. Согласно одному варианту осуществления концентрация соли в первой и/или второй среде (например, первом и/или втором буфере) составляет 15-70 мM, например, 20-60 мM, 25-50 мM или 30-50 мM, в частности, если буферное вещество представляет собой TRIS. Согласно одному варианту осуществления концентрация соли в первой и/или второй среде (например, первом и/или втором буфере) составляет 100-200 мM, например, 110-190 мM, 120-180 мM, 130-170 мM, 140-160 мM или 145-155 мM, в частности, если буферное вещество представляет собой HEPES.
Используемые в настоящем документе термины "буферное вещество" и "буферное средство" означают смесь соединений, способную поддерживать значение pH раствора почти постоянным, даже если к раствору добавляют сильную кислоту или основание. Согласно одному варианту осуществления буферное вещество или буферное средство представляет собой смесь слабой кислоты и сопряженного с ней основания. Согласно другому варианту осуществления буферное вещество или буферное средство представляет собой смесь слабого основания и сопряженной с ним кислоты. Предпочтительно буферное вещество не представляет собой хелатирующее средство. Примеры буферных веществ, подходящих для первой и второй сред (например, первого и второго буферов), включают в себя следующее: трис(гидроксиметил)аминометан (TRIS), 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES), 3-морфолино-2-гидроксипропансульфоновая кислота (MOPSO), 3-(N-морфолино)пропансульфоновая кислота (MOPS), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота (BES), 2-[(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]этансульфоновая кислота (TES), пиперазин-N,N′-бис(2-этансульфоновая кислота) (PIPES) и 3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота (DIPSO), предпочтительно TRIS или HEPES, более предпочтительно TRIS. Требуемое значение pH (такое как pH 6,5-8,0, предпочтительно pH 6,6-7,8, такое как pH 6,8-7,6, pH 6,8-7,2, pH 6,9-7,5, pH 6,9-7,3, pH 7,0-7,7, pH 7,0-7,5, pH 7,0-7,3, pH 7,3-7,8, pH 7,3-7,7 или pH 7,3-7,6) может быть достигнуто путем добавления достаточного количества кислоты (например, такой неорганической кислоты, как соляная кислота) к соответствующему основанию (например, TRIS) или путем добавления достаточного количества основания (например, такого неорганического основания, как гидроксид натрия) к соответствующей кислоте (например, PIPES, если необходимо значение pH выше своего значения pKa, составляющего 6,76 (например, pH, составляющее 7,0 или 7,3-7,7)). Согласно одному варианту осуществления концентрация буферного вещества в первой и/или второй среде (например, первом и/или втором буфере) составляет 5-40 мМ, например, 6-30 мM, 8-20 мM или 10-15 мM.
Используемый в настоящем документе в отношении первой и второй сред (например, первого и второго буферов) термин "хелатирующее средство" означает соединение (предпочтительно органическое соединение), которое представляет собой полидентатный лиганд и которое способно формировать две или больше (предпочтительно три или больше, например, четыре или больше) координационных связей с одним центральным атомом (предпочтительно одним центральным катионом металла, таким как Ca2+ или Mg2+). В этом отношении "полидентатный" относится к лиганду, характеризующемуся более одной (т.е. двумя или больше, предпочтительно тремя или больше, например, четырьмя или больше) донорными группами в одной молекуле лиганда, причем донорные группы предпочтительно включают в себя атомы, характеризующиеся парой свободных электронов (например, O-, =O, -NH2, -NRH (где R представляет собой органический фрагмент, такой как алкил, в частности, C1-3 алкил) и -NR2 (где каждый R независимо представляет собой органический фрагмент, такой как алкил, в частности, C1-3 алкил)). Предпочтительно хелатирующее средство не представляет собой буферное вещество. Примеры хелатирующих средств включают в себя следующее: EDTA, нитрилотриуксусная кислота, цитратные соли (например, цитрат натрия), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA), 1,4,7-триазациклононан-1,4,7-трисуксусная кислота (NOTA), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусная кислота (PCTA) и 1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота (DO3A), предпочтительно EDTA или нитрилотриуксусная кислота, более предпочтительно EDTA. Согласно одному варианту осуществления концентрация хелатирующего средства в первой и/или второй среде (например, первом и/или втором буфере) составляет 10-50 мM, например, 15-40 мM или 20-30 мM.
Используемый в настоящем документе термин "целлюлозный материал" относится к любым целлюлозным волокнам, предпочтительно характеризующимся степенью чистоты, подходящей для применения в качестве реагента для распределительной хроматографии. Конкретные примеры целлюлозного материала, подходящего для способов согласно настоящему изобретению, включают в себя порошок целлюлозы CF-11 и коммерчески доступные целлюлозы, такие как целлюлоза от Sigma-Aldrich (например, № по кат. C6288) и Macherey-Nagel (например, MN 100 или MN 2100). Согласно одному варианту осуществления целлюлозный материал промывают до использования в способах согласно настоящему изобретению. Таким образом, согласно одному предпочтительному варианту осуществления способов согласно настоящему изобретению целлюлозный материал получают в виде промытого целлюлозного материала, например, в сухой форме или в виде суспензии в промывочном растворе (причем указанный промывочный раствор может представлять собой первую или вторую среду (например, первый или второй буфер), как указано в настоящем документе). Промывка целлюлозного материала может включать в себя (I) смешивание целлюлозного материала с промывочным раствором при встряхивании и/или перемешивании (предпочтительно в течение по меньшей мере 5 мин, более предпочтительно в течение по меньшей мере 10 мин, например, в течение 5-10 мин); и (II) или удаление жидкости (например, с использованием пипетки), или сбор целлюлозного материала (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами и с использованием магнита); и необязательно (III) повторение стадий (I) и (II) один раз или два или больше раз (такие как один раз, два раза или три раза). Например, если наличие смеси целлюлозного материала и промывочного раствора обеспечивают в пробирке, предпочтительным является то, что силу тяжести или центробежную силу (например, 4000 × g - 15000 × g, такую как 5000 × g - 10000 × g в течение 1-5 мин) прилагают к пробирке с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить), и что либо супернатант удаляют (например, с использованием пипетки), либо целлюлозный материал собирают (например, с использованием, в качестве целлюлозного материала, целлюлозы, которая ковалентно соединена с магнитными гранулами и с использованием магнита). Альтернативно, если наличие смеси целлюлозного материала и промывочного раствора обеспечивают в спин-колонке или фильтровальном устройстве, предпочтительным является то, что силу тяжести, центробежную силу (например, 4000 × g - 15000 × g, такую как 5000 × g - 10000 × g в течение 1-5 мин), давление (например, 1000 гПа - 3000 гПа) или вакуум (например, 100 гПа - 900 гПа, такой как 200 гПа - 800 гПа) прилагают к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы (предпочтительно полностью разделить), и сток отбрасывают. Композиция промывочного буфера предпочтительно зависит от предусмотренного способа селективного связывания РНК с промытым целлюлозным материалом: (1) если только дцРНК должна селективно связываться с промытым целлюлозным материалом, тогда как оцРНК должна оставаться несвязанной, промывочный раствор должен являться таким, чтобы он обеспечивал возможность связывания дцРНК с целлюлозным материалом и не позволял оцРНК связываться с целлюлозным материалом. Таким образом, согласно предпочтительному варианту осуществления согласно (1) промывочный раствор характеризуется композицией первой среды (например, первого буфера), как указано выше. (2) Если как дцРНК, так и оцРНК должны связываться с промытым целлюлозным материалом, промывочный раствор должен являться таким, чтобы он обеспечивал возможность связывания дцРНК и оцРНК с целлюлозным материалом. Таким образом, согласно предпочтительному варианту осуществления согласно (2) промывочный раствор характеризуется композицией второй среды (например, второго буфера), как указано выше.
После промывки промытый целлюлозный материал можно хранить (или использовать в способах согласно настоящему изобретению) в виде сухого продукта (т.е. после того, как промывочный раствор полностью удаляют из промытой целлюлозы, как указано в настоящем документе) или в виде суспензии в промывочном растворе. Тем не менее, если промытый целлюлозный материал, который хранят в промывочном растворе, подлежит использованию в способах согласно настоящему изобретению, предпочтительным является то, что перед тем, как промытый целлюлозный материал приводят в контакт с препаратом РНК, жидкую фазу (т.е. промывочный раствор, в котором целлюлозный материал суспендируют для хранения) удаляют из промытого целлюлозного материала (например, путем приложения силы тяжести или центробежной силы (как указано выше в отношении промывки целлюлозного материала), если наличие промытой целлюлозы обеспечивают в пробирке, или путем приложения силы тяжести, центробежной силы, давления или вакуума (как указано выше в отношении промывки целлюлозного материала), если наличие промытой целлюлозы обеспечивают в спин-колонке или фильтровальном устройстве), и полученный промытый целлюлозный материал без дополнительной обработки (т.е. в сухой форме) затем используют в способах согласно настоящему изобретению или суспендируют в промывочном растворе (причем указанный промывочный раствор может представлять собой первую или вторую среду (например, первый или второй буфер), как указано в настоящем документе), и затем используют в способах согласно настоящему изобретению.
Используемый в настоящем документе термин "свежий целлюлозный материал" означает, что указанный свежий целлюлозный материал не был приведен в контакт с препаратом РНК. Такой свежий целлюлозный материал может являться либо непромытым, либо промытым. Согласно предпочтительному варианту осуществления свежий целлюлозный материал получают в виде промытого целлюлозного материала, как указано выше (например, в сухой форме или в виде суспензии в промывочном растворе). Таким образом, в зависимости от предусмотренного применения промытого свежего целлюлозного материала (т.е. для селективного связывания либо (1) дцРНК, но не оцРНК, либо (2) дцРНК и оцРНК), промытый свежий целлюлозный материал получали с использованием или (1) первой среды (например, первого буфера), как указано выше, или (2) второй среды (например, второго буфера), как указано выше.
Соотношение РНК (содержащейся в препарате РНК) к целлюлозному материалу на стадии (ii) способов согласно настоящему изобретению является таким, чтобы способность целлюлозного материала связывать РНК не была превышена. Согласно предпочтительному варианту осуществления количество РНК на 100 мг целлюлозного материала составляет не больше чем 250 мкг, более предпочтительно не больше чем 200 мкг, например, не больше чем 150 мкг. Таким образом, согласно одному варианту осуществления количество РНК на 100 мг целлюлозного материала находится в диапазоне, составляющем 10-250 мкг, например, 20-220 мкг, 30-200 мкг, 40-180 мкг, 50-160 мкг, 60-140 мкг, 70-120 мкг, 80-110 мкг или 90-100 мкг. Следовательно, согласно одному варианту осуществления количество целлюлозного материала на 1 мкг РНК может составлять по меньшей мере 0,4 мг, предпочтительно по меньшей мере 0,5 мг, например, по меньшей мере 0,67 мг. Например, количество целлюлозного материала на 1 мкг РНК может находиться в диапазоне, составляющем 0,4-10 мг, например, 0,45-5 мг, 0,5-3,3 мг, 0,56-2,5 мг, 0,63-2 мг, 0,71-1,67 мг, 0,83-1,43 мг, 0,91-1,25 мг или 1-1,11 мг.
Используемый в настоящем документе термин "пробирка" относится к контейнеру, в частности, продолговатому контейнеру, который характеризуется только одним отверстием так, чтобы соединения и/или жидкости можно было вводить в и/или удалять из контейнера. Согласно предпочтительному варианту осуществления отверстие пробирки сконфигурировано так, чтобы его можно было закрыть с помощью подходящего средства, такого как крышка, которую можно завинтить или которая входит в отверстие таким образом, чтобы плотно закрыть отверстие. Согласно одному варианту осуществления пробирка сконфигурирована таким образом, что силу тяжести или центробежную силу можно приложить к пробирке (чтобы разделить содержимое в пробирке на основании их относительной плотности), не проливая ничего из содержимого и не повреждая целостность пробирки.
Используемые в настоящем документе термины "спин-колонка" и "фильтровальное устройство" относятся к контейнеру, в частности продолговатому контейнеру, характеризующемуся двумя отверстиями на противоположных сторонах и фриттой или фильтром, причем первое отверстие является таким, чтобы соединения и/или жидкости можно было вводить и/или удалять из контейнера, тогда как второе отверстие отделено от первого отверстия с помощью фритты или фильтра так, что твердые соединения (в частности, целлюлозный материал) удерживаются внутри контейнера с помощью фритты или фильтра, но жидкие могут проходить к фритте или фильтру и ко второму отверстию. Фритта или фильтр предпочтительно характеризуется размером пор, составляющим не больше чем 1 мкм, таким как не больше чем 0,8 мкм, не больше чем 0,6 мкм, например, в диапазоне, составляющем 0,30-0,60 мкм, таком как 0,35-0,55 мкм. Согласно предпочтительному варианту осуществления по меньшей мере первое отверстие спин-колонки или фильтровального устройства (предпочтительно каждое из отверстий) сконфигурировано так, чтобы его можно было закрыть с помощью подходящего средства, такого как крышка, которую можно завинтить или которая входит в первое или второе отверстие таким образом, чтобы плотно закрыть отверстие. Согласно одному варианту осуществления спин-колонка или фильтровальное устройство сконфигурировано таким образом, чтобы силу тяжести, центробежную силу, давление или вакуум можно было приложить к спин-колонке или фильтровальному устройству (для разделения содержимого в спин-колонке или фильтровальном устройстве) без повреждения целостности спин-колонки или фильтровального устройства. Примеры подходящих спин-колонок включают в себя микроцентрифужные спин-колонки (такие как микроцентрифужные спин-колонки, доступные от Macherey-Nagel, например, NucleoSpin Filters (№ по кат. 740606)), и примеры подходящих фильтровальных устройств включают в себя одноразовые фильтровальные устройства с вакуумным приводом (такие как фильтровальные устройства, доступные от Merck Chemicals GmbH / Millipore, например, Steriflip-HV, размер пор 0,45 мкм, PVDF (№ по кат. SE1M003M00)).
Используемые в настоящем документе термины "жидкость" и "жидкая фаза" относятся к жидкой среде при стандартном условии. Конкретные примеры жидкости включают в себя среду (например, буфер), промывочный раствор и препарат РНК, растворенный в среде (например, буфере). Используемые в настоящем документе термины "твердое вещество" и "твердая фаза" относятся к веществу или смеси веществ, которые характеризуются определенной формой и объемом, но которые являются не жидкими и не газообразными при стандартном условии. Конкретный пример твердого вещества включает в себя целлюлозный материал.
Используемый в настоящем документе термин "стандартное условие" относится к температуре, составляющей 20°C, и абсолютному давлению, составляющему 101325 гПа.
Используемый в настоящем документе термин "супернатант" относится к верхней фазе, которая создается, когда жидкую фазу и твердую фазу смешивают и обеспечивают возможность разделения смеси (например, путем приложения силы тяжести или центробежной силы). В случае, когда твердая фаза характеризуется более высокой относительной плотностью по сравнению с жидкой фазой, жидкая фаза будет представлять собой супернатант.
Используемый в настоящем документе термин "сток" относится к жидкой фазе, которая проходит через спин-колонку или фильтровальное устройство.
Используемый в настоящем документе термин "аликвота" означает объем жидкости, который необходимо добавить к твердому веществу или который необходимо загрузить на неподвижную фазу колонки, причем объем аликвоты является, как правило, 0,1-10 - кратным (например, 0,5-5 - кратным, 1-4 - кратным, 1-3 - кратным или 1-2 - кратным) объему твердой или неподвижной фазы. Согласно одному варианту осуществления жидкость представляет собой среду (например, буфер) (например, первую, вторую или третью среду (например, первый, второй или третий буфер), как указано в настоящем документе) или промывочный раствор. Согласно одному варианту осуществления твердое вещество представляет собой целлюлозный материал, такой как промытый целлюлозный материал.
Используемый в настоящем документе термин "приложение силы тяжести" означает, что контейнер, такой пробирка, спин-колонка или фильтровальное устройство, подвергают действию только "нормальной" силе земного тяготения (приблизительно 1 × g), т.е. никакой силы тяжести в дополнение к "нормальной" силе земного тяготения не прилагают к контейнеру (например, среде позволяют пассивно проходить через неподвижную фазу колонки, причем колонка расположена так, что продольная ось колонки (т.е. линия через оба отверстия колонки) указывает на геоцентр). Согласно одному варианту осуществления силу тяжести прилагают к контейнеру с продолжительностью, достаточной для разделения (предпочтительно полного разделения) фаз (таких как жидкая фаза и твердая фаза), содержащихся в контейнере.
Используемый в настоящем документе термин "приложение центробежной силы" означает, что контейнер, такой как пробирку, спин-колонку или фильтровальное устройство, подвергают действию силы, кратной нормальной силе земного тяготения (т.е. более чем 1 × g, например, по меньшей мере 2 × g, по меньшей мере 10 × g, по меньшей мере 100 × g и вплоть до 20000 × g, например, вплоть до 15000 × g, вплоть до 10000 × g, вплоть до 5000 × g или вплоть до 4,000 × g). Подходящее устройство, способное создавать такую центробежную силу, включает в себя центрифугу. Согласно одному варианту осуществления центробежную силу прилагают к контейнеру с продолжительностью, достаточной для разделения (предпочтительно полного разделения) фаз (таких как жидкая фаза и твердая фаза), содержащихся в контейнере. Иллюстративные продолжительности находятся в диапазоне, составляющем 1 мин - 30 мин (например, 1, 2, 3, 4 или 5 мин - 25 мин, 5, 6, 7, 8, 9 или 10 мин - 20 мин или 10 - 15 мин). Как правило, уровень и продолжительность прилагаемой центробежной силы будет зависеть от таких факторов, как предусмотренное применение (например, промывка целлюлозного материала, связывание РНК с целлюлозным материалом или высвобождение РНК из целлюлозного материала) и объема и массы контейнера (включая в себя его содержимое). Например, высокая центробежная сила (такая как 10000 × g - 20000 × g), прилагаемая с короткой продолжительностью (например, 1-5 мин), может являться достаточной для (полного) разделения, тогда как низкая центробежная сила (такая как вплоть до 100 × g) может требовать более длительной продолжительности (например, 20-30 мин) для (полного) разделения. Аналогично для небольшого объема и массы (например, вплоть до объема, составляющего приблизительно 2 мл, и массы, составляющей приблизительно 2 г) высокая центробежная сила (такая как 10000 × g - 20000 × g), прилагаемая с короткой продолжительностью (например, 1-5 мин), может являться достаточной для (полного) разделения, тогда как для большего объема и/или массы, где можно приложить только пониженную центробежную силу (такую как 200 × g - 10000 × g), более длительная продолжительность (например, в течение 20-30 мин) может являться необходимой для достижения (полного) разделения.
Используемый в настоящем документе термин "приложение давления" означает, что контейнер, такой как спин-колонку, фильтровальное устройство или колонку, подвергают действию положительной силы (по сравнению со стандартным условием), прилагаемой к одному отверстию контейнера. В частности, если контейнер представляет собой колонку, приложение давления означает, что жидкость (такую как среда или буфер) прокачивают через контейнер, например, с использованием одного или нескольких насосов. Давление, прилагаемое в способах согласно настоящему изобретению, намного ниже по сравнению с давлением, прилагаемым в способах ВЭЖХ, и предпочтительно составляет не больше чем 2 МПа (например, не больше чем 1 МПа, не больше чем 5000 гПа, не больше чем 4000 гПа, не больше чем 3000 гПа, не больше чем 2000 гПа).
Используемый в настоящем документе термин "приложение вакуума" означает, что контейнер, такой как спин-колонку, фильтровальное устройство или колонку, подвергают действию отрицательного давления (по сравнению со стандартным условием), причем отрицательное давление предпочтительно прилагают к отверстию контейнера. Предпочтительно отрицательное давление составляет не больше чем 900 гПа, например, как не больше чем 800 гПа, не больше чем 700 гПа, не больше чем 600 гПа, не больше чем 500 гПа, не больше чем 400 гПа, не больше чем 300 гПа, не больше чем 200 гПа или не больше чем 100 гПа. Согласно одному варианту осуществления вакуум прилагают к контейнеру с продолжительностью, достаточной для разделения (предпочтительно полного разделения) фаз (таких как жидкая фаза и твердая фаза), содержащихся в контейнере. Устройства для создания отрицательного давления известны специалисту в настоящей области техники и включают в себя водоструйный вакуумный насос.
Используемое в настоящем документе выражение "повторяемый один раз или два или больше раз" означает, что соответствующую стадию или стадии проводят по меньшей мере один раз, например, два или больше раз, три или больше раз, четыре или больше раз и т.д., предпочтительно один раз, два раза или три раза.
Используемое в настоящем документе выражение "один цикл стадий (ii) и (iii)" означает, что каждую из стадий (ii) и (iii) проводят только один раз. Если один цикл стадий (ii) и (iii) завершают, можно необязательно проводить дополнительный цикл (который в настоящем документе также называется "последующий цикл") стадий (ii) и (iii). Например, на стадии (ii) такого последующего цикла стадий (ii) и (iii), препарат РНК, полученный после стадии (iii) предыдущего цикла стадий (ii) и (iii) (т.е. препарат РНК, который предпочтительно содержит дцРНК в меньшем количестве по сравнению с препаратом РНК, используемым на стадии (ii) предыдущего цикла), используют в качестве препарата РНК. Предпочтительным является то, что в каждом цикле стадий (ii) и (iii) используют свежий целлюлозный материал (во избежание загрязнения со стороны, например, дцРНК). Таким образом, путем проведения стадий (ii) и (iii) и необязательно повторения указанных стадий один раз или два или больше раз, возможно удалить дцРНК из препарата оцРНК до такой степени, что полученный в итоге оцРНК по существу не содержит дцРНК и/или по существу не содержит ДНК, предпочтительно по существу не содержит дцРНК и ДНК.
Выражение "препарат РНК, который содержит дцРНК в меньшем количестве по сравнению с препаратом РНК, используемым на стадии (ii) предыдущего цикла" означает, что проведение одного цикла стадий (ii) и (iii) является эффективным в удалении дцРНК так, что общее количество дцРНК в препарате РНК, полученном после стадии (iii) одного цикла, меньше чем общее количество дцРНК в препарате РНК, используемом на стадии (ii) предыдущего цикла. Предпочтительно первый цикл стадий (ii) и (iii) является эффективным в удалении по меньшей мере 70%, более предпочтительно по меньшей мере 75% (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%) дцРНК, содержащейся в препарате РНК, используемом на стадии (ii) первого цикла стадий (ii) и (iii). Согласно предпочтительному варианту осуществления проведение всего двух, трех или четырех циклов стадий (ii) и (iii) является эффективным в удалении по меньшей мере 95%, более предпочтительно по меньшей мере 96% (например, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%) дцРНК, содержащейся в препарате РНК, используемом на стадии (ii) первого цикла стадий (ii) и (iii).
Используемый в настоящем документе термин "элюент" означает жидкость, которая способна изменить связывающие свойства соединения (такие как дцРНК или оцРНК) по отношению к неподвижной фазе (такой как целлюлозный материал). "Изменение связывающих свойств" означает увеличение или уменьшение способности соединения (такого как дцРНК или оцРНК) связываться с неподвижной фазой (такой как целлюлозный материал). Предпочтительно элюент способен уменьшать способность соединения (такого как дцРНК или оцРНК) связываться с неподвижной фазой (такой как целлюлозный материал). Таким образом, согласно этому предпочтительному варианту осуществления (1) если соединение связано с неподвижной фазой, стадия приведения неподвижной фазы в контакт с элюентом приводит к высвобождению соединения из неподвижной фазы, или (2) если соединение растворено в элюенте, элюент уменьшает способность соединения связываться с неподвижной фазой, предпочтительно элюент предотвращает связывание соединения с неподвижной фазой. Используемый в настоящем документе термин "элюирование" означает нанесение или загрузку элюента на (в) колонку (включая в себя спин-колонку), содержащую неподвижную фазу (такую как целлюлозный материал), с которой соединение (такое как оцРНК) связано, для высвобождения соединения из неподвижной фазы. Предпочтительный элюент для оцРНК, связанной с целлюлозным материалом, представляет собой первую среду (например, первый буфер), как указано выше, тогда как предпочтительный элюент для дцРНК, связанной с целлюлозным материалом, представляет собой третью среду (например, третий буфер), который может характеризоваться такой же композицией, как и первая или вторая среда (например, первый или второй буфер), но который не содержит EtOH (например, третья среда может представлять собой воду). Предпочтительный промывочный раствор, который не высвобождает дцРНК или оцРНК, связанные с целлюлозным материалом, представляет собой вторую среду (например, второй буфер), как указано выше.
Используемый в настоящем документе термин "элюат" относится к жидкости, находящейся в колонке, когда элюент наносят или загружают на колонку.
Используемый в настоящем документе термин "колонка" относится к контейнеру, в частности, цилиндрическому контейнеру, характеризующемуся двумя отверстиями на противоположных сторонах, по меньшей мере одной фриттой и неподвижной фазой (такой как целлюлозный материал), причем первое отверстие сконфигурировано так, чтобы позволять осуществлять введение жидкостей (таких как среда, например, промывочный раствор или среда, например, первый или второй буфер) в контейнер, тогда как второе отверстие отделено от первого отверстия и неподвижной фазы с помощью фритты так, что (i) неподвижная фаза удерживается внутри колонки с помощью фритты, но (ii) жидкости могут проходить сквозь к фритте и ко второму отверстию. Колонки можно сконфигурировать так, чтобы их можно было использовать в способах ВЭЖХ или способах ЖХБР. Тем не менее, колонки, подлежащие использованию в способах согласно настоящему изобретению, предпочтительно сконфигурированы так, чтобы они являлись применимыми в способах ЖХБР.
Используемый в настоящем документе термин "ВЭЖХ" означает жидкостную хроматографию высокого давления, при которой жидкую фазу прокачивают под высоким давлением (как правило, по меньшей мере 5 MПa, например, 5-35 MПa) через колонку для разделения, идентификации и/или количественного определения по меньшей мере одного компонента в смеси.
Используемый в настоящем документе термин "ЖХБР" означает жидкостную хроматографию быстрого разрешения, при которой жидкой фазе позволяют проходить через колонку для разделения, идентификации и/или количественного определения по меньшей мере одного компонента в смеси. Поток жидкости через ЖХБР-колонку может быть достигнут путем приложения силы тяжести или давления, причем давление предпочтительно составляет не больше чем 2 MПa (например, не больше чем 1 MПa, не больше чем 5000 гПа, не больше чем 4000 гПа, не больше чем 3000 гПа, не больше чем 2000 гПа или не больше чем 1000 гПа).
Используемый в настоящем документе термин в отношении препарата РНК "обработка перед очисткой" означает процедуру для частичного или полного удаления примесей препарата РНК, причем примеси предпочтительно включают в себя все соединения, отличные от РНК, такие как следующее: начальные материалы, используемые для создания IVT РНК (которая является необязательно модифицированной) и их продукты разложения, например, матрица ДНК; РНК-полимераза (такая как T7, T3 или SP6); монорибонуклеотиды в немодифицированной форме (например, rATP, rGTP, rCTP, rUTP и их аналоги, характеризующиеся только одной или двумя фосфатными группами) или модифицированной форме (например, r(1mΨ)TP или rΨTP и их аналоги, характеризующиеся только одной или двумя фосфатными группами); пирофосфат; кэп-реагент (т.е. реагент для введения 5'-кэпа или аналога 5'-кэпа); и добавки, используемые для создания IVT РНК (например, буферные средства, соли, антиоксиданты и полиамины (такие как спермидин)). Примеры подходящих обработок перед очисткой, которые известны специалисту в настоящей области техники, включают в себя следующее: осаждение нуклеиновых кислот (предпочтительно с использованием хлорида лития); связывание нуклеиновых кислот (в частности РНК) с магнитными гранулами (например, примеси, которые не связываются с магнитными гранулами, затем можно промыть с использованием соответствующей среды); ультрафильтрация; и разложение ДНК, предпочтительно с использованием специфической для двойной спирали нуклеазы (DSN). Например, РНК можно осаждать с использованием способа осаждения с помощью ацетата натрия/изопропанола или способа осаждения с помощью LiCl (предпочтительно с использованием способа осаждения с помощью LiCl), оба из которых дают в результате препарат РНК в высушенной форме. В каждом случае осажденную и высушенную РНК, полученную таким образом, можно растворить в подходящем количестве воды или буфера TE (10 мM TRIS, 1 мM EDTA), каждый из которых предпочтительно не содержит РНКазу.
Способ осаждения с помощью ацетата натрия/изопропанола включает в себя следующие стадии: добавление 0,1 объема 3 M ацетат натрия (pH 4,0) и 1 объема изопропанола к препарату РНК, смешивание полученной смеси, инкубация смеси при -20°C в течение 1 ч, приложение центробежной силы (например, 14000 × g в течение 10 мин), удаление супернатанта из осадка РНК, промывка осадка РНК с помощью 200 мкл 70% (объем./объем.) ледяного EtOH (т.е. добавление 200 мкл 70% (объем./объем.) ледяного EtOH к осадку РНК, приложение центробежной силы (например, 14000 × g в течение 5 мин) и удаление супернатанта из осадка РНК) и высушивание (предпочтительно высушивание воздухом) осадка РНК (предпочтительно таким образом, чтобы удалить этанол).
Способ осаждения с помощью LiCl включает в себя следующие стадии: добавление хлорида лития (LiCl) к препарату РНК так, чтобы конечная концентрация LiCl составляла 2,5 M, инкубация смеси при -20°C в течение 30 мин, приложение центробежной силы (например, 14000 × g в течение 10 мин), удаление супернатанта из осадка РНК, промывка осадка РНК с помощью 200 мкл 70% (объем./объем.) ледяного EtOH (т.е. добавление 200 мкл 70% (объем./объем.) ледяного EtOH к осадку РНК, приложение центробежной силы (например, 14000 × g в течение 5 мин) и удаление супернатанта из осадка РНК) и высушивание (предпочтительно высушивание воздухом) осадка РНК (предпочтительно таким образом, чтобы удалить этанол).
Используемый в настоящем документе термин "РНК-полимераза" относится к ДНК-зависимой РНК-полимеразе, которая производит первичный транскрипт РНК. Примеры РНК-полимераз, подходящих для создания IVT РНК согласно настоящему изобретению, включают в себя РНК-полимеразы T7, T3 и SP6. Предпочтительная РНК-полимераза представляет собой РНК-полимеразу T7.
Термин "по существу не содержит дцРНК", используемый в настоящем документе во взаимосвязи с оцРНК или препаратом РНК, содержащим оцРНК, причем указанную оцРНК или препарат РНК, содержащий оцРНК, подвергли способу согласно настоящему изобретению, означает, что количество дцРНК в оцРНК или препарате РНК, содержащем оцРНК, уменьшили по меньшей мере на 70% (предпочтительно по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 82%, по меньшей мере на 84%, по меньшей мере на 86%, по меньшей мере на 88%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%) по сравнению с количеством дцРНК, содержащейся в оцРНК или препарате РНК, содержащем оцРНК, до того, как указанную оцРНК или препарат РНК, содержащий оцРНК, подвергли способу согласно настоящему изобретению. Предпочтительно указанная оцРНК или препарат РНК, содержащий оцРНК, которые подвергли способу согласно настоящему изобретению, характеризуются таким содержанием дцРНК, что указанная оцРНК или препарат РНК, содержащий оцРНК, при введении субъекту по существу не индуцирует нежелательный ответ (такой как нежелательная индукция воспалительных цитокинов (например, IFN-α) и/или нежелательная активация эффекторного фермента, которая ведет к ингибированию синтеза белка из оцРНК согласно настоящему изобретению) у указанного субъекта. Например, термины "по существу не содержит дцРНК" и "по существу не индуцирует нежелательный ответ" могут означать, что при введении субъекту оцРНК или препарат РНК, содержащий оцРНК, причем указанную оцРНК или препарат РНК подвергли способу согласно настоящему изобретению, индуцируют воспалительные цитокины (в частности, IFN-α) в количестве, которое снижено по меньшей мере на 60% (например, по меньшей мере на 62%, по меньшей мере на 64%, по меньшей мере на 66%, по меньшей мере на 68%, по меньшей мере на 70%, по меньшей мере на 72%, по меньшей мере на 74%, по меньшей мере на 76%, по меньшей мере на 78%, по меньшей мере на 80%) по сравнению с контрольной оцРНК (т.е. оцРНК или препаратом РНК, содержащим оцРНК, которые не подвергли способу согласно настоящему изобретению). Предпочтительно термины "по существу не содержит дцРНК" и "по существу не индуцирует нежелательная ответ" означают, что при введении субъекту оцРНК или препарат РНК, содержащий оцРНК, причем указанную оцРНК или препарат РНК подвергли способу согласно настоящему изобретению, и указанная оцРНК кодирует пептид или белок, приводят к трансляции оцРНК в пептид или белок в течение по меньшей мере 10 ч (например, по меньшей мере 12 ч, по меньшей мере 14 ч, по меньшей мере 16 ч, по меньшей мере 18 ч, по меньшей мере 20 ч, по меньшей мере 22 ч или по меньшей мере 24 ч) после введения. Например, содержание дцРНК в оцРНК или препарате РНК, содержащем оцРНК, причем указанную оцРНК или препарат РНК, содержащий оцРНК, подвергли способу согласно настоящему изобретению, может составлять не больше чем 5% по массе (предпочтительно не больше чем 4% по массе, не больше чем 3% по массе, не больше чем 2% по массе, не больше чем 1% по массе, не больше чем 0,5% по массе, не больше чем 0,1% по массе, не больше чем 0,05% по массе, не больше чем 0,01% по массе, не больше чем 0,005% по массе, не больше чем 0,001% по массе), исходя из общей массы указанной оцРНК или препарата РНК, содержащего оцРНК.
Термин "по существу не содержит ДНК", используемый в настоящем документе во взаимосвязи с оцРНК или препаратом РНК, содержащим оцРНК, причем указанную оцРНК или препарат РНК, содержащий оцРНК, подвергли способу согласно настоящему изобретению, означает, что количество дцРНК в оцРНК или препарате РНК, содержащем оцРНК, может составлять не больше чем 5% по массе (предпочтительно не больше чем 4% по массе, не больше чем 3% по массе, не больше чем 2% по массе, не больше чем 1% по массе, не больше чем 0,5% по массе, не больше чем 0,1% по массе, не больше чем 0,05% по массе, не больше чем 0,01% по массе, не больше чем 0,005% по массе, не больше чем 0,001% по массе), исходя из общей массы указанной оцРНК или препарата РНК, содержащего оцРНК.
Термин "по существу не содержит дцРНК и ДНК" используемый в настоящем документе во взаимосвязи с оцРНК или препаратом РНК, содержащим оцРНК, причем указанную оцРНК или препарат РНК, содержащий оцРНК, подвергли способу согласно настоящему изобретению, означает, что указанная оцРНК или препарат РНК, содержащий оцРНК, по существу не содержит дцРНК, как указано выше (например, трансляция продолжается по меньшей мере 10 ч после введения, и/или содержание дцРНК составляет не больше чем 5% по массе), и по существу не содержит ДНК, как указано выше (например, содержание ДНК составляет не больше чем 5% по массе).
Согласно контексту настоящего изобретения термин "РНК" относится к молекуле, которая содержит рибонуклеотидные остатки и предпочтительно полностью или главным образом состоит из рибонуклеотидных остатков. "Рибонуклеотид" относится к нуклеотиду с гидроксильной группой в 2’-положении β-D-рибофуранозильной группы. Термин "РНК" включает в себя следующее: выделенная РНК, такая как частично или полностью очищенная РНК, по существу чистая РНК, синтетическая РНК и полученная рекомбинантно РНК и включает в себя модифицированную РНК, которая отличается от встречающейся в природе РНК добавлением, делецией, заменой и/или изменением одного или нескольких нуклеотидов. Такие изменения могут включать в себя добавление ненуклеотидного материала, например, к концу(ам) РНК или внутри, например, на одном или нескольких нуклеотидах РНК. Нуклеотиды в молекулах РНК также могут содержать нестандартные нуклеотиды, такие как не встречающиеся в природе нуклеотиды или химически синтезированные нуклеотиды или дезоксинуклеотиды. Указанные измененные/модифицированные нуклеотиды можно назвать аналогами встречающихся в природе нуклеотидов и соответствующие РНК, содержащие такие измененные/модифицированные нуклеотиды (т.е. измененные/модифицированные РНК), можно назвать аналогами встречающихся в природе РНК. Молекула "по существу состоит из рибонуклеотидных остатков", если содержание рибонуклеотидных остатков в молекуле составляет по меньшей мере 40% (например, как по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%), исходя из общего числа нуклеотидных остатков в молекуле. Общее число нуклеотидных остатков в молекуле представляет собой сумму всех нуклеотидных остатков (независимо от того, являются ли нуклеотидные остатки стандартными (т.е. встречающимися в природе) нуклеотидными остатками или их аналогами).
РНК можно выделить из клеток, можно получить из матрицы ДНК или можно химически синтезировать с использованием способов, известных в настоящей области техники. Согласно предпочтительным вариантам осуществления РНК синтезируют in vitro из матрицы ДНК. Согласно одному особенно предпочтительному варианту осуществления РНК, в частности оцРНК, такую как иРНК или ингибирующую оцРНК (например, антисмысловую РНК, киРНК или микроРНК), получают с помощью in vitro транскрипции из матрицы ДНК. Методика in vitro транскрипции известна специалисту в настоящей области техники; см., например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989. Более того, существуют разнообразные наборы для in vitro транскрипции, коммерчески доступные, например, от Thermo Fisher Scientific (такие как набор T7TranscriptAidTM, набор T7MEGAscript®, MAXIscript®), New England BioLabs Inc. (такие как набор HiScribe™ T7, набор T7 ARCA иРНК HiScribe™), Promega (такие как системы RiboMAX™, HeLaScribe®, Riboprobe®), Jena Bioscience (такие как наборы для транскрипции SP6 или T7) и Epicentre (такие как AmpliScribe™). Согласно одному особенно предпочтительному варианту осуществления РНК представляет собой in vitro транскрибированную РНК (IVT РНК). Для получения модифицированной РНК соответствующим образом модифицированные нуклеотиды, такие как модифицированные встречающиеся в природе нуклеотиды, не встречающиеся в природе нуклеотиды и/или модифицированные не встречающиеся в природе нуклеотиды, можно встроить во время синтеза (предпочтительно in vitro транскрипции) или модификации можно осуществить в РНК и/или добавить к РНК после транскрипции.
Согласно настоящему изобретению предпочтительными в качестве РНК являются синтетические олигонуклеотиды из 6-100, предпочтительно 10-50, в частности 15-30 или 15-20 нуклеотидов или более длинные транскрипты из более чем 50 нуклеотидов, предпочтительно 100-15000, более предпочтительно 50-10000, более предпочтительно 100-5000, в частности 200-1000 нуклеотидов.
Согласно настоящему изобретению "РНК" включает в себя иРНК, тРНК, рРНК, мяРНК (малые ядерные РНК), оцРНК, дцРНК и ингибирующую РНК.
Согласно настоящему изобретению "оцРНК" включает в себя иРНК и ингибирующую оцРНК (такую как антисмысловая оцРНК, киРНК или микроРНК).
"оцРНК" означает одноцепочечную РНК. оцРНК может содержать самокомплементарные последовательности, которые позволяют частям РНК сворачиваться и образовывать пары самими с собой с образованием двойных спиралей. Размер оцРНК может варьировать от 6 нуклеотидов до 15000, предпочтительно 10-12000, в частности 100-10000, 150-8000, 200-7000, 250-6000 или 300-5000 нуклеотидов. Согласно одному варианту осуществления оцРНК характеризуется длиной, составляющей по меньшей мере 2700 нуклеотидов (например, по меньшей мере 2800, по меньшей мере 2900, по меньшей мере 3000, по меньшей мере 3100, по меньшей мере 3200, по меньшей мере 3300, по меньшей мере 3400, по меньшей мере 3500, по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000 нуклеотидов). Используемая в настоящем документе длинная оцРНК означает оцРНК, характеризующуюся размером, составляющим по меньшей мере 3500 нуклеотидов (например, по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000, по меньшей мере 5500, по меньшей мере 6000, по меньшей мере 6500, по меньшей мере 7000, по меньшей мере 7500, по меньшей мере 8000, по меньшей мере 8500, по меньшей мере 9000, по меньшей мере 9500 нуклеотидов), предпочтительно вплоть до 15000, например, вплоть до 14000, вплоть до 13000 или вплоть до 12000 нуклеотидов.
Согласно настоящему изобретению "дцРНК" означает двухцепочечную РНК и представляет собой РНК с двумя частично или полностью комплементарными цепями. Размер цепей моет варьировать от 6 нуклеотидов до 10000, предпочтительно 10-8000, в частности 200-5000, 200-2000 или 200-1000 нуклеотидов.
Согласно настоящему изобретению термин "иРНК" означает "информационная РНК" и относится к "транскрипту", который можно получить с использованием матрицы ДНК и который может кодировать пептид или белок. Как правило, иРНК содержит 5’-UTR (нетранслируемую область), кодирующую белок область и 3’-UTR. Согласно контексту настоящего изобретения иРНК предпочтительно получают с помощью in vitro транскрипции из матрицы ДНК. Как представлено выше, методика in vitro транскрипции известна специалисту в настоящей области техники, и разнообразные наборы для in vitro транскрипции являются коммерчески доступными. Размер иРНК может варьировать от приблизительно 1000 нуклеотидов до 15000, предпочтительно 2000-12000, в частности 2700-11000, 3000-10000, 3500-9000, 4000-9000, 4500-7000 или 5000-8000 нуклеотидов. Согласно одному варианту осуществления иРНК характеризуется длиной, составляющей по меньшей мере 2700 нуклеотидов (например, по меньшей мере 2800, по меньшей мере 2900, по меньшей мере 3000, по меньшей мере 3100, по меньшей мере 3200, по меньшей мере 3300, по меньшей мере 3400, по меньшей мере 3500, по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000 нуклеотидов). Длинная иРНК означает иРНК, характеризующуюся размером, составляющим по меньшей мере 3500 нуклеотидов (например, по меньшей мере по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000, по меньшей мере 5500, по меньшей мере 6000, по меньшей мере 6500, по меньшей мере 7000, по меньшей мере 7500, по меньшей мере 8000, по меньшей мере 8500, по меньшей мере 9000, по меньшей мере 9500 нуклеотидов), предпочтительно вплоть до 15000, например, вплоть до 14000, вплоть до 13000, вплоть до 12000, вплоть до 11000 или вплоть до 10000 нуклеотидов.
иРНК обладает лишь ограниченным периодом полужизни в клетках и in vitro. Таким образом, согласно настоящему изобретению стабильность и эффективность трансляции РНК можно модифицировать при необходимости. Например, иРНК можно стабилизировать и ее трансляцию можно увеличивать с помощью одной или нескольких модификаций, характеризующихся стабилизирующим эффектом, и/или увеличивающих эффективность трансляции иРНК. Такие модификации описаны, например, в международной патентной публикации № WO 2007/036366, полное раскрытие которой включено в настоящий документ посредством ссылки. Для увеличения экспрессии иРНК согласно настоящему изобретению ее можно модифицировать в пределах кодирующей области, т.е. последовательности, кодирующей экспрессируемый пептид или белок, предпочтительно без изменения последовательности экспрессируемого пептида или белка, с тем, чтобы увеличить GC-содержание для увеличения стабильности иРНК и проведения оптимизации кодонов и, таким образом, усиления трансляции в клетках.
Термин "модификация" в контексте РНК, предпочтительно оцРНК (такой как иРНК) согласно настоящему изобретению включает в себя любую модификацию РНК (предпочтительно оцРНК, такой как иРНК), которая не встречается в природе в указанной РНК.
Согласно одному варианту осуществления настоящего изобретения оцРНК (предпочтительно иРНК) согласно настоящему изобретению не содержит некэпированные 5'-трифосфаты. Удаление таких некэпированных 5'-трифосфатов может быть достигнуто путем обработки оцРНК (предпочтительно иРНК) фосфатазой.
оцРНК (предпочтительно иРНК) согласно настоящему изобретению может содержать модифицированные рибонуклеотиды для увеличения ее стабильности и/или уменьшения цитотоксичности. Например, согласно одному варианту осуществления в оцРНК (предпочтительно иРНК) согласно настоящему изобретению 5-метилцитидином замещают частично или полностью, предпочтительно полностью, цитидин. Альтернативно или дополнительно согласно одному варианту осуществления в оцРНК (предпочтительно иРНК) согласно настоящему изобретению уридин замещают частично или полностью, предпочтительно полностью, псевдоуридином или N(1)-метилпсевдоуридином. РНК (предпочтительно оцРНК, такая как иРНК), которая является модифицированной псевдоуридином (замещающим частично или полностью, предпочтительно полностью, уридин), в настоящем документе называется "Ψ-модифицированная", тогда как термин "1mΨ-модифицированная" означает, что РНК (предпочтительно оцРНК, такая как иРНК) содержит N(1)-метилпсевдоуридин (замещающий частично или полностью, предпочтительно полностью, уридин).
Согласно одному варианту осуществления термин "модификация" относится к получению РНК (предпочтительно оцРНК, такой как иРНК) с 5'-кэпом или аналогом 5'-кэпа. Термин "5'-кэп" относится к кэп-структуре, встречающейся на 5'-конце молекулы РНК (предпочтительно оцРНК, такой как иРНК), и, как правило, состоит из нуклеотида гуанозина, соединенного с РНК (предпочтительно оцРНК, такой как иРНК) посредством необычной 5'-5' трифосфатной связи. Согласно одному варианту осуществления этот гуанозин метилирован в 7-положении. Термин "общепринятый 5'-кэп" относится к встречающемуся в природе РНК 5'-кэпу, предпочтительно к 7-метилгуанозиновому кэпу (m7G). Согласно контексту настоящего изобретения термин "5'-кэп" включает в себя аналог 5'-кэпа, который напоминает кэп-структуру РНК и является модифицированным, чтобы обладать способностью стабилизировать РНК (предпочтительно оцРНК, такую как иРНК) и/или усиливать трансляцию РНК (предпочтительно оцРНК, такой как иРНК), будучи прикрепленным к ней, предпочтительно in vivo и/или в клетке.
Предпочтительно 5'-конец РНК (предпочтительно оцРНК, такой как иРНК) включает в себя кэп-структуру, характеризующуюся следующей общей формулой:
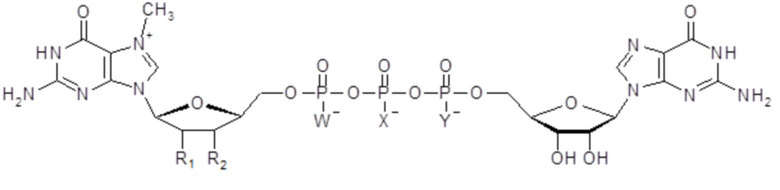
где R1 и R2 представляют собой независимо гидрокси или метокси, и W, X и Y представляют собой независимо кислород, серу, селен или BH3. Согласно предпочтительному варианту осуществления R1 и R2 представляют собой гидрокси, и W, X и Y представляют собой кислород. Согласно дополнительному предпочтительному варианту осуществления один из R1 и R2, предпочтительно R1 представляет собой гидрокси, и другой представляет собой метокси, и W, X и Y представляют собой кислород. Согласно дополнительному предпочтительному варианту осуществления R1 и R2 представляют собой гидрокси, и один из W, X и Y, предпочтительно X представляет собой серу, селен или BH3, предпочтительно серу, тогда как другие представляют собой кислород. Согласно дополнительному предпочтительному варианту осуществления один из R1 и R2, предпочтительно R2 представляет собой гидрокси, и другой представляет собой метокси, и один из W, X и Y, предпочтительно X представляет собой серу, селен или BH3, предпочтительно серу, тогда как другие представляют собой кислород.
В представленной выше формуле нуклеотид справа соединен с цепью РНК (предпочтительно оцРНК, такой как иРНК) посредством своей 3' группы.
Те кэп-структуры, в которых по меньшей мере один из W, X и Y представляет собой серу, т.е. которые содержат тиофосфатный фрагмент, существуют в различных диастереоизомерных формах, все из которых предусмотрены в настоящем документе. Более того, настоящее изобретение включает в себя все таутомеры и стереоизомеры представленной выше формулы.
Например, кэп-структура, характеризующаяся представленной выше структурой, где R1 представляет собой метокси, R2 представляет собой гидрокси, X представляет собой серу, и W и Y представляют собой кислород, существует в двух диастереоизомерных формах (Rp и Sp). Их можно проанализировать с помощью обращенно-фазовой ВЭЖХ, и они называются D1 и D2 согласно их порядку элюирования из колонки обращенно-фазовой ВЭЖХ. Согласно настоящему изобретению изомер D1 m27,2'-OGppSpG является особенно предпочтительным. Следовательно, используемый в настоящем документе термин "D1-кэпированная" относится к РНК (предпочтительно оцРНК, такой как иРНК), которая является кэпированной с помощью изомера D1 m27,2'-OGppSpG, как указано выше. Аналогично, используемый в настоящем документе термин "D2-кэпированная" относится к РНК (предпочтительно оцРНК, такой как иРНК), которая кэпирована с помощью изомера D2 m27,2'-OGppSpG, как указано выше. Дополнительные примеры кэп-структур известны специалисту в настоящей области техники и включают в себя те, которые описаны в международной патентной публикации № WO 2008/157688, полное раскрытие которой включено в настоящий документ посредством ссылки.
Обеспечение РНК (предпочтительно оцРНК, такой как иРНК) 5'-кэпом или аналогом 5'-кэпа может быть достигнуто с помощью in vitro транскрипции матрицы ДНК в присутствии указанного 5'-кэпа или аналога 5'-кэпа, причем указанный 5'-кэп котранскрипционно вводят в созданную цепь РНК (предпочтительно оцРНК, такой как иРНК) или РНК (предпочтительно оцРНК, такую как иРНК) можно создать, например, с помощью in vitro транскрипция, и 5'-кэп можно прикрепить к РНК (предпочтительно оцРНК, такой как иРНК) посттранскрипционно с использованием кэпирующих ферментов, например, кэпирующих ферментов вируса осповакцины.
РНК (предпочтительно оцРНК, такая как иРНК) может содержать дополнительные модификации. Например, дополнительная модификация оцРНК согласно настоящему изобретению может представлять собой удлинение или усечение встречающегося в природе поли(A)-хвоста или изменение 5'- или 3'-нетранслируемых (также называемых "5'- или 3'-нетранслированных") областей (UTR).
РНК (предпочтительно оцРНК, такая как иРНК), характеризующаяся немаскированной последовательностью поли-A, транслируется более эффективно, чем РНК (предпочтительно оцРНК, такая как иРНК), характеризующаяся маскированной поли-A последовательностью. Термин "поли(A)-хвост" или "последовательность поли-A" относится к последовательности остатков аденозина (в частности, аденилила) (A), которая, как правило, расположена на 3'-конце молекулы РНК (предпочтительно оцРНК, такой как иРНК), и "немаскированная последовательность поли-A" означает, что последовательность поли-A на 3'-конце молекулы РНК (предпочтительно оцРНК, такой как иРНК) заканчивается A последовательности поли-A, и за ним не следуют нуклеотиды, отличные от A, расположенные на 3'-конце, т.е. ниже последовательности поли-A. Более того, длинная последовательность поли-A, характеризующаяся длиной, составляющей приблизительно 120 нуклеотидов, дает в результате оптимальную стабильность транскрипта и эффективность трансляции РНК (предпочтительно оцРНК, такой как иРНК).
Следовательно, для увеличения стабильности и/или экспрессии РНК, предпочтительно оцРНК (такой как иРНК) согласно настоящему изобретению, ее можно модифицировать так, чтобы она присутствовала во взаимосвязи с последовательностью поли-A, предпочтительно характеризующейся длиной, составляющей 10-500, более предпочтительно 30-300, даже более предпочтительно 65-200 и особенно 100-150 остатки аденозина (в частности, аденилила). Согласно особенно предпочтительному варианту осуществления последовательность поли-A характеризуется длиной, составляющей приблизительно 120 остатков аденозина (в частности, аденилила). Для дополнительного увеличения стабильности и/или экспрессии РНК, предпочтительно оцРНК (такой как иРНК) согласно настоящему изобретению последовательность поли-A можно демаскировать.
Кроме того, введение 3'-UTR в 3'-нетранслированную область молекулы РНК (предпочтительно оцРНК, такой как иРНК) может приводить к усилению эффективности трансляции. Синергический эффект может быть достигнут путем введения двух или больше таких 3'-UTR. 3'-UTR могут являться аутологичными или гетерологичными РНК (предпочтительно оцРНК, такой как иРНК), в которую их вводят. Согласно одному конкретному варианту осуществления 3'-UTR происходит из гена глобина или иРНК, например, гена или иРНК α2-глобина, α1-глобина или β-глобина, предпочтительно β-глобина, более предпочтительно β-глобина человека.
Комбинация вышеописанных модификаций, т.е. введения последовательности поли-A, демаскирование последовательности поли-A, введение одной или нескольких 3'-UTR и замещение одного или нескольких встречающихся в природе нуклеотидов синтетическими нуклеотидами (например, цитидин 5-метилцитидином и/или уридин псевдоуридином (Ψ) или N(1)-метилпсевдоуридином (1mΨ)), обладает синергическим влиянием на стабильность РНК (предпочтительно оцРНК, такой как иРНК) и увеличение эффективности трансляции.
Используемый в настоящем документе термин "ингибирующая РНК" означает РНК, которая селективно гибридизируется и/или является специфической в отношении целевой иРНК, тем самым ингибируя (например, снижая) ее транскрипцию и/или трансляцию. Ингибирующая РНК включает в себя молекулы РНК, характеризующиеся последовательностями в антисмысловой ориентации относительно целевой иРНК. Подходящие ингибирующие олигонуклеотиды, как правило, варьируют по длине от пяти до нескольких сотен нуклеотидов, более типично приблизительно 20-70 нуклеотидов в длину или короче, даже более типично приблизительно 10-30 нуклеотидов в длину. Примеры ингибирующей РНК включают в себя антисмысловую РНК, рибозим, iРНК, киРНК и микроРНК.
Используемый в настоящем документе термин "антисмысловая РНК" относится к РНК, которая гибридизируется при физиологических условиях с ДНК, содержащей конкретный ген, или с иРНК указанного гена, тем самым ингибируя транскрипцию указанного гена и/или трансляцию указанной иРНК. Антисмысловой транскрипт нуклеиновой кислоты или ее части может формировать двойную спираль с встречающейся в природе иРНК и, таким образом, предотвращать накопление или трансляцию иРНК. Другая возможность состоит в применении рибозимов для инактивации нуклеиновой кислоты. Антисмысловая РНК может гибридизироваться с N-концевым или расположенным против ходя транскрипции 5'-сайтом, таким как сайт инициации трансляции, сайт инициации транскрипции или сайт промотора. Согласно дополнительным вариантам осуществления антисмысловая РНК может гибридизироваться с 3'-нетранслируемой областью или сайтом сплайсинга иРНК.
Размер антисмысловой РНК может варьировать от 15 нуклеотидов до 15000, предпочтительно 20-12000, в частности, 100-10000, 150-8000, 200-7000, 250-6000, 300-5000 нуклеотидов, например, 15-2000, 20-1000, 25-800, 30-600, 35-500, 40-400, 45-300, 50-250, 55-200, 60-150 или 65-100 нуклеотидов. Согласно одному варианту осуществления антисмысловая РНК характеризуется длиной, составляющей по меньшей мере 2700 нуклеотидов (например, по меньшей мере 2800, по меньшей мере 2900, по меньшей мере 3000, по меньшей мере 3100, по меньшей мере 3200, по меньшей мере 3300, по меньшей мере 3400, по меньшей мере 3500, по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000 нуклеотидов). Используемая в настоящем документе длинная антисмысловая РНК означает антисмысловую РНК, характеризующуюся размером, составляющим по меньшей мере 3500 нуклеотидов (например, по меньшей мере 3600, по меньшей мере 3700, по меньшей мере 3800, по меньшей мере 3900, по меньшей мере 4000, по меньшей мере 4100, по меньшей мере 4200, по меньшей мере 4300, по меньшей мере 4400, по меньшей мере 4500, по меньшей мере 4600, по меньшей мере 4700, по меньшей мере 4800, по меньшей мере 4900, по меньшей мере 5000, по меньшей мере 5500, по меньшей мере 6000, по меньшей мере 6500, по меньшей мере 7000, по меньшей мере 7500, по меньшей мере 8000, по меньшей мере 8500, по меньшей мере 9000, по меньшей мере 9500 нуклеотидов), предпочтительно вплоть до 15000, например, вплоть до 14000, вплоть до 13000, вплоть до 12000, вплоть до 11000 или вплоть до 10000 нуклеотидов.
Стабильность антисмысловой РНК можно модифицировать при необходимости. Например, антисмысловую РНК можно стабилизировать с помощью одной или нескольких модификаций, характеризующихся стабилизирующим эффектом. Такие модификации включают в себя модифицированные фосфодиэфирные связи (такие как метилфосфонатные, тиофосфатные, фосфородитиоатные или фосфорамидатные связи вместо встречающихся в природе фосфодиэфирных связей) и 2'-замены (например, 2'-фтор, 2'-O-алкил (такой как 2'-O-метил, 2'-O-пропил или 2'-O-пентил) и 2'-O-аллил). Например, согласно одному варианту осуществления антисмысловой РНК тиофосфатными связями частично замещают фосфодиэфирные связи. Альтернативно или дополнительно согласно одному варианту осуществления антисмысловой РНК фрагмент рибозы частично замещают на 2'-положении с помощью O-алкила (такого как 2'-O-метил).
Антисмысловую РНК можно нацелить на любой участок, составляющий приблизительно 19-25 смежных нуклеотидов в любой из целевых последовательностей иРНК ("целевая последовательность"). Как правило, целевую последовательность на целевой иРНК можно выбрать из данной последовательности кДНК, соответствующей целевой иРНК, предпочтительно начиная с 50-100 нуклеотидов по ходу транскрипции (т.е. в 3'-направлении) от старт-кодона. Целевая последовательность, тем не менее, может быть расположена в 5'- или 3'-нетранслируемых областях или в области вблизи старт-кодона.
Антисмысловую РНК можно получить с использованием ряда техник, известных специалистам в настоящей области техники. Например, антисмысловую РНК можно химически синтезировать или получить рекомбинантно с использованием способов, известных в настоящей области техники. Предпочтительно антисмысловую РНК транскрибируют из рекомбинантных кольцевых или линейных ДНК-плазмид с использованием любого подходящего промотора.
Выбор плазмид, подходящих для экспрессии антисмысловой РНК, способов вставки последовательностей нуклеиновых кислот для экспрессии антисмысловой РНК в плазмиду и IVT способы in vitro транскрипции указанной антисмысловой РНК находятся в пределах компетенции специалиста в настоящей области техники.
"Антисмысловая оцРНК" относится к антисмысловой РНК, как указано выше, которая является одноцепочечной.
Под используемой в настоящем документе "короткой интерферирующей РНК" или "киРНК" подразумевают молекулу РНК, составляющую предпочтительно больше чем 10 нуклеотидов в длину, более предпочтительно больше чем 15 нуклеотидов в длину и наиболее предпочтительно 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов в длину, которая способна специфически связываться с частью целевой иРНК. Это связывание индуцирует процесс, в котором указанную часть целевой иРНК отрезают или разлагают, и, тем самым, генная экспрессия указанной целевой иРНК ингибируется. Диапазон, составляющий 19-25 нуклеотидов, представляет собой наиболее предпочтительный размер для киРНК. Несмотря на то, что, в принципе, смысловые и антисмысловые цепи киРНК могут содержать две комплементарные, одноцепочечные молекулы РНК, киРНК согласно настоящему изобретению содержат одну молекулу, в которой две комплементарные части, основания которых спарены, и которые ковалентно связаны с помощью одноцепочечной "шпилечной" области. Иными словами, смысловая область и антисмысловая область могут быть ковалентно соединены посредством линкерной молекулы. Линкерная молекула может представлять собой полинуклеотидный или ненуклеотидный линкер, но представляет собой предпочтительно полинуклеотидный линкер. Без ограничения какой-либо теорией, полагают, что шпилечная область молекулы одноцепочечной киРНК отщепляется внутриклеточно с помощью белка "дайсер" (или его эквивалента) с образованием киРНК двух индивидуальных молекул РНК со спаренными основаниями.
киРНК также может содержать 3'-свисающий конец. Используемый в настоящем документе "3'-свисающий конец" относится по меньшей мере к одному неспаренному нуклеотиду, продолжающемуся от 3'-конца цепи РНК. Таким образом, согласно одному варианту осуществления киРНК содержит по меньшей мере один 3'-свисающий конец, составляющий от 1 до приблизительно 6 нуклеотидов (который включает в себя рибонуклеотиды или дезоксинуклеотиды) в длину, предпочтительно от 1 до приблизительно 5 нуклеотидов в длину, более предпочтительно от 1 до приблизительно 4 нуклеотидов в длину и особенно предпочтительно от приблизительно 2 до приблизительно 4 нуклеотидов в длину. Согласно варианту осуществления, в котором обе цепи молекулы киРНК (т.е. после того, как молекула одноцепочечной киРНК отщепилась внутриклеточно с помощью белка "дайсер") содержат 3'-свисающий конец, длина свисающих концов может являться одинаковой или различной для каждой цепи. Согласно наиболее предпочтительному варианту осуществления 3'-свисающий конец присутствует на обеих цепях киРНК и составляет 2 нуклеотида в длину. Например, каждая цепь киРНК может содержать 3'-свисающие концы дидезокситимидиловой кислоты ("TT") или диуридиловой кислоты ("uu").
Для усиления стабильности киРНК 3'-свисающие концы также можно стабилизировать от разложения. Согласно одному варианту осуществления свисающие концы стабилизируют путем включения пуриновых нуклеотидов, таких как аденозиновые или гуанозиновые нуклеотиды. Альтернативно замена пиримидиновых нуклеотидов модифицированными аналогами, например, замена уридиновых нуклеотидов в 3'-свисающих концах 2'-дезокситимидином является переносимой и не влияет на эффективность РНКi-разложения. В частности, отсутствие 2'-гидроксила в 2'-дезокситимидине значительно усиливает устойчивость 3'-свисающего конца к нуклеазам в среде культивирования тканей.
Используемая в настоящем документе "целевая иРНК" относится к молекуле РНК, которая представляет собой мишень для отрицательной регуляции.
киРНК согласно настоящему изобретению можно нацелить на любой участок, составляющий приблизительно 19-25 смежных нуклеотидов в любой из целевых последовательностей иРНК ("целевая последовательность"). Техники для выбора целевых последовательностей для киРНК представлены, например, в Tuschl T. et al., "The siRNA User Guide", ред. 11 октября 2002, полное раскрытие которой включено в настоящий документ посредством ссылки. "The siRNA User Guide" доступен в сети Интернет на Интернет-сайте, находящимся в ведении Dr. Thomas Tuschl, лаборатории молекулярной биологии РНК (Laboratory of RNA Molecular Biology), Рокфеллеровского университета (Rockefeller University), Нью-Йорк, США, и его можно найти, обратившись к Интернет-сайту Rockefeller University и произведя поиск по ключевому слову "siRNA". Дополнительное руководство в отношении выбора целевых последовательностей и/или структуры киРНК можно найти на Интернет-страницах Protocol Online (www.protocol-online.com) с использованием ключевого слова "siRNA". Таким образом, согласно одному варианту осуществления смысловая цепь киРНК согласно настоящему изобретению содержит нуклеотидную последовательность, по существу идентичную любому непрерывному участку, составляющему приблизительно 19 - приблизительно 25 нуклеотидов в целевой иРНК.
Как правило, целевую последовательность на целевой иРНК можно выбрать из данной последовательности кДНК, соответствующей целевой иРНК, предпочтительно начиная с 50-100 нуклеотидов по ходу транскрипции (т.е. в 3'-направлении) от старт-кодона. Целевая последовательность, тем не менее, может быть расположена в 5'- или 3'-нетранслируемых областях или в области вблизи старт-кодона.
киРНК можно получить с использованием ряда техник, известных специалистам в настоящей области техники. Например, киРНК можно химически синтезировать или получить рекомбинантно с использованием способов, известных в настоящей области техники, таких как in vitro система Drosophila, описанная в заявке на выдачу патента США № 2002/0086356 Tuschl с соавт., полное раскрытие которой включено в настоящий документ посредством ссылки. киРНК можно экспрессировать из экспрессионных векторов pol III без изменения в нацеливающем сайте, так как экспрессия РНК из промоторов pol III, как считают, является эффективной только тогда, когда первый транскрибируемый нуклеотид представляет собой пурин.
Предпочтительно киРНК транскрибируют из рекомбинантных кольцевых или линейных ДНК-плазмид с использованием любого подходящего промотора. Подходящие промоторы для транскрипции киРНК согласно настоящему изобретению из плазмиды включают в себя, например, промоторные последовательности U6 или H1 РНК pol III и цитомегаловирусный промотор. Выбор других подходящих промоторов находится в компетенции специалистов в настоящей области техники.
Выбор плазмид, подходящих для транскрипции киРНК, способов вставки нуклеиновокислотных последовательностей для экспрессии киРНК в плазмиду и IVT способы in vitro транскрипции указанной киРНК находятся в компетенции специалистов в настоящей области техники.
Используемый в настоящем документе термин "микроРНК" (миРНК) относится к некодирующим РНК, которые характеризуются длиной, составляющей 21-25 (например, 21-23, предпочтительно 22) нуклеотидов, и которые индуцируют разложение и/или предотвращают трансляцию целевых иРНК. микроРНК, как правило, встречаются у растений, животных и некоторых вирусов, причем они кодируются эукариотической ядерной ДНК у растений и животных и вирусной ДНК (у вирусов, чей геном основан на ДНК), соответственно. микроРНК представляют собой посттранскрипционные регуляторы, которые связываются с комплементарными последовательностями на транскриптах целевых информационных РНК (иРНК), как правило, приводя к трансляционной репрессии или разложению мишени и сайленсингу генов.
микроРНК можно получить с использованием ряда техник, известных специалистам в настоящей области техники. Например, антисмысловую РНК можно химически синтезировать или получить рекомбинантно с использованием способов, известных в настоящей области техники (например, с использованием коммерчески доступных наборов, таких как miRNA cDNA Synthesis Kit, продаваемый Applied Biological Materials Inc.). Предпочтительно антисмысловую РНК транскрибируют из рекомбинантных кольцевых или линейных ДНК-плазмид с использованием любого подходящего промотора. Техники прогнозирования вторичной структуры РНК представлены, например, в Sato et al. (Nucleic Acids Res. 37(2009):W277–W280), Hamada et al. (Nucleic Acids Res. 39(2011):W100–W106 2011) и Reuter and Mathews (BMC Bioinformatics 11(2010):129).
Термин "нуклеозид" относится к соединениям, которые можно рассматривать как нуклеотиды без фосфатной группы. Наряду с тем, что нуклеозид представляет собой нуклеиновое основание, соединенное с сахаром (например, рибозой или дезоксирибозой), нуклеотид состоит из нуклеозида и одной или нескольких фосфатных групп. Примеры нуклеозидов включают в себя цитидин, уридин, аденозин и гуанозин.
Пять стандартных нуклеозидов, которые образуют нуклеиновые кислоты, представляют собой уридин, аденозин, тимидин, цитидин и гуанозин. Пять нуклеозидов обычно сокращают до их однобуквенных кодов U, A, T, C и G, соответственно. Тем не менее, тимидин чаще всего записывают как "dT" ("d" представляет "дезокси"), так как он содержит 2'-дезоксирибофуранозный фрагмент, а не рибофуранозное кольцо, обнаруженное в уридине. Это связано с тем, что тимидин находится в дезоксирибонуклеиновой кислоте (ДНК), а не в рибонуклеиновой кислоте (РНК). Напротив, уридин находится в РНК, а не в ДНК. Оставшиеся три нуклеозида могут встречаться как в РНК, так и ДНК. В РНК они будут представлены как A, C и G, тогда как в ДНК они будут представлены как dA, dC и dG.
Термин "стабильность" РНК (предпочтительно оцРНК, такой как иРНК) относится к "периоду полужизни" РНК. "Период полужизни" относится к периоду времени, который необходим для устранения половины активности, количества или числа молекул. Согласно контексту настоящего изобретения период полужизни РНК (предпочтительно оцРНК, такой как иРНК или ингибирующая оцРНК) является показателем стабильности указанной РНК.
Разумеется, если согласно настоящему изобретению необходимо уменьшить стабильность РНК (предпочтительно оцРНК, такой как иРНК или ингибирующей оцРНК), можно модифицировать РНК (предпочтительно оцРНК, такую как иРНК или ингибирующую оцРНК) с тем, чтобы препятствовать функции элементов, описанных выше, увеличивающих стабильность РНК (предпочтительно оцРНК, такой как иРНК или ингибирующая оцРНК).
Согласно одному варианту осуществления оцРНК согласно настоящему изобретению представляет собой (модифицированную) оцРНК, в частности (модифицированную) иРНК, кодирующую пептид или белок. Согласно настоящему изобретению термин "оцРНК, кодирующая пептид или белок" означает, что оцРНК, если она находится в соответствующем окружении, предпочтительно внутри клетки, может управлять сборкой аминокислот для продукции, т.е. экспрессии пептида или белка во время процесса трансляции. Предпочтительно оцРНК (такие как иРНК) согласно настоящему изобретению способна взаимодействовать с клеточным аппаратом трансляции, обеспечивающим возможность трансляции пептида или белка.
Термин "экспрессия" используют согласно настоящему изобретению в его наиболее общем значении, и он предусматривает продукцию РНК и/или пептидов или белков, например, путем транскрипции и/или трансляции. В отношении РНК термин "экспрессия" или "трансляция" относится, в частности, к продукции пептидов или белков. Он также включает в себя частичную экспрессию нуклеиновых кислот. Более того, экспрессия может являться транзиентной или стабильной.
Согласно контексту настоящего изобретения термин "транскрипция" относится к процессу, при котором генетический код в последовательности ДНК транскрибируется в РНК. Впоследствии РНК может транслироваться в белок. Согласно настоящему изобретению термин "транскрипция" включает в себя "in vitro транскрипцию", причем термин "in vitro транскрипция" относится к процессу, при котором РНК, в частности оцРНК, такая как иРНК, in vitro синтезируют в бесклеточной системе, предпочтительно с использованием подходящих клеточных экстрактов. Предпочтительно клонирующие векторы применяют для создания транскриптов. Указанные клонирующие векторы, как правило, обозначают как транскрипционные векторы и согласно настоящему изобретению они включены в термин "вектор". Согласно настоящему изобретению препарат РНК содержит оцРНК, полученную с помощью in vitro транскрипции, в частности in vitro транскрипции соответствующей матрицы ДНК. Промотор для контроля транскрипции может представлять собой любой промотор для любой РНК-полимеразы. Конкретные примеры РНК-полимераз представляют собой РНК-полимеразы T7, T3 и SP6. Предпочтительно in vitro транскрипцию контролирует промотор T7, T3 или SP6. Матрицу ДНК для in vitro транскрипции можно получить путем клонирования нуклеиновой кислоты, в частности кДНК, и введения ее в соответствующий вектор для in vitro транскрипции. кДНК можно получить путем обратной транскрипции РНК.
Содержащая кДНК векторная матрица может содержать векторы, несущие различные вставки кДНК, которые после транскрипции, дают в результате популяцию различных молекул РНК, необязательно способных экспрессировать различные пептиды или белки, или может содержать векторы, несущие только один вид вставки кДНК, которая после транскрипции, дает в результате только популяцию одного вида РНК, способного экспрессировать только один пептид или белок. Таким образом, возможно получить РНК, способную экспрессировать только один пептид или белок, или можно получить композиции различных РНК, такие как библиотеки РНК и РНК цельной клетки, способные экспрессировать более одного пептида или белка, например, композицию пептидов или белков. Согласно настоящему изобретению предусмотрено введение всей такой РНК в клетки.
Термин "трансляция" согласно настоящему изобретению относится к процессу в рибосомах клетки, с помощью которого цепь иРНК управляет сборкой последовательности аминокислот для получения пептида или белка.
Используемый в настоящем документе термин "пептид" включает в себя олиго- и полипептиды и относится к веществам, содержащим две или больше, предпочтительно 3 или больше, предпочтительно 4 или больше, предпочтительно 6 или больше, предпочтительно 8 или больше, предпочтительно 10 или больше, предпочтительно 13 или больше, предпочтительно 16 или больше, предпочтительно 21 или больше и вплоть до предпочтительно 8, 10, 20, 30, 40 или 50, в частности 100 аминокислот, соединенных ковалентно с помощью пептидных связей. Термин "белок" предпочтительно относится к большим пептидам, предпочтительно к пептидам с более чем 100 аминокислотными остатками, но, в целом, термины "пептид" и "белок" представляют собой синонимы, и в настоящем документе их используют взаимозаменяемо.
Согласно настоящему изобретению оцРНК, такая как иРНК, может кодировать пептид или белок. Соответственно, оцРНК может содержать кодирующую область (открытую рамку считывания (ORF)), кодирующую пептид или белок. Например, оцРНК может кодировать и экспрессировать антиген или фармацевтически активный пептид или белок, такой как иммунологически активное соединение (которое предпочтительно не является антигеном). В этом отношении "открытая рамка считывания" или "ORF" представляет собой непрерывный участок кодонов, начиная со страт-кодона и заканчивая стоп-кодоном.
Термин "фармацевтически активный пептид или белок" включает в себя пептид или белок, который можно использовать в лечении субъекта, если экспрессия пептида или белка принесет пользу, например, в уменьшения интенсивности симптомов заболевания или нарушения. Например, фармацевтически активный белок может заменять или увеличивать экспрессию белка в клетке, которая в норме не экспрессирует белок или которая мисэкспрессирует белок, например, фармацевтически активный белок может компенсировать мутацию за счет поставки требуемого белка. Кроме того, "фармацевтически активный пептид или белок" может производить благоприятный эффект вмешательства у субъекта, например, его можно использовать для получения белка, который вакцинирует субъекта против инфекционного заболевания. Предпочтительно "фармацевтически активный пептид или белок" обладает положительным или благоприятным эффектом на состояние или болезненное состояние субъекта при введении субъекту в терапевтически эффективном количестве. Предпочтительно фармацевтически активный пептид или белок обладает направленными на полное излечение или паллиативными свойствами, и его можно вводить для уменьшения интенсивности, облегчения, ослабления, обратного развития, задержки начала или уменьшения тяжести одного или нескольких симптомов заболевания или нарушения. Фармацевтически активный пептид или белок могут обладать профилактическими свойствами, и их можно использовать для задержки начала заболевания или уменьшения тяжести такого заболевания или патологического состояния. Термин "фармацевтически активный пептид или белок" включает в себя целые белки или полипептиды, и может также относиться к их фармацевтически активным фрагментам. Он также может включать в себя фармацевтически активные аналоги пептида или белка. Термин "фармацевтически активный пептид или белок" включает в себя пептиды и белки, которые представляют собой антигены, т.е. пептид или белок вызывает иммунный ответ у субъекта, который может являться терапевтическим или частично или полностью защитным.
Примеры фармацевтически активных белков включают в себя без ограничения следующее: цитокины и белки иммунной системы, такие как иммунологически активные соединения (например, интерлейкины, колониестимулирующий фактор (CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, фактор некроза опухоли (TNF), интерфероны, интегрины, адрессины, селектины, «хоминг»-рецепторы, T-клеточные рецепторы, иммуноглобулины, растворимые антигены главного комплекса гистосовместисмости, иммунологически активные антигены, такие как антигены бактерий, простейших или вирусов, аллергены, аутоантигены, антитела), гормоны (инсулин, гормон щитовидной железы, катехоламины, гонадотропины, трофические гормоны, пролактин, окситоцин, дофамин, бычий соматотропин, лептины и т.п.), гормоны роста (например, гормон роста человека), факторы роста (например, эпидермальный фактор роста, фактор роста нервов, инсулиноподобный фактор роста и т.п.), рецепторы факторов роста, ферменты (активатор тканевого плазминогена, стрептокиназа, холестрин биосинтетический или деструктивный, стероидогенные ферменты, киназы, фосфодиэстеразы, метилазы, деметилaзы, дегидрогеназы, целлюлазы, протеазы, липазы, фосфолипазы, ароматазы, цитохромы, аденилат- или гуанилатциклазы, нейрамидазы и т.п.), рецепторы (рецепторы стероидных гормонов, пептидные рецепторы), связывающие белки (белки, связывающие гормоны роста и факторы роста и т.п.), транскрипционные и трансляционные факторы, подавляющие рост опухоли белки (например, белки, которые ингибируют ангиогенез), структурные белки (такие как коллаген, фиброин, фибриноген, эластин, тубулин, актин и миозин) и белки крови (тромбин, сывороточный альбумин, Фактор VII, Фактор VIII, инсулин, Фактор IX, Фактор X, активатор тканевого плазминогена, белок C, фактор фон Виллебранда, антитромбин III, глюкоцереброзидаза, эритропоэтин, гранулоцитарный колониестимулирующий фактор (GCSF) или модифицированный Фактор VIII, антикоагулянты и т.п.).
Согласно одному варианту осуществления фармацевтически активный белок представляет собой цитокин, который вовлечен в регуляцию лимфоидного гомеостаза, предпочтительно цитокин, который вовлечен и предпочтительно индуцирует или усиливает развитие, примирование, экспансию, дифференцировку и/или выживаемость T-клеток. Согласно одному варианту осуществления цитокин представляет собой интерлейкин. Согласно одному варианту осуществления фармацевтически активный белок представляет собой интерлейкин, выбранный из группы, состоящей из IL-2, IL-7, IL-12, IL-15 и IL-21.
Термин "иммунологически активное соединение" относится к любому соединению, изменяющему иммунный ответ, предпочтительно путем индукции и/или супрессии созревания иммунных клеток, индукции и/или супрессии цитокинового биосинтеза и/или изменяющему гуморальный иммунитет путем стимуляции продукции антител B-клетками. Иммунологически активные соединения обладают сильной иммуностимулирующей активностью, включая в себя без ограничения антивирусную и противоопухолевую активность, и также могут отрицательно регулировать другие аспекты иммунного ответа, например, сдвигая иммунный ответ в направлении от иммунного ответа TH2, что является применимым для лечения широкого спектра опосредованных TH2 заболеваний. Иммунологически активные соединения можно применять в качестве адъювантов вакцин.
Согласно одному варианту осуществления оцРНК (такую как иРНК), которая кодирует антиген, такой как ассоциированный с заболеванием антиген, вводят млекопитающему, в частности, если необходимо лечение млекопитающего, характеризующегося наличием заболевания, в которое вовлечен или при котором экспрессируется антиген (ассоциированный с заболеванием антиген). оцРНК предпочтительно захватывается в антигенпрезентирующие клетки млекопитающего (моноциты, макрофаги, дендритные клетки или другие клетки). Формируется антигенный продукт трансляции оцРНК, и продукт представлен на поверхности клеток для распознавания T-клетками. Согласно одному варианту осуществления антиген или продукт, произведенный путем его необязательного процессирования, представлен на клеточной поверхности в контексте молекул MHC для распознавания T-клетками посредством их T-клеточного рецептора, приводя к их активации.
Интерфероны представляют собой важные цитокины, характеризующиеся антивирусной, антипролиферативной и иммуномодулирующей активностями. Интерфероны представляют собой белки, которые изменяют и регулируют транскрипцию генов внутри клетки путем связывания с рецептором интерферона на поверхности регулируемой клетки, тем самым предотвращая вирусную репликацию внутри клеток. Интерфероны можно разделить на два типа. IFN-гамма представляет собой единственный интерферон типа II; все другие относятся к интерферонам типа I. Интерфероны типа I и типа II различаются по генной структуре (гены интерферона типа II содержат три экзона; а типа I - один), расположением на хромосомах (у людей интерферон типа II расположен на хромосоме -12; гены интерферона типа I соединены и расположены на хромосоме-9), и типам тканей, где они производятся (интерфероны типа I синтезируются повсеместно, а типа II лимфоцитами). Интерфероны типа I конкурентно ингибируют связывание друг друга с клеточными рецепторами, тогда как интерферон типа II обладает отдельным рецептором. Согласно настоящему изобретению термин "интерферон" или "IFN" предпочтительно относится к интерферонам типа I, в частности IFN-альфа и IFN-бета.
Согласно одному варианту осуществления РНК, в частности РНК, которая подлежит экспрессии в клетке, представляет собой одноцепочечную самореплицирующуюся РНК. Согласно одному варианту осуществления самореплицирующаяся РНК представляет собой одноцепочечную РНК с положительной полярностью. Согласно одному варианту осуществления самореплицирующаяся РНК представляет собой вирусную РНК или РНК, происходящую из вирусной РНК. Согласно одному варианту осуществления самореплицирующаяся РНК представляет собой альфавирусную геномную РНК или происходит из альфавирусной геномной РНК. Согласно одному варианту осуществления самореплицирующаяся РНК представляет собой экспрессионный вектор вирусного гена. Согласно одному варианту осуществления вирус представляет собой вирус леса Семлики. Согласно одному варианту осуществления самореплицирующаяся РНК содержит один или несколько трансгенов, которые согласно одному варианту осуществления, если РНК представляет собой вирусную РНК, могут частично или полностью замещать вирусные последовательности, такие как вирусные последовательности, кодирующие структурные белки.
Используемый в настоящем документе термин "препарат РНК" относится к любой композиции, содержащей по меньшей мере один тип различных типов РНК, указанных выше (т.е. иРНК, тРНК, рРНК, мяРНК, оцРНК, дцРНК и ингибирующая оцРНК (например, антисмысловая РНК, киРНК или микроРНК)). Используемый в настоящем документе термин "препарат РНК, содержащий оцРНК" относится к любой композиции, содержащей по меньшей мере оцРНК (тем не менее, указанная композиция также может содержать дцРНК). Термин "препарат РНК, содержащий оцРНК, полученную с помощью in vitro транскрипции" относится к любой композиции, содержащей по меньшей мере оцРНК, причем указанную оцРНК создали с помощью in vitro транскрипции.
Используемый в настоящем документе термин "in vitro транскрипция" или "IVT" означает, что транскрипцию (т.е. создание РНК) проводят бесклеточным способом. Иными словами, IVT не использует живые/культивированные клетки, а вместо этого транскрипционный аппарат, экстрагированный из клеток (например, клеточные лизаты или их выделенные компоненты, включая в себя РНК-полимеразу (предпочтительно полимераза T7, T3 или SP6)).
Используемый в настоящем документе термин "необязательный" или "необязательно" означает, что описанное впоследствии событие, обстоятельство или условие может происходить или нет, и что описание включает в себя случаи, где указанное обстоятельство или условие происходит, и случаи, в которых оно не происходит.
"Изомеры" представляют собой соединения, характеризующиеся одинаковой молекулярной формулой, но различающиеся по структуре ("структурные изомеры") или геометрическому расположению функциональных групп и/или атомов ("стереоизомеры"). "Энантиомеры" представляют собой пару стереоизомеров, которые представляют собой несовпадающие при наложении зеркальные отражения друг друга. "Рацемическая смесь" или "рацемат" включает в себя пару энантиомеров в равных количествах и обозначен приставкой (±). "Диастереомеры" представляют собой стереоизомеры, которые представляют собой несовпадающие при наложении зеркальные отражения друг друга. "Таутомеры" представляют собой структурные изомеры одного и того же химического вещества, которые спонтанно превращаются друг в друга, даже будучи чистыми.
Такие термины, как "уменьшение", "снижение" или "ингибирование" относятся к способности вызывать общее уменьшение уровня предпочтительно на 5% или больше, 10% или больше, 20% или больше, более предпочтительно на 50% или больше и наиболее предпочтительно на 75% или больше. Это также включает в себя полное или по существу полное уменьшение, т.e. уменьшение до нуля или по существу до нуля.
Такие термины, как "увеличение", "усиление", или "пролонгирование" предпочтительно относятся к увеличению, усилению или пролонгированию приблизительно по меньшей мере на 10%, предпочтительно по меньшей мере на 20%, предпочтительно по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, предпочтительно по меньшей мере на 50%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 100%, предпочтительно по меньшей мере на 200% и, в частности, по меньшей мере на 300%. Указанные термины могут также относиться к увеличению, усилению или пролонгированию от нуля или неизмеряемого или необнаруживаемого уровня до уровня, являющегося больше чем нулевой, или уровня, который является измеряемым или обнаруживаемым.
Используемый в настоящем документе термин "встречающийся в природе" относится к тому факту, что объект можно найти в природе. Например, белок или нуклеиновую кислоту, которые присутствуют в организме (включая в себя вирусы), можно выделить из источника в природе, и они не были намеренно модифицированы человеком в лаборатории, являются встречающимися в природе.
оцРНК согласно настоящему изобретению может являться изотопно-меченной, т.е. один или несколько атомов оцРНК замещены соответствующим атомом, характеризующимся одинаковым числом протонов, но отличающимся по числу нейтронов. Например, атом водорода можно заменить атомом дейтерия. Иллюстративные изотопы, которые можно использовать в оцРНК согласно настоящему изобретению, включают в себя дейтерий, 11C, 13C, 14C, 15N, 18F, 32S, 36Cl и 125I. Изотопно-меченную оцРНК можно получить с использованием соответствующим образом изотопно-меченных нуклеотидов во время in vitro транскрипции или путем добавления таких соответствующим образом изотопно-меченных нуклеотидов после транскрипции.
Согласно одному аспекту настоящее изобретение относится к фармацевтической композиции, содержащей оцРНК согласно настоящему изобретению и одно или несколько фармацевтически приемлемых вспомогательных веществ. Согласно одному варианту осуществления фармацевтическая композиция содержит оцРНК согласно настоящему изобретению, одно или несколько фармацевтически приемлемых вспомогательных веществ и одно или несколько дополнительных/вспомогательных активных соединений.
Согласно дополнительным аспектам настоящая заявка относится к оцРНК, как указано выше, или фармацевтической композиции, как указано в настоящем документе, для применения в терапии.
Например, оцРНК и фармацевтические композиции согласно настоящему изобретению можно использовать в лечении (включая в себя профилактическое лечение) состояния, нарушения или заболевания, выбранного из группы, состоящей из инфекционных заболеваний (например, заболеваний, вызванных вирусами, бактериями, грибами или другими микроорганизмами); нежелательного воспаления (такого как иммунное нарушение); и злокачественной опухоли.
Таким образом, согласно дополнительным аспектам настоящее изобретение относится к следующему: (i) оцРНК согласно настоящему изобретению (или фармацевтическая композиция, содержащая такую оцРНК необязательно вместе с фармацевтически приемлемым вспомогательным веществом) для применения в способе лечения состояния, нарушения или заболевания, как указано в настоящем документе, в частности, заболевания, выбранного из группы, состоящей из инфекционных заболеваний (например, заболеваний, вызванных вирусом, бактерией, грибом или другим микроорганизмом); нежелательного воспаления и злокачественной опухоли; и (ii) способ лечения нуждающегося в этом индивидуума, предусматривающий введение фармацевтически эффективного количества оцРНК согласно настоящему изобретению (или фармацевтической композиции, содержащей такую оцРНК необязательно вместе с фармацевтически приемлемым вспомогательным веществом) индивидууму. Согласно одному варианту осуществления индивидуум страдает или является чувствительным или подвержен риску одного или нескольких условий, нарушений или заболеваний, раскрытых в настоящем документе. Состояние, нарушение или заболевание можно выбрать из группы, состоящей из инфекционных заболеваний (например, заболеваний, вызванных вирусом, бактерией, грибом или другим микроорганизмом); нежелательного воспаления и злокачественной опухоли. Более того, индивидуум представляет собой предпочтительно млекопитающее и более предпочтительно человека.
Злокачественная опухоль (медицинский термин: злокачественное новообразование) представляет собой класс заболеваний, при которых группа клеток проявляет неконтролируемый рост (деление превышает нормальные границы), инвазию (вторжение и разрушение соседних тканей) и иногда метастазирование (распространение на другие участки в организме через лимфу или кровь). Указанные три злокачественные свойства злокачественных опухолей отличают их от доброкачественных опухолей, которые являются самоограниченными и не инвазируют или метастазируют. Большинство злокачественных опухолей образуют опухоль, т.е. набухание или поражение, образованные аномальным ростом клеток (которые называются неопластические клетки или опухолевые клетки), но некоторые, такие как лейкоз, не образуют опухоль. Термин "злокачественная опухоль" согласно настоящему изобретению предусматривает следующее: лейкозы, семиномы, меланомы, тератомы, лимфомы, нейробластомы, глиомы, злокачественная опухоль прямой кишки, злокачественная опухоль эндометрия, злокачественная опухоль почки, злокачественная опухоль надпочечника, злокачественная опухоль щитовидной железы, злокачественная опухоль крови, злокачественная опухоль кожи, злокачественная опухоль головного мозга, злокачественная опухоль шейки матки, злокачественная опухоль кишечника, злокачественная опухоль печени, злокачественная опухоль толстой кишки, злокачественная опухоль желудка, злокачественная опухоль кишечника, злокачественная опухоль головы и шеи, злокачественная опухоль желудка и кишечника, злокачественная опухоль лимфатического узла, злокачественная опухоль пищевода, злокачественная опухоль толстой и прямой кишки, злокачественная опухоль поджелудочной железы, злокачественная опухоль глаза, носа и горла (ENT), злокачественная опухоль молочной железы, злокачественная опухоль предстательной железы, злокачественная опухоль матки, злокачественная опухоль яичника и злокачественная опухоль легкого и их метастазы. Их примеры представляют собой карциномы легкого, карциномы молочной железы, карциномы предстательной железы, карциномы толстой кишки, печеночноклеточные карциномы, карциномы шейки матки или метастазы описанных выше типов злокачественных опухолей или опухолей. Термин злокачественная опухоль согласно настоящему изобретению также включает в себя метастазы злокачественной опухоли.
Примеры злокачественных опухолей, поддающихся лечению с помощью оцРНК и фармацевтических композиций согласно настоящему изобретению, включают в себя злокачественную меланому, все типы карциномы (карцинома толстой кишки, печеночноклеточная карцинома, карцинома мочевого пузыря, предстательной железы, немелкоклеточная и мелкоклеточная карцинома легкого и т.д.), лимфомы, саркомы, бластомы, глиомы и т.д.
Злокачественная меланома представляет собой серьезный тип злокачественной опухоли кожи. Она вызвана неконтролируемым ростом пигментных клеток, которые называются меланоциты.
Согласно настоящему изобретению "карцинома" представляет собой злокачественную опухоль, происходящую из эпителиальных клеток. Эта группа представляет наиболее распространенные злокачественные опухоли, включая в себя часто встречающиеся формы злокачественной опухоли молочной железы, предстательной железы, легкого и толстой кишки.
Лимфома и лейкоз представляют собой злокачественные опухоли, происходящие из гемопоэтических (кроветворных) клеток.
Саркома представляет собой злокачественную опухоль, которая возникает из трансформированных клеток в одной из ряда тканей, которые развиваются из эмбриональной мезодермы. Таким образом, саркомы включают в себя опухоли костной, хрящевой, жировой, мышечной, сосудистой и гемопоэтической тканей.
Бластная опухоль или бластома представляет собой опухоль (как правило, злокачественную), которая напоминает незрелую или эмбриональную ткань. Многие из указанных опухолей наиболее распространены у детей.
Глиома представляет собой тип опухоли, которая начинается в головном или спинном мозге. Она называется глиома, поскольку она происходит из глиальных клеток. Наиболее распространенное место расположения глиом представляет собой головной мозг.
Под "метастазированием" подразумевают распространение злокачественных клеток из их исходного места расположения на другую часть организма. Образование метастазов представляет собой очень сложный процесс и зависит от открепления злокачественных клеток от первичной опухоли, инвазии внеклеточного матрикса, проникновения через эндотелиальные базальные мембраны для выхода в полость и сосуды организма и затем, после транспорта кровью, инфильтрации целевых органов. В итоге рост новой опухоли, т.е. вторичной опухоли или метастатической опухоли, на целевом сайте зависит от ангиогенеза. Метастазирование опухоли часто происходит даже после удаления первичной опухоли, поскольку опухолевые клетки или компоненты могут оставаться и развивать метастатический потенциал. Согласно одному варианту осуществления термин "метастазирование" согласно настоящему изобретению относится к "отдаленному метастазированию", которое относится к метастазированию, которое удалено от первичной опухоли и системы региональных лимфатических узлов.
Иллюстративные иммунные нарушения включают в себя без ограничения аутоиммунные заболевания (например, сахарный диабет, артрит (включая в себя ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит и псориатический артрит), рассеянный склероз, энцефаломиелит, тяжелая миастения, системная красная волчанка, аутоиммунный тиреоидит, дерматит (включая в себя атопический дерматит и экзематозный дерматит), псориаз, синдром Шегрена, болезнь Крона, афтозная язва, ирит, конъюнктивит, кератоконъюнктивит, неспецифический язвенный колит, бронхиальная астма, аллергическая астма, сепсис и септический шок, воспалительное заболевание кишечника, кожная красная волчанка, склеродермия, вагинит, проктит, лекарственные сыпи, обратимые лепрозные реакции, узловатая лепрозная эритема, аутоиммунный увеит, аллергический энцефаломиелит, острая некротизирующая геморрагическая энцефалопатия, идиопатическая двухсторонняя прогрессирующая нейросенсорная тугоухость, апластическая анемия, врожденная апластичекская анемия, идиопатическая тромбоцитопения, полихондрия, гранулематоз Вегенера, хронический активный гепатит, синдром Стивенса-Джонсона, гломерулонефрит, идиопатическая целиакия, красный плоский лишай, болезнь Грейвса, саркоидоз, первичный билиарный цирроз, задний увеит и интерстициальный фиброз легкого), реакция «трансплантат-против-хозяина», случаи трансплантации и аллергия, такая как атопическая аллергия.
Иллюстративные вирусы включают в себя без ограничения вирус иммунодефицита человека (ВИЧ, или HIV), вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV) (например, CMV5), герпесвирусы человека (HHV) (например, HHV6, 7 или 8), вирусы простого герпеса (HSV), вирус герпеса крупного рогатого скота (BHV) (например, BHV4), вирус герпеса лошадей (EHV) (например, EHV2), вирусы T-клеточного лейкоза человека (HTLV)5, вирус ветряной оспы (VZV), вирус кори, паповавирусы (JC и BK), вирусы гепатита (например, HBV или HCV), вирус миксомы, аденовирус, парвовирусы, вирус полиомы, вирусы гриппа, папилломавирусы и поксвирусы, такие как вирус осповакцины, и вирус контагиозного моллюска (MCV), и лиссавирусы. Такой вирус может экспрессировать или не экспрессировать ингибитор апоптоза. Иллюстративные заболевания, вызываемые вирусной инфекцией, включают в себя без ограничения ветряную оспу, цитомегаловирусные инфекции, генитальный герпес, гепатит B и C, грипп и опоясывающий герпес и бешенство.
Иллюстративные бактерии включают в себя без ограничения следующее: Campylobacter jejuni, виды Enterobacter, Enterococcus faecium, Enterococcus faecalis, Escherichia coli (например, F. coli O157:H7), стрептококки группы A, Haemophilus influenzae, Helicobacter pylori, листерия, Mycobacterium tuberculosis, Pseudomonas aeruginosa, S. pneumoniae, Salmonella, Shigella, Staphylococcus aureus и Staphylococcus epidermidis и Borrelia и Rickettsia. Иллюстративные заболевания, вызываемые бактериальной инфекцией, включают в себя без ограничения следующее: сибиреязвенный карбункул, холера, дифтерия, пищевая инфекция, лепра, менингит, пептическая язва, пневмония, сепсис, септический шок, сифилис, столбняк, туберкулез, брюшной тиф и инфекция мочевыводящих путей, и болезнь Лайма, и американский клещевой риккетсиоз.
Конкретные примеры инфекционных заболеваний, поддающихся лечению с помощью оцРНК и фармацевтических композиций согласно настоящему изобретению, включают в себя следующее: вирусные инфекционные заболевания, такие как СПИД (ВИЧ), гепатит A, B или C, герпес, опоясывающий герпес (ветряная оспа), коревая краснуха (краснуха), амарилльная лихорадка, лихорадка денге; инфекционные заболевания, вызываемые флавивирусами; грипп; геморрагические инфекционные заболевания (Марбургские вирусы или вирусы Эбола); бактериальные инфекционные заболевания (такие как болезнь легионеров (Legionella), язвенная болезнь желудка (Helicobacter), холера (Vibrio), инфекции, вызванные E. coli, Staphylococci, Salmonella или Streptococci (столбняк); инфекции, вызванные патогенами - простейшими, такие как малярия, африканский трипаносомоз, лейшманиоз, токсоплазмоз, т.e. инфекции, вызванные Plasmodium, Trypanosoma, Leishmania и Toxoplasma; или грибковые инфекции, которые вызваны, например, Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis или Candida albicans.
оцРНК и фармацевтическая композиции согласно настоящему изобретению можно использовать отдельно или в сочетании с одним или несколькими дополнительными/вспомогательными активными соединениями, которые можно вводить перед, одновременно или после введения оцРНК или фармацевтической композиции согласно настоящему изобретению. Такие одно или несколько дополнительных/вспомогательных активных соединений включают в себя химиотерапевтические лекарственные средства для пациентов со злокачественной опухолью (например, гемцитабин, этопофос, цисплатин, карбоплатин), антивирусные средства, противопаразитарные средства, антибактериальные средства, иммунотерапевтические средства (например, антигены или их фрагменты (в частности их иммуногенные фрагменты)), и адъюванты, и, при введении одновременно с оцРНК согласно настоящему изобретению, могут присутствовать в фармацевтической композиции согласно настоящему изобретению.
В частности, одно или несколько дополнительных/вспомогательных активных соединений могут включать в себя иммунотерапевтическое средство, предпочтительно иммунотерапевтическое средство, индуцирующее или осуществляющее целевую, т.е. специфическую, иммунную реакцию. Таким образом, согласно одному варианту осуществления оцРНК и фармацевтическую композицию согласно настоящему изобретению можно использовать в сочетании с иммунотерапевтическим средством, предпочтительно иммунотерапевтическим средством, индуцирующим или осуществляющим целевую, т.е. специфическую иммунную реакцию. Такие иммунотерапевтические средства включают в себя средства, направленные против ассоциированного с заболеванием антигена, такие как терапевтические антитела или средства, индуцирующие иммунный ответ, направленные против ассоциированного с заболеванием антигена, или клеток, экспрессирующих ассоциированный с заболеванием антиген. Применимые иммунотерапевтические средства включают в себя белки или пептиды, индуцирующие B-клеточный или T-клеточный ответ против ассоциированного с заболеванием антигена или клеток, экспрессирующих ассоциированный с заболеванием антиген. Указанные белки или пептиды могут содержать последовательность, по существу соответствующую или являющуюся идентичной последовательности ассоциированного с заболеванием антигена или его одного или нескольких фрагментов. Согласно одному варианту осуществления белок или пептид содержит последовательность презентированного MHC пептида, происходящего из ассоциированного с заболеванием антигена. Вместо введения белка или пептида, также можно вводить нуклеиновую кислоту, предпочтительно иРНК, кодирующую белок или пептид. РНК, кодирующая белок или пептид, может представлять собой оцРНК согласно настоящему изобретению. Альтернативно или дополнительно РНК, кодирующая белок или пептид, может представлять собой другую РНК, не предусмотренную согласно настоящему изобретению, причем эту РНК можно вводить одновременно (в этом случае РНК может образовывать часть фармацевтической композиции согласно настоящему изобретению) и/или перед и/или после введения фармацевтической композиции согласно настоящему изобретению. Соответственно фармацевтическую композицию согласно настоящему изобретению можно использовать в генетической вакцинации, при которой иммунный ответ стимулируют путем введения в организм субъекта подходящей молекулы нуклеиновой кислоты (ДНК или иРНК), которая кодирует антиген или его фрагмент.
Согласно одному варианту осуществления ассоциированный с заболеванием антиген представляет собой опухолеассоциированный антиген. Согласно этому варианту осуществления оцРНК и фармацевтические композиции согласно настоящему изобретению могут являться применимыми в лечении злокачественной опухоли или метастазирования злокачественной опухоли. Предпочтительно пораженный заболеванием орган или ткань характеризуются пораженными заболеванием клетками, такими как злокачественные клетки, экспрессирующие ассоциированный с заболеванием антиген и/или характеризуются ассоциацией ассоциированного с заболеванием антигена с их поверхностью. Иммунизация с помощью интактного или по существу интактного опухолеассоциированного антигена или его фрагментов, таких как пептиды или нуклеиновые кислоты MHC I класса и II класса, в частности иРНК, кодирующей такой антиген или фрагмент, позволяет вызвать ответ типа MHC I класса и/или II класса и, таким образом, стимулировать такие T-клетки, как CD8+ цитотоксические T-лимфоциты, которые способны лизировать злокачественные клетки и/или CD4+ T-клетки. Такая иммунизация также может вызвать гуморальный иммунный ответ (B-клеточный ответ), приводя в результате к продукции антител к опухолеассоциированному антигену. Более того, антигенпрезентирующие клетки (APC), такие как дендритные клетки (DC), также можно нагружать презентированными MHC I класса пептидами напрямую или путем трансфекции нуклеиновыми кислотами, кодирующими опухолевые антигены или опухолевые антигенные пептиды in vitro, и вводить пациенту.
Согласно настоящему изобретению опухолеассоциированный антиген предпочтительно содержит любой антиген, который является характерным для опухолей или злокачественных опухолей, а также для опухолевых или злокачественных клеток по отношению к типу и/или уровню экспрессии. Согласно одному варианту осуществления термин "опухолеассоциированный антиген" относится к белкам, которые при нормальных условиях, т.е. у здорового субъекта, специфически экспрессируются в ограниченном числе органов и/или тканей или на конкретных стадиях развития, например, опухолеассоциированный антиген может при нормальных условиях специфически экспрессироваться в ткани желудка, предпочтительно в слизистой оболочке желудка, в репродуктивных органах, например, в яичке, в трофобластной ткани, например, в плаценте, или в клетках зародышевой линии, и экспрессируются или аберрантно экспрессируются в одной или нескольких тканях опухоли или злокачественной опухоли. В этом контексте "ограниченное число" предпочтительно означает не более чем 3, более предпочтительно не более чем 2 или 1. Опухолеассоциированные антигены согласно контексту настоящего изобретения включают в себя, например, дифференцировочные антигены, предпочтительно специфические для клеточного типа дифференцировочные антигены, т.е. белки, которые при нормальных условиях специфически экспрессируются в определенном типе клеток на определенной стадии дифференцировки, антигены злокачественной опухоли/яичка, т.е. белки, которые при нормальных условиях специфически экспрессируются в яичке и иногда в плаценте, и специфические для зародышевой линии антигены. Согласно контексту настоящего изобретения опухолеассоциированный антиген предпочтительно ассоциирован с клеточной поверхностью злокачественной клетки и предпочтительно не экспрессируется или лишь редко экспрессируется в нормальных тканях. Предпочтительно опухолеассоциированный антиген или аберрантная экспрессия опухолеассоциированного антигена идентифицирует злокачественные клетки. Согласно контексту настоящего изобретения опухолеассоциированный антиген, который экспрессируется злокачественной клеткой у субъекта, например, пациента, страдающего от заболевания - злокачественной опухоли, предпочтительно представляет собой собственный белок указанного субъекта. Согласно предпочтительные вариантам осуществления опухолеассоциированный антиген согласно контексту настоящего изобретения экспрессируется при нормальных условиях специфически в ткани или органе, которые не являются жизненно необходимыми, т.е. тканях или органах, которые при повреждении иммунной системой не приводят к смерти субъекта, или в органах или структурах организма, которые являются недоступными или лишь тяжелодоступными для иммунной системы. Согласно одному варианту осуществления аминокислотная последовательность опухолеассоциированного антигена идентична между опухолеассоциированным антигеном, который экспрессируется в нормальных тканях, и опухолеассоциированным антигеном, который экспрессируется в тканях злокачественной опухоли. Предпочтительно опухолеассоциированный антиген презентируется в контексте молекул MHC злокачественной клеткой, в которой он экспрессируется.
Примеры дифференцировочных антигенов, которые идеально удовлетворяют критериям для опухолеассоциированных антигенов, как предусмотрено настоящим изобретением в качестве целевых структур в иммунотерапии опухолей, в частности, в противоопухолевой вакцинации, представляют собой белки клеточной поверхности семейства клаудина, такие как CLDN6 и CLDN18.2. Указанные дифференцировочные антигены экспрессируются в опухолях различного происхождения и являются особенно подходящими в качестве целевых структур в связи с опосредованной антителами противоопухолевой иммунотерапии вследствие их селективной экспрессии (отсутствие экспрессии в релевантной в отношении токсичности нормальной ткани) и локализации в плазматической мембране.
Дополнительные примеры антигенов, которые могут являться применимыми в настоящем изобретении, представляют собой следующее: p53, ART-4, BAGE, бета-катенин/m, Bcr-abL CAMEL, CAP-1, CASP-8, CDC27/m, CDK4/m, CEA, CLAUDIN-12, c-MYC, CT, Cyp-B, DAM, ELF2M, ETV6-AML1, G250, GAGE, GnT-V, Gap100, HAGE, HER-2/neu, HPV-E7, HPV-E6, HAST-2, hTERT (или hTRT), LAGE, LDLR/FUT, MAGE-A, предпочтительно MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, или MAGE-A12, MAGE-B, MAGE-C, MART-1/Melan-A, MC1R, миозин/m, MUC1, MUM-1, -2, -3, NA88-A, NF1, NY-ESO-1, NY-BR-1, p190 (малый BCR-abL), Pm1/RARa, PRAME, протеиназа 3, PSA, PSM, RAGE, RU1 или RU2, SAGE, SART-1 или SART-3, SCGB3A2, SCP1, SCP2, SCP3, SSX, сурвивин, TEL/AML1, TPI/m, TRP-1, TRP-2, TRP-2/INT2, TPTE и WT, предпочтительно WT-1.
Термин "антиген" следует понимать как обозначающий любую структуру, которая может вызвать образование антител и/или активацию клеточного иммунного ответа. Примеры антигенов представляют собой полипептиды, белки, клетки, клеточные экстракты, углеводы/полисахариды, полисахаридные конъюгаты, липиды и гликолипиды. Указанные антигены могут представлять собой опухолевые антигены или вирусные, бактериальные, грибковые и относящиеся к простейшим антигены или аллергены. Термин "антиген" также включает в себя дериватизированные антигены в качестве вторичного вещества, которое становится антигенным – и сенсибилизирующим – только посредством трансформации (например, опосредованно в молекуле, путем дополнения до завершенной формы белком организма), и конъюгированные антигены, которые, посредством искусственного введения атомных групп (например, изоцианатов, солей диазония), проявляют новую конститутивную специфичность. Антиген может присутствовать в вакцине согласно настоящему изобретению в форме гаптена, соединенного с подходящим носитель. Подходящие носители известны средним специалистам в настоящей области техники и включают в себя, например, альбумин сыворотки человека (HSA), полиэтиленгликоли (PEG). Гаптен можно соединить с носителем с помощью способов, хорошо известных в предшествующем уровне техники, например, в случае полипептидного носителя посредством амидной связи с остатком Lys (лизина).
Термин "иммуногенность" относится к способности конкретного вещества, в частности РНК (предпочтительно оцРНК, такой как иРНК), провоцировать иммунный ответ в организме такого субъекта, как человек. Другими словами, иммуногенность представляет собой способность индуцировать иммунный ответ.
"Индукция иммунного ответа" может означать, что иммунный ответ отсутствовал до индукции иммунного ответа, но также может означать, что присутствовал определенный уровень иммунного ответа до индукции иммунного ответа, и после индукции иммунного ответа указанный иммунный ответ усиливается. Таким образом, "индукция иммунного ответа" включает в себя "усиление иммунного ответа". Предпочтительно после индукции иммунного ответа у субъекта, указанный субъект является защищенным от развития заболевания, такого как злокачественная опухоль или инфекционное заболевание, или снижается интенсивность болезненного состояния за счет индукции иммунного ответа.
Термин "иммунотерапия" относится к лечению, предпочтительно предусматривающему специфическую иммунную реакцию и/или функцию(и) иммунных эффекторов.
Термин "иммунизация" или "вакцинация" описывает способ лечения субъекта по терапевтическим или профилактическим причинам.
Термины "субъект", "пациент" или "индивидуум" относятся к позвоночным. Например, позвоночные согласно контексту настоящего изобретения представляют собой млекопитающих, птиц (например, домашних птиц), рептилий, амфибий, костных рыб и хрящевых рыб, в частности, одомашненных животных, любого из вышеперечисленных, а также животных в неволе, таких как животных зоопарков, и представляют собой предпочтительно млекопитающих. Млекопитающие согласно контексту настоящего изобретения включают в себя без ограничения людей, не являющихся людьми приматов, одомашненных млекопитающих, таких как собаки, кошки, овцы, крупный рогатый скот, козы, свиньи, лошади и т.д., лабораторных млекопитающих, таких как мыши, крысы, кролики, морские свинки и т.д., а также млекопитающих в неволе, таких как млекопитающие зоопарков. Используемый в настоящем документе термин "субъект" также включает в себя людей.
Такие термины, как "перенос", "трансфекция" или "введение в клетки" используют в настоящем документе взаимозаменяемо, и они относятся к введению нуклеиновых кислот, в частности экзогенных или гетерологичных нуклеиновых кислот, в частности оцРНК в клетку. Согласно настоящему изобретению клетка может образовывать часть органа, ткани и/или организма.
Фармацевтические композиции согласно настоящему изобретению, как правило, применяют в "фармацевтически приемлемых количествах" и в "фармацевтически приемлемых препаратах". Термин "фармацевтически приемлемый" относится к отсутствию токсичности материала, который не взаимодействует с действием активного(ых) средства(средств) фармацевтической композиции.
Согласно настоящему изобретению введение нуклеиновой кислоты (такой как оцРНК) осуществляют либо в виде «оголенной» нуклеиновой кислоты, либо в комбинации с одним или несколькими фармацевтически приемлемыми вспомогательными веществами. Предпочтительно введение нуклеиновых кислот происходит в форме «оголенных» нуклеиновых кислот. Предпочтительно РНК вводят в комбинации со стабилизирующими веществами, такими как ингибиторы РНКазы. Настоящее изобретение также предусматривает повторное введение нуклеиновых кислот в клетки для обеспечения пролонгированной экспрессии в течение длительных периодов времени.
Клетки можно трансфицировать любыми вспомогательными веществами (в частности носителями), с которыми оцРНК может быть ассоциирована, например, путем формирования комплексов с оцРНК или формирования везикул, в которых оцРНК заключена или инкапсулирована, приводя в результате к увеличенной стабильности оцРНК по сравнению с «оголенной» оцРНК. Вспомогательные вещества (в частности носители), применимые согласно настоящему изобретению, включают в себя, например, липид-содержащие носители, такие как катионные липиды, липосомы, в частности катионные липосомы, и мицеллы, и наночастицы. Катионные липиды могут образовывать комплексы с отрицательно заряженными нуклеиновыми кислотами. Любой катионный липид можно использовать согласно настоящему изобретению. Более того, клетки можно извлечь из организма субъекта, клетки можно трансфицировать с помощью оцРНК или фармацевтической композиции согласно настоящему изобретению, и трансфицированные клетки можно ввести субъекту.
Предпочтительно введение оцРНК, которая кодирует пептид или полипептид, в клетку, в частности в клетку, присутствующую in vivo, приводит к экспрессии указанного пептида или полипептида в клетке. Согласно конкретным вариантам осуществления нацеливание нуклеиновых кислот на конкретные клетки является предпочтительным. Согласно таким вариантам осуществления носитель, который применяют для введения нуклеиновой кислоты в клетку (например, ретровирус или липосома), экспонирует нацеливающую молекулу. Например, такая молекула, как антитело, которое является специфическим в отношении поверхностного мембранного белка на целевой клетке, или лиганд для рецептора на целевой клетке, могут являться встроенными в нуклеиновокислотный носитель или могут являться связанными с ним. В случае, когда нуклеиновую кислоту вводят с помощью липосом, белки, которые связываются с поверхностным мембранным белком, который ассоциирован с эндоцитозом, могут являться включенными в липосомный состав для обеспечения нацеливания и/или поглощения. Такие белки включают в себя капсидные белки или их фрагменты, которые являются специфическими в отношении конкретного типа клеток, антитела к белкам, которые являются интернализованными, белки, которые нацелены на внутриклеточную локализацию и т.д.
Подразумевается, что используемый в настоящем документе термин "вспомогательное вещество" указывает на все вещества в фармацевтической композиции, которые не представляют собой активные средства (например, которые представляют собой терапевтически неактивные ингредиенты, которые не проявляют какой-либо терапевтический эффект в используемом количестве/концентрации), такие как, например, соли, носители, связующие, смазывающие средства, загустители, поверхностно-активные средства, диспергирующие средства, консерванты, эмульгаторы, буферные средства, смачивающие средства, ароматизаторы, красящие средства, стабилизирующие средства (такие как ингибиторы РНКазы) или антиоксиданты, все из которых предпочтительно являются фармацевтически приемлемыми.
"Фармацевтически приемлемые соли" включают в себя, например, соли присоединения кислоты, которые могут быть образованы, например, с использованием фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота, угольная кислота или ортофосфорная кислота. Более того, подходящие фармацевтически приемлемые соли могут включать в себя соли щелочных металлов (например, соли натрия или калия); соли щелочноземельных металлов (например, соли кальция или магния); соли аммония (NH4+); и соли, образованные с подходящими органическими лигандами (например, катионами четвертичного аммония и амина, образованные с использованием таких противоионов, как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, алкилсульфонат и арилсульфонат). Иллюстративные примеры фармацевтически приемлемых солей включают в себя без ограничения следующее: ацетат, адипат, альгинат, аргинат, аскорбат, аспартат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, бутират, эдетат кальция, камфорат, камфорсульфонат, камсилат, карбонат, хлорид, цитрат, клавуланат, циклопентанпропионат, диглюконат, дигидрохлорид, додецилсульфат, эдетат, эдисилат, эстолат, эсилат, этансульфонат, формиат, фумарат, галактат, галактуронат, глюцептат, глюкогептонат, глюконат, глутамат, глицерофосфат, гликолиларсанилат, гемисульфат, гептаноат, гексаноат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидройодид, 2-гидроксиэтансульфонат, гидроксинафтоат, йодид, изобутират, изотионат, лактат, лактобионат, лаурат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метансульфонат, метилсульфат, мукат, 2-нафталинсульфонат, напсилат, никотинат, нитрат, соль N-метилглюкамин аммония, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, пектинат, персульфат, 3-фенилпропионат, фосфат/дифосфат, фталат, пикрат, пивалат, полигалактуронат, пропионат, салицилат, стеарат, сульфат, суберат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид, ундеканоат, валерат и т.п. (см., например, S. M. Berge et al., "Pharmaceutical Salts", J. Pharm. Sci., 66, pp. 1-19 (1977)). Соли, которые не являются фармацевтически приемлемыми, можно использовать для получения фармацевтически приемлемых солей, и они включены в настоящее изобретение.
Композиции согласно настоящему изобретению могут содержать фармацевтически приемлемый носитель. Используемый в настоящем документе "фармацевтически приемлемый носитель" включает в себя любой и все растворители, дисперсионные среды, оболочки, изотонические и замедляющие абсорбцию средства и т.п., которые являются физиологически совместимыми. "Фармацевтически приемлемый носитель" может находиться в твердой, полутвердой, жидкой форме или их комбинациях.
Фармацевтически приемлемые носители включают в себя стерильные водные растворы или дисперсии, стерильные неводные растворы или дисперсии и стерильные порошки для экстемпорального получения стерильных инъекционных растворов или дисперсий. Применение таких сред и средств для фармацевтически активных средств известно в настоящей области техники. За исключением случаев, когда какая-либо общепринятая среда или средство являются несовместимым с активным средством, предусмотрено их применение в фармацевтических композициях согласно настоящему изобретению. Иллюстративные фармацевтически приемлемые носители для инъекционного состава включают в себя следующее: вода, изотонический забуференный раствор хлорида натрия (например, раствор Рингера или лактатный раствор Рингера), этанол, многоатомные спирты (например, глицерин), полиалкиленгликоли (например, пропиленгликоль и жидкий полиэтиленгликоль), гидрогенизированные нафталины и, в частности, биосовместимые лактидные полимеры (например, сополимеры лактида/гликолида или сополимеры полиоксиэтилена/полиоксипропилена).
Примеры фармацевтически приемлемых антиоксидантов включают в себя: (1) растворимые в воде антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) металлохелатирующие средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, ортофосфорная кислота, и т.п.
Подходящие буферные средства для применения в фармацевтических композициях согласно настоящему изобретению включают в себя уксусную кислоту в соли, лимонную кислоту в соли, борную кислоту в соли соль и ортофосфорную кислоту в соли.
Подходящие консерванты для применения в фармацевтических композициях согласно настоящему изобретению включают в себя различные антибактериальные и противогрибковые средства, такие как хлорид бензалкония, хлорбутанол, парабен, сорбиновая кислота и тиомерсал. Предотвращение наличия микроорганизмов также можно обеспечить процедурами стерилизации (например, стерилизующая фильтрация, в частности стерилизующая микрофильтрация).
Фармацевтическую композицию согласно настоящему изобретению можно вводить индивидууму любым путем, предпочтительно парентерально. Используемые в настоящем документе выражения "парентеральное введение" и "введенный парентерально" означают способы введения, отличные от энтерального введения (используемые в настоящем документе выражения "энтеральное введение" и "введенный энтерально" означают, что введенное лекарственное средство поглощается желудком и/или кишечником). Парентеральное введение, как правило, с помощью инъекции и/или инфузии и включает в себя без ограничения внутривенное, внутримышечное, внутриартериальное, интратекальное, внутрикапсулярное, внутрикостное, внутриглазничное, внутрисердечное, интрадермальное, интраперитонеальное, транстрахеальное, подкожное, субкутикулярное, внутрисуставное, субкапсулярное, интрацеребральное, интрацеребровентрикулярное, субарахноидальное, интраспинальное, эпидуральное, внутригрудинное и местное введение.
оцРНК или фармацевтическую композицию согласно настоящему изобретению можно вводить разнообразными способами, известными в настоящей области техники. Как понятно специалисту в настоящей области техники, путь и/или способ введения будут варьировать в зависимости от требуемых результатов.
Активные средства (т.е. оцРНК согласно настоящему изобретению и необязательно одно или несколько дополнительных/вспомогательных активных соединений) можно получить вместе с носителями, которые будут защищать соединения от быстрого высвобождения, такие как состав контролируемого высвобождения, включая в себя имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких составов, как правило, известны специалистам в настоящей области техники. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Для введения активного средства (т.е. оцРНК согласно настоящему изобретению и необязательно одного или нескольких дополнительных/вспомогательных активных соединений) определенными путями введения, может потребоваться покрыть активное средство материалом или совместно ввести соединение с материалом для предотвращения его инактивации и/или для увеличения эффективности активного средства (в частности оцРНК согласно настоящему изобретению), подлежащего трансляции. Например, активное средство можно вводить индивидууму в соответствующем носителе, например, содержащих липид носителях (в частности, катионных липидах), липосомах (таких как эмульсии вода-в-масле-в-воде CGF, а также общепринятые липосомы (Strejan et al., J. Neuroimmunol. 7: 27 (1984)), в частности, катионные липосомы), мицеллах, наночастицах, в которых заключена или инкапсулирована оцРНК, или разбавителе. Фармацевтически приемлемые разбавители включают в себя водный раствор хлорида натрия и водные забуференные растворы.
Фармацевтические композиции, как правило, должны являться стерильными и стабильными при условиях производства и хранения. Композицию можно составить в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Правильную текучесть можно поддерживать, например, путем применения такого материала оболочки, как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Во многих случаях будет предпочтительным включить в фармацевтическую композицию изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Пролонгированную абсорбцию инъекционных композиций можно обеспечить путем включения в композицию средства, которое замедляет абсорбцию, например, моностеаратные соли и желатин.
Как правило, дисперсии получают путем введения активного средства в стерильную несущую среду, которая содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительные способы получения представляют собой вакуумную сушку и сублимационную сушку (лиофилизацию), которые дают в результате порошок активного средства вместе с любым дополнительным требуемым ингредиентом из его предварительно подвергнутого стерилизационной фильтрации раствора.
Схемы введения дозировок регулируют для обеспечения оптимального требуемого ответа (например, терапевтического ответа). Например, можно вводить однократный болюс, несколько разделенных доз можно вводить в течение определенного времени или дозу можно пропорционально снизить или увеличить, в соответствии с потребностями терапевтической ситуации. Особенно преимущественным является составление фармацевтических композиций в единичной лекарственной форме для простоты введения и однородности дозировки. Используемая в настоящем документе единичная лекарственная форма относится к физически отдельным единицам, подходящим в качестве единичных дозировок для подлежащих лечению индивидуумов; каждая единица содержит заданное количество активного средства, рассчитанное так, чтобы производить требуемый терапевтический эффект, в ассоциации с требуемым фармацевтическим носителем. Технические характеристики единичных лекарственных форм согласно настоящему изобретению продиктованы и напрямую зависят от (a) уникальных характеристик активного средства и конкретного терапевтического эффекта, который необходимо достичь, и (b) ограничений, присущих области техники получения составов такого активного средства для лечения чувствительности у индивидуумов. Количество активного средства (в частности, количество оцРНК), которое можно комбинировать с материалом носителя с получением фармацевтической композиции (такой как отдельная лекарственная форма), будет варьировать в зависимости от индивидуума, подлежащего лечению, и конкретного способа введения. Количество активного средства, которое можно комбинировать с материалом носителя с получением отдельной лекарственной формы будет, как правило, представлять собой такое количество композиции, которое производит терапевтический эффект.
Как правило, из 100% (для фармацевтических составов/композиций) количество активного средства (в частности, количество оцРНК согласно настоящему изобретению, необязательно вместе с одним или несколькими дополнительными/вспомогательными активными соединениями, если они присутствуют в фармацевтических составах/композициях) будет находиться в диапазоне от приблизительно 0,01% до приблизительно 99%, предпочтительно от приблизительно 0,1% до приблизительно 70%, наиболее предпочтительно от приблизительно 1% до приблизительно 30%, причем оставшаяся часть предпочтительно состоит из одного или нескольких фармацевтически приемлемых вспомогательных веществ.
Количество активного средства, например, оцРНК согласно настоящему изобретению, в единичной лекарственной форме и/или при введении индивидууму или используемое в терапии, может находиться в диапазоне от приблизительно 0,001 мг до приблизительно 1000 мг (например, от приблизительно 0,01 мг до приблизительно 500 мг, от приблизительно 0,1 мг до приблизительно 100 мг, например, от приблизительно 1 мг до приблизительно 50 мг) на единицу, введение или терапию. Согласно определенным вариантам осуществления подходящее количество такого активного средства можно рассчитать с использованием массы или площади поверхности тела индивидуума, включая в себя количества, составляющие приблизительно 0,1 мг/кг - 10 мг/кг (такие как приблизительно 0,2 мг/кг - 5 мг/кг) или приблизительно 0,1 мг/м2 - приблизительно 400 мг/м2 (такие как приблизительно 0,3 мг/м2 - приблизительно 350 мг/м2 или приблизительно 1 мг/м2 - приблизительно 200 мг/м2).
Независимо от выбранного пути введения активные средства (т.е. оцРНК и необязательно одно или несколько дополнительных/вспомогательных активных соединений), которые можно использовать в подходящей гидратированной форме и/или фармацевтических композициях согласно настоящему изобретению, составляют в фармацевтически приемлемые лекарственные формы с помощью общепринятых способов, известных специалистам в настоящей области техники (см., например, Remington, "The Science and Practice of Pharmacy" edited by Allen, Loyd V., Jr., 22nd edition, Pharmaceutical Sciences, September 2012; Ansel et al., "Pharmaceutical Dosage Forms and Drug Delivery Systems", 7th edition, Lippincott Williams & Wilkins Publishers, 1999.).
Фактические уровни дозировок активных средств в фармацевтических композициях согласно настоящему изобретению можно изменять так, чтобы получить количество активного средства, которое является эффективным для достижения требуемого терапевтического ответа для конкретного пациента, композиции и способа введения, не будучи токсичным для пациента. Выбранный уровень дозировки будет зависеть от разнообразных фармакокинетических факторов, включая в себя активность конкретных используемых композиций согласно настоящему изобретению, путь введения, время введения, скорость выведения конкретного используемого активного средства, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общее состояние здоровья и предшествующую медицинскую историю пациента, подлежащего лечению, и подобные факторы, хорошо известные в медицинской области техники.
Врач или ветеринар, обладающий навыками в настоящей области техники, может без труда определить и назначить необходимое эффективное количество фармацевтической композиции. Например, врач или ветеринар мог начать с дозы активных средств, используемых в фармацевтической композиции, на уровнях, ниже чем уровни, необходимые для достижения требуемого терапевтического эффекта, и мог постепенно повышать дозировку до достижения требуемого эффекта. В общем, подходящая суточная доза фармацевтической композиции согласно настоящему изобретению будет представлять собой такое количество активного средства, которое представляет собой самую низкую дозу, эффективную для достижения терапевтического эффекта. Такая эффективная доза, как правило, будет зависеть от факторов, описанных выше. Предпочтительным является то, что введение является парентеральным, таким как внутривенным, внутримышечным, интаперитонеальным или подкожным, предпочтительно вводимым вблизи целевого участка. Введение также может являться внутриопухолевым. При необходимости эффективную суточную дозу фармацевтической композиции можно вводить в виде двух, трех, четырех, пяти, шести или больше поддоз, вводимых отдельно с соответствующими интервалами в течение дня, необязательно, в единичных лекарственных формах. Наряду с тем, что возможно введение активного средства (в частности оцРНК) согласно настоящему изобретению отдельно, предпочтительно вводить активный средство в виде фармацевтического состава/композиции.
Согласно одному варианту осуществления оцРНК или фармацевтические композиции согласно настоящему изобретению можно вводить с помощью инфузии, предпочтительно медленной непрерывной инфузии в течение длительного периода, такого как более чем 24 ч, для снижения токсических побочных эффектов. Введение также можно проводить с помощью непрерывной инфузии в течение периода, составляющего 2-24 ч, например, 2-12 ч. Такую схему можно повторять один или несколько раз при необходимости, например, через 6 месяцев или 12 месяцев.
Фармацевтическую композицию согласно настоящему изобретению можно составить для парентерального введения с помощью инъекции, например, с помощью болюсной инъекции или непрерывной инфузии. Составы для инъекции могут быть представлены в единичной лекарственной форме (например, во флаконе, в контейнере для многократных доз), и с добавленным консервантом. Фармацевтическая композиция согласно настоящему изобретению может принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных несущих средах, и может содержать такие вспомогательные средства, как суспендирующие, стабилизирующие или диспергирующие средства. Альтернативно средство может находиться в порошкообразной форме для разведения подходящей несущей средой (например, стерильной апирогенной водой) перед использованием. Как правило, фармацевтические композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости фармацевтическая композиция также может включать в себя солюбилизирующее средство и местное обезболивающее средство, такое как лигнокаин, для облегчения боли в месте инъекции. Как правило, ингредиенты поставляют либо отдельно, либо смешивают вместе в единичной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически запаянном контейнере, таком как ампула или саше, на котором указано количество активного средства. Если фармацевтическая композиция подлежит введению с помощью инфузии, ее могут отпускать вместе с инфузионным флаконом, содержащим стерильную фармацевтической степени чистоты воду или водный раствор хлорида натрия. Если композицию вводят с помощью инъекции, быть предоставлена ампула стерильной воды для инъекций или водного раствора хлорида натрия может с тем, чтобы можно было смешать ингредиенты перед введением.
Фармацевтические композиции можно вводить с помощью медицинских устройств, известных в настоящей области техники. Например, согласно предпочтительному варианту осуществления фармацевтическую композицию согласно настоящему изобретению можно вводить с помощью безыгольного устройства для подкожных инъекций, причем такие как устройства раскрыты в патентах США №№ US 5399163; US 5383851; US 5312335; US 5064413; US 4941880; US 4790824 или US 4596556. Примеры хорошо известных имплантатов и модулей, применимых в настоящем изобретении, включают в себя те, которые описаны в патенте США № US 4487603, в котором раскрыт имплантируемый микроинфузионный насос для подачи лекарственного средства с контролируемой скоростью; в патенте США № US 4486194, в котором раскрыто терапевтическое устройство для введения лекарственного средства через кожу; в патенте США № US 4447233, в котором раскрыт инфузионный насос для лекарственного средства для доставки лекарственных средств в точной скоростью инфузии; в патенте США № US 4447224, в котором раскрыта имплантируемая инфузионная система с регулятором расхода для непрерывной доставки лекарственного средства; в патенте США № US 4439196, в котором раскрыта осмотическая система доставки лекарственных средств, характеризующаяся многокамерными отсеками; и в патенте США № US 4475196, в котором раскрыта осмотическая система доставки лекарственных средств.
Многие другие такие имплантаты, системы доставки и модули известны специалистам в настоящей области техники. Согласно определенным вариантам осуществления оцРНК или фармацевтические композиции согласно настоящему изобретению можно составить для обеспечения правильного распределения in vivo. Например, гематоэнцефалический барьер (BBB) не пропускает многие высокогидрофильные соединения. Для обеспечения проникновения оцРНК или фармацевтических композиций согласно настоящему изобретению через BBB (при необходимости) их можно составить, например, в липосомах. В отношении способов производства липосом, см., например, патенты США №№ US 4522811; US 5374548 и US 5399331. Липосомы могут содержать один или несколько фрагментов, которые селективно транспортируются в специфические клетки или органы, и, таким образом, усиливают нацеленную доставку лекарственных средств (см., например, V.V. Ranade (1989) J. Clin. Pharmacol. 29: 685). Иллюстративные нацеливающие фрагменты включают в себя фолат или биотин (см., например, патент США № US 5416016 Low et al.); маннозиды (Umezawa et al., (1988) Biochem. Biophys. Res. Commun. 153: 1038); антитела (P.G. Bloeman et al. (1995) FEBS Lett. 357: 140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39: 180); и рецептор поверхностно-активного белка A (Briscoe et al. (1995) Am. J. Physiol. 1233: 134).
Согласно одному варианту осуществления настоящего изобретения оцРНК согласно настоящему изобретению составляют в липосомах. Согласно более предпочтительному варианту осуществления липосомы включают в себя нацеливающий фрагмент. Согласно наиболее предпочтительному варианту осуществления оцРНК в липосомах доставляют с помощью болюсной инъекции в участок, ближайший к требуемой области. Такая композиция на основе липосом должна быть жидкой в той степени, чтобы существовала легкая возможность введения с помощью шприца, должна быть стабильной в условиях производства и хранения, и ее необходимо сохранить от загрязняющего действия микроорганизмов, таких как бактерии и грибы.
"Терапевтически эффективную дозировку" для лечения можно измерить по объективным ответам, которые могут являться либо полными, либо частичными. Полный ответ (CR) определяют как отсутствие клинических, радиологических или других признаков состояния, нарушения или заболевания. Частичный ответ (PR) является результатом снижения заболевания больше чем на 50%. Медианное время до прогрессирования представляет собой величину, которая характеризует продолжительность объективного ответа.
"Терапевтически эффективную дозировку" для лечения также можно измерить по ее способности стабилизировать прогрессирование состояния, нарушения или заболевания, например, с использованием соответствующих модельных систем с использованием животных и/или in vitro анализов, известных специалисту в настоящей области техники. Терапевтически эффективное количество активного средства относится к количеству, которое достигает требуемую реакцию или требуемый эффект отдельно или вместе с дополнительными дозами. В случае лечения конкретного заболевания или конкретного состояния требуемая реакция предпочтительно относится к ингибированию течения заболевания. Оно предусматривает замедление прогрессирования заболевания и, в частности, прерывание или инвертирование прогрессирования заболевания. Требуемая реакция в лечении заболевания или состояния также может представлять собой задержку начала или предотвращения возникновения указанного заболевания или указанного состояния. Таким образом, терапевтически эффективное количество активного средства может вылечивать, заживлять, смягчать, облегчать, изменять, устранять, уменьшать интенсивность, улучшать или воздействовать на состояние, нарушение или заболевание или симптомы состояния, нарушения или заболевания или предрасположенность к состоянию, нарушению или заболеванию у индивидуума. Средний специалист в настоящей области техники сможет определить такие количества на основании таких факторов, как заболевание, нарушение или состояние, подлежащее лечению, тяжесть заболевания, нарушения или состояния, параметры индивидуума, подлежащего лечению (включая в себя возраст, физиологическое состояние, размер и массу), продолжительность лечения, тип сопутствующей терапии (если она присутствует), конкретный путь введения и сходные факторы. Соответственно, вводимые дозы активных средств, описанных в настоящем документе, могут зависеть от таких различных параметров. В случае, когда реакция у индивидуума/пациента является недостаточной с использованием начальной дозы, можно использовать повышенные дозы (или эффективно повышенные дозы, достигнутые другим, более локализованным путем введения).
Фармацевтическая композиция согласно настоящему изобретению может принимать форму препарата вакцины, содержащего оцРНК согласно настоящему изобретению и по меньшей мере один антиген, такой как антиген, как обсуждалось выше, или его фрагмент (в частности, его иммуногенный фрагмент), или нуклеиновая кислота, в частности РНК, кодирующая указанный антиген или фрагмент.
Фармацевтическая композиция согласно настоящему изобретению также при необходимости может присутствовать в упаковке, наборе или устройстве-дозаторе, которые могут содержать одну или несколько единичных лекарственных форм, содержащих активное средство (т.е. оцРНК и необязательно одно или несколько дополнительных/вспомогательных активных соединений). Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка, набор или устройство-дозатор могут сопровождаться инструкцией для введения.
Одно или несколько дополнительных/вспомогательных активных соединений могут предусматривать иммуномодулирующее средство, такое как анти-CTL-A4 или анти-PD1 или анти-PDL1 реагенты или реагенты к регуляторным T-клеткам, такие как антитело к CD25 или циклофосфамид.
Фармацевтические композиции согласно настоящему изобретению можно вводить вместе с дополнительными усиливающими иммунитет веществами, такими как один или несколько адъювантов, и они могут содержать одно или несколько усиливающих иммунитет веществ для дополнительного увеличения своей эффективности, предпочтительно для достижения синергического эффекта иммуностимуляции.
Термин "адъювант" относится к соединениям, которые пролонгируют или усиливают или ускоряют иммунный ответ. В этом отношении возможны различные механизмы в зависимости от различных типов адъювантов. Например, соединения, которые обеспечивают созревание DC, например, липополисахариды или лиганд CD40, из первого класса подходящих адъювантов. Как правило, любое средство, которое влияет на иммунную систему типа "сигнал опасности" (LPS, GP96, дцРНК и т.д.) или цитокины, такие как GM-CSF, можно использовать в качестве адъюванта, который обеспечивает возможность интенсифицировать иммунный ответ и/или влиять на него контролируемым образом. Олигодезоксинуклеотиды CpG необязательно также можно использовать в этом контексте, хотя следует принимать во внимание их побочные эффекты, которые возникают при определенных обстоятельствах, как объяснено выше. В случае, когда оцРНК (предпочтительно иРНК) согласно настоящему изобретению согласно одному варианту осуществления может кодировать иммуностимулирующее средство и указанное иммуностимулирующее средство, кодируемое указанной оцРНК должно действовать в качестве первичного иммуностимулятора, тем не менее, требуется лишь относительно небольшое количество CpG ДНК (по сравнению с иммуностимуляцией с помощью только CpG ДНК). Особенно предпочтительные адъюванты представляют собой цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IFN-α, IFN-γ, GM-CSF, LT-α, или факторы роста, например hGH. Липопептиды, такие как Pam3Cys, также являются подходящими для применения в качестве адъювантов в фармацевтических композициях согласно настоящему изобретению.
Лечение можно проводить дома, в кабинете врача, клинике, амбулаторном отделении больницы или в больнице. Лечение, как правило, начинают под медицинским наблюдением с тем, чтобы медицинский персонал мог внимательно следить за эффектами лечения и вносить какие-либо корректировки, которые будут необходимы. Продолжительность лечения зависит от возраста и состояния пациента, а также того, как пациент отвечает на лечение.
Индивидуум, характеризующийся повышенным риском развития состояния, нарушения или заболевания, может получать профилактическое лечение, чтобы ингибировать или замедлить симптомы состояния, нарушения или заболевания.
Термин "лечение" является известным среднему специалисту в настоящей области техники и включает в себя нанесение или введение активного средства (например, фармацевтической композиции, содержащей указанное активное средство) или процедуры индивидууму/пациенту или нанесение или введение активного средства (например, фармацевтической композиции, содержащей указанное активное средство) или процедуры по отношению к клетке, клеточной культуре, клеточной линии, образцу, ткани или органу, выделенному из субъекта, который характеризуется наличием состояния, нарушения или заболевания, симптома состояния, нарушения или заболевания или предрасположенности к состоянию, нарушению или заболеванию, с целью вылечить, заживлять, смягчать, облегчать, изменять, устранять, уменьшать интенсивность, улучшать, воздействовать или предотвращать состояние, нарушение или заболевание, симптомы состояния, нарушения или заболевания или предрасположенность к состоянию, нарушению или заболеванию (например, предотвращать или устранять заболевание, включая в себя сокращение размера опухоли или количества опухолей у субъекта; прекращать или замедлять заболевание у субъекта; ингибировать или замедлять развитие нового заболевания у субъекта; уменьшать частоту или тяжесть симптомов и/или рецидивов у субъекта, который в настоящее время характеризуется наличием или который ранее характеризовался наличием заболевания; и/или пролонгировать, т.е. увеличивать продолжительность жизни субъекта). В частности, термин "лечение заболевания" включает в себя излечение, сокращение продолжительности, уменьшение интенсивности, предотвращение, замедление или ингибирование прогрессирования или ухудшения, или предотвращение или задержку возникновения заболевания или его симптомов. Следовательно, термин "лечение" может включать в себя профилактическое лечение состояния, нарушения или заболевания или симптома состояния, нарушения или заболевания. Активное средство при использовании в лечении включает в себя оцРНК согласно настоящему изобретению, а также одно или несколько дополнительных/вспомогательных активных соединений, описанных в настоящем документе, и включает в себя без ограничения другие терапевтически активные соединения, которые могут представлять собой малые молекулы, пептиды, пептидомиметики, полипептиды/белки, антитела, другие полинуклеотиды, такие как ДНК или дцРНК, клетки, вирусы, рибозимы и антисмысловые олигонуклеотиды.
Настоящее изобретение проиллюстрировано следующими примерами, которые иллюстрируют предпочтительные варианты осуществления настоящего изобретения и не должны интерпретироваться для ограничения объема настоящего изобретения, определенного в формуле изобретения. Те примеры, которые не охватываются прилагаемой формулой изобретения, приведены только для сравнительных целей.
Примеры
Сокращения
Экспериментальные процедуры
Целлюлозная очистка IVT РНК
Если не указано иное, целлюлозный порошок, состоящий из волокон среднего размера (Sigma-Aldrich, № по кат. C6288) и 1× буфер STE (10 мM TRIS, pH 7,0, 50 мM NaCl, 20 мM EDTA) использовали для процедур очистки. Все эксперименты проводили при комнатной температуре.
Процедура "отрицательной" очистки
Процедура "отрицательной" очистки основана на инкубации IVT РНК с целлюлозой в 1× буфере STE, содержащем 16% EtOH. Это условие обеспечивает возможность селективного связывания дцРНК с целлюлозой, при этом оцРНК остается в растворимой фракции.
Целлюлозу сначала суспендировали в 1× буфере STE, содержащем 16% (объем./объем.) EtOH в концентрации, составляющей 0,2 г целлюлозы/мл, и инкубировали в течение 10 мин при энергичном встряхивании. После центрифугирования в течение 5 мин при 4000 × g целлюлозу ресуспендировали в 1× буфере STE, содержащем 16% (объем./объем.) EtOH в концентрации, составляющей 0,2 г целлюлозы/мл (промытая целлюлоза).
Для экспериментов с копреципитацией 500 мкл густой суспензии промытой целлюлозы переносили в 1,5 мл пробирку и центрифугировали в течение 5 мин при 14000 × g. После удаления супернатанта 50 мкг IVT РНК в 100 мкл 1× буфере STE, содержащем 16% (объем./объем.) EtOH, добавляли к целлюлозе и инкубировали в течение 15 мин при энергичном встряхивании. После центрифугирования в течение 5 мин при 14000 × g супернатант удаляли и нуклеиновые кислоты осаждали. Целлюлозу затем инкубировали в течение 15 мин с 100 мкл 1× буфером STE, не содержащим EtOH, при энергичном встряхивании для высвобождения связанных нуклеиновых кислот. После центрифугирования в течение 5 мин при 14000 × g супернатант удаляли и элюированные нуклеиновые кислоты осаждали.
Для целлюлозной очистки с использованием микроцентрифужных спин-колонок (NucleoSpin Filters, Macherey-Nagel, № по кат. 740606) 600 мкл густой суспензии предварительно промытой целлюлозы (0,12 г целлюлозы) переносили на спин-колонку и центрифугировали в течение 60 с при 14000 × g. Сток отбрасывали и 500 мкл 1× буфера STE, содержащего 16% (объем./объем.) EtOH, добавляли к спин-колонке и инкубировали в течение 5 мин при энергичном встряхивании для ресуспендирования целлюлозы. После центрифугирования в течение 60 с при 14000 × g сток отбрасывали и IVT РНК (50-500 мкг) в 300-500 мкл 1× буфера STE, содержащего 16% (объем./объем.) EtOH, добавляли к спин-колонке и инкубировали в течение 20 мин при энергичном встряхивания для ресуспендирования целлюлозы. Спин-колонку затем центрифугировали в течение 60 с при 14000 × g и сток собирали для осаждения нуклеиновых кислот. Если проводили многочисленные циклы целлюлозной очистки, сток напрямую переносили в спин-колонку со свежеприготовленной целлюлозой и процедуру повторяли. В итоге путем добавления 300-500 мкл 1× буфера STE связанные с целлюлозой нуклеиновые кислоты высвобождали во время инкубации в течение 20 мин при энергичном встряхивании и центрифугировании спин-колонки в течение 60 с при 14000 × g.
Масштабирование процесса очистки проводили в 50 мл пробирках с использованием избыточных 1,5 г целлюлозы и 5 мг IVT РНК в 15 мл 1× буфера STE, содержащего 16% (объем./объем.) EtOH. РНК добавляли к сухой целлюлозе и инкубировали при перемешивании с магнитной мешалкой в течение 30 мин. Несвязанные нуклеиновые кислоты извлекали с помощью фильтрования с использованием одноразового фильтровального устройства с вакуумным приводом (Steriflip-HV, размер пор 0,45 мкм, PVDF, Merck Chemicals GmbH/ Millipore, № по кат. SE1M003M00). Если указано, фильтрат использовали для второго цикла очистки путем добавления 1,5 г свежей целлюлозы и повторяя процесс. В итоге, нуклеиновые кислоты в фильтрате осаждали путем добавления равного объема изопропанола.
Процедура "положительной" очистки
Принцип процедуры "положительной" очистки состоит в связывании сначала всех РНК с целлюлозой путем инкубации IVT РНК с целлюлозой в 1× буфере STE, содержащем 40% EtOH. На второй стадии оцРНК селективно высвобождают путем инкубации в 1× буфере STE, содержащем 16% EtOH, при этом при указанных условиях дцРНК остается связанной с целлюлозными волокнами.
Перед применением целлюлозу суспендировали в 1× буфере STE, содержащем 40% (объем./объем.) EtOH в концентрации, составляющей 0,2 г целлюлозы/мл, и инкубировали в течение 10 мин при энергичном встряхивании. После центрифугирования в течение 5 мин при 4000 × g целлюлозу ресуспендировали в 1× буфере STE, содержащем 40% (объем./объем.) EtOH в концентрации, составляющей 0,2 г целлюлозы/мл (промытая целлюлоза).
Для целлюлозной очистки с использованием микроцентрифужных спин-колонок (NucleoSpin Filters, Macherey-Nagel, № по кат. 740606) 600 мкл густой суспензии промытой целлюлозы (0,12 г целлюлозы) переносили на спин-колонку и центрифугировали в течение 60 с при 14000 × g. Сток отбрасывали и 500 мкл 1× буфера STE, содержащего 40% (объем./объем.) EtOH, добавляли к спин-колонке и инкубировали в течение 5 мин при энергичном встряхивании для ресуспендирования целлюлозы. После центрифугирования при 14000 × g в течение 60 с сток отбрасывали и IVT РНК (50-500 мкг) в 300-500 мкл 1× буфера STE, содержащего 40% (объем./объем.) EtOH, добавляли к спин-колонке и инкубировали в течение 20 мин при энергичном встряхивании для ресуспендирования целлюлозы. Спин-колонку затем центрифугировали при 14000 × g в течение 60 с и сток собирали для осаждения нуклеиновых кислот. Путем добавления 300-500 мкл 1× буфера STE, содержащего 16% (объем./объем.) EtOH, оцРНК высвобождали из целлюлозы во время инкубации в течение 20 мин при энергичном встряхивании и центрифугировании спин-колонки в течение 60 с при 14000 × g. Если проводили многочисленные циклы целлюлозной очистки, сток напрямую переносили в спин-колонку со свежеприготовленной целлюлозой и процедуру повторяли. В итоге, путем добавления 300-500 мкл 1× буфера STE связанные с целлюлозой нуклеиновые кислоты высвобождали во время инкубации в течение 20 мин при энергичном встряхивании и центрифугировании спин-колонки в течение 60 с при 14000 × g.
Для ЖХБР с использованием целлюлозы в качестве неподвижной фазы сначала получали густую суспензию целлюлозы (0,2 г/мл) в 1× буфере STE, содержащем 40% (объем./объем.) EtOH, и перемешивали в течение 30 мин. 20 мл этой густой суспензии (4 г целлюлозы) использовали для заполнения колонки XK 16/20 (GE Healthcare Life Sciences, Cat #28-9889-37). Основание колонки имело конечную высоту, составляющую приблизительно 5 см. Хроматографию проводили с использованием системы ÄKTA Avant 25 (GE Healthcare Life Sciences) и мониторингом УФ (260 нм) поглощения. В качестве буфера для связывания использовали 1× буфер STE, содержащий 40% (объем./объем.) EtOH (буфер B), и в качестве буфера для элюирования использовали 1× буфер STE (буфер A). Колонку уравновешивали в течение 15 мин с помощью 100% буфера B со скоростью потока, составляющей 2 мл/мин. После инъекции 500 мкг РНК (объем образца: 500 мкл) скорость потока снижали до 1 мл/мин в течение 40 мин. оцРНК элюировали с использованием 40% буфера B (16% (объем./объем.) EtOH) в течение 40 мин при скорости потока, составляющей 2 мл/мин. В итоге, путем замены композиции буфера на 0% буфер B (0% EtOH) дцРНК элюировали из колонки. Хроматографические пики собирали и нуклеиновые кислоты осаждали для дополнительного анализа.
Осаждение нуклеиновых кислот изопропанолом
РНК, полученную из целлюлозных очисток, осаждали путем добавления 0,1 объемов 3 M ацетата натрия (pH 4,0) и 1 объема изопропанола. После перемешивания вихревым способом образцы инкубировали в течение 1 ч при -20°C с последующим центрифугированием в течение 10 мин при 14000 × g. Осадок РНК промывали с помощью 200 мкл ледяного 70% (объем./объем.) EtOH, высушивали воздухом и растворяли в подходящем объеме не содержащей нуклеазу H2O. Концентрации РНК измеряли спектрофотометрически с использованием системы Nanodrop (Eppendorf).
Анализ методом дот-блот
Для определения количества примесей дцРНК и гибрида РНК-ДНК получали серийные разведения образцов РНК с различными концентрациями и увеличивающиеся количества РНК (как правило, 40 нг, 200 нг и 1000 нг) наносили пятнами (0,5 мкл) на нейлоновую мембрану для блоттинга (Nytran SuPerCharge (SPC) Nylon Blotting Membrane (GE Healthcare Life Sciences, № по кат. 10416216)). Мембрану затем блокировали в течение 1 ч в буфере TBS-T (20 мM TRIS pH 7,4, 137 мM NaCl, 0,1% (объем./объем.) TWEEN-20), содержащем 5% (масс./объем.) порошка обезжиренного молока. Для обнаружения дцРНК мембрану инкубировали в течение 1 ч со специфическим в отношении дцРНК мышиным моноклональным антителом J2 (English & Scientific Consulting, Szirák, Hungary), разведенным в соотношении, составляющем 1:10000 в буфере TBS-T, содержащем 1% (масс./объем.) порошка обезжиренного молока. Если это указано, использовали специфическое к гибриду РНК-ДНК мышиное моноклональное антитело IgG2a S 9.6 (KeraFAST, № по кат. ENH001), разведенное в соотношении, составляющем 1:10000 для обнаружения примесей гибрида РНК-ДНК. После промывки с помощью TBS-T мембрану инкубировали в течение 1 ч с HRP-конъюгированным IgG осла к антителам мыши (Jackson ImmunoResearch, № по кат. 715-035-150), разведенным в соотношении, составляющем 1:10000 в буфере TBS-T, содержащем 1% (масс./объем.) порошка обезжиренного молока, промывали с помощью TBS-T и проявляли с использованием реагента для обнаружения в вестерн-блоттинге Amersham ECL Prime Western Blotting Detection Reagent (Fisher Scientific, № по кат. RPN2232) и системы получения изображений ChemiDoc MP Imaging (BIO-RAD). Если указано, интенсивности сигналов гибридизации количественно определяли с помощью денситометрии с использованием программного обеспечения Image Lab 5.1 (BIO-RAD).
Электрофорез в агарозном геле
Для мониторинга целостности очищенных РНК и подтверждения количеств, загруженных на системы для дот-блоттинга использовали электрофорез в агарозном геле. Анализировали равные количества РНК (например, 2 мкл) 40 нг/мкл серийного разведения РНК, полученного для дот-блоттинга. Образцы РНК денатурировали согласно Masek с соавт. (Anal. Biochem. 336 (2005), 46-50) путем смешивания 2 мкл РНК (80 нг) с 6 мкл формамида и инкубации в течении 5 мин при 65°C перед загрузкой на 1,4% (масс./объем.) агарозный гель, содержащий 0,005% (объем./объем.) GelRed™ Nucleic Acid Gel Stain (Biotium Inc., № по кат. 41003). Электрофорез проводили при 100 В в течение 20 мин с использованием TAE (40 мM TRIS ацетат, 1 мM EDTA) в качестве подвижного буфера с последующим получением изображений геля с использованием системы Gel Doc™ EZ Imager (BIO-RAD).
Пример 1 – Копреципитация дцРНК из IVT РНК с использованием целлюлозы
Для исследования осуществимости применения целлюлозы для удаления примесей дцРНК из IVT РНК сначала проводили эксперимент простой копреципитации. 50 мкг составляющей 2500 нуклеотидов в длину модифицированной за счет N1-метил-псевдоуридина (m1Ψ) IVT РНК, которую предварительно очищали с помощью осаждения хлоридом лития (LiCl) из IVT реакции, инкубировали с 0,1 г целлюлозы в присутствии 1× буфера STE, содержащего 16% (объем./объем.) EtOH. После центрифугирования несвязанную РНК в супернатанте осаждали. Связанную с целлюлозой РНК извлекали путем ресуспендирования целлюлозы в 1x STE, не содержащем EtOH, центрифугирования и осаждения супернатанта. Содержание дцРНК в РНК из обеих фракций, а также исходном РНК-материале анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Целостность РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Анализ методом дот-блот показал, что по сравнению с необработанной вводимой IVT РНК содержание дцРНК во фракции несвязанной РНК после инкубации с целлюлозой сильно снижалось (фиг. 1). Это обусловлено селективным связыванием примеси дцРНК с целлюлозным материалом в присутствии 16% (объем./объем.) EtOH, что обеспечивало отделение дцРНК от оцРНК путем седиментации целлюлозы. После разделения примеси дцРНК можно высвободить из целлюлозы с использованием буфера, который не содержит EtOH. Это подтверждается демонстрацией значительных количеств реакционноспособной в отношении J2 РНК во фракции связанной РНК (фиг. 1). Более того, электрофорез РНК демонстрирует, что целостность РНК сохраняется во время этой процедуры целлюлозной очистки. Этот пример демонстрирует успешное применение целлюлозы для удаления примесей дцРНК из IVT РНК.
Пример 2 – Влияние различных концентраций EtOH на эффективность удаления дцРНК из IVT РНК с помощью целлюлозы
На последующей стадии вышеописанный способ очистки (см. пример 1) адаптировали для использования микроцентрифужных спин-колонок для отделения несвязанной РНК от целлюлозы. Преимущество этой техники состоит в полном удалении жидкости и, таким образом, несвязанной РНК из целлюлозы с помощью центрифугирования. Кроме того, исследовали, будет ли увеличение концентрации EtOH во время инкубации IVT РНК с целлюлозой вплоть до 18% (объем./объем.) или 20% (объем./объем.) увеличивать эффективность удаления дцРНК. Сначала 50 мкг составляющей 1500 нуклеотидов в длину модифицированной за счет псевдоуридина (Ψ) и D2-кэпированной IVT РНК, которую предварительно очищали от реакции IVT с помощью магнитных гранул, инкубировали в микроцентрифужной спин-колонке с 0,1 г целлюлозы в присутствии 1× буфера STE, содержащего 16% (объем./объем.), 18% (объем./объем.) или 20% (объем./объем.) EtOH. После центрифугирования несвязанную РНК собирали путем центрифугирования колонки и осаждали. Связанную с целлюлозой РНК извлекали с помощью добавления 1× STE, не содержащего EtOH, к колонке, ресуспендирования целлюлозы с помощью интенсивного встряхивания и в итоге центрифугирования и осаждения. Содержание дцРНК в РНК из обеих фракций, а также исходного РНК-материала анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Вторую мембрану загружали теми же количествами различных фракций РНК и гибридизировали с помощью специфического в отношении гибрида РНК/ДНК антитела S 9.6 для исследования того, можно ли указанные примеси IVT РНК также удалять с помощью целлюлозной очистки.
По сравнению с неочищенной IVT РНК содержание дцРНК во всех несвязанных фракциях РНК (сток) сильно снижается после инкубации с целлюлозой (фиг. 2). Количество гибридов РНК/ДНК в указанных фракциях, тем не менее, лишь немного снижалось, демонстрируя, что гибриды РНК/ДНК не связываются эффективно с целлюлозой при исследуемых условиях, и, таким образом, их нельзя удалить из IVT РНК с использованием целлюлозы. Увеличение концентрации EtOH с 16% (объем./объем.) до 18% (объем./объем.) или 20% (объем./объем.) не увеличивает значительно эффективность удаления дцРНК. Высокие количества реакционноспособной в отношении J2 РНК во фракциях связанной РНК указывает на обогащение в отношении дцРНК (фиг. 2), подтверждая разделение примесей дцРНК и оцРНК с помощью этого способа. Этот результат дополнительно показывает успешную адаптацию процедуры "отрицательной" целлюлозной очистки к формату микроцентрифужной спин-колонки.
Пример 3 – Сравнение целлюлозной очистки с обработкой РНКазой III и очисткой с помощью ВЭЖХ
Для исследования того, усиливают ли многочисленные циклы целлюлозной очистки согласно вышеописанному способу (см. пример 2) с использованием микроцентрифужных спин-колонок эффективность удаления дцРНК, 100 мкг составляющей 2500 нуклеотидов в длину m1Ψ-модифицированной IVT РНК, которую предварительно очищали с помощью осаждения хлоридом лития (LiCl) из реакции IVT, очищали 1-, 2- или 3-кратно, как описано выше, с использованием 1× буфера STE, содержащего 16% (объем./объем.) EtOH. Кроме того, РНК, очищенные с помощью целлюлозы, сравнивали с IVT РНК, которую обрабатывали либо с помощью РНКазы III E. coli (0,2 ед./100 мкг РНК) в течение 30 мин при 37°C, либо очищали с помощью ВЭЖХ согласно протоколу, описанному Weissman с соавт. (ранее). Содержание дцРНК во всех РНК анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 и количественно определяли с помощью денситометрического анализа сигналов гибридизации. Целостность РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Увеличение числа циклов целлюлозной очистки увеличивает количество дцРНК, удаленной из IVT РНК (фиг. 3). Наряду с тем, что один цикл очистки удаляет приблизительно 90% примесей дцРНК, это количество увеличивается вплоть до 95% и 97% при проведении 2 и 3 циклов очистки, соответственно. Интересно, что один цикл целлюлозной очистки удаляет почти такое же количество дцРНК, как и обработка IVT РНК с помощью РНКазы III. Более того, проведение 3 циклов целлюлозной очистки приближается к эффективности очистки с помощью ВЭЖХ. Таким образом, эффективность целлюлозной очистки находится в диапазоне между эффективностью обработки РНКазой III и эффективностью очистки с помощью ВЭЖХ.
Пример 4 – Сравнение производительности различных марок целлюлозы в удалении дцРНК из IVT РНК
Для исследования того, ограничено ли удаление примесей дцРНК конкретной маркой целлюлозы, используемой в вышеописанном эксперименте (Sigma-Aldrich, № по кат. C6288) или можно ли также использовать целлюлозу от других поставщиков, авторы настоящего изобретения исследовали производительность двух других типов целлюлозы от Macherey-Nagel (MN 100, MN 2100). Сначала 100 мкг состоящей из 1500 нуклеотидов в длину m1Ψ-модифицированной IVT РНК, которую предварительно очищали осаждением хлоридом лития (LiCl) из реакции IVT, инкубировали в микроцентрифужной спин-колонке с 0,15 г различных типов целлюлозы в присутствии 1× буфера STE, содержащего 16% (объем./объем.) EtOH. После центрифугирования несвязанную РНК собирали путем центрифугирования колонки и осаждения РНК в стоке. Связанную с целлюлозой РНК извлекали путем добавления 1× STE к колонке с последующим ресуспендированием целлюлозы с помощью энергичного встряхивания и в итоге центрифугирования и осаждения. Содержание дцРНК во всех образцах РНК анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 и количественно определяли с помощью денситометрического анализа сигналов гибридизации. Целостность РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Независимо от целлюлозы, используемой для очистки, содержание дцРНК во всех фракциях несвязанной РНК сильно снижалось по сравнению с неочищенной вводимой РНК (фиг. 4). Высокие количества реакционноспособной в отношении J2 РНК во фракциях связанной РНК указывает на обогащение в отношении дцРНК, подтверждая разделение дцРНК примесей и оцРНК с помощью всех исследуемых типов целлюлозы.
Пример 5 – Масштабируемость способа целлюлозной очистки
Важным моментом являлось исследование того, является ли способ целлюлозной очистки масштабируемым. В связи с этим, проводили эксперимент для удаления примесей дцРНК из 5 мг составляющей 1900 нуклеотидов в длину D1-кэпированной IVT РНК, которую предварительно очищали из реакции IVT с помощью магнитных гранул. РНК инкубировали с 1,5 г целлюлозы (Sigma, № по кат. C6288) в 15 мл 1× буфера STE, содержащего 16% (объем./объем.) EtOH. Несвязанную РНК отделяли от целлюлозы с помощью фильтровального устройства с вакуумным приводом (размер пор - 0,45 мкм) и осаждали. С другими 5 мг той же РНК проводили 2 цикла очистки. Содержание дцРНК в обеих очищенных РНК анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 и количественно определяли с помощью денситометрического анализа интенсивностей сигналов гибридизации. Целостность РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Результат анализа методом дот-блот показывает, что после 1 цикла очистки с помощью 1,5 г целлюлозы 72% примесей дцРНК удаляют из 5 мг IVT РНК. Эффективность очистки можно дополнительно увеличить вплоть до 83% с помощью второго цикла очистки с помощью 1,5 г свежей целлюлозы. Как предполагали, степень извлечения РНК снижается с 67% после 1 цикла очистки до 53% после второго цикла, что является все еще приемлемым и сопоставимым со степенью извлечения, составляющей приблизительно 50%, достигаемой с помощью протокола очистки ВЭЖХ, описанного Weismann с соавт. (ранее). Этот результат ясно демонстрирует, что способ целлюлозной очистки согласно настоящему изобретению можно масштабировать для удаления примесей дцРНК из нескольких мг IVT РНК в одной одноступенчатой очистке.
Пример 6 – Очистка IVT РНК с различной длиной с использованием процедуры "положительной" очистки
На следующей стадии исследовали, возможно ли сначала связать все РНК-компоненты препарата IVT РНК с целлюлозой в присутствии высоких концентраций EtOH перед селективным высвобождением фракции оцРНК путем уменьшения концентрации EtOH до 16% (объем./объем.). При этом условии примеси дцРНК должны оставаться связанными с целлюлозным материалом и, таким образом, их отделяют от оцРНК ("положительная" очистка). Эта процедура будет более преимущественной по сравнению с "отрицательной" очисткой, поскольку она также позволит удалить не являющиеся нуклеиновыми кислотами примеси (например, белки, свободные нуклеотиды), которые не связываются с целлюлозой в присутствии EtOH. В связи с этим, проводили эксперименты, в которых 400 мкг трех IVT РНК с различными длинами (1300 нуклеотидов, 2500 нуклеотидов и >10000 нуклеотидов) и кэп-структур (D1, D2, отсутствие кэпа) связывали полностью с 0,12 г целлюлозы в микроцентрифужной спин-колонке с использованием 1× буфера STE, содержащего 40% (объем./объем.) EtOH. оцРНК элюировали с помощью 1× буфера STE, содержащего 16% (объем./объем.) EtOH, и переносили на вторую спин-колонку, содержащую 1,2 мг свежей целлюлозы. После инкубации при энергичном встряхивании и после центрифугирования РНК в стоке осаждали и анализировали в отношении примесей дцРНК с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Целостность РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Независимо от длины РНК содержание дцРНК всех IVT РНК снижается значительно до едва обнаруживаемого уровня после целлюлозной очистки (фиг. 6), демонстрируя осуществимость вышеописанной процедуры "положительной" очистки. Неожиданно, что IVT РНК, составляющую >10000 нуклеотидов в длины, также можно было успешно очистить от примесей дцРНК (фиг. 6A). Это показывает, что очистка не ограничена более короткой РНК (такой как 1300 - 2500 нуклеотидов в длину) и позволяет предположить, что длина РНК не является ограничивающим фактором для успешной очистки. Тем не менее, по сравнению со степенью извлечения обеих РНК, составляющих 1300 нуклеотидов и 2500 нуклеотидов в длину (45-55% извлечение), степень извлечения длинной IVT РНК ниже (35% извлечение). Хотя целостность IVT РНК, составляющей >10000 нуклеотидов в длину, ниже, чем целостность обеих более коротких IVT РНК, на нее не оказывает отрицательное влияние способ целлюлозной очистки согласно настоящему изобретению. Поскольку РНК, используемые для указанных экспериментов, несли различные 5’ кэп-структуры (10000 нуклеотидов: кэп D1, 1300 нуклеотидов: кэп D2, 2500 нуклеотидов: отсутствие кэпа), указанные примеры демонстрируют, что этот структурный признак не является критически важным фактором для успешной очистки IVT РНК с помощью целлюлозы.
Пример 7 – Очистка IVT РНК с использованием буферов с различной ионной силой
Стабильность двухцепочечных нуклеиновых кислот подвержена влиянию со стороны ионной силы окружающей среды. Наряду с тем, что высокие концентрации соли стимулируют формирование двухцепочечных структур, их диссоциация до одноцепочечных нуклеиновых кислот усиливается при низких концентрациях соли. Для анализа влияния ионной силы буфера на эффективность удаления дцРНК с помощью целлюлозы составляющую 1300 нуклеотидов в длину m1Ψ-модифицированную IVT РНК, которую предварительно очищали осаждением хлоридом лития (LiCl) из реакции IVT, инкубировали в 1,5 мл пробирке с 0,1 г целлюлозы в 500 мкл 1× буфера STE, содержащего 40% (объем./объем.) EtOH и различные концентрации NaCl (0-150 мM). После центрифугирования супернатант удаляли и целлюлозу ресуспендировали в 500 мкл соответствующих 1× буферов STE, содержащих 16% (объем./объем.) EtOH, для высвобождения оцРНК. После центрифугирования супернатант собирали и РНК извлекали с помощью осаждения. На последней стадии целлюлозу ресуспендировали в 500 мкл соответствующих 1× буферов STE, не содержащих EtOH, центрифугировали и извлекали РНК с помощью осаждения супернатанта. Содержание дцРНК в РНК из обеих фракций (элюат: 16% EtOH, элюат: 0% EtOH), а также в исходном РНК-материале (IVT РНК) анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 и количественно определяли с помощью денситометрического анализа сигналов гибридизации. Целостность РНК подвергали мониторингу электрофореза в агарозном геле.
На эффективность удаления дцРНК с помощью целлюлозы влияет концентрация NaCl в буфере STE. В присутствии 25 мM или 50 мM NaCl 94%-98% примесей дцРНК устраняют из элюата 16% EtOH (фиг. 7A, B). Либо увеличение концентрации NaCl до 75 мM (фиг. 7A), либо уменьшение ее до 10 мM (фиг. 7B) снижает эффективность очистки. Концентрации NaCl выше 125 мM приводили к значительному уменьшению эффективности очистки (фиг. 7A). Этот результат демонстрирует, что концентрация NaCl используемого буфера STE может влиять на эффективность очистки, которая является самой высокой в диапазоне, составляющем 25 - 50 мM NaCl. Сильная реакционная способность всех из элюатов с 0% EtOH, за исключением образца с 150 мM NaCl (фиг. 7A), в отношении антитела J2 отражает обогащение примесями дцРНК указанных образцов.
Пример 8 – Целлюлозная очистка IVT РНК с помощью ЖХБР
Поскольку отделение оцРНК от примесей дцРНК с помощью целлюлозы с использованием процедуры "положительной" очистки является осуществимым (см. примеры 6 и 7), сделали попытку адаптировать протокол очистки для ЖХБР. 4 г целлюлозы использовали в качестве неподвижной фазы для заполнения колонки XK 16/20. После уравновешивания с помощью 1× буфера STE, содержащего 40% (объем./объем.) EtOH, 500 мкг составляющей 1300 нуклеотидов в длину m1Ψ-модифицированной IVT РНК, которую предварительно очищали осаждением хлоридом лития (LiCl) из реакции IVT, загружали на колонку. Связанные оцРНК и дцРНК элюировали путем снижения концентрации EtOH в буфере до 16% (объем./объем.) и 0% (объем./объем.), соответственно, и фракции собирали. РНК извлекали путем осаждения и содержание дцРНК в РНК из обеих фракций (F1: элюат - 16% EtOH, F2: элюат - 0% EtOH), а также в исходном РНК-материале (вводимой РНК) анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2. Целостность РНК подвергали мониторингу электрофореза в агарозном геле.
Профиль элюирования (поглощение при 260 нм) хроматограммы показывает, что высокое процентное отношение загруженной IVT РНК связывается с целлюлозным материалом в присутствии 40% (объем./объем.) EtOH. Только небольшие количества РНК остаются несвязанными и элюируют из колонки при указанных условиях (фиг. 8A). При уменьшении концентрации EtOH до 16% (объем./объем.) большинство РНК элюирует, на что указывает острый единичный пик в УФ поглощении. Этот пик собирали (фракция F1), и он содержит очищенную оцРНК. По сравнению с неочищенной вводимой РНК приблизительно 88% содержания дцРНК удаляли из этой фракции (фиг. 8B). После снижения концентрации EtOH в буфере дополнительно до 0% (объем./объем.) только небольшие количества РНК элюируют из колонки (фракция F2). Анализ методом дот-блот выявил, что дцРНК является обогащенной в этой фракции РНК (фиг. 8B). Это подтверждает отделение оцРНК от дцРНК и демонстрирует успешное применение целлюлозы в качестве неподвижной фазы для очистки IVT РНК с помощью ЖХБР для удаления примесей дцРНК.
Пример 9 – Очистка IVT РНК с использованием различных концентраций EtOH для элюирования оцРНК
Для оптимизации протокола процедуры "положительной" целлюлозной очистки исследовали влияние различных концентраций EtOH на эффективность удаления дцРНК и извлечение РНК. 200 мкг составляющей 1500 нуклеотидов в длину D1-кэпированной IVT РНК, которую предварительно очищали из реакции IVT с помощью магнитных гранул, инкубировали с 0,1 г промытой целлюлозы в 500 мкл 1× буфера STE, содержащего 40% (объем./объем.) EtOH, в микроцентрифужной спин-колонке. Связанную с целлюлозой оцРНК элюировали с помощью 1× буфера STE, содержащего 6, 10, 12, 14, 16, 18, 20 или 24% (объем./объем.) EtOH, и извлекали из элюата путем осаждения. Содержание дцРНК в РНК, полученной из различных элюатов, а также исходном РНК-материале (вводимой РНК) анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 и количественно определяли с помощью денситометрического анализа сигналов гибридизации. Целостность РНК подтверждали с помощью электрофореза в агарозном геле.
Оптимальный диапазон концентраций EtOH для элюирования оцРНК во время процедуры "положительной" очистки составляет 14-16% (объем./объем.) (фиг. 9A, B). При указанных концентрациях EtOH 83-84% дцРНК оставались связанными с целлюлозой и 58-64% оцРНК извлекали из соответствующих элюатов. Увеличение концентрации EtOH до 18% (объем./объем.) или 20% (объем./объем.) дополнительно улучшает эффективность удаления дцРНК (85% или 90%, соответственно), но значительно снижает степень извлечения РНК (47% или 36%, соответственно). Напротив, уменьшение концентрации EtOH до 12% (объем./объем.) ухудшает эффективность очистки (63% удаленной дцРНК) без значительного улучшения извлечения РНК. Этот результат демонстрирует, что эффективность удаления дцРНК и степень извлечения РНК из элюатов коррелируют обратно пропорционально. Кроме того, относительную чистоту оцРНК в отношении примесей дцРНК можно контролировать с помощью концентрации EtOH, используемой для элюирования. Повышенные концентрации EtOH приводят к более эффективному удалению дцРНК, тем не менее, ценой сниженного извлечения оцРНК. Следовательно, при корректировке концентрации EtOH для элюирования оцРНК, соотношение примесей дцРНК к извлечению РНК можно корректировать, чтобы удовлетворять требованиям к чистоте/цене в отношении IVT РНК для различных применений.
Пример 10 – Определение способности целлюлозы связывать РНК
Для масштабирования процедуры "положительной" целлюлозной очистки важно знать РНК-связывающую способность целлюлозы для минимизации потери РНК, вызванной избыточной загрузкой. Для определения РНК-связывающей способности инкубировали фиксированное количество промытой целлюлозы (100 мг, Sigma, C6288) с 25 мкг, 50 мкг, 100 мкг, 250 мкг, 500 мкг, 750 мкг, 1000 мкг или 1500 мкг составляющей 1500 нуклеотидов в длину D1-кэпированной IVT РНК, которую предварительно очищали из реакции IVT с помощью магнитных гранул, в 500 мкл 1× буфера STE, содержащего 40% (объем./объем.) EtOH, в микроцентрифужной спин-колонке. После центрифугирования оцРНК элюировали с помощью 500 мкл 1× буфера STE, содержащего 16% (объем./объем.) EtOH. В итоге, РНК, которая являлась все еще связанной с целлюлозой, высвобождали путем инкубации с H2O (0% (объем./объем.) EtOH). РНК в стоке (40% (объем./объем.) EtOH) и обоих элюатах, 16% (объем./объем.) и 0% (объем./объем.), извлекали с помощью осаждения и количество извлеченной РНК определяли с помощью спектрофотометрии. Кроме того, содержание дцРНК в РНК, полученной из элюатов 16% (объем./объем.) EtOH, а также исходном РНК-материале (вводимой РНК) анализировали с помощью дот-блоттинга с использованием специфического в отношении дцРНК антитела J2 для мониторинга эффективности удаления дцРНК в отдельных образцах. Целостность указанных РНК подвергали мониторингу с помощью электрофореза в агарозном геле.
Максимальная РНК-связывающая способность исследуемой целлюлозы (Sigma, C6288) находилась в диапазоне от 100 мкг до 250 мкг РНК на 100 мг целлюлозы, что соответствует 1-2,5 мг РНК на 1 г целлюлозы. Это находит отражение в том факте, что степень извлечения РНК (фиг. 10A) и выход РНК (фиг. 10B), извлеченной из стока 40% (объем./объем.) EtOH, что представляет фракцию несвязанной РНК, неуклонно увеличивается при использовании 250 мкг или больше РНК для очистки с помощью 100 мг целлюлозы. Количество связанной РНК в элюатах 16% (объем./объем.) EtOH и 0% (объем./объем.) EtOH, тем не менее, не увеличивается соответственно при использовании 250 мкг или больше РНК для очистки, что впоследствии приводит к сниженной степени извлечения РНК из обеих фракций (фиг. 10A, B). Максимальная степень извлечения РНК из элюата 16% (объем./объем.) EtOH была достигнута, когда использовали 100 мкг РНК для очистки с помощью 100 мг целлюлозы (68% извлечение РНК). Кроме того, при этом соотношении РНК:целлюлоза достигнута самая высокая эффективность очистки, составляющая 88% удаления дцРНК (фиг. 10C, D). Интересно, что относительное количество дцРНК, удаленной из IVT РНК, не уменьшалось значительно при превышении РНК-связывающей способности целлюлозы.
Пример 11 – Влияние целлюлозной очистки IVT РНК на ее способности к трансляции и иммуногенность
Как представлено выше, IVT РНК содержит примеси дцРНК вследствие аберрантной активности РНК-полимеразы T7. Тем не менее, дцРНК индуцирует воспалительные цитокины (такие как интерферон) путем активации различных клеточных сенсоров, включая в себя RIG-I, MDA5 и TLR3, а также ингибирует трансляцию напрямую за счет активации протеинкиназы R (PKR) и олигоаденилатсинтетазы (OAS). Для исследования того, индуцирует ли IVT РНК, подвергнутая способу согласно настоящему изобретению, меньше воспалительных цитокинов и/или может ли она транслироваться более эффективно по сравнению с IVT РНК, которая не была подвергнута способу согласно настоящему изобретению, IVT РНК, кодирующую мышиный эритропоэтин (EPO), либо оставляли неочищенной, либо очищали с помощью 2-стадийной процедуры с использованием 2 спин-колонок, каждую из которых заполняли целлюлозным материалом (0,12 г целлюлозы (Sigma, C6288)). Сначала IVT РНК подвергали процедуре положительной очистки, как описано выше, с использованием 1ой спин-колонки (т.е. инкубация IVT РНК с целлюлозным материалом в 1ой спин-колонке и в присутствии 1× буфера STE, содержащего 40% (объем./объем.) EtOH, для связывания дцРНК и оцРНК с целлюлозным материалом; приложение центробежной силы к 1ой спин-колонке; отбрасывание стока; элюирование оцРНК из 1ой спин-колонки путем добавления 1× буфера STE, содержащего 16% (объем./объем.) EtOH, и приложение центробежной силы к 1ой спин-колонке). Затем полученный таким образом элюат, содержащий оцРНК, подвергали процедуре отрицательной очистки, как описано выше, с использованием 2ой спин-колонки (т.е. инкубация элюата, содержащего оцРНК, с целлюлозным материалом во 2ой спин-колонке; приложение центробежной силы ко 2ой спин-колонке; и сбор стока). Сток, полученный из 2ой спин-колонки, затем осаждали с помощью смеси изопропанол/ацетат натрия и повторно растворяли в H2O. После составления с TransIT (Mirus Bio) IVT РНК вводили с помощью интаперитонеальной инъекции мышам (n=4) в дозе, составляющей 3 мкг РНК/животное. Проводили забор крови через 2, 6 и 24 ч после инъекции и собирали образцы плазмы. Контрольным мышам вводили инъекцию только TransIT. Содержания мышиного интерферона альфа (IFN-α) и мышиного EPO измеряли с использованием специфических анализов ELISA (специфический в отношении мышиного интерферона альфа ELISA (eBioscience); набор для специфического в отношении мышиного EPO ELISA DuoSet ELISA Development kit (R&D)).
Как показано на фиг. 11A, IVT РНК, которую подвергли способу согласно настоящему изобретению, индуцировала значительно меньше IFN-α по сравнению с неочищенной IVT РНК. Таким образом, этот пример демонстрирует, что способ согласно настоящему изобретению эффективно удаляет загрязняющие двухцепочечные молекулы из IVT РНК. Наиболее вероятно, что остаточный IFN-α, индуцированный очищенной с помощью целлюлозы IVT РНК, был обусловлен активацией TLR7 с помощью оцРНК, которая содержит уридины.
Более того, на фиг. 11B показано, что препарат IVT РНК, кодирующей EPO, который подвергли способу согласно настоящему изобретению, за счет чего в нем отсутствует ингибирующая синтез белка дцРНК, транслировался очень эффективно, приводя в результате к высоким содержаниям EPO в плазме даже через 24 ч после введения IVT РНК, очищенной согласно настоящему изобретению. Напротив, препарат IVT РНК, кодирующей EPO, который не подвергли способу согласно настоящему изобретению, но который оставляли неочищенным, транслировался менее эффективно вследствие ингибирования синтеза белка за счет прямых и опосредованных IFN-α эффектов дцРНК.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОЧИСТКА иРНК ФИЛЬТРАЦИЕЙ В ТАНГЕНЦИАЛЬНОМ ПОТОКЕ | 2020 |
|
RU2810003C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЯВЛЕНИЯ КРОВОТЕЧЕНИЯ У БОЛЬНОГО ГЕМОФИЛИЕЙ | 2018 |
|
RU2801263C2 |
| СПОСОБЫ ОЧИСТКИ МАТРИЧНОЙ РНК | 2020 |
|
RU2825579C2 |
| РЕЦЕПТУРА ДЛЯ ВВЕДЕНИЯ РНК | 2019 |
|
RU2797147C2 |
| НОВЫЙ ИММУНОГЕННЫЙ ЭКСТРАКТ ГРИБОВ И ПАТТЕРН-РАСПОЗНАЮЩИЙ РЕЦЕПТОР РАСТЕНИЙ | 2013 |
|
RU2700621C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ЛИПИДОВ И ЛИПОСОМ | 2015 |
|
RU2738060C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ИНТЕРФЕРОН-РЕГУЛЯТОРНЫМ ФАКТОРОМ 8 (IRF8), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К IRF8 | 2011 |
|
RU2611187C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С РНКазой Н1, ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К РНКазе Н1 | 2011 |
|
RU2611192C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 21 (FGF21), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К FGF21 | 2011 |
|
RU2610661C2 |
| РНК ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2790447C2 |
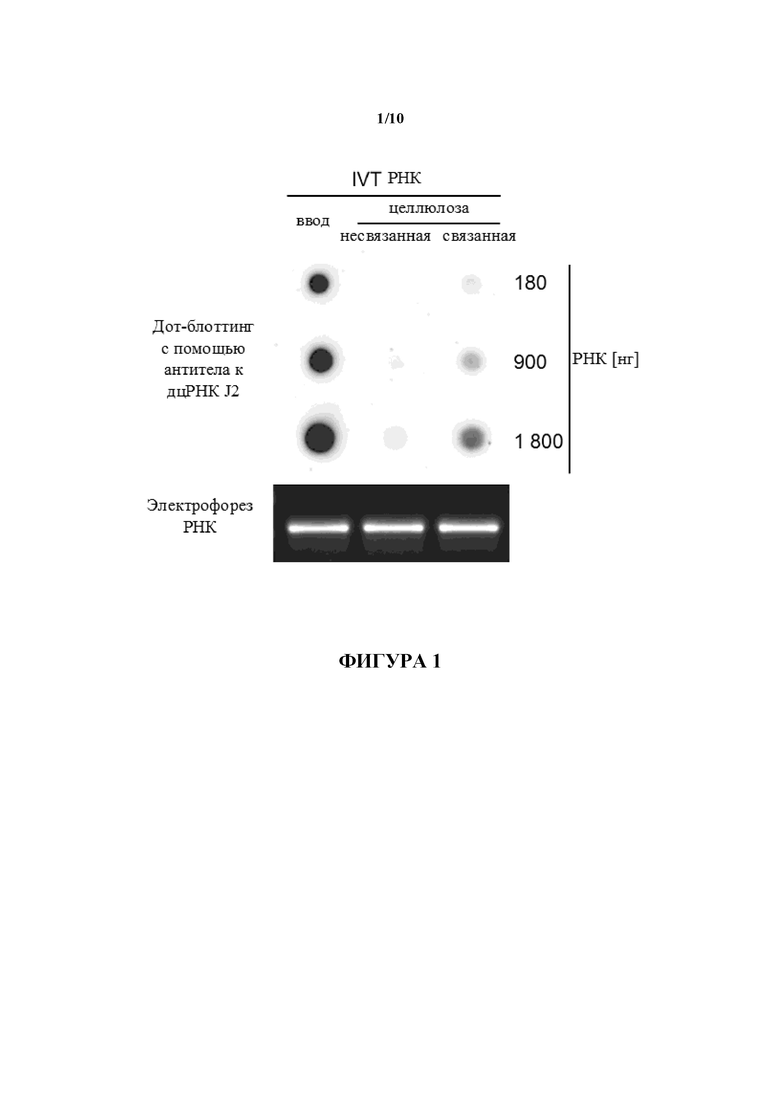


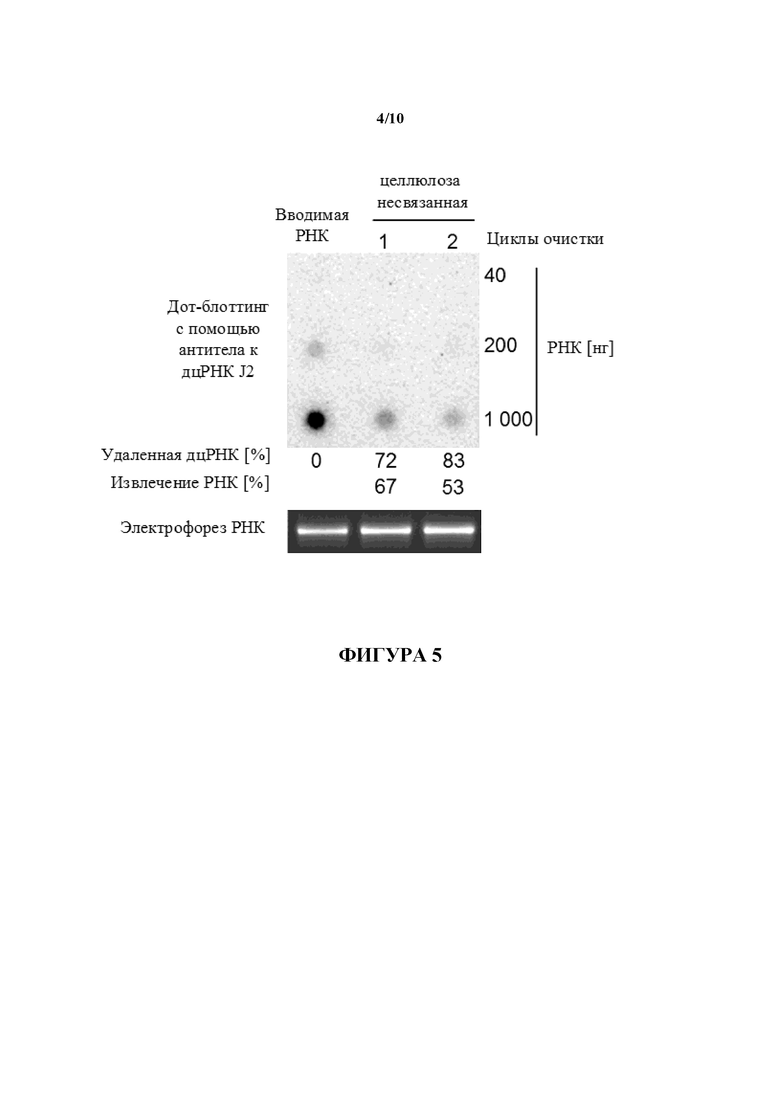
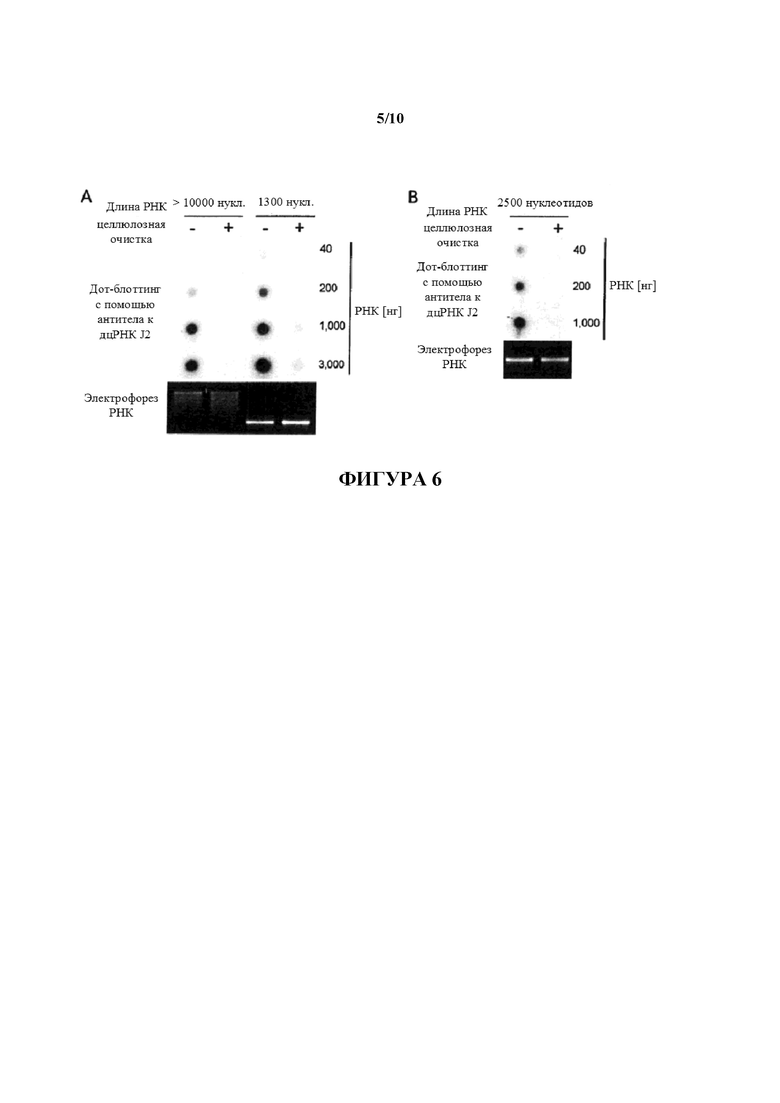
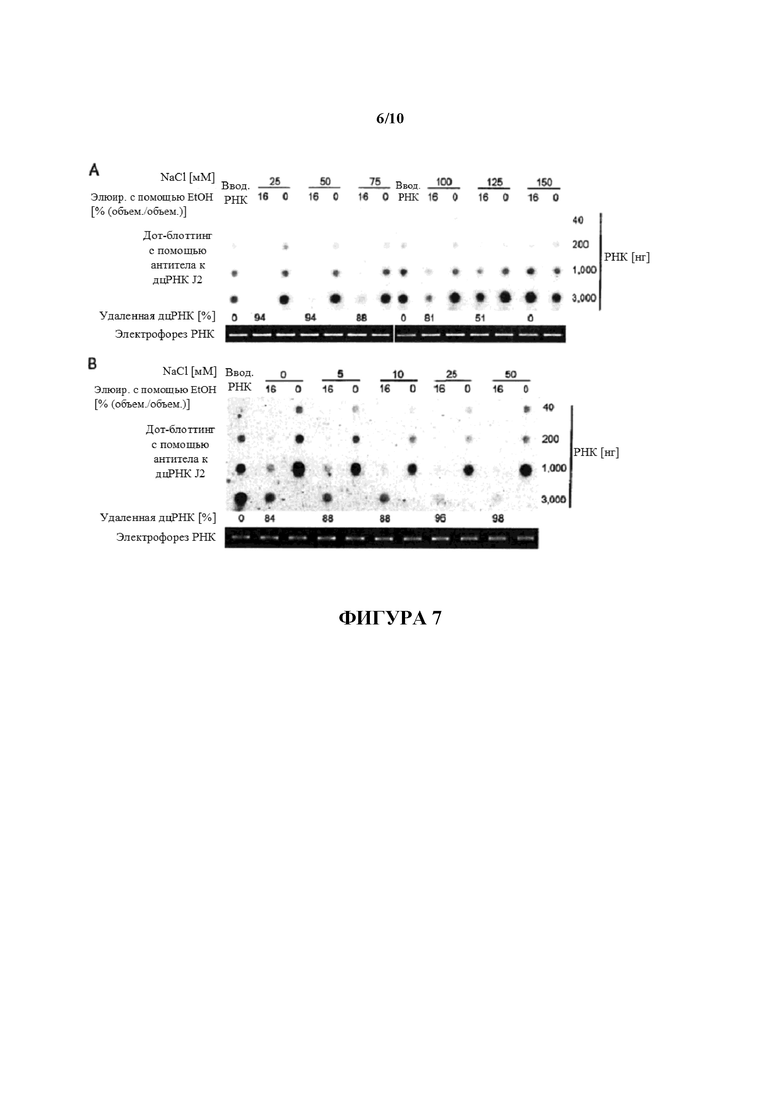
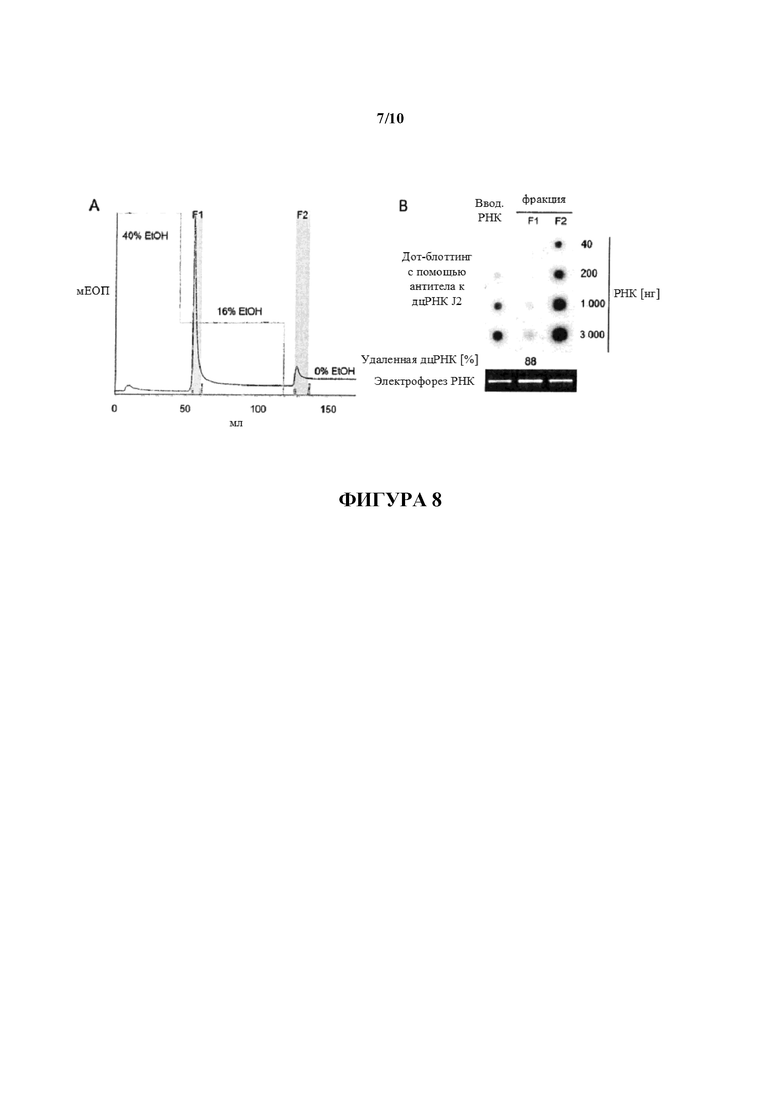
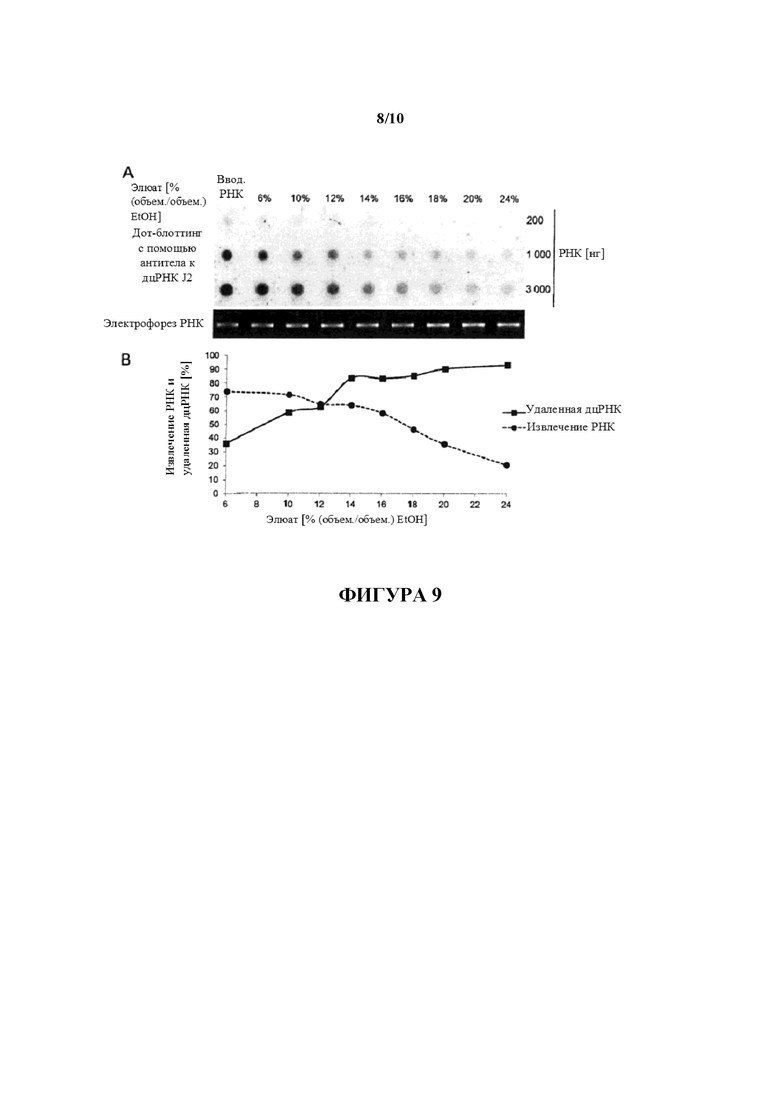
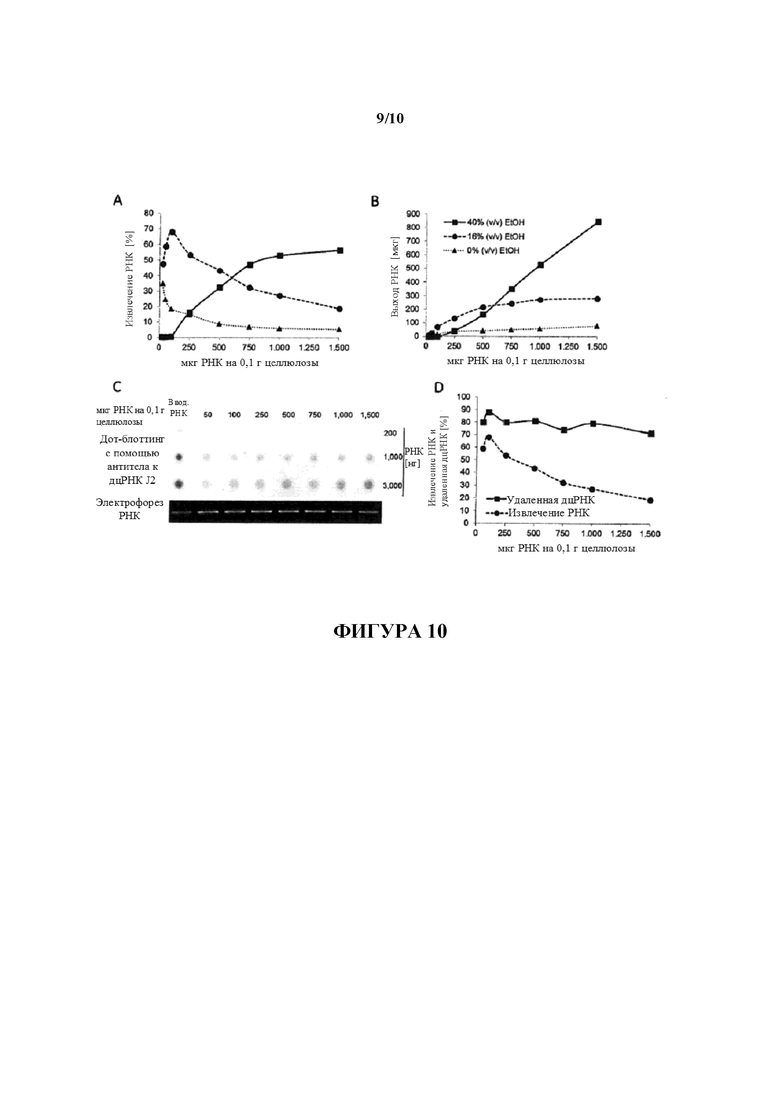
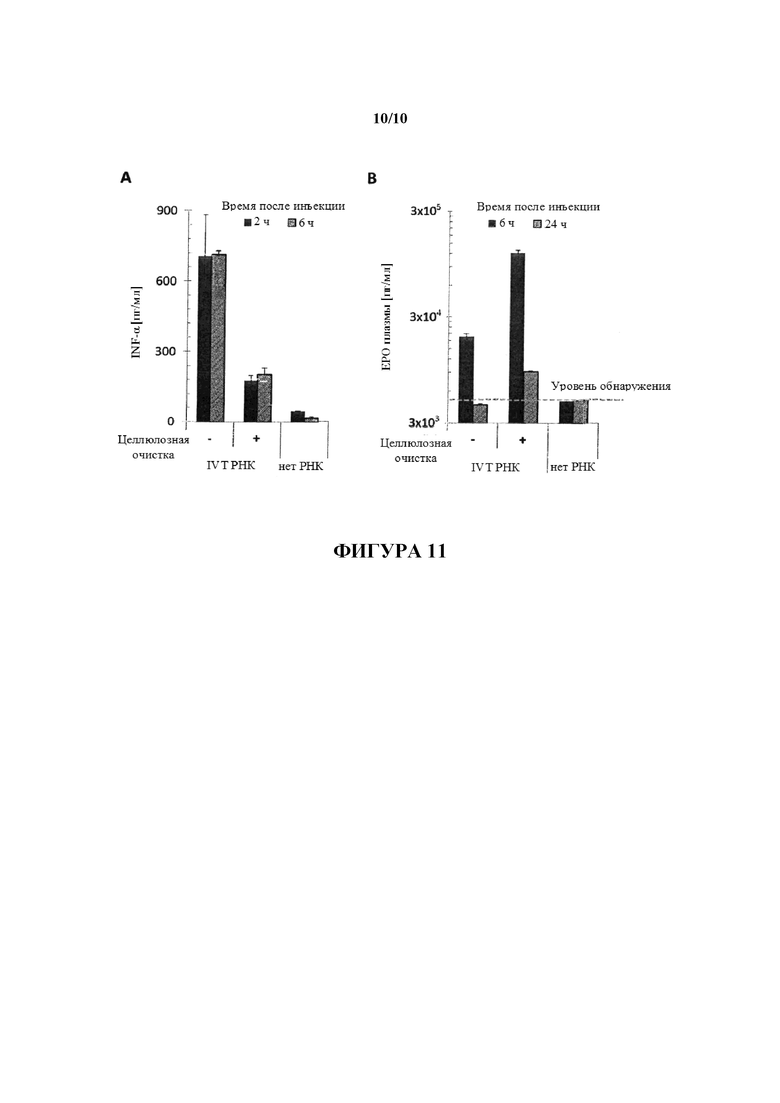
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ получения очищенной одноцепочечной РНК (оцРНК) (варианты). В одном из вариантов реализации способ включает в себя стадии (i) производства препарата РНК, содержащего оцРНК, с помощью in vitro транскрипции, (ii) приведения препарата РНК в контакт с целлюлозным материалом при условиях, которые предусматривают возможность связывания двухцепочечной РНК (дцРНК) с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом; и (iii) отделения оцРНК от целлюлозного материала при условиях, которые предусматривают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом. Изобретение расширяет арсенал способов получения очищенных одноцепочечных РНК. 2 н. и 37 з.п. ф-лы, 11 ил., 11 пр.
1. Способ получения очищенной одноцепочечной РНК (оцРНК), предусматривающий:
(i) производство препарата РНК, содержащего оцРНК, с помощью in vitro транскрипции;
(ii) приведение препарата РНК в контакт с целлюлозным материалом при условиях, которые предусматривают возможность связывания двухцепочечной РНК (дцРНК) с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом; и
(iii) отделение оцРНК от целлюлозного материала при условиях, которые предусматривают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом,
при котором
на стадии (ii) препарат РНК обеспечивается в виде жидкости, содержащей оцРНК и первый буфер, и/или целлюлозный материал обеспечивается в виде суспензии в первом буфере, причем первый буфер содержит воду, этанол и соль в концентрации, которая предусматривает возможность связывания дцРНК с целлюлозным материалом и которая не предусматривает оцРНК связываться с целлюлозным материалом; соль, содержащаяся в первом буфере, представляет собой хлорид натрия; первый буфер дополнительно содержит буферное вещество, представляющее собой трис(гидроксиметил)аминометан (TRIS), и хелатирующее средство, представляющее собой этилендиаминтетрауксусную кислоту (EDTA); и концентрация этанола в первом буфере составляет 14-20% (об./об.) и концентрация соли в первом буфере составляет 15-70 мM; и
на стадии (iii) обеспечивают наличие в пробирке смеси препарата РНК, целлюлозного материала и первого буфера, и стадия (iii) предусматривает (1) приложение силы тяжести или центробежной силы к пробирке так, чтобы разделить жидкую и твердую фазы; и (2) или сбор супернатанта, содержащего оцРНК, или удаление целлюлозного материала; или
на стадии (iii) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК, целлюлозного материала и первого буфера, и стадия (iii) предусматривает (1') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы; и (2') сбор жидкого фильтрата, содержащего оцРНК.
2. Способ получения очищенной одноцепочечной РНК (оцРНК), предусматривающий:
(i) производство препарата РНК, содержащего оцРНК, с помощью in vitro транскрипции;
(ii) приведение препарата РНК в контакт с целлюлозным материалом при условиях, которые предусматривают возможность связывания двухцепочечной РНК (дцРНК) и оцРНК с целлюлозным материалом; и
(iii) отделение оцРНК от целлюлозного материала при условиях, которые предусматривают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом,
при котором
на стадии (ii) препарат РНК обеспечивается в виде жидкости, содержащей оцРНК и второй буфер, и/или целлюлозный материал обеспечивается в виде суспензии во втором буфере, причем второй буфер содержит воду, этанол и соль в концентрации, которая предусматривает возможность связывания дцРНК и оцРНК с целлюлозным материалом; соль, содержащаяся во втором буфере, представляет собой хлорид натрия; второй буфер дополнительно содержит буферное вещество, представляющее собой TRIS, и хелатирующее средство, представляющее собой EDTA; и концентрация этанола во втором буфере составляет по меньшей мере 35% (об./об.) и концентрация соли во втором буфере составляет 15-70 мM; и
стадия (iii) предусматривает:
(1) смешивание целлюлозного материала, с которым связаны дцРНК и оцРНК, с первым буфером при встряхивании и/или перемешивании, причем первый буфер содержит воду, этанол и соль в концентрации, которая предусматривает возможность связывания дцРНК с целлюлозным материалом и не позволяет оцРНК связываться с целлюлозным материалом; соль, содержащаяся в первом буфере, представляет собой хлорид натрия; первый буфер дополнительно содержит буферное вещество, представляющее собой TRIS, и хелатирующее средство, представляющее собой EDTA; и концентрация этанола в первом буфере составляет 14-20% (об./об.) и концентрация соли в первом буфере составляет 15-70 мM; и
(2) отделение жидкой фазы, содержащей оцРНК, от целлюлозного материала.
3. Способ по п. 1, при котором стадия (ii) предусматривает смешивание препарата РНК, содержащего оцРНК, с целлюлозным материалом при встряхивании и/или перемешивании, предпочтительно в течение от 5 мин до 30 мин.
4. Способ по п. 1 или 3, при котором концентрация этанола в первом буфере составляет 14-16% (об./об.).
5. Способ по любому из пп. 1, 3 и 4, при котором концентрация соли в первом буфере составляет 20-60 мM.
6. Способ по любому из пп. 1 и 3-5, при котором стадии (ii) и (iii) повторяют один раз или два или больше раз, причем препарат оцРНК, полученный после стадии (iii) одного цикла стадий (ii) и (iii), используют в качестве препарата РНК на стадии (ii) следующего цикла и на стадии (ii) каждого цикла стадий (ii) и (iii) используют свежий целлюлозный материал.
7. Способ по п. 2, при котором стадия (ii) предусматривает (1) смешивание препарата РНК, содержащего оцРНК, с целлюлозным материалом при встряхивании и/или перемешивании, предпочтительно в течение от 5 до 30 минут; и (2) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от остатка.
8. Способ по п. 2 или 7, при котором концентрация этанола во втором буфере составляет 38-42% (об./об.).
9. Способ по любому из пп. 2, 7 и 8, при котором концентрация соли во втором буфере составляет 20-60 мM.
10. Способ по любому из пп. 2 и 7-9, при котором на стадии (ii)(2) обеспечивают наличие в пробирке смеси препарата РНК и целлюлозного материала, полученной на стадии (ii)(1), и стадия (ii)(2) предусматривает (2a) приложение силы тяжести или центробежной силы к пробирке с тем, чтобы разделить жидкую и твердую фазы; и (2b) либо удаление супернатанта, либо сбор целлюлозного материала, с которым связаны дцРНК и оцРНК.
11. Способ по любому из пп. 2 и 7-9, при котором на стадии (ii)(2) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси препарата РНК и целлюлозного материала, полученной на стадии (ii)(1), и стадия (ii)(2) предусматривает (2a') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству с тем, чтобы разделить жидкую и твердую фазы; и (2b') сброс жидкого фильтрата.
12. Способ по любому из пп. 2 и 7-11, при котором стадия (ii) дополнительно предусматривает (3) добавление аликвоты второго буфера к целлюлозному материалу, с которым связаны дцРНК и оцРНК; (4) инкубацию полученной смеси при встряхивании и/или перемешивании, предпочтительно в течение от 5 до 30 минут; и (5) отделение целлюлозного материала, с которым связаны дцРНК и оцРНК, от жидкой фазы; и необязательно (6) повторение стадий (3)-(5) один раз или два или больше раз.
13. Способ по любому из пп. 2 и 7-12, при котором на стадии (iii) целлюлозный материал, с которым связаны дцРНК и оцРНК, смешивают с первым буфером при встряхивании и/или перемешивании в течение от 5 мин до 30 мин.
14. Способ по любому из пп. 2 и 7-13, при котором концентрация этанола в первом буфере составляет 14-16% (об./об.).
15. Способ по любому из пп. 2 и 7-14, при котором концентрация соли в первом буфере составляет 20-60 мM.
16. Способ по любому из пп. 13-15, при котором на стадии (iii) обеспечивают наличие в пробирке смеси целлюлозного материала и первого буфера, и стадия (iii)(2) предусматривает (2a) приложение силы тяжести или центробежной силы к пробирке с тем, чтобы разделить жидкую и твердую фазы; и (2b) или сбор супернатанта, содержащего оцРНК, или удаление целлюлозного материала.
17. Способ по любому из пп. 13-15, при котором на стадии (iii) обеспечивают наличие в спин-колонке или фильтровальном устройстве смеси целлюлозного материала и первого буфера, и стадия (iii)(2) предусматривает (2a') приложение силы тяжести, центробежной силы, давления или вакуума к спин-колонке или фильтровальному устройству; и (2b') сбор жидкого фильтрата, содержащего оцРНК.
18. Способ по любому из пп. 2 и 7-17, при котором стадии (ii) и (iii) повторяют один раз или два или больше раз, причем препарат оцРНК, полученный после стадии (iii) одного цикла стадий (ii) и (iii), используют в качестве препарата РНК на стадии (ii) следующего цикла и на стадии (ii) каждого цикла стадий (ii) и (iii) используют свежий целлюлозный материал.
19. Способ по п. 2, при котором на стадии (ii) обеспечивают наличие в колонке целлюлозного материала, стадия (ii) предусматривает загрузку препарата РНК на колонку при условиях, которые предусматривают возможность связывания дцРНК и оцРНК с целлюлозным материалом, и стадия (iii) предусматривает элюирование оцРНК из целлюлозного материала при условиях, которые предусматривают возможность связывания дцРНК с целлюлозным материалом и не позволяют оцРНК связываться с целлюлозным материалом.
20. Способ по п. 19, при котором на стадии (ii) препарат РНК получают и загружают на колонку в виде жидкости, содержащей оцРНК и второй буфер.
21. Способ по п. 19 или 20, при котором концентрация этанола во втором буфере составляет 38-42% (об./об.).
22. Способ по любому из пп. 19-21, при котором концентрация соли во втором буфере составляет 20-60 мM.
23. Способ по любому из пп. 19-22, при котором стадию (iii) проводят с использованием первого буфера в качестве элюента.
24. Способ по любому из пп. 19-23, при котором концентрация этанола в первом буфере составляет 14-16% (об./об.).
25. Способ по любому из пп. 19-24, при котором концентрация соли в первом буфере составляет 20-60 мM.
26. Способ по любому из пп. 1-25, при котором препарат РНК получают с использованием РНК-полимеразы, выбранной из группы, состоящей из РНК-полимераз T3, T7 и SP6.
27. Способ по любому из пп. 1-26, при котором перед стадией (ii) препарат РНК подвергают по меньшей мере одной обработке, предшествующей очистке.
28. Способ по п. 27, при котором по меньшей мере одна обработка, предшествующая очистке, предусматривает одно или несколько из следующего: осаждение нуклеиновых кислот, предпочтительно с использованием хлорида лития; связывание нуклеиновых кислот с магнитными гранулами; ультрафильтрация и разложение ДНК, предпочтительно с использованием специфической для двойной спирали нуклеазы (DSN).
29. Способ по любому из пп. 1-28, при котором оцРНК представляет собой иРНК или ингибирующую РНК, такую как антисмысловая РНК, киРНК или микроРНК.
30. Способ по любому из пп. 1-29, при котором оцРНК представляет собой иРНК и характеризуется длиной, составляющей по меньшей мере 2700 нуклеотидов, предпочтительно по меньшей мере 3000 нуклеотидов, более предпочтительно по меньшей мере 3500 нуклеотидов, более предпочтительно по меньшей мере 4500 нуклеотидов.
31. Способ по любому из пп. 1-30, при котором целлюлозный материал содержит целлюлозные волокна, предпочтительно целлюлозные волокна степени чистоты, подходящей для применения в качестве реагента для распределительной хроматографии.
32. Способ по любому из пп. 1-31, при котором перед приведением в контакт с препаратом РНК на стадии (ii) целлюлозный материал обеспечивается в виде промытого целлюлозного материала.
33. Способ по п. 32, при котором промывка целлюлозного материала включает в себя (I) смешивание целлюлозного материала с промывочным раствором при встряхивании и/или перемешивании, предпочтительно в течение от 5 мин до 30 мин; и (II) либо удаление жидкости, либо сбор целлюлозного материала; и необязательно (III) повторение стадий (I) и (II) один раз или два или больше раз.
34. Способ по п. 33, при котором, если стадию (ii) проводят при условиях, которые предусматривают возможность связывания дцРНК с промытым целлюлозным материалом и не позволяют оцРНК связываться с промытым целлюлозным материалом, промывочный раствор характеризуется композицией первого буфера.
35. Способ по п. 34, при котором концентрация этанола в первом буфере составляет 14-16% (об./об.).
36. Способ по п. 34 или 35, при котором концентрация соли в первом буфере составляет 20-60 мM.
37. Способ по п. 33, при котором, если стадию (ii) проводят при условиях, которые предусматривают возможность связывания дцРНК и оцРНК с промытым целлюлозным материалом, промывочный раствор характеризуется композицией второго буфера, причем второй буфер содержит воду, этанол и соль в концентрации, которая предусматривает возможность связывания дцРНК и оцРНК с промытым целлюлозным материалом; соль, содержащаяся во втором буфере, представляет собой хлорид натрия; второй буфер дополнительно содержит буферное вещество, представляющее собой TRIS, и хелатирующее средство, представляющее собой EDTA; и концентрация этанола во втором буфере составляет по меньшей мере 35% (об./об.) и концентрация соли во втором буфере составляет 15-70 мM.
38. Способ по п. 37, при котором концентрация этанола во втором буфере составляет 38-42% (об./об.).
39. Способ по п. 37 или 38, при котором концентрация соли во втором буфере составляет 20-60 мM.
| T | |||
| PE’ERY, M | |||
| B | |||
| MATHEWS, "Synthesis and Purification of Single-Stranded RNA for Use in Experiments with PKR and in Cell-Free Translation Systems." Methods, 1997, 11(4), 371-381 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| R | |||
| M | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2021-11-30—Публикация
2017-04-19—Подача