I. Уровень техники
[0001] Лиганд программируемой клеточной смерти 1 или PD-L1 (также известный как кластер дифференцировки 274 или CD274 и B7 гомолог 1 или B7-H1) представляет собой однопроходный мембранный белок I типа, принадлежащий к семейству B7 костимулирующих/коингибиторных молекул презентации антигенов. Внеклеточная часть PD-L1 содержит два домена, N-концевой IgV-подобный домен и IgC-подобный домен. PD-L1 имеет короткий цитоплазматический домен без какого-либо очевидного мотива сигнальной трансдукции, вследствие чего возникло первоначальное убеждение, что PD-L1 как рецептору не присуща передача сигналов. Однако последние данные показывают, что цитоплазматический домен PD-L1 содержит неклассические консервативные мотивы сигнальной трансдукции, способные ингибировать трансдукцию интерферона (IFN) и защищать раковые клетки от цитотоксичности IFN (Gato-Canas et al., Cell Rep, 2017).
[0002] PD-L1 играет ключевую роль в подавлении иммунной системы во время беременности, хронических инфекций, тканевой аллотрансплантации, аутоиммунных заболеваний и рака. PD-L1 экспрессируется на различных типах клеток, включая В-клетки, Т-клетки, макрофаги, миелоидные дендритные клетки, тучные клетки, эпителиальные клетки и клетки эндотелия сосудов. Он также экспрессируется при нескольких типах рака, включая, помимо прочего, меланому, рак легкого, мочевого пузыря, ободочной кишки и молочной железы. Высокие уровни экспрессии PD-L1 сопряжены с повышенной агрессивностью опухоли, опосредуя истощение и анергию опухоль-инфильтрирующих Т-клеток, секрецию иммуносупрессивных цитокинов и защиту от лизиса цитотоксическими Т-клетками.
[0003] PD-L1 представляет собой лиганд белка программируемой клеточной смерти 1 (PD-1) - ключевого ингибирующего рецептора иммунной контрольной точки, который в основном экспрессируется на активированных Т-клетках, но также и на других клетках иммунной системы, в том числе B-клетках и моноцитах. PD-1 является членом семейства иммуноглобулинов, содержащим IgV-подобный внеклеточный домен, трансмембранный домен и цитоплазматический хвост с ITIM (иммунорецепторным ингибирующим мотивом на основе тирозина) и ITSM (иммунорецепторным мотивом переключения на основе тирозина). Связывание PD-1 с PD-L1 приводит к привлечению тирозинфосфатаз 1 и 2, содержащих домен гомологии 2 с Src (SHP 1 и 2), во внутриклеточные мотивы переключения PD-1, и к экспрессии убиквитинлигаз E3 семейства CBL. Затем эти убиквитинлигазы убиквитинируют и инактивируют ключевые медиаторы сигнальной трансдукции TCR, что приводит к удалению TCR с клеточной поверхности (Karwacz et al., EMBO Mol Med, 2011). Фосфатазы SHP 1 и SHP 2 ингибируют передачу сигналов TCR напрямую, прекращая фосфорилирование ZAP70 и PI3K. Кроме того, PD-1, связанный посредством PD-L1, может вызывать ингибирование сигнальных путей TCR, влияя на экспрессию и активность CK2 и циклинзависимых киназ (CDK) (Arasanz et al., Oncotarget, 2017). Также было показано, что связывание PD-1 приводит к перепрограммированию метаболизма Т-клеток от повышенного гликолиза, который необходим для выработки энергии для эффекторных функций, до β-окисления жирных кислот, которое связано с долгоживущими клетками. Это также может объяснить выживание и персистенцию клеток с высоким уровнем экспрессии PD-1 у пациентов с хроническими инфекциями и раком (Patsoukis et al., Nat Commun, 2015).
[0004] Блокирование взаимодействия PD-1/PD-L1 агентами, нацеленными против PD-1 или против PD-L1, может обратить вспять функцию иммунных контрольных точек и ослабить торможение Т-клеточных ответов. В настоящее время для лечения рака одобрены три антитела к PD-L1: атезолизумаб (TECENTRIQ, MPDL3280A, RG7466), авелумаб (BAVENCIO, MSB0010718C) и дурвалумаб (IMFINZI, MEDI4736). Несколько успешных клинических исследований этих антител показали высокую частоту объективного ответа, устойчивость ответа или улучшение показателей выживаемости при раке мочевого пузыря, раке кожи и раке легкого (Xu-Monette et al., Front Immunol, 2017).
[0005] Кластер дифференцировки 137 или CD137 (также известный как 4-1BB или TNFRS9) является костимулирующим иммунным рецептором и членом суперсемейства рецепторов фактора некроза опухоли (TNFR). Он главным образом экспрессируется на активированных CD4+ и CD8+ T-клетках, активированных B-клетках и естественных киллерах (NK), но также может быть обнаружен на покоящихся моноцитах и дендритных клетках (Li and Liu, Clin Pharmacol, 2013) или эндотелиальных клетках (Snell et al., Immunol Rev, 2011). CD137 играет важную роль в регуляции иммунного ответа и, таким образом, является мишенью для иммунотерапии рака. Лиганд CD137 (CD137L) является единственным известным природным лигандом CD137 и конститутивно экспрессируется на нескольких типах антигенпрезентирующих клеток, таких как активированные В-клетки, моноциты и дендритные клетки селезенки, и может быть индуцирован на Т-лимфоцитах.
[0006] CD137L представляет собой тримерный белок, который существует в виде мембраносвязанной формы и растворимого варианта. Однако, способность растворимого CD137L активировать CD137, например, на CD137-экспрессирующих лимфоцитах, ограничена, и чтобы вызвать эффект, необходимы большие концентрации (Wyzgol et al., J Immunol, 2009). Естественный путь активации CD137 - взаимодействие CD137-положительной клетки с CD137L-положительной клеткой. Полагают, что затем активация CD137 индуцируется кластеризацией посредством CD137L на противоположной клетке, что приводит к сигнализации с помощью TRAF1, 2 и 3 (Yao et al., Nat Rev Drug Discov, 2013, Snell et al., Immunol Rev, 2011) и дальнейшим сопутствующим нисходящим эффектам в CD137-положительной T-клетке. В случае Т-клеток, активируемых распознаванием их соответствующих родственных мишеней, эффекты, вызываемые костимуляцией CD137, представляют собой дальнейшую усиленную активацию, увеличенную выживаемость и пролиферацию, продукцию провоспалительных цитокинов и улучшенную способность к уничтожению.
[0007] Преимущества костимуляции CD137 для уничтожения раковых клеток были продемонстрированы на ряде моделей in vivo. Например, принудительная экспрессия CD137L на опухоли приводит к отторжению опухоли (Melero et al., Eur J Immunol, 1998). Точно так же, принудительная экспрессия анти-CD137 ScFv на опухоли приводит к зависимому от CD4+ Т-клеток и NK-клеток устранению опухоли (Yang et al., Cancer Res, 2007, Zhang et al., Mol Cancer Ther, 2006, Ye et al., Nat Med, 2002). Было показано, что системно вводимое антитело к CD137 приводит к замедлению роста опухоли (Martinet et al., Gene Ther, 2002).
[0008] Было показано, что CD137 является отличным маркером для естественных опухоль-реактивных Т-клеток в опухолях человека (Ye et al., Clin Cancer Res, 2014), и что анти-CD137 антитела могут быть использованы для улучшения экспансии и активности CD8+ опухоль-инфильтрирующих лимфоцитов меланомы для применения в адоптивной Т-клеточной терапии (Chacon et al., PLoS One, 2013).
[0009] Доклиническая демонстрация потенциальной терапевтической эффективности костимуляции CD137 стимулировала разработку терапевтических антител, нацеленных на CD137, включая BMS-663513 (описано в патенте США № 7,288,638) и PF-05082566 (Fisher et al., Cancer Immunol Immunother, 2012).
[0010] В настоящем описании предложены, среди прочего, новые подходы для одновременного связывания CD137 и PD-L1 с помощью одного или более слитых белков, обладающих свойствами специфичности связывания с CD137 и специфичности связывания с PD-L1.
II. ОПРЕДЕЛЕНИЯ
[0011] В следующем списке определены термины, фразы и сокращения, используемые в настоящем описании. Все термины, перечисленные и определенные в настоящем документе, охватывают все грамматические формы.
[0012] В контексте настоящего документа, если не указано иное, «CD137» означает человеческий CD137 (huCD137). Человеческий CD137 означает полноразмерный белок, определенный UniProt Q07011, его фрагмент или вариант. CD137 также известен как 4-1BB, член 9 суперсемейства рецепторов фактора некроза опухолей (TNFRSF9), и индуцируемый активацией лимфоцитов (ILA). В некоторых частных вариантах осуществления используется CD137 отличного от человека вида, например, CD137 яванского макака и мышиный CD137.
[0013] В контексте настоящего документа, если не указано иное, «лиганд программируемой клеточной смерти 1» или «PD-L1» означает человеческий PD-L1 (huPD-L1). Человеческий PD-L1 означает полноразмерный белок, определенный UniProt Q9NZQ7, его фрагмент или вариант. Человеческий PD-L1 кодируется геном CD274. PD-L1 также известен как кластер дифференцировки 274 (CD274) или гомолог B7 1-го типа (B7-H1). В некоторых частных вариантах осуществления используется PD-L1 отличного от человека вида, например, PD-L1 яванского макака и мышиный PD-L1.
[0014] В контексте настоящего документа «аффинность связывания» описывает способность биомолекулы (например, полипептида или белка) согласно изобретению (например, мутеина липокалина, антитела, слитого белка или любого другого пептида или белка) к связыванию определенной мишени и образованию комплекса. Аффинность связывания измеряют с помощью ряда методов, известных специалистам в данной области техники, включая, не ограничиваясь перечисленным, флуоресцентное титрование, анализы на основе твердофазного иммуноферментного анализа (ELISA), в том числе прямого и конкурентного ELISA, калориметрические методы, например, изотермическая титрационная калориметрия (ITC), и поверхностный плазмонный резонанс (SPR). Эти методы хорошо известны в данной области техники, и некоторые примеры таких методов дополнительно описаны в настоящем документе. Аффинность связывания, таким образом, выражают значением константы диссоциации (KD), полумаксимальной эффективной концентрации (EC50) или концентрации полумаксимального ингибирования (IC50), измеренного с использованием таких методов. Более низкое значение KD, EC50 или IC50 отражают лучшую (более высокую) связывающую способность (аффинность). Соответственно, аффинность связывания двух биомолекул с определенной мишенью может быть измерена и сопоставлена. При сравнении аффинностей связывания двух биомолекул с определенной мишенью термин «приблизительно такая же», «по существу такая же» или «по существу аналогичная» означает, что один биомолекула имеет аффинность связывания, выраженную значением KD, EC50 или IC50, идентичным или схожим с другой молекулой в пределах вариабельности результатов эксперимента по измерению аффинности связывания. Вариабельность результатов эксперимента по измерению аффинности связывания зависит от конкретного используемого метода и известна специалистам в данной области техники.
[0015] В контексте настоящего документа термин «по существу» может также относиться к качественному условию демонстрации полной или почти полной степени или величины характеристики или свойства, представляющего интерес. Специалисту в области биологии будет ясно, что биологические и химические явления редко, если вообще когда-либо, доходят до завершения и/или протекают до завершения, или достигают или избегают абсолютного результата. Таким образом, термин «по существу» используется в настоящем документе для обозначения потенциального отсутствия полноты, присущего многим биологическим и химическим явлениям.
[0016] В контексте настоящего документа термин «обнаруживать», «обнаружение», «обнаружимый» или «проведение обнаружения» понимается как на количественном, так и на качественном уровне, а также в их комбинации. Таким образом, он включает количественные, полуколичественные и качественные измерения, осуществленные в отношении биомолекулы согласно изобретению.
[0017] В контексте настоящего документа «обнаружимая аффинность» обычно означает, что связывающая способность между биомолекулой и ее мишенью, выраженная значением KD, EC50 или IC50, составляет не более чем приблизительно 10-5 М, или ниже. Аффинность связывания, выраженная значением KD, EC50 или IC50, превышающим 10-5 M, как правило, уже не поддается измерению с помощью обычных методов, таких как ELISA и SPR, и поэтому имеет второстепенное значение.
[0018] Следует отметить, что образование комплекса между биомолекулой согласно изобретению и ее мишенью зависит от многих различных факторов, таких как концентрации соответствующей мишени, присутствие конкурентов, рН и ионная сила используемой буферной системы, экспериментальный метод, используемый для определения аффинности связывания (например, флуоресцентное титрование, конкурентный ELISA (также называемый конкурирующим ELISA) и поверхностный плазмонный резонанс), и даже математический алгоритм, используемый для оценки экспериментальных данных. Следовательно, специалисту ясно, что аффинность связывания, выраженная значением KD, EC50 или IC50, может варьироваться в пределах определенного экспериментального диапазона, в зависимости от используемого метода и условий эксперимента. Это означает, что может иметь место небольшое отклонение измеренных значений KD, EC50 или IC50 или диапазон допустимых значений в зависимости, например, от того, были ли такие значения определены с помощью ELISA (включая прямой или конкурентный ELISA), SPR, или другим методом.
[0019] В контексте настоящего документа термины «специфичный к», «специфичное связывание», «специфически связывать» или «специфичность связывания» относятся к способности биомолекулы различать желаемую мишень (например, CD137 и PD-L1) и одну или более референсных мишеней (например, клеточный рецептор липокалина, ассоциированного с желатиназой нейтрофилов). Подразумевается, что такая специфичность является не абсолютным, а относительным свойством и может быть определена, например, согласно SPR, вестерн-блоттингу, ELISA, флуоресцентно-активированной сортировке клеток (FACS), радиоиммуноанализу (RIA), электрохемилюминесценции (ECL), иммунорадиометрическому анализу (IRMA), иммуногистохимии (IHC) и пептидному сканированию.
[0020] При использовании в настоящем документе в контексте слитого белка согласно настоящему изобретению, который связывается с CD137 и PD-L1, термин «специфичный к», «специфическое связывание», «специфически связывать» или «специфичность связывания» означает, что слитый белок связывается, реагирует с или направлен против CD137 и PD-L1, как описано в настоящем документе, но по существу не связывает другой белок. Термин «другой белок» включает любые белки, которые не являются CD137 или PD-L1, или белками, родственными CD137 или PD-L1 или гомологичными им. Однако CD137 или PD-L1 видов, отличных от человека, и фрагменты и/или варианты CD137 или PD-L1 не исключаются термином «другой белок». Термин «по существу не связывает» означает, что слитые белки согласно настоящему изобретению связывают другой белок с более низкой аффинностью связывания, чем CD137 и/или PD-L1, т. е. проявляют перекрестную реактивность менее 30%, предпочтительно 20%, более предпочтительно 10%, особенно предпочтительно менее 9, 8, 7, 6 или 5%. Способность слитого белка специфически реагировать, как определено выше в настоящем документе, может быть легко проверена, среди прочего, путем сравнения реакции слитого белка согласно настоящему изобретению с CD137 и/или PD-L1 и реакции указанного слитого белка с другим белком(ами).
[0021] В контексте настоящего документа термин «липокалин» относится к мономерному белку массой приблизительно 18-20 кДа, имеющему супервторичную структурную область цилиндрического β-складчатого листа, содержащую множество β-цепей (предпочтительно восемь β-цепей, обозначенных как А-Н), соединенных попарно множеством петель (предпочтительно четырьмя) на одном конце, содержащих, таким образом, лиганд-связывающий карман и образующих вход в лиганд-связывающий карман. Предпочтительно петли, содержащие лиганд-связывающий карман, используемые в настоящем изобретении, представляют собой петли, соединяющие открытые концы β-цепей А и В, С и D, Е и F, и G и Н, и обозначенные как петли AB, CD, EF и GH. Точно установлено, что разнообразие указанных петель в составе в остальном жесткого каркаса липокалина приводит к возникновению различных механизмов связывания у членов семейства липокалинов, каждый из которых способен вмещать мишени различных размеров, формы и химического характера (обзор приведен, например, в Skerra, Biochim Biophys Acta, 2000, Flower et al., Biochim Biophys Acta, 2000, Flower, Biochem J, 1996). Согласно имеющимся сведениям семейство белков липокалинов естественным образом эволюционировало, чтобы связывать широкий спектр лигандов, характеризуясь необычно низкими уровнями общей консервативности последовательностей (часто с идентичностью последовательностей менее 20%), но сохраняя при этом высококонсервативный общий характер фолдинга. Соответствие между положениями в различных липокалинах также хорошо известно специалистам в данной области техники (см., например, патент США № 7,250,297). Белки, попадающие под определение «липокалин» в контексте настоящего документа, включают, не ограничиваясь перечисленным, человеческие липокалины, включая липокалин слезной жидкости (Tlc, Lcn1), липокалин-2 (Lcn2) или липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), аполипопротеин D (ApoD), аполипопротеин M, α1-кислый гликопротеин 1, α1-кислый гликопротеин 2, α1-микроглобулин, компонент комплемента 8γ, ретинол-связывающий белок (RBP), эпидидимальный белок, связывающий ретиноевую кислоту, гликоделин, одорант-связывающий белок IIa, одорант-связывающий белок IIb, липокалин-15 (Lcn15) и простагландин D-синтазу.
[0022] В контексте настоящего документа, если не указано иное, «липокалин слезной жидкости» относится к человеческому липокалину слезной жидкости (hTlc) и также относится к зрелому человеческому липокалину слезной жидкости. Термин «зрелый», при использовании для характеристики белка, означает белок, по существу не содержащий сигнального пептида. «Зрелый hTlc» в настоящем изобретении относится к зрелой форме человеческого липокалина слезной жидкости, не содержащей сигнального пептида. Зрелый hTlc описывается остатками 19-176 последовательности, депонированной в банке данных SWISS-PROT под регистрационным номером P31025, и его аминокислотная последовательность представлена в SEQ ID NO: 1.
[0023] В контексте настоящего документа «липокалин-2» или «липокалин, ассоциированный с желатиназой нейтрофилов» относится к человеческому липокалину-2 (hLcn2) или человеческому липокалину, ассоциированному с желатиназой нейтрофилов (hNGAL), и также относится к зрелому человеческому липокалину-2 или зрелому человеческому липокалину, ассоциированному с желатиназой нейтрофилов. Термин «зрелый», при использовании для характеристики белка, означает белок, по существу не содержащий сигнального пептида. «Зрелый hNGAL» в настоящем изобретении относится к зрелой форме человеческого липокалина, ассоциированного с желатиназой нейтрофилов, не содержащей сигнального пептида. Зрелый hNGAL описывается остатками 21-198 последовательности, депонированной в банке данных SWISS-PROT под регистрационным номером P80188, и его аминокислотная последовательность представлена в SEQ ID NO: 2.
[0024] В контексте настоящего документа «нативная последовательность» относится к белку или полипептиду, имеющему последовательность, которая встречается в природе, или имеющему последовательность дикого типа, независимо от способа его получения. Такой белок или полипептид с нативной последовательностью может быть выделен из природных источников или может быть получен с помощью других средств, например, рекомбинантными или синтетическими методами.
[0025] «Липокалин с нативной последовательностью» относится к липокалину, имеющему ту же аминокислотную последовательность, что и соответствующий полипептид природного происхождения. Таким образом, липокалин с нативной последовательностью может иметь аминокислотную последовательность соответствующего природного липокалина (дикого типа) из любого организма, в частности, млекопитающего. Термин «нативная последовательность» применительно к липокалину, в частности, охватывает природные укороченные или секретируемые формы липокалина, природные вариантные формы, такие как альтернативно сплайсированные формы, и природные аллельные варианты липокалина. Термины «липокалин с нативной последовательностью» и «липокалин дикого типа» используются в настоящем документе взаимозаменяемо.
[0026] В контексте настоящего документа «мутеин», «мутированный» фрагмент (будь то фрагмент белка или нуклеиновой кислоты) или «мутант» относится к обмену, делеции или вставке одной или нескольких аминокислот или нуклеотидов по сравнению с природным белком или нуклеиновой кислотой (дикого типа). Указанный термин также включает фрагменты мутеина, как описано в настоящем документе. Настоящее изобретение явным образом охватывает мутеины липокалина, как описано в настоящем документе, имеющие супервторичную структурную область цилиндрического β-складчатого листа, содержащую восемь β-цепей, соединенных попарно четырьмя петлями на одном конце, содержащими, таким образом, лиганд-связывающий карман и образующими вход в лиганд-связывающий карман, где по меньшей мере одна аминокислота каждой из по меньшей мере трех из четырех указанных петель была мутирована по сравнению с липокалином с нативной последовательностью. Мутеины липокалина согласно настоящему изобретению предпочтительно обладают функцией связывания CD137, как описано в настоящем документе.
[0027] В контексте настоящего документа термин «фрагмент» применительно к мутеинам липокалина согласно изобретению относится к белкам или полипептидам, полученным из полноразмерного зрелого hTlc или hNGAL, или мутеинам липокалина, усеченным с N-конца и/или C-конца, т. е. лишенным по меньшей мере одной из N-концевых и/или C-концевых аминокислот. Такие фрагменты могут включать по меньшей мере 10 или более, например, 20 или 30 или более последовательно расположенных аминокислот первичной последовательности зрелого hTlc или hNGAL или мутеина липокалина, из которого они получены, и обычно являются обнаружимыми в иммуноанализе на зрелый hTlc или hNGAL. В таком фрагменте может отсутствовать до 2, до 3, до 4, до 5, до 10, до 15, до 20, до 25 или до 30 (включая все числа между ними) N-концевых и/или C-концевых аминокислот. В качестве иллюстративного примера, в таком фрагменте может отсутствовать одна, две, три или четыре N-концевые (His-His-Leu-Leu) и/или одна или две C-концевые аминокислоты (Ser-Asp) зрелого hTlc. Подразумевается, что фрагмент предпочтительно представляет собой функциональный фрагмент зрелого hTlc или hNGAL или мутеина липокалина, из которого он получен, что означает, что он предпочтительно сохраняет специфичность связывания, предпочтительно с CD137, зрелых hTlc/hNGAL или мутеина липокалина, из которого он получен. В качестве иллюстративного примера такой функциональный фрагмент может содержать по меньшей мере аминокислоты в положениях 5-153, 5-150, 9-148, 12-140, 20-135 или 26-133, соответствующих линейной полипептидной последовательности зрелого hTlc. В качестве еще одного иллюстративного примера такой функциональный фрагмент может содержать по меньшей мере аминокислоты в положениях 13-157, 15-150, 18-141, 20-134, 25-134 или 28-134, соответствующих линейной полипептидной последовательности зрелого hNGAL.
[0028] «Фрагмент» применительно к соответствующей мишени CD137 или PD-L1 слитого белка согласно изобретению относится к усеченному с N-конца и/или C-конца CD137 или PD-L1, или белковым доменам CD137 или PD-L1. Фрагменты CD137 или фрагменты PD-L1, как описано в настоящем документе, сохраняют способность полноразмерного CD137 или PD-L1 распознаваться и/или быть связанным слитым белком согласно изобретению. В качестве иллюстративного примера фрагмент может представлять собой внеклеточный домен CD137 или PD-L1. В качестве иллюстративного примера такой внеклеточный домен может содержать аминокислоты внеклеточных субдоменов CD137, такие как отдельные или комбинированные аминокислотные последовательности домена 1 (остатки 24-45 UniProt Q07011), домена 2 (остатки 46-86), домена 3 (87-118) и домена 4 (остатки 119-159). В качестве еще одного иллюстративного примера такой внеклеточный домен может содержать аминокислотные остатки 19-238 UniProt Q9NZQ7.
[0029] В контексте настоящего документа термин «вариант» относится к производным белка или полипептида, которые включают мутации, например, путем замен, делеций, вставок и/или химических модификаций аминокислотной последовательности или нуклеотидной последовательности. В некоторых вариантах осуществления такие мутации и/или химические модификации не снижают функциональность белка или пептида. Такие замены могут быть консервативными, т. е. аминокислотный остаток может быть заменен химически схожим аминокислотным остатком. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин, треонин и валин; 2) аспарагиновая кислота, глутаминовая кислота, глутамин, аспарагин и гистидин; 3) аргинин, лизин, глутамин, аспарагин и гистидин; 4) изолейцин, лейцин, метионин, валин, аланин, фенилаланин, треонин и пролин; и 5) изолейцин, лейцин, метионин, фенилаланин, тирозин и триптофан. Такие варианты включают белки или полипептиды, в которых одна или более аминокислот были заменены их соответствующими D-стереоизомерами или аминокислотами, отличными от 20 природных аминокислот, такими как, например, орнитин, гидроксипролин, цитруллин, гомосерин, гидроксилизин, норвалин. Такие варианты также включают, например, белки или полипептиды, в которых добавлены или удалены один или более аминокислотных остатков на N- и/или C-конце. Как правило, вариант обладает по меньшей мере приблизительно 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95% или по меньшей мере приблизительно 98% идентичностью аминокислотной последовательности с белком или полипептидом с нативной последовательностью. Вариант предпочтительно сохраняет биологическую активность, например связывание с той же мишенью, белка или полипептида, из которого он получен.
[0030] Термин «вариант» в контексте настоящего документа применительно к соответствующему белку лиганда CD137 или PD-L1 слитого белка согласно изобретению относится к CD137 или PD-L1 или его фрагменту, соответственно, имеющему одну или более, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 40, 50, 60, 70, 80 или более замен, делеций и/или вставок аминокислот по сравнению с нативной последовательностью CD137 или PD-L1 (CD137 или PD-L1 дикого типа), например, CD137, депонированным как UniProt Q07011, или PD-L1, депонированным как UniProt Q9NZQ7, как описано в настоящем документе. Вариант CD137 или вариант PD-L1, соответственно, предпочтительно обладает по меньшей мере 50%, 60%, 70%, 80%, 85%, 90% или 95% идентичностью аминокислотной последовательности CD137 или PD-L1 дикого типа. Вариант CD137 или вариант PD-L1, как описано в настоящем документе, сохраняет способность связывать слитые белки, специфичные к CD137 и PD-L1, раскрытые в настоящем изобретении.
[0031] Термин «вариант», используемый в настоящем документе применительно к мутеину липокалина, относится к мутеину липокалина или его фрагменту согласно изобретению, где последовательность имеет мутации, включая замены, делеции и вставки, и/или химические модификации. Описанный в настоящем документе вариант мутеина липокалина сохраняет биологическую активность, например, связывание с CD137, мутеина липокалина, из которого он получен. Как правило, вариант мутеина липокаина обладает по меньшей мере приблизительно 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 98% идентичностью аминокислотной последовательности с мутеином липокалина, из которого он получен.
[0032] В контексте настоящего документа термин «мутагенез» относится к введению мутаций в полинуклеотидную или аминокислотную последовательность. Мутации предпочтительно вводят в таких экспериментальных условиях, что природная аминокислота в данном положении последовательности белка или полипептида может быть изменена, например, заменена, по меньшей мере одной аминокислотой. Термин «мутагенез» также включает (дополнительную) модификацию длины сегментов последовательности путем делеции или вставки одной или более аминокислот. Таким образом, в рамках изобретения, например, одна аминокислота в выбранном положении последовательности может быть заменена отрезком из трех аминокислот, что приводит к добавлению двух аминокислотных остатков по сравнению с длиной соответствующего сегмента нативной аминокислотной последовательности белка или полипептида. Такая вставка или делеция могут быть введены независимо друг от друга в любой из сегментов последовательности, которые могут быть подвергнуты мутагенезу в изобретении. В одном иллюстративном варианте осуществления настоящего изобретения вставка может быть введена в сегмент аминокислотной последовательности, соответствующий петле AB липокалина с нативной последовательностью (см. публикацию международной патентной заявки WO 2005/019256, полностью включенную в настоящий документ посредством ссылки).
[0033] В контексте настоящего документа термин «случайный мутагенез» означает, что в определенном положении последовательности нет заранее определенной мутации (изменения аминокислоты), но что по меньшей мере две аминокислоты с определенной вероятностью могут быть включены в заранее определенное положение последовательности во время мутагенеза.
[0034] В контексте настоящего документа термин «идентичность последовательностей» или «идентичность» означает свойство последовательностей, которое является мерой их сходства или родства. Термин «идентичность последовательностей» или «идентичность» в контексте настоящего документа означает процент попарно идентичных остатков - после (гомологичного) выравнивания последовательности белка или полипептида согласно изобретению с рассматриваемой последовательностью - относительно количества остатков в более длинной из этих двух последовательностей. Идентичность последовательностей измеряют путем деления количества идентичных аминокислотных остатков на общее количество остатков и умножения результата на 100.
[0035] В контексте настоящего документа термин «гомология последовательностей» или «гомология» имеет свое обычное значение, и гомологичная аминокислота включает идентичные аминокислоты, а также аминокислоты, которые считаются консервативными заменами, в эквивалентных положениях в линейной аминокислотной последовательности белка или полипептида согласно изобретению (например, любых слитых белках или мутеинах липокалина согласно изобретению).
[0036] Специалисту известны доступные компьютерные программы, например, BLAST (Altschul et al., Nucleic Acids Res, 1997), BLAST2 (Altschul et al., J Mol Biol, 1990) и Смита-Ватермана (Smith and Waterman, J Mol Biol, 1981), для определения гомологии последовательностей или идентичности последовательностей с использованием стандартных параметров. Процент гомологии последовательностей или идентичности последовательностей может, например, быть определен в настоящем документе с использованием программы BLASTP, версия 2.2.5 (16 ноября 2002 г.; (Altschul et al., Nucleic Acids Res, 1997). В этом варианте осуществления процент гомологии основан на выравнивании целых последовательностей белка или полипептида (матрица: BLOSUM 62; вес гэпов: 11,1; пороговое значение установлено на 10-3), включая пропептидные последовательности, предпочтительно с использованием белкового каркаса дикого типа в качестве эталона при попарном сравнении. Он рассчитывается как процент числа «положительных» (гомологичных аминокислот), указанных в качестве результата в выходных данных программы BLASTP, деленный на общее количество аминокислот, выбранных программой для выравнивания.
[0037] В частности, чтобы определить, отличается ли аминокислотный остаток в аминокислотной последовательности мутеина липокалина от липокалина дикого типа, соответствующий определенному положению в аминокислотной последовательности липокалина дикого типа, специалист может использовать средства и методы, хорошо известные в данной области техники, например, выравнивания, вручную или с использованием компьютерных программ, таких как BLAST 2.0, что расшифровывается как средство поиска основного локального выравнивания, или ClustalW, или любой другой подходящей программы, которая подходит для генерации выравниваний последовательностей. Соответственно, последовательность липокалина дикого типа может служить «рассматриваемой последовательностью» или «референсной последовательностью», в то время как аминокислотная последовательность мутеина липокалина, отличная от липокалина дикого типа, описанного в настоящем документе, служит «искомой последовательностью». Термины «последовательность дикого типа», «референсная последовательность» и «рассматриваемая последовательность» используются в настоящем документе взаимозаменяемо. Предпочтительной последовательностью липокалина дикого типа является последовательность hTLc, представленная в SEQ ID NO: 1, или hNGAL, представленная в SEQ ID NO: 2.
[0038] «Гэпы» представляют собой пропуски в выравнивании, которые являются результатом добавлений или делеций аминокислот. Таким образом, две копии одной и той же последовательности имеют 100% идентичность, но последовательности, которые не обладают столь высокой консервативностью и имеют делеции, добавления или замены, могут иметь более низкую степень идентичности.
[0039] В контексте настоящего документа термин «положение» означает положение либо аминокислоты в аминокислотной последовательности, показанной в настоящем документе, либо положение нуклеотида в последовательности нуклеиновой кислоты, показанной в настоящем документе. Следует понимать, что при использовании термина «соответствует» или «соответствующий», в настоящем документе в контексте положений аминокислотной последовательности одного или более мутеинов липокалина соответствующее положение определяется не только количеством предшествующих нуклеотидов или аминокислот. Соответственно, абсолютное положение данной аминокислоты согласно изобретению может варьироваться относительно соответствующего положения из-за делеций или добавлений аминокислот в других местах липокалина (мутантного или дикого типа). Аналогичным образом, абсолютное положение данного нуклеотида согласно настоящему изобретению может отличаться от соответствующего положения из-за делеций или дополнительных нуклеотидов в других местах в 5'-нетранслируемой области (UTR) мутеина липокалина или липокалина дикого типа, включая промотор и/или любые другие регуляторные последовательности или ген (включая экзоны и интроны).
[0040] «Соответствующее положение» согласно изобретению может представлять собой положение последовательности, которое совпадает с положением последовательности, которому оно соответствует при попарном или множественном выравнивании последовательностей согласно настоящему изобретению. Предпочтительно подразумевается, что для «соответствующего положения» согласно изобретению абсолютные положения нуклеотидов или аминокислот могут отличаться от соседних нуклеотидов или аминокислот, но указанные соседние нуклеотиды или аминокислоты, которые могли быть заменены, удалены, или добавлены, могут охватываться одним или более «соответствующими положениями».
[0041] Кроме того, для соответствующего положения в мутеине липокалина на основе референсной последовательности согласно изобретению предпочтительно подразумевается, что положения нуклеотидов или аминокислот мутеина липокалина могут структурно соответствовать положениям в других местах референсного липокалина (липокалина дикого типа) или другого мутеина липокалина, даже если они могут отличаться по абсолютным номерам положений, что ясно специалистам с учетом высококонсервативного общего характера фолдинга, присущего липокалинам.
[0042] Используемые здесь взаимозаменяемо, термины «конъюгат», «конъюгация», «гибридизовать», «слияние» или «связанный» относятся к соединению вместе двух или более субъединиц посредством всех форм ковалентного или нековалентного связывания, включая, помимо прочего, генетическое слияние, химическую конъюгацию, связывание с помощью линкера или сшивающего агента и нековалентную ассоциацию.
[0043] В контексте настоящего документа термин «слитый полипептид» или «слитый белок» относится к полипептиду или белку, содержащему две или более субъединиц. В некоторых вариантах осуществления слитый белок, как описано в настоящем документе, содержит две или более субъединиц, по меньшей мере одна из которых способна специфически связываться с CD137, а другая субъединица способна специфически связываться с PD-L1. Внутри слитого белка эти субъединицы могут быть связаны ковалентной или нековалентной связью. Предпочтительно, слитый белок представляет собой трансляционное слияние двух или более субъединиц. Трансляционное слияние может быть произведено путем генетической модификации кодирующей последовательности для одной субъединицы в рамке считывания с кодирующей последовательностью другой субъединицы. Обе субъединицы могут быть разделены нуклеотидной последовательностью, кодирующей линкер. Однако субъединицы слитого белка согласно настоящему изобретению также могут быть связаны посредством химической конъюгации. Субъединицы, образующие слитый белок, как правило, связаны друг с другом путем связывания C-конца одной субъединицы с N-концом другой субъединицы, или C-конца одной субъединицы с C-концом другой субъединицы, или N-конца одной субъединицы с N-концом другой субъединицы, или N-конца одной субъединицы с С-концом другой субъединицы. Субъединицы слитого белка могут быть связаны в любом порядке и могут включать более одной из любых составляющих субъединиц. Если одна или более субъединиц являются частью белка (комплекса), который состоит из более чем одной полипептидной цепи, термин «слитый белок» может также относиться к белку, содержащему слитые последовательности и все другие полипептидные цепи (цепь) белка (комплекса). В качестве иллюстративного примера, когда полноразмерный иммуноглобулин слит с мутеином липокалина посредством тяжелой или легкой цепи иммуноглобулина, термин «слитый белок» может относиться к одной полипептидной цепи, содержащей мутеин липокалина и тяжелую или легкую цепь иммуноглобулина. Термин «слитый белок» может также относиться ко всему иммуноглобулину (как легкой, так и тяжелой цепям) и липокалину мутеина, слитому с одной или обеими из его тяжелой и/или легкой цепей.
[0044] В контексте настоящего документа термин «субъединица» слитого белка, описанного в настоящем документе, относится к одному белку или отдельной полипептидной цепи, которая сама по себе может образовывать стабильную свернутую структуру и определять уникальную функцию обеспечения связывающего мотива к мишени. В некоторых вариантах осуществления предпочтительной субъединицей согласно изобретению является мутеин липокалина. В некоторых других вариантах осуществления предпочтительной субъединицей согласно изобретению является полноразмерный иммуноглобулин или его антигенсвязывающий домен.
[0045] «Линкер», который может содержаться в слитом белке согласно настоящему изобретению, объединяет две или более субъединиц слитого белка, как описано в настоящем документе. Связь может быть ковалентной или нековалентной. Предпочтительная ковалентная связь образована посредством пептидной связи, такой как пептидная связь между аминокислотами. Предпочтительным линкером является пептидный линкер. Соответственно, в предпочтительном варианте осуществления указанный линкер содержит одну или более аминокислот, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот. В настоящем документе описаны предпочтительные пептидные линкеры, включая глицин-сериновые (GS) линкеры, гликозилированные GS линкеры и пролин-аланин-сериновые полимерные (PAS) линкеры. В некоторых предпочтительных вариантах осуществления для соединения вместе субъединиц слитого белка используют GS линкер, представляющий собой (G4S)3, как описано в SEQ ID NO: 13. Другие предпочтительные линкеры включают химические линкеры.
[0046] В контексте настоящего документа термин «альбумин» включает все альбумины млекопитающих, такие как человеческий сывороточный альбумин, или бычий сывороточный альбумин, или крысиный сывороточный альбумин.
[0047] В контексте настоящего документа термин «органическая молекула» или «малая органическая молекула» обозначает органическую молекулу, содержащую по меньшей мере два атома углерода, но предпочтительно не более 7 или 12 вращающихся углеродных связей, имеющую молекулярную массу в диапазоне от 100 до 2000 дальтон, предпочтительно от 100 до 1000 дальтон, и необязательно включающую один или два атома металла.
[0048] «Образец» определен как биологический образец, взятый у любого субъекта. Биологические образцы включают, не ограничиваясь перечисленным, кровь, сыворотку, мочу, фекалии, сперму или ткань, включая опухолевую ткань.
[0049] «Субъект» представляет собой позвоночное животное, предпочтительно млекопитающее, более предпочтительно человека. Термин «млекопитающее» используется в настоящем документе для обозначения любого животного, классифицируемого как млекопитающее, включая, не ограничиваясь перечисленным, например, людей, домашних и сельскохозяйственных животных, а также животных из зоопарков, животных для спорта или домашних питомцев, таких как овцы, собаки, лошади, кошки, коровы, крысы, свиньи, обезьяны, такие как яванские макаки. Предпочтительно «млекопитающее» в контексте настоящего документа представляет собой человека.
[0050] «Эффективное количество» представляет собой количество, достаточное для получения полезных или желаемых результатов. Эффективное количество можно вводить за одно или несколько отдельных введений или доз.
[0051] В контексте настоящего документа «антитело» включает целые антитела или любой их антигенсвязывающий фрагмент (т. е. «антигенсвязывающую часть») или одну их цепь. Целое антитело относится к гликопротеину, содержащему по меньшей мере две тяжелые цепи (HC) и две легкие цепи (LC), соединенные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельного домена тяжелой цепи (VH или HCVR) и константной области тяжелой цепи (CH). Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельного домена легкой цепи (VL или LCVR) и константной области легкой цепи (CL). Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), перемежающиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных в следующем порядке от аминоконца к карбоксиконцу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном (например, PD-L1). Константные области антител могут необязательно опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
[0052] В контексте настоящего документа «антигенсвязывающий фрагмент» антитела относится к одному или более фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, PD-L1). Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающий фрагмент» антитела, включают (i) фрагмент Fab, состоящий из доменов VH, VL, CL и CH1; (ii) фрагмент F(ab′)2, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области; (iii) фрагмент Fab′, состоящий из доменов VH, VL, CL и CH1 и области между доменами CH1 и CH2; (iv) фрагмент Fd, состоящий из доменов VH и CH1; (v) одноцепочечный фрагмент Fv, состоящий из доменов VH и VL одного плеча антитела, (vi) фрагмент dAb (Ward et al., Nature, 1989), состоящий из домена VH; и (vii) выделенную определяющую комплементарность область (CDR) или комбинацию двух или более выделенных CDR, которые необязательно могут быть соединены синтетическим линкером; (VIII) «диатело», содержащее VH и VL, соединенные в одной и той же полипептидной цепи с помощью короткого линкера (см., например, патентные документы EP 404,097; WO 93/11161; и Holliger et al., Proc Natl Acad Sci U S A, 1993); (ix) «фрагмент доменного антитела», содержащий только VH или VL, где в некоторых случаях ковалентно соединены две или более областей VH.
[0053] Антитела могут быть поликлональными или моноклональными; ксеногенными, аллогенными или сингенными; или их модифицированными формами (например, гуманизированными, химерными или полиспецифическими). Антитела также могут быть полностью человеческими.
[0054] В контексте настоящего документа «каркас» или «FR» относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (CDR).
[0055] «Область кристаллизующегося фрагмента» или «Fc-область» относится к C-концевой области тяжелой цепи иммуноглобулина, включая Fc-области с нативной последовательностью и вариантные области Fc. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи человеческого IgG обычно определена как лежащая от аминокислотного остатка в положении Cys226, или от Pro230, до его карбоксильного конца, где нумерация соответствует индексу EU Кабат (Johnson and Wu, Nucleic Acids Res, 2000). С-концевой лизин (остаток 447 согласно индексу EU Кабат) Fc-области может быть удален, например, во время продуцирования или очистки антитела или путем генетической модификации нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может включать популяции антител с полностью удаленными остатками K447, популяции антител, в которых не удалены остатки K447, и популяции антител, содержащие смесь антител с остатком K447 и без него. Подходящие Fc-области с нативной последовательностью для применения в антителах согласно изобретению включают человеческий IgG1, IgG2 (IgG2A, IgG2B), IgG3 и IgG4.
[0056] «Fc-рецептор» или «FcR» относится к рецептору, который связывается с Fc-областью антитела.
[0057] В контексте настоящего документа «выделенное антитело» относится к антителу, по существу свободному от его естественного окружения. Например, выделенное антитело практически не содержит клеточного материала и других белков из клеточного или тканевого источника, из которого оно получено. «Выделенное антитело» также относится к антителу, которое по существу не содержит других антител, обладающих другой антигенной специфичностью. В данном случае выделенное антитело, которое специфически связывает PD-L1, по существу не содержит антител, специфически связывающих антигены, отличные от PD-L1. Однако выделенное антитело, которое специфически связывает PD-L1, может иметь перекрестную реактивность с другими антигенами, такими как молекулы PD-L1 других видов.
[0058] В контексте настоящего документа «моноклональное антитело» относится к препарату молекул антитела с одним типом молекулы в составе. Композиция моноклонального антитела демонстрирует единственную специфичность связывания и аффинность к определенному эпитопу.
[0059] В контексте настоящего документа «гуманизированное антитело» относится к антителу, состоящему из CDR антител, полученных от млекопитающих, отличных от человека, и области FR и константной области человеческого антитела или полученных из человеческого антитела. В некоторых вариантах осуществления гуманизированное антитело содержит вариабельный домен, который имеет аминокислотную последовательность вариабельной области, которая, в целом, ближе к человеческой, чем к другим видам, по оценке с использованием инструмента DomainGapAlign от Immunogenetics Information System (IMGT), как описано Ehrenmann et al. (2010). В некоторых вариантах осуществления гуманизированное антитело может быть использовано в качестве эффективного компонента терапевтического агента из-за пониженной антигенности. В контексте настоящего документа термин «терапевтический агент» или «терапевтически активный агент» относится к агенту, который является терапевтически пригодным. Терапевтический агент может представлять собой любой агент для предупреждения, облегчения или лечения заболеваний, физиологического состояния, симптома или для их оценки или диагностики.
[0060] В контексте настоящего документа «человеческое антитело» включает антитела, имеющие вариабельные области, в которых как каркасная область, так и области CDR получены из последовательностей иммуноглобулина зародышевой линии человека. Кроме того, если антитело содержит константную область, эта константная область также получена из последовательностей иммуноглобулина зародышевой линии человека. Человеческие антитела согласно изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo). Однако термин «человеческое антитело» в контексте настоящего документа не подразумевает антитела, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающих, такого как мышь, были привиты на человеческие каркасные последовательности.
III. Описание графических материалов
[0061] Фиг. 1: представляет собой обзор конструкции иллюстративных слитых белков, описанных в данной заявке, которые являются биспецифическими для мишеней CD137 и PD-L1. Иллюстративные слитые белки были созданы на основе антитела, специфичного к PD-L1 (например, антитела, тяжелые цепи которого представлены SEQ ID NO: 86, или содержат вариабельный домен тяжелой цепи SEQ ID NO: 77, или содержат последовательности CDR GFSLSNYD (HCDR1, SEQ ID NO: 60), IWTGGAT (HCDR2, SEQ ID NO: 61) и VRDSNYRYDEPFTY (HCDR3; SEQ ID NO: 62), и легкие цепи представлены SEQ ID NO: 87, или содержат вариабельный домен тяжелой цепи SEQ ID NO: 82, или содержат последовательности CDR QSIGTN (LCDR1, SEQ ID NO: 63), YAS (LCDR2) и QQSNSWPYT (LCDR3; SEQ ID NO: 64)), и одного или более мутеинов липокалина, специфичных к CD137 (например, мутеина липокалина с SEQ ID NO: 42). Один или более мутеинов липокалина были генетически слиты с C- и/или N-концом тяжелой цепи либо легкой цепи PD-L1-специфического антитела, как показано на фиг. 1A-1I, в результате чего были получены слитые белки, например, SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91. Полученные слитые белки могут быть бивалентными к CD137 (например, как продемонстрировано на фиг. 1A-1D), или четырехвалентными к CD137 (например, как продемонстрировано на фиг. 1E-1H), или иметь даже более высокую валентность к CD137 (например, как продемонстрировано на фиг. 1I). Дополнительные моноспецифические слитые белки были получены путем слияния одного или более CD137-специфических мутеинов липокалина (например, как продемонстрировано на фиг. 1J-1K) с С-концом Fc-области антитела, полученного, как описано в настоящем документе, посредством пептидного линкера. Полученные моноспецифические слитые белки представлены, например, в SEQ ID NO: 88 и SEQ ID NO: 89.
[0062] Фиг. 2: демонстрирует результаты экспериментов ELISA, в которых связывание с PD-L1 или CD137 иллюстративных слитых белков определяли, как описано в примере 4. PD-L1 или CD137 (с C-концевой меткой His или Fc) наносили на планшет для микротитрования и титровали тестируемые агенты, начиная с наивысшей концентрации 100 нМ. Изучаемые связанные агенты детектировали с помощью антител к человеческому IgG Fc-HRP или к NGAL-HRP, соответственно. Данные аппроксимировали моделью связывания 1:1 со значением EC50 и максимальным сигналом в качестве свободных параметров, и угловым коэффициентом, который был установлен равным единице. Полученные значения EC50 представлены в таблице 4.
[0063] Фиг. 3: иллюстрирует результаты эксперимента ELISA, в котором определяли способность иллюстративных слитых белков одновременно связывать обе мишени, PD-L1 и CD137, как описано в примере 5. Рекомбинантный huPD-L1-His или huCD137-His наносили на планшет для микротитрования с последующим титрованием слитых белков, начиная с наивысшей концентрации 100 нМ. Затем добавляли постоянную концентрацию биотинилированного huCD137-His или биотинилированного huPD-L1-His, соответственно, которые детектировали с помощью ExtrAvidin-пероксидазы.
[0064] Фиг. 4: демонстрирует результаты оценки связывания с мишенью слитых белков с помощью проточной цитометрии с использованием клеток Flp-In-CHO, экспрессирующих CD137 человека или яванского макака (фиг. 4A-4B), а также PD-L1 человека или яванского макака (фиг. 4C-4D), как описано в примере 6. Связывание не наблюдалось при использовании ложно трансфицированных клеток Flp-In-CHO (фиг. 4E). Средние геометрические значения интенсивности флуоресценции использовали для расчета значений EC50 с использованием нелинейной регрессии (общая нижняя асимптота, наклон =1). Значения EC50 представлены в таблице 6.
[0065] Фиг. 5: демонстрирует связывание слитых белков с PD-L1-положительными опухолевыми клетками, оцененное с помощью проточной цитометрии путем инкубации клеток РКО и слитых белков, как описано в примере 7.
[0066] Фиг. 6: демонстрирует примеры эксперимента на основе SPR с мультисвязыванием, предназначенного для исследования того, затрудняет ли связывание CD137L с CD137 взаимодействия слитого белка с CD137, как описано в примере 8. Это оценивают путем создания комплекса huCD137 (C-концевое слияние с Fc) и huCD137L (с C-концевой His-меткой) на сенсорном чипе SPR и проверки того, могут ли слитые белки по-прежнему связывать комплекс huCD137 и CD137L. Для сравнения, huCD137 в отсутствие huCD137L также инкубируют с тестируемыми слитыми белками. Кривая SPR для связывания соответствующего слитого белка только с huCD137 отмечена стрелкой со сплошным стержнем. Кривая SPR для связывания соответствующего слитого белка с huCD137, насыщенного huCD137L, отмечена стрелкой с пунктирным стержнем. В качестве контролей использовали холостые введения без слитых белков. Эксперимент показывает, что все протестированные слитые белки способны связывать CD137 в присутствии CD137L.
[0067] Фиг. 7: демонстрирует, что слитые белки конкурируют с PD-L1 за связывание с PD-1, как проиллюстрировано в исследованиях методом конкурентного ELISA, как описано в примере 9. Постоянную концентрацию huPD-1-His наносили на планшет для микротитрования с последующим добавлением смеси тестируемых молекул в различных концентрациях и индикатора huPD-L1-Fc в фиксированной концентрации. Связанный индикатор детектировали с использованием меченого HRP антитела к Fc IgG. Наблюдали дозозависимое ингибирование связывания huPD-L1-Fc с PD-1 биспецифическими слитыми белками к CD137 и PD-L1 или специфическими антителами к PD-L1.
[0068] Фиг. 8: Потенциал иллюстративных слитых белков в отношении костимуляции активации Т-клеток зависимым от мишени PD-L1 образом оценивали с использованием биоанализа с CD137. Клетки NFκB-luc2/CD137 Jurkat культивировали совместно с линией опухолевых клеток RKO, экспрессирующих PD-L1, в присутствии различных концентраций слитых белков или контролей. Через 4 часа добавляли реагент для анализа люциферазы и измеряли люминесцентные сигналы. Анализ с использованием четырехпараметрической логистической кривой был выполнен с помощью GraphPad Prism® для расчета значений EC50 (см. таблицу 9). Слитые белки костимулируют активацию Т-клеток только в присутствии PD-L1 (фиг. 8A и 8C), но не в отсутствие PD-L1 (фиг. 8B и 8D). Напротив, референсное mAb к CD137 (SEQ ID NO: 28 и 29) демонстрирует аналогичную активацию в присутствии и в отсутствие PD-L1-положительных клеток RKO.
[0069] Фиг. 9: демонстрирует результаты иллюстративного эксперимента, в котором была исследована способность выбранных слитых белков индуцировать активацию Т-клеток. Антитела к PD-L1, включая соответствующее антитело к PD-L1-строительный блок, CD137-связывающие мутеины липокалина в виде слияний с Fc и референсное антитело анти-CD137, тестировали по отдельности и в комбинации в виде коктейля анти-PD-L1/анти-CD137. В эксперименте человеческие мононуклеарные клетки периферической крови (МНПК) инкубировали со слитыми белками, антителами, слияниями мутеина липокалина с Fc, коктейлями или контролем в присутствии 1 нг/мл стафилококкового энтеротоксина B (SEB). Уровни секретируемого интерлейкина 2 (IL-2), отражающие активацию Т-клеток, определяли с помощью анализа на основе электрохемолюминесценции в качестве считываемой величины, отражающей активацию Т-клеток, и нормировали к уровням соответствующего контрольного IgG4, как описано в примере 11. Все слитые белки способны индуцировать активацию Т-клеток, и индуцируют в большей степени или по меньшей мере сопоставимо с отдельными строительными блоками или смесью референсных антител анти-PD-L1/анти-CD137.
[0070] Фиг. 10: демонстрирует способность иллюстративных слитых белков костимулировать активацию Т-клеток зависимым от мишени PD-L1 образом. Антитела к PD-L1, включая соответствующее антитело к PD-L1-строительный блок, CD137-связывающие мутеины липокалина в виде слияний с Fc и референсное антитело анти-CD137, тестировали по отдельности и в комбинации в виде коктейля анти-PD-L1/анти-CD137. Различные линии опухолевых клеток, экспрессирующие разные уровни PD-L1 (высокий: RKO; средний: HCC827; отрицательный: HepG), высевали в планшеты, покрытые антителами к человеческому CD3. Добавляли пан-T-клетки и различные концентрации слитых белков и отдельных строительных блоков и инкубировали в течение 3 дней. Уровни секретируемого IL-2 определяли с помощью анализа на основе электрохемолюминесценции, как описано в примере 12. Все слитые белки способны повышать секрецию IL-2 зависимым от PD-L1 образом.
[0071] Фиг. 11: иллюстрирует стабильность слитых белков при хранении в PBS или 25 мМ гистидина, 60 мМ NaCl, 200 мМ аргинина при рН 6 после 1-, 2-, 3- или 4-недельной инкубации при 37°C или 40°C в концентрации 1 мг/мл или 20 мг/мл. Стабильность оценивают по проценту пика мономеров в аналитической эксклюзионной хроматографии или по проценту найденных функциональных белков в количественном ELISA, как описано в примере 13.
[0072] Фиг. 12: демонстрирует способность иллюстративного слитого белка (SEQ ID NO: 90 и 87) стимулировать секрецию IL-2 в реакции смешанной культуры лимфоцитов (MLR) с CD4+ Т-клетками. Слитые белки, антитело к PD-L1-строительный блок (SEQ ID NO: 86 и 87), CD137-связывающий мутеин липокалина в виде слияния с Fc (SEQ ID NO: 89) и референсное антитело к CD137 или референсное антитело к PD-L1, по отдельности или в комбинации в виде коктейля анти-PD-L1/анти-CD137, тестировали при эквимолярных концентрациях, как описано в примере 14. Секрецию IL-2 измеряли в супернатантах спустя 6 дней инкубации с общими человеческими CD4+ Т-клетками и моноцитарными дендритными клетками (moDC) от разных здоровых доноров. Фиг. 12A иллюстрирует, что слитый белок с последовательностями SEQ ID NO: 90 и 87 показал значительное повышение секреции IL-2 по сравнению с строительным блоком по отдельности (антитело к PD-L1 с последовательностями SEQ ID NO: 86 и 87 или CD137-специфический мутеин липокалина с последовательностью SEQ ID NO: 89) и референсным антителом к PD-L1 или к CD137 (SEQ ID NO: 26 и 27 или SEQ ID NO: 28 и 29, соответственно), при эквимолярных концентрациях (эквивалентных 10 или 0,1 мкг/мл тестируемого слитого белка). Приведены данные из 8 независимых экспериментов. Фиг. 12B демонстрирует, что слитый белок с последовательностями SEQ ID NO: 90 и 87 был способен индуцировать дозозависимую секрецию IL-2 в диапазоне концентраций от 0,001 до 20 мкг/мл. Уровни IL-2, индуцированные слитым белком, были выше по сравнению с эквимолярными концентрациями коктейля из референсного антитела к PD-L1 (SEQ ID NO: 26 и 27) и референсного антитела к CD137 (SEQ ID NO: 28 и 29). Показаны данные для иллюстративного донора.
[0073] Фиг. 13: демонстрирует способность иллюстративного слитого белка (SEQ ID NO: 90 и 87) индуцировать секрецию эффекторных молекул CD8+ Т-клеток. Слитый белок культивировали с moDC и CD8+ Т-клетками от несовместимых здоровых доноров в течение 6 дней, после чего количественно определяли секрецию IL-2 и эффекторных молекул CD8+ Т-клеток в супернатантах с использованием анализа Luminex, как описано в примере 15. Слитый белок с последовательностями SEQ ID NO: 90 и 87 показал повышение секреции IL-2 и цитотоксических факторов (перфорин, гранзим B и гранзим A) при 10 мкг/мл по сравнению с референсным антителом к PD-L1 (SEQ ID NO: 26 и 27) и референсным антителом к CD137 (SEQ ID NO: 28 и 29), при использовании по отдельности или в виде коктейля.
[0074] Фиг. 14: демонстрирует, что слитые белки связывают перекрывающиеся эпитопы с клинически активным антителом к CD137 (SEQ ID NO: 28 и 29), как проиллюстрировано в исследованиях методом конкурентного ELISA, как описано в примере 17. Постоянную концентрацию SEQ ID NO: 28 и 29 наносили на планшет для микротитрования с последующим добавлением смеси тестируемых молекул в различных концентрациях и индикатора биотинилированного huCD137-Fc в фиксированной концентрации. Связанный индикатор детектировали с использованием ExtrAvidin-пероксидазы. Слитые белки конкурируют с антителом к CD137 за связывание с CD137.
[0075] Фиг. 15: демонстрирует потенциал иллюстративных слитых белков блокировать ингибирующий сигнал, опосредованный взаимодействием PD-1/PD-L1, оцененный с использованием биоанализа блокады PD-1/PD-L1, как описано в примере 18. T-клетки PD-1-NFAT-luc Jurkat (линия клеток Jurkat, экспрессирующая PD-1 и NFAT-опосредованный ген люциферазы под контролем промотора NFAT) культивировали совместно с клетками PD-L1 aAPC/CHO-K1 в присутствии различных концентраций тестируемых молекул. Через 6 часов добавляли реагент для анализа люциферазы и измеряли люминесцентные сигналы. Фоновый сигнал представляет собой Т-клетки PD-1-NFAT-luc Jurkat, культивируемые только совместно с клетками PD-L1 aAPC/CHO-K1. Слитый белок с последовательностями SEQ ID NO: 90 и 87 блокирует сигнальный путь PD-1/PD-L1 на уровне, сопоставимом с протестированными антителами к PD-L1, включая антитело к PD-L1-строительный блок, представленное в SEQ ID NO: 86 и 87, и референсное антитело к PD-L1, представленное в SEQ ID NO: 26 и 27.
[0076] Фиг. 16: демонстрирует способность иллюстративного слитого белка индуцировать активацию Т-клеток. Также были протестированы антитело к PD-L1-строительный блок и референсное антитело к CD137 при использовании по отдельности и в комбинации с антителом к PD-L1. В эксперименте человеческие МНПК инкубировали со слитым белком, антителами, коктейлями или контролем в присутствии 0,1 нг/мл SEB. Уровни секретируемого IL-2 определяли с помощью анализа на основе электрохемилюминесценции в качестве считываемой величины, отражающей активацию Т-клеток, как описано в примере 19 и изображено на фиг. 16A. Фиг. 16B демонстрирует кратность повышения уровней секреции IL-2, индуцированного тестируемыми молекулами, по сравнению с уровнем фоновой секреции IL-2 (МНПК стимулировали с помощью 0,1 нг/мл SEB и без каких-либо тестируемых молекул). Слитый белок вызывает дозозависимое повышение секреции IL-2 на уровне, превышающем антитело к PD-L1 или антитело к CD137, по отдельности или в комбинации.
[0077] Фиг. 17: демонстрирует способность иллюстративного слитого белка осуществлять костимуляцию активации Т-клеток в присутствии PD-L1. Параллельно тестировали антитело к PD-L1-строительный блок, референсное антитело к CD137 и коктейль из антитела к CD137 и референсного антитела к PD-L1. Клетки СНО, трансфицированные человеческим PD-L1 (фиг. 17A) или ложно трансфицированные (отрицательные по человеческому PD-L1, фиг. 17B), высевали в планшеты, покрытые антителом к человеческому CD3. Добавляли пан-T-клетки, а также различные концентрации тестируемых молекул, и инкубировали в течение 2 дней. Уровни секретируемого IL-2 в супернатанте определяли с помощью анализа на основе электрохемолюминесценции, как описано в примере 20. Уровни секреции IL-2 были нормированы к фоновым уровням (пан-T-клетки + анти-CD3 + клетки CHO), чтобы отобразить кратность повышения секреции IL-2 в присутствии клеток CHO, экспрессирующих человеческий PD-L1 (фиг. 17C), или ложно трансфицированных клеток CHO (фиг. 17D). Слитый белок индуцирует сильное дозозависимое повышение секреции IL-2 только в присутствии PD-L1, на уровне, превышающем референсное антитело к CD137 по отдельности или в комбинации с референсным антителом к PD-L1.
[0078] Фиг. 18: демонстрирует результат фармакокинетических анализов биспецифических слитых белков и антитела к PD-L1-строительного блока (SEQ ID NO: 86 и 87) у мышей, как описано в примере 21. Самцам мышей CD-1 (3 мыши на временную точку) внутривенно вводили слитые белки в дозе 10 мг/кг. Уровни лекарственного средства определяли с помощью сэндвич-ELISA, детектируя целую молекулу посредством мишеней PD-L1 и CD137. Уровни антител к PD-L1 в плазме определяли с использованием сэндвич-ELISA с мишенями PD-L1 и человеческим Fc.
[0079] Фиг. 19: демонстрирует результаты фармакокинетического анализа иллюстративного слитого белка (SEQ ID NO: 90 и 87) по сравнению с двумя ранее описанными CD137- и PD-L1-связывающими слитыми белками (SEQ ID NO: 147 и SEQ ID NO: 148) у мышей, как описано в примере 22. Самцам мышей CD-1 (2 мыши на временную точку) внутривенно вводили тестируемые молекулы в дозе 2 мг/кг. Уровни лекарственного средства определяли с помощью ELISA в указанных временных точках. Данные были нанесены на график зависимости концентрации от времени. SEQ ID NO: 90 и 87, описанный в настоящем документе, но не SEQ ID NO: 147 или SEQ ID NO: 148, демонстрирует благоприятный фармакокинетический профиль или антителоподобную фармакокинетику.
IV. Подробное описание изобретения
[0080] Как описано в настоящем документе, настоящее изобретение включает установление того, что бивалентной CD137-связывающей молекулы, такой как антитело, самой по себе может быть недостаточно для кластеризации CD137 на Т-клетках или NK-клетках и обеспечения эффективной активации, подобно отсутствию активности трехвалентного растворимого CD137L. В недавних публикациях с использованием доклинических моделей на мышах in vivo были представлены доказательства того, что механизм действия других антител к TNFR требует взаимодействия антител посредством их Fc-части с Fc-гамма-рецепторами на клетках, экспрессирующих Fc-гамма-рецепторы (Bulliard et al., Immunol Cell Biol, 2014, Bulliard et al., J Exp Med, 2013). Таким образом, в механизме действия этих антител к TNFR может преобладать нецелевая кластеризация посредством Fc-гамма-рецепторов, в зависимости от присутствия клеток, экспрессирующих Fc-гамма-рецептор, который не обязательно может быть сверхэкспрессирован в микроокружении опухоли-мишени по сравнению с нормальными тканями.
[0081] Таким образом, существует неудовлетворенная потребность в создании терапевтических средств, которые кластеризуют и активируют CD137 со специфическим, нацеленным на опухоль механизмом действия.
[0082] Для удовлетворения этой неудовлетворенной потребности в настоящем описании предложены, среди прочего, новые подходы для одновременного связывания CD137 и PD-L1 с помощью одного или более слитых белков, обладающих специфичностью связывания с CD137 и специфичностью связывания с PD-L1.Предложенные слитые белки разработаны для способствования кластеризации CD137 путем соединения CD137-положительных Т-клеток с PD-L1, экспрессируемым в микроокружении опухоли. Такие биспецифические молекулы могут сочетать CD137-индуцированную активацию и экспансию Т-клеток с блокадой иммунных контрольных точек, опосредованной анти-PD-L1, и, таким образом, могут преодолевать определенные ограничения монотерапии и обеспечивать преимущества, например, для резистентных или невосприимчивых пациентов. Слитые белки также разработаны для обеспечения возможностей комбинированной терапии в одной молекуле, и в то же время позволяют осуществлять локализованную индукцию антигенспецифических Т-клеток в микроокружении опухоли, потенциально снижая периферическую токсичность.
[0083] В некоторых аспектах настоящего изобретения предложены слитые белки, связывающие CD137 и PD-L1, а также способы и их полезные применения. В изобретении также предложены способы получения слитых белков, связывающих CD137 и PD-L1, описанных в настоящем документе, а также композиции, содержащие такие белки. Слитые белки, связывающие CD137 и PD-L1, согласно изобретению, а также содержащие их композиции могут быть использованы в способах обнаружения CD137 и/или PD-L1 в образце, в способах связывания CD137 и/или PD-L1 у субъекта, или в способах модуляции иммунных ответов у субъекта. Подобные слитые белки, обладающие этими характеристиками, соответствующими применениям, предусмотренным настоящим изобретением, ранее не были описаны. В отличие от слитых белков, предложенных в настоящем документе, ранее известные слитые белки, нацеленные как на CD137, так и на PD-L1, имели один или более из следующих недостатков: плохая фармакокинетика, неприемлемая степень нецелевого связывания, сниженная или иным образом ухудшенная способность связывать одну или обе мишени отдельно взятого слитого белка (например, PD-L1 и/или CD137) и/или неприемлемая степень неспецифической (например, независимой от PD-L1) активации, например, иммунной системы.
A. Иллюстративные слитые белки, специфичные к CD137 и PD-L1, согласно изобретению.
[0084] В некоторых вариантах осуществления предложенный слитый белок содержит по меньшей мере две субъединицы в любом порядке: (1) первую субъединицу, содержащую полноразмерный иммуноглобулин или его антигенсвязывающий домен, специфичный к PD-L1, и (2) вторую субъединицу, содержащую мутеин липокалина, специфичный к CD137.
[0085] В некоторых вариантах осуществления предложенный слитый белок также может содержать по меньшей мере одну дополнительную субъединицу, например, третью субъединицу. Например, слитый белок может содержать третью субъединицу, специфичную к CD137. В некоторых вариантах осуществления третья субъединица может представлять собой или содержать мутеин липокалина, специфичный к CD137. Например, два мутеина липокалина могут быть слиты с первой субъединицей иммуноглобулина, один на С-конце и один на N-конце иммуноглобулина. В некоторых вариантах осуществления мутеины липокалина могут быть слиты с тяжелой цепью или легкой цепью иммуноглобулина.
[0086] В некоторых вариантах осуществления предложенные слитые белки могут содержать одну или более дополнительных субъединиц (например, четвертую, пятую или шестую субъединицу).
[0087] В некоторых вариантах осуществления по меньшей мере одна субъединица может быть слита на ее N-конце и/или ее С-конце с другой субъединицей.
[0088] В некоторых вариантах осуществления по меньшей мере одна субъединица может быть связана с другой субъединицей посредством линкера. В некоторых дополнительных вариантах осуществления линкер представляет собой пептидный линкер, например, неструктурированный глицин-сериновый (GS) линкер, гликозилированный GS линкер или пролин-аланин-сериновый полимерный (PAS) линкер. В некоторых вариантах осуществления GS линкер представляет собой линкер (Gly4Ser)3 ((G4S)3), представленный в SEQ ID NO: 13. Другие иллюстративные линкеры представлены в SEQ ID NO: 14-23. В некоторых вариантах осуществления пептидный линкер может содержать от 1 до 50 аминокислот, например, 1, 2, 3, 4, 5, 10, 11, 12, 13, 14, 15, 16, 17 18, 19, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Например, когда первая субъединица содержит полноразмерный иммуноглобулин, вторая субъединица может быть связана посредством пептидного линкера между N-концом второй субъединицы и C-концом константной области тяжелой цепи (СН) указанного иммуноглобулина. В некоторых дополнительных вариантах осуществления третья субъединица может быть связана посредством пептидного линкера между N-концом третьей субъединицы и C-концом константной области легкой цепи (CL) указанного иммуноглобулина.
[0089] В некоторых вариантах осуществления одна субъединица может быть связана с другой субъединицей по существу как описано на фиг. 1. Как правило, одна субъединица может быть слита на ее N-конце и/или ее С-конце с другой субъединицей. Например, в некоторых вариантах осуществления субъединица мутеина липокалина может быть слита на ее N-конце и/или на ее C-конце с субъединицей иммуноглобулина. В качестве еще одного примера, один мутеин липокалина может быть связан, предпочтительно посредством пептидной связи, с C-концом домена тяжелой цепи иммуноглобулина (HC), N-концом HC, C-концом легкой цепи иммуноглобулина (LC) и/или N-концом LC (фиг. 1A-1D).
[0090] В некоторых вариантах осуществления субъединица мутеина липокалина может быть слита на ее N-конце и/или на ее C-конце с фрагментом иммуноглобулина. Например, в некоторых вариантах осуществления мутеин липокалина может быть связан, предпочтительно посредством пептидного линкера, на C-конце константной области тяжелой цепи (CH) или C-конце константной области легкой цепи (CL) иммуноглобулина.
[0091] В некоторых вариантах осуществления, когда одна субъединица содержит полноразмерный иммуноглобулин, вторая субъединица может быть связана между N-концом второй субъединицы и C-концом константной области тяжелой цепи (СН) указанного иммуноглобулина.
[0092] В некоторых вариантах осуществления третья субъединица может быть связана между N-концом третьей субъединицы и C-концом константной области легкой цепи (CL) указанного иммуноглобулина.
[0093] В некоторых вариантах осуществления в отношении слитого белка согласно изобретению, где по меньшей мере одна субъединица может представлять собой или содержать полноразмерный иммуноглобулин, Fc-функция Fc-области полноразмерного иммуноглобулина по отношению к Fc-рецептор-положительной клетке может быть сохранена, и слитый белок при этом может одновременно связывать CD137 и PD-L1.
[0094] В некоторых вариантах осуществления, где по меньшей мере одна субъединица предложенного слитого белка может представлять собой или содержать полноразмерный иммуноглобулин, Fc-функция Fc-области полноразмерного иммуноглобулина по отношению к Fc-рецептор-положительной клетке может быть снижена или полностью подавлена посредством белковой инженерии, и слитый белок при этом может одновременно связывать CD137 и PD-L1. В некоторых вариантах осуществления это может быть достигнуто, например, путем замены остова IgG1 на IgG4, поскольку известно, что IgG4 демонстрирует сниженные взаимодействия с Fc-гамма-рецептором по сравнению с IgG1. В некоторых вариантах осуществления, чтобы дополнительно снизить остаточное связывание с Fc-гамма-рецепторами, в остов IgG4 могут быть введены мутации, такие как F234A и L235A. В некоторых вариантах осуществления мутация S228P также может быть введена в остов IgG4 для минимизации обмена половинами молекул IgG4 (Silva et al., J Biol Chem, 2015). В некоторых вариантах осуществления могут быть введены мутации F234A и L235A для снижения ADCC (антителозависимой клеточноопосредованной цитотоксичности) и ADCP (антителозависимого клеточноопосредованного фагоцитоза) (Glaesner et al., Diabetes Metab Res Rev, 2010) и/или мутации M428L и N434S или мутации M252Y, S254T и T256E для увеличения периода полувыведения из сыворотки (Dall'Acqua et al., J Biol Chem, 2006, Zalevsky et al., Nat Biotechnol, 2010). В некоторых вариантах осуществления в тяжелой цепи иммуноглобулина в составе слитого белка может присутствовать дополнительная мутация N297A для того, чтобы удалить природный мотив гликозилирования.
[0095] В некоторых вариантах осуществления Fc-часть иммуноглобулина, включенная в слитый белок согласно изобретению, может способствовать поддержанию сывороточных уровней слитого белка. Например, когда Fc-часть связывается с Fc-рецепторами на эндотелиальных клетках и фагоцитах, слитый белок может интернализоваться и возвращаться обратно в кровоток, увеличивая свой период полувыведения из организма.
[0096] В одном из аспектов слитые белки согласно изобретению связывают CD137 с высокой аффинностью. В еще одном аспекте предложенные слитые белки связывают PD-L1 с высокой аффинностью. В некоторых предпочтительных вариантах осуществления предложенные слитые белки одновременно связывают CD137 и PD-L1. В некоторых вариантах осуществления изобретения одновременное связывание с CD137 и PD-L1 позволяет предложенным слитым белкам демонстрировать устойчивый противоопухолевый или противоинфекционный ответ.
[0097] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать PD-L1 со значением KD не более чем приблизительно 2 нМ или даже ниже, например, приблизительно 1,5 нМ или ниже, приблизительно 1 нМ или ниже, приблизительно 0,6 нМ или ниже или приблизительно 0,4 нМ или ниже. В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать PD-L1 со значением KD, сопоставимым или более низким, чем значение KD иммуноглобулина, специфичного к PD-L1, входящего в состав такого слитого белка, такого как антитело, имеющее тяжелую и легкую цепи, представленные SEQ ID NO: 86 и 87. Значения KD предложенных слитых белков могут быть измерены, например, в анализе методом поверхностного плазмонного резонанса (SPR), таком как анализ методом SPR, как по существу описано в примере 3.
[0098] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать CD137 со значением KD не более чем приблизительно 10 нМ или даже ниже, например, приблизительно 7 нМ, приблизительно 6 нМ или приблизительно 5 нМ, приблизительно 4 нМ, приблизительно 3 нМ, приблизительно 2 нМ или даже ниже. В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать CD137 со значением KD, сопоставимым или более низким, чем значение KD мутеина липокалина, специфичного к CD137, включенного в состав конкретного слитого белка, например, SEQ ID NO: 42, или мутеина липокалина, слитого с Fc-областью антитела, например, SEQ ID NO: 89. Значения KD предложенных слитых белков могут быть измерены, например, в анализе методом SPR, таком как анализ методом SPR, как по существу описано в примере 3.
[0099] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать PD-L1 со значением EC50 не более чем приблизительно 0,5 нМ или даже ниже, например, приблизительно 0,3 нМ или ниже, приблизительно 0,2 нМ или ниже, приблизительно 0,15 нМ или ниже или приблизительно 0,1 нМ или ниже. В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать PD-L1 со значением EC50, сопоставимым или более низким, чем значение EC50 иммуноглобулина, специфичного к PD-L1, входящего в состав конкретного слитого белка, такого как антитело, имеющее тяжелую и легкую цепи, представленные SEQ ID NO: 86 и 87. Значения EC50 предложенных слитых белков могут быть измерены, например, в анализе методом твердофазного иммуноферментного анализа (ELISA), таком как анализ ELISA, как по существу описано в примере 4.
[00100] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать CD137 со значением EC50 не более чем приблизительно 0,6 нМ или даже ниже, например, приблизительно 0,5 нМ или ниже, приблизительно 0,2 нМ или ниже, приблизительно 0,15 нМ или ниже или приблизительно 0,1 нМ или ниже. В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать CD137 со значением EC50, сопоставимым или более низким, чем значение EC50 мутеина липокалина, специфичного к CD137, включенного в состав конкретного слитого белка, например, SEQ ID NO: 42, или мутеина липокалина, слитого с Fc-областью антитела, например, SEQ ID NO: 89. Значения EC50 предложенных слитых белков могут быть измерены, например, в анализе методом ELISA, таком как анализ ELISA, как по существу описано в примере 4.
[00101] В некоторых вариантах осуществления слитые белки согласно изобретению обладают перекрестной реактивностью с PD-L1 яванского макака. В некоторых вариантах осуществления предложенный слитый белок может быть способен связывать PD-L1 яванского макака со значением EC50 не более чем приблизительно 0,5 нМ или даже ниже, например, приблизительно 0,2 нМ или ниже, приблизительно 0,1 нМ или ниже или приблизительно 0,05 нМ. или ниже. Значения EC50 предложенных слитых белков могут быть измерены, например, измерены в анализе методом ELISA, таком как анализ ELISA, как по существу описано в примере 4.
[00102] В некоторых вариантах осуществления слитые белки согласно изобретению обладают перекрестной реактивностью с CD137 яванского макака. В некоторых вариантах осуществления предложенный слитый белок может быть способен связывать CD137 яванского макака со значением EC50 не более чем приблизительно 15 nM или даже ниже, например, приблизительно 10 нМ или ниже, приблизительно 8 нМ или ниже, приблизительно 6 нМ или ниже, приблизительно 3 нМ или ниже, приблизительно 1 нМ или ниже, приблизительно 0,5 нМ или ниже, приблизительно 3 нМ или ниже или приблизительно 0,1 нМ или ниже. Значения EC50 предложенных слитых белков могут быть измерены, например, в анализе методом ELISA, таком как анализ ELISA, как по существу описано в примере 4. В некоторых вариантах осуществления связывание предложенного слитого белка с CD137 яванского макака может быть усилено за счет эффекта авидности, как описано в примере 22.
[00103] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны одновременно связывать CD137 и PD-L1. В некоторых вариантах осуществления предложенный слитый белок может быть способен одновременно связывать CD137 и PD-L1 со значением EC50 не более чем приблизительно 1 нМ или даже ниже, например, 0,8 нМ или ниже, 0,6 нМ или ниже или 0,4 нМ или ниже. В некоторых других вариантах осуществления предложенный слитый белок может быть способен одновременно связывать CD137 и PD-L1 со значением EC50 не более чем приблизительно 10 нМ или даже ниже, например, 8 нМ или ниже, 6 нМ или ниже, 3 нМ или ниже или 2 нМ или ниже. Одновременное связывание может быть определено, например, в анализе методом ELISA, таком как анализ ELISA, как по существу описано в примере 5.
[00104] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать CD137, экспрессируемый на клетке, со значением EC50 не более чем приблизительно 60 нМ или даже ниже, например, приблизительно 50 нМ или даже ниже, приблизительно 40 нМ или даже ниже, приблизительно 30 нМ или ниже, приблизительно 10 нМ или ниже, приблизительно 7 нМ или ниже, приблизительно 5 нМ или ниже, приблизительно 3 нМ или ниже или приблизительно 1 нМ или даже ниже. Значение EC50 предложенного слитого белка может быть измерено, например, в анализе методом проточной цитометрии, как по существу описано в примере 6. Клетка, экспрессирующая CD137, может представлять собой, например, клетку СНО, трансфицированную человеческим CD137 или CD137 яванского макака.
[00105] В некоторых вариантах осуществления слитый белок согласно изобретению может быть способен связывать PD-L1, экспрессируемый на клетке, со значением EC50 не более чем приблизительно 10 нМ или даже ниже, например, приблизительно 8 нМ или даже ниже, приблизительно 6 нМ или даже ниже, приблизительно 4 нМ или ниже, приблизительно 2 нМ или ниже или приблизительно 1 или даже ниже. Значение EC50 предложенного слитого белка может быть измерено, например, в анализе методом проточной цитометрии, как по существу описано в примере 6. Клетка, экспрессирующая PD-L1, может представлять собой, например, клетку СНО, трансфицированную человеческим PD-L1 или PD-L1 яванского макака.
[00106] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны связывать PD-L1, экспрессируемый на опухолевых клетках. В некоторых вариантах осуществления предложенный слитый белок может быть способен связывать PD-L1, экспрессируемый на опухолевой клетке, со значением EC50 не более чем приблизительно 2 нМ или даже ниже, например, приблизительно 1,5 нМ или ниже, приблизительно 1 нМ или ниже, приблизительно 0,6 нМ или ниже или приблизительно 0,3 нМ или даже ниже. Значение EC50 слитого белка для связывания опухолевых клеток, экспрессирующих PD-L1, может быть измерено, например, в анализе методом проточной цитометрии, как по существу описано в примере 7. Опухолевые клетки, экспрессирующие PD-L1, могут представлять собой, например, клетки RKO.
[00107] В некоторые варианты осуществления слитые белки согласно изобретению по существу не влияют на связывание CD137 с CD137L. В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны связывать CD137, находящийся в комплексе с CD137L. В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны связывать CD137 с помощью механизма, подобного антителу к CD137, имеющему тяжелую и легкую цепи, представленные SEQ ID NO: 28 и 29. Механизм связывания с CD137 слитого белка может быть определен, например, посредством анализа методом SPR, такого как анализ методом SPR, как по существу описано в примере 8.
[00108] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны конкурировать с PD-1 за связывание с PD-L1. В некоторых вариантах осуществления предложенный слитый белок может быть способен конкурировать с PD-1 за связывание с PD-L1 со значением IC50 не более чем приблизительно 5 нМ или даже ниже, например, приблизительно 3 нМ или ниже, приблизительно 2 нМ или ниже или приблизительно 1 или даже ниже. Механизм ингибирующего действия может быть определен, например, посредством анализа методом ELISA, такого как анализ ELISA, как по существу описано в примере 9.
[00109] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны конкурировать с антителом к CD137, представленным в SEQ ID NO: 28 и 29, за связывание с CD137. Такую конкуренцию можно оценить с помощью анализа методом ELISA, как по существу описано в примере 17. В некоторых вариантах осуществления предложенный слитый белок может иметь перекрывающийся эпитоп с антителом к CD137, представленным в SEQ ID NO: 28 и 29.
[00110] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны костимулировать Т-клеточные ответы. В некоторых вариантах осуществления предложенные слитые белки приводят к сопоставимой или более сильной активации Т-клеток по сравнению с антителом к PD-L1, таким как антитело к PD-L1-строительный блок с последовательностями SEQ ID NO: 86 и 87 или референсное антитело к PD-L1 с последовательностями SEQ ID NO: 26 и 27, или антитело к CD137, такое как референсное антитело с последовательностями SEQ ID NO: 28 и 29. В некоторых вариантах осуществления предложенные слитые белки приводят к активации Т-клеток с сопоставимой или лучшей эффективностью по сравнению с комбинацией антитела к PD-L1 и молекулы, нацеленной на CD137, такой как антитело к CD137 или ранее известный CD137-специфический мутеин липокалина. Стимулированный Т-клеточный ответ или активация Т-клеток могут быть измерены, например, в биоанализе с CD137, как по существу описано в примере 10, в биоанализе с блокадой PD-1/PD-L1, как описано в примере 18, или в функциональном анализе активации Т-клеток, как по существу описано в примере 11, примере 12, примере 19 и примере 20.
[00111] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны индуцировать повышенную секрецию IL-2. В некоторых предпочтительных вариантах осуществления предложенные слитые белки могут быть способны индуцировать зависимую от концентрации секрецию IL-2 и/или демонстрируют тенденцию к индукции повышенной секреции IL-2 при более высоких концентрациях, предпочтительно концентрациях при нанесении в виде покрытия. В некоторых вариантах осуществления предложенные слитые белки могут приводить к повышенной секреции IL-2 с сопоставимой или лучшей эффективностью по сравнению с комбинацией антитела к PD-L1 и молекулы, нацеленной на CD137, такой как антитело к CD137 или ранее известный CD137-специфический мутеин липокалина. Секреция IL-2 может быть измерена, например, в функциональном анализе активации Т-клеток, как по существу описано в примере 11 и примере 19.
[00112] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны костимулировать Т-клеточные ответы PD-L1-зависимым образом. В некоторых вариантах осуществления предложенные слитые белки могут приводить к локальной индукции продукции IL-2 Т-клетками вблизи PD-L1-положительных клеток, таких как клетки, трансфицированные PD-L1, или PD-L1-положительные опухолевые клетки. «Вблизи PD-L1-положительных клеток» в контексте настоящего документа относится к Т-клетке и PD-L1-положительной клетке, сближенным друг с другом посредством предложенного слитого белка, который одновременно связывает CD137 и PD-L1. PD-L1-зависимая активация Т-клеток предложенными слитыми белками может быть определена, например, в биоанализе с CD137, по существу описанном в примере 10, в биоанализе с блокадой PD-1/PD-L1, по существу описанном в примере 18, или в функциональном анализе активации Т-клеток, по существу описанном в примере 12 и примере 20.
[00113] В некоторых предпочтительных вариантах осуществления предложенные слитые белки могут быть способны костимулировать Т-клеточные ответы в присутствии опухолевых клеток, экспрессирующих PD-L1, и/или в микроокружении опухоли. В некоторых вариантах осуществления предложенный слитый белок может быть способен костимулировать Т-клеточные ответы в присутствии PD-L1-положительных опухолевых клеток со значением EC50 приблизительно 1 нМ или ниже, приблизительно 0,5 нМ или ниже, приблизительно 0,3 нМ или ниже, приблизительно 0,1 нМ или ниже или приблизительно 0,05 нМ или ниже. Активация Т-клеток предложенными слитыми белками в присутствии опухолевых клеток, экспрессирующих PD-L1, и/или в микроокружении опухоли может быть оценена, например, в CD137-биоанализе, по существу описанном в примере 10, или в функциональном анализе активации Т-клеток, по существу описанном в примере 12.
[00114] В некоторых вариантах осуществления предложенные слитые белки неспособны костимулировать Т-клеточные ответы в отсутствие PD-L1. В некоторых вариантах осуществления предложенные слитые белки неспособны костимулировать Т-клеточные ответы в отсутствие клеток, экспрессирующих PD-L1. В некоторых вариантах осуществления предложенный слитый белок может быть лучше способен распознавать присутствие PD-L1 и приводить к соответствующей активации Т-клеток, чем антитело к CD137, представленное в SEQ ID NO: 28 и 29. PD-L1-зависимое действие слитых белков может быть определено, например, в биоанализе с CD137, по существу описанном в примере 10, в биоанализе с блокадой PD-1/PD-L1, по существу описанном в примере 18, или в функциональном анализе активации Т-клеток, по существу описанном в примере 12 и примере 20.
[00115] В некоторых вариантах осуществления предложенные слитые белки могут быть способны блокировать ингибирующий сигнал, опосредованный связыванием PD-1 с PD-L1. В некоторых вариантах осуществления предложенный слитый белок может быть способен ослабить тормоз активации Т-клеток или привести к успешной активации Т-клеток путем блокирования взаимодействия PD-1/PD-L1. Блокада ингибирующего сигнала PD-1 может быть измерена, например, в биоанализе с блокадой PD-1/PD-L1, как описано в примере 18.
[00116] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны стимулировать пролиферацию и/или активацию Т-клеток. В некоторых вариантах осуществления предложенные слитые белки могут быть способны стимулировать пролиферацию и/или активацию CD4+ Т-клеток. В некоторых вариантах осуществления предложенные слитые белки могут быть способны индуцировать секрецию IL-2, предпочтительно дозозависимую секрецию IL-2. В некоторых вариантах осуществления предложенные слитые белки могут быть способны индуцировать более высокий уровень секреции IL-2 по сравнению с комбинацией антитела к PD-L1 и молекулы, нацеленной на CD137, такой как антитело к CD137 или ранее известный CD137-специфический мутеин липокалина. Секреция IL-2 в контексте настоящего документа может быть мерой активации Т-клеток. Пролиферация и/или активация CD4+ Т-клеток, стимулированная предложенными слитыми белками, может быть оценена с помощью, например, анализа реакции смешанной культуры лимфоцитов (MLR), как по существу описано в примере 14.
[00117] В некоторых вариантах осуществления слитые белки согласно изобретению могут быть способны стимулировать пролиферацию и/или активацию CD8+ Т-клеток. В некоторых вариантах осуществления предложенные слитые белки могут быть способны индуцировать продукцию IL-2 и эффекторных молекул, таких как перфорин, гранзим А и гранзим В. В некоторых вариантах осуществления предложенные слитые белки могут быть способны индуцировать повышенную продукцию IL-2 и цитотоксических факторов, таких как перфорин, гранзим В и гранзим А, по сравнению с комбинацией антитела к PD-L1 и молекулы, нацеленной на CD137, такой как антитело к CD137 или ранее известный CD137-специфический мутеин липокалина. Пролиферация и/или активация CD8+ Т-клеток, стимулированная предложенными слитыми белками, может быть оценена с помощью, например, анализа MLR, как по существу описано в примере 15.
[00118] В некоторых вариантах осуществления предложенные слитые белки обладают благоприятным профилем стабильности и фармакокинетическим профилем. В некоторых вариантах осуществления предложенный слитый белок имеет фармакокинетический профиль, сопоставимый с антителом-строительным блоком с последовательностями SEQ ID NO: 86 и 87. В некоторых вариантах осуществления предложенный слитый белок имеет антителоподобную фармакокинетику. В некоторых вариантах осуществления предложенный слитый белок имеет конечный период полувыведения приблизительно 200 часов или дольше, приблизительно 250 часов или дольше, приблизительно 300 часов или дольше, приблизительно 350 часов или дольше, приблизительно 400 часов или дольше, или даже дольше. В некоторых вариантах осуществления предложенный слитый белок имеет более благоприятный фармакокинетический профиль, чем SEQ ID NO: 147. В некоторых вариантах осуществления предложенный слитый белок имеет более благоприятный фармакокинетический профиль, чем SEQ ID NO: 148. Фармакокинетические профили предложенных слитых белков могут быть проанализированы, как описано в примере 21 и примере 22. В некоторых вариантах осуществления можно считать, что благоприятный фармакокинетический профиль или антителоподобная фармакокинетика достигнуты, если % cmax был выше 10% спустя 336 часов.
[00119] В некоторых вариантах осуществления предложенный слитый белок содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 88-94.
[00120] В некоторых вариантах осуществления предложенный слитый белок содержит аминокислотную последовательность, обладающую по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотными последовательностями, представленными в любой из SEQ ID NO: 88-94.
[00121] В некоторых вариантах осуществления предложенный слитый белок содержит аминокислоты, представленные в SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 или SEQ ID NO: 90 и 91.
[00122] В некоторых вариантах осуществления предложенный слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 или SEQ ID NO: 90 и 91.
B. Иллюстративные иммуноглобулины, входящие в состав слитых белков.
[00123] В некоторых вариантах осуществления в отношении предложенного слитого белка первая субъединица может представлять собой или содержать полноразмерный иммуноглобулин или его антигенсвязывающий домен, специфичный к PD-L1. В некоторых вариантах осуществления иммуноглобулин, например, может представлять собой IgG1, IgG2 или IgG4. В некоторых вариантах осуществления иммуноглобулин представляет собой или содержит IgG4. В некоторых вариантах осуществления иммуноглобулин представляет собой моноклональное антитело к PD-L1.
[00124] Иллюстративные примеры PD-L1-связывающих антител согласно изобретению могут содержать антигенсвязывающую область, которая перекрестно блокирует или связывается с тем же эпитопом, что и PD-L1-связывающее антитело, содержащее области вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL) известного антитела, такого как атезолизумаб (также известно как MPDL3280A или RG7446, торговое наименование Tecentriq®), авелумаб (также известно как MSB0010718C, торговое наименование Bavencio®), дурвалумаб (ранее известно как MEDI4736, торговое наименование Imfinzi®) и BMS-936559 (также известно как MDX-1105), 5C10 (включая гуманизированное 5C10), 5F10 (включая гуманизированное 5F10) и 9F6 (включая гуманизированное 9F6). В некоторых вариантах осуществления PD-L1-связывающее антитело согласно изобретению может содержать антигенсвязывающую область, такую как любая из трех определяющих комплементарность областей (CDR) тяжелой цепи (HCDR1, HCDR2 и HCDR3) и трех CDR легкой цепи (LCDR1, LCDR2 и LCDR3) из антитела, выбранного из группы, состоящей из атезолизумаба, авелумаба, дурвалумаба, BMS-936559, 5C10, 5F10 и 9F6.
[00125] В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен может иметь вариабельную область тяжелой цепи (HCVR), выбранную из группы, состоящей из SEQ ID NO: 75-79, и/или вариабельную область легкой цепи (LCVR), выбранную из группы, состоящей из SEQ ID NO: 80-84.
[00126] В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен может иметь тяжелую цепь, представляющую собой любую из SEQ ID NO: 85-86, и/или легкую цепь, представляющую собой SEQ ID NO: 87.
[00127] В некоторых вариантах осуществления пара тяжелой цепи и легкой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена представляет собой или содержит следующие HCVR и LCVR, соответственно: SEQ ID NO: 75 и 80, SEQ ID NO: 76 и 81, SEQ ID NO: 77 и 82, SEQ ID NO: 78 и 83 или SEQ ID NO:79 и 84.
[00128] В некоторых вариантах осуществления пара тяжелой цепи и легкой цепи предложенного антитела к PD-L1 представляет собой или содержит аминокислотные последовательности, представленные в SEQ ID NO: 85 и 87 или SEQ ID NO: 86 и 87.
[00129] В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен может иметь HCVR, обладающую по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 75-79, и/или LCVR, обладающую по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 80-84. В других вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен может иметь тяжелую цепь, обладающую по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 85-86, и/или легкую цепь, обладающую по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или даже более высокой идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 87.
[00130] В некоторых вариантах осуществления вариабельная область тяжелой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: GFSLSNYD (HCDR1, SEQ ID NO: 60), IWTGGAT (HCDR2, SEQ ID NO: 61), VRDSNYRYDEPFTY (HCDR3; SEQ ID NO: 62). В некоторых вариантах осуществления вариабельная область тяжелой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: GFDIKDTY (HCDR1, SEQ ID NO: 65), IDPADGNT (HCDR2, SEQ ID NO: 66), ARGLGAWFAS (HCDR3; SEQ ID NO: 67). В некоторых вариантах осуществления вариабельная область тяжелой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: GFNIKDTY (HCDR1, SEQ ID NO: 70), IDPANGNT (HCDR2, SEQ ID NO: 71), SRGPPGGIGEYIYAMDY (HCDR3; SEQ ID NO: 72).
[00131] В некоторых вариантах осуществления вариабельная область легкой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: QSIGTN (LCDR1, SEQ ID NO: 63), YAS (LCDR2), QQSNSWPYT (LCDR3; SEQ ID NO: 64). В некоторых вариантах осуществления вариабельная область легкой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: QDITNS (LCDR1, SEQ ID NO: 68), YTS (LCDR2), QQGHTLPPT (LCDR3; SEQ ID NO: 69). В некоторых вариантах осуществления вариабельная область легкой цепи предложенного антитела к PD-L1 или его антигенсвязывающего домена может иметь три CDR, имеющие следующие последовательности: SSVSSSY (LCDR1, SEQ ID NO: 73), STS (LCDR2), HQYHRSPPT (LCDR3; SEQ ID NO: 74).
[00132] В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен содержит вариабельную область тяжелой цепи, имеющую три CDR, имеющие следующие последовательности: GFSLSNYD (HCDR1, SEQ ID NO: 60), IWTGGAT (HCDR2, SEQ ID NO: 61), VRDSNYRYDEPFTY (HCDR3; SEQ ID NO: 62), и вариабельную область легкой цепи, имеющую три CDR, имеющие следующие последовательности: QSIGTN (LCDR1, SEQ ID NO: 63), YAS (LCDR2), QQSNSWPYT (LCDR3; SEQ ID NO: 64). В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен содержит вариабельную область тяжелой цепи, имеющую три CDR, имеющие следующие последовательности: GFDIKDTY (HCDR1, SEQ ID NO: 65), IDPADGNT (HCDR2, SEQ ID NO: 66), ARGLGAWFAS (HCDR3; SEQ ID NO: 67), и вариабельную область легкой цепи, имеющую три CDR, имеющие следующие последовательности: QDITNS (LCDR1, SEQ ID NO: 68), YTS (LCDR2), QQGHTLPPT (LCDR3; SEQ ID NO: 69).В некоторых вариантах осуществления предложенное антитело к PD-L1 или его антигенсвязывающий домен содержит вариабельную область тяжелой цепи, имеющую три CDR, имеющие следующие последовательности: GFNIKDTY (HCDR1, SEQ ID NO: 70), IDPANGNT (HCDR2, SEQ ID NO: 71), SRGPPGGIGEYIYAMDY (HCDR3; SEQ ID NO: 72), и вариабельную область легкой цепи, имеющую три CDR, имеющие следующие последовательности: SSVSSSY (LCDR1, SEQ ID NO: 73), STS (LCDR2), HQYHRSPPT (LCDR3; SEQ ID NO: 74).
[00133] Если не указано иное, все раскрытые в настоящем документе последовательности CDR определены согласно методу IMGT, как описано в Lefranc, M.-P., The Immunologist, 7, 132-136 (1999). CDR1 состоит из положений с 27 по 38, CDR2 состоит из положений с 56 по 65, CDR3 для генов V зародышевой линии состоит из положений со 105 по 116, CDR3 для реаранжированных генов V-J или генов V-D-J состоит из положений со 105 по 117 (положение, предшествующее J-PHE или J-TRP 118) с гэпами наверху петли для реаранжированной CDR3-IMGT с менее чем 13 аминокислотами, или с дополнительными положениями 112.1, 111.1, 112.2, 111.2 и т. д. для реаранжированной CDR3-IMGT с более чем 13 аминокислотами. Положения, приведенные в этом абзаце, соответствуют нумерации IMGT, описанной в Lefranc, M.-P., The Immunologist, 7, 132-136 (1999).
[00134] Антитела, специфически связывающиеся с PD-L1, входящие в состав слитых белков согласно изобретению, могут содержать Fc-часть, которая позволяет продлить период полувыведения in vivo биспецифической связывающей молекулы согласно изобретению. В некоторых вариантах осуществления такая Fc-часть предпочтительно имеет происхождение от человека, более предпочтительно, представляет собой человеческую Fc-часть антитела IgG1 или lgG4, еще более предпочтительно генетически модифицированную человеческую Fc-часть IgG1 или lgG4 с активированными или подавленными эффекторными функциями. В некоторых вариантах осуществления подавление эффекторных функций может быть предпочтительнее активации эффекторных функций. В некоторых вариантах осуществления такую Fc-часть генетически модифицируют для подавления эффекторных функций посредством мутации(ий) в положениях 234 и/или 235, нумерация согласно индексу EU Кабат (Johnson and Wu, Nucleic Acids Res, 2000). В некоторых вариантах осуществления для подавления эффекторных функций могут быть введены мутации в положениях F234 и L235 предложенного антитела к PD-L1. В других вариантах осуществления для подавления эффекторной функции могут быть введены мутации в положениях D265 и P329 предложенного антитела к PD-L1. Нумерация для обоих наборов этих возможных мутаций приведена согласно индексу EU Кабат (Shields et al., J Biol Chem, 2001).
[00135] Различные способы получения антител и их фрагментов хорошо известны в данной области техники и описаны, например, в Altshuler et al. (2010). Таким образом, например, поликлональные антитела могут быть получены из крови животного после иммунизации антигеном в смеси с добавками и адъювантами, а моноклональные антитела могут быть получены любым методом, который обеспечивает антитела, продуцируемые культурами стабильных клеточных линий. Примеры таких методов описаны, например, Harlow and Lane (1999), (1988), и включают гибридомную технологию, впервые описанную Köhler and Milstein, 1975, триомную технологию, технологию гибридомы из человеческих B-клеток (см., например, Li et al., Proc Natl Acad Sci U S A, 2006, Kozbor and Roder, Immunol Today, 1983) и технологию EBV-гибридомы для получения человеческих моноклональных антител (Cole et al., Cancer Res, 1984). Кроме того, рекомбинантные антитела могут быть получены из моноклональных антител или могут быть получены de novo с использованием различных методов дисплея, таких как фаговый, рибосомный, мРНК или клеточный дисплей. В некоторых вариантах осуществления подходящая система для экспрессии рекомбинантных (гуманизированных) антител или их фрагментов может быть выбрана, например, из линий клеток бактерий, дрожжей, насекомых, млекопитающих или трансгенных животных или растений см., например, патент США № 6,080,560; Holliger and Hudson, Nat Biotechnol, 2005). Кроме того, методы, описанные для получения одноцепочечных антител (см., среди прочего, патент США № 4,946,778), могут быть адаптированы для получения одноцепочечных антител, специфичных к мишени согласно данному изобретению. Поверхностный плазмонный резонанс, используемый в системе BIAcore, может быть использован для повышения эффективности фаговых антител.
C. Иллюстративные мутеины липокалина согласно изобретению.
[00136] Липокалины представляют собой белковые связывающие молекулы, которые естественным образом эволюционировали до связывания лигандов. Липокалины содержатся во многих организмах, включая позвоночных, насекомых, растений и бактерии. Члены семейства белков липокалинов (Pervaiz and Brew, FASEB J, 1987), как правило, представляют собой небольшие секретируемые белки и имеет одну полипептидную цепь. Они характеризуются рядом различных свойств молекулярного распознавания: их связыванием с различными, преимущественно гидрофобными малыми молекулами (такими как ретиноиды, жирные кислоты, холестерины, простагландины, биливердины, феромоны, вкусовые добавки и отдушки) и их связыванием с определенными рецепторами клеточной поверхности и образованием ими макромолекулярных комплексов. Хотя в прошлом их классифицировали в первую очередь как транспортные белки, теперь ясно, что липокалины выполняют множество физиологических функций. Они включают роль в транспорте ретинола, обонянии, феромоновой сигнализации и синтезе простагландинов. Липокалины также участвуют в регуляции иммунного ответа и опосредовании клеточного гомеостаза (обзор приведен, например, в Flower et al., Biochim Biophys Acta, 2000, Flower, Biochem J, 1996).
[00137] Липокалины обладают необычно низким уровнем общей консервативности последовательностей, часто с идентичностью последовательностей менее 20%. Напротив, их общий характер фолдинга в высокой степени консервативен. Центральная часть структуры липокалина состоит из одного восьмицепочечного антипараллельного β-листа, образующего замкнутую фигуру, представляющую собой непрерывно связанный водородными связями β-цилиндр. Этот β-цилиндр образует центральную полость. Один конец цилиндра стерически заблокирован N-концевым пептидным сегментом, который проходит через его дно, а также тремя пептидными петлями, соединяющими β-цепи. Другой конец β-цилиндра открыт для растворителя и охватывает сайт связывания мишени, который образован четырьмя гибкими пептидными петлями (AB, CD, EF и GH). Именно разнообразие петель в составе в остальном жесткого каркаса липокалина приводит к возникновению различных механизмов связывания, каждый из которых способен вмещать мишени различного размера, формы и химического характера (обзор приведен, например, в Skerra, Biochim Biophys Acta, 2000, Flower et al., Biochim Biophys Acta, 2000, Flower, Biochem J, 1996).
[00138] Мутеин липокалина согласно настоящему изобретению может представлять собой мутеин любого липокалина. Примеры подходящих липокалинов (также иногда называемых «референсный липокалин», «липокалин дикого типа», «референсные белковые каркасы» или просто «каркасы»), мутеин которых можно использовать, включают, не ограничиваясь перечисленным, липокалин слезной жидкости (липокалин-1, Tlc или белок железы фон Эбнера), ретинол-связывающий белок, нейтрофильную простагландин-D-синтазу липокалинового типа, β-лактоглобулин, билин-связывающий белок (BBP), аполипопротеин D (APOD), липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), белок, связанный с α2-микроглобулином (A2m), 24p3/утерокалин (24p3), белок железы фон Эбнера 1 (VEGP 1), белок железы фон Эбнера 2 (VEGP 2) и мажорный аллерген Can f 1 (ALL-1). В связанных вариантах осуществления мутеин липокалина получают из группы липокалинов, состоящей из человеческого липокалина слезной жидкости (hTlc), человеческого липокалина, ассоциированного с желатиназой нейтрофилов (hNGAL), человеческого аполипопротеина D (hAPOD) и билин-связывающего белка из Pieris brassicae.
[00139] Аминокислотная последовательность мутеина липокалина согласно изобретению может обладать высокой идентичностью последовательности по сравнению с референсным липокалином (или липокалином дикого типа), из которого он получен, например, hTlc или hNGAL, по сравнению с идентичностью последовательностей с другим липокалином (см. также выше). В этом общем контексте аминокислотная последовательность мутеина липокалина согласно изобретению по меньшей мере по существу схожа с аминокислотной последовательностью соответствующего референсного липокалина (дикого типа) при условии, что при выравнивании могут быть использованы гэпы (как определено в настоящем документе), которые является результатом добавлений или делеций аминокислот. Соответствующая последовательность мутеина липокалина согласно изобретению, будучи по существу схожей с последовательностями соответствующего референсного липокалина (дикого типа), в некоторых вариантах осуществления обладает по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 82%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 90% идентичностью, в том числе по меньшей мере 95% идентичностью последовательности соответствующего липокалина. При этом мутеин липокалина согласно изобретению, безусловно, может содержать замены, как описано в настоящем документе, которые придают мутеину липокалина способность связываться с CD137.
[00140] Как правило, мутеин липокалина содержит один или более мутированных аминокислотных остатков - относительно аминокислотной последовательности липокалина дикого типа или референсного липокалина, например, hTlc и hNGAL - в четырех петлях на открытом конце, которые содержат лиганд-связывающий карман и образуют вход в лиганд-связывающий карман (см. выше). Как объяснялось выше, эти области имеют ключевое значение для определения специфичности связывания мутеина липокалина к желаемой мишени. В некоторых вариантах осуществления мутеин липокалина согласно изобретению может также содержать области мутированных аминокислотных остатков за пределами четырех петель. В некоторых вариантах осуществления мутеин липокалина согласно изобретению может содержать один или более мутированных аминокислотных остатков в одной или более из трех пептидных петель (обозначенных BC, DE и FG), соединяющих β-цепи на закрытом конце липокалина. В некоторых вариантах осуществления мутеин, полученный из липокалина слезной жидкости, липокалина NGAL или его гомолога, может иметь 1, 2, 3, 4 или более мутантных аминокислотных остатков в любом положении последовательности в N-концевой области и/или в трех пептидных петлях BC, DE и FG, расположенных на конце β-цилиндрической структуры, противоположной естественному связывающему карману липокалина. В некоторых вариантах осуществления мутеин, полученный из липокалина слезной жидкости, липокалина NGAL или его гомолога, может не иметь мутированных аминокислотных остатков в пептидной петле DE, расположенной на конце β-цилиндрической структуры, по сравнению с последовательностью липокалина слезной жидкости дикого типа.
[00141] В некоторых вариантах осуществления мутеин липокалина согласно изобретению может включать один или более, например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или даже более мутированных аминокислотных остатков по сравнению с аминокислотной последовательностью соответствующего референсного липокалина (дикого типа), при условии, что такой мутеин липокалина должен быть способен связываться с CD137. В некоторых вариантах осуществления мутеин липокалина согласно изобретению включает по меньшей мере два, включая 2, 3, 4, 5 или даже более, мутированных аминокислотных остатков, где нативный аминокислотный остаток соответствующего референсного липокалина (дикого типа) замещен остатком аргинина.
[00142] Рассматриваются любые типы и количества мутаций, включая замены, делеции и вставки, при условии, что полученный мутеин липокалина сохраняет свою способность связывать CD137 и/или обладает по меньшей мере 60%, например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, или более высокой идентичностью последовательности с аминокислотной последовательностью референсного липокалина (дикого типа), например, зрелого hTlc или зрелого hNGAL.
[00143] В некоторых вариантах осуществления замена представляет собой консервативную замену. В некоторых вариантах осуществления замена представляет собой неконсервативную замену или одну или более из приведенных ниже иллюстративных замен.
[00144] В частности, чтобы определить, соответствует ли аминокислотный остаток в аминокислотной последовательности мутеина липокалина, отличающийся от референсного липокалина (дикого типа), определенному положению в аминокислотной последовательности референсного липокалина (дикого типа), специалист может использовать средства и методы, хорошо известные в данной области техники, например, выравнивания, вручную или с использованием компьютерных программ, таких как BLAST 2.0, что расшифровывается как средство поиска основного локального выравнивания, или ClustalW, или любой другой подходящей программы, которая подходит для генерации выравниваний последовательностей. Соответственно, аминокислотная последовательность референсного липокалина (дикого типа) может служить «рассматриваемой последовательностью» или «референсной последовательностью», в то время как аминокислотная последовательность мутеина липокалина служит «искомой последовательностью» (см. также выше).
[00145] Консервативные замены обычно представляют собой следующие замены, перечисленные в соответствии с подлежащей мутации аминокислотой, за каждой из которых следует одна или более замен, которые можно считать консервативными: Ala → Ser, Thr или Val; Arg → Lys, Gln, Asn или His; Asn → Gln, Glu, Asp или His; Asp → Glu, Gln, Asn или His; Gln → Asn, Asp, Glu или His; Glu → Asp, Asn, Gln или His; His → Arg, Lys, Asn, Gln, Asp или Glu; Ile → Thr, Leu, Met, Phe, Val, Trp, Tyr, Ala или Pro; Leu → Thr, Ile, Val, Met, Ala, Phe, Pro, Tyr или Trp; Lys → Arg, His, Gln или Asn; Met → Thr, Leu, Tyr, Ile, Phe, Val, Ala, Pro или Trp; Phe → Thr, Met, Leu, Tyr, Ile, Pro, Trp, Val или Ala; Ser → Thr, Ala или Val; Thr → Ser, Ala, Val, Ile, Met, Val, Phe, Pro или Leu; Trp → Tyr, Phe, Met, Ile или Leu; Tyr → Trp, Phe, Ile, Leu или Met; Val → Thr, Ile, Leu, Met, Phe, Ala, Ser или Pro. Другие замены также допустимы и могут быть определены эмпирически или в соответствии с другими известными консервативными или неконсервативными заменами. В качестве дополнительного ориентира каждая из следующих групп содержит аминокислоты, которые обычно можно использовать для определения консервативных замен друг друга:
(a) Аланин (Ala), серин (Ser), треонин (Thr), валин (Val)
(b) Аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), аспарагин (Asn), гистидин (His)
(c) Аргинин (Arg), лизин (Lys), глутамин (Gln), аспарагин (Asn), гистидин (His)
(d) Изолейцин (Ile), лейцин (Leu), метионин (Met), валин (Val), аланин (Ala), фенилаланин (Phe), треонин (Thr), пролин (Pro)
(e) Изолейцин (Ile), лейцин (Leu), метионин (Met), фенилаланин (Phe), тирозин (Tyr), триптофан (Trp).
[00146] Если такие консервативные замены приводят к изменению биологической активности, могут быть внесены более существенные изменения, такие как следующие, или как дополнительно описано ниже со ссылкой на классы аминокислот, и продукты могут быть подвергнуты скринингу на наличие желаемых характеристик. Примерами таких более существенных изменений являются: Ala → Leu или Phe; Arg → Glu; Asn → Ile, Val или Trp; Asp → Met; Cys → Pro; Gln → Phe; Glu → Arg; His → Gly; Ile → Lys, Glu или Gln; Leu → Lys или Ser; Lys → Tyr; Met → Glu; Phe → Glu, Gln или Asp; Trp → Cys; Tyr → Glu или Asp; Val → Lys, Arg, His.
[00147] В некоторых вариантах осуществления существенные модификации физических и биологических свойств липокалина (мутеина) достигаются путем выбора замен, которые значительно различаются по своему влиянию на поддержание (а) структуры полипептидного остова в области замены, например, в виде листовой или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом сайте, или (c) объема боковой цепи.
[00148] Природные остатки делятся на группы на основе общих свойств боковой цепи: (1) гидрофобные: метионин, аланин, валин, лейцин, изолейцин; (2) нейтральные гидрофильные: цистеин, серин, треонин, аспарагин, глутамин; (3) кислые: аспарагиновая кислота, глутаминовая кислота; (4) основные: гистидин, лизин, аргинин; (5) остатки, влияющие на ориентацию цепи: глицин, пролин; и (6) ароматические: триптофан, тирозин, фенилаланин. В некоторых вариантах осуществления замены могут повлечь за собой замену члена одного из этих классов на другой класс.
[00149] Любой остаток цистеина, не участвующий в поддержании надлежащей конформации соответствующего липокалина, также может быть заменен, обычно серином, для улучшения окислительной устойчивости молекулы и предотвращения аберрантного перекрестного связывания. И наоборот, цистеиновая связь (связи) может быть добавлена к липокалину для улучшения его стабильности.
D. Иллюстративные CD137-специфические мутеины липокалина согласно изобретению.
[00150] Как отмечалось выше, липокалин представляет собой полипептид, определяемый его супервторичной структурой, а именно, супервторичной структурной областью цилиндрического β-складчатого листа, содержащей восемь β-цепей, соединенных попарно четырьмя петлями на одном конце, образуя, таким образом, связывающий карман. Настоящее описание не ограничивается мутеинами липокалина, конкретно раскрытыми в настоящем документе. В этой связи изобретение относится к мутеину липокалина, имеющему супервторичную структурную область цилиндрического β-складчатого листа, содержащую восемь β-цепей, соединенных попарно четырьмя петлями на одном конце, образуя, таким образом, связывающий карман, в котором по меньшей мере одна аминокислота каждой из по меньшей мере трех из четырех указанных петель была мутирована, и где указанный липокалин эффективен для связывания CD137 с обнаружимой аффинностью.
[00151] В некоторых вариантах осуществления мутеины липокалина, раскрытые в настоящем документе, могут представлять собой или содержать мутеин зрелого человеческого липокалина слезной жидкости (hTlc). Мутеин зрелого hTlc может называться в настоящем документе «мутеином hTlc». В некоторых других вариантах осуществления мутеин липокалина, раскрытый в настоящем документе, представляет собой мутеин зрелого человеческого липокалина, ассоциированного с желатиназой нейтрофилов (hNGAL). Мутеин зрелого hNGAL может называться в настоящем документе «мутеином hNGAL».
[00152] В одном из аспектов настоящее изобретение включает любое количество мутеинов липокалина, полученных из референсного липокалина (дикого типа), предпочтительно полученных из зрелого hTlc или зрелого hNGAL, которые связывают CD137 с обнаружимой аффинностью. В связанном аспекте изобретение включает различные мутеины липокаинов, способные активировать нисходящие сигнальные пути CD137 путем связывания с CD137. В этом смысле CD137 можно рассматривать как неприродную мишень референсного липокалина (дикого типа), предпочтительно hTlc или hNGAL, где «неприродная мишень» относится к веществу, которое не связывается с референсным липокалином (дикого типа) при физиологических условиях. Путем генетической модификации референсных липокалинов (дикого типа) с помощью одной или более мутаций в определенных положениях последовательности авторы настоящего изобретения продемонстрировали, что возможно достижение высокой аффинности и высокой специфичности к неприродной мишени, CD137. В некоторых вариантах осуществления в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или даже более триплетах нуклеотидов, кодирующих определенные положения последовательности в липокалинах дикого типа, может быть осуществлен случайный мутагенез путем замены подмножества нуклеотидных триплетов в этих положениях с целью создания мутеина липокалина, способного связывать CD137.
[00153] В некоторых вариантах осуществления мутеины липокалинов согласно изобретению могут иметь мутацию, включая замену, делецию и вставку аминокислотного остатка(ов) в одном или более положениях последовательности, соответствующих линейной полипептидной последовательности референсного липокалина, предпочтительно hTlc или hNGAL. В некоторых вариантах осуществления количество аминокислотных остатков мутеина липокалина согласно изобретению, которые являются мутированными по сравнению с аминокислотной последовательностью референсного липокалина, предпочтительно hTlc или hNGAL, составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более, например, 25, 30, 35, 40, 45 или 50, где 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 является предпочтительным, а 9, 10 или 11 даже более предпочтительным. Однако предпочтительно, чтобы мутеин липокалина согласно изобретению оставался способным связывать CD137.
[00154] В некоторых вариантах осуществления в мутеине липокалина согласно настоящему изобретению может отсутствовать 1, 2, 3, 4 или более аминокислот на его N-конце и/или 1, 2 или более аминокислот на его C-конце, по сравнению с соответствующим референсным липокалином (дикого типа); например, SEQ ID NO: 34-40. В некоторых вариантах осуществления настоящее изобретение охватывает мутеины hTlc, как определено выше, в которых первые один, два, три или четыре N-концевых аминокислотных остатка последовательности зрелого hTlc (His-His-Leu-Leu; положения 1-4) и/или последние один или два C-концевых аминокислотных остатка (Ser-Asp; положения 157-158) линейной полипептидной последовательности зрелого hTlc были подвергнуты делеции (например, SEQ ID NO: 34-40). В некоторых вариантах осуществления настоящее изобретение охватывает мутеины hNGAL, как определено выше, в которых аминокислотные остатки (Lys-Asp-Pro, положения 46-48) линейной полипептидной последовательности зрелого hNGAL были подвергнуты делеции (SEQ ID NO: 45). Кроме того, мутеин липокалина согласно изобретению может включать (природную) аминокислотную последовательность дикого типа референсного липокалина (дикого типа), предпочтительно hTlc или hNGAL, вне мутированных положений аминокислотной последовательности.
[00155] В некоторых вариантах осуществления один или более мутированных аминокислотных остатков, включенных в мутеин липокалина согласно изобретению, существенно не затрудняют или не препятствуют связывающей активности к выбранной мишени и фолдингу мутеина. Такие мутации, включая замену, делецию и вставку, могут быть выполнены на уровне ДНК с использованием принятых стандартных методов (Sambrook and Russell, 2001, Molecular cloning: a laboratory manual). В некоторых вариантах осуществления мутированный аминокислотный остаток (остатки) в одном или более положениях последовательности, соответствующих линейной полипептидной последовательности референсного липокалина (дикого типа), предпочтительно hTlc или hNGAL, введен посредством случайного мутагенеза путем замены триплета(ов) нуклеотидов, кодирующих соответствующие положения последовательности референсного липокалина, подмножеством триплетов нуклеотидов.
[00156] В некоторых вариантах осуществления предложенный мутеин липокалина, который связывается с CD137 с обнаружимой аффинностью, может включать по меньшей мере одну аминокислотную замену нативного остатка цистеина другой аминокислотой, например, остатком серина. В некоторых вариантах осуществления мутеин липокалина, который связывает CD137 с обнаружимой аффинностью, может включать один или более ненативных остатков цистеина, заменяющих одну или более аминокислот референсного липокалина (дикого типа), предпочтительно hTlc или hNGAL. В некоторых вариантах осуществления мутеин липокалина согласно изобретению включает по меньшей мере две аминокислотные замены нативной аминокислоты остатком цистеина, чтобы образовать таким образом один или более цистеиновых мостиков. В некоторых вариантах осуществления указанный цистеиновый мостик может соединять по меньшей мере две петлевые области. Определение этих областей используется в настоящем документе в соответствии с (Biochim Biophys Acta, 2000), Flower (1996) и Breustedt et al. (2005).
[00157] Как правило, мутеин липокалина согласно изобретению может обладать по меньшей мере 70%, в том числе по меньшей мере приблизительно 80%, например, по меньшей мере приблизительно 85% идентичностью аминокислотной последовательности с аминокислотной последовательностью зрелого hTlc (SEQ ID NO: 1) или зрелого hNGAL (SEQ ID NO: 2).
[00158] В некоторых аспектах настоящего изобретения предложены CD137-связывающие мутеины hTlc. В этом отношении в изобретении предложены один или более мутеинов hTlc, способных связывать CD137 с аффинностью, измеряемой посредством KD, равной приблизительно 300 нМ, 200 нМ, 150 нМ, 100 нМ или ниже. В некоторых вариантах осуществления предложенные мутеины hTlc способны связывать CD137 со значением EC50 приблизительно 250 нМ, 150 нМ, 100 нМ, 50 нМ, 20 нМ или даже ниже. В некоторых других вариантах осуществления CD137-связывающие мутеины hTlc могут обладать перекрестной реактивностью с CD137 яванского макака (cyCD137).
[00159] В некоторых вариантах осуществления мутеин hTlc согласно изобретению может препятствовать связыванию CD137L с CD137.
[00160] В некоторых вариантах осуществления предложенные мутеины hTlc могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 5, 26-31, 33-34, 42, 46, 52, 56, 58, 60-61, 65, 71, 85, 94, 101, 104-106, 108, 111, 114, 121, 133, 148, 150 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1).
[00161] В некоторых вариантах осуществления предложенные мутеины hTlc могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 26-34, 55-58, 60-61, 65, 104-106 и 108 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1).
[00162] В некоторых вариантах осуществления предложенные мутеины hTlc могут дополнительно содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 101, 111, 114 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1).
[00163] В некоторых вариантах осуществления предложенные мутеины hTlc могут содержать мутированный аминокислотный остаток в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или даже более положениях, соответствующих положениям 5, 26-31, 33-34, 42, 46, 52, 56, 58, 60-61, 65, 71, 85, 94, 101, 104-106, 108, 111, 114, 121, 133, 148, 150 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1). В некоторых предпочтительных вариантах осуществления предложенные мутеины hTlc способны связывать CD137, в частности, человеческий CD137.
[00164] В некоторых вариантах осуществления предложенные мутеины hTlc могут содержать мутированный аминокислотный остаток в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или даже более положениях, соответствующих положениям 26-34, 55-58, 60-61, 65, 104-106 и 108 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1). В некоторых предпочтительных вариантах осуществления предложенные мутеины hTlc способны связывать CD137, в частности, человеческий CD137.
[00165] В некоторых вариантах осуществления мутеин липокалина согласно изобретению может включать по меньшей мере одну аминокислотную замену нативного остатка цистеина, например, остатком серина. В некоторых вариантах осуществления мутеин hTlc согласно изобретению включает аминокислотную замену нативного остатка цистеина в положениях, соответствующих положениям 61 и/или 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), другой аминокислотой, такой как остаток серина. В этом контексте следует отметить, что было обнаружено, что удаление структурной дисульфидной связи (на уровне соответствующей наивной библиотеки нуклеиновых кислот) hTlc дикого типа, которая образована остатками цистеина 61 и 153 (cf. Breustedt et al., J Biol Chem, 2005), может обеспечить мутеины hTlc, которые не только стабильно свернуты, но также способны связывать выбранную неприродную мишень с высокой аффинностью. В некоторых вариантах осуществления устранение структурной дисульфидной связи может обеспечить дополнительное преимущество, состоящее в возможности создания или преднамеренного введения неприродных дисульфидных связей в мутеины согласно изобретению, что повышает стабильность мутеинов. Однако мутеины hTlc, которые связывают CD137 и которые имеют дисульфидный мостик, образованный между Cys 61 и Cys 153, также являются частью настоящего изобретения.
[00166] В некоторых частных вариантах осуществления мутеин hTlc согласно изобретению может включать одну или более аминокислотных замен Cys 61 → Ala, Phe, Lys, Arg, Thr, Asn, Gly, Gln, Asp, Asn, Leu, Tyr, Met, Ser, Pro или Trp и/или Cys 153 → Ser или Ala, в положениях, соответствующих положениям 61 и/или 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1).
[00167] В некоторых вариантах осуществления либо два, либо все три цистеиновых кодона в положениях, соответствующих положениям 61, 101 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), заменены кодоном другой аминокислоты. Кроме того, в некоторых вариантах осуществления мутеин hTlc согласно изобретению включает аминокислотную замену нативного остатка цистеина в положении, соответствующем положению 101 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), остатком серина или гистидина.
[00168] В некоторых вариантах осуществления мутеин согласно изобретению содержит аминокислотную замену нативной аминокислоты остатком цистеина в положениях, соответствующих положениям 28 или 105 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1). Кроме того, в некоторых вариантах осуществления мутеин согласно изобретению содержит аминокислотную замену нативного остатка аргинина в положении, соответствующем положению 111 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), остатком пролина. Кроме того, в некоторых вариантах осуществления мутеин согласно изобретению содержит аминокислотную замену нативного остатка лизина в положении, соответствующем положению 114 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), остатком триптофана или глутаминовой кислоты.
[00169] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hTlc могут содержать в одном или более положениях, соответствующих положениям 5, 26-31, 33-34, 42, 46, 52, 56, 58, 60-61, 65, 71, 85, 94, 101, 104-106, 108, 111, 114, 121, 133, 148, 150 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), один или более из следующих мутированных аминокислотных остатков: Ala 5 → Val или Thr; Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Thr 42 → Ser; Gly 46 → Asp; Lys 52 → Glu; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Lys 65 → Arg или Asn; Thr 71 → Ala; Val 85 → Asp; Lys 94 → Arg или Glu; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Lys 121 → Glu; Ala 133 → Thr; Arg 148 → Ser; Ser 150 → Ile; и Cys 153 → Ser. В некоторых вариантах осуществления мутеин hTlc согласно изобретению содержит два или более, например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или более, или даже все мутированные аминокислотные остатки в этих положениях последовательности зрелого hTlc (SEQ ID NO: 1).
[00170] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hTlc могут содержать один из следующих наборов мутированных аминокислотных остатков по сравнению с линейной полипептидной последовательностью зрелого hTlc (SEQ ID NO: 1):
(a) Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; и Cys 153 → Ser;
(b) Ala 5 → Thr; Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Lys 65 → Arg; Val 85 → Asp; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Lys 121 → Glu; Ala 133 → Thr; и Cys 153 → Ser;
(c) Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Lys 65 → Asn; Lys 94 → Arg; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Lys 121 → Glu; Ala 133 → Thr; и Cys 153 → Ser;
(d) Ala 5 → Val; Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Lys 65 → Arg; Lys 94 → Glu; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Lys 121 → Glu; Ala 133 → Thr; и Cys 153 → Ser;
(e) Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Thr 42 → Ser; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Ser 150 → Ile; и Cys 153 → Ser;
(f) Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Lys 52 → Glu; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Thr 71 → Ala; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Ala 133 → Thr; Arg 148 → Ser; Ser 150 → Ile; и Cys 153 → Ser; и
(g) Ala 5 → Thr; Arg 26 → Glu; Glu 27 → Gly; Phe 28 → Cys; Pro 29 → Arg; Glu 30 → Pro; Met 31 → Trp; Leu 33 → Ile; Glu 34 → Phe; Gly 46 → Asp; Leu 56 → Ala; Ser 58 → Asp; Arg 60 → Pro; Cys 61 → Ala; Thr 71 → Ala; Cys 101 → Ser; Glu 104 → Val; Leu 105 → Cys; His 106 → Asp; Lys 108 → Ser; Arg 111 → Pro; Lys 114 → Trp; Ser 150 → Ile; и Cys 153 → Ser.
[00171] В некоторых вариантах осуществления остаточная область, то есть область, отличная от положений, соответствующих положениям 5, 26-31, 33-34, 42, 46, 52, 56, 58, 60-61, 65, 71, 85, 94, 101, 104-106, 108, 111, 114, 121, 133, 148, 150 и 153 линейной полипептидной последовательности зрелого hTlc (SEQ ID NO: 1), в мутеине hTlc согласно изобретению может содержать (природную) аминокислотную последовательность дикого типа линейной полипептидной последовательности зрелого hTlc вне мутированных положений аминокислотной последовательности.
[00172] В некоторых вариантах осуществления мутеин hTlc согласно изобретению обладает по меньшей мере 70% идентичностью последовательности или по меньшей мере 70% гомологией последовательности с последовательностью зрелого hTlc (SEQ ID NO: 1). В качестве иллюстративного примера мутеин SEQ ID NO: 34 обладает идентичностью аминокислотной последовательности или гомологией последовательности, равной приблизительно 84%, с аминокислотной последовательностью зрелого hTlc.
[00173] В некоторых вариантах осуществления мутеин hTlc согласно изобретению содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 34-40, или ее фрагмент или вариант.
[00174] В некоторых вариантах осуществления мутеин hTlc согласно изобретению обладает по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или более высокой идентичностью последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 34-40.
[00175] Настоящее изобретение также включает структурные гомологи мутеина hTlc, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 34-40, причем структурные гомологи обладают гомологией или идентичностью аминокислотной последовательности относительно указанного мутеина hTlc, равной более приблизительно 60%, предпочтительно более 65%, более 70%, более 75%, более 80%, более 85%, более 90%, более 92% и наиболее предпочтительно более 95%.
[00176] В некоторых аспектах настоящего изобретения предложены CD137-связывающие мутеины hNGAL. В этом отношении в изобретении предложены один или более мутеинов hNGAL, способных связывать CD137 с аффинностью, измеряемой посредством KD, равной приблизительно 800 нМ, 700 нМ, 200 нМ, 140 нМ, 100 нМ или ниже, предпочтительно приблизительно 70 нМ, 50 нМ, 30 нМ, 10 нМ, 5 нМ, 2 нМ, или даже ниже. В некоторых вариантах осуществления предложенные мутеины hNGAL способны связывать CD137 со значением EC50 приблизительно 1000 нМ, 500 нМ, 100 нМ, 80 нМ, 50 нМ, 25 нМ, 18 нМ, 15 нМ, 10 нМ, 5 нМ или ниже.
[00177] В некоторых вариантах осуществления CD137-связывающие мутеины hNGAL могут обладать перекрестной реактивностью с CD137 яванского макака. В некоторых вариантах осуществления предложенные мутеины hNGAL способны связывать CD137 яванского макака с аффинностью, измеряемой посредством KD, равной приблизительно 50 нМ, 20 нМ, 10 нМ, 5 нМ, 2 нМ или даже ниже. В некоторых вариантах осуществления предложенные мутеины hNGAL способны связывать CD137 яванского макака со значением EC50 приблизительно 100 нМ, 80 нМ, 50 нМ, 30 нМ или даже ниже.
[00178] В некоторых вариантах осуществления мутеин hNGAL согласно изобретению может препятствовать связыванию CD137L с CD137 или конкурировать за него. В некоторых других вариантах осуществления мутеин hNGAL согласно изобретению может быть способен связывать CD137 в присутствии CD137L и/или связывать комплекс CD137/CD137L.
[00179] В некоторых вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 87, 94, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2).
[00180] В некоторых вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или даже более положениях, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 87, 94, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2). В некоторых предпочтительных вариантах осуществления предложенные мутеины hNGAL способны связывать CD137, в частности, человеческий CD137.
[00181] В некоторых вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 87, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2). В некоторых предпочтительных вариантах осуществления предложенные мутеины hNGAL способны связывать CD137, в частности, человеческий CD137.
[00182] В некоторых вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 36, 87 и 96 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), и в одном или более положениях, соответствующих положениям 28, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 94, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2).
[00183] В некоторых других вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в одном или более положениях, соответствующих положениям 20, 25, 28, 33, 36, 40-41, 44, 49, 52, 59, 68, 70-73, 77-82, 87, 92, 96, 98, 100, 101, 103, 122, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2).
[00184] В других вариантах осуществления предложенные мутеины hNGAL могут содержать мутированный аминокислотный остаток в одном или более положениях 36, 40, 41, 49, 52, 68, 70, 72, 73, 77, 79, 81, 96, 100, 103, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), и в одном или более положениях, соответствующих положениям 20, 25, 33, 44, 59, 71, 78, 80, 82, 87, 92, 98, 101 и 122 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2).
[00185] В некоторых вариантах осуществления мутеин липокалина согласно изобретению может содержать по меньшей мере одну аминокислотную замену нативного остатка цистеина, например, остатком серина. В некоторых вариантах осуществления мутеин hNGAL согласно изобретению может содержать аминокислотную замену нативного остатка цистеина в положениях, соответствующих положениям 76 и/или 175 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), другой аминокислотой, такой как остаток серина. В этом контексте следует отметить, что было обнаружено, что удаление структурной дисульфидной связи (на уровне соответствующей наивной библиотеки нуклеиновых кислот) hNGAL дикого типа, которая образована остатками цистеина 76 и 175 (cf. Breustedt et al., J Biol Chem, 2005), может обеспечить мутеины hNGAL, которые не только стабильно свернуты, но также способны связывать выбранную неприродную мишень с высокой аффинностью. В некоторых вариантах осуществления устранение структурной дисульфидной связи может обеспечить дополнительное преимущество, состоящее в возможности создания или преднамеренного введения неприродных дисульфидных связей в мутеины согласно изобретению, что повышает стабильность мутеинов. Однако мутеины hNGAL, которые связывают CD137 и которые имеют дисульфидный мостик, образованный между Cys 76 и Cys 175, также являются частью настоящего изобретения.
[00186] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать в одном или более положениях, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 87, 94, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), один или более из следующих мутированных аминокислотных остатков. Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Arg или Lys; Gln 49 → Val, Ile, His, Ser или Asn; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Met, Ala или Gly; Leu 70 → Ala, Lys, Ser или Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Met, Arg, Thr или Asn; Trp 79 → Ala или Asp; Arg 81 → Met, Trp или Ser; Phe 83 → Leu; Cys 87 → Ser; Leu 94 → Phe; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu и Lys 134 → Tyr. В некоторых вариантах осуществления мутеин hNGAL согласно изобретению содержит два или более, например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, даже более, например, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или все мутированные аминокислотные остатки в этих положениях последовательности зрелого hNGAL (SEQ ID NO: 2).
[00187] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать в одном или более положениях, соответствующих положениям 20, 25, 28, 33, 36, 40-41, 44, 49, 52, 59, 68, 70-73, 77-82, 87, 92, 96, 98, 100, 101, 103, 122, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), один или более из следующих мутированных аминокислотных остатков. Gln 20 → Arg; Asn 25 → Tyr или Asp; Gln 28 → His; Val 33 → Ile; Leu 36 →Met; Ala 40 → Asn; Ile 41 → Leu; Glu 44 → Val или Asp; Gln 49 → His; Tyr 52 →Ser или Gly; Lys 59 → Asn; Ser 68 → Asp; Leu 70 → Met; Phe 71 → Leu; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln или His; Tyr 78 → His; Trp 79 → Ile; Ile 80 → Asn; Arg 81 → Trp или Gln; Thr 82 → Pro; Cys 87 → Ser; Phe 92 → Leu или Ser; Asn 96 → Phe; Lys 98 → Arg; Tyr 100 → Asp; Pro 101 → Leu; Leu 103 → His или Pro; Phe 122 → Tyr; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly.
[00188] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать в одном или более положениях, соответствующих положениям 36, 40, 41, 49, 52, 68, 70, 72, 73, 77, 79, 81, 96, 100, 103, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), один или более из следующих мутированных аминокислотных остатков. Leu 36 →Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 →Ser или Gly; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln или His; Trp 79 → Ile; Arg 81 → Trp или Gln; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His или Pro; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly. В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать в одном или более положениях, соответствующих положениям 20, 25, 33, 44, 59, 71, 78, 80, 82, 87, 92, 98, 101 и 122 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), один или более из следующих мутированных аминокислотных остатков. Gln 20 → Arg; Asn 25 → Tyr или Asp; Val 33 → Ile; Glu 44 → Val или Asp; Lys 59 → Asn; Phe 71 → Leu; Tyr 78 → His; Ile 80 → Asn; Thr 82 → Pro; Phe 92 → Leu или Ser; Lys 98 → Arg; Pro 101 → Leu; и Phe 122 → Tyr.
[00189] В некоторых вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать один из следующих наборов мутированных аминокислотных остатков по сравнению с линейной полипептидной последовательностью зрелого hNGAL (SEQ ID NO: 2):
(a) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Lys; Gln 49 → Asn; Tyr 52 → Met; Ser 68 → Gly; Leu 70 → Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Ala; Arg 81 → Ser; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(b) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Arg; Gln 49 → Ile; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Met; Leu 70 → Lys; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Met; Trp 79 → Asp; Arg 81 → Trp; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(c) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Arg; Gln 49 → Asn; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Ala; Leu 70 → Ala; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Asp; Arg 81 → Trp; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(d) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Lys; Gln 49 → Asn; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Ala; Leu 70 → Ala; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Asp; Arg 81 → Trp; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(e) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Lys; Gln 49 → Ser; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Gly; Leu 70 → Ser; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Ala; Arg 81 → Met; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(f) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Lys; Gln 49 → Val; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Gly; Leu 70 → Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Arg; Trp 79 → Asp; Arg 81 → Ser; Cys 87 → Ser; Leu 94 → Phe; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(g) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Arg; Gln 49 → His; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Gly; Leu 70 → Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Ala; Arg 81 → Ser; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr;
(h) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Lys; Gln 49 → Asn; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Gly; Leu 70 → Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Thr; Trp 79 → Ala; Arg 81 → Ser; Phe 83 → Leu; Cys 87 → Ser; Leu 94 → Phe; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr; или
(i) Gln 28 → His; Leu 36 → Gln; Ala 40 → Ile; Ile 41 → Arg; Gln 49 → Ser; Tyr 52 → Met; Asn 65 → Asp; Ser 68 → Ala; Leu 70 → Thr; Arg 72 → Asp; Lys 73 → Asp; Asp 77 → Asn; Trp 79 → Ala; Arg 81 → Ser; Cys 87 → Ser; Asn 96 → Lys; Tyr 100 → Phe; Leu 103 → His; Tyr 106 → Ser; Lys 125 → Phe; Ser 127 → Phe; Tyr 132 → Glu; и Lys 134 → Tyr.
[00190] В некоторых дополнительных вариантах осуществления в остаточной области, то есть области, отличной от положений 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 87, 94, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), мутеин hNGAL согласно изобретению может включать (природную) аминокислотную последовательность дикого типа зрелого hNGAL вне мутированных положений аминокислотной последовательности.
[00191] В некоторых других вариантах осуществления предложенные CD137-связывающие мутеины hNGAL могут содержать один из следующих наборов мутированных аминокислотных остатков по сравнению с линейной полипептидной последовательностью зрелого hNGAL (SEQ ID NO: 2):
(a) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Ser; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(b) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Ser; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Lys 98 → Arg; Tyr 100 → Asp; Pro 101 → Leu; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(c) Asn 25 → Tyr; Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Gly; Ser 68 → Asp; Leu 70 → Met; Phe 71 → Leu; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Gln; Phe 92 → Ser; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(d) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Gly; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Tyr 78 → His; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(e) Asn 25 → Asp; Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Gly; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(f) Val 33 → Ile; Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Gly; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(g) Gln 20 → Arg; Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Glu 44 → Val; Gln 49 → His; Tyr 52 → Gly; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Phe 122 → Tyr; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(h) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Ser; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Ile 80 → Asn; Arg 81 → Trp; Thr 82 → Pro; Asn 96 → Phe; Tyr 100 → Asp; Pro 101 → Leu; Leu 103 → Pro; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly;
(i) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Gln 49 → His; Tyr 52 → Gly; Lys 59 → Asn; Ser 68 → Asp; Leu 70 → Met; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → Gln; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly; и
(j) Leu 36 → Met; Ala 40 → Asn; Ile 41 → Leu; Glu 44 → Asp; Gln 49 → His; Tyr 52 → Ser; Ser 68 → Asp; Leu 70 → Met; Phe 71 → Leu; Arg 72 → Leu; Lys 73 → Asp; Asp 77 → His; Trp 79 → Ile; Arg 81 → Trp; Phe 92 → Leu; Asn 96 → Phe; Tyr 100 → Asp; Leu 103 → His; Lys 125 → Ser; Ser 127 → Ile; Tyr 132 → Trp; и Lys 134 → Gly.
[00192] В некоторых вариантах осуществления в остаточной области, то есть области, отличной от положений 20, 25, 28, 33, 36, 40-41, 44, 49, 52, 59, 68, 70-73, 77-82, 87, 92, 96, 98, 100, 101, 103, 122, 125, 127, 132 и 134 линейной полипептидной последовательности зрелого hNGAL (SEQ ID NO: 2), мутеин hNGAL согласно изобретению может включать (природную) аминокислотную последовательность дикого типа зрелого hNGAL вне мутированных положений аминокислотной последовательности.
[00193] В некоторых вариантах осуществления мутеин hNGAL согласно изобретению обладает по меньшей мере 70% идентичностью последовательности или по меньшей мере 70% гомологией последовательности с последовательностью зрелого hNGAL (SEQ ID NO: 2). В качестве иллюстративного примера мутеин SEQ ID NO: 42 обладает идентичностью аминокислотной последовательности или гомологией последовательности, равной приблизительно 87%, с аминокислотной последовательностью зрелого hNGAL.
[00194] В некоторых вариантах осуществления мутеин hNGAL согласно изобретению содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 41-59, или ее фрагмент или вариант.
[00195] В некоторых вариантах осуществления мутеин hNGAL согласно изобретению обладает по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или более высокой идентичностью последовательности с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 41-59.
[00196] Настоящее изобретение также включает структурные гомологи мутеина hNGAL, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41-59, причем структурные гомологи обладают гомологией или идентичностью аминокислотной последовательности относительно указанного мутеина hNGAL, равной приблизительно 60%, предпочтительно более 65%, более 70%, более 75%, более 80%, более 85%, более 90%, более 92% и наиболее предпочтительно более 95%.
[00197] В некоторых вариантах осуществления настоящего изобретения предложен мутеин липокалина, который связывает CD137 с аффинностью, измеряемой посредством KD, равной приблизительно 5 нМ или ниже, где мутеин липокалина обладает по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или более высокой идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 42.
[00198] В некоторых вариантах осуществления мутеин липокалина согласно настоящему изобретению может содержать гетерологичную аминокислотную последовательность на его N- или C-конце, предпочтительно C-конце, такую как метка Strep II tag (SEQ ID NO: 12) или последовательность сайта расщепления для некоторых ферментов рестрикции, не оказывающие влияния на биологическую активность мутеина липокалина (связывание с его мишенью, например, CD137).
[00199] В некоторых вариантах осуществления в мутеин липокалина могут быть введены дополнительные модификации для того, чтобы модулировать некоторые характеристики мутеина, например, для улучшения стабильности фолдинга, стабильности в сыворотке, устойчивости белка или растворимости в воде, или для уменьшения склонности к агрегации, или чтобы придать мутину новые характеристики. В некоторых вариантах осуществления модификация(и) может привести к модуляции двух или более (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) характеристик предложенного мутеина.
[00200] Например, можно мутировать одно или более положений аминокислотной последовательности мутеина липокалина, чтобы ввести новые реакционноспособные группы, например, для конъюгации с другими соединениями, такими как полиэтиленгликоль (ПЭГ), гидроксиэтилкрахмал (ГЭК), биотин, пептиды или белки, или для образования не встречающихся в природе дисульфидных связей. Конъюгированное соединение, например, ПЭГ и ГЭК, может в некоторых случаях увеличивать период полувыведения из сыворотки соответствующего мутеина липокалина.
[00201] В некоторых вариантах осуществления реакционноспособная группа мутеина липокалина может естественным образом содержаться в его аминокислотной последовательности, например, природные остатки цистеина в указанной аминокислотной последовательности. В некоторых других вариантах осуществления такая реакционноспособная группа может быть введена посредством мутагенеза. В случае, если реакционноспособная группа вводится посредством мутагенеза, одной из возможностей является мутация аминокислоты в соответствующем положении в остаток цистеина. Примеры таких возможных мутаций для введения остатка цистеина в аминокислотную последовательность мутеина hTlc включают замены Thr 40 → Cys, Glu 73 → Cys, Arg 90 → Cys, Asp 95 → Cys и Glu 131 → Cys последовательности hTlc дикого типа (SEQ ID NO: 1). Примеры таких возможных мутаций для введения остатка цистеина в аминокислотную последовательность мутеина hNGAL включают введение остатка цистеина в одно или более положений последовательности, которые соответствуют положениям 14, 21, 60, 84, 88, 116, 141, 145, 143, 146 или 158 последовательности hNGAL дикого типа (SEQ ID NO: 2).Образованный тиольный фрагмент может быть использован для ПЭГилирования или ГЭКилирования мутеина, например, для увеличения периода полувыведения из сыворотки соответствующего мутеина липокалина.
[00202] В некоторых вариантах осуществления, чтобы обеспечить подходящие боковые цепи аминокислот в качестве новых реакционноспособных групп для конъюгирования одного из вышеуказанных соединений с мутеином липокалина, в аминокислотную последовательность мутеина липокалина могут быть введены искусственные аминокислоты. Обычно такие искусственные аминокислоты предназначены для того, чтобы быть более реакционноспособными и, таким образом, облегчить конъюгацию с желаемым соединением. Такие искусственные аминокислоты могут быть введены путем мутагенеза, например, с использованием искусственной тРНК может быть введен пара-ацетилфенилаланин.
[00203] В некоторых вариантах осуществления мутеин липокалина согласно изобретению слит на его N-конце или его C-конце с белком, белковым доменом или пептидом, например, антителом, сигнальной последовательностью и/или аффинной меткой. В некоторых других вариантах осуществления мутеин липокалина согласно изобретению конъюгирован на его N-конце или его C-конце с партнером, представляющим собой белок, белковый домен или пептид, например, антитело, сигнальную последовательность и/или аффинную метку.
[00204] Аффинные метки, такие как метка Strep-tag или метка Strep-tag II (Schmidt et al., J Mol Biol, 1996), метка c-myc, FLAG-метка, His-метка или HA-метка, или белки, такие как глутатион-S-трансфераза, которые позволяют легко обнаруживать и/или очищать рекомбинантные белки, являются примерами подходящих партнеров по слиянию. Белки с хромогенными или флуоресцентными свойствами, такие как зеленый флуоресцентный белок (GFP) или желтый флуоресцентный белок (YFP), также являются подходящими партнерами по слиянию для мутеинов липокалина согласно изобретению. В целом мутеины липокалина согласно изобретению могут быть мечены любым подходящим химическим веществом или ферментом, который прямо или опосредованно генерирует детектируемое соединение или сигнал в химической, физической, оптической или ферментативной реакции. Например, флуоресцентная или радиоактивная метка может быть конъюгирована с мутеином липокалина для генерации флуоресценции или рентгеновских лучей в качестве детектируемого сигнала. Щелочная фосфатаза, пероксидаза хрена и β-галактозидаза являются примерами ферментных меток (и в то же время оптических меток), которые катализируют образование хромогенных продуктов реакции. В целом все метки, обычно используемые для антител (за исключением меток, используемых исключительно с сахарным фрагментом в Fc-части иммуноглобулинов), также можно использовать для конъюгации с мутеинами липокалина согласно изобретению.
[00205] В некоторых вариантах осуществления мутеин липокалина согласно изобретению может быть слит или конъюгирован с фрагментом, который продлевает период полувыведения мутеина из сыворотки (в этой связи см. также публикацию международной патентной заявки WO 2006/056464, где описаны такие стратегии с ссылкой на мутеины человеческого липокалина, ассоциированного с желатиназой нейтрофилов (hNGAL), с аффинностью связывания с CTLA-4). Фрагмент, продлевающий период полувыведения из сыворотки, может представлять собой, например, молекулу ПЭГ, молекулу ГЭК, молекулу жирной кислоты, такую как пальмитиновая кислота (Vajo and Duckworth, Pharmacol Rev, 2000), Fc-часть иммуноглобулина, домен CH3 иммуноглобулина, домен CH4 иммуноглобулина, альбумин-связывающий пептид, альбумин-связывающий белок или трансферрин.
[00206] В некоторых вариантах осуществления, если в качестве партнера по конъюгации используется ПЭГ, молекула ПЭГ может быть замещенной, незамещенной, линейной или разветвленной. Он также может представлять собой активированное производное полиэтилена. Примерами подходящих соединений являются молекулы ПЭГ, как описано в публикации международной патентной заявки WO 1999/64016, в патенте США № 6,177,074 или в патенте США № 6,403,564 в отношении интерферона, или как описано для других белков, таких как ПЭГ-модифицированная аспарагиназа, ПЭГ-аденозиндезаминаза (ПЭГ-АДА) или ПЭГ-супероксиддисмутаза (Fuertges and Abuchowski, Journal of Controlled Release, 1990). Молекулярная масса такого полимера, такого как полиэтиленгликоль, может находиться в диапазоне от приблизительно 300 до приблизительно 70 000 дальтон, включая, например, полиэтиленгликоль с молекулярной массой приблизительно 10 000, приблизительно 20 000, приблизительно 30 000 или приблизительно 40 000 дальтон. Более того, как, например, описано в патентах США № 6,500,930 или 6,620,413, углеводные олигомеры и полимеры, такие как ГЭК, могут быть конъюгированы с мутеином согласно изобретению с целью увеличения периода полувыведения из сыворотки.
[00207]v В некоторых вариантах осуществления, если Fc-часть иммуноглобулина используется с целью увеличения периода полувыведения из сыворотки мутеинов липокалинов согласно изобретению, может быть использована технология SynFusion™, коммерчески доступная от Syntonix Pharmaceuticals, Inc. (Массачусетс, США). Использование этой технологии Fc-слияния позволяет создавать биофармацевтические препараты длительного действия и может, например, состоять из двух копий мутеина, связанного с Fc-областью антитела, для улучшения фармакокинетики, растворимости и эффективности производства.
[00208] Примерами альбумин-связывающих пептидов, которые могут быть использованы для увеличения периода полувыведения из сыворотки мутеина липокалина, являются, например, пептиды, имеющие консенсусную последовательность Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Xaa2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Xaa3 представляет собой Ala, Asp, Phe, Trp или Tyr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, как описано в патентной публикации US 20030069395 или в Dennis et al. (2002).Альбумин-связывающий белок, слитый или конъюгированный с мутеином липокалина для увеличения периода полувыведения из сыворотки, может представлять собой бактериальный альбумин-связывающий белок, антитело, фрагмент антитела, включая доменные антитела (см., например, патент США 6,696,245), или мутеин липокалина со связывающей активностью к альбумину. Примеры бактериальных альбумин-связывающих белков включают стрептококковый белок G (Konig and Skerra, J Immunol Methods, 1998).
[00209] В некоторых вариантах осуществления, если альбумин-связывающий белок представляет собой фрагмент антитела, он может представлять собой доменное антитело. Доменные антитела (dAb) сконструированы для точного контроля биофизических свойств и периода полувыведения in vivo для создания оптимального профиля безопасности и эффективности продукта. Доменные антитела, например, коммерчески доступны от Domantis Ltd. (Кембридж, Великобритания и Массачусетс, США).
[00210] В некоторых вариантах осуществления в качестве партнера мутеина липокалина согласно изобретению для увеличения периода полувыведения из сыворотки может быть использован альбумин как таковой (Osborn et al., J Pharmacol Exp Ther, 2002) или биологически активный фрагмент альбумина. Термин «альбумин» включает все альбумины млекопитающих, такие как человеческий сывороточный альбумин, или бычий сывороточный альбумин, или крысиный альбумин. Альбумин или его фрагмент могут быть получены рекомбинантно, как описано в патенте США № 5,728,553 или европейских патентных публикациях EP0330451 и EP0361991. Соответственно, рекомбинантный человеческий альбумин (например, Recombumin® от Novozymes Delta Ltd., Ноттингем, Великобритания) может быть конъюгирован или слит с мутеином липокалина согласно изобретению.
[00211] В некоторых вариантах осуществления, если в качестве партнера для увеличения периода полувыведения из сыворотки мутеинов липокалинов согласно изобретению используется трансферрин, мутеины могут быть генетически слиты с N- или C-концом, или с обоими, негликозилированного трансферрина. Негликозилированный трансферрин имеет период полувыведения 14-17 дней, и слитый с трансферрином белок аналогичным образом будет иметь увеличенный период полувыведения. Трансферрин в качестве носителя также обеспечивает высокую биодоступность, биораспределение и стабильность в кровотоке. Эта технология коммерчески доступна от BioRexis (BioRexis Pharmaceutical Corporation, Пенсильвания, США). Рекомбинантный человеческий трансферин (DeltaFerrin™) для применения в качестве стабилизатора белка/партнера для увеличения периода полувыведения также коммерчески доступен от Novozymes Delta Ltd. (Ноттингем, Великобритания).
[00212] Еще одним вариантом продления периода полувыведения мутеинов липокалинов согласно изобретению является слияние с N- или С-концом мутеина длинных, неструктурированных, гибких богатых глицином последовательностей (например, полиглицина с приблизительно 20-80 последовательно расположенными остатками глицина). Этот подход, раскрытый, например, в международной патентной публикации WO2007/038619, также был назван «рПЭГ» (рекомбинантная ПЭГ).
E. Примеры вариантов и областей применения слитых белков, специфичных к CD137 и PD-L1
[00213] В некоторых вариантах осуществления слитые белки согласно изобретению могут обеспечивать синергетический эффект посредством двойного нацеливания на CD137 и PD-L1.В некоторых вариантах осуществления слитые белки согласно изобретению могут обеспечивать синергетический эффект посредством костимуляции CD137 и блокады сигнального пути PD-1/PD-L1.В некоторых вариантах осуществления слитые белки согласно изобретению могут обеспечивать локализованное противоопухолевое действие посредством двойного нацеливания на CD137 и PD-L1.Таким образом, существует множество возможных вариантов медицинского применения слитых белков согласно изобретению.
[00214] В некоторых вариантах осуществления настоящее изобретение относится к применению одного или более слитых белков, раскрытых в настоящем документе, или одной или более композиций, содержащих такие слитые белки, для одновременного связывания CD137 и PD-L1.
[00215] Настоящее изобретение также включает применение одного или более описанных слитых белков для образования комплекса с CD137 и/или PD-L1.
[00216] Следовательно, в одном из аспектов изобретения предложенные слитые белки могут применяться для обнаружения CD137 и PD-L1. Такое применение может включать в себя стадии приведения одного или более указанных слитых белков, в подходящих условиях, в контакт с образцом, предположительно содержащим CD137 и/или PD-L1, тем самым обеспечивая возможность образования комплекса между слитыми белками и CD137 и/или PD-L1, и обнаружение комплекса с помощью подходящего сигнала. Детектируемый сигнал может быть вызван меткой, как объяснено выше, или изменением физических свойств из-за связывания, т. е. образованием комплекса как таковым. Одним из примеров является поверхностный плазмонный резонанс, значение которого изменяется во время связывания партнеров по связыванию, один из которых иммобилизован на поверхности, такой как золотая фольга.
[00217] Слитые белки согласно изобретению могут быть также использованы для разделения CD137 и/или PD-L1. Такое применение может включать в себя стадии приведения одного или более указанных слитых белков, в подходящих условиях, в контакт с образцом, предположительно содержащим CD137 и/или PD-L1, тем самым обеспечивая возможность образования комплекса между слитыми белками и CD137 и/или PD-L1, и отделение комплекса от образца.
[00218] В некоторых аспектах настоящего изобретения предложены диагностические и/или аналитические наборы, содержащие один или более слитых белков согласно изобретению.
[00219] Помимо применения в диагностике в еще одном аспекте изобретения рассматриваются фармацевтические композиции, содержащие один или более слитых белков согласно изобретению и фармацевтически приемлемое вспомогательное вещество.
[00220] Кроме того, в некоторых вариантах осуществления настоящего изобретения предложены слитые белки, одновременно связывающие CD137 и/или PD-L1, для применения в качестве противоопухолевых и/или противоинфекционных агентов, а также иммуномодуляторов. В некоторых вариантах осуществления предусмотрено применение слитых белков согласно настоящему изобретению в способе предупреждения, облегчения или лечения заболеваний человека, таких как различные раковые заболевания, в том числе PD-L1-положительные раковые заболевания. Соответственно, также предложены способы предупреждения, облегчения или лечения заболеваний человека, таких как различные раковые заболевания, в том числе PD-L1-положительные раковые заболевания, у нуждающегося в этом субъекта, включающие введение указанному субъекту терапевтически эффективного количества одного или более слитых белков согласно изобретению.
[00221] Примеры раковых заболеваний, подлежащих лечению с помощью слитых белков согласно изобретению, включают рак печени, рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, рак молочной железы, рак легкого, кожную или внутриглазную злокачественную меланому, рак почки, рак матки, рак яичника, колоректальный рак, рак ободочной кишки, рак прямой кишки, рак анальной области, рак желудка, рак яичка, рак матки, карциному маточных труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, неходжкинскую лимфому, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак уретры, рак полового члена, солидные опухоли детского возраста, лимфоцитарную лимфому, рак мочевого пузыря, рак почки или мочеточника, карциному почечной лоханки, новообразование центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухолевый ангиогенез, опухоль оси позвоночника, глиому ствола головного мозга, аденому гипофиза, саркому Капоши, эпидермоидный рак, плоскоклеточный рак, раковые заболевания, вызванные факторами окружающей среды, в том числе вызванные асбестом, гематологические злокачественные новообразования, включая, например, множественную миелому, В-клеточную лимфому, лимфому Ходжкина/первичную медиастинальную В-клеточную лимфому, неходжкинские лимфомы, острую миелоидную лимфому, хронический миелоидный лейкоз, хронический лимфолейкоз, фолликулярную лимфому, диффузную крупноклеточную B-клеточную лимфому, лимфому Беркитта, иммунобластную крупноклеточную лимфому, В-лимфобластную лимфому из клеток-предшественников, лимфому из клеток мантийной зоны, острый лимфобластный лейкоз, фунгоидный микоз, анапластическую крупноклеточную лимфому, Т-клеточную лимфому и T-лимфобластную лимфому из клеток-предшественников, а также любые комбинации указанных раковых заболеваний. В некоторых вариантах осуществления настоящее изобретение также применимо для лечения метастатических раковых заболеваний.
[00222] В некоторых вариантах осуществления слитые белки согласно изобретению могут одновременно нацеливаться на опухолевые клетки, в которых экспрессируется PD-L1, и активировать лимфоциты иммунной системы хозяина вблизи таких опухолевых клеток. В некоторых вариантах осуществления слитые белки согласно изобретению могут увеличивать направленную противоопухолевую активность Т-клеток, повышать противоопухолевый иммунитет и/или оказывать прямое ингибирующее действие на рост опухоли, тем самым обеспечивая синергетические противоопухолевые результаты. В некоторых вариантах осуществления слитые белки согласно изобретению могут активировать иммунные ответы в микроокружении опухоли. В некоторых вариантах осуществления слитые белки согласно изобретению могут снижать побочные действия эффекторных лимфоцитов на здоровые клетки, т. е. нецелевую токсичность, например, посредством локального ингибирования активности онкогена и индукции активации лимфоцитов.
[00223] В некоторых вариантах осуществления настоящее изобретение охватывает применение слитого белка согласно изобретению или композиции, содержащей предложенный слитый белок, для индукции локализованного ответа лимфоцитов вблизи PD-L1-положительных опухолевых клеток. Соответственно, в некоторых вариантах осуществления настоящее изобретение относится к способам индукции локализованного ответа лимфоцитов вблизи PD-L1-положительных опухолевых клеток, включающим применение одного или более слитых белков согласно изобретению или одной или более композиций, содержащих такие слитые белки. «Локализованный» означает, что при одновременном связывании Т-клеток посредством CD137 и взаимодействии с PD-L1-положительными опухолевыми клетками Т-клетки продуцируют цитокины, в частности, IL-2 и/или IFN гамма, вблизи PD-L1-положительных клеток. Такие цитокины отражают активацию Т-клеток, которые затем могут быть способны уничтожать PD-L1-положительные клетки, прямо или опосредованно, путем привлечения других клеток-киллеров, таких как Т-клетки или NK-клетки.
[00224] В некоторых вариантах осуществления настоящее изобретение включает применение слитого белка согласно изобретению или композиции, содержащей такой слитый белок, для костимуляции Т-клеток и/или активации нисходящих сигнальных путей CD137. Предпочтительно предложенный слитый белок костимулирует Т-клетки и/или активирует нисходящие сигнальные пути CD137 при связывании с опухолевыми клетками, на которых экспрессируется PD-L1. Соответственно, в настоящем изобретении предложены способы индукции пролиферации Т-лимфоцитов и/или активации нисходящих сигнальных путей CD137, предпочтительно при связывании с опухолевыми клетками, на которых экспрессируется PD-L1, включающие применение одного или более слитых белков согласно изобретению и/или одной или более композиций, содержащих такие слитые белки.
[00225] В некоторых вариантах осуществления настоящее изобретение включает применение слитого белка согласно изобретению или композиции, содержащей такой слитый белок, для индукции кластеризации и активации CD137 на Т-клетках и направления таких Т-клеток на опухолевые клетки, на которых экспрессируется PD-L1.
[00226] Дополнительные цели, преимущества и особенности данного изобретения будут ясны специалистам в данной области техники после изучения следующих примеров и прилагаемых к ним графических материалов, которые не должны толковаться ограничительно. Таким образом, следует понимать, что, хотя настоящее изобретение конкретно раскрыто с помощью иллюстративных вариантов осуществления и необязательных признаков, специалисты в данной области техники могут прибегать к модификации и вариации раскрытых в настоящем документе вариантов изобретения, и что такие модификации и вариации рассматриваются как входящие в объем данного изобретения.
F. Получение иллюстративных предложенных слитых белков, специфичных к CD137 и PD-L1.
[00227] В некоторых вариантах осуществления настоящего изобретения предложены молекулы нуклеиновой кислоты (ДНК и РНК), которые включают нуклеотидные последовательности, кодирующие предложенные слитые белки. В некоторых вариантах осуществления изобретение охватывает клетку-хозяина, содержащую предложенную молекулу нуклеиновой кислоты. Поскольку вырожденность генетического кода допускает замены отдельных кодонов другими кодонами, определяющими ту же аминокислоту, изобретение не ограничивается конкретной молекулой нуклеиновой кислоты, кодирующей слитый белок, как описано в настоящем документе, скорее, оно охватывает все молекулы нуклеиновой кислоты, которые включают нуклеотидные последовательности, кодирующие функциональный слитый белок. В этой связи настоящее изобретение также относится к нуклеотидным последовательностям, кодирующим предложенные слитые белки.
[00228] Молекула нуклеиновой кислоты, такая как ДНК, называется «способной экспрессировать молекулу нуклеиновой кислоты» или «способной обеспечивать экспрессию нуклеотидной последовательности», если она включает элементы последовательности, содержащие информацию, касающуюся регуляции транскрипции и/или трансляции, и такие последовательности «функционально связаны» с нуклеотидной последовательностью, кодирующей белок. Функциональная связь представляет собой связь, в которой элементы регуляторной последовательности и экспрессируемая последовательность связаны таким образом, чтобы обеспечить экспрессию гена. Точная природа регуляторных областей, необходимых для экспрессии генов, может различаться у разных видов, но в целом эти области включают промотор, который у прокариот содержит как промотор как таковой, то есть элементы ДНК, управляющие инициацией транскрипции, так и элементы ДНК, которые при транскрибировании в РНК будут сигнализировать об инициации трансляции. Такие промоторные области обычно включают 5'-некодирующие последовательности, участвующие в инициации транскрипции и трансляции, такие как -35/-10 боксы и элемент Шайна-Далгарно у прокариот или ТАТА-бокс, последовательности СААТ и 5'-кэпирующие элементы у эукариот. Эти области могут также включать энхансерные или репрессорные элементы, а также транслируемые сигнальные и лидерные последовательности для направления нативного белка в конкретный компартмент клетки-хозяина.
[00229] Кроме того, 3'-некодирующие последовательности могут содержать регуляторные элементы, участвующие в терминации транскрипции, полиаденилировании и т. п. Если, однако, эти терминирующие последовательности неудовлетворительно функционируют в конкретной клетке-хозяине, то они могут быть заменены сигналами, функционирующими в этой клетке.
[00230] Следовательно, молекула нуклеиновой кислоты согласно изобретению может быть «функционально связана» с одной или более регуляторными последовательностями, такими как промоторная последовательность, для обеспечения возможности экспрессии этой молекулы нуклеиновой кислоты. В некоторых вариантах осуществления молекула нуклеиновой кислоты согласно изобретению включает промоторную последовательность и последовательность терминации транскрипции. Подходящими прокариотическими промоторами являются, например, промотор tet, промотор lacUV5 или промотор T7. Примерами промоторов, подходящих для экспрессии в эукариотических клетках, являются промотор SV40 или промотор CMV.
[00231] В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая мутеин липокалина, раскрытый в данной заявке, может быть «функционально связана» с другой молекулой нуклеиновой кислоты, кодирующей иммуноглобулин согласно изобретению, чтобы обеспечить экспрессию слитого белка, раскрытого в настоящем документе.
[00232] В некоторых вариантах осуществления предложенные способы могут включать подвергание по меньшей мере одной молекулы нуклеиновой кислоты, кодирующей зрелый hTlc, мутагенезу по нуклеотидным триплетам, кодирующим одно или более положений, соответствующих положениям 5, 26-31, 33-34, 42, 46, 52, 56, 58, 60-61, 65, 71, 85, 94, 101, 104-106, 108, 111, 114, 121, 133, 148, 150 и 153 линейной полипептидной последовательности hTlc (SEQ ID NO: 1), для получения мутеинов липокалинов, входящих в состав предложенных слитых белков. В некоторых вариантах осуществления предложенные способы могут включать подвергание по меньшей мере одной молекулы нуклеиновой кислоты, кодирующей зрелый hNGAL, мутагенезу по нуклеотидным триплетам, кодирующим одно или более положений, соответствующих положениям 28, 36, 40-41, 49, 52, 65, 68, 70, 72-73, 77, 79, 81, 83, 87, 94, 96, 100, 103, 106, 125, 127, 132 и 134 линейной полипептидной последовательности hNGAL (SEQ ID NO: 2), для получения мутеинов липокалинов, входящих в состав предложенных слитых белков. В некоторых вариантах осуществления предложенный способ может включать подвергание по меньшей мере одной молекулы нуклеиновой кислоты, кодирующей зрелый hNGAL, мутагенезу по нуклеотидным триплетам, кодирующим одно или более положений, соответствующих положениям 20, 25, 28, 33, 36, 40-41, 44, 49, 52, 59, 68, 70-73, 77-82, 87, 92, 96, 98, 100, 101, 103, 122, 125, 127, 132 и 134 линейной полипептидной последовательности hNGAL (SEQ ID NO: 2), для получения мутеинов липокалинов, входящих в состав предложенных слитых белков.
[00233] Кроме того, применительно к мутеинам hTlc или мутеинам hNGAL согласно изобретению, входящим в состав слитых белков, в некоторых вариантах осуществления природная дисульфидная связь между Cys 61 и Cys 153 или Cys 76 и Cys 175, соответственно, может быть удалена. Соответственно, такие мутеины могут продуцироваться в клеточном компартменте, имеющем восстанавливающую окислительно-восстановительную среду, например, в цитоплазме грамотрицательных бактерий.
[00234] Кроме того, применительно к предложенным мутеинам hTlc или мутеинам hNGAL согласно изобретению, входящим в состав слитых белков, изобретение также включает молекулы нуклеиновой кислоты, кодирующие такие мутеины, которые в некоторых вариантах осуществления могут включать одну или более дополнительных мутаций вне указанных положений экспериментального мутагенеза в последовательности. Такие мутации часто допустимы или даже могут оказаться полезными, например, если они вносят вклад в улучшенную эффективность фолдинга, стабильность в сыворотке, термостабильность или аффинность связывания лиганда мутеинов липокалинов и/или слитых белков.
[00235] В некоторых вариантах осуществления предложенные молекулы нуклеиновой кислоты также могут быть частью вектора или любого другого типа клонирующего носителя, такого как плазмида, фагмида, фаг, бакуловирус, космида или искусственная хромосома.
[00236] В некоторых вариантах осуществления предложенная молекула нуклеиновой кислоты может быть включена в фагмиду. В данном контексте фагмидный вектор означает вектор, кодирующий межгенную область умеренного фага, такого как M13 или f1, или его функциональную часть, слитую с представляющей интерес кДНК. Например, в некоторых вариантах осуществления после суперинфекции бактериальных клеток-хозяев таким предоставленным фагмидным вектором и подходящим фагом-помощником (например, M13K07, VCS-M13 или R408) получают интактные фаговые частицы, тем самым обеспечивая физическое связывание кодируемой гетерологичной кДНК с ее соответствующим полипептидом, экспонируемым на поверхности фага (Lowman, Annu Rev Biophys Biomol Struct, 1997, Rodi and Makowski, Curr Opin Biotechnol, 1999).
[00237] В соответствии с различными вариантами осуществления клонирующие носители могут включать, помимо регуляторных последовательностей, описанных выше, и последовательности нуклеиновой кислоты, кодирующей слитый белок, как описано в настоящем документе, репликационные и контрольные последовательности, происходящие от видов, совместимых с клеткой-хозяином, которая используется для экспрессии, а также селектируемые маркеры, придающие селектируемый фенотип трансформированным или трансфицированным клеткам. Большое количество подходящих клонирующих векторов известно в данной области техники и коммерчески доступно.
[00238] В некоторых вариантах осуществления изобретение также относится к способам получения слитых белков согласно изобретению, начиная с нуклеиновой кислоты, кодирующей слитый белок или любые его субъединицы, с использованием методов генной инженерии. В некоторых вариантах осуществления предложенный способ можно осуществлять in vivo, где предложенный слитый белок может, например, быть продуцирован в бактериальном или эукариотическом организме-хозяине, а затем выделен из этого организма-хозяина или его культуры. Также возможно получить слитый белок согласно изобретению in vitro, например, с использованием системы трансляции in vitro.
[00239] При получении слитого белка in vivo нуклеиновая кислота, кодирующая такой слитый белок, может быть введена в подходящий бактериальный или эукариотический организм-хозяин с использованием технологии рекомбинантных ДНК, хорошо известной в данной области техники. В некоторых вариантах осуществления молекула ДНК, кодирующая слитый белок, как описано в настоящем документе (например, SEQ ID NO: 138-144), и, в частности, клонирующий вектор, содержащий кодирующую последовательность такого слитого белка, может быть трансформирована в клетку-хозяина, способную экспрессировать ген. Трансформация может быть проведена стандартными методами. Таким образом, изобретение также относится к клеткам-хозяевам, содержащим молекулу нуклеиновой кислоты, как раскрыто в настоящем документе.
[00240] В некоторых вариантах осуществления трансформированные клетки-хозяева можно культивировать в условиях, подходящих для экспрессии нуклеотидной последовательности, кодирующей слитый белок согласно изобретению. В некоторых вариантах осуществления клетки-хозяева могут быть прокариотическими, такими как Escherichia coli (E. coli) или Bacillus subtilis, или эукариотическими, такими как Saccharomyces cerevisiae, Pichia pastoris, клетки насекомых SF9 или High5, иммортализованные линии клеток млекопитающих (например, клетки HeLa или клетки CHO) или первичная культура клеток млекопитающих.
[00241] В некоторых вариантах осуществления, где мутеин липокалина согласно изобретению, в том числе входящий в состав слитого белка, раскрытого в настоящем документе, включает внутримолекулярные дисульфидные связи, может быть предпочтительным направлять формирующийся белок в клеточный компартмент, имеющий окисляющую окислительно-восстановительную среду, с использованием соответствующей сигнальной последовательности. Такая окисляющая среда может быть обеспечена периплазмой грамотрицательных бактерий, таких как E. coli, во внеклеточной среде грамположительных бактерий или просвете эндоплазматического ретикулума эукариотических клеток, и обычно способствует образованию структурных дисульфидных связей.
[00242] В некоторых вариантах осуществления также возможно продуцировать слитый белок согласно изобретению в цитозоле клетки-хозяина, предпочтительно E. coli. В этом случае предложенный слитый белок может быть либо непосредственно получен в растворимом и свернутом состоянии, либо выделен в форме телец включения с последующей ренатурацией in vitro. Еще одним вариантом является использование определенных штаммов-хозяев, имеющих окисляющую внутриклеточную среду, которая может, таким образом, обеспечить возможность образования дисульфидных связей в цитозоле (Venturi et al., J Mol Biol, 2002).
[00243] В некоторых вариантах осуществления слитый белок согласно изобретению, описанный в настоящем документе, не обязательно должен быть создан или продуцирован полностью или частично с использованием генной инженерии. Скорее, такой белок также может быть получен любым из многих традиционных и хорошо известных методов, таких как простые стратегии органического синтеза, методы твердофазного синтеза, коммерчески доступные автоматические синтезаторы, или с помощью транскрипции и трансляции in vitro. Например, возможно, что многообещающие слитые белки или мутеины липокалинов, включенные в такие слитые белки, будут идентифицированы с помощью молекулярного моделирования, синтезированы in vitro и исследованы на предмет связывающей активности к представляющей интерес мишени(ям). Методы твердофазного и/или жидкофазного синтеза белков хорошо известны в данной области техники (см., например, Bruckdorfer et al., Curr Pharm Biotechnol, 2004).
[00244] В некоторых вариантах осуществления слитый белок согласно изобретению может быть получен путем транскрипции/трансляции in vitro с использованием общепризнанных методов, известных специалистам в данной области техники.
[00245] В некоторых дополнительных вариантах осуществления слитые белки, как описано в настоящем документе, также могут быть получены обычными рекомбинантными методами, отдельно или в сочетании с обычными методами синтеза.
[00246] Более того, в некоторых вариантах осуществления слитый белок согласно настоящему изобретению может быть получен путем конъюгирования вместе отдельных субъединиц, например, иммуноглобулинов и мутеинов, входящих в состав слитого белка. Такая конъюгация может быть достигнута, например, с помощью всех форм ковалентной или нековалентной связи с использованием обычных методов.
[00247] Специалисту известны способы, подходящие для получения слитых белков, которые предусмотрены настоящим изобретением, но белковые последовательности или последовательности нуклеиновых кислот которых не раскрыты в настоящем документе в явном виде. В общих чертах, такие модификации аминокислотной последовательности включают, например, направленный мутагенез отдельных положений аминокислот для упрощения субклонирования гена белка или его частей путем включения сайтов расщепления для отдельных ферментов рестрикции. Кроме того, эти мутации могут быть включены для дальнейшего улучшения аффинности слитого белка к его мишеням (например, CD137 и PD-L1). Кроме того, могут быть введены мутации для модуляции одной или нескольких характеристик белка, например, для улучшения стабильности фолдинга, стабильности в сыворотке, устойчивости белка или растворимости в воде, или для уменьшения склонности к агрегации, если это необходимо.
V. ПРИМЕРЫ
[00248] Пример 1: Экспрессия и анализ иллюстративных слитых белков
[00249] В этом примере были получены иллюстративные слитые белки антитело-мутеин липокалина путем слияния PD-L1-специфического антитела, имеющего тяжелую цепь, представленную SEQ ID NO: 86, или содержащего вариабельный домен тяжелой цепи SEQ ID NO: 77, или содержащего CDR с последовательностями GFSLSNYD (HCDR1, SEQ ID NO: 60), IWTGGAT (HCDR2, SEQ ID NO: 61), VRDSNYRYDEPFTY (HCDR3; SEQ ID NO: 62), и легкие цепи, представленные SEQ ID NO: 87, или содержащего вариабельный домен тяжелой цепи SEQ ID NO: 82, или содержащего CDR с последовательностями QSIGTN (LCDR1, SEQ ID NO: 63), YAS (LCDR2), QQSNSWPYT (LCDR3; SEQ ID NO: 64), и CD137-специфического мутеина липокалина с последовательностью SEQ ID NO: 42 посредством линкера, такого как неструктурированный линкер (G4S)3 с последовательностью SEQ ID NO: 13, для одновременного связывания PD-L1 и CD137. Различные созданные форматы показаны на фиг. 1. Например, такие слитые белки, например, SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91, были получены путем слияния одного или более мутеинов липокалина с последовательностью SEQ ID NO: 42 с одним или более из четырех концов антитела, содержащего тяжелую цепь, представленную тяжелой цепью, представленной SEQ ID NO: 86, или содержащего вариабельный домен тяжелой цепи с последовательностью SEQ ID NO: 77, или содержащего CDR с последовательностями GFSLSNYD (HCDR1, SEQ ID NO: 60), IWTGGAT (HCDR2, SEQ ID NO: 61), VRDSNYRYDEPFTY (HCDR3; SEQ ID NO: 62), и легкие цепи, представленные SEQ ID NO: 87, или содержащего вариабельный домен тяжелой цепи с последовательностью SEQ ID NO: 82, или содержащего CDR с последовательностями QSIGTN (LCDR1, SEQ ID NO: 63), YAS (LCDR2), QQSNSWPYT (LCDR3; SEQ ID NO: 64). Полученные слитые белки могут быть бивалентными к CD137 (например, как продемонстрировано на фиг. 1A-1D), или четырехвалентными к CD137 (например, как продемонстрировано на фиг. 1E-1H), или иметь даже более высокую валентность к CD137 (например, как продемонстрировано на фиг. 1I).
[00250] PD-L1-специфические антитела, а также все слитые белки антитела и мутеина липокалина, описанные в этом примере, имели сконструированный остов IgG4, который содержал мутацию S228P для минимизации обмена половинами молекул IgG4 in vitro и in vivo (Silva et al., J Biol Chem, 2015). Дополнительные мутации в остовах IgG4 также могут существовать во всех описанных здесь антителах и слитых белках, включая любую одну или более мутаций F234A, L235A, M428L, N434S, M252Y, S254T и T256E. Мутации F234A и L235A могут быть введены для снижения ADCC и ADCP (Glaesner et al., Diabetes Metab Res Rev, 2010). Мутации M428L и N434S или мутации M252Y, S254T и T256E могут быть введены для увеличения периода полувыведения из сыворотки (Dall'Acqua et al., J Biol Chem, 2006, Zalevsky et al., Nat Biotechnol, 2010). Все антитела были экспрессированы без карбоксиконцевого лизина, чтобы избежать неоднородности.
[00251] Кроме того, были получены моноспецифические слияния мутеина липокалина и Fc путем слияния одного или более CD137-специфических мутеинов липокалина с последовательностью SEQ ID NO: 42 посредством линкера, например, неструктурированного (G4S)3 линкера с последовательностью SEQ ID NO: 13, с С-концом Fc-области антитела, представленного в SEQ ID NO: 30, как показано на фиг. 1J-1K. Полученная конструкция представлена в SEQ ID NO: 88-89.
[00252] Настоящее изобретение также включает форматы асимметричного слияния антитела и мутеина липокалина, в которых, например, одна легкая цепь антитела может быть слита с мутеином липокалина, а другая - нет.
[00253] Конструкции слитых белков были созданы путем генного синтеза и клонированы в вектор экспрессии млекопитающих. Затем они были временно экспрессированы в клетках Expi293FTM (Life Technologies). Концентрацию слитых белков в среде для культивирования клеток измеряли с помощью ВЭЖХ (Agilent Technologies) с использованием аффинной колонки POROS® с белком A (Applied Biosystems). Сводные данные по титрам слитых белков приведены в таблице 1.
[00254] Слитые белки очищали с использованием хроматографии с белком А с последующей эксклюзионной хроматографией (SEC) в натрий-фосфатном буфере (PBS). После очистки методом SEC фракции, содержащие мономерный белок, объединяли и снова анализировали с помощью аналитической SEC.
[00255] Таблица 1: Титры временной экспрессии
[мг/мл]
[00256] Пример 2: Экспрессия слитых белков
[00257] Конструкции иллюстративных слитых белков были созданы путем генного синтеза, включая оптимизацию кодонов, и клонированы в вектор экспрессии млекопитающих. Затем они были стабильно экспрессированы в клетках яичника китайского хомячка (СНО). Концентрацию слитых белков в среде для культивирования клеток измеряли с помощью Octet (ForteBio, Pall Corp.) с сенсорами на белок A и определяли количественно с использованием стандарта человеческого IgG1. Сводные данные по титрам слитых белков приведены в таблице 2. Данные дают основания полагать, что геометрия слитых белков может влиять на выход продукта и продуктивность клеток.
[00258] Таблица 2: Титры стабильной экспрессии
[мг/мл]
[00259] Пример 3: Связывание слитых белков с PD-L1 или CD137, определенное методом поверхностного плазмонного резонанса (SPR)
[00260] Кинетику связывания и аффинность иллюстративных слитых белков к huPD-L1-His или huCD137-His (человеческий PD-L1 или человеческий CD137 с С-концевой полигистидиновой меткой, R&D Systems) определяли с помощью поверхностного плазмонного резонанса (SPR) с использованием Biacore 8K или Biacore T200 (GE Healthcare).
[00261] Антитело к человеческому Fc IgG (GE Healthcare) иммобилизовали на сенсорном чипе CM5 с использованием стандартной реакции аминов: карбоксильные группы на чипе были активированы с использованием 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS). Затем раствор антитела к Fc человеческого IgG (GE Healthcare) в концентрации 25 мкг/мл в 10 мМ ацетате натрия (pH 5,0) наносили при скорости потока 5 мкл/мин до уровня иммобилизации 6000-10000 единиц резонанса (RU). Остаточные непрореагировавшие сложные эфиры NHS блокировали пропусканием через поверхность раствора 1M этаноламина. Аналогичным образом был обработан референсный канал. Затем тестируемые слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91, SEQ ID NO: 88 и SEQ ID NO: 89) при 0,25 мкг/мл или 0,5 мкг/мл в буфере HBS-EP+ захватывали антителом к человеческому Fc-IgG на поверхности чипа в течение 180 сек при скорости потока 10 мкл/мин. После каждого шага захвата иглу промывали. Антитела к PD-L1, включая референсное антитело (SEQ ID NO: 26 и 27) и антитело, входящее в состав слитых белков (SEQ ID NO: 86 и 87), и референсное антитело к CD137 (SEQ ID NO: 28 и 29) также тестировали в качестве контролей.
[00262] Для определения аффинности были приготовлены разведения huPD-L1-His (10 нМ, 5 нМ и 2,5 нМ или huCD137-His (900 нМ, 300 нМ и 100 нМ) в буфере HBS-EP+ и нанесены на подготовленную поверхность чипа. Анализ связывания проводили при времени контакта 180 сек, времени диссоциации 900 сек и скорости потока 30 мкл/мин. Все измерения проводились при 25°C. Регенерация поверхности чипа достигалась введениями 3 М MgCl2 в течение 120 сек. Перед измерением белка было проведено три пусковых цикла для целей подготовки. Данные оценивали с помощью программного обеспечения для оценки Biacore T200 (v2.0) или с помощью программного обеспечения для оценки Biacore 8K (V1.1.1). Для аппроксимации необработанных данных использовали двойное сравнение с контролем и модель связывания 1:1.
[00263] Сводные значения, определенные для kon, koff и результирующей константы равновесной диссоциации (KD) для иллюстративных слитых белков приведены в таблице 3. Все биспецифические слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, и SEQ ID NO: 90 и 91) связывают PD-L1, а также CD137 с аффинностью в субнаномолярном или низком наномолярном диапазоне. Моноспецифические CD137-специфические слияния мутеин липокалина-Fc (SEQ ID NO: 88 и SEQ ID NO: 89) связывают только CD137 с аффинностью в низком наномолярном диапазоне.
[00264] Таблица 3: Кинетические константы и аффинности слитых белков, определенные с помощью SPR
[00265] Пример 4. Связывание слитых белков с PD-L1 или CD137 в твердофазном иммуноферментном анализе (ELISA)
[00266] Твердофазный иммуноферментный анализ (ELISA) использовали для определения силы связывания иллюстративных слитых белков с человеческим PD-L1 и PD-L1 яванского макака.
[00267] Рекомбинантный huPD-L1-His или cyPD-L1-His (PD-L1 человека или яванского макака с C-концевой полигистидиновой меткой, R&D Systems или Sino Biologics) в концентрации 1 мкг/мл в PBS наносили на ночь на планшеты для микротитрования при 4°С. После промывки PBS-0,05%T (PBS с добавкой 0,05% (об./об.) Tween 20) планшеты блокировали 2% BSA (мас./об.) в PBS-0,1%T (PBS с добавкой 0,1% (об./об.) Tween 20) в течение 1 ч при комнатной температуре. После пятикратной промывки 100 мкл PBS-0,05%T иллюстративные слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91), CD137-специфические слияния Fc с мутеином липокалина (SEQ ID NO: 88 и SEQ ID NO: 89) и антитела к PD-L1 (SEQ ID NO: 26 и 27, SEQ ID NO: 86 и 87) в различных концентрациях добавляли в лунки и инкубировали в течение 1 ч при комнатной температуре, после чего следовала еще одна стадия промывки. Изучаемые связанные молекулы детектировали путем инкубации с разведенным 1:5000 античеловеческим IgG Fc-HRP (Jackson Laboratory) в PBS-0,1%T-2%BSA. После дополнительной стадии промывки в каждую лунку добавляли флуорогенный субстрат HRP (QuantaBlu, Thermo) и определяли интенсивность флуоресценции с помощью считывающего флуоресценцию устройства для микропланшетов.
[00268] Такую же схему ELISA также использовали для определения силы связывания слитых белков с CD137, где на планшет для микротитрования взаимен наносили huCD137-His (человеческий CD137 с C-концевой полигистидиновой меткой, R&D Systems) или cyCD137-Fc (CD137 яванского макака, слитый с Fc на C-конце). Тестируемые агенты титровали аналогичным образом и детектировали связанные агенты с помощью антитела к NGAL-HRP.
[00269] Результаты иллюстративных экспериментов представлены на фиг. 2A-2D вместе с аппроксимирующими кривыми, полученными в результате аппроксимации сигмоидальной кривой связывания 1:1, где значение EC50 и максимальный сигнал были свободными параметрами, а наклон был установлен равным единице. Полученные значения EC50 представлены в таблице 4.
[00270] Наблюдаемые значения ЕС50 по отношению к двум человеческим мишеням предложенных слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91, SEQ ID NO: 88, и SEQ ID NO: 89) были очень похожи или сопоставимы с тестируемыми антителами к PD-L1 (референсное антитело к PD-L1 с последовательностями SEQ ID NO: 26 и 27 и антитело к PD-L1 с последовательностью SEQ ID NO: 86 и 87, включенные в слитые белки), и/или CD137-специфическим мутеином липокалина, входящим в состав слитых белков (SEQ ID NO: 42).
[00271] Все протестированные слитые белки демонстрируют перекрестную реактивность с PD-L1 яванского макака, при этом значения EC50 сопоставимы с референсным антителом к PD-L1 (SEQ ID NO: 26 и 27) или антителом к PD-L1, включенным в слитые белки (SEQ ID NO: 86 и 87). Только слитые белки, которые являются четырехвалентными к CD137 (SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91 и SEQ ID NO: 88), демонстрируют перекрестную реактивность с CD137 яванского макака на уровне, сопоставимом с человеческим CD137, т. е. связывают CD137 яванского макака со значениями ЕС50 в том же диапазоне, что и соответствующие ЕС50 для человеческого CD137.
[00272] Таблица 4. Данные ELISA для связывания PD-L1 или CD137
Связывание с huPD-L1
Связывание с cyPD-L1
Связывание с huCD137
Связывание с cyCD137
[00273] Пример 5. Одновременное связывание слитых белков с PD-L1 и CD137 в ELISA
[00274] Чтобы продемонстрировать одновременное связывание иллюстративных слитых белков с PD-L1 и CD137, использовали формат ELISA с двойным связыванием.
[00275] Рекомбинантный huPD-L1-His (R&D Systems) в PBS (1 мкг/мл) наносили на ночь на планшеты для микротитрования при 4°C. Планшеты промывали пять раз после каждой стадии инкубации 100 мкл PBS-0,05%T. Планшеты блокировали 2% BSA (мас./об.) в PBS-0,1%T в течение 1 ч при комнатной температуре, а затем снова промывали. В лунки добавляли различные концентрации тестируемых слитых белков и инкубировали в течение 1 ч при комнатной температуре с последующей стадией промывки. Затем добавляли биотинилированный huCD137-His (huCD137-His-Bio, Sino Biological) при постоянной концентрации 1 мкг/мл в PBS-0,1%T-2%BSA на 1 ч. После промывки в лунки добавляли разведенный 1:5000 ExtrAvidin-HRP (Sigma-Aldrich) в PBS-0,1%T-2% BSA и инкубировали в течение 1 ч. После дополнительной стадии промывки в каждую лунку добавляли флуорогенный субстрат HRP (QuantaBlu, Thermo) и определяли интенсивность флуоресценции с помощью считывающего флуоресценцию устройства для микропланшетов.
[00276] Двойное связывание иллюстративных слитых белков также тестировали с использованием обратной схемы, где рекомбинантный 1 мкг/мл huCD137-His (R&D Systems) наносили на планшеты для микротитрования, а связанные слитые белки детектировали путем добавления биотинилированного huPD-L1-His (R&D Systems).
[00277] Данные по двойному связыванию слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, и SEQ ID NO: 90 и 91) показаны на фиг. 3A и 3B вместе с аппроксимирующими кривыми, полученными в результате аппроксимации сигмоидальной кривой связывания 1:1, где значение EC50 и максимальный сигнал были свободными параметрами, а наклон был установлен равным единице. Сводные значения EC50 приведены в таблице 5. Все биспецифические слитые белки демонстрируют явные сигналы связывания, что говорит о том, что слитые белки способны одновременно связывать PD-L1 и CD137. Данные также дают основания полагать, что слияние CD137-специфических мутеинов липокалинов с С-концами PD-L1-специфических антител может быть более предпочтительным, чем с N-концами.
[00278] Таблица 5. Данные ELISA по одновременному целевому связыванию PD-L1 и CD37
Захват PD-L1_детекция CD137
Захват CD137_детекция PD-L1
[00279] Пример 6. Анализ связывания слитых белков с клетками, экспрессирующими CD137 и PD-L1 человека и яванского макака, методом проточной цитометрии
[00280] Целевое специфическое связывание слитых белков с клетками, экспрессирующими PD-L1 человека и яванского макака, и клетками, экспрессирующими CD137 человека и яванского макака, оценивали методом проточной цитометрии.
[00281] Клетки CHO стабильно трансфицировали человеческим PD-L1, PD-L1 яванского макака, человеческим CD137, CD137 яванского макака или имитационным контролем с использованием системы Flp-In (Life technologies) в соответствии с инструкциями производителя.
[00282] Трансфицированные клетки СНО поддерживали в среде F12 Хэма (Life technologies) с добавкой 10% фетальной телячьей сыворотки (Biochrom) и 500 мкг/мл гигромицина B (Roth). Клетки культивировали в колбах для клеточных культур в соответствии с инструкциями производителя (37°C, атмосфера 5% CO2).
[00283] Для анализа методом проточной цитометрии соответствующие клеточные линии инкубировали со слитыми белками (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91, SEQ ID NO: 88, и SEQ ID NO: 89) и детектировали с использованием флуоресцентно меченого антитела к человеческому IgG в анализе FACS, как описано ниже:
[00284] 5 × 104 клеток на лунку инкубировали в течение 1 ч в ледяном PBS, содержащем 5% фетальной телячьей сыворотки (PBS-FCS). К клеткам добавляли последовательные разведения слитых белков и контрольных антител и инкубировали в течение 1 ч на льду. Клетки дважды промывали PBS и затем инкубировали с козьим антителом к hIgG, меченым Alexa647, в течение 30 мин на льду. Затем клетки промывали и анализировали с помощью проточного цитометра iQue (Intellicyte Screener). Средние геометрические значения сигналов флуоресценции наносили на график и аппроксимировали с помощью программного обеспечения Graphpad с использованием нелинейной регрессии (общая нижняя асимптота, наклон = 1).
[00285] Способность слитых белков связывать PD-L1 и CD137 человека и яванского макака показана на фиг. 4. Аффинности связывания (EC50) биспецифических слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, и SEQ ID NO: 90 и 91) к клеткам, экспрессирующим PD-L1 человека и яванского макака, находятся в одноразрядном наномолярном диапазоне, демонстрируя полную перекрестную реактивность с яванским макаком (сводные данные представлены в таблице 6). Аффинности связывания слитых белков с клетками, экспрессирующими человеческий CD137, находится в низком наномолярном диапазоне. Протестированные слитые белки полностью перекрестно реагируют с CD137 яванского макака (SEQ ID NO: 94 и 87, SEQ ID NO: 90 и 91 и SEQ ID NO: 88), связывают CD137 яванского макака со сниженной в 6-13 раз аффинностью по сравнению с соответствующими аффинностями связывания с человеческим CD137 (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91 и SEQ ID NO: 89), или не связывают CD137 яванского макака (SEQ ID NO: 92 и 87 и 86 и 93). Ни один из слитых белков не связывается с ложно трансфицированными клетками.
[00286]
[00287] Таблица 6. Аффинности связывания слитых белков с клетками, экспрессирующими PD-L1 или CD137 человека и яванского макака
Flp-In-CHO::huCD137
Flp-In-CHO::cynoCD137
Flp-In-CHO::huPDL-1
Flp-In-CHO::cynoPDL-1
[00288] Пример 7. Аффинности связывания слитых белков с PD-L1-положительными опухолевыми клетками
[00289] Связывание слитых белков с опухолевыми клетками, экспрессирующими PD-L1, оценивали методом проточной цитометрии.
[00290] Экспрессирующую PD-L1 линию клеток колоректального рака RKO поддерживали в RPMI1640 (Life technologies) с добавкой 10% FCS при 37°C в увлажненной атмосфере с 5% CO2.
[00291] Для анализа методом проточной цитометрии клетки RKO инкубировали со слитыми белками и детектировали с использованием флуоресцентно меченого антитела к человеческому IgG, как описано в примере 6.
[00292] Способность слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, и SEQ ID NO: 90 и 91) связывать PD-L1-положительные опухолевые клетки показана на фиг. 5, а сводные данные по соответствующим аффинностям связывания (EC50) представлены в таблице 7. Аффинности связывания слитых белков с PD-L1-экспрессирующими клетками RKO находилась в низком наномолярном или субнаномолярном диапазоне и были сопоставимы с антителом к PD-L1, включенным в слитые белки (SEQ ID NO: 86 и 87).
[00293] Таблица 7. Аффинности связывания слитых белков с PD-L1-положительными опухолевыми клетками
RKO
[00294] Пример 8. Определение конкуренции между CD137L и слитыми белками за связывание с CD137 методом SPR
[00295] Для исследования конкуренции между человеческим CD137L (huCD137L-His, R&D Systems) и иллюстративными слитыми белками за связывание с человеческим CD137 использовали анализ методом SPR. Анализ конкуренции проводили при 25°C на приборе Biacore T200 (GE Healthcare).
[00296] Реагент BiotinCAPture (GE Healthcare) иммобилизовали на сенсорном чипе CAP при концентрации 50 мкг/мл и скорости потока 2 мкл/мин в течение 300 сек. Аналогичным образом был обработан референсный канал. Биотинилированный huCD137-Fc (R&D systems) был захвачен на поверхности чипа в течение 300 сек при концентрации 1 мкг/мл и при скорости потока 5 мкл/мин по другому каналу.
[00297] Чтобы проанализировать, конкурируют ли тестируемые слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 90 и 91, SEQ ID NO: 88, и SEQ ID NO: 89) с CD137L за связывание CD137, подвижный буфер (буфер HBS-EP+) либо 500 нМ huCD137L-His наносили на поверхность чипа на 180 с со скоростью потока 30 мкл/мин. Затем тестируемые слитые белки наносили на подготовленную поверхность чипа в буфере HBS-EP+ при фиксированной концентрации 1 мкМ. Анализ связывания проводили при времени контакта 180 сек, времени диссоциации 15 сек и скорости потока 30 мкл/мин. В качестве контроля осуществляли введения буфера с теми же параметрами. Регенерация поверхности чипа достигалась введениями 6M гуанидина-HCl, 0,25M NaOH в течение 120 сек при скорости потока 10 мкл/мин, с последующей дополнительной стадией промывки H2O (120 сек, 10 мкл/мин).
[00298] Иллюстративные примеры для релевантного сегмента полученных сенсограмм представлены на фиг. 6 для слитых белков SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 90 и 91, SEQ ID NO: 88 и SEQ ID NO: 89. Кривая SPR для связывания соответствующего слитого белка только с huCD137-Fc отмечена стрелкой со сплошным стержнем. Кривая SPR для связывания слитого белка с huCD137-Fc, насыщенного huCD137L-His, отмечена стрелкой с пунктирным стержнем. Данные показывают, что все слитые белки связываются с huCD137 в присутствии huCD137L, но со слегка уменьшенными сигналами по сравнению с их связыванием с CD137 в отсутствие CD137L. Это дает основания полагать, что тестируемые слитые белки могут быть в некоторой степени стерически затруднены связыванием CD137L с CD137. Такое поведение связывания слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 90 и 91, SEQ ID NO: 88 и SEQ ID NO: 89) аналогично поведению антитела к CD137 с последовательностями SEQ ID NO: 28 и 29.
[00299] Пример 9. Конкуренция слитых белков с PD-L1 за связывание с PD-1, определенная с помощью ELISA
[00300] Чтобы продемонстрировать способность слитых белков ингибировать взаимодействие между PD-1 и PD-L1, использовали конкурентный формат ELISA.
[00301] Рекомбинантный huPD-1-His (Acrobiosystems) в PBS (1 мкг/мл) наносили на ночь на планшеты для микротитрования при 4°C. Планшеты промывали пять раз после каждой стадии инкубации 100 мкл PBS-0,05%T (PBS с добавкой 0,05% (об./об.) Tween 20). Планшеты блокировали 2% BSA (мас./об.) в PBS-0,1%T (PBS с добавкой 0,1% (об./об.) Tween 20) в течение 1 ч при комнатной температуре, а затем снова промывали. Слитые белки в различных концентрациях смешивали с 15 нМ рекомбинантного huPD-L1-Fc (R&D systems) в качестве индикатора и инкубировали в течение 1 ч при комнатной температуре. Смеси слитых белков и индикатора добавляли в планшеты и инкубировали в течение 20 мин при комнатной температуре, после чего проводили пять этапов промывки 100 мкл PBS-0,05%T. Затем в лунки добавляли разведенные 1:5000 козьи антитела к человеческому Fc-IgG HRP (Jackson) и инкубировали в течение 1 ч. После дополнительной стадии промывки в каждую лунку добавляли флуорогенный субстрат HRP (QuantaBlu, Thermo) и определяли интенсивность флуоресценции с помощью считывающего флуоресценцию устройства для микропланшетов.
[00302] Данные по конкуренции иллюстративных слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93 и SEQ ID NO: 90 и 91) показаны на фиг. 7 вместе с аппроксимирующими кривыми, полученными в результате аппроксимации сигмоидальной кривой связывания 1:1, где значение IC50 и максимальный сигнал были свободными параметрами, а наклон был установлен равным единице. Сводные значения IC50 приведены в таблице 9. Все биспецифические слитые белки продемонстрировали явное ингибирование взаимодействия PD-1/PD-L1 со значениями IC50, сопоставимыми с антителом-строительным блоком (SEQ ID NO: 86 и 87) и референсным антителом к PD-L1 (SEQ ID NO: 26 и 27).
[00303] Таблица 8. Конкуренция слитых белков с PD-L1 за связывание с PD-1
[00304] Пример 10. PD-L1-зависимая костимуляция Т-клеток с помощью биоанализа с CD137
[00305] Потенциал выбранных слитых белков в отношении индукции активации сигнального пути CD137 в присутствии PD-L1 оценивали с использованием коммерчески доступной дважды стабильно трансфицированной линии клеток Jurkat, экспрессирующей CD137 и ген luc2 (гуманизированная версия люциферазы светлячка), где экспрессия luc2 регулируется NFκB-отвечающим элементом. В этом биоанализе связывание CD137 приводит к внутриклеточной передаче сигнала CD137, что приводит к люминесценции, опосредованной NFκB.
[00306] Экспрессирующую PD-L1 линию клеток колоректального рака RKO культивировали, как описано в примере 7. За день до анализа клетки RKO высевали из расчета 1,25 × 104 клеток на лунку и оставляли на ночь для прикрепления при 37°C в увлажненной атмосфере с 5% CO2.
[00307] На следующий день в каждую лунку добавляли 3,75 × 104 клеток NF-kB-Luc2/CD137 Jurkat с последующим добавлением различных концентраций, обычно в диапазоне от 0,001 до 5 нМ, слитых белков или референсного антитела к CD137 (SEQ ID NO: 28 и 29). Планшеты закрывали газопроницаемой пленкой и инкубировали при 37°C в увлажненной атмосфере с 5% CO2. Спустя 4 часа в каждую лунку добавляли 30 мкл реагента Bio-Glo™ и количественно определяли биолюминесцентный сигнал с помощью люминометра (PHERAstar). Анализ с использованием четырехпараметрической логистической кривой был выполнен с помощью GraphPad Prism® для расчета значений EC50 (общая нижняя асимптота, фиксированный наклон), которые обобщены в таблице 9. Чтобы продемонстрировать зависимость связывания CD137 слитыми белками от PD-L1, параллельно проводили этот же эксперимент в отсутствие клеток RKO. Анализ проводили в трех повторностях.
[00308] Результаты иллюстративного эксперимента представлены на фиг. 8A-8D. Данные показывают, что все протестированные слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87 и SEQ ID NO: 86 и 93) индуцировали сильную костимуляцию Т-клеток, опосредованную CD137. На фиг. 8B и 8D показано, что активация CD137 слитыми белками зависит от PD-L1, поскольку активация клеток NF-kB-Luc2/CD137 Jurkat не была обнаружена в отсутствие опухолевых клеток, экспрессирующих PD-L1. Напротив, референсное mAb к CD137 (SEQ ID NO: 28 и 29) продемонстрировало опосредованную CD137 костимуляцию Т-клеток независимо от наличия или отсутствия клеток-мишеней.
[00309] Таблица 9. Оценка активации Т-клеток с помощью биоанализа с CD137
С клетками RKO
[00310] Пример 11. Оценка активации Т-клеток с использованием человеческих мононуклеарных клеток периферической крови (МНПК)
[00311] Анализ на T-клетках использовали для оценки способности выбранных слитых белков костимулировать Т-клеточные ответы, а также предотвращать коингибирование, опосредованное связыванием PD-L1 с PD-1. С этой целью слитые белки в различных концентрациях добавляли к стафилококковому энтеротоксину B (SEB), стимулированному человеческими мононуклеарными клетками периферической крови (МНПК), и инкубировали в течение 4 дней при 37°C. В супернатантах измеряли уровни секреции IL-2.
[00312] МНПК от здоровых добровольцев-доноров выделяли из лейкотромбоцитарного слоя центрифугированием в градиенте плотности полисахарозы (Biocoll, 1,077 г/мл, Biochrom), следуя протоколам Biochrom. Очищенные МНПК ресуспендировали в буфере, состоящем из 90% FCS и 10% ДМСО, немедленно замораживали и хранили в жидком азоте до дальнейшего использования. Для анализа МНПК размораживали и помещали в культуральную среду (RPMI 1640, Life Technologies) с добавкой 10% FCS и 1% пенициллин-стрептомицина (Life Technologies) на 16 ч при 37°C в увлажненной атмосфере с 5% CO2.
[00313] Следующая процедура была проведена в трех повторностях для каждого условия эксперимента: 2,5x104 МНПК инкубировали в каждой лунке 384-луночных планшетов с плоским дном для тканевых культур в культуральной среде. Последовательные разведения слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91), антитела к PD-L1-строительного блока (SEQ ID NO: 86 и 87), референсного антитела к PD-L1 (SEQ ID NO: 26 и 27), референсного антитела к CD137 (SEQ ID NO: 28 и 29), коктейля из референсного антитела к CD137 (SEQ ID NO: 28 и 29) и антитела к PD-L1 (SEQ ID NO: 86 и 87 или SEQ ID NO: 26 и 27) или изотипического контроля (SEQ ID NO: 24 и 25), обычно в диапазоне от 10 до 0,002 нМ, и SEB в концентрации 0,1 нг/мл добавляли в соответствующие лунки. Планшеты закрывали газопроницаемой пленкой (4titude) и инкубировали при 37°C в увлажненной атмосфере с 5% CO2 в течение четырех дней. Затем оценивали уровни IL-2 в супернатанте с использованием набора для определения человеческого IL-2 DuoSet (R&D Systems), как описано в следующих процедурах.
[00314] 384-луночные планшеты покрывали на 2 ч при комнатной температуре 1 мкг/мл «антитела захвата к человеческому IL-2» в PBS. Затем лунки 5 раз промывали 80 мкл PBS с добавкой 0,05% Tween (PBS-T). Спустя 1 ч блокирования в PBS-0,05%T, содержащем 1% казеина (мас./мас.), супернатанты из анализа и серию концентраций стандарта IL-2, разведенного в культуральной среде, переносили в соответствующие лунки и инкубировали в течение ночи при 4°C. На следующий день добавляли смесь 100 нг/мл козьего детектирующего антитела анти-hIL-2-Bio (R&D Systems) и 1 мкг/мл меченого Sulfotag стрептавидина (Mesoscale Discovery) в PBS-T, содержащем 0,5% казеина, и инкубировали при комнатной температуре в течение 1 ч. После промывки в каждую лунку добавляли 25 мкл буфера для считывания (Mesoscale Discovery) и детектировали полученный сигнал электрохемилюминесценции (ECL) считывающим устройством Mesoscale Discovery. Анализ и количественную оценку проводили с использованием программного обеспечения Mesoscale Discovery.
[00315] Результат иллюстративного эксперимента представлен на фиг. 9. Биспецифические слитые белки SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91 способны индуцировать активацию Т-клеток, о чем свидетельствуют повышенные уровни секреции IL-2 по сравнению с изотипическим контролем (hIgG4, Sigma). Самое большое повышение секреции IL-2 наблюдается для слитых белков, четырехвалентных к CD137 (SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91), за ними следуют слитые белки, бивалентные к CD137, где мутеин липокалина слит с C-концом PD-L1-специфического антитела (SEQ ID NO: 90 и 87 и SEQ ID NO: 86 и 91). Самое маленькое повышение наблюдается для слитых белков, бивалентных к CD137, где мутеин липокалина слит с N-концом PD-L1-специфического антитела (SEQ ID NO: 92 и 87 и SEQ ID NO: 86 и 93), однако оно все еще сопоставимо с коктейлем из референсного антитела к CD137 (SEQ ID NO: 28 и 29) и референсного антитела к PD-L1 (SEQ ID NO: 26 и 27). Все слитые белки демонстрируют более высокие уровни секреции IL-2, чем отдельные строительные блоки, т. е. CD137-специфический мутеин липокалина-Fc (SEQ ID NO: 88 или SEQ ID NO: 89) или mAb к PD-L1-строительный блок (SEQ ID NO: 86 и 87).
[00316] Пример 12. Оценка активации Т-клеток в присутствии опухолевых клеток, экспрессирующих различные уровни PD-L1
[00317] Дополнительный анализ на Т-клетках использовали для оценки способности слитых белков костимулировать активацию Т-клеток зависимым от мишени PD-L1 образом. Слитые белки применяли в различных концентрациях к Т-клеткам, стимулированным антителом к CD3, в присутствии линий опухолевых клеток с различными уровнями экспрессии PD-L1. Протестированные линии опухолевых клеток включают RKO (высокий уровень PD-L1), HCC827 (умеренный уровень PD-L1) и Hep-G2 (PD-L1-отрицательные). В супернатантах измеряли уровни секреции IL-2.
[00318] МНПК от здоровых добровольцев-доноров выделяли из лейкотромбоцитарного слоя, как описано в примере 11. Т-лимфоциты дополнительно выделяли из МНПК с помощью магнитно-активированной сортировки клеток с использованием набора для очистки пан-T-клеток (Miltenyi Biotec GmbH) в соответствии с инструкциями производителя. Очищенные пан-T-клетки ресуспендировали в буфере, состоящем из 90% FCS и 10% ДМСО, немедленно замораживали и хранили в жидком азоте до дальнейшего использования.
[00319] Для анализа T-клетки размораживали и помещали в культуральную среду (RPMI 1640, Life Technologies) с добавкой 10% FCS и 1% пенициллин-стрептомицина (Life Technologies) на 16 ч при 37°C в увлажненной атмосфере с 5% CO2.
[00320] Следующая процедура была проведена в трех повторах для каждого условия эксперимента: планшеты с плоским дном для тканевых культур предварительно покрывали 0,25 мкг/мл антитела к CD3 на 1 ч при 37°C, а затем дважды промывали PBS. Линии опухолевых клеток RKO, HCC827 или Hep-G2 обрабатывали в течение 30 минут 30 мкг/мл митомицина C (Sigma Aldrich) для блокирования пролиферации. Затем обработанные митомицином опухолевые клетки дважды промывали PBS и высевали из расчета 2,5 × 104 клеток на лунку в культуральную среду, чтобы обеспечить прикрепление, на ночь при 37°C в увлажненной атмосфере с 5% CO2. Клетки-мишени, до этого выращивавшиеся в стандартных условиях, отделяли с помощью Accutase (PAA Laboratories) и ресуспендировали в культуральной среде.
[00321] В следующие дни после двукратной промывки планшетов PBS к опухолевым клеткам добавляли 1,25 × 104 Т-клеток на лунку. Последовательные разведения слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87 и SEQ ID NO: 86 и 93), референсного антитела к PD-L1 (SEQ ID NO: 26 и 27) и референсного антитела к CD137 (SEQ ID NO: 28 и 29), использованных по отдельности или в комбинации, или изотипического контроля (SEQ ID NO: 24 и 25), обычно в диапазоне от 0,005 нМ до 10 нМ, добавляли в соответствующие лунки. Планшеты закрывали газопроницаемой пленкой и инкубировали при 37°C в увлажненной атмосфере с 5% CO2 в течение 3 дней.
[00322] Спустя 3 дня совместного культивирования оценивали уровень IL-2 в супернатанте, как описано в примере 11.
[00323] Иллюстративные данные показаны на фиг. 10. Совместное культивирование пан-T-клеток с клетками RKO (высокий уровень PD-L1) или HCC827 (умеренный уровень PD-L1) в присутствии слитых белков, где мутеин липокалина слит с C-концом PD-L1-специфического антитела (SEQ ID NO: 90 и 87 и SEQ ID NO: 86 и 91), приводило к явному повышению секреции IL-2 по сравнению с изотипическим контролем hIgG4. Повышение секреции IL-2, вызванное слитыми белками, где мутеин липокалина слит с N-концом PD-L1-специфического антитела (SEQ ID NO: 92 и 87 и SEQ ID NO: 86 и 93), было более слабым, но тем не менее выше, чем с коктейлем из референсного антитела к CD137 (SEQ ID NO: 28 и 29) и референсного антитела к PD-L1 (SEQ ID NO: 26 и 27). Никакого повышения секреции IL-2 не наблюдалось с коктейлем из строительных блоков: CD137-специфического мутеина липокалина (слияние с Fc, SEQ ID NO: 89) и антитела к PD-L1 (SEQ ID NO: 86 и 87). Кроме того, совместное культивирование с Hep-G2 (PD-L1-отрицательные) не вызывало повышения уровней секреции IL-2 ни с какими слитыми белками, в отличие от коктейля из референсного антитела к CD137 (SEQ ID NO: 28 и 29) и референсного антитела к PD-L1 (SEQ ID NO: 26 и 27).
[00324] Данные показывают, что функциональная активность слитых белков, измеренная по их способности активировать Т-клетки или повышать секрецию IL-2, зависит от PD-L1. Напротив, активация Т-клеток или секреция IL-2, индуцированная референсным антителом к CD137 (SEQ ID NO: 28 и 29) при использовании в комбинации с референсным антителом к PD-L1 (SEQ ID NO: 26 и 27), не обязательно зависит от PD-L1 и ее трудно предсказать. Кроме того, данные показывают, что биспецифический формат нацеливания на PD-L1 и CD137 превосходит коктейль из двух отдельных молекул, нацеленных на CD137 и PD-L1, в присутствии клеток-мишеней, экспрессирующих PD-L1.
[00325] Пример 13. Оценка стабильности слитых белков при хранении
[00326] Для оценки стабильности при хранении иллюстративные слитые белки (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87, SEQ ID NO: 88 и SEQ ID NO: 89) инкубировали в течение 1 недели при 37°C в концентрации 1 мг/мл в PBS. Затем определяли мономерные слитые белки с использованием аналитической эксклюзионной хроматографии путем нанесения 20 мкг образца на колонку Superdex 200, 3.2/300 Increase (GE Healthcare) при скорости потока 0,15 мл/мин и PBS в качестве подвижного буфера. Все протестированные слитые пептиды были стабильными после инкубации в течение 1 недели в PBS при 37°C. Иллюстративные результаты показаны на фиг. 11A.
[00327] Дальнейшие оценки стабильности при хранении были выполнены для выбранного слитого белка с последовательностями SEQ ID NO: 90 и 87. Слитый белок в концентрации 20 мг/мл инкубировали в течение четырех недель при 40°C в 25 мМ гистидине, 60 мМ NaCl, 200 мМ аргинине, pH 6. Содержание функционального слитого белка измеряли с помощью количественного анализа ELISA, используя анализ одновременного связывания, как описано в примере 5. Иллюстративные результаты показаны на фиг. 11B.
[00328] Пример 14. Оценка реакции смешанной культуры лимфоцитов (MLR) с CD4+ Т-клетками
[00329] Анализ реакции смешанной культуры лимфоцитов (MLR) использовали для оценки способности иллюстративного слитого белка индуцировать активацию CD4+ Т-клеток в присутствии антигенпрезентирующих клеток. Слитый белок (SEQ ID NO: 90 и 87) в различных концентрациях тестировали в присутствии моноцитарных дендритных клеток (moDC) и CD4+ Т-клеток от несовместимых здоровых доноров. Спустя 6 дней культивирования в присутствии тестируемых молекул количественно определяли секрецию IL-2 и IFN-гамма в супернатантах.
[00330] МНПК очищали из пакета концентрата тромбоцитов, полученного аферезом, используя раствор Lymphoprep, следуя инструкциям производителя (StemCell). Суммарные CD4+ Т-лимфоциты очищали от МНПК с использованием набора от Miltenyi и замораживали в растворе 90% FBS 10% ДМСО. CD14+ моноциты очищали с использованием набора CD14+ микросфер (Miltenyi) и использовали в свежем виде.
[00331] MoDC были получены путем культивирования CD14+ моноцитов в RPMI1640 с 10% FBS и пенициллин/стрептомицином (LifeTech) в присутствии 50 нг/мл IL-4 и 100 нг/мл ГМ-КСФ (Miltenyi) в течение 6 дней при 2x106 клеток/мл. На 3-й день добавляли 10 мл свежей среды, содержащей цитокины. Фенотип (CD14, CD1a, HLADR, PD-L1) оценивали на 7-й день дифференцировки с помощью FACS.
[00332] 10000 moDC культивировали в присутствии 50000 CD4+ T-клеток в 96-луночных планшетах с U-образным дном в полной среде RPMI, в присутствии тестируемых молекул в течение 6 дней в RPMI в трех параллельных лунках. По окончании культивирования супернатанты немедленно замораживали и хранили для количественного определения цитокинов.
[00333] Уровень IL-2 измеряли в супернатантах с использованием технологии Luminex, и иллюстративные данные показаны на фиг. 12. На фиг. 12A показано, что слитый белок (SEQ ID NO: 90 и 87) продемонстрировал значительно лучшую индукцию IL-2 при 10 и 0,1 мкг/мл по сравнению с соответствующими строительными блоками (SEQ ID NO: 89 и SEQ ID NO: 86 и 87) по отдельности или референсным антителом к CD137 или к PD-L1 (SEQ ID NO: 28 и 29 или SEQ ID NO: 26 и 27) в нескольких сериях экспериментов MLR (N=8). На фиг. 12B показано, что слитый белок (SEQ ID NO: 90 и 87) индуцировал дозозависимую секрецию IL-2 по сравнению с антителом изотипического контроля. Уровни IL-2, индуцированные слитым белком с последовательностями SEQ ID NO: 90 и 87, были выше по сравнению с эквимолярными концентрациями коктейля из референсного антитела к PD-L1 (SEQ ID NO: 26 и 27) и референсного антитела к CD137 (SEQ ID NO: 28 и 29) в диапазоне концентраций от 0,001 до 20 мкг/мл.
[00334] Пример 15. Оценка реакции смешанной культуры лимфоцитов с CD8+ Т-клетками
[00335] Учитывая сведения об экспрессии и активности CD137 в человеческих CD8+ Т-клетках, описанные в литературе, способность иллюстративного слитого белка индуцировать активацию CD8+ Т-клеток в присутствии антигенпрезентирующих клеток оценили в анализе MLR. Слитый белок (SEQ ID NO: 90 и 87) тестировали в присутствии moDC и суммарных CD8+ Т-клеток от несовместимых здоровых доноров. Спустя 6 дней культивирования в присутствии тестируемых молекул количественно определяли секрецию IL-2 и эффекторных молекул CD8 (перфорина, гранзима B и гранзима A) в супернатантах.
[00336] МНПК очищали из пакета концентрата тромбоцитов, полученного аферезом, используя раствор Lymphoprep, следуя инструкциям производителя (StemCell). Суммарные CD8+ Т-лимфоциты очищали от МНПК с использованием набора от Miltenyi и использовали свежими. CD14-положительные моноциты очищали с использованием набора микросфер CD14+ (Miltenyi) и использовали в свежем виде.
[00337] MoDC были получены путем культивирования CD14+ моноцитов в RPMI1640 с 10% FBS и пенициллин/стрептомицином (LifeTech) в присутствии 50 нг/мл IL-4 и 100 нг/мл ГМ-КСФ (Miltenyi) в течение 6 дней при 2x106 клеток/мл. На 3-й день добавляли 10 мл свежей среды, содержащей цитокины. Фенотип (CD14, CD1a, HLADR, PD-L1) оценивали на 7-й день дифференцировки с помощью FACS.
[00338] 10000 moDC культивировали с 50000 CD8+ T-клеток в присутствии тестируемых молекул в 96-луночных планшетах с U-образным дном (в трех параллельных лунках) в полной среде RPMI в течение 6 дней. По окончании культивирования супернатанты немедленно замораживали и хранили для количественного определения секретированных факторов.
[00339] В супернатантах количественно определяли IL-2, перфорин, гранзим А и гранзим В с использованием технологии Luminex. Иллюстративные данные показаны на фиг. 13.
[00340] На фиг. 13 показано, что слитый белок (SEQ ID NO: 90 и 87) продемонстрировал повышение секреции IL-2, перфорина, гранзима B и гранзима A по сравнению с эквимолярной концентрацией референсного антитела к PD-L1 (SEQ ID NO: 26 и 27), референсного антитела к CD137 (SEQ ID NO: 28 и 29) или коктейлем из этих двух антител в концентрации 10 мкг/мл (N=4). Данные также указывают на то, что слитый белок (SEQ ID NO: 90 и 87) обладает активностью в отношении цитотоксических CD8+ Т-клеток.
[00341] Пример 16. Оценка функциональной активности in vivo на мышиной модели ксенотрансплантата с привитыми человеческими МНПК
[00342] Чтобы исследовать активность предложенных слитых белков in vivo, будет использована мышиная модель ксенотрансплантата, полученного из клеточной линии. В соответствии с этим линия человеческих раковых клеток будет подкожно имплантирована самкам мышей NOG с иммунодефицитом, доставленным в возрасте 4-6 недель с по меньшей мере 1 неделей карантина. После того, как опухоли достигнут объема примерно 80-100 мм3, мышам будут переносить человеческие МНПК. Тестируемые соединения будут инъецированы не менее трех раз, и рост и активность опухоли будут постоянно измеряться. По достижении конца исследования мыши будут умерщвлены. Внутриопухолевую инфильтрацию CD3-, CD4- и CD8-положительными клетками будут оценивать с помощью иммуногистохимии. В качестве дополнительного показателя будет проведен анализ IFN-гамма методом RNAscope.
[00343] Пример 17. Анализ эпитопа слитых белков
[00344] Для оценки эпитопов, которые распознают слитые белки, и того, являются ли они клинически значимыми, был использован конкурентный формат ELISA для определения конкуренции между слитыми белками и референсным антителом к CD137.
[00345] Планшеты для микротитрования покрывали референсным антителом к CD137 с последовательностями SEQ ID NO: 28 и 29 в PBS (4 мкг/мл) при 4°C на ночь. Планшеты промывали пять раз после каждой стадии инкубации 100 мкл PBS-0,05%T (PBS с добавкой 0,05% (об./об.) Tween 20). Планшеты блокировали 2% BSA (мас./об.) в PBS-0,1%T (PBS с добавкой 0,1% (об./об.) Tween 20) в течение 1 ч при комнатной температуре, а затем снова промывали. Слитые белки (SEQ ID NO: 90 и 87 и SEQ ID NO: 86 и 91), мутеин липокалина, специфичный к CD137 (SEQ ID NO: 42), референсное антитело к CD137 (SEQ ID NO: 28 и 29) и контрольное антитело (SEQ ID NO: 86 и 87) в различных концентрациях смешивали с 1 нМ биотинилированного человеческого CD137, слитого с Fc (huCD137-Fc-bio), в качестве индикатора и инкубировали в течение 1 ч при комнатной температуре. Смеси тестируемых молекул и индикатора добавляли в планшеты и инкубировали в течение 20 мин при комнатной температуре, после чего проводили пять этапов промывки 100 мкл PBS-0,05%T. Затем в лунки добавляли разведенный 1:5000 ExtrAvidin-HRP (Sigma-Aldrich) в PBS-0,1%T-2%BSA и инкубировали в течение 1 ч. После дополнительной стадии промывки в каждую лунку добавляли флуорогенный субстрат HRP (QuantaBlu, Thermo) и определяли интенсивность флуоресценции с помощью считывающего флуоресценцию устройства для микропланшетов.
[00346] Данные о конкуренции для иллюстративного эксперимента показаны на фиг. 14, где на оси x обозначена концентрация тестируемой молекулы, а на оси y - измеренная концентрация индикаторной молекулы. Данные аппроксимировали сигмоидальной кривой 1:1, где значение IC50 и максимальный сигнал были свободными параметрами, а наклон был установлен равным единице. Результаты демонстрируют, что иллюстративные слитые белки (SEQ ID NO: 90 и 87 и SEQ ID NO: 86 и 91) конкурируют с антителом к CD137 с последовательностями SEQ ID NO: 28 и 29 за связывание с CD137, что позволяет предположить, что слитые белки связывают перекрывающиеся с антителом эпитопы.
[00347] Таблица 10. Конкуренция слитых белков
[00348] Пример 18. Оценка активации Т-клеток с помощью биоанализа блокады PD-1/PD-L1
[00349] Потенциал выбранных слитых белков в отношении блокады опосредованной PD-1/PD-L1 супрессии оценивали с использованием Т-клеток PD-1-NFAT-luc Jurkat (клеточная линия Jurkat, генетически модифицированная для экспрессии PD-1 и гена luc (гена люциферазы светлячка), управляемая элементом ответа NFAT (NFAT-RE)), совместно культивированных с клетками PD-L1 aAPC/CHO-K1 (клетки CHO-K1, экспрессирующие человеческий PD-L1 и генетически модифицированный белок клеточной поверхности, предназначенный для активации родственных TCR антиген-независимым образом). В этом биоанализе, когда T-клетки PD-1-NFAT-luc Jurkat и клетки PD-L1 aAPC/CHO-K1 совместно культивируются, взаимодействие PD-1/PD-L1 ингибирует передачу сигналов TCR и опосредованную NFAT-RE люминесценцию. Добавление агента, блокирующего PD-1/PD-L1, такого как слитые белки, специфичные к CD137 и PD-L1, как описано в настоящем документе, высвобождает ингибирующий сигнал и приводит к активации TCR и опосредованной NFAT-RE люминесценции.
[00350] Клетки PD-L1 aAPC/CHO-K1 выращивали в среде F12 Хэма с добавкой 10% FCS и высевали из расчета 8,00 × 103 клеток на лунку и оставляли на ночь для прикрепления при 37°C в увлажненной атмосфере с 5% CO2. На следующий день культуральные среды отбрасывали. В каждую лунку добавляли 1,00 × 104 T-клеток PD-1-NFAT-luc Jurkat с последующим добавлением различных концентраций, обычно в диапазоне от 0,005 нМ до 50 нМ, слитого белка (SEQ ID NO: 90 и 87) или антитела к PD-L1 (SEQ ID NO: 86 и 87 или SEQ ID NO: 26 и 27). Планшеты закрывали газопроницаемой пленкой и инкубировали при 37°C в увлажненной атмосфере с 5% CO2. Через 6 ч в каждую лунку добавляли 30 мкл реагента Bio-Glo™ и количественно определяли биолюминесцентный сигнал с помощью люминометра. Анализ с использованием четырехпараметрической логистической кривой был выполнен с помощью GraphPad Prism® для расчета значений EC50, которые обобщены в таблице 11. Анализ проводили в трех повторностях.
[00351] Результаты иллюстративного эксперимента представлены на фиг. 15 Данные демонстрируют, что тестируемый слитый белок ингибирует блокаду PD-1/PD-L1 и активирует Т-клетки дозозависимым образом со значением EC50, сопоставимым со значением EC50 для антитела к PD-L1 (SEQ ID NO: 86 и 87 или SEQ ID NO: 26 и 27). Используемые в качестве отрицательных контролей референсное антитело к CD137 (SEQ ID NO: 28 и 29) и/или антитело изотипического контроля (SEQ ID NO: 24 и 25) не приводят к увеличению сигнала люминесценции.
[00352] Таблица 11. Оценка активации Т-клеток с помощью биоанализа блокады PD-1/PD-L1
[00353] Пример 19. Оценка активации Т-клеток с использованием человеческих МНПК
[00354] Для оценки способности выбранных слитых белков костимулировать Т-клеточные ответы использовали дополнительный анализ на Т-клетках, в котором слитые белки в различных концентрациях добавляли к стимулированным SEB человеческим МНПК и инкубировали в течение 3 дней при 37°C. В супернатантах измеряли уровни секреции IL-2.
[00355] МНПК от здоровых добровольцев-доноров выделяли и хранили, как описано в примере 11. Для анализа МНПК размораживали и помещали в культуральную среду (RPMI 1640, Life Technologies) с добавкой 10% FCS и 1% пенициллин-стрептомицина (Life Technologies) на 24 ч при 37°C в увлажненной атмосфере с 5% CO2.
[00356] Следующая процедура была проведена в трех повторностях для каждого условия эксперимента: 2,5x104 МНПК инкубировали в каждой лунке 384-луночных планшетов с плоским дном для тканевых культур в культуральной среде. Последовательные разведения выбранного слитого белка (SEQ ID NO: 90 и 87), антитела к PD-L1-строительного блока (SEQ ID NO: 86 и 87), референсного антитела к CD137 (SEQ ID NO: 28 и 29), использованного по отдельности или в комбинации с референсным антителом к PD-L1 (SEQ ID NO: 26 и 27), или изотипического контроля (SEQ ID NO: 24 и 25), обычно в диапазоне от 0,0002 до 10 нМ, и 0,1 нг/мл SEB добавляли в соответствующие лунки. Планшеты закрывали газопроницаемой пленкой (4titude) и инкубировали при 37°C в увлажненной атмосфере с 5% CO2 в течение трех дней. Затем оценивали уровень IL-2 в супернатанте, как описано в примере 11.
[00357] Результаты иллюстративного эксперимента представлены на фиг. 16 Сводные значения EC50 тестируемых молекул в отношении индукции секреции IL-2 приведены в таблице 12. Биспецифический слитый белок с последовательностями SEQ ID NO: 90 и 87 индуцирует сильное дозозависимое повышение секреции IL-2 до более высоких уровней по сравнению с антителом к PD-L1-строительным блоком, референсным антителом к CD137 и коктейлем из референсных антител к PD-L1 и к CD137, а также снижает значение эффективности EC50 по сравнению с антителами к PD-L1 и к CD137, используемыми по отдельности или в комбинации.
[00358] Таблица 12. Оценка активации Т-клеток с использованием человеческих МНПК
[00359] Пример 20. Оценка PD-L1-зависимой активации Т-клеток, индуцированной слитыми белками
[00360] Зависимую от мишени PD-L1 костимуляцию Т-клеток слитыми белками дополнительно анализировали с использованием анализа активации Т-клеток. Слитые белки применяли в различных концентрациях к Т-клеткам, стимулированным антителом к CD3, совместно культивированным с клетками Flp-In-CHO, трансфицированными человеческим PD-L1 или ложно трансфицированными. В супернатантах измеряли уровни секреции IL-2.
[00361] МНПК от здоровых добровольцев-доноров выделяли из лейкотромбоцитарного слоя, как описано в примере 11. Т-лимфоциты дополнительно очищали и хранили, как описано в примере 12.
[00362] Для анализа T-клетки размораживали и помещали в культуральную среду (RPMI 1640, Life Technologies) с добавкой 10% FCS и 1% пенициллин-стрептомицина (Life Technologies) на ночь при 37°C в увлажненной атмосфере с 5% CO2.
[00363] Следующая процедура была проведена в трех повторах для каждого условия эксперимента: планшеты с плоским дном для тканевых культур предварительно покрывали 0,25 мкг/мл антитела к CD3 на 2 ч при 37°C, а затем дважды промывали PBS. Клетки СНО, трансфицированные человеческим PD-L1 или ложно трансфицированные, обрабатывали в течение 30 минут 30 мкг/мл митомицина C (Sigma Aldrich) для блокирования пролиферации. Затем обработанные митомицином клетки дважды промывали PBS и высевали из расчета 1,0 × 107 клеток на лунку в культуральной среде, чтобы обеспечить прикрепление, в течение ночи при 37°C в увлажненной атмосфере с 5% CO2. Клетки CHO, до этого выращивавшиеся в стандартных условиях, отделяли с помощью Accutase (PAA Laboratories) и ресуспендировали в культуральной среде.
[00364] В следующие дни к клеткам СНО добавляли 8,33 × 103 Т-клеток на лунку. Последовательные разведения иллюстративного слитого белка с последовательностями SEQ ID NO: 90 и 87, антитела к PD-L1-строительного блока (SEQ ID NO: 86 и 87), референсного антитела к CD137 (SEQ ID NO: 28 и 29) и коктейля из референсного антитела к PD-L1 (SEQ ID NO: 26 и 27) и референсного антитела к CD137 (SEQ ID NO: 28 и 29), или изотипического контроля (SEQ ID NO: 24 и 25), обычно в диапазоне от 0,003 нМ до 50 нМ, добавляли в соответствующие лунки. Планшеты закрывали газопроницаемой пленкой и инкубировали при 37°C в увлажненной атмосфере с 5% CO2 в течение 2 дней.
[00365] Спустя 2 дня совместного культивирования оценивали уровни IL-2 в супернатанте, как описано в примере 11.
[00366] Иллюстративные данные показаны на фиг. 17. Совместное культивирование пан-Т-клеток с клетками СНО, трансфицированными человеческим PD-L1, в присутствии слитого белка (SEQ ID NO: 90 и 87 и SEQ ID NO: 86 и 91) привело к сильной дозозависимой секреции IL-2 по сравнению с изотипическим контролем hIgG4 и намного более сильной, чем у референсных антител, где наблюдалось лишь небольшое повышение секреции IL-2 для референсного антитела к CD137 или коктейля из референсного антитела к CD137 и референсного антитела к PD-L1. При совместном культивировании с ложно трансфицированными клетками СНО (PD-L1-отрицательными) только референсное антитело к CD137 и коктейль из референсного антитела к CD137 и референсного антитела к PD-L1 показали небольшое дозозависимое повышение секреции IL-2. Результаты показывают, что активация Т-клеток слитыми белками зависит от PD-L1, тогда как референсное антитело к CD137 (SEQ ID NO: 28 и 29) продемонстрировало опосредованную CD137 костимуляцию Т-клеток независимо от наличия или отсутствия клеток-мишеней.
[00367] Пример 21. Фармакокинетика слитых белков у мышей
[00368] Проводили анализы фармакокинетики иллюстративных слитых белков (SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91) на мышах. Самцам мышей CD-1 возрастом приблизительно 5 недель (3 мыши на временную точку; Charles River Laboratories, Research Models and Services, Germany GmbH) вводили в хвостовую вену слитый белок в дозе 10 мг/кг. Тестируемые препараты вводили в виде болюса объемом 5 мл/кг. Образцы плазмы мышей получали во временных точках 5 мин, 1 час, 4 часа, 8 часов, 24 часа, 48 часов, 4 дня, 8 дней, 14 дней, 21 день и 28 дней. Собирали достаточное количество цельной крови – кровь брали под анестезией изофлураном – для получения не менее 100 мкл плазмы с Li-гепарином на животное и временную точку. Уровни лекарственного средства определяли с помощью сэндвич-ELISA, детектируя целую биспецифическую конструкцию посредством мишеней PD-L1 и CD137. Данные аппроксимировали с использованием двухкомпартментной модели с использованием программного обеспечения Prism GraphPad 5.
[00369] На фиг. 18 показаны графики зависимости концентрации в плазме от времени для слитых белков SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 и SEQ ID NO: 90 и 91, нанесенные на график вместе со значениями, полученными для антитела к PD-L1-строительного блока (SEQ ID NO: 86 и 87) в качестве референсного. Фармакокинетика во всех случаях была схожей. Начиная с концентрации в плазме около 200 мкг/мл, уровни в плазме упали до уровня около 50 мкг/мл в течение 48 часов, а затем снижались гораздо медленнее до уровня около 10 мкг/мл в конце эксперимента через 28 дней. К этим данным был применен некомпартментный анализ. Сводные значения конечных периодов полувыведения приведены в таблице 13.
[00370] Данные демонстрируют, что слитые белки имеют длительные, антителоподобные конечные периоды полувыведения у мышей. Поскольку анализ, используемый для определения концентраций слитых белков в плазме, требует сохранения активности как в отношении PD-L1, так и CD137, результат также демонстрирует, что биспецифические молекулы остаются неизменными в течение 28 дней.
[00371]
[00372] Таблица 13. Конечные периоды полувыведения у мышей, определенные с использованием некомпартментного анализа
[00373] Пример 22. Фармакокинетика слитых белков у мышей
[00374] Был проведен анализ фармакокинетики иллюстративного слитого белка с последовательностями SEQ ID NO: 90 и 87 у мышей и сопоставлен с двумя ранее описанными CD137- и PD-L1-связывающими слитыми белками (SEQ ID NO: 147 и SEQ ID NO: 148). Самцам мышей CD-1 возрастом приблизительно 5 недель (2 мыши на временную точку; Charles River Laboratories, Research Models and Services, Germany GmbH) вводили в хвостовую вену соответствующую молекулу в дозе 2 мг/кг. Образцы плазмы мышей получали во временных точках 5 мин, 24 часа, 168 часов и 336 часов. Собирали достаточное количество цельной крови – х овь брали под анестезией изофлураном – для получения не менее 30-50 мкл плазмы с Li-гепарином на животное и временную точку.
[00375] Затем анализировали уровни лекарственного средства в плазме с помощью ELISA. HuCD137-His (человеческий CD137 с C-концевой полигистидиновой меткой) растворяли в PBS (1 мкг/мл) и наносили на микротитровальные планшеты на ночь при 4 °C. Планшет пять раз промывали после каждой стадии инкубации 80 мкл PBS с добавкой 0,05% (об./об.) Tween 20. Планшеты блокировали PBS/BSA/Tween (PBS, содержащий 2% BSA (мас./об.) и 0,1% (об./об.) Tween 20) в течение 1 ч при комнатной температуре, а затем промывали. Образцы плазмы разводили в PBS/BSA/Tween до концентрации плазмы 20%, добавляли в лунки и инкубировали в течение 1 ч при комнатной температуре. Затем проводили еще одну стадию промывки. Спустя 1 ч инкубации исследуемые связанные агенты детектировали смесью биотинилированного человеческого PD-L1 и стрептавидина SULFO-TAG (Mesoscale Discovery) в концентрации 1 мкг/мл каждый, разведенных в PBS, содержащем 2% BSA (мас./об.) и 0,1% (об./об.) Tween 20. После дополнительной стадии промывки в каждую лунку добавляли 35 мкл буфера для считывания и считывали сигнал электрохемилюминесценции (ECL) из каждой лунки с помощью считывающего устройства Mesoscale Discovery. Данные переносили в Excel для анализа и количественной оценки. Была построена градуировочная кривая со стандартными разведениями белка.
[00376] На фиг. 19 показаны графики зависимости концентрации в плазме от времени для SEQ ID NO: 90 и 87, SEQ ID NO: 147 и SEQ ID NO: 148. SEQ ID NO: 90 и 87 демонстрирует благоприятный фармакокинетический профиль или антителоподобную фармакокинетику, в отличие от SEQ ID NO: 147 и SEQ ID NO: 148. В контексте настоящего документа можно считать, что благоприятный фармакокинетический профиль или антителоподобная фармакокинетика достигнуты, если % cmax был выше 10% спустя 336 часов.
[00377] Варианты осуществления, описанные в настоящем документе в целях иллюстрации, могут подходящим образом быть осуществлены на практике при отсутствии какого-либо элемента или элементов, ограничения или ограничений, конкретно не раскрытых в настоящем документе. Таким образом, например, термины «содержащий», «включающий» и т. д. следует толковать расширительно и без ограничения. Кроме того, используемые в настоящем документе термины и выражения использовались как термины для описания, а не ограничения, и при использовании таких терминов и выражений не подразумевается исключение каких-либо эквивалентов показанных и описанных признаков или их частей, но считается, что в объеме заявленного изобретения возможны различные модификации. Таким образом, следует понимать, что, хотя настоящие варианты осуществления были конкретно раскрыты с помощью предпочтительных вариантов осуществления и необязательных признаков, специалисты в данной области техники могут прибегать к его модификации и вариациям, и что такие модификации и вариации рассматриваются как входящие в объем данного изобретения. Все патенты, патентные заявки, учебники и рецензируемые публикации, описанные в настоящем документе, настоящим полностью включены посредством ссылки. Кроме того, если определение или использование термина в источнике, включенном в настоящий документ посредством ссылки, не согласуется или противоречит определению этого термина, приведенному в настоящем документе, применяется определение этого термина, приведенное в настоящем документе, а определение этого термина в источнике не применяется. Каждый из более узких видов и субродовых групп, подпадающих под общее раскрытие, также составляет часть изобретения. Это включает общее описание изобретения с условием или отрицательным ограничением, исключающим любой объект из рода, независимо от того, упомянут ли конкретно удаленный материал в настоящем документе. Кроме того, если признаки описаны в виде групп Маркуша, специалисты в данной области техники поймут, что изобретение тем самым также описано посредством любого отдельного члена или подгруппы членов группы Маркуша. Дополнительные варианты осуществления станут очевидными из следующей формулы изобретения.
[00378] Эквиваленты: Специалисты в данной области техники поймут или смогут установить, используя не более чем обычное экспериментирование, многие эквиваленты конкретных вариантов осуществления изобретения, описанных в настоящем документе. Подразумевается, что такие эквиваленты охватываются следующей формулой изобретения. Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были специально и индивидуально указаны как включенные в настоящий документ посредством ссылки.
VI. НЕПАТЕНТНЫЕ ИСТОЧНИКИ
1. GATO-CANAS, M., ZUAZO, M., ARASANZ, H., IBANEZ-VEA, M., LORENZO, L., FERNANDEZ-HINOJAL, G., VERA, R., SMERDOU, C., MARTISOVA, E., AROZARENA, I., WELLBROCK, C., LLOPIZ, D., RUIZ, M., SAROBE, P., BRECKPOT, K., KOCHAN, G. & ESCORS, D. 2017. PDL1 Signals through Conserved Sequence Motifs to Overcome Interferon-Mediated Cytotoxicity. Cell Rep, 20, 1818-1829.
2. KARWACZ, K., BRICOGNE, C., MACDONALD, D., ARCE, F., BENNETT, C. L., COLLINS, M. & ESCORS, D. 2011. PD-L1 co-stimulation contributes to ligand-induced T cell receptor down-modulation on CD8+ T cells. EMBO Mol Med, 3, 581-92.
3. ARASANZ, H., GATO-CANAS, M., ZUAZO, M., IBANEZ-VEA, M., BRECKPOT, K., KOCHAN, G. & ESCORS, D. 2017. PD1 signal transduction pathways in T cells. Oncotarget, 8, 51936-51945.
4. PATSOUKIS, N., BARDHAN, K., CHATTERJEE, P., SARI, D., LIU, B., BELL, L. N., KAROLY, E. D., FREEMAN, G. J., PETKOVA, V., SETH, P., LI, L. & BOUSSIOTIS, V. A. 2015. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun, 6, 6692.
5. XU-MONETTE, Z. Y., ZHANG, M., LI, J. & YOUNG, K. H. 2017. PD-1/PD-L1 Blockade: Have We Found the Key to Unleash the Antitumor Immune Response? Front Immunol, 8, 1597.
6. LI, S. Y. & LIU, Y. 2013. Immunotherapy of melanoma with the immune costimulatory monoclonal antibodies targeting CD137. Clin Pharmacol, 5, 47-53.
7. SNELL, L. M., LIN, G. H., MCPHERSON, A. J., MORAES, T. J. & WATTS, T. H. 2011. T-cell intrinsic effects of GITR and 4-1BB during viral infection and cancer immunotherapy. Immunol Rev, 244, 197-217.
8. WYZGOL, A., MULLER, N., FICK, A., MUNKEL, S., GRIGOLEIT, G. U., PFIZENMAIER, K. & WAJANT, H. 2009. Trimer stabilization, oligomerization, and antibody-mediated cell surface immobilization improve the activity of soluble trimers of CD27L, CD40L, 41BBL, and glucocorticoid-induced TNF receptor ligand. J Immunol, 183, 1851-61.
9. YAO, S., ZHU, Y. & CHEN, L. 2013. Advances in targeting cell surface signalling molecules for immune modulation. Nat Rev Drug Discov, 12, 130-46.
10. MELERO, I., BACH, N., HELLSTROM, K. E., ARUFFO, A., MITTLER, R. S. & CHEN, L. 1998. Amplification of tumor immunity by gene transfer of the co-stimulatory 4-1BB ligand: synergy with the CD28 co-stimulatory pathway. Eur J Immunol, 28, 1116-21.
11. YANG, Y., YANG, S., YE, Z., JAFFAR, J., ZHOU, Y., CUTTER, E., LIEBER, A., HELLSTROM, I. & HELLSTROM, K. E. 2007. Tumor cells expressing anti-CD137 scFv induce a tumor-destructive environment. Cancer Res, 67, 2339-44.
12. ZHANG, H., KNUTSON, K. L., HELLSTROM, K. E., DISIS, M. L. & HELLSTROM, I. 2006. Antitumor efficacy of CD137 ligation is maximized by the use of a CD137 single-chain Fv-expressing whole-cell tumor vaccine compared with CD137-specific monoclonal antibody infusion. Mol Cancer Ther, 5, 149-55.
13. YE, Z., HELLSTROM, I., HAYDEN-LEDBETTER, M., DAHLIN, A., LEDBETTER, J. A. & HELLSTROM, K. E. 2002. Gene therapy for cancer using single-chain Fv fragments specific for 4-1BB. Nat Med, 8, 343-8.
14. MARTINET, O., DIVINO, C. M., ZANG, Y., GAN, Y., MANDELI, J., THUNG, S., PAN, P. Y. & CHEN, S. H. 2002. T cell activation with systemic agonistic antibody versus local 4-1BB ligand gene delivery combined with interleukin-12 eradicate liver metastases of breast cancer. Gene Ther, 9, 786-92.
15. YE, Q., SONG, D. G., POUSSIN, M., YAMAMOTO, T., BEST, A., LI, C., COUKOS, G. & POWELL, D. J., JR. 2014. CD137 accurately identifies and enriches for naturally occurring tumor-reactive T cells in tumor. Clin Cancer Res, 20, 44-55.
16. CHACON, J. A., WU, R. C., SUKHUMALCHANDRA, P., MOLLDREM, J. J., SARNAIK, A., PILON-THOMAS, S., WEBER, J., HWU, P. & RADVANYI, L. 2013. Co-stimulation through 4-1BB/CD137 improves the expansion and function of CD8(+) melanoma tumor-infiltrating lymphocytes for adoptive T-cell therapy. PLoS One, 8, e60031.
17. FISHER, T. S., KAMPERSCHROER, C., OLIPHANT, T., LOVE, V. A., LIRA, P. D., DOYONNAS, R., BERGQVIST, S., BAXI, S. M., ROHNER, A., SHEN, A. C., HUANG, C., SOKOLOWSKI, S. A. & SHARP, L. L. 2012. Targeting of 4-1BB by monoclonal antibody PF-05082566 enhances T-cell function and promotes anti-tumor activity. Cancer Immunol Immunother, 61, 1721-33.
18. SKERRA, A. 2000. Lipocalins as a scaffold. Biochim Biophys Acta, 1482, 337-50.
19. FLOWER, D. R., NORTH, A. C. & SANSOM, C. E. 2000. The lipocalin protein family: structural and sequence overview. Biochim Biophys Acta, 1482, 9-24.
20. FLOWER, D. R. 1996. The lipocalin protein family: structure and function. Biochem J, 318 ( Pt 1), 1-14.
21. ALTSCHUL, S. F., MADDEN, T. L., SCHAFFER, A. A., ZHANG, J., ZHANG, Z., MILLER, W. & LIPMAN, D. J. 1997. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res, 25, 3389-402.
22. ALTSCHUL, S. F., GISH, W., MILLER, W., MYERS, E. W. & LIPMAN, D. J. 1990. Basic local alignment search tool. J Mol Biol, 215, 403-10.
23. SMITH, T. F. & WATERMAN, M. S. 1981. Identification of common molecular subsequences. J Mol Biol, 147, 195-7.
24. WARD, E. S., GUSSOW, D., GRIFFITHS, A. D., JONES, P. T. & WINTER, G. 1989. Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichia coli. Nature, 341, 544-6.
25. HOLLIGER, P., PROSPERO, T. & WINTER, G. 1993. "Diabodies": small bivalent and bispecific antibody fragments. Proc Natl Acad Sci U S A, 90, 6444-8.
26. JOHNSON, G. & WU, T. T. 2000. Kabat database and its applications: 30 years after the first variability plot. Nucleic Acids Res, 28, 214-8.
27. EHRENMANN, F., KAAS, Q. & LEFRANC, M. P. 2010. IMGT/3Dstructure-DB and IMGT/DomainGapAlign: a database and a tool for immunoglobulins or antibodies, T cell receptors, MHC, IgSF and MhcSF. Nucleic Acids Res, 38, D301-7.
28. BULLIARD, Y., JOLICOEUR, R., ZHANG, J., DRANOFF, G., WILSON, N. S. & BROGDON, J. L. 2014. OX40 engagement depletes intratumoral Tregs via activating FcgammaRs, leading to antitumor efficacy. Immunol Cell Biol, 92, 475-80.
29. BULLIARD, Y., JOLICOEUR, R., WINDMAN, M., RUE, S. M., ETTENBERG, S., KNEE, D. A., WILSON, N. S., DRANOFF, G. & BROGDON, J. L. 2013. Activating Fc gamma receptors contribute to the antitumor activities of immunoregulatory receptor-targeting antibodies. J Exp Med, 210, 1685-93.
30. SILVA, J. P., VETTERLEIN, O., JOSE, J., PETERS, S. & KIRBY, H. 2015. The S228P mutation prevents in vivo and in vitro IgG4 Fab-arm exchange as demonstrated using a combination of novel quantitative immunoassays and physiological matrix preparation. J Biol Chem, 290, 5462-9.
31. GLAESNER, W., VICK, A. M., MILLICAN, R., ELLIS, B., TSCHANG, S. H., TIAN, Y., BOKVIST, K., BRENNER, M., KOESTER, A., PORKSEN, N., ETGEN, G. & BUMOL, T. 2010. Engineering and characterization of the long-acting glucagon-like peptide-1 analogue LY2189265, an Fc fusion protein. Diabetes Metab Res Rev, 26, 287-96.
32. DALL'ACQUA, W. F., KIENER, P. A. & WU, H. 2006. Properties of human IgG1s engineered for enhanced binding to the neonatal Fc receptor (FcRn). J Biol Chem, 281, 23514-24.
33. ZALEVSKY, J., CHAMBERLAIN, A. K., HORTON, H. M., KARKI, S., LEUNG, I. W., SPROULE, T. J., LAZAR, G. A., ROOPENIAN, D. C. & DESJARLAIS, J. R. 2010. Enhanced antibody half-life improves in vivo activity. Nat Biotechnol, 28, 157-9.
34. SHIELDS, R. L., NAMENUK, A. K., HONG, K., MENG, Y. G., RAE, J., BRIGGS, J., XIE, D., LAI, J., STADLEN, A., LI, B., FOX, J. A. & PRESTA, L. G. 2001. High resolution mapping of the binding site on human IgG1 for Fc gamma RI, Fc gamma RII, Fc gamma RIII, and FcRn and design of IgG1 variants with improved binding to the Fc gamma R. J Biol Chem, 276, 6591-604.
35. ALTSHULER, E. P., SEREBRYANAYA, D. V. & KATRUKHA, A. G. 2010. Generation of recombinant antibodies and means for increasing their affinity. Biochemistry (Mosc), 75, 1584-605.
36. HARLOW, E. & LANE, D. 1999. Using antibodies: a laboratory manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory Press.
37. HARLOW, E. & LANE, D. 1988. Antibodies: a laboratory manual, Cold Spring Harbor, NY, Cold Spring Harbor Laboratory.
38. LI, J., SAI, T., BERGER, M., CHAO, Q., DAVIDSON, D., DESHMUKH, G., DROZDOWSKI, B., EBEL, W., HARLEY, S., HENRY, M., JACOB, S., KLINE, B., LAZO, E., ROTELLA, F., ROUTHIER, E., RUDOLPH, K., SAGE, J., SIMON, P., YAO, J., ZHOU, Y., KAVURU, M., BONFIELD, T., THOMASSEN, M. J., SASS, P. M., NICOLAIDES, N. C. & GRASSO, L. 2006. Human antibodies for immunotherapy development generated via a human B cell hybridoma technology. Proc Natl Acad Sci U S A, 103, 3557-62.
39. KOZBOR, D. & RODER, J. C. 1983. The production of monoclonal antibodies from human lymphocytes. Immunol Today, 4, 72-9.
40. COLE, S. P., CAMPLING, B. G., LOUWMAN, I. H., KOZBOR, D. & RODER, J. C. 1984. A strategy for the production of human monoclonal antibodies reactive with lung tumor cell lines. Cancer Res, 44, 2750-3.
41. HOLLIGER, P. & HUDSON, P. J. 2005. Engineered antibody fragments and the rise of single domains. Nat Biotechnol, 23, 1126-36.
42. PERVAIZ, S. & BREW, K. 1987. Homology and structure-function correlations between alpha 1-acid glycoprotein and serum retinol-binding protein and its relatives. FASEB J, 1, 209-14.
43. SAMBROOK, J. & RUSSELL, D. W. 2001. Molecular cloning: a laboratory manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory Press.
44. FLOWER, D. R. 2000. Beyond the superfamily: the lipocalin receptors. Biochim Biophys Acta, 1482, 327-36.
45. BREUSTEDT, D. A., KORNDORFER, I. P., REDL, B. & SKERRA, A. 2005. The 1.8-A crystal structure of human tear lipocalin reveals an extended branched cavity with capacity for multiple ligands. J Biol Chem, 280, 484-93.
46. SCHMIDT, T. G., KOEPKE, J., FRANK, R. & SKERRA, A. 1996. Molecular interaction between the Strep-tag affinity peptide and its cognate target, streptavidin. J Mol Biol, 255, 753-66.
47. VAJO, Z. & DUCKWORTH, W. C. 2000. Genetically engineered insulin analogs: diabetes in the new millenium. Pharmacol Rev, 52, 1-9.
48. FUERTGES, F. & ABUCHOWSKI, A. 1990. The clinical efficacy of poly(ethylene glycol)-modified proteins. Journal of Controlled Release, 11, 139-148.
49. DENNIS, M. S., ZHANG, M., MENG, Y. G., KADKHODAYAN, M., KIRCHHOFER, D., COMBS, D. & DAMICO, L. A. 2002. Albumin binding as a general strategy for improving the pharmacokinetics of proteins. J Biol Chem, 277, 35035-43.
50. KONIG, T. & SKERRA, A. 1998. Use of an albumin-binding domain for the selective immobilisation of recombinant capture antibody fragments on ELISA plates. J Immunol Methods, 218, 73-83.
51. OSBORN, B. L., OLSEN, H. S., NARDELLI, B., MURRAY, J. H., ZHOU, J. X., GARCIA, A., MOODY, G., ZARITSKAYA, L. S. & SUNG, C. 2002. Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-alpha fusion protein in cynomolgus monkeys. J Pharmacol Exp Ther, 303, 540-8.
52. LOWMAN, H. B. 1997. Bacteriophage display and discovery of peptide leads for drug development. Annu Rev Biophys Biomol Struct, 26, 401-24.
53. RODI, D. J. & MAKOWSKI, L. 1999. Phage-display technology--finding a needle in a vast molecular haystack. Curr Opin Biotechnol, 10, 87-93.
54. VENTURI, M., SEIFERT, C. & HUNTE, C. 2002. High level production of functional antibody Fab fragments in an oxidizing bacterial cytoplasm. J Mol Biol, 315, 1-8.
55. BRUCKDORFER, T., MARDER, O. & ALBERICIO, F. 2004. From production of peptides in milligram amounts for research to multi-tons quantities for drugs of the future. Curr Pharm Biotechnol, 5, 29-43.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Pieris Pharmaceuticals GmbH
LES LABORATOIRES SERVIER
<120> Новый слитый белок, специфичный к CD137 и PD-L1
<130> PIE16305PCT
<150> EP18186445.5
<151> 2018-07-31
<150> EP18204548.4
<151> 2018-11-06
<160> 148
<170> PatentIn версии 3.5
<210> 1
<211> 158
<212> ПРТ
<213> Homo sapiens
<400> 1
His His Leu Leu Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr
1 5 10 15
Trp Tyr Leu Lys Ala Met Thr Val Asp Arg Glu Phe Pro Glu Met Asn
20 25 30
Leu Glu Ser Val Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn
35 40 45
Leu Glu Ala Lys Val Thr Met Leu Ile Ser Gly Arg Cys Gln Glu Val
50 55 60
Lys Ala Val Leu Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp
65 70 75 80
Gly Gly Lys His Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His
85 90 95
Tyr Ile Phe Tyr Cys Glu Gly Glu Leu His Gly Lys Pro Val Arg Gly
100 105 110
Val Lys Leu Val Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu
115 120 125
Asp Phe Glu Lys Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile
130 135 140
Leu Ile Pro Arg Gln Ser Glu Thr Cys Ser Pro Gly Ser Asp
145 150 155
<210> 2
<211> 178
<212> ПРТ
<213> Homo sapiens
<400> 2
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Leu Ala Gly Asn Ala Ile Leu Arg Glu Asp Lys Asp Pro
35 40 45
Gln Lys Met Tyr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Ser Val Leu Phe Arg Lys Lys Lys Cys Asp Tyr Trp Ile
65 70 75 80
Arg Thr Phe Val Pro Gly Cys Gln Pro Gly Glu Phe Thr Leu Gly Asn
85 90 95
Ile Lys Ser Tyr Pro Gly Leu Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Lys Val Ser Gln
115 120 125
Asn Arg Glu Tyr Phe Lys Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 3
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 3
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Leu Ala Gly Asn Ala Ile Leu Arg Glu Asp Lys Asp Pro
35 40 45
Gln Lys Met Tyr Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Ser Val Leu Phe Arg Lys Lys Lys Cys Asp Tyr Trp Ile
65 70 75 80
Arg Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Asn
85 90 95
Ile Lys Ser Tyr Pro Gly Leu Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Lys Val Ser Gln
115 120 125
Asn Arg Glu Tyr Phe Lys Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 4
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 4
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Arg Glu Cys Pro Glu Met Asn Leu Glu Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Leu Ile Ser Gly Arg Ser Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Glu Cys His Gly Lys Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 5
<211> 4
<212> ПРТ
<213> Homo sapiens
<400> 5
His His Leu Leu
1
<210> 6
<211> 272
<212> ПРТ
<213> Homo sapiens
<400> 6
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His Leu Val
210 215 220
Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr Phe Ile
225 230 235 240
Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys Gly Ile
245 250 255
Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu Glu Thr
260 265 270
<210> 7
<211> 232
<212> ПРТ
<213> Homo sapiens
<400> 7
Leu Gln Asp Pro Cys Ser Asn Cys Pro Ala Gly Thr Phe Cys Asp Asn
1 5 10 15
Asn Arg Asn Gln Ile Cys Ser Pro Cys Pro Pro Asn Ser Phe Ser Ser
20 25 30
Ala Gly Gly Gln Arg Thr Cys Asp Ile Cys Arg Gln Cys Lys Gly Val
35 40 45
Phe Arg Thr Arg Lys Glu Cys Ser Ser Thr Ser Asn Ala Glu Cys Asp
50 55 60
Cys Thr Pro Gly Phe His Cys Leu Gly Ala Gly Cys Ser Met Cys Glu
65 70 75 80
Gln Asp Cys Lys Gln Gly Gln Glu Leu Thr Lys Lys Gly Cys Lys Asp
85 90 95
Cys Cys Phe Gly Thr Phe Asn Asp Gln Lys Arg Gly Ile Cys Arg Pro
100 105 110
Trp Thr Asn Cys Ser Leu Asp Gly Lys Ser Val Leu Val Asn Gly Thr
115 120 125
Lys Glu Arg Asp Val Val Cys Gly Pro Ser Pro Ala Asp Leu Ser Pro
130 135 140
Gly Ala Ser Ser Val Thr Pro Pro Ala Pro Ala Arg Glu Pro Gly His
145 150 155 160
Ser Pro Gln Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu
165 170 175
Leu Phe Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys Arg
180 185 190
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
195 200 205
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
210 215 220
Glu Glu Glu Gly Gly Cys Glu Leu
225 230
<210> 8
<211> 272
<212> ПРТ
<213> Macaca fascicularis
<400> 8
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Thr Ser Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Asn Tyr Arg
50 55 60
Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Arg Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Leu Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Ala Asn Glu Ile Phe Tyr Cys Ile
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala Leu Pro Pro Asn Glu Arg Thr His Leu Val
210 215 220
Ile Leu Gly Ala Ile Phe Leu Leu Leu Gly Val Ala Leu Thr Phe Ile
225 230 235 240
Phe Tyr Leu Arg Lys Gly Arg Met Met Asp Met Lys Lys Ser Gly Ile
245 250 255
Arg Val Thr Asn Ser Lys Lys Gln Arg Asp Thr Gln Leu Glu Glu Thr
260 265 270
<210> 9
<211> 231
<212> ПРТ
<213> Macaca fascicularis
<400> 9
Leu Gln Asp Leu Cys Ser Asn Cys Pro Ala Gly Thr Phe Cys Asp Asn
1 5 10 15
Asn Arg Ser Gln Ile Cys Ser Pro Cys Pro Pro Asn Ser Phe Ser Ser
20 25 30
Ala Gly Gly Gln Arg Thr Cys Asp Ile Cys Arg Gln Cys Lys Gly Val
35 40 45
Phe Lys Thr Arg Lys Glu Cys Ser Ser Thr Ser Asn Ala Glu Cys Asp
50 55 60
Cys Ile Ser Gly Tyr His Cys Leu Gly Ala Glu Cys Ser Met Cys Glu
65 70 75 80
Gln Asp Cys Lys Gln Gly Gln Glu Leu Thr Lys Lys Gly Cys Lys Asp
85 90 95
Cys Cys Phe Gly Thr Phe Asn Asp Gln Lys Arg Gly Ile Cys Arg Pro
100 105 110
Trp Thr Asn Cys Ser Leu Asp Gly Lys Ser Val Leu Val Asn Gly Thr
115 120 125
Lys Glu Arg Asp Val Val Cys Gly Pro Ser Pro Ala Asp Leu Ser Pro
130 135 140
Gly Ala Ser Ser Ala Thr Pro Pro Ala Pro Ala Arg Glu Pro Gly His
145 150 155 160
Ser Pro Gln Ile Ile Phe Phe Leu Ala Leu Thr Ser Thr Val Val Leu
165 170 175
Phe Leu Leu Phe Phe Leu Val Leu Arg Phe Ser Val Val Lys Arg Ser
180 185 190
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
195 200 205
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
210 215 220
Glu Glu Gly Gly Cys Glu Leu
225 230
<210> 10
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> сайт расщепления
<400> 10
Ile Glu Gly Arg
1
<210> 11
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый пептид
<400> 11
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
1 5 10
<210> 12
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид с меткой Step-Tag II
<400> 12
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 13
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 13
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 14
<211> 18
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 14
Pro Ser Thr Pro Pro Thr Asn Ser Ser Ser Thr Pro Pro Thr Pro Ser
1 5 10 15
Pro Ser
<210> 15
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 15
Gly Gly Ser Gly Asn Ser Ser Gly Ser Gly Gly Ser Pro Val
1 5 10
<210> 16
<211> 20
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 16
Ala Ser Pro Ala Ala Pro Ala Pro Ala Ser Pro Ala Ala Pro Ala Pro
1 5 10 15
Ser Ala Pro Ala
20
<210> 17
<211> 66
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 17
Ala Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Pro Val Pro Ser
1 5 10 15
Thr Pro Pro Thr Pro Ser Pro Ser Thr Pro Pro Thr Pro Ser Pro Ser
20 25 30
Gly Gly Ser Gly Asn Ser Ser Gly Ser Gly Gly Ser Pro Val Pro Ser
35 40 45
Thr Pro Pro Thr Pro Ser Pro Ser Thr Pro Pro Thr Pro Ser Pro Ser
50 55 60
Ala Ser
65
<210> 18
<211> 32
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 18
Pro Ser Thr Pro Pro Thr Pro Ser Pro Ser Thr Pro Pro Thr Pro Ser
1 5 10 15
Pro Ser Gly Gly Ser Gly Asn Ser Ser Gly Ser Gly Gly Ser Pro Val
20 25 30
<210> 19
<211> 74
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 19
Ala Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Pro Val Pro Ser
1 5 10 15
Thr Pro Pro Thr Asn Ser Ser Ser Thr Pro Pro Thr Pro Ser Pro Ser
20 25 30
Pro Val Pro Ser Thr Pro Pro Thr Asn Ser Ser Ser Thr Pro Pro Thr
35 40 45
Pro Ser Pro Ser Pro Val Pro Ser Thr Pro Pro Thr Asn Ser Ser Ser
50 55 60
Thr Pro Pro Thr Pro Ser Pro Ser Ala Ser
65 70
<210> 20
<211> 40
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 20
Ala Ser Pro Ala Ala Pro Ala Pro Ala Ser Pro Ala Ala Pro Ala Pro
1 5 10 15
Ser Ala Pro Ala Ala Ser Pro Ala Ala Pro Ala Pro Ala Ser Pro Ala
20 25 30
Ala Pro Ala Pro Ser Ala Pro Ala
35 40
<210> 21
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 21
Val Asp Asp Ile Glu Gly Arg Met Asp Glu
1 5 10
<210> 22
<211> 11
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 22
Glu Asn Leu Tyr Phe Gln Gly Arg Met Asp Glu
1 5 10
<210> 23
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> линкер
<400> 23
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 24
<211> 327
<212> ПРТ
<213> Homo sapiens
<400> 24
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 25
<211> 214
<212> ПРТ
<213> Homo sapiens
<400> 25
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 26
<211> 448
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 27
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь антитела
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 28
<211> 448
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 28
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Gly Gly Tyr Val Thr Tyr Asn Pro Ser Leu Glu
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Tyr Gly Pro Gly Asn Tyr Asp Trp Tyr Phe Asp Leu Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 29
<211> 216
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь антитела
<400> 29
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Ala Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 30
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> фрагмент антитела
<400> 30
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala
1 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 31
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> фрагмент антитела
<400> 31
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 32
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> фрагмент антитела
<400> 32
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 33
<211> 228
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> фрагмент антитела
<400> 33
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 34
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 34
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 35
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 35
Thr Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Arg Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Asp Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Glu Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Thr Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 36
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 36
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Asn Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Arg Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Glu Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Thr Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 37
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 37
Val Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Arg Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Glu Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Glu Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Thr Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ser Glu Thr Ser Ser Pro Gly
145 150
<210> 38
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 38
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Ser Thr Leu Glu Gly Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Thr Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ile Glu Thr Ser Ser Pro Gly
145 150
<210> 39
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 39
Ala Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Gly Gly Asn Leu Glu Ala Glu
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Ala Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Thr Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Ser
130 135 140
Gln Ile Glu Thr Ser Ser Pro Gly
145 150
<210> 40
<211> 152
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 40
Thr Ser Asp Glu Glu Ile Gln Asp Val Ser Gly Thr Trp Tyr Leu Lys
1 5 10 15
Ala Met Thr Val Asp Glu Gly Cys Arg Pro Trp Asn Ile Phe Ser Val
20 25 30
Thr Pro Met Thr Leu Thr Thr Leu Glu Asp Gly Asn Leu Glu Ala Lys
35 40 45
Val Thr Met Ala Ile Asp Gly Pro Ala Gln Glu Val Lys Ala Val Leu
50 55 60
Glu Lys Ala Asp Glu Pro Gly Lys Tyr Thr Ala Asp Gly Gly Lys His
65 70 75 80
Val Ala Tyr Ile Ile Arg Ser His Val Lys Asp His Tyr Ile Phe Tyr
85 90 95
Ser Glu Gly Val Cys Asp Gly Ser Pro Val Pro Gly Val Trp Leu Val
100 105 110
Gly Arg Asp Pro Lys Asn Asn Leu Glu Ala Leu Glu Asp Phe Glu Lys
115 120 125
Ala Ala Gly Ala Arg Gly Leu Ser Thr Glu Ser Ile Leu Ile Pro Arg
130 135 140
Gln Ile Glu Thr Ser Ser Pro Gly
145 150
<210> 41
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 41
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Lys Leu Arg Glu Asp Lys Asp Pro
35 40 45
Asn Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Gly Val Thr Phe Asp Asp Lys Lys Cys Thr Tyr Ala Ile
65 70 75 80
Ser Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 42
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 42
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 43
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 43
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
Asn Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Ala Val Ala Phe Asp Asp Lys Lys Cys Thr Tyr Asp Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 44
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 44
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Lys Leu Arg Glu Asp Lys Asp Pro
35 40 45
Asn Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Ala Val Ala Phe Asp Asp Lys Lys Cys Thr Tyr Asp Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 45
<211> 175
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 45
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Lys Leu Arg Glu Asp Ser Lys Met
35 40 45
Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val Thr
50 55 60
Gly Val Ser Phe Asp Asp Lys Lys Cys Thr Tyr Ala Ile Met Thr Phe
65 70 75 80
Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys Ser
85 90 95
Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn Tyr
100 105 110
Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg Glu
115 120 125
Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser Glu
130 135 140
Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro Glu
145 150 155 160
Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly
165 170 175
<210> 46
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 46
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Lys Leu Arg Glu Asp Lys Asp Pro
35 40 45
Val Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Gly Val Thr Phe Asp Asp Lys Lys Cys Arg Tyr Asp Ile
65 70 75 80
Ser Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Phe Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 47
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 47
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Gly Val Thr Phe Asp Asp Lys Lys Cys Thr Tyr Ala Ile
65 70 75 80
Ser Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 48
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 48
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Lys Leu Arg Glu Asp Lys Asp Pro
35 40 45
Asn Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Gly Val Thr Phe Asp Asp Lys Lys Cys Thr Tyr Ala Ile
65 70 75 80
Ser Thr Leu Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Phe Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 49
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 49
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
Ser Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Ala Val Thr Phe Asp Asp Lys Lys Cys Asn Tyr Ala Ile
65 70 75 80
Ser Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 50
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 50
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Ser Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 51
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 51
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Ser Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Arg Ser Asp Leu Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 52
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 52
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Tyr Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Leu Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Gln Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Ser Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 53
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 53
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln His Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 54
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 54
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asp Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 55
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 55
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Ile Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 56
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 56
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Arg Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Val Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Tyr Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 57
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 57
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Ser Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Asn
65 70 75 80
Trp Pro Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Leu Gly Pro Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 58
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 58
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Glu Asp Lys Asp Pro
35 40 45
His Lys Met Gly Ala Thr Ile Tyr Glu Leu Asn Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Phe Leu Asp Lys Lys Cys Gln Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 59
<211> 178
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 59
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe Gln Gly Lys Trp Tyr
20 25 30
Val Val Gly Met Ala Gly Asn Asn Leu Leu Arg Asp Asp Lys Asp Pro
35 40 45
His Lys Met Ser Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asn Val Thr Asp Val Met Leu Leu Asp Lys Lys Cys His Tyr Ile Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Leu Thr Leu Gly Phe
85 90 95
Ile Lys Ser Asp Pro Gly His Thr Ser Tyr Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Ser Val Ile Gln
115 120 125
Asn Arg Glu Trp Phe Gly Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly
<210> 60
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 тяжелой цепи антитела
<400> 60
Gly Phe Ser Leu Ser Asn Tyr Asp
1 5
<210> 61
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR2 тяжелой цепи антитела
<400> 61
Ile Trp Thr Gly Gly Ala Thr
1 5
<210> 62
<211> 14
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 тяжелой цепи антитела
<400> 62
Val Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr
1 5 10
<210> 63
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 легкой цепи антитела
<400> 63
Gln Ser Ile Gly Thr Asn
1 5
<210> 64
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 легкой цепи антитела
<400> 64
Gln Gln Ser Asn Ser Trp Pro Tyr Thr
1 5
<210> 65
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 тяжелой цепи антитела
<400> 65
Gly Phe Asp Ile Lys Asp Thr Tyr
1 5
<210> 66
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR2 тяжелой цепи антитела
<400> 66
Ile Asp Pro Ala Asp Gly Asn Thr
1 5
<210> 67
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 тяжелой цепи антитела
<400> 67
Ala Arg Gly Leu Gly Ala Trp Phe Ala Ser
1 5 10
<210> 68
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 легкой цепи антитела
<400> 68
Gln Asp Ile Thr Asn Ser
1 5
<210> 69
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 легкой цепи антитела
<400> 69
Gln Gln Gly His Thr Leu Pro Pro Thr
1 5
<210> 70
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 тяжелой цепи антитела
<400> 70
Gly Phe Asn Ile Lys Asp Thr Tyr
1 5
<210> 71
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR2 тяжелой цепи антитела
<400> 71
Ile Asp Pro Ala Asn Gly Asn Thr
1 5
<210> 72
<211> 17
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 тяжелой цепи антитела
<400> 72
Ser Arg Gly Pro Pro Gly Gly Ile Gly Glu Tyr Ile Tyr Ala Met Asp
1 5 10 15
Tyr
<210> 73
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR1 легкой цепи антитела
<400> 73
Ser Ser Val Ser Ser Ser Tyr
1 5
<210> 74
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> CDR3 легкой цепи антитела
<400> 74
His Gln Tyr His Arg Ser Pro Pro Thr
1 5
<210> 75
<211> 120
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 75
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Asn Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Ser Ala Phe Met
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 76
<211> 120
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 76
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Asn Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Phe Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Leu Gln Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 77
<211> 120
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 77
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 78
<211> 117
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 78
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asp Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asp Gly Asn Thr Arg Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Lys Thr Thr Ile Thr Thr Asp Thr Ser Ser Asn Thr Ala His
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Gly Ala Trp Phe Ala Ser Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 79
<211> 124
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 79
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ala Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Pro Pro Gly Gly Ile Gly Glu Tyr Ile Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 80
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 80
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Phe Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105
<210> 81
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 81
Glu Ile Val Leu Thr Gln Ser Pro Asp Thr Leu Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Phe Gln Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 82
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 82
Glu Ile Val Leu Thr Gln Ser Pro Asp Thr Leu Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 83
<211> 106
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 83
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Thr Asn Ser
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105
<210> 84
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 84
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105
<210> 85
<211> 450
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 85
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 86
<211> 446
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 86
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
<210> 87
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь антитела
<400> 87
Glu Ile Val Leu Thr Gln Ser Pro Asp Thr Leu Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 88
<211> 614
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 88
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala
1 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
225 230 235 240
Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu
245 250 255
Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly
260 265 270
Lys Trp Tyr Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp
275 280 285
Lys Asp Pro Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp
290 295 300
Lys Ser Tyr Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met
305 310 315 320
Tyr Asp Ile Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr
325 330 335
Leu Gly Lys Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg
340 345 350
Val Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe
355 360 365
Val Phe Gln Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr
370 375 380
Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys
385 390 395 400
Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp
405 410 415
Gln Cys Ile Asp Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
420 425 430
Gly Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro
435 440 445
Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His
450 455 460
Gly Lys Trp Tyr Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu
465 470 475 480
Asp Lys Asp Pro Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu
485 490 495
Asp Lys Ser Tyr Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys
500 505 510
Met Tyr Asp Ile Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe
515 520 525
Thr Leu Gly Lys Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val
530 535 540
Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys
545 550 555 560
Phe Val Phe Gln Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg
565 570 575
Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser
580 585 590
Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile
595 600 605
Asp Gln Cys Ile Asp Gly
610
<210> 89
<211> 422
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 89
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala
1 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro
245 250 255
Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His
260 265 270
Gly Lys Trp Tyr Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu
275 280 285
Asp Lys Asp Pro Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu
290 295 300
Asp Lys Ser Tyr Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys
305 310 315 320
Met Tyr Asp Ile Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe
325 330 335
Thr Leu Gly Lys Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val
340 345 350
Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys
355 360 365
Phe Val Phe Gln Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg
370 375 380
Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser
385 390 395 400
Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile
405 410 415
Asp Gln Cys Ile Asp Gly
420
<210> 90
<211> 639
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 90
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Gly Gly
435 440 445
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Ser
450 455 460
Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val Pro Leu Gln
465 470 475 480
Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr Val Val Gly
485 490 495
Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro Ile Lys Met
500 505 510
Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val Thr
515 520 525
Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile Trp Thr Phe
530 535 540
Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys Ser
545 550 555 560
Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn Tyr
565 570 575
Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg Glu
580 585 590
Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser Glu
595 600 605
Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro Glu
610 615 620
Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly
625 630 635
<210> 91
<211> 407
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 91
Glu Ile Val Leu Thr Gln Ser Pro Asp Thr Leu Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro
225 230 235 240
Pro Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe
245 250 255
His Gly Lys Trp Tyr Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg
260 265 270
Glu Asp Lys Asp Pro Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys
275 280 285
Glu Asp Lys Ser Tyr Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys
290 295 300
Cys Met Tyr Asp Ile Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu
305 310 315 320
Phe Thr Leu Gly Lys Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu
325 330 335
Val Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe
340 345 350
Lys Phe Val Phe Gln Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly
355 360 365
Arg Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe
370 375 380
Ser Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val Phe Pro Val Pro
385 390 395 400
Ile Asp Gln Cys Ile Asp Gly
405
<210> 92
<211> 639
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 92
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
180 185 190
Ser Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
195 200 205
Glu Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn
210 215 220
Tyr Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
225 230 235 240
Leu Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu
245 250 255
Lys Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser
260 265 270
Leu Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
275 280 285
Val Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly
290 295 300
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
305 310 315 320
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
325 330 335
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
340 345 350
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
355 360 365
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
370 375 380
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
385 390 395 400
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
405 410 415
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
420 425 430
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
435 440 445
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
450 455 460
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
465 470 475 480
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
485 490 495
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
500 505 510
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
515 520 525
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
530 535 540
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
545 550 555 560
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
565 570 575
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
580 585 590
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
595 600 605
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
610 615 620
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
625 630 635
<210> 93
<211> 407
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 93
Gln Asp Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val
1 5 10 15
Pro Leu Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr
20 25 30
Val Val Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro
35 40 45
Ile Lys Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr
50 55 60
Asp Val Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile
65 70 75 80
Trp Thr Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys
85 90 95
Ile Lys Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser
100 105 110
Thr Asn Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln
115 120 125
Asn Arg Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu
130 135 140
Thr Ser Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly
145 150 155 160
Leu Pro Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile
165 170 175
Asp Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
180 185 190
Ser Glu Ile Val Leu Thr Gln Ser Pro Asp Thr Leu Ser Val Thr Pro
195 200 205
Lys Glu Lys Val Thr Leu Thr Cys Arg Ala Ser Gln Ser Ile Gly Thr
210 215 220
Asn Ile His Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu
225 230 235 240
Ile Lys Tyr Ala Ser Glu Ser Ile Ser Gly Val Pro Ser Arg Phe Ser
245 250 255
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Val Glu
260 265 270
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro
275 280 285
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
290 295 300
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
305 310 315 320
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
325 330 335
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
340 345 350
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
355 360 365
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
370 375 380
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
385 390 395 400
Ser Phe Asn Arg Gly Glu Cys
405
<210> 94
<211> 832
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 94
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Asn Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ala Thr Asn Tyr Asn Pro Ala Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Ser Asn Tyr Arg Tyr Asp Glu Pro Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Gly Gly
435 440 445
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Ser
450 455 460
Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val Pro Leu Gln
465 470 475 480
Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr Val Val Gly
485 490 495
Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro Ile Lys Met
500 505 510
Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val Thr
515 520 525
Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile Trp Thr Phe
530 535 540
Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys Ser
545 550 555 560
Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn Tyr
565 570 575
Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg Glu
580 585 590
Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser Glu
595 600 605
Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro Glu
610 615 620
Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly Gly
625 630 635 640
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
645 650 655
Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val Pro Leu
660 665 670
Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr Val Val
675 680 685
Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro Ile Lys
690 695 700
Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val
705 710 715 720
Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile Trp Thr
725 730 735
Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys
740 745 750
Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn
755 760 765
Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg
770 775 780
Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser
785 790 795 800
Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro
805 810 815
Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly
820 825 830
<210> 95
<211> 474
<212> ДНК
<213> Homo sapiens
<400> 95
catcatctgc tggcctctga cgaagagatc caggatgtgt ccggcacctg gtatctgaag 60
gccatgaccg tggaccgcga gttccctgag atgaacctgg aaagcgtgac ccctatgaca 120
ctgaccacac tggaaggcgg caacctggaa gccaaagtga ccatgctgat ctccggccgg 180
tgccaagaag tgaaggccgt cctggaaaag accgacgagc ctggcaagta caccgctgat 240
ggcggcaagc acgtggccta catcatcaga tcccacgtga aggaccacta catcttctac 300
tgcgagggcg agctgcacgg aaagcctgtt agaggcgtga agctcgtggg cagagatccc 360
aagaacaatc tggaagccct ggaagatttc gagaaggccg ctggcgctag aggcctgtcc 420
acagagtcta tcctgattcc tcggcagtcc gagacatgct cccctggctc tgat 474
<210> 96
<211> 534
<212> ДНК
<213> Homo sapiens
<400> 96
caggatagca ccagcgatct gattccggcg ccgccgctga gcaaagtgcc gctgcagcag 60
aactttcagg ataaccagtt tcagggcaaa tggtatgtgg tgggcctggc gggcaacgcg 120
attctgcgcg aagataaaga tccgcagaaa atgtatgcga ccatttatga actgaaagaa 180
gataaaagct ataacgtgac cagcgtgctg tttcgcaaaa aaaaatgcga ttattggatt 240
cgcacctttg tgccgggctg ccagccgggc gaatttaccc tgggcaacat taaaagctat 300
ccgggcctga ccagctatct ggtgcgcgtg gtgagcacca actataacca gcatgcgatg 360
gtgtttttta aaaaagtgag ccagaaccgc gaatatttta aaattaccct gtatggccgc 420
accaaagaac tgaccagcga actgaaagaa aactttattc gctttagcaa aagcctgggc 480
ctgccggaaa accatattgt gtttccggtg ccgattgatc agtgcattga tggc 534
<210> 97
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 97
caggatagca ccagcgatct gattccggcg ccgccgctga gcaaagtgcc gctgcagcag 60
aactttcagg ataaccagtt tcatggcaaa tggtatgtgg tgggcctggc gggcaacgcg 120
attctgcgcg aagataaaga tccgcagaaa atgtatgcga ccatttatga actgaaagaa 180
gataaaagct ataacgtgac cagcgtgctg tttcgcaaaa aaaaatgcga ttattggatt 240
cgcacctttg tgccgggcag ccagccgggc gaatttaccc tgggcaacat taaaagctat 300
ccgggcctga ccagctatct ggtgcgcgtg gtgagcacca actataacca gcatgcgatg 360
gtgtttttta aaaaagtgag ccagaaccgc gaatatttta aaattaccct gtatggccgc 420
accaaagaac tgaccagcga actgaaagaa aactttattc gctttagcaa aagcctgggc 480
ctgccggaaa accatattgt gtttccggtg ccgattgatc agtgcattga tggc 534
<210> 98
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 98
caggatagca ccagcgatct gattccggcg ccgccgctga gcaaagtgcc gctgcagcag 60
aactttcagg ataaccagtt tcatggcaaa tggtatgtgg tgggcctggc gggcaacgcg 120
attctgcgcg aagataaaga tccgcagaaa atgtatgcga ccatttatga actgaaagaa 180
gataaaagct ataacgtgac cagcgtgctg tttcgcaaaa aaaaatgcga ttattggatt 240
cgcacctttg tgccgggcag ccagccgggc gaatttaccc tgggcaacat taaaagctat 300
ccgggcctga ccagctatct ggtgcgcgtg gtgagcacca actataacca gcatgcgatg 360
gtgtttttta aaaaagtgag ccagaaccgc gaatatttta aaattaccct gtatggccgc 420
accaaagaac tgaccagcga actgaaagaa aactttattc gctttagcaa aagcctgggc 480
ctgccggaaa accatattgt gtttccggtg ccgattgatc agtgcattga tggc 534
<210> 99
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 99
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc catgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
aaagcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc aggggtgtgg ctcgtgggca gagaccccaa gaacaacctg 360
gaagccttgg aggactttga gaaagccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagagcga aaccagctct ccaggg 456
<210> 100
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 100
acctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
agagcagtgt tagagaagac agatgaaccg ggtaaatata cggccgacgg cggtaaacat 240
gatgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gagaccccga gaacaacctg 360
gaagccttgg aggactttga gaaaaccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagagcga aaccagctct ccaggg 456
<210> 101
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 101
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
aacgcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaga gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gggaccccga gaacaacctg 360
gaagccttgg aggactttga gaaaaccgca ggagcccgcg gactcagcac ggagagcatt 420
ctcattccca ggcagagcga aaccagctct ccaggg 456
<210> 102
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 102
gtctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
agagcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtggaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gagaccccga gaacaacctg 360
gaagccttgg aggactttga gaaaaccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagagcga aaccagctct ccaggg 456
<210> 103
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 103
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gtctaccctt 120
gaaggcggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
aaagcagtgt tagagaagac agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gagaccccaa gaacaacctg 360
gaagccttgg aggactttga gaaagccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagatcga aaccagctct ccaggg 456
<210> 104
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 104
gcctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaaggcggca atctggaggc tgaggtcacc atggcaatag atgggccggc acaggaggtg 180
aaagcagtgt tagagaaggc agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gagaccccaa gaacaacctg 360
gaagccttgg aggactttga gaaaaccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca gtcagatcga aaccagctct ccaggg 456
<210> 105
<211> 456
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 105
acctcagacg aggagattca ggatgtgtca gggacgtggt atctgaaggc gatgacggtg 60
gatgaggggt gtcgtccttg gaatatattt tcagttacgc caatgactct gactaccctt 120
gaagacggca atctggaggc taaggtcacc atggcaatag atgggccggc acaggaggtg 180
aaagcagtgt tagagaaggc agatgaaccg ggtaaatata cggccgatgg cggtaaacat 240
gttgcctata tcattcgcag ccatgtgaaa gatcattaca tcttttatag cgagggcgtg 300
tgcgatgggt ctcctgttcc gggggtgtgg ctcgtgggca gagaccccaa gaacaacctg 360
gaagccttgg aggactttga gaaagccgca ggagcccgcg gactcagcac ggagagcatc 420
ctcatcccca ggcagatcga aaccagctct ccaggg 456
<210> 106
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 106
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaag tggtatgtgg taggtcaggc agggaatatc 120
aaactcagag aagacaaaga cccgaacaag atgatggcca ccatctatga gctgaaagaa 180
gacaagagct acaatgtcac cggtgtcact tttgacgaca agaagtgtac ttacgctatc 240
tctacttttg ttccaggttc ccagccaggc gagttcacgc tgggcaaaat taagagtttc 300
cctggacata cgagttctct cgtccgagtg gtgagcacca actacaacca gcatgctatg 360
gtgttcttca agttcgtttt ccaaaacagg gaggaattct acatcaccct ctacgggaga 420
accaaggagc tgacttcgga actaaaggag aacttcatcc gcttctccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 107
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 107
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aggctgcgtg aggataagga tccgattaaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac catggtgaag tttgatgata agaaatgcat gtacgatatt 240
tggacctttg tgccggggag ccagccgggc gagtttactt taggcaagat taaaagtttt 300
ccgggccata catcatcgtt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 108
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 108
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aggctgcgtg aggataagga tccgaataaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cgcggtggcg tttgatgata agaaatgcac gtacgatatt 240
tggacctttg tgccggggag ccagccgggc gagtttactt taggcaagat taaaagtttt 300
ccgggccata catcatcgtt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 109
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 109
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aagctgcgtg aggataagga tccgaataaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cgcggtggcg tttgatgata agaaatgcac gtacgatatt 240
tggacctttg tgccggggag ccagccgggc gagtttactt taggcaagat taaaagtttt 300
ccgggccata catcatcttt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 110
<211> 525
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 110
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aagctgcgtg aggatagtaa aatgatggcg accatttacg agttgaaaga agataaatca 180
tatgacgtca ccggtgtgag ttttgatgat aagaaatgca cgtacgctat tatgaccttt 240
gtgccgggga gccagccggg cgagtttact ttaggcaaga ttaaaagttt tccgggccat 300
acatcatcgt tggtccgcgt cgtgagcacc aactacaacc agcatgccat ggtgttcttc 360
aagtttgtgt ttcagaaccg cgaggagttt tatatcacac tgtacgggcg cacgaaagaa 420
ctgacaagcg agctgaagga aaattttatc cgcttttcca aatctctggg cctccctgaa 480
aaccacatcg tcttccctgt cccaatcgac cagtgtatcg acggc 525
<210> 111
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 111
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aagctgcgtg aggataagga tccggttaaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cggggtgacg tttgatgata agaaatgcag gtacgatatt 240
tcgacctttg tgccggggag ccagccgggc gagtttactt ttggcaagat taaaagtttt 300
ccgggccata catcatcgtt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 112
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 112
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aggctgcgtg aggataagga tccgcataaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cggggtgact tttgatgata agaaatgcac gtacgctatt 240
tcgacctttg tgccggggag ccagccgggc gagtttactt taggcaagat taaaagtttt 300
ccgggccata catcatcttt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 113
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 113
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aagctgcgtg aggataagga tccgaataaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cggggtgact tttgatgata agaaatgcac gtacgctatt 240
tctacccttg tgccggggag ccagccgggc gagtttactt ttggcaagat taaaagtttt 300
ccgggccata catcatcgtt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 114
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 114
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtacgttg tcgggcaggc cggaaatatt 120
aggctgcgtg aggataagga tccgtctaaa atgatggcga ccatttacga gttgaaagaa 180
gataaatcat atgacgtcac cgctgtgacg tttgatgata agaaatgcaa ttacgctatt 240
tctacctttg tgccggggag ccagccgggc gagtttactt taggcaagat taaaagtttt 300
ccgggccata catcatcgtt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agtttgtgtt tcagaaccgc gaggagtttt atatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 115
<211> 534
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 115
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccatgggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgagcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagtttactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggc 534
<210> 116
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 116
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgagcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagcttactt taggcttcat tagaagtgac 300
ctgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 117
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 117
caggactcca cctcagacct gatccctgcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg actaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgggcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg cttctggaca agaaatgcca atacatcatt 240
cagacctttg tgccggggag ccagccgggc gagtctactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 118
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 118
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgggcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca acacatcata 240
tggacctttg tgccggggag ccagccgggc gagttaactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 119
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 119
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acgaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgttgcgtg aggataagga tccgcacaaa atgggcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagttgactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 120
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 120
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatatcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgggcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagcttactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 121
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 121
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcgg 60
aacttccagg acaaccaatt ccaagggaag tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg tggataagga tccgcacaaa atgggcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagttaactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgtacttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 122
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 122
caggactcca cctcagatct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgagcgcga ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcaat 240
tggccctttg tgccggggag ccagccgggc gagtttactt taggcttcat taaaagtgac 300
ctgggcccca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 123
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 123
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg aggataagga tccgcacaaa atgggtgcga ccatttacga gttgaatgaa 180
gataaatcat ataacgtcac cgacgtgatg tttctggaca agaaatgcca atacatcatt 240
tggacctttg tgccggggag ccagccgggc gagcttactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca agagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 124
<211> 535
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мутеин липокалина
<400> 124
caggactcca cctcagacct gatcccagcc ccacctctga gcaaggtccc tctgcagcag 60
aacttccagg acaaccaatt ccaagggaaa tggtatgtcg tgggcatggc cggaaataat 120
ctgctgcgtg atgataagga tccgcacaaa atgagcgcta ccatttacga gttgaaagaa 180
gataaatcat ataacgtcac cgacgtgatg ttactggaca agaaatgcca ttacatcatt 240
tggacctttg tgccggggag ccagccgggc gagcttactt taggcttcat taaaagtgac 300
ccgggccaca catcatactt ggtccgcgtc gtgagcacca actacaacca gcatgccatg 360
gtgttcttca aaagcgtgat ccagaaccgc gagtggtttg gaatcacact gtacgggcgc 420
acgaaagaac tgacaagcga gctgaaggaa aattttatcc gcttttccaa atctctgggc 480
ctccctgaaa accacatcgt cttccctgtc ccaatcgacc agtgtatcga cggca 535
<210> 125
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 125
caggtgcaac tgaaggagtc aggacctggc ctggtggcgc cctcacagaa cctgtccatt 60
acctgcactg tctctgggtt ctcattaagc aactatgata taagctggat tcgccagcca 120
ccaggaaagg gtctggagtg gctcggagta atatggactg gtggagccac aaattataat 180
tcagctttca tgtccagact gagcatcagt agggacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatatatt actgtgtgag agattcgaac 300
tataggtacg acgagccgtt tacttactgg ggccaaggga ctctggtcac tgtctctgca 360
<210> 126
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 126
caggtccagc tgcaggagtc aggccccggc ctggtgaagc ccagtgagaa cctgtcaatc 60
acctgcacag tctctggctt ctcactgagc aattacgaca tcagttggat tcgacagccc 120
cctggaaagg gcctggaatg gctgggcgtg atctggacag gcggggcaac taactataat 180
ccagccttta aaagccggct gaccatttcc agagacaact ccaagtctca ggtgtctctg 240
aaaatgagct ccctgcaggc cgctgatacc gctgtgtact attgtgtcag ggacagcaat 300
taccgctatg atgagccctt cacatactgg gggcagggaa ctctggtgac cgtctctagt 360
<210> 127
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 127
caggtccagc tgcaggagtc cggccccggc ctggtgaagc cctccgagac actgtctatc 60
acctgcacag tcagcggctt ctcactgagc aactacgaca tctcctggat tcgacagccc 120
cctggaaagg gcctggaatg gctgggcgtg atctggacag gcggggcaac taactataat 180
ccagccctga aatctcggct gactattagt agagacaact caaagaatca ggtgtccctg 240
aaaatgagct ccgtcaccgc cgctgataca gctgtgtact attgtgtcag ggacagcaat 300
taccgctatg atgagccctt tacctactgg gggcagggaa ctctggtgac cgtctctagt 360
<210> 128
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 128
gaggttcagc tgcagcagtc tggggcagag cttgtgaagc caggggcctc agtcaagttg 60
tcctgcacag cttctggctt cgacattaaa gacacctata tccactgggt gaagcagagg 120
cctgaacagg gcctggagtg gattggaagg attgatcctg cggacggtaa tactaggtat 180
gacccgaagt tccaggacaa gaccactata acaaccgaca catcctccaa cacagcccac 240
ctgcagctca gcagcctgac atctgaggac actgccgtct attactgtgc tagaggcctc 300
ggagcttggt ttgcttcctg gggccaaggg actctggtca ctgtctctgc a 351
<210> 129
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи антитела
<400> 129
gaggttcagc tgcagcagtc tggggcagag cttgtgaagc caggggcctc agtcaagttg 60
tcctgcacag cttctggctt caacattaaa gacacctata tgtactgggt gaagcagagg 120
cctgaacagg gcctggagtg gattggaagg attgatcctg cgaatggtaa tactaaatat 180
gacccgaagt tccagggcaa ggccactata acagcagaca catccgccaa cacagcctac 240
ctgcagctca gcagcctgac atctgaggac actgccgtct attactgttc tagaggccct 300
ccaggaggta tcggcgagta tatctatgct atggactact ggggtcaagg aacctcagtc 360
accgtctcct ca 372
<210> 130
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 130
gacatcttgc tgactcagtc tccagccatc ctgtctgtga gtccaggaga aagagtcagt 60
ctctcctgca gggccagtca gagcattggc acaaacatac actggtttca gcaaagaaca 120
aatggttctc caaggcttct cataaagtat gcttctgagt ctatctctgg gatcccttcc 180
aggtttagtg gcagtggatc agggacagat tttactctta gcatcaacag tgtggagtct 240
gaagatattg cagattacta ctgtcaacaa agtaatagct ggccgtacac gttcggaggg 300
gggaccaagc tggaaata 318
<210> 131
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 131
gaaatcgtgc tgacacagag ccctgacaca ctgagcgtga ctcccaagga gaaagtcacc 60
ctgacatgcc gggcatcaca gagcatcgga acaaacattc actggttcca gcagagacca 120
ggccagagcc ccaagctgct gatcaaatac gcctccgaat ctatcagtgg cattccttcc 180
cgattctcag gcagcgggtc cggaaccgac tttactctga ccattaactc tgtggaggct 240
gaagatgccg ctacatacta ttgccagcag tctaatagtt ggccttatac cttcggccag 300
gggacaaagc tggagatcaa a 321
<210> 132
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 132
gaaatcgtgc tgacacagtc tcctgatacc ctgagcgtga ctcccaagga gaaagtcacc 60
ctgacatgca gggcatcaca gagcatcgga acaaacattc actggttcca gcagaagcca 120
ggccagagcc ccaagctgct gatcaaatac gcctccgaat ctattagtgg agtgccttcc 180
cgcttctcag gcagcgggtc cggaaccgac tttactctga ccatcaactc tgtggaggct 240
gaagatgccg ctacatacta ttgccagcag tctaatagtt ggccttatac cttcggccag 300
gggacaaagc tggagatcaa a 321
<210> 133
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 133
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattacc aattccttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatccactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcaa cctggagcaa 240
gaagatattg ccacttactt ttgccaacag ggtcatacgc ttcctccgac gttcggtgga 300
ggcaccaagc tggaaatc 318
<210> 134
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> вариабельная область легкой цепи антитела
<400> 134
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcatggag 240
gctgaagatg ctgccactta ttactgccac cagtatcatc gttccccacc cacgttcggt 300
ggaggcacca agctggaaat c 321
<210> 135
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 135
caggtccagc tgcaagagtc tggccctgga ctggtcaagc cttccgagac actgtccatc 60
acctgtaccg tgtccggctt ctccctgtcc aactacgaca tctcctggat cagacagcct 120
cctggcaaag gcctggaatg gctgggagtg atttggaccg gcggagccac caactacaac 180
cccgctctga agtcccggct gaccatctcc agagacaact ccaagaacca ggtgtccctg 240
aagatgtcct ccgtgaccgc tgctgatacc gccgtgtact actgcgtgcg ggactccaac 300
tacagatacg acgagccctt cacctactgg ggccagggaa cactggtcac cgtgtcctct 360
gcttccacca agggaccctc tgtgttccct ctggctcctt ccagcaagtc tacctctggc 420
ggaacagctg ctctgggctg cctggtcaag gactactttc ctgagccagt gaccgtgtct 480
tggaactctg gcgctctgac atccggcgtg cacacctttc cagctgtgct gcaatcctcc 540
ggcctgtact ctctgtccag cgtcgtgacc gtgccttcta gctctctggg cacccagacc 600
tacatctgca atgtgaacca caagcctagc aacaccaagg tggacaagaa ggtggaaccc 660
aagtcctgcg acaagaccca cacctgtcct ccatgtcctg ctccagaagc tgctggcgcc 720
ccttccgtgt ttctgttccc tccaaagcct aaggacaccc tgatgatctc tcggacccct 780
gaagtgacct gcgtggtggt ggatgtgtct cacgaggatc ccgaagtgaa gttcaattgg 840
tacgtggacg gcgtggaagt gcacaacgcc aagaccaagc ctagagagga acagtacaac 900
agcacctaca gagtggtgtc cgtgctgacc gtgctgcacc aggattggct gaacggcaaa 960
gagtacaagt gcaaggtgtc caacaaggcc ctgcctgctc ctatcgaaaa gaccatcagc 1020
aaggccaagg gccagcctag ggaaccccag gtttacacct tgcctccatc tcgggacgag 1080
ctgacaaaaa atcaggtttc cctgacctgc ctcgtgaagg gattctaccc ctccgatatc 1140
gccgtggaat gggagtctaa tggccagcct gagaacaact acaagacaac ccctcctgtg 1200
ctggactccg acggctcatt cttcctgtac tccaagctga cagtggacaa gtccagatgg 1260
cagcagggca acgtgttctc ctgctccgtg atgcacgagg ccctgcacaa tcactacacc 1320
cagaagtccc tgtctctgtc ccctggcaaa 1350
<210> 136
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 136
caggtccagc tgcaagagtc tggccctgga ctggtcaagc cttccgagac actgtccatc 60
acctgtaccg tgtccggctt ctccctgtcc aactacgaca tctcctggat cagacagcct 120
cctggcaaag gcctggaatg gctgggagtg atttggaccg gcggagccac caactacaac 180
cccgctctga agtcccggct gaccatctcc agagacaact ccaagaacca ggtgtccctg 240
aagatgtcct ccgtgaccgc tgctgatacc gccgtgtact actgcgtgcg ggactccaac 300
tacagatacg acgagccctt cacctactgg ggccagggaa cactggtcac cgtgtcctct 360
gctagcacca aagggccgtc cgtcttcccc ctggccccct gcagccggtc gacgtccgag 420
tccaccgccg ccctcgggtg cctggtcaag gactacttcc cggagccggt aaccgtgagc 480
tggaactccg gcgcgctgac ctccggcgtg cacacgttcc ccgccgtcct gcagtcctcc 540
ggcctctact ccctctcgtc cgtcgtcacc gtcccgagca gttccctggg caccaagacc 600
tacacgtgca acgtcgacca caagccctcc aacaccaagg tagacaagcg cgtcgagtcc 660
aaatacggcc ccccgtgccc gccctgtccg gcccccgagg ccgcgggcgg cccctcagtg 720
ttcctgttcc cgccgaagcc caaggacacc ctgatgatct cgcgcacgcc cgaggtcacg 780
tgcgtggtcg tcgacgtctc acaggaagac cccgaggtgc agttcaactg gtatgtcgac 840
ggcgtggagg ttcacaacgc gaagaccaag ccccgggagg agcagttcaa cagcacatac 900
cgggtggtgt cggtcctcac cgtgctgcat caggactggc tgaacggtaa ggagtacaag 960
tgcaaggtgt ccaacaaggg cctcccgagc agcatagaga agaccatctc caaggcgaag 1020
ggtcagcccc gcgaaccgca ggtgtacacc ctgccgccga gccaggagga gatgacgaag 1080
aaccaggtct ccctgacgtg cctggtgaag ggtttctacc cctcggacat cgcggtcgaa 1140
tgggaatcga acgggcagcc ggagaacaac tacaagacca cgccgccggt cctggactcc 1200
gacgggtcct tcttcctgta ctcccggctg accgtagaca agtcgcgctg gcaggagggt 1260
aacgtgttca gctgcagcgt gatgcacgag gccctccaca accactacac gcaaaagtcg 1320
ctctccctgt ccctgggc 1338
<210> 137
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> легкая цепь антитела
<400> 137
gaaattgtgc tgacccagtc tcctgacaca ctgagcgtga cccctaaaga aaaagtgacc 60
ctgacctgcc gggccagcca gtctatcggc accaacatcc actggttcca gcagaagcct 120
ggccagtctc caaagctgct gattaagtac gcctccgagt ccatctccgg cgtgccctct 180
agattttccg gctctggctc tggcaccgac ttcaccctga ccatcaactc cgtggaagcc 240
gaggatgccg ctacctacta ctgccagcag tccaactcct ggccttacac ctttggccag 300
ggcaccaagc tggaaatcaa gcggacagtg gccgctcctt ccgtgttcat cttcccacct 360
tccgacgagc agctgaagtc cggcacagct tctgtcgtgt gcctgctgaa caacttctac 420
cctcgggaag ccaaggtgca gtggaaggtg gacaatgccc tgcagtccgg caactcccaa 480
gagtctgtga ccgagcagga ctccaaggac agcacctaca gcctgtcctc cacactgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccatcagggc 600
ctgtctagcc ctgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 138
<211> 1842
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 138
gagtccaaat acggcccccc gtgcccgccc tgtccggccc ccgaggccgc gggcggcccc 60
tcagtgttcc tgttcccgcc gaagcccaag gacaccctga tgatctcgcg cacgcccgag 120
gtcacgtgcg tggtcgtcga cgtctcacag gaagaccccg aggtgcagtt caactggtat 180
gtcgacggcg tggaggttca caacgcgaag accaagcccc gggaggagca gttcaacagc 240
acataccggg tggtgtcggt cctcaccgtg ctgcatcagg actggctgaa cggtaaggag 300
tacaagtgca aggtgtccaa caagggcctc ccgagcagca tagagaagac catctccaag 360
gcgaagggtc agccccgcga accgcaggtg tacaccctgc cgccgagcca ggaggagatg 420
acgaagaacc aggtctccct gacgtgcctg gtgaagggtt tctacccctc ggacatcgcg 480
gtcgaatggg aatcgaacgg gcagccggag aacaactaca agaccacgcc gccggtcctg 540
gactccgacg ggtccttctt cctgtactcc cggctgaccg tagacaagtc gcgctggcag 600
gagggtaacg tgttcagctg cagcgtgatg cacgaggccc tccacaacca ctacacgcaa 660
aagtcgctct ccctgtccct gggcggaggc ggaggatctg gtggtggtgg atctggcggc 720
ggaggttctc aggactctac ctccgatctg atccccgctc ctccactgtc taaggtgcca 780
ctgcagcaga acttccagga caaccagttc cacggcaagt ggtacgtcgt cggccaggcc 840
ggaaacatca gactgagaga ggacaaggac cccatcaaga tgatggctac catctacgag 900
ctgaaagagg ataagtccta cgacgtcacc atggtcaagt tcgacgacaa aaagtgtatg 960
tacgacatct ggaccttcgt gcccggctct cagcctggcg agtttaccct gggcaagatc 1020
aagagcttcc ccggccacac ctcttctctc gtgcgtgtgg tgtccaccaa ctacaaccag 1080
cacgccatgg tgttcttcaa gttcgtgttc cagaaccggg aagagttcta catcaccctg 1140
tacggccgga ccaaagagct gacctccgaa ctgaaagaga acttcatccg gttctccaag 1200
agcctgggcc tgccagagaa ccacatcgtg tttccagtgc ctatcgacca gtgcatcgat 1260
ggcggaggcg gaggatctgg tggtggtgga tctggcggcg gaggttctca ggactctacc 1320
tccgatctga tccccgctcc tccactgtct aaggtgccac tgcagcagaa cttccaggac 1380
aaccagttcc acggcaagtg gtacgtcgtc ggccaggccg gaaacatcag actgagagag 1440
gacaaggacc ccatcaagat gatggctacc atctacgagc tgaaagagga taagtcctac 1500
gacgtcacca tggtcaagtt cgacgacaaa aagtgtatgt acgacatctg gaccttcgtg 1560
cccggctctc agcctggcga gtttaccctg ggcaagatca agagcttccc cggccacacc 1620
tcttctctcg tgcgtgtggt gtccaccaac tacaaccagc acgccatggt gttcttcaag 1680
ttcgtgttcc agaaccggga agagttctac atcaccctgt acggccggac caaagagctg 1740
acctccgaac tgaaagagaa cttcatccgg ttctccaaga gcctgggcct gccagagaac 1800
cacatcgtgt tccctgtgcc tatcgatcag tgtatcgacg gc 1842
<210> 139
<211> 1266
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 139
gagagcaagt acggccctcc ctgccccccc tgccctgccc ctgaagccgc gggcggacct 60
tccgtgtttc tgttcccccc gaagcccaag gacaccctga tgatctcccg gacccccgaa 120
gtgacctgcg tggtggtgga cgtgtcccag gaagatccag aggtgcagtt caactggtat 180
gttgacggcg tggaagtgca caacgccaag accaagccca gagaggaaca gttcaactcc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaagag 300
tacaagtgca aggtgtccaa caagggcctg ccctccagca tcgaaaagac catctccaag 360
gccaagggcc agccccgcga gccccaggtg tacaccctgc cccctagcca ggaagagatg 420
accaagaacc aggtgtccct gacctgtctg gtgaaaggct tctacccctc cgacattgcc 480
gtggaatggg agtccaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gactccgacg gctccttctt cctgtactct cggctgacag tggataagtc ccggtggcag 600
gaaggcaatg tgttctcctg cagcgtgatg cacgaggccc tgcacaacca ctatacccag 660
aagtccctgt ccctgagcct gggcaagggc ggcggcggat ccggcggcgg cggctctggc 720
ggcggcggct ctcaggactc tacatccgat ctgatccccg ctcctccact gtccaaggtg 780
cctctgcaac agaactttca ggacaaccag tttcatggca agtggtatgt ggtgggccag 840
gctggcaata tcagactgag ggaggataag gaccctatca agatgatggc cacaatctac 900
gagctgaagg aggacaagtc ttacgatgtg acaatggtga agttcgacga caagaagtgc 960
atgtacgaca tctggacatt cgtgccaggc tcccagcctg gcgagtttac actgggcaag 1020
atcaagtcct tcccaggcca tacctccagc ctggtgcggg tggtgtccac aaactataac 1080
cagcatgcta tggtgttttt caagttcgtg ttccagaatc gggaggagtt ctacatcacc 1140
ctgtacggcc ggaccaagga gctgacatct gagctgaagg agaacttcat cagattttcc 1200
aagagcctgg gcctgcctga gaaccacatc gtgtttcccg tgccaatcga tcagtgtatc 1260
gacggc 1266
<210> 140
<211> 1917
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 140
caggtccagc tgcaagagtc tggccctgga ctggtcaagc cttccgagac actgtccatc 60
acctgtaccg tgtccggctt ctccctgtcc aactacgaca tctcctggat cagacagcct 120
cctggcaaag gcctggaatg gctgggagtg atttggaccg gcggagccac caactacaac 180
cccgctctga agtcccggct gaccatctcc agagacaact ccaagaacca ggtgtccctg 240
aagatgtcct ccgtgaccgc tgctgatacc gccgtgtact actgcgtgcg ggactccaac 300
tacagatacg acgagccctt cacctactgg ggccagggaa cactggtcac cgtgtcctct 360
gctagcacca aagggccgtc cgtcttcccc ctggccccct gcagccggtc gacgtccgag 420
tccaccgccg ccctcgggtg cctggtcaag gactacttcc cggagccggt aaccgtgagc 480
tggaactccg gcgcgctgac ctccggcgtg cacacgttcc ccgccgtcct gcagtcctcc 540
ggcctctact ccctctcgtc cgtcgtcacc gtcccgagca gttccctggg caccaagacc 600
tacacgtgca acgtcgacca caagccctcc aacaccaagg tagacaagcg cgtcgagtcc 660
aaatacggcc ccccgtgccc gccctgtccg gcccccgagg ccgcgggcgg cccctcagtg 720
ttcctgttcc cgccgaagcc caaggacacc ctgatgatct cgcgcacgcc cgaggtcacg 780
tgcgtggtcg tcgacgtctc acaggaagac cccgaggtgc agttcaactg gtatgtcgac 840
ggcgtggagg ttcacaacgc gaagaccaag ccccgggagg agcagttcaa cagcacatac 900
cgggtggtgt cggtcctcac cgtgctgcat caggactggc tgaacggtaa ggagtacaag 960
tgcaaggtgt ccaacaaggg cctcccgagc agcatagaga agaccatctc caaggcgaag 1020
ggtcagcccc gcgaaccgca ggtgtacacc ctgccgccga gccaggagga gatgacgaag 1080
aaccaggtct ccctgacgtg cctggtgaag ggtttctacc cctcggacat cgcggtcgaa 1140
tgggaatcga acgggcagcc ggagaacaac tacaagacca cgccgccggt cctggactcc 1200
gacgggtcct tcttcctgta ctcccggctg accgtagaca agtcgcgctg gcaggagggt 1260
aacgtgttca gctgcagcgt gatgcacgag gccctccaca accactacac gcaaaagtcg 1320
ctctccctgt ccctgggcgg aggcggagga tctggtggtg gtggatctgg cggcggaggt 1380
tctcaggact ctacctccga tctgatcccc gctcctccac tgtctaaggt gccactgcag 1440
cagaacttcc aggacaacca gttccacggc aagtggtacg tcgtcggcca ggccggaaac 1500
atcagactga gagaggacaa ggaccccatc aagatgatgg ctaccatcta cgagctgaaa 1560
gaggataagt cctacgacgt caccatggtc aagttcgacg acaaaaagtg tatgtacgac 1620
atctggacct tcgtgcccgg ctctcagcct ggcgagttta ccctgggcaa gatcaagagc 1680
ttccccggcc acacctcttc tctcgtgcgt gtggtgtcca ccaactacaa ccagcacgcc 1740
atggtgttct tcaagttcgt gttccagaac cgggaagagt tctacatcac cctgtacggc 1800
cggaccaaag agctgacctc cgaactgaaa gagaacttca tccggttctc caagagcctg 1860
ggcctgccag agaaccacat cgtgttccct gtgcctatcg accagtgcat cgatggc 1917
<210> 141
<211> 1221
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 141
gaaattgtgc tgacccagtc tcctgacaca ctgagcgtga cccctaaaga aaaagtgacc 60
ctgacctgcc gggccagcca gtctatcggc accaacatcc actggttcca gcagaagcct 120
ggccagtctc caaagctgct gattaagtac gcctccgagt ccatctccgg cgtgccctct 180
agattttccg gctctggctc tggcaccgac ttcaccctga ccatcaactc cgtggaagcc 240
gaggatgccg ctacctacta ctgccagcag tccaactcct ggccttacac ctttggccag 300
ggcaccaagc tggaaatcaa gcggacagtg gccgctcctt ccgtgttcat cttcccacct 360
tccgacgagc agctgaagtc cggcacagct tctgtcgtgt gcctgctgaa caacttctac 420
cctcgggaag ccaaggtgca gtggaaggtg gacaatgccc tgcagtccgg caactcccaa 480
gagtctgtga ccgagcagga ctccaaggac agcacctaca gcctgtcctc cacactgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccatcagggc 600
ctgtctagcc ctgtgaccaa gtctttcaac cggggcgagt gtggtggcgg aggatctggc 660
ggaggtggaa gcggcggagg cggatctcaa gactctacct ccgatctgat ccccgctcct 720
ccactgtcta aggtgccact gcagcagaac ttccaggaca accagttcca cggcaagtgg 780
tacgtcgtcg gccaggccgg aaacatcaga ctgagagagg acaaggaccc catcaagatg 840
atggctacca tctacgagct gaaagaggat aagtcctacg acgtcaccat ggtcaagttc 900
gacgacaaaa agtgtatgta cgacatctgg accttcgtgc ccggctctca gcctggcgag 960
tttaccctgg gcaagatcaa gagcttcccc ggccacacct cttctctcgt gcgtgtggtg 1020
tccaccaact acaaccagca cgccatggtg ttcttcaagt tcgtgttcca gaaccgggaa 1080
gagttctaca tcaccctgta cggccggacc aaagagctga cctccgaact gaaagagaac 1140
ttcatccggt tctccaagag cctgggcctg cctgagaacc acatcgtgtt ccctgtgcct 1200
atcgaccagt gcatcgatgg c 1221
<210> 142
<211> 1917
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 142
caggactcca cctccgatct gatccctgct cctccactgt ctaaggtgcc cctgcagcag 60
aacttccagg acaaccagtt ccacggcaag tggtacgtcg tcggccaggc cggaaacatc 120
agactgagag aggacaagga ccccatcaag atgatggcta ccatctacga gctgaaagag 180
gataagtcct acgacgtcac catggtcaag ttcgacgaca aaaagtgtat gtacgacatc 240
tggaccttcg tgcccggctc tcagcctggc gagtttaccc tgggcaagat caagagcttc 300
cccggccaca cctcttctct cgtgcgtgtg gtgtccacca actacaacca gcacgccatg 360
gtgttcttca agttcgtgtt ccagaaccgg gaagagttct acatcaccct gtacggccgg 420
accaaagagc tgacctccga actgaaagag aacttcatcc ggttctccaa gagcctgggc 480
ctgcctgaga accacatcgt gttccctgtg cctatcgacc agtgcatcga tggcggaggc 540
ggaggatctg gtggtggtgg atctggcggc ggaggttctc aggtccagct gcaagagtct 600
ggccctggac tggtcaagcc ttccgagaca ctgtccatca cctgtaccgt gtccggcttc 660
tccctgtcca actacgacat ctcctggatc agacagcctc ctggcaaagg cctggaatgg 720
ctgggagtga tttggaccgg cggagccacc aactacaacc ccgctctgaa gtcccggctg 780
accatctcca gagacaactc caagaaccag gtgtccctga agatgtcctc cgtgaccgct 840
gctgataccg ccgtgtacta ctgcgtgcgg gactccaact acagatacga cgagcccttc 900
acctactggg gccagggaac actggtcacc gtgtcctctg ctagcaccaa agggccgtcc 960
gtcttccccc tggccccctg cagccggtcg acgtccgagt ccaccgccgc cctcgggtgc 1020
ctggtcaagg actacttccc ggagccggta accgtgagct ggaactccgg cgcgctgacc 1080
tccggcgtgc acacgttccc cgccgtcctg cagtcctccg gcctctactc cctctcgtcc 1140
gtcgtcaccg tcccgagcag ttccctgggc accaagacct acacgtgcaa cgtcgaccac 1200
aagccctcca acaccaaggt agacaagcgc gtcgagtcca aatacggccc cccgtgcccg 1260
ccctgtccgg cccccgaggc cgcgggcggc ccctcagtgt tcctgttccc gccgaagccc 1320
aaggacaccc tgatgatctc gcgcacgccc gaggtcacgt gcgtggtcgt cgacgtctca 1380
caggaagacc ccgaggtgca gttcaactgg tatgtcgacg gcgtggaggt tcacaacgcg 1440
aagaccaagc cccgggagga gcagttcaac agcacatacc gggtggtgtc ggtcctcacc 1500
gtgctgcatc aggactggct gaacggtaag gagtacaagt gcaaggtgtc caacaagggc 1560
ctcccgagca gcatagagaa gaccatctcc aaggcgaagg gtcagccccg cgaaccgcag 1620
gtgtacaccc tgccgccgag ccaggaggag atgacgaaga accaggtctc cctgacgtgc 1680
ctggtgaagg gtttctaccc ctcggacatc gcggtcgaat gggaatcgaa cgggcagccg 1740
gagaacaact acaagaccac gccgccggtc ctggactccg acgggtcctt cttcctgtac 1800
tcccggctga ccgtagacaa gtcgcgctgg caggagggta acgtgttcag ctgcagcgtg 1860
atgcacgagg ccctccacaa ccactacacg caaaagtcgc tctccctgtc cctgggc 1917
<210> 143
<211> 1221
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 143
caggattcta cctccgatct gatccccgct cctccactgt ctaaggtgcc cctgcagcag 60
aacttccagg acaaccagtt ccacggcaag tggtacgtcg tcggccaggc cggaaacatc 120
agactgagag aggacaagga ccccatcaag atgatggcta ccatctacga gctgaaagag 180
gataagtcct acgacgtcac catggtcaag ttcgacgaca aaaagtgtat gtacgacatc 240
tggaccttcg tgcccggctc tcagcctggc gagtttaccc tgggcaagat caagagcttc 300
cccggccaca cctcttctct cgtgcgtgtg gtgtccacca actacaacca gcacgccatg 360
gtgttcttca agttcgtgtt ccagaaccgg gaagagttct acatcaccct gtacggccgg 420
accaaagagc tgacctccga actgaaagag aacttcatcc ggttctccaa gagcctgggc 480
ctgcctgaga accacatcgt gttccctgtg cctatcgacc agtgcatcga tggcggaggc 540
ggaggatctg gcggaggtgg aagcggaggc ggtggatctg aaattgtgct gacccagtct 600
cctgacacac tgagcgtgac ccctaaagaa aaagtgaccc tgacctgccg ggccagccag 660
tctatcggca ccaacatcca ctggttccag cagaagcctg gccagtctcc aaagctgctg 720
attaagtacg cctccgagtc catctccggc gtgccctcta gattttccgg ctctggctct 780
ggcaccgact tcaccctgac catcaactcc gtggaagccg aggatgccgc tacctactac 840
tgccagcagt ccaactcctg gccttacacc tttggccagg gcaccaagct ggaaatcaag 900
cggacagtgg ccgctccttc cgtgttcatc ttcccacctt ccgacgagca gctgaagtcc 960
ggcacagctt ctgtcgtgtg cctgctgaac aacttctacc ctcgggaagc caaggtgcag 1020
tggaaggtgg acaatgccct gcagtccggc aactcccaag agtctgtgac cgagcaggac 1080
tccaaggaca gcacctacag cctgtcctcc acactgaccc tgtccaaggc cgactacgag 1140
aagcacaagg tgtacgcctg cgaagtgacc catcagggcc tgtctagccc tgtgaccaag 1200
tctttcaacc ggggcgagtg t 1221
<210> 144
<211> 2496
<212> ДНК
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 144
caggtccagc tgcaagagtc tggccctgga ctggtcaagc cttccgagac actgtccatc 60
acctgtaccg tgtccggctt ctccctgtcc aactacgaca tctcctggat cagacagcct 120
cctggcaaag gcctggaatg gctgggagtg atttggaccg gcggagccac caactacaac 180
cccgctctga agtcccggct gaccatctcc agagacaact ccaagaacca ggtgtccctg 240
aagatgtcct ccgtgaccgc tgctgatacc gccgtgtact actgcgtgcg ggactccaac 300
tacagatacg acgagccctt cacctactgg ggccagggaa cactggtcac cgtgtcctct 360
gctagcacca aagggccgtc cgtcttcccc ctggccccct gcagccggtc gacgtccgag 420
tccaccgccg ccctcgggtg cctggtcaag gactacttcc cggagccggt aaccgtgagc 480
tggaactccg gcgcgctgac ctccggcgtg cacacgttcc ccgccgtcct gcagtcctcc 540
ggcctctact ccctctcgtc cgtcgtcacc gtcccgagca gttccctggg caccaagacc 600
tacacgtgca acgtcgacca caagccctcc aacaccaagg tagacaagcg cgtcgagtcc 660
aaatacggcc ccccgtgccc gccctgtccg gcccccgagg ccgcgggcgg cccctcagtg 720
ttcctgttcc cgccgaagcc caaggacacc ctgatgatct cgcgcacgcc cgaggtcacg 780
tgcgtggtcg tcgacgtctc acaggaagac cccgaggtgc agttcaactg gtatgtcgac 840
ggcgtggagg ttcacaacgc gaagaccaag ccccgggagg agcagttcaa cagcacatac 900
cgggtggtgt cggtcctcac cgtgctgcat caggactggc tgaacggtaa ggagtacaag 960
tgcaaggtgt ccaacaaggg cctcccgagc agcatagaga agaccatctc caaggcgaag 1020
ggtcagcccc gcgaaccgca ggtgtacacc ctgccgccga gccaggagga gatgacgaag 1080
aaccaggtct ccctgacgtg cctggtgaag ggtttctacc cctcggacat cgcggtcgaa 1140
tgggaatcga acgggcagcc ggagaacaac tacaagacca cgccgccggt cctggactcc 1200
gacgggtcct tcttcctgta ctcccggctg accgtagaca agtcgcgctg gcaggagggt 1260
aacgtgttca gctgcagcgt gatgcacgag gccctccaca accactacac gcaaaagtcg 1320
ctctccctgt ccctgggcgg aggcggagga tctggtggtg gtggatctgg cggcggaggt 1380
tctcaggact ctacctccga tctgatcccc gctcctccac tgtctaaggt gccactgcag 1440
cagaacttcc aggacaacca gttccacggc aagtggtacg tcgtcggcca ggccggaaac 1500
atcagactga gagaggacaa ggaccccatc aagatgatgg ctaccatcta cgagctgaaa 1560
gaggataagt cctacgacgt caccatggtc aagttcgacg acaaaaagtg tatgtacgac 1620
atctggacct tcgtgcccgg ctctcagcct ggcgagttta ccctgggcaa gatcaagagc 1680
ttccccggcc acacctcttc tctcgtgcgt gtggtgtcca ccaactacaa ccagcacgcc 1740
atggtgttct tcaagttcgt gttccagaac cgggaagagt tctacatcac cctgtacggc 1800
cggaccaaag agctgacctc cgaactgaaa gagaacttca tccggttctc caagagcctg 1860
ggcctgccag agaaccacat cgtgtttcca gtgcctatcg accagtgcat cgatggcgga 1920
ggcggaggat ctggtggtgg tggatctggc ggcggaggtt ctcaggactc tacctccgat 1980
ctgatccccg ctcctccact gtctaaggtg ccactgcagc agaacttcca ggacaaccag 2040
ttccacggca agtggtacgt cgtcggccag gccggaaaca tcagactgag agaggacaag 2100
gaccccatca agatgatggc taccatctac gagctgaaag aggataagtc ctacgacgtc 2160
accatggtca agttcgacga caaaaagtgt atgtacgaca tctggacctt cgtgcccggc 2220
tctcagcctg gcgagtttac cctgggcaag atcaagagct tccccggcca cacctcttct 2280
ctcgtgcgtg tggtgtccac caactacaac cagcacgcca tggtgttctt caagttcgtg 2340
ttccagaacc gggaagagtt ctacatcacc ctgtacggcc ggaccaaaga gctgacctcc 2400
gaactgaaag agaacttcat ccggttctcc aagagcctgg gcctgccaga gaaccacatc 2460
gtgttccctg tgcctatcga tcagtgtatc gacggc 2496
<210> 145
<211> 442
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь антитела
<400> 145
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Thr Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe
180 185 190
Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro
210 215 220
Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 146
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь антитела
<400> 146
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Lys Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Tyr Thr Gly Phe Gly Ser Leu
85 90 95
Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 147
<211> 472
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 147
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Glu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Ile Phe Ala Ile Lys
20 25 30
Pro Ile Ser Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Trp Val
35 40 45
Ser Thr Thr Thr Ser Ser Gly Ala Thr Asn Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Asn
85 90 95
Val Phe Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Lys Pro Gly
100 105 110
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Gly
115 120 125
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
130 135 140
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
145 150 155 160
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
165 170 175
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
180 185 190
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
195 200 205
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
210 215 220
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
225 230 235 240
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
245 250 255
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
260 265 270
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
275 280 285
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
290 295 300
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
305 310 315 320
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
325 330 335
Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln
340 345 350
Leu Leu Glu Ser Gly Gly Gly Glu Val Gln Pro Gly Gly Ser Leu Arg
355 360 365
Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ile Asn Ala Met Gly
370 375 380
Trp Tyr Arg Gln Ala Pro Gly Lys Arg Arg Glu Phe Val Ala Ala Ile
385 390 395 400
Glu Ser Gly Arg Asn Thr Val Tyr Ala Glu Ser Val Lys Gly Arg Phe
405 410 415
Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Ser
420 425 430
Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Gly Leu Leu Lys
435 440 445
Gly Asn Arg Val Val Ser Pro Ser Val Ala Tyr Trp Gly Gln Gly Thr
450 455 460
Leu Val Thr Val Lys Pro Gly Gly
465 470
<210> 148
<211> 466
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> слитый белок
<400> 148
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Glu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Ile Phe Ala Ile Lys
20 25 30
Pro Ile Ser Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Trp Val
35 40 45
Ser Thr Thr Thr Ser Ser Gly Ala Thr Asn Tyr Ala Glu Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Asn
85 90 95
Val Phe Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Lys Pro Gly
100 105 110
Gly Ser Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Glu
115 120 125
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
130 135 140
Ser Phe Ser Ile Asn Ala Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys
145 150 155 160
Arg Arg Glu Phe Val Ala Ala Ile Glu Ser Gly Arg Asn Thr Val Tyr
165 170 175
Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys
180 185 190
Asn Thr Val Tyr Leu Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Gly Leu Leu Lys Gly Asn Arg Val Val Ser Pro Ser
210 215 220
Val Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Lys Pro Gly Gly
225 230 235 240
Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Gly Gly
245 250 255
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
260 265 270
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
275 280 285
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
290 295 300
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
305 310 315 320
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
450 455 460
Gly Lys
465
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| БЕЛКИ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ CD137 | 2016 |
|
RU2736312C2 |
| НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723034C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА С АФФИННОСТЬЮ В ОТНОШЕНИИ ГЛИПИКАНА-3 (GPC3) | 2016 |
|
RU2756318C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АНГИОГЕНЕЗА | 2016 |
|
RU2720688C2 |
| МОЛЕКУЛЫ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ PD-L1 и CD137 | 2019 |
|
RU2826084C2 |
| МНОГОФУНКЦИОНАЛЬНЫЕ СЛИТЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2815388C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2019 |
|
RU2804336C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2010 |
|
RU2707126C2 |

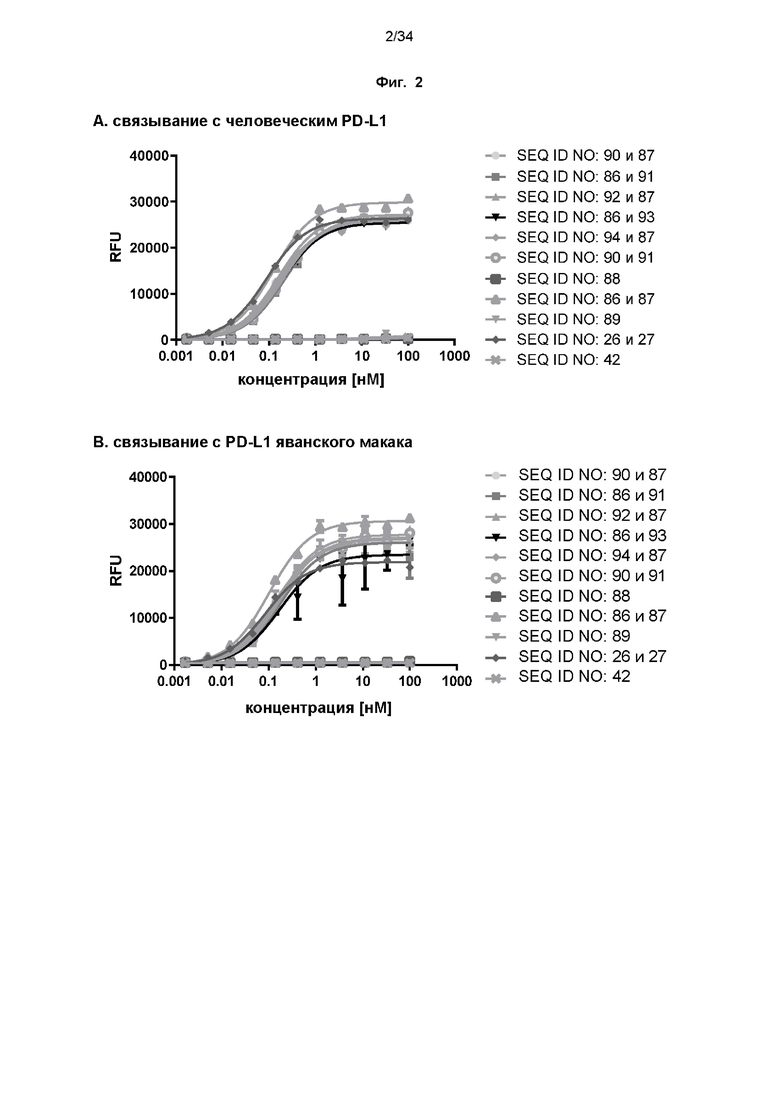
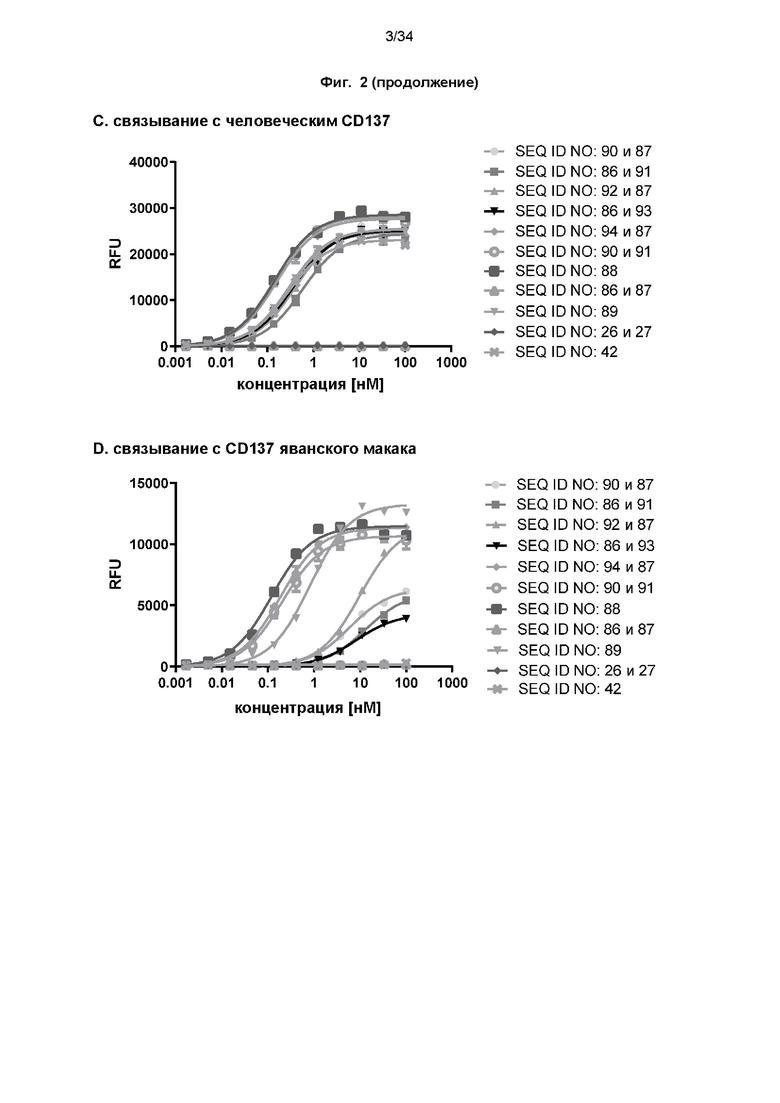


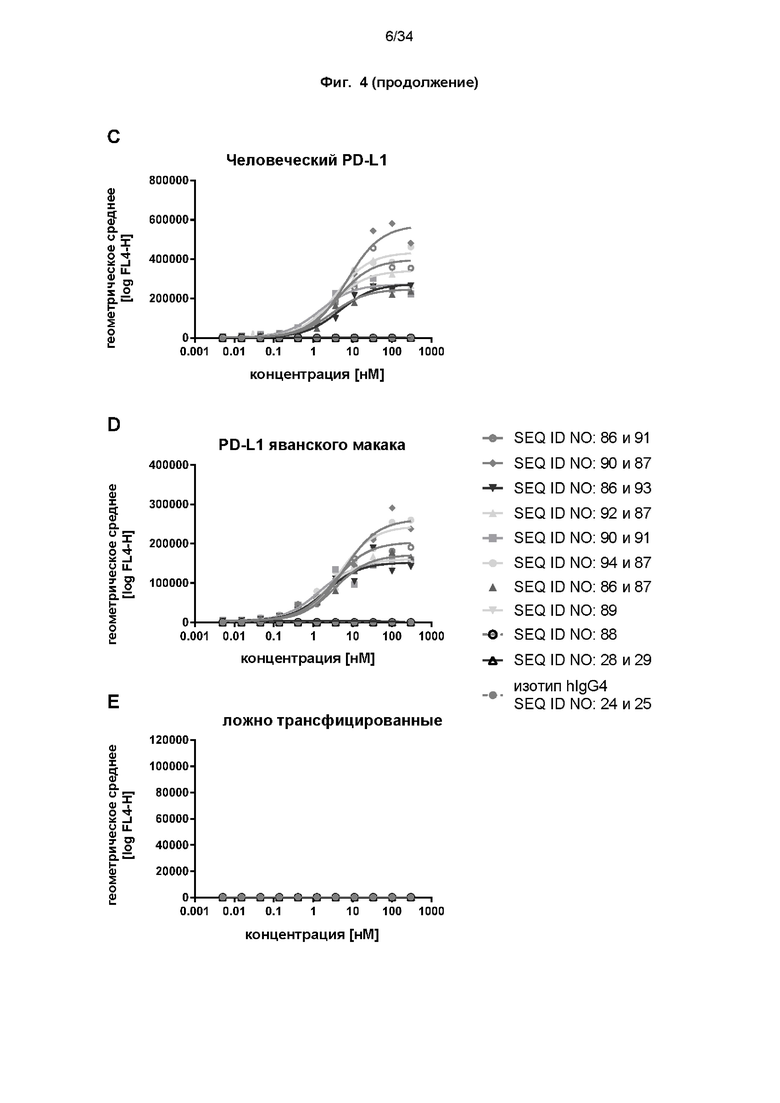



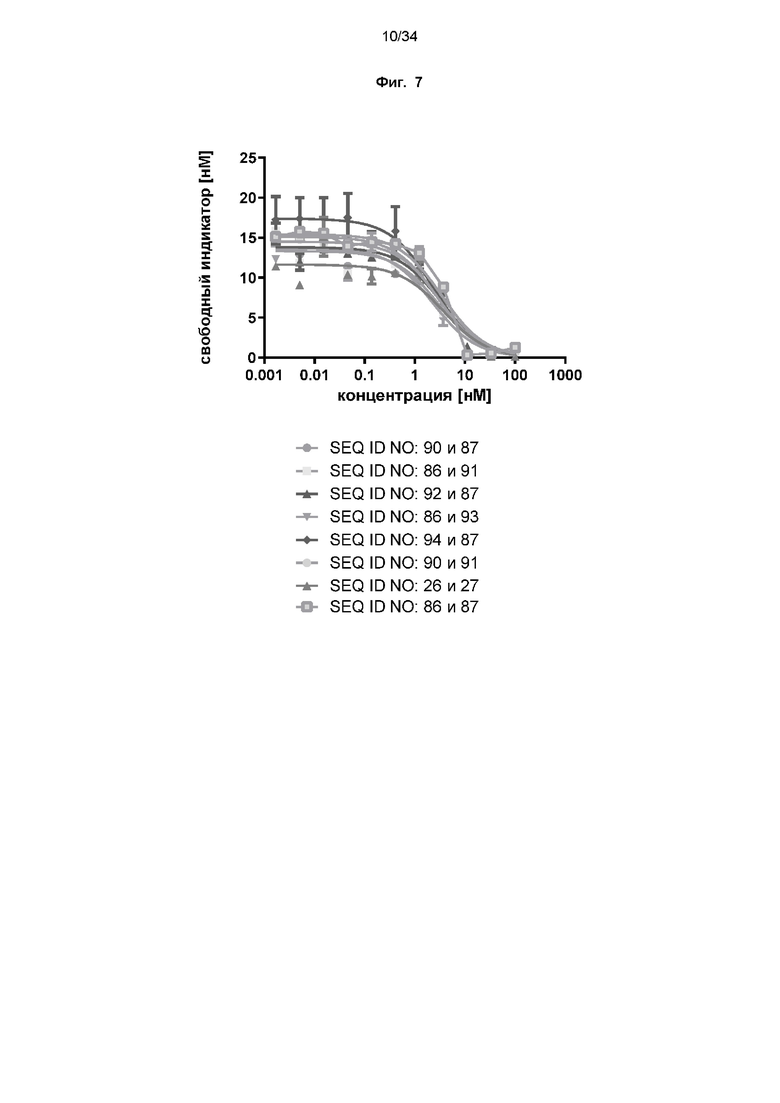
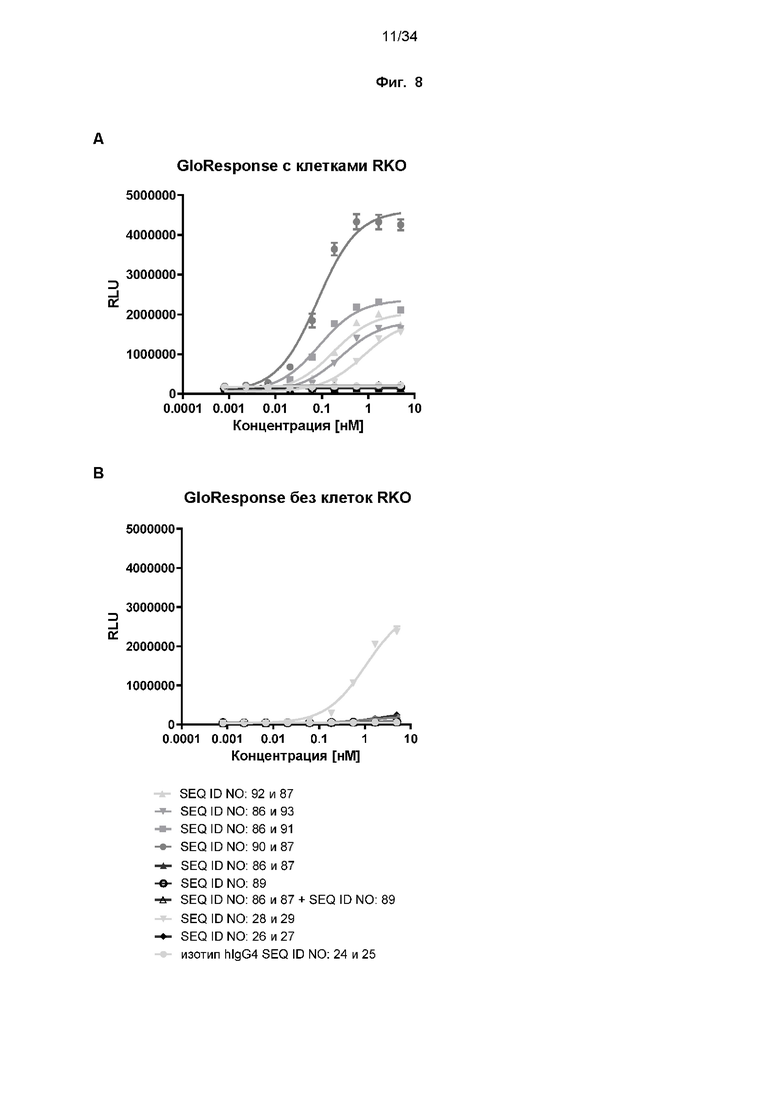
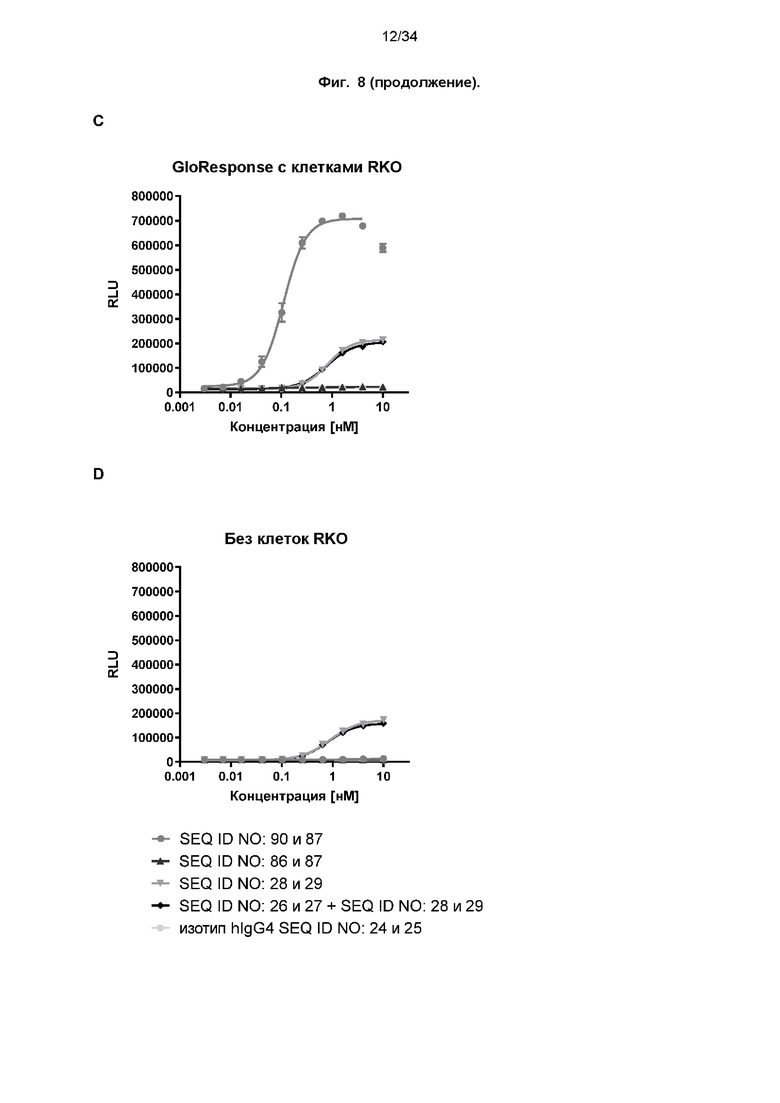

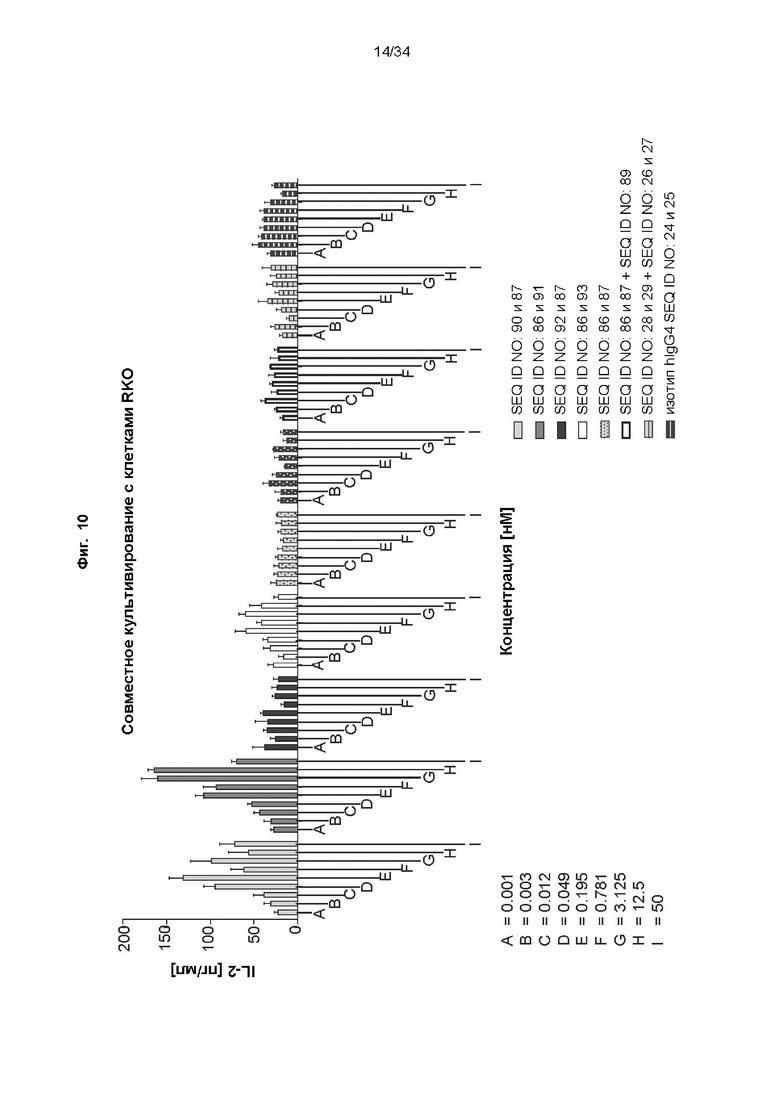
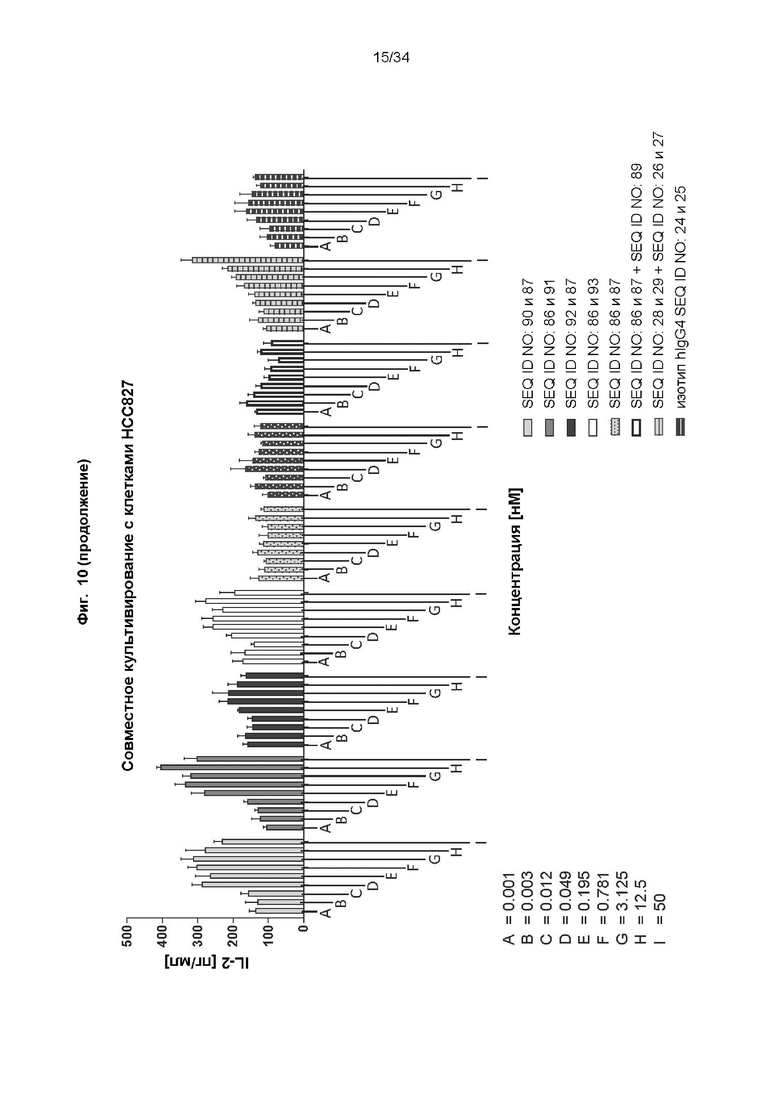




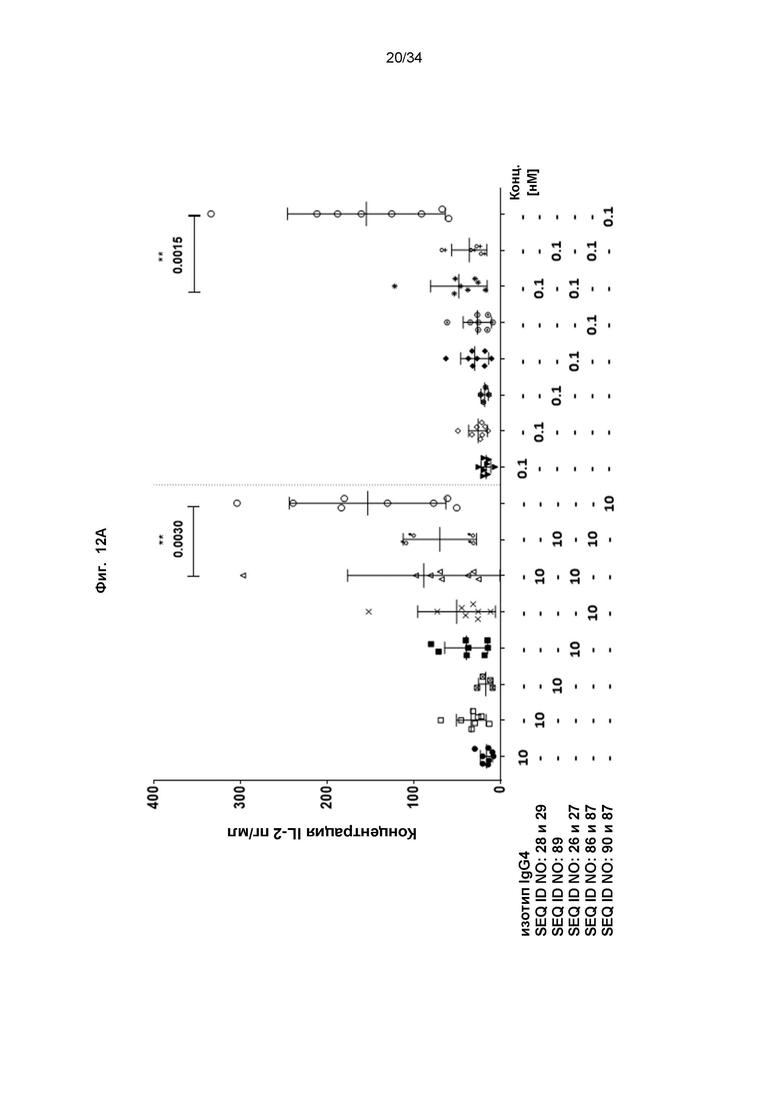





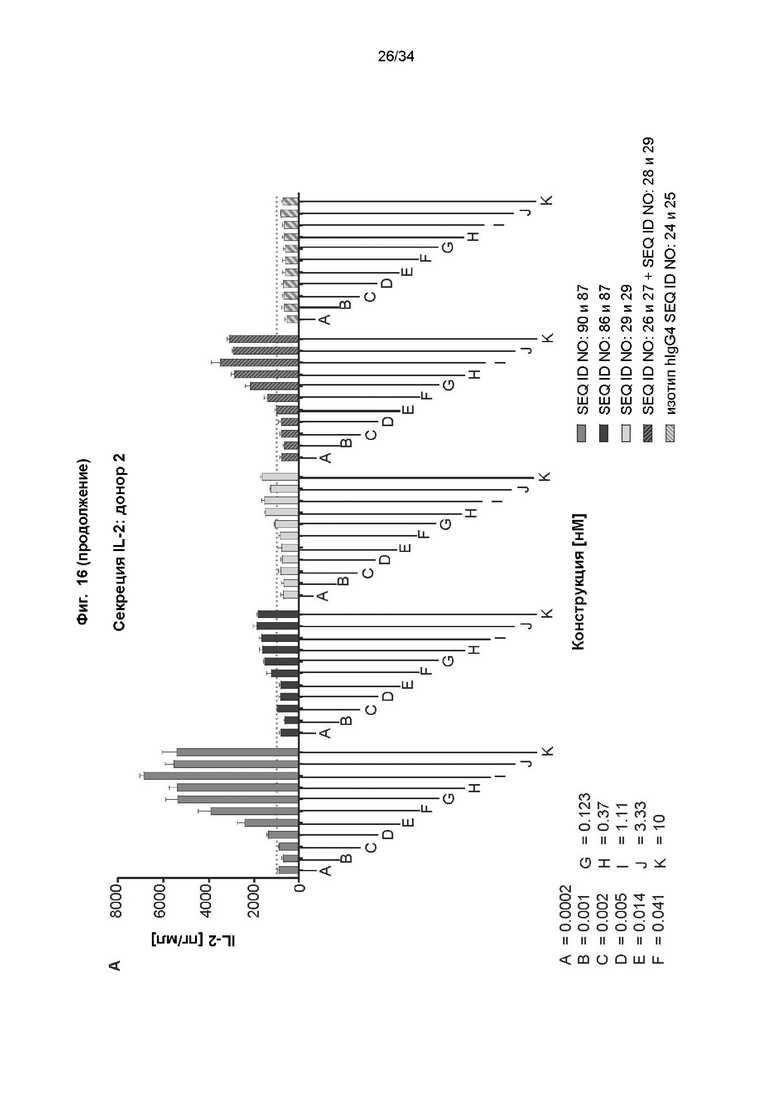



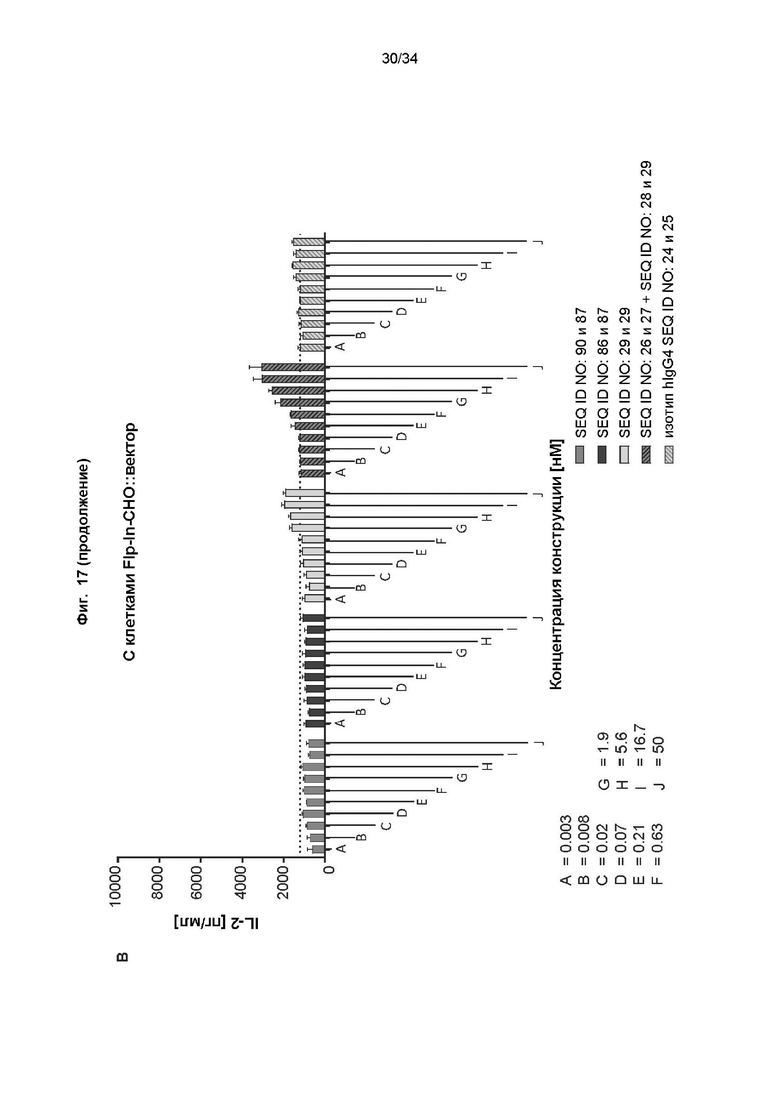



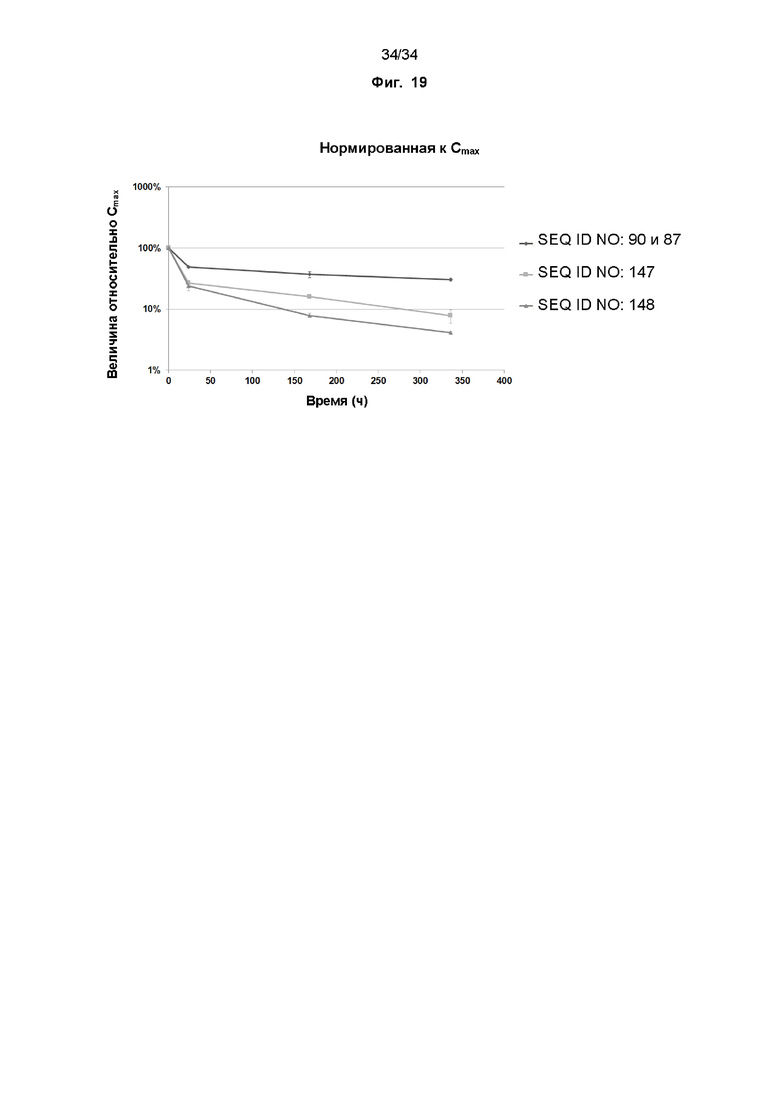
Изобретение относится к области биотехнологии, конкретно к слитым белкам, специфичным как к кластеру дифференцировки 137 (CD137), так и к лиганду программируемой клеточной смерти 1 (PD-L1), и может быть использовано в медицине для лечения PD-L1-положительного рака. Предложен слитый белок, имеющий две или три субъединицы, связанные посредством линкера, где первая субъединица содержит полноразмерный иммуноглобулин, который специфически связывает PD-L1, вторая субъединица или вторая субъединица и третья субъединица обе содержат мутеин липокалина, который специфически связывает CD137. При этом вторая субъединица может быть связана с концом каждой тяжелой цепи первой субъединицы или с концом каждой легкой цепи первой субъединицы, а третья субъединица - с C-концом каждой второй субъединицы или с C-концом каждой легкой цепи первой субъединицы. Изобретение обеспечивает получение слитых белков, эффективных в костимуляции активации лимфоцитов зависимым от мишени PD-L1 образом. 9 н. и 14 з.п. ф-лы, 19 ил., 13 табл., 22 пр.
1. Слитый белок, который специфически связывает одновременно как кластер дифференцировки 137 (CD137), так и лиганд программируемой клеточной смерти 1 (PD-L1), где указанный слитый белок имеет две или три субъединицы,
где первая субъединица содержит полноразмерный иммуноглобулин, который специфически связывает PD-L1, где тяжелая цепь иммуноглобулина содержит следующий набор последовательностей CDR: HCDR1, имеющую последовательность GFSLSNYD, как представлено в SEQ ID NO: 60, HCDR2, имеющую последовательность IWTGGAT, как представлено в SEQ ID NO: 61, и HCDR3, имеющую последовательность VRDSNYRYDEPFTY, как представлено в SEQ ID NO: 62, и где легкая цепь иммуноглобулина содержит следующий набор последовательностей CDR: LCDR1, имеющую последовательность QSIGTN, как представлено в SEQ ID NO: 63, LCDR2, имеющую последовательность YAS, и LCDR3, имеющую последовательность QQSNSWPYT, как представлено в SEQ ID NO: 64;
и где вторая субъединица или вторая субъединица и третья субъединица обе содержат мутеин липокалина, который специфически связывает CD137, где аминокислотная последовательность мутеина липокалина обладает по меньшей мере 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 42, и где аминокислотная последовательность мутеина липокалина содержит следующий набор мутированных аминокислотных остатков по сравнению с линейной полипептидной последовательностью зрелого hNGAL, как представлено в SEQ ID NO: 2: Gln 28→His; Leu 36→Gln; Ala 40→Ile; Ile 41→Arg; Gln 49→Ile; Tyr 52→Met; Asn 65→Asp; Ser 68→Met; Leu 70→Lys; Arg 72→Asp; Lys 73→Asp; Asp 77→Met; Trp 79→Asp; Arg 81→Trp; Cys 87→Ser; Asn 96→Lys; Tyr 100→Phe; Leu 103→His; Tyr 106→Ser; Lys 125→Phe; Ser 127→ Phe; Tyr 132→Glu; и Lys 134→Tyr;
где
(1) вторая субъединица связана посредством линкера с C-концом каждой тяжелой цепи первой субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 90 и 87;
(2) вторая субъединица связана посредством линкера с C-концом каждой легкой цепи первой субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 86 и 91;
(3) вторая субъединица связана посредством линкера с N-концом каждой тяжелой цепи первой субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 92 и 87;
(4) вторая субъединица связана посредством линкера с N-концом каждой легкой цепи первой субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 86 и 93;
(5) вторая субъединица связана посредством линкера с C-концом каждой тяжелой цепи первой субъединицы, и третья субъединица связана посредством линкера с C- концом каждой второй субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 94 и 87; или
(6) вторая субъединица связана посредством линкера с C-концом каждой тяжелой цепи первой субъединицы, и третья субъединица связана посредством линкера с C- концом каждой легкой цепи первой субъединицы, и где слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 90% идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 90 и 91.
2. Слитый белок по п. 1, в котором аминокислотная последовательность мутеина липокалина обладает по меньшей мере 95% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO: 42.
3. Слитый белок по п. 1, в котором аминокислотная последовательность мутеина липокалина содержит аминокислотную последовательность SEQ ID NO: 42.
4. Слитый белок по п. 1, в котором линкер представляет собой линкер с SEQ ID NO: 13.
5. Слитый белок по п. 1, в котором антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, содержащие аминокислотные последовательности, как представлено в SEQ ID NO: 77 и 82.
6. Слитый белок по п. 1, в котором иммуноглобулин содержит тяжелую цепь и легкую цепь, содержащие аминокислотные последовательности SEQ ID NO: 86 и 87.
7. Слитый белок по п. 1, в котором иммуноглобулин имеет остов IgG4.
8. Слитый белок по п. 7, в котором указанный остов IgG4 имеет одну или более из следующих мутаций: S228P, N297A, F234A, L235A, M428L, N434S, M252Y, S254T и T256E.
9. Слитый белок по п. 1, отличающийся тем, что указанный слитый белок содержит аминокислотные последовательности, обладающие по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или более высокой идентичностью последовательности с аминокислотными последовательностями, представленными в SEQ ID NO: 90 и 87, SEQ ID NO: 86 и 91, SEQ ID NO: 92 и 87, SEQ ID NO: 86 и 93, SEQ ID NO: 94 и 87 или SEQ ID NO: 90 и 91.
10. Слитый белок по п. 1, отличающийся тем, что указанный слитый белок содержит аминокислотные последовательности, представленные в SEQ ID NO: 90 и 87, аминокислотные последовательности, представленные в SEQ ID NO: 86 и 91, аминокислотные последовательности, представленные в SEQ ID NO: 92 и 87, аминокислотные последовательности, представленные в SEQ ID NO: 86 и 93, аминокислотные последовательности, представленные в SEQ ID NO: 94 и 87, или аминокислотные последовательности, представленные в SEQ ID NO: 90 и 91.
11. Молекула нуклеиновой кислоты, кодирующая слитый белок по любому из пп. 1-10.
12. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 11, в котором указанная молекула нуклеиновой кислоты функционально связана с регуляторной последовательностью для обеспечения возможности экспрессии указанной молекулы нуклеиновой кислоты.
13. Вектор по п. 12, где указанный вектор представляет собой фагмидный вектор.
14. Клетка-хозяин для продуцирования слитого белка по любому из пп. 1-10, содержащая молекулу нуклеиновой кислоты по п. 11, функционально связанную с регуляторной последовательностью для обеспечения возможности экспрессии указанной молекулы нуклеиновой кислоты.
15. Способ получения слитого белка по любому из пп. 1-10, включающий культивирование клетки-хозяина по п. 14 в условиях, обеспечивающих продуцирование слитого белка.
16. Способ по п. 15, согласно которому слитый белок выделяют из этой клетки-хозяина или его культуры.
17. Фармацевтическая композиция для специфического связывания одновременно как с CD137, так и PD-L1, содержащая эффективное количество слитого белка по любому из пп. 1-10.
18. Применение слитого белка по любому из пп. 1-10 для лечения PD-L1-положительного рака.
19. Применение слитого белка по любому из пп. 1-10 для производства лекарственного средства для лечения PD-L1-положительного рака.
20. Способ лечения PD-L1-положительного рака, включающий введение субъекту, нуждающемуся в этом, эффективного количества слитого белка по любому из пп. 1-10.
21. Применение по п. 18, где указанное лечение ассоциировано с одним или более из следующего:
(i) одновременной активацией нисходящих сигнальных путей CD137 и связывания PD-L1-положительных опухолевых клеток;
(ii) одновременной костимуляцией T-клеток и связывания PD-L1-положительных опухолевых клеток;
(iii) одновременной индукцией активности лимфоцитов и связывания PD-L1-положительных опухолевых клеток;
(iv) индукцией кластеризации и активации CD137 на T-клетках и направления указанных T-клеток на PD-L1-положительные опухолевые клетки;
(v) индукцией локализованного ответа лимфоцитов вблизи PD-L1-положительных опухолевых клеток;
(vi) индукцией повышенной секреции IL-2 и/или цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток, где цитотоксические факторы выбраны из группы, состоящей из перфорина, гранзима B и гранзима A; или
(vii) индукцией повышенной секреции цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток.
22. Применение по п. 19, где указанное лечение ассоциировано с одним или более из следующего:
(i) одновременной активацией нисходящих сигнальных путей CD137 и связывания PD-L1-положительных опухолевых клеток;
(ii) одновременной костимуляцией T-клеток и связывания PD-L1-положительных опухолевых клеток;
(iii) одновременной индукцией активности лимфоцитов и связывания PD-L1-положительных опухолевых клеток;
(iv) индукцией кластеризации и активации CD137 на T-клетках и направления указанных T-клеток на PD-L1-положительные опухолевые клетки;
(v) индукцией локализованного ответа лимфоцитов вблизи PD-L1-положительных опухолевых клеток;
(vi) индукцией повышенной секреции IL-2 и/или цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток, где цитотоксические факторы выбраны из группы, состоящей из перфорина, гранзима B и гранзима A; или
(vii) индукцией повышенной секреции цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток.
23. Способ по п. 20, где указанное лечение ассоциировано с одним или более из следующего:
(i) одновременной активацией нисходящих сигнальных путей CD137 и связывания PD-L1-положительных опухолевых клеток;
(ii) одновременной костимуляцией T-клеток и связывания PD-L1-положительных опухолевых клеток;
(iii) одновременной индукцией активности лимфоцитов и связывания PD-L1-положительных опухолевых клеток;
(iv) индукцией кластеризации и активации CD137 на T-клетках и направления указанных T-клеток на PD-L1-положительные опухолевые клетки;
(v) индукцией локализованного ответа лимфоцитов вблизи PD-L1-положительных опухолевых клеток;
(vi) индукцией повышенной секреции IL-2 и/или цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток, где цитотоксические факторы выбраны из группы, состоящей из перфорина, гранзима B и гранзима A; или
(vii) индукцией повышенной секреции цитотоксических факторов T-клетками вблизи PD-L1-положительных опухолевых клеток.
| WO 2017123650 A2, 20.07.2017 | |||
| WO 2017215590 A1, 21.12.2017 | |||
| HINNER M | |||
| J | |||
| et al | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-05-02—Публикация
2019-07-31—Подача