Перекрестные ссылки на родственные заявки
Данная заявка испрашивает приоритет по предварительной заявке на патент США № 62/437,588, поданной 21 декабря 2016 г., описание которой включено в данный документ в полном объеме посредством ссылки.
Перечень последовательностей
Рассматриваемая заявка содержит перечень последовательностей, поданный в электронном виде в формате ASCII и включенный в данный документ в полном объеме посредством ссылки. Указанная копия в формате ASCII, созданная 17 января 2018 г., называется TNO-0002-WO_SL.txt и имеет размер 46 768 байт.
Область техники
Настоящее изобретение относится к анти-BCMA антителам, содержащим только тяжелую цепь (HCAb). Настоящее изобретение также относится к способам получения таких антител, композициям, включая фармацевтические композиции, содержащие такие антитела, и их применению для лечения В-клеточного расстройства, характеризующегося экспрессией ВСМА.
Уровень техники
Антиген созревания В-клеток (ВСМА)
BCMA, также известный как член 17 суперсемейства рецепторов фактора некроза опухоли (TNFRSF17) (UniProt Q02223), представляет собой рецептор клеточной поверхности, экспрессирующийся исключительно на плазматических клетках и плазмобластах. BCMA представляет собой рецептор двух лигандов в суперсемействе факторов некроза опухолей (TNF): APRIL (лиганд, индуцирующий пролиферацию, также известный как TNFSF13; TALL-2 и TRDL-1; лиганд с высокой аффинностью к BCMA) и фактор активации B-клеток (BAFF) (также известный как BLyS; TALL-1; THANK; zTNF4; TNFSF20 и D8Ertd387e; лиганд с низкой аффинностью к ВСМА). APRIL и BAFF являются факторами роста, которые связывают BCMA и способствуют выживанию плазмоцитов. ВСМА также высоко экспрессируется на злокачественных плазмоцитах при множественной миеломе человека (ММ). Антитела, связывающиеся с ВСМА, описаны, например, в Gras et al., 1995, Int. Immunol. 7:1093-1106, WO200124811 и WO200124812. Анти-BCMA антитела, которые вступают в перекрестную реакцию с TACI, описаны в WO 2002/066516. Биспецифичные анти-BCMA и анти-CD3 антитела описаны, например, в патенте США 2013/0156769 A1 и в патенте США 2015/0376287 A1. Сообщалось, что конъюгат анти-BCMA антитела -MMAE или -MMAF избирательно индуцирует уничтожение клеток множественной миеломы (Tai et al., Blood 2014, 123(20): 3128-38). Ali et al., Blood 2016, 128(13):1688-700 сообщили, что в клиническом исследовании (# NCT02215967) Т-клетки химерного антигенного рецептора (CAR), нацеленные на BCMA, приводили к ремиссии множественной миеломы у пациентов-людей.
Антитела, содержащие только тяжелую цепь
В обычном антителе IgG, ассоциация тяжелой цепи и легкой цепи частично обусловлена гидрофобным взаимодействием между константной областью легкой цепи и константным доменом CH1 тяжелой цепи. В областях тяжелой цепи каркаса 2 (FR2) и каркаса 4 (FR4) имеются дополнительные остатки, которые также способствуют этому гидрофобному взаимодействию между тяжелой и легкой цепями.
Известно, однако, что сыворотка верблюдовых (подгруппа Tylopoda, которая включает верблюдов, дромадеров и лам) содержит основной тип антител, состоящих исключительно из парных H-цепей (антитела, содержащие только тяжелую цепь или HCAb). HCAb Camelidae (Camelus dromedarius, Camelus bactrianus, Lama glama, Lama guanaco, Lama alpaca и Lama vicugna) имеют уникальную структуру, состоящую из одного вариабельного домена (VHH), шарнирной области и двух константных доменов (CH2 и CH3), которые высокогомологичны доменам СН2 и СН3 классических антител. Данные HCAb не имеют первого домена константной области (CH1), который присутствует в геноме, но удаляется во время процессинга мРНК. Отсутствие домена CH1 объясняет отсутствие легкой цепи в HCAb, поскольку этот домен является местом закрепления константного домена легкой цепи. Такие HCAb естественным образом эволюционировали для придания антигенсвязывающей специфичности и высокой аффинности тремя CDR из обычных антител или их фрагментов (Muyldermans, 2001; J Biotechnol 74:277–302; Revets et al., 2005; Expert Opin Biol Ther 5:111–124). Хрящевые рыбы, такие как акулы, также выработали особый тип иммуноглобулина, обозначенный как IgNAR, который лишен легких полипептидных цепей и полностью состоит из тяжелых цепей. Молекулами IgNAR можно манипулировать с помощью молекулярной инженерии с получением вариабельного домена одного полипептида с тяжелой цепью (vNARs) (Nuttall et al. Eur. J. Biochem. 270, 3543-3554 (2003); Nuttall et al. Function and Bioinformatics 55, 187-197 (2004); Dooley et al., Molecular Immunology 40, 25-33 (2003)).
Способность антител, содержащих только тяжелую цепь, лишенных легкой цепи, связывать антиген была установлена в 1960-х годах (Jaton et al. (1968) Biochemistry, 7, 4185-4195). Тяжелая цепь иммуноглобулина, физически отделенная от легкой цепи, сохранила 80% антигенсвязывающей активности относительно тетрамерного антитела. Sitia et al. (1990) Cell, 60, 781-790 продемонстрировали, что удаление домена CH1 из перегруппированного гена µ мыши приводит к получению антитела, содержащего только тяжелую цепь, лишенного легкой цепи, в клеточной культуре млекопитающих. Вырабатываемые антитела сохраняли специфичность связывания VH и эффекторные функции.
Антитела с тяжелой цепью с высокой специфичностью и аффинностью могут генерироваться против различных антигенов посредством иммунизации (van der Linden, R. H., et al. Biochim. Biophys. Acta. 1431, 37-46 (1999)) и часть VHH может быть легко клонирована и экспрессирована в дрожжевых грибах (Frenken, L. G. J., et al. J. Biotechnol. 78, 11-21 (2000)). Их уровни экспрессии, растворимости и стабильности значительно выше, чем у классических фрагментов F(ab) или Fv (Ghahroudi, M. A. et al. FEBS Lett. 414, 521-526 (1997)).
Мыши, у которых λ (лямбда) локус легкой (L)-цепи и/или λ и κ (каппа) локусы L-цепи были функционально подавлены и антитела, продуцируемые такими мышами, описаны в патентах США № 7,541,513 и 8,367,888. Рекомбинантное продуцирование антител, содержащих только тяжелую цепь, у мышей и крыс было описано, например, в WO 2006008548; публикации заявки на патент США № 20100122358; Nguyen et al., 2003, Immunology; 109(1), 93-101; Brüggemann et al., Crit. Rev. Immunol.; 2006, 26(5):377-90; and Zou et al., 2007, J Exp Med; 204(13): 3271–3283. Получение нокаутных крыс с помощью микроинъекций эмбрионам цинк-пальцевой нуклеазы описано в Geurts et al., 2009, Science, 325(5939):433. Растворимые антитела, содержащие только тяжелую цепь, и трансгенные грызуны, содержащие гетерологичный локус тяжелой цепи, продуцирующий такие антитела, описаны в патентах США № 8,883,150 и 9,365,655. Структуры CAR-T, содержащие однодоменные антитела в качестве связывающего (нацеливающего) домена, описаны, например, в Iri-Sofla et al., 2011, Experimental Cell Research 317:2630-2641 и Jamnani et al., 2014, Biochim Biophys Acta, 1840:378-386.
Сущность изобретения
Настоящее изобретение относится к анти-BCMA антителам.
В одном аспекте изобретение относится к связыванию антитела, содержащего только тяжелые цепи, с антигеном созревания В-клеток человека (ВСМА), содержащего вариабельную область тяжелой цепи, содержащую:
(a) CDR1, имеющую по меньшей мере 95% идентичность последовательности с любой из последовательностей SEQ ID NO: от 1 до 4; и/или
(b) CDR2, имеющую по меньшей мере 95% идентичность последовательности с любой из последовательностей SEQ ID NO: от 5 до 18 и 54; и/или
(c) CDR3, имеющую по меньшей мере 95% идентичность последовательности с SEQ ID NO: 19.
В одном варианте осуществления последовательности CDR1, CDR2 и CDR3 присутствуют в каркасе человека.
В другом варианте осуществления анти-ВСМА антитело, содержащее только тяжелую цепь, дополнительно содержит последовательность константной области тяжелой цепи в отсутствие последовательности СН1.
В еще одном варианте осуществления антитело, содержащее только тяжелую цепь, содержит:
(a) последовательность, выбранную из группы, состоящей из SEQ ID NO: от 1 до 4; и/или
(b) последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: от 5 до 18 и 54; и/или
(c) CDR3 SEQ ID NO: 19.
В дополнительном варианте осуществления анти-BCMA антитело, содержащее только тяжелую цепь, содержит:
(a) последовательность CDR1, выбранную из группы, состоящей из SEQ ID NO: от 1 до 4; и
(b) последовательность CDR2, выбранную из группы, состоящей из SEQ ID NO: от 5 до 18 и 54; и
(c) CDR3 SEQ ID NO: 19.
В еще одном варианте осуществления анти-BCMA антитело, содержащее только тяжелую цепь, содержит вариабельную область тяжелой цепи, имеющую по меньшей мере 95% идентичность последовательности с любой из последовательностей SEQ ID NO: от 20 до 53.
В другом варианте осуществления анти-BCMA антитело, содержащее только тяжелую цепь, содержит последовательность вариабельной области тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: от 20 до 53.
В другом аспекте изобретение относится к связыванию антитела, содержащего только тяжелые цепи, с антигеном созревания В-клеток человека (ВСМА), содержащего вариабельную область тяжелой цепи, содержащую вариабельный домен тяжелой цепи, содержащий
(а) последовательность CDR1 формулы:
G F T F X1 X2 Y A (SEQ ID NO: 55),
где
X1 представляет собой S или T; и
X2 представляет собой S, N или R; и
(b) последовательность CDR2 формулы:
X3 X4 X5 X6 G X7 X8 X9 (SEQ ID NO: 56),
где
X3 представляет собой I или L;
X4 представляет собой S, T, I или V;
X5 представляет собой G или E;
X6 представляет собой S, G, N или D;
X7 представляет собой G, D или A;
X8 представляет собой S, T или N;
X9 представляет собой T или S, и
(c) последовательность CDR3 SEQ ID NO: 19
в каркасе VH человека.
В дополнительном аспекте изобретение относится к связыванию антитела, содержащего только тяжелые цепи, с антигеном созревания В-клеток человека (ВСМА), содержащим вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 в каркасе VH человека, причем последовательности CDR представляют собой последовательность с по меньшей мере 95% идентичностью последовательности CDR, выбранной из группы, состоящей из SEQ ID NO: 1-19 и 54.
В одном варианте осуществления такое антитело содержит вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 в каркасе VH человека, причем последовательности CDR выбраны из группы, состоящей из SEQ ID NO: 1-19 и 54.
В дополнительном аспекте изобретение относится к связыванию антитела, содержащего только тяжелые цепи, с антигеном созревания В-клеток человека (ВСМА), содержащим вариабельную область тяжелой цепи, содержащую:
(a) CDR1 SEQ ID NO: 1, CDR2 SEQ ID NO: 5; и CDR3 SEQ ID NO: 19; или
(b) CDR1 SEQ ID NO: 2, CDR2 SEQ ID NO: 54; и CDR3 SEQ ID NO: 19
в каркасе VH человека.
В одном варианте осуществления антитело, содержащее только тяжелую цепь, является мультиспецифичным, например, биспецифичным.
В другом варианте осуществления антитело, содержащее только тяжелую цепь, имеет аффинность связывания с двумя различными белками ВСМА.
В еще одном варианте осуществления антитело, содержащее только тяжелую цепь, имеет аффинность связывания с двумя разными эпитопами на одном и том же белке ВСМА.
В дополнительном варианте осуществления антитело, содержащее только тяжелую цепь, имеет аффинность связывания с эффекторной клеткой.
В еще одном варианте осуществления антитело, содержащее только тяжелую цепь, имеет аффинность связывания с Т-клеточным антигеном.
В другом варианте осуществления антитело, содержащее только тяжелую цепь, имеет аффинность связывания с CD3.
В другом аспекте описанное выше антитело, содержащее только тяжелую цепь, имеет формат CAR-T.
В дополнительном аспекте изобретение относится к фармацевтической композиции, содержащей анти-ВСМА антитело, содержащее только тяжелую цепь, по данному изобретению.
В еще одном дополнительном аспекте, изобретение относится к способу лечения В-клеточного расстройства, характеризующегося экспрессией ВСМА, включающему введение субъекту с таким расстройством анти-ВСМА антитела, содержащего только тяжелые цепи по данному изобретению, или фармацевтической композиции, содержащей такое антитело.
В различных вариантах осуществления B-клеточное расстройство может представлять собой, например, множественную миелому или системную красную волчанку.
В дополнительном аспекте изобретение относится к полинуклеотиду, кодирующему анти-ВСМА антитело, содержащее только тяжелую цепь.
В еще одном дополнительном аспекте изобретение относится к вектору, содержащему полинуклеотид, кодирующий анти-ВСМА антитело, содержащее только тяжелую цепь.
В другом аспекте изобретение относится к клетке, содержащей полинуклеотид, кодирующий анти-ВСМА антитело, содержащее только тяжелую цепь, или к вектору, содержащему такой полинуклеотид.
В еще одном аспекте, изобретение относится к способу получения антитела по данному документу, включающему выращивание клетки, как описано выше в условиях, допускающих экспрессию антитела и выделение антитела из клеток.
В дополнительном аспекте изобретение относится к способу получения анти-ВСМА антитела, содержащего только тяжелые цепи, как описано в данном документе, включающему иммунизацию животного UniRat с помощью ВСМА и идентификацию ВСМА-связывающих последовательностей тяжелых цепей.
Данные и другие аспекты будут дополнительно объяснены в остальной части раскрытия, включая примеры.
Краткое описание графических материалов
На фиг. 1 проиллюстрированы аминокислотные последовательности CDR1, CDR2 и CDR3 34 анти-ВСМА антител, содержащих только тяжелую цепь по данному изобретению.
На фиг. 2 проиллюстрированы последовательности вариабельной области тяжелой цепи 34 анти-ВСМА антител, содержащих только тяжелую цепь по данному изобретению.
На фиг. 3. Краткая карта интенсивности активности связывания 34 анти-ВСМА антител, содержащих только тяжелую цепь, экспрессированных в клетках НЕК 293. Красный указывает на сильное связывание, в то время как синий указывает на слабые или отрицательные результаты связывания. Анализы связывания клеток проводили на всех 34 антителах, и было показано связывание ими клеток H929. Два антитела, кодирующие либо последовательность VH 308607, либо последовательность VH 308915, были протестированы на связывание с немеченным ECD-фрагментом BCMA человека и двумя нецелевыми белковыми контролями, включая IgG1 человека и экстракт белка бакуловируса (BVP), и клеточную линию BCMA + MM RPMI8226. Два UniAb также оценивали на способность блокировать связывание APRIL (лиганд)/BCMA (рецептор) в анализе ELISA с рекомбинантным белком.
На фиг. 4. Активность связывания сыворотки с иммуногеном и другими целевыми и нецелевыми белками. Одно разведение 1:500 сыворотки d35 от подгруппы животных анализировали на активность связывания с серией белков в стандартном анализе ELISA. Целевые белки включают область Fc BCMA человека (huBCMA-Fc), ECD BCMA cyno, слитый с последовательностью Fc человека (cyBCMA), и huBCMA из двух других источников, которые не имеют слияния Fc (E. coli и зародыш пшеницы). Сывороточный альбумин человека и IgG1 человека использовали для оценки нецелевой реактивности.
На фиг. 5. Активность связывания сыворотки с линиями клеток BCMA+ (NCI-H929). Титры оценивали путем тестирования связывания сыворотки с клетками NCI-H929 методом проточной цитометрии с использованием PE-конъюгированного анти-IgG2a антитела крысы. Оценивали процент клеток NCI-H929, демонстрирующих значительное окрашивание.
На фиг. 6. Типичные конструкции CAR-T, содержащие внеклеточный связывающий домен VH человека.
Детальное описание предпочтительных вариантов осуществления
При практической реализации настоящего изобретения применяют, если не указано иное, традиционные способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области техники. Такие способы подробно описаны в литературе, например, “Molecular Cloning: A Laboratory Manual”, second edition (Sambrook et al., 1989); “Oligonucleotide Synthesis” (M. J. Gait, ed., 1984); “Animal Cell Culture” (R. I. Freshney, ed., 1987); “Methods in Enzymology” (Academic Press, Inc.); “Current Protocols in Molecular Biology” (F. M. Ausubel et al., eds., 1987, and periodic updates); “PCR: The Polymerase Chain Reaction”, (Mullis et al., ed., 1994); “A Practical Guide to Molecular Cloning” (Perbal Bernard V., 1988); “Phage Display: A Laboratory Manual” (Barbas et al., 2001); Harlow, Lane and Harlow, Using Antibodies: A Laboratory Manual: Portable Protocol No. I, Cold Spring Harbor Laboratory (1998); и Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory; (1988).
Когда приводится диапазон значений, следует понимать, что данное изобретение охватывает каждое промежуточное значение с точностью до десятого знака нижнего предела, если в контексте явно не указано иное, между верхним и нижним пределом этого диапазона, а также любое другое указанное или промежуточное значение в таком указанном диапазоне. Верхний и нижний пределы данных меньших диапазонов могут быть независимо включены в меньшие диапазоны и также включены в данное изобретение с учетом любого специальным образом исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба предела, диапазоны, исключающие один или оба этих включенных предела, также включены в данное изобретение.
Если не указано иное, остатки антител в данном документе нумеруются в соответствии с номенклатурой Кэбота (e.g., Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)).
Для обеспечения полного понимания настоящего изобретения в нижеследующем подробном описании изложены многочисленные конкретные детали. Однако для специалиста в данной области техники будет очевидно, что настоящее изобретение может применяться на практике и без одной или более указанных конкретных деталей. В других случаях общеизвестные отличительные признаки и процедуры, хорошо известные специалистам в данной области техники, не были описаны во избежание затруднения понимания изобретения.
Все приведенные в настоящем документе ссылки, включая патентные заявки и публикации, включены в данный документ посредством ссылки в полном объеме.
I. Определения
Под термином «содержащий» подразумевается, что перечисленные элементы требуются для композиции/способа/набора, однако для формирования композиции/способа/набора и т.д. в рамках формулы изобретения могут быть включены и другие элементы.
Под термином «состоящий по существу из» подразумевается ограничение рамок описанной композиции или способа указанными материалами или поэтапными действиями, не оказывающими существенного влияния на основную и новую характеристику (-и) объекта изобретения.
Под термином «состоящий из» подразумевается исключение любого элемента, поэтапного действия или ингредиента, не указанного в формуле изобретения, из композиции, способа или набора.
Термин «моноклональное антитело» в данном документе относится к антителу, полученному из популяции в значительной степени однородных антител, то есть отдельные антитела в составе популяции являются идентичными, за исключением мутаций, происходящих по естественным причинам, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного сайта. Кроме того, в отличие от препаратов обычных (поликлональных) антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одиночной детерминанты на антигене.
Термины «антитело, содержащее только тяжелую цепь», «антитело с тяжелой цепью» и «HCAb» используются взаимозаменяемо и относятся в самом широком смысле к антителам, в которых отсутствует легкая цепь обычного антитела. Поскольку гомодимерные HCAb лишены легкой цепи и, следовательно, домена VL, антиген распознается одним единственным доменом, то есть вариабельным доменом тяжелой цепи антитела, содержащего тяжелую цепь (VH). Термин, в частности, включает, без ограничения, гомодимерные антитела, содержащие антигенсвязывающий домен VH и константные домены CH2 и CH3, в отсутствие домена CH1; функциональные (антигенсвязывающие) варианты таких антител, растворимые варианты VH, Ig-NAR, содержащие гомодимер одного вариабельного домена (V-NAR) и пяти C-подобных константных доменов (C-NAR), и их функциональные фрагменты; и растворимые однодоменные антитела (sdAbs). В одном варианте осуществления антитело, содержащее только тяжелую цепь, состоит из антигенсвязывающего домена вариабельной области, состоящего из каркаса 1, CDR1, каркаса 2, CDR2, каркаса 3, CDR3 и каркаса 4. В одном варианте осуществления антитело, содержащее только тяжелую цепь, состоит из антигенсвязывающего домена по меньшей мере части шарнирной области и доменов CH2, и CH3. В другом варианте осуществления антитело, содержащее только тяжелую цепь, состоит из антигенсвязывающего домена по меньшей мере части шарнирной области и домена CH2. В дополнительном варианте осуществления антитело, содержащее только тяжелую цепь, состоит из антигенсвязывающего домена, по меньшей мере части шарнирной области и домена CH3. Антитела, содержащие только тяжелую цепь, у которых домен СН2 и/или СН3 укорочен, также включены в данный документ. В дополнительном варианте осуществления тяжелая цепь состоит из антигенсвязывающего домена и по меньшей мере одного домена СН (СН1, СН2, СН3 или СН4), но без шарнирной области. Антитело, содержащее только тяжелую цепь, может быть в форме димера, в котором две тяжелые цепи дисульфидно связаны друг с другом, ковалентно или нековалентно связаны друг с другом. Антитело, содержащее только тяжелую цепь, может принадлежать к подклассу IgG, но также в данном документе включены антитела, относящиеся к другим подклассам, таким как подкласс IgM, IgA, IgD и IgE. В конкретном варианте осуществления антитело, содержащее тяжелую цепь, имеет подтип IgG1, IgG2, IgG3 или IgG4, в частности подтип IgG1. В одном варианте осуществления антитела, содержащие только тяжелую цепь, в данном документе используются в качестве связывающего (нацеливающего) домена химерного антигенного рецептора (CAR).
Термин «вариабельный», в контексте данного документа, в связи с антителами относится к тому факту, что последовательности некоторых частей вариабельных доменов антитела сильно различаются у разных антител и вносят вклад в связывание и специфичность каждого конкретного антитела по отношению к его конкретному антигену. В то же время вариабельность не является равномерно распределенной по вариабельным доменам антител. Она сосредоточена в трех сегментах вариабельных доменов как легкой, так и тяжелой цепи, называемых гипервариабельными областями. Более консервативные фрагменты вариабельных доменов называются каркасными областями (FR). Вариабельные домены нативных легких и тяжелых цепей содержат по четыре FR, преимущественно принимающих конфигурацию β-листа и соединенных тремя гипервариабельными областями, образующими петли, соединяющие структуры β-типа, а в некоторых случаях, являющиеся их частью. Гипервариабельные области каждой цепи удерживаются вместе в непосредственной близости FR и, вместе с гипервариабельными областями другой цепи, участвуют в образовании антиген-связывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, однако проявляют различные эффекторные функции, например, участие антитела в антителозависимой клеточно-опосредованной цитотоксичности АЗКЦ (ADCC).
Термин «гипервариабельная область» при применении в данном документе, относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область обычно содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR» (например, остатки 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или остатки из остатков «гипервариабельной петли» 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia и Lesk J. Mol. Biol. 196:901-917 (1987)). «Каркасная область» или остатки «FR», как определено в данном документе, представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области.
Примерные обозначения CDR показаны в данном документе, однако специалист в данной области техники поймет, что обычно используется ряд определений CDR, включая определение Кэбота (см. «Zhao et al. A germline knowledge based computational approach for determining antibody complementarity determining regions.” Mol Immunol. 2010;47:694–700), которое основано на изменчивости последовательности и является наиболее часто используемым. Определение Чотиа основано на расположении областей замкнутой структуры (Chothia et al. “Conformations of immunoglobulin hypervariable regions.” Nature. 1989; 342:877–883). Интересующие альтернативные определения CDR включают, без ограничения, те, которые раскрыты Honegger, “Yet another numbering scheme for immunoglobulin variable domains: an automatic modeling and analysis tool.” J Mol Biol. 2001;309:657–670; Ofran et al. “Automated identification of complementarity determining regions (CDRs) reveals peculiar characteristics of CDRs and B cell epitopes.” J Immunol. 2008;181:6230–6235; Almagro “Identification of differences in the specificity-determining residues of antibodies that recognize antigens of different size: implications for the rational design of antibody repertoires.” J Mol Recognit. 2004;17:132–143; и Padlanet al. “Identification of specificity-determining residues in antibodies.” Faseb J. 1995;9:133–139., содержание каждого из которых включено в данный документ в полном объеме посредством ссылки.
«Выделенное» антитело представляет собой антитело, которое было идентифицировано и отделено и/или извлечено из компонента его естественной среды. Загрязняющий компонент естественного окружения представляет собой вещества, которые влияют на диагностическое или терапевтическое применение антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело будет очищено (1) до более 95% по массе антитела, как определено методом Лоури, и наиболее предпочтительно более 99% по массе, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, используя секвенатор с вращающимся стаканом, или (3) до гомогенности (SDS-PAGE) в восстанавливающих или невосстанавливающих условиях с использованием красителя Кумасси синего или, предпочтительнее, красителя на основе серебра. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент естественной среды антитела будет отсутствовать. Обычно, однако, выделенное антитело будет получено с помощью по меньшей мере одного этапа очистки.
Антитела по настоящему изобретению включают мультиспецифичные антитела. Мультиспецифичные антитела имеют более чем одну специфичность связывания. Термин «мультиспецифичный», в частности, включает «биспецифичный» и «триспецифичный», а также аффинность независимого специфического связывания высшего порядка, такую как полиэпитопная специфичность высшего порядка, а также тетравалентные антитела и фрагменты антител. «Мультиспецифичные» антитела, в частности, включают антитела, содержащие комбинацию различных связывающих объектов, а также антитела, содержащие более чем один и тот же связывающий объект. Термины «мультиспецифичное антитело», «мультиспецифическое антитело, содержащее только одну цепь» и «мультиспецифическое HCAb» используются в данном документе в самом широком смысле и охватывают все антитела с более чем одной специфичностью связывания.
Термин «валентный», в контексте настоящего документа, относится к указанному количеству сайтов связывания в молекуле антитела.
«Поливалентное» антитело имеет два или более сайтов связывания. Таким образом, термины «двухвалентный», «трехвалентный» и «четырехвалентный» относятся к наличию двух сайтов связывания, трех сайтов связывания и четырех сайтов связывания, соответственно. Таким образом, биспецифичное антитело по изобретению является по меньшей мере двухвалентным и может быть трехвалентным, четырехвалентным или иным образом поливалентным.
Известно большое разнообразие способов и конфигураций белка и используется для получения биспецифичных моноклональных антител (BsMAB), триспецифичных антител и тому подобного.
Термин «биспецифичная трехцепочечная антителоподобная молекула» или «ТСА» используется в настоящем документе для обозначения антителоподобных молекул, включающих, состоящих по существу или состоящих из трех полипептидных субъединиц, две из которых содержат, состоят по существу из или состоят из одной тяжелой и одной легкой цепи моноклонального антитела, или функциональных антигенсвязывающих фрагментов таких цепей антитела, содержащие антигенсвязывающую область и по меньшей мере один СН-домен. Данная пара тяжелая цепь/легкая цепь обладает специфичностью связывания для первого антигена. Третья полипептидная субъединица содержит, состоит по существу или состоит из антитела, содержащего только тяжелые цепи, содержащего участок Fc, содержащий домены СН2 и/или СН3, и/или СН4, в отсутствие домена СН1, и антигенсвязывающий домен, который связывает эпитоп второго антигена или другой эпитоп первого антигена, причем такой связывающий домен происходит из или имеет идентичность последовательности вариабельной области тяжелой или легкой цепи антитела. Части такой вариабельной области могут кодироваться сегментами гена VH и/или VL, сегментами гена D и JH, или сегментами гена JL. Вариабельная область может кодироваться реаранжированными генными сегментами VHDJH, VLDJH, VHJL или VLJL. Белок TCA использует антитело, содержащее только тяжелую цепь, как определено выше.
Термин «химерный антигенный рецептор» или «CAR» используется в данном описании в самом широком смысле для обозначения сконструированного рецептора, который прививает желаемую специфичность связывания (например, антигенсвязывающую область моноклонального антитела или другого лиганда) к охватывающему мембрану и внутриклеточному сигнальному доменам. Как правило, рецептор используется для прививки специфичности моноклонального антитела на Т-клетку для создания химерного антигенного рецептора (CAR). (J Natl Cancer Inst, 2015; 108(7):dvj439; and Jackson et al., Nature Reviews Clinical Oncology, 2016; 13:370–383.) Типичная конструкция CAR-T, содержащая внеклеточный связывающий домен VH человека продемонстрирована на фиг. 6.
Под «идиотип человека» подразумевается эпитоп полипептидной последовательности, присутствующий на антителе человека в вариабельной области тяжелой и/или легкой цепи иммуноглобулина. Используемый в данном документе термин «идиотип человека» включает как встречающиеся в природе последовательности антитела человека, так и синтетические последовательности, по существу идентичные полипептиду, обнаруженному в встречающихся в природе человеческих антителах. «По существу» означает, что степень идентичности аминокислотной последовательности составляет по меньшей мере около 85-95%. Предпочтительно, степень идентичности аминокислотной последовательности составляет более 90%, более предпочтительно, более 95%.
Под «химерным антителом» или «химерным иммуноглобулином» подразумевается молекула иммуноглобулина, содержащая аминокислотные последовательности по меньшей мере из двух разных локусов Ig, например, трансгенное антитело, содержащее часть, кодируемую локусом Ig человека, и часть, кодируемую локусом Ig крысы. Химерные антитела включают трансгенные антитела с нечеловеческими Fc-областями или искусственными Fc-областями, и человеческие идиотипы. Такие иммуноглобулины могут быть выделены из животных по изобретению, которые были сконструированы для получения таких химерных антител.
«Эффекторные функции» антитела относятся к той биологической активности, которая относится к области Fc (области Fc нативной последовательности или области Fc варианта аминокислотной последовательности) антитела. Примеры эффекторных функций антитела включают связывание C1q; комплемент-зависимую цитотоксичность; связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность АЗКЦ (ADCC); фагоцитоз; подавление рецепторов поверхности клетки. (например, B-клеточный рецептор, BCR) и т.д.
«Антителозависимая клеточно-опосредованная цитотоксичность» и АЗКЦ (ADCC) соответствуют опосредованной клетками реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, клетки Natural Killer (NK), нейтрофилы и макрофаги), распознают связанное антитело на целевой клетке и, таким образом, приводят к лизису клетки-мишени. Первичные клетки, опосредующие АЗКЦ (ADCC), естественные клетки-киллеры, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Сводная информация об экспрессии FcR на кроветворных клетках приведена в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности АЗКЦ (ADCC) интересующей молекулы может быть проведен анализ АЗКЦ (ADCC) in vitro, описанный в патенте США № 5500362 или 5821337. Эффекторные клетки, пригодные для такого анализа, включают мононуклеарные клетки периферической крови МКПК (PBMC) и естественные клетки-киллеры (NK). В качестве альтернативы или дополнения, АЗКЦ (ADCC)-активность молекулы, представляющей интерес, можно оценить in vivo, например, на животной модели, например, согласно описанию в публикации Clynes et al. PNAS (USA) 95:652-656 (1998).
«Эффекторные клетки человека» представляют собой лейкоциты, которые экспрессируют один или более FcR и осуществляют эффекторные функции. Предпочтительно, такие клетки экспрессируют по меньшей мере FcγRIII и осуществляют эффекторную функцию АЗКЦ (ADCC). Примеры лейкоцитов человека, которые опосредуют АЗКЦ (ADCC), включают мононуклеарные клетки периферической крови МКПК (PBMC), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы; причем МКПК (РВМС) и NK-клетки являются предпочтительными. Эффекторные клетки могут быть выделены из нативного источника, например, из крови или РВМС, как описано в данном документе.
«Комплементзависимая цитотоксичность» или «CDC» относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с распознаваемым антигеном. Для оценки активации комплемента может быть выполнен анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
«Аффинность связывания» относится к силе суммарного количества нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и ее связывающим партнером (например, антигеном). Если не указано иное, как используется в данном документе, «аффинность связывания» относится к аффинности собственного связывания, которая отражает взаимодействие 1: 1 между членами пары связывания (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом можно выразить константой диссоциации (Kd). Аффинность может быть измерена обычными методами, известными в данной области техники. Низкоаффинные антитела обычно связывают антиген медленно и склонны легко диссоциировать, тогда как высокоаффинные антитела обычно связывают антиген быстрее и имеют тенденцию оставаться связанными.
Используемый в данном документе термин «Kd» или «значение Kd» относится к константе диссоциации, определенной методом интерферометрии BioLayer, с использованием прибора Octet QK384 (Fortebio Inc., Menlo Park, CA) в режиме кинетики. Например, анти-мышиные Fc-датчики загружают со слитым Fc-антигеном мыши и затем погружают в лунки, содержащие антитела, для измерения зависимых от концентрации скоростей (kon). Скорости диссоциации антител (koff) измеряются на последнем этапе, когда датчики погружают в лунки, содержащие только буфер. Kd представляет собой соотношение koff/kon. (Подробнее см. Concepcion, J, et al., Comb Chem High Throughput Screen, 12(8), 791-800, 2009).
«Эпитоп» представляет собой участок на поверхности молекулы антигена, с которым связывается одна молекула антитела. Обычно антиген имеет несколько или много разных эпитопов и вступает в реакцию со многими различными антителами. Термин, в частности, включает линейные эпитопы и конформационные эпитопы.
«Картирование эпитопов» представляет собой процесс идентификации сайтов связывания или эпитопов антител на их мишенях- антигенах. Эпитопы антител могут быть линейными или конформационными эпитопами. Линейные эпитопы образованы непрерывной последовательностью аминокислот в белке. Конформационные эпитопы образуются из аминокислот, которые являются прерывистыми в последовательности белка, но которые объединяются при сворачивании белка в его трехмерную структуру.
Термин «полиэпитопная специфичность» относится к способности специфически связываться с двумя или более различными эпитопами на одной или разных мишенях.
Антитело связывает «по существу тот же эпитоп», что и эталонное антитело, когда два антитела распознают идентичные или стерически перекрывающиеся эпитопы. Наиболее широко используемыми и быстрыми способами для определения того, связываются ли два эпитопа с идентичными или стерически перекрывающимися эпитопами, являются анализы конкурентного связывания, которые могут быть сконфигурированы во всем количестве различных форматов с использованием либо меченого антигена, либо меченого антитела. Обычно антиген иммобилизуют в 96-луночном планшете, и способность немеченых антител блокировать связывание меченых антител измеряют с использованием радиоактивных или ферментных меток.
Термины «лечение», «лечить» и тому подобное используются в данном документе для обозначения достижения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения заболевания или его симптомов и/или может быть терапевтическим с точки зрения частичного или полного излечения заболевания и/или неблагоприятного явления, связанного с этим заболеванием. В контексте данного документа термин «лечение» охватывает любое лечение заболевания у млекопитающего, и включает в себя: (а) предотвращение появления заболевания у субъекта, который может быть предрасположен к заболеванию, но у которого это заболевание еще не диагностировано; (b) ингибирование заболевания, т.е. прекращение его развития; или (c) облегчение заболевания, т.е. регрессию заболевания. Терапевтическое средство можно вводить до, во время или после начала заболевания или травмы. Лечение текущего заболевания, при котором лечение стабилизирует или уменьшает нежелательные клинические симптомы пациента, представляет особый интерес. Такое лечение желательно проводить до полной потери функции в пораженных тканях. Терапия субъекту может быть введена во время симптоматической стадии заболевания, и в некоторых случаях после симптоматической стадии заболевания.
Термин «терапевтически эффективное количество» означает количество активного агента, которое необходимо для придания терапевтического эффекта у субъекта. Например, «терапевтически эффективное количество» представляет собой количество, которое вызывает, ослабляет или иным образом вызывает улучшение патологических симптомов, прогрессирования заболевания или физиологических состояний, связанных с заболеванием, или которое повышает устойчивость к расстройству.
Термины «субъект», «индивидуум» и «пациент» используются в данном документе взаимозаменяемо для обозначения млекопитающего, которого оценивают на предмет лечения и/или которое подвергается лечению. В одном варианте осуществления млекопитающее является человеком. Термины «субъект», «индивидуум» и «пациент» охватывают, без ограничения, индивидуумов, имеющих рак, индивидуумов с аутоиммунными заболеваниями, патогенными инфекциями и тому подобное. Субъектами могут быть люди, но также могут быть и другие млекопитающие, в частности те млекопитающие, которые могут быть использованы в качестве лабораторных моделей заболеваний человека, например, мышь, крыса и т.д.
II. Подробное описание сущности изобретения
Анти-BCMA антитела
Настоящее изобретение относится к семейству тесно связанных антител, содержащих только тяжелую цепь, которые связываются с ВСМА человека. Антитела данного семейства содержат последовательности CDR, как определено в данном документе и показано на фиг. 1, и иллюстрируются приведенными последовательностями вариабельной области тяжелой цепи (VH) SEQ ID NO: 20-53, указанными на фиг. 2. Семейства антител обеспечивают ряд преимуществ, которые благоприятствуют применению их в качестве клинического(-их) терапевтического(-их) агента(-ов). Антитела включают членов с диапазоном аффинностей связывания, позволяющих выбирать конкретную последовательность с желаемой аффинностью связывания.
Подходящее антитело может быть выбрано из представленных в данном документе, для разработки и терапевтического или другого применения, включая, без ограничения, использование в качестве биспецифичного или триспецифичного антитела или части структуры CAR-T. Определение аффинности к белку-кандидату может быть выполнено с использованием способов, известных в данной области, таких как измерения Biacore. Члены семейства антител могут иметь аффинность к ВСМА с Kd от около 10-6 до около 10-11, в том числе без ограничения: от около 10-6 до около 10-10; от около 10-6 до около 10-9; от около 10-6 до около 10-8; от около 10-8 до около 10-11; от около 10-8 до около 10-10; от около 10-8 до около 10-9; от около 10-9 до около 10-11; от около 10-9 до около 10-10; или любое значение в этих диапазонах. Выбор аффинности может быть подтвержден биологической оценкой для модуляции, например, блокирование, биологическая активность BCMA, включая анализы in vitro, доклинические модели и клинические испытания, а также оценку потенциальной токсичности.
Члены данного семейства антител не являются перекрестно-реактивными с белком BCMA макака Cynomolgus, но могут быть сконструированы для обеспечения перекрестной реактивности, если это желательно.
Семейство специфических для BCMA антител в данном документе включает домен VH, содержащий последовательности CDR1, CDR2 и CDR3 в каркасе VH человека. Последовательности CDR могут быть расположены, например, в области около аминокислотных остатков 26-35; 53-59; и 98-117, для CDR1, CDR2 и CDR3 соответственно, предоставленных примерных последовательностей вариабельной области, приведенных в SEQ ID NO: 20-53. Специалисту в данной области техники должно быть понятно, что последовательности CDR могут находиться в другом положении, если выбрана другая каркасная последовательность, хотя, как правило, порядок последовательностей остается неизменным.
Антитела по данному изобретению имеют общую аминокислотную последовательность CDR3 SEQ ID NO: 19. Последовательности CDR1 и CDR2 анти-BCMA антител по данному изобретению могут охватываться следующими структурными формулами, где X обозначает вариабельную аминокислоту, которая может представлять собой специфические аминокислоты, как указано ниже.
CDR1
G F T F X1 X2 Y A (SEQ ID NO : 55),
где
X1 представляет собой S или T;
Х2 представляет собой S, N или R
CDR2
X3 X4 X5 X6 G X7 X8 X9 (SEQ ID NO : 56),
где
X3 представляет собой I или L;
X4 представляет собой S, T, I или V;
X5 представляет собой G или E;
X6 представляет собой S, G, N или D;
X7 представляет собой G, D или A;
X8 представляет собой S, T или N;
Х9 является Т или S.
Типичные последовательности CDR1, CDR2 и CDR3 показаны на фиг. 1.
В некоторых вариантах осуществления анти-BCMA антитело по изобретению содержит последовательность CDR1 SEQ ID NO: 1, 2, 3 или 4. В конкретном варианте осуществления последовательность CDR1 представляет собой SEQ ID NO: 1 или SEQ ID NO: 2.
В некоторых других вариантах осуществления анти-BCMA антитело по изобретению содержит последовательность CDR2 любой из SEQ ID NO: 5-18 и 54. В конкретном варианте осуществления последовательность CDR2 представляет собой SEQ ID NO: 5 или SEQ ID NO: 54.
В другом варианте осуществления анти-BCMA антитело по настоящему изобретению содержит последовательность CDR1 SEQ ID NO: 1, последовательность CDR2 SEQ ID NO: 5 и последовательность CDR3 SEQ ID NO: 19.
В дополнительном варианте осуществления анти-BCMA антитело по настоящему изобретению содержит последовательность CDR1 SEQ ID NO: 2, последовательность CDR2 SEQ ID NO: 54 и последовательность CDR3 SEQ ID NO: 19.
В других вариантах осуществления анти-BCMA антитело по настоящему изобретению содержит любую из аминокислотных последовательностей тяжелой цепи SEQ ID NO: от 20 до 53 (фиг. 2).
В некоторых вариантах осуществления последовательность CDR по изобретению содержит одну, две, три или более аминокислотных замен относительно последовательности CDR1, CDR2 и/или CDR3 или набора последовательностей CDR1, CDR2 и CDR3 в любой из SEQ ID NO: 1 - 19 и 54 (фиг. 1). В некоторых вариантах осуществления указанная аминокислотная замена(ы) представляет собой одно или более аминокислотных положений 5 и 6 CDR1 и/или одно или более аминокислотных положений 1-4 и 6-8 CDR2 относительно формул, предложенных выше. В некоторых вариантах осуществления последовательности CDR анти-BCMA антитела в данном документе имеют последовательность с по меньшей мере 85% идентичности, по меньшей мере 90% идентичности, по меньшей мере 95% идентичности, по меньшей мере 98% идентичности или по меньшей мере 99% идентичности относительно последовательности CDR1, CDR2 и/или CDR3 или набора последовательностей CDR1, CDR2 и CDR3 в любой из SEQ ID NO: от 1 до 19 и 54 (фиг. 1). В некоторых других вариантах осуществления анти-BCMA антитела, содержащие только одну цепь, будут содержать последовательность вариабельной области тяжелой цепи с по меньшей мере 85% идентичности, по меньшей мере 90% идентичности, по меньшей мере 95% идентичности, по меньшей мере 98% идентичности, или по меньшей мере 99% идентичности последовательностям вариабельной области тяжелой цепи, изображенным на фиг. 2.
В некоторых вариантах осуществления предлагаются биспецифичные или мультиспецифичные антитела, которые могут иметь любую из конфигураций, обсуждаемых в данном документе, включая, без ограничения, трехцепочечное биспецифичное антитело. Биспецифичные антитела содержат, по меньшей мере, вариабельную область тяжелой цепи антитела, специфичного для белка, отличного от ВСМА.
Когда белок по изобретению представляет собой биспецифичное антитело, один связывающий фрагмент специфичен для ВСМА человека, в то время как другой фрагмент может быть специфичным для клеток-мишеней, ассоциированных с опухолью антигенов, целевых антигенов, например, интегринов и т.д., антигенов патогенов, белков контрольных точек и тому подобное. Клетки-мишени конкретно включают в себя раковые клетки, такие как гематологические опухоли, например В-клеточные опухоли.
Различные форматы биспецифичных антител находятся в пределах объема изобретения, включая без ограничения одноцепочечные полипептиды, двухцепочечные полипептиды, трехцепочечные полипептиды, четырехцепочечные полипептиды и кратные им полипептиды. В данном документе биспецифичные антитела конкретно включают биспецифичные антитела Т-клеток, связывающиеся с ВСМА, который избирательно экспрессируется на плазматических клетках (plasma cells - РС) и множественной миеломе (ММ), а также CD3 (анти- ВСМА × анти-CD3-антитела). Такие антитела индуцируют сильное опосредованное Т-клетками уничтожение клеток, несущих ВСМА.
Фармацевтические композиции
Другим аспектом настоящего изобретения является предложение фармацевтических композиций, содержащих одно или более антител по настоящему изобретению в смеси с подходящим фармацевтически приемлемым носителем. Фармацевтически приемлемые носители, используемые в данном документе, например, но не ограничиваются ими, адъюванты, твердые носители, вода, буферы или другие носители, используемые в данной области для хранения терапевтических компонентов или их комбинаций.
Фармацевтическую композицию антител, используемых согласно настоящему изобретению, готовят для хранения путем смешивания белков, имеющих желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами (см., например, Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), например, в форме лиофилизированных композиций или водных растворов. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN ™, PLURONICS ™ или полиэтиленгликоль (ПЭГ).
Составы анти-ВСМА антител раскрыты, например, в патенте США № 9034324. Подобные составы могут быть использованы для белков по настоящему изобретению.
Способы применения
Фармацевтические композиции по данному изобретению могут быть использованы для лечения расстройств, связанных с В-клетками, характеризующимися экспрессией ВСМА.
Такие В-клеточные расстройства включают в себя злокачественные новообразования В-клеток и плазматических клеток и аутоиммунные расстройства, включая, без ограничения, плазмоцитому, лимфому Ходжкина, фолликулярные лимфомы, мелкоклеточные лимфомы с нерасщепленными ядрами, эндемическую лимфому Беркитта, спорадическую лимфому Беркитта, лимфому маргинальной зоны , лимфому лимфоидной ткани, ассоциированную со слизистыми оболочками, узловую моноцитоидную В-клеточную лимфому, лимфому селезенки, мантийноклеточную лимфому, крупноклеточную лимфому, диффузную смешанно-клеточную лимфому, иммунобластную лимфому, первичную средостенную В-клеточную лимфому, В-клеточную легочную ангиоцентрическую лимфому, мелкоклеточную лимфоцитарную лимфому, В-клеточные пролиферации с неопределенным злокачественным потенциалом, лимфоматоидный гранулематоз, посттрансплантационное лимфопролиферативное расстройство, иммунорегуляторное расстройство, ревматоидный артрит, миастению, идиопатическую тромбоцитопению пурпура, антифосфолипидный синдром, болезнь Шагаса, болезнь Грейвса, гранулематоз Вегенера, узелковый полиартериит, синдром Шегрена, пузырчатку обыкновенную, склеродермию, рассеянный склероз, антифосфолипидный синдром, ANCA-ассоциированный васкулит, болезнь Гудпасчера, болезнь Кавасаки, аутоиммунную гемолитическую анемию и быстро прогрессирующий гломерулонефрит, болезнь тяжелых цепей, первичный или иммуноцит-ассоциированный амилоидоз или моноклональную гаммопатию.
Плазмоклеточные расстройства, характеризующиеся экспрессией ВСМА, включают в себя множественную миелому (ММ). MM представляет собой В-клеточное злокачественное образование, характеризующееся моноклональным расширением и накоплением аномальных плазматических клеток в компартменте костного мозга. Современные способы лечения ММ часто вызывают ремиссии, но почти все пациенты в конечном итоге рецидивируют и умирают. Существуют убедительные доказательства иммуноопосредованной элиминации клеток миеломы в условиях трансплантации аллогенных гемопоэтических стволовых клеток; однако токсичность данного подхода высока, и лишь немногие пациенты излечиваются. Хотя некоторые моноклональные антитела продемонстрировали перспективность лечения ММ в доклинических исследованиях и ранних клинических испытаниях, последовательная клиническая эффективность любой терапии моноклональными антителами для ММ не была убедительно продемонстрирована. Следовательно, существует большая потребность в новых способах лечения, включая иммунотерапию ММ (см., например, Carpenter et al., Cliln Cancer Res 2013, 19(8):2048-2060).
Другое В-клеточное расстройство, включающее плазматические клетки, т.е. экспрессирующие ВСМА клетки, представляет собой системную красную волчанку (СКВ), также известную как красная волчанка. СКВ представляет собой системное аутоиммунное заболевание, которое может поражать любую часть тела и проявляется иммунной системой, поражающей собственные клетки и ткани организма, что приводит к хроническому воспалению и повреждению тканей. Это реакция гиперчувствительности типа III, при которой антитело-иммунные комплексы осаждаются и вызывают дальнейший иммунный ответ ((Inaki & Lee, Nat Rev Rheumatol 2010; 6: 326-337).
Антитела по настоящему изобретению можно использовать для разработки терапевтических средств для лечения ММ, СКВ и других В-клеточных расстройств, характеризующихся экспрессией ВСМА, таких как перечисленные выше.
В одном варианте осуществления антитела в данном документе могут быть в форме структур анти-BCMA антитело, состоящее только из тяжелых цепей-CAR, т.е. структуры анти-BCMA антитело, состоящее только из тяжелых цепей-CAR-трансдуцированные Т-клетки.
Эффективные дозы композиций по данному изобретению для лечения заболевания варьируются в зависимости от многих различных факторов, включая способы введения, место назначения, физиологическое состояние пациента, является ли пациент человеком или животным, вводятся ли другие лекарственные препараты, и является ли лечение профилактическим или терапевтическим. Обычно пациентом является человек, но млекопитающие, отличные от человека, также могут поддаваться лечению, например, домашние животные, такие как собаки, кошки, лошади и т.д., лабораторные млекопитающие, такие как кролики, мыши, крысы и т.д. и тому подобное. Для оптимизации безопасности и эффективности можно подбирать лекарственные дозировки.
Уровни дозировки могут быть легко определены обычным квалифицированным врачом и могут быть изменены при необходимости, например, при необходимости изменения реакции субъекта на терапию. Количество действующего вещества, которое можно комбинировать с материалами носителя для получения единичной лекарственной формы, варьируется в зависимости от хозяина, который поддается лечению, и конкретного способа введения. Стандартные лекарственные формы обычно содержат от около 1 до около 500 мг действующего вещества.
В некоторых вариантах осуществления терапевтическая дозировка агента может составлять от около 0,0001 до 100 мг/кг и более обычно от 0,01 до 5 мг/кг от массы тела хозяина. Например, дозировка может составлять 1 мг кг массы тела или 10 мг/кг массы тела или в пределах 1-10 мг/кг. Примерный режим лечения включает введение один раз каждые две недели или один раз в месяц или один раз каждые от 3 до 6 месяцев. Терапевтические вещества по настоящему изобретению обычно вводят несколько раз. Интервалы между однократными дозами могут быть еженедельными, ежемесячными или ежегодными. Интервалы также могут быть нерегулярными, на что указывает измерение уровня терапевтического вещества в крови пациента. Альтернативно, терапевтические вещества по настоящему изобретению можно вводить в виде композиции с замедленным высвобождением, и в этом случае требуется менее частое введение. Дозировка и частота варьируются в зависимости от периода полувыведения полипептида у пациента.
Как правило, композиции готовят в виде инъекционных препаратов, либо в виде жидких растворов, либо суспензий; также могут быть получены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Препарат также может быть эмульгирован или инкапсулирован в липосомы или микрочастицы, такие как полилактид, полигликолид или сополимер, для усиления адъювантного эффекта, как описано выше. Langer, Science 249: 1527, 1990 и Hanes, Advanced Drug Delivery Reviews 28: 97-119, 1997. Вещества по данному изобретению можно вводить в форме депо-инъекции или препарата имплантата, который может быть составлен таким образом, чтобы обеспечить длительное или пульсирующее высвобождение действующего вещества. Фармацевтические композиции, как правило, сформулированы как стерильные, практически изотонические и полностью соответствующие всем нормам Правил производства и контроля качества лекарственных средств (GMP) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Токсичность антител и структур антител, описанных в данном документе, может быть определена стандартными фармацевтическими процедурами на клеточных культурах или экспериментальных животных, например, путем определения LD50 (доза, летальная для 50% популяции) или LD100 (доза, летальная до 100% популяции). Соотношение доз между токсическим и терапевтическим эффектом является терапевтическим показателем. Данные, полученные из этих анализов клеточных культур и исследований на животных, могут быть использованы при составлении диапазона доз, который не токсичен для применения у людей. Дозировка антител, описанных в данном документе, предпочтительно находится в диапазоне циркулирующих концентраций, которые включают эффективную дозу с небольшой токсичностью или без нее. Дозировка может варьироваться в пределах данного диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Точный состав, способ введения и дозировка могут быть выбраны индивидуально врачом с учетом состояния пациента.
Композиции для введения обычно содержат антитело или другой абляционный агент, растворенный в фармацевтически приемлемом носителе, предпочтительно в водном носителе. Могут быть использованы различные водные носители, например забуференный солевой раствор и тому подобное. Данные растворы являются стерильными и, как правило, не содержат нежелательных веществ. Данные композиции могут быть стерилизованы обычными, хорошо известными способами стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения их к физиологическим условиям, такие как регулирующие рН агенты и буферные агенты, регулирующие токсичность агенты и тому подобное, например ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное. Концентрация активного агента в данных составах может варьироваться в широких пределах и будет выбираться в основном на основе объемов жидкости, вязкости, массы тела и тому подобного в соответствии с конкретным выбранным способом введения и потребностями пациента (например, Remington's Pharmaceutical Science (15th ed., 1980) и Goodman & Gillman, The Pharmacological Basis of Therapeutics (Hardman et al., eds., 1996)).
Также в объем изобретения входят наборы, содержащие активные агенты и их составы, изобретения и инструкции по применению. Набор может дополнительно содержать по меньшей мере один дополнительный компонент, например, химиотерапевтический препарат и др. Наборы обычно включают в себя этикетку, указывающую на предполагаемое использование содержимого набора. Термин «этикетка» включает в себя любые письменные или записанные материалы, поставляемые в комплекте или вместе с ним, или иным образом сопровождающие набор.
Теперь, когда изобретение полностью описано, для специалиста в данной области техники будет очевидно, что различные изменения и модификации могут быть сделаны без отклонения от сущности или объема изобретения.
Примеры
Пример 1
Генетически сконструированные крысы, экспрессирующие антитела, содержащие только тяжелые цепи
Локус IgH человека и крысы был сконструирован и собран из нескольких частей. Это включало модификацию и объединение генов С-области крысы ниже JH человека, а затем добавление выше области VH6 –D-сегмента человека. Два BAC с отдельными кластерами генов VH человека [BAC6 и BAC3] затем совместно вводили с помощью BAC, называемого Georg, кодирующим собранную и модифицированную область, включающую VH6 человека, все D, все JH и модифицированный Cγ2a/1/2b (ΔCH1) крысы.
Были получены трансгенные крысы, несущие искусственные локусы иммуноглобулинов тяжелой цепи в неупорядоченной конфигурации. IgG2a(ΔCH1)., igG1(ΔCH1)., IgG2b(ΔCH1) гены отсутствовали в CH1 сегменте. Гены константной области IgE, IgA и 3’энхансер были включены в BAC Georg. ПЦР-РВ и анализ сыворотки (ELISA) трансгенных крыс выявили продуктивную перестройку локусов трансгенных иммуноглобулинов и экспрессию в сыворотке только антител, содержащие только тяжелую цепь, различных изотипов. Трансгенные крысы скрещивались с крысами с мутированными эндогенными локусами тяжелой цепи и легкой цепи, ранее описанными в публикации патента США 2009/0098134 A1. Анализ таких животных продемонстрировал инактивацию экспрессии тяжелой и легкой цепи иммуноглобулина крысы и высокий уровень экспрессии антител, содержащих только тяжелую цепь, с вариабельными областями, кодируемыми генами V, D и J человека. Иммунизация трансгенных крыс приводила к получению сывороточных ответов с высоким титром антиген-специфических антител, содержащие только тяжелую цепь. Данные трансгенные крысы, экспрессирующие антитела, содержащие только тяжелую цепь, с областью VDJ человека, были названы UniRats.
Пример 2
Иммунизация
Иммунизация рекомбинантным внеклеточным доменом ВСМА.
Двенадцать животных UniRat (6 HC27, 6 HC28) были иммунизированы рекомбинантным белком BCMA человека. Животных иммунизировали в соответствии со стандартным протоколом с использованием адъюванта Titermax/Alhydrogel. Рекомбинантный внеклеточный домен ВСМА был приобретен у R&D Systems и разбавлен стерильным физиологическим раствором и объединен с адъювантом. Иммуноген комбинировали с адъювантами Titermax и Alhydrogel. Первая иммунизация (прайминг) иммуногеном в Titermax проводилась на левой и правой ногах. Последующие бустерные иммунизации были проведены в присутствии Alhydrogel и за три дня до отбора бустов были проведены иммуногеном в PBS. Сыворотку собирали у крыс при последнем заборе крови для определения сывороточных титров.
Результаты сывороточных титров
Сводная информация о сывороточном титре представлена на фиг. 4 и 5. Для половины животных активность связывания для одного разведения сывороточного титра 1:500 проверяли методом ELISA против белка huBCMA + Fc и белка cynoBCMA + Fc, продуцируемых в эукариотических клетках, и двух белков BCMA человека из E.coli и зародышей пшеницы, соответственно. Кроме того, образцы сыворотки были протестированы против двух нецелевых белков, HSA и IgG1 человека. Кроме того, сыворотку от всех 12 животных анализировали на связывание с клетками NCI-H929 (BCMA +, лямбда-).
Среди данной группы животных мы наблюдали значительный разброс уровней реактивности сыворотки к клеткам NCI-H929 (BCMA +, лямбда-). Актуальность данных результатов подтверждается данными связывания ELISA, полученными для подгруппы животных. Некоторая общая Fc-специфическая реактивность наблюдается для ряда животных, но случаи, которые выглядят наиболее многообещающими, также демонстрируют высокий видимый титр в анализах против ВСМА человека без метки из альтернативных источников (E.coli, зародыш пшеницы), что указывает на значительную BCMA ECD-специфическую связывающую активность. Положительный сигнал для связывания с белком cynoBCMA+Fc может отражать связывание либо с ECD, либо с частью Fc молекулы, которая также включена в иммуноген человека. В обоих типах анализа анализ сыворотки, взятой у данных животных до иммунизации, показал отсутствие реактивности к иммуногену или белку-мишени.
Пример 3
Сборка генов, экспрессия и анализы связывания
309 кДНК, кодирующих антитела, содержащие только тяжелые цепи, с высокой экспрессией в клетках лимфатических узлов, были отобраны для сборки генов и клонированы в экспрессирующий вектор. Впоследствии указанные 309 последовательностей тяжелых цепей были экспрессированы в клетках HEK в виде антител, содержащих только тяжелую цепь, UniAb (удаленный CH1, без легкой цепи). Результаты связывания, включая аминокислотные последовательности для 34 протестированных областей VH, можно найти в BCMA_FAM2_DATA.
Супернатанты двух антител тестировали на связывание в стандартном анализе ELISA с ВСМА человека. Связывание с рекомбинантным белком BCMA определяли методом ELISA с использованием BCMA ECD человека, полученного от Abcam (ab50089). Белок BCMA ECD использовали в концентрации 2 мкг/мл для захвата UniAbs при 50 нг/мл. Связывание UniAbs определяли с использованием конъюгированного с HRP козьего антитела против IgG человека (ThermoFisher 31413). Все антитела разводили в 1X TBS с 0,05% Tween-20 и 1% сухого молока.
Нецелевое связывание с экстрактом белка вируса бакуло (BVP) определяли методом ELISA, как описано выше, с модификацией с использованием 1X PBS и 1% сухого молока для разбавителя. Экстракт BVP был получен от INSERM (Нант, Франция). Считается, что связывание с частицами бакуловируса (> 5-кратное превышение фона в нашем анализе) указывает на низкоаффинные взаимодействия с тканями человека, что коррелирует с уменьшенным периодом полувыведения антител у людей и обезьян (Hotzel et al., MAbs 4: 6, p753- 760, 2012). Нецелевое связывание с IgG1 человека оценивали методом ELISA с использованием UniAbs для захвата каппа IgG1 человека с последующим обнаружением каппа-цепи с помощью конъюгированного с HRP козьего антитела против каппа человека (Southern Biotech 2060-05).
Супернатанты всех антител также тестировали методом проточной цитометрии на связывание с клетками RPMI-8226 (BCMA +, лямбда +) и клетками H929 (BCMA +, лямбда-). Образцы измеряли методом проточной цитометрии с использованием прибора Guava easyCyte 8HT от EMD Millipore и анализировали с использованием guavaSoft. Связанные антитела были обнаружены козьим антителом против IgG F (ab ') 2 человека, конъюгированным с РЕ (Southern Biotech 2042-09). Все антитела разводили в PBS с 1% BSA. Положительное окрашивание определяли путем сравнения с окрашиванием контрольным изотипом IgG1 человека. Клеточные линии NCI-H929 и RPMI-8226 представляют собой линии множественной миеломы человека, экспрессирующие BCMA человека, которые были получены из Американской коллекции типовых культур (ATCC) и культивированы в соответствии с рекомендациями ATCC.
Два UniAb также оценивали на способность блокировать связывание APRIL (лиганд) / BCMA (рецептор) в анализе ELISA с рекомбинантным белком. Чтобы оценить блокирование взаимодействия рецептор/лиганд между BCMA и APRIL, рекомбинантный BCMA человека (Sino Biological 10620-H03H) непосредственно наносили на чашки с последующей инкубацией с серией разведений каждого UniAb. HA-меченный рекомбинантный белок APRIL (RnD Systems 5860-AP-010) затем инкубировали с комплексами ВСМА/антитело, и связывание APRIL с ВСМА определяли с использованием анти-НА антитела курицы, конъюгированного с HRP (Abcam ab1190). RnD системы анти-BCMA антитела (AF193) использовали в качестве положительного контроля для блокирования BCMA/APRIL.
Дополнительный анализ нецелевого связывания проводили на интактных бакуловирусных частицах (BVP), хотя ни один из протестированных UniAbs не показал положительного связывания.
Несмотря на то, что в настоящем документе были показаны и описаны предпочтительные варианты осуществления настоящего изобретения, специалистам в данной области техники будет очевидно, что данные варианты осуществления приведены исключительно с целью иллюстрации. Множество вариаций, изменений и замен будут очевидны специалистам в данной области техники без отхода от объема и сущности настоящего изобретения. Следует понимать, что различные альтернативные варианты осуществления настоящего изобретения, описанные в настоящем документе, могут применяться при практической реализации настоящего изобретения. Предполагается, что нижеследующая формула изобретения определяет объем изобретения и, что таким образом охватываются способы и структуры в пределах объема данной формулы изобретения и их эквивалентов.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> TENEOBIO, INC.
<120> АНТИ-BCMA АНТИТЕЛА, СОДЕРЖАЩИЕ ТОЛЬКО ТЯЖЕЛУЮ ЦЕПЬ
<130> TNO-0002-WO
<140> PCT/US2017/067870
<141> 21.12.2017
<150> 62/437 588
<151> 21.12.2016
<160> 56
<170> PatentIn версия 3.5
<210> 1
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 1
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 2
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 2
Gly Phe Thr Phe Thr Asn Tyr Ala
1 5
<210> 3
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 3
Gly Phe Thr Phe Ser Asn Tyr Ala
1 5
<210> 4
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 4
Gly Phe Thr Phe Ser Arg Tyr Ala
1 5
<210> 5
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 5
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<210> 6
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 6
Ile Thr Glu Asn Gly Gly Ser Thr
1 5
<210> 7
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 7
Ile Thr Gly Asp Gly Gly Ser Thr
1 5
<210> 8
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 8
Ile Ile Gly Ser Gly Gly Ser Thr
1 5
<210> 9
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 9
Ile Thr Gly Ser Gly Gly Thr Thr
1 5
<210> 10
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 10
Leu Thr Gly Asn Gly Asp Ser Thr
1 5
<210> 11
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 11
Ile Thr Gly Ser Gly Gly Ser Thr
1 5
<210> 12
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 12
Ile Thr Gly Ser Gly Asp Ser Thr
1 5
<210> 13
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 13
Leu Thr Gly Ser Gly Asp Ser Thr
1 5
<210> 14
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 14
Ile Val Gly Ser Gly Gly Asn Thr
1 5
<210> 15
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 15
Leu Thr Gly Ser Gly Gly Ser Thr
1 5
<210> 16
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 16
Ile Ile Gly Ser Gly Ala Thr Thr
1 5
<210> 17
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 17
Ile Val Gly Gly Gly Gly Thr Ser
1 5
<210> 18
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 18
Ile Ile Gly Ser Gly Gly Thr Thr
1 5
<210> 19
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 19
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu
1 5 10
<210> 20
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Ala Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 21
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 21
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Gly Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 22
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 22
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Glu Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 23
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Asp Gly Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 24
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 24
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 25
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 26
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 26
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 27
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 27
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Leu Thr Gly Asn Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 28
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 28
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 29
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 29
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 30
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 30
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 31
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 31
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Asp Ser Thr Tyr Tyr Ala Ala Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Gln Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 32
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 32
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Leu Thr Gly Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Asp Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 33
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Thr Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Asp Gly Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 34
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 34
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ala Met Asn Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Gly Ser Gly Gly Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 35
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asp
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 36
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 36
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ser Gly Leu Thr Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 37
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 37
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 38
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 38
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 39
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 39
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ser Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 40
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 40
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 41
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 42
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 42
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 43
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 43
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Thr Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Ala Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asn
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 44
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 44
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 45
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 45
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 46
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 46
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 47
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 47
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Gly Gly Gly Gly Thr Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 48
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 48
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Thr Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Asp Gly Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 49
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 49
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Thr Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Gly Gly Gly Gly Thr Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 50
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 50
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Asn
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 51
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 51
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Thr Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 52
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 52
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Val Gly Gly Gly Gly Thr Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 53
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
полипептид»
<400> 53
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ile Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Trp Asn Thr Thr Met Ile Thr Glu Arg Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 54
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<400> 54
Ile Ser Gly Gly Gly Gly Ser Thr
1 5
<210> 55
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /заменить="Thr"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /заменить="Asn" или "Arg"
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(8)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не являются
предпочтительными по сравнению с приведенными в сносках
для вариантных позиций"
<400> 55
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 56
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический
пептид»
<220>
<221> ВАРИАНТ
<222> (1)..(1)
<223> /заменить="Leu"
<220>
<221> ВАРИАНТ
<222> (2)..(2)
<223> /заменить="Thr" или "Ile" или "Val"
<220>
<221> ВАРИАНТ
<222> (3)..(3)
<223> /заменить="Glu"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /заменить="Gly" или "Asn" или "Asp"
<220>
<221> ВАРИАНТ
<222> (6)..(6)
<223> /заменить="Asp" или "Ala"
<220>
<221> ВАРИАНТ
<222> (7)..(7)
<223> /заменить="Thr" или "Asn"
<220>
<221> ВАРИАНТ
<222> (8)..(8)
<223> /заменить="Ser"
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(8)
<223> / примечание="Вариантные остатки, приведенные в последовательности,
не являются
предпочтительными по сравнению с приведенными в сносках
для вариантных позиций"
<400> 56
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2766094C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ВСМА, NKG2D И CD16 | 2018 |
|
RU2805254C2 |
| АНТИТЕЛО, НАЦЕЛЕННОЕ НА ВСМА, И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2799655C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2019 |
|
RU2810092C2 |
| Антитело к BCMA, его антигенсвязывающий фрагмент и их медицинское применение | 2020 |
|
RU2819660C2 |
| ТРИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2829901C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2761632C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ CD269 (BCMA) | 2015 |
|
RU2749041C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2809125C2 |




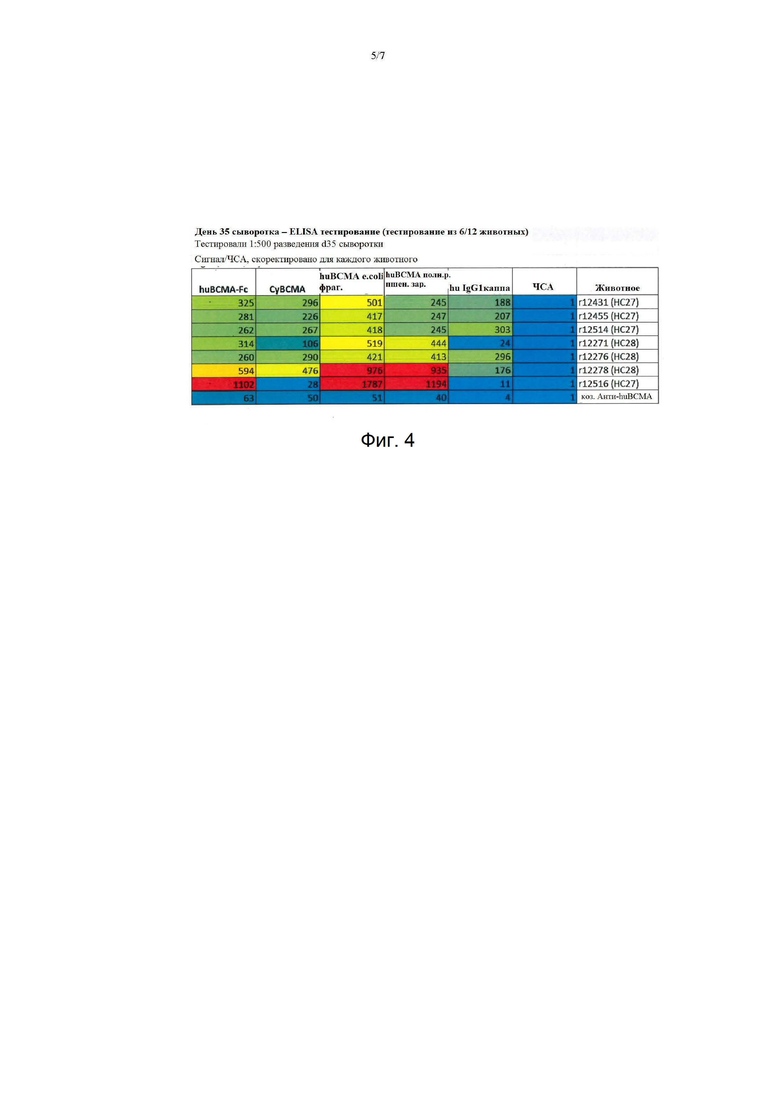
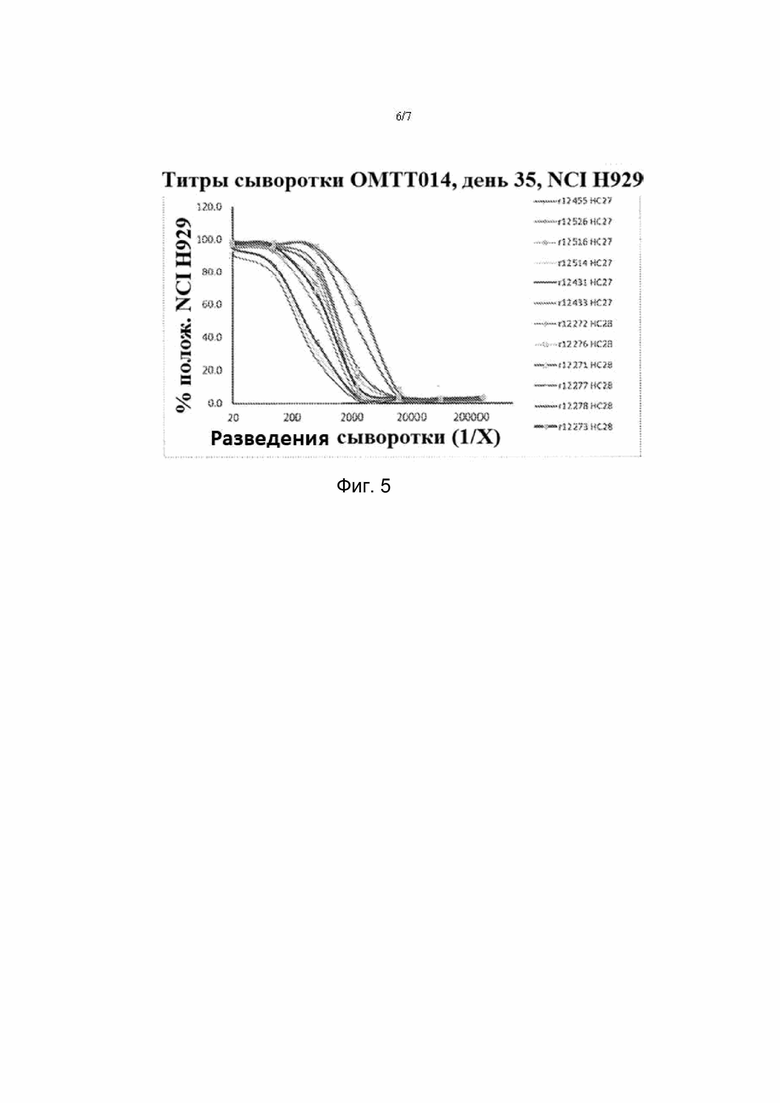
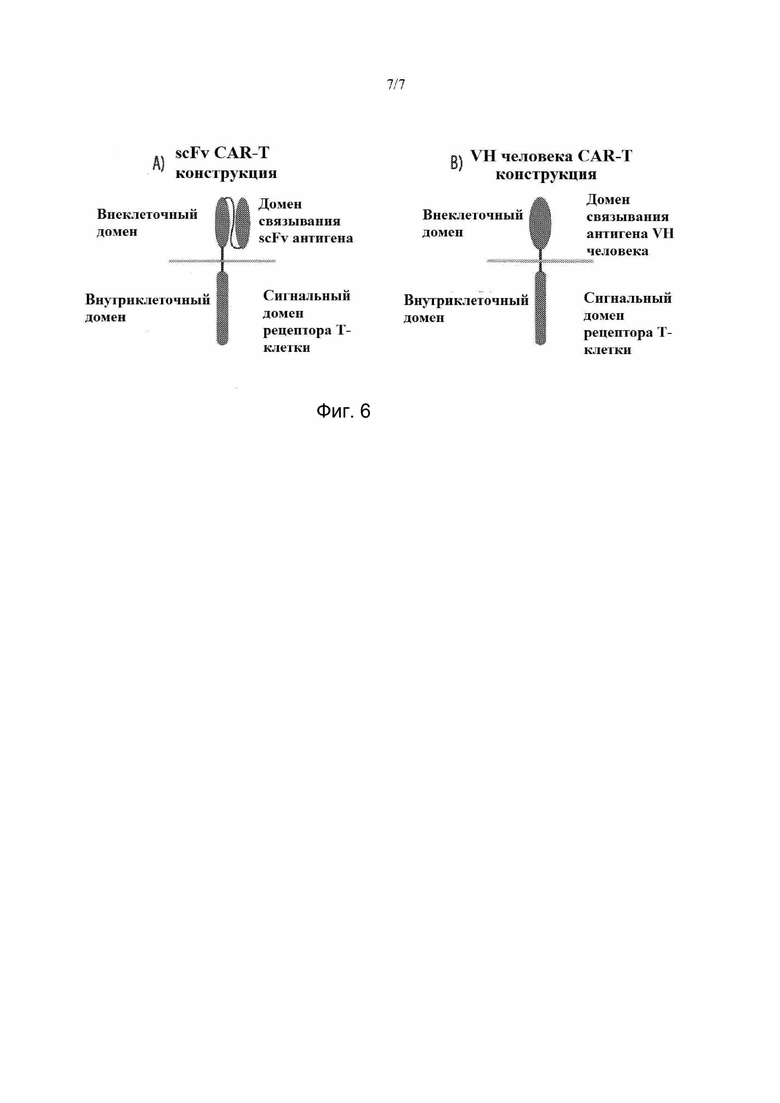
Изобретение относится к области биотехнологии. Предложено связывающееся с ВСМА антитело, содержащее только тяжелую цепь. Также предложены фармацевтическая композиция, содержащая указанное антитело, и ее применение для лечения В-клеточных расстройств, характеризующихся экспрессией ВСМА. Изобретение обеспечивает высокую связывающую активность в отношении ВСМА. 3 н. и 28 з.п. ф-лы, 6 ил., 3 пр.
1. Антитело, содержащее только тяжелую цепь, которое связывается с антигеном созревания В-клеток человека (ВСМА), содержащее вариабельную область тяжелой цепи, содержащую:
(a) CDR1 последовательности, содержащей GFTFSNYA (SEQ ID NO: 3), CDR2 последовательности, содержащей ITGDGGST (SEQ ID NO: 7), и CDR3 последовательности, содержащей VKDWNTTMITE (SEQ ID NO: 19); или
(b) CDR1 последовательности, содержащей GFTFSSYA (SEQ ID NO: 1), CDR2 последовательности, содержащей ISGSGGST (SEQ ID NO: 5), и CDR3 последовательности, содержащей VKDWNTTMITE (SEQ ID NO: 19); или
(c) CDR1 последовательности, содержащей GFTFTNYA (SEQ ID NO: 2), CDR2 последовательности, содержащей ISGGGGST (SEQ ID NO: 54), и CDR3 последовательности, содержащей VKDWNTTMITE (SEQ ID NO: 19),
в каркасе VH человека.
2. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую GFTFSNYA (SEQ ID NO: 3), последовательность CDR2, содержащую ITGDGGST (SEQ ID NO: 7), и последовательность CDR3, содержащую VKDWNTTMITE (SEQ ID NO: 19).
3. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую GFTFSSYA (SEQ ID NO: 1), последовательность CDR2, содержащую ISGSGGST (SEQ ID NO: 5), и последовательность CDR3, содержащую VKDWNTTMITE (SEQ ID NO: 19).
4. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую GFTFTNYA (SEQ ID NO: 2), последовательность CDR2, содержащую ISGGGGST (SEQ ID NO: 54), и последовательность CDR3, содержащую VKDWNTTMITE (SEQ ID NO: 19).
5. Антитело, содержащее только тяжелую цепь, по любому из пп. 1-4, содержащее последовательность константной области тяжелой цепи в отсутствие последовательности CH1.
6. Антитело, содержащее только тяжелую цепь, по любому из пп. 1-5, содержащее вариабельную область тяжелой цепи, имеющую по меньшей мере 95% идентичность последовательности с любой из последовательностей SEQ ID NO: 48, 20 или 21.
7. Антитело, содержащее только тяжелую цепь, по п. 6, содержащее последовательность вариабельной области тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 48, 20 и 21.
8. Антитело, содержащее только тяжелую цепь, по любому из пп. 1-7, которое является частью структуры CAR-T.
9. Антитело, содержащее только тяжелую цепь, по п. 8, которое присутствует в CAR-трансдуцированной Т-клетке.
10. Фармацевтическая композиция для лечения В-клеточного расстройства, характеризующегося экспрессией BCMA у субъекта, содержащая антитело, содержащее только тяжелую цепь, по любому из пп. 1-9, и фармацевтически приемлемый носитель.
11. Применение антитела по любому из пп. 1-9 или содержащей его фармацевтической композиции по п. 10 для лечения В-клеточного расстройства, характеризующегося экспрессией BCMA у субъекта.
12. Применение по п. 11, отличающееся тем, что В-клеточное расстройство представляет собой множественную миелому.
13. Применение по п. 11, отличающееся тем, что В-клеточное расстройство представляет собой системную красную волчанку.
14. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую GFTFSNYA (SEQ ID NO: 3), последовательность CDR2, содержащую ITGDGGST (SEQ ID NO: 7), и последовательность CDR3, содержащую VKDWNTTMITE (SEQ ID NO: 19) в каркасе VH человека.
15. Антитело, содержащее только тяжелую цепь, по п. 14, отличающееся тем, что вариабельная область тяжелой цепи имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 48.
16. Антитело, содержащее только тяжелую цепь, по п. 15, отличающееся тем, что вариабельная область тяжелой цепи содержит SEQ ID NO: 48.
17. Антитело, содержащее только тяжелую цепь, по п. 14, содержащее последовательность константной области тяжелой цепи в отсутствие последовательности CH1.
18. Антитело, содержащее только тяжелую цепь, по п. 14, которое является частью структуры CAR-T.
19. Антитело, содержащее только тяжелую цепь, по п. 14, которое присутствует в CAR-трансдуцированной Т-клетке.
20. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую SEQ ID NO: 1, последовательность CDR2, содержащую SEQ ID NO: 5, и последовательность CDR3, содержащую SEQ ID NO: 19, в каркасе VH человека.
21. Антитело, содержащее только тяжелую цепь, по п. 20, отличающееся тем, что вариабельная область тяжелой цепи имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 20.
22. Антитело, содержащее только тяжелую цепь, по п. 21, отличающееся тем, что вариабельная область тяжелой цепи содержит SEQ ID NO: 20.
23. Антитело, содержащее только тяжелую цепь, по п. 20, содержащее последовательность константной области тяжелой цепи в отсутствие последовательности CH1.
24. Антитело, содержащее только тяжелые цепи, по п. 20, которое является частью структуры CAR-T.
25. Антитело, содержащее только тяжелую цепь, по п. 20, которое присутствует в CAR-трансдуцированной Т-клетке.
26. Антитело, содержащее только тяжелую цепь, по п. 1, отличающееся тем, что вариабельная область тяжелой цепи содержит последовательность CDR1, содержащую SEQ ID NO: 2, последовательность CDR2, содержащую SEQ ID NO: 54, и последовательность CDR3, содержащую SEQ ID NO: 19, в каркасе VH человека.
27. Антитело, содержащее только тяжелую цепь, по п. 26, отличающееся тем, что вариабельная область тяжелой цепи имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 21.
28. Антитело, содержащее только тяжелую цепь, по п. 27, отличающееся тем, что вариабельная область тяжелой цепи содержит SEQ ID NO: 21.
29. Антитело, содержащее только тяжелую цепь, по п. 26, дополнительно содержащее последовательность константной области тяжелой цепи в отсутствие последовательности CH1.
30. Антитело, содержащее только тяжелую цепь, по п. 26, которое является частью структуры CAR-T.
31. Антитело, содержащее только тяжелую цепь, по п. 26, которое присутствует в CAR-трансдуцированной Т-клетке.
| WO 2012066058 A1, 24.05.2012 | |||
| WO 2014089335 A2, 12.06.2014 | |||
| ROMAIN ROUET et al | |||
| Fully Human VH Single Domains That Rival the Stability and Cleft Recognition of Camelid Antibodies, THE JOURNAL OF BIOLOGICAL CHEMISTRY, 2015, vol.290, no.19, pp.11905-11917 | |||
| CARPENTER R.O | |||
| et al | |||
| B-cell Maturation Antigen Is a Promising Target for Adoptive T-cell |
Авторы
Даты
2022-10-11—Публикация
2017-12-21—Подача