Область техники
Группа изобретений относится к биотехнологии, иммунологии и микробиологии. Создан экспрессионный вектор на основе аденоассоциированного вируса, обладающий защитными свойствами против интоксикации, вызванной ботулотоксином типа А, а так же предложено применение данного вектора для профилактики интоксикации, вызываемой ботулиническим нейротоксином типа А.
Предшествующий уровень техники.
Ботулизм - тяжелое, потенциально смертельное токсикоинфекционное заболевание, вызываемое нейротоксинами бактерий Clostridium botulinum (Gill, D. Bacterial toxins - a table of lethal amounts. Microbiol. Rev. 1982, 46(1), 86-94. PMID: 6806598; Goonetilleke, A; Harris, J; Clostridial neurotoxins. J. Neurol. Neurosurg. & Psychiatry 2004, 75, 35-39. http://dx.doi.org/10.1136/jnnp.2004.046102. PMID: 15316043). Предполагаемая смертельная доза для человека составляет около 10 нанограмм на килограмм веса тела при вдыхании и 1 микрограмм при пероральном приеме (Arnon, S; Schechter, R; Inglesby, T; Henderson, D.A.; Bartlett, J.G.; Ascher, M.S.; Eitzen, E.; Fine, A.D.; Hauer, J.; Layton, M.; et al. Botulinum toxin as a biological weapon - medical and public health management. JAMA 2001, 285(8), 1059-1070. http://dx.doi.org/10.1001/jama.285.8.1059. PMID: 11209178. Emmeluth, D. Botulism. 2nd; New York, NY, USA; Infobase Publishing; 2010). Наиболее распространенные естественные формы ботулизма - пищевой, раневой и младенческий (Goonetilleke, A; Harris, J; Clostridial neurotoxins. J. Neurol. Neurosurg. & Psychiatry 2004, 75, 35-39. http://dx.doi.org/10.1136/jnnp.2004.046102. PMID: 15316043). Пищевым ботулизмом можно заразиться при потреблении загрязненной пищи, раневой формой - при попадании спор C. botulinum в открытую рану. Младенческая форма возникает у детей при попадании спор токсина в желудочно-кишечный тракт. Ингаляционная форма ботулизма не встречается в естественных условиях и может произойти только в случае биотеррористической атаки (Goonetilleke, A; Harris, J; Clostridial neurotoxins. J. Neurol. Neurosurg. & Psychiatry 2004, 75, 35-39. http://dx.doi.org/10.1136/jnnp.2004.046102. PMID: 15316043), Spickler, A.R. Botulism. Iowa State University, USA; 2018 Jan. Available online: http://www.cfsph.iastate.edu/DiseaseInfo/factsheets.php [accessed February 19, 2019]). Токсин состоит из 3 нековалентно связанных белковых компонентов: нейротоксина, гемагглютинина и протектина, обеспечивая высокую токсичность и устойчивость к агрессивным условиям среды. Токсин нарушает процесс активации нейронов, влияя на процесс доставки ацетилхолина к пресинаптической мембране путем расщепления белкового комплекса SNARE, что делает невозможным высвобождение нейромедиатора из синаптических везикул, в результате чего прекращается передача нервных сигналов, что приводит к параличу. Существует 8 типов ботулинического токсина (A-H), из которых тип А является наиболее распространенным. Ежегодно в России регистрируется около 300 случаев ботулизма, 15% из которых являются летальными. Кроме того, ботулинический нейротоксин считается одним из наиболее опасных (Центр по контролю и профилактике заболеваний США (CDC) - категория А) из существующих угроз биотерроризма. Доступная в настоящее время терапия ботулизма имеет ряд недостатков и ограничивается применением поддерживающей терапии, в частности, длительной искусственной вентиляцией легких, а также введением антитоксина, полученного из гипериммунной сыворотки лошади, применение которой способно вызывать аллергические реакции, реакции гиперчувствительности замедленного типа и анафилактический шок в ответ на не человеческие антитела. Для терапии детского ботулизма FDA одобрило применение препарат Baby BIG, представляющий собой очищенный антиботулинический иммуноглобулин человека (https://www.fda.gov/drugs/bioterrorism-and-drug-preparedness/products-approved-other-bioterrorism-emergencies). Однако этот препарат имеет ряд ограничений (https://www.drugs.com/mtm/botulism-immune-globulin.html). Кроме того, крупные фрагменты IgG имеют ограниченную способность к проникновению в периферические ткани и взаимодействию с эпитопами. В большинстве случаев лечение ботулизма является симптоматическим, при котором искусственная вентиляция лёгких является способом сохранения жизни (Nantel, A.J. Clostridium botulinum - international programme on chemical safety.Centre de Toxicologie du Québec, August, 1999. World Health Organization: Bacteria; 1999. Available online: https://www.who.int/csr/delibepidemics/clostridiumbotulism.pdf [Accessed February 8, 2019]; Patel, K.; Cai, S.; Singh, B. Current strategies for designing antidotes against botulinum neurotoxins. Expert Opin. Drug. Discov. 2014, 9(3), 319-333. http://dx.doi.org/10.1517/17460441.2014.884066. PMID: 24520991).
Также, существуют средства для профилактики ботулизма, однако их эффективность и безопасность не доказаны (Rusnak J.M., Smith L.A. Botulinum neurotoxin vaccines: Past history and recent developments. Hum. Vaccines. 2009;5:794-805. doi: 10.4161/hv.9420.). Тем не менее, существуют такие группы риска как медицинские работники, исследователи и военнослужащие, для которых вакцинация против ботулизма показана (109. Smith, L.A. Botulism and vaccines for its prevention. Vaccine 2009, 27 (Suppl. S4), D33-D39).
В связи с этим, актуальной задачей является получение эффективного и безопасного средства профилактики интоксикации, вызванной ботулотоксином. Существующие на сегодняшний день новые подходы к вакцинации против ботулизма сосредоточены в основном на создании рекомбинантных плазмидных и вирусных векторов, а также рекомбинантных субъединиц ботулотоксина.
Известно решение, где в качестве трехвалетной вакцины была использована рекомбинантная ДНК, индуцирующая гуморальный и клеточный иммунный ответ у мышей против ботулотоксинов А, В и Е после двух кратной иммунизации (Scott, V.L.; Villarreal, D.O.; Hutnick, N.A.; Walters, J.N.; Ragwan, E.; Bdeir, K.; Yan, J.; Sardesai, N.Y.; Finnefrock, A.C.; Casimiro, D.R.; et al. DNA vaccines targeting heavy chain c-terminal fragments of clostridium botulinum neurotoxin serotypes A, B, and E induce potent humoral and cellular immunity and provide protection from lethal toxin challenge. Hum. Vaccin Immunother. 2015, 11, 1961-1971).
Существуют работы по применению рекомбинантного аденовирусного вектора для индукции специфического иммунного ответа и способные защищать против летальной дозы ботулинического нейротоксина (Zeng, J.; Du, J.; Zhao, Y.; Palanisamy, N.;Wang, S. Baculoviral vector-mediated transient and stable transgene expression in human embryonic stem cells. Stem Cells 2007, 25, 1055-1061).
Также ведутся исследования по изучению кандидатной субъединичной вакцины против ботулинического токсина типа А (Yu, C.H.; Song, D.H.; Choi, J.Y.; Joe, H.E.; Jeong, W.H.; Hur, G.H.; Shin, Y.K.; Jeong, S.T. A mutated recombinant subunit vaccine protects mice and guinea pigs against botulinum type A intoxication. Hum. Vaccin Immunother. 2018, 14, 329-336.) и поливалентной субъединичной вакцины (Webb, R.P.; Smith, T.J.; Smith, L.A.; Wright, P.M.; Guernieri, R.L.; Brown, J.L.; Skerry, J.C. Recombinant botulinum neurotoxin hc subunit (bont hc) and catalytically inactive clostridium botulinum holoproteins (cibont hps) as vaccine candidates for the prevention of botulism. Toxins (Basel) 2017, 9, 269).
Моноклональные и однодоменные антитела также могут рассматриваться в качестве средств профилактики ботулизма, однако существуют трудности, связанные с их ограниченным периодом циркуляции в организме. Известна работа, в которой был получен препарат рекомбинантного репликативно-дефектного аденовируса человека, несущий ген однодоменного антитела специфичного к ботулотоксину типа А (Mukherjee J, Dmitriev I, Debatis M, Tremblay JM, Beamer G, Kashentseva EA, Curiel DT, Shoemaker CB. Prolonged prophylactic protection from botulism with a single adenovirus treatment promoting serum expression of a VHH-based antitoxin protein. PLoS One. 2014 Aug 29;9(8):e106422. doi: 10.1371/journal.pone.0106422. PMID: 25170904; PMCID: PMC4149568). Продемонстрировано, что введение данного препарата мышам способно обеспечивать экспрессию однодоменного антитела и индуцировать защиту против летальной дозы ботулотоксина типа А. Данное решение, как наиболее близкое к заявляемому, было выбрано авторами патента за прототип. Однако, недостатком прототипа является высокая иммуногенность и воспалительный потенциал аденовирусного вектора. Известно, что рекомбинантный аденовирус способен индуцировать высокий уровень иммунного ответа на белок, экспрессируемый в его составе, а также иммунный ответ на белки капсида аденовируса. Все выше перечисленное, будет создавать препятствия для повторного введения препарата в организм, после нивелирования специфической активности препарата после первичного введения. Кроме того, экспрессируемое в составе вектора однодоменное антитело лишено Fc-опосредованных функций, таких как Fc-зависимая цитотоксичность, Fc-зависимый фагоцитоз и активация системы комплимента. Также необходимо отметить, что прототип способен обеспечивать полную защиту мышей против 10ЛД50 ботулотоксина на срок - около 2-2,5 месяцев, после чего наблюдается лишь частичная защита животных.
Таким образом, в уровне техники существует потребность в создании нового рекомбинантного вирусного вектора для доставки и экспрессии гена однодоменного антитела, специфичного к ботулотоксину для профилактики интоксикации вызванной ботулотоксином типа А.
Раскрытие сущности изобретения
Технической задачей заявленной группы изобретений является расширение арсенала рекомбинантных вирусных векторов для профилактики интоксикации, вызываемой ботулиническим нейротоксином типа А.
Технический результат заключается в создании аденоассоциированного вирусного вектора, экспрессирующего рекомбинантное антитело, представляющее собой однодоменное антитело слитое с Fc-фрагментом IgG1 человека, специфичное к ботулиническому нейротоксину типа А (rAAV-B7-Fc), и который может быть использован для профилактики интоксикации, вызванной ботулиническим нейротоксином типа А. Кроме того, технический результат заключается в том, что разработан рекомбинантный вирусный вектор, который обладает меньшим воспалительным потенциалом и более продолжительным временным интервалом протективной активности.
Указанный технический результат достигается тем, что создан рекомбинантный аденоаcсоцированный вирусный вектор, несущий генетическую конструкцию, содержащую нуклеотидную последовательность SEQ ID NO: 2, экспрессирующую рекомбинантное антитело, имеющее аминокислотную последовательность SEQ ID NO: 1.
Также технический результат достигается тем, что экспрессируемое в составе вектора рекомбинантное антитело специфически связывается с ботулиническим нейротоксином типа А и обладает защитной активностью против летальной дозы ботулинического нейротоксина типа А.
Также технический результат достигается тем, что введение созданного препарата рекомбинантного аденоассоциированного вирусного вектора (rAAV-B7-Fc) в эффективном количестве обеспечивает продолжительную экспрессию в организме рекомбинантного антитела.
Кроме того, введение созданного препарата рекомбинантного аденоассоциированного вирусного вектора rAAV-B7-Fc в эффективном количестве обеспечивает длительную защиту (не менее 120 суток) от летальной дозы ботулинического токсина типа А.
А также разработан способ профилактики интоксикации, вызванной ботулиническим нейротоксином типа А, заключающийся во введении в организм млекопитающих в эффективном количестве полученного рекомбинантного аденоассоциированного вирусного вектора rAAV-B7-Fc.
Краткое описание чертежей
На фиг. 1 представлено схематическое изображение плазмиды pAAV-DJ-B7-Fc,
где
5,778 bp - число, пар нуклеотидов (молекулярный вес плазмиды),
Signal peptide - нуклеотидная последовательность сигнального пептида тяжелой цепи иммуноглобуллина человека,
В7 - нуклеотидная последовательность однодоменного антитела В7,
Hinge - нуклеотидная последовательность шарнирного региона,
Fc - нуклеотидная последовательность Fc-фрагмента IgG1 человека.
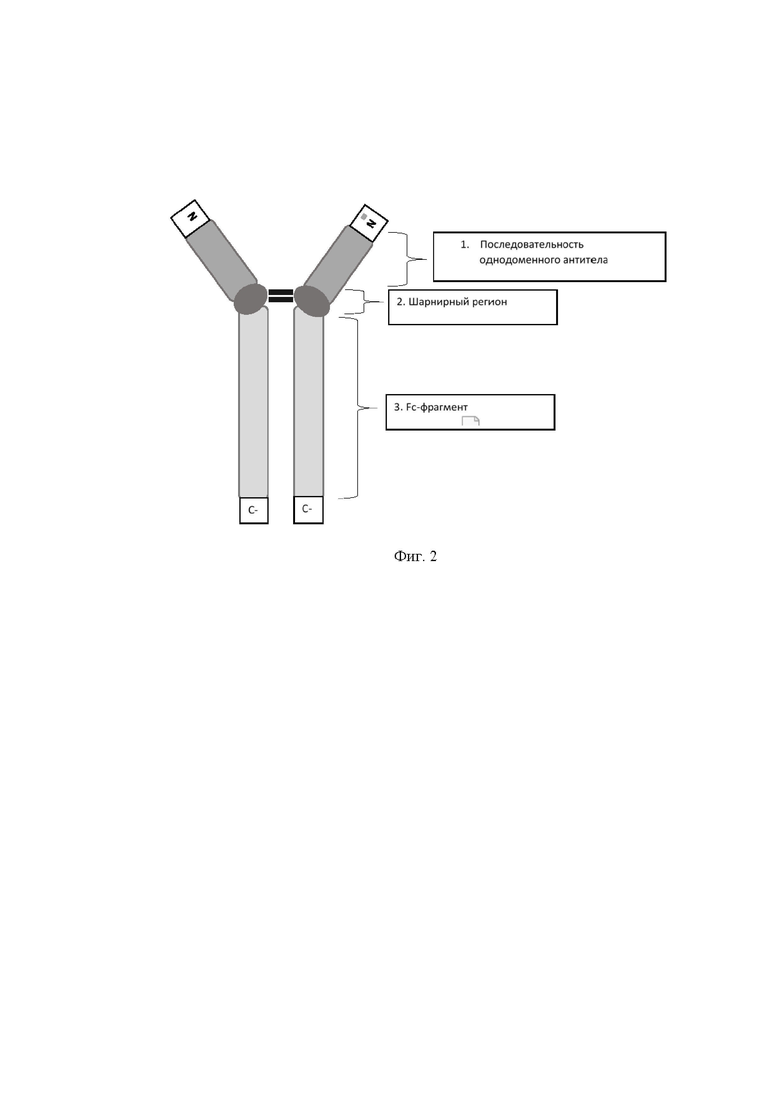
На фиг. 2 представлено схематическое изображение аминокислотной последовательности рекомбинантного антитела B7-Fc,
где
1 - последовательность однодоменного антитела;
2 - шарнирный регион;
3 - Fc-фрагмент IgG1 человека.
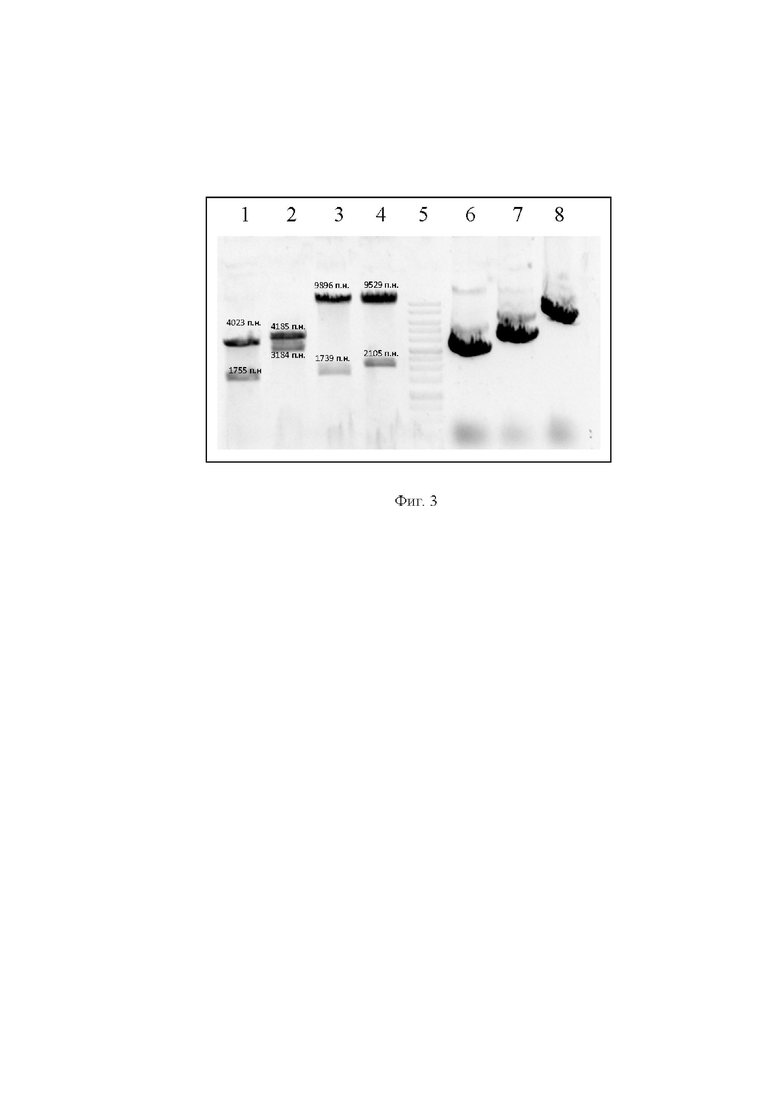
На фиг. 3 представлены данные рестрикционного гидролиза плазмид pAAV-DJ-B7-Fc, pAAV-DJ Vector и pHelper Vector,
где
1 - плазмида pAAV-DJ-B7-Fc, гидролизованная по сайтам рестрикции SacI и XbaI;
2 - плазмида pAAV-DJ Vector, гидролизованная по сайтам рестрикции NcoI;
3 - плазмида pHelper Vector, гидролизованная по сайтам рестрикции EcoRI;
4 - плазмида pHelper Vector, гидролизованная по сайтам рестрикции HindIII;
5 - маркер молекулярного веса GeneRuler 1 kb DNA Ladder (ThermoFisherScientific)
6 - не гидролизованная плазмида pAAV-DJ-B7-Fc;
7 - не гидролизованная плазмида pAAV-DJ Vector;
3 - не гидролизованная плазмида pHelper Vector.
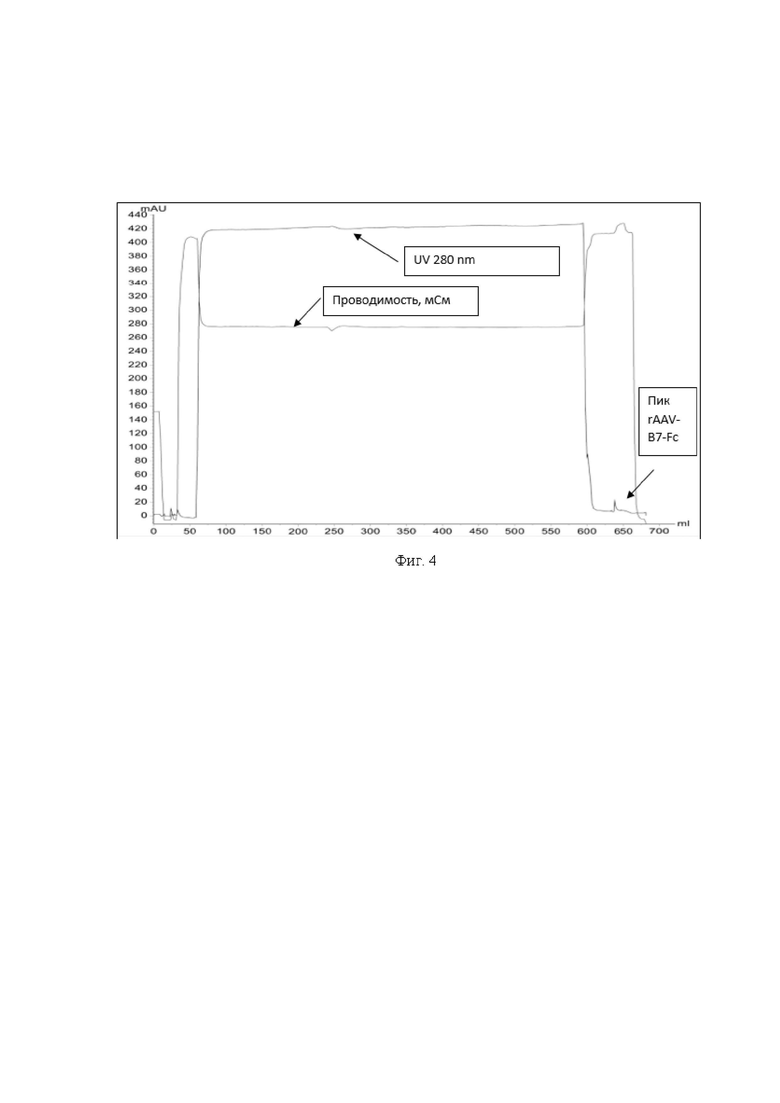
На фиг. 4 представлена хроматограмма аффинной очистки препарата rAAV-B7-Fc.
Ось ординат - поглощение при длине волны 280 нм, mAU
Ось абсцисс - количество жидкости, пропущенное через систему хроматографа, мл
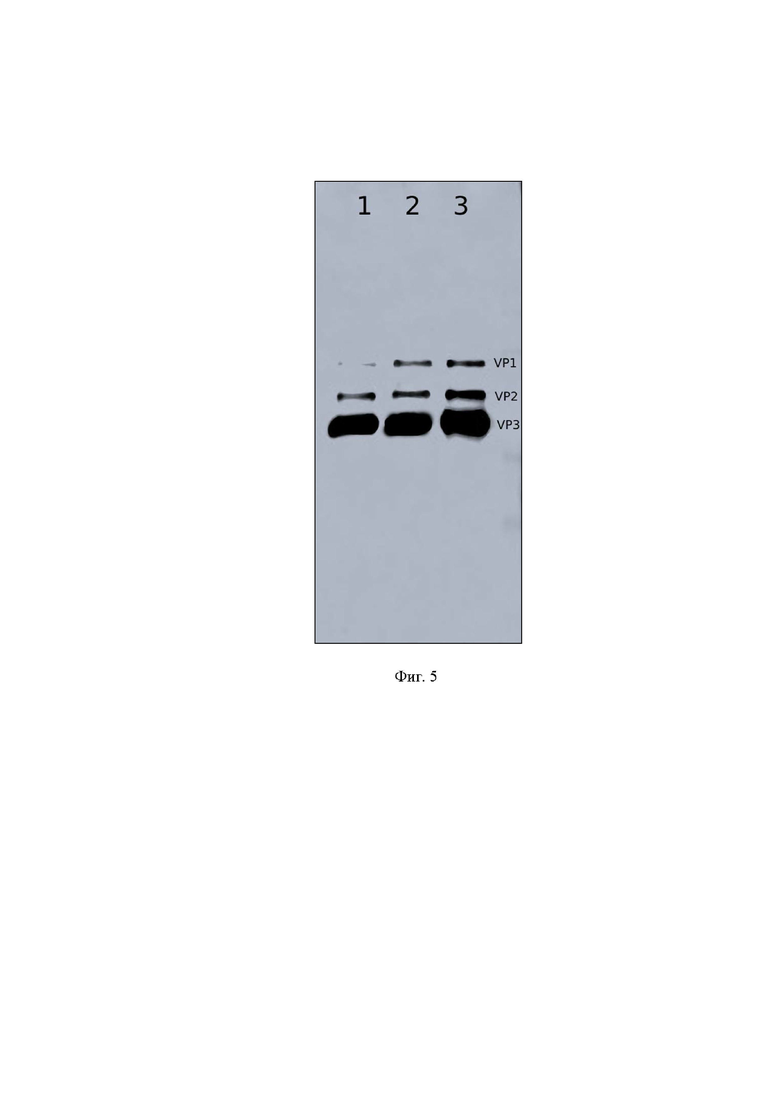
На фиг. 5 представлены результаты оценки подлинности очищенного препарата rAAV-B7-Fc, методом иммуноблоттинга с использованием поликлональных антител к капсидным белкам аденоассоциированного вируса,
где
1,2,3 - фракции препарата rAAV-B7-Fc после хроматографической очистки;
VP1, VP2, VP3 - поверхностные структурные белки аденоассоциированного вируса.
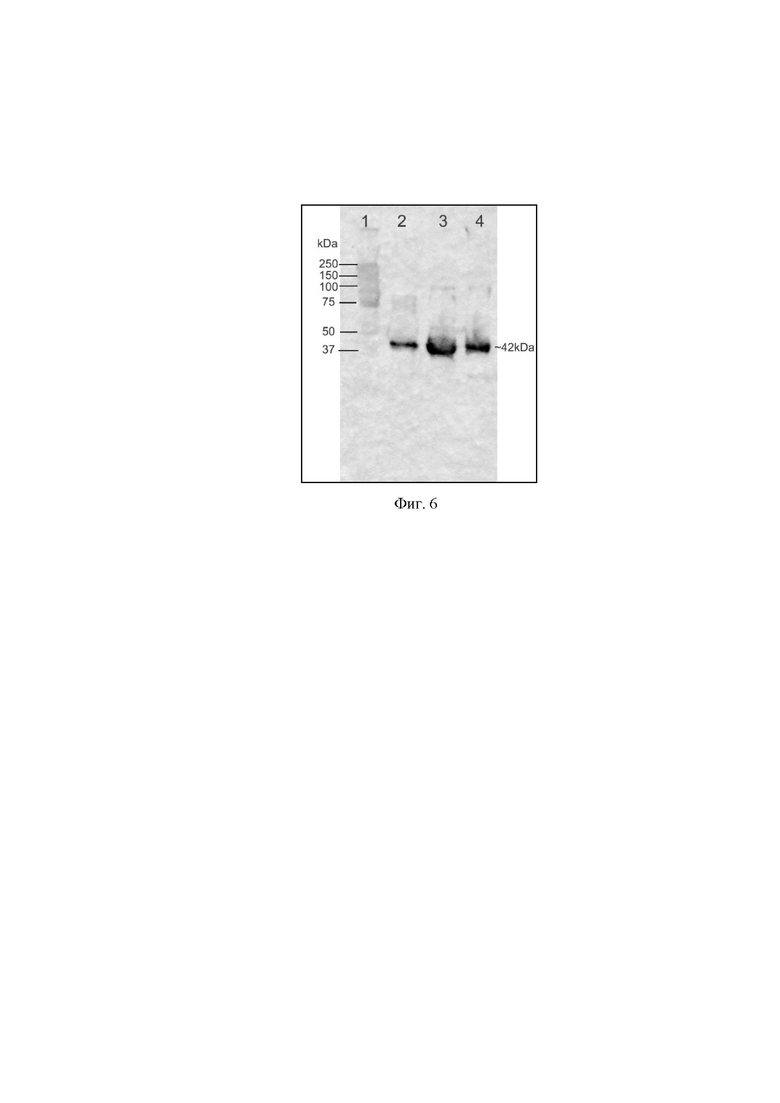
На фиг. 6 представлены результаты оценки экспрессии рекомбинантного антитела B7-Fc в составе очищенного препарата rAAV-B7-Fc, методом иммуноблоттинга с использованием моноклональных антител к Fc-фрагменту IgG человека,
где
1 - маркер молекулярного веса Precision Plus Dual Color (Bio-Rad);
2,3,4 - образцы культуральной жидкости клеток НЕК293, трансдуцированных препаратом rAAV-B7-Fc в различных дозировках.
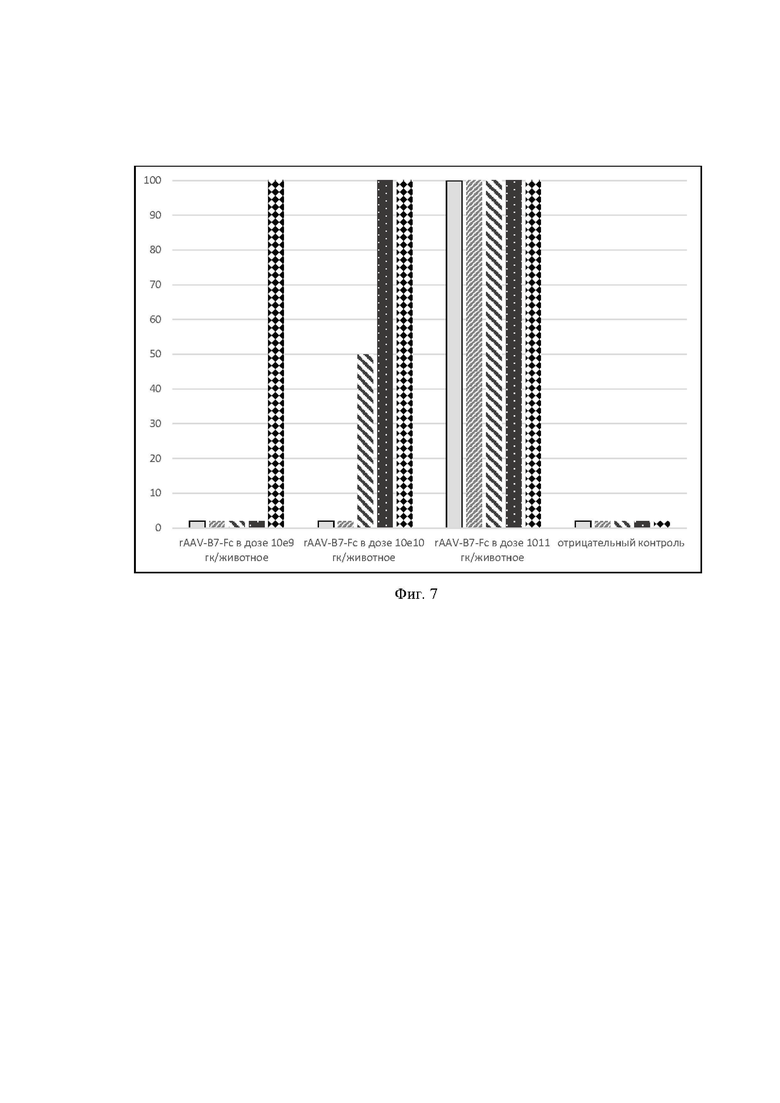
На фиг. 7 представлены данные по изучению протективной активности различных доз препарата rAAV-B7-Fc против 10ЛД50 ботулотоксина типа А.
Ось ординат - выживаемость животных, %
Ось абсцисс - группы животных с различными дозировками препарата.
 - мыши, получившие 10ЛД50 ботулотоксина типа А, на 3 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
- мыши, получившие 10ЛД50 ботулотоксина типа А, на 3 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
 - мыши, получившие 10ЛД50 ботулотоксина типа А, на 7 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
- мыши, получившие 10ЛД50 ботулотоксина типа А, на 7 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
 - мыши, получившие 10ЛД50 ботулотоксина типа А, на 10 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
- мыши, получившие 10ЛД50 ботулотоксина типа А, на 10 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
 - мыши, получившие 10ЛД50 ботулотоксина типа А, на 14 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
- мыши, получившие 10ЛД50 ботулотоксина типа А, на 14 сутки после введения препарата или плацебо (фосфатно-солевой буфер);
 - мыши, получившие 10ЛД50 ботулотоксина типа А, на 21 сутки после введения препарата или плацебо (фосфатно-солевой буфер).
- мыши, получившие 10ЛД50 ботулотоксина типа А, на 21 сутки после введения препарата или плацебо (фосфатно-солевой буфер).
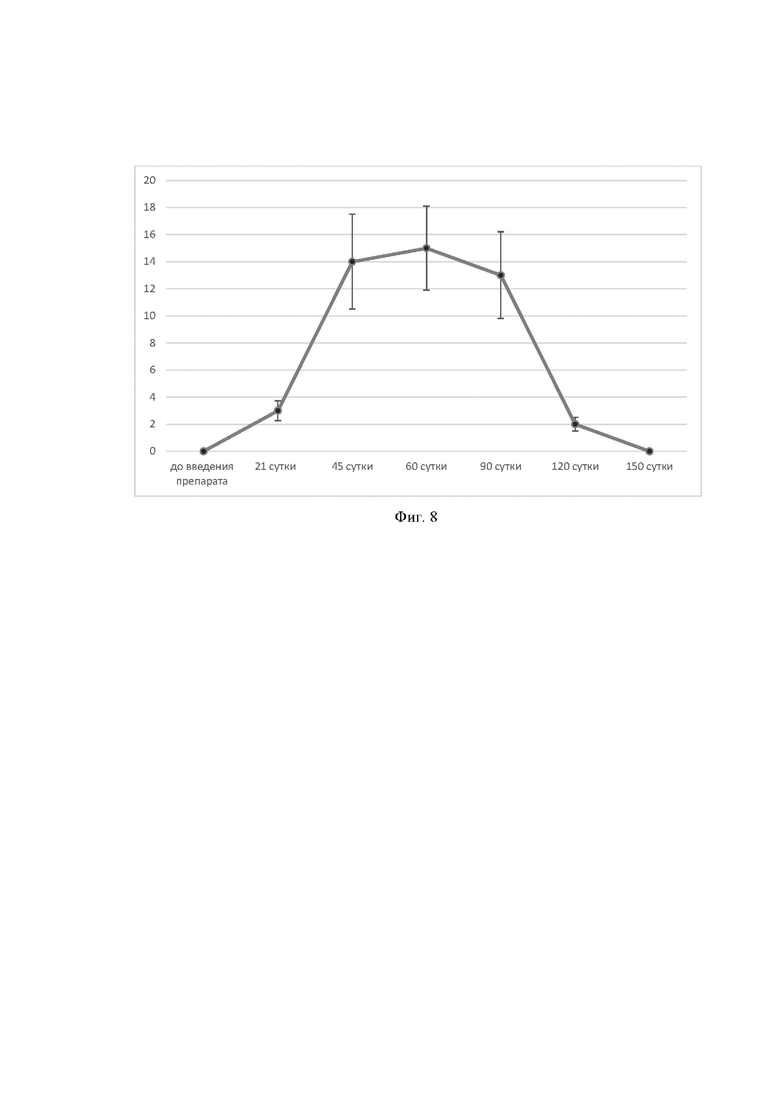
На фиг. 8. Представлены результаты изучения фармакокинетических свойств рекомбинантного антитела B7-Fc, при введении мышам препарата rAAV-B7-Fc, в дозе 1011 гк на животное однократно.
Ось ординат - концентрация рекомбинантного антитела B7-Fc в сыворотки крови мышей, получивших препарат rAAV-B7-Fc, нг/мл.
Ось абсцисс - временные точки забора образцов сыворотки, суток.
На фиг. 9 представлены результаты изучение возможности применения препарата rAAV-B7-Fc, для длительной профилактики интоксикации, вызванной ботулотоксином типа А.
Ось ординат - выживаемость животных, %.
Ось абсцисс - временные точки введения 10ЛД50 ботулотоксина типа А.
 - мыши, получившие препарат rAAV-B7-Fc в дозе 1011 гк на животное однократно.
- мыши, получившие препарат rAAV-B7-Fc в дозе 1011 гк на животное однократно.
 - мыши, получившие фосфатно-солевой буфер.
- мыши, получившие фосфатно-солевой буфер.
Осуществление изобретения
Для осуществления настоящего изобретения на первом этапе получают плазмидную систему необходимую для сборки рекомбинантного аденоассоциированного вирусного вектора rAAV-B7-Fc. Для этого была использована трехплазмидная система AVV-DJ Packaging System (Cell Biolabs, Inc), содержащая плазмиды pAAV-DJ-EGFP, несущую гены зеленого флуоресцентного белка в качестве трансгена, pAAV-DJ-Vector, несущую гены rep и cap, и pAAV-DJ-Helper, несущую гены областей E2a, E4, VA аденовируса. Необходимые рекомбинантные плазмиды получали в препаративных количествах путем трансформации клеток E. coli штамма Dh5α. Плазмиды выделяли с помощью коммерческого набора для выделения ДНК PureLink™ HiPure Plasmid Maxiprep Kit. Для проверки полученных плазмид проводили рестрикционные гидролизы с использованием специфических эндонуклеаз рестрикции. Все полученные в результате рестрикционного гидролиза фрагменты полностью соответствуют по молекулярной массе теоретически расчетным. Для получения плазмиды, несущей ген однодоменного антитела, слитого Fc-фрагментом IgG1 человека и специфичное к ботулиническому нейротоксину типа А, использовали плазмиду pAAV-DJ-EGFP. Нуклеотидную последовательность гена однодоменного антитела, слитого Fc-фрагментом IgG1 человека и специфичное к ботулиническому нейротоксину типа А (SEQ ID NO: 2) синтензировали в ЗАО «Евроген» и клонировали в плазмиду pAAV-DJ-EGFP, заменяя ген зеленого флуоресцирующего белка по сайтам рестрикции EcoRI и XbaI, что делает возможным получение rAAV, экспрессирующего данное антитело, в описанной системе. Таким образом, получали плазмиду pAAV-DJ-B7-Fc, содержащую инвертированные концевые повторы рекомбинантного аденоассоциированного вируса человека 2 серотипа, со встроенной экспрессионной кассетой, содержащей ген рекомбинантного антитела B7-Fc.
Специалистам в данной области известно, что для получение рекомбинантного аденоассоциированного вирусного вектора можно использовать любые другие плазмидные системы. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие нуклеотидную последовательность, кодирующую рекомбинантное антитело (SEQ ID NO: 1).
Также, специалистам в данной области известно, что в целях осуществления настоящего изобретения последовательность рекомбинатного антитела (SEQ ID NO: 1), специфичного к ботулиническому нейротоксину типа А, может содержать в себе аминокислотные замены, которые не сказываются на вторичной и третичной структуре рекомбинатного антитела и не влияют на его способность связывать и нейтрализовать ботулинический нейротоксин типа А. Более того, поскольку в связывании с антигеном участвуют только антигенсвязывающие петли (CDR домены) однодоменных антител, то, как известно специалистам в данной области, любой иммуноглобулин или его аналог, содержащий такие же аминокислотные последовательности CDR доменов, попадает под объем настоящего изобретения. Более того, последовательности CDR доменов могут содержать замены/делеции/вставки аминокислот, которые при парном выравнивании аминокислотных последовательностей обеспечивают гомологичность не менее 70% и не оказывают качественного влияния на способность связываться с антигеном. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие нуклеотидную последовательность, кодирующую последовательности CDR доменов, гомология которых составляет не менее 70% с предлагаемыми последовательностями.
Кроме того, специалистам в данной области известно, что в целях осуществления настоящего изобретения нуклеотидная последовательность, кодирующая рекомбинантное антитело, может отличаться, основываясь на принципе вырожденности генетического кода. Таким образом, любые плазмидные системы могут быть использованы для получения рекомбинантного аденоассоциированного вирусного вектора, содержащие последовательности нуклеотидов, кодирующие аминокислотную последовательность рекомбинантного антитела SEQ ID NO: 1.
После трансформации компетентных бактерий E.coli и их лизиса выделение суперскрученной ДНК проводили на наборе PlasmidSelect Xtra Starter Kit согласно инструкции производителя. После хроматографической очистки плазмидные ДНК переосаживали ацетатом натрия для избавления от ЭДТА и других составляющих буфера, способных к ингибированию процесса трансфекции.
Далее для получения аденоассоциированного вирусного вектора, экспрессирующего рекомбинантное антитело, специфичное к ботулиническому нейротоксину типа А, полученными плазмидами трансфецировали клеточную линию НЕК293, в которой происходила продукция и сборка рекомбинантного аденоассоциированного вируса, несущего ген рекомбинантного антитела специфичного к ботулиническому токсину типа А. Очистку рекомбинантного аденоассоциированного вируса, несущего ген рекомбинантного антитела специфичного к ботулиническому токсину типа А, осуществляли при помощи тангенцальной фильтрации и аффинной хроматографии.
Специалистам в данной области известно, что в целях осуществления настоящего изобретения для продукции и сборки рекомбинантного аденоассоциированного вирусного вектора можно использовать другие эукариотические системы экспрессии. При необходимости способ получения дополнительно включает в себя выделение и очистку любым способом, известным в данной области.
Далее авторами, были изучены количественные и качественные характеристики полученного препарата rAAV-B7-Fc, была оценена продукция рекомбинантного антитела в составе полученного препарата rAAV-B7-Fc.
При изучении полученного препарата rAAV-B7-Fc in vivo, была оценена фармакокинетика рекомбинантного антитела в сыворотке крови мышей, получивших препарат rAAV-B7-Fc. Была подобрана оптимальная доза препарата rAAV-B7-Fc, обеспечивающая продолжительную защиту от 10ЛД50 ботулотоксина типа А. Была изучена фармакокинетика рекомбинантного антитела B7-Fc в организме мышей, получивших препарат rAAV-B7-Fc. Была оценена продолжительность протективной активности rAAV-B7-Fc против 10ЛД50 ботулотоксина типа А. Было продемонстрировано, что протективная активность препарата начинается с 3 дня составляет не менее 120 дней после введения.
Кроме того, разработан способ профилактики интоксикации, вызываемой ботулотоксином типа А, заключающийся во внутримышечном введении в эффективном количестве препарата рекомбинантного аденоассоциированного вируса rAAV-B7-Fc, несущего ген рекомбинантного антитела специфичного к ботулиническому токсину типа А.
Осуществление изобретения подтверждается следующими примерами.
Пример 1. Получение плазмидных конструкций
Для получения генетических конструкций, необходимых для сборки и продукции рекомбинантного аденоассоциированного вирусного вектора использовали систему AAV-DJ Packaging System (Cell Biolabs, Inc), состоящую из плазмид pAAV-DJ Vector, pHelper Vector и pAAV-GFP Control Vector. Нуклеотидную последовательность, кодирующую однодоменное антитело, слитое с Fc-фрагментом, синтезировали в ЗАО «Евроген» и клонировали в плазмиду pAAV-EGFP Control Vector, заменяя ген EGFP по сайтам рестрикции EcoRI и XbaI, получив конструкцию pAAV-DJ-В7-Fc (фиг. 1). Схематическое изображение рекомбинантного антитела В7-Fc представлено на фиг.2.
Полученную плазмиду наращивали в E.coli. Для этого бактерии трансформировали целевыми плазмидами методом теплового шока. Компетентные клетки получали по стандартным протоколам. При проведении трансформации к компетентным клеткам штамма Dh5α добавляли 5-10 нг целевой плазмидной ДНК, инкубировали на льду 30 минут. После инкубации пробирку с клетками помещали в водяную баню при температуре 42 °C на 45 секунд. Затем инкубировали на льду в течение 10 минут, добавляли 1 мл среды SOB и инкубировали при 37 °C в течение 1 часа на шейкер-инкубаторе. Впоследствии с помощью селективных антибиотиков их помещали в чашки Петри на твердую среду и инкубировали при 37 °С в течение ночи. После 16 часов инкубации отобранные колонии высевали в колбы с 100 мл среды LB и инкубировали в шейкер-инкубаторе при 210 об/мин 16-18 часов при 37 °С.
Целевые плазмидные ДНК полученные из бактерий Е.coli штаммов DH5α выделяли с помощью набора PureLink HiPure Plasmid Maxiprep Kit (Invitrogen, Thermo Fisher Scientific). Выделение выполняли согласно протоколу производителя. Полученные плазмидные ДНК впоследствии идентифицируются рестрикцией по соответствующим эндонуклеазам рестрикции (фиг. 3). Рестрикционный гидролиз осуществляли путем смешивания в пробирке деионизированной воды и буферной смеси согласно рекомендациям производителей. Добавляли специфические эндонуклеазы рестрикции и целевую плазмидную ДНК, перемешивали с использованием вортекса. Инкубировали в течение 60 минут в термостате при рекомендуемой температуре, описанной производителем для соответствующей эндонуклеазы рестрикции.
Итоговый результат оценивали с помощью горизонтального электрофореза в агарозном геле (0,8%). Визуализировали результаты с помощью системы гель-документирования Gel Doc EZ (Bio-Rad).
Таким образом, в данном примере была получена система плазмидных векторов, необходимая для продукции рекомбинантного аденоассоциированного вируса, несущего ген рекомбинантного антитела (rAAV-В7-Fc).
Пример 2. Продукция rAAV в культуре клеток линии HEK293.
Плазмиды трансфецировали в культуру клеток линии HEK293. Для этого суспензионную культуру клеток HEK293 культивировали в среде BalanCD HEK293 (Fujifilm Irvine Scientifics) приготовленной согласно инструкции производителя. Для культивации использовали колбы Эрленмейера с вентилируемой крышкой объемами 125, 500 и 1000 мл (Corning) с помощью шейкер-инкубатора Multitron (Infors HT) со скоростью перемешивания 110 об/мин при амплитуде 50 мм. В условиях культивирования использовали 37 °С, 80% влажности и 5% CO2. Пассажи проводили при достижении концентрации клеток 2-3*106 кл/мл.
Трансфекцию проводили в 10 культуральных колбах на 1000 мл с объемом клеточной суспензии 200 мл и концентрацией клеток 106 кл/мл. Трансфекцию осуществляли с использованием трансфецирующего агента PEI linear 25 kDa (Polyscience). Конечная концентрация ДНК, используемая для трансфекции, составляла 1 мкг/мл культуральной среды. В качестве среды для трансфекции использовали Opti-MEM™ I Reduced Serum Medium (Gibco™, Thermo Fisher Scientific) в объеме 10% от конечного объема среды. Трансфецирующий агент использовали в концентрации 1 мг/мл. Объем PEI к ДНК брали в соотношении 3:1. Полученную смесь инкубировали при комнатной температуре 7 минут для образования транфецирующего комплекса. После, смесь вносили в культуру клеток. После трансфекции клетки культивировали в течение 5 суток со скоростью перемешивания 110 об/мин при амплитуде 50 мм. В условиях культивирования использовали 37 °С, 80% влажности и 5% CO2. Таким образом, было получено 2000 мл трансфецированной культуральной суспензии.
Количественный выход рекомбинантных вирусных частиц оценивали по количеству геномных копий в клетках на 5 сутки после трансфекции при помощи набора QuickTiter ™ AAV Quantitation Kit (Cell Biolabs) согласно инструкции производителя. Количественный выход рекомбинантного rAAV-В7-Fc составил 5*108 геномных копий на мл культуральной жидкости и тотальный выход на 2л культуральной суспензии 1012 геномных копий.
Таким образом, в результате проделанной работы была получена клеточная суспензия содержащая рекомбинантные аденоассоциированные вирусные частицы rAAV-В7-Fc, содержащие ген однодоменного антитела, специфичного к ботулиническому токсину типа А, слитого с Fc-фрагментом человеческого IgG1.
Пример 3. Очистка препарата rAAV-В7-Fc из клеточной суспензии.
По истечении 5 дней культивирования проводили лизис клеточной суспензии добавлением в культуральную жидкость 1% твин-20, трис-HCl до 20 мМ, хлорида натрия до 50 мМ, хлорида магния до 2 мМ, бензонуклеаза (Merck) 20U на мл культуральной жидкости. Лизис проводили при комнатной температуре в течение 4 часов при слабом перемешивании. После лизиса проводили осветление культуральной жидкости центрифугированием при 8000 об/мин 20 минут и последующую фильтрацию через капсульный фильтр Sartopore 2 0,45/0.2 мкм (Sartorius Stedim Biotech).
Очистку rAAV-В7-Fc проводили с использованием сорбента AVB Sepharose (Cytiva Life Sciences) согласно инструкции производителя. Хроматограмма очистки препарата rAAV-В7-Fc представлена на фиг. 4. Полученный препарат концентрировали с использованием центрифужных концентраторов 50 кДа Amicon Ultra-15 (Merck) и стерилизовали мембранным фильтром 0,22 мкм (MF-Millipore). Концентрацию вирусных частиц (препарата) оценивали с помощью спектрофотометра NanoDrop 2000 (Thermo Scientific, USA) при длине волны 260 нм. Препарат замораживали и хранили при -70°С. В результате хроматографической очистки было получено 4 мл препарата rAAV-В7-Fc с концентрацией 1 ое/мл и соотношением 260/280 = 1.2. Для определения титра полученного препарата использовали набор AAVpro® Titration Kit (for Real Time PCR) Ver.2 согласно инструкции производителя. Количество геномных копий в очищенном препарате составило 1,64*1012/мл.
Таким образом, в данном примере был получен очищенный препарат rAAV-В7-Fc с общей концентрацией геномных копий 6,56*1012 гк/мл.
Пример 4. Оценка подлинности препарата rAAV-В7-Fc.
Для оценки подлинности, полученного препарата rAAV-В7-Fc, применяли метод иммуноблотинга с использованием антител специфичных к капсидным белкам AAV. Для этого очищенный препарат вносили в 4-20% полиакриламидном геле (4-20% Mini-PROTEAN TGX Precast Protein Gels, 15-well, 15 μl #4561096, Bio-Rad) с использованием красителя для образцов 4x Laemmli Sample Buffer (#161-0747, BioRad) с добавлением 2-Mercaptoethanol (Sigma-Aldrich) для анализа в восстанавливающих условиях. Иммуноблотинг проводили по стандартной методике, используя для переноса белков мембрану Amersham Protran Premium 0.45 μm NC (GE Healthcare Life science) с использованием Trans-Blot Turbo Transfer System. Далее мембрану инкубировали в 5% растворе обезжиренного молока (Sigma-Aldrich) в PBS-T для блокировки. Затем добавляли первичные антитела Adeno-Associated Virus 2 / AAV2 (VP1 + VP2 + VP3) Rabbit Polyclonal Antibody (OriGene) в соотношении 1:1000 и инкубировали в течение 60 минут. После, проводили трехкратную отмывку в PBS-T. Затем добавляли конъюгат антикроличьи антитела, меченные пероксидазой хрена, в соотношении 1:2500 и инкубировали в течение 60 минут. После, проводили пятикратную отмывку в 0,1 % PBS-T и визуализировали, используя ECL Substrate (Bio-Rad) и Amersham Imager 600 (GE Healthcare). Результаты анализа представлены на фиг. 5.
Из полученных результатов следует, что полученный препарат действительно является аденоассоциированным вирусом, так в нем присутствуют все структурные белки, а именно VP1, VP2, VP3.
Таким образом, в данном примере была подтверждена подлинность препарата rAAV-В7-Fc.
Пример 5. Оценка трансдуцирующей способности и экспрессии рекомбинантного антитела в составе препарата rAAV-В7-Fc.
Для оценки трансдуцирующей способности и экспрессии трансгена в составе препарата rAAV-В7-Fc, очищенным препаратом трансдуцировали культуру клеток HEK293. Для этого на 96-луночный планшет высевали клетки в среде DMEM (4 мМ глутамина, 10% FBS, бикарбонат натрия 3,8 г/л) в объеме 100 мкл с концентрацией 0,5*106 клеток/мл. Спустя 4 часа вносили 10 мкл препарата rAAV-В7-Fc после очистки. Спустя 48 часов отбирали культуральную жидкость для дальнейшего анализа. Культуральную жидкость оценивали белковым электрофорезом, в 4-20% полиакриламидном геле (4-20% Mini-PROTEAN TGX Precast Protein Gels, 15-well, 15 μl #4561096, Bio-Rad) с использованием красителя для образцов 4x Laemmli Sample Buffer (#161-0747, BioRad) с добавлением 2-Mercaptoethanol (Sigma-Aldrich) для анализа в восстанавливающих условиях. Иммуноблотинг проводили по стандартной методике, используя для переноса белков мембрану Amersham Protran Premium 0.45 μm NC (GE Healthcare Life science) с использованием Trans-Blot Turbo Transfer System. Далее мембрану инкубировали в 5% растворе обезжиренного молока (Sigma-Aldrich) в PBS-T для блокировки. Затем добавляли конъюгат Anti-Human IgG (Fc specific) Peroxidase antibody produced in goat (Sigma-Aldrich) в соотношении 1:2500 и инкубировали в течение 60 минут. После, проводили пятикратную отмывку в 0,1 % PBS-T и визуализировали, используя ECL Substrate (Bio-Rad) и Amersham Imager 600 (GE Healthcare). Результаты анализа представлены на фиг. 6.
Из полученных результатов следует, что клетки, трансдуцированные препаратом rAAV-В7-Fc, экспрессируют рекомбинантное антитело B7-Fc, специфичное к ботулотоксину типа А.
Таким образом, в данном примере была подтверждена экспрессия рекомбинантного антитела, специфичного к ботулотоксину типа А, в составе препарата rAAV-В7-Fc.
Пример 6. Подбор оптимальной дозы препарата rAAV-В7-Fc для индукции защиты против летальной дозы ботулинического токсина.
Целью данного эксперимента являлась оценка способности разработанного препарата rAAV-В7-Fc, защищать против летальной дозы ботулинического нейротоксина типа А.
Изучение протективной активности препарата rAAV-В7-Fc проводили на летальной модели интоксикации мышей линии BALB/c 10ЛД50 ботулинического нейротоксина типа А (ботулотоксина). В эксперименте использовали 40 мышей 18-20 гр. Животные были разделены на 4 группы, которым вводили:
1) Внутримышечно, во внутреннюю поверхность бедра препарат rAAV-В7-Fc в дозе 109 гк/животное (итого 10 животных),
2) Внутримышечно, во внутреннюю поверхность бедра препарат rAAV-В7-Fc в дозе 1010 гк/животное (итого 10 животных),
3) Внутримышечно, во внутреннюю поверхность бедра препарат rAAV-В7-Fc в дозе 1011 гк/животное (итого 10 животных),
4) Внутримышечно, во внутреннюю поверхность бедра фосфатно-солевой буфер, отрицательный контроль (итого 10 животных).
Затем, на 3-и, 7-е, 10-е, 14-е и 21-е сутки, после введения препарата мышам вводили 10ЛД50 ботулотоксина типа А. Для каждой временной точки использовали 2 мыши из группы. В результате эксперимента было продемонстрировано, что введение препарата rAAV-В7-Fc в дозе 109 гк/животное, обеспечивает протекцию против 10ЛД50 ботулотоксина типа А, начиная с 21-х суток, введение препарат rAAV-В7-Fc в дозе 1010 гк/животное обеспечило частичную защиту на 10-ые сутки после введения и полную на 14 сутки после введения, и, наконец, введение препарат rAAV-В7-Fc в дозе 1011 гк/животное, обеспечило полную защиту мышей уже с 3-го дня после введения. Результаты эксперимента представлены на фиг. 7.
Из результатов данного эксперимента следует, что все дозы препарата rAAV-В7-Fc обладают протективной активностью против 10ЛД50 ботулотоксина типа А, однако доза 1011 гк/животное обеспечивает защиту начиная с 3 дня после введения. Следовательно, исходя из того, что мышь весит около 20гр, в пересчете на человека рабочие дозы препарата будут составлять от 5*1010 гк/кг веса до 5*1012 гк/кг веса. При этом, оптимальная доза для индукции полной защиты с 3его для после введения составляет 5*1012 гк/кг веса.
Таким образом, в данном примере была подобрана оптимальная доза препарата rAAV-В7-Fc (1011 гк/животное), обеспечивающая защиту против 10ЛД50 ботулотоксина типа А. Была определена протективная доза препарата rAAV-В7-Fc, которая составляет от 5*1010 гк/кг до 5*1012 гк/кг веса.
Пример 7. Изучение фармакокинетики рекомбинантного антитела В7-Fc в организме мышей, получивших препарат rAAV-В7-Fc.
Для изучения длительности циркуляции рекомбинантного антитела В7-Fc, 10 мышам линии BALB/c вводили препарат rAAV-В7-Fc в дозе 1011 гк/животное. Далее у мышей отбирали сыворотку и анализировали в ней количество рекомбинантного антитела В7-Fc методом непрямого ИФА использую набор для количественного определения IgG человека в сыворотке крови «Вектор-БЕСТ», в качестве стандартов использовали очищенный аффинной хроматографией препарат рекомбинантного антитела В7-Fc, а в качестве конъюгата использовали антитела 933NA (GE healthcare, США). Для анализа отбирали следующие точки: до введения, на 21, 45, 60, 90, 120, 150-е сутки после введения. Для каждой точки отбирали образцы сыворотки минимум у двух животных. Результаты анализа представлены на фиг. 8. Было продемонстрировано, что концентрация рекомбинантного антитела В7-Fc в сыворотке крови на 21-е сутки после введения составляет около 3 нг/мл. Пик концентрации антитела наблюдается на 60-е сутки после введения и составляет 15 нг/мл. После 90 суток, наблюдается значительное падение концентрации антитела В7-Fc и в промежутке между 120-ми и 150-ми сутками, после введения препарата rAAV-В7-Fc происходит полное выведение антител из организма.
Таким образом, в данном примере продемонстрировано, что рекомбинантного антитело В7-Fc, способно циркулировать в организме млекопитающих в течение как минимум 120 дней, с момента введения препарата rAAV-В7-Fc.
Пример 8. Способ профилактики интоксикации вызванной ботулиническим токсином типа А.
В данном примере, была изучена возможно индукции длительной защиты, против интоксикации, вызванной ботулотоксином типа А и применения препарата rAAV-В7-Fc в качестве средства профилактики интоксикации, вызванной ботулотоксином типа А.
В данном эксперименте использовали мышей линии BALB/c, которых разделили на 2 группы, по 30 голов в каждой. Опытной группе вводили препарат rAAV-В7-Fc (1011 гк/животное) внутримышечно в заднюю поверхность бедра. Далее по 3 мышам из опытной и контрольной группы вводили 10ЛД50 ботулотоксина типа А на 0, 3, 21, 45, 60, 75, 90, 105, 120, 150 сутки после введения препарата rAAV-В7-Fc. Результаты эксперимента представлены на фиг. 9. В результате, было продемонстрировано, что животные, получившие rAAV-В7-Fc, защищены от летальной дозы ботулотоксина типа А с 3 по, как минимум 120 сутки после введения препарата. При этом гибель контрольных животных наблюдалась во всех временных точках.
Таким образом, в данном эксперименте была продемонстрирована возможность использования препарата rAAV-В7-Fc для профилактики интоксикации, вызванной ботулотоксином типа А. При этом защитный эффект при введении 5*1012 гк/кг веса, обеспечивает защиту с 3 по 120 сутки после введения препарата.
Для обеспечения защиты от 10ЛД50 ботулотоксина типа А, человеку данный препарат можно вводиться в концентрации от 5*1010 до 5*1012 гк на кг веса.
Промышленная применимость
Все приведенные примеры подтверждают эффективность созданного вектора на основе аденоассоциированного вируса человека, экспрессирующего рекомбинантного антитело и обладающего защитными свойствами против ботулинического нейротоксина типа А и его промышленную применимость.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ФГБУ "НИЦЭМ им. Н.Ф.Гамалеи" Минздрава России
<120> Экспрессионный вектор на основе аденоассоциированного
вируса, обладающий защитными свойствами против интоксикации,
вызванной ботулиническим нейротоксином типа А.
<160> 4
<170> BISSAP1.3.6
<210> 1
<211> 356
<212> PRT
<213> Artificial Sequence
<220>
<223> аминокислотная последовательность рекомбинантного антитела
B7-Fc, представляющего собой однодоменное антитело B7,
модифицированное Fc-фрагментом
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Ala Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ser Ser Ser Ser Tyr
20 25 30
Gly Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Asn Trp Ser Gly Gly Ser Thr His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Thr Leu Gly Gly Tyr Tyr Tyr Ile Tyr Glu Tyr Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Ser Ser Thr Met Val Arg
115 120 125
Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
130 135 140
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
145 150 155 160
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
165 170 175
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
180 185 190
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
195 200 205
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
210 215 220
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
225 230 235 240
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
245 250 255
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
260 265 270
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
275 280 285
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
290 295 300
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
305 310 315 320
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
325 330 335
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
340 345 350
Ser Pro Gly Lys
355 360 365
<210> 2
<211> 1068
<212> DNA
<213> Artificial Sequence
<220>
<223> нуклеотидная последовательность рекомбинантного антитела B7,
представляющего собой однодоменное антитело B7, модифицированное
Fc-фрагментом
<400> 2
GAGGTGCAGC TGGTGGAGTC TGGGGGAGGA GCGGTGCAGG CTGGGGGCTC TTTGAGACTT 60
TCCTGTGCAG CCTCTGGACG CTCCTCCAGT AGCTATGGCA TGGGCTGGTT CCGCCAGGCT 120
CCAGGGAAGG AGCGTGAGTT TGTAGCAGCT ATTAACTGGA GTGGTGGTAG CACACACTAT 180
GCAGACTCCG TGAAGGGCCG ATTCACCATC TCCAGAGACA ACGCCAAGAA CACGGTGTAT 240
CTGCAAATGA ACAGCCTGAA ACCTGAGGAC ACGGCCGTTT ATTACTGTGC AGCAACCCTC 300
GGGGGTTACT ACTATATATA TGAGTATGAC TACTGGGGCC AGGGGACCCA GGTCACTGTC 360
TCCTCATCGA GCACCATGGT TAGATCTGAC AAAACTCACA CATGCCCACC GTGCCCAGCA 420
CCTGAACTCC TGGGGGGACC GTCAGTCTTC CTCTTCCCCC CAAAACCCAA GGACACCCTC 480
ATGATCTCCC GGACCCCTGA GGTCACATGC GTGGTGGTGG ACGTGAGCCA CGAAGACCCT 540
GAGGTCAAGT TCAACTGGTA CGTGGACGGC GTGGAGGTGC ATAATGCCAA GACAAAGCCG 600
CGGGAGGAGC AGTACAACAG CACGTACCGT GTGGTCAGCG TCCTCACCGT CCTGCACCAG 660
GACTGGCTGA ATGGCAAGGA GTACAAGTGC AAGGTCTCCA ACAAAGCCCT CCCAGCCCCC 720
ATCGAGAAAA CCATCTCCAA AGCCAAAGGG CAGCCCCGAG AACCACAGGT GTACACCCTG 780
CCCCCATCCC GGGAGGAGAT GACCAAGAAC CAGGTCAGCC TGACCTGCCT GGTCAAAGGC 840
TTCTATCCCA GCGACATCGC CGTGGAGTGG GAGAGCAATG GGCAGCCGGA GAACAACTAC 900
AAGACCACGC CTCCCGTGCT GGACTCCGAC GGCTCCTTCT TCCTCTACAG CAAGCTCACC 960
GTGGACAAGA GCAGGTGGCA GCAGGGGAAC GTCTTCTCAT GCTCCGTGAT GCACGAGGCT 1020
CTGCACAACC ACTACACGCA GAAGAGCCTC TCCCTGTCTC CGGGTAAA 1068
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Однодоменное антитело и его модификации, специфически связывающиеся с ботулиническим нейротоксином типа А, и способ их применения для терапии или экстренной профилактики интоксикации, вызванной ботулиническим нейротоксином типа А. | 2021 |
|
RU2766348C1 |
| ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2017 |
|
RU2762257C2 |
| СЛИТЫЙ БЕЛОК КОРОТКОЙ ФОРМЫ ФАКТОРА ЖИЗНЕСПОСОБНОСТИ КОЛБОЧЕК, ПОЛУЧЕННОГО ИЗ ПАЛОЧЕК, И ГИДРОФИЛЬНОГО ПЕПТИДА | 2017 |
|
RU2773368C2 |
| Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок SMN1, и ее применение | 2020 |
|
RU2742837C1 |
| РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ С МОДИФИЦИРОВАННЫМ ТРОПИЗМОМ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛЕННОГО ВВЕДЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА В КЛЕТКИ ЧЕЛОВЕКА | 2018 |
|
RU2809246C2 |
| ГЕНОТЕРАПЕВТИЧЕСКИЕ КОНСТРУКЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА | 2020 |
|
RU2807158C2 |
| Синергетическое действие SMN1 и miR-23a при лечении спинальной мышечной атрофии | 2021 |
|
RU2839898C2 |
| КОМПОЗИЦИЯ ДЛЯ ОБЛЕГЧЕНИЯ ИЛИ ЛЕЧЕНИЯ БОЛИ | 2017 |
|
RU2725830C1 |
| Выделенный модифицированный белок VPI капсида аденоассоциированного вируса 9 серотипа (AAV9), капсид и вектор на его основе | 2021 |
|
RU2825667C2 |
| Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2019 |
|
RU2751592C2 |
Группа изобретений относится к биотехнологии, иммунологии и микробиологии. Создан экспрессионный вектор на основе аденоассоциированного вируса, со встроенной генетической конструкцией, содержащей нуклеотидную последовательность SEQ ID NO: 2, кодирующую рекомбинантное антитело SEQ ID NO: 1, а также предложено применение данного вектора для профилактики интоксикации, вызываемой ботулиническим нейротоксином типа А. Группа изобретений обеспечивает создание рекомбинантного вирусного вектора, который обладает меньшим воспалительным потенциалом и более продолжительным временным интервалом протективной активности. 2 н. и 4 з.п. ф-лы, 9 ил., 8 пр.
1. Экспрессионный вектор на основе рекомбинантного аденоассоциированного вируса, со встроенной генетической конструкцией, содержащей нуклеотидную последовательность SEQ ID NO: 2, кодирующую рекомбинантное антитело SEQ ID NO: 1.
2. Экспрессионный вектор по п. 1, отличающийся тем, что экспрессируемое в его составе рекомбинантное антитело, представляющее собой однодоменное антитело, слитое с Fc-фрагментом иммуноглобуллина G1 человека.
3. Экспрессионный вектор по п. 2, отличающийся тем, что экспрессируемое в его составе рекомбинантное антитело специфично связывает ботулотоксин типа А.
4. Экспрессионный вектор по п. 1, отличающийся тем, что его введение млекопитающим в эффективном количестве обеспечивает продолжительную экспрессию в организме рекомбинантного антитела, специфичного к ботулотоксину типа А.
5. Экспрессионный вектор по п. 4, отличающийся тем, что его введение млекопитающим в эффективном количестве обеспечивает длительную защиту от летальной дозы ботулотоксина типа А.
6. Применение экспрессионного вектора по пп. 1-5 для профилактики интоксикации, вызванной ботулиническим нейротоксином типа А.
| WO 2018022668 A2, 01.02.2018 | |||
| WO 2008116165 A9, 25.09.2008 | |||
| US 20060259995 A1, 16.11.2006 | |||
| RU 2016144146 A, 11.05.2018 | |||
| Т.Н | |||
| Королькова, В.О | |||
| Матыцин и др., Роль антителогенеза в формировании резистентности к препаратам ботулотоксина A в эстетической практике, РОССИЙСКИЙ ЖУРНАЛ КОЖНЫХ И ВЕНЕРИЧЕСКИХ БОЛЕЗНЕЙ, 2013, номер 6, стр.43-47. |
Авторы
Даты
2022-03-23—Публикация
2021-12-28—Подача