Уровень техники
Двойные сигнальные белки (DSP), также известные как преобразующие сигналы белки (SCP), которые в настоящее время известны как бифункциональные слитые белки, которые связывают внеклеточную часть мембранного белка типа I (внеклеточный амино-конец), с внеклеточной частью мембранного белка типа II (внеклеточный карбоксильный конец), образуя слитый белок с двумя активными сторонами (смотрите, например, патенты США № 7569663 и 8039437, оба из которых включены в настоящий документ посредством ссылки, как если бы они были полностью изложены в настоящем документе).
PD1 представляет собой поверхностный коингибирующий рецептор суперсемейства иммуноглобулинов. PD1 экспрессируется на Т-клетках, В-клетках, моноцитах, натуральных киллерах, дендритных клетках и многих инфильтрирующих опухоль лимфоцитах (TIL). PD1 имеет два лиганда: PDL1 (также называемый B7H1; CD274) и PDL2 (B7DC; CD273), которые являются коингибирующими. PDL1 экспрессируется на покоящихся Т-клетках, В-клетках, дендритных клетках, макрофагах, эндотелиальных клетках сосудов и островковых клетках поджелудочной железы. Также известно, что PDL1 экспрессируется при различных типах рака, особенно при NSCLC, меланоме, почечно-клеточной карциноме, раке желудка, гепатоцеллюлярном, а также при кожном раке и различных лейкозах, множественной миеломе и других. Экспрессия PDL2 наблюдается только на макрофагах и дендритных клетках и намного менее распространена, чем PDL1, среди типов опухолей. Экспрессия PDL1 индуцируется множеством провоспалительных молекул, включая в себя IFN-γ I и II типов, TNF-α, LPS, GM-CSF и VEGF, а также цитокины IL-10 и IL-4, причем IFN-γ представляет собой самый мощный индуктор. Опухолевое микроокружение усиливает экспрессию PDL1, тем самым способствуя супрессии иммунитета. В ответ на иммунную атаку раковые клетки сверхэкспрессируют PDL1, который связывается с рецептором PD1 на Т-клетках, ингибируя активацию Т-клеток, таким образом, супрессируя атаку Т-клеток и вызывая ускользание от иммунного ответа опухоли. Путь PD1/PDL1 регулирует иммунную супрессию с помощью нескольких механизмов:
• индуцирует апоптоз активированных Т-клеток,
• ограничивает активность цитотоксических Т-лимфоцитов (CTL-CD8),
• ингибирует пролиферацию Т-клеток,
• облегчает Т-клеточную толерантность и истощение,
• улучшает функцию регуляторных Т-клеток,
• ограничивает нарушенную активацию Т-клеток и производство IL-2.
4-1BBL представляет собой активирующий лиганд рецептора 4-1BB (CD137), представителя суперсемейства рецепторов TNF и мощную костимулирующую молекулу Т-клеток, индуцированную активацией. 4-1BBL в норме образует гомотример, но передача сигналов через 4-1BB требует значительной олигомеризации 4-1BBL. 4-1BBL присутствует на различных антигенпрезентирующих клетках (APC), включая в себя дендритные клетки (DC), B-клетки и макрофаги. Рецептор 4-1BB не обнаруживается (<3%) в покоящихся Т-клетках или Т-клеточных линиях, однако 4-1BB стабильно активируется при активации Т-клеток. Активация 4-1BB активирует гены выживания, усиливает деление клеток, индуцирует производство цитокинов и предотвращает вызванную активацией гибель клеток у Т-клеток.
Дополнительный предшествующий уровень техники настоящего изобретения включает в себя:
публикацию Международной заявки на патент № WO2017059168;
публикацию Международной заявки на патент № WO2001/049318;
публикацию Международной заявки на патент № WO2016/139668;
публикацию Международной заявки на патент № WO2014/106839;
публикацию Международной заявки на патент № WO2012/042480;
публикацию заявки на патент США № 20150183881;
публикацию заявки на патент США № US20070110746;
публикацию заявки на патент США № US20070036783; а также
патент США № US9562087.
Сущность изобретения
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, содержащий единственный аминокислотный линкер между PD1 и 4-1BBL.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, причем аминокислотная последовательность PD1 составляет 123-166 аминокислот в длину.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, причем аминокислотная последовательность PD1 содержит SEQ ID NO: 2.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен слитый белок PD1-4-1BBL в форме по меньшей мере гомотримера.
Согласно некоторым вариантам осуществления настоящего изобретения по меньшей мере гомотример характеризуется молекулярной массой по меньшей мере 100 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
Согласно некоторым вариантам осуществления настоящего изобретения слитый белок PD1-4-1BBL содержит линкер между PD1 и 4-1BBL.
Согласно некоторым вариантам осуществления настоящего изобретения линкер составляет в длину от одной до шести аминокислот.
Согласно некоторым вариантам осуществления настоящего изобретения линкер представляет собой единственный аминокислотный линкер.
Согласно некоторым вариантам осуществления настоящего изобретения линкер не представляет собой Fc-домен антитела или его фрагмент.
Согласно некоторым вариантам осуществления настоящего изобретения линкер представляет собой глицин.
Согласно некоторым вариантам осуществления настоящего изобретения аминокислотная последовательность PD1 составляет 123-166 аминокислот в длину.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения аминокислотная последовательность PD1 содержит SEQ ID NO: 2.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения аминокислотная последовательность PD1 состоит из SEQ ID NO: 2.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения слитый белок PD1-4-1BBL является растворимым.
Согласно некоторым вариантам осуществления настоящего изобретения PD1 содержит внеклеточный домен PD1 или его функциональный фрагмент.
Согласно некоторым вариантам осуществления настоящего изобретения 4-1BBL содержит внеклеточный домен 4-1BBL или его функциональный фрагмент.
Согласно некоторым вариантам осуществления настоящего изобретения слитый белок способен по меньшей мере к одному из следующего:
(i) связывание PD-L1 и 4-1BB;
(ii) активация сигнального пути 4-1BB в клетке, экспрессирующей 4-1BB; и/или
(iii) костимуляция иммунных клеток, экспрессирующих 4-1BB.
Согласно некоторым вариантам осуществления настоящего изобретения аминокислотная последовательность слитого белка PD1-4-1BBL содержит SEQ ID NO: 1.
Согласно некоторым вариантам осуществления настоящего изобретения аминокислотная последовательность слитого белка PD1-4-1BBL состоит из SEQ ID NO: 1.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрен полинуклеотид, кодирующий слитый белок PD1-4-1BBL по настоящему изобретению.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрена конструкция нуклеиновой кислоты, содержащая полинуклеотид по настоящему изобретению и регуляторный элемент для направления экспрессии полинуклеотида в клетке-хозяине.
Согласно некоторым вариантам осуществления настоящего изобретения полинуклеотид содержит SEQ ID NO: 9.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрена клетка-хозяин, содержащая слитый белок PD1-4-1BBL по настоящему изобретению или полинуклеотид или конструкцию нуклеиновой кислоты по настоящему изобретению.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрен способ получения слитого белка PD1-4-1BBL, предусматривающий экспрессию в клетке-хозяине полинуклеотида или конструкции нуклеиновой кислоты по настоящему изобретению.
Согласно некоторым вариантам осуществления настоящего изобретения способ предусматривает выделение слитого белка.
Согласно некоторым вариантам осуществления настоящего изобретения клетку выбирают из группы, состоящей из CHO, PERC.6 и 293.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрен способ лечения рака, предусматривающий введение слитого белка PD1-4-1BBL по настоящему изобретению нуждающемуся в этом субъекту.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрен способ лечения заболевания, для которого может быть выгодна активация иммунных клеток, предусматривающий введение нуждающемуся в этом субъекту слитого белка PD1-4-1BBL по настоящему изобретению, полинуклеотида или конструкции нуклеиновой кислоты по настоящему изобретению или клетки-хозяина по настоящему изобретению.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрено изделие, идентифицированное для лечения заболевания, для которого может быть выгодна активация иммунных клеток, содержащее упаковочный материал, упаковывающий терапевтическое средство для лечения заболевания и слитый белок PD1-4-1BBL, кодирующий его полинуклеотид, кодирующую его конструкцию нуклеиновой кислоты или экспрессирующую его клетку-хозяина.
Согласно некоторым вариантам осуществления настоящего изобретения заболевание включает в себя гиперпролиферативное заболевание.
Согласно некоторым вариантам осуществления настоящего изобретения гиперпролиферативное заболевание включает в себя склероз, фиброз, идиопатический легочный фиброз, псориаз, системный склероз/склеродермию, первичный желчный холангит, первичный склерозирующий холангит, фиброз печени, профилактику радиационно-индуцированного легочного фиброза, миелофиброз или забрюшинный фиброз.
Согласно некоторым вариантам осуществления настоящего изобретения гиперпролиферативное заболевание включает в себя рак.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ лечения рака, предусматривающий введение нуждающемуся в этом субъекту противоракового средства и слитого белка PD1-4-1BBL, кодирующего его полинуклеотида, кодирующей его конструкции нуклеиновой кислоты или экспрессирующей его клетки-хозяина.
Согласно некоторым вариантам осуществления настоящего изобретения противораковое средство включает в себя антитело.
Согласно некоторым вариантам осуществления настоящего изобретения, антитело выбрано из группы, включающей в себя ритуксимаб, цетуксимаб, трастузумаб, эдреколомаб, алемтузумаб, гемтузумаб, ибритумомаб, панитумумаб, белимумаб, бевацизумаб, биватузумаб-мертанзин, блинатумомаб, блонтуветмаб, брентуксимаб ведотин, катумаксомаб, циксутумумаб, даклизумаб, адалимумаб, безлотоксумаб, цертолизумаб пэгол, цитатузумаб богатокс, даратумумаб, динутуксимаб, элотузумаб, эртумаксомаб, этарацизумаб, гемтузумаб озогамицина, гирентуксимаб, нецитумумаб, обинутузумаб, офатумумаб, пертузумаб, рамуцирумаб, силтуксимаб, тозитумомаб, трастузумаб и ипилимумаб.
Согласно некоторым вариантам осуществления настоящего изобретения антитело выбрано из группы, состоящей из ритуксимаба и цетуксимаба.
Согласно некоторым вариантам осуществления настоящего изобретения рак выбран из группы, состоящей из лимфомы, лейкоза, рака толстой кишки, рака поджелудочной железы, рака яичника, рака легкого и плоскоклеточной карциномы.
Согласно некоторым вариантам осуществления настоящего изобретения клетки рака экспрессируют PD-L1.
Согласно некоторым вариантам осуществления настоящего изобретения заболевание включает в себя заболевание, связанное с иммуносупрессией или медикаментозно-индуцированной иммуносупрессией.
Согласно некоторым вариантам осуществления настоящего изобретения заболевание включает в себя вирусы HIV, кори, гриппа, LCCM, RSV, человеческие риновирусы, EBV, CMV или Parvo.
Согласно некоторым вариантам осуществления настоящего изобретения заболевание включает в себя инфекцию.
Согласно некоторым вариантам осуществления настоящего изобретения патологические клетки субъекта экспрессируют PD-L1.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ активации Т-клеток, предусматривающий активацию Т-клеток in vitro в присутствии слитого белка PD1-4-1BBL и экспрессирующих PD-L1 клеток.
Согласно аспекту некоторых вариантов осуществления настоящего изобретения предусмотрен способ активации иммунных клеток, предусматривающий активацию иммунных клеток in vitro в присутствии слитого белка PD1-4-1BBL, кодирующего его полинуклеотида, кодирующей его конструкции нуклеиновой кислоты или экспрессирующей его клетки-хозяина.
Согласно некоторым вариантам осуществления настоящего изобретения активация происходит в присутствии клеток, экспрессирующих PD-L1 или экзогенный PD-L1.
Согласно некоторым вариантам осуществления настоящего изобретения клетки, экспрессирующие PD-L1, включают в себя раковые клетки.
Согласно некоторым вариантам осуществления настоящего изобретения способ предусматривает адоптивный перенос иммунных клеток после активации нуждающемуся в этом субъекту.
Согласно некоторым вариантам осуществления настоящего изобретения субъект страдает от заболевания, связанного с экспрессирующими PD-L1 клетками.
Согласно некоторым вариантам осуществления настоящего изобретения слитый белок PD1-4-1BBL включает в себя слитый белок PD1-4-1BBL по настоящему изобретению, полинуклеотид или конструкция нуклеиновой кислоты включает в себя полинуклеотид или конструкцию нуклеиновой кислоты по настоящему изобретению и клетка-хозяин включает в себя клетку-хозяина по настоящему изобретению.
Согласно некоторым вариантам осуществления настоящего изобретения иммунные клетки включают в себя Т-клетки.
Если не указано иное, все используемые в настоящем документе технические и/или научные термины характеризуются тем же значением, которое обычно понимают специалисты в настоящей области техники, к которой относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные тем, которые описаны в настоящем документе, могут использоваться при практическом применении или испытании вариантов осуществления настоящего изобретения, иллюстративные способы и/или материалы описаны ниже. В случае конфликта, патентная спецификация, включая в себя определения, будет иметь преимущественное право. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для обязательного ограничения.
Краткое описание чертежей
Некоторые варианты осуществления настоящего изобретения описаны в настоящем документе только в качестве примера со ссылкой на прилагаемые графические материалы. С конкретной ссылкой теперь на графические материалы подробно подчеркивается, что показанные подробности приведены в качестве примера и в целях иллюстративного обсуждения вариантов осуществления настоящего изобретения. В связи с этим описание, взятое с графическими материалами, делает очевидным для специалистов в настоящей области техники, как могут быть реализованы варианты осуществления настоящего изобретения.
На графических материалах:
Фиг. 1 представляет собой фотографию вестерн-блоттинга меченного His PD1-4-1BBL (SEQ ID NO: 5) в восстанавливающих или невосстанавливающих условиях. После аффинной очистки белки (250 нг/лунку) разделяли на геле ДСН-ПААГ в денатурирующих или неденатурирующих условиях, как указано, с последующим иммуноблоттингом с антителом к His-метке.
Фиг. 2А-В представляют собой фотографии вестерн-блоттинга меченного His PD1-4-1BBL (SEQ ID NO: 5) в восстанавливающих или невосстанавливающих условиях. После аффинной очистки белки (250 нг/лунку) разделяли на геле ДСН-ПААГ в денатурирующих (фиг. 2А) или неденатурирующих (фиг. 2В) условиях с последующим иммуноблоттингом с антителом к 4-1BBL.
Фиг. 2С представляет собой фотографию окрашивания кумасси синим при анализе ДСН-ПААГ-электрофорез меченного His PD1-4-1BBL (SEQ ID NO: 5) в восстанавливающих условиях, обработанных или не обработанных дегликозилазой. Меченные His полосы PD1-4-1BBL отмечены маленькими черными стрелками.
Фиг. 3A-B представляют собой графики, демонстрирующие взаимодействие меченного His PD1-4-1BBL (SEQ ID NO: 5) с его лигандами-аналогами, как определено с помощью биослойной интерферометрии Blitz®. На фиг. 3А показано связывание с PD-L1 - биосенсор предварительно загружали PD-L1:Fc и затем инкубировали с меченным His PD1-4-1BBL (SEQ ID NO: 5) или SIRPα-4-1BBL (SEQ ID NO: 6, в качестве отрицательного контроля). На фиг. 3B показано связывание с 4-1BB - биосенсор предварительно загружали 4-1BB:Fc и затем инкубировали с меченным His PD1-4-1BBL (SEQ ID NO: 5) или PD1-CD70 (SEQ ID NO: 6, в качестве отрицательного контроля).
Фиг. 4A-B представляют собой гистограммы (фиг. 4А) и таблицу, в которой сведено воедино геометрическое среднее интенсивности флуоресценции (GMFI) (фиг. 4В), демонстрирующие экспрессию указанных рецепторов на клеточных линиях HT1080-WT (HT1080), HT1080-CD27, HT1080-4-1BB, DLD1-WT и DLD1-PDL1. Уровни экспрессии на поверхности CD27, PD-L1, 4-1BB и CD47 определяли путем иммуноокрашивания каждой клеточной линии соответствующими антителами с последующим анализом проточной цитометрией.
На фиг. 5A-B показано связывание меченного His белка PD1-4-1BBL (SEQ ID NO: 5) с клетками HT1080-4-1BB (фиг. 5A), но не с клетками отрицательного контроля HT1080-CD27 (фиг. 5B). Клетки инкубировали с различными концентрациями меченного His белка PD1-4-1BBL (SEQ ID NO: 5) в течение 30 минут на льду с последующим иммуноокрашиванием антителом к PD-1 и анализом с помощью проточной цитометрии. Значения GMFI использовали для создания графика кривой связывания с помощью программного обеспечения GraphPad Prism.
На фиг. 6А-В показано связывание меченного His белка PD1-4-1BBL (SEQ ID NO: 5) с клетками DLD1-PDL1 (фиг. 6А), но не с клетками DLD1-PDL1 отрицательного контроля. Клетки инкубировали с различными концентрациями меченного His белка PD1-4-1BBL (SEQ ID NO: 5) в течение 30 минут на льду с последующим иммуноокрашиванием антителом к 4-1BBL и анализом с помощью проточной цитометрии. Значения GMFI использовали для создания графика кривой связывания с помощью программного обеспечения GraphPad Prism.
Фиг. 7 представляет собой график, демонстрирующий, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) стимулирует передачу сигналов TNFR, что продемонстрировано секрецией IL-8 из клеток HT1080-4-1BB в среде, содержащей FBS.
Фиг. 8 представляет собой график, демонстрирующий, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) стимулирует передачу сигналов TNFR, что продемонстрировано секрецией IL-8 из клеток HT1080-4-1BB в бессывороточной среде.
На фиг. 9А-D показано, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) запускает костимулирующую передачу сигнала 4-1BB и стимулирует активацию Т-клеток. На фиг. 9А показана гистограмма, демонстрирующая экспрессию 4-1BB в клетках HT1080-4-1BB и отсутствие экспрессии 4-1BB в клетках DLD1-WT (DLD1). На фиг. 9B показаны гистограммы, демонстрирующие экспрессию PDL1 в клетках DLD1-PDL1 и отсутствие экспрессии PDL1 в DLD1-WT (DLD1). Фиг. 9C представляет собой график, демонстрирующий секрецию IL-8 клетками HT1080-4-1BB при обработке отдельно меченным His белком PD1-4-1BBL (SEQ ID NO: 5) или при обработке в смешанных культурах с клетками DLD1. Фиг. 9D представляет собой график, демонстрирующий секрецию IL8 клетками HT1080-4-1BB при обработке отдельно меченным His белком PD1-4-1BBL (SEQ ID NO: 5) или при обработке в смешанных культурах с клетками DLD1-PDL1.
На фиг. 10 показано, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) активирует свежевыделенные Т-клетки человека на покрытых PDL1-Fc планшетах в присутствии субоптимальных концентраций гранул активации анти-CD3/анти-CD28, тогда как SIRPα:4-1BBL (SEQ ID NO: 6) не индуцирует активацию. Активацию Т-клеток измеряли путем оценки экспрессии CD25 с помощью проточной цитометрии через 7 дней лечения.
На фиг. 11А-В показано, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) стимулирует секрецию INF-γ из PBMC человека, примированных к CD3. Фиг. 11А представляет собой график, демонстрирующий концентрацию IFN-γ, обнаруженную в супернатанте культуры PBMC человека, инкубированных в течение 40 часов с различными концентрациями меченного His белка PD1-4-1BBL (SEQ ID NO: 5) в присутствии анти-CD3 или анти-CD3 плюс IL2, как указано. Фиг. 11B представляет собой график, демонстрирующий концентрацию IFN-γ, обнаруженную в культуральном супернатанте PBMC человека, совместно культивированных с экспрессирующими PDL1 мышиными клетками LivMet и инкубированных в течение 40 часов с различными концентрациями меченного His белка PD1-4-1BBL (SEQ ID NO: 5) в присутствии анти-CD3 или анти-CD3 плюс IL2, как указано.
На фиг. 12A-С показано, что лечение мышей, которым инокулировали СТ-26, меченным His белком PD1-4-1BBL (SEQ ID NO: 5), значительно уменьшает объем опухоли. Фиг. 12А представляет собой схематическую иллюстрацию сроков эксперимента: мышам инокулировали S.C. 1×106 клеток CT-26 в день 0, контроль PBS или PD1-4-1BBL вводили в дни 3, 7, 10 и 14. Фиг. 12B представляет собой лепестковые диаграммы, демонстрирующие объем опухоли различных мышей в двух группах лечения. Фиг. 12С представляет собой среднее значение ± стандартная ошибка объема опухоли в двух группах лечения.
На фиг. 13А-В показано, что меченный His белок PD1-4-1BBL (SEQ ID NO: 5) эффективен для лечения мышей, которым инокулировали опухолью сингенного лейкоза P388. Фиг. 13А представляет собой схематическую иллюстрацию временной шкалы эксперимента: мышам инокулировали I.P. 1×106 клеток P388 в день 0, контроль PBS, αPD1 или PD1-4-1BBL вводили в дни 1, 3, 5 и 7. Фиг. 13В представляет собой график, демонстрирующий среднее значение ± стандартная ошибка массы селезенки в трех группах лечения после умерщвления.
Подробное описание изобретения
Настоящее изобретение согласно некоторым его вариантам осуществления относится к слитому белку PD1-4-1BBL и способам его применения.
Перед подробным объяснением по меньшей мере одного варианта осуществления настоящего изобретения следует понимать, что настоящее изобретение не обязательно ограничено в его применении подробностями, изложенными в последующем описании или приведенными в качестве примеров в Примерах. Настоящее изобретение допускает другие варианты осуществления или может быть применено на практике или осуществлено различными способами.
Двойные сигнальные белки (DSP), также известные как преобразующие сигналы белки (SCP), которые в настоящее время известны в настоящей области техники как бифункциональные слитые белки, связывают внеклеточную часть мембранного белка типа I (внеклеточный амино-конец) с внеклеточной частью мембранного белка типа II (внеклеточный карбоксильный конец), образуя слитый белок с двумя активными сторонами.
Неожиданно было обнаружено, что конкретный слитый белок может преимущественно вводиться субъектам, страдающим от раковых заболеваний, в зависимости от наличия опухолей, которые имеют инфильтрирующие опухоль лимфоциты (TIL) на опухолевых клетках или в опухолевом микроокружении, а также опухолей с относительно высокой экспрессией PD-L1 в опухолевом микроокружении.
Как проиллюстрировано ниже и в разделе примеров, который следует ниже, авторы настоящего изобретения создали меченный his слитый белок PD1-4-1BBL (SEQ ID NO: 5) и показывают, что слитый белок (SEQ ID NO: 5) содержит оба домена и производится в форме по меньшей мере тримеров (эксперименты 1А-В, фиг. 1 и 2А-С). Далее авторы настоящего изобретения демонстрируют, что полученный меченный his слитый белок PD1-4-1BBL (SEQ ID NO: 5) сохраняет функциональную активность связывания с его родственными рецепторами PD-L1 и 4-1BB (эксперименты 1C-D, фиг. 3A-B, 4A-B, 5A-B и 6А-В) и может запускать костимуляцию 4-1BB и активацию клеток, экспрессирующих 4-1BB (например, T-клетки, PBMC), где присутствие PD-L1 усиливает эту активность (эксперименты 2-3, 3A-B, фиг. 7-8, 9A-D, 10, 11A-B). Авторы настоящего изобретения также демонстрируют, что меченный his слитый белок PD1-4-1BBL (SEQ ID NO: 5) эффективен для лечения опухолей, как показано на опухолевых моделях сингенной карциномы толстой кишки и сингенного лейкоза у мышей in vivo (эксперименты 4, 4A-В, фиг. 12А-С и 13А-В).
Следовательно, настоящее изобретение предлагает слитые белки PD1-4-1BBL, кодирующие их полинуклеотиды и экспрессирующие их клетки-хозяева и их применение, например, активацию иммунных клеток (посредством костимуляции) в целом и лечение заболеваний, которым может быть выгодна активация иммунных клеток (например, рака), в частности.
Таким образом, согласно первому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL или любые его варианты или фрагменты, необязательно с линкером между ними, или слитый белок PD1-4-1BBL, который по меньшей мере приблизительно на 70% гомологичен последовательности, изложенной выше в SEQ ID No. 4, необязательно с линкером между ними.
Согласно другому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, содержащий линкер из одной аминокислоты между указанным PD1 и указанным 4-1BBL.
Согласно другому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, причем аминокислотная последовательность указанного PD1 составляет 123-166 аминокислот в длину.
Согласно другому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, причем аминокислотная последовательность указанного PD1 содержит SEQ ID NO: 2.
Согласно другому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL в форме по меньшей мере гомотримера.
Согласно конкретным вариантам осуществления по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% слитого белка PD1-4-1BBL находится в форме по меньшей мере гомотримера, каждая возможность представляет отдельный вариант осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления по меньшей мере гомотример включает в себя гомотример.
Согласно конкретным вариантам осуществления по меньшей мере гомотример включает в себя гомотетрамер.
Согласно конкретным вариантам осуществления по меньшей мере гомотример включает в себя гомопентамер.
Согласно конкретным вариантам осуществления по меньшей мере гомотример включает в себя гомогексамер.
Способы определения тримеризации хорошо известны в настоящей области техники и предусматривают, без ограничения, ДСН-ПААГ-электрофорез, нативный-ПААГ-электрофорез, эксклюзионную ВЭЖХ, 2D гели, гель-фильтрацию, SEC MALLS, аналитическое ультрацентрифугирование (AUC), масс-спектрометрию (MS), капиллярный гель-электрофорез (CGE).
Согласно конкретным вариантам осуществления молекулярная масса по меньшей мере гомотримера составляет по меньшей мере 100 кДа, по меньшей мере 120 кДа, по меньшей мере 140 кДа, по меньшей мере 160 кДа, по меньшей мере 180 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
Согласно конкретным вариантам осуществления по меньшей мере гомотример характеризуется молекулярной массой по меньшей мере 100 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
Согласно конкретным вариантам осуществления, по меньшей мере гомотример характеризуется молекулярной массой по меньшей мере 200 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
Используемый в настоящем документе термин «PD1 (программируемая смерть 1, также известный как CD279)» относится к полипептиду гена PDCD1 (идентификатор гена 5133) или функциональному гомологу, например, его функциональному фрагменту. Согласно конкретным вариантам осуществления термин «PD1» относится к функциональному гомологу полипептида PD1. Согласно конкретным вариантам осуществления PD1 представляет собой PD1 человека. Согласно конкретному варианту осуществления белок PD1 относится к человеческому белку, такому как приведен в следующем номере GenBank NP_005009.
Были идентифицированы два лиганда для PD-1, PD-L1 и PD-L2 (также известный как B7-DC). Согласно конкретному варианту осуществления белок PD-L1 относится к человеческому белку, такому как представлен в следующих номерах GenBank NP_001254635 и NP_054862. Согласно конкретному варианту осуществления белок PD-L2 относится к человеческому белку, такому как представлен в следующем номере GenBank NP_079515.
Используемый в настоящем документе «функциональный PD1» способен связывать свои родственные лиганды PD-L1 и/или PD-L2.
Согласно конкретным вариантам осуществления функциональный PD1 способен связываться с PD-L1.
Используемое в настоящем документе выражение «функциональный гомолог» или «функциональный фрагмент» применительно к PD1 относится к части полипептида, которая поддерживает активность полноразмерного PD1, например, связывание с PD-L1.
Анализы для испытания связывания хорошо известны в настоящей области техники и включают в себя, без ограничения, проточную цитометрию, BiaCore, биослойную интерферометрию Blitz®, ВЭЖХ.
Согласно конкретным вариантам осуществления PD1 связывается с PD-L1 с Kd 1 нМ-100 мкМ, 10 нМ-10 мкМ, 100 нМ-100 мкМ, 200 нМ-10 мкМ, как определено посредством анализа SPR, каждая возможность представляла отдельный вариант осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления PD1 связывается с PD-L1 с Kd приблизительно 270 нМ, как определено посредством анализа SPR.
Согласно конкретным вариантам осуществления PD1 включает в себя внеклеточный домен указанного PD1 или его функциональный фрагмент.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 содержит SEQ ID NO: 10.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 состоит из SEQ ID NO: 10.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты PD1 содержит SEQ ID NO: 11.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты PD1 состоит из SEQ ID NO: 11.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 содержит SEQ ID NO: 2.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 состоит из SEQ ID NO: 2.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты PD1 содержит SEQ ID NO: 12.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты PD1 состоит из SEQ ID NO: 12.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 содержит SEQ ID NO: 16 или SEQ ID NO: 17.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 состоит из SEQ ID NO: 16 или SEQ ID NO: 17.
Термин «PD1» также охватывает функциональные гомологи (встречающиеся в природе или полученные синтетически/рекомбинантно), которые проявляют желаемую активность (т.е. связывание PD-L1 или PD-L2). Такие гомологи могут быть, например, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичны или гомологичны полипептиду SEQ ID NO: 2, 10, 16 или 17; или по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97% по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичны полинуклеотидной последовательности, кодирующей ее (как дополнительно описано ниже).
Идентичность или гомологию последовательности можно определить с использованием любого алгоритма выравнивания последовательности белка или нуклеиновой кислоты, такого как Blast, ClustalW и MUSCLE.
Гомолог может также относиться к ортологу, варианту делеции, вставки или замещения, включая в себя аминокислотную замену, как дополнительно описано ниже.
Согласно конкретным вариантам осуществления полипептид PD1 может содержать консервативные аминокислотные замены.
Согласно конкретным вариантам осуществления одно или несколько аминокислотных изменений расположены в положении аминокислоты, выбранном из: V39, L40, N41, Y43, R44, M45, S48, N49, Q50, T51, D52, K53, A56, Q63, G65 Q66, V72, H82, M83, R90, Y96, L97, A100, S102, L103, A104, P105, K106 и A107 относительно аминокислотной последовательности PD1, представленной в SEQ ID NO: 17; или соответствующем аминокислотном положении относительно другого полипептида PD1.
Согласно конкретным вариантам осуществления одно или несколько аминокислотных изменений выбраны из группы, состоящей из: (1) V39H или V39R; (2) L40V или L40I; (3) N41I или N41V; (4) Y43F или Y43H; (5) R44Y или R44L; (6) M45Q, M45E, M45L или M45D; (7) S48D, S48L, S48N, S48G или S48V; (8) N49C, N49G, N49Y или N49S; (9) Q50K, Q50E или Q50H; (10) T51V, T51L или T51A; (11) D52F, D52R, D52Y или D52V; (12) K53T или K53L; (13) A56S или A56L; (14) Q63T, Q63I, Q63E, Q63L или Q63P; (15) G65N, G65R, G65I, G65L, G65F или G65V; (16) Q66P; (17) V72I; (18) H82Q; (19) M83L или M83F; (20) R90K; (21) Y96F; (22) L97Y, L97V или L97I; (23) A100I или A100V; (24) S102T или S102A; (25) L103I, L103Y или L103F; (26) A104S, A104H или A104D; (27) P105A; (28) K106G, K106E, K106I, K106V, K106R или K106T; и (29) A107P, A107I или A107V относительно аминокислотной последовательности PD1, представленной в SEQ ID NO: 17; или изменение, которое приводит к той же аминокислоте в соответствующем аминокислотном положении относительно другого полипептида PD1.
Дополнительное описание консервативных аминокислотных и неконсервативных аминокислотных замен приведено ниже.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 содержит 100-200 аминокислот, 120-180 аминокислот, 120-160, 130-170 аминокислот, 130-160, 130-150, 140-160 аминокислот, 145-155 аминокислот кислоты, каждая возможность представляет отдельный вариант осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 составляет в длину 123-166 аминокислот.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 составляет в длину 145-155 аминокислот.
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1 составляет в длину 150 аминокислот.
Используемый в настоящем документе термин «4-1BBL (также известный как CD137L и TNFSF9)» относится к полипептиду гена TNFSF9 (идентификатор гена 8744) или функциональному гомологу, например, его функциональному фрагменту. Согласно конкретным вариантам осуществления термин «4-1BBL» относится к функциональному гомологу полипептида 4-1BBL. Согласно конкретным вариантам осуществления 4-1BBL представляет собой человеческий 4-1BBL. Согласно конкретному варианту осуществления белок 4-1BBL относится к человеческому белку, такому как представлен в следующем номере GenBank NP_003802.
Согласно конкретным вариантам осуществления 4-1BBL содержит внеклеточный домен указанного 4-1BBL или его функциональный фрагмент.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL содержит SEQ ID NO: 13.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL состоит из SEQ ID NO: 13.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты 4-1BBL содержит SEQ ID NO: 14.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты 4-1BBL состоит из SEQ ID NO: 14.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL содержит SEQ ID NO: 3.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL состоит из SEQ ID NO: 3.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты 4-1BBL содержит SEQ ID NO: 15.
Согласно конкретным вариантам осуществления последовательность нуклеиновой кислоты 4-1BBL состоит из SEQ ID NO: 15.
Термин «4-1BBL» также охватывает функциональные гомологи (встречающиеся в природе или полученные синтетически/рекомбинантно), которые проявляют желаемую активность (как определено ниже). Такие гомологи могут быть, например, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичны или гомологичны полипептиду SEQ ID NO: 3, 13; или по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97% по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичны полинуклеотидной последовательности, кодирующей его (как дополнительно описано ниже).
Согласно конкретным вариантам осуществления полипептид 4-1BBL может содержать консервативные аминокислотные замены, как дополнительно описано ниже.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL содержит 100-300 аминокислот, 150-250 аминокислот, 100-250 аминокислот, 150-220 аминокислот, 180-220 аминокислот, 190-210 аминокислот, каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL составляет в длину 190-210 аминокислот.
Согласно конкретным вариантам осуществления аминокислотная последовательность 4-1BBL составляет в длину 204 аминокислоты.
Как используется в настоящем документе, «функциональный 4-1BBL» способен по меньшей мере к одному из следующего:
(i) связывание его родственного рецептора 4-1BB (также известного как CD137),
(ii) активация сигнального пути 4-1BB в иммунной клетке, экспрессирующей 4-1BB; и/или
(iii) активация иммунных клеток, экспрессирующих указанный 4-1ВВ.
Согласно конкретным вариантам осуществления функциональный 4-1BBL способен к (i), (ii), (iii), (i) + (ii), (i) + (iii), (ii) + (iii).
Согласно конкретным вариантам осуществления функциональный 4-1BBL способен к (i) + (ii) + (iii).
Используемое в настоящем документе выражение «функциональный гомолог» или «функциональный фрагмент» применительно к 4-1BBL относится к части полипептида, которая поддерживает активность полноразмерного 4-1BBL, например, связывает 4-1BB, активирует сигнальный путь 4-1BB, активирует иммунные клетки, экспрессирующие 4-1BB.
Согласно конкретному варианту осуществления белок 4-1BB относится к человеческому белку, такому как представлен в следующем номере GenBank NP_001552.
Анализы для испытания связывания хорошо известны в настоящей области техники и дополнительно описаны выше.
Согласно конкретным вариантам осуществления SIRPα связывается с CD47 с Kd 0,1-100 мкМ, 0,1-10 мкМ, 1-10 мкМ, 0,1-5 мкМ или 1-2 мкМ, как определено посредством SPR, каждая возможность представляет отдельный вариант осуществления заявленного изобретения.
Согласно конкретным вариантам осуществления 4-1BBL связывается с 4-1BB с Kd приблизительно 55,2 нМ, как определено посредством SPR.
Используемые в настоящем документе термины «активирование» или «активация» относятся к процессу стимуляции иммунной клетки (например, Т-клетки, В-клетки, NK-клетки, дентритной клетки), которая приводит к клеточной пролиферации, созреванию, выработке цитокинов, фагоцитозу и/или индукции регуляторных или эффекторных функций.
Согласно конкретным вариантам осуществления активация включает в себя костимуляцию.
Используемый в настоящем документе термин «костимулирование» или «костимуляция» относится к передаче вторичного антиген-независимого стимулирующего сигнала (например, сигнала 4-1BB), приводящего к активации иммунной клетки.
Согласно конкретным вариантам осуществления активация включает в себя супрессию ингибирующего сигнала (например, сигнала PD1), приводящего к активации иммунной клетки.
Способы определения передачи сигналов стимулирующего или ингибирующего сигнала хорошо известны в настоящей области техники и также раскрыты в разделе «Примеры», который следует ниже, и включают в себя, без ограничения, анализ связывания с использованием, например, BiaCore, ВЭЖХ или проточной цитометрии, такие анализы ферментативной активности, как анализы киназной активности, и экспрессии молекул, вовлеченных в сигнальный каскад, с использованием, например, ПЦР, вестерн-блоттинга, иммунопреципитации и иммуногистохимии. Дополнительно или альтернативно, определение передачи сигнала (костимулирующего или ингибирующего) может быть осуществлено путем оценки активации или функции иммунных клеток. Способы оценки активации или функции иммунных клеток хорошо известны в настоящей области техники и предусматривают, без ограничения, анализы пролиферации, такие как окрашивание CFSE, MTS, Alamar blue, BRDU и тимидином, анализы цитотоксичности, такие как окрашивание CFSE, высвобождение хрома, Calcin AM, анализы секреции цитокинов, такие как внутриклеточное окрашивание цитокинов, ELISPOT и ИФА, экспрессия маркеров активации, таких как CD25, CD69, CD137, CD107a, PD1 и CD62L, с использованием проточной цитометрии.
Согласно конкретным вариантам осуществления определение сигнальной активности или активации осуществляют in vitro или ex vivo, например, в смешанной реакции лимфоцитов (MLR), как дополнительно описано ниже.
Для тех же условий культивирования сигнальная активность или активация или функция иммунных клеток, как правило, выражается в сравнении с передачей сигналов, активацией или функцией в клетке того же вида, но не контактирующей со слитым белком PD1-4-1BBL, кодирующим его полинуклеотидом или кодирующей его клеткой-хозяином, или контактирующей с контролем-наполнителем, также называемым контролем.
Термины «DSP» и «слитый белок», «химерный белок» или «химера» используются в настоящем документе взаимозаменяемо и относятся к аминокислотной последовательности, имеющей две или более частей, которые не встречаются вместе в одной аминокислотной последовательности в природе.
Согласно одному варианту осуществления настоящее изобретение направлено на слитый белок, содержащий PD1-4-1BBL (далее слитый белок PD1-4-1BBL), или любые его варианты или фрагменты, необязательно, с линкером между ними.
PD1-4-1BBL представляет собой химерный белок двойной сигнальный белок (DSP), сливающий внеклеточные домены двух разных мембранных белков человека. N-концевой домен представляет собой внеклеточный домен человеческого PD1 (ген: PDCD1), который представляет собой мембранный белок типа 1, а С-концевой домен химеры представляет собой внеклеточный домен человеческого 4-1BBL (ген: TNFSF9), который представляет собой мембранный белок типа 2.
Согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL является растворимым (т.е. не иммобилизованным на синтетической или встречающейся в природе поверхности).
Согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL иммобилизован на синтетической или встречающейся в природе поверхности.
Согласно конкретным вариантам осуществления PD1-4-1BBL не содержит линкера между PD1 и 4-1BBL.
Согласно некоторым вариантам осуществления PD1-4-1BBL содержит линкер, который может характеризоваться любой длиной.
Следовательно, согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL содержит линкер между указанным PD1 и указанным 4-1BBL.
Любой известный в настоящей области техники линкер может быть использован с конкретными вариантами осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления линкер может быть получен из встречающихся в природе многодоменных белков или представлять собой эмпирический линкер, как описано, например, в Chichili et al. (2013), Protein Sci. 22 (2): 153-167, Chen et al. (2013), Adv Drug Deliv Rev. 65 (10): 1357-1369, полное содержание которых включено в настоящий документ посредством ссылки. Согласно некоторым вариантам осуществления линкер может быть разработан с использованием баз данных для разработки линкеров и компьютерных программ, таких как описанные в Chen et al. (2013), Adv Drug Deliv Rev. 65 (10): 1357-1369 и Crasto et al. (2000). , Protein Eng. 13 (5): 309-312, полное содержание которых включено в настоящий документ посредством ссылки.
Согласно конкретным вариантам осуществления линкер представляет собой синтетический линкер, такой как ПЭГ.
Согласно конкретным вариантам осуществления линкер представляет собой Fc-домен или шарнирную область антитела (например, IgG, IgA, IgD или IgE) или его фрагмента.
Согласно другим конкретным вариантам осуществления линкер не представляет собой Fc-домен или шарнирную область антитела или его фрагмента.
Согласно конкретным вариантам осуществления линкер может быть функциональным. Например, без ограничения, линкер может функционировать для улучшения фолдинга и/или стабильности, улучшения экспрессии, улучшения фармакокинетики и/или улучшения биоактивности слитого белка PD1-4-1BBL. В другом примере линкер может функционировать для нацеливания слитого белка PD1-4-1BBL на конкретный тип или местоположение клетки.
Согласно конкретным вариантам осуществления линкер представляет собой полипептид.
Согласно некоторым вариантам осуществления слитый белок PD1-4-1BBL содержит линкер длиной от одной до шести аминокислот.
Согласно конкретным вариантам осуществления линкер по существу состоит из остатков глицина и/или серина (например, приблизительно 30% или приблизительно 40%, или приблизительно 50%, или приблизительно 60%, или приблизительно 70%, или приблизительно 80%, или приблизительно 90% или приблизительно 95%, или приблизительно 97% или 100% глицинов и серинов).
Согласно конкретным вариантам осуществления линкер представляет собой линкер из одной аминокислоты.
Согласно некоторым вариантам осуществления настоящего изобретения одна аминокислота, которая связывается с PD1 и 4-1BBL, представляет собой глицин, также упоминаемый в настоящем документе как слитый белок PD1-G-4-1BBL.
Согласно конкретным вариантам осуществления аминокислотная последовательность слитого белка PD1-4-1BBL содержит SEQ ID NO: 1.
Согласно конкретным вариантам осуществления аминокислотная последовательность слитого белка PD1-4-1BBL состоит из SEQ ID NO: 1.
Согласно некоторым вариантам осуществления термин «слитый белок PD1-G-4-1BBL» относится к белку, идентифицированному посредством SEQ ID NO. 1:
Аминокислотная последовательность химерного белка (PD1- G - 4-1BBL):
PGWFLDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDK LAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAE LRVTERRAEVPTAHPSPSPRPAGQFQTLV G ACPWAVSGARASPGSAASPRLREGPELSPDDP AGLLDLRQGMFAQLVAQNVLLIDGPLSWYSDPGLAGVSLTGGLSYKEDTKELVVAKAG VYYVFFQLELRRVVAGEGSGSVSLALHLQPLRSAAGAAALALTVDLPPASSEARNSAFGF QGRLLHLSAGQRLGVHLHTEARARHAWQLTQGATVLGLFRVTPEIPAGLPSPRSE
Внеклеточный домен человеческого белка PD1 подчеркнут, т.е. PGWFLDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRPAGQFQTLV (SEQ ID NO. 2)
Внеклеточный домен человеческого 4-1BBL выделен жирным шрифтом, т.е.
ACPWAVSGARASPGSAASPRLREGPELSPDDPAGLLDLRQGMFAQLVAQNVLLIDGPL SWYSDPGLAGVSLTGGLSYKEDTKELVVAKAGVYYVFFQLELRRVVAGEGSGSVSLALHLQ PLRSAAGAAALALTVDLPPASSEARNSAFGFQGRLLHLSAGQRLGVHLHTEARARHAWQLTQ GATVLGLFRVTPEIPAGLPSPRS (SEQ ID NO. 3)
Согласно конкретным вариантам осуществления аминокислотная последовательность PD1- G - 4-1BBL по меньшей мере приблизительно на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологична аминокислотной последовательности, представленной в SEQ ID No. 1, или кодирующей ее полинуклеотидной последовательности.
Согласно дополнительным вариантам осуществления слитый белок PD1- G - 4-1BBL может представлять собой функциональный фрагмент, вариант и/или производное аминокислотной последовательности, показанной в SEQ ID NO. 1. Ряд таких вариантов известен в настоящей области техники, смотрите, например, публикации Young Won, et al., 2010; Rabu, et al., 2005; Maute, et al., 2015 и Parry, et al., 2005, настоящим включенные посредством ссылки, как если бы они были полностью изложены в настоящем документе.
Согласно некоторым вариантам осуществления предусмотрен слитый белок PD1-4-1BBL, который по меньшей мере приблизительно на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологичен последовательность, представленной в SEQ ID No. 4, необязательно с линкером между пептидом PD1 или его ECD и пептидом 4-1BBL или его ECD, причем SEQ ID No. 4 представляет собой:
PGWFLDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDK LAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAE LRVTERRAEVPTAHPSPSPRPAGQFQTLV ACPWAVSGARASPGSAASPRLREGPELSPDDPA GLLDLRQGMFAQLVAQNVLLIDGPLSWYSDPGLAGVSLTGGLSYKEDTKELVVAKAGV YYVFFQLELRRVVAGEGSGSVSLALHLQPLRSAAGAAALALTVDLPPASSEARNSAFGFQ GRLLHLSAGQRLGVHLHTEARARHAWQLTQGATVLGLFRVTPEIPAGLPSPRSE
Согласно некоторым вариантам осуществления предусмотрен PD1-4-1BBL, представленный в SEQ ID No. 4, необязательно, с линкером между пептидом PD1 или его ECD и пептидом 4-1BBL или его ECD, причем SEQ ID No. 4 представляет собой:
PGWFLDSPDRPWNPPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDK LAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAE LRVTERRAEVPTAHPSPSPRPAGQFQTLV ACPWAVSGARASPGSAASPRLREGPELSPDDPA GLLDLRQGMFAQLVAQNVLLIDGPLSWYSDPGLAGVSLTGGLSYKEDTKELVVAKAGV YYVFFQLELRRVVAGEGSGSVSLALHLQPLRSAAGAAALALTVDLPPASSEARNSAFGFQ GRLLHLSAGQRLGVHLHTEARARHAWQLTQGATVLGLFRVTPEIPAGLPSPRSE
Согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL способен по меньшей мере к одному из следующего:
(i) связывание PD-L1 и 4-1BB,
(ii) активация сигнального пути 4-1BB в иммунной клетке (например, T-клетке), экспрессирующей 4-1BB и/или
(iii) активация иммунных клеток (например, Т-клеток), экспрессирующих указанный 4-1ВВ.
Согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL способен к (i), (ii), (iii), (i)+(ii), (i)+(iii), (ii)+(iii).
Согласно конкретным вариантам осуществления слитый белок PD1-4-1BBL способен к (i) + (ii) + (iii).
Способы определения связывания, активации сигнального пути 4-1BB и активации иммунных клеток хорошо известны в настоящей области техники и дополнительно описаны выше и ниже, а также в разделе «Примеры», который следует ниже.
Поскольку композиции некоторых вариантов осуществления настоящего изобретения (например, слитый белок, кодирующий его полинуклеотид или нуклеиновая кислота или экспрессирующая его клетка-хозяин) способны активировать иммунные клетки, их можно использовать в способе активации иммунных клеток in vitro, ex vivo и/или in vivo.
Таким образом, согласно аспекту настоящего изобретения предложен способ активации иммунных клеток, предусматривающий активацию иммунных клеток in vitro или ex vivo в присутствии слитого белка PD1-4-1BBL, кодирующего его полинуклеотида, кодирующей его конструкции нуклеиновой кислоты или экспрессирующей его клетки-хозяина.
Согласно другому аспекту настоящего изобретения предложен способ активации Т-клеток, предусматривающий активацию Т-клеток in vitro или ex vivo в присутствии слитого белка PD1-4-1BBL и экспрессирующих PD-L1 клеток.
Согласно конкретным вариантам осуществления иммунные клетки экспрессируют 4-1BB.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя периферические мононуклеарные клетки крови (РВМС).
Используемый в настоящем документе термин «периферические мононуклеарные клетки крови (РВМС)» относится к клетке крови, содержащей единственное ядро, и включает в себя лимфоциты, моноциты и дендритные клетки (DC).
Согласно конкретным вариантам осуществления РВМС выбраны из группы, состоящей из дендритных клеток (DC), T-клеток, B-клеток, NK-клеток и NKT-клеток.
Согласно конкретным вариантам осуществления РВМС включают в себя Т-клетки, В-клетки, NK-клетки и NKT-клетки.
Способы получения PBMC хорошо известны в настоящей области техники, например, взятие цельной крови у субъекта и сбор в контейнере, содержащем антикоагулянт (например, гепарин или цитрат), и аферез. Далее, согласно конкретным вариантам осуществления по меньшей мере один тип РВМС очищают из периферической крови. Специалистам в настоящей области техники известно несколько способов и реагентов для очистки PBMC из цельной крови, таких как лейкаферез, седиментация, центрифугирование в градиенте плотности (например, фиколл), центробежное элюирование, фракционирование, химический лизис, например, эритроцитов (например, ACK), выбор определенных типов клеток с использованием маркеров клеточной поверхности (с использованием, например, сортера FACS или способов магнитного разделения клеток, таких как коммерчески доступные, например, от Invitrogen, Stemcell Technologies, Cellpro, Advanced Magnetics или Miltenyi Biotec.) и истощение определенных типов клеток с помощью таких способов, как ликвидация (например, уничтожение) с помощью специфических антител, или путем аффинной очистки на основе отрицательного отбора (с использованием, например, способов магнитного разделения клеток, сортера FACS и/или захвата с помощью ИФА-маркировки). Такие способы описаны, например, в THE HANDBOOK OF EXPERIMENTAL IMMUNOLOGY, Volumes 1 to 4, (D.N. Weir, editor) и FLOW CYTOMETRY AND CELL SORTING (A. Radbruch, editor, Springer Verlag, 2000).
Согласно конкретным вариантам осуществления иммунные клетки включают в себя инфильтрирующие опухоль лимфоциты.
Используемый в настоящем документе термин «инфильтрирующие опухоль лимфоциты (TIL)» относится к мононуклеарным лейкоцитам, которые попадают в кровоток и мигрируют в опухоль.
Согласно конкретным вариантам осуществления TIL выбирают из группы, состоящей из T-клеток, B-клеток, NK-клеток и моноцитов.
Способы получения TIL хорошо известны в настоящей области техники, такие как получение образцов опухоли у субъекта, например, путем биопсии или вскрытия и приготовление суспензии отдельных клеток. Суспензия отдельных клеток может быть получена любым подходящим способом, например, механическим способом (дезагрегация опухоли с использованием, например, диссоциатора gentleMACS™, Miltenyi Biotec, Auburn, CA) или ферментативно (например, коллагеназа или ДНКаза). После этого по меньшей мере один тип TIL может быть очищен из клеточной суспензии. Специалистам в настоящей области техники известно несколько способов и реагентов для очистки TIL желаемого типа, таких как выбор определенных типов клеток с использованием маркеров клеточной поверхности (например, с использованием сортера FACS или способов магнитного разделения клеток, таких как коммерчески доступные, например, от Invitrogen, Stemcell Technologies, Cellpro, Advanced Magnetics или Miltenyi Biotec.), и истощение определенных типов клеток такими способами, как ликвидация (например, уничтожение) специфическими антителами, или очисткой на основе аффинности на основе отрицательного отбора (с использованием, например, способов магнитного разделения клеток, FACS сортера и/или захвата мечения ИФА). Такие способы описаны, например, в THE HANDBOOK OF EXPERIMENTAL IMMUNOLOGY, Volumes 1 to 4, (D.N. Weir, editor) и FLOW CYTOMETRY AND CELL SORTING (A. Radbruch, editor, Springer Verlag, 2000).
Согласно конкретным вариантам осуществления иммунные клетки включают в себя фагоциты.
Используемый в настоящем документе термин «фагоциты» относится к клетке, которая способна к фагоцитозу и включает в себя как профессиональные, так и непрофессиональные фагоциты. Способы анализа фагоцитоза хорошо известны в настоящей области техники и включают в себя, например, киллинг-анализ, проточную цитометрию и/или микроскопию (визуализацию живых клеток, флуоресцентную микроскопию, конфокальную микроскопию, электронную микроскопию). Согласно конкретным вариантам осуществления фагоцитарные клетки выбраны из группы, состоящей из моноцитов, дендритных клеток (DC) и гранулоцитов.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя моноциты.
Согласно конкретным вариантам осуществления термин «моноциты» относится как к циркулирующим моноцитам, так и к макрофагам (также называемым мононуклеарными фагоцитами), присутствующим в ткани.
Согласно конкретным вариантам осуществления моноциты включают в себя макрофаги. Как правило, фенотип клеточной поверхности макрофагов включает в себя CD14, CD40, CD11b, CD64, F4/80 (мыши)/EMR1 (человек), лизоцим M, MAC-1/MAC-3 и CD68.
Согласно конкретным вариантам осуществления моноциты включают в себя циркулирующие моноциты. Как правило, фенотип клеточной поверхности циркулирующих моноцитов включает в себя CD14 и CD16 (например, CD14++, CD16-, CD14+ CD16++, CD14++, CD16+).
Согласно конкретным вариантам осуществления иммунные клетки включают в себя DC.
Используемый в настоящем документе термин «дендритные клетки (DC)» относится к любому представителю разнообразной популяции морфологически сходных типов клеток, обнаруженных в лимфоидных или нелимфоидных тканях. DC представляют собой класс профессиональных антигенпрезентирующих клеток и обладают высокой способностью сенсибилизировать HLA-ограниченные T-клетки. DC включают в себя, например, плазмоцитоидные дендритные клетки, миелоидные дендритные клетки (в том числе незрелые и зрелые дендритные клетки), клетки Лангерганса, интердигитальные клетки, фолликулярные дендритные клетки. Дендритные клетки могут распознаваться по функции или по фенотипу, в частности по фенотипу клеточной поверхности. Эти клетки характеризуются своей отличительной морфологией, имеющей вуалеподобные выступы на клеточной поверхности, промежуточными и высокими уровнями экспрессии HLA-класса II на поверхности и способностью презентировать антиген Т-клеткам, особенно наивным Т-клеткам (смотрите Steinman R, et al. Ann. Rev. Immunol. 1991; 9: 271-196.). Как правило, фенотип клеточной поверхности DC включает в себя CD1a+, CD4+, CD86+ или HLA-DR. Термин «DC» охватывает как незрелые, так и зрелые DC.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя гранулоциты.
Используемый в настоящем документе термин «гранулоциты» относится к полиморфноядерным лейкоцитам, характеризующимся наличием гранул в их цитоплазме.
Согласно конкретным вариантам осуществления гранулоциты включают в себя нейтрофилы.
Согласно конкретным вариантам осуществления гранулоциты включают в себя тучные клетки.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя Т-клетки.
Используемый в настоящем документе термин «Т-клетки» относится к дифференцированному лимфоциту с CD3+, T-клеточным рецептором (TCR)+, имеющим фенотип CD4+ или CD8+. Т-клетка может представлять собой эффекторную или регуляторную Т-клетку.
Используемый в настоящем документе термин «эффекторные Т-клетки» относится к Т-клетке, которая активирует или направляет другие иммунные клетки, например, путем производства цитокинов, или обладает цитотоксической активностью, например, CD4+, Th1/Th2, CD8+ цитотоксический Т-лимфоцит.
Используемый в настоящем документе термин «регуляторная Т-клетка» или «Treg» относится к Т-клетке, которая отрицательно регулирует активацию других Т-клеток, включая в себя эффекторные Т-клетки, а также клетки врожденной иммунной системы. Клетки Treg характеризуются устойчивой супрессией ответов эффекторных Т-клеток. Согласно конкретному варианту осуществления Treg представляет собой CD4+CD25+Foxp3+ T-клетку.
Согласно конкретным вариантам осуществления Т-клетки представляют собой CD4+ Т-клетки.
Согласно другим конкретным вариантам осуществления Т-клетки представляют собой CD8+ Т-клетки.
Согласно конкретным вариантам осуществления Т-клетки представляют собой Т-клетки памяти. Неограничивающие примеры T-клеток памяти включают в себя эффекторные CD4+ T-клетки памяти с фенотипом CD3+/CD4+/CD45RA-/CCR7-, центральные CD4+ T-клетки памяти с фенотипом CD3+/CD4+/CD45RA-/CCR7+, эффекторные CD8+ T-клетки памяти с фенотипом CD3+/CD8+/CD45RA-/CCR7- и центральные CD8+ Т-клетки памяти с фенотипом CD3+/CD8+/CD45RA-/CCR7+.
Согласно конкретным вариантам осуществления Т-клетки содержат сконструированные Т-клетки, трансдуцированные последовательностью нуклеиновой кислоты, кодирующей представляющий интерес продукт экспрессии.
Согласно конкретным вариантам осуществления представляющий интерес продукт экспрессии представляет собой рецептор Т-клеток (TCR) или рецептор химерного антигена (CAR).
Используемое в настоящем документе выражение «трансдуцированный последовательностью нуклеиновой кислоты, кодирующей TCR» или «трансдуцирование последовательностью нуклеиновой кислоты, кодирующей TCR» относится к клонированию вариабельных α- и β-цепей из T-клеток со специфичностью в отношении желаемого антигена, представленного в контексте МНС. Способы трансдукции с помощью TCR известны в настоящей области техники и раскрыты, например, в Nicholson et al., Adv Hematol. 2012; 2012:404081; Wang and  Cancer Gene Ther. 2015 Mar;22(2):85-94) и Lamers et al., Cancer Gene Therapy (2002) 9, 613-623.
Cancer Gene Ther. 2015 Mar;22(2):85-94) и Lamers et al., Cancer Gene Therapy (2002) 9, 613-623.
Используемый в настоящем документе термин «трансдуцированный последовательностью нуклеиновой кислоты, кодирующей CAR» или «трансдуцирующий последовательностью нуклеиновой кислоты, кодирующей CAR», относится к клонированию последовательности нуклеиновой кислоты, кодирующей рецептор химерного антигена (CAR), причем CAR содержит фрагмент распознавания антигена и фрагмент активации Т-клеток. Химерный рецептор антигена (CAR) представляет собой искусственно сконструированный гибридный белок или полипептид, содержащий антигенсвязывающий домен антитела (например, вариабельный фрагмент с одной цепью (scFv)), связанный с сигнальными доменами T-клеток или доменами активации T-клеток. Способы трансдукции с помощью CAR известны в настоящей области техники и раскрыты, например, в Davila et al., Oncoimmunology. 2012 Dec 1;1(9):1577-1583; Wang and  Cancer Gene Ther. 2015 Mar; 22(2):85-94); Maus et al., Blood. 2014 Apr 24;123(17):2625-35; Porter DL The New England journal of medicine. 2011, 365(8):725-733; Jackson HJ, Nat Rev Clin Oncol. 2016;13(6):370-383 и Globerson-Levin et al., Mol Ther. 2014;22(5):1029-1038.
Cancer Gene Ther. 2015 Mar; 22(2):85-94); Maus et al., Blood. 2014 Apr 24;123(17):2625-35; Porter DL The New England journal of medicine. 2011, 365(8):725-733; Jackson HJ, Nat Rev Clin Oncol. 2016;13(6):370-383 и Globerson-Levin et al., Mol Ther. 2014;22(5):1029-1038.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя В-клетки.
Используемый в настоящем документе термин «В-клетки» относится к лимфоциту с фенотипом В-клеточного рецептора (BCR)+, CD19+ и/или B220+. В-клетки характеризуются способностью связывать специфический антиген и вызывать гуморальный ответ.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя NK-клетки.
Используемый в настоящем документе термин «NK-клетки» относится к дифференцированным лимфоцитам с TCR-фенотипом CD16+CD56 + и/или CD57+. NK характеризуются способностью связывать и уничтожать клетки, которые не способны экспрессировать «собственные» антигены MHC/HLA путем активации специфических цитолитических ферментов, способностью уничтожать опухолевые клетки или другие патологические клетки, которые экспрессируют лиганд для рецепторов, активирующих NK, и способностью высвобождать белковые молекулы, называемые цитокинами, которые стимулируют или ингибируют иммунный ответ.
Согласно конкретным вариантам осуществления иммунные клетки включают в себя NKT-клетки.
Используемый в настоящем документе термин «NKT-клетки» относится к специализированной популяции T-клеток, которые экспрессируют полуинвариантный рецептор αβ T-клеток, но также экспрессируют различные молекулярные маркеры, которые, как правило, связаны с NK-клетками, такие как NK1.1. Клетки NKT включают в себя клетки NK1.1+ и NK1.1-, а также клетки CD4+, CD4-, CD8+ и CD8-. TCR на клетках NKT уникален тем, что он распознает гликолипидные антигены, представленные MHC I-подобной молекулой CD1d. Клетки NKT могут оказывать защитное или вредное действие из-за их способности производить цитокины, которые способствуют воспалению или иммунной толерантности.
Согласно конкретным вариантам осуществления иммунные клетки получают от здорового субъекта.
Согласно конкретным вариантам осуществления иммунные клетки получают от субъекта, страдающего патологией.
Согласно конкретным вариантам осуществления активация происходит в присутствии клеток, экспрессирующих PD-L1 или экзогенный PD-L1.
Согласно конкретным вариантам осуществления активация происходит в присутствии экзогенного PD-L1.
Согласно конкретным вариантам осуществления экзогенный PD-L1 является растворимым.
Согласно другим конкретным вариантам осуществления экзогенный PD-L1 иммобилизован на твердой подложке.
Согласно конкретным вариантам осуществления активация происходит в присутствии клеток, экспрессирующих PD-L1.
Согласно конкретным вариантам осуществления клетки, экспрессирующие PD-L1, включают в себя патологические (больные) клетки.
Согласно конкретным вариантам осуществления клетки, экспрессирующие PD-L1, содержат клетки рака.
Согласно конкретным вариантам осуществления активация происходит в присутствии стимулирующего средства, способного по меньшей мере передавать первичный активирующий сигнал [например, лигирование T-клеточного рецептора (TCR) с комплексом главного комплекса гистосовместимости (MHC)/пептида на антигенпрезентирующей клетке (APC)], приводящий к клеточной пролиферации, созреванию, производству цитокинов, фагоцитозу и/или индукции регуляторных или эффекторных функций иммунной клетки. Согласно конкретным вариантам осуществления стимулирующее средство также может передавать вторичный костимулирующий сигнал.
Способы определения количества стимулирующего средства и соотношения между стимулирующим средством и иммунными клетками находятся в пределах возможностей специалиста в настоящей области техники и, таким образом, в настоящем документе не указаны.
Стимулирующее средство может активировать иммунные клетки зависимым или независимым от антигена (т.е. поликлональным) образом.
Согласно конкретным вариантам осуществления стимулирующее средство включает в себя неспецифический к антигену стимулятор.
Неспецифические стимуляторы известны специалисту в настоящей области техники. Таким образом, в качестве неограничивающего примера, когда иммунные клетки включают в себя Т-клетки, неспецифический к антигену стимулятор может представлять собой средство, способное связываться со структурой поверхности Т-клеток и индуцировать поликлональную стимуляцию Т-клеток, такую как, без ограничения, к антителу к CD3 в комбинации с костимулирующим белком, таким как антитело к CD28. Другие неограничивающие примеры включают в себя анти-CD2, анти-CD137, анти-CD134, Notch-лиганды, например, Delta-подобные 1/4, Jaggedl/2 либо в отдельности, либо в различных комбинациях с анти-CD3. Другие средства, которые могут индуцировать поликлональную стимуляцию Т-клеток, включают в себя, без ограничения, митогены, PHA, PMA-иономицин, CEB и CytoStim (Miltenyi Biotech). Согласно конкретным вариантам осуществления неспецифический к антигену стимулятор включает в себя антитела к CD3 и к CD28. Согласно конкретным вариантам осуществления стимулятор Т-клеток включает в себя гранулы, покрытые анти-CD3 и анти-CD28, такие как CD3CD28 MACSiBead, полученные от Miltenyi Biotec.
Согласно конкретным вариантам осуществления стимулирующее средство включает в себя специфический к антигену стимулятор.
Неограничивающие примеры специфических к антигену стимуляторов Т-клеток включают в себя нагруженную антигеном антигенпрезентирующую клетку [APC, например, дендритная клетка] и нагруженный пептидом рекомбинантный МНС. Таким образом, например, стимулятор Т-клеток может представлять собой дендритную клетку, предварительно нагруженную желаемым антигеном (например, опухолевым антигеном) или трансфицированную мРНК, кодирующей желаемый антиген.
Согласно конкретным вариантам осуществления антиген представляет собой раковый антиген.
Используемый в настоящем документе термин «раковый антиген» относится к антигену, который сверхэкспрессируется или экспрессируется исключительно злокачественной клеткой по сравнению с незлокачественной клеткой. Раковый антиген может представлять собой известный раковый антиген или новый специфический антиген, который развивается в злокачественной клетке (т.е. неоантигены).
Неограничивающие примеры известных раковых антигенов включают в себя MAGE-AI, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-AS, MAGE-A6, MAGE-A7, MAGE-AS, MAGE-A9, MAGE-AIO, MAGE -Все, MAGE-A12, GAGE-I, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, BAGE-1, RAGE-1, LB33/MUM -1, PRAME, NAG, MAGE-Xp2 (MAGE-B2), MAGE-Xp3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-Cl/CT7, MAGE-C2, NY-ES0-1, LAGE-1, SSX-1, SSX-2 (HOM-MEL-40), SSX-3, SSX-4, SSX-5, SCP-1 и XAGE, антигены дифференцировки меланоцитов, p53, ras, CEA, MUCI, PMSA, PSA, тирозиназу, Melan-A, MART-I, gplOO, gp75, альфаактинин-4, слитый белок Bcr-Abl, Casp-8, бета-катенин, cdc27, cdk4, cdkn2a, coa-l, слитый белок dek-can, EF2, слитый белок ETV6-AML1, слитый белок LDLR-фукозилтрансфераза AS, HLA-A2, HLA-All, hsp70-2, KIAA0205, Mart2, Mum-2 и 3, нео-PAP, миозин класса I, OS-9, слитый белок pml-RAR-альфа, PTPRK, K-ras, N-ras, триозофосфат-изомеразу, GnTV, Herv-K-mel, NA-88, SP17 и TRP2-Int2, (MART-I), E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барр, EBNA, антигены вируса папилломы человека (HPV) E6 и E7, TSP-180, MAGE-4, MAGE-5, MAGE-6, p185erbB2, plSOerbB-3, c-met, nm-23Hl, PSA, TAG- 72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, альфа-фетопротеин, 13HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68\KP1, C0-029, FGF-5, 0250, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB\170K, NYCO-I, RCASI, SDCCAG16, TA-90 (Mac-2-связывающий белок\ассоциированный с циклофилином C белок), TAAL6, TAG72, TLP, TPS, родственные тирозиназе белки, TRP-1 или TRP-2.
Другие опухолевые антигены, которые могут быть экспрессированы, хорошо известны в настоящей области техники (смотрите, например, W000/20581; Cancer Vaccines and Immunotherapy (2000) Eds Stern, Beverley and Carroll, Cambridge University Press, Cambridge). Последовательности этих опухолевых антигенов легкодоступны из общедоступных баз данных, но их также можно найти в WO 1992/020356 AI, WO 1994/005304 AI, WO 1994/023031 AI, WO 1995/020974 AI, WO 1995/023874 AI и WO 1996/026214 AI.
Альтернативно или дополнительно, опухолевый антиген может быть идентифицирован с использованием злокачественных клеток, полученных от субъекта, например, с помощью биопсии.
Таким образом, согласно конкретным вариантам осуществления стимулирующее средство включает в себя злокачественные клетки.
Согласно конкретным вариантам осуществления активация происходит в присутствии противоракового средства.
Согласно конкретным вариантам осуществления иммунные клетки очищают после активации.
Таким образом, настоящее изобретение также предусматривает выделенные иммунные клетки, которые можно получать в соответствии со способами по настоящему изобретению.
Согласно конкретным вариантам осуществления иммунные клетки, используемые и/или полученные в соответствии с настоящим изобретением, могут быть свежевыделенными, храниться, например, криоконсервированными (т.е. замороженными), например, при температуре жидкого азота, на любой стадии в течение длительных периодов времени (например, месяцев, лет) для будущего применения; и клеточные линии.
Способы криоконсервирования, как правило, известны специалисту в настоящей области техники и раскрыты, например, в публикациях международной заявки на патент № WO2007054160 и WO 2001039594 и публикации заявки на патент США № US20120149108.
Согласно конкретным вариантам осуществления клетки, полученные в соответствии с настоящим изобретением, могут храниться в банке клеток или на складе или в хранилище.
Следовательно, настоящее изобретение дополнительно предусматривает применение выделенных иммунных клеток и способов по настоящему изобретению в качестве, но без ограничения, источника для адоптивной терапии иммунными клетками заболеваний, для которых может быть выгодна активация иммунных клеток, например, гиперпролиферативное заболевание; заболевание, связанное с иммуносупрессией и инфекциями.
Таким образом, согласно конкретным вариантам осуществления способ по настоящему изобретению предусматривает адоптивный перенос иммунных клеток после указанной активации нуждающемуся в этом субъекту.
Согласно конкретным вариантам осуществления иммунные клетки, получаемые в соответствии со способами по настоящему изобретению, предназначены для применения в адоптивной клеточной терапии.
Клетки, используемые в соответствии с конкретными вариантами осуществления настоящего изобретения, могут быть аутологичными или неаутологичными; они могут быть сингенными или несингенными: аллогенными или ксеногенными для субъекта; каждая возможность представляет отдельный вариант осуществления настоящего изобретения.
Настоящее изобретение также предусматривает применение композиций по настоящему изобретению (например, слитого белка, кодирующего его полинуклеотида или конструкции нуклеиновой кислоты или экспрессирующей его клетки-хозяина) в способах лечения заболевания, для которого может быть выгодна активация иммунных клеток.
Таким образом, согласно другому аспекту настоящего изобретения предложен способ лечения заболевания, для которого может быть выгодна активация иммунных клеток, предусматривающий введение нуждающемуся в этом субъекту слитого белка PD1-4-1BBL, кодирующего его полинуклеотида или конструкции нуклеиновой кислоты или кодирующей его клетки-хозяина.
Согласно другому аспекту настоящего изобретения предусмотрен слитый белок PD1-4-1BBL, кодирующий его полинуклеотид или конструкция нуклеиновой кислоты или кодирующая его клетка-хозяин, для применения при лечении заболевания, для которого может быть выгодна активация иммунных клеток.
Термин «лечение» или «лечить» относится к ингибированию, предотвращению или прекращению развития патологии (заболевания, нарушения или медицинского состояния) и/или к снижению, ремиссии или регрессии патологии или симптома патологии. Специалистам в настоящей области техники должно быть понятно, что различные методологии и анализы могут применяться для оценки развития патологии, и аналогично, различные методологии и анализы могут применяться для оценки уменьшения, ремиссии или регрессии патологии.
Используемый в настоящем документе термин «субъект» включает в себя млекопитающих, например, людей, в любом возрасте и любого пола. Согласно конкретным вариантам осуществления термин «субъект» относится к субъекту, который страдает от патологии (заболевания, нарушения или медицинского состояния). Согласно конкретным вариантам осуществления этот термин охватывает индивидуумов, которым грозит риск развития патологии.
Согласно конкретным вариантам осуществления субъект страдает от заболевания, связанного с экспрессирующими PD-L1 клетками.
Согласно конкретным вариантам осуществления патологические клетки субъекта экспрессируют PD-L1.
Используемое в настоящем документе выражение «заболевание, для которого может быть выгодна активация иммунных клеток» относится к заболеваниям, при которых активность иммунного ответа субъекта может быть достаточной по меньшей мере для ослабления симптомов заболевания или задержки появления симптомов, однако по любой причине активность иммунного ответа субъекта при этом меньше оптимальной.
Неограничивающие примеры заболеваний, для которых может быть выгодна активация иммунных клеток, включают в себя гиперпролиферативные заболевания, заболевания, связанные с иммуносупрессией, медикаментозно-индуцированной иммуносупрессией (например, ингибиторами mTOR, ингибитором кальциневрина, стероидами) и инфекции.
Согласно конкретным вариантам осуществления заболевание включает в себя гиперпролиферативное заболевание.
Согласно конкретным вариантам осуществления гиперпролиферативное заболевание включает в себя склероз или фиброз, идиопатический легочный фиброз, псориаз, системный склероз/склеродермию, первичный желчный холангит, первичный склерозирующий холангит, фиброз печени, профилактику радиационно-индуцированного легочного фиброза, миелофиброз или забрюшинный фиброз.
Согласно другим конкретным вариантам осуществления гиперпролиферативное заболевание включает в себя рак.
Таким образом, согласно другому аспекту настоящего изобретения, предложен способ лечения рака, предусматривающий введение слитого белка PD1-4-1BBL нуждающемуся в этом субъекту.
Используемый в настоящем документе термин «рак» охватывает как злокачественные, так и предзлокачественные формы рака.
Что касается предзлокачественных или доброкачественных форм рака, необязательно композиции и способы можно применять для остановки прогрессирования предзлокачественного рака в злокачественную форму.
Рак, который можно лечить способами по некоторым вариантам осуществления настоящего изобретения, может представлять собой любой солидный или не солидный рак и/или метастазирование рака.
Согласно конкретным вариантам осуществления рак включает в себя злокачественный рак.
Типы рака, которые можно лечить с помощью способов согласно некоторым вариантам осуществления настоящего изобретения, могут представлять собой солидный или несолидный рак и/или раковые метастазы. Примеры форм рака включают в себя, без ограничения, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких форм рака включают в себя плоскоклеточный рак, рак легкого (включая в себя мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, гепатоцеллюлярный рак, рак желудка (включая в себя рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, рак эндометрия или матки, рак слюнной железы, рак почки или почечный рак, рак печени, рак предстательной железы, рак влагалища, рак щитовидной железы, рак печени и различные виды рака головы и шеи, а также В-клеточную лимфому (включая в себя высокодифференцированную/фолликулярную неходжкинскую лимфому (NHL); малую лимфоцитарную (SL) NHL, NHL промежуточной дифференцировки/фолликулярную, диффузную NHL промежуточной дифференцировки, низкодифференцированную иммунобластическую NHL, лимфому Беркитта, диффузную крупноклеточную В-клеточную лимфому (DLBCL), низкодифференцированную лимфобластную NHL, низкодифференцированную NHL клеток с нерасщепленным ядром; NHL с генерализованной лимфаденопатией; лимфому из клеток мантийной зоны; связанную с AIDS лимфому и макроглобулинемию Вальденстрема); Т-клеточную лимфому, лимфому Ходжкина, хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); острый миелоидный лейкоз (AML), острый промиелоцитарный лейкоз (APL), лейкоз ворсистых клеток; хронический миелобластный лейкоз (CML) и посттрансплантационное лимфопролиферативное расстройство (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозами, отеками (такими, как опухоли головного мозга) и синдромом Мейгса. Предпочтительно, рак выбран из группы, состоящей из рака молочной железы, колоректального рака, рака прямой кишки, немелкоклеточного рака легкого, неходжкинской лимфомы (NHL), почечно-клеточного рака, рака простаты, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной саркомы, рака головы и шеи, меланомы, рака яичников, мезотелиомы и множественной миеломы. Раковые состояния, поддающиеся лечению по настоящему изобретению, включают в себя метастатические типы рака.
Согласно конкретным вариантам осуществления рак включает в себя предзлокачественный рак.
Предзлокачественные формы рака (или предраковые заболевания) хорошо охарактеризованы и известны в настоящей области техники (смотрите, например, Berman JJ. and Henson DE., 2003. Classifying the precancers: a metadata approach. BMC Med Inform Decis Mak. 3:8). Классы предзлокачественных форм рака, поддающихся лечению с помощью способа по настоящему изобретению, включают в себя приобретенные мелкие или микроскопические предзлокачественные раковые заболевания, приобретенные крупные поражения с ядерной атипией, предраковые поражения, возникающие с наследственными гиперпластическими синдромами, которые прогрессируют до рака, и приобретенные диффузные гиперплазии и диффузные метаплазии. Примеры небольших или микроскопических предзлокачественных форм рака включают в себя HGSIL (плоскоклеточное внутриэпителиальное поражение шейки матки высокой степени тяжести), AIN (анальную интраэпителиальную неоплазию анального отверстия), дисплазию голосовых связок, аберрантные крипты (толстой кишки), PIN (интраэпителиальную неоплазию предстательной железы). Примеры приобретенных крупных поражений с ядерной атипией включают в себя тубулярную аденому, AILD (ангиоиммунобластическую лимфаденопатию с диспротеинемией), атипичную менингиому, полип желудка, крупный бляшечный парапсориаз, миелодисплазию, папиллярную переходно-клеточную карциному in situ, эксцентричную плоскоклеточную карциному in situ, рефракторную анемию с избытком бластов и папиллому Schneiderian. Примеры предраковых поражений, возникающих при наследственных гиперпластических синдромах, которые прогрессируют до рака, включают в себя синдром атипичной родинки, аденоматоз C-клеток и MEA. Примеры приобретенной диффузной гиперплазии и диффузной метаплазии включают в себя AIDS, атипичную лимфоидную гиперплазию, болезнь Педжета кости, лимфопролиферативное заболевание после трансплантации и язвенный колит.
Согласно некоторым вариантам осуществления настоящего изобретения заболевания, подлежащие лечению слитым белком, содержащим PD1 или его ECD и 4-1BBL или его ECD, такие как, например, PD1- G - 4-1BBL, представляют собой следующие:
острый миелоидный лейкоз, рак анального канала, базальноклеточная карцинома, В-клеточная неходжкинская лимфома, рак желчного протока, рак мочевого пузыря, рак молочной железы, рак шейки матки, хронический лимфолейкоз (CLL), хронический миелоцитарный лейкоз (CML), рак толстой и прямой кишок, Т-клеточная лимфома кожи, диффузная В-крупноклеточная лимфома, рак эндометрия, рак пищевода, рак фаллопиевых труб, фолликулярная лимфома, рак желудка, карциномы гастроэзофагеального перехода (GE), опухоли половых клеток, герминомные опухоли половых клеток (семиномные), мультиформная глиобластома, глиосаркома, рак головы и шеи, гепатоцеллюлярная карцинома, лимфома Ходжкина, рак гипофарингеального канала, рак гортани, лейомиосаркома, мантийноклеточная лимфома, меланома, карцинома из клеток Меркеля, множественная миелома, нейроэндокринные опухоли, неходжкинская лимфома, немелкоклеточный рак легких, рак ротовой полости (рта), рак ротоглотки, остеосаркома, рак яичников, рак поджелудочной железы, опухоль оболочки периферических нервов (нейрофибросаркома), периферические Т-клеточные лимфомы (PTCL), рак брюшной полости, рак предстательной железы, почечно-клеточная карцинома, рак слюнных желез, рак кожи, мелкоклеточный рак легких, саркома мягких тканей, плоскоклеточная карцинома, синовиальная саркома, рак яичка, карцинома тимуса, рак щитовидной железы, рак мочеточника, рак уретры, рак матки, рак влагалища, рак вульвы.
Согласно некоторым вариантам осуществления настоящего изобретения заболеваниями, которые подвергаются лечению слитым белком, содержащим PD1 или его ECD и 4-1BBL или его ECD, таким как, например, PD1- G - 4-1BBL, являются: острый миелолейкоз, рак мочевого пузыря, рак молочной железы, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, рак толстой и прямой кишок, диффузная крупноклеточная B-клеточная лимфома, эпителиальный рак яичников, эпителиальная опухоль, рак фаллопиевых труб, фолликулярная лимфома, мультиформная глиобластома, гепатоцеллюлярная карцинома, рак головы и шеи, лейкоз, лимфома, мантийноклеточная лимфома, меланома, мезотелиома, множественная миелома, рак носоглотки, неходжкинская лимфома, немелкоклеточная карцинома легких, рак яичников, рак простаты, почечно-клеточный рак.
Согласно конкретным вариантами осуществления рак выбран из группы, состоящей из лимфомы, лейкоза, рака толстой кишки, рака поджелудочной железы, рака яичника, рака легкого и плоскоклеточной карциномы.
Согласно конкретным вариантам осуществления, рак выбран из группы, состоящей из лимфомы, карциномы и лейкоза.
Согласно конкретным вариантам осуществления рак представляет собой рак толстой кишки.
Согласно конкретным вариантам осуществления рак представляет собой рак яичника.
Согласно конкретным вариантам осуществления рак представляет собой карциному легкого.
Согласно конкретным вариантам осуществления рак представляет собой рак головы и шеи.
Согласно конкретным вариантам осуществления рак представляет собой лейкоз.
Согласно конкретным вариантам осуществления лейкоз выбран из группы, состоящей из острого нелимфоцитарного лейкоза, хронического лимфолейкоза, острого гранулоцитарного лейкоза, хронического гранулоцитарного лейкоза, острого промиелоцитарного лейкоза, Т-клеточного лейкоза у взрослых, алейкемического лейкоза, базофильного лейкоза, недифференцируемого лейкоза, лейкоза крупного рогатого скота, хронического миелоцитарного лейкоза, лейкоза кожи, эмбрионального лейкоза, эозинофильного лейкоза, лейкоза Росса, лейкоз ворсистых клеток, гемобластного лейкоза, гемоцитобластного лейкоза, гистиоцитарной лимфомы, недифференцируемого лейкоза, острого моноцитарного лейкоза, лейкопенического лейкоза, лимфолейкоза, лимфобластного лейкоза, лимфоцитарного лейкоза, лимфогенного лейкоза, лимфатического лейкоза, клеточного лейкоза лимфосаркомы, лейкоза тучных клеток, мегакариоцитарного лейкоза, микромиелобластного лейкоза, моноцитарного лейкоза, миелобластного лейкоза, миелолейкоза, миелоидного гранулоцитарного лейкоза, миеломоноцитарного лейкоза, лейкоза Нейджела, плазмоклеточного лейкоза, плазмоцитарного лейкоза, промиелоцитарного лейкоза, лейкоза клеток Ридера, лейкоза Шиллинга, лейкоза стволовых клеток, сублейкемического лейкоза и лейкоза недифференцированных клеток.
Согласно конкретным вариантам осуществления лейкоз представляет собой промиелоцитарный лейкоз, острый миелоидный лейкоз или хронический миелогенный лейкоз.
Согласно конкретным вариантам осуществления рак представляет собой лимфому.
Согласно конкретным вариантам осуществления лимфома представляет собой В-клеточную лимфому
Согласно конкретным вариантам осуществления лимфома представляет собой Т-клеточную лимфому.
Согласно другим конкретным вариантам осуществления лимфома представляет собой лимфому Ходжкина.
Согласно конкретным вариантам осуществления лимфома представляет собой неходжкинскую лимфому.
Согласно конкретным вариантам осуществления неходжкинская лимфома выбрана из группы, состоящей из агрессивной NHL, трансформированной NHL, индолентной NHL, рецидивирующей NHL, рефрактерной NHL, высокодифференцированной неходжкинской лимфомы, фолликулярной лимфомы, крупноклеточной лимфомы, В-клеточной лимфомы, Т-клеточной лимфомы, мантийноклеточной лимфомы, лимфомы Беркитта, лимфомы NK-клеток, диффузной крупноклеточной В-клеточной лимфомы, острой лимфобластной лимфомы и Т-клеточного рака кожи, включая в себя грибовидный микоз/синдром Сезри.
Согласно конкретным вариантам осуществления рак представляет собой множественную миелому.
Согласно по меньшей мере некоторым вариантам осуществления множественная миелома выбрана из группы, состоящей из множества раковых заболеваний миеломы, которые производят легкие цепи каппа-типа и/или легкие цепи лямбда-типа; агрессивной множественной миеломы, включая в себя первичный плазматический лейкоз (PCL); доброкачественных нарушений в плазматических клетках, таких как MGUS (моноклональная гаммопатия неопределенного значения), макроглобулинемии Вальденстрема (WM, также известной как лимфоплазмоцитарная лимфома), которая может протекать при множественной миеломе; тлеющей множественной миеломы (SMM), невыраженной множественной миеломы, предраковых форм множественной миеломы, которые могут также переходить в множественную миелому; первичного амилоидоза.
Примерный способ действия PD1-4-1BBL
Согласно одному варианту осуществления химера PD1-4-1BBL может быть использована для лечения рака посредством следующего возможного способа действия:
• Благодаря относительно высокой экспрессии PDL1 на поверхности опухолевых клеток и в опухолевом микроокружении, фрагмент PD1 химеры PD1-4-1BBL будет нацеливать молекулу на участки опухоли и метастазирования и будет связывать химеру с PDL1 в пределах опухолевого микроокружение.
• Нацеливание химеры на опухолевые клетки и/или опухолевое микроокружение будет способствовать увеличению концентрации PD1-4-1BBL в опухолевом микроокружении и последующей олигомеризации фрагмента 4-1BBL химеры в сайте опухоли. Поскольку олигомеризация 4-1BBL является необходимой стадией для передачи сигналов 4-1BB, это связывание и олигомеризация 4-1BBL будет давать костимулирующий сигнал 4-1BB, который будет стимулировать активацию T-клеток, B-клеток, NK-клеток, особенно инфильтрующих опухоли лимфоцитов (TIL) и других иммунных клеток в сайте опухоли, чтобы уничтожить раковые клетки.
• В дополнение к костимулирующему сигналу 4-1BBL - 4-1BB, связывание фрагмента PD1 химеры с PDL1 в опухолевом сайте будет конкурировать с эндогенным PD1, экспрессируемым на Т-клетках, таким образом, устраняя ингибирование на Т-клетках и дополнительно способствуя активации TIL в опухолевом микроокружении.
Ожидается, что вышеуказанные активности PD1-4-1BBL приведут к синергетическому эффекту на активацию TIL в опухолевом микроокружении, что, как ожидается, будет представлять собой более специфический и более устойчивый эффект по сравнению с эффектом каждого пептида или их ECD отдельно, а также при использовании двух разных пептидов или их ECD в комбинации.
Таким образом, согласно конкретным вариантам осуществления, рак определяется наличием опухолей, которые имеют инфильтрирующие опухоль лимфоциты (TIL) в опухолевом микроокружении, и/или опухолей с экспрессией PDL1 в опухолевом микроокружении.
Таким образом, согласно конкретным вариантам осуществления, рак определяется наличием опухолей, которые имеют инфильтрирующие опухоль лимфоциты (TIL) в опухолевом микроокружении, и/или опухолей с относительно высокой экспрессией PDL1 в опухолевом микроокружении.
Согласно конкретным вариантам осуществления клетки рака экспрессируют PDL1.
Согласно конкретным вариантам осуществления заболевание включает в себя заболевание, связанное с иммуносупрессией или медикаментозно-индуцированной иммуносупрессией (например, ингибиторы mTOR, ингибитор кальциневрина, стероиды).
Согласно конкретным вариантам осуществления заболевание включает в себя вирусы HIV, кори, гриппа, LCCM, RSV, человеческого риновируса, EBV, CMV или Parvo.
Согласно конкретным вариантам осуществления заболевание включает в себя инфекцию.
Используемый в настоящем документе термин «инфекция» или «инфекционное заболевание» относится к заболеванию, вызываемому патогеном. Конкретные примеры патогенов включают в себя вирусные патогены, бактериальные патогены, например, внутриклеточные микобактериальные патогены (такие как, например, Mycobacterium tuberculosis), внутриклеточные бактериальные патогены (такие как, например, Listeria monocytogenes) или внутриклеточные патогенные микроорганизмы (такие как, например, лейшмания и трипаносома).
Конкретные типы вирусных патогенов, вызывающих инфекционные заболевания, которые можно лечить в соответствии с принципами настоящего изобретения, включают в себя, без ограничения, ретровирусы, цирковирусы, парвовирусы, паповавирусы, аденовирусы, вирусы герпеса, иридовирусы, поксвирусы, гепаднавирусы, пикорнавирусы, калицивирусы, тогавирусы, флавивирусы, реовирусы, ортомиксовирусы, парамиксовирусы, рабдовирусы, буньявирусы, коронавирусы, аренавирусы и филовирусы.
Конкретные примеры вирусных инфекций, которые можно лечить в соответствии с принципами настоящего изобретения, включают в себя, без ограничения, синдром приобретенного иммунодефицита (AIDS), вызванного вирусом иммунодефицита человека (HIV), грипп, риновирусную инфекцию, вирусный менингит, вирус Эпштейна-Барр (EBV), вирус гепатита A, B или C, корь, вирус папилломы/бородавки, цитомегаловирус (CMV), вирус простого герпеса, желтую лихорадку, вирус Эбола, бешенство и т.д.
Согласно конкретным вариантам осуществления композиции по настоящему изобретению (например, слитый белок PD1-4-1BBL, кодирующий его полинуклеотид или конструкция нуклеиновой кислоты и/или экспрессирующая его клетка-хозяин) могут вводиться субъекту в сочетании с другой установленной или экспериментальной схемой лечения для лечения заболевания, для которого может быть выгодна активация иммунных клеток (например, рак), включая в себя, без ограничения, анальгетики, химиотерапевтические средства, радиотерапевтические средства, цитотоксическую терапию (кондиционирование), гормональную терапию, антитела и другие схемы лечения (например, хирургическое вмешательство), которые хорошо известны в настоящей области техники.
Согласно конкретным вариантам осуществления композиции по настоящему изобретению (например, слитый белок PD1-4-1BBL, кодирующий его полинуклеотид или конструкция нуклеиновой кислоты и/или экспрессирующая его клетка-хозяин) могут быть введены субъекту в комбинации с трансплантацией адоптивных клеток, такой как, без ограничения, трансплантация клеток костного мозга, гемопоэтических стволовых клеток, РВМС, стволовых клеток пуповинной крови и/или индуцированных плюрипотентных стволовых клеток.
Согласно конкретным вариантам осуществления терапевтическое средство, вводимое в комбинации с композицией по настоящему изобретению, содержит противораковое средство.
Таким образом, согласно другому аспекту настоящего изобретения предложен способ лечения рака, предусматривающий введение нуждающемуся в этом субъекту противоракового средства и слитого белка PD1-4-1BBL, кодирующего его полинуклеотида, кодирующей его конструкции нуклеиновой кислоты или экспрессирующей его клетки-хозяина.
Противораковые средства, которые можно использовать с конкретными вариантами осуществления настоящего изобретения, включают в себя, без ограничения, такие противораковые лекарственные средства, как ацивицин; акларубицин; акодазола гидрохлорид; акронин; адриамицин; адозелезин; алдеслейкин; алтретамин; амбомицин; аметантрон ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бисантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; брекинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карзелезин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазиквон; доцетаксла; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; эльзамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбулозол; эсорубицин гидрохлорид; эстрамустин; эстрамустин фосфат натрия; этанидазол; этопозид; этопозид фосфат; этоприн; фадрозол гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабин фосфат; фторурацил; фторцитабин; фосквидоан; фострицин натрия; гемцитабин; гемцитабина гидрохлорид; гидроксимочевина; идарубицин гидрохлорид; изофосфамид; илмофозин; интерферон альфа-2а; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-1а; интерферон гамма- b; ипроплатин; иринотекан гидрохлорид; ланреотид ацетат; летрозол; леупролид ацетат; лиарозол гидрохлорид; лометрексол натрия; ломустин; лосоксантрон гидрохлорид; масопрокол; майтансин; мехлорэтамина гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митиндомид; митокарцин; митокромин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофеноловая кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргаз; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамидин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфосат натрия; спарзомицин; спирогерманий гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; талисомицин; таксол; текогалан натрий; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофуирин; тирапазамин; топотекан гидрохлорид; торемифен цитрат; трестолон ацетат; трицирибин фосфат; триметрексат; триметрексат глюкуронат; трипторелин; тубулозол гидрохлорид; урациловый иприт; уредепа; вапреотид; вертепорфин; винбластин сульфат; винкристин сульфат; виндезин; виндезин сульфат; винепидин сульфат; винглицинат сульфат; винлейрозин сульфат; винорелбин тартрат; винросидин сульфат; винзолидин сульфат; ворозол; зениплатин; зиностатин; зорубицин гидрохлорид. Дополнительные противоопухолевые средства включают те, которые описаны в главе 52 «Противоопухолевые средства» (Paul Calabresi and Bruce A. Chabner) и введении к ней, 1202-1263, of Goodman and Gilman's "The Pharmacological Basis of Therapeutics", Eighth Edition, 1990, McGraw-Hill, Inc. (Health Professions Division).
Согласно конкретным вариантам осуществления противораковое средство включает в себя антитело.
Согласно конкретным вариантам осуществления антитело выбрано из группы, содержащей ритуксимаб, цетуксимаб, трастузумаб, эдреколомаб, алемтузумаб, гемтузумаб, ибритумомаб, панитумумаб, белимумаб, бевацизумаб, биватузумаб мертанзин, блинатумомаб, блонтуветмаб, брентуксимаб ведотин, катумаксомаб, циксутумумаб, даклизумаб, адалимумаб, безлотоксумаб, цертолизумаб пегол, цитатузумаб богатокс, даратумумаб, динутуксимаб, элотузумаб, эртумаксомаб, этарацизумаб, гемтузумаб озогамицин, гирентуксимаб, нецитумумаб, обинутузумаб, офатумумаб, пертузумаб, рамуцирумаб, силтуксимаб, тоситумомаб, трастузумаб и ипилимумаб.
Согласно конкретным вариантам осуществления антитело выбрано из группы, состоящей из ритуксимаба и цетуксимаба.
Согласно конкретным вариантам осуществления терапевтическое средство, вводимое в комбинации с композицией по настоящему изобретению, содержит противоинфекционное средство (например, антибиотики и противовирусные средства).
Согласно конкретным вариантам осуществления терапевтическое средство, вводимое в комбинации с композицией по настоящему изобретению, включает в себя средство-супрессор иммунитета (например, GCSF и другие стимуляторы костного мозга, стероиды).
Согласно конкретным вариантам осуществления комбинированная терапия оказывает аддитивный эффект.
Согласно конкретным вариантам осуществления комбинированная терапия оказывает синергетический эффект.
Согласно другому аспекту настоящего изобретения предусмотрено изделие, идентифицированное для лечения заболевания, для которого может быть выгодна активация иммунных клеток, содержащее упаковочный материал, упаковывающий терапевтическое средство для лечения указанного заболевания и слитый белок PD1-4-1BBL, кодирующий его полинуклеотид, кодирующую его конструкцию нуклеиновой кислоты или экспрессирующую его клетку-хозяина.
Согласно конкретным вариантам осуществления терапевтическое средство для лечения указанного заболевания и слитый белок PD1-4-1BBL, кодирующий его полинуклеотид, кодирующая его конструкция нуклеиновой кислоты или экспрессирующая его клетка-хозяин представляют собой пакеты в отдельных контейнерах.
Согласно конкретным вариантам осуществления терапевтическое средство для лечения указанного заболевания и слитый белок PD1-4-1BBL, кодирующий его полинуклеотид, кодирующая его конструкция нуклеиновой кислоты или экспрессирующая его клетка-хозяин представляют собой пакеты в совместной композиции.
Как используется в настоящем документе, согласно одному варианту осуществления термин «производное аминокислоты» или «производное» относится к группе, получаемой из встречающейся в природе или не встречающейся в природе аминокислоты, как описано и приведено в качестве примера в настоящем документе. Производные аминокислот очевидны для специалистов в настоящей области техники и включают в себя, без ограничения, сложный эфир, аминоспирт, аминоальдегид, аминолактон и N-метильные производные встречающихся в природе или не встречающихся в природе аминокислот. Согласно варианту осуществления производное аминокислоты предоставляется в качестве заместителя соединения, описанного в настоящем документе, причем заместитель представляет собой -NH-G(Sc)-C(0)-Q или -OC(0)G(Sc)-Q, где Q представляет собой -SR, -NRR или алкоксил, R представляет собой водород или алкил, Sc представляет собой боковую цепь встречающейся в природе или не встречающейся в природе аминокислоты, а G представляет собой C1-C2-алкил. Согласно некоторым вариантам осуществления G представляет собой Ci алкил и Sc выбран из группы, состоящей из водорода, алкила, гетероалкила, арилалкила и гетероарилалкила.
Используемый в настоящем документе согласно одному варианту осуществления термин «пептид», «полипептид» или «белок», которые взаимозаменяемо используются в настоящем документе, может происходить из природного биологического источника, быть синтезирован или получен рекомбинантной технологией. Он может быть получен любым способом, известным в настоящей области синтеза пептидов или белков, в том числе путем химического синтеза. Что касается твердофазного пептидного синтеза, краткое изложение многих техник можно найти в J. M. Stewart and J. D. Young, Solid Phase Peptide Synthesis, W. H. Freeman Co. (San Francisco), 1963 и J. Meienhofer, Hormonal Proteins and Peptides, vol. 2, p. 46, Academic Press (New York), 1973. О синтезе классического решения смотрите G. Schroder and K. Lupke, The Peptides, vol. 1, Academic Press (New York), 1965. Одна или несколько аминокислот могут быть модифицированы, например, путем добавления химического соединения, такого как углеводная группа, фосфатная группа, фарнезильная группа, изофамеситная группа, группа жирной кислоты, ацильная группа (например, ацетильная группа), линкер для конъюгации, функционализации или другие известные защитные/блокирующие группы. Модификации пептида или белка могут быть введены путем синтеза генов, сайт-направленного (например, на основе ПЦР) или случайного мутагенеза (например, EMS) путем делеции экзонуклеазы, химической модификации или слияния полинуклеотидных последовательностей, кодирующих гетерологичный домен или связывающий белок, например.
Используемый в настоящем документе термин «пептид» может представлять собой фрагменты, производные, аналоги или варианты вышеуказанных пептидов и любую их комбинацию. Фрагменты пептидов, как этот термин или фраза используются в настоящем документе, включают в себя протеолитические фрагменты, а также фрагменты делеции. Варианты пептидов включают в себя фрагменты и пептиды с измененными аминокислотными последовательностями вследствие аминокислотных замен, делеций или вставок.
Варианты могут представлять собой встречающиеся в природе или не встречающиеся в природе варианты. Примеры включают в себя слитые белки, пептиды, имеющие один или несколько остатков, химически дериватизированные путем реакции функциональной боковой группы, и пептиды, которые содержат одно или несколько встречающихся в природе аминокислотных производных двадцати стандартных аминокислот. Эти модификации могут также включать в себя включение D-аминокислот или других некодированных аминокислот. Согласно одному варианту осуществления ни одна из модификаций не должна существенно влиять на желаемую биологическую активность пептида, его фрагмента. Согласно другому варианту осуществления модификации могут изменять характеристику пептида, его фрагмента, например, стабильность или период полураспада, без нарушения желаемой биологической активности пептида, его фрагмента. Согласно одному варианту осуществления, используемые в настоящем документе термины «пептид» и «белок» могут использоваться взаимозаменяемо, характеризуясь все теми же значениями и качествами.
Согласно одному варианту осуществления для облегчения восстановления экспрессированная кодирующая последовательность может быть сконструирована так, чтобы кодировать пептид по настоящему изобретению и слитый расщепляемый фрагмент. Согласно одному варианту осуществления слитый белок может быть разработан так, что пептид может быть легко выделен аффинной хроматографией; например, путем иммобилизации на колонке, специфической для расщепляемого фрагмента. Согласно одному варианту осуществления сайт расщепления конструируют между пептидом и расщепляемым фрагментом, и пептид может высвобождаться из хроматографической колонки путем обработки подходящим ферментом или средством, которое специфически расщепляет слитый белок в этом месте [например, смотрите Booth et al., Immunol. Lett. 19:65-70 (1988) и Gardella et al., J. Biol. Chem. 265:15854-15859 (1990)].
Согласно одному варианту осуществления каждый из пептидов, которые образуют слитый белок (также называемый в настоящем документе «пептидом») по настоящему изобретению, также может быть синтезирован с использованием систем экспрессии in vitro. Согласно одному варианту осуществления способы синтеза in vitro хорошо известны в настоящей области техники, и компоненты системы коммерчески доступны.
Согласно одному варианту осуществления для получения пептида по настоящему изобретению используется технология рекомбинантных ДНК. «Рекомбинантный» пептид или белок относится к пептиду или белку, полученному способами рекомбинантной ДНК; т.е. полученному из клеток, трансформированных экзогенной ДНК-конструкцией, кодирующей желаемый пептид или белок.
Таким образом, согласно другому аспекту настоящего изобретения предусмотрен выделенный полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую любой из описанных выше слитых белков.
Согласно конкретным вариантам осуществления полинуклеотид содержит SEQ ID NO: 9.
Согласно конкретным вариантам осуществления полинуклеотид состоит из SEQ ID NO: 9.
Согласно конкретным вариантам осуществления полинуклеотид по меньшей мере приблизительно на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологичен нуклеиновой последовательности, представленной в SEQ ID No. 9.
Используемый в настоящем документе термин «полинуклеотид» относится к одноцепочечной или двухцепочечной последовательности нуклеиновой кислоты, которая выделена и представлена в виде последовательности РНК, комплементарной полинуклеотидной последовательности (кДНК), геномной полинуклеотидной последовательности и/или составной полинуклеотидной последовательности (например, комбинации вышеуказанных).
Для экспрессии экзогенного PD1-4-1BBL в клетках млекопитающих полинуклеотидную последовательность, кодирующую PD1-4-1BBL, предпочтительно лигируют в конструкцию нуклеиновой кислоты, подходящую для экспрессии в клетках млекопитающих. Такая конструкция нуклеиновой кислоты включает в себя промоторную последовательность для направления транскрипции полинуклеотидной последовательности в клетке конститутивным или индуцибельным образом.
Следовательно, согласно конкретным вариантам осуществления предусмотрена конструкция нуклеиновой кислоты, содержащая полинуклеотид и регуляторный элемент для направления экспрессии указанного полинуклеотида в клетке-хозяине.
Конструкция нуклеиновой кислоты (также называемая в настоящем документе «вектором экспрессии») по некоторым вариантам осуществления настоящего изобретения включает в себя дополнительные последовательности, которые делают этот вектор пригодным для репликации и интеграции в прокариоты, эукариоты или, предпочтительно, и туда и туда (например, челночные векторы). Кроме того, типичные векторы клонирования могут также содержать последовательность инициации транскрипции и трансляции, терминатор транскрипции и трансляции и сигнал полиаденилирования. В качестве примера, такие конструкции, как правило, включают в себя 5'-LTR, сайт связывания тРНК, сигнал упаковки, точку начала синтеза второй цепи ДНК и 3'-LTR или его часть.
Конструкция нуклеиновой кислоты согласно некоторым вариантам осуществления настоящего изобретения, как правило, включает в себя сигнальную последовательность для секреции пептида из клетки-хозяина, в которую она помещена. Предпочтительно сигнальная последовательность для этой цели представляет собой сигнальную последовательность млекопитающего или сигнальную последовательность полипептидных вариантов согласно некоторым вариантам осуществления настоящего изобретения.
Эукариотические промоторы, как правило, содержат два типа последовательностей распознавания, TATA-бокс и промоторные элементы, расположенные выше против хода транскрипции. Считается, что TATA-бокс, расположенный на 25-30 пар оснований выше против хода транскрипции от сайта инициации транскрипции, участвует в направлении РНК-полимеразы к началу синтеза РНК. Другие расположенные выше против хода транскрипции промоторные элементы определяют скорость, с которой начинается транскрипция.
Предпочтительно, промотор, используемый конструкцией нуклеиновой кислоты согласно некоторым вариантам осуществления настоящего изобретения, является активным в трансформированной специфической клеточной популяции. Примеры специфических для типа клеток и/или тканеспецифических промоторов включают в себя такие промоторы, как альбумин, который является специфическим для печени [Pinkert et al., (1987) Genes Dev. 1: 268-277], лимфоид-специфические промоторы [Calame et al., (1988) Adv. Immunol. 43: 235-275]; в частности, промоторы рецепторов Т-клеток [Winoto et al., (1989) EMBO J. 8: 729-733] и иммуноглобулины; [Banerji et al. (1983) Cell 33729-740], нейрон-специфические промоторы, такие как промотор нейрофиламента [Byrne et al. (1989) Proc. Natl. Acad. Sci. USA 86:5473-5477], промоторы, специфические для поджелудочной железы [Edlunch et al. (1985) Science 230: 912-916] или специфические для молочной железы промоторы, такие как промотор молочной сыворотки (патент США № 4873316 и публикация европейской заявки № 264166).
Энхансерные элементы могут стимулировать транскрипцию до 1000 раз от связанных гомологичных или гетерологичных промоторов. Энхансеры активны, когда размещены ниже по ходу транскрипции или выше против хода транскрипции от сайта инициации транскрипции. Многие энхансерные элементы, полученные из вирусов, имеют широкий спектр хозяев и активны в различных тканях. Например, ранний энхансер гена SV40 подходит для многих типов клеток. Другие комбинации энхансер/промотор, подходящие для некоторых вариантов осуществления настоящего изобретения, включают в себя комбинации, полученные из вируса полиомы, цитомегаловируса человека или мыши (CMV), долгосрочный повтор от различных ретровирусов, таких как вирус лейкоза мыши, вирус саркомы мыши или Рауса и HIV. Смотрите публикацию Enhancers and Eukaryotic Expression, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. 1983, которая включена в настоящий документ посредством ссылки.
При конструировании вектора экспрессии промотор предпочтительно расположен приблизительно на таком же расстоянии от гетерологичного сайта старта транскрипции, как и от сайта старта транскрипции в его естественном окружении. Однако, как известно в настоящей области техники, некоторые изменения в этом расстоянии могут быть выполнены без потери функции промотора.
Последовательности полиаденилирования также можно добавлять в вектор экспрессии для повышения эффективности трансляции мРНК PD1-4-1BBL. Для точного и эффективного полиаденилирования требуются два различных элемента последовательности: последовательности, обогащенные GU или U, расположенные ниже по ходу транскрипции от сайта полиаденилирования, и высококонсервативная последовательность из шести нуклеотидов, AAUAAA, расположенная на 11-30 нуклеотидов выше против хода транскрипции. Сигналы терминации и полиаденилирования, которые подходят для некоторых вариантов осуществления настоящего изобретения, включают в себя сигналы, полученные из SV40.
В дополнение к уже описанным элементам вектор экспрессии согласно некоторым вариантам осуществления настоящего изобретения может, как правило, содержать другие специализированные элементы, предназначенные для повышения уровня экспрессии клонированных нуклеиновых кислот или для облегчения идентификации клеток, несущих рекомбинантную ДНК. Например, ряд вирусов животных содержат последовательности ДНК, которые способствуют внехромосомной репликации вирусного генома в пермиссивных типах клеток. Плазмиды, несущие эти вирусные репликоны, реплицируются эписомально до тех пор, пока соответствующие факторы обеспечиваются генами, переносимыми на плазмиде или с геномом клетки-хозяина.
Вектор может включать в себя эукариотический репликон или не включать в себя его. Если присутствует эукариотический репликон, то этот вектор амплифицируется в эукариотических клетках с использованием соответствующего селектируемого маркера. Если вектор не содержит эукариотического репликона, эписомальная амплификация невозможна. Вместо этого рекомбинантная ДНК интегрируется в геном сконструированной клетки, где промотор направляет экспрессию желаемой нуклеиновой кислоты.
Вектор экспрессии согласно некоторым вариантам осуществления настоящего изобретения может дополнительно включать в себя дополнительные полинуклеотидные последовательности, которые позволяют, например, трансляцию нескольких белков из одной мРНК, такой как участок внутренней посадки рибосомы (IRES), и последовательности для геномной интеграции промотора-химерного полипептида.
Понятно, что отдельные элементы, содержащиеся в векторе экспрессии, могут быть расположены во множестве конфигураций. Например, энхансерные элементы, промоторы и т.п., и даже полинуклеотидная последовательность(и), кодирующая PD1-4-1BBL, могут быть расположены в конфигурации «голова к хвосту», могут присутствовать в виде инвертированного комплемента или в комплементарной конфигурации, как анти-параллельная нить. Хотя такое разнообразие конфигурации более вероятно встречается с некодирующими элементами вектора экспрессии, также предусмотрены альтернативные конфигурации кодирующей последовательности в векторе экспрессии.
Примеры векторов экспрессии у млекопитающих включают в себя, без ограничения, pcDNA3, pcDNA3.1(+/-), pGL3, pZeoSV2(+/-), pSecTag2, pDisplay, pEF/myc/cyto, pCMV/myc/cyto, pCR3.1, pSinRep5, DH26S, DHBB, pNMT1, pNMT41, pNMT81, которые доступны от Invitrogen, pCI, который доступен от Promega, pMbac, pPbac, pBK-RSV и pBK-CMV, которые доступны от Strategene, pTRES, который доступен от Clontech и их производные.
Также могут быть использованы векторы экспрессии, содержащие регуляторные элементы из эукариотических вирусов, таких как ретровирусы. Векторы SV40 включают в себя pSVT7 и pMT2. Векторы, полученные из вируса папилломы крупного рогатого скота, включают в себя pBV-1MTHA, а векторы, полученные из вируса Эпштейна-Барр, включают в себя pHEBO и p2O5. Другие иллюстративные векторы включают в себя pMSG, pAV009/A+, pMTO10/A+, pMAMneo-5, pDSVE бакуловируса и любой другой вектор, обеспечивающий экспрессию белков под руководством раннего промотора SV-40, позднего промотора SV-40, промотора металлотионеина, мышиного промотора вируса молочной железы, промотора вируса саркомы Рауса, промотора полиэдрина или другие промоторы, показанные как эффективные для экспрессии в эукариотических клетках.
Как описано выше, вирусы являются очень специализированными возбудителями инфекции, которые во многих случаях эволюционировали, чтобы избежать механизмов защиты хозяина. Как правило, вирусы заражают и размножаются в определенных типах клеток. Направленная специфичность вирусных векторов использует их природную специфичность для специфического нацеливания на заранее определенные типы клеток и, таким образом, вводит рекомбинантный ген в инфицированную клетку. Таким образом, тип вектора, используемого некоторыми вариантами осуществления настоящего изобретения, будет зависеть от типа трансформированной клетки. Возможность выбора подходящих векторов в соответствии с трансформированным типом клеток находится в пределах возможностей обычного специалиста в настоящей области техники, и поэтому в настоящем документе не приводится общее описание рассмотрения выбора. Например, на клетки костного мозга можно нацеливаться с использованием вируса типа I лейкоза Т-клеток человека (HTLV-I), а на клетки почек можно воздействовать с использованием гетерологичного промотора, присутствующего в бакуловирусе нуклеополиэдровируса Autographa californica (AcMNPV), как описано в Liang CY et al., 2004 (Arch Virol. 149: 51-60).
Рекомбинантные вирусные векторы применимы для экспрессии in vivo PD1-4-1BBL, поскольку они обладают такими преимуществами, как латеральная инфекция и направленная специфичность. Латеральная инфекция присуща, например, жизненному циклу ретровируса и представляет собой процесс, при котором одна инфицированная клетка производит множество вирионов потомства, которые отрываются и заражают соседние клетки. В результате происходит быстрое заражение большой области, большая часть которой изначально не была заражена исходными вирусными частицами. Это контрастирует с вертикальным типом инфекции, при которой возбудитель инфекции распространяется только через дочернее потомство. Также могут быть получены вирусные векторы, которые не могут распространяться латерально. Эта характеристика может быть применимой, если желаемой целью является введение указанного гена только в локализованное количество клеток-мишеней.
Различные способы могут быть использованы для введения вектора экспрессии согласно некоторым вариантам осуществления настоящего изобретения в клетки. Такие способы, как правило, описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992), в Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989), Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995), Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995), Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988) и Gilboa et at. [Biotechniques 4 (6): 504-512, 1986] и включают в себя, например, стабильную или временную трансфекцию, липофекцию, электропорацию и инфицирование рекомбинантными вирусными векторами. Кроме того, смотрите патент США № 4464764 и 5487992 для способов положительного-отрицательного отбора.
Введение нуклеиновых кислот при вирусной инфекции предлагает несколько преимуществ по сравнению с другими способами, такими как липофекция и электропорация, поскольку благодаря инфекционной природе вирусов может быть достигнута более высокая эффективность трансфекции.
В настоящее время предпочтительные способы переноса нуклеиновых кислот in vivo включают в себя трансфекцию вирусными или невирусными конструкциями, такими как аденовирус, лентивирус, вирус Herpes simplex I или аденоассоциированный вирус (AAV) и системы на основе липидов. Пригодными липидами для липид-опосредованного переноса генов являются, например, DOTMA, DOPE и DC-Chol [Tonkinson et al., Cancer Investigation, 14 (1): 54-65 (1996)]. Наиболее предпочтительными конструкциями для применения в генной терапии являются вирусы, наиболее предпочтительно аденовирусы, AAV, лентивирусы или ретровирусы. Вирусная конструкция, такая как ретровирусная конструкция, включает в себя по меньшей мере один промотор/энхансер транскрипции или элемент(ы), определяющий локус, или другие элементы, которые контролируют экспрессию гена другими способами, такими как альтернативный сплайсинг, экспорт ядерной РНК или посттрансляционная модификация мессенджера. Такие векторные конструкции также включают в себя сигнал упаковки, длинные концевые повторы (LTR) или их части и сайты связывания праймера положительной и отрицательной нити, соответствующие используемому вирусу, если он уже не присутствует в вирусной конструкции. Кроме того, такая конструкция, как правило, включает в себя сигнальную последовательность для секреции пептида из клетки-хозяина, в которую он помещен. Предпочтительно сигнальная последовательность для этой цели представляет собой сигнальную последовательность млекопитающего или сигнальную последовательность полипептидных вариантов согласно некоторым вариантам осуществления настоящего изобретения. Необязательно, конструкция также может включать в себя сигнал, который направляет полиаденилирование, а также один или несколько сайтов рестрикции и последовательность терминации трансляции. В качестве примера, такие конструкции, как правило, включают в себя 5'-LTR, сайт связывания тРНК, сигнал упаковки, точку начала синтеза второй цепи ДНК и 3'-LTR или его часть. Могут быть использованы другие векторы, которые не являются вирусными, такие как катионные липиды, полилизин и дендримеры.
Как указано, кроме содержания необходимых элементов для транскрипции и трансляции вставленной кодирующей последовательности, конструкция экспрессии согласно некоторым вариантам осуществления настоящего изобретения также может включать в себя последовательности, сконструированные для повышения стабильности, производства, очистки, выхода или токсичности экспрессируемого пептида. Например, может быть сконструирована экспрессия слитого белка или расщепляемого слитого белка, содержащего белок PD1-4-1BBL согласно некоторым вариантам осуществления настоящего изобретения и гетерологичный белок. Такой слитый белок может быть сконструирован так, что слитый белок может быть легко выделен аффинной хроматографией; например, путем иммобилизации на колонке, специфической для гетерологичного белка. Когда сайт расщепления создается между белком PD1-4-1BBL и гетерологичным белком, белок PD1-4-1BBL может высвобождаться из хроматографической колонки путем обработки подходящим ферментом или средством, который разрушает сайт расщепления [например, смотрите Booth et al. (1988) Immunol. Lett. 19:65-70 и Gardella et al., (1990) J. Biol. Chem. 265:15854-15859].
Настоящее изобретение также рассматривает клетки, содержащие описанную в настоящем документе композицию.
Таким образом, согласно конкретным вариантам осуществления предусмотрена клетка-хозяин, содержащая слитый белок PD1-4-1BBL, кодирующий его полинуклеотид или кодирующую его конструкцию нуклеиновой кислоты.
Как указано выше, различные прокариотические или эукариотические клетки могут быть использованы в качестве систем экспрессии хозяина для экспрессии полипептидов согласно некоторым вариантам осуществления настоящего изобретения. Они включают в себя, без ограничения, микроорганизмы, такие как бактерии, трансформированные рекомбинантной ДНК бактериофага, плазмидной ДНК или вектором экспрессии космидной ДНК, содержащей кодирующую последовательность; дрожжи, трансформированные рекомбинантными дрожжевыми векторами экспрессии, содержащими кодирующую последовательность; системы растительных клеток, инфицированные векторами экспрессии рекомбинантных вирусов (например, вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV) или трансформированными векторами экспрессии рекомбинантных плазмид, такими как плазмида Ti, содержащая кодирующую последовательность. Системы экспрессии млекопитающих могут также использоваться для экспрессии полипептидов согласно некоторым вариантам осуществления настоящего изобретения.
Примеры бактериальных конструкций включают в себя серию pET векторов экспрессии E.coli [Studier et al. (1990) Methods in Enzymol. 185: 60-89).
Примеры эукариотических клеток, которые можно использовать вместе с принципами настоящего изобретения, включают в себя, без ограничения, клетки млекопитающих, клетки грибов, клетки дрожжей, клетки насекомых, клетки водорослей или клетки растений.
В дрожжах может быть использован ряд векторов, содержащих конститутивные или индуцибельные промоторы, как раскрыто в заявке на патент США №: 5932447. В качестве альтернативы можно использовать векторы, которые способствуют интеграции чужеродных последовательностей ДНК в хромосому дрожжей.
В тех случаях, когда используются векторы экспрессии растений, экспрессия кодирующей последовательности может управляться рядом промоторов. Например, вирусные промоторы, такие как промоторы 35S РНК и 19S РНК CaMV [Brisson et al. (1984) Nature 310: 511-514], или промотор белка оболочки для TMV [Takamatsu et al. (1987) EMBO J. 6: 307-311]. Альтернативно, промоторы растений, такие как малая субъединица RUBISCO [Coruzzi et al. (1984) EMBO J. 3: 1671-1680 и Brogli et al., (1984) Science 224: 838-843] или промоторы теплового шока, например, hsp17.5-E или hsp17.3-B сои [Gurley et al., (1986), Mol. Cell. Biol. 6: 559-565]. Эти конструкции могут быть введены в растительные клетки с использованием Ti-плазмиды, Ri-плазмиды, растительных вирусных векторов, прямой трансформации ДНК, микроинъекции, электропорации и других способов, хорошо известных специалисту в настоящей области техники. Смотрите, например, Weissbach & Weissbach, 1988, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp 421-463.
Другие системы экспрессии, такие как системы клеток-хозяев насекомых и млекопитающих, которые хорошо известны в настоящей области техники, также могут быть использованы согласно некоторым вариантам осуществления настоящего изобретения.
Согласно конкретным вариантам осуществления клетка представляет собой клетку млекопитающего.
Согласно конкретному варианту осуществления клетка представляет собой клетку человека.
Согласно конкретному варианту осуществления клетка представляет собой клеточную линию.
Согласно другому конкретному варианту осуществления клетка представляет собой первичную клетку.
Клетка может быть получена из подходящей ткани, включая в себя, без ограничения, кровь, мышцу, нерв, головной мозг, сердце, легкое, печень, поджелудочную железу, селезенку, тимус, пищевод, желудок, кишечник, почку, семенник, яичник, волосы, кожу, кость, молочную железу, матку, мочевой пузырь, спинной мозг или различные виды биологических жидкостей. Клетки могут быть получены на любой стадии развития, включая в себя стадии эмбриона, плода и взрослой особи, а также происхождения развития, т.е. эктодермального, мезодермального и энтодермального происхождения.
Неограничивающие примеры клеток млекопитающих включают в себя линию CV1 почки обезьяны, трансформированную SV40 (COS, например, COS-7, ATCC CRL 1651); эмбриональную почечную линию человека (клетки HEK293 или HEK293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol., 36:59 1977); клетки почек детенышей хомяка (BHK, ATCC CCL 10); клетки сертоли мыши (TM4, Mather, Biol. Reprod., 23: 243-251 1980); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HeLa, ATCC CCL 2); NIH3T3, Jurkat, клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс буффало (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci., 383: 44-68 1982); клетки MRC 5; клетки FS4 и линию гепатомы человека (Hep G2), PER.C6, K562 и клетки яичника китайского хомячка (CHO).
Согласно некоторым вариантам осуществления настоящего изобретения клетка млекопитающего выбрана из группы, состоящей из клетки яичника китайского хомяка (СНО), HEK293, PER.C6, HT1080, NS0, Sp2/0, BHK, Namalwa, COS, HeLa и Vero.
Согласно некоторым вариантам осуществления настоящего изобретения клетка-хозяин включает в себя клетку яичника китайского хомячка (СНО), PER.C6 или 293 (например, Expi293F).
Согласно другому аспекту настоящего изобретения предложен способ получения слитого белка PD1-4-1BBL, предусматривающий экспрессию в клетке-хозяине полинуклеотида или конструкции нуклеиновой кислоты, описанной в настоящем документе.
Согласно конкретным вариантам осуществления способы предусматривают выделение слитого белка.
Согласно конкретным вариантам осуществления извлечение рекомбинантного полипептида осуществляют после соответствующего времени в культуре. Фраза «выделение рекомбинантного полипептида» относится к сбору всей ферментационной среды, содержащей полипептид, и не требует дополнительных стадий разделения или очистки. Несмотря на вышесказанное, полипептиды согласно некоторым вариантам осуществления настоящего изобретения могут быть очищены с использованием различных стандартных способов очистки белка, таких как, без ограничения, аффинная хроматография, ионообменная хроматография, фильтрация, электрофорез, хроматография гидрофобного взаимодействия, гель-фильтрационная хроматография, обращенно-фазовая хроматография, хроматография на конканавалине А, смешанная хроматография, металло-аффинная хроматография, аффинная хроматография с лектинами, хроматофокусирование и дифференциальная солюбилизация.
Согласно некоторым вариантам осуществления рекомбинантные пептиды, их фрагменты или пептиды синтезируют и очищают; их терапевтическая эффективность может быть оценена либо in vivo, либо in vitro. Согласно одному варианту осуществления активность рекомбинантных фрагментов или пептидов по настоящему изобретению можно определить с использованием различных анализов, включая в себя жизнеспособность клеток, выживание трансгенных мышей и экспрессию маркеров мегакариоцитарной и лимфоидной РНК.
Согласно одному варианту осуществления пептид по настоящему изобретению содержит по меньшей мере 3 аминокислоты. Согласно другому варианту осуществления пептид содержит по меньшей мере 5 аминокислот. Согласно другому варианту осуществления пептид содержит по меньшей мере 10 аминокислот. Согласно другому варианту осуществления пептид содержит по меньшей мере 20 аминокислот. Согласно другому варианту осуществления пептид содержит по меньшей мере 25 аминокислот. Согласно другому варианту осуществления пептид содержит по меньшей мере 30 аминокислот или по меньшей мере 50 аминокислот, или 75 аминокислот, или 100 аминокислот, или 125 аминокислот, или 150 аминокислот, или 200 аминокислот, или 250 аминокислот, или 300 аминокислот, или 350 аминокислот или 400 аминокислот. Согласно одному варианту осуществления пептид по настоящему изобретению состоит по существу по меньшей мере из 5 аминокислот. Согласно другому варианту осуществления пептид состоит по существу по меньшей мере из 10 аминокислот. Согласно другим вариантам осуществления пептид состоит по существу по меньшей мере из 30 аминокислот или по меньшей мере из 50 аминокислот, или 75 аминокислот, или 100 аминокислот, или 125 аминокислот, или 150 аминокислот, или 200 аминокислот, или 250 аминокислот, или 300 аминокислот или 350 аминокислот или 400 аминокислот. Согласно одному варианту осуществления пептид по настоящему изобретению состоит по меньшей мере из 5 аминокислот. Согласно другому варианту осуществления пептид состоит по меньшей мере из 10 аминокислот. Согласно другим вариантам осуществления пептид состоит по меньшей мере из 30 аминокислот, или по меньшей мере из 50 аминокислот, или 75 аминокислот, или 100 аминокислот, или 125 аминокислот, или 150 аминокислот, или 200 аминокислот, или 250 аминокислот, или 300 аминокислоты, или 350 аминокислот, или 400 аминокислот, или 500, или 600 или 700 аминокислот.
Используемые в настоящем документе, согласно одному варианту осуществления, термины «пептид» и «фрагмент» могут использоваться взаимозаменяемо, характеризуясь всеми теми же значениями и качествами. Используемый в настоящем документе, согласно одному варианту осуществления, термин «пептид» включает в себя нативные пептиды (или продукты разложения, синтетически синтезированные пептиды или рекомбинантные пептиды) и пептидомиметики (как правило, синтетически синтезированные пептиды), такие как пептоиды и семипептоиды, которые являются пептидными аналогами, которые могут иметь, например, модификации, делающие пептиды более стабильными в организме или более способными проникать в бактериальные клетки. Такие модификации включают в себя, без ограничения, модификацию N-конца, модификацию C-конца, модификацию пептидной связи, включая в себя, без ограничения, CH2-NH, CH2-S, CH2-S=O, O=C-NH, CH2-O, CH2-CH2, S=C-NH, CH=CH или CF=CH, модификации основной цепи и модификации остатка. Способы получения пептидомиметических соединений хорошо известны в настоящей области техники и указаны, например, в публикации Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992), которая включена посредством ссылки, как если бы она была полностью изложена в настоящем документе. Дальнейшие подробности в этом отношении приведены ниже.
Пептидные связи (-CO-NH-) внутри пептида могут быть замещены, например, N-метилированными связями (-N(CH3)-CO-), сложноэфирными связями (-C(R)HCOOC(R)-N-), кетометиленовыми связями (-CO-CH2-), α-аза связями (-NH-N(R)-CO-), где R представляет собой любой алкил, например, метил, карбамидными связями (-CH2-NH-), гидроксиэтиленовыми связями (-CH(OH)-CH2-), тиоамидными связями (-CS-NH-), олефиновыми двойными связями (-CH=CH-), ретроамидными связями (-NH-CO-), пептидными производными (-N(R)-CH2-CO-), где R представляет собой «нормальную» боковую цепь, естественно представленную на атоме углерода.
Эти модификации могут происходить в любой из связей вдоль пептидной цепи и даже в нескольких (2-3) одновременно.
Природные ароматические аминокислоты, Trp, Tyr и Phe, могут быть заменены синтетической неприродной кислотой, такой как TIC, нафтиламин (Nol), метилированные по кольцу производные Phe, галогенированные производные Phe или o-метил-Tyr.
Согласно одному варианту осуществления пептид по настоящему изобретению дополнительно содержит обнаруживаемую метку. Используемый в настоящем документе, согласно одному варианту осуществления, термин «обнаруживаемая метка» относится к любому фрагменту, который может быть обнаружен квалифицированным специалистом с использованием известных в настоящей технике способов. Обнаруживаемые метки для использования в способах скрининга по настоящему изобретению могут представлять собой пептидные последовательности. Необязательно, обнаруживаемая метка может быть удалена химическими средствами или ферментативными средствами, такими как протеолиз. Например, термин «обнаруживаемая метка» включает в себя метку хитинсвязывающего белка (CBP), метку мальтозосвязывающего белка (MBP), метку глутатион-S-трансферазы (GST), метку поли-(His), метку FLAG, метки Epitope такие как V5-метка, c-myc-метка и HA-метка, и флуоресцентные метки, такие как зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP), желтый флуоресцентный белок (YFP), синий флуоресцентный белок (BFP) и голубой флуоресцентный белок (CFP); а также производные этих меток или любые метки, известные в настоящей области техники. Термин «обнаруживаемая метка» также включает в себя термин «обнаруживаемый маркер».
Согласно одному варианту осуществления пептид по настоящему изобретению представляет собой выделенный пептид. Такой выделенный пептид может включать в себя пептидную метку.
Пептиды согласно некоторым вариантам осуществления настоящего изобретения предпочтительно используются в линейной форме, хотя следует понимать, что в случаях, когда циклизация не оказывает серьезного влияния на характеристики пептида, также могут использоваться циклические формы пептида.
Используемый в настоящем документе термин «аминокислота» относится к встречающимся в природе и синтетическим аминокислотам α, β, γ или δ и включает в себя, без ограничения, обнаруженные в белках аминокислоты, т.е. глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, серин, треонин, цистеин, тирозин, аспарагин, глутамин, аспартат, глутамат, лизин, аргинин и гистидин. Согласно определенным вариантам осуществления аминокислота находится в L-конфигурации. Альтернативно, аминокислота может представлять собой производное аланила, валинила, лейцинила, изолейцинила, пролинила, фенилаланинила, триптофанила, метионинила, глицинила, серинила, треонинила, цистеинила, тирозинила, аспарагинила, глутаминила, аспартоила, глутароила, лизинила, аргининила, гистидинила, β-аланила, β-валинила, β-лейцинила, β-изолейцинила, β-пролинила, β-фенилаланинила, β-триптофанила, β-метионинила, β-глицинила, β-серинила, β-треонинила, β-цистеинила, β-тирозинила, β-аспарагинила, β-глутаминила, β-аспартоила, β-глутароила, β-лизинила, β-аргининила или β-гистидинила.
Поскольку настоящие пептиды предпочтительно используются в терапии или диагностике, которые требуют, чтобы пептиды находились в растворимой форме, пептиды согласно некоторым вариантам осуществления настоящего изобретения предпочтительно включают в себя одну или несколько неприродных или природных полярных аминокислот, включая в себя, без ограничения, серин и треонин, которые способны увеличивать растворимость пептидов благодаря своей гидроксилсодержащей боковой цепи.
Используемое в настоящем документе, согласно одному варианту осуществления, выражение «консервативно модифицированные варианты» относится как к аминокислотным последовательностям, так и к последовательностям нуклеиновых кислот. «Аминокислотные варианты» относятся к аминокислотным последовательностям. Что касается конкретных последовательностей нуклеиновых кислот, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные аминокислотные последовательности, или где нуклеиновая кислота не кодирует аминокислотную последовательность, по существу к идентичным или связанным (например, естественным образом смежным) последовательностям. Из-за вырожденности генетического кода большое количество функционально идентичных нуклеиновых кислот кодирует большинство белков. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, где аланин указан кодоном, кодон может быть изменен на другой из соответствующих описанных кодонов, не изменяя кодированный полипептид. Такие вариации нуклеиновых кислот представляют собой «молчащие вариации», которые являются одним из видов консервативно модифицированных вариаций. Каждая последовательность нуклеиновой кислоты в настоящем документе, которая кодирует полипептид, также описывает молчащие вариации нуклеиновой кислоты. Специалисту в настоящей области техники будет понятно, что в определенных контекстах каждый кодон в нуклеиновой кислоте (кроме AUG, который, как правило, является единственным кодоном для метионина, и TGG, который, как правило, является единственным кодоном для триптофана), может быть модифицирован для получения функционально идентичной молекулы. Соответственно, молчащие вариации нуклеиновой кислоты, которая кодирует полипептид, подразумеваются в описанной последовательности по отношению к продукту экспрессии.
Что касается аминокислотных последовательностей, специалисту в настоящей области техники будет понятно, что отдельные замены, делеции или добавления к последовательности нуклеиновой кислоты, пептида, полипептида или белка, которые изменяют, добавляют или удаляют одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности представляет собой «консервативно модифицированный вариант», в том числе в том случае, когда изменение приводит к замене аминокислоты на химически сходную аминокислоту. Таблицы консервативных замен, обеспечивающие функционально сходные аминокислоты, хорошо известны в настоящей области техники. Руководство относительно того, какие аминокислотные изменения могут быть фенотипически молчащими, также можно найти в Bowie et al., 1990, Science 247: 1306 1310. Такие консервативно модифицированные варианты являются дополнением и не исключают полиморфные варианты, межвидовые гомологи и аллели. Типичные консервативные замены включают в себя, без ограничения: 1) аланин (A), глицин (G); 2) аспарагиновую кислоту (D), глутаминовую кислоту (E); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (M), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серин (S), треонин (T) и 8) цистеин (C), метионин (M) (смотрите, например, Creighton, Proteins (1984)). Аминокислоты могут быть замещены на основе свойств, связанных с боковыми цепями, например, аминокислоты с полярными боковыми цепями могут быть замещены, например, серином (S) и треонином (T); аминокислоты на основе электрического заряда боковых цепей, например, аргинином (R) и гистидином (H); и аминокислоты, которые имеют гидрофобные боковые цепи, например, валином (V) и лейцином (L). Как указано, изменения, как правило, имеют второстепенную природу, такую как консервативные аминокислотные замены, которые не оказывают существенного влияния на укладку или активность белка.
ХИМИЧЕСКИЕ МОДИФИКАЦИИ БЕЛКА
В настоящем изобретении любая часть белка по настоящему изобретению может быть химически модифицирована, т.е. изменена путем добавления функциональных групп. Например, боковые аминокислотные остатки, присутствующие в нативной последовательности, могут быть необязательно модифицированы, хотя, как описано ниже, альтернативно, другие части белка могут быть необязательно модифицированы, в дополнение или вместо боковых аминокислотных остатков. Модификация может необязательно выполняться во время синтеза молекулы, если следует процесс химического синтеза, например, путем добавления химически модифицированной аминокислоты. Однако химическая модификация аминокислоты, когда она уже присутствует в молекуле (модификация «in situ»), также возможна.
Аминокислота любой из областей последовательности молекулы может быть необязательно модифицирована в соответствии с любым из следующих иллюстративных типов модификации (в пептиде, концептуально рассматриваемом как «химически модифицированный»). Неограничивающие иллюстративные типы модификации включают в себя карбоксиметилирование, ацилирование, фосфорилирование, гликозилирование или ацилирование жирных кислот. Эфирные связи могут необязательно использоваться для присоединения гидроксила серина или треонина к гидроксилу сахара. Амидные связи могут необязательно использоваться для присоединения глутаматных или аспартатных карбоксильных групп к аминогруппе на сахаре (Garg and Jeanloz, Advances in Carbohydrate Chemistry and Biochemistry, Vol. 43, Academic Press (1985); Kunz, Ang. Chem. Int. Ed. English 26: 294-308 (1987). Ацетальные и кетальные связи могут также необязательно образовываться между аминокислотами и углеводами. Ацильные производные жирных кислот необязательно могут быть получены, например, путем ацилирования свободной аминогруппы (например, лизина) (Toth et al., Peptides: Chemistry, Structure and Biology, Rivier and Marshal, eds., ESCOM Publ., Leiden, 1078-1079 (1990)).
Используемый в настоящем документе термин «химическая модификация», когда он относится к белку или пептиду по настоящему изобретению, относится к белку или пептиду, где по меньшей мере один из его аминокислотных остатков модифицируется либо естественными процессами, такими как процессинг или другие посттрансляционные модификации, или способами химической модификации, которые хорошо известны в настоящей области техники. Примеры многочисленных известных модификаций, как правило, включают в себя, без ограничения: ацетилирование, ацилирование, амидирование, ADP-рибозилирование, гликозилирование, образование якоря GPI, ковалентное присоединение липида или производного липида, метилирование, миристилирование, пегилирование, пренилирование, фосфорилирование, убиквитинирование или любой подобный процесс.
Другие типы модификаций необязательно включают в себя добавление циклоалканового фрагмента к биологической молекуле, такой как белок, как описано в заявке PCT № WO 2006/050262, включенной в настоящий документ посредством ссылки, как если бы она была полностью представлена в настоящем документе. Эти фрагменты предназначены для использования с биомолекулами и могут при желании использоваться для придания различных свойств белкам.
Кроме того, необязательно любая точка на белке может быть модифицирована. Например, пегилирование гликозилирующего фрагмента на белке может быть необязательно выполнено, как описано в заявке PCT № WO 2006/050247, включенной в настоящий документ посредством ссылки, как если бы она была полностью представлена в настоящем документе. Одна или несколько групп полиэтиленгликоля (ПЭГ) могут быть необязательно добавлены к О-связанному и/или N-связанному гликозилированию. Группа ПЭГ может быть разветвленной или линейной. Необязательно любой тип водорастворимого полимера может быть присоединен к сайту гликозилирования белка через гликозильный линкер.
Под «пегилированным белком» подразумевается белок или его фрагмент, обладающий биологической активностью, имеющий фрагмент полиэтиленгликоля (ПЭГ), ковалентно связанный с аминокислотным остатком белка.
Под «полиэтиленгликолем» или «ПЭГ» понимают соединение полиалкиленгликоля или его производное, со связующими средствами или без них, или дериватизацию с помощью связывающих или активирующих фрагментов (например, с тиолом, трифлатом, трезилатом, азирдином, оксираном или предпочтительно с малеимидным фрагментом). Такие соединения, как малеимидо-монометокси-ПЭГ, представляют собой иллюстративные или активированные соединения ПЭГ по настоящему изобретению. Другие соединения полиалкиленгликоля, такие как полипропиленгликоль, могут быть использованы в настоящем изобретении. Другие подходящие соединения полиалкиленгликоля включают в себя, без ограничения, заряженные или нейтральные полимеры следующих типов: декстран, коломиновые кислоты или другие полимеры на основе углеводов, полимеры аминокислот и производные биотина.
МОДИФИКАЦИЯ БЕЛКА ПОСРЕДСТВОМ ИЗМЕНЕННОГО ГЛИКОЗИЛИРОВАНИЯ
Белки по настоящему изобретению могут быть модифицированы, чтобы иметь измененный профиль гликозилирования (т.е. измененный по сравнению с исходным или нативным профилем гликозилирования). Используемый в настоящем документе термин «измененный» означает удаление одной или нескольких углеводных групп и/или добавление по меньшей мере одного сайта гликозилирования к исходному белку.
Гликозилирование белков, как правило, является либо N-связанным, либо O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности, аспарагин-Х-серин и аспарагин-Х-треонин, где Х представляет собой любую аминокислоту, кроме пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к белкам по настоящему изобретению удобно осуществлять путем изменения аминокислотной последовательности белка таким образом, чтобы он содержал одну или несколько описанных выше трипептидных последовательностей (для N-связанных сайтов гликозилирования). Изменение также может быть осуществлено путем добавления или замены одним или несколькими остатками серина или треонина в последовательности исходного белка (для О-связанных сайтов гликозилирования). Аминокислотная последовательность белка также может быть изменена путем внесения изменений на уровне ДНК.
Другим средством увеличения количества углеводных фрагментов в белках является химическое или ферментативное связывание гликозидов с аминокислотными остатками белка. В зависимости от используемого способа сахара могут быть присоединены к (а) аргинину и гистидину, (b) свободным карбоксильным группам, (c) свободным сульфгидрильным группам, таким как группы цистеина, (d) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (е) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина. Эти способы описаны в WO 87/05330 и в Aplin and Wriston, CRC Crit. Rev. Biochem., 22: 259-306 (1981).
Удаление любых углеводных фрагментов, присутствующих в белках по настоящему изобретению, может быть осуществлено химически, ферментативно или путем внесения изменений на уровне ДНК. Химическое дегликозилирование требует воздействия на белок трифторметансульфоновой кислотой или эквивалентным соединением. Эта обработка приводит к расщеплению большинства или всех сахаров, кроме связывающего сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), оставляя аминокислотную последовательность нетронутой.
Химическое дегликозилирование описано Hakimuddin et al., Arch. Biochem. Biophys., 259: 52 (1987) и Edge et al., Anal. Biochem., 118: 131 (1981). Ферментативное расщепление углеводных остатков на белках может быть достигнуто путем использования различных эндо- и экзогликозидаз, как описано Thotakura et al., Meth. Enzymol., 138: 350 (1987).
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Композиции (например, слитый белок PD1-4-1BBL, кодирующий его полинуклеотид, кодирующая его конструкция нуклеиновой кислоты и/или клетки) согласно некоторым вариантам осуществления настоящего изобретения могут быть введены в организм per se или в фармацевтической композиции, где они смешаны с подходящими носителями или вспомогательными веществами.
Согласно некоторым вариантам осуществления настоящего изобретения предусмотрена фармацевтическая композиция, содержащая терапевтически эффективное количество терапевтического средства в соответствии с настоящим изобретением. Согласно настоящему изобретению терапевтическое средство может представлять собой полипептид, как описано в настоящем документе. Фармацевтическая композиция в соответствии с настоящим изобретением дополнительно используется для лечения рака или связанного с иммунитетом нарушения, как описано в настоящем документе. Терапевтические средства по настоящему изобретению могут быть предоставлены субъекту отдельно или в виде части фармацевтической композиции, где они смешаны с фармацевтически приемлемым носителем.
Используемый в настоящем документе термин «фармацевтическая композиция» относится к препарату одного или нескольких активных ингредиентов, описанных в настоящем документе, с другими химическими компонентами, такими как физиологически подходящие носители и вспомогательные вещества. Цель фармацевтической композиции заключается в том, чтобы облегчить введение соединения в организм.
В настоящем документе термин «активный ингредиент» относится к композиции (например, слитому белку PD1-4-1BBL, полинуклеотиду, конструкции нуклеиновой кислоты и/или клеткам, описанным в настоящем документе), ответственным за биологический эффект.
В настоящем документе термин «вспомогательное вещество» относится к инертному веществу, добавляемому к фармацевтической композиции для дополнительного облегчения введения активного ингредиента. Примеры, без ограничения, вспомогательных веществ включают в себя карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
В настоящем документе и далее фразы «физиологически приемлемый носитель» и «фармацевтически приемлемый носитель», которые могут взаимозаменяемо использоваться, относятся к носителю или разбавителю, который не вызывает значительного раздражения организма и не отменяет биологическую активность и свойства вводимого соединения. Вспомогательное средство включено в эти фразы.
Используемый в настоящем документе термин «фармацевтически приемлемый носитель» включает в себя любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие абсорбцию средства и т.п., которые являются физиологически совместимыми. Предпочтительно носитель подходит для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии). В зависимости от пути введения активное соединение, т.е. полипептид, полинуклеотид, конструкция нуклеиновой кислоты и/или клетка, как описано в настоящем документе, может включать в себя одну или несколько фармацевтически приемлемых солей. «Фармацевтически приемлемая соль» относится к соли, которая сохраняет желаемую биологическую активность исходного соединения и не вызывает каких-либо нежелательных токсикологических эффектов (смотрите, например, Berge, S. M., et al. (1977) J. Pharm. Sci. 66: 1-19). Примеры таких солей включают в себя соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включают в себя соли, полученные из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромистоводородная, йодистоводородная, фосфорная и т.п., а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.п. Соли присоединения основания включают в себя соли, полученные из щелочноземельных металлов, таких как натрий, калий, магний, кальций и т.п., а также из нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также может включать в себя фармацевтически приемлемые антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают в себя: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) хелатирующие металлы средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота и т.п. Фармацевтическая композиция согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также может включать в себя добавки, такие как детергенты и солюбилизирующие средства (например, TWEEN 20 (полисорбат-20), TWEEN 80 (полисорбат-80)) и консерванты (например, тимерсол, бензиловый спирт) и наполнители (например, лактоза, маннит).
Примеры подходящих водных и неводных носителей, которые могут быть использованы в фармацевтических композициях согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, включают в себя воду, забуференный солевой раствор с различным содержанием буфера (например, трис-HCl, ацетат, фосфат), pH и ионной силы, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат.
Надлежащая текучесть может поддерживаться, например, путем использования материалов для покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные средства, такие как консерванты, смачивающие средства, эмульгирующие средства и диспергирующие средства. Предотвращение присутствия микроорганизмов может быть обеспечено как процедурами стерилизации, выше, так и включением различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Также может быть желательно включить в композиции изотонические средства, такие как сахара, хлорид натрия и т.п. Кроме того, длительное всасывание инъецируемой фармацевтической формы может быть вызвано включением средств, которые замедляют всасывание, таких как моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают в себя стерильные водные растворы или дисперсии и стерильные порошки для немедленного приготовления стерильных инъекционных растворов или дисперсий. Использование таких сред и средств для фармацевтически активных веществ известно в настоящей области техники. За исключением случаев, когда какая-либо обычная среда или средство несовместимы с активным соединением, предполагается их применение в фармацевтических композициях, по меньшей мере согласно некоторым вариантам осуществления настоящего изобретения. Дополнительные активные соединения также могут быть включены в композиции.
Терапевтические композиции, как правило, должны быть стерильными и стабильными в условиях производства и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащая текучесть может поддерживаться, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Во многих случаях будет предпочтительно включать в композицию изотонические средства, например, сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть достигнута включением в композицию средства, которое задерживает абсорбцию, например, солей моностеарата и желатина. Стерильные растворы для инъекций могут быть приготовлены путем включения активного соединения в необходимом количестве в подходящем растворителе с одним или комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизационной микрофильтрацией. Как правило, дисперсии готовят путем включения активного соединения в стерильный наполнитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно отфильтрованного раствора.
Стерильные растворы для инъекций могут быть приготовлены путем включения активного соединения в необходимом количестве в подходящем растворителе с одним или комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизационной микрофильтрацией. Как правило, дисперсии готовят путем включения активного соединения в стерильный наполнитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами приготовления являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно отфильтрованного раствора.
Количество активного ингредиента, которое можно комбинировать с материалом носителя для получения единичной дозированной формы, будет варьировать в зависимости от подвергаемого лечению субъекта и конкретного способа введения. Количество активного ингредиента, которое можно комбинировать с материалом-носителем для получения формы однократной дозы, как правило, будет представлять собой такое количество композиции, которое оказывает терапевтический эффект. Как правило, из ста процентов это количество будет составлять от приблизительно 0,01 процента до приблизительно девяноста девяти процентов активного ингредиента, предпочтительно от приблизительно 0,1 процента до приблизительно 70 процентов, наиболее предпочтительно от приблизительно 1 процента до приблизительно 30 процентов активного ингредиента в сочетании с фармацевтически приемлемым носителем.
Схемы приема лекарственных средств подбираются так, чтобы обеспечить оптимальный желаемый ответ (например, терапевтический ответ). Например, может быть введен один болюс, несколько разделенных доз могут вводиться с течением времени или доза может быть пропорционально уменьшена или увеличена, как указано в зависимости от терапевтической ситуации. Особенно выгодно составлять парентеральные композиции в единичной дозированной форме для простоты введения и единообразия дозировки. Используемая в настоящем документе единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для подлежащих лечению субъектов; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация дозированных лекарственных форм согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения продиктована и напрямую зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и (b) ограничений, присущих в области составления рецептур такого активного соединения для лечения чувствительности у индивидуумов.
Способы приготовления и введения лекарственных средств можно найти в «Remington's Pharmaceutical Sciences», Mack Publishing Co., Easton, PA, последнее издание, которое включено в настоящий документ посредством ссылки.
Фармацевтические композиции в соответствии с некоторыми вариантами осуществления настоящего изобретения могут быть изготовлены способами, хорошо известными в настоящей области техники, например, посредством обычных процессов смешивания, растворения, гранулирования, изготовления драже, левитации, эмульгирования, инкапсуляции, захвата или лиофилизации.
Композицию по настоящему изобретению можно вводить одним или несколькими путями введения, используя один или несколько из множества способов, известных в настоящей области техники. Как будет понятно специалисту в настоящей области техники, путь и/или способ введения будет варьировать в зависимости от желаемых результатов. Предпочтительные пути введения терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения включают в себя внутрисосудистую доставку (например, инъекцию или инфузию), внутривенную, внутримышечную, внутрикожную, внутрибрюшинную, подкожную, спинальную, оральную, энтеральную, ректальную, легочную (например, ингаляцию), носовую, местную (включая трансдермальную, буккальную и сублингвальную), внутрипузырную, интравитреальную, внутрибрюшинную, вагинальную, доставку в головной мозг (например, интрацеребровентрикулярная, интрацеребральная и конвекционная диффузия), доставку в ЦНС (например, интратекальную, периспинальную и интраспинальную) или парентеральное (в том числе подкожное, внутримышечное, внутрибрюшинное, внутривенное (IV) и внутрикожное), трансдермальное (либо пассивно, либо с помощью ионофореза или электропорации), трансмукозальное (например, подъязычное введение, назальное, вагинальное, ректальное или сублингвальное) введение или введение через имплантат или другими парентеральными путями введения, например, инъекцией или инфузией, или другими путями доставки и/или формами введения, известными в настоящей области техники. Используемое в настоящем документе выражение «парентеральное введение» означает способы введения, отличные от энтерального и местного введения, как правило, путем инъекции, и включает в себя, без ограничения, внутривенные, внутримышечные, внутриартериальные, интратекальные, внутрикапсулярные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные и интрастернальные инъекции и инфузии или с использованием биоразрушаемых вставок, и могут быть составлены в дозированных формах, подходящих для каждого пути введения. Согласно конкретному варианту осуществления белок, терапевтическое средство или фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить внутрибрюшинно или внутривенно.
Композиции по настоящему изобретению могут доставляться в легкие при вдыхании и прохождении через эпителиальную оболочку легкого в кровоток при доставке либо в виде аэрозольных, либо высушенных распылением частиц, имеющих аэродинамический диаметр менее чем приблизительно 5 микрон. Можно использовать широкий спектр механических устройств, предназначенных для доставки терапевтических продуктов в легкие, включая в себя, без ограничения, небулайзеры, дозирующие ингаляторы и порошковые ингаляторы, все из которых знакомы специалистам в настоящей области техники. Некоторыми конкретными примерами коммерчески доступных устройств являются распылитель Ultravent (Mallinckrodt Inc., St. Louis, Mo.); распылитель Acorn II (Marquest Medical Products, Englewood, Colo.); дозирующий ингалятор Ventolin (Glaxo Inc., Research Triangle Park, N.C.) и порошковый ингалятор Spinhaler (Fisons Corp., Bedford, MA). Nektar, Alkermes и Mannkind имеют порошкообразые препараты ингаляционной формы инсулина, одобренные или находящиеся в клинических испытаниях, где технология может быть применена к составам, описанным в настоящем документе.
В некоторых подходах in vivo раскрытые в настоящем документе композиции вводят субъекту в терапевтически эффективном количестве. Используемый в настоящем документе термин «эффективное количество» или «терапевтически эффективное количество» означает дозировку, достаточную для лечения, ингибирования или ослабления одного или нескольких симптомов подвергаемого лечению нарушения или для иного обеспечения желаемого фармакологического и/или физиологического эффекта. Точная доза будет варьировать в зависимости от множества факторов, таких как зависимые от субъекта переменные (например, возраст, состояние иммунной системы и т.д.), заболевание и проводимое лечение. Для раскрытых в настоящем документе полипептидных композиций, кодирующих их полинуклеотидов и конструкций нуклеиновых кислот и клеток, описанных в настоящем документе, по мере проведения дальнейших исследований появится информация относительно подходящих уровней дозировки для лечения различных состояний у различных пациентов, и обычный квалифицированный работник, учитывая терапевтический контекст, возраст и общее состояние здоровья реципиента, сможет определить правильную дозировку. Выбранная дозировка зависит от желаемого терапевтического эффекта, от пути введения и от продолжительности требуемого лечения. Для полипептидных композиций млекопитающим, как правило, вводят уровни доз от 0,0001 до 100 мг/кг массы тела в день, а чаще от 0,001 до 20 мг/кг. Например, дозировки могут составлять 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела или в пределах 1-10 мг/кг. Иллюстративная схема лечения предусматривает введение 5 раз в неделю, 4 раза в неделю, 3 раза в неделю, 2 раза в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз в месяц, один раз каждые 3 месяца или один раз каждые три-шесть месяцев. Как правило, для внутривенных инъекций или инфузий дозировка может быть ниже. Схемы приема лекарственных средств подбираются так, чтобы обеспечить оптимальный желаемый ответ (например, терапевтический ответ). Например, может быть введен один болюс, несколько разделенных доз могут вводиться с течением времени или доза может быть пропорционально уменьшена или увеличена, как указано, в зависимости от терапевтической ситуации. Особенно выгодно составлять парентеральные композиции в единичной дозированной форме для простоты введения и единообразия дозировки. Используемая в настоящем документе единичная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных доз для субъектов, подлежащих лечению; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация дозированных лекарственных форм согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения продиктована и напрямую зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и (b) ограничений, присущих в настоящей области составления рецептур такого активного соединения для лечения чувствительности у индивидуумов.
Необязательно полипептидная композиция может вводиться в количестве от 0,0001 до 100 мг/кг массы пациента/день, предпочтительно от 0,001 до 20,0 мг/кг/день, в соответствии с любой подходящей схемой хронометража. Терапевтическую композицию согласно по меньшей мере некоторым вариантам осуществления согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить, например, три раза в день, два раза в день, один раз в день, три раза в неделю, два раза в неделю или один раз в неделю, один раз каждые две недели или 3, 4, 5, 6, 7 или 8 недель. Кроме того, композицию можно вводить в течение короткого или длительного периода времени (например, 1 неделя, 1 месяц, 1 год, 5 лет).
Альтернативно, терапевтическое средство, такое как раскрытые в настоящем документе композиции, можно вводить в виде композиции с замедленным высвобождением, и в этом случае требуется менее частое введение. Дозировка и частота варьируют в зависимости от периода полувыведения терапевтического средства у пациента. В целом, человеческие антитела показывают самый длинный период полураспада, за которым следуют гуманизированные антитела, химерные антитела и отличные от человеческих антитела. Период полувыведения для слитых белков может широко варьировать. Дозировка и частота введения могут варьировать в зависимости от того, является ли лечение профилактическим или терапевтическим. В профилактических целях относительно низкие дозы вводят с относительно редкими интервалами в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца своей жизни. В терапевтических применениях иногда требуется относительно высокая доза с относительно короткими интервалами, пока прогрессирование заболевания не уменьшится или не прекратится, и предпочтительно, пока пациент не покажет частичное или полное улучшение симптомов заболевания. После этого пациенту может быть назначена профилактическая схема лечения.
Фактические уровни дозирования активных ингредиентов в фармацевтических композициях по настоящему изобретению можно варьировать, чтобы получить количество активного ингредиента, которое эффективно для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения без того, чтобы быть токсичным для пациента. Выбранный уровень дозирования будет зависеть от множества фармакокинетических факторов, включая в себя активность конкретных используемых композиций по настоящему изобретению, путь введения, время введения, скорость выведения конкретного используемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в сочетании с конкретными применяемыми композициями, возрастом, полом, массой, состоянием, общим состоянием здоровья и предыдущей историей болезни подвергаемого лечению пациента и аналогичными факторами, хорошо известными в медицине.
«Терапевтически эффективная дозировка» раскрытого в настоящем документе полипептида предпочтительно приводит к уменьшению тяжести симптомов заболевания, увеличению частоты и продолжительности периодов без симптомов заболевания, увеличению продолжительности жизни, ремиссии заболевания или предотвращению или уменьшению нарушения или инвалидности из-за заболевания.
Специалист в настоящей области техники сможет определить терапевтически эффективное количество, особенно в свете подробного раскрытия, представленного в настоящем документе, на основе таких факторов, как размер субъекта, серьезность симптомов субъекта и конкретная композиция или путь выбранного введения.
Согласно некоторым вариантам осуществления полипептид, полинуклеотид, конструкция нуклеиновой кислоты или клеточные композиции вводят локально, например, путем инъекции непосредственно в подлежащий лечению участок. Как правило, инъекция вызывает повышенную локализованную концентрацию композиций полипептида, полинуклеотида, конструкции нуклеиновой кислоты или клеток, которая выше, чем та, которая может быть достигнута системным введением. Полипептидные композиции могут быть объединены с матрицей, как описано выше, чтобы помочь в создании повышенной локализованной концентрации полипептидных композиций путем уменьшения пассивной диффузии полипептидов за пределы подлежащего лечению участка.
Фармацевтические композиции по настоящему изобретению можно вводить с помощью медицинских устройств, известных в настоящей области техники. Например, согласно необязательному варианту осуществления фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить с помощью устройства с иглами для подкожных инъекций, такого как устройства, раскрытые в патентах США № 5399163; 5383851; 5312335; 5064413; 4941880; 4790824 или 4596556. Примеры хорошо известных имплантатов и модулей, применимых в настоящем изобретении, включают в себя: патент США № 4487603, в котором раскрыт имплантируемый микроинфузионный насос для дозирования лекарственного средства с контролируемой скоростью; патент США № 4486194, в котором раскрыто терапевтическое устройство для введения лекарственных средств через кожу; патент США № 4447233, в котором раскрыт инфузионный насос для доставки лекарственного средства с точной скоростью инфузии; патент США № 4447224, в котором раскрыт имплантируемый инфузионный аппарат с переменным потоком для непрерывной доставки лекарственного средства; патент США № 4439196, в котором раскрыта осмотическая система доставки лекарственного средства, имеющая многокамерные отделения; и патент США № 4475196, в котором раскрыта осмотическая система доставки лекарственных средств. Эти патенты включены в настоящий документ посредством ссылки. Многие другие такие имплантаты, системы доставки и модули известны специалистам в настоящей области техники.
Активные соединения могут быть получены с носителями, которые будут защищать соединение от быстрого высвобождения, такими как состав с контролируемым высвобождением, включая в себя имплантаты, трансдермальные пластыри и микрокапсулированные системы доставки. Могут быть использованы биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы получения таких составов запатентованы или общеизвестны специалистам в настоящей области техники. Смотрите, например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Терапевтические композиции можно вводить с помощью медицинских устройств, известных в настоящей области техники. Например, согласно необязательному варианту осуществления фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить с помощью устройства с иглами для подкожных инъекций, такого как устройства, раскрытые в патентах США № 5399163; 5383851; 5312335; 5064413; 4941880; 4790824 или 4596556. Примеры хорошо известных имплантатов и модулей, применимых в настоящем изобретении, включают в себя: патент США № 4487603, в котором раскрыт имплантируемый микроинфузионный насос для дозирования лекарственного средства с контролируемой скоростью; патент США № 4486194, в котором раскрыто терапевтическое устройство для введения лекарственных средств через кожу; патент США № 4447233, в котором раскрыт инфузионный насос для доставки лекарственного средства с точной скоростью инфузии; патент США № 4447224, в котором раскрыт имплантируемый инфузионный аппарат с переменным потоком для непрерывной доставки лекарственного средства; патент США № 4439196, в котором раскрыта осмотическая система доставки лекарственного средства, имеющая многокамерные отделения; и патент США № 4475196, в котором раскрыта осмотическая система доставки лекарственных средств. Эти патенты включены в настоящий документ посредством ссылки. Многие другие такие имплантаты, системы доставки и модули известны специалистам в настоящей области техники.
Согласно определенным вариантам осуществления, чтобы гарантировать, что терапевтические соединения в соответствии по меньшей мере с некоторыми вариантами осуществления настоящего изобретения пересекают BBB (при желании), их можно составлять, например, в липосомы. Относительно способов производства липосом смотрите, например, патент США № 4522811; 5374548 и 5399331. Липосомы могут содержать одну или несколько групп, которые селективно транспортируются в конкретные клетки или органы, таким образом, улучшая целевую доставку лекарственных средств (смотрите, например, V.V. Ranade (1989) J. Clin. Pharmacol. 29: 685). Иллюстративные нацеливающие фрагменты включают в себя фолат или биотин (смотрите, например, патент США № 5416016, выданный Low et al.); маннозиды (Umezawa et al. (1988) Biochem. Biophys. Res. Commun. 153: 1038); антитела (P. G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39:180); рецептор белка А сурфактанта (Briscoe et al. (1995) Am. J Physiol. 1233: 134); р120 (Schreier et al. (1994) J. Biol. Chem. 269: 9090); смотрите также K. Keinanen; M. L. Laukkanen (1994) FEBS Lett. 346:123; J. J. Killion; I. J. Fidler (1994) Immunomethods 4:273.
СОСТАВЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ
Согласно дополнительному варианту осуществления раскрытые в настоящем документе композиции, включая в себя композиции, содержащие пептиды и полипептиды, вводят в водном растворе путем парентеральной инъекции. Состав также может быть в форме суспензии или эмульсии. В целом, предусмотрены фармацевтические композиции, включая в себя эффективные количества пептида или полипептида, полинуклеотида, конструкции нуклеиновой кислоты или клеток, описанных в настоящем документе, и необязательно включают в себя фармацевтически приемлемые разбавители, консерванты, солюбилизаторы, эмульгаторы, вспомогательные средства и/или носители. Такие композиции необязательно включают в себя один или несколько из следующих компонентов: разбавители, стерильная вода, забуференный солевой раствор с различным содержанием буфера (например, трис-HCl, ацетат, фосфат), pH и ионная сила; и такие добавки, как детергенты и солюбилизирующие средства (например, TWEEN 20 (полисорбат-20), TWEEN 80 (полисорбат-80)), антиоксиданты (например, такие водорастворимые антиоксиданты, как аскорбиновая кислота, метабисульфит натрия, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия, такие маслорастворимые антиоксиданты, как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол, и такие хелатирующие металлы средства, как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота) и консерванты (например, тимерсол, бензиловый спирт) и наполнители (например, лактоза, маннит). Примерами неводных растворителей или носителей являются этанол, пропиленгликоль, полиэтиленгликоль, такие растительные масла, как оливковое масло и кукурузное масло, желатин, и такие инъецируемые органические сложные эфиры, как этилолеат. Составы могут быть высушены вымораживанием (лиофилизированы) или высушены в вакууме и повторно растворены/ресуспендированы непосредственно перед использованием. Состав можно стерилизовать, например, фильтрованием через задерживающий бактерии фильтр, включением стерилизующих средств в композиции, облучением композиций или нагреванием композиций.
СОСТАВЫ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
Различные раскрытые в настоящем документе композиции (например, полипептиды) могут применяться местно. Местное применение неэффективно для большинства пептидных составов, хотя оно может быть эффективным, особенно если оно применяется к слизистой оболочке легких, носа, полости рта (подъязычной, буккальной), влагалища или прямой кишки.
Композиции могут доставляться в легкие при вдыхании и прохождении через эпителиальную оболочку легкого в кровоток при доставке либо в виде аэрозольных, либо высушенных распылением частиц, имеющих аэродинамический диаметр менее чем приблизительно 5 микрон.
Можно использовать широкий спектр механических устройств, предназначенных для доставки терапевтических продуктов в легкие, включая в себя, без ограничения, небулайзеры, дозирующие ингаляторы и порошковые ингаляторы, все из которых знакомы специалистам в настоящей области техники. Некоторыми конкретными примерами коммерчески доступных устройств являются распылитель Ultravent (Mallinckrodt Inc., St. Louis, Mo.); распылитель Acorn II (Marquest Medical Products, Englewood, Colo.); дозирующий ингалятор Ventolin (Glaxo Inc., Research Triangle Park, N.C.) и порошковый ингалятор Spinhaler (Fisons Corp., Bedford, MA). Nektar, Alkermes и Mannkind имеют порошкообразые препараты ингаляционной формы инсулина, одобренные или находящиеся в клинических испытаниях, где технология может быть применена к составам, описанным в настоящем документе.
Составы для применения к слизистой оболочке, как правило, представляют собой высушенные распылением частицы лекарственного средства, которые могут быть включены в таблетку, гель, капсулу, суспензию или эмульсию. Стандартные фармацевтические вспомогательные вещества доступны от любого разработчика. Пероральные составы могут быть в форме жевательной резинки, гелевых полосок, таблеток или пастилок.
Также могут быть получены трансдермальные составы. Как правило, они будут представлять собой мази, лосьоны, спреи или пластыри, которые можно приготовить по стандартной технологии. Трансдермальные составы потребуют включения усилителей проникновения.
КОНТРОЛИРУЕМАЯ ДОСТАВКА ПОЛИМЕРНЫХ МАТРИЦ
Раскрытые в настоящем документе различные композиции (например, полипептиды) также могут вводиться в составах с контролируемым высвобождением. Полимерные устройства с контролируемым высвобождением могут быть изготовлены для длительного высвобождения системно после имплантации полимерного устройства (стержня, цилиндра, пленки, диска) или инъекции (микрочастицы). Матрица может быть в форме микрочастиц, таких как микросферы, где пептиды диспергированы в твердой полимерной матрице, или микрокапсулы, где ядро изготовлено из материала, отличного от полимерной оболочки, и пептид диспергирован или суспендирован в ядре, которое может быть жидким или твердым по своей природе. Если специально не определено в настоящем документе, микрочастицы, микросферы и микрокапсулы используются взаимозаменяемо. Альтернативно, полимер может быть отлит в виде тонкой пластины или пленки размером от нанометров до четырех сантиметров, порошка, полученного измельчением или другими стандартными способами, или даже геля, такого как гидрогель.
Для доставки полипептидов или нуклеиновых кислот, кодирующих полипептиды, можно использовать либо небиоразлагаемые, либо биоразлагаемые матрицы, хотя биоразлагаемые матрицы являются предпочтительными. Это могут быть природные или синтетические полимеры, хотя синтетические полимеры являются предпочтительными из-за лучшей характеристики профилей разложения и высвобождения. Полимер выбирают на основе периода, в течение которого желательно высвобождение. В некоторых случаях линейное высвобождение может быть наиболее полезным, хотя в других случаях импульсное высвобождение или «массовое высвобождение» может обеспечить более эффективные результаты. Полимер может быть в форме гидрогеля (как правило, с поглощением приблизительно до 90 мас.% воды) и может быть необязательно сшит с многовалентными ионами или полимерами.
Матрицы могут быть составлены выпариванием растворителя, распылительной сушкой, экстракцией растворителем и другими способами, известными специалистам в настоящей области техники. Биоразлагаемые микросферы могут быть приготовлены с использованием любого из способов, разработанных для изготовления микросфер для доставки лекарственных средств, например, как описано Mathiowitz and Langer, J. Controlled Release, 5: 13-22 (1987); Mathiowitz, et al., Reactive Polymers, 6: 275-283 (1987) и Mathiowitz, et al., J. Appl Polymer ScL, 35: 755-774 (1988).
Устройства могут быть разработаны для местного высвобождения для лечения области имплантации или инъекции, которая обычно доставляет дозу, намного меньшую, чем дозировка для лечения всего тела, или системной доставки. Они могут быть имплантированы или введены подкожно, в мышцу, жир или проглочены.
Композиции согласно некоторым вариантам осуществления настоящего изобретения могут, при желании, быть представлены в упаковке или дозирующем устройстве, таком как одобренный FDA набор, который может содержать одну или несколько единичных дозированных форм, содержащих активный ингредиент. Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или дозирующее устройство могут сопровождаться инструкциями по применению. Упаковка или дозатор также могут быть размещены посредством уведомления, связанного с контейнером, в форме, предписанной правительственным агентством, регулирующим производство, использование или продажу фармацевтических препаратов, причем это уведомление отражает одобрение агентством формы композиций для введения человеку или животному. Такое уведомление, например, может иметь маркировку, одобренную Управлением по контролю за продуктами и лекарственными средствами США для лекарственных средств, отпускаемых по рецепту, или утвержденный вкладыш продукта. Композиции, содержащие препарат по настоящему изобретению, составленный в совместимом фармацевтическом носителе, также могут быть приготовлены, помещены в соответствующий контейнер и маркированы для лечения указанного состояния, как более подробно описано выше.
Используемый в настоящем документе термин «приблизительно» относится к ±10%.
Термины «содержит», «содержащий», «включает в себя», «включающий в себя», «имеющий» и их родственные слова по корню и значению означают «включающий в себя, без ограничения».
Термин «состоящий из» означает «включающий в себя и ограниченный».
Термин «состоящий по существу из» означает, что композиция, способ или структура могут включать в себя дополнительные ингредиенты, стадии и/или части, но только если дополнительные ингредиенты, стадии и/или части не изменяют существенно основные и новые характеристики заявленной композиции, способа или структуры.
Используемые в настоящем документе формы единственного числа включают в себя множественное число, если контекст явно не предписывает иное. Например, термин «соединение» или «по меньшей мере одно соединение» может включать в себя множество соединений, включая в себя их смеси.
На протяжении настоящей заявки различные варианты осуществления настоящего изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона предназначено только для удобства и краткости и не должно рассматриваться как негибкое ограничение объема настоящего изобретения. Соответственно, следует считать, что описание диапазона конкретно раскрывает все возможные поддиапазоны, а также отдельные числовые значения в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, должно рассматриваться как специально раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 6 и т.д., а также отдельные числа в этом диапазоне, например, 1, 2, 3, 4, 5 и 6. Это применимо независимо от ширины диапазона.
Всякий раз, когда числовой диапазон указан в настоящем документе, он подразумевает включение любого цитируемого числа (дробного или целого) в указанный диапазон. Выражения «диапазон/диапазоны между» первым указанным числом и вторым указанным числом и «диапазон/диапазоны от» первого указанного числа «до» второго указанного числа используются в настоящем документе взаимозаменяемо и предназначены для включения первого и второго указанных чисел и всех дробных и целых чисел между ними.
Используемый в настоящем документе термин «способ» относится к способам, средствам, техникам и процедурам для выполнения данной задачи, включая в себя, без ограничениям, те способы, средства, техники и процедуры, которые известны или легко разработаны из известных способов, средств, техник и процедур практиков химической, фармакологической, биологической, биохимической и медицинской области техники.
Когда делается ссылка на конкретные перечни последовательностей, следует понимать, что такая ссылка также охватывает последовательности, которые по существу соответствуют ее дополнительной последовательности, включая в себя незначительные вариации последовательности, возникающие, например, в результате ошибок последовательности, ошибок клонирования или других изменений, приводящих к замене основания, делеции основания или добавлению основания при условии, что частота таких вариаций составляет менее чем 1 на 50 нуклеотидов, альтернативно, менее чем 1 на 100 нуклеотидов, альтернативно, менее чем 1 на 200 нуклеотидов, альтернативно, менее чем 1 на 500 нуклеотидов, альтернативно менее чем 1 на 1000 нуклеотидов, альтернативно, менее чем 1 на 5000 нуклеотидов, альтернативно, менее чем 1 на 10000 нуклеотидов.
ПРИМЕРЫ
Эксперименты подтверждения концепции (POC)
Изготовление меченного His PD1-4-1BBL
Для первоначального анализа POC получают меченный гистидином белок. Последовательность кДНК, кодирующую меченный 6-His PD1-4-1BBL, субклонируют в вектор экспрессии млекопитающего. Плазмидный препарат трансфекционного уровня используют для трансфекции плазмиды в клетки Expi293 или другие клеточные линии. Супернатант экспрессирующих Expi293 клеток (по 100 мл) оценивают в отношении производства PD1-4-1BBL с помощью восстановленного и невосстановленного ДСН-ПААГ-электрофореза и вестерн-блоттинга (WB) с антителом к His. PD1-4-1BBL с меткой His затем очищают от положительного супернатанта одностадийной очисткой на основе аффинности (никелевые гранулы). Производство меченого химерного белка подтверждают с помощью ДСН-ПААГ-электрофореза и вестерн-блоттинга с использованием специфических антител против каждого домена молекулы (т.е. внеклеточного домена каждого из PD1 и 4-1BBL).
Эксперимент 1А - Получение меченного His слитого белка PD1-4-1BBL.
Производство меченного His слитого белка PD1-4-1BBL (SEQ ID NO: 5) осуществляли в клетках Expi293F, трансфицированных вектором экспрессии pcDNA3.4, клонированным с кодирующей последовательностью для полного слитого белка. Последовательность клонировали в вектор с использованием рестрикционных ферментов EcoRI и HindIII с добавлением последовательности Kozak, искусственного сигнального пептида и 6 His-метки на N-конце и стоп-кодона на C-конце (SEQ ID NO: 18).
Белок собирали из супернатанта клеточной культуры и очищали одностадийной очисткой на колонке HisTrap™ FF Crude.
Эксперимент 1B - полученный меченный His слитый белок PD1-4-1BBL содержит оба домена
Материалы - Меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше, белковый маркер: Spectra BR (Thermo Fisher Scientific, кат. номер 26634), анти-PD1 (SHPS1) (Cell Signaling, кат. номер 86163), анти-4-1BB-L (BioVision, 5369-100), мышиное моноклональное антитело к His (GenScript, кат. номер A00186), вторичный конъюгат козьего антитела к IgG кролика (H+L)-HRP (1:3333) (R&D, кат. номер 170-6515), рекомбинантный PD1 человека 0,5 мг/мл (4546-SA-050) R&D, рекомбинантный 4-1BBL человека (TNFSF9) 0,1 мг/мл (8460 LF) буфер для удаления сигнальных клеток (Thermoscientific, кат. номер 21059), протеиновая смесь для дегликозилирования: (NEB p6044).
Способы - Белки (250 нг на линию) инкубировали в денатурирующих или неденатурирующих условиях (в буфере для образцов, содержащем β-меркаптоэтанол, и кипятили в течение 5 минут при температуре 95°C, или в буфере для образцов без β-меркаптоэтанола без нагревания, соответственно) и разделяли на 12% геле ДСН-ПААГ с последующим вестерн-блоттингом. Воздействие дегликозилированием осуществляли ферментом PNGase F в соответствии с инструкциями изготовителя Protein De-glycosylation Mix.
Результаты - Анализ вестерн-блоттинга меченного His PD1-4-1BBL (SEQ ID NO: 5), разделенного на геле ДСН-ПААГ в денатурирующих условиях с последующим иммуноблоттингом с антителом к His-метке или антителом к 4-1BBL, продемонстрировал, что присутствуют как N-концевая сторона молекулы, так и С-концевая сторона молекулы (фиг. 1 и 2А-В). Хотя предполагаемая молекулярная масса белка в соответствии с его аминокислотной последовательностью составляет приблизительно 39 кДа, белок мигрировал при денатурирующих условиях приблизительно в размере 50-60 кДа по молекулярной массе. Было обнаружено, что этот сдвиг связан с гликозилированием белка, что определяется обработкой белка ферментом PNGase F, который удаляет почти все N-связанные олигосахариды из гликопротеинов. После обработки наблюдалась основная полоса приблизительно 39 кДа (фиг. 2С).
При разделении на ДСН-ПААГ в неденатурирующих условиях меченный His PD1-4-1BBL (SEQ ID NO: 5) был обнаружен в той же молекулярной массе, что и при денатурирующих условиях (фиг. 1 и 2В). Также были обнаружены дополнительные полосы с более высокой молекулярной массой, которые были сильнее в неденатурирующих условиях по сравнению с денатурирующими условиями. Это может указывать на образование мультимеров, возможно, тримеров, в соответствии с молекулярным размером и тем фактом, что белок 4-1BBL естественным образом имеет тенденцию образовывать тримеры (Eun-Young et al., 2010, JOURNAL OF BIOLOGICAL CHEMISTRY VOL. 285, NO. 12, с. 9202-9210).
Эксперимент 1C - Анализ связывания фрагментов PD1 и 4-1BBL химеры с PDL1 и 4-1BB
Связывание домена PD1 молекулы с PDL1 и связывание домена 4-1BBL молекулы с 4-1BB определяли с помощью анализа биослойной интерферометрии Blitz®.
Материалы - PD-L1:FC (Sino Biological, кат. номер 12283-H02H), 4-1BB:FC (Sino Biological, кат. номер 10041-H03H), меченный His PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше; SIRPα-4-1BBL (SEQ ID NO: 6, в качестве отрицательного контроля), растворимый PD-L1 (в качестве конкурента, Sino Biological, кат. номер 12283-H02H), PD1-CD70 (SEQ ID NO: 7, в качестве отрицательного контроля), антитело для проточной цитометрии 4-1BB PE (eBioscience, кат. номер 12-1379-42), антитело для проточной цитометрии PDL1 APC (Biolegend, кат. номер 329708).
Способы и результаты - Биосенсор предварительно загружали PD-L1:Fc, что приводило к стабильному плато ассоциации (фиг. 3А). При последующей инкубации с меченным His PD1-4-1BBL (SEQ ID NO: 5) была обнаружена быстрая ассоциация меченного His PD1-4-1BBL с PD-L1:Fc (фиг. 3А, верхняя линия). Аналогичная инкубация с контрольным белком SIRPα-4-1BBL (состоящим из домена SIRPα, слитого с 4-1BBL, SEQ ID NO: 6), не приводила к связыванию с PD-L1:Fc (фиг. 3A, средняя нижняя линия). Кроме того, когда биосенсор не был предварительно загружен PD-L1:Fc, меченный His PD1-4-1BBL не ассоциировал (фиг. 3А, нижняя линия). По достижении стабильного плато ассоциации биосенсор промывали средой для определения скорости диссоциации меченного His PD1-4-1BBL из PD-L1:Fc. Диссоциация меченного His PD1-4-1BBL из загруженного PD-L1:Fc биосенсора была медленной, что свидетельствует о стабильном взаимодействии PD1 с PD-L1. Кроме того, растворимый PD-L1 (sPD-L1) загружали в качестве ингибитора конкурентного связывания. Действительно, связывание меченного His PD1-4-1BBL с PD-L1:Fc происходило с более низкой, но обнаруживаемой скоростью во время фазы ассоциации, что предполагает конкурентное связывание с sPD-L1 (фиг. 3A, средняя верхняя линия).
При аналогичной загрузке биосенсора 4-1BB:Fc оценивали связывание единицы 4-1BBL меченного His PD1-4-1BBL (SEQ ID NO: 5) (фиг. 3B). Как и в случае домена PD1, домен 4-1BBL PD1-4-1BBL быстро связывался с его рецептором-мишенью (фиг. 3B, верхняя линия), причем скорость диссоциации для взаимодействия 4-1BBL/4-1BB также очень медленная, как видно из ограниченной диссоциации, происходящей во время последней фазы диссоциации. Контрольная обработка PD1-CD70 (SEQ ID NO: 7), в которой отсутствует домен 4-1BBL, не приводила к какому-либо обнаруживаемому связыванию с 4-1BBL:Fc (фиг. 3B, средняя линия). Кроме того, в отсутствие предварительной загрузки 4-1BB:Fc меченный His PD1-4-1BBL не обнаруживал видимого связывания биосенсора (фиг. 3B, нижняя линия).
В целом, оба домена меченного His PD1-4-1BBL (SEQ ID NO: 5) сохраняют функциональную активность связывания для своих родственных рецепторов.
Эксперимент 1D - Анализ связывания фрагментов PD1 и 4-1BBL химеры с PDL1 и 4-1BB на поверхности клеток.
Связывание домена PD1 молекулы с человеческим PDL1 оценивают с использованием клеток НТ1080 или клетки СНО-К1, или другой линии клеток со сверхэкспрессией PDL1. Клетки окрашивают различными концентрациями меченного His PD1-4-1BBL, а затем вторичным антителом к 4-1BBL. Связывание анализируют с помощью проточной цитометрии с использованием сортировки флуоресцентно-активированных клеток (FACS). Использование различных концентраций химеры позволяет определить аффинность молекулы к PDL1. В этом испытании на связывание рекомбинантный PD1 также используется в качестве конкурента меченного His PD1-4-1BBL для проверки специфичности связывания. Антитела, которые блокируют взаимодействие между PD1 и PDL1, также могут быть использованы для той же цели. Для этого анализа также можно использовать клетки карциномы DLD1, которые обрабатывают IFN-гамма для экспрессии PDL1.
Связывание фрагмента 4-1BBL химеры с человеческим 4-1BB исследуют с использованием клеток HT1080 или другой линии клеток, которые сверхэкспрессируют 4-1BB. Клетки окрашивают различными концентрациями меченного His PD1-4-1BBL, а затем вторичным антителом к PD1, а аффинность связывания анализируют с помощью FACS. В этом исследовании связывания рекомбинантный 4-1BBL используется в качестве конкурента PD1-4-1BBL для проверки специфичности связывания. Антитела, которые блокируют взаимодействие между 4-1BB и 4-1BBL, также могут быть использованы для той же цели.
Материалы - Меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше; клеточные линии HT1080-WT, HT1080-CD27, HT1080-4-1BB, DLD1-WT и DLD1-PDL1 (Lang et al. 2015, Hendriks et al., 2016), краситель Fixable Viability Dye (BD Biosciences, кат. номер 562247), блокатор Fc человека, истинное окрашивание FCX (Bioledgend, кат. номер 422302) и следующие антитела:
Способы - Для анализа экспрессии клетки (0,5 М клеток/образец) иммуноокрашивали указанными антителами с последующим анализом проточной цитометрией. Для анализа связывания клетки предварительно инкубировали с блокатором Fc человека перед инкубацией с меченным His белком PD1-4-1BBL (SEQ ID NO: 5) в течение 30 минут на льду с последующим иммуноокрашиванием антителами против «свободного» плеча молекулы, фиксацией и анализом способом проточной цитометрии.
Результаты - Как показано на фиг. 4A-B, клетки HT1080-CD27 и HT1080-4-1BB действительно экспрессируют соответствующие рецепторы CD27 и 4-1BB, соответственно, тогда как клетки HT1080-WT, DLD1-WT и DLD1-PDL1 не экспрессируют оба рецептора. CD47 и PDL1 эндогенно экспрессируются на поверхности всех исследованных клеточных линий на разных уровнях (фиг. 4A-B)
Анализы связывания показывают, что меченный His PD1-4-1BBL (SEQ ID NO: 5) связывается с клетками HT1080-4-1BB и с клетками DLD1-PDL1 зависимым от дозы образом (фиг. 5А и 6А), в то время как он не связывается с клетками отрицательного контроля HT1080-CD27 и клетками DLD1-WT (фиг. 5B и 6В).
В целом, обе стороны меченного His белка PD1-4-1BBL (SEQ ID NO: 5), N- и C-концы, могут связываться с их соответствующими партнерами, сверхэкспрессированными на поверхности клеток.
Эксперимент 2 - Активация рецептора 4-1BB химерой
Эффект активации рецептора 4-1BB посредством меченного His PD1-4-1BBL исследуют с использованием клеток HT1080 или другой линии клеток, которые сверхэкспрессируют рецептор 4-1BB. В частности, клеточная линия HT1080-4-1BB сверхэкспрессирует 4-1BB и, как известно, секретирует IL-8 при связывании 4-1BBL (Wyzgol, et al., 2009, The Journal of Immunology). При связывании 4-1BBL с рецептором 4-1BB на поверхности этих клеток активируется сигнальный путь, приводящий к секреции IL8. Клетки инкубируют в присутствии меченного His PD1-4-1BBL в различных концентрациях, и секрецию IL8 в культуральную среду определяют с помощью ИФА. Олигомеризацию исследуют путем добавления сшивающего антитела к His-метке в различных концентрациях. При добавлении антитела к His-метке молекулы химер будут сшиты и образуют олигомеры, что приведет к увеличению секреции IL8. Антитело к PD1 также может быть использовано для той же цели (сшивание фрагмента PD1 молекулы). Рекомбинантный PDL1 используется в качестве отрицательного контроля (рекомбинантный PDL1 не будет сшивать PD1 и не будет образовывать олигомеризацию молекулы).
Олигомеризацию также исследуют путем совместного культивирования клеток, сверхэкспрессирующих рецептор 4-1BB, с клетками HT1080, которые сверхэкспрессируют человеческий PDL1. PD1-4-1BBL связывается с PDL1, который сверхэкспрессируется на HT1080 клетках, а фрагмент 4-1BBL презентируется HT1080, которые сверхэкспрессируют рецептор 4-1BB. Благодаря этой презентации нескольких молекул в непосредственной близости, требование для олигомеризации выполняется.
Активация рецептора 4-1BBL посредством меченного His PD1-4-1BBL может быть сравнена с активацией его частей, а именно рекомбинантного PD1 или 4-1BBL отдельно или в комбинации.
Материалы - Меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано выше в эксперименте 1A, клеточная линия HT1080-4-1BB, набор ИФА для IL-8 (кат. номер D8000C, R&D), DMEM (кат. номер 01-055-1A, Biological industries), FBS (кат. номер 10270106, Rhenium), AIM V (бессывороточная среда) (Thermo Scientific).
Способы - Клетки HT1080-4-1BB (5000 на лунку) инкубировали в течение 24 часов с различными концентрациями меченного His белка PD1-4-1BBL (SEQ ID NO: 5). Концентрацию IL-8 в супернатанте определяли с помощью набора ИФА для IL-8 в соответствии с протоколом производителя. В некоторых экспериментах использовали бессывороточную среду для устранения относительно высокого фона, который наблюдали с использованием среды с FBS.
Результаты - Несколько независимых экспериментов показали функциональность меченного His белка PD1-4-1BBL (SEQ ID NO: 5): меченный His белок PD1-4-1BBL был способен запускать передачу сигналов TNFR, как определено секрецией IL8 клетками HT1080-4-1BBL, зависимым от дозы образом, как в среде, содержащей FBS (фиг. 7), так и в бессывороточной среде (фиг. 8).
Эксперимент 3 - Активация Т-клеток с помощью PD1-4-1BBL
Влияние PD1-4-1BBL на активацию Т-клеток исследуют с использованием либо Т-клеток в РВМС здоровых доноров человека, либо с использованием TIL человека. Т-клетки сначала совместно культивируют с раковыми клетками карциномы человека и обрабатывают биспецифическими антителами к CD3 и к Epcam1 для индукции активации Т-клеток, а затем PD1-4-1BBL. Антитело к CD3/Epcam1 доставляет первый сигнал для активации Т-клеток против экспрессирующих Epcam1 раковых клеток. Молекула PD1-4-1BBL взаимодействует с PD-L1, экспрессируемым на поверхности раковых клеток, это взаимодействие облегчает презентацию и олигомеризацию молекулы и тем самым обеспечивает взаимодействие фрагмента 4-1BBL с рецептором 4-1BB на Т-клетке и доставку второго костимулирующего сигнала к Т-клетке. Уровень активации Т-клеток определяют путем измерения нескольких параметров; во-первых, путем исследования экспрессии маркеров активации на поверхности Т-клеток (например: CD69, CD137, CD107a, PD1 и т.д.). Экспрессию маркеров активации исследуют путем окрашивания клеток специфическими антителами и анализом проточной цитометрии (FACS). Вторым способом определения активации Т-клеток является измерение секреции воспалительных цитокинов (например, IL2, IL6, INF-гамма и т.д.). Секрецию воспалительных цитокинов исследуют способом ИФА. Пролиферацию Т-клеток измеряют путем предварительного окрашивания Т-клеток CFSE (карбоксифлуоресцеин-сукцинимидиловый эфир) и определения отклонения клеток путем разведения CFSE, которое определяют с помощью FACS. Дополнительным параметром, который исследуют, является уничтожение раковых клеток, которое измеряют путем предварительного мечения раковых клеток с использованием реагента Calcine-AM и измерения высвобождения кальцина в культуральную среду с использованием люминесцентного планшетного ридера.
Влияние PD1-4-1BBL на активацию TIL исследуют на TIL, которые экстрагируют из опухолей и затем совместно культивируют с опухолевыми раковыми клетками и обрабатывают PD1-4-1BBL.
Первый сигнал для активации Т-клеток доставляется раковыми клетками по пути МНС класса I: пептид - TCR (рецептор Т-клеток). Слитый белок PD1-4-1BBL взаимодействует с PDL1, экспрессируемым на поверхности опухолевых клеток, это взаимодействие облегчает презентацию и олигомеризацию молекулы и, соответственно, обеспечивает взаимодействие фрагмента 4-1BBL с рецептором 4-1BB на Т-клетке и доставку второго костимулирующего сигнала к Т-клетке. Уровень активации TIL и уничтожение опухолевых клеток определяют так же, как описано (маркеры активации, секреция цитокинов, пролиферация и уничтожение опухолевых клеток).
Активацию Т-клеток с помощью His-PD1-4-1BBL можно сравнить с активацией его частей, а именно рекомбинантного PD1 или 4-1BBL, отдельно или в комбинации.
Эксперимент 3A - Белок PD1-4-1BBL демонстрирует костимулирующую активность Т-клеток
Материалы - Меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше; клетки HT1080-WT, клетки HT1080-4-1BB, клетки DLD1-PD-L1, клетки DLD1-WT (Lang et al. 2015), свежевыделенные T-клетки человека, набор ИФА IL8 (R&D systems, кат. номер DY208), PD-L1:Fc (Sino Biological, кат. номер 10084-H02H), анти-CD3/анти-CD28 активационные гранулы (Life Technologies, кат. номер 11131D), антитело к CD25 (Immuno Tools, кат. номер 21270256).
Способы и результаты
PD1-4-1BBL разрабатывали для связывания с PD-L1, тем самым блокируя передачу ингибирующих PD-1/PDL1 сигналов; и в то же время запуская опосредованную 4-1BB активацию Т-клеток. В этом эксперименте домен 4-1BBL белка PD1-4-1BBL оценивали на его способность стимулировать Т-клетки.
Окрашивание клеток HT1080-WT показало, что 4-1BB не был обнаружен на поверхности клеток, в то время как клетки HT1080-4-1BB были положительными в отношении 4-1BB (фиг. 9A). Аналогично, клетки DLD1-WT, окрашенные на PDL1, были отрицательными для PDL1, тогда как клетки DLD1-PDL1 были положительными в отношении PDL1 (фиг. 9B).
Затем клетки HT1080-4-1BB смешивали с клетками DLD10PD-L1 или с контрольным DLD1 дикого типа. После обработки отдельных культур HT1080 меченным His белком PD1-4-1BBL (SEQ ID NO: 5) минимальное производство IL-8 обнаруживали через 24 часа инкубации (фиг. 9С). Аналогично, обработка меченным His белком PD1-4-1BBL (SEQ ID NO: 5) минимально индуцировала секрецию IL-8, когда клетки HT1080-4-1BB смешивали с клетками DLD1 дикого типа (фиг. 9С). Таким образом, в отсутствие связывания PD-L1 PD1-4-1BBL характеризовался минимальной костимулирующей активностью. Однако обработка смешанных культур HT1080-4-1BB и DLD1-PD-L1 меченным His PD1-4-1BBL (SEQ ID NO: 5) запускала сильное увеличение секреции IL-8, которое достигало максимума при 2500 пг/мл (фиг. 9D). Эти результаты демонстрируют, что после связывания домена PD1 меченого His белка PD1-4-1BBL (SEQ ID NO: 5) с экспрессирующими PD-L1 клетками домен 4-1BBL презентируется в сшитой форме, которая может запускать костимуляцию 4-1BB. Таким образом, связывание меченного His белка PD1-4-1BBL (SEQ ID NO: 5) с PD-L1 выгодно для функционального взаимодействия 4-1BBL/4-1BB.
Затем оценивали потенциальную индукцию активации Т-клеток доменом 4-1BBL меченного His белка PD1-4-1BBL (SEQ ID NO: 5). С этой целью свежевыделенные Т-клетки добавляли в покрытые PDL1-Fc планшеты и активировали субоптимальными концентрациями гранул активации анти-CD3/анти-CD28 в течение 7 дней. После обработки в клетках, обработанных меченным His белком PD1-4-1BBL (SEQ ID NO: 5) (фиг. 10), обнаруживали явное увеличение процента активированных CD25-положительных T-клеток с оптимальной индукцией при ~7,5 мкг/мл. Напротив, контрольный слитый белок SIRPα:4-1BBL (SEQ ID NO: 6) не запускал активацию Т-клеток (фиг. 10). Таким образом, связывание меченного His белка PD1-4-1BBL (SEQ IDNO: 5) с PDL1 обеспечивает опосредованную 4-1BBL/4-1BB костимуляцию и активацию Т-клеток.
В целом, эти данные предоставляют четкие доказательства того, что после опосредованного PDL1 связывания меченный His белок PD1-4-1BBL (SEQ ID NO: 5) приобретает опосредованную 4-1BBL костимулирующую активность, которая может усиливать активацию Т-клеток.
Эксперимент 3B - Белок PD1-4-1BBL усиливает активацию PBMC человека
Материалы - Меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше, набор ИФА INF-γ [кат. номер 900-TM27, кат. номер 900-T00 - буферный набор ИФА (TMB)], RPMI (кат. номер 01-100-1A, Biological industries), FBS (кат. номер 12657-029, Gibco), L-глутамин (кат. номер 25030-24, Gibco), Pen/Strep (кат. номер 15140-122, Gibco), очищенный Leaf анти-человеческий CD3 (кат. номер BLG-317315, BioLegend), рекомбинантный человеческий IL2 (кат. номер 202-IL-500, R&D Systems), мононуклеарные клетки периферической крови человека (РВМС), выделенные из периферической крови здорового донора с помощью Ficoll-Paque (кат. номер 17-1440-03, GE Healthcare), раковые клетки поджелудочной железы мышей LivMet (Partecke et al., 2011).
Способы - РВМС человека выделяли из периферической крови здорового донора с использованием Ficoll-Paque (Grienvic et al. 2016). После этого РВМС культивировали в течение 40 часов с добавлением различных концентраций меченного His белка PD1-4-1BBL (SEQ ID NO: 5) в присутствии анти-CD3 (30 нг/мл) или анти-CD3 плюс IL2 (1000 Ед/мл). Эксперимент проводили с совместным культивирование с экспрессирующими PDL1 мышиными клетками LivMet (соотношение Е:Т 1:1) или без него. Концентрацию INF-γ в супернатанте клеток оценивали с помощью набора ИФА для INF-γ в соответствии с протоколом производителя.
Результаты - Известно, что PBMC человека, включая в себя NK-клетки, NKT-клетки, CD4+ и CD8+ эффекторные Th1 клетки, секретируют провоспалительный интерферон-γ (INF-γ) в ответ на активацию. Активация Т-клетки требует двух сигналов: лигирование Т-клеточного рецептора (TCR) с комплексом главного комплекса гистосовместимости (MHC)/пептида на антигенпрезентирующей клетке (APC) и перекрестное связывание костимулирующих рецепторов на Т-клетке с соответствующими лигандами на APC. 4-1BB представляет собой костимулирующий рецептор Т-клеток, индуцированный лигированием 4-1BBL. 4-1BB передает мощный костимулирующий сигнал как CD8+, так и CD4+ T-клеткам, способствуя их экспансии, выживанию, дифференцировке и экспрессии цитокинов. Лиганд 4-1BB, 4-1BBL, представляет собой мембранный белок, который обеспечивает костимулирующий сигнал для Т-клеток.
В этом эксперименте оценивали функциональность молекулы PD1-4-1BBL в усилении активации PBMC человека.
Добавление меченного His белка PD1-4-1BBL (SEQ ID NO: 5) усиливало активацию РВМС зависимым от дозы образом, что можно наблюдать по увеличению секреции INF-γ РВМС, которых стимулировали антителом к CD3, с добавлением или без добавления IL2 (фиг. 11А).
Совместное культивирование РВМС с клетками LivMet приводит к секреции INF-γ, вероятно, из-за прямого активирующего эффекта РВМС опухолевыми клетками. Обработка меченным His белком PD1-4-1BBL (SEQ ID NO: 5) характеризовалась умеренным эффектом при добавлении к совместной культуре, и показала более выраженный эффект при добавлении вместе с IL2 (фиг. 11B).
В целом, меченный His белок PD1-4-1BBL (SEQ ID NO: 5) усиливает активацию PBMC человека, что можно наблюдать по увеличению секреции IFN-γ.
Эксперимент 4 - In vivo подтверждение концепции
Влияние PD1-4-1BBL, как на нацеливание, так и на активацию T-, NK- и B-клеток, исследуют in vivo на мышиной модели. Мышиный меченный His слитый белок PD1-4-1BBL производят и очищают в виде меченого белка таким же образом, что и молекулу человека. Мышиные модели опухоли получают путем инъекции мышам мышиных раковых клеток, которые, как известно, образуют опухоли, которые экспрессируют мышиный PD-L1. Мышей подвергают лечению молекулой меченного His слитого белка PD1-4-1BBL мыши или молекулой меченного His слитого белка PD1-4-1BBL человека. Размер опухоли, выживаемость мышей и воспалительную реакцию в месте опухоли контролируют.
Подобные эксперименты могут быть выполнены на гуманизированной мышиной модели с использованием опухолей человека. Эта модель построена с использованием мышей, у которых отсутствует иммунная система (мыши Nude/SCID/NSG). Подобную человеческой иммунную систему создают у этих мышей путем инъекции только человеческих Т-клеток, РВМС или с использованием генетически сконструированных мышей, которые обладают полностью гуманизированной иммунной системой. Мышей инокулируют раковыми клетками человека и подвергают лечению меченной His молекулой PD1-4-1BBL. Размер опухоли, выживаемость мышей и воспалительную реакцию в месте опухоли также контролируют в этой модели.
Эффективность меченного His PD1-4-1BBL in vivo можно сравнить с эффективностью его частей, а именно рекомбинантного PD1 или 4-1BBL, отдельно или в комбинации.
Эксперимент 4А - Белок PD1-4-1BBL ингибирует рост опухоли у мышей, которым инокулировали сингенную карциному толстой кишки
Материалы - Мыши, автоклавированные продукты питания и подстилка (Ssniff, Soest, Германия), самки мышей Balb/C (Janvier, Saint Berthevin Cedex, Франция), клеточная линия карциномы толстой кишки мыши CT-26 (ATCC-CRL-2638), меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный, как описано в эксперименте 1A выше, PBS.
Способы - Мышей содержали в индивидуально вентилируемых клетках в группах по четыре мыши на клетку. Мыши получали автоклавированную пищу и подстилку и подкисленную (pH 4,0) водопроводную воду ad libitum. Помещение для животных было оборудовано автоматической 12-часовой регулировкой света/темноты, температурным режимом при 22±2°C и относительной влажностью 50±10%. Самкам мышей Balb/C инокулировали подкожно 1×106 клеток CT-26, и лечение начинали три дня спустя. После случайного распределения 10 животным на группу вводили два раза в неделю четыре внутривенные инъекции меченного His белка PD1-4-1BBL (SEQ ID NO: 5) (100 мкг/инъекция) или его растворимого буфера (PBS) (фиг. 12A). Все введения выполняли утром, без наркоза. Объем опухоли определяли три раза в неделю, используя измерения штангенциркулем, и отдельные объемы рассчитывали по формуле: V=([ширина]2×длина)/2. Все эксперименты на животных проводили в соответствии с правилами Координационного комитета Соединенного Королевства по исследованию рака для благополучия животных Workman et al., Committee of the National Cancer Research Institute. Guidelines for the welfare of animals in cancer research. Br J Cancer 2010; 102:1555-77) и немецкого закона о защите животных, одобренного местными ответственными органами (Gen0030/15).
Результаты - В этом эксперименте эффект PD1-4-1BBL in vivo оценивали с использованием модели рака толстой кишки мыши CT-26. Лечение мышей, которым инокулировали CT-26, меченным His белком PD1-4-1BBL (SEQ ID NO: 5) значительно уменьшало объем опухоли (максимум на 42%) (фиг. 123B-С).
Эксперимент 4B - Белок PD1-4-1BBL эффективен для лечения мышей, которым инокулировали сингенную лейкозную опухоль
Материалы - Мыши, автоклавированные продукты питания и подстилка (Ssniff, Soest, Германия), самки мышей DBA/2 (Janvier, Saint Berthevin Cedex, Франция), клеточная линия лейкоза P388 (Max-Delbrueck-Center for Molecular Medicine, Берлин, Германия), антитело к мышиному PD-1 (BioXcell, West Lebanon, США), меченный His белок PD1-4-1BBL (SEQ ID NO: 5), полученный как описано в эксперименте 1А выше, PBS.
Способы - Мышей содержали в индивидуально вентилируемых клетках в группах по четыре мыши на клетку. Мыши получали автоклавированную пищу и подстилку и подкисленную (pH 4,0) водопроводную воду ad libitum. Помещение для животных было оборудовано автоматической 12-часовой регулировкой света/темноты, температурным режимом при 22±2°C и относительной влажностью 50±10%. Самкам мышей DBA/2 инокулировали внутрибрюшинно 1×106 клеток P388, и лечение начинали на следующий день. После случайного распределения 10 мышам на группу вводили через день четыре внутривенные инъекции меченного His белка PD1-4-1BBL (SEQ ID NO: 5) (100 мкг/инъекция) или его растворимого буфера (PBS). 5 мг/кг анти-мышиного PD1 при той же схеме лечения включали в качестве терапевтического эталона (фиг. 13А). Все введения выполняли утром, без наркоза. Мышей, несущих Р388, ежедневно взвешивали, и как только мыши становились умирающими, их умерщвляли и определяли объем асцита. Кроме того, селезенку и печень от каждой мыши забирали и взвешивали.
Все эксперименты на животных проводили в соответствии с Координационным комитетом Соединенного Королевства по правилам исследования рака для обеспечения благополучия животных (Workman et al., committee of the National Cancer Research Institute. Guidelines for the welfare of animals in cancer research. Br J Cancer 2010; 102:1555-77) и немецкого закона о защите животных, одобренного местными ответственными органами (Gen0030/1).
Результаты - В этом эксперименте эффект in vivo меченного His белка PD1-4-1BBL (SEQ ID NO: 5) оценивали с использованием модели асцитного лейкоза у мышей P388. В этой модели масса селезенки является маркером тяжести заболевания, поскольку селезенка служит лимфодренажем для асцита. Лечение мышей, которым инокулировали лейкоз Р388, меченным His белком PD1-4-1BBL (SEQ ID NO: 5) было эффективным, о чем можно судить по значительному снижению массы селезенки (среднее 27%, P-величина = 0,003) (фиг. 13B). Различий в массе печени не было обнаружено (данные не показаны).
--->
Перечень последовательностей
<110> КАХР МЕДИКАЛ ЛТД.
ТЫКОЧИНСКИ, Марк Л.
ШАНИ, Ноам
ГОЗЛАН, Йоси
ДРАНИТЗКИ ЭЛХАЛЕЛ, Михал
БРЕМЕР, Эдвин
КАМИНСКИ, Идо
<120> СЛИТЫЙ БЕЛОК PD1-41BBL И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ
<130> 72307
<150> US 62/442,471
<151> 2017-01-05
<160> 18
<170> PatentIn version 3.5
<210> 1
<211> 356
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of the chimera protein (PD1- G -4-1BBL)
<400> 1
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Gly Ala Cys Pro Trp Ala Val Ser Gly Ala
145 150 155 160
Arg Ala Ser Pro Gly Ser Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro
165 170 175
Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly
180 185 190
Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro
195 200 205
Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly
210 215 220
Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala
225 230 235 240
Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala
245 250 255
Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu
260 265 270
Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro
275 280 285
Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg
290 295 300
Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr
305 310 315 320
Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val
325 330 335
Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser
340 345 350
Pro Arg Ser Glu
355
<210> 2
<211> 150
<212> PRT
<213> homo sapiens
<400> 2
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 3
<211> 205
<212> PRT
<213> homo sapiens
<400> 3
Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala
1 5 10 15
Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro
20 25 30
Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala
35 40 45
Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro
50 55 60
Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp
65 70 75 80
Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe
85 90 95
Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val
100 105 110
Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala
115 120 125
Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg
130 135 140
Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly
145 150 155 160
Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala
165 170 175
Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr
180 185 190
Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
195 200 205
<210> 4
<211> 355
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of the chimera protein (PD1- 4-1BBL, no
linker)
<400> 4
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Ala Cys Pro Trp Ala Val Ser Gly Ala Arg
145 150 155 160
Ala Ser Pro Gly Ser Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu
165 170 175
Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met
180 185 190
Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu
195 200 205
Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly
210 215 220
Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly
225 230 235 240
Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly
245 250 255
Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg
260 265 270
Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro
275 280 285
Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu
290 295 300
Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr Glu
305 310 315 320
Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu
325 330 335
Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro
340 345 350
Arg Ser Glu
355
<210> 5
<211> 362
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of His-tagged PD1-41BBL
<400> 5
His His His His His His Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg
1 5 10 15
Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu
20 25 30
Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser
35 40 45
Phe Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys
50 55 60
Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg
65 70 75 80
Phe Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val
85 90 95
Val Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile
100 105 110
Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu
115 120 125
Arg Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro
130 135 140
Ser Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Ala Cys Pro
145 150 155 160
Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser Pro
165 170 175
Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu
180 185 190
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
195 200 205
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
210 215 220
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
225 230 235 240
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
245 250 255
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
260 265 270
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
275 280 285
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
290 295 300
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
305 310 315 320
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
325 330 335
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
340 345 350
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
355 360
<210> 6
<211> 554
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of SIRP alpha 41BBL
<400> 6
His His His His His Glu Glu Glu Leu Gln Val Ile Gln Pro Asp Lys
1 5 10 15
Ser Val Leu Val Ala Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr Ala
20 25 30
Thr Ser Leu Ile Pro Val Gly Pro Ile Gln Trp Phe Arg Gly Ala Gly
35 40 45
Pro Gly Arg Glu Leu Ile Tyr Asn Gln Lys Glu Gly His Phe Pro Arg
50 55 60
Val Thr Thr Val Ser Asp Leu Thr Lys Arg Asn Asn Met Asp Phe Ser
65 70 75 80
Ile Arg Ile Gly Asn Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Phe Arg Lys Gly Ser Pro Asp Asp Val Glu Phe Lys Ser Gly
100 105 110
Ala Gly Thr Glu Leu Ser Val Arg Ala Lys Pro Ser Ala Pro Val Val
115 120 125
Ser Gly Pro Ala Ala Arg Ala Thr Pro Gln His Thr Val Ser Phe Thr
130 135 140
Cys Glu Ser His Gly Phe Ser Pro Arg Asp Ile Thr Leu Lys Trp Phe
145 150 155 160
Lys Asn Gly Asn Glu Leu Ser Asp Phe Gln Thr Asn Val Asp Pro Val
165 170 175
Gly Glu Ser Val Ser Tyr Ser Ile His Ser Thr Ala Lys Val Val Leu
180 185 190
Thr Arg Glu Asp Val His Ser Gln Val Ile Cys Glu Val Ala His Val
195 200 205
Thr Leu Gln Gly Asp Pro Leu Arg Gly Thr Ala Asn Leu Ser Glu Thr
210 215 220
Ile Arg Val Pro Pro Thr Leu Glu Val Thr Gln Gln Pro Val Arg Ala
225 230 235 240
Glu Asn Gln Val Asn Val Thr Cys Gln Val Arg Lys Phe Tyr Pro Gln
245 250 255
Arg Leu Gln Leu Thr Trp Leu Glu Asn Gly Asn Val Ser Arg Thr Glu
260 265 270
Thr Ala Ser Thr Val Thr Glu Asn Lys Asp Gly Thr Tyr Asn Trp Met
275 280 285
Ser Trp Leu Leu Val Asn Val Ser Ala His Arg Asp Asp Val Lys Leu
290 295 300
Thr Cys Gln Val Glu His Asp Gly Gln Pro Ala Val Ser Lys Ser His
305 310 315 320
Asp Leu Lys Val Ser Ala His Pro Lys Glu Gln Gly Ser Asn Thr Ala
325 330 335
Ala Glu Asn Thr Gly Ser Asn Glu Arg Asn Ile Tyr Gly Ala Cys Pro
340 345 350
Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser Pro
355 360 365
Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu
370 375 380
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
385 390 395 400
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
405 410 415
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
420 425 430
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
435 440 445
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
450 455 460
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
465 470 475 480
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
485 490 495
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
500 505 510
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
515 520 525
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
530 535 540
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
545 550
<210> 7
<211> 312
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of PD1-CD70
<400> 7
His His His His His His Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg
1 5 10 15
Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu
20 25 30
Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser
35 40 45
Phe Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys
50 55 60
Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg
65 70 75 80
Phe Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val
85 90 95
Val Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile
100 105 110
Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu
115 120 125
Arg Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro
130 135 140
Ser Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gln Arg Phe
145 150 155 160
Ala Gln Ala Gln Gln Gln Leu Pro Leu Glu Ser Leu Gly Trp Asp Val
165 170 175
Ala Glu Leu Gln Leu Asn His Thr Gly Pro Gln Gln Asp Pro Arg Leu
180 185 190
Tyr Trp Gln Gly Gly Pro Ala Leu Gly Arg Ser Phe Leu His Gly Pro
195 200 205
Glu Leu Asp Lys Gly Gln Leu Arg Ile His Arg Asp Gly Ile Tyr Met
210 215 220
Val His Ile Gln Val Thr Leu Ala Ile Cys Ser Ser Thr Thr Ala Ser
225 230 235 240
Arg His His Pro Thr Thr Leu Ala Val Gly Ile Cys Ser Pro Ala Ser
245 250 255
Arg Ser Ile Ser Leu Leu Arg Leu Ser Phe His Gln Gly Cys Thr Ile
260 265 270
Ala Ser Gln Arg Leu Thr Pro Leu Ala Arg Gly Asp Thr Leu Cys Thr
275 280 285
Asn Leu Thr Gly Thr Leu Leu Pro Ser Arg Asn Thr Asp Glu Thr Phe
290 295 300
Phe Gly Val Gln Trp Val Arg Pro
305 310
<210> 8
<211> 1086
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence of PD1-41BBL (with his tag)
<400> 8
caccatcatc accaccatcc tggctggttt ctggacagcc ccgacagacc ttggaaccct 60
cctacattca gccccgctct gctggtggtt accgagggcg ataatgccac cttcacctgt 120
agcttcagca acaccagcga gagcttcgtg ctgaactggt acagaatgag ccccagcaac 180
cagaccgaca agctggccgc ctttcctgag gatagatctc agcccggcca ggactgccgg 240
ttcagagtta cacagctgcc caacggccgg gacttccaca tgtctgtcgt ccgggccaga 300
agaaacgaca gcggcacata tctgtgcggc gccatttctc tggcccctaa ggctcagatc 360
aaagagagcc tgagagccga gctgagagtg acagaaagac gggccgaagt gcccacagct 420
cacccttcac cttctccaag acctgccggc cagtttcaga cactcgtggg agcttgtcct 480
tgggccgttt ctggcgctag agcctctcct ggatctgccg cttctcccag actgagagag 540
ggacctgagc tgagccctga tgatcctgct ggactgctgg atctgagaca gggcatgttt 600
gcccagctgg tggcccagaa tgtgctgctg attgatggcc ctctgtcctg gtacagcgat 660
cctggacttg ctggcgttag cctgactggc ggcctgagct acaaagagga caccaaagaa 720
ctggtggtgg ccaaggccgg cgtgtactac gtgttctttc agctggaact gcggagagtg 780
gtggccggcg aaggatctgg atctgtgtct ctggctctgc atctgcagcc tctgagatct 840
gctgctggtg ctgctgctct ggccctgaca gttgatctgc ctcctgcctc tagcgaggcc 900
agaaactccg cctttggctt ccaaggcaga ctgctgcacc tgagcgctgg acagagactg 960
ggagtccatc tgcacacaga agccagagct agacacgcct ggcagctgac acaaggcgct 1020
acagtgctgg gcctgttcag agtgacccct gagattccag ccggcctgcc atctcctaga 1080
tctgag 1086
<210> 9
<211> 1068
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence of PD1-41BBL
<400> 9
cctggctggt ttctggacag ccccgacaga ccttggaacc ctcctacatt cagccccgct 60
ctgctggtgg ttaccgaggg cgataatgcc accttcacct gtagcttcag caacaccagc 120
gagagcttcg tgctgaactg gtacagaatg agccccagca accagaccga caagctggcc 180
gcctttcctg aggatagatc tcagcccggc caggactgcc ggttcagagt tacacagctg 240
cccaacggcc gggacttcca catgtctgtc gtccgggcca gaagaaacga cagcggcaca 300
tatctgtgcg gcgccatttc tctggcccct aaggctcaga tcaaagagag cctgagagcc 360
gagctgagag tgacagaaag acgggccgaa gtgcccacag ctcacccttc accttctcca 420
agacctgccg gccagtttca gacactcgtg ggagcttgtc cttgggccgt ttctggcgct 480
agagcctctc ctggatctgc cgcttctccc agactgagag agggacctga gctgagccct 540
gatgatcctg ctggactgct ggatctgaga cagggcatgt ttgcccagct ggtggcccag 600
aatgtgctgc tgattgatgg ccctctgtcc tggtacagcg atcctggact tgctggcgtt 660
agcctgactg gcggcctgag ctacaaagag gacaccaaag aactggtggt ggccaaggcc 720
ggcgtgtact acgtgttctt tcagctggaa ctgcggagag tggtggccgg cgaaggatct 780
ggatctgtgt ctctggctct gcatctgcag cctctgagat ctgctgctgg tgctgctgct 840
ctggccctga cagttgatct gcctcctgcc tctagcgagg ccagaaactc cgcctttggc 900
ttccaaggca gactgctgca cctgagcgct ggacagagac tgggagtcca tctgcacaca 960
gaagccagag ctagacacgc ctggcagctg acacaaggcg ctacagtgct gggcctgttc 1020
agagtgaccc ctgagattcc agccggcctg ccatctccta gatctgag 1068
<210> 10
<211> 288
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of full length PD1
<400> 10
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 11
<211> 867
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence of full length PD1
<400> 11
atgcagatcc cacaggcgcc ctggccagtc gtctgggcgg tgctacaact gggctggcgg 60
ccaggatggt tcttagactc cccagacagg ccctggaacc cccccacctt ctccccagcc 120
ctgctcgtgg tgaccgaagg ggacaacgcc accttcacct gcagcttctc caacacatcg 180
gagagcttcg tgctaaactg gtaccgcatg agccccagca accagacgga caagctggcc 240
gccttccccg aggaccgcag ccagcccggc caggactgcc gcttccgtgt cacacaactg 300
cccaacgggc gtgacttcca catgagcgtg gtcagggccc ggcgcaatga cagcggcacc 360
tacctctgtg gggccatctc cctggccccc aaggcgcaga tcaaagagag cctgcgggca 420
gagctcaggg tgacagagag aagggcagaa gtgcccacag cccaccccag cccctcaccc 480
aggccagccg gccagttcca aaccctggtg gttggtgtcg tgggcggcct gctgggcagc 540
ctggtgctgc tagtctgggt cctggccgtc atctgctccc gggccgcacg agggacaata 600
ggagccaggc gcaccggcca gcccctgaag gaggacccct cagccgtgcc tgtgttctct 660
gtggactatg gggagctgga tttccagtgg cgagagaaga ccccggagcc ccccgtgccc 720
tgtgtccctg agcagacgga gtatgccacc attgtctttc ctagcggaat gggcacctca 780
tcccccgccc gcaggggctc agctgacggc cctcggagtg cccagccact gaggcctgag 840
gatggacact gctcttggcc cctctga 867
<210> 12
<211> 450
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence encoding the extracellular domain of the
human PD1 protein
<400> 12
ccaggatggt tcttagactc cccagacagg ccctggaacc cccccacctt ctccccagcc 60
ctgctcgtgg tgaccgaagg ggacaacgcc accttcacct gcagcttctc caacacatcg 120
gagagcttcg tgctaaactg gtaccgcatg agccccagca accagacgga caagctggcc 180
gccttccccg aggaccgcag ccagcccggc caggactgcc gcttccgtgt cacacaactg 240
cccaacgggc gtgacttcca catgagcgtg gtcagggccc ggcgcaatga cagcggcacc 300
tacctctgtg gggccatctc cctggccccc aaggcgcaga tcaaagagag cctgcgggca 360
gagctcaggg tgacagagag aagggcagaa gtgcccacag cccaccccag cccctcaccc 420
aggccagccg gccagttcca aaccctggtg 450
<210> 13
<211> 254
<212> PRT
<213> Artificial sequence
<220>
<223> Amino-acid sequence of full length 41BBL
<400> 13
Met Glu Tyr Ala Ser Asp Ala Ser Leu Asp Pro Glu Ala Pro Trp Pro
1 5 10 15
Pro Ala Pro Arg Ala Arg Ala Cys Arg Val Leu Pro Trp Ala Leu Val
20 25 30
Ala Gly Leu Leu Leu Leu Leu Leu Leu Ala Ala Ala Cys Ala Val Phe
35 40 45
Leu Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser
50 55 60
Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp
65 70 75 80
Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val
85 90 95
Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp
100 105 110
Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu
115 120 125
Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe
130 135 140
Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser
145 150 155 160
Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala
165 170 175
Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala
180 185 190
Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala
195 200 205
Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His
210 215 220
Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val
225 230 235 240
Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
245 250
<210> 14
<211> 765
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence of full length 41BBL
<400> 14
atggaatacg cctctgacgc ttcactggac cccgaagccc cgtggcctcc cgcgccccgc 60
gctcgcgcct gccgcgtact gccttgggcc ctggtcgcgg ggctgctgct gctgctgctg 120
ctcgctgccg cctgcgccgt cttcctcgcc tgcccctggg ccgtgtccgg ggctcgcgcc 180
tcgcccggct ccgcggccag cccgagactc cgcgagggtc ccgagctttc gcccgacgat 240
cccgccggcc tcttggacct gcggcagggc atgtttgcgc agctggtggc ccaaaatgtt 300
ctgctgatcg atgggcccct gagctggtac agtgacccag gcctggcagg cgtgtccctg 360
acggggggcc tgagctacaa agaggacacg aaggagctgg tggtggccaa ggctggagtc 420
tactatgtct tctttcaact agagctgcgg cgcgtggtgg ccggcgaggg ctcaggctcc 480
gtttcacttg cgctgcacct gcagccactg cgctctgctg ctggggccgc cgccctggct 540
ttgaccgtgg acctgccacc cgcctcctcc gaggctcgga actcggcctt cggtttccag 600
ggccgcttgc tgcacctgag tgccggccag cgcctgggcg tccatcttca cactgaggcc 660
agggcacgcc atgcctggca gcttacccag ggcgccacag tcttgggact cttccgggtg 720
acccccgaaa tcccagccgg actcccttca ccgaggtcgg aataa 765
<210> 15
<211> 615
<212> DNA
<213> Artificial sequence
<220>
<223> Nucleic-acid sequence encoding the extracellular domain of the
human 41BBL
<400> 15
gcctgcccct gggccgtgtc cggggctcgc gcctcgcccg gctccgcggc cagcccgaga 60
ctccgcgagg gtcccgagct ttcgcccgac gatcccgccg gcctcttgga cctgcggcag 120
ggcatgtttg cgcagctggt ggcccaaaat gttctgctga tcgatgggcc cctgagctgg 180
tacagtgacc caggcctggc aggcgtgtcc ctgacggggg gcctgagcta caaagaggac 240
acgaaggagc tggtggtggc caaggctgga gtctactatg tcttctttca actagagctg 300
cggcgcgtgg tggccggcga gggctcaggc tccgtttcac ttgcgctgca cctgcagcca 360
ctgcgctctg ctgctggggc cgccgccctg gctttgaccg tggacctgcc acccgcctcc 420
tccgaggctc ggaactcggc cttcggtttc cagggccgct tgctgcacct gagtgccggc 480
cagcgcctgg gcgtccatct tcacactgag gccagggcac gccatgcctg gcagcttacc 540
cagggcgcca cagtcttggg actcttccgg gtgacccccg aaatcccagc cggactccct 600
tcaccgaggt cggaa 615
<210> 16
<211> 167
<212> PRT
<213> Artificial sequence
<220>
<223> PD1 amino acid sequence
<400> 16
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln
165
<210> 17
<211> 122
<212> PRT
<213> Artificial sequence
<220>
<223> PD1 amino acid sequence
<400> 17
Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu
1 5 10 15
Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser
20 25 30
Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro Ser
35 40 45
Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro
50 55 60
Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg Asp
65 70 75 80
Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr
85 90 95
Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser
100 105 110
Leu Arg Ala Glu Leu Arg Val Thr Glu Arg
115 120
<210> 18
<211> 1170
<212> DNA
<213> Artificial sequence
<220>
<223> The cloning sequence of PD1-41BBL in the vector
<400> 18
gaattcccgc cgccaccatg ggctggtcct gcatcattct gtttctggtg gccacagcca 60
ccggcgtgca ctctcaccat catcaccacc atcctggctg gtttctggac agccccgaca 120
gaccttggaa ccctcctaca ttcagccccg ctctgctggt ggttaccgag ggcgataatg 180
ccaccttcac ctgtagcttc agcaacacca gcgagagctt cgtgctgaac tggtacagaa 240
tgagccccag caaccagacc gacaagctgg ccgcctttcc tgaggataga tctcagcccg 300
gccaggactg ccggttcaga gttacacagc tgcccaacgg ccgggacttc cacatgtctg 360
tcgtccgggc cagaagaaac gacagcggca catatctgtg cggcgccatt tctctggccc 420
ctaaggctca gatcaaagag agcctgagag ccgagctgag agtgacagaa agacgggccg 480
aagtgcccac agctcaccct tcaccttctc caagacctgc cggccagttt cagacactcg 540
tgggagcttg tccttgggcc gtttctggcg ctagagcctc tcctggatct gccgcttctc 600
ccagactgag agagggacct gagctgagcc ctgatgatcc tgctggactg ctggatctga 660
gacagggcat gtttgcccag ctggtggccc agaatgtgct gctgattgat ggccctctgt 720
cctggtacag cgatcctgga cttgctggcg ttagcctgac tggcggcctg agctacaaag 780
aggacaccaa agaactggtg gtggccaagg ccggcgtgta ctacgtgttc tttcagctgg 840
aactgcggag agtggtggcc ggcgaaggat ctggatctgt gtctctggct ctgcatctgc 900
agcctctgag atctgctgct ggtgctgctg ctctggccct gacagttgat ctgcctcctg 960
cctctagcga ggccagaaac tccgcctttg gcttccaagg cagactgctg cacctgagcg 1020
ctggacagag actgggagtc catctgcaca cagaagccag agctagacac gcctggcagc 1080
tgacacaagg cgctacagtg ctgggcctgt tcagagtgac ccctgagatt ccagccggcc 1140
tgccatctcc tagatctgag tgataagctt 1170
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЙ БЕЛОК SIRPα-4-1BBL И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2769769C2 |
| ВАРИАНТЫ СЛИТОГО БЕЛКА SIRP-альфа-4-1BBL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2815515C2 |
| HER-2-НАПРАВЛЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ 4-1BBL | 2019 |
|
RU2815451C2 |
| ИСКУССТВЕННЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2763798C1 |
| ИММУНОМОДУЛИРУЮЩИЕ СЛИТЫЕ БЕЛКИ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2755227C2 |
| ПОЛУЧЕННЫЕ ПУТЕМ РАЦИОНАЛЬНОГО ДИЗАЙНА НОВЫЕ БЕЛКОВЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2816719C2 |
| МЕЗОТЕЛИНОВЫЕ CAR-РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2822193C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СОЕДИНЕНИЯ ВНЕКЛЕТОЧНЫХ ДОМЕНОВ ТИПА I И ТИПА II В КАЧЕСТВЕ ГЕТЕРОЛОГИЧНЫХ ХИМЕРНЫХ БЕЛКОВ | 2016 |
|
RU2766200C1 |
| ВЕКТОР, КОЭКСПРЕССИРУЮЩИЙ МОЛЕКУЛЫ ДЛЯ ВАКЦИНАЦИИ И КОСТИМУЛИРУЮЩИЕ МОЛЕКУЛЫ | 2016 |
|
RU2714157C2 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
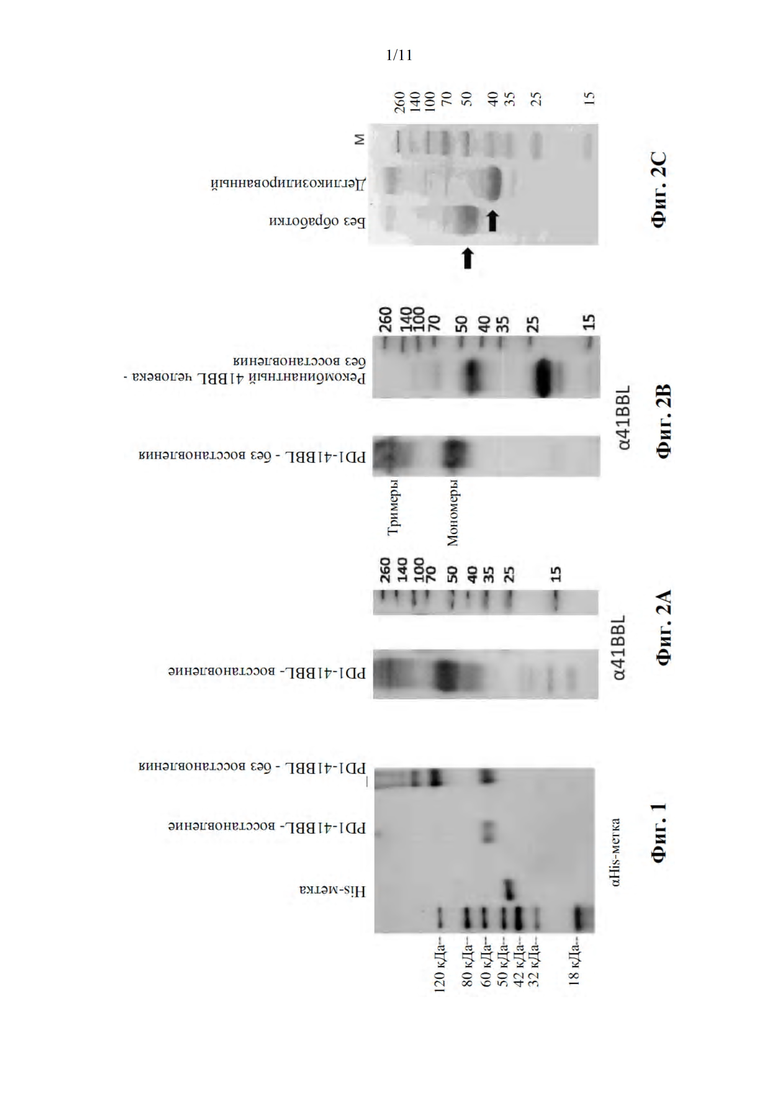
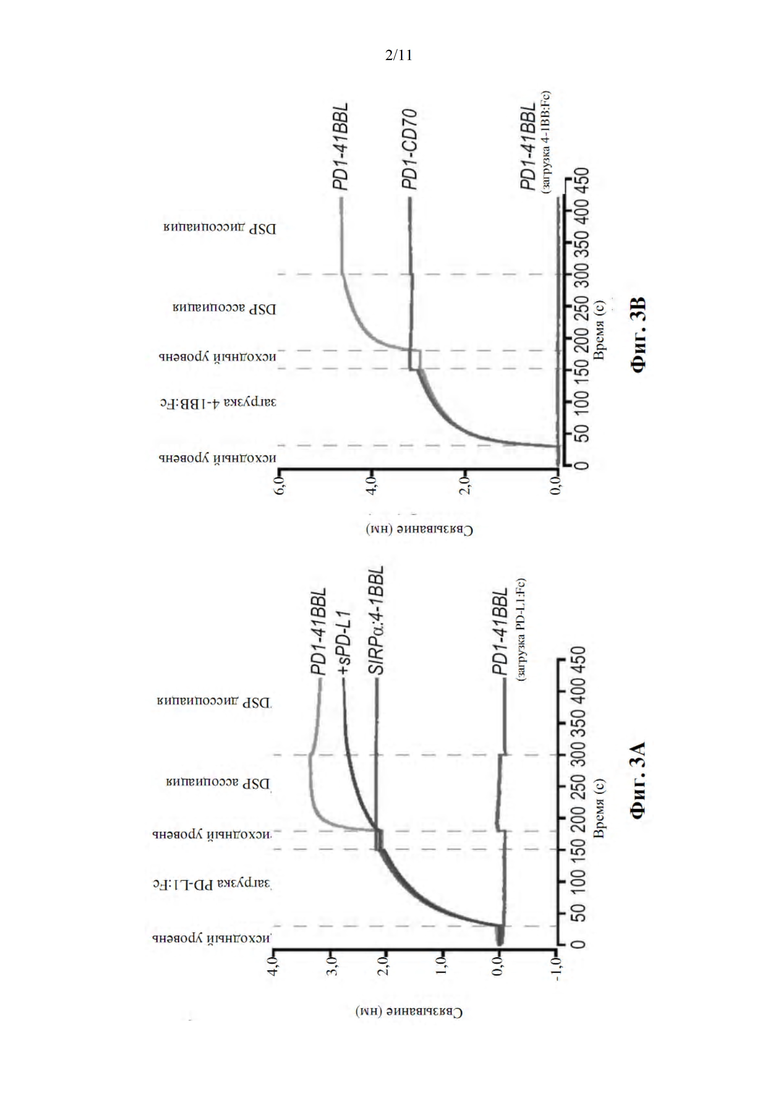

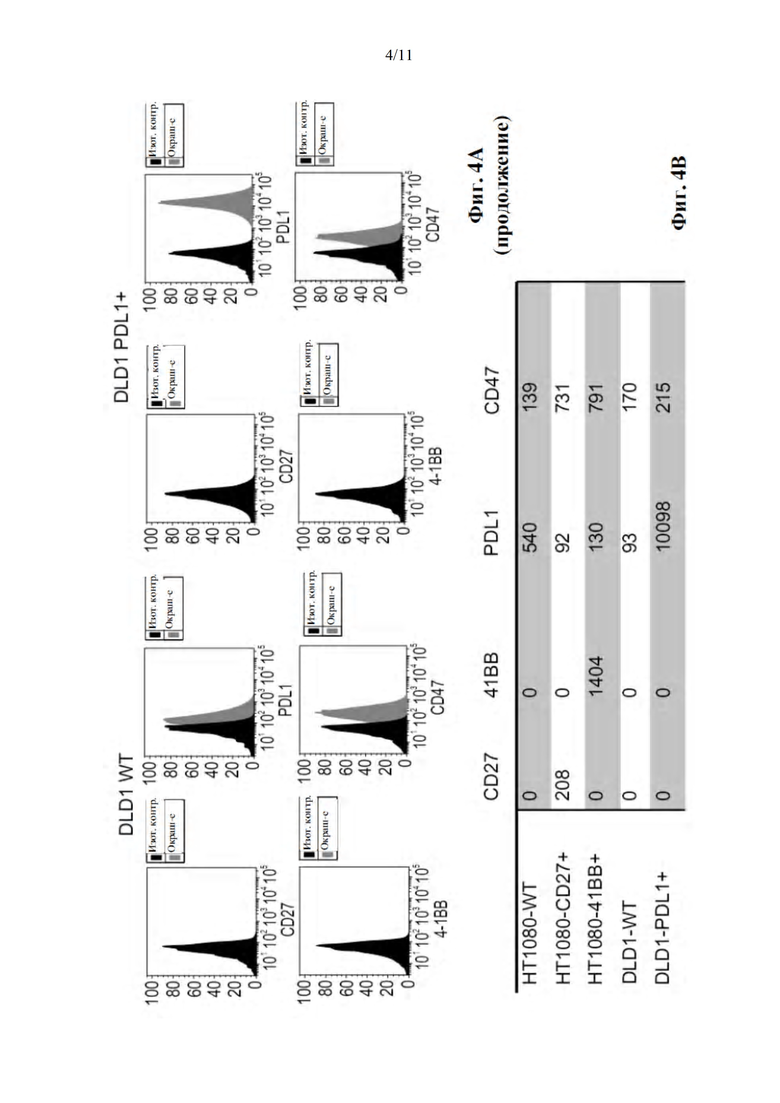
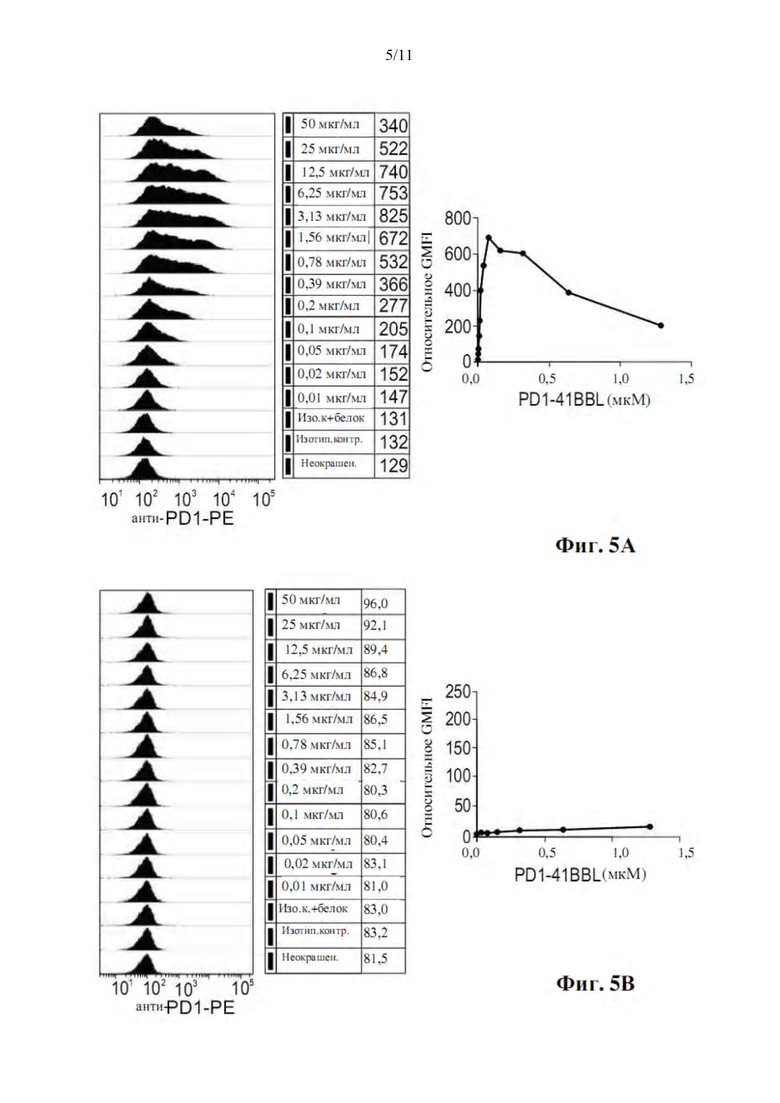
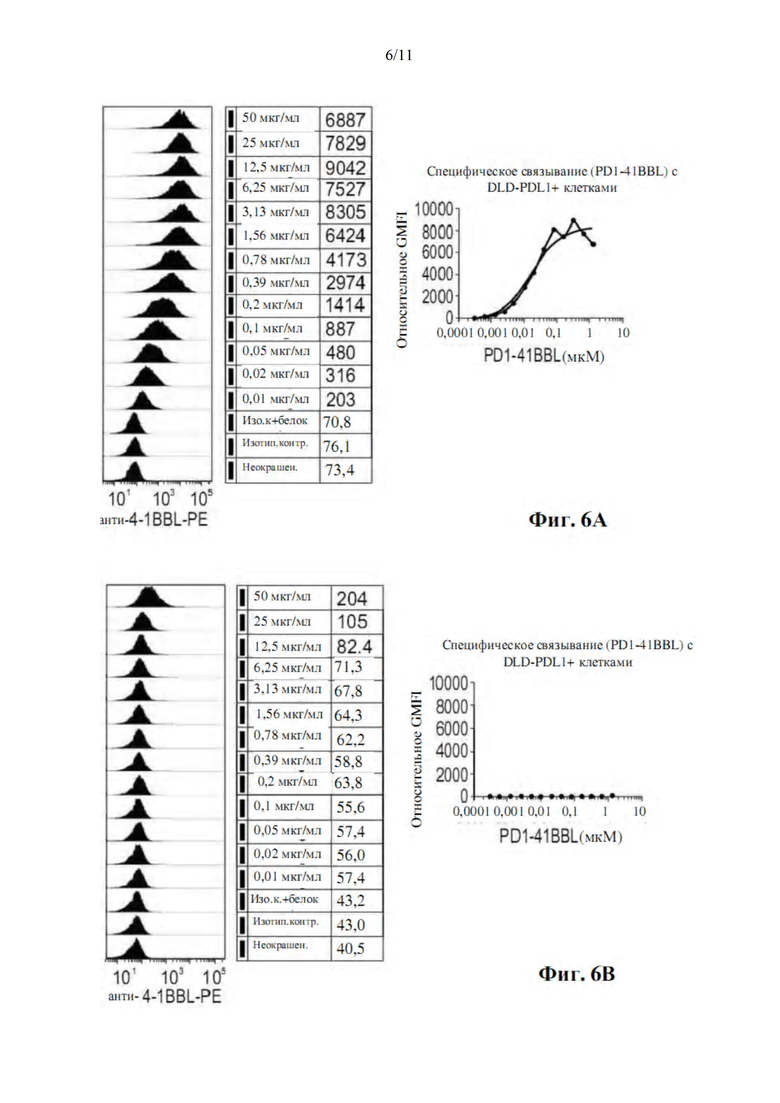
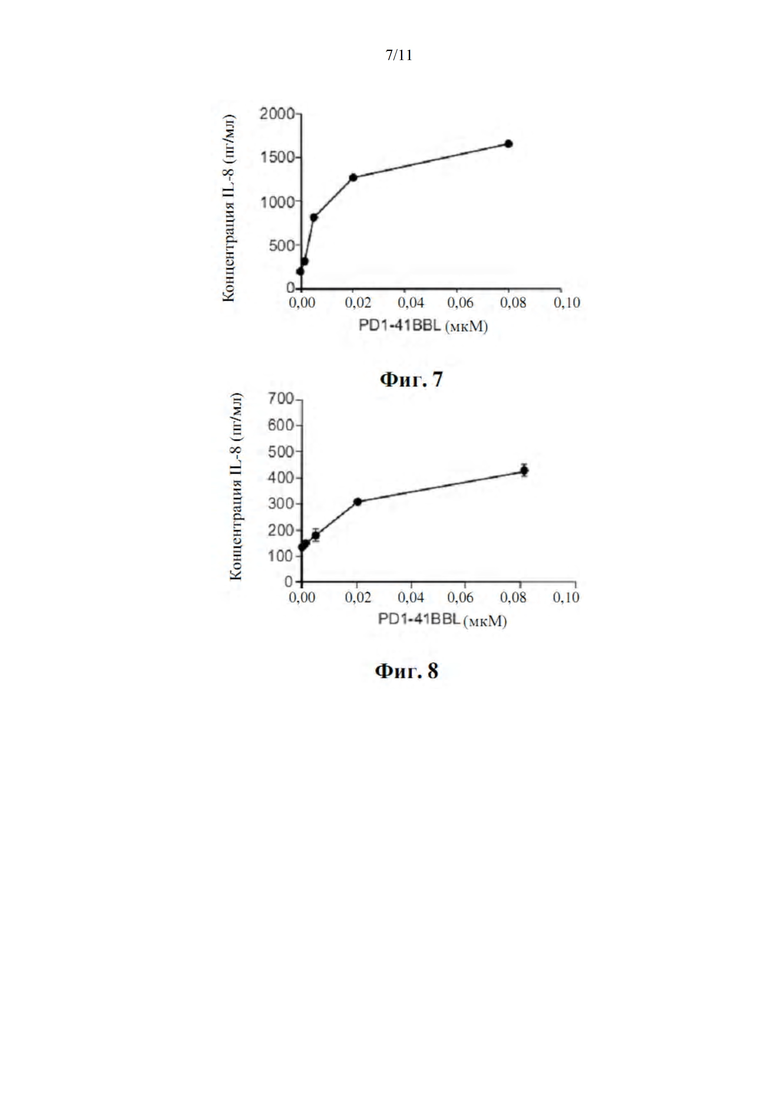


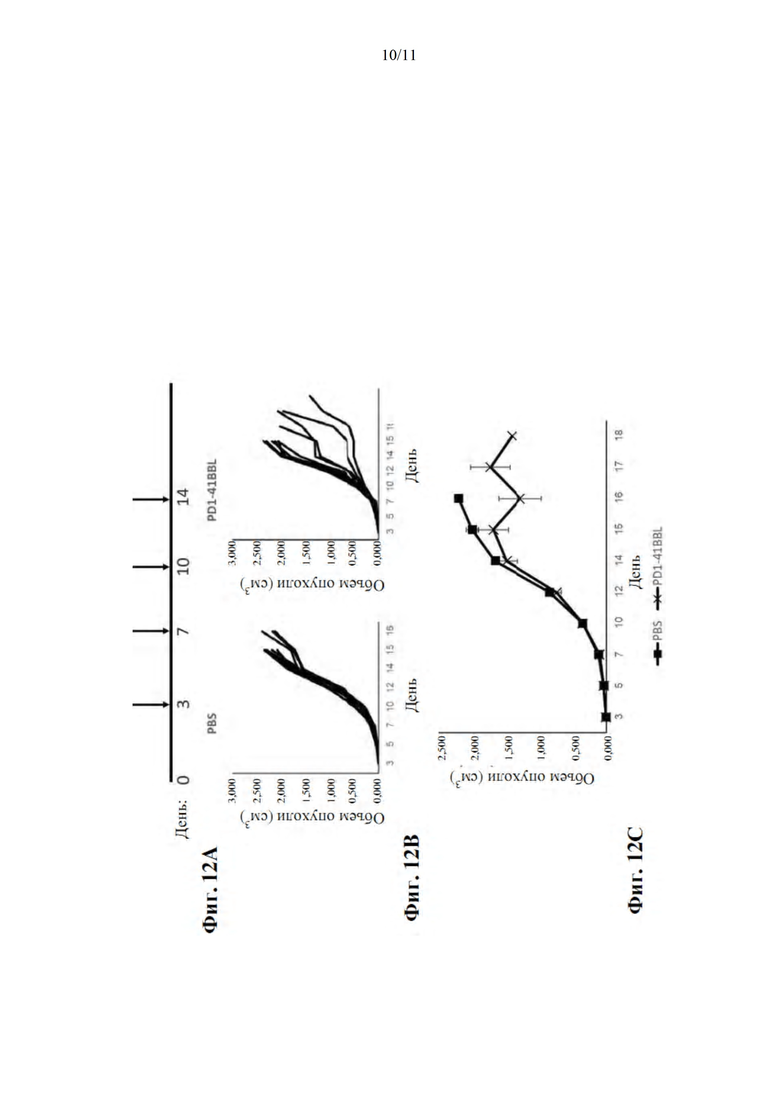
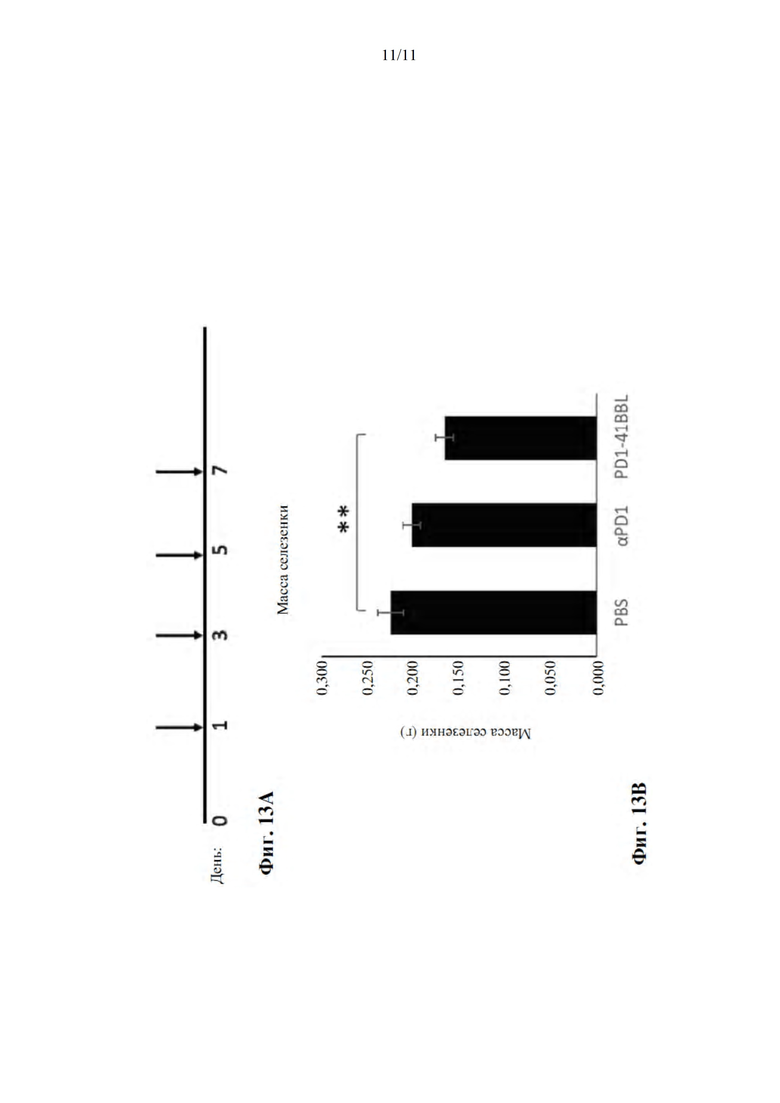
Изобретение относится к области биотехнологии, конкретно к слитым белкам PD1-4-1BBL, и может быть использовано в медицине для лечения рака, клетки которого экспрессируют PD-L1. Конструируют слитый белок PD1-4-1BBL в форме гомотримера, содержащий на своем N-конце аминокислотную последовательность программируемой смерти 1 (PD1), а на своем С-конце аминокислотную последовательность лиганда 4-1BB (4-1BBL), соединенные посредством линкера из одного глицина. Изобретение позволяет получить слитый белок, который способен к связыванию PD-L1 и 4-1BB, активации указанного сигнального пути 4-1BB в клетке, экспрессирующей указанный 4-1BB и костимуляции иммунных клеток, экспрессирующих указанный 4-1BB. 5 н. и 6 з.п. ф-лы, 1 табл., 12 пр., 13 ил.
1. Слитый белок PD1-4-1BBL, содержащий на своем N-конце аминокислотную последовательность программируемой смерти 1 (PD1), причем указанная аминокислотная последовательность PD1 представлена в SEQ ID No. 2 или представляет собой ее фрагмент, составляющий в длину по меньшей мере 123 аминокислоты, способный связывать PD-L1, а на своем С-конце аминокислотную последовательность лиганда 4-1BB (4-1BBL), причем указанная аминокислотная последовательность 4-1BBL представлена в SEQ ID NO: 3 или представляет собой ее фрагмент, способный связывать 4-1BB, причем указанный слитый белок характеризуется линкером из одного глицина между указанным PD1 и указанным 4-1BBL и находится в форме гомотримера, и причем указанный слитый белок способен к:
(i) связыванию PD-L1 и 4-1BB;
(ii) активации указанного сигнального пути 4-1BB в клетке, экспрессирующей указанный 4-1BB; и
(iii) костимуляции иммунных клеток, экспрессирующих указанный 4-1BB.
2. Слитый белок PD1-4-1BBL по п. 1, причем указанный гомотример характеризуется молекулярной массой по меньшей мере 100 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
3. Слитый белок PD1-4-1BBL по п. 1, причем указанный слитый белок PD1-4-1BBL является растворимым.
4. Слитый белок PD1-4-1BBL по п. 1, причем аминокислотная последовательность указанного слитого белка PD1-4-1BBL представлена в SEQ ID NO: 1.
5. Полинуклеотид, кодирующий слитый белок PD1-4-1BBL по любому из пп. 1-4.
6. Вектор экспрессии, содержащий полинуклеотид по п. 5 и регуляторный элемент для направления экспрессии указанного полинуклеотида в клетке-хозяине.
7. Применение слитого белка PD1-4-1BBL по любому из пп. 1-4 для лечения рака у субъекта, нуждающегося в этом, причем клетки указанного рака экспрессируют PD-L1.
8. Способ активации иммунных клеток, предусматривающий активацию иммунных клеток in vitro, выбранных из группы, состоящей из PBMC и Т-клеток, в присутствии
(а) слитого белка PD1-4-1BBL, содержащего на своем N-конце аминокислотную последовательность программируемой смерти 1 (PD1), причем указанная аминокислотная последовательность PD1 представлена в SEQ ID No. 2 или представляет собой ее фрагмент, составляющий в длину по меньшей мере 123 аминокислоты, способный связывать PD-L1, а на своем С-конце аминокислотную последовательность лиганда 4-1BB (4-1BBL), причем указанная аминокислотная последовательность 4-1BBL представлена в SEQ ID NO: 3 или представляет собой ее фрагмент, способный связывать 4-1BB, причем указанный слитый белок характеризуется линкером из одного глицина между указанным PD1 и указанным 4-1BBL и находится в форме гомотримера, и причем указанный слитый белок способен к:
(i) связыванию PD-L1 и 4-1BB;
(ii) активации указанного сигнального пути 4-1BB в клетке, экспрессирующей указанный 4-1BB; и
(iii) костимуляции иммунных клеток, экспрессирующих указанный 4-1BB; и
(b) раковых клеток, экспрессирующих PD-L1.
9. Способ по п. 8, причем указанный гомотример характеризуется молекулярной массой по меньшей мере 100 кДа, как определено с помощью ДСН-ПААГ-электрофореза.
10. Способ по п. 8, причем указанный слитый белок PD1-4-1BBL является растворимым.
11. Способ по п. 8, причем аминокислотная последовательность указанного слитого белка PD1-4-1BBL представлена в SEQ ID NO: 1.
| US 20130287802 A1, 31.10.2013; WO 2011109789 А2, 09.09.2011; XIAO H | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Г | |||
| и др., Таргетная иммунотерапия в онкологии, Аллергология и | |||
Авторы
Даты
2022-04-01—Публикация
2018-01-04—Подача