Область техники
Изобретение относится к Her2-таргетным 4-1ВВ агонистам, в частности, к антигенсвязывающим молекулам, содержащим 4-1BBL тример, и включающим антигенсвязывающий домен, способный к специфическому связыванию с Her2, а также к способу применения указанных молекул для лечения рака. Изобретение также относится к способам получения таких молекул и к способам их применения.
Предпосылки создания изобретения
4-1ВВ (CD137), член суперсемейства рецепторов TNF (аббрев. от англ. Tumor Necrosis Factor), впервые был идентифицирован как индуцируемая молекула, экспрессируемая активированными Т-клетками (Kwon and Weissman, 1989, Proc Natl Acad Sci USA 86, 1963-1967). В последующих исследованиях было продемонстрировано, что многие другие иммунные клетки также экспрессируют 4-1ВВ, включая NK клетки, В-клетки, NKT клетки, моноциты, нейтрофилы, тучные клетки, дендритные клетки (DC аббрев. от англ. Dendritic Cell) и клетки не-гемопоэтического происхождения, такие, как эндотелиальные клетки и клетки гладкой мышечной мускулатуры (Vinay and Kwon, 2011, Cell Mol Immunol 8, 281-284). Экспрессия 4-1BB клетками различных типов, как правило, индуцируется и направляется разнообразными стимулирующими сигналами, такими, как сигналы Т-клеточных (TCR) или В-клеточных триггерных рецепторов, а также сигналами, индуцируемыми посредством костимулирующих молекул или рецепторов провоспалительных цитокинов (Diehl et al., 2002, J Immunol 168, 3755-3762; Zhang et al., 2010, Clin Cancer Res 13, 2758-2767).
4-1BB лиганд (4-1BBL или CD137L) был идентифицирован в 1993 (Goodwin и соавт., 1993, Eur J Immunol 23, 2631-2641). Было показано, что в профессиональных антигенпрезентирующих клетках (АРС, от англ. Antigen Presenting Cells), такими, как В-клетки, ДК и макрофаги. Индуцируемая экспрессия 4-1BBL характерна для Т-клеток, включая αβ и γδ подклассы Т клеток, а также для эндотелиальных клеток (Shao and Schwarz, 2011, J Leukoc Biol 89, 21-29).
Совместная стимуляция посредством 4-1BB рецептора (например, путем связывания 4-1BBL) активирует множественные сигнальные каскады в системе Т-клеток (как в CD4+ подклассе, так и в CD8+ подклассе), значительно усиливая активацию Т-клеток (Bartkowiak and Curran, 2015). В сочетании со стимуляцией TCR, 4-1ВВ-специфичные агонистические антитела усиливают пролиферацию Т-клеток, стимулируют секрецию лимфокинов и снижают чувствительность Т-лимфоцитов к индуцированной активацией гибели клеток (Snell et al., 2011, Immunol Rev 244, 197-217). Этот механизм получил дальнейшее развитие в качестве первого доказательства концепции иммунотерапии рака. При изучении на доклинических моделях введение агонистического антитела против 4-1ВВ мышам с опухолями вызывало мощный противоопухолевый эффект (Melero et al., 1997, Nat Med 3, 682-685). Позднее накопленные доказательства подтвердили, что 4-1 ВВ обычно оказывает свое противоопухолевое действие только при введении в комбинации с другими иммуномодулирующими соединениями, химиотерапевтическими агентами, опухолеспецифическими вакцинами или лучевой терапией (Bartkowiak and Curran, 2015, Front Oncol 5, 117).
Передача сигнала суперсемейством TNFR требует перекрестного связывания тримеризированных лигандов для взаимодействия с рецепторами, также как и агонистические антитела 4-1ВВ, которые требуют связывания с Fc дикого типа (Li and Ravetch, 2011, Science 333, 1030-1034). Однако системное введение 4-1ВВ-специфичных агонистических антител с функционально активным Fc доменом приводило к притоку CD8+Т-клеток, ассоциированному с токсическим действием на печень (Dubrot et al., 2010, Cancer Immunol Immunother 59, 1223-1233), которое уменьшалось или существенно подавлялось при отсутствии у мышей Fc-рецепторов. В клинических исследованиях Fc-компетентные 4-1ВВ агонистические антитела (BMS-663513) (NCT00612664) вызывали токсический гепатит 4 стадии, что вынудило прекратить исследование (Simeone and Ascierto, 2012, J Immunotoxicol 9, 241-247). Таким образом, существует потребность в эффективных и безопасных 4-1ВВ агонистах.
Рецептор эпидермального фактора роста-2 человека (Her2; ErbB2) является рецептором тирозинкиназы и членом семейства трансмембранных рецепторов эпидермального фактора роста (EGFR). Her2 избыточно экспрессируется при опухолях различных типов и, как было показано, участвует в инициации и прогрессии заболевания. Его экспрессия ассоциируется с плохим прогнозом. Например, сверхэкспрессия Her2 наблюдается приблизительно в 30% рака молочной железы у людей и ассоциируется с агрессивным ростом и плохим клиническим исходом для такого рода опухолей (Slamon et al (1987) Science 235:177-182).
Гуманизированное анти-Her2 моноклональное антитело трастузумаб (CAS 180288-69-1, HERCEPTIN®, huMAb4D5-8, rhuMAb Her2, Genentech) селективно связывает внеклеточный домен HER-2 US 5677171; US 5821337; US 6054297; US 6165464; US 6339142; US 6407213; US 6639055; US 6719971; US 6800738; US 7074404; Coussens et al (1985) Science 230:1 132-9; Slamon et al (1989) Science 244:707-12; Slamon et al (2001) New Engl. J. Med. 344:783-792). Было показано, что трастузумаб ингибирует пролиферацию опухолевых клеток человека, которые сверхэкспрессируют HER-2, и представляет собой медиатор антитело-зависимой клеточной цитотоксичности, ADCC (Hudziak et al (1989) Mol Cell Biol 9:1 165-72; Lewis et al (1993) Cancer Immunol Immunother; 37:255-63; Baselga et al (1998) Cancer Res. 58:2825-2831; Hotaling et al (1996) [abstract]. Proc. Annual Meeting Am Assoc Cancer Res; 37:471; Pegram MD, et al (1997) [abstract]. Proc Am Assoc Cancer Res; 38:602; Sliwkowski et al (1999) Seminars in Oncology 26(4), Suppl 12:60-70; Yarden Y. and Sliwkowski, M. (2001) Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol. 2:127-137).
ГЕРЦЕПТИН® (трастузумаб, Genentech Inc.) был одобрен в 1998 году для лечения пациентов с Her-2 экспрессирующими метастатическими опухолями молочной железы (Baselga et al, (1996) J. Clin. Oncol. 14:737-744). В 2006 году FDA (Управление по контролю качества продуктов и лекарств США) одобрило ГЕРЦЕПТИН® как часть комплексного протокола лечения, включающего еще доксорубицин, циклофосфамид и паклитаксел, для адъювантной терапии пациентов с Her-2 положительным раком молочной железы с поражением лимфатических узлов.
Пертузумаб (также известный как рекомбинантное гуманизированное моноклональное антитело 2С4, rhuMAb, 2С4, ПЕРЬЕТА®, Genentech, Inc, South San Francisco) представляет собой другое антитело, связывающееся с Her-2. Пертузумаб представляет собой ингибитор димеризации Her (HDI) и способен образовывать активные гетеродимеры или гомодимеры с другими Her рецепторами (такими, как EGFR/Her1, Her2, Her3 и Her4. см, например, Harari и Yarden Oncogene 19:6102-14 (2000); Yarden and Sliwkowski. Nat Rev Mol Cell Biol 2:127-37 (2001); Sliwkowski, Nat Struct Biol 10:158-9 (2003); Cho et al. Nature 421:756-60 (2003); и Malik et al., Pro Am Soc Cancer Res 44:176-7 (2003); US 7560111). ПЕРЬЕТА® впервые была одобрена в 2012 году в комбинации с трастузумабом и доцетакселом для лечения пациентов с распространенным раком или раком на поздней стадии (метастатическим) Her2-позитивным раком молочной железы. Комбинированная терапия трастузумабом и пертузумабом к этому времени была также одобрена для неоадъювантной (перед хирургическим лечением) терапии Her2-позитивного, местнораспространенного, воспалительного рака молочной железы и рака молочной железы на ранней стадии, а также для адъювантного (после хирургического лечения) лечения Her2-позитивного раннего рака молочной железы (ЕВС) с высоким риском рецидива. Механизмы действия Перьеты и Герцептина считаются комплементарными и дополняют друг друга, поскольку они оба связываются с Her2 рецептором, но в разных его участках. Считается, что комбинация Перьеты и Герцептина оказывает более полноценное, двойное блокирующее действие на HER сигнальные пути, что предотвращает рост и выживание опухолевых клеток.
Биспецифические, бивалентные Her2 антитела, которые связываются с доменами II, III и IV ErbB2 человека, описаны в заявке WO 2012/143523. Биспецифические HER-2 антитела, включая оптимизированные варианты антител rhuMab 2С4 и hu4D5, под названием Герцептарг (Herceptarg) были раскрыты в WO 2015/091738.
Несмотря на то, что терапевтическая эффективность трастузумаба при карциноме молочной железы хорошо доказана, у множества пациентов вследствие резистентности не удается достичь положительных результатов. Принимая во внимание недостаточное количество эффективных препаратов для анти-Her2 терапии при специфических типах рака с низким уровнем экспрессии Her2, резистентность к существующей терапии, и распространенность Her2-ассоциированного рака, требуются новые лекарственные средства для лечения рака.
Новые антигенсвязывающие молекулы, заявленные в настоящем изобретении, объединяют анти-Her2 антигенсвязывающий домен с молекулой, которая способна образовывать костимулирующий тримерный 4-1BBL лиганд, и которая является достаточно стабильной для использования в фармацевтических целях. Слитые белки, состоящие из специфичности в отношении CD137 и специфичности в отношении Her2/neu, раскрыты, в WO 2016/177802. Этими молекулами являются слитые полипептиды антитело - мутеин липокалина, это означает, что мутеин липокалина со специфичностью связывания CD137 слит с анти-Her2 антителом. Мутеины липокалина (антикалины) являются каркасом без антител и были осуществлены испытания по преобразованию такой модальности в различные лекарственные средства (Vazquez-Lombardi et al. 2015? Drug Discovery Today 20? 1271-1283). Трудности по сравнению антител могут возникнуть из-за различного периода полураспада в сыворотке, проникновения в ткани и иммуногенности. Таким образом, все еще нужны кандидаты лекарственных средств с улучшенными свойствами, которые основаны на технологии антител или подобных человеку протеинов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Новые антигенсвязывающие молекулы, заявленные в настоящем изобретении, объединяют анти-Her2 антигенсвязывающий домен с молекулой, которая способна образовывать костимулирующий тримерный 4-1BBL лиганд, и которая является достаточно стабильной для использования в фармацевтических целях. Неожиданно оказалось, что антигенсвязывающие молекулы, согласно изобретению, представляют собой тримерный и, таким образом, биологически активный 4-1ВВ лиганд человека, хотя один из тримеризирущих 4-1BBL эктодоменов расположен на другом полипептиде, чем два других 4-1BBL эктодомена молекулы. Направляемые анти-Her2 антигенсвязывающим доменом антигенсвязывающие молекулы согласно изобретению обладают повышенной активностью в месте опухоли, содержат естественный 4-1ВВ лиганд человека и, следовательно, благодаря этому имеют меньше проблем с профилем безопасности, по сравнению с традиционными 4-1ВВ агонистическими антителами или даже с синтетическими слитыми белками.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, включающей:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептиды, которые соединены между собой дисульфидной связью,
при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или их фрагменты, которые соединены между собой пептидным линкером, и тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно определенному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом эктодомен 4-1BBL или его фрагмент включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8, в частности, аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 5.
Согласно дополнительному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, включающей:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептиды, которые соединены между собой дисульфидной связью,
при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, а второй полипептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 3 и SEQ ID NO: 4, и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно одному аспекту, Fc домен представляет собой домен IgG, в частности, Fc домен IgG1 или Fc домен IgG4. Конкретнее, Fc домен представляет собой Fc домен IgG1. Согласно определенному аспекту настоящего изобретения, Fc домен содержит модификацию, которая способствует ассоциации первой и второй субъединицы Fc домена. Согласно определенному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом Fc домен содержит две модификации по типу "выступ-во-впадину", которые способствуют ассоциации первой и второй субъединицы Fc домена. Согласно специфическому аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом первая субъединица Fc домена включает аминокислотные замены S354C и T366W (нумерация согласно EU индексу Кабата), а вторая субъединица Fc домена включает аминокислотные замены Y349C, T366S, L368A и Y407V (нумерация согласно EU индексу Кабата).
Согласно другому аспекту, настоящее изобретение касается содержащей 4-1BBL тример антигенсвязывающей молекулы, как указано выше, включающей (с) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации, при этом Fc домен включает одну или более аминокислотную замену, которая снижает связывание с Fc рецептором, в частности, с Fcγ рецептором. В частности, Fc домен включает аминокислотные замены в положениях 234 и 235 (нумерация согласно EU индексу Кабата) и/или 329 (нумерация согласно EU индексу Кабата) тяжелых цепей IgG. Конкретнее, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом Fc домен представляет собой IgG1 Fc домен, включающий аминокислотные замены L234A, L235A и P329G (нумерация согласно EU индексу Кабата).
Согласно одному аспекту, содержащая 4-1BBL-тример антигенсвязывающая молекула представляет собой молекулу, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her2, представляет собой Fab молекулу, способную к специфическому связыванию с Her2. Согласно другому аспекту, антигенсвязывающий домен, способный к специфическому связыванию к Her2, представляет собой кроссоверную Fab молекулу или scFV молекулу, способную к специфическому связыванию с Her2.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, как описано в настоящем описании выше, при этом указанная содержащая 4-1BBL тример антигенсвязывающая молекула включает один Fab домен, способный к специфическому связыванию к Her2, что означает, что он моновалентно связывается с Her2.
Согласно дополнительному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом антигенсвязывающий домен, способный к специфическому связыванию с Her2, включает (a) VH домен, содержащий (i) CDR-H1, включающий аминокислотную последовательность SEQ ID NO: 13, (ii) CDR-H2, включающий аминокислотную последовательность SEQ ID NO: 14, и (iii) CDR-H3, включающий аминокислотную последовательность SEQ ID NO: 15; а также VL домен, содержащий (iv) CDR-L1, включающий аминокислотную последовательность SEQ ID NO: 16, (v), CDR-L2, включающий аминокислотную последовательность SEQ ID NO: 17, и (vi) CDR-L3, включающий аминокислотную последовательность SEQ ID NO: 18, или (b) VH домен, содержащий (i) CDR-H1, включающий аминокислотную последовательность SEQ ID NO: 21, (ii) CDR-H2, включающий аминокислотную последовательность SEQ ID NO: 22, и (iii) CDR-Н3, включающий аминокислотную последовательность SEQ ID NO: 23; а также VL домен, содержащий (iv) CDR-L1, включающий аминокислотную последовательность SEQ ID NO: 24, (v), CDR-L2, включающий аминокислотную последовательность SEQ ID NO: 25, и (vi) CDR-L3, включающий аминокислотную последовательность SEQ ID NO: 26, или (с) VH домен, содержащий (i) CDR-H1, включающий аминокислотную последовательность SEQ ID NO: 29, (ii) CDR-H2, включающий аминокислотную последовательность SEQ ID NO: 30, и (iii) CDR-H3, включающий аминокислотную последовательность SEQ ID NO: 31; а также VL домен, содержащий (iv) CDR-L1, включающий аминокислотную последовательность SEQ ID NO: 32, (v), CDR-L2, включающий аминокислотную последовательность SEQ ID NO: 33, и (vi) CDR-L3, включающий аминокислотную последовательность SEQ ID NO: 34.
Согласно дополнительному аспекту, содержащая 4-1BBL тример антигенсвязывающая молекула согласно настоящему изобретению, включает
(a) VH домен, включающий аминокислотную последовательность SEQ ID NO: 19 и VL домен, включающий аминокислотную последовательность SEQ ID NO: 20, или
(b) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27 и VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или
(с) VH домен, включающий аминокислотную последовательность SEQ ID NO: 35 и VL домен, включающий аминокислотную последовательность SEQ ID NO: 36.
Согласно дополнительному аспекту изобретения предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом указанная антигенсвязывающая молекула включает
первую тяжелую цепь и первую легкую цепь, обе цепи включают Fab молекулу, способную к специфическому связыванию с Her2,
вторую тяжелую цепь, включающую константные домены и два эктодомена 4-1BBL или его фрагменты, соединенные между собой первым пептидным линкером, который на своем С-конце посредством второго пептидного линкера соединен со второй легкой цепью,
и вторую легкую цепь, включающую константный домен и один эктодомен 4-1BBL или его фрагмент, который на своем С-конце соединен посредством третьего пептидного линкера со второй легкой или тяжелой цепью, соответственно.
Конкретнее, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом первый пептид, содержащий два эктодомена 4-1BBL или его фрагменты, соединенные между собой первым пептидным линкером, который на своем С-конце посредством второго пептидного линкера присоединен к CL домену, который является частью тяжелой цепи, а второй пептид, содержащий один эктодомен указанного 4-1BBL или его фрагмент, на своем С-конце посредством третьего пептидного линкера присоединен к СН1 домену, который является частью легкой цепи.
Согласно определенному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, как определено выше, при этом пептидный линкер представляет собой (G4S)2, то есть пептидный линкер по SEQ ID NO: 68. Согласно одному аспекту, пептидный линкер во всех случаях представляет собой (G4S)2.
Кроме того, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом в CL домене, который принадлежит члену семейства лигандов TNF, аминокислота в положении 123 (EU нумерация) была замещена аргинином (R), а аминокислота в положении 124 (EU нумерация) была замещена лизином (К), и при этом в СН1 домене, принадлежащем члену семейства лигандов TNF, аминокислота в положении 147 (EU нумерация) и 213 (EU нумерация) была замещена глутаминовой кислотой (Е). Согласно другому аспекту изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом указанная антигенсвязывающая молекула включает
(i) первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 19, и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 20, или первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 27 и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 35 и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 36, или
(ii) вторую тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43, и
(iii) вторую легкую цепь, включающую аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42 и SEQ ID NO: 44.
Согласно определенному аспекту изобретения, предлагается содержащая 4-1BBL-тример антигенсвязывающая молекула, при этом указанная антигенсвязывающая молекула включает
(a) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 45, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 46, вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38, или
(b) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 47, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 48, вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38, или
(c) первую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 49, первую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 50, вторую тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 37 и вторую легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38.
Согласно дополнительному аспекту изобретения, предлагается изолированная молекула нуклеиновой кислоты, кодирующая содержащую 4-1BBL-тример антигенсвязывающую молекулу, как определено в настоящем описании выше. Настоящее изобретение также относится к вектору, конкретно, к вектору экспрессии, содержащему изолированную молекулу нуклеиновой кислоты по изобретению, и к клетке-хозяину, содержащей изолированную молекулу нуклеиновой кислоты или вектор по изобретению. Согласно некоторым вариантам осуществления изобретения, клетка-хозяин представляет собой эукариотическую клетку, конкретнее, клетку млекопитающего.
Согласно другому аспекту изобретения, предлагается способ получения содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению, включающий культивирование клеток-хозяев по изобретению в условиях, подходящих для экспрессии содержащей 4-1BBL тример антигенсвязывающей молекулы, и последующее выделение содержащей 4-1BBL тример антигенсвязывающей молекулы из клеток. Настоящее изобретение также относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, полученной при помощи способа, заявленного в соответствии с настоящим изобретением.
Настоящее изобретение также относится к фармацевтической композиции, включающей содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению и по меньшей мере один фармацевтически приемлемый носитель. Согласно другому аспекту изобретения, предлагается фармацевтическая композиция, включающая содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению, и по меньшей мере один фармацевтически приемлемый носитель, а также содержащая дополнительный терапевтический агент, например, химиотерапевтический агент и/или другие агенты, которые используются в иммунотерапии рака. Согласно другому аспекту изобретения, предлагается фармацевтическая композиция, дополнительно содержащая активирующее Т-клетки анти-CD3 биспецифическое антитело, в частности, анти-Her2/анти-CD3 биспецифическое антитело.
Кроме того, настоящее изобретение объединяет содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению или фармацевтическую композицию по изобретению, которые предназначаются для применения в качестве лекарственного средства. Согласно одному аспекту изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению, или фармацевтическая композиция по изобретению, предназначенные для лечения заболевания у нуждающегося в этом индивидуума. Согласно специфическому варианту осуществления изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению, или фармацевтическая композиция по изобретению, предназначенные для применения в лечении рака. Согласно другому аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению, или фармацевтическая композиция по изобретению, предназначенные для повышающей регуляции или пролонгирования цитотоксической Т-клеточной активности. Согласно другому аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению, или фармацевтическая композиция по изобретению, предназначенные для лечения рака, при этом указанная содержащая 4-1BBL тример антигенсвязывающая молекула применяется в комбинации с другим лекарственным агентом, в частности, активирующим Т-клетки анти-CD3 биспецифическим антителом. Согласно одному аспекту, активирующее Т-клетки анти-CD3 биспецифическое антитело вводится одновременно, до или после введения содержащей 4-1BBL тример антигенсвязывающей молекулы.
Также в настоящем изобретении предлагается применение содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению для производства лекарственного средства, предназначенного для лечения заболевания у индивидуума, нуждающегося в этом, в частности, для производства лекарственного средства, предназначенного для лечения рака; а также способ лечения заболевания у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества композиции, содержащей 4-1BBL тример антигенсвязывающую молекулу, как описано в настоящем описании в фармацевтически доступной форме. Согласно конкретному аспекту настоящего изобретения, заболевание представляет собой рак. Также предлагается применение содержащей 4-1BBL триммер антигенсвязывающей молекулы по изобретению для производства лекарственного средства, предназначенного для лечения рака, при этом содержащая 4-1BBL тример антигенсвязывающая молекула применяется в комбинации с активирующим Т-клетки анти-CD3 биспецифическим антителом, в частности, с анти-Her2/анти-CD3 антителом. Кроме того предлагается способ лечения индивидуума, страдающего от рака, который включает введение субъекту эффективного количества содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению, или ее фармацевтической композиции, а также эффективного количества активирующего Т-клетки анти-CD3 биспецифического антитела, в частности, анти-Her2/анти-CD3 антитела. Также предлагается способ повышающей регуляции или пролонгирования цитотоксической Т-клеточной активности у индивидуума, страдающего от рака, который заключается во введении индивидууму эффективного количества содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению, или ее фармацевтической композиции. Согласно любому из описанных выше воплощений изобретения индивидуумом, предпочтительно, является млекопитающее, конкретнее, человек.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фигура 1 демонстрирует компоненты для сборки моновалентных Her-2-таргетных антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд. На Фиг. 1А представлен димерный 4-1ВВ лиганд, который на своем С-конце слит с CL доменом IgG1 человека, содержащим мутации E123R и Q124K (заряженный вариант), а на Фиг. 1В представлен мономерный 4-1ВВ лиганд, который на своем С-конце слит с СН1 доменом IgG1 человека, содержащим мутации K147E и K213E (заряженный вариант).
Фигура 2А схематически иллюстрирует структуру моновалентной Her-2-таргетной слитой антигенсвязывающей молекулы, содержащей сплит тримерный 4-1ВВ лиганд Fc (kih), включающий кроссоверные CH-CL с заряженными остатками. Жирная черная точка указывает на место модификации "выступ-во-впадину". Значком * отмечены аминокислотные модификации в СН1 и CL доменах (так называемый заряженный вариант). На Фигуре 2В показан мышиный суррогат, то есть биспецифическое 4-1ВВ антитело с бивалентным связыванием с мышиным 4-1ВВ и моновалентным связыванием с Her2 (анти-4-1ВВ/анти-Her2 moIgG1 DDKK DAPG, обозначаемым термином mu4-1BB-Her2). Жирная черная точка указывает на место модификации DD/KK "выступ-во-впадину". Мутации DAPG препятствуют перекрестному связыванию слитого белка через мышиные Fcγ рецепторы или связыванию с комплементом, но допускают связывание с FcRn таким образом, что молекула сохраняет свою фармакокинетику как антитела.
На Фигуре 3А показаны результаты набора SPR экспериментов по одновременному связыванию Her-2-таргетных антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, по изобретению. Одновременное связывание Her2(PER)-4-1BBL (Анализируемый образец 1) с иммобилизованным человеческим 4-1ВВ и иммобилизованным Her2 (Анализируемый образец 2) представлено на Фиг. 3В. Одновременное связывание с человеческим 4-1ВВ и человеческим Her2 (aff PER)-4-1BBL представлено на Фиг. 3С.
На Фигурах 4A-4D показано связывание Her2-таргетных слитых антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд Fc, с Her2, экспрессируемом на поверхности человеческой клеточной линии SK-Br3 рака молочной железы (Фиг. 4А и 4С) или человеческой клеточной линии NCI-N87 карциномы желудка (Фиг. 4В и 4D). Her-2-таргетные, содержащие сплит 4-1ВВ антигенсвязывающие молекулы, представляющие Her-2 связывающие соединения пертузумаб (PER) или пертузумаб со зрелой аффинностью (aff-PER) или слитый белок Her2 (TRAS)-антикалин 4-1ВВ huIgG4 (как описано в патенте WO 2016/177802) или описанные ранее агонистические антитела к 4-1ВВ человека клон 20Н4.9 huIgG4 (описанный в патенте US7659384 В2) или антитела к 4-1ВВ человека клон MOR-7480 huIgG2 9 (описанный в WO 2012/032433) или контрольные молекулы в соответствии с подписью, инкубировали с Her2-экспрессирующими клеточными линиями SK-Br3 (Фиг. 4А и 4С) или NCI-N87 (Фиг. 4В или 4D) при различных концентрациях, что показано на оси X. Впоследствии избыточные и не связавшиеся молекулы удаляли, а связавшиеся молекулы определяли при помощи вторичного связывания с F(ab`)2 фрагментом специфического IgG козы к РЕ-конъюгированному Fc-фрагменту человека. Среднюю интенсивность флуоресценции (MFI) измеряли проточной цитометрией и с ее помощью определяли аффинность (моновалентные связывающие молекулы) или авидность (бивалентные связывающие молекулы) тестируемых молекул дозозависимым образом. Значения являются базовыми, которые корректируются путем вычитания пустых проб (например, окрашенных только 2-ым детекторным фрагментом), показаны средние величины +/- SEM.
На Фигурах 5А и 5В показано связывание Her2-таргетных слитых антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc, с Her2, экспрессируемым на поверхности клеточной линии KPL-4 рака молочной железы человека. Her2-таргетные, содержащие сплит 4-1BBL антигенсвязывающие молекулы, включающие Her2 связывающий PER, aff-PER или трастузумаб (TRAS), слитый белок Her2 (TRAS)-антикалин 4-1ВВ huIgG4 (как описано в патенте WO 2016/177802) или описанные ранее агонистические антитела к 4-1ВВ человека клон 20Н4.9 huIgG4 или клон MOR-7480 huIgG2, или контрольные молекулы, в соответствии с подписями, инкубировали с Her2-экспрессирующими клеточными линиями KL-4 при различных концентрациях, что показано на оси X. Впоследствии избыточные и не связавшиеся молекулы вымывали, а связавшиеся молекулы определяли при помощи вторичного связывания с F(ab`)2 фрагментом специфического IgG козы к РЕ-конъюгированному Fc-фрагменту человека. Среднюю интенсивность флуоресценции (MFI) измеряли проточной цитометрией и с ее помощью определяли аффинность (моновалентные связывающиеся молекулы) или авидность (бивалентно связывающиеся молекулы) тестируемых молекул дозозависимым образом. Значения являются базовыми, которые корректируются путем вычитания пустых проб (например, окрашенных только 2-ым детекторным фрагментом), показаны средние величины +/- SEM.
На Фигуре 6 показана схема, иллюстрирующая общие принципы анализа активации NFκB 4-1ВВ-экспрессирующей человеческой репортерной клеточной линией Jurkat. Перекрестное связывание человеческого 4-1ВВ, экспрессируемого на репортерных клетках, индуцирует активацию NFκB и NFκB-опосредованную экспрессию люциферазы. После лизирования клеток, люцифераза может катализировать окисление люциферина в оксилюциферин. Эта химическая реакция положительным образом коррелирует с силой NFκB-опосредованной экспрессии люциферазы, которая может определяться по интенсивности свечения (в единицах испускаемого света).
NFκB-опосредованная активность люциферазы в репортерной клеточной линии Jurkat-hu4-1BB-NFkB-luc2 показана на Фигурах 7A-7F. На 96-луночных планшетах клетки репортерной линии Jurkat-hu4-1BB-NFkB-luc2 инкубировали с различными концентрациями (отложены на оси х) Her2 (PER)-4-1BBL или Her2 (PER)-4-1BBL молекул или белком слияния Her2 (TRAS)-антикалин 4-1ВВ huIgG4 или агонистическими антителами к 4-1ВВ человека клон 20Н4.9 huIgG4 или клон MOR-7480 huIgG2 или контрольными молекулами, в соответствии с подписями. Результаты при отсутствии Her2+ клеток показаны на Фиг. 7А и 7D, в присутствии человеческой Her2+ клеточной линии рака молочной железы SK-Br3 на Фиг. 7В и 7Е или в присутствии человеческой Her2+ клеточной линии карциномы желудка NCI-N87 на Фиг. 7С и 7F. Репортерные клетки инкубировали с Her2-экспрессирующими опухолевыми клетками при соотношении 1:5 в течение 6 ч. Затем клетки отмывали, лизировали и инкубировали с Люциферином в детекторном буфере. Катализируемое люциферазой окисление люциферина определяли путем регистрации испускаемого света, которую измеряли в единицах испускаемого света (ось у). Показаны средние величины +/- SEM. Значения являются базовыми, которые скорректированы путем вычитания исходного светового излучения.
Результаты второго эксперимента по сравнению Her2 (PER)-4-1BBL и Her2 (TRAS)-4-1BBL представлены на Фигурах 8А - 8Н. На 348-луночные планшетах инкубировали репортерные клетки Jurkat-hu4-1BB-NFkB-luc2 с различными концентрациями (отложены на оси х) Her2 (PER)-4-1BBL или Her2 (TRAS)-4-1BBL или белком слияния Her2 (TRAS)-антикалин 4-1ВВ huIgG4 или агонистическими антителами к 4-1ВВ человека клон 20Н4.9 huIgG4 или клон MOR-7480 huIgG2 или контрольными молекулами, в соответствии с подписями. Показана NFκB-опосредованная экспрессия люциферазы репортерной клеточной линией Jurkat-hu4-lBB-NFκB-luc2 в отсутствии (Фиг. 8А и 8Е) или в присутствии Her2+ клеточной линии рака молочной железы SK-Br3 (Фиг. 8В и 8F), в присутствии человеческой клеточной линии рака молочной железы KPL-4 (Фиг. 8С и 8G) или человеческой Her2+ клеточной линии карциномы желудка NCI-N87 (Фиг. 8D и 8Н) при заданном соотношении репортерных клеток и опухолевых клеток 1:5 в течение 6 ч. Затем клетки отмывали, лизировали и инкубировали с Люциферином в детекторном буфере. Катализируемое люциферазой окисление люциферина определяли путем регистрации испускаемого света, которую измеряли в единицах испускаемого света (ось у). Показаны средние величины +/- SEM. Все величины скорректированы по базовым путем вычитания исходного светового излучения.
На Фигуре 9 показана схема, которая иллюстрирует общий принцип анализа активации с человеческими PBMCs, как описано в Примере 3.2.2. Т-клетки активировали с помощью 2нМ агонистического антитела к CD3 и костимулировали различными концентрациями агонистических 4-1ВВ молекул в присутствии Her2-экспрессируюших клеток карциномы желудка NCI-N87. Содержание на лунку было следующим: 2х104 NCI-N87 клеток, облученных дозой 50 Гр, 7.5х104 CFSE -меченых человеческих PBMCs, 2нМ агонистических антител IgG wt к CD3 человека (клон V9), кроме того использовали Her2-таргетные 4-1ВВ агонистические молекулы (в настоящем описании представлены как Her2-4-1BBL). Клетки инкубировали в течение 4-х дней и затем при помощи проточной цитометрии определяли активацию Т-клеток.
Результаты активации CD8+ Т клеток показаны на Фигурах 10A-10F. Покоящиеся PBMCs, выделенные из лейкоцитарной пленки здорового донора, активировали с помощью 2нМ агонистического антитела к CD3 и костимулировали различными концентрациями агонистических 4-1ВВ молекул, как показано на оси х и указано в надписях, в присутствии Her2-экспрессирующих клеток карциномы желудка NCI-N87 в течение 4-х дней. Клетки совмещали с живыми CD8+ Т-клетками и анализировали величину экспрессии CD25+ (Фиг. 10А и 10D), Гранзима Bhigh (Фиг. 10В и 10Е) или пролиферации (низкая CFSE MFI) CD8+ Т-клеток (Фиг. 10С и 10F). Представлены средние величины +/- SD.
Активация CD4+ Т клеток показана на Фигурах 11A-11F. Оставшиеся PBMCs, выделенные из лейкоцитарной пленки здорового донора, активировали с помощью 2нМ агонистических антител к CD3 и костимулировали агонистическими 4-1ВВ молекулами в различных концентрациях, как показано на оси х, и в присутствии Her-2-экспрессирующих клеток карциномы желудка NCI-N87 в течение 4 дней. Затем клетки совмещали с живыми CD4+ Т-клетками и анализировали величину экспрессии CD25+ (Фиг. 11А и 11D), Гранзима Bhigh (Фиг. 11В и 11Е) или пролиферации (низкая CFSE MFI) CD4+ Т-клеток (Фиг. 11С и 11F). Представлены средние величины +/- SD.
На Фигуре 12 представлена схема, которая иллюстрирует общий принцип анализа активации с использованием мышиных спленоцитов, описанный в Примере 3.2.3. Т-клетки активировали 0,5 мкг/мл (~3.6 нМ) агонистических антител армянского хомячка IgG к CD3 мыши (клон 1452С11) и костимулировали агонистическим суррогатным антителом мыши mu4-1BB-Her2 в различных концентрациях в присутствии Her2-экспрессирующих клеток рака молочной железы человека KPL-4. Содержание на лунку было следующим: 2х104 KPL-4 клеток, облученных дозой 50 Гр, 15х104 мышиных спленоцитов, меченных фиолетовым красителем для индикации пролиферации, 0.5 мкг/мл (~3.6 нМ) агонистических антител армянского хомячка IgG (клон 1452С11) к CD3 мыши, кроме того использовали мышиные суррогатные mu4-1ВВ-Her2 в различных концентрациях или нетаргетные контрольные mu4-1BB mulgG1 DAPG. Клетки инкубировали в течение 3 дней и затем определяли активацию Т-клеток с помощью проточной цитометрии.
Результаты активации мышиных CD8+ и CD4+ Т клеток показаны на Фигурах 13A-13D. Оставшиеся мышиные спленоциты, выделенные из селезенок C57BL/6, активировали 0,5 мкг/мл ((~3.6 нМ) агонистических антител армянского хомячка IgG (клон 1452С11) к CD3 мыши и костимулировали различными концентрациями мышиных суррогатных mu4-1ВВ-Her2 антител или нетаргетным контролем, как показано на оси х и указано на подписях, в присутствии Her2-экспрессирущих клеток рака молочной железы человека KPL-4 в течение 3-х дней. Клетки совмещали с живыми CD8+ или CD8+ Т-клетками и анализировали на величину экспрессии CD25+ (Фиг. 13А и 13С) или пролиферации (фиолетовый краситель на пролиферацию MFI) (Фиг. 13В и 13D). Представлены средние величины +/- SD технических трипликатов на один пункт анализа.
На Фигуре 14А показана активация Т-клеток комбинацией анти-Her2/анти-CD3 биспецифических антител (Her2 TDB) с Her2(PER)-4-1BBL, а также активация Т-клеток единичными агентами. Сильная активация Т-клеток индуцировалась отдельно Her2 TDB, а также комбинацией обоих агентов. Таргетная клеточная гибель, индуцированная комбинацией анти-Her2/анти-CD3 биспецифического антитела (Her2 TDB) с Her2 (PER)-4-1BBL, а также отдельными агентами, показана на Фигуре 14В.
Результаты анализа Т-клеточной пролиферации для комбинации анти-Her2/анти-CD3 биспецифического антитела (Her2 TDB) с Her2(PER)-4-1BBL представлены на Фигурах 15А и 15В. Добавление HER2-4-1BBL значительно усиливало анти-HER2/CD3-TDB индуцированную пролиферацию/выживаемость Т-клеток in vitro.
На Фигурах 16A-16D показана кинетика опухолевого роста (линейная шкала), наблюдаемая у иммунокомпетентных мышей, которым были имлантированы человеческие HER2-экспрессирующие Fo5 опухолевые аллографты и которые получали лечение контролем (Фиг. 16А), отдельно Her2 TDB (Фиг. 14В), отдельно мышиным суррогатом 4-1ВВ-Her2 (Фиг. 14С) и комбинацией Her2 TDB и mu 4-1ВВ-Her2 (Фиг. 14D). Представлена кинетика индивидуального опухолевого роста для каждого животного из всех лечебных групп.CR означает отсутствие определяемой опухоли на момент окончания эксперимента, PR означает, что сохраняется, по меньшей мере, 50% от исходного опухолевого объема по сравнению с днем 0. У четырех из семи мышей (57%), получавших лечение комбинацией с mu4-1ВВ-Her2 агонистом, отмечался полноценный ответ на лечение и не определялись опухоли на момент окончания эксперимента (CR=57%).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Все технические и научные термины, которые используются в настоящем описании, имеют общепринятое значение, известное из области техники, к которой относится изобретение.
Для целей интерпретации описания применяются указанные ниже определения и в любом подходящем случае термины, используемые в единственном числе, также подразумевают множественное число и наоборот.
Используемый в настоящем описании термин "антигенсвязывающая молекула" относится в широком смысле к молекуле, которая специфически связывается с антигенной детерминантой. Примерами антигенсвязывающих молекул являются антитела, фрагменты антител и скаффолд-антигенсвязывающие белки.
Термин "антигенсвязывающий домен" относится к части антигенсвязывающей молекулы, которая включает участок, который специфически связывается с частью или всем антигеном и комплементарен ему. В том случае, если антиген является большим, антигенсвязывающая молекула может связываться только с определенным участком антигена, который называется эпитопом. Антигенсвязывающий домен может быть представлен, например, одним или более вариабельным доменом (также называемым вариабельным участком). Предпочтительно, антигенсвязывающий домен включает вариабельный участок (VL) легкой цепи антитела и вариабельный участок тяжелой цепи антитела (VH).
Используемый в настоящем изобретении термин "антигенсвязывающий домен, способный к специфическому связыванию с Her2" или "молекула, способная к специфическому связыванию с Her2" относится к полипептидной молекуле, которая специфически связывается с Her2. Согласно одному аспекту, антигенсвязывающий домен обладает способностью активировать или ингибировать передачу сигнала посредством Her2. Согласно определенному аспекту, антигенсвязывающий домен способен направлять молекулу, к структуре, к которой он прикреплен (например, 4-1BBL тример) к таргетному сайту, например, к специфическому типу опухолевых клеток, несущих Her2. Антигенсвязывающие домены, способные к специфическому связыванию с Her2, включают антитела и их фрагменты, как далее определено в настоящем описании. По отношению к антителу или его фрагменту, термин "молекула, способная к специфическому связыванию с таргетным клеточным антигеном" относится к части молекулы, включающей участок, который специфически связывается с частью или целым антигеном и комплементарен ему. Молекула, способная к специфическому связыванию антигена может быть представлена, например, одним или более вариабельным доменом антитела (также называемым вариабельными участками антитела). В частности, молекула, способная к специфическому связыванию с антигеном, включает вариабельный участок легкой цепи антитела (VL) и вариабельный участок тяжелой цепи антитела (VH).
Термин "антитело" используется в широком смысле и объединяет различные антительные структуры, включая, без ограничений указанными, моноклональные антитела, поликлональные антитела, моноспецифические и мультиспецифические антитела (например, биспецифические антитела), а также фрагменты антител, до тех пор, пока они обладают необходимой антигенсвязывающей активностью.
Термин "моноклональное антитело", используемый в настоящем описании, относится к антителу, полученному из популяции практически гомогенных антител, то есть отдельные антитела из популяции являются идентичными и/или связываются с одним эпитопом, за исключением возможных вариантов антител, например, включающих мутации, существующие в природе или произошедшие в процессе получения моноклонального антитела; такие варианты обычно присутствуют в минимальных количествах. В отличие от композиций поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело из композиции моноклональных антител направлено против одной детерминанты антигена.
Термин "моноспецифическое" антитело, используемый в настоящем описании, относится к антителу, которое имеет один или более сайтов связывания, каждый из которых связывается с тем же эпитопом одного и того же антигена. Термин "биспецифический" означает, что антигенсвязывающая молекула обладает способностью специфически связываться по меньшей мере с двумя различными антигенными детерминантами. Обычно биспецифическая антигенсвязывающая молекула имеет два антигенсвязывающих сайта, каждый из которых специфичен по отношению к другой антигенной детерминанте. Согласно определенным вариантам осуществления изобретения, биспецифическая антигенсвязывающая молекула обладает способностью к одновременному связыванию с двумя антигенными детерминантами, а конкретнее, с двумя антигенными детерминантами, экспрессируемыми двумя разными клетками.
Термин "валентность", используемый в настоящем описании, означает наличие определенного числа сайтов связывания в антигенсвязывающей молекуле. Таким образом, термины "моновалентный", "бивалентный", "тетравалентный" и "гексавалентный" означают наличие одного сайта связывания, двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания, соответственно, в антигенсвязывающей молекуле.
Термин "полноразмерное антитело", "интактное антитело" и "целое антитело", используемые в настоящем описании взаимозаменяемо, относятся к антителу, имеющему структуру, которая практически полностью аналогична структуре нативного антитела. Термин "нативные антитела" относится к существующим в природе молекулам иммуноглобулинов с различной структурой. Например, нативные антитела класса IgG представляют собой гетеротетрамерные гликопротеины весом приблизительно 150,000 дальтон, состоящие из двух легких и двух тяжелых цепей, которые связаны между собой дисульфидной связью. В направлении от N- к С-концу каждая тяжелая цепь имеет вариабельный участок (VH), также называемый вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которым идут три константных домена (CH1, СН2, и СН3), также называемые константными участками тяжелой цепи. Аналогично, в направлении от N- к С-концу каждая легкая цепь содержит вариабельный участок (VL), также называемый вариабельный легкий домен или вариабельный домен легкой цепи, за которым следует константный домен легкой цепи (CL), также называемый константным участком легкой цепи. Тяжелая цепь антитела может принадлежать к одному из пяти типов, обозначаемых α (IgA), δ (IgD), ε (IgE), γ (IgG), или μ (IgM), некоторые из них могут быть дополнительно разделены на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь антитела может принадлежать к одному из двух типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности константного домена.
Термин "антительный фрагмент" относится к молекуле, которая отличается от интактного антитела и включает его часть, которая связывается с антигеном, с которым связывается интактное антитело. Примерами антительных фрагментов являются, без ограничений указанными, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела, триатела, тетратела, кросс-Fab фрагменты; линейные антитела; одноцепочечные антительные молекулы (например, scFv) и однодоменные антитела. Для обзора определенных антительных фрагментов см. Hudson и соавт., Nat Med 9, 129-134 (2003). Для обзора scFv фрагментов, см. например,  in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg и Moore eds., Springer-Verlag, New York, pp.269-315 (1994); а также WO 93/16185; и патенты США Nos. 5,571,894 и 5,587,458. Обсуждение Fab и F(ab')2 фрагментов, включая остатки эпитопа связывания рецептора реутилизации, имеющих увеличенный период полувыведения in vivo, приведено в патенте США 5,869,046. Диатела и антительные фрагменты с двумя антигенсвязывающими сайтами, которые могут быть бивалентными или биспецифическими, описаны, например, в ЕР 404,097; WO 1993/01161; у Hudson и соавт., Nat Med 9, 129-134 (2003); и Hollinger и соавт., Proc Natl Acad Sci USA 90, 6444-6448 (1993). Триатела и тетратела также описаны у Hudson и соавт., Nat Med 9, 129-134 (2003). Однодоменные антитела представляют собой антительные фрагменты, включающие вариабельный домен тяжелой цепи целиком или его часть, или вариабельный домен легкой цепи целиком или его часть. Согласно определенным вариантам осуществления изобретения, однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; see e.g. U.S. Patent No. 6,248,516 B1). Антительные фрагменты могут быть получены при помощи различных методик, включая, без ограничений указанными, протеолитическое расщепление интактного антитела, а также синтез при помощи рекомбинантных клеток-хозяев (например, Е. coli или фага), как описано в настоящем описании.
in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg и Moore eds., Springer-Verlag, New York, pp.269-315 (1994); а также WO 93/16185; и патенты США Nos. 5,571,894 и 5,587,458. Обсуждение Fab и F(ab')2 фрагментов, включая остатки эпитопа связывания рецептора реутилизации, имеющих увеличенный период полувыведения in vivo, приведено в патенте США 5,869,046. Диатела и антительные фрагменты с двумя антигенсвязывающими сайтами, которые могут быть бивалентными или биспецифическими, описаны, например, в ЕР 404,097; WO 1993/01161; у Hudson и соавт., Nat Med 9, 129-134 (2003); и Hollinger и соавт., Proc Natl Acad Sci USA 90, 6444-6448 (1993). Триатела и тетратела также описаны у Hudson и соавт., Nat Med 9, 129-134 (2003). Однодоменные антитела представляют собой антительные фрагменты, включающие вариабельный домен тяжелой цепи целиком или его часть, или вариабельный домен легкой цепи целиком или его часть. Согласно определенным вариантам осуществления изобретения, однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; see e.g. U.S. Patent No. 6,248,516 B1). Антительные фрагменты могут быть получены при помощи различных методик, включая, без ограничений указанными, протеолитическое расщепление интактного антитела, а также синтез при помощи рекомбинантных клеток-хозяев (например, Е. coli или фага), как описано в настоящем описании.
Расщепление интактных антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab" фрагментами, каждый из которых содержит вариабельные домены тяжелой и легкой цепи, а также константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Таким образом, используемый в настоящем описании термин "Fab фрагмент" относится к антительному фрагменту, включающему фрагмент легкой цепи с VL доменом и константным доменом легкой цепи (CL), а также VH домен и первый константный домен (СН1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов тем, что на карбокси конце имеют несколько добавленных остатков СН1 константного домена тяжелой цепи, включая один или более остаток цистеина из шарнирной области антитела. Fab'-SH это Fab' фрагменты, в которых остатки цистеина константных доменов имеют свободную тиоловую группу. Обработка трипсином приводит к образованию F(ab')2 фрагмента, который содержит два антигенсвязывающих сайта (два Fab фрагмента) и часть Fc области.
Термин "кросс-Fab фрагмент" или " xFab фрагмент" или "кроссоверный Fab фрагмент" относится к Fab фрагменту, в котором вариабельные участки или константные участки тяжелой и легкой цепей поменяны местами. Возможно, два разных сочетания цепей в кроссоверной Fab молекуле, они представлены в биспецифических антителах по изобретению: в одном случае поменяны местами вариабельные участки Fab тяжелой и легкой цепи, то есть кроссоверная Fab молекула содержит пептидную цепь, состоящую из вариабельного участка легкой цепи (VL) и константного участка тяжелой цепи (СН1), а также пептидную цепь, состоящую из вариабельного участка тяжелой цепи (VH) и константного участка легкой цепи (CL). Такая кроссоверная Fab молекула также обозначается как CrossFab(VLVH). Во втором случае, когда местами поменяны константные участки Fab тяжелой и легкой цепей, кроссоверная Fab молекула содержит пептидную цепь, состоящую из вариабельного участка тяжелой цепи (VH) и константного участка легкой цепи (CL), а также пептидную цепь, состоящую из вариабельного участка легкой цепи (VL) и константного участка тяжелой цепи (СН1). Такая кроссоверная Fab молекула также обозначается как CrossFab(CLCH1).
Термин "одноцепочечный Fab фрагмент" или "scFab" представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи (VH), константного домена 1 антитела (СН1), вариабельного домена легкой цепи антитела (VL), константного домена легкой цепи антитела (CL), и линкера, при этом указанные антительные домены и указанный линкер расположены в следующей последовательности, начиная от N-конца к С-концу: a) VH-CH1-линкер-VL-CL, b) VL-CL-линкер-VH-СН1, с) VH-CL-линкер-VL-СН1 или d) VL-СН1-линкер-VH-CL; и при этом указанный линкер представляет собой полипептид, включающий по меньшей мере 30 аминокислот, предпочтительно, от 32 до 50 аминокислот. Указанные одноцепочечные Fab фрагменты стабилизированы посредством существующей в природе дисульфидной связи между CL доменом и СН1 доменом. Кроме того, указанные одноцепочечные Fab молекулы могут быть дополнительно стабилизированы за счет создания межцепочечных дисульфидных связей путем вставки дополнительных остатков цистеина (например, в положение 44 вариабельного участка тяжелой цепи или в положение 100 вариабельного участка легкой цепи согласно нумерации по Кабату).
Термин "кроссоверный одноцепочечный Fab фрагмент" или "x-scFab" представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи (VH), константного домена 1 антитела (СН1), вариабельного домена легкой цепи антитела (VL), константного домена легкой цепи антитела (CL) и линкера, при этом указанные антительные домены и указанный линкер расположены в следующей последовательности, начиная от N-конца к С-концу: a) VH-CL-линкер-VL-CH1 и b) VL-CH1-линкер-VH-CL; при этом VH и VL вместе образуют антигенсвязывающий сайт, который специфически связывается с антигеном, при этом указанный линкер представляет собой полипептид, включающий по меньшей мере 30 аминокислот. Кроме того, указанные x-scFab молекулы могут быть дополнительно стабилизированы за счет создания межцепочечных дисульфидных связей путем вставки дополнительных остатков цистеина (например, в положение 44 вариабельного участка тяжелой цепи или в положение 100 вариабельного участка легкой цепи согласно нумерации по Кабату).
Термин "одноцепочечный вариабельный фрагмент (scFv)" представляет собой белок слияния вариабельных участков тяжелой (VH) и легкой цепей (VL) антитела, которые соединены между собой коротким пептидным линкером приблизительно из 10-25 аминокислот. Линкер обычно обогащен остатками глицина для большей гибкости, а также серином или треонином для растворимости и может соединять N-конец VH с С-концом VL, или vice versa. Такой белок сохраняет специфичность оригинального антитела, несмотря на удаление константных участков, и встраивания линкера. scFv антитела описаны, например, у Houston, J.S., Methods in Enzymol. 203 (1991) 46-96). Кроме того, антительные фрагменты включают одноцепочечные полипептиды, имеющие свойства VH домена, главным образом, способность объединяться с VL доменом, или свойства VL домена, главным образом, способность объединяться с VH доменом с формированием функционального антигенсвязывающего сайта, сохраняя таким образом антигенсвязывающие свойства полноразмерного антитела.
"Скаффолд-антигенсвязывающие белки" известны из области техники, например, фибронектин или сконструированный белок с анкириновыми повторами (DARPins) использовались как альтернативные скаффолды для антигенсвязывающих доменов, см., например, Gebauer и Skerra, Engineered protein scaffolds as next-generation antibody therapeutics. Curr Opin Chem Biol 13:245-255 (2009) и Stumpp и соавт., Darpins: A new generation of protein therapeutics. Drug Discovery Today 13: 695-701 (2008). Согласно одному аспекту настоящего изобретения, скаффолд антигенсвязывающий белок выбран из группы, включающей CTLA-4 (Evibody), Липокалины (Антикалин), молекулы, выделенные из белка-А, такие, как, Z -домен белка-А (Affibody), А-домен (Avimer/Maxibody), сывороточный трансферрин (транс-тело); сконструированный белок анкириновых повторов (DARPin), вариабельный домен легкой цепи или тяжелой цепи антитела (одноцепочечное антитело. sdAb), вариабельный домен тяжелой цепи антитела (нанотело, aVH), VNAR фрагменты, фибронектин (AdNectin), и домен лектина С-типа (Тетранектин); вариабельный домен нового антигенного рецептора бета-лактамазы (VNAR фрагменты), человеческий гамма-кристаллин или убиквитин (молекулы Аффилина), домен Кунитца ингибиторов протеаз человека, микротела, такие, как белки из семейства кноттинов, пептидные аптамеры и фибронектин (аднектин). CTLA-4 (антиген 4, ассоциированный с цитотоксическими Т лимфоцитами) представляет собой рецептор семейства CD28-рецепторов, экспрессируемый главным образом CD4+ Т-клетками. Его внеклеточный домен имеет складку наподобие вариабельного домена Ig. Петли, соответствующие CDRs антител, могут быть замещены гетерологичной последовательностью для обеспечения различных связывающих свойств. CTLA-4 молекулы, сгенерированные таким образом, чтобы иметь различную специфичность связывания, также известны как Evibodies (например, US7166697B1). Evibodies имеют приблизительно такой же размер, как и изолированный вариабельный участок антитела (например, домен антитела). Для более подробной информации см. Journal of Immunological Methods 248 (1-2), 31-45 (2001). Липокалины представляют собой семейство внеклеточных белков, которые транспортируют небольшие гидрофобные молекулы, такие, как стероиды, билины, ретиноиды и липиды. Они имеют ригидную бета-складчатую вторичную структуру с набором петель на открытом конце конической структуры, которая может быть синтезирована при помощи генной инженерии для связывания различных таргетных антигенов. Антикалины содержат от 160 до 180 аминокислот и выделены из липокалинов. Для более подробной информации см. Biochim Biophys Acta 1482: 337-350 (2000), US 7250297 B1 и US 20070224633. Аффитело (Affibody) это скаффолд, выделенный из Белка A Staphylococcus aureus, который также может быть сгенерирован для связывания антигена. Домен состоит из трехспирального узла, включающего приблизительно 58 аминокислот. Библиотеки были сгенерированы путем рандомизации поверхностных остатков. Для более подробной информации см. Protein Eng. Des. Sel. 2004, 17, 455-462 и ЕР 1641818 А1. Авимеры представляют собой мультидоменные белки, выделенные из А-домена семейства скаффолд-белков. Нативные домены приблизительно из 35 аминокислот принимают определенную структуру, скрепленную дисульфидными связями. Разнообразие достигается путем шаффлинга естественных вариаций, свойственных семейству А-доменов. Для более подробной информации см. Nature Biotechnology 23(12), 1556 - 1561 (2005) и Expert Opinion on Investigational Drugs 16(6), 909-917 (июнь 2007). Трансферрин представляет собой мономерный сывороточный транспортный гликопротеин. Трансферрин может быть сгенерирован для связывания различных таргетных антигенов путем вставки пептидных последовательностей в наружную доступную для встраивания петлю. Примеры сконструированных трансферриновых скаффолдов включают Транс-тела. Для дополнительной информации см. J. Biol. Chem 274, 24066-24073 (1999). Сгенерированные белки анкириновых повторов (DARPins) получены из Анкирина, который относится к семейству белков, которые опосредуют прикрепление интегральных белков мембраны к цитоскелету. Один анкириновый повтор содержит 33 остатка и включает две альфа-спирали и бета-изгиб. Они могут быть сконструированы для связывания различных таргетных антигенов путем рандомизации остатков в первой альфа-спирали или бета-изгибе каждого из повторов. Их связывающий интерфейс может быть увеличен путем увеличения количества модулей (способ созревания аффинности). Для дополнительной информации см. J. Mol. Biol. 332, 489-503 (2003), PNAS 100(4), 1700-1705 (2003) и J. Mol. Biol. 369, 1015-1028 (2007) и US 20040132028 A1. Однодоменное антитело представляет собой антительный фрагмент, состоящий из единичного мономерного вариабельного домена антитела. Первые единичные домены были выделены из вариабельного домена тяжелой цепи антител животных семейства верблюдовых (нанотела или VHH фрагменты). Кроме того, термин одноцепочечное антитело включает автономный человеческий вариабельный домен тяжелой цепи (VH) или VNAR фрагменты, выделенные из организма акул. Фибронектин представляет собой скаффолд, который может быть сконструирован для связывания с антигеном. Аднектины состоят из остова натуральной аминокислотной последовательности 10-го домена 15-ти повторяющихся единиц человеческого фибронектина III типа (FN3). Три петли на одном конце бета-сэндвичевой структуры могут быть сконструированы таким образом, чтобы обеспечивать специфическое распознавание Анднектином, представляющей интерес терапевтической мишени. Для более подробной информации см. Protein Eng. Des. Sel. 18, 435-444 (2005), US20080139791, WO 2005056764 и US 6818418 B1. Пептидные аптамеры представляют собой комбинаторные распознаваемые молекулы, которые состоят из постоянного скафффолд белка, обычно тиоредоксина (TrxA), который включает сконструированную вариабельную пептидную петлю, встроенную в активный сайт. Для более подробной информации см. Expert Opin. Biol. Ther. 5, 783-797 (2005). Микротела получают из существующих в природе микропротеинов, имеющих 25-50 аминокислот в длину и содержащих 3-4 цистеиновых мостика, примерами микропротеинов являются KalataBI и конотоксин, а также кноттины. Микропротеины имеют петлю, которая может быть сконструирована для включения до 25 аминокислот без нарушения общей укладки микропротеина. Для более подробной информации о сконструированных кноттиновых доменах см. WO 2008098796.
Липокалины представляют собой семейство внеклеточных белков, которые транспортируют небольшие гидрофобные молекулы, такие, как стероиды, билины, ретиноиды и липиды. Они имеют ригидную бета-складчатую вторичную структуру с набором петель на открытом конце конической структуры, которая может быть синтезирована при помощи генной инженерии для связывания различных таргетных антигенов. Антикалины содержат от 160 до 180 аминокислот и выделены из липокалинов. Для более подробной информации см. Biochim Biophys Acta 1482: 337-350 (2000), US 7250297 B1 и US 20070224633.
Термин "антигенсвязывающая молекула, которая связывается с тем же эпитопом" по отношению к контрольной молекуле означает антигенсвязывающую молекулу, которая блокирует связывание контрольной молекулы с ее антигеном в конкурентном анализе на 50% и более, и наоборот, контрольная молекула блокирует связывание антигенсвязывающей молекулы с ее антигеном в конкурентном анализе на 50% и более.
Используемый в настоящем описании термин "антигенная детерминанта" является синонимом термина "антиген" и "эпитоп" и относится к сайту (например, к непрерывному участку аминокислотной последовательности или к конформационной структуре, образованной различными участками прерывающихся аминокислот) пептидной макромолекулы, с которым связывается антигенсвязывающая молекула с образованием комплекса "антигенсвязывающая молекула-антиген". Подходящие антигенные детерминанты могут быть обнаружены, например, на поверхности опухолевых клеток, на поверхности клеток, инфицированных вирусами, на поверхности других больных клеток, на поверхности иммунных клеток, в свободной форме в сыворотке крови и/или во внеклеточном матриксе (ЕСМ). Белки, которые могут быть полезны в качестве антигенов в контексте настоящего изобретения, могут представлять собой любую нативную форму белка из любого организма позвоночного животного, включая млекопитающих, таких, как приматы (например, люди) и грызуны (например, мыши и крысы), если дополнительно не оговаривается иное. Согласно определенному варианту осуществления изобретения, антигеном является человеческий белок. В том случае если в настоящем описании делается ссылка на специфический белок, термин также будет объединять "полноразмерный", не подвергшийся процессингу белок, а также любые формы белков, которые образуются после процессинга в клетке. Термин также относится к существующим в природе вариантам белка, например, сплайсинг-вариантам или аллельным вариантам.
Термин "способный к специфическому связыванию с Her-2", относится к антигенсвязывающей молекуле, способной связываться с Her-2 аффинностью, достаточной для того, чтобы антигенсвязывающая молекула была полезна в качестве диагностического и/или терапевтического агента в тех случаях, когда мишенью является Her-2. Антигенсвязывающая молекула включает, без ограничений указанным, антитела, Fab-молекулы, кроссоверные Fab-молекулы, одноцепочечные Fab-молекулы, Fv-молекулы, scFv-молекулы, однодоменные антитела и VH и скаффолд-антигенсвязывающий белок. Согласно одному аспекту, величина связывания анти- Her-2-антигенсвязывающей молекулы с неродственным, не Her-2-белком, составляет менее чем приблизительно 10% от величины связывания антигенсвязывающей молекулы с Her-2, как измерено, например, поверхностным плазмонным резонансом (SPR). В частности, антигенсвязывающая молекула, которая способна специфически связываться с -Her-2, имеет константу диссоциации (Kd) ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ, ≤ 0,1 нМ, ≤ 0,01 нМ или ≤ 0,001 нм (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых случаях анти-Her-2-антигенсвязывающая молекула связывается с Her-2 организмов различных видов. В частности, анти-Her-2-антигенсвязывающая молекула связывается с Her-2 человека и циномолгуса.
Термин "эпитоп" относится к участку антигена, как белковой природы, так и небелковой природы, с которым связывается анти-[[PRO]]-антитело. Эпитопы могут быть представлены непрерывными аминокислотными отрезками антигена (линейный эпитоп) или быть сформированы из прерывающихся аминокислотных отрезков антигена (конформационный эпитоп), например, таких, которые оказываются в непосредственной близости в результате укладки антигена, т.е. за счет образования четвертичной структуры белкового антигена. Линейные эпитопы обычно связываются антителом после того, как белковый антиген подвергся действию денатурирующего агента, в то время как конформационные эпитопы обычно разрушаются при обработке денатурирующими агентами. Эпитоп содержит по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или 8-10 аминокислот в уникальной пространственной конформации.
"Эпитоп 4D5" или "4D5-эпитоп" или "4D5" представляет собой участок внеклеточного домена HER2, с которым связываются антитело 4D5 (АТСС CRL 10463) и Трастузумаб. Этот эпитоп расположен близко к трансмембранному домену HER2 и находится в пределах домена IV HER2. Для скрининга антител, которые связываются с 4D5-эпитопом, может быть осуществлен обычный перекрестно-связывающий анализ, такой, как описан в руководстве «Антитела», A Laboratory Manual, Cold Spring Harbor Laboratory, под ред. Harlow David Lane (1988). Альтернативно, эпитопное картирование может быть осуществлено для оценки того, связывается ли антитело с 4D5-эпитопом HER2 (например, с одним или более остатками в участке HER2 человека (SEQ ID NO: 54), расположенном, приблизительно, от остатка 550 до, приблизительно, остатка 610 включительно.
"Эпитоп 2С4" или "2С4-эпитоп" представляет собой участок внеклеточного домена HER2, с которым связывается антитело 2С4. Для скрининга антител, которые связываются с 2С4-эпитопом, может быть осуществлен обычный перекрестно-связывающий анализ, такой, как описан в руководстве «Антитела», A Laboratory Manual, Cold Spring Harbor Laboratory, под ред. Harlow David Lane (1988). Альтернативно, эпитопное картирование может быть осуществлено для оценки того, связывается ли антитело с 2С4-эпитопом HER2. 2С4-эпитоп включает остатки из домена II во внеклеточном домене HER2. Антитело 2С4 и Пертузумаб связываются с внеклеточным доменом HER2 на стыке доменов I, II III (Franklin et al. Cancer Cell 5:317-328 (2004).
Путем "специфического связывания" означает, что связывание является селективным для антигена и может быть отделено от нежелательных неспецифических взаимодействий. Способность антиген-связывающей молекулы связываться со специфическим антигеном может быть измерена посредством фермент-связанного иммуносорбентного анализа (ELISA) или с помощью других методик, известных специалисту в данной области, например, поверхностным плазмонным резонансом (SPR) (осуществляемым на оборудовании BIAcore) (Liljeblad et al., Glyco J 17, 323-329 (2000)) и традиционными связывающими анализами (Heeley, Endocr Res 28, 217-229 (2002)). Согласно одному аспекту осуществления изобретения, величина связывания антигенсвязывающей молекулы с неродственным белком составляет менее чем около 10% от величины связывания антигенсвязывающей молекулы с антигеном, как измерено, например, SPR. В некоторых случаях антиген-связывающая молекула, которая связывает антиген, имеет константу диссоциации (Kd) ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ, ≤ 0,1 нМ, ≤ 0,01 нМ или ≤ 0,001 нм (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
"Аффинность" или "связывающая аффинность" относится к силе суммарных нековалентных взаимодействий между отдельным связывающим сайтом молекулы (например, антитела) и его связывающим партнером (например, антигеном). Если не указано иное, то, как здесь используется, «связывающая аффинность» относится к истинной связывающей аффинности, которая соответствует взаимодействию при соотношении 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X по отношению к своему связывающему партнеру Y может, в целом, быть представлена константной диссоциации (Kd), которая является отношением констант скоростей диссоциации и ассоциации (koff и kon, соответственно). Таким образом, эквивалентные аффинности могут соответствовать различным скоростным константам, если только отношение скоростных констант остается одним и тем же. Аффинность может быть измерена традиционными методами, известными из уровня техники, включая те, которые здесь описаны. Одним из методов измерения аффинности является поверхностный плазмонный резонанс (SPR).
"Таргетный клеточный антиген", как здесь используется, относится к антигенной детерминанте, присутствующей на клетке-мишени, например, на Т-или В-клетке, опухолевой клетке, такой, как раковая клетка, или клетка опухолевой стромы. В некоторых случаях, таргетный клеточный антиген является антигеном на поверхности раковой клетки. Согласно одному аспекту, таргетный клеточный антиген представляет собой Her2.
Термин "Her2", также известный, как "ErbB2", "ErbB2-рецептор" или "с-Erb-B2", относится к любому нативному, зрелому HER2, который образуется в результате процессинга предшественника HER2 в клетке. Термин охватывает HER2, происходящий из организма любого позвоночного животного, включая млекопитающих, таких, как приматы (например, человек и обезьяны циномолгус) и грызуны (например, мыши и крысы), если не указано иное. Термин также включает природно существующие варианты HER2, например, сплайсинговые варианты или аллельные варианты. Аминокислотная последовательность взятого в качестве примера белка HER2 человека приведена как SEQ ID NO: 54.
"Т-клеточный антиген", как здесь используется, относится к антигенной детерминанте на поверхности Т-лимфоцита, в частности, цитотоксического Т-лимфоцита.
"Активирующий Т-клетку терапевтический агент", как здесь используется, относится к терапевтическому агенту, способному индуцировать Т-клеточную активацию в организме субъекта, в частности, терапевтическому агенту, сконструированному для Т-клеточной активации в организме субъекта. Примерами активирующих Т-клетку терапевтических агентов являются биспецифические антитела, которые специфически связывают активирующий Т-клетку антиген, такой, как CD3, и таргетный клеточный антиген, такой, как СЕА или рецептор фолата.
"Активирующий Т-клетку антиген", как здесь используется, относится к антигенной детерминанте, экспрессируемой Т-лимфоцитом, в частности, цитотоксическим Т-лимфоцитом, которая способна индуцировать или усиливать Т-клеточную активацию при взаимодействии с антигенсвязывающей молекулой. Более точно, взаимодействие антигенсвязывающей молекулы с активирующим Т-клетку антигеном может индуцировать активацию Т-клетки путем запуска сигнального каскада Т-клеточного рецепторного комплекса. Примером активирующего Т-клетку антигена может служить CD3.
Термин "CD3" относится к любой нативной структуре CD3 из организма любого позвоночного животного, включая млекопитающих, таких, как приматы (например, человек), не приматы (например, обезьяны циномолгус) и грызуны (например, мыши и крысы), если дополнительно не оговаривается иное. Термин охватывает полноразмерную молекулу CD3, а также любую форму CD3, которая образуется в результате процессинга в клетке. Термин также относится к природно существующим вариантам CD3, например, сплайсинговым вариантам или аллельным вариантам. В одном варианте осуществления изобретения CD3 представляет собой CD3 человека, преимущественно, эпсилон субъединицу CD3 человека (CD3ε). Аминокислотная последовательность CD3ε человека представлена в банке UniProt (www.uniprot.org) под номером Р07766 (версия 144), или в NCBI (www.ncbi.nlm.nih.gov/) RefSeq NP 000724.1. См. также SEQ ID NO: 85. Аминокислотная последовательность CD3s яванской макаки [Масаса fascicularis] представлена в NCBI GenBank no. ВАВ71849.1 см. также SEQ ID NO: 86.
Термин "вариабельный домен" или "вариабельный участок" относится к домену легкой или тяжелой цепи антитела, который участвует в связывании антигенсвязывающий молекулы с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют одинаковую структуру, при этом каждый домен содержит четыре консервативных каркасных участка (FRs) и три гипервариабельных участка (HVRs). См, например, Kindt и соавт., Kuby Immunology, 6th ed., W.H. Freeman и Co., стр. 91 (2007). Одного VH или VL домена может быть достаточно для обеспечения антигенсвязывающей специфичности.
Термин "гипервариабельный участок" или "HVR", используемый в настоящем описании, относится к каждому из участков антигенсвязывающего вариабельного домена, которые являются гипервариабельными по своей последовательности и которые определяют антигенсвязывающую специфичность, например, к "участкам, определяющим комплементарность" ("CDRs"). В целом, антигенсвязывающие домены включают шесть CDRs: три в VH (CDR-H1, CDR-H2, CDR-H3) и три в VL (CDR-L1, CDR-L2, CDR-L3). Примерами CDRs являются:
(a) гипервариабельные петли, существующие в области аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2), и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196:901-917 (1987));
(b) CDRs, существующие в области аминокислотных остатков 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2), и 95-102 (Н3) (Kabat Е.А. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)); и
(с) антигенные контакты, существующие в области аминокислотных остатков 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2), и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)).
Если дополнительно не оговаривается иное, CDRs определяются согласно нумерации Kabat и соавт., см. выше. Специалисту в данной области будет понятно, что обозначения CDR могут определяться согласно Chothia, см. выше, McCallum, см. выше или согласно любой принятой научной номенклатуре. Kabat и соавт. также предложили систему нумерации для последовательностей вариабельных участков, которая применима для любого антитела. Любой специалист в данной области может однозначно применить эту систему "нумерации по Кабату" к любой последовательности вариабельного участка, не опираясь на экспериментальные данные помимо собственно последовательности. Используемый в настоящем описании термин "нумерация по Кабату" относится к системе нумерации, предложенной Kabat и соавт.U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Если дополнительно не оговаривается иное, все ссылки на номера положений специфических аминокислотных остатков в вариабельном участке антитела указываются в соответствии с системой нумерации Кабата.
Используемый в настоящем описании термин "с созревшей аффинностью" в отношении антигенсвязывающих молекул (например, антител) относится к антигенсвязывающей молекуле, которая получена из референсной антигенсвязывающей молекулы, например, путем мутации, и связывается с тем же антигеном, предпочтительно, связывается с тем же эпитопом, что и референсное антитело; при этом она обладает более высокой аффинностью по отношению к антигену, чем исходная референсная антиген-связывающая молекула. Созревание аффинности обычно включает модификацию одного или более аминокислотного остатка в одной или более CDRs антигенсвязывающей молекулы. Обычно антигенсвязывающая молекула с созревшей аффинностью связывается с тем же эпитопом, что и исходная референсная антигенсвязывающая молекула.
"Каркасный участок" или "FR" относится к остаткам вариабельного домена, которые не принадлежат к остаткам гипервариабельного участка (HVR).
FR вариабельного домена обычно состоят из четырех FR доменов: FR1, FR2, FR3 и FR4. Соответственно, HVR и FR последовательности обычно располагаются в следующем порядке в VH (или VL):FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термин "акцепторный каркасный участок человека" для целей настоящего изобретения означает каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), происходящую из каркасного участка иммуноглобулина человека или консенсусного каркасного участка иммуноглобулина человека, как определено ниже. Акцепторный каркасный участок человека, «происходящий из» каркасного участка иммуноглобулина человека или консенсусного каркасного участка иммуноглобулина человека, может содержать одинаковую с ними последовательность, или может содержать последовательность с изменениями. В некоторых случаях число изменений аминокислотных остатков составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. Согласно определенным вариантам, VL акцепторный каркасный участок человека идентичен последовательности VL каркасного участка иммуноглобулина человека или консенсусного каркасного участка иммуноглобулина человека.
Термин "химерное" антитело относится к антителу, в котором участок тяжелой и/или легкой цепи происходит из определенного источника или из организма определенного вида, в то время как остальная часть тяжелой и/или легкой цепи происходит из другого источника или из организма другого вида.
"Класс" антитела относится к типу константного домена или константного участка тяжелой цепи данного антитела. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них могут быть далее подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
Термины "константный участок, имеющий человеческое происхождение" или "константный участок человека" относятся к константному участку тяжелой цепи антитела человека подклассов IgG1, IgG2, IgG3, IgG4 и/или константному участку легкой цепи каппа или лямбда. Такие константные участки хорошо известны из уровня техники и описаны, например, Kabat E.A. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991) (см. также, например, Johnson, G., and Wu, T.T. Nucleic Acids Res. 28 (2000) 214-218; Kabat E.A. et al., Proc. Natl. Acad. Sci. USA 72 (1975) 2785-2788). Если специально не указано иное, нумерация аминокислотных остатков константного участка приведена в соответствии с системой нумерации EU, также называемой EU индексом Кабата, как описано Kabat E.A. et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), публикация NIH 91-3242.
"Гуманизированное антитело" относится к химерному антителу, содержащему аминокислотные остатки из HVRs нечеловеческого происхождения и аминокислотные остатки из FRs человека. В некоторых случаях гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно два вариабельных домена, в которых все и практически все из HVRs (например, CDRs) соответствуют таковым антитела нечеловеческого происхождения и все или практически все из FRs соответствуют таковым антитела человека. Гуманизированное антитело необязательно может содержать по меньшей мере часть константного участка, происходящего из антитела человека. "Гуманизированная форма" антитела, например антитела нечеловеческого происхождения, относится к антителу, которое подверглось гуманизации. Другие формы "гуманизированных антител", которые охватываются настоящим изобретением, являются такими, в которых константный участок был дополнительно модифицирован или изменен по сравнению с исходным антителом, для придания антителу нужных свойств в соответствии с изобретением, особенно в отношении связывания C1q и/или Fc-рецептора (FcR).
"Человеческое" антитело - это такое антитело, которое имеет аминокислотную последовательность, соответствующую таковой антитела, продуцируемого человеком или человеческой клеткой, или выделенного из нечеловеческого источника, использующего репертуар человеческих антител; или другую последовательность, кодирующую человеческое антитело. Это определение человеческого антитела не включает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Термин "Fc домен" или "Fc участок", используемые в настоящем описании, относятся к С-концевому участку тяжелой цепи антитела, который содержит по меньшей мере часть константного участка. Термин относится к нативным последовательностям Fc участков и к вариантам Fc участков. Согласно одному варианту осуществления изобретения, Fc участок тяжелой цепи IgG человека располагается от Cys226 или от Pro230, до карбокси-конца тяжелой цепи. Однако антитела, продуцируемые клеткой-хозяином, могут подвергаться посттрансляционному отщеплению одного или более, в частности, одного или двух аминокислотных остатков от С-конца тяжелой цепи. Таким образом, антитело, продуцируемое клеткой-хозяином после экспрессии специфической молекулы нуклеиновой кислоты, кодирующей полноразмерную тяжелую цепь, может представлять собой как полноразмерную тяжелую цепь, так и расщепленный вариант полноразмерной тяжелой цепи. Может быть вариант, когда две конечные аминокислоты на С-конце тяжелой цепи представлены глицином (G446) и лизином (K447, нумерация согласно EU индексу Кабата). Следовательно, С-концевой лизин (Lys447), или С-концевой глицин (Gly446) и лизин (Lys447) в Fc участке могут, как присутствовать, так и отсутствовать. Аминокислотные последовательности тяжелых цепей, включая Fc участок, приведены в настоящем описании без С-концевого глицин-лизинового дипептида, если дополнительно не оговаривается иное. Согласно одному варианту осуществления изобретения, тяжелая цепь, включая Fc участок, как определено в настоящем описании, находящаяся в составе антитела по изобретению, содержит дополнительный С-концевой глицин-лизиновый дипептид (G446 и K447, нумерация согласно EU индексу Кабата). Согласно одному варианту осуществления изобретения, тяжелая цепь, включая Fc участок, как определено в настоящем описании, находящаяся в составе антитела по изобретению, содержит дополнительный С-концевой остаток глицина (G446, нумерация согласно EU индексу Кабата). Если дополнительно не оговаривается иное, нумерация аминокислотных остатков в Fc участке осуществляется согласно EU системе нумерации, также называемой EU индекс, как описано у Kabat и соавт., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Fc участок IgG содержит CH2 IgG и CH3 IgG домен. "CH2 домен" Fc участка IgG человека обычно располагается от аминокислотного остатка приблизительно в положении 231 до аминокислотного остатка в положении приблизительно 340. Согласно одному варианту осуществления изобретения, углеводородная цепь прикреплена к СН2 домену. СН2 домен, согласно настоящему описанию, может иметь нативную последовательность СН2 домена или представлять собой вариант СН2 домена. "СНЗ домен" представляет собой участок на С-конце Fc участка по отношению к СН2 домену (то есть участок, располагающийся от аминокислотного остатка приблизительно в положении 341 до аминокислотного остатка приблизительно в положении 447 IgG). СН3 участок, согласно настоящему описанию, может иметь нативную последовательность СНЗ или представлять собой вариант СН3 домена (например, СН3 домен со встроенным "выпячиванием" ("выступом") на одной цепи и соответствующей ему "полостью" ("впадиной") на другой цепи; см. патент США No. 5,821,333, включенный в настоящее описание в качестве ссылки). Такой вариант СН3 доменов может применяться для усиления гетеродимеризации двух неидентичных тяжелых цепей антитела, как описывается в настоящем описании.
Технология "выступ-во-впадину" описана, например, в патентах США 5,731,168; 7,695,936; и у Ridgway и соавт., Prot Eng 9, 617-621 (1996) и Carter, J Immunol Meth 248, 7-15 (2001). Способ включает встраивание выпячивания ("выступа") на границу контакта первого полипептида и соответствующей ему полости ("впадины") на границе контакта второго полипептида, таким образом, чтобы "выступ" располагался во впадине так, что стимулировал формирование гетеродимера и препятствовал формированию гомодимера. Выпячивания конструируют путем замещения небольших боковых аминокислотных цепей на границе контакта первого полипептида большими боковыми аминокислотными цепями (например, тирозином или триптофаном). Компенсаторные впадины, размер которых идентичен или аналогичен размеру "выступов", создают на границе контакта второго полипептида путем замещения больших аминокислотных боковых цепей меньшими аминокислотными боковыми цепями (например, аланином или треонином). Выступ и впадина могут быть сгенерированы путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, при помощи сайт-специфического мутагенеза, или пептидного синтеза. Согласно специфическому варианту осуществления изобретения, модификация "выступ" включает аминокислотную замену T366W в одной или двух субъединицах Fc домена, а модификация впадина содержит аминокислотные замены T366S, L368A и Y407V в другой одной или двух субъединицах Fc домена. Согласно другому специфическому варианту осуществления изобретения, субъединица Fc домена, содержащая модификацию "выступ" дополнительно включает аминокислотную замену S354C, а субъединица Fc домена, содержащая модификацию впадина дополнительно включает аминокислотную замену Y349C. Встраивание двух указанных остатков цистеина приводит к образованию дисфульфидного мостика между двумя субъединицами Fc участка, что дополнительно стабилизирует димер (Carter, J Immunol Methods 248, 7-15 (2001)). Нумерация осуществляется согласно EU индексу Кабата, см. Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Термин "участок, эквивалентный Fc участку иммуноглобулина" относится как к природным аллельным вариантам Fc участка иммуноглобулина, так и к вариантам, имеющим модификации, такие, как замены, вставки или делеции, не снижающие при этом способность иммуноглобулина реализовывать эффекторные функции (такие как антителозависимая клеточная цитотоксичность). Например, одна или более аминокислота может быть удалена с N-конца или С-конца Fc участка без значительной потери биологической функции. Такие варианты могут быть выбраны согласно общим правилам, известным из области техники, таким образом, чтобы влияние на активность было минимальным (см., например., Bowie, J. U. et al., Science 247:1306-10 (1990)).
Термин "эффекторные функции" означает те биологические активности, которые присущи Fc участку антитела и которые отличаются в зависимости от изотипа антитела. Примерами эффекторных функций антител являются: Clq связывание и комплемент зависимая цитотоксичность (CDC), связывание Fc рецептора, антителозависимая клеточная цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP), секреция цитокинов, захват антигена антигенпрезентирующими клетками, опосредуемый иммунными комплексами, понижающая регуляция поверхностных клеточных рецепторов (например, В-клеточных рецепторов) и активация В клеток.
"Активирующий Fc рецептор" - это такой рецептор, который после соединения с Fc рецептором вызывает сигнальные события, которые стимулируют несущую рецептор клетку реализовывать эффекторные функции. К активирующим Fc рецепторам относятся FcγRIIIa (CD 16а), FcγRI (CD64), FcγRIIa (CD32), и FcαRI (CD89). Конкретным примером активирующего Fc рецептора является человеческий FcγRIIIa (см. базу UniProt код доступа Р08637, версия 141).
Термин "член семейства TNF лигандов" или "лиганд из семейства TNF" относится к провоспалительным цитокинам. Цитокины в целом, а в частности члены семейства лигандов TNF, играют ключевую роль в стимуляции и координации иммунной системы. В настоящее время идентифицировано девятнадцать цитокинов как членов суперсемейства лигандов TNF (фактор некроза опухолей) на основании сходства последовательностей, функциональности и структуры. Все указанные лиганды относятся к II типу трансмембранных белков с С-концевым внеклеточным доменом (эктодоменом), N-концевым внутриклеточным доменом и одним сигнальным трансмембранным доменом. С-концевой внеклеточный домен, также известный как домен гомологии TNF (THD), обладает 20-30% аминокислотной идентичностью у всех членов суперсемейства и не отвечает за связывание с рецептором. TNF эктодомен также отвечает за формирование лигандами TNF тримерных комплексов, которые распознаются их специфическими рецепторами. Члены семейства TNF рецепторов выбраны из группы, включающей Лимфотоксин (также известный как LTA или TNFSF1), TNF (также известный как TNFSF2), LTb (также известный как TNFSF3), OX40L (также известный как TNFSF4), CD40L (также известный как CD154 или TNFSF5), FasL (также известный как CD95L, CD178 или TNFSF6), CD27L (также известный как CD70 или TNFSF7), CD30L (также известный как CD153 или TNFSF8), 4-1BBL (также известный как TNFSF9), TRAIL (также известный как AP02L, CD253 или TNFSF10), RANKL (также известный как CD254 или TNFSF11), TWEAK (также известный как TNFSF12), APRIL (также известный как CD256 или TNFSF13), BAFF (также известный как CD257 или TNFSF13B), LIGHT (также известный как CD258 или TNFSF14), TL1A (также известный как VEGI или TNFSF15), GITRL (также известный как TNFSF18), EDA-A1 (также известный как эктодисплазин А1) и EDA-A2 (также известный как эктодисплазин А2). Термин также относится к любому нативному лиганду TNF семейства из любого организма позвоночного животного, включая млекопитающих, таких, как приматы (например, человек), нечеловекообразные приматы (например, яванские макаки) и грызуны (например, мыши и крысы), если дополнительно не оговаривается иное. Термин "костимулирующий член семейства TNF лигандов" или "костимулирующий лиганд TNF семейства" относится к подгруппе членов семейства TNF лигандов, которые обладают способностью костимулировать пролиферацию и продукцию цитокинов Т-клетками. Указанные лиганды TNF семейства могут костимулировать TCR сигналы за счет взаимодействия с их соответствующими TNF рецепторами, при этом взаимодействие с этими рецепторами приводит к рекрутингу TNFR-ассоциированных факторов (TRAF), которые, в свою очередь, инициируют сигнальные каскады, которые приводят к активации Т-клеток. Костимулирующие лиганды TNF семейства выбраны из группы, включающей 4-1BBL, 4-1BBL, OX40L, GITRL, CD70, CD30L и LIGHT, в частности, костимулирующий член семейства лигандов TNF - 4-1BBL.
Как описано в настоящем описании ранее, 4-1BBL представляет собой трансмембранный белок II типа и является членом семейства лигандов TNF. Полный или полноразмерный 4-1BBL, имеющий аминокислотную последовательность SEQ ID NO: 69, как было описано, образует тримеры на поверхности клеток. Образование тримеров обеспечивается специфическими элементами эктодомена 4-1BBL. Указанные элементы обозначаются в настоящем описании как "участки тримеризации". Аминокислоты 50-254 последовательности человеческого 4-1BBL (SEQ ID NO: 70) образуют внеклеточный домен 4-1BBL, но даже его фрагменты могут образовывать тримеры.
Согласно специфическим вариантам, термин "эктодомен 4-1BBL или его фрагмент" относится к полипептиду, имеющему аминокислотную последовательность, выбранную из SEQ ID NO:4 (аминокислоты 52-254 человеческого 4-1BBL), SEQ ID NO: 1 (аминокислоты 71-254 человеческого 4-1BBL), SEQ ID NO: 3 (аминокислоты 80-254 человеческого 4-1BBL) и SEQ ID NO: 2 (аминокислоты 85-254 человеческого 4-1BBL) или полипептиду, имеющему аминокислотную последовательность, выбранную из SEQ ID NO: 5 (аминокислоты 71-248 человеческого 4-1BBL), SEQ ID NO: 8 (аминокислоты 52-248 человеческого 4-1BBL), SEQ ID NO: 7 (аминокислоты 80-248 человеческого 4-1BBL) и SEQ ID NO: 6 (аминокислоты 85-248 человеческого 4-1BBL), а также к другим фрагментам эктодомена, способным к тримеризации и включенным в настоящее описание.
"Эктодомен" представляет собой домен мембранного белка, который простирается во внеклеточное пространство (то есть в пространство снаружи от клетки-мишени). Эктодомены обычно являются частью белков, которые инициируют контакт с поверхностями клеток, что приводит к передаче сигнала. Эктодомен члена семейства TNF лигандов, как определено в настоящем описании, таким образом представляет собой часть белка -лиганда TNF, которая простирается во внеклеточное пространство (внеклеточный домен), но также имеет и короткие участки или фрагменты, которые отвечают за тримеризацию и за связывание с соответствующим TNF рецептором. Термин "эктодомен члена семейства TNF лигандов или его фрагмент" таким образом обозначает внеклеточный домен члена семейства TNF лигандов, который образует внеклеточный домен или его части, которые все еще сохраняют способность связываться с рецептором (домен, связывающийся с рецептором).
Термин "пептидный линкер" относится к пептиду, состоящему из одной или более аминокислоты, обычно, приблизительно, из 2-20 аминокислот. Пептидные линкеры хорошо известны из области техники или описаны в настоящем описании. Подходящими неиммуногенными пептидными линкерами являются, например, (G4S)n, (SG4)n или G4(SG4)n пептидные линкеры, в которых "n" обычно представляет собой число от 1 до 10, обычно от 1 до 4, конкретнее, 2, а также пептидные линкеры, выбранные из группы, включающей GGGGS (SEQ ID NO: 71), GGGGSGGGGS (SEQ ID NO: 68), SGGGGSGGGG (SEQ ID NO: 72), (G4S)3 или GGGGSGGGGSGGGGS (SEQ ID NO: 73), GGGGSGGGGSGGGG или G4(SG4)2 (SEQ ID NO: 74), и (G4S)4 или GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 75), а также последовательности GSPGSSSSGS (SEQ ID NO: 76), GSGSGSGS (SEQ ID NO: 77), GSGSGNGS (SEQ ID NO: 78), GGSGSGSG (SEQ ID NO: 79), GGSGSG (SEQ ID NO: 80), GGSG (SEQ ID NO: 81), GGSGNGSG (SEQ ID NO: 82), GGNGSGSG (SEQ ID NO: 83) и GGNGSG (SEQ ID NO: 84). Пептидными линкерами, представляющими особый интерес, являются (G4S)1 или GGGGS (SEQ ID NO: 71), (G4S)2 или GGGGSGGGGS (SEQ ID NO: 68) и (G4S)3 (SEQ ID NO: 73).
Термин "аминокислота" используется в настоящем описании для обозначения группы существующих в природе карбокси α-аминокислот, включая аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновая кислота (asp, D), цистеин (cys, С), глутамин (gin, Q), глутаминовая кислота (glu, E), глицин (gly, G), гистидин (his, H), изолейцин (ile, I), лейцин (leu, L), лизин (lys, К), метионин (met, M), фенилаланин (phe, F), пролин (pro, P), серии (ser, S), треонин (thr, T), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Термин "слитый полипептид" или "слитый белок", используемый в настоящем описании, относится к одноцепочечному полипептиду, включающему антительный фрагмент, а также пептид, который не получен из антитела. Согласно одному аспекту, слитый полипептид состоит из одного или двух эктодоменов 4-1BBL или его фрагментов, слитых с частью антигенсвязывающего домена или частью Fc. Слияние может осуществляться путем прямого связывания N или С-концевой аминокислоты антигенсвязывающей молекулы с С- или N-концевой аминокислотой эктодомена указанного 4-1BBL или его фрагмента посредством пептидного линкера
Под термином "слитый" или "соединенный" имеется в виду, что компоненты (например, полипептид и эктодомен указанного члена семейства TNF лигандов) соединены между собой пептидными связями, либо напрямую, либо посредством одного или более пептидного линкера.
Термин "процент (%) идентичности аминокислотной последовательности" используемый по отношению к референсной полипептидной (белковой) последовательности означает процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности, подсчитанный после выравнивания последовательностей и встраивания гэпов, при необходимости, для достижения максимальной процентной идентичности последовательностей, без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивания для определения процента идентичности аминокислотной последовательности может осуществляться различными способами, хорошо известными специалистам в данной области, например, с использованием широкодоступных компьютерных программ, таких, как программы BLAST, BLAST-2, ALIGN. SAWI или Megalign (DNASTAR). Специалист в данной области может определить подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего изобретения, однако, величины % идентичности аминокислотной последовательности определяют при помощи компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана Genentech, Inc., а программный код вместе с пользовательской документацией был подан в Бюро регистрации авторских прав США, Washington D.C., 20559, где был зарегистрирован под регистрационным номером TXU510087. Программа ALIGN-2 находится в открытом доступе, предоставляемом Genentech, Inc., South San Francisco, California, или может быть скомпилирована из программного кода. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, включая цифровую систему UNIX V4.0D. Все параметры сравнения последовательностей задаются программой ALIGN-2 и не меняются. В ситуациях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, % идентичности аминокислотной последовательности заданной аминокислотной последовательности А, относительно другой заданной аминокислотной последовательности В (которая альтернативно может быть обозначена как заданная аминокислотная последовательность А, которая может иметь или включать определенный % идентичности аминокислотной последовательности относительно другой заданной аминокислотной последовательности В) рассчитывается следующим образом:
100-кратное увеличение фракции X/Y
где X представляет собой число аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 при выравнивании последовательностей А и В, и где Y - общее количество аминокислотных остатков в последовательности В. Следует понимать, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А и В не будет равен % идентичности аминокислотной последовательности В и А. Если дополнительно не оговаривается иное, все используемые здесь значения % идентичности аминокислотной последовательности подсчитаны, как описано в предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
Согласно определенным вариантам осуществления изобретения, варианты аминокислотной последовательности антигенсвязывающих молекул, содержащих тример лиганда TNF, также предусмотрены. Например, может быть желательно улучшить аффинность связывания и/или другие биологические свойства антигенсвязывающих молекул, содержащих тример лиганда TNF. Варианты аминокислотных последовательностей антигенсвязывающих молекул, содержащих тример лиганда TNF, могут быть получены путем встраивания подходящих модификаций в нуклеотидную последовательность, кодирующую молекулы, либо при помощи пептидного синтеза. К таким модификациям относятся, например, делеции, и/или вставки и/или замены аминокислотных остатков в аминокислотной последовательности антитела. Любые сочетания делеций, вставок и замен могут осуществляться для получения конечного конструкта таким образом, чтобы конечный конструкт обладал желаемыми свойствами, например, антигенсвязывающими. К сайтам, представляющим интерес в отношении замещающего мутагенеза, относятся HVRs и каркасный участок (FRs). Консервативные замены представлены в Таблице В под заголовком "Предпочтительные замены" и дополнительно описываются ниже со ссылкой на классы боковых цепей аминокислот (1)-(6). Аминокислотные замены могут быть встроены в молекулу, представляющую интерес, а продукты подвергнуты скринингу на предмет желаемой активности, например, сохранения / улучшения связывания антигена, снижения иммуногенности или улучшения ADCC или CDC.
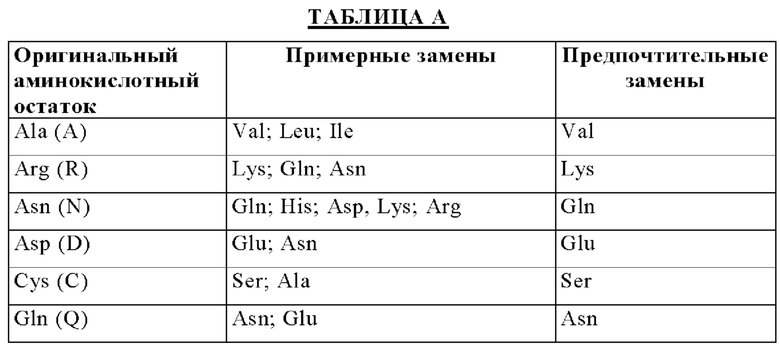
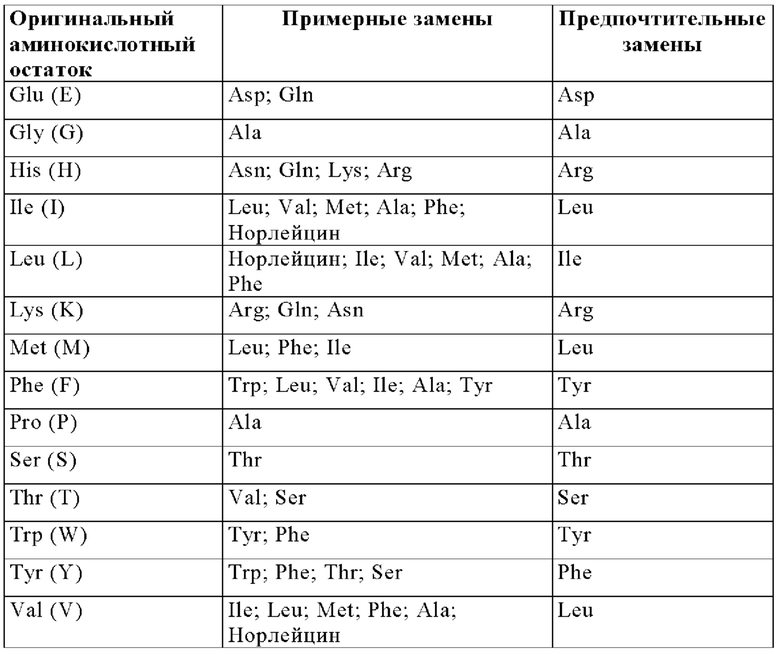
Аминокислоты можно разделить на группы в зависимости от общих свойств боковой цепи:
(1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, He;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gin;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены подразумевают замену члена одного класса членом другого класса.
Термин "варианты аминокислотной последовательности" включает основные варианты с заменами, в которых имеются аминокислотные замены одного или нескольких остатков в гипервариабельном участке исходной антигенсвязывающей молекулы (например, гуманизированного или человеческого антитела). В целом, конечный вариант(ы), отобранные для дополнительного изучения, будут иметь изменения (например, улучшения) определенных биологических свойств (например, повышенную аффинность, сниженную иммуногенность) по сравнению с исходной антигенсвязывающей молекулой и/или их биологические свойства будут сохраняться практически неизменными по сравнению с исходной антигенсвязывающей молекулой. Примером такого варианта с заменой является антитело со зрелой аффинностью, которое может быть легко получено, например при помощи методик созревания аффинности с использованием фагового дисплея, описанных, например, в настоящем описании. Вкратце, один или более CDR остаток подвергается мутации, а вариантные антигенсвязывающие молекулы отображаются на фаге и подвергаются скринингу на конкретную биологическую активность (например, аффинность связывания). Согласно некоторым вариантам, замены, вставки или делеции могут происходить в одной или более CDR, если такие изменения существенно не снижают способность антигенсвязывающей молекулы связывать антиген. Например, консервативные изменения (например, консервативные замены, как описано в настоящем описании) существенно не снижающие аффинность связывания могут производиться в CDR. Полезный метод идентификации остатков или областей антитела, которые могут быть мишенями для мутагенеза, называется "аланин-сканирующий мутагенез", как описано у Cunningham and Wells (1989) Science, 244:1081-1085. Согласно данному методу, остаток или группа таргетных остатков (например, заряженные остатки, такие, как Arg, Asp, His, Lys, и Glu) идентифицируются и замещаются нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином) для того, чтобы установить, насколько меняется взаимодействие антитела с антигеном. Дополнительные замены могут быть встроены в аминокислотные положения, которые продемонстрировали функциональную чувствительность к первоначальным заменам. Альтернативно, или дополнительно, изучается кристаллическая структура комплекса антиген-антигенсвязывающая молекула для идентификации контактных точек между антителом и антигеном. Такие контактные остатки и соседствующие остатки, являющиеся потенциальными вариантами для замены, могут быть отмечены или исключен, в к4ачестве кандидатов для замен. Варианты могут быть скринированы для того, чтобы понять обладают ли они желаемыми свойствами. Вставки в аминокислотные последовательности могут включать амино- и/или карбокси-концевые слияния, которые могут варьировать по длине от одного остатка до полипептида, содержащего сто и более остатков, а также вставки в середину последовательности как одного, так и множества аминокислотных остатков. Примерами концевых вставок являются содержащие 4-1BBL-тример антигенсвязывающие молекулы с N-концевым остатком метионина. Другие инсерционные варианты молекулы включают слияние N- или С-концов с полипептидом, который будет увеличивать период полужизни в сыворотке-содержащей 4-1BBL-тример антигенсвязывающей молекулы.
Согласно определенным вариантам, содержащие 4-1BBL-тример антигенсвязывающие молекулы, заявленные в настоящем изобретении, модифицируют для того, чтобы повысить или понизить степень гликозилирования антитела. Гликозилированые варианты молекул могут быть без труда получены путем изменения аминокислотной последовательности, таким образом, что в нее либо встраиваются, либо удаляются из нее участки гликозилирования. В том случае, если содержащая 4-1BBL-тример антигенсвязывающая молекула содержит Fc участок, модификации может подвергаться углеводород, прикрепленный к нему. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный, биантенарный олигосахарид, который обычно посредством N-связи прикреплен к Asn297 СН2 домена Fc участка. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может включать различные углеводороды, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, прикрепленную к GlcNAc в "стебле" биантенарной олигосахаридной структуры. Согласно некоторым вариантам, модификации олигосахарида в содержащей 4-1BBL антигенсвязывающей молекуле,, могут осуществляться для того, чтобы создать варианты с определенными улучшенными свойствами. Согласно одному аспекту, предлагаются варианты содержащих 4-1BBL-тример антигенсвязывающих молекул, которые имеют углеродную структуру без фукозы, прикрепленной (напрямую или опосредованно) к Fc участку. Такие варианты фукозилирования могут демонстрировать улучшенную ADCC функцию, см., например, патентные публикации США Nos. US 2003/0157108 (Presta, L.) или US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Дополнительные варианты содержащих 4-1ВВЕ-тример антигенсвязывающих молекул по изобретению включают варианты с раздвоенными олигосахаридами, например, в которых биантенарные олигосахариды, прикрепленные к Fc участку, разделены GlcNAc. Такие варианты могут иметь пониженное фукозилирование и/или улучшенную ADCC функцию, см, например, WO 2003/011878 (Jean-Mairet et al.); патент США No. 6,602,684 (Umana et al.); и патент США 2005/0123546 (Umana et al.). Варианты, содержащие по меньшей мере один остаток галактозы в олигосахариде, прикрепленном к Fc участку, также предлагаются в настоящем изобретении. Такие варианты антител могут иметь улучшенную CDC функцию, и описаны, например, в документах WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
Согласно определенным вариантам осуществления изобретения может быть желательным создать варианты 4-1BBL тример-содержащих антигенсвязывающих молекул на основе инжиниринга цистеинов, например, "thoMABs", в которых один или более аминокислотный остаток заменен на остатки цистеина. В конкретных вариантах осуществления изобретения заменяемые остатки находятся в доступных участках молекулы. Для замены этих остатков на остатки цистеина в доступные сайты антитела вводят реакционноспособные тиоловые группы, которые могут быть использованы для конъюгации антитела с другими веществами, такими, как молекулы лекарственных средств или молекулы линкеров, связанных с молекулами лекарственных средств, с целью создания иммуноконъюгатов. В некоторых случаях один или более следующий остаток может быть заменен на цистеин: V205 (нумерация по Кабату) в легкой цепи; А118 (EU нумерация) тяжелой цепи; и S400 (EU нумерация) Fc-участка тяжелой цепи. Антигенсвязывающие молекулы на основе инжиниринга цистеина могут быть созданы, как раскрыто, например, в патенте США 7, 521, 541.
Согласно некоторым аспектам изобретения, 4-1BBL-тример содержащие антигенсвязывающие молекулы могут быть дополнительно модифицированы для включения в их состав дополнительных соединений небелковой природы, которые известны из области техники и легко доступны. Соединения, подходящие для дериватизации антител, включают без ограничений указанным, водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксалан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (как гомополимеры, так и рандомизированные сополимеры), декстран или поли(п-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерол), поливиниловый спирт или их смеси. Пропиональдегид полиэтиленгликоля может иметь преимущества для использования благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу, и быть как разветвленным, так и неразветвленным. К антителу может быть прикреплено различное число полимеров и, если более, чем один полимер прикреплен к антителу, это могут быть одинаковые или разные молекулы. В целом, число и/или тип полимеров, используемых для дериватизации антитела, могут определяться, без ограничений указанным, а именно свойствами или функциями антитела, которые подлежат улучшению, возможностью использования антитела в терапии при определенных условиях, и т.д. Согласно другому аспекту осуществления изобретения предлагаются конъюгаты антитела и компонентов небелковой природы, которые могут быть селективно нагреты в результате воздействия радиоактивного облучения. Согласно одному из вариантов осуществления изобретения, частным случаем компонента небелковой природы служит углеродная нанотрубка (Kam et al., Proc. Natl. Acad. Sci. USA 102:11600-11605 (2005)). Радиоактивное облучение может иметь волны различной длины и включает, без ограничений указанными, волны, которые не повреждают обычные клетки, но нагревают небелковый компонент до температуры, при которой погибают клетки в проксимальной ориентации по отношению к антителу в конъюгате антитело-небелковый компонент.
Согласно другому аспекту, в настоящем изобретении предлагаются иммуноконъюгаты содержащей 4-1BBL-тример антигенсвязывающей молекулы. "Иммуноконъюгаты" представляют собой антитело, конъюгированное с одной или более гетерологичной молекулой, включая, без ограничений указанными, цитотоксический агент.
Термин "молекула нуклеиновой кислоты" или "полинуклеотид" относится к любому веществу и/или соединению, которое представляет собой полимер нуклеотидов. Каждый нуклеотид состоит из основания, в частности, пуринового- или пиримидинового основания (то есть цитозина (С), гуанина (G), аденина (А), тимина (Т) или урацила (U)), молекулы сахара (то есть деоксирибозы или рибозы) и фосфатной группы. Часто молекула нуклеиновой кислоты описывается как последовательность оснований, при этом указанные основания формируют первичную (линейную структуру) молекулы нуклеиновой кислоты. Последовательность оснований обычно представлена в направлении от 5' к 3'. В настоящем описании термин нуклеиновая кислота объединяет дезоксирибонуклеиновую кислоту (ДНК), включая, например, комплементарную ДНК (кДНК) и геномную ДНК, рибонуклеиновую кислоту (РНК), в частности, информационную/матричную РНК (мРНК), синтетические формы ДНК и РНК, а также смешанные полимеры, включающие две или более указанные молекулы. Молекулы нуклеиновых кислот могут быть линейными или кольцевыми. Кроме того, термин молекула нуклеиновой кислоты включает как смысловую, так и антисмысловую нити, а также одноцепочечные и двуцепочечные формы. Кроме того, описанные в настоящем описании молекулы нуклеиновой кислоты могут содержать как существующие в природе, так и искусственные нуклеотиды. Примеры не существующих в природе нуклеотидов являются модифицированные нуклеотидные основания с дериватизированными сахарами или фосфатными связями остова или химически модифицированными остатками. Нуклеиновые кислоты также объединяют молекулы ДНК и РНК, которые являются подходящими для использования в качестве вектора для прямой экспрессии антитела по изобретению in vitro и/или in vivo, например, в организме хозяина или пациента. Такие молекулы ДНК (например, кДНК) или РНК (например, мРНК) векторы могут быть как модифицированными, так и немодифицированными. Например, мРНК может быть химически модифицирована для увеличения стабильности РНК вектора и/или экспрессии закодированной молекулы таким образом, что мРНК могут вводиться в организм субъекта для получения антител in vivo (см, например, Stadler et al, Nature Medicine 2017, опубликованной в интернете 12 июня 2017, doi: 10.1038/nm.4356 или ЕР 2 101 823 В1).
Под "выделенной" молекулой нуклеиновой кислоты или полинуклеотидом подразумевается молекула нуклеиновой кислоты, ДНК или РНК, которая была выделена из естественной среды. Например, рекомбинантный полинуклеотид кодирующий полипептид, содержащийся в векторе, считается выделенными для целей настоящего изобретения. Другие примеры выделенного полинуклеотида включают рекомбинантные полинуклеотиды, которые содержатся в гетерологичных клетках-хозяевах или очищенные (частично или полностью) полинуклеотиды в растворе. Выделенный полинуклеотид включает также полинуклеотидную молекулу, содержащуюся в клетке, которая обычно и так содержит полинуклеотидную молекулу, но при этом указанная полинуклеотидная молекула находится экстрахромосомно или в хромосоме, но в месте, которое отличается от традиционного хромосомного расположения. Выделенные молекулы РНК включают РНК транскрипты in vivo или in vitro по настоящему изобретению, а также позитивные и негативные цепи и двухнитевые формы. Выделенные полинуклеотиды или нуклеиновые кислоты согласно настоящему изобретению, также включают молекулы, получаемые синтетически. Кроме того, полинуклеотид или нуклеиновая кислота могут сами представлять собой регуляторный элемент или включать его, такой, как промотор, сайт связывания рибосомы или терминатор транскрипции.
Под нуклеиновой кислотой или полинуклеотидом, имеющим нуклеотидную последовательность по меньшей мере например, на 95% "идентичную" референсной нуклеотидной последовательности по настоящему изобретению, подразумевается нуклеотидная последовательность полинуклеотида идентичная референсной последовательности, за тем исключением, что полинуклеотидная последовательность может включать до пяти точечных мутаций на каждые 100 нуклеотидов референсной нуклеотидной последовательности. Другими словами, для получения нуклеотида, имеющего нуклеотидную последовательность по меньшей мере на 95% идентичную референсной нуклеотидной последовательности, или вплоть до 5% нуклеотидов в референсной последовательности могут быть удалены или замещены другим нуклеотидом, или вплоть до 5% нуклеотидов от общего количества в референсной последовательности могут быть встроены в референсную последовательность. Все эти изменения в референсной последовательности могут происходить в 5' или 3' концевых положениях референсной нуклеотидной последовательности или в любом месте между указанными концевыми положениями, или индивидуально рассеиваться среди других остатков референсной последовательности, или группироваться в одну или несколько непрерывных групп в референсной последовательности. На практике, является ли любая определенная полинуклеотидная последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичной нуклеотидной последовательности по настоящему изобретению, может быть легко установлена при помощи известных компьютерных программ, например, той, которая упоминалась выше для полипептидов (например, ALIGN-2).
Термин "кассета экспрессии" относится к полинуклеотиду, сгенерированному рекомбинантно или синтетически, с серией специфических элементов нуклеиновых кислот, которые обеспечивают транскрипцию определенной нуклеиновой кислоты в клетке-мишени. Рекомбинантная кассета экспрессии может быть встроена в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Обычно часть рекомбинантной кассеты экспрессии вектора экспрессии включает, среди других последовательностей, последовательность транскрибируемой нуклеиновой кислоты и промотор. Согласно определенным вариантам осуществления изобретения, кассета экспрессии включает полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы согласно изобретению или их фрагменты.
Термин "вектор" или "вектор экспрессии" является синонимом термина "экспрессионный конструкт" и относится к молекуле ДНК, которая применяется для встраивания и направления экспрессии специфического гена, с которым она функционально связана в клетке-мишени. Термин включает вектор как самореплицирующуюся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был встроен. Вектор экспрессии в соответствии с настоящим изобретением содержит кассету экспрессии. Векторы экспрессии обеспечивают транскрипцию больших количеств стабильной мРНК. Как только вектор экспрессии оказывается внутри клетки-мишени, молекула или белок рибонуклеиновой кислоты, который кодируется геном, начинает продуцироваться клеточными механизмами транскрипции и/или трансляции. Согласно одному варианту осуществления изобретения, вектор экспрессии содержит кассету экспрессии, которая включает полинуклеотидные последовательности, кодирующие антитела или биспецифические антигенсвязывающие молекулы согласно изобретению или их фрагменты.
Термины "клетка-хозяин", "линия клеток-хозяев," и "культура клеток-хозяев" используются взаимозаменяемо и относятся к клеткам, в которые встраиваются экзогенные молекулы нуклеиновых кислот, а также к потомству таких клеток. К клеткам-хозяевам относятся "трансформанты" и "трансформированные клетки", к которым относятся первично трансформированные клетки и их потомство, вне зависимости от количества пассажей. Потомство может быть не полностью идентично родительской клетке по своей нуклеотидной последовательности, поскольку могут содержать мутации. Мутантное потомство, которое обладает той же функциональностью или биологической активностью, которая наблюдается у оригинально трансформированных клеток, также включено в настоящее изобретение. Клетка-хозяин представляет собой любой тип клеточной системы, который может использоваться для получения антител или биспецифических антигенсвязывающих молекул по настоящему изобретению. К клеткам-хозяевам относятся культивируемые клетки, например, культивируемые клетки млекопитающих, такие, как СНО клетки, ВНК клетки, NS0 клетки, SP2/0 клетки, YO миеломные клетки, Р3Х63 мышиные миеломные клетки, PER клетки, PER.C6 клетки или гибридомные клетки, дрожжевые клетки, клетки насекомых и растений, были перечислены лишь некоторые, а также клетки трансгенных животных, трансгенных растений или культивируемых тканей растений или животных.
Термин "эффективное количество" агента относится к количеству, которое является необходимым для того, чтобы вызвать физиологические изменения в клетке или ткани, в которые он вводится.
Термин "терапевтически эффективное количество" агента, например, фармацевтической композиции, относится к количеству, которое при введении в определенных дозах и с определенными временными промежутками, позволяет достичь желаемого терапевтического или профилактического результата. Терапевтически эффективное количество агента, например, устраняет, снижает, замедляет, минимизирует или предотвращает негативные проявления заболеваний.
"Индивидуум" или "субъект" представляет собой млекопитающее. К млекопитающим относятся, без ограничений указанными, одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, люди и нечеловекообразные приматы, такие, как обезьяны), кролики и грызуны (например, мыши и крысы). В частности, индивидуумом или субъектом является человек.
Термин "фармацевтическая композиция" относится к лекарственной форме, которая обеспечивает биологическую активность и эффективность активных ингредиентов в составе и не содержит дополнительных компонентов, которые являются недопустимо токсичными для субъекта, которому вводится такая композиция.
"Фармацевтически приемлемый носитель" относится к ингредиенту в составе фармацевтической композиции, отличному от активного ингредиента, который не является токсичным для субъекта. Фармацевтически доступные носители включают, без ограничений указанными, буферные агенты, эксципиенты, стабилизаторы или консерванты.
Термин "листок-вкладыш" используется для обозначения инструкции для пациента, которую вкладывают в промышленные упаковки лекарственных средств, содержащие информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях относительно использования таких продуктов.
Термин "лечение", используемый в настоящем описании (и его грамматические вариации, такие, как "лечить") относится к клиническому вмешательству для изменения естественного течения заболевания у индивидуума, подлежащего лечению, которое может осуществляться также для профилактики заболевания или во время его клинического течения. К желаемым эффектам лечения относятся, без ограничений указанными, предотвращение возникновения или рецидива заболевания, смягчение симптомов, уменьшение прямых или непрямых патологических последствий заболевания, профилактика метастазирования, снижение скорости прогрессирования заболевания, смягчение или временное облегчение течения заболевания, а также ремиссия или улучшение прогноза. Согласно некоторым вариантам осуществления изобретения, молекулы согласно изобретению, используются для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин "рак" используемый в настоящем изобретении относится к пролиферативным заболеваниям, таким, как лимфомы, карцинома, лимфома, бластома, саркома, лейкоз, лимфоцитарный лейкоз, рак легких, немелкоклеточный рак легкого (NSCL), бронхиолоальвиолярно-клеточный рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак ЖКТ, колоректальный рак (CRC), рак поджелудочной железы, рак молочной железы, трижды негативный рак молочной железы, рак матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, рак вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркома мягких тканей, рак уретры, рак полового члена, рак простаты, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, рак почечной лоханки, мезотелиома, гепатоцеллюлярный рак, рак желчевыводящих путей, новообразования центральной нервной системы (ЦНС), опухоли позвоночного столба, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шваномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза и саркома Юинга, меланома, множественная миелома, В-клеточный рак (лимфома), хронический лимфоцитарный лейкоз (CLL), острый лимфобластный лейкоз (ALL), волосатоклеточный лейкоз, хронический миелобластный лейкоз, включая рефрактерные версии любого из вышеперечисленных видов рака или комбинацию одного или нескольких из вышеуказанных видов рака.
Термин "Her2-позитивный" рак относится к раковым клеткам, которые имеют уровень экспрессии Her2 выше нормального. Примерами Her2-позитивного рака является Her2-позитивный рак молочной железы и Her2-позитивный рак желудка. Обычно, Her2-позитивный рак имеет балл по иммуногистохимической шкале (IHC) 2+ или 3+ и/или соотношение гибридизации in situ (ISH) к амплификации >2,0.
Термин "ранняя стадия рака молочной железы (ЕВС)" или "ранний рак молочной железы" используемый в настоящем описании, относится к раку молочной железы, который не распространился за пределы самой железы или подмышечных лимфатических узлов. Он включает карциному протоков in situ и рак молочной железы I стадии, стадии IIA, стадии IIB и стадии IIIA.
Обозначение опухоли или рака как имеющего "Стадию 0", "Стадию I", "Стадию II", "Стадию III" или "Стадию IV" или различные подстадии в рамках этой классификации осуществляется согласно общепринятым и известным из области техники принципам группирования по стадиям рака с использованием римских цифр. И хотя действительная стадия рака зависит от типа рака, в целом, Стадия 0 рака обозначает повреждение in situ, Стадия I обозначает небольшую локализованную опухоль, Стадия II и III означает местнораспространенную опухоль, которая распространяется на регионарные лимфатические узлы, и Стадия IV означает метастатический рак. Специфические стадии для каждого типа опухоли хорошо известны опытному клиницисту.
Термин "метастатический рак молочной железы" относится к такому типу рака молочной железы, при котором раковые клетки распространились из первичного очага в одно или более отдаленное место организма по кровеносным и лимфатическим сосудам с формированием одной или более вторичной опухоли в одном или более органе помимо молочной железы.
Термин "распространенный" рак означает такой тип рака, при котором опухоль распространилась из первичного места или органа, либо путем местной инвазии, либо путем метастазирования. Соответственно, термин "распространенный" рак включает как местнораспространенный рак, так и метастатический рак.
Термин "рецидивирующий" рак относится к раку, который возобновил свой рост, либо в первичном очаге, либо в отдаленном месте после ответа на первичную терапию, такую, как оперативное лечение. Термин "локально рецидивирующий" рак представляет собой рак, который возвращается после лечения в месте первоначальной локализации. Термин "операбельный" или "резецируемый" рак относится к раку, который находится в пределах первичной локализации (органа) и может быть удален хирургически (резецирован). Термин "нерецезируемый" или "неоперабельный" означает рак, который не может быть удален (резецирован) хирургически.
Содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению
Настоящее изобретение относится к новым содержащим 4-1BBL тример антигенсвязывающим молекулам, обладающим свойствами, обеспечивающими преимущество, такими, как возможность производства, стабильность, аффинность связывания, биологическая активность, таргетная эффективность, пониженная токсичность и иммуногенность.
Согласно первому аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, включающей
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или их фрагменты, которые соединены между собой пептидным линкером, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагменты, и
(c) Fc домен, состоящий из первой и второй субъединиц, способных к стабильной ассоциации.
Согласно дополнительному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, как определено в настоящем описании выше, включающая:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что
(i) первый полипептид содержит СН1 или CL домен и второй полипептид содержит CL или СН1 домен, соответственно, при этом второй полипептид соединен с первым полипептидом посредством дисульфидной связи между СН1 и CL доменами, и при этом первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с СН1 или CL доменом пептидным линкером и при этом второй полипептид содержит один эктодомен указанного 4-1BBL или его фрагмент, соединенный с CL или СН1 доменом указанного полипептида посредством пептидного линкера, или
(ii) первый полипептид содержит СНЗ домен и второй полипептид содержит СН3 домен, соответственно, при этом первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с С-концом СН3 домена посредством пептидного линкера, и при этом второй полипептид содержит только один эктодомен указанного 4-1BBL или его фрагмент, соединенный с С-концом СН3 домена указанного полипептида посредством пептидного линкера, или
(iii) первый полипептид содержит VH-CL или VL-CH1 домен и второй полипептид содержит VL-CH1 домен или VH-CL домен соответственно, при этом второй полипептид присоединен к первому полипептиду посредством дисульфидной связи между СН1 и CL доменами, и при этом первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с VH или VL пептидным линкером, и при этом второй полипептид содержит один эктодомен указанного члена семейства TNF лигандов или его фрагмент, который присоединен к VL или VH указанного полипептида посредством пептидного линкера, и
(с) Fc домен, состоящий из первой и второй субъединиц, способных к стабильной ассоциации.
Согласно другому аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, как определено в настоящем описании выше, включающая:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2, и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что
(i) первый полипептид содержит СН1 или CL домен и второй полипептид содержит CL или СН1 домен, соответственно, при этом второй полипептид соединен с первым полипептидом посредством дисульфидной связи между СН 1 и CL доменами, и при этом первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с СН1 или CL доменом пептидным линкером и при этом второй полипептид содержит только один эктодомен указанного 4-1BBL или его фрагмент, соединенный с CL или СН1 доменом указанного полипептида посредством пептидного линкера, или
(ii) первый полипептид содержит СН3 домен и второй полипептид содержит СН3 домен, соответственно, и при этом первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с С-концом СН3 домена посредством пептидного линкера, и при этом второй полипептид содержит только один эктодомен указанного 4-1BBL или его фрагмент, соединенный с С-концом СН3 домена указанного полипептида посредством пептидного линкера, или
(c) Fc домен, состоящий из первой и второй субъединиц, способных к стабильной ассоциации.
Согласно одному аспекту осуществления изобретения, эктодомен 4-1BBL включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8, в частности, аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 5. Более конкретно, эктодомен 4-1BBL включает аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 5. Еще конкретнее, эктодомен 4-1BBL включает аминокислотную последовательность SEQ ID NO: 5. В частности, предлагается содержащая 4-1BBLтример антигенсвязывающая молекула, как определено в настоящем описании выше, при этом все три эктодомена 4-1BBL или его фрагменты являются идентичными.
Согласно дополнительному аспекту настоящего изобретения, содержащая 4-1 ВВЬтример антигенсвязывающая молекула по изобретению включает:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, а второй полипептид включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 3 и SEQ ID NO: 4, и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно одному аспекту настоящего изобретения содержащая 4-1BBL тример антигенсвязывающая молекула включает:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2, и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает аминокислотную последовательность SEQ ID NO: 10, а второй полипептид включает аминокислотную последовательность, SEQ ID NO: 5; и
(с) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно дополнительному аспекту настоящего изобретения содержащая 4-1BBL тример антигенсвязывающая молекула включает:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает аминокислотную последовательность SEQ ID NO: 9, а второй полипептид включает аминокислотную последовательность, SEQ ID NO: 1; и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно другому аспекту настоящего изобретения содержащая 4-1BBL тример антигенсвязывающая молекула включает:
антигенсвязывающий домен, способный к специфическому связыванию с Her2, (b) первый полипептид, содержащий СН1 или CL домен, и второй полипептид, содержащий CL или СН1 домен, соответственно, при этом второй полипептид связан с первым полипептидом дисульфидной связью между СН1 и CL доменами, и при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с СН1 или CL доменом пептидным линкером, а также тем, что второй полипептид содержит только один эктодомен указанного 4-1BBL или его фрагмент, соединенный с CL или СН1 доменом указанного полипептида посредством пептидного линкера.
Согласно одному аспекту настоящего изобретения предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, включающая:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый полипептид, содержащий СН1 домен, и второй полипептид, содержащий CL домен, при этом второй полипептид связан с первым полипептидом дисульфидной связью между СН1 и CL доменами, и при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты соединены между собой и с CHI доменом посредством пептидного линкера, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, соединенный с CL доменом указанного полипептида посредством пептидного линкера.
Согласно одному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, включающая:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2, и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно еще одному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, включающая:
(a) более чем один антигенсвязывающий домен, способный к специфическому связыванию с Her2, и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, и
(с) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, включающей:
(a) два антигенсвязывающих домена, способных к специфическому связыванию с Her2, и
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, и
(с) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно дополнительному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, как определено выше, при этом антигенсвязывающий домен способный к специфическому связыванию с Her2, выбран из группы, включающей антитело, антительный фрагмент и скаффолд антигенсвязывающий белок.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, как определено выше, при этом антигенсвязывающий домен способный к специфическому связыванию с Her2, выбран из группы, включающей антительный фрагмент, Fab молекулу, кроссоверную Fab молекулу, одноцепочечную Fab молекулу, Fv молекулу, scFv молекулу, однодоменное антитело или aVH и скаффолд антигенсвязывающий белок. Согласно одному аспекту, антигенсвязывающий домен, способный к специфическому связыванию с Her2, представляет собой VH или скаффлод антигенсвязывающий белок.
Согласно определенному аспекту, предлагается содержащая 4-1BBL-тример антигенсвязывающая молекула, при этом антигенсвязывающий домен, способный к специфическому связыванию с Her2, представляет собой Fab молекулу или кроссоверную Fab молекулу, способную к специфическому связыванию с Her2. В частности, антигенсвязывающий домен, способный к специфическому связыванию с Her2, представляет собой Fab, способный к специфическому связыванию с Her2.
Согласно дополнительному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом пептид, содержащий два эктодомена 4-1BBL или его фрагменты, соединенные между собой посредством первого пептидного линкера, на своем С-конце присоединен к СН1 домену тяжелой цепи посредством второго пептидного линкера, и при этом один эктодомен указанного 4-1BBL или его фрагмент присоединен на своем С-конце к CL домену легкой цепи посредством третьего пептидного линкера.
Согласно дополнительному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом пептид, содержащий два эктодомена 4-1BBL или его фрагменты, соединенные между собой посредством первого пептидного линкера, на своем С-конце присоединен к CL домену тяжелой цепи посредством второго пептидного линкера, и при этом один эктодомен указанного 4-1BBL или его фрагмент присоединен на своем С-конце к СН1 домену легкой цепи посредством третьего пептидного линкера.
Согласно дополнительному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом пептид, содержащий два эктодомена 4-1BBL или его фрагменты, соединенные между собой посредством первого пептидного линкера, на своем С-конце присоединен к CL домену легкой цепи посредством второго пептидного линкера и при этом один эктодомен указанного 4-1BBL или его фрагмент на своем С-конце присоединен к СН1 домену тяжелой цепи посредством третьего пептидного линкера.
Согласно определенному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле как определено в настоящем описании ранее, при этом пептидный линкер представляет собой (G4S)2. Согласно одному аспекту настоящего изобретения, первый пептидный линкер представляет собой (G4S)2 (SEQ ID NO: 68), второй пептидный линкер представляет собой (G4S)2 (SEQ ID NO: 68) третий пептидный линкер представляет собой (G4S)2 (SEQ ID NO: 68).
Согласно другому аспекту, содержащая 4-1BBL тример антигенсвязывающая молекула как определено в настоящем описании ранее, включает Fc домен, содержащий первую и вторую субъединицы, способные к стабильной ассоциации.
В частности, содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению включает (a) Fab молекулу, способную к специфическому связыванию с Her2, при этом Fab тяжелой цепи на своем С-конце присоединен к N-концу СН2 домена в Fc домене и (с) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации.
Согласно дополнительному аспекту, Fc домен представляет собой домен IgG, конкретнее, Fc домен IgG1 или Fc домен IgG4. Более конкретно, Fc домен представляет собой Fc домен IgG1. Согласно определенному аспекту настоящего изобретения, Fc домен имеет модификацию, усиливающую ассоциацию первой и второй субъединиц Fc домена.
Модификации Fc домена, уменьшающие Fc рецепторное связывание и/или эффекторные функции
Fc домен содержащих 4-1BBL тример антигенсвязывающих молекул по изобретению состоит из пары полипептидных цепей, включая домены тяжелой цепи молекулы иммуноглобулина. Например, Fc домен молекулы иммуноглобулина G (IgG) представляет собой димер, каждая субъединица которого включает СН2 и СН3 константные домены тяжелой цепи IgG. Две субъединицы Fc домена способны к стабильной ассоциации друг с другом.
Fc домен придает благоприятные фармакокинетические свойства антигенсвязывающим молекулам по изобретению, включая длинный период полу-жизни в сыворотке, что обеспечивает хорошее накопление в тканях-мишенях и хорошее распределение между тканями и кровью. В то же время это может приводить к нежелательному таргетингу биспецифических антител по изобретению к клеткам, экспрессирующим Fc рецепторы, а не к предпочтительным антиген-несущим клеткам. Соответственно, согласно конкретным аспектам, Fc домен содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению демонстрирует пониженную аффинность связывания к Fc рецептору и/или уменьшенные эффекторные функции, по сравнению с нативным Fc доменом IgG1. Согласно одному аспекту, Fc не полностью связывается с Fc рецептором и/или не индуцирует эффекторную функцию. Согласно определенному аспекту, Fc рецептор представляет собой Fcγ рецептор. Согласно одному аспекту, Fc рецептор представляет собой человеческий Fc рецептор. Согласно специфическому аспекту, Fc рецептор представляет собой активирующий человеческий Fcγ рецептор, конкретнее, человеческий FcγRIIIa, FcγRI или FcγRIIa, еще конкретнее, человеческий FcγRIIIa. Согласно одному аспекту, Fc домен не индуцирует эффекторную функцию. Сниженная эффекторная функция подразумевает, без ограничений указанными, уменьшенную комплементзависимую цитотоксичность (CDC), уменьшенную антителозависимую клеточную цитотоксичность (ADCC), сниженный антителозависимый клеточный фагоцитоз (ADCP), пониженную секрецию цитокинов, пониженный захват антигена антигенпрезентирующими клетками, опосредуемый иммунными комплексами, пониженное связывание с NK клетками, пониженное связывание с макрофагами, пониженное связывание с моноцитами, пониженное связывание с полиморфноядерными клетками, пониженную передачу сигнала, индуцирующего апоптоз, пониженное созревание дендритных клеток и сниженное Т-клеточное примирование.
Согласно определенным аспектам, одна или несколько аминокислотных модификаций могут быть введены в Fc участок, содержащей 4-1BBL тример антигенсвязывающей молекулы по настоящему изобретению, что позволяет получить вариант Fc участка. Вариант Fc участка может включать последовательность человеческого Fc человека (например, Fc участок человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотные модификации (например, замены) в одном или более положении.
Согласно конкретному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, включающая:
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, и
(c) Fc домен, состоящий из первой и второй субъединицы, способных к стабильной ассоциации, при этом Fc домен имеет одну или более аминокислотную замену, которая уменьшает связывание с Fc рецептором, конкретнее, с Fcγ рецептором.
Согласно одному аспекту, Fc домен содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению включает одну или более аминокислотную мутацию, которая снижает аффинность связывания Fc домена с Fc рецептором и/или эффекторную функцию. Как правило, одна или несколько аминокислотных мутаций присутствуют в каждой из двух субъединиц домена Fc. Конкретнее, Fc домен включает аминокислотную замену в положении Е233, L234, L235, N297, Р331 и Р329 (EU нумерация). В частности, Fc домен включает аминокислотную замену в положениях 234 и 235 (EU нумерация) и/или 329 (EU нумерация) тяжелой цепи IgG. Более предпочтительно, предлагается антигенсвязывающая молекула, содержащая тример лиганда из семейства TNF, которая также включает Fc домен с аминокислотными заменами L234A, L235A и P329G ("P329G LALA", EU нумерация) в тяжелых цепях IgG. Аминокислотные замены L234A и L235A относятся к так называемым LALA мутациям. "P329G LALA" комбинация аминокислотных замен практически полностью предотвращает связывание Fc домена человеческого IgG1 с Fcγ рецептором, как описано в публикации международной патентной публикации No. WO 2012/130831 А1, которая также описывает способы получения таких мутантных Fc доменов, а также способы определения их свойств, например, Fc рецепторного связывания или эффекторных функций. "EU нумерация" означает нумерацию согласно EU индексу Кабата и соавт, описанную в Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Fc домены с пониженным связыванием с Fc рецептором и/или сниженной эффекторной функцией также включают домены с заменой одного или нескольких остатков в положении 238, 265, 269, 270, 297, 327 и 329 Fc домена (патент США No. 6,737,056). Такие Fc мутанты включают Fc мутанты с заменами двух и более аминокислот в положениях 265, 269, 270, 297 и 327, включая так называемый "DANA" Fc мутант с заменой остатков 265 и 297 на аланин (патент США No. 7,332,581).
Согласно другому аспекту, Fc домен представляет собой Fc домен IgG4. IgG4 антитела демонстрируют пониженную аффинность связывания с Fc рецепторами и сниженные эффекторные функции, по сравнению с антителами IgG1. Согласно более конкретному варианту осуществления изобретения, Fc домен представляет собой Fc домен IgG4, включающий аминокислотную замену в положении S228 (нумерация по Кабату), конкретнее, аминокислотную замену S228P. Согласно еще одному специфическому аспекту настоящего изобретения, Fc домен представляет собой Fc домен IgG4, включающий аминокислотные замены в положениях L235E и S228P, и P329G (EU нумерация). Такие мутантные Fc домены IgG4 и их характеристики связывания с Fcγ рецептором также описаны в WO 2012/130831.
Мутантные Fc домены могут быть получены путем делеции, замены, вставки или модификации аминокислот с использованием генетических или химических методов, хорошо известных из области техники. Генетические методы могут включать сайт-специфический мутагенез кодирующей последовательности ДНК, ПЦР, генный синтез и т.п. Правильные нуклеотидные замены могут быть верифицированы, например, путем секвенирования.
Связывание с Fc рецепторами можно легко определить, например, с помощью ELISA или поверхностного плазмонного резонанса (SPR) с использованием стандартного оборудования, такого как прибор BIAcore (GE Healthcare), и рецепторов Fc, которые могут быть получены путем рекомбинантной экспрессии. Подходящий анализ связывания описан в настоящем описании. Альтернативно, аффинность связывания Fc-доменов или активирующих клетки биспецифических антигенсвязывающих молекул, содержащих Fc-домен, с Fc-рецепторами, может быть оценена с использованием клеточных линий, которые, как известно, экспрессируют определенные Fc-рецепторы, такие как NK-клетки человека, экспрессирующие рецептор FcγIIIa.
Эффекторная функция Fc домена, или биспецифических антител по изобретению, содержащих Fc домен, может быть измерена при помощи способов, известных из области техники. Подходящий анализ для измерения ADCC описан в настоящем описании. Другие примеры методик оценки ADCC активности молекулы, представляющей интерес, in vitro, описаны в патенте США No. 5,500,362; а также у Hellstrom и соавт. Proc Natl Acad Sci USA 83, 7059-7063 (1986) и Hellstrom et al., Proc Natl Acad Sci USA 82, 1499-1502 (1985); патент США No. 5,821,337; Bruggemann et al., J Exp Med 166, 1351-1361 (1987). Альтернативно могут применяться нерадиоактивные методики анализа (см, например, нерадиоактивный анализ цитотоксичности ACTI ™ для проточной цитометрии (CellTechnology, Inc., Mountain View, CA); и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI)). Подходящими эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (РВМС) и натуральные киллеры (NK). В качестве альтернативного или дополнительного метода может применяться анализ ADCC активности молекулы, представляющей интерес, in vivo, например, на модельных животных, таких, как описаны, например у Clynes и соавт., Proc Natl Acad Sci USA 95, 652-656 (1998).
Согласно некоторым вариантам осуществления изобретения, связывание Fc домена с компонентами системы комплемента, конкретно, с C1q, снижено. Соответственно, согласно некоторым вариантам осуществления изобретения, в том случае, когда Fc домен сконструирован таким образом, чтобы иметь пониженную эффекторную функцию, указанная эффекторная функция включает пониженную CDC. Анализ связывания C1q может осуществляться для того, чтобы установить, способны ли биспецифические антитела по изобретению связываться с C1q и обладают ли они CDC активностью. См. например, ELISA связывания C1q и С3с, описанный в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента, может быть проведен анализ CDC (см, например, Gazzano-Santoro и соавт., J Immunol Methods 202, 163 (1996); Cragg и соавт., Blood 101, 1045-1052 (2003); и Cragg, и Glennie, Blood 103, 2738-2743 (2004)).
Согласно конкретному аспекту, Fc домен содержит модификацию, способствующую ассоциации первой и второй субъединиц Fc домена.
Модификации Fc домена, усиливающие гетеродимеризацию
Согласно одному аспекту, содержащие 4-1BBL тример антигенсвязывающие молекулы, согласно изобретению, включают:
(а) антигенсвязывающий домен, способный к специфическому связыванию с Her2, (b) первый и второй полипептид, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает два эктодомена 4-1BBL или его фрагменты, которые соединены между собой посредством пептидного линкера, и (с) Fc домен, состоящий из первой и второй субъединиц, способных к стабильной ассоциации. Таким образом, заявленные молекулы включают различные фрагменты, слитые с одной из двух субъединиц Fc домена, которые обычно состоят из двух неидентичных полипептидных цепей ("тяжелых цепей"). Рекомбинантная совместная экспрессия указанных полипептидов и последующая димеризация приводит к нескольким возможным комбинациям двух полипептидов. Для улучшения выхода и чистоты содержащих 4-1BBL тример антигенсвязывающих молекул в ходе рекомбинантного синтеза было выгодно встраивание в Fc домен содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению модификаций, усиливающих ассоциацию желаемых полипептидов.
Соответственно, Fc домен содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению включает модификации, усиливающие ассоциацию первой и второй субъединицы Fc домена. Сайт наиболее продолжительного белок-белкового взаимодействия между двумя субъединицами Fc домена человеческого IgG - это СН3 домен Fc домена. Таким образом, указанная модификация обычно находится в СН3 домене Fc домена.
Согласно конкретному аспекту настоящего изобретения, указанная модификация представляет собой, так называемую модификацию "выступ-во-впадину", включающую модификацию "выступ" в одной из двух субъединиц Fc домена и модификацию "впадина" в другой из двух субъединиц Fc домена. Таким образом, согласно конкретному аспекту, настоящее изобретение относится к содержащей 4-1BBL- тример антигенсвязывающей молекуле, как описано выше в настоящем описании, которая представляет собой молекулу IgG, при этом Fc часть первой тяжелой цепи содержит первый модуль димеризации, а Fc часть второй тяжелой цепи содержит второй модуль димеризации, что обеспечивает гетеродимеризацию двух тяжелых цепей молекулы IgG, при этом первый модуль димеризации содержит выступы, а второй модуль димеризации содержит впадины, согласно методике "выступ-во-впадину".
Технология "выступ-во-впадину" описана, например, в патентах США 5,731,168; 7,695,936; и у Ridgway и соавт., Prot Eng 9, 617-621 (1996) и Carter, J Immunol Meth 248, 7-15 (2001). В целом способ включает встраивание выпячивания ("выступа") на границу контакта первого полипептида и соответствующей ему полости ("впадины") на границе контакта второго полипептида, таким образом, чтобы "выступ" располагался во "впадине", стимулировал формирование гетеродимера и препятствовал формированию гомодимера. Выпячивания конструируют путем замещения небольших боковых аминокислотных цепей на границе контакта первого полипептида большими боковыми аминокислотными цепями (например, тирозином или триптофаном). Компенсаторные впадины, размер которых идентичен или аналогичен размеру выступов, создают на границе контакта второго полипептида путем замещения больших аминокислотных боковых цепей меньшими аминокислотными боковыми цепями (например, аланином или треонином).
Соответственно, согласно конкретному аспекту, в СН3 домене первой субъединицы Fc домена содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению аминокислотный остаток замещен другим аминокислотным остатком, имеющим больший объем боковой цепи, что позволяет создать выступ в структуре СН3 домена первой субъединицы, который позиционируется в полости также в структуре СН3 домена второй субъединицы, а в СН3 домене второй субъединицы Fc домена аминокислотный остаток замещен другим аминокислотным остатком, имеющим меньший размер боковой цепи, что позволяет создать впадину в структуре СН3 домена, в которой позиционируется выступ СН3 домена первой субъединицы.
Выступ и впадина могут быть сгенерированы путем изменения нуклеиновой кислоты, кодирующей полипептиды, например, при помощи сайт-специфического мутагенеза или пептидного синтеза.
Согласно конкретному аспекту настоящего изобретения, в СН3 домене первой субъединицы Fc домена остаток треонина в положении 366 замещен остатком триптофана (T366W), а в СН3 домене второй субъединицы Fc домена остаток тирозина в положении 407 замещен остатком валина (Y407V). Конкретнее, во второй субъединице Fc домена дополнительно остаток треонина в положении 366 замещен остатком триптофана (T366S), а остаток лейцина в положении 368 замещен остатком аланина (L368A). Конкретнее, в первой субъединице Fc домена дополнительно остаток серина в положении 354 замещен остатком цистеина (S354C), а во второй субъединице Fc домена дополнительно остаток тирозина в положении 349 замещен остатком цистеина (Y349C). Встраивание указанных двух остатков цистеина приводит к формированию дисульфидного мостика между двумя субъединицами Fc домена. Дисульфидный мостик дополнительно стабилизирует димер (Carter, J Immunol Methods 248, 7-15 (2001)).
Согласно альтернативному аспекту настоящего изобретения, модификация, усиливающая ассоциацию первой и второй субъединиц Fc домена, представляет собой модификацию, влияющую на электростатическое взаимодействие, например, как описано в РСТ публикации WO 2009/089004. В общем плане данный метод включает замещение одного или более аминокислотного остатка на границе взаимодействия двух субъединиц Fc домена заряженным аминокислотным остатком таким образом, что образование гомодимера становится электростатически невыгодным, а гетеродимеризация, наоборот, электростатически выгодной.
Модификации в CH1/CL доменах
Для того, чтобы еще улучшить корректное образование пар содержащие 4-1BBL тример антигенсвязывающие молекулы могут включать различные заряженные аминокислотные замены (так называемые "заряженные остатки"). Такие модификации встроены в перекрестные и неперекрестные СН1 и CL домены. Согласно определенному аспекту, настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающий молекулам, в которых в одном из CL доменов аминокислота в положении 123 (нумерация EU) была замещена аргинином (R), а аминокислота в положении 124 (нумерация EU) была замещена лизином (К), и при этом в одном из СН1 доменов аминокислота в положении 147 (нумерация EU) и аминокислота в положении 213 (нумерация EU) была замещена глутаминовой кислотой (Е).
Таким образом, согласно конкретному варианту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, включающая
(a) антигенсвязывающий домен, способный к специфическому связыванию с Her2,
(b) первый полипептид, содержащий CL домен, включающий аминокислотные мутации E123R и Q124K, и второй полипептид, содержащий СН1 домен, включающий аминокислотные мутации K147E и K213E, при этом второй полипептид соединен с первым полипептидом дисульфидной связью между СН1 и CL доменами,
и при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид содержит два эктодомена 4-1BBL или его фрагменты, которые соединены между собой и с CL доменом посредством пептидного линкера, а также тем, что второй полипептид содержит один эктодомен 4-1BBL или его фрагмент, соединенный посредством пептидного линкера с СН1 доменом указанного полипептида, или
(c) Fc домен, состоящий из первой и второй субъединиц, способных к стабильной ассоциации.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом в CL домене, который принадлежит члену семейства лигандов TNF, аминокислотный остаток в положении 123 (EU нумерация) был замещен аргинином (R), а аминокислотный остаток в положении 124 (EU нумерация) был замещен лизином (К), и при этом в СН1 домене, который принадлежит члену семейства лигандов TNF, аминокислотный остаток в положении 147 (EU нумерация) и в положении 213 (EU нумерация) был замещен глутаминовой кислотой (Е). Указанные модификации приводят к встраиванию так называемых заряженных остатков с преимущественными свойствами, которые позволяют избежать нежелательных эффектов, например, неправильного образования пар.
Конкретнее, CL домен включает аминокислотные мутации E123R и Q124K, а СН1 домен включает аминокислотные мутации K147E и K213E.
Конкретные содержащие 4 1BBL тример антигенсвязывающие молекулы
Настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающим молекулам, которые включают антигенсвязывающий домен, способный к специфическому связыванию с Her2. Согласно одному конкретному варианту осуществления изобретения содержащие 4-1BBL тример антигенсвязывающие молекулы включают один элемент, способный к специфическому связыванию с Her2, что означает, что содержащие 4-1BBL тример антигенсвязывающие молекулы являются моновалентными. Согласно другому конкретному аспекту, настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающим молекулам, включающим два элемента, способных к специфическому связыванию с Her2, что означает, что содержащие 4-1BBL тример антигенсвязывающие молекулы являются бивалентными.
Согласно конкретному аспекту, настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающим молекулам, при этом антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит
(a) VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательностью SEQ ID NO: 13, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 14, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 15, а также VL домен, включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 16, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 17, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 18, или
(b) VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 21, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 22, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 23, а также VL домен, включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 24, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 25, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 26, или
(с) a VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 29, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 30, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 31, а также VL домен включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 32, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 33, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 34.
Согласно одному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her 2, содержит VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 13, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 14, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 15, а также VL домен, включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 16, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 17, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 18.
Согласно другому аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her 2, содержит VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 21, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 22, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 23, а также VL домен включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 24, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 25, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 26.
Согласно дополнительному аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит VH домен, включающий (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 29, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 30, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 31, а также VL домен, включающий (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 32, (v) CDR-L2, содержащую аминокислотную последовательность SEQ ID NO: 33, и (vi) CDR-L3, содержащую аминокислотную последовательность SEQ ID NO: 34.
Согласно дополнительному аспекту настоящего изобретения, антигенсвязывающий домен, способный к специфическому связыванию с Her2, включает вариабельный участок тяжелой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 19, а также вариабельный участок легкой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 20. Согласно другому аспекту настоящего изобретения, антигенсвязывающий домен, способный к специфическому связыванию с Her2, включает вариабельный участок тяжелой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 27, а также вариабельный участок легкой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 28.
Согласно дополнительному аспекту, антигенсвязывающий домен, способный к специфическому связыванию с Her2, включает вариабельный участок тяжелой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 35, а также вариабельный участок легкой цепи с аминокислотной последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 36.
Согласно дополнительному аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her2, включает
(a) VH домен, включающий аминокислотную последовательность SEQ ID NO: 19 и VL домен, включающий аминокислотную последовательностью SEQ ID N0:20, или
(b) VH домен, включающий аминокислотную последовательность SEQ ID NO: 27 и VL домен с аминокислотной последовательностью SEQ ID NO: 28, или
(c) VH домен, включающий аминокислотную последовательность SEQ ID NO: 35 и VL домен с аминокислотной последовательностью SEQ ID NO: 36.
Согласно одному аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, как определено в настоящем описании выше, в которой антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 19, и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 20, или в которой антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 35, и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 36.
Согласно конкретному аспекту, антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 19 и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 20. Согласно другому конкретному аспекту, антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 35 и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 36. Согласно специфическому аспекту, антигенсвязывающий домен, способный к специфическому связыванию с Her2, содержит VH домен, состоящий из аминокислотной последовательности SEQ ID NO: 27 и VL домен, состоящий из аминокислотной последовательности SEQ ID NO: 28.
Согласно дополнительному аспекту, содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению включает:
(i) первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 19, и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 20, или первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или первую тяжелую цепь, содержащую VH домен, включающий аминокислотную 10 последовательность SEQ ID NO: 35, и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 36,
(ii) вторую тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43, и
(iii) вторую легкую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42 и SEQ ID NO: 44.
Согласно конкретному аспекту, содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению включает
(а) антигенсвязывающий домен, способный к специфическому связыванию в Her2, содержащий вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 19, и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 20 или вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 27, и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 28 или вариабельный участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 35, и вариабельный участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 36, и
(b) первый и второй полипептиды, которые соединены между собой дисульфидной связью, при этом антигенсвязывающая молекула характеризуется тем, что первый полипептид включает аминокислотную последовательность SEQ ID NO: 10, а второй полипептид включает аминокислотную последовательность SEQ ID NO: 5.
Согласно конкретному аспекту настоящего изобретения предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, при этом указанная антигенсвязывающая молекула включает
(i) первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 19 и первую легкую цепь, содержащую VL домен, включающий аминокислотной последовательностью SEQ ID NO: 20 или
первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 27, первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или
первую тяжелую цепь, содержащую VH домен, включающий аминокислотную последовательность SEQ ID NO: 35 первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 36, или
(ii) вторую тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43, и
(iii) вторую легкую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42 и SEQ ID NO: 44.
Согласно другому аспекту, настоящее изобретение относится к содержащей 4-1BBL тример антигенсвязывающей молекуле, при этом указанная антигенсвязывающая молекула включает
(a) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 45, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 47, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 48, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 50, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38.
Полинуклеотиды
Настоящее изобретение также относится к изолированным молекулам нуклеиновой кислоты, кодирующим содержащие 4-1ВВ тример антигенсвязывающие молекулы как раскрыто в настоящем описании, или их фрагменты.
Изолированные полинуклеотиды, кодирующие содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению, могут экспрессироваться как единичные полинуклеотиды, кодирующие целую антигенсвязывающую молекулу, или как множественные (например, два и более (полинуклеотида), которые экспрессируются совместно. Полипептиды, кодируемые полинуклеотидами, которые экспрессируются совместно могут быть связаны, например, дисульфидными связями или другими способами с формированием функциональной антигенсвязывающей молекулы. Например, часть легкой цепи иммуноглобулина может кодироваться отдельным полинуклеотидом, другим, чем часть легкой цепи иммуноглобулина. При совместной экспрессии, полипептиды тяжелой цепи будут ассоциироваться с полипептидами легкой цепи с формированием иммуноглобулина.
Согласно некоторым аспектам, изолированная молекула нуклеиновой кислоты кодирует целую, содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению, как описано в настоящем описании. В частности, изолированный полинуклеотид кодирует полипептид, представляющий собой содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению, как раскрыто в настоящем описании.
Согласно одному аспекту, настоящее изобретение относится к изолированной молекуле нуклеиновой кислоты, кодирующей содержащую 4-1BBL тример антигенсвязывающую молекулу, при этом указанная молекула нуклеиновой кислоты включает (а) последовательность, которая кодирует антигенсвязывающий домен, способный к специфическому связыванию с Her2, (b) последовательность, которая кодирует полипептид, содержащий два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером и (с) последовательность, которая кодирует полипептид, содержащий один эктодомен указанной 4-1BBL или его фрагмент.
Согласно другому аспекту изобретения, предлагается изолированный полинуклеотид, кодирующий содержащую 4-1BBL тример антигенсвязывающую молекулу, при этом указанный полинуклеотид включает (а) последовательность, которая кодирует антигенсвязывающий домен, способный к специфическому связыванию с Her2, (b) последовательность, которая кодирует полипептид, содержащий два эктодомена 4-1BBL или его фрагменты, которые соединены между собой пептидным линкером и (с) последовательность, которая кодирует полипептид, содержащий один эктодомен указанного 4-1BBL или его фрагмент.
Согласно конкретному аспекту изобретения, полинуклеотид или нуклеиновая кислота представляют собой ДНК. Согласно другому варианту осуществления изобретения, полинуклеотид по настоящему изобретению 15 представляет собой РНК, например, в форме информационной РНК (иРНК). РНК по настоящему изобретению может быть как одноцепочечной, так и двухцепочечной.
Рекомбинантные методы
Содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению могут быть получены, например, при помощи твердофазного пептидного синтеза (например, твердофазного синтеза по Меррифильду) или с помощью рекомбинантных технологий. Для рекомбинантного синтеза один или более полинуклеотид, кодирующий содержащую 4-1BBL тример антигенсвязывающую молекулу или полипептидные ее фрагменты, например, как описано выше, изолируют и встраивают в один или более вектор для дополнительного клонирования и/или экспрессии в клетке-хозяине. Такие полинуклеотиды могут быть легко изолированы и секвенированы при помощи стандартных технологий. Согласно одному аспекту настоящего изобретения предлагается вектор, предпочтительно, вектор экспрессии, содержащий один или более полинуклеотид по изобретению. Методы, которые хорошо известны специалисту в данной области и могут использоваться для конструирования векторов экспрессии, содержащих кодирующую последовательность для содержащей 4-1BBL тример антигенсвязывающей молекулы (фрагмента) наравне с необходимыми контролирующими сигналами транскрипции/трансляции. Эти методы включают рекомбинантные ДНК технологии, методики синтеза и рекомбинантные методики in vivo/генетическую рекомбинацию см, например, технологии описанные у Maniatis и соавт., MOLECULAR CLONING: A LABORATORY MANUAL, Cold Spring Harbor 5 Laboratory, N.Y. (1989); и Ausubel и соавт., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Greene Publishing Associates and Wiley Interscience, N.Y. (1989). Вектор экспрессии может быть частью плазмиды, вируса или может представлять собой фрагмент нуклеиновой кислоты. Вектор экспрессии содержит кассету экспрессии в которой в функциональной связи с промотором и/или другими элементами контроля транскрипции/трансляции клонируется полинуклеотид, кодирующий содержащую 4-1BBL тример антигенсвязывающую молекулу или ее полипептидные фрагменты (то есть кодирующий участок). Используемый в настоящем изобретении термин "кодирующий участок" представляет собой участок нуклеиновой кислоты, который состоит из кодонов, транслируемых в аминокислоты. Несмотря на то, что "стоп кодон" (TAG, TGA, или ТАА) не транслируется в аминокислоту, он все равно в случае его наличия считается частью кодирующего участка, а при этом любые фланкирующие последовательности, например, промоторы, сайты связывания рибосом, терминаторы транскрипции, интроны, 5' и 3' нетранслируемые участки и подобные области не считаются частью кодирующего участка. Два или более кодирующих участка могут находиться в одном полинуклеотидном конструкте, например, в одном векторе, или в отдельных полинуклеотидных конструктах, например в отдельных (различных) векторах. Кроме того, любой вектор может содержать один кодирующий участок, или может содержать два и более кодирующих участка, например, вектор согласно настоящему изобретению может кодировать один или несколько полипептидов, которые пост- или ко-трансляционно разделяются на несколько конечных продуктов посредством протеолитического расщепления. Кроме того, вектор, полинуклеотид или нуклеиновая кислота по изобретению могут кодировать гетерологичные кодирующие участки, как слитые, так и неслитые с полинуклеотидом, кодирующим содержащие 4-1BBL-тример антигенсвязывающие молекулы по изобретению или их полипептидные фрагменты, а также их варианты и производные. Гетерогенные кодирующие участки включают, без ограничений указанными, специализированные элементы или мотивы, такие, как секреторный сигнальный пептид или гетерологичный функциональный домен. О функциональной связи говорят, когда кодирующий участок для генного продукта, например, полипептид, связан с одной или более регуляторной последовательностью таким образом, что экспрессия этого генного продукта находится под влиянием и контролем указанной регуляторной (ых) последовательности (ей). Два фрагмента ДНК (такие, как участок, кодирующий полипептид, и ассоциированный с ним промотор) являются "функционально связанными" в том случае, если индукция функции промотора приводит к транскрипции мРНК, кодирующей желаемый генный продукт, а также в том случае, если природа связи между двумя фрагментами ДНК не препятствует способности регуляторной последовательности направлять экспрессию генного продукта или мешает ДНК матрице транскрибироваться. Таким образом, промоторный участок будет функционально связан с нуклеиновой кислотой, кодирующей полипептид, в том случае, если промотор способен воздействовать на транскрипцию этой нуклеиновой кислоты. Промотор может представлять собой клеточноспецифический промотор, который направляет полную транскрипцию ДНК только в предетерминированных клетках. Другие элементы, контролирующие транскрипцию, помимо промоторов, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, могут быть функционально связаны с полинуклеотидом для того, чтобы направлять клеточноспецифическую транскрипцию.
Подходящие промоторы и другие участки контроля транскрипции описываются в настоящем описании. Разнообразные участки контроля транскрипции известны специалистам в данной области. К ним относятся, без ограничений указанными, участки контроля транскрипции, которые работают в клетках позвоночных, такие, как без ограничения, промоторы и энхансеры из цитомегаловирусов (например, немедленно-ранний промотор вместе с интроном-А), вируса обезьян 40 (например, ранний промотор) или ретровирусов (такие, как, например, вирус саркомы Рауса). К другим участкам контроля транскрипции относятся участки, выделенные из генов позвоночных, таких, как ген актина, белок теплового шока, гормон роста крупного рогатого скота и а-глобин кролика, а также другие последовательности, способные контролировать экспрессию генов в эукариотических клетках. Дополнительными подходящими участками контроля транскрипции являются тканеспецифические промоторы и энхансеры, а также индуцибельные промоторы (например, промоторы, индуцируемые тетрациклином). Аналогично, специалистам в данной области известно множество элементов контроля трансляции. К ним относятся, без ограничений указанными, сайты связывания рибосом, кодоны инициации и терминации трансляции, а также элементы, выделенные из вирусных систем (конкретно, внутренние участки посадки рибосом или IRES, аббрев. от англ. Internal Ribosome Entry Site, также обозначаемые как CITE последовательности). Кассета экспрессии также может включать другие элементы, такие, как точка начала репликации, и/или элементы хромосомной интеграции, такие как ретровирусные длинные концевые повторы (LTRs), или инвертированные концевые повторы (ITRs) аденоассоциированного вируса (AAV).
Кодирующие участки нуклеиновых кислот и полинуклеотидов по настоящему изобретению могут быть связаны с дополнительными кодирующими участками, которые кодируют секреторные или сигнальные пептиды, которые направляют секрецию полипептида, кодируемого полинуклеотидом по настоящему изобретению. Например, если требуется секреция содержащей 4-1BBL тример антигенсвязывающей молекулы или ее полипептидных фрагментов, ДНК, кодирующая сигнальную последовательность, может быть встроена в рамку считывания выше нуклеиновой кислоты, кодирующей содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению или ее полипептидные фрагменты. Согласно сигнальной гипотезе, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, которая отщепляется от зрелого белка после того, как был инициирован экспорт растущей белковой цепи через шероховатый эндоплазматический ретикулум. Специалистам в данной области известно, что полипептиды, секретируемые клетками позвоночных, обычно имеют сигнальный пептид, слитый с N-концом полипептида, который отщепляется от транслированного полипептида с образованием секретируемой или "зрелой" формы полипептида. Согласно определенным вариантам осуществления изобретения, применяется нативный сигнальный пептид, например, сигнальный пептид тяжелой или легкой цепи иммуноглобулина, или функциональное производное той последовательности, которая сохраняет способность направлять секрецию полипептида, функционально с ней связанного. Альтернативно могут применяться, гетерологичные сигнальные пептиды млекопитающих, а также их функциональные производные. Например, лидерная последовательность дикого типа может быть замещена лидерной последовательностью активатора тканевого плазминогена (ТРА) или мышиной β-глюкуронидазы.
ДНК, кодирующая короткую белковую последовательность, которую можно использовать для облегчения последующей очистки (например, гистидиновую метку) или маркировки слитого белка, может быть включена в состав или присоединена к концам полинуклеотида, кодирующего содержащую 4-1BBL-тример антигенсвязывающую молекулу по изобретению или ее полипептидные фрагменты.
Согласно дополнительному аспекту настоящего изобретения, предлагается клетка-хозяин, содержащая один или более полинуклеотидов по изобретению. Согласно определенным вариантам осуществления изобретения, предлагается клетка-хозяин, содержащая один или более вектор по изобретению. Полинуклеотиды и векторы могут включать любые элементы, поодиночке или в комбинации, описанные в настоящем описании по отношению к полипептидам и векторам, соответственно. Согласно одному аспекту, клетка-хозяин включает (то есть была трансформирована или трансфецирована) вектором, содержащим полинуклеотид, который кодирует (часть), содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению. Используемый в настоящем описании термин "клетка-хозяин" относится к любому типу клеточной системы, которая может быть сконструирована для синтеза белков-слияния по изобретению или их фрагментов. Клетки-хозяина, подходящие для репликации или поддержания экспрессии антигенсвязывающих молекул хорошо известны из области техники. Такие клетки могут быть трансфецированы или трансдуцированы, в зависимости от условий, определенным вектором экспрессии; большое количество содержащих векторы клеток может быть выращено для засева крупных ферментеров и получения достаточного количества антигенсвязывающей молекулы для клинического применения. К подходящим клеткам-хозяина относятся прокариотические микроорганизмы, такие, как Е. coli, а также разнообразные эукариотические клетки, такие, как клетки яичника китайского хомячка (СНО), клетки насекомых и им подобные. Например, полипептиды могут быть синтезированы в бактериях, особенно тогда, когда гликозилирование не требуется. После экспрессии полипептид может быть выделен из массы бактериальных клеток в растворимой фракции и может подвергаться дополнительной очистке. Помимо прокариот, подходящими хозяином для клонирования или экспрессии полипептид-кодирующих векторов являются эукариотические микробы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были "гуманизированы", что приводит к продукции полипептида с частично или полностью человеческим паттерном гликозилирования. См. Gerngross, Nat Biotech 22, 1409-1414 (2004), и Li и соавт., Nat Biotech 24, 210-215 (2006). Подходящие клетки-хозяина для экспрессии (гликозилированных) полипептидов также могут быть выделены из многоклеточных организмов (беспозвоночных и позвоночных). Примерами клеток беспозвоночных являются клетки растений и насекомых. Было идентифицировано множество штаммов бакуловирусов, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda. Культуры растительных клеток также могут быть использованы в качестве хозяев. См, например, патенты США 5,959,177, 6,040,498, 6,420,548, 7,125,978, и 6,417,429 (описывающие технологию PLANTIBODIESTM получения антител у трансгенных животных). Клетки позвоночных также могут применяться в качестве хозяев. Например, клеточные линии млекопитающих, адаптированные для роста в суспензии, могут быть полезны. Другими примерами подходящих клеток-хозяина млекопитающих являются клеточная линия CV1 почек обезьяны, трансформированная SV40 (COS-7); линия почек эмбриона человека (клетки 293 или 293Т, как описано, например, у Graham и соавт., J Gen Virol 36, 59 (1977)), клетки почки новорожденного хомячка (ВНК), мышиные клетки Сертоли (ТМ4 клетки, как описано, например, у Mather, Biol Reprod 23, 243-251 (1980)), клетки почек обезьяны (CV1), клетки почки африканской зеленой мартышки (VERO-76), клетки карциномы шейки матки человека (HELA), клетки почек собаки (MDCK), клетки печени серой крысы (BRL 3А), клетки легких человека (W138), клетки печени человека (Hep G2), клетки опухоли молочных желез мышей (ММТ 060562), TRI клетки (как описано, например, у Mather и соавт., Annals N.Y. Acad Sci 383, 44-68 (1982)), MRC 5 клетки, и FS4 клетки. Другими подходящими клеточными линиями млекопитающих, которые могут использоваться в качестве хозяев, являются клетки яичников китайского хомячка (СНО), включая dhfr-СНО клетки (Urlaub и соавт., Proc Natl Acad Sci USA 77, 4216 (1980)); и клеточные линии миеломы, такие, как YO, NS0, Р3Х63 и Sp2/0. Для обзора некоторых линий клеток-хозяев млекопитающих, подходящих для продукции белка, см., например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003). Клетки-хозяина включают культивируемые клетки, например, культивируемые клетки млекопитающих, дрожжевые клетки, клетки насекомых, бактериальные клетки и растительные клетки, и это лишь некоторые из них, а также клетки из трансгенного животного, трансгенного или культивируемые ткани растения или животного. Согласно одному варианту осуществления изобретения, клетка-хозяин представляет собой эукариотическую клетку, предпочтительно, клетку млекопитающего, такую, как клетки яичников китайского хомячка (СНО), эмбриональные клетки почки человека (HEK) или лимфоидные клетки (например, Y0, NS0, Sp20 клетки).
Стандартные методики экспрессии чужеродных генов в указанных системах хорошо известны специалистам в данной области. Клетки, экспрессирующие полипептид, включающий либо тяжелую, либо легкую цепь иммуноглобулина, могут быть сконструированы таким образом, чтобы экспрессировать другие цепи иммуноглобулина и продуктом экспрессии таких клеток будет являться иммуноглобулин, включающий как тяжелую, так легкую цепь.
Согласно одному аспекту, настоящее изобретение относится к способу получения содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению или ее полипептидных фрагментов, при этом указанный способ включает культивирование клетки-хозяина, содержащей полинуклеотиды, кодирующие содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению или ее полипептидные фрагменты, как раскрыто в настоящем описании, в условиях, подходящих для экспрессии содержащих 4-1BBL тример антигенсвязывающих молекул по изобретению или ее полипептидных фрагментов, а также выделение содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению или ее полипептидных фрагментов из клетки-хозяина (или культуральной среды клеток-хозяев).
В содержащей 4-1BBL тример антигенсвязывающей молекуле по настоящему изобретению компоненты (по меньшей мере, один фрагмент, способный специфически связываться с антигеном клетки-мишени, один полипептид, содержащий два эктодомена члена семейства лигандов TNF или его фрагменты, и полипептид, содержащий один эктодомен указанного члена семейства 4-1BBL или его фрагмент) генетически не слиты друг с другом. Полипептиды сконструированы таким образом, что их компоненты (два эктодомена члена семейства TNF лигандов или их фрагменты, а также другие компоненты, такие, как СН или CL) слиты друг с другом напрямую или посредством линкерной последовательности. Состав и длина линкера может определяться в соответствии со способами, хорошо известными в данной области; линкер может быть протестирован на эффективность. Примеры линкерных последовательностей для соединения различных компонентов антигенсвязывающих молекул по изобретению могут быть обнаружены в последовательностях, представленных в настоящем описании. Дополнительные последовательности, включающие сайты расщепления, для разделения индивидуальных компонентов слитых белков, если необходимо, также могут включаться в состав молекул, например, последовательности, распознаваемые эндопептидазой.
Согласно определенным вариантам осуществления изобретения, молекулы, способные к специфическому связыванию с таргетным клеточным антигеном (например, Fab фрагментами), являющиеся частью антигенсвязывающей молекулы, включают по меньшей мере вариабельный участок иммуноглобулина, способный к связыванию с антигеном. Вариабельные участки могут быть частью или выделены из существующих в природе или искусственных антител, а также их фрагментов. Способы получения поликлональных или моноклональных антител хорошо известны из области техники (см., например, Harlow and Lane, "Antibodies, a laboratory manual", Cold Spring Harbor Laboratory, 1988). He существующие в природе антитела могут быть сконструированы при помощи твердофазного пептидного синтеза или получены при помощи рекомбинантных технологий (например, как описано в патенте США No. 4,186,567), например, путем скрининга комбинаторных библиотек, включающих вариабельные тяжелые цепи и вариабельные легкие цепи (см., например, патент США No. 5,969,108, McCafferty).
В соответствии с изобретением могут применяться любые виды иммуноглобулинов животных. Иммуноглобулины (не имеющие ограничивающего характера), полезные для применения в соответствии с настоящим изобретением, могут происходить из организма мышей, приматов или человека. Если слитый белок предназначен для применения у человека, может применяться химерная форма иммуноглобулина, в которой константные участки выделены из организма человека. Гуманизированная или полностью человеческая форма иммуноглобулина также может быть получена в соответствии со способами, хорошо известными специалистам в данной области (см, например, патент США 5 565 332, Winter). Гуманизация может достигаться различными способами, включая, без ограничений указанными (а) трансплантации нечеловеческих (например, донорских антител) CDRs в каркас и константные участки человеческих (например, реципиентных антител) с или без сохранения критических каркасных остатков (например, тех, которые важны для сохранения хорошей антигенсвязывающей аффинности или функций), (b) трансплантации только нечеловеческих областей, определяющих специфичность (SDRs или a-CDRs; остатки, критичные для взаимодействия антитело-антиген) в человеческие каркасные и константные участки, или (с) трансплантации нечеловеческих вариабельных доменов целиком, но с "маскировкой" их человекоподобными участками за счет замещения поверхностных остатков. Гуманизированные антитела и способы их получения подробно описаны, например, у Almagro и Fransson, Front Biosci 13, 1619-1633 (2008), а также, например, у Riechmann и соавт, Nature 332, 323-329 (1988); Queen и соавт., Proc Natl Acad Sci USA 86, 10029-10033 (1989); патентах США 5,821,337, 7,527,791, 6,982,321, и 7,087,409; Jones и соавт., Nature 321, 522-525 (1986); Morrison и соавт., Proc Natl Acad Sci 81, 6851-6855 (1984); Morrison and Oi, Adv Immunol 44, 65-92 (1988); Verhoeyen и соавт., Science 239, 1534-1536 (1988); Padlan, Molec Immun 31(3), 169-217 (1994); Kashmiri и соавт., Methods 36, 25-34 (2005) (описывается SDR (a-CDR) трансплантация); Padlan, Mol Immunol 28, 489-498 (1991) (описывается "маскировка поверхности"); Dall'Acqua и соавт., Methods 36, 43-60 (2005) (описывается "FR перетасовка"); и Osbourn и соавт., Methods 36, 61-68 (2005) и Klimka и соавт., Br J Cancer 83, 252-260 (2000) (описывается подход "управляемой селекции" к FR перетасовке). Конкретные иммуноглобулины, согласно изобретению, представляют собой иммуноглобулины человека. Человеческие антитела и человеческие вариабельные области могут быть получены с использованием различных методов, известных в данной области. Человеческие антитела, в общем, описаны у van Dijk and van de Winkel, Curr Opin Pharmacol 5, 368-74 (2001) и Lonberg, Curr Opin Immunol 20, 450-459 (2008). Человеческие вариабельные участки могут быть частью или выделены из человеческих моноклональных антител, полученных при помощи гибридомных методов (см., например, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)). Человеческие антитела и человеческие вариабельные области также могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для выработки интактных человеческих антител или интактных антител с человеческими вариабельными областями в ответ на антигенную стимуляцию (см, например, Lonberg, Nat Biotech 23, 1117-1125 (2005). Человеческие антитела и вариабельные области также могут быть получены путем выделения последовательностей вариабельной области Fv клона, выбранных из фаг-дисплейных библиотек человека (см, например., Hoogenboom и соавт. in Methods in Molecular Biology 178, 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001); и McCafferty и соавт., Nature 348, 552-554; Clackson и соавт., Nature 352, 624-628 (1991)). Фаги обычно демонстрируют как антительные фрагменты, так и одноцепочечные Fv (scFv) фрагменты или Fab фрагменты.
Согласно конкретным аспектам, элементы в составе антигенсвязывающих молекул по изобретению, способные к специфическому связыванию с таргетным клеточным антигеном (например, Fab фрагментами), конструируют таким образом, чтобы они обладали повышенной аффинностью связывания, в соответствии, например, с методами, изложенными в РСТ публикации WO 2012/020006 (см. Примеры, касающиеся созревания аффинности) или в публикации заявки на патент США No. 2004/0132066. Способность антигенсвязывающих молекул по изобретению связываться со специфической антигенной детерминантой может быть измерена, например, как при помощи твердофазного иммуноферментного анализа (ELISA), так и при помощи других способов, известных специалистам в данной области, например, поверхностного плазмонного резонанса (Liljeblad, et al., Glyco J 17, 323-329 (2000)) и традиционных методик анализа связывания (Heeley, Endocr Res 28, 217-229 (2002)). Конкурентный анализ может применяться для идентификации антигенсвязывающей молекулы, которая конкурирует с референсным антителом за связывание с определенным антигеном. Согласно конкретным вариантам осуществления изобретения, такая конкурирующая антигенсвязывающая молекула связывается с тем же эпитопом (например, линейным или конформационным эпитопом), что и референсная антигенсвязывающая молекула. Подробное описание способов картирования эпитопов, с которыми связывается антигенсвязывающая молекула, представлено у Morris (1996) "Epitope Mapping Protocols", in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ). Во время стандартного конкурентного анализа иммобилизованный антиген инкубируют в растворе, содержащем первую меченую антигенсвязывающую молекулу, которая связывается с антигеном, и вторую немеченую антигенсвязывающую молекулу, которая как раз тестируется на способность конкурировать с первой антигенсвязывающей молекулой за связывание с антигеном. Вторая антигенсвязывающая молекула может находиться в супернатанте гибридомы. В качестве контроля иммобилизованный антиген инкубируют в растворе, содержащем только первую меченую антигенсвязывающую молекулу, без второй немеченой антигенсвязывающей молекулы. После инкубации в условиях, обеспечивающих связывание первого антитела с антигеном, избыточное количество несвязавшегося антитела удаляют и измеряют количество метки, связанной с иммобилизованным антигеном. Если количество метки, связанной с иммобилизованным антигеном, значительно снижено в тестовом образце по сравнению с контрольным образцом, это указывает на то, что вторая антигенсвязывающая молекула конкурирует с первой антигенсвязывающей молекулой за связывание с антигеном. См. Harlow и Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY)
Содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению, полученная, как раскрыто в настоящем описании, может затем подвергаться очистке при помощи способов, хорошо известных специалистам в данной области, таких, как высокоэффективная жидкостная хроматография, ионообменная хроматография, гель-электрофорез, аффинная хроматография, эксклюзионная хроматография и проч. Конкретные условия очистки определенного белка будут зависеть отчасти от таких факторов как суммарный заряд, гидрофобность, гидрофильность и т.д., и будут очевидны специалистам в данной области. Для очистки антитела с помощью аффинной хроматографии могут использоваться лиганд, рецептор и антиген, с которыми связывается содержащая 4-1BBL тример антигенсвязывающая молекула. Например, для очистки слитых белков по изобретению с помощью аффинной хроматографии, может применяться матрица с белком А или белком G. Последовательная аффинная хроматография с Белком А или G, а также эксклюзионная хроматография в большинстве случаев может применяться для выделения антигенсвязывающей молекулы, как описано в Примерах. Степень очистки содержащей 4-1BBL тример антигенсвязывающей молекулы или ее фрагментов может быть определена любым из множества хорошо известных аналитических методов, включая гель-электрофорез, жидкостную хроматографию высокого давления и проч. Например, содержащие 4-1BBL тример антигенсвязывающие молекулы, экспрессируемые, как описано в Примерах, как было показано, являются интактными и организуются правильно, что было подтверждено с помощью восстанавливающего и невосстанавливающего ДНС-ПААГ (электрофореза в полиакриламидном геле).
Исследования
Антигенсвязывающие молекулы, представленные в настоящем изобретении, могут быть идентифицированы, изучены или подвергнуты скринингу в отношении физических/химических свойств и/или биологической активности при помощи различных исследований, хорошо известных из области техники. Под биологической активностью может подразумеваться, например, способность усиливать активацию и/или пролиферацию различных иммунных клеток, в частности, Т-клеток. Например, они усиливают секрецию иммуномодулирующих цитокинов. К другим иммуномодулирующим цитокинам, активность которых может быть усилена, относятся ИЛ2, Гранзим В и т.д. Биологическая активность также может включать перекрестную реактивность с антителами яванской макаки, а также связывание с клетками разных типов. Антигенсвязывающие молекулы, обладающие такой биологической активностью in vivo и/или in vitro, также предлагаются в настоящем изобретении.
1. Исследования аффинности
Аффинность содержащей 4-1BBL-тример антигенсвязывающей молекулы, заявленной в настоящем изобретении, по отношению к 4-1ВВ (CD137) может быть определена в соответствии с методами, описанными в настоящем описании в разделе Примеры, такими, как поверхностный плазмонный резонанс (SPR) с применением стандартных приборов, таких, как прибор BIAcore (GE Healthcare), а также рецепторных и таргетных белков, которые могут быть получены при помощи рекомбинантной экспрессии. Аффинность содержащей 4-1BBL тример антигенсвязывающей молекулы к HER2 также может быть определена при помощи поверхностного плазмонного резонанса (SPR), с применением стандартных приборов, таких, как прибор BIAcore (GE Healthcare), а также рецепторных и таргетных белков, которые могут быть получены при помощи рекомбинантной экспрессии. Конкретный иллюстративный и примерный вариант измерения аффинности связывания описан в Примере 4. Согласно одному аспекту, KD измеряют при помощи поверхностного плазмонного резонанса с использованием прибора BIACORE® Т100 (GE Healthcare) при 25 С.
2. Анализ связывания и другие исследования
Связывание содержащей 4-1BBL тример антигенсвязывающей молекулы, заявленной в настоящем изобретении, с соответствующими рецепторами, экспрессируемыми на поверхности клеток, может оцениваться с использованием клеточных линий, экспрессирующих определенный рецептор или таргетный антиген, например, с помощью проточной цитометрии (FACS). Согласно одному аспекту, свежие мононуклеарные клетки периферической крови (МКПК), экспрессирующие 4-1ВВ, могут использоваться в анализе связывания. Эти клетки используют сразу же после выделения (нативные МКПК) или после стимуляции (активированные МКПК). Согласно другому аспекту, активированные мышиные спленоциты (экспрессирующие 4-1ВВ) могут применяться для того, чтобы продемонстрировать способность содержащих 4-1BBL тример антигенсвязывающих молекул по изобретению связываться с 4-1ВВ экспрессирующими клетками.
Согласно дополнительному аспекту настоящего изобретения, клеточные линии, экспрессирующие Her2, применялись для демонстрации связывания антигенсвязывающих молекул с указанным таргетным клеточным антигеном.
Согласно другому аспекту, конкурентный анализ может использоваться для идентификации антигенсвязывающей молекулы, которая конкурирует со специфическим антителом или антигенсвязывающей молекулой за связывание с Her2 или 4-1ВВ, соответственно. Согласно конкретным вариантам осуществления изобретения, такая конкурирующая антигенсвязывающая молекула связывается с тем же эпитопом (например, линейным или конформационным эпитопом), что и специфическое анти-Her2 антитело или специфическое 4-1ВВ антитело. Детальное описание примерных способов картирования эпитопов, с которым связывается антитело, описано у Morris (1996) "Epitope Mapping Protocols," in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
3. Исследование активности
Согласно одному аспекту настоящего изобретения, предлагаются способы идентификации содержащих 4-1BBL тример антигенсвязывающих молекул, которые связывают Her2 и 4-1ВВ, обладающих биологической активностью. Биологическая активность может включать, например, агонистический сигнальный путь через 4-1ВВ на раковых клетках, экспрессируюших Her2. -Содержащие 4-1BBL тример антигенсвязывающие молекулы, идентифицированные при помощи исследований, как молекулы, обладающие активностью in vivo, также предлагаются в настоящем изобретении.
Согласно конкретным аспектам, содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению, тестируют на наличие такой биологической активности. Исследования, которые используются для определения биологической активности молекул по изобретению, описаны в Примере 3. Кроме того, исследование клеточного лизиса (например, путем измерения высвобождения ЛДГ), кинетики индуцированного апоптоза (например, путем измерения активности Каспазы 3/7) или исследование апоптоза (например, при помощи TUNEL-анализа) хорошо известны специалистам в данной области. Кроме того, биологическая активность таких комплексов может оцениваться путем измерения степени их влияния на выживаемость, пролиферацию и секрецию лимфокинов различными подклассами лимфоцитов, такими, как NK клетки, NTK-клетки или γδ Т-клетки, а также путем оценки их способности изменять фенотип и функцию антигенпрезентирующих клеток, таких, как дендритные клетки, моноциты/макрофаги или В-клетки.
Фармацевтические композиции, лекарственные средства и способы введения
Согласно дополнительному аспекту, настоящее изобретение относится к фармацевтическим композициям, содержащим любую содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению, предназначенную, например, для применения согласно любому из описанных ниже терапевтических методов. Согласно одному варианту своего осуществления, фармацевтическая композиция содержит любую содержащую 4-1BBL тример антигенсвязывающую молекулу, заявленную в настоящем изобретении, и по меньшей мере один фармацевтически доступный носитель. Согласно другому варианту осуществления изобретения, фармацевтическая композиция содержит любую содержащую 4-1BBL тример антигенсвязывающую молекулу, заявленную в настоящем изобретении и, по меньшей мере, один дополнительный терапевтический агент, например, описанный ниже.
Фармацевтические композиции по настоящему изобретению содержат терапевтически эффективное количество одной или более содержащей 4-1BBL тример антигенсвязывающей молекулы, растворенной или диспергированной в фармацевтически приемлемом носителе. Фразы "фармацевтически или фармакологически доступный" относится к молекулярным структурам и композициям, которые в целом являются нетоксичными для реципиента в используемых дозировках и концентрациях, то есть не вызывают нежелательных, аллергических иди других неблагоприятных реакций при введении в организм животных, таких, как, например, человек. Фармацевтической композиции, включающая по меньшей мере одну содержащую 4-1BBL тример антигенсвязывающую молекулу и, возможно, один дополнительный активный ингредиент, будет очевидна специалисту в данной области в свете настоящего описания; примеры изложены, например, у Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, данный источник включен в настоящее описание в качестве ссылки. В частности, композиции представляют собой лиофилизированные лекарственные формы или водные растворы. Используемый в настоящем описании термин "фармацевтически приемлемый носитель" включает любой и все растворители, буферные растворы, дисперсионные среды, покрывающие агенты, сурфактанты, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, соли, стабилизаторы и их комбинации, что будет понятно специалисту в данной области.
Парентеральные композиции - это лекарственные формы, разработанные для введения путем инъекции, например, подкожной, внутрикожной, внутриочаговой, внутривенной, интраартериальной, внутримышечной, интретекальной или интраперитонеальной. Для инъекционного введения, содержащие 4-1BBL-тример антигенсвязывающие молекулы по изобретению, могут быть в составе лекарственной формы вместе с водными растворами, предпочтительно, вместе с физиологически совместимыми буферными растворами, такими, как раствор Хэнкса, раствор Рингера или физиологический солевой раствор. Раствор может содержать другие составные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, слитые белки могут быть представлены в виде порошка для последующего разведения в подходящем носителе перед применением, например, стерильной апирогенной воде. Стерильные растворы для инъекций готовят путем объединения слитых белков по настоящему изобретению в необходимом количестве с соответствующим растворителем вместе другими различными ингредиентами, перечисленными ниже, по мере необходимости. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны. Обычно дисперсии готовят путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для приготовления стерильных растворов, суспензий или эмульсий для инъекционного введения, предпочтительными методами приготовления являются методы вакуумной сушки или сублимационной сушки, которые позволяют получить порошок активного ингредиента, а также любой дополнительный желаемый ингредиент из предварительно простерилизованной фильтрацией жидкой среды. Перед инъекцией жидкая среда должна быть подходящим образом буферизована, если это необходимо, а жидкий растворитель доведен до изотонического состояния достаточным количеством солевого раствора или глюкозы. Композиция должна быть стабильной в условиях производства и хранения и защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Очевидно, что степень загрязнения эндотоксином должна поддерживаться на минимальном безопасном уровне, например, на уровне менее 0,5 нг/мг белка. Подходящие фармацевтически приемлемые эксципиенты включают, без ограничений указанными: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (менее примерно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбитол; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Водные суспензии для инъекционного введения могут содержать соединения, которые увеличивают вязкость суспензии, такие как натрий карбоксиметилцеллюлоза, сорбитол, декстран и т.п. Возможно, суспензия может также содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, что позволяет приготовить высококонцентрированные растворы. Кроме того, суспензии активных соединений могут быть приготовлены в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этиловые эфиры или триглицериды, или липосомы.
Активные ингредиенты могут быть заключены в микрокапсулы, приготовленные, например, при помощи методики коацервации или путем полимеризации на границе фаз, например, гидроксиметилцеллюлозные капсулы или желатиновые микрокапсулы и поли-(метилметацилат)ные микрокапсулы, соответственно, в коллоидных системах доставки лекарств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в микроэмульсиях. Такие технологии описаны у Remington's в Pharmaceutical Sciences (18th Ed. Mack Printing Company, 1990). Композиции с замедленным высвобождением также могут быть получены. Предпочтительные примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих полипептид, при этом матрицы находятся в форме капсулоподобных изделий, например, пленок, или микрокапсул. В конкретных вариантах осуществления изобретения, пролонгированная абсорбция композиции для инъекций может быть достигнута за счет использования в композициях агентов, замедляющих абсорбцию, таких как, например, моностеарат алюминия, желатин или их комбинации.
Примеры фармацевтически приемлемых эксципиентов в данном описании дополнительно включают интерстициальные диспергирующие агенты для лекарственных средств, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например, растворимые гликопротеины гиалуронидазы РН-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примерные sHASEGP и способы их применения, включая rHuPH20, описаны в патентных публикациях США номер 2005/0260186 и 2006/0104968. Согласно одному аспекту sHASEGP комбинируется с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных антительных составов описаны в патенте США No. 6267958. Водные антительные составы включают те, которые описаны в патенте США №6171586 и WO2006 / 044908, причем последние лекарственные формы содержат гистидин-ацетатный буфер.
В дополнение к композициям, описанным выше, слитые белки также могут быть приготовлены в виде депо-препаратов. Такие лекарственные составы длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Таким образом, например, слитые белки могут быть сформулированы с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли.
Фармацевтические композиции, содержащие слитые белки по настоящему изобретению, могут быть получены с помощью стандартных процессов смешивания, растворения, эмульгирования, инкапсулирования, улавливания или лиофилизации. Фармацевтические композиции могут быть составлены обычным способом с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые облегчают создание лекарственных форм белков, которые можно использовать в фармацевтике. Подходящая лекарственная форма зависит от выбранного пути введения.
Содержащие 4-1ВВ тример антигенсвязывающие молекулы могут быть включены в композицию в виде свободной кислоты или основания, в нейтральной форме или в форме соли.
Фармацевтически приемлемые соли представляют собой соли, которые практически полностью сохраняют биологическую активность свободной кислоты или основания. К ним относятся кислотно-аддитивные соли, например те, которые образованы со свободными аминогруппами белковой композиции или которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, винная или миндальная кислоты. Соли, образованные свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа; или такие органические основания, как изопропиламин, триметиламин, гистидин или прокаин. Фармацевтические соли обычно более растворимы в водных и других протонных растворителях, чем соответствующие формы свободного основания.
Композиции, заявленные в соответствии с настоящим изобретением, также могут содержать более одного активного ингредиента, если это необходимо для лечения конкретного состояния, подлежащего терапии; предпочтительно, указанные ингредиенты обладают комплементарными активностями, которые не оказывают нежелательного влияния друг на друга. Такие активные ингредиенты скомбинированы подходящим образом в количествах, эффективных для достижения нужной цели.
Согласно одному аспекту, фармацевтические композиции могут содержать любую содержащую 4-1BBL тример антигенсвязывающую молекулу, заявленную в настоящем изобретении, и по меньшей мере один дополнительный лекарственный агент. Согласно одному аспекту, фармацевтические композиции могут содержать любую содержащую 4-1BBL тример антигенсвязывающую молекулу, заявленную в настоящем изобретении, и, активирующее Т-клетки анти-CD3 биспецифическое антитело, конкретнее, анти-Her2/анти-CD3 антитело.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит первый антигенсвязывающий домен, который связывается с CD3, и второй антигенсвязывающий домен, который связывается с Her2. Согласно конкретному варианту осуществления изобретения, второй антигенсвязывающий домен, связывающийся с Her2, связывается с другим эпитопом на поверхности Her2, чем содержащая 4-1BBL тример антигенсвязывающая молекула.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело, используемое в настоящем изобретении, содержит первый антигенсвязывающий домен, содержащий вариабельный участок тяжелой цепи (VHCD3), включающий CDR-H1 с последовательностью SEQ ID NO: 91, CDR-H2 с последовательностью SEQ ID NO: 92, и CDR-H3 с последовательностью SEQ ID NO: 93; и/или вариабельный участок легкой цепи (VLCD3), включающий CDR-L1 с последовательностью SEQ ID NO: 94, CDR-L2 с последовательностью SEQ ID NO: 95, и CDR-L3 с последовательностью SEQ ID NO: 96. Более конкретно, анти-Her2/анти-CD3 биспецифическое антитело содержит первый антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHCD3), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 97 и/или вариабельный участок легкой цепи (VLCD3), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 98. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит вариабельный участок тяжелой цепи (VHCD3) с аминокислотной последовательностью SEQ ID NO: 97 и/или вариабельный участок легкой цепи (VLCD3) с аминокислотной последовательностью SEQ ID NO: 98.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 4D5 (его гуманизированная версия известна как трастузумаб). Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 2С4 (его гуманизированная версия известна как пертузумаб). Согласно еще одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 7С2 (патент США номер 9,518,118).
Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий
(a) вариабельный участок тяжелой цепи (VHHer2), включающий CDR-H1 с последовательностью SEQ ID NO: 21, CDR-H2 с последовательностью SEQ ID NO: 22, и CDR-H3 с последовательностью SEQ ID NO: 23, и/или вариабельный участок легкой цепи (VLHer2) включающий CDR-L1 с последовательностью SEQ ID NO: 24, CDR-L2 с последовательностью SEQ ID NO: 25, и CDR-L3 с последовательностью SEQ ID NO: 26, или
(b) вариабельный участок тяжелой цепи (VHHer2), включающий CDR-H1 с последовательностью SEQ ID NO: 13, CDR-H2 с последовательностью SEQ ID NO: 14, и CDR-H3 с последовательностью SEQ ID NO: 15, и/или вариабельный участок легкой цепи (VLHer2) включающий CDR-L1 с последовательностью SEQ ID NO: 16, CDR-L2 с последовательностью SEQ ID NO: 17, и CDR-L3 с последовательностью SEQ ID NO: 18, или
(c) вариабельный участок тяжелой цепи (VHHer2), включающий CDR-H1 с последовательностью SEQ ID NO: 99, CDR-H2 с последовательностью SEQ ID NO: 100, и CDR-H3 с последовательностью SEQ ID NO: 101, и/или вариабельный участок легкой цепи (VLHer2) включающий CDR-L1 с последовательностью SEQ ID NO: 102, CDR-L2 с последовательностью SEQ ID NO: 103, и CDR-L3 с последовательностью SEQ ID NO: 104.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 27 и/или вариабельный участок легкой цепи (VLHer2) который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 28. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 27 и/или вариабельный участок легкой цепи (VLHer2), содержащий аминокислотную последовательность SEQ ID NO: 28. Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 19 и/или вариабельный участок легкой цепи (VLHer2) который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 20.
Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 19, и/или вариабельный участок легкой цепи (VLCEA), содержащий аминокислотную последовательность SEQ ID NO: 20. Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 105 и/или вариабельный участок легкой цепи (VLHer2) который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 106. Согласно еще одному варианту осуществления изобретения, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 105, и/или вариабельный участок легкой цепи (VLCEA), содержащий аминокислотную последовательность SEQ ID NO: 106. Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит первый антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHCD3), содержащий аминокислотную последовательность SEQ ID NO: 97 и/или вариабельный участок легкой цепи (VLCD3), содержащий аминокислотную последовательность SEQ ID NO: 98, и второй антигенсвязывающий домен, содержащий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 27, и/или вариабельный участок легкой цепи (VLHer2), содержащий аминокислотную последовательность SEQ ID NO: 28.
Лекарственные формы, которые могут применяться для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, при помощи фильтрации через стерильные фильтрационные мембраны.
Терапевтические методы и лекарственные композиции
Любая из содержащих 4-1BBL тример антигенсвязывающих молекул, заявленных в соответствии с настоящим изобретением, может применяться в терапевтических способах.
Для применения в терапевтических способах содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению могут быть приготовлены, дозированы и введены в соответствии со способами, принятыми в клинической практике. К факторам, которые следует учитывать в этом контексте, относятся: конкретное заболевание, которое подлежит лечению, конкретное млекопитающее, которому проводят лечение, клиническое состояние конкретного пациента, причина расстройства, место доставки агента, способ введения, режим введения и другие факторы, известные практикующим врачам.
Согласно одному аспекту, предлагаются содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению для применения в качестве лекарственных средств. Согласно дополнительным аспектам, предлагаются содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению, предназначенные для применения в лечении заболевания, в частности, для применения в лечении рака. Согласно определенным аспектам, предлагаются содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению, предназначенные для применения согласно заявленному способу лечения. Согласно одному аспекту, настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающим молекулам, как раскрыто в настоящем описании, предназначенным для применения в лечении заболевания у индивидуума, нуждающегося в этом. Согласно конкретным аспектам, настоящее изобретение относится к содержащим 4-1BBL тример антигенсвязывающим молекулам, предназначенным для применения согласно способу лечения заболевания у индивидуума, включающему введение индивидууму терапевтически эффективного количества слитого белка. Согласно определенным аспектам, заболевание представляет собой Her2-позитивный рак. Примерами Her2-позитивных раков являются рак молочной железы, рак яичников, рак желудка, рак мочевого пузыря, рак слюнных желез, рак эндометрия, рак поджелудочной железы и немелкоклеточный рак легкого (NSCLC). Согласно одному аспекту, Her2-позитивный рак представляет собой Her2+ позитивный рак молочной железы, в частности, ранний или местнораспространенный Her2+ позитивный рак молочной железы. Таким образом, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, описанная в настоящем описании, предназначенная для применения согласно способу лечения указанных типов рака. Субъект, пациент или "индивидуум", нуждающийся в лечении, обычно представляет собой млекопитающее, конкретнее, человека.
Согласно другому аспекту, в настоящем изобретении предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, описанная в настоящем описании, предназначенная для применения согласно способу лечения инфекционных заболеваний, в частности, вирусных инфекций. Согласно дополнительному аспекту, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, описанная в настоящем описании, предназначенная для применения согласно способу лечения аутоиммунных заболеваний, таких как, например, системная красная волчанка.
Согласно дополнительному аспекту, настоящее изобретение относится к применению содержащих 4-1BBL-тример антигенсвязывающих молекул для производства или подготовки лекарственной формы и лекарственного средства для лечения заболевания у индивидуума, нуждающегося в этом. Согласно одному аспекту изобретения, лекарственное средство предназначено для применения согласно способу лечения заболевания, включающему введение индивидууму с заболеванием терапевтически эффективного количества этого лекарственного средства. Согласно определенному варианту осуществления изобретения, заболевание, которое подлежит лечению, представляет собой пролиферативное заболевание, конкретнее, рак. Таким образом, согласно одному аспекту, настоящее изобретение относится к применению содержащих 4-1BBL тример антигенсвязывающих молекул по изобретению для производства или приготовления лекарственного средства для лечения рака, конкретнее, Her2-позитивных типов рака. Примерами Her2-позитивных раков являются рак молочной железы, рак яичников, рак желудка, рак мочевого пузыря, рак слюнных желез, рак эндометрия, рак поджелудочной железы и немелкоклеточный рак легкого (NSCLC). Согласно определенным аспектам, раком, который подлежит лечению, является Her2-позитивный рак молочной железы, конкретнее, Her2-позитивный метастатический рак молочной железы. Квалифицированному специалисту понятно, что в некоторых случаях 4-1BBL тример содержащая антигенсвязывающая молекула не вылечивает заболевание, а лишь дает частичное облегчение. В некоторых случаях, физиологические изменения, дающие частичное облегчение, все равно рассматриваются как терапевтически благоприятные. Таким образом, согласно некоторым аспектам, количество содержащей 4-1BBL тример антигенсвязывающей молекулы, которое обеспечивает физиологические изменения считается "эффективным количеством" или "терапевтически эффективным количеством".
Согласно дополнительному аспекту, настоящее изобретение относится к способу лечения заболевания у индивидуума, включающему введение указанному индивидууму терапевтически эффективного количества содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению. Согласно одному аспекту, указанному индивидууму вводится композиция, содержащая слитый белок по изобретению, в фармацевтически доступной форме. Согласно конкретным аспектам, заболевание, которое подлежит лечению, представляет собой пролиферативное заболевание. Согласно конкретному варианту осуществления изобретения, таким заболеванием является рак. Согласно определенным аспектам, способ дополнительно включает введение индивидууму терапевтически эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, противоопухолевого агента, в том случае, если заболевание представляет собой рак. "Индивидуум", согласно любому из указанных выше вариантов осуществления изобретения, представляет собой млекопитающее, предпочтительно, человека.
Для профилактики или лечения заболевания, подходящая дозировка содержащей 4-1BBL тример антигенсвязывающей молекулы по изобретению (при использовании отдельно или в комбинации с одним или более дополнительным лекарственным агентом) будет зависеть от типа заболевания, которое подлежит лечению, способа введения лекарственного средства, массы тела пациента, типа антигенсвязывающей молекулы, тяжести и течения заболевания, целей введения слитого белка (лечебных или профилактических), предшествующих и сопутствующих лечебных вмешательств, клинического анамнеза пациента и ответа на введение слитого белка, а также от соображений лечащего врача. Практикующий врач, ответственный за введение, в любом случае будет определять концентрацию активного ингредиента(ов) в композиции и подходящую дозу (ы) для конкретного субъекта. Различные режимы дозирования, включая, без ограничений указанными, однократное или многократное введение в различные временные точки, болюсное введение или пульс-терапию, подразумеваются в настоящем изобретении.
Содержащая 4-1BBL тример антигенсвязывающая молекула вводится пациенту однократно или в течение курса лечения. В зависимости от типа и тяжести заболевания, приблизительно, от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг-10 мг/кг) содержащей 4-1BBL тример антигенсвязывающей молекулы может являться начальной потенциальной дозой для введения пациенту, например, однократно или посредством многократных введений, или путем продолжительной инфузии. Стандартная дневная доза может составлять, приблизительно, от 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, перечисленных выше. При повторных введениях в течение нескольких дней и дольше, в зависимости от состояния, лечение, как правило, продолжается до тех пор, пока не произойдет желаемое облегчение симптомов заболевания. Одна примерная доза слитого белка находится в диапазоне, приблизительно, от 0,005 мг/кг до приблизительно 10 мг/кг. В других примерах доза может также составлять, приблизительно 1 мкг/кг массы тела, приблизительно 5 мкг/кг массы тела, приблизительно 10 мкг/кг массы тела, приблизительно 50 мкг/кг массы тела, приблизительно 100 мкг/кг массы тела, приблизительно 200 мкг/кг массы тела, приблизительно 350 мкг/кг массы тела, приблизительно 500 мкг/кг массы тела, приблизительно 1 мг/кг массы тела, приблизительно 5 мг/кг массы тела, приблизительно 10 мг/кг массы тела, приблизительно 50 мг/кг массы тела, приблизительно 100 мг/кг массы тела, приблизительно 200 мг/кг массы тела, приблизительно 350 мг/кг массы тела, приблизительно 500 мг/кг массы тела, до приблизительно 1000 мг/кг массы тела или даже более для однократного введения, а также находиться в любом перечисленном выше диапазоне. На основании чисел, приведенных выше, доза для введения пациенту может находиться в следующих диапазонах, например, приблизительно, от 5 мг/кг массы тела до, приблизительно 100 мг/кг массы тела, или, приблизительно, от 5 мкг/кг массы тела до, приблизительно, 500 мг/кг массы тела и т.д. Таким образом, пациенту может быть введена одна или более доза, составляющая, приблизительно, 0,5 мг/кг, 2,0 мг/кг, 5,0 мг/кг или 10 мг/кг (или любые их комбинации). Указанные дозы могут вводиться с перерывами, например, каждую неделю или каждые три недели (например, таким образом, чтобы пациент получал, приблизительно, от двух до двенадцати доз или, например, приблизительно шесть доз слитого белка). Может быть сразу введена начальная ударная доза с последующим введением одной или более низкой дозы. Однако и другие режимы дозирования могут быть подходящими. Эффективность такого лечения легко оценивается при помощи стандартных процедур и анализов.
Содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению обычно будет применяться в количестве, достаточном для достижения поставленной цели. При применении для профилактики или лечения заболевания, содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению или фармацевтическая композиция с ней в составе, будет вводиться или применяться в терапевтически эффективном количестве. Определение терапевтически эффективного количества находится в рамках компетенции специалистов в данной области, особенно в свете подробного описания, представленного здесь.
Для системного введения терапевтически эффективная доза может быть изначально определена путем исследований in vitro, таких, как исследование в культуре клеток. Затем на животных моделях может быть подобрана дозировка для достижения диапазона циркулирующих концентраций, который включает IC50, определенную в культуре клеток. Такую информацию можно использовать для более точного определения подходящих доз для человека.
Первичные дозировки также можно установить на основании данных, полученных in vivo, например, на животных моделях, с использованием методик, хорошо известных специалистам в данной области. Специалист в данной области легко оптимизирует введение людям на основании данных, полученных для животных.
Дозировка и интервал введения может быть подобран индивидуально для обеспечения уровня содержащей 4-1BBL тример антигенсвязывающей молекулы в плазме, который является достаточным для поддержания терапевтического эффекта. Обычно доза для инъекционного введения пациентам находится в диапазоне, приблизительно, от 0,1 до 50 мг/кг/день, обычно, приблизительно, от 0,5 до 1 мг/кг/день. Терапевтически эффективный уровень в плазме может достигаться за счет введения многократных доз ежедневно. Уровень в плазме можно измерить, например, при помощи HPLC.
В случае местного введения или селективного захвата, эффективная локальная концентрация содержащей 4-1BBL тример антигенсвязывающей молекулы может быть не связана с концентрацией в плазме. Специалист в данной области способен оптимизировать терапевтически эффективные местные дозы без излишних экспериментов.
Терапевтически эффективная доза содержащей 4-1BBL тример антигенсвязывающей молекулы, как раскрыто в настоящем описании, будет оказывать благоприятный терапевтический эффект без сопутствующего токсического действия. Токсичность и терапевтическая эффективность слитого белка может быть определена при помощи стандартных фармацевтических методик в культуре клеток или на экспериментальных животных. Исследования в культуре клеток и на животных могут применяться для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Соотношение между токсическим и терапевтическим эффектом называется терапевтическим индексом, который может быть выражен через отношение LD50/ED50. Согласно одному варианту осуществления изобретения, 4-1BBL тример содержащая антигенсвязывающая молекула по изобретению обладает высоким терапевтическим индексом. Данные, полученные на основании исследований в культуре клеток и на животных, могут использоваться для определения подходящего диапазона доз, которые могут применяться у человека. Дозировка предпочтительно находится в диапазоне циркулирующих концентраций, который включает ED50 с небольшой токсичностью или без нее. Дозировка может варьировать в пределах указанного диапазона в зависимости от множества факторов, например, используемой лекарственной формы, используемого пути введения, состояния субъекта и т.п. Точный состав, способ введения и дозировка могут быть подобраны врачом индивидуально с учетом состояния пациента (см., например, Fingl et al., 1975, в: The Pharmacological Basis of Therapeutics, Ch. 1, p. 1, источник включен в настоящее описание в качестве ссылки во всей полноте).
Лечащий врач пациентов, получающих лечение слитыми белками по изобретению, будет знать, как и когда прекратить, прервать или скорректировать введение препарата по причине токсичности, органной дисфункции и подобных нежелательных явлений. И наоборот, лечащий врач также знает, в каком случае требуется скорректировать лечение и увеличить дозы до более высоких, если клинический ответ не был адекватным (исключая токсичность). Величина вводимой дозы при лечении представляющего интерес заболевания будет варьировать в зависимости от тяжести состояния, подлежащего лечению, от пути введения и т.п. Тяжесть состояния может, например, частично оцениваться стандартными методами прогностической оценки. Кроме того, доза и, возможно, частота приема также будут варьировать в зависимости от возраста, массы тела и ответа на лечение конкретного пациента.
Другие агенты и способы лечения
Содержащие 4-1BBL тример антигенсвязывающие молекулы по изобретению могут вводиться в комбинации в одним или более терапевтическим агентом. Например, слитый белок по изобретению может вводиться совместно по меньшей мере одним дополнительным терапевтическим агентом. Термин "терапевтический агент" относится к любому агенту, который может вводиться для лечения симптома или заболевания у индивидуума, нуждающегося в подобном лечении. Такой дополнительный терапевтический агент может содержать любые пригодные активные ингредиенты, в соответствии с показаниями для лечения, по которым они вводятся, предпочтительно, агенты, обладающие комплементарными эффектами, которые не влияют друг на друга нежелательным образом. Согласно определенным вариантам осуществления изобретения, дополнительный терапевтический агент представляет собой другой противораковый агент.
Такие другие терапевтические агенты обычно присутствуют в комбинации в количествах, эффективных для достижения желаемой цели. Эффективное количество таких других терапевтических агентов зависит от количества используемой содержащей 4-1BBL тример антигенсвязывающей молекулы, типа заболевания или лечения лечению и других факторов, которые обсуждались выше. Содержащие 4-1BBL тример антигенсвязывающие молекулы обычно применяются в тех же дозировках и вводятся теми же способами, которые описаны в настоящем описании, или, в дозировках, составляющих, приблизительно, от 1 до 99% от дозировок, описанных в настоящем описании выше; либо дозировки и способы введения устанавливаются как подходящие эмпирически/клинически.
Такая комбинированная терапия, как описано выше, включает комбинированное введение (когда два или более терапевтических агента входят в состав одной или разных лекарственных форм) и отдельное введение, в случае которого, содержащая 4-1BBL тример антигенсвязывающая молекула по изобретению вводится до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта.
Таким образом, согласно одному аспекту настоящего изобретения, предлагается содержащая 4-1BBL тример антигенсвязывающая молекула, как раскрыто в настоящем описании, предназначенная для применения для лечения рака, конкретно, Her2 позитивного рака, при этом указанная содержащая 4-1BBL тример антигенсвязывающая молекула применяется в комбинации с активирующим Т-клетки CD3 биспецифическим антителом, в частности, анти-Her2/анти-CD3 биспецифическим антителом.
Согласно одному аспекту, анти-Her2/анти-CD3 антитело содержит первый антигенсвязывающий домен, который связывается с CD3, и второй антигенсвязывающий домен, который связывается с Her2. Согласно определенному аспекту, второй антигенсвязывающий домен, связывающийся с Her2, связывается с другим эпитопом на Her2, чем содержащая 4-1BBL тример антигенсвязывающая молекула.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело, как описано в настоящем изобретении, содержит первый антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHCD3), содержащий CDR-H1 с последовательностью SEQ ID NO: 91, CDR-H2 с последовательностью SEQ ID NO: 92, и CDR-H3 с последовательностью SEQ ID NO: 93; и/или вариабельный участок легкой цепи (VLCD3), включающий CDR-L1 с последовательностью SEQ ID NO: 94, CDR-L2 с последовательностью SEQ ID NO: 95, и CDR-L3 с последовательностью SEQ ID NO: 96. Конкретнее, анти-Her2/анти-CD3 биспецифическое антитело содержит первый антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VCD3), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 98. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит вариабельный участок тяжелой цепи (VHCD3), имеющий аминокислотную последовательность SEQ ID NO: 97 и/или вариабельный участок легкой цепи (VLCD3), имеющий аминокислотную последовательность SEQ ID NO: 98.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 4D5 (гуманизированная версия его известна как трастузумаб). Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 2С4 (его гуманизированная версия известна как пертузумаб). Согласно еще одному аспекту настоящего изобретения, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, который связывается с тем же эпитопом, что и антитело 7С2 (патент США No. 9,518,118).
Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий
(a) вариабельный участок тяжелой цепи (VHHer2), включающий CDR-H1 с последовательностью SEQ ID NO: 21, CDR-H2 с последовательностью SEQ ID NO: 22, и CDR-H3 с последовательностью SEQ ID NO: 23, и/или вариабельный участок легкой цепи (VLHer2), включающий CDR-L1 с последовательностью SEQ ID NO: 24, CDR-L2 с последовательностью SEQ ID NO: 25, и CDR-L3 с последовательностью SEQ ID NO: 26, или
(b) вариабельный участок тяжелой цепи (VHHer2) включающий CDR-H1 с последовательностью SEQ ID NO: 13, CDR-H2 с последовательностью SEQ ID NO: 14, и CDR-H3 с последовательностью SEQ ID NO: 15, и/или вариабельный участок легкой цепи (VLHer2) включающий CDR-L1 с последовательностью SEQ ID NO: 16, CDR-L2 с последовательностью SEQ ID NO: 17, и CDR-L3 с последовательностью SEQ ID NO: 18, или
(c) вариабельный участок тяжелой цепи (VHHer2) включающий CDR-H1 с последовательностью SEQ ID NO: 99, CDR-H2 с последовательностью SEQ ID NO: 100, и CDR-H3 с последовательностью SEQ ID NO: 101, и/или вариабельный участок легкой цепи (VLHer2) включающий CDR-L1 с последовательностью SEQ ID NO: 102, CDR-L2 с последовательностью SEQ ID NO: 103, и CDR-L3 с последовательностью SEQ ID NO: 104.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 27 и/или вариабельный участок легкой цепи (VLHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 28. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, содержащий вариабельный участок тяжелой цепи (VHHer2) с аминокислотной последовательностью SEQ ID NO: 27 и/или вариабельный участок легкой цепи (VLHer2), включающий аминокислотную последовательность SEQ ID NO: 28. Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 19 и/или вариабельный участок легкой цепи (VLHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 20. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, содержащий вариабельный участок тяжелой цепи (VHHer2), включающий аминокислотную последовательность SEQ ID NO: 19, и/или вариабельный участок легкой цепи (VLCEA), включающий аминокислотную последовательность SEQ ID NO: 20. Согласно другому аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, содержащий вариабельный участок тяжелой цепи (VHHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 105 и/или вариабельный участок легкой цепи (VLHer2), который по меньшей мере на 90%, 95%, 96%, 97%, 98%, или 99% идентичен аминокислотной последовательности SEQ ID NO: 106. Согласно дополнительному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 105, и/или вариабельный участок легкой цепи (VLCEA), содержащий аминокислотную последовательность SEQ ID NO: 106.
Согласно одному аспекту, анти-Her2/анти-CD3 биспецифическое антитело содержит первый антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHCD3), содержащий аминокислотную последовательность SEQ ID NO: 97, и/или вариабельный участок легкой цепи (VLCD3), содержащий аминокислотную последовательность SEQ ID NO: 98, и второй антигенсвязывающий домен, включающий вариабельный участок тяжелой цепи (VHHer2), содержащий аминокислотную последовательность SEQ ID NO: 27, и/или вариабельный участок легкой цепи (VLHer2) с аминокислотной последовательностью SEQ ID NO: 28.
Согласно дополнительному аспекту, содержащая 4-1BBL тример антигенсвязывающая молекула применяется в комбинации с активирующим Т-клетки анти-CD3 биспецифическим антителом, при этом активирующее Т-клетки анти-CD3 биспецифическое антитело вводится одновременно, до или после введения содержащей 4-1BBL тример антигенсвязывающей молекулы.
Согласно дополнительному аспекту, предлагается применение содержащей 4-1BBL тример антигенсвязывающей молекулы для производства лекарственного средства, предназначенного для лечения рака, при этом содержащая 4-1BBL-тример антигенсвязывающая молекула применяется в комбинации с активирующим Т-клетки CD3 биспецифическим антителом, конкретно, с анти-Her2/анти-CD3 биспецифическое антителом. Согласно определенным аспектам, заболевание, которое подлежит лечению, представляет собой Her2-позитивный рак. Примерами Her2-позитивных раков являются рак молочной железы, рак яичников, рак желудка, рак мочевого пузыря, слюнной железы, рак эндометрия, рак поджелудочной железы и немелкоклеточный рак легкого (NSCLC). Согласно определенным аспектам, раком, который подлежит лечению, является Her2-позитивный метастатический рак молочной железы.
Согласно дополнительному аспекту, настоящее изобретение относится к способу лечения рака у индивидуума, включающему введение указанному индивидууму терапевтически эффективного количества содержащей 4-1BBL-тример антигенсвязывающей молекулы по изобретению, а также эффективного количества активирующего Т-клетки анти-CD3 биспецифического антитела, конкретно, анти-Her2/анти-CD3 биспецифического антитела, как определено выше. Согласно определенным аспектам, способ предназначен для лечения Her2-позитивных раков. Примерами Her2-позитивных раков являются: молочной железы, рак яичников, рак желудка, рак мочевого пузыря, рак слюнной железы, рак эндометрия, рак поджелудочной железы и немелкоклеточный рак легкого (NSCLC). Согласно одному аспекту, способ предназначен для лечения Her2-позитивного метастатического рака молочной железы.
Промышленные изделия
Согласно другому аспекту, настоящее изобретение относится к промышленному изделию, включающему материалы, полезные для лечения, профилактики и/или диагностики заболеваний, описанных выше. Промышленное изделие включает контейнер и этикетку или листок-вкладыш, расположенный внутри контейнера или связанный с контейнером. Подходящими контейнерами являются, например, пузырьки, флаконы, шприцы, мешки для внутривенных растворов и т.д. Контейнеры могут быть сделаны из различных материалов, таких, как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, профилактики и/или диагностики заболевания; а также стерильный порт для доступа (например, контейнер может представлять собой мешок для внутривенных растворов или флакон, имеющий пробку, которую протыкают инъекционной иглой). По крайней мере, один активный агент в составе композиции представляет собой содержащую 4-1BBL тример антигенсвязывающую молекулу по изобретению.
Этикетка или листок вкладыш указывают на то, что композиция применяется для лечения выбранных состояний. Кроме того, промышленное изделие может включать (а) первый контейнер, содержащий композицию, при этом композиция включает содержащую 4-1BBL тример антигенсвязывающую молекулу; и (b) второй контейнер, содержащий композицию, при этом указанная композиция включает дополнительный цитотоксический или другой терапевтический агент. Промышленное изделие согласно данному варианту осуществления изобретения может дополнительно содержать листок-вкладыш, указывающий на то, что композиция может применяться для лечения определенного заболевания.
Альтернативно или дополнительно, промышленное изделие может дополнительно включать второй (или третий) контейнер, содержащий фармацевтически доступный буфер, такой, как вода для инъекций с бактериостатическими свойствами (BWFI), физиологический раствор с фосфатным буфером, раствор Рингера или раствор декстрозы. Оно также может дополнительно включать другие материалы в зависимости от коммерческих целей и пожеланий пользователя, включая другие буферные растворы, растворители, фильтры, игры и шприцы.

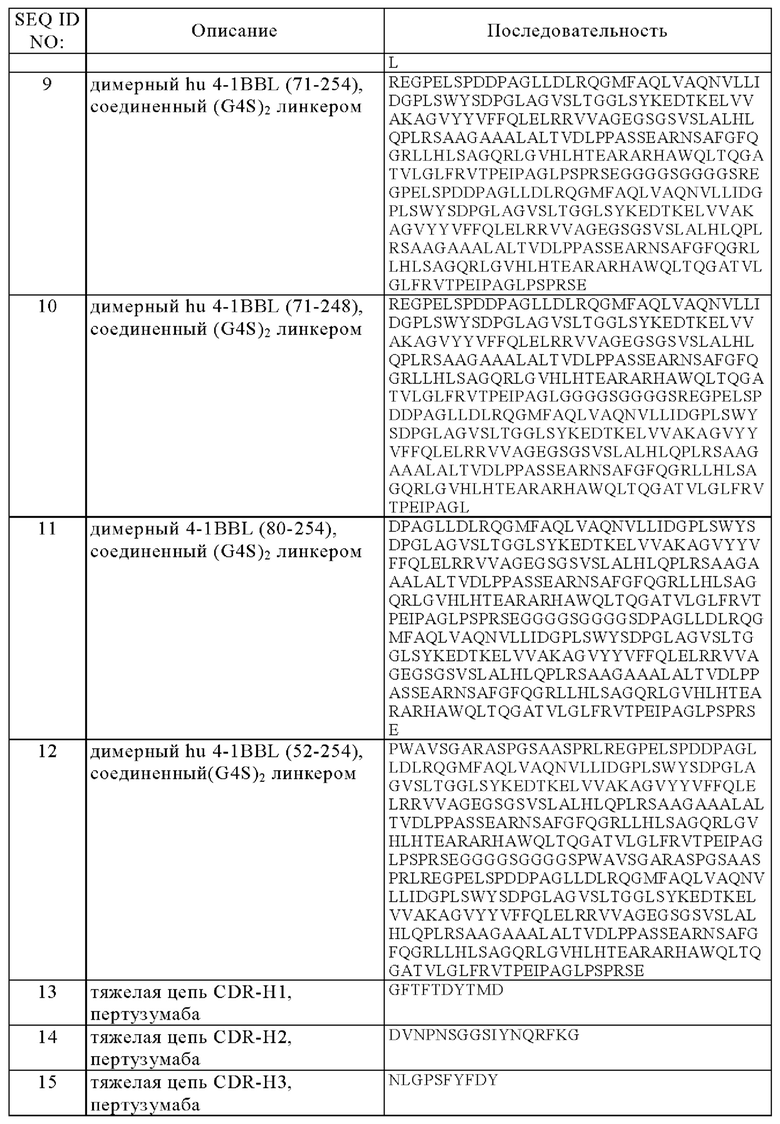

Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей иммуноглобулинов дана у Kabat, Е.А., и соавт., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991). Аминокислоты и цепи антител пронумерованы и обозначены согласно системе нумерации EU по Кабату (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)) как определено выше.
ПРИМЕРЫ
Ниже приведены примеры способов и композиций, заявленных в соответствии с настоящим изобретением. Понятно, что другие различные варианты осуществления изобретения также могут быть применены на практике с учетом представленного выше общего описания.
Рекомбинантные ДНК технологии
Для манипуляций с ДНК применяли стандартные методики, как описано у Sambrook et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярные биологические реагенты применяли в соответствии с инструкцией производителя. Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей иммуноглобулина человека дана у Kabat, Е.А. и соавт., (1991) Sequences of Proteins of Immunological Interest, Fifth Ed., NIH Publication No 91-3242.
Секвенирование ДНК
ДНК последовательности определяли с помощью двуцепочечного секвенирования.
Синтез генов
Необходимые сегменты генов генерировали как при помощи ПЦР с применением подходящих матриц, так и синтезировали в Geneart AG (Regensburg, Germany) из синтетических олигонуклеотидов и ПЦР продуктов с помощью автоматического синтеза генов. В тех случаях, когда конкретная генная последовательность не была доступна, конструировали олигонуклеотидные праймеры на основании последовательностей наиболее близких гомологов и гены выделяли при помощи ПЦР в реальном времени из РНК, происходящей из подходящей ткани. Сегменты генов, фланкированные единичными рестрикционными сайтами расщепления эндонуклеазы, клонировали в стандартных клонирующих/секвенирующих векторах. Плазмидную ДНК очищали от трансформированных бактерий, а концентрацию определяли при помощи УФ спектроскопии. ДНК последовательность субклонированных генных фрагментов подтверждали секвенированием ДНК. Генные сегменты конструировали с подходящими рестрикционными сайтами для обеспечения субклонирования в соответствующие векторы экспрессии. Все конструкты создавали с 5'-концевой ДНК последовательностью, кодирующей лидерный пептид, направляющий секрецию белков в эукариотических клетках. Методики культивирования клеток
Стандартные методики культивирования клеток применяли согласно тому, что описано в текущих протоколах клеточной биологии (2000), Bonifacino, J.S., Dasso, М., Harford, J.В., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.
Очистка белков
Белки очищали от супернатантов после фильтрации клеточной культуры в соответствии со стандартными протоколами. Вкратце, антитела наносили на колонку с Белок А Сефарозой (GE healthcare) и отмывали с помощьюРВв. Элюирование антител достигалось при рН 2,8 с последующей незамедлительной нейтрализацией образца. Агрегированный белок отделяли от мономерных антител с помощью эксклюзионной хроматографии (200, GE Healthcare) в PBS или в 20 мМ гистидина, 150 мМ NaCl рН 6.0. Фракции мономерных антител объединяли, концентрировали (при необходимости) с использованием, например, центрифугирующего концентратора MILLIPORE Amicon Ultra (30 MWCO), замораживали и хранили при -20°С или -80°С. Часть образцов отбирали для последующего белкового анализа и аналитического исследования, например, с помощью, электрофореза в полиакриламидном геле, эксклюзионной хроматографии или масс-спектрометрии Superdex ДНС-ПААГ (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия)
Гелевую систему NuPAGE® Pre-Cast (Invitrogen) использовали в соответствии с инструкцией производителя. Конкретнее, использовали 10% или 4-12% NuPAGE® Novex® Bis-TRIS Pre-Cast гели (рН 6.4) и NuPAGE® MES (восстановленные гели с NuPAGE® антиоксидантным подвижным добавочным буфером) или MOPS (невосстановленные гели) с подвижным буфером.
Аналитическая эксклюзионная хроматография
Эксклюзионную хроматографию по размеру (SEC) для определения агрегации и олигомерного состояния антител проводили с помощью HPLC хроматографии. Вкратце, очищенные с помощью Белка А антитела наносили на колонку Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KH2PO4/K2HPO4, рН 7.5 на систему Agilent HPLC 1100 или на колонку Superdex 200 (GE Healthcare) с 2×PBS в системе Dionex HPLC. Элюированный белок подсчитывали с помощью поглощения УФ и интеграции пиковых областей. В качестве стандарта использовали. BioRad Gel Filtration Standard 151 1901.
Пример 1
Создание и получение Her-2-таргетных 4-1ВВ агонистических антигенсвязывающих молекул
1.1 Создание и получение Her-2-таргетных, содержащих 4-1ВВ тримерный лиганд, слитый с Fc, агонистических антигенсвязывающих молекул
Связывающие Her-2 молекулы, которые были использованы для нацеливания тримерного 4-1ВВ лиганда, представляли собой пертузумаб (далее называемый PER), трастузумаб (TRAS) и аффинно зрелый пертузумаб (aff-PER), как описано в заявке WO 2015/091738.
Последовательности ДНК вариабельного участка тяжелой и легкой цепи, кодирующие молекулу, специфически связывающую Her-2, субклонировали в рамке считывания с последовательностями, кодирующими константный участок тяжелой цепи с модификацией "впадина" или константный участок легкой цепи IgG1 человека.
Последовательность ДНК, кодирующую часть эктодомена (аминокислоты 71-248) лиганда 4-1ВВ человека, синтезировали согласно последовательности Р41273 базы данных Uniprot.
Полипептид, содержащий два эктодомена лиганда 4-1ВВ, разделенные линкерами (G4S)2, и слитый с доменом IgG1-CL человека, клонировали, как показано на Фигуре 1А: лиганд 4-1ВВ человека, коннектор (G4S)2, лиганд 4-1ВВ человека, коннектор (G4S)2, CL человека.
Полипептид, содержащий один эктодомен лиганда 4-1ВВ и слитый с доменом IgG1-CH человека, клонировали, как показано на Фигуре 1В: лиганд 4-1ВВ человека, коннектор (G4S)2, СН человека.
Для улучшения корректного спаривания следующие мутации были введены в перекрестно-сшиваемый CH-CL. В димерный лиганд 4-1ВВ, слитый с CL человека, были введены мутации E123R и Q124K. В мономерном 4-1ВВ лиганде, слитом с СН1 человека, мутации К147Е и K213E были клонированы в домене СН1 человека, как описано в международной заявке WO 2015/150447.
Последовательности ДНК вариабельного участка тяжелой и легкой цепи, кодирующие молекулы, специфически связывающие Her-2 (PER, TRAS aff-PER, субклонировали в рамке считывания с последовательностями, кодирующими константный участок тяжелой цепи, содержащей модификацию по типу "впадина", или константный участок легкой цепи IgG1 человека.
В Fc домене мутации P329G, L234G и L235A были введены в константный участок тяжелых цепей с модификацией "выступ" и "впадина" для аннулирования связывания с Fc гамма-рецепторами согласно методу, описанному в международной заявке WO 2012/130831. Комбинация димерного лиганда с Fc-цепью с модификацией "выступ", содержащей мутации S354C/T366W, мономерного слитого СН1, таргетной цепи анти-Her2-Fc с модификацией "впадина", содержащей мутации Y349C/T366S/L368A/Y407V, и легкой цепи анти-Her2, обеспечивающая создание гетеродимера, включающего собранный тримерный 4-1ВВ лиганд и Her2 связывающий Fab, приведена на Фигуре 2А.
В Таблице 1 показаны аминокислотные последовательности моновалентных анти-Her2 (PER) антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд,слитый с Fc (kih), и содержащих кроссовер СН1-CL и заряженные остатки. Молекула обозначена как Her2(PER)-4-1BBL.
В Таблице 2 показаны аминокислотные последовательности моновалентных анти-Her2 (TRAS) антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc (kih), и содержащих кроссовер CH1-CL и заряженные остатки. Молекула обозначена как Her2(TRAS)-4-1BBL.
В Таблице 3 показаны аминокислотные последовательности моновалентных анти-Her2 (aff-PER) антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc (kih), и содержащих кроссовер CH1-CL и заряженные остатки. Молекула обозначена как Her2(aff-PER)-4-1BBL



Биспецифические конструкции были получены путем контрансфекции клеток HEK293-EBNA векторами экспрессии млекопитающих при использовании полиэтиленимина. Клетки трансфицировали соответствующими векторами в соотношении 1:1:1:1 ("вектор 4-1BBL Fc-цепь с модификацией выступ": "вектор 4-1BBL легкая цепь": "вектор Fc-цепь с модификацией впадина": "вектор легкая цепь").
Конструкции получали в шейкерных флаконах с помощью клеток HEK293-EBNA. Для трансфекции клетки центрифугировали и среду заменяли на предварительно подогретую среду CD СНО. Векторы экспрессии перемешивали в среде CD СНО, добавляли PEI, раствор перемешивали в вортексе и инкубировали в течение 10 мин при комнатной температуре. Далее клетки смешивали с раствором DNA/PEI, переносили в шейкерные флаконы и инкубировали в течение 3 ч при 37°С в термостате в атмосфере 5% СО2. После инкубации добавляли минимальную среду с добавками. Через день после трансфекции добавляли 12% питательной среды. После культивирования в течение 7 дней собирали клеточный супернатант центрифугированием. Раствор стерилизовали фильтрованием, добавляли азид натрия до конечной концентрации 0,01% (вес/объем) и выдерживали при 4°С.
Секретируемые белки очищали из супернатантов клеточной культуры аффинной хроматографией при использовании белка А и далее хроматографией с исключением по размеру. Для аффинной хроматографии супернатант наслаивали на колонку MabSelect SuRe с белком A (GE Healthcare), уравновешенную 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5. Несвязавшийся белок удаляли путем отмывания уравновешивающим буфером. Связавшийся белок элюировали при использовании градиента элюции, создаваемого с помощью 20 мМ цитрата натрия, 100 мМ хлорида натрия, 100 мМ глицина, рН 3,0. РН собранных фракций доводили путем добавления 1/10 (объем/объем) 0,5 М фосфата натрия, рН 8,0. Белок концентрировали и фильтровали до наслаивания на колонку HiLoad Superdex 200 (GE Healthcare), уравновешенную 20 мМ гистидина, 140 мМ хлорида натрия, рН 6,0.
Концентрацию белка очищенных конструкций определяли измерением OD при 280 нм при использовании коэффициента молярной экстинции, вычисленного на основе аминокислотной последовательности. Чистоту и молекулярный вес биспецифических конструкций анализировали путем CE-SDS в присутствии и в отсутствие восстанавливающего агента (Invitrogen, USA) с использованием LabChipGXII (Caliper). Содержание агрегатов биспецифических конструкций анализировали с использованием аналитической колонки с исключением по размеру TSKgel G3000SWXL (Tosoh), уравновешенной подвижным буфером с 25 мМ K2HP04, 125 мМ NaCl, 200 мМ L-аргинин-моногидрохлорида, 0,02% (вес/объем) NaN3, рН 6,7, при 25°С.
В Таблице 4 суммированы выход и конечное содержание мономера Her-2-таргетных и нетаргетных антигенсвязывающих молекул, содержащих тримерный 4-1ВВ лиганд, слитый с Fc (kih), и контрольных молекул.

1.2. Создание и получение Her-2-таргетных содержащих 4-1ВВ агонистических антигенсвязывающих молекул в форме мышиного суррогата (mu4-1ВВ-Her2)
Поскольку mu4-1BB в природе образует димер (A. Brita et al. 2018), а не тример, как у человека, было получено биспецифическое агонистическое 4-1ВВ антитело с бивалентным связыванием 4-1ВВ мыши и моновалентным связыванием Her2, также называемое 2+1, как проиллюстрировано на Фигуре 2В.
В этом примере HCl конструкции состоял из следующих компонентов: VHCH1 антимышиного 4-1ВВ (клон MU137-1), за которым следовали СН2 и СН3. НС2 состоял из VLCH1 анти-Her2 (клон 2С4, Adams CW et al, Cancer Immunol Immunother, 55(6), 2006, стр. 717-727, cross Fab), за которым следовали VHCH1 антимышиного 4-IBB (клон MU 137-1) и CH2 и СН3. Мутации, обеспечивающие гетеродимеризацию, описанные Gunasekaran et al., J. Biol. Chem. 2010, 19637-19646, а именно E356K и D399K (обозначенные KK) и K392D и K409D (обозначенные DD), были введены в HCl и НС2, соответственно.
Более того, DAPG мутации были введены в константные участки тяжелых цепей для аннулирования связывания с Fc гамма-рецепторами согласно методу, описанному, например, Baudino et al. J. Immunol. (2008), 181, 6664-6669 или в международной заявке WO 2016/030350 Al. Вкратце, мутации D265A и P329G были введены в константный участок Fc-DD и Fc-KK тяжелых цепей для аннулирования связывания с Fc гамма-рецепторами (нумерация согласно индексу Кабат EU; т.е. D265A, P329G).
Комбинация Fc-DD с цепью Fc-KK обеспечивала образование гетеродимера, который включал один Her2-связывающий Fab и два 4-1ВВ связывающих Fabs. Для улучшения корректного спаривания следующие мутации были введены в CH-CL анти-4-1ВВ Fab: E123R и Q124K в CL и К147Е и K213E в СН1.
Аминокислотные последовательности 2+1 анти-4-1ВВ (MU137-1), анти-Her2 (2С4) антитела приведены в Таблице 4А.



Пример 2
Функциональная характеристика Her-2-таргетных антигенсвязывающих молекул, содержащих лиганд 4-1ВВ. слитый с Fc. методом поверхностного плазмонного резонанса
Получение слитой молекулы 4-1ВВ Fc (kih)
Последовательность ДНК, кодирующую эктодомен 4-1ВВ человека (аминокислоты 24-186 4-1ВВ человека согласно Q07011, SEQ ID NO:51) субклонировали в рамке с доменами СН2 и СН3 с выступом тяжелой цепи IgG1 человека с модификацией "выступ". Сайт расщепления протеазой AcTEV вводили между эктодоменом антигена и Fc IgG1 человека. Avi-мишень для направленного биотинилирования вводили на С-концевом участке антиген Fc-выступ. Комбинация антиген-Fc цепь с модификацией "выступ", содержащая мутации S354C/T366W, с Fc цепью с модификацией "впадина», содержащей мутации Y349C/T366S/L368A/Y407V, обеспечивает образование гетеродимера, который включает одиночную копию содержащей эктодомен 4-1ВВ цепи, что создает мономерную форму Fc-связанного антигена. В Таблице 5 приведены аминокислотные последовательности конструкции слияния антигена с Fc.
Все последовательности, кодирующие слитую молекулу 4-1ВВ Fc, клонировали в плазмидном векторе, который направляет экспрессию вставки с промотора MPSV и содержит синтетическую поли(А) сигнальную последовательность, локализованную на 3'-конце CDS. Дополнительно, вектор содержит последовательность Ori EBV для эписомного поддержания плазмиды. Для получения биотинилированной мономерной слитой молекулы антиген/Fc суспензию клеток HEK293 EBNA в экспоненциальной фазе роста совместно трансфицировали тремя векторами, кодирующими два компонента белка слияния (цепи с модификацией "выступ" и с модификацией "впадина"), а также BirA, фермент, необходимый для реакции биотинилирования. Соответствующие векторы использовали при соотношении 2:1:0,05 ("антиген ECD-AcTEV-Fc с модификацией "впадина": Fc с модификацией "впадина": "BirA").
Для получения белка в шейкерные флаконы объемом 500 мл засевали 400 млн клеток HEK293 EBNA за 24 ч до начала трансфекции. Для трансфекции клетки центрифугировали 5 мин при 210 g и супернатант замещали предварительно подогретой средой CD СНО. Векторы экспрессии суспендировали в 20 мл среды CD СНО, содержащей 200 мкг ДНК-вектора. После добавления 540 мкл полиэтиленимина (PEI) раствор перемешивали на вортексе в течение 15 сек. и инкубировали в течение 10 мин при комнатной температуре. После этого клетки смешивали с раствором ДНК/PEI, переносили в шейкерные флаконы объемом 500 мл и инкубировали 3 ч при 37°С в термостате в атмосфере 5% СО2. После инкубирования, добавляли 160 мл среды F17 и клетки культивировали в течение 24 ч. Через день после трансфекции к культуре добавляли 1 мМ вальпроевой кислоты и 7% питательной среды 1 с добавками. Через 7 дней культивирования собирали центрифугированием клеточный супернатант в течение 15 мин при 210 g. Раствор фильтровали стерилизацией (фильтр с диаметром пор 0,22 мкм), добавляли в него азид натрия до конечной концентрации 0, 01% (вес/объем) и выдерживали при 4°С.
Секретируемые белки очищали из супернатантов клеточных культур аффинной хроматографией при использовании белка А и далее хроматографией с исключением по размеру. Для аффинной хроматографии супернатант наслаивали на HiTrap HP колонку с белком A (CV=5 мл, GE Healthcare), уравновешенную 40 мл 20 мМ фосфатом натрия, 20 мМ цитратом натрия, рН 7,5. Несвязавшийся белок удаляли отмыванием в количестве по меньшей мере 10 объемов колонки, буфером, содержащим 20 мМ фосфата натрия, 20 мМ цитрата натрия, 0,5 М хлорида натрия (рН 7,5). Связавшийся белок элюировали линейным рН-градиентом хлорида натрия (от 0 до 500 мМ) в 20 объемах колонки из 20 мМ цитрата натрия, 0,01% (объем/объем) Твина-20, рН 3,0. Колонку затем промывали 20 мМ цитратом натрия, 500 мМ хлоридом натрия, 0,01% (объем/объем) Твином-20, рН 3,0 в 10 объемах колонки.
РН собранных фракций доводили до нужного значения добавлением 1/40 (объем/объем) 2М Триса, рН 8,0. Белок концентрировали и фильтровали до наслаивания на колонку HiLoad Superdex 200 (GE Healthcare), уравновешенную 2 мМ MOPS, 150 мМ хлоридом натрия, 0,02% (вес/объем) раствором азида натрия, рН 7,4.
Рекомбинантный белок человека Her2 (ECD белка Erb, аминокислоты 23-652 SEQ ID NO:54, UniProt Асе. No. Р04626-1) коммерчески доступен (например, от abeam, Cat No. ab 168896) и был использован для определения связывания с Her2.
Определение одновременного связывания Her2-таргентных антигенсвязывающих молекул. содержащих сплит тримерного лиганда 4-1ВВ лиганда. слитого с Fc
Способность одновременного связывания 4-1ВВ Fc (kih) человека и Her2 человека определяли методом поверхностного плазмонного резонанса (SPR). Все SPR-эксперименты осуществляли на приборе Biacore Т200 при 25°С в подвижном буфере HBS-EP (0, 01 М HEPES, рН 7,4, 0, 15 М NaCl, 3 мМ ЭДТА, 0,005% сурфактанта Р20, Biacore, Freiburg/Germany). Биотинилированнный 4-1ВВ Fc (kih) человека непосредственно связывали с сенсорным биочипом на основе стрептавидина (SA) в потоке клеток. Для оценки уровня иммобилизации использовали до 450 резонансных единиц (RU).
Конструкты направленных к Her2 антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc, пропускали в концентрации на уровне 200 нМ со скоростью потока 30 мкл/мин через клеточный поток в течение 90 сек и диссоциация была установлена на нулевую секунду. Her2 человека инъецировали как второй аналит со скоростью потока 30 мкл/мин через клеточный поток в течение 90 сек в концентрации 500 нМ (Фигура ЗА). Мониторинг диссоциации осуществляли в течение 120 сек. Различия в общем индексе преломления корректировали путем вычитания ответа, полученного в контрольном потоке клеток, где не было иммобилизованного белка.
Как можно видеть на графиках Фигур 3В и 3С, биспецифические конструкции способны одновременно связывать 4-1ВВ человека и Her2 человека.
Пример 3
Функциональная характеристика Her2-таргетных антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд. слитый с Fc
Для функциональных исследований тестировали описанные выше моновалентные Her2-таргетные антигенсвязывающие молекулы, содержащие сплит тримерный 4-1ВВ лиганд, слитый с Fc, обозначенные как Her2 (PER)-4-1BBL, Her2 (aff-PER)-4-1BBL и Her2 (TRAS)-4-1BBL, против двух ранее описанных агонистических антител к 4-1ВВ человека, т.е. антитела IgG4 человека клона 20Н4.9 к 4-1ВВ человека ((описанного в патентах ЕР 1670828 В1 и US 7659384 (В2), антитело с тяжелой цепью SEQ ID NO:55 и легкой цепью SEQ ID NO:56)) и антитела IgG2 человека клона MOR7480 к 4-1ВВ человека (описанного в заявке WO 2012/032433), антитело с тяжелой цепью SEQ ID NO:57 и легкой цепью SEQ ID NO:58), и ранее описанного полипептида слияния Her2 (ТР\.А8)-антикалин-4-1ВВ IgG4 человека (полипептид слияния SEQ ID NO:59 и 60, как описано в заявке WO 2016/177802).
Кроме того, использовали различные контрольные молекулы, подобные нетаргетной молекуле DP47-4-1BBL (молекула, содержащая аминокислотные последовательности SEQ ID NOs: 37, 28, 61 и 62 и описанная как контроль D в заявке WO 2016/075278 А1, контроль зародышевой линии, обозначенный DP47 и не связывающий антиген, был применен для замещения антиген-связывающего домена), ОР47-антикалин-4-1ВВ IgG4 человека (полипептид слияния SEQ ID NO:63 и 64, полученный аналогично молекулам, раскрытым в заявке WO 2016/177802), Her2 (TRAS) IgG1 P329G LALA человека (антитело с тяжелой цепью SEQ ID NO:65 и легкой цепью SEQ ID NO:48), Her2 (PER) IgG1 P329G LALA человека (антитело с тяжелой цепью SEQ ID NO:66 и легкой цепью SEQ ID NO:46) и нетаргетная DP47 молекула IgG1 P329G LALA человека (антитело с тяжелой цепью SEQ ID NO:67 и легкой цепью SEQ ID NO:62). Эти IgG1 содержали мутации Pro329Gly, Leu234Ala и Leu235Ala для аннулирования связывания с Fc гамма-рецепторами.
3.1. Связывание с Her2-экспрессирующими опухолевыми клетками
Для тестирования связывания с клетками, экспрессирующими на поверхности Her2, использовали различные опухолевые клетки человека, экспрессирующие Her2: линию клеток опухоли молочной железы человека SK-Br3 (АТСС НТВ-30), линию клеток опухоли молочной железы человека KPL-4 (Kawasaki Medical School) и линию клеток рака желудка человека NCI-N87 (АТСС CRL-5822).
0,2×106 опухолевых клеток, ресуспендированных в DPBS (Gibco от Life Technologies, Cat. No. 14190-326), добавляли в каждую лунку 96-луночных планшетов с круглым дном для клеточных суспензий (greiner bio-one, cellstar, Cat. No. 650185). Клетки один раз отмывали 200 мкл DPBS и осадки ресуспендировали. Затем добавляли из расчета 100 мкл/лунку охлажденного до 4°С DPBS буфера, содержащего разведенный в отношении 1:5000 краситель для определения жизнеспособности клеток Fluor 450 (eBioscience, Cat. No. 65-0863-18), и планшеты инкубировали в течение 30 мин при 4°С. Клетки один раз отмывали 200 мкл охлажденного до 4°С DPBS буфера и ресуспендировали в 50 мкл/лунку охлажденного до 4°С FACS буфера (DPBS с добавлением 2% эмбриональной бычьей сыворотки (FBS), 5 мМ ЭДТА, рН 8 (Amresco, Cat. No. Е177) и 7,5 мМ азида натрия (Sigma-Aldrich S2002), содержащего титрованные раствор с концентрацией молекул сплит лиганда 4-1ВВ человека, обозначенных Her2 (PER)-4-1BBL, Her2 (aff-PER)-4-1BBL или Her2 (TRAS)-4-1BBL, и контрольной молекулы, т.е. нетаргетной DP47-4-1BBL молекулы или антител к 4-1ВВ человека, называемых huIgG4 клона 20Н4.9, или антител к 4-1ВВ человека, называемых huIgG2 клона MOR-7480 или белков слияния Her2 (TRAS)-антикалин-4-1BB huIgG4 или их нетаргетного контроля DP47-антикалин-4-1ВВ huIgG4, или Her2 (TRAS) hulgGI P329G LALA, или Her2 (PER) huIgG1 P329G LALA, или DP47 hulgGI P329G LALA. Клетки инкубировали в течение 1 ч при 4°С и далее отмывали несколько раз холодным FACS буфером для удаления несвязавшихся антител. Затем клетки окрашивали охлажденным до 4°С FACS буфером в количестве 50 мкл/лунку с 5 мкг/мл РЕ-конъюгированного аффинно-очищенного F(ab')2 фрагмента антитела козы, специфичного к F(ab')2 фрагменту IgG человека (Jackson ImmunoResearch, Cat. No. 109 116 097) в течение 30 мин при 4°С. Клетки отмывали дважды 200 мкл охлажденного до 4°С FACS буфера и фиксировали в DPBS в количестве 50 мкл/лунку, содержащем 1% формальдегид (Sigma, HT501320-9.5L) по меньшей мере в течение 10 мин. Далее клетки ресуспендировали в 100 мкл FACS буфера при 4°С и исследовали при использовании проточного цитометра MACS Quant Analyzer 10 (Miltenyi Biotech), соединенного с Cytomat (ThermoFisher). Данные анализировали с использованием FlowJo Version 10 (FLowJo LLC), Microsoft Excel и Graph Pad Prism Version 6 (Graph Pad Software Inc).
Как показано на Фигурах 4A-4D, Her2 (PER)-4-1BBL и Her2 (aff-PER)-4-1BBL демонстрируют сходное связывание с Her2 человека, экспрессируемым опухолевыми клетками человека SK-Br3 или NCI-N87, в то время, как молекула Her2 (aff-PER)-4-1BBL проявляет немногим более высокие значения ЕС50, как показано в Таблице 6. Антитело Her2 (PER) hulgG P329G LALA различным образом связывается с Her2 (PER)-4-1BBL, а именно связывает бивалентный Her2 (PER)-4-1BBL вместо моновалентного. Это подтверждается слегка пониженным MFI (меньше антител/клеточную поверхность, поскольку антитело может взаимодействовать с двумя молекулами вместо одной молекулы Her2), как показано на Фигуре 4, и незначительно пониженным значением ЕС50, что соответствует эффекту авидности, как представлено в Таблице 6. Бивалентный трастузумаб связывающий белок слияния Her2 (TRAS)-антикалин-4-1ВВ huIgG4 обнаруживает более низкое значение MFI, чем бивалентный связывающий белок слияния Her2 (PER) hulgG P329G LALA и более высокое значение ЕС50 (показано на Фигуре 4 и в Таблице 6). Эти данные отражают более низкую аффинность и авидность трастузумаб (TRAS)-связывающей молекулы по сравнению с пертузумаб (PER)-связывающей молекулой.
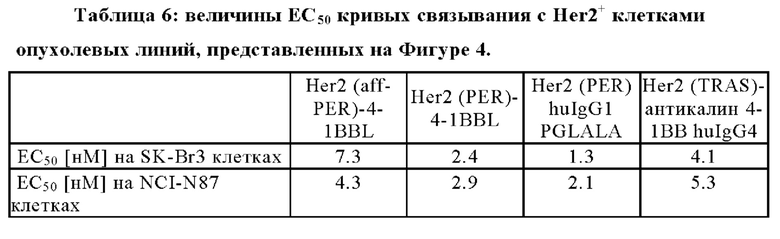
Как показано на Фигурах 5А и 5 В, Her2 (PER)-4-1BBL и Her2 (aff-PER)-4-1BBL демонстрируют сходное связывание с Her2 человека, экспрессируемым клеточной линией рака человека KPL-4. Her2 (TRAS)-4-1BBL имеет более низкое значение MFI (Фигура 5А) и незначительно более высокое значение ЕС50 (Таблица 7), чем Her2 (PER)-4-1BBL и Her2 (aff-PER)-4-1BBL, отражая более низкую аффинность трастузумаба (TRAS) по сравнению с пертузумабом (PER). Это показано только для моновалентных Her2-связывающих конструкций, поскольку бивалентные Her2-связывающие молекулы Her2 (TRAS) hulgGI PG LALA и Her2 (PER) huGl PG LALA (проявляющие авидность) имеют сходную связывающую способность (Фигура 5 В и Таблица 7). Бивалентная Her2-связывающая молекула Her2 (TRAS)-антикалин-4-IBB huIgG4 обнаруживает более низкое значение MFI, чем Her2 (TRAS)-4-1BBL (Фигура 5А), но более низкое значение ЕС50 (Таблица 6) это отражает различие между аффинностью (моновалентное связывание) и авидностью (бивалентное связывание) двух Her2 (TRAS)-нацеленных молекул.

3.2. Исследования биологической активности
3.2.1. Активация NFkB в клетках Jurkat, экспрессирующих 4-1ВВ человека, и репортерная кассета NFkB-luc
Репортерную клеточную линию Jurkat-hu4-1BB-NFkB-luc2, заказанную и полученную от фирмы Promega (CS1966004), культивировали в среде RPMI 1640 (GIBCO от Life Technologies, Cat. No. 42401-042) с добавлением 10% FCS (GIBCO от Life Technologies, Cat. No. 16000-044), 2 мМ GlutaMAX-I (GIBCO от Life Technologies, Cat. No. 35050-038), 1 мМ пирувата натрия (SIGMA-Aldrich, Cat. No. S8636), 0,1 мМ MEM-раствора, содержащего незаменимые аминокислоты (SIGMA-Aldrich, Cat. No. M7145), 25 мМ HEPES (Sigma Life Science, Cat. No. H0887), 600 мкг/мл G-418 (Roche, Cat. No. 04727894001) и 400 мкг/мл гигромицина В (Roche, Cat. No. 10843555001). Для осуществления исследования активности клетки Jurkat-hu4-1BB-NFkB-luc2 ресуспендировали в среде RPMI 1640 с добавлением 10% FCS и 2 мМ GlutaMAX-I (далее называемой средой исследования) и 20000 клеток в 100 мкл высевали в каждую лунку 96-луночного обработанного белого планшета для тканевых культур с плоским дном (Huber lab, greiner bio-one, Cat. No. 655083) или 2000 клеток в 10 мкл высевали в каждую лунку 384-луночного обработанного белого планшета для тканевых культур с плоским дном (Corning, Cat. No. 3826). Далее добавляли 50 мкл (96-луночный планшет) или 10 мкл (384-луночный планшет) каждой среды исследования или Her2-экспрессирующих опухолевых клеток (SK-Br3, KLP-4 или NCI-N87, 100000 клеток/лунку 96-луночного планшета или 10000 клеток/лунку 384-луночного планшета). В завершение, добавляли 50 мкл (96-луночный планшет) или 10 мкл (384-луночный планшет) среды исследования, содержащей различные титрованные концентрации моновалентных Her2-таргетных антигенсвязывающих молекул, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc, обозначенных Her2 (PER)-4-1BBL, Her2 (aff-PER)-4-1BBL или Her2 (TRAS)-4-1BBL, и контрольной нетаргетной молекулы DP47-4-1BBL или антител к 4-1ВВ человека, huIgG4 клона 20Н4.9 или huIgG2 клон MOR-7480, или белков слияния Her2 (TRAS)-антикалин-4-1BB huIgG4, или их нетаргетной контрольной молекулы ВР47-антикалин-4-1ВВ huIgG4, или контрольных антител Her2 (TRAS) hulgGI P329G LALA, или Her2 (PER) hulgGI P329G LALA, или DP47 hulgGI P329G LALA. Планшеты инкубировали в течение 6 ч при 37°С в атмосфере 5% СО2 в термостате для культур клеток.
Для определения люциферазной активности при использовании 96-луночных планшетов планшеты дважды отмывали 200 мкл/лунку DPBS. В каждую лунку добавляли 40 мкл свежеприготовленного репортерного лизирующего буфера (Promega, Cat. No. Е3971) и планшеты выдерживали в течение ночи при -20°С. На следующий день замороженные планшеты и детекционный буфер (Luciferase 1000 Assay System, Promega, Cat. No. E4550) оттаивали до комнатной температуры. Затем в каждую лунку добавляли 100 мкл детекционного буфера и планшеты обсчитывали так быстро, как это только возможно, при использовании ридера микропланшетов Тесап (Тесап) при времени интегрирования 500 мсек, без использования фильтра, учитывая все длины волн и верхнее значение.
Для определения люциферазной активности при использовании 384-луночных планшетов в каждую лунку добавляли 6 мкл свежеприготовленной оттаянной до комнатной температуры One-Glo люциферазы (Promega, Cat. No. Е6110) и планшеты обсчитывали так быстро, как это только возможно, при использовании ридера микропланшетов Тесап (Тесап) при времени интегрирования 500 мсек, без использования фильтра, учитывая все длины волн и верхнее значение. Световую эмиссию, обусловленную окислением люциферина, опосредованным люциферазой, детектировали в единицах высвобождаемого света (URLs). Данные анализировали при использовании Microsoft Excel и Graph Pad Prism, версия 6 (Graph Pad Software Inc.).
На Фигуре 6 проиллюстрированы результаты исследования активации Jurkat-hu4-1BB-NFkB-luc2. Как показано на Фигурах 7A-7F, Her2 (PER)-4-1BBL и Her2 (aff-PER)-4-1BBL проявляют сходную активность в присутствии Her2-экспрессирующих опухолевых клеток (Фигуры 7 В и 7С), в то время, как белок слияния Her2 (TRAS)-антикалин-4-1BB huIgG4 обнаруживает потенциал меньшей активности, что выражается в меньшей области под кривой, а также более высокое значение ЕС50, приведенное в Таблице 8. Все три Her2-нацеленные агонистические молекулы 4-1ВВ не индуцируют никакой активации репортерной клеточной линии Jurkat-hu4-1BB-NFkB-luc2 в отсутствие Her2-экспрессирующих клеток (Фигура 7А). Только агонистические антитела к 4-1ВВ человека huIgG4 клона 20Н4.9 способны индуцировать активацию Jurkat-hu4-1BB-NFkB-luc2, причем независимо от присутствия или отсутствия Her2-экспрессирующих опухолевых клеток (Фигуры 7D, 7Е и 7F).
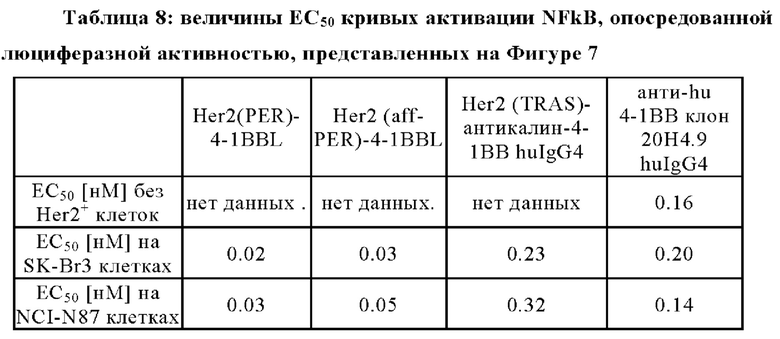
На Фигурах 8A-8D Her2 (PER)-4-1BBL сравнивается с Her2 (TRAS)-4-1BBL. Благодаря более низкой аффинности связывающей молекулы трастузумаб (TRAS), Her2 (TRAS)-4-1BBL обнаруживает меньшую активность, чем Her2 (PER)-4-1BBL (Фигуры 8 В, 8С и 8D). Это выражается в меньшей области под кривой, а также в более высоком значении ЕС50, приведенном в Таблице 9. В отсутствие Her2+опухолевых клеток обе молекулы не активируют репортерную клеточную линию Jurkat-hu4-1BB-NFkB-luc2 (Фигура 8А). Белок слияния Her2 (TRAS)-антикалин-4-1BB hulgGI опять обнаруживает меньшую активность, чем Her2 (PER)-4-1BBL или Her2 (TRAS)-4-1BBL, что выражается в меньшей области под кривой, более низкими значениями плато и более высокими значениями ЕС50 (показано на Фигурах 8B-8D и в Таблице 9). Сходным образом, как и на Фигуре 7, в данном эксперименте также только агонистические антитела huIgG4 клона 20Н4.9 к 4-1ВВ человека были способны индуцировать активацию Jurkat-hu4-1BB-NFkB-luc2, причем независимо от присутствия или отсутствия Her2-экспрессирующих опухолевых клеток (Фигуры 8Е-8Н).


3.2.2. Исследование активации PBMCs человека в присутствии Her2-экспрессирующей опухолевой клеточной линии NCI-N87
Для перекрестного связывания, опосредованного Her2-связыванием, использовали Her2-экспрессирующую адгезивную линию клеток карциномы желудка человека NCI-N87. Клетки NCI-N87 отмывали DPBS (Gibco от Life Technologies, Cat. No. 14190 326) и обрабатывали свободным от ферментов буфером для диссоциации клеток на основе PBS (Gibco от Life Technologies, Cat. No. 13151-014) в течение 15 мин при 37°С. Клетки собирали и ресуспендировали в Т-клеточной среде, состоящей из RPMI 1640 с добавлением 10% FCS, 2 мМ GlutaMAX-I, 1 мМ пир у вата натрия (SIGMA-Aldrich, Cat. No. S8636), 1% MEM-раствора, содержащего незаменимые аминокислоты (SIGMA-Aldrich, Cat. No. М7145), и 50 мкМ β-меркаптоэтанола (SIGMA-Aldrich, Cat. No. М3148) и облучали 50 Gy (Х-лучевой излучатель RS 2000, Rad-источник).
2×104 клеток NCI-N87 в 50 мкл Т-клеточной среды высевали в каждую лунку 96-луночного планшета для тканевых культур с круглым дном (ТТР, Cat. No. 92697). Затем добавляли 50 мкл Т-клеточной среды, содержащей различные титрованные концентрации моновалентных Her2-таргетных антигенсвязывающих молекул, содержащих, содержащих сплит тримерный 4-1ВВ лиганд, слитый с Fc, обозначенных, как Her2 (PER)-4-1BBL, Her2 (aff-PER)-4-1BBL или Her2 (TRAS)-4-1BBL, или контрольной нетаргетной молекулы DP47-4-1BBL, или агонистических антител к 4-1ВВ человека huIgG4 клон 20Н4.9 или huIgG2 клон MOR-7480, или белков слияния Her2 (TRAS)-антикалин-4-1ВВ huIgG4, или их нетаргетного контроля ОР47-антикалин-4-1ВВ huIgG4, или контрольных антител Her2 (TRAS) hulgGI P329G LALA, или Her2 (PER) hulgGI P329G LALA, или DP47 hulgGI P329G LALA. PBMCs человека, выделенные из лейкоцитарной пленки здорового донора, метили в подогретом до 37°С буфере DPBS, содержащем 40 нМ CFDA-SE (SIGMA-Aldrich, Cat. No. 21888-25MG-F) в течение 15 мин при 37°С. CFSE-мечение останавливали добавлением фетальной бычьей сыворотки (FBC), затем PBMCs дважды отмывали и ресуспендировали в Т-клеточной среде до конечной концентрации 1,5×106 клеток/мл. 50 мкл указанного раствора клеток PBMCs высевали в каждую лунку до достижения количества 7,5×104 CFSE-меченных PBMCs на лунку. В завершение готовили стоковый раствор Т-клеточной среды, содержащей 8 нМ агонистического антитела к CD3 человека IgG1 клон V9, и в каждую лунку добавляли 50 мкл указанного раствора до конечной концентрации антител к CD3 человека IgG1 клон V9, составляющей 2 нМ.
Планшеты инкубировали в течение 6 ч при 37°С в атмосфере 5% СО2 в термостате для культур клеток. Клетки дважды отмывали DPBS и окрашивали 100 мкл/лунку DPBS, содержащего 1:1000 разведенный LIVE/DEAD Fixable Aqua Dead Cell Stain Kit (Molecular Probes от Life Technology, Cat.No. L34957) в течение 30 мин при 4°С. Затем клетки отмывали один раз 200 мкл/лунку DPBS и окрашивали 50 мкл буфера FACS (DPBS с добавлением 2% FBS, 5 мМ ЭДТА, рН 8 (Amresco, Cat. No. Е177)) и 7,5 мМ азида натрия (SIGMA-Aldrich S2002)), содержащего 0,1 мкг/мл РегСР-Су5.5-конъюгированного антитела мыши IgG1 к к CD137 человека (клон 4В4-1, BioLegend, Cat. No. 309814), 0,1 мкг/мл РЕ/Су7-конъюгированных антител мыши IgG1 к к PD-1 человека (клон ЕН12.2Н7, BioLegend, Cat. No. 329918), 0,03 мкг/мл АРС-конъюгированного антитела мыши IgG1 к к CD25 человека (клон ВС96, BioLegend, Cat. No. 302610), 0,06 мкг/мл АРС/Су7-конъюгированного антитела мыши IgG1 к к CD8 человека (клон RPA-Т8, BioLegend, Cat. No. 3301016), ВУ421-конъюгированного антитела мыши IgG1 к к CD4 человека (клон RPA-T4, BioLegend, Cat. No. 300532), в течение 30 мин при 4оС. Клетки дважды отмывали 200 мкл/лунку DPBS и инкубировали в течение 30 мин при 4°С с 50 мкл/лунку свежеприготовленного буфера FoxP3 Perm/Fix (eBioscience Cat. No. 00-5123). Далее клетки дважды отмывали 200 мкл/лунку DPBS, ресуспендировали в 50 мкл/лунку свежеприготовленного Perm -буфера (eBioscience Cat. No. 8333) с добавлением РЕ-конъюгированного антитела мыши IgG1 к гранзиму в человека (клон GB11, лот 4269803, BD Pharmingen, Cat. No. 561142), разведенного 1:250, и инкубировали в течение 1 ч при 4°С. Планшеты дважды отмывали 200 мкл/лунку DPBS и клетки фиксировали в течение 15 мин DPBS, содержащем 1% формальдегида (Sigma, HT501320-9.5L). Клетки ресуспендировали в 100 мкл/лунку FACS-буфера и исследовали с помощью прибора MACS Quant Analyzer X (Miltenyi Biotech). Данные анализировали при использовании FlowJo V10 (FlowJo, LLC), Microsoft Excel и Graph Pad Prism, версия 6 (Graph Pad Software Inc.).
На Фигуре 9 проиллюстрированы результаты исследования активации РВМС. Как показано на Фигурах 10A-10F и Фигурах 11A-11F, Her2 (PER)-4-1BBL индуцирует наиболее сильную активацию CD8 и CD4 Т-клеток, на что указывает повышающая регуляция (upregulation) IL-2Ra (CD25) (Фигуры 10А и 11А), увеличение внутриклеточного гранзима В (Фигуры 11В и 11В) и увеличенная пролиферация (Фигуры ЮС и НС). Her2 (TRAS)-4-1BBL также индуцирует сильную активацию CD8 (Фигуры 10А-10С) и CD4 Т-клеток (Фигуры 11А-11С), однако с более высокими значениями ЕС50. Полипептид слияния Her2 (TRAS)-антикалин 4-1ВВ huIgG4 опосредует меньшую активацию Т-клеток, что проявляется главным образом в значительно более низкой частоте CD25+, гранзима Bhigh и пролиферации CD8 (Фигуры 10А-10С) и CD4 Т-клеток (Фигуры 11А-11С). Агонистические антитела huIgG4 клона 20Н4.9 к 4-1ВВ человека снова обнаруживают некоторый активационный потенциал, однако не такой сильный, как направленные к Her2 4-1ВВ агонистические полипептиды (Фигуры 10D-10F и Фигуры 11D-11F). Значения ЕС50 и области под кривой, превышающие фоновые, приведены в Таблице 10 и Таблице 11.
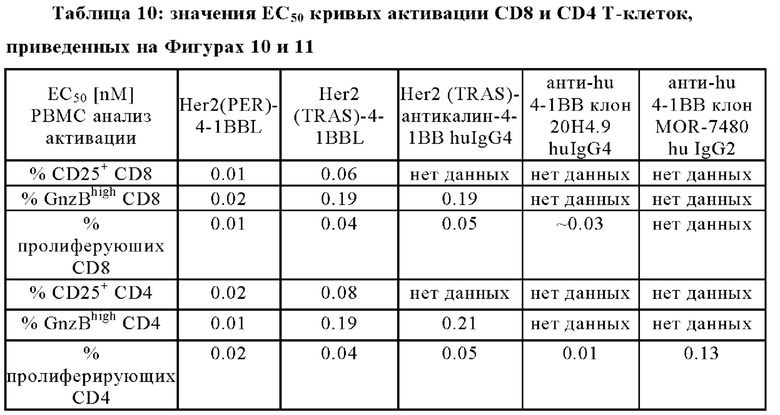

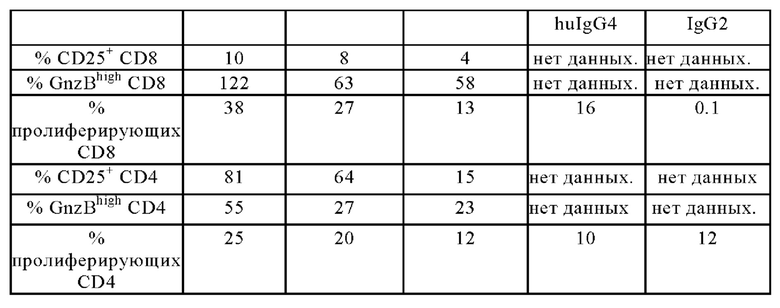
3.2.3. Исследование активации спленоцитов мыши в присутствии Her2-экспрессирующей опухолевой клеточной линии KPL-4
Для перекрестного связывания, опосредованного Her2-связыванием, использовали Her2-экспрессирующую адгезивнуюся линию клеток рака молочной железы человека KPL-4. Клетки KPL-4 отмывали DPBS (Gibco от Life Technologies, Cat. No. 14190 326) и обрабатывали свободным от ферментов буфером для диссоциации клеток на основе PBS (Gibco от Life Technologies, Cat. No. 13151-014) в течение 15 мин при 37°С. Клетки собирали и ресуспендировали в Т-клеточной среде, состоящей из RPMI 1640 с добавлением 10% FCS, 2 мМ GlutaMAX-I, 1 мМ пир у вата натрия (SIGMA-Aldrich, Cat. No. S8636), 1% MEM-раствора, содержащего незаменимые аминокислоты (SIGMA-Aldrich, Cat. No. М7145), и 50 мкМ β-меркаптоэтанола (SIGMA-Aldrich, Cat. No. М3148) и облучали 50 Gy (Х-лучевой излучатель RS 2000, Rad-источник).
2×10+облученных клеток KPL-4 в 50 мкл Т-клеточной среды высевали в каждую лунку 96-луночного планшета для тканевых культур с круглым дном (ТТР, Cat. No. 92697). Затем добавляли 50 мкл Т-клеточной среды, содержащей различные титрованные концентрации мышиного суррогатного mu4-1ВВ-Her2 или контрольных ненаправленных антител mu4-1ВВ mulgGI DAPG. Спленоциты мыши выделяли из свежесобранных селезенок мышей C57BL/6 (Octo Dissociator, Miltenyi Biotech) согласно протоколу производителя. Далее лизировали эритроциты путем инкубирования в течение 10 мин при комнатной температуре в лизирующем буфере АСК (0,15 М NH4Cl, 10 мМ КНС03, 0,1 мМ ЭДТА в ddfbO, рН 7,2). Лизис останавливали добавлением Т-клеточной среды и клетки отмывали DPBS. Спленоциты мыши метили путем инкубации в подогретом до 37°С буфере DPBS, содержащем 0,5 мкМ фиолетового красителя пролиферации CellTrace (Molecular Probes от Life Technologies, Cat. No. C34557) в течение 15 мин при 37°С. Мечение останавливали добавлением фетальной бычьей сыворотки (FBC), затем спленоциты мыши дважды отмывали и ресуспендировали в Т-клеточной среде до конечной концентрации 3×106 клеток/мл. 50 мкл указанного раствора спленоцитов мыши высевали в каждую лунку до достижения количества клеток 15×104, меченных фиолетовым красителем пролиферации, на лунку. В завершение готовили стоковый раствор Т-клеточной среды, содержащей 2 мкг/мл агонистических антител армянского хомячка IgG1) к CD3e мыши клон 1452С11 (BioLegend, Cat. No. 100331, и в каждую лунку добавляли 50 мкл указанного раствора до конечной концентрации агонистических антител армянского хомячка IgG1 к CD3e мыши клон 1452С11, составляющей 0,5 мкг/мл.
Планшеты инкубировали в течение 3 дней при 37°С в атмосфере 5% СО2 в клеточном инкубаторе. Клетки отмывали DPBS и окрашивали 100 мкл/лунку DPBS, содержащего 1:1000 разведенный LIVE/DEAD Fixable Aqua Dead Cell Stain Kit (Molecular Probes от Life Technology, Cat.No. L34957) в течение 30 мин при 4°С. Затем клетки отмывали один раз 200 мкл/лунку DPBS и окрашивали 50 мкл буфера FACS (DPBS с добавлением 2% FBS, 5 мМ ЭДТА, рН 8 (Amresco, Cat. No. Е177) и 7,5 мМ азида натрия (SIGMA-Aldrich S2002)), содержащего 0,67 мкг/мл АРС-Су7- к CD8a мыши (BioLegend, Cat. No. 100714, клон 53-6.7, IgG2a к крысы), 0,67 мкг/мл АРС- к CD4 мыши (BioLegend, Cat. No. 100412, клон GK1.5, IgG2b к крысы), 0,67 мкг/мл РЕ - к CD137 мыши (BioLegend, Cat. No. 106106, клон 17 В5, IgG сирийского хомячка), 0,67 мкг/мл РегСР-Су5.5- к CD25 мыши (BioLegend, Cat. No. 101912, клон 3С7, IgG2b к крысы) в течение 30 мин при 4°С. Клетки дважды отмывали 200 мкл/лунку DPBS и инкубировали в течение 30 мин при 4°С с 50 мкл/лунку свежеприготовленного буфера FoxP3 Perm/Fix (eBioscience Cat. No. 00-5123). Далее клетки дважды отмывали 200 мкл/лунку DPBS, ресуспендировали в 50 мкл/лунку свежеприготовленного Perm -буфера (eBioscience Cat. No. 8333) с добавлением 10 мкг/мл антимышиных антител Eomes-AlexaFluor 488 (eBioscience, Cat. No. 53-4875-82, клон Dan 1 mag, IgG2a крысы) и инкубировали в течение 1 ч при 4°С. Планшеты дважды отмывали 200 мкл/лунку DPBS и клетки фиксировали в течение 15 мин DPBS, содержащем 1% формальдегида (Sigma, HT501320-9.5L). Клетки ресуспендировали в 100 мкл/лунку FACS-буфера и исследовали с помощью прибора MACS Quant Analyzer X (Miltenyi Biotech). Данные анализировали при использовании FlowJo V10 (FlowJo, LLC), Microsoft Excel и Graph Pad Prism, версия 6 (Graph Pad Software Inc.).
На Фигуре 12 проиллюстрированы результаты исследования активации спленоцитов мыши. Как показано на Фигурах 13A-13D, мышиный суррогатный mu4-1ВВ-Her2 индуцирует активацию CD8 и CD4 Т-клеток, на что указывает повышающая регуляция (upregulation) IL-2Ra (CD25) (Фигуры 13А и 13С) и увеличенная пролиферация (Фигуры 13В и 13D). В противоположность указанному, нетаргетные агонистические антитела mu4-1ВВ mulgGI DAPG не индуцируют такую активацию. Таким образом, синергический костимулирующий эффект строго зависит от Her2-перекрестного связывания. Значения ЕС50 и области под кривой, превышающие фоновые, приведены в Таблице 12 и Таблице 13.

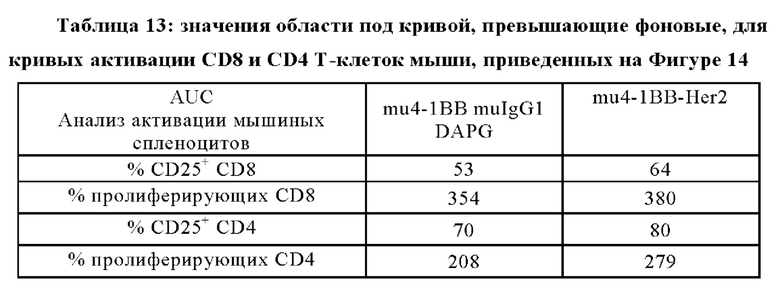
Пример 4
Тестирование in vitro комбинации Her2(PER)-4-1BBL и Her2/CD3 биспецифического антитела
Для тестирования комбинации Her2(PER)-4-1BBL и Her2/CD3 биспецифического антитела (Her2 TDB, Junttila et al., 2014) получали 4-1BBL биспецифическую молекулу, которая связывает Her2, при использовании происходящего из пертузумаба (2С4) Fab (Фигура 2А). Основанное на трастузумабе Her2/CD3 биспецифическое антитело (Her2 TDB) связывается с доменом IV Her2 (Cho et al., 2003), в то время как Her2(PER)-4-1BBL связывается с доменом II HER2 (Franklin et al., 2004) неконкурентно. Her2 TDB получали, как описано в заявке WO 2015/095392 А1. Мышиное суррогатное антитело представляет собой muIgG2a YER2 TBD с модификацией "выступ" мышиного антитела анти-HER2(hu4D5) и с модификацией "впадина" химерного антитела к CD3(2C11) мыши (Leo et al. Proc. Natl. Acad Sci USA. 84:1374-1378, 1978).
Выделение мононуклеарных клеток периферической крови человека (РВМС) и CD8+Т-клеток.
РВМС человека выделяли из крови здоровых добровольцев при использовании среды Lymphoprep (STEMCELL Technologies). CD8+- клетки изолировали из РВМС с помощью набора для выделения CD8+- клеток человека от Miltenyi Biotec (#130-094-156) негативной селекцией.
Т-клеточная активация in vitro.
Все антитела для окрашивания клеток при проточной цитометрии получали от BD eBiosciences (San Jose, СА). CD8+- клетки человека и клетки клеточной линии рака молочной железы человека SKBR3 (в соотношении 3:1) инкубировали в присутствии тестируемого средства в течение 24 ч в 96-луночном планшете с круглым дном (BD). После инкубации клетки переносили в новый 96-луночный планшет с V-образным дном. Клетки окрашивали анти-CD8-FITC, анти-CD69-РЕ и анти-CD25-АРС. Поверхностную экспрессию CD69 и CD25 детектировали на CD8+Т-клетках методом проточной цитометрии. Процент CD8+CD69+CD25+принимали за показатель Т-клеточной активации.
Уничтожение клеток-мишеней in vitro.
Эффекторные клетки (CD8+- клетки человека) и клетки-мишени (SKBR3 при плотности 20 0000 клеток/лунку) инкубировали в соотношении 3:1 в присутствии тестируемого средства в течение 48 ч в 96-луночных черных планшетах с прозрачным дном. В конце инкубации клеточный супернатант удаляли и планшеты дважды отмывали PBS. Затем добавляли 100 мкл реагента для оценки жизнеспособности клеток с помощью люминесценции (Cell Titer-Glow Luminescent Cell Viability reagent, Promega cat#G7570) и планшеты считывали на люминометре согласно инструкциям производителя.
Пролиферация и выживаемость Т-клеток in vitro.
CD8+Т-клеточный пролиферативный ответ оценивали измерением разбавления интенсивности флуоресценции карбоксилфлуоресцеинового сукцинимидилового эфира (CFSE). Вкратце, CD8+Т-клетки человека метили CFSE и совместно культивировали с клетками-мишенями SKBR3 и тестируемым средством. HER2 TBD использовали в количестве 100 нг/мл, а 4-1ВВ агонист использовали в количестве 1000 нг/мл. Аликвоты клеток в день 0 (свежевыделенные и меченные CD8+), день 3 и день 7 анализировали путем проточной цитометрии для определения интенсивности флуоресценции CFSE. Выживаемость CD8+Т-клеток определяли по количеству живых CD8+Т-клеток в день 0, день 3 и день 7.
Как и ожидалось, сам по себе агент Her2(PER)-4-1BBL не индуцирует Т-клеточную активацию или уничтожение клеток-мишеней in vitro (Фигуры 14А и 14В, соответственно). Ahth-HER2/CD3-TBD индуцирует незначительную Т-клеточную активацию и уничтожение опухолевых клеток, но это не усиливается существенным образом при совместном культивировании с Her2(PER)-4-1BBL. В противоположность указанному, добавление Her2(PER)-4-1BBL существенным образом усиливает индуцируемую анти-HER2/CD3-TDB Т-клеточную пролиферацию/выживаемость in vitro (Фигуры 15А и 15В).
Пример 5
Противоопухолевая эффективность in vivo комбинации мышиного суррогатного Her2(2C4)-4-1BBL и Her2/CD3 биспецифического антитела
Противоопухолевую активность мышиного агониста 4-1ВВ тестировали на иммунокомпетентных мышах, которым были имплантированы опухолевые аллотрансплантаты Fo5, экспрессирующие HER2 человека (Lewis Phillips et al., 2008). Обработка одним агентом HER2 TDB обычно приводит к транзиторным ответам на лечение у данной модели и полные ответы являются редкими даже при дозах высокого уровня (Li et al., 2018). Совместная обработка TDB и mu4-1ВВ Her2 не приводит к значительному улучшению ответов, однако четыре мыши из семи мышей (57%), обработанных комбинацией HER2 TDB и mu4-1ВВ-Her2, продемонстрировали полные ответы без детектируемых опухолей в конце исследования (Фигура 16D).
Противоопухолевая эффективность на модели опухолевых аллотрансплантатов Fo5
Выполняли разрез длиной 1 см на коже самок мышей FVB WT рострально по отношению к жировой подушке третьей молочной железы. Карман для опухоли делали в области жировой подушки 2/3 молочной железы и в него помещали срез опухоли ММТУ-Her2-трансгенный #5 (Fo5) размером 2x2 мм (Lewis Phillips et al., 2008). Кожу закрывали с помощью клипс для ран. Клипсы удаляли на 7-10 день после хирургического вмешательства и отслеживали у мышей появление опухолей. Когда объем опухоли увеличивался примерно до значения около 190 мм3, животных помещали в группу, подлежащую лечению, причем животные в каждой группе имели опухоли эквивалентного среднего размера.
Мышей с опухолями подразделяли на группы, содержащие по семь животных (N=7). Животным одной группы дважды еженедельно (qwx2) внутривенно вводили HER2 TBD в дозе 0,5 мг/кг (qwx2) в дни 0, 7 и 14. Другой группе дважды еженедельно (qwx2) внутривенно вводили mu4-1-BB-Her(2C4) (мышиное суррогатное антитело) в дозе 10 мг/кг в день 0 и интраперитонеально в день 7 и еще одной группе дважды еженедельно (qwx2) внутривенно вводили HER2 TBD в дозе 0,5 мг/кг в дни 0, 7 и 14 и дважды еженедельно (qwx2) внутривенно вводили mu4-1-BB-Her(2C4) (мышиное суррогатное антитело) в дозе 10 мг/кг в день 0 и интраперитонеально в день 7. Контрольной группе вводили только носитель.
* * *
Список литературы
Ascierto, P.А., Е. Simeone, М. Sznol, Y.X. Fu, and I. Melero (2010), Clinical experiences with anti-CD137 and anti-HER2 therapeutic antibodies. Semin Oncol 37:508-516.
Aggarwal B.B. (2003), Signalling pathways of the TNF superfamily: a double-edged sword. Nat. Rev. Immunol. 3(9), 745-56.
Banner D. et al (1993), Crystal structure of the soluble human 55 kd TNF receptor-human TNF beta complex: implications for TNF receptor activation. Cell 73, 431-445.
Bodmer J., Schneider P. and Tschopp, J. (2002), The molecular architecture of the TNF superfamily. Trends in Biochemical Sciences 27(1), 19-26.
Broil, K., Richter, G., Pauly, S., Hofstaedter, F., and Schwarz, H. (2001). CD137 expression in tumor vessel walls. High correlation with malignant tumors. Am J Clin Pathol 115, 543-549.
Buechele, C, Baessler, Т., Schmiedel, B.J., Schumacher, C.E., Grosse-Hovest, L., Rittig, K., and Salih, H.R. (2012). 4-1BB ligand modulates direct and Rituximab-induced NK-cell reactivity in chronic lymphocytic leukemia. Eur J Immunol 42, 737-748.
Chen S., Lee L., Fisher Т., Jessen В., Elliott M., Evering W., Logronio K., Tu K.H., Tsaparikos K., Li X., Wang H., Ying C, Xiong M.., Van Arsdale Т., and. Lin J.C. (2015), Combination of 4-IBB Agonist and PD-1 Antagonist Promotes Antitumor Effector/Memory CD8 T Cells in a Poorly Immunogenic Tumor Model. Cancer Immunology Research 3(2), 149-160. Published online 11 November 2014.
Cho, H. S., Mason, K., Ramyar, К. X., Stanley, A. M., Gabelli, S. В., Denney, D. W., Jr., and Leahy, D. J. (2003). Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab. Nature 421, 756-760
Choi, B.K., Kim, Y.H., Kwon, P.M., Lee, S.C., Kang, S.W., Kim, M.S., Lee, M.J., and Kwon, B.S. (2009). 4-1BB functions as a survival factor in dendritic cells. J Immunol 182, 4107-4115.
Cuadros, C, Dominguez, A.L., Lollini, P.L., Croft, M., Mittler, R.S., Borgstrom, P., and Lustgarten, J. (2005). Vaccination with dendritic cells pulsed with apoptotic tumors in combination with anti-OX40 and anti-4-1BB monoclonal antibodies induces T cell-mediated protective immunity in Her-2/neu transgenic mice, hit J Cancer 116, 934-943.
Curran, M.A., Kim, M., Montalvo, W., Al-Shamkhani, A., and Allison, J.P. (2011). Combination CTLA-4 blockade and 4-IBB activation enhances tumor rejection by increasing T-cell infiltration, proliferation, and cytokine production. PLoS One 6, el9499.
Diehl, L., van Mierlo, G. J., den Boer, A.T., van der Voort, E., Fransen, M., van Bostelen, L., Krimpenfort, P., Melief, C.J., Mittler, R., Toes, R.E., and Offringa, R. (2002). hi vivo triggering through 4-IBB enables Th-independent priming of CTL in the presence of an intact CD28 costimulatory pathway. J Immunol 168, 3755-3762.
Dubrot, J., Milheiro, F., Alfaro, C, Palazon, A., Martinez-Forero, I., Perez-Gracia, J.L., Morales-Kastresana, A., Romero-Trevejo, J.L., Ochoa, M.C., Hervas-Stubbs, S., et al. (2010). Treatment with anti-CD 137 mAbs causes intense accumulations of liver T cells without selective antitumor immunotherapeutic effects in this organ. Cancer Immunol knmunother 59, 1223-1233.
Franklin, M. C, Carey, K. D., Vajdos, F. F., Leahy, D. J., de Vos, A. M., and Sliwkowski, M. X. (2004). Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex. Cancer Cell 5, 317-328.
Futagawa, Т., Akiba, H., Kodama, Т., Takeda, K., Hosoda, Y., Yagita, H., and Okumura, K. (2002). Expression and function of 4-1BB and 4-1BB ligand on murine dendritic cells. Int Immunol 14, 275-286.
Guo, Z., Cheng, D., Xia, Z., Luan, M., Wu, L., Wang, G., and Zhang, S. (2013). Combined TIM-3 blockade and CD 137 activation affords the long-term protection in a murine model of ovarian cancer. J Transl Med 11, 215.
Heinisch, I.V., Daigle, I., Knopfli, В., and Simon, H.U. (2000). CD137 activation abrogates granulocyte-macrophage colony-stimulating factor-mediated anti-apoptosis in neutrophils. Eur J Immunol 30, 3441-3446.
Hornig, N., Kermer, V., Frey, K., Diebolder, P., Kontermann, R.E., Mueller, D. (2012), Combination of a bispecific antibody and costimulatory antibody-ligand fusion proteins for targeted cancer immunotherapy. J. knmunother. 35, 418-429.
Ju, S.A, Cheon, S.H., Park, S.M., Tarn, N.Q., Kim, Y.M., An, W.G., and Kim, B.S. (2008). Eradication of established renal cell carcinoma by a combination of 5-fluorouracil and anti-4-1BB monoclonal antibody in mice. Int J Cancer 122, 2784-2790.
Junttila, Т.Т., Li, J., Johnston, J., Hristopoulos, M., Clark, R., Ellerman, D., Wang, В. E., Li, Y., Mathieu, M., Li, G., et al. (2014). Antitumor efficacy of a bispecific antibody that targets HER2 and activates T cells. Cancer Res 74, 5561-5571.
Kienzle, G., and von Kempis, J. (2000). CD 137 (ILA/4-1BB), expressed by primary human monocytes, induces monocyte activation and apoptosis of В lymphocytes, hit Immunol 12, 73-82.
Kim, D.H., Chang, W.S., Lee, Y.S., Lee, K.A., Kim, Y.K., Kwon, B.S., and Kang, C.Y. (2008). 4-IBB engagement costimulates NKT cell activation and exacerbates NKT cell ligand-induced airway hyperresponsiveness and inflammation. J Immunol 180, 2062-2068.
Kim, Y.H., Choi, B.K., Oh, H.S., Kang, W.J., Mittler, R.S., and Kwon, B.S. (2009). Mechanisms involved in synergistic anticancer effects of anti-4-1BB and cyclophosphamide therapy. Mol Cancer Ther 8, 469-478.
Kwon, B.S., and Weissman, S.M. (1989). cDNA sequences of two inducible T-cell genes. Proc Natl Acad Sci U S A 86, 1963-1967.
Lee, H., Park, H.J., Sohn, H.J., Kim, J.M., and Kim, S.J. (2011). Combinatorial therapy for liver metastatic colon cancer: dendritic cell vaccine and low-dose agonistic anti-4-1BB antibody co-stimulatory signal. J Surg Res 169, e43-50.
Levitsky, V., de Campos-Lima, P.O., Frisan, Т., and Masucci, M.G. (1998). The clonal composition of a peptide-specific oligoclonal CTL repertoire selected in response to persistent EBV infection is stable overtime. J Immunol 161, 594-601.
Lewis Phillips, G. D., Li, G., Dugger, D. L., Crocker, L. M., Parsons, K. L., Mai, E., Blattler, W. A., Lambert, J.M., Chari, R.V., Lutz, R. J., et al. (2008). Targeting HER2-positive breast cancer with trastuzumab-DMl, an antibody-cytotoxic drug conjugate. Cancer Res 68, 9280-9290.
Li, F., and Ravetch, J.V. (2011). Inhibitory Fcgamma receptor engagement drives adjuvant and anti-tumor activities of agonistic CD40 antibodies. Science 333, 1030-1034.
Li, J., Ybarra, R., Мак, J., Herault, A., De Almeida, P., Arrazate, A., Ziai, J., Totpal, K., Junttila, M. R., Walsh, K.В., and Junttila, Т. T. (2018). IFNgamma-induced Chemokines Are Required for CXCR3-mediated T-Cell Recruitment and Antitumor Efficacy of Anti-HER2/CD3 Bispecific Antibody. Clinical Cancer Research 24, 6447-6458.
Lin, W., Voskens, C.J., Zhang, X., Schindler, D.G., Wood, A., Burch, E., Wei, Y., Chen, L., Tian, G., Tamada, K., et al. (2008). Fc-dependent expression of CD137 on human NK cells: insights into "agonistic" effects of anti-CD 137 monoclonal antibodies. Blood 112, 699-707.
Melero, I., Johnston, J.V., Shufford, W.W., Mittler, R.S., and Chen, L. (1998). NK1.1 cells express 4-1BB (CDwl37) costimulatory molecule and are required for tumor immunity elicited by anti-4-1BB monoclonal antibodies. Cell Immunol 190, 167-172.
Melero, I., Shuford, W.W., Newby, S.A., Aruffo, A., Ledbetter, J.A., Hellstrom, K.E., Mittler, R.S., and Chen, L. (1997). Monoclonal antibodies against the 4-IBB T-cell activation molecule eradicate established tumors. Nat Med 3, 682-685.
Merchant, A.M., Zhu, Z., Yuan, J.Q., Goddard, A., Adams, C.W., Presta, L.G., and Carter, P. (1998). An efficient route to human bispecific IgG. Nat Biotechnol 16, 677-681.
Morales-Kastresana, A., Sanmamed, M.F., Rodriguez, L, Palazon, A., Martinez-Forero, I., Labiano, S., Hervas-Stubbs, S., Sangro, В., Ochoa, C, Rouzaut, A., et al. (2013). Combined immunostimulatory monoclonal antibodies extend survival in an aggressive transgenic hepatocellular carcinoma mouse model. Clin Cancer Res 19, 6151-6162.
Mueller, D., Frey, K., Kontermann, R.E. (2008), A novel antibody-4-1BBl fusion protein for targeted costimulation in cancer immunotherapy, J. Immunother. 31, 714-722.
Murillo, O., Dubrot, J., Palazon, A., Arina, A., Azpilikueta, A., Alfaro, C, Solano, S., Ochoa, M.C., Berasain, C, Gabari, I., et al. (2009). In vivo depletion of DC impairs the anti-tumor effect of agonistic anti-CD 137 mAb. Eur J Immunol 39, 2424-2436.
Narazaki, H., Zhu, Y., Luo, L., Zhu, G., and Chen, L. (2010). CD137 agonist antibody prevents cancer recurrence: contribution of CD137 on both hematopoietic and nonhematopoietic cells. Blood 115, 1941-1948.
Nishimoto, H., Lee, S.W., Hong, H., Potter, K.G., Maeda-Yamamoto, M., Kinoshita, Т., Kawakami, Y., Mittler, R.S., Kwon, B.S., Ware, C.F., et al. (2005). Costimulation of mast cells by 4-IBB, a member of the tumor necrosis factor receptor superfamily, with the high-affinity IgE receptor. Blood 106, 4241-4248.
Olofsson, P.S., Soderstrom, L.A., Wagsater, D., Sheikine, Y., Ocaya, P., Lang, F., Rabu, C, Chen, L., Rudling, M., Aukrust, P., et al. (2008). CD137 is expressed in human atherosclerosis and promotes development of plaque inflammation in hypercholesterolemic mice. Circulation 117, 1292-1301.
Palazon, A., Teijeira, A., Martinez-Forero, I., Hervas-Stubbs, S., Roncal, C, Penuelas, I., Dubrot, J., Morales-Kastresana, A., Perez-Gracia, J.L., Ochoa, M.C., et al. (2011). Agonist anti-CD137 mAb act on tumor endothelial cells to enhance recruitment of activated T lymphocytes. Cancer Res 71, 801-811.
Taraban, V. Y., Rowley, T. F., O'Brien, L., Chan, H. Т., Haswell, L. E., Green, M. H., Tutt, A. L., Glennie, M. J., and Al-Shamkhani, A. (2002). Expression and costimulatory effects of the TNF receptor superfamily members CD 134 (OX40) and CD 137 (4-IBB), and their role in the generation of anti-tumor immune responses. Eur J Immunol 32, 3617-3627.
Schwarz, H., Valbracht, J., Tuckwell, J., von Kempis, J., and Lotz, M. (1995). I LA, the human 4-IBB homologue, is inducible in lymphoid and other cell lineages. Blood 85, 1043-1052.
Shao, Z., and Schwarz, H. (2011). CD137 ligand, a member of the tumor necrosis factor family, regulates immune responses via reverse signal transduction. J Leukoc Biol 89, 21-29.
Shi, W., and Siemann, D.W. (2006). Augmented antitumor effects of radiation therapy by 4-1BB antibody (BMS-469492) treatment. Anticancer Res 26, 3445-3453.
Shindo Y., Yoshimura K., Kuramasu A, Watanabe Y., Ito H.; Kondo Т., et al. (2015). Combination Immunotherapy with 4-IBB activation and PD-1 blockade enhances antitumor efficacy in a mouse model of subcutaneous tumor. Anticancer Res. 35(1), 129-136.
Simeone, E., and Ascierto, P. A. (2012). Immunomodulating antibodies in the treatment of metastatic melanoma: the experience with anti-CTLA-4, anti-CD 137, and anti-HER2. J Immunotoxicol 9, 241-247.
Snell, L.M., Lin, G.H., McPherson, A.J., Moraes, T.J., and Watts, Т.Н. (2011). T-cell intrinsic effects of GITR and 4-IBB during viral infection and cancer immunotherapy. Immunol Rev 244, 197-217.
Stagg, J., Loi, S., Divisekera, U., Ngiow, S.F., Duret, H., Yagita, H., Teng, M.W., and Smyth, M.J. (2011). Anti-ErbB-2 mAb therapy requires type I and II interferons and synergizes with anti-PD-1 or anti-CD137 mAb therapy. Proc Natl Acad Sci U S A 108, 7142-7147.
Teng, M.W., Sharkey, J., McLaughlin, N.M., Exley, M.A., and Smyth, M.J. (2009). CDld-based combination therapy eradicates established tumors in mice. J Immunol 183, 1911-1920.
von Kempis, J., Schwarz, H., and Lotz, M. (1997). Differentiation-dependent and stimulus-specific expression of ILA, the human 4-1BB-homologue, in cells of mesenchymal origin. Osteoarthritis Cartilage 5, 394-406.
Wei, H., Zhao, L., Li, W., Fan, K., Qian, W., Hou, S., Wang, H., Dai, M., Hellstrom, L, Hellstrom, K.E., and Guo, Y. (2013). Combinatorial PD-1 blockade and CD137 activation has therapeutic efficacy in murine cancer models and synergizes with cisplatin. PLoS One 8, e84927.
Wei H., Zhao L., Hellstrom I., Hellstrom K.E. and Guo Y. (2014). Dual targeting of CD137 со-stimulatory and PD-1 co-inhibitory molecules for ovarian cancer immunotherapy, Oncolmmunology, 3:4, e28248, DOI: 10.4161/onci.28248.
Wilcox, R.A., Chapoval, A.I., Gorski, K.S., Otsuji, M., Shin, Т., Flies, D.B., Tamada, K., Mittler, R.S., Tsuchiya, H., Pardoll, D.M., and Chen, L. (2002). Cutting edge: Expression of functional CD137 receptor by dendritic cells. J Immunol 168, 4262-4267.
Wilcox, R.A., Tamada, К., Flies, D.B., Zhu, G., Chapoval, A.I., Blazar, B.R., Kast, W.M., and Chen, L. (2004). Ligation of CD 137 receptor prevents and reverses established anergy of CD8+cytolytic T lymphocytes in vivo. Blood 103, 177-184.
Zhang, N., Sadun, R.E., Arias, R.S., Flanagan, M.L., Sachsman, S.M., Nien, Y, Khawli, L.A., Hu, P., Epstein, A.L. (2007). Targeted and untargeted CD137L fusion proteins for the immunotherapy of experimental solid tumors. Clin. Cancer Res. 13, 2758-2767.
Zhang, X., Voskens, C.J., Sallin, M., Maniar, A., Montes, C.L., Zhang, Y., Lin, W., Li, G., Burch, E., Tan, M., et al. (2010). CD137 promotes proliferation and survival of human В cells. J Immunol 184, 787-795.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F. Hoffmann-La Roche AG
<120> Her2-targeting Antigen Binding Molecules comprising 4-1BBL
<130> P34738-WO
<150> EP18167147.0
<151> 2018-04-13
<160> 106
<170> PatentIn version 3.5
<210> 1
<211> 184
<212> PRT
<213> Homo sapiens
<400> 1
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu
180
<210> 2
<211> 170
<212> PRT
<213> Homo sapiens
<400> 2
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
1 5 10 15
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
20 25 30
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
35 40 45
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
50 55 60
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
65 70 75 80
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
85 90 95
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
100 105 110
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
115 120 125
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
130 135 140
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
145 150 155 160
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
165 170
<210> 3
<211> 175
<212> PRT
<213> Homo sapiens
<400> 3
Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu
1 5 10 15
Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser
20 25 30
Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys
35 40 45
Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val
50 55 60
Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly
65 70 75 80
Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly
85 90 95
Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu
100 105 110
Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser
115 120 125
Ala Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg
130 135 140
His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg
145 150 155 160
Val Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
165 170 175
<210> 4
<211> 203
<212> PRT
<213> Homo sapiens
<400> 4
Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser
1 5 10 15
Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly
20 25 30
Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn
35 40 45
Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu
50 55 60
Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys
65 70 75 80
Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu
85 90 95
Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu
100 105 110
Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu
115 120 125
Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser
130 135 140
Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg
145 150 155 160
Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln
165 170 175
Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu
180 185 190
Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
195 200
<210> 5
<211> 178
<212> PRT
<213> Homo sapiens
<400> 5
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu
<210> 6
<211> 164
<212> PRT
<213> Homo sapiens
<400> 6
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
1 5 10 15
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
20 25 30
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
35 40 45
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
50 55 60
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
65 70 75 80
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
85 90 95
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
100 105 110
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
115 120 125
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
130 135 140
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
145 150 155 160
Pro Ala Gly Leu
<210> 7
<211> 169
<212> PRT
<213> Homo sapiens
<400> 7
Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu
1 5 10 15
Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser
20 25 30
Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys
35 40 45
Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val
50 55 60
Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly
65 70 75 80
Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly
85 90 95
Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu
100 105 110
Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser
115 120 125
Ala Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg
130 135 140
His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg
145 150 155 160
Val Thr Pro Glu Ile Pro Ala Gly Leu
165
<210> 8
<211> 197
<212> PRT
<213> Homo sapiens
<400> 8
Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser
1 5 10 15
Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly
20 25 30
Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn
35 40 45
Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu
50 55 60
Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys
65 70 75 80
Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu
85 90 95
Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu
100 105 110
Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu
115 120 125
Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser
130 135 140
Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg
145 150 155 160
Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln
165 170 175
Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu
180 185 190
Ile Pro Ala Gly Leu
195
<210> 9
<211> 378
<212> PRT
<213> Artificial Sequence
<220>
<223> dimeric hu 4-1BBL (71-254) connected by (G4S)2 linker
<400> 9
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly Gly Gly
180 185 190
Gly Ser Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu
195 200 205
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
210 215 220
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
225 230 235 240
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
245 250 255
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
260 265 270
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
275 280 285
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
290 295 300
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
305 310 315 320
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
325 330 335
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
340 345 350
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
355 360 365
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
370 375
<210> 10
<211> 366
<212> PRT
<213> Artificial Sequence
<220>
<223> dimeric hu 4-1BBL (71-248) connected by (G4S)2 linker
<400> 10
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Glu Gly Pro
180 185 190
Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly
195 200 205
Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro
210 215 220
Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly
225 230 235 240
Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala
245 250 255
Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala
260 265 270
Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu
275 280 285
Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro
290 295 300
Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg
305 310 315 320
Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr
325 330 335
Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val
340 345 350
Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu
355 360 365
<210> 11
<211> 360
<212> PRT
<213> Artificial Sequence
<220>
<223> dimeric hu 4-1BBL (80-254) connected by (G4S)2 linker
<400> 11
Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu
1 5 10 15
Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser
20 25 30
Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys
35 40 45
Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val
50 55 60
Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly
65 70 75 80
Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly
85 90 95
Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu
100 105 110
Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser
115 120 125
Ala Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg
130 135 140
His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg
145 150 155 160
Val Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu Gly
165 170 175
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Pro Ala Gly Leu Leu Asp
180 185 190
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
195 200 205
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
210 215 220
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
225 230 235 240
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
245 250 255
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
260 265 270
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
275 280 285
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
290 295 300
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
305 310 315 320
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
325 330 335
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
340 345 350
Gly Leu Pro Ser Pro Arg Ser Glu
355 360
<210> 12
<211> 416
<212> PRT
<213> Artificial Sequence
<220>
<223> dimeric hu 4-1BBL (52-254) connected by (G4S)2 linker
<400> 12
Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala Ala Ser
1 5 10 15
Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly
20 25 30
Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn
35 40 45
Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu
50 55 60
Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys
65 70 75 80
Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu
85 90 95
Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu
100 105 110
Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu
115 120 125
Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser
130 135 140
Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg
145 150 155 160
Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln
165 170 175
Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu
180 185 190
Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser
195 200 205
Gly Gly Gly Gly Ser Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro
210 215 220
Gly Ser Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro
225 230 235 240
Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln
245 250 255
Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr
260 265 270
Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr
275 280 285
Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr
290 295 300
Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser
305 310 315 320
Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala
325 330 335
Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser
340 345 350
Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu
355 360 365
Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala
370 375 380
Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe
385 390 395 400
Arg Val Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
405 410 415
<210> 13
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H1, pertuzumab
<400> 13
Gly Phe Thr Phe Thr Asp Tyr Thr Met Asp
1 5 10
<210> 14
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H2, pertuzumab
<400> 14
Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe Lys
1 5 10 15
Gly
<210> 15
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H3, pertuzumab
<400> 15
Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr
1 5 10
<210> 16
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L1, pertuzumab
<400> 16
Lys Ala Ser Gln Asp Val Ser Ile Gly Val Ala
1 5 10
<210> 17
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L2, pertuzumab
<400> 17
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L3, pertuzumab
<400> 18
Gln Gln Tyr Tyr Ile Tyr Pro Tyr Thr
1 5
<210> 19
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain VH, pertuzumab
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 20
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain VL, pertuzumab
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H1, trastuzumab
<400> 21
Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
1 5 10
<210> 22
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H2, trastuzumab
<400> 22
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 23
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H3, trastuzumab
<400> 23
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 24
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L1, trastuzumab
<400> 24
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala
1 5 10
<210> 25
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L2, trastuzumab
<400> 25
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 26
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L3, trastuzumab
<400> 26
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 27
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain VH, trastuzumab
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain VL, trastuzumab
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H1, aff. pertuzumab
<400> 29
Gly Phe Thr Phe Asn Asp Tyr Thr Met Asp
1 5 10
<210> 30
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H2, aff. pertuzumab
<400> 30
Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Val Asn Arg Arg Phe Lys
1 5 10 15
Gly
<210> 31
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H3,aff pertuzumab
<400> 31
Asn Leu Gly Pro Phe Phe Tyr Phe Asp Tyr
1 5 10
<210> 32
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L1,aff. pertuzumab
<400> 32
Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 33
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L2, aff. pertuzumab
<400> 33
Ser Ala Ser Phe Arg Tyr Thr
1 5
<210> 34
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L3, aff. pertuzumab
<400> 34
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 35
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain VH, aff. pertuzumab
<400> 35
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Val Asn Arg Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Phe Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 36
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain VL, aff. pertuzumab
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 708
<212> PRT
<213> Artificial Sequence
<220>
<223> Dimeric 4-1BB ligand (71-248) - CL* Fc knob chain
<400> 37
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Glu Gly Pro
180 185 190
Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly
195 200 205
Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro
210 215 220
Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly
225 230 235 240
Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala
245 250 255
Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala
260 265 270
Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu
275 280 285
Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro
290 295 300
Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg
305 310 315 320
Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr
325 330 335
Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val
340 345 350
Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu Gly Gly
355 360 365
Gly Gly Ser Gly Gly Gly Gly Ser Arg Thr Val Ala Ala Pro Ser Val
370 375 380
Phe Ile Phe Pro Pro Ser Asp Arg Lys Leu Lys Ser Gly Thr Ala Ser
385 390 395 400
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
405 410 415
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
420 425 430
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
435 440 445
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
450 455 460
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
465 470 475 480
Gly Glu Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
485 490 495
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
500 505 510
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
515 520 525
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
530 535 540
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
545 550 555 560
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
565 570 575
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly
580 585 590
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
595 600 605
Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn
610 615 620
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
625 630 635 640
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
645 650 655
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
660 665 670
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
675 680 685
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
690 695 700
Ser Leu Ser Pro
705
<210> 38
<211> 291
<212> PRT
<213> Artificial Sequence
<220>
<223> Monomeric 4-1BB ligand (71-248)-CH1*
<400> 38
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Ser Thr Lys
180 185 190
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
195 200 205
Gly Thr Ala Ala Leu Gly Cys Leu Val Glu Asp Tyr Phe Pro Glu Pro
210 215 220
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
225 230 235 240
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
245 250 255
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
260 265 270
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Glu Lys Val Glu Pro
275 280 285
Lys Ser Cys
290
<210> 39
<211> 708
<212> PRT
<213> Artificial Sequence
<220>
<223> Dimeric 4-1BB ligand (71-248) - CL Fc knob chain
<400> 39
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Glu Gly Pro
180 185 190
Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly
195 200 205
Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu Ile Asp Gly Pro
210 215 220
Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val Ser Leu Thr Gly
225 230 235 240
Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val Val Ala Lys Ala
245 250 255
Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg Arg Val Val Ala
260 265 270
Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His Leu Gln Pro Leu
275 280 285
Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr Val Asp Leu Pro
290 295 300
Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg
305 310 315 320
Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val His Leu His Thr
325 330 335
Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln Gly Ala Thr Val
340 345 350
Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala Gly Leu Gly Gly
355 360 365
Gly Gly Ser Gly Gly Gly Gly Ser Arg Thr Val Ala Ala Pro Ser Val
370 375 380
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
385 390 395 400
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
405 410 415
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
420 425 430
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
435 440 445
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
450 455 460
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
465 470 475 480
Gly Glu Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
485 490 495
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
500 505 510
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
515 520 525
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
530 535 540
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
545 550 555 560
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
565 570 575
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly
580 585 590
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
595 600 605
Pro Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn
610 615 620
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
625 630 635 640
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
645 650 655
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
660 665 670
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
675 680 685
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
690 695 700
Ser Leu Ser Pro
705
<210> 40
<211> 291
<212> PRT
<213> Artificial Sequence
<220>
<223> Monomeric 4-1BB ligand (71-248)-CH1
<400> 40
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Ser Thr Lys
180 185 190
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
195 200 205
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
210 215 220
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
225 230 235 240
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
245 250 255
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
260 265 270
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
275 280 285
Lys Ser Cys
290
<210> 41
<211> 720
<212> PRT
<213> Artificial Sequence
<220>
<223> Dimeric 4-1BB ligand (71-254) - CL* Fc knob chain
<400> 41
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly Gly Gly
180 185 190
Gly Ser Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu
195 200 205
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
210 215 220
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
225 230 235 240
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
245 250 255
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
260 265 270
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
275 280 285
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
290 295 300
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
305 310 315 320
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
325 330 335
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
340 345 350
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
355 360 365
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
385 390 395 400
Pro Ser Asp Arg Lys Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
405 410 415
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
420 425 430
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
435 440 445
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
450 455 460
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
465 470 475 480
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp
485 490 495
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
500 505 510
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
515 520 525
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
530 535 540
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
545 550 555 560
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
565 570 575
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
580 585 590
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
595 600 605
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
610 615 620
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
625 630 635 640
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
645 650 655
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
660 665 670
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
675 680 685
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
690 695 700
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
705 710 715 720
<210> 42
<211> 297
<212> PRT
<213> Artificial Sequence
<220>
<223> Monomeric 4-1BB ligand (71-254)-CH1*
<400> 42
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly Gly Gly
180 185 190
Gly Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
195 200 205
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Glu
210 215 220
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
225 230 235 240
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
245 250 255
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
260 265 270
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
275 280 285
Asp Glu Lys Val Glu Pro Lys Ser Cys
290 295
<210> 43
<211> 720
<212> PRT
<213> Artificial Sequence
<220>
<223> Dimeric 4-1BB ligand (71-254) - CL Fc knob chain
<400> 43
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly Gly Gly
180 185 190
Gly Ser Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu
195 200 205
Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val
210 215 220
Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala
225 230 235 240
Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu
245 250 255
Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu
260 265 270
Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala
275 280 285
Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala
290 295 300
Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala
305 310 315 320
Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu
325 330 335
Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu
340 345 350
Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile
355 360 365
Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
385 390 395 400
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
405 410 415
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
420 425 430
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
435 440 445
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
450 455 460
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
465 470 475 480
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp
485 490 495
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
500 505 510
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
515 520 525
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
530 535 540
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
545 550 555 560
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
565 570 575
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
580 585 590
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
595 600 605
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
610 615 620
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
625 630 635 640
Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
645 650 655
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
660 665 670
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
675 680 685
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
690 695 700
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
705 710 715 720
<210> 44
<211> 297
<212> PRT
<213> Artificial Sequence
<220>
<223> Monomeric 4-1BB ligand (71-254) -CH1
<400> 44
Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro Ala Gly Leu Leu Asp
1 5 10 15
Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala Gln Asn Val Leu Leu
20 25 30
Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro Gly Leu Ala Gly Val
35 40 45
Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp Thr Lys Glu Leu Val
50 55 60
Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe Gln Leu Glu Leu Arg
65 70 75 80
Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val Ser Leu Ala Leu His
85 90 95
Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala Ala Leu Ala Leu Thr
100 105 110
Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg Asn Ser Ala Phe Gly
115 120 125
Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly Gln Arg Leu Gly Val
130 135 140
His Leu His Thr Glu Ala Arg Ala Arg His Ala Trp Gln Leu Thr Gln
145 150 155 160
Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr Pro Glu Ile Pro Ala
165 170 175
Gly Leu Pro Ser Pro Arg Ser Glu Gly Gly Gly Gly Ser Gly Gly Gly
180 185 190
Gly Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
195 200 205
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
210 215 220
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
225 230 235 240
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
245 250 255
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
260 265 270
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
275 280 285
Asp Lys Lys Val Glu Pro Lys Ser Cys
290 295
<210> 45
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (PER) Fc hole chain
<400> 45
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 46
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (PER) light chain
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 47
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (TRAS) Fc hole chain
<400> 47
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 48
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (TRAS) light chain
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 49
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (aff-PER) Fc hole chain
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Val Asn Arg Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Phe Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 50
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-Her2 (aff-PER) light chain
<400> 50
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 51
<211> 163
<212> PRT
<213> Homo sapiens
<400> 51
Leu Gln Asp Pro Cys Ser Asn Cys Pro Ala Gly Thr Phe Cys Asp Asn
1 5 10 15
Asn Arg Asn Gln Ile Cys Ser Pro Cys Pro Pro Asn Ser Phe Ser Ser
20 25 30
Ala Gly Gly Gln Arg Thr Cys Asp Ile Cys Arg Gln Cys Lys Gly Val
35 40 45
Phe Arg Thr Arg Lys Glu Cys Ser Ser Thr Ser Asn Ala Glu Cys Asp
50 55 60
Cys Thr Pro Gly Phe His Cys Leu Gly Ala Gly Cys Ser Met Cys Glu
65 70 75 80
Gln Asp Cys Lys Gln Gly Gln Glu Leu Thr Lys Lys Gly Cys Lys Asp
85 90 95
Cys Cys Phe Gly Thr Phe Asn Asp Gln Lys Arg Gly Ile Cys Arg Pro
100 105 110
Trp Thr Asn Cys Ser Leu Asp Gly Lys Ser Val Leu Val Asn Gly Thr
115 120 125
Lys Glu Arg Asp Val Val Cys Gly Pro Ser Pro Ala Asp Leu Ser Pro
130 135 140
Gly Ala Ser Ser Val Thr Pro Pro Ala Pro Ala Arg Glu Pro Gly His
145 150 155 160
Ser Pro Gln
<210> 52
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Fc hole chain
<400> 52
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro
225
<210> 53
<211> 422
<212> PRT
<213> Artificial Sequence
<220>
<223> human 4-1BB antigen Fc knob chain
<400> 53
Leu Gln Asp Pro Cys Ser Asn Cys Pro Ala Gly Thr Phe Cys Asp Asn
1 5 10 15
Asn Arg Asn Gln Ile Cys Ser Pro Cys Pro Pro Asn Ser Phe Ser Ser
20 25 30
Ala Gly Gly Gln Arg Thr Cys Asp Ile Cys Arg Gln Cys Lys Gly Val
35 40 45
Phe Arg Thr Arg Lys Glu Cys Ser Ser Thr Ser Asn Ala Glu Cys Asp
50 55 60
Cys Thr Pro Gly Phe His Cys Leu Gly Ala Gly Cys Ser Met Cys Glu
65 70 75 80
Gln Asp Cys Lys Gln Gly Gln Glu Leu Thr Lys Lys Gly Cys Lys Asp
85 90 95
Cys Cys Phe Gly Thr Phe Asn Asp Gln Lys Arg Gly Ile Cys Arg Pro
100 105 110
Trp Thr Asn Cys Ser Leu Asp Gly Lys Ser Val Leu Val Asn Gly Thr
115 120 125
Lys Glu Arg Asp Val Val Cys Gly Pro Ser Pro Ala Asp Leu Ser Pro
130 135 140
Gly Ala Ser Ser Val Thr Pro Pro Ala Pro Ala Arg Glu Pro Gly His
145 150 155 160
Ser Pro Gln Val Asp Glu Gln Leu Tyr Phe Gln Gly Gly Ser Pro Lys
165 170 175
Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
180 185 190
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
195 200 205
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
210 215 220
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
225 230 235 240
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
245 250 255
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
260 265 270
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
275 280 285
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
290 295 300
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
305 310 315 320
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
325 330 335
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
340 345 350
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
355 360 365
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
370 375 380
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
385 390 395 400
Leu Ser Pro Gly Lys Ser Gly Gly Leu Asn Asp Ile Phe Glu Ala Gln
405 410 415
Lys Ile Glu Trp His Glu
420
<210> 54
<211> 1245
<212> PRT
<213> Homo sapiens
<400> 54
Met Glu Leu Ala Ala Leu Cys Arg Trp Gly Leu Leu Leu Ala Leu Leu
1 5 10 15
Pro Pro Gly Ala Ala Ser Thr Gln Val Cys Thr Gly Thr Asp Met Lys
20 25 30
Leu Arg Leu Pro Ala Ser Pro Glu Thr His Leu Asp Met Leu Arg His
35 40 45
Leu Tyr Gln Gly Cys Gln Val Val Gln Gly Asn Leu Glu Leu Thr Tyr
50 55 60
Leu Pro Thr Asn Ala Ser Leu Ser Phe Leu Gln Asp Ile Gln Glu Val
65 70 75 80
Gln Gly Tyr Val Leu Ile Ala His Asn Gln Val Arg Gln Val Pro Leu
85 90 95
Gln Arg Leu Arg Ile Val Arg Gly Thr Gln Leu Phe Glu Asp Asn Tyr
100 105 110
Ala Leu Ala Val Leu Asp Asn Gly Asp Pro Leu Asn Asn Thr Thr Pro
115 120 125
Val Thr Gly Ala Ser Pro Gly Gly Leu Arg Glu Leu Gln Leu Arg Ser
130 135 140
Leu Thr Glu Ile Leu Lys Gly Gly Val Leu Ile Gln Arg Asn Pro Gln
145 150 155 160
Leu Cys Tyr Gln Asp Thr Ile Leu Trp Lys Asp Ile Phe His Lys Asn
165 170 175
Asn Gln Leu Ala Leu Thr Leu Ile Asp Thr Asn Arg Ser Arg Ala Cys
180 185 190
His Pro Cys Ser Pro Met Cys Lys Gly Ser Arg Cys Trp Gly Glu Ser
195 200 205
Ser Glu Asp Cys Gln Ser Leu Thr Arg Thr Val Cys Ala Gly Gly Cys
210 215 220
Ala Arg Cys Lys Gly Pro Leu Pro Thr Asp Cys Cys His Glu Gln Cys
225 230 235 240
Ala Ala Gly Cys Thr Gly Pro Lys His Ser Asp Cys Leu Ala Cys Leu
245 250 255
His Phe Asn His Ser Gly Ile Cys Glu Leu His Cys Pro Ala Leu Val
260 265 270
Thr Tyr Asn Thr Asp Thr Phe Glu Ser Met Pro Asn Pro Glu Gly Arg
275 280 285
Tyr Thr Phe Gly Ala Ser Cys Val Thr Ala Cys Pro Tyr Asn Tyr Leu
290 295 300
Ser Thr Asp Val Gly Ser Cys Thr Leu Val Cys Pro Leu His Asn Gln
305 310 315 320
Glu Val Thr Ala Glu Asp Gly Thr Gln Arg Cys Glu Lys Cys Ser Lys
325 330 335
Pro Cys Ala Arg Val Cys Tyr Gly Leu Gly Met Glu His Leu Arg Glu
340 345 350
Val Arg Ala Val Thr Ser Ala Asn Ile Gln Glu Phe Ala Gly Cys Lys
355 360 365
Lys Ile Phe Gly Ser Leu Ala Phe Leu Pro Glu Ser Phe Asp Gly Asp
370 375 380
Pro Ala Ser Asn Thr Ala Glu Thr Leu Glu Glu Ile Thr Gly Tyr Leu
385 390 395 400
Tyr Ile Ser Ala Trp Pro Asp Ser Leu Pro Asp Leu Ser Val Phe Gln
405 410 415
Asn Leu Gln Val Ile Arg Gly Arg Ile Leu His Asn Gly Ala Tyr Ser
420 425 430
Leu Thr Leu Gln Gly Leu Gly Ile Ser Trp Leu Gly Leu Arg Ser Leu
435 440 445
Arg Glu Leu Gly Ser Gly Leu Ala Leu Ile His His Asn Thr His Leu
450 455 460
Cys Phe Val His Thr Val Pro Trp Asp Gln Leu Phe Arg Asn Pro His
465 470 475 480
Gln Ala Leu Leu His Thr Ala Asn Arg Pro Glu Asp Glu Cys Val Gly
485 490 495
Glu Gly Leu Ala Cys His Gln Leu Cys Ala Arg Gly His Cys Trp Gly
500 505 510
Pro Gly Pro Thr Gln Cys Val Asn Cys Ser Gln Phe Leu Arg Gly Gln
515 520 525
Glu Cys Val Glu Glu Cys Arg Val Leu Gln Gly Leu Pro Arg Glu Tyr
530 535 540
Val Asn Ala Arg His Cys Leu Pro Cys His Pro Glu Cys Gln Pro Gln
545 550 555 560
Asn Gly Ser Val Thr Cys Phe Gly Pro Glu Ala Asp Gln Cys Val Ala
565 570 575
Cys Ala His Tyr Lys Asp Pro Pro Phe Cys Val Ala Arg Cys Pro Ser
580 585 590
Gly Val Lys Pro Asp Leu Ser Tyr Met Pro Ile Trp Lys Phe Pro Asp
595 600 605
Glu Glu Gly Ala Cys Gln Pro Cys Pro Ile Asn Cys Thr His Ser Cys
610 615 620
Val Asp Leu Asp Asp Lys Gly Cys Pro Ala Glu Gln Arg Ala Ser Pro
625 630 635 640
Leu Thr Ser Ile Ile Ser Ala Val Val Gly Ile Leu Leu Val Val Val
645 650 655
Leu Gly Val Val Phe Gly Ile Leu Ile Lys Arg Arg Gln Gln Lys Ile
660 665 670
Arg Lys Tyr Thr Met Arg Arg Leu Leu Gln Glu Thr Glu Leu Val Glu
675 680 685
Pro Leu Thr Pro Ser Gly Ala Met Pro Asn Gln Ala Gln Met Arg Ile
690 695 700
Leu Lys Glu Thr Glu Leu Arg Lys Val Lys Val Leu Gly Ser Gly Ala
705 710 715 720
Phe Gly Thr Val Tyr Lys Gly Ile Trp Ile Pro Asp Gly Glu Asn Val
725 730 735
Lys Ile Pro Val Ala Ile Lys Val Leu Arg Glu Asn Thr Ser Pro Lys
740 745 750
Ala Asn Lys Glu Ile Leu Asp Glu Ala Tyr Val Met Ala Gly Val Gly
755 760 765
Ser Pro Tyr Val Ser Arg Leu Leu Gly Ile Cys Leu Thr Ser Thr Val
770 775 780
Gln Leu Val Thr Gln Leu Met Pro Tyr Gly Cys Leu Leu Asp His Val
785 790 795 800
Arg Glu Asn Arg Gly Arg Leu Gly Ser Gln Asp Leu Leu Asn Trp Cys
805 810 815
Met Gln Ile Ala Lys Gly Met Ser Tyr Leu Glu Asp Val Arg Leu Val
820 825 830
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Lys Ser Pro Asn His
835 840 845
Val Lys Ile Thr Asp Phe Gly Leu Ala Arg Leu Leu Asp Ile Asp Glu
850 855 860
Thr Glu Tyr His Ala Asp Gly Gly Lys Val Pro Ile Lys Trp Met Ala
865 870 875 880
Leu Glu Ser Ile Leu Arg Arg Arg Phe Thr His Gln Ser Asp Val Trp
885 890 895
Ser Tyr Gly Val Thr Val Trp Glu Leu Met Thr Phe Gly Ala Lys Pro
900 905 910
Tyr Asp Gly Ile Pro Ala Arg Glu Ile Pro Asp Leu Leu Glu Lys Gly
915 920 925
Glu Arg Leu Pro Gln Pro Pro Ile Cys Thr Ile Asp Val Tyr Met Ile
930 935 940
Met Val Lys Cys Trp Met Ile Asp Ser Glu Cys Arg Pro Arg Phe Arg
945 950 955 960
Glu Leu Val Ser Glu Phe Ser Arg Met Ala Arg Asp Pro Gln Arg Phe
965 970 975
Val Val Ile Gln Asn Glu Asp Leu Gly Pro Ala Ser Pro Leu Asp Ser
980 985 990
Thr Phe Tyr Arg Ser Leu Leu Glu Asp Asp Asp Met Gly Asp Leu Val
995 1000 1005
Asp Ala Glu Glu Tyr Leu Val Pro Gln Gln Gly Phe Phe Cys Pro
1010 1015 1020
Asp Pro Ala Pro Gly Ala Gly Gly Met Val His His Arg His Arg
1025 1030 1035
Ser Ser Ser Thr Arg Ser Gly Gly Gly Asp Leu Thr Leu Gly Leu
1040 1045 1050
Glu Pro Ser Glu Glu Glu Ala Pro Arg Ser Pro Leu Ala Pro Ser
1055 1060 1065
Glu Gly Ala Gly Ser Asp Val Phe Asp Gly Asp Leu Gly Met Gly
1070 1075 1080
Ala Ala Lys Gly Leu Gln Ser Leu Pro Thr His Asp Pro Ser Pro
1085 1090 1095
Leu Gln Arg Tyr Ser Glu Asp Pro Thr Val Pro Leu Pro Ser Glu
1100 1105 1110
Thr Asp Gly Tyr Val Ala Pro Leu Thr Cys Ser Pro Gln Pro Glu
1115 1120 1125
Tyr Val Asn Gln Pro Asp Val Arg Pro Gln Pro Pro Ser Pro Arg
1130 1135 1140
Glu Gly Pro Leu Pro Ala Ala Arg Pro Ala Gly Ala Thr Leu Glu
1145 1150 1155
Arg Pro Lys Thr Leu Ser Pro Gly Lys Asn Gly Val Val Lys Asp
1160 1165 1170
Val Phe Ala Phe Gly Gly Ala Val Glu Asn Pro Glu Tyr Leu Thr
1175 1180 1185
Pro Gln Gly Gly Ala Ala Pro Gln Pro His Pro Pro Pro Ala Phe
1190 1195 1200
Ser Pro Ala Phe Asp Asn Leu Tyr Tyr Trp Asp Gln Asp Pro Pro
1205 1210 1215
Glu Arg Gly Ala Pro Pro Ser Thr Phe Lys Gly Thr Pro Thr Ala
1220 1225 1230
Glu Asn Pro Glu Tyr Leu Gly Leu Asp Val Pro Val
1235 1240 1245
<210> 55
<211> 464
<212> PRT
<213> Artificial Sequence
<220>
<223> 4-1BB antibody 20H4.9 IgG4, Heavy chain
<400> 55
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Ser Pro Glu Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Gly Gly Tyr Val Thr Tyr Asn Pro
65 70 75 80
Ser Leu Glu Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Tyr Gly Pro Gly Asn Tyr Asp Trp Tyr Phe Asp
115 120 125
Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
130 135 140
Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu
145 150 155 160
Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
165 170 175
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
180 185 190
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
195 200 205
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn
210 215 220
Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser
225 230 235 240
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
275 280 285
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr
305 310 315 320
Arg Trp Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
325 330 335
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
340 345 350
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
355 360 365
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
370 375 380
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
385 390 395 400
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
405 410 415
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
420 425 430
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
435 440 445
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
450 455 460
<210> 56
<211> 216
<212> PRT
<213> Artificial Sequence
<220>
<223> 4-1BB antibody 20H4.9 IgG4, Light chain
<400> 56
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Ala Leu Thr Phe Cys Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 57
<211> 440
<212> PRT
<213> Artificial Sequence
<220>
<223> 4-1BB antibody MOR7480 IgG2, Heavy chain
<400> 57
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Thr Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe
180 185 190
Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro
210 215 220
Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 58
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> 4-1BB antibody MOR7480 IgG2, Light chain
<400> 58
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Lys Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Tyr Thr Gly Phe Gly Ser Leu
85 90 95
Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Tyr Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 59
<211> 640
<212> PRT
<213> Artificial Sequence
<220>
<223> Her2 (TRAS)-anticalin-4-1BB human IgG4 heavy chain
<400> 59
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
435 440 445
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
450 455 460
Ser Thr Ser Asp Leu Ile Pro Ala Pro Pro Leu Ser Lys Val Pro Leu
465 470 475 480
Gln Gln Asn Phe Gln Asp Asn Gln Phe His Gly Lys Trp Tyr Val Val
485 490 495
Gly Gln Ala Gly Asn Ile Arg Leu Arg Glu Asp Lys Asp Pro Ile Lys
500 505 510
Met Met Ala Thr Ile Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val
515 520 525
Thr Met Val Lys Phe Asp Asp Lys Lys Cys Met Tyr Asp Ile Trp Thr
530 535 540
Phe Val Pro Gly Ser Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys
545 550 555 560
Ser Phe Pro Gly His Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn
565 570 575
Tyr Asn Gln His Ala Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg
580 585 590
Glu Glu Phe Tyr Ile Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser
595 600 605
Glu Leu Lys Glu Asn Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro
610 615 620
Glu Asn His Ile Val Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly
625 630 635 640
<210> 60
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Her2 (TRAS)-anticalin-4-1BB human IgG4 light chain
<400> 60
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 61
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> DP47 Fc hole chain
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Ser Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 62
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> DP47 light chain
<400> 62
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 63
<211> 635
<212> PRT
<213> Artificial Sequence
<220>
<223> DP47-anticalin-4-1BB human IgG4 heavy chain
<400> 63
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Ser Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Ser Thr Ser Asp Leu
450 455 460
Ile Pro Ala Pro Pro Leu Ser Lys Val Pro Leu Gln Gln Asn Phe Gln
465 470 475 480
Asp Asn Gln Phe His Gly Lys Trp Tyr Val Val Gly Gln Ala Gly Asn
485 490 495
Ile Arg Leu Arg Glu Asp Lys Asp Pro Ile Lys Met Met Ala Thr Ile
500 505 510
Tyr Glu Leu Lys Glu Asp Lys Ser Tyr Asp Val Thr Met Val Lys Phe
515 520 525
Asp Asp Lys Lys Cys Met Tyr Asp Ile Trp Thr Phe Val Pro Gly Ser
530 535 540
Gln Pro Gly Glu Phe Thr Leu Gly Lys Ile Lys Ser Phe Pro Gly His
545 550 555 560
Thr Ser Ser Leu Val Arg Val Val Ser Thr Asn Tyr Asn Gln His Ala
565 570 575
Met Val Phe Phe Lys Phe Val Phe Gln Asn Arg Glu Glu Phe Tyr Ile
580 585 590
Thr Leu Tyr Gly Arg Thr Lys Glu Leu Thr Ser Glu Leu Lys Glu Asn
595 600 605
Phe Ile Arg Phe Ser Lys Ser Leu Gly Leu Pro Glu Asn His Ile Val
610 615 620
Phe Pro Val Pro Ile Asp Gln Cys Ile Asp Gly
625 630 635
<210> 64
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> DP47-anticalin-4-1BB human IgG4 light chain
<400> 64
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 65
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> Her2 (TRAS) human IgG1 P329G LALA, Heavy chain
<400> 65
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 66
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Her2 (PER) human IgG1 P329G LALA, Heavy chain
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 67
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> DP47 human IgG1 P329G LALA, Heavy chain
<400> 67
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Ser Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440
<210> 68
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> (G4S)2 peptide linker
<400> 68
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 69
<211> 254
<212> PRT
<213> Homo sapiens
<400> 69
Met Glu Tyr Ala Ser Asp Ala Ser Leu Asp Pro Glu Ala Pro Trp Pro
1 5 10 15
Pro Ala Pro Arg Ala Arg Ala Cys Arg Val Leu Pro Trp Ala Leu Val
20 25 30
Ala Gly Leu Leu Leu Leu Leu Leu Leu Ala Ala Ala Cys Ala Val Phe
35 40 45
Leu Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser
50 55 60
Ala Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp
65 70 75 80
Pro Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val
85 90 95
Ala Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp
100 105 110
Pro Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu
115 120 125
Asp Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe
130 135 140
Phe Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser
145 150 155 160
Val Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala
165 170 175
Ala Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala
180 185 190
Arg Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala
195 200 205
Gly Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His
210 215 220
Ala Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val
225 230 235 240
Thr Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
245 250
<210> 70
<211> 205
<212> PRT
<213> Homo sapiens
<400> 70
Ala Cys Pro Trp Ala Val Ser Gly Ala Arg Ala Ser Pro Gly Ser Ala
1 5 10 15
Ala Ser Pro Arg Leu Arg Glu Gly Pro Glu Leu Ser Pro Asp Asp Pro
20 25 30
Ala Gly Leu Leu Asp Leu Arg Gln Gly Met Phe Ala Gln Leu Val Ala
35 40 45
Gln Asn Val Leu Leu Ile Asp Gly Pro Leu Ser Trp Tyr Ser Asp Pro
50 55 60
Gly Leu Ala Gly Val Ser Leu Thr Gly Gly Leu Ser Tyr Lys Glu Asp
65 70 75 80
Thr Lys Glu Leu Val Val Ala Lys Ala Gly Val Tyr Tyr Val Phe Phe
85 90 95
Gln Leu Glu Leu Arg Arg Val Val Ala Gly Glu Gly Ser Gly Ser Val
100 105 110
Ser Leu Ala Leu His Leu Gln Pro Leu Arg Ser Ala Ala Gly Ala Ala
115 120 125
Ala Leu Ala Leu Thr Val Asp Leu Pro Pro Ala Ser Ser Glu Ala Arg
130 135 140
Asn Ser Ala Phe Gly Phe Gln Gly Arg Leu Leu His Leu Ser Ala Gly
145 150 155 160
Gln Arg Leu Gly Val His Leu His Thr Glu Ala Arg Ala Arg His Ala
165 170 175
Trp Gln Leu Thr Gln Gly Ala Thr Val Leu Gly Leu Phe Arg Val Thr
180 185 190
Pro Glu Ile Pro Ala Gly Leu Pro Ser Pro Arg Ser Glu
195 200 205
<210> 71
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker G4S
<400> 71
Gly Gly Gly Gly Ser
1 5
<210> 72
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker (SG4)2
<400> 72
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10
<210> 73
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker (G4S)3
<400> 73
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 74
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker G4(SG4)2
<400> 74
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10
<210> 75
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker (G4S)4
<400> 75
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 76
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GSPGSSSSGS
<400> 76
Gly Ser Pro Gly Ser Ser Ser Ser Gly Ser
1 5 10
<210> 77
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GSGSGSGS
<400> 77
Gly Ser Gly Ser Gly Ser Gly Ser
1 5
<210> 78
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GSGSGNGS
<400> 78
Gly Ser Gly Ser Gly Asn Gly Ser
1 5
<210> 79
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GGSGSGSG
<400> 79
Gly Gly Ser Gly Ser Gly Ser Gly
1 5
<210> 80
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GGSGSG
<400> 80
Gly Gly Ser Gly Ser Gly
1 5
<210> 81
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GGSG
<400> 81
Gly Gly Ser Gly
1
<210> 82
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> GGSGNGSG
<400> 82
Gly Gly Ser Gly Asn Gly Ser Gly
1 5
<210> 83
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide inker GGNGSGSG
<400> 83
Gly Gly Asn Gly Ser Gly Ser Gly
1 5
<210> 84
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide linker GGNGSG
<400> 84
Gly Gly Asn Gly Ser Gly
1 5
<210> 85
<211> 207
<212> PRT
<213> Homo sapiens
<400> 85
Met Gln Ser Gly Thr His Trp Arg Val Leu Gly Leu Cys Leu Leu Ser
1 5 10 15
Val Gly Val Trp Gly Gln Asp Gly Asn Glu Glu Met Gly Gly Ile Thr
20 25 30
Gln Thr Pro Tyr Lys Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr
35 40 45
Cys Pro Gln Tyr Pro Gly Ser Glu Ile Leu Trp Gln His Asn Asp Lys
50 55 60
Asn Ile Gly Gly Asp Glu Asp Asp Lys Asn Ile Gly Ser Asp Glu Asp
65 70 75 80
His Leu Ser Leu Lys Glu Phe Ser Glu Leu Glu Gln Ser Gly Tyr Tyr
85 90 95
Val Cys Tyr Pro Arg Gly Ser Lys Pro Glu Asp Ala Asn Phe Tyr Leu
100 105 110
Tyr Leu Arg Ala Arg Val Cys Glu Asn Cys Met Glu Met Asp Val Met
115 120 125
Ser Val Ala Thr Ile Val Ile Val Asp Ile Cys Ile Thr Gly Gly Leu
130 135 140
Leu Leu Leu Val Tyr Tyr Trp Ser Lys Asn Arg Lys Ala Lys Ala Lys
145 150 155 160
Pro Val Thr Arg Gly Ala Gly Ala Gly Gly Arg Gln Arg Gly Gln Asn
165 170 175
Lys Glu Arg Pro Pro Pro Val Pro Asn Pro Asp Tyr Glu Pro Ile Arg
180 185 190
Lys Gly Gln Arg Asp Leu Tyr Ser Gly Leu Asn Gln Arg Arg Ile
195 200 205
<210> 86
<211> 198
<212> PRT
<213> Macacis fascularis
<400> 86
Met Gln Ser Gly Thr Arg Trp Arg Val Leu Gly Leu Cys Leu Leu Ser
1 5 10 15
Ile Gly Val Trp Gly Gln Asp Gly Asn Glu Glu Met Gly Ser Ile Thr
20 25 30
Gln Thr Pro Tyr Gln Val Ser Ile Ser Gly Thr Thr Val Ile Leu Thr
35 40 45
Cys Ser Gln His Leu Gly Ser Glu Ala Gln Trp Gln His Asn Gly Lys
50 55 60
Asn Lys Glu Asp Ser Gly Asp Arg Leu Phe Leu Pro Glu Phe Ser Glu
65 70 75 80
Met Glu Gln Ser Gly Tyr Tyr Val Cys Tyr Pro Arg Gly Ser Asn Pro
85 90 95
Glu Asp Ala Ser His His Leu Tyr Leu Lys Ala Arg Val Cys Glu Asn
100 105 110
Cys Met Glu Met Asp Val Met Ala Val Ala Thr Ile Val Ile Val Asp
115 120 125
Ile Cys Ile Thr Leu Gly Leu Leu Leu Leu Val Tyr Tyr Trp Ser Lys
130 135 140
Asn Arg Lys Ala Lys Ala Lys Pro Val Thr Arg Gly Ala Gly Ala Gly
145 150 155 160
Gly Arg Gln Arg Gly Gln Asn Lys Glu Arg Pro Pro Pro Val Pro Asn
165 170 175
Pro Asp Tyr Glu Pro Ile Arg Lys Gly Gln Gln Asp Leu Tyr Ser Gly
180 185 190
Leu Asn Gln Arg Arg Ile
195
<210> 87
<211> 442
<212> PRT
<213> Artificial Sequence
<220>
<223> VHCH1(EE) (MU137-1) Fc-KK (mu4-1BB-Her2)
<400> 87
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Tyr Phe
20 25 30
Asp Met Ala Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Ser Pro Ser Gly Asp Ile Pro Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Val Ser Arg Glu Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Arg Ser Tyr Gly Gly Tyr Ser Glu Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Val Met Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Glu Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Gln Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Glu Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Lys Pro
275 280 285
Arg Glu Glu Gln Ile Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Lys Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asn
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Lys Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro
435 440
<210> 88
<211> 663
<212> PRT
<213> Artificial Sequence
<220>
<223> VLCH1 (2C4) VHCH1(EE) (MU137-1) Fc-DD (mu4-1BB-Her2)
<400> 88
Asp Thr Val Met Thr Gln Ser His Lys Ile Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Ser Ser Ala Lys Thr
100 105 110
Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr
115 120 125
Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu
130 135 140
Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His
145 150 155 160
Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser
165 170 175
Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val Thr Cys Asn
180 185 190
Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro
195 200 205
Arg Asp Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln
210 215 220
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Lys
225 230 235 240
Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Tyr Phe Asp Met Ala
245 250 255
Trp Val Arg Gln Ala Pro Thr Lys Gly Leu Glu Trp Val Ala Ser Ile
260 265 270
Ser Pro Ser Gly Asp Ile Pro Tyr Tyr Arg Asp Ser Val Lys Gly Arg
275 280 285
Phe Thr Val Ser Arg Glu Asn Ala Lys Ser Ser Leu Tyr Leu Gln Met
290 295 300
Asp Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Arg
305 310 315 320
Ser Tyr Gly Gly Tyr Ser Glu Leu Asp Tyr Trp Gly Gln Gly Val Met
325 330 335
Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu
340 345 350
Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys
355 360 365
Leu Val Glu Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser
370 375 380
Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
385 390 395 400
Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp
405 410 415
Pro Ser Gln Thr Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr
420 425 430
Lys Val Asp Glu Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys
435 440 445
Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys
450 455 460
Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val
465 470 475 480
Val Val Ala Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe
485 490 495
Val Asp Asp Val Glu Val His Thr Ala Gln Thr Lys Pro Arg Glu Glu
500 505 510
Gln Ile Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His
515 520 525
Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala
530 535 540
Ala Phe Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg
545 550 555 560
Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met
565 570 575
Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asn Phe Phe Pro
580 585 590
Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn
595 600 605
Tyr Asp Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val
610 615 620
Tyr Ser Asp Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr
625 630 635 640
Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu
645 650 655
Lys Ser Leu Ser His Ser Pro
660
<210> 89
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> VLCL(RK)-Light chain (MU137-1) (mu4-1BB-Her2)
<400> 89
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Glu
1 5 10 15
Glu Ile Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Gly Asn Trp
20 25 30
Leu Ala Trp Tyr His Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Gly Thr Ser Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Ser Ser Gly Ser Gln Tyr Ser Leu Lys Ile Ser Arg Leu Gln Val
65 70 75 80
Glu Asp Ile Gly Ile Tyr Tyr Cys Leu Gln Ala Tyr Gly Ala Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Arg Lys Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 90
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> VHCL-Light chain (2C4)
<400> 90
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Lys Ala Ser Leu Thr Val Asp Arg Ser Ser Arg Ile Val Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Phe Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Asp Ala Ala Pro Thr Val Ser
115 120 125
Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val
130 135 140
Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp
145 150 155 160
Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr
165 170 175
Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr
180 185 190
Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala
195 200 205
Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn
210 215 220
Glu Cys
225
<210> 91
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H1, CD3
<400> 91
Asn Tyr Tyr Ile His
1 5
<210> 92
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H2, CD3
<400> 92
Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 93
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H3, CD3
<400> 93
Asp Ser Tyr Ser Asn Tyr Tyr Phe Asp Tyr
1 5 10
<210> 94
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L1, CD3
<400> 94
Lys Ser Ser Gln Ser Leu Leu Asn Ser Arg Thr Arg Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 95
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L2, CD3
<400> 95
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 96
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L3, CD3
<400> 96
Thr Gln Ser Phe Ile Leu Arg Thr
1 5
<210> 97
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain VH, CD3
<400> 97
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ser Tyr Ser Asn Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 98
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain VL, CD3
<400> 98
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Thr Gln
85 90 95
Ser Phe Ile Leu Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 99
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H1, Her2 (7C2)
<400> 99
Gly Tyr Trp Met Asn
1 5
<210> 100
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H2, Her2 (7C2)
<400> 100
Met Ile His Pro Ser Asp Ser Glu Ile Arg Ala Asn Gln Lys Phe Arg
1 5 10 15
Asp
<210> 101
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain CDR-H3, Her2 (7C2)
<400> 101
Gly Thr Tyr Asp Gly Gly Phe Glu Tyr
1 5
<210> 102
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L1, Her2 (7C2)
<400> 102
Arg Ala Ser Gln Ser Val Ser Gly Ser Arg Phe Thr Tyr Met His
1 5 10 15
<210> 103
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L2, Her2 (7C2)
<400> 103
Tyr Ala Ser Ile Leu Glu Ser
1 5
<210> 104
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain CDR-L3, Her2 (7C2)
<400> 104
Gln His Ser Trp Glu Ile Pro Pro Trp Thr
1 5 10
<210> 105
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> heavy chain variable domain VH, Her2 (7C2)
<400> 105
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Trp Met Asn Trp Leu Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Ser Asp Ser Glu Ile Arg Ala Asn Gln Lys Phe
50 55 60
Arg Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Tyr Asp Gly Gly Phe Glu Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 106
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> light chain variable domain VL, Her2 (7C2)
<400> 106
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Val Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Ser Gly Ser
20 25 30
Arg Phe Thr Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Ile Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Asp Asp Thr Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧНЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2800779C2 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| ТРИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2822200C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2015 |
|
RU2723940C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ НА ОСНОВЕ ПСЕВДО-FAB | 2019 |
|
RU2820254C2 |
| ДИСПЛЕЙ ИНТЕГРАЛЬНОГО МЕМБРАННОГО БЕЛКА НА ВНЕКЛЕТОЧНЫХ ОБОЛОЧЕЧНЫХ ВИРИОНАХ ПОКСВИРУСА | 2017 |
|
RU2759846C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
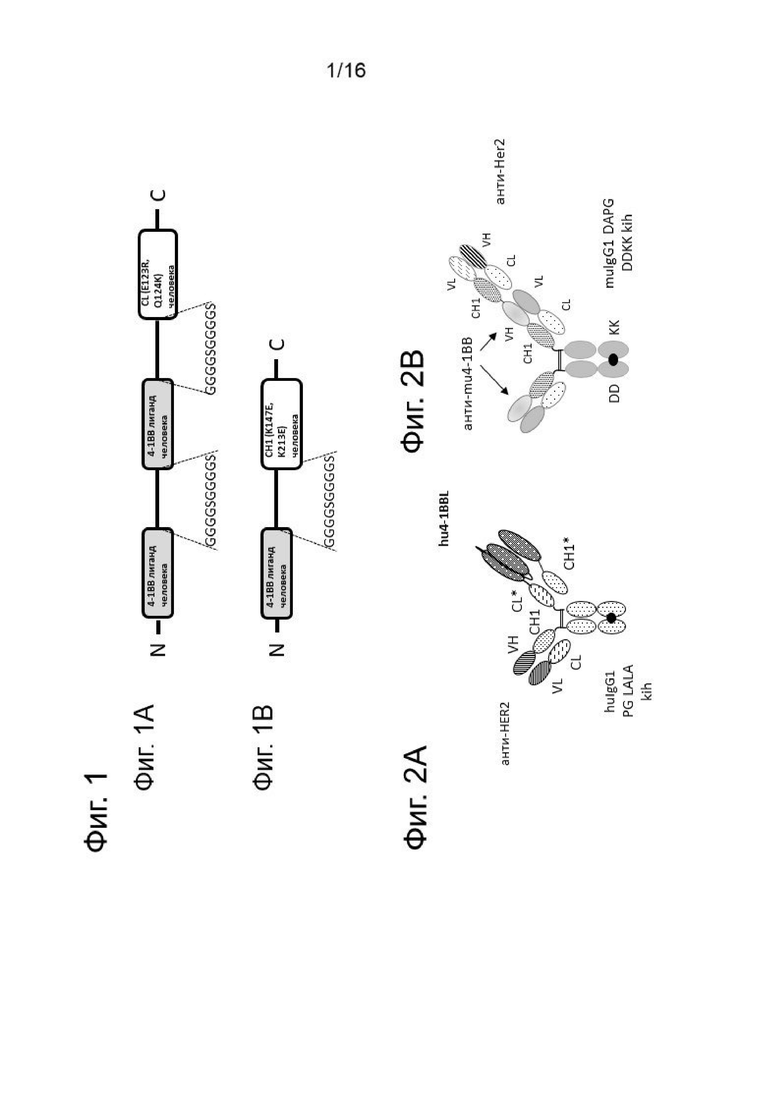


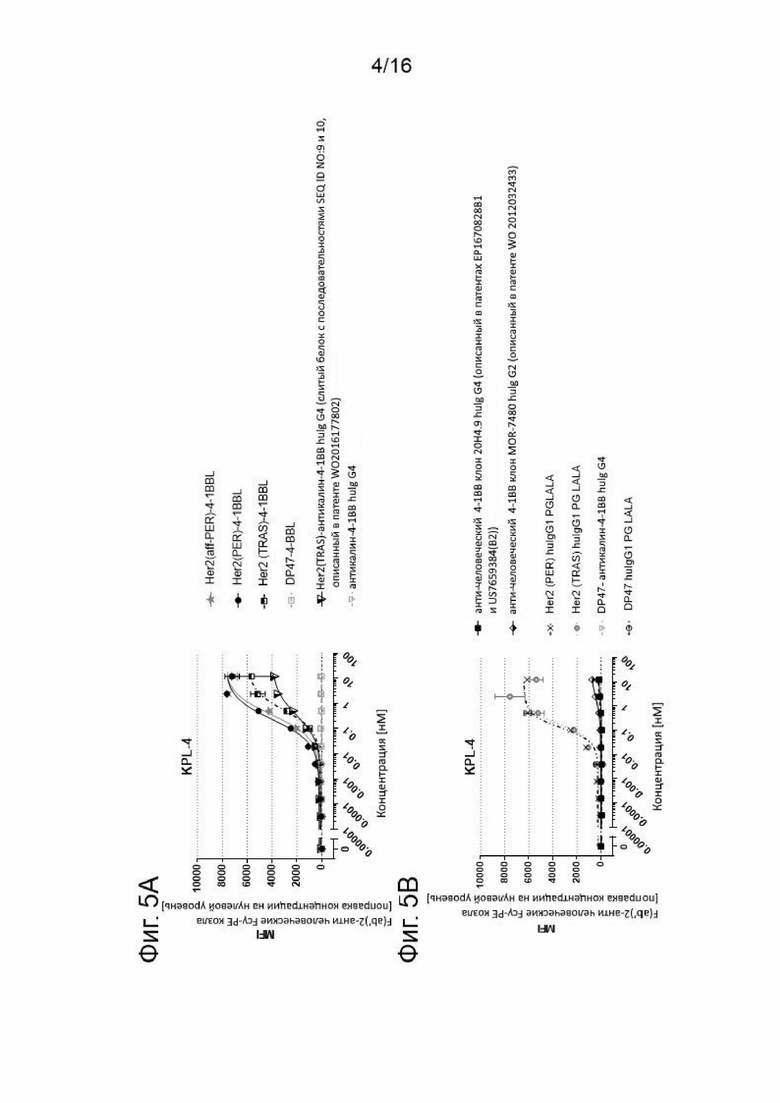
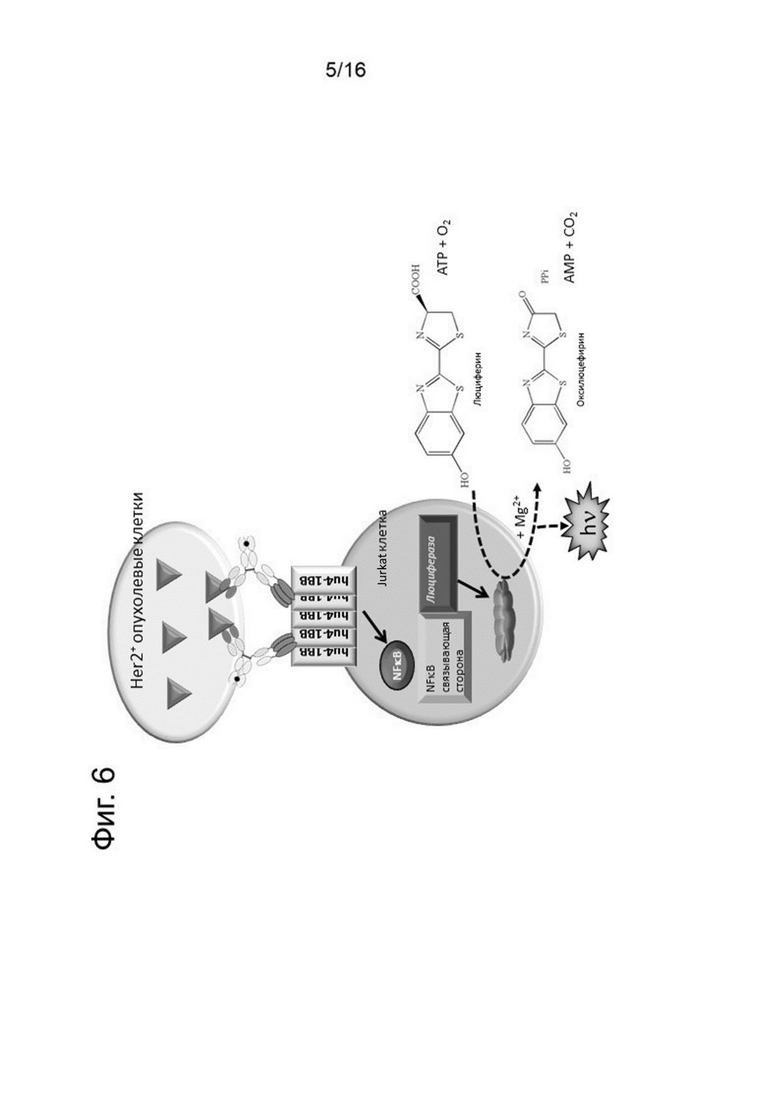
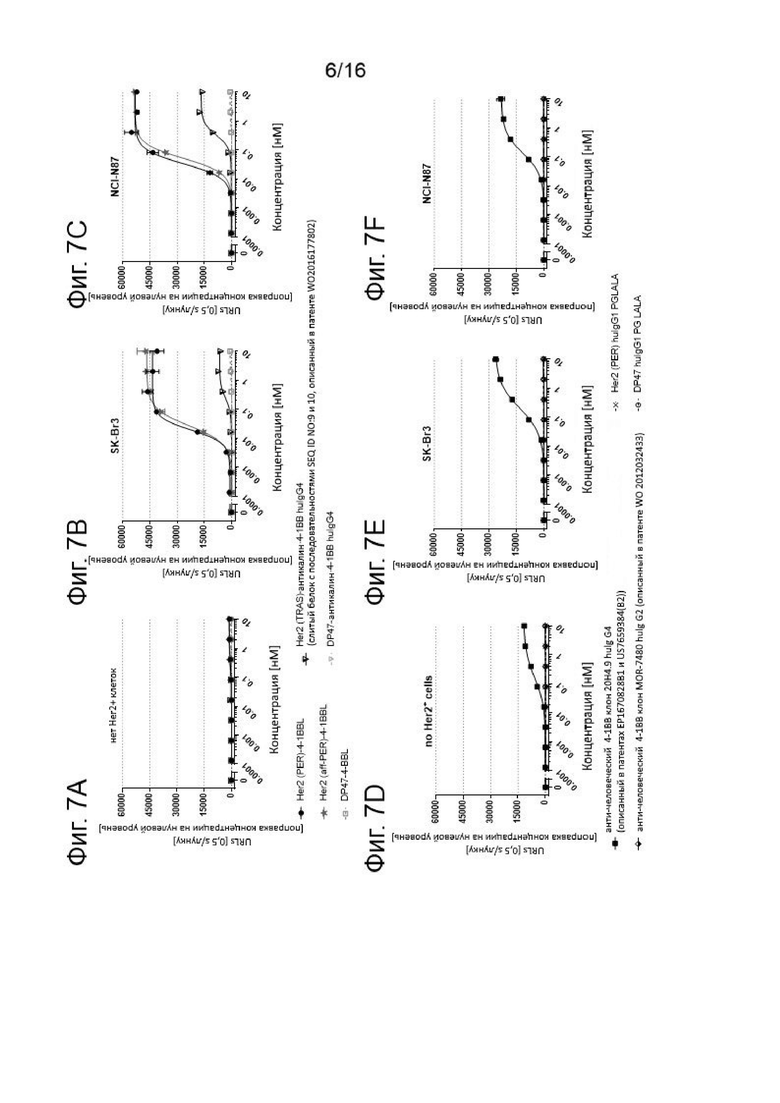
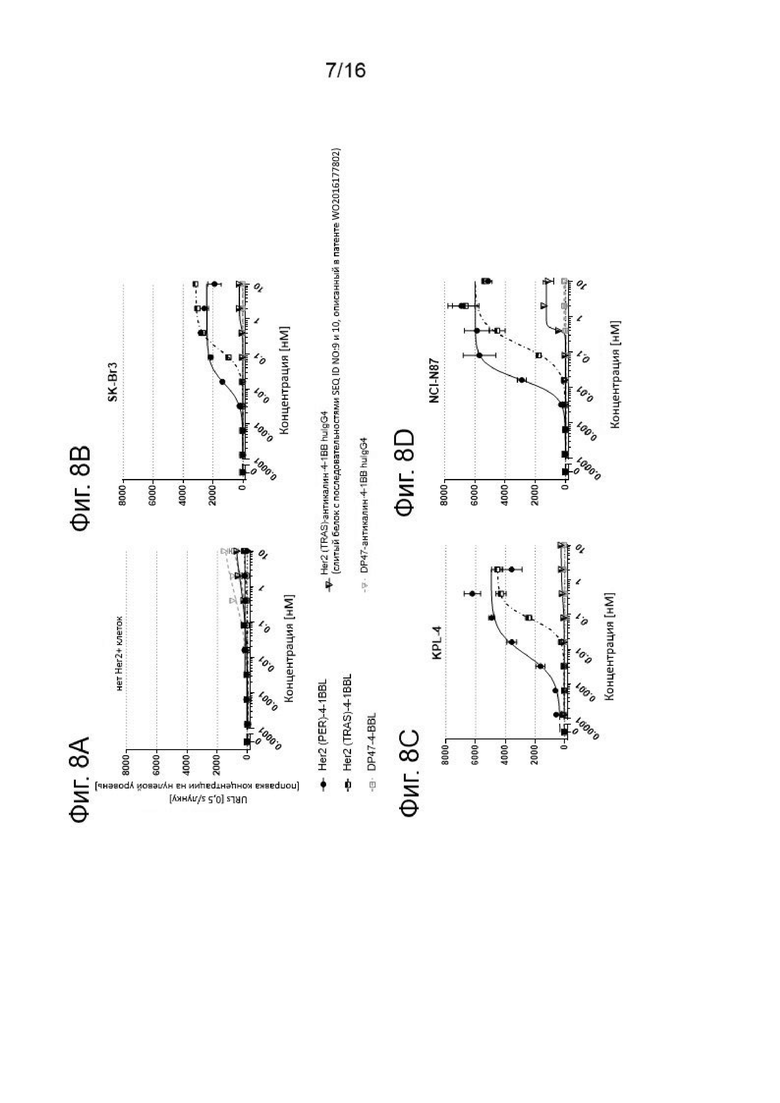
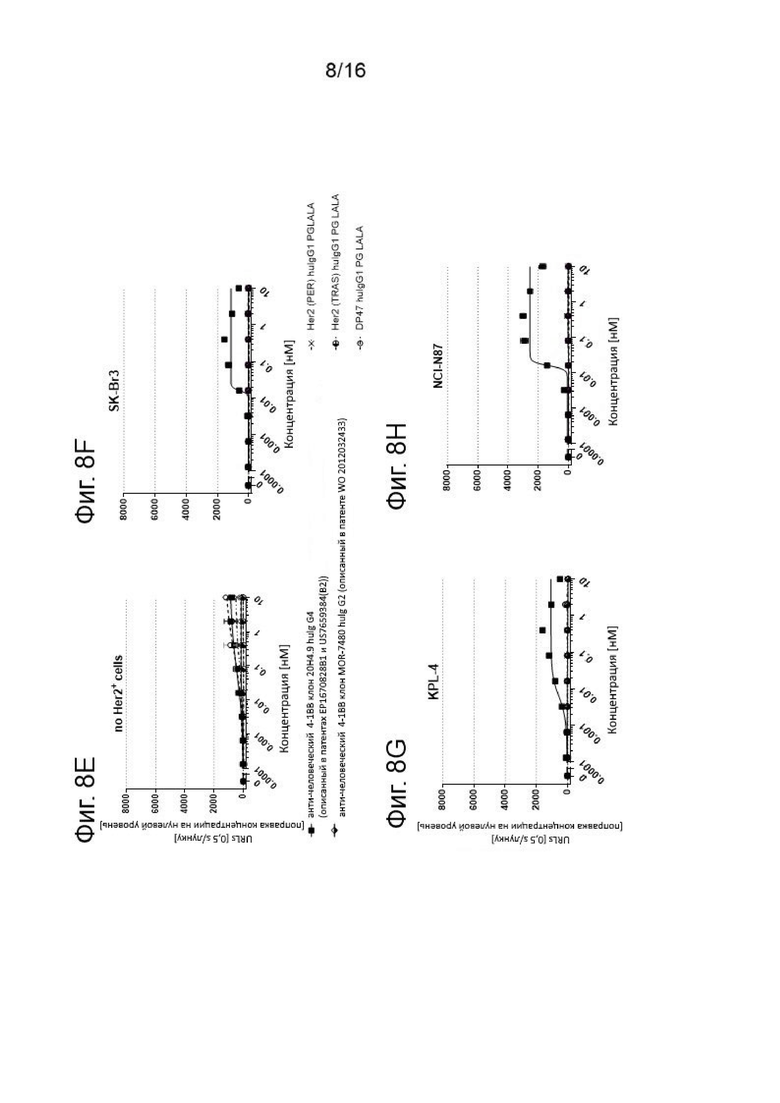
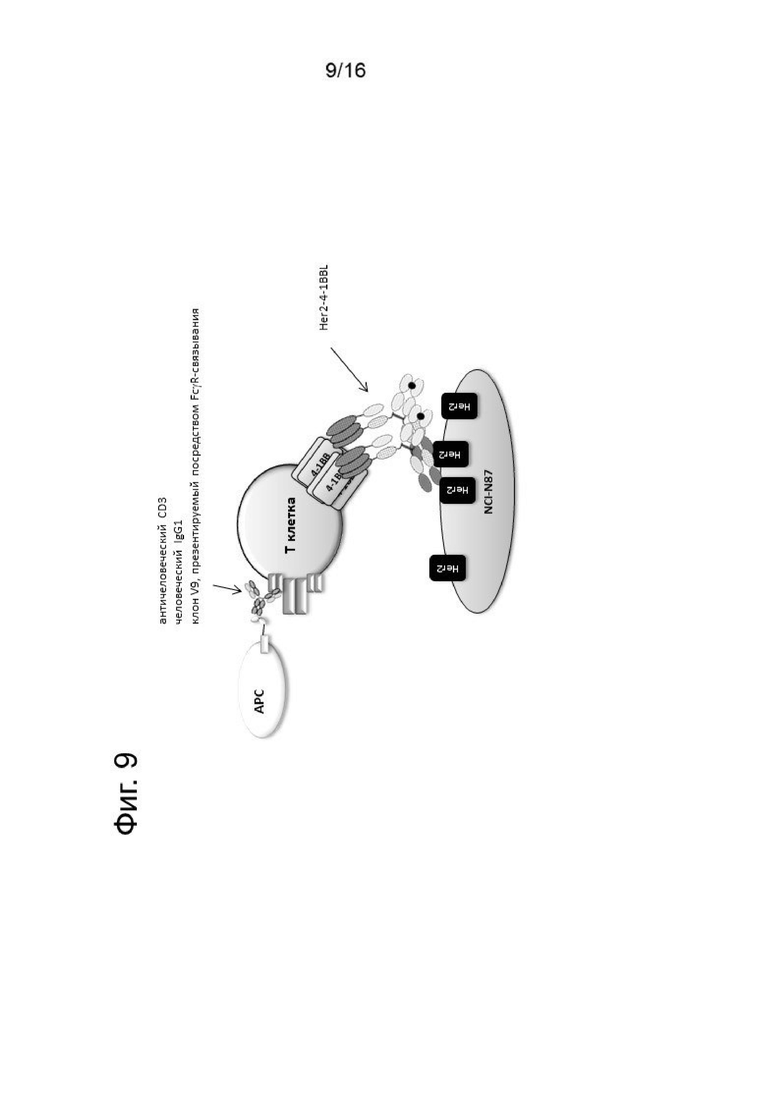
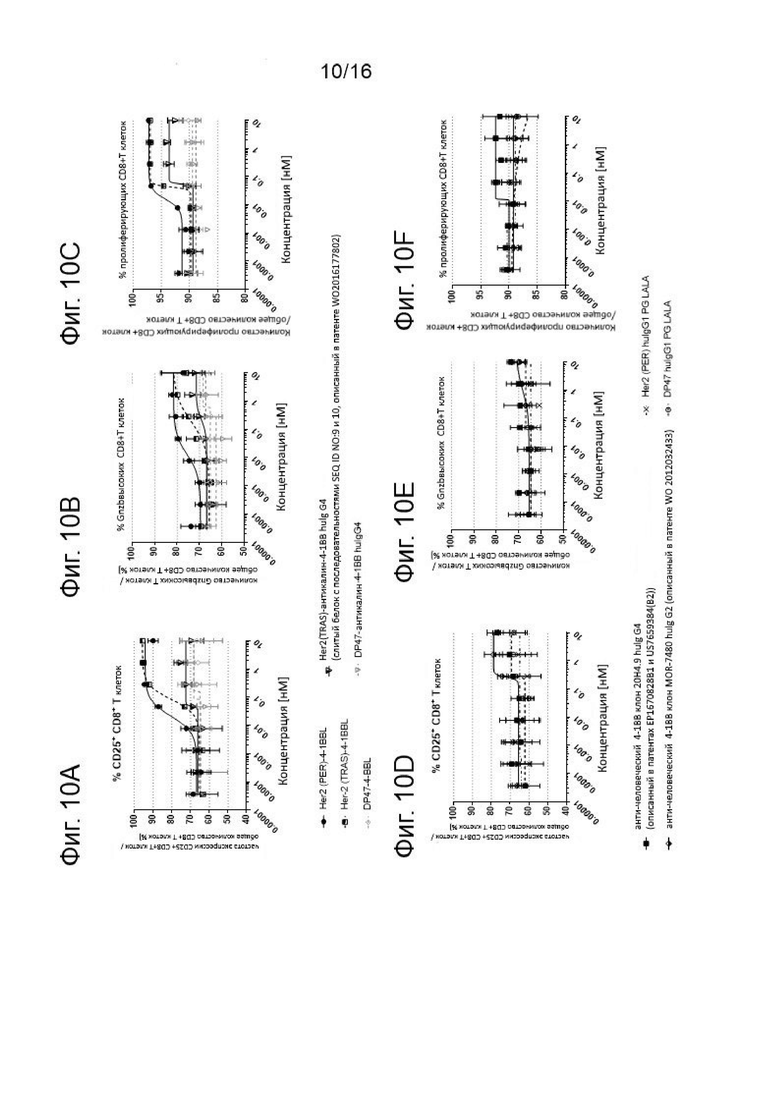
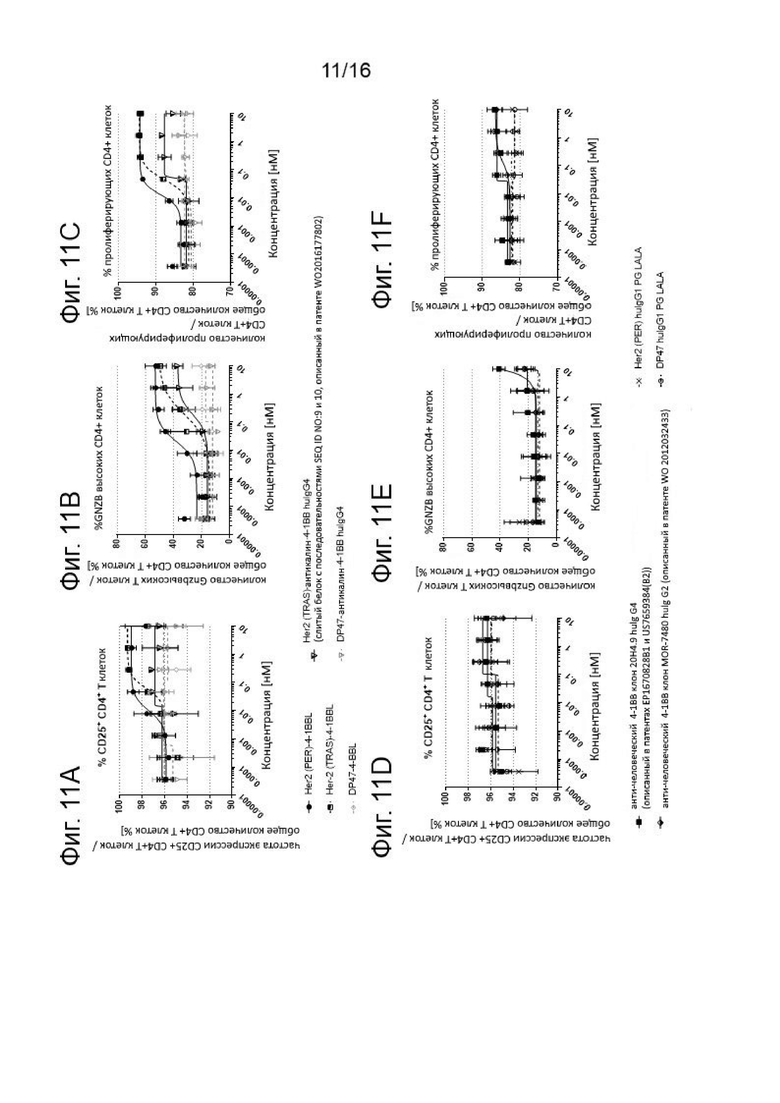


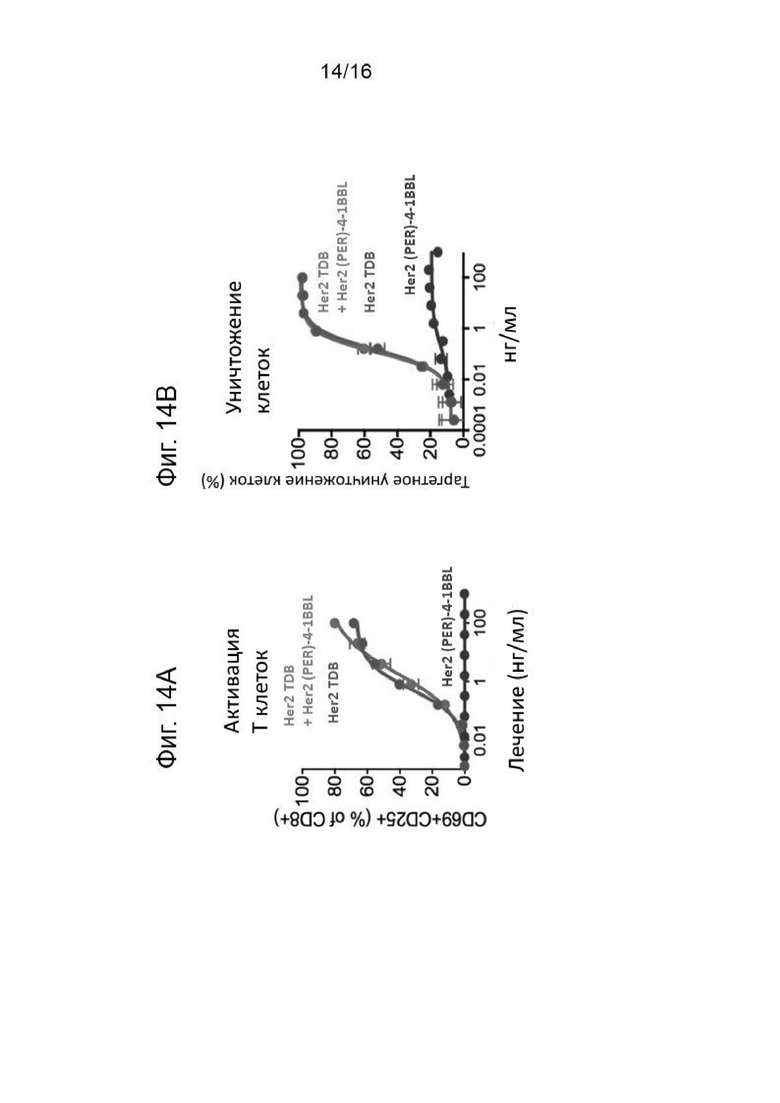
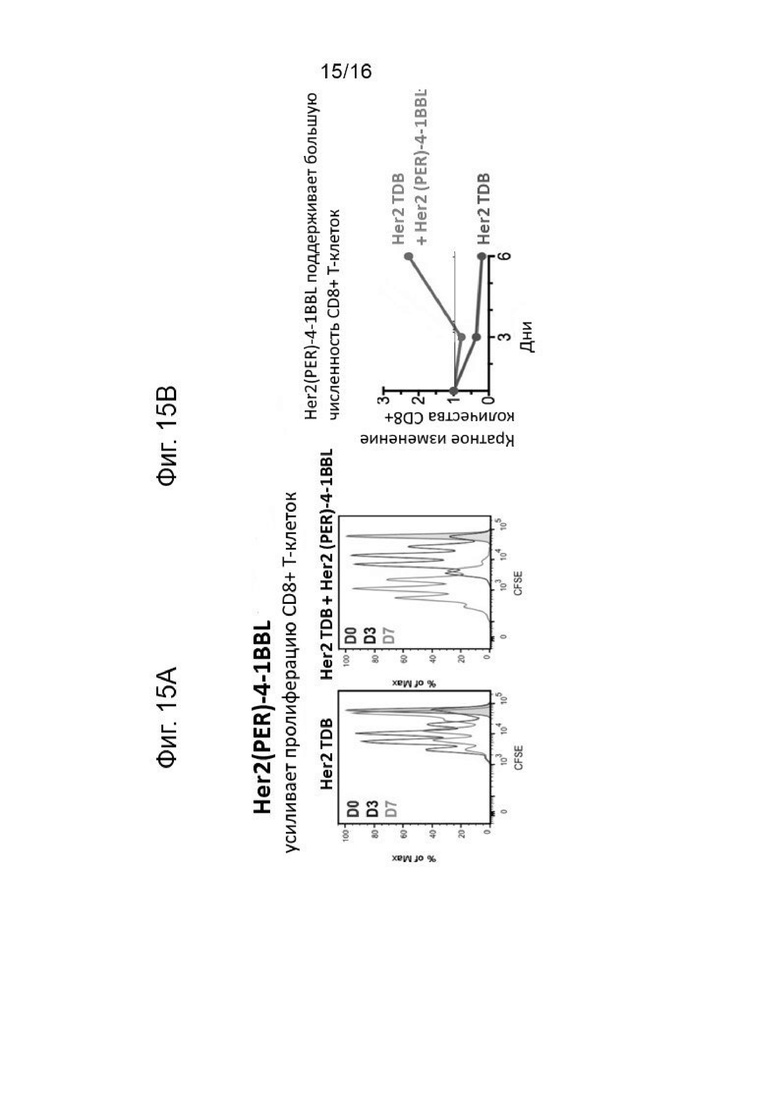
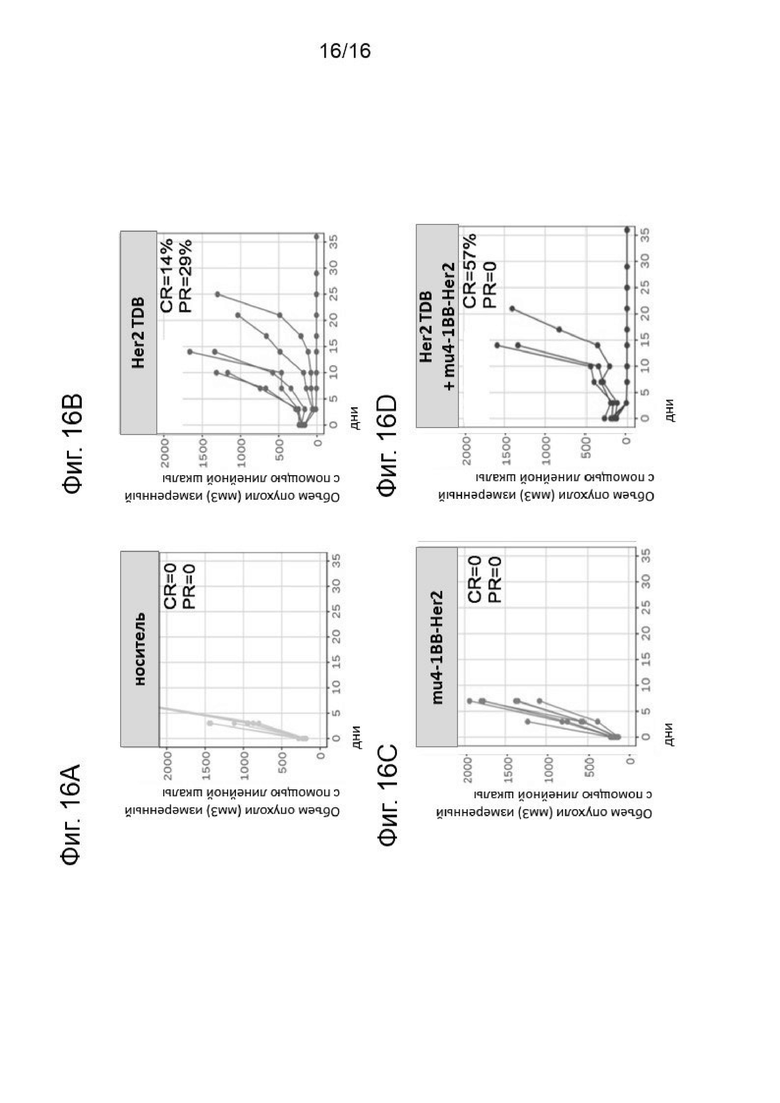
Изобретение относится к области биотехнологии, в частности к новым антигенсвязывающим молекулам. Изобретение раскрывает специфичное в отношении HER2 антитело, содержащее 4-1BBL-тример. Изобретение может быть применимо в медицине для лечения рака, в том числе и в комбинации с активирующими Т-клетки CD3-биспецифическими антителами. 8 н. и 8 з.п. ф-лы, 5 пр., 13 табл., 16 ил.
1. Cодержащее 4-1BBL-тример антитело для лечения Her2-положительного рака, включающее:
(а) молекулу Fab, способную к специфическому связыванию с Her2, включающую
домен VH, включающий аминокислотную последовательность SEQ ID NO: 19, и
домен VL, включающий аминокислотную последовательность SEQ ID NO: 20, или
домен VH, включающий аминокислотную последовательность SEQ ID NO: 27, и
домен VL, включающий аминокислотную последовательность SEQ ID NO: 28, или
домен VH, включающий аминокислотную последовательность SEQ ID NO: 35, и
домен VL, включающий аминокислотную последовательность SEQ ID NO: 36,
(b) первый и второй полипептид, которые связаны между собой дисульфидной связью, где антитело характеризуется тем, что первый полипептид содержит домен CH1 или CL, а второй полипептид содержит домен CL или CH1, соответственно, где второй полипептид связан с первым полипептидом дисульфидной связью между доменами CH1 и CL, и где
первый полипептид включает два эктодомена 4-1BBL, включающих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8, которые соединены друг с другом и с доменом CH1 или CL пептидным линкером, и где
второй полипептид включает один эктодомен указанного 4-1BBL, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8, соединенных через пептидный линкер с доменом CL или CH1 указанного полипептида, и
(с) домен Fc, состоящий из первой и второй субъединиц, способных к стабильной ассоциации, где домен Fc представляет собой IgG1 домен Fc, содержащий аминокислотные замены L234A, L235A и P329G (нумерация согласно EU индексу Кабата).
2. Содержащее 4-1BBL-тример антитело по п. 1, где эктодомен 4-1BBL или его фрагмент включает аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 5.
3. Содержащее 4-1BBL-тример антитело по п. 1 или 2, где домен Fc включает модификации по типу “выступ-во-впадину”, которые способствуют ассоциации первой и второй субъединиц домена Fc.
4. Содержащее 4-1BBL-тример антитело по любому из пп. 1-3, при этом антитело включает:
i) первую тяжелую цепь, содержащую домен VH, включающий аминокислотную последовательность SEQ ID NO: 19, и первую легкую цепь, содержащую домен VL, включающий аминокислотную последовательность SEQ ID NO: 20, или первую тяжелую цепь, содержащую домен VH, включающий аминокислотную последовательность SEQ ID NO: 27, и первую легкую цепь, содержащую VL домен, включающий аминокислотную последовательность SEQ ID NO: 28, или первую тяжелую цепь, содержащую домен VH, включающий аминокислотную последовательность SEQ ID NO: 35, и первую легкую цепь, содержащую домен VL, включающий аминокислотную последовательность SEQ ID NO: 36,
(ii) вторую тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41 и SEQ ID NO: 43, и
(iii) вторую легкую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42 и SEQ ID NO: 44.
5. Содержащее 4-1BBL-тример антитело по любому из пп. 1-4, где указанное антитело включает:
(a) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 45, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38, или
(b) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 47, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 48, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38, или
(c) первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49, первую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 50, вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 37, и вторую легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 38.
6. Выделенная молекула нуклеиновой кислоты, кодирующая содержащее 4-1BBL-тример антитело по любому из пп. 1-5.
7. Вектор экспрессии, содержащий выделенную молекулу нуклеиновой кислоты по п. 6.
8. Клетка-хозяин для получения содержащего 4-1BBL-тример антитела по любому из пп. 1-5, содержащая молекулу нуклеиновой кислоты по п. 6 или вектор экспрессии по п. 7.
9. Способ получения содержащего 4-1BBL-тример антитела по любому из пп. 1-5, включающий культивирование клетки-хозяина по п. 8 в условиях, подходящих для экспрессии содержащего 4-1BBL-тример антитела.
10. Способ по п. 9, дополнительно включающий выделение антитела из клетки-хозяина.
11. Фармацевтическая композиция для лечения Her2-положительного рака, включающая эффективное количество содержащего 4-1BBL-тример антитела по любому из пп. 1-5 и по меньшей мере один фармацевтически приемлемый эксципиент.
12. Фармацевтическая композиция по п. 11, дополнительно содержащая дополнительный терапевтический агент.
13. Фармацевтическая композиция по п. 11 или 12, дополнительно содержащая активирующее Т-клетки анти-CD3 биспецифическое антитело.
14. Фармацевтическая композиция по п. 13, где активирующее Т-клетки анти-CD3 биспецифическое антитело представляет собой анти-Her2/анти-CD3 биспецифическое антитело.
15. Применение содержащего 4-1BBL-тример антитела по любому из пп. 1-5 для получения лекарственного средства, предназначенного для лечения Her2-положительного рака.
16. Применение содержащего 4-1BBL-тример антитела по любому из пп. 1-5 для получения лекарственного средства, предназначенного для лечения Her2-положительного рака, где содержащее 4-1BBL-тример антитело применяется в комбинации с активирующим Т-клетки анти-CD3 биспецифическим антителом.
| WO 2016075278 A1, 19.05.2016 | |||
| WO 2017194438 A1, 16.11.2017 | |||
| WO 2017194442 A1, 16.11.2017 | |||
| WO 2017194641 A1, 16.11.2017 | |||
| US 2016000842 A1, 07.01.2016 | |||
| WO 2016207091 A1, 29.12.2016 | |||
| WO 2018060301 A1, 05.04.2018 | |||
| WO 2016177802 A1, 10.11.2016 | |||
| RU 2016128894 A1, 19.01.2018. |
Авторы
Даты
2024-03-15—Публикация
2019-04-12—Подача