Изобретение относится к способам получения органических соединений, а именно азоокисей, которые содержат в ароматических кольцах гидроксиалкильный фрагмент. Известно, что среди азоокисей имеются вещества с жидкокристаллическими свойствами, различными видами биологической активности, а азокси-группа благодаря своей реакционной способности позволяет применять их как полупродукты для тонкого органического синтеза.
Подавляющее число способов получения гидроксиалкилсодержащих азоокисей заключается в восстановлении нитросоединений. Способы отличаются используемыми восстановителями, катализаторами, реакционными средами и исходными нитросоединениями. Чаще в качестве исходных нитросоединений используются нитроарилальдегиды, в которых происходит одновременное восстановление нитро- и альдегидной групп.
Например, известен способ получения 3,3'-азоксидибензилового спирта из 3-нитробензальдегида восстановлением боргидридом калия в кипящем этаноле в течение суток. Способ реализуется в соответствии со схемой:
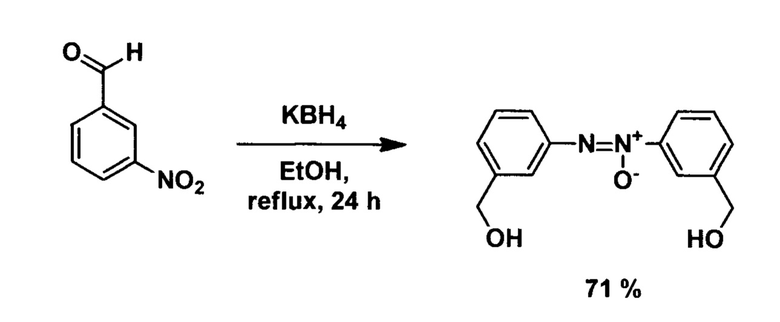
(H.J. Shine, Н.Е. Mallory. The reduction of aromatic nitro compounds by potassium borohydride. J. Org. Chem. 1962, vol. 27, p. 2390-2391.)
Ускорить процесс восстановления удается, используя различные сореагенты и катализаторы, например реализованы способы с использованием дифенилдителлурида (А), различных форм палладиевых катализаторов (В), мезопористого триметального катализатора (С), одноиодистой меди (D).
А:

(K. Ohe, Н. Takahashi, S. Uemura, N. Sugita. Sodium benzenetellurolate-catalysed selective reduction of aromatic nitro compounds to azoxy compounds. J. Chem. Soc, Chem. Commun., 1988, p. 591-592. K. Ohe, S. Uemura, N. Sugita. Sodium arenetellurolate catalysed selective conversion of nitroaromatics to aromatic azoxy or azo compounds and its application for facile preparation of 3,3'- and 4,4'-bis[β-(aryltelluro)vinyl]azobenzenes from (3- and 4-nitrophenyl)acetylenes. J. Org. Chem. 1989, Vol. 54, p. 4169-4174.)
B:
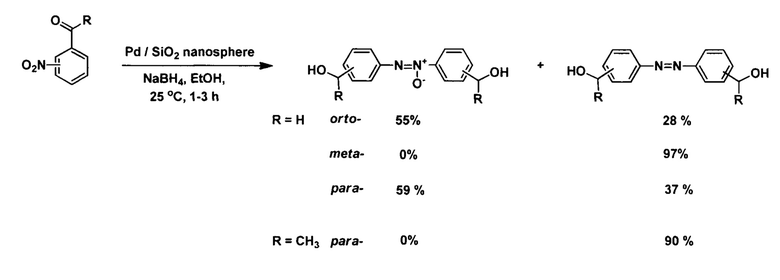
(B. Lakshminarayana, A. K. Manna, G. Satyanarayana, C. Subrahmanyam. Palladium nanoparticles on silica nanospheres for switchable reductive coupling of nitroarenes. Catalysis Letters, 2020, Vol.150, Iss. 8, p. 2309-2321. doi.10.1007/s10562-020-03127-w)
C:
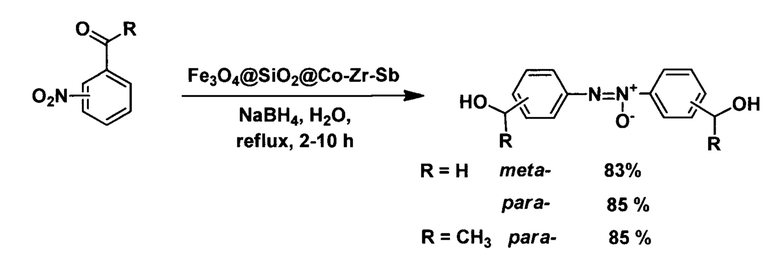
(Zeynizadeh, В., Gilanizadeh, M. Green and highly efficient approach for the reductive coupling of nitroarenes to azoxyarenes using the new mesoporous Fe304@SiO2@Co-Zr-Sb catalyst. Res Chem Intermed 46, 2969-2984 (2020). https://doi.org/10.1007/s11164-020-04126-7)
D:

(S.M. Bhosale, A.A. Momin, S. Kunjir, P.R. Rajamohanan, R.S. Kusurkar. Unexpected observations during the total synthesis of calothrixin B-sodium methoxide as a source of hydride, Tetrahedron Letters, 2014, Vol. 55, Iss. 1, P. 155-162. https://doi.org/10.1016/j.tetlet. 2013.10.140.)
Известны способы, в которых в качестве исходных соединений используют нитроарилсодержащие спирты. Восстановление проводят также действием боргидрида натрия в присутствии катализаторов на основе палладия, процесс протекает в соответствии со схемами:
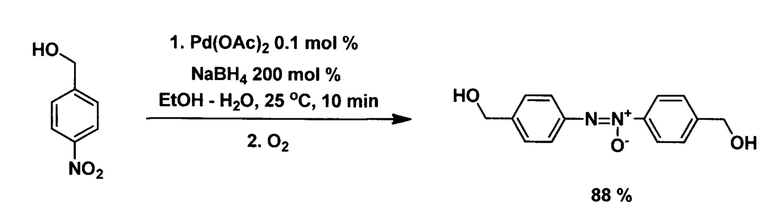
(Z Yan, X. Xie, Q. Song, F. Ma, X. Sui, Z. Huo, M. Ma. Tandem selective reduction of nitroarenes catalyzed by palladium nanoclusters. Green Chem., 2020, Vol. 22, p. 1301-1307. https://doi.org/10.1039/C9GC03957K)

(B. Lakshminarayana, A.K. Manna, G. Satyanarayana, C. Subrahmanyam. Palladium nanoparticles on silica nanospheres for switchable reductive coupling of nitroarenes. Catalysis Letters, 2020, Vol. 150, Iss. 8, p. 2309-2321. doi: 10.1007/s10562-020-03127-w).
Описанные способы основаны на использовании активных восстановителей, таких как боргидриды щелочных металлов, во многих случаях в присутствии металлсодержащих катализаторов, в том числе на основе дорогостоящего палладия. Кроме того, в ряде случаем наряду с целевыми азоокисями образуются азосоединения, отделение которых представляет дополнительную задачу.
Известен способ получения 4,4'-азоксидибензилового спирта, являющегося полупродуктом в синтезе стимулятора роста гипокотиле и корней пшеницы и ячменя, основанный на восстановлении соответствующего бензилового спирта металлическим натрием в среде метилового спирта. (Патент 2368140 RU МПК A01N 33/26 (2006.01), С07С 291/08 (2006.01) А01Р 21/00 27/00(2006.01)/ Стимулятор роста корневой системы озимых пшеницы и ячменя. В.А. Котова, Е.В. Рубанова, ВТ. Яцынин. - №2008113642/04; заявл. 07.04.2008; опубл. 27.09.2009, Бюл. №27).
В способе использован металлический натрий, который представляет собой легковоспламеняющийся, опасный в применении реагент. 4,4'-Азоксидибензиловый спирт является промежуточным продуктом, поэтому о его выходе ничего неизвестно из описания патента.
Задачей предлагаемого изобретения является создание способа получения гидроксиалкилсодержащих азоокисей, которые могут быть использованы для получения биологически активных соединений.
Техническим результатом настоящего изобретения является расширение ассортимента способов получения азоокисей, используемых в качестве многоцелевых органических соединений.
Технический результат достигается путем восстановления нитроарилсодержащих спиртов 200 мольными % глюкозы в присутствии гидроксида натрия в водно-этанольной среде при 50°С в течение 30 мин в соответствии со схемой:
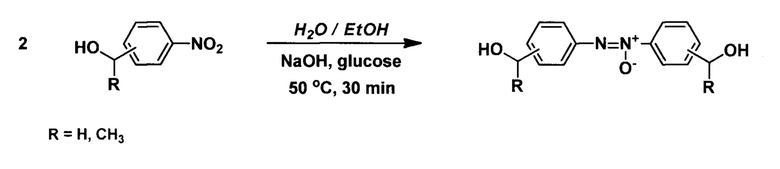
После завершения реакции, ход которой контролируется тонкослойной хроматографией (силикагель, хлороформ - метанол 10:0,2), реакционную массу охлаждают, прибавляют 50 мл 2 М раствора соляной кислоты, образовавшийся осадок отфильтровывают, промывают на фильтре дистиллированной водой и перекристаллизовывают из этанола.
В качестве нитроарилсодержащих спиртов используют соединения, содержащие первичный спиртовый гидроксил, например 2-нитробензиловый и 4-нитробензиловый спирты, а также вторичный спиртовый гидроксил, например 1-(4-нитрофенил)этанол. Подобного рода спирты являются коммерчески доступными или могут быть легко получены восстановлением соответствующих карбонильных соединений.
Оптимальное время проведения реакции определяли мониторингом реакционной массы тонкослойной хроматографией по расходованию исходного соединения и установили, что время восстановления предпочтительно составляет 30 минут.
Чистота образующихся продуктов подтверждена тонкослойной хроматографией, а строение совокупностью спектральных методов (ИК, 1Н, 13С ЯМР-спектроскопией).
Пример 1. Получение 1,2-бис(4-(гидроксиметил)фенил)диазен оксида.
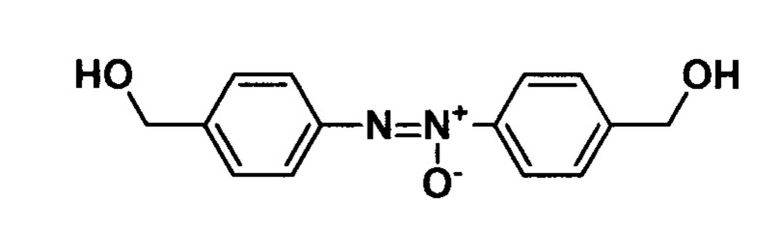
В колбу вносят 6 мл этанола, 7,5 мл 30% водного раствора гидроксида натрия и 0,50 г (0,00326 моль) (2-нитрофенил)метанола. Реакционную массу термостатируют при 50°С и вносят порциями 1,29 г (0,0065 моль) моногидрата глюкозы, после чего выдерживают 30 минут при указанной температуре. Затем реакционную массу охлаждают, прибавляют 50 мл 2 М раствора соляной кислоты, образовавшийся осадок отфильтровывают, промывают на фильтре дистиллированной водой и перекристаллизовывают из этанола. Выход 76%. Тпл 163-164°С.
ИК (KBr), v/см-1: 3284 (ОН), 3055 (Csp2-H), 2974, 2933, 2899, 2872 (Csp3-H), 1600, 1498 (Csp2-Csp2).
1Н ЯМР (399.78 МГц, DMSO-d6, δ, м.д.): 4.57 (с, 2Н, СН2), 4.62 (с, 2Н, СН2), 5.33 (уш. с, 1Н, ОН), 5.43 (уш. с, 1Н, ОН), 7.45-7.50 (м., 2Н, СН), 7.52-7.56 (м., 2Н, СН), 8.07-8.11 (м., 2Н, СН), 8.18-8.23 (м., 2Н, СН).
13С ЯМР (100.5 МГц, DMSO-d6, δ, м.д.): 62.1 (СН2), 62.5 (СН2), 121.8 (СН), 125.0 (СН), 126.6 (СН), 126.7 (СН), 142.2 (С), 144.6 (С), 146.3 (С), 147.0 (С).
Пример 2. Получение 1,2-бис(2-(гидроксиметил)фенил)диазен оксида.

В колбу вносят 6 мл этанола, 7,5 мл 30% водного раствора гидроксида натрия и 0,50 г (0,00326 моль) (2-нитрофенил)метанола. Реакционную массу термостатируют при 50°С и вносят порциями 1,29 г (0,0065 моль) моногидрата глюкозы, после чего выдерживают 30 минут при указанной температуре. Затем реакционную массу охлаждают, прибавляют 50 мл 2 М раствора соляной кислоты, образовавшийся осадок отфильтровывают, промывают на фильтре дистиллированной водой и перекристаллизовывают из этанола. Выход 76%. Тпл 118-120°С.
ИК (KBr), v/см-1: 3230 (ОН), 2922, 2864 (Csp3-H), 1600, 1498 (Csp2-Csp2).
1Н ЯМР (399.78 МГц, DMSO-d6, δ, м.д.): 4.58 (д., 5.7 Гц, 2Н, СН2), 4.74 (д., 5.7 Гц, 2Н, СН2), 5.20 (т., 5.7 Гц, 1Н, ОН), 5.41 (т., 5.7 Гц, 1Н, ОН), 7.35-7.42 (м., 2Н), 7.45-7.51 (м., 1Н), 7.58-7.62 (м., 2Н), 7.70-7.74 (м., 1Н), 7.77-7.82 (м., 1Н), 7.88-7.92 (м., 1Н).
13С ЯМР (100.5 МГц, DMSO-d6, δ, м.д.): 59.22 (СН2), 59.35 (СН2), 121.0 (СН), 123.4 (СН), 126.8 (СН), 127.2 (СН), 127.6 (СН), 128.1 (СН), 128.4 (СН), 130.5 (СН), 135.6 (С), 137.6 (С), 140.8 (С), 147.0 (С).
Пример 3. Получение 1,2-бис(4-(1-гидроксиэтил)фенил)диазен оксида.
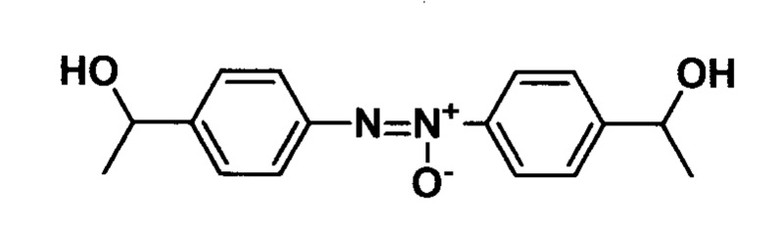
В колбу вносят 9 мл этанола, 11 мл 30% водного раствора гидроксида натрия и 0,84 г (0,005 моль) 1-(4-нитрофенил)этанола. Реакционную массу термостатируют при 50°С и вносят порциями 1,95 г (0,0098 моль) моногидрата глюкозы, после чего выдерживают 30 минут при указанной температуре. Затем реакционную массу охлаждают, прибавляют 50 мл 2 М раствора соляной кислоты, образовавшийся осадок отфильтровывают, промывают на фильтре дистиллированной водой и перекристаллизовывают из этанола. Выход 72%. Тпл 105-106°С.
ИК (KBr), v/см-1: 3327 (ОН), 3074, 3053, 3034 (Csp2-H), 2970, 2924 (Csp3-H), 1602, 1498 (Csp2-Csp2).
1Н ЯМР (399.78 МГц, DMSO-d6, δ, м.д.): 1.34 (д., 2.3 Гц, ЗН, СН3), 1.35 (д., 2.5 Гц, 3Н, СН3), 4.75-4.87 (м, 3Н, СН), 5.30 (д., 4.3 Гц, 1Н, ОН), 5.40 (д., 4.4 Гц, 1Н, ОН), 7.48-7.52 (м, 2Н, СН), 7.54-7.58 (м, 2Н, СН), 8.06-8.09 (м, 2Н, СН), 8.17-8.20 (м, 2Н, СН).
13С ЯМР (100.5 МГц, DMSO-d6, δ, м.д.): 25.78 (СН3), 25.82 (СН3), 67.47, 67.51, 67.77, 67.80 (СН), 121.8 (СН), 125.0 (СН), 125.7 (СН), 126.0 (СН), 142.1 (С), 146.2 (С), 149.4 (С), 151.7 (С).
В предлагаемом способе восстановление осуществляют действием глюкозы в водно-этанольной среде, т.е. с применение безопасных, дешевых реагентов, источником которых является возобновляемое сырье, таким образом, условия реализации способа соответствуют принципам «зеленой химии».
На основании изложенного делаем вывод, что способ является новым, обладает изобретательским уровнем, и техническим результатом, т.е. является патентоспособным.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 1,3-диоксациклоалкилсодержащих азоокисей | 2021 |
|
RU2767880C1 |
| Способ получения тетраалкинилсиланов | 2019 |
|
RU2724877C1 |
| Способ получения производных фуро[3,2-c]изохинолин-5(4Н)-она | 2019 |
|
RU2713199C1 |
| Способ получения (1-адамантил)фуранов | 2017 |
|
RU2661482C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛИРОВАННЫХ АМИДОВ | 2013 |
|
RU2549901C1 |
| Способ получения производных 5Н-фуро[3,2-c]изохромен-5-она | 2017 |
|
RU2657732C1 |
| Способ получения 2-гидрокси-2-((5-метилфуран-2-ил)метил)-3,3,3-трифторпропановой кислоты | 2023 |
|
RU2813205C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДИБЕНЗОСУБЕРЕНИЛЬНЫЙ ФРАГМЕНТ | 2014 |
|
RU2560727C1 |
| Способ получения производного неокупроина | 2022 |
|
RU2799334C1 |
| Способ получения 1-(3-(триметоксисилил)пропил)-1H-1,2,4-триазола | 2023 |
|
RU2820705C1 |
Изобретение относится к способам получения органических соединений, конкретно к способу получения гидроксиалкилсодержащих азоокисей указанной ниже общей формулы. Предлагаемый способ заключается в восстановлении нитроарилсодержащих спиртов общей формулы 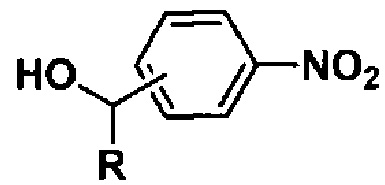 , где R = H, CH3, которое проводят под действием 200 мол.% глюкозы в присутствии гидроокиси натрия в водно-этанольной среде при 50°С в течение 30 мин. Данный способ позволяет расширить ассортимент способов получения азоокисей, используемых в качестве многоцелевых органических соединений. 3 пр.
, где R = H, CH3, которое проводят под действием 200 мол.% глюкозы в присутствии гидроокиси натрия в водно-этанольной среде при 50°С в течение 30 мин. Данный способ позволяет расширить ассортимент способов получения азоокисей, используемых в качестве многоцелевых органических соединений. 3 пр.
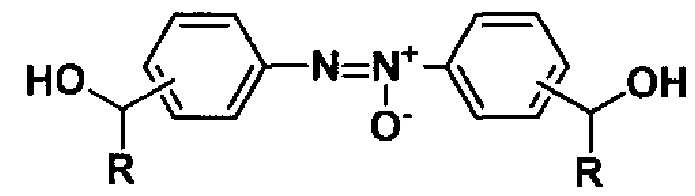
Способ получения гидроксиалкилсодержащих азоокисей общей формулы
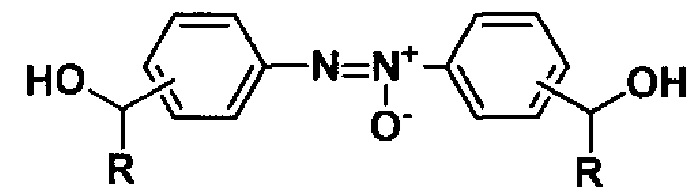
восстановлением нитроарилсодержащих спиртов общей формулы
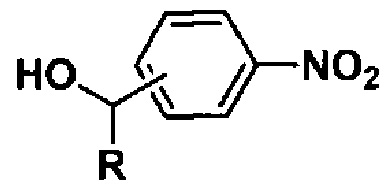 ,
,
где R = H, CH3, отличающийся тем, что восстановление проводят под действием 200 мол.% глюкозы в присутствии гидроокиси натрия в водно-этанольной среде при 50°С в течение 30 мин.
| Z | |||
| YAN ET AL., Tandem selective reduction of nitroarenes catalyzed by palladium nanoclusters, GREEN CHEM., 2020, Vol | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Турбина, работающая угольной кислотой | 1924 |
|
SU1301A1 |
| B | |||
| LAKSHMINARAYANA ET AL., Palladium nanoparticles on silica nanospheres for switchable reductive coupling of nitroarenes, CATALYSIS LETTERS, 2020, Vol | |||
| Деревянный коленчатый рычаг | 1919 |
|
SU150A1 |
| Приспособление для предохранения электрических ламп от толчков | 1923 |
|
SU2309A1 |
Авторы
Даты
2022-04-13—Публикация
2021-04-28—Подача