РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке по 35 U.S.C. 119(e) испрашивается приоритет Предварительной патентной заявки США серийный No: 62/473699, поданной 20 марта 2017 г., Предварительной патентной заявки США серийный No: 62/460652, поданной 17 февраля 2017 г., и Предварительной патентной заявки США серийный No: 62/370211, поданной 2 августа 2016 г., полное содержание каждой из которых приведено в настоящем описании в качестве ссылки.
ПОДДЕРЖКА ПРАВИТЕЛЬСТВА
Это изобретение выполнено при поддержке правительства в рамках гранта No. R01EB015498, выданного Национальным институтом здравоохранения. Правительство имеет определенные права на это изобретение.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Полное содержание текстового файла «29297-132001WO_SEQUENCE_LISTING_ST25.txt», созданного 2 августа 2017 г., размером 292 килобайт, подано в качестве части этой заявки, и таким образом, приведено в настоящем описании в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
Дендритные клетки (DC) собирают и процессируют антигены для представления T-клеткам. DC являются наиболее сильными активаторами иммунной системы среди антигенпредставляющих клеток. Исследования, сфокусированные на использовании дендритных клеток для обеспечения терапевтического преимущества, были медленными, поскольку дендритные клетки являются редкими и сложными для выделения.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Объект настоящего изобретения относится к устройствам, биологическим материалам, композициям и способам модуляции иммунного ответа.
В одном аспекте, настоящее изобретение относится к устройству, содержащему носитель для доставки, содержащий композицию каркаса и любую комбинацию одного или более соединений (например, одного или более адъювантов и/или одного или более антигенов), описанных в настоящем описании. В некоторых вариантах осуществления, устройство содержит PEI. В некоторых вариантах осуществления, устройство не содержит PEI. В некоторых вариантах осуществления, один или более адъювантов и/или один или более антигенов являются присоединенными к (например, конденсированными с) PEI (например, ковалентно или нековалентно). Настоящее изобретение относится к композиции каркаса и к любому одному из или к любой комбинации (например, в композиции каркаса или на ней), следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок.
В одном аспекте, настоящее изобретение относится к способу увеличения, усиления или стимуляции иммунного ответа, включающему приведение в контакт одного или более иммуноцитов (таких как дендритные клетки или T-клетки), с использованием устройства, представленного в настоящем описании. Аспекты объекта настоящего изобретения включают способ увеличения, усиления или стимуляции иммунного ответа (например, вакцинацию) у субъекта, включающий введение устройства, представленного в настоящем описании, субъекту. В некоторых вариантах осуществления, иммунный ответ вызван против антигена злокачественной опухоли (например, неоантигена). В некоторых вариантах осуществления, иммунный ответ вызван против патогена или паразита (например, патогена или паразита из вируса, бактерии, гриба или простейшего).
В одном аспекте, настоящее изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему введение устройства, описанного в настоящем описании, субъекту.
В одном аспекте, настоящее изобретение относится к способу увеличения иммуногенности антигена. В некоторых вариантах осуществления, способ включает объединение антигена с PEI. В некоторых вариантах осуществления, способ дополнительно включает объединение антигена с одним или более или любой комбинацией из: (a) по меньшей мере одного иммуностимулирующего соединения; (b) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (c) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (d) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (e) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок. В некоторых вариантах осуществления комбинация находится в устройстве, которое дополнительно содержит композицию каркаса. В некоторых вариантах осуществления, комбинация находится в или на композиции каркаса.
В одном аспекте, настоящее изобретение относится к библиотеке палочек из мезопористого диоксида кремния, содержащей множество палочек из мезопористого диоксида кремния (например, различные группы или типы палочек из мезопористого диоксида кремния). В некоторых вариантах осуществления, множество палочек из мезопористого диоксида кремния содержит различные палочки из мезопористого диоксида кремния, где каждая палочка из мезопористого диоксида кремния (например, каждая из различных групп или типов палочек из мезопористого диоксида кремния) содержит любое из следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок. В некоторых вариантах осуществления, каждая палочка из мезопористого диоксида кремния (например, каждая из различных групп или типов палочек из мезопористого диоксида кремния) содержит антиген, отличный от антигена каждой другой отдельной палочки из мезопористого диоксида кремния (например, каждой другой отдельной группы или типа палочек из мезопористого диоксида кремния). В некоторых вариантах осуществления, библиотека содержит одну или более из любых палочек из мезопористого диоксида кремния, описанных в настоящем описании.
В одном аспекте, настоящее изобретение относится к смеси палочек из мезопористого диоксида кремния, содержащей 2 или более палочек из мезопористого диоксида кремния (например, различные группы или типы палочек из мезопористого диоксида кремния). В некоторых вариантах осуществления, 2 или более палочки из мезопористого диоксида кремния содержат различные палочки из мезопористого диоксида кремния, где каждая палочка из мезопористого диоксида кремния (например, каждая из различных групп или типов палочек из мезопористого диоксида кремния) содержит любое из следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок. В некоторых вариантах осуществления, каждая палочка из мезопористого диоксида кремния (например, каждая из различных групп или типов палочек из мезопористого диоксида кремния) содержит антиген, отличный от антигена каждой другой отдельной палочки из мезопористого диоксида кремния (например, каждой другой отдельной группы или типа палочек из мезопористого диоксида кремния). В некоторых вариантах осуществления, смесь содержит одну или более из любых палочек из мезопористого диоксида кремния, описанных в настоящем описании.
В одном аспекте, настоящее изобретение относится к способу изготовления устройства (например, устройства для вакцинации), включающему объединение композиции каркаса (например, полимерной композиции, такой как любая полимерная композиция, описанная в настоящем описании) с PEI и/или с любым из следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок. В некоторых вариантах осуществления, PEI объединяют с любым из следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок, до объединения PEI с композицией каркаса. В некоторых вариантах осуществления, композицию каркаса объединяют с PEI до его объединения с любым из следующего: (a) по меньшей мере одного антигена; (b) по меньшей мере одного иммуностимулирующего соединения; (c) по меньшей мере одного соединения, привлекающего иммуноцит к носителю или в носитель для доставки; (d) по меньшей мере одного соединения, индуцирующего иммуногенную гибель клеток опухоли; (e) по меньшей мере одного соединения, ингибирующего супрессию T-клеток или дендритных клеток; и/или (f) по меньшей мере одного соединения, которое ингибирует ингибирующий иммунитет белок.
Объект настоящего изобретения включает устройство, библиотеку или смесь, в рамках изобретения, для лечения злокачественной опухоли, уменьшения опухолевой нагрузки, вызова иммунного ответа на антиген опухоли, увеличения иммуногенности антигена и/или лечения инфекции.
Аспекты объекта настоящего изобретения относятся к устройству, содержащему (a) носитель для доставки, содержащий композицию каркаса, и (b) (i) полиэтиленимин (PEI); (ii) свободный PEI; (iii) PEI и антиген; или (iv) PEI, присоединенный к антигену. В различных вариантах осуществления, PEI может присутствовать в форме, например, свободного PEI или PEI, присоединенного к другому соединению. В рамках изобретения, «свободный PEI» представляет собой PEI, не присоединенный к другому соединению, за исключением того, что свободный PEI может, необязательно, иметь электростатическое взаимодействие с структурным компонентом композиции каркаса (например, полимером или палочкой из мезопористого диоксида кремния), например, катионный PEI, ассоциированный с анионным полимером из устройства. PEI, который является «присоединенным» к другому соединению, может быть связан с соединением, например, посредством ковалентной связи или электростатического взаимодействия. Например, PEI может являться присоединенным к одному или более антигенам посредством ковалентной связи или электростатического взаимодействия. В некоторых вариантах осуществления, PEI электростатически взаимодействует с одним или более антигенами с формированием наночастицы. В конкретных вариантах осуществления, наночастица представляет собой катионную наночастицу.
В одном аспекте, настоящее изобретение относится к устройству, содержащему носитель для доставки, содержащий композицию каркаса. В некоторых вариантах осуществления, композиция каркаса не содержит адъювант (например, CpG или поли(I:C)), такой как адъювант, конденсированный посредством вещества, например, PEI. В некоторых вариантах осуществления, устройство содержит, в основном состоит из или состоит из композиции каркаса и PEI. В некоторых вариантах осуществления, устройство не содержит агониста TLR. В некоторых вариантах осуществления, устройство содержит антиген, но не агонист TLR.
Объект настоящего изобретения относится также к способу изготовления устройства с модифицированной PEI поверхностью (например, устройства для вакцинации), включающему покрытие полимерной композицией с PEI, и последующую адсорбцию антигена (например, антигена, описанного в настоящем описании) на покрытой полимерной композиции, таким образом, изготовление устройства с модифицированной PEI поверхностью. В одном аспекте, настоящее изобретение относится к способу изготовления устройства из MPS с модифицированной PEI поверхностью (например, устройства для вакцинации), включающему покрытие множества палочек из MPS с использованием PEI, и последующую адсорбцию антигена (например, антигена, описанного в настоящем описании) на покрытых палочках из MPS, таким образом, изготовление устройства из MPS с модифицированной PEI поверхностью. Настоящее изобретение относится также к способу изготовления устройства из PLG с модифицированной PEI поверхностью (например, устройства для вакцинации), включающему покрытие множества сфер из PLG (например, микросфер) с использованием PEI и последующую адсорбцию антигена (например, антигена, описанного в настоящем описании) на покрытых сферах из PLG, таким образом, изготовление устройства из PLG с модифицированной PEI поверхностью. В некоторых вариантах осуществления, способ дополнительно включает приведение покрытых палочек из MPS или покрытых сфер из PLG в контакт с: (a) иммуностимулирующим соединением; (b) соединением, привлекающим иммуноцит к носителю или в носитель для доставки; (c) соединением, индуцирующим иммуногенную гибель клеток опухоли; (d) соединением, ингибирующим супрессию T-клеток или дендритных клеток; (e) соединением, которое ингибирует ингибирующий иммунитет белок, или любой их комбинацией.
В некоторых вариантах осуществления, где PEI является присоединенным к CpG-олигодезоксинуклеотиду (CpG-ODN) или поли(I:C) посредством электростатического взаимодействия в катионной наночастице, устройство или каркас, представленные в настоящем описании, дополнительно содержат (i) свободный PEI, (ii) PEI, присоединенный к антигену, или (iii) PEI, присоединенный к иммуностимулирующему соединению, отличному от CpG-ODN или поли(I:C). В конкретных вариантах осуществления, иммуностимулирующее соединение не представляет собой полинуклеотид.
В некоторых вариантах осуществления, PEI является присоединенным к CpG-ODN, поли(I:C), или полиадениловой-полиуридиловой кислоте (поли(A:U)), например, посредством электростатического взаимодействия. В некоторых вариантах осуществления, PEI не является присоединенным к CpG-ODN, поли(I:C), или поли(A:U) посредством электростатического взаимодействия. В различных вариантах осуществления, устройство, биологический материал, композиция, или способ не включают наночастицу (такую как катионная наночастица), содержащую PEI и полинуклеотид. В конкретных вариантах осуществления, устройство, биологический материал, композиция, или способы не включают наночастицу (такую как катионная наночастица), содержащую PEI и CpG-ODN, поли(I:C) или поли(A:U). В некоторых вариантах осуществления, где PEI является присоединенным к CpG-ODN, поли (I:C) или поли(A:U) посредством электростатического взаимодействия в катионной наночастице, устройство или каркас, представленные в настоящем описании, дополнительно содержат (i) свободный PEI, (ii) PEI, присоединенный к антигену и/или (iii) PEI, присоединенный к иммуностимулирующему соединению, отличному от CpG-ODN, поли(I:C), или поли(A:U). В конкретных вариантах осуществления, PEI не является присоединенным к полинуклеотиду посредством электростатического взаимодействия. В различных вариантах осуществления, PEI не является присоединенным к полинуклеотиду в катионной наночастице. В некоторых вариантах осуществления, устройство, биологический материал, композиция или способ, представленные в настоящем описании, не включают полинуклеотид. В некоторых вариантах осуществления, устройство, биологический материал, композиция или способ, представленные в настоящем описании, не включают CpG-ODN, поли(I:C) или поли(A:U).
В конкретных вариантах осуществления PEI является присоединенным к антигену, например, антигену опухоли или антигену микроорганизма. В некоторых вариантах осуществления антиген представляет собой пептидный антиген опухоли. Например, антиген опухоли может содержать лизат клеток опухоли, очищенный антиген, например, белковый или пептидный антиген опухоли (например, длиной 5, 6, 7, 8, 9, 10, 15, 20, 50, 75, 100, 200 или более аминокислот). В некоторых примерах, антиген не содержит гликопротеина или происходящего из патогена антигена, например, антигена вируса [такого как вирус иммунодефицита человека (HIV) или вирус гриппа]. В предпочтительных вариантах осуществления, комбинация антиген опухоли/PEI вызывает ответ цитотоксических T-клеток против опухоли/антигена опухоли, таким образом, приводя к или внося вклад в регрессию опухолей. В различных вариантах осуществления, PEI является присоединенным к антигену, такому как антиген опухоли. Например, PEI может являться присоединенным к антигену посредством электростатического взаимодействия или может являться ковалентно связанным с антигеном. В некоторых вариантах осуществления, устройство или каркас, представленные в настоящем описании, содержит иммуностимулирующий комплекс, содержащий катионный полимер PEI и пептидный антиген. Альтернативно или дополнительно, устройство или каркас содержит антиген и свободный PEI, который не является присоединенным к антигену. В некоторых вариантах осуществления, антиген содержит ассоциированный с патогеном антиген (например, белок или фактор вирулентности, или его аминокислотную последовательность или фрагмент).
В различных вариантах осуществления, антиген содержит неоантиген. В некоторых вариантах осуществления, неоантиген содержит полипептид, содержащий фрагмент из приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 150, 200, 250, 10-250, 50-250, 100-250 или 50-150 аминокислот (или по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 150, 200 или 250 аминокислот), идентичный последовательности аминокислот в антигене опухоли или онкобелке [таком как Her2, E7, родственный тирозиназе белок 2 (Trp2), Myc, Ras или фактор роста эндотелия сосудов (VEGF)]. Неограничивающие примеры неоантигенов включают полипептиды, содержащие аминокислоты в последовательности связывающего домена или части связывающего домена белка, с которым связывается терапевтическое противораковое антитело, такое как трастузумаб. В различных вариантах осуществления, антиген содержит слитый пептид, включающий (i) полипептид, содержащий аминокислоты в последовательности, обнаруженной в онкобелке, в сочетании с (ii) эпитопом (например, эпитопом CD4), происходящим из патогена (например, вируса, такого как вирус кори) или другого высокоиммуногенного полипептида. В неограничивающем примере, слитый пептид содержит эпитоп CD4, происходящий из вируса кори, связанный с полипептидом из онкобелка (такого как Her2, E7, Trp2, Myc, Ras или VEGF). В некоторых вариантах осуществления, эпитоп, происходящий из патогена, происходит из вируса кори и содержит аминокислоты в последовательности: KLLSLIKGVIVHRLEGVEG (SEQ ID NO: 38). В конкретных вариантах осуществления, антиген содержит слитый пептид, содержащий эпитоп CD4, происходящий из вируса кори, слитый с коротким (например, из приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 75, 100, 50-100 или 50-150 аминокислот) линейным доменом внутри связывающего трастузумаб домена на Her2. В некоторых вариантах осуществления, антиген содержит линейный домен внутри связывающего трастузумаб домена Her2, который содержит аминокислоты в последовательности KFPDEEGACQP. В конкретных вариантах осуществления, антиген содержит (i) полипептид, содержащий аминокислоты в последовательности, обнаруженной в онкобелке, и (ii) эпитоп (например, эпитоп CD4), происходящий из патогена (например, вируса, такого как вирус кори) или другой высокоиммуногенный полипептид, где (i) и (ii) соединены посредством линкера. В некоторых вариантах осуществления, линкер содержит приблизительно, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот. В конкретных вариантах осуществления, линкер содержит аминокислоты в последовательности GPSL. В различных вариантах осуществления, неоантиген содержит неоантиген B16. В некоторых вариантах осуществления, антиген содержит любую из следующих аминокислотных последовательностей: (i) аминокислотной последовательности MVP-Her2: KLLSLIKGVIVHRLEGVEGPSLIWKFPDEEGACQPL (SEQ ID NO: 39) (в которой KLLSLIKGVIVHRLEGVEG (SEQ ID NO: 38) происходит из вируса кори, GPSL представляет собой гибкий линкер, и IWKFPDEEGACQPL (SEQ ID NO: 40) происходит из Her2/neu); (ii) аминокислотной последовательности, происходящей из связывающего трастузумаб домена Her2: KFPDEEGACQP (SEQ ID NO: 41); (iii) аминокислотной последовательности, происходящей из онкобелка E7: GQAEPDRAHYNIVTFCCKCDSTLRLCVQSTHVDIR (SEQ ID NO: 42); (iv) аминокислотной последовательности, происходящей из онкобелка E7: RAHYNIVTF (SEQ ID NO: 43); (v) аминокислотной последовательности из неоантигена B16-M27: REGVELCPGNKYEMRRHGTTHSLVIHD (SEQ ID NO: 44); аминокислотной последовательности из неоантигена B16-M30: PSKPSFQEFVDWENVSPELNSTDQPFL (SEQ ID NO: 45); аминокислотной последовательности из неоантигена B16-M47: GRGHLLGRLAAIVGKQVLLGRKVVVVR (SEQ ID NO: 46); аминокислотной последовательности из неоантигена M48: SHCHWNDLAVIPAGVVHNWDFEPRKVS (SEQ ID NO: 47); или аминокислот из неоантигена Trp2: SVYDFFVWLKFFHRTCKCTGNFAGGDDD (SEQ ID NO: 48). Дополнительные неограничивающие примеры неоантигенов включают SVGDFSQEFSPIQEA (SEQ ID NO: 49),
DFSQEFSPIQEAQQD (SEQ ID NO: 50),
LPGKIHLFEAEFTQV (SEQ ID NO: 51),
IHLFEAEFTQVAKKE (SEQ ID NO: 52),
HDLGRLHSCVMASLRAQ (SEQ ID NO: 53),
RTQLLWTPAAPTAMA (SEQ ID NO: 54),
DRASFLLTDYALSPD (SEQ ID NO: 55),
DRSVLAKKLKFVTLVFRHGDRSPID (SEQ ID NO: 56),
NNSKKKWFLFQDSKKIQVEQPQ (SEQ ID NO: 57),
SPIKLVQKVASKIPFPDRITEESV (SEQ ID NO: 58),
TKRQVILLHTELERFLEYLPLRF (SEQ ID NO: 59),
SHTQTTLFHTFYELLIQKNKHK (SEQ ID NO: 60),
RLVLGKFGDLTNNFSSPHAR (SEQ ID NO: 61),
LSPREEFLRLCKKIMMRSIQ (SEQ ID NO: 62),
PSTANYNSFSSAPMPQIPVASVTPT (SEQ ID NO: 63),
LCPREEFLRLCKKIMMRSIQ (SEQ ID NO: 64),
SHNELADSGIPENSFNVSSLVE (SEQ ID NO: 65),
SGSPPLRVSVGDFSQEFSPIQEAQQD (SEQ ID NO: 66), RPAGRTQLLWTPAAPTAMAEVGPGHTP (SEQ ID NO: 67),
RGQIKLADFRLARLYSSEESR (SEQ ID NO: 68),
DEQGREAELARSGPSAAGPVRLKPGLVPGL (SEQ ID NO: 69),
AAVRPEQRPAARGSRV (SEQ ID NO: 70),
PETGEIQVKTFLDREQRESYELKV (SEQ ID NO: 71),
EVVGGYTWPSGNIYQGYWAQGKR (SEQ ID NO: 72),
TIKNSDKNVVLEHFG (SEQ ID NO: 73),
TRNSFALVPSLQRLMLRKVALKNVDSSPS (SEQ ID NO: 74),
SSHYKFSKPALQSQSISLVQQS (SEQ ID NO: 75),
TETVNHHYLLFQNTDLGSFHDLLR (SEQ ID NO: 76),
DRASFLLTDYALSPDGSIRKATG (SEQ ID NO: 77),
ERFWRNILLLSLHKGSLYPRIPGLGKE (SEQ ID NO: 78),
RGRLPAGAVRTLLSQVNKVWDQSS (SEQ ID NO: 79),
GHEHQPDMQKSLLRAAFFGKCFLDR (SEQ ID NO: 80), ELQYRGRELRFNLIANQHLLAPGFVSETR (SEQ ID NO: 81),
EDLDANLRKLNFRLFVIRGQPAD (SEQ ID NO: 82),
GHQKLPGKIHLFEAEFTQVAKKEPDG (SEQ ID NO: 83),
TTPSGSAEYMASEVVEVFTDQAT (SEQ ID NO: 84),
SVLREDLGQLEYKYQYAYFRMGIKHPD (SEQ ID NO: 85),
PENDDLFMMPRIVDVTSLATEGG (SEQ ID NO: 86),
TLDDIKEWLEDEGQVLNIQMRRTLHK (SEQ ID NO: 87), GRMSPSQFARVPGYVGSPLAAMNPK (SEQ ID NO: 88),
KAHVEGDGVVEEIIRYHPFLYDRET (SEQ ID NO: 89),
DGVSEEFWLVDLLPSTHYT (SEQ ID NO: 90),
DSYHLYAYHEELSATVPSQWKKIG (SEQ ID NO: 91), GDQYKATDFVADWAGTFKMVFTPKDGSG (SEQ ID NO: 92), EYWKVLDGELEVAPEYPQSTARDWL (SEQ ID NO: 93),
TTTSVKKEELVLSEEDFQGITPGAQ (SEQ ID NO: 94),
SLTEESGGAVAFFPGNLSTSSSA (SEQ ID NO: 95),
KLRTIPLSDNTIFRRICTIAKHLE (SEQ ID NO: 96),
SHHTHSYQRYSHPLFLPGHRLDPPI (SEQ ID NO: 97),
DVTGPHLYSIYLHGSTDKLPYVTMGS (SEQ ID NO: 98),
ARLQSKEYPVIFKSIMRQRLISPQL (SEQ ID NO: 99),
LHTHYDYVSALHPVSTPSKEYTSA (SEQ ID NO: 100),
SDAFSGLTALPQSILLFGP (SEQ ID NO: 101),
SHQIHSYQLYTHPLLHPWDHRD (SEQ ID NO: 102),
STQHADLTIIDNIKEMNFLRRYK (SEQ ID NO: 103),
ASATEPANDSLFSPGAANLFSTYLAR (SEQ ID NO: 104), AASAAAFPSQRTSWEFLQSLVSIKQEK (SEQ ID NO: 105), GSVLQFMPFTTVSELMKVSAMSSPKV (SEQ ID NO: 106),
DKGHQFHVHPLLHSGDDLDP (SEQ ID NO: 107),
NQVLASRYGIRGFSTIKIFQKGESPV (SEQ ID NO: 108),
MAGPKGFQYRALYPFRRER (SEQ ID NO: 109),
VTLNDMKARQKALVRERERQLA (SEQ ID NO: 110),
SRLQTRKNKKLALSSTPSNIAPSD (SEQ ID NO: 111),
LNTGLFRIKFKEPLENLI (SEQ ID NO: 112),
SLRNNMFEISDRFIGIYKTYNITK (SEQ ID NO: 113),
WCTEMKRVFGFPVHYTDVSNMS (SEQ ID NO: 114),
VKQLERGEASVVDFKKNLEYAAT (SEQ ID NO: 115),
STEVEPKESPHLARHRHLMKTLVKSLST (SEQ ID NO: 116),
LMSNLAFADFCMRMYL (SEQ ID NO: 117),
TKLKSKAPHWTNCILHEYKNLSTS (SEQ ID NO: 118),
PAAGDFIRFRFFQLLRLERFF (SEQ ID NO: 119),
YLSHTLGAASSFMRPTVPPPQF (SEQ ID NO: 120),
ALLQNVELRRNVLVSPTPLAN (SEQ ID NO: 121),
FAKGFRESDLNSWPVAPRPLLSV (SEQ ID NO: 122),
GLTRISIQRAQPLPPCLPSFRPPTALQGLS (SEQ ID NO: 123), TGKPEMDFVRLAQLFARARPMGLF (SEQ ID NO: 124),
DGAWPVLLDKFVEWYKDKQMS (SEQ ID NO: 125),
DRSVLAKKLKFVTLVFRHGDRSPID (SEQ ID NO: 126),
DRSVLAKKLKFVTLVFRHGDRSPID (SEQ ID NO: 127),
TKRQVILLHTELERFLEYLPLRF (SEQ ID NO: 128),
LGETMGQVTEKLQPTYMEET (SEQ ID NO: 129),
TFPKKIQMLARDFLDEY (SEQ ID NO: 130),
ERFWRNILLLSLHKGSLYPRIPGLGKE (SEQ ID NO: 131),
RGRLPAGAVRTLLSQVNKVWDQSS (SEQ ID NO: 132),
GHEHQPDMQKSLLRAAFFGKCFLDR (SEQ ID NO: 133),
KMQRRNDDKSILMHGLVSLRESSRG (SEQ ID NO: 134),
STLPVISDSTTKRRWSALVIGL (SEQ ID NO: 135),
KLRTIPLSDNTIFRRICTIAKHLE (SEQ ID NO: 136),
PASAKSRREFDKIELAYRR (SEQ ID NO: 137),
ARLQSKEYPVIFKSIMRQRLISPQL (SEQ ID NO: 138),
FPVVQSTEDVFPQGLPNEYAFVT (SEQ ID NO: 139),
FPVVQSTEDVFPQGLPNEYAFVT (SEQ ID NO: 140),
FPVVQSTEDVFPQGLPNEYAFVT (SEQ ID NO: 141),
VTLNDMKARQKALVRERERQLA (SEQ ID NO: 142),
LNTGLFRIKFKEPLENLI (SEQ ID NO: 143),
KVVQHALDKARTGKTCLVVTHRLSAIQ (SEQ ID NO: 144), NQEAFKHLYFEKFSGYYDTMDAGYMDE (SEQ ID NO: 145), PSFLGMESCGIHEITFNSIMKCDVDIR (SEQ ID NO: 146), YPKGAGEMLEDQQAARMEKLAGLVEEL (SEQ ID NO: 147), KEELQKSLNILTALQKKGAEKEEL (SEQ ID NO: 148),
VTCVPNGTWRNYKVEVRFEPRHRPTRF (SEQ ID NO: 149), VFDTAFSRHFSLLKSQREFVRRFRGQA (SEQ ID NO: 150), PQTLGKKGSKNNIFVYMTLNQKKSDSS (SEQ ID NO: 151), CEDCRTRGQFNAFPYHFRGRRSLEFSY (SEQ ID NO: 152), SPELSAAESAVVLNLLMSLPEELPLLP (SEQ ID NO: 153), VFARVAPKQKEFVFTSLKELGYVTLMC (SEQ ID NO: 154), SADARLMVFDKTERTWRLLCSSRSNAR (SEQ ID NO: 155), MGPLLVATFWPELSEKIDAVYEAPQEE (SEQ ID NO: 156), CGPCSEKRFLLPSRSSKPVRICDFCYD (SEQ ID NO: 157), LTVTLRSPTWMRMNQGVCCNLEYHSSG (SEQ ID NO: 158), LHSNVLARIDAAALTGLALLEQLDLSD (SEQ ID NO: 159), LTAVRPEGSEPPGLPTSGPRRRPGCSR (SEQ ID NO: 160),
ALPSLTCSLTPLGVALVLWTVLGPC (SEQ ID NO: 161),
GGGTGDSEGSGALRSLTCSLTPLGLAL (SEQ ID NO: 162), DVEERVQKSFPHPVDKWAIADAQSAIE (SEQ ID NO: 163), SPGDLDVFVRFDFLYPNVEEAQKDKTS (SEQ ID NO: 164), DFIAGFCGETEEDYVQTVSLLREVQYN (SEQ ID NO: 165), RSQMTTSFTDPAIFMDLLRAVLQPSIN (SEQ ID NO: 166),
TAAGIHPQISSIFILGSLVYFSQEASR (SEQ ID NO: 167), RKDLLKANVKIFKFQGAALDKYAKKSV (SEQ ID NO: 168), HVLSGLSKDKEKRKENVRNSFWIYDIV (SEQ ID NO: 169), KTEWKSNVYLARSWIQGLGLYAARDIE (SEQ ID NO: 170), PPTPLLNTTSSLSEYPLGRADFDHYTG (SEQ ID NO: 171), LFLALLAGAHAEFSGCKIRVTSKALEL (SEQ ID NO: 172), FTRAFDQIRMAAIFESNINLCGSHCGV (SEQ ID NO: 173), GKSYQLLVVENTVKVAQFINNNPEFLQ (SEQ ID NO: 174), SRWDDSQRFLSDHLYLVCEETAKYLIL (SEQ ID NO: 175), ITKHLYEDPRQHSSGVLTDLRSALVNN (SEQ ID NO: 176), DVEERHHAYLKPFCVLISLLDKPEIGP (SEQ ID NO: 177), ATGQSAFAQVIADCHKILFDRNSAIKS (SEQ ID NO: 178), VTVLFAGQHIAKSLFEVYVDKSQGDAS (SEQ ID NO: 179), VNAVFEWHITKGGIIGAKWTIDLKSGS (SEQ ID NO: 180), SSSTTNNDPYAKPSDTPRPVMTDQFPK (SEQ ID NO: 181), MTEYKLVVVGAGDVGKSALTIQLIQN (SEQ ID NO: 182), VKLLIGNRDSLDNLYYDWYILVTNKCH (SEQ ID NO: 183), MAISFLTTLAKVYSSSLSKISGSILNE (SEQ ID NO: 184),
VLSHVSGLGWLASNLPSFLRVPKWIIA (SEQ ID NO: 185), IAELENKNREILQKIQRLRLEHEQASQ (SEQ ID NO: 186), PKGMPKDLNVGQQSLSNSGISEVEGLS (SEQ ID NO: 187), LAVGHLYRLSFLKKDSQSCRVAALEAS (SEQ ID NO: 188), PLPPHPHPHPHSVVLPPAHLPVQQQQP (SEQ ID NO: 189),
MPPLPIFSLPWSVHTWTQGP (SEQ ID NO: 190),
AKTVKHGAGAEISIVNPEQYSKRFLDF (SEQ ID NO: 191), PSRAGRPHHDQRSLSPHLGRSKSPPSH (SEQ ID NO: 192),
PPPPPQNNKPPVPFTPRPSASSQAPPP (SEQ ID NO: 193),
VVYSILQGQPYFSLDPKTGVIRTALHN (SEQ ID NO: 194), EIGWLKPVIGSQYLLEKVAEAHENIIH (SEQ ID NO: 195), VVCYQSNRDELRRCIIQWLEAEIIPDG (SEQ ID NO: 196), AVVDTLESEYLKISGDQVVSVVFIKEL (SEQ ID NO: 197), KEAKRSNSNKTMDLSCLKWTPPKGT (SEQ ID NO: 198), RDWAFVPAPCATSSYTGFANKHGSKPS (SEQ ID NO: 199), LSKVTKVKTDRPLLENPYHSRPRPDPS (SEQ ID NO: 200),
MAAVSVYAPLVGGFSFDNCRRNA (SEQ ID NO: 201),
DTPPFYSNSTNSFQNTVEGYSDPTGKY (SEQ ID NO: 202), KSRPGSVVPTTLFKGIKTVNPTFRGYS (SEQ ID NO: 203), IGLIFVVDSNDREQVNEAREELMRMLA (SEQ ID NO: 204), QGLIFVVDSNDREQVNEAREELMRMLA (SEQ ID NO: 205), SRKKRGCSSSKYASSYYHVMPKQNSTL (SEQ ID NO: 206), AMAATCISDTLGIFLSGLLALPLHDFL (SEQ ID NO: 207), KLIVQIKGSVEDISVMLVGNKCDETQR (SEQ ID NO: 208), GHQENAKNEEILNFLKYVRPGGGFEPN (SEQ ID NO: 209),
SILDLFLGRWFRSW (SEQ ID NO: 210),
RAQCHGHGRCVRRHPSASTFLHLSTNS (SEQ ID NO: 211), TSLELPMAMRFRHFKKTSKEAVGVYRS (SEQ ID NO: 212), CGKDFSQRAHLTIYQRTHTGEKPYKCL (SEQ ID NO: 213), KETTEAACRYGAFRLPITVAHVDGQTH (SEQ ID NO: 214), ELVTEGVAESLFLLRTDYSFHKFHYLT (SEQ ID NO: 215), AVRQAEKYYILRPDVIETYWYLWRFTH (SEQ ID NO: 216),
SVLHLVLALRGGGSLRQ (SEQ ID NO: 217),
QAVFSTSSRFWSSSPLLGQQPGPSQDI (SEQ ID NO: 218), PQWQKDELRETLKFLKKVMDDLDRASK (SEQ ID NO: 219), VIKDGCIVERGRHKALLSRGGVYADMW (SEQ ID NO: 220), RAESDVERKEWMQVLQQAMAEQRARAR (SEQ ID NO: 221), RSLRKINSAPPTEIKSLRIASRSTRHS (SEQ ID NO: 222), SNKYDPPLEDGAMLSARLRKLEVEANN (SEQ ID NO: 223), SDRCKDFSLCYWNLYWMLPSDVCGMNC (SEQ ID NO: 224), GVKLVVETPEETLLTYQGASVILPCRY (SEQ ID NO: 225), GMSTAMGRSPSPKISLSAPPNSSSTEN (SEQ ID NO: 226),
GGPPSPPPGIPGQSLPSPTRLHLGGGR (SEQ ID NO: 227), QVGRMERELNHEKVRCDQLQAEQKGLT (SEQ ID NO: 228), EDAELAEAAENSLFSYNSEVDEIPDEL (SEQ ID NO: 229), EIGVGAYGTVYKALDPHSGHFVALKSV (SEQ ID NO: 230), IQVGSLLGAVAMFSPTSIYHVFHSRKD (SEQ ID NO: 231), GYLLKLSAMGWGFSIFLVTLVALVDVD (SEQ ID NO: 232), IDNLSASNHSVAEVLLLFLESLPEPVI (SEQ ID NO: 233), AVLDLQLRSAPAAFERPLWDTSLRAPS (SEQ ID NO: 234), FLRKTECHCQIVNFGAGMDTTFWRLKD (SEQ ID NO: 235), YAGYSFEKLFPDVFFPADSEHNKLKAS (SEQ ID NO: 236), RPGFVFAPCPHELSCPQLTNLACSFSQ (SEQ ID NO: 237), KKFIRRDFLLDEAIGLLPDDKLTLFCE (SEQ ID NO: 238), ELRKEYGMTYNDFLMVLTDVDLRVKQY (SEQ ID NO: 239),
KFGQGLEDQLAQTKSLSLDDC (SEQ ID NO: 240),
HLLLVYTGKTRLAWNLLQDVLRSWYAR (SEQ ID NO: 241), PVPGVPFRNVDNDFPTSVELEDWVDAQ (SEQ ID NO: 242), STKVESLVALLNNFSEMKLVQMKWHEA (SEQ ID NO: 243), LFGQLAAFAGRKWIKFFTSQVKQTRDS (SEQ ID NO: 244), VPLERGAPNKEETSATESPDTGLYYHR (SEQ ID NO: 245), YCMHHSLVEFHLKKLRNKDTNIEVTFL (SEQ ID NO: 246), QIKISTRKQKSVKVISSYTPKDCTSRN (SEQ ID NO: 247), ILTVLQCATVIGFFYWASELILAQQQQ (SEQ ID NO: 248), VRLFLDSKHPGHYVVYNLSPRTYRPSR, (SEQ ID NO: 249)
SHTKGIWMWCVPHFKKPGHILVLLDTE (SEQ ID NO: 250), STLISVPDRDPASFLRMANSALISVGC (SEQ ID NO: 251), FAESADAALQGDPVLQDAGDSSRKEYF (SEQ ID NO: 252),
ANLEIMTKRSNYTSITNDKFTPPVVNV (SEQ ID NO: 253), EQTLVLQIVAGILYLGNISFKEVGNYA (SEQ ID NO: 254), KYTAQESREMFPRLFIRLLRSKVSRFL (SEQ ID NO: 255),
RDEEVSSADISSSFEVISQHLVSYRNI (SEQ ID NO: 256),
SQNTDMVQKSVSKILPSTWSDPSVNIS (SEQ ID NO: 257), DEIPLYLKGGVADVLLYRATMILTVGG (SEQ ID NO: 258),
IIARTDLKKNRDYRLAS KDAKKQLLCG (SEQ ID NO: 259), LFRHLLSSDQMMDYILADEAFFSVNSS (SEQ ID NO: 260), WESVKLLFVKTEKLAALPIFSSFVSNW (SEQ ID NO: 261), VLSEERAALLELWKLRRQQYEQCMDLQ (SEQ ID NO: 262), EKRQAKYSENKLKLIKARNEYLLTLEA (SEQ ID NO: 263), KSHRLPRLPKRHSYDDMLLLAQLSLPS (SEQ ID NO: 264),
MSEFRIYHDVNELLSLLRVH (SEQ ID NO: 265) и
TRLSKVFSAMLAIYSNKPALWIMAAKW (SEQ ID NO: 266) или их фрагмент.
В различных вариантах осуществления, неоантигены злокачественных опухолей возникают в результате мутаций, приводящих к экспрессии на клетках злокачественных опухолей антигенов, не разделяемых другими клетками-хозяевами в организме. Таким образом, в некоторых вариантах осуществления, неоантиген злокачественной опухоли не кодирован геномом хозяина (т.е. геномом незлокачественных клеток у субъекта). В конкретных вариантах осуществления, эти неоантигены может предварительно узнавать или может предварительно не узнавать иммунная система до использования способов иммунотерапии, таких как вакцинация, направленных на увеличение их иммуногенности. В различных вариантах осуществления, неоантигены представляют собой белки или пептиды (как правило, 8 или более аминокислот), содержащие мутантные последовательности эпитопа. В некоторых вариантах осуществления, мутантная последовательность возникает в результате одиночной точечной мутации. В конкретных вариантах осуществления, мутация находится в гене члена 5 (ABCB5) подсемейства B связывающей АТФ кассеты (MDR/TAP), члена 3 (ACSS3) семейства короткой цепи ацил-CoA-синтетазы, актина, гамма 1 (ACTG1), субъединицы 16 комплекса стимуляции анафазы (ANAPC16), белка 29 эндоплазматического ретикулума (ERP29), члена B семейства 101 со сходством последовательности (FAM101B), белка, подобного фактору узнавания ядерного преламина A (NARFL), домена PWWP, содержащего 2A (PWWP2A), гомолога пероксидазина (Drosophila) (PXDN), полипептида 2, 45 кДа, комплекса активации малой ядерной РНК (SNAPC2), АТФазы типа 13A1, гепсина, матриксной металлопептидазы 2 (желатиназы A, желатиназы 72 кДа, коллагеназы типа IV, 72 кДа), члена 2 семейства F, содержащего домен гомологии с плекстрином (с доменом FYVE), белка, взаимодействующего с полипептидом протеинтирозинфосфатазы рецепторного типа f (PTPRF) (липрина), альфа 4 (PPFIA4), рецептора ретикулона 4 (RTN4R), потомка гомолога 1 sevenless (Drosophila) (SOS1), белка 1A, содержащего суперспиральный домен и домен C2 (CC2D1A), ассоциированного с регуляторной субъединицей CDK5 белка 1 (CDK5RAP1), взаимодействующего с терминальной дезоксинуклеотилилтрансферазой белка 1 (DNTTIP1), индуцированным инсулином гене 1 (INSIG), гене NAD-малатдегидрогеназы 1 (растворимой) (MDH1), мускелина 1, внутриклеточного медиатора, содержащего мотивы kelch (MKLN1), белка 3 миелоидного/лимфоидного или смешанного лейкоза (MLL3), члена 2 семейства B с доменом, подобным гомологичному плекстрину домену (PHLDB2), белка переноса фосфолипидов (PLTP), транскетолазы (TKT), компонента комплемента 7 (C7), белка 1, подобного белку 37 цикла деления клеток (CDC37L1), рибонуклеазы типа III dicer 1 (DICER1), члена 2 семейства dopey (DOPEY2), дерматансульфат-эпимеразы (DSE), филамина A альфа (FLNA), дегидрогеназы 4 гидроксистероида (17-бета) (HSD17B4), гомолога онкогена нейробластомы вирусного RAS (v-ras) (NRAS), белка, подобного белку 9, содержащему домен с мотивом стерильности альфа (SAMD9L), белка 1, ассоциированного с куллином и диссоциированного при неддилировании (CAND1), члена 1 семейства дегидрогеназы/редуктазы (семейства SDR) (DHRS1), дистробревина бета (DTNB), члена B семейства 135 со сходством последовательности, (FAM135B), гомолога MMS19 белка эксцизионной репарации нуклеотидов (S. cerevisiae) (MMS19), связывающего MAX белка (MNT), члена 1 группы A подсемейства 4 ядерного рецептора (NR4A1), фосфатидилинозитол-5-фосфат-4-киназы, типа II, альфа (PIP4K2A), тубулин-киназы 2 tau (TTBK2), члена 1 семейства взаимодействующих с WAS/WASL белков (WIPF1), кадгерина 18 типа 2 (CDH18), кристаллина зета (хинон-редуктазы) (CRYZ), подобного фоллистатину белка 1 (FSTL1), гепарансульфат-протеогликана 2 (HSPG2), K(лизин)-ацетилтрансферазы 7 (KAT7), члена 26B семейства кинезина (KIF26B), белка 19 кДа субкомплекса 8 NADH-дегидрогеназы (убихинона) 1 альфа (NDUFA8), субъединицы бета типа 7 протеасомы (просомы, макропаина) (PSMB7), родственного тирозиназе белка 1 (TYRP1), специфической для убиквитина пептидазы 33 (USP33), фактора 3 ADP-рибозилирования (ARF3), члена 2 семейства АТФаз, содержащих домен AAA (ATAD2), белка 3 цероид-липофусциноза, нейронального (CLN3), члена 1 семейства DIRAS связывающих ГТФ подобных RAS белков (DIRAS1), глутатион-пероксидазы 1 (GPX1), ассоциированного с HCLS1 белка X-1 (HAX1), гиалуроноглюкозаминидазы 2 (HYAL2), белка 4 миелоидного/лимфоидного или смешанного лейкоза (MLL4), белка 287 с цинковыми пальцами (ZNF287), глутатион-S-трансферазы каппа 1 (GSTK1), белка главного комплекса гистосовместимости, класса II, DP альфа 1 (HLADPA1), члена 2 класса 1A манноидазы, альфа (MAN1A2), белка 8, экспрессирующегося в предшественниках нервных клеток, поддающегося понижающей регуляции в зависимости от стадии развития (NEDD8), члена 3 семейства с доменом TEA (TEAD3), аланил-тРНК-синтетазы (AARS), члена 6 подсемейства B связывающей АТФ кассеты (MDR/TAP) (ABCB6), ArfGAP с доменом RhoGAP с анкириновыми повторами и доменом 1 PH (ARAP1), белке с бромдоменом, соседним с доменом 1A с цинковыми пальцами (BAZ1A), кэпирующего белка (актиновых филаментов) бета Z-линии мышц (CAPZB), глюкозид-ксилозилтрансферазы 1 (GXYLT1), белка 3, связывающем гиалуронан и протеогликан (HAPLN3), индуцируемого интерфероном гамма белка 16 (IFI16), белка с доменом sema, доменом иммуноглобулина (Ig), трансмембранным доменом (TM) и коротким цитоплазматическим доменом (семафорина) 4C (SEMA4C), белка 1, связывающего Tax1 (вирус T-клеточного лейкоза типа I человека) (TAX1BP1), белка 111, содержащего суперспиральный домен (CCDC111), циклин-зависимой киназы 4 (CDK4), сопряженного с белком G рецептора 172A (GPR172A), сопряженного с белком G рецептора 56 (GPR56), инозитол-полифосфат-5-фосфатазы, 75 кДа (INPP5B), KIAA0415 (KIAA0415), лейцин-карбокси-метилтрансферазы 1 (LCMT1), активируемой митогенами протеинкиназы 8 (MAPK8), подобного метилтрансферазе белка 17 (METTL17), белка спекл-типа POZ (SPOP), содержащего суперспиральный домен белка 80 (CCDC80), белка 1 с доменами двойной цинковой молнии и анкиринового повтора (DZANK1), фукокиназы (FUK), антигена семейства C антигенов меланомы, (MAGEC2), субъединицы 24 медиаторного комплекса (MED24), maestro (MRO), нуклеобиндина 1 (NUCB1), члена A семейства фосфолипазы A1 (PLA1A), сенатаксина (SETX), трансмембранного белка 127 (TMEM127), ассоциированного с циклином G киназы (GAK), связывающего гуанилат белка 1, индуцируемого интерфероном (GBP1), гликопротеина nmb (трансмембранного) (GPNMB), гликофорина C (группа крови Гербич) (GYPC), белка DR альфа главного комплекса гистосовместимости, класса II, (HLA-DRA), миозина IE (MYO1E), ретинол-сатуразы (полностью-транс-ретинол-13,14-редуктазы) (RETSAT), белка 3, содержащего домен RWD (RWDD3), белка 2 с сигнальным пептидом, доменом CUB, подобным EGF доменом (SCUBE2), транслоцированной промоторной области (к активированному онкогену MET) (TPR), гене белка 1, взаимодействующего с клатрином (CLINT1), полипептида 2 субъединицы VIIa цитохром c-оксидазы (печени) (COX7A2), ИМФ (инозин-5'-монофосфат)-дегидрогеназы 2 (IMPDH2), протеинкиназы, активируемого ДНК каталитического полипептида (PRKDC), белка 1, содержащего рибосомальный домен L1 (RSL1D1), спектрина, альфа, не эритроцитарного 1 (альфа-фодрина) (SPTAN1), активирующего ГТФазу SLIT-ROBO Rho белка 1 (SRGAP1), супрессора онкогенности 5 (ST5), белка 2, ассоциированного с гамма-комплексом тубулина (TUBGCP2), UTP6, гомолога компонента малой субъединицы (SSU) процессомы (дрожжей) (UTP6), кислой фосфатазы предстательной железы (ACPP), содержащей домен дефосфо-CoA-киназы (DCAKD) хеликазы 3 с DEAD-боксом, X-сцепленной (DDX3X), каспазы 1 (CASP1), каспазы 5 (CASP5), богатго пролином суперспирального белка 2C (PRRC2C), люмикана (LUM), содержащего домены RUN и SH3 белка 2 (RUSC2), адреномедуллина 2 (ADM2), циклинзависимой киназы 13 (CDK13), протокадгерина 1 (PCDH1), джанктофилина 1 (JPH1), Toll-подобного рецептора 3 (TLR3), трансмембранного белка 260 (C14orf101), взаимодействующей с цитроном Rho серин/треонин-киназы (CIT), хеликазы 40 с DEAH-боксом (DHX40), члена A семейства 200 со сходством последовательности (FAM200A), субъединицы 2B ионотропного рецептора глутамата типа NMDA (GRIN2B), цепи альфа 1 коллагена типа XXII (COL22A1), RALGAPB (некаталитической бета-субъединицы белка, активирующего ГТФазу Ral), члена B семейства 50 со сходством последовательности (FAM50B), члена A семейства 190 со сходством последовательности (FAM190A), протогенина (PRTG), члена 4 семейства NLR, содержащего домен CARD (NLRC4), аденозин-дезаминеазы B1, специфической для РНК (ADARB1), субъединицы 2 общего фактора транскрипции IIIC (GTF3C2), члена 3 подсемейства C калиевого потенциалзависимого канала (KCNC3), белка вакуолярной сортировки 16 (VPS16), криптохрома 1 биологических часов (CRY1), металлопептидазы ADAM с мотивом 7 тромбоспондина типа 1 (ADAMTS7), активирующего ГТФазу Rho белка 29 (ARHGAP29), взаимодействующей с киназой MAP серин/треонин-киназы 1 (MKNK1), митохондриального фактора 4 терминации трансляции (MTERFD2), ассоциированного с геном MAX белка (MGA), антигена B синдрома Шегрена (SSB), белка 1 для поддержания структуры хромосом, содержащего гибкий шарнирный домен (SMCHD1), тенасцина R (TNR), взаимодействующего с фактором активации транскрипции 7 белка (ATF7IP), изоцитрат-дегидрогеназы (NADP(+)) 2, митохондриальной (IDH2), матриксной металлопептидазы 17 (MMP17), RNF40 (белка с доменом безымянного пальца 40), T-бокса 4 (TBX4), олигомерного муцина 5B, образующего слизь/гель (MUC5B), фиджетина, фактора разрыва микротрубочек (FIGN), белка 26, содержащего цинковый палец типа FYVE (ZFYVE26), белка 281 с цинковыми пальцами (ZNF281), регуляторной субъединицы 2 фосфоинозитид-3-киназы (PIK3R2), члена 6 семейства A белков дисульфид-изомераз (PDIA6), белка 4 для поддержания структуры хромосом (SMC4), рецептора тиреостимулирующего гормона (TSHR), белка 1, захватываемого при взаимодействии с krev (KRIT1), изозима B маннозил-(альфа-1,3-)-гликопротеид-бета-1,4-n-ацетилглюкозаминилтрансферазы (MGAT4B), связывающего SET белка 1 (SETBP1), коактиватора 6 ядерного рецептора (NCOA6), тензина 1 (TNS1), белка 4, содержащего домен 1, дефектный по недделированию куллина (DCUN1D4), Her2, Trp2, Myc, Ras, фактора роста эндотелия сосудов (VEGF), эукариотического фактора элонгации трансляции 2 (Eef2), хеликазы 23 с DEAD-боксом (Ddx23), локусе комплекса GNAS (GNAS), гена транспортина 3 (Tnpo3), тубулина бета 3 класса III (Tubb3), АТФазы, переносчика фосфолипидов 11A (Atp11a), шаперона гистонов 1B с функцией против выключения генов (Asf1b), дистрогликана 1 (Dag1), проколлаген-лизин,2-оксоглутарат-5-диоксигеназы 1 (Plod1), подобного обскурину белка 1 (Obsl1), регуляторной субъединицы 7 протеинфосфатазы 1 (Ppp1r7), белка 1, подобного метилентетрагидрофолат-дегидрогеназе (зависимой от NADP+) (Mthfd1l), члена 18B семейства кинезина (Kif18b), связывающей PDZ киназе (Pbk), члена 3 суперсемейства трансмембранных белков 9 (Tm9sf3), специфическом факторе 3 расщепления и полиаденилирования (Cpsf3l), белка 1 с доменом безымянного пальца Makorin (Mkrn1), актинина альфа 4 (Actn4), рибосомального белка L13a (Rpl13a), дифференциально экспрессированного в FDCP гомолога 8 (Def8), семафорина 3B (Sema3b), члена 1 семейства 20 транспортеров растворенных веществ (Slc20a1), глипикана 1 (Gpc1), нефроцистина 3 (Nphp3), трансмембранного белка 87A (Tmem87a), члена 3 семейства 4 транспортеров растворенных веществ (Slc4a3), рецептора 7 хемокинов (с мотивом C-X-C) (Cxcr7), фактора транскрипции E2F 8 (E2f8), белка 2, подобного аланин-гликосилат-аминотрансферазе 2 (Agxt2l2), белка 4, подобного белку 1 сборки нуклеосом (Nap1l4), хеликазы 35 с DEAH-боксом (Dhx35), белка гена-кандидата 6 хромосомной области 2 бокового амиотрофического склероза (Als2), взаимодействующего с MTOR белка, содержащего домен DEP (Deptor), тимин-ДНК-гликозилазы (Tdg), ингибитора Dickkopf 2 пути передачи сигнала WNT (Dkk2), белка 2, ассоциированного с РНК-полимеразой II (Rpap2), металлоредуктазы STEAP2 (Steap2), специфической для убиквитина пептидазы 26 (Usp26), нейробичина (Nbea), члена A1 семейства альдегид-дегидрогеназы 18 (Aldh18a1), белка 14, содержащего цинковый палец типа CCCH (Zc3h14), рибонуклеазы III Drosha (Drosha), гене гомолога 1 эндонуклеазы (Gen1), субъединицы A РНК-полимеразы II (Polr2a), трансмембранногом белка 2, содержащего тетратрикопептидные повторы (Tmtc2), связывающего РНК белка с цинковыми пальцами (Zfr), центросомального белка 120 (Cep120), гене транслокации 1 лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой (Malt1), домена повтора WD 11 (Wdr11), белка 2, содержащего повтор Kelch и домен BTB (Kbtbd2), металлопептидазы ADAM с мотивом 9 тромбоспондина типа 1 (Adamts9), белка зоны беременности (Pzp), члена A группы 5 сопряженных с G-белком рецепторов класса C (Gprc5a), ассоциированного с энергетическим гомеостазом белка (Enho), родственного Doublesex и Mab-3 фактора транскрипции 5 (Dmrta2), родственного Ras связывающего ГТФ белка D (Rragd), белка 3, содержащего цинковый палец типа ZZ (Zzz3), ассоциированной с ILK серин/треонин-фосфатазы (Ilkap) или белка центромеры F (Cenpf), что приводит к мутантной аминокислотной последовательности (например, замене или вставке) в белке, кодированном и экспрессированным этим геном. Дополнительные неограничивающие примеры последовательностей неоантигенов и генов, из которых могут возникать неоантигены, так же как иллюстративные способы идентификации последовательностей неоантигенов описаны в Kreiter et al. (2015) Nature 520(7549): 692-696, Ott et al. (2017) Nature 547:217-221, и Sahin et al. (2017) Nature 547: 222-226, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
В рамках изобретения, термин «антиген» представляет собой вещество, индуцирующее иммунный ответ.
В рамках изобретения, термин «неоантиген» представляет собой антиген, имеющий по меньшей мере одно изменение, которое делает его отличным от соответствующей исходной формы антигена, дикого типа. Например, неоантиген может возникать посредством мутации в клетке опухоли или посттрансляционной модификации, специфической для клетки опухоли. В различных вариантах осуществления, неоантиген представляет собой продукт гена. Неоантиген может включать полипептидную последовательность или нуклеотидную последовательность. Мутация может включать приводящие к сдвигу рамки считывания или не приводящие к сдвигу рамки считывания индел, точечную мутацию, миссенс- или нонсенс-замену, изменение участка сплайсинга, геномную реаранжировку или слияние генов, или любое изменение генома или экспрессии, приводящее к образованию молекулы ДНК или РНК (такой как мРНК), отличающейся от соответствующей ДНК или РНК дикого типа. Мутация может также включать вариант сплайсинга. Посттрансляционные модификации, специфические для клетки опухоли, могут включать измененное фосфорилирование. Посттрансляционные модификации, специфические для клетки опухоли, могут включать также образованный посредством протеасомы подвергнутый сплайсингу антиген. См. Liepe et al., A large fraction of HLA class I ligands are proteasome-generated spliced peptides; Science. 2016 Oct. 21; 354(6310):354-358, полное содержание которого приведено в настоящем описании в качестве ссылки.
В рамках изобретения, термин «неоантиген опухоли» представляет собой неоантиген, присутствующий в клетке или ткани опухоли субъекта, но не в соответствующих нормальной клетке или ткани субъекта.
Настоящее изобретение относится к наночастицам или микрочастицам мезопористого диоксида кремния (MPS). Неограничивающие примеры включают палочки из MPS. В некоторых вариантах осуществления, палочки из MPS содержат модификацию поверхности (например, палочки из MPS обработаны веществом, таким как гликолевая кислота или молочная кислота, конъюгированы с группой амина, тиола, хлора или фосфоната, или соединение, такое как PEI, добавлено к палочкам из MPS). В различных вариантах осуществления палочка из MPS с модифицированной поверхностью представляет собой палочку из MPS, к которой добавлен свободный PEI. Палочка представляет собой прямую, по существу цилиндрическую структуру, более длинную, чем ее ширина.
В некоторых вариантах осуществления, свободный PEI добавляют к каркасу (такому как MPS, например, палочки из MPS, или полимер) отдельно от другого соединения, такого как антиген (такой как антиген, содержащий полипептид, ассоциированный с злокачественной опухолью или патогеном), иммуностимулирующее соединение (такое как агонист TLR или агонист STING) и/или ингибитор иммуносупрессии. В конкретных вариантах осуществления, свободный PEI добавляют к каркасу до (например, по меньшей мере приблизительно за 1, 6, 12, 15, 30, 60, 120, или 1-120 секунд или минут до, или менее, чем за приблизительно 1, 6, 12, 15, 30, 60, 120 или 1-120 секунд или минут до) другого соединения или соединений. В различных вариантах осуществления, свободный PEI добавляют к каркасу после другого (например, по меньшей мере приблизительно через 1, 6, 12, 15, 30, 60, 120 или 1-120 секунд или минут после или менее, чем через приблизительно 1, 6, 12, 15, 30, 60, 120 или 1-120 секунд или минут после) соединения или соединений. В конкретных вариантах осуществления PEI добавляют к каркасу параллельно с другим соединением или соединениями.
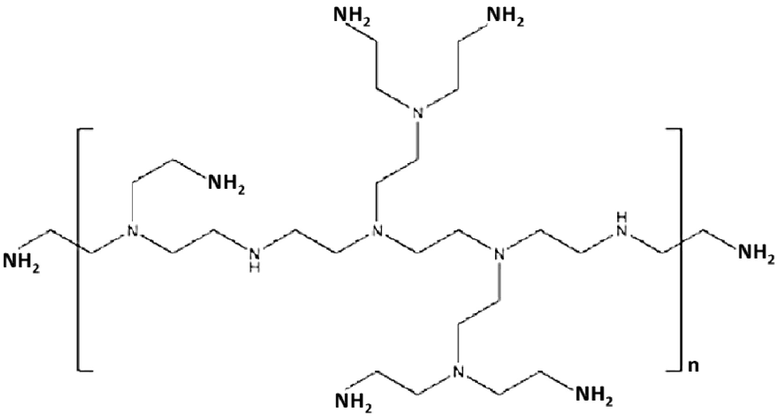
PEI может включать, например, разветвленный или линейный PEI. В некоторых вариантах осуществления, устройство или композиция каркаса, в рамках изобретения, содержит как разветвленный PEI, так и линейный PEI. В различных вариантах осуществления, PEI содержит разветвленный дендримерный PEI. В конкретных вариантах осуществления, PEI содержит по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 20 или 30 первичных, вторичных и/или третичных аминогрупп. В некоторых вариантах осуществления, PEI имеет молекулярную массу (a) по меньшей мере приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 100, 125, 150, 175 или 200 килодальтон (кДа); (b) менее, чем приблизительно 200, 175, 150, 125, 100, 75, 70, 65, 60, 55, 50, 45, 35, 25, 20, 15, 10, 5, 4, 3, 2 или 1 кДа; или (c) приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 1-10, 2-25, 25-60, 25-75, 50-100 или 100-200 кДа. Например, PEI может содержать линейный PEI, имеющий молекулярную массу приблизительно 25 кДа и/или разветвленный PEI, имеющий молекулярную массу приблизительно 60 кДа.
В некоторых вариантах осуществления, PEI содержит структуру:

 или
или
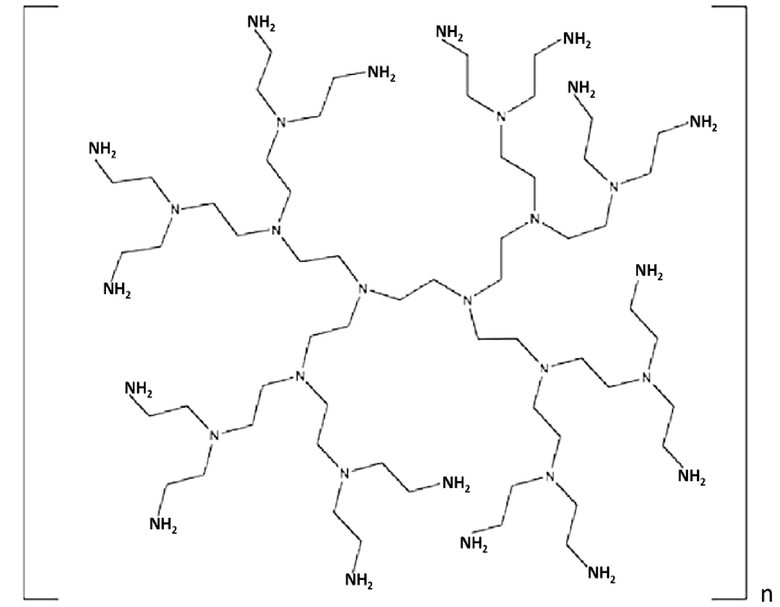
где n составляет по меньшей мере приблизительно 1, 2, 3, 4, 5, 10, 15 или 20; (b) менее чем приблизительно 20, 15, 10, 5, 4, 3, 2 или 1 кДа; или (c) приблизительно 1, 2, 3, 4, 5, 10, 15 или 20.
В некоторых вариантах осуществления, PEI присутствует в количестве, которое является эффективным для усиления представления антигена, например, перекрестного представления. В конкретных вариантах осуществления, лечение субъекта усиливает гуморальный и/или опосредованный T-клетками иммунитет против антигена или клетки, или вируса, содержащих антиген (таких как клетка злокачественной опухоли или патогенный микрорганизм). В различных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для усиления рестрицированного по главному комплексу гистосовместимости (MHC) класса I представления антигена цитотоксическим T-лимфоцитам (CTL). В конкретных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для усиления представления антигена CTL посредством MHC класса I, по сравнению с соответствующими условиями (например, введения) без PEI, и усиление составляет приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, 100%, 150% или 200%.
В конкретных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для увеличения титра одного или более антител, которые являются специфическими для антигена. В некоторых вариантах осуществления, антитело, которое является «специфическим» для антигена, имеет более чем 10-кратную, предпочтительно, более чем 100-кратную, и наиболее предпочтительно, более чем 1000-кратную аффинность для антигена-мишени по сравнению с другой молекулой. Как понятно специалисту в данной области, термин специфический используют, чтобы показать, что другие биомолекулы, присутствующие в образце, значительно не связываются с антителом, которое является специфическим для антигена-мишени. Предпочтительно, уровень связывания с биомолекулой, отличной от антигена-мишени, приводит к аффинности связывания, составляющей самое большее, только 10% или менее, только 5% или менее, только 2% или менее, или только 1% или менее от аффинности для молекулы-мишени, соответственно. Предпочтительное специфическое антитело удовлетворяет обоим вышеуказанным минимальным критериям по аффинности, так же как по специфичности. Например, антитело имеет аффинность связывания в низком микромолярном (10-6), наномолярном (10-7-10-9), где высокая аффинность антитела лежит в низком наномолярном (10-9) или пикомолярном (10-12) диапазоне (или менее) для его специфического антигена-мишени. В некоторых вариантах осуществления, антитело представляет собой антитело IgG1 или IgG2. В различных вариантах осуществления, антитело представляет собой антитело IgG2a. В конкретных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для увеличения титра одного или более антител, которые являются специфическими для антигена, по сравнению с соответствующими условиями (например, введения) без PEI, и увеличение составляет приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, 100%, 150% или 200%. В различных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для усиления активации B-клеток. В конкретных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для усиления активации B-клеток, по сравнению с соответствующими условиями (например, введения) без PEI, и усиление составляет приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 75%, 100%, 150% или 200%.
В конкретных вариантах осуществления, носитель для доставки имеет размер, превышающий приблизительно 5, 10, 15, 20, 25, 50, 100, 200, 300, 400, 500, 1000 или 10000 мкм. В неограничивающих примерах, носитель для доставки имеет объем по меньшей мере приблизительно 0,1, 0,5, 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мм3.
В некоторых вариантах осуществления, PEI присутствует в количестве, которое является эффективным для увеличения продукции гранулоцитарного колониестимулирующего фактора (G-CSF), воспалительного белка-1a макрофагов (MIP-1a), хемокина, экспрессируемого и секретируемого нормальными T-клетками при активации (RANTES), хемоаттрактанта кератиноцитов (KC), интерлейкина-2 (IL-2), воспалительного белка-1b макрофагов (MIP-1b) и/или интерлейкина 12 (IL-12) иммуноцитами у субъекта, по сравнению с соответствующим устройством, не содержащим PEI. В конкретных вариантах осуществления, PEI присутствует в количестве, которое является эффективным для увеличения уровня активных дендритных клеток, выходящих из устройства, по меньшей мере приблизительно в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 раза, по сравнению с соответствующим устройством, не содержащим PEI.
В различных вариантах осуществления, композиция каркаса (i) содержит открытые взаимосвязанные макропоры; или (ii) представляет собой порообразующую композицию каркаса. В некоторых вариантах осуществления, композиция каркаса содержит гидрогель или криогель. В конкретных вариантах осуществления, композиция каркаса содержит криогель, характеризующийся эффектом памяти формы после деформации посредством выдавливания через иглу. Например, криогель может характеризоваться эффектом памяти формы после деформации посредством выдавливания через иглу, так что криогель возвращается к своей исходной недеформированной трехмерной форме менее, чем через 1, 2, 3, 4 или 5 секунд после выдавливания через иглу.
В некоторых вариантах осуществления, композиция каркаса является анионной или катионной.
В различных вариантах осуществления, композиция каркаса содержит полимер или сополимер альгината, производного альгината, желатина, коллагена, агарозы, фибрина, декстрана, хитозана, карбоксиметилцеллюлозы, пуллуланы, полиэтиленгликоля (PEG), производного PEG, амфифильного пептида, шелка, фибронектина, хитина, гиалуроновой кислоты, богатого ламинином геля, природного или синтетического полисахарида, полиаминокислоты, полипептида, полиэфира, полимолочной кислоты, полиглутаминовой кислоты, полигликолевой кислоты, сополимера (лактида-гликолида), сополимера (молочной-гликолевой кислоты), полилизина, полигидроксибутирата, поли[(карбокси фенокси)пропан-себациновой кислоты], сополимера[пиромеллитилимидоаланина-1,6-бис(п-карбоксифенокси)гексана], полифосфазена, крахмала, ксантановой камеди, геллана, эмульсана, целлюлозы, альбумина, полигидроксиалканоатов, поли-эпсилон-капролактон, поликапролактон, полидиоксанона, полигликоната, полифосфазина, поливинилового спирта, полиалкиленоксида, полиэтиленоксида, полиаллиламина (PAM), поли(ортоэфира I), поли(ортоэфира) II, поли(ортоэфира) III, поли(ортоэфира) IV, полиакрилата, поли(4-аминометилстирол), поли(2-гидроксиэтилметакрилата), поли(метилметакрилата), поли(этилентерефталата), поли(диметилсилоксана), поли(N-изопропилакриламида), полипропиленфумарата, политетрафторэтилена, полиэтилена, модифицированного полиуретаном стирольного полимера, полиола плюроника, полиоксамера, полиуроновой кислоты, полиангидрида, полиакриловой кислоты и/или поливинилпирролидона. В конкретных вариантах осуществления, полимер или сополимер являются метакрилированными. В некоторых вариантах осуществления, анионный композиция каркаса содержит сополимер(лактида-гликолида), сополимер(молочной-гликолевой кислоты), альгинат, ксантановую камедь, геллан или эмульсан.
Неограничивающие примеры каркаса включают каркасные композиции, содержащие сополимер D,L-лактида и гликолида (PLG). В некоторых вариантах осуществления, PLG содержит 85:15, 120 кДа сополимер D,L-лактида и гликолида. В различных вариантах осуществления, PLG имеет соотношение D,L-лактида к гликолиду приблизительно 50:50, 55:45, 60:40, 65:35, 70:30, 75:25, 80:20, 85:15, 90:10 или 95:5. В конкретных вариантах осуществления, сополимер имеет молекулярную массу приблизительно 5 кДа, 6 кДа, 7 кДа, 8 кДа, 9 кДа, 10 кДа, 15 кДа, 20 кДа, 25 кДа, 30 кДа, 35 кДа, 40 кДа, 45 кДа, 50 кДа, 60 кДа, 70 кДа, 80 кДа, 90 кДа, 100 кДа, 110 кДа, 120 кДа, 130 кДа, 140 кДа, 150 кДа, 160 кДа, 170 кДа, 180 кДа, 190 кДа, 200 кДа, 210 кДа, 220 кДа, 230 кДа, 240 кДа, 250 кДа, 5-250 кДа, 7-240 кДа, 50-100 кДа, 50-150 кДа, 50-200 кДа, 100-150 кДа, 100-200 кДа, 150-250 кДа. В некоторых вариантах осуществления, PLG имеет вязкость в диапазоне от приблизительно 0,16-2,2 дл/г, 0,16-1,5 дл/г, 0,16-1 дл/г, 0,16-0,5 дл/г, или 1,5-2,2 дл/г, или приблизительно 0,16 дл/г, 0,18 дл/г, 0,2 дл/г, 0,3 дл/г, 0,4 дл/г, 0,5 дл/г, 0,6 дл/г, 0,7 дл/г, 0,8 дл/г, 0,9 дл/г, 1,0 дл/г, 1,1 дл/г, 1,2 дл/г, 1,3 дл/г, 1,4 дл/г, 1,5 дл/г, 1,6 дл/г, 1,7 дл/г, 1,8 дл/г, 1,9 дл/г, 2,0 дл/г, 2,1 дл/г или 2,2 дл/г.
В некоторых вариантах осуществления, композиция каркаса содержит открытые взаимосвязанные макропоры. Альтернативно или дополнительно, композиция каркаса содержит порообразующую композицию каркаса. В конкретных вариантах осуществления, порообразующая композиция каркаса может содержать жертвуемый порогенный гидрогель и придающий объем гидрогель, где порообразующая композиция каркаса лишена макропор. Например, жертвуемый порогенный гидрогель может деградировать по меньшей мере на 10% быстрее, чем придающий объем гидрогель, оставляющий макропоры на своем месте после введения указанного порообразующего каркаса субъекту. В некоторых вариантах осуществления, жертвуемый порогенный гидрогель находится в форме порообразующих веществ, которые деградируют для формирования указанных макропор. Например, макропоры могут включать поры, имеющие диаметр, например, приблизительно 10-400 мкм.
В конкретных вариантах осуществления, композиция каркаса содержит (i) первую зону, содержащую хемоаттрактант клеток злокачественных опухолей и индуцирующую цитотоксичность композицию, и (ii) вторую зону, содержащую композицию для привлечения иммуноцитов. В неограничивающем примере, вторая зона не содержит индуцирующую цитотоксичность композицию.
В различных вариантах осуществления, композиция каркаса содержит палочки из мезопористого диоксида кремния. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину приблизительно 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, 500 нм, 600 нм, 700 нм, 800 нм, 900 нм, 100-250 нм, 250-500 нм, 500-750 нм, 750-1000 нм, 1 мкм, 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм, 15 мкм, 25 мкм, 30 мкм, 35 мкм, 40 мкм, 45 мкм, 50 мкм, 55 мкм, 60 мкм, 65 мкм, 70 мкм, 75 мкм, 80 мкм, 85 мкм, 90 мкм, 95 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм, 300 мкм, 350 мкм, 400 мкм, 450 мкм, 500 мкм, 1-5 мкм, 1-500 мкм, 5-500 мкм, 25-50 мкм, 25-100 мкм, 50-100 мкм, 25-500 мкм, или 50-500 мкм. В конкретных вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину от 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, 500 нм, 600 нм, 700 нм, 800 нм, 900 нм, 100-250 нм, 250-500 нм, 500-750 нм, 750-1000 нм, 1 мкм, 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм, 15 мкм, 25 мкм, 30 мкм, 35 мкм, 40 мкм, 45 мкм, или 50 мкм до 55 мкм, 60 мкм, 65 мкм, 70 мкм, 75 мкм, 80 мкм, 85 мкм, 90 мкм, 95 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм, 300 мкм, 350 мкм, 400 мкм, 450 мкм или 500 мкм. В различных вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину, приблизительно или по меньшей мере приблизительно любую из 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, 500 нм, 600 нм, 700 нм, 800 нм, 900 нм, 100-250 нм, 250-500 нм, 500-750 нм, 750-1000 нм, 1 мкм, 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм, 15 мкм, 25 мкм, 30 мкм, 35 мкм, 40 мкм, 45 мкм, 50 мкм, 55 мкм, 60 мкм, 65 мкм, 70 мкм, 75 мкм, 80 мкм, 85 мкм, 90 мкм, 95 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм, 1-500 мкм, 5-500 мкм, 25-50 мкм, 25-100 мкм, 50-100 мкм, 25-500 мкм или 50-500 мкм, но менее, чем 550 мкм. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния имеют диаметр, приблизительно или по меньшей мере приблизительно любой из 75 нм, 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, 500 нм, 600 нм, 700 нм, 800 нм, 900 нм, 100-1000 нм, 100-500 нм, 100-250 нм, 250-500 нм, 500-750 нм или 750-1000 нм, при условии, что палочки из мезопористого диоксида кремния имеют длину, по меньшей мере на 10% больше, чем их диаметр. В конкретных вариантах осуществления, палочки из мезопористого диоксида кремния имеют диаметр от 75 нм, 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, или 500 нм до 600 нм, 700 нм, 800 нм, 900 нм, или 1000 нм. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину, по меньшей мере приблизительно на 10, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или 150% больше чем диаметр палочек из мезопористого диоксида кремния. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину, по меньшей мере приблизительно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 400 или 500 раз, превышающую диаметр палочек из мезопористого диоксида кремния. В конкретных вариантах осуществления, палочки из мезопористого диоксида кремния содержат поры, имеющие диаметр приблизительно или по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 нм, или приблизительно 1-10, 1-15, 1-5, 2-5, 2-10, 3-10, 4-10, 5-10, 5-15 или 10-25 нм. В конкретных вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину от 80 до 120 мкм. Например, палочки из мезопористого диоксида кремния могут иметь (a) поры, имеющие диаметр между 2-50 нм, 3-50 нм, 5-50 нм, 5-25 нм, 5-10 нм; и/или (b) длину приблизительно 5-25 мкм, 80 до 120 мкм. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния могут содержать комбинацию палочек различной длины и/или палочки с диапазоном различных размеров (например, в пределах диапазонов, описанных выше, или 1, 2, 3, 4, 5 или более из диапазонов, описанных выше). В некоторых вариантах осуществления, палочки с длиной приблизительно 100 нм, 150 нм, 200 нм, 250 нм, 300 нм, 350 нм, 400 нм, 450 нм, 500 нм, 600 нм, 700 нм, 800 нм, 900 нм, 100-250 нм, 250-500 нм, 500-750 нм или 750-1000 нм комбинируют с палочками, имеющими длину приблизительно 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм, 10 мкм, 15 мкм, 25 мкм, 30 мкм, 35 мкм, 40 мкм, 45 мкм, 50 мкм, 55 мкм, 60 мкм, 65 мкм, 70 мкм, 75 мкм, 80 мкм, 85 мкм, 90 мкм, 95 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм, 300 мкм, 350 мкм, 400 мкм, 450 мкм, 500 мкм, 5-500 мкм, 25-50 мкм, 25-100 мкм, 50-100 мкм, 25-500 мкм или 50-500 мкм. В конкретных вариантах осуществления, палочки имеют ширину приблизительно 0,5 мкм, 1 мкм, 1,5 мкм, 2 мкм, 2,5 мкм, 3 мкм, 3,5 мкм, 4 мкм, 4,5 мкм, 5 мкм, 5,5 мкм, 6 мкм, 6,5 мкм, 7 мкм, 7,5 мкм, 8 мкм, 8,5 мкм, 9 мкм, 9,5 мкм, 10 мкм, 11 мкм, 12 мкм, 13 мкм, 14 мкм, 15 мкм, 16 мкм, 17 мкм, 18 мкм, 19 мкм, 20 мкм, 1-20 мкм, 1-10 мкм, 5-10 мкм, 1-5 мкм, 0,5-20 мкм, 7,5-12,5 мкм или 5-15 мкм. В некоторых вариантах осуществления, одна группа палочек является достаточно мелкой, чтобы поддаваться фагоцитозу посредством иммуноцитов, таких как дендритные клетки или макрофаги, и другая группа палочек является слишком большой, чтобы поддаваться фагоцитозу посредством иммуноцитов. В различных вариантах осуществления, палочки, имеющие различные антигены или другие соединения, описанные в настоящем описании, смешивают. Таким образом, настоящее изобретение относится к смесям из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более классов палочек из мезопористого диоксида кремния, где каждый класс палочек имеет различный антиген (например, антигенный пептид, такой как очищенный пептид). Например, смесь может содержать первый класс палочек, содержащий первый антиген, второй класс палочек, содержащий второй антиген, третий класс палочек, содержащий третий антиген, и так далее. Смесь палочек может иметь одинаковые или сходные размеры или диапазон размеров, или может включать одну или более палочек с конкретным антигеном или антигенами (например, палочек, достаточно мелких, чтобы поддаваться фагоцитозу) и другую одну или более палочек с другим антигеном или антигенами (например, палочек, слишком больших, чтобы поддаваться фагоцитозу). В конкретных вариантах осуществления, палочки, которые являются слишком большими, чтобы поддаваться фагоцитозу, формируют каркасы после введения (например, инъекции) субъекту. Пригодные для инъекции палочки из мезопористого диоксида кремния подвергаются случайной самосборке для формирования 3-мерного (3D) каркаса in vivo. Эту систему конструируют таким образом, что она привлекает и временно вмещает иммуноциты (такие как дендритные клетки), представляет им антиген и активирует их (например, с использованием иммуностимулирующего соединения, такого как PEI). После привлечения и временного вмещения или присутствия клеток в структуре, эти иммуноциты мигрируют из структуры устройства и подвергаются хомингу в лимфатическом узле. Таким образом, композиция представляет собой композицию, в которой клетки мигрируют/циркулируют внутрь и наружу, их статус иммунной активации изменяется/модулируется в результате миграции через устройство. В различных вариантах осуществления, палочки из мезопористого диоксида кремния суспендируют в водном растворе, таком как буфер [например, фосфатно-солевой буфер (PBS), сбалансированный солевой раствор Хенкса (HBSS), или другой физиологически (например, фармацевтически приемлемый) буфер] для инъекции. В некоторых вариантах осуществления, палочки из мезопористого диоксида кремния инъецируют в воде. Палочки из мезопористого диоксида кремния можно инъецировать во множестве концентраций. В некоторых вариантах осуществления, палочки инъецируют в концентрации приблизительно 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 11 мг/мл, 12 мг/мл, 13 мг/мл, 14 мг/мл, 15 мг/мл, 16 мг/мл, 17 мг/мл, 18 мг/мл, 19 мг/мл, 20 мг/мл, 21 мг/мл, 22 мг/мл, 23 мг/мл, 24 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл, 50 мг/мл, 55 мг/мл, 60 мг/мл, 10-40 мг/мл, 20-35 мг/мл, 20-40 мг/мл, 25-35 мг/мл, 25-50 мг/мл, 25-45 мг/мл, 25-30 мг/мл, 30-50 мг/мл, 1-30 мг/мл, 1-40 мг/мл, 1-50 мг/мл, 1-60 мг/мл, 5-50 мг/мл или 5-60 мг/мл.
Один или более антигенов можно выбирать на основании антигенного профиля злокачественной опухоли субъекта или патогена. Настоящее изобретение относится к библиотекам палочек из мезопористого диоксида кремния. В различных вариантах осуществления, библиотека палочек из мезопористого диоксида кремния содержит множество палочек, где каждая содержит различный антиген. Палочки, имеющие конкретный антиген, можно отделять от палочек, содержащих другой антиген, так что различные палочки можно отбирать, и необязательно, комбинировать. Некоторые аспекты относятся к детекции одного или более антигенов, присутствующих на и/или в клетках злокачественных опухолей или опухолях субъекта, и к отбору затем одного или более палочек, содержащих антигены (или их части), которые являются сходными с такими же, как один или более антигенов на/в клетках злокачественных опухолей или опухолях субъекта. Таким образом, комбинацию палочек из мезопористого диоксида кремния можно извлечь из библиотеки, так что комбинацию отбирают в свете антигенного профиля субъекта. В различных вариантах осуществления, палочки дополнительно содержат PEI. Подобным образом, настоящее изобретение относится к библиотекам антигенов, из которых можно отбирать антигены для включения в гидрогель или криогель, такой как каркас, содержащий PLG, альгинат и/или желатин (или любой другой полимер, известный в данной области и/или описанный в настоящем описании), на основании антигенов, присутствующих в/на клетке злокачественной опухоли или опухоли субъекта. В некоторых вариантах осуществления, каркасы дополнительно содержат PEI. В неограничивающих примерах, библиотека палочек или антигенов содержит по меньшей мере приблизительно 5, 6, 7, 8, 9, 10, 15, 20, 25 или 50 типов палочек (например, отдельные группы палочек, где каждая содержит различный антиген) или антигенов. В некоторых вариантах осуществления, библиотека аранжирована в форме массива или представляет собой коллекцию отдельных контейнеров (например, пробирок или флаконов, каждый из которых содержит различную палочку или антиген).
В некоторых вариантах осуществления, устройство является пригодным для инъекций. В различных вариантах осуществления, устройство дополнительно содержит (a) иммуностимулирующее соединение; (b) соединение, привлекающее иммуноцит к носителю или в носитель для доставки; (c) соединение, индуцирующее иммуногенную гибель клеток опухоли; (d) соединением, ингибирующее супрессию T-клеток или дендритных клеток; (e) соединение, которое ингибирует ингибирующий иммунитет белок, или любую их комбинацию.
В конкретных вариантах осуществления, иммуностимулирующее соединение включает агонист toll-подобного рецептора (TLR), агонист стимулятора генов интерферона (STING), и/или мезопористый диоксид кремния. В некоторых вариантах осуществления, иммуностимулирующее соединение включает ассоциированный с патогеном молекулярный паттерн (PAMP). В некоторых вариантах осуществления, агонист STING включает циклический динуклеотид. В конкретных вариантах осуществления, агонист TLR содержит агонист TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13. В неограничивающих примерах, устройство содержит агонист TLR, такой как триациллипопротеин, гликолипид, липопептиды, гепарансульфат, диациллипопептиды, бропиримин, липопротеины, липотейхоевую кислоту, белок теплового шока 70 (HSP70), зимозан, профилин, CpG-олигонуклеотид, двухцепочечную рибонуклеиновую кислоту (РНК), поли(I:C), поли(I:C), поли(A:U), монофосфориллипид A (MPLA), липополисахарид (LPS), белок теплового шока, фибриноген, гепаринсульфат или его фрагмент, гиалуроновая кислота или ее фрагмент, никель, опиоид, α1-кислый гликопротеин (AGP), RC-529, мышиный β-дефензин 2, полный адъювант Фрейнда (CFA), флагеллин, одноцепочечную РНК, аналог гуанозина, имидазохинолин, локсорибин, бета-глюкан грибов, имиквимод, CRX-527 или OM-174.
В различных вариантах осуществления, устройство содержит соединение, привлекающее иммуноцит к носителю или в носитель для доставки, где иммуноцит включает макрофаг, T-клетку, B-клетку, клетку естественного киллера (NK) или дендритную клетку. Неограничивающие примеры соединений, которые можно использовать для привлечения иммуноцита к носителю или в носитель для доставки, включают гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), лиганд подобной FMS тирозинкиназы 3 (Flt3L), лиганд 19 хемокина (с мотивом C-C) (CCL-19), лиганд 20 хемокина (с мотивом C-C) (CCL20), лиганд 21 хемокина (с мотивом C-C) (CCL-21), N-формилпептид, фракталкин, моноцитарный хемотаксический белок-1 и макрофагальный воспалительный белок-3 (MIP-3α).
В некоторых вариантах осуществления, соединение, ингибирующее супрессию T-клеток или дендритных клеток, включает соединение, которое ингибирует ингибирующий иммунитет белок. В конкретных вариантах осуществления, иммуноингибирующий белок представляет собой ассоциированный с цитотоксическими T-лимфоцитами антиген 4 (CTLA4), белок 1 программируемой гибели клеток (PD1), лиганд белка 1 программируемой гибели клеток (PDL1), продукт гена активации лимфоцитов 3 (LAG3), B7-H3, B7-H4 или T-клеточный мембранный белок 3 (TIM3).
В различных вариантах осуществления, устройство дополнительно содержит антиген. Например, в некоторых вариантах осуществления, устройство содержит как свободный PEI, так и антиген. В некоторых вариантах осуществления, антиген содержит антиген опухоли или не относится к антигену опухоли. PEI можно добавлять к носителю для доставки до антигена, вместе с антигеном (например, в водной композиции или смеси, содержащей PEI и антиген) или после антигена. В некоторых вариантах осуществления, PEI покрывают внешнюю часть носителя для доставки, содержащего антиген. В конкретных вариантах осуществления, PEI добавляют к носителю для доставки и затем антиген добавляют к носителю для доставки. В различных вариантах осуществления, антиген добавляют к носителю для доставки и затем PEI добавляют к носителю для доставки. Некоторые варианты осуществления относятся к комбинации PEI с антигеном, с которым PEI не взаимодействует электростатически. В некоторых вариантах осуществления, свободный PEI не становится связанным (например, электростатически связанным) с антигеном внутри носителя для доставки. В конкретных вариантах осуществления, свободный PEI становится связанным (например, электростатически связанным) с антигеном внутри носителя для доставки. В различных вариантах осуществления, PEI становится связанным (например, электростатически связанным) с антигеном и затем его добавляют к носителю для доставки. Неограничивающие примеры добавления соединения (например, PEI или антиген) в носитель для доставки включают включение соединения в носитель для доставки в ходе его получения (например, во время или после полимеризации или криогелеобразования гидрогеля или криогеля), посредством добавления (например, по каплям) композиции, содержащей соединение, в носитель для доставки, или посредством пропитывания носителя для доставки композицией, содержащей соединение.
В конкретных вариантах осуществления, устройство лишено антигена опухоли до введения субъекту. В некоторых вариантах осуществления, устройство содержит иммуноконъюгат, где иммуноконъюгат содержит иммуностимулирующее соединение, ковалентно связанное с антигеном. В различных вариантах осуществления, антиген включает антиген опухоли, такой как антиген злокачественной опухоли центральной нервной системы (ЦНС), антиген опухоли зародышевых клеток ЦНС, антиген рака легкого, антиген лейкоза, антиген острого миелоидного лейкоза, антиген множественной миеломы, антиген злокачественной опухоли почек, антиген злокачественной глиомы, антиген медуллобластомы, антиген рака молочной железы, антиген рака предстательной железы, антиген саркомы Капоши, антиген рака яичника, антиген аденокарциномы или антиген меланомы. В некоторых вариантах осуществления, лечение субъекта включает уменьшение метастазирования у субъекта.
В конкретных вариантах осуществления, антиген содержит не относящийся к опухоли антиген, такой как антиген микроорганизма. Например, антиген микроорганизма может включать антиген бактерии, антиген вируса, антиген гриба, антиген архей или антиген простейшего. В некоторых вариантах осуществления, антиген микроорганизма является отличным от антигена вируса, например, является отличным от антигена HIV или вируса гриппа. В различных вариантах осуществления, антиген является отличным от гликопротеина или его фрагмента.
Аспекты объекта настоящего изобретения относятся также к способу лечения злокачественной опухоли у субъекта, включающему введение устройства или биологического материала, описанных в настоящем описании, субъекту.
В различных вариантах осуществления, гибкий пригодный для инъекций биологический материал криогель или гидрогель (такой как клик-гидрогель) вводят в опухоль или в анатомическую локализацию поблизости от опухоли, например, в прямом контакте с опухолью/соприкосновении с опухолью, в пределах приблизительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 мм от опухоли, или собственно в опухолевую массу, для доставки иммуномодулирующих средств непосредственно в участок растущей опухоли, чтобы способствовать иммунотерапии злокачественных опухолей, в то же время обходя системную доставку (которая может быть ассоциирована с неблагоприятными побочными эффектами) и без загрузки антигена опухоли или лизата опухоли в устройство для доставки до введения, например, инъекции, пациенту. Соответственно, устройство/биологический материал (например, криогель или гидрогель) вводят перитуморальным или внутриопухолевым способом. Перитуморальная доставка по существу окружает (50, 75, 85, 95, 99-100% периметра опухолевой массы) опухоли с использованием устройства/биологического материала, либо посредством прямого биологического контакта, либо в непосредственной близости к границе опухолевой массы. Внутриопухолевую доставку проводят посредством прямого введения в опухолевую массу через границу между опухолью и нормальной тканью. Например, биологический материал можно вводить поблизости, но без нарушения целостности, например, прокалывания, капсулы опухоли, например, в случае солидной опухоли. Альтернативно, капсулу опухоли повреждают или прокалывают (внутриопухолевая инъекция). В некоторых вариантах осуществления, опухоль полностью или частично оборачивает устройство или каркас, который помещают в соприкосновение с опухолью или поблизости от опухоли. В таких вариантах осуществления, устройство или каркас видоизменяет локализацию иммуноцитов на или внутри опухоли. Объект настоящего изобретения относится также к введению биологического материала непосредственно в опухоль (внутриопухолевому), например, с использованием иглы. Любую опухоль, которую можно диагностировать посредством проведения игольной биопсии, можно лечить этим способом. Например, опухоли, подлежащие лечению, включают опухоли молочной железы, головного мозга, легкого, предстательной железы, печени, кости, щитовидной железы, кожи, шейки матки, полости рта, яичников, эндометрия, ободочной кишки, мочевого пузыря и дополнительные типы опухолей, описанные ниже.
В различных вариантах осуществления, опухоль представляет собой солидную опухоль или дискретную опухоль внутри определенных, поддающихся детекции границ. Соответственно, объект настоящего изобретения относится к способу уменьшения опосредованного опухолью ускользания от иммунологического надзора, включающему введение в участок опухоли (например, в опухоль (в соприкосновении) или в участок по соседству или поблизости от солидной или дискретной опухолевой массы) биоразлагаемого пористого полимерного устройства, содержащего ингибитор супрессии T-клеток или дендритных клеток. Например, ингибитор включает ингибитор пути трансформирующего фактора роста-бета (TGF-β), ингибитор пути передатчика сигнала и активатора транскрипции 3 (STAT3) или ингибитор индолeамин-пиррол-2,3-диоксигеназы (IDO или INDO EC 1.13.11.52). В некоторых примерах, ингибитор включает по меньшей мере одну малую молекулу, такую как ингибитор пути TGF-β LY2157299, GW788388, LY364947, R268712, RepSox, SB525334 и SD208; и/или ингибитор пути STAT3 BP-1-102, S3I-M2001, STA-21, S3I-201, статтик, галиеллалактон, полипептид, имеющий последовательность PY*LKTK (где Y* представляет фосфотирозин; SEQ ID NO: 1), и полипептид, имеющий последовательность Y*LPQTV (где Y* представляет фосфотирозин; SEQ ID NO: 2); и/или ингибитор IDO INCB24360, NLG919 (также известный как GDC-0919), норгарман, розмариновую кислоту, 1-метилтриптофан и индоксимод. В другом примере, ингибитор включает блокатор белка иммунной контрольной точки, такой как ингибиторы белка 1 программируемой гибели клеток (PD-1), лиганда 1 PD-1 (PD-L1), ассоциированного с цитотоксическими T-лимфоцитами антигена 4 (CTLA-4), гена-3 активации лимфоцитов (LAG-3), кластера дифференцировки 276 (CD276; также известного как B7-H3) и/или белка с доменом T-клеточного иммуноглобулина и доменом 3 муцина (TIM3). В некоторых вариантах осуществления, ингибитор белка иммунной контрольной точки включает антитело против PD-1, антитело против PD-L1 и/или антитело против CTLA-4. В предпочтительных вариантах осуществления, устройство не содержит антигена опухоли, например, полученного от пациента антигена опухоли или лизата клеток опухоли (или другого антигена опухоли), до введения в локализацию опухоли у субъекта.
В различных вариантах осуществления, биологический материал/устройство содержит нанопоры, микропоры, макропоры или их комбинацию. Размер микропор и макропор позволяет миграцию или движение клеток (например, иммуноцитов, например, миграцию DC в носитель и/или выход из носителя для доставки) через микропоры и макропоры. Например, композиция содержит поры, характеризующиеся диаметром 1-600 мкм (например, 10-600 мкм, 20-600 мкм, 50-600 мкм, 10-500 мкм, 20-500 мкм, 50-500 мкм, или 10-300 мкм).
В некоторых ситуациях, устройство дополнительно содержит химиотерапевтическое средство, индуцирующее гибель клеток опухолей, например, иммуногенную гибель клеток. Иммуногенная гибель клеток является формой гибели клеток, узнаваемой иммунной системой и приводящей к иммунной активации (в отличие от апоптоза, как наблюдают для большинства других химиотерапевтических средств). При этой форме гибели клеток, кальретикулин присутствует на поверхности умирающих клеток, позволяя поглощение антигена опухоли; высвобождается белок с боксом 1 группы высокой подвижности (HMGB1), что приводит к стимуляции toll-подобного рецептора-4 (TLR-4) на дендритных клетках, чтобы вызвать их созревание; и высвобождение АТФ из умирающих клеток приводит к привлечению антигенпредставляющих клеток в ложе опухоли. Такие химиотерапевтические средства включают члены антрациклинового класса соединений, например, доксорубицин, даунорубицин, эпирубицин, идарубицин и валрубицин, так же как митоксантрон, аналог антрациклина. Этот класс соединений является предпочтительным из-за их способности активировать иммунную систему, в дополнение к непосредственному уничтожению клеток злокачественных опухолей. Средства оксалиплатин и циклофосфамид также приводят к иммуногенной гибели клеток. Другие неограничивающие примеры соединений, индуцирующих иммуногенную гибель клеток, включают шиконин, ингибитор протеасомы бортезомиб, 7A7 (специфическое для рецептора эпидермального фактора роста антитело), сердечные гликозиды и вориностат (ингибитор гистон-деацетилазы). См., например, H Inoue and K Tani (2014) Cell Death and Differentiation 21, 39-49, полное содержание которого, таким образом, приведено в настоящем описании в качестве ссылки. В дополнение к химиотерапевтических лекарственным средствам, устройство используют в комбинации с радиотерапией, которая также приводит к иммуногенной гибели клеток, так же, как с другими способами, уничтожающими клетки опухолей, в то же время активируя иммунные ответы на опухоль.
Необязательно, устройство или каркас дополнительно содержит индуцирующую гипертермию композицию. Пригодная индуцирующая гипертермию композиция включает магнитную наночастицу или поглощающую в ближней инфракрасной области спектра (NIR) наночастицу. В некоторых случаях, наночастица является магнитной, и способ дополнительно включает приведение магнитной наночастицы в контакт со знакопеременным магнитным полем (AMF) для индукции гипертермии in situ, таким образом, изменяя или разрушая клетку злокачественной опухоли и получая процессированный антиген опухоли. В другом примере, способ дополнительно включает приведение наночастицы NIR в контакт с излучением NIR для индукции местной гипертермии in situ, таким образом, изменяя или разрушая клетку злокачественной опухоли и получая процессированный антиген опухоли. Гипертермия характеризуется локальной температурой больше чем 37 градусов Цельсия (°C). Например, температуру устройства временно повышают до приблизительно 40, 45, 50, 60, 70, 75, 80, 85, 90, 95°C или более. В некоторых вариантах осуществления, индуцирующая гипертермию композиция находится на поверхности устройства или каркаса по изобретению, например, устройство или каркас покрыты индуцирующей гипертермию композицией. В различных вариантах осуществления, индуцирующая гипертермию композиция находится внутри или на всем протяжении устройства или каркаса.
В некоторых вариантах осуществления, устройство или каркас дополнительно содержит радиоактивный изотоп. Пригодные радиоактивные изотопы включают иод-131, иод-125, рений-185, фосфор-33, фосфор-32, палладий-100, палладий-101, палладий-201, палладий-103, палладий-105, палладий-106, палладий-108, палладий-109, палладий-110, палладий-111, палладий-112, цезий-137, иридий-192, кобальт-60, лютеций-177, иттрий-90, таллий-201, галлий-67, технеций-99m, стронций-90 или стронций-89. В некоторых вариантах осуществления, радиоактивный изотоп находится на поверхности устройства или каркаса по изобретению, например, устройство или каркас покрыты радиоактивным изотопом. В различных вариантах осуществления, композиция радиоактивного изотопа находится внутри или на всем протяжении устройства или каркаса.
В различных вариантах осуществления, устройство дополнительно содержит молекулу РНК (например, мРНК или геном вируса, или их часть) или ДНК (например, плазмиду или геном вируса, или их часть), кодирующую полипептид. В некоторых вариантах осуществления, полипептид представляет собой антигенный полипептид. В некоторых вариантах осуществления, пептид содержит аминокислотную последовательность, не присутствующую ни в каком полипептиде, кодируемом геномом субъекта. В некоторых вариантах осуществления, пептид содержит аминокислотную последовательность, не присутствующую ни в каком полипептиде, кодируемом геномом нормальной клетки субъекта. В конкретных вариантах осуществления, полипептид присутствует на поверхности злокачественных клеток. В некоторых вариантах осуществления, полипептид содержит аминокислотную последовательность полипептида, продуцируемого относящимся к микроорганизмам патогеном или паразитом (например, относящимся к вирусу, грибу, бактерии или простейшему патогеном или паразитом). В некоторых вариантах осуществления, пептиды могут присутствовать на аутореактивных иммуноцитах, включая, например, T-клетки, B-клетки или антигенпредставляющие клетки. В конкретных вариантах осуществления, пептид может присутствовать внутри терапевтического соединения.
В некоторых примерах, опухоль включает дискретную опухоль с определенными границами. В различных вариантах осуществления, опухоль представляет собой солидную опухоль или локализованную опухолевую массу. Например, содержащее устройство из биологического материала помещают непосредственно на опухолевую массу, в опухолевую массу или рядом с опухолевой массой (т.е. в физическом контакте с или в непосредственной близости от) собственно опухолевой массы, а не в участок, отдаленный (например, более чем на 10 мм) от опухолевой массы, например, помещают под кожу в участке, отдаленном от опухоли. При использовании системы, описанной выше, отсутствует необходимость в полученном от пациента материале, например, полученном от пациента или при биопсии лизате опухоли или процессированном антигене, в качестве компонента устройства, который служит антигеном опухоли, поскольку умирающие клетки опухолей сами по себе предоставляют любой антиген, необходимый для получения адаптивного ответа иммуноцитов. В некоторых вариантах осуществления, каркас или устройство не содержит антиген опухоли до введения субъекту.
Аспекты объекта настоящего изобретения относятся к лечению солидных опухолей. Например, опухоль представляет собой злокачественную опухоль, отличную от злокачественной опухоли из клеток крови, такой как лейкоз. В конкретных вариантах осуществления, злокачественная опухоль является метастазирующей. В различных вариантах осуществления, опухоль представляет собой рак кожи, такой как меланома. Варианты осуществления объекта настоящего изобретения относятся к лечению злокачественной опухоли, для которого можно проводить биопсию опухолей (в то же время исключающего необходимость биопсии, например, для получения антигена опухоли, такого как лизат клеток опухоли). В некоторых вариантах осуществления, опухоль представляет собой опухоль саркому или карциному. Неограничивающие опухоли, на которые можно нацеливаться, в некоторых вариантах осуществления объекта настоящего изобретения, включают рак молочной железы, рак яичка, рак предстательной железы, рак яичника, рак поджелудочной железы, рак легкого, рак щитовидной железы, рак печени (например, немелкоклеточный рак легкого), рак ободочной кишки, рак пищевода, рак желудка, рак шейки матки, злокачественную опухоль полости рта, злокачественную опухоль, ассоциированную с вирусом, таким как папилломавирус человека (HPV), злокачественную опухоль мозга, злокачественную опухоль почек, ретинобластому, острый миелоидный лейкоз, остеосаркому, хондробластому, хондросаркому, саркому Юинга, опухоль Вильмса, злокачественную рабдоидную опухоль, гепатобластому, печеночно-клеточную карциному, нейробластому, медуллобластому, глиобластому, адренокортикальную карциному, носоглоточную карциному, рабдомиосаркому, десмоидную опухоль, фибросаркому или липосаркому. В некоторых вариантах осуществления, относящихся к инъекции устройства или каркас из биологического материала, иглу можно направлять визуально и/или с помощью устройства для визуализации, такого как рентгеновское (например, с использованием сканирования компьютерной томографии (CT)), ультразвуковое, эндоскопическое или лапароскопическое устройство.
Способы и устройства из биологического материала из объекта настоящего изобретения можно использовать для лечения любого позвоночного субъекта, страдающего от опухоли. В различных вариантах осуществления, субъект представляет собой субъекта из земноводных, рептилий, лошадиных, млекопитающих, грызунов, собачьих, кошачьих, птиц, свиней или приматов. Например, представлены варианты осуществления объекта настоящего изобретения для медицины человека и ветеринарии. В конкретных вариантах осуществления, субъект представляет собой собаку, кошку (такую как домашняя кошка или такая кошка, как лев, тигр, леопард или гепард), морскую свинку, свинью, лошадь, осла, мула, мышь, крысу, человека, обезьяну, шимпанзе, гориллу, орангутанга, медведя (такого как панда) или верблюда. Объект настоящего изобретения относится также к животным, отличным от человека, содержащим устройство из биологического материала, описанное в настоящем описании.
Объект настоящего изобретения относится также к устройству из биологического материала, содержащему активные компоненты, описанные в настоящем описании. В некоторых вариантах осуществления, устройство из биологического материала содержит PEI. В конкретных вариантах осуществления, биологический материал дополнительно содержит одно или более из (i) иммуностимулирующего соединения; (ii) соединения, вызывающего иммунологическую гибель клеток для клеток опухоли; (iii) соединения, ингибирующего супрессию T-клетки или дендритной клетки; (iv) соединения, которое ингибирует ингибирующий иммунитет белок, и (v) цитокина (например, хемоаттрактанта иммуноцитов, таких как дендритные клетки).
В некоторых вариантах осуществления, иммуностимулирующее соединение представляет собой агонист TLR или лиганда STING. В некоторых вариантах осуществления, соединение, вызывающее иммунологическую гибель клеток, представляет собой доксорубицин, митоксантрон, оксалиплатин или паклитаксел. В некоторых вариантах осуществления, соединение, ингибирующее супрессию T-клетки или дендритной клетки, представляет собой ингибитор TGF-β, ингибитор STAT3, ингибитор IDO, антитело против PD-1 или антитело против CTLA-4. В некоторых вариантах осуществления, устройство или каркас содержит цитокин, такой как GM-CSF, Flt3L, XCL1, IL-2 или IL-12. В различных вариантах осуществления, устройство или каркас из объекта настоящего изобретения содержит мРНК или экспрессирующий вектор, кодирующие белок, такой как иммуностимулирующее соединение или цитокин. мРНК или экспрессирующий вектор можно комбинировать в устройстве или каркасе с полипептидом, который они кодируют, или без полипептида, который они кодируют. В некоторых вариантах осуществления, устройство или каркас содержит молекулу мРНК или экспрессирующий вектор, которые кодируют цитокин, описанный в настоящем описании, такой как цитокин, привлекающий дендритную клетку в устройство или каркас. В конкретных вариантах осуществления, мРНК или экспрессирующий вектор конденсируют для облегчения доставки в клетки субъекта. В различных вариантах осуществления, мРНК или экспрессирующий вектор может присутствовать в устройстве или каркасе со средством для трансфекции. Например, мРНК или экспрессирующий вектор можно конденсировать с дендримером полиэтилимина (PEI), поли-L-лизина (PLL) или полиамидоамина (PAMAM). См., например, Huang et al. (2005) Human Gene Therapy 16:609-617. Дополнительные неограничивающие примеры средств для трансфекции включают липосомы (например, липофектамин). В некоторых вариантах осуществления, устройство содержит ингибитор супрессии T-клеток или дендритных клеток. В некоторых вариантах осуществления, устройство содержит иммуностимулирующее соединение. В некоторых вариантах осуществления, указанный ингибитор содержит ингибитор пути трансформирующего фактора роста-бета (TGF-β), или ингибитор пути передатчика сигнала и активатора транскрипции 3 (STAT3). В некоторых вариантах осуществления, указанный ингибитор включает малую молекулу, аптамер, белок, молекулу РНКи, антитело или фрагмент антитела. В некоторых вариантах осуществления, малая молекула представляет собой органическое соединение, имеющее молекулярную массу менее чем 1000 Дальтон. В некоторых вариантах осуществления, указанный ингибитор пути TGF-β включает LY2157299 GW788388, LY364947, R268712, RepSox, SB525334 или SD208, и указанный ингибитор пути STAT3 содержит BP-1-102, S3I-M2001, STA-21, S3I-201, статтик, галиеллалактон, полипептид, имеющий последовательность PY*LKTK (SEQ ID NO: 1) (где Y* представляет фосфотирозин), и полипептид, имеющий последовательность Y*LPQTV (SEQ ID NO: 2) (где Y* представляет фосфотирозин). В некоторых вариантах осуществления, указанный ингибитор включает ингибитор иммунной контрольной точки. В некоторых вариантах осуществления, ингибитор иммунной контрольной точки представляет собой ингибитор пути PD-1, ингибитор пути LAG-3, ингибитор пути IDO, ингибитор пути B7-H3, или a ингибитор пути TIM3. В некоторых вариантах осуществления, указанный ингибитор представляет собой малую молекулу, аптамер, белок, молекулу РНКи, антитело или фрагмент антитела. В некоторых вариантах осуществления, малая молекула представляет собой органическое соединение, имеющее молекулярную массу менее, чем 1000 Дальтон. В некоторых вариантах осуществления, ингибитор представляет собой антитело. В некоторых вариантах осуществления, указанное антитело содержит антитело против PD-1, антитело против PD-L1 или антитело против CTLA-4. В некоторых вариантах осуществления, антитело против PD-1 представляет собой ниволумаб, пембролизумаб или пидилизумаб. В некоторых вариантах осуществления, антитело против PD-L1 представляет собой BMS-936559 или MPDL3280A. В некоторых вариантах осуществления, антитело против CTLA-4 представляет собой ипилимумаб. В некоторых вариантах осуществления, антитело представляет собой Fv, Fab, Fab', Fab'-SH, F (ab')2, диатело, линейные антитела или scFv. В некоторых вариантах осуществления, антитело представляет собой поликлональное антитело, моноклональное антитело, химерное антитело, гуманизированное антитело или человеческое антитело. В некоторых вариантах осуществления, указанный ингибитор is an ингибитор IDO. В некоторых вариантах осуществления, указанный ингибитор IDO представляет собой ингибитор IDO1. В некоторых вариантах осуществления, указанный ингибитор представляет собой малую молекулу, аптамер, белок, молекулу РНКи, антитело или фрагмент антитела. В некоторых вариантах осуществления, малая молекула представляет собой органическое соединение, имеющее молекулярную массу менее, чем 1000 Дальтон. В некоторых вариантах осуществления, малая молекула представляет собой INCB24360 или NLG919. В некоторых вариантах осуществления, указанное устройство дополнительно содержит индуцирующее иммуногенную гибель клеток химиотерапевтическое средство. В некоторых вариантах осуществления, указанное химиотерапевтическое средство включает члена антрациклинового класса соединений. В некоторых вариантах осуществления, указанный химиотерапевтическое средство содержит доксорубицин. В некоторых вариантах осуществления, указанная опухоль включает солидную опухоль или локализованную опухолевую массу. В некоторых вариантах осуществления, указанное устройство не содержит очищенный антиген опухоли или лизат клеток опухоли до введения в указанный участок опухоли. В некоторых вариантах осуществления, указанное устройство содержит гидрогель. В некоторых вариантах осуществления, указанное устройство содержит криогель. В некоторых вариантах осуществления, указанный криогель содержит поры. В некоторых вариантах осуществления, указанное устройство содержит метакрилированный желатиновый криогель, метакрилированный альгинатный криогель, или альгинатный клик-криогель. В некоторых вариантах осуществления, указанное устройство содержит альгинатный гидрогель. В некоторых вариантах осуществления, альгинатный гидрогель представляет собой альгинатный криогель. В некоторых вариантах осуществления, указанный альгинатный гидрогель содержит клик-альгинат. В некоторых вариантах осуществления, устройство вводят посредством инъекции. В некоторых вариантах осуществления, устройство инъецируют в опухоль. В некоторых вариантах осуществления, устройство инъецируют в участок у субъекта в пределах приблизительно 0,1-10 мм от опухоли. В некоторых вариантах осуществления, устройство дополнительно содержит цитокин или мРНК, или экспрессирующий вектор, кодирующие цитокин. В некоторых вариантах осуществления, цитокин представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), лиганд подобной FMS тирозинкиназы 3 (Flt3L), лиганд 20 хемокина (с мотивом C-C) (CCL20), интерлейкин 15 (IL-15), лиганд 1 хемокина (с мотивом C) (XCL1), лиганд 10 хемокина (с мотивом C-X-C) (CXCL10), интерферон альфа 1 (IFN-альфа), интерферон бета (IFN-бета) или интерлейкин 12 (IL-12). В некоторых вариантах осуществления, устройство дополнительно содержит иммуностимулирующее соединение. В некоторых вариантах осуществления, иммуностимулирующее соединение представляет собой агонист TLR, лиганд STING или иммуностимулирующее антитело. В некоторых вариантах осуществления, устройство имеет объем приблизительно 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или 50-500 мкл, или менее чем приблизительно 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или 50-500 мкл. В некоторых вариантах осуществления, указанное устройство дополнительно содержит лапонит.
Аспекты объекта настоящего изобретения относятся к способу лечения субъекта, пораженного опухолью, включающему введение в участок опухоли биоразлагаемого пористого полимерного устройства, описанного в настоящем описании. В некоторых вариантах осуществления, устройство содержит ингибитор супрессии T-клеток или дендритных клеток. В некоторых вариантах осуществления, устройство содержит иммуностимулирующее соединение. В некоторых вариантах осуществления, лечение субъекта включает (a) уменьшение объема опухоли; (b) уменьшение роста опухоли; (c) уменьшение метастазирования опухоли; (d) увеличение выживаемости субъекта; (e) увеличение выживаемости без прогрессирования субъекта; (f) усиление T-клеточного ответа на антиген внутри опухоли; и/или (g) вакцинацию субъекта против антигена внутри опухоли. В некоторых вариантах осуществления, лечение субъекта включает уменьшение объема опухоли по меньшей мере приблизительно на 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100%. В некоторых вариантах осуществления, лечение субъекта включает уменьшение объема опухоли по меньшей мере приблизительно на 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100% в пределах приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 14, 21, 28, 35, 41, 48, 180, 365 или 1-365 суток или в пределах приблизительно 1-12 месяцев. В некоторых вариантах осуществления, (a) одно такое биоразлагаемое пористое полимерное устройство вводят субъекту; или (b) два таких биоразлагаемых пористых полимерных устройства вводят субъекту. В некоторых вариантах осуществления, указанное устройство содержит альгинатный гидрогель. В некоторых вариантах осуществления, указанный альгинатный гидрогель содержит клик-альгинат. В некоторых вариантах осуществления, устройство вводят посредством инъекции. В некоторых вариантах осуществления, устройство инъецируют в опухоль. В некоторых вариантах осуществления, устройство инъецируют в участок у субъекта в пределах приблизительно 0-10 мм от опухоли. В некоторых вариантах осуществления, устройство дополнительно содержит цитокин. В некоторых вариантах осуществления, цитокин представляет собой гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), лиганд подобной FMS тирозинкиназы 3 (Flt3L), лиганд 20 хемокина (с мотивом C-C) (CCL20), интерлейкин 15 (IL-15), лиганд 1 хемокина (с мотивом C) (XCL1), лиганд 10 хемокина (с мотивом C-X-C) (CXCL10), интерферон альфа 1 (IFN-альфа), интерферон бета (IFN-бета) или интерлейкин 12 (IL-12). В некоторых вариантах осуществления, устройство дополнительно содержит иммуностимулирующее соединение. В некоторых вариантах осуществления, иммуностимулирующее соединение представляет собой CpG, полиинозин-полицитидиловую кислоту (поли(I:C)) PEI-поли(I:C), полиадениловую-полиуридиловую кислоту (поли(A:U)), PEI-поли(A:U), двухцепочечную рибонуклеиновую кислоту (РНК), монофосфориллипид A (MPLA) или имиквимод. В некоторых вариантах осуществления, устройство имеет объем приблизительно 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, или 50-500 мкл или менее, чем приблизительно 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, или 50-500 мкл. В некоторых вариантах осуществления, указанный субъект идентифицирован как имеющий солидную опухоль.
Аспекты объекта настоящего изобретения относятся к не относящемуся к человеку млекопитающему или шприцу, содержащим устройство из объекта настоящего изобретения. В некоторых вариантах осуществления, шприц является предварительно заполненным и упакованным вместе с устройством. В некоторых вариантах осуществления, опухоль приводят в контакт с радиоактивным излучением. В некоторых вариантах осуществления, химиотерапевтическое средство системно вводят субъекту.
Настоящее изобретение относится также к устройствам, биологическим материалам, способам и композициям для увеличения иммуногенности соединения, такого как антиген, содержащий полипептид. Увеличение иммуногенности соединения может включать увеличение продукции одного или более антител, которые являются специфическими для соединения в некотором типе клеток или у животного (например, млекопитающего). В некоторых вариантах осуществления, антитело является человеческим, или его гуманизируют до или после того, как определяют, что оно является специфическим для соединения. В различных вариантах осуществления, увеличение иммуногенности соединения включает комбинацию соединения с PEI. В некоторых вариантах осуществления, соединение и PEI присутствуют в устройстве, содержащем носитель для доставки, такой как каркас. В конкретных вариантах осуществления, соединение является электростатически связанным с PEI.
Неограничивающие описания биологических материалов и композиций для вызова специфических иммунных ответов (например, на опухоли и/или патогены) представлены в Патенте США No. 9132210, выданном 15 сентября 2015 г.; Публикации патентной заявки США No. 2012-0100182, опубликованной 26 апреля 2012 г.; Патенте США No. 9370558, выданном 21 июня 2016 г.; Публикации международной патентной заявки PCT No. WO 2015/168379, опубликованной 11 мая 2015 г.; и Международной патентной заявке PCT No. PCT/US2016/025717, поданной 1 апреля 2016 г., полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Неограничивающие признаки, относящиеся к пригодным для инъекций порообразующим биологическим материалам для вызова специфических иммунных ответов, описаны в Публикации патентной заявки США No. 2014-0079752, опубликованной 20 марта 2014 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
Неограничивающие описания пригодных для инъекций криогелей из биологических материалов для вызова специфических иммунных ответов (например, на опухоли и/или патогены) описаны в Публикации патентной заявки США No. 2014-0112990, опубликованной 24 апреля 2014 г.; и Публикации патентной заявки США No. 2014-0227327, опубликованной 14 августа 2014 г., полное содержание каждой из которых приведено в настоящем описании в качестве ссылки.
Неограничивающие аспекты образующих антигены in situ противораковых биологических материалов описаны в Публикации патентной заявки США No. 2014-0193488, опубликованной 10 июля 2014 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
Иллюстративные описания композиции мезопористого диоксида кремния для модуляции иммунных ответов представлены в Kim et al., (2015) Nature Biotechnology 33, 64-72; Публикации патентной заявки США No. 2015-0072009, опубликованной 12 марта 2015 г.; и  et al. (2013) Langmuir, 29 (44): 13551-13561, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки. В различных вариантах осуществления, наночастицы мезопористого диоксида кремния синтезируют посредством реакции тетраэтилортосиликата с матрицей, изготовленной из мицеллярных палочек. Результатом является коллекция сфер или палочек наноразмера, заполненных порами с регулярным расположением. Затем матрицу можно удалять посредством промывки растворителем, доведенным до надлежащего pH. По другому неограничивающему способу, мезопористую частицу синтезируют с использованием простого золь-гель способа или способа сушки распылением. В некоторых вариантах осуществления, тетраэтилортосиликат используют вместе с мономером дополнительного полимера (в качестве матрицы). Другие неограничивающие способы включают способы, описанные в Публикациях патентов США 20120264599 и 20120256336, содержание которых, таким образом, приведено в качестве ссылки. В неограничивающем примере, палочки получают способом, включающим растворение поверхностно-активного вещества в кислом растворе, затем нагревание, добавление силиката (такого как тетраэтилортосиликат) и нагревание, и сбор палочкообразных частиц. Например, палочки можно получать способом, включающим: растворение поверхностно-активного вещества плюроника P-123 (Sigma-Aldrich) в 1,6 М HCl при комнатной температуре, и нагревание до 40°C; добавление 42 ммоль тетраэтилортосиликата (TEOS) (Sigma-Aldrich) и нагревание в течение 20 часов при 40°C при перемешивании (600 об/мин); нагревание до 100°C в течение 24 часа; сбор палочкообразных частиц посредством фильтрации и высушивания на воздухе при комнатной температуре; и экстракции частиц в этаноле/HCl (5 частей HCl на 500 частей EtOH) в течение ночи при 80°C. В некоторых вариантах осуществления, композицию MPS можно сохранять и транспортировать для использования до или после добавления соединений (таких как соединения для привлечения, активации, антигены и ингибиторы иммуносупрессии). Например, одно или более соединений, таких как антигены, могут быть процессированы и добавлены к частицам MPS незадолго до введения пациенту.
et al. (2013) Langmuir, 29 (44): 13551-13561, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки. В различных вариантах осуществления, наночастицы мезопористого диоксида кремния синтезируют посредством реакции тетраэтилортосиликата с матрицей, изготовленной из мицеллярных палочек. Результатом является коллекция сфер или палочек наноразмера, заполненных порами с регулярным расположением. Затем матрицу можно удалять посредством промывки растворителем, доведенным до надлежащего pH. По другому неограничивающему способу, мезопористую частицу синтезируют с использованием простого золь-гель способа или способа сушки распылением. В некоторых вариантах осуществления, тетраэтилортосиликат используют вместе с мономером дополнительного полимера (в качестве матрицы). Другие неограничивающие способы включают способы, описанные в Публикациях патентов США 20120264599 и 20120256336, содержание которых, таким образом, приведено в качестве ссылки. В неограничивающем примере, палочки получают способом, включающим растворение поверхностно-активного вещества в кислом растворе, затем нагревание, добавление силиката (такого как тетраэтилортосиликат) и нагревание, и сбор палочкообразных частиц. Например, палочки можно получать способом, включающим: растворение поверхностно-активного вещества плюроника P-123 (Sigma-Aldrich) в 1,6 М HCl при комнатной температуре, и нагревание до 40°C; добавление 42 ммоль тетраэтилортосиликата (TEOS) (Sigma-Aldrich) и нагревание в течение 20 часов при 40°C при перемешивании (600 об/мин); нагревание до 100°C в течение 24 часа; сбор палочкообразных частиц посредством фильтрации и высушивания на воздухе при комнатной температуре; и экстракции частиц в этаноле/HCl (5 частей HCl на 500 частей EtOH) в течение ночи при 80°C. В некоторых вариантах осуществления, композицию MPS можно сохранять и транспортировать для использования до или после добавления соединений (таких как соединения для привлечения, активации, антигены и ингибиторы иммуносупрессии). Например, одно или более соединений, таких как антигены, могут быть процессированы и добавлены к частицам MPS незадолго до введения пациенту.
Неограничивающие признаки, относящиеся к биологическим материалам для ослабления, обращения и/или преодоления иммуносупрессивных механизмов опухолей, описаны в PCT/US2016/015825, поданной 29 января 2016 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
Изобретение относится к использованию устройства, библиотеки или смеси, как описано в настоящем описании, для лечения злокачественной опухоли у субъекта, для уменьшения опухолевой нагрузки у субъекта, для лечения инфекции у субъекта и/или для вызова иммунного ответа на антиген опухоли или неоантиген опухоли у субъекта, так же, как для стимуляции иммунного ответа ex vivo или in vitro. Каждый вариант осуществления, описанный в настоящем описании, рассматривают как применимый к каждому из других описанных вариантов осуществления. Таким образом, все комбинации различных элементов, описанных в настоящем описании, включены в объем изобретения.
Другие признаки и преимущества изобретения очевидны из следующего ниже описания предпочтительных вариантов его осуществления, и из формулы изобретения. Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, какое является общепринятым для специалиста в области, к которой относится это изобретение. Несмотря на то, что способы и материалы, сходные или эквивалентные описанным в настоящем описании, можно использовать в практическом осуществлении или тестировании настоящего изобретения, пригодные способы и материалы описаны ниже. Содержание всех опубликованных иностранных патентов и патентных заявок, процитированных в настоящем описании, приведено в настоящем описании в качестве ссылки. Содержание данных, представленных в Genbank и NCBI, указанных под номерами доступа, процитированными в настоящем описании, приведено в настоящем описании в качестве ссылки. Содержание всех других опубликованных ссылок, документов, манускриптов и научных литературных источников, процитированных в настоящем описании, приведено в настоящем описании в качестве ссылки. В случае противоречия, настоящее описание, включая определения, имеет преимущество. Кроме того, материалы, способы и примеры являются только иллюстративными и не являются ограничивающими.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1A-I представляют собой графики, показывающие, что PEI может абсорбироваться в палочки из мезопористого диоксида кремния (MSR) in vitro, и что PEI активирует BMDC мыши и DC человека in vitro. (A) Анализ проточной цитометрии экспрессии главного комплекса гистосовместимости класса II (MHC-II) и кластера дифференцировки 86 (CD86) на BMDC после 18 часов стимуляции с использованием различных концентраций PEI. (B) и (C) Твердофазный иммуноферментный анализ (ELISA) концентраций TNF-α и IL-6 в супернатанте происходящих из костного мозга дендритных клеток (BMDC) после 18 часов стимуляции с использованием различных концентраций PEI. (D) Эффективность загрузки PEI в MSR. (E) Анализ проточной цитометрии экспрессии MHC-II и CD86 на BMDC после 18 часов стимуляции с использованием различных концентраций PEI-MSR. (F) Анализ ELISA концентрации фактора некроза опухоли альфа (TNF-α) в супернатанте BMDC после 18 часов стимуляции с использованием различных концентраций PEI-MSR. PBS=фосфатно-солевой буфер; MPS=Мезопористый диоксид кремния; L25=линейный PEI, имеющий молекулярную массу 25 кДа. (G) Различные концентрации PEI добавляли к репортерным клеткам TLR5 (Invivogen, HEK Blue TLR-5) и активность мониторировали с использованием среды для детекции репортера в клетках эмбриональной почки человека (HEK) HEK-Blue detection (Invivogen). (H) Анализ ELISA концентрации TNF-α в супернатанте BMDC мыши после стимуляции с использованием MSR-PEI. (I) Анализ проточной цитометрии представляющих SIINFEKL BMDC мыши после стимуляции с использованием OVA и OVA+PEI. B60=Разветвленный PEI, имеющий молекулярную массу 60 кДа. OVA=Овальбумин. MSR может быть использован взаимозаменяемо с MPS (мезопористый диоксид кремния) на протяжении фигур в настоящем описании.
ФИГ. 2A-H представляют собой графики, показывающие, что PEI в вакцине на основе MSR усиливает активацию и миграцию BMDC. ФИГ. 2I представляет собой серию изображений MRS. (A) Схемы вакцины на основе MSR (V) и вакцины на основе MSR-PEI (VP). (B) Общее количество клеток в участке вакцинации, эксплантированных на сутки 3 после иммунизации. Количество CD11c+ CD86+ активированных DC (C), осуществляющих хоминг в LN CD11c+ CCR7+ DC (D) и DC, представляющих модельный антигенный пептид овальбумина (OVA), SIINFEKL, (E), привлеченных в участок вакцинации на сутки 3 после иммунизации. (F) Общее количество клеток в дренирующем лимфатическом узле (dLN) на сутки 3 и 5 после иммунизации. Количества CD11c+CD86+ или CD11c+MHC-II+ активированных DC (G) и антигенпредставляющих DC (H) в dLN на сутки 3 и сутки 5 после иммунизации. (I) Изображения после флуоресцентной микроскопии MSR, нагруженных родамином-PEI и AF488-OVA. V=вакцина на основе MPS в составе: 5 мг MPS+1 мкг GM-CSF, 100 мкг CpG, 100 мкг антигена (белка OVA); VP=вакцинный состав на основе MPS с PEI: 5 мг MPS+10 мкг PEI, 1 мкг GM-CSF, 100 мкг CpG, 100 мкг антигена (белка OVA). 100 мкг белка OVA использовали для этих экспериментов. Антиген адсорбировали на PEI-MPS. Кратко, PEI адсорбировали на MPS в течение 15 мин при 37°C для получения PEI-MPS. Затем 100 мкг антигена адсорбировали на PEI-MPS.
ФИГ. 3A-F представляют собой временной график и графики, показывающие, что PEI в вакцине на основе MSR усиливает ответ цитотоксических CD8+T-клеток. (A) Схема иммунизации и анализа, и процент тетрамер+ T-клеток в периферической крови на сутки 7. (B) Процент IFN-γ+ T-клеток после стимуляции с использованием SIINFEKL в периферической крови на сутки 7. (C) Соотношение CD8+ эффекторных T-клеток (Tэфф) и Foxp3+CD4+ регуляторных T-клеток (Tрег) в участке вакцинации на сутки 11. (D) Процент тетрамер+ T-клеток в периферической крови на сутки 7. (E) Процент IFN-γ+ T-клеток после стимуляции с использованием SIINFEKL в периферической крови на сутки 7 после иммунизации с использованием вакцины на основе MSR-PEI, содержащей различные типы PEI. (F) Процент IFN-γ+ T-клеток после стимуляции с использованием SIINFEKL в периферической крови на сутки 7 после иммунизации с использованием вакцины на основе MSR-PEI содержащей различные дозы B60 PEI. L2=Линейный PEI, имеющий молекулярную массу 2 кДа; B2=Разветвленный PEI, имеющий молекулярную массу 2 кДа; N=наивные животные; V=вакцина на основе MPS в составе: 5 мг MPS+1 мкг GM-CSF, 100 мкг CpG, 100 мкг антигена (белка OVA); VP=вакцинный состав на основе MPS с PEI: 5 мг MPS+10 мкг PEI, 1 мкг GM-CSF, 100 мкг CpG, 100 мкг антигена (белка OVA). 100 мкг белка OVA использовали для этих экспериментов. Антиген адсорбировали на PEI-MPS. Кратко, PEI адсорбировали на MPS в течение 15 мин при 37°C для получения PEI-MPS. Затем 100 мкг антигена адсорбировали на PEI-MPS.
ФИГ. 4A-C представляют собой графики, показывающие, что вакцина MSR PEI-CpG не приводит к усилению ответов CD8 T-клеток. (A) Кумулятивное высвобождение CpG из MSR-PEI. (B) Процент IFN+ T-клеток в периферической крови после иммунизации с использованием вакцины на основе MSR (V), вакцины на основе MSR, содержащей 1 мкг GM-CSF, 100 мкг OVA и 100 мкг CpG, адсорбированные на 10 мкг PEI (V PC), и вакцины на основе MSR, содержащей 1 мкг GM-CSF, 100 мкг овальбумина (OVA), адсорбированные на 10 мкг PEI, и 100 мкг CpG (V PO). Неожиданно, иммунная стимуляция была больше, когда антиген (OVA) являлся абсорбированным на (т.е. связанным посредством электростатического взаимодействия) PEI, чем когда CpG-ODN являлся абсорбированным на PEI. (C) Процент тетрамер+ T-клеток в периферической крови после иммунизации с использованием вакцины на основе MSR, содержащей 1 мкг GM-CSF, 100 мкг OVA и 100 мкг CpG, адсорбированные на различных количествах B60 PEI.
ФИГ. 5A-K представляют собой графики и временной график, показывающие, что вакцина на основе MSR-PEI усиливает иммуногенность и терапевтическую эффективность пептидных вакцин. (A) Процент тетрамер+ T-клеток и (B) IFNγ+ T-клеток в периферической крови на сутки 7. (C) Схема терапевтических исследований подкожных опухолей TC-1. (D) Анализ ELISA уровня TNF-α и (E) IFN-γ в сыворотке через 24 часа после иммунизации. (F) Процент циркулирующих Foxp3+CD4+ регуляторных T-клеток через 7 суток после иммунизации. (G) Рост опухолей у мышей C57BL/6, подвергнутых инокуляции 3×105 TC-1. Мышей вакцинировали с использованием вакцины на основе MSR (V) и вакцины на основе MSR-PEI (VP). (H) Рост опухолей у мышей C57BL/6, подвергнутых инокуляции 3×105 TC-1. Мышей подвергали лечению с использованием вакцины на основе MSR-PEI при 5 мкг PEI или 20 мкг PEI, или болюсной вакцины (болюса). (I) Выживаемость мышей, подвергнутых инокуляции с использованием 3×105 TC-1 клеток, обработанных вакциной на основе MSR (V) и вакциной на основе MSR-PEI (VP). (J) Выживаемость мышей, подвергнутых повторному заражению с использованием 3×105 клеток через 6 месяцев после первой инокуляции. (K) Циркулирующие регуляторные T-клетки после вакцинации с использованием вакцины на основе MSR или вакцины на основе MSR-PEI. N=наивные животные; V=вакцины на основе MPS в составе: 5 мг MPS+1 мкг GM-CSF, 100 мкг CpG, 50 мкг пептида E7; VP=вакцинный состав на основе MPS с PEI: 5 мг MPS+10 (или конкретная доза, если указано иное) мкг PEI, 1 мкг GM-CSF, 100 мкг CpG, 50 мкг пептида E7. Аминокислотная последовательность для пептида E7 представляла собой GQAEPDRAHYNIVTFCCKCDSTLRLCVQSTHVDIR (SEQ ID NO: 42). Использовали 50 мкг пептида E7. Пептид адсорбировали на PEI-MPS.
ФИГ. 6 представляет собой схему, иллюстрирующую неограничивающие аспекты, относящиеся к иллюстративным вакцинам против злокачественных опухолей на основе наночастиц и каркаса.
ФИГ. 7 представляет собой схему, иллюстрирующую неограничивающую систему из биологического материала для программирования иммуноцитов.
ФИГ. 8 представляет собой иллюстрацию неограничивающих примеров разветвленного, линейного и дендримерного PEI. Пунктирные линии показывают, где иллюстративные структуры могут продолжаться. PEI представляет собой катионный полимер, синтезированный в различных формах, включая линейные, разветвленные или дендримерные виды, и виды с высокой или низкой молекулярной массой.
ФИГ. 9A представляет собой серию рисунков, показывающих неограничивающие аспекты активации врожденного и адаптивного иммуннитета с использованием PEI, и ФИГ. 9B представляет собой набор графиков, показывающих, что MPS, содержащий PEI, увеличивает иммунную активацию. B=B-клетка; Th2=T-клетка-помощник 2.
ФИГ. 10. представляет собой рисунок, показывающий неограничивающий пример образования криогеля. Криогели представляют собой макропористые каркасы со свойствами памяти формы. Гидрогели представляют собой трехмерные (3D) сети, которые могут абсорбировать большое количество воды, в то же время сохраняя свою структурную целостность. Гидрогели, как правило, имеют структуру нанопористой сети, однако, обеспечивает преимущество использование гидрофильных сетей с большими взаимосвязанными порами (>10 мкм), чтобы обеспечивать инфильтрацию и рассредоточение клеток, и предоставлять увеличенную площадь поверхности для прикрепления и взаимодействия клеток. Одним способом получения каркасов из макропористого гидрогеля является криогелеобразование. В иллюстративном способе синтеза, (i) альгинат (природный, биосовместимый полисахарид) химически модифицируют для обеспечения радикальной полимеризации, (ii) метакрилированный (MA)-альгинат добавляют в инициаторную систему аммоний персульфат (APS)/тетраметилэтилендиамин (TEMED) до инкубации при -20°C для обеспечения формирования кристаллов льда, (iii) процесс криогелеобразования проходит посредством следующих стадий: разделение фаз с формированием кристаллов льда, перекрестное сшивание свободных радикалов, и полимеризация с последующим размораживанием кристаллов льда (порогенов) для формирования сетей с взаимосвязанными макропорами в криогеле, и (iv) присутствует стадия воздействия кальция. MA-альгинатные криогели можно подвергать большой степени растяжения, в то же время их можно легко сжимать до части их размера и инъецировать через хирургическую иглу для доставки. После инъекции в подкожную ткань, эти каркасы быстро восстанавливают свою исходную запомненную форму.
ФИГ. 11A представляет собой рисунок, показывающий использование MSR в качестве платформы для вакцинации. ФИГ. 11B представляет собой набор изображений, показывающих формирование макропористого каркаса после инъекции MSR. ФИГ. 11C представляет собой график, показывающий инфильтрацию в участок вакцинации с использованием MPS.
Мезопористый диоксид кремния характеризуется большой площадью поверхности. Известно, что синтетический аморфный диоксид кремния имеет хорошую биосовместимость, что поддерживает его разработку в качестве многофункциональной платформы для клинических применений. MSR с высоким относительным удлинением, инъецированные с использованием иглы, подвергаются спонтанной сборке in vivo с формированием макропористых структур, обеспечивающих 3D клеточное микроокружение для иммуноцитов хозяина. Привлечение дендритных клеток и их последующий хоминг в лимфатических узлах можно модулировать посредством замедленного высвобождения сигнальных молекул из каркаса.
MSR являются пригодными для инъекций, что преодолевает ограничения, относящиеся к каркасам, которые необходимо хирургически имплантировать. MSR могут подвергаться сборке в 3D микроокружение для дендритных клеток непосредственно в организме. В некоторых вариантах осуществления, используют палочкообразные микрочастицы, которые на несколько порядков величины превышают размер одного иммуноцита. В конкретных вариантах осуществления, эти микрочастицы инъецируют в ткани, такие как кожа, и из-за их размера, они не диффундируют из участка инъекции. В различных вариантах осуществления, из-за высокого относительного удлинения, палочки штабелируются друг поверх друга, формируя поры между частицами, позволяющие инфильтрацию клеток. В некоторых вариантах осуществления, мезопористый диоксид кремния используют для получения микропалочек. В конкретных вариантах осуществления, вакцину инъецируют посредством стандартной иглы 23 калибра (G). Как показано на ФИГ 11A и B, после инъекции таких палочек под кожу животным, быстро сформировался каркас, и миллионы иммуноцитов являлись способными к инфильтрации в каркас. В неограничивающих примерах, GM-CSF и CpG можно включать для привлечения и активации DC хозяина, для составления вакцины на основе MPS. В различных вариантах осуществления, вакцина поддается деградации и, как правило, выводится из участка инъекции в пределах приблизительно 2 месяцев. В некоторых вариантах осуществления, такую систему вакцины на основе MPS используют для получения противоопухолевого иммунитета посредством как гуморальных, так и управляемых T-клетками путей.
ФИГ. 12 представляет собой график, показывающий, что PEI полностью поглощается BMDC через 24 часа. Происходящие из костного мозга DC (BMDC) стимулировали с использованием меченного родамином PEI в течение 0, 2, 6, 24 или 72 часов, и поглощение оценивали количественно с использованием проточной цитометрии.
ФИГ. 13 представляет собой серию графиков, показывающих, что для BMDC, обработанных с использованием увеличивающихся доз свободного PEI, показан усиленный провоспалительный профиль. Анализ ELISA концентрации TNF-α, IL-6 и IFN-γ в супернатанте BMDC после 18 часов стимуляции с использованием различных концентраций PEI.
ФИГ. 14 представляет собой график и набор графиков активированной флуоресценцией сортировки клеток (FACS), показывающие, что для BMDC, обработанных с использованием увеличивающихся доз свободного PEI, показаны усиленные активация и созревание. Показан анализ проточной цитометрии экспрессии CD11c и CD86 на BMDC после 18 часов стимуляции с использованием различных концентраций PEI. Данные показывают явную тенденцию линейного повышения для групп L25K, и для первых двух доз B60K. L1=Линейный PEI 25 кДа 1 мкг; L7=Линейный PEI 25 кДа 7 мкг; B1=Разветвленный PEI 60 кДа 1 мкг; B7=Разветвленный PEI 60 кДа 7 мкг.
ФИГ. 15 представляет собой серию изображений и графиков, относящихся к неограничивающей оптимизации загрузки PEI в криогели. Использовали способы прямого посева и пропитывания. Исследовали эти два способа загрузки PEI в прочный альгинатный криогель. PEI разводили в небольшом объеме и добавляли непосредственно в криогель (способ посева). Альтернативно, альгинатный криогель сначала частично схлопывали и затем регидратировали в небольшом объеме PEI (способ пропитывания).
Способ «пропитывания»: экстрагировать свободный раствор из криогеля для частичного схлопывания пор, затем поместить его в содержащий PEI раствор для получения преимущества расширения пор для включения PEI посредством электростатических взаимодействий. Неограничивающий пример способа «пропитывания»: (i) Получить 30 мкл растворов PEI, содержащих желательную массу PEI (одна пробирка Eppendorf на гель); (ii) Удалить ~25 мкл воды вокруг геля; (iii) Поместить гель в соответствующие 30 мкл раствора PEI; (iv) инкубировать при 37°C в течение 30 минут; (iv) Собрать гели, промыть в 100 мкл дистиллированной воды (dH2O), поместить в чашку Петри; (v) Сохранить 100 мкл смыва и остаток геля в исходной пробирке Eppendorf для количественной оценки потери PEI. Количественную оценку эффективности загрузки немеченного PEI в криогели проводили с использованием набора для количественной оценки пептидов LavaPep™ (Gel Company, San Francisco, CA, USA). В неограничивающем примере способа «посева», небольшой объем (например, 1-30 мкл) раствора PEI добавляли непосредственно в гель.
ФИГ. 16A и B представляют собой графики, показывающие, что BMDC, инкапсулированные в криогели, загруженные с PEI, улучшали провоспалительный профиль. В пустом криогеле также присутствовала активация, возможно, возникающая из-за избытка кальция, который формирует микрочастицы фосфата кальция (из-за взаимодействия либо с PBS, либо со средами), которые могут запускать иммунный ответ. (A) BMDC культивировали в альгинатном криогеле-PEI в течение 18 часов, и поверхностную экспрессию CD11c и CD86 анализировали с использованием проточной цитометрии. (B) BMDC культивировали в альгинатном криогеле-PEI в течение 18 часов, и в супернатанте измеряли продукцию TNF-α.
ФИГ. 17 представляет собой набор графиков, показывающих, что для BMDC, инкапсулированных в криогели, загруженных с PEI, можно показать улучшенный провоспалительный профиль. Правая панель: BMDC культивировали в альгинатном криогеле-PEI (синтезированном с использованием способа «посева» или «пропитывания», как указано) в течение 18 часов, и супернатант собирали и анализировали TNF-α с использованием ELISA.
ФИГ. 18A и B представляют собой графики, показывающие, что для BMDC, инкапсулированных в MPS, загруженных с PEI, показаны улучшенные активация, созревание и провоспалительный профиль. (A) Анализ проточной цитометрии экспрессии CD11c и CD86 на BMDC после 18 часов стимуляции с использованием различных концентраций PEI-MSR. (B) Анализ ELISA концентрации TNF-α в супернатанте BMDC после 18 часов стимуляции с использованием различных концентраций PEI-MSR.
ФИГ. 19A и B представляют собой графики, показывающие стимуляцию in vitro посредством PEI, включенного в каркасы PLG. (A) Клетки HEK293, совместно трансфицированные геном hTLR5 и несущей зависимую от NF-κB секретируемую эмбриональную щелочную фосфатазу репортерной плазмидой, рассевали на каркасы из PLG (PLG) или каркасы, содержащие либо линейный (L25), либо разветвленный PEI (B60). (B) Продукция цитокинов IL-12 и IFN-α посредством BMDC, рассеянных на каркасы из разветвленного PEI, нормализованная по контролю с PLG.
ФИГ. 20A-C представляют собой графики, показывающие индукцию in vivo цитокинов и активированных DC и профилактическую вакцинацию с использованием нагруженных PEI вакцин на основе PLG. (A) Log различий концентрации цитокинов в участке вакцинации с использованием PEI относительно контрольных вакцин. (n=5) (B) Количество MHCII+ и CD86+ на сутки 7 после имплантации вакцин на основе PLG (контроль) и вакцин на основе PEI-PLG (PEI). (N=5) (C) Мышей подвергали вакцинации с использованием вакцин на основе PLG за 14 суток до заражения опухолью меланомой B16-F10 (105 клеток). Сравнение выживаемости мышей без лечению (контроль) и мышей, подвергнутых лечению с использованием вакцин на основе PLG, нагруженных GM-CSF в комбинации либо с лизатом B16 (PLG), либо с лизатом, объединенным с PEI (PEI-PLG). n=10. **P<0,01 по сравнению со всеми другими условиями эксперимента.
ФИГ. 21A-C представляют собой графики, показывающие терапевтическую вакцинацию с использованием каркасов из PLG, содержащих конъюгированный с PEI лизат. Конъюгация (прикрепление) происходит посредством электростатических взаимодействий. (A) Сравнение размера опухолей на сутки 17 и (B) кинетика роста опухолей у мышей, несущих развившиеся опухоли B16-F10 (подвергнутых инокуляции с использованием 5×105 клеток B16-F10 и оставленных для развития опухоли на 9 суток), не подвергнутые лечению (Контроль) или подвергнутые лечению с использованием вакцин на основе PLG, нагруженных GM-CSF в комбинации с лизатом опухоли (PLG), или с лизатом, объединенным с PEI до включения. (C) Суспензии отдельных клеток получали из опухолей B16 на сутки 17 и окрашивали по маркерам активированных, цитотоксических T-клеток, IFNγ и CD107a. Количество CD3+CD8+, инфильтрующих опухоль T-клеток, положительных либо по IFNγ, либо по CD107a, у не подвергнутых лечению мышей (наивных) или у мышей, вакцинированных с использованием вакцин на основе PLG (PLG) или вакцин на основе PEI-PLG (PEI-PLG). * P<0,05 ** P<0,01 по сравнению с контролем, если не указано иное.
ФИГ. 22A-C представляют собой графики, показывающие экспрессию HLA и CD83 дендритными клетками человека, рассеянными на каркасы из PLG. (A) Репрезентативная гистограмма FACS для экспрессии HLA-DR in vitro на дендритных клетках человека, рассеянных на каркасы из PLG, нагруженные CpG или PEI. Экспрессия (B) HLA-DR и (C) CD83 in vitro на DC, рассеянных на пустые каркасы из PLG (нестимулированные) или каркасы, нагруженные CpG-ODN (CpG), полиI:C (P(IC)), только PEI или PEI в комбинации с p(IC) [PEI-p(IC)] или CpG (PEI-CpG). *P<0,05**P<0,01 по сравнению с контролем, если не указано иное.
ФИГ. 23A-C представляют собой графики, показывающие продукцию цитокинов дендритными клетками человека, рассеянными на каркасы из PLG. Продукция (A) IL-2 (B) TNF-альфа и (C) IL-6 in vitro DC человека отдельно (только клетки) или DC, рассеянными на нагруженные hGM-CSF каркасы из PLG (каркас GM), или каркасы, нагруженные hGM-CSF в комбинации с PEI (каркас GM+PEI) или CpG-ODN (полный каркас). *P<0,05, **P<0,01 по сравнению с контролем, если не указано иное.
ФИГ. 24A и B представляют собой графики, показывающие кинетику поглощения меченного родамином PEI дендритными клетками. (A) Графики проточной цитометрии, показывающие кинетику поглощения меченного родамином PEI дендритными клетками от 0 час до 72 час. (B) Количественная компиляция данных из (A).
ФИГ. 25A-C представляют собой графики, показывающие иммунную активацию. Процент (A) макрофагов и (B) активированных макрофагов в дренирующем вакцину лимфатическом узле после иммунизации с использованием вакцины на основе MSR (V) или вакцины на основе MSR-PEI (VP). (C) Циркулирующие специфические для SIINFEKL CD8 T-клетки после иммунизации с использованием вакцины на основе MSR (V) или вакцины, содержащей только GM-CSF, PEI и антиген OVA (PEI-OVA).
ФИГ. 26A-D представляют собой графики, показывающие характеризацию вакцины на основе MSR-PEI. (A) Общее количество клеток, (B) процент CD11c DC, и (C) процент активированных DC в дренирующем вакцину лимфатическом узле после иммунизации с использованием вакцины на основе MSR (V) и вакцины на основе MSR-PEI, в которую PEI включен с CpG (V PC). (D) Кинетика роста опухолей после инокуляции 3×105 клеток TC-1 и лечения с использованием вакцины на основе MSR (V) и вакцины на основе MSR-PEI, в которую PEI включен с CpG (V PC).
ФИГ. 27A представляет собой рисунок, и ФИГ. 27B представляет собой набор изображений, относящихся к иллюстративным сконструированным полимерным каркасам, улучшающим вакцины против злокачественных опухолей. Настоящее изобретение относится к способам использования биологических материалов для модуляции функции иммуноцитов in vivo. Без связи с какой-либо научной теорией, на ФИГ. 27A показан иллюстративный способ привлечения, программирования и распространения иммуноцитов с использованием сконструированных полимерных (таких как PLG) каркасов для улучшения вакцинации против злокачественных опухолей. На ФИГ. 27B показана иллюстративная вакцина из биологического материала, представляющая собой фрагмент пластика размером с таблетку, который содержит взаимосвязанные поры и высвобождает факторы, поддерживающие функцию дендритной клетки. Этот сконструированный биологический материал можно хирургически имплантировать под кожу несущего опухоль хозяина в качестве вакцины для получения противоопухолевого иммунитета против отдаленных опухолей. Когда ее тестировали в терапевтической модели меланомы B16-F10, вакцина из биологического материала излечивала большую долю мышей от развившихся опухолей. В некоторых вариантах осуществления, каркас в рамках изобретения можно хирургически имплантировать или инъецировать. В конкретных вариантах осуществления, лизат опухоли или специфические очищенные антигены опухолей встраивают в или на каркас.
ФИГ. 28A и B представляют собой графики, и ФИГ. 28C представляет собой набор изображений, показывающие, что вакцина на основе MPS индуцирует персистентную реакцию зародышевого центра. Одной из проблем для получения эффективного гуморального ответа является получение сильной реакции B-клеток зародышевого центра. Однократная инъекция вакцины на основе MPS против собственного пептида, связанного с OVA, вызывала персистентную реакцию B-клеток зародышевого центра в течение более одного месяца. В отличие от этого, способ болюсной вакцинации с использованием такого же адъюванта, CpG и GM-CSF, вызывал временную реакцию зародышевого центра, которая быстро исчезала через неделю. (A) График первичной проточной цитометрии для временной точки из панели B, сутки 14. (B) На левой панели показано общее количество клеток в лимфатических узлах. На правой панели показаны клетки, имеющие маркеры активированных B-клеток. (C) Флуоресцентные изображения показывают увеличение количества B-клеток, подвергающихся активации в зародышевых центрах лимфатических узлов мышей, подвергнутых лечению вакциной, по сравнению с мышами, подвергнутыми лечению болюсом. B220 представляет собой маркер B-клеток, и GL7 представляет собой маркер B-клеток зародышевого центра. Изображения показывают, что уровень GL7 является более высоким для вакцины, по сравнению с болюсом на сутки 7, 14 и 25.
ФИГ. 29A представляет собой таблицу и график, и ФИГ. 29B представляет собой набор графиков, показывающих, что вакцина на основе MPS вызывает образование высокого титра антитела против связывающего трастузумаб домена Her2 и имеет реакционную способность. Настоящее изобретение относится к способам и композициям для получения антител. Например, антитела могут быть нацелены против связывающего герцептин® (трастузумаб) домена на белке Her2, чтобы обойти необходимость множественного введения герцептина и получить память против Her2. В конкретных вариантах осуществления, слитый пептид, содержащий эпитоп CD4, происходящий из вируса кори, связанный с коротким линейным доменом внутри связывающего герцептин домена на Her2, используют для получения иммунного ответа. На ФИГ. 29A и B показано, что для мышей, иммунизированных с использованием вакцины на основе MPS, показан ответ с титром антител против Her2, более чем на порядок величины более высоким, по сравнению с болюсной вакциной без каркаса. Кроме того, данные показывают, что антисыворотка против Her2 являлась способной узнавать белок Her2 на положительных по Her2 человека клетках рака молочной железы, в то время как для сыворотки от мышей, подвергнутых болюсной вакцинации, не показано значительного связывания по сравнению с контрольной сывороткой. В различных вариантах осуществления, вакцину, содержащую палочки из мезопористого диоксида кремния и полипептид, происходящий из Her2, используют для получения иммунного ответа против клеток рака молочной железы, например, для лечения рака молочной железы. Клетки SK-BR-3 являются Her2+. Клетки CT26 являются Her2-. PE=Фикоэритрин.
ФИГ. 30 представляет собой рисунок, показывающий, что вакцина с модифицированной поверхностью усиливает иммуногенность пептида опухоли. В дополнение к ответам антител, противоопухолевыми ответами могут управлять ответы T-клеток против неоантигенов, которые часто находятся в форме пептидов. Однако получение эффективного ответа против этих пептидов является проблематичным, поскольку они очень быстро выводятся из организма и, как правило, являются не очень иммуногенными. Вакцины, в рамках изобретения, такие как вакцины, содержащие палочки из MPS, могут быть нацелены на эту проблему. В некоторых вариантах осуществления, антигены опухолей пассивно включают в вакцину. В конкретных вариантах осуществления, поверхность вакцины модифицируют с использованием простого электростатического взаимодействия, которое делает каркас (например, палочки из MPS) более липким для пептидов, так что пептиды остаются в или на каркасе дольше, а также делает пептиды более иммуногенными. В различных вариантах осуществления, такая модификация позволяет включение широкого диапазона пептидов с различными физическими свойствами без использования каких-либо химических реакций. В некоторых вариантах осуществления, это является важным, поскольку химические модификации пептидов потенциально могут изменять способность к представлению. В неограничивающем примере, модификация поверхности включает приведение каркаса в контакт с PEI.
ФИГ. 31A представляет собой последовательность, временной график, набор графиков и изображение, показывающие, что однократная инъекция вакцины на основе MPS с модифицированной поверхностью приводила к усилению регрессии развившихся опухолей. ФИГ. 31B представляет собой набор графиков, показывающих ответ долгосрочной памяти после повторного заражения опухолью. Вакцину с модифицированной поверхностью тестировали с использованием пептида из онкобелка E7 из HPV, который экспрессируется в ряде опухолей, таких как рак шейки матки и злокачественная опухоль полости рта. Как показано на ФИГ. 31A, мышей подвергали инокуляции с использованием экспрессирующей E7 линии клеток TC-1 и иммунизировали на сутки 8 с использованием вакцины с модифицированной поверхностью или с немодифицированной поверхностью. Для вакцин с модифицированной поверхностью показана намного лучшая регрессия опухолей по сравнению с немодифицированной вакциной. Кроме того, вакцину с модифицированной поверхностью на основе MPS сравнивали со способом с использованием болюсной вакцины и показали, что вакцина на основе MPS индуцировала полную регрессию опухолей, в то время как для болюсной вакцины получали только частичную регрессию. Изображение на этой фигуре показывает пример для мыши, подвергнутой лечению с использованием вакцины VP, которая имела большую (1 см × 1 см) опухоль до полной регрессии. Как показано на ФИГ. 31B, более 80% мышей, подвергнутых лечению вакциной на основе MPS с модифицированной поверхностью, имели длительную выживаемость. Выживших мышей подвергали повторной инокуляции с использованием экспрессирующих E7 опухолей через 6 месяцев и показали, что 100% мышей являлись свободными от опухолей, что позволяет предполагать ответ долгосрочной памяти, полученный посредством вакцины.
ФИГ. 32A представляет собой временной график, набор последовательностей и график, и ФИГ. 32B представляет собой набор графиков, показывающих, что вакцина на основе MPS с модифицированной поверхностью усиливала контроль опухоли с использованием неоантигена B16 и фенотипа эффекторных лимфоцитов в микроокружении опухоли у мышей. Вакцину на основе MPS (содержащую PEI) тестировали в модели B16 с использованием недавно открытых неоантигенов (последовательности показаны на ФИГ. 32A). Как показано на ФИГ. 32A, в терапевтической подкожной модели, для вакцины с модифицированной поверхностью показан лучший контроль роста по сравнению с немодифицированной вакциной (лишенной PEI). Кроме того, популяцию инфильтрующих опухоль лимфоцитов (TIL) анализировали на сутки 15 после инокуляции, когда опухоли у не подвергнутых лечению мышей достигли максимального размера. Как показано на ФИГ. 32B, для вакцины с модифицированной поверхностью получено больше гранзим B+, IFN+ и TNFa+ лимфоцитов в опухоли. Интересно, что при более подробном рассмотрении группы CD8 и CD4, большая часть ответа была обусловлена CD4 лимфоцитами. VP=вакцина с модифицированной поверхностью. V=немодифицированная вакцина.
На ФИГ. 33A-C показаны терапевтические эффекты в подкожной модели на мышах B16F10 с использованием неоантигенов. ФИГ. 33A представляет собой набор иллюстративных последовательностей неоантигенов, временной график, изображения и график, показывающие, что искусственное метастазирование в легкие уменьшалось по сравнению с наивными (не подвергнутыми лечению) мышами. Клетки B16 инъецировали в кровоток мышей C57 и проводили лечение с использованием вакцины VP через 24 часа. Легкие вырезали на сутки 16, и подсчитывали количество метастазов в легком. ФИГ. 33B представляет собой набор иллюстративных последовательностей, временной график, и графики, показывающие режим лечения с примированием-бустером (при котором вакцину инъецировали более одного раза) в терапевтической модели B16 с использованием пептидов M27 и M30. После бустер-иммунизации, присутствовала временная регрессия развившейся опухоли меланомы в течение приблизительно 5 суток. ФИГ. 33C представляет собой набор иллюстративных последовательностей, временной график и графики, показывающие терапевтический синергизм с лечением антителом против CTLA4. Оценивали вакцину с модифицированной поверхностью в комбинации с терапией против CTLA4. Для мышей, подвергнутых лечению только антителом против CTLA4, не показано лучшего контроля опухоли по сравнению с не подвергнутыми лечению животными. В отличие от этого, для мышей, подвергнутых лечению с использованием как вакцины, так и антитела против CTLA4, показан впечатляющий контроль роста опухоли.
ФИГ. 34A представляет собой таблицу, показывающую иллюстративные ответы in vivo, и ФИГ. 34B представляет собой рисунок, показывающий иллюстративный способ введения индивидуализированной вакцины против опухоли субъекту. Как показано на ФИГ. 34A, ряд относящихся к заболеванию антигенов тестировали в форме белка, в форме пептида и в форме малой молекулы. Тестированные антигены включают как T, так и B-клеточные эпитопы (T-клеточные эпитопы представляют собой эпитопы, которые могут связываться с молекулами класса MHC-I или MHC-II, B-клеточные эпитопы представляют собой домены, которые может узнавать антитело). T-клеточные и B-клеточные эпитопы не являются взаимоисключающими. Положительные ответы наблюдали с использованием 4 независимых моделей опухолей. Настоящее изобретение относится к платформам для вакцин, которые представляют собой минимально инвазивные, высоко разнообразные и эффективные платформы для вакцин из биологического материала. Как показано на ФИГ. 34B, поскольку вакцина на основе MPS собрана из индивидуальных частиц, библиотеку различных антигенов (таких как антигены опухолей) можно включать в индивидуальные частицы. Такие частицы можно сочетать и комбинировать, и легко масштабировать для получения индивидуализированных вакцин против злокачественных опухолей. Каждая вакцина может содержать множество антигенов опухолей, и затем ее можно вводить пациенту посредством простой инъекции. В неограничивающих примерах, вакцину вводят в форме однократной инъекции или в форме множественных инъекций (например, одновременно или с течением времени). В различных вариантах осуществления, антиген можно очищать, например, из лизата опухоли, или получать рекомбинантным способом (например, в клетках, продуцирующих антиген) или синтетически (посредством химического синтеза в отсутствие клеток).
ФИГ. 35 представляет собой пару графиков, показывающих T-клеточный ответ, специфический для неоантигена меланомы мыши. Животных подвергали вакцинации с использованием вакцины на основе MSR (V) или вакцины на основе MSR-PEI (VP) с использованием 50 мкг пептидов неоантигенов B16-M27 или B16-M30, или оставляли без вакцинации (наивные). Через 14 суток, мышей подвергали инокуляции с использованием 0,1×106 клеток B16F10. Через 10 суток, CD4 и CD8 T-клетки собирали из селезенки и дренирующего опухоль LN, окрашивали с использованием сукцинимидилового сложного эфира карбоксифлуоресцеина (CFSE) и совместно культивировали с сенсибилизированными пептидом DC селезенки. Затем пролиферирующие и секретирующие IFNγ популяции (IFN+ CFSE-) анализировали с использованием проточной цитометрии.
ПОДРОБНОЕ ОПИСАНИЕ
Аспекты объекта настоящего изобретения относятся к открытию, что полиэтиленимин (PEI) можно использовать в качестве адъюванта в вакцинах с каркасом из биологического материала для усиления ответов цитотоксических T-лимфоцитов и индукции сильного иммунитета против опухолей. Например, пригодные для инъекций криогели и пригодные для инъекций палочки из мезопористого диоксида кремния, содержащие PEI, усиливают противоопухолевый иммунитет значительно больше (например, приблизительно на 10%, 20%, 25%, 50%, 75%, 100%, в 2 раза, 5 раз, 10 раз или более), чем криогели или палочки из мезопористого диоксида кремния, лишенные PEI. Неожиданно, палочки из мезопористого диоксида кремния, содержащие антиген, связанный с PEI, были значительно более иммуногенными, чем соответствующие палочки из мезопористого диоксида кремния, содержащие CpG-ODN, связанный с PEI (см., например, ФИГ. 4B). Кроме того, палочки из мезопористого диоксида кремния, содержащие антиген, связанный с PEI, были более эффективными для уменьшения размера опухолей in vivo, чем соответствующие палочки из мезопористого диоксида кремния, лишенные PEI (см., например, ФИГ. 5G).
Иммунотерапия
Иммунотерапия разработана как эффективный вариант лечения злокачественных опухолей. Иммунотерапия злокачественных опухолей относится к любому вмешательству, задействующему иммунную систему, чтобы атаковать, уменьшать или уничтожать злокачественное новообразование. Задействование иммунной системы стало жизнеспособным способом лечения злокачественных опухолей человека в течение последних пяти лет. Недавний прогресс в понимании иммунной системы - такой как открытие молекул, играющих ключевую роль в получении иммунных ответов, например, Toll-подобных рецепторов (TLR) и их лигандов, позволил разработку платформ для точной регуляции иммунного ответа, чтобы стимулировать противораковый иммунитет. Выдающиеся примеры успешной иммунотерапии включают ингибиторы иммунных контрольных точек для лечения ряда злокачественных опухолей на поздних стадиях, так же, как адоптивную клеточную терапию (ACT) для конкретных гематологических злокачественных новообразований.
Несмотря на то, что недавний успех некоторых видов иммунотерапии показал их потенциал, у современных способов иммунотерапии злокачественных опухолей остаются недостатки. Например, лекарственные средства общепринятым образом вводят в форме растворимых инъекций, как правило, с необходимостью высоких доз и частого повторного дозирования для достижения биологически значимых концентраций в тканях-мишенях, что часто приводит к системной токсичности. Для большинства растворимых болюсных вакцинных составов также не удалось получить значительно активных иммунных ответов для достижения длительного терапевтического успеха, что ограничивает их эффективное использование для злокачественных опухолей.
Биологические материалы можно использовать для преодоления этих ограничений, и таким образом, увеличения эффективности вакцин и других иммунотерапевтических средств. Способы рационального дизайна биологического материала для доставки иммуномодулирующих лекарственных средств потенциально могут иметь улучшенные профили безопасности, в то же время предоставляя многофункциональные и пространственно-временным образом контролируемые сигналы иммуноцитам для улучшения их противораковой активности. Получение продуктивного противоракового иммунного ответа, приводящего к уничтожению клеток злокачественных опухолей, зависит от скоординированных серий событий, которые должны происходить повторяющимся и самоподдерживаемым образом.
Без намерения быть связанными какой-либо научной теорией, антигены (например, полученные или высвобожденные из клеток злокачественных опухолей) подвергаются захвату DC, первичными медиаторами адаптивного иммунитета. Активация DC, ассоциированная с повышающей регуляцией костимулирующих молекул клеточной поверхности и продукцией цитокинов, является необходимой для эффективного нижестоящего примирования ответа T-клеток, и может быть стимулирована в эндогенной ситуации посредством факторов, высвобождаемых умирающими клетками злокачественных опухолей, которые можно в широком смысле назвать «ассоциированными с опасностью молекулярными паттернами». Активация DC способствует эффективному процессингу поглощенного антигена и последующему представлению антигенных пептидов на молекулах MHC на поверхности клеток. В дренирующих лимфатических узлах, активированные DC представляют антигены злокачественных опухолей наивным T-клеткам, что приводит к примированию и активации специфических для антигена злокачественной опухоли T-клеток, подгруппа которых подвергается дифференцировке в долгоживущие клетки памяти. Активированные T-клетки, в частности, эффекторные CD8+ цитотоксические T лимфоциты (CTL), затем мигрируют в опухоль и инфильтрируют ее, узнают клетки злокачественных опухолей, представляющие родственные антигенные детерминанты, и уничтожают клетки злокачественных опухолей.
У пациентов с злокачественными опухолями, цикл иммунитета против злокачественных опухолей блокирован на одной или более из этих стадий, ослабляя противораковый иммунный ответ и позволяя ускользание от иммунитета. Целью иммунотерапевтических средств против злокачественных опухолей является стимуляция противоракового иммунитета посредством усиления конкретных стадий в этом цикле. Терапевтические вакцины в рамках изобретения нацелены на DC, чтобы способствовать представлению антигена злокачественной опухоли (например, ФИГ. 6, стадия 2) для стимуляции более активных примирования и активации T-клеток (например, ФИГ. 6, стадия 3) и последующей эффекторной функции CTL.
PEI является адъювантом для антигенов вирусных гликопротеинов через пути слизистых оболочек, активируя сильный и защитный иммунитет против вируса гриппа и вируса простого герпеса-2 после однократного интраназального введения соответствующего антигена, составленного совместно с PEI (Wegmann et al., Nat Biotechnol. 2012, 30(9): 883-888.).
Врожденные иммунные пути активируются посредством высвобождения внутриклеточной дцДНК, которая действует как ассоциированный с повреждением молекулярный паттерн, запускающий путь интерферона Irf3 через цитоплазматические сенсоры ДНК. Другим врожденным иммунным путем, активируемым посредством PEI, является инфламмасома, потенциально либо посредством активности дестабилизации лизосом PEI3, либо посредством высвобождения других ассоциированных с повреждением молекулярных паттернов, таких как мочевая кислота. PEI запускает приток антигенпредставляющих клеток (APC) в участок иммунизации и вступает в ассоциацию с антигеном с формированием наночастиц, эффективно поглощаемых APC. Sheppard et al. (2014) показали, что PEI также имеет системную иммуностимулирующую активность против вирусных гликопротеинов (Sheppard et al., International Immunology, 2014, Vol. 26, No. 10, pp. 531-538). PEI тестировали в моделях как подкожной, так и внутрибрюшинной иммунизации. Различные формы PEI действуют как сильные системные адъюванты, индуцирующие получение более высоких титров антитела против нативно свернутого антигена по сравнению с квасцами (клинически значимым адъювантом на основе алюминия). Дальнейшая характеризация разветвленного 25 кДа PEI выявила, что он управляет адаптивным иммунным ответом смешанного Th1/Th2-типа при системном введении, с активной продукцией антител у мышей и кроликов. Смешанный ответ Th1/Th2, индуцированный PEI, является адекватным для вызова ответов антител с высоким титром, и эти исследователи характеризовали PEI как маловероятно являющийся оптимальным для совместной индукции цитотоксических T-клеток, требующей окружения цитокинов Th1. Получение совместного состава PEI с лигандом TLR CpG ODN синергически увеличивает диапазон адаптивного иммунного ответа и сдвигает ответ в сторону Th1. Таким образом, PEI действует на многих уровнях для обеспечения активности адъюванта для гликопротеиновых антигенов. Это хорошо соответствует устройствам из биологического материала, представленным в настоящем описании, таким как устройства, содержащие криогели.
Как показано на фигурах в настоящем описании, PEI индуцировал созревание DC и продукцию провоспалительных цитокинов. PEI загружали в каркас из MSR/MPS и каркасы из прочного альгинатного криогеля с высокой эффективностью. MPS/MSR-PEI индуцировал созревание DC и продукцию провоспалительных цитокинов. PEI также приводит к усилению провоспалительного профиля в криогелях.
Преодоление толерогенных сигналов и отсутствия костимулирующих сигналов в микроокружении опухоли (TME) является ключевой проблемой в дизайне вакцины против злокачественных опухолей. Ключевой проблемой в дизайне вакцины против злокачественных опухолей является преодоление отсутствия костимулирующих сигналов и присутствия толерогенных сигналов в микроокружении опухоли, без запуска системной воспалительной токсичности, таким образом, расширение клинического диапазона вакцин против злокачественных опухолей на менее иммуногенные злокачественные новообразования. Устройства и биологические материалы по настоящему изобретению можно использовать для стимуляции и/или вызова противоракового иммунного ответа. Иллюстративные способы включают длительное программирование дендритных клеток in situ, включающее введение субъекту устройства, содержащего композицию каркаса, где композиция каркаса привлекает дендритную клетку, предоставляет один или более иммуногенных факторов (например, включая PEI, отдельно или в комбинации с (a) иммуностимулирующим соединением; (b) соединением, привлекающим иммуноцит к носителю или в носитель для доставки; (c) соединением, индуцирующим иммуногенную гибель клеток опухоли; (d) соединением, ингибирующим супрессию T-клеток или дендритных клеток; (e) соединением, которое ингибирует ингибирующий иммунитет белок; или (f) антигеном, или любой их комбинацией) дендритной клетке для стимуляции активации дендритной клетки, и индуцирует дендритную клетку для миграции из композиции каркаса. Устройства могут привлекать и стимулировать гетерогенную популяцию дендритных клеток (где каждая подгруппа является специализированной и вносит значительный вклад в образование иммунного ответа).
В некоторых вариантах осуществления, способ программирования дендритной клетки in situ осуществляют посредством введения субъекту устройства, содержащего композицию каркаса и инкапсулированную композицию для привлечения. В конкретных вариантах осуществления, композицию для привлечения можно высвобождать из устройства импульсным способом, в пределах, например, 1-7 суток после введения устройства, оставляя остаточное количество композиции для привлечения в или на устройстве. За импульсом может следовать медленное высвобождение остаточного количества в течение нескольких недель. Местная концентрация композиции для привлечения и временной паттерн высвобождения опосредует привлечение, удержание и последующее высвобождение дендритных клеток из устройства. Например, импульс может включать по меньшей мере 50, 60, 75, 90 или 95% от количества композиции для привлечения, ассоциированной с устройством. Иллюстративный временной профиль высвобождения включает импульс, характеризующийся высвобождением по меньшей мере 60% от количества композиции для привлечения, ассоциированной с устройством, приблизительно за 1-5 суток после введения устройства субъекту. После импульса, остаточное количество медленно высвобождается в течение длительного периода времени (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12 суток или 2, 3, 4, 5 или более недель) после периода импульса. Соединения для привлечения, известные в данной области и/или описанные в настоящем описании, можно использовать индивидуально или в комбинации.
Аспекты объекта настоящего изобретения относятся также к увеличению эффективности вакцины, включающему введение субъекту устройства, содержащего композицию каркаса и одно или более соединений, таких как PEI (например, отдельно или в комбинации с (a) иммуностимулирующим соединением; (b) соединением, привлекающим иммуноцит к носителю или в носитель для доставки; (c) соединением, индуцирующим иммуногенную гибель клеток опухоли; (d) соединением, ингибирующим супрессию T-клеток или дендритных клеток; (e) соединением, которое ингибирует ингибирующий иммунитет белок; или (f) антигеном, или любой их комбинацией), включенных в композицию или конъюгированных с композицией каркаса, где устройство привлекает дендритную клетку, предоставляет одно или более соединений дендритной клетке, таким образом, активируя дендритную клетку, и индуцирует миграцию дендритной клетки из композиции каркаса, таким образом, увеличивая эффективность способа вакцинации. Объект настоящего изобретения относится также к способу, включающему вакцинацию субъекта против злокачественной опухоли, включающую введение субъекту устройства, содержащего композицию каркаса и одно или более соединений, таких как PEI (например, отдельно или в комбинации с (a) иммуностимулирующим соединением; (b) соединением, привлекающим иммуноцит к носителю или в носитель для доставки; (c) соединением, индуцирующим иммуногенную гибель клеток опухоли; (d) соединением, ингибирующим супрессию T-клеток или дендритных клеток; (e) соединением, которое ингибирует ингибирующий иммунитет белок; или (f) антигеном, или любой их комбинацией), где композиция каркаса привлекает дендритную клетку, предоставляет одно или более соединений дендритной клетке, таким образом, активируя дендритную клетку, и индуцирует миграцию дендритной клетки из композиции каркаса, таким образом, обеспечивая субъекту противоопухолевый иммунитет, например, продукцию IL-12, и уменьшение опухолевой нагрузки.
В различных вариантах осуществления, клетки, покидающие устройство после встречи с PEI, антигеном и/или другими факторами (и/или клетки, контактирующие с клетками, покидающими устройство), являются активированными для поиска клеток опухолей в организме, в котором вызван иммунный ответ. Активность клеток, покидающих устройство, отличается от активности до входя в устройство. В некоторых вариантах осуществления, клетки привлекаются в устройство и остаются удерживаемыми в устройстве в течение некоторого периода времени, например, нескольких минут; 0,2, 0,5, 1, 2, 4, 6, 12, 24 часа; 2, 4, 6 суток; 1-4 недель; 2, 4, 6, 8, 10 или 12 месяцев; или более лет, во время которого клетки подвергаются воздействию структурных элементов и биологически активных соединений, что приводит к изменению активности или уровня активности клеток. Необязательно, антиген, соответствующий мишени, иммунный ответ против которой является желательным, включают в или на структуру каркаса. Цитокины также могут являться компонентом устройства для усиления иммунной активации и/или индукции миграции примированных клеток в лимфатические узлы. Различные соединения, которые можно включать в устройства и каркасы (например, PEI отдельно или в комбинации с (a) иммуностимулирующим соединением; (b) соединением, привлекающим иммуноцит к носителю или в носитель для доставки; (c) соединением, индуцирующим иммуногенную гибель клеток опухоли; (d) соединением, ингибирующим супрессию T-клеток или дендритных клеток; (e) соединением, которое ингибирует ингибирующий иммунитет белок; или (f) антигеном, или любой их комбинацией), описаны в настоящем описании. Встреча с антигеном и другими соединениями в устройстве индуцирует выход измененных (заново обученных или перепрограммированных) клеток, и клетки мигрируют из устройства и в окружающие ткани или в отдаленные целевые локализации для поиска пораженных заболеванием клеток и опосредования иммунитета против пораженных заболеванием клеток, таких как клетки опухолей. Например, после поглощения антигена, DC становятся активированными и мигрируют в лимфатические узлы, селезенку и другие анатомические локализации, где они контактируют с T-клетками для дальнейшего усиления антигенспецифического иммунного ответа, например, противоракового ответа. Иммуноциты, такие как T-клетки, B-клетки или дендритные клетки (DC) индивидуума могут привлекаться в устройство, примироваться и активироваться для развития иммунного ответа против антигенспецифической мишени.
В различных вариантах осуществления, биологический материал в рамках изобретения содержит 1) цитокин, такой как гранулолцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), лиганд подобной FMS тирозинкиназы 3 (Flt3L), лиганд 20 хемокина (с мотивом C-C) (CCL20), интерлейкин 15 (IL-15), лиганд 1 хемокина (с мотивом C) (XCL1), лиганд 10 хемокина (с мотивом C-X-C) (CXCL10), интерферон альфа 1 (IFN-альфа), интерферон бета (IFN-бета) или интерлейкин 12 (IL-12); 2) иммуностимулирующее соединение, такое как агонист TLR, например, CpG-олигонуклеотид, полиинозин-полицитидиловая кислота (поли(I:C)) PEI-поли(I:C), полиадениловая-полиуридиловая кислота (поли(A:U)), PEI-поли(A:U), двухцепочечный рибонуклеиновая кислота (РНК), монофосфориллипид A (MPLA), имиквимод, CRX-527 и OM-174; 3) низкомолекулярный ингибитор иммуносупрессии, такой как LY2157299, GW788388, LY364947, R268712, RepSox, SB525334, SD208, BP-1-102, S3I-M2001, STA-21, S3I-201, статтик, галиеллалактон, INCB24360, NLG919, норгарман, розмариновая кислота, 1-метилтриптофан и индоксимод; и/или 4) антитело, ингибирующее иммуносупрессию. Неограничивающие примеры человеческих аминокислотных последовательностей для изоформ каждого из цитокинов, перечисленных выше, являются публично доступными с использованием следующих номеров доступа: GM-CSF - GenBank No: AAA52578.1 (SEQ ID NO: 3); Flt3L - UniProtKB/Swiss-Prot No: P49771.1 (SEQ ID NO: 4); CCL20 - GenBank No: AAH20698.1 (SEQ ID NO: 5); IL-15 - GenBank No: AAI00963.1 (SEQ ID NO: 6); XCL1 - GenBank No: AAH69817.1 (SEQ ID NO: 7); CXCL10 - GenBank No: EAX05693.1 (SEQ ID NO: 8); IFN-альфа - GenBank No: AAI12303.1 (SEQ ID NO: 9); IFN-бета - GenBank No: AAC41702.1 (SEQ ID NO: 10); и IL-12 - No. доступа в NCBI 1F45_A (цепь A) (SEQ ID NO: 11) и No. доступа в NCBI 1F45_B (цепь B) (SEQ ID NO: 12).
В конкретных вариантах осуществления, преимуществом устройств для специфической для пациента иммунизации по настоящему изобретению является уменьшенная токсичность иммуномодулирующих и/или химиотерапевтических средств, поскольку устройства доставляют средства местно в участок опухоли и/или позволяют использование более низких концентраций средств. Индукторы иммуногенной гибели клеток, например, химиотерапевтические средства/цитотоксические средства против опухолей, действуют совместно с опосредуемой устройством иммуномодуляцией, что приводит к улучшенным регрессии/уменьшению опухоли, в то же время уменьшая побочные эффекты. В одном примере, криогель или гидрогель включает PEI, антрациклин или другой индуктор иммуногенной гибели клеток вместе с композицией для обогащения иммуноцитов и иммуностимулирующим средством (в отсутствие антигена опухоли до введения пациенту). В другом примере, криогель или гидрогель включает PEI, композицию для обогащения иммуноцитов и лиганд TLR или лиганд STING, без антрациклина или другого индуктора иммуногенной гибели клеток, где антрациклин или другой индуктор иммуногенной гибели клеток вводят пациенту системно.
В различных вариантах осуществления, в которых устройство или каркас по изобретению вводят без хирургической имплантации, устройство или каркас инъецируют с использованием иглы. Например, устройство или каркас можно инъецировать через иглу 16 калибра, 18 калибра, 20 калибра, 22 калибра, 24 калибра, 26 калибра, 28 калибра, 30 калибра, 32 калибра или 34 калибра.
В рамках изобретения, инъекция или другое введение в «участок опухоли» может означать размещение устройства или каркаса по изобретению таким образом, что (i) по меньшей мере часть устройства или каркаса находится внутри опухоли, (ii) устройство или каркас полностью находится внутри опухоли, (iii) по меньшей мере часть устройства или каркаса находится в контакте с опухолью, или (iv) устройство или каркас находится поблизости от опухоли. В конкретных вариантах осуществления, устройство или каркас вводят таким образом, что они находятся перитуморально (т.е. в непосредственном контакте с опухолью или в непосредственной близости от опухоли). Альтернативно, капсулу опухоли прокалывают для доставки устройства или каркаса непосредственно в опухолевую массу. В некоторых вариантах осуществления, опухоль не контактирует с устройством или каркасом. Различные варианты осуществления объекта настоящего изобретения исключают прокол опухоли или физическое повреждение опухоли иным образом. Таким образом, аспекты настоящего изобретения относятся к получению иммунного ответа без физического повреждения или разрушения капсулы опухоли. В неограничивающих примерах, устройство или каркас можно помещать в пределах от 0 (т.е. в соприкосновении с опухолью) до 10 мм от опухоли. В различных вариантах осуществления, точка устройства или каркаса, наиболее близкая к опухоли, находится за приблизительно 0 (т.е. в непосредственном контакте с опухолевой массой), 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мм от границы опухолевой массы. В некоторых вариантах осуществления, точка устройства или каркаса, наиболее близкая к опухоли, находится менее чем приблизительно за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мм от опухоли. В конкретных вариантах осуществления, точка устройства или каркаса, наиболее близкая к опухоли, находится по меньшей мере приблизительно за 1, 2, 3, или 5 мм и менее чем приблизительно за 6, 7, 8, 9 или 10 мм от опухоли.
Различные варианты осуществления объекта настоящего изобретения исключают необходимость в полученном от пациента материале (например, полученных от пациента антигенах опухоли). В различных вариантах осуществления, устройства и каркасы не содержат антигена опухоли (от субъекта или из другого источника) на время введения. Противоопухолевую вакцинацию можно осуществлять посредством введения устройства или каркаса в опухоль с использованием, например, иглы, или посредством доставки устройства или каркаса поблизости от опухоли без повреждения опухолевой массы с использованием иглы. Таким образом, варианты осуществления настоящего изобретения относятся к устройствам и каркасам, стимулирующим иммунную активацию против опухоли in vivo без (i) контакта с антигеном опухоли при введении или (ii) повреждения капсулы опухоли.
Доставка иммуномодулирующих факторов (например, средств, модулирующих действие мишеней в контрольных точках T-клеток) непосредственно в участок опухоли уменьшает иммуносупрессивное местное микроокружение в/около опухоли.
Иллюстративные соединения для доставки
Полиэтиленимин
Полиэтиленимин (PEI) или полиазиридин представляет собой полимер с повторяющимися звеньями, состоящими из аминогруппы и алифатического спейсера с двумя атомами углерода CH2CH2. Линейные полиэтиленимины содержат полностью вторичные амины, в отличие от разветвленных PEI, которые содержат первичные, вторичные и третичные аминогруппы. Доступны полностью разветвленные, дендримерные формы. PEI является доступным со множеством молекулярных масс, например, 1-60 кДа.
Разветвленный PEI можно синтезировать посредством полимеризации с раскрытием цикла азиридина (Zhuket al., Russian Chemical Reviews; Vol 34:7,1965). В зависимости от условий реакции, можно достигать различной степени разветвления. Линейный PEI можно получать посредством пост-модификации других полимеров, подобных поли(2-оксазолинам) (Tanaka et al., Macromolecules, 1983, 16 (6): 849-853) или N-замещенным полиазиридинам (Weyts et al., Polymer Bulletin, 1988, 19 (1): 13-19). Линейный PEI можно синтезировать посредством гидролиза поли(2-этил-2-оксазолина) (Brissault et al., Bioconjugate Chemistry, 2003, 14: 581-587). Неограничивающие примеры способов синтеза линейного PEI описаны также в Публикации патентной заявки США No. 2010-0197888, опубликованной 5 августа 2010 г., полное содержание которого приведено в настоящем описании в качестве ссылки. Разветвленный 60 кДа PEI является коммерчески доступным из Sigma Aldrich (St. Louis, MO, USA), линейный 25 кДа PEI получен из Polysciences (Warrington, PA, USA). Разветвленный 2 кДа PEI и линейный 2 кДа PEI является коммерчески доступным из Sigma Aldrich.
До этого изобретения, PEI использовали для конденсации плазмидной ДНК, так же, как нуклеиновых кислот, таких как CpG и поли(I:C).
Химиотерапевтические средства
Аспекты объекта настоящего изобретения относятся к соединениям, индуцирующим иммуногенную гибель клеток. Такие химиотерапевтические средства включают члены антрациклинового класса соединений, например, доксорубицин, даунорубицин, эпирубицин, идарубицин и валрубицин, так же как митоксантрон, аналог антрациклина.
Химиотерапевтические средства можно использовать для получения антигена и примирования иммунной системы. Антрациклиновый класс химиотерапевтических средств уничтожает клетки опухолей таким образом, который вызывает примирование иммунной системы (иммуногенная гибель клеток). Антрациклины представляют собой противораковые соединения, первоначально происходящие из видов Streptomyces. Антрациклины представляют собой красные ароматические поликетиды и встречаются во множестве форм из-за структурных различий в агликонe и различных связанных остатках сахаров.
Иллюстративное химиотерапевтическое средство, вызывающее иммуногенную гибель клеток, представляет собой трициклическое соединение, как показано ниже. В одном варианте осуществления, настоящее изобретение относится к соединению формулы (I):
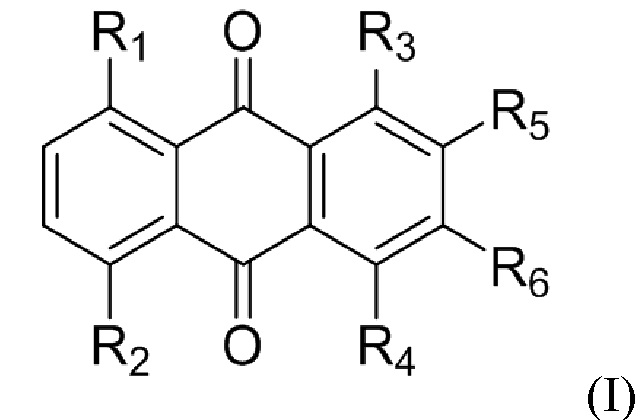
или его фармацевтически приемлемой соли или сольвату, где R1 и R2 независимо выбраны из -OCH3, -OH или -H; R3 и R4 независимо выбраны из -OH или -NHCH2CH2NHCH2CH2OH; R5 и R6 выбраны из H или альтернативно, совместно формируют шестичленный ненасыщенный карбоцикл, замещенный с использованием R7, R8 и R9; и R7, R8 и R9 независимо выбраны из -OH, -C(=O)CH3, -C(=O)CH2OC(O)CH2CH2CH2CH3, -C(=O)CH2OH,
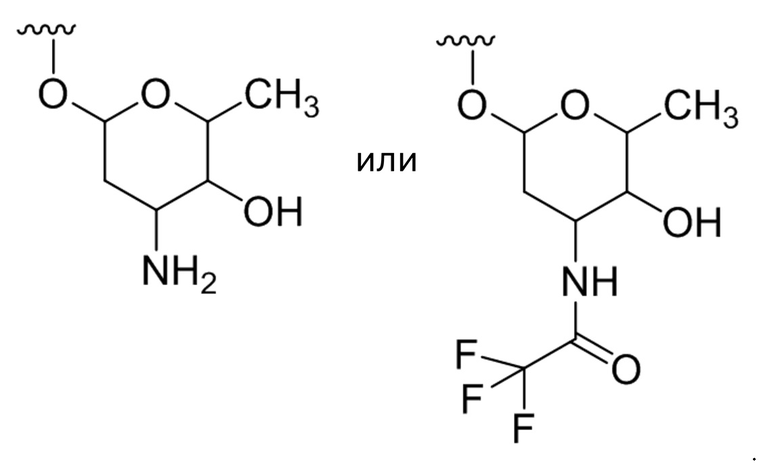
Например, одна группа соединений формулы (I) включает соединения, в которых R3 и R4 представляют собой OH. Кроме того, эта группа соединений может содержать подгруппу соединений формулы (I), где R3 и R4 представляют собой OH, и R1 представляет собой H.
Другая группа соединений формулы (I) включает соединения, в которых R1 и R2 представляют собой OH. Эта группа соединений может также включать подгруппу соединений формулы (I), где R1 и R2 представляют собой OH, и R3 и R4 представляют собой NHCH2CH2NHCH2CH2OH. Другая подгруппа соединений формулы (I) включает соединения, в которых R1 и R2 представляют собой OH, R3 и R4 представляют собой NHCH2CH2NHCH2CH2OH, и R5 и R6 представляют собой H.
Другой вариант осуществления настоящего изобретения относится к подгруппе соединений формулы (II):
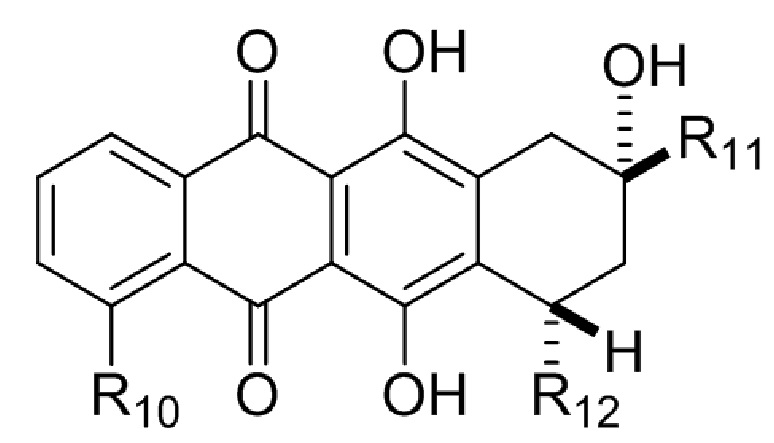
или их фармацевтически приемлемым соли или сольвату, где R10 представляет собой H или -OCH3; R11 представляет собой -C(=O), C(=O)CH2OH или -C(=O)CH2OC(=O)CH2CH2CH2CH3; и R12 представляет собой
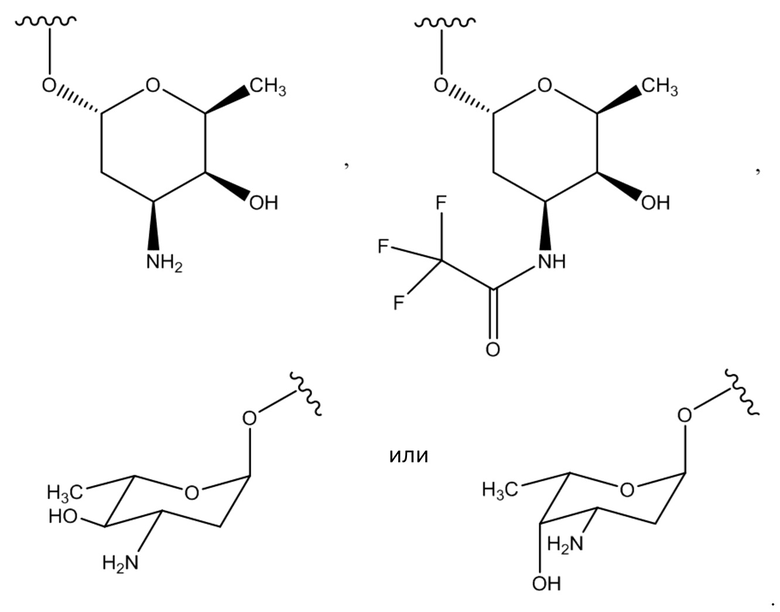
Например, одна группа соединений формулы (II) включает соединения, в которых R11 представляет собой OCH3.
Под «антрациклином» понимают класс лекарственных средств, общепринятых в качестве химиотерапевтического средства. В некоторых вариантах осуществления, антрациклин имеет трициклический кор (например, митоксантрон) или тетрациклический кор. В некоторых вариантах осуществления, антрациклин имеет структуру в соответствии со следующей формулой,
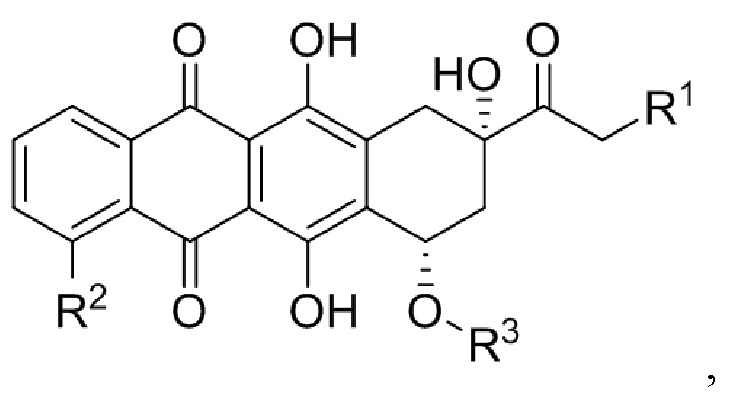
где
R1 представляет собой -H,- OH, или -O(C=O)(C1-C6 алкил);
R2 представляет собой -H или -OCH3; и
R3 представляет собой аминосахар. Иллюстративные антрациклины доксорубицин, даунорубицин, эпирубицин, идарубицин и валрубицин описаны в таблице 1. Дополнительные иллюстративные антрациклины включают антрациклины, описанные в формулах I и II из Патента США No. 9107962, полное содержание которого приведено в настоящем описании в качестве ссылки.
Другие классы химиотерапевтических соединений, индуцирующих иммуногенную гибель клеток, включают алкилирующие средства, такие как содержащие платину противораковые лекарственные средства (например, цисплатин, оксалиплатин и карбоплатин), так же как (RS)-N,N-бис(2-хлорэтил)-1,3,2-оксазафосфинан-2-амин-2-оксид (циклофосфамид) и родственный метаболит 4-гидроксициклофосфамид.
Иммуногенную гибель клеток можно также индуцировать посредством сердечных гликозидов, таких как олеандрин, уабаин, буфалин, дигитоксин, дигоксин, цинобуфаталин, цинобуфагин и резибуфогенин.
Активность таких индукторов иммуногенной гибели клеток приводит к получению антигенпредставляющих клеток, привлекаемых для поглощения умирающих клеток опухолей в участке устройства для инъекции.
Ингибиторы супрессии иммунного ответа
Ингибиторы образованного опухолью иммуносупрессивного микроокружения используют для понижающей регуляции иммуносупрессии в участке опухоли, усиливающей действие средств, перечисленных выше. Ингибиторы могут включать, например, белки, пептиды, антитела, малые молекулы или молекулы для РНК-интерференции (РНКи), уменьшающие экспрессию белка-мишени.
Внутри опухолей существует множество ингибирующих путей, которые супрессируют представление антигена опухоли и противоопухолевый иммунный ответ. Например, TGF-β смягчает иммунологический надзор над опухолями и поляризует врожденные иммуноциты в сторону незрелого статуса дифференцировки, что предотвращает оптимальный противоопухолевый иммунитет. Кроме того, путь STAT3 стимулирует продукцию ингибирующих иммунитет цитокинов в опухоли, смягчает опосредованный T-клетками-помощниками 1 противоопухолевый иммунитет, и ингибирует созревание дендритных клеток. А также, индолeамин-пиррол 2,3-диоксигеназа (IDO или INDO EC 1.13.11.52). IDO представляет собой фермент, который у человека кодирован геном IDO1 и катализирует деградацию незаменимой аминокислоты L-триптофана до N-формилкинуренина. IDO может вызывать истощение триптофана в микроокружении опухоли, ингибируя активность T-клеток и дендритных клеток. Низкомолекулярные ингибиторы этих (TGF-β, STAT3 и IDO) и других иммуносупрессивных путей разработаны и протестированы клинически. Примеры таких ингибиторов включают ингибиторы пути TGF-β (LY2157299), ингибиторы пути STAT3 (BP-1-102), ингибиторы пути IDO (NLG919); ингибиторы пути PD-1, ингибиторы пути CTLA-4, ингибиторы пути LAG-3, ингибиторы пути B7-H3 и/или ингибиторы пути TIM3.
В дополнение к белковым ингибиторам и ингибиторам на основе антител, низкомолекулярные ингибиторы загружают в или на устройство и доставляют в локализацию опухоли/участок опухоли для ингибирования локальной опосредованной опухолью иммуносупрессии. Малые молекулы представляют собой соединения, имеющие молекулярную массу менее чем 1000 дальтон, например, 500 дальтон или менее, 250 дальтон или менее, 100 дальтон или менее. Иллюстративные низкомолекулярные иммуномодулирующие соединения, например, ингибиторы иммуносупрессии, описаны ниже. Многие являются в основном гидрофобными.
Ингибиторы TGF-β
Неограничивающие примеры ингибиторов TGF-β включают LY2157299, GW788388, LY364947, R268712, RepSox, SB525334 и SD208.
LY2157299 имеет следующую структуру:
LY2157299 также известен как галунисертиб и описан в Maier A, et al. (2015) Cell Oncol 38:131-144, полное содержание которого приведено в настоящем описании в качестве ссылки. Это соединение использовали для лечения солидных опухолей, таких как рак печени (например, печеночно-клеточная карцинома) (clinicaltrials.gov/ct2/show/NCT02240433?term=LY2157299&rank=2) и использовали в комбинации с антителом против PD-1 из Bristol Meyers Squibb для находящихся на поздних стадиях (метастазирующих и/или неоперабельных) глиобластомы, печеночно-клеточной карциномы и немелкоклеточного рака легкого - news.bms.com/press-release/rd-news/bristol-myers-squibb-and-lilly-enter-clinical-collaboration-agreement-evaluate
Эти и другие неограничивающие примеры ингибиторов TGF-β описаны в Патенте США No. 7265225, выданном 4 сентября 2007 г.; Патенте США No. 7834029, выданном 16 ноября 2010 г.; и Патенте США No. 7872020, выданном 8 января 2011 г., полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
GW788388 имеет следующую структуру:
GW788388 описан в Gellibert et al., (2006) Discovery of 4-{4-[3-(pyridin-2-yl)-1H-pyrazol-4-yl]pyridin-2-yl}-N-(tetrahydro-2H-pyran-4-yl)benzamide (GW788388): a potent, selective, and orally active transforming growth factor-β type I receptor inhibitor. J.Med.Chem. 49 2210, полное содержание которого приведено в настоящем описании в качестве ссылки.
LY364947 имеет следующую структуру:
LY364947 описан в Sawyer et al., (2003) Synthesis and activity of new aryl- and heteroaryl-substituted pyrazole inhibitors of the transforming growth factor-μ type I receptor kinase domain. Journal of Medicinal Chemistry, 46(19), 3953-3956, полное содержание которого приведено в настоящем описании в качестве ссылки.
R268712 имеет следующую структуру:
R268712 описан в Terashima et al., (2014) R-268712, an orally active transforming growth factor-β type I receptor inhibitor, prevents glomerular sclerosis in a Thy1 nephritis model. Eur.J.Pharmacol. 734:60, полное содержание которого приведено в настоящем описании в качестве ссылки.
RepSox имеет следующую структуру:
RepSox также известен как E-616452, SJN 2511, и ALK5 Ингибитор II. RepSox описан в Gellibert et al., (2004) Identification of 1,5-naphthyridine derivatives as a novel series of potent and selective TGF-γ type I receptor inhibitors. J.Med.Chem. 47(18), 4494-4506, полное содержание которого приведено в настоящем описании в качестве ссылки.
SB525334 имеет следующую структуру:
SB525334 описан в Grygielko et al., (2005) Inhibition of gene markers of fibrosis with a novel inhibitor of transforming growth factor-β type I receptor kinase in puromycin-induced nephritis. J.Pharmacol.Exp.Ther. 313 943, полное содержание которого приведено в настоящем описании в качестве ссылки.
SD208 имеет следующую структуру:
SD208 описан в Uhl et al., (2004) SD-208, a novel transforming growth factor β feceptor I kinase inhibitor, inhibits growth and invasiveness and enhances immunogeneicity of murine and human glioma cells in vitro and in vivo. Cancer Res. 64(21), 7954-7961, полное содержание которого приведено в настоящем описании в качестве ссылки.
Неограничивающие примеры антител, являющихся антагонистами TGF-β, включают метелимумаб (также известный как CAT-192) и фрезолимумаб (также известный как GC1008). Фрезолимумаб описан в  et al. (2008) «A cytokine-neutralizing antibody as a structural mimetic of 2 receptor interactions» Proceedings of the National Academy of Sciences 105 (51): 20251-20256, полное содержание которого приведено в настоящем описании в качестве ссылки.
et al. (2008) «A cytokine-neutralizing antibody as a structural mimetic of 2 receptor interactions» Proceedings of the National Academy of Sciences 105 (51): 20251-20256, полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы STAT3
Неограничивающие примеры ингибиторов STAT3 включают BP-1-102, S3I-M2001, STA-21, S3I-201, статтик, галиеллалактон, полипептид, имеющий последовательность PY*LKTK (SEQ ID NO: 1) (где Y* представляет фосфотирозин), и полипептид, имеющий последовательность Y*LPQTV (SEQ ID NO: 2) (где Y* представляет фосфотирозин). Дополнительные неограничивающие примеры ингибиторов STAT3 описаны в Yue and Turkson Expert Opin Investig Drugs. 2009 Jan; 18(1): 45-56, полное содержание которого приведено в настоящем описании в качестве ссылки.
S3I-M2001 имеет следующую структуру:
S3I-M2001 описан в Патенте США No. 8609639, выданном 17 декабря 2013 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
STA-21 имеет следующую структуру:
STA-21 описан в Miyoshi et al., J Invest Dermatol. 2011 Jan;131(1):108-17, полное содержание которого приведено в настоящем описании в качестве ссылки.
S3I-201 имеет следующую структуру:
S3I-201 описан в Siddiquee K, et al., Proc Natl Acad Sci U S A, 2007, 104(18), 7391-7396, полное содержание которого приведено в настоящем описании в качестве ссылки.
Статтик имеет следующую структуру:
Статтик описан в Schust J, et al., Chem Biol, 2006, 13(11), 1235-1242, полное содержание которого приведено в настоящем описании в качестве ссылки.
Галиеллалактон имеет следующую структуру:
Галиеллалактон описан в Don-Doncow et al., J Biol Chem. 2014 Jun 6;289(23):15969-78, полное содержание которого приведено в настоящем описании в качестве ссылки.
BP-1-102 имеет следующую структуру:
Передатчик сигнала и активатор транскрипции 3 (STAT3) представляет собой фактор транскрипции, который у человека кодирован геном STAT3. Ингибитор STAT3, BP-1-102, является активным против опухолей (например, солидных опухолей), таких как рак легкого человека и рак молочной железы у животных (PNAS 2012 109 (24) 9623-9628). Другой низкомолекулярный ингибитор STAT3 представляет собой OPB-31121 (Cancer Lett. 2013 Jul 10;335(1):145-52. doi: 10.1016/j.canlet.2013.02.010. Epub 2013 Feb 10).
Другим неограничивающим примером является OPB-31121 - clinicaltrials.gov/ct2/show/NCT00955812, clinicaltrials.gov/ct2/show/NCT01406574, OPB-31121 представляет собой биодоступный при пероральном введении ингибитор STAT3, с антинеопластической активностью. OPB-31121 ингибирует фосфорилирование STAT3, что предотвращает связывание STAT3 с последовательностями ДНК на множестве отвечающих на STAT3 промоторов и приводит к ингибированию опосредованной STAT3-транскрипции и, потенциально, к ингибированию пролиферации клеток опухоли. STAT3 является конститутивно активированным во множестве злокачественных опухолей, внося вклад в потерю контроля роста клеток и неопластическую трансформацию. OPB-31121 описан в Kim et al. (2013) OPB-31121, a novel small molecular inhibitor, disrupts the JAK2/STAT3 pathway and exhibits an antitumor activity in gastric cancer cells. Cancer Lett 335: 145-152, полное содержание которого приведено в настоящем описании в качестве ссылки.
Другие ингибиторы описаны в Miklossy et al., 2013 Nat. Rev. Drug Discov.12:611-629, полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы IDO
IDO экспрессируют клетки злокачественных опухолей в ряде типов опухоли. Высокая экспрессия IDO коррелирует с плохим исходом в ряде злокачественных опухолей, таких как рак яичника, рак эндометрия, рак толстого кишечника и меланома. Неограничивающие примеры ингибиторов IDO включают INCB24360, аналоги INCB24360, NLG919 (также известный как GDC-0919), норгарман, розмариновую кислоту, 1-метилтриптофан и индоксимод.
INCB24360
Структура аналога INCB24360, который также ингитбирует IDO, имеет следующую структуру:
Этот аналог описан в Yue et al., J Med Chem. 2009, 52(23), 7364-7367, полное содержание которого приведено в настоящем описании в качестве ссылки.
INCB24360, его аналог, показанный выше, и NLG919, представляют собой ингибиторы IDO1. Избирательное ингибирование IDO1 эффективно регулирует медиаторы противоопухолевого иммунитета (Liu et al., Blood, 2010, 115: 3520-3530, содержание которого приведено в настоящем описании в качестве ссылки). Эти лекарственные средства можно использовать для ингибирования опосредованных опухолями ускользания от иммунологического надзора или супрессии, и их, необязательно, комбинируют с блокаторами иммунных контрольных точек, такими как ингибиторы на основе антител, например, антитела против PD1 (clinicaltrials.gov/ct2/show/NCT02327078, содержание которого приведено в настоящем описании в качестве ссылки).
Норгарман представляет собой другой пример ингибитора IDO и имеет следующую структуру:
Норгарман описан в Chiarugi et al. (2000) Journal of Leukocyte Biology 68 (2): 260-6, полное содержание которого приведено в настоящем описании в качестве ссылки.
Розмариновая кислота представляет собой дополнительный пример ингибитора IDO и имеет следующую структуру:
Розмариновая кислота описана в Lee et al. (2007) Biochemical Pharmacology 73 (9): 1412-21, полное содержание которого приведено в настоящем описании в качестве ссылки.
1-метилтриптофан представляет собой дополнительный пример ингибитора IDO и имеет следующую структуру:
1-метилтриптофан описан в Hou et al. (2007) Cancer Res. 67 (2): 792-801, полное содержание которого приведено в настоящем описании в качестве ссылки.
Структура индоксимода представляет собой
Индоксимод описан в Soliman HH, Jackson E, Neuger T et al. A first in man phase I trial of the oral immunomodulator, indoximod, combined with docetaxel in patients with metastatic solid tumors. Oncotarget. 2014 Sep 30;5 (18):8136-46, полное содержание которого приведено в настоящем описании в качестве ссылки.
Дополнительные неограничивающие примеры ингибиторов IDO описаны в Публикации патентной заявки США No. US 2014315962, опубликованной 23 октября 2014 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы пути PD-1
PD-1 ограничивает активность T-клеток в периферических тканях во время воспалительного ответа на инфекцию и для ограничения аутоиммунитета. Блокада PD-1 in vitro усиливает пролиферацию T-клеток и продукцию цитокинов в ответ на заражение специфическими антигенными мишенями или посредством аллогенных клеток в реакциях смешанной культуры лимфоцитов. Показана сильная корреляция между экспрессией PD-1 и ответом с использованием блокады PD-1 (Pardoll, Nature Reviews Cancer, 12: 252-264, 2012). Блокаду PD-1 можно осуществлять посредством множества механизмов, включая антитела, которые связывают PD-1 или его лиганд, PD-L1. Примеры блокаторов PD-1 и PD-L1 описаны в Патентах США No. 7488802; 7943743; 8008449; 8168757; 8217149, и Опубликованных патентных заявках PCT No: WO03042402, WO2008156712, WO2010077634, WO2010089411, WO2010036959, WO2011066342, WO2011159877, WO2011082400, WO2011161699 и WO2013181452, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки. В конкретных вариантах осуществления блокаторы PD-1 включают антитела против PD-L1.
Неограничивающие примеры ингибиторов пути PD-1 включают AMP-224, ниволумаб (также известный как MDX-1106; ONO-4538), пембролизумаб, пидилизумаб, BMS 936559 (также известный как MDX-1105), MPDL3280A (также известный как атезолизумаб), MEDI4736 и MSB0010718C. Неограничивающие примеры ингибиторов пути PD-1 описаны также в Dolan and Gupta Cancer Control. 2014 Jul;21(3):231-7 полное содержание которого приведено в настоящем описании в качестве ссылки.
AMP-224, также известный как B7-DCIg, представляет собой слитый растворимый рецептор PD-L2-Fc. AMP-224 использовали в клинических исследованиях Национальных институтов здравоохранения США (NIH) номер NCT02298946. AMP-224 описан в Публикации патентной заявки США No. 2011/0223188, опубликованной 15 сентября 2011 г.; Публикации патентной заявки США No. 2013/0017199, опубликованной 17 января 2013 г.; и Smothers et al., Ann Oncol (2013) 24 (suppl 1): i7, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Ниволумаб также известен как ONO-4538, BMS-936558, MDX1106 и Opdivo. Ниволумаб описан в Патенте США No. 8008449, выданном 30 августа 2011 г.; и Sundar R, Cho BC, Brahmer JR, Soo RA (2015). «Nivolumab in NSCLC: latest evidence and clinical potential» Ther Adv Med Oncol 7 (2): 85-96, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Пембролизумаб также известен как MK-3475, ламбролизумаб и кейтруда. Пембролизумаб описан также в Патенте США No. 8952136, выданном 10 февраля 2015 г.; Патенте США No. 8168757, выданном 1 мая 2012 г.; и Hamid et al., (2013) «Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma» New England Journal of Medicine 369 (2): 134-44, полное содержание каждого из которых таким образом приведено в настоящем описании в качестве ссылки.
Пидилизумаб, также известный как CT-011 и описанный в Патенте США No. 8747847, выданном 10 июня 2014 г.; Westin et al. (2014) «Safety and Activity of PD1 Blockade by Pidilizumab in Combination with Rituximab in Patients with Relapsed Follicular Lymphoma: a Single Group, Open-label, Phase 2 Trial» Lancet Oncol. 15: 69-77, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
BMS 936559 также известен как MDX-1105. BMS 936559 описан в Патенте США No. 7943743,, выданном 17 мая 2011 г.; и Brahmer, J. R. et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N. Engl. J. Med. 366, 2455-2465 (2012), полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
MPDL3280A также известен как атезолизумаб. MPDL3280A имеет регистрационный номер CAS 1422185-06-5. MPDL3280A описан в McDermott et al., Atezolizumab, an Anti-Programmed Death-Ligand 1 Antibody, in Metastatic Renal Cell Carcinoma: Long-Term Safety, Clinical Activity, and Immune Correlates From a Phase Ia Study, J Clin Oncol. 2016 Jan 11. pii: JCO637421 (Epub ahead of print) PMID: 26755520.
MEDI4736 описан в Патенте США No. 8779108, выданном 15 июля 2014 г.; и Ibrahim et al., Semin Oncol. 2015 Jun;42(3):474-83, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
MSB0010718C также известен как авелумаб. Регистрационный номер CAS для MSB0010718C представляет собой 1537032-82-8. MSB0010718C описан в Boyerinas B, Jochems C, Fantini M, Heery CR, Gulley JL, Tsang KY, Schlom J. Cancer Immunol Res. 2015 Oct;3(10):1148-57, полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы CTLA-4
Неограничивающие примеры ингибиторы CTLA-4 включают тремелимумаб и ипилимумаб. См., например, Pardoll DM (April 2012). «The blockade of immune checkpoints in cancer immunotherapy». Nat. Rev. Cancer 12 (4): 252-64, полное содержание которого приведено в настоящем описании в качестве ссылки.
Тремелимумаб также известен как тицилимумаб и CP-675,206. Тремелимумаб описан в Antoni Ribas (28 June 2012). «Tumor immunotherapy directed at PD-1». New England Journal of Medicine 366 (26): 2517-9, полное содержание которого приведено в настоящем описании в качестве ссылки.
Ипилимумаб также известен как ервой, MDX-010 и MDX-101. Ипилимумаб описан в Antoni Ribas (28 June 2012). «Tumor immunotherapy directed at PD-1». New England Journal of Medicine 366 (26): 2517-9, полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы LAG-3
Неограничивающим примером ингибитора LAG-3 является IMP321. IMP321 представляет собой растворимый вариант молекулы иммунной контрольной точки LAG-3, использованный для усиления иммунного ответа на опухоли. IMP321 описан в Brignone et al. (2007) «IMP321 (sLAG-3), an immunopotentiator for T cell responses against a HBsAg antigen in healthy adults: a single blind randomised controlled phase I study» J Immune Based Ther Vaccines 5 (1): 5, полное содержание которого приведено в настоящем описании в качестве ссылки.
Неограничивающие примеры растворимых фракций белка LAG-3, которые можно использовать в некоторых вариантах осуществления изобретения, описанных в Патенте США No. 5955300, выданном 21 сентября 1999 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
Неограничивающие примеры антител против LAG-3 включают BMS-986016 и GSK2831781.
GSK2831781 описан в Публикации патентной заявки США No. 2014/0286935, опубликованной 25 сентября 2014 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
BMS-986016 описан в Международной патентной заявке PCT No. WO 2015/042246, опубликованной 26 марта 2015 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
Неограничивающие примеры антител против LAG-3 описаны в Публикации патентной заявки США No. 2014/0286935, опубликованной 25 сентября 2014 г.; Публикации патентной заявки США No. 2015/0307609, опубликованной 29 октября 2015 г.; PCT Публикация международной патентной заявки No. WO2008132601, опубликованной 6 ноября 2008 г., полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Ингибиторы B7-H3
Неограничивающий пример ингибитора B7-H3 представляет собой антитело, известное как MGA271. MGA271 описан в Loo et al. (2012) Cancer Res. 2012 Jul 15;18(14):3834-45, полное содержание которого приведено в настоящем описании в качестве ссылки.
Дополнительные неограничивающие примеры ингибиторов против B7-H3 описаны в Патенте США No. 8802091, выданном 12 августа 2014 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
Ингибиторы TIM3
Неограничивающие примеры ингибиторов TIM3 включают антитела, описанные в Патенте США No. 8841418, выданном 23 сентября 2014 г.; и Патент США No. 8552156, выданном 8 октября 2013 г., полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Иммуностимулирующие соединения
В рамках изобретения, и в зависимости от контекста, термин «иммуностимулирующее соединение» включает соединения, увеличивающие иммунный ответ субъекта на антиген. Примеры иммуностимулирующих соединений включают иммуностимуляторы и активирующие иммуноциты соединения. Устройства из объекта настоящего изобретения могут содержать иммуностимулирующие соединения, которые помогают программировать иммуноциты для узнавания лигандов и усиливать представление антигена.
Пример иммуностимулирующего соединения представляет собой PEI.
Иммуностимулирующее соединение включает также лиганды STING, например, циклические динуклеотиды (такие как циклический пуриновый динуклеотид). В некоторых вариантах осуществления, циклический динуклеотид представляет собой соединение, содержащее 2'-5' и/или 3'-5' фосфодиэфирную связь между двумя пуриновыми (например, адениновыми и/или гуаниновыми) нуклеотидами. Неограничивающие примеры лигандов STING описаны в Публикации международной патентной заявки PCT No. WO 2015/077354, опубликованной 28 мая 2015 г.; Патенте США No. 7709458, выданном 4 мая 2010 г.; Патенте США No. 7592326,, выданном 22 сентября 2009 г.; и Публикации патентной заявки США No. 2014/0205653, опубликованной 19 июня 2014 г., полное содержание каждого из которых, таким образом, приведено в настоящем описании в качестве ссылки. Циклические-динуклеотиды (CDN) включают, но без ограничения, ц-диаденозинмонофосфат (АМФ), ц-дигуанозинмонофосфат (ГМФ), ц-диинозинмонофосфат (ИМФ), ц-АМФ-ГМФ, ц-АМФ-ИМФ и ц-ГМФ-ИМФ, и их аналоги, включая, но без ограничения, фосфоротиоатные аналоги, обозначенные в настоящем описании как «тиофосфаты». Фосфоротиоаты представляют собой вариант нормальных нуклеотидов, в котором один из не образующих мостики атомов кислорода заменен на серу. Сульфирование межнуклеотидной связи очень сильно уменьшает действие эндо- и экзонуклеаз, включая экзонуклеазу 5′-3′- и 3′-5′-ДНК-полимеразы 1, нуклеазы S1 и P1, РНКазы, сывороточные нуклеазы и фосфодиэстеразу из яда змеи. Кроме того, увеличивается потенциал для пересечения липидного бислоя. Фосфоротиоатная связь является по своей природе хиральной. Специалисту в данной области известно, что каждый из фосфатов в этой структуре может существовать в R или S формах. Таким образом, формы Rp,Rp, Sp,Sp и Rp,Sp являются возможными. В каждом случае, предпочтительными являются в основном чистые диастереомеры Rp,Rp и Rp,Sp этих молекул. Примеры таких молекул тиофосфатов CDN включают тиофосфатные формы Rp,Rp-ц-диаденозинмонофосфата; Rp,Sp-ц-диаденозинмонофосфата; Rp,Rp-ц-дигуанозинмонофосфата и Rp,Sp-ц-дигуанозинмонофосфата.
Агонисты TLR, такие как агонисты TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 и TLR13, также представляют собой иммуностимулирующие соединения. TLR представляют собой класс имеющих одиночный трансмембранный домен, некаталитических рецепторов, которые узнают структурно консервативные молекулы, обозначенные как ассоциированные с патогенами молекулярные паттерны (PAMP). PAMP присутствуют на микроорганизмах и отличаются от молекул хозяина. TLR присутствуют у всех позвоночных. Тринадцать TLR (обозначенные как TLR1-13, последовательно) идентифицированы у человека и мышей. Человек содержит TLR 1-10. Иллюстративные агонисты TLR включают ассоциированные с патогенами молекулярные паттерны (PAMP), например, имитирующую инфекцию композицию, такую как происходящий из бактерий иммуномодулятор. Агонисты TLR включают композиции нуклеиновой кислоты или липида [например, монофосфориллипида A (MPLA)].
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR1 человека, представлен в No. доступа в GenBank NM_003263.3 (GI:41350336) (SEQ ID NO: 267), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR1 человека представлен в No. доступа в GenBank NP_003254.2 (GI:41350337) (SEQ ID NO: 268), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR1 включают триациллипопептиды.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR2 человека, представлен в No. доступа в GenBank NM_003264.3 (GI:68160956) (SEQ ID NO: 269), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR2 человека представлен в No. доступа в GenBank NP_003255.2 (GI:19718734) (SEQ ID NO: 270), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR2 включают бактериальные пептидогликаны, гликолипиды из бактериальных пептидогликанов, липопептиды из бактериальных пептидогликанов, липопротеины из бактериальных пептидогликанов, липотейхоевую кислоту, белок теплового шока 70 и зимозан.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR3 человека, представлен в No. доступа в GenBank NM_003265.2 (GI:19718735) (SEQ ID NO: 271), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR3 человека представлен в No. доступа в GenBank ABC86910.1 (GI:86161330) (SEQ ID NO: 272), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR3 включают двухцепочечную РНК, поли I:C и поли(A:U).
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR4 человека, представлен в No. доступа в GenBank NM_138554.4 (GI:373432600) (SEQ ID NO: 273), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR4 человека представлен в No. доступа в GenBank NP_612564.1 (GI:19924149) (SEQ ID NO: 274), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR4 включают липополисахарид (LPS), монофосфориллипид A (MPLA), белок теплового шока, фибриноген, гепаринсульфат или его фрагмент, гиалуроновую кислоту или ее фрагмент, никель, опиоид, α1-кислый гликопротеин (AGP), RC-529, β-дефензин 2 мыши, и полный адъювант Фрейнда (CFA).
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR5 человека, представлен в No. доступа в GenBank NM_003268.5 (GI:281427130) (SEQ ID NO: 275), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR5 человека представлен в No. доступа в GenBank NP_003259.2 (GI:16751843) (SEQ ID NO: 276), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR5 включают бактериальный флагеллин и профилин из Toxoplasma gondii.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR6 человека, представлен в No. доступа в GenBank NM_006068.4 (GI:318067953) (SEQ ID NO: 277), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR6 человека представлен в No. доступа в GenBank NP_006059.2 (GI:20143971) (SEQ ID NO: 278), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR6 включают диациллипопептиды из микоплазмы.
Неограничивающий пример последовательности нуклеиновой кислоты TLR7 человека представлен в No. доступа в GenBank NM_016562.3 (GI:67944638) (SEQ ID NO: 279), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR7 человека представлен в No. доступа в GenBank NP_057646.1 (GI:7706093) (SEQ ID NO: 280), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR7 включают имидазохинолины, такие как имидазохинолин, аналоги гуанозина, такие как локсорибин, имиквимод, гардиквимод, резиквимод, бропиримин и одноцепочечную РНК.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR8 человека, представлен в No. доступа в GenBank NM_138636.4 (GI:257196253) (SEQ ID NO: 281), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR8 человека представлен в No. доступа в GenBank NP_619542.1 (GI:20302168) (SEQ ID NO: 282), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры агонистов TLR8 включают малые синтетические соединения, одноцепочечную вирусную РНК и фагоцитированную бактериальную РНК.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR9 человека, изоформу A, представлен в No. доступа в NCBI NM_017442 (SEQ ID NO: 283), содержание которого приведено в настоящем описании в качестве ссылки. Аминокислотная последовательность TLR9 человека, изоформы A, представлена в No. доступа в NCBI NP_059138 (SEQ ID NO: 284), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающие примеры олигонуклеотидов TLR9 включают CpG-олигодезоксинуклеотиды.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR10 человека, представлен в No. доступа в GenBank NM_030956.3 (GI:306140488) (SEQ ID NO: 285), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR10 человека представлен в No. доступа в GenBank NP_112218.2 (GI:62865618) (SEQ ID NO: 286), содержание которого приведено в настоящем описании в качестве ссылки.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR11 мыши, представлен в No. доступа в GenBank NM_205819.3 (GI:408684412) (SEQ ID NO: 287), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR11 мыши представлен в No. доступа в GenBank NP_991388.2 (GI:408684413) (SEQ ID NO: 288), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающий пример агониста TLR11 включает профилин из Toxoplasma gondii.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR12 мыши, представлен в No. доступа в GenBank NM_205823.2 (GI:148539900) (SEQ ID NO: 289), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR12 мыши представлен в No. доступа в GenBank NP_991392.1 (GI:45430001) (SEQ ID NO: 290), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающий пример агониста TLR12 включает профилин из Toxoplasma gondii.
Неограничивающий пример последовательности нуклеиновой кислоты, кодирующей TLR13 мыши, представлен в No. доступа в GenBank NM_205820.1 (GI:45429998) (SEQ ID NO: 291), содержание которого приведено в настоящем описании в качестве ссылки. Пример аминокислотной последовательности TLR13 мыши представлен в No. доступа в GenBank NP_991389.1 (GI:45429999) (SEQ ID NO: 292), содержание которого приведено в настоящем описании в качестве ссылки. Неограничивающий пример агониста TLR13 включает последовательность рибосомальной РНК «CGGAAAGACC». (SEQ ID NO: 34)
Репрезентативный список агонистов TLR (как синтетических, так и природных лигандов), вместе с их соответствующими рецепторами, представлен в таблице 2 ниже.
Таблица 2
В различных вариантах осуществления, лиганд TLR содержит CpG-олигонуклеотид или полиI:C полинуклеотид. ПолиI:C представляет собой двухцепочечную РНК с несовпадениями, где одна цепь является полимером инозиновой кислоты, другая цепь является полимером цитидиловой кислоты. Полиинозиновая:полицитидиловая кислота (обозначенная полиI:C) является также иммуностимулятором или адъювантом. В некоторых вариантах осуществления, полиI:C полинуклеотид имеет длину по меньшей мере приблизительно, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 1, 0,1-1, 0,2-1, 1-1,5, 0,5-1,5, 0,5-2, 1-5, 1,5-5 или 1,5-8 тысяч пар оснований. В конкретных вариантах осуществления, полиI:C полинуклеотид имеет длину приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 1, 0,1-1, 0,2-1, 1-1,5, 0,5-1,5, 0,5-2, 1-5, 1,5-5, 1,5-8 или более тысяч пар оснований. Необязательно, его используют в форме его натриевой соли. ПолиI:C взаимодействует с TLR3 (т.е. полиI:C представляет собой лиганд TLR 3), который экспрессируется на мембране B-клеток, макрофагов и дендритных клетки. Необязательно, CpG или полиI:C являются конденсированными. Например, адъювант конденсируют и затем связывают с антигеном; альтернативно, адъювант связывают с антигеном и затем конъюгат конденсируют. Иллюстративные конденсирующие средства включают поли-L-лизин (PLL), полиэтиленимин (PEI), хлорид гексааминкобальта и пептид TAT 47-57 (YGRKKRRQRRR SEQ ID NO: 293).
Иммуностимулирующие соединения включают имиквимод, CRX-527 и OM-174.
Имиквимод имеет следующую структуру:
Это соединение описано в Патенте США No. 7323568, выданном 29 января 2008 г.; Патент США No. 8642616, выданном 4 февраля 2004 г.; Walter et al. (2013) Nat Commun 4: 1560; Bilu and Sauder (2003) Br. J. Dermatol. 149 Suppl 66: 5-8; и Miller et al. (1999) Int J Immunopharmacol 21 (1): 1-14, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Дополнительные неограничивающие примеры агонистов TLR включают CRX-527 и OM-174.
CRX-527 описан в Lembo et al., J Immunol. 2008 Jun 1;180(11):7574-81; и Hennessy et al., Nature Reviews Drug Discovery 9, 293-307 (April 2010), полное содержание каждого из которых, таким образом, приведено в настоящем описании в качестве ссылки. CRX-527 имеет химическое наименование (2S)-2-[[(3R)-3-деканоилокситетрадеканоил]амино]-3-[(2R,3R,4R,5S,6R)-3-[[(3R)-3-деканоилокситетрадеканоил]амино]-4-[(3R)-3-деканоилокситетрадеканоил]окси-6-(гидроксиметил)-5-фосфонооксиоксан-2-ил]оксипропионовая кислота.
OM-174 имеет химическое наименование [(3R)-1-[[(2R,3R,4R,5S,6R)-2-[[(2R,3S,4R,5R,6R)-3,4-дигидрокси-5-[[(3R)-3-гидрокситетрадеканоил]амино]-6-фосфонооксиоксан-2-ил]метокси]-4-гидрокси-6-(гидроксиметил)-5-фосфонооксиоксан-3-ил]амино]-1-оксотетрадекан-3-ил]додеканоат. OM-174 описан в Onier et al., Int J Cancer. 1999 May 31;81(5):755-60; Isambert et al., BMC Cancer (2013) 13:172; и Hennessy et al., Nature Reviews Drug Discovery 9, 293-307 (April 2010), полное содержание каждого из которых, таким образом, приведено в настоящем описании в качестве ссылки.
Последовательности цитозин-гуанозин (CpG)-олигонуклеотидов (CpG-ODN)
CpG-олигодезоксинуклеотиды (или CpG-ODN) представляют собой молекулы короткой одноцепочечной синтетической дезоксирибонуклеиновой кислоты (ДНК), содержащие дезоксинуклеотид цитозинтрифосфат («C»), за которым следует дезоксинуклеотид гуанинтрифосфат («G»). «p» относится к фосфодиэфирной связи между последовательными нуклеотиды, хотя некоторые ODN имеют вместо нее модифицированный фосфоротиоатный (PS) остов. В некоторых вариантах осуществления, CpG-олигодезоксинуклеотид имеет длину по меньшей мере приблизительно 15, 16, 17, 18, 19, 20, 25, 26, 27, 28, 29, 30, 15-30, 20-30, 20-25 или более нуклеотидов.
Участки CpG играют ключевую роль в метилировании ДНК, которое является одним из нескольких эндогенных механизмов, которые клетки используют для выключения экспрессии гена. Метилирование участков CpG внутри промоторных элементов может приводить к выключению гена. В случае злокачественной опухоли, известно, что гены супрессоров опухолей часто являются молчащими, в то время как онкогены, или индуцирующие развитие злокачественных опухолей гены, экспрессируются. Показано, что участки CpG в промоторных областях генов супрессоров опухолей (которые предотвращают образование злокачественных опухолей) являются метилированными, в то время как участки CpG в промоторных областях онкогенов являются гипометилированными или неметилированными в определенных злокачественных опухолях. Рецептор TLR-9 связывает неметилированные участки CpG в ДНК.
Различные композиции, описанные в настоящем описании, содержат CpG-олигонуклеотиды. CpG-олигонуклеотиды являются выделенными из эндогенных источников или синтезированными in vivo или in vitro. Иллюстративные источники эндогенных CpG-олигонуклеотидов включают, но без ограничения, микроорганизмы, бактерии, грибы, простейшие, вирусы, плесень или паразиты. Альтернативно, эндогенные CpG-олигонуклеотиды являются выделенными из доброкачественных или злокачественных неопластических опухолей млекопитающих. Синтетические CpG-олигонуклеотиды синтезируют in vivo после трансфекции или трансформации ДНК-матрицей организма-хозяина. Альтернативно, синтетические CpG-олигонуклеотиды синтезируют in vitro посредством полимеразной цепной реакции (ПЦР) или других известных в данной области способов (Sambrook, J., Fritsch, E.F., and Maniatis, T., Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, NY, Vol. 1, 2, 3 (1989), содержание которого приведено в настоящем описании в качестве ссылки).
CpG-олигонуклеотиды представляют для клеточного поглощения дендритными клетками. Например, используют голые CpG-олигонуклеотиды. Термин «голый» используют для описания выделенного эндогенного или синтетического полинуклеотида (или олигонуклеотида), который является свободным от дополнительных заместителей. В другом варианте осуществления, CpG-олигонуклеотиды связывают с одним или более соединениями для увеличения эффективности клеточного поглощения. Альтернативно или дополнительно, CpG-олигонуклеотиды связывают с одним или более соединениями для увеличения стабильности олигонуклеотида внутри каркаса и/или дендритной клетки. CpG-олигонуклеотиды, необязательно, конденсируют до клеточного поглощения. Например, CpG-олигонуклеотиды можно конденсировать с использованием полиэтилимина (PEI), катионного полимера, который увеличивает эффективность клеточного поглощения дендритными клетками для получения катионных наночастиц. CpG-олигонуклеотиды можно также конденсировать с использованием других поликатионных реагентов для получения катионный наночастицы. Дополнительные неограничивающие примеры поликатионных реагентов, которые можно использовать, включают дендримеры поли-L-лизина (PLL) и полиамидоамина (PAMAM).
Разработаны векторные системы, способствующие интернализации CpG в DC для улучшения доставки и ее локализации по TLR9. Богатый амином поликатион, полиэтилимин (PEI) широко использовали для конденсации плазмидной ДНК, посредством ассоциации с фосфатными группами ДНК, приводящей к получению небольших, положительно заряженных конденсатов, способствующих ассоциации с мембраной клеток и поглощению ДНК клетками (Godbey W. T., Wu K. K., and Mikos, A. G. J. of Biomed Mater Res, 1999, 45, 268-275; Godbey W. T., Wu K. K., and Mikos, A. G. Proc Natl Acad Sci USA. 96(9), 5177-81. (1999); содержание каждого из которых приведено в настоящем описании в качестве ссылки). Иллюстративный способ для конденсации CpG-ODN описан в Патентной заявке США No. US 20130202707 A1, опубликованной 8 августа 2013 г., полное содержание которой приведено в настоящем описании в качестве ссылки. Следовательно, PEI использовали в качестве невирусного вектора для улучшения трансфекции генов и для изготовления нагруженных PEI-ДНК матриц из PLG, способствующих длительной экспрессии гена в клетках-хозяевах in situ (Huang Y C, Riddle F, Rice K G, and Mooney D J. Hum Gene Ther. 5, 609-17. (2005), содержание которого приведено в настоящем описании в качестве ссылки).
CpG-олигонуклеотиды можно разделить на множество классов. Например, иллюстративные CpG-ODN, включенные в композиции, способы и устройства по настоящему изобретению, являются стимулирующими, нейтральными или супрессорными. Термин «стимулирующий» описывает класс последовательностей CpG-ODN, которые активируют TLR9. Термин «нейтральный» описывает класс последовательностей CpG-ODN, которые не активируют TLR9. Термин «супрессорный» описывает класс последовательностей CpG-ODN, которые ингибируют TLR9. Термин «активировать TLR9» описывает способ, посредством которого TLR9 инициирует внутриклеточную передачу сигналов.
Стимулирующие CpG-ODN можно далее разделить на три типа A, B и C, которые отличаются по их иммуностимулирующей активности. Стимулирующие CpG-ODN типа A характеризуются фосфодиэфирным центральным содержащим CpG палиндромным мотивом и фосфоротиоатным 3'-отрезком поли-G. После активации TLR9, эти CpG-ODN индуцируют высокую продукцию IFN-α в плазмацитоидных дендритных клетках (pDC). CpG-ODN типа A слабо стимулируют зависимую от TLR9 передачу сигналов NF-κB.
Стимулирующие CpG-ODN типа B содержат полностью фосфоротиоатный остов с одним или более CpG-динуклеотидами. После активации TLR9, эти CpG-ODN сильно активируют B-клетки. В отличие от CpG-ODN типа A, CpG-ODN типа B слабо стимулируют секрецию IFN-α.
Стимулирующие CpG-ODN типа C имеют признаки типов A и B. CpG-ODN типа C содержат полностью фосфоротиоатный остов и содержащий CpG палиндромный мотив. Подобно CpG-ODN типа A, CpG-ODN типа C индуцируют сильную продукцию IFN-α в pDC. Подобно CpG-ODN типа B, Подобно CpG-ODN типа C индуцируют сильную стимуляцию B-клеток.
Иллюстративные стимулирующие CpG-ODN содержат, но без ограничения, ODN 1585 (5'-ggGGTCAACGTTGAgggggg-3') (SEQ ID NO: 21), ODN 1668 (5'-tccatgacgttcctgatgct-3') (SEQ ID NO: 22), ODN 1826 (5'-tccatgacgttcctgacgtt-3') (SEQ ID NO: 23), ODN 2006 (5'-tcgtcgttttgtcgttttgtcgtt-3') (SEQ ID NO: 24), ODN 2006-G5 (5'-TCGTCGTTTTGTCGTTTTGTCGTTGGGGG-3') (SEQ ID NO: 25), ODN 2216 (5'-ggGGGACGA:TCGTCgggggg-3') (SEQ ID NO: 26), ODN 2336 (5'-gggGACGAC:GTCGTGgggggg-3') (SEQ ID NO: 27), ODN 2395 (5'-tcgtcgttttcggcgc:gcgccg-3') (SEQ ID NO: 28), ODN M362 (5'-tcgtcgtcgttc:gaacgacgttgat-3') (SEQ ID NO: 29) (все из InvivoGen). Настоящее изобретение относится также к любому гуманизированному варианту предшествующих CpG-ODN. В одном предпочтительном варианте осуществления, композиции, способы и устройства по настоящему изобретению содержат ODN 1826 (последовательность, которая от 5' до 3' представляет собой tccatgacgttcctgacgtt, где элементы CpG подчеркнуты, SEQ ID NO: 23).
Нейтральные, или контрольные, CpG-ODN, которые не стимулируют TLR9, включены в настоящее изобретение. Эти ODN содержат такую же последовательность, как их стимулирующие эквиваленты, но содержат GpC-динуклеотиды вместо CpG-динуклеотидов.
Иллюстративные нейтральные или контрольные, CpG-ODN, включенные в настоящее изобретение, включают, но без ограничения, контрольный ODN 1585, контрольный ODN 1668, контрольный ODN 1826, контрольный ODN 2006, контрольный ODN 2216, контрольный ODN 2336, контрольный ODN 2395, контрольный ODN M362 (все из InvivoGen). Настоящее изобретение относится также к любому гуманизированному варианту предшествующих CpG-ODN.
Иммуностимулирующие антитела
Дополнительные иммуностимулирующие соединения включают иммуностимулирующие антитела. Аспекты объекта настоящего изобретения относятся к использованию иммуностимулирующих антител для стимуляции или активации клеток иммунной системы. Обеспечение стимуляции иммуноцитов, таких как T-клетки и дендритные клетки, в микроокружении опухоли улучшает противоопухолевый иммунный ответ. В некоторых вариантах осуществления, стимуляцию проводят с использованием иммуностимулирующего антитела, которое осуществляет связывание и является агонистом поверхностного рецептора на T-клетках или дендритных клетках. В конкретных вариантах осуществления, функцию T-клеток улучшают с использованием одного или более антител, нацеленных на одну или более костимулирующих молекул клеточной поверхности, таких как 4-1BB (CD137) и OX40 (CD134), что приводит к улучшенным пролиферации и выживаемости T-клетки. В некоторых вариантах осуществления, активацию дендритной клетки облегчают с использованием одного или более агонистических антител против CD40. Как правило из-за их иммуностимулирующего характера, эти антитела могут приводить к неспецифической связанной с иммунитетом токсичности при системном введении. Введение этих антител в участок действия с использованием устройства или каркаса из объекта настоящего изобретения позволяет обойти эту проблему посредством фокусирования дозы в желательном участке действия. Кроме того, клиническую активность иммуностимулирующих антител улучшают посредством концентрирования их дозы в участке опухоли с использованием устройства или каркаса, как описано в настоящем описании.
Антитела против CD137
CD137 представляет собой поверхностную молекулу, обнаруженную на активированных T-клетках, которая обеспечивает костимуляцию этих клеток. Стимуляция CD137 приводит к усиленной пролиферации T-клеток и защищает T-клетки от индуцированной активацией гибели клеток. Показано, что в нескольких доклинических моделях CD137 приводил к противоопухолевый активности. BMS-66513 (урелумаб), один из неограничивающих примеров антитела против CD137, тестировали в нескольких клинических исследований, и показано, что он приводит к частичной ремиссии заболевания, но с токсичностью для печени, среди других аутоиммунных осложнений (Ascierto et al., 2010, Seminars in Oncology). PF-05082566 представляет собой другой пример антитела против CD137 в клинической обработке. PF-05082566 описан в Fisher et al. (2012) Cancer Immunol Immunother. 61(10):1721-33, полное содержание которого приведено в настоящем описании в качестве ссылки. Как указано выше, множество антител против CD137, включая антитела, непригодные для системной доставки, можно использовать в устройствах и каркасах из объекта настоящего изобретения.
Иллюстративный неограничивающий пример аминокислотной последовательности CD137 является публично доступным из GenBank No: AAH06196.1 (SEQ ID NO: 35).
Антитела против CD134
CD134 экспрессируется в первую очередь на активированных CD4+ и CD8+ T-клетках и обеспечивает костимуляцию при привлечении. Привлечение CD134 с использованием лиганда, такого как антитело против CD134, стимулирует выживаемость и размножение T-клеток. Неограничивающие примеры антител против CD134 включают 9B12 и MEDI6469. 9B12 описан в Curti et al. (2013) Cancer Res 73: 7189, полное содержание которого приведено в настоящем описании в качестве ссылки. MEDI6469 описан в Leidner et al. Journal of Clinical Oncology, 2015 ASCO Annual Meeting (May 29 - June 2, 2015). Vol 33, No 15_suppl (May 20 Supplement), 2015: TPS6083, полное содержание которого приведено в настоящем описании в качестве ссылки.
Иллюстративный неограничивающий пример аминокислотной последовательности CD134 является публично доступным как GenBank No: AAI05071.1 (SEQ ID NO: 36).
Антитела против CD40
CD40 представляет собой поверхностный рецептор, обнаруженный на антигенпредставляющих клетках, таких как дендритные клетки. Привлечение CD40 приводит к активации антигенпредставляющих клеток, процессу, важному для их функции. Эта активация дендритных клеток приводит к повышающей регуляции костимулирующих рецепторов и продукции провоспалительных цитокинов, что приводит к увеличенной способности к примированию T-клеток. Показано, что агонистические антитела против CD40 имеют ограниченную активность в клинике (Vonderheide and Glennie, 2013, Clinical Cancer Research). Неограничивающие примеры антител против CD40 включают HCD122 (лукатумумаб), CP-870,893, SGN-40 huS2C6 (дацетузумаб) и Chi Lob 7/4. Эти антитела находятся в клинической разработке. Как объяснено выше, даже антитела, непригодные для системного применения, можно использовать в некоторых вариантах осуществления объекта настоящего изобретения с небольшим количеством или отсутствием неблагоприятных побочных эффектов. Лукатумумаб описан в Fanale et al. (2014) Br J Haematol. 164(2):258-65, полное содержание которого приведено в настоящем описании в качестве ссылки. CP-870,893 описан в Glaude et al. (2011) Cancer Immunol. Immunother. 60, 1009-1017 (2011), полное содержание которого приведено в настоящем описании в качестве ссылки. Дацетузумаб описан в de Vos et al. (2014) Journal of Hematology & Oncology20147:44, полное содержание которого приведено в настоящем описании в качестве ссылки. Chi Lob 7/4 описан в Vonderheide and Glennie (2013) Clin Cancer Res. 19(5): 1035-1043, полное содержание которого приведено в настоящем описании в качестве ссылки.
Иллюстративный неограничивающий пример аминокислотной последовательности CD40 является публично доступным как GenBank No: AAH12419.1 (SEQ ID NO: 37).
Ингибиторы и блокирование иммунных контрольных точек
Различные варианты осуществления объекта настоящего изобретения относятся к введению ингибитора супрессии T-клеток или дендритных клеток и каркасов или устройств, содержащих ингибитор супрессии T-клеток или дендритных клеток. Неограничивающие примеры таких ингибиторов включают ингибиторы пути TGF-β, ингибиторы пути STAT3 и ингибиторы пути IDO, так же как ингибиторы иммунных контрольных точек, такие как ингибиторы пути PD-1, ингибиторы пути CTLA-4, ингибиторы пути LAG-3, ингибиторы пути CD276 (также известного как B7-H3) и ингибиторы пути TIM3.
Внутри опухолей существует множество ингибирующих путей, супрессирующих представление антигена опухоли и противоопухолевый иммунный ответ. Например, TGF-β смягчает иммунологический надзор над опухолью и поляризует врожденные иммуноциты в сторону незрелого статуса дифференцировки, что предотвращает оптимальный противоопухолевый иммунитет. Кроме того, путь STAT3 стимулирует продукцию ингибирующих иммунитет цитокинов в опухоли, смягчает опосредованный T-клетками-помощниками 1 противоопухолевый иммунитет, и ингибирует созревание дендритных клеток. Низкомолекулярные ингибиторы этих путей и других иммуносупрессивных путей, описанные выше, доставляют в опухоль с использованием устройств с криогелем или гидрогелем. Можно использовать также другие способы изменения микроокружения опухоли, например, антитела против белков иммунных контрольных точек.
Ассоциированный с цитотоксическими T-лимфоцитами антиген 4 (CTLA-4) представляет собой белок иммунных контрольных точек, осуществляющий понижающую регуляцию путей активации T-клеток (Fong et al., Cancer Res. 69(2):609-615, 2009; Weber Cancer Immunol. Immunother, 58:823-830, 2009). Показано, что блокирование CTLA-4 усиливает активацию и пролиферацию T-клеток. Ингибиторы CTLA-4 включают антитела против CTLA-4. Антитела против CTLA-4 связываются с CTLA-4 и блокируют взаимодействие CTLA-4 с его лигандами CD80/CD86, экспрессированными на антигенпредставляющих клетках, и таким образом, блокируют отрицательную понижающую регуляцию иммунных ответов, вызываемых взаимодействием этих молекул. Примеры антител против CTLA-4 описаны в Патентах США No: 5811097; 5811097; 5855887; 6051227; 6207157; 6682736; 6984720; и 7605238. Одно антитело против CTLA-4 представляет собой тремелимумаб, (тицилимумаб, CP-675.206). В одном варианте осуществления, антитело против CTLA-4 представляет собой ипилимумаб (также известный как 10D1, MDX-D010) полностью человеческое моноклональное антитело IgG, которое связывается с CTLA-4. Ипилимумаб выпущен на рынок под наименованием ервой™ и одобрен для лечения неоперабельной или метастазирующей меланомы.
Другие ингибиторы иммунных контрольных точек включают ингибиторы гена-3 активации лимфоцитов (LAG-3), такие как IMP321, растворимый слитый с Ig белок (Brignone et al., 2007, J. Immunol. 179:4202-4211). Другие ингибиторы иммунных контрольных точек включают ингибиторы B7, такие как ингибиторы B7-H3 и B7-H4. В частности, антитело против B7-H3 MGA271 (Loo et al., 2012, Clin. Cancer Res. July 15 (18) 3834). Включены также ингибиторы TIM3 (белка с доменом T-клеточного иммуноглобулина и доменом 3 муцина) (Fourcade et al., 2010, J. Exp. Med. 207:2175-86 и Sakuishi et al., 2010, J. Exp. Med. 207:2187-94).
Взаимодействие лиганд-рецептор, которое исследовали в качестве мишени для лечения злокачественных опухолей, представляет собой взаимодействие между трансмембранным белком 1 программируемой гибели клеток (PDCD1, PD-1; также известным как CD279) и его лигандом, лигандом 1 PD-1 (PD-L1, CD274). В нормальной физиологии, PD-L1 на поверхности клетки связывается с PD1 на поверхности иммуноцита, что ингибирует активность иммуноцита. Повышающая регуляция PD-L1 на поверхности клеток злокачественных опухолей может позволять им ускользать от иммунной системы хозяина посредством ингибирования T-клеток, которые в ином случае могут атаковать клетку опухоли. Антитела, которые связываются либо с PD-1, либо с PD-L1, и таким образом блокируют взаимодействие, могут позволять T-клеткам атаковать опухоль. Описано антитело IgG4 против PD1, называемое ниволумаб (Pardoll, DM, 2012, Nature reviews. Cancer 12 (4): 252-64). Множество иммунных контрольных точек инициируется посредством взаимодействий лиганд-рецептор; таким образом, их можно легко блокировать посредством антител или модулировать посредством рекомбинантных форм лигандов или рецепторов. Другие примеры блокаторов на основе антител включают антитела, специфические для ассоциированного с цитотоксическими T-лимфоцитами антигена 4 (CTLA4).
В различных вариантах осуществления, антитело представляет собой поликлональное антитело, моноклональное антитело, химерное антитело, гуманизированное антитело или человеческое антитело.
В некоторых вариантах осуществления, антитело против PD-1 представляет собой ниволумаб, пембролизумаб или пидилизумаб. Ниволумаб описан в Johnson et al. (2015) Ther Adv Med Oncol 7 (2): 97-106; и Sundar R et al. (2015) Ther Adv Med Oncol 7 (2): 85-96, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки. Пембролизумаб описан в Hamid et al. (2013) New England Journal of Medicine 369 (2): 134-44, полное содержание которого приведено в настоящем описании в качестве ссылки. Пидилизумаб описан в Westin et al. (2014) «Safety and Activity of PD1 Blockade by Pidilizumab in Combination with Rituximab in Patients with Relapsed Follicular Lymphoma: a Single Group, Open-label, Phase 2 Trial» doi:10,1016/S1470-2045(13)70551-5, полное содержание которого приведено в настоящем описании в качестве ссылки.
В конкретных вариантах осуществления, антитело против PD-L1 представляет собой BMS-936559 или MPDL3280A. BMS-936559 описан в Brahmer JR et al. (2012) N Engl J Med. 2012;366:2455, полное содержание которого приведено в настоящем описании в качестве ссылки. MPDL3280A описан в Herbst RS et al. (2013) J Clin Oncol. 31(suppl; abstr 3000); Soria JC et al. (2013) European Cancer Congress Amsterdam (abstr 3408); Hamid O et al. (2013) J Clin Oncol31(suppl; abstr 9010); и Kohrt H et al. (2013) J Immunother Cancer. 2013; 1(suppl 1):O12, полное содержание каждого из которых приведено в настоящем описании в качестве ссылки.
Дополнительные антитела против PD1 и PD-L1 описаны в Патенте США No. 8952136, выданном 10 февраля 2015 г., полное содержание которого приведено в настоящем описании в качестве ссылки.
В различных вариантах осуществления, антитело против CTLA-4 представляет собой ипилимумаб. Ипилимумаб описан во вкладыше в упаковку «Yervoy (ipilimumab) (package insert)» Princeton, NJ: Bristol-Myers Squibb Company; Dec 2013. Retrieved 29 October 2014, полное содержание которого приведено в настоящем описании в качестве ссылки.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)
Гранулолцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) представляет собой белок, секретируемый макрофагами, T-клетками, тучными клетками, эндотелиальными клетками и фибробластами. Конкретно, GM-CSF представляет собой цитокин, функционирующий в качестве фактора роста лейкоцитов. GM-CSF стимулирует стволовые клетки к образованию гранулоцитов и моноцитов. Моноциты выходят в кровоток, мигрируют в ткани и затем созревают до макрофагов.
Различные устройства каркасов, описанные в настоящем описании, содержат и высвобождают полипептиды GM-CSF для привлечения DC хозяина в устройство. Предусмотренные полипептиды GM-CSF являются выделенными из эндогенных источников или синтезированными in vivo или in vitro. Эндогенный полипептиды GM-CSF являются выделенными из здоровой ткани человека. Синтетические полипептиды GM-CSF синтезируют in vivo после трансфекции или трансформации ДНК-матрицей организма или клетки - хозяина, например, млекопитающего или культивированной линии клеток человека. Альтернативно, синтетические полипептиды GM-CSF синтезируют in vitro посредством полимеразной цепной реакции (ПЦР) или других известных в данной области способов Sambrook, J., Fritsch, E.F., and Maniatis, T., Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, NY, Vol. 1, 2, 3 (1989), содержание которого приведено в настоящем описании в качестве ссылки).
Полипептиды GM-CSF модифицируют для увеличения стабильности белка in vivo. Альтернативно, полипептиды GM-CSF конструируют, чтобы они являлись более или менее иммуногенными. Эндогенные зрелые полипептиды GM-CSF человека являются гликозилированными, по сообщениям, по аминокислотным остаткам 23 (лейцин), 27 (аспарагин) и 39 (глутаминовая кислота) (см. Патент США No. 5073627). Полипептиды GM-CSF по настоящему изобретению являются модифицированными по одному или более из этих аминокислотных остатков применительно к состоянию гликозилирования.
Полипептиды GM-CSF являются рекомбинантными. Альтернативно, полипептиды GM-CSF представляют собой гуманизированные производные полипептидов GM-CSF млекопитающих. Иллюстративные виды млекопитающих, из которых происходят полипептиды GM-CSF, включают, но без ограничения, мышь, крысу, хомяка, морскую свинку, хорька, кошку, собаку, обезьяну или примата. В предпочтительном варианте осуществления, GM-CSF представляет собой рекомбинантный белок человека (PeproTech, каталожный # 300-03). Альтернативно, GM-CSF представляет собой рекомбинантный мышиный белок (мыши) (PeproTech, каталожный #315-03). Наконец, GM-CSF представляет собой гуманизированное производное рекомбинантного мышиного белка.
Рекомбинантный GM-CSF человека (PeproTech, каталожный # 300-03) кодирован следующей полипептидной последовательностью (SEQ ID NO: 30):
MAPARSPSPS TQPWEHVNAI QEARRLLNLS RDTAAEMNET VEVISEMFDL QEPTCLQTRL ELYKQGLRGS LTKLKGPLTM MASHYKQHCP PTPETSCATQ IITFESFKEN LKDFLLVIPF DCWEPVQE
Рекомбинантный GM-CSF мыши (PeproTech, каталожный # 315-03) кодирован следующей полипептидной последовательностью (SEQ ID NO: 31):
MAPTRSPITV TRPWKHVEAI KEALNLLDDM PVTLNEEVEV VSNEFSFKKL TCVQTRLKIF EQGLRGNFTK LKGALNMTAS YYQTYCPPTP ETDCETQVTT YADFIDSLKT FLTDIPFECK KPVQK
Эндогенный GM-CSF человека кодирован следующей последовательностью мРНК (No. доступа в NCBI NM_000758 и SEQ ID NO: 32):
1 acacagagag aaaggctaaa gttctctgga ggatgtggct gcagagcctg ctgctcttgg
61 gcactgtggc ctgcagcatc tctgcacccg cccgctcgcc cagccccagc acgcagccct
121 gggagcatgt gaatgccatc caggaggccc ggcgtctcct gaacctgagt agagacactg
181 ctgctgagat gaatgaaaca gtagaagtca tctcagaaat gtttgacctc caggagccga
241 cctgcctaca gacccgcctg gagctgtaca agcagggcct gcggggcagc ctcaccaagc
301 tcaagggccc cttgaccatg atggccagcc actacaagca gcactgccct ccaaccccgg
361 aaacttcctg tgcaacccag attatcacct ttgaaagttt caaagagaac ctgaaggact
421 ttctgcttgt catccccttt gactgctggg agccagtcca ggagtgagac cggccagatg
481 aggctggcca agccggggag ctgctctctc atgaaacaag agctagaaac tcaggatggt
541 catcttggag ggaccaaggg gtgggccaca gccatggtgg gagtggcctg gacctgccct
601 gggccacact gaccctgata caggcatggc agaagaatgg gaatatttta tactgacaga
661 aatcagtaat atttatatat ttatattttt aaaatattta tttatttatt tatttaagtt
721 catattccat atttattcaa gatgttttac cgtaataatt attattaaaa atatgcttct
781 a
Эндогенный GM-CSF человека кодирован следующей аминокислотной последовательностью (No. доступа в NCBI NP_000749.2 и SEQ ID NO: 33):
MWLQSLLLLGTVACSISAPARSPSPSTQPWEHVNAIQEARRLLNLSRDTAAEMNETVEVISEMFDLQEPTCLQTRLELYKQGLRGSLTKLKGPLTMMASHYKQHCPPTPETSCATQIITFESFKENLKDFLLVIPFDCWEPVQE
Антигены злокачественных опухолей
Композиции, способы, и устройства по настоящему изобретению включают антигены злокачественных опухолей, предназначенные для вакцинации и/или обеспечения защитного иммунитета для субъекта, которому вводят такое устройство. В некоторых вариантах осуществления, антиген злокачественной опухоли/опухоли происходит из субъекта, которому вводят устройство в рамках изобретения. В конкретных вариантах осуществления, антиген злокачественной опухоли/опухоли происходит от различных субъектов. В различных вариантах осуществления, антиген опухоли присутствует в лизате клеток опухоли. Например, лизат клеток опухоли может содержать одну или более лизированных клеток из биоптата. В некоторых вариантах осуществления, антиген опухоли присутствует на ослабленной живой клетке злокачественной опухоли. Например, ослабленная живая клетка злокачественной опухоли может представлять собой облученную клетку злокачественной опухоли.
Иллюстративные антигены злокачественных опухолей, включенные в композиции, способы и устройства по настоящему изобретению включают, но без ограничения, лизаты опухолей, экстрагированные из биоптатов, облученные клетки опухолей, серии антигенов MAGE (MAGE-1 представляет собой один пример), MART-1/мелан a, тирозиназу, ганглиозид, gp100, GD-2, O-ацетилированный GD-3, GM-2, муцин 1, Sos1, связывающий протеинкиназу C белок, белок обратную транскриптазу, белок AKAP, VRK1, KIAA1735, T7-1, T11-3, T11-9, фермент теломеразу Homo sapiens (hTRT), цитокератин-19 (CYFRA21-1), антиген 1 плоскоклеточной карциномы (SCCA-1), белок T4-A, антиген 2 плоскоклеточной карциномы (SCCA-2), антиген CA125 (1A1-3B) карциномы яичников (KIAA0049), антиген se1-1 опухоли CTCL, антиген se14-3 опухоли CTCL, антиген se20-4 опухоли CTCL, антиген se20-9 опухоли CTCL, антиген se33-1 опухоли CTCL, антиген se37-2 опухоли CTCL, антиген se57-1 опухоли CTCL, антиген se89-1 опухоли CTCL, специфический для предстательной железы мембранный антиген, онкофетальный гликопротеин трофобластов 5T4, Orf73 ассоциированного с саркомой Капоши- вируса герпеса, MAGE-C1 (антиген CT7 злокачественных опухолей/яичек), антиген MAGE-B1 (антиген MAGE-XP), DAM10, антиген MAGE-B2 (DAM6), антиген MAGE-2, антиген MAGE-4a, антиген MAGE-4b, антиген NY-CO-45 рака толстого кишечника, вариант A антигена NY-LU-12 рака легкого, ассоциированный со злокачественными опухолями поверхностный антиген, антиген ART1 аденокарциномы, ассоциированный с злокачественными опухолями головного мозга-яичек паранеопластический антиген, онконейрональный антиген MA2, паранеопластический нейрональный антиген, нейроонкологический вентральный антиген 2 (NOVA2), антиген гена 520 печеночно-клеточной карциномы, опухолеассоциированный антиген CO-029, опухолеассоциированный антиген MAGE-X2, точка разрыва 2 хромосомы X при синовиальной саркоме, антиген плоскоклеточной карциномы, узнаваемый T-клетками, серологически определенный антиген 1 рака толстого кишечника, серологически определенный антиген NY-BR-15 рака молочной железы, серологически определенный антиген NY-BR-16 рака молочной железы антиген, белок опухоли Вильмса (пептид WT-1), хромогранин A; паратиреоидный секреторный белок 1, DUPAN-2, CA 19-9, CA 72-4, CA 195 или карциноэмбриональный антиген (CEA).
Антигены микроорганизмов
В некоторых вариантах осуществления, антиген происходит из микроорганизма, такого как бактерия, вирус, простейшее, архея или гриб. Различные варианты осуществления относятся к вакцинации против или к лечению бактериальной, вирусной или грибковой инфекции. В различных вариантах осуществления, a носитель для доставки содержит антиген из патогена. Например, патоген включает но без ограничения, гриб, бактерию (например, вид Staphylococcus, Staphylococcus aureus, вид Streptococcus, Streptococcus pyogenes, Pseudomonas aeruginosa, Burkholderia cenocepacia, вид Mycobacterium, Mycobacterium tuberculosis, Mycobacterium avium, вид Salmonella, Salmonella typhi, Salmonella typhimurium, вид Neisseria, вид Brucella, вид Bordetella, вид Borrelia, вид Campylobacter, вид Chlamydia, вид Chlamydophila, вид Clostrium, Clostrium botulinum, Clostridium difficile, Clostridium tetani, вид Helicobacter, Helicobacter pylori, Mycoplasma pneumonia, вид Corynebacterium, Neisseria gonorrhoeae, Neisseria meningitidis, вид Enterococcus, вид Escherichia, Escherichia coli, вид Listeria, вид Francisella, вид Vibrio, Vibrio cholera, вид Legionella или Yersinia pestis), вирус (например, аденовирус, вирус Эпштейна-Барр, вирус гепатита A, вирус гепатита B, вирус гепатита C, вирус простого герпеса типа 1, 2 или 8, вирус иммунодефицита человека, вирус гриппа, кори, вирус свинки, папилломавирус человека, вирус полиомиелита, вирус бешенства, респираторно-синцитиальный вирус, вирус краснухи или вирус ветряной оспы), паразит или простейшее (например, Entamoeba histolytica, Plasmodium, Giardia lamblia, Trypanosoma brucei или паразитическое простейшее, такое как вызывающий малярию Plasmodium). Например, антиген патогена происходит из клетки или частицы патогена, описанных в настоящем описании.
Антитела
Термин «антитело» используют в самом широком смысле, и он конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), одновалентные антитела, мультивалентные антитела и фрагменты антител, при условии, что они имеют желательную биологическую активность (например, Fab и/или антитела с одним плечом).
«Фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но без ограничения, Fv, Fab, Fab', Fab'-SH, F (ab')2; диатела; линейные антитела; молекулы одноцепочечного антитела (например, scFv); и мультиспецифические антитела, сформированные из фрагментов антител.
Термины «полноразмерное антитело», «интактное антитело» и «полное антитело» используют в настоящем описании взаимозаменяемо для обозначения антитела, имеющего структуру, по существу сходную со структурой природного антитела, или имеющего тяжелые цепи, содержащие область Fc.
Фрагмент «Fv» представляет собой фрагмент антитела, содержащий полный участок узнавания и связывания антигена. Эта область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в жесткой связи, которая может являться ковалентной по природе, например, в scFv. В этой конфигурации три гипервариабельные области (HVR) каждого вариабельного домена взаимодействуют для определения антигенсвязывающего участка на поверхности димера VH-VL. Совместно, шесть HVR или их подгруппа придает антителу специфичность связывания антигена. Однако даже одиночный вариабельный домен (или половина Fv, содержащая только три HVR, специфические для антигена) имеет способность узнавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный участок связывания.
Фрагмент «Fab» содержит вариабельный и константный домен легкой цепи и вариабельный домен и первый константный домен (CHI) тяжелой цепи. Фрагменты антитела F(ab')2 содержат пару фрагментов Fab, которые, как правило, являются ковалентно связанными около их карбокси-концов посредством шарнирных остатков цистеина между ними. Другие химические соединения фрагментов антител также известны в данной области.
«Одноцепочечные Fv» или фрагменты «scFv» антител содержат домены VH и VL антитела, где эти домены присутствуют на одной полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и L, который позволяет scFv формировать желательную структуру для связывания антигена. Обзор scFv, см. в Pluckthun in The Pharmacology of Monoclonal Antibodies, Vol 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-31S (1994), полное содержание которого приведено в настоящем описании в качестве ссылки.
Термин «диатела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, содержащими вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) на одной и той же полипептидной цепи (VH и VL). Посредством использования линкера, который является слишком коротким, чтобы позволять спаривание между двумя доменами на одной и той же цепи, домены вынуждают спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка. Диатела более полно описаны, например, в BP 404,097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), полное содержание которого приведено в настоящем описании в качестве ссылки.
Выражение «линейные антитела» относится к антителам, описанным в Zapata et al., Protein Eng., 8 (10): 1057-1062 (1995), полное содержание которого приведено в настоящем описании в качестве ссылки. Кратко, эти антитела содержат пару тандемных фрагментов Fd (VH-CH1-VH-CH1) которые, вместе с комплементарными полипептидами легкой цепи, формируют пару антигенсвязывающих областей. Линейные антитела могут являться биспецифическими или моноспецифическими.
Термин «моноклональное антитело», в рамках изобретения, относится к антителу, полученному из популяции в основном гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантов антител, например, содержащих природные мутации или возникающих во время получения препарата моноклонального антитела, такие варианты, как правило, присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), где каждое моноклональное антитело из препарата моноклональных антител направлено против одной детерминанты антигена. Таким образом, определение «моноклональные» указывает на характер антитела, как полученное из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые можно использовать, можно получать множеством способов, включая, но без ограничения, способ гибридомы, способ рекомбинантной ДНК, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов иммуноглобулинов человека, такие способы и другие иллюстративные способы получения моноклональных антител описаны в настоящем описании.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, в то время как остаток тяжелой и/или легкой цепи происходит из другого источника или вида.
«Гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из не относящихся к человеку HVR и аминокислотные остатки из человеческих FR. В конкретных вариантах осуществления, гуманизированное антитело содержит в основном все из по меньшей мере одного, и как правило, двух, вариабельных доменов, в которых все или в основном все из HVR (например, CDR) соответствуют областям из не относящегося к человеку антитела, и все или в основном все из FR соответствуют областям из человеческого антитела. Гуманизированное антитело, необязательно, может содержать по меньшей мере часть константной области антитела, происходящий из человеческого антитела. «Гуманизированная форма» антитела, например, не относящегося к человеку антитела, относится к антителу, подвергнутому гуманизации.
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или клеткой человека, или происходящего из не относящегося к человеку источника, который использует репертуар антител человека или другие кодирующие антитело человека последовательности. Это определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее не относящиеся к человеку антигенсвязывающие остатки.
РНК-интерференция
В рамках изобретения, «индуцирующее РНК-интерференцию соединение» или «соединение для РНКи» относится к соединению, способному индуцировать РНК-интерференцию или «РНКи» экспрессии белка, в зависимости от контекста. РНКи включает деградацию мРНК, однако, многие из биохимических механизмов, лежащих в основе этой интерференции, неизвестны. Использование РНКи описано в Fire et al., 1998, Carthew et al., 2001, и Elbashir et al., 2001, содержание которого приведено в настоящем описании в качестве ссылки.
Выделенные молекулы РНК могут опосредовать РНКи. То есть, выделенные молекулы РНК по настоящему изобретению опосредуют деградацию или блокирование экспрессии мРНК, которая является продуктом транскрипции гена, который также обозначен как ген-мишень. Для удобства, такая мРНК может быть также обозначена в настоящем описании как мРНК, подлежащая деградации. Термины РНК, молекула(молекулы) РНК, сегмент(ы) РНК и фрагмент(ы) РНК можно использовать взаимозаменяемо для обозначения РНК, опосредующей РНК-интерференцию. Эти термины включают двухцепочечную РНК, малую интерферирующую РНК (миРНК), шпилечную РНК, одноцепочечную РНК, выделенную РНК (частично очищенную РНК, в основном чистую РНК, синтетическую РНК, полученную рекомбинантным способом РНК), так же как измененную РНК, которая отличается от природной РНК из-за добавления, делеции, замены и/или изменения одного или более нуклеотидов. Такое изменение может включать добавление не относящегося к нуклеотидам материала, например, на конце (концах) РНК или внутри (в одном или более нуклеотидах РНК). Нуклеотиды в молекулах РНК по настоящему изобретению могут также содержать нестандартные нуклеотиды, включая неприродные нуклеотиды или дезоксирибонуклеотиды. Совместно, все такие измененные молекулы РНКи обозначают как аналоги или аналоги природной РНК. Для РНК по настоящему изобретению необходимо только значительное сходство с природной РНК, так чтобы она имела способность опосредовать РНКи.
В рамках изобретения, фраза «опосредовать РНКи» обозначает и показывает способность различать, какие молекулы РНК должны быть затронуты аппаратом или процессом РНКи. РНК, опосредующая РНКи, взаимодействует с аппаратом РНКи таким образом, что она направляет этот аппарат на деградацию конкретных мРНК или на уменьшение иным образом экспрессии белка-мишени. В одном варианте осуществления, настоящее изобретение относится к молекулам РНК, управляющим расщеплением специфической мРНК, которой соответствует их последовательность. Не является необходимым, чтобы присутствовало точное соответствие последовательностям, однако, соответствие должно быть достаточным, чтобы позволять РНК управлять ингибированием с помощью РНКи посредством расщепления или блокирования экспрессии мРНК-мишени.
Как отмечено выше, молекулы РНК по настоящему изобретению, как правило, содержат часть РНК и какую-либо дополнительную часть, например, дезоксирибонуклеотидную часть. В некоторых вариантах осуществления, молекулы РНКи содержат приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 нуклеотидов, приблизительно от 16 до 29 нуклеотидов, приблизительно от 18 до 23 нуклеотидов или приблизительно 21-23 нуклеотида. В различных вариантах осуществления, устройство или каркас содержит одну или более молекул РНКи, которые опосредуют РНКи одного или более генов, ингибирующих супрессию T-клетки или дендритной клетки. В некоторых вариантах осуществления, ген-мишень представляет собой ген иммунных контрольных точек. В некоторых вариантах осуществления, ген-мишень представляет собой иммуносупрессирующий ген. В конкретных вариантах осуществления, ген-мишень кодирует белок TGF-β, STAT3, IDO, PD-1, PD-1 лиганд 1, CTLA-4, LAG-3 или TIM3. Неограничивающие примеры нуклеотидных последовательностей для каждой из этих мишеней являются следующими: TGF-β (GenBank No: M60316.1, SEQ ID NO: 13); STAT3 (эталонная последовательность в NCBI No: NM_139276.2, SEQ ID NO: 14); IDO1 (эталонная последовательность в NCBI No: NM_002164.5, SEQ ID NO: 15); PD-1 (эталонная последовательность в NCBI No: NM_005018.2, SEQ ID NO: 16); PD-L1 (эталонная последовательность в NCBI No: NM_014143.3, SEQ ID NO: 17); CTLA-4 (эталонная последовательность в NCBI No: NM_001037631.2, SEQ ID NO: 18); LAG-3 (GenBank No: X51985.3, SEQ ID NO: 19); и TIM3 (GenBank No: AF450242.1, SEQ ID NO: 20). Эти последовательности не являются ограничивающими, поскольку можно нацеливаться на дополнительные варианты и изоформы каждого белка.
В различных вариантах осуществления, молекула РНКи может присутствовать в устройстве или каркасе вместе со средством для трансфекции. Например, молекула РНКи может являться конденсированной с дендримером полиэтилимина (PEI), поли-L-лизина (PLL) или полиамидоамина (PAMAM). См., например, Huang et al. (2005) Human Gene Therapy 16:609-617. Дополнительные неограничивающие примеры средств для трансфекции включают липосомы (например, липофектамин).
Дендритные клетки
Дендритные клетки (DC) представляют собой иммуноциты в составе иммунной системы млекопитающих и происходят из гематопоэтических клеток-предшественников костного мозга. Более конкретно, дендритные клетки можно подразделять на такие категории, как лимфоидная (или плазмацитоидная) дендритная клетка (pDC) и миелоидная дендритная клетка (mDC), образованные из лимфоидной (или плазмацитоидной) или миелоидной клетки-предшественника, соответственно. Из клетки-предшественника, вне зависимости от типа клетки-предшественника, образуется незрелая дендритная клетка. Незрелые дендритные клетки характеризуются высокой эндоцитозной активностью и низким потенциалом активации T-клеток. Таким образом, незрелые дендритные клетки постоянно анализируют свое непосредственное окружение на наличие патогенов. Иллюстративные патогены включают, но без ограничения, вирус или бактерию. Анализ осуществляется посредством узнающих паттерн рецепторов (PRR), таких как toll-подобные рецепторы (TLR). Дендритные клетки активируются и созревают после узнавания патогена узнающим паттерн рецептором, таким как toll-подобный рецептор.
Зрелые дендритные клетки не только фагоцитируют патогены и разрушают их, но также осуществляют деградацию их белков и представляют фрагменты этих белков, также обозначаемые как антигены, на своей клеточной поверхности с использованием молекул MHC (главного комплекса гистосовместимости) (классов I, II и III). Зрелые дендритные клетки также осуществляют повышающую регуляцию рецепторов поверхности клетки, которые служат корецепторами для активации T-клетки. Иллюстративные корецепторы включают, но без ограничения, CD80, CD86 и CD40. Одновременно, зрелые дендритные клетки осуществляют повышающую регуляцию хемотаксических рецепторов, таких как CCR7, позволяющих клеткам мигрировать через кровоток или лимфатическую систему в селезенку или лимфатический узел, соответственно.
Дендритные клетки присутствуют во внешних тканях, которые находятся в контакте с внешним окружением, таких как кожа (дендритные клетки, находящиеся в коже, также обозначены как клетки Лангерганса). Альтернативно, дендритные клетки присутствуют во внутренних тканях, которые находятся в контакте с внешним окружением, таких как слизистые оболочки носа, легких, желудка и кишечника. Наконец, незрелые дендритные клетки находятся в кровотоке. После активации, дендритные клетки из всех этих тканей мигрируют в лимфоидные ткани, где они представляют антигены и взаимодействуют с T-клетками и B-клетками для инициации иммунного ответа. Одна из систем передачи сигналов, представляющих особую важность для настоящего изобретения, включает рецептор хемокинов CCR7, экспрессированный на поверхности дендритных клеток, и лиганд рецептора хемокинов CCL19, секретируемый структурами лимфатического узла для привлечения зрелых дендритных клеток к высоким концентрациям иммуноцитов. Иллюстративные иммуноциты, активированные посредством контакта с зрелыми дендритными клетками, включают, но без ограничения, T-клетки-помощники, T-клетки-киллеры и B-клетки. Несмотря на то, что множество типов клеток в иммунной системе представляют антигены, включая макрофаги и B-лимфоциты, дендритные клетки являются наиболее сильными активаторами всех антигенпредставляющих клеток.
Дендритные клетки получили свое наименование из-за характерной формы клеток, включающей множество дендритов, выступающих из тела клетки. Функциональным преимуществом этой формы клеток является значительно увеличенная клеточная поверхность и площадь контакта с окружением, по отношению к объему клетки. Незрелые дендритные клетки иногда лишены характерных дендритных образований, и обозначены как вуалевидные клетки. Вуалевидные клетки имеют большие цитоплазматические вуалевидные отростки, а не дендриты.
Плазмацитоидные дендритные клетки (pDC) представляют собой врожденные иммуноциты, циркулирующие в крови и обнаруженные в периферических лимфоидных органах. Они составляют <0,4% мононуклеарных клеток периферической крови (PBMC). У человека эти клетки экспрессируют поверхностные маркеры CD123, BDCA-2(CD303) и BDCA-4(CD304), но не экспрессируют высокие уровни CD11c или CD14, что отличает их от обычных дендритных клеток или моноцитов, соответственно. pDC мыши экспрессируют CD11c, B220, BST-2 (mPDCA) и Siglec-H и являются отрицательными по CD11b. Как компоненты врожденной иммунной системы, эти клетки экспрессируют внутриклеточные Toll-подобные рецепторы 7 и 9, которые детектируют оцРНК и CpG-мотивы ДНК, соответственно. При стимуляции и последующей активации, эти клетки продуцируют большие количества интерферона типа I (в основном IFN-α (альфа) и IFN-β (бета)), которые являются критическими плейотропными противовируснными соединениями, опосредующими широкий диапазон эффектов. CD8- подгруппа представляет антиген с использованием пути класса II CD4+ T-клеткам-помощникам. CD8+ подгруппа представляет антигены с использованием пути класса I. Пептид/молекулы MHC класса I представляют CD8+ T-клеткам, которые переходят к тому, чтобы становиться цитотоксическими T-лимфоцитами (CTL). Белок клеточной поверхности CD8 у мышей соответствует белку клеточной поверхности CD141 у человека. CD8/CD141-положительные клетки экспрессируют TLR3, и их предпочтительно активируют посредством агонистов TLR3.
Системы материалов
Композиции каркаса могут содержать биоразлагаемые и/или небиоразлагаемые материалы. Иллюстративные небиоразлагаемые материалы включают, но без ограничения, металл, пластиковый полимер или шелковый полимер. В различных вариантах осуществления, композиция каркаса содержит биосовместимый материал, который является нетоксичным или неиммуногенным. В некоторых вариантах осуществления, композиция каркаса содержит воспалительный материал, например, мезопористый диоксид кремния. В конкретных вариантах осуществления, композиция каркаса деградирует с предопределенной скоростью, основанной на физическом параметре, выбранном из группы, состоящей из температуры, pH, статуса гидратации и пористости, плотности перекрестного сшивания, типа и химической природы или чувствительности связей главной цепи к деградации, или она деградирует с предопределенной скоростью на основании соотношения химических полимеров. Например, высокомолекулярный полимер, состоящий только из лактида, как правило, деградирует в течение периода нескольких лет, например, 1-2 лет, в то время как низкомолекулярный полимер, состоящий из смеси 50:50 лактида и гликолида, как правило, деградирует за несколько недель, например, 1, 2, 3, 4, 6, 10 недель. Перекрестно сшитые посредством кальция гели, состоящие из высокомолекулярного, альгината с высоким содержанием гулуроновой кислоты, как правило, деградируют в течение от нескольких месяцев (1, 2, 4, 6, 8, 10, 12 месяцев) до нескольких лет (1, 2, 5 лет) in vivo, в то время как гель, состоящий из низкомолекулярного альгината, и/или альгината, который был частично окислен, может деградировать за несколько недель.
В конкретных вариантах осуществления, одно или более соединений, описанных в настоящем описании, являются ковалентно или не ковалентно связанным или соединенным с композиция каркаса. В различных вариантах осуществления, одно или более соединений, описанных в настоящем описании, включены в структуру или поры каркаса, присутствуют внутри структуры или пор каркаса, или включены в композицию каркаса.
В различных вариантах осуществления, любой тип криогеля или гидрогеля является пригодным в качестве устройства для доставки.
Гидрогель (также называемый аквагелем) представляет собой сеть цепей полимеров, которые являются гидрофильными и иногда бывают обнаружены в форме коллоидного геля, в котором вода является диспергирующей средой. Гидрогели представляют собой высоко абсорбирующие (они могут содержать более 99% воды) природные или синтетические полимеры, имеющие степень гибкости, очень сходную с природной тканью, из-за их значительного содержания воды. В отличие от общепринятых гидрогелей, уникальной характеристикой устройств, описанных в настоящем описании, является то, что при воздействии соответствующего напряжения сдвига, поддающийся деформации гидрогель очень сильно и обратимо сжимается (вплоть до 95% от своего объема), что обеспечивает получение пригодных для инъекций макропористых предварительно сформированных каркасов. Это свойство позволяет доставлять устройства посредством шприца с высокой точностью в участки-мишени.
Аспекты объекта настоящего изобретения относятся к клик-гидрогелям и клик-криогелям. Клик-гидрогель или криогель представляет собой гель, в котором перекрестное сшивание между полимерами гидрогеля или криогеля облегчают посредством клик-реакций между полимерами. Каждый полимер может содержать одну или более функциональных групп, которые можно использовать в клик-реакции. Принимая во внимание высокий уровень специфичности пар функциональных групп в клик-реакции, активные соединения можно добавлять в предварительно сформированное устройство до или во время формирования гидрогелевого устройства посредством клик-химии. Неограничивающие примеры клик-реакций, которые можно использовать для формирования клик-гидрогелей, включают катализируемое медью I циклоприсоединение азида-алкина, стимулируемое растяжением циклоприсоединение азида-алкина, тиол-еновое фотоприсоединение, реакции Дильса-Альдера, реакции Дильса-Альдера с обратными электронными требованиями, тетразол-алкеновые фото-клик-реакции, реакции оксимов, реакцию присоединения тиола по Михаэлю и сочетание альдегида-гидразида. Неограничивающие аспекты клик-гидрогелей описаны в Jiang et al. (2014) Biomaterials, 35:4969-4985, полное содержание которого приведено в настоящем описании в качестве ссылки.
В различных вариантах осуществления, используют клик-альгинат (см., например, Публикацию международной патентной заявки PCT No. WO 2015/154078 опубликованной 8 октября 2015 г., полное содержание которой, таким образом, приведено в качестве ссылки).
Иллюстративные клик-гидрогелевые материалы устройств и каркасов включают гидрогель, содержащий первый полимер и второй полимер, где первый полимер соединен с вторым полимером посредством линкеров формулы (A):
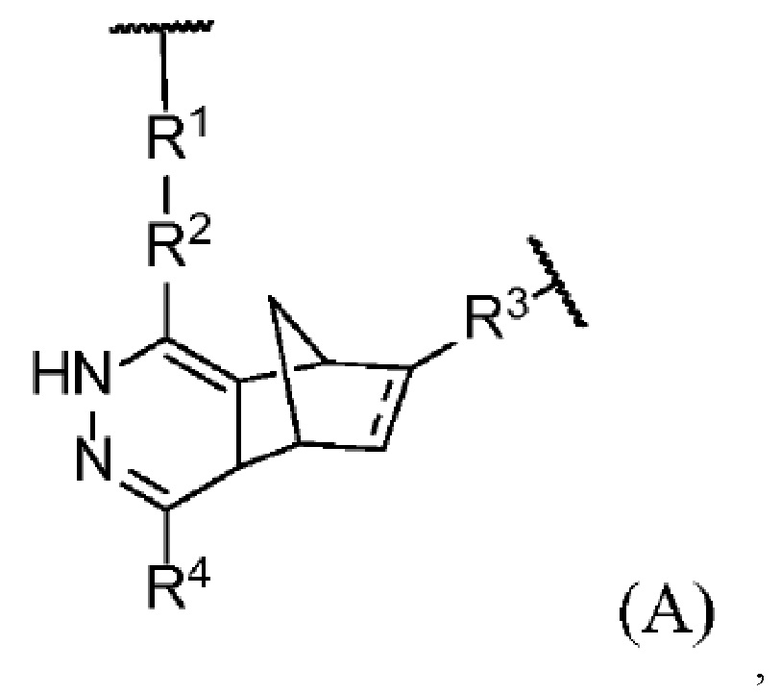
где
связь --- представляет собой одинарную или двойную связь;
R1 представляет собой -C0-C6алкил-NR2N-, -C0-C6алкил -O- или -C0-C3алкил-C(O)-;
R2 представляет собой связь, арил или гетероарил, где арил и гетероарил, необязательно, являются замещенными галогеном, гидрокси, C1-C6алкилом, C1-C6алкокси, (C1-C6алкил)амино или ди(C1-C6алкил)амино;
R3 представляет собой -C0-C6алкил-NR2N-, -C0-C6алкил-O-, или -C0-C3алкил-C(O)-; и R4 представляет собой водород, C1-C6алкил, арил, или гетероарил, где арил и гетероарил, необязательно, являются замещенными галогеном, гидрокси, C1-C6алкилом, C1-C6алкокси, (C1-C6алкил)амино или ди(C1-C6алкил)амино.
R2N независимо представляет собой водород, C1-C6 алкил, арил, гетероарил, R2N, или R2, где C1-C6 алкил, арил и гетероарил, необязательно, являются замещенными галогеном, гидрокси, C1-C6алкил, C1-C6алкокси, (C1-C6алкил)амино или ди(C1-C6алкил)амино. В одном варианте осуществления, гидрогель по этому описанию представляет собой гидрогель, в котором линкеры формулы (A) находятся в форме формулы (I):
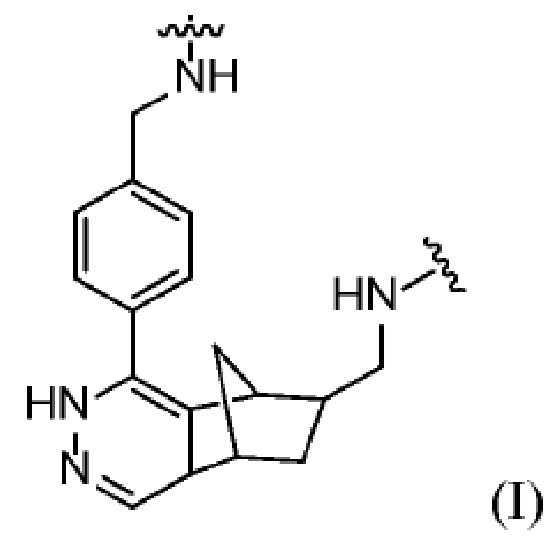
или формулы (II):
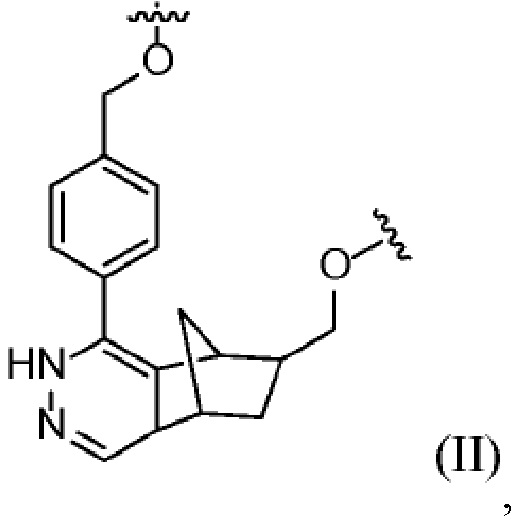
или формулы (III):
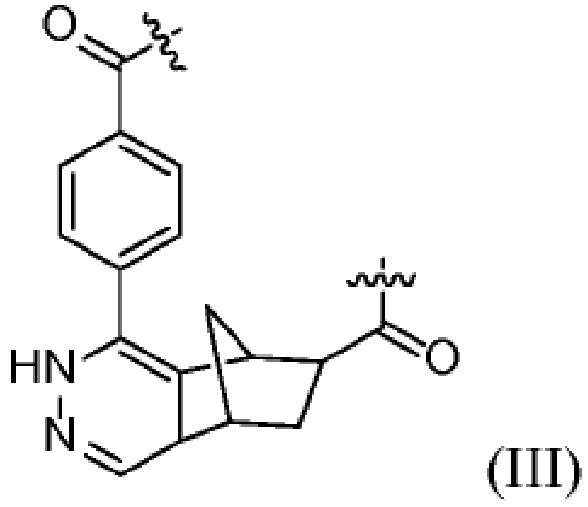
где линкеры формулы (I), (II) или (III), необязательно, являются замещенными в любом подходящем положении.
Другой вариант осуществления относится к линкерам формулы (A) в соответствии с любым предшествующим вариантом осуществления, где R1 представляет собой
a. -NR2N-, -C1-C6 алкил-NR2N-, -O-, -C1-C6алкил-O-, -C(O)- или -C1-C3алкил-C(O)-;
b. -C0-C6алкил-NR2N-;
c. -C1-C6алкил-NR2N-;
d. -C1-C3алкил-NR2N-;
e. -метил-NH- или -пентил-NH-;
f. -C0-C6алкил-O-;
г. -C1-C6алкил-O-;
h. -C1-C3алкил-O-;
i. -метил-O- или -пентил-O-;
j. -C0-C3алкил-C(O)-;
k. -C(O)-;
1. -метил-C(O)-;
m. такой же, как R3.
R2N независимо представляет собой водород, C1-C6алкил, арил, гетероарил, R2N или R2, где C1-C6алкил, арил и гетероарил необязательно, являются замещенными галогеном, гидрокси, C1-C6 алкилом, C1-C6алкокси, (C1-C6алкил)амино или ди(C1-C6 алкил)амино.
Другой вариант осуществления относится к линкерам формулы (A) в соответствии с любым предшествующим вариантом осуществления, где R2 представляет собой связь.
В одном варианте осуществления, линкеры формулы (A), в соответствии с любым предшествующим вариантом осуществления, представляют собой линкеры, в которых R2 представляет собой
a. арил или гетероарил, каждый, необязательно, замещенный;
b. необязательно, замещенный арил;
c. фенил;
d. необязательно, замещенный гетероарил; или
e. пиридил, пиримидил или пиразинил.
Другой вариант осуществления относится к линкерам формулы (A), в соответствии с любым предшествующим вариантом осуществления, где R3 представляет собой
a. -NR2N-, -C1-C6алкил-NR2N-, -O-, -C1-C6алкил-O-, -C(O)-, или -C1-C3алкил-C(O)-;
b. -C0-C6алкил-NR2N-;
c. -C1-C6алкил-NR2N-;
d. -C1-C3алкил-NR2N-;
e. -метил-NH- или -пентил-NH-;
f. -C0-C6алкил-O-;
г. -C1-C6алкил-O-;
h. -C1-C3алкил-O-;
i. -метил-O- или -пентил-O-;
j. -C0-C3алкил-C(O)-;
k. -C(O)-;
1. -метил-C(O)-; или
m. такой же, как R1.
R2N независимо представляет собой водород, C1-C6алкил, арил, гетероарил, R2N, или R2, где C1-C6алкил, арил и гетероарил, необязательно, являются замещенными галогеном, гидрокси, C1-C6 алкилом, C1-C6 алкокси, (C1-C6 алкил)амино, или ди(C1-C6 алкил)амино. В одном варианте осуществления, линкеры формулы (A), в соответствии с любым предшествующим вариантом осуществления, представляют собой линкеры, в которых R4 представляет собой водород.
В одном варианте осуществления, линкеры формулы (A), в соответствии с любым предшествующим вариантом осуществления, представляют собой линкеры, где R4 представляет собой
a. C1-C6 алкил, арил, или гетероарил, где арил и гетероарил, необязательно, являются замещенными;
b. арил или гетероарил, где арил и гетероарил, необязательно, являются замещенными; c. необязательно, замещенный арил;
d. фенил;
e. необязательно, замещенный гетероарил; или
f. пиридил, пиримидил или пиразинил.
Другой вариант осуществления относится к линкерам формулы (A), в соответствии с любым предшествующим вариантом осуществления, где R4 представляет собой C1-C6 алкил, C1-C3 алкил или метил.
В некоторых вариантах осуществления, гидрогель содержит множество линкеров формулы (A); или формулы (I), формулы (II) или формулы (III).
Изобретение также относится к гидрогелю, содержащему взаимосвязанную сеть из множества полимеров, например, включающую первый полимер и второй полимер. Например, полимеры являются соединенными посредством множества линкеров формулы (A) или формулы (I), формулы (II), или формулы (III).
Некоторые варианты осуществления настоящего описания относятся к гидрогелям, где первый полимер и второй полимер независимо представляют собой растворимые полимеры. В других вариантах осуществления, первый полимер и второй полимер независимо представляют собой водорастворимые полимеры.
В некоторых случаях, концентрация перекрестных сшивок на гидрогель (например, где каждая перекрестная ссылка имеет формулу I) составляет по меньшей мере приблизительно 10% (масс./масс.), например, по меньшей мере приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 97%, приблизительно 99% или приблизительно 100% (масс./масс.).
Первый полимер и второй полимер могут являться одинаковыми или различными. В некоторых вариантах осуществления, первый полимер и второй полимер представляют собой один и тот же тип полимера. В других вариантах осуществления, первый полимер и/или второй полимер содержат полисахарид. Например, первый полимер и второй полимер оба могут содержать полисахарид. В некоторых вариантах осуществления, первый полимер и/или второй полимер независимо выбраны из группы, состоящей из альгината, хитозана, полиэтиленгликоля (PEG), желатина, гиалуроновой кислоты, коллагена, хондроитина, агарозы, полиакриламида и гепарина. В некоторых вариантах осуществления, первый полимер и второй полимер представляют собой один и тот же полимер, независимо выбранный из группы, состоящей из альгината, хитозана, полиэтиленгликоля (PEG), желатина, гиалуроновой кислоты, коллагена, хондроитина, агарозы, полиакриламида и гепарина.
Такие каркасы и материалы каркаса, так же как способы получения таких каркасов, описаны в Публикации международной патентной заявки PCT No. WO 2015/154078, опубликованной 8 октября 2015 г., полное содержание которой приведено в настоящем описании в качестве ссылки. Например, клик-гидрогель можно получать способом: a) получения первого полимера, содержащего первую группу для клик-реакции, и второго полимера, содержащего вторую группу для клик-реакции. В неограничивающих примерах, первая группа для клик-реакции и вторая группа для клик-реакции могут вступать в реакцию друг с другом в катализируемом медью I циклоприсоединении азида-алкина, стимулируемом растяжением циклоприсоединении азида-алкина, тиол-еновом фотоприсоединении, реакции Дильса-Альдера, реакции Дильса-Альдера с обратными электронными требованиями, тетразол-алкеновой фото-клик-реакции, реакции оксимов, присоединении тиола по Михаэлю, или сочетании альдегида-гидразида. В одном варианте осуществления, первая группа для клик-реакции представляет собой диеновую группу, и вторая группа для клик-реакции представляет собой диенофильную группу. В одном варианте осуществления, первая группа для клик-реакции представляет собой тетразиновую группу, и вторая группа для клик-реакции представляет собой норборненовую группу. В рамках изобретения, термины «тетразин» и «тетразиновая группа» включают молекулы, которые содержат 1,2,4,5-тетразин, замещенный пригодным спейсером для связывания с полимером (например, алкиламинами, подобными метиламину или пентиламину), и необязательно, дополнительно замещенные одним или более заместителями в любом доступном положении. Иллюстративные тетразиновые группы, пригодные для композиций и способов по настоящему описанию, описаны в Karver et al. Bioconjugate Chem. 22(2011):2263-2270, и WO 2014/ 065860, содержание обоих из которых приведено в настоящем описании в качестве ссылки). В рамках изобретения, термины «норборнен» и «норборненовые группы» включают, но без ограничения, группы норборнадиена и норборнена, дополнительно содержащие пригодный спейсер для связывания с полимером (например, алкиламины, подобные метиламину или пентиламину), и необязательно, дополнительно замещенные одним или более заместителями в любом доступном положении. Такие группы включают, например, норборнен-5-метиламин и норборнадиенметиламин.
Соответственно, некоторые варианты осуществления относятся к совместимой с клетками и необязательно, адгезивной для клеток, полимерной композиции гидрогеля с высоким уровнем перекрестного сшивания (например, криогеля), содержащего открытые взаимосвязанные поры, где гидрогель (например, криогель) характеризуется эффектом памяти формы после деформации посредством сжатия или дегидратации. Устройство имеет высокую плотность открытых взаимосвязанных пор. А также, гидрогель (например, криогель) содержит перекрестно сшитый желатиновый полимер или перекрестно сшитый альгинатный полимер.
В некоторых вариантах осуществления, система с криогелем может доставлять (вместе с несущими антиген клетками опухолей) GM-CSF и специфический агонист TLR (такой как CpG-ODN), в то же время создавая пространство для инфильтрации и миграции DC. GM-CSF представляет собой цитокин, который действует как фактор усиления/привлечения DC, и CpG ODN представляет собой адъювант, являющийся специфическим агонистом TLR (фактор активации DC).
Устройства с MA-альгинатным криогелем могут функционировать в качестве платформы для вакцины посредством создания локальной иммуногенной ниши. В общем, криогель создает локальную иммуногенную нишу, в которой встреча DC и клеток опухолей находится под жестким контролем, что является благоприятным для индукции сильного и продолжительного противоопухолевого иммунного ответа. Вакцину на основе криогеля можно конструировать для координации доставки адъюванта и антигена в пространстве и времени, потенциально усиливая общую производительность вакцины посредством более близкого совпадения доставки факторов с кинетикой примирования и активации DC-T-клеток. Эта платформа для вакцины разработана для обеспечения соответствующей костимуляции DC посредством создания локального пространства, где DC могут иметь поверхность контакта с клетками опухолей в присутствии иммуномодулирующих факторов. Конкретно, макропоры создают физическое пространство для взаимодействия DC и клеток опухолей в присутствии высвобожденных иммуномодулирующих факторов, в отсутствие толерогенных условий, присутствующих в ложе опухоли. В отличие от болюсной доставки клеток опухолей и адъюванта, клетки и иммуномодулирующие средства локализованы в небольшом объеме, и доставку факторов в пространстве и времени можно контролировать количественно. Поскольку иммуномодулирующие факторы высвобождаются локально, ожидают немного системных эффектов, в отличие от системно доставляемых средств, таких как антитела, блокирующие иммунные контрольные точки.
Примеры полимерных композиций, из которых изготавливают криогель или гидрогель, описаны на протяжении настоящего описания, и включают альгинат, гиалуроновую кислоту, желатин, гепарин, декстран, камедь рожкового дерева, PEG, производные PEG, включая сополимеры PEG-PGA и конъюгаты PEG-пептид. Эти способы можно использовать для любых биосовместимых полимеров, например, коллагена, хитозана, карбоксиметилцеллюлозы, пуллулана, поливинилового спирта (PVA), поли(2-гидроксиэтилметакрилата) (PHEMA), поли(N-изопропилакриламида) (PNIPAAm) или поли(акриловой кислоты) (PAAc). Например, композиция содержит гидрогель/криогель на основе альгината. В другом примере, композиция содержит гидрогель/криогель на основе желатина.
Криогели представляют собой класс материалов с высокопористой взаимосвязанной структурой, которые получают с использованием способа криотропного гелеобразования (или криогелеобразования). Криогели также имеют высокопористую структуру. Как правило, активные соединения добавляют в устройство с криогелем после замораживания-формирования структуры пор/стенок криогеля. Криогели характеризуются высокой пористостью, например, по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, или 95% пор со стенками пор, характеризующимися высокой плотностью перекрестного сшивания полимера. Стенки криогелей, как правило, являются плотными и имеют высокое перекрестное сшивание, позволяющее им подвергаться выдавливанию через иглу при введении субъекту без постоянной деформации или значительного повреждения структуры. В различных вариантах осуществления, стенки пор содержат по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 10-40% или более полимера. В некоторых вариантах осуществления, используют концентрацию полимера приблизительно 0,5-4% (до криогелеобразования), и концентрация значительно увеличивается при завершении криогелеобразования. Неограничивающие аспекты гелеобразования криогеля и увеличение концентрации полимера после криогелеобразования обсуждают в  et al. (2015) Advanced Healthcare Materials Volume 4, Issue 2, pages 301-312, полное содержание которого приведено в настоящем описании в качестве ссылки. В различных вариантах осуществления, криогелеобразование включает способ, в котором реакции полимеризация-перекрестное сшивание проводят в полузамороженном реакционном растворе. Неограничивающие примеры способов криогелеобразования описаны в Публикации патентной заявки США No. 2014/0227327, опубликованной 14 августа 2014 г., полное содержание которой приведено в настоящем описании в качестве ссылки. Одним из преимуществ криогелей по сравнению с общепринятыми макропористыми гидрогелями, полученными посредством разделения фаз, является их высокая способность к обратимой деформации. Криогели могут являться необычайно мягкими, но могут подвергаться деформации и повторно принимать свою форму. Они являются очень прочными, и могут выдерживать высокие уровни деформации, такой как растяжение и скручивание; их также можно отжимать под воздействием механической силы для высушивания содержащегося растворителя. В различных вариантах осуществления, свойства улучшенной способности к деформации альгинатных криогелей происходят от их высокой плотности перекрестного сшивания каналов с незамороженной жидкостью в реакционной системе.
et al. (2015) Advanced Healthcare Materials Volume 4, Issue 2, pages 301-312, полное содержание которого приведено в настоящем описании в качестве ссылки. В различных вариантах осуществления, криогелеобразование включает способ, в котором реакции полимеризация-перекрестное сшивание проводят в полузамороженном реакционном растворе. Неограничивающие примеры способов криогелеобразования описаны в Публикации патентной заявки США No. 2014/0227327, опубликованной 14 августа 2014 г., полное содержание которой приведено в настоящем описании в качестве ссылки. Одним из преимуществ криогелей по сравнению с общепринятыми макропористыми гидрогелями, полученными посредством разделения фаз, является их высокая способность к обратимой деформации. Криогели могут являться необычайно мягкими, но могут подвергаться деформации и повторно принимать свою форму. Они являются очень прочными, и могут выдерживать высокие уровни деформации, такой как растяжение и скручивание; их также можно отжимать под воздействием механической силы для высушивания содержащегося растворителя. В различных вариантах осуществления, свойства улучшенной способности к деформации альгинатных криогелей происходят от их высокой плотности перекрестного сшивания каналов с незамороженной жидкостью в реакционной системе.
Примеры полимерных композиций, из которых изготавливают криогель, включают альгинат, гиалуроновую кислоту, желатин, гепарин, декстран, камедь рожкового дерева, PEG, производные PEG, включая сополимеры PEG-PGA и конъюгаты PEG-пептид. Эти способы можно использовать для любых биосовместимых полимеров, например, коллагена, хитозана, карбоксиметилцеллюлозы, пуллулана, поливинилового спирта (PVA), Поли(2-гидроксиэтилметакрилата) (PHEMA), поли(N-изопропилакриламид) (PNIPAAm) или поли(акриловой кислоты) (PAAc). Например, композиция содержит гидрогель/криогель на основе альгината. В другом примере, композиция содержит гидрогель/криогель на основе желатина.
В некоторых вариантах осуществления, изобретение относится также к желатиновым каркасам, например, желатиновым гидрогелям, таким как желатиновые криогели, представляющим собой платформу для клеточных ответов для терапии на основе биологического материала. Желатин представляет собой смесь полипептидов, полученных из коллагена посредством частичного гидролиза. Эти желатиновые каркасы имеют отдельные преимущества над другими типами каркасов и гидрогелей/криогелей. Например, желатиновые каркасы по изобретению поддерживают прикрепление, пролиферацию и выживаемость клеток и поддаются деградации посредством клеток, например, под действием ферментов, таких как матриксные металлопротеиназы (MMP) (например, рекомбинантные матриксные металлопротеиназы-2 и -9).
Предварительно изготовленные желатиновые криогели быстро повторно принимают свою исходную форму («эффект памяти формы») при подкожной инъекции субъекту (например, млекопитающему, такому как человек, собака, кошка, свинья или лошадь) и вызывают небольшое количество или не вызывают опасных иммунных ответов хозяина (например, иммунного отторжения) после инъекции.
В некоторых вариантах осуществления, гидрогель (например, криогель) содержит полимеры, которые являются модифицированными, например, участки в молекуле полимера являются модифицированными с использованием группы метакриловой кислоты (метакрилата (MA)) или группы акриловой кислоты (акрилата). Иллюстративные модифицированные гидрогели/криогели представляют собой MA-альгинат (метакрилированный альгинат) или MA-желатин. В случае MA-альгината или MA-желатина, степень метакрилирования альгината или желатина соответствует 50%. Это означает, что каждое второе повторяющееся звено содержит метакрилатную группу. Степень метакрилирования можно менять от 1% до 90%. Выше 90%, химическая модификация может уменьшать растворимость для растворимости полимера в воде.
Полимеры можно также модифицировать с использованием акрилатных групп вместо метакрилатных групп. Тогда продукт может быть обозначен как акрилированный полимер. Степень метакрилирования (или акрилирования) можно менять для большинства полимеров. Однако, некоторые полимеры (например, PEG) сохраняют свои свойства растворимости в воде даже при 100% химической модификации. После перекрестного сшивания, полимеры в норме достигают почти полного превращения метакрилатных групп, что указывает на приблизительно 100% эффективность перекрестного сшивания. Например, полимеры в гидрогеле являются на 50-100% перекрестно сшитыми (ковалентные связи). Степень перекрестного сшивания коррелирует с долговечностью гидрогеля. Таким образом, высокий уровень перекрестного сшивания (90-100%) модифицированных полимеров является желательным.
Например, полимерная композиция из гидрогеля/криогеля с высоким уровнем перекрестного сшивания характеризуется по меньшей мере 50% перекрестным сшиванием полимера (например, 75%, 80%, 85%, 90%, 95%, 98%). Высокий уровень перекрестного сшивания придает механическую прочность структуре. Однако, % перекрестного сшивания, как правило, составляет менее 100%. Композицию получают с использованием способа полимеризации свободных радикалов и способа криогелеобразования. Например, криогель получают посредством криополимеризации метакрилированного желатина или метакрилированного альгината. В некоторых случаях, криогель содержит концентрацию макромономера метакрилированного желатина или макромономера метакрилированного альгината 1,5% (масс./об.) или менее (например, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1% 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2% или менее). Например, концентрация макромономера метакрилированного желатина или альгината составляет приблизительно 1% (масс./об.).
В некоторых вариантах осуществления, перекрестно сшитые желатиновые гидрогели/криогели получают посредством модификации желатина с использованием выступающих метакрилатных групп. Например, перекрестное сшивание происходит посредством радикальной полимеризации. В некоторых примерах, 2-6% (например, 3-4%) из аминокислотного состава желатина составляет лизин. В некоторых случаях, лизин в желатине переводят в реакционноспособные метакрилатные группы. В некоторых случаях, 70-90% (например, 80%) лизина в желатине переводят в реакционноспособные метакрилатные группы. Эти реакционноспособные метакрилатные группы на желатине затем подвергают перекрестному сшиванию, например, посредством радикальной полимеризации. В некоторых вариантах осуществления, желатиновые полимеры по изобретению (например, перекрестно сшитые посредством радикальной полимеризации) содержат большее количество перекрестных сшивок по сравнению с желатиновым полимером, инкубированным при комнатной температуре без радикальной полимеризации (например, без модификации посредством метакрилата).
Криогель содержит по меньшей мере 75% пор, например, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, или более пор. Эти поры являются взаимосвязанными. Взаимосвязь является важной для функционирования композиции, поскольку без взаимосвязи вода становится запертой внутри геля. Взаимосвязь пор позволяет прохождение воды (и других композиций, таких как клетки и соединения) в структуру и из структуры. В полностью гидратированном состоянии, композиция содержит по меньшей мере 90% воды (например, между 90-99%, по меньшей мере 92%, 95%, 97%, 99%, или более) воды. Например, по меньшей мере 90% (например, по меньшей мере 92%, 95%, 97%, 99% или более) объема криогеля состоит из жидкости (например, воды), содержащейся в порах. В сжатом или дегидратированном гидрогеле, вплоть до 50%, 60%, 70% этой воды отсутствует, например, криогель содержит менее чем 25% (20%, 15%, 10%, 5% или менее) воды.
Криогели по изобретению содержат достаточно большие поры для прохождения через них клеток. Например, криогель содержит поры диаметром 20-500 мкм, например, 20-300 мкм, 30-150 мкм, 50-500 мкм, 50-450 мкм, 100-400 мкм, 200-500 мкм. В некоторых случаях, размер гидратированной поры составляет 1-500 мкм (например, 10-400 мкм, 20-300 мкм, 50-250 мкм).
В некоторых вариантах осуществления, пригодные для инъекций гидрогели или криогели подвергают дополнительной функционализации посредством добавления функциональной группы, выбранной из группы, состоящей из: амино, винила, альдегида, тиола, силана, карбоксила, азида, алкина. Альтернативно или дополнительно, криогель подвергают дополнительной функционализации посредством добавления дополнительного перекрестно сшивающего средства (например, полимеров с множеством ветвей, солей, альдегидов и т.д.). Растворитель может являться водным, и в частности, кислым или щелочным. Водный растворитель может содержать смешивающийся с водой растворитель (например, метанол, этанол, DMF, DMSO, ацетон, диоксан и т.д.).
В случае криогелей, перекрестное криосшивание можно проводить в форме, и криогели (которые можно инъецировать) могут поддаваться деградации. Размер пор можно контролировать посредством выбора основного используемого растворителя, включения порогена, используемых температуры и скорости замораживания, условий перекрестного сшивания (например, концентрации полимера), а также типа и молекулярной массы используемого полимера. Форму криогеля можно определять посредством матрицы для формовки, и таким образом, он может принимать любую форму, определяемую производителем, например, различные размеры и формы (диски, цилиндры, квадраты, нити и т.д.) получают посредством криогенной полимеризации. Пригодные для инъекций криогели можно получать в масштабе от микрометров до миллиметров. Иллюстративные объемы меняются от нескольких сотен мкм3 (например, 100-500 мкм3) до более 100 мм3. Иллюстративная композиция каркаса имеет размер между 100 мкм3 и 100 мм3 (например, размер между 1 мм3 и 10 мм3). В некоторых применениях, криогели являются гидратированными, нагруженными соединениями и загруженными в шприц или другое устройство для доставки. Например, шприцы предварительно заполняют и охлаждают до использования. В другом примере, криогель дегидратируют, например, лиофилизуют, необязательно, вместе с соединением (таким как PEI), загруженным в гель, и хранят сухим или охлажденным. Перед введением, заполненные криогелем шприц или устройство можно приводить в контакт с раствором, содержащим соединения, подлежащие доставке. Например, цилиндр предварительно заполненного криогелем шприца заполняют физиологически совместимым раствором, например, фосфатно-солевым буфером (PBS). В некоторых вариантах осуществления, в желательный анатомический участок можно вводить криогель, затем некоторый объем раствора, необязательно, содержащего другие ингредиенты, например, PEI, отдельно или вместе с одним или более соединениями, описанными в настоящем описании. Затем криогель регидратируется и возвращает целостность своей формы in situ. Объем PBS или другого физиологического раствора, вводимого после размещения криогеля, как правило, приблизительно в 10 раз превышает объем самого криогеля. Криогель имеет также то преимущество, что после сжатия, криогелевая композиция сохраняет свойства структурной целостности и эффекта памяти формы. Например, криогель является пригодным для инъекций через полую иглу. Например, криогель возвращается к своей исходной геометрии после прохождения через иглу (например, иглу 16 калибра (G), например, имеющую внутренний диаметр 1,65 мм). Другие иллюстративные размеры игл представляют собой иглу 16 калибра, 18 калибра, 20 калибра, 22 калибра, 24 калибра, 26 калибра, 28 калибра, 30 калибра, 32 калибра или 34 калибра. Пригодные для инъекций криогели разработаны для прохождения через полую структуру, например, очень тонкие иглы, такие как иглы 18-30 G. Пригодные для инъекций криогели можно формовать до желательной формы, в форме палочек, квадратов, дисков, сфер, кубов, волокон, пен. В некоторых случаях, криогель имеет форму диска, цилиндра, квадрата, прямоугольника или нити. Например, криогелевая композиция имеет размер между 100 мкм3 и 100 мм3, например, между 1 мм3 и 50 мм3. Например, криогелевая композиция составляет между 1 мм в диаметре и 50 мм в диаметре (например, приблизительно 5 мм). Необязательно, толщина криогеля составляет между 0,2 мм и 50 мм (например, приблизительно 2 мм).
В некоторых примерах, композиция каркаса содержит композицию для адгезии клеток, химически связанную, например, ковалентно связанную, с полимером. Например, композиция для адгезии клеток содержит пептид, содержащий аминокислотную последовательность RGD. В неограничивающих примерах, гидрогелевая или криогелевая композиция (например, желатин) имеет свойства адгезии клеток. В некоторых случаях, композиция каркаса не является модифицированной с использованием молекулы для адгезии клеток, такой как аргинин-глицин-аспартат (RGD).
Три иллюстративные системы криогелевых материалов описаны ниже.
a) Метакрилированный желатиновый криогель (CryoGelMA) -Иллюстративный криогель с использованием метакрилированного желатина и результаты подробно описаны в Публикации патентной заявки США No. 2014-0227327, опубликованной 14 августа 2014 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
b) Метакрилированный альгинатный криогель (CryoMAAlginate) - Иллюстративный криогель с использованием метакрилированного альгината и результаты подробно описаны в Публикации патентной заявки США No. 2014-0227327, опубликованной 14 августа 2014 г., полное содержание которой приведено в настоящем описании в качестве ссылки.
c) Клик-альгинатный криогель с наночастицами лапонита (CryoClick) -Материал основы представляет собой клик-альгинат (Публикация международной патентной заявки PCT No. WO 2015/154078 опубликованная 8 октября 2015 г., полное содержание которой, таким образом, приведено в качестве ссылки). В некоторых примерах, материал основы содержит лапонит (коммерчески доступную силикатную глину, используемую во множестве потребительских продуктов, таких как косметика). Лапонит имеет большую площадь поверхности и высокую плотность отрицательного заряда, позволяющую ему адсорбировать положительно заряженные группы на множестве белков и других биологически активных молекул посредством электростатического взаимодействия, позволяя загрузку лекарственного средства. При помещении в окружение с низкой концентрацией лекарственного средства, адсорбированное лекарственное средство высвобождается из лапонита замедленным образом. Эта система позволяет высвобождение более гибкого массива иммуномодуляторов по сравнению только с материалом основы.
Различные варианты осуществления объекта настоящего изобретения включают носитель для доставки, содержащий порообразующую композицию каркаса. Например, поры (такие как макропоры) формируются in situ внутри гидрогеля после инъекции гидрогеля субъекту. Поры, которые формируются in situ посредством деградации жертвуемого порогенного гидрогеля внутри окружающего гидрогеля (придающего объем гидрогеля), способствуют привлечению и миграции клеток, так же как высвобождению соединений, таких как PEI, иммуностимулирующее соединение; соединение, привлекающее иммуноцит к носителю или в носитель для доставки; соединение, индуцирующее иммуногенную гибель клеток опухоли; соединением, ингибирующим супрессию T-клеток или дендритных клеток; соединение, которое ингибирует ингибирующий иммунитет белок; или антиген, или любой их комбинации. В некоторых вариантах осуществления, жертвуемый порогенный гидрогель, придающий объем гидрогель, или как жертвуемый порогенный гидрогель, так и придающий объем гидрогель, содержат PEI, иммуностимулирующее соединение, соединение, привлекающее иммуноцит к носителю или в носитель для доставки, соединение, индуцирующее иммуногенную гибель клеток опухоли, соединение, ингибирующее супрессию T-клеток или дендритных клеток, соединение, которое ингибирует ингибирующий иммунитет белок, и/или антиген, или любую их комбинацию.
В различных вариантах осуществления, порообразующая композиция становится макропористой с течением времени при нахождении в организме животного-реципиента, такого как субъект-млекоопитающее. Например, порообразующая композиция может содержать жертвуемый порогенный гидрогель и придающий объем гидрогель, где жертвуемый порогенный гидрогель деградирует по меньшей мере на 10% быстрее (например, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, или по меньшей мере на 50% быстрее), чем придающий объем гидрогель. Жертвуемый порогенный гидрогель может деградировать, оставляя макропоры на своем месте. В конкретных вариантах осуществления, макропоры представляют собой открытые взаимосвязанные макропоры. В некоторых вариантах осуществления, жертвуемый порогенный гидрогель может деградировать более быстро, чем придающий объем гидрогель, поскольку жертвуемый порогенный гидрогель (i) является более растворимым в воде (имеет более низкий индекс растворимости), (ii) является перекрестно сшитым с мотивами опосредованной протеазами деградации, как описано в Публикации патентной заявки США No. 2005-0119762, опубликованной 2 июня 2005 г. (содержание которой приведено в настоящем описании в качестве ссылки), (iii) содержит более короткий полимер, который деградирует более быстро по сравнению с более длинным полимером придающего объем гидрогеля, (iv) является модифицированным, чтобы сделать его более поддающимся гидролитической деградации, чем придающий объем гидрогель (например, посредством окисления) и/или (v) является более поддающимся ферментативной деградации, чем придающий объем гидрогель.
В различных вариантах осуществления, устройство или каркас нагружают (например, пропитывают) одним или более активными соединениями после полимеризации. В конкретных вариантах осуществления, материал, образующий полимер для устройства или каркаса, смешивают с одним или более активными соединениями до полимеризации. В некоторых вариантах осуществления, материал, образующий полимер для устройства или каркаса, смешивают с одним или более активными соединениями до полимеризации, и затем его нагружают большим количеством тех же самых или одним или более дополнительными активными соединениями после полимеризации.
В некоторых вариантах осуществления, размер пор или общий объем пор устройства или каркаса выбирают для влияния на высвобождение соединений из устройства или каркаса. Иллюстративные виды пористости (например, нанопористые, микропористые и макропористые каркасы и устройства) и общие объемы пор (например, приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90 или 95%) описаны в настоящем описании. Увеличение размера пор и общего объема пор увеличивает количество соединений, которые можно доставлять в опухоль или поблизости от опухоли. В некоторых вариантах осуществления, размер пор или общий объем пор выбирают для увеличения скорости, с которой активные ингредиенты выходят из устройства или каркаса. В различных вариантах осуществления, активный ингредиент можно включать в материал каркаса из гидрогеля или криогеля, например, для обеспечения непрерывного высвобождения активного ингредиента из каркаса или устройства в течение более длительного периода времени, по сравнению активным ингредиентом, который может диффундировать из полости пор.
Пористость влияет на привлечение клеток в устройства и каркасы и высвобождение веществ из устройств и каркасов. Поры могут являться, например, нанопористыми, микропористыми или макропористыми. Например, диаметр нанопор составляет менее, чем приблизительно 10 нм. Микропоры имеют диаметр в диапазоне от приблизительно 100 нм до приблизительно 20 мкм. Макропоры составляют больше, чем приблизительно 20 мкм (например, больше, чем приблизительно 100 мкм или больше, чем приблизительно 400 мкм). Иллюстративные размеры макропор включают 50 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм, 300 мкм, 350 мкм, 400 мкм, 450 мкм, 500 мкм, 550 мкм и 600 мкм. Макропоры представляют собой поры размером, который позволяет эукариотической клетке проходить в композицию или из композиции. В одном примере, макропористая композиция имеет поры диаметром приблизительно от 400 мкм до 500 мкм. Предпочтительный размер пор зависит от применения.
В различных вариантах осуществления, устройство изготавливают за одну стадию, в которой изготавливают один слой или компартмент и подвергают инфузии или покрытию с использованием одного или более соединений. Иллюстративный биологически активные композиции содержат полипептиды или полинуклеотиды. В конкретных альтернативных вариантах осуществления, устройство изготавливают за две или более (3, 4, 5, 6, … 10 или более) стадий, в которых изготавливают один слой или компартмент и подвергают инфузии или покрытию с использованием одного или более соединений с последующим конструированием второго, третьего, четвертого или более слоев, которые, в свою очередь, подвергают инфузии или покрытию с использованием одного или более соединений последовательно. В некоторых вариантах осуществления, каждый слой или компартмент является идентичным другим, или отличается от другого количеством или смесью биологически активных композиций, так же как отличными химическими, физическими и биологическими свойствами. Можно получать составы полимеров для специфических применений посредством контроля молекулярной массы, скорости деградации и способа получения каркаса. Реакции связывания можно использовать для ковалентного присоединения биологически активных эпитопов, таких как последовательность RGD для адгезии клеток, к остову полимера.
В некоторых вариантах осуществления, одно или более соединений добавляют в композицию каркаса с использованием известного способа, включая поверхностную абсорбцию, физическую иммобилизацию, например, с использованием фазового перехода, для заключения вещества в материал каркаса. Например, иммуностимулирующее соединение смешивают с композицией каркаса, в то время как он находится в водной или жидкой фазе, и после изменения условий внешней среды (например, pH, температуры, концентрации ионов), жидкость образует гель или отверждается, таким образом, захватывая биологически активное вещество. В некоторых вариантах осуществления, ковалентное присоединение, например, с использованием средств для алкилирования или ацилирования, используют для обеспечения стабильного, долгосрочного присутствия соединения в каркасе в определенной конформации. Иллюстративные реагенты для ковалентного присоединения таких веществ представлены в таблице ниже.
Способы ковалентного присоединения пептидов/белков к полимерам
[a] EDC: гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида; DCC: дициклогексилкарбодиимид.
Палочки из мезопористого диоксида кремния
Различные варианты осуществления объекта настоящего изобретения включают использования носителей для доставки, содержащих палочки из мезопористого диоксида кремния. Пригодные для инъекций палочки из мезопористого диоксида кремния подвергаются случайной самосборке для формирования 3D каркасной структуры in vivo. 3D каркасная структура содержит микропространства, позволяющие инфильтрацию и/или миграцию иммуноцита (например, дендритной клетки). Как и другие композиции каркаса, описанные в настоящем описании, палочки из мезопористого диоксида кремния могут содержать, например, PEI, отдельно или вместе с иммуностимулирующим соединением; соединением, привлекающим иммуноцит к носителю или в носитель для доставки; соединением, индуцирующим иммуногенную гибель клеток опухоли; соединением, ингибирующим супрессию T-клеток или дендритных клеток; соединением, которое ингибирует ингибирующий иммунитет белок; или антигеном, или любой их комбинацией. В некоторых вариантах осуществления, палочка из мезопористого диоксида кремния сама служит иммуностимулирующим соединением.
В некоторых вариантах осуществления, палочки или каркас, содержащий палочки, содержат поры диаметром между 1-50 нм, например, поры, лежащие в диапазоне приблизительно 1-50, 2-50, 3-50, 4-50, 5-50, 6-50, 7-50, 8-50, 9-10, 10-50, 15-50, 25-50, 1-25, 2-25, 3-25, 4-25, 5-25, 6-25, 7-25, 8-25, 9-25, 10-25 или 15-25 нм. В различных вариантах осуществления, длина палочек из мезопористого диоксида кремния лежит в диапазоне от 5 мкм до 500 мкм. В одном примере, палочки имеют длину 5-25 мкм, например, 10-20 мкм. В других примерах, палочки имеют длину от 50 мкм до 250 мкм или от 80 мкм до 120 мкм. В конкретных вариантах осуществления, палочки из мезопористого диоксида кремния имеют длину приблизительно 25-100, 25-250, 25-500, 50-250 или 50-500 мкм, или длину по меньшей мере приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75 или 100 мкм, но не более, чем приблизительно 500 мкм.
Связь PEI с другими соединениями
В различных вариантах осуществления, PEI является ковалентно связанным с другим соединением, таким как антиген и/или другое иммуностимулирующее средство. Ковалентная конъюгация с использованием ковалентных связей или линкера способствует доставке обеих молекул (например, PEI и антигена) в одну и ту же клетку. Неограничивающие примеры линкеров включают пептидные линкеры, например, меняющиеся от 1 до 10 или более аминокислот, линкеры для клик-химии, и множество других, известных в данной области. Другие примеры включают карбаматную, малеинимидную связь, триазольное кольцо, дисульфидную, тиоэфирную, амидную, сложноэфирную связь или карбодиимидную связь (от нескольких атомов вплоть до настолько большого количества, насколько желательно). Дополнительные реакционноспособные химические вещества можно использовать для связывания PEI с антигеном, например, сложные NHS-эфиры (амин-амин), сложные имидоэфиры (амин-амин), гидразид (альдегид-гидразид), малеинимиды (сульфгидрил-сульфгидрил), циклоприсоединение Хуисгена азида-алкина и конъюгацию стрептавидина-биотина, так же, как клик-химические вещества. В некоторых случаях, линкер является расщепляемым. Например, линкер является расщепляемым посредством ферментов, нуклеофильных/основных реагентов, восстанавливающих/окисляющих средств (например, внутри клетки), фотооблучение, температуры, электрофильных/кислых реагентов или металлорганических/металлических реагентов. В некоторых вариантах осуществления, PEI присоединяют к другому соединению посредством линкера и/или связи, сформированной посредством клик-реакции. Ковалентное присоединение увеличивает вероятность того, что клетка, поглощающая PEI, поглощает также антиген.
Аспекты объекта настоящего изобретения относятся к иммуноконъюгатам, в которых PEI является конъюгированным, например, ковалентно связанным, с антигеном или другим иммуномодулирующим средством, например, напрямую посредством ковалентной связи или необязательно, посредством линкера или спейсера. Ковалентные связи могут иметь различную длину. Неограничивающие примеры длины ковалентных связей включают длину приблизительно от 1 ангстрем до 3 ангстрем. В различных вариантах осуществления, линкер или спейсер является достаточно коротким, чтобы способствовать ассоциации PEI и конъюгата антигена или иммуномодулирующего средства с отдельной клеткой или чтобы ограничивать ассоциацию PEI и антигена или иммуномодулирующего средства с отдельной клеткой. Например, линкер или спейсер может иметь длину менее, чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 50, 1-5, 5-10, 5-15, 5-25, 10-30 или 5-50 ангстрем. Таким образом, в некоторых вариантах осуществления, антиген находится не далее, чем за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 50, 1-5, 5-10, 5-15, 5-25, 10-30 или 5-50 ангстрем от иммуномодулирующего средства. В некоторых вариантах осуществления, антиген и иммуномодулирующее средство являются напрямую связанными посредством ковалентной связи [без спейсерного линкерного соединения(соединений)]. В конкретных вариантах осуществления, линкер или спейсер представляет собой аминокислоту, или полипептид, содержащий приблизительно 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот. В некоторых вариантах осуществления, полипептид содержит приблизительно 2, 3, 4, 5, 6, 7, 8, 9 или 10 остатков глицина. Контакт отдельной клетки с содержащим PEI или другим иммуноконъюгатом из объекта настоящего изобретения уменьшает неспецифические эффекты, которые могут возникать в результате доставки компонентов иммуноконъюгата к различным клеткам.
Аспекты объекта настоящего изобретения относятся к молекуле PEI, ковалентно связанной с антигеном. В некоторых вариантах осуществления, PEI является ковалентно связанным с более, чем одной молекулой антигена, например, линейный PEI является ковалентно связанным на каждом из его концов, или разветвленный PEI является ковалентно связанным на концах множества ветвей. В некоторых вариантах осуществления, одна молекула PEI является ковалентно связанной по меньшей мере приблизительно с 2, 3, 4, 5, 6, 7, 8, 9 или 10 молекулами антигена. «Ковалентно связанные» молекулы включают молекулы, связанные одной ковалентной связью, или связанные более, чем одной ковалентной связью (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более), например, связанные посредством линкера или спейсера. В некоторых случаях, PEI и антиген являются ковалентно связанными посредством связи, например, карбаматной, амидной, малеинимидной связи, триазольного кольца, дисульфидной, тиоэфирной или сложноэфирной связи. В некоторых вариантах осуществления, PEI и антиген являются связанными посредством связи, сформированной посредством клик-реакции. В некоторых случаях, PEI и антиген являются ковалентно связанными посредством линкера или спейсера. В некоторых случаях, PEI и антиген являются связанными посредством карбодиимидной связи. Иллюстративный линкер включает фрагмент из 2, 3, 4, 5 или более остатков глицина, необязательно, также включающий 1 или более остатков серина. В некоторых вариантах осуществления, PEI является ковалентно связанным с антигеном посредством бифункционального малеинимидного линкера (амин-сульфгидрил), карбодиимидного линкера (амин-карбоновая кислота) или фото-клик-линкера (норборнен-тиол). В некоторых примерах, один или более, например, множество, (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более) антигенов смешивают вместе, например, присоединяют к PEI, например, для получения иммуногенного коктейля, для обеспечения более широкого антигенного охвата, чем только с одним антигеном.
В некоторых вариантах осуществления, PEI является связанным с другим соединением (например, антигеном или другим иммуностимулирующим соединением) посредством биоортогональной химической реакции, такой как биоортогональная клик-реакция. Под «биоортогональной» понимают функциональную группу или химическую реакцию, которая может происходить в живой клетке, ткани или организме, не мешая природным биологическим или биохимическим процессам. Однако объект настоящего изобретения не требует, чтобы конъюгация PEI с другим соединением происходила в присутствии или внутри живой клетки, ткани или организма. Биоортогональная функциональная группа или реакция не является токсичной для клеток. Например, биоортогональная реакция может функционировать в биологических условиях, например, при биологическом pH, в водном окружении и при температурах внутри живых организмов или клеток. Например, биоортогональная реакция должна проходить быстро, чтобы обеспечивать прохождение ковалентного связывания между двумя функциональными группами до подвергания метаболизму и/или выводу одной или более функциональных групп из организма. В других примерах, ковалентная связь, сформированная между двумя функциональными группами, должна являться инертной к биологическим реакциям в живых клетках, тканях или организмах.
Биоортогональная функциональная группа и узнаваемая молекула-мишень содержат комплементарные функциональные группы, где биоортогональная функциональная группа является способной к химической реакции с комплементарной функциональной группой для формирования ковалентной связи.
Иллюстративные пары биоортогональная функциональная группа/комплементарная функциональная группа включают азид с фосфином; азид с циклооктином; нитрон с циклооктином; нитрилоксид с норборненом; оксанорборнадиен с азидом; транс-циклооктен с s-тетразином; квадрициклан с бис(дитиобензил)никелем(II). Например, биоортогональная функциональная группа является способной к реакции посредством клик-химии с комплементарной функциональной группой. В некоторых случаях, биоортогональная функциональная группа содержит транс-циклооктен (TOC) или норборнен (NOR), и комплементарная функциональная группа содержит тетразин (Tz). В некоторых примерах, биоортогональная функциональная группа содержит дибензоциклооктин (DBCO), и комплементарная функциональная группа содержит азид (Az). В других примерах, биоортогональная функциональная группа содержит Tz, и комплементарная функциональная группа содержит транс-циклооктен (TOC) или норборнен (NOR). Альтернативно или дополнительно, биоортогональная функциональная группа содержит Az, и комплементарная функциональная группа содержит дибензоциклооктин (DBCO).
Например, мишень содержит биоортогональную функциональную группу, и узнающая мишень молекула содержит комплементарную функциональную группу, где биоортогональная функциональная группа является способной к химической реакции с комплементарной функциональной группой с формированием ковалентной связи, например, с использованием реакций типа, описанного в таблице ниже, например, посредством клик-химии.
Иллюстративные пары биоортогональная функциональная группа/комплементарная функциональная группа показаны в таблице ниже.
(Khomyakova EA, et al.
Nucleosides Nucleotides Nucleic Acids. 30(7-8) (2011) 577-84
В некоторых примерах, молекула-мишень содержит биоортогональную функциональную группу, такую как транс-циклооктен (TCO), дибензоциклооктин (DBCO), норборнен, тетразин (Tz) или азид (Az). В другом примере, узнающая мишень молекула (например, на устройстве) содержит биоортогональную функциональную группу, такую как транс-циклооктен (TCO), дибензоциклооктин (DBCO), норборнен, тетразин (Tz) или азид (Az). TCO вступает в специфическую реакцию посредством клик-химии с группой тетразина (Tz). DBCO вступает в специфическую реакцию посредством клик-химии с группой азида (Az). Норборнен вступает в специфическую реакцию посредством клик-химии с группой тетразина (Tz). Например, TCO образует пару с группой тетразина в качестве молекулы-мишени/узнающей мишень молекулы. Например, DBCO образует пару с группой азида в качестве молекулы-мишени/узнающей мишень молекулы. Например, норборнен образует пару с группой тетразина в качестве молекулы-мишени/узнающей мишень молекулы.
Иллюстративные реакции клик-химии имеют высокую специфичность, эффективную кинетику и происходят in vivo в физиологических условиях. См., например, Baskin et al. Proc. Natl. Acad. Sci. USA 104(2007):16793; Oneto et al. Acta biomaterilia (2014); Neves et al. Bioconjugate chemistry 24(2013):934; Koo et al. Angewandte Chemie 51(2012):11836; и Rossin et al. Angewandte Chemie 49(2010):3375.
Как описано выше, реакции клик-химии являются особенно эффективными для конъюгации биомолекул. Они также проходят в биологических условиях. Иллюстративные реакции клик-химии представляют собой (a) циклоприсоединение азида-алкина, (b) циклоприсоединение азида-алкина без участия меди и (c) лигирование по Штаудингеру, показанные на схемах ниже.
Общие определения
Если конкретно не определено иное, все технические и научные термины, используемые в настоящем описании, следует понимать как имеющие такое же значение, какое является общепринятым для специалиста в данной области (например, в культивировании клеток, молекулярной генетике и биохимии).
В рамках изобретения, термин «приблизительно» в контексте числового значения или диапазона обозначает ±10% от указанного или заявленного числового значения или диапазона, если контекст не требует более ограниченного диапазона.
В приведенном выше описании и в формуле изобретения, такие фразы, как «по меньшей мере один из» или «один или более из», могут встречаться со следующим за ними соединительным списком элементов или признаков. Термин «и/или» также может встречаться в списке из двух или более элементов или признаков. Если иное неявно или явно не противоречит контексту, в котором ее используют, такая фраза предназначена для обозначения любого из перечисленных элементов или признаков отдельно, или любого из перечисленных элементов или признаков в комбинации с любым из других перечисленных элементов или признаков. Например, каждая из фраз «по меньшей мере один из A и B»; «один или более из A и B»; и «A и/или B» предназначена для обозначения «A отдельно, B отдельно, или A и B вместе». Подобная интерпретация также предусмотрена для списков, включающих три или более пунктов. Например, каждая из фраз «по меньшей мере один из A, B и C»; «один или более из A, B и C»; и «A, B и/или C» предназначена для обозначения «A отдельно, B отдельно, C отдельно, A и B вместе, A и C вместе, B и C вместе или A и B и C вместе». Кроме того, использование термина «основан на», выше и в формуле изобретения, предназначено для обозначения, «основан, по меньшей мере частично, на», так что не указанный признак или элемент также является допустимым.
Понятно, что когда представлен диапазон параметров, все целые числа внутри этого диапазона и их десятые доли также включены в изобретение. Например, «0,2-5 мг» представляет собой описание 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг и т.д., вплоть до и включая 5,0 мг.
Малая молекула представляет собой соединение массой менее 2000 дальтон. Молекулярная масса малой молекулы предпочтительно составляет менее, чем 1000 дальтон, более предпочтительно, менее, чем 600 дальтон, например, соединение составляет менее, чем 500 дальтон, 400 дальтон, 300 дальтон, 200 дальтон или 100 дальтон.
Полинуклеотиды, полипептиды, или другие средства могут являться очищенными и/или выделенными. Конкретно, в рамках изобретения, «выделенные» или «очищенные» молекула нуклеиновой кислоты, полинуклеотид, полипептид или белок, являются в основном свободными от другого клеточного материала или культуральной среды при получении рекомбинантными способами, или от химических предшественников или других химических веществ при химическом синтезе. Очищенные соединения содержат по меньшей мере 60% по массе (массе в сухом состоянии) представляющего интерес соединения. Предпочтительно, препарат содержит по меньшей мере 75%, более предпочтительно, по меньшей мере 90% и наиболее предпочтительно, по меньшей мере 99% по массе представляющего интерес соединения. Например, очищенное соединение представляет собой соединение, содержащее по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 98%, 99% или 100% (масс./масс.) желательного соединения по массе. Чистоту измеряют любым подходящим стандартным способом, например, посредством анализа колоночной хроматографии, тонкослойной хроматографии или высокоэффективной жидкостной хроматографии (HPLC). Очищенный или выделенный полинуклеотид (рибонуклеиновая кислота (РНК) или дезоксирибонуклеиновая кислота (ДНК)) является свободным от генов или последовательностей, фланкирующих его в его природном состоянии. Очищенный или выделенный полипептид является свободным от аминокислот или последовательностей, фланкирующих его в его природном состоянии. Очищенный может также определять степень стерильности, которая является безопасной для введения субъекту-человеку, например, лишенный инфекционных или токсичных агентов.
Подобным образом, под «в основном чистый», применительно к нуклеотиду или полипептиду, понимают нуклеотид или полипептид, отделенный от компонентов, сопровождающих его в естественном состоянии. Как правило, нуклеотиды и полипептиды являются в основном чистыми, когда они составляют по меньшей мере 60%, 70%, 80%, 90%, 95% или даже 99%, по массе, являются свободными от белков и природных органических молекул, с которыми они ассоциированы в естественном состоянии.
Под «выделенной нуклеиновой кислотой» понимают нуклеиновую кислоту, свободную от генов, фланкирующих ее в природном геноме организма, из которого происходит эта нуклеиновая кислота. Термин включает, например: (a) ДНК, которая является частью молекулы природной геномной ДНК, но которая не является фланкированной обеими последовательностями нуклеиновой кислоты, фланкирующими эту часть молекулы в геноме организма, в котором она встречается в природе; (b) нуклеиновую кислоту, включенную в вектор или в геномную ДНК прокариоты или эукариоты таким образом, что полученная молекула не является идентичной какой-либо встречающейся в природе векторной или геномной ДНК; (c) отдельную молекулу, такую как кДНК, геномный фрагмент, фрагмент, полученный посредством полимеразной цепной реакции (ПЦР), или фрагмент рестрикции; и (d) рекомбинантную нуклеотидную последовательность, которая является частью гибридного гена, т.е., гена, кодирующего слитый белок. Выделенные молекулы нуклеиновой кислоты в соответствии с настоящим изобретением, кроме того, включают молекулы, полученные синтетически, так же как любые нуклеиновые кислоты, которые изменены химически и/или которые имеют модифицированные остовы. Например, выделенная нуклеиновая кислота представляет собой полинуклеотид очищенный кДНК или РНК. Выделенные молекулы нуклеиновой кислоты также включают молекулы матричной рибонуклеиновой кислоты (мРНК).
Переходный термин «содержащий», который является синонимическим с «включающий», «вмещающий» или «характеризующийся», является включительным или неограничивающим, и не исключает дополнительных, не перечисленных элементов или стадий способа. В отличие от этого, переходная фраза «состоящий из» исключает любой элемент, стадию или ингредиент, не указанный в пункте формуле изобретения. Переходная фраза «в основном состоящий из» ограничивает объем пункта формулы изобретения указанными материалами или стадиями «и теми, которые не оказывают существенного влияния на основную и новую характеристику(характеристики)» заявленного изобретения.
В рамках изобретения, «экспрессирующий вектор» представляет собой ДНК- или РНК-вектор, способный трансформировать клетку и обеспечивать экспрессию одного или более указанных полинуклеотидов. Предпочтительно, экспрессирующий вектор является также способным к репликации внутри клетки-хозяина. Экспрессирующие векторы могут являться, например, эукариотическими, и как правило, представляют собой вирусы или плазмиды. Экспрессирующие векторы по настоящему изобретению содержат регуляторные последовательности, такие как последовательности для контроля транскрипции, последовательности для контроля трансляции, точки начала репликации и другие регуляторные последовательности, которые являются совместимыми с клеткой-хозяином (например, клеткой субъекта, такой как клетка опухоли, иммуноцит или клетки, окружающие устройство или каркас после их введения), и которые контролируют экспрессию полинуклеотидов по настоящему изобретению. В частности, экспрессирующие векторы по настоящему изобретению включают последовательности для контроля транскрипции. Последовательности для контроля транскрипции представляют собой последовательности, контролирующие инициацию, элонгацию и терминацию транскрипции. Особенно важными последовательностями для контроля транскрипции являются те, которые контролируют инициацию транскрипции, такие как промоторные, энхансерные, операторные и репрессорные последовательности. Пригодные последовательности для контроля транскрипции включают любую последовательность для контроля транскрипции, которая может функционировать в клетке или клетках субъекта. Такие регуляторные последовательности могут быть получены, например, из вирусов или эукариотических организмов, или могут быть химически синтезированы. Множество таких последовательностей для контроля транскрипции известно специалистам в данной области. Особенно предпочтительными последовательностями для контроля транскрипции являются промоторы, активные для управления транскрипцией в клетках субъекта, конститутивно, и/или в одной или более специфических тканях. В различных вариантах осуществления, экспрессирующий вектор обеспечивает временную экспрессию.
Примеры представлены ниже, чтобы способствовать более полному пониманию изобретения. Следующие примеры иллюстрируют иллюстративные способы получения и практического осуществления изобретения. Однако объем изобретения не является ограниченным конкретными вариантами осуществления, описанными в этих примерах, которые представлены только с целью иллюстрации, поскольку альтернативные способы можно использовать для получения сходных результатов.
Пример 1: Вакцина на оснвое мезопористого диоксида кремния (MPS) для усиления противоопухолевого иммунитета
Показано, что биологические материалы имеют значительный потенциал для синергической интеграции в современные способы вакцинации против злокачественных опухолей и увеличения их эффективности. Авторы настоящего изобретения недавно разработали пригодную для инъекций вакцину на основе биологического материала посредством спонтанной сборки микрочастиц мезопористого диоксида кремния (MPS) в 3D каркас in vivo. При составлении вместе с GM-CSF и CpG, вакцина на основе MPS модулирует активацию и миграцию дендритной клетки (DC) хозяина. В настоящем описании авторы настоящего изобретения показали, что однократная инъекция вакцины на основе MPS индуцирует персистентную активность зародышевого центра, например, в дренирующем лимфатическом узле, в течение более, чем 30 суток. Следовательно, при иммунизации с использованием небольшого линейного пептида Her2/neu внутри связывающего трастузумаб домена, вакцина на основе MPS приводит к получению на более, чем на 2 порядка величины увеличенному титру антитела IgG1 и IgG2a, по сравнению с болюсной вакциной, и антитело проявляет реакционную способность по отношению к природной структуре Her2 на клетках рака молочной железы. Для дальнейшего усиления ответов CTL против антигенов опухолей, авторы настоящего изобретения осуществляли совместное представление антигена с полиэтиленимином (PEI) в вакцине на основе MPS. PEI усиливал перекрестное представление антигена мышиным DC, и продукцию TNF-a и IL-6 как в мышиных, так и в человеческих DC in vitro. По сравнению с вакциной на основе MPS, вакцина на основе MPS-PEI увеличивала количество активированных DC в вакцине и dLN вакцины в ~2 раза. Системно, вакцина на основе MPS-PEI индуцировала в ~2,5 раз более высокое количество продуцирующих IFN-y антигенспецифических циркулирующих CD8+ T-клеток по сравнению с вакциной на основе MPS. Впечатляет то, что с использованием экспрессирующей HPV-E7 модели опухоли, авторы настоящего изобретения показали, что однократная инъекция вакцины на основе MPS-PEI полностью уничтожала большие развившиеся опухоли у более, чем 80% мышей. Наконец, при иммунизации с использованием пула недавно секвенированных пептидов неоантигена меланомы B16, вакцина на основе MPS-PEI индуцировала терапевтический контроль роста опухолей и синергию с терапией против CTLA4. Эти обнаружения показывают, что вакцина на основе MPS служит в качестве гибкой многофункциональной и мультиэпитопной платформы для модуляции функции иммуноцитов хозяина и усиления индивидуализированного противоопухолевого иммунитета.
Пример 2: Каркасы из D,L-лактида и гликолида (PLG), содержащие PEI
Покрытие каркасов из PLG полиэтиленимином (PEI) усиливает активацию дендритных клеток (DC). Нанесение PEI на системы PLG до адсорбции антигена усиливает противоопухолевые ответы в моделях вакцинации против злокачественных опухолей.
Нагруженные PEI каркасы стимулировали увеличение активности TLR5 в 3-4 раза по сравнению с контролем in vitro (ФИГ. 19A). Кроме того, мышиные DC, рассеянные на каркасы из PEI-PLG, продуцировали более, чем в 3 раза больше IL-12 и почти в 30 раз больше IFN-альфа, чем клетки, рассеянные на каркасы без PEI. (ФИГ. 19B). Эти результаты позволяют предполагать, что модифицированный посредством PEI PLG может вызывать локальную активацию DC и других антигенпредставляющих клеток APC, потенциально посредством пути TLR5.
Антигены из лизатов опухоли меланомы B16-F10 адсорбировали на системах PEI-PLG для получения вакцин против злокачественных опухолей. Имплантация покрытых PEI-антигеном вакцин мышам индуцировала местную продукцию иммуностимулирующих цитокинов in situ, включая G-CSF, MIP-a, RANTES, KC, IL-2, MIP-1b, IL-12 (ФИГ. 20A). Кроме того, нагруженные PEI-антигеном каркасы ингибировали потенциально супрессорные цитокины, такие как IL-10 и GM-CSF, индуцированные системами PLG, не покрытыми PEI (ФИГ. 20A). Модифицированные посредством PEI вакцины на основе PLG обеспечивали также получение увеличения количества активированных DC в 11-22 раз среди привлеченных в участок каркаса, как показано по экспрессии MHC-II и CD86 (ФИГ. 20B).
При использовании в качестве профилактической вакцины в модели летальной меланомы B16-F10, каркасы с PEI-антигеном защищали 50% мышей от развития опухолей, в то время как нагруженные антигеном каркасы без покрытий PEI защищали только 10% мышей (ФИГ. 20C). Эта положительная эффективность вакцины распространялась на терапевтические условия, где вакцины с PEI-антигеном являлись способными значительно замедлять рост опухолей по сравнению с пустым контролем, который не оказывал влияния на рост опухолей (ФИГ. 21A и 21B). Эта эффективность коррелировала с диапазоном инфильтрации активированных T-клеток в опухолевые массы, поскольку представляющие PEI-антиген вакцины на основе PLG приводили к получению в 15-32 раз больше активированных T-клеток в участке опухоли по сравнению с системами, в которых не использовали покрытия PEI-антигеном (ФИГ. 21C). Эти данные показывают, что покрытие PEI-антигеном систем PLG усиливает представление антигена и активацию посредством дендритных клеток для получения специфической противоопухолевой эффективности.
Авторы настоящего изобретения исследовали также, могут ли системы PEI-PLG стимулировать активацию DC человека in vitro. Рассев происходящих из мононуклеарных клеток периферической крови человека (PBMC) DC на каркасы из PEI-PLG значительно увеличивал экспрессию в DC маркеров активации HLA-DR и CD83, по сравнению с контролем (ФИГ. 22). Интересно, что диапазон активации DC посредством нагруженных PEI каркасов являлся сходным с уровнями активации, индуцированными посредством адъювантов CpG-ODN и P(I:C). Кроме того, PBMC, рассеянные на PEI-каркасы, индуцировали значимо более высокие уровни продукции IL-6, IL-2 и TNF-альфа по сравнению с контролем и каркасами, содержащими адъюванты адъюванты CpG-ODN и P(I:C).
Материалы и способы
Линии клеток
Клетки меланомы B16-F10 получали из Американской коллекции типовых культур (каталожный номер: ATCC CRL-6475) в 2010 г. и 2012 г. После получения, клетки культивировали до пассажа три, разделяли на аликвоты и замораживали в жидком азоте. Для экспериментов с опухолями, клетки B16-F10 размораживали и культивировали в DMEM (Life Technologies, Inc.), содержащей 10% эмбриональной бычьей сыворотки (Life Technologies, Inc.), 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Клетки поддерживали при 37°C в атмосфере увлажненного 5% CO2/95% воздуха, и клетки на ранних пассажах (между 4 и 9) использовали для экспериментов.
Выделение и культивирование DC
Известные способы, например, протокол, разработанный Lutz et al, использовали для получения первичных происходящих из костного мозга дендритных клеток (BMDC) (Lutz 1999 J Immunol Methods 223(1):77-92). Кратко, клетки костного мозга вымывали из бедренных костей мышей C57BL/6 и культивировали в 100-мм бактериологических чашках Петри (Falcon, номер 1029/Becton Dickinson). Культуральную среду RPMI-1640 (R10) (Sigma) дополняли 1% пенициллином-стрептомицином (Invitrogen), 2 мМ l-глутамином (Invitrogen), 50 мкМ 2-меркаптоэтанолом (Sigma) и 10% инактивированной нагреванием эмбриональной бычьей сывороткой (FBS, Invitrogen). На сутки 0, лейкоциты костного мозга рассевали при 2×106 клеток на 100-мм чашку в 10 мл среды R10, содержащей 20 нг/мл гранулолцитарно-макрофагального колониестимулирующего фактора (GM-CSF) (Peprotech). На сутки 3 другие 10 мл среды R10, содержащей 20 нг/мл GM-CSF, добавляли в чашки. На сутки 6 и 8, половину культурального супернатанта собирали и центрифугировали, осадок клеток ресуспендировали в 10 мл свежей R10, содержащей 20 нг/мл GM-CSF, и помещали обратно в исходную чашку. Авторы настоящего изобретения использовали популяцию неадгерентных клеток в культуральном супернатанте между сутками 8 и 12 для всех своих экспериментов.
Для выделения лимфоцитов человека, мононуклеарные клетки периферической крови (PBMC) получали от пациентов. Дендритные клетки получали из культур адгерентных PBMC с GM-CSF и IL-4.
Изготовление вакцины на основе PLG
A 85:15, 120 кДа сополимер D,L-лактида и гликолида (PLG) (Alkermes, Cambridge, MA) использовали в способе вспенивания газом для формирования пористых матриц PLG (Harris et al. 1998 J. Biomed. Mater. Res. 42, 396-402). Для покрытия полимера PLG с использованием PEI, 40 мкМ микросфер PLG (phosphorex) инкубировали с растворами разветвленного 60K и линейного 25K полиэтиленимина в ddH2O до конечного % масс. 4% PEI. Микросферы PEI-PLG размораживали и лиофилизировали, и хранили при 4°C до адсорбции антигена. Для включения антигена или лизатов опухолей, содержащих антигены, в сферы из PEI-PLG, белковые антигены встряхивали и инкубировали в ddH20 при комнатной температуре в течение 15 мин, чтобы позволить адсорбцию, и сушили сублимацией. Для получения антигенов меланомы, биопсии опухолей B16-F10, выращенных подкожно на спине мышей C57BL/6J (Jackson Laboratory, Bar Harbor Maine), расщепляли в коллагеназе (250 ед./мл) (Worthington, Lakewood, NJ) и суспендировали в концентрации, эквивалентной 107 клеток на мл после фильтрации через 40 мкм клеточные сита. GM-CSF включали в микросферы из PLG с использованием стандартного способа двойной эмульсии. Суспензию клеток опухоли подвергали 4 циклам быстрого замораживания в жидком азоте и размораживания (37°C), и затем центрифугировали при 400 об./мин в течение 10 мин. Супернатант (1 мл), содержащий лизаты опухолей, собирали и лиофилизировали. Для включения CpG-ODN или поли(I:C) в каркасы из PLG, CpG-ODN 1826 (для исследований на мышах), HMW P(I:C) и CpG-ODN 2216 (для исследований на DC человека) (Invivogen, San Diego, CA) сначала конденсировали с поли(этиленимином) (PEI, Mn ~60000, Sigma Aldrich) посредством добавления по каплям растворов CpG-ODN 1826 в раствор PEI, во время встряхивания смеси. Соотношение загрузки между PEI и CpG-ODN (NH3+:PO4-) сохраняли постоянно равным 7 во время конденсации. Затем растворы конденсата встряхивали с 60 мкл 50% (масс./об.) раствора сахарозы, лиофилизировали и смешивали с сухой сахарозой до конечной массы 150 мг.
Затем микросферы из PLG с покрытиями или без покрытий PEI смешивали с сахарозой, содержащей конденсат PEI-CpG-ODN, PEI-P(I:C) или лизат опухоли, и формовали прессованием. Полученному диску позволяли достичь равновесия в окружении CO2 под высоким давлением, и быстрое уменьшение давления заставляет частицы полимера расширяться и сливаться во взаимосвязанную структуру. Сахарозу выщелачивали из каркасов посредством погружения в воду, получая каркасы с 80-90% пор.
Анализы вакцин
Для профилактической вакцинации, животных вакцинировали с использованием нагруженных B16-лизатом вакцин на основе PLG с покрытиями или без покрытий PEI за 14 суток до заражения опухолями из 105 клеток меланомы B16-F10 (ATCC, Manassas, NJ). Для терапевтической вакцинации, животных заражали с использованием подкожной инъекции 105 клеток меланомы B16-F10 (ATCC, Manassas, NJ) в заднюю часть шеи. На сутки 9 после заражения опухолями, вакцины на основе PLG с покрытием или без покрытия PEI использовали для включения антигенов лизата опухоли меланомы. Животных мониторировали по началу роста опухолей (приблизительно 1 мм3) и умерщвляли из гуманных соображений, когда опухоли вырастали до 20-25 мм (наиболее длинный диаметр).
Активация клеток и продукция цитокинов in vitro
Вакцины на основе PLG рассевали с 5×106 PBMC человека или мышиных клеток, как указано, и помещали непосредственно в среды RPMI, дополненные 10% FBS. В указанных временных точках, каркасы механически встряхивали для высвобождения клеток для анализа поверхностных маркеров клеток, и среды собирали для оценки продукции цитокинов. Проводили окрашивание и анализы проточной цитометрии с использованием антител APC-CD11c в сочетании с FITC-MHCII и APC-CD86 для определения активации мышиных DC. Активацию клеток человека анализировали с использованием красителей FITC-HLA-DR и APC-CD83. Все антитела получали из eBioscience, San Diego, CA. Клетки отбирали в соответствии с отдельным положительным окрашиванием по FITC, APC и PE, с использованием контроля изотипов. Процент клеток, положительно окрашенных по каждому поверхностному антигену, регистрировали. Продукцию воспалительных цитокинов анализировали с использованием ELISA для мышиного IL12 или IFN-a или с использованием ELISA для человеческих IL-2, TNF-a и Il-6.
Для оценки активации TLR посредством покрытых PEI каркасов, клетки HEK293, совместно трансфицированные геном hTLR5 и несущей зависимую от NF-κB секретируемую эмбриональную щелочную фосфатазу репортерной плазмидой (Invivogen), рассевали на каркасы из PLG (PLG) или каркасы, содержащие либо линейный (L25), либо разветвленный PEI (B60). Через 36 часов в 3-мерных культурах в PLG, секретируемую щелочную фосфатазу проявляли с использованием реагента Quantiblue® (Invivogen), и значения нормализовали по нестимулированным клеткам.
Инфильтрация и активация in vivo DC и T-клеток, и продукция цитокинов
Вакцины на основе PLG извлекали в указанных временных точках, и растущую внутри ткань расщепляли до суспензий отдельных клеток с использованием раствора коллагеназы (Worthington, 250 ед./мл), который встряхивали при 37°C в течение 45 минут. Затем суспензии клеток проливали через 40 мкм клеточное сито для отделения клеток от частиц каркаса, и клетки осаждали и промывали холодным PBS, и подсчитывали с использованием счетчика Культера Z2 (Beckman Coulter). На указанные сутки, опухоли B16-F10 также удаляли у мышей, и расщепляли в 1 мг/мл коллагеназы II (250 ед./мл) (Worthington, Lakewood, NJ) и 0,1 мг/мл ДНКазы в течение 1 часа при 37°C, и диссоциированные клетки фильтровали через 40-мкм фильтр. Отрицательное отделение T-клеток проводили с использованием набора для выделения мышиных пан-T-клеток (Miltenyi Biotec, San Diego, CA), который сначала удаляет врожденные иммуноциты и APC вместе с дебрисом и некротическими клетками из суспензии.
Для оценки DC, выделенных из участка вакцинации, выделенные клетки напрямую окрашивали с использованием антител для характеризации фенотипа посредством анализа активированной флуоресценцией сортировки клеток (FACS). Окрашивание конъюгированным с APC антителом против CD11c проводили в сочетании с окрашиваниями конъюгированным с FITC антителом против MHC-II и конъюгированным с PE антителом против CD86, и анализировали с использованием проточной цитометрии, чтобы отметить активацию DC. Инфильтрующие опухоль лейкоциты совместно окрашивали с использованием PE-Cy7 CD3e, APC CD8a для идентификаци T-клеток, вместе с маркером активации FITC-анти-IFNγ и PE-анти-CD107a. Все антитела получали из eBioscience, San Diego, CA. Клетки отбирали в соответствии с отдельным положительным окрашиванием по FITC, APC и PE, с использованием контроля изотипов. Процент клеток, положительно окрашенных по каждому поверхностному антигену, регистрировали.
Для определения концентраций in vivo воспалительных цитокинов в участке имплантации матрицы, соседнюю ткань вырезали и расщепляли с использованием реагента для экстракции белка из ткани (Pierce). После центрифугирования, концентрации цитокинов в супернатанте затем анализировали с использованием ELISA (R&D systems) и 23-плексного анализа цитокинов мыши Bio-Plex Pro™ (Biorad), в соответствии с инструкциями производителя. Местный анализ цитокинов в участке вакцинации проводили у мышей дикого типа C57BL/6J, мышей Batf3-/- и мышей с нокаутом CD8 в T-клетках.
Статистический анализ
Все значения в настоящем исследовании выражали как среднее±S.D. Статистическую значимость различий между группами анализировали посредством двустороннего t-критерия Стьюдента, и значение p менее чем 0,05, считали значимым.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
В то время как изобретение описано в сочетании с его подробным описанием, вышеприведенное описание предназначено для иллюстрации, а не ограничения объема изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации включены в объем следующей ниже формулы изобретения.
Патентная и научная литература, на которую ссылаются в настоящем описании, устанавливает уровень техники, доступный специалисту в данной области. Содержание всех патентов Соединенных Штатов и опубликованных или неопубликованных патентных заявок Соединенных Штатов, процитированных в настоящем описании, включено в качестве ссылки. Содержание всех опубликованных иностранных патентов и патентных заявок, процитированных в настоящем описании, таким образом, приведено в качестве ссылки. Содержание данных, представленных в Genbank и NCBI, указанных под номерами доступа, процитированными в настоящем описании, таким образом, приведено в качестве ссылки. Содержание всех других опубликованных ссылок, документов, манускриптов и научных литературных источников, процитированных в настоящем описании, таким образом, приведено в качестве ссылки.
В то время как это изобретение конкретно показано и описано по отношению к предпочтительным вариантам его осуществления, специалисту в данной области понятно, что можно вносить различные изменения в их форму и детали, без отклонения от объема изобретения, включенного в прилагаемую формулу изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> President and Fellows of Harvard College
<120> Биологические материалы для модуляции иммунных ответов
<130> 29297-132001WO
<150> 62/473,699
<151> 2017-03-20
<150> 62/460,652
<151> 2017-02-17
<150> 62/370,211
<151> 2016-08-02
<160> 293
<170> PatentIn версии 3.5
<210> 1
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Ингибитор TGF-бета
<220>
<221> Y представляет собой фосфотирозин
<222> (2)..(2)
<400> 1
Pro Tyr Leu Lys Thr Lys
1 5
<210> 2
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Ингибитор TGF-бета
<220>
<221> Y представляет собой фосфотирозин
<222> (1)..(1)
<400> 2
Tyr Leu Pro Gln Thr Val
1 5
<210> 3
<211> 143
<212> PRT
<213> Homo sapiens
<400> 3
Trp Leu Gln Ser Leu Leu Leu Leu Gly Thr Val Ala Cys Ser Ile Ser
1 5 10 15
Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His Val
20 25 30
Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp Thr
35 40 45
Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe Asp
50 55 60
Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys Gln
65 70 75 80
Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met Met
85 90 95
Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser Cys
100 105 110
Ala Thr Gln Ile Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys Asp
115 120 125
Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
130 135 140
<210> 4
<211> 235
<212> PRT
<213> Homo sapiens
<400> 4
Met Thr Val Leu Ala Pro Ala Trp Ser Pro Thr Thr Tyr Leu Leu Leu
1 5 10 15
Leu Leu Leu Leu Ser Ser Gly Leu Ser Gly Thr Gln Asp Cys Ser Phe
20 25 30
Gln His Ser Pro Ile Ser Ser Asp Phe Ala Val Lys Ile Arg Glu Leu
35 40 45
Ser Asp Tyr Leu Leu Gln Asp Tyr Pro Val Thr Val Ala Ser Asn Leu
50 55 60
Gln Asp Glu Glu Leu Cys Gly Gly Leu Trp Arg Leu Val Leu Ala Gln
65 70 75 80
Arg Trp Met Glu Arg Leu Lys Thr Val Ala Gly Ser Lys Met Gln Gly
85 90 95
Leu Leu Glu Arg Val Asn Thr Glu Ile His Phe Val Thr Lys Cys Ala
100 105 110
Phe Gln Pro Pro Pro Ser Cys Leu Arg Phe Val Gln Thr Asn Ile Ser
115 120 125
Arg Leu Leu Gln Glu Thr Ser Glu Gln Leu Val Ala Leu Lys Pro Trp
130 135 140
Ile Thr Arg Gln Asn Phe Ser Arg Cys Leu Glu Leu Gln Cys Gln Pro
145 150 155 160
Asp Ser Ser Thr Leu Pro Pro Pro Trp Ser Pro Arg Pro Leu Glu Ala
165 170 175
Thr Ala Pro Thr Ala Pro Gln Pro Pro Leu Leu Leu Leu Leu Leu Leu
180 185 190
Pro Val Gly Leu Leu Leu Leu Ala Ala Ala Trp Cys Leu His Trp Gln
195 200 205
Arg Thr Arg Arg Arg Thr Pro Arg Pro Gly Glu Gln Val Pro Pro Val
210 215 220
Pro Ser Pro Gln Asp Leu Leu Leu Val Glu His
225 230 235
<210> 5
<211> 95
<212> PRT
<213> Homo sapiens
<400> 5
Met Cys Cys Thr Lys Ser Leu Leu Leu Ala Ala Leu Met Ser Val Leu
1 5 10 15
Leu Leu His Leu Cys Gly Glu Ser Glu Ala Ser Asn Phe Asp Cys Cys
20 25 30
Leu Gly Tyr Thr Asp Arg Ile Leu His Pro Lys Phe Ile Val Gly Phe
35 40 45
Thr Arg Gln Leu Ala Asn Glu Gly Cys Asp Ile Asn Ala Ile Ile Phe
50 55 60
His Thr Lys Lys Lys Leu Ser Val Cys Ala Asn Pro Lys Gln Thr Trp
65 70 75 80
Val Lys Tyr Ile Val Arg Leu Leu Ser Lys Lys Val Lys Asn Met
85 90 95
<210> 6
<211> 135
<212> PRT
<213> Homo sapiens
<400> 6
Met Val Leu Gly Thr Ile Asp Leu Cys Ser Cys Phe Ser Ala Gly Leu
1 5 10 15
Pro Lys Thr Glu Ala Asn Trp Val Asn Val Ile Ser Asp Leu Lys Lys
20 25 30
Ile Glu Asp Leu Ile Gln Ser Met His Ile Asp Ala Thr Leu Tyr Thr
35 40 45
Glu Ser Asp Val His Pro Ser Cys Lys Val Thr Ala Met Lys Cys Phe
50 55 60
Leu Leu Glu Leu Gln Val Ile Ser Leu Glu Ser Gly Asp Ala Ser Ile
65 70 75 80
His Asp Thr Val Glu Asn Leu Ile Ile Leu Ala Asn Asn Ser Leu Ser
85 90 95
Ser Asn Gly Asn Val Thr Glu Ser Gly Cys Lys Glu Cys Glu Glu Leu
100 105 110
Glu Glu Lys Asn Ile Lys Glu Phe Leu Gln Ser Phe Val His Ile Val
115 120 125
Gln Met Phe Ile Asn Thr Ser
130 135
<210> 7
<211> 114
<212> PRT
<213> Homo sapiens
<400> 7
Met Arg Leu Leu Ile Leu Ala Leu Leu Gly Ile Cys Ser Leu Thr Ala
1 5 10 15
Tyr Ile Val Glu Gly Val Gly Ser Glu Val Ser Asp Lys Arg Thr Cys
20 25 30
Val Ser Leu Thr Thr Gln Arg Leu Pro Val Ser Arg Ile Lys Thr Tyr
35 40 45
Thr Ile Thr Glu Gly Ser Leu Arg Ala Val Ile Phe Ile Thr Lys Arg
50 55 60
Gly Leu Lys Val Cys Ala Asp Pro Gln Ala Thr Trp Val Arg Asp Val
65 70 75 80
Val Arg Ser Met Asp Arg Lys Ser Asn Thr Arg Asn Asn Met Ile Gln
85 90 95
Thr Lys Pro Thr Gly Thr Gln Gln Ser Thr Asn Thr Ala Val Thr Leu
100 105 110
Thr Gly
<210> 8
<211> 107
<212> PRT
<213> Homo sapiens
<400> 8
Met Ala Arg Ala Ala Leu Ser Ala Ala Pro Ser Asn Pro Arg Leu Leu
1 5 10 15
Arg Val Ala Leu Leu Leu Leu Leu Leu Val Ala Ala Gly Arg Arg Ala
20 25 30
Ala Gly Ala Ser Val Ala Thr Glu Leu Arg Cys Gln Cys Leu Gln Thr
35 40 45
Leu Gln Gly Ile His Pro Lys Asn Ile Gln Ser Val Asn Val Lys Ser
50 55 60
Pro Gly Pro His Cys Ala Gln Thr Glu Val Ile Ala Thr Leu Lys Asn
65 70 75 80
Gly Arg Lys Ala Cys Leu Asn Pro Ala Ser Pro Ile Val Lys Lys Ile
85 90 95
Ile Glu Lys Met Leu Asn Ser Asp Lys Ser Asn
100 105
<210> 9
<211> 189
<212> PRT
<213> Homo sapiens
<400> 9
Met Ala Ser Pro Phe Ala Leu Leu Met Val Leu Val Val Leu Ser Cys
1 5 10 15
Lys Ser Ser Cys Ser Leu Gly Cys Asp Leu Pro Glu Thr His Ser Leu
20 25 30
Asp Asn Arg Arg Thr Leu Met Leu Leu Ala Gln Met Ser Arg Ile Ser
35 40 45
Pro Ser Ser Cys Leu Met Asp Arg His Asp Phe Gly Phe Pro Gln Glu
50 55 60
Glu Phe Asp Gly Asn Gln Phe Gln Lys Ala Pro Ala Ile Ser Val Leu
65 70 75 80
His Glu Leu Ile Gln Gln Ile Phe Asn Leu Phe Thr Thr Lys Asp Ser
85 90 95
Ser Ala Ala Trp Asp Glu Asp Leu Leu Asp Lys Phe Cys Thr Glu Leu
100 105 110
Tyr Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Met Gln Glu Glu Arg
115 120 125
Val Gly Glu Thr Pro Leu Met Asn Ala Asp Ser Ile Leu Ala Val Lys
130 135 140
Lys Tyr Phe Arg Arg Ile Thr Leu Tyr Leu Thr Glu Lys Lys Tyr Ser
145 150 155 160
Pro Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Leu Ser
165 170 175
Leu Ser Thr Asn Leu Gln Glu Arg Leu Arg Arg Lys Glu
180 185
<210> 10
<211> 187
<212> PRT
<213> Homo sapiens
<400> 10
Met Thr Asn Lys Cys Leu Leu Gln Ile Ala Leu Leu Leu Cys Phe Ser
1 5 10 15
Thr Thr Ala Leu Ser Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg
20 25 30
Ser Ser Asn Cys Gln Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg
35 40 45
Leu Glu Tyr Cys Leu Lys Asp Arg Arg Asn Phe Asp Ile Pro Glu Glu
50 55 60
Ile Lys Gln Leu Gln Gln Phe Gln Lys Glu Asp Ala Ala Val Thr Ile
65 70 75 80
Tyr Glu Met Leu Gln Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser
85 90 95
Ser Thr Gly Trp Asn Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val
100 105 110
Tyr His Gln Arg Asn His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu
115 120 125
Lys Glu Asp Phe Thr Arg Gly Lys Arg Met Ser Ser Leu His Leu Lys
130 135 140
Arg Tyr Tyr Gly Arg Ile Leu His Tyr Leu Lys Ala Lys Glu Asp Ser
145 150 155 160
His Cys Ala Trp Thr Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr
165 170 175
Val Ile Asn Arg Leu Thr Gly Tyr Leu Arg Asn
180 185
<210> 11
<211> 306
<212> PRT
<213> Homo sapiens
<400> 11
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 12
<211> 197
<212> PRT
<213> Homo sapiens
<400> 12
Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu
1 5 10 15
His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys
20 25 30
Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp
35 40 45
His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu
50 55 60
Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr
65 70 75 80
Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe
85 90 95
Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr
100 105 110
Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys
115 120 125
Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu
130 135 140
Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser
145 150 155 160
Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu
165 170 175
Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser
180 185 190
Tyr Leu Asn Ala Ser
195
<210> 13
<211> 1448
<212> ДНК
<213> Homo sapiens
<400> 13
gtgaccgagc ggcgcggacg gccgcctgcc ccctctgcca cctggggcgg tgcgggcccg 60
gagcccggag cccgggtagc gcgtagagcc ggcgcgatgc acgtgcgctc actgcgagct 120
gcggcgccgc acagcttcgt ggcgctctgg gcacccctgt tcctgctgcg ctccgccctg 180
gccgacttca gcctggacaa cgaggtgcac tcgagcttca tccaccggcg cctccgcagc 240
caggagcggc gggagatgca gcgcgagatc ctctccattt tgggcttgcc ccaccgcccg 300
cgcccgcacc tccagggcaa gcacaactcg gcacccatgt tcatgctgga cctgtacaac 360
gccatggcgg tggaggaggg cggcgggccc ggcggccagg gcttctccta cccctacaag 420
gccgtcttca gtacccaggg cccccctctg gccagcctgc aagatagcca tttcctcacc 480
gacgccgaca tggtcatgag cttcgtcaac ctcgtggaac atgacaagga attcttccac 540
ccacgctacc accatcgaga gttccggttt gatctttcca agatcccaga aggggaagct 600
gtcacggcag ccgaattccg gatctacaag gactacatcc gggaacgctt cgacaatgag 660
acgttccgga tcagcgttta tcaggtgctc caggagcact tgggcaggga atcggatctc 720
ttcctgctcg acagccgtac cctctgggcc tcggaggagg gctggctggt gtttgacatc 780
acagccacca gcaaccactg ggtggtcaat ccgcggcaca acctgggcct gcagctctcg 840
gtggagacgc tggatgggca gagcatcaac cccaagttgg cgggcctgat tgggcggcac 900
gggccccaga acaagcagcc cttcatggtg gctttcttca aggccacgga ggtccacttc 960
cgcagcatcc ggtccacggg gagcaaacag cgcagccaga accgctccaa gacgcccaag 1020
aaccaggaag ccctgcggat ggccaacgtg gcagagaaca gcagcagcga ccagaggcag 1080
gcctgtaaga agcacgagct gtatgtcagc ttccgagacc tgggctggca ggactggatc 1140
atcgcgcctg aaggctacgc cgcctactac tgtgaggggg agtgtgcctt ccctctgaac 1200
tcctacatga acgccaccaa ccacgccatc gtgcagacgc tggtccactt catcaacccg 1260
gaaacggtgc ccaagccctg ctgtgcgccc acgcagctca atgccatctc cgtcctctac 1320
ttcgatgaca gctccaacgt catcctgaag aaatacagaa acatggtggt ccgggcctgt 1380
ggctgccact agctcctccg agaattcaga ccctttgggg ccaagttttt ctggatcctc 1440
cattgctc 1448
<210> 14
<211> 4978
<212> ДНК
<213> Homo sapiens
<400> 14
ggtttccgga gctgcggcgg cgcagactgg gagggggagc cgggggttcc gacgtcgcag 60
ccgagggaac aagccccaac cggatcctgg acaggcaccc cggcttggcg ctgtctctcc 120
ccctcggctc ggagaggccc ttcggcctga gggagcctcg ccgcccgtcc ccggcacacg 180
cgcagccccg gcctctcggc ctctgccgga gaaacagttg ggacccctga ttttagcagg 240
atggcccaat ggaatcagct acagcagctt gacacacggt acctggagca gctccatcag 300
ctctacagtg acagcttccc aatggagctg cggcagtttc tggccccttg gattgagagt 360
caagattggg catatgcggc cagcaaagaa tcacatgcca ctttggtgtt tcataatctc 420
ctgggagaga ttgaccagca gtatagccgc ttcctgcaag agtcgaatgt tctctatcag 480
cacaatctac gaagaatcaa gcagtttctt cagagcaggt atcttgagaa gccaatggag 540
attgcccgga ttgtggcccg gtgcctgtgg gaagaatcac gccttctaca gactgcagcc 600
actgcggccc agcaaggggg ccaggccaac caccccacag cagccgtggt gacggagaag 660
cagcagatgc tggagcagca ccttcaggat gtccggaaga gagtgcagga tctagaacag 720
aaaatgaaag tggtagagaa tctccaggat gactttgatt tcaactataa aaccctcaag 780
agtcaaggag acatgcaaga tctgaatgga aacaaccagt cagtgaccag gcagaagatg 840
cagcagctgg aacagatgct cactgcgctg gaccagatgc ggagaagcat cgtgagtgag 900
ctggcggggc ttttgtcagc gatggagtac gtgcagaaaa ctctcacgga cgaggagctg 960
gctgactgga agaggcggca acagattgcc tgcattggag gcccgcccaa catctgccta 1020
gatcggctag aaaactggat aacgtcatta gcagaatctc aacttcagac ccgtcaacaa 1080
attaagaaac tggaggagtt gcagcaaaaa gtttcctaca aaggggaccc cattgtacag 1140
caccggccga tgctggagga gagaatcgtg gagctgttta gaaacttaat gaaaagtgcc 1200
tttgtggtgg agcggcagcc ctgcatgccc atgcatcctg accggcccct cgtcatcaag 1260
accggcgtcc agttcactac taaagtcagg ttgctggtca aattccctga gttgaattat 1320
cagcttaaaa ttaaagtgtg cattgacaaa gactctgggg acgttgcagc tctcagagga 1380
tcccggaaat ttaacattct gggcacaaac acaaaagtga tgaacatgga agaatccaac 1440
aacggcagcc tctctgcaga attcaaacac ttgaccctga gggagcagag atgtgggaat 1500
gggggccgag ccaattgtga tgcttccctg attgtgactg aggagctgca cctgatcacc 1560
tttgagaccg aggtgtatca ccaaggcctc aagattgacc tagagaccca ctccttgcca 1620
gttgtggtga tctccaacat ctgtcagatg ccaaatgcct gggcgtccat cctgtggtac 1680
aacatgctga ccaacaatcc caagaatgta aactttttta ccaagccccc aattggaacc 1740
tgggatcaag tggccgaggt cctgagctgg cagttctcct ccaccaccaa gcgaggactg 1800
agcatcgagc agctgactac actggcagag aaactcttgg gacctggtgt gaattattca 1860
gggtgtcaga tcacatgggc taaattttgc aaagaaaaca tggctggcaa gggcttctcc 1920
ttctgggtct ggctggacaa tatcattgac cttgtgaaaa agtacatcct ggccctttgg 1980
aacgaagggt acatcatggg ctttatcagt aaggagcggg agcgggccat cttgagcact 2040
aagcctccag gcaccttcct gctaagattc agtgaaagca gcaaagaagg aggcgtcact 2100
ttcacttggg tggagaagga catcagcggt aagacccaga tccagtccgt ggaaccatac 2160
acaaagcagc agctgaacaa catgtcattt gctgaaatca tcatgggcta taagatcatg 2220
gatgctacca atatcctggt gtctccactg gtctatctct atcctgacat tcccaaggag 2280
gaggcattcg gaaagtattg tcggccagag agccaggagc atcctgaagc tgacccaggt 2340
agcgctgccc catacctgaa gaccaagttt atctgtgtga caccaacgac ctgcagcaat 2400
accattgacc tgccgatgtc cccccgcact ttagattcat tgatgcagtt tggaaataat 2460
ggtgaaggtg ctgaaccctc agcaggaggg cagtttgagt ccctcacctt tgacatggag 2520
ttgacctcgg agtgcgctac ctcccccatg tgaggagctg agaacggaag ctgcagaaag 2580
atacgactga ggcgcctacc tgcattctgc cacccctcac acagccaaac cccagatcat 2640
ctgaaactac taactttgtg gttccagatt ttttttaatc tcctacttct gctatctttg 2700
agcaatctgg gcacttttaa aaatagagaa atgagtgaat gtgggtgatc tgcttttatc 2760
taaatgcaaa taaggatgtg ttctctgaga cccatgatca ggggatgtgg cggggggtgg 2820
ctagagggag aaaaaggaaa tgtcttgtgt tgttttgttc ccctgccctc ctttctcagc 2880
agctttttgt tattgttgtt gttgttctta gacaagtgcc tcctggtgcc tgcggcatcc 2940
ttctgcctgt ttctgtaagc aaatgccaca ggccacctat agctacatac tcctggcatt 3000
gcacttttta accttgctga catccaaata gaagatagga ctatctaagc cctaggtttc 3060
tttttaaatt aagaaataat aacaattaaa gggcaaaaaa cactgtatca gcatagcctt 3120
tctgtattta agaaacttaa gcagccgggc atggtggctc acgcctgtaa tcccagcact 3180
ttgggaggcc gaggcggatc ataaggtcag gagatcaaga ccatcctggc taacacggtg 3240
aaaccccgtc tctactaaaa gtacaaaaaa ttagctgggt gtggtggtgg gcgcctgtag 3300
tcccagctac tcgggaggct gaggcaggag aatcgcttga acctgagagg cggaggttgc 3360
agtgagccaa aattgcacca ctgcacactg cactccatcc tgggcgacag tctgagactc 3420
tgtctcaaaa aaaaaaaaaa aaaaaagaaa cttcagttaa cagcctcctt ggtgctttaa 3480
gcattcagct tccttcaggc tggtaattta tataatccct gaaacgggct tcaggtcaaa 3540
cccttaagac atctgaagct gcaacctggc ctttggtgtt gaaataggaa ggtttaagga 3600
gaatctaagc attttagact tttttttata aatagactta ttttcctttg taatgtattg 3660
gccttttagt gagtaaggct gggcagaggg tgcttacaac cttgactccc tttctccctg 3720
gacttgatct gctgtttcag aggctaggtt gtttctgtgg gtgccttatc agggctggga 3780
tacttctgat tctggcttcc ttcctgcccc accctcccga ccccagtccc cctgatcctg 3840
ctagaggcat gtctccttgc gtgtctaaag gtccctcatc ctgtttgttt taggaatcct 3900
ggtctcagga cctcatggaa gaagaggggg agagagttac aggttggaca tgatgcacac 3960
tatggggccc cagcgacgtg tctggttgag ctcagggaat atggttctta gccagtttct 4020
tggtgatatc cagtggcact tgtaatggcg tcttcattca gttcatgcag ggcaaaggct 4080
tactgataaa cttgagtctg ccctcgtatg agggtgtata cctggcctcc ctctgaggct 4140
ggtgactcct ccctgctggg gccccacagg tgaggcagaa cagctagagg gcctccccgc 4200
ctgcccgcct tggctggcta gctcgcctct cctgtgcgta tgggaacacc tagcacgtgc 4260
tggatgggct gcctctgact cagaggcatg gccggatttg gcaactcaaa accaccttgc 4320
ctcagctgat cagagtttct gtggaattct gtttgttaaa tcaaattagc tggtctctga 4380
attaaggggg agacgacctt ctctaagatg aacagggttc gccccagtcc tcctgcctgg 4440
agacagttga tgtgtcatgc agagctctta cttctccagc aacactcttc agtacataat 4500
aagcttaact gataaacaga atatttagaa aggtgagact tgggcttacc attgggttta 4560
aatcataggg acctagggcg agggttcagg gcttctctgg agcagatatt gtcaagttca 4620
tggccttagg tagcatgtat ctggtcttaa ctctgattgt agcaaaagtt ctgagaggag 4680
ctgagccctg ttgtggccca ttaaagaaca gggtcctcag gccctgcccg cttcctgtcc 4740
actgccccct ccccatcccc agcccagccg agggaatccc gtgggttgct tacctaccta 4800
taaggtggtt tataagctgc tgtcctggcc actgcattca aattccaatg tgtacttcat 4860
agtgtaaaaa tttatattat tgtgaggttt tttgtctttt tttttttttt ttttttttgg 4920
tatattgctg tatctacttt aacttccaga aataaacgtt atataggaac cgtaaaaa 4978
<210> 15
<211> 1944
<212> ДНК
<213> Homo sapiens
<400> 15
aatttctcac tgcccctgtg ataaactgtg gtcactggct gtggcagcaa ctattataag 60
atgctctgaa aactcttcag acactgaggg gcaccagagg agcagactac aagaatggca 120
cacgctatgg aaaactcctg gacaatcagt aaagagtacc atattgatga agaagtgggc 180
tttgctctgc caaatccaca ggaaaatcta cctgattttt ataatgactg gatgttcatt 240
gctaaacatc tgcctgatct catagagtct ggccagcttc gagaaagagt tgagaagtta 300
aacatgctca gcattgatca tctcacagac cacaagtcac agcgccttgc acgtctagtt 360
ctgggatgca tcaccatggc atatgtgtgg ggcaaaggtc atggagatgt ccgtaaggtc 420
ttgccaagaa atattgctgt tccttactgc caactctcca agaaactgga actgcctcct 480
attttggttt atgcagactg tgtcttggca aactggaaga aaaaggatcc taataagccc 540
ctgacttatg agaacatgga cgttttgttc tcatttcgtg atggagactg cagtaaagga 600
ttcttcctgg tctctctatt ggtggaaata gcagctgctt ctgcaatcaa agtaattcct 660
actgtattca aggcaatgca aatgcaagaa cgggacactt tgctaaaggc gctgttggaa 720
atagcttctt gcttggagaa agcccttcaa gtgtttcacc aaatccacga tcatgtgaac 780
ccaaaagcat ttttcagtgt tcttcgcata tatttgtctg gctggaaagg caacccccag 840
ctatcagacg gtctggtgta tgaagggttc tgggaagacc caaaggagtt tgcagggggc 900
agtgcaggcc aaagcagcgt ctttcagtgc tttgacgtcc tgctgggcat ccagcagact 960
gctggtggag gacatgctgc tcagttcctc caggacatga gaagatatat gccaccagct 1020
cacaggaact tcctgtgctc attagagtca aatccctcag tccgtgagtt tgtcctttca 1080
aaaggtgatg ctggcctgcg ggaagcttat gacgcctgtg tgaaagctct ggtctccctg 1140
aggagctacc atctgcaaat cgtgactaag tacatcctga ttcctgcaag ccagcagcca 1200
aaggagaata agacctctga agacccttca aaactggaag ccaaaggaac tggaggcact 1260
gatttaatga atttcctgaa gactgtaaga agtacaactg agaaatccct tttgaaggaa 1320
ggttaatgta acccaacaag agcacatttt atcatagcag agacatctgt atgcattcct 1380
gtcattaccc attgtaacag agccacaaac taatactatg caatgtttta ccaataatgc 1440
aatacaaaag acctcaaaat acctgtgcat ttcttgtagg aaaacaacaa aaggtaatta 1500
tgtgtaatta tactagaagt tttgtaatct gtatcttatc attggaataa aatgacattc 1560
aataaataaa aatgcataag atatattctg tcggctgggc gcggtggctc acgcctgtaa 1620
tcccagcact ttgggaggcc gaggcgggcg gatcacaagg tcaggagatc gagaccatct 1680
tggctaacac ggtgaaaccc cgtctctact aaaaatacaa aaaattagcc gggcgcggtg 1740
gcgggcacct gtagtcccag ctactcggga ggctgaggca ggagaatggc gtgaacctgg 1800
gaggcggagc ttgcagtgag ccaagattgt gccactgcaa tccggcctgg gctaaagagc 1860
gggactccgt ctcaaaaaaa aaaaaaaaaa gatatattct gtcataataa ataaaaatgc 1920
ataagatata aaaaaaaaaa aaaa 1944
<210> 16
<211> 2115
<212> ДНК
<213> Homo sapiens
<400> 16
agtttccctt ccgctcacct ccgcctgagc agtggagaag gcggcactct ggtggggctg 60
ctccaggcat gcagatccca caggcgccct ggccagtcgt ctgggcggtg ctacaactgg 120
gctggcggcc aggatggttc ttagactccc cagacaggcc ctggaacccc cccaccttct 180
ccccagccct gctcgtggtg accgaagggg acaacgccac cttcacctgc agcttctcca 240
acacatcgga gagcttcgtg ctaaactggt accgcatgag ccccagcaac cagacggaca 300
agctggccgc cttccccgag gaccgcagcc agcccggcca ggactgccgc ttccgtgtca 360
cacaactgcc caacgggcgt gacttccaca tgagcgtggt cagggcccgg cgcaatgaca 420
gcggcaccta cctctgtggg gccatctccc tggcccccaa ggcgcagatc aaagagagcc 480
tgcgggcaga gctcagggtg acagagagaa gggcagaagt gcccacagcc caccccagcc 540
cctcacccag gccagccggc cagttccaaa ccctggtggt tggtgtcgtg ggcggcctgc 600
tgggcagcct ggtgctgcta gtctgggtcc tggccgtcat ctgctcccgg gccgcacgag 660
ggacaatagg agccaggcgc accggccagc ccctgaagga ggacccctca gccgtgcctg 720
tgttctctgt ggactatggg gagctggatt tccagtggcg agagaagacc ccggagcccc 780
ccgtgccctg tgtccctgag cagacggagt atgccaccat tgtctttcct agcggaatgg 840
gcacctcatc ccccgcccgc aggggctcag ctgacggccc tcggagtgcc cagccactga 900
ggcctgagga tggacactgc tcttggcccc tctgaccggc ttccttggcc accagtgttc 960
tgcagaccct ccaccatgag cccgggtcag cgcatttcct caggagaagc aggcagggtg 1020
caggccattg caggccgtcc aggggctgag ctgcctgggg gcgaccgggg ctccagcctg 1080
cacctgcacc aggcacagcc ccaccacagg actcatgtct caatgcccac agtgagccca 1140
ggcagcaggt gtcaccgtcc cctacaggga gggccagatg cagtcactgc ttcaggtcct 1200
gccagcacag agctgcctgc gtccagctcc ctgaatctct gctgctgctg ctgctgctgc 1260
tgctgctgcc tgcggcccgg ggctgaaggc gccgtggccc tgcctgacgc cccggagcct 1320
cctgcctgaa cttgggggct ggttggagat ggccttggag cagccaaggt gcccctggca 1380
gtggcatccc gaaacgccct ggacgcaggg cccaagactg ggcacaggag tgggaggtac 1440
atggggctgg ggactcccca ggagttatct gctccctgca ggcctagaga agtttcaggg 1500
aaggtcagaa gagctcctgg ctgtggtggg cagggcagga aacccctcca cctttacaca 1560
tgcccaggca gcacctcagg ccctttgtgg ggcagggaag ctgaggcagt aagcgggcag 1620
gcagagctgg aggcctttca ggcccagcca gcactctggc ctcctgccgc cgcattccac 1680
cccagcccct cacaccactc gggagaggga catcctacgg tcccaaggtc aggagggcag 1740
ggctggggtt gactcaggcc cctcccagct gtggccacct gggtgttggg agggcagaag 1800
tgcaggcacc tagggccccc catgtgccca ccctgggagc tctccttgga acccattcct 1860
gaaattattt aaaggggttg gccgggctcc caccagggcc tgggtgggaa ggtacaggcg 1920
ttcccccggg gcctagtacc cccgccgtgg cctatccact cctcacatcc acacactgca 1980
cccccactcc tggggcaggg ccaccagcat ccaggcggcc agcaggcacc tgagtggctg 2040
ggacaaggga tcccccttcc ctgtggttct attatattat aattataatt aaatatgaga 2100
gcatgctaag gaaaa 2115
<210> 17
<211> 3691
<212> ДНК
<213> Homo sapiens
<400> 17
ggcgcaacgc tgagcagctg gcgcgtcccg cgcggcccca gttctgcgca gcttcccgag 60
gctccgcacc agccgcgctt ctgtccgcct gcagggcatt ccagaaagat gaggatattt 120
gctgtcttta tattcatgac ctactggcat ttgctgaacg catttactgt cacggttccc 180
aaggacctat atgtggtaga gtatggtagc aatatgacaa ttgaatgcaa attcccagta 240
gaaaaacaat tagacctggc tgcactaatt gtctattggg aaatggagga taagaacatt 300
attcaatttg tgcatggaga ggaagacctg aaggttcagc atagtagcta cagacagagg 360
gcccggctgt tgaaggacca gctctccctg ggaaatgctg cacttcagat cacagatgtg 420
aaattgcagg atgcaggggt gtaccgctgc atgatcagct atggtggtgc cgactacaag 480
cgaattactg tgaaagtcaa tgccccatac aacaaaatca accaaagaat tttggttgtg 540
gatccagtca cctctgaaca tgaactgaca tgtcaggctg agggctaccc caaggccgaa 600
gtcatctgga caagcagtga ccatcaagtc ctgagtggta agaccaccac caccaattcc 660
aagagagagg agaagctttt caatgtgacc agcacactga gaatcaacac aacaactaat 720
gagattttct actgcacttt taggagatta gatcctgagg aaaaccatac agctgaattg 780
gtcatcccag aactacctct ggcacatcct ccaaatgaaa ggactcactt ggtaattctg 840
ggagccatct tattatgcct tggtgtagca ctgacattca tcttccgttt aagaaaaggg 900
agaatgatgg atgtgaaaaa atgtggcatc caagatacaa actcaaagaa gcaaagtgat 960
acacatttgg aggagacgta atccagcatt ggaacttctg atcttcaagc agggattctc 1020
aacctgtggt ttaggggttc atcggggctg agcgtgacaa gaggaaggaa tgggcccgtg 1080
ggatgcaggc aatgtgggac ttaaaaggcc caagcactga aaatggaacc tggcgaaagc 1140
agaggaggag aatgaagaaa gatggagtca aacagggagc ctggagggag accttgatac 1200
tttcaaatgc ctgaggggct catcgacgcc tgtgacaggg agaaaggata cttctgaaca 1260
aggagcctcc aagcaaatca tccattgctc atcctaggaa gacgggttga gaatccctaa 1320
tttgagggtc agttcctgca gaagtgccct ttgcctccac tcaatgcctc aatttgtttt 1380
ctgcatgact gagagtctca gtgttggaac gggacagtat ttatgtatga gtttttccta 1440
tttattttga gtctgtgagg tcttcttgtc atgtgagtgt ggttgtgaat gatttctttt 1500
gaagatatat tgtagtagat gttacaattt tgtcgccaaa ctaaacttgc tgcttaatga 1560
tttgctcaca tctagtaaaa catggagtat ttgtaaggtg cttggtctcc tctataacta 1620
caagtataca ttggaagcat aaagatcaaa ccgttggttg cataggatgt cacctttatt 1680
taacccatta atactctggt tgacctaatc ttattctcag acctcaagtg tctgtgcagt 1740
atctgttcca tttaaatatc agctttacaa ttatgtggta gcctacacac ataatctcat 1800
ttcatcgctg taaccaccct gttgtgataa ccactattat tttacccatc gtacagctga 1860
ggaagcaaac agattaagta acttgcccaa accagtaaat agcagacctc agactgccac 1920
ccactgtcct tttataatac aatttacagc tatattttac tttaagcaat tcttttattc 1980
aaaaaccatt tattaagtgc ccttgcaata tcaatcgctg tgccaggcat tgaatctaca 2040
gatgtgagca agacaaagta cctgtcctca aggagctcat agtataatga ggagattaac 2100
aagaaaatgt attattacaa tttagtccag tgtcatagca taaggatgat gcgaggggaa 2160
aacccgagca gtgttgccaa gaggaggaaa taggccaatg tggtctggga cggttggata 2220
tacttaaaca tcttaataat cagagtaatt ttcatttaca aagagaggtc ggtacttaaa 2280
ataaccctga aaaataacac tggaattcct tttctagcat tatatttatt cctgatttgc 2340
ctttgccata taatctaatg cttgtttata tagtgtctgg tattgtttaa cagttctgtc 2400
ttttctattt aaatgccact aaattttaaa ttcatacctt tccatgattc aaaattcaaa 2460
agatcccatg ggagatggtt ggaaaatctc cacttcatcc tccaagccat tcaagtttcc 2520
tttccagaag caactgctac tgcctttcat tcatatgttc ttctaaagat agtctacatt 2580
tggaaatgta tgttaaaagc acgtattttt aaaatttttt tcctaaatag taacacattg 2640
tatgtctgct gtgtactttg ctatttttat ttattttagt gtttcttata tagcagatgg 2700
aatgaatttg aagttcccag ggctgaggat ccatgccttc tttgtttcta agttatcttt 2760
cccatagctt ttcattatct ttcatatgat ccagtatatg ttaaatatgt cctacatata 2820
catttagaca accaccattt gttaagtatt tgctctagga cagagtttgg atttgtttat 2880
gtttgctcaa aaggagaccc atgggctctc cagggtgcac tgagtcaatc tagtcctaaa 2940
aagcaatctt attattaact ctgtatgaca gaatcatgtc tggaactttt gttttctgct 3000
ttctgtcaag tataaacttc actttgatgc tgtacttgca aaatcacatt ttctttctgg 3060
aaattccggc agtgtacctt gactgctagc taccctgtgc cagaaaagcc tcattcgttg 3120
tgcttgaacc cttgaatgcc accagctgtc atcactacac agccctccta agaggcttcc 3180
tggaggtttc gagattcaga tgccctggga gatcccagag tttcctttcc ctcttggcca 3240
tattctggtg tcaatgacaa ggagtacctt ggctttgcca catgtcaagg ctgaagaaac 3300
agtgtctcca acagagctcc ttgtgttatc tgtttgtaca tgtgcatttg tacagtaatt 3360
ggtgtgacag tgttctttgt gtgaattaca ggcaagaatt gtggctgagc aaggcacata 3420
gtctactcag tctattccta agtcctaact cctccttgtg gtgttggatt tgtaaggcac 3480
tttatccctt ttgtctcatg tttcatcgta aatggcatag gcagagatga tacctaattc 3540
tgcatttgat tgtcactttt tgtacctgca ttaatttaat aaaatattct tatttatttt 3600
gttacttggt acaccagcat gtccattttc ttgtttattt tgtgtttaat aaaatgttca 3660
gtttaacatc ccagtggaga aagttaaaaa a 3691
<210> 18
<211> 1923
<212> ДНК
<213> Homo sapiens
<400> 18
cttctgtgtg tgcacatgtg taatacatat ctgggatcaa agctatctat ataaagtcct 60
tgattctgtg tgggttcaaa cacatttcaa agcttcagga tcctgaaagg ttttgctcta 120
cttcctgaag acctgaacac cgctcccata aagccatggc ttgccttgga tttcagcggc 180
acaaggctca gctgaacctg gctaccagga cctggccctg cactctcctg ttttttcttc 240
tcttcatccc tgtcttctgc aaagcaatgc acgtggccca gcctgctgtg gtactggcca 300
gcagccgagg catcgccagc tttgtgtgtg agtatgcatc tccaggcaaa gccactgagg 360
tccgggtgac agtgcttcgg caggctgaca gccaggtgac tgaagtctgt gcggcaacct 420
acatgatggg gaatgagttg accttcctag atgattccat ctgcacgggc acctccagtg 480
gaaatcaagt gaacctcact atccaaggac tgagggccat ggacacggga ctctacatct 540
gcaaggtgga gctcatgtac ccaccgccat actacctggg cataggcaac ggaacccaga 600
tttatgtaat tgctaaagaa aagaagccct cttacaacag gggtctatgt gaaaatgccc 660
ccaacagagc cagaatgtga aaagcaattt cagccttatt ttattcccat caattgagaa 720
accattatga agaagagagt ccatatttca atttccaaga gctgaggcaa ttctaacttt 780
tttgctatcc agctattttt atttgtttgt gcatttgggg ggaattcatc tctctttaat 840
ataaagttgg atgcggaacc caaattacgt gtactacaat ttaaagcaaa ggagtagaaa 900
gacagagctg ggatgtttct gtcacatcag ctccactttc agtgaaagca tcacttggga 960
ttaatatggg gatgcagcat tatgatgtgg gtcaaggaat taagttaggg aatggcacag 1020
cccaaagaag gaaaaggcag ggagcgaggg agaagactat attgtacaca ccttatattt 1080
acgtatgaga cgtttatagc cgaaatgatc ttttcaagtt aaattttatg ccttttattt 1140
cttaaacaaa tgtatgatta catcaaggct tcaaaaatac tcacatggct atgttttagc 1200
cagtgatgct aaaggttgta ttgcatatat acatatatat atatatatat atatatatat 1260
atatatatat atatatatat atatatattt taatttgata gtattgtgca tagagccacg 1320
tatgtttttg tgtatttgtt aatggtttga atataaacac tatatggcag tgtctttcca 1380
ccttgggtcc cagggaagtt ttgtggagga gctcaggaca ctaatacacc aggtagaaca 1440
caaggtcatt tgctaactag cttggaaact ggatgaggtc atagcagtgc ttgattgcgt 1500
ggaattgtgc tgagttggtg ttgacatgtg ctttggggct tttacaccag ttcctttcaa 1560
tggtttgcaa ggaagccaca gctggtggta tctgagttga cttgacagaa cactgtcttg 1620
aagacaatgg cttactccag gagacccaca ggtatgacct tctaggaagc tccagttcga 1680
tgggcccaat tcttacaaac atgtggttaa tgccatggac agaagaaggc agcaggtggc 1740
agaatggggt gcatgaaggt ttctgaaaat taacactgct tgtgttttta actcaatatt 1800
ttccatgaaa atgcaacaac atgtataata tttttaatta aataaaaatc tgtggtggtc 1860
gttttaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaa 1923
<210> 19
<211> 1872
<212> ДНК
<213> Homo sapiens
<400> 19
tcaggctgcc tgatctgccc agctttccag ctttcctctg gattccggcc tctggtcatc 60
cctccccacc ctctctccaa ggccctctcc tggtctccct tcttctagaa ccccttcctc 120
cacctccctc tctgcagaac ttctccttta ccccccaccc cccaccactg ccccctttcc 180
ttttctgacc tccttttgga gggctcagcg ctgcccagac cataggagag atgtgggagg 240
ctcagttcct gggcttgctg tttctgcagc cgctttgggt ggctccagtg aagcctctcc 300
agccaggggc tgaggtcccg gtggtgtggg cccaggaggg ggctcctgcc cagctcccct 360
gcagccccac aatccccctc caggatctca gccttctgcg aagagcaggg gtcacttggc 420
agcatcagcc agacagtggc ccgcccgctg ccgcccccgg ccatcccctg gcccccggcc 480
ctcacccggc ggcgccctcc tcctgggggc ccaggccccg ccgctacacg gtgctgagcg 540
tgggtcccgg aggcctgcgc agcgggaggc tgcccctgca gccccgcgtc cagctggatg 600
agcgcggccg gcagcgcggg gacttctcgc tatggctgcg cccagcccgg cgcgcggacg 660
ccggcgagta ccgcgccgcg gtgcacctca gggaccgcgc cctctcctgc cgcctccgtc 720
tgcgcctggg ccaggcctcg atgactgcca gccccccagg atctctcaga gcctccgact 780
gggtcatttt gaactgctcc ttcagccgcc ctgaccgccc agcctctgtg cattggttcc 840
ggaaccgggg ccagggccga gtccctgtcc gggagtcccc ccatcaccac ttagcggaaa 900
gcttcctctt cctgccccaa gtcagcccca tggactctgg gccctggggc tgcatcctca 960
cctacagaga tggcttcaac gtctccatca tgtataacct cactgttctg ggtctggagc 1020
ccccaactcc cttgacagtg tacgctggag caggttccag ggtggggctg ccctgccgcc 1080
tgcctgctgg tgtggggacc cggtctttcc tcactgccaa gtggactcct cctgggggag 1140
gccctgacct cctggtgact ggagacaatg gcgactttac ccttcgacta gaggatgtga 1200
gccaggccca ggctgggacc tacacctgcc atatccatct gcaggaacag cagctcaatg 1260
ccactgtcac attggcaatc atcacagtga ctcccaaatc ctttgggtca cctggatccc 1320
tggggaagct gctttgtgag gtgactccag tatctggaca agaacgcttt gtgtggagct 1380
ctctggacac cccatcccag aggagtttct caggaccttg gctggaggca caggaggccc 1440
agctcctttc ccagccttgg caatgccagc tgtaccaggg ggagaggctt cttggagcag 1500
cagtgtactt cacagagctg tctagcccag gtgcccaacg ctctgggaga gccccaggtg 1560
ccctcccagc aggccacctc ctgctgtttc tcacccttgg tgtcctttct ctgctccttt 1620
tggtgactgg agcctttggc tttcaccttt ggagaagaca gtggcgacca agacgatttt 1680
ctgccttaga gcaagggatt caccctccgc aggctcagag caagatagag gagctggagc 1740
aagaaccgga gccggagccg gagccggaac cggagcccga gcccgagccc gagccggagc 1800
agctctgacc tggagctgag gcagccagca gatctcagca gcccagtcca aataaacgtc 1860
ctgtctagca gc 1872
<210> 20
<211> 1116
<212> ДНК
<213> Homo sapiens
<400> 20
ggagagttaa aactgtgcct aacagaggtg tcctctgact tttcttctgc aagctccatg 60
ttttcacatc ttccctttga ctgtgtcctg ctgctgctgc tgctactact tacaaggtcc 120
tcagaagtgg aatacagagc ggaggtcggt cagaatgcct atctgccctg cttctacacc 180
ccagccgccc cagggaacct cgtgcccgtc tgctggggca aaggagcctg tcctgtgttt 240
gaatgtggca acgtggtgct caggactgat gaaagggatg tgaattattg gacatccaga 300
tactggctaa atggggattt ccgcaaagga gatgtgtccc tgaccataga gaatgtgact 360
ctagcagaca gtgggatcta ctgctgccgg atccaaatcc caggcataat gaatgatgaa 420
aaatttaacc tgaagttggt catcaaacca gccaaggtca cccctgcacc gactctgcag 480
agagacttca ctgcagcctt tccaaggatg cttaccacca ggggacatgg cccagcagag 540
acacagacac tggggagcct ccctgatata aatctaacac aaatatccac attggccaat 600
gagttacggg actctagatt ggccaatgac ttacgggact ctggagcaac catcagaata 660
ggcatctaca tcggagcagg gatctgtgct gggctggctc tggctcttat cttcggcgct 720
ttaattttca aatggtattc tcatagcaaa gagaagatac agaatttaag cctcatctct 780
ttggccaacc tccctccctc aggattggca aatgcagtag cagagggaat tcgctcagaa 840
gaaaacatct ataccattga agagaacgta tatgaagtgg aggagcccaa tgagtattat 900
tgctatgtca gcagcaggca gcaaccctca caacctttgg gttgtcgctt tgcaatgcca 960
tagatccaac caccttattt ttgagcttgg tgttttgtct ttttcagaaa ctatgagctg 1020
tgtcacctga ctggttttgg aggttctgtc cactgctatg gagcagagtt ttcccatttt 1080
cagaagataa tgactcacat gggaattgaa ctggga 1116
<210> 21
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 1585
<400> 21
ggggtcaacg ttgagggggg 20
<210> 22
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 1668.
<400> 22
tccatgacgt tcctgatgct 20
<210> 23
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 1826
<400> 23
tccatgacgt tcctgacgtt 20
<210> 24
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 2006
<400> 24
tcgtcgtttt gtcgttttgt cgtt 24
<210> 25
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 2006-G5
<400> 25
tcgtcgtttt gtcgttttgt cgttggggg 29
<210> 26
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 2216
<400> 26
gggggacgat cgtcgggggg 20
<210> 27
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 2336
<400> 27
ggggacgacg tcgtgggggg g 21
<210> 28
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN 2395
<400> 28
tcgtcgtttt cggcgcgcgc cg 22
<210> 29
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN M362
<400> 29
tcgtcgtcgt tcgaacgacg ttgat 25
<210> 30
<211> 128
<212> PRT
<213> Homo sapiens
<400> 30
Met Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His
1 5 10 15
Val Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp
20 25 30
Thr Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe
35 40 45
Asp Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys
50 55 60
Gln Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met
65 70 75 80
Met Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser
85 90 95
Cys Ala Thr Gln Ile Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys
100 105 110
Asp Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
115 120 125
<210> 31
<211> 125
<212> PRT
<213> Mus musculus
<400> 31
Met Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His
1 5 10 15
Val Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val
20 25 30
Thr Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys
35 40 45
Lys Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu
50 55 60
Arg Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser
65 70 75 80
Tyr Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr
85 90 95
Gln Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu
100 105 110
Thr Asp Ile Pro Phe Glu Cys Lys Lys Pro Val Gln Lys
115 120 125
<210> 32
<211> 781
<212> ДНК
<213> Homo sapiens
<400> 32
acacagagag aaaggctaaa gttctctgga ggatgtggct gcagagcctg ctgctcttgg 60
gcactgtggc ctgcagcatc tctgcacccg cccgctcgcc cagccccagc acgcagccct 120
gggagcatgt gaatgccatc caggaggccc ggcgtctcct gaacctgagt agagacactg 180
ctgctgagat gaatgaaaca gtagaagtca tctcagaaat gtttgacctc caggagccga 240
cctgcctaca gacccgcctg gagctgtaca agcagggcct gcggggcagc ctcaccaagc 300
tcaagggccc cttgaccatg atggccagcc actacaagca gcactgccct ccaaccccgg 360
aaacttcctg tgcaacccag attatcacct ttgaaagttt caaagagaac ctgaaggact 420
ttctgcttgt catccccttt gactgctggg agccagtcca ggagtgagac cggccagatg 480
aggctggcca agccggggag ctgctctctc atgaaacaag agctagaaac tcaggatggt 540
catcttggag ggaccaaggg gtgggccaca gccatggtgg gagtggcctg gacctgccct 600
gggccacact gaccctgata caggcatggc agaagaatgg gaatatttta tactgacaga 660
aatcagtaat atttatatat ttatattttt aaaatattta tttatttatt tatttaagtt 720
catattccat atttattcaa gatgttttac cgtaataatt attattaaaa atatgcttct 780
a 781
<210> 33
<211> 144
<212> PRT
<213> Homo sapiens
<400> 33
Met Trp Leu Gln Ser Leu Leu Leu Leu Gly Thr Val Ala Cys Ser Ile
1 5 10 15
Ser Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His
20 25 30
Val Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp
35 40 45
Thr Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe
50 55 60
Asp Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys
65 70 75 80
Gln Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met
85 90 95
Met Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser
100 105 110
Cys Ala Thr Gln Ile Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys
115 120 125
Asp Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
130 135 140
<210> 34
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность агониста TLR13
<400> 34
cggaaagacc 10
<210> 35
<211> 255
<212> PRT
<213> Homo sapiens
<400> 35
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Ser Phe Phe Leu
180 185 190
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
195 200 205
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250 255
<210> 36
<211> 277
<212> PRT
<213> Homo sapiens
<400> 36
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Val Thr Gly Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ser Lys Pro
65 70 75 80
Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Ala Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Gly Gly Arg Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Val
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Ile Leu Leu Ala Leu Tyr Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Thr Leu Ala Lys Ile
275
<210> 37
<211> 277
<212> PRT
<213> Homo sapiens
<400> 37
Met Val Arg Leu Pro Leu Gln Cys Val Leu Trp Gly Cys Leu Leu Thr
1 5 10 15
Ala Val His Pro Glu Pro Pro Thr Ala Cys Arg Glu Lys Gln Tyr Leu
20 25 30
Ile Asn Ser Gln Cys Cys Ser Leu Cys Gln Pro Gly Gln Lys Leu Val
35 40 45
Ser Asp Cys Thr Glu Phe Thr Glu Thr Glu Cys Leu Pro Cys Gly Glu
50 55 60
Ser Glu Phe Leu Asp Thr Trp Asn Arg Glu Thr His Cys His Gln His
65 70 75 80
Lys Tyr Cys Asp Pro Asn Leu Gly Leu Arg Val Gln Gln Lys Gly Thr
85 90 95
Ser Glu Thr Asp Thr Ile Cys Thr Cys Glu Glu Gly Trp His Cys Thr
100 105 110
Ser Glu Ala Cys Glu Ser Cys Val Leu His Arg Ser Cys Ser Pro Gly
115 120 125
Phe Gly Val Lys Gln Ile Ala Thr Gly Val Ser Asp Thr Ile Cys Glu
130 135 140
Pro Cys Pro Val Gly Phe Phe Ser Asn Val Ser Ser Ala Phe Glu Lys
145 150 155 160
Cys His Pro Trp Thr Ser Cys Glu Thr Lys Asp Leu Val Val Gln Gln
165 170 175
Ala Gly Thr Asn Lys Thr Asp Val Val Cys Gly Pro Gln Asp Arg Leu
180 185 190
Arg Ala Leu Val Val Ile Pro Ile Ile Phe Gly Ile Leu Phe Ala Ile
195 200 205
Leu Leu Val Leu Val Phe Ile Lys Lys Val Ala Lys Lys Pro Thr Asn
210 215 220
Lys Ala Pro His Pro Lys Gln Glu Pro Gln Glu Ile Asn Phe Pro Asp
225 230 235 240
Asp Leu Pro Gly Ser Asn Thr Ala Ala Pro Val Gln Glu Thr Leu His
245 250 255
Gly Cys Gln Pro Val Thr Gln Glu Asp Gly Lys Glu Ser Arg Ile Ser
260 265 270
Val Gln Glu Arg Gln
275
<210> 38
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> эпитоп, происходящий из вируса кори
<400> 38
Lys Leu Leu Ser Leu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly
1 5 10 15
Val Glu Gly
<210> 39
<211> 36
<212> PRT
<213> Искусственная последовательность
<220>
<223> MVP-Her2
<400> 39
Lys Leu Leu Ser Leu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly
1 5 10 15
Val Glu Gly Pro Ser Leu Ile Trp Lys Phe Pro Asp Glu Glu Gly Ala
20 25 30
Cys Gln Pro Leu
35
<210> 40
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Her2/neu
<400> 40
Ile Trp Lys Phe Pro Asp Glu Glu Gly Ala Cys Gln Pro Leu
1 5 10
<210> 41
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> связывающий трастузумаб домен Her2
<400> 41
Lys Phe Pro Asp Glu Glu Gly Ala Cys Gln Pro
1 5 10
<210> 42
<211> 35
<212> PRT
<213> Искусственная последовательность
<220>
<223> онкобелок E7
<400> 42
Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys
1 5 10 15
Cys Lys Cys Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val
20 25 30
Asp Ile Arg
35
<210> 43
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> онкобелок E7
<400> 43
Arg Ala His Tyr Asn Ile Val Thr Phe
1 5
<210> 44
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген B16-M27
<400> 44
Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg
1 5 10 15
His Gly Thr Thr His Ser Leu Val Ile His Asp
20 25
<210> 45
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген B16-M30
<400> 45
Pro Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser
1 5 10 15
Pro Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu
20 25
<210> 46
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген B16-M47
<400> 46
Gly Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln
1 5 10 15
Val Leu Leu Gly Arg Lys Val Val Val Val Arg
20 25
<210> 47
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген Trp2
<400> 47
Ser His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val
1 5 10 15
His Asn Trp Asp Phe Glu Pro Arg Lys Val Ser
20 25
<210> 48
<211> 28
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген Trp2
<400> 48
Ser Val Tyr Asp Phe Phe Val Trp Leu Lys Phe Phe His Arg Thr Cys
1 5 10 15
Lys Cys Thr Gly Asn Phe Ala Gly Gly Asp Asp Asp
20 25
<210> 49
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 49
Ser Val Gly Asp Phe Ser Gln Glu Phe Ser Pro Ile Gln Glu Ala
1 5 10 15
<210> 50
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 50
Asp Phe Ser Gln Glu Phe Ser Pro Ile Gln Glu Ala Gln Gln Asp
1 5 10 15
<210> 51
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 51
Leu Pro Gly Lys Ile His Leu Phe Glu Ala Glu Phe Thr Gln Val
1 5 10 15
<210> 52
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 52
Ile His Leu Phe Glu Ala Glu Phe Thr Gln Val Ala Lys Lys Glu
1 5 10 15
<210> 53
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 53
His Asp Leu Gly Arg Leu His Ser Cys Val Met Ala Ser Leu Arg Ala
1 5 10 15
Gln
<210> 54
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 54
Arg Thr Gln Leu Leu Trp Thr Pro Ala Ala Pro Thr Ala Met Ala
1 5 10 15
<210> 55
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 55
Asp Arg Ala Ser Phe Leu Leu Thr Asp Tyr Ala Leu Ser Pro Asp
1 5 10 15
<210> 56
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 56
Asp Arg Ser Val Leu Ala Lys Lys Leu Lys Phe Val Thr Leu Val Phe
1 5 10 15
Arg His Gly Asp Arg Ser Pro Ile Asp
20 25
<210> 57
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 57
Asn Asn Ser Lys Lys Lys Trp Phe Leu Phe Gln Asp Ser Lys Lys Ile
1 5 10 15
Gln Val Glu Gln Pro Gln
20
<210> 58
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 58
Ser Pro Ile Lys Leu Val Gln Lys Val Ala Ser Lys Ile Pro Phe Pro
1 5 10 15
Asp Arg Ile Thr Glu Glu Ser Val
20
<210> 59
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 59
Thr Lys Arg Gln Val Ile Leu Leu His Thr Glu Leu Glu Arg Phe Leu
1 5 10 15
Glu Tyr Leu Pro Leu Arg Phe
20
<210> 60
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 60
Ser His Thr Gln Thr Thr Leu Phe His Thr Phe Tyr Glu Leu Leu Ile
1 5 10 15
Gln Lys Asn Lys His Lys
20
<210> 61
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 61
Arg Leu Val Leu Gly Lys Phe Gly Asp Leu Thr Asn Asn Phe Ser Ser
1 5 10 15
Pro His Ala Arg
20
<210> 62
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 62
Leu Ser Pro Arg Glu Glu Phe Leu Arg Leu Cys Lys Lys Ile Met Met
1 5 10 15
Arg Ser Ile Gln
20
<210> 63
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 63
Pro Ser Thr Ala Asn Tyr Asn Ser Phe Ser Ser Ala Pro Met Pro Gln
1 5 10 15
Ile Pro Val Ala Ser Val Thr Pro Thr
20 25
<210> 64
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген.
<400> 64
Leu Cys Pro Arg Glu Glu Phe Leu Arg Leu Cys Lys Lys Ile Met Met
1 5 10 15
Arg Ser Ile Gln
20
<210> 65
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 65
Ser His Asn Glu Leu Ala Asp Ser Gly Ile Pro Glu Asn Ser Phe Asn
1 5 10 15
Val Ser Ser Leu Val Glu
20
<210> 66
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 66
Ser Gly Ser Pro Pro Leu Arg Val Ser Val Gly Asp Phe Ser Gln Glu
1 5 10 15
Phe Ser Pro Ile Gln Glu Ala Gln Gln Asp
20 25
<210> 67
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 67
Arg Pro Ala Gly Arg Thr Gln Leu Leu Trp Thr Pro Ala Ala Pro Thr
1 5 10 15
Ala Met Ala Glu Val Gly Pro Gly His Thr Pro
20 25
<210> 68
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 68
Arg Gly Gln Ile Lys Leu Ala Asp Phe Arg Leu Ala Arg Leu Tyr Ser
1 5 10 15
Ser Glu Glu Ser Arg
20
<210> 69
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 69
Asp Glu Gln Gly Arg Glu Ala Glu Leu Ala Arg Ser Gly Pro Ser Ala
1 5 10 15
Ala Gly Pro Val Arg Leu Lys Pro Gly Leu Val Pro Gly Leu
20 25 30
<210> 70
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 70
Ala Ala Val Arg Pro Glu Gln Arg Pro Ala Ala Arg Gly Ser Arg Val
1 5 10 15
<210> 71
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 71
Pro Glu Thr Gly Glu Ile Gln Val Lys Thr Phe Leu Asp Arg Glu Gln
1 5 10 15
Arg Glu Ser Tyr Glu Leu Lys Val
20
<210> 72
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 72
Glu Val Val Gly Gly Tyr Thr Trp Pro Ser Gly Asn Ile Tyr Gln Gly
1 5 10 15
Tyr Trp Ala Gln Gly Lys Arg
20
<210> 73
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 73
Thr Ile Lys Asn Ser Asp Lys Asn Val Val Leu Glu His Phe Gly
1 5 10 15
<210> 74
<211> 29
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 74
Thr Arg Asn Ser Phe Ala Leu Val Pro Ser Leu Gln Arg Leu Met Leu
1 5 10 15
Arg Lys Val Ala Leu Lys Asn Val Asp Ser Ser Pro Ser
20 25
<210> 75
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 75
Ser Ser His Tyr Lys Phe Ser Lys Pro Ala Leu Gln Ser Gln Ser Ile
1 5 10 15
Ser Leu Val Gln Gln Ser
20
<210> 76
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 76
Thr Glu Thr Val Asn His His Tyr Leu Leu Phe Gln Asn Thr Asp Leu
1 5 10 15
Gly Ser Phe His Asp Leu Leu Arg
20
<210> 77
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 77
Asp Arg Ala Ser Phe Leu Leu Thr Asp Tyr Ala Leu Ser Pro Asp Gly
1 5 10 15
Ser Ile Arg Lys Ala Thr Gly
20
<210> 78
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 78
Glu Arg Phe Trp Arg Asn Ile Leu Leu Leu Ser Leu His Lys Gly Ser
1 5 10 15
Leu Tyr Pro Arg Ile Pro Gly Leu Gly Lys Glu
20 25
<210> 79
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 79
Arg Gly Arg Leu Pro Ala Gly Ala Val Arg Thr Leu Leu Ser Gln Val
1 5 10 15
Asn Lys Val Trp Asp Gln Ser Ser
20
<210> 80
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 80
Gly His Glu His Gln Pro Asp Met Gln Lys Ser Leu Leu Arg Ala Ala
1 5 10 15
Phe Phe Gly Lys Cys Phe Leu Asp Arg
20 25
<210> 81
<211> 29
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 81
Glu Leu Gln Tyr Arg Gly Arg Glu Leu Arg Phe Asn Leu Ile Ala Asn
1 5 10 15
Gln His Leu Leu Ala Pro Gly Phe Val Ser Glu Thr Arg
20 25
<210> 82
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 82
Glu Asp Leu Asp Ala Asn Leu Arg Lys Leu Asn Phe Arg Leu Phe Val
1 5 10 15
Ile Arg Gly Gln Pro Ala Asp
20
<210> 83
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 83
Gly His Gln Lys Leu Pro Gly Lys Ile His Leu Phe Glu Ala Glu Phe
1 5 10 15
Thr Gln Val Ala Lys Lys Glu Pro Asp Gly
20 25
<210> 84
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 84
Thr Thr Pro Ser Gly Ser Ala Glu Tyr Met Ala Ser Glu Val Val Glu
1 5 10 15
Val Phe Thr Asp Gln Ala Thr
20
<210> 85
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 85
Ser Val Leu Arg Glu Asp Leu Gly Gln Leu Glu Tyr Lys Tyr Gln Tyr
1 5 10 15
Ala Tyr Phe Arg Met Gly Ile Lys His Pro Asp
20 25
<210> 86
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 86
Pro Glu Asn Asp Asp Leu Phe Met Met Pro Arg Ile Val Asp Val Thr
1 5 10 15
Ser Leu Ala Thr Glu Gly Gly
20
<210> 87
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 87
Thr Leu Asp Asp Ile Lys Glu Trp Leu Glu Asp Glu Gly Gln Val Leu
1 5 10 15
Asn Ile Gln Met Arg Arg Thr Leu His Lys
20 25
<210> 88
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 88
Gly Arg Met Ser Pro Ser Gln Phe Ala Arg Val Pro Gly Tyr Val Gly
1 5 10 15
Ser Pro Leu Ala Ala Met Asn Pro Lys
20 25
<210> 89
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 89
Lys Ala His Val Glu Gly Asp Gly Val Val Glu Glu Ile Ile Arg Tyr
1 5 10 15
His Pro Phe Leu Tyr Asp Arg Glu Thr
20 25
<210> 90
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 90
Asp Gly Val Ser Glu Glu Phe Trp Leu Val Asp Leu Leu Pro Ser Thr
1 5 10 15
His Tyr Thr
<210> 91
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 91
Asp Ser Tyr His Leu Tyr Ala Tyr His Glu Glu Leu Ser Ala Thr Val
1 5 10 15
Pro Ser Gln Trp Lys Lys Ile Gly
20
<210> 92
<211> 28
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 92
Gly Asp Gln Tyr Lys Ala Thr Asp Phe Val Ala Asp Trp Ala Gly Thr
1 5 10 15
Phe Lys Met Val Phe Thr Pro Lys Asp Gly Ser Gly
20 25
<210> 93
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 93
Glu Tyr Trp Lys Val Leu Asp Gly Glu Leu Glu Val Ala Pro Glu Tyr
1 5 10 15
Pro Gln Ser Thr Ala Arg Asp Trp Leu
20 25
<210> 94
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 94
Thr Thr Thr Ser Val Lys Lys Glu Glu Leu Val Leu Ser Glu Glu Asp
1 5 10 15
Phe Gln Gly Ile Thr Pro Gly Ala Gln
20 25
<210> 95
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 95
Ser Leu Thr Glu Glu Ser Gly Gly Ala Val Ala Phe Phe Pro Gly Asn
1 5 10 15
Leu Ser Thr Ser Ser Ser Ala
20
<210> 96
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 96
Lys Leu Arg Thr Ile Pro Leu Ser Asp Asn Thr Ile Phe Arg Arg Ile
1 5 10 15
Cys Thr Ile Ala Lys His Leu Glu
20
<210> 97
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 97
Ser His His Thr His Ser Tyr Gln Arg Tyr Ser His Pro Leu Phe Leu
1 5 10 15
Pro Gly His Arg Leu Asp Pro Pro Ile
20 25
<210> 98
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 98
Asp Val Thr Gly Pro His Leu Tyr Ser Ile Tyr Leu His Gly Ser Thr
1 5 10 15
Asp Lys Leu Pro Tyr Val Thr Met Gly Ser
20 25
<210> 99
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 99
Ala Arg Leu Gln Ser Lys Glu Tyr Pro Val Ile Phe Lys Ser Ile Met
1 5 10 15
Arg Gln Arg Leu Ile Ser Pro Gln Leu
20 25
<210> 100
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 100
Leu His Thr His Tyr Asp Tyr Val Ser Ala Leu His Pro Val Ser Thr
1 5 10 15
Pro Ser Lys Glu Tyr Thr Ser Ala
20
<210> 101
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 101
Ser Asp Ala Phe Ser Gly Leu Thr Ala Leu Pro Gln Ser Ile Leu Leu
1 5 10 15
Phe Gly Pro
<210> 102
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 102
Ser His Gln Ile His Ser Tyr Gln Leu Tyr Thr His Pro Leu Leu His
1 5 10 15
Pro Trp Asp His Arg Asp
20
<210> 103
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 103
Ser Thr Gln His Ala Asp Leu Thr Ile Ile Asp Asn Ile Lys Glu Met
1 5 10 15
Asn Phe Leu Arg Arg Tyr Lys
20
<210> 104
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 104
Ala Ser Ala Thr Glu Pro Ala Asn Asp Ser Leu Phe Ser Pro Gly Ala
1 5 10 15
Ala Asn Leu Phe Ser Thr Tyr Leu Ala Arg
20 25
<210> 105
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 105
Ala Ala Ser Ala Ala Ala Phe Pro Ser Gln Arg Thr Ser Trp Glu Phe
1 5 10 15
Leu Gln Ser Leu Val Ser Ile Lys Gln Glu Lys
20 25
<210> 106
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 106
Gly Ser Val Leu Gln Phe Met Pro Phe Thr Thr Val Ser Glu Leu Met
1 5 10 15
Lys Val Ser Ala Met Ser Ser Pro Lys Val
20 25
<210> 107
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 107
Asp Lys Gly His Gln Phe His Val His Pro Leu Leu His Ser Gly Asp
1 5 10 15
Asp Leu Asp Pro
20
<210> 108
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 108
Asn Gln Val Leu Ala Ser Arg Tyr Gly Ile Arg Gly Phe Ser Thr Ile
1 5 10 15
Lys Ile Phe Gln Lys Gly Glu Ser Pro Val
20 25
<210> 109
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 109
Met Ala Gly Pro Lys Gly Phe Gln Tyr Arg Ala Leu Tyr Pro Phe Arg
1 5 10 15
Arg Glu Arg
<210> 110
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 110
Val Thr Leu Asn Asp Met Lys Ala Arg Gln Lys Ala Leu Val Arg Glu
1 5 10 15
Arg Glu Arg Gln Leu Ala
20
<210> 111
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 111
Ser Arg Leu Gln Thr Arg Lys Asn Lys Lys Leu Ala Leu Ser Ser Thr
1 5 10 15
Pro Ser Asn Ile Ala Pro Ser Asp
20
<210> 112
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 112
Leu Asn Thr Gly Leu Phe Arg Ile Lys Phe Lys Glu Pro Leu Glu Asn
1 5 10 15
Leu Ile
<210> 113
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 113
Ser Leu Arg Asn Asn Met Phe Glu Ile Ser Asp Arg Phe Ile Gly Ile
1 5 10 15
Tyr Lys Thr Tyr Asn Ile Thr Lys
20
<210> 114
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 114
Trp Cys Thr Glu Met Lys Arg Val Phe Gly Phe Pro Val His Tyr Thr
1 5 10 15
Asp Val Ser Asn Met Ser
20
<210> 115
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 115
Val Lys Gln Leu Glu Arg Gly Glu Ala Ser Val Val Asp Phe Lys Lys
1 5 10 15
Asn Leu Glu Tyr Ala Ala Thr
20
<210> 116
<211> 28
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 116
Ser Thr Glu Val Glu Pro Lys Glu Ser Pro His Leu Ala Arg His Arg
1 5 10 15
His Leu Met Lys Thr Leu Val Lys Ser Leu Ser Thr
20 25
<210> 117
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 117
Leu Met Ser Asn Leu Ala Phe Ala Asp Phe Cys Met Arg Met Tyr Leu
1 5 10 15
<210> 118
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 118
Thr Lys Leu Lys Ser Lys Ala Pro His Trp Thr Asn Cys Ile Leu His
1 5 10 15
Glu Tyr Lys Asn Leu Ser Thr Ser
20
<210> 119
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 119
Pro Ala Ala Gly Asp Phe Ile Arg Phe Arg Phe Phe Gln Leu Leu Arg
1 5 10 15
Leu Glu Arg Phe Phe
20
<210> 120
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 120
Tyr Leu Ser His Thr Leu Gly Ala Ala Ser Ser Phe Met Arg Pro Thr
1 5 10 15
Val Pro Pro Pro Gln Phe
20
<210> 121
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 121
Ala Leu Leu Gln Asn Val Glu Leu Arg Arg Asn Val Leu Val Ser Pro
1 5 10 15
Thr Pro Leu Ala Asn
20
<210> 122
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 122
Phe Ala Lys Gly Phe Arg Glu Ser Asp Leu Asn Ser Trp Pro Val Ala
1 5 10 15
Pro Arg Pro Leu Leu Ser Val
20
<210> 123
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 123
Gly Leu Thr Arg Ile Ser Ile Gln Arg Ala Gln Pro Leu Pro Pro Cys
1 5 10 15
Leu Pro Ser Phe Arg Pro Pro Thr Ala Leu Gln Gly Leu Ser
20 25 30
<210> 124
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 124
Thr Gly Lys Pro Glu Met Asp Phe Val Arg Leu Ala Gln Leu Phe Ala
1 5 10 15
Arg Ala Arg Pro Met Gly Leu Phe
20
<210> 125
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 125
Asp Gly Ala Trp Pro Val Leu Leu Asp Lys Phe Val Glu Trp Tyr Lys
1 5 10 15
Asp Lys Gln Met Ser
20
<210> 126
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 126
Asp Arg Ser Val Leu Ala Lys Lys Leu Lys Phe Val Thr Leu Val Phe
1 5 10 15
Arg His Gly Asp Arg Ser Pro Ile Asp
20 25
<210> 127
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 127
Asp Arg Ser Val Leu Ala Lys Lys Leu Lys Phe Val Thr Leu Val Phe
1 5 10 15
Arg His Gly Asp Arg Ser Pro Ile Asp
20 25
<210> 128
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 128
Thr Lys Arg Gln Val Ile Leu Leu His Thr Glu Leu Glu Arg Phe Leu
1 5 10 15
Glu Tyr Leu Pro Leu Arg Phe
20
<210> 129
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 129
Leu Gly Glu Thr Met Gly Gln Val Thr Glu Lys Leu Gln Pro Thr Tyr
1 5 10 15
Met Glu Glu Thr
20
<210> 130
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 130
Thr Phe Pro Lys Lys Ile Gln Met Leu Ala Arg Asp Phe Leu Asp Glu
1 5 10 15
Tyr
<210> 131
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 131
Glu Arg Phe Trp Arg Asn Ile Leu Leu Leu Ser Leu His Lys Gly Ser
1 5 10 15
Leu Tyr Pro Arg Ile Pro Gly Leu Gly Lys Glu
20 25
<210> 132
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 132
Arg Gly Arg Leu Pro Ala Gly Ala Val Arg Thr Leu Leu Ser Gln Val
1 5 10 15
Asn Lys Val Trp Asp Gln Ser Ser
20
<210> 133
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 133
Gly His Glu His Gln Pro Asp Met Gln Lys Ser Leu Leu Arg Ala Ala
1 5 10 15
Phe Phe Gly Lys Cys Phe Leu Asp Arg
20 25
<210> 134
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 134
Lys Met Gln Arg Arg Asn Asp Asp Lys Ser Ile Leu Met His Gly Leu
1 5 10 15
Val Ser Leu Arg Glu Ser Ser Arg Gly
20 25
<210> 135
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 135
Ser Thr Leu Pro Val Ile Ser Asp Ser Thr Thr Lys Arg Arg Trp Ser
1 5 10 15
Ala Leu Val Ile Gly Leu
20
<210> 136
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 136
Lys Leu Arg Thr Ile Pro Leu Ser Asp Asn Thr Ile Phe Arg Arg Ile
1 5 10 15
Cys Thr Ile Ala Lys His Leu Glu
20
<210> 137
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 137
Pro Ala Ser Ala Lys Ser Arg Arg Glu Phe Asp Lys Ile Glu Leu Ala
1 5 10 15
Tyr Arg Arg
<210> 138
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 138
Ala Arg Leu Gln Ser Lys Glu Tyr Pro Val Ile Phe Lys Ser Ile Met
1 5 10 15
Arg Gln Arg Leu Ile Ser Pro Gln Leu
20 25
<210> 139
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 139
Phe Pro Val Val Gln Ser Thr Glu Asp Val Phe Pro Gln Gly Leu Pro
1 5 10 15
Asn Glu Tyr Ala Phe Val Thr
20
<210> 140
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 140
Phe Pro Val Val Gln Ser Thr Glu Asp Val Phe Pro Gln Gly Leu Pro
1 5 10 15
Asn Glu Tyr Ala Phe Val Thr
20
<210> 141
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 141
Phe Pro Val Val Gln Ser Thr Glu Asp Val Phe Pro Gln Gly Leu Pro
1 5 10 15
Asn Glu Tyr Ala Phe Val Thr
20
<210> 142
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 142
Val Thr Leu Asn Asp Met Lys Ala Arg Gln Lys Ala Leu Val Arg Glu
1 5 10 15
Arg Glu Arg Gln Leu Ala
20
<210> 143
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 143
Leu Asn Thr Gly Leu Phe Arg Ile Lys Phe Lys Glu Pro Leu Glu Asn
1 5 10 15
Leu Ile
<210> 144
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 144
Lys Val Val Gln His Ala Leu Asp Lys Ala Arg Thr Gly Lys Thr Cys
1 5 10 15
Leu Val Val Thr His Arg Leu Ser Ala Ile Gln
20 25
<210> 145
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 145
Asn Gln Glu Ala Phe Lys His Leu Tyr Phe Glu Lys Phe Ser Gly Tyr
1 5 10 15
Tyr Asp Thr Met Asp Ala Gly Tyr Met Asp Glu
20 25
<210> 146
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 146
Pro Ser Phe Leu Gly Met Glu Ser Cys Gly Ile His Glu Ile Thr Phe
1 5 10 15
Asn Ser Ile Met Lys Cys Asp Val Asp Ile Arg
20 25
<210> 147
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 147
Tyr Pro Lys Gly Ala Gly Glu Met Leu Glu Asp Gln Gln Ala Ala Arg
1 5 10 15
Met Glu Lys Leu Ala Gly Leu Val Glu Glu Leu
20 25
<210> 148
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 148
Lys Glu Glu Leu Gln Lys Ser Leu Asn Ile Leu Thr Ala Leu Gln Lys
1 5 10 15
Lys Gly Ala Glu Lys Glu Glu Leu
20
<210> 149
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 149
Val Thr Cys Val Pro Asn Gly Thr Trp Arg Asn Tyr Lys Val Glu Val
1 5 10 15
Arg Phe Glu Pro Arg His Arg Pro Thr Arg Phe
20 25
<210> 150
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 150
Val Phe Asp Thr Ala Phe Ser Arg His Phe Ser Leu Leu Lys Ser Gln
1 5 10 15
Arg Glu Phe Val Arg Arg Phe Arg Gly Gln Ala
20 25
<210> 151
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 151
Pro Gln Thr Leu Gly Lys Lys Gly Ser Lys Asn Asn Ile Phe Val Tyr
1 5 10 15
Met Thr Leu Asn Gln Lys Lys Ser Asp Ser Ser
20 25
<210> 152
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 152
Cys Glu Asp Cys Arg Thr Arg Gly Gln Phe Asn Ala Phe Pro Tyr His
1 5 10 15
Phe Arg Gly Arg Arg Ser Leu Glu Phe Ser Tyr
20 25
<210> 153
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 153
Ser Pro Glu Leu Ser Ala Ala Glu Ser Ala Val Val Leu Asn Leu Leu
1 5 10 15
Met Ser Leu Pro Glu Glu Leu Pro Leu Leu Pro
20 25
<210> 154
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 154
Val Phe Ala Arg Val Ala Pro Lys Gln Lys Glu Phe Val Phe Thr Ser
1 5 10 15
Leu Lys Glu Leu Gly Tyr Val Thr Leu Met Cys
20 25
<210> 155
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 155
Ser Ala Asp Ala Arg Leu Met Val Phe Asp Lys Thr Glu Arg Thr Trp
1 5 10 15
Arg Leu Leu Cys Ser Ser Arg Ser Asn Ala Arg
20 25
<210> 156
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 156
Met Gly Pro Leu Leu Val Ala Thr Phe Trp Pro Glu Leu Ser Glu Lys
1 5 10 15
Ile Asp Ala Val Tyr Glu Ala Pro Gln Glu Glu
20 25
<210> 157
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 157
Cys Gly Pro Cys Ser Glu Lys Arg Phe Leu Leu Pro Ser Arg Ser Ser
1 5 10 15
Lys Pro Val Arg Ile Cys Asp Phe Cys Tyr Asp
20 25
<210> 158
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 158
Leu Thr Val Thr Leu Arg Ser Pro Thr Trp Met Arg Met Asn Gln Gly
1 5 10 15
Val Cys Cys Asn Leu Glu Tyr His Ser Ser Gly
20 25
<210> 159
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 159
Leu His Ser Asn Val Leu Ala Arg Ile Asp Ala Ala Ala Leu Thr Gly
1 5 10 15
Leu Ala Leu Leu Glu Gln Leu Asp Leu Ser Asp
20 25
<210> 160
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 160
Leu Thr Ala Val Arg Pro Glu Gly Ser Glu Pro Pro Gly Leu Pro Thr
1 5 10 15
Ser Gly Pro Arg Arg Arg Pro Gly Cys Ser Arg
20 25
<210> 161
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 161
Ala Leu Pro Ser Leu Thr Cys Ser Leu Thr Pro Leu Gly Val Ala Leu
1 5 10 15
Val Leu Trp Thr Val Leu Gly Pro Cys
20 25
<210> 162
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 162
Gly Gly Gly Thr Gly Asp Ser Glu Gly Ser Gly Ala Leu Arg Ser Leu
1 5 10 15
Thr Cys Ser Leu Thr Pro Leu Gly Leu Ala Leu
20 25
<210> 163
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 163
Asp Val Glu Glu Arg Val Gln Lys Ser Phe Pro His Pro Val Asp Lys
1 5 10 15
Trp Ala Ile Ala Asp Ala Gln Ser Ala Ile Glu
20 25
<210> 164
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 164
Ser Pro Gly Asp Leu Asp Val Phe Val Arg Phe Asp Phe Leu Tyr Pro
1 5 10 15
Asn Val Glu Glu Ala Gln Lys Asp Lys Thr Ser
20 25
<210> 165
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 165
Asp Phe Ile Ala Gly Phe Cys Gly Glu Thr Glu Glu Asp Tyr Val Gln
1 5 10 15
Thr Val Ser Leu Leu Arg Glu Val Gln Tyr Asn
20 25
<210> 166
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 166
Arg Ser Gln Met Thr Thr Ser Phe Thr Asp Pro Ala Ile Phe Met Asp
1 5 10 15
Leu Leu Arg Ala Val Leu Gln Pro Ser Ile Asn
20 25
<210> 167
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 167
Thr Ala Ala Gly Ile His Pro Gln Ile Ser Ser Ile Phe Ile Leu Gly
1 5 10 15
Ser Leu Val Tyr Phe Ser Gln Glu Ala Ser Arg
20 25
<210> 168
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 168
Arg Lys Asp Leu Leu Lys Ala Asn Val Lys Ile Phe Lys Phe Gln Gly
1 5 10 15
Ala Ala Leu Asp Lys Tyr Ala Lys Lys Ser Val
20 25
<210> 169
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 169
His Val Leu Ser Gly Leu Ser Lys Asp Lys Glu Lys Arg Lys Glu Asn
1 5 10 15
Val Arg Asn Ser Phe Trp Ile Tyr Asp Ile Val
20 25
<210> 170
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 170
Lys Thr Glu Trp Lys Ser Asn Val Tyr Leu Ala Arg Ser Trp Ile Gln
1 5 10 15
Gly Leu Gly Leu Tyr Ala Ala Arg Asp Ile Glu
20 25
<210> 171
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 171
Pro Pro Thr Pro Leu Leu Asn Thr Thr Ser Ser Leu Ser Glu Tyr Pro
1 5 10 15
Leu Gly Arg Ala Asp Phe Asp His Tyr Thr Gly
20 25
<210> 172
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 172
Leu Phe Leu Ala Leu Leu Ala Gly Ala His Ala Glu Phe Ser Gly Cys
1 5 10 15
Lys Ile Arg Val Thr Ser Lys Ala Leu Glu Leu
20 25
<210> 173
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 173
Phe Thr Arg Ala Phe Asp Gln Ile Arg Met Ala Ala Ile Phe Glu Ser
1 5 10 15
Asn Ile Asn Leu Cys Gly Ser His Cys Gly Val
20 25
<210> 174
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 174
Gly Lys Ser Tyr Gln Leu Leu Val Val Glu Asn Thr Val Lys Val Ala
1 5 10 15
Gln Phe Ile Asn Asn Asn Pro Glu Phe Leu Gln
20 25
<210> 175
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 175
Ser Arg Trp Asp Asp Ser Gln Arg Phe Leu Ser Asp His Leu Tyr Leu
1 5 10 15
Val Cys Glu Glu Thr Ala Lys Tyr Leu Ile Leu
20 25
<210> 176
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген.
<400> 176
Ile Thr Lys His Leu Tyr Glu Asp Pro Arg Gln His Ser Ser Gly Val
1 5 10 15
Leu Thr Asp Leu Arg Ser Ala Leu Val Asn Asn
20 25
<210> 177
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 177
Asp Val Glu Glu Arg His His Ala Tyr Leu Lys Pro Phe Cys Val Leu
1 5 10 15
Ile Ser Leu Leu Asp Lys Pro Glu Ile Gly Pro
20 25
<210> 178
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 178
Ala Thr Gly Gln Ser Ala Phe Ala Gln Val Ile Ala Asp Cys His Lys
1 5 10 15
Ile Leu Phe Asp Arg Asn Ser Ala Ile Lys Ser
20 25
<210> 179
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 179
Val Thr Val Leu Phe Ala Gly Gln His Ile Ala Lys Ser Leu Phe Glu
1 5 10 15
Val Tyr Val Asp Lys Ser Gln Gly Asp Ala Ser
20 25
<210> 180
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 180
Val Asn Ala Val Phe Glu Trp His Ile Thr Lys Gly Gly Ile Ile Gly
1 5 10 15
Ala Lys Trp Thr Ile Asp Leu Lys Ser Gly Ser
20 25
<210> 181
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 181
Ser Ser Ser Thr Thr Asn Asn Asp Pro Tyr Ala Lys Pro Ser Asp Thr
1 5 10 15
Pro Arg Pro Val Met Thr Asp Gln Phe Pro Lys
20 25
<210> 182
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 182
Met Thr Glu Tyr Lys Leu Val Val Val Gly Ala Gly Asp Val Gly Lys
1 5 10 15
Ser Ala Leu Thr Ile Gln Leu Ile Gln Asn
20 25
<210> 183
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 183
Val Lys Leu Leu Ile Gly Asn Arg Asp Ser Leu Asp Asn Leu Tyr Tyr
1 5 10 15
Asp Trp Tyr Ile Leu Val Thr Asn Lys Cys His
20 25
<210> 184
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген.
<400> 184
Met Ala Ile Ser Phe Leu Thr Thr Leu Ala Lys Val Tyr Ser Ser Ser
1 5 10 15
Leu Ser Lys Ile Ser Gly Ser Ile Leu Asn Glu
20 25
<210> 185
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 185
Val Leu Ser His Val Ser Gly Leu Gly Trp Leu Ala Ser Asn Leu Pro
1 5 10 15
Ser Phe Leu Arg Val Pro Lys Trp Ile Ile Ala
20 25
<210> 186
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 186
Ile Ala Glu Leu Glu Asn Lys Asn Arg Glu Ile Leu Gln Lys Ile Gln
1 5 10 15
Arg Leu Arg Leu Glu His Glu Gln Ala Ser Gln
20 25
<210> 187
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 187
Pro Lys Gly Met Pro Lys Asp Leu Asn Val Gly Gln Gln Ser Leu Ser
1 5 10 15
Asn Ser Gly Ile Ser Glu Val Glu Gly Leu Ser
20 25
<210> 188
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 188
Leu Ala Val Gly His Leu Tyr Arg Leu Ser Phe Leu Lys Lys Asp Ser
1 5 10 15
Gln Ser Cys Arg Val Ala Ala Leu Glu Ala Ser
20 25
<210> 189
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 189
Pro Leu Pro Pro His Pro His Pro His Pro His Ser Val Val Leu Pro
1 5 10 15
Pro Ala His Leu Pro Val Gln Gln Gln Gln Pro
20 25
<210> 190
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 190
Met Pro Pro Leu Pro Ile Phe Ser Leu Pro Trp Ser Val His Thr Trp
1 5 10 15
Thr Gln Gly Pro
20
<210> 191
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 191
Ala Lys Thr Val Lys His Gly Ala Gly Ala Glu Ile Ser Ile Val Asn
1 5 10 15
Pro Glu Gln Tyr Ser Lys Arg Phe Leu Asp Phe
20 25
<210> 192
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 192
Pro Ser Arg Ala Gly Arg Pro His His Asp Gln Arg Ser Leu Ser Pro
1 5 10 15
His Leu Gly Arg Ser Lys Ser Pro Pro Ser His
20 25
<210> 193
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 193
Pro Pro Pro Pro Pro Gln Asn Asn Lys Pro Pro Val Pro Phe Thr Pro
1 5 10 15
Arg Pro Ser Ala Ser Ser Gln Ala Pro Pro Pro
20 25
<210> 194
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 194
Val Val Tyr Ser Ile Leu Gln Gly Gln Pro Tyr Phe Ser Leu Asp Pro
1 5 10 15
Lys Thr Gly Val Ile Arg Thr Ala Leu His Asn
20 25
<210> 195
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 195
Glu Ile Gly Trp Leu Lys Pro Val Ile Gly Ser Gln Tyr Leu Leu Glu
1 5 10 15
Lys Val Ala Glu Ala His Glu Asn Ile Ile His
20 25
<210> 196
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 196
Val Val Cys Tyr Gln Ser Asn Arg Asp Glu Leu Arg Arg Cys Ile Ile
1 5 10 15
Gln Trp Leu Glu Ala Glu Ile Ile Pro Asp Gly
20 25
<210> 197
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 197
Ala Val Val Asp Thr Leu Glu Ser Glu Tyr Leu Lys Ile Ser Gly Asp
1 5 10 15
Gln Val Val Ser Val Val Phe Ile Lys Glu Leu
20 25
<210> 198
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 198
Lys Glu Ala Lys Arg Ser Asn Ser Asn Lys Thr Met Asp Leu Ser Cys
1 5 10 15
Leu Lys Trp Thr Pro Pro Lys Gly Thr
20 25
<210> 199
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 199
Arg Asp Trp Ala Phe Val Pro Ala Pro Cys Ala Thr Ser Ser Tyr Thr
1 5 10 15
Gly Phe Ala Asn Lys His Gly Ser Lys Pro Ser
20 25
<210> 200
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 200
Leu Ser Lys Val Thr Lys Val Lys Thr Asp Arg Pro Leu Leu Glu Asn
1 5 10 15
Pro Tyr His Ser Arg Pro Arg Pro Asp Pro Ser
20 25
<210> 201
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 201
Met Ala Ala Val Ser Val Tyr Ala Pro Leu Val Gly Gly Phe Ser Phe
1 5 10 15
Asp Asn Cys Arg Arg Asn Ala
20
<210> 202
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 202
Asp Thr Pro Pro Phe Tyr Ser Asn Ser Thr Asn Ser Phe Gln Asn Thr
1 5 10 15
Val Glu Gly Tyr Ser Asp Pro Thr Gly Lys Tyr
20 25
<210> 203
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 203
Lys Ser Arg Pro Gly Ser Val Val Pro Thr Thr Leu Phe Lys Gly Ile
1 5 10 15
Lys Thr Val Asn Pro Thr Phe Arg Gly Tyr Ser
20 25
<210> 204
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 204
Ile Gly Leu Ile Phe Val Val Asp Ser Asn Asp Arg Glu Gln Val Asn
1 5 10 15
Glu Ala Arg Glu Glu Leu Met Arg Met Leu Ala
20 25
<210> 205
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 205
Gln Gly Leu Ile Phe Val Val Asp Ser Asn Asp Arg Glu Gln Val Asn
1 5 10 15
Glu Ala Arg Glu Glu Leu Met Arg Met Leu Ala
20 25
<210> 206
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 206
Ser Arg Lys Lys Arg Gly Cys Ser Ser Ser Lys Tyr Ala Ser Ser Tyr
1 5 10 15
Tyr His Val Met Pro Lys Gln Asn Ser Thr Leu
20 25
<210> 207
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 207
Ala Met Ala Ala Thr Cys Ile Ser Asp Thr Leu Gly Ile Phe Leu Ser
1 5 10 15
Gly Leu Leu Ala Leu Pro Leu His Asp Phe Leu
20 25
<210> 208
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 208
Lys Leu Ile Val Gln Ile Lys Gly Ser Val Glu Asp Ile Ser Val Met
1 5 10 15
Leu Val Gly Asn Lys Cys Asp Glu Thr Gln Arg
20 25
<210> 209
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 209
Gly His Gln Glu Asn Ala Lys Asn Glu Glu Ile Leu Asn Phe Leu Lys
1 5 10 15
Tyr Val Arg Pro Gly Gly Gly Phe Glu Pro Asn
20 25
<210> 210
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 210
Ser Ile Leu Asp Leu Phe Leu Gly Arg Trp Phe Arg Ser Trp
1 5 10
<210> 211
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 211
Arg Ala Gln Cys His Gly His Gly Arg Cys Val Arg Arg His Pro Ser
1 5 10 15
Ala Ser Thr Phe Leu His Leu Ser Thr Asn Ser
20 25
<210> 212
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 212
Thr Ser Leu Glu Leu Pro Met Ala Met Arg Phe Arg His Phe Lys Lys
1 5 10 15
Thr Ser Lys Glu Ala Val Gly Val Tyr Arg Ser
20 25
<210> 213
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 213
Cys Gly Lys Asp Phe Ser Gln Arg Ala His Leu Thr Ile Tyr Gln Arg
1 5 10 15
Thr His Thr Gly Glu Lys Pro Tyr Lys Cys Leu
20 25
<210> 214
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 214
Lys Glu Thr Thr Glu Ala Ala Cys Arg Tyr Gly Ala Phe Arg Leu Pro
1 5 10 15
Ile Thr Val Ala His Val Asp Gly Gln Thr His
20 25
<210> 215
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 215
Glu Leu Val Thr Glu Gly Val Ala Glu Ser Leu Phe Leu Leu Arg Thr
1 5 10 15
Asp Tyr Ser Phe His Lys Phe His Tyr Leu Thr
20 25
<210> 216
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 216
Ala Val Arg Gln Ala Glu Lys Tyr Tyr Ile Leu Arg Pro Asp Val Ile
1 5 10 15
Glu Thr Tyr Trp Tyr Leu Trp Arg Phe Thr His
20 25
<210> 217
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 217
Ser Val Leu His Leu Val Leu Ala Leu Arg Gly Gly Gly Ser Leu Arg
1 5 10 15
Gln
<210> 218
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 218
Gln Ala Val Phe Ser Thr Ser Ser Arg Phe Trp Ser Ser Ser Pro Leu
1 5 10 15
Leu Gly Gln Gln Pro Gly Pro Ser Gln Asp Ile
20 25
<210> 219
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 219
Pro Gln Trp Gln Lys Asp Glu Leu Arg Glu Thr Leu Lys Phe Leu Lys
1 5 10 15
Lys Val Met Asp Asp Leu Asp Arg Ala Ser Lys
20 25
<210> 220
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 220
Val Ile Lys Asp Gly Cys Ile Val Glu Arg Gly Arg His Lys Ala Leu
1 5 10 15
Leu Ser Arg Gly Gly Val Tyr Ala Asp Met Trp
20 25
<210> 221
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 221
Arg Ala Glu Ser Asp Val Glu Arg Lys Glu Trp Met Gln Val Leu Gln
1 5 10 15
Gln Ala Met Ala Glu Gln Arg Ala Arg Ala Arg
20 25
<210> 222
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 222
Arg Ser Leu Arg Lys Ile Asn Ser Ala Pro Pro Thr Glu Ile Lys Ser
1 5 10 15
Leu Arg Ile Ala Ser Arg Ser Thr Arg His Ser
20 25
<210> 223
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 223
Ser Asn Lys Tyr Asp Pro Pro Leu Glu Asp Gly Ala Met Leu Ser Ala
1 5 10 15
Arg Leu Arg Lys Leu Glu Val Glu Ala Asn Asn
20 25
<210> 224
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 224
Ser Asp Arg Cys Lys Asp Phe Ser Leu Cys Tyr Trp Asn Leu Tyr Trp
1 5 10 15
Met Leu Pro Ser Asp Val Cys Gly Met Asn Cys
20 25
<210> 225
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 225
Gly Val Lys Leu Val Val Glu Thr Pro Glu Glu Thr Leu Leu Thr Tyr
1 5 10 15
Gln Gly Ala Ser Val Ile Leu Pro Cys Arg Tyr
20 25
<210> 226
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 226
Gly Met Ser Thr Ala Met Gly Arg Ser Pro Ser Pro Lys Ile Ser Leu
1 5 10 15
Ser Ala Pro Pro Asn Ser Ser Ser Thr Glu Asn
20 25
<210> 227
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 227
Gly Gly Pro Pro Ser Pro Pro Pro Gly Ile Pro Gly Gln Ser Leu Pro
1 5 10 15
Ser Pro Thr Arg Leu His Leu Gly Gly Gly Arg
20 25
<210> 228
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 228
Gln Val Gly Arg Met Glu Arg Glu Leu Asn His Glu Lys Val Arg Cys
1 5 10 15
Asp Gln Leu Gln Ala Glu Gln Lys Gly Leu Thr
20 25
<210> 229
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 229
Glu Asp Ala Glu Leu Ala Glu Ala Ala Glu Asn Ser Leu Phe Ser Tyr
1 5 10 15
Asn Ser Glu Val Asp Glu Ile Pro Asp Glu Leu
20 25
<210> 230
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 230
Glu Ile Gly Val Gly Ala Tyr Gly Thr Val Tyr Lys Ala Leu Asp Pro
1 5 10 15
His Ser Gly His Phe Val Ala Leu Lys Ser Val
20 25
<210> 231
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 231
Ile Gln Val Gly Ser Leu Leu Gly Ala Val Ala Met Phe Ser Pro Thr
1 5 10 15
Ser Ile Tyr His Val Phe His Ser Arg Lys Asp
20 25
<210> 232
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 232
Gly Tyr Leu Leu Lys Leu Ser Ala Met Gly Trp Gly Phe Ser Ile Phe
1 5 10 15
Leu Val Thr Leu Val Ala Leu Val Asp Val Asp
20 25
<210> 233
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 233
Ile Asp Asn Leu Ser Ala Ser Asn His Ser Val Ala Glu Val Leu Leu
1 5 10 15
Leu Phe Leu Glu Ser Leu Pro Glu Pro Val Ile
20 25
<210> 234
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 234
Ala Val Leu Asp Leu Gln Leu Arg Ser Ala Pro Ala Ala Phe Glu Arg
1 5 10 15
Pro Leu Trp Asp Thr Ser Leu Arg Ala Pro Ser
20 25
<210> 235
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 235
Phe Leu Arg Lys Thr Glu Cys His Cys Gln Ile Val Asn Phe Gly Ala
1 5 10 15
Gly Met Asp Thr Thr Phe Trp Arg Leu Lys Asp
20 25
<210> 236
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 236
Tyr Ala Gly Tyr Ser Phe Glu Lys Leu Phe Pro Asp Val Phe Phe Pro
1 5 10 15
Ala Asp Ser Glu His Asn Lys Leu Lys Ala Ser
20 25
<210> 237
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 237
Arg Pro Gly Phe Val Phe Ala Pro Cys Pro His Glu Leu Ser Cys Pro
1 5 10 15
Gln Leu Thr Asn Leu Ala Cys Ser Phe Ser Gln
20 25
<210> 238
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 238
Lys Lys Phe Ile Arg Arg Asp Phe Leu Leu Asp Glu Ala Ile Gly Leu
1 5 10 15
Leu Pro Asp Asp Lys Leu Thr Leu Phe Cys Glu
20 25
<210> 239
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 239
Glu Leu Arg Lys Glu Tyr Gly Met Thr Tyr Asn Asp Phe Leu Met Val
1 5 10 15
Leu Thr Asp Val Asp Leu Arg Val Lys Gln Tyr
20 25
<210> 240
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 240
Lys Phe Gly Gln Gly Leu Glu Asp Gln Leu Ala Gln Thr Lys Ser Leu
1 5 10 15
Ser Leu Asp Asp Cys
20
<210> 241
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 241
His Leu Leu Leu Val Tyr Thr Gly Lys Thr Arg Leu Ala Trp Asn Leu
1 5 10 15
Leu Gln Asp Val Leu Arg Ser Trp Tyr Ala Arg
20 25
<210> 242
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 242
Pro Val Pro Gly Val Pro Phe Arg Asn Val Asp Asn Asp Phe Pro Thr
1 5 10 15
Ser Val Glu Leu Glu Asp Trp Val Asp Ala Gln
20 25
<210> 243
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 243
Ser Thr Lys Val Glu Ser Leu Val Ala Leu Leu Asn Asn Phe Ser Glu
1 5 10 15
Met Lys Leu Val Gln Met Lys Trp His Glu Ala
20 25
<210> 244
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 244
Leu Phe Gly Gln Leu Ala Ala Phe Ala Gly Arg Lys Trp Ile Lys Phe
1 5 10 15
Phe Thr Ser Gln Val Lys Gln Thr Arg Asp Ser
20 25
<210> 245
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 245
Val Pro Leu Glu Arg Gly Ala Pro Asn Lys Glu Glu Thr Ser Ala Thr
1 5 10 15
Glu Ser Pro Asp Thr Gly Leu Tyr Tyr His Arg
20 25
<210> 246
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 246
Tyr Cys Met His His Ser Leu Val Glu Phe His Leu Lys Lys Leu Arg
1 5 10 15
Asn Lys Asp Thr Asn Ile Glu Val Thr Phe Leu
20 25
<210> 247
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 247
Gln Ile Lys Ile Ser Thr Arg Lys Gln Lys Ser Val Lys Val Ile Ser
1 5 10 15
Ser Tyr Thr Pro Lys Asp Cys Thr Ser Arg Asn
20 25
<210> 248
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 248
Ile Leu Thr Val Leu Gln Cys Ala Thr Val Ile Gly Phe Phe Tyr Trp
1 5 10 15
Ala Ser Glu Leu Ile Leu Ala Gln Gln Gln Gln
20 25
<210> 249
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 249
Val Arg Leu Phe Leu Asp Ser Lys His Pro Gly His Tyr Val Val Tyr
1 5 10 15
Asn Leu Ser Pro Arg Thr Tyr Arg Pro Ser Arg
20 25
<210> 250
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 250
Ser His Thr Lys Gly Ile Trp Met Trp Cys Val Pro His Phe Lys Lys
1 5 10 15
Pro Gly His Ile Leu Val Leu Leu Asp Thr Glu
20 25
<210> 251
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 251
Ser Thr Leu Ile Ser Val Pro Asp Arg Asp Pro Ala Ser Phe Leu Arg
1 5 10 15
Met Ala Asn Ser Ala Leu Ile Ser Val Gly Cys
20 25
<210> 252
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 252
Phe Ala Glu Ser Ala Asp Ala Ala Leu Gln Gly Asp Pro Val Leu Gln
1 5 10 15
Asp Ala Gly Asp Ser Ser Arg Lys Glu Tyr Phe
20 25
<210> 253
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 253
Ala Asn Leu Glu Ile Met Thr Lys Arg Ser Asn Tyr Thr Ser Ile Thr
1 5 10 15
Asn Asp Lys Phe Thr Pro Pro Val Val Asn Val
20 25
<210> 254
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 254
Glu Gln Thr Leu Val Leu Gln Ile Val Ala Gly Ile Leu Tyr Leu Gly
1 5 10 15
Asn Ile Ser Phe Lys Glu Val Gly Asn Tyr Ala
20 25
<210> 255
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 255
Lys Tyr Thr Ala Gln Glu Ser Arg Glu Met Phe Pro Arg Leu Phe Ile
1 5 10 15
Arg Leu Leu Arg Ser Lys Val Ser Arg Phe Leu
20 25
<210> 256
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 256
Arg Asp Glu Glu Val Ser Ser Ala Asp Ile Ser Ser Ser Phe Glu Val
1 5 10 15
Ile Ser Gln His Leu Val Ser Tyr Arg Asn Ile
20 25
<210> 257
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 257
Ser Gln Asn Thr Asp Met Val Gln Lys Ser Val Ser Lys Ile Leu Pro
1 5 10 15
Ser Thr Trp Ser Asp Pro Ser Val Asn Ile Ser
20 25
<210> 258
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 258
Asp Glu Ile Pro Leu Tyr Leu Lys Gly Gly Val Ala Asp Val Leu Leu
1 5 10 15
Tyr Arg Ala Thr Met Ile Leu Thr Val Gly Gly
20 25
<210> 259
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 259
Ile Ile Ala Arg Thr Asp Leu Lys Lys Asn Arg Asp Tyr Arg Leu Ala
1 5 10 15
Ser Lys Asp Ala Lys Lys Gln Leu Leu Cys Gly
20 25
<210> 260
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 260
Leu Phe Arg His Leu Leu Ser Ser Asp Gln Met Met Asp Tyr Ile Leu
1 5 10 15
Ala Asp Glu Ala Phe Phe Ser Val Asn Ser Ser
20 25
<210> 261
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 261
Trp Glu Ser Val Lys Leu Leu Phe Val Lys Thr Glu Lys Leu Ala Ala
1 5 10 15
Leu Pro Ile Phe Ser Ser Phe Val Ser Asn Trp
20 25
<210> 262
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 262
Val Leu Ser Glu Glu Arg Ala Ala Leu Leu Glu Leu Trp Lys Leu Arg
1 5 10 15
Arg Gln Gln Tyr Glu Gln Cys Met Asp Leu Gln
20 25
<210> 263
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 263
Glu Lys Arg Gln Ala Lys Tyr Ser Glu Asn Lys Leu Lys Leu Ile Lys
1 5 10 15
Ala Arg Asn Glu Tyr Leu Leu Thr Leu Glu Ala
20 25
<210> 264
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 264
Lys Ser His Arg Leu Pro Arg Leu Pro Lys Arg His Ser Tyr Asp Asp
1 5 10 15
Met Leu Leu Leu Ala Gln Leu Ser Leu Pro Ser
20 25
<210> 265
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 265
Met Ser Glu Phe Arg Ile Tyr His Asp Val Asn Glu Leu Leu Ser Leu
1 5 10 15
Leu Arg Val His
20
<210> 266
<211> 27
<212> PRT
<213> Искусственная последовательность
<220>
<223> неоантиген
<400> 266
Thr Arg Leu Ser Lys Val Phe Ser Ala Met Leu Ala Ile Tyr Ser Asn
1 5 10 15
Lys Pro Ala Leu Trp Ile Met Ala Ala Lys Trp
20 25
<210> 267
<211> 2867
<212> ДНК
<213> Homo sapiens
<400> 267
acagactgcc aaatggaaca gacaagcagg ttgtcttgtg ttaaagaaaa tgagatataa 60
gtcagttact cccggaggca atgctgctgt tcagctcttc tgtttttgtg gccagggtct 120
tcatgaacac taataggggt accaggccct cttcctcgtt agaagaaatc aggataacaa 180
aggcatattg ggcaccccta caaaaggaat ctgtatctgt atcaagatga tctgaagaac 240
agcttctacc tttaggaatg tctagtgttc caaaatgact agcatcttcc attttgccat 300
tatcttcatg ttaatacttc agatcagaat acaattatct gaagaaagtg aatttttagt 360
tgataggtca aaaaacggtc tcatccacgt tcctaaagac ctatcccaga aaacaacaat 420
cttaaatata tcgcaaaatt atatatctga gctttggact tctgacatct tatcactgtc 480
aaaactgagg attttgataa tttctcataa tagaatccag tatcttgata tcagtgtttt 540
caaattcaac caggaattgg aatacttgga tttgtcccac aacaagttgg tgaagatttc 600
ttgccaccct actgtgaacc tcaagcactt ggacctgtca tttaatgcat ttgatgccct 660
gcctatatgc aaagagtttg gcaatatgtc tcaactaaaa tttctggggt tgagcaccac 720
acacttagaa aaatctagtg tgctgccaat tgctcatttg aatatcagca aggtcttgct 780
ggtcttagga gagacttatg gggaaaaaga agaccctgag ggccttcaag actttaacac 840
tgagagtctg cacattgtgt tccccacaaa caaagaattc cattttattt tggatgtgtc 900
agtcaagact gtagcaaatc tggaactatc taatatcaaa tgtgtgctag aagataacaa 960
atgttcttac ttcctaagta ttctggcgaa acttcaaaca aatccaaagt tatcaaatct 1020
taccttaaac aacattgaaa caacttggaa ttctttcatt aggatcctcc agctggtttg 1080
gcatacaact gtatggtatt tctcaatttc aaacgtgaag ctacagggtc agctggactt 1140
cagagatttt gattattctg gcacttcctt gaaggccttg tctatacacc aagttgtcag 1200
cgatgtgttc ggttttccgc aaagttatat ctatgaaatc ttttcgaata tgaacatcaa 1260
aaatttcaca gtgtctggta cacgcatggt ccacatgctt tgcccatcca aaattagccc 1320
gttcctgcat ttggattttt ccaataatct cttaacagac acggtttttg aaaattgtgg 1380
gcaccttact gagttggaga cacttatttt acaaatgaat caattaaaag aactttcaaa 1440
aatagctgaa atgactacac agatgaagtc tctgcaacaa ttggatatta gccagaattc 1500
tgtaagctat gatgaaaaga aaggagactg ttcttggact aaaagtttat taagtttaaa 1560
tatgtcttca aatatactta ctgacactat tttcagatgt ttacctccca ggatcaaggt 1620
acttgatctt cacagcaata aaataaagag cattcctaaa caagtcgtaa aactggaagc 1680
tttgcaagaa ctcaatgttg ctttcaattc tttaactgac cttcctggat gtggcagctt 1740
tagcagcctt tctgtattga tcattgatca caattcagtt tcccacccat cggctgattt 1800
cttccagagc tgccagaaga tgaggtcaat aaaagcaggg gacaatccat tccaatgtac 1860
ctgtgagcta ggagaatttg tcaaaaatat agaccaagta tcaagtgaag tgttagaggg 1920
ctggcctgat tcttataagt gtgactaccc ggaaagttat agaggaaccc tactaaagga 1980
ctttcacatg tctgaattat cctgcaacat aactctgctg atcgtcacca tcgttgccac 2040
catgctggtg ttggctgtga ctgtgacctc cctctgcagc tacttggatc tgccctggta 2100
tctcaggatg gtgtgccagt ggacccagac ccggcgcagg gccaggaaca tacccttaga 2160
agaactccaa agaaatctcc agtttcatgc atttatttca tatagtgggc acgattcttt 2220
ctgggtgaag aatgaattat tgccaaacct agagaaagaa ggtatgcaga tttgccttca 2280
tgagagaaac tttgttcctg gcaagagcat tgtggaaaat atcatcacct gcattgagaa 2340
gagttacaag tccatctttg ttttgtctcc caactttgtc cagagtgaat ggtgccatta 2400
tgaactctac tttgcccatc acaatctctt tcatgaagga tctaatagct taatcctgat 2460
cttgctggaa cccattccgc agtactccat tcctagcagt tatcacaagc tcaaaagtct 2520
catggccagg aggacttatt tggaatggcc caaggaaaag agcaaacgtg gccttttttg 2580
ggctaactta agggcagcca ttaatattaa gctgacagag caagcaaaga aatagattac 2640
acatcaagtg aaaaatattc ctcctgttga tattgctgct tttggaagtt ccaacaatga 2700
ctttattttg catcagcata gatgtaaaca caattgtgag tgtatgatgt aggtaaaaat 2760
atataccttc gggtcgcagt tcaccattta tatgtggtat taaaaattaa tgaaatgata 2820
taactttgat ttaaacagtt ctgacacata aaaaaaaaaa aaaaaaa 2867
<210> 268
<211> 786
<212> PRT
<213> Homo sapiens
<400> 268
Met Thr Ser Ile Phe His Phe Ala Ile Ile Phe Met Leu Ile Leu Gln
1 5 10 15
Ile Arg Ile Gln Leu Ser Glu Glu Ser Glu Phe Leu Val Asp Arg Ser
20 25 30
Lys Asn Gly Leu Ile His Val Pro Lys Asp Leu Ser Gln Lys Thr Thr
35 40 45
Ile Leu Asn Ile Ser Gln Asn Tyr Ile Ser Glu Leu Trp Thr Ser Asp
50 55 60
Ile Leu Ser Leu Ser Lys Leu Arg Ile Leu Ile Ile Ser His Asn Arg
65 70 75 80
Ile Gln Tyr Leu Asp Ile Ser Val Phe Lys Phe Asn Gln Glu Leu Glu
85 90 95
Tyr Leu Asp Leu Ser His Asn Lys Leu Val Lys Ile Ser Cys His Pro
100 105 110
Thr Val Asn Leu Lys His Leu Asp Leu Ser Phe Asn Ala Phe Asp Ala
115 120 125
Leu Pro Ile Cys Lys Glu Phe Gly Asn Met Ser Gln Leu Lys Phe Leu
130 135 140
Gly Leu Ser Thr Thr His Leu Glu Lys Ser Ser Val Leu Pro Ile Ala
145 150 155 160
His Leu Asn Ile Ser Lys Val Leu Leu Val Leu Gly Glu Thr Tyr Gly
165 170 175
Glu Lys Glu Asp Pro Glu Gly Leu Gln Asp Phe Asn Thr Glu Ser Leu
180 185 190
His Ile Val Phe Pro Thr Asn Lys Glu Phe His Phe Ile Leu Asp Val
195 200 205
Ser Val Lys Thr Val Ala Asn Leu Glu Leu Ser Asn Ile Lys Cys Val
210 215 220
Leu Glu Asp Asn Lys Cys Ser Tyr Phe Leu Ser Ile Leu Ala Lys Leu
225 230 235 240
Gln Thr Asn Pro Lys Leu Ser Asn Leu Thr Leu Asn Asn Ile Glu Thr
245 250 255
Thr Trp Asn Ser Phe Ile Arg Ile Leu Gln Leu Val Trp His Thr Thr
260 265 270
Val Trp Tyr Phe Ser Ile Ser Asn Val Lys Leu Gln Gly Gln Leu Asp
275 280 285
Phe Arg Asp Phe Asp Tyr Ser Gly Thr Ser Leu Lys Ala Leu Ser Ile
290 295 300
His Gln Val Val Ser Asp Val Phe Gly Phe Pro Gln Ser Tyr Ile Tyr
305 310 315 320
Glu Ile Phe Ser Asn Met Asn Ile Lys Asn Phe Thr Val Ser Gly Thr
325 330 335
Arg Met Val His Met Leu Cys Pro Ser Lys Ile Ser Pro Phe Leu His
340 345 350
Leu Asp Phe Ser Asn Asn Leu Leu Thr Asp Thr Val Phe Glu Asn Cys
355 360 365
Gly His Leu Thr Glu Leu Glu Thr Leu Ile Leu Gln Met Asn Gln Leu
370 375 380
Lys Glu Leu Ser Lys Ile Ala Glu Met Thr Thr Gln Met Lys Ser Leu
385 390 395 400
Gln Gln Leu Asp Ile Ser Gln Asn Ser Val Ser Tyr Asp Glu Lys Lys
405 410 415
Gly Asp Cys Ser Trp Thr Lys Ser Leu Leu Ser Leu Asn Met Ser Ser
420 425 430
Asn Ile Leu Thr Asp Thr Ile Phe Arg Cys Leu Pro Pro Arg Ile Lys
435 440 445
Val Leu Asp Leu His Ser Asn Lys Ile Lys Ser Ile Pro Lys Gln Val
450 455 460
Val Lys Leu Glu Ala Leu Gln Glu Leu Asn Val Ala Phe Asn Ser Leu
465 470 475 480
Thr Asp Leu Pro Gly Cys Gly Ser Phe Ser Ser Leu Ser Val Leu Ile
485 490 495
Ile Asp His Asn Ser Val Ser His Pro Ser Ala Asp Phe Phe Gln Ser
500 505 510
Cys Gln Lys Met Arg Ser Ile Lys Ala Gly Asp Asn Pro Phe Gln Cys
515 520 525
Thr Cys Glu Leu Gly Glu Phe Val Lys Asn Ile Asp Gln Val Ser Ser
530 535 540
Glu Val Leu Glu Gly Trp Pro Asp Ser Tyr Lys Cys Asp Tyr Pro Glu
545 550 555 560
Ser Tyr Arg Gly Thr Leu Leu Lys Asp Phe His Met Ser Glu Leu Ser
565 570 575
Cys Asn Ile Thr Leu Leu Ile Val Thr Ile Val Ala Thr Met Leu Val
580 585 590
Leu Ala Val Thr Val Thr Ser Leu Cys Ser Tyr Leu Asp Leu Pro Trp
595 600 605
Tyr Leu Arg Met Val Cys Gln Trp Thr Gln Thr Arg Arg Arg Ala Arg
610 615 620
Asn Ile Pro Leu Glu Glu Leu Gln Arg Asn Leu Gln Phe His Ala Phe
625 630 635 640
Ile Ser Tyr Ser Gly His Asp Ser Phe Trp Val Lys Asn Glu Leu Leu
645 650 655
Pro Asn Leu Glu Lys Glu Gly Met Gln Ile Cys Leu His Glu Arg Asn
660 665 670
Phe Val Pro Gly Lys Ser Ile Val Glu Asn Ile Ile Thr Cys Ile Glu
675 680 685
Lys Ser Tyr Lys Ser Ile Phe Val Leu Ser Pro Asn Phe Val Gln Ser
690 695 700
Glu Trp Cys His Tyr Glu Leu Tyr Phe Ala His His Asn Leu Phe His
705 710 715 720
Glu Gly Ser Asn Ser Leu Ile Leu Ile Leu Leu Glu Pro Ile Pro Gln
725 730 735
Tyr Ser Ile Pro Ser Ser Tyr His Lys Leu Lys Ser Leu Met Ala Arg
740 745 750
Arg Thr Tyr Leu Glu Trp Pro Lys Glu Lys Ser Lys Arg Gly Leu Phe
755 760 765
Trp Ala Asn Leu Arg Ala Ala Ile Asn Ile Lys Leu Thr Glu Gln Ala
770 775 780
Lys Lys
785
<210> 269
<211> 3417
<212> ДНК
<213> Homo sapiens
<400> 269
cggaggcagc gagaaagcgc agccaggcgg ctgctcggcg ttctctcagg tgactgctcg 60
gagttctccc agtgtttggt gttgcaagca ggatccaaag gagacctata gtgactccca 120
ggagctctta gtgaccaagt gaaggtacct gtggggctca ttgtgcccat tgctctttca 180
ctgctttcaa ctggtagttg tgggttgaag cactggacaa tgccacatac tttgtggatg 240
gtgtgggtct tgggggtcat catcagcctc tccaaggaag aatcctccaa tcaggcttct 300
ctgtcttgtg accgcaatgg tatctgcaag ggcagctcag gatctttaaa ctccattccc 360
tcagggctca cagaagctgt aaaaagcctt gacctgtcca acaacaggat cacctacatt 420
agcaacagtg acctacagag gtgtgtgaac ctccaggctc tggtgctgac atccaatgga 480
attaacacaa tagaggaaga ttctttttct tccctgggca gtcttgaaca tttagactta 540
tcctataatt acttatctaa tttatcgtct tcctggttca agcccctttc ttctttaaca 600
ttcttaaact tactgggaaa tccttacaaa accctagggg aaacatctct tttttctcat 660
ctcacaaaat tgcaaatcct gagagtggga aatatggaca ccttcactaa gattcaaaga 720
aaagattttg ctggacttac cttccttgag gaacttgaga ttgatgcttc agatctacag 780
agctatgagc caaaaagttt gaagtcaatt cagaatgtaa gtcatctgat ccttcatatg 840
aagcagcata ttttactgct ggagattttt gtagatgtta caagttccgt ggaatgtttg 900
gaactgcgag atactgattt ggacactttc catttttcag aactatccac tggtgaaaca 960
aattcattga ttaaaaagtt tacatttaga aatgtgaaaa tcaccgatga aagtttgttt 1020
caggttatga aacttttgaa tcagatttct ggattgttag aattagagtt tgatgactgt 1080
acccttaatg gagttggtaa ttttagagca tctgataatg acagagttat agatccaggt 1140
aaagtggaaa cgttaacaat ccggaggctg catattccaa ggttttactt attttatgat 1200
ctgagcactt tatattcact tacagaaaga gttaaaagaa tcacagtaga aaacagtaaa 1260
gtttttctgg ttccttgttt actttcacaa catttaaaat cattagaata cttggatctc 1320
agtgaaaatt tgatggttga agaatacttg aaaaattcag cctgtgagga tgcctggccc 1380
tctctacaaa ctttaatttt aaggcaaaat catttggcat cattggaaaa aaccggagag 1440
actttgctca ctctgaaaaa cttgactaac attgatatca gtaagaatag ttttcattct 1500
atgcctgaaa cttgtcagtg gccagaaaag atgaaatatt tgaacttatc cagcacacga 1560
atacacagtg taacaggctg cattcccaag acactggaaa ttttagatgt tagcaacaac 1620
aatctcaatt tattttcttt gaatttgccg caactcaaag aactttatat ttccagaaat 1680
aagttgatga ctctaccaga tgcctccctc ttacccatgt tactagtatt gaaaatcagt 1740
aggaatgcaa taactacgtt ttctaaggag caacttgact catttcacac actgaagact 1800
ttggaagctg gtggcaataa cttcatttgc tcctgtgaat tcctctcctt cactcaggag 1860
cagcaagcac tggccaaagt cttgattgat tggccagcaa attacctgtg tgactctcca 1920
tcccatgtgc gtggccagca ggttcaggat gtccgcctct cggtgtcgga atgtcacagg 1980
acagcactgg tgtctggcat gtgctgtgct ctgttcctgc tgatcctgct cacgggggtc 2040
ctgtgccacc gtttccatgg cctgtggtat atgaaaatga tgtgggcctg gctccaggcc 2100
aaaaggaagc ccaggaaagc tcccagcagg aacatctgct atgatgcatt tgtttcttac 2160
agtgagcggg atgcctactg ggtggagaac cttatggtcc aggagctgga gaacttcaat 2220
ccccccttca agttgtgtct tcataagcgg gacttcattc ctggcaagtg gatcattgac 2280
aatatcattg actccattga aaagagccac aaaactgtct ttgtgctttc tgaaaacttt 2340
gtgaagagtg agtggtgcaa gtatgaactg gacttctccc atttccgtct ttttgatgag 2400
aacaatgatg ctgccattct cattcttctg gagcccattg agaaaaaagc cattccccag 2460
cgcttctgca agctgcggaa gataatgaac accaagacct acctggagtg gcccatggac 2520
gaggctcagc gggaaggatt ttgggtaaat ctgagagctg cgataaagtc ctaggttccc 2580
atatttaaga ccagtctttg tctagttggg atctttatgt cactagttat agttaagttc 2640
attcagacat aattatataa aaactacgtg gatgtaccgt catttgagga cttgcttact 2700
aaaactacaa aacttcaaat tttgtctggg gtgctgtttt ataaacatat gccagattta 2760
aaaattggtt tttggttttt cttttttcta tgagataacc atgatcataa gtctattact 2820
gatatctgaa tatagtccct tggtatccaa gggaattggt tgcaggatcc tcgtggatat 2880
caaaattcat agatgatcaa gtcccttata agagtggcat agtatttgca tataacctgt 2940
gtacattctc ctgtatactt taaatcatct ctagattact tatgataccc aatacaatgt 3000
aaatactatg taaatagttg tactgtcttt ttatttatat tattattgtt attttttatt 3060
ttcaaaattt ttaaaacata cttttgatcc acagttggtt gacttcatgg atgcagaacc 3120
catggatata gagggccaac tgtaatctgt agcaactggc ttagttcatt aggaaacagc 3180
acaaatgaac ttaagattct caatgactgt gtcattcttt cttcctgcta agagactcct 3240
ctgtggccac aaaaggcatt ctctgtccta cctagctgtc acttctctgt gcagctgatc 3300
tcaagagcaa caaggcaaag tatttggggc actccccaaa acttgttgct attcctagaa 3360
aaaagtgctg tgtatttcct attaaacttt acaggatgag aaaaaaaaaa aaaaaaa 3417
<210> 270
<211> 784
<212> PRT
<213> Homo sapiens
<400> 270
Met Pro His Thr Leu Trp Met Val Trp Val Leu Gly Val Ile Ile Ser
1 5 10 15
Leu Ser Lys Glu Glu Ser Ser Asn Gln Ala Ser Leu Ser Cys Asp Arg
20 25 30
Asn Gly Ile Cys Lys Gly Ser Ser Gly Ser Leu Asn Ser Ile Pro Ser
35 40 45
Gly Leu Thr Glu Ala Val Lys Ser Leu Asp Leu Ser Asn Asn Arg Ile
50 55 60
Thr Tyr Ile Ser Asn Ser Asp Leu Gln Arg Cys Val Asn Leu Gln Ala
65 70 75 80
Leu Val Leu Thr Ser Asn Gly Ile Asn Thr Ile Glu Glu Asp Ser Phe
85 90 95
Ser Ser Leu Gly Ser Leu Glu His Leu Asp Leu Ser Tyr Asn Tyr Leu
100 105 110
Ser Asn Leu Ser Ser Ser Trp Phe Lys Pro Leu Ser Ser Leu Thr Phe
115 120 125
Leu Asn Leu Leu Gly Asn Pro Tyr Lys Thr Leu Gly Glu Thr Ser Leu
130 135 140
Phe Ser His Leu Thr Lys Leu Gln Ile Leu Arg Val Gly Asn Met Asp
145 150 155 160
Thr Phe Thr Lys Ile Gln Arg Lys Asp Phe Ala Gly Leu Thr Phe Leu
165 170 175
Glu Glu Leu Glu Ile Asp Ala Ser Asp Leu Gln Ser Tyr Glu Pro Lys
180 185 190
Ser Leu Lys Ser Ile Gln Asn Val Ser His Leu Ile Leu His Met Lys
195 200 205
Gln His Ile Leu Leu Leu Glu Ile Phe Val Asp Val Thr Ser Ser Val
210 215 220
Glu Cys Leu Glu Leu Arg Asp Thr Asp Leu Asp Thr Phe His Phe Ser
225 230 235 240
Glu Leu Ser Thr Gly Glu Thr Asn Ser Leu Ile Lys Lys Phe Thr Phe
245 250 255
Arg Asn Val Lys Ile Thr Asp Glu Ser Leu Phe Gln Val Met Lys Leu
260 265 270
Leu Asn Gln Ile Ser Gly Leu Leu Glu Leu Glu Phe Asp Asp Cys Thr
275 280 285
Leu Asn Gly Val Gly Asn Phe Arg Ala Ser Asp Asn Asp Arg Val Ile
290 295 300
Asp Pro Gly Lys Val Glu Thr Leu Thr Ile Arg Arg Leu His Ile Pro
305 310 315 320
Arg Phe Tyr Leu Phe Tyr Asp Leu Ser Thr Leu Tyr Ser Leu Thr Glu
325 330 335
Arg Val Lys Arg Ile Thr Val Glu Asn Ser Lys Val Phe Leu Val Pro
340 345 350
Cys Leu Leu Ser Gln His Leu Lys Ser Leu Glu Tyr Leu Asp Leu Ser
355 360 365
Glu Asn Leu Met Val Glu Glu Tyr Leu Lys Asn Ser Ala Cys Glu Asp
370 375 380
Ala Trp Pro Ser Leu Gln Thr Leu Ile Leu Arg Gln Asn His Leu Ala
385 390 395 400
Ser Leu Glu Lys Thr Gly Glu Thr Leu Leu Thr Leu Lys Asn Leu Thr
405 410 415
Asn Ile Asp Ile Ser Lys Asn Ser Phe His Ser Met Pro Glu Thr Cys
420 425 430
Gln Trp Pro Glu Lys Met Lys Tyr Leu Asn Leu Ser Ser Thr Arg Ile
435 440 445
His Ser Val Thr Gly Cys Ile Pro Lys Thr Leu Glu Ile Leu Asp Val
450 455 460
Ser Asn Asn Asn Leu Asn Leu Phe Ser Leu Asn Leu Pro Gln Leu Lys
465 470 475 480
Glu Leu Tyr Ile Ser Arg Asn Lys Leu Met Thr Leu Pro Asp Ala Ser
485 490 495
Leu Leu Pro Met Leu Leu Val Leu Lys Ile Ser Arg Asn Ala Ile Thr
500 505 510
Thr Phe Ser Lys Glu Gln Leu Asp Ser Phe His Thr Leu Lys Thr Leu
515 520 525
Glu Ala Gly Gly Asn Asn Phe Ile Cys Ser Cys Glu Phe Leu Ser Phe
530 535 540
Thr Gln Glu Gln Gln Ala Leu Ala Lys Val Leu Ile Asp Trp Pro Ala
545 550 555 560
Asn Tyr Leu Cys Asp Ser Pro Ser His Val Arg Gly Gln Gln Val Gln
565 570 575
Asp Val Arg Leu Ser Val Ser Glu Cys His Arg Thr Ala Leu Val Ser
580 585 590
Gly Met Cys Cys Ala Leu Phe Leu Leu Ile Leu Leu Thr Gly Val Leu
595 600 605
Cys His Arg Phe His Gly Leu Trp Tyr Met Lys Met Met Trp Ala Trp
610 615 620
Leu Gln Ala Lys Arg Lys Pro Arg Lys Ala Pro Ser Arg Asn Ile Cys
625 630 635 640
Tyr Asp Ala Phe Val Ser Tyr Ser Glu Arg Asp Ala Tyr Trp Val Glu
645 650 655
Asn Leu Met Val Gln Glu Leu Glu Asn Phe Asn Pro Pro Phe Lys Leu
660 665 670
Cys Leu His Lys Arg Asp Phe Ile Pro Gly Lys Trp Ile Ile Asp Asn
675 680 685
Ile Ile Asp Ser Ile Glu Lys Ser His Lys Thr Val Phe Val Leu Ser
690 695 700
Glu Asn Phe Val Lys Ser Glu Trp Cys Lys Tyr Glu Leu Asp Phe Ser
705 710 715 720
His Phe Arg Leu Phe Asp Glu Asn Asn Asp Ala Ala Ile Leu Ile Leu
725 730 735
Leu Glu Pro Ile Glu Lys Lys Ala Ile Pro Gln Arg Phe Cys Lys Leu
740 745 750
Arg Lys Ile Met Asn Thr Lys Thr Tyr Leu Glu Trp Pro Met Asp Glu
755 760 765
Ala Gln Arg Glu Gly Phe Trp Val Asn Leu Arg Ala Ala Ile Lys Ser
770 775 780
<210> 271
<211> 3057
<212> ДНК
<213> Homo sapiens
<400> 271
cactttcgag agtgccgtct atttgccaca cacttccctg atgaaatgtc tggatttgga 60
ctaaagaaaa aaggaaaggc tagcagtcat ccaacagaat catgagacag actttgcctt 120
gtatctactt ttgggggggc cttttgccct ttgggatgct gtgtgcatcc tccaccacca 180
agtgcactgt tagccatgaa gttgctgact gcagccacct gaagttgact caggtacccg 240
atgatctacc cacaaacata acagtgttga accttaccca taatcaactc agaagattac 300
cagccgccaa cttcacaagg tatagccagc taactagctt ggatgtagga tttaacacca 360
tctcaaaact ggagccagaa ttgtgccaga aacttcccat gttaaaagtt ttgaacctcc 420
agcacaatga gctatctcaa ctttctgata aaacctttgc cttctgcacg aatttgactg 480
aactccatct catgtccaac tcaatccaga aaattaaaaa taatcccttt gtcaagcaga 540
agaatttaat cacattagat ctgtctcata atggcttgtc atctacaaaa ttaggaactc 600
aggttcagct ggaaaatctc caagagcttc tattatcaaa caataaaatt caagcgctaa 660
aaagtgaaga actggatatc tttgccaatt catctttaaa aaaattagag ttgtcatcga 720
atcaaattaa agagttttct ccagggtgtt ttcacgcaat tggaagatta tttggcctct 780
ttctgaacaa tgtccagctg ggtcccagcc ttacagagaa gctatgtttg gaattagcaa 840
acacaagcat tcggaatctg tctctgagta acagccagct gtccaccacc agcaatacaa 900
ctttcttggg actaaagtgg acaaatctca ctatgctcga tctttcctac aacaacttaa 960
atgtggttgg taacgattcc tttgcttggc ttccacaact agaatatttc ttcctagagt 1020
ataataatat acagcatttg ttttctcact ctttgcacgg gcttttcaat gtgaggtacc 1080
tgaatttgaa acggtctttt actaaacaaa gtatttccct tgcctcactc cccaagattg 1140
atgatttttc ttttcagtgg ctaaaatgtt tggagcacct taacatggaa gataatgata 1200
ttccaggcat aaaaagcaat atgttcacag gattgataaa cctgaaatac ttaagtctat 1260
ccaactcctt tacaagtttg cgaactttga caaatgaaac atttgtatca cttgctcatt 1320
ctcccttaca catactcaac ctaaccaaga ataaaatctc aaaaatagag agtgatgctt 1380
tctcttggtt gggccaccta gaagtacttg acctgggcct taatgaaatt gggcaagaac 1440
tcacaggcca ggaatggaga ggtctagaaa atattttcga aatctatctt tcctacaaca 1500
agtacctgca gctgactagg aactcctttg ccttggtccc aagccttcaa cgactgatgc 1560
tccgaagggt ggcccttaaa aatgtggata gctctccttc accattccag cctcttcgta 1620
acttgaccat tctggatcta agcaacaaca acatagccaa cataaatgat gacatgttgg 1680
agggtcttga gaaactagaa attctcgatt tgcagcataa caacttagca cggctctgga 1740
aacacgcaaa ccctggtggt cccatttatt tcctaaaggg tctgtctcac ctccacatcc 1800
ttaacttgga gtccaacggc tttgacgaga tcccagttga ggtcttcaag gatttatttg 1860
aactaaagat catcgattta ggattgaata atttaaacac acttccagca tctgtcttta 1920
ataatcaggt gtctctaaag tcattgaacc ttcagaagaa tctcataaca tccgttgaga 1980
agaaggtttt cgggccagct ttcaggaacc tgactgagtt agatatgcgc tttaatccct 2040
ttgattgcac gtgtgaaagt attgcctggt ttgttaattg gattaacgag acccatacca 2100
acatccctga gctgtcaagc cactaccttt gcaacactcc acctcactat catgggttcc 2160
cagtgagact ttttgataca tcatcttgca aagacagtgc cccctttgaa ctctttttca 2220
tgatcaatac cagtatcctg ttgattttta tctttattgt acttctcatc cactttgagg 2280
gctggaggat atctttttat tggaatgttt cagtacatcg agttcttggt ttcaaagaaa 2340
tagacagaca gacagaacag tttgaatatg cagcatatat aattcatgcc tataaagata 2400
aggattgggt ctgggaacat ttctcttcaa tggaaaagga agaccaatct ctcaaatttt 2460
gtctggaaga aagggacttt gaggcgggtg tttttgaact agaagcaatt gttaacagca 2520
tcaaaagaag cagaaaaatt atttttgtta taacacacca tctattaaaa gacccattat 2580
gcaaaagatt caaggtacat catgcagttc aacaagctat tgaacaaaat ctggattcca 2640
ttatattggt tttccttgag gagattccag attataaact gaaccatgca ctctgtttgc 2700
gaagaggaat gtttaaatct cactgcatct tgaactggcc agttcagaaa gaacggatag 2760
gtgcctttcg tcataaattg caagtagcac ttggatccaa aaactctgta cattaaattt 2820
atttaaatat tcaattagca aaggagaaac tttctcaatt taaaaagttc tatggcaaat 2880
ttaagttttc cataaaggtg ttataatttg tttattcata tttgtaaatg attatattct 2940
atcacaatta catctcttct aggaaaatgt gtctccttat ttcaggccta tttttgacaa 3000
ttgacttaat tttacccaaa ataaaacata taagcacgta aaaaaaaaaa aaaaaaa 3057
<210> 272
<211> 904
<212> PRT
<213> Homo sapiens
<400> 272
Met Arg Gln Thr Leu Pro Cys Ile Tyr Phe Trp Gly Gly Leu Leu Pro
1 5 10 15
Phe Gly Met Leu Cys Ala Ser Ser Thr Thr Lys Cys Thr Val Ser His
20 25 30
Glu Val Ala Asp Cys Ser His Leu Lys Leu Thr Gln Val Pro Asp Asp
35 40 45
Leu Pro Thr Asn Ile Thr Val Leu Asn Leu Thr His Asn Gln Leu Arg
50 55 60
Arg Leu Pro Ala Ala Asn Phe Thr Arg Tyr Ser Gln Leu Thr Ser Leu
65 70 75 80
Asp Val Gly Phe Asn Thr Ile Ser Lys Leu Glu Pro Glu Leu Cys Gln
85 90 95
Lys Leu Pro Met Leu Lys Val Leu Asn Leu Gln His Asn Glu Leu Ser
100 105 110
Gln Leu Ser Asp Lys Thr Phe Ala Phe Cys Thr Asn Leu Thr Glu Leu
115 120 125
His Leu Met Ser Asn Ser Ile Gln Lys Ile Lys Asn Asn Pro Phe Val
130 135 140
Lys Gln Lys Asn Leu Ile Thr Leu Asp Leu Ser His Asn Gly Leu Ser
145 150 155 160
Ser Thr Lys Leu Gly Thr Gln Val Gln Leu Glu Asn Leu Gln Glu Leu
165 170 175
Leu Leu Ser Asn Asn Lys Ile Gln Ala Leu Lys Ser Glu Glu Leu Asp
180 185 190
Ile Phe Ala Asn Ser Ser Leu Lys Lys Leu Glu Leu Ser Ser Asn Gln
195 200 205
Ile Lys Glu Phe Ser Pro Gly Cys Phe His Ala Ile Gly Arg Leu Phe
210 215 220
Gly Leu Phe Leu Asn Asn Val Gln Leu Gly Pro Ser Leu Thr Glu Lys
225 230 235 240
Leu Cys Leu Glu Leu Ala Asn Thr Ser Ile Arg Asn Leu Ser Leu Ser
245 250 255
Asn Ser Gln Leu Ser Thr Thr Ser Asn Thr Thr Phe Leu Gly Leu Lys
260 265 270
Trp Thr Asn Leu Thr Met Leu Asp Leu Ser Tyr Asn Asn Leu Asn Val
275 280 285
Val Gly Asn Asp Ser Phe Ala Trp Leu Pro Gln Leu Glu Tyr Phe Phe
290 295 300
Leu Glu Tyr Asn Asn Ile Gln His Leu Phe Ser His Ser Leu His Gly
305 310 315 320
Leu Phe Asn Val Arg Tyr Leu Asn Leu Lys Arg Ser Phe Thr Lys Gln
325 330 335
Ser Ile Ser Leu Ala Ser Leu Pro Lys Ile Asp Asp Phe Ser Phe Gln
340 345 350
Trp Leu Lys Cys Leu Glu His Leu Asn Met Glu Asp Asn Asp Ile Pro
355 360 365
Gly Ile Lys Ser Asn Met Phe Thr Gly Leu Ile Asn Leu Lys Tyr Leu
370 375 380
Ser Leu Ser Asn Ser Phe Thr Ser Leu Arg Thr Leu Thr Asn Glu Thr
385 390 395 400
Phe Val Ser Leu Ala His Ser Pro Leu His Ile Leu Asn Leu Thr Lys
405 410 415
Asn Lys Ile Ser Lys Ile Glu Ser Asp Ala Phe Ser Trp Leu Gly His
420 425 430
Leu Glu Val Leu Asp Leu Gly Leu Asn Glu Ile Gly Gln Glu Leu Thr
435 440 445
Gly Gln Glu Trp Arg Gly Leu Glu Asn Ile Phe Glu Ile Tyr Leu Ser
450 455 460
Tyr Asn Lys Tyr Leu Gln Leu Thr Arg Asn Ser Phe Ala Leu Val Pro
465 470 475 480
Ser Leu Gln Arg Leu Met Leu Arg Arg Val Ala Leu Lys Asn Val Asp
485 490 495
Ser Ser Pro Ser Pro Phe Gln Pro Leu Arg Asn Leu Thr Ile Leu Asp
500 505 510
Leu Ser Asn Asn Asn Ile Ala Asn Ile Asn Asp Asp Met Leu Glu Gly
515 520 525
Leu Glu Lys Leu Glu Ile Leu Asp Leu Gln His Asn Asn Leu Ala Arg
530 535 540
Leu Trp Lys His Ala Asn Pro Gly Gly Pro Ile Tyr Phe Leu Lys Gly
545 550 555 560
Leu Ser His Leu His Ile Leu Asn Leu Glu Ser Asn Gly Phe Asp Glu
565 570 575
Ile Pro Val Glu Val Phe Lys Asp Leu Phe Glu Leu Lys Ile Ile Asp
580 585 590
Leu Gly Leu Asn Asn Leu Asn Thr Leu Pro Ala Ser Val Phe Asn Asn
595 600 605
Gln Val Ser Leu Lys Ser Leu Asn Leu Gln Lys Asn Leu Ile Thr Ser
610 615 620
Val Glu Lys Lys Val Phe Gly Pro Ala Phe Arg Asn Leu Thr Glu Leu
625 630 635 640
Asp Met Arg Phe Asn Pro Phe Asp Cys Thr Cys Glu Ser Ile Ala Trp
645 650 655
Phe Val Asn Trp Ile Asn Glu Thr His Thr Asn Ile Pro Glu Leu Ser
660 665 670
Ser His Tyr Leu Cys Asn Thr Pro Pro His Tyr His Gly Phe Pro Val
675 680 685
Arg Leu Phe Asp Thr Ser Ser Cys Lys Asp Ser Ala Pro Phe Glu Leu
690 695 700
Phe Phe Met Ile Asn Thr Ser Ile Leu Leu Ile Phe Ile Phe Ile Val
705 710 715 720
Leu Leu Ile His Phe Glu Gly Trp Arg Ile Ser Phe Tyr Trp Asn Val
725 730 735
Ser Val His Arg Val Leu Gly Phe Lys Glu Ile Asp Arg Gln Thr Glu
740 745 750
Gln Phe Glu Tyr Ala Ala Tyr Ile Ile His Ala Tyr Lys Asp Lys Asp
755 760 765
Trp Val Trp Glu His Phe Ser Ser Met Glu Lys Glu Asp Gln Ser Leu
770 775 780
Lys Phe Cys Leu Glu Glu Arg Asp Phe Glu Ala Gly Val Phe Glu Leu
785 790 795 800
Glu Ala Ile Val Asn Ser Ile Lys Arg Ser Arg Lys Ile Ile Phe Val
805 810 815
Ile Thr His His Leu Leu Lys Asp Pro Leu Cys Lys Arg Phe Lys Val
820 825 830
His His Ala Val Gln Gln Ala Ile Glu Gln Asn Leu Asp Ser Ile Ile
835 840 845
Leu Val Phe Leu Glu Glu Ile Pro Asp Tyr Lys Leu Asn His Ala Leu
850 855 860
Cys Leu Arg Arg Gly Met Phe Lys Ser His Cys Ile Leu Asn Trp Pro
865 870 875 880
Val Gln Lys Glu Arg Ile Gly Ala Phe Arg His Lys Leu Gln Val Ala
885 890 895
Leu Gly Ser Lys Asn Ser Val His
900
<210> 273
<211> 5661
<212> ДНК
<213> Homo sapiens
<400> 273
tagcttcctc ttgctgtttc tttagccact ggtctgcagg cgttttcttc ttctaacttc 60
ctctcctgtg acaaaagaga taactattag agaaacaaaa gtccagaatg ctaaggttgc 120
cgctttcact tcctctcacc ctttagccca gaactgcttt gaatacacca attgctgtgg 180
ggcggctcga ggaagagaag acaccagtgc ctcagaaact gctcggtcag acggtgatag 240
cgagccacgc attcacaggg ccactgctgc tcacagaagc agtgaggatg atgccaggat 300
gatgtctgcc tcgcgcctgg ctgggactct gatcccagcc atggccttcc tctcctgcgt 360
gagaccagaa agctgggagc cctgcgtgga ggtggttcct aatattactt atcaatgcat 420
ggagctgaat ttctacaaaa tccccgacaa cctccccttc tcaaccaaga acctggacct 480
gagctttaat cccctgaggc atttaggcag ctatagcttc ttcagtttcc cagaactgca 540
ggtgctggat ttatccaggt gtgaaatcca gacaattgaa gatggggcat atcagagcct 600
aagccacctc tctaccttaa tattgacagg aaaccccatc cagagtttag ccctgggagc 660
cttttctgga ctatcaagtt tacagaagct ggtggctgtg gagacaaatc tagcatctct 720
agagaacttc cccattggac atctcaaaac tttgaaagaa cttaatgtgg ctcacaatct 780
tatccaatct ttcaaattac ctgagtattt ttctaatctg accaatctag agcacttgga 840
cctttccagc aacaagattc aaagtattta ttgcacagac ttgcgggttc tacatcaaat 900
gcccctactc aatctctctt tagacctgtc cctgaaccct atgaacttta tccaaccagg 960
tgcatttaaa gaaattaggc ttcataagct gactttaaga aataattttg atagtttaaa 1020
tgtaatgaaa acttgtattc aaggtctggc tggtttagaa gtccatcgtt tggttctggg 1080
agaatttaga aatgaaggaa acttggaaaa gtttgacaaa tctgctctag agggcctgtg 1140
caatttgacc attgaagaat tccgattagc atacttagac tactacctcg atgatattat 1200
tgacttattt aattgtttga caaatgtttc ttcattttcc ctggtgagtg tgactattga 1260
aagggtaaaa gacttttctt ataatttcgg atggcaacat ttagaattag ttaactgtaa 1320
atttggacag tttcccacat tgaaactcaa atctctcaaa aggcttactt tcacttccaa 1380
caaaggtggg aatgcttttt cagaagttga tctaccaagc cttgagtttc tagatctcag 1440
tagaaatggc ttgagtttca aaggttgctg ttctcaaagt gattttggga caaccagcct 1500
aaagtattta gatctgagct tcaatggtgt tattaccatg agttcaaact tcttgggctt 1560
agaacaacta gaacatctgg atttccagca ttccaatttg aaacaaatga gtgagttttc 1620
agtattccta tcactcagaa acctcattta ccttgacatt tctcatactc acaccagagt 1680
tgctttcaat ggcatcttca atggcttgtc cagtctcgaa gtcttgaaaa tggctggcaa 1740
ttctttccag gaaaacttcc ttccagatat cttcacagag ctgagaaact tgaccttcct 1800
ggacctctct cagtgtcaac tggagcagtt gtctccaaca gcatttaact cactctccag 1860
tcttcaggta ctaaatatga gccacaacaa cttcttttca ttggatacgt ttccttataa 1920
gtgtctgaac tccctccagg ttcttgatta cagtctcaat cacataatga cttccaaaaa 1980
acaggaacta cagcattttc caagtagtct agctttctta aatcttactc agaatgactt 2040
tgcttgtact tgtgaacacc agagtttcct gcaatggatc aaggaccaga ggcagctctt 2100
ggtggaagtt gaacgaatgg aatgtgcaac accttcagat aagcagggca tgcctgtgct 2160
gagtttgaat atcacctgtc agatgaataa gaccatcatt ggtgtgtcgg tcctcagtgt 2220
gcttgtagta tctgttgtag cagttctggt ctataagttc tattttcacc tgatgcttct 2280
tgctggctgc ataaagtatg gtagaggtga aaacatctat gatgcctttg ttatctactc 2340
aagccaggat gaggactggg taaggaatga gctagtaaag aatttagaag aaggggtgcc 2400
tccatttcag ctctgccttc actacagaga ctttattccc ggtgtggcca ttgctgccaa 2460
catcatccat gaaggtttcc ataaaagccg aaaggtgatt gttgtggtgt cccagcactt 2520
catccagagc cgctggtgta tctttgaata tgagattgct cagacctggc agtttctgag 2580
cagtcgtgct ggtatcatct tcattgtcct gcagaaggtg gagaagaccc tgctcaggca 2640
gcaggtggag ctgtaccgcc ttctcagcag gaacacttac ctggagtggg aggacagtgt 2700
cctggggcgg cacatcttct ggagacgact cagaaaagcc ctgctggatg gtaaatcatg 2760
gaatccagaa ggaacagtgg gtacaggatg caattggcag gaagcaacat ctatctgaag 2820
aggaaaaata aaaacctcct gaggcatttc ttgcccagct gggtccaaca cttgttcagt 2880
taataagtat taaatgctgc cacatgtcag gccttatgct aagggtgagt aattccatgg 2940
tgcactagat atgcagggct gctaatctca aggagcttcc agtgcagagg gaataaatgc 3000
tagactaaaa tacagagtct tccaggtggg catttcaacc aactcagtca aggaacccat 3060
gacaaagaaa gtcatttcaa ctcttacctc atcaagttga ataaagacag agaaaacaga 3120
aagagacatt gttcttttcc tgagtctttt gaatggaaat tgtattatgt tatagccatc 3180
ataaaaccat tttggtagtt ttgactgaac tgggtgttca ctttttcctt tttgattgaa 3240
tacaatttaa attctacttg atgactgcag tcgtcaaggg gctcctgatg caagatgccc 3300
cttccatttt aagtctgtct ccttacagag gttaaagtct agtggctaat tcctaaggaa 3360
acctgattaa cacatgctca caaccatcct ggtcattctc gagcatgttc tattttttaa 3420
ctaatcaccc ctgatatatt tttattttta tatatccagt tttcattttt ttacgtcttg 3480
cctataagct aatatcataa ataaggttgt ttaagacgtg cttcaaatat ccatattaac 3540
cactattttt caaggaagta tggaaaagta cactctgtca ctttgtcact cgatgtcatt 3600
ccaaagttat tgcctactaa gtaatgactg tcatgaaagc agcattgaaa taatttgttt 3660
aaagggggca ctcttttaaa cgggaagaaa atttccgctt cctggtctta tcatggacaa 3720
tttgggctag aggcaggaag gaagtgggat gacctcagga ggtcaccttt tcttgattcc 3780
agaaacatat gggctgataa acccggggtg acctcatgaa atgagttgca gcagaagttt 3840
atttttttca gaacaagtga tgtttgatgg acctctgaat ctctttaggg agacacagat 3900
ggctgggatc cctcccctgt acccttctca ctgccaggag aactacgtgt gaaggtattc 3960
aaggcaggga gtatacattg ctgtttcctg ttgggcaatg ctccttgacc acattttggg 4020
aagagtggat gttatcattg agaaaacaat gtgtctggaa ttaatggggt tcttataaag 4080
aaggttccca gaaaagaatg ttcatccagc ctcctcagaa acagaacatt caagaaaagg 4140
acaatcagga tgtcatcagg gaaatgaaaa taaaaaccac aatgagatat caccttatac 4200
caggtagaat ggctactata aaaaaatgaa gtgtcatcaa ggatatagag aaattggaac 4260
ccttcttcac tgctggaggg aatggaaaat ggtgtagccg ttatgaaaaa cagtacggag 4320
gtttctcaaa aattaaaaat agaactgcta tatgatccag caatctcact tctgtatata 4380
tacccaaaat aattgaaatc agaatttcaa gaaaatattt acactcccat gttcattgtg 4440
gcactcttca caatcactgt ttccaaagtt atggaaacaa cccaaatttc cattgaaaaa 4500
taaatggaca aagaaaatgt gcatatacgt acaatgggat attattcagc ctaaaaaaag 4560
ggggaatcct gttatttatg acaacatgaa taaacccgga ggccattatg ctatgtaaaa 4620
tgagcaagta acagaaagac aaatactgcc tgatttcatt tatatgaggt tctaaaatag 4680
tcaaactcat agaagcagag aatagaacag tggttcctag ggaaaaggag gaagggagaa 4740
atgaggaaat agggagttgt ctaattggta taaaattata gtatgcaaga tgaattagct 4800
ctaaagatca gctgtatagc agagttcgta taatgaacaa tactgtatta tgcacttaac 4860
attttgttaa gagggtacct ctcatgttaa gtgttcttac catatacata tacacaagga 4920
agcttttgga ggtgatggat atatttatta ccttgattgt ggtgatggtt tgacaggtat 4980
gtgactatgt ctaaactcat caaattgtat acattaaata tatgcagttt tataatatca 5040
attatgtctg aatgaagcta taaaaaagaa aagacaacaa aattcagttg tcaaaactgg 5100
aaatatgacc acagtcagaa gtgtttgtta ctgagtgttt cagagtgtgt ttggtttgag 5160
caggtctagg gtgattgaac atccctgggt gtgtttccat gtctcatgta ctagtgaaag 5220
tagatgtgtg catttgtgca catatcccta tgtatcccta tcagggctgt gtgtatttga 5280
aagtgtgtgt gtccgcatga tcatatctgt atagaagaga gtgtgattat atttcttgaa 5340
gaatacatcc atttgaaatg gatgtctatg gctgtttgag atgagttctc tactcttgtg 5400
cttgtacagt agtctcccct tatcccttat gcttggtgga tacgttctta gaccccaagt 5460
ggatctctga gaccgcagat ggtaccaaac ctcatatatg caatattttt tcctatacat 5520
aaatacctaa gataaagttc atcttctgaa ttaggcacag taagagatta acaataacta 5580
acaataaaat tgaatagtta taataatata ttgtaataaa agttatgtga atgtgatctc 5640
tttctttctc tctctcaaaa t 5661
<210> 274
<211> 839
<212> PRT
<213> Homo sapiens
<400> 274
Met Met Ser Ala Ser Arg Leu Ala Gly Thr Leu Ile Pro Ala Met Ala
1 5 10 15
Phe Leu Ser Cys Val Arg Pro Glu Ser Trp Glu Pro Cys Val Glu Val
20 25 30
Val Pro Asn Ile Thr Tyr Gln Cys Met Glu Leu Asn Phe Tyr Lys Ile
35 40 45
Pro Asp Asn Leu Pro Phe Ser Thr Lys Asn Leu Asp Leu Ser Phe Asn
50 55 60
Pro Leu Arg His Leu Gly Ser Tyr Ser Phe Phe Ser Phe Pro Glu Leu
65 70 75 80
Gln Val Leu Asp Leu Ser Arg Cys Glu Ile Gln Thr Ile Glu Asp Gly
85 90 95
Ala Tyr Gln Ser Leu Ser His Leu Ser Thr Leu Ile Leu Thr Gly Asn
100 105 110
Pro Ile Gln Ser Leu Ala Leu Gly Ala Phe Ser Gly Leu Ser Ser Leu
115 120 125
Gln Lys Leu Val Ala Val Glu Thr Asn Leu Ala Ser Leu Glu Asn Phe
130 135 140
Pro Ile Gly His Leu Lys Thr Leu Lys Glu Leu Asn Val Ala His Asn
145 150 155 160
Leu Ile Gln Ser Phe Lys Leu Pro Glu Tyr Phe Ser Asn Leu Thr Asn
165 170 175
Leu Glu His Leu Asp Leu Ser Ser Asn Lys Ile Gln Ser Ile Tyr Cys
180 185 190
Thr Asp Leu Arg Val Leu His Gln Met Pro Leu Leu Asn Leu Ser Leu
195 200 205
Asp Leu Ser Leu Asn Pro Met Asn Phe Ile Gln Pro Gly Ala Phe Lys
210 215 220
Glu Ile Arg Leu His Lys Leu Thr Leu Arg Asn Asn Phe Asp Ser Leu
225 230 235 240
Asn Val Met Lys Thr Cys Ile Gln Gly Leu Ala Gly Leu Glu Val His
245 250 255
Arg Leu Val Leu Gly Glu Phe Arg Asn Glu Gly Asn Leu Glu Lys Phe
260 265 270
Asp Lys Ser Ala Leu Glu Gly Leu Cys Asn Leu Thr Ile Glu Glu Phe
275 280 285
Arg Leu Ala Tyr Leu Asp Tyr Tyr Leu Asp Asp Ile Ile Asp Leu Phe
290 295 300
Asn Cys Leu Thr Asn Val Ser Ser Phe Ser Leu Val Ser Val Thr Ile
305 310 315 320
Glu Arg Val Lys Asp Phe Ser Tyr Asn Phe Gly Trp Gln His Leu Glu
325 330 335
Leu Val Asn Cys Lys Phe Gly Gln Phe Pro Thr Leu Lys Leu Lys Ser
340 345 350
Leu Lys Arg Leu Thr Phe Thr Ser Asn Lys Gly Gly Asn Ala Phe Ser
355 360 365
Glu Val Asp Leu Pro Ser Leu Glu Phe Leu Asp Leu Ser Arg Asn Gly
370 375 380
Leu Ser Phe Lys Gly Cys Cys Ser Gln Ser Asp Phe Gly Thr Thr Ser
385 390 395 400
Leu Lys Tyr Leu Asp Leu Ser Phe Asn Gly Val Ile Thr Met Ser Ser
405 410 415
Asn Phe Leu Gly Leu Glu Gln Leu Glu His Leu Asp Phe Gln His Ser
420 425 430
Asn Leu Lys Gln Met Ser Glu Phe Ser Val Phe Leu Ser Leu Arg Asn
435 440 445
Leu Ile Tyr Leu Asp Ile Ser His Thr His Thr Arg Val Ala Phe Asn
450 455 460
Gly Ile Phe Asn Gly Leu Ser Ser Leu Glu Val Leu Lys Met Ala Gly
465 470 475 480
Asn Ser Phe Gln Glu Asn Phe Leu Pro Asp Ile Phe Thr Glu Leu Arg
485 490 495
Asn Leu Thr Phe Leu Asp Leu Ser Gln Cys Gln Leu Glu Gln Leu Ser
500 505 510
Pro Thr Ala Phe Asn Ser Leu Ser Ser Leu Gln Val Leu Asn Met Ser
515 520 525
His Asn Asn Phe Phe Ser Leu Asp Thr Phe Pro Tyr Lys Cys Leu Asn
530 535 540
Ser Leu Gln Val Leu Asp Tyr Ser Leu Asn His Ile Met Thr Ser Lys
545 550 555 560
Lys Gln Glu Leu Gln His Phe Pro Ser Ser Leu Ala Phe Leu Asn Leu
565 570 575
Thr Gln Asn Asp Phe Ala Cys Thr Cys Glu His Gln Ser Phe Leu Gln
580 585 590
Trp Ile Lys Asp Gln Arg Gln Leu Leu Val Glu Val Glu Arg Met Glu
595 600 605
Cys Ala Thr Pro Ser Asp Lys Gln Gly Met Pro Val Leu Ser Leu Asn
610 615 620
Ile Thr Cys Gln Met Asn Lys Thr Ile Ile Gly Val Ser Val Leu Ser
625 630 635 640
Val Leu Val Val Ser Val Val Ala Val Leu Val Tyr Lys Phe Tyr Phe
645 650 655
His Leu Met Leu Leu Ala Gly Cys Ile Lys Tyr Gly Arg Gly Glu Asn
660 665 670
Ile Tyr Asp Ala Phe Val Ile Tyr Ser Ser Gln Asp Glu Asp Trp Val
675 680 685
Arg Asn Glu Leu Val Lys Asn Leu Glu Glu Gly Val Pro Pro Phe Gln
690 695 700
Leu Cys Leu His Tyr Arg Asp Phe Ile Pro Gly Val Ala Ile Ala Ala
705 710 715 720
Asn Ile Ile His Glu Gly Phe His Lys Ser Arg Lys Val Ile Val Val
725 730 735
Val Ser Gln His Phe Ile Gln Ser Arg Trp Cys Ile Phe Glu Tyr Glu
740 745 750
Ile Ala Gln Thr Trp Gln Phe Leu Ser Ser Arg Ala Gly Ile Ile Phe
755 760 765
Ile Val Leu Gln Lys Val Glu Lys Thr Leu Leu Arg Gln Gln Val Glu
770 775 780
Leu Tyr Arg Leu Leu Ser Arg Asn Thr Tyr Leu Glu Trp Glu Asp Ser
785 790 795 800
Val Leu Gly Arg His Ile Phe Trp Arg Arg Leu Arg Lys Ala Leu Leu
805 810 815
Asp Gly Lys Ser Trp Asn Pro Glu Gly Thr Val Gly Thr Gly Cys Asn
820 825 830
Trp Gln Glu Ala Thr Ser Ile
835
<210> 275
<211> 4277
<212> ДНК
<213> Homo sapiens
<400> 275
ggttttcagg agcccgagcg agggcgccgc ttttgcgtcc gggaggagcc aaccgtggcg 60
caggcggcgc ggggaggcgt cccagagtct cactctgccg cccaggctgg actgcagtga 120
cacaatctcg gctgactgca accactgcct ccagggttca agcgattctc ttgcctcagc 180
ctcccaagta gctgggatta cagattgatg ttcatgttcc tgacactact acaagattca 240
tactcctgat gctactgaca acgtggcttc tccacagtca ccaaaccagg gatgctatac 300
tggacttccc tactctcatc tgctccagcc ccctgacctt atagttgccc agctttcctg 360
gcaattgact ttgcccatca atacacagga tttagcatcc agggaagatg tcggagcctc 420
agatgttaat tttctaattg agaatgttgg cgctgtccga acctggagac aggaaaacaa 480
aaagtccttt ctcctgattc accaaaaaat aaaatactga ctaccatcac tgtgatgaga 540
ttcctatagt ctcaggaact gaagtcttta aacaaccagg gaccctctgc ccctagaata 600
agaacatact agaagtccct tctgctagga caacgaggat catgggagac cacctggacc 660
ttctcctagg agtggtgctc atggccggtc ctgtgtttgg aattccttcc tgctcctttg 720
atggccgaat agccttttat cgtttctgca acctcaccca ggtcccccag gtcctcaaca 780
ccactgagag gctcctgctg agcttcaact atatcaggac agtcactgct tcatccttcc 840
cctttctgga acagctgcag ctgctggagc tcgggagcca gtataccccc ttgactattg 900
acaaggaggc cttcagaaac ctgcccaacc ttagaatctt ggacctggga agtagtaaga 960
tatacttctt gcatccagat gcttttcagg gactgttcca tctgtttgaa cttagactgt 1020
atttctgtgg tctctctgat gctgtattga aagatggtta tttcagaaat ttaaaggctt 1080
taactcgctt ggatctatcc aaaaatcaga ttcgtagcct ttaccttcat ccttcatttg 1140
ggaagttgaa ttccttaaag tccatagatt tttcctccaa ccaaatattc cttgtatgtg 1200
aacatgagct cgagccccta caagggaaaa cgctctcctt ttttagcctc gcagctaata 1260
gcttgtatag cagagtctca gtggactggg gaaaatgtat gaacccattc agaaacatgg 1320
tgctggagat actagatgtt tctggaaatg gctggacagt ggacatcaca ggaaacttta 1380
gcaatgccat cagcaaaagc caggccttct ctttgattct tgcccaccac atcatgggtg 1440
ccgggtttgg cttccataac atcaaagatc ctgaccagaa cacatttgct ggcctggcca 1500
gaagttcagt gagacacctg gatctttcac atgggtttgt cttctccctg aactcacgag 1560
tctttgagac actcaaggat ttgaaggttc tgaaccttgc ctacaacaag ataaataaga 1620
ttgcagatga agcattttac ggacttgaca acctccaagt tctcaatttg tcatataacc 1680
ttctggggga actttacagt tcgaatttct atggactacc taaggtagcc tacattgatt 1740
tgcaaaagaa tcacattgca ataattcaag accaaacatt caaattcctg gaaaaattac 1800
agaccttgga tctccgagac aatgctctta caaccattca ttttattcca agcatacccg 1860
atatcttctt gagtggcaat aaactagtga ctttgccaaa gatcaacctt acagcgaacc 1920
tcatccactt atcagaaaac aggctagaaa atctagatat tctctacttt ctcctacggg 1980
tacctcatct ccagattctc attttaaatc aaaatcgctt ctcctcctgt agtggagatc 2040
aaaccccttc agagaatccc agcttagaac agcttttcct tggagaaaat atgttgcaac 2100
ttgcctggga aactgagctc tgttgggatg tttttgaggg actttctcat cttcaagttc 2160
tgtatttgaa tcataactat cttaattccc ttccaccagg agtatttagc catctgactg 2220
cattaagggg actaagcctc aactccaaca ggctgacagt tctttctcac aatgatttac 2280
ctgctaattt agagatcctg gacatatcca ggaaccagct cctagctcct aatcctgatg 2340
tatttgtatc acttagtgtc ttggatataa ctcataacaa gttcatttgt gaatgtgaac 2400
ttagcacttt tatcaattgg cttaatcaca ccaatgtcac tatagctggg cctcctgcag 2460
acatatattg tgtgtaccct gactcgttct ctggggtttc cctcttctct ctttccacgg 2520
aaggttgtga tgaagaggaa gtcttaaagt ccctaaagtt ctcccttttc attgtatgca 2580
ctgtcactct gactctgttc ctcatgacca tcctcacagt cacaaagttc cggggcttct 2640
gttttatctg ttataagaca gcccagagac tggtgttcaa ggaccatccc cagggcacag 2700
aacctgatat gtacaaatat gatgcctatt tgtgcttcag cagcaaagac ttcacatggg 2760
tgcagaatgc tttgctcaaa cacctggaca ctcaatacag tgaccaaaac agattcaacc 2820
tgtgctttga agaaagagac tttgtcccag gagaaaaccg cattgccaat atccaggatg 2880
ccatctggaa cagtagaaag atcgtttgtc ttgtgagcag acacttcctt agagatggct 2940
ggtgccttga agccttcagt tatgcccagg gcaggtgctt atctgacctt aacagtgctc 3000
tcatcatggt ggtggttggg tccttgtccc agtaccagtt gatgaaacat caatccatca 3060
gaggctttgt acagaaacag cagtatttga ggtggcctga ggatctccag gatgttggct 3120
ggtttcttca taaactctct caacagatac taaagaaaga aaaagaaaag aagaaagaca 3180
ataacattcc gttgcaaact gtagcaacca tctcctaatc aaaggagcaa tttccaactt 3240
atctcaagcc acaaataact cttcactttg tatttgcacc aagttatcat tttggggtcc 3300
tctctggagg tttttttttt ctttttgcta ctatgaaaac aacataaatc tctcaatttt 3360
cgtatcaaca ccatgttctg tctcactaac ctccaaatgg aaaataatag atctagaaaa 3420
ttgcaactgc ccttagaggt ttccagtctc cattgatttt ctttcagatc caataatacc 3480
gttctgtcct gctgtgttga ttatggaatg tatcctaatc atgggaaggg caccttggga 3540
gaagttgcag atggctgacg tgctttctct agcattcagc taaaaaatgg gatggtccat 3600
gattctgcgt tctctgtgtt ctgcaaaaca acattaagta gaaaacaaac agaagcagag 3660
gcacatttcc ttcttttgcc acagaaacaa tgccactgtt gagtgcaagt cacactttgt 3720
ctcatagata agaggtggcc ccaaagaagc tgggatgaat gagtcactac ctgtcttgtg 3780
actgtactgc acttcatgtt cttaccttcg gcttctccag gtctcgccct agtgagccaa 3840
gaactttctc tcacatgctg cctttattta agcctggcct tcaagacctt ccatgattta 3900
tcaccaacct accttttcag ctttgtttcc tagcacacct cattgatcag ctgctcaggc 3960
tgttgcatga agaacatgga ctttgcacac agatcctggg ttgagttctg agtcagctgt 4020
gtattagcca tgtaaccttg gccttggtat gcccttgctg gacctacatt ttctcacgta 4080
acagcatcta tgtcatagaa ttcctgtgaa aattaaattg gccaaggatg tcagggcttc 4140
tcagatcttt tccttcgttg ccctaatgac cacaagagaa cacatacact gaaggcctcc 4200
tggggggcag ttgcaatttc actgaagttg tattttttta tcttaaatga aatctatgtg 4260
tattttcaaa aaaaaaa 4277
<210> 276
<211> 858
<212> PRT
<213> Homo sapiens
<400> 276
Met Gly Asp His Leu Asp Leu Leu Leu Gly Val Val Leu Met Ala Gly
1 5 10 15
Pro Val Phe Gly Ile Pro Ser Cys Ser Phe Asp Gly Arg Ile Ala Phe
20 25 30
Tyr Arg Phe Cys Asn Leu Thr Gln Val Pro Gln Val Leu Asn Thr Thr
35 40 45
Glu Arg Leu Leu Leu Ser Phe Asn Tyr Ile Arg Thr Val Thr Ala Ser
50 55 60
Ser Phe Pro Phe Leu Glu Gln Leu Gln Leu Leu Glu Leu Gly Ser Gln
65 70 75 80
Tyr Thr Pro Leu Thr Ile Asp Lys Glu Ala Phe Arg Asn Leu Pro Asn
85 90 95
Leu Arg Ile Leu Asp Leu Gly Ser Ser Lys Ile Tyr Phe Leu His Pro
100 105 110
Asp Ala Phe Gln Gly Leu Phe His Leu Phe Glu Leu Arg Leu Tyr Phe
115 120 125
Cys Gly Leu Ser Asp Ala Val Leu Lys Asp Gly Tyr Phe Arg Asn Leu
130 135 140
Lys Ala Leu Thr Arg Leu Asp Leu Ser Lys Asn Gln Ile Arg Ser Leu
145 150 155 160
Tyr Leu His Pro Ser Phe Gly Lys Leu Asn Ser Leu Lys Ser Ile Asp
165 170 175
Phe Ser Ser Asn Gln Ile Phe Leu Val Cys Glu His Glu Leu Glu Pro
180 185 190
Leu Gln Gly Lys Thr Leu Ser Phe Phe Ser Leu Ala Ala Asn Ser Leu
195 200 205
Tyr Ser Arg Val Ser Val Asp Trp Gly Lys Cys Met Asn Pro Phe Arg
210 215 220
Asn Met Val Leu Glu Ile Leu Asp Val Ser Gly Asn Gly Trp Thr Val
225 230 235 240
Asp Ile Thr Gly Asn Phe Ser Asn Ala Ile Ser Lys Ser Gln Ala Phe
245 250 255
Ser Leu Ile Leu Ala His His Ile Met Gly Ala Gly Phe Gly Phe His
260 265 270
Asn Ile Lys Asp Pro Asp Gln Asn Thr Phe Ala Gly Leu Ala Arg Ser
275 280 285
Ser Val Arg His Leu Asp Leu Ser His Gly Phe Val Phe Ser Leu Asn
290 295 300
Ser Arg Val Phe Glu Thr Leu Lys Asp Leu Lys Val Leu Asn Leu Ala
305 310 315 320
Tyr Asn Lys Ile Asn Lys Ile Ala Asp Glu Ala Phe Tyr Gly Leu Asp
325 330 335
Asn Leu Gln Val Leu Asn Leu Ser Tyr Asn Leu Leu Gly Glu Leu Tyr
340 345 350
Ser Ser Asn Phe Tyr Gly Leu Pro Lys Val Ala Tyr Ile Asp Leu Gln
355 360 365
Lys Asn His Ile Ala Ile Ile Gln Asp Gln Thr Phe Lys Phe Leu Glu
370 375 380
Lys Leu Gln Thr Leu Asp Leu Arg Asp Asn Ala Leu Thr Thr Ile His
385 390 395 400
Phe Ile Pro Ser Ile Pro Asp Ile Phe Leu Ser Gly Asn Lys Leu Val
405 410 415
Thr Leu Pro Lys Ile Asn Leu Thr Ala Asn Leu Ile His Leu Ser Glu
420 425 430
Asn Arg Leu Glu Asn Leu Asp Ile Leu Tyr Phe Leu Leu Arg Val Pro
435 440 445
His Leu Gln Ile Leu Ile Leu Asn Gln Asn Arg Phe Ser Ser Cys Ser
450 455 460
Gly Asp Gln Thr Pro Ser Glu Asn Pro Ser Leu Glu Gln Leu Phe Leu
465 470 475 480
Gly Glu Asn Met Leu Gln Leu Ala Trp Glu Thr Glu Leu Cys Trp Asp
485 490 495
Val Phe Glu Gly Leu Ser His Leu Gln Val Leu Tyr Leu Asn His Asn
500 505 510
Tyr Leu Asn Ser Leu Pro Pro Gly Val Phe Ser His Leu Thr Ala Leu
515 520 525
Arg Gly Leu Ser Leu Asn Ser Asn Arg Leu Thr Val Leu Ser His Asn
530 535 540
Asp Leu Pro Ala Asn Leu Glu Ile Leu Asp Ile Ser Arg Asn Gln Leu
545 550 555 560
Leu Ala Pro Asn Pro Asp Val Phe Val Ser Leu Ser Val Leu Asp Ile
565 570 575
Thr His Asn Lys Phe Ile Cys Glu Cys Glu Leu Ser Thr Phe Ile Asn
580 585 590
Trp Leu Asn His Thr Asn Val Thr Ile Ala Gly Pro Pro Ala Asp Ile
595 600 605
Tyr Cys Val Tyr Pro Asp Ser Phe Ser Gly Val Ser Leu Phe Ser Leu
610 615 620
Ser Thr Glu Gly Cys Asp Glu Glu Glu Val Leu Lys Ser Leu Lys Phe
625 630 635 640
Ser Leu Phe Ile Val Cys Thr Val Thr Leu Thr Leu Phe Leu Met Thr
645 650 655
Ile Leu Thr Val Thr Lys Phe Arg Gly Phe Cys Phe Ile Cys Tyr Lys
660 665 670
Thr Ala Gln Arg Leu Val Phe Lys Asp His Pro Gln Gly Thr Glu Pro
675 680 685
Asp Met Tyr Lys Tyr Asp Ala Tyr Leu Cys Phe Ser Ser Lys Asp Phe
690 695 700
Thr Trp Val Gln Asn Ala Leu Leu Lys His Leu Asp Thr Gln Tyr Ser
705 710 715 720
Asp Gln Asn Arg Phe Asn Leu Cys Phe Glu Glu Arg Asp Phe Val Pro
725 730 735
Gly Glu Asn Arg Ile Ala Asn Ile Gln Asp Ala Ile Trp Asn Ser Arg
740 745 750
Lys Ile Val Cys Leu Val Ser Arg His Phe Leu Arg Asp Gly Trp Cys
755 760 765
Leu Glu Ala Phe Ser Tyr Ala Gln Gly Arg Cys Leu Ser Asp Leu Asn
770 775 780
Ser Ala Leu Ile Met Val Val Val Gly Ser Leu Ser Gln Tyr Gln Leu
785 790 795 800
Met Lys His Gln Ser Ile Arg Gly Phe Val Gln Lys Gln Gln Tyr Leu
805 810 815
Arg Trp Pro Glu Asp Leu Gln Asp Val Gly Trp Phe Leu His Lys Leu
820 825 830
Ser Gln Gln Ile Leu Lys Lys Glu Lys Glu Lys Lys Lys Asp Asn Asn
835 840 845
Ile Pro Leu Gln Thr Val Ala Thr Ile Ser
850 855
<210> 277
<211> 5891
<212> ДНК
<213> Homo sapiens
<400> 277
aattgtattt ccgttcattt acaagttatt ttctcttctt ctgaaaaaga gatcttgaat 60
ttggactcat atcaagatgc tctgaagaag aacaaccctt taggatagcc actgcaacat 120
catgaccaaa gacaaagaac ctattgttaa aagcttccat tttgtttgcc ttatgatcat 180
aatagttgga accagaatcc agttctccga cggaaatgaa tttgcagtag acaagtcaaa 240
aagaggtctt attcatgttc caaaagacct accgctgaaa accaaagtct tagatatgtc 300
tcagaactac atcgctgagc ttcaggtctc tgacatgagc tttctatcag agttgacagt 360
tttgagactt tcccataaca gaatccagct acttgattta agtgttttca agttcaacca 420
ggatttagaa tatttggatt tatctcataa tcagttgcaa aagatatcct gccatcctat 480
tgtgagtttc aggcatttag atctctcatt caatgatttc aaggccctgc ccatctgtaa 540
ggaatttggc aacttatcac aactgaattt cttgggattg agtgctatga agctgcaaaa 600
attagatttg ctgccaattg ctcacttgca tctaagttat atccttctgg atttaagaaa 660
ttattatata aaagaaaatg agacagaaag tctacaaatt ctgaatgcaa aaacccttca 720
ccttgttttt cacccaacta gtttattcgc tatccaagtg aacatatcag ttaatacttt 780
agggtgctta caactgacta atattaaatt gaatgatgac aactgtcaag ttttcattaa 840
atttttatca gaactcacca gaggttcaac cttactgaat tttaccctca accacataga 900
aacgacttgg aaatgcctgg tcagagtctt tcaatttctt tggcccaaac ctgtggaata 960
tctcaatatt tacaatttaa caataattga aagcattcgt gaagaagatt ttacttattc 1020
taaaacgaca ttgaaagcat tgacaataga acatatcacg aaccaagttt ttctgttttc 1080
acagacagct ttgtacaccg tgttttctga gatgaacatt atgatgttaa ccatttcaga 1140
tacacctttt atacacatgc tgtgtcctca tgcaccaagc acattcaagt ttttgaactt 1200
tacccagaac gttttcacag atagtatttt tgaaaaatgt tccacgttag ttaaattgga 1260
gacacttatc ttacaaaaga atggattaaa agaccttttc aaagtaggtc tcatgacgaa 1320
ggatatgcct tctttggaaa tactggatgt tagctggaat tctttggaat ctggtagaca 1380
taaagaaaac tgcacttggg ttgagagtat agtggtgtta aatttgtctt caaatatgct 1440
tactgactct gttttcagat gtttacctcc caggatcaag gtacttgatc ttcacagcaa 1500
taaaataaag agcgttccta aacaagtcgt aaaactggaa gctttgcaag aactcaatgt 1560
tgctttcaat tctttaactg accttcctgg atgtggcagc tttagcagcc tttctgtatt 1620
gatcattgat cacaattcag tttcccaccc atcggctgat ttcttccaga gctgccagaa 1680
gatgaggtca ataaaagcag gggacaatcc attccaatgt acctgtgagc taagagaatt 1740
tgtcaaaaat atagaccaag tatcaagtga agtgttagag ggctggcctg attcttataa 1800
gtgtgactac ccagaaagtt atagaggaag cccactaaag gactttcaca tgtctgaatt 1860
atcctgcaac ataactctgc tgatcgtcac catcggtgcc accatgctgg tgttggctgt 1920
gactgtgacc tccctctgca tctacttgga tctgccctgg tatctcagga tggtgtgcca 1980
gtggacccag actcggcgca gggccaggaa cataccctta gaagaactcc aaagaaacct 2040
ccagtttcat gcttttattt catatagtga acatgattct gcctgggtga aaagtgaatt 2100
ggtaccttac ctagaaaaag aagatataca gatttgtctt catgagagaa actttgtccc 2160
tggcaagagc attgtggaaa atatcatcaa ctgcattgag aagagttaca agtccatctt 2220
tgttttgtct cccaactttg tccagagtga gtggtgccat tacgaactct attttgccca 2280
tcacaatctc tttcatgaag gatctaataa cttaatcctc atcttactgg aacccattcc 2340
acagaacagc attcccaaca agtaccacaa gctgaaggct ctcatgacgc agcggactta 2400
tttgcagtgg cccaaggaga aaagcaaacg tgggctcttt tgggctaaca ttagagccgc 2460
ttttaatatg aaattaacac tagtcactga aaacaatgat gtgaaatctt aaaaaaattt 2520
aggaaattca acttaagaaa ccattattta cttggatgat ggtgaatagt acagtcgtaa 2580
gtaactgtct ggaggtgcct ccattatcct catgccttca ggaaagactt aacaaaaaca 2640
atgtttcatc tggggaactg agctaggcgg tgaggttagc ctgccagtta gagacagccc 2700
agtctcttct ggtttaatca ttatgtttca aattgaaaca gtctcttttg agtaaatgct 2760
cagtttttca gctcctctcc actctgcttt cccaaatgga ttctgttgtg agcaagagtt 2820
tatatggctt catggcagca agggaacagt caacttcagc atcatatgca ccagtcctcg 2880
gagtgccctg tgaatcatat tggtctttgg gtcagtgtca tcattctctt caagtctggg 2940
gcttggggaa aaaattagat cagctacggc atataaaaaa gtcttttgtt tcacatatgt 3000
gtaatagctt atttaatttt ttatcctgct acacaaatat gtaattaacc aatgaggact 3060
catgacttga tagtgtatgt atgtaaaggg atatatggac ttaatcataa gctgttgagg 3120
tgaaagacgt ggatccacct gctttccaag aaaactcggc caaatttatt tgcagctgga 3180
tattgaatgg gacttttctg gttgtcttag aattctggct aaaggctcaa agctgacgaa 3240
agacagtaac tgcaccaaca tgatactaga cacagccagt ctggacttat caaaagagca 3300
gaaagagacc aatgactccc agtccgtatt atccatctct agaagactag agtcaaaagc 3360
gtgattaaag agtcattaag cggaggttct aggccatagg gagattgctt tgaatttctt 3420
gcagacaagt gtgagggact cagcatggta gaaggtagcc tggcatccca ctccaagact 3480
gaaagcttgc agagtaacag gagcacacag gttcagtgca gcagatgtgg tgtggcttga 3540
gaattcttgg aagagcttga tgagtgtttg ctggagtccg agggtgggca ctgggaacac 3600
agagactggt aaatagtgtt tggcaaatac aagtgcttga tgaatatttg ttgaatgaat 3660
agatgagttc ttcccccctg gggaattcag gaggtgaaag gttggcttga gcacccaaaa 3720
tggcaggatg agagaagaga agcactgata gcaacctgcc ctcccattat tgacatggta 3780
aaaggatgtg aatttcttca catggctttg actatggaag agtagctggg cttgcattgt 3840
catgacggga tatcagccaa cagggtagcc tgttgtgcaa agaaactata gcagtaagag 3900
gacacggggt taggcagaag aggggtttgg ggtggaggtt gctgcaagag gtcagccaga 3960
taatgtggcc ctgcatcatg gaactgtgca atgtggggta cactcaaggc cctccaataa 4020
ctcacagatg tgccctatga aaaagccagc atttggactc tgccatagca gctggcagga 4080
tcatgctggc ctgtctgcct tattcaatag ttaactacag gaagatctgc tcctctttgt 4140
gtaataccct cttcccttgc aatggcatag ggacatctag aatatagaga agacagagac 4200
aatggaggaa gagtaaagaa actgactata tgccttcgtc atttcactgc aaggaaggcc 4260
aagcagattt ttgaatgagg tgtgagattg ctgttaaatt ggactggcct ggacatttta 4320
atcccttaaa tagaggtgca atgactaaag tgagatttgt cactaaaatt tatggtatct 4380
gcccaagatt caggagtgat gatgggagga gatccaacag aactttgttg taaggcaatg 4440
gttagagaaa aatgaagccc tcgctttctg gacttagttc attcaataaa ccagtttcgg 4500
ccaggcacgt tggctcacat ctataatccc agtactgtgg gaggctgagg caggtggatc 4560
acttgaggtc aggagttcga gaccagcctg gccaacatgg tgaaaccctg tctgtactaa 4620
aaatacaaaa attagccggg tgtggtggtg tgcacctgta gtcccagcta ctcgggaggc 4680
tgaggcagga aaatcacttg aacctgggag acagaggctg tagtgagctg agacagcgct 4740
actgtactcc ccgctgggca acagagtgag actccatctc aaaaaagtta aaagaaaaaa 4800
aatctggttt cataatagct gtaacgaaat aagccttaat gatattttat tagcatcatc 4860
ttctgtctgc attagccctt ccttgctctt caggagaaca acatttgttt tcctccctag 4920
gctctatccc aaacggcaca ttcttccaca acccctgttg aacagatttt ttaaactgtt 4980
gcctaatcta aaaacaataa aaacaacaaa caaccacagt aacaacaacg acaaaaaaaa 5040
ctgccacaga ttctaaataa tcagatcttt ttaaatggta tcaatgtttc ccacaaaata 5100
ttgttgacat tgaaaatata gaattttagc attaattttg ttaaacctac atcccctcgg 5160
cagaggggcc tccctgcatc ccagtggaaa gtaggttcct cacagtcctc tccgtcacat 5220
tcttcccatt tcttttcttc acagaacaca tcactgtcta aaattatctt gtttgcttag 5280
ttgcttactc atcttcttct tctctcctct gaagtctaag ctccaggaaa aagggagact 5340
tctccacctg ttccctgcct ctccccagtg ccgaggggac actgtgcacc ccattgtaga 5400
tgcgcagtaa aaactcgtgg gatgagcaaa tgactctgaa acggtcccat gcgggaaatg 5460
tccatgaagt cctggatttt atctaaaaag cccaggcagg ggggggcggg ggcggcgggg 5520
ctacagttcc acgctgagct gcctcctggc cgctcgtccc cgccgcagtg cctgggcggc 5580
ccgggcgccc gaccttggcc gtggacacct tcgcggtggg tgctgctcct ccccatctgc 5640
cactggaaga tgctggggcg acccggctcc aggtttagca ggacactgag aaaagggaat 5700
ggctgccttt cggaggctgg gtgagccctt ctctgtgcct cacctgcccg ccccacagcg 5760
gccctgcacc tcgtcccacg gggcccattg ccccggtagg atgcgcgctt ttgttttgag 5820
ggtcaggcat cttccctgcc gtcgtttctg ggaggttgaa aaattgatcc agaaagacct 5880
aaaacaaaaa a 5891
<210> 278
<211> 796
<212> PRT
<213> Homo sapiens
<400> 278
Met Thr Lys Asp Lys Glu Pro Ile Val Lys Ser Phe His Phe Val Cys
1 5 10 15
Leu Met Ile Ile Ile Val Gly Thr Arg Ile Gln Phe Ser Asp Gly Asn
20 25 30
Glu Phe Ala Val Asp Lys Ser Lys Arg Gly Leu Ile His Val Pro Lys
35 40 45
Asp Leu Pro Leu Lys Thr Lys Val Leu Asp Met Ser Gln Asn Tyr Ile
50 55 60
Ala Glu Leu Gln Val Ser Asp Met Ser Phe Leu Ser Glu Leu Thr Val
65 70 75 80
Leu Arg Leu Ser His Asn Arg Ile Gln Leu Leu Asp Leu Ser Val Phe
85 90 95
Lys Phe Asn Gln Asp Leu Glu Tyr Leu Asp Leu Ser His Asn Gln Leu
100 105 110
Gln Lys Ile Ser Cys His Pro Ile Val Ser Phe Arg His Leu Asp Leu
115 120 125
Ser Phe Asn Asp Phe Lys Ala Leu Pro Ile Cys Lys Glu Phe Gly Asn
130 135 140
Leu Ser Gln Leu Asn Phe Leu Gly Leu Ser Ala Met Lys Leu Gln Lys
145 150 155 160
Leu Asp Leu Leu Pro Ile Ala His Leu His Leu Ser Tyr Ile Leu Leu
165 170 175
Asp Leu Arg Asn Tyr Tyr Ile Lys Glu Asn Glu Thr Glu Ser Leu Gln
180 185 190
Ile Leu Asn Ala Lys Thr Leu His Leu Val Phe His Pro Thr Ser Leu
195 200 205
Phe Ala Ile Gln Val Asn Ile Ser Val Asn Thr Leu Gly Cys Leu Gln
210 215 220
Leu Thr Asn Ile Lys Leu Asn Asp Asp Asn Cys Gln Val Phe Ile Lys
225 230 235 240
Phe Leu Ser Glu Leu Thr Arg Gly Ser Thr Leu Leu Asn Phe Thr Leu
245 250 255
Asn His Ile Glu Thr Thr Trp Lys Cys Leu Val Arg Val Phe Gln Phe
260 265 270
Leu Trp Pro Lys Pro Val Glu Tyr Leu Asn Ile Tyr Asn Leu Thr Ile
275 280 285
Ile Glu Ser Ile Arg Glu Glu Asp Phe Thr Tyr Ser Lys Thr Thr Leu
290 295 300
Lys Ala Leu Thr Ile Glu His Ile Thr Asn Gln Val Phe Leu Phe Ser
305 310 315 320
Gln Thr Ala Leu Tyr Thr Val Phe Ser Glu Met Asn Ile Met Met Leu
325 330 335
Thr Ile Ser Asp Thr Pro Phe Ile His Met Leu Cys Pro His Ala Pro
340 345 350
Ser Thr Phe Lys Phe Leu Asn Phe Thr Gln Asn Val Phe Thr Asp Ser
355 360 365
Ile Phe Glu Lys Cys Ser Thr Leu Val Lys Leu Glu Thr Leu Ile Leu
370 375 380
Gln Lys Asn Gly Leu Lys Asp Leu Phe Lys Val Gly Leu Met Thr Lys
385 390 395 400
Asp Met Pro Ser Leu Glu Ile Leu Asp Val Ser Trp Asn Ser Leu Glu
405 410 415
Ser Gly Arg His Lys Glu Asn Cys Thr Trp Val Glu Ser Ile Val Val
420 425 430
Leu Asn Leu Ser Ser Asn Met Leu Thr Asp Ser Val Phe Arg Cys Leu
435 440 445
Pro Pro Arg Ile Lys Val Leu Asp Leu His Ser Asn Lys Ile Lys Ser
450 455 460
Val Pro Lys Gln Val Val Lys Leu Glu Ala Leu Gln Glu Leu Asn Val
465 470 475 480
Ala Phe Asn Ser Leu Thr Asp Leu Pro Gly Cys Gly Ser Phe Ser Ser
485 490 495
Leu Ser Val Leu Ile Ile Asp His Asn Ser Val Ser His Pro Ser Ala
500 505 510
Asp Phe Phe Gln Ser Cys Gln Lys Met Arg Ser Ile Lys Ala Gly Asp
515 520 525
Asn Pro Phe Gln Cys Thr Cys Glu Leu Arg Glu Phe Val Lys Asn Ile
530 535 540
Asp Gln Val Ser Ser Glu Val Leu Glu Gly Trp Pro Asp Ser Tyr Lys
545 550 555 560
Cys Asp Tyr Pro Glu Ser Tyr Arg Gly Ser Pro Leu Lys Asp Phe His
565 570 575
Met Ser Glu Leu Ser Cys Asn Ile Thr Leu Leu Ile Val Thr Ile Gly
580 585 590
Ala Thr Met Leu Val Leu Ala Val Thr Val Thr Ser Leu Cys Ile Tyr
595 600 605
Leu Asp Leu Pro Trp Tyr Leu Arg Met Val Cys Gln Trp Thr Gln Thr
610 615 620
Arg Arg Arg Ala Arg Asn Ile Pro Leu Glu Glu Leu Gln Arg Asn Leu
625 630 635 640
Gln Phe His Ala Phe Ile Ser Tyr Ser Glu His Asp Ser Ala Trp Val
645 650 655
Lys Ser Glu Leu Val Pro Tyr Leu Glu Lys Glu Asp Ile Gln Ile Cys
660 665 670
Leu His Glu Arg Asn Phe Val Pro Gly Lys Ser Ile Val Glu Asn Ile
675 680 685
Ile Asn Cys Ile Glu Lys Ser Tyr Lys Ser Ile Phe Val Leu Ser Pro
690 695 700
Asn Phe Val Gln Ser Glu Trp Cys His Tyr Glu Leu Tyr Phe Ala His
705 710 715 720
His Asn Leu Phe His Glu Gly Ser Asn Asn Leu Ile Leu Ile Leu Leu
725 730 735
Glu Pro Ile Pro Gln Asn Ser Ile Pro Asn Lys Tyr His Lys Leu Lys
740 745 750
Ala Leu Met Thr Gln Arg Thr Tyr Leu Gln Trp Pro Lys Glu Lys Ser
755 760 765
Lys Arg Gly Leu Phe Trp Ala Asn Ile Arg Ala Ala Phe Asn Met Lys
770 775 780
Leu Thr Leu Val Thr Glu Asn Asn Asp Val Lys Ser
785 790 795
<210> 279
<211> 4992
<212> ДНК
<213> Homo sapiens
<400> 279
gaagactcca gatataggat cactccatgc catcaagaaa gttgatgcta ttgggcccat 60
ctcaagctga tcttggcacc tctcatgctc tgctctcttc aaccagacct ctacattcca 120
ttttggaaga agactaaaaa tggtgtttcc aatgtggaca ctgaagagac aaattcttat 180
cctttttaac ataatcctaa tttccaaact ccttggggct agatggtttc ctaaaactct 240
gccctgtgat gtcactctgg atgttccaaa gaaccatgtg atcgtggact gcacagacaa 300
gcatttgaca gaaattcctg gaggtattcc cacgaacacc acgaacctca ccctcaccat 360
taaccacata ccagacatct ccccagcgtc ctttcacaga ctggaccatc tggtagagat 420
cgatttcaga tgcaactgtg tacctattcc actggggtca aaaaacaaca tgtgcatcaa 480
gaggctgcag attaaaccca gaagctttag tggactcact tatttaaaat ccctttacct 540
ggatggaaac cagctactag agataccgca gggcctcccg cctagcttac agcttctcag 600
ccttgaggcc aacaacatct tttccatcag aaaagagaat ctaacagaac tggccaacat 660
agaaatactc tacctgggcc aaaactgtta ttatcgaaat ccttgttatg tttcatattc 720
aatagagaaa gatgccttcc taaacttgac aaagttaaaa gtgctctccc tgaaagataa 780
caatgtcaca gccgtcccta ctgttttgcc atctacttta acagaactat atctctacaa 840
caacatgatt gcaaaaatcc aagaagatga ttttaataac ctcaaccaat tacaaattct 900
tgacctaagt ggaaattgcc ctcgttgtta taatgcccca tttccttgtg cgccgtgtaa 960
aaataattct cccctacaga tccctgtaaa tgcttttgat gcgctgacag aattaaaagt 1020
tttacgtcta cacagtaact ctcttcagca tgtgccccca agatggttta agaacatcaa 1080
caaactccag gaactggatc tgtcccaaaa cttcttggcc aaagaaattg gggatgctaa 1140
atttctgcat tttctcccca gcctcatcca attggatctg tctttcaatt ttgaacttca 1200
ggtctatcgt gcatctatga atctatcaca agcattttct tcactgaaaa gcctgaaaat 1260
tctgcggatc agaggatatg tctttaaaga gttgaaaagc tttaacctct cgccattaca 1320
taatcttcaa aatcttgaag ttcttgatct tggcactaac tttataaaaa ttgctaacct 1380
cagcatgttt aaacaattta aaagactgaa agtcatagat ctttcagtga ataaaatatc 1440
accttcagga gattcaagtg aagttggctt ctgctcaaat gccagaactt ctgtagaaag 1500
ttatgaaccc caggtcctgg aacaattaca ttatttcaga tatgataagt atgcaaggag 1560
ttgcagattc aaaaacaaag aggcttcttt catgtctgtt aatgaaagct gctacaagta 1620
tgggcagacc ttggatctaa gtaaaaatag tatatttttt gtcaagtcct ctgattttca 1680
gcatctttct ttcctcaaat gcctgaatct gtcaggaaat ctcattagcc aaactcttaa 1740
tggcagtgaa ttccaacctt tagcagagct gagatatttg gacttctcca acaaccggct 1800
tgatttactc cattcaacag catttgaaga gcttcacaaa ctggaagttc tggatataag 1860
cagtaatagc cattattttc aatcagaagg aattactcat atgctaaact ttaccaagaa 1920
cctaaaggtt ctgcagaaac tgatgatgaa cgacaatgac atctcttcct ccaccagcag 1980
gaccatggag agtgagtctc ttagaactct ggaattcaga ggaaatcact tagatgtttt 2040
atggagagaa ggtgataaca gatacttaca attattcaag aatctgctaa aattagagga 2100
attagacatc tctaaaaatt ccctaagttt cttgccttct ggagtttttg atggtatgcc 2160
tccaaatcta aagaatctct ctttggccaa aaatgggctc aaatctttca gttggaagaa 2220
actccagtgt ctaaagaacc tggaaacttt ggacctcagc cacaaccaac tgaccactgt 2280
ccctgagaga ttatccaact gttccagaag cctcaagaat ctgattctta agaataatca 2340
aatcaggagt ctgacgaagt attttctaca agatgccttc cagttgcgat atctggatct 2400
cagctcaaat aaaatccaga tgatccaaaa gaccagcttc ccagaaaatg tcctcaacaa 2460
tctgaagatg ttgcttttgc atcataatcg gtttctgtgc acctgtgatg ctgtgtggtt 2520
tgtctggtgg gttaaccata cggaggtgac tattccttac ctggccacag atgtgacttg 2580
tgtggggcca ggagcacaca agggccaaag tgtgatctcc ctggatctgt acacctgtga 2640
gttagatctg actaacctga ttctgttctc actttccata tctgtatctc tctttctcat 2700
ggtgatgatg acagcaagtc acctctattt ctgggatgtg tggtatattt accatttctg 2760
taaggccaag ataaaggggt atcagcgtct aatatcacca gactgttgct atgatgcttt 2820
tattgtgtat gacactaaag acccagctgt gaccgagtgg gttttggctg agctggtggc 2880
caaactggaa gacccaagag agaaacattt taatttatgt ctcgaggaaa gggactggtt 2940
accagggcag ccagttctgg aaaacctttc ccagagcata cagcttagca aaaagacagt 3000
gtttgtgatg acagacaagt atgcaaagac tgaaaatttt aagatagcat tttacttgtc 3060
ccatcagagg ctcatggatg aaaaagttga tgtgattatc ttgatatttc ttgagaagcc 3120
ctttcagaag tccaagttcc tccagctccg gaaaaggctc tgtgggagtt ctgtccttga 3180
gtggccaaca aacccgcaag ctcacccata cttctggcag tgtctaaaga acgccctggc 3240
cacagacaat catgtggcct atagtcaggt gttcaaggaa acggtctagc ccttctttgc 3300
aaaacacaac tgcctagttt accaaggaga ggcctggctg tttaaattgt tttcatatat 3360
atcacaccaa aagcgtgttt tgaaattctt caagaaatga gattgcccat atttcagggg 3420
agccaccaac gtctgtcaca ggagttggaa agatggggtt tatataatgc atcaagtctt 3480
ctttcttatc tctctgtgtc tctatttgca cttgagtctc tcacctcagc tcctgtaaaa 3540
gagtggcaag taaaaaacat ggggctctga ttctcctgta attgtgataa ttaaatatac 3600
acacaatcat gacattgaga agaactgcat ttctaccctt aaaaagtact ggtatataca 3660
gaaatagggt taaaaaaaac tcaagctctc tctatatgag accaaaatgt actagagtta 3720
gtttagtgaa ataaaaaacc agtcagctgg ccgggcatgg tggctcatgc ttgtaatccc 3780
agcactttgg gaggccgagg caggtggatc acgaggtcag gagtttgaga ccagtctggc 3840
caacatggtg aaaccccgtc tgtactaaaa atacaaaaat tagctgggcg tggtggtggg 3900
tgcctgtaat cccagctact tgggaggctg aggcaggaga atcgcttgaa cccgggaggt 3960
ggaggtggca gtgagccgag atcacgccac tgcaatgcag cccgggcaac agagctagac 4020
tgtctcaaaa gaacaaaaaa aaaaaaacac aaaaaaactc agtcagcttc ttaaccaatt 4080
gcttccgtgt catccagggc cccattctgt gcagattgag tgtgggcacc acacaggtgg 4140
ttgctgcttc agtgcttcct gctctttttc cttgggcctg cttctgggtt ccatagggaa 4200
acagtaagaa agaaagacac atccttacca taaatgcata tggtccacct acaaatagaa 4260
aaatatttaa atgatctgcc tttatacaaa gtgatattct ctacctttga taatttacct 4320
gcttaaatgt ttttatctgc actgcaaagt actgtatcca aagtaaaatt tcctcatcca 4380
atatctttca aactgttttg ttaactaatg ccatatattt gtaagtatct gcacacttga 4440
tacagcaacg ttagatggtt ttgatggtaa accctaaagg aggactccaa gagtgtgtat 4500
ttatttatag ttttatcaga gatgacaatt atttgaatgc caattatatg gattcctttc 4560
attttttgct ggaggatggg agaagaaacc aaagtttata gaccttcaca ttgagaaagc 4620
ttcagttttg aacttcagct atcagattca aaaacaacag aaagaaccaa gacattctta 4680
agatgcctgt actttcagct gggtataaat tcatgagttc aaagattgaa acctgaccaa 4740
tttgctttat ttcatggaag aagtgatcta caaaggtgtt tgtgccattt ggaaaacagc 4800
gtgcatgtgt tcaagcctta gattggcgat gtcgtatttt cctcacgtgt ggcaatgcca 4860
aaggctttac tttacctgtg agtacacact atatgaatta tttccaacgt acatttaatc 4920
aataagggtc acaaattccc aaatcaatct ctggaataaa tagagaggta attaaattgc 4980
tggagccaac ta 4992
<210> 280
<211> 1049
<212> PRT
<213> Homo sapiens
<400> 280
Met Val Phe Pro Met Trp Thr Leu Lys Arg Gln Ile Leu Ile Leu Phe
1 5 10 15
Asn Ile Ile Leu Ile Ser Lys Leu Leu Gly Ala Arg Trp Phe Pro Lys
20 25 30
Thr Leu Pro Cys Asp Val Thr Leu Asp Val Pro Lys Asn His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Gly Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Asp Ile
65 70 75 80
Ser Pro Ala Ser Phe His Arg Leu Asp His Leu Val Glu Ile Asp Phe
85 90 95
Arg Cys Asn Cys Val Pro Ile Pro Leu Gly Ser Lys Asn Asn Met Cys
100 105 110
Ile Lys Arg Leu Gln Ile Lys Pro Arg Ser Phe Ser Gly Leu Thr Tyr
115 120 125
Leu Lys Ser Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Gly Leu Pro Pro Ser Leu Gln Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Arg Lys Glu Asn Leu Thr Glu Leu Ala Asn Ile Glu Ile
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Tyr Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Asn Leu Thr Lys Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Ala Val Pro Thr Val Leu Pro
210 215 220
Ser Thr Leu Thr Glu Leu Tyr Leu Tyr Asn Asn Met Ile Ala Lys Ile
225 230 235 240
Gln Glu Asp Asp Phe Asn Asn Leu Asn Gln Leu Gln Ile Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Ala Pro Phe Pro Cys Ala Pro
260 265 270
Cys Lys Asn Asn Ser Pro Leu Gln Ile Pro Val Asn Ala Phe Asp Ala
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Pro Arg Trp Phe Lys Asn Ile Asn Lys Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Phe Leu Ala Lys Glu Ile Gly Asp Ala Lys Phe Leu
325 330 335
His Phe Leu Pro Ser Leu Ile Gln Leu Asp Leu Ser Phe Asn Phe Glu
340 345 350
Leu Gln Val Tyr Arg Ala Ser Met Asn Leu Ser Gln Ala Phe Ser Ser
355 360 365
Leu Lys Ser Leu Lys Ile Leu Arg Ile Arg Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Ser Phe Asn Leu Ser Pro Leu His Asn Leu Gln Asn Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asn Leu Ser Met
405 410 415
Phe Lys Gln Phe Lys Arg Leu Lys Val Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Gly Asp Ser Ser Glu Val Gly Phe Cys Ser Asn Ala
435 440 445
Arg Thr Ser Val Glu Ser Tyr Glu Pro Gln Val Leu Glu Gln Leu His
450 455 460
Tyr Phe Arg Tyr Asp Lys Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Ala Ser Phe Met Ser Val Asn Glu Ser Cys Tyr Lys Tyr Gly Gln
485 490 495
Thr Leu Asp Leu Ser Lys Asn Ser Ile Phe Phe Val Lys Ser Ser Asp
500 505 510
Phe Gln His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn Leu
515 520 525
Ile Ser Gln Thr Leu Asn Gly Ser Glu Phe Gln Pro Leu Ala Glu Leu
530 535 540
Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu His Ser Thr
545 550 555 560
Ala Phe Glu Glu Leu His Lys Leu Glu Val Leu Asp Ile Ser Ser Asn
565 570 575
Ser His Tyr Phe Gln Ser Glu Gly Ile Thr His Met Leu Asn Phe Thr
580 585 590
Lys Asn Leu Lys Val Leu Gln Lys Leu Met Met Asn Asp Asn Asp Ile
595 600 605
Ser Ser Ser Thr Ser Arg Thr Met Glu Ser Glu Ser Leu Arg Thr Leu
610 615 620
Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Glu Gly Asp Asn
625 630 635 640
Arg Tyr Leu Gln Leu Phe Lys Asn Leu Leu Lys Leu Glu Glu Leu Asp
645 650 655
Ile Ser Lys Asn Ser Leu Ser Phe Leu Pro Ser Gly Val Phe Asp Gly
660 665 670
Met Pro Pro Asn Leu Lys Asn Leu Ser Leu Ala Lys Asn Gly Leu Lys
675 680 685
Ser Phe Ser Trp Lys Lys Leu Gln Cys Leu Lys Asn Leu Glu Thr Leu
690 695 700
Asp Leu Ser His Asn Gln Leu Thr Thr Val Pro Glu Arg Leu Ser Asn
705 710 715 720
Cys Ser Arg Ser Leu Lys Asn Leu Ile Leu Lys Asn Asn Gln Ile Arg
725 730 735
Ser Leu Thr Lys Tyr Phe Leu Gln Asp Ala Phe Gln Leu Arg Tyr Leu
740 745 750
Asp Leu Ser Ser Asn Lys Ile Gln Met Ile Gln Lys Thr Ser Phe Pro
755 760 765
Glu Asn Val Leu Asn Asn Leu Lys Met Leu Leu Leu His His Asn Arg
770 775 780
Phe Leu Cys Thr Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn His
785 790 795 800
Thr Glu Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Val Gly
805 810 815
Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr Thr
820 825 830
Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Leu Ser Ile Ser
835 840 845
Val Ser Leu Phe Leu Met Val Met Met Thr Ala Ser His Leu Tyr Phe
850 855 860
Trp Asp Val Trp Tyr Ile Tyr His Phe Cys Lys Ala Lys Ile Lys Gly
865 870 875 880
Tyr Gln Arg Leu Ile Ser Pro Asp Cys Cys Tyr Asp Ala Phe Ile Val
885 890 895
Tyr Asp Thr Lys Asp Pro Ala Val Thr Glu Trp Val Leu Ala Glu Leu
900 905 910
Val Ala Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys Leu
915 920 925
Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu Ser
930 935 940
Gln Ser Ile Gln Leu Ser Lys Lys Thr Val Phe Val Met Thr Asp Lys
945 950 955 960
Tyr Ala Lys Thr Glu Asn Phe Lys Ile Ala Phe Tyr Leu Ser His Gln
965 970 975
Arg Leu Met Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu Glu
980 985 990
Lys Pro Phe Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu Cys
995 1000 1005
Gly Ser Ser Val Leu Glu Trp Pro Thr Asn Pro Gln Ala His Pro
1010 1015 1020
Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Ala Thr Asp Asn His
1025 1030 1035
Val Ala Tyr Ser Gln Val Phe Lys Glu Thr Val
1040 1045
<210> 281
<211> 4216
<212> ДНК
<213> Homo sapiens
<400> 281
agtttctctt ctcggccacc tcctgcatag agggtaccat tctgcgctgc tgcaagttac 60
ggaatgaaaa attagaacaa cagaaacatg gaaaacatgt tccttcagtc gtcaatgctg 120
acctgcattt tcctgctaat atctggttcc tgtgagttat gcgccgaaga aaatttttct 180
agaagctatc cttgtgatga gaaaaagcaa aatgactcag ttattgcaga gtgcagcaat 240
cgtcgactac aggaagttcc ccaaacggtg ggcaaatatg tgacagaact agacctgtct 300
gataatttca tcacacacat aacgaatgaa tcatttcaag ggctgcaaaa tctcactaaa 360
ataaatctaa accacaaccc caatgtacag caccagaacg gaaatcccgg tatacaatca 420
aatggcttga atatcacaga cggggcattc ctcaacctaa aaaacctaag ggagttactg 480
cttgaagaca accagttacc ccaaataccc tctggtttgc cagagtcttt gacagaactt 540
agtctaattc aaaacaatat atacaacata actaaagagg gcatttcaag acttataaac 600
ttgaaaaatc tctatttggc ctggaactgc tattttaaca aagtttgcga gaaaactaac 660
atagaagatg gagtatttga aacgctgaca aatttggagt tgctatcact atctttcaat 720
tctctttcac acgtgccacc caaactgcca agctccctac gcaaactttt tctgagcaac 780
acccagatca aatacattag tgaagaagat ttcaagggat tgataaattt aacattacta 840
gatttaagcg ggaactgtcc gaggtgcttc aatgccccat ttccatgcgt gccttgtgat 900
ggtggtgctt caattaatat agatcgtttt gcttttcaaa acttgaccca acttcgatac 960
ctaaacctct ctagcacttc cctcaggaag attaatgctg cctggtttaa aaatatgcct 1020
catctgaagg tgctggatct tgaattcaac tatttagtgg gagaaatagc ctctggggca 1080
tttttaacga tgctgccccg cttagaaata cttgacttgt cttttaacta tataaagggg 1140
agttatccac agcatattaa tatttccaga aacttctcta aacttttgtc tctacgggca 1200
ttgcatttaa gaggttatgt gttccaggaa ctcagagaag atgatttcca gcccctgatg 1260
cagcttccaa acttatcgac tatcaacttg ggtattaatt ttattaagca aatcgatttc 1320
aaacttttcc aaaatttctc caatctggaa attatttact tgtcagaaaa cagaatatca 1380
ccgttggtaa aagatacccg gcagagttat gcaaatagtt cctcttttca acgtcatatc 1440
cggaaacgac gctcaacaga ttttgagttt gacccacatt cgaactttta tcatttcacc 1500
cgtcctttaa taaagccaca atgtgctgct tatggaaaag ccttagattt aagcctcaac 1560
agtattttct tcattgggcc aaaccaattt gaaaatcttc ctgacattgc ctgtttaaat 1620
ctgtctgcaa atagcaatgc tcaagtgtta agtggaactg aattttcagc cattcctcat 1680
gtcaaatatt tggatttgac aaacaataga ctagactttg ataatgctag tgctcttact 1740
gaattgtccg acttggaagt tctagatctc agctataatt cacactattt cagaatagca 1800
ggcgtaacac atcatctaga atttattcaa aatttcacaa atctaaaagt tttaaacttg 1860
agccacaaca acatttatac tttaacagat aagtataacc tggaaagcaa gtccctggta 1920
gaattagttt tcagtggcaa tcgccttgac attttgtgga atgatgatga caacaggtat 1980
atctccattt tcaaaggtct caagaatctg acacgtctgg atttatccct taataggctg 2040
aagcacatcc caaatgaagc attccttaat ttgccagcga gtctcactga actacatata 2100
aatgataata tgttaaagtt ttttaactgg acattactcc agcagtttcc tcgtctcgag 2160
ttgcttgact tacgtggaaa caaactactc tttttaactg atagcctatc tgactttaca 2220
tcttcccttc ggacactgct gctgagtcat aacaggattt cccacctacc ctctggcttt 2280
ctttctgaag tcagtagtct gaagcacctc gatttaagtt ccaatctgct aaaaacaatc 2340
aacaaatccg cacttgaaac taagaccacc accaaattat ctatgttgga actacacgga 2400
aacccctttg aatgcacctg tgacattgga gatttccgaa gatggatgga tgaacatctg 2460
aatgtcaaaa ttcccagact ggtagatgtc atttgtgcca gtcctgggga tcaaagaggg 2520
aagagtattg tgagtctgga gctaacaact tgtgtttcag atgtcactgc agtgatatta 2580
tttttcttca cgttctttat caccaccatg gttatgttgg ctgccctggc tcaccatttg 2640
ttttactggg atgtttggtt tatatataat gtgtgtttag ctaaggtaaa aggctacagg 2700
tctctttcca catcccaaac tttctatgat gcttacattt cttatgacac caaagatgcc 2760
tctgttactg actgggtgat aaatgagctg cgctaccacc ttgaagagag ccgagacaaa 2820
aacgttctcc tttgtctaga ggagagggat tgggatccgg gattggccat catcgacaac 2880
ctcatgcaga gcatcaacca aagcaagaaa acagtatttg ttttaaccaa aaaatatgca 2940
aaaagctgga actttaaaac agctttttac ttggctttgc agaggctaat ggatgagaac 3000
atggatgtga ttatatttat cctgctggag ccagtgttac agcattctca gtatttgagg 3060
ctacggcagc ggatctgtaa gagctccatc ctccagtggc ctgacaaccc gaaggcagaa 3120
ggcttgtttt ggcaaactct gagaaatgtg gtcttgactg aaaatgattc acggtataac 3180
aatatgtatg tcgattccat taagcaatac taactgacgt taagtcatga tttcgcgcca 3240
taataaagat gcaaaggaat gacatttctg tattagttat ctattgctat gtaacaaatt 3300
atcccaaaac ttagtggttt aaaacaacac atttgctggc ccacagtttt tgagggtcag 3360
gagtccaggc ccagcataac tgggtcctct gctcagggtg tctcagaggc tgcaatgtag 3420
gtgttcacca gagacatagg catcactggg gtcacactca tgtggttgtt ttctggattc 3480
aattcctcct gggctattgg ccaaaggcta tactcatgta agccatgcga gcctctccca 3540
caaggcagct tgcttcatca gagctagcaa aaaagagagg ttgctagcaa gatgaagtca 3600
caatcttttg taatcgaatc aaaaaagtga tatctcatca ctttggccat attctatttg 3660
ttagaagtaa accacaggtc ccaccagctc catgggagtg accacctcag tccagggaaa 3720
acagctgaag accaagatgg tgagctctga ttgcttcagt tggtcatcaa ctattttccc 3780
ttgactgctg tcctgggatg gcctgctatc ttgatgatag attgtgaata tcaggaggca 3840
gggatcactg tggaccatct tagcagttga cctaacacat cttcttttca atatctaaga 3900
acttttgcca ctgtgactaa tggtcctaat attaagctgt tgtttatatt tatcatatat 3960
ctatggctac atggttatat tatgctgtgg ttgcgttcgg ttttatttac agttgctttt 4020
acaaatattt gctgtaacat ttgacttcta aggtttagat gccatttaag aactgagatg 4080
gatagctttt aaagcatctt ttacttctta ccatttttta aaagtatgca gctaaattcg 4140
aagcttttgg tctatattgt taattgccat tgctgtaaat cttaaaatga atgaataaaa 4200
atgtttcatt ttacaa 4216
<210> 282
<211> 1041
<212> PRT
<213> Homo sapiens
<400> 282
Met Glu Asn Met Phe Leu Gln Ser Ser Met Leu Thr Cys Ile Phe Leu
1 5 10 15
Leu Ile Ser Gly Ser Cys Glu Leu Cys Ala Glu Glu Asn Phe Ser Arg
20 25 30
Ser Tyr Pro Cys Asp Glu Lys Lys Gln Asn Asp Ser Val Ile Ala Glu
35 40 45
Cys Ser Asn Arg Arg Leu Gln Glu Val Pro Gln Thr Val Gly Lys Tyr
50 55 60
Val Thr Glu Leu Asp Leu Ser Asp Asn Phe Ile Thr His Ile Thr Asn
65 70 75 80
Glu Ser Phe Gln Gly Leu Gln Asn Leu Thr Lys Ile Asn Leu Asn His
85 90 95
Asn Pro Asn Val Gln His Gln Asn Gly Asn Pro Gly Ile Gln Ser Asn
100 105 110
Gly Leu Asn Ile Thr Asp Gly Ala Phe Leu Asn Leu Lys Asn Leu Arg
115 120 125
Glu Leu Leu Leu Glu Asp Asn Gln Leu Pro Gln Ile Pro Ser Gly Leu
130 135 140
Pro Glu Ser Leu Thr Glu Leu Ser Leu Ile Gln Asn Asn Ile Tyr Asn
145 150 155 160
Ile Thr Lys Glu Gly Ile Ser Arg Leu Ile Asn Leu Lys Asn Leu Tyr
165 170 175
Leu Ala Trp Asn Cys Tyr Phe Asn Lys Val Cys Glu Lys Thr Asn Ile
180 185 190
Glu Asp Gly Val Phe Glu Thr Leu Thr Asn Leu Glu Leu Leu Ser Leu
195 200 205
Ser Phe Asn Ser Leu Ser His Val Pro Pro Lys Leu Pro Ser Ser Leu
210 215 220
Arg Lys Leu Phe Leu Ser Asn Thr Gln Ile Lys Tyr Ile Ser Glu Glu
225 230 235 240
Asp Phe Lys Gly Leu Ile Asn Leu Thr Leu Leu Asp Leu Ser Gly Asn
245 250 255
Cys Pro Arg Cys Phe Asn Ala Pro Phe Pro Cys Val Pro Cys Asp Gly
260 265 270
Gly Ala Ser Ile Asn Ile Asp Arg Phe Ala Phe Gln Asn Leu Thr Gln
275 280 285
Leu Arg Tyr Leu Asn Leu Ser Ser Thr Ser Leu Arg Lys Ile Asn Ala
290 295 300
Ala Trp Phe Lys Asn Met Pro His Leu Lys Val Leu Asp Leu Glu Phe
305 310 315 320
Asn Tyr Leu Val Gly Glu Ile Ala Ser Gly Ala Phe Leu Thr Met Leu
325 330 335
Pro Arg Leu Glu Ile Leu Asp Leu Ser Phe Asn Tyr Ile Lys Gly Ser
340 345 350
Tyr Pro Gln His Ile Asn Ile Ser Arg Asn Phe Ser Lys Leu Leu Ser
355 360 365
Leu Arg Ala Leu His Leu Arg Gly Tyr Val Phe Gln Glu Leu Arg Glu
370 375 380
Asp Asp Phe Gln Pro Leu Met Gln Leu Pro Asn Leu Ser Thr Ile Asn
385 390 395 400
Leu Gly Ile Asn Phe Ile Lys Gln Ile Asp Phe Lys Leu Phe Gln Asn
405 410 415
Phe Ser Asn Leu Glu Ile Ile Tyr Leu Ser Glu Asn Arg Ile Ser Pro
420 425 430
Leu Val Lys Asp Thr Arg Gln Ser Tyr Ala Asn Ser Ser Ser Phe Gln
435 440 445
Arg His Ile Arg Lys Arg Arg Ser Thr Asp Phe Glu Phe Asp Pro His
450 455 460
Ser Asn Phe Tyr His Phe Thr Arg Pro Leu Ile Lys Pro Gln Cys Ala
465 470 475 480
Ala Tyr Gly Lys Ala Leu Asp Leu Ser Leu Asn Ser Ile Phe Phe Ile
485 490 495
Gly Pro Asn Gln Phe Glu Asn Leu Pro Asp Ile Ala Cys Leu Asn Leu
500 505 510
Ser Ala Asn Ser Asn Ala Gln Val Leu Ser Gly Thr Glu Phe Ser Ala
515 520 525
Ile Pro His Val Lys Tyr Leu Asp Leu Thr Asn Asn Arg Leu Asp Phe
530 535 540
Asp Asn Ala Ser Ala Leu Thr Glu Leu Ser Asp Leu Glu Val Leu Asp
545 550 555 560
Leu Ser Tyr Asn Ser His Tyr Phe Arg Ile Ala Gly Val Thr His His
565 570 575
Leu Glu Phe Ile Gln Asn Phe Thr Asn Leu Lys Val Leu Asn Leu Ser
580 585 590
His Asn Asn Ile Tyr Thr Leu Thr Asp Lys Tyr Asn Leu Glu Ser Lys
595 600 605
Ser Leu Val Glu Leu Val Phe Ser Gly Asn Arg Leu Asp Ile Leu Trp
610 615 620
Asn Asp Asp Asp Asn Arg Tyr Ile Ser Ile Phe Lys Gly Leu Lys Asn
625 630 635 640
Leu Thr Arg Leu Asp Leu Ser Leu Asn Arg Leu Lys His Ile Pro Asn
645 650 655
Glu Ala Phe Leu Asn Leu Pro Ala Ser Leu Thr Glu Leu His Ile Asn
660 665 670
Asp Asn Met Leu Lys Phe Phe Asn Trp Thr Leu Leu Gln Gln Phe Pro
675 680 685
Arg Leu Glu Leu Leu Asp Leu Arg Gly Asn Lys Leu Leu Phe Leu Thr
690 695 700
Asp Ser Leu Ser Asp Phe Thr Ser Ser Leu Arg Thr Leu Leu Leu Ser
705 710 715 720
His Asn Arg Ile Ser His Leu Pro Ser Gly Phe Leu Ser Glu Val Ser
725 730 735
Ser Leu Lys His Leu Asp Leu Ser Ser Asn Leu Leu Lys Thr Ile Asn
740 745 750
Lys Ser Ala Leu Glu Thr Lys Thr Thr Thr Lys Leu Ser Met Leu Glu
755 760 765
Leu His Gly Asn Pro Phe Glu Cys Thr Cys Asp Ile Gly Asp Phe Arg
770 775 780
Arg Trp Met Asp Glu His Leu Asn Val Lys Ile Pro Arg Leu Val Asp
785 790 795 800
Val Ile Cys Ala Ser Pro Gly Asp Gln Arg Gly Lys Ser Ile Val Ser
805 810 815
Leu Glu Leu Thr Thr Cys Val Ser Asp Val Thr Ala Val Ile Leu Phe
820 825 830
Phe Phe Thr Phe Phe Ile Thr Thr Met Val Met Leu Ala Ala Leu Ala
835 840 845
His His Leu Phe Tyr Trp Asp Val Trp Phe Ile Tyr Asn Val Cys Leu
850 855 860
Ala Lys Val Lys Gly Tyr Arg Ser Leu Ser Thr Ser Gln Thr Phe Tyr
865 870 875 880
Asp Ala Tyr Ile Ser Tyr Asp Thr Lys Asp Ala Ser Val Thr Asp Trp
885 890 895
Val Ile Asn Glu Leu Arg Tyr His Leu Glu Glu Ser Arg Asp Lys Asn
900 905 910
Val Leu Leu Cys Leu Glu Glu Arg Asp Trp Asp Pro Gly Leu Ala Ile
915 920 925
Ile Asp Asn Leu Met Gln Ser Ile Asn Gln Ser Lys Lys Thr Val Phe
930 935 940
Val Leu Thr Lys Lys Tyr Ala Lys Ser Trp Asn Phe Lys Thr Ala Phe
945 950 955 960
Tyr Leu Ala Leu Gln Arg Leu Met Asp Glu Asn Met Asp Val Ile Ile
965 970 975
Phe Ile Leu Leu Glu Pro Val Leu Gln His Ser Gln Tyr Leu Arg Leu
980 985 990
Arg Gln Arg Ile Cys Lys Ser Ser Ile Leu Gln Trp Pro Asp Asn Pro
995 1000 1005
Lys Ala Glu Gly Leu Phe Trp Gln Thr Leu Arg Asn Val Val Leu
1010 1015 1020
Thr Glu Asn Asp Ser Arg Tyr Asn Asn Met Tyr Val Asp Ser Ile
1025 1030 1035
Lys Gln Tyr
1040
<210> 283
<211> 3922
<212> ДНК
<213> Homo sapiens
<400> 283
ggaggtcttg tttccggaag atgttgcaag gctgtggtga aggcaggtgc agcctagcct 60
cctgctcaag ctacaccctg gccctccacg catgaggccc tgcagaactc tggagatggt 120
gcctacaagg gcagaaaagg acaagtcggc agccgctgtc ctgagggcac cagctgtggt 180
gcaggagcca agacctgagg gtggaagtgt cctcttagaa tggggagtgc ccagcaaggt 240
gtacccgcta ctggtgctat ccagaattcc catctctccc tgctctctgc ctgagctctg 300
ggccttagct cctccctggg cttggtagag gacaggtgtg aggccctcat gggatgtagg 360
ctgtctgaga ggggagtgga aagaggaagg ggtgaaggag ctgtctgcca tttgactatg 420
caaatggcct ttgactcatg ggaccctgtc ctcctcactg ggggcagggt ggagtggagg 480
gggagctact aggctggtat aaaaatctta cttcctctat tctctgagcc gctgctgccc 540
ctgtgggaag ggacctcgag tgtgaagcat ccttccctgt agctgctgtc cagtctgccc 600
gccagaccct ctggagaagc ccctgccccc cagcatgggt ttctgccgca gcgccctgca 660
cccgctgtct ctcctggtgc aggccatcat gctggccatg accctggccc tgggtacctt 720
gcctgccttc ctaccctgtg agctccagcc ccacggcctg gtgaactgca actggctgtt 780
cctgaagtct gtgccccact tctccatggc agcaccccgt ggcaatgtca ccagcctttc 840
cttgtcctcc aaccgcatcc accacctcca tgattctgac tttgcccacc tgcccagcct 900
gcggcatctc aacctcaagt ggaactgccc gccggttggc ctcagcccca tgcacttccc 960
ctgccacatg accatcgagc ccagcacctt cttggctgtg cccaccctgg aagagctaaa 1020
cctgagctac aacaacatca tgactgtgcc tgcgctgccc aaatccctca tatccctgtc 1080
cctcagccat accaacatcc tgatgctaga ctctgccagc ctcgccggcc tgcatgccct 1140
gcgcttccta ttcatggacg gcaactgtta ttacaagaac ccctgcaggc aggcactgga 1200
ggtggccccg ggtgccctcc ttggcctggg caacctcacc cacctgtcac tcaagtacaa 1260
caacctcact gtggtgcccc gcaacctgcc ttccagcctg gagtatctgc tgttgtccta 1320
caaccgcatc gtcaaactgg cgcctgagga cctggccaat ctgaccgccc tgcgtgtgct 1380
cgatgtgggc ggaaattgcc gccgctgcga ccacgctccc aacccctgca tggagtgccc 1440
tcgtcacttc ccccagctac atcccgatac cttcagccac ctgagccgtc ttgaaggcct 1500
ggtgttgaag gacagttctc tctcctggct gaatgccagt tggttccgtg ggctgggaaa 1560
cctccgagtg ctggacctga gtgagaactt cctctacaaa tgcatcacta aaaccaaggc 1620
cttccagggc ctaacacagc tgcgcaagct taacctgtcc ttcaattacc aaaagagggt 1680
gtcctttgcc cacctgtctc tggccccttc cttcgggagc ctggtcgccc tgaaggagct 1740
ggacatgcac ggcatcttct tccgctcact cgatgagacc acgctccggc cactggcccg 1800
cctgcccatg ctccagactc tgcgtctgca gatgaacttc atcaaccagg cccagctcgg 1860
catcttcagg gccttccctg gcctgcgcta cgtggacctg tcggacaacc gcatcagcgg 1920
agcttcggag ctgacagcca ccatggggga ggcagatgga ggggagaagg tctggctgca 1980
gcctggggac cttgctccgg ccccagtgga cactcccagc tctgaagact tcaggcccaa 2040
ctgcagcacc ctcaacttca ccttggatct gtcacggaac aacctggtga ccgtgcagcc 2100
ggagatgttt gcccagctct cgcacctgca gtgcctgcgc ctgagccaca actgcatctc 2160
gcaggcagtc aatggctccc agttcctgcc gctgaccggt ctgcaggtgc tagacctgtc 2220
ccacaataag ctggacctct accacgagca ctcattcacg gagctaccgc gactggaggc 2280
cctggacctc agctacaaca gccagccctt tggcatgcag ggcgtgggcc acaacttcag 2340
cttcgtggct cacctgcgca ccctgcgcca cctcagcctg gcccacaaca acatccacag 2400
ccaagtgtcc cagcagctct gcagtacgtc gctgcgggcc ctggacttca gcggcaatgc 2460
actgggccat atgtgggccg agggagacct ctatctgcac ttcttccaag gcctgagcgg 2520
tttgatctgg ctggacttgt cccagaaccg cctgcacacc ctcctgcccc aaaccctgcg 2580
caacctcccc aagagcctac aggtgctgcg tctccgtgac aattacctgg ccttctttaa 2640
gtggtggagc ctccacttcc tgcccaaact ggaagtcctc gacctggcag gaaaccagct 2700
gaaggccctg accaatggca gcctgcctgc tggcacccgg ctccggaggc tggatgtcag 2760
ctgcaacagc atcagcttcg tggcccccgg cttcttttcc aaggccaagg agctgcgaga 2820
gctcaacctt agcgccaacg ccctcaagac agtggaccac tcctggtttg ggcccctggc 2880
gagtgccctg caaatactag atgtaagcgc caaccctctg cactgcgcct gtggggcggc 2940
ctttatggac ttcctgctgg aggtgcaggc tgccgtgccc ggtctgccca gccgggtgaa 3000
gtgtggcagt ccgggccagc tccagggcct cagcatcttt gcacaggacc tgcgcctctg 3060
cctggatgag gccctctcct gggactgttt cgccctctcg ctgctggctg tggctctggg 3120
cctgggtgtg cccatgctgc atcacctctg tggctgggac ctctggtact gcttccacct 3180
gtgcctggcc tggcttccct ggcgggggcg gcaaagtggg cgagatgagg atgccctgcc 3240
ctacgatgcc ttcgtggtct tcgacaaaac gcagagcgca gtggcagact gggtgtacaa 3300
cgagcttcgg gggcagctgg aggagtgccg tgggcgctgg gcactccgcc tgtgcctgga 3360
ggaacgcgac tggctgcctg gcaaaaccct ctttgagaac ctgtgggcct cggtctatgg 3420
cagccgcaag acgctgtttg tgctggccca cacggaccgg gtcagtggtc tcttgcgcgc 3480
cagcttcctg ctggcccagc agcgcctgct ggaggaccgc aaggacgtcg tggtgctggt 3540
gatcctgagc cctgacggcc gccgctcccg ctacgtgcgg ctgcgccagc gcctctgccg 3600
ccagagtgtc ctcctctggc cccaccagcc cagtggtcag cgcagcttct gggcccagct 3660
gggcatggcc ctgaccaggg acaaccacca cttctataac cggaacttct gccagggacc 3720
cacggccgaa tagccgtgag ccggaatcct gcacggtgcc acctccacac tcacctcacc 3780
tctgcctgcc tggtctgacc ctcccctgct cgcctccctc accccacacc tgacacagag 3840
caggcactca ataaatgcta ccgaaggcta aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aa 3922
<210> 284
<211> 1032
<212> PRT
<213> Homo sapiens
<400> 284
Met Gly Phe Cys Arg Ser Ala Leu His Pro Leu Ser Leu Leu Val Gln
1 5 10 15
Ala Ile Met Leu Ala Met Thr Leu Ala Leu Gly Thr Leu Pro Ala Phe
20 25 30
Leu Pro Cys Glu Leu Gln Pro His Gly Leu Val Asn Cys Asn Trp Leu
35 40 45
Phe Leu Lys Ser Val Pro His Phe Ser Met Ala Ala Pro Arg Gly Asn
50 55 60
Val Thr Ser Leu Ser Leu Ser Ser Asn Arg Ile His His Leu His Asp
65 70 75 80
Ser Asp Phe Ala His Leu Pro Ser Leu Arg His Leu Asn Leu Lys Trp
85 90 95
Asn Cys Pro Pro Val Gly Leu Ser Pro Met His Phe Pro Cys His Met
100 105 110
Thr Ile Glu Pro Ser Thr Phe Leu Ala Val Pro Thr Leu Glu Glu Leu
115 120 125
Asn Leu Ser Tyr Asn Asn Ile Met Thr Val Pro Ala Leu Pro Lys Ser
130 135 140
Leu Ile Ser Leu Ser Leu Ser His Thr Asn Ile Leu Met Leu Asp Ser
145 150 155 160
Ala Ser Leu Ala Gly Leu His Ala Leu Arg Phe Leu Phe Met Asp Gly
165 170 175
Asn Cys Tyr Tyr Lys Asn Pro Cys Arg Gln Ala Leu Glu Val Ala Pro
180 185 190
Gly Ala Leu Leu Gly Leu Gly Asn Leu Thr His Leu Ser Leu Lys Tyr
195 200 205
Asn Asn Leu Thr Val Val Pro Arg Asn Leu Pro Ser Ser Leu Glu Tyr
210 215 220
Leu Leu Leu Ser Tyr Asn Arg Ile Val Lys Leu Ala Pro Glu Asp Leu
225 230 235 240
Ala Asn Leu Thr Ala Leu Arg Val Leu Asp Val Gly Gly Asn Cys Arg
245 250 255
Arg Cys Asp His Ala Pro Asn Pro Cys Met Glu Cys Pro Arg His Phe
260 265 270
Pro Gln Leu His Pro Asp Thr Phe Ser His Leu Ser Arg Leu Glu Gly
275 280 285
Leu Val Leu Lys Asp Ser Ser Leu Ser Trp Leu Asn Ala Ser Trp Phe
290 295 300
Arg Gly Leu Gly Asn Leu Arg Val Leu Asp Leu Ser Glu Asn Phe Leu
305 310 315 320
Tyr Lys Cys Ile Thr Lys Thr Lys Ala Phe Gln Gly Leu Thr Gln Leu
325 330 335
Arg Lys Leu Asn Leu Ser Phe Asn Tyr Gln Lys Arg Val Ser Phe Ala
340 345 350
His Leu Ser Leu Ala Pro Ser Phe Gly Ser Leu Val Ala Leu Lys Glu
355 360 365
Leu Asp Met His Gly Ile Phe Phe Arg Ser Leu Asp Glu Thr Thr Leu
370 375 380
Arg Pro Leu Ala Arg Leu Pro Met Leu Gln Thr Leu Arg Leu Gln Met
385 390 395 400
Asn Phe Ile Asn Gln Ala Gln Leu Gly Ile Phe Arg Ala Phe Pro Gly
405 410 415
Leu Arg Tyr Val Asp Leu Ser Asp Asn Arg Ile Ser Gly Ala Ser Glu
420 425 430
Leu Thr Ala Thr Met Gly Glu Ala Asp Gly Gly Glu Lys Val Trp Leu
435 440 445
Gln Pro Gly Asp Leu Ala Pro Ala Pro Val Asp Thr Pro Ser Ser Glu
450 455 460
Asp Phe Arg Pro Asn Cys Ser Thr Leu Asn Phe Thr Leu Asp Leu Ser
465 470 475 480
Arg Asn Asn Leu Val Thr Val Gln Pro Glu Met Phe Ala Gln Leu Ser
485 490 495
His Leu Gln Cys Leu Arg Leu Ser His Asn Cys Ile Ser Gln Ala Val
500 505 510
Asn Gly Ser Gln Phe Leu Pro Leu Thr Gly Leu Gln Val Leu Asp Leu
515 520 525
Ser His Asn Lys Leu Asp Leu Tyr His Glu His Ser Phe Thr Glu Leu
530 535 540
Pro Arg Leu Glu Ala Leu Asp Leu Ser Tyr Asn Ser Gln Pro Phe Gly
545 550 555 560
Met Gln Gly Val Gly His Asn Phe Ser Phe Val Ala His Leu Arg Thr
565 570 575
Leu Arg His Leu Ser Leu Ala His Asn Asn Ile His Ser Gln Val Ser
580 585 590
Gln Gln Leu Cys Ser Thr Ser Leu Arg Ala Leu Asp Phe Ser Gly Asn
595 600 605
Ala Leu Gly His Met Trp Ala Glu Gly Asp Leu Tyr Leu His Phe Phe
610 615 620
Gln Gly Leu Ser Gly Leu Ile Trp Leu Asp Leu Ser Gln Asn Arg Leu
625 630 635 640
His Thr Leu Leu Pro Gln Thr Leu Arg Asn Leu Pro Lys Ser Leu Gln
645 650 655
Val Leu Arg Leu Arg Asp Asn Tyr Leu Ala Phe Phe Lys Trp Trp Ser
660 665 670
Leu His Phe Leu Pro Lys Leu Glu Val Leu Asp Leu Ala Gly Asn Gln
675 680 685
Leu Lys Ala Leu Thr Asn Gly Ser Leu Pro Ala Gly Thr Arg Leu Arg
690 695 700
Arg Leu Asp Val Ser Cys Asn Ser Ile Ser Phe Val Ala Pro Gly Phe
705 710 715 720
Phe Ser Lys Ala Lys Glu Leu Arg Glu Leu Asn Leu Ser Ala Asn Ala
725 730 735
Leu Lys Thr Val Asp His Ser Trp Phe Gly Pro Leu Ala Ser Ala Leu
740 745 750
Gln Ile Leu Asp Val Ser Ala Asn Pro Leu His Cys Ala Cys Gly Ala
755 760 765
Ala Phe Met Asp Phe Leu Leu Glu Val Gln Ala Ala Val Pro Gly Leu
770 775 780
Pro Ser Arg Val Lys Cys Gly Ser Pro Gly Gln Leu Gln Gly Leu Ser
785 790 795 800
Ile Phe Ala Gln Asp Leu Arg Leu Cys Leu Asp Glu Ala Leu Ser Trp
805 810 815
Asp Cys Phe Ala Leu Ser Leu Leu Ala Val Ala Leu Gly Leu Gly Val
820 825 830
Pro Met Leu His His Leu Cys Gly Trp Asp Leu Trp Tyr Cys Phe His
835 840 845
Leu Cys Leu Ala Trp Leu Pro Trp Arg Gly Arg Gln Ser Gly Arg Asp
850 855 860
Glu Asp Ala Leu Pro Tyr Asp Ala Phe Val Val Phe Asp Lys Thr Gln
865 870 875 880
Ser Ala Val Ala Asp Trp Val Tyr Asn Glu Leu Arg Gly Gln Leu Glu
885 890 895
Glu Cys Arg Gly Arg Trp Ala Leu Arg Leu Cys Leu Glu Glu Arg Asp
900 905 910
Trp Leu Pro Gly Lys Thr Leu Phe Glu Asn Leu Trp Ala Ser Val Tyr
915 920 925
Gly Ser Arg Lys Thr Leu Phe Val Leu Ala His Thr Asp Arg Val Ser
930 935 940
Gly Leu Leu Arg Ala Ser Phe Leu Leu Ala Gln Gln Arg Leu Leu Glu
945 950 955 960
Asp Arg Lys Asp Val Val Val Leu Val Ile Leu Ser Pro Asp Gly Arg
965 970 975
Arg Ser Arg Tyr Val Arg Leu Arg Gln Arg Leu Cys Arg Gln Ser Val
980 985 990
Leu Leu Trp Pro His Gln Pro Ser Gly Gln Arg Ser Phe Trp Ala Gln
995 1000 1005
Leu Gly Met Ala Leu Thr Arg Asp Asn His His Phe Tyr Asn Arg
1010 1015 1020
Asn Phe Cys Gln Gly Pro Thr Ala Glu
1025 1030
<210> 285
<211> 3990
<212> ДНК
<213> Homo sapiens
<400> 285
agccaattct gaccgtgtca acgaatcatc cacgcacctg cagctctgct gagagagtgc 60
aagccgtggg aattcagcag ctgaatatca agacctttga attcaacaag aagttaagac 120
atttatagtt gtctaacaac agactgaaga ttgtggcttg gtattcactg gcaggtttca 180
gacatttaga tctttctttt aatgactaac accatgccta tctgtggaga agctggcaac 240
atgtcacacc tggaaattgt ttttcaacat taatactatt atttggcagt aatccagatt 300
gcttttgcca ccaacctgaa gacatataga ggcagaagga caggaataat tctatttgtt 360
tcctgttttg aaacttccat ctgtaaggct atcaaaagga gatgtgagag agggtattga 420
gtctggcctg acaatgcagt tcttaaacca aaggtccatt atgcttctcc tctctgagaa 480
tcctgactta cctcaacaac ggagacatgg cacagtagcc agcttggaga cttctcagcc 540
aatgctctga gatcaagtcg aagacccaat atacagggtt ttgagctcat cttcatcatt 600
catatgagga aataagtggt aaaatccttg gaaatacaat gagactcatc agaaacattt 660
acatattttg tagtattgtt atgacagcag agggtgatgc tccagagctg ccagaagaaa 720
gggaactgat gaccaactgc tccaacatgt ctctaagaaa ggttcccgca gacttgaccc 780
cagccacaac gacactggat ttatcctata acctcctttt tcaactccag agttcagatt 840
ttcattctgt ctccaaactg agagttttga ttctatgcca taacagaatt caacagctgg 900
atctcaaaac ctttgaattc aacaaggagt taagatattt agatttgtct aataacagac 960
tgaagagtgt aacttggtat ttactggcag gtctcaggta tttagatctt tcttttaatg 1020
actttgacac catgcctatc tgtgaggaag ctggcaacat gtcacacctg gaaatcctag 1080
gtttgagtgg ggcaaaaata caaaaatcag atttccagaa aattgctcat ctgcatctaa 1140
atactgtctt cttaggattc agaactcttc ctcattatga agaaggtagc ctgcccatct 1200
taaacacaac aaaactgcac attgttttac caatggacac aaatttctgg gttcttttgc 1260
gtgatggaat caagacttca aaaatattag aaatgacaaa tatagatggc aaaagccaat 1320
ttgtaagtta tgaaatgcaa cgaaatctta gtttagaaaa tgctaagaca tcggttctat 1380
tgcttaataa agttgattta ctctgggacg accttttcct tatcttacaa tttgtttggc 1440
atacatcagt ggaacacttt cagatccgaa atgtgacttt tggtggtaag gcttatcttg 1500
accacaattc atttgactac tcaaatactg taatgagaac tataaaattg gagcatgtac 1560
atttcagagt gttttacatt caacaggata aaatctattt gcttttgacc aaaatggaca 1620
tagaaaacct gacaatatca aatgcacaaa tgccacacat gcttttcccg aattatccta 1680
cgaaattcca atatttaaat tttgccaata atatcttaac agacgagttg tttaaaagaa 1740
ctatccaact gcctcacttg aaaactctca ttttgaatgg caataaactg gagacacttt 1800
ctttagtaag ttgctttgct aacaacacac ccttggaaca cttggatctg agtcaaaatc 1860
tattacaaca taaaaatgat gaaaattgct catggccaga aactgtggtc aatatgaatc 1920
tgtcatacaa taaattgtct gattctgtct tcaggtgctt gcccaaaagt attcaaatac 1980
ttgacctaaa taataaccaa atccaaactg tacctaaaga gactattcat ctgatggcct 2040
tacgagaact aaatattgca tttaattttc taactgatct ccctggatgc agtcatttca 2100
gtagactttc agttctgaac attgaaatga acttcattct cagcccatct ctggattttg 2160
ttcagagctg ccaggaagtt aaaactctaa atgcgggaag aaatccattc cggtgtacct 2220
gtgaattaaa aaatttcatt cagcttgaaa catattcaga ggtcatgatg gttggatggt 2280
cagattcata cacctgtgaa taccctttaa acctaagggg aactaggtta aaagacgttc 2340
atctccacga attatcttgc aacacagctc tgttgattgt caccattgtg gttattatgc 2400
tagttctggg gttggctgtg gccttctgct gtctccactt tgatctgccc tggtatctca 2460
ggatgctagg tcaatgcaca caaacatggc acagggttag gaaaacaacc caagaacaac 2520
tcaagagaaa tgtccgattc cacgcattta tttcatacag tgaacatgat tctctgtggg 2580
tgaagaatga attgatcccc aatctagaga aggaagatgg ttctatcttg atttgccttt 2640
atgaaagcta ctttgaccct ggcaaaagca ttagtgaaaa tattgtaagc ttcattgaga 2700
aaagctataa gtccatcttt gttttgtctc ccaactttgt ccagaatgag tggtgccatt 2760
atgaattcta ctttgcccac cacaatctct tccatgaaaa ttctgatcat ataattctta 2820
tcttactgga acccattcca ttctattgca ttcccaccag gtatcataaa ctgaaagctc 2880
tcctggaaaa aaaagcatac ttggaatggc ccaaggatag gcgtaaatgt gggcttttct 2940
gggcaaacct tcgagctgct attaatgtta atgtattagc caccagagaa atgtatgaac 3000
tgcagacatt cacagagtta aatgaagagt ctcgaggttc tacaatctct ctgatgagaa 3060
cagattgtct ataaaatccc acagtccttg ggaagttggg gaccacatac actgttggga 3120
tgtacattga tacaaccttt atgatggcaa tttgacaata tttattaaaa taaaaaatgg 3180
ttattccctt catatcagtt tctagaagga tttctaagaa tgtatcctat agaaacacct 3240
tcacaagttt ataagggctt atggaaaaag gtgttcatcc caggattgtt tataatcatg 3300
aaaaatgtgg ccaggtgcag tggctcactc ttgtaatccc agcactatgg gaggccaagg 3360
tgggtgaccc acgaggtcaa gagatggaga ccatcctggc caacatggtg aaaccctgtc 3420
tctactaaaa atacaaaaat tagctgggcg tgatggtgca cgcctgtagt cccagctact 3480
tgggaggctg aggcaggaga atcgcttgaa cccgggaggt ggcagttgca gtgagctgag 3540
atcgagccac tgcactccag cctggtgaca gagcgagact ccatctcaaa aaaaagaaaa 3600
aaaaaaaaga aaaaaatgga aaacatcctc atggccacaa aataaggtct aattcaataa 3660
attatagtac attaatgtaa tataatatta catgccacta aaaagaataa ggtagctgta 3720
tatttcctgg tatggaaaaa acatattaat atgttataaa ctattaggtt ggtgcaaaac 3780
taattgtggt ttttgccatt gaaatggcat tgaaataaaa gtgtaaagaa atctatacca 3840
gatgtagtaa cagtggtttg ggtctgggag gttggattac agggagcatt tgatttctat 3900
gttgtgtatt tctataatgt ttgaattgtt tagaatgaat ctgtatttct tttataagta 3960
gaaaaaaaat aaagatagtt tttacagcct 3990
<210> 286
<211> 811
<212> PRT
<213> Homo sapiens
<400> 286
Met Arg Leu Ile Arg Asn Ile Tyr Ile Phe Cys Ser Ile Val Met Thr
1 5 10 15
Ala Glu Gly Asp Ala Pro Glu Leu Pro Glu Glu Arg Glu Leu Met Thr
20 25 30
Asn Cys Ser Asn Met Ser Leu Arg Lys Val Pro Ala Asp Leu Thr Pro
35 40 45
Ala Thr Thr Thr Leu Asp Leu Ser Tyr Asn Leu Leu Phe Gln Leu Gln
50 55 60
Ser Ser Asp Phe His Ser Val Ser Lys Leu Arg Val Leu Ile Leu Cys
65 70 75 80
His Asn Arg Ile Gln Gln Leu Asp Leu Lys Thr Phe Glu Phe Asn Lys
85 90 95
Glu Leu Arg Tyr Leu Asp Leu Ser Asn Asn Arg Leu Lys Ser Val Thr
100 105 110
Trp Tyr Leu Leu Ala Gly Leu Arg Tyr Leu Asp Leu Ser Phe Asn Asp
115 120 125
Phe Asp Thr Met Pro Ile Cys Glu Glu Ala Gly Asn Met Ser His Leu
130 135 140
Glu Ile Leu Gly Leu Ser Gly Ala Lys Ile Gln Lys Ser Asp Phe Gln
145 150 155 160
Lys Ile Ala His Leu His Leu Asn Thr Val Phe Leu Gly Phe Arg Thr
165 170 175
Leu Pro His Tyr Glu Glu Gly Ser Leu Pro Ile Leu Asn Thr Thr Lys
180 185 190
Leu His Ile Val Leu Pro Met Asp Thr Asn Phe Trp Val Leu Leu Arg
195 200 205
Asp Gly Ile Lys Thr Ser Lys Ile Leu Glu Met Thr Asn Ile Asp Gly
210 215 220
Lys Ser Gln Phe Val Ser Tyr Glu Met Gln Arg Asn Leu Ser Leu Glu
225 230 235 240
Asn Ala Lys Thr Ser Val Leu Leu Leu Asn Lys Val Asp Leu Leu Trp
245 250 255
Asp Asp Leu Phe Leu Ile Leu Gln Phe Val Trp His Thr Ser Val Glu
260 265 270
His Phe Gln Ile Arg Asn Val Thr Phe Gly Gly Lys Ala Tyr Leu Asp
275 280 285
His Asn Ser Phe Asp Tyr Ser Asn Thr Val Met Arg Thr Ile Lys Leu
290 295 300
Glu His Val His Phe Arg Val Phe Tyr Ile Gln Gln Asp Lys Ile Tyr
305 310 315 320
Leu Leu Leu Thr Lys Met Asp Ile Glu Asn Leu Thr Ile Ser Asn Ala
325 330 335
Gln Met Pro His Met Leu Phe Pro Asn Tyr Pro Thr Lys Phe Gln Tyr
340 345 350
Leu Asn Phe Ala Asn Asn Ile Leu Thr Asp Glu Leu Phe Lys Arg Thr
355 360 365
Ile Gln Leu Pro His Leu Lys Thr Leu Ile Leu Asn Gly Asn Lys Leu
370 375 380
Glu Thr Leu Ser Leu Val Ser Cys Phe Ala Asn Asn Thr Pro Leu Glu
385 390 395 400
His Leu Asp Leu Ser Gln Asn Leu Leu Gln His Lys Asn Asp Glu Asn
405 410 415
Cys Ser Trp Pro Glu Thr Val Val Asn Met Asn Leu Ser Tyr Asn Lys
420 425 430
Leu Ser Asp Ser Val Phe Arg Cys Leu Pro Lys Ser Ile Gln Ile Leu
435 440 445
Asp Leu Asn Asn Asn Gln Ile Gln Thr Val Pro Lys Glu Thr Ile His
450 455 460
Leu Met Ala Leu Arg Glu Leu Asn Ile Ala Phe Asn Phe Leu Thr Asp
465 470 475 480
Leu Pro Gly Cys Ser His Phe Ser Arg Leu Ser Val Leu Asn Ile Glu
485 490 495
Met Asn Phe Ile Leu Ser Pro Ser Leu Asp Phe Val Gln Ser Cys Gln
500 505 510
Glu Val Lys Thr Leu Asn Ala Gly Arg Asn Pro Phe Arg Cys Thr Cys
515 520 525
Glu Leu Lys Asn Phe Ile Gln Leu Glu Thr Tyr Ser Glu Val Met Met
530 535 540
Val Gly Trp Ser Asp Ser Tyr Thr Cys Glu Tyr Pro Leu Asn Leu Arg
545 550 555 560
Gly Thr Arg Leu Lys Asp Val His Leu His Glu Leu Ser Cys Asn Thr
565 570 575
Ala Leu Leu Ile Val Thr Ile Val Val Ile Met Leu Val Leu Gly Leu
580 585 590
Ala Val Ala Phe Cys Cys Leu His Phe Asp Leu Pro Trp Tyr Leu Arg
595 600 605
Met Leu Gly Gln Cys Thr Gln Thr Trp His Arg Val Arg Lys Thr Thr
610 615 620
Gln Glu Gln Leu Lys Arg Asn Val Arg Phe His Ala Phe Ile Ser Tyr
625 630 635 640
Ser Glu His Asp Ser Leu Trp Val Lys Asn Glu Leu Ile Pro Asn Leu
645 650 655
Glu Lys Glu Asp Gly Ser Ile Leu Ile Cys Leu Tyr Glu Ser Tyr Phe
660 665 670
Asp Pro Gly Lys Ser Ile Ser Glu Asn Ile Val Ser Phe Ile Glu Lys
675 680 685
Ser Tyr Lys Ser Ile Phe Val Leu Ser Pro Asn Phe Val Gln Asn Glu
690 695 700
Trp Cys His Tyr Glu Phe Tyr Phe Ala His His Asn Leu Phe His Glu
705 710 715 720
Asn Ser Asp His Ile Ile Leu Ile Leu Leu Glu Pro Ile Pro Phe Tyr
725 730 735
Cys Ile Pro Thr Arg Tyr His Lys Leu Lys Ala Leu Leu Glu Lys Lys
740 745 750
Ala Tyr Leu Glu Trp Pro Lys Asp Arg Arg Lys Cys Gly Leu Phe Trp
755 760 765
Ala Asn Leu Arg Ala Ala Ile Asn Val Asn Val Leu Ala Thr Arg Glu
770 775 780
Met Tyr Glu Leu Gln Thr Phe Thr Glu Leu Asn Glu Glu Ser Arg Gly
785 790 795 800
Ser Thr Ile Ser Leu Met Arg Thr Asp Cys Leu
805 810
<210> 287
<211> 3212
<212> ДНК
<213> Mus musculus
<400> 287
agagcagcca ccattgtgga gggaagagga aggttttctt ctttaactac gggagatgaa 60
agaaaacacc tcctgagaac ctgaatctgt ctccaccacc ccatgctcaa agaatcgatg 120
ccaaggatgg aaagacatca gttctgctct gttctcctca ttctgatact attgactctg 180
gtgagcctta ccttgactgg ctgggcatgg accatccctg attgcatcat agcagacagt 240
ttgttatttc ctaacctttc ctactacatc ccattctgta cctcggcccc aggactgcac 300
cttttggcat cttgctctaa tgttaaaaac ttaaatcaga ccctaaaaag agtgcccaga 360
aatacagagg tactctgcct ccagggcatg gttcctactc tgccagctaa ggcctttatt 420
cgcttccact ccctacagct tctaaggctg caattgcgta caaccagtgt cacatctagg 480
acttttcaag gactggacca gctacaatac cttttttttg atcatcatgc tccctgttgc 540
ctaagtttgt tcctctctcc aaattgtttt gagtctctta gatcccttag tagtctttcc 600
tttcaaggat attgcctgac ttatagccaa agcatctact tgccaactag tcttaggcat 660
ctaactctga ggaatagctg tctaacaaag tttcaggacc ttcaaaggct cttcccagac 720
cttctgctga gtacctcctc tacacccaat atcaaaccag gggcaccctt tttagagacg 780
ctggatttat cttacaacct tcagctgaaa caggcaggtg tcagagactt gtatggcctc 840
acactccatt ccctaatatt ggatggtacc ccactaaaag cacttgatct cacagactca 900
ggactgctcc acttgcattt cctctccctt gtgggaacag gaatagaaaa agtgcctgca 960
agtttgactg gctactctga gcttcgtgca cttgaccttg ggaaaaacca aatccaaaac 1020
atcttggaaa atggagaaat cccaggttat aaagccctgg aattccttag ccttcatgat 1080
aaccatctgc aaacacttcc taccaggttt ctacatactc taccccagct tcagaagctc 1140
aacctatcta tgaataagct tggcccaatc ttggagcttc cagaaggact ctttagcaca 1200
aacttaaaag tgctagatct atcctataat caactctgtg atgtacccca tggggcttta 1260
tcccttttgt cacagctcca ggagctctgg ttgagtggca ataacatctc tagtttatcc 1320
aatgaaagcc tgcagggact gaggcagctg aggacactag acttaagttg gaatcaaatt 1380
aaagtactca aaccaggctg gctctctcat cttcctgctc tgactacctt gaaccttctg 1440
ggcacctact tagaatatat cttaggcata caacttcagg gtcccaagat gctaaggcat 1500
ttacaactgg gttcttatcc aatactggac atatatcctc cctggccccc aacactcctt 1560
agcttagaaa tacaagcaga atcatgtatt cagtttatga ttcacagtgg acagccattc 1620
ttattcttgg agaaccttac cttagagact tccattctat tactaaaacc agacaacatc 1680
acaattcatt ttccctccct gcgtcgcctc accttgcgtg gctacagctt catcttctca 1740
accagtcaac ttcagagatt cttcccacaa cagcttcctc ttctggagca cttctttatc 1800
tggtgtgaaa acagctatgc agtagacctc tatctatttg ggatgcccag gctacgtgtg 1860
ctagagctgg ggtaccttaa ctttttctat gagtcaagta ctatgaagct agagatgcta 1920
ttgaaggagg tacctcagtt acaggtactg gcattgagcc acctgaatct caggaacctc 1980
tctgtgtcca gctttaagag cttgcaggac ctcaaactgc tgctcttcaa ctctgaaagg 2040
gcgctggaga tgaacagcaa cctccaggag tttattcctc agatgcctca gtacgtttac 2100
ttctctgatg tcacctttac ttgccagtgt gaagcttcct ggctggagtc ttgggctaca 2160
cgggccccaa acacatttgt ttatgggctg gaaaaatcca tttgcatagc taatgcctca 2220
gactactcca aaactctact attctctttc cttgctacta attgtccaca cggtactgag 2280
ttttggggct ttctcaccag tttcattctg ctgcttctgt tgattatcct tcctctgatt 2340
agctgtccta aatggtcctg gcttcatcac ctctggacac tctttcatac ttgttggtgg 2400
aaattatgtg gacatagact cagaggccaa ttcaactatg atgtctttat atcctattgt 2460
gaggaggatc aagcttgggt gctggaagaa ctggttccag ttctggagaa agcccctcct 2520
gaaggtgaag gcttgaggtt gtgcctgcct gccagggact ttgggattgg aaatgacagg 2580
atggaatcca tgattgccag catgggcaaa agcagagcca ccctctgtgt gctcacagga 2640
caggccttag caagtccctg gtgcaatcta gagttacgac tggccactta ccacttggta 2700
gccaggcctg ggaccactca tctcctgctg ttgtttctgg agccccttga taggcagagg 2760
ctccatagtt accatcgcct atcccgttgg ctccagaagg aggactattt tgatttgtcc 2820
caagggaaag tggagtggaa ctctttctgt gagcaactga agagacggct cagcaaagct 2880
ggacaagaaa gagattaagg actgcaggaa tgctgttgtg cagaagatcc tttcagcagc 2940
agagggaatg tgctctcatc actaaagcat gggctcacca agggggcaaa atgatatatt 3000
aaattccact gggagggaag tcttttaaaa cactgaaaaa tattaatcca ggaagggaaa 3060
aattcattca gaaaacaatt ctgttacctg ttagtgtgtt ccagcacgag atactgctca 3120
ccacacaaga catgcataca aagtggtttg tgcaatcctg tgtatgtttt tccaaagttt 3180
ttcaaaagta aatacattct gcctctaaaa aa 3212
<210> 288
<211> 931
<212> PRT
<213> Mus musculus
<400> 288
Met Leu Lys Glu Ser Met Pro Arg Met Glu Arg His Gln Phe Cys Ser
1 5 10 15
Val Leu Leu Ile Leu Ile Leu Leu Thr Leu Val Ser Leu Thr Leu Thr
20 25 30
Gly Trp Ala Trp Thr Ile Pro Asp Cys Ile Ile Ala Asp Ser Leu Leu
35 40 45
Phe Pro Asn Leu Ser Tyr Tyr Ile Pro Phe Cys Thr Ser Ala Pro Gly
50 55 60
Leu His Leu Leu Ala Ser Cys Ser Asn Val Lys Asn Leu Asn Gln Thr
65 70 75 80
Leu Lys Arg Val Pro Arg Asn Thr Glu Val Leu Cys Leu Gln Gly Met
85 90 95
Val Pro Thr Leu Pro Ala Lys Ala Phe Ile Arg Phe His Ser Leu Gln
100 105 110
Leu Leu Arg Leu Gln Leu Arg Thr Thr Ser Val Thr Ser Arg Thr Phe
115 120 125
Gln Gly Leu Asp Gln Leu Gln Tyr Leu Phe Phe Asp His His Ala Pro
130 135 140
Cys Cys Leu Ser Leu Phe Leu Ser Pro Asn Cys Phe Glu Ser Leu Arg
145 150 155 160
Ser Leu Ser Ser Leu Ser Phe Gln Gly Tyr Cys Leu Thr Tyr Ser Gln
165 170 175
Ser Ile Tyr Leu Pro Thr Ser Leu Arg His Leu Thr Leu Arg Asn Ser
180 185 190
Cys Leu Thr Lys Phe Gln Asp Leu Gln Arg Leu Phe Pro Asp Leu Leu
195 200 205
Leu Ser Thr Ser Ser Thr Pro Asn Ile Lys Pro Gly Ala Pro Phe Leu
210 215 220
Glu Thr Leu Asp Leu Ser Tyr Asn Leu Gln Leu Lys Gln Ala Gly Val
225 230 235 240
Arg Asp Leu Tyr Gly Leu Thr Leu His Ser Leu Ile Leu Asp Gly Thr
245 250 255
Pro Leu Lys Ala Leu Asp Leu Thr Asp Ser Gly Leu Leu His Leu His
260 265 270
Phe Leu Ser Leu Val Gly Thr Gly Ile Glu Lys Val Pro Ala Ser Leu
275 280 285
Thr Gly Tyr Ser Glu Leu Arg Ala Leu Asp Leu Gly Lys Asn Gln Ile
290 295 300
Gln Asn Ile Leu Glu Asn Gly Glu Ile Pro Gly Tyr Lys Ala Leu Glu
305 310 315 320
Phe Leu Ser Leu His Asp Asn His Leu Gln Thr Leu Pro Thr Arg Phe
325 330 335
Leu His Thr Leu Pro Gln Leu Gln Lys Leu Asn Leu Ser Met Asn Lys
340 345 350
Leu Gly Pro Ile Leu Glu Leu Pro Glu Gly Leu Phe Ser Thr Asn Leu
355 360 365
Lys Val Leu Asp Leu Ser Tyr Asn Gln Leu Cys Asp Val Pro His Gly
370 375 380
Ala Leu Ser Leu Leu Ser Gln Leu Gln Glu Leu Trp Leu Ser Gly Asn
385 390 395 400
Asn Ile Ser Ser Leu Ser Asn Glu Ser Leu Gln Gly Leu Arg Gln Leu
405 410 415
Arg Thr Leu Asp Leu Ser Trp Asn Gln Ile Lys Val Leu Lys Pro Gly
420 425 430
Trp Leu Ser His Leu Pro Ala Leu Thr Thr Leu Asn Leu Leu Gly Thr
435 440 445
Tyr Leu Glu Tyr Ile Leu Gly Ile Gln Leu Gln Gly Pro Lys Met Leu
450 455 460
Arg His Leu Gln Leu Gly Ser Tyr Pro Ile Leu Asp Ile Tyr Pro Pro
465 470 475 480
Trp Pro Pro Thr Leu Leu Ser Leu Glu Ile Gln Ala Glu Ser Cys Ile
485 490 495
Gln Phe Met Ile His Ser Gly Gln Pro Phe Leu Phe Leu Glu Asn Leu
500 505 510
Thr Leu Glu Thr Ser Ile Leu Leu Leu Lys Pro Asp Asn Ile Thr Ile
515 520 525
His Phe Pro Ser Leu Arg Arg Leu Thr Leu Arg Gly Tyr Ser Phe Ile
530 535 540
Phe Ser Thr Ser Gln Leu Gln Arg Phe Phe Pro Gln Gln Leu Pro Leu
545 550 555 560
Leu Glu His Phe Phe Ile Trp Cys Glu Asn Ser Tyr Ala Val Asp Leu
565 570 575
Tyr Leu Phe Gly Met Pro Arg Leu Arg Val Leu Glu Leu Gly Tyr Leu
580 585 590
Asn Phe Phe Tyr Glu Ser Ser Thr Met Lys Leu Glu Met Leu Leu Lys
595 600 605
Glu Val Pro Gln Leu Gln Val Leu Ala Leu Ser His Leu Asn Leu Arg
610 615 620
Asn Leu Ser Val Ser Ser Phe Lys Ser Leu Gln Asp Leu Lys Leu Leu
625 630 635 640
Leu Phe Asn Ser Glu Arg Ala Leu Glu Met Asn Ser Asn Leu Gln Glu
645 650 655
Phe Ile Pro Gln Met Pro Gln Tyr Val Tyr Phe Ser Asp Val Thr Phe
660 665 670
Thr Cys Gln Cys Glu Ala Ser Trp Leu Glu Ser Trp Ala Thr Arg Ala
675 680 685
Pro Asn Thr Phe Val Tyr Gly Leu Glu Lys Ser Ile Cys Ile Ala Asn
690 695 700
Ala Ser Asp Tyr Ser Lys Thr Leu Leu Phe Ser Phe Leu Ala Thr Asn
705 710 715 720
Cys Pro His Gly Thr Glu Phe Trp Gly Phe Leu Thr Ser Phe Ile Leu
725 730 735
Leu Leu Leu Leu Ile Ile Leu Pro Leu Ile Ser Cys Pro Lys Trp Ser
740 745 750
Trp Leu His His Leu Trp Thr Leu Phe His Thr Cys Trp Trp Lys Leu
755 760 765
Cys Gly His Arg Leu Arg Gly Gln Phe Asn Tyr Asp Val Phe Ile Ser
770 775 780
Tyr Cys Glu Glu Asp Gln Ala Trp Val Leu Glu Glu Leu Val Pro Val
785 790 795 800
Leu Glu Lys Ala Pro Pro Glu Gly Glu Gly Leu Arg Leu Cys Leu Pro
805 810 815
Ala Arg Asp Phe Gly Ile Gly Asn Asp Arg Met Glu Ser Met Ile Ala
820 825 830
Ser Met Gly Lys Ser Arg Ala Thr Leu Cys Val Leu Thr Gly Gln Ala
835 840 845
Leu Ala Ser Pro Trp Cys Asn Leu Glu Leu Arg Leu Ala Thr Tyr His
850 855 860
Leu Val Ala Arg Pro Gly Thr Thr His Leu Leu Leu Leu Phe Leu Glu
865 870 875 880
Pro Leu Asp Arg Gln Arg Leu His Ser Tyr His Arg Leu Ser Arg Trp
885 890 895
Leu Gln Lys Glu Asp Tyr Phe Asp Leu Ser Gln Gly Lys Val Glu Trp
900 905 910
Asn Ser Phe Cys Glu Gln Leu Lys Arg Arg Leu Ser Lys Ala Gly Gln
915 920 925
Glu Arg Asp
930
<210> 289
<211> 3174
<212> ДНК
<213> Mus musculus
<400> 289
agtgctaagt atctccaagt cggcctcctc acttcccggc ttccacagtg gccctttgac 60
ggtgctcccg gaccttgcag gtactctgag gtggatgaga gtattggtaa cccggaggca 120
taggagtcta aagtcctctc agctctgatt cctctggtgt agagatgggc aggtactggc 180
tgctgccagg tctcctcctt tccctgcctc tggtaactgg gtggagcact tccaactgcc 240
tggtgaccga aggctcccga ctgcccctgg tctcccgcta tttcacattc tgccgccatt 300
ccaagctatc ctttcttgct gcatgcctct ccgtgagcaa cctgacacag accttggaag 360
ttgtacctcg gactgtggag gggctctgcc tcggtggtac tgtgtctact ctgcttccag 420
atgctttctc tgcttttcct ggtctcaagg tcctggcact gagtctgcac cttacccaac 480
ttctgccagg agctctccgg ggtctgggac agttgcagag cctctctttt tttgactctc 540
ctcttaggag atctctcttt ctacctcctg atgccttcag tgacctgatt tccctccaga 600
gactccatat ctctggccct tgcctggata agaaggcagg catccgcctg cctcccggtc 660
tgcaatggct gggtgtcacg ctcagttgca ttcaggacgt gggagagctg gctggtatgt 720
tcccagatct ggtgcaaggt tcctcctcca gggtttcgtg gaccctgcag aagttggatc 780
tgtcatccaa ctggaagctg aagatggcta gtcctgggtc cctccagggt ctccaggtgg 840
agattctgga cctgacaaga acaccactgg atgccgtgtg gctgaagggc ctgggacttc 900
agaaactcga tgtcttgtat gcacagactg ccacggccga gctggctgct gaggctgttg 960
cccactttga gctgcagggc ttgattgtga aagaaagcaa gataggatct atatctcagg 1020
aggctctggc ttcctgccac agcctgaaga ccttgggtct ttcaagcact ggcctaacca 1080
agcttccacc aggcttcctg actgccatgc ctaggcttca gcgactggag ctgtccggaa 1140
accaactgca gagcgccgtg ctgtgcatga atgagacggg agatgtgtca ggactcacga 1200
ctctggatct gtcaggcaac aggttgcgca tcctgcctcc agccgccttc tcctgcttac 1260
cccacttgcg agagctgctg cttcggtaca accagctgct ttccctggag ggatacctat 1320
tccaggagct ccagcaacta gagaccttga agctggatgg aaaccccctg cttcacctgg 1380
gtaagaactg gttggcggct ctgcctgcat tgaccaccct tagcttgcta gatacccaaa 1440
tacggatgag cccagagcct ggcttctggg gagcaaagaa tctgcatacc ttgagcctga 1500
agcttcccgc tctccctgct ccggcagtat tgttcctgcc catgtatctg accagcttag 1560
agcttcatat agcctcaggc acgacggagc actggacgct gtccccagcg atctttcctt 1620
ccttggagac cttgactata agcggcgggg gactgaagct gaagctgggg tcccagaatg 1680
cttctggggt cttccctgct ctccagaagc tctccctgct taagaacagc ttggatgcct 1740
tctgctccca gggtacctcc aaccttttcc tctggcagct ccccaaactt cagtccttga 1800
gggtatgggg tgctggaaac agctccagac cctgccttat cactgggctg cccagcctac 1860
gggagctgaa gctggcgtcg cttcagtcca taacccagcc ccgttcggtg cagctggagg 1920
agctggtggg tgaccttcca cagctccagg ccttagtgct atccagcaca ggcctcaagt 1980
cactgtcggc tgctgctttc cagcgcctgc acagtctcca ggtcttagtg ctagaatacg 2040
agaaggactt gatgctgcag gacagtctga gggagtacag ccctcagatg ccccactata 2100
tatacattct ggagtcaaac ctggcctgcc actgtgccaa tgcgtggatg gagccatggg 2160
ttaagcggtc cactaaaacg tacatataca taagagacaa tcgcttatgt ccaggacaag 2220
acaggctctc tgctaggggt tcccttccct cctttctctg ggaccactgc ccccagacgt 2280
tggagctgaa actctttttg gctagttctg ccttggtgtt catgctaatt gccttgcctc 2340
tcctccaaga agccaggaac tcttggatcc cctacctgca ggccttgttc agggtttggc 2400
tccagggtct gaggggtaag ggagacaagg ggaagaggtt cctttttgat gtattcgtgt 2460
cccactgcag gcaagaccag ggctgggtga tagaggaact tctgcctgct ctggagggct 2520
tccttccagc tggcctgggc ctgcgcctct gtctccccga gcgtgacttt gagcctggta 2580
aggatgtagt tgataatgtg gtagatagca tgttgagcag ccgtaccaca ctctgcgtgt 2640
tgagtgggca ggccctgtgt aacccccgat gccgcctgga gctccgcttg gccacctctc 2700
tcctcctggc tgccccgtcc cctccagtgt tgctgctagt cttcttggaa cccatttctc 2760
ggcaccagct tccgggttac cacagactgg ctcggctgct tcgaagagga gactactgtc 2820
tgtggcccga ggaagaggag agaaagagtg ggttctggac ttggctgagg agcaggctag 2880
ggtagccata gccagcactg gtgtggggtg gtgcatgtga attttggggt ggggttgggg 2940
gaagggaagc aagcctgcct gtcaaggagt tggtgtgttt gtaggtgcag ggtcggggac 3000
agtgggtcta agaggctgaa gtcagccttt tgcagcgcag gaatccacgt gctgtgaaca 3060
caggttttgg ggggcctgga ggttgaatga ggaaaactga gagatggaag gtgtccgcgg 3120
ggtatgtgac attcccaaga tcttcaaatc ctcagtaaac ttgctaaatt catg 3174
<210> 290
<211> 906
<212> PRT
<213> Mus musculus
<400> 290
Met Gly Arg Tyr Trp Leu Leu Pro Gly Leu Leu Leu Ser Leu Pro Leu
1 5 10 15
Val Thr Gly Trp Ser Thr Ser Asn Cys Leu Val Thr Glu Gly Ser Arg
20 25 30
Leu Pro Leu Val Ser Arg Tyr Phe Thr Phe Cys Arg His Ser Lys Leu
35 40 45
Ser Phe Leu Ala Ala Cys Leu Ser Val Ser Asn Leu Thr Gln Thr Leu
50 55 60
Glu Val Val Pro Arg Thr Val Glu Gly Leu Cys Leu Gly Gly Thr Val
65 70 75 80
Ser Thr Leu Leu Pro Asp Ala Phe Ser Ala Phe Pro Gly Leu Lys Val
85 90 95
Leu Ala Leu Ser Leu His Leu Thr Gln Leu Leu Pro Gly Ala Leu Arg
100 105 110
Gly Leu Gly Gln Leu Gln Ser Leu Ser Phe Phe Asp Ser Pro Leu Arg
115 120 125
Arg Ser Leu Phe Leu Pro Pro Asp Ala Phe Ser Asp Leu Ile Ser Leu
130 135 140
Gln Arg Leu His Ile Ser Gly Pro Cys Leu Asp Lys Lys Ala Gly Ile
145 150 155 160
Arg Leu Pro Pro Gly Leu Gln Trp Leu Gly Val Thr Leu Ser Cys Ile
165 170 175
Gln Asp Val Gly Glu Leu Ala Gly Met Phe Pro Asp Leu Val Gln Gly
180 185 190
Ser Ser Ser Arg Val Ser Trp Thr Leu Gln Lys Leu Asp Leu Ser Ser
195 200 205
Asn Trp Lys Leu Lys Met Ala Ser Pro Gly Ser Leu Gln Gly Leu Gln
210 215 220
Val Glu Ile Leu Asp Leu Thr Arg Thr Pro Leu Asp Ala Val Trp Leu
225 230 235 240
Lys Gly Leu Gly Leu Gln Lys Leu Asp Val Leu Tyr Ala Gln Thr Ala
245 250 255
Thr Ala Glu Leu Ala Ala Glu Ala Val Ala His Phe Glu Leu Gln Gly
260 265 270
Leu Ile Val Lys Glu Ser Lys Ile Gly Ser Ile Ser Gln Glu Ala Leu
275 280 285
Ala Ser Cys His Ser Leu Lys Thr Leu Gly Leu Ser Ser Thr Gly Leu
290 295 300
Thr Lys Leu Pro Pro Gly Phe Leu Thr Ala Met Pro Arg Leu Gln Arg
305 310 315 320
Leu Glu Leu Ser Gly Asn Gln Leu Gln Ser Ala Val Leu Cys Met Asn
325 330 335
Glu Thr Gly Asp Val Ser Gly Leu Thr Thr Leu Asp Leu Ser Gly Asn
340 345 350
Arg Leu Arg Ile Leu Pro Pro Ala Ala Phe Ser Cys Leu Pro His Leu
355 360 365
Arg Glu Leu Leu Leu Arg Tyr Asn Gln Leu Leu Ser Leu Glu Gly Tyr
370 375 380
Leu Phe Gln Glu Leu Gln Gln Leu Glu Thr Leu Lys Leu Asp Gly Asn
385 390 395 400
Pro Leu Leu His Leu Gly Lys Asn Trp Leu Ala Ala Leu Pro Ala Leu
405 410 415
Thr Thr Leu Ser Leu Leu Asp Thr Gln Ile Arg Met Ser Pro Glu Pro
420 425 430
Gly Phe Trp Gly Ala Lys Asn Leu His Thr Leu Ser Leu Lys Leu Pro
435 440 445
Ala Leu Pro Ala Pro Ala Val Leu Phe Leu Pro Met Tyr Leu Thr Ser
450 455 460
Leu Glu Leu His Ile Ala Ser Gly Thr Thr Glu His Trp Thr Leu Ser
465 470 475 480
Pro Ala Ile Phe Pro Ser Leu Glu Thr Leu Thr Ile Ser Gly Gly Gly
485 490 495
Leu Lys Leu Lys Leu Gly Ser Gln Asn Ala Ser Gly Val Phe Pro Ala
500 505 510
Leu Gln Lys Leu Ser Leu Leu Lys Asn Ser Leu Asp Ala Phe Cys Ser
515 520 525
Gln Gly Thr Ser Asn Leu Phe Leu Trp Gln Leu Pro Lys Leu Gln Ser
530 535 540
Leu Arg Val Trp Gly Ala Gly Asn Ser Ser Arg Pro Cys Leu Ile Thr
545 550 555 560
Gly Leu Pro Ser Leu Arg Glu Leu Lys Leu Ala Ser Leu Gln Ser Ile
565 570 575
Thr Gln Pro Arg Ser Val Gln Leu Glu Glu Leu Val Gly Asp Leu Pro
580 585 590
Gln Leu Gln Ala Leu Val Leu Ser Ser Thr Gly Leu Lys Ser Leu Ser
595 600 605
Ala Ala Ala Phe Gln Arg Leu His Ser Leu Gln Val Leu Val Leu Glu
610 615 620
Tyr Glu Lys Asp Leu Met Leu Gln Asp Ser Leu Arg Glu Tyr Ser Pro
625 630 635 640
Gln Met Pro His Tyr Ile Tyr Ile Leu Glu Ser Asn Leu Ala Cys His
645 650 655
Cys Ala Asn Ala Trp Met Glu Pro Trp Val Lys Arg Ser Thr Lys Thr
660 665 670
Tyr Ile Tyr Ile Arg Asp Asn Arg Leu Cys Pro Gly Gln Asp Arg Leu
675 680 685
Ser Ala Arg Gly Ser Leu Pro Ser Phe Leu Trp Asp His Cys Pro Gln
690 695 700
Thr Leu Glu Leu Lys Leu Phe Leu Ala Ser Ser Ala Leu Val Phe Met
705 710 715 720
Leu Ile Ala Leu Pro Leu Leu Gln Glu Ala Arg Asn Ser Trp Ile Pro
725 730 735
Tyr Leu Gln Ala Leu Phe Arg Val Trp Leu Gln Gly Leu Arg Gly Lys
740 745 750
Gly Asp Lys Gly Lys Arg Phe Leu Phe Asp Val Phe Val Ser His Cys
755 760 765
Arg Gln Asp Gln Gly Trp Val Ile Glu Glu Leu Leu Pro Ala Leu Glu
770 775 780
Gly Phe Leu Pro Ala Gly Leu Gly Leu Arg Leu Cys Leu Pro Glu Arg
785 790 795 800
Asp Phe Glu Pro Gly Lys Asp Val Val Asp Asn Val Val Asp Ser Met
805 810 815
Leu Ser Ser Arg Thr Thr Leu Cys Val Leu Ser Gly Gln Ala Leu Cys
820 825 830
Asn Pro Arg Cys Arg Leu Glu Leu Arg Leu Ala Thr Ser Leu Leu Leu
835 840 845
Ala Ala Pro Ser Pro Pro Val Leu Leu Leu Val Phe Leu Glu Pro Ile
850 855 860
Ser Arg His Gln Leu Pro Gly Tyr His Arg Leu Ala Arg Leu Leu Arg
865 870 875 880
Arg Gly Asp Tyr Cys Leu Trp Pro Glu Glu Glu Glu Arg Lys Ser Gly
885 890 895
Phe Trp Thr Trp Leu Arg Ser Arg Leu Gly
900 905
<210> 291
<211> 4014
<212> ДНК
<213> Mus musculus
<400> 291
tttagcaaag atgaacaatt gtactatgtg ctaggagctt ctgagagaac cttttccttg 60
caagatacct gtggtatgtg tcttggggcc cagcaatgat tcctggttct ctgcttcctc 120
tgttgcatga tgtcgagaca ctgatacact gatgcttgaa ggatgaagca gagttcagaa 180
tgagtgggct ctacaggatc ctggtccagc tggaacaaag tccatatgtg aagaccgtgc 240
ctttgaacat gagaagggat ttttttttcc tggttgtaac ctggatgcct aagacagtca 300
agatgaatgg gagcagcttt gtgccatctc tacagctcct gctcatgtta gtaggatttt 360
ctctgccgcc tgtggcagag acatatgggt tcaacaagtg cacacagtat gaatttgata 420
ttcaccatgt gctctgcatt aggaagaaga tcaccaactt gacagaggcc attagtgaca 480
tacctagata tactactcac cttaacctca cacacaacga aattcaagtc ctccctccct 540
ggagttttac caatctgtct gctctggtgg acttgagact agagtggaac tcaatttgga 600
agatcgacga aggtgccttt aggggacttg aaaatttgac tctgctgaat ttagtggaaa 660
ataagattca aagtgtgaat aactcctttg agggcctgtc cagcctgaag accctgctcc 720
tgagccataa tcagattacc catattcaca aagacgcctt cactcctcta atcaaattga 780
aatatttgag cctatctcga aacaacatta gcgatttttc tggtattctt gaagcagtcc 840
agcatcttcc atgcctggag cgccttgatc taactaacaa cagcatcatg tacttggacc 900
acagccctag gtcactggtt tctctgaccc acctgagttt tgaggggaac aaactaaggg 960
agttaaactt ctctgctttg tcattaccta acttaaccaa tctaagtgct tcccggaatg 1020
gcaataaagt cattcagaat gtgtatctta aaactctgcc ccaacttaaa agcttgaatc 1080
tgagtggaac ggtgataaaa ttggaaaatc tttcggccaa acacctgcag aatctaagag 1140
ctatggatct cagtaattgg gagcttagac atggtcactt agatatgaaa actgtttgtc 1200
acctgctcgg aaacctaccc aagttagaga cactggtttt tcagaaaaat gtcaccaatg 1260
cagagggcat taagcagctg gcaaagtgca ccaggctctt gttccttgac ctgggtcaaa 1320
acagtgactt gatttatctc aatgacagcg agttcaatgc tctgcccagt ctccaaaaac 1380
tgaatttgaa caagtgccag ctctccttca tcaacaacag gacctggagt tccttgcaga 1440
acttgaccag cctagatctg agccacaaca agtttaaaag ctttccagat tttgcatttt 1500
cccccttgaa gcacttggag tttctctctc tttcaagaaa ccccatcaca gaactcaata 1560
atctggcctt tagtgggcta tttgcactga aggagctcaa cttggctgca tgttggattg 1620
taacaattga caggtattcc tttactcagt ttccaaactt agaggtctta gatcttggag 1680
acaacaatat tcggactctc aaccacggaa ccttccgacc tctgaaaaaa ctccagtctt 1740
tgattctttc ccacaactgc ctaaaaatcc tggagccaaa ttcgttttct ggtctcacta 1800
acctacgttc ccttgacctg atgtacaaca gcttgtcata ttttcatgaa caccttttct 1860
cgggccttga aaagcttctg attttgaaac ttggttttaa taagatcaca tatgaaacta 1920
ctaggaccct tcagtatcct ccatttataa agctcaagtc tttgaaacag cttaacctag 1980
aaggacaaag acacgggatt caggttgttc cgagcaactt tttccaagga ttgggtagtt 2040
tgcaggagtt actcttagga aaaaatccct ctgtattcct ggaccaccac caatttgacc 2100
ctctgattaa cctcacaaag ttggatatct caggaacaaa agatggagat cgaagcctct 2160
atttaaatgc ttccttattc caaaacctca aaaggctaaa gatcctccgc cttgaaaata 2220
acaacttaga gtcactggtt cctgacatgt tctccagctt acagagcctc caggtctttt 2280
ctttaagatt caacaacttg aaggtcatta atcaaagtca tctgaagaat ctgaaatcac 2340
tgatgttttt tgatgtctat gggaacaaac ttcagtgcac ctgtgacaat ttgtggttca 2400
agaactggtc aatgaacaca gaggaggtcc acatcccctt cctccggagc tatccctgtc 2460
agcagccagg cagccagagt ttacttatag attttgatga tgccatgtgt aattttgact 2520
tgggaaaggt ctacttctta tgttccttca gtatggtcct cagcaccatg gtcttctctt 2580
ggttcagtac caagatgatt gcatctctgt ggtatggttt gtacatatgt agggcctggt 2640
acctcactaa atggcacaaa acggagaaga agttcttata tgatgcgttt gtctctttct 2700
cggccactga tgaggcatgg gtatacaaag agcttgttcc agccctagaa caaggcagcc 2760
agaccacctt taaactctgt cttcaccaac gggattttga accaggcatt gatatcttcg 2820
agaacatcca gaatgctatt aacacaagca ggaaaacctt gtgcgtagtc agtaaccact 2880
acctacacag tgaatggtgc cgacttgaag tccagctggc tagcatgaag atgttttatg 2940
agcacaagga tgtcattatc ttgatcttcc ttgaagagat tccgaactat aagctgtcca 3000
gctaccaccg actcaggaaa ctcataaaca aacagacgtt tatcacttgg ccggacagtg 3060
ttcaccagca gccacttttc tgggctcgca tcagaaatgc gttgggcaag gagactgtgg 3120
agaaagaaaa tacacatcta attgttgttg agtgactcga gtcttaacaa tcccaaaccc 3180
ggctgcatga atgttgccca aaataaatgt aagctgtttg actaaatgaa ctctctctct 3240
ctctccagag acaaacatga ttgcttagat agtgttcatc agaagagtag ggaggactgc 3300
ttggaaaact ttcaggagca gggtcccact atgatgggat tggatatgca gaaggaattc 3360
ctattttatt aaggagagga cttagaacaa cagtcatctg aacactgagg aacaggaagg 3420
tcttcgcata tattcgatat ctttgctcat gttgtttctc caaatcagtt gtggtcatgg 3480
gagactgcac ttgtgtatcc aaattgcccc aagattgaaa ctttccatct tgaaaggaaa 3540
cttcctatga cagaggttta cagggagaga gaacaacagg atgttctaag gggagattga 3600
aatattccac cctgcatgga agcttgttaa gacaggaggt aaatgactca aaatagtttc 3660
atgaagtctc tgaaactgac cagggactag gccctttcct tccccaagtg tatataaaac 3720
aatagagact gctgagacaa tcagacaagc ctagctgcct ggaagaagca gagagcagcc 3780
ttggtgcctg gaagaggctc agaccagctg agccaccagg aaaggacact ctccatcctg 3840
ttgagctgcc tgcagcctgt gcagtatgct ccaggttccc agcatttttg agctgtcacc 3900
catgctgggg tgggctttag tgatgcagct gtctttgaaa catttctgct cctgtgagta 3960
acccttcacc tatgttcttg taagtaaccc caataaaact cattggttca ccaa 4014
<210> 292
<211> 991
<212> PRT
<213> Mus musculus
<400> 292
Met Ser Gly Leu Tyr Arg Ile Leu Val Gln Leu Glu Gln Ser Pro Tyr
1 5 10 15
Val Lys Thr Val Pro Leu Asn Met Arg Arg Asp Phe Phe Phe Leu Val
20 25 30
Val Thr Trp Met Pro Lys Thr Val Lys Met Asn Gly Ser Ser Phe Val
35 40 45
Pro Ser Leu Gln Leu Leu Leu Met Leu Val Gly Phe Ser Leu Pro Pro
50 55 60
Val Ala Glu Thr Tyr Gly Phe Asn Lys Cys Thr Gln Tyr Glu Phe Asp
65 70 75 80
Ile His His Val Leu Cys Ile Arg Lys Lys Ile Thr Asn Leu Thr Glu
85 90 95
Ala Ile Ser Asp Ile Pro Arg Tyr Thr Thr His Leu Asn Leu Thr His
100 105 110
Asn Glu Ile Gln Val Leu Pro Pro Trp Ser Phe Thr Asn Leu Ser Ala
115 120 125
Leu Val Asp Leu Arg Leu Glu Trp Asn Ser Ile Trp Lys Ile Asp Glu
130 135 140
Gly Ala Phe Arg Gly Leu Glu Asn Leu Thr Leu Leu Asn Leu Val Glu
145 150 155 160
Asn Lys Ile Gln Ser Val Asn Asn Ser Phe Glu Gly Leu Ser Ser Leu
165 170 175
Lys Thr Leu Leu Leu Ser His Asn Gln Ile Thr His Ile His Lys Asp
180 185 190
Ala Phe Thr Pro Leu Ile Lys Leu Lys Tyr Leu Ser Leu Ser Arg Asn
195 200 205
Asn Ile Ser Asp Phe Ser Gly Ile Leu Glu Ala Val Gln His Leu Pro
210 215 220
Cys Leu Glu Arg Leu Asp Leu Thr Asn Asn Ser Ile Met Tyr Leu Asp
225 230 235 240
His Ser Pro Arg Ser Leu Val Ser Leu Thr His Leu Ser Phe Glu Gly
245 250 255
Asn Lys Leu Arg Glu Leu Asn Phe Ser Ala Leu Ser Leu Pro Asn Leu
260 265 270
Thr Asn Leu Ser Ala Ser Arg Asn Gly Asn Lys Val Ile Gln Asn Val
275 280 285
Tyr Leu Lys Thr Leu Pro Gln Leu Lys Ser Leu Asn Leu Ser Gly Thr
290 295 300
Val Ile Lys Leu Glu Asn Leu Ser Ala Lys His Leu Gln Asn Leu Arg
305 310 315 320
Ala Met Asp Leu Ser Asn Trp Glu Leu Arg His Gly His Leu Asp Met
325 330 335
Lys Thr Val Cys His Leu Leu Gly Asn Leu Pro Lys Leu Glu Thr Leu
340 345 350
Val Phe Gln Lys Asn Val Thr Asn Ala Glu Gly Ile Lys Gln Leu Ala
355 360 365
Lys Cys Thr Arg Leu Leu Phe Leu Asp Leu Gly Gln Asn Ser Asp Leu
370 375 380
Ile Tyr Leu Asn Asp Ser Glu Phe Asn Ala Leu Pro Ser Leu Gln Lys
385 390 395 400
Leu Asn Leu Asn Lys Cys Gln Leu Ser Phe Ile Asn Asn Arg Thr Trp
405 410 415
Ser Ser Leu Gln Asn Leu Thr Ser Leu Asp Leu Ser His Asn Lys Phe
420 425 430
Lys Ser Phe Pro Asp Phe Ala Phe Ser Pro Leu Lys His Leu Glu Phe
435 440 445
Leu Ser Leu Ser Arg Asn Pro Ile Thr Glu Leu Asn Asn Leu Ala Phe
450 455 460
Ser Gly Leu Phe Ala Leu Lys Glu Leu Asn Leu Ala Ala Cys Trp Ile
465 470 475 480
Val Thr Ile Asp Arg Tyr Ser Phe Thr Gln Phe Pro Asn Leu Glu Val
485 490 495
Leu Asp Leu Gly Asp Asn Asn Ile Arg Thr Leu Asn His Gly Thr Phe
500 505 510
Arg Pro Leu Lys Lys Leu Gln Ser Leu Ile Leu Ser His Asn Cys Leu
515 520 525
Lys Ile Leu Glu Pro Asn Ser Phe Ser Gly Leu Thr Asn Leu Arg Ser
530 535 540
Leu Asp Leu Met Tyr Asn Ser Leu Ser Tyr Phe His Glu His Leu Phe
545 550 555 560
Ser Gly Leu Glu Lys Leu Leu Ile Leu Lys Leu Gly Phe Asn Lys Ile
565 570 575
Thr Tyr Glu Thr Thr Arg Thr Leu Gln Tyr Pro Pro Phe Ile Lys Leu
580 585 590
Lys Ser Leu Lys Gln Leu Asn Leu Glu Gly Gln Arg His Gly Ile Gln
595 600 605
Val Val Pro Ser Asn Phe Phe Gln Gly Leu Gly Ser Leu Gln Glu Leu
610 615 620
Leu Leu Gly Lys Asn Pro Ser Val Phe Leu Asp His His Gln Phe Asp
625 630 635 640
Pro Leu Ile Asn Leu Thr Lys Leu Asp Ile Ser Gly Thr Lys Asp Gly
645 650 655
Asp Arg Ser Leu Tyr Leu Asn Ala Ser Leu Phe Gln Asn Leu Lys Arg
660 665 670
Leu Lys Ile Leu Arg Leu Glu Asn Asn Asn Leu Glu Ser Leu Val Pro
675 680 685
Asp Met Phe Ser Ser Leu Gln Ser Leu Gln Val Phe Ser Leu Arg Phe
690 695 700
Asn Asn Leu Lys Val Ile Asn Gln Ser His Leu Lys Asn Leu Lys Ser
705 710 715 720
Leu Met Phe Phe Asp Val Tyr Gly Asn Lys Leu Gln Cys Thr Cys Asp
725 730 735
Asn Leu Trp Phe Lys Asn Trp Ser Met Asn Thr Glu Glu Val His Ile
740 745 750
Pro Phe Leu Arg Ser Tyr Pro Cys Gln Gln Pro Gly Ser Gln Ser Leu
755 760 765
Leu Ile Asp Phe Asp Asp Ala Met Cys Asn Phe Asp Leu Gly Lys Val
770 775 780
Tyr Phe Leu Cys Ser Phe Ser Met Val Leu Ser Thr Met Val Phe Ser
785 790 795 800
Trp Phe Ser Thr Lys Met Ile Ala Ser Leu Trp Tyr Gly Leu Tyr Ile
805 810 815
Cys Arg Ala Trp Tyr Leu Thr Lys Trp His Lys Thr Glu Lys Lys Phe
820 825 830
Leu Tyr Asp Ala Phe Val Ser Phe Ser Ala Thr Asp Glu Ala Trp Val
835 840 845
Tyr Lys Glu Leu Val Pro Ala Leu Glu Gln Gly Ser Gln Thr Thr Phe
850 855 860
Lys Leu Cys Leu His Gln Arg Asp Phe Glu Pro Gly Ile Asp Ile Phe
865 870 875 880
Glu Asn Ile Gln Asn Ala Ile Asn Thr Ser Arg Lys Thr Leu Cys Val
885 890 895
Val Ser Asn His Tyr Leu His Ser Glu Trp Cys Arg Leu Glu Val Gln
900 905 910
Leu Ala Ser Met Lys Met Phe Tyr Glu His Lys Asp Val Ile Ile Leu
915 920 925
Ile Phe Leu Glu Glu Ile Pro Asn Tyr Lys Leu Ser Ser Tyr His Arg
930 935 940
Leu Arg Lys Leu Ile Asn Lys Gln Thr Phe Ile Thr Trp Pro Asp Ser
945 950 955 960
Val His Gln Gln Pro Leu Phe Trp Ala Arg Ile Arg Asn Ala Leu Gly
965 970 975
Lys Glu Thr Val Glu Lys Glu Asn Thr His Leu Ile Val Val Glu
980 985 990
<210> 293
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> пептид TAT 47-57
<400> 293
Tyr Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКАЯ ПРОТИВОРАКОВАЯ НЕОЭПИТОПНАЯ ВАКЦИНА | 2017 |
|
RU2782422C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ T-КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2835034C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2718499C2 |
| Т-КЛЕТКИ С КОСТИМУЛИРУЮЩИМ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ, НАЦЕЛЕННЫЕ НА IL13Rα2 | 2015 |
|
RU2749922C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CTLA-4, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2756100C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| Новые варианты интерлейкина-2 для лечения рака | 2020 |
|
RU2833537C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| НАЦЕЛЕННЫЕ НА uPARAP КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2740311C2 |
| АНТИТЕЛО К TIGIT И ЕГО ИСПОЛЬЗОВАНИЕ | 2019 |
|
RU2786434C2 |
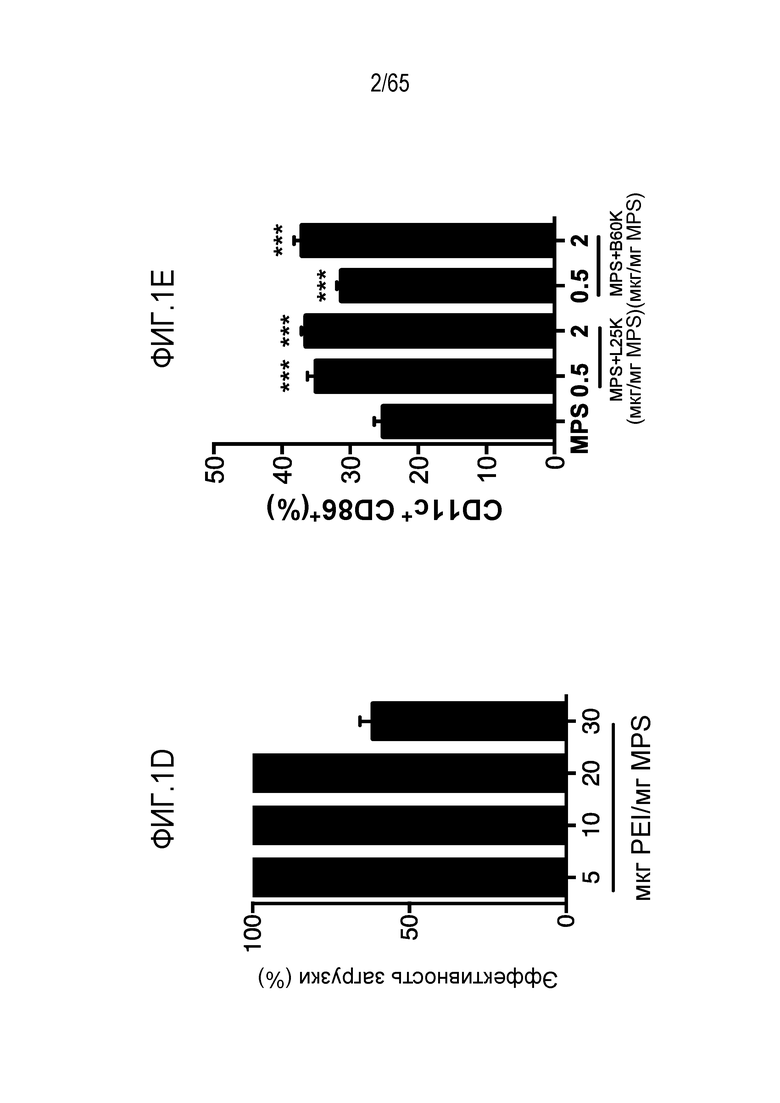
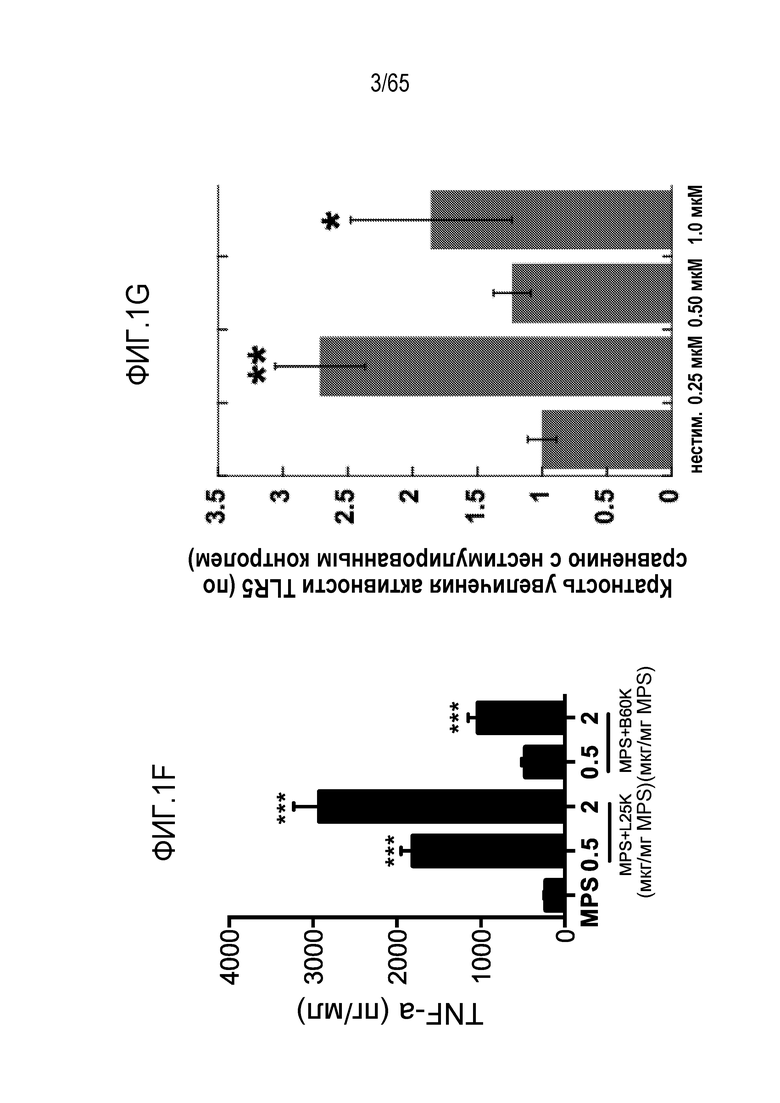
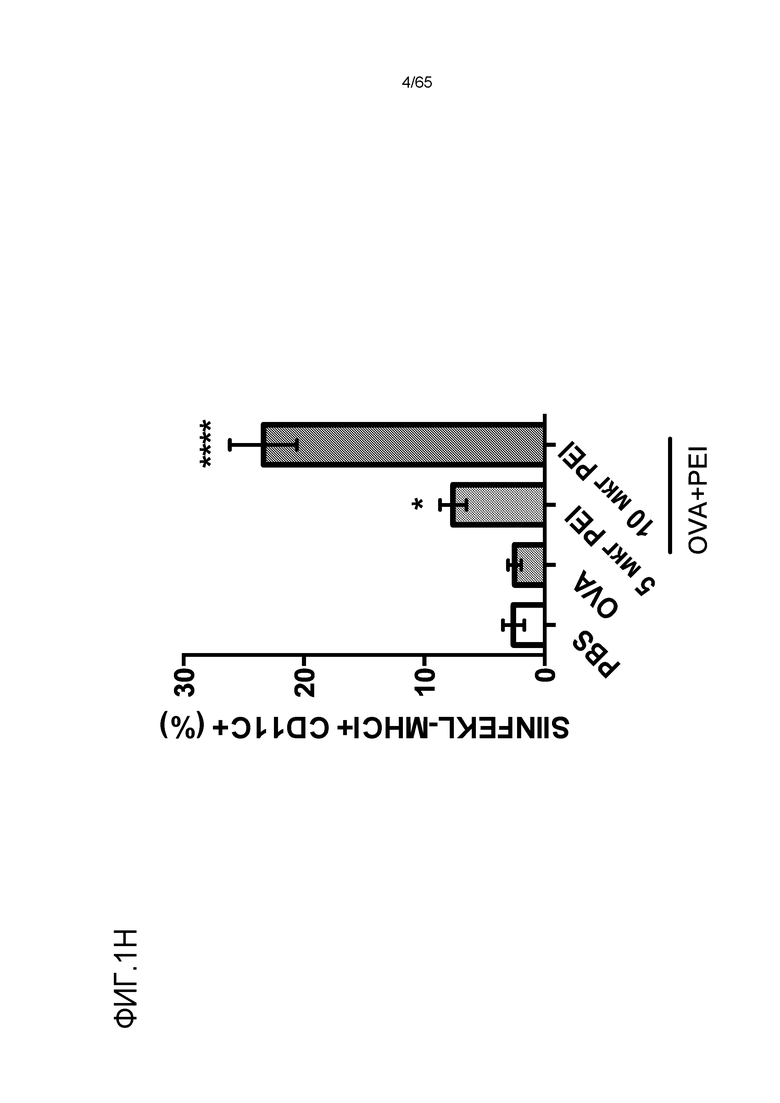
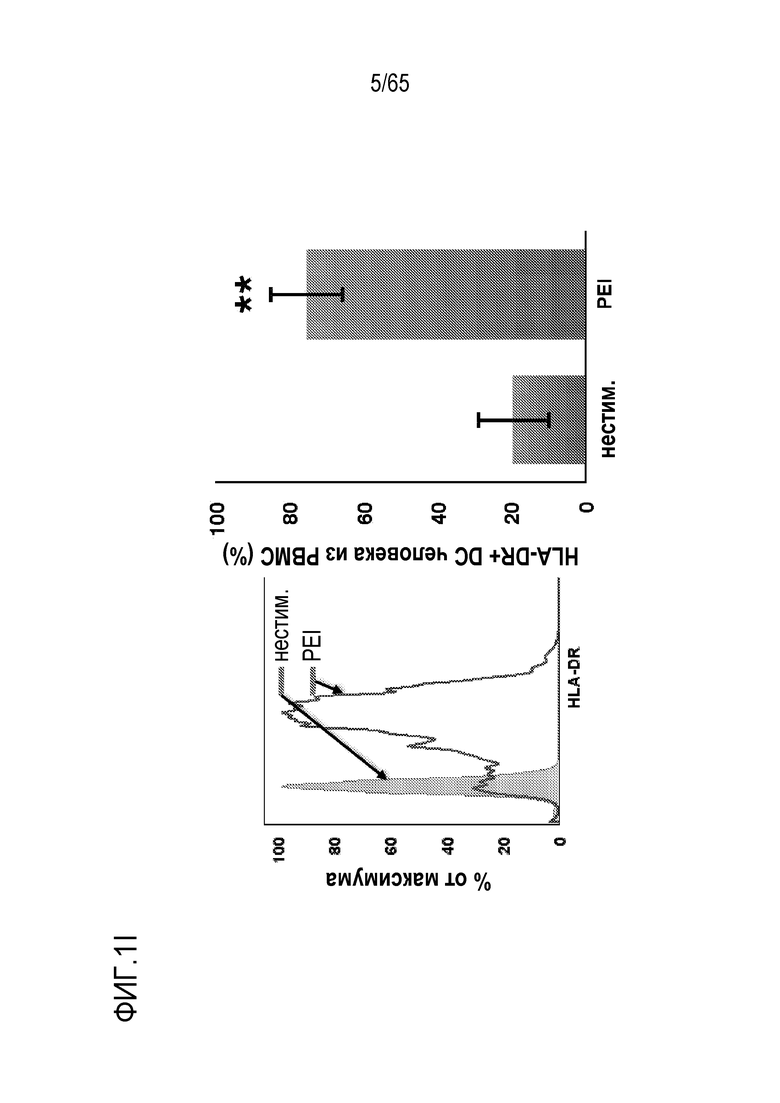
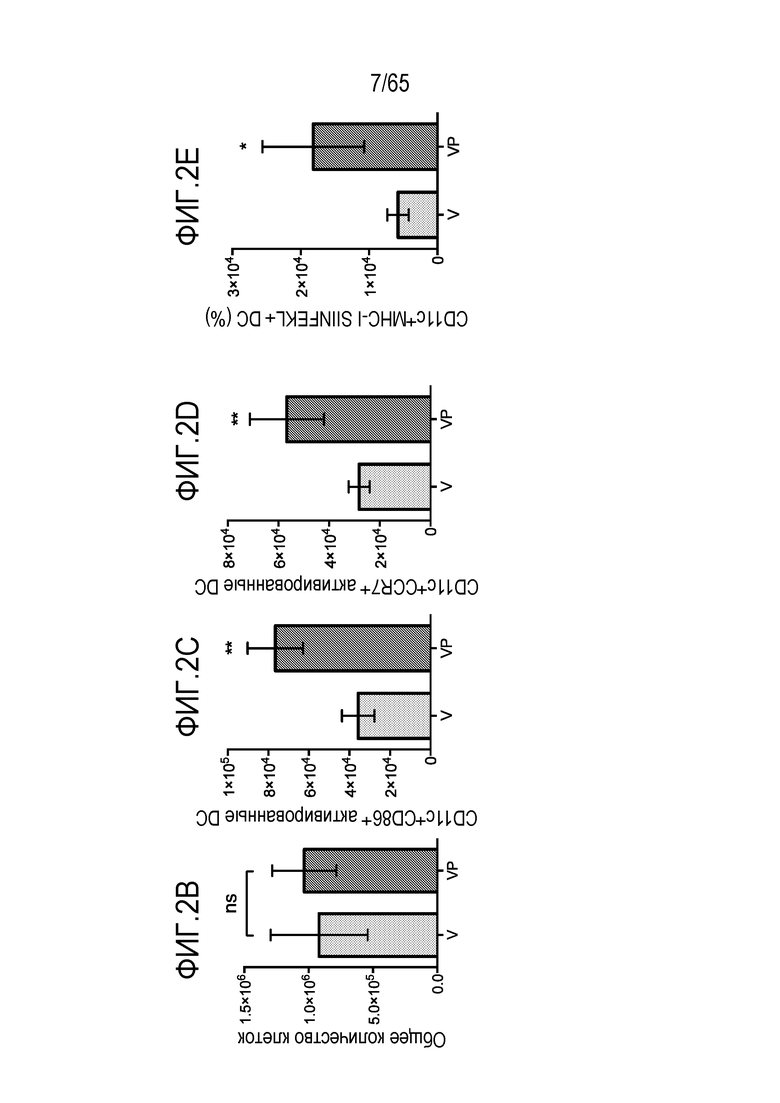
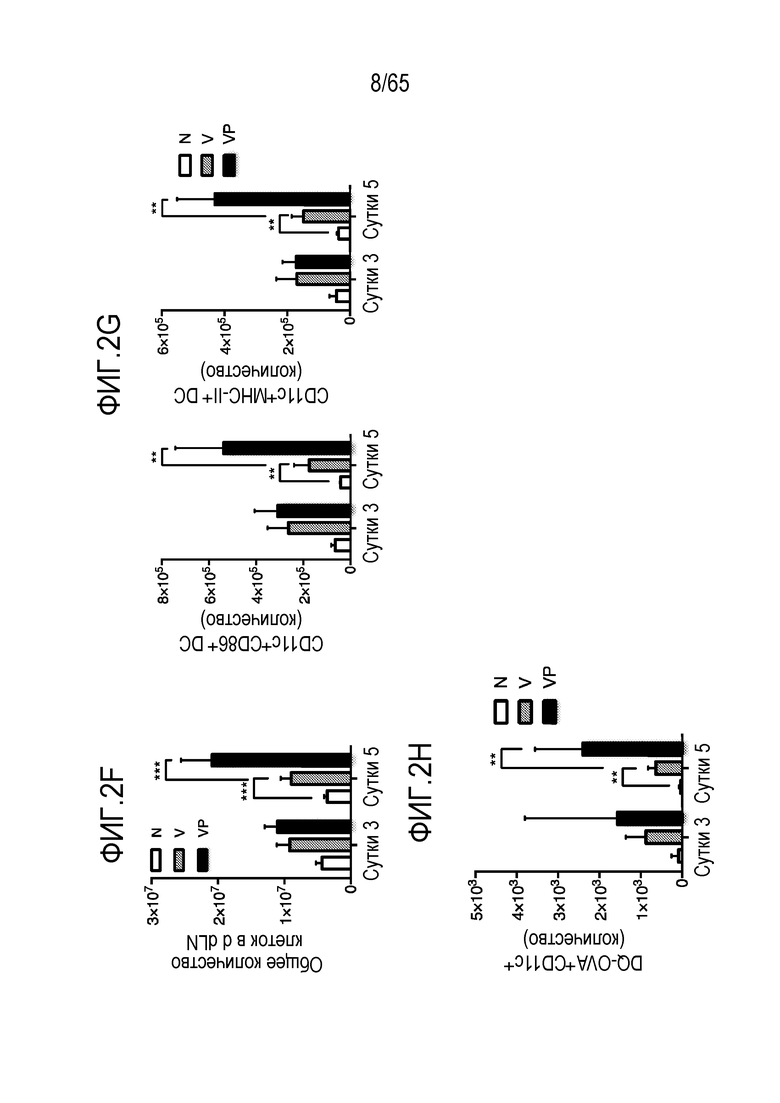
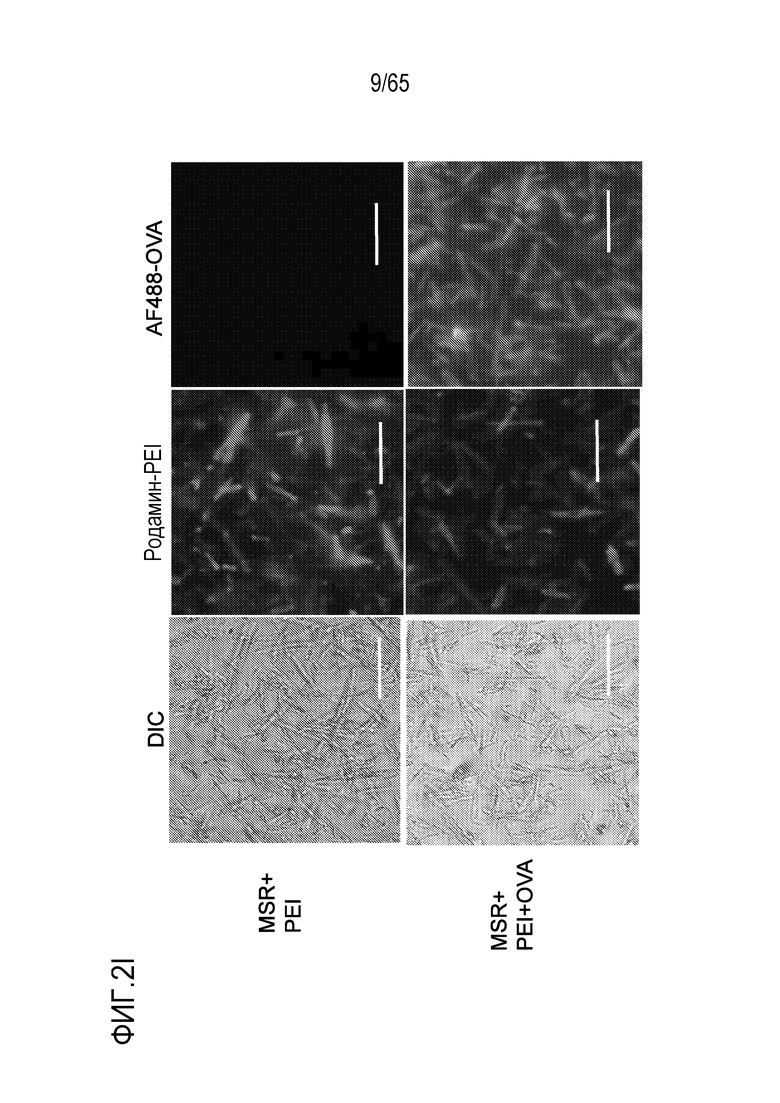
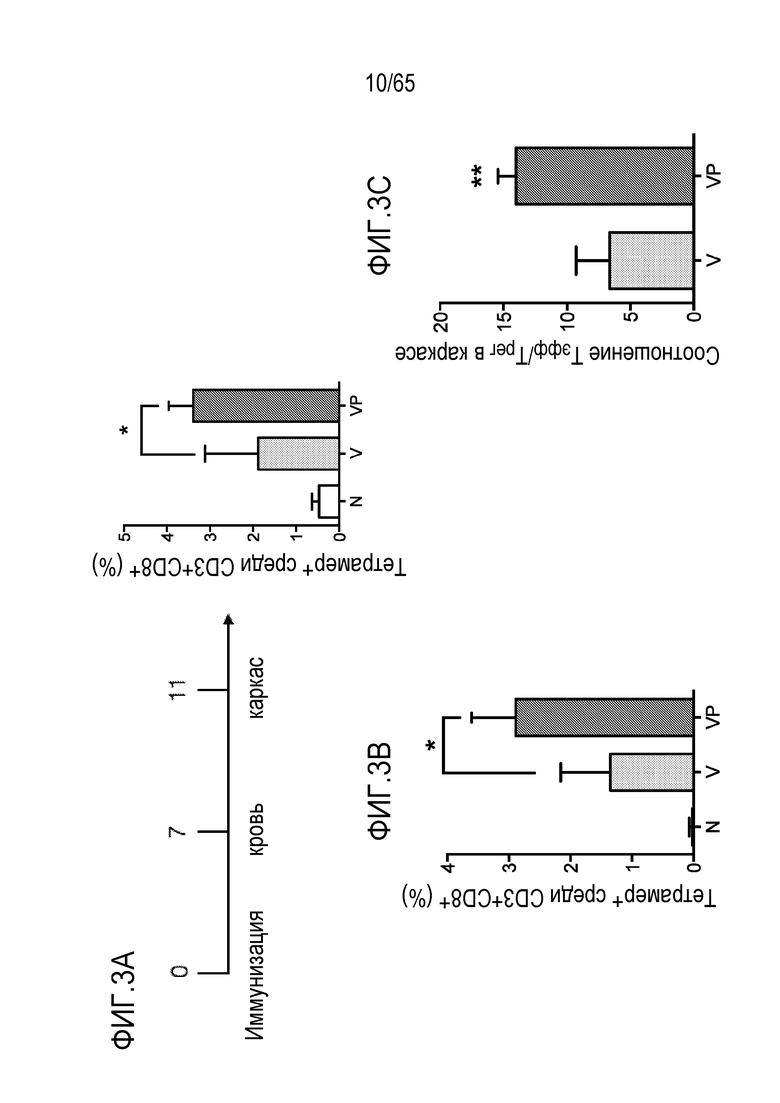
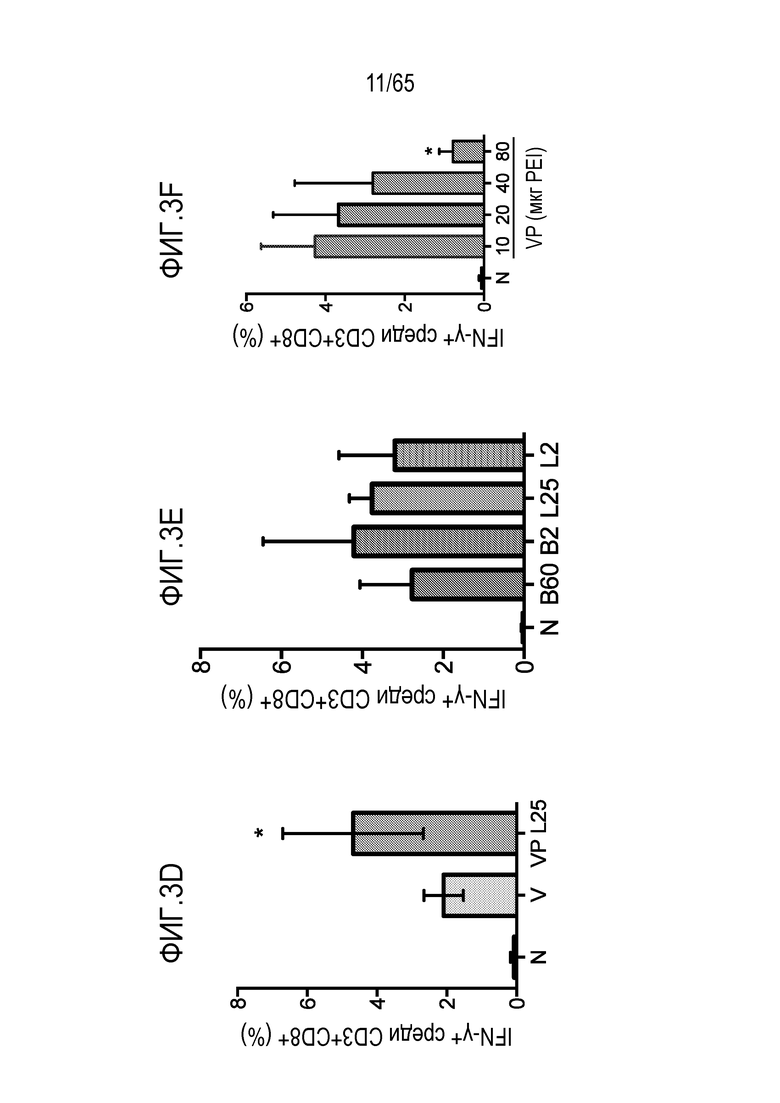
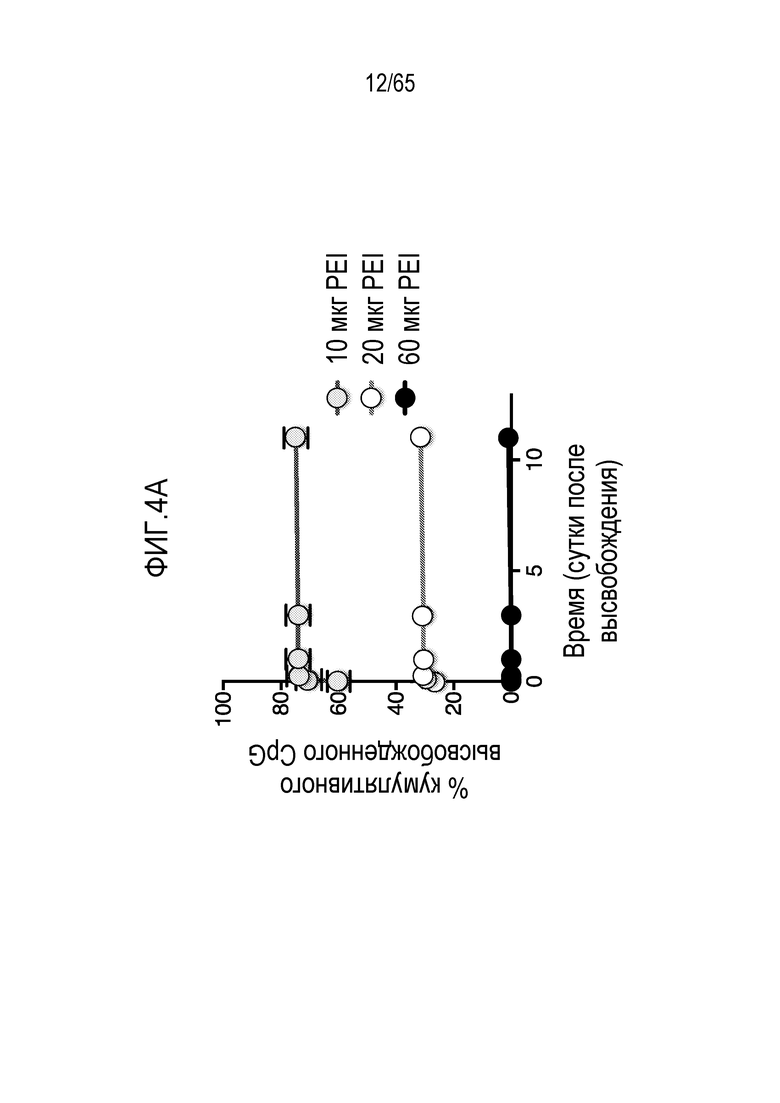
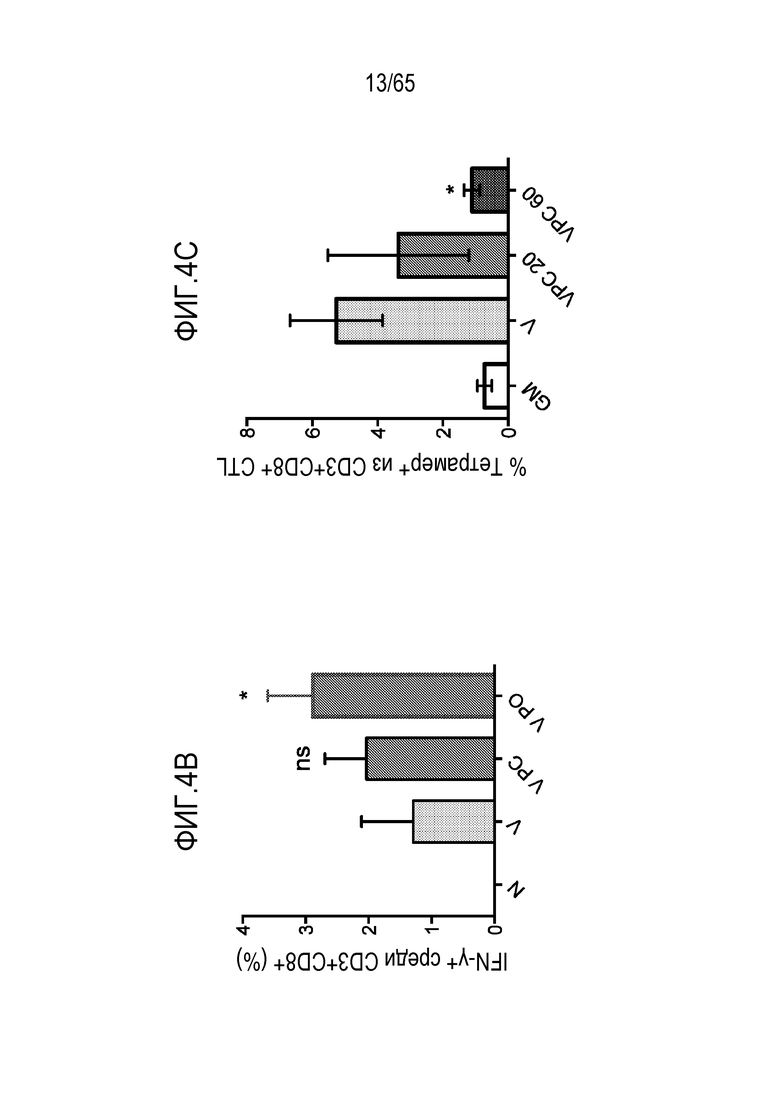
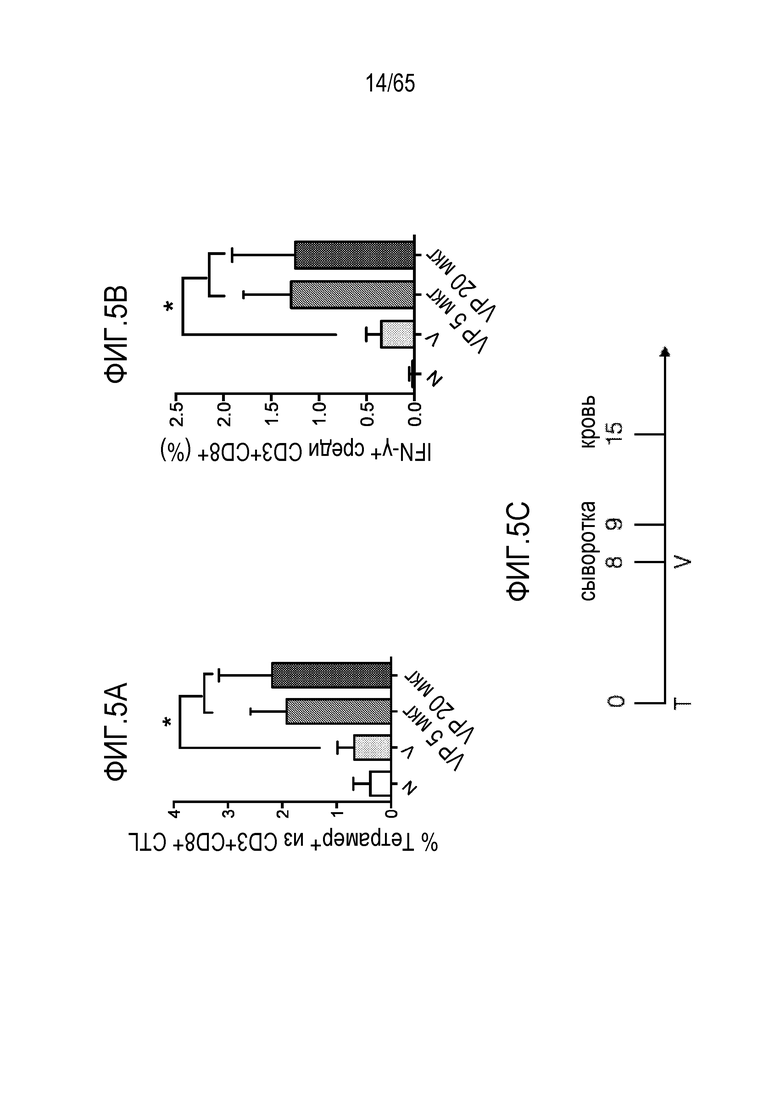
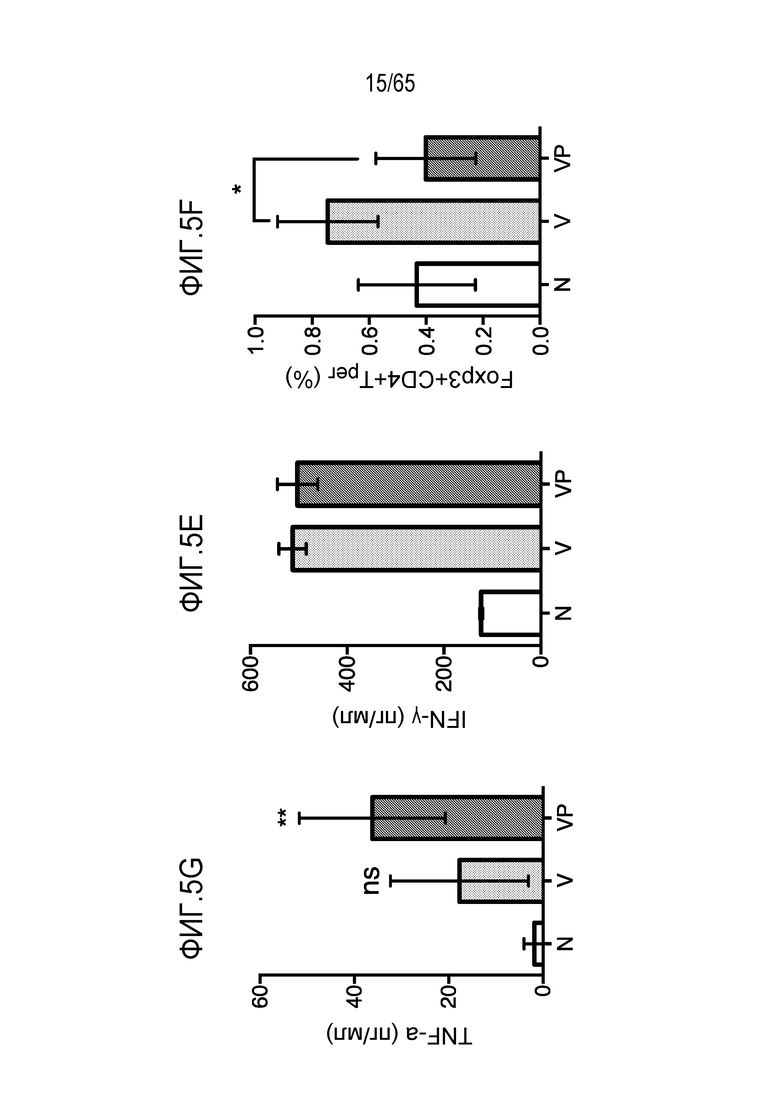
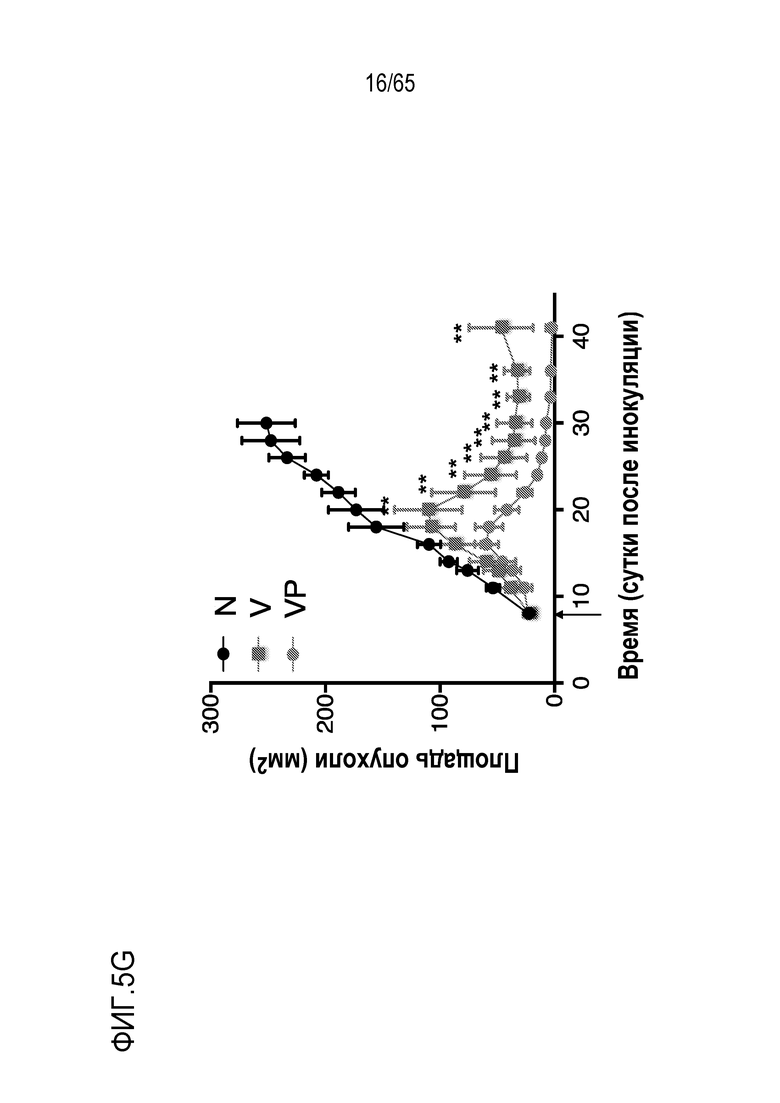
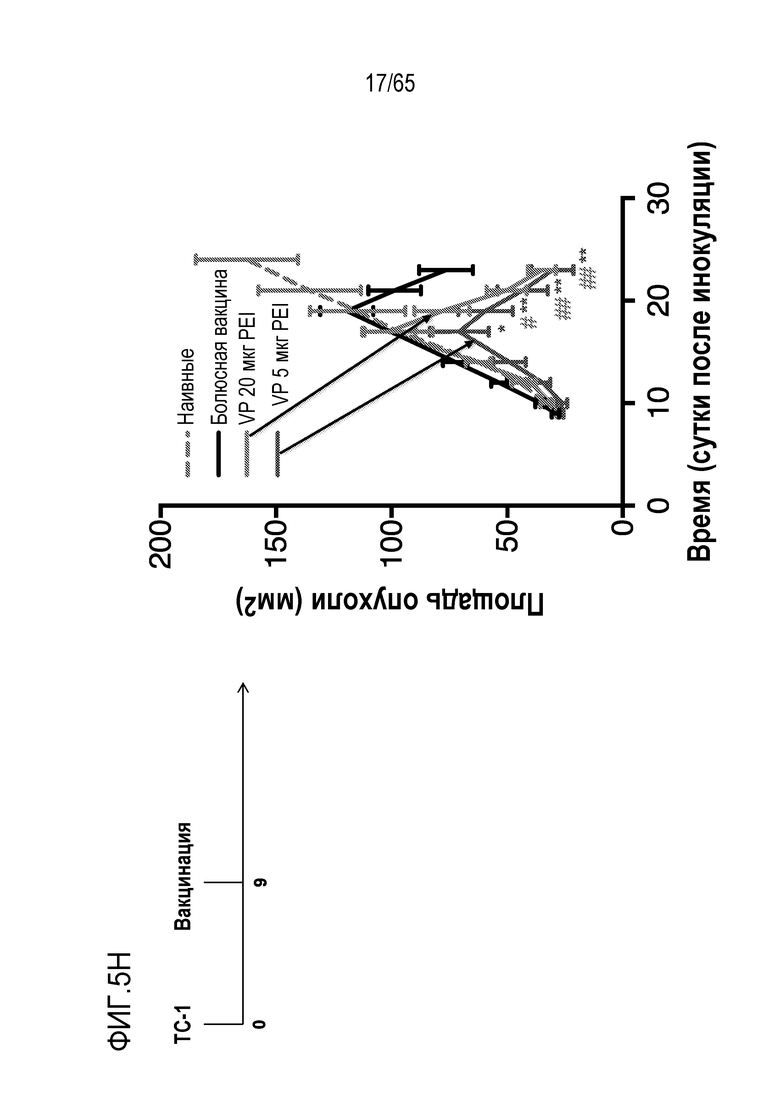
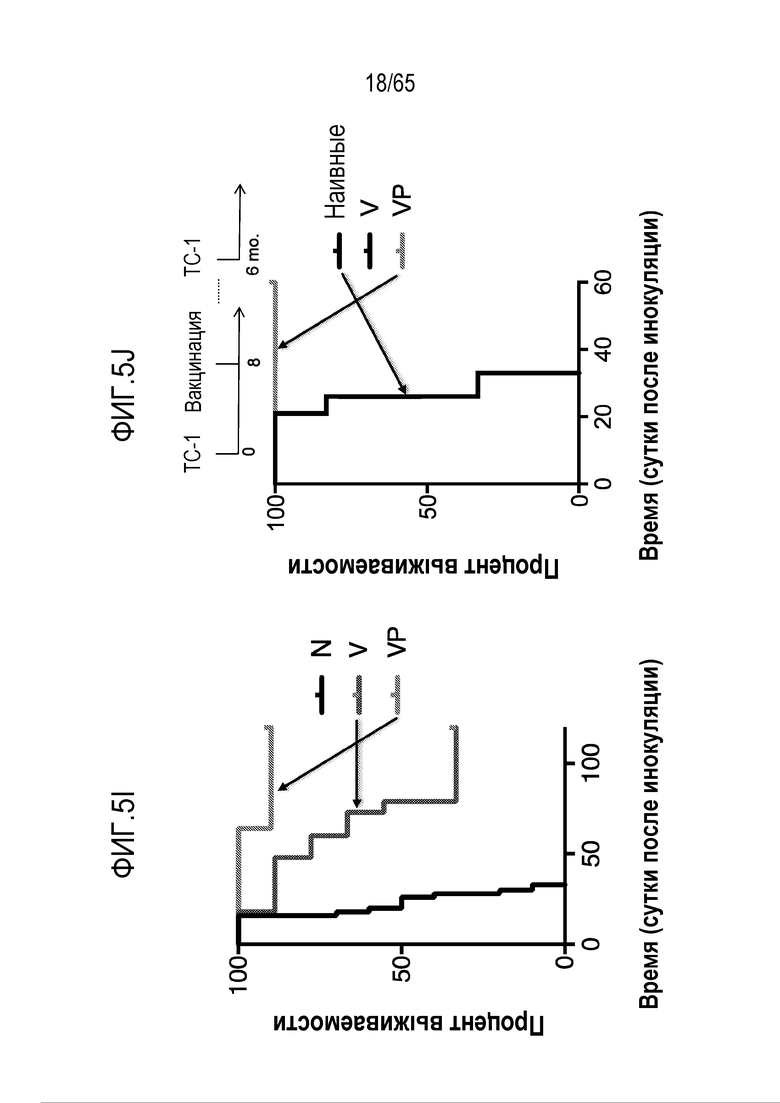
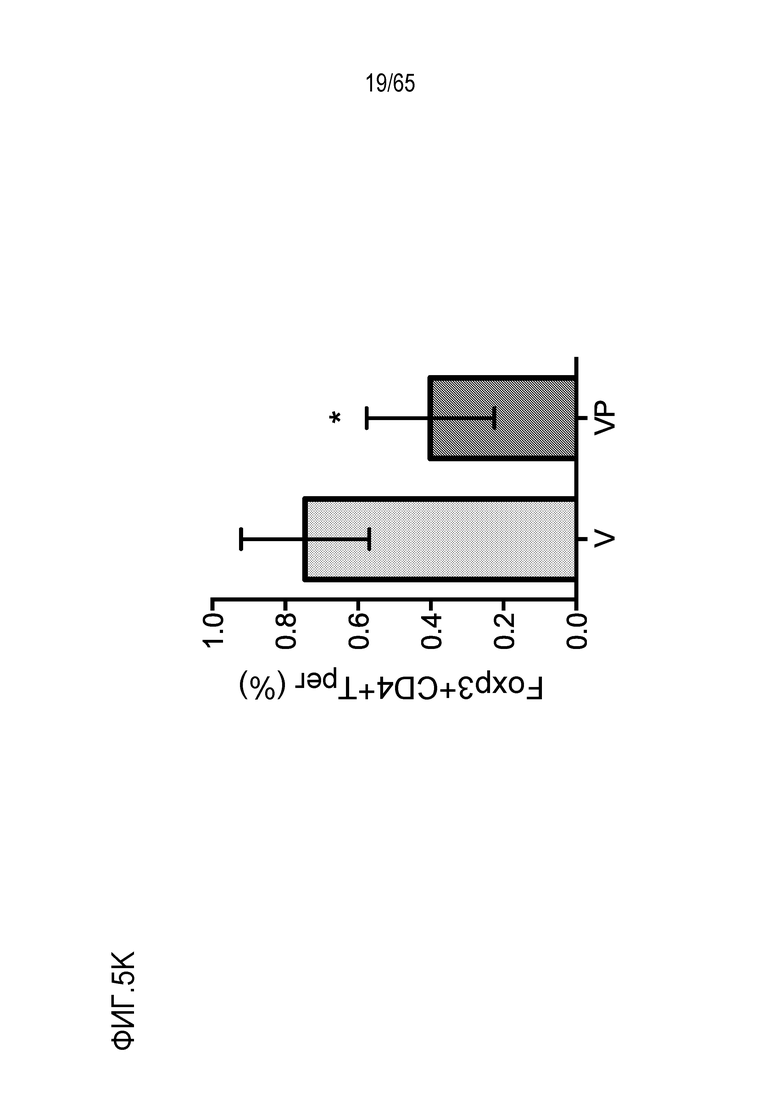
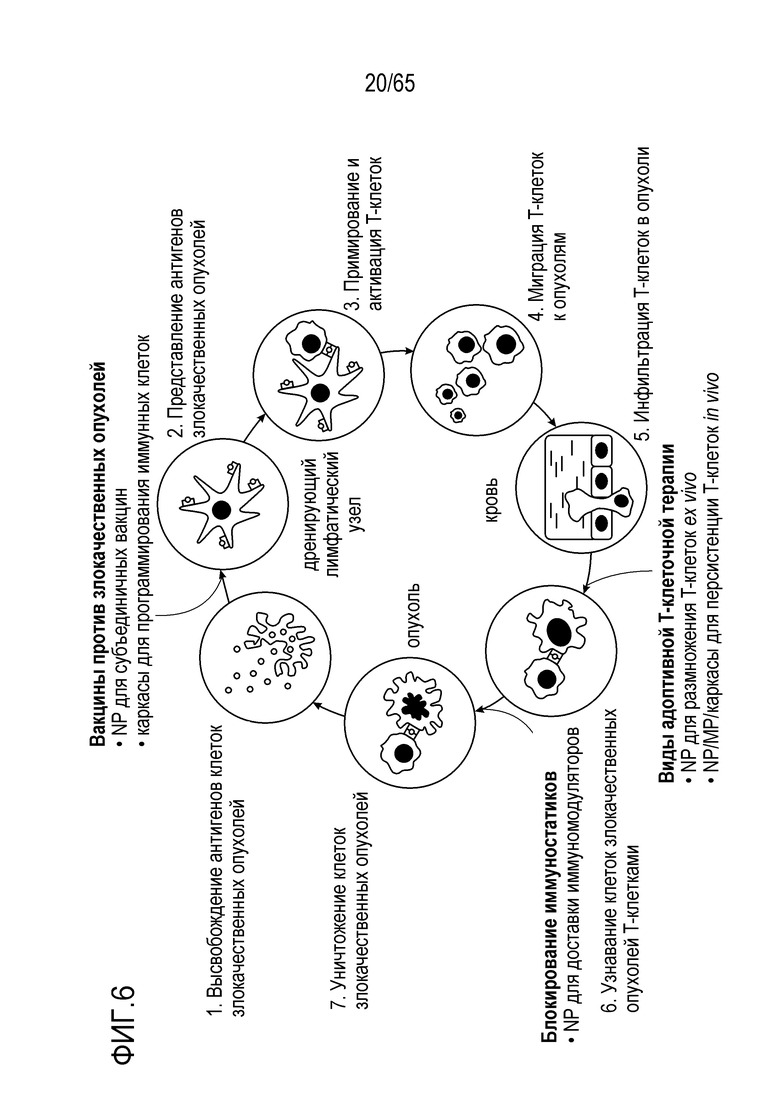
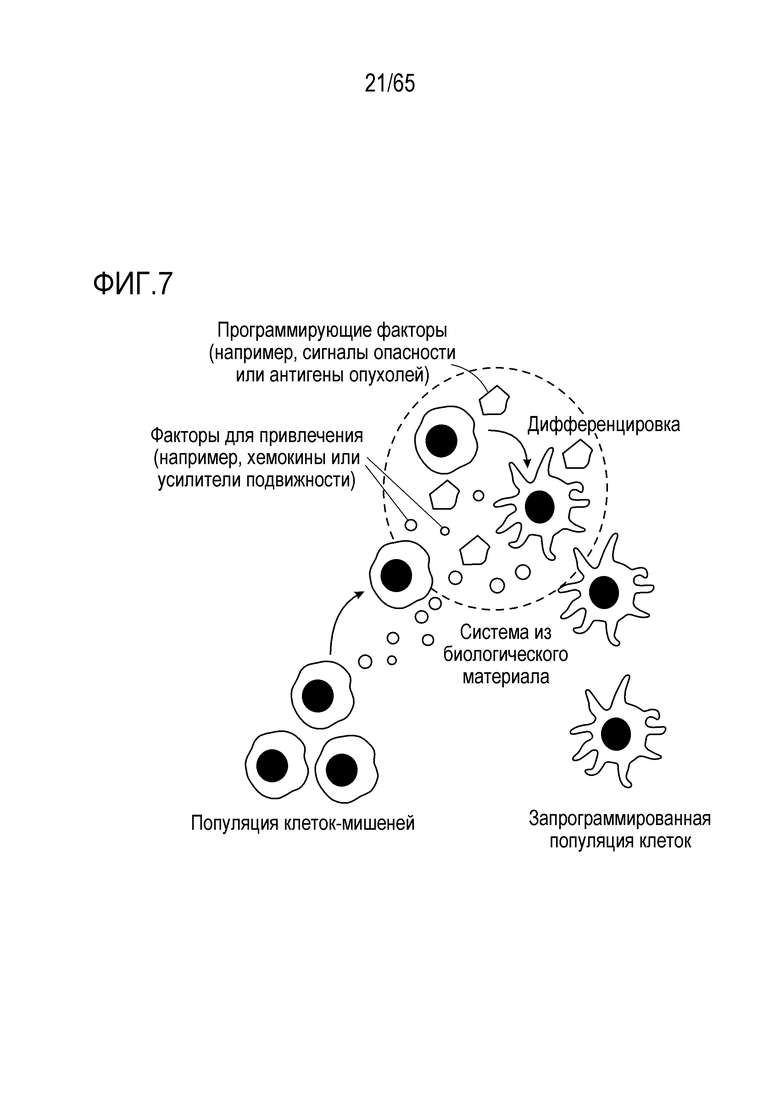
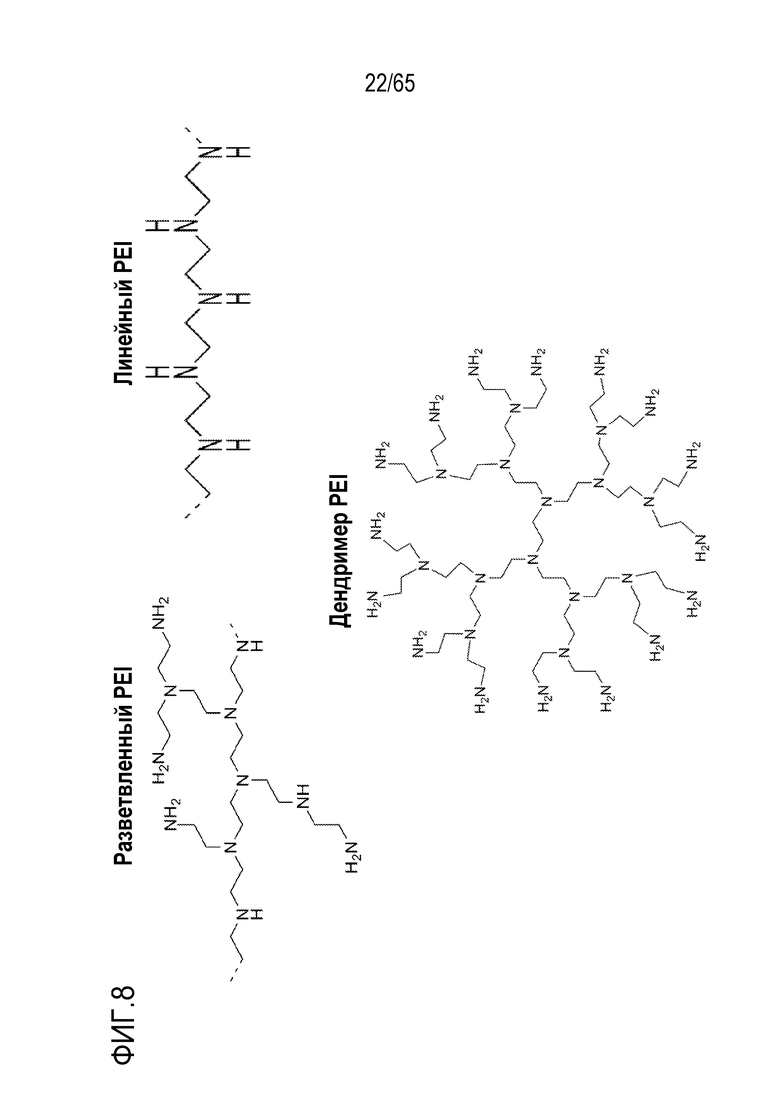
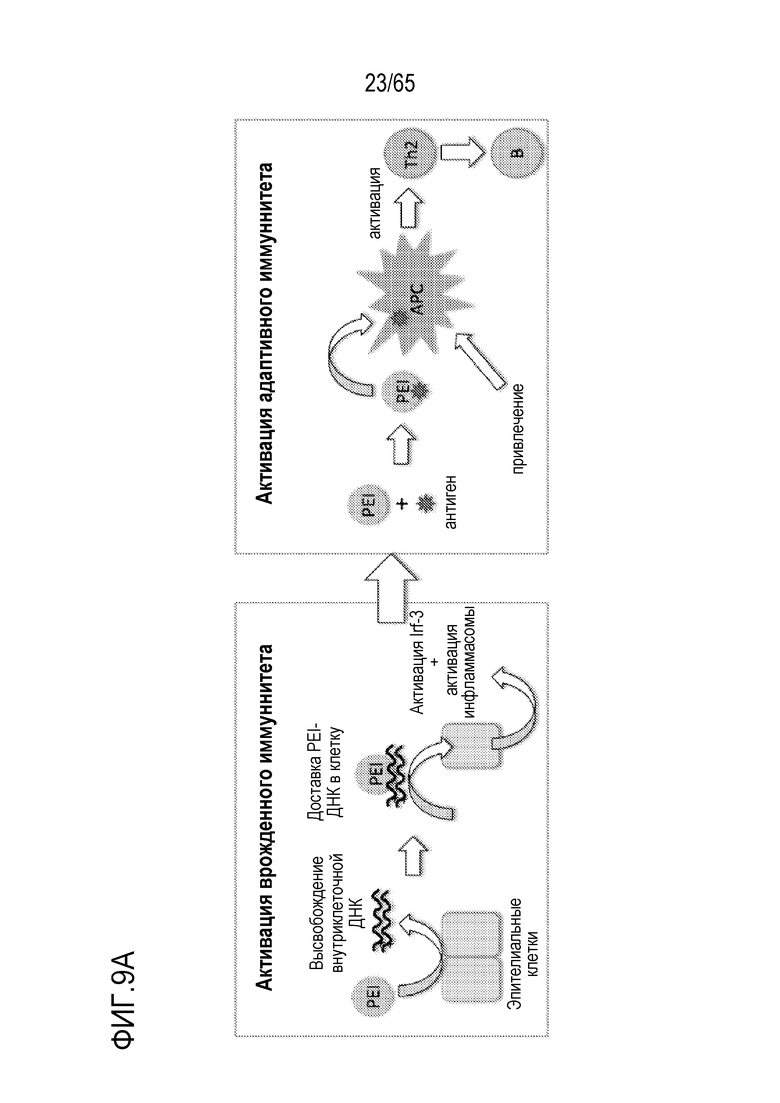
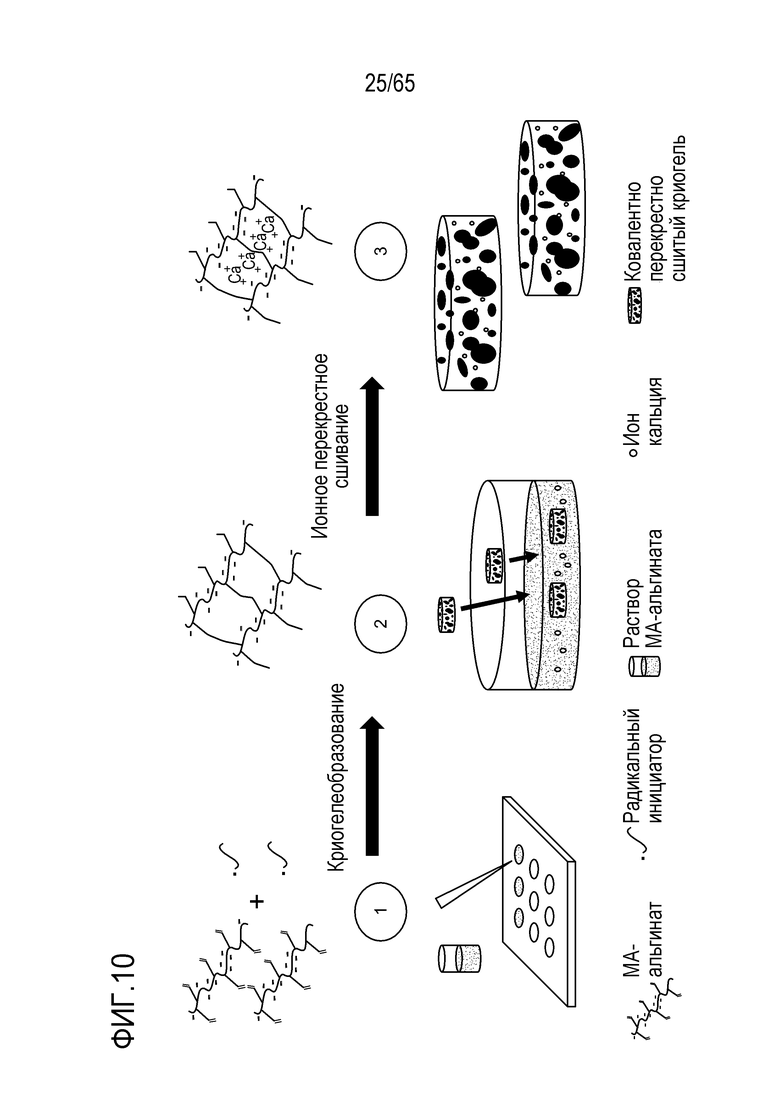
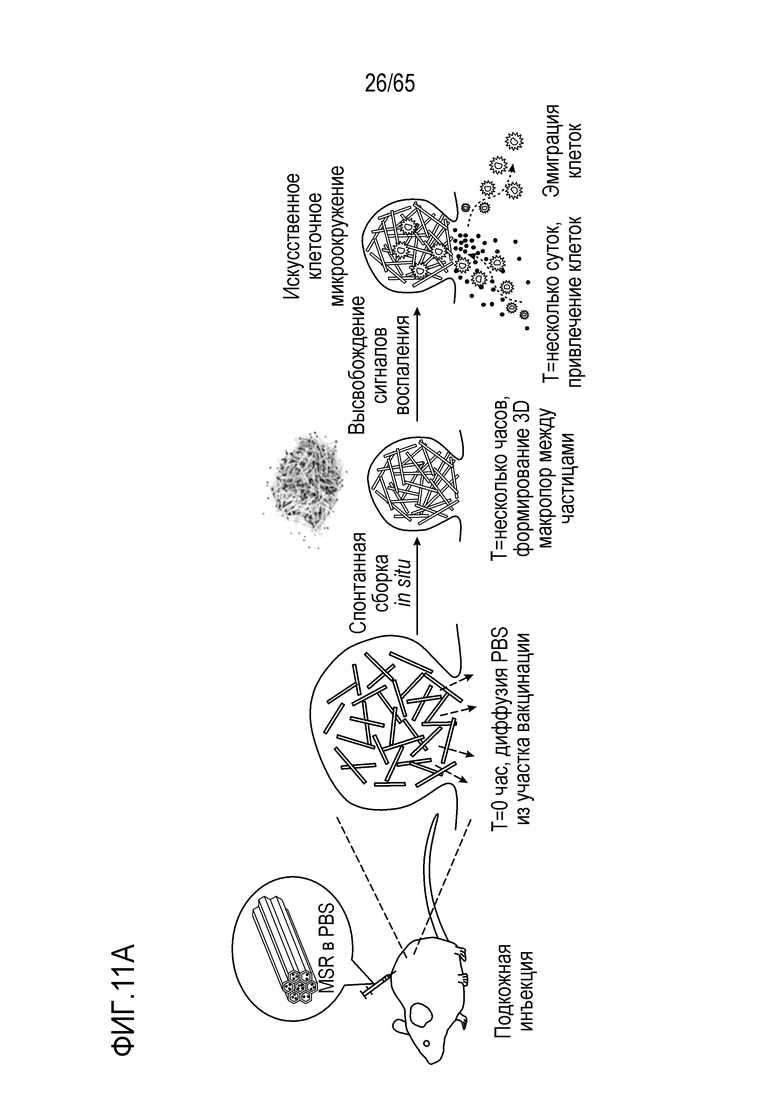
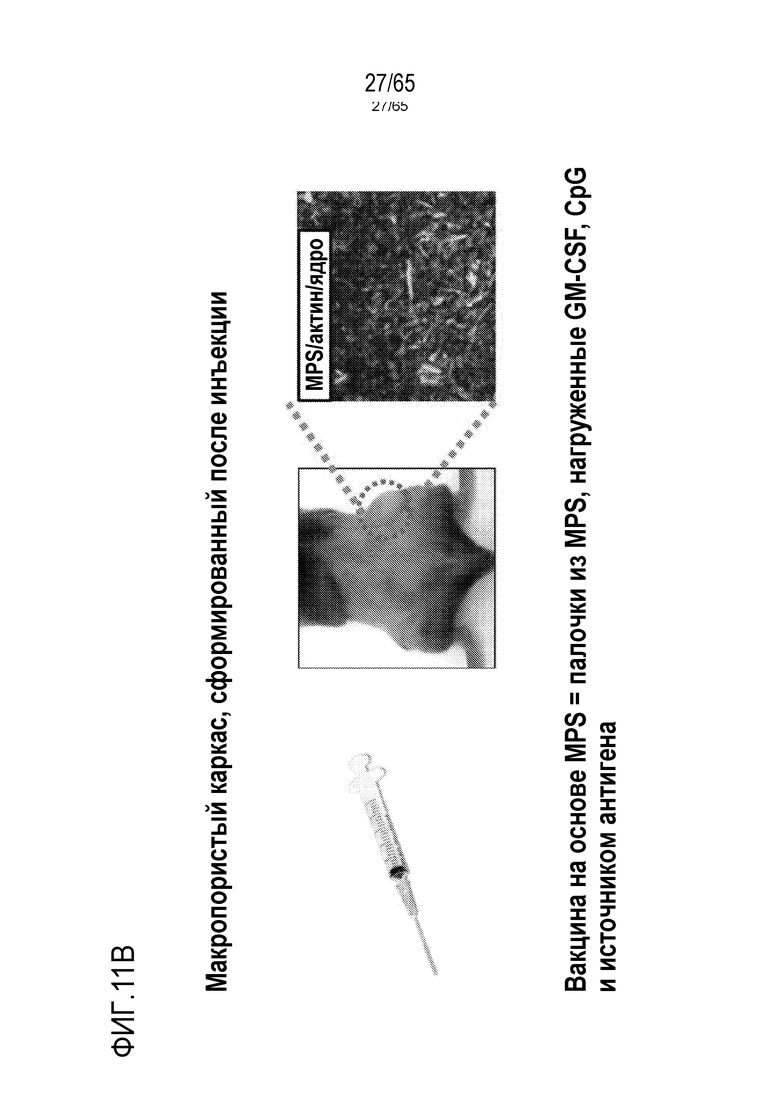
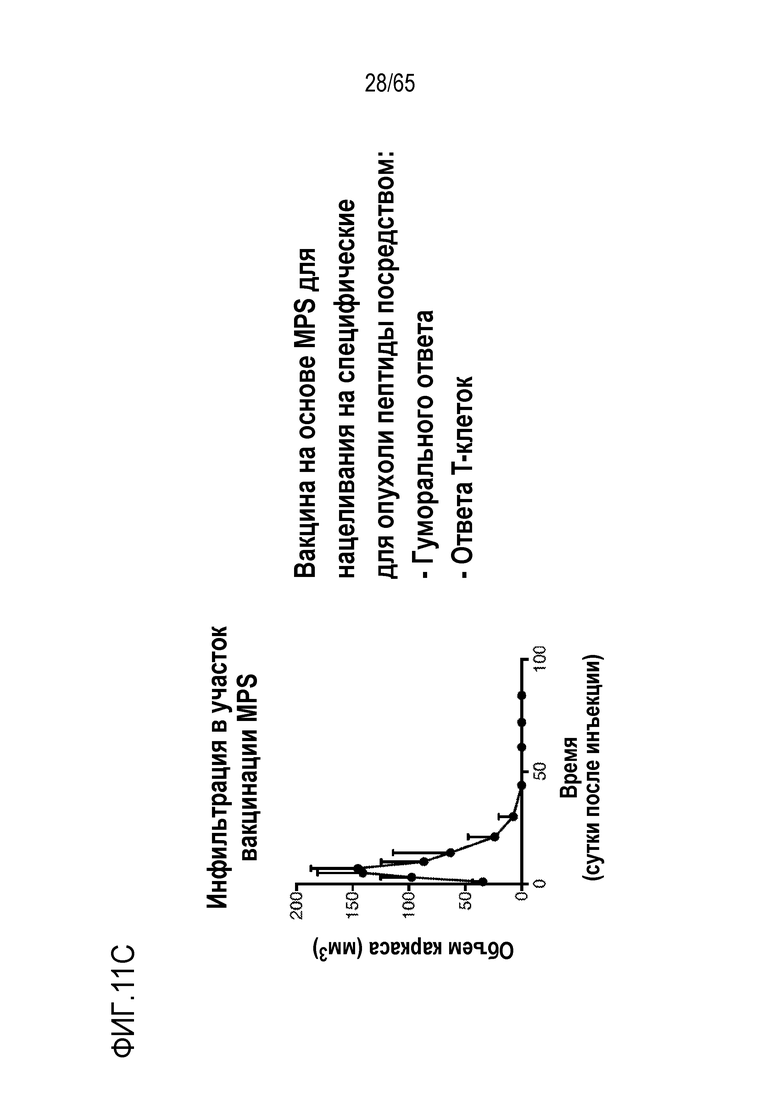

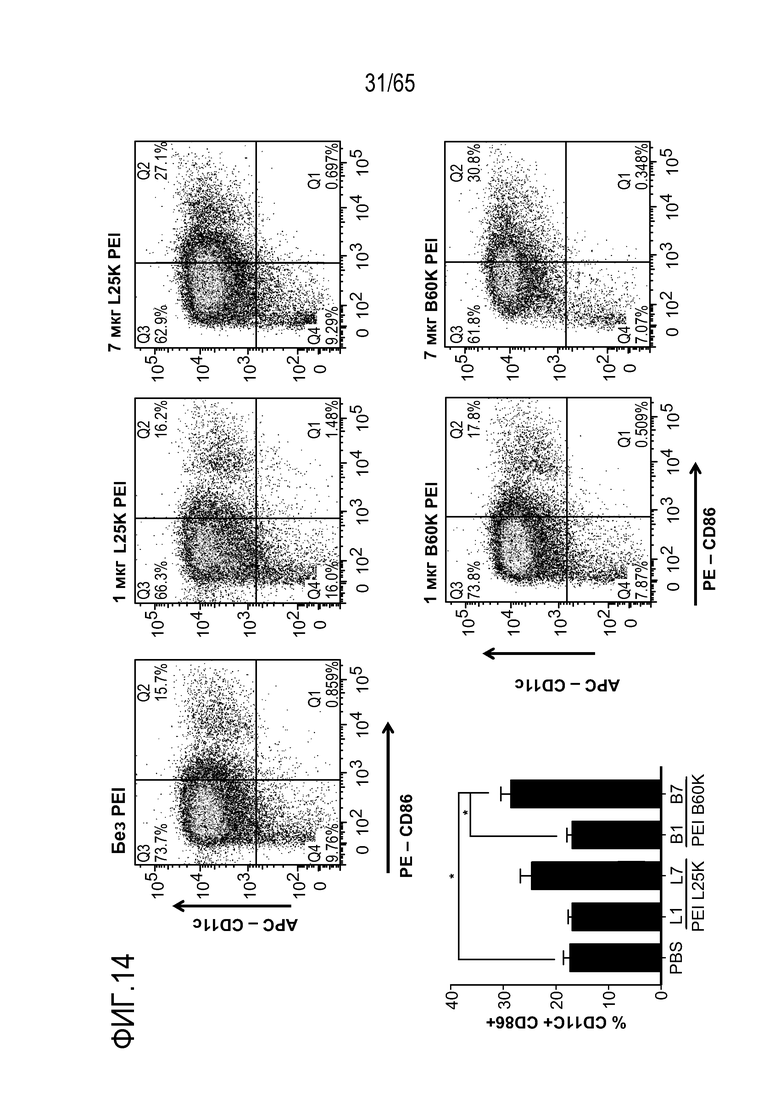
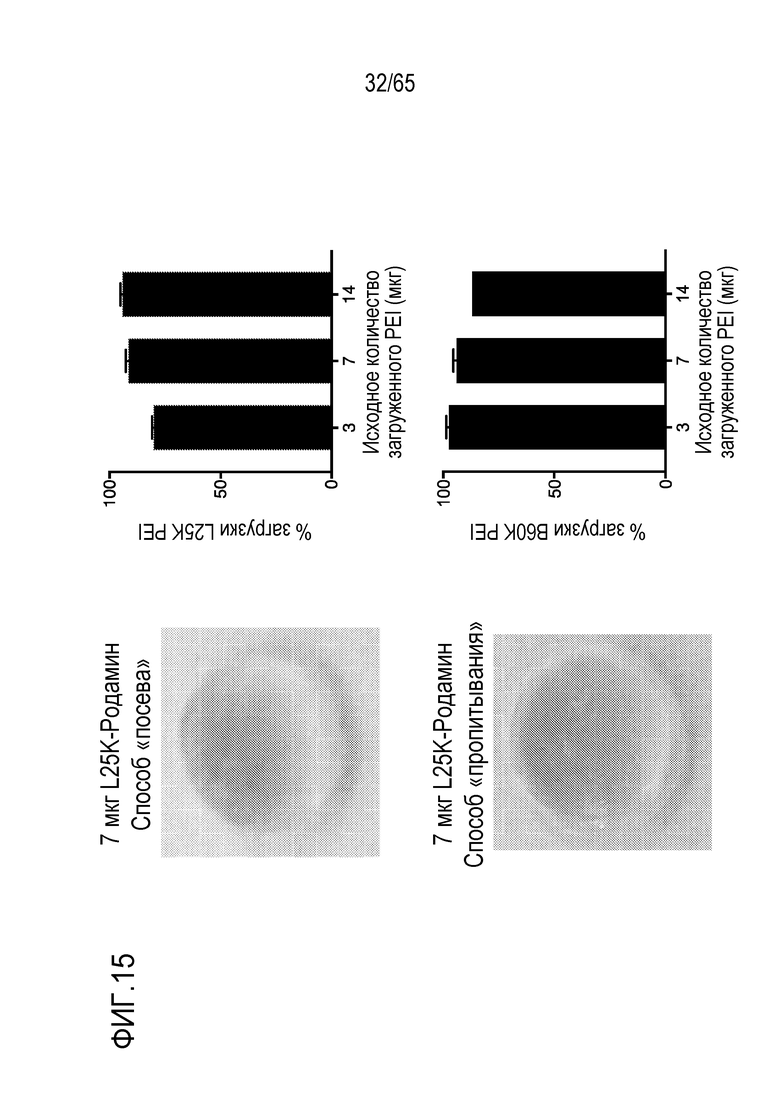
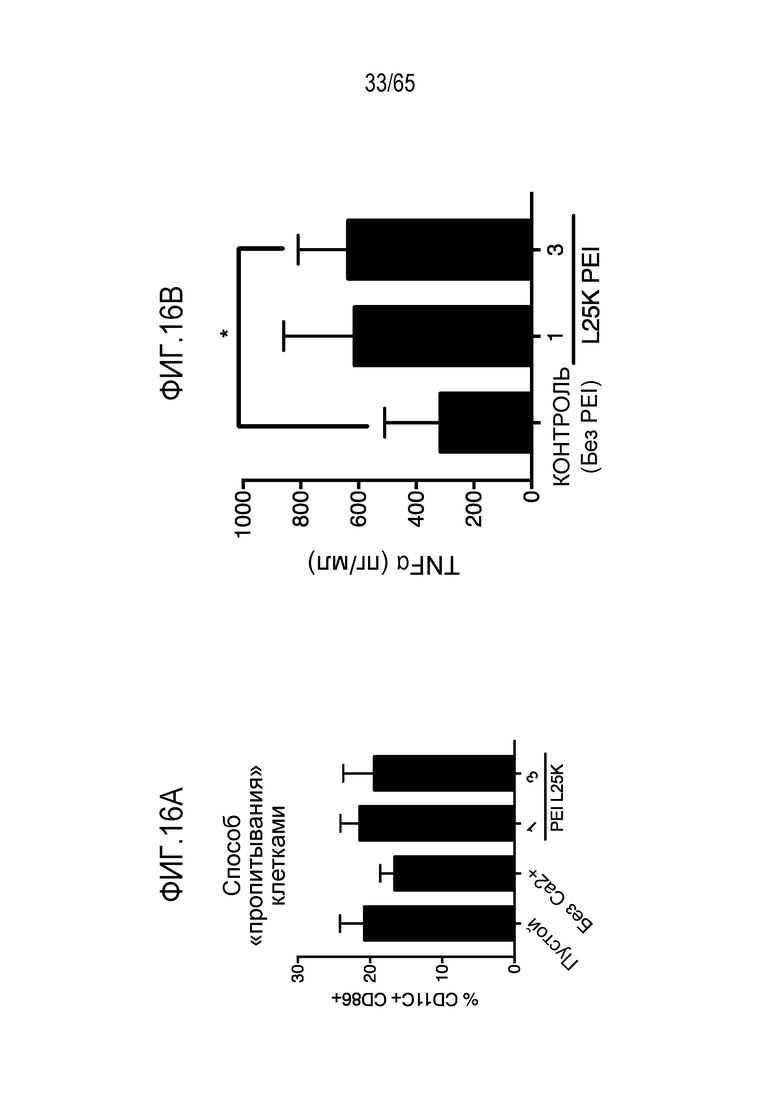
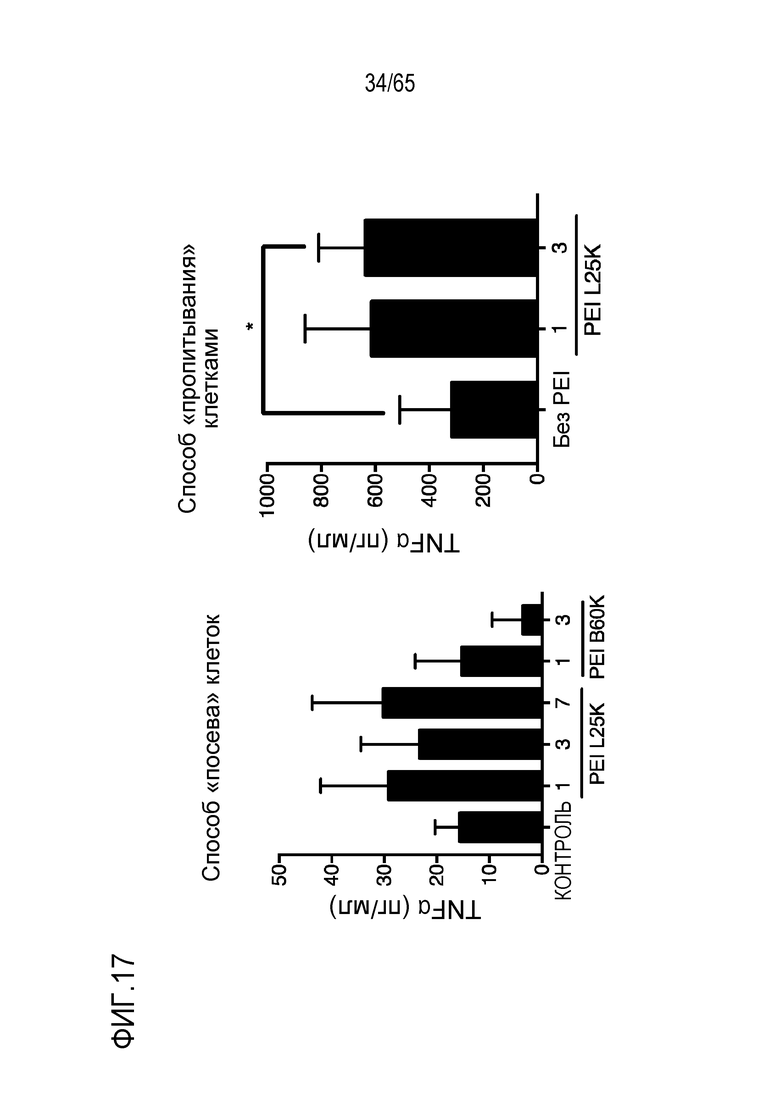
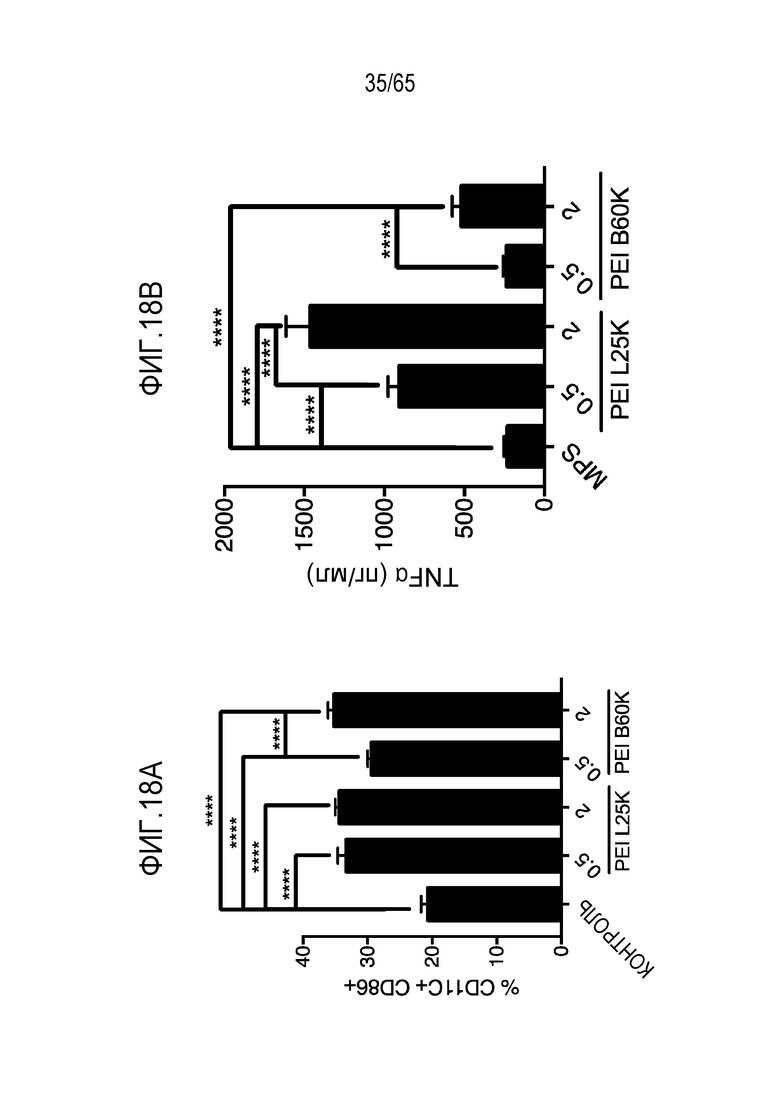
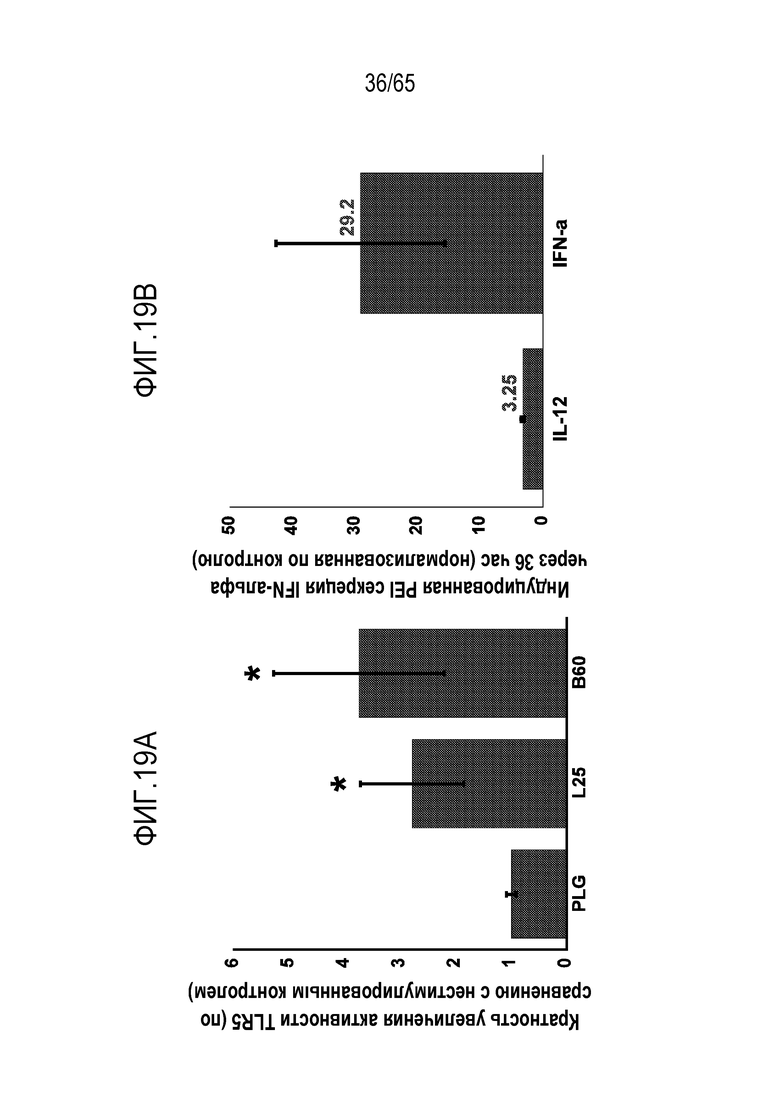
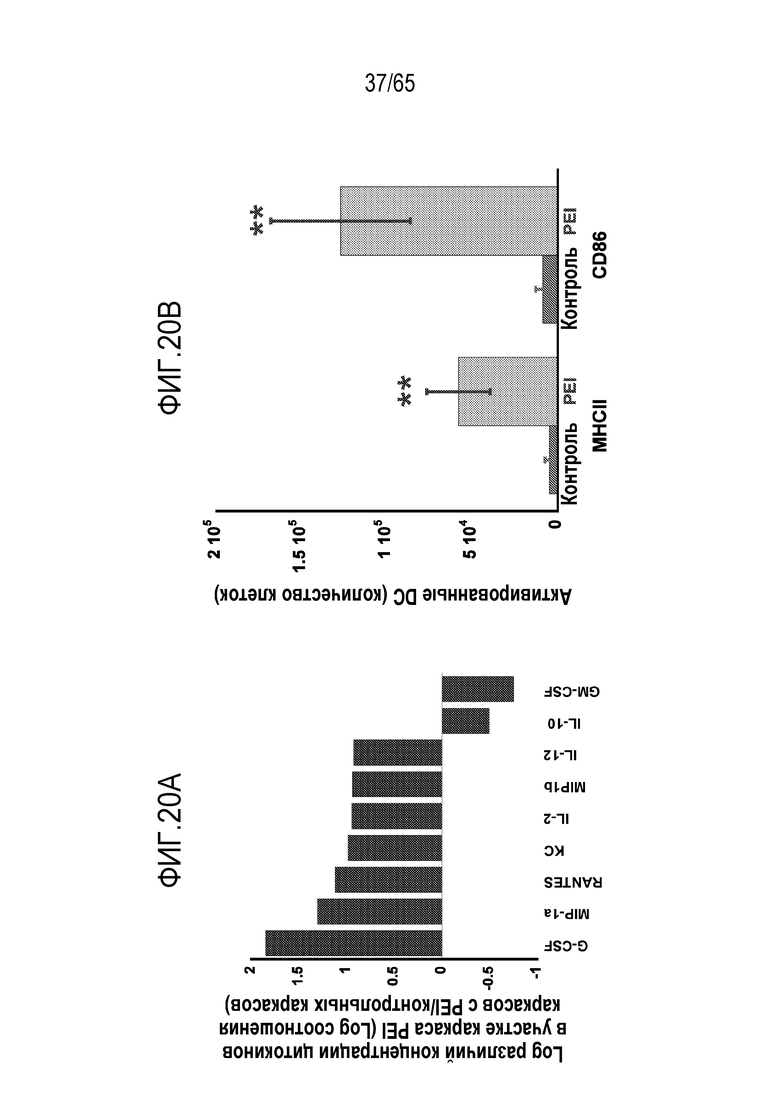
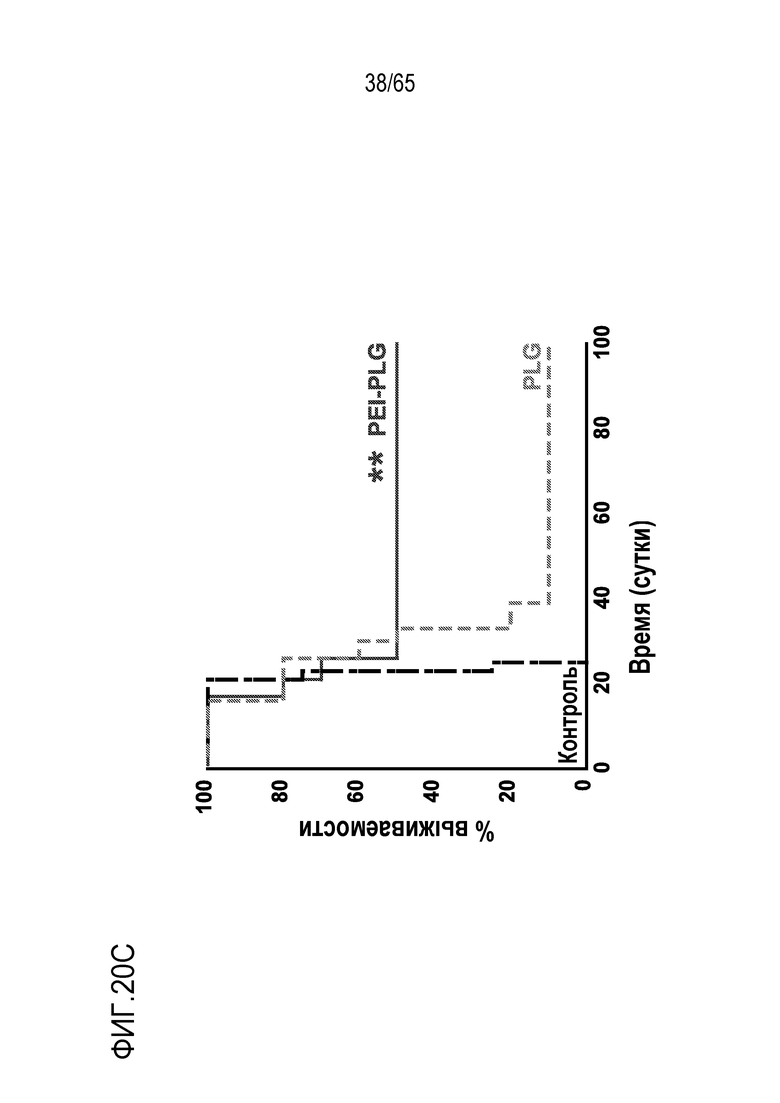
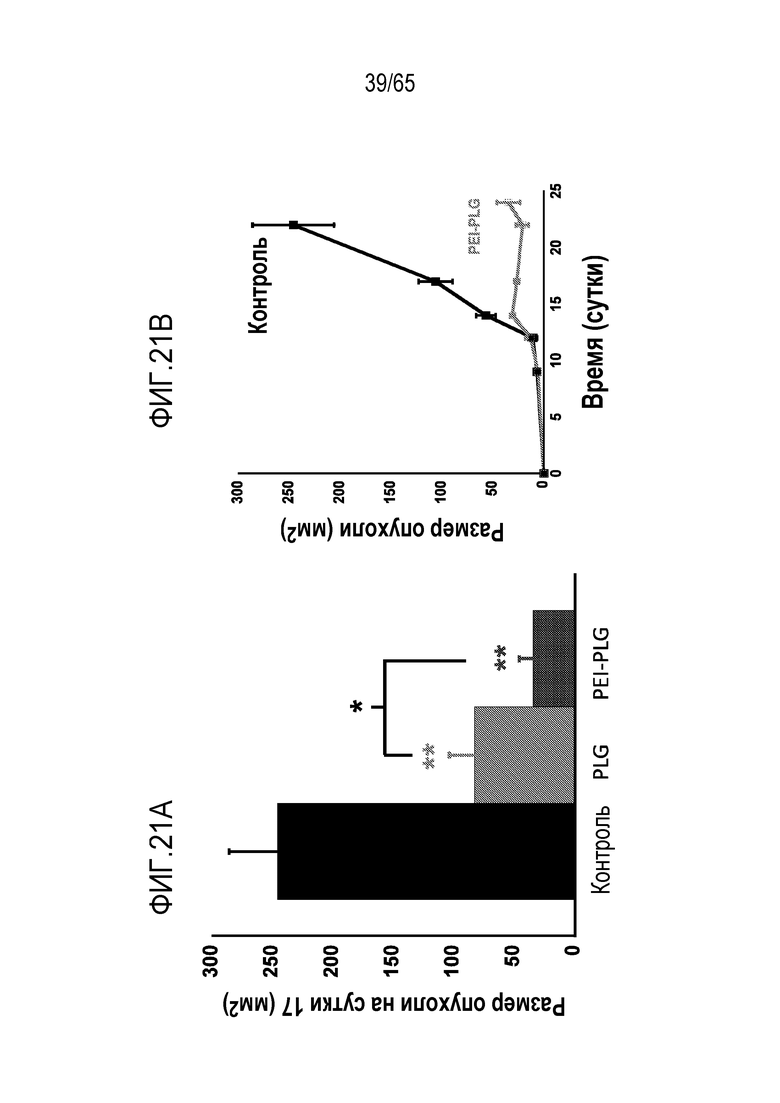
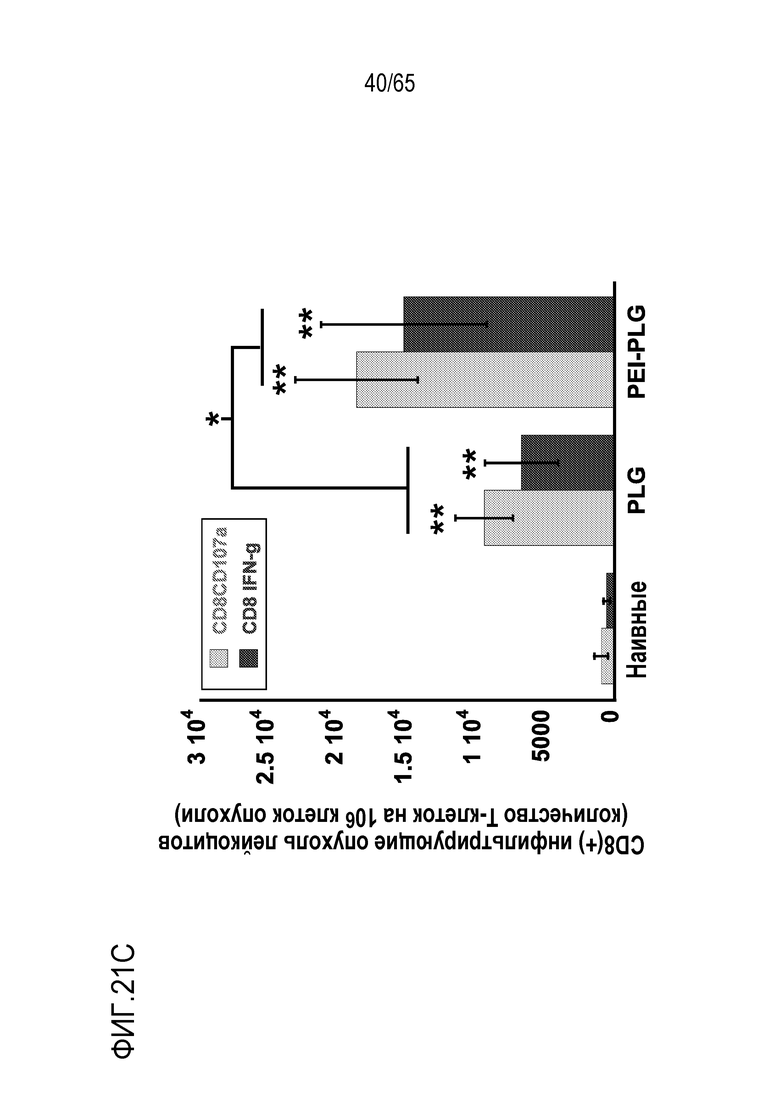
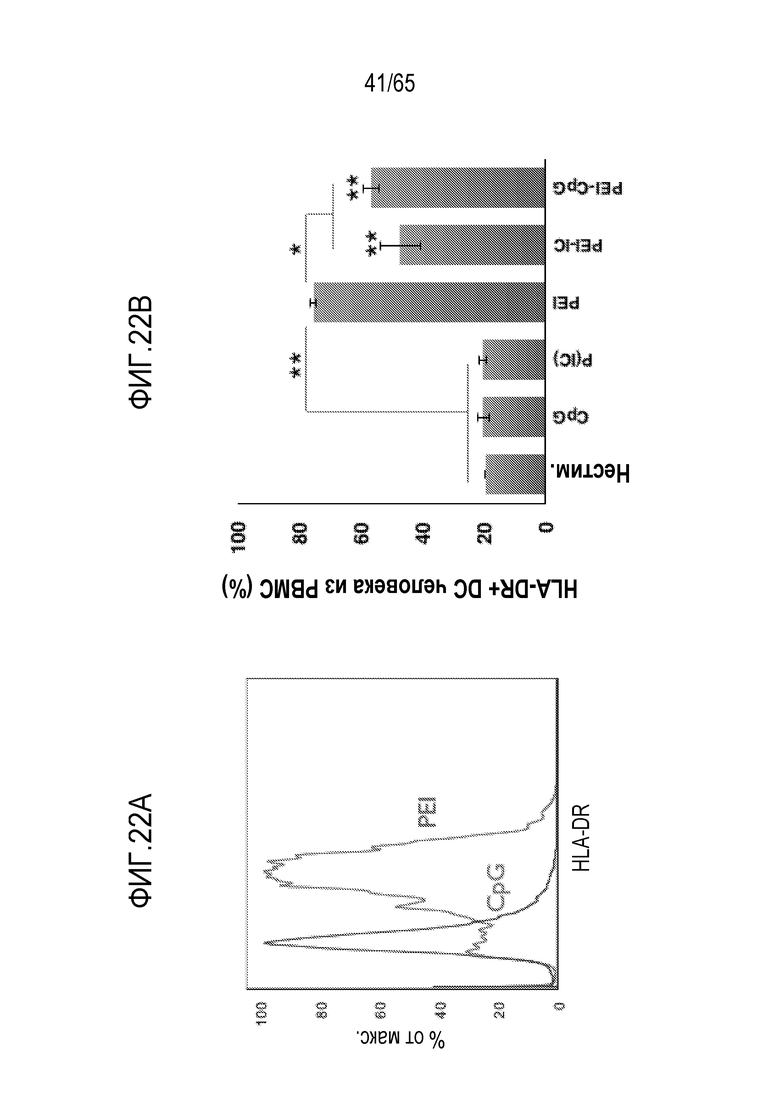
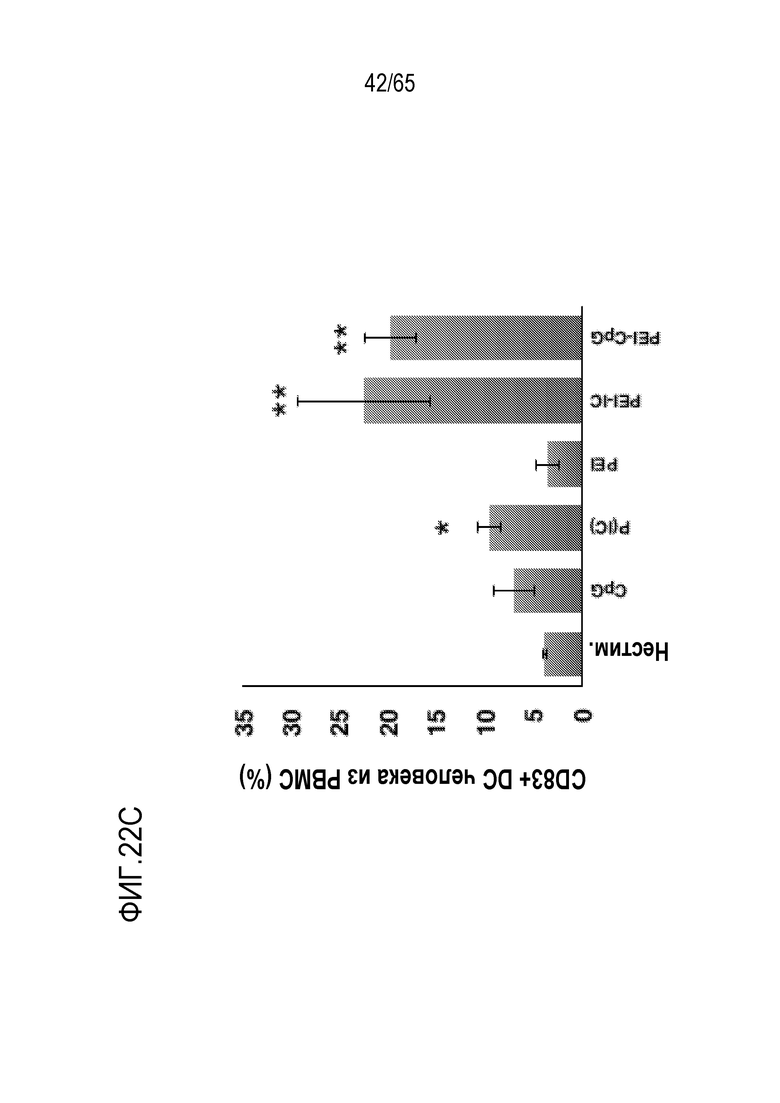
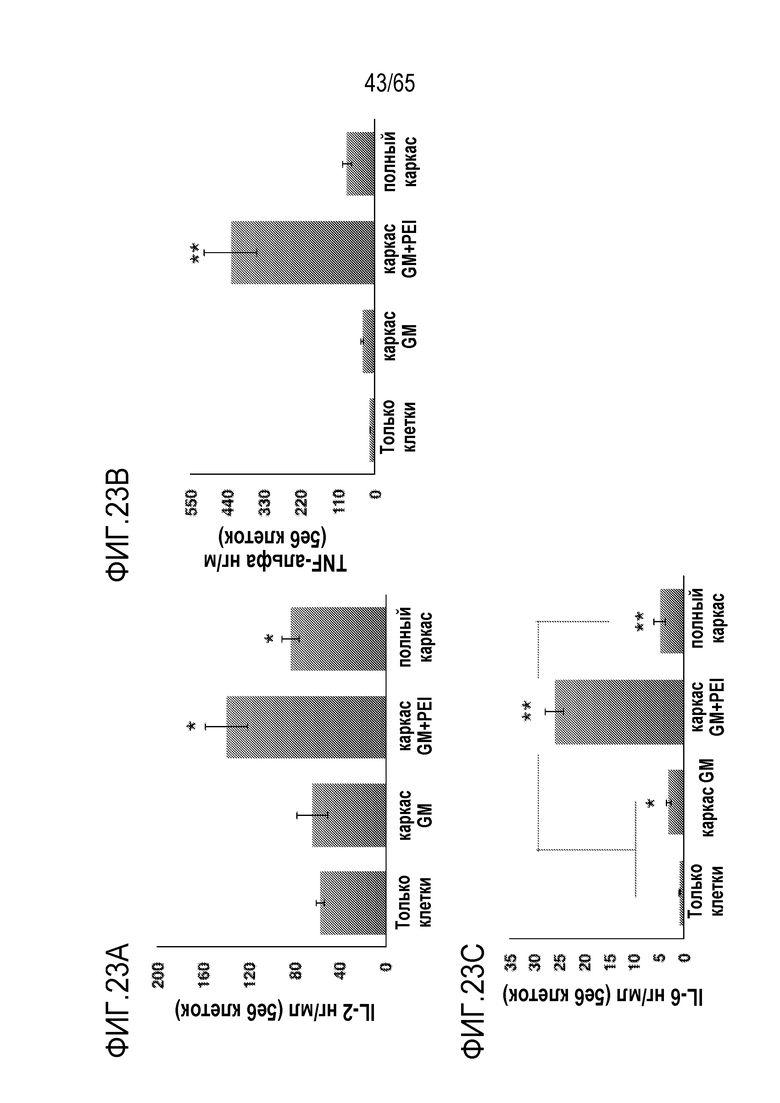
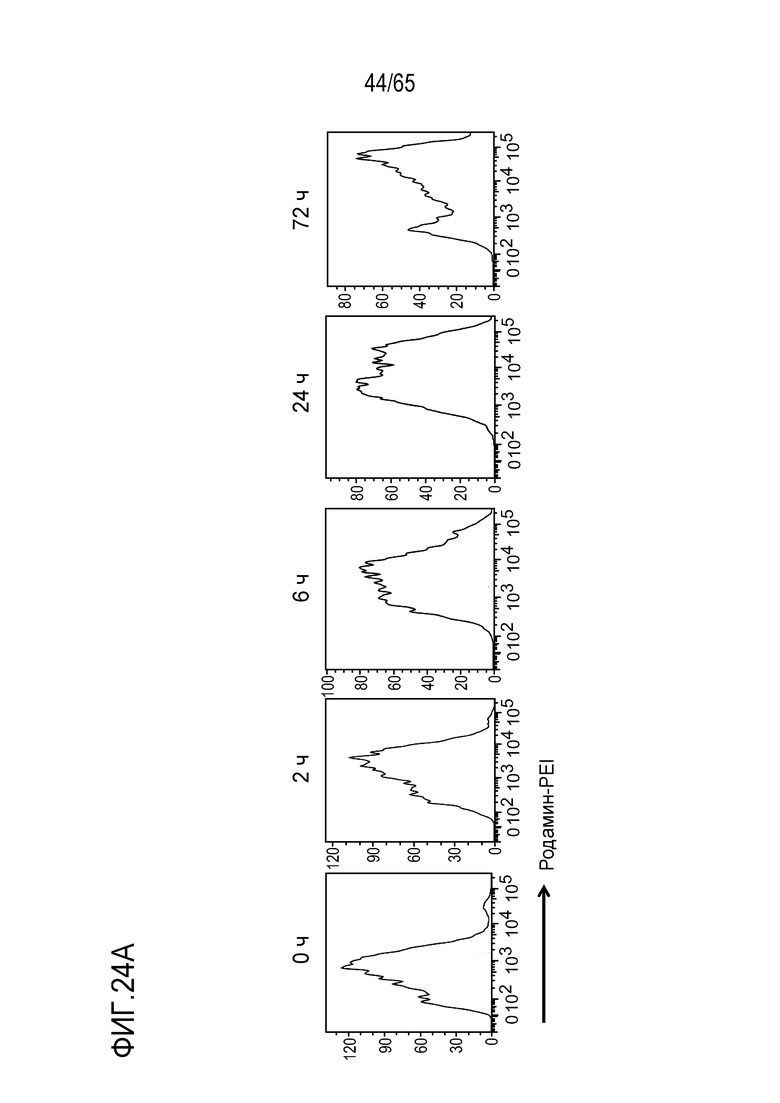
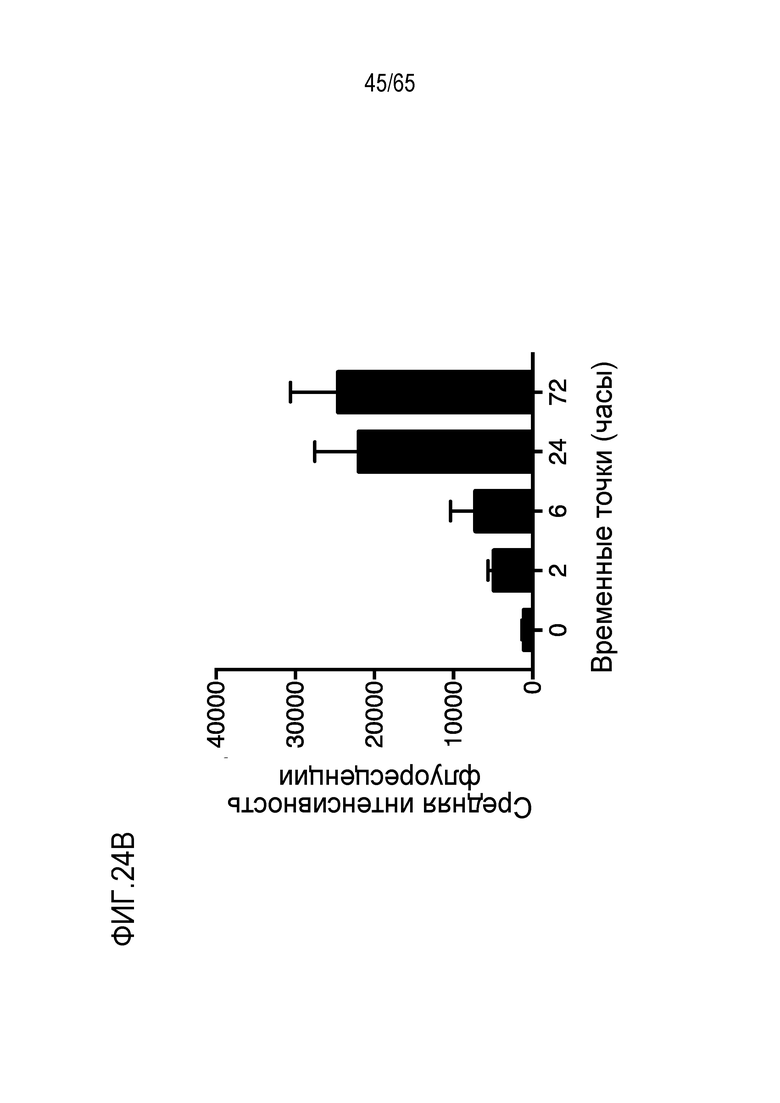
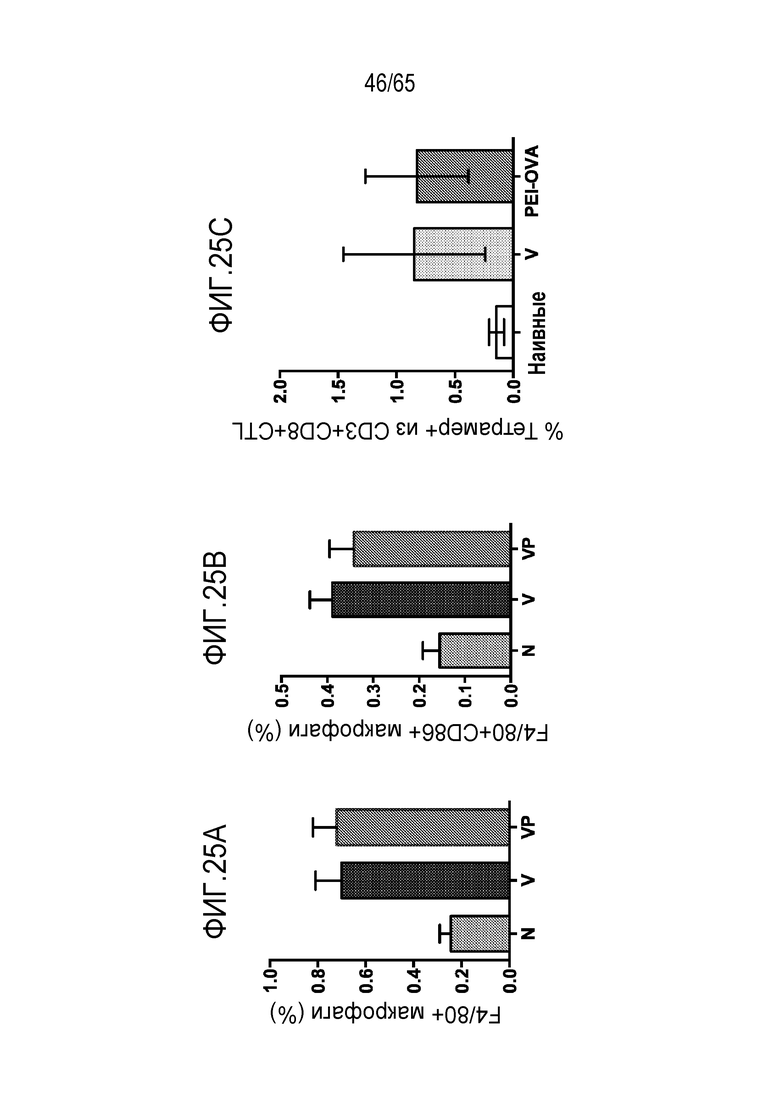
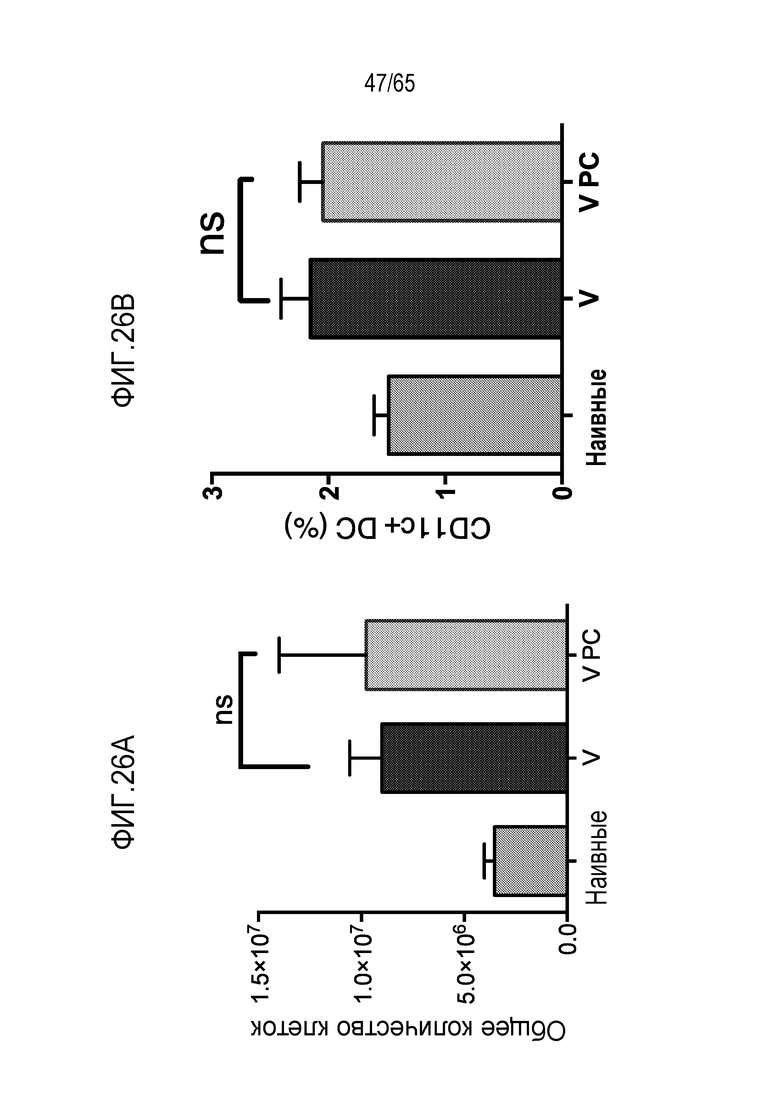
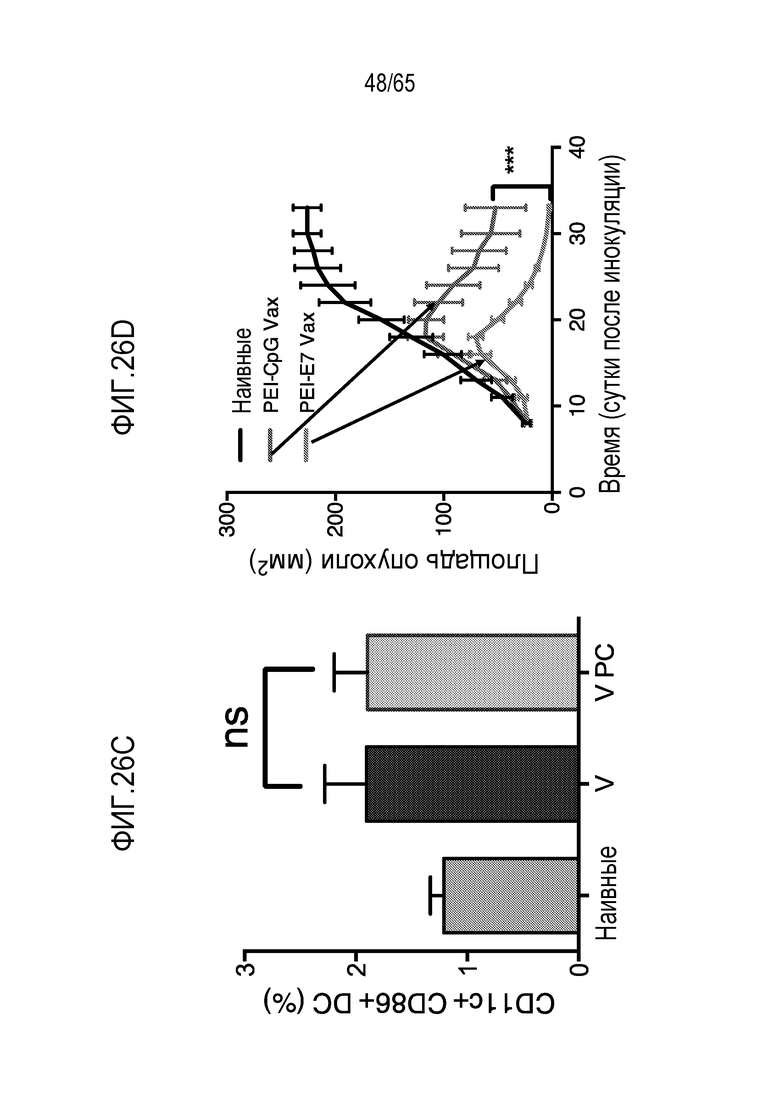
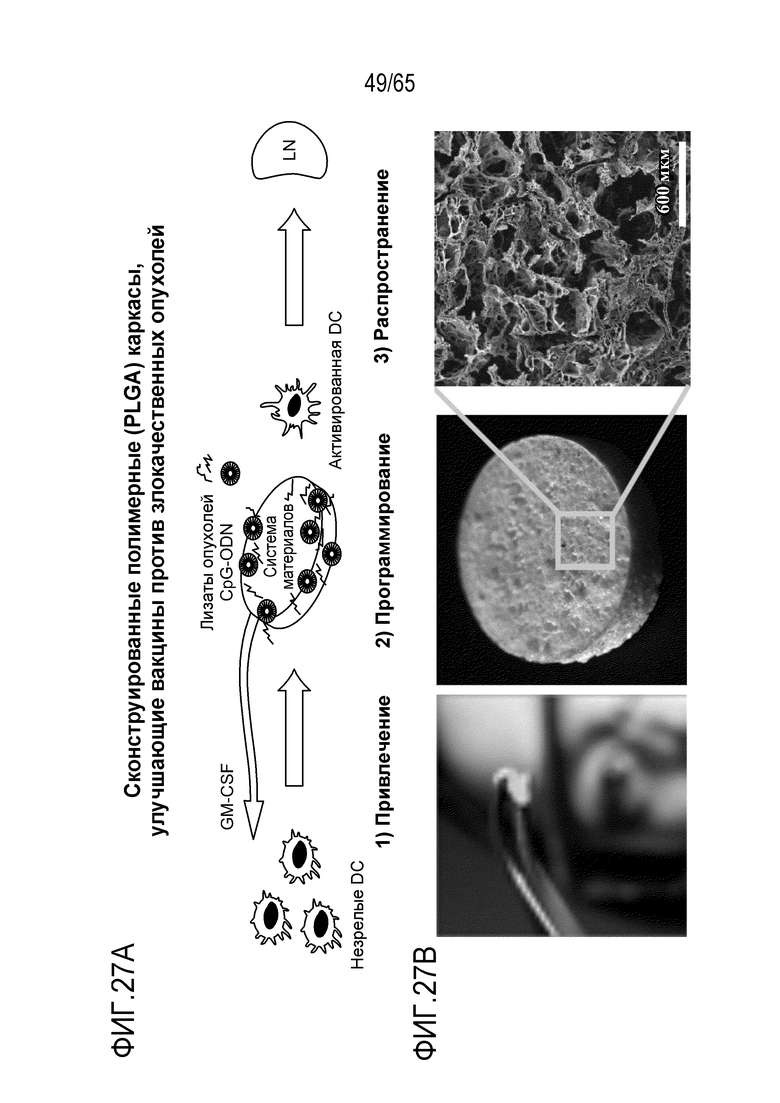
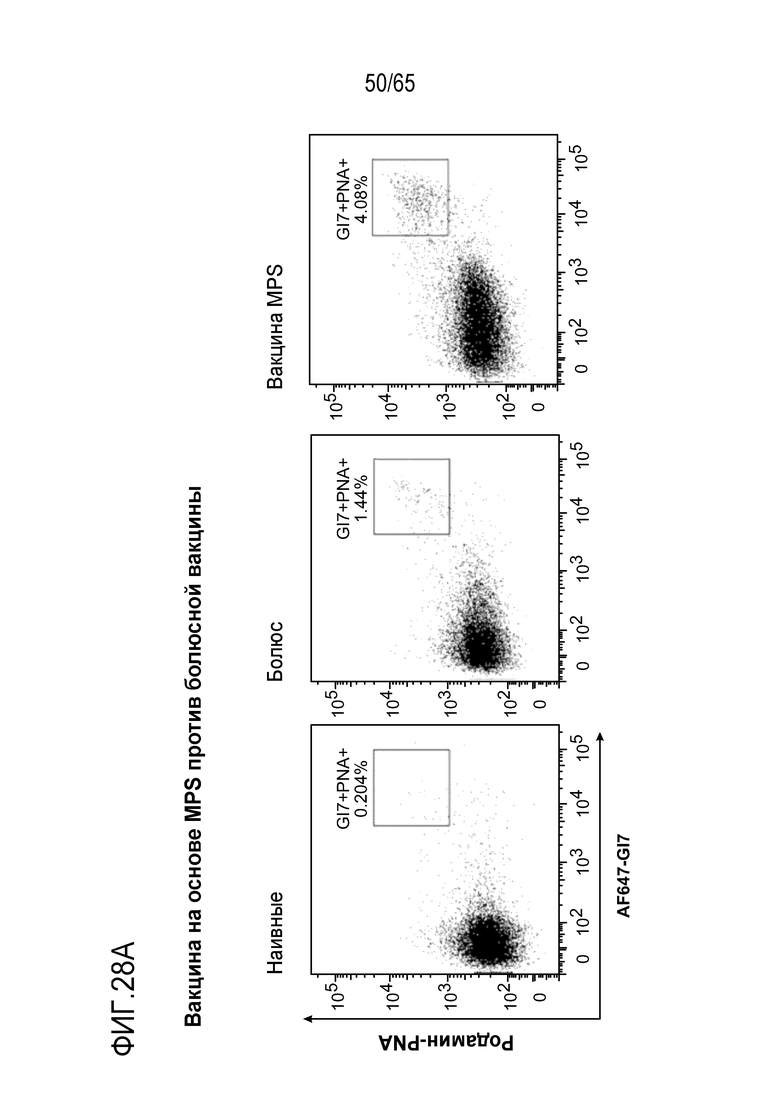
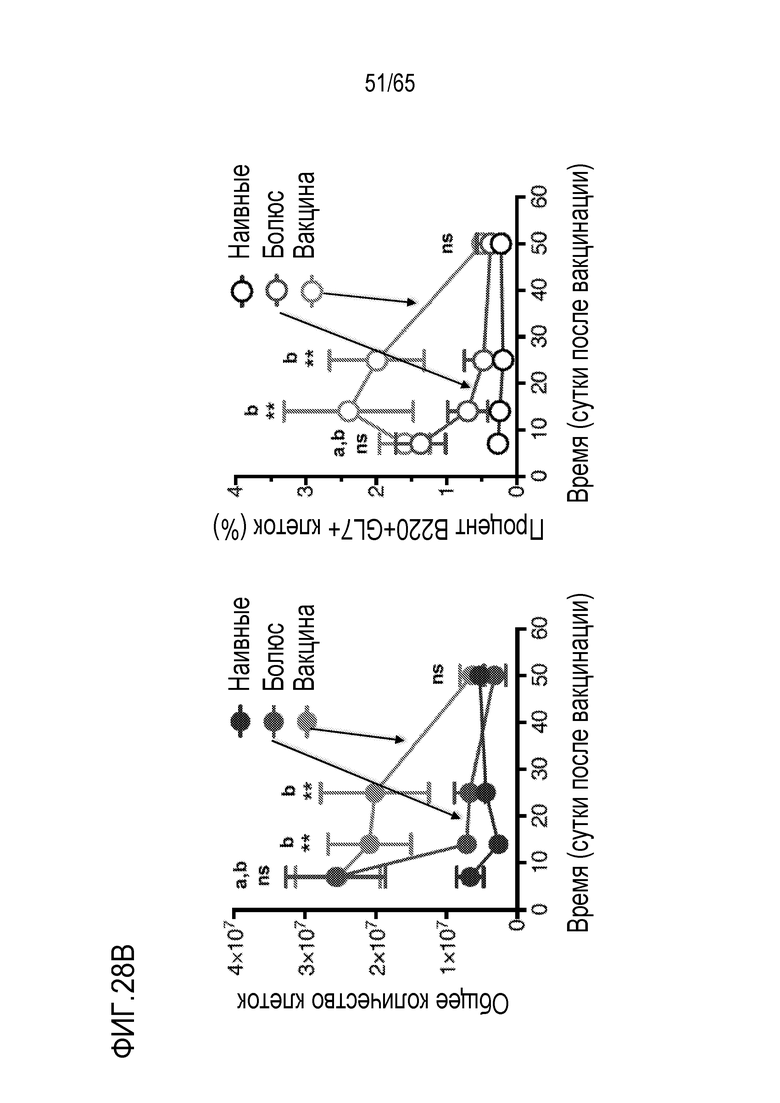
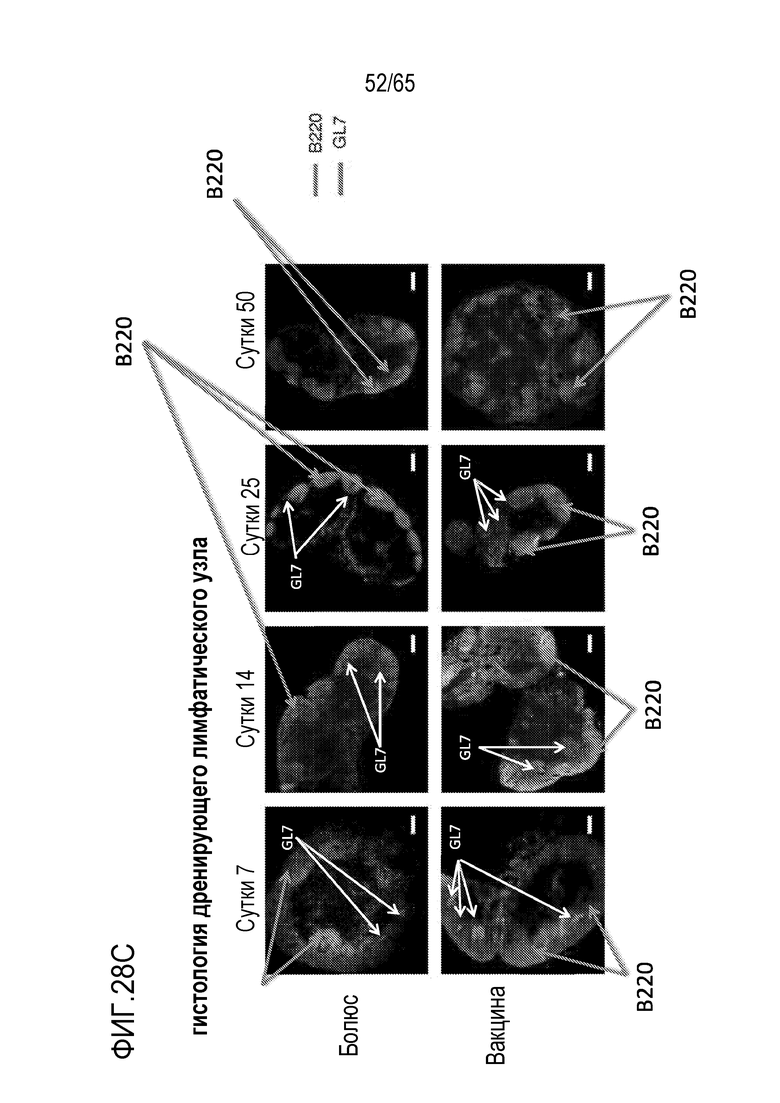
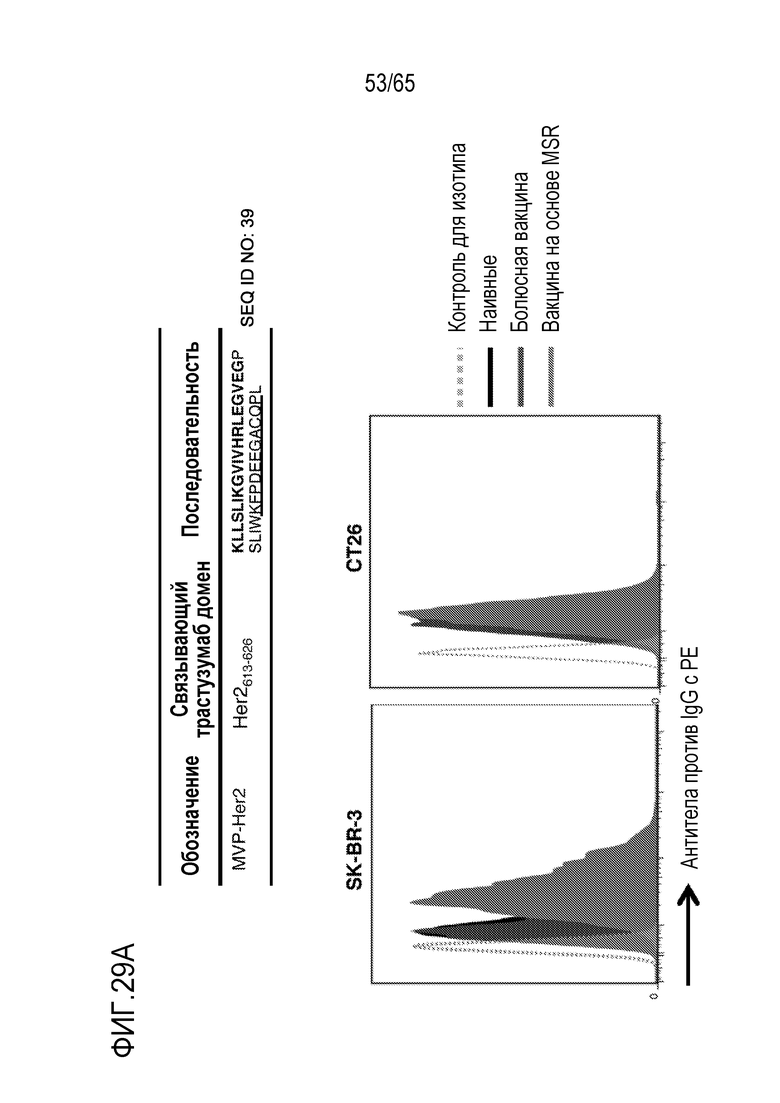
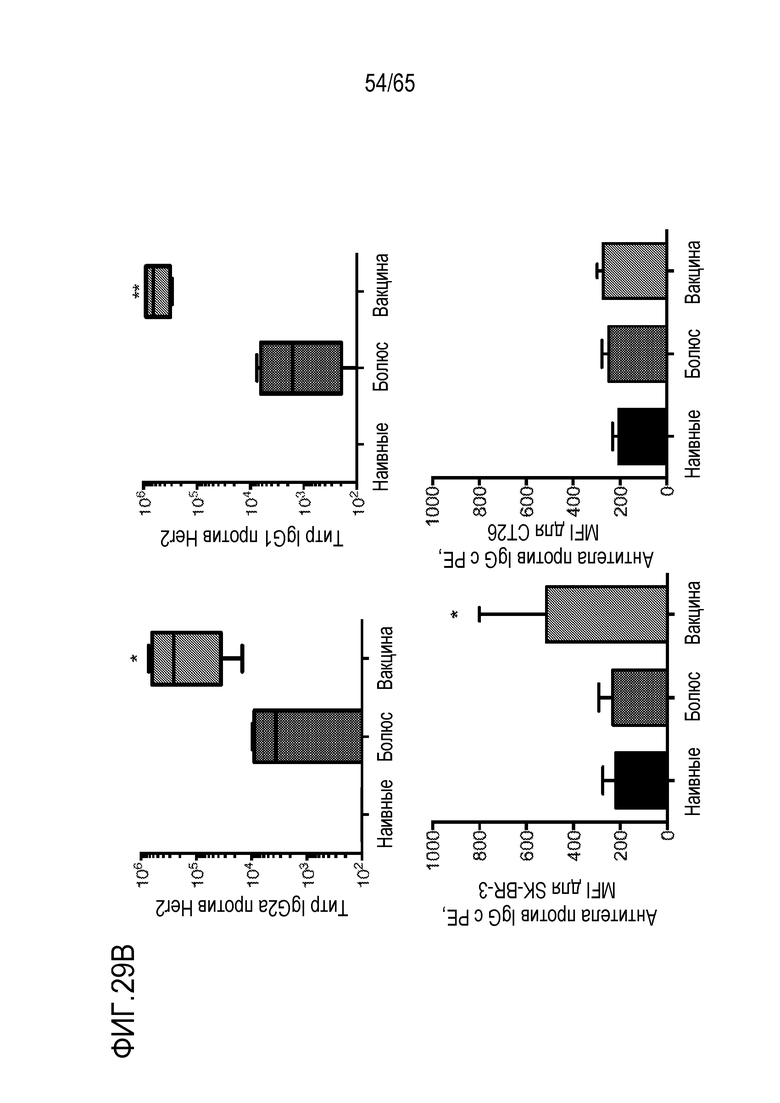
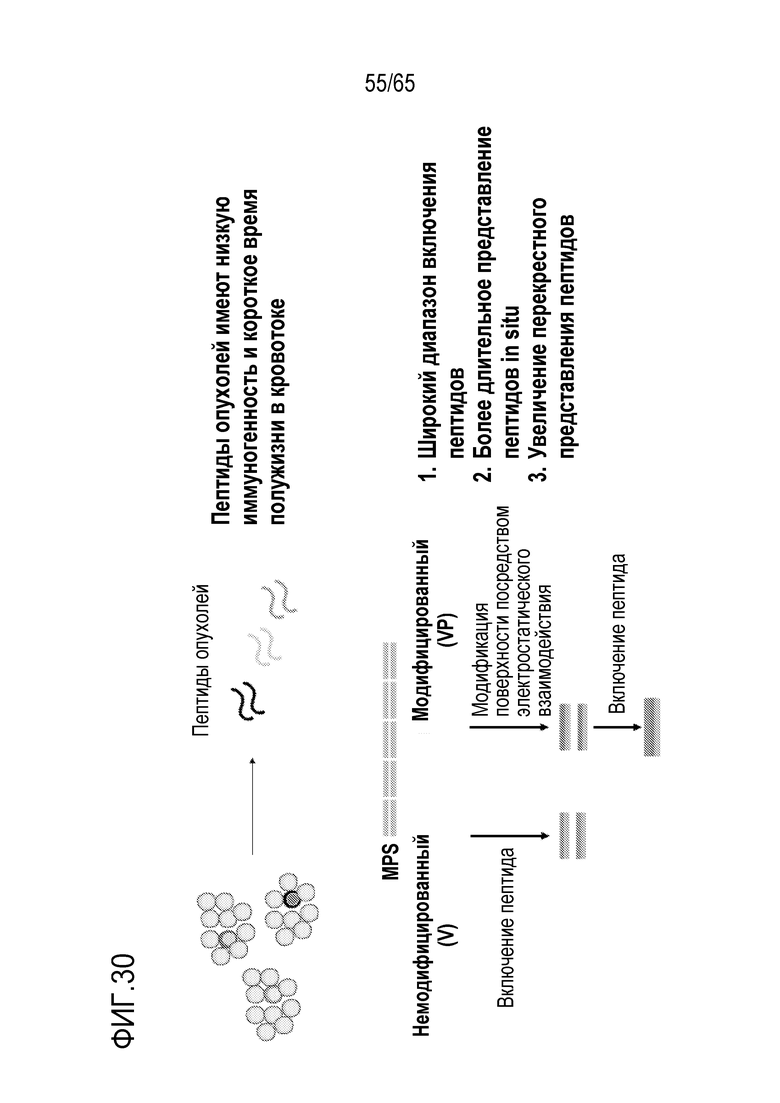
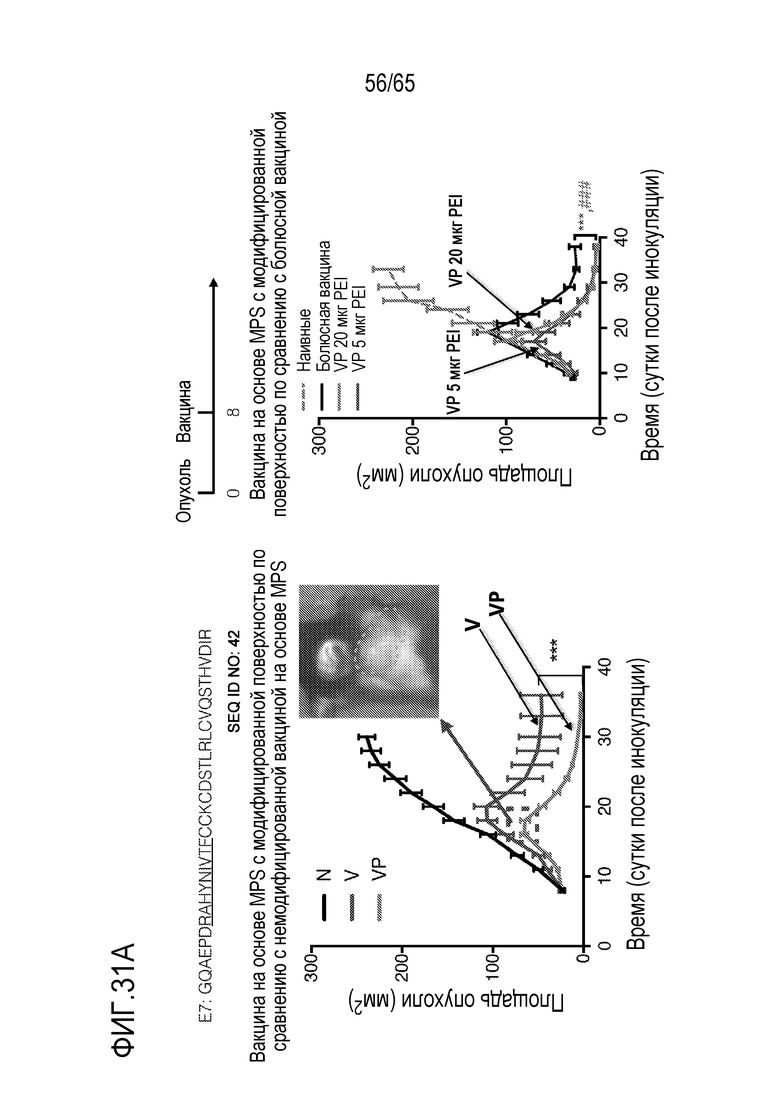
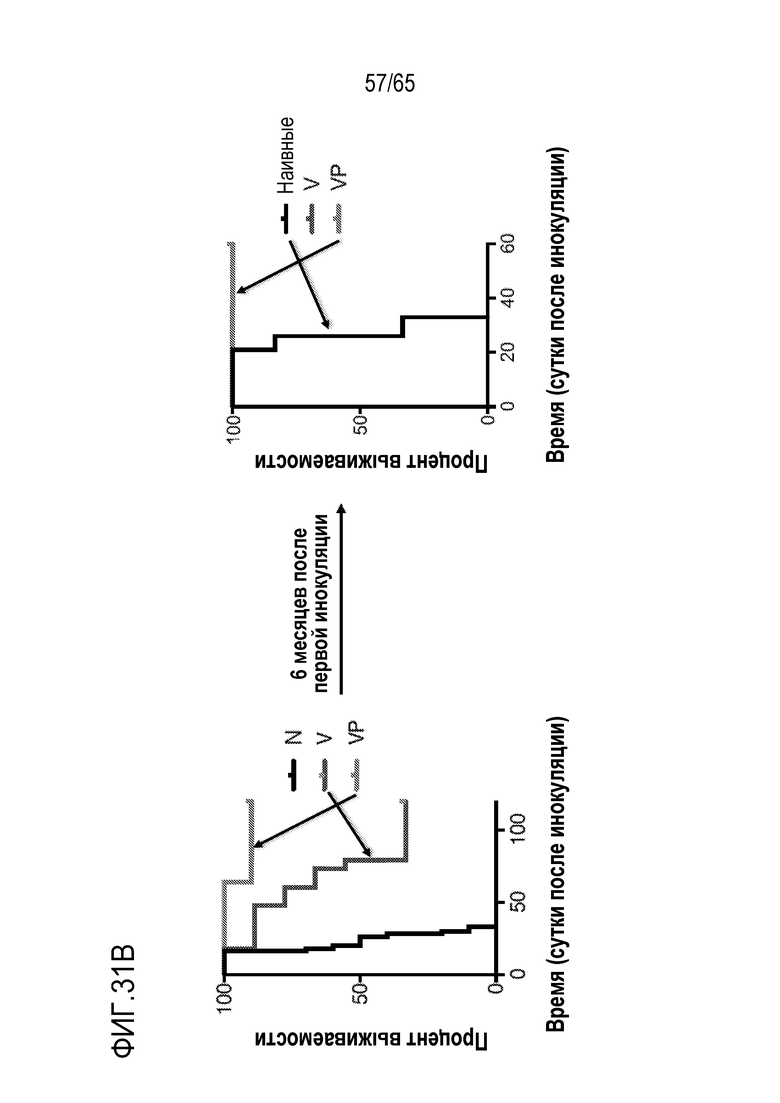
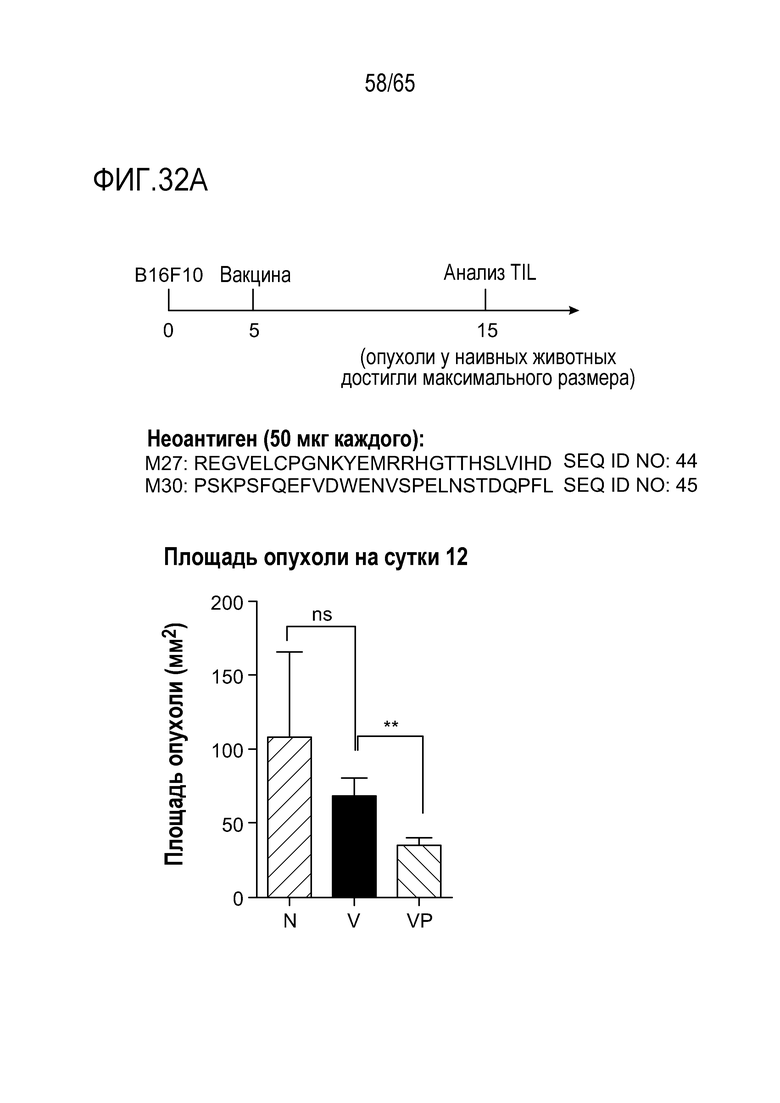
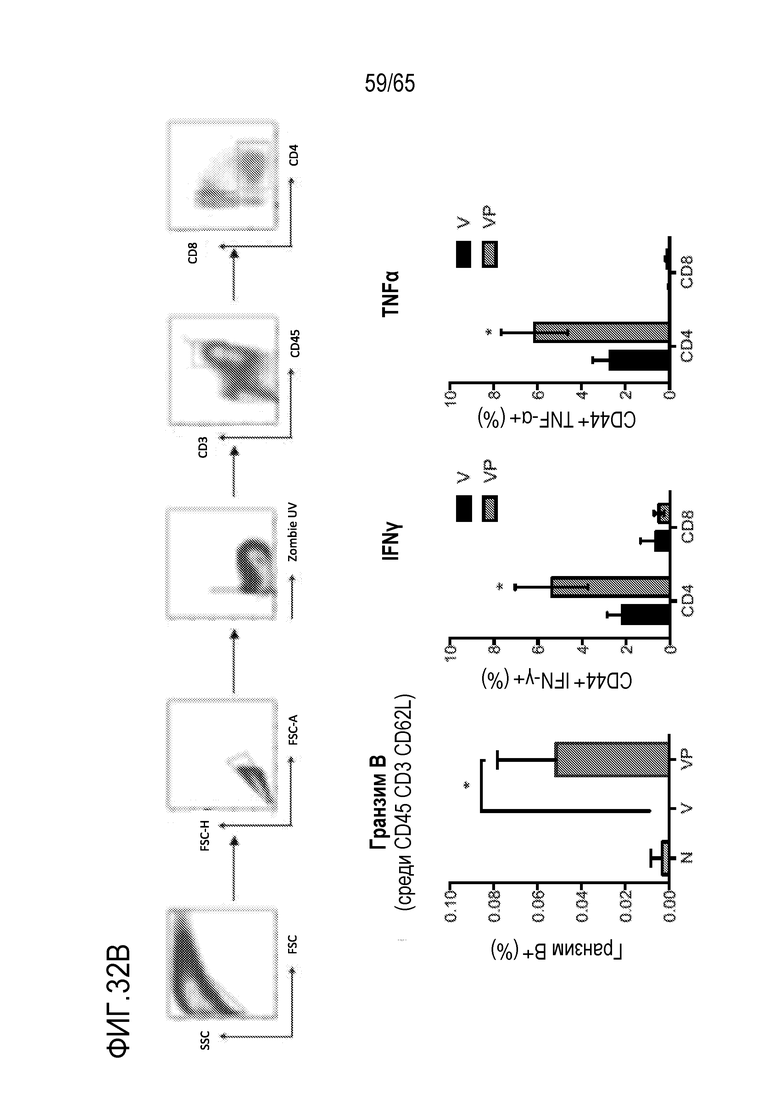
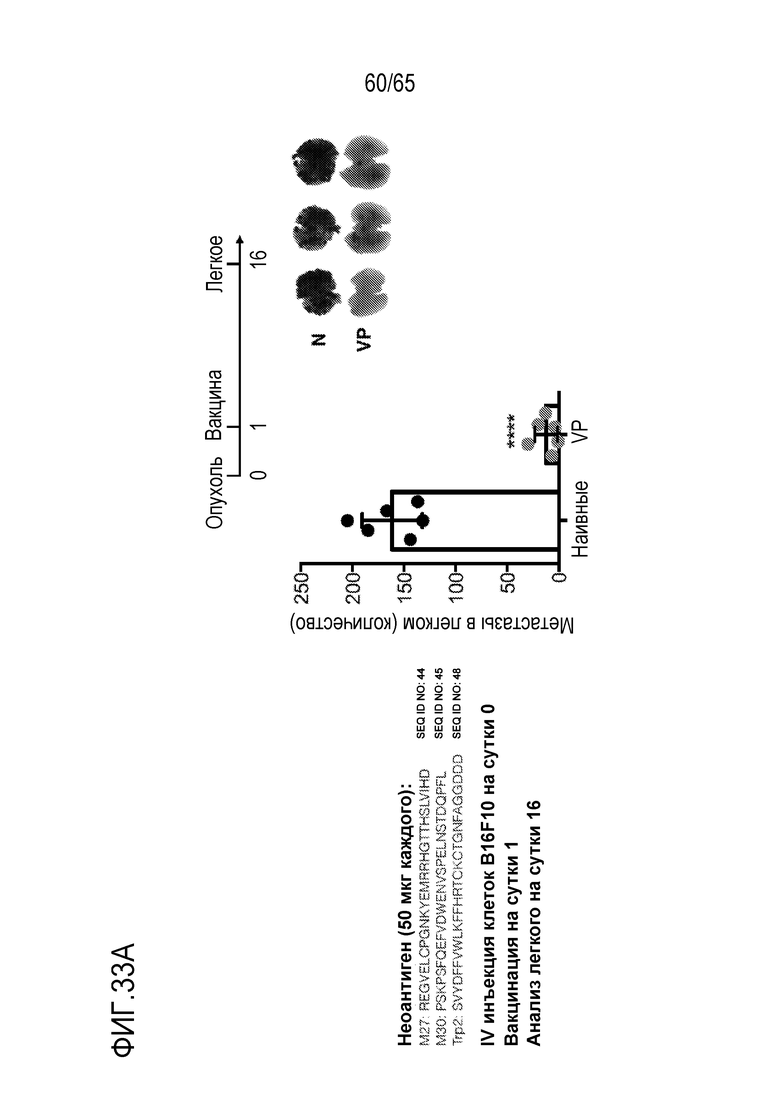
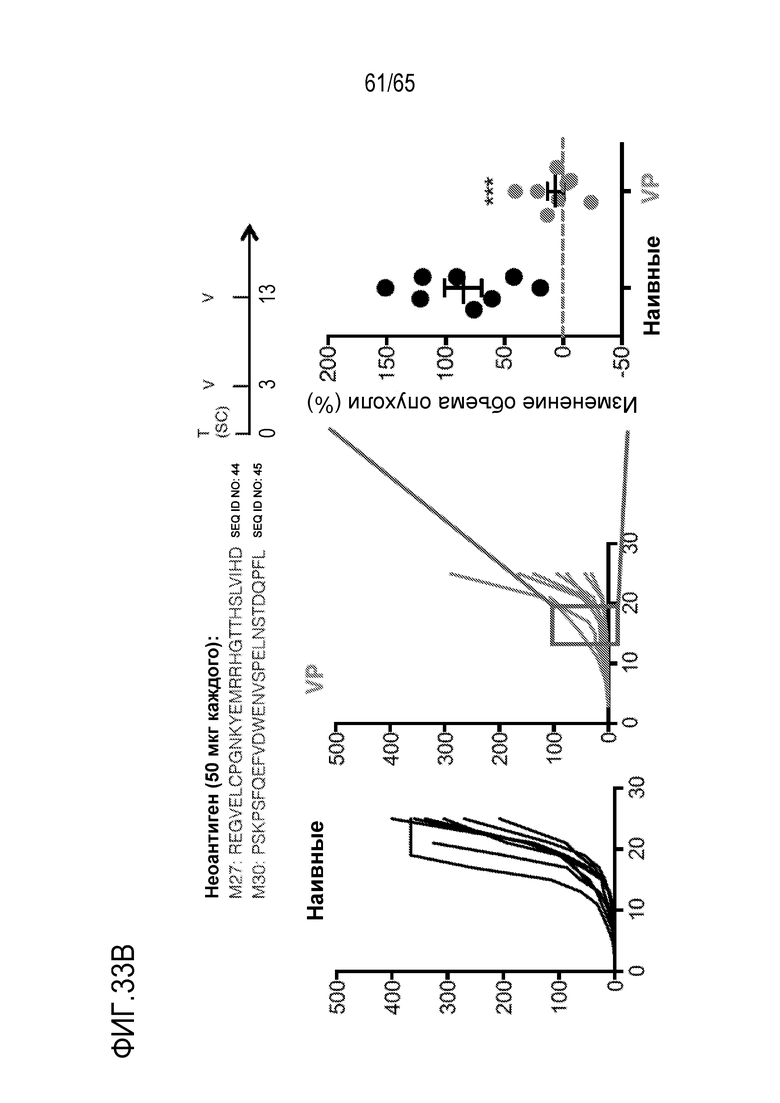
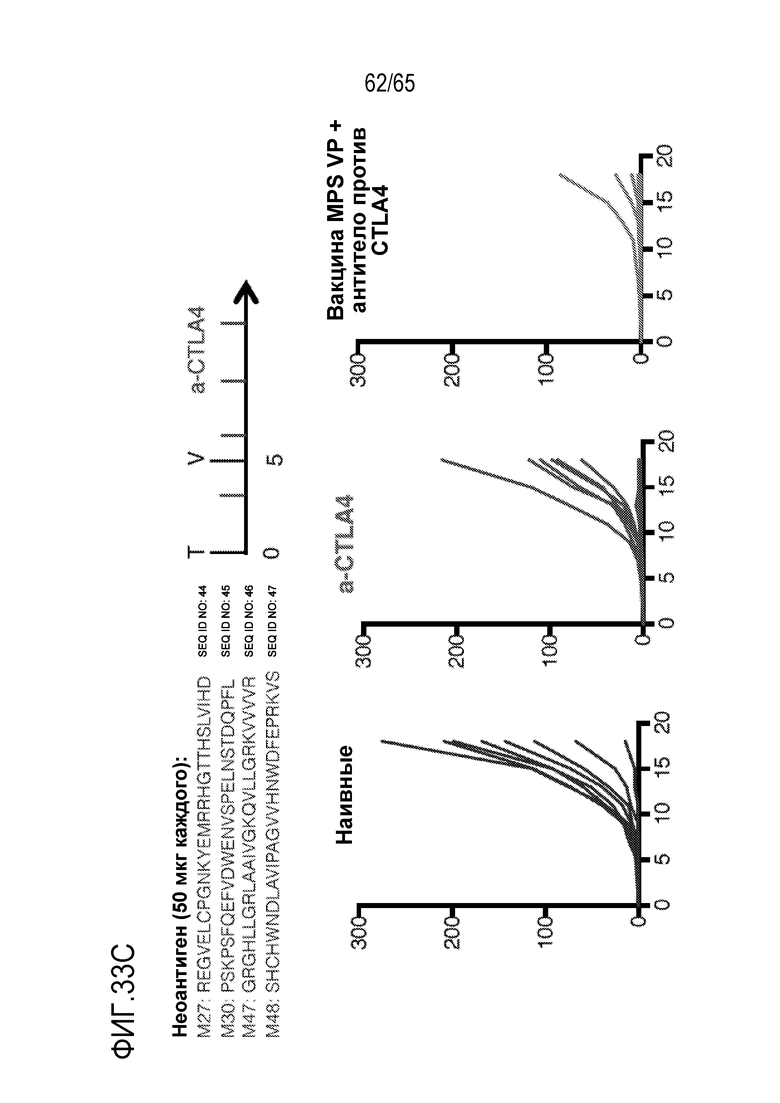
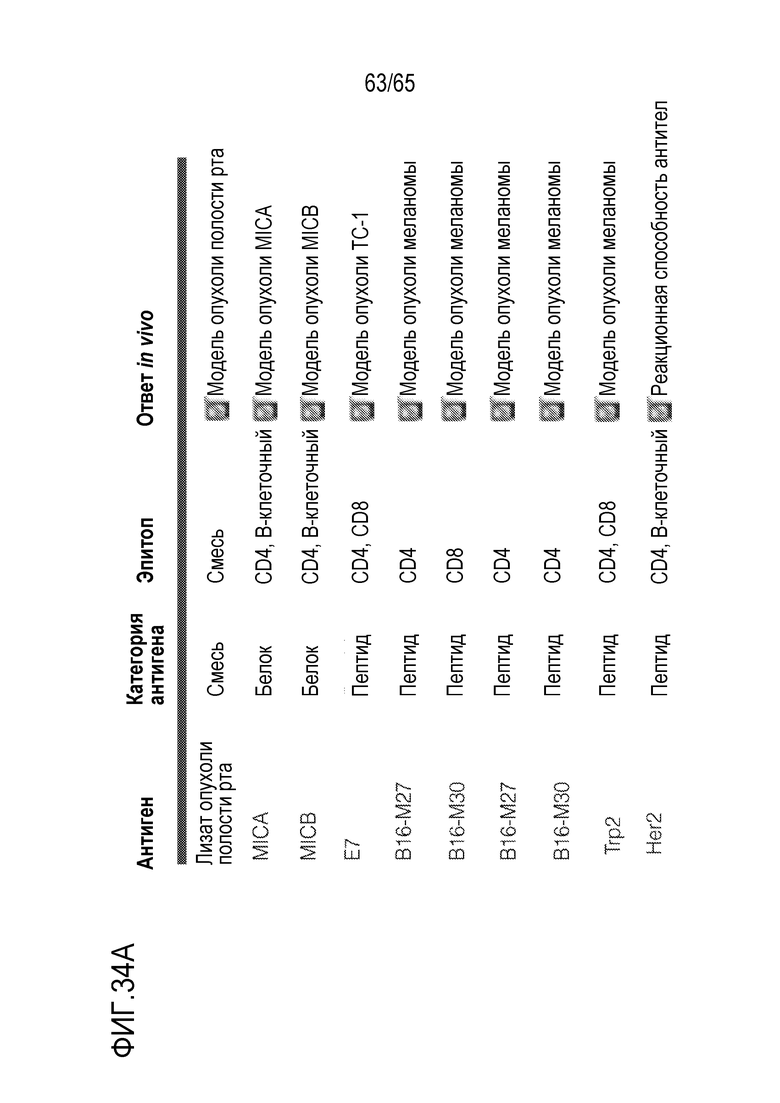

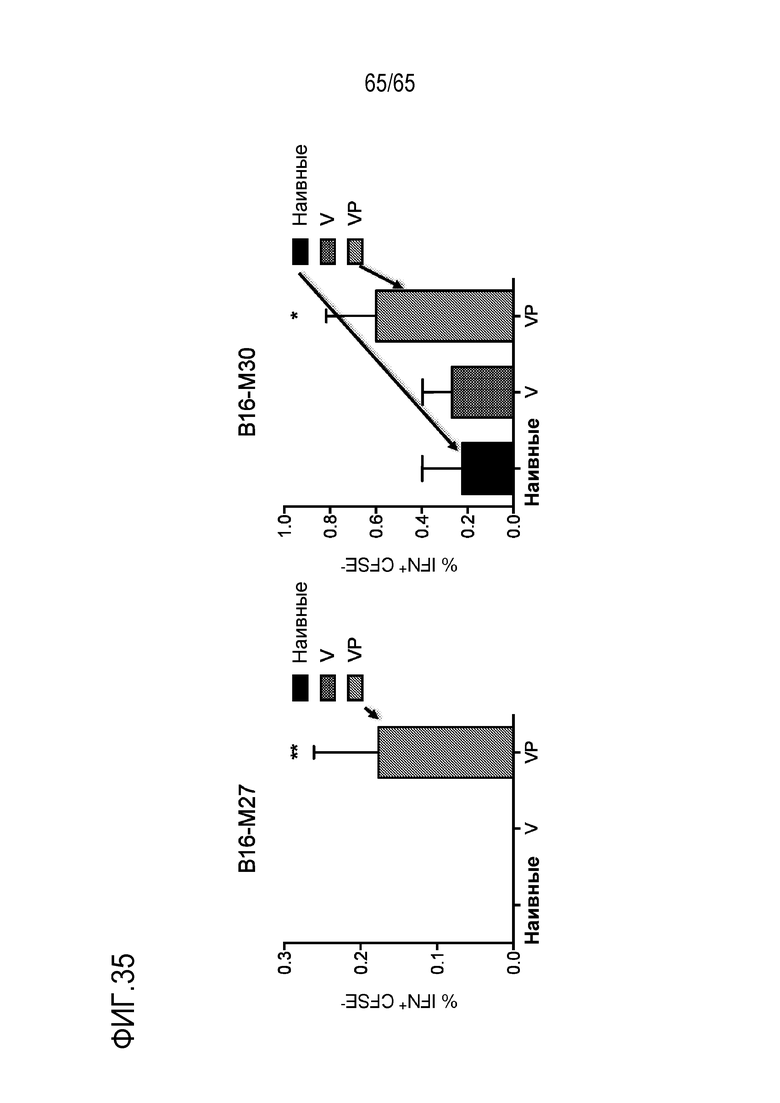
Группа изобретений относится к области медицины, а именно к онкологии и иммунологии, и предназначена для вызова иммунного ответа на антиген, такой как антигены злокачественных опухолей и микроорганизмов. Устройство для модулирования иммунного ответа содержит композицию каркаса, содержащую палочки из мезопористого диоксида кремния. Указанная композиция каркаса имеет поверхность, модифицированную полиэтиленимином (PEI). Указанная композиция каркаса содержит открытые взаимосвязанные макропоры или представляет собой порообразующую композицию каркаса. В другом воплощении раскрыт способ лечения злокачественной опухоли у нуждающегося в этом субъекта, включающий введение указанного устройства. Также представлен способ увеличения иммуногенности антигена, включающий объединение антигена с PEI в указанном устройстве. Использование группы изобретений позволяет повысить иммуногенность антигена. 3 н. и 26 з.п. ф-лы, 35 ил., 4 табл., 2 пр.
1. Устройство для модулирования иммунного ответа, содержащее композицию каркаса, содержащую палочки из мезопористого диоксида кремния, где указанная композиция каркаса имеет поверхность, модифицированную полиэтиленимином (PEI); и где указанная композиция каркаса содержит открытые взаимосвязанные макропоры или представляет собой порообразующую композицию каркаса.
2. Устройство по п.1, содержащее PEI, присоединенный к антигену, где указанный антиген содержит антиген опухоли.
3. Устройство по п.2, где указанный PEI является присоединенным к указанному антигену посредством электростатического взаимодействия.
4. Устройство по п.2, где указанный PEI является ковалентно связанным с указанным антигеном.
5. Устройство по п.1, где указанный PEI является разветвленным или линейным.
6. Устройство по п.1, содержащее как разветвленный PEI, так и линейный PEI.
7. Устройство по п.1, где указанный PEI содержит разветвленный дендримерный PEI.
8. Устройство по п.1, где указанный PEI содержит по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, или 30 первичных, вторичных и/или третичных аминогрупп.
9. Устройство по п.1, где указанный PEI имеет молекулярную массу (a) по меньшей мере приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 100, 125, 150, 175 или 200 килодальтон (кДа); (b) менее чем приблизительно 200, 175, 150, 125, 100, 75, 70, 65, 60, 55, 50, 45, 35, 25, 20, 15, 10, 5, 4, 3, 2 или 1 кДа; или (c) приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 1-10, 2-25, 25-60, 25-75, 50-100 или 100-200 кДа.
10. Устройство по п.1, где указанный PEI содержит линейный PEI, имеющий молекулярную массу приблизительно 25 кДа, или разветвленный PEI, имеющий молекулярную массу приблизительно 60 кДа.
11. Устройство по п.1, где указанная композиция каркаса имеет объем по меньшей мере приблизительно 0,1, 0,5, 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мм3.
12. Устройство по п.1, где указанная композиция каркаса представляет собой порообразующую композицию каркаса.
13. Устройство по п.1, где указанная композиция каркаса содержит гидрогель или криогель.
14. Устройство по п.1, где указанная композиция каркаса является анионной или катионной.
15. Устройство по п.1, где указанная композиция каркаса содержит метакрилированный полимер или сополимер.
16. Устройство по п.1, где указанная композиция каркаса содержит (i) первую зону, содержащую хемоаттрактант клеток злокачественных опухолей и индуцирующую цитотоксичность композицию, и (ii) вторую зону, содержащую композицию для привлечения иммуноцитов.
17. Устройство по п.1, дополнительно содержащее
(a) иммуностимулирующее соединение;
(b) соединение, привлекающее иммуноцит к композиции каркаса или в композицию каркаса;
(c) соединение, индуцирующее иммуногенную гибель клеток опухоли;
(d) соединение, ингибирующее супрессию T-клеток или дендритных клеток;
(e) соединение, которое ингибирует ингибирующий иммунитет белок,
или любую их комбинацию.
18. Устройство по п.17, где указанное иммуностимулирующее соединение содержит агонист toll-подобного рецептора (TLR), агонист стимулятора генов интерферона (STING) и/или мезопористый диоксид кремния.
19. Устройство по п.1, содержащее антиген.
20. Устройство по п.19, где указанный антиген содержит антиген опухоли или не относящийся к опухоли антиген.
21. Устройство по п.1, где указанный антиген содержит пептидный антиген опухоли.
22. Способ лечения злокачественной опухоли у нуждающегося в этом субъекта, включающий введение устройства по любому из пп. 1-21 указанному субъекту.
23. Способ по п.22, где указанное устройство стимулирует активацию дендритных клеток.
24. Способ по п.22, где указанное устройство вызывает опосредованный цитотоксическими T-клетками иммунный ответ против указанного антигена опухоли.
25. Способ увеличения иммуногенности антигена, включающий объединение антигена с PEI в устройстве по п.1.
26. Способ по п.25, где антиген содержит неоантиген.
27. Способ по п.25, где антиген содержит полипептид.
28. Способ по п.27, где полипептид содержит аминокислоты в последовательности, идентичной фрагменту по меньшей мере из приблизительно 10 аминокислот из антигена опухоли или ассоциированного с патогеном антигена.
29. Устройство по п.1, где палочки из мезопористого диоксида кремния подвергнуты модификации поверхности с использованием PEI.
| WO 2013106852 А1, 18.07.2013 | |||
| GRABOWSKA AM et al | |||
| Systemic in vivo Delivery of siRNA to Tumours Using Combination of Polyethyleneimine and Transferrin-Polyethleneimine Conjugates | |||
| Biomater | |||
| Sci., 2015, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| XIAOMING CHEN et al | |||
| Enhanced Humoral and Cell-Mediated Immune Responses Generated by Cationic Polymer-Coated PLA | |||
Авторы
Даты
2022-04-14—Публикация
2017-08-02—Подача