ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В отношении противоопухолевого лечения исследовали иммунотерапии на основе опухолеспецифичных Т-клеток, включая терапии с использованием генетически модифицированных Т-клеток. В некоторых случаях Т-клетки, используемые в таких терапиях, не остаются активными in vivo в течение достаточно длительного периода времени. В некоторых случаях опухолеспецифичность Т-клеток является относительно низкой. Следовательно, в данной области существует потребность в опухолеспецифичных противораковых терапиях с более долговременным противоопухолевым функционированием.
Злокачественные глиомы (MG), которые включают анапластическую астроцитому (АА степени III) и глиобластому (GBM степени IV), имеют в Соединенных Штатах коэффициент заболеваемости приблизительно 20000 новых диагностированных случаев в год. Согласно Американской ассоциации опухоли мозга общее число индивидов, живущих со злокачественной опухолью мозга, на основе данных переписи Соединенных Штатов 2010 года грубо составляет 140000 человек. Несмотря на то, что MG является редким заболеванием, она является высокоагрессивной и гетерогенной в отношении ее злокачественного характера и почти поголовно летальной. Современные терапии в отношении MG высокой степени согласно стандартам оказания медицинской помощи дают только кратковременную пользу, и данные опухоли мозга являются фактически неизлечимыми. В самом деле, даже с использованием современных хирургических и радиотерапевтических методик, которые часто усугубляют уже тяжелые клинические проявления, накладываемые расположением в центральной нервной системе (ЦНС), 5-летняя выживаемость является довольно низкой. Кроме того, для большинства пациентов, у которых заболевание рецидивирует, имеется мало терапевтических возможностей. Таким образом, существует значительная потребность в более эффективных терапиях, в частности, для тех пациентов, у которых заболевание рецидивировало/прогрессировало после терапий первой линии, и участие этой группы пациентов в клинических испытаниях оправдано.
Адоптивная Т-клеточная терапия (ACT) с использованием генетически модифицированных Т-клеток с химерным антигенным рецептором (CAR) может обеспечивать безопасный и эффективный способ уменьшения частоты рецидивов MG, так как Т-клетки с CAR могут быть генетически модифицированы для специфичного распознавания антигенно отличных популяций опухолей (Cartellieri et al. 2010 J Biomed Biotechnol 2010:956304; Ahmed et al. 2010 Clin Cancer Res 16:474; Sampson et al. 2014 Clin Cancer Res 20:972; Brown et al. 2013 Clin Cancer Res 2012 18:2199; Chow et al. 2013 Mol Ther 21:629), и Т-клетки могут мигрировать через паренхиму мозга к мишени и умерщвлять инфильтрирующие злокачественные клетки (Hong et al. 2010 Clin Cancer Res 16:4892; Brown et al. 2007 J Immunol 179:3332; Hong et al. 2010 Clin Cancer Res 16:4892; Yaghoubi 2009 Nat Clin PRact Oncol 6:53). Доклинические исследования продемонстрировали то, что Т-клетки CAR+, нацеленные на IL13Rα2, демонстрируют мощную, независимую от главного комплекса гистосовместимости (МНС), IL13Rα2-специфичную цитолитическую активность против как стволоподобных, так и дифференцированных глиомных клеток, и индуцируют регрессию прижившихся глиомных ксенотрансплантатов in vivo (Kahlon et al. 2004 Cancer Res 64:9160; Brown et al. 2012 Clin Cancer Res 18:2199).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном документе описаны химерные трансмембранные иммунорецепторы (химерные антигенные рецепторы или «CAR»), которые содержат внеклеточный домен, трансмембранную область и внутриклеточный домен сигнализации. Внеклеточный домен составлен из лиганда - IL-13, который связывается с интерлейкин-13Rα2 (IL13Rα2) (рецептор α2 интерлейкина-13), и, возможно, спейсер, содержащий, например, часть человеческого домена Fc. Трансмембранная часть включает трансмембранный домен CD4, трансмембранный домен CD8, трансмембранный домен CD28, трансмембранный домен CD3 или трансмембранный домен 4IBB. Внутриклеточный домен сигнализации включает домен сигнализации из зета цепи комплекса человеческого CD3 (CD3ζ) и один или более чем один костимулирующий домен, например, костимулирующий домен 4-1ВВ. Внеклеточный домен обеспечивает то, что CAR, при экспрессии на поверхности Т-клетки, направляет активность Т-клетки на те клетки, которые экспрессируют IL13Rα2 - рецептор, экспрессируемый на поверхности опухолевых клеток, включая глиому. Важно то, что IL13Rα2-связывающая часть CAR включает модификацию аминокислот, такую как мутация E13Y, которая увеличивает специфичность связывания. Включение костимулирующего домена, такого как костимулирующий домен 4-1ВВ (CD137), расположенный последовательно с CD3ζ, во внутриклеточной области, обеспечивает принятие Т-клеткой костимулирующих сигналов. Т-клетки, например, специфичные для пациента аутологичные Т-клетки, могут быть генетически модифицированы для экспрессии CAR, описанных в данном документе, и данные генетически модифицированные клетки можно размножать и использовать в ACT. Можно использовать разные поднаборы Т-клеток. Кроме того, CAR могут экспрессироваться в других иммунных клетках, таких как клетки NK (натуральные киллеры). Когда пациента лечат описанной в данном документе иммунной клеткой, экспрессирующей CAR, данная клетка может быть аутологичной или аллогенной Т-клеткой. В некоторых случаях используемые клетки представляют собой центральные Т-клетки памяти (ТСМ) CD4+ и CD8+, которые являются CD45RO+CD62L+, и применение таких клеток может улучшать долговременную сохранность клеток после адоптивного переноса по сравнению с применением других типов специфичных для пациента Т-клеток.
В данном документе описана молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор (CAR)r, где химерный антигенный рецептор содержит: человеческий IL-13 или его вариант, имеющий 1-10 (например, 1 или 2) модификаций аминокислот; трансмембранный домен, выбранный из: трансмембранного домена CD4 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, трансмембранного домена CD8 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, трансмембранного домена CD28 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, и трансмембранного домена CD3ζ или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 (например, 1 или 2) модификаций аминокислот.
В разных воплощениях костимулирующий домен выбран из группы, состоящей из: костимулирующего домена CD28 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, костимулирующего домена 4-IBB или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, и костимулирующего домена ОХ40 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот. В некоторых воплощениях присутствует костимулирующий домена 4IBB или его вариант, имеющий 1-10 (например, 1 или 2) модификаций аминокислот.
Дополнительное воплощение CAR включает: вариант человеческого IL-13, имеющий 1-10 модификаций аминокислот, которые увеличивают специфичность связывания в отношении IL13Rα2 по сравнению с IL13Rα1; человеческий IL-13 или его вариант представляет собой вариант IL-13, содержащий аминокислотную последовательность SEQ ID NO:3 с 1-5 модификациями аминокислот, при условии, что аминокислота в положении 11 SEQ ID NO:3 отличается от Е; два разных костимулирующих домена, выбранных из группы, состоящей из: костимулирующего домена CD28 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, костимулирующего домена 4-IBB или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот, и костимулирующего домена ОХ40 или его варианта, имеющего 1-10 (например, 1 или 2) модификаций аминокислот; два разных костимулирующих домена, выбранных из группы, состоящей из: костимулирующего домена CD28 или его варианта, имеющего 1-2 модификации аминокислот, костимулирующего домена 4-IBB или его варианта, имеющего 1-2 модификации аминокислот, и костимулирующего домена ОХ40 или его варианта, имеющего 1-2 модификации аминокислот; человеческий IL-13 или его вариант, имеющий 1-2 модификации аминокислот; трансмембранный домен, выбранный из: трансмембранного домена CD4 или его варианта, имеющего 1-2 модификации аминокислот, трансмембранного домена CD8 или его варианта, имеющего 1-2 модификации аминокислот, трансмембранного домена CD28 или его варианта, имеющего 1-2 модификации аминокислот, и трансмембранного домена CD3ζ или его варианта, имеющего 1-2 модификации аминокислот; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-2 модификации аминокислот; спейсерную область, расположенную между IL-13 или его вариантом и трансмембранным доменом (например, спейсерная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, 14-20, 50 и 52); спейсер содержит шарнирную область IgG; спейсерная область содержит 10-150 аминокислот; домен сигнализации 4-1 ВВ содержит аминокислотную последовательность SEQ ID NO: 6; домен сигнализации CD3ζ содержит аминокислотную последовательность SEQ ID NO: 7; и линкер из 3-15 аминокислот, который расположен между костимулирующим доменом и доменом сигнализации CD3ζ или его вариантом. В некоторых воплощениях, когда имеется два костимулирующих домена, один представляет собой костимулирующий домен 4-IBB, а другой костимулирующий домен выбран из: CD28 и CD28gg.
В некоторых воплощениях молекула нуклеиновой кислоты экспрессирует полипептид, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 10, 31-48 и 52; химерный антигенный рецептор содержит область IL-13/lgG4/CD4t/41-BB, содержащую аминокислотную последовательность SEQ ID NO:11, и домен сигнализации CD3ζ, содержащий аминокислотную последовательность SEQ ID NO:7; и химерный антигенный рецептор содержит аминокислотную последовательность SEQ ID NO: 10, 31-48 и 52.
Также раскрыта популяция человеческих Т-клеток, трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный антигенный рецептор, где химерный антигенный рецептор содержит: человеческий IL-13 или его вариант, имеющий 1-10 модификаций аминокислот; трансмембранный домен, выбранный из: трансмембранного домена CD4 или его варианта, имеющего 1-10 модификаций аминокислот, трансмембранного домена CD8 или его варианта, имеющего 1-10 модификаций аминокислот, трансмембранного домена CD28 или его варианта, имеющего 1-10 модификаций аминокислот, и трансмембранного домена CD3ζ или его варианта, имеющего 1-10 модификаций аминокислот; костимулирующий домен; и домен сигнализации CD3ζ или его вариант, имеющий 1-10 модификаций аминокислот. В разных воплощениях: популяция человеческих Т-клеток содержит вектор, экспрессирующий химерный антигенный рецептор, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 10, 31-48 и 52; популяция человеческих Т-клеток содержит центральные Т-клетки памяти (клетки Tcm) (например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки Tcm; по меньшей мере 15%, 20%, 25%, 30%, 35% клеток Tcm представляют собой CD4+; и по меньшей мере 15%, 20%, 25%, 30%, 35% клеток Tcm представляют собой клетки CD8+).
Также описан способ лечения рака у пациента, включающий введение популяции аутологических или аллогенных человеческих Т-клеток (например, аутологических или аллогенных Т-клеток, включающих клетки Tcm, например, по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% клеток представляют собой клетки Tcm; по меньшей мере 15%, 20%, 25%, 30%, 35% клеток Tcm представляют собой CD4+; и по меньшей мере 15%, 20%, 25%, 30%, 35% клеток Tcm представляют собой клетки CD8+), трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный антигенный рецептор, где химерный антигенный рецептор содержит аминокислотную последовательность, выбранную из SEQ ID NO: 10, 31-48 и 52. В разных воплощениях: популяция человеческих Т-клеток содержит центральные Т-клетки памяти; раковое заболевание представляет собой глиобластому; и трансдуцированные человеческие Т-клетки были получены способом, включающим получение Т-клеток от пациента, обработку Т-клеток для выделения центральных Т-клеток памяти и трансдуцирование по меньшей мере части центральных клеток памяти вирусным вектором, содержащим экспрессионную кассету, кодирующую химерный антигенный рецептор, где химерный антигенный рецептор содержит аминокислотную последовательность, выбранную из SEQ ID NO: 10, 31-48 и 52.
Также описана: молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности, выбранной из SEQ ID NO: 10 и SEQ ID NO: 10, 31-48 и 52; молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 10, 31-48 и 52, за исключением присутствия не более чем 5 замен, делеций или вставок аминокислот; молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 10 и SEQ ID NO: 10, 31-48 и 52, за исключением присутствия не более чем 5 замен аминокислот; и молекула нуклеиновой кислоты, кодирующая полипептид, содержащий аминокислотную последовательность, которая идентична аминокислотной последовательности, выбранной из SEQ ID NO: 10 и SEQ ID NO: 10, 31-48 и 52, за исключением присутствия не более чем 2 замен аминокислот.
Некоторые CAR, описанные в данном документе, например, CAR IL13(EQ)BBζ и CAR IL13(EQ)CD28 - ВВζ, имеют определенные полезные характеристики по сравнению с некоторыми другими CAR, нацеленными на IL13. Например, они имеют улучшенную селективность в отношении IL13Rα, вызывают меньшую продукцию цитокина Th2, в частности, меньшую продукцию IL13.
Т-клетки, экспрессирующие CAR, нацеленный на IL13Rα2, могут быть полезными при лечении раковых заболеваний, таких как глиобластома, а также других раковых заболеваний, при которых экспрессируется IL13Rα2, которые включают медуллобластому, рак молочной железы, рак головы и шеи, рак почки, рак яичника и саркому Капоши, но не ограничиваются ими. Таким образом, данное раскрытие включает способы лечения рака с использованием Т-клеток, экспрессирующих CAR, описанный в данном документе.
Данное раскрытие также включает молекулы нуклеиновой кислоты, которые кодируют любой из CAR, описанных в данном документе (например, векторы, которые включают последовательность нуклеиновой кислоты, кодирующую один из CAR), и выделенные Т-лимфоциты, которые экспрессируют любой из CAR, описанных в данном документе.
CAR, описанный в данном документе, может включать спейсерную область, расположенную между доменом IL13 и трансмембранным доменом. Можно использовать множество разных спейсеров. Некоторые из них включают по меньшей мере часть человеческой области Fc, например, шарнирную часть человеческой области Fc или домен CH3 или их варианты. В Таблице 1 ниже приведены разные спейсеры, которые можно использовать в CAR, описанных в данном документе.


Некоторые спейсерные области включают всю шарнирную область иммуноглобулина (например, lgG1, lgG2, lgG3, lgG4) или ее часть, т.е. последовательность, которая попадает между доменами СН1 и СН2 иммуноглобулина, например, шарнир Fc lgG4 или шарнир CD8. Некоторые спейсерные области включают домен CH3 иммуноглобулина или и домен CH3, и домен СН2. Последовательности, происходящие от иммуноглобулина, могут включать одну или более чем одну модификацию аминокислоты, например, 1, 2, 3, 4 или 5 замен, например, замены, которые уменьшают связывание вне мишени.
Термин «модификация аминокислоты» относится к замене, вставке и/или делеции аминокислоты в последовательности белка или пептида. Термин «замена аминокислоты» или «замена» относится к замене аминокислоты в конкретном положении в последовательности родительского белка или пептида другой аминокислотой. Замену можно делать для изменения аминокислоты в полученном белке неконсервативным образом (т.е. посредством изменения кодона от аминокислоты, принадлежащей к одной группе аминокислот, имеющих конкретный размер или характеристику, до аминокислоты, принадлежащей к другой группе) или консервативным образом (т.е. посредством изменения кодона от аминокислоты, принадлежащей к одной группе аминокислот, имеющих конкретный размер или характеристику, до аминокислоты, принадлежащей к той же самой группе). Такое консервативное изменение обычно приводит к меньшему изменению в структуре и функции образующегося в результате белка. Примеры разных групп аминокислот являются следующими: 1) аминокислоты с неполярными группами R: аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин; 2) аминокислоты с незаряженными полярными группами R: глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин; 3) аминокислоты с заряженными полярными группами R (отрицательно заряженными при рН 6,0): аспарагиновая кислота, глутаминовая кислота; 4) основные аминокислоты (положительно заряженные при рН 6,0): лизин, аргинин, гистидин (при рН 6,0). Другой группой могут быть аминокислоты с фенильными группами: фенилаланин, триптофан и тирозин.
В некоторых воплощениях спейсер происходит из lgG1, lgG2, lgG3 или lgG4 и включает один или более чем один аминокислотный остаток, замененный аминокислотным остатков, отличным от остатка, присутствующего в немодифицированном спейсере. Один или более чем один замененный аминокислотный остаток выбран из одного или более чем одного аминокислотного остатка в положениях 220, 226, 228, 229, 230, 233, 234, 235, 234, 237, 238, 239, 243, 247, 267, 268, 280, 290, 292, 297, 298, 299, 300, 305, 309, 218, 326, 330, 331, 332, 333, 334, 336, 339 или их комбинации, но не ограничивается ими. В данной схеме нумерации, описанной с большими подробностями ниже, первая аминокислота в спейсере lgG4(L235E,N297Q) в Таблице 1 находится в положении 219, и первая аминокислота в спейсере lgG4(HL-CH3) в Таблице 1 находится в положении 219, как и первая аминокислота в последовательности шарнира IgG и в последовательности линкера на основе шарнира (HL) lgG4 в Таблице 1.
В некоторых воплощениях модифицированный спейсер происходит из lgG1, lgG2, lgG3 или lgG4, который включает одну или более чем одну из следующих замен аминокислотных остатков: C220S, C226S, S228P, C229S, P230S, Е233Р, V234A, L234V, L234F, L234A, L235A, L235E, G236A, G237A, P238S, S239D, F243L, P247I, S267E, H268Q, S280H, K290S, К290Е, K290N, R292P, N297A, N297Q, S298A, S298G, S298D, S298V, Т299А, Y300L, V305I, V309L, Е318А, К326А, K326W, К326Е, L328F, A330L, A330S, A331S, P331S, I332E, Е333А, E333S, E333S, К334А, A339D, A339Q, P396L или их комбинацию, но не ограничивается ими.
В некоторых воплощениях модифицированный спейсер происходит из области lgG4, которая включает один или более чем один аминокислотный остаток, замененный аминокислотным остатком, отличным от остатка, присутствующего в немодифицированной области. Один или более чем один замененный аминокислотный остаток выбран из одного или более чем одного аминокислотного остатка в положениях 220, 226, 228, 229, 230, 233, 234, 235, 234, 237, 238, 239, 243, 247, 267, 268, 280, 290, 292, 297, 298, 299, 300, 305, 309, 218, 326, 330, 331, 332, 333, 334, 336, 339 или их комбинации.
В некоторых воплощениях модифицированный спейсер происходит из области lgG4, которая включает одну или более чем одну из следующих замен аминокислотных остатков: 220S, 226S, 228Р, 229S, 230S, 233Р, 234А, 234V, 234F, 234А, 235А, 235Е, 236А, 237А, 238S, 239D, 243L, 247I, 267Е, 268Q, 280Н, 290S, 290Е, 290N, 292Р, 297А, 297Q, 298А, 298G, 298D, 298V, 299А, 300L, 305I, 309L, 318А, 326А, 326W, 326Е, 328F, 330L, 330S, 331S, 331S, 332Е, 333А, 333S, 333S, 334А, 339D, 339Q, 396L или их комбинацию, но не ограничивается ими, где аминокислота в немодифицированном спейсере заменена идентифицированными выше аминокислотами в указанном положении.
Для обсуждаемых в данном документе положений аминокислот в иммуноглобулине нумерация осуществляется согласно индексу EU (Европейский Союз) или схеме нумерации EU (Kabat et al. 1991 Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda, тем самым целиком включена посредством ссылки). Индекс EU или индекс EU по Kabat, или схема нумерации EU относится к нумерации EU антитела (Edelman et al. 1969 Proc Natl Acad Sci USA 63:78-85).
В CAR, направленном против IL13Rα2, можно использовать целый ряд трансмембранных доменов. Таблица 2 включает примеры подходящих трансмембранных доменов. Когда присутствует спейсерный домен, трансмембранный домен располагается ближе к карбоксильному концу относительно спейсерного домена.
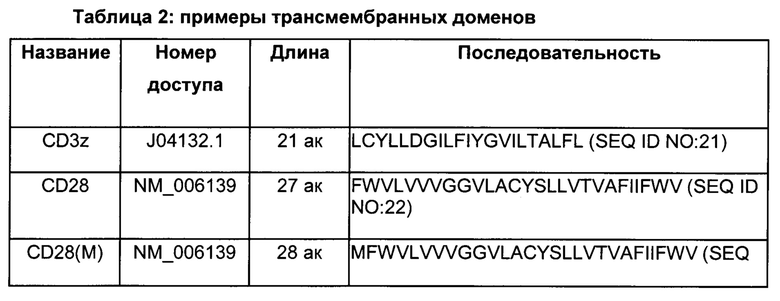

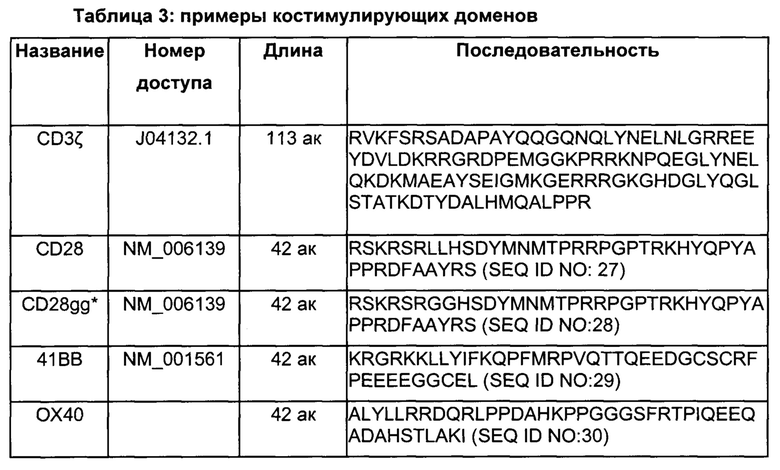
Многие из CAR, описанных в данном документе, включают один или более чем один (например, два) костимулирующих домена. Костимулирующий(щие) домен(ны) располагается(ются) между трансмембранным доменом и доменом сигнализации CD3ζ. Таблица 3 включает примеры подходящих костимулирующих доменов, совместно с последовательностью домена сигнализации CD3ζ.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 представляет собой схематическое изображение CAR IL13(E13Y)-зетакин (слева), состоящего из варианта человеческого IL-13, специфичного в отношении IL13Rα2 (hulL-13(E13Y)), спейсера на основе Fc человеческого lgG4 (huγ4Fc), частей в виде человеческого трансмембранного CD4 (huCD4 tm) и цитоплазматической цепи человеческого CD3Cζ (huCD3ζ cyt), как указано. Также показан CAR IL13(EQ)BBζ, который является таким же как и IL13(E13Y)-зетакин, за исключением двух точечных мутаций - L235E и N297Q, указанных красным, которые располагаются в домене СН2 спейсера на основе lgG4, и добавления костимулирующего цитоплазматического домена 4-1ВВ (4-1ВВ cyt).
На Фиг. 2А-В показаны открытые рамки считывания определенных векторов. А представляет собой диаграмму открытой рамки считывания кДНК из 2670 нуклеотидов конструкции IL13(EQ)BBZ-T2ACD19t, где показаны последовательности IL13Rα2-специфичного лиганда IL13(E13Y), шарнира Fc lgG4(EQ), трансмембранного CD4, цитоплазматического домена сигнализации 4-1ВВ, трехглицинового линкера и цитоплазматического домена сигнализации CD3ζ CAR IL13(EQ)BBZ, а также перескакивания рибосомы Т2А и усеченного CD19. Также показаны сигнальные последовательности человеческого рецептора альфа GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) и CD19, которые управляют поверхностной экспрессией CAR IL13(EQ)BBζ и CD19t. Б представляет собой диаграмму последовательностей, фланкированных длинными концевыми повторами (показанными как «R»), которые будут интегрированы в геном хозяина. В представляет собой карту плазмиды IL13(EQ)BBZ-T2A-CD19t_epHIV7.
На Фиг. 3 показана конструкцию pHIV7.
На Фиг. 4 показаны элементы pHIV7.
На Фиг. 5 показана схема получения IL13(EQ)BBζ/CD19t+ТСМ.
На Фиг. 6А-В показаны результаты анализа экспрессии поверхностного трансгена и маркера Т-клеток посредством проточной цитометрии. IL13(EQ)BBζ/CD19t+ТСМ HD006.5 и HD187.1 совместно окрашивали антителом против IL13-PE (фикоэритрин) и антителом против CD8-FITC (флуоресцеина изотиоцианат) для выявления клеток CD8+ CAR+ и CD4+ (т.е. CD8-негативных) CAR+ (А), или антителом против CD19-PE и антителом против CD4-FITC для выявления клеток CD4+CD19t+ и CD8+ (т.е. CD4-негативных) CAR+ (Б). IL13(EQ)BBζ/CD19t+TCM HD006.5 и HD187.1 окрашивали антителами против CD3, TCR, CD4, CD8, CD62L и CD28, конъюгированными с флуорохромом (серые гистограммы) или изотипическими контролями (черные гистограммы) (В). Во всех случаях процентные доли основаны на жизнеспособных лимфоцитах (негативных в отношении DAPI (4',6-диамидин-2-фенилиндол)), которые окрашивались сильнее, чем изотипический контроль.
На Фиг. 7А-Б показана функциональная характеризация in vitro эффекторной функции IL13Rα2-специфичного IL13(EQ)BBZ+TCM. IL13(EQ)BBZ/CD19t+TCM HD006.5 и HD187.1 использовали в качестве эффекторов в 6-часовом анализе высвобождения 51Cr с использованием соотношения Е:Т (эффектор : мишень) 10:1 на основе экспрессии CD19t. IL13Rα2-позитивными опухолями-мишенями были К562, генетически модифицированная для экспрессии IL13Rα2 (K562-IL13Rα2), и линия первичной глиомы РВТ030-2, а IL13Rα2-негативной контрольной опухолью-мишенью была родительская линия К562 (А). IL13(EQ)BBZ/CD19t+TCM HD006.5 и HD187.1 оценивали на антигензависимую продукцию цитокинов после совместной культуры в течение ночи при соотношении Е:Т 10:1 с использованием IL13Rα2-позитивных и негативных мишеней. Уровни цитокинов измеряли с использованием набора для анализа Bio-Plex Pro Human Cytokine TH1/TH2, и приводится уровень IFN-γ (Б).
На Фиг. 8А-В показан результат исследований, демонстрирующих регрессию прижившихся ксенотрансплантатов глиомной опухоли после адоптивного переноса IL13(EQ)BBζ/CD19t+TCM. Опухолевые клетки EGFP-ffLuc+РВТ030-2 (1×105) стереотактически имплантировали в правую часть переднего мозга мышей NSG. В сутки 5 мыши получали либо 2×106 IL13(EQ)BBζ/CD19t+TCM (1,1×106 CAR+; n равно 6), либо 2×106 имитации ТСМ (без CAR; n равно 6), либо PBS (фосфатно-солевой буферный раствор) (n равно 6). Репрезентативные мыши из каждой группы, демонстрирующие относительную опухолевую нагрузку с использованием Xenogen Living Image (А). Количественное измерение потока ffLuc (фотоны/с) показывает то, что IL13(EQ)BBζ/CD19t+TCM индуцирует регрессию опухоли по сравнению с TCM с имитацией трансдукции и с PBS (#р меньше 0,02; *р меньше 0,001, ANOVA (дисперсионный анализ) с повторными измерениями (Б). Кривая выживания Каплана-Мейера (n равно 6 на группу), демонстрирующая значимо улучшенное выживание (р равно 0,0008; логранговый критерий) для мышей, обработанных IL13(EQ)BBζ/CD19t+TCM (В).
На Фиг. 9А-В показаны результаты исследований, сравнивающих противоопухолевую эффективность клонов CTL (цитолитический Т-лимфоцит) IL13(EQ)BBZ TCM и IL13-зетакин. EGFP-ffLuc+РВТ030-2 TSs (1×105) стереотактически имплантировали в правую часть переднего мозга мышей NSG. В сутки 8 мыши получали либо 1,6×106 имитации TCM (без CAR), либо 1,0×106 CAR+IL13(EQ)BBζ TCM (всего 1,6×106 Т-клеток; 63% CAR), либо 1,0×106 IL13-зетакин CD8+CTL, клон 2D7 (клональный CAR+), либо не получали обработки (n равно 6 на группу). Репрезентативные мыши из каждой группы, демонстрирующие относительную опухолевую нагрузку с использованием Xenogen Living Image (А). Линии линейной регрессии натурального log потока ffLuc (фотоны/с) с течение времени, значения Р приводятся для сравнений взаимодействия групп по времени (Б). Анализ выживания Каплана-Мейера (n равно 6 на группу) демонстрирует значительно улучшенное выживание (р равно 0,02; логранговый критерий) для мышей, обработанных IL13(EQ)BBζ TCM по сравнению с IL13-зетакин CD8+CTL, клон 2D7 (В).
На Фиг. 10А-В показаны результаты исследований, сравнивающих противоопухолевую эффективность клонов CTL IL13(EQ)BBζ TCM и IL13-зетакин. EGFP-ffLuc+ РВТ030-2 TSs (1×105) стереотактически имплантировали в правую часть переднего мозга мышей NSG. В сутки 8 мыши получали либо 1,3×106 имитирующих TCM (без CAR; n равно 6), либо 1,0, 0,3 или 0,1×106 CAR+ IL13(EQ)BBζ TCM (78% CAR+; n равно 6-7), либо 1,0, 0,3 или 0,1×106 клона 2D7 CTL IL13-зетакин CD8+ (клональный CAR+; n равно 6-7), либо не получали обработки (n равно 5). Xenogen Imaging репрезентативных мышей из каждой группы, демонстрирующее относительную опухолевую нагрузку (А). Линии линейной регрессии натурального log потока ffLuc (фотоны/с) показывают то, что IL13(EQ)BBζ TCM достигают превосходящей регрессии опухоли по сравнению с первым поколением клона 2D7 CTL IL13-зетакин, имитирующими TCM и только опухолью (Б). Средний поток на группу в сутки 27 после инъекции опухоли, демонстрирующий то, что доза 0,1×106 IL13(EQ)BBζ TCM превосходит по эффективности в десять раз большую дозу клона 2D7 CTL IL13-зетакин CD8+ - 1,0×106 (р равно 0,043; двухвыборочный t-критерий Уелча) (В).
На Фиг. 11 показаны результаты исследований, демонстрирующих то, что IL13(EQ)BBζ TCM показывают лучшую стойкость по сравнению с клонами CTL IL13-зетакин. Иммуногистохимия CD3, оценивающая стойкость Т-клеток в сайте опухоли через 7 суток после инфузии Т-клеток. Значительное число Т-клеток выявляется для IL13(EQ)BBζ TCM (верхняя панель). В отличие от этого выявляется очень мало жизнеспособных Т-клеток CD3+IL13-зетакин (нижняя панель).
На Фиг. 12А-Г показаны результаты экспериментов, сравнивающих путь доставки Т-клеток CAR+ (в.ч. (внутричерепно) по сравнению с в.в. (внутривенно)) для больших установившихся опухолей. EGFP-ffLuc+РВТ030-2 TSs (1×105) имплантировали в правую часть переднего мозга мышей NSG. В сутки 19 и 26 мышам в.в. инъецировали через хвостовую вену либо 5×106 CAR+IL13(EQ)BBζ+TCM (всего 11,8×106 клеток; n равно 4), либо имитацию - TCM (11,8×106 клеток; n равно 4). В качестве альтернативы, в сутки 19, 22, 26 и 29 мышам в.ч. инъецировали либо 1×106 CAR+IL13(EQ)BBζ+TCM (всего 2,4×106 клеток; n равно 4), либо имитацию - TCM (2,4×106 клеток; n равно 5). Средний поток ffLuc (фотоны/с) с течением времени показывает то, что IL13(EQ)BBζ TCM, доставленный в.ч., опосредует регрессию опухоли в сутки 19 опухолей. В отличие от этого, Т-клетки, доставленные в.в., не демонстрируют уменьшения опухолевой нагрузки по сравнению с необработанными или имитирующими TCM контролями (А). Кривая выживания Каплана-Мейера демонстрирует улучшенное выживание для мышей, обработанных в.ч. IL13(EQ)BBZ TCM, по сравнению с мышами, обработанными в.в. введенными TCM CAR+ (р равно 0,0003, логранговый критерий) (Б). Репрезентативное окрашивание Н&Е (гематоксилином и эозином) и IHC (иммуногистохимия) CD3 мышей, обработанных IL13(EQ)BBZ+TCM в.в. (В) по сравнению с в.ч. (Г). Т-клетки CD3+ выявляли только в группе, обработанной в.ч., при отсутствии клеток CD3+, выявленных в опухоли или в окружающей паренхиме мозга для мышей, обработанных в.в.
На Фиг. 13А-Б показаны результаты исследований, демонстрирующих то, что Т-клетки CAR+, инъецированные внутричерепно, либо внутриопухолево (в.о.), либо внутрижелудочково (в.ж.), могут транспортироваться в опухоли на противоположном полушарии. EGFP-ffLuc+РВТ030-2 TSs (1×105) стереотактически имплантировали в правую и левую части переднего мозга мышей NSG. В сутки 6 мышам в.ч. инъецировали в место правой опухоли 1,0×106 IL13(EQ)BBζ+TCM (всего 1,6×106 клеток; 63% CAR; n равно 4). Схема экспериментальной модели множественной глиомы (A). IHC CD3, демонстрирующая Т-клетки, инфильтрующие в правый и левый сайты опухолей (Б).
На Фиг. 14А-В показаны результаты серии исследований, оценивающих костимулирующие домены IL13Rα2-специфичных CAR. Схема конструкций IL13Rα2-специфичных CAR, сравнивающая разные внутриклеточные эндодомены/домены сигнализации, включающая первое поколение CAR CD3z, не имеющее костимуляции, относительно второго поколения CAR, включающего либо 4-1ВВ, либо CD28, относительно третьего поколения CAR, содержащего и CD28, и 4-1ВВ. Все кассеты CAR также содержат последовательности перескакивания рибосомы Т2А и усеченного CD19 (CD19t) в качестве маркера трансдуцированных клеток (А). TCM CD4 и CD8 трансдуцировали лентивирусом, и Т-клетки, экспрессирующие CAR, иммуномагнитно обогащали посредством антитела против CD19. Уровни экспрессии CD19 и IL13 (т.е. CAR), измеренные проточной цитометрией (Б). Стабильность каждой конструкции CAR определяли путем деления средней интенсивности флуоресценции (MFI) CAR (IL13) на MFI маркера трансдукции (CD19t) (В). CAR, содержащие 4-1 ВВ, демонстрировали наименьшие уровни экспрессии по сравнению с маркером трансдукции CD19t.
На Фиг. 15А-Б показаны результаты исследований, демонстрирующих то, что IL13Rα2-специфичные CAR, содержащие костимулирующий домен 4-1ВВ, продуцируют меньше цитокинов Th1 и Th2. Способность указанных Т-клеток с имитацией трансдукции или экспрессирующих CAR умерщвлять опухолевые клетки-мишени РВТ030-2, экспрессирующие IL13Rα2, определяли в 4-часовом анализе высвобождения 51Cr при указанных соотношениях эффектор : мишень. На (А) показан средний % высвобождения хрома плюс S.D. (стандартное отклонение) от лунок в тройной повторности. Как и ожидалось, Т-клетки с имитацией трансдукции не лизировали мишени эффективно. В отличие от этого, все Т-клетки, экспрессирующие CAR, лизировали опухолевые клетки аналогичным образом. Указанные Т-клетки с имитацией трансдукции или экспрессирующие CAR сокультивировали в течение ночи с опухолевыми клетками РВТ030-2, экспрессирующими IL13Rα2, в соотношении 10:1, и супернатанты анализировали на уровни IL-13 и IFN-γ посредством цитометрического анализа с использованием шариков (Б). Показаны средние значения плюс S.D. от лунок в тройной повторности. Интересно то, что Т-клетки, экспрессирующие CAR зета, 41ВВ-зета или CD28-41ВВ-зета, демонстрировали меньшую стимулированную антигеном продукцию цитокинов, чем Т-клетки, экспрессирующие CAR CD28-зета.
На Фиг. 16А-В показаны результаты ряда исследований по эффективности in vivo IL13Rα2-специфичных CAR. Мыши NSG получали внутричерепную инъекцию опухолевых клеток ffLuc+РВТ030-2 в сутки 0 и были рандомизированы на 6 групп (n равно 9-10 мышей на группу) для в.ч. обработки либо PBS (только опухоль), либо Т-клетками с имитацией трансдукции, либо Т-клетками, экспрессирующими указанный IL13Rα2-специфичный CAR в сутки 8. Затем проводили количественную биолюминесцентную визуализацию для отслеживания роста опухоли с течением времени. Биолюминесцентные изображения для репрезентативных мышей в каждой группе (А). Среднее плюс S.E. (стандартная ошибка среднего) общих уровней потока люциферазной активности с течением времени в каждой группе (Б). Уровни потока для каждой мыши в сутки 27. Все группы, обработанные Т-клетками с IL13Rα2-специфичными CAR, за исключением группы, обработанной Т-клетками, экспрессирующими CD28-CAR, демонстрируют статистически значимое уменьшение объема опухоли по сравнению с мышами, обработанными Т-клетками с имитацией трансдукции (В).
На Фиг. 17 показана аминокислотная последовательность IL13(EQ)BBζ/CD19t+(SEQ ID NO:10).
На Фиг. 18 показано сравнение последовательности IL13(EQ)41BBζ[IL13{EQ}41BBζ T2A-CD19t_epHIV7; pF02630] (SEQ ID NO:12) и CD19Rop_epHIV7 (pJ01683) (SEQ ID NO:13).
На Фиг. 19 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD8tm2-41ВВ-зета (SEQ ID NO:31 с сигнальным пептидом GMSCFRa; SEQ ID NO:39 без сигнального пептида GMSCFRa).
На Фиг. 20 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD28tm-CD28gg-41ВВ-зета (SEQ ID NO:32 с сигнальным пептидом GMSCFRa; SEQ ID NO:40 без сигнального пептида GMSCFRa).
На Фиг. 21 показана аминокислотная последовательность IL13(EmY)-lgG4(HL-CH3)-CD4tm-41ВВ-зета (SEQ ID NO:33 с сигнальным пептидом GMSCFRa; SEQ ID NO:41 без сигнального пептида GMSCFRa).
На Фиг. 22 показана аминокислотная последовательность IL13(EmY)-lgG4(L235E,N297Q)-CD8tm-41ВВ-зета (SEQ ID NO:34 с сигнальным пептидом GMSCFRa; SEQ ID NO:42 без сигнального пептида GMSCFRa).
На Фиг. 23 показана аминокислотная последовательность IL13(EmY)-линкер-CD28tm-CD28gg-41ВВ-зета (SEQ ID NO:35 с сигнальным пептидом GMSCFRa; SEQ ID NO:43 без сигнального пептида GMSCFRa).
На Фиг. 24 показана аминокислотная последовательность IL13(EmY)-HL-CD28m-CD28gg-41ВВ-зета (SEQ ID NO:36 с сигнальным пептидом GMSCFRa; SEQ ID NO:44 без сигнального пептида GMSCFRa).
На Фиг. 25 показана аминокислотная последовательность IL13(EmY)-lgG4(HL-CH3)-CD28tm-CD28gg-41ВВ-зета (SEQ ID NO:37 с сигнальным пептидом GMSCFRa; SEQ ID NO:45 без сигнального пептида GMSCFRa).
На Фиг. 26 показана аминокислотная последовательность IL13(EmY) lgG4(L235E,N297Q)-CD28tm-CD28gg-41ВВ-зета (SEQ ID NO:38 с сигнальным пептидом GMSCFRa; SEQ ID NO:46 без сигнального пептида GMSCFRa).
На Фиг. 27 показана аминокислотная последовательность IL13(EmY)-CD8h3-CD8tm-41ВВ-зета (SEQ ID NO:47 с сигнальным пептидом GMSCFRa; SEQ ID NO:48 без сигнального пептида GMSCFRa).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ниже описана структура, конструирование и характеризация разных IL13Rα2-специфичных химерных антигенных рецепторов. Химерный антиген (CAR) представляет собой рекомбинантную биомолекулу, которая содержит, как минимум, внеклеточный домен распознавания, трансмембранную область и внутриклеточный домен сигнализации. Термин «антиген», следовательно, не ограничивается молекулами, которые связываются антителами, но относится и к любой молекуле, которая может специфично связываться с мишенью. Например, CAR может включать лиганд, который специфично связывается с рецептором поверхности клетки. Внеклеточный домен распознавания (также именуемый внеклеточный домен или просто именуется по элементу распознавания, который он содержит) содержит элемент распознавания, который специфично связывается с молекулой, присутствующей на поверхности клетки клетки-мишени. Трансмембранная область заякоривает CAR в мембране. Внутриклеточный домен сигнализации содержит домен сигнализации из цепи зета человеческого комплекса CD3 и возможно содержит один или более чем один костимулирующий домен сигнализации. CAR может связываться и с антигеном, и трансдуцировать активацию Т-клетки, независимо от ограничения МНС. Таким образом, CAR представляют собой «универсальные» иммунорецепторы, которыми можно лечить группу пациентов с антигенпозитивными опухолями, независимо от их генотипа HLA (антиген лейкоцитов человека). Адоптивная иммунотерапия с использованием Т-лимфоцитов, которые экспрессируют опухолеспецифичный CAR, может быть мощной терапевтической стратегией для лечения рака.
Один описанный в данном документе IL13Rα2-специфичный CAR называется IL13(EQ)BBζ. Данный CAR включает целый ряд важных элементов, включая: лиганд IL13α2, имеющий аминокислотную замену, которая улучшает специфичность связывания с IL13Rα2; домен CD137 (4-1ВВ) последовательно с CD3C, для обеспечения полезной костимуляции; и область Fc lgG4, которая мутирована в двух сайтах в пределах области СН2 (L235E; N297Q) таким способом, который уменьшает связывание Fc рецепторами (FcR). Другой CAR, описанный в данном документе, содержит второй костимулирующий домен.
В некоторых случаях описанный в данном документе CAR, включающий CAR IL13(EQ)BBζ, может быть получен с использованием вектора, в котором после открытой рамки считывания CAR следует последовательность перепрыгивания рибосомы Т2А и усеченный CD19 (CD19t), у которого отсутствует цитоплазматический сигнальный хвост (усеченный в аминокислоте 323). При данной организации коэкспрессия CD19t дает инертный неиммуногенный маркер поверхности, который обеспечивает точное измерение генно-модифицированных клеток и делает возможными позитивную селекцию генно-модифицированных клеток, а также эффективное отслеживание и/или визуализацию терапевтических Т-клеток in vivo после адоптивного переноса. Коэкспрессия CD19t дает маркер иммунологического нацеливания трансдуцированных клеток in vivo с использованием клинически доступных антител и/или реактивов на основе иммунотоксинов для селективного удаления терапевтических клеток и, посредством этого, функционирования в качестве суицидного переключателя.
Глиомы экспрессируют рецепторы IL13 и, в частности, высокоаффинные рецепторы IL13. Однако, в отличие от рецептора IL13, глиомные клетки сверхэкспрессируют уникальную цепь IL13Rα2, способную к связыванию IL13 независимо от требования IL4Rβ или γс44. Подобно его гомологу - IL4, IL13 имеет плеотропную иммунорегуляторную активность вне ЦНС. И IL13, и IL4 стимулируют продукцию IgE В-лимфоцитами и подавляют продукцию провоспалительных цитокинов макрофагами.
Подробные исследования с использованием ауторадиографии с радиоактивно меченым IL13 продемонстрировали обильное связывание IL13 почти на всех исследованных злокачественных глиомных тканях. Это связывание является высокогомогенным в пределах срезов опухоли и при анализе одиночных клеток. Однако анализ с молекулярным зондом, специфичным в отношении мРНК IL13Rα2 не выявил экспрессии глиомоспецифичного рецептора элементами нормального мозга, и ауторадиография с радиоактивно меченым IL13 также не могла выявить специфичное связывание IL13 в нормальной ЦНС. Данные исследования свидетельствуют о том, что общий рецептор IL13Rα1/IL4β/γc не экспрессируется выявляемо в нормальной ЦНС. Следовательно, IL13Rα2 является очень специфичной мишенью поверхности клетки для глиомы и является подходящей мишенью для CAR, разработанных для лечения глиомы.
Связывание терапевтических молекул на основе IL13 с широко экспрессируемым рецепторным комплексом IL13Rα1/IL4β/γc, однако, имеет потенциал опосредования нежелательных токсичностей в нормальных тканях вне ЦНС, и, таким образом, ограничивает системное введение данных агентов. Замена аминокислоты - нативной глутаминовой кислоты на тирозин в альфа-спирали А IL13 в аминокислотном остатке 13 селективно уменьшает аффинность IL13 в отношении рецептора IL13Rα1/IL4β/γc. Связывание данного мутанта (названного IL13(E13Y)) с IL13Rα2, однако, увеличивается относительно IL13 дикого типа. Таким образом, данный минимально измененный аналог IL13 одновременно увеличивает специфичность и аффинность IL13 в отношении глиомных клеток. Следовательно, описанный в данном документе CAR включает IL13, содержащий мутацию (от Е до Y или от Е до некоторой другой аминокислоты, такой как K или R, или L, или V) в аминокислотном остатке 13 (согласно нумерации Debinski et al., 1999, Clin Cancer Res 5:3143s). Однако IL13, имеющий природную последовательность, также можно использовать, и он может быть полезным, особенно в ситуациях, когда модифицированные Т-клетки подлежат местному введению, как, например, посредством инъекции непосредственно в опухолевую массу.
CAR, описанный в данном документе, может быть получен любыми способами, известными в данной области, хотя предпочтительно его получают с использованием методик генной инженерии. Нуклеиновые кислоты, кодирующие несколько областей химерного рецептора, можно получать и собирать в полную кодирующую последовательность стандартными методиками молекулярного клонирования, известными в данной области (скрининг геномной библиотеки, ПЦР (полимеразная цепная реакция), лигирование с помощью праймеров, сайт-направленный мутагенез и т.д.), в зависимости от того, что является удобным. Образующаяся кодирующая область предпочтительно вставляется в экспрессионный вектор и используется для трансформации подходящей экспрессионной линии клетки-хозяина, предпочтительно линии клеток Т-лимфоцитов и наиболее предпочтительно аутологичной линии клеток Т-лимфоцитов.
Трансдуцировать вектором для экспрессии CAR можно разные поднаборы Т-клеток, выделенных из пациента, включая поднаборы не подвергавшихся селекции РВМС (одноядерные клетки периферической крови) или обогащенных CD3 Т-клеток, или обогащенных CD3 или Т-клеток памяти. Центральные Т-клетки памяти являются одним полезным поднабором Т-клеток. Центральные Т-клетки памяти могут быть выделены из одноядерных клеток периферической крови (РВМС) посредством селекции на клетки CD45RO+/CD62L+, используя, например, прибор CliniMACS® для иммуномагнитной селекции клеток, экспрессирующих желательные рецепторы. Клетки, обогащенные центральными Т-клетками памяти, можно активировать с использованием антител против CD3/CD28, трансдуцировать, например, лентивирусным вектором SIN, который управляет экспрессией IL13Rα2-специфичного CAR (например, IL13(EQ)BBζ), а также усеченного человеческого CD19 (CD19t), неиммуногенного маркера поверхности как для выявления in vivo, так и для потенциальной селекции ex vivo. Активированные/генетически модифицированные центральные Т-клетки памяти могут быть размножены in vitro с использованием IL-2/IL-15 и затем подвергнуты криоконсервации.
Пример 1: конструирование и структура IL13Rα2-специфичного CAR
Структура полезного IL13Rα2-специфичного CAR описывается ниже. Последовательность CAR с оптимизированными кодонами содержит связанный с мембраной лиганд - IL13, мутированный в одном сайте (E13Y) для уменьшения потенциального связывания с IL13Rα1, спейсер на основе Fc lgG4, содержащий две мутации (L235E; N297Q), которые значительно ослабляют модели распознавания, опосредованные рецептором Fc, трансмембранный домен CD4, костимулирующий цитоплазматический домен сигнализации 4-1ВВ и цитоплазматический домен сигнализации CD3ζ. Последовательность перескакивания рибосомы Т2А отделяет эту последовательность CAR IL13(EQ)BBζ от CD19t - инертного, неиммуногенного маркера поверхности клетки для выявления/селекции. Эта Т2А-связка приводит к координированной экспрессии и IL13(EQ)BBζ, и CD19t от одного транскрипта. Фиг. 1А представляет собой схематический рисунок открытой рамки считывания из 2670 нуклеотидов, кодирующей конструкцию IL13(EQ)BBZ-T2ACD19t. На этом рисунке показаны все: IL13Rα2-специфичный лиганд - IL13(E13Y), Fc lgG4(EQ), трансмембранный домен CD4, цитоплазматический домен сигнализации 4-1ВВ, трехглициновый линкер и цитоплазматический домен сигнализации CD3ζ CAR IL13(EQ)BBZ, а также последовательности перескакивания рибосомы Т2А и усеченного CD19. Также показаны сигнальные последовательности человеческого рецептора GM-CSF альфа и CD19, которые управляют поверхностной экспрессией CAR IL13(EQ)BBZ и CD19t. Таким образом, конструкция IL13(EQ)BBZ-T2ACD19t включает последовательность IL13Rα2-специфичного, оптимизированного в отношении шарнирной области, костимулирующего химерного иммунорецептора (обозначенного IL13(EQ)BBZ), последовательность перескакивания рибосомы Т2А и последовательность CD19t.
Последовательность IL13(EQ)BBZ получали посредством слияния лидерного пептида человеческого рецептора GM-CSF альфа с последовательностями лиганда IL13(E13Y), L235E/N2970-модифицированного шарнира Fc lgG4 (где двойная мутация препятствует распознаванию FcR), трансмембранного CD4, цитоплазматического домена сигнализации 4-1ВВ и цитоплазматического домена сигнализации CD3ζ. Данную последовательность синтезировали de novo после оптимизации кодонов. Последовательность Т2А получали в результате расщепления плазмиды, содержащей Т2А. Последовательность CD19t получали из последовательности, охватывающей последовательность лидерного пептида с трансмембранными компонентами (т.е. пары оснований 1-972) плазмиды, содержащей CD19. Все три фрагмента: 1) IL13(EQ)BBZ, 2) Т2А и 3) CD19t клонировали в сайт множественного клонирования лентивирусного вектора epHIV7. При трансфекции в подходящие клетки данный вектор интегрирует в геном клеток-хозяев последовательность, схематически показанную на Фиг. 1Б. На Фиг. 1В приведен схематический рисунок 9515 пар оснований самой плазмиды IL13(EQ)BBZ-T2A-CD19t_epHIV7.
Как схематически показано на Фиг. 2, CAR IL13(EQ)BBZ отличается в нескольких важных аспектах от описанного ранее IL13Rα2-специфичного CAR, названного IL13(E13Y)-зетакин (Brown et al. 2012 Clinical Cancer Research 18:2199). IL13(E13Y)-зетакин состоит из IL13Rα2-специфичного мутеина человеческого IL-13 (hulL-13(E13Y)), спейсера на основе Fc человеческого lgG4 (huy4Fc), трансмембранной части человеческого CD4 (huCD4 tm) и цитоплазматической части цепи человеческого CD3ζ (huCD3ζ cyt), как показано. В отличие от него, IL13(EQ)BBζ имеет две точечные мутации - L235E и N297Q, которые расположены в домене СН2 спейсера на основе lgG4, и костимулирующий цитоплазматический домен 4-1ВВ (4-1ВВ cyt).
Пример 2: конструирование и структура epHIV7, используемого для экспрессии IL13Rα2-специфичного CAR
Плазмида pHIV7 представляет собой родительскую плазмиду, из которой был получен клинический вектор IL13(EQ)BBZ-T2A-CD19t_epHIV7 в исследовательской лаборатории терапевтических средств на основе Т-клеток (TCTRL) в City of Норе (СОН). Вектор epHIV7, используемый для экспрессии CAR, получали из вектора pHIV7. Важно то, что в данном векторе для управления экспрессией CAR используется человеческий промотор EF1. И 5', и 3' последовательности данного вектора получали из pv653RSN, полученного из провируса НХВс2. Вытесняемые последовательности ДНК полипуринового участка (рРРТ) происходили из штамма pNL4-3 HIV-1 (вирус иммунодефицита человека-1) из репозитория реактивов СПИД (синдром приобретенного иммунодефицита человека) NIH (Национальный институт здравоохранения США). Последовательность посттранскрипционного регуляторного элемента лесного сурка (WPRE) была описана ранее.
Конструирование pHIV7 схематически показано на Фиг. 3. Вкратце, pv653RSN, содержащую 653 п.о. из gag-pol плюс 5' и 3' длинных концевых повторов (LTR) с находящимся между ними геном SL3-неомицинфосфотрансферазы (Neo), субклонировали в pBluesript следующим образом: на стадии 1 из последовательностей от 5' LTR до отвечающего элемента rev (RRE) создавали p5'HIV-1 51, и затем 5' LTR модифицировали посредством удаления последовательностей, расположенных выше ТАТА-бокса, и лигировали сначала с энхансером CMV (цитомегаловирус) и затем с репликатором SV40 (p5'HIV-2). На стадии 2 после клонирования 3' LTR в pBluesript с получением p3'HIV-1 делали делецию 400 п.о. в 3' LTR энхансера/промотора с удалением цис-регулирующих элементов в U3 HIV и образованием p3'HIV-2. На стадии 3 фрагменты, выделенные из p5'HIV-3 и p3'HIV-2, лигировали с получением pHIV-3. На стадии 4 p3'HIV-2 дополнительно модифицировали посредством удаления дополнительных, расположенных выше последовательностей HIV с получением p3'HIV-3, и к p3'HIV-3 добавляли фрагмент из 600 п.о. BamHI-Sall, содержащий WPRE, с получением p3'HIV-4. На стадии 5 уменьшали размер RRE pHIV-3 посредством ПЦР и лигировали с 5' фрагментом из pHIV-3 (не показано) и с p3'HIV-4 с получением pHIV-6. На стадии 6 фрагмент из 190 п.о. BgIII-BamHI, содержащий вытесняемую последовательность ДНК рРРТ из pNL4-3 (55) HIV-1, амплифицировали из pNL4-3 и размещали между последовательностями RRE и WPRE в pHIV6 с получением pHIV-7. Эту родительскую плазмиду pHIV7-GFP (GFP - зеленый флуоресцентный белок) использовали для упаковки родительского вектора с использованием четырехплазмидной системы.
Упаковочный сигнал - пси ψ - требуется для эффективной упаковки вирусного генома в вектор. RRE и WPRE усиливают транспорт РНК-транскрипта и экспрессию трансгена. Было продемонстрировано, что вытесняемая последовательность в комбинации с WPRE усиливает эффективность трансдукции лентивирусного вектора в клетках млекопитающих.
Хелперные функции, требующиеся для получения вирусного вектора, разделены на три отдельные плазмиды для уменьшения вероятности получения лентивируса, компетентного к репликации, посредством рекомбинации: 1) pCgp кодирует белок gag/pol, требующийся для сборки вирусного вектора; 2) pCMV-Rev2 кодирует белок Rev, который действует на последовательность RRE, помогая транспорту вирусного генома для эффективной упаковки и 3) pCMV-G кодирует гликопротеин вируса везикулостоматита (VSV), который требуется для инфективности вирусного вектора.
Имеется минимальная гомология последовательности ДНК между геномом вектора, кодируемого pHIV7, и хелперными плазмидами. Области гомологии включают область упаковочного сигнала из приблизительно 600 нуклеотидов, расположенную в последовательности gag/pol хелперной плазмиды pCgp; последовательность промотора CMV во всех трех хелперных плазмидах и последовательность RRE в хелперной плазмиде pCgp. Весьма маловероятно, что компетентный к репликации рекомбинантный вирус мог бы быть генерирован из-за гомологии в данных областях, так как потребовались бы многие события рекомбинации. Кроме того, у любых образующихся в результате рекомбинантов отсутствовали бы функциональные LTR и последовательности tat, требующиеся для репликации лентивируса.
Промотор CMV заменяли промотором EF1α-HTLV (EF1p), и новую плазмиду называли epHIV7 (Фиг. 4). EF1p имеет 563 п.о., и его вводили в epHIV7 с использованием Nrul и Nhel после вырезания промотора CMV.
Лентивирусный геном, исключая gag/pol и rev, которые необходимы для патогенности вируса дикого типа и требуются для продуктивной инфекции клеток-мишеней, удаляли из данной системы. Кроме того, конструкция вектора IL13(EQ)BBZ-T2ACD19t_epHIV7 не содержит интактный промотор 3'LTR, таким образом, образующийся экспрессируемый и подвергающийся обратной транскрипции в клетках-мишенях провирусный геном на основе ДНК будет иметь неактивные LTR. В результате этой конструкции из провируса не будут транскрибироваться последовательности, происходящие из HIV-I, и от их соответствующих промоторов будут экспрессироваться только терапевтические последовательности. Ожидается, что удаление активности промотора LTR в векторе SIN значительно уменьшает вероятность ненамеренной активации генов хозяина (56). В Таблице 4 обобщены разные регуляторные элементы, присутствующие в IL13(EQ)BBZ-T2ACD19t_epHIV7.
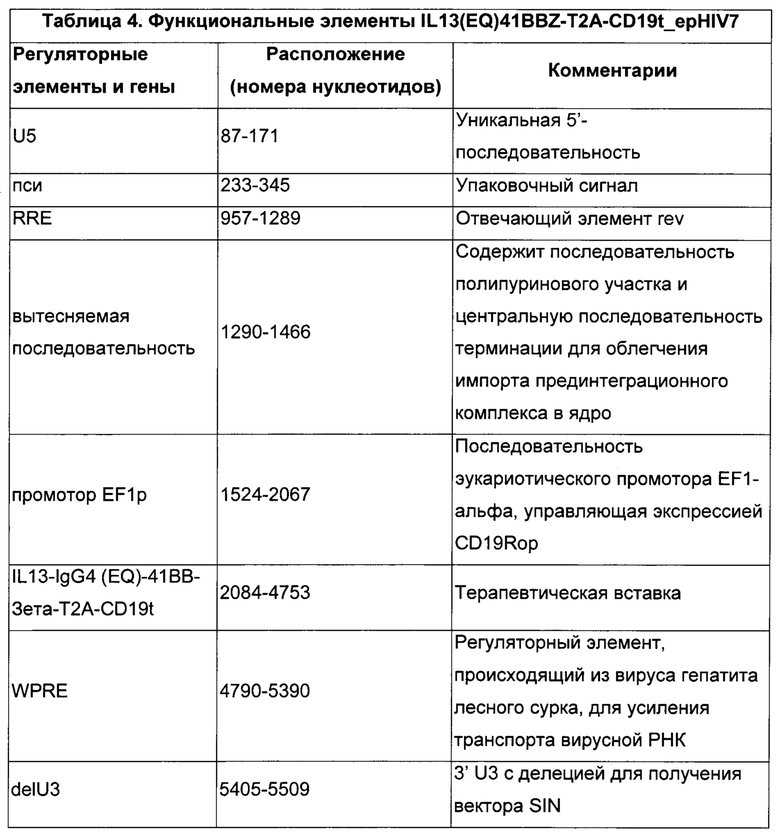
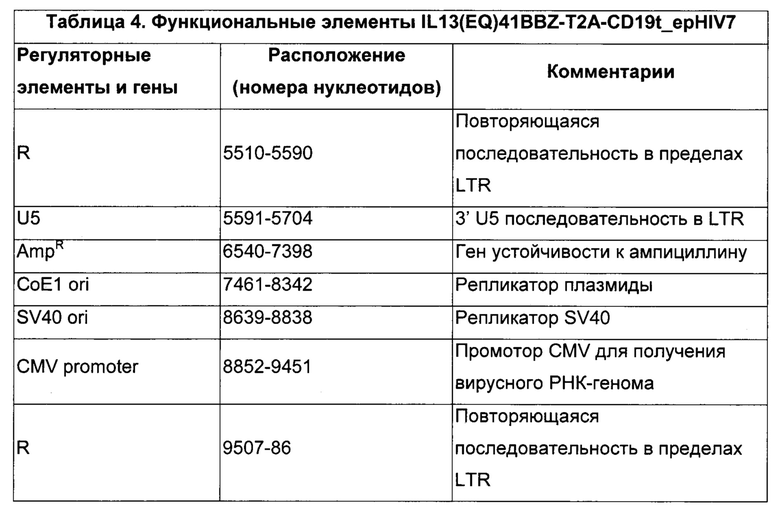
Пример 3: получение векторов для трансдукции Т-клеток пациента
Для каждой плазмиды (IL13(EQ)BBZ-T2A-CD19t_epHIV7, pCgp, pCMV-G и pCMV-Rev2) генерируется семенной банк, который используется для инокуляции ферментера для продукции достаточных количеств плазмидной ДНК. Плазмидную ДНК тестируют на идентичность, стерильность и уровень эндотоксинов до ее применения в продуцировании лентивирусного вектора.
Вкратце, клетки размножали от рабочей клетки 293Т (WCB), которая была протестирована на соответствие стерильности и отсутствию вирусного загрязнения. Флакон с клетками 293Т из WCB 293Т оттаивали. Клетки выращивали и размножали до тех пор, пока не образовалось достаточное число клеток для посева в подходящее число 10-слойных клеточных фабрик (CF) для продукции вектора и поддержания линии клеток. Для продукции можно использовать одну линию клеток.
Лентивирусный вектор продуцировали в подпартиях вплоть до 10 CF. В ту же самую неделю можно продуцировать две подпартии, что приводит к продукции приблизительно 20 л лентивирусного супернатанта/неделю. Материал, продуцированный из всех подпартий, объединяли во время фазы последующей переработки для того, чтобы получить одну партию продукта. Клетки 293Т высевали в CF в среду 293Т (DMEM (среда Игла, модифицированная по Дульбеко) с 10% FBS (фетальная телячья сыворотка)). Фабрики помещали в инкубатор при 37°C и выравнивали горизонтально для того, чтобы получать равномерное распределение клеток на всех слоях CF. Через двое суток клетки трансфицировали четырьмя лентивирусными плазмидами, описанными выше, с использованием способа с CaPO4, который включает смесь Tris:EDTA, 2М CaCl2, 2×HBS и четырех ДНК-плазмид. В сутки 3 после трансфекции собирали супернатант, содержащий секретированные лентивирусные векторы, очищали и концентрировали. После удаления супернатанта из CF из каждой CF отбирали клетки конечной продукции. Клетки из каждой фабрики трипсинизировали и собирали центрифугированием. Клетки ресуспендировали в среде для замораживания и криоконсервировали. Данные клетки позднее использовали для тестирования лентивируса, компетентного в отношении репликации (RCL).
Для очистки и приготовления векторов неочищенный супернатант осветляли фильтрованием через мембрану для удаления клеточных обломков. ДНК клетки-хозяина и остаточную плазмидную ДНК деградировали эндонуклеазным расщеплением (Benzonase®). Вирусный супернатант осветляли от клеточных обломков с использованием 0,45 мкм фильтра. Осветленный супернатант собирали в предварительно взвешенный контейнер, в который добавляли Benzonase® (конечная концентрация 50 U (единиц)/мл). Эндонуклеазное расщепление остаточной плазмидной ДНК и геномной ДНК хозяина проводится при 37°C в течение 6 ч. Для удаления из неочищенного супернатанта остаточных низкомолекулярных компонентов использовали концентрирование обработанного эндонуклеазой супернатанта с использованием исходной ультрафильтрации с тангенциальным потоком (TFF), концентрируя вирус ~ в 20 раз. Осветленный вирусный супернатант, обработанный эндонуклеазой, циркулировал через картридж на основе полых волокон с порогом отсечения молекулярной массы 500 кДа, и скорость тока продумывали так, чтобы поддерживать скорость сдвига ~4000 с-1 или менее при максимизации скорости тока. Диафильтрацию супернатанта, обработанного нуклеазой, инициировали во время процесса концентрирования для поддержания эффективности работы картриджа. Устанавливали скорость замены пермеата 80% с использованием 4% лактозы в PBS (фосфатно-солевой буферный раствор) в качестве диафильтрационного буфера. Вирусный супернатант доводили до намеченного объема, обеспечивая 20-кратное концентрирование неочищенного супернатанта, и диафильтрацию продолжали с использованием 4 дополнительных замен объемов со скоростью замены пермеата 100%.
Дополнительное концентрирование вирусного продукта осуществляли с использованием методики высокоскоростного центрифугирования. Каждую подпартию лентивируса осаждали с использованием центрифуги Sorvall RC-26 plus при 6000 об/мин (RCF 6088) при 60°C в течение 16-20 ч. Вирусный осадок из каждой подпартии затем растворяли в объеме 50 мл с использованием 4% лактозы в PBS. Растворенный в данном буфере осадок представляет собой конечную композицию препарата вируса. Весь способ концентрирования вектора приводил приблизительно к 200-кратному уменьшению объема. После завершения получения всех подпартий материал затем помещали при -80°C, в то время как образцы из каждой подпартии тестировали на стерильность. После подтверждения стерильности образцов подпартии быстро оттаивали при 37°C с частым встряхиванием. Данный материал затем объединяли и вручную делили на аликвоты в боксе микробиологической безопасности класса II типа А/В3 в кабинете для получения вирусных векторов. Использовали конфигурацию заполнения 1 мл концентрированного лентивируса в стерильных криофлаконах класса 6 USP (фармакопея Соединенных Штатов) с наружной резьбой и О-кольцом. Системы контроля качества (QS) Центра разработки прикладных технологий (CATD) в СОН выпускали все материалы согласно политике и стандартному регламенту работы для CBG и в соответствии с современной надлежащей производственной практикой (cGMP).
Для обеспечения чистоты препарата лентивирусного вектора его тестировали на остаточные загрязнения ДНК хозяина и перенос остаточной ДНК хозяина и плазмиды. Среди других анализов идентичность вектора оценивали посредством ПЦР-ОТ (полимеразная цепная реакция с обратной транскриптазой) для того, чтобы убедиться, что присутствует правильный вектор. Для вектора, предназначенного для применения в данном исследовании, удовлетворяются все критерии выпуска.
Пример 4: получение Т-клеток, подходящих для применения в ACT
Т-лимфоциты получают от пациента посредством лейкафереза, и подходящий поднабор аллогенных или аутологических Т-клеток, например, центральных Т-клеток памяти (TCM), генетически изменяют для экспрессии CAR, затем вводят обратно пациенту любым клинически приемлемым способом для осуществления противораковой терапии.
Краткий обзор стратегии изготовления TCM проиллюстрирован на Фиг. 8 (схема изготовления IL13(EQ)BBζ/CD19t+TCM). В частности, продукты афереза, полученные от участников исследования, подписавших информированное согласие, разделяли на фиколе, промывали и инкубировали в течение ночи. Затем клетки обедняли популяциями моноцитов, регуляторных Т-клеток и наивных Т-клеток с использованием реактивов на основе антитела против CD14, антитела против CD25 и антитела против CD45RA уровня качества GMP (Miltenyi Biotec) и прибора для разделения CliniMACS™. После обеднения негативные фракции клеток обогащаются в отношении клеток TCM CD62L+ с использованием DREG56-биотина (клинический уровень качества СОН) и микрошариков против биотина (Miltenyi Biotec) на приборе для разделения CliniMACSTM.
После обогащения клетки TCM готовят в виде препарата в полной X-Vivo15 плюс 50 IU (Международные единицы)/мл IL-2 и 0,5 нг/мл IL-15 и переносят в тефлоновый мешок для культуры клеток, где они стимулируются шариками Dynal ClinEx™ Vivo CD3/CD28. Вплоть до пяти суток после стимулирования клетки трансдуцируются лентивирусным вектором IL13(EQ)BBZ-T2A-CD19t_epHIV7 при множественности инфекции (MOI) от 1,0 до 0,3. Культуры поддерживаются в течение вплоть до 42 суток с добавлением полной X-Vivo15 и цитокина IL-2 и IL-15 по мере необходимости для размножения клеток (поддерживая плотность клеток от 3×105 до 2×106 жизнеспособных клеток/мл) и дополнением цитокинами каждый понедельник, среду и пятницу культуры). При данных условиях клетки типично размножаются до приблизительно 109 клеток в пределах 21 суток. В конце периода культивирования клетки отбирают, дважды промывают и готовят в криоконсервирующей среде клинического уровня качества (Cryostore CS5, BioLife Solutions).
В сутки инфузии Т-клеток криоконсервированный и высвобожденный продукт оттаивают, промывают и готовят для повторной инфузии. Криоконсервированные флаконы, содержащие высвобожденный клеточный продукт, удаляют из хранилища с жидким азотом, оттаивают, охлаждают и промывают промывочным буфером на основе PBS/2%-ного человеческого сывороточного альбумина (HSA). После центрифугирования супернатант удаляется и клетки ресуспендируются в инфузионном разбавителе на основе нормального физиологического раствора, не содержащего консерванты (PFNS)/2% HSA. Образцы удаляются для тестирования для контроля качества.
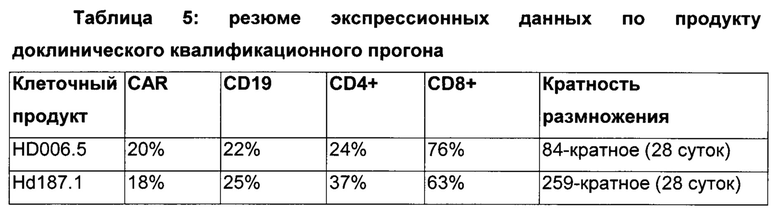
Два квалификационных прогона на клетках, полученных от здоровых доноров, осуществляли с использованием производственной платформы, описанной выше. Каждому продукту доклинического квалификационного прогона присваивали номер донора-человека (HD) - HD006.5 и HD187.1. Важно то, что как показано в Таблице 5, данные клетки квалификационных прогонов размножались более чем 80 раз в пределах 28 суток, и размноженные клетки экспрессировали трансгены IL13(EQ)BBγ/CD19t.
Пример 5: анализ экспрессии трансгена поверхности и маркера Т-клеток в IL13(EQ)BBy/CD19t+TCM посредством проточной цитометрии
В доклинических исследованиях использовали продукты двух доклинических квалификационных прогонов, описанные в Примере 4, как описано ниже. На Фиг. 6А-В показаны результаты анализа экспрессии трансгена поверхности и маркера Т-клеток посредством проточной цитометрии. IL13(EQ)BBγ/CD19t+TCM HD006.5 и HD187.1 совместно окрашивали антителом против IL13-PE и антителом против CD8-FITC для выявления клеток CD8+ CAR+ и CD4+ (т.е. CD8-негативных) CAR+ (Фиг. 6А), или антителом против CD19-PE и антителом против CD4-FITC для выявления клеток CD4+ CD19t+ и CD8+ (т.е. CD4-негативных) CAR+ (Фиг. 6Б). IL13(EQ)BBγ/CD19t+TCM HD006.5 и HD187.1 окрашивали антителами против CD3, TCR, CD4, CD8, CD62L и CD28, конъюгированными с флуорохромом (серые гистограммы), или изотипическими контролями (черные гистограммы). (Фиг. 6В). На каждой из Фиг. 6А-В указанные процентные доли основаны на жизнеспособных лимфоцитах (негативных в отношении DAPI), которые окрашивались сильнее, чем изотипический контроль.
Пример 6: Эффекторная активность IL13(EQ)BBγ/CD19t+TCM
Оценивали эффекторную активность IL13(EQ)BBγ/CD19t+TCM, и результаты данного анализа показаны на Фиг. 7А-Б. Вкратце, IL13(EQ)BBγ/CD19t+TCM HD006.5 и HD187.1 использовали в качестве эффекторов в 6-часовом анализе высвобождения 51Cr с использованием соотношения 10Е:1Т на основе экспрессии CD19t. IL13Rα2-позитивными опухолями-мишенями были К562, генетически модифицированная для экспрессии IL13Rα2 (K562-IL13Rα2), и линия первичной глиомы РВТ030-2, а IL13Rα2-негативной контрольной опухолью-мишенью была родительская линия К562 (Фиг. 7А). IL13(EQ)BBγ/CD19t+HD006.5 и HD187.1 оценивали на антигензависимую продукцию цитокинов после совместной культуры в течение ночи при соотношении 10Е:1Т с использованием таких же IL13Rα2-позитивных и негативных мишеней, как описано выше. Уровни цитокинов измеряли с использованием набора для анализа Bio-Plex Pro Human Cytokine TH1/TH2, и показаны уровни IFN-γ (Фиг. 7Б).
Пример 7: противоопухолевая активность IL13(EQ)BBγ/CD19t+TCM in vivo
Описанные ниже исследования демонстрируют то, что IL13(EQ)BBγ/CD19t+TCM показывают противоопухолевую эффективность в мышиных моделях in vivo. В частности, авторы изобретения оценили противоопухолевую эффективность IL13(EQ)BBγ/CD19t+TCM относительно линии РВТ030-2 IL13Rα2+ сфер первичной глиобластомной опухоли с малым числом пассажей, которую генетически модифицировали для экспрессии репортерных генов: и EGFP (усиленный зеленый флуоресцентный белок), и люциферазы светляка (ffLuc) (РВТ030-2 EGFP:ffLuc) (6). Ряд первичных линий (РВТ) из образцов глиобластомы пациента выращивали в виде сфер опухоли (TSs) в бессывороточных средах. Данные размноженные линии TS демонстрируют характеристики, подобные стволовым клеткам, включающие экспрессию маркеров стволовых клеток, многолинейную дифференциацию и способность к инициации ортотопических опухолей у иммунодефицитных мышй (NSG) при малом числе клеток. Модель TS-инициированного ксенотрансплантата РВТ030-2 EGFP:ffLuc (0,1×106 клеток; 5 суток после приживления) ранее использовали для оценки противоопухолевой активности in vivo Т-клеток, экспрессирующих IL13Rα2-специфичный CAR, у мышей NSG, при этом было показано, что три инъекции 2×106 цитолитических Т-лимфоцитов (CTL) на протяжении 2 недель уменьшают рост опухоли. Однако в данных экспериментах большинство опухолей РВТ030-2 в конечном счете давали рецидив. По сравнению с этим однократная инъекция IL13(EQ)BBγ/CD19t+TCM (1,1×106 CAR+ TCM; общее число TCM 2×106) демонстрировала надежную противоопухолевую активность против TS-инициированных опухолей РВТ030-2 EGFP:ffLuc (0,1×106 клеток; 5 суток после приживления), как показано на Фиг. 8А-В. По сравнению с мышами NSG, обработанными либо PBS, либо TCM с имитацией трансдукции (без CAR), IL13(EQ)BBγ/CD19t+ TCM значимо уменьшают поток ffLuc (р меньше 0,001 в моменты времени больше, чем 18 суток) и значительно улучшают выживание (р равно 0,0008).
Вкратце, опухолевые клетки EGFP-ffLuc+РВТ030-2 (1×105) стереотактически имплантировали в правую часть переднего мозга мышей NSG. В сутки 5 мыши получали либо 2×106 IL13(EQ)BBζ/CD19t+ TCM (1,1×106 CAR+; n равно 6), либо 2×106 имитации трансдукции TCM (без CAR; n равно 6), либо PBS (фосфатно-солевой буферный раствор) (n равно 6). На Фиг. 8А показаны репрезентативные мыши из каждой группы, демонстрирующие относительную опухолевую нагрузку с использованием Xenogen Living Image. Количественное измерение потока ffLuc (фотоны/с) показывает то, что IL13(EQ)BBζ/CD19t+ TCM индуцируют регрессию опухоли по сравнению с TCM с имитацией трансдукции и с PBS (#р меньше 0,02; *р меньше 0,001, ANOVA с повторными измерениями) (Фиг. 8Б). Как показано на Фиг. 8В, кривая выживания Каплана-Мейера (n равно 6 на группу) демонстрирует значимо улучшенное выживание (р равно 0,0008; логранговый критерий) для мышей, обработанных IL13(EQ)BBγ/CD19t+ TCM.
Пример 8: сравнение клонов CTL IL13(EQ)BBζ+ TCM и не TCM IL13-зетакин CD8+ по противоопухолевой эффективности и стойкости Т-клеток
В исследованиях, описанных ниже, сравниваются IL13(EQ)BBζ+ TCM и созданные ранее IL13Rα2-специфичные человеческие CTL CD8+ (CTL IL13-зетакин CD8+ (описанные в Brown et al. 2012 Clin Cancer Res 18:2199 и Kahlon et al. 2004 Cancer Res 64:9160). В IL13-зетакин используется стимулирующий домен CD3ζ, отсутствует костимулирующий домен и используется тот же самый вариант IL13, что и в IL13(EQ)BBζ+.
Получали ряд первичных линий (РВТ) из образцов глиобластомы пациента, выращенных в виде сфер опухолей (TSs) в бессывороточных средах (Brown et al. 2012 Clin Cancer Res 18:2199; Brown et al. 2009 Cancer Res 69:8886). Данные размноженные линии TS демонстрируют характеристики, подобные стволовым клеткам, включающие экспрессию маркеров стволовых клеток, многолинейную дифференциацию и способность к инициации ортотопических опухолей у иммунодефицитных мышей (NSG) при малом числе клеток. Для экспериментов, описанных ниже, использовали IL13Rα2+ линию TS первичной глиобластомы с малым числом пассажей РВТ030-2, которая была генетически модифицирована для экспрессии репортерных генов: и EGFP, и люциферазы светляка (ffLuc) (РВТ030-2 EGFP:ffLuc) (Brown et al. 2012 Clin Cancer Res 18:2199).
Сначала сравнивали одну дозу (1×106 Т-клеток CAR) продукта IL13(EQ)BBζ+TCM с клонами CTL IL13-зетакин CD8+, оцениваемыми относительно TS-инициированных ксенотрансплантатов РВТ030-2 EGFP:ffLuc в сутки 8 (0,1×106 клеток). В то время как и Т-клетки с IL13Rα2-специфичным CAR (CTL с IL13-зетакин и IL13(EQ)BBζ+ TCM) демонстрировали противоопухолевую активность против прижившихся опухолей РВТ030-2 по сравнению с необработанным контролем или контролем в виде TCM с имитацией трансдукции (CAR-негативным) (Фиг. 9А и 9Б), IL13(EQ)BBZ+ TCM опосредовали значимо улучшенное выживание и надежную ремиссию опухоли с мышами, живущими больше 150 суток, по сравнению с первым поколением клонов CTL IL13-зетакин CD8+ авторов изобретения (Фиг. 9В).
Для дальнейшего сравнения терапевтических эффективностей данных двух Т-клеточных продуктов IL13Rα2-CAR осуществляли титрование дозы - 1,0, 0,3 и 0,1×106 Т-клеток с CAR относительно TS-инициированных опухолей РВТ030-2 EGFP:ffLuc в сутки 8 (Фиг. 10А-В). Наивысшая доза (1×106) клона 2D7 CTL IL13-зетакин CD8+ опосредовала противоопухолевые ответы при измерении потока посредством Xenogen у 3 из 6 животных (Фиг. 10В), но при меньших дозах Т-клеток с CAR не наблюдали значимых противоопухолевых ответов. По сравнению с этим, инъекция продукта IL13(EQ)BBζ+TCM опосредовала полную регрессию опухоли у большинства мышей при всех уровнях дозы, включая обработку всего лишь 0,1×106 Т-клеток с CAR. Эти данные демонстрируют то, что IL13(EQ)BBζ+TCM являются по меньшей мере в 10 раз более эффективными по противоопухолевой эффективности, чем клоны CTL IL13-зетакин CD8+. Улучшенная противоопухолевая эффективность обусловлена улучшенной стойкостью Т-клеток в микроокружении опухоли. Оценка Т-клеток CD3+ через 7 суток после в.ч. инъекции выявила значимое число IL13(EQ)BBζ+TCM в микроокружении опухоли, тогда как присутствовало очень мало CTL первого поколения IL13-зета (Фиг. 11).
Пример 9: сравнение пути доставки Т-клеток с CAR для лечения больших, РВТ опухолей, инициированных TS
Ниже описаны исследования, в которых сравнивается влияние пути доставки - внутривенного (в.в.) или внутричерепного (в.ч.) - на противоопухолевую активность против линий инвазивных первичных РВТ. В пилотных исследованиях (данные не показаны) неожиданно наблюдали то, что в.в. введенные IL13(EQ)BBζ+Tcm не давали терапевтической пользы по сравнению с PBS для лечения маленьких (сутки 5) опухолей РВТ030-2 EGFP:ffLuc. Это отличается от надежной терапевтической эффективности, наблюдаемой с в.ч. введенными Т-клетками CAR+. Обоснованием является то, что в сутки 5 опухоли РВТ030-2 возможно были слишком маленькими для рекрутирования терапевтических Т-клеток с периферии - делали сравнение в.в. относительно в.ч. доставки против больших опухолей РВТ030-2 EGFP:ffLuc в сутки 19. Для этих исследований мышей с прижившимися РВТ030-2 обрабатывали либо двумя в.в. инфузиями (5×106 CAR+ TCM; сутки 19 и 26), либо четырьмя в.ч. инфузиями (1×106 CAR+TCM; сутки 19, 22, 26 и 29) IL13(EQ)BBZ+TCM, или TCM с имитацией трансдукции (без CAR). Здесь также не отслеживали терапевтической пользы посредством визуализации Xenogen или анализом выживания Каплана-Мейера в отношении в.в. введенных Т-клеток CAR+(Фиг. 12А и 12Б). В отличие от этого, для в.ч. введенных IL13(EQ)BBζ+ TCM наблюдали мощную противоопухолевую активность (Фиг. 12А-Б). Затем отбирали мозги из когорты мышей 7 суток после инъекции Т-клеток и оценивали на человеческие клетки CD3+ посредством IHC. Неожиданно, для мышей, обработанных в.в. либо TCM с имитацией трансдукции, либо IL13(EQ)BBζ+TCM, в опухоли или в других областях мозга мыши, где типично находятся человеческие Т-клетки (т.е. мягкая и паутинная оболочки мозга), не было выявляемых человеческих Т-клеток CD3+ (Фиг. 12В), свидетельствуя о недостатке в тропизме в опухоль. Это отличается от значительного числа Т-клеток, выявленного у мышей, обработанных в.ч. (Фиг. 12Г).
Цитокины, происходящие из опухоли, в частности, MCP-1/CCL2, являются важными в рекрутировании Т-клеток в опухоль. Таким образом, оценивали клетки опухоли РВТ030-2, и обнаружили, что данная линия продуцирует высокие уровни MCP-1/CCL2, сравнимые с клетками U251T (данные не показаны) - линией глиомы, для которой ранее было показано, что она привлекает в.в. введенные эффекторные Т-клетки CD8+к в.ч. прижившимся опухолям. Злокачественные глиомы представляют собой высокоинвазивные опухоли и часто являются множественными по проявлению. В исследованиях, описанных выше, установлено то, что IL13BBZ ТСМ могут устранять инфильтрующие опухоли, такие как РВТ030-2, и опосредовать долговременную надежную противоопухолевую активность. Также проверили способность Т-клеток с CAR, доставленных внутричерепно, к транспорту в многоочаговое заболевание. Для этого исследования РВТ030-2 EGFP:ffLuc TSs имплантировали как в левое, так и в правое полушария (Фиг. 13А), и Т-клетки CAR+ инъецировали только сайт правой опухоли. Ободряющим было то, что для всех оцененных мышей (n равно 3) авторы изобретения выявили Т-клетки посредством IHC против CD3 через 7 суток после инфузии Т-клеток как в месте инфекции (т.е. в правой опухоли), так и в опухоли на левом полушарии (Фиг. 13Б). Эти данные дают доказательство того, что Т-клетки CAR+ способны транспортироваться к и инфильтровать очаги опухоли в удаленных сайтах. Аналогичные данные также наблюдали во второй модели опухоли с использованием линии клеток глиомы U251T (данные не показаны).
Пример 10: сравнение костимулирующих доменов
Провели ряд исследований для оценки разных костимулирующих доменов. Разные оцененные CAR схематически описаны на Фиг. 14А и включали CAR первого поколения CD3ζ, не имеющий костимулирующего домена, два CAR второго поколения, включающие либо костимулирующий домен 4-1ВВ, либо костимулирующий домен CD28, и CAR третьего поколения, содержащий и костимулирующий домен CD28, и костимулирующий домен 4-1ВВ. Все конструкции CAR также содержат последовательность перескакивания рибосомы Т2А и последовательность усеченного CD19 (CD19t) в качестве маркера трансдуцированных клеток.
ТСМ CD4 и CD8 лентивирусно трансдуцировали, и Т-клетки, экспрессирующие CAR, иммуномагнитно обогащали посредством антитела против CD19. Уровни экспрессии CD19 и IL13 (т.е. CAR) измеряются посредством проточной цитометрии. Результаты показаны на Фиг. 14Б. Стабильность каждой конструкции CAR определяли путем деления средней интенсивности флуоресценции (MFI) CAR (IL13) на MFI маркера трансдукции (CD19t) (Фиг. 14В). Два CAR, включающие костимулирующий домен 4-1ВВ, демонстрировали наименьшие уровни экспрессии по сравнению с маркером трансдукции CD19t.
Способность указанных Т-клеток с имитацией трансдукции или экспрессирующих CAR умерщвлять опухолевые клетки-мишени РВТ030-2, экспрессирующие IL13Rα2, определяли в 4-часовом анализе высвобождения 51Cr при указанных соотношениях эффектор : мишень. Результаты данного исследования представлены на Фиг. 15А (показан средний % высвобождения хрома плюс/минус S.D. от лунок в тройной повторности). Как и ожидалось, Т-клетки с имитацией трансдукции не лизировали мишени эффективно. В отличие от этого, все Т-клетки, экспрессирующие CAR, лизировали опухолевые клетки аналогичным образом. На Фиг. 15Б показаны результаты исследования, в котором указанные Т-клетки с имитацией трансдукции или экспрессирующие CAR сокультивировали в течение ночи с опухолевыми клетками РВТ030-2, экспрессирующими IL13Rα2, в соотношении 10:1, и супернатанты анализировали на уровни IL-13 и IFN-γ посредством цитометрического анализа с использованием шариков. Интересно то, что Т-клетки, экспрессирующие CAR зета, 41ВВ-зета или CD28-41ВВ-зета, демонстрировали меньшую стимулированную антигеном продукцию цитокинов, чем Т-клетки, экспрессирующие CAR СР28-зета.
Эффективность in vivo разных CAR проверяли следующим образом. Вкратце, мыши NSG получали внутричерепную инъекцию опухолевых клеток ffLuc+РВТ030-2 в сутки 0 и были рандомизированы на 6 групп (n равно 9-10 мышей на группу) для в.ч. обработки либо PBS (только опухоль), либо Т-клетками с имитацией трансдукции, либо Т-клетками, экспрессирующими указанный IL13Ra2-специфичный CAR, в сутки 8. Затем проводили количественную биолюминесцентную визуализацию для отслеживания роста опухоли с течением времени. Биолюминесцентные изображения для репрезентативных мышей в каждой группе (Фиг. 16А). Уровни потока для каждой мыши в сутки 27 (Фиг. 16Б). Все группы, обработанные Т-клетками с IL13Rα2-специфичными CAR, за исключением группы, обработанной Т-клетками, экспрессирующими CD28-CAR, демонстрируют статистически значимое уменьшение объема опухоли по сравнению с мышами, обработанными Т-клетками с имитацией трансдукции (Фиг. 16В).
Пример 11: аминокислотная последовательность IL13(EQ)BBζ/CD19t
Полная аминокислотная последовательность IL13(EQ)BBζ/CD19t показана на Фиг. 17. Полная последовательность (SEQ ID NO:1) включает: сигнальный пептид GMCSF из 22 аминокислот (SEQ ID NO:2), последовательность IL-13 из 112 аминокислот (SEQ ID NO:3, замена аминокислоты E13Y показана жирным шрифтом); последовательность lgG4 из 229 аминокислот (SEQ ID NO:4, с заменами аминокислот L235E и N297Q, показанными жирным шрифтом), трансмембранную последовательность CD4 из 22 аминокислот (SEQ ID NO:5), последовательность 4-1ВВ из 42 аминокислот (SEQ ID NO:6), 3-аминокислотный Gly линкер; последовательность CD3ζ из 112 аминокислот (SEQ ID NO:7), последовательность Т2А из 24 аминокислот (SEQ ID NO:8) и последовательность CD19t из 323 аминокислот (SEQ ID NO:9).
Последовательность зрелого химерного антигенного рецептора (SEQ ID NO:10) включает: последовательность IL-13 из 112 аминокислот (SEQ ID NO:3, замена аминокислоты E13Y показана жирным шрифтом); последовательность lgG4 из 229 аминокислот (SEQ ID NO:4, с заменами аминокислот L235E и N297Q, показанными жирным шрифтом), последовательность CD4 из 22 аминокислот (SEQ ID NO:5), последовательность 4-1ВВ из 42 аминокислот (SEQ ID NO:6), 3-аминокислотный Gly линкер и последовательность CD3ζ, из 112 аминокислот (SEQ ID NO:7). В пределах данной последовательности CAR (SEQ ID NO:10) присутствует последовательность IL-13/lgG4/CD4t/41-BB (SEQ ID NO:11), которая включает: последовательность IL-13 из 112 аминокислот (SEQ ID NO:3, замена аминокислоты E13Y показана жирным шрифтом); последовательность lgG4 из 229 аминокислот (SEQ ID NO:4, с заменами аминокислот L235E и N297Q, показанными жирным шрифтом), последовательность CD4 из 22 аминокислот (SEQ ID NO:5) и последовательность 4-1ВВ из 42 аминокислот (SEQ ID NO:6). Последовательность IL-13/lgG4/CD4t/4-1BB (SEQ ID NO:11) может быть соединена с последовательностью CD3ζ из 112 аминокислот (SEQ ID NO:7) посредством линкера, такого как GlyGlyGly линкер. Последовательности CAR (SEQ ID NO:10) может предшествовать сигнальный пептид GMCSF из 22 аминокислот (SEQ ID NO:2).
На Фиг. 18 показано сравнение последовательностей IL13(EQ)41BBζ[IL13{EQ}41BBζ T2A-CD19t_epHIV7; pF02630] (SEQ ID NO:12) и CD19Rop_epHIV7 (pJ01683) (SEQ ID NO:13).
Пример 12: аминокислотная последовательность IL13(EQ)BBζ/CD19t
На Фиг. 19-26 показаны аминокислотные последовательности дополнительных CAR, направленных против IL13Rα2, в каждом случае отмечены разные домены, за исключением спейсера GlyGlyGly, расположенного между определенными внутриклеточными доменами. Каждый включает человеческий IL13 с заменой Glu до Туr (SEQ ID NO:3, показанная замена аминокислоты E13Y выделена). В экспрессионном векторе, используемом для экспрессии данных CAR, экспресируемая аминокислотная последовательность может включать последовательность Т2А из 24 аминокислот (SEQ ID NO:8); и последовательность CD19t из 323 аминокислот (SEQ ID NO:9) для обеспечения координированной экспрессии последовательности усеченного CD19 на поверхности клеток, экспрессирующих CAR.
Ряд CAR, содержащих домен в виде человеческого IL13(E13Y), домен в виде CD28 tm, костимулирующий домен CD28gg, костимулирующий домен 4-1ВВ и домен в виде CD3ζ, в качестве остова CAR, и включающих либо спейсер HL (22 аминокислоты), спейсер в виде шарнира CD8 (48 аминокислот), спейсер в виде lgG4-HL-CH3 (129 аминокислот) или спейсер в виде lgG4(EQ) (229 аминокислот), тестировали на их способность опосредовать IL13Rα2-специфичное умерщвление при оценке в 72-часовом анализе сокультуры. За исключением HL (22 аминокислоты), который, по-видимому, давал плохую экспрессию CAR в данной системе, все были активны.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CITY OF HOPE
<120> Т-КЛЕТКИ С КОСТИМУЛИРУЮЩИМ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ, НАЦЕЛЕННЫЕ
НА IL13R(альфа)2
<130> 40056-0002WO1
<140> PCT/US2015/051089
<141> 2015-09-18
<150> 62/053,068
<151> 2014-09-19
<160> 54
<170> PatentIn version 3.5
<210> 1
<211> 889
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 1
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Ala Leu Ile Val
355 360 365
Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe
370 375 380
Phe Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
385 390 395 400
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
405 410 415
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val
420 425 430
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
435 440 445
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
450 455 460
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
465 470 475 480
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
485 490 495
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
500 505 510
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
515 520 525
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Leu Glu
530 535 540
Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
545 550 555 560
Glu Asn Pro Gly Pro Arg Met Pro Pro Pro Arg Leu Leu Phe Phe Leu
565 570 575
Leu Phe Leu Thr Pro Met Glu Val Arg Pro Glu Glu Pro Leu Val Val
580 585 590
Lys Val Glu Glu Gly Asp Asn Ala Val Leu Gln Cys Leu Lys Gly Thr
595 600 605
Ser Asp Gly Pro Thr Gln Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu
610 615 620
Lys Pro Phe Leu Lys Leu Ser Leu Gly Leu Pro Gly Leu Gly Ile His
625 630 635 640
Met Arg Pro Leu Ala Ile Trp Leu Phe Ile Phe Asn Val Ser Gln Gln
645 650 655
Met Gly Gly Phe Tyr Leu Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala
660 665 670
Trp Gln Pro Gly Trp Thr Val Asn Val Glu Gly Ser Gly Glu Leu Phe
675 680 685
Arg Trp Asn Val Ser Asp Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn
690 695 700
Arg Ser Ser Glu Gly Pro Ser Ser Pro Ser Gly Lys Leu Met Ser Pro
705 710 715 720
Lys Leu Tyr Val Trp Ala Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu
725 730 735
Pro Pro Cys Val Pro Pro Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln
740 745 750
Asp Leu Thr Met Ala Pro Gly Ser Thr Leu Trp Leu Ser Cys Gly Val
755 760 765
Pro Pro Asp Ser Val Ser Arg Gly Pro Leu Ser Trp Thr His Val His
770 775 780
Pro Lys Gly Pro Lys Ser Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg
785 790 795 800
Pro Ala Arg Asp Met Trp Val Met Glu Thr Gly Leu Leu Leu Pro Arg
805 810 815
Ala Thr Ala Gln Asp Ala Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu
820 825 830
Thr Met Ser Phe His Leu Glu Ile Thr Ala Arg Pro Val Leu Trp His
835 840 845
Trp Leu Leu Arg Thr Gly Gly Trp Lys Val Ser Ala Val Thr Leu Ala
850 855 860
Tyr Leu Ile Phe Cys Leu Cys Ser Leu Val Gly Ile Leu His Leu Gln
865 870 875 880
Arg Ala Leu Val Leu Arg Arg Lys Arg
885
<210> 2
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 2
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro
20
<210> 3
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 3
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
<210> 4
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 4
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 5
<211> 22
<212> PRT
<213> Homo sapiens
<400> 5
Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe Ile
1 5 10 15
Gly Leu Gly Ile Phe Phe
20
<210> 6
<211> 42
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 6
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 7
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 7
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 8
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 8
Leu Glu Gly Gly Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp
1 5 10 15
Val Glu Glu Asn Pro Gly Pro Arg
20
<210> 9
<211> 323
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 9
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
1 5 10 15
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
20 25 30
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
35 40 45
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
50 55 60
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
65 70 75 80
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
85 90 95
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
100 105 110
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
115 120 125
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
130 135 140
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
145 150 155 160
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Val Pro Pro
165 170 175
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
180 185 190
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
195 200 205
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
210 215 220
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
225 230 235 240
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
245 250 255
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
260 265 270
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
275 280 285
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
290 295 300
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg
305 310 315 320
Arg Lys Arg
<210> 10
<211> 520
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 10
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly
340 345 350
Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly Arg Lys
355 360 365
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
370 375 380
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
385 390 395 400
Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala
405 410 415
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
420 425 430
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
435 440 445
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
450 455 460
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
465 470 475 480
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
485 490 495
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
500 505 510
His Met Gln Ala Leu Pro Pro Arg
515 520
<210> 11
<211> 405
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 11
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly
340 345 350
Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly Arg Lys
355 360 365
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
370 375 380
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
385 390 395 400
Gly Gly Cys Glu Leu
405
<210> 12
<211> 7754
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 12
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccctg gccccgtgcc 2160
ccctagcacc gccctgcgct acctgatcga ggaactggtg aacatcaccc agaaccagaa 2220
agcccccctg tgcaacggca gcatggtgtg gagcatcaac ctgaccgccg gcatgtactg 2280
tgccgccctg gaaagcctga tcaacgtgag cggctgcagc gccatcgaga aaacccagcg 2340
gatgctgtcc ggcttctgcc cccacaaggt gtccgccgga cagttcagca gcctgcacgt 2400
gcgggacacc aagatcgagg tggcccagtt cgtgaaggac ctgctgctgc acctgaagaa 2460
gctgttccgg gagggccggt tcaactacaa gaccaccccc cctgtgctgg acagcgacgg 2520
cagcttcttc ctgtacagca ggctgaccgt ggacaagagc cggtggcagg aaggcaacgt 2580
ctttagctgc agcgtgatgc acgaggccct gcacaaccac tacacccaga agagcctgtc 2640
cctgagcctg ggcaagcggg tgaagttcag ccggtccgcc gacgcccctg cctaccagca 2700
gggccagaac cagctgtaca acgagctgaa cctgggcagg cgggaggaat acgacgtgct 2760
ggacaagcgg agaggccggg accctgagat gggcggcaag cctcggcgga agaaccccca 2820
ggaaggcctg tataacgaac tgcagaaaga caagatggcc gaggcctaca gcgagatcgg 2880
catgaagggc gagcggaggc ggggcaaggg ccacgacggc ctgtatcagg gcctgtccac 2940
cgccaccaag gatacctacg acgccctgca catgcaggcc ctgcccccaa ggtctagacc 3000
cgggctgcag gaattcgata tcaagcttat cgataatcaa cctctggatt acaaaatttg 3060
tgaaagattg actggtattc ttaactatgt tgctcctttt acgctatgtg gatacgctgc 3120
tttaatgcct ttgtatcatg ctattgcttc ccgtatggct ttcattttct cctccttgta 3180
taaatcctgg ttgctgtctc tttatgagga gttgtggccc gttgtcaggc aacgtggcgt 3240
ggtgtgcact gtgtttgctg acgcaacccc cactggttgg ggcattgcca ccacctgtca 3300
gctcctttcc gggactttcg ctttccccct ccctattgcc acggcggaac tcatcgccgc 3360
ctgccttgcc cgctgctgga caggggctcg gctgttgggc actgacaatt ccgtggtgtt 3420
gtcggggaaa tcatcgtcct ttccttggct gctcgcctgt gttgccacct ggattctgcg 3480
cgggacgtcc ttctgctacg tcccttcggc cctcaatcca gcggaccttc cttcccgcgg 3540
cctgctgccg gctctgcggc ctcttccgcg tcttcgcctt cgccctcaga cgagtcggat 3600
ctccctttgg gccgcctccc cgcatcgata ccgtcgacta gccgtacctt taagaccaat 3660
gacttacaag gcagctgtag atcttagcca ctttttaaaa gaaaaggggg gactggaagg 3720
gctaattcac tcccaaagaa gacaagatct gctttttgcc tgtactgggt ctctctggtt 3780
agaccagatc tgagcctggg agctctctgg ctaactaggg aacccactgc ttaagcctca 3840
ataaagcttg ccttgagtgc ttcaagtagt gtgtgcccgt ctgttgtgtg actctggtaa 3900
ctagagatcc ctcagaccct tttagtcagt gtggaaaatc tctagcagaa ttcgatatca 3960
agcttatcga taccgtcgac ctcgaggggg ggcccggtac ccaattcgcc ctatagtgag 4020
tcgtattaca attcactggc cgtcgtttta caacgtcgtg actgggaaaa ccctggcgtt 4080
acccaactta atcgccttgc agcacatccc cctttcgcca gctggcgtaa tagcgaagag 4140
gcccgcaccg atcgcccttc ccaacagttg cgcagcctga atggcgaatg gaaattgtaa 4200
gcgttaatat tttgttaaaa ttcgcgttaa atttttgtta aatcagctca ttttttaacc 4260
aataggccga aatcggcaaa atcccttata aatcaaaaga atagaccgag atagggttga 4320
gtgttgttcc agtttggaac aagagtccac tattaaagaa cgtggactcc aacgtcaaag 4380
ggcgaaaaac cgtctatcag ggcgatggcc cactacgtga accatcaccc taatcaagtt 4440
ttttggggtc gaggtgccgt aaagcactaa atcggaaccc taaagggagc ccccgattta 4500
gagcttgacg gggaaagccg gcgaacgtgg cgagaaagga agggaagaaa gcgaaaggag 4560
cgggcgctag ggcgctggca agtgtagcgg tcacgctgcg cgtaaccacc acacccgccg 4620
cgcttaatgc gccgctacag ggcgcgtcag gtggcacttt tcggggaaat gtgcgcggaa 4680
cccctatttg tttatttttc taaatacatt caaatatgta tccgctcatg agacaataac 4740
cctgataaat gcttcaataa tattgaaaaa ggaagagtat gagtattcaa catttccgtg 4800
tcgcccttat tccctttttt gcggcatttt gccttcctgt ttttgctcac ccagaaacgc 4860
tggtgaaagt aaaagatgct gaagatcagt tgggtgcacg agtgggttac atcgaactgg 4920
atctcaacag cggtaagatc cttgagagtt ttcgccccga agaacgtttt ccaatgatga 4980
gcacttttaa agttctgcta tgtggcgcgg tattatcccg tattgacgcc gggcaagagc 5040
aactcggtcg ccgcatacac tattctcaga atgacttggt tgagtactca ccagtcacag 5100
aaaagcatct tacggatggc atgacagtaa gagaattatg cagtgctgcc ataaccatga 5160
gtgataacac tgcggccaac ttacttctga caacgatcgg aggaccgaag gagctaaccg 5220
cttttttgca caacatgggg gatcatgtaa ctcgccttga tcgttgggaa ccggagctga 5280
atgaagccat accaaacgac gagcgtgaca ccacgatgcc tgtagcaatg gcaacaacgt 5340
tgcgcaaact attaactggc gaactactta ctctagcttc ccggcaacaa ttaatagact 5400
ggatggaggc ggataaagtt gcaggaccac ttctgcgctc ggcccttccg gctggctggt 5460
ttattgctga taaatctgga gccggtgagc gtgggtctcg cggtatcatt gcagcactgg 5520
ggccagatgg taagccctcc cgtatcgtag ttatctacac gacggggagt caggcaacta 5580
tggatgaacg aaatagacag atcgctgaga taggtgcctc actgattaag cattggtaac 5640
tgtcagacca agtttactca tatatacttt agattgattt aaaacttcat ttttaattta 5700
aaaggatcta ggtgaagatc ctttttgata atctcatgac caaaatccct taacgtgagt 5760
tttcgttcca ctgagcgtca gaccccgtag aaaagatcaa aggatcttct tgagatcctt 5820
tttttctgcg cgtaatctgc tgcttgcaaa caaaaaaacc accgctacca gcggtggttt 5880
gtttgccgga tcaagagcta ccaactcttt ttccgaaggt aactggcttc agcagagcgc 5940
agataccaaa tactgttctt ctagtgtagc cgtagttagg ccaccacttc aagaactctg 6000
tagcaccgcc tacatacctc gctctgctaa tcctgttacc agtggctgct gccagtggcg 6060
ataagtcgtg tcttaccggg ttggactcaa gacgatagtt accggataag gcgcagcggt 6120
cgggctgaac ggggggttcg tgcacacagc ccagcttgga gcgaacgacc tacaccgaac 6180
tgagatacct acagcgtgag ctatgagaaa gcgccacgct tcccgaaggg agaaaggcgg 6240
acaggtatcc ggtaagcggc agggtcggaa caggagagcg cacgagggag cttccagggg 6300
gaaacgcctg gtatctttat agtcctgtcg ggtttcgcca cctctgactt gagcgtcgat 6360
ttttgtgatg ctcgtcaggg gggcggagcc tatggaaaaa cgccagcaac gcggcctttt 6420
tacggttcct ggccttttgc tggccttttg ctcacatgtt ctttcctgcg ttatcccctg 6480
attctgtgga taaccgtatt accgcctttg agtgagctga taccgctcgc cgcagccgaa 6540
cgaccgagcg cagcgagtca gtgagcgagg aagcggaaga gcgcccaata cgcaaaccgc 6600
ctctccccgc gcgttggccg attcattaat gcagctggca cgacaggttt cccgactgga 6660
aagcgggcag tgagcgcaac gcaattaatg tgagttagct cactcattag gcaccccagg 6720
ctttacactt tatgcttccg gctcgtatgt tgtgtggaat tgtgagcgga taacaatttc 6780
acacaggaaa cagctatgac catgattacg ccaagctcga aattaaccct cactaaaggg 6840
aacaaaagct ggagctccac cgcggtggcg gcctcgaggt cgagatccgg tcgaccagca 6900
accatagtcc cgcccctaac tccgcccatc ccgcccctaa ctccgcccag ttccgcccat 6960
tctccgcccc atggctgact aatttttttt atttatgcag aggccgaggc cgcctcggcc 7020
tctgagctat tccagaagta gtgaggaggc ttttttggag gcctaggctt ttgcaaaaag 7080
cttcgacggt atcgattggc tcatgtccaa cattaccgcc atgttgacat tgattattga 7140
ctagttatta atagtaatca attacggggt cattagttca tagcccatat atggagttcc 7200
gcgttacata acttacggta aatggcccgc ctggctgacc gcccaacgac ccccgcccat 7260
tgacgtcaat aatgacgtat gttcccatag taacgccaat agggactttc cattgacgtc 7320
aatgggtgga gtatttacgg taaactgccc acttggcagt acatcaagtg tatcatatgc 7380
caagtacgcc ccctattgac gtcaatgacg gtaaatggcc cgcctggcat tatgcccagt 7440
acatgacctt atgggacttt cctacttggc agtacatcta cgtattagtc atcgctatta 7500
ccatggtgat gcggttttgg cagtacatca atgggcgtgg atagcggttt gactcacggg 7560
gatttccaag tctccacccc attgacgtca atgggagttt gttttggcac caaaatcaac 7620
gggactttcc aaaatgtcgt aacaactccg ccccattgac gcaaatgggc ggtaggcgtg 7680
tacggaattc ggagtggcga gccctcagat cctgcatata agcagctgct ttttgcctgt 7740
actgggtctc tctg 7754
<210> 13
<211> 8732
<212> DNA
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 13
gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac tgcttaagcc 60
tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt gtgactctgg 120
taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca gtggcgcccg 180
aacagggact tgaaagcgaa agggaaacca gaggagctct ctcgacgcag gactcggctt 240
gctgaagcgc gcacggcaag aggcgagggg cggcgactgg tgagtacgcc aaaaattttg 300
actagcggag gctagaagga gagagatggg tgcgagagcg tcagtattaa gcgggggaga 360
attagatcga tgggaaaaaa ttcggttaag gccaggggga aagaaaaaat ataaattaaa 420
acatatagta tgggcaagca gggagctaga acgattcgca gttaatcctg gcctgttaga 480
aacatcagaa ggctgtagac aaatactggg acagctacaa ccatcccttc agacaggatc 540
agaagaactt agatcattat ataatacagt agcaaccctc tattgtgtgc atcaaaggat 600
agagataaaa gacaccaagg aagctttaga caagatagag gaagagcaaa acaaaagtaa 660
gaaaaaagca cagcaagcag cagctgacac aggacacagc aatcaggtca gccaaaatta 720
ccctatagtg cagaacatcc aggggcaaat ggtacatcag gccatatcac ctagaacttt 780
aaatgcatgg gtaaaagtag tagaagagaa ggctttcagc ccagaagtga tacccatgtt 840
ttcagcatta tcagaaggag ccaccccaca agatttaaac accatgctaa acacagtggg 900
gggacatcaa gcagccatgc aaatgttaaa agagaccatc aatgaggaag ctgcaggcaa 960
agagaagagt ggtgcagaga gaaaaaagag cagtgggaat aggagctttg ttccttgggt 1020
tcttgggagc agcaggaagc actatgggcg cagcgtcaat gacgctgacg gtacaggcca 1080
gacaattatt gtctggtata gtgcagcagc agaacaattt gctgagggct attgaggcgc 1140
aacagcatct gttgcaactc acagtctggg gcatcaagca gctccaggca agaatcctgg 1200
ctgtggaaag atacctaaag gatcaacagc tcctggggat ttggggttgc tctggaaaac 1260
tcatttgcac cactgctgtg ccttggatct acaaatggca gtattcatcc acaattttaa 1320
aagaaaaggg gggattgggg ggtacagtgc aggggaaaga atagtagaca taatagcaac 1380
agacatacaa actaaagaat tacaaaaaca aattacaaaa attcaaaatt ttcgggttta 1440
ttacagggac agcagagatc cagtttgggg atcaattgca tgaagaatct gcttagggtt 1500
aggcgttttg cgctgcttcg cgaggatctg cgatcgctcc ggtgcccgtc agtgggcaga 1560
gcgcacatcg cccacagtcc ccgagaagtt ggggggaggg gtcggcaatt gaaccggtgc 1620
ctagagaagg tggcgcgggg taaactggga aagtgatgtc gtgtactggc tccgcctttt 1680
tcccgagggt gggggagaac cgtatataag tgcagtagtc gccgtgaacg ttctttttcg 1740
caacgggttt gccgccagaa cacagctgaa gcttcgaggg gctcgcatct ctccttcacg 1800
cgcccgccgc cctacctgag gccgccatcc acgccggttg agtcgcgttc tgccgcctcc 1860
cgcctgtggt gcctcctgaa ctgcgtccgc cgtctaggta agtttaaagc tcaggtcgag 1920
accgggcctt tgtccggcgc tcccttggag cctacctaga ctcagccggc tctccacgct 1980
ttgcctgacc ctgcttgctc aactctacgt ctttgtttcg ttttctgttc tgcgccgtta 2040
cagatccaag ctgtgaccgg cgcctacggc tagcgccgcc accatgctgc tgctggtgac 2100
cagcctgctg ctgtgcgagc tgccccaccc cgcctttctg ctgatccccg acatccagat 2160
gacccagacc acctccagcc tgagcgccag cctgggcgac cgggtgacca tcagctgccg 2220
ggccagccag gacatcagca agtacctgaa ctggtatcag cagaagcccg acggcaccgt 2280
caagctgctg atctaccaca ccagccggct gcacagcggc gtgcccagcc ggtttagcgg 2340
cagcggctcc ggcaccgact acagcctgac catctccaac ctggaacagg aagatatcgc 2400
cacctacttt tgccagcagg gcaacacact gccctacacc tttggcggcg gaacaaagct 2460
ggaaatcacc ggcagcacct ccggcagcgg caagcctggc agcggcgagg gcagcaccaa 2520
gggcgaggtg aagctgcagg aaagcggccc tggcctggtg gcccccagcc agagcctgag 2580
cgtgacctgc accgtgagcg gcgtgagcct gcccgactac ggcgtgagct ggatccggca 2640
gccccccagg aagggcctgg aatggctggg cgtgatctgg ggcagcgaga ccacctacta 2700
caacagcgcc ctgaagagcc ggctgaccat catcaaggac aacagcaaga gccaggtgtt 2760
cctgaagatg aacagcctgc agaccgacga caccgccatc tactactgcg ccaagcacta 2820
ctactacggc ggcagctacg ccatggacta ctggggccag ggcaccagcg tgaccgtgag 2880
cagcgagagc aagtacggcc ctccctgccc cccttgccct gcccccgagt tcctgggcgg 2940
acccagcgtg ttcctgttcc cccccaagcc caaggacacc ctgatgatca gccggacccc 3000
cgaggtgacc tgcgtggtgg tggacgtgag ccaggaagat cccgaggtcc agttcaattg 3060
gtacgtggac ggcgtggagg tgcacaacgc caagaccaag cccagggaag agcagttcaa 3120
cagcacctac cgggtggtgt ccgtgctgac cgtgctgcac caggactggc tgaacggcaa 3180
agaatacaag tgcaaggtgt ccaacaaggg cctgcccagc agcatcgaga aaaccatcag 3240
caaggccaag ggccagcctc gggagcccca ggtgtacacc ctgccccctt cccaggaaga 3300
gatgaccaag aatcaggtgt ccctgacctg cctggtgaag ggcttctacc ccagcgacat 3360
cgccgtggag tgggagagca acggccagcc cgagaacaac tacaagacca ccccccctgt 3420
gctggacagc gacggcagct tcttcctgta cagcaggctg accgtggaca agagccggtg 3480
gcaggaaggc aacgtcttta gctgcagcgt gatgcacgag gccctgcaca accactacac 3540
ccagaagagc ctgtccctga gcctgggcaa gatggccctg atcgtgctgg gcggcgtggc 3600
cgggctgctg ctgttcatcg gcctgggcat ctttttccgg gtgaagttca gccggtccgc 3660
cgacgcccct gcctaccagc agggccagaa ccagctgtac aacgagctga acctgggcag 3720
gcgggaggaa tacgacgtgc tggacaagcg gagaggccgg gaccctgaga tgggcggcaa 3780
gcccaggcgg aagaaccctc aggaaggcct gtataacgaa ctgcagaaag acaagatggc 3840
cgaggcctac agcgagatcg gcatgaaggg cgagcggcgg aggggcaagg gccacgacgg 3900
cctgtaccag ggcctgagca ccgccaccaa ggatacctac gacgccctgc acatgcaggc 3960
cctgcccccc aggtgacccg ggctgcagga attcgatatc aagcttatcg ataatcaacc 4020
tctggattac aaaatttgtg aaagattgac tggtattctt aactatgttg ctccttttac 4080
gctatgtgga tacgctgctt taatgccttt gtatcatgct attgcttccc gtatggcttt 4140
cattttctcc tccttgtata aatcctggtt gctgtctctt tatgaggagt tgtggcccgt 4200
tgtcaggcaa cgtggcgtgg tgtgcactgt gtttgctgac gcaaccccca ctggttgggg 4260
cattgccacc acctgtcagc tcctttccgg gactttcgct ttccccctcc ctattgccac 4320
ggcggaactc atcgccgcct gccttgcccg ctgctggaca ggggctcggc tgttgggcac 4380
tgacaattcc gtggtgttgt cggggaaatc atcgtccttt ccttggctgc tcgcctgtgt 4440
tgccacctgg attctgcgcg ggacgtcctt ctgctacgtc ccttcggccc tcaatccagc 4500
ggaccttcct tcccgcggcc tgctgccggc tctgcggcct cttccgcgtc ttcgccttcg 4560
ccctcagacg agtcggatct ccctttgggc cgcctccccg catcgatacc gtcgactagc 4620
cgtaccttta agaccaatga cttacaaggc agctgtagat cttagccact ttttaaaaga 4680
aaagggggga ctggaagggc taattcactc ccaaagaaga caagatctgc tttttgcctg 4740
tactgggtct ctctggttag accagatctg agcctgggag ctctctggct aactagggaa 4800
cccactgctt aagcctcaat aaagcttgcc ttgagtgctt caagtagtgt gtgcccgtct 4860
gttgtgtgac tctggtaact agagatccct cagacccttt tagtcagtgt ggaaaatctc 4920
tagcagaatt cgatatcaag cttatcgata ccgtcgacct cgaggggggg cccggtaccc 4980
aattcgccct atagtgagtc gtattacaat tcactggccg tcgttttaca acgtcgtgac 5040
tgggaaaacc ctggcgttac ccaacttaat cgccttgcag cacatccccc tttcgccagc 5100
tggcgtaata gcgaagaggc ccgcaccgat cgcccttccc aacagttgcg cagcctgaat 5160
ggcgaatgga aattgtaagc gttaatattt tgttaaaatt cgcgttaaat ttttgttaaa 5220
tcagctcatt ttttaaccaa taggccgaaa tcggcaaaat cccttataaa tcaaaagaat 5280
agaccgagat agggttgagt gttgttccag tttggaacaa gagtccacta ttaaagaacg 5340
tggactccaa cgtcaaaggg cgaaaaaccg tctatcaggg cgatggccca ctacgtgaac 5400
catcacccta atcaagtttt ttggggtcga ggtgccgtaa agcactaaat cggaacccta 5460
aagggagccc ccgatttaga gcttgacggg gaaagccggc gaacgtggcg agaaaggaag 5520
ggaagaaagc gaaaggagcg ggcgctaggg cgctggcaag tgtagcggtc acgctgcgcg 5580
taaccaccac acccgccgcg cttaatgcgc cgctacaggg cgcgtcaggt ggcacttttc 5640
ggggaaatgt gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc 5700
cgctcatgag acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga 5760
gtattcaaca tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt 5820
ttgctcaccc agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag 5880
tgggttacat cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag 5940
aacgttttcc aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgta 6000
ttgacgccgg gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg 6060
agtactcacc agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca 6120
gtgctgccat aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag 6180
gaccgaagga gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc 6240
gttgggaacc ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg 6300
tagcaatggc aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc 6360
ggcaacaatt aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg 6420
cccttccggc tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg 6480
gtatcattgc agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga 6540
cggggagtca ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac 6600
tgattaagca ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa 6660
aacttcattt ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca 6720
aaatccctta acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag 6780
gatcttcttg agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac 6840
cgctaccagc ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa 6900
ctggcttcag cagagcgcag ataccaaata ctgttcttct agtgtagccg tagttaggcc 6960
accacttcaa gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag 7020
tggctgctgc cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac 7080
cggataaggc gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc 7140
gaacgaccta caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc 7200
ccgaagggag aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca 7260
cgagggagct tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc 7320
tctgacttga gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg 7380
ccagcaacgc ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct 7440
ttcctgcgtt atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata 7500
ccgctcgccg cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc 7560
gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctggcacg 7620
acaggtttcc cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg agttagctca 7680
ctcattaggc accccaggct ttacacttta tgcttccggc tcgtatgttg tgtggaattg 7740
tgagcggata acaatttcac acaggaaaca gctatgacca tgattacgcc aagctcgaaa 7800
ttaaccctca ctaaagggaa caaaagctgg agctccaccg cggtggcggc ctcgaggtcg 7860
agatccggtc gaccagcaac catagtcccg cccctaactc cgcccatccc gcccctaact 7920
ccgcccagtt ccgcccattc tccgccccat ggctgactaa ttttttttat ttatgcagag 7980
gccgaggccg cctcggcctc tgagctattc cagaagtagt gaggaggctt ttttggaggc 8040
ctaggctttt gcaaaaagct tcgacggtat cgattggctc atgtccaaca ttaccgccat 8100
gttgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 8160
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 8220
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 8280
ggactttcca ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 8340
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 8400
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 8460
tattagtcat cgctattacc atggtgatgc ggttttggca gtacatcaat gggcgtggat 8520
agcggtttga ctcacgggga tttccaagtc tccaccccat tgacgtcaat gggagtttgt 8580
tttggcacca aaatcaacgg gactttccaa aatgtcgtaa caactccgcc ccattgacgc 8640
aaatgggcgg taggcgtgta cggaattcgg agtggcgagc cctcagatcc tgcatataag 8700
cagctgcttt ttgcctgtac tgggtctctc tg 8732
<210> 14
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 14
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
1 5 10
<210> 15
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 15
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 16
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 16
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly
20
<210> 17
<211> 39
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 17
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 18
<211> 48
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 18
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
1 5 10 15
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
20 25 30
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 19
<211> 45
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 19
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 20
<211> 129
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 20
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
1 5 10 15
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
20 25 30
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
35 40 45
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
50 55 60
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
65 70 75 80
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
85 90 95
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
100 105 110
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
115 120 125
Lys
<210> 21
<211> 21
<212> PRT
<213> Homo sapiens
<400> 21
Leu Cys Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu
1 5 10 15
Thr Ala Leu Phe Leu
20
<210> 22
<211> 27
<212> PRT
<213> Homo sapiens
<400> 22
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 23
<211> 21
<212> PRT
<213> Homo sapiens
<400> 23
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 24
<211> 23
<212> PRT
<213> Homo sapiens
<400> 24
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr
20
<210> 25
<211> 24
<212> PRT
<213> Homo sapiens
<400> 25
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 26
<211> 27
<212> PRT
<213> Homo sapiens
<400> 26
Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu
1 5 10 15
Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val
20 25
<210> 27
<211> 41
<212> PRT
<213> Homo sapiens
<400> 27
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 28
<211> 41
<212> PRT
<213> Homo sapiens
<400> 28
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 29
<211> 42
<212> PRT
<213> Homo sapiens
<400> 29
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 30
<211> 42
<212> PRT
<213> Homo sapiens
<400> 30
Ala Leu Tyr Leu Leu Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His
1 5 10 15
Lys Pro Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln
20 25 30
Ala Asp Ala His Ser Thr Leu Ala Lys Ile
35 40
<210> 31
<211> 362
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 31
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Lys Arg Gly
195 200 205
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
210 215 220
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
225 230 235 240
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
245 250 255
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
260 265 270
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
275 280 285
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
290 295 300
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
305 310 315 320
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
325 330 335
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
340 345 350
Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 32
<211> 410
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 32
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Phe Trp Val Leu Val Val Val Gly Gly Val
180 185 190
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
195 200 205
Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met
210 215 220
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
225 230 235 240
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly
245 250 255
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
260 265 270
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
275 280 285
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
290 295 300
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
305 310 315 320
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
325 330 335
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
340 345 350
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
355 360 365
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
370 375 380
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
385 390 395 400
Ala Leu His Met Gln Ala Leu Pro Pro Arg
405 410
<210> 33
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 33
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg
145 150 155 160
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
165 170 175
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
180 185 190
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
195 200 205
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
210 215 220
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
225 230 235 240
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
245 250 255
Leu Ser Leu Ser Leu Gly Lys Met Ala Leu Ile Val Leu Gly Gly Val
260 265 270
Ala Gly Leu Leu Leu Phe Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly
275 280 285
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
290 295 300
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
305 310 315 320
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
325 330 335
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
340 345 350
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
355 360 365
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
370 375 380
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
385 390 395 400
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
405 410 415
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
420 425 430
Ala Leu His Met Gln Ala Leu Pro Pro Arg
435 440
<210> 34
<211> 541
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 34
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala
355 360 365
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
370 375 380
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
385 390 395 400
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
405 410 415
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys
420 425 430
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
435 440 445
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
450 455 460
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
465 470 475 480
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
485 490 495
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
500 505 510
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
515 520 525
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
530 535 540
<210> 35
<211> 373
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 35
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
130 135 140
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
145 150 155 160
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
165 170 175
Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
180 185 190
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
195 200 205
Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu
210 215 220
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
225 230 235 240
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
245 250 255
Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 36
<211> 385
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Met Phe Trp Val
145 150 155 160
Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr
165 170 175
Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly
180 185 190
His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg
195 200 205
Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg
210 215 220
Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
225 230 235 240
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
245 250 255
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly
260 265 270
Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
275 280 285
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
290 295 300
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
305 310 315 320
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
325 330 335
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
340 345 350
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
355 360 365
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
370 375 380
Arg
385
<210> 37
<211> 492
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 37
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg
145 150 155 160
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
165 170 175
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
180 185 190
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
195 200 205
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
210 215 220
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
225 230 235 240
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
245 250 255
Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val Val Val Gly
260 265 270
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
275 280 285
Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met
290 295 300
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
305 310 315 320
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys
325 330 335
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
340 345 350
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
355 360 365
Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 38
<211> 592
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 38
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
130 135 140
Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
145 150 155 160
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
165 170 175
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
180 185 190
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
195 200 205
Glu Glu Gln Phe Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
210 215 220
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
225 230 235 240
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
245 250 255
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
260 265 270
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
275 280 285
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
290 295 300
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
305 310 315 320
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
325 330 335
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
340 345 350
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Met Phe Trp Val Leu
355 360 365
Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val
370 375 380
Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His
385 390 395 400
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
405 410 415
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
420 425 430
Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
435 440 445
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
450 455 460
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly
465 470 475 480
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
485 490 495
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
500 505 510
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
515 520 525
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
530 535 540
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
545 550 555 560
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
565 570 575
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
580 585 590
<210> 39
<211> 340
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 39
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
165 170 175
Ser Leu Val Ile Thr Leu Tyr Lys Arg Gly Arg Lys Lys Leu Leu Tyr
180 185 190
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
195 200 205
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
210 215 220
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
225 230 235 240
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
245 250 255
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
260 265 270
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
275 280 285
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
290 295 300
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
305 310 315 320
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
325 330 335
Leu Pro Pro Arg
340
<210> 40
<211> 388
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 40
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
165 170 175
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser
180 185 190
Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly
195 200 205
Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala
210 215 220
Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr
225 230 235 240
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
245 250 255
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
260 265 270
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
275 280 285
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
290 295 300
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
305 310 315 320
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
325 330 335
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
340 345 350
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
355 360 365
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
370 375 380
Leu Pro Pro Arg
385
<210> 41
<211> 420
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 41
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
130 135 140
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
145 150 155 160
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
165 170 175
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
180 185 190
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
195 200 205
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
210 215 220
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
225 230 235 240
Lys Met Ala Leu Ile Val Leu Gly Gly Val Ala Gly Leu Leu Leu Phe
245 250 255
Ile Gly Leu Gly Ile Phe Phe Lys Arg Gly Arg Lys Lys Leu Leu Tyr
260 265 270
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
275 280 285
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
290 295 300
Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
305 310 315 320
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
325 330 335
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
340 345 350
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
355 360 365
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
370 375 380
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
385 390 395 400
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
405 410 415
Leu Pro Pro Arg
420
<210> 42
<211> 519
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 42
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
340 345 350
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Lys Arg Gly Arg Lys Lys
355 360 365
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
370 375 380
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
385 390 395 400
Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp
405 410 415
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
420 425 430
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
435 440 445
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
450 455 460
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
465 470 475 480
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
485 490 495
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
500 505 510
Met Gln Ala Leu Pro Pro Arg
515
<210> 43
<211> 351
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Met Phe Trp Val Leu Val
115 120 125
Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala
130 135 140
Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser
145 150 155 160
Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His
165 170 175
Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly
180 185 190
Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
195 200 205
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
210 215 220
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg
225 230 235 240
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
245 250 255
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
260 265 270
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
275 280 285
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
290 295 300
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
305 310 315 320
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
325 330 335
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
340 345 350
<210> 44
<211> 363
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 44
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Met Phe Trp Val Leu Val Val Val Gly Gly
130 135 140
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
145 150 155 160
Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn
165 170 175
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
180 185 190
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg
195 200 205
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
210 215 220
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
225 230 235 240
Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 45
<211> 470
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Gly Gly Gly Ser
115 120 125
Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
130 135 140
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
145 150 155 160
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
165 170 175
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
180 185 190
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
195 200 205
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
210 215 220
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
225 230 235 240
Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr
245 250 255
Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys
260 265 270
Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg
275 280 285
Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp
290 295 300
Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu
305 310 315 320
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
325 330 335
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
340 345 350
Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
355 360 365
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
370 375 380
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
385 390 395 400
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
405 410 415
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
420 425 430
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
435 440 445
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
450 455 460
Gln Ala Leu Pro Pro Arg
465 470
<210> 46
<211> 570
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 46
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
115 120 125
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
130 135 140
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
145 150 155 160
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
165 170 175
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Gln Ser
180 185 190
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
195 200 205
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
210 215 220
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
225 230 235 240
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
245 250 255
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
260 265 270
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
275 280 285
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
290 295 300
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
305 310 315 320
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
325 330 335
Leu Ser Leu Gly Lys Met Phe Trp Val Leu Val Val Val Gly Gly Val
340 345 350
Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp
355 360 365
Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met
370 375 380
Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala
385 390 395 400
Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Lys Arg Gly
405 410 415
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
420 425 430
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
435 440 445
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg
450 455 460
Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn
465 470 475 480
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
485 490 495
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
500 505 510
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
515 520 525
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
530 535 540
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
545 550 555 560
Ala Leu His Met Gln Ala Leu Pro Pro Arg
565 570
<210> 47
<211> 363
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Met Leu Leu Leu Val Thr Ser Leu Leu Leu Cys Glu Leu Pro His Pro
1 5 10 15
Ala Phe Leu Leu Ile Pro Gly Pro Val Pro Pro Ser Thr Ala Leu Arg
20 25 30
Tyr Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn Gln Lys Ala Pro
35 40 45
Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu Thr Ala Gly Met
50 55 60
Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser Gly Cys Ser Ala
65 70 75 80
Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys Pro His Lys Val
85 90 95
Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp Thr Lys Ile Glu
100 105 110
Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu Lys Lys Leu Phe
115 120 125
Arg Glu Gly Arg Phe Asn Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Gly Gly Gly Lys Arg
195 200 205
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
210 215 220
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
225 230 235 240
Glu Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360
<210> 48
<211> 341
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 48
Gly Pro Val Pro Pro Ser Thr Ala Leu Arg Tyr Leu Ile Glu Glu Leu
1 5 10 15
Val Asn Ile Thr Gln Asn Gln Lys Ala Pro Leu Cys Asn Gly Ser Met
20 25 30
Val Trp Ser Ile Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu
35 40 45
Ser Leu Ile Asn Val Ser Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg
50 55 60
Met Leu Ser Gly Phe Cys Pro His Lys Val Ser Ala Gly Gln Phe Ser
65 70 75 80
Ser Leu His Val Arg Asp Thr Lys Ile Glu Val Ala Gln Phe Val Lys
85 90 95
Asp Leu Leu Leu His Leu Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
100 105 110
Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro
115 120 125
Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro
130 135 140
Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
145 150 155 160
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
165 170 175
Ser Leu Val Ile Thr Gly Gly Gly Lys Arg Gly Arg Lys Lys Leu Leu
180 185 190
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
195 200 205
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
210 215 220
Glu Leu Gly Gly Gly Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
225 230 235 240
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
245 250 255
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
260 265 270
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
275 280 285
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
290 295 300
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
305 310 315 320
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
325 330 335
Ala Leu Pro Pro Arg
340
<210> 49
<211> 112
<212> PRT
<213> Homo sapiens
<400> 49
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 50
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 50
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
1 5 10 15
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
100 105
<210> 51
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Gln Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 52
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 52
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 53
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<221> source
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 53
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Gln Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 54
<211> 28
<212> PRT
<213> Homo sapiens
<400> 54
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
1 5 10 15
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦЕНТРАЛЬНЫЕ Т-КЛЕТКИ ПАМЯТИ ДЛЯ АДОПТИВНОЙ Т-КЛЕТОЧНОЙ ТЕРАПИИ | 2015 |
|
RU2763523C2 |
| ВВЕДЕНИЕ СКОНСТРУИРОВАННЫХ Т-КЛЕТОК ДЛЯ ЛЕЧЕНИЯ РАКА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2017 |
|
RU2757308C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА, НАЦЕЛЕННЫЕ НА HER2 | 2016 |
|
RU2753695C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА, НАЦЕЛЕННЫЕ НА PSCA | 2016 |
|
RU2759879C2 |
| Т-КЛЕТКИ, МОДИФИЦИРОВАННЫЕ ХИМЕРНЫМ РЕЦЕПТОРОМ АНТИГЕНА, НАЦЕЛЕННЫМ НА CS1 | 2015 |
|
RU2727451C2 |
| МОЛЕКУЛА РЕЦЕПТОРА IL4/IL13 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2795591C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ ПРОТИВ CD20 | 2017 |
|
RU2782699C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛИВАЮЩИЕСЯ НА ВАРИАНТ III РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА | 2017 |
|
RU2751662C2 |
| ИНДУЦИБЕЛЬНЫЕ ХИМЕРНЫЕ ЦИТОКИНОВЫЕ РЕЦЕПТОРЫ | 2019 |
|
RU2826155C2 |
| КЛЕТКА | 2014 |
|
RU2717984C2 |

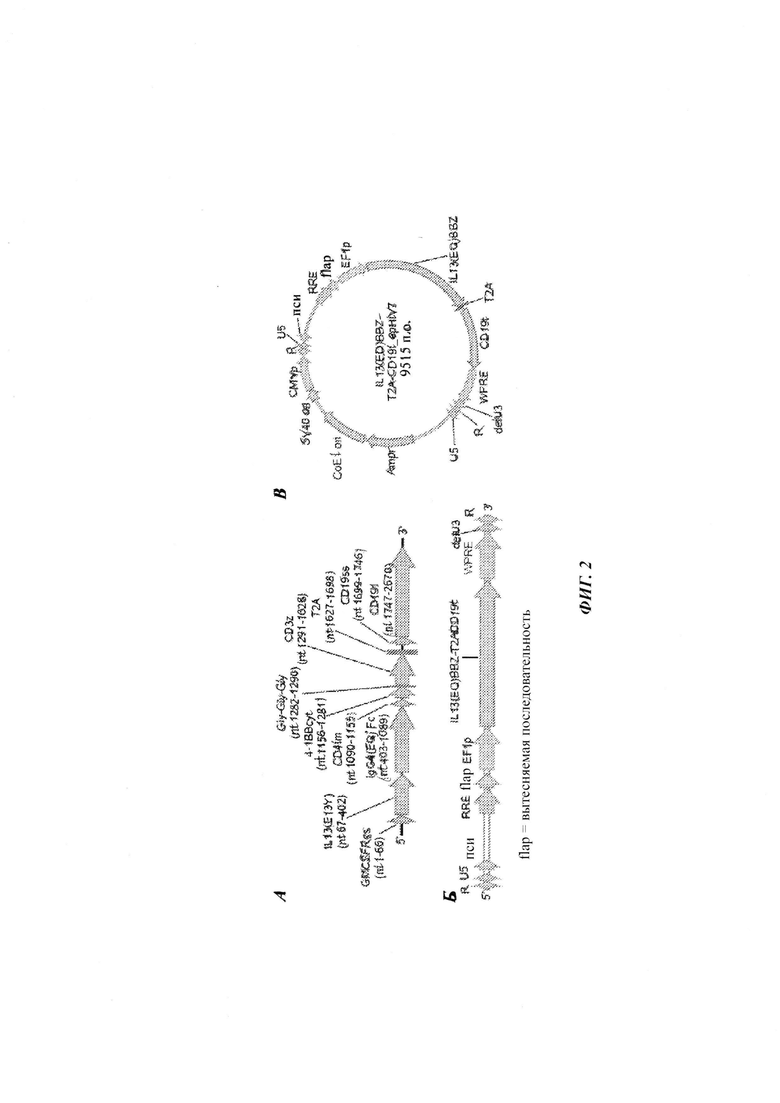

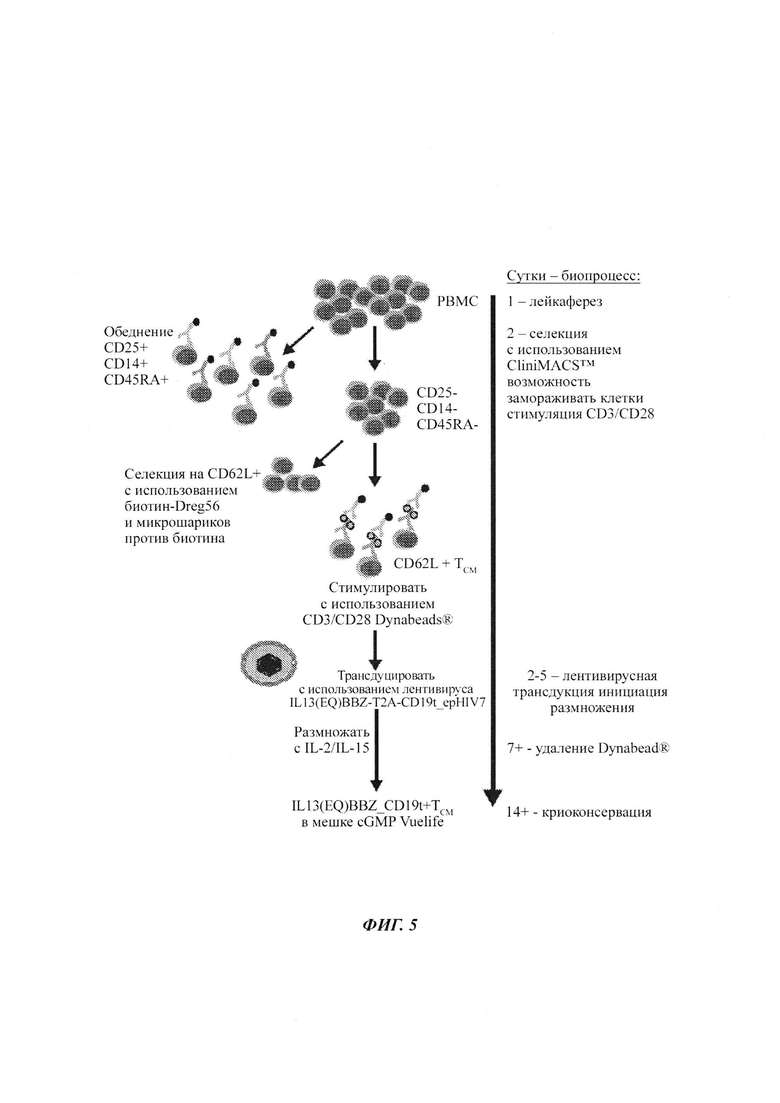





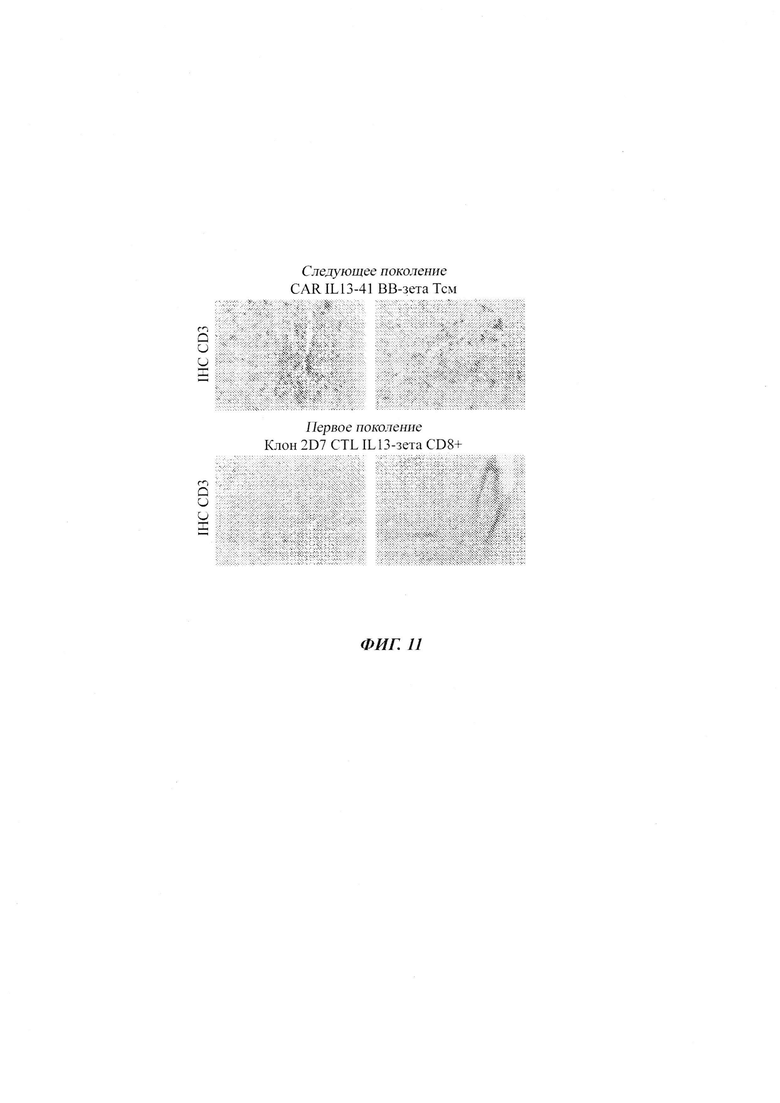

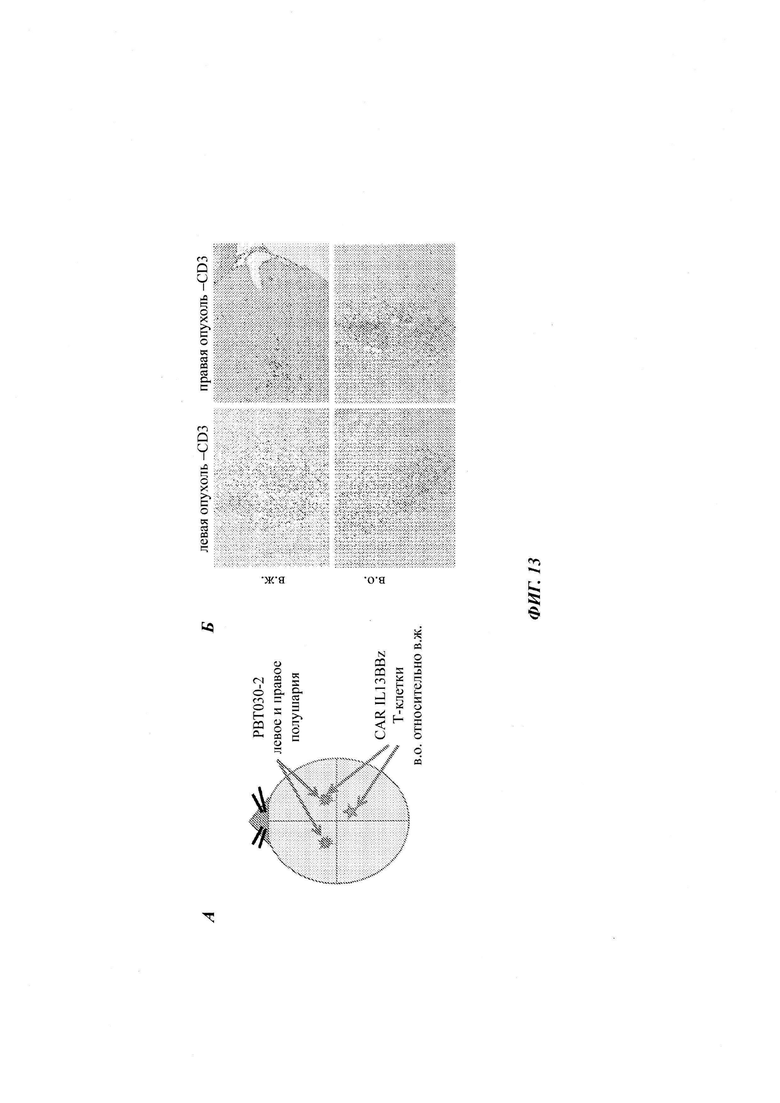

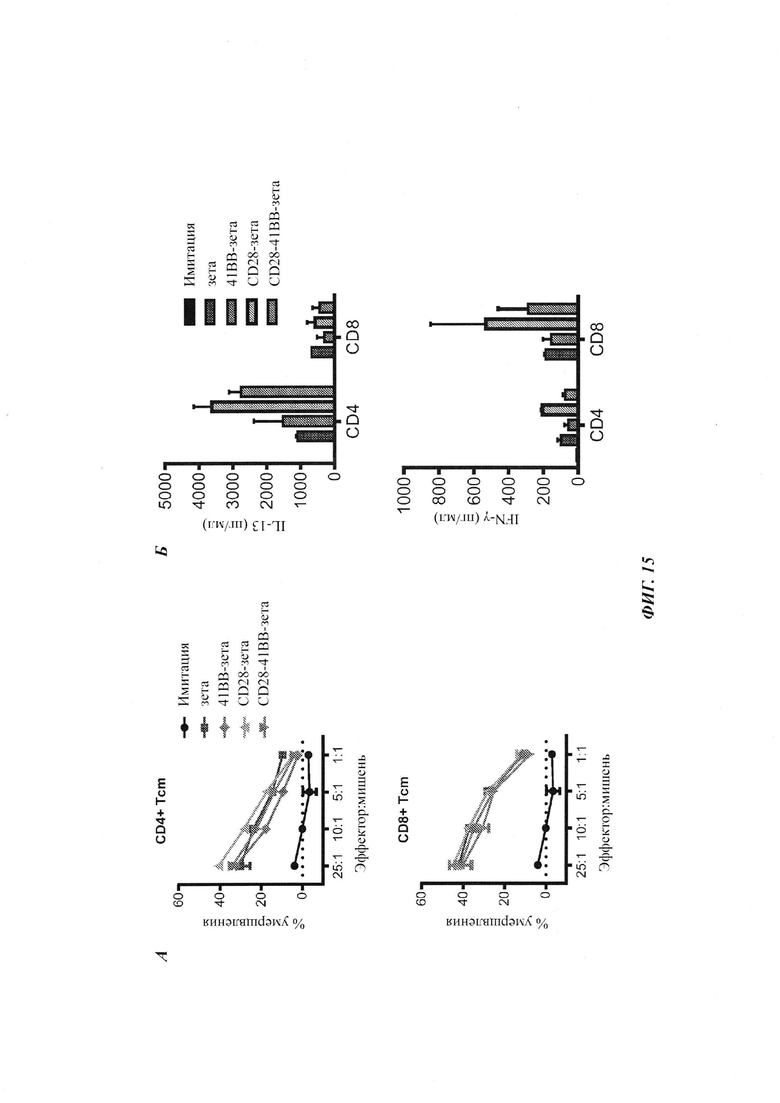

























Изобретение относится к области биотехнологии. Предложены молекулы нуклеиновой кислоты, кодирующие химерные антигенные рецепторы (CAR), и содержащие их векторы экспрессии. CAR включают внеклеточный домен, который включает IL-13 или его вариант, который связывается с интерлейкин-13Rα2 (IL13Rα2), трансмембранную область, костимулирующий домен и внутриклеточный домен сигнализации. Также предложена популяция человеческих Т-клеток, экспрессирующих CAR, нацеленные на IL13Rα2. Популяция человеческих Т-клеток содержит центральные Т-клетки памяти. Кроме того, изобретение относится к композиции для лечения рака, содержащей указанную популяцию Т-клеток. Изобретение обеспечивает улучшенную противоопухолевую эффективность, обусловленную улучшенной стойкостью Т-клеток в микроокружении опухоли. 6 н. и 4 з.п. ф-лы, 5 табл., 12 пр., 27 ил.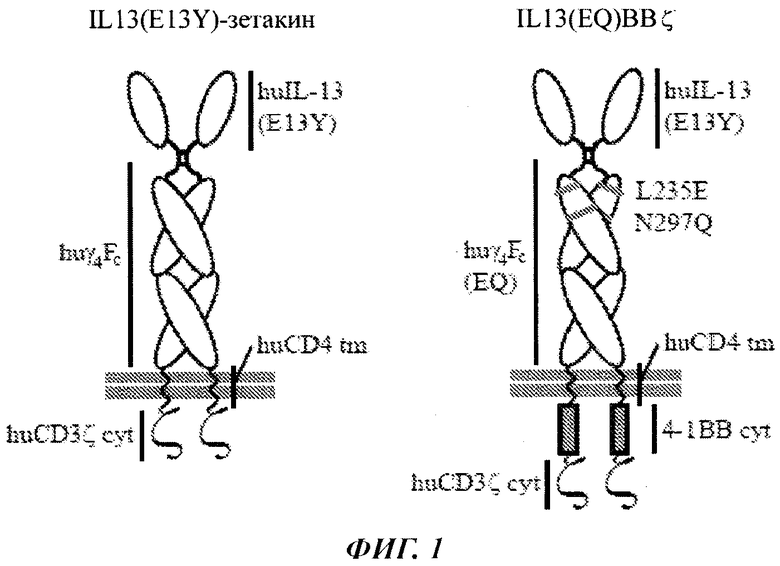
1. Молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор, где молекула нуклеиновой кислоты экспрессирует полипептид, содержащий аминокислотную последовательность: GPVPPSTALRYLIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFNESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMALIVLGGVAGLLLFIGLGIFFKRGRKKLLYIFKQPFMRPVQTIQEEDGCSCRFPEEEEGGCELGGGRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO:10).
2. Молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор, содержащая молекулу по п. 1 и дополнительно содержащая нуклеотидную последовательность, кодирующую сигнальную последовательность GMSCFRa, расположенную перед нуклеотидной последовательностью, кодирующей химерный антигенный рецептор.
3. Молекула нуклеиновой кислоты по п. 2, где сигнальная последовательность GMSCFRa содержит аминокислотную последовательность MLLLVTSLLLCELPHPAFLLIP (SEQ ID NO:2).
4. Молекула нуклеиновой кислоты, кодирующая химерный антигенный рецептор, содержащая молекулу по п. 1 и дополнительно содержащая нуклеотидную последовательность, кодирующую последовательность перескакивания рибосомы Т2А и усеченный CD19, расположенные после нуклеотидной последовательности, кодирующей химерный антигенный рецептор.
5. Молекула нуклеиновой кислоты по п. 4, в которой последовательность перескакивания рибосомы Т2А содержит последовательность LEGGGEGRGSLLTCGDVEENPGPR (SEQ ID NO:8) и в которой усеченный CD19 содержит аминокислотную последовательность MPPPRLLFFLLFLTPMEVRPEEPLVVKVEEGDNAVLQCLKGTSDGPTQQLTWSRESPLKPFLKLSLGLPGLGIHMRPLAIWLFIFNVSQQMGGFYLCQPGPPSEKAWQPGWTVNVEGSGELFRWNVSDLGGLGCGLKNRSSEGPSSPSGKLMSPKLYVWAKDRPEIWEGEPPCVPPRDSLNQSLSQDLTMAPGSTLWLSCGVPPDSVSRGPLSWTHVHPKGPKSLLSLELKDDRPARDMWVMETGLLLPRATAQDAGKYYCHRGNLTMSFHLEITARPVLWHWLLRTGGWKVSAVTLAYLIFCLCSLVGILHLQRALVLRRKR (SEQ ID NO:9).
6. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по любому из пп. 1-5.
7. Популяция человеческих Т-клеток, экспрессирующих химерные антигенные рецепторы, нацеленные на IL13Rα2, содержащая вектор, экспрессирующий химерный антигенный рецептор, содержащий аминокислотную последовательность GPVPPSTALRYLIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFNESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMALIVLGGVAGLLLFIGLGIFFKRGRKKLLYIFKQPFMRPVQTIQEEDGCSCRFPEEEEGGCELGGGRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 10),
где популяция человеческих Т-клеток содержит центральные Т-клетки памяти.
8. Композиция для лечения рака у пациента, содержащая популяцию аутологичных или аллогенных человеческих Т-клеток, трансдуцированных вектором, содержащим экспрессионную кассету, кодирующую химерный антигенный рецептор, где химерный антигенный рецептор содержит аминокислотную последовательность GPVPPSTALRYLIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFNESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMALIVLGGVAGLLLFIGLGIFFKRGRKKLLYIFKQPFMRPVQTIQEEDGCSCRFPEEEEGGCELGGGRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 10),
где популяция человеческих Т-клеток содержит центральные Т-клетки памяти.
9. Композиция по п. 8, где раковое заболевание представляет собой глиобластому.
10. Композиция по п. 8, где трансдуцированные человеческие Т-клетки были получены способом, включающим обработку Т-клеток, полученных от пациента, для выделения центральных Т-клеток памяти и трансдуцирование по меньшей мере части центральных клеток памяти вирусным вектором, содержащим экспрессионную кассету, кодирующую химерный антигенный рецептор, где химерный антигенный рецептор содержит аминокислотную последовательность GPVPPSTALRYLIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFNESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFQSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKMALIVLGGVAGLLLFIGLGIFFKRGRKKLLYIFKQPFMRPVQTIQEEDGCSCRFPEEEEGGCELGGGRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 10).
| WO 2010025177 A1, 04.03.2010 | |||
| KONG S | |||
| et al., Suppression of Human Glioma Xenografts with Second-Generation IL13R-Specific Chimeric Antigen Receptor-Modified T Cells, CLINICAL CANCER RESEARCH, 2012, vol | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| PORTER D.L | |||
| et al., Chimeric Antigen Receptor-Modified T Cells in Chronic Lymphoid Leukemia, The New England Journal | |||
Авторы
Даты
2021-06-21—Публикация
2015-09-18—Подача