ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области биотехнологии, иммунологии, микробиологии, генетики, молекулярной биологии и медицины. Более конкретно, настоящее изобретение относится к способу определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию (варианты), пробиотической композиции и применению данной композиции, а также к способу корректировки состава микробиоты кишечника пациента с диагнозом меланома кожи.
УРОВЕНЬ ТЕХНИКИ
Недавно был открыт и внедрен в практику новый метод лечения онкологических заболеваний, основанный на использовании иммунной системы человеческого организма для воздействия на опухоль. Ингибиторы иммунных контрольных точек (immune checkpoint inhibitors - ICIs) как новые терапевтические агенты дали многообещающие клинические результаты в отношении различных злокачественных новообразований. Однако у некоторых пациентов во время лечения возникает первичная или приобретенная резистентность, что препятствует расширению клинического применения ICIs технологий (O'Donnell J.S. et al. Resistance to PD1/PDL1 checkpoint inhibition // Cancer treatment reviews. - 2017. - T. 52. - C. 71-81). Учитывая это, выбор оптимальных пациентов-кандидатов важен для того, чтобы избежать лекарственной устойчивости и повысить эффективность и оптимизировать затраты на лечение. Более того, исследование механизмов формирования резистентности позволило бы расширить показания к применению такого рода лечения (Sharma P. et al. Primary, adaptive, and acquired resistance to cancer immunotherapy // Cell. - 2017. - T. 168. - №. 4. - C. 707-723).
Накопленные данные подтверждают, что микробиота кишечника человека играет важную роль в лечении онкологических заболеваний (Li W. et al. Gut microbiome and cancer immunotherapy // Cancer letters. - 2019. - T. 447. - C. 41-47).
Кишечный микробном состоит из множества микроорганизмов таких как бактерии, грибы, археи, простейшие и вирусы (Costello Е.K. et al. The application of ecological theory toward an understanding of the human microbiome // Science. - 2012. - T. 336. - №. 6086. - C. 1255-1262; Cho I., Blaser M.J. The human microbiome: at the interface of health and disease // Nature Reviews Genetics. - 2012. - T. 13. - №. 4. - C. 260) и взаимодействует с клетками, выполняя различные жизненно важные регуляторные функции (Wells J. М. et al. Epithelial crosstalk at the microbiota-mucosal interface // Proceedings of the national academy of sciences. - 2011. - T. 108. - №. Supplement 1. - C. 4607-4614; Chen D.S., Mellman I. Elements of cancer immunity and the cancer-immune set point // Nature. - 2017. - T. 541. - №. 7637. - C. 321).
Недавние исследования показали, что микробиота кишечника связана с терапевтической эффективностью ICIs против рака (Chaput N. et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab // Annals of Oncology. - 2017. - T. 28. - №. 6. - C. 1368-1379; Frankel A.E. et al. Metagenomic shotgun sequencing and unbiased metabolomic profiling identify specific human gut microbiota and metabolites associated with immune checkpoint therapy efficacy in melanoma patients // Neoplasia. - 2017. - T. 19. - №. 10. - C. 848-855; Matson V. et al. The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients // Science. - 2018. - T. 359. - №. 6371. - C. 104-108; Gopalakrishnan V. et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients // Science. - 2018. - T. 359. - №. 6371. - C. 97-103; Routy B. et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors // Science. - 2018. - T. 359. - №. 6371. - C. 91-97). Однако важно знать, какие именно характеристики человеческих микробиомов играют роль в регуляции ответа.
Таким образом, в целях повышения эффективности иммунотерапии онкологических болезней, возникает необходимость в выявлении детерминант микробиоты кишечника, вовлеченных в данный процесс, а также в изучении биологических процессов, лежащих в основе данного явления.
Международная заявка WO 2018226690 (А1) описывает способ прогнозирования клинического ответа субъекта на лечение рака, включающий: (а) характеристику состава микрофлоры кишечника субъекта, при этом характеристика состава микрофлоры кишечника включает определение количества различных полезных бактерий и вредных бактерий в кишечнике субъекта; (b) определение того, является ли субъект вероятным ответчиком или, вероятно, не отвечающим на лечение рака на основании относительных количеств полезных и неблагоприятных бактерий в кишечнике субъекта, где лечение рака представляет собой иммунотерапию, а также способ характеристики степени чувствительности / нечувствительности опухоли у субъекта, подвергающегося иммунотерапевтическому лечению, включающий определение присутствия, отсутствия уровня одной или нескольких бактерий, при этом повышенные уровни бактерий вида Enterococcus faecium, Columella aerofaciens, Bifidobacterium adolescentis, Klebsiella pneumoniae, Veillonella parvula, Parabacteroides merdae, Lactobacillus sp.и/или Bifidobacterium longum у субъекта указывают на чувствительность опухоли к иммунотерапевтическому лечению, и при этом повышенные уровни бактерий видов Ruminococcus obeum и/или Roseburia intestinals у субъекта указывают на нечувствительность опухоли к иммунотерапевтическому лечению.
Международная заявка WO 2018064165 (А2) описывает способ прогнозирования ответа на ингибитор иммунной контрольной точки у пациента, страдающего раком, включающий определение микробного профиля в образце, полученном от указанного пациента, причем, если микробный профиль включает одну или несколько бактериальных популяций композиции из семейств Ruminococcaceae, Clostridiaceae, Lachnospiraceae, Micrococcaceae, и или Veilonellaceae, ответ на ингибитор иммунных контрольных точек является благоприятным и способ прогнозирования ответа на ингибитор иммунной контрольной точки у пациента, страдающего раком, включающий определение микробного профиля в образце, полученном от указанного пациента, причем, если микробный профиль включает: (а) высокое альфа-разнообразие; (б) большое количество бактерий, продуцирующих бутират; (с) одну или несколько бактерий, выбранных из группы, состоящей из видов, указанных с индексом обогащения (ei) более 0,5; или (d) один или несколько видов бактерий, обозначенных как отвечающий статус (R), тогда прогнозируется, что у пациента будет благоприятный ответ на ингибитор иммунных контрольных точек.
Международная заявка WO 2019165285 (А1) описывает способ повышения эффективности противораковой терапии, включающий введение субъекту терапевтической композиции, содержащей микробную композицию; где субъекту назначена противораковая терапия; и при этом микробная композиция включает фекальную микробиоту.
Описание изобретения
Авторами изобретения был разработан способ определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию и были определены наборы микроорганизмов, которые являются маркерами положительного или отрицательного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию. Авторами также была разработана пробиотическая композиции, которая включает микроорганизмы Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, и предложены способы ее использования для корректировки состава микробиоты кишечника пациента с диагнозом меланома кожи.
Краткое описание изобретения
В одном из аспектов настоящее изобретение относится к способу определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, который включает:
а) выделение ДНК из образца кала пациента с диагнозом меланома кожи,
б) полногеномное метагеномное секвенирование,
в) анализ данных полногеномного метагеномного секвенирования,
где высокая представленность микробной ДНК следующего набора микроорганизмов: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, является маркером положительного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию.
В одном из аспектов настоящее изобретение относится к способу определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, который включает:
а) выделение ДНК из образца кала пациента с диагнозом меланома кожи,
б) полногеномное метагеномное секвенирование,
в) анализ данных полногеномного метагеномного секвенирования,
где высокая представленность микробной ДНК следующего набора микроорганизмов видов: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans, является маркером отрицательного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию.
В одном из аспектов настоящее изобретение относится к способу определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, который включает:
а) выделение ДНК из образца кала пациента с диагнозом меланома кожи,
б) полногеномное метагеномное секвенирование,
в) анализ данных полногеномного метагеномного секвенирования,
где низкая представленность микробной ДНК следующего набора микроорганизмов видов: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans, и низкая представленность микроорганизмов видов: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, является маркером неоднозначного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию.
В одном из аспектов настоящее изобретение относится к пробиотической композиции, которая включает микроорганизмы Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, a также фармацевтически приемлемые добавки.
В одном из аспектов настоящее изобретение относится к применению вышеуказанной пробиотической композиции для корректировки состава микробиоты кишечника пациента с диагнозом меланома кожи.
В одном из аспектов настоящее изобретение относится к способу корректировки состава микробиоты кишечника пациента с диагнозом меланома кожи, который включает:
а) определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию по любому из вышеуказанных способов и
б) прием пробиотической вышеуказанной композиции, при отрицательном прогнозе успешного ответа на анти-PD1-терапию.
Краткое описание чертежей
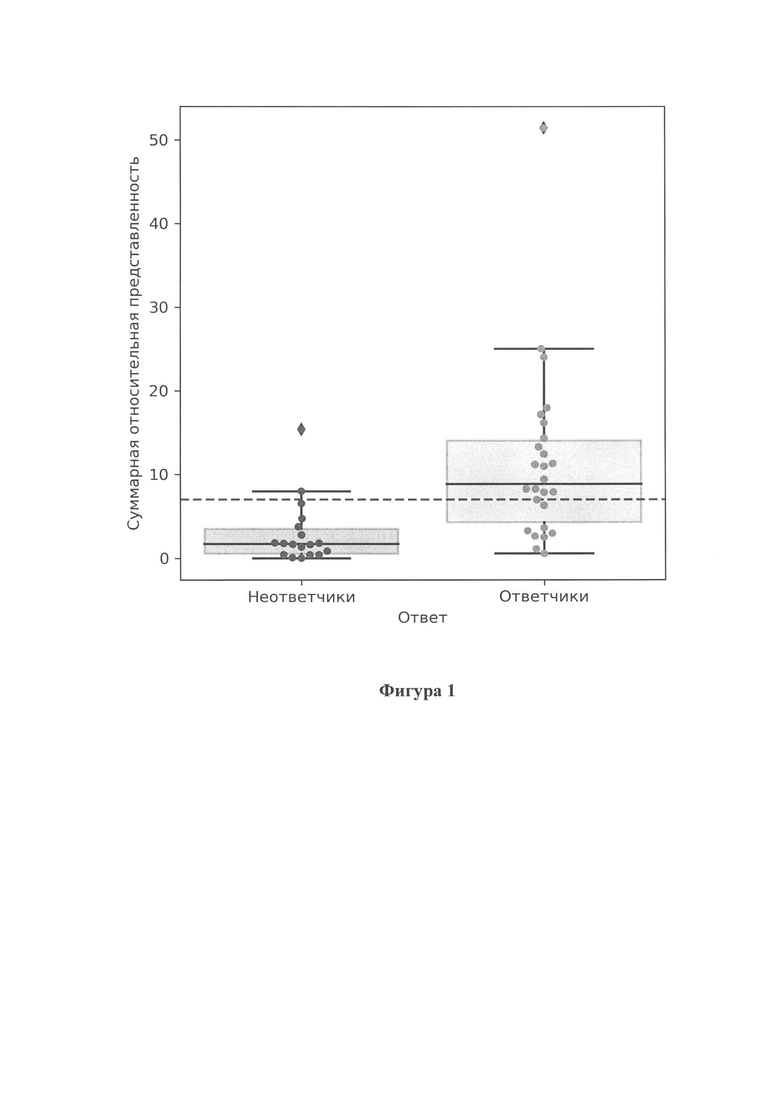
Фигура 1 показывает распределение суммарной относительной представленности бактерий, ассоциированных с успешным ответом на анти-PD1 терапию у ответчиков и неответчиков, соответственно. Горизонтальная пунктирная линия соответствует рассчитанному пороговому уровню.
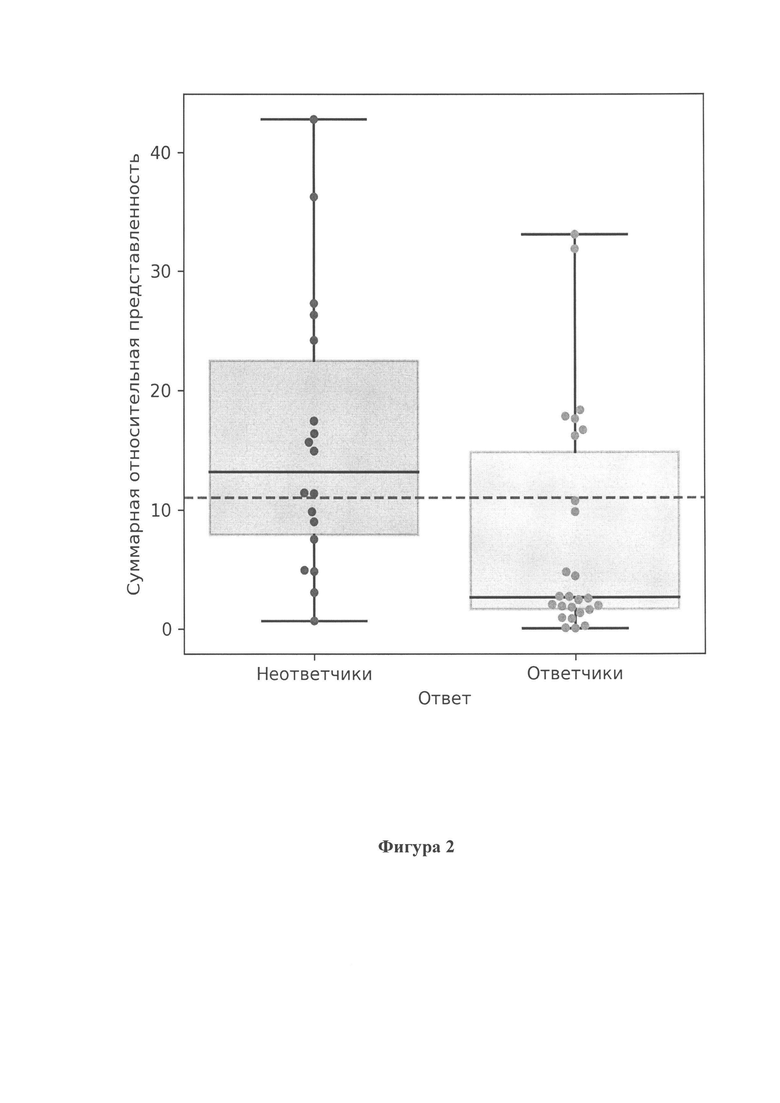
Фигура 2 показывает распределение суммарной относительной представленности бактерий, ассоциированных с неуспешным ответом на анти-PD1 терапию у ответчиков и неответчиков, соответственно. Горизонтальная пунктирная линия соответствует рассчитанному пороговому уровню.
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
Подробное описание изобретения
Выделение ДНК и пробоподготовку для секвенирования производят согласно требованиям и рекомендациям приборов, используемых для метагеномного секвенирования. Под полногеномным метагеномным секвенированием мы понимаем получение фрагментов из тотальной совокупности молекул ДНК, находящихся в образце. Под фрагментами мы понимаем фрагменты длиной не менее 100 пар нуклеотидов. Под таксономической аннотацией мы понимаем вычислительную процедуру, на вход которой подаются прочтения, полученные из полногеномного метагеномного секвенирования, а на выходе - относительная представленность видов организмов, (включая бактерий, архей и эукариот) в образце.
В исследование, которое легло в основу данного патента, были включены 44 образца фекалий, отобранных от пациентов с меланомой перед курсом анти-PD1 терапии препаратом производства ООО Биокад. По последующему терапевтическому эффекту, собранные образцы от пациентов разделили на две группы: ответчики (n=26) и неответчики (n=18).
Выделение тотальной ДНК из образцов фекалий проводили на установке MagNA Pure Compact System. Для разделения в образцах микробной фракции и фракции хозяина проводили обогащение ДНК. Полногеномное секвенирование обогащенной микробной ДНК проводили на приборе Illumina HiSeq.
Фильтрация низкокачественных прочтений осуществлялась программой Trimmomatic. Таксономическую аннотацию проводили с помощью программы MetaPhlan 3.0. Поиск биомаркеров производился с помощью пакетов LeFSe, а также языка Python и библиотеки scikit-learn. В анализ были включены только образцы с числом коротких прочтений больше 2,000,000. Биомаркер признавался пригодным к дальнейшему рассмотрению в случае, если значимое различие между группами сохранялось при удалении всех образцов, где представленность биомаркера нулевая. Такой подход был выбран для контроля возможных артефактов анализа.
В результате анализа были выявлены таксоны, суммарная относительная представленность которых является предиктором успешности применения анти-PD1 терапии (фиг. 1), а также таксоны, суммарная относительная представленность которых является предиктором неуспешности применения анти-PD1 терапии (фиг. 2).
Параметрами определения принадлежности к тому или иному классу стали: 1) суммарная представленность таксонов, ассоциированных с успешным ответом; 2) суммарная представленность таксонов, ассоциированных с отсутствием ответа.
Для определения граничных уровней для каждого параметра отдельно был использован линейный классификатор (RidgeClassifier в реализации scikit-learn, параметр solver = 'balanced').
Полученные относительные представленности таксонов логарифмировались, разбивались на тестовую и тренировочную выборки в соотношении 30:70. Данные выборки использовались для обучения наивного байесовского классификатора. Площадь под ROC кривой составила, в среднем, 0.72.
Таким образом, согласно полученным результатам, возможно предсказание успешности применения анти-PD1 терапии на основе данных полногеномного метагеномного секвенирования.
Под высокой представленностью микробной ДНК следующего набора микроорганизмов видов: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, которая является маркером положительного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, мы понимаем представленность выше 7 процентов.
Под высокой представленностью микробной ДНК следующего набора микроорганизмов видов: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans, которая является маркером отрицательного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, мы понимаем представленность выше 12 процентов.
Под пробиотической композицией мы понимаем смесь из бактерий, принадлежащих видам Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens.
Примеры
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема предлагаемых вариантов осуществления изобретения.
Пример 1
Пациент с диагнозом меланома, до начала терапии, сдает образец кала. Образец помещается в контейнер для сбора кала. Контейнер хранится и транспортируется при температуре не выше -20 С.
Для метагеномного анализа образцов кала, выделение ДНК бактерий проводится с помощью набора MagNA Pure Compact Nucleic Acid Isolation Kit I (Roche) и автоматической выделительной станции MagNA Pure Compact (Roche). Для этого 180-220 мг стула помещаются в заранее приготовленные пробирки со смесью силикатных шариков диаметрами 1 и 0,5 мм. Далее к каждому образцу добавляется 700 мкл натрия-фосфатного буфера (PBS). Гомогенизация образцов проводится с помощью прибора Minibeadbeater в течение 2 минут. Далее образцы центрифугируют 1 минуту при 9000 rpm для осаждения взвеси. 300 мкл супернатанта переносится в новые, 1,5 мл пробирки, содержащие 30 мкл протеиназы К и 270 мкл буферного раствора для лизиса бактерий (Roche) и все это перемешивается на вортексе. Полученный микс инкубируется 10 минут при 65°С и 10 минут при 95°С в термостате. Далее образцы центрифугируют 1 минуту при 9000 rpm и отбирается 400 мкл в новую пробирку. Полученный лизат загружали в прибор MagNA Pure Compact (Roche) где происходило дальнейшее автоматическое выделение ДНК. Элюция ДНК проводится в объеме 50 мкл Elution Buffer (Roche). Количество продукта оценивается на приборе Qubit fluorometer с использованием набора Quanti-iT dsDNA BR Assay Kit, (Invitrogen, США). Например, была получена концентрация 11,4 нг/мкл.
Метагеномные библиотеки смешиваются в необходимых соотношениях и готовится раствор библиотек с концентрацией 2 нМ. Секвенирование полученной библиотеки (разведенной до 12 рМ) проводится на приборе HiSeq 2500, используя набор парных прочтений 2×250 п. н. с добавлением 10% PhiX в качестве контроля.
Проводится денатурация и разведение библиотек. Для этого смешивается 10 мкл раствора библиотек и 10 мкл 0,1 М раствора NaOH. Инкубируется 5 минут при комнатной температуре. Добавляется 980 мкл раствора НТ1 из набора HiSeq Rapid Duo cBot Sample Loading Kit (Illumina).
Проводится денатурация и разведение контрольной ДНК из набора PhiX Control v3 (Illumina). Смешивается 2 мкл раствора контрольной ДНК, 8 мкл деионизованной воды и 10 мкл 0,1 М раствора NaOH. Инкубируется 5 минут при комнатной температуре. Добавляется 980 мкл раствора НТ1 из набора HiSeq Rapid Duo cBot Sample Loading Kit (Illumina).
Готовится рабочий раствор библиотек, смешанных с контрольной ДНК в соотношении 100:1. Для этого к 990 мкл раствора библиотек добавляется 10 мкл раствора контрольной ДНК PhiX.
Проточную ячейку HiSeq Rapid РЕ Flow Cell v2 промывается снаружи деионизованной водой и высушивается безворсовыми салфетками.
Процедуру секвенирования осуществляется с помощью инструмента HiSeq 2500 с использованием набора расходных материалов HiSeq Rapid SBS Kit v2 (200) (Illumina) согласно рекомендациям производителя.
Непосредственно перед запуском прибора проводится его автоматическая промывка деионизированной водой. Растворы и расходные материалы из набора HiSeq Rapid SBS Kit v2 (200) (Illumina) устанавливаются в прибор в соответствии с маркировкой и инструкциями производителя. После загрузки реагентов проводится первичное заполнение системы растворами командой Prime. По окончании работы станции cBot 2 проточную ячейку с готовыми кластерными колониями ДНК переносится в прибор HiSeq 2500 и запускается программа секвенирования согласно инструкциям. Процесс секвенирования одной проточной ячейки занимает около 2 суток.
Прочтения, полученные на этапе секвенирования, обрабатываются на вычислительном кластере (например, содержащим процессор EPYC 7502 и 128 гигабайт оперативной памяти) по следующей схеме. Прочтения фильтруются по качеству программой Trimmomatic, происходит вырезание последовательностей праймеров. Происходит классификация прочтений полученных на основе ДНК человека при помощи bbtools, данные прочтения удаляются.
Далее происходит таксономическая классификация прочтений при помощи Metaphlan3 и вычисляется суммарная доля прочтений, принадлежащих таксонам: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, являющихся маркерами положительного ответа на анти-PD1 терапию. В случае, если эта доля оказывается ниже, чем пороговое значение 7% (значение, рассчитанное на основе выборки ответчиков и неответчиков на терапию), то пациенту назначается прием пробиотической смеси, содержащей следующие бактерии: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens.
Пример 2
Пробоподготовка, секвенирование и обработка данных секвенирования для пациента производится полностью идентичным образом с тем, что описан в примере 1.
Далее происходит таксономическая классификация прочтений при помощи Metaphlan3 и вычисляется суммарная доля прочтений, принадлежащих таксонам: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans, являющихся маркерами отрицательного ответа на анти-PD1 терапию. В случае, если эта доля оказывается выше, чем пороговое значение 12% (значение, рассчитанное на основе выборки ответчиков и неответчиков на терапию), то пациенту назначается прием пробиотической смеси, содержащей следующие бактерии: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens.
Пример 3
Пробоподготовка, секвенирование и обработка данных секвенирования для пациента производится полностью идентичным образом с тем, что описан в примере 1.
Далее происходит таксономическая классификация прочтений при помощи Metaphlan3 и вычисляется суммарная доля прочтений, принадлежащих А) таксонам: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens, являющихся маркерами отрицательного ответа на анти-PD1 терапию, Б) таксонам: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans. В случае, если обе эти доли, описанные в пунктах А) и Б), оказываются ниже, соответственно, чем пороговые значения 7% и 12%, соответственно, то заключение о вероятности успешности терапии не делается и прием пробиотической смеси не назначется.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ УСОВЕРШЕНСТВОВАНИЯ БЛОКАДНОЙ ТЕРАПИИ ИММУННЫХ КОНТРОЛЬНЫХ ТОЧЕК ПОСРЕДСТВОМ МОДУЛЯЦИИ МИКРОБИОМА | 2017 |
|
RU2793582C2 |
| КОМПОЗИЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ УМЕНЬШЕНИЯ ИНДУЦИРОВАННОГО ЛЕЧЕНИЕМ ВОСПАЛЕНИЯ | 2019 |
|
RU2816462C2 |
| КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2664479C2 |
| СПОСОБ ОЦЕНКИ РИСКА ЗАБОЛЕВАНИЯ У ПОЛЬЗОВАТЕЛЯ НА ОСНОВАНИИ ГЕНЕТИЧЕСКИХ ДАННЫХ И ДАННЫХ О СОСТАВЕ МИКРОБИОТЫ КИШЕЧНИКА | 2018 |
|
RU2699517C2 |
| Способ прогнозирования исхода распространённой меланомы кожи при проведении терапии ингибиторами контрольных точек | 2023 |
|
RU2810433C1 |
| СИСТЕМА ДЕТЕКЦИИ НАИБОЛЕЕ ЗНАЧИМЫХ ПРОКАРИОТИЧЕСКИХ ПРЕДСТАВИТЕЛЕЙ МИКРОБИОТЫ КИШЕЧНИКА ЧЕЛОВЕКА НА ОСНОВЕ ПЦР ПАНЕЛИ | 2017 |
|
RU2680268C1 |
| СПОСОБ ТЕРАПИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА С ИСПОЛЬЗОВАНИЕМ АУТОПРОБИОТИКОВ | 2024 |
|
RU2839320C1 |
| ПРИМЕНЕНИЕ ПРОБИОТИКОВ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ПСОРИАЗА | 2017 |
|
RU2767967C2 |
| Способ создания таргетной панели для исследования геномных регионов для выявления терапевтических биомаркеров ингибиторов иммунных контрольных точек (ИКТ) | 2023 |
|
RU2818360C1 |
| СПОСОБ ДИАГНОСТИКИ СОСТОЯНИЯ МИКРОБИОТЫ КИШЕЧНИКА НА ФОНЕ ЭРАДИКАЦИОННОЙ ТЕРАПИИ HELICOBACTER PYLORI И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2616280C1 |
Группа изобретений относится к области биотехнологии, иммунологии и медицины. Заявлен способ определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию (варианты). Способ включает выделение ДНК из образца кала пациента с диагнозом меланома кожи, полногеномное метагеномное секвенирование, анализ полученных данных; определение представленности микробной ДНК. Представленность микробной ДНК выше 7 процентов набора микроорганизмов Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens является маркером положительного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию. Представленность микробной ДНК выше 12 процентов набора микроорганизмов видов Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans, является маркером отрицательного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию. Изобретения обеспечивают прогнозирование эффективности иммунотерапии онкологических болезней. 2 н.п. ф-лы, 2 ил., 3 пр.
1. Способ определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, включающий:
а) выделение ДНК из образца кала пациента с диагнозом меланома кожи,
б) полногеномное метагеномное секвенирование,
в) анализ данных полногеномного метагеномного секвенирования,
где высокая представленность микробной ДНК выше 7 процентов следующего набора микроорганизмов: Bifidobacterium adolescentis, Bacteroides thetaiotaomicron, Barnesiella intestinihominis, Parabacteroides merdae, Ruminococcus bromii, Eubacterium eligens является маркером положительного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию.
2. Способ определения ответа пациента с диагнозом меланома кожи на анти-PD1-терапию, включающий:
а) выделение ДНК из образца кала пациента с диагнозом меланома кожи,
б) полногеномное метагеномное секвенирование,
в) анализ данных полногеномного метагеномного секвенирования,
где высокая представленность микробной ДНК выше 12 процентов следующего набора микроорганизмов видов: Bifidobacterium longum, Collinsella aerofaciens, Oscillibacter sp cag241, Ruminococcus bicirculans является маркером отрицательного ответа пациента с диагнозом меланома кожи на анти-PD1-терапию.
| Gopalakrishnan V | |||
| et al | |||
| "The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy" | |||
| Cancer Cell, 2018, N 33, p.570 - 580 | |||
| WO 2018226690 A1, 13.12.2018 | |||
| WO 2019165285 A1, 29.09.2019 | |||
| СЕМИГЛАЗОВА Т.Ю | |||
| и др | |||
| "Значение кишечной микробиоты при иммунотерапии злокачественных новообразований | |||
| Взгляд онколога, иммунолога, |
Авторы
Даты
2022-04-26—Публикация
2020-09-29—Подача